RU2356535C2 - Synergistic suppositories for infectious gynecopathies treatment (versions) - Google Patents
Synergistic suppositories for infectious gynecopathies treatment (versions) Download PDFInfo
- Publication number
- RU2356535C2 RU2356535C2 RU2007127815/15A RU2007127815A RU2356535C2 RU 2356535 C2 RU2356535 C2 RU 2356535C2 RU 2007127815/15 A RU2007127815/15 A RU 2007127815/15A RU 2007127815 A RU2007127815 A RU 2007127815A RU 2356535 C2 RU2356535 C2 RU 2356535C2
- Authority
- RU
- Russia
- Prior art keywords
- suppositories
- diphilic
- compound
- hydrophilic
- metronidazole
- Prior art date
Links
Images
Abstract
Description
ОБЛАСТЬ ТЕХНИКИFIELD OF TECHNOLOGY
Изобретение относится к биоцидным лекарственным препаратам для наружного применения, в частности к лекарственным формам с упруговязкопластичной средой, предназначенным для лечения инфекционных гинекологических заболеваний.The invention relates to biocidal drugs for external use, in particular to dosage forms with an elastic-viscoplastic medium intended for the treatment of infectious gynecological diseases.
УРОВЕНЬ ТЕХНИКИBACKGROUND
В настоящее время в связи с высокой частотой протозойных, грибковых и бактериальных инфекций нижнего отдела женских половых органов большую важность в гинекологии имеют биоцидные препараты местного действия. Ввиду большой вариабельности и широкой распространенности штаммов возбудителей вульвитов и вагинитов особое значение имеет широта спектра действия применяемого препарата [Красильников А.П. Справочник по антисептике. - Минск: Вышейшая школа, 1995. - 367 с.].Currently, due to the high frequency of protozoan, fungal and bacterial infections of the lower part of the female genital organs, topical biocidal preparations are of great importance in gynecology. In view of the great variability and wide prevalence of strains of the causative agents of vulvitis and vaginitis, the breadth of the spectrum of action of the drug used is of particular importance [A. Krasilnikov Handbook of antiseptics. - Minsk: Higher School, 1995. - 367 p.].
Применение эффективной композиции веществ с антипротозойным, антимикробным и фунгицидным действием представляет только часть решения, остальное остается за созданием рациональной лекарственной формы. В большинстве случаев существует необходимость обеспечения равномерного распределения препарата по всей поверхности слизистой оболочки влагалища для достижения тотального уничтожения возбудителя, а также пролонгированного действия. Интравагинальная лекарственная форма должна обеспечивать комфортность при введении (не травмировать слизистую оболочку, иметь оптимальную консистенцию и время полной деформации/растворения) и высокую биодоступность действующих веществ [Промышленная технология лекарств / под ред. проф. В.И.Чуешова - Харьков: НФАУ, - 2002].The use of an effective composition of substances with antiprotozoal, antimicrobial and fungicidal action is only part of the solution, the rest is left to the creation of a rational dosage form. In most cases, there is a need to ensure uniform distribution of the drug over the entire surface of the vaginal mucosa to achieve total destruction of the pathogen, as well as a prolonged action. The intravaginal dosage form should provide comfort during administration (not to injure the mucous membrane, have an optimal consistency and time of complete deformation / dissolution) and high bioavailability of the active substances [Industrial technology of drugs / ed. prof. V.I. Chueshov - Kharkov: NFAA, - 2002].
Среди пролонгированных лекарственных форм местного действия, применяемых в гинекологии, можно перечислить таблетки, мази, суппозитории. Мягкие лекарственные формы (суппозитории и мази) обладают преимуществом перед водными растворами, обеспечивая более существенное пролонгирование терапевтического эффекта за счет высокой вязкости и структурированности [Синев Д.Н., Марченко Л.Г., Синева Т.Д. Справочное пособие по аптечной технологии лекарств. - СПб.: Невский диалект, 2001. - 316 с.]. Известны преимущества гидрофильных и дифильных суппозиторных основ перед липофильными: лучшие растворимость в вагинальном секрете, распределение по слизистой оболочке, параметры высвобождения, снижение риска микробной контаминации [Полимеры в фармации / под ред. А.И.Тенцовой, Медицина, Москва (1985)].Among the prolonged dosage forms of local action used in gynecology, tablets, ointments, suppositories can be listed. Soft dosage forms (suppositories and ointments) have an advantage over aqueous solutions, providing a more significant prolongation of the therapeutic effect due to the high viscosity and structure [Sinev DN, Marchenko LG, Sineva TD Reference manual for pharmacy technology of drugs. - St. Petersburg: Nevsky dialect, 2001. - 316 p.]. The advantages of hydrophilic and diphilic suppository bases over lipophilic ones are known: the best solubility in the vaginal secretion, distribution over the mucous membrane, release parameters, reduced risk of microbial contamination [Polymers in Pharmacy / ed. A.I. Tenzova, Medicine, Moscow (1985)].
Дифильные основы могут быть представлены продуктами направленной этерификации и гидрогенизации жирных кислот (витепсол, массупол, лазупол), а также смесями поверхностно-активных (Твины, Спэны, полоксамеры, эмульгаторы), липофильных (жиры, воски) и гидрофильных веществ. В качестве гидрофильных основ используют полиэтиленгликоли (макроголы), гели желатина, высшие жирные спирты.The diphilic bases can be represented by the products of directed esterification and hydrogenation of fatty acids (vitepsol, massupol, lazupol), as well as mixtures of surface-active (Twins, Spens, poloxamers, emulsifiers), lipophilic (fats, waxes) and hydrophilic substances. Polyethylene glycols (macrogols), gelatin gels, and higher fatty alcohols are used as hydrophilic bases.
Известны составы вагинальных суппозиториев, предназначенных для лечения бактериальных вагинитов и содержащих в качестве основного действующего вещества антибактериального и противомикробного действия препараты ряда нитроимидазолов (например, метронидазол), и дополнительно необязательно содержащих антибиотик в качестве действующего вещества антифунгального действия. Общим недостатком указанных решений является слабая растворимость действующих компонентов в липофильных, дифильных и гидрофильных суппозиторных основах. Данное явление напрямую влияет на высвобождение лекарственных веществ из основы и реализацию терапевтического действия.Known compositions of vaginal suppositories intended for the treatment of bacterial vaginitis and containing, as the main active substance, antibacterial and antimicrobial agents, preparations of a number of nitroimidazoles (e.g. metronidazole), and additionally optionally containing an antibiotic as an active substance of antifungal action. A common drawback of these solutions is the poor solubility of the active components in lipophilic, diphilic and hydrophilic suppository bases. This phenomenon directly affects the release of drugs from the base and the implementation of the therapeutic effect.
Среди вагинальных суппозиториев противогрибкового действия известен препарат «Пимафуцин» (№ гос. регистрации П №013552/01-2002), производства Яманучи, который содержит в качестве действующего вещества полиеновый макролидный противогрибковый агент натамицин (пимафуцин). Преимуществом введения натамицина в суппозиторий является его низкая токсичность, он показан для введения беременным [Справочник Видаль. Лекарственные препараты в России: Справочник. Б-476, изд-во ЗАО АстраФармСервис, 2002].Among the vaginal suppositories of antifungal action is known the drug "Pimafucin" (state registration number P No. 013552 / 01-2002), manufactured by Yamanouchi, which contains the polyene macrolide antifungal agent natamycin (pimafucin) as the active substance. The advantage of introducing natamycin into the suppository is its low toxicity, it is indicated for administration to pregnant women [Vidal Handbook. Medicines in Russia: A Handbook. B-476, publishing house ZAO AstraFarmService, 2002].
В заявке США 20060241061 указано, что натамицин слабо растворим в этаноле и воде, однако поднятие рН среды до 12 гидроксидом натрия увеличивает растворимость. Такое изменение рН может негативно сказаться на состоянии вагинального тракта, имеющего в норме рН 4-5.US application 20060241061 states that natamycin is slightly soluble in ethanol and water, but raising the pH to 12 with sodium hydroxide increases solubility. Such a change in pH can adversely affect the state of the vaginal tract, which normally has a pH of 4-5.
Натамицин, по сведениям европейского патента №1642500, менее активен в кристаллической форме, чем в виде раствора. Данный факт может свидетельствовать в пользу введения растворителя для натамицина в пропись.According to European patent No. 1642500, natamycin is less active in crystalline form than in solution. This fact may indicate the introduction of a solvent for natamycin in the prescription.
В патенте России №2032402 описаны композиции для введения во влагалище, при этом рН крема, по утверждению авторов патента, оптимизирован под нормальный рН влагалища и составляет 3,75-4,75. Кроме того, в описании патента приведен целый ряд ПАВов, консервантов и загустителей. В качестве адъювантов и сорастворителей приведены этанол и другие одноатомные спирты, а также пропиленгликоль и другие многоатомные спирты.Russian patent No. 2032402 describes compositions for administration to the vagina, while the pH of the cream, according to the authors of the patent, is optimized for the normal pH of the vagina and is 3.75-4.75. In addition, a number of surfactants, preservatives and thickeners are given in the patent description. Ethanol and other monohydric alcohols, as well as propylene glycol and other polyhydric alcohols are given as adjuvants and cosolvents.
В ряде патентов в качестве вспомогательного вещества используется пропиленгликоль в количестве предпочтительно не более 5 мас.%. Патент России №2032402 содержит метронидазол в смеси полиэтиленгликолей, которые растворяются в вагинальном секрете. В заявке США №2005080038 указана композиция метронидазола и пропиленгликоля в форме вагинального геля, в заявке США №2006024243 - композиция метронидазола с пропиленгликолем в форме пены, в международной заявке WO 2006/050303 - буферированная композиция для лечения бактериальных вагинитов, содержащая метронидазол в комбинации с пропиленгликолем.In a number of patents, propylene glycol is used as an excipient in an amount of preferably not more than 5 wt.%. Russian patent No. 2032402 contains metronidazole in a mixture of polyethylene glycols, which are dissolved in vaginal secretion. In US application No. 20050080038, a composition of metronidazole and propylene glycol in the form of a vaginal gel is indicated, in US application No.2006024243 a composition of metronidazole with propylene glycol in the form of a foam, in the international application WO 2006/050303, a buffered composition for treating bacterial vaginitis containing metronidazole in combination with .
Вместе с тем, ни в одной композиции не достигается оптимальная дисперсность метронидазола и натамицина при условии их совместного использования наряду с пролонгированным эффектом.However, in none of the compositions the optimal dispersion of metronidazole and natamycin is achieved if they are used together with a prolonged effect.
Наиболее близкое к предлагаемому нами решению рассмотрено в патенте США №6432935, где описана фармацевтическая суппозиторная композиция, состоящая из антибиотика, сульфонамида, нистатина и метронидазола. В качестве основы используется ПЭГ и какао-масло.Closest to our proposed solution is considered in US patent No. 6432935, which describes a pharmaceutical suppository composition consisting of an antibiotic, sulfonamide, nystatin and metronidazole. PEG and cocoa butter are used as the base.
Недостатками указанного решения является низкая дисперсность применяемых лекарственных веществ, обусловленная свойствами суппозиторной основы, что обуславливает ухудшение параметров их высвобождения и доставки к очагу инфекционного поражения, а также низкая комфортность применения и возможность абразивного действия на слизистую оболочку влагалища.The disadvantages of this solution is the low dispersion of the drugs used, due to the properties of the suppository base, which leads to a deterioration in the parameters of their release and delivery to the focus of infection, as well as low comfort of use and the possibility of abrasive effects on the vaginal mucosa.
В патенте России №2195281 заявлена композиция пессариев, содержащих метронидазол, миконазол и лидокаин. Подобная композиция имеет высокую комфортность применения за счет местного анестетика, вместе с тем, присутствует ряд недостатков, обусловленных присутствием азолового противогрибкового агента миконазола: разнообразные проявления токсичности [Т.С.Meeker, M.S.Siegel, F.M.Shiota, J.J.Crowley, R.W.Mcguffin. Toxicity of Amphotericin B, Miconazole, and Ketoconazole to Human Granulocyte Progenitor Cells In Vitro/Antimicrobial agents and chemotherapy, 1983, p.169-171], аллергенность, наличие резистентных форм грибов.In Russian patent No. 2195281 a composition of pessaries containing metronidazole, miconazole and lidocaine is claimed. Such a composition has a high comfort of use due to a local anesthetic, however, there are a number of disadvantages due to the presence of the azole antifungal agent miconazole: various manifestations of toxicity [T.S. Meeker, M.S. Siegel, F.M.Shiota, J.J. Crowley, R.W. Mcguffin. Toxicity of Amphotericin B, Miconazole, and Ketoconazole to Human Granulocyte Progenitor Cells In Vitro / Antimicrobial agents and chemotherapy, 1983, p. 169-171], allergenicity, presence of resistant forms of fungi.
ОПИСАНИЕ ИЗОБРЕТЕНИЯDESCRIPTION OF THE INVENTION
Задачей настоящего изобретения является создание комбинированных биоцидных составов местного применения для лечения широкого спектра инфекционных заболеваний нижнего отдела женских половых органов, обеспечивающих улучшенное высвобождение метронидазола и натамицина при совместном использовании наряду с пролонгированным действием и комфортностью.The present invention is the creation of combined biocidal topical formulations for the treatment of a wide range of infectious diseases of the lower female genital organs, providing improved release of metronidazole and natamycin when used together with a prolonged action and comfort.
В соответствии с изобретением описываются интравагинальные суппозитории для лечения инфекционных заболеваний нижнего отдела женских половых органов, содержащие в качестве антибактериального и противомикробного агента соединение из ряда нитроимидазолов, в качестве противогрибкового средства - полиеновые макролидные соединения и местный анестетик в дифильной или гидрофильной суппозиторной основе при следующем соотношении компонентов, % мас.:In accordance with the invention, intravaginal suppositories for the treatment of infectious diseases of the lower female genital organs are described containing, as an antibacterial and antimicrobial agent, a compound from a number of nitroimidazoles, polyene macrolide compounds and a local anesthetic in a diphilic or hydrophilic suppository base in the following ratio of components as an antifungal agent % wt .:
В следующем аспекте настоящего изобретения описываются интравагинальные суппозитории для лечения инфекционных заболеваний нижнего отдела женских половых органов, содержащие, помимо соединения ряда нитроимидазолов в качестве антибактериального и противомикробного агента, соединения ряда полиеновых макролидов в качестве противогрибкового агента и местного анестетика, репаративный агент, способствующий ускоренному заживлению ран, в следующем соотношении компонентов, % мас.:The following aspect of the present invention describes intravaginal suppositories for the treatment of infectious diseases of the lower female genital organs, containing, in addition to combining a number of nitroimidazoles as an antibacterial and antimicrobial agent, combining a number of polyene macrolides as an antifungal agent and local anesthetic, a reparative agent that promotes accelerated wound healing , in the following ratio of components,% wt .:
В следующем аспекте настоящего изобретения описываются интравагинальные суппозитории для лечения инфекционных заболеваний нижнего отдела женских половых органов, дополнительно содержащие буферную систему для поддержания естественного для влагалища уровня рН, при следующем соотношении компонентов, % мас.:The following aspect of the present invention describes intravaginal suppositories for the treatment of infectious diseases of the lower part of the female genital organs, additionally containing a buffer system to maintain a natural pH level for the vagina, in the following ratio, wt.%:
В следующем аспекте настоящего изобретения описываются интравагинальные суппозитории для лечения инфекционных заболеваний нижнего отдела женских половых органов, дополнительно содержащие антиоксидант при следующем соотношении компонентов, % мас.:The following aspect of the present invention describes intravaginal suppositories for the treatment of infectious diseases of the lower female genital organs, additionally containing an antioxidant in the following ratio, wt.%:
В соответствии с настоящим изобретением применяемые биоцидные агенты ряда нитроимидазола выбирают из группы, включающей метронидазол, тинидазол, секнидазол, орнидазол и группы полиеновых антибиотиков: натамицин, нистатин, амфотерицин, рифамицин, входят в действующее издание Британской, Европейской, Американской Фармакопей.In accordance with the present invention, the biocidal agents used in the nitroimidazole series are selected from the group consisting of metronidazole, tinidazole, secnidazole, ornidazole and the group of polyene antibiotics: natamycin, nystatin, amphotericin, rifamycin, are included in the current edition of the British, European, and American Pharmacopoeias.
Кроме того, в заявленный состав для повышения комфортности вводят местные антибиотики: лидокаина гидрохлорид, ксилокаин, бупивакаин, новокаин, бензокаин, обладающие местным обезболивающим действием. Для ускорения заживления пораженных инфекцией тканей в состав суппозиториев включены аминокислоты, ускоряющие репарацию (репарационные агенты). В предпочтительном варианте осуществления изобретения кислоты выбраны из группы, включающей таурин, аргинин, триптофан, лизин, пролин, гистидин [Jacobsen, J.; Smith, L.; Biochemistry and Physiology of Taurine and Taurine Derivatives. Phys. Rev. 48; 1968], также входящие в действующие издания Американской и Европейской Фармакопей.In addition, local antibiotics are introduced into the claimed composition to increase comfort: lidocaine hydrochloride, xylocaine, bupivacaine, novocaine, benzocaine, which have a local analgesic effect. To accelerate the healing of tissues affected by infection, amino acids that accelerate repair (repair agents) are included in the composition of suppositories. In a preferred embodiment, the acids are selected from the group consisting of taurine, arginine, tryptophan, lysine, proline, histidine [Jacobsen, J .; Smith, L .; Biochemistry and Physiology of Taurine and Taurine Derivatives. Phys. Rev. 48; 1968], also included in the current editions of the American and European Pharmacopoeia.
В одном из вариантов осуществления изобретения в состав суппозитория в качестве компонента для регулирования рН входит буферная система. В предпочтительном варианте осуществления изобретения под буферными системами, добавляемыми к составу для регулировки значения рН, подразумевают аскорбатный, карбонатный, фосфатный, цитратный, оксалатный буферы. В предпочтительном варианте осуществления изобретения в состав суппозиториев добавляют от 0,1 до 1 мас.% аскорбатного буфера. Аскорбатный буфер, помимо регулировки значения рН в суппозитории, может выполнять роль антиоксиданта для предотвращения окисления действующих веществ (например, натамицина) в процессе приготовления и упаковки суппозитория.In one embodiment of the invention, a buffering system is included in the suppository as a component for adjusting the pH. In a preferred embodiment of the invention, under buffer systems added to the composition for adjusting the pH value are meant ascorbate, carbonate, phosphate, citrate, oxalate buffers. In a preferred embodiment, 0.1 to 1 wt.% Ascorbate buffer is added to the suppository. The ascorbate buffer, in addition to adjusting the pH in the suppository, can act as an antioxidant to prevent the oxidation of active substances (for example, natamycin) during the preparation and packaging of the suppository.
Согласно еще одному варианту осуществления изобретения в качестве дополнительных антиоксидантов в состав суппозитория добавляют соединения, чьи антиоксидантные свойства проявляются в дифильных и гидрофильных суппозиторных основах. Такие антиоксиданты выбирают из группы, включающей аскорбиновую кислоту, аскорбил пальмитат, гипофосфорную кислоту, аскорбат натрия, витамины С и Е, бисульфит натрия, ЭДТА, лимонную кислоту и другие соединения, известные специалистам, которые проявляют свои антиоксидантные свойства в полимерных дифильных или гидрофильных основах.According to another embodiment of the invention, compounds are added to the suppository as additional antioxidants whose antioxidant properties appear in diphilic and hydrophilic suppository bases. Such antioxidants are selected from the group consisting of ascorbic acid, ascorbyl palmitate, hypophosphoric acid, sodium ascorbate, vitamins C and E, sodium bisulfite, EDTA, citric acid and other compounds known to those skilled in the art that exhibit their antioxidant properties in polymeric diphilic or hydrophilic bases.
Сочетание и соотношение указанных компонентов было установлено экспериментальным путем и является оптимальным по результатам физико-химических, фармакотехнологических и биологических исследований.The combination and ratio of these components was established experimentally and is optimal according to the results of physico-chemical, pharmacotechnological and biological studies.
Дозировка метронидазола в вагинальных суппозиториях («Флагил» производства Лабораториз Авентис) составляет от 200 до 500 мг при высшей разовой дозе 1 г.The dosage of metronidazole in vaginal suppositories (Flagil produced by Laboratories Aventis) is from 200 to 500 mg with a single dose of 1 g.
Дозировка натамицина в препаратах «Пимафуцин» производства Яманучи - 100 мг.The dosage of natamycin in the preparations "Pimafucin" manufactured by Yamanouchi is 100 mg.
Лидокаина гидрохлорид взят в минимальном количестве, рекомендованном в Справочнике Машковского М.Д. (Машковский М.Д. Лекарственные средства. - Харьков, 1997) для местного применения в гинекологии.Lidocaine hydrochloride is taken in the minimum amount recommended in the Mashkovsky Handbook M.D. (Mashkovsky M.D. Medicines. - Kharkov, 1997) for local use in gynecology.
В соответствии с изобретением дифильная суппозиторная основа представляет собой смесь жирорастворимых компонентов (твердого жира различных типов, восков) и водорастворимых компонентов (эмульгатора №1, эмульгатора Т-2, Твинов, Спэнов, гликолей, дистиллированных моноглицеринов). В предпочтительном варианте осуществления изобретения в качестве жирорастворимых компонентов используют твердые жиры, а в качестве водорастворимых компонентов - эмульгатор Т-2, Твин-80, ПЭГ-1500 (полиэтиленгликоль-1500) и пропиленгликоль. В наиболее предпочтительном варианте осуществления изобретения используют дифильную суппозиторную основу при следующем соотношении компонентов, % мас.:In accordance with the invention, the diphilic suppository base is a mixture of fat-soluble components (solid fat of various types, waxes) and water-soluble components (emulsifier No. 1, emulsifier T-2, Twins, Spans, glycols, distilled monoglycerins). In a preferred embodiment, solid fats are used as the fat-soluble components, and the emulsifier T-2, Tween-80, PEG-1500 (polyethylene glycol-1500) and propylene glycol are used as water-soluble components. In the most preferred embodiment of the invention, a diphilic suppository base is used in the following ratio, wt.%:
В соответствии с изобретением в качестве компонентов гидрофильной суппозиторной основы выступают водорастворимые компоненты: глицерины, гликоли. В предпочтительном варианте изобретения в качестве компонентов гидрофильной основы используют ПЭГ-1500 и пропиленгликоль. В наиболее предпочтительном варианте изобретения указанные компоненты включают в суппозиторную основу в следующих соотношениях, мас.%:In accordance with the invention, the components of the hydrophilic suppository base are water-soluble components: glycerins, glycols. In a preferred embodiment of the invention, PEG-1500 and propylene glycol are used as components of the hydrophilic base. In a most preferred embodiment of the invention, these components are included in a suppository base in the following proportions, wt.%:
Суппозитории в соответствии с изобретением характеризуются следующими физико-химическими свойствами.Suppositories in accordance with the invention are characterized by the following physicochemical properties.
Температура плавления или период полной деформации. Для разработанных составов значения данных характеристик соответствуют требованиям Государственной Фармакопеи (ГФ-XI), а именно температура плавления не превышает 37°С, а время полной деформации составляет менее 1 часа.Melting point or period of complete deformation. For the developed compositions, the values of these characteristics correspond to the requirements of the State Pharmacopoeia (GF-XI), namely, the melting temperature does not exceed 37 ° C, and the time of complete deformation is less than 1 hour.
Время растворения. Время растворения суппозиториев по изобретению, а точнее время превращения суппозиториев в водной среде в тонкую дисперсию, соответствует требованиям, изложенным в Государственной Фармакопее. Следовательно, описываемые в изобретении составы обеспечивают эффективное распределение действующих веществ по слизистой оболочке.Dissolution time. The dissolution time of the suppositories according to the invention, and more precisely the time for the suppository to be transformed into an aqueous dispersion into a fine dispersion, meets the requirements set forth in the State Pharmacopoeia. Therefore, the compositions described in the invention provide an effective distribution of active substances in the mucous membrane.
рН. Интервал значений рН составов с дифильной основой и гидрофильной основой составляет 5-7. Действующее вещество - соединение из ряда нитроимидазолов - повышает значение рН суппозиторной основы. Значение рН разработанных препаратов соответствует физиологическому значению рН слизистых оболочек организма и немного превышает естественный рН влагалища (4-5). Вместе с тем, учитывая то, что препарат применяют при воспалительных процессах, возможно, кислые значения рН нежелательны.pH The pH range of formulations with a diphilic base and a hydrophilic base is 5-7. The active substance - a compound from a number of nitroimidazoles - increases the pH of the suppository base. The pH value of the developed drugs corresponds to the physiological pH of the mucous membranes of the body and slightly exceeds the natural pH of the vagina (4-5). However, given the fact that the drug is used in inflammatory processes, acidic pH values may be undesirable.
Структурно-механические свойства. Осуществлено определение оптимальной консистенции суппозиториев путем измерения динамической вязкости разработанных составов (см. табл.5 в разделе «Примеры»).Structural and mechanical properties. The determination of the optimal consistency of suppositories was carried out by measuring the dynamic viscosity of the developed formulations (see table 5 in the "Examples" section).
Размеры частиц. В разработанных суппозиториях размеры частиц при использованной в лабораторных условиях методике диспергирования относились к среднедисперсным, тогда как данный показатель для препаратов сравнения (Флагил, Пимафуцин) промышленного производства - к тонкодисперсным. Основа влияет значительнее на размер частиц метронидазола: в гидрофильных суппозиториях степень дисперсности метронидазола намного выше по сравнению с дифильной. Разброс значений диаметра частиц меньше в гидрофильных основах.Particle size. In the developed suppositories, the particle sizes under the dispersion technique used in laboratory conditions were medium-dispersed, while this indicator for comparative preparations (Flagil, Pimafucin) for industrial production was finely dispersed. The basis influences more significantly the particle size of metronidazole: in hydrophilic suppositories, the degree of dispersion of metronidazole is much higher than that of diphilic. The variation in particle diameter is less in hydrophilic substrates.
Применение модуля «Коллоидная мельница» (гомогенизатор Labor Pilot, IKA) в составе технологической линии позволило получить суппозитории с размером частиц не более 1 мкм.The use of the Colloid Mill module (Labor Pilot homogenizer, IKA) as part of the production line made it possible to obtain suppositories with a particle size of not more than 1 μm.
Таким образом, дисперсность получаемого препарата сопоставима с препаратами сравнения.Thus, the dispersion of the resulting drug is comparable with the comparison drugs.
Ускоренное хранение. Совместимость компонентов разработанных суппозиторных составов исследовали в ходе ускоренного хранения. Суппозитории помещали в термостат при температуре 30°С. По истечении 6 месяцев хранения оценивали параметры: внешний вид, однородность на срезе, рН, время растворения или полной деформации. Оценка физико-химических параметров проводилась согласно статье «Общие методы анализа» Американской фармакопеи, 26 изд. (USP-26) и статье «Суппозитории» Государственной Фармакопеи, изд.XI (ГФ-XI).Expedited storage. The compatibility of the components of the developed suppository formulations was investigated during accelerated storage. Suppositories were placed in a thermostat at a temperature of 30 ° C. After 6 months of storage, the following parameters were evaluated: appearance, uniformity at the cut, pH, time of dissolution or complete deformation. Assessment of physico-chemical parameters was carried out according to the article "General methods of analysis" of the American Pharmacopoeia, 26th ed. (USP-26) and the Suppositories article of the State Pharmacopoeia, ed. XI (GF-XI).
В соответствии с изобретением описан способ лечения инфекционных гинекологических заболеваний, включающих вагиниты, вульвиты, вульвовагиниты, вызываемых анаэробными бактериями, грибами и простейшими.In accordance with the invention, a method for the treatment of infectious gynecological diseases, including vaginitis, vulvitis, vulvovaginitis caused by anaerobic bacteria, fungi and protozoa, is described.
Как видно из табл.10 раздела «Примеры», антибактериальная активность в отношении анаэробной флоры предложенных в соответствии с изобретением комбинаций превышает аналогичный показатель для аналога, проявляя активность в разведении до 1:10000 (25 мкг/мл). Натамицин повышает антибактериальную эффективность метронидазола.As can be seen from table 10 of the "Examples" section, the antibacterial activity against the anaerobic flora of the combinations proposed in accordance with the invention exceeds that of the analogue, being active in dilution up to 1: 10000 (25 μg / ml). Natamycin increases the antibacterial effectiveness of metronidazole.
Таким образом, препарат оказывает выраженный антипротозойный, микробоцидный и антифунгальный эффект в эксперименте на представителях основных видов возбудителей инфекционных вагинитов, наиболее распространенных среди населения: Trichomonas, Bacteroides, Fusobacterium, Candida. Эффективность разработанного препарата не уступает монопрепаратам метронидазола (Флагил) и натамицина (Пимафуцин), а в отношении трихомонад - превосходит.Thus, the drug has a pronounced antiprotozoal, microbicidal and antifungal effect in the experiment on representatives of the main types of infectious vaginitis pathogens, the most common among the population: Trichomonas, Bacteroides, Fusobacterium, Candida. The effectiveness of the developed drug is not inferior to monopreparations of metronidazole (Flagil) and natamycin (Pimafucin), and in relation to trichomonads it is superior.
Согласно следующему аспекту настоящего изобретения описан способ получения суппозиториев, состоящий в сплавлении компонентов основы при 30-75°С, измельчении твердых компонентов с расплавленной основой, розливе в упаковку и охлаждении.According to another aspect of the present invention, a method for producing suppositories is described, which consists in fusing the components of a base at 30-75 ° C, grinding the solid components with a molten base, packaging and cooling.
КРАТКОЕ ОПИСАНИЕ ФИГУРBRIEF DESCRIPTION OF THE FIGURES
Фиг.1. Зависимость напряжения сдвига от скорости сдвига разработанного гидрофильного состава (Пример 1) и Пимафуцина.Figure 1. The dependence of shear stress on the shear rate of the developed hydrophilic composition (Example 1) and Pimafucin.
Фиг.2. Зависимость напряжения сдвига от скорости сдвига разработанного дифильного состава (Пример 3) и Флагила.Figure 2. The dependence of shear stress on the shear rate of the developed diphilic composition (Example 3) and Flagil.
Далее описаны примеры осуществления изобретения, которые приводятся для иллюстрации и не ограничивают объем изобретения.The following are examples of embodiments of the invention, which are provided for illustration and do not limit the scope of the invention.
ПРИМЕРЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯMODES FOR CARRYING OUT THE INVENTION
Пример №1.Example No. 1.
Суппозитории для интравагинального применения, содержащие метронидазола 26%, натамицина 4,75%, лидокаина гидрохлорида 0,45%, таурина 0,5%, пропиленгликоля 0,85%, ПЭГ 1500 - 0,9%, эмульгатора Т-2 - 4,5%, твина-80 - 1,5% и твердого жира типа А - 50,45%.Suppositories for intravaginal administration containing metronidazole 26%, natamycin 4.75%, lidocaine hydrochloride 0.45%, taurine 0.5%, propylene glycol 0.85%, PEG 1500 - 0.9%, emulsifier T-2 - 4, 5%, tween-80 - 1.5% and solid fat type A - 50.45%.
Способ изготовления включает следующие основные этапы.The manufacturing method includes the following main steps.
1. Отвешивание компонентов, подготовка оборудования.1. Weighing components, preparation of equipment.
2. Приготовление расплава твердого жира с Т-2 и расплава ПЭГ с твином 80 и пропиленгликолем.2. Preparation of a solid fat melt with T-2 and a PEG melt with tween 80 and propylene glycol.
3. Смешивание твердых веществ с расплавами, одновременное перемешивание и измельчение в гомогенизаторе.3. Mixing solids with melts, simultaneous mixing and grinding in a homogenizer.
4. Дозирование в блистеры из фольги.4. Dosing in foil blisters.
5. Охлаждение.5. Cooling.
Пример №2.Example No. 2.
Суппозитории для интравагинального применения, содержащие метронидазола 26,5%, натамицина 5,75%, лидокаина гидрохлорида 0,01%, таурина 1%, пропиленгликоля 4,73%, ПЭГ 1500 - 1%, эмульгатора Т-2 - 5%, твина-80 - 2,0% и твердого жира типа А - 50,45%. Этапы приготовления соответствуют примеру 1.Suppositories for intravaginal administration containing metronidazole 26.5%, natamycin 5.75%, lidocaine hydrochloride 0.01%, taurine 1%, propylene glycol 4.73%, PEG 1500 - 1%, emulsifier T-2 - 5%, tween -80 - 2.0% and solid fat type A - 50.45%. The cooking steps correspond to example 1.
Пример №3.Example No. 3.
Суппозитории для интравагинального применения, содержащие метронидазола 26,0%, натамицина 4,75%, лидокаина гидрохлорида 0,45%, таурина 0,5%, пропиленгликоля 0,85%, ПЭГ 1500 - 65,25%.Suppositories for intravaginal administration containing metronidazole 26.0%, natamycin 4.75%, lidocaine hydrochloride 0.45%, taurine 0.5%, propylene glycol 0.85%, PEG 1500 - 65.25%.
Способ изготовления включает следующие этапы.The manufacturing method includes the following steps.
1. Отвешивание компонентов, подготовка оборудования.1. Weighing components, preparation of equipment.
2. Приготовление расплава ПЭГ с пропиленгликолем.2. Preparation of a PEG melt with propylene glycol.
3. Смешивание твердых веществ с расплавами, одновременное перемешивание и измельчение в гомогенизаторе.3. Mixing solids with melts, simultaneous mixing and grinding in a homogenizer.
4. Дозирование в блистеры из алюминиевой фольги.4. Dosing in aluminum foil blisters.
5. Охлаждение.5. Cooling.
Пример №4.Example No. 4.
Суппозитории для интравагинального применения, содержащие метронидазола 26,5%, натамицина 5,75%, лидокаина гидрохлорида 0,5%, таурина 0,02%, пропиленгликоля 0,01%, полиэтиленгликоля 1500 - 65,25%. Этапы приготовления соответствуют примеру 3.Suppositories for intravaginal administration containing metronidazole 26.5%, natamycin 5.75%, lidocaine hydrochloride 0.5%, taurine 0.02%, propylene glycol 0.01%, polyethylene glycol 1500 - 65.25%. The cooking steps correspond to example 3.
Пример №5.Example No. 5.
Суппозитории для интравагинального применения, содержащие тинидазола 0,5 г, амфотерицина 0,1 г, бензокаина 0,02 г, аргинина 0,1 г, гидрофильной основы 1,48 г.Suppositories for intravaginal administration, containing tinidazole 0.5 g, amphotericin 0.1 g, benzocaine 0.02 g, arginine 0.1 g, hydrophilic base 1.48 g.
Способ изготовления включает следующие основные этапы.The manufacturing method includes the following main steps.
1. Отвешивание компонентов, подготовка оборудования.1. Weighing components, preparation of equipment.
2. Приготовление расплава ПЭГ 1500 с пропиленгликолем при 50-60°С.2. Melt preparation of PEG 1500 with propylene glycol at 50-60 ° C.
3. Смешивание твердых веществ с расплавленной основой, одновременное перемешивание и измельчение в гомогенизаторе в течение 10-15 минут.3. Mixing solids with the molten base, simultaneous mixing and grinding in a homogenizer for 10-15 minutes.
4. Дозирование в блистеры из алюминиевой фольги.4. Dosing in aluminum foil blisters.
5. Охлаждение.5. Cooling.
Состав стабилен, размер частиц в пределах 10 мкм, среднее время растворения 22 минуты.The composition is stable, particle size within 10 microns, average dissolution time 22 minutes.
Пример №6.Example No. 6.
Суппозитории для интравагинального применения, содержащие орниадзола 0,5 г, нистатина 0,015 г, бупивакаина 0,01 г, лизина 0,05 г, дифильной основы 1,67 г.Suppositories for intravaginal administration, containing orniadzole 0.5 g, nystatin 0.015 g, bupivacaine 0.01 g, lysine 0.05 g, diphilic base 1.67 g.
Способ изготовления включает следующие основные этапы.The manufacturing method includes the following main steps.
1. Отвешивание компонентов, подготовка оборудования.1. Weighing components, preparation of equipment.
2. Приготовление расплава твердого жира с эмульгатором Т-2 и расплава ПЭГ с твином 80 и пропиленгликолем.2. Preparation of a solid fat melt with T-2 emulsifier and a PEG melt with tween 80 and propylene glycol.
3. Смешивание твердых веществ с расплавленной основой, одновременное перемешивание, частичное растворение и измельчение в гомогенизаторе в течение 10-15 минут.3. Mixing solids with the molten base, simultaneous mixing, partial dissolution and grinding in a homogenizer for 10-15 minutes.
4. Дозирование в блистеры из алюминиевой фольги.4. Dosing in aluminum foil blisters.
5. Охлаждение.5. Cooling.
Состав стабилен, размер частиц в пределах 20 мкм, среднее значение периода полной деформации 8 минут.The composition is stable, particle size within 20 microns, the average value of the period of complete deformation of 8 minutes.
Пример №7.Example No. 7.
Суппозитории для интравагинального применения, содержащие метронидазола 26%, натамицина 4,75%, лидокаина гидрохлорида 0,45%, таурина 0,5%, пропиленгликоля 0,85%, ПЭГ 1500 - 0,9%, эмульгатора Т-2 - 4,5%, твина-80 - 1,5% и твердого жира типа А - 50,4%, аскорбатного буфера 0,2%.Suppositories for intravaginal administration containing metronidazole 26%, natamycin 4.75%, lidocaine hydrochloride 0.45%, taurine 0.5%, propylene glycol 0.85%, PEG 1500 - 0.9%, emulsifier T-2 - 4, 5%, tween-80 - 1.5% and solid fat type A - 50.4%, ascorbate buffer 0.2%.
Способ изготовления включает следующие основные этапы.The manufacturing method includes the following main steps.
1. Отвешивание компонентов, подготовка оборудования.1. Weighing components, preparation of equipment.
2. Приготовление расплава твердого жира с эмульгатогром Т-2 и расплава ПЭГ с твином 80 и пропиленгликолем.2. Preparation of a solid fat melt with T-2 emulsifier and a PEG melt with tween 80 and propylene glycol.
3. Смешивание твердых веществ с расплавами, одновременное перемешивание и измельчение в гомогенизаторе.3. Mixing solids with melts, simultaneous mixing and grinding in a homogenizer.
4. Дозирование в блистеры из алюминиевой фольги.4. Dosing in aluminum foil blisters.
5. Охлаждение.5. Cooling.
Пример №8.Example No. 8.
Суппозитории для интравагинального применения, содержащие метронидазола 26%, натамицина 4,75%, лидокаина гидрохлорида 0,45%, таурина 0,5%, пропиленгликоля 0,85%, ПЭГ 1500 - 0,9%, эмульгатора Т-2 - 4,5%, твина-80 - 1,5% и твердого жира типа А - 50,4%, оксалатного буфера 0,2%, ЭДТА 0,1%.Suppositories for intravaginal administration containing metronidazole 26%, natamycin 4.75%, lidocaine hydrochloride 0.45%, taurine 0.5%, propylene glycol 0.85%, PEG 1500 - 0.9%, emulsifier T-2 - 4, 5%, tween-80 - 1.5% and solid fat type A - 50.4%, oxalate buffer 0.2%, EDTA 0.1%.
Способ изготовления включает следующие основные этапы.The manufacturing method includes the following main steps.
1. Отвешивание компонентов, подготовка оборудования.1. Weighing components, preparation of equipment.
2. Приготовление расплава твердого жира с Т-2 и расплава ПЭГ с твином 80 и пропиленгликолем.2. Preparation of a solid fat melt with T-2 and a PEG melt with tween 80 and propylene glycol.
3. Смешивание твердых веществ с расплавами, одновременное перемешивание и измельчение в гомогенизаторе.3. Mixing solids with melts, simultaneous mixing and grinding in a homogenizer.
4. Дозирование в блистеры из алюминиевой фольги.4. Dosing in aluminum foil blisters.
5. Охлаждение.5. Cooling.
Пример №9.Example No. 9.
Суппозитории для интравагинального применения, содержащие метронидазола 26,0%, натамицина 4,75%, лидокаина гидрохлорида 0,45%, таурина 0,5%, пропиленгликоля 0,85%, ПЭГ 1500 - 65,1%, аскорбатного буфера 0,2%.Suppositories for intravaginal administration, containing metronidazole 26.0%, natamycin 4.75%, lidocaine hydrochloride 0.45%, taurine 0.5%, propylene glycol 0.85%, PEG 1500 - 65.1%, ascorbate buffer 0.2 %
Способ изготовления включает следующие этапы.The manufacturing method includes the following steps.
1. Отвешивание компонентов, подготовка оборудования.1. Weighing components, preparation of equipment.
2. Приготовление расплава ПЭГ с пропиленгликолем.2. Preparation of a PEG melt with propylene glycol.
3. Смешивание твердых веществ с расплавами, одновременное перемешивание и измельчение в гомогенизаторе.3. Mixing solids with melts, simultaneous mixing and grinding in a homogenizer.
4. Дозирование в блистеры из алюминиевой фольги.4. Dosing in aluminum foil blisters.
5. Охлаждение.5. Cooling.
Пример №10.Example No. 10.
Суппозитории для интравагинального применения, содержащие метронидазола 26,0%, натамицина 4,75%, лидокаина гидрохлорида 0,45%, таурина 0,5%, пропиленгликоля 0,85%, ПЭГ 1500 - 65,1%, ЭДТА 0,2%.Suppositories for intravaginal administration containing metronidazole 26.0%, natamycin 4.75%, lidocaine hydrochloride 0.45%, taurine 0.5%, propylene glycol 0.85%, PEG 1500 - 65.1%, EDTA 0.2% .
Способ изготовления включает следующие этапы.The manufacturing method includes the following steps.
1. Отвешивание компонентов, подготовка оборудования.1. Weighing components, preparation of equipment.
2. Приготовление расплава ПЭГ с пропиленгликолем.2. Preparation of a PEG melt with propylene glycol.
3. Смешивание твердых веществ с расплавами, одновременное перемешивание и измельчение в гомогенизаторе.3. Mixing solids with melts, simultaneous mixing and grinding in a homogenizer.
4. Дозирование в блистеры из алюминиевой фольги.4. Dosing in aluminum foil blisters.
5. Охлаждение.5. Cooling.
ПРИМЕРЫ ИССЛЕДОВАНИЯ СВОЙСТВ СУППОЗИТОРИЕВEXAMPLES OF RESEARCH OF PROPERTIES OF SUPPOSITORIES
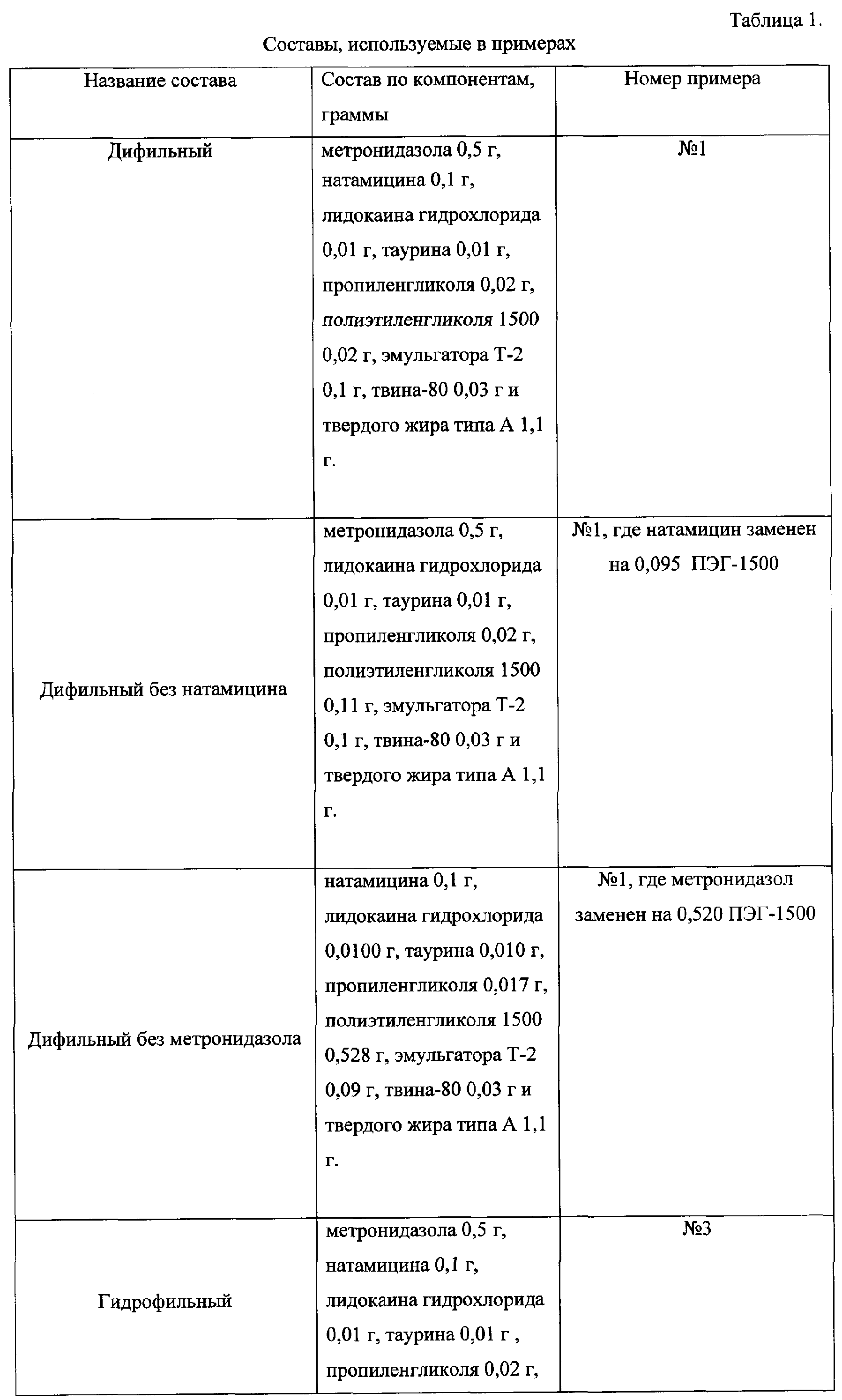
В качестве препаратов сравнения в исследованиях были использованы монопрепараты метронидазола и натамицина: «Флагил» производства Лабораториз Авентис (№ гос. регистрации П №014269/01-2002) и «Пимафуцин» (№ гос. регистрации П №013552/01-2002) производства Яманучи, а также монопрепараты метронидазола и натамицина в избранных нами основах (табл.1).Monronodications of metronidazole and natamycin were used as reference preparations: Flagil manufactured by Laboratories Aventis (state registration number P No. 014269 / 01-2002) and Pimafucin (state registration number P No. 013552 / 01-2002) manufactured Yamanouchi, as well as monopreparations of metronidazole and natamycin in our chosen basics (Table 1).
Пример №11. Распадаемость в водной средеExample No. 11. Disintegration in the aquatic environment
Время и характер растворения (образования однородной дисперсии в воде) разработанных дифильных и гидрофильных составов в водной среде проводили согласно требованиям статьи «Определение распадаемости лекарственных форм» ГФ-XI, вып.2, стр.158, с использованием прибора «Качающаяся корзинка» производства Эрвека и изотонического раствора натрия хлорида в качестве дисперсионной среды.The time and nature of dissolution (formation of a homogeneous dispersion in water) of the developed diphilic and hydrophilic compositions in the aquatic environment was carried out according to the requirements of the article “Determining the Disintegration of Dosage Forms” GF-XI,
Время растворения (образования дисперсии) препаратов метронидазола и натамицина и характер образующихся системtable 2
The dissolution time (dispersion formation) of metronidazole and natamycin preparations and the nature of the systems formed
*Название состава соответствует названию в табл.1* The name of the composition corresponds to the name in table 1
Как видно из табл.2, среднее время растворения дифильного состава, а точнее образование однородной дисперсии, по результатам трех экспериментов составило 45 мин. Время растворения гидрофильного состава составило 25 мин в трех последовательных экспериментах. Метронидазол улучшает распадаемость и растворимость формы в водной среде. Флагил, имеющий липофильную основу, не образует водную дисперсию в данном тесте. Пимафуцин образует дисперсию в течение 40-45 минут. Данные показатели отличаются в лучшую сторону от показателей для препаратов сравнения. Время растворения дифильного состава и гидрофильного состава удовлетворяет требованиям ГФ-Х1, следовательно, составы обеспечивают эффективное распределение по слизистой оболочке.As can be seen from table 2, the average dissolution time of the diphilic composition, or rather the formation of a homogeneous dispersion, according to the results of three experiments was 45 minutes. The dissolution time of the hydrophilic composition was 25 minutes in three consecutive experiments. Metronidazole improves the disintegration and solubility of the form in the aquatic environment. Flagyl having a lipophilic base does not form an aqueous dispersion in this test. Pimafucin forms a dispersion within 40-45 minutes. These indicators differ for the better from indicators for comparison drugs. The dissolution time of the diphilic composition and the hydrophilic composition meets the requirements of GF-X1, therefore, the compositions provide an effective distribution over the mucous membrane.
Пример №12. (Измерение значений рН разработанных составов)Example No. 12. (PH measurement of formulations)
Значение рН разработанных составов (комбинированных и моно-) сравнивали со значением рН монопрепаратов: Пимафуцина (только натамицин, дифильная основа) и Флагила (только метронидазол, липофильная основа). Пробоподготовку дифильных суппозиториев осуществляли в соответствии с ГФ-XI для мазей (стр.114), диспергируя суппозиторий стеклянными бусами в воде в отношении 1:10 для получения эмульсии, включения диспергировали ультразвуком на установке Ultrasonic, Германия.The pH value of the developed formulations (combined and mono-) was compared with the pH of monopreparations: Pimafucin (natamycin only, diphilic base) and Flagil (metronidazole only, lipophilic base). Sample preparation of diphilic suppositories was carried out in accordance with GF-XI for ointments (p. 114), dispersing the suppository with glass beads in water in a ratio of 1:10 to obtain an emulsion, inclusions were dispersed by ultrasound in an Ultrasonic installation, Germany.
Настройка прибора и измерения производились в термостатированных условиях при температуре 20°С. рН определяли потенциометрическим методом (ГФ-XI, стр.113-114) при помощи автоматического рН-метра марки РН-150 (Россия) с точностью до 0,01.Instrument setup and measurements were carried out under thermostated conditions at a temperature of 20 ° С. The pH was determined by the potentiometric method (GF-XI, pp. 113-114) using an automatic pH meter of the RN-150 brand (Russia) with an accuracy of 0.01.
Значения рН препаратов метронидазола и натамицинаTable 3
PH values of metronidazole and natamycin
*Название состава соответствует названию в табл.1* The name of the composition corresponds to the name in table 1
Пример №13. (Температуры плавления)Example No. 13. (Melting point)
Температуру плавления (Тпл, °С эксп.) определяли на приборе с капилляром, снабженном термометром Убеллоде по методике ГФ-XI, вып.1, стр.18. Достоверными считали показатели с разбросом не более 1°С при трех последовательных измерениях.The melting temperature (T pl , ° С exp.) Was determined on a device with a capillary equipped with a Ubellode thermometer according to the method of GF-XI, issue 1, p. 18. Reliable considered indicators with a spread of not more than 1 ° C in three consecutive measurements.
Температуру плавления (Тпл, °С теор.) составов предварительно устанавливали по формуле:The melting temperature (T PL , ° C theory.) Of the compositions was previously set according to the formula:
где Тпл - температура плавления смеси;where T PL - the melting temperature of the mixture;
T1, Т2 и Т3 - температура плавления отдельных компонентов;T 1 , T 2 and T 3 - the melting temperature of the individual components;
Q1, Q2 и Q3 - содержание их в %;Q 1 , Q 2 and Q 3 - their content in%;
Результаты теоретических расчетов и практических измерений представлены в табл.4.The results of theoretical calculations and practical measurements are presented in table 4.
Температуры плавления составов с метронидазолом и натамициномTable 4
Melting points of formulations with metronidazole and natamycin
Пример №14. (Консистенция разработанных составов)Example No. 14. (Consistency of formulations developed)
Структурно-механические свойства, характеризующие течение, сохранение формы и внутреннее трение суппозиторной основы при температуре тела оценивались по значениям в определенных интервалах. Препараты расплавляли на водяной бане при 37°С, расплав немедленно переносили в цилиндр ротационного вискозиметра «Реотест-2» (Германия) с системой воспринимающих элементов «цилиндр-цилиндр» T1-В3. Цилиндр находился в аквариуме с непрерывным подогревом воды до 37±1°С. Измеряли динамическую вязкость при различных скоростях (диапазон 4-2048 с-1) сдвига вначале в направлении возрастания, затем в направлении убывания значений скорости. На основании полученных рядов зависимости вязкости от скорости сдвига находили значения напряжения сдвига по формуле:Structural and mechanical properties that characterize the flow, shape retention, and internal friction of the suppository base at body temperature were evaluated by values at certain intervals. The preparations were melted in a water bath at 37 ° C, the melt was immediately transferred to the cylinder of the Reotest-2 rotational viscometer (Germany) with a cylinder-to-cylinder sensing system T 1 -B 3 . The cylinder was in an aquarium with continuous heating of water to 37 ± 1 ° C. The dynamic viscosity was measured at various speeds (range 4-2048 s -1 ) of shear, first in the direction of increase, then in the direction of decreasing speed values. Based on the obtained series of the dependence of viscosity on shear rate, shear stress values were found by the formula:
τ=γ·η,τ = γ
где τ - напряжение сдвига, сН/м (дин/см);where τ is the shear stress, sN / m (dyne / cm);
γ - скорость сдвига, с-1;γ is the shear rate, s -1 ;
η - динамическая вязкость, сП·с.η - dynamic viscosity, cP · s.
Строили графики зависимости τ(γ), где отмечали наличие петель гистерезиса и прохождения через реологический оптимум [Аркуша А.А. Исследования структурно-механических свойств мазей с целью определения оптимальной консистенции. Автореферат диссертации на соискание степени канд. фарм. наук. - Харьков, 1982. - 55 с.].Plots of the dependence τ (γ) were constructed, where the presence of hysteresis loops and passage through the rheological optimum was noted [A. Arkusha Studies of the structural and mechanical properties of ointments in order to determine the optimal consistency. Abstract of dissertation for the degree of Cand. farm. sciences. - Kharkov, 1982. - 55 p.].
Графики τ(log2γ) разработанного состава по примеру 3 (гидрофильный состав), а также Пимафуцина (Фиг.1) обладают слабовыраженной петлей гистерезиса, что обусловлено преобладанием в составе ПАВ со сравнительно большой молекулярной массой (полиэтиленгликоль в разработанном составе, цетиловый спирт в Пимафуцине), в составе основы и свидетельствует о возможности изменения структуры расплава при постоянном давлении. Графики обоих разработанных составов проходят через реологический оптимум, значит, при распределении расплава при слизистой оболочке при естественном трении (эквивалент с-1).The graphs τ (log 2 γ) of the developed composition according to example 3 (hydrophilic composition), as well as Pimafucin (Fig. 1) have a weakly expressed hysteresis loop, which is due to the predominance in the composition of surfactants with a relatively large molecular weight (polyethylene glycol in the developed composition, cetyl alcohol in Pimafucin), as part of the base, and indicates the possibility of changing the structure of the melt at constant pressure. The graphs of both developed compounds pass through the rheological optimum, which means that during the distribution of the melt during the mucous membrane during natural friction (equivalent to -1 ).
Отсутствие существенных петель на графиках составов свидетельствует о сохранении структуры при возрастающем механическом воздействии или же о быстром восстановлении при снижении силы механического воздействия. Составы, содержащие в качестве основы преимущественно жир (пример 1, дифильный состав и Флагил) (Фиг.2), обладают максимальной вязкостью и стойкостью структуры расплавов. Вместе с тем, прохождение их графиков τ(log2γ) через оптимум консистенции говорит об отсутствии дискомфорта и трудности распределения по слизистой оболочке. Наличие выраженной дисперсной фазы (более 25%) в разработанных составах относительно препаратов сравнения повышает значение динамической вязкости относительно препаратов сравнения, что выражается более крутой линией графика.The absence of significant loops in the composition graphs indicates the preservation of the structure with increasing mechanical stress or the rapid recovery with a decrease in the strength of the mechanical stress. Compositions containing mainly fat as a base (Example 1, diphilic composition and Flagyl) (FIG. 2) have maximum viscosity and structure stability of the melts. At the same time, the passage of their graphs τ (log2γ) through the optimum of consistency indicates the absence of discomfort and the difficulty of distribution over the mucous membrane. The presence of a pronounced dispersed phase (more than 25%) in the developed formulations relative to comparison preparations increases the value of dynamic viscosity relative to comparison preparations, which is expressed by a steeper graph line.
Пример №15. (Определение размеров частиц суспензионной фазы)Example No. 15. (Determination of particle sizes of the suspension phase)
Определение размера частиц суспензионной фазы (метронидазол, натамицин) производили при помощи микроскопа со счетным окуляром. Суппозитории расплавляли при 40-50°С, расплав переносили на нагретое лабораторное стекло, накрывали покровным стеклом. Препарат исследовали с использованием микроскопа марки «ЛОМО» при увеличении х150, на объектив устанавливали микрометрометрическую счетную сетку MOB (Микрометра Окулярного Винтового). Размер частиц дисперсной фазы определяли согласно методике ГФ-XI, изложенной в статье «Мази», вып.2, с.146.The particle size of the suspension phase (metronidazole, natamycin) was determined using a microscope with a counting eyepiece. Suppositories were melted at 40-50 ° C, the melt was transferred to heated laboratory glass, covered with a coverslip. The drug was examined using a LOMO microscope at a magnification of x150, and a MOB (Ocular Screw Micrometer) micrometer counting grid was installed on the lens. The particle size of the dispersed phase was determined according to the method of GF-XI, described in the article "Ointment",
Линейные размеры частиц препаратов натамицина и метронидазола в поле зренияTable 6
Linear particle sizes of natamycin and metronidazole preparations in the field of view
По табл.6 распределение размеров частиц подчинялось кривой Гаусса, посторонних включений отмечено не было. Для всех разработанных составов преобладает фракция со среднеарифметическим размеров частиц 5-7 мкм, дисперсия порядка 20%, максимальный размер 15 мкм. Размеры частиц всех препаратов укладываются в требования к препаратам суспензионного типа для наружного применения (от 0,1 до 100 мкм).According to Table 6, the particle size distribution obeyed the Gauss curve; no foreign inclusions were noted. For all developed compositions, a fraction with an arithmetic mean particle size of 5-7 microns, a dispersion of about 20%, and a maximum size of 15 microns prevail. The particle sizes of all drugs fit into the requirements for suspension-type drugs for external use (from 0.1 to 100 microns).
Пример №16 (изучение специфической активности препарата)Example No. 16 (study of the specific activity of the drug)
Кинетика высвобождения была оценена в тесте «Растворение», был использован прибор «Вращающаяся корзинка» (Erweka DT-6), эксперимент проведен в соответствии с требованиями ГФ-XI, стр.159. В качестве диализной среды использован изотоничный раствор натрия хлорида. Учитывая пролонгированный характер высвобождения из суппозиториев, пробы по 5 мл отбирали каждые 30 минут, объем восполняли диализной средой.The kinetics of release was evaluated in the Dissolution test, the Rotating Basket instrument (Erweka DT-6) was used, the experiment was carried out in accordance with the requirements of GF-XI, p. 159. An isotonic sodium chloride solution was used as a dialysis medium. Considering the prolonged nature of the release from suppositories, 5 ml samples were taken every 30 minutes, the volume was replenished with dialysis medium.
Отобранные пробы тестировались на способность к подавлению роста стандартных штаммов микроорганизмов: анаэробы: Fusobacterium necroforum, Bacteroides nodosus, грибы: Candida utilis (метод разведения со средой) [Красильников А.П. Справочник по антисептике. - Минск: Вышейшая школа, 1995. - 367 с.], а также трихомонад.The samples were tested for their ability to suppress the growth of standard strains of microorganisms: anaerobes: Fusobacterium necroforum, Bacteroides nodosus, fungi: Candida utilis (dilution method with medium) [Krasilnikov A.P. Handbook of antiseptics. - Minsk: Higher School, 1995. - 367 p.], As well as Trichomonas.
Изучение противотрихомонадной активности метронидазола проводили в опытах in vitro. Штаммы трихомонад в ассоциации с бактериями, в частности с кишечной палочкой, культивировали на среде Павловой, перевивая такие культуры каждые 2-3 дня. [Экспериментальное изучение антипротозойной активности фармакологических веществ (Методические рекомендации) / чл.-корр. РАМН Т.А.Гуськова]. Trichomonas vaginalis, выделенный из очага поражения, пересев со среды Павловой (совместный рост с Е. coli) на жидкую питательную среду (МПБ). Проверяли активность трихомонад (не менее 80% активно движется), наблюдая жидкий препарат при увеличении ×1000 на микроскопе «Lumex». Приготовление разведений производили десятичным методом, разводя 1 мл диализной среды, отобранной в эксперименте «Растворение» (время растворения 60 минут), 9 мл стерильного изотоничного хлорида натрия. Далее 1 мл полученного раствора переносили в пробирку с 9 мл стерильного изотоничного хлорида натрия, получая разведение 1:100 и т.д. Вносили 1 мл жидкой культуры трихомонады в пробирку с 1 мл разведения, оставляли на 1 ч, далее переносили препарат на стекло, микроскопировали, наблюдая за состоянием жгутиков и мембраны. За минимальную ингибирующую концентрацию принимали максимальное разведение, вызывающее остановку движения жгутиков и мембраны 98% микроорганизмов в поле зрения. В качестве стандарта использовали разведения 1%-ного водного раствора субстанции метронидазола, из расчета в одном суппозитории 500 мг, что эквивалентно 1% при 100%-ном высвобождении в 50 мл диализной среды.The study of the antitrichomonas activity of metronidazole was carried out in in vitro experiments. Trichomonas strains in association with bacteria, in particular with E. coli, were cultured on Pavlova's medium, transplanting such cultures every 2-3 days. [Experimental study of the antiprotozoal activity of pharmacological substances (guidelines) / Corr. RAMS T.A. Guskova]. Trichomonas vaginalis isolated from the lesion, reseeding from Pavlova's medium (co-growth with E. coli) into a liquid nutrient medium (MPB). The activity of Trichomonas was checked (at least 80% actively moving), observing a liquid preparation at a magnification of × 1000 with a Lumex microscope. Dilutions were prepared using the decimal method, diluting 1 ml of the dialysis medium selected in the Dissolution experiment (dissolution time 60 minutes), 9 ml of sterile isotonic sodium chloride. Next, 1 ml of the resulting solution was transferred into a test tube with 9 ml of sterile isotonic sodium chloride, obtaining a dilution of 1: 100, etc. 1 ml of Trichomonas liquid culture was introduced into a test tube with 1 ml of dilution, left for 1 h, then the preparation was transferred to glass, microscopic, observing the state of flagella and membranes. For the minimum inhibitory concentration, the maximum dilution was taken, which caused the stoppage of movement of flagella and membranes of 98% of microorganisms in the field of view. Dilutions of 1% aqueous solution of the substance metronidazole were used as a standard, based on 500 mg in one suppository, which is equivalent to 1% with 100% release in 50 ml of dialysis medium.
Исследованию подвергали составы: на дифильной основе метронидазол+натамицин (1), натамицин (2) и метронидазол отдельно (3), на гидрофильной основе метронидазол + натамицин (4), натамицин (5) и метронидазол отдельно (6), препараты «Флагил» (метронидазол) (7) и «Пимафуцин» (8) для сравнения.The compositions were studied: on a diphilic basis, metronidazole + natamycin (1), natamycin (2) and metronidazole separately (3), on a hydrophilic basis, metronidazole + natamycin (4), natamycin (5) and metronidazole separately (6), Flagil preparations (metronidazole) (7) and Pimafucin (8) for comparison.
Из табл.8 следует, что стандарт оказывает тотальное трихомоностатическое действие в разведении 1:1000 (0,001%). Все пробы диализатов оказывают трихомоностатическое действие, наиболее выраженное для комплексных препаратов метронидазол + натамицин. Липофильная основа (Флагил) обладает наименьшей высвобождающей способностью по отношению к метронидазолу - около 10% за 1 ч, гидрофильная и дифильная основы высвобождают за 1 ч примерно одинаковые количества метронидазола - около 50%. Натамицин потенцирует трихомонацидное действие метронидазола. Пимафуцин обладает слабым трихомонацидным эффектом в разведении 1:100.From table 8 it follows that the standard has a total trichomonostatic effect at a dilution of 1: 1000 (0.001%). All dialysate samples have a trichomonostatic effect, most pronounced for complex preparations of metronidazole + natamycin. The lipophilic base (Flagil) has the least releasing ability with respect to metronidazole - about 10% per 1 hour, hydrophilic and diphilic bases release about the same amount of metronidazole in about 1 hour - about 50%. Natamycin potentiates the trichomonacid action of metronidazole. Pimafucin has a weak trichomonacid effect at a dilution of 1: 100.
Активность в отношении патогенной грибковой оценивалась на штаммах Candida utilis в соответствии с методикой ГФ-XI (метод серийных разведений со средой). Пошаговые разведения водных экстрактов из препаратов смешивали с питательной средой, на которую засевали тестовые культуры микроорганизмов. Результаты испытания серийных разведений препарата сравнительно с монопрепаратами натамицина представлены в Табл.9.Pathogenic fungal activity was evaluated on Candida utilis strains in accordance with the GF-XI method (serial dilution method with medium). Stepwise dilutions of aqueous extracts from preparations were mixed with a nutrient medium onto which test cultures of microorganisms were seeded. The test results of serial dilutions of the drug compared with natamycin monopreparations are presented in Table 9.
Очевидно, что по фунгицидной эффективности натамицин в предложенных нами комбинациях не уступает аналогу, проявляя активность в разведении до 31,25 мкг/мл. Метронидазол не влияет на противокандидозную активность натамицина.Obviously, in the fungicidal efficacy of natamycin in the combinations we have proposed, it is not inferior to the analogue, showing activity in dilution to 31.25 μg / ml. Metronidazole does not affect the anti-candidiasis activity of natamycin.
Эффективность в отношении анаэробной бактериальной микрофлоры (метронидазол) рассматривалась на патогенных штаммах Bacteroides и Fusobacterium на базе ФГУ «ВГНКИ».Efficacy against anaerobic bacterial microflora (metronidazole) was examined on pathogenic strains of Bacteroides and Fusobacterium based on FGU VGNKI.
В ходе хранения составы проверялись на отсутствие роста патогенных штаммов согласно методике ГФ-XI по отсутствию роста микроорганизмов групп Pseudomonas, Enterobacteriaceae, Staphylococcus. Составы суспендировали стерильной водой 1:10, выдерживали на ультразвуковой бане для гомогенизации, далее подвергали прямому посеву на специальные питательные среды: тиогликолевую (группа синегнойной палочки), Сабуро (грибы) и МПА (кокки). В течение 1 недели не было отмечено роста колоний микроорганизмов, что свидетельствует о сохранении микробиологической чистоты в течение срока годности.During storage, the compositions were tested for the absence of growth of pathogenic strains according to the GF-XI method for the absence of growth of microorganisms of the groups Pseudomonas, Enterobacteriaceae, Staphylococcus. The compositions were suspended with sterile water 1:10, kept in an ultrasonic bath for homogenization, then they were directly inoculated on special nutrient media: thioglycolic (Pseudomonas aeruginosa group), Saburo (mushrooms) and MPA (cocci). Within 1 week there was no growth of colonies of microorganisms, which indicates the preservation of microbiological purity over the expiration date.
Пример №17 (острая и хроническая токсичность)Example No. 17 (acute and chronic toxicity)
Токсичность препаратов, острая и хроническая, оценивалась на базе Государственного Научного центра по антибиотикам (ФГУП «ГНЦА»). Эксперимент был проведен на крысах чистой линии Wistar при ежедневном ректальном введении по 200 мг суппозиторной массы при одновременном плацебо-контроле (группы по 50 и 10 животных соответственно). [Методические указания по изучению общетоксического действия фармакологических веществ. / Е.В.Арзамасцев, Т.А.Гуськова, И.В.Березовская, Б.И.Любимов и др. - М., 2000.]The toxicity of the drugs, acute and chronic, was evaluated on the basis of the State Scientific Center for Antibiotics (FSUE SSCA). The experiment was conducted on rats of the pure Wistar line with daily rectal administration of 200 mg of suppository mass with simultaneous placebo control (groups of 50 and 10 animals, respectively). [Guidelines for the study of the general toxic effects of pharmacological substances. / E.V. Arzamastsev, T.A. Guskova, I.V. Berezovskaya, B.I. Lyubimov, etc. - M., 2000.]
Оценка влияния препарата производилась на протяжении курса введения - на общее состояние животных, сразу после окончания курса введения и спустя 2 недели - на биохимические показатели крови, картину периферической крови и показатели свертываемости крови, а также проведение морфометрического анализа и патогистологического исследования внутренних органов животных. Опыты проводились на четырех экспериментальных группах крыс по 15 самок и 15 самцов в каждой группе.Evaluation of the effect of the drug was carried out during the course of administration — on the general condition of the animals, immediately after the end of the administration course, and after 2 weeks — on biochemical blood parameters, the picture of peripheral blood and blood coagulability, as well as morphometric analysis and histopathological examination of the internal organs of animals. The experiments were conducted on four experimental groups of rats, 15 females and 15 males in each group.
В эксперименте острой токсичности было установлено, что превышение предполагаемой дозы препарата в 10 раз не ведет к патологическим изменениям в организме.In an acute toxicity experiment, it was found that exceeding the estimated dose of the drug by 10 times does not lead to pathological changes in the body.
В течение 2 недель (исходя из предполагаемого срока терапии 6-9 дней) не было зарегистрировано случаев смерти или острого отравления, биохимические показатели (уровень общего белка, соотношение белковых фракций и общего холестерина сыворотки крови, содержания глюкозы, мочевины, креатинина, а также активность аланин- и аспартат-трансаминаз, щелочной фосфатазы) оставались в норме. Гистологическое исследование органов не выявило отклонений в их строении.No deaths or acute poisoning, biochemical parameters (total protein level, ratio of protein fractions and total serum cholesterol, glucose, urea, creatinine, or activity were recorded within 2 weeks (based on the expected duration of therapy of 6-9 days) alanine and aspartate transaminases, alkaline phosphatase) remained normal. Histological examination of the organs did not reveal abnormalities in their structure.
Изучение местно-раздражающего действия испытуемого препарата производили в экспериментах (введение по схеме, предусмотренной для человека - 6-7 дней, не более). По окончании эксперимента производилась экспертиза состояния слизистой оболочки влагалища.The study of the local irritating effect of the test drug was carried out in experiments (introduction according to the scheme prescribed for humans - 6-7 days, no more). At the end of the experiment, an examination was made of the condition of the vaginal mucosa.
Случаев раздражающего действия отмечено не было, также как и видоизменения эпителия влагалища. Аппликация состава на слизистую оболочку глаза кролика (N=5) также не вызывала раздражения. Было установлено, что разработанные составы в форме суппозиториев не оказывают раздражающего действия.No cases of irritating effects were noted, as well as modifications of the vaginal epithelium. Application of the composition to the mucous membrane of the rabbit eye (N = 5) also did not cause irritation. It was found that the developed formulations in the form of suppositories do not have an irritating effect.
Учитывая дозовый уровень токсического действия, разработанные суппозитории комбинированного состава по степени опасности можно классифицировать как малоопасный препарат (степень токсичности по ГОСТу 12.1.00.7.76-IY), который может быть рекомендован в качестве лекарственного препарата для медицинского применения. Соотношение было установлено экспериментальным путем и является оптимальным по результатам физико-химических, фармакотехнологических и биологических исследований.Given the dose level of toxic effects, the developed suppositories of a combined composition according to the degree of danger can be classified as a low-hazard drug (degree of toxicity according to GOST 12.1.00.7.76-IY), which can be recommended as a medicine for medical use. The ratio was established experimentally and is optimal according to the results of physico-chemical, pharmacotechnological and biological studies.
Таким образом, разработанные составы суппозиториев для интравагинального применения обладают:Thus, the developed suppository formulations for intravaginal use have:
1) биологической безопасностью, проявляющейся в отсутствии раздражающего и токсического действия;1) biological safety, manifested in the absence of irritating and toxic effects;
2) биоцидной эффективностью в отношении специфичных штаммов возбудителей, включая простейших, грибы и анаэробную микрофлору;2) biocidal efficacy against specific strains of pathogens, including protozoa, fungi and anaerobic microflora;
3) высокой дисперсностью и биодоступностью метронидазола и натамицина, сопоставимой с эффективностью монопрепаратов сравнения «Флагил» и «Пимафуцин»;3) the high dispersion and bioavailability of metronidazole and natamycin, comparable with the effectiveness of the monopreparations “Flagil” and “Pimafucin”;
соответствуют требованиям нормативно-технической документации к качеству суппозиториев.meet the requirements of normative and technical documentation for the quality of suppositories.
Claims (12)
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2007127815/15A RU2356535C2 (en) | 2007-07-23 | 2007-07-23 | Synergistic suppositories for infectious gynecopathies treatment (versions) |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2007127815/15A RU2356535C2 (en) | 2007-07-23 | 2007-07-23 | Synergistic suppositories for infectious gynecopathies treatment (versions) |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2007127815A RU2007127815A (en) | 2009-01-27 |
| RU2356535C2 true RU2356535C2 (en) | 2009-05-27 |
Family
ID=40543641
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2007127815/15A RU2356535C2 (en) | 2007-07-23 | 2007-07-23 | Synergistic suppositories for infectious gynecopathies treatment (versions) |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2356535C2 (en) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2011152755A1 (en) * | 2010-06-03 | 2011-12-08 | Общество С Ограниченной Ответственностью "Цитонир" | Pharmaceutical composition for the treatment of disorders of the lower section of the urogenital system |
| EA023024B1 (en) * | 2012-11-23 | 2016-04-29 | Общество с ограниченной ответственностью "НПК "Трифарма" | Pharmaceutical composition containing nalbuphine hydrochloride, use thereof to treat moderate to severe pain and method for producing said pharmaceutical composition |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN116327679A (en) * | 2023-04-23 | 2023-06-27 | 郑州大学第一附属医院 | Ornidazole suppository and preparation method thereof |
-
2007
- 2007-07-23 RU RU2007127815/15A patent/RU2356535C2/en not_active IP Right Cessation
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2011152755A1 (en) * | 2010-06-03 | 2011-12-08 | Общество С Ограниченной Ответственностью "Цитонир" | Pharmaceutical composition for the treatment of disorders of the lower section of the urogenital system |
| EA023024B1 (en) * | 2012-11-23 | 2016-04-29 | Общество с ограниченной ответственностью "НПК "Трифарма" | Pharmaceutical composition containing nalbuphine hydrochloride, use thereof to treat moderate to severe pain and method for producing said pharmaceutical composition |
Also Published As
| Publication number | Publication date |
|---|---|
| RU2007127815A (en) | 2009-01-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US9480678B2 (en) | Antifungal pharmaceutical composition | |
| US20050277634A1 (en) | Liquid composition for veterinary medicine and process for the preparation and use thereof | |
| KR20130050394A (en) | Use of meloxicam formulations in veterinary medicine | |
| US6913759B2 (en) | Gel composition and method for treatment of vaginal infections | |
| CN101273971A (en) | Ethosomes preparation of antimycotics pharmaceutical and method for preparing the same | |
| KR20050084294A (en) | Pharmaceutical compositions of sertaconazole for vaginal use | |
| US9205149B2 (en) | Pharmaceutical topical composition of mupirocin | |
| RU2356535C2 (en) | Synergistic suppositories for infectious gynecopathies treatment (versions) | |
| US11266600B2 (en) | Emulsions for the topical treatment of dermal and mucosal infections | |
| JP2020526512A (en) | New Secnidazole soft gelatin capsule formulation and its use | |
| Phaechamud et al. | Texture and topography analysis of doxycycline hyclate thermosensitive systems comprising zinc oxide | |
| RU2367469C2 (en) | Antibacterial and necrolytic local lisoamidase pharmaceutical composition | |
| CN114209646A (en) | Povidone-iodine temperature-sensitive gel preparation | |
| Su et al. | Thermosensitive hydrogels as a controlled release system for alkannin to improve localized treatment of Candida vaginitis after external beam radiotherapy in vitro and in vivo | |
| RU2730021C1 (en) | Topical agent for treating infectious vaginitis | |
| RU2281102C2 (en) | Pharmaceutical composition possessing anti-allergic and anti-inflammatory effect | |
| KR102658716B1 (en) | Emulsion for topical treatment of skin and mucous membrane infections | |
| RU2329790C1 (en) | Treatment-and-preventive agent of antibacterial and spermicidal action | |
| EA041079B1 (en) | EMULSION FOR TOPICAL TREATMENT OF SKIN AND MUCOSA INFECTIONS | |
| RU2347568C1 (en) | Vaginal pharmaceutical composition and method for its preparation | |
| WO2023203249A1 (en) | Composition comprising cytidine analogs and uses and methods thereof | |
| UA142172U (en) | PHARMACEUTICAL COMPOSITION FOR VAGINAL USE FOR THE TREATMENT OF GYNECOLOGICAL DISEASES | |
| WO2016137352A1 (en) | Pharmaceutical composition for treatment of inflammatory ear diseases, method for producing same and method for treatment using said composition | |
| ES2387440A1 (en) | Topical amphotericin b formulations and production method thereof | |
| Małolepsza-Jarmołowska | Assessment of pharmaceutical properties of gynaecological hydrophilic gels containing lactic acid complexed with chitosan |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20170724 |