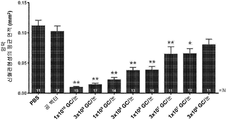
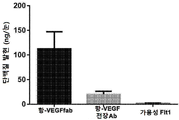
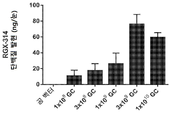
KR20200060456A - 완전-인간 번역후 변형된 항-VEGF Fab를 이용한 안구 질환의 치료 - Google Patents
완전-인간 번역후 변형된 항-VEGF Fab를 이용한 안구 질환의 치료 Download PDFInfo
- Publication number
- KR20200060456A KR20200060456A KR1020207011989A KR20207011989A KR20200060456A KR 20200060456 A KR20200060456 A KR 20200060456A KR 1020207011989 A KR1020207011989 A KR 1020207011989A KR 20207011989 A KR20207011989 A KR 20207011989A KR 20200060456 A KR20200060456 A KR 20200060456A
- Authority
- KR
- South Korea
- Prior art keywords
- antigen
- cells
- binding fragment
- seq
- human subject
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/22—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against growth factors ; against growth regulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F9/00—Methods or devices for treatment of the eyes; Devices for putting-in contact lenses; Devices to correct squinting; Apparatus to guide the blind; Protective devices for the eyes, carried on the body or in the hand
- A61F9/0008—Introducing ophthalmic products into the ocular cavity or retaining products therein
- A61F9/0017—Introducing ophthalmic products into the ocular cavity or retaining products therein implantable in, or in contact with, the eye, e.g. ocular inserts
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0048—Eye, e.g. artificial tears
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M25/00—Catheters; Hollow probes
- A61M25/0067—Catheters; Hollow probes characterised by the distal end, e.g. tips
- A61M25/0082—Catheter tip comprising a tool
- A61M25/0084—Catheter tip comprising a tool being one or more injection needles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M25/00—Catheters; Hollow probes
- A61M25/01—Introducing, guiding, advancing, emplacing or holding catheters
- A61M25/0194—Tunnelling catheters
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M5/00—Devices for bringing media into the body in a subcutaneous, intra-vascular or intramuscular way; Accessories therefor, e.g. filling or cleaning devices, arm-rests
- A61M5/178—Syringes
- A61M5/31—Details
- A61M5/32—Needles; Details of needles pertaining to their connection with syringe or hub; Accessories for bringing the needle into, or holding the needle on, the body; Devices for protection of needles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
- C12N15/86—Viral vectors
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N7/00—Viruses; Bacteriophages; Compositions thereof; Preparation or purification thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/53—DNA (RNA) vaccination
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/54—Medicinal preparations containing antigens or antibodies characterised by the route of administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M25/00—Catheters; Hollow probes
- A61M25/0067—Catheters; Hollow probes characterised by the distal end, e.g. tips
- A61M25/0082—Catheter tip comprising a tool
- A61M25/0084—Catheter tip comprising a tool being one or more injection needles
- A61M2025/0089—Single injection needle protruding axially, i.e. along the longitudinal axis of the catheter, from the distal tip
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M2210/00—Anatomical parts of the body
- A61M2210/06—Head
- A61M2210/0612—Eyes
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/21—Immunoglobulins specific features characterized by taxonomic origin from primates, e.g. man
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/40—Immunoglobulins specific features characterized by post-translational modification
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/40—Immunoglobulins specific features characterized by post-translational modification
- C07K2317/41—Glycosylation, sialylation, or fucosylation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/54—F(ab')2
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/55—Fab or Fab'
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/622—Single chain antibody (scFv)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2750/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssDNA viruses
- C12N2750/00011—Details
- C12N2750/14011—Parvoviridae
- C12N2750/14111—Dependovirus, e.g. adenoassociated viruses
- C12N2750/14141—Use of virus, viral particle or viral elements as a vector
- C12N2750/14143—Use of virus, viral particle or viral elements as a vector viral genome or elements thereof as genetic vector
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2750/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssDNA viruses
- C12N2750/00011—Details
- C12N2750/14011—Parvoviridae
- C12N2750/14111—Dependovirus, e.g. adenoassociated viruses
- C12N2750/14171—Demonstrated in vivo effect
Abstract
인간 혈관 내피 성장 인자("hVEGF")에 대한 완전 인간 번역후 변형된(HuPTM) 단클론 항체("mAb") 또는 mAb의 항원-결합 단편 - 예를 들어, 완전 인간-당화된(HuGly) 항-hVEGF 항원-결합 단편 - 을, 증가된 신혈관형성에 의해 야기된 안구 질환, 예를 들어 "습성" 연령-관련 황반 변성("WAMD")으로도 알려진 신혈관 연령-관련 황반 변성("nAMD"), 연령-관련 황반 변성("AMD"), 및 당뇨 망막병증으로 진단된 인간 대상의 눈(들) 내의 망막/유리체 액에 전달하기 위한 조성물 및 방법이 기재된다.
Description
관련 출원에 대한 교차 참조
본 출원은 2017년 9월 27일자로 출원된 미국 가특허 출원 62/564,095호, 2017년 10월 19일자로 출원된 62/574,657호, 2017년 10월 31일자로 출원된 62/579,682호, 및 2018년 2월 20일자로 출원된 62/632,812호의 우선권을 주장하며, 이들은 그 전체가 본원에 참고로 포함된다.
전자적으로 제출된 서열 목록에 대한 참조
본 출원은 2018년 9월 19일에 생성되고 크기가 97,512 바이트인 "Sequence_Listing_12656-110-228.TXT" 제목의 텍스트 파일로서 본 출원과 함께 제출된 서열 목록을 참고로 포함한다.
1. 도입
혈관 내피 성장 인자(vascular endothelial growth factor)("VEGF")에 대한 완전 인간 번역후 변형된(HuPTM) 단클론 항체("mAb") 또는 mAb의 항원-결합 단편 - 예를 들어, 완전 인간-당화된(HuGly) 항-VEGF 항원-결합 단편 - 을, 안구 질환, 특히 증가된 신혈관형성에 의해 야기된 안구 질환, 예를 들어 "습성" 연령-관련 황반 변성("wet" age-related macular degeneration)("WAMD" 또는 "습성 AMD")으로도 알려진 신혈관 연령-관련 황반 변성("nAMD"), 연령-관련 황반 변성("AMD"), 및 당뇨 망막병증(diabetic retinopathy)으로 진단된 인간 대상체의 눈(들)내의 망막/유리체 액에 전달하기 위한 조성물 및 방법이 기재된다.
2. 발명의 배경
연령-관련 황반 변성(AMD)은 중심 시력의 진행성이고 비가역적이며 심각한 손실을 야기하는 퇴행성 망막 눈 질환이다. 상기 질환은 황반 - 최고 시력(VA)의 영역 -을 손상시키며 60세 이상의 미국인에서 실명의 주요 원인이다(NIH 2008).
신혈관 연령-관련 황반 변성(nAMD)으로도 알려진, AMD의 "습성" 신혈관 형태(WAMD 또는 "습성 AMD")는 AMD 케이스의 15-20%를 차지하며, 다양한 자극에 대한 반응으로 망막신경(neuroretina) 내 및 아래에서의 비정상적인 신혈관형성을 특징으로 한다. 이 비정상적인 혈관 성장은 누수 혈관의 형성 및 종종 출혈뿐 아니라, 정상 망막 구성의 왜곡 및 파괴를 야기한다. 시각 기능은 nAMD에서 심각하게 손상되고, 결국에는 염증 및 흉터가 발병된 망막에서 시각 기능의 영구적인 손실을 야기한다. 궁극적으로는, 광수용기 사멸 및 흉터 형성이 중심 시력의 심각한 손실 및 읽기, 쓰기, 안면 인식 또는 운전 불능을 야기한다. 많은 환자는 더이상 소득을 얻는 일자리를 유지하거나, 일상 활동을 수행할 수 없으며 결과적으로 삶의 질의 감소를 보고한다(Mitchell, 2006).
당뇨 망막병증은 미세동맥류, 경성 삼출물, 출혈 및 비증식성 형태의 정맥 이상 및 신혈관형성, 망막앞 또는 유리체 출혈, 및 증식성 형태의 섬유혈관 증식을 특징으로 하는, 당뇨병의 안구의 합병증이다. 고혈당은 미세혈관 망막 변화를 유도하여, 흐린 시력, 암점 또는 섬광, 및 갑작스러운 시력 손실을 야기한다(Cai & McGinnis, 2016).
예방적 요법은 효과를 거의 입증하지 못하였으며, 치료 전략은 주로 신혈관 병변의 치료에 초점을 맞추었다. nAMD를 위해 이용가능한 치료는 레이저 광응고법, 베르테포르핀을 이용한 광선역학적 요법, 및 혈관 내피 성장 인자("VEGF") - 혈관신생을 자극하는데 관여하며 개입을 위한 표적이 되는 사이토카인 -에 결합하여 중화시키는 것을 목표로 하는 약제를 이용한 유리체내("IVT") 주사를 포함한다. 사용되는 이러한 항-VEGF 약제는 예를 들어, 베바시주맙(CHO 세포에서 생산된 VEGF에 대한 인간화 단클론 항체(mAb)), 라니비주맙(원핵 대장균(E. coli)에서 만들어진 베바시주맙의 친화성-개량 변이체의 Fab 부분), 아플리베르셉트(인간 IgG1의 Fc 부분에 융합된 인간 VEGF-수용체의 세포외 도메인의 VEGF-결합 영역으로 구성된 재조합 융합 단백질), 또는 페갑타닙(VEGF에 결합하는 페길화 앱타머(단일-가닥 핵산 분자))을 포함한다. 이들 요법 각각은 최고 교정 시력(Best-Corrected Visual Acuity)에 대해 일부 효과를 갖지만; 이들의 효과는 시력 회복에서 그리고 지속성에서 제한되는 것으로 나타났다.
항-VEGF IVT 주사는 누수를 감소시키고 때로는 시력 손실을 회복시키는데 있어서 효과적인 것으로 나타났다. 그러나, 이들 약제는 단기간 동안만 효과적이므로, 장기 지속을 위해서는 반복된 주사가 종종 요구되며, 따라서 환자들에게 상당한 치료 부담을 주게 된다. 매월 라니비주맙 또는 매월/8주마다 아플리베르셉트를 이용한 장기 요법은 시력 손실의 진행을 늦추고 시력을 개선할 수 있으나, 이들 치료 중 어느 것도 신혈관형성의 재발을 방지하지 못한다(Brown 2006; Rosenfeld, 2006; Schmidt-Erfurth, 2014). 각각은 질환이 악화되는 것을 예방하기 위해 재투여되어야 한다. 반복 치료의 필요는 환자에게 추가적인 위험을 불러올 수 있으며 환자와 치료하는 의사 둘 다에게 불편하다.
3. 발명의 요약
VEGF에 대한 완전 인간 번역후 변형된(HuPTM) 항체를, 안구 질환, 특히 증가된 신혈관형성에 의해 야기된 안구 질환, 예를 들어 nAMD("습성 AMD"로도 알려짐), 건성 AMD, 망막 정맥 폐쇄(retinal vein occlusion)(RVO), 당뇨병성 황반부종(diabetic macular edema)(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 환자(인간 대상체)의 눈(들)내의 망막/유리체 액에 전달하기 위한 조성물 및 방법이 기재된다. 항체는, 비제한적으로, 단클론 항체, 다클론 항체, 재조합적으로 생산된 항체, 인간 항체, 인간화 항체, 키메라 항체, 합성 항체, 2 개의 중쇄 및 2 개의 경쇄 분자를 포함하는 사량체 항체, 항체 경쇄 단량체, 항체 중쇄 단량체, 항체 경쇄 이량체, 항체 중쇄 이량체, 항체 경쇄-중쇄 쌍, 인트라바디, 이종콘쥬게이트(heteroconjugate) 항체, 1가 항체, 전장 항체의 항원-결합 단편, 및 상기 것의 융합 단백질을 포함한다. 이러한 항원-결합 단편은, 비제한적으로, 단일-도메인 항체(중쇄 가변 도메인 항체(variable domain of heavy chain antibody)(VHH) 또는 나노바디), 전장 항-VEGF 항체(바람직하게는, 전장 항-VEGF 단클론 항체(mAb))의 Fab, F(ab')2, 및 scFv(단일쇄 가변 단편)(본원에서 전체적으로 "항원-결합 단편"으로서 지칭됨)를 포함한다. 바람직한 실시양태에서, VEGF에 대한 완전 인간 번역후 변형된 항체는 VEGF에 대한 단클론 항체(mAb)의 완전 인간 번역후 변형된 항원-결합 단편("HuPTMFabVEGFi")이다. 추가로 바람직한 실시양태에서, HuPTMFabVEGFi는 항-VEGF mAb의 완전 인간 당화된 항원-결합 단편("HuGlyFabVEGFi")이다. 대안적 실시양태에서, 전장 mAb가 사용될 수 있다. 전달은 유전자 요법을 통해 - 예를 들어, 항-VEGF 항원-결합 단편 또는 mAb(또는 초고당화된 유도체)를 코딩하는 바이러스 벡터 또는 다른 DNA 발현 구조체를 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)로 진단된 환자(인간 대상체)의 눈(들) 내의 맥락막상 공간, 망막하 공간(경유리체 접근법(transvitreal approach)으로부터 또는 맥락막상 공간을 통해 카테터로), 망막내 공간, 및/또는 공막 외면(즉, 공막옆 투여)에 투여하여, 인간 PTM, 예를 들어 인간-당화된, 전이유전자 산물을 연속적으로 공급하는 영구적 저장소(depot)를 눈에서 생성함으로써 이루어질 수 있다. 바람직한 실시양태에서, 본원에 제공된 방법은 습성 AMD로 진단된 환자(인간 대상체)에서 사용된다.
본원은 인간 망막 세포에 의해 생산된, 항-인간 혈관 내피 성장 인자(hVEGF) 항체, 예를 들어 항-hVEGF 항원-결합 단편을 기재한다. 인간 VEGF(hVEGF)는 VEGF(VEGFA, VEGFB, VEGFC, 또는 VEGFD) 유전자에 의해 코딩된 인간 단백질이다. hVEGF의 예시적인 아미노산 서열은 젠뱅크(GenBank) 기탁 번호 AAA35789.1에서 찾을 수 있다. hVEGF의 예시적인 핵산 서열은 젠뱅크 기탁 번호 M32977.1에서 찾을 수 있다.
특정 양태에서, 본원은 인간 망막 세포에 의해 생산된 항-hVEGF 항원-결합 단편의 치료적 유효량을 인간 대상체의 망막에 전달하는 것을 포함하는, 신혈관 연령-관련 황반 변성(nAMD)(습성 AMD 또는 WAMD로도 알려짐), 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 양태에서, 본원은 항-hVEGF 항원-결합 단편을 코딩하는 발현 벡터를 인간 대상체의 눈 내의 맥락막상 공간, 망막하 공간, 또는 공막 외면에 투여함으로써(예를 들어, 맥락막상 주사에 의해(예를 들어, 맥락막상 약물 전달 장치, 예컨대 미세바늘이 있는 미량주사기를 통함), 경유리체 접근법을 통한 망막하 주사(외과적 수술(surgical procedure)), 맥락막상 공간을 통한 망막하 투여(예를 들어, 소형 바늘이 망막하 공간 내로 주사되는, 후극을 향해 맥락막상 공간을 통해 삽입되고 뚫릴 수 있는 카테터를 포함하는 망막하 약물 전달 장치를 통한 외과적 수술), 또는 후방 공막옆 데포(depot) 수술(예를 들어, 팁(tip)이 공막 표면에 대해 직접 병치(direct apposition)로 삽입되고 유지될 수 있는 캐뉼라를 포함하는 공막옆(juxtascleral) 약물 전달 장치를 통함)에 의함), 인간 망막 세포에 의해 생산된 항-hVEGF 항원-결합 단편의 치료적 유효량을 인간 대상체의 망막에 전달하는 것을 포함하는, nAMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 양태에서, 본원은 맥락막상 약물 전달 장치, 예컨대 미량주사기의 사용에 의해, 인간 망막 세포에 의해 생산된 항-hVEGF 항원-결합 단편의 치료적 유효량을 인간 대상체의 망막에 전달하는 것을 포함하는, nAMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 양태에서, 본원은 인간 망막 세포에 의해 생산된 항-hVEGF 항원-결합 단편의 치료적 유효량을 인간 대상체의 망막에 전달하는 것을 포함하되, 인간 대상체가 ≤20/20 및 ≥20/400인 최고 교정 시력(BCVA)을 갖는, 신혈관 연령-관련 황반 변성(nAMD), 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다.
특정 양태에서, 본원은 외경계막 내의 인간 광수용기 세포(예를 들어, 원뿔 세포 및/또는 간상 세포), 수평 세포, 양극 세포, 아마크린 세포, 망막 신경절 세포(예를 들어, 난쟁이 세포, 양산 세포, 이중층 세포, 거대 망막 신경절 세포, 감광성 신경절 세포, 및/또는 뮬러() 교세포), 및/또는 망막 색소 상피 세포에 의해 생산된 항-hVEGF 항원-결합 단편의 치료적 유효량을 인간 대상체의 망막에 전달하는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 양태에서, 본원은 항-hVEGF 항원-결합 단편을 코딩하는 발현 벡터를 인간 대상체의 눈 내의 맥락막상 공간, 망막하 공간, 또는 공막 외면에 투여함으로써(예를 들어, 맥락막상 주사(예를 들어, 맥락막상 약물 전달 장치, 예컨대 미세바늘이 있는 미량주사기를 통함), 경유리체 접근법을 통한 망막하 주사(외과적 수술), 맥락막상 공간을 통한 망막하 투여(예를 들어, 소형 바늘이 망막하 공간 내로 주사되는, 후극을 향해 맥락막상 공간을 통해 삽입되고 뚫릴 수 있는 카테터를 포함하는 망막하 약물 전달 장치를 통한 외과적 수술), 또는 후방 공막옆 데포 수술(예를 들어, 팁이 공막 표면에 대해 직접 병치로 삽입되고 유지될 수 있는 캐뉼라를 포함하는 공막옆 약물 전달 장치를 통함)에 의함), 외경계막 내의 인간 광수용기 세포(예를 들어, 원뿔 세포 및/또는 간상 세포), 수평 세포, 양극 세포, 아마크린 세포, 망막 신경절 세포(예를 들어, 난쟁이 세포, 양산 세포, 이중층 세포, 거대 망막 신경절 세포, 감광성 신경절 세포, 및/또는 뮬러 교세포), 및/또는 망막 색소 상피 세포에 의해 생산된 항-hVEGF 항원-결합 단편의 치료적 유효량을 인간 대상체의 망막에 전달하는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 양태에서, 본원은 맥락막상 약물 전달 장치, 예컨대 미량주사기의 사용에 의해, 외경계막 내의 인간 광수용기 세포(예를 들어, 원뿔 세포 및/또는 간상 세포), 수평 세포, 양극 세포, 아마크린 세포, 망막 신경절 세포(예를 들어, 난쟁이 세포, 양산 세포, 이중층 세포, 거대 망막 신경절 세포, 감광성 신경절 세포, 및/또는 뮬러 교세포), 및/또는 망막 색소 상피 세포에 의해 생산된 항-hVEGF 항원-결합 단편의 치료적 유효량을 인간 대상체의 망막에 전달하는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 양태에서, 본원은 외경계막 내의 인간 광수용기 세포(예를 들어, 원뿔 세포 및/또는 간상 세포), 수평 세포, 양극 세포, 아마크린 세포, 망막 신경절 세포(예를 들어, 난쟁이 세포, 양산 세포, 이중층 세포, 거대 망막 신경절 세포, 감광성 신경절 세포, 및/또는 뮬러 교세포), 및/또는 망막 색소 상피 세포에 의해 생산된 항-hVEGF 항원-결합 단편의 치료적 유효량을 인간 대상체의 망막에 전달하는 것을 포함하되, 인간 대상체가 ≤20/20 및 ≥20/400인 BCVA를 갖는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다.
특정 양태에서, 본원은 인간 망막 세포에 의해 생산된 항-hVEGF 항원-결합 단편의 치료적 유효량을 인간 대상체의 눈에 전달하는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 양태에서, 본원은 항-hVEGF 항원-결합 단편을 코딩하는 발현 벡터를 인간 대상체의 눈 내의 맥락막상 공간, 망막하 공간, 또는 공막 외면에 투여함으로써(예를 들어, 맥락막상 주사(예를 들어, 맥락막상 약물 전달 장치, 예컨대 미세바늘이 있는 미량주사기를 통함), 경유리체 접근법을 통한 망막하 주사(외과적 수술), 맥락막상 공간을 통한 망막하 투여(예를 들어, 소형 바늘이 망막하 공간 내로 주사되는, 후극을 향해 맥락막상 공간을 통해 삽입되고 뚫릴 수 있는 카테터를 포함하는 망막하 약물 전달 장치를 통한 외과적 수술), 또는 후방 공막옆 데포 수술(예를 들어, 팁이 공막 표면에 대해 직접 병치로 삽입되고 유지될 수 있는 캐뉼라를 포함하는 공막옆 약물 전달 장치를 통함)에 의함), 인간 망막 세포에 의해 생산된 항-hVEGF 항원-결합 단편의 치료적 유효량을 인간 대상체의 눈에 전달하는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 양태에서, 본원은 맥락막상 약물 전달 장치, 예컨대 미량주사기의 사용에 의해, 인간 망막 세포에 의해 생산된 항-hVEGF 항원-결합 단편의 치료적 유효량을 인간 대상체의 눈에 전달하는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 양태에서, 본원은 인간 망막 세포에 의해 생산된 항-hVEGF 항원-결합 단편의 치료적 유효량을 인간 대상체의 눈에 전달하는 것을 포함하되, 인간 대상체가 ≤20/20 및 ≥20/400인 BCVA를 갖는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다.
특정 양태에서, 본원은 외경계막 내의 인간 광수용기 세포(예를 들어, 원뿔 세포 및/또는 간상 세포), 수평 세포, 양극 세포, 아마크린 세포, 망막 신경절 세포(예를 들어, 난쟁이 세포, 양산 세포, 이중층 세포, 거대 망막 신경절 세포, 감광성 신경절 세포, 및/또는 뮬러 교세포), 및/또는 망막 색소 상피 세포에 의해 생산된 항-hVEGF 항원-결합 단편의 치료적 유효량을 인간 대상체의 눈에 전달하는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 양태에서, 본원은 항-hVEGF 항원-결합 단편을 코딩하는 발현 벡터를 인간 대상체의 눈 내의 맥락막상 공간, 망막하 공간, 또는 공막 외면에 투여함으로써(예를 들어, 맥락막상 주사(예를 들어, 맥락막상 약물 전달 장치, 예컨대 미세바늘이 있는 미량주사기를 통함), 경유리체 접근법을 통한 망막하 주사(외과적 수술), 맥락막상 공간을 통한 망막하 투여(예를 들어, 소형 바늘이 망막하 공간 내로 주사되는, 후극을 향해 맥락막상 공간을 통해 삽입되고 뚫릴 수 있는 카테터를 포함하는 망막하 약물 전달 장치를 통한 외과적 수술), 또는 후방 공막옆 데포 수술(예를 들어, 팁이 공막 표면에 대해 직접 병치로 삽입되고 유지될 수 있는 캐뉼라를 포함하는 공막옆 약물 전달 장치를 통함)에 의함), 외경계막 내의 인간 광수용기 세포(예를 들어, 원뿔 세포 및/또는 간상 세포), 수평 세포, 양극 세포, 아마크린 세포, 망막 신경절 세포(예를 들어, 난쟁이 세포, 양산 세포, 이중층 세포, 거대 망막 신경절 세포, 감광성 신경절 세포, 및/또는 뮬러 교세포), 및/또는 망막 색소 상피 세포에 의해 생산된 항-hVEGF 항원-결합 단편의 치료적 유효량을 인간 대상체의 눈에 전달하는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 양태에서, 본원은 맥락막상 약물 전달 장치, 예컨대 미량주사기의 사용에 의해, 외경계막 내의 인간 광수용기 세포(예를 들어, 원뿔 세포 및/또는 간상 세포), 수평 세포, 양극 세포, 아마크린 세포, 망막 신경절 세포(예를 들어, 난쟁이 세포, 양산 세포, 이중층 세포, 거대 망막 신경절 세포, 감광성 신경절 세포, 및/또는 뮬러 교세포), 및/또는 망막 색소 상피 세포에 의해 생산된 항-hVEGF 항원-결합 단편의 치료적 유효량을 인간 대상체의 눈에 전달하는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 양태에서, 본원은 외경계막 내의 인간 광수용기 세포(예를 들어, 원뿔 세포 및/또는 간상 세포), 수평 세포, 양극 세포, 아마크린 세포, 망막 신경절 세포(예를 들어, 난쟁이 세포, 양산 세포, 이중층 세포, 거대 망막 신경절 세포, 감광성 신경절 세포, 및/또는 뮬러 교세포), 및/또는 망막 색소 상피 세포에 의해 생산된 항-hVEGF 항원-결합 단편의 치료적 유효량을 인간 대상체의 눈에 전달하는 것을 포함하되, 인간 대상체가 ≤20/20 및 ≥20/400인 BCVA를 갖는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다.
본원에 기재된 방법의 특정 양태에서, 항원-결합 단편은 서열번호 1 또는 서열번호 3의 아미노산 서열을 포함하는 중쇄, 및 서열번호 2, 또는 서열번호 4의 아미노산 서열을 포함하는 경쇄를 포함한다.
본원에 기재된 방법의 일부 양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 17-19 또는 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함한다.
본원에 기재된 방법의 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyroglutamation)(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 경쇄 CDR1의 제8 및 제11 아미노산 잔기(즉, SASQDISNYLN(서열번호 14) 내의 2 개의 N) 각각은 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 아세틸화되지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 경쇄 CDR1의 제8 및 제11 아미노산 잔기(즉, SASQDISNYLN(서열번호 14) 내의 2 개의 N) 각각은 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 아세틸화되지 않는다. 바람직한 실시양태에서, 본원에 기재된 화학적 변형(들) 또는 (경우에 따라) 화학적 변형(들)의 결여는 질량 분광법에 의해 결정된다.
본원에 기재된 방법의 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 중쇄 CDR1의 제9 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 M)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 중쇄 CDR2의 제3 아미노산 잔기(즉, WINTYTGEPTYAADFKR(서열번호 18) 내의 N)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하며, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 아세틸화되지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 중쇄 CDR1의 제9 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 M)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 중쇄 CDR2의 제3 아미노산 잔기(즉, WINTYTGEPTYAADFKR(서열번호 18) 내의 N)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하며, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 아세틸화되지 않는다. 바람직한 실시양태에서, 본원에 기재된 화학적 변형(들) 또는 (경우에 따라) 화학적 변형(들)의 결여는 질량 분광법에 의해 결정된다.
본원에 기재된 방법의 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않고, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, (1) 중쇄 CDR1의 제9 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 M)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 중쇄 CDR2의 제3 아미노산 잔기(즉, WINTYTGEPTYAADFKR(서열번호 18) 내의 N)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하며, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않고; (2) 경쇄 CDR1의 제8 및 제11 아미노산 잔기(즉, SASQDISNYLN(서열번호 14) 내의 2 개의 N) 각각은 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 아세틸화되지 않고, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 아세틸화되지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, (1) 중쇄 CDR1의 제9 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 M)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 중쇄 CDR2의 제3 아미노산 잔기(즉, WINTYTGEPTYAADFKR(서열번호 18) 내의 N)은 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하며, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 아세틸화되지 않고; (2) 경쇄 CDR1의 제8 및 제11 아미노산 잔기(즉, SASQDISNYLN(서열번호 14) 내의 2 개의 N) 각각은 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 아세틸화되지 않는다. 바람직한 실시양태에서, 본원에 기재된 화학적 변형(들) 또는 (경우에 따라) 화학적 변형(들)의 결여는 질량 분광법에 의해 결정된다.
특정 양태에서, 본원은 인간 망막 세포에 의해 생산된 항-hVEGF 항체의 치료적 유효량을 인간 대상체의 눈에 전달하는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 양태에서, 본원은 항-hVEGF 항체를 코딩하는 발현 벡터를 인간 대상체의 눈 내의 맥락막상 공간, 망막하 공간, 또는 공막 외면에 투여함으로써(예를 들어, 맥락막상 주사(예를 들어, 맥락막상 약물 전달 장치, 예컨대 미세바늘이 있는 미량주사기를 통함), 경유리체 접근법을 통한 망막하 주사(외과적 수술), 맥락막상 공간을 통한 망막하 투여(예를 들어, 소형 바늘이 망막하 공간 내로 주사되는, 후극을 향해 맥락막상 공간을 통해 삽입되고 뚫릴 수 있는 카테터를 포함하는 망막하 약물 전달 장치를 통한 외과적 수술), 또는 후방 공막옆 데포 수술(예를 들어, 팁이 공막 표면에 대해 직접 병치로 삽입되고 유지될 수 있는 캐뉼라를 포함하는 공막옆 약물 전달 장치를 통함)에 의함), 인간 망막 세포에 의해 생산된 항-hVEGF 항체의 치료적 유효량을 인간 대상체의 눈에 전달하는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 양태에서, 본원은 맥락막상 약물 전달 장치, 예컨대 미량주사기의 사용에 의해, 인간 망막 세포에 의해 생산된 항-hVEGF 항체의 치료적 유효량을 인간 대상체의 눈에 전달하는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 양태에서, 본원은 인간 망막 세포에 의해 생산된 항-hVEGF 항체의 치료적 유효량을 인간 대상체의 눈에 전달하는 것을 포함하되, 인간 대상체가 ≤20/20 및 ≥20/400인 BCVA를 갖는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다.
특정 양태에서, 본원은 외경계막 내의 인간 광수용기 세포(예를 들어, 원뿔 세포 및/또는 간상 세포), 수평 세포, 양극 세포, 아마크린 세포, 망막 신경절 세포(예를 들어, 난쟁이 세포, 양산 세포, 이중층 세포, 거대 망막 신경절 세포, 감광성 신경절 세포, 및/또는 뮬러 교세포), 및/또는 망막 색소 상피 세포에 의해 생산된 항-hVEGF 항체의 치료적 유효량을 인간 대상체의 눈에 전달하는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 양태에서, 본원은 항-hVEGF 항체를 코딩하는 발현 벡터를 인간 대상체의 눈 내의 맥락막상 공간, 망막하 공간, 또는 공막 외면에 투여함으로써(예를 들어, 맥락막상 주사(예를 들어, 맥락막상 약물 전달 장치, 예컨대 미세바늘이 있는 미량주사기를 통함), 경유리체 접근법을 통한 망막하 주사(외과적 수술), 맥락막상 공간을 통한 망막하 투여(예를 들어, 소형 바늘이 망막하 공간 내로 주사되는, 후극을 향해 맥락막상 공간을 통해 삽입되고 뚫릴 수 있는 카테터를 포함하는 망막하 약물 전달 장치를 통한 외과적 수술), 또는 후방 공막옆 데포 수술(예를 들어, 팁이 공막 표면에 대해 직접 병치로 삽입되고 유지될 수 있는 캐뉼라를 포함하는 공막옆 약물 전달 장치를 통함)에 의함), 외경계막 내의 인간 광수용기 세포(예를 들어, 원뿔 세포 및/또는 간상 세포), 수평 세포, 양극 세포, 아마크린 세포, 망막 신경절 세포(예를 들어, 난쟁이 세포, 양산 세포, 이중층 세포, 거대 망막 신경절 세포, 감광성 신경절 세포, 및/또는 뮬러 교세포), 및/또는 망막 색소 상피 세포에 의해 생산된 항-hVEGF 항체의 치료적 유효량을 인간 대상체의 눈에 전달하는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 양태에서, 본원은 맥락막상 약물 전달 장치, 예컨대 미량주사기의 사용에 의해, 외경계막 내의 인간 광수용기 세포(예를 들어, 원뿔 세포 및/또는 간상 세포), 수평 세포, 양극 세포, 아마크린 세포, 망막 신경절 세포(예를 들어, 난쟁이 세포, 양산 세포, 이중층 세포, 거대 망막 신경절 세포, 감광성 신경절 세포, 및/또는 뮬러 교세포), 및/또는 망막 색소 상피 세포에 의해 생산된 항-hVEGF 항체의 치료적 유효량을 인간 대상체의 눈에 전달하는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 양태에서, 본원은 외경계막 내의 인간 광수용기 세포(예를 들어, 원뿔 세포 및/또는 간상 세포), 수평 세포, 양극 세포, 아마크린 세포, 망막 신경절 세포(예를 들어, 난쟁이 세포, 양산 세포, 이중층 세포, 거대 망막 신경절 세포, 감광성 신경절 세포, 및/또는 뮬러 교세포), 및/또는 망막 색소 상피 세포에 의해 생산된 항-hVEGF 항체의 치료적 유효량을 인간 대상체의 눈에 전달하는 것을 포함하되, 인간 대상체가 ≤20/20 및 ≥20/400인 BCVA를 갖는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다.
특정 양태에서, 본원은 인간 망막 세포에 의해 생산된 항-hVEGF 항체의 치료적 유효량을 인간 대상체의 망막에 전달하는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 양태에서, 본원은 항-hVEGF 항체를 코딩하는 발현 벡터를 인간 대상체의 눈 내의 맥락막상 공간, 망막하 공간, 또는 공막 외면에 투여함으로써(예를 들어, 맥락막상 주사(예를 들어, 맥락막상 약물 전달 장치, 예컨대 미세바늘이 있는 미량주사기를 통함), 경유리체 접근법을 통한 망막하 주사(외과적 수술), 맥락막상 공간을 통한 망막하 투여(예를 들어, 소형 바늘이 망막하 공간 내로 주사되는, 후극을 향해 맥락막상 공간을 통해 삽입되고 뚫릴 수 있는 카테터를 포함하는 망막하 약물 전달 장치를 통한 외과적 수술), 또는 후방 공막옆 데포 수술(예를 들어, 팁이 공막 표면에 대해 직접 병치로 삽입되고 유지될 수 있는 캐뉼라를 포함하는 공막옆 약물 전달 장치를 통함)에 의함), 인간 망막 세포에 의해 생산된 항-hVEGF 항체의 치료적 유효량을 인간 대상체의 망막에 전달하는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 양태에서, 본원은 맥락막상 약물 전달 장치, 예컨대 미량주사기의 사용에 의해, 인간 망막 세포에 의해 생산된 항-hVEGF 항체의 치료적 유효량을 인간 대상체의 망막에 전달하는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 양태에서, 본원은 인간 망막 세포에 의해 생산된 항-hVEGF 항체의 치료적 유효량을 인간 대상체의 망막에 전달하는 것을 포함하되, 인간 대상체가 ≤20/20 및 ≥20/400인 BCVA를 갖는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다.
특정 양태에서, 본원은 외경계막 내의 인간 광수용기 세포(예를 들어, 원뿔 세포 및/또는 간상 세포), 수평 세포, 양극 세포, 아마크린 세포, 망막 신경절 세포(예를 들어, 난쟁이 세포, 양산 세포, 이중층 세포, 거대 망막 신경절 세포, 감광성 신경절 세포, 및/또는 뮬러 교세포), 및/또는 망막 색소 상피 세포에 의해 생산된 항-hVEGF 항체의 치료적 유효량을 인간 대상체의 망막에 전달하는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 양태에서, 본원은 항-hVEGF 항체를 코딩하는 발현 벡터를 인간 대상체의 눈 내의 맥락막상 공간, 망막하 공간, 또는 공막 외면에 투여함으로써(예를 들어, 맥락막상 주사(예를 들어, 맥락막상 약물 전달 장치, 예컨대 미세바늘이 있는 미량주사기를 통함), 경유리체 접근법을 통한 망막하 주사(외과적 수술), 맥락막상 공간을 통한 망막하 투여(예를 들어, 소형 바늘이 망막하 공간 내로 주사되는, 후극을 향해 맥락막상 공간을 통해 삽입되고 뚫릴 수 있는 카테터를 포함하는 망막하 약물 전달 장치를 통한 외과적 수술), 또는 후방 공막옆 데포 수술(예를 들어, 팁이 공막 표면에 대해 직접 병치로 삽입되고 유지될 수 있는 캐뉼라를 포함하는 공막옆 약물 전달 장치를 통함)에 의함), 외경계막 내의 인간 광수용기 세포(예를 들어, 원뿔 세포 및/또는 간상 세포), 수평 세포, 양극 세포, 아마크린 세포, 망막 신경절 세포(예를 들어, 난쟁이 세포, 양산 세포, 이중층 세포, 거대 망막 신경절 세포, 감광성 신경절 세포, 및/또는 뮬러 교세포), 및/또는 망막 색소 상피 세포에 의해 생산된 항-hVEGF 항체의 치료적 유효량을 인간 대상체의 망막에 전달하는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 양태에서, 본원은 맥락막상 약물 전달 장치, 예컨대 미량주사기의 사용에 의해, 외경계막 내의 인간 광수용기 세포(예를 들어, 원뿔 세포 및/또는 간상 세포), 수평 세포, 양극 세포, 아마크린 세포, 망막 신경절 세포(예를 들어, 난쟁이 세포, 양산 세포, 이중층 세포, 거대 망막 신경절 세포, 감광성 신경절 세포, 및/또는 뮬러 교세포), 및/또는 망막 색소 상피 세포에 의해 생산된 항-hVEGF 항체의 치료적 유효량을 인간 대상체의 망막에 전달하는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 양태에서, 본원은 외경계막 내의 인간 광수용기 세포(예를 들어, 원뿔 세포 및/또는 간상 세포), 수평 세포, 양극 세포, 아마크린 세포, 망막 신경절 세포(예를 들어, 난쟁이 세포, 양산 세포, 이중층 세포, 거대 망막 신경절 세포, 감광성 신경절 세포, 및/또는 뮬러 교세포), 및/또는 망막 색소 상피 세포에 의해 생산된 항-hVEGF 항체의 치료적 유효량을 인간 대상체의 망막에 전달하는 것을 포함하되, 인간 대상체가 ≤20/20 및 ≥20/400인 BCVA를 갖는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다.
본원에 기재된 방법의 특정 양태에서, 항체는 서열번호 1 또는 서열번호 3의 아미노산 서열을 포함하는 중쇄, 및 서열번호 2, 또는 서열번호 4의 아미노산 서열을 포함하는 경쇄를 포함한다.
본원에 기재된 방법의 특정 양태에서, 항체는 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 17-19 또는 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함한다.
본원에 기재된 방법의 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 경쇄 CDR1의 제8 및 제11 아미노산 잔기(즉, SASQDISNYLN(서열번호 14) 내의 2 개의 N) 각각은 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 아세틸화되지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 경쇄 CDR1의 제8 및 제11 아미노산 잔기(즉, SASQDISNYLN(서열번호 14) 내의 2 개의 N) 각각은 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 아세틸화되지 않는다. 바람직한 실시양태에서, 본원에 기재된 화학적 변형(들) 또는 (경우에 따라) 화학적 변형(들)의 결여는 질량 분광법에 의해 결정된다.
본원에 기재된 방법의 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 중쇄 CDR1의 제9 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 M)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 중쇄 CDR2의 제3 아미노산 잔기(즉, WINTYTGEPTYAADFKR(서열번호 18) 내의 N)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하며, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 아세틸화되지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 중쇄 CDR1의 제9 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 M)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 중쇄 CDR2의 제3 아미노산 잔기(즉, WINTYTGEPTYAADFKR(서열번호 18) 내의 N)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하며, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 아세틸화되지 않는다. 바람직한 실시양태에서, 본원에 기재된 화학적 변형(들) 또는 (경우에 따라) 화학적 변형(들)의 결여는 질량 분광법에 의해 결정된다.
본원에 기재된 방법의 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않고, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, (1) 중쇄 CDR1의 제9 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 M)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 중쇄 CDR2의 제3 아미노산 잔기(즉, WINTYTGEPTYAADFKR(서열번호 18) 내의 N)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하며, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않고; (2) 경쇄 CDR1의 제8 및 제11 아미노산 잔기(즉, SASQDISNYLN(서열번호 14) 내의 2 개의 N) 각각은 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 아세틸화되지 않고, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 아세틸화되지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, (1) 중쇄 CDR1의 제9 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 M)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 중쇄 CDR2의 제3 아미노산 잔기(즉, WINTYTGEPTYAADFKR(서열번호 18) 내의 N)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하며, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 아세틸화되지 않고; (2) 경쇄 CDR1의 제8 및 제11 아미노산 잔기(즉, SASQDISNYLN(서열번호 14) 내의 2 개의 N) 각각은 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 아세틸화되지 않는다. 바람직한 실시양태에서, 본원에 기재된 화학적 변형(들) 또는 (경우에 따라) 화학적 변형(들)의 결여는 질량 분광법에 의해 결정된다.
특정 양태에서, 본원은 hVEGF에 대한 mAb의 항원-결합 단편의 치료적 유효량(상기 항원-결합 단편은 α2,6-시알화 글리칸을 함유함)을 인간 대상체의 눈에 전달하는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 양태에서, 본원은 hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 발현 벡터를 인간 대상체의 눈 내의 맥락막상 공간, 망막하 공간, 또는 공막 외면에 투여함으로써(예를 들어, 맥락막상 주사(예를 들어, 맥락막상 약물 전달 장치, 예컨대 미세바늘이 있는 미량주사기를 통함), 경유리체 접근법을 통한 망막하 주사(외과적 수술), 맥락막상 공간을 통한 망막하 투여(예를 들어, 소형 바늘이 망막하 공간 내로 주사되는, 후극을 향해 맥락막상 공간을 통해 삽입되고 뚫릴 수 있는 카테터를 포함하는 망막하 약물 전달 장치를 통한 외과적 수술), 또는 후방 공막옆 데포 수술(예를 들어, 팁이 공막 표면에 대해 직접 병치로 삽입되고 유지될 수 있는 캐뉼라를 포함하는 공막옆 약물 전달 장치를 통함)에 의함), hVEGF에 대한 mAb의 항원-결합 단편의 치료적 유효량(상기 항원-결합 단편은 α2,6-시알화 글리칸을 함유함)을 인간 대상체의 눈에 전달하는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 양태에서, 본원은 맥락막상 약물 전달 장치, 예컨대 미량주사기의 사용에 의해, hVEGF에 대한 mAb의 항원-결합 단편의 치료적 유효량(상기 항원-결합 단편은 α2,6-시알화 글리칸을 함유함)을 인간 대상체의 눈에 전달하는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 양태에서, 본원은 hVEGF에 대한 mAb의 항원-결합 단편의 치료적 유효량(상기 항원-결합 단편은 α2,6-시알화 글리칸을 함유함)을 인간 대상체의 눈에 전달하는 것을 포함하되, 인간 대상체가 ≤20/20 및 ≥20/400인 BCVA를 갖는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다.
특정 양태에서, 본원은 hVEGF에 대한 mAb의 당화된 항원-결합 단편의 치료적 유효량을 인간 대상체의 눈에 전달하는 것을 포함하되, 상기 항원-결합이 검출가능한 NeuGc 및/또는 α-Gal 항원(즉, 본원에 사용된 바와 같이, "검출가능한"은 하기에 기재된 표준 에세이(assay)에 의해 검출가능한 수준을 의미함)을 함유하지 않는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 실시양태에서, 본원은 hVEGF에 대한 mAb의 당화된 항원-결합 단편을 코딩하는 발현 벡터를 인간 대상체의 눈 내의 맥락막상 공간, 망막하 공간, 또는 공막 외면에 투여함으로써(예를 들어, 맥락막상 주사(예를 들어, 맥락막상 약물 전달 장치, 예컨대 미세바늘이 있는 미량주사기를 통함), 경유리체 접근법을 통한 망막하 주사(외과적 수술), 맥락막상 공간을 통한 망막하 투여(예를 들어, 소형 바늘이 망막하 공간 내로 주사되는, 후극을 향해 맥락막상 공간을 통해 삽입되고 뚫릴 수 있는 카테터를 포함하는 망막하 약물 전달 장치를 통한 외과적 수술), 또는 후방 공막옆 데포 수술(예를 들어, 팁이 공막 표면에 대해 직접 병치로 삽입되고 유지될 수 있는 캐뉼라를 포함하는 공막옆 약물 전달 장치를 통함)에 의함), hVEGF에 대한 mAb의 당화된 항원-결합 단편의 치료적 유효량을 인간 대상체의 눈에 전달하는 것을 포함하되, 상기 항원-결합 단편이 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 실시양태에서, 본원은 맥락막상 약물 전달 장치, 예컨대 미량주사기에 의해, hVEGF에 대한 mAb의 당화된 항원-결합 단편의 치료적 유효량을 인간 대상체의 눈에 전달하는 것을 포함하되, 상기 항원-결합 단편이 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 양태에서, 본원은 hVEGF에 대한 mAb의 당화된 항원-결합 단편의 치료적 유효량을 인간 대상체의 눈에 전달하는 것을 포함하되, 상기 항원-결합 단편이 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않고, 인간 대상체가 ≤20/20 및 ≥20/400인 BCVA를 갖는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다.
특정 양태에서, 본원은 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재하되, 상기 방법은 hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 발현 벡터를 상기 인간 대상체의 눈 내의 맥락막상 공간, 망막하 공간, 또는 공막 외면에 투여하는 것(예를 들어, 맥락막상 주사, 경유리체 접근법을 통한 망막하 주사(외과적 수술), 맥락막상 공간을 통한 망막하 투여, 또는 후방 공막옆 데포 수술에 의함)을 포함하고, 상기 항원-결합 단편의 발현은 인간, 불멸화 망막-유래 세포 내의 상기 발현 벡터로부터의 발현시 α2,6-시알화된다. 구체적 실시양태에서, 투여 단계는 맥락막상 약물 전달 장치, 예컨대 미량주사기의 사용을 포함한다. 구체적 양태에서, 본원은 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재하되, 상기 방법은 hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 발현 벡터를 상기 인간 대상체의 눈 내의 맥락막상 공간, 망막하 공간, 또는 공막 외면에 투여하는 것(예를 들어, 맥락막상 주사, 경유리체 접근법을 통한 망막하 주사(외과적 수술), 맥락막상 공간을 통한 망막하 투여), 또는 후방 공막옆 데포 수술에 의함)을 포함하고, 상기 항원-결합 단편의 발현은 인간, 불멸화 망막-유래 세포 내의 상기 발현 벡터로부터의 발현시 α2,6-시알화되며, 인간 대상체는 ≤20/20 및 ≥20/400인 BCVA를 갖는다. 구체적 실시양태에서, 투여 단계는 맥락막상 약물 전달 장치, 예컨대 미량주사기의 사용을 포함한다.
특정 양태에서, 본원은 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재하되, 상기 방법은 hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 발현 벡터를 상기 인간 대상체의 눈 내의 맥락막상 공간을 통해 상기 인간 대상체의 망막에 투여 또는 전달하는 것(예를 들어, 맥락막상 약물 전달 장치, 예컨대 미세바늘이 있는 미량주사기를 통함)을 포함하고, 상기 항원-결합 단편의 발현은 인간, 불멸화 망막-유래 세포 내의 상기 발현 벡터로부터의 발현시 α2,6-시알화된다. 구체적 양태에서, 본원은 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재하되, 상기 방법은 hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 발현 벡터를 상기 인간 대상체의 눈 내의 맥락막상 공간을 통해 상기 인간 대상체의 망막에 투여 또는 전달하는 것(예를 들어, 맥락막상 약물 전달 장치, 예컨대 미세바늘이 있는 미량주사기를 통함)을 포함하고, 상기 항원-결합 단편의 발현은 인간, 불멸화 망막-유래 세포 내의 상기 발현 벡터로부터의 발현시 α2,6-시알화되며, 인간 대상체는 ≤20/20 및 ≥20/400인 BCVA를 갖는다.
특정 양태에서, 본원은 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재하되, 상기 방법은 hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 발현 벡터를 상기 인간 대상체의 눈 내의 맥락막상 공간을 통해 상기 인간 대상체의 망막하 및/또는 망막내 공간에 투여하는 것(예를 들어, 맥락막상 공간을 통해 삽입되고 뚫릴 수 있는 카테터를 포함하는 망막하 약물 전달 장치를 통함)을 포함하고, 상기 항원-결합 단편의 발현은 인간, 불멸화 망막-유래 세포 내의 상기 발현 벡터로부터의 발현시 α2,6-시알화된다. 구체적 양태에서, 본원은 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재하되, 상기 방법은 hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 발현 벡터를 상기 인간 대상체의 눈 내의 맥락막상 공간을 통해 상기 인간 대상체의 망막하 및/또는 망막내 공간에 투여하는 것(예를 들어, 소형 바늘이 망막하 공간 내로 주사되는, 후극을 향해 맥락막상 공간을 통해 삽입되고 뚫릴 수 있는 카테터를 포함하는 망막하 약물 전달 장치를 통함)을 포함하고, 상기 항원-결합 단편의 발현은 인간, 불멸화 망막-유래 세포 내의 상기 발현 벡터로부터의 발현시 α2,6-시알화되며, 인간 대상체는 ≤20/20 및 ≥20/400인 BCVA를 갖는다.
특정 양태에서, 본원은 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재하되, 상기 방법은 hVEGF에 대한 항원-결합 단편을 코딩하는 발현 벡터를 상기 대상체의 눈 내의 맥락막상 공간, 망막하 공간, 또는 공막 외면에 투여하는 것(예를 들어, 맥락막상 주사, 경유리체 접근법을 통한 망막하 주사(외과적 수술), 맥락막상 공간을 통한 망막하 투여, 또는 후방 공막옆 데포 수술에 의함)을 포함하고, 상기 항원-결합 단편의 발현은 인간, 불멸화 망막-유래 세포 내의 상기 발현 벡터로부터의 발현시 α2,6-시알화되며, 상기 항원-결합 단편은 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않는다. 구체적 실시양태에서, 투여 단계는 맥락막상 약물 전달 장치, 예컨대 미량주사기의 사용을 포함한다. 구체적 양태에서, 본원은 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재하되, 상기 방법은 hVEGF에 대한 항원-결합 단편을 코딩하는 발현 벡터를 상기 인간 대상체의 눈 내의 맥락막상 공간, 망막하 공간, 또는 공막 외면에 투여하는 것(예를 들어, 맥락막상 주사, 경유리체 접근법을 통한 망막하 주사(외과적 수술), 맥락막상 공간을 통한 망막하 투여, 또는 후방 공막옆 데포 수술에 의함)을 포함하고, 상기 항원-결합 단편의 발현은 인간, 불멸화 망막-유래 세포 내의 상기 발현 벡터로부터의 발현시 α2,6-시알화되며, 상기 항원-결합 단편은 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않고, 인간 대상체는 ≤20/20 및 ≥20/400인 BCVA를 갖는다. 구체적 실시양태에서, 투여 단계는 맥락막상 약물 전달 장치, 예컨대 미량주사기의 사용을 포함한다.
특정 양태에서, 본원은 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재하되, 상기 방법은 hVEGF에 대한 항원-결합 단편을 코딩하는 발현 벡터를 상기 인간 대상체의 눈 내의 맥락막상 공간을 통해 상기 인간 대상체의 망막에 투여 또는 전달하는 것(예를 들어, 맥락막상 약물 전달 장치, 예컨대 미세바늘이 있는 미량주사기를 통함)을 포함하고, 상기 항원-결합 단편의 발현은 인간, 불멸화 망막-유래 세포 내의 상기 발현 벡터로부터의 발현시 α2,6-시알화되며, 상기 항원-결합 단편은 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않는다. 구체적 양태에서, 본원은 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재하되, 상기 방법은 hVEGF에 대한 항원-결합 단편을 코딩하는 발현 벡터를 상기 인간 대상체의 눈 내의 맥락막상 공간을 통해 상기 인간 대상체의 망막에 투여 또는 전달하는 것(예를 들어, 맥락막상 약물 전달 장치, 예컨대 미세바늘이 있는 미량주사기를 통함)을 포함하고, 상기 항원-결합 단편의 발현은 인간, 불멸화 망막-유래 세포 내의 상기 발현 벡터로부터의 발현시 α2,6-시알화되며, 상기 항원-결합 단편은 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않으며, 인간 대상체는 ≤20/20 및 ≥20/400인 BCVA를 갖는다.
특정 양태에서, 본원은 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재하되, 상기 방법은 hVEGF에 대한 항원-결합 단편을 코딩하는 발현 벡터를 상기 인간 대상체의 눈 내의 맥락막상 공간을 통해 상기 인간 대상체의 망막하 및/또는 망막내 공간에 투여하는 것(예를 들어, 소형 바늘이 망막하 공간 내로 주사되는, 후극을 향해 맥락막상 공간을 통해 삽입되고 뚫릴 수 있는 카테터를 포함하는 망막하 약물 전달 장치를 통함)을 포함하고, 상기 항원-결합 단편의 발현은 인간, 불멸화 망막-유래 세포 내의 상기 발현 벡터로부터의 발현시 α2,6-시알화되며, 상기 항원-결합 단편은 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않는다. 구체적 양태에서, 본원은 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재하되, 상기 방법은 hVEGF에 대한 항원-결합 단편을 코딩하는 발현 벡터를 상기 인간 대상체의 눈 내의 맥락막상 공간을 통해 상기 인간 대상체의 망막하 및/또는 망막내 공간에 투여하는 것(예를 들어, 소형 바늘이 망막하 공간 내로 주사되는, 후극을 향해 맥락막상 공간을 통해 삽입되고 뚫릴 수 있는 카테터를 포함하는 망막하 약물 전달 장치를 통함)을 포함하고, 상기 항원-결합 단편의 발현은 인간, 불멸화 망막-유래 세포 내의 상기 발현 벡터로부터의 발현시 α2,6-시알화되며, 상기 항원-결합 단편은 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않고, 인간 대상체는 ≤20/20 및 ≥20/400인 BCVA를 갖는다.
특정 양태에서, 본원은 hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터의 치료적 유효량을 인간 대상체의 눈 내의 맥락막상 공간, 망막하 공간, 또는 공막 외면에 투여하여(예를 들어, 맥락막상 주사, 경유리체 접근법을 통한 망막하 주사(외과적 수술), 맥락막상 공간을 통한 망막하 투여, 또는 후방 공막옆 데포 수술에 의함), α2,6-시알화 글리칸을 함유하는 상기 항원-결합 단편을 방출하는 저장소가 형성되는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 실시양태에서, 투여 단계는 맥락막상 약물 전달 장치, 예컨대 미량주사기의 사용을 포함한다. 특정 양태에서, 본원은 hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터의 치료적 유효량을 인간 대상체의 눈 내의 맥락막상 공간, 망막하 공간, 또는 공막 외면에 투여하여(예를 들어, 맥락막상 주사, 경유리체 접근법을 통한 망막하 주사(외과적 수술), 맥락막상 공간을 통한 망막하 투여, 또는 후방 공막옆 데포 수술에 의함), α2,6-시알화 글리칸을 함유하는 상기 항원-결합 단편을 방출하는 저장소가 형성되는 것을 포함하되, 인간 대상체가 ≤20/20 및 ≥20/400인 BCVA를 갖는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 실시양태에서, 투여 단계는 맥락막상 약물 전달 장치, 예컨대 미량주사기의 사용을 포함한다.
특정 양태에서, 본원은 hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터의 치료적 유효량을 인간 대상체의 눈 내의 맥락막상 공간을 통해 인간 대상체의 망막에 투여 또는 전달하여(예를 들어, 맥락막상 약물 전달 장치, 예컨대 미세바늘이 있는 미량주사기를 통함), α2,6-시알화 글리칸을 함유하는 상기 항원-결합 단편을 방출하는 저장소가 형성되는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 제공한다. 특정 양태에서, 본원은 hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터의 치료적 유효량을 인간 대상체의 눈 내의 맥락막상 공간을 통해 인간 대상체의 망막에 투여 또는 전달하여, α2,6-시알화 글리칸을 함유하는 상기 항원-결합 단편을 방출하는 저장소가 형성되는 것을 포함하되, 인간 대상체가 ≤20/20 및 ≥20/400인 BCVA를 갖는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다.
특정 양태에서, 본원은 hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터의 치료적 유효량을 인간 대상체의 눈 내의 맥락막상 공간을 통해 인간 대상체의 망막하 및/또는 망막내 공간에 투여하여(예를 들어, 소형 바늘이 망막하 공간 내로 주사되는, 후극을 향해 맥락막상 공간을 통해 삽입되고 뚫릴 수 있는 카테터를 포함하는 망막하 약물 전달 장치를 통함), α2,6-시알화 글리칸을 함유하는 상기 항원-결합 단편을 방출하는 저장소가 형성되는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 특정 양태에서, 본원은 hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터의 치료적 유효량을 인간 대상체의 눈 내의 맥락막상 공간을 통해 인간 대상체의 망막하 및/또는 망막내 공간에 투여하여(예를 들어, 소형 바늘이 망막하 공간 내로 주사되는, 후극을 향해 맥락막상 공간을 통해 삽입되고 뚫릴 수 있는 카테터를 포함하는 망막하 약물 전달 장치를 통함), α2,6-시알화 글리칸을 함유하는 상기 항원-결합 단편을 방출하는 저장소가 형성되는 것을 포함하되, 인간 대상체가 ≤20/20 및 ≥20/400인 BCVA를 갖는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다.
특정 양태에서, 본원은 hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터의 치료적 유효량을 인간 대상체의 눈 내의 맥락막상 공간, 망막하 공간, 또는 공막 외면에 투여하여(예를 들어, 맥락막상 주사, 경유리체 접근법을 통한 망막하 주사(외과적 수술), 맥락막상 공간을 통한 망막하 투여, 또는 후방 공막옆 데포 수술에 의함), 당화되지만, 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않는 상기 항원-결합 단편을 방출하는 저장소가 형성되는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 실시양태에서, 투여 단계는 맥락막상 약물 전달 장치, 예컨대 미량주사기의 사용을 포함한다. 특정 양태에서, 본원은 hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터의 치료적 유효량을 인간 대상체의 눈 내의 맥락막상 공간, 망막하 공간, 또는 공막 외면에 투여하여(예를 들어, 맥락막상 주사, 경유리체 접근법을 통한 망막하 주사(외과적 수술), 맥락막상 공간을 통한 망막하 투여, 또는 후방 공막옆 데포 수술에 의함), 당화되지만, 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않는 상기 항원-결합 단편을 방출하는 저장소가 형성되는 것을 포함하되, 인간 대상체가 ≤20/20 및 ≥20/400인 BCVA를 갖는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 실시양태에서, 투여 단계는 맥락막상 약물 전달 장치, 예컨대 미량주사기의 사용을 포함한다.
특정 양태에서, 본원은 hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터의 치료적 유효량을 인간 대상체의 눈 내의 맥락막상 공간을 통해 인간 대상체의 망막에 투여 또는 전달하여(예를 들어, 맥락막상 약물 전달 장치, 예컨대 미세바늘이 있는 미량주사기를 통함), 당화되지만, 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않는 상기 항원-결합 단편을 방출하는 저장소가 형성되는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 특정 양태에서, 본원은 hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터의 치료적 유효량을 인간 대상체의 눈 내의 맥락막상 공간을 통해 인간 대상체의 망막에 투여 또는 전달하여(예를 들어, 맥락막상 약물 전달 장치, 예컨대 미세바늘이 있는 미량주사기를 통함), 당화되지만, 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않는 상기 항원-결합 단편을 방출하는 저장소가 형성되는 것을 포함하되, 인간 대상체가 ≤20/20 및 ≥20/400인 BCVA를 갖는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다.
특정 양태에서, 본원은 hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터의 치료적 유효량을 인간 대상체의 눈 내의 맥락막상 공간을 통해 인간 대상체의 망막하 및/또는 망막내 공간에 투여하여(예를 들어, 소형 바늘이 망막하 공간 내로 주사되는, 후극을 향해 맥락막상 공간을 통해 삽입되고 뚫릴 수 있는 카테터를 포함하는 망막하 약물 전달 장치를 통함), 당화되지만, 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않는 상기 항원-결합 단편을 방출하는 저장소가 형성되는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 특정 양태에서, 본원은 hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터의 치료적 유효량을 인간 대상체의 눈 내의 맥락막상 공간을 통해 인간 대상체의 망막하 및/또는 망막내 공간에 투여하여(예를 들어, 소형 바늘이 망막하 공간 내로 주사되는, 후극을 향해 맥락막상 공간을 통해 삽입되고 뚫릴 수 있는 카테터를 포함하는 망막하 약물 전달 장치를 통함), 당화되지만, 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않는 상기 항원-결합 단편을 방출하는 저장소가 형성되는 것을 포함하되, 인간 대상체가 ≤20/20 및 ≥20/400인 BCVA를 갖는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다.
본원에 기재된 방법의 특정 양태에서, 항원-결합 단편은 서열번호 1 또는 서열번호 3의 아미노산 서열을 포함하는 중쇄, 및 서열번호 2, 또는 서열번호 4의 아미노산 서열을 포함하는 경쇄를 포함한다.
본원에 기재된 방법의 특정 양태에서, 항원-결합 단편은 티로신-황산화를 추가로 함유한다.
본원에 기재된 방법의 특정 양태에서, α2,6-시알화 글리칸을 함유하는 상기 항원-결합 단편의 생산은 세포 배양에서 상기 재조합 뉴클레오티드 발현 벡터를 PER.C6 또는 RPE 세포주에 형질도입함으로써 확인된다.
본원에 기재된 방법의 특정 양태에서, 티로신-황산화를 함유한 상기 항원-결합 단편의 생산은 세포 배양에서 상기 재조합 뉴클레오티드 발현 벡터를 PER.C6 또는 RPE 세포주에 형질도입함으로써 확인된다.
본원에 기재된 방법의 특정 양태에서, 벡터는 저산소증-유도성 프로모터를 갖는다.
본원에 기재된 방법의 특정 양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 17-19 또는 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함한다.
본원에 기재된 방법의 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 경쇄 CDR1의 제8 및 제11 아미노산 잔기(즉, SASQDISNYLN(서열번호 14) 내의 2 개의 N) 각각은 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 아세틸화되지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 경쇄 CDR1의 제8 및 제11 아미노산 잔기(즉, SASQDISNYLN(서열번호 14) 내의 2 개의 N) 각각은 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 아세틸화되지 않는다. 바람직한 실시양태에서, 본원에 기재된 화학적 변형(들) 또는 (경우에 따라) 화학적 변형(들)의 결여는 질량 분광법에 의해 결정된다.
본원에 기재된 방법의 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 중쇄 CDR1의 제9 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 M)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 중쇄 CDR2의 제3 아미노산 잔기(즉, WINTYTGEPTYAADFKR(서열번호 18) 내의 N)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하며, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 아세틸화되지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 중쇄 CDR1의 제9 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 M)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 중쇄 CDR2의 제3 아미노산 잔기(즉, WINTYTGEPTYAADFKR(서열번호 18) 내의 N)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하며, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 아세틸화되지 않는다. 바람직한 실시양태에서, 본원에 기재된 화학적 변형(들) 또는 (경우에 따라) 화학적 변형(들)의 결여는 질량 분광법에 의해 결정된다.
본원에 기재된 방법의 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않고, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, (1) 중쇄 CDR1의 제9 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 M)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 중쇄 CDR2의 제3 아미노산 잔기(즉, WINTYTGEPTYAADFKR(서열번호 18) 내의 N)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하며, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않고; (2) 경쇄 CDR1의 제8 및 제11 아미노산 잔기(즉, SASQDISNYLN(서열번호 14) 내의 2 개의 N) 각각은 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 아세틸화되지 않고, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 아세틸화되지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, (1) 중쇄 CDR1의 제9 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 M)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 중쇄 CDR2의 제3 아미노산 잔기(즉, WINTYTGEPTYAADFKR(서열번호 18) 내의 N)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하며, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 아세틸화되지 않고; (2) 경쇄 CDR1의 제8 및 제11 아미노산 잔기(즉, SASQDISNYLN(서열번호 14) 내의 2 개의 N) 각각은 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 아세틸화되지 않는다. 바람직한 실시양태에서, 본원에 기재된 화학적 변형(들) 또는 (경우에 따라) 화학적 변형(들)의 결여는 질량 분광법에 의해 결정된다.
본원에 기재된 방법의 특정 양태에서, 항원-결합 단편 전이유전자는 리더(leader) 펩티드를 코딩한다. 리더 펩티드는 또한 본원에서 시그널 펩티드 또는 리더 서열로서 지칭될 수 있다.
특정 양태에서, 본원은 hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터의 치료적 유효량을 인간 대상체의 눈 내의 맥락막상 공간, 망막하 공간, 또는 공막 외면에 투여하여(예를 들어, 맥락막상 주사, 경유리체 접근법을 통한 망막하 주사(외과적 수술), 맥락막상 공간을 통한 망막하 투여, 또는 후방 공막옆 데포 수술에 의함), α2,6-시알화 글리칸을 함유하는 상기 항원-결합 단편을 방출하는 저장소가 형성되는 것을 포함하되; 상기 재조합 벡터는 배양에서 PER.C6 또는 RPE 세포에 형질도입하기 위해 사용될 때, 상기 세포 배양에서 α2,6-시알화 글리칸을 함유하는 상기 항원-결합 단편의 생산을 야기하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 실시양태에서, 투여 단계는 맥락막상 약물 전달 장치, 예컨대 미량주사기의 사용을 포함한다. 특정 양태에서, 본원은 hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터의 치료적 유효량을 인간 대상체의 눈 내의 맥락막상 공간, 망막하 공간, 또는 공막 외면에 투여하여(예를 들어, 맥락막상 주사, 경유리체 접근법을 통한 망막하 주사(외과적 수술), 맥락막상 공간을 통한 망막하 투여, 또는 후방 공막옆 데포 수술에 의함), α2,6-시알화 글리칸을 함유하는 상기 항원-결합 단편을 방출하는 저장소가 형성되는 것을 포함하되; 상기 재조합 벡터는 배양에서 PER.C6 또는 RPE 세포에 형질도입하기 위해 사용될 때, 상기 세포 배양에서 α2,6-시알화 글리칸을 함유하는 상기 항원-결합 단편의 생산을 야기하고, 인간 대상체는 ≤20/20 및 ≥20/400인 BCVA를 갖는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 실시양태에서, 투여 단계는 맥락막상 약물 전달 장치, 예컨대 미량주사기의 사용을 포함한다.
특정 양태에서, 본원은 hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터의 치료적 유효량을 인간 대상체의 눈 내의 맥락막상 공간을 통해 인간 대상체의 망막에 투여 또는 전달하여(예를 들어, 맥락막상 약물 전달 장치, 예컨대 미세바늘이 있는 미량주사기를 통함), α2,6-시알화 글리칸을 함유하는 상기 항원-결합 단편을 방출하는 저장소가 형성되는 것을 포함하되; 상기 재조합 벡터는 배양에서 PER.C6 또는 RPE 세포에 형질도입하기 위해 사용될 때, 상기 세포 배양에서 α2,6-시알화 글리칸을 함유하는 상기 항원-결합 단편의 생산을 야기하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 특정 양태에서, 본원은 hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터의 치료적 유효량을 인간 대상체의 눈 내의 맥락막상 공간을 통해 인간 대상체의 망막에 투여 또는 전달하여(예를 들어, 맥락막상 약물 전달 장치, 예컨대 미세바늘이 있는 미량주사기를 통함), α2,6-시알화 글리칸을 함유하는 상기 항원-결합 단편을 방출하는 저장소가 형성되는 것을 포함하되; 상기 재조합 벡터는 배양에서 PER.C6 또는 RPE 세포에 형질도입하기 위해 사용될 때, 상기 세포 배양에서 α2,6-시알화 글리칸을 함유하는 상기 항원-결합 단편의 생산을 야기하고, 인간 대상체는 ≤20/20 및 ≥20/400인 BCVA를 갖는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다.
특정 양태에서, 본원은 hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터의 치료적 유효량을 인간 대상체의 눈 내의 맥락막상 공간을 통해 인간 대상체의 망막하 및/또는 망막내 공간에 투여하여(예를 들어, 소형 바늘이 망막하 공간 내로 주사되는, 후극을 향해 맥락막상 공간을 통해 삽입되고 뚫릴 수 있는 카테터를 포함하는 망막하 약물 전달 장치를 통함), α2,6-시알화 글리칸을 함유하는 상기 항원-결합 단편을 방출하는 저장소가 형성되는 것을 포함하되; 상기 재조합 벡터는 배양에서 PER.C6 또는 RPE 세포에 형질도입하기 위해 사용될 때, 상기 세포 배양에서 α2,6-시알화 글리칸을 함유하는 상기 항원-결합 단편의 생산을 야기하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 특정 양태에서, 본원은 hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터의 치료적 유효량을 인간 대상체의 눈 내의 맥락막상 공간을 통해 인간 대상체의 망막하 및/또는 망막내 공간에 투여하여(예를 들어, 소형 바늘이 망막하 공간 내로 주사되는, 후극을 향해 맥락막상 공간을 통해 삽입되고 뚫릴 수 있는 카테터를 포함하는 망막하 약물 전달 장치를 통함), α2,6-시알화 글리칸을 함유하는 상기 항원-결합 단편을 방출하는 저장소가 형성되는 것을 포함하되; 상기 재조합 벡터는 배양에서 PER.C6 또는 RPE 세포에 형질도입하기 위해 사용될 때, 상기 세포 배양에서 α2,6-시알화 글리칸을 함유하는 상기 항원-결합 단편의 생산을 야기하고, 인간 대상체는 ≤20/20 및 ≥20/400인 BCVA를 갖는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다.
특정 양태에서, 본원은 hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터의 치료적 유효량을 인간 대상체의 눈 내의 맥락막상 공간, 망막하 공간, 또는 공막 외면에 투여하여(예를 들어, 맥락막상 주사, 경유리체 접근법을 통한 망막하 주사(외과적 수술), 맥락막상 공간을 통한 망막하 투여, 또는 후방 공막옆 데포 수술에 의함), 당화되지만, 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않는 상기 항원-결합 단편을 방출하는 저장소가 형성되는 것을 포함하되; 상기 재조합 벡터는 배양에서 PER.C6 또는 RPE 세포에 형질도입하기 위해 사용될 때, 상기 세포 배양에서 당화되지만, 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않는 상기 항원-결합 단편의 생산을 야기하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 실시양태에서, 투여 단계는 맥락막상 약물 전달 장치, 예컨대 미량주사기의 사용을 포함한다. 특정 양태에서, 본원은 hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터의 치료적 유효량을 인간 대상체의 눈 내의 맥락막상 공간, 망막하 공간, 또는 공막 외면에 투여하여(예를 들어, 맥락막상 주사, 경유리체 접근법을 통한 망막하 주사(외과적 수술), 맥락막상 공간을 통한 망막하 투여, 또는 후방 공막옆 데포 수술에 의함), 당화되지만, 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않는 상기 항원-결합 단편을 방출하는 저장소가 형성되는 것을 포함하되; 상기 재조합 벡터는 배양에서 PER.C6 또는 RPE 세포에 형질도입하기 위해 사용될 때, 상기 세포 배양에서 당화되지만, 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않는 상기 항원-결합 단편의 생산을 야기하고, 인간 대상체는 ≤20/20 및 ≥20/400인 BCVA를 갖는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 구체적 실시양태에서, 투여 단계는 맥락막상 약물 전달 장치, 예컨대 미량주사기의 사용을 포함한다.
특정 양태에서, 본원은 hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터의 치료적 유효량을 인간 대상체의 눈 내의 맥락막상 공간을 통해 인간 대상체의 망막에 투여 또는 전달하여(예를 들어, 맥락막상 약물 전달 장치, 예컨대 미세바늘이 있는 미량주사기를 통함), 당화되지만, 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않는 상기 항원-결합 단편을 방출하는 저장소가 형성되는 것을 포함하되; 상기 재조합 벡터는 배양에서 PER.C6 또는 RPE 세포에 형질도입하기 위해 사용될 때, 상기 세포 배양에서 당화되지만, 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않는 상기 항원-결합 단편의 생산을 야기하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 특정 양태에서, 본원은 hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터의 치료적 유효량을 인간 대상체의 눈 내의 맥락막상 공간을 통해 인간 대상체의 망막에 투여 또는 전달하여(예를 들어, 맥락막상 약물 전달 장치, 예컨대 미세바늘이 있는 미량주사기를 통함), 당화되지만, 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않는 상기 항원-결합 단편을 방출하는 저장소가 형성되는 것을 포함하되; 상기 재조합 벡터는 배양에서 PER.C6 또는 RPE 세포에 형질도입하기 위해 사용될 때, 상기 세포 배양에서 당화되지만, 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않는 상기 항원-결합 단편의 생산을 야기하고, 인간 대상체는 ≤20/20 및 ≥20/400인 BCVA를 갖는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다.
특정 양태에서, 본원은 hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터의 치료적 유효량을 인간 대상체의 눈 내의 맥락막상 공간을 통해 인간 대상체의 망막하 및/또는 망막내 공간에 투여하여(예를 들어, 소형 바늘이 망막하 공간 내로 주사되는, 후극을 향해 맥락막상 공간을 통해 삽입되고 뚫릴 수 있는 카테터를 포함하는 망막하 약물 전달 장치를 통함), 당화되지만, 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않는 상기 항원-결합 단편을 방출하는 저장소가 형성되는 것을 포함하되; 상기 재조합 벡터는 배양에서 PER.C6 또는 RPE 세포에 형질도입하기 위해 사용될 때, 상기 세포 배양에서 당화되지만, 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않는 상기 항원-결합 단편의 생산을 야기하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다. 특정 양태에서, 본원은 hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터의 치료적 유효량을 인간 대상체의 눈 내의 맥락막상 공간을 통해 인간 대상체의 망막하 및/또는 망막내 공간에 투여하여(예를 들어, 소형 바늘이 망막하 공간 내로 주사되는, 후극을 향해 맥락막상 공간을 통해 삽입되고 뚫릴 수 있는 카테터를 포함하는 망막하 약물 전달 장치를 통함), 당화되지만, 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않는 상기 항원-결합 단편을 방출하는 저장소가 형성되는 것을 포함하되; 상기 재조합 벡터는 배양에서 PER.C6 또는 RPE 세포에 형질도입하기 위해 사용될 때, 상기 세포 배양에서 당화되지만, 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않는 상기 항원-결합 단편의 생산을 야기하고, 인간 대상체는 ≤20/20 및 ≥20/400인 BCVA를 갖는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법을 기재한다.
본원에 기재된 방법의 특정 양태에서, 인간 대상체는 ≤20/63 및 ≥20/400인 BCVA를 갖는다.
본원에 기재된 방법의 특정 양태에서, BCVA는 인간 대상체에서 치료될 눈의 BCVA이다.
본원에 기재된 방법의 특정 양태에서, 눈에 대한 전달은 눈의 망막, 맥락막, 및/또는 유리체 액에 전달하는 것을 포함한다.
본원에 기재된 방법의 특정 양태에서, 항원-결합 단편은 C-말단에서 1, 2, 3, 또는 4 개의 추가 아미노산을 포함하는 중쇄를 포함한다.
본원에 기재된 방법의 특정 양태에서, 항원-결합 단편은 C-말단에서 추가의 아미노산을 포함하지 않는 중쇄를 포함한다.
항원-결합 단편 분자의 집단을 생산하는 본원에 기재된 방법의 특정 양태에서, 항원-결합 단편 분자는 중쇄를 포함하고, 항원-결합 단편 분자의 집단의 0.5%, 1%, 2%, 3%, 4%, 5%, 10%, 또는 20% 이하는 중쇄의 C-말단에서 1, 2, 3, 또는 4 개의 추가 아미노산을 포함한다. 항원-결합 단편 분자의 집단을 생산하는 본원에 기재된 방법의 특정 양태에서, 항원-결합 단편 분자는 중쇄를 포함하고, 항원-결합 단편 분자의 집단의 0.5%, 1%, 2%, 3%, 4%, 5%, 10%, 또는 20% 이하이지만, 0% 초과는 중쇄의 C-말단에서 1, 2, 3, 또는 4 개의 추가 아미노산을 포함한다.
항원-결합 단편 분자의 집단을 생산하는 본원에 기재된 방법의 특정 양태에서, 항원-결합 단편 분자는 중쇄를 포함하고, 항원-결합 단편 분자의 집단의 0.5-1%, 0.5%-2%, 0.5%-3%, 0.5%-4%, 0.5%-5%, 0.5%-10%, 0.5%-20%, 1%-2%, 1%-3%, 1%-4%, 1%-5%, 1%-10%, 1%-20%, 2%-3%, 2%-4%, 2%-5%, 2%-10%, 2%-20%, 3%-4%, 3%-5%, 3%-10%, 3%-20%, 4%-5%, 4%-10%, 4%-20%, 5%-10%, 5%-20%, 또는 10%-20%는 중쇄의 C-말단에서 1, 2, 3, 또는 4 개의 추가 아미노산을 포함한다.
이러한 유전자 요법이 투여되는 대상체는 항-VEGF 요법에 대해 반응성인 대상체여야 한다. 특별한 실시양태에서, 상기 방법은 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단되고 항-VEGF 항체를 이용한 치료에 대해 반응성으로 확인된 환자를 치료하는 것을 포함한다. 더욱 구체적인 실시양태에서, 환자는 항-VEGF 항원-결합 단편을 이용한 치료에 대해 반응성이다. 특정 실시양태에서, 환자는 유전자 요법으로 치료하기 전에 유리체내로 주사된 항-VEGF 항원-결합 단편을 이용한 치료에 대해 반응성인 것으로 나타났다. 구체적 실시양태에서, 환자는 이전에 LUCENTIS®(라니비주맙), EYLEA®(아플리베르셉트), 및/또는 AVASTIN®(베바시주맙)으로 치료되었으며, 상기 LUCENTIS®(라니비주맙), EYLEA®(아플리베르셉트), 및/또는 AVASTIN®(베바시주맙) 중 1 이상에 대해 반응성인 것으로 밝혀졌다.
이러한 바이러스 벡터 또는 다른 DNA 발현 구조체가 전달되는 대상체는 바이러스 벡터 또는 발현 구조체 내의 전이유전자에 의해 코딩되는 항-hVEGF 항원-결합 단편에 대해 반응성이어야 한다. 반응성을 결정하기 위해, 항-VEGF 항원-결합 단편 전이유전자 산물(예를 들어, 세포 배양, 생물반응기 등에서 생산됨)은 유리체내 주사에 의해서와 같이, 대상체에 직접 투여될 수 있다.
전이유전자에 의해 코딩된 HuPTMFabVEGFi, 예를 들어 HuGlyFabVEGFi는, 비제한적으로, 베바시주맙과 같은 hVEGF에 결합하는 항체의 항원-결합 단편; 라니비주맙과 같은 항-hVEGF Fab 모이어티; 또는 Fab 도메인 상에 추가의 당화 부위를 함유하도록 조작된 이러한 베바시주맙 또는 라니비주맙 Fab 모이어티를 포함할 수 있다(예를 들어, 전장 항체의 Fab 도메인 상에서 초고당화된 베바시주맙의 유도체의 설명을 위해 그 전체가 본원에 참고로 포함되는 Courtois et al., 2016, mAbs 8: 99-112 참고).
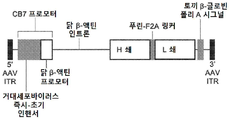
전이유전자를 전달하기 위해 사용되는 재조합 벡터는 인간 망막 세포 또는 광수용기 세포에 대해 향성(tropism)을 가져야 한다. 이러한 벡터는 비-복제성 재조합 아데노-연관 바이러스 벡터("rAAV")를 포함할 수 있으며, 특히 AAV8 캡시드를 보유한 것이 바람직하다. 그러나, 비제한적으로, 렌티바이러스 벡터, 백시니아 바이러스 벡터, 또는 "네이키드(naked) DNA" 구조체로 지칭되는 비-바이러스 발현 벡터를 포함하는 다른 바이러스 벡터가 사용될 수 있다. 바람직하게는, HuPTMFabVEGFi, 예를 들어 HuGlyFabVEGFi, 전이유전자는 적절한 발현 제어 요소, 몇가지 예를 들자면, 예를 들어 CB7 프로모터(닭 β-액틴 프로모터 및 CMV 인핸서), RPE65 프로모터, 또는 옵신 프로모터에 의해 제어되어야 하며, 벡터에 의해 추진되는 전이유전자의 발현을 향상시키는 다른 발현 제어 요소를 포함할 수 있다(예를 들어, 인트론, 예컨대 닭 β-액틴 인트론, 미세생쥐바이러스(minute virus of mice)(MVM) 인트론, 인간 인자 IX 인트론(예를 들어, FIX 절단된 인트론 1), β-글로빈 스플라이스 공여체/면역글로불린 중쇄 스플라이스 수용체 인트론, 아데노바이러스 스플라이스 공여체/면역글로불린 스플라이스 수용체 인트론, SV40 후기 스플라이스 공여체/스플라이스 수용체(19S/16S) 인트론, 및 하이브리드 아데노바이러스 스플라이스 공여체/IgG 스플라이스 수용체 인트론 및 폴리A 시그널, 예컨대 토끼 β-글로빈 폴리A 시그널, 인간 성장 호르몬(hGH) 폴리A 시그널, SV40 후기 폴리A 시그널, 합성 폴리A(SPA) 시그널, 및 소 성장 호르몬(bGH) 폴리A 시그널). 예를 들어, Powell and Rivera-Soto, 2015, Discov. Med., 19(102):49-57를 참고한다.
유전자 요법 구조체는 중쇄 및 경쇄 둘 다 발현되도록 설계된다. 더욱 구체적으로, 중쇄 및 경쇄는 대략 동일한 양으로 발현되어야 하며, 다시 말해, 중쇄 및 경쇄는 대략 1:1 비의 중쇄 대 경쇄로 발현된다. 중쇄 및 경쇄를 위한 코딩 서열은, 중쇄와 경쇄가 절단가능한 링커 또는 IRES에 의해 분리되어 분리된 중쇄 및 경쇄 폴리펩티드가 발현되는 단일 구조체로 조작될 수 있다. 예를 들어, 구체적인 리더 서열에 대해서는 섹션 5.2.4 및 구체적인 IRES, 2A 및 본원에서 제공되는 방법 및 조성물과 사용될 수 있는 다른 링커 서열에 대해서는 섹션 5.2.5를 참고한다.
맥락막상, 망막하, 공막옆 및/또는 망막내 투여를 위해 적합한 약학 조성물은 생리학적 양립성 수성 버퍼, 계면활성제 및 선택적 부형제를 포함하는 제형 버퍼 내의 재조합(예를 들어, rHuGlyFabVEGFi) 벡터의 현탁액을 포함한다.
재조합 벡터의 치료적 유효 용량은 ≥ 0.1 mL 내지 ≤ 0.5 mL, 바람직하게는 0.1 내지 0.30 mL(100 - 300 μL) 범위의 부피로, 및 가장 바람직하게는 0.25 mL(250 μL)의 부피로 망막하로 및/또는 망막내로 투여(예를 들어, 경유리체 접근법을 통한 망막하 주사(외과적 수술), 또는 맥락막상 공간을 통한 망막하 투여에 의함)되어야 한다. 재조합 벡터의 치료적 유효 용량은 100 μL 이하의 부피로, 예를 들어 50-100 μL의 부피로 맥락막상으로 투여(예를 들어, 맥락막상 주사에 의함)되어야 한다. 재조합 벡터의 치료적 유효 용량은 500 μL 이하의 부피로, 예를 들어 10-20 μL, 20-50 μL, 50-100 μL, 100-200 μL, 200-300 μL, 300-400 μL, 또는 400-500 μL의 부피로 공막 외면에 투여(예를 들어, 후방 공막옆 데포 수술에 의함)되어야 한다. 망막하 주사는 국소 마취 하에서 대상체의 유리체절제술 및 망막 내로 유전자 요법의 망막하 주사를 포함하는, 숙련된 망막 외과의에 의해 수행되는 외과적 수술이다(예를 들어, 그 전체가 본원에 참고로 포함되는 Campochiaro et al., 2017, Hum Gen Ther 28(1):99-111 참고). 구체적 실시양태에서, 망막하 투여는 망막하 공간 내로 약물을 주사하는 맥락막상 카테터, 예컨대 소형 바늘이 망막하 공간 내로 주사되는, 맥락막상 공간을 통해 후극으로 삽입되고 뚫릴 수 있는 카테터를 포함하는 망막하 약물 전달 장치를 사용하여 맥락막상 공간을 통해 수행된다(예를 들어, Baldassarre et al., 2017, Subretinal Delivery of Cells via the Suprachoroidal Space: Janssen Trial. In: Schwartz et al. (eds) Cellular Therapies for Retinal Disease, Springer, Cham; 국제 특허 출원 공개 WO 2016/040635 A1호 참고; 이들 각각은 그 전체가 본원에 참고로 포함됨). 맥락막상 투여 수술은 눈의 맥락막상 공간에 대한 약물의 투여를 포함하고, 보통 맥락막상 약물 전달 장치, 예컨대 미세바늘이 있는 미량주사기를 사용하여 수행된다(예를 들어, Hariprasad, 2016, Retinal Physician 13: 20-23; Goldstein, 2014, Retina Today 9(5): 82-87 참고; 이들 각각은 그 전체가 본원에 참고로 포함됨). 본원에 기재된 발명에 따라 맥락막상 공간 내에 발현 벡터를 배치하기 위해 사용될 수 있는 맥락막상 약물 전달 장치는, 비제한적으로, Clearside® Biomedical, Inc.에 의해 제조된 맥락막상 약물 전달 장치(예를 들어, Hariprasad, 2016, Retinal Physician 13: 20-23 참고) 및 MedOne 맥락막상 카테터를 포함한다. 본원에 기재된 발명에 따라 맥락막상 공간을 통해 망막하 공간 내에 발현 벡터를 배치하기 위해 사용될 수 있는 망막하 약물 전달 장치는, 비제한적으로, Janssen Pharmaceuticals, Inc.에 의해 제조된 망막하 약물 전달 장치(예를 들어, 국제 특허 출원 공개 WO 2016/040635 A1호 참고)를 포함한다. 구체적 실시양태에서, 공막 외면에 대한 투여는 팁이 공막 표면에 대해 직접 병치로 삽입되고 유지될 수 있는 캐뉼라를 포함하는 공막옆 약물 전달 장치에 의해 수행된다. 상이한 방식의 투여의 더욱 상세내용에 대해서는 섹션 5.3.2를 참고한다. 맥락막상, 망막하, 공막옆 및/또는 망막내 투여는 가용성 전이유전자 산물을 망막, 유리체 액, 및/또는 방수로 전달되게 해야 한다. 망막 세포, 예를 들어 간상, 원뿔, 망막 색소 상피, 수평, 양극, 아마크린, 신경절, 및/또는 뮬러 세포에 의한 전이유전자 산물(예를 들어, 코딩된 항-VEGF 항체)의 발현은 망막, 유리체 액 및/또는 방수에서 전이유전자 산물의 전달 및 유지를 야기한다. 유리체 액에서 적어도 0.330 ㎍/mL, 또는 방수(눈의 전방)에서 0.110 ㎍/mL의 Cmin에서 전이유전자 산물의 농도를 3 개월 동안 유지하는 용량이 바람직하며; 그 후, 1.70 내지 6.60 ㎍/mL 범위의 전이유전자 산물의 유리체 Cmin 농도, 및/또는 0.567 내지 2.20 ㎍/mL 범위의 방수 Cmin 농도가 유지되어야 한다. 그러나, 전이유전자 산물은 연속적으로 생산되므로, 더 낮은 농도의 유지가 효과적일 수 있다. 전이유전자 산물의 농도는 치료된 눈의 유리체 액 및/또는 전방으로부터의 방수의 환자 샘플에서 측정될 수 있다. 대안적으로, 유리체 액 농도는 전이유전자 산물의 환자의 혈청 농도를 측정함으로써 추정 및/또는 모니터링될 수 있다 - 전이유전자 산물에 대한 전신 대 유리체 노출의 비는 약 1:90,000이다. (예를 들어, 그 전체가 본원에 참고로 포함되는 Xu L, et al., 2013, Invest. Opthal. Vis. Sci. 54: 1616-1624, at p. 1621 및 Table 5 at p. 1623에서 보고된 라니비주맙의 유리체 액 및 혈청 농도 참고).
본 발명은 시간 경과에 따라 소멸되어 최고 및 최저 수준을 야기하는 VEGF 억제제의 고용량 볼루스의 반복되는 안구 주사를 포함하는 케어 치료의 표준에 비해 여러 이점을 갖는다. 항체를 반복적으로 주사하는 것과 반대로, 전이유전자 산물 항체의 지속적인 발현은 작용 부위에서 더욱 일관된 수준의 항체가 존재하도록 하며, 더 적은 주사가 필요하도록 하여 더 적은 의사 방문을 야기하므로 환자를 위해 덜 위험하고 더 편리하다. 일관된 단백질 생산은 망막에서 다시 튀어나오는 부종이 발생할 가능성이 더 적기 때문에 양호한 임상 결과를 야기할 수 있다. 또한, 전이유전자로부터 발현된 항체는 번역 동안 및 번역 후 존재하는 상이한 미세환경 때문에 직접적으로 주사되는 것과 상이한 방식으로 번역후 변형된다. 임의의 특정 이론에 구애됨 없이, 이는 상이한 확산, 생활성, 분포, 친화성, 약동학, 및 면역원성 특징을 갖는 항체를 야기하여, 직접적으로 주사된 항체와 비교하여, 작용 부위에 전달된 항체가 "바이오베터(biobetter)"이도록 한다.
또한, 생체내(in vivo)에서 전이유전자로부터 발현된 항체는 단백질 응집 및 단백질 산화와 같은, 재조합 기술에 의해 생산된 항체와 연관된 분해 산물을 함유할 가능성이 적다. 응집은 높은 단백질 농도, 제조 장비 및 용기와의 표면 상호작용, 및 특정 버퍼 시스템을 이용한 정제로 인한 단백질 생산 및 저장과 연관된 문제이다. 응집을 촉진하는 이들 조건은 유전자 요법에서의 전이유전자 발현에서는 존재하지 않는다. 메티오닌, 트립토판, 및 히스티딘 산화와 같은 산화는 또한 단백질 생산 및 저장과 연관되며, 스트레스가 가해진 세포 배양 조건, 금속 및 공기 접촉, 및 버퍼와 부형제 내의 불순물에 의해 야기된다. 생체내에서 전이유전자로부터 발현된 단백질은 또한 스트레스가 가해진 조건에서 산화될 수 있다. 그러나, 인간 및 많은 다른 유기체는 항산화 방어 시스템을 구비하여, 산화 스트레스를 감소시킬 뿐만 아니라, 때로는 또한 산화를 회복 및/또는 역전시킨다. 따라서, 생체내에서 생산된 단백질은 산화된 형태로 있을 가능성이 적다. 응집 및 산화 둘 다는 역가(potency), 약동학(소거) 및 면역원성에 영향을 줄 수 있다.
이론에 구애됨없이, 본원에서 제공되는 방법 및 조성물은 부분적으로 다음 원리를 기본으로 한다:
(i) 인간 망막 세포는 망막 세포에서 왕성한 과정인 당화 및 티로신-O-황산화를 비롯한, 분비된 단백질의 번역후 처리를 위한 세포 조직을 보유하는 분비 세포이다. (예를 들어, 망막 세포에 의한 당단백질의 생산을 보고하는 Wang et al., 2013, Analytical Biochem. 427: 20-28 및 Adamis et al., 1993, BBRC 193: 631-638; 및 망막 세포에 의해 분비되는 티로신-황산화된 당단백질의 생산을 보고하는 Kanan et al., 2009, Exp. Eye Res. 89: 559-567 및 Kanan & Al-Ubaidi, 2015, Exp. Eye Res. 133: 126-131을 참고하며, 이들 각각은 인간 망막 세포에 의해 이루어지는 번역후 변형에 대해 그 전체가 참고로 포함됨).
(ii) 당업계의 이해와 반대로, 라니비주맙과 같은 항-VEGF 항원-결합 단편(및 베바시주맙과 같은 전장 항-VEGF mAb의 Fab 도메인)은 사실상 N-연결 당화 부위를 보유한다. 예를 들어, 라니비주맙의 VH 도메인(Q115GT) 및 VL 도메인(TFQ100GT) 내의 당화 부위인 글루타민("Q") 잔기(및 베바시주맙의 Fab 내의 상응하는 부위)뿐만 아니라, CH 도메인(TVSWN165SGAL) 및 CL 도메인(QSGN158SQE) 내의 비-컨센서스 아스파라긴("N") 당화 부위를 확인하는 도 1을 참고한다. (예를 들어, Valliere-Douglass et al., 2009, J. Biol. Chem. 284: 32493-32506, 및 Valliere-Douglass et al., 2010, J. Biol. Chem. 285: 16012-16022를 참고하며, 이들 각각은 항체 내의 N-연결 당화 부위의 확인에 대해 그 전체가 참고로 포함됨).
(iii) 이러한 비-정규적인 부위(non-canonical site)가 보통 항체 집단의 낮은 수준 당화(예를 들어, 약 1-5%)를 야기하는 반면, 기능적 이익은 눈과 같은 면역학적특권을 가진 장기에서는 상당할 수 있다(예를 들어, van de Bovenkamp et al., 2016, J. Immunol. 196:1435-1441 참고). 예를 들어, Fab 당화는 항체의 안정성, 반감기, 및 결합 특징에 영향을 줄 수 있다. 그의 표적에 대한 항체의 친화성에 대한 Fab 당화의 효과를 결정하기 위해, 당업자에게 알려진 임의의 기술, 예를 들어 효소 연결 면역흡착 분석(ELISA), 또는 표면 플라즈몬 공명(SPR)이 사용될 수 있다. 항체의 반감기에 대한 Fab 당화의 효과를 결정하기 위해, 당업자에게 알려진 임의의 기술, 예를 들어 방사성라벨링된 항체가 투여된 대상체에서 혈액 또는 장기(예를 들어, 눈)에서의 방사성활성 수준의 측정이 사용될 수 있다. 항체의 안정성, 예를 들어 응집 또는 단백질 풀림의 수준에 대한 Fab 당화의 효과를 결정하기 위해, 당업자에게 알려진 임의의 기술, 예를 들어 시차 주사 열량계(DSC), 고성능 액체 크로마토그래피(HPLC), 예를 들어 크기 배제 고성능 액체 크로마토그래피(SEC-HPLC), 모세관 전기영동, 질량 분광법, 또는 탁도 측정이 사용될 수 있다. 본원에서 제공되는 HuPTMFabVEGFi, 예를 들어 HuGlyFabVEGFi, 전이유전자는 비-정규적인 부위에서 0.5%, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 또는 10% 이상 당화된 Fab의 생산을 야기한다. 특정 실시양태에서, Fab 집단으로부터의 0.5%, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 또는 10% 이상의 Fab가 비-정규적인 부위에서 당화된다. 특정 실시양태에서, 0.5%, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 또는 10% 이상의 비-정규적인 부위가 당화된다. 특정 실시양태에서, 이들 비-정규적인 부위에서 Fab의 당화는 HEK293 세포에서 생산된 Fab 내의 이들 비-정규적인 부위의 당화의 양에 비해 25%, 50%, 100%, 200%, 300%, 400%, 500% 이상 더 크다.
(iv) 당화 부위에 더하여, 라니비주맙(및 베바시주맙의 Fab)과 같은 항-VEGF Fab는 CDR 내에서 또는 그 근처에서 티로신("Y") 황산화 부위를 함유하며; 라니비주맙의 VH(EDTAVY94Y95) 및 VL(EDFATY86) 도메인 내의 티로신-O-황산화 부위(및 베바시주맙의 Fab 내의 상응하는 부위)를 확인하는 도 1을 참고한다. (예를 들어, 단백질 티로신 황산화를 거친 티로신 잔기 주변의 아미노산의 분석에 대해 그 전체가 참고로 포함되는 Yang et al., 2015, Molecules 20:2138-2164, 특히, p. 2154를 참고함. "규칙"은 다음과 같이 요약될 수 있음: Y의 +5 내지 -5 위치 이내에 E 또는 D를 가진 Y 잔기, 및 Y의 위치 -1은 중성 또는 산성 전하를 가진 아미노산이지만 황산화를 없애는 염기성 아미노산, 예를 들어, R, K, 또는 H는 아님). 인간 IgG 항체는 N-말단 변형, C-말단 변형, 아미노산 잔기의 분해 또는 산화, 시스테인 관련 변이체, 및 당화와 같은 많은 다른 번역후 변형을 나타낼 수 있다(예를 들어, Liu et al., 2014, mAbs 6(5):1145-1154 참고).
(v) 인간 망막 세포에 의한 라니비주맙 또는 베바시주맙의 Fab 단편과 같은, 항-VEGF Fab의 당화는 전이유전자 산물의 안정성, 반감기를 개선하고 원치않는 응집 및/또는 면역원성을 감소시킬 수 있는 글리칸의 추가를 야기할 것이다(예를 들어, Fab 당화의 드러난 중요성의 리뷰를 위해 Bovenkamp et al., 2016, J. Immunol. 196: 1435-1441을 참고). 중요하게도, 본원에서 제공되는 HuPTMFabVEGFi, 예를 들어 HuGlyFabVEGFi에 추가될 수 있는 글리칸은 2,6-시알산(예를 들어, HuPTMFabVEGFi, 예를 들어 HuGlyFabVEGFi 내로 통합될 수 있는 글리칸을 도시하는 도 2 참고) 및 양분(bisecting) GlcNAc를 함유하지만 NGNA(N-Glycolylneuraminic acid(N-글리콜릴뉴라민산), Neu5Gc)는 함유하지 않는 고도로 처리된 복합체-형 바이안테너리(biantennary) N-글리칸이다. 이러한 글리칸은 라니비주맙(대장균에서 만들어지며 전혀 당화되지 않음)에서 또는 베바시주맙(이 번역후 변형을 만들기 위해 요구되는 2,6-시알릴트랜스퍼라제를 갖지 않으며, Neu5Ac(NANA) 대신에 인간에 대해 통상적이지 않은(또한 잠재적으로 면역원성인) 시알산으로서 Neu5Gc(NGNA)를 추가하지만 양분 GlcNAc를 생산하지 않는 CHO 세포에서 만들어짐)에서 존재하지 않는다. 예를 들어, Dumont et al., 2015, Crit. Rev. Biotechnol. (2015년 9월 18일에 온라인으로 조기 공개됨, pp. 1-13 at p. 5)를 참고한다. 또한, CHO 세포는 면역원성 글리칸인 α-Gal 항원을 생산할 수도 있으며, 이는 대부분의 개체에서 존재하는 항-α-Gal 항체와 반응하고, 높은 농도는 아나필락시스를 촉발시킬 수 있다. 예를 들어, Bosques, 2010, Nat Biotech 28: 1153-1156을 참고한다. 본원에서 제공되는 HuPTMFabVEGFi, 예를 들어 HuGlyFabVEGFi의 인간 당화 패턴은 전이유전자 산물의 면역원성을 감소시키고 효능을 개선해야 한다.
(vi) 라니비주맙 또는 베바시주맙의 Fab 단편과 같은 항-VEGF Fab의 티로신-황산화 - 인간 망막 세포에서 왕성한 번역후 과정 -는 VEGF에 대해 증가된 결합활성을 갖는 전이유전자 산물을 야기할 수 있다. 사실상, 다른 표적에 대한 치료 항체의 Fab의 티로신-황산화는 항원에 대한 결합활성 및 활성을 극적으로 증가시키는 것으로 나타났다(예를 들어, Loos et al., 2015, PNAS 112: 12675-12680, 및 Choe et al., 2003, Cell 114: 161-170 참고). 이러한 번역후 변형은 라니비주맙(티로신-황산화를 위해 요구되는 효소를 보유하지 않는 대장균 숙주에서 만들어짐) 상에 존재하지 않으며, 기껏해야 베바시주맙 - CHO 세포 산물에서 불충분하게 나타난다(under-represented). 인간 망막 세포와 달리, CHO 세포는 분비성 세포가 아니며 번역후 티로신-황산화를 위해 제한된 능력을 갖는다. (예를 들어, Mikkelsen & Ezban, 1991, Biochemistry 30: 1533-1537, 특히, p. 1537에서의 논의를 참고).
전술한 이유로, HuPTMFabVEGFi, 예를 들어 HuGlyFabVEGFi의 생산은 유전자 요법을 통해 - 예를 들어, 형질도입된 망막 세포에 의해 생산된 완전-인간 번역후 변형된, 예를 들어, 인간-당화된, 황산화된 전이유전자 산물을 연속적으로 공급하는 영구적 저장소를 눈에서 생성하기 위해, HuPTMFabVEGFi, 예를 들어 HuGlyFabVEGFi를 코딩하는 바이러스 벡터 또는 다른 DNA 발현 구조체를 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 환자(인간 대상)의 눈(들) 내의 맥락막상 공간, 망막하 공간, 또는 공막 외면에 투여함으로써(예를 들어, 맥락막상 주사, 경유리체 접근법을 통한 망막하 주사(외과적 수술), 맥락막상 공간을 통한 망막하 투여, 또는 후방 공막옆 데포 수술에 의함), 이루어진 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)의 치료를 위한 "바이오베터" 분자를 야기해야 한다. FabVEGFi를 위한 cDNA 구조체는 형질도입된 망막 세포에 의한 적절한 번역과 동시에 그리고 번역후 처리(당화 및 단백질 황산화)를 보장하는 시그널 펩티드를 포함해야 한다. 망막 세포에 의해 사용되는 이러한 시그널 서열은, 비제한적으로, 다음을 포함할 수 있다:
· MNFLLSWVHW SLALLLYLHH AKWSQA(VEGF-A 시그널 펩티드)
· MERAAPSRRV PLPLLLLGGL ALLAAGVDA(피부린(Fibulin)-1 시그널 펩티드)
· MAPLRPLLIL ALLAWVALA(비트로넥틴(Vitronectin) 시그널 펩티드)
· MRLLAKIICLMLWAICVA(보체 인자 H 시그널 펩티드)
· MRLLAFLSLL ALVLQETGT(옵티신(Opticin) 시그널 펩티드)
· MKWVTFISLLFLFSSAYS(알부민 시그널 펩티드)
· MAFLWLLSCWALLGTTFG(키모트립시노겐 시그널 펩티드)
· MYRMQLLSCIALILALVTNS(인터루킨-2 시그널 펩티드)
· MNLLLILTFVAAAVA(트립시노겐-2 시그널 펩티드).
· 예를 들어, Stern et al., 2007, Trends Cell. Mol. Biol., 2:1-17 및 Dalton & Barton, 2014, Protein Sci, 23: 517-525를 참고하며, 이들 각각은 사용될 수 있는 시그널 펩티드에 대해 그 전체가 본원에 참고로 포함된다.
대안으로서, 또는 유전자 요법에 대한 추가적 치료로서, HuPTMFabVEGFi 산물, 예를 들어 HuGlyFabVEGFi 당단백질이 재조합 DNA 기술에 의해 인간 세포주에서 생산되고, 유리체내 주사에 의해 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 환자에게 투여될 수 있다. HuPTMFabVEGFi 산물, 예를 들어 당단백질은 또한 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)을 갖는 환자에게 투여될 수 있다. 이러한 재조합 당단백질 생산을 위해 사용될 수 있는 인간 세포주는 몇몇을 들자면, 비제한적으로, 인간 배아 신장 293 세포(HEK293), 섬유육종 HT-1080, HKB-11, CAP, HuH-7, 및 망막 세포주, PER.C6, 또는 RPE를 포함한다(예를 들어, HuPTMFabVEGFi 산물, 예를 들어 HuGlyFabVEGFi 당단백질의 재조합 생산을 위해 사용될 수 있는 인간 세포주의 리뷰를 위해 그 전체가 참고로 포함되는 Dumont et al., 2015, Crit. Rev. Biotechnol.(2015년 9월 18일에 온라인으로 조기 공개됨,, pp. 1-13) "Human cell lines for biopharmaceutical manufacturing: history, status, and future perspectives" 참고). 완전한 당화, 특히 시알화, 및 티로신-황산화를 보장하기 위하여, 생산을 위해 사용되는 세포주는 숙주 세포가 α-2,6-시알릴트랜스퍼라제(또는 α-2,3- 및 α-2,6-시알릴트랜스퍼라제 둘 다) 및/또는 망막 세포에서 티로신-O-황산화를 책임지는 TPST-1 및 TPST-2 효소를 공동-발현하도록 조작함으로써 향상될 수 있다.
다른 이용가능한 치료의 전달이 수반되는 눈/망막에 대한 HuPTMFabVEGFi, 예를 들어 HuGlyFabVEGFi의 전달의 조합이 본원에서 제공되는 방법에 의해 포함된다. 추가의 치료는 유전자 요법 치료 전에, 그와 동시에 또는 그에 이어서 투여될 수 있다. 본원에서 제공되는 유전자 요법과 조합될 수 있는 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)을 위해 이용가능한 치료는, 비제한적으로, 레이저 광응고법, 베르테포르핀을 이용한 광선역학적 요법, 및 비제한적으로, 페갑타닙, 라니비주맙, 아플리베르셉트, 또는 베바시주맙을 포함하는 항-VEGF 약제를 이용한 유리체내(IVT) 주사를 포함한다. 생물의약품과 같은 항-VEGF 약제를 이용한 추가 치료는 "구제" 요법("rescue" therapy)으로서 지칭될 수 있다.
소분자 약물과 달리, 생물의약품은 보통 상이한 역가, 약동학, 및 안전성 프로파일을 갖는 상이한 변형 또는 형태를 가진 많은 변이체의 혼합물을 포함한다. 유전자 요법 또는 단백질 요법 접근에서 생산되는 모든 분자가 완전히 당화되고 황산화될 필요는 없다. 오히려, 생산된 당단백질 집단은 효능을 입증하기 위해 2,6-시알화 및 황산화를 비롯한, 충분한 당화(집단의 약 1% 내지 약 10%)를 가져야 한다. 본원에서 제공되는 유전자 요법 치료의 목표는 망막 변성의 진행을 늦추거나 정지시키고, 최소의 개입/침습성 수술을 이용하여 시력 손실을 늦추거나 예방하는 것이다. 효능은 BCVA(최고 교정 시력), 안압, 세극등 생체현미경검사, 간접적 검안, SD-OCT(SD-Optical Coherence Tomography(SD-광간섭 단층촬영술)), 망막전위도검사(ERG)를 측정함으로써 모니터링될 수 있다. 시력손실, 감염, 염증 및 망막 박리를 비롯한 다른 안전성 이벤트의 징후가 또한 모니터링될 수 있다. 망막 두께는 본원에서 제공되는 치료의 효능을 결정하기 위해 모니터링될 수 있다. 임의의 특별한 이론에 구애됨 없이, 망막의 두께는 임상적 판독정보(readout)로서 사용될 수 있으며, 망막 두께에서 감소가 더 크거나 또는 망막이 두꺼워지기 전 기간이 더 길수록, 치료는 더 효율적이다. 망막 두께는 예를 들어, SD-OCT에 의해 결정될 수 있다. SD-OCT는 반사 시간 지연(echo time delay) 및 관심 물체로부터 반사된 후방산란된 광의 양을 결정하기 위해 저-간섭성 간섭계(low-coherence interferometry)를 사용하는 삼차원 영상화 기술이다. OCT는 3 내지 15 ㎛ 축방향 해상력으로 조직 샘플(예를 들어, 망막)의 층을 스캔하기 위해 사용될 수 있으며, SD-OCT는 이전 형태의 기술에 비하여 축방향 해상력 및 스캔 속도를 개선한다(Schuman, 2008, Trans. Am. Opthamol. Soc. 106:426-458). 망막 기능은 예를 들어, ERG에 의해 결정될 수 있다. ERG는 인간에서의 사용을 위해 FDA에 의해 승인된, 망막 기능의 비-침습성 전기생리학적 시험이며, 눈의 광 민감성 세포(간상 및 원뿔), 및 이들의 연결 신경절 세포, 특히 플래쉬 자극에 대한 그들의 반응을 검사한다.
바람직한 실시양태에서, 항원-결합 단편은 검출가능한 NeuGc 및/또는 α-Gal을 함유하지 않는다. 본원에서 사용된 어구 "검출가능한 NeuGc 및/또는 α-Gal"은 당업계에 알려진 표준 에세이 방법에 의해 검출가능한 NeuGc 및/또는 α-Gal 모이어티를 의미한다. 예를 들어, NeuGc는 NeuGc을 검출하는 방법에 대한 참고로 본원에 포함되는 Hara et al., 1989, "Highly Sensitive Determination of N-Acetyl-and N-Glycolylneuraminic Acids in Human Serum and Urine and Rat Serum by Reversed-Phase Liquid Chromatography with Fluorescence Detection." J. Chromatogr., B: Biomed. 377: 111-119에 따라 HPLC에 의해 검출될 수 있다. 대안적으로, NeuGc는 질량 분광법에 의해 검출될 수 있다. α-Gal은 ELISA(예를 들어, Galili et al., 1998, "A sensitive assay for measuring alpha-Gal epitope expression on cells by a monoclonal 항-Gal antibody." Transplantation. 65(8):1129-32 참고)를 사용하여, 또는 질량 분광법(예를 들어, Ayoub et al., 2013, "Correct primary structure assessment and extensive glyco-profiling of cetuximab by a combination of intact, middle-up, middle-down and bottom-up ESI and MALDI mass spectrometry techniques." Landes Bioscience. 5(5): 699-710 참고)에 의해 검출될 수 있다. 또한, Platts-Mills et al., 2015, "Anaphylaxis to the Carbohydrate Side-Chain Alpha-gal" Immunol Allergy Clin North Am. 35(2): 247-260에 인용된 참고문헌을 참고한다.
특정 양태에서, 본원은 또한 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는 항-VEGF 항원-결합 단편(즉, VEGF에 면역특이적으로 결합하는 항원-결합 단편)을 제공한다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 경쇄 CDR1의 제8 및 제11 아미노산 잔기(즉, SASQDISNYLN(서열번호 14) 내의 2 개의 N) 각각은 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 아세틸화되지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 경쇄 CDR1의 제8 및 제11 아미노산 잔기(즉, SASQDISNYLN(서열번호 14) 내의 2 개의 N) 각각은 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 아세틸화되지 않는다. 본원에서 제공되는 항-VEGF 항원-결합 단편은 본원에 기재된 발명에 따른 임의의 방법에서 사용될 수 있다. 바람직한 실시양태에서, 본원에 기재된 화학적 변형(들) 또는 (경우에 따라) 화학적 변형(들)의 결여는 질량 분광법에 의해 결정된다.
특정 양태에서, 본원은 또한 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는 항-VEGF 항원-결합 단편을 제공한다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 중쇄 CDR1의 제9 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 M)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 중쇄 CDR2의 제3 아미노산 잔기(즉, WINTYTGEPTYAADFKR(서열번호 18) 내의 N)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하며, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 아세틸화되지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 중쇄 CDR1의 제9 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 M)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 중쇄 CDR2의 제3 아미노산 잔기(즉, WINTYTGEPTYAADFKR(서열번호 18) 내의 N)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하며, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 아세틸화되지 않는다. 본원에서 제공되는 항-VEGF 항원-결합 단편은 본원에 기재된 발명에 따른 임의의 방법에서 사용될 수 있다. 바람직한 실시양태에서, 본원에 기재된 화학적 변형(들) 또는 (경우에 따라) 화학적 변형(들)의 결여는 질량 분광법에 의해 결정된다.
특정 양태에서, 본원은 또한 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않고, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는 항-VEGF 항원-결합 단편을 제공한다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, (1) 중쇄 CDR1의 제9 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 M)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 중쇄 CDR2의 제3 아미노산 잔기(즉, WINTYTGEPTYAADFKR(서열번호 18) 내의 N)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하며, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않고; (2) 경쇄 CDR1의 제8 및 제11 아미노산 잔기(즉, SASQDISNYLN(서열번호 14) 내의 2 개의 N) 각각은 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 아세틸화되지 않고, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 아세틸화되지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, (1) 중쇄 CDR1의 제9 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 M)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 중쇄 CDR2의 제3 아미노산 잔기(즉, WINTYTGEPTYAADFKR(서열번호 18) 내의 N)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하며, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 아세틸화되지 않고; (2) 경쇄 CDR1의 제8 및 제11 아미노산 잔기(즉, SASQDISNYLN(서열번호 14) 내의 2 개의 N) 각각은 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 아세틸화되지 않는다. 본원에서 제공되는 항-VEGF 항원-결합 단편은 본원에 기재된 발명에 따른 임의의 방법에서 사용될 수 있다. 바람직한 실시양태에서, 본원에 기재된 화학적 변형(들) 또는 (경우에 따라) 화학적 변형(들)의 결여는 질량 분광법에 의해 결정된다.
본 발명의 예상치못한 효과는 하기의 실시예에서 예시되며, 실시예는 망막하 공간내로 주사된 rAAV8.항-hVEGF Fab 벡터로부터의 HuPTMFabVEGFi의 발현이 (i) 인간 대상체에서의 nAMD의 모델인 트랜스제닉 마우스에서 망막하 신혈관형성을 감소시켰으며; (ii) 심각한 증식성 망막병증 및 VEGF의 안구 생산에 의해 야기된 망막 박리를 일으키는 안구 신혈관 질환의 트랜스제닉 마우스 모델에서 망막 박리를 놀랍게도 예방하였음을 입증한다.
실시예는 또한 rAAV8.항-hVEGF Fab 벡터의 맥락막상 투여가 VEGF-유도된 손상을 중화시 벡터의 망막하 주사와 동일하게 효과적이었음을 입증한다. 맥락막상 투여는 합병증의 낮은 위험을 갖는 신속하고 용이한 사무실내(in-office) 수술을 허용한다.
다른 고려된 투여 경로는 소형 바늘이 망막하 공간 내로 주사되는, 후극을 향해 망막하 공간 내로 주사되도록 맥락막상 공간을 통해 삽입되고 뚫리는 카테터를 갖는 망막하 약물 전달 장치를 사용하는 맥락막상 공간을 통한 망막하 투여이다. 이 투여 경로는 유리체가 온전하게 유지되게 하므로, 합병증 위험이 거의 없고(유전자 요법 탈출, 및 망막 박리와 황반 원공과 같은 합병증의 적은 위험), 유리체절제술 없이, 생성된 물집이 더욱 확산하여 분산되어, 망막의 더 큰 표면적이 작은 부피로 형질도입되게 할 수 있다. 이 수술 후 유도된 백내장의 위험이 최소화되며, 이는 어린 환자에 대해 바람직하다. 또한, 이 수술은 중심와 하부의 물집을 표준 경유리체 접근법에 비해 더욱 안전하게 전달할 수 있으며, 이는 형질도입을 위한 표적 세포가 황반 내에 있는 중심 시력에 영향을 주는 유전된 망막 질환을 갖는 환자에 대해 바람직하다. 이 수술은 또한 다른 전달 경로에 영향을 줄 수 있는 전신 순환 내에 존재하는 AAV에 대한 중화 항체(Nab)를 갖는 환자에 대해 선호된다. 또한, 이 방법은 표준 경유리체 접근법에 비해 망막절개 부위가 덜 탈출하면서 물집을 생성하는 것으로 나타났다.
공막옆 투여는 안구내 감염 및 망막 박리의 위험, 눈 내로 직접 치료제를 주사하는 것과 일반적으로 연관된 부작용을 회피하는 추가 투여 경로를 제공한다.
3.1 예시적 실시양태
3.1.1 세트 1
1.
인간 망막 세포에 의해 생산된 항-hVEGF 항원-결합 단편의 치료적 유효량을 인간 대상체의 망막에 전달하는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법.
2.
경유리체 접근법을 통하거나 인간 대상체의 눈 내의 맥락막상 공간을 통한 망막하 주사에 의해, 항-hVEGF 항원-결합 단편을 코딩하는 발현 벡터를 인간 대상체의 눈 내의 망막하 공간에 투여함으로써, 인간 망막 세포에 의해 생산된 항-hVEGF 항원-결합 단편의 치료적 유효량을 인간 대상체의 망막에 전달하는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법.
3.
맥락막상 약물 전달 장치, 예컨대 미량주사기의 사용에 의해, 인간 망막 세포에 의해 생산된 항-hVEGF 항원-결합 단편의 치료적 유효량을 인간 대상체의 망막에 전달하는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 및 당뇨 망막병증(DR)으로 진단된 인간 대상체를 치료하는 방법.
4.
외경계막 내의 인간 광수용기 세포(예를 들어, 원뿔 세포 및/또는 간상 세포), 수평 세포, 양극 세포, 아마크린 세포, 망막 신경절 세포(예를 들어, 난쟁이 세포, 양산 세포, 이중층 세포, 거대 망막 신경절 세포, 감광성 신경절 세포, 및/또는 뮬러 교세포), 및/또는 망막 색소 상피 세포에 의해 생산된 항-hVEGF 항원-결합 단편의 치료적 유효량을 인간 대상체의 망막에 전달하는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법.
5.
경유리체 접근법을 통하거나 인간 대상체의 눈 내의 맥락막상 공간을 통한 망막하 주사에 의해, 항-hVEGF 항원-결합 단편을 코딩하는 발현 벡터를 인간 대상체의 눈 내의 망막하 공간에 투여함으로써, 외경계막 내의 인간 광수용기 세포(예를 들어, 원뿔 세포 및/또는 간상 세포), 수평 세포, 양극 세포, 아마크린 세포, 망막 신경절 세포(예를 들어, 난쟁이 세포, 양산 세포, 이중층 세포, 거대 망막 신경절 세포, 감광성 신경절 세포, 및/또는 뮬러 교세포), 및/또는 망막 색소 상피 세포에 의해 생산된 항-hVEGF 항원-결합 단편의 치료적 유효량을 인간 대상체의 망막에 전달하는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법.
6.
맥락막상 약물 전달 장치, 예컨대 미량주사기의 사용에 의해, 외경계막 내의 인간 광수용기 세포(예를 들어, 원뿔 세포 및/또는 간상 세포), 수평 세포, 양극 세포, 아마크린 세포, 망막 신경절 세포(예를 들어, 난쟁이 세포, 양산 세포, 이중층 세포, 거대 망막 신경절 세포, 감광성 신경절 세포, 및/또는 뮬러 교세포), 및/또는 망막 색소 상피 세포에 의해 생산된 항-hVEGF 항원-결합 단편의 치료적 유효량을 인간 대상체의 망막에 전달하는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법.
7.
단락 1 내지 6 중 어느 하나에 있어서,
항원-결합 단편이 Fab인 방법.
8.
단락 1 내지 6 중 어느 하나에 있어서,
항원-결합 단편이 F(ab')2인 방법.
9.
단락 1 내지 6 중 어느 하나에 있어서,
항원-결합 단편이 단일쇄 가변 도메인(scFv)인 방법.
10.
단락 1 내지 6 중 어느 하나에 있어서,
항원-결합 단편이 서열번호 1 또는 서열번호 3의 아미노산 서열을 포함하는 중쇄, 및 서열번호 2, 또는 서열번호 4의 아미노산 서열을 포함하는 경쇄를 포함하는 것인 방법.
11.
단락 1 내지 6 중 어느 하나에 있어서,
항원-결합 단편이 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호17-19 또는 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하는 것인 방법.
12.
단락 11에 있어서,
경쇄 CDR3의 제2 아미노산 잔기가 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는 것인 방법.
13.
단락 12에 있어서,
경쇄 CDR3의 제2 아미노산 잔기가 아세틸화되지 않는 것인 방법.
14.
단락 12 또는 13에 있어서,
경쇄 CDR1의 제8 및 제11 아미노산 잔기 각각이 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하는 것인 방법.
15.
단락 11 내지 14 중 어느 하나에 있어서,
항원-결합 단편이 서열번호 20의 중쇄 CDR1을 포함하고 중쇄 CDR1의 최종 아미노산 잔기가 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는 것인 방법.
16.
단락 15에 있어서,
중쇄 CDR1의 최종 아미노산 잔기가 아세틸화되지 않는 것인 방법.
17.
단락 15 또는 16에 있어서,
중쇄 CDR1의 제9 아미노산 잔기가 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 중쇄 CDR2의 제3 아미노산 잔기가 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하는 것인 방법.
18.
단락 1 내지 17 중 어느 하나에 있어서,
전달 단계가 3 x 109 게놈 카피 내지 2.5 x 1011 게놈 카피 범위의 용량의 항-hVEGF 항원-결합 단편을 코딩하는 발현 벡터를 투여하는 것을 포함하는 것인 방법.
19.
단락 1 내지 17 중 어느 하나에 있어서,
전달 단계가 약 3 x 109 게놈 카피의 용량의 항-hVEGF 항원-결합 단편을 코딩하는 발현 벡터를 투여하는 것을 포함하는 것인 방법.
20.
단락 1 내지 17 중 어느 하나에 있어서,
전달 단계가 약 1 x 1010 게놈 카피의 용량의 항-hVEGF 항원-결합 단편을 코딩하는 발현 벡터를 투여하는 것을 포함하는 것인 방법.
21.
단락 1 내지 17 중 어느 하나에 있어서,
전달 단계가 약 6 x 1010 게놈 카피의 용량의 항-hVEGF 항원-결합 단편을 코딩하는 발현 벡터를 투여하는 것을 포함하는 것인 방법.
22.
단락 1 내지 17 중 어느 하나에 있어서,
전달 단계가 약 1.6 x 1011 게놈 카피의 용량의 항-hVEGF 항원-결합 단편을 코딩하는 발현 벡터를 투여하는 것을 포함하는 것인 방법.
23.
단락 1 내지 17 중 어느 하나에 있어서,
전달 단계가 약 2.5 x 1011 게놈 카피의 용량의 항-hVEGF 항원-결합 단편을 코딩하는 발현 벡터를 투여하는 것을 포함하는 것인 방법.
24.
hVEGF에 대한 mAb의 항원-결합 단편(Fab, F(ab')2, 또는 scFv, 본원에서 전체적으로 "항원-결합 단편"으로서 지칭됨)의 치료적 유효량(상기 항원-결합 단편은 α2,6-시알화 글리칸을 함유함)을 인간 대상체의 눈에 전달하는 것을 포함하는, 신혈관 연령-관련 황반 변성(습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD))으로 진단된 인간 대상체를 치료하는 방법.
25.
경유리체 접근법을 통하거나 인간 대상체의 눈 내의 맥락막상 공간을 통한 망막하 주사에 의해, hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 발현 벡터를 인간 대상체의 눈 내의 망막하 공간에 투여함으로써, hVEGF에 대한 mAb의 항원-결합 단편(Fab, F(ab')2, 또는 scFv, 본원에서 전체적으로 "항원-결합 단편"으로서 지칭됨)의 치료적 유효량을 인간 대상체의 눈에 전달하는 것을 포함하되, 상기 항원-결합 단편은 α2,6-시알화 글리칸을 함유하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법.
26.
맥락막상 약물 전달 장치, 예컨대 미량주사기의 사용에 의해, hVEGF에 대한 mAb의 항원-결합 단편(Fab, F(ab')2, 또는 scFv, 본원에서 전체적으로 "항원-결합 단편"으로서 지칭됨)의 치료적 유효량을 인간 대상체의 눈에 전달하는 것을 포함하되, 상기 항원-결합 단편은 α2,6-시알화 글리칸을 함유하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법.
27.
hVEGF에 대한 mAb의 당화된 항원-결합 단편의 치료적 유효량을 인간 대상체의 눈에 전달하는 것을 포함하되, 상기 항원-결합 단편이 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법.
28.
경유리체 접근법을 통하거나 인간 대상체의 눈 내의 맥락막상 공간을 통한 망막하 주사에 의해, hVEGF에 대한 mAb의 당화된 항원-결합 단편을 코딩하는 발현 벡터를 인간 대상체의 눈 내의 망막하 공간에 투여함으로써, hVEGF에 대한 mAb의 당화된 항원-결합 단편의 치료적 유효량을 인간 대상체의 눈에 전달하는 것을 포함하되, 상기 항원-결합 단편이 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법.
29.
맥락막상 약물 전달 장치, 예컨대 미량주사기의 사용에 의해, hVEGF에 대한 mAb의 당화된 항원-결합 단편의 치료적 유효량을 인간 대상체의 눈에 전달하는 것을 포함하되, 상기 항원-결합 단편이 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법.
30.
단락 24 내지 29 중 어느 하나에 있어서,
전달 단계가 3 x 109 게놈 카피 내지 2.5 x 1011 게놈 카피 범위의 용량의 hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터를 투여하는 것을 포함하는 것인 방법.
31.
단락 24 내지 29 중 어느 하나에 있어서,
전달 단계가 약 3 x 109 게놈 카피의 용량의 hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터를 투여하는 것을 포함하는 것인 방법.
32.
단락 24 내지 29 중 어느 하나에 있어서,
전달 단계가 약 1 x 1010 게놈 카피의 용량의 hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터를 투여하는 것을 포함하는 것인 방법.
33.
단락 24 내지 29 중 어느 하나에 있어서,
전달 단계가 약 6 x 1010 게놈 카피의 용량의 hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터를 투여하는 것을 포함하는 것인 방법.
34.
단락 24 내지 29 중 어느 하나에 있어서,
전달 단계가 약 1.6 x 1011 게놈 카피의 용량의 hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터를 투여하는 것을 포함하는 것인 방법.
35.
단락 24 내지 29 중 어느 하나에 있어서,
전달 단계가 약 2.5 x 1011 게놈 카피의 용량의 hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터를 포함하는 것인 방법.
36.
습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법으로서, 상기 방법이 hVEGF에 대한 항원-결합 단편을 코딩하는 발현 벡터를 상기 인간 대상체의 눈 내의 망막하 공간에 투여하는 것을 포함하되, 상기 항원-결합 단편의 발현이 인간, 불멸화 망막-유래 세포 내의 상기 발현 벡터로부터의 발현시 α2,6-시알화되는 것인 방법.
37.
습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법으로서, 상기 방법이 hVEGF에 대한 항원-결합 단편을 코딩하는 발현 벡터를 상기 인간 대상체의 눈 내의 망막하 공간에 투여하는 것을 포함하되, 상기 항원-결합 단편의 발현이 인간, 불멸화 망막-유래 세포 내의 상기 발현 벡터로부터의 발현시 α2,6-시알화되며, 투여 단계는 소형 바늘이 망막하 공간 내로 주사되는, 후극을 향해 맥락막상 공간을 통해 삽입되고 뚫릴 수 있는 카테터를 포함하는 망막하 약물 전달 장치의 사용을 포함하는 것인 방법.
38.
습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법으로서, 상기 방법이 hVEGF에 대한 항원-결합 단편을 코딩하는 발현 벡터를 상기 인간 환자의 망막에 투여 또는 전달하는 것을 포함하되, 상기 항원-결합 단편의 발현이 인간, 불멸화 망막-유래 세포 내의 상기 발현 벡터로부터의 발현시 α2,6-시알화되는 것인 방법.
39.
습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법으로서, 상기 방법이 hVEGF에 대한 항원-결합 단편을 코딩하는 발현 벡터를 상기 인간 대상체의 눈 내의 망막하 공간에 투여하는 것을 포함하되, 상기 항원-결합 단편의 발현이 인간, 불멸화 망막-유래 세포 내의 상기 발현 벡터로부터의 발현시 α2,6-시알화되며, 상기 항원-결합 단편이 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않는 것인 방법.
40.
습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법으로서, 상기 방법이 hVEGF에 대한 항원-결합 단편을 코딩하는 발현 벡터를 상기 인간 대상체의 눈 내의 망막하 공간에 투여하는 것을 포함하되, 상기 항원-결합 단편의 발현이 인간, 불멸화 망막-유래 세포 내의 상기 발현 벡터로부터의 발현시 α2,6-시알화되며, 상기 항원-결합 단편이 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않고, 투여 단계는 소형 바늘이 망막하 공간 내로 주사되는, 후극을 향해 맥락막상 공간을 통해 삽입되고 뚫릴 수 있는 카테터를 포함하는 망막하 약물 전달 장치의 사용을 포함하는 것인 방법.
41.
습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법으로서, 상기 방법이 hVEGF에 대한 항원-결합 단편을 코딩하는 발현 벡터를 상기 인간 대상체의 눈 내의 맥락막상 공간을 통해 상기 인간 환자의 망막에 투여 또는 전달하는 것을 포함하되, 상기 항원-결합 단편의 발현이 인간, 불멸화 망막-유래 세포 내의 상기 발현 벡터로부터의 발현시 α2,6-시알화되며, 상기 항원-결합 단편이 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않는 것인 방법.
42.
단락 36 내지 41 중 어느 하나에 있어서,
hVEGF에 대한 항원-결합 단편을 코딩하는 발현 벡터가 3 x 109 게놈 카피 내지 2.5 x 1011 게놈 카피 범위의 용량으로 투여되는 것인 방법.
43.
단락 36 내지 41 중 어느 하나에 있어서,
hVEGF에 대한 항원-결합 단편을 코딩하는 발현 벡터가 약 3 x 109 게놈 카피의 용량으로 투여되는 것인 방법.
44.
단락 36 내지 41 중 어느 하나에 있어서,
hVEGF에 대한 항원-결합 단편을 코딩하는 발현 벡터가 약 1 x 1010 게놈 카피의 용량으로 투여되는 것인 방법.
45.
단락 36 내지 41 중 어느 하나에 있어서,
hVEGF에 대한 항원-결합 단편을 코딩하는 발현 벡터가 약 6 x 1010 게놈 카피의 용량으로 투여되는 것인 방법.
46.
단락 36 내지 41 중 어느 하나에 있어서,
hVEGF에 대한 항원-결합 단편을 코딩하는 발현 벡터가 약 1.6 x 1011 게놈 카피의 용량으로 투여되는 것인 방법.
47.
단락 36 내지 41 중 어느 하나에 있어서,
hVEGF에 대한 항원-결합 단편을 코딩하는 발현 벡터가 약 2.5 x 1011 게놈 카피의 용량으로 투여되는 것인 방법.
48.
hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터의 치료적 유효량을 인간 대상체의 눈 내의 망막하 공간에 투여하여, α2,6-시알화 글리칸을 함유하는 상기 항원-결합 단편을 방출하는 저장소가 형성되는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법.
49.
hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터의 치료적 유효량을 인간 대상체의 눈 내의 망막하 공간에 투여하여, α2,6-시알화 글리칸을 함유하는 상기 항원-결합 단편을 방출하는 저장소가 형성되는 것을 포함하되, 투여 단계는 소형 바늘이 망막하 공간 내로 주사되는, 후극을 향해 맥락막상 공간을 통해 삽입되고 뚫릴 수 있는 카테터를 포함하는 망막하 약물 전달 장치의 사용을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법.
50.
hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터의 치료적 유효량을 인간 대상체의 눈 내의 맥락막상 공간을 통해 인간 환자의 망막에 투여 또는 전달하여, α2,6-시알화 글리칸을 함유하는 상기 항원-결합 단편을 방출하는 저장소가 형성되는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법.
51.
hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터의 치료적 유효량을 인간 대상체의 눈 내의 망막하 공간에 투여하여, 당화되지만, 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않는 상기 항원-결합 단편을 방출하는 저장소가 형성되는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법.
52.
hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터의 치료적 유효량을 인간 대상체의 눈 내의 망막하 공간에 투여하여, 당화되지만, 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않는 상기 항원-결합 단편을 방출하는 저장소가 형성되는 것을 포함하되, 투여 단계는 소형 바늘이 망막하 공간 내로 주사되는, 후극을 향해 맥락막상 공간을 통해 삽입되고 뚫릴 수 있는 카테터를 포함하는 망막하 약물 전달 장치의 사용을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법.
53.
hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터의 치료적 유효량을 인간 대상체의 눈 내의 맥락막상 공간을 통해 인간 환자의 망막에 투여 또는 전달하여, 당화되지만, 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않는 상기 항원-결합 단편을 방출하는 저장소가 형성되는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법.
54.
단락 48 내지 53 중 어느 하나에 있어서,
hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터가 3 x 109 게놈 카피 내지 2.5 x 1011 게놈 카피 범위의 용량으로 투여되는 것인 방법.
55.
단락 48 내지 53 중 어느 하나에 있어서,
hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터가 약 3 x 109 게놈 카피의 용량으로 투여되는 것인 방법.
56.
단락 48 내지 53 중 어느 하나에 있어서,
hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터가 약 1 x 1010 게놈 카피의 용량으로 투여되는 것인 방법.
57.
단락 48 내지 53 중 어느 하나에 있어서,
hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터가 약 6 x 1010 게놈 카피의 용량으로 투여되는 것인 방법.
58.
단락 48 내지 53 중 어느 하나에 있어서,
hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터가 약 1.6 x 1011 게놈 카피의 용량으로 투여되는 것인 방법.
59.
단락 48 내지 53 중 어느 하나에 있어서,
hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터가 약 2.5 x 1011 게놈 카피의 용량으로 투여되는 것인 방법.
60.
단락 24 내지 59 중 어느 하나에 있어서,
항원-결합 단편이 서열번호 1 또는 서열번호 3의 아미노산 서열을 포함하는 중쇄, 및 서열번호 2, 또는 서열번호 4의 아미노산 서열을 포함하는 경쇄를 포함하는 것인 방법.
61.
단락 24 내지 60 중 어느 하나에 있어서,
항원-결합 단편이 티로신-황산화를 추가로 함유하는 것인 방법.
62.
단락 24 내지 61 중 어느 하나에 있어서,
α2,6-시알화 글리칸을 함유한 상기 항원-결합 단편의 생산이 세포 배양에서 상기 재조합 뉴클레오티드 발현 벡터를 PER.C6 또는 RPE 세포주에 형질도입함으로써 확인되는 것인 방법.
63.
단락 24 내지 61 중 어느 하나에 있어서,
티로신-황산화를 함유한 상기 항원-결합 단편의 생산이 세포 배양에서 상기 재조합 뉴클레오티드 발현 벡터를 PER.C6 또는 RPE 세포주에 형질도입함으로써 확인되는 것인 방법.
64.
단락 24 내지 63 중 어느 하나에 있어서,
벡터가 저산소증-유도성 프로모터를 갖는 것인 방법.
65.
단락 24 내지 64 중 어느 하나에 있어서,
항원-결합 단편이 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 17-19 또는 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하는 것인 방법.
66.
단락 65에 있어서,
경쇄 CDR3의 제2 아미노산 잔기가 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는 것인 방법.
67.
단락 66에 있어서,
경쇄 CDR3의 제2 아미노산 잔기가 아세틸화되지 않는 것인 방법.
68.
단락 66 또는 67에 있어서,
경쇄 CDR1의 제8 및 제11 아미노산 잔기 각각이 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하는 것인 방법.
69.
단락 65 내지 68 중 어느 하나에 있어서,
항원-결합 단편이 서열번호 20의 중쇄 CDR1을 포함하고 중쇄 CDR1의 최종 아미노산 잔기가 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는 것인 방법.
70.
단락 69에 있어서,
중쇄 CDR1의 최종 아미노산 잔기가 아세틸화되지 않는 것인 방법.
71.
단락 69 또는 70에 있어서,
중쇄 CDR1의 제9 아미노산 잔기가 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 중쇄 CDR2의 제3 아미노산 잔기가 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하는 것인 방법.
72.
단락 24 내지 71 중 어느 하나에 있어서,
항원-결합 단편 전이유전자가 리더 펩티드를 코딩하는 것인 방법.
73.
hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터의 치료적 유효량을 인간 대상체의 눈 내의 망막하 공간에 투여하여, α2,6-시알화 글리칸을 함유하는 상기 항원-결합 단편을 방출하는 저장소가 형성되는 것을 포함하되, 상기 재조합 벡터가 배양에서 PER.C6 또는 RPE 세포에 형질도입하기 위해 사용될 때, 상기 세포 배양에서 α2,6-시알화 글리칸을 함유하는 상기 항원-결합 단편의 생산을 야기하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법.
74.
hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터의 치료적 유효량을 인간 대상체의 눈 내의 망막하 공간에 투여하여, α2,6-시알화 글리칸을 함유하는 상기 항원-결합 단편을 방출하는 저장소가 형성되는 것을 포함하되, 상기 재조합 벡터가 배양에서 PER.C6 또는 RPE 세포에 형질도입하기 위해 사용될 때, 상기 세포 배양에서 α2,6-시알화 글리칸을 함유하는 상기 항원-결합 단편의 생산을 야기하고, 투여 단계는 소형 바늘이 망막하 공간 내로 주사되는, 후극을 향해 맥락막상 공간을 통해 삽입되고 뚫릴 수 있는 카테터를 포함하는 망막하 약물 전달 장치의 사용을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법.
75.
hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터의 치료적 유효량을 인간 대상체의 눈 내의 맥락막상 공간을 통해 인간 환자의 망막에 투여 또는 전달하여, α2,6-시알화 글리칸을 함유하는 상기 항원-결합 단편을 방출하는 저장소가 형성되는 것을 포함하되, 상기 재조합 벡터가 배양에서 PER.C6 또는 RPE 세포에 형질도입하기 위해 사용될 때, 상기 세포 배양에서 α2,6-시알화 글리칸을 함유하는 상기 항원-결합 단편의 생산을 야기하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법.
76.
hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터의 치료적 유효량을 인간 대상체의 눈 내의 망막하 공간에 투여하여, 당화되지만, 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않는 상기 항원-결합 단편을 방출하는 저장소가 형성되는 것을 포함하되, 상기 재조합 벡터가 배양에서 PER.C6 또는 RPE 세포에 형질도입하기 위해 사용될 때, 상기 세포 배양에서 당화되지만, 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않는 상기 항원-결합 단편의 생산을 야기하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법.
77.
hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터의 치료적 유효량을 인간 대상체의 눈 내의 망막하 공간에 투여하여, 당화되지만, 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않는 상기 항원-결합 단편을 방출하는 저장소가 형성되는 것을 포함하되, 상기 재조합 벡터가 배양에서 PER.C6 또는 RPE 세포에 형질도입하기 위해 사용될 때, 상기 세포 배양에서 당화되지만, 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않는 상기 항원-결합 단편의 생산을 야기하고, 투여 단계는 소형 바늘이 망막하 공간 내로 주사되는, 후극을 향해 맥락막상 공간을 통해 삽입되고 뚫릴 수 있는 카테터를 포함하는 망막하 약물 전달 장치의 사용을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법.
78.
hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터의 치료적 유효량을 인간 대상체의 눈 내의 맥락막상 공간을 통해 인간 환자의 망막에 투여 또는 전달하여, 당화되지만, 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않는 상기 항원-결합 단편을 방출하는 저장소가 형성되는 것을 포함하되, 상기 재조합 벡터가 배양에서 PER.C6 또는 RPE 세포에 형질도입하기 위해 사용될 때, 상기 세포 배양에서 당화되지만, 검출가능한 NeuGc 및/또는 α-Gal 항원을 함유하지 않는 상기 항원-결합 단편의 생산을 야기하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법.
79.
단락 73 내지 78 중 어느 하나에 있어서,
hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터가 3 x 109 게놈 카피 내지 2.5 x 1011 게놈 카피 범위의 용량으로 투여되는 것인 방법.
80.
단락 73 내지 78 중 어느 하나에 있어서,
hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터가 약 3 x 109 게놈 카피의 용량으로 투여되는 것인 방법.
81.
단락 73 내지 78 중 어느 하나에 있어서,
hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터가 약 1 x 1010 게놈 카피의 용량으로 투여되는 것인 방법.
82.
단락 73 내지 78 중 어느 하나에 있어서,
hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터가 약 6 x 1010 게놈 카피의 용량으로 투여되는 것인 방법.
83.
단락 73 내지 78 중 어느 하나에 있어서,
hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터가 약 1.6 x 1011 게놈 카피의 용량으로 투여되는 것인 방법.
84.
단락 73 내지 78 중 어느 하나에 있어서,
hVEGF에 대한 mAb의 항원-결합 단편을 코딩하는 재조합 뉴클레오티드 발현 벡터가 약 2.5 x 1011 게놈 카피의 용량으로 투여되는 것인 방법.
85.
단락 24 내지 35 중 어느 하나에 있어서,
눈에 대한 전달이 눈의 망막, 맥락막, 및/또는 유리체 액에 대한 전달을 포함하는 것인 방법.
86.
단락 1 내지 85 중 어느 하나에 있어서,
항원-결합 단편이 C-말단에서 1, 2, 3, 또는 4 개의 추가 아미노산을 포함하는 중쇄를 포함하는 것인 방법.
87.
단락 1 내지 85 중 어느 하나에 있어서,
항원-결합 단편이 C-말단에서 추가 아미노산을 포함하지 않는 중쇄를 포함하는 것인 방법.
88.
단락 1 내지 85 중 어느 하나에 있어서,
항원-결합 단편 분자의 집단을 생산하되, 항원-결합 단편 분자가 중쇄를 포함하고, 항원-결합 단편 분자의 집단의 0.5%, 1%, 2%, 3%, 4%, 5%, 10%, 또는 20% 이하이지만, 0% 초과가 중쇄의 C-말단에서 1, 2, 3, 또는 4 개의 추가 아미노산을 포함하는 것인 방법.
89.
단락 1 내지 85 중 어느 하나에 있어서,
항원-결합 단편 분자의 집단을 생산하되, 항원-결합 단편 분자가 중쇄를 포함하고, 항원-결합 단편 분자의 집단의 0.5-1%, 0.5%-2%, 0.5%-3%, 0.5%-4%, 0.5%-5%, 0.5%-10%, 0.5%-20%, 1%-2%, 1%-3%, 1%-4%, 1%-5%, 1%-10%, 1%-20%, 2%-3%, 2%-4%, 2%-5%, 2%-10%, 2%-20%, 3%-4%, 3%-5%, 3%-10%, 3%-20%, 4%-5%, 4%-10%, 4%-20%, 5%-10%, 5%-20%, 또는 10%-20%가 중쇄의 C-말단에서 1, 2, 3, 또는 4 개의 추가 아미노산을 포함하는 것인 방법.
90.
단락 1 내지 89 중 어느 하나에 있어서,
인간 대상체가 ≤20/20 및 ≥20/400인 BCVA를 갖는 것인 방법.
91.
단락 1 내지 90 중 어느 하나에 있어서,
인간 대상체가 ≤20/63 및 ≥20/400인 BCVA를 갖는 것인 방법.
92.
단락 90 또는 91에 있어서,
BCVA가 인간 대상체에서 치료될 눈의 BCVA인 방법.
93.
VEGF에 면역특이적으로 결합하는 항원-결합 단편으로서, 항원-결합 단편이 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하고, 경쇄 CDR3의 제2 아미노산 잔기가 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는 항원-결합 단편.
94.
단락 93에 있어서,
경쇄 CDR3의 제2 아미노산 잔기가 아세틸화되지 않는 항원-결합 단편.
95.
단락 93 또는 94에 있어서,
경쇄 CDR1의 제8 및 제11 아미노산 잔기 각각이 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하는 항원-결합 단편.
96.
단락 93 내지 95 중 어느 하나에 있어서,
중쇄 CDR1의 최종 아미노산 잔기가 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는 항원-결합 단편.
97.
단락 96에 있어서,
중쇄 CDR1의 최종 아미노산 잔기가 아세틸화되지 않는 항원-결합 단편.
98.
단락 96 또는 97에 있어서,
중쇄 CDR1의 제9 아미노산 잔기가 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 중쇄 CDR2의 제3 아미노산 잔기가 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하는 항원-결합 단편.
3.1.2 세트 2
1.
항-인간 혈관 내피 성장 인자(hVEGF) 항체를 코딩하는 발현 벡터를 인간 대상체의 눈 내의 맥락막상 공간에 투여하는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법.
2.
단락 1에 있어서,
투여가 맥락막상 약물 전달 장치를 사용하여 맥락막상 공간 내로 발현 벡터를 주사하는 것에 의한 것인 방법.
3.
단락 1 또는 2에 있어서,
맥락막상 약물 전달 장치가 미량주사기인 방법.
4.
인간 대상체의 눈 내의 맥락막상 공간을 통해 항-hVEGF 항체를 코딩하는 발현 벡터를 인간 대상체의 눈 내의 망막하 공간에 투여하는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법.
5.
단락 4에 있어서,
투여는 소형 바늘이 망막하 공간 내로 주사되는, 후극을 향해 맥락막상 공간을 통해 삽입되고 뚫릴 수 있는 카테터를 포함하는 망막하 약물 전달 장치의 사용에 의한 것인 방법.
6.
단락 5에 있어서,
투여가 맥락막상 공간을 통해 망막하 약물 전달 장치의 카테터를 삽입하고 뚫는 것을 포함하는 것인 방법.
7.
항-hVEGF 항체를 코딩하는 발현 벡터를 인간 대상체의 눈 내의 공막 외면에 투여하는 것을 포함하는, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 인간 대상체를 치료하는 방법.
8.
단락 7에 있어서,
투여는 팁이 공막 표면에 대해 직접 병치로 삽입되고 유지될 수 있는 캐뉼라를 포함하는 공막옆 약물 전달 장치의 사용에 의한 것인 방법.
9.
단락 8에 있어서,
투여가 공막 표면에 대해 직접 병치로 팁을 삽입하고 유지하는 것을 포함하는 것인 방법.
10.
단락 1 내지 9 중 어느 하나에 있어서,
투여가 항-hVEGF 항체의 치료적 유효량을 상기 인간 대상체의 망막에 전달하는 것인 방법.
11.
단락 10에 있어서,
항-hVEGF 항체의 치료적 유효량이 상기 인간 대상체의 인간 망막 세포에 의해 생산되는 것인 방법.
12.
단락 10에 있어서,
항-hVEGF 항체의 치료적 유효량이 상기 인간 대상체의 외경계막 내의 인간 광수용기 세포, 수평 세포, 양극 세포, 아마크린 세포, 망막 신경절 세포, 및/또는 망막 색소 상피 세포에 의해 생산되는 것인 방법.
13.
단락 12에 있어서,
인간 광수용기 세포가 원뿔 세포 및/또는 간상 세포인 방법.
14.
단락 12에 있어서,
망막 신경절 세포가 난쟁이 세포, 양산 세포, 이중층 세포, 거대 망막 신경절 세포, 감광성 신경절 세포, 및/또는 뮬러 교세포인 방법.
15.
단락 1 내지 14 중 어느 하나에 있어서,
인간 대상체가 ≤20/20 및 ≥20/400인 최고 교정 시력(BCVA)을 갖는 것인 방법.
16.
단락 1 내지 14 중 어느 하나에 있어서,
인간 대상체가 ≤20/63 및 ≥20/400인 BCVA를 갖는 것인 방법.
17.
단락 15 또는 16에 있어서,
BCVA가 인간 대상체에서 치료될 눈의 BCVA인 방법.
18.
단락 1 내지 17 중 어느 하나에 있어서,
항-hVEGF 항체가 항-hVEGF 항원-결합 단편인 방법.
19.
단락 18에 있어서,
항원-결합 단편이 Fab인 방법.
20.
단락 18에 있어서,
항원-결합 단편이 F(ab')2인 방법.
21.
단락 18에 있어서,
항원-결합 단편이 단일쇄 가변 도메인(scFv)인 방법.
22.
단락 1 내지 21 중 어느 하나에 있어서,
항-hVEGF 항체가 서열번호 1 또는 서열번호 3의 아미노산 서열을 포함하는 중쇄, 및 서열번호 2, 또는 서열번호 4의 아미노산 서열을 포함하는 경쇄를 포함하는 것인 방법.
23.
단락 1 내지 21 중 어느 하나에 있어서,
항-hVEGF 항체가 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 17-19 또는 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하는 것인 방법.
24.
단락 22에 있어서,
경쇄 CDR3의 제2 아미노산 잔기가 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는 것인 방법.
25.
단락 23에 있어서,
경쇄 CDR3의 제2 아미노산 잔기가 아세틸화되지 않는 것인 방법.
26.
단락 23 또는 24에 있어서,
경쇄 CDR1의 제8 및 제11 아미노산 잔기 각각이 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하는 것인 방법.
27.
단락 22 내지 25 중 어느 하나에 있어서,
항-hVEGF 항체가 서열번호 20의 중쇄 CDR1을 포함하고 중쇄 CDR1의 최종 아미노산 잔기가 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는 것인 방법.
28.
단락 26에 있어서,
중쇄 CDR1의 최종 아미노산 잔기가 아세틸화되지 않는 것인 방법.
29.
단락 26 또는 27에 있어서,
중쇄 CDR1의 제9 아미노산 잔기가 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 중쇄 CDR2의 제3 아미노산 잔기가 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하는 것인 방법.
30.
단락 1 내지 29 중 어느 하나에 있어서,
발현 벡터가 AAV 벡터인 방법.
31.
단락 30에 있어서,
발현 벡터가 AAV8 벡터인 방법.
4. 도면의 간단한 설명
도 1. 베바시주맙 Fab(하부)에서 5 개의 상이한 잔기를 나타내는 라니비주맙(상부)의 아미노산 서열. 가변 및 불변 중쇄(VH 및 CH) 및 경쇄(VL 및 VC)의 시작은 화살표(→)로 표시되며, CDR은 밑줄 그어진다. 비-컨센서스 당화 부위("Gsite") 및 티로신-O-황산화 부위("Ysite")가 표시된다.
도 2. HuGlyFabVEGFi에 부착될 수 있는 글리칸. (Bondt et al., 2014, Mol & Cell Proteomics 13.1: 3029-3039로부터 채택됨).
도 3. 라니비주맙(상부) 및 베바시주맙 Fab(하부)의 초고당화된 변이체의 아미노산 서열. 가변 및 불변 중쇄(VH 및 CH) 및 경쇄(VL 및 VC)의 시작은 화살표(→)로 표시되며, CDR은 밑줄 그어진다. 비-컨센서스 당화 부위("Gsite") 및 티로신-O-황산화 부위("Ysite")가 표시된다. 4 개의 초고당화된 변이체가 별표(*)로 표시된다.
도 4. 벡터 1의 망막하 주사가 투여된 Rho/VEGF 마우스에서 신혈관 면적에서의 용량-의존적 감소. Rho/VEGF 마우스에게 벡터 1 또는 대조군(PBS 또는 1x1010 GC/눈의 공(empty) 벡터)의 표시된 용량을 망막하로 주사하고, 1 주 후에 망막 신혈관형성 면적을 정량하였다. 마우스/그룹의 수는 각각의 막대 상에 표시된다. *는 0.0019 내지 0.0062의 p 값을 나타내고; **는 p 값 <0.0001을 나타낸다.
도 5. 벡터 1이 망막하 주사로 투여된 Tet/옵신/VEGF 마우스에서 망막 박리의 발생과 심각성에서의 감소. Tet/옵신/VEGF 마우스에게 벡터 1 또는 대조군(PBS 또는 1x1010 GC/눈의 공 벡터)의 표시된 용량을 망막하로 주사하였다. 10일 후, 음용수에 독시사이클린을 첨가하여 VEGF 발현을 유도하고, 4일 후, 전체 망막 박리, 부분 박리, 또는 무 박리의 존재에 대해 눈을 평가하였다.
도 6. 3 개의 상이한 VEGF 중화 단백질에 대한 발현 카세트의 망막하 주사 후 단백질 수준. 항-VEGFfab, 항-VEGF 전장 항체(Ab), 및 가용성 Flt1에 대한 cDNA를 CMV 프로모터 및 토끼 β-글로빈 폴리 A 시그널을 함유한 동일한 발현 카세트 내로 삽입하고 AAV8 내에 패키징하였다. 성체 C57BL/6 마우스에게 한쪽 눈에 3x109 GC의 망막하 주사가 주어졌다. 주사 후 14 일에, 마우스를 안락사시키고, 망막을 해부하였으며, 각각의 전이유전자의 수준을 ELISA에 의해 측정하였다. 각각의 막대는 첫번째 2 개의 막대에 대해 n = 6 및 세번째 막대에 대해 n = 22를 이용한 평균(±SEM)을 나타낸다.
도 7a. AAV8-항VEGFfab 게놈의 도식.
도 7b. 성체 C57BL/6 마우스에게 1010 게놈 카피(GC)의 공 AAV8 벡터 또는 1x108 내지 1x1010 GC의 AAV8-항VEGFfab의 용량의 망막하 주사가 주어졌다. 7 일 후, 마우스를 안락사시켰으며, 눈을 제거하고 에세이까지 냉동하였다. 눈을 용균 버퍼에서 균질화하였으며 AAV8-항VEGFfab 단백질을 ELISA에 의해 측정하였다. 막대는 각각의 막대에 대해 n = 또는 각각의 막대에 대해 n ≥을 이용한 평균(±SEM)을 나타낸다.
도 8a. AAV8-항VEGFfab의 망막하 주사는 rho/VEGF 마우스에서 3 형 맥락막 신혈관형성을 억제한다. 출생후 14 일차(P)에, 로돕신 프로모터가 광수용기에서 인간 VEGF165의 발현을 추진하는 rho/VEGF 트랜스제닉 마우스에게 1x1010 GC의 공 AAV8, 3x106 내지 1x1010 GC의 AAV8-항VEGFfab의 용량, 또는 포스페이트-완충 염수(PBS)의 망막하 주사가 주어졌다. P21에, 혈관 세포를 염색하는 FITC-라벨링된 Griffonia Simplicifolia 렉틴으로 망막 평면 표면고정(flat mount)을 염색하였다. PBS-주사된 눈으로부터의 망막 평면 표면고정은 고배율(상부 열, 중심)에서 망막의 깊은 모세혈관상으로부터 유래되어 망막하 공간 내로 연장된 것으로 보이는 많은 신혈관형성(NV) 싹을 나타내었다. 공 벡터가 주사된 눈은 PBS-주사된 눈에서 보이는 것과 유사한 많은 NV 싹을 나타내었다(상부 열, 우측). 반면에, 1010 GC, 3x109 GC, 또는 109 GC의 AAV8-항VEGFfab가 주사된 눈으로부터의 평면 표면고정은 NV 싹을 거의 나타내지 않았고(제2 열), 3x108 GC 내지 107 GC의 용량이 투여된 눈으로부터의 평면 표면고정은 중간 수의 NV 싹을 나타내었으며(제2 및 제3 열), 3x106 GC가 주사된 눈은 대조군 눈과 유사해보였다. 축척 바 = 100 ㎛.
도 8b. 망막 당 NV의 면적을 측정하기 위해 이미지 분석을 사용하였으며 막대는 평균(± SEM)을 나타낸다. 다중 비교를 위한 본페로니(Bonferroni) 교정을 이용한 ANOVA에 의한 공 벡터로부터의 차이에 대해 *p<0.05; **p<0.01.
도 9a, 9b. 성체 Tet/옵신/VEGF 이중 트랜스제닉 마우스에게 한쪽 눈에 1x108 내지 1x1010 GC 범위의 용량의 AAV8-항VEGFfab를 망막하 주사하고 다른 눈에 주사하지 않거나 한쪽 눈에 1 x 1010 GC의 영(null) 벡터를 주사하고 다른 눈에 PBS를 주사하였다. 주사 후 10 일에, 2 mg/mL의 독시사이클린을 음용수에 첨가하고 4 일 후 총, 부분, 또는 무 망막 박리의 존재에 대해 안저 사진을 등급을 매기고 박리 %를 각각의 눈에 대해 측정하였다. 대표적인 안저 사진은 PBS 또는 공 벡터(B)가 주사된 마우스에서 나타난 것과 유사한 1x108 또는 3x109 GC의 AAV8-항VEGFfab(A, 좌측)가 주사된 마우스에서의 총 망막 박리를 나타낸다. 1x109 GC가 주사된 눈에서 부분 망막 박리가 있었으며 3x109 또는 1x1010 GC의 AAV8-항VEGFfab(A, 우측 3 개의 칼럼)가 주사된 눈에서는 망막 박리가 없었다.
도 9c. 3x109 GC의 AAV8-항VEGFfab가 주사된 눈으로부터의 훽스트(Hoechst)로 염색된 안구 절편은 망막 박리를 나타내지 않은 한편, 주사되지 않은 다른 눈으로부터의 절편은 총 망막 박리를 나타내었다.
도 9d. 파이 차트는 AAV8-항VEGFfab가 주사된 눈에서의 삼출성 망막 박리에서 용량-의존적 감소를 나타낸다.
도 9e. 피셔 시험(Fisher's test)에 의해 수행된 P-값은 상이한 용량에 대해 공 벡터 그룹으로부터 무, 부분, 또는 총 박리의 존재에 관한 차이점이 있는지 여부를 나타내었다. 평균 (± SEM) % 망막 박리는 다중 비교를 위한 본페로니 교정을 이용한 일원 ANOVA에 의해 임의의 다른 그룹에 비해 3x109 또는 1x1010 GC의 AAV8-항VEGFfab가 주사된 눈에 대해 상당히 적었다(*p=0.002, **p=0.001).
도 10a. 성체 Tet/옵신/VEGF 이중 트랜스제닉 마우스에게 한쪽 눈에 3x109 GC AAV8-항VEGFfab를 망막하 주사하고 다른 눈에 주사하지 않거나 한쪽 눈에 3x109 GC의 영 벡터를 주사하고 다른 눈에 주사하지 않았다. 주사 후 1 개월에, 2 mg/mL의 독시사이클린을 음용수에 첨가하고 4 일 후 총, 부분, 또는 무 망막 박리의 존재에 대해 안저 사진을 등급을 매기고 박리된 망막의 %를 각각의 눈에서 측정하였다. 3x109 GC의 AAV8-항VEGFfab가 주사된 대표적인 마우스로부터의 안저 사진은 주사된 눈에서 박리를 나타내지 않고 다른 눈에서 총 박리를 나타낸 한편(A, 좌측 2 개 패널), 3x109 GC 공 벡터가 주사된 대표적인 마우스로부터의 것은 각각의 눈에서 심각한 총 망막 박리를 나타내었다(A, 우측 2 개 패널).
도 10b. 3x109 GC의 AAV8-항VEGFfab가 주사된 마우스로부터의 훽스트로 염색된 안구 절편은 주사된 눈에서 부착된 망막 및 다른 눈에서 총 박리를 나내었다(B, 좌측 2 개 패널). 3x109 GC 공 벡터가 주사된 마우스로부터의 안구 절편은 각각의 눈에서 총 망막 박리를 나타내었다(B, 우측 2 개 패널).
도 10c. AAV8-antiVEGFfab가 주사된 10 개의 눈 중 9 개가 망막 박리를 갖지 않은 한편, 10 개의 다른 눈 중 8 개가 총 망막 박리를 가졌다(피셔 시험에 의해 p<0.001). 반면에, 공 벡터가 주사된 8 개의 눈 중 7 개 및 다른 눈은 총 망막 박리를 가졌다(p=1.0). 공 벡터가 주사된 눈과 비교하여, AAV8-항VEGFfab가 주사된 눈에서 망막 박리의 상당한 예방이 있었다(피셔 시험에 의해 p=0.001).
도 10d. AAV8-항VEGFfab가 주사된 눈(n=10)에서, 눈 당 평균(±SEM) % 망막 박리(RD)는 다른 눈(* p<0.001) 또는 공 벡터가 주사된 눈(n=8; † p=0.001, 본페로니 교정을 이용한 일원 ANOVA에 의함)에서의 것에 비해 상당히 적었다.
도 11. 표적 서열(서열번호 38 및 서열번호 39)을 도시한다.
도 12. 4 x 2.5 ㎍의 대조군 및 망막 세포주를 SDS-PAGE를 사용하여 분리하였다. ~25 kD의 밴드를 제외하였다.
도 13. 샘플 대조군에 대한 젤-기반 펩티드 맵핑(mapping) 결과. 데이터를 양측 서열(서열번호 38 및 서열번호 40)에 매칭시켰다. 상자 내의 아미노산 잔기 각각은 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 하나의 화학적 변형을 보유한다.
도 14. 샘플 대조군에 대한 용액-기반 펩티드 맵핑 결과. 데이터를 양측 서열(서열번호 38 및 서열번호 40)에 매칭시켰다. 상자 내의 아미노산 잔기 각각은 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 하나의 화학적 변형을 보유한다.
도 15a, 15b. 샘플 대조군에 대한 온전한 질량 결과. 관찰된 크로마토그램 내의 주요 피크를 합하여, 디콘볼루션(deconvolution)을 위한 스펙트럼을 얻었다(a). 스펙트럼을 24,432.0 Da 및 24,956.0 Da 평균 질량의 2 개의 성분으로 디콘볼루팅시켰다. 디콘볼루팅된 스펙트럼 및 주석이 달린 미가공 데이터를 도시한다(b).
도 16. 샘플 망막 세포주에 대한 젤-기반 펩티드 맵핑 결과. 데이터를 양측 서열(서열번호 38 및 서열번호 39)에 매칭시켰다. 상자 내의 아미노산 잔기 각각은 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 하나의 화학적 변형을 보유한다.
도 17a, 17b. 샘플 망막 세포주에 대한 온전한 질량 결과. 관찰된 크로마토그램 내의 주요 피크를 합하여, 디콘볼루션을 위한 스펙트럼을 얻었다(a). 스펙트럼을 24,428.0 Da 및 24,952.0 Da 평균 질량의 2 개의 성분으로 디콘볼루팅시켰다. 디콘볼루팅된 스펙트럼 및 주석이 달린 미가공 데이터를 도시한다(b).
도 18. AAV 캡시드 1 - 9(서열번호 41-51)의 Clustal 다중 서열 정렬. 아미노산 치환(하부 열에서 볼드체로 나타냄)이 다른 정렬된 AAV 캡시드의 상응하는 위치로부터 아미노산 잔기를 "모집"함으로써 AAV9 및 AAV8 캡시드에 대해 이루어질 수 있다. "HVR"로 표시된 서열 영역 = 초가변 영역.
도 19. AAV8.GFP의 맥락막상 주사 후 1 주 및 2 주 사이의 GFP 발현의 증가된 면적 및 강도. GFP의 평균(± SEM) 수준은 맥락막상 주사 후 1 주 및 2 주에 망막 및 RPE/맥락막의 파쇄액에서 높았다.
도 20a, 20b. AAV8.항VEGFfab의 맥락막상 주사가 주어진 눈 대 맥락막상 AAV8.GFP가 주어진 다른 눈에 대한 ELISA에 의한 유리체 샘플 내의 알부민의 측정(a). 동일하게 높은 수준의 항VEGFfab가 맥락막상 또는 망막하 AAV8.항VEGFfab가 주사된 눈에서 검출되었다(b).
도 21. ELISA에 의해 측정된 GFP의 평균(± SEM) 수준은 2 회 주사된 눈 대 1 회 주사된 눈으로부터의 RPE/맥락막의 파쇄액에서 상당히 높았다. 차이는 망막 파쇄액에 대해 유의하게 상이하지 않았다.
도 22. 사전 벡터 주사를 받지 않거나 2 또는 7 주 전에 AAV8.GFP의 SC 또는 SR 주사를 받은 눈, 및 항VEGFfab의 SC 또는 SR 주사를 받은 눈의 유리체 알부민 수준. 사전 벡터 주사를 받지 않거나 2 또는 7 주 전에 AAV8.GFP의 SC 또는 SR 주사를 받은 눈과 비교하여, 항VEGFfab의 SC 또는 SR 주사를 받은 눈은 유리체 알부민에서 상당히 적은 VEGF-유도된 증가를 나타내었다.
도 23. RPE/맥락막 및 망막 파쇄액에서 ELISA에 의한 항VEGFfab의 측정은 어느 시점에서도 SC 및 SR AAV8.항VEGFfab 사이의 상당한 차이를 나타내지 않았다.
도 24. Clearside® Biomedical, Inc.에 의해 제조된 맥락막상 약물 전달 장치.
도 25. Janssen Pharmaceuticals, Inc.에 의해 제조된, 소형 바늘이 망막하 공간 내로 주사되는, 후극을 향해 맥락막상 공간을 통해 삽입되고 뚫릴 수 있는 카테터를 포함하는 망막하 약물 전달 장치.
도 26a-26d. 후방 공막옆 데포 수술의 예시.
도 1. 베바시주맙 Fab(하부)에서 5 개의 상이한 잔기를 나타내는 라니비주맙(상부)의 아미노산 서열. 가변 및 불변 중쇄(VH 및 CH) 및 경쇄(VL 및 VC)의 시작은 화살표(→)로 표시되며, CDR은 밑줄 그어진다. 비-컨센서스 당화 부위("Gsite") 및 티로신-O-황산화 부위("Ysite")가 표시된다.
도 2. HuGlyFabVEGFi에 부착될 수 있는 글리칸. (Bondt et al., 2014, Mol & Cell Proteomics 13.1: 3029-3039로부터 채택됨).
도 3. 라니비주맙(상부) 및 베바시주맙 Fab(하부)의 초고당화된 변이체의 아미노산 서열. 가변 및 불변 중쇄(VH 및 CH) 및 경쇄(VL 및 VC)의 시작은 화살표(→)로 표시되며, CDR은 밑줄 그어진다. 비-컨센서스 당화 부위("Gsite") 및 티로신-O-황산화 부위("Ysite")가 표시된다. 4 개의 초고당화된 변이체가 별표(*)로 표시된다.
도 4. 벡터 1의 망막하 주사가 투여된 Rho/VEGF 마우스에서 신혈관 면적에서의 용량-의존적 감소. Rho/VEGF 마우스에게 벡터 1 또는 대조군(PBS 또는 1x1010 GC/눈의 공(empty) 벡터)의 표시된 용량을 망막하로 주사하고, 1 주 후에 망막 신혈관형성 면적을 정량하였다. 마우스/그룹의 수는 각각의 막대 상에 표시된다. *는 0.0019 내지 0.0062의 p 값을 나타내고; **는 p 값 <0.0001을 나타낸다.
도 5. 벡터 1이 망막하 주사로 투여된 Tet/옵신/VEGF 마우스에서 망막 박리의 발생과 심각성에서의 감소. Tet/옵신/VEGF 마우스에게 벡터 1 또는 대조군(PBS 또는 1x1010 GC/눈의 공 벡터)의 표시된 용량을 망막하로 주사하였다. 10일 후, 음용수에 독시사이클린을 첨가하여 VEGF 발현을 유도하고, 4일 후, 전체 망막 박리, 부분 박리, 또는 무 박리의 존재에 대해 눈을 평가하였다.
도 6. 3 개의 상이한 VEGF 중화 단백질에 대한 발현 카세트의 망막하 주사 후 단백질 수준. 항-VEGFfab, 항-VEGF 전장 항체(Ab), 및 가용성 Flt1에 대한 cDNA를 CMV 프로모터 및 토끼 β-글로빈 폴리 A 시그널을 함유한 동일한 발현 카세트 내로 삽입하고 AAV8 내에 패키징하였다. 성체 C57BL/6 마우스에게 한쪽 눈에 3x109 GC의 망막하 주사가 주어졌다. 주사 후 14 일에, 마우스를 안락사시키고, 망막을 해부하였으며, 각각의 전이유전자의 수준을 ELISA에 의해 측정하였다. 각각의 막대는 첫번째 2 개의 막대에 대해 n = 6 및 세번째 막대에 대해 n = 22를 이용한 평균(±SEM)을 나타낸다.
도 7a. AAV8-항VEGFfab 게놈의 도식.
도 7b. 성체 C57BL/6 마우스에게 1010 게놈 카피(GC)의 공 AAV8 벡터 또는 1x108 내지 1x1010 GC의 AAV8-항VEGFfab의 용량의 망막하 주사가 주어졌다. 7 일 후, 마우스를 안락사시켰으며, 눈을 제거하고 에세이까지 냉동하였다. 눈을 용균 버퍼에서 균질화하였으며 AAV8-항VEGFfab 단백질을 ELISA에 의해 측정하였다. 막대는 각각의 막대에 대해 n = 또는 각각의 막대에 대해 n ≥을 이용한 평균(±SEM)을 나타낸다.
도 8a. AAV8-항VEGFfab의 망막하 주사는 rho/VEGF 마우스에서 3 형 맥락막 신혈관형성을 억제한다. 출생후 14 일차(P)에, 로돕신 프로모터가 광수용기에서 인간 VEGF165의 발현을 추진하는 rho/VEGF 트랜스제닉 마우스에게 1x1010 GC의 공 AAV8, 3x106 내지 1x1010 GC의 AAV8-항VEGFfab의 용량, 또는 포스페이트-완충 염수(PBS)의 망막하 주사가 주어졌다. P21에, 혈관 세포를 염색하는 FITC-라벨링된 Griffonia Simplicifolia 렉틴으로 망막 평면 표면고정(flat mount)을 염색하였다. PBS-주사된 눈으로부터의 망막 평면 표면고정은 고배율(상부 열, 중심)에서 망막의 깊은 모세혈관상으로부터 유래되어 망막하 공간 내로 연장된 것으로 보이는 많은 신혈관형성(NV) 싹을 나타내었다. 공 벡터가 주사된 눈은 PBS-주사된 눈에서 보이는 것과 유사한 많은 NV 싹을 나타내었다(상부 열, 우측). 반면에, 1010 GC, 3x109 GC, 또는 109 GC의 AAV8-항VEGFfab가 주사된 눈으로부터의 평면 표면고정은 NV 싹을 거의 나타내지 않았고(제2 열), 3x108 GC 내지 107 GC의 용량이 투여된 눈으로부터의 평면 표면고정은 중간 수의 NV 싹을 나타내었으며(제2 및 제3 열), 3x106 GC가 주사된 눈은 대조군 눈과 유사해보였다. 축척 바 = 100 ㎛.
도 8b. 망막 당 NV의 면적을 측정하기 위해 이미지 분석을 사용하였으며 막대는 평균(± SEM)을 나타낸다. 다중 비교를 위한 본페로니(Bonferroni) 교정을 이용한 ANOVA에 의한 공 벡터로부터의 차이에 대해 *p<0.05; **p<0.01.
도 9a, 9b. 성체 Tet/옵신/VEGF 이중 트랜스제닉 마우스에게 한쪽 눈에 1x108 내지 1x1010 GC 범위의 용량의 AAV8-항VEGFfab를 망막하 주사하고 다른 눈에 주사하지 않거나 한쪽 눈에 1 x 1010 GC의 영(null) 벡터를 주사하고 다른 눈에 PBS를 주사하였다. 주사 후 10 일에, 2 mg/mL의 독시사이클린을 음용수에 첨가하고 4 일 후 총, 부분, 또는 무 망막 박리의 존재에 대해 안저 사진을 등급을 매기고 박리 %를 각각의 눈에 대해 측정하였다. 대표적인 안저 사진은 PBS 또는 공 벡터(B)가 주사된 마우스에서 나타난 것과 유사한 1x108 또는 3x109 GC의 AAV8-항VEGFfab(A, 좌측)가 주사된 마우스에서의 총 망막 박리를 나타낸다. 1x109 GC가 주사된 눈에서 부분 망막 박리가 있었으며 3x109 또는 1x1010 GC의 AAV8-항VEGFfab(A, 우측 3 개의 칼럼)가 주사된 눈에서는 망막 박리가 없었다.
도 9c. 3x109 GC의 AAV8-항VEGFfab가 주사된 눈으로부터의 훽스트(Hoechst)로 염색된 안구 절편은 망막 박리를 나타내지 않은 한편, 주사되지 않은 다른 눈으로부터의 절편은 총 망막 박리를 나타내었다.
도 9d. 파이 차트는 AAV8-항VEGFfab가 주사된 눈에서의 삼출성 망막 박리에서 용량-의존적 감소를 나타낸다.
도 9e. 피셔 시험(Fisher's test)에 의해 수행된 P-값은 상이한 용량에 대해 공 벡터 그룹으로부터 무, 부분, 또는 총 박리의 존재에 관한 차이점이 있는지 여부를 나타내었다. 평균 (± SEM) % 망막 박리는 다중 비교를 위한 본페로니 교정을 이용한 일원 ANOVA에 의해 임의의 다른 그룹에 비해 3x109 또는 1x1010 GC의 AAV8-항VEGFfab가 주사된 눈에 대해 상당히 적었다(*p=0.002, **p=0.001).
도 10a. 성체 Tet/옵신/VEGF 이중 트랜스제닉 마우스에게 한쪽 눈에 3x109 GC AAV8-항VEGFfab를 망막하 주사하고 다른 눈에 주사하지 않거나 한쪽 눈에 3x109 GC의 영 벡터를 주사하고 다른 눈에 주사하지 않았다. 주사 후 1 개월에, 2 mg/mL의 독시사이클린을 음용수에 첨가하고 4 일 후 총, 부분, 또는 무 망막 박리의 존재에 대해 안저 사진을 등급을 매기고 박리된 망막의 %를 각각의 눈에서 측정하였다. 3x109 GC의 AAV8-항VEGFfab가 주사된 대표적인 마우스로부터의 안저 사진은 주사된 눈에서 박리를 나타내지 않고 다른 눈에서 총 박리를 나타낸 한편(A, 좌측 2 개 패널), 3x109 GC 공 벡터가 주사된 대표적인 마우스로부터의 것은 각각의 눈에서 심각한 총 망막 박리를 나타내었다(A, 우측 2 개 패널).
도 10b. 3x109 GC의 AAV8-항VEGFfab가 주사된 마우스로부터의 훽스트로 염색된 안구 절편은 주사된 눈에서 부착된 망막 및 다른 눈에서 총 박리를 나내었다(B, 좌측 2 개 패널). 3x109 GC 공 벡터가 주사된 마우스로부터의 안구 절편은 각각의 눈에서 총 망막 박리를 나타내었다(B, 우측 2 개 패널).
도 10c. AAV8-antiVEGFfab가 주사된 10 개의 눈 중 9 개가 망막 박리를 갖지 않은 한편, 10 개의 다른 눈 중 8 개가 총 망막 박리를 가졌다(피셔 시험에 의해 p<0.001). 반면에, 공 벡터가 주사된 8 개의 눈 중 7 개 및 다른 눈은 총 망막 박리를 가졌다(p=1.0). 공 벡터가 주사된 눈과 비교하여, AAV8-항VEGFfab가 주사된 눈에서 망막 박리의 상당한 예방이 있었다(피셔 시험에 의해 p=0.001).
도 10d. AAV8-항VEGFfab가 주사된 눈(n=10)에서, 눈 당 평균(±SEM) % 망막 박리(RD)는 다른 눈(* p<0.001) 또는 공 벡터가 주사된 눈(n=8; † p=0.001, 본페로니 교정을 이용한 일원 ANOVA에 의함)에서의 것에 비해 상당히 적었다.
도 11. 표적 서열(서열번호 38 및 서열번호 39)을 도시한다.
도 12. 4 x 2.5 ㎍의 대조군 및 망막 세포주를 SDS-PAGE를 사용하여 분리하였다. ~25 kD의 밴드를 제외하였다.
도 13. 샘플 대조군에 대한 젤-기반 펩티드 맵핑(mapping) 결과. 데이터를 양측 서열(서열번호 38 및 서열번호 40)에 매칭시켰다. 상자 내의 아미노산 잔기 각각은 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 하나의 화학적 변형을 보유한다.
도 14. 샘플 대조군에 대한 용액-기반 펩티드 맵핑 결과. 데이터를 양측 서열(서열번호 38 및 서열번호 40)에 매칭시켰다. 상자 내의 아미노산 잔기 각각은 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 하나의 화학적 변형을 보유한다.
도 15a, 15b. 샘플 대조군에 대한 온전한 질량 결과. 관찰된 크로마토그램 내의 주요 피크를 합하여, 디콘볼루션(deconvolution)을 위한 스펙트럼을 얻었다(a). 스펙트럼을 24,432.0 Da 및 24,956.0 Da 평균 질량의 2 개의 성분으로 디콘볼루팅시켰다. 디콘볼루팅된 스펙트럼 및 주석이 달린 미가공 데이터를 도시한다(b).
도 16. 샘플 망막 세포주에 대한 젤-기반 펩티드 맵핑 결과. 데이터를 양측 서열(서열번호 38 및 서열번호 39)에 매칭시켰다. 상자 내의 아미노산 잔기 각각은 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 하나의 화학적 변형을 보유한다.
도 17a, 17b. 샘플 망막 세포주에 대한 온전한 질량 결과. 관찰된 크로마토그램 내의 주요 피크를 합하여, 디콘볼루션을 위한 스펙트럼을 얻었다(a). 스펙트럼을 24,428.0 Da 및 24,952.0 Da 평균 질량의 2 개의 성분으로 디콘볼루팅시켰다. 디콘볼루팅된 스펙트럼 및 주석이 달린 미가공 데이터를 도시한다(b).
도 18. AAV 캡시드 1 - 9(서열번호 41-51)의 Clustal 다중 서열 정렬. 아미노산 치환(하부 열에서 볼드체로 나타냄)이 다른 정렬된 AAV 캡시드의 상응하는 위치로부터 아미노산 잔기를 "모집"함으로써 AAV9 및 AAV8 캡시드에 대해 이루어질 수 있다. "HVR"로 표시된 서열 영역 = 초가변 영역.
도 19. AAV8.GFP의 맥락막상 주사 후 1 주 및 2 주 사이의 GFP 발현의 증가된 면적 및 강도. GFP의 평균(± SEM) 수준은 맥락막상 주사 후 1 주 및 2 주에 망막 및 RPE/맥락막의 파쇄액에서 높았다.
도 20a, 20b. AAV8.항VEGFfab의 맥락막상 주사가 주어진 눈 대 맥락막상 AAV8.GFP가 주어진 다른 눈에 대한 ELISA에 의한 유리체 샘플 내의 알부민의 측정(a). 동일하게 높은 수준의 항VEGFfab가 맥락막상 또는 망막하 AAV8.항VEGFfab가 주사된 눈에서 검출되었다(b).
도 21. ELISA에 의해 측정된 GFP의 평균(± SEM) 수준은 2 회 주사된 눈 대 1 회 주사된 눈으로부터의 RPE/맥락막의 파쇄액에서 상당히 높았다. 차이는 망막 파쇄액에 대해 유의하게 상이하지 않았다.
도 22. 사전 벡터 주사를 받지 않거나 2 또는 7 주 전에 AAV8.GFP의 SC 또는 SR 주사를 받은 눈, 및 항VEGFfab의 SC 또는 SR 주사를 받은 눈의 유리체 알부민 수준. 사전 벡터 주사를 받지 않거나 2 또는 7 주 전에 AAV8.GFP의 SC 또는 SR 주사를 받은 눈과 비교하여, 항VEGFfab의 SC 또는 SR 주사를 받은 눈은 유리체 알부민에서 상당히 적은 VEGF-유도된 증가를 나타내었다.
도 23. RPE/맥락막 및 망막 파쇄액에서 ELISA에 의한 항VEGFfab의 측정은 어느 시점에서도 SC 및 SR AAV8.항VEGFfab 사이의 상당한 차이를 나타내지 않았다.
도 24. Clearside® Biomedical, Inc.에 의해 제조된 맥락막상 약물 전달 장치.
도 25. Janssen Pharmaceuticals, Inc.에 의해 제조된, 소형 바늘이 망막하 공간 내로 주사되는, 후극을 향해 맥락막상 공간을 통해 삽입되고 뚫릴 수 있는 카테터를 포함하는 망막하 약물 전달 장치.
도 26a-26d. 후방 공막옆 데포 수술의 예시.
5. 발명의 상세한 설명
VEGF에 대한 완전 인간 번역후 변형된(HuPTM) 항체를, 안구 질환, 특히 증가된 신혈관형성에 의해 야기된 안구 질환, 예를 들어 nAMD("습성 AMD"로도 알려짐), 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 환자(인간 대상체)의 눈(들)내의 망막/유리체 액에 전달하기 위한 조성물 및 방법이 기재된다. 항체는, 비제한적으로, 단클론 항체, 다클론 항체, 재조합적으로 생산된 항체, 인간 항체, 인간화 항체, 키메라 항체, 합성 항체, 2 개의 중쇄 및 2 개의 경쇄 분자를 포함하는 사량체 항체, 항체 경쇄 단량체, 항체 중쇄 단량체, 항체 경쇄 이량체, 항체 중쇄 이량체, 항체 경쇄-중쇄 쌍, 인트라바디, 이종콘쥬게이트(heteroconjugate) 항체, 1가 항체, 전장 항체의 항원-결합 단편, 및 상기 것의 융합 단백질을 포함한다. 이러한 항원-결합 단편은, 비제한적으로, 단일-도메인 항체(중쇄 항체(VHH)의 가변 도메인 또는 나노바디), 전장 항-VEGF 항체(바람직하게는, 전장 항-VEGF 단클론 항체(mAb))의 Fab, F(ab')2, 및 scFv(단일쇄 가변 단편)(본원에서 전체적으로 "항원-결합 단편"으로서 지칭됨)를 포함한다. 바람직한 실시양태에서, VEGF에 대한 완전 인간 번역후 변형된 항체는 VEGF에 대한 단클론 항체(mAb)의 완전 인간 번역후 변형된 항원-결합 단편("HuPTMFabVEGFi")이다. 추가로 바람직한 실시양태에서, HuPTMFabVEGFi는 항-VEGF mAb의 완전 인간 당화된 항원-결합 단편("HuGlyFabVEGFi")이다. 또한, 국제 특허 출원 공개 WO/2017/180936호(2017년 4월 14일자로 출원된 국제 특허 출원 PCT/US2017/027529호), 및 국제 특허 출원 공 WO/2017/181021호(2017년 4월 14일자로 출원된 국제 특허 출원 PCT/US2017/027650호)를 참고하며, 이들 각각은 본원에 기재된 발명에 따라 사용될 수 있는 조성물 및 방법에 대해 그 전체가 본원에 참고로 포함된다. 대안적 실시양태에서, 전장 mAb가 사용될 수 있다. 전달은 유전자 요법을 통해 - 예를 들어, 항-VEGF 항원-결합 단편 또는 mAb(또는 초고당화된 유도체)를 코딩하는 바이러스 벡터 또는 다른 DNA 발현 구조체를 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)로 진단된 환자(인간 대상체)의 눈(들) 내의 맥락막상 공간, 망막하 공간(경유리체 접근법으로부터 또는 맥락막상 공간을 통해 카테터로), 망막내 공간, 및/또는 공막 외면(즉, 공막옆 투여)에 투여하여, 인간 PTM, 예를 들어 인간-당화된, 전이유전자 산물을 연속적으로 공급하는 영구적 저장소를 눈에서 생성함으로써 이루어질 수 있다. 예를 들어, 섹션 5.3.2에 기재된 투여 방식을 참고한다. 바람직한 실시양태에서, 본원에 제공된 방법은 습성 AMD로 진단된 환자(인간 대상체)에서 사용된다.
이러한 유전자 요법이 투여되는 대상체는 항-VEGF 요법에 대해 반응성인 대상체여야 한다. 특별한 실시양태에서, 본 방법은 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단되고 항-VEGF 항체를 이용한 치료에 대해 반응성으로 확인된 환자를 치료하는 것을 포함한다. 더욱 구체적인 실시양태에서, 환자는 항-VEGF 항원-결합 단편을 이용한 치료에 대해 반응성이다. 특정 실시양태에서, 환자는 유전자 요법으로 치료하기 전에 유리체내로 주사된 항-VEGF 항원-결합 단편을 이용한 치료에 대해 반응성인 것으로 나타났다. 구체적 실시양태에서, 환자는 이전에 LUCENTIS®(라니비주맙), EYLEA®(아플리베르셉트), 및/또는 AVASTIN®(베바시주맙)으로 치료되었으며, 상기 LUCENTIS®(라니비주맙), EYLEA®(아플리베르셉트), 및/또는 AVASTIN®(베바시주맙) 중 1 이상에 대해 반응성인 것으로 밝혀졌다.
이러한 바이러스 벡터 또는 다른 DNA 발현 구조체가 전달되는 대상체는 바이러스 벡터 또는 발현 구조체 내의 전이유전자에 의해 코딩되는 항-VEGF 항원-결합 단편에 대해 반응성이어야 한다. 반응성을 결정하기 위해, 항-hVEGF 항원-결합 단편 전이유전자 산물(예를 들어, 세포 배양, 생물반응기 등에서 생산됨)은 유리체내 주사에 의해서와 같이, 대상체에 직접 투여될 수 있다.
전이유전자에 의해 코딩된 HuPTMFabVEGFi, 예를 들어 HuGlyFabVEGFi는, 비제한적으로, 베바시주맙과 같은 hVEGF에 결합하는 항체의 항원-결합 단편; 라니비주맙과 같은 항-hVEGF Fab 모이어티; 또는 Fab 도메인 상에 추가의 당화 부위를 함유하도록 조작된 이러한 베바시주맙 또는 라니비주맙 Fab 모이어티를 포함할 수 있다(예를 들어, 전장 항체의 Fab 도메인 상에서 초고당화된 베바시주맙의 유도체의 설명을 위해 그 전체가 본원에 참고로 포함되는 Courtois et al., 2016, mAbs 8: 99-112 참고).
전이유전자를 전달하기 위해 사용되는 재조합 벡터는 인간 망막 세포 또는 광수용기 세포에 대해 향성을 가져야 한다. 이러한 벡터는 비-복제성 재조합 아데노-연관 바이러스 벡터("rAAV")를 포함할 수 있으며, 특히 AAV8 캡시드를 보유한 것이 바람직하다. 그러나, 비제한적으로, 렌티바이러스 벡터, 백시니아 바이러스 벡터, 또는 "네이키드 DNA" 구조체로 지칭되는 비-바이러스 발현 벡터를 포함하는 다른 바이러스 벡터가 사용될 수 있다. 바람직하게는, HuPTMFabVEGFi, 예를 들어 HuGlyFabVEGFi, 전이유전자는 적절한 발현 제어 요소, 몇가지 예를 들자면, 예를 들어 CB7 프로모터(닭 β-액틴 프로모터 및 CMV 인핸서), RPE65 프로모터, 또는 옵신 프로모터에 의해 제어되어야 하며, 벡터에 의해 추진되는 전이유전자의 발현을 향상시키는 다른 발현 제어 요소를 포함할 수 있다(예를 들어, 인트론, 예컨대 닭 β-액틴 인트론, 미세생쥐바이러스(MVM) 인트론, 인간 인자 IX 인트론(예를 들어, FIX 절단된 인트론 1), β-글로빈 스플라이스 공여체/면역글로불린 중쇄 스플라이스 수용체 인트론, 아데노바이러스 스플라이스 공여체/면역글로불린 스플라이스 수용체 인트론, SV40 후기 스플라이스 공여체/스플라이스 수용체(19S/16S) 인트론, 및 하이브리드 아데노바이러스 스플라이스 공여체/IgG 스플라이스 수용체 인트론 및 폴리A 시그널, 예컨대 토끼 β-글로빈 폴리A 시그널, 인간 성장 호르몬(hGH) 폴리A 시그널, SV40 후기 폴리A 시그널, 합성 폴리A(SPA) 시그널, 및 소 성장 호르몬(bGH) 폴리A 시그널). 예를 들어, Powell and Rivera-Soto, 2015, Discov. Med., 19(102):49-57를 참고한다.
바람직한 실시양태에서, 유전자 요법 구조체는 중쇄 및 경쇄 둘 다가 발현되도록 설계된다. 더욱 구체적으로, 중쇄 및 경쇄는 대략 동일한 양으로 발현되어야 하며, 다시 말해, 중쇄 및 경쇄는 대략 1:1 비의 중쇄 대 경쇄로 발현된다. 중쇄 및 경쇄를 위한 코딩 서열은, 중쇄와 경쇄가 절단가능한 링커 또는 IRES에 의해 분리되어 분리된 중쇄 및 경쇄 폴리펩티드가 발현되는 단일 구조체로 조작될 수 있다. 예를 들어, 구체적인 리더 서열에 대해서는 섹션 5.2.4 및 구체적인 IRES, 2A 및 본원에서 제공되는 방법 및 조성물과 사용될 수 있는 다른 링커 서열에 대해서는 섹션 5.2.5를 참고한다.
맥락막상, 망막하, 공막옆 및/또는 망막내 투여를 위해 적합한 약학 조성물은 생리학적 양립성 수성 버퍼, 계면활성제 및 선택적 부형제를 포함하는 제형 버퍼 내의 재조합(예를 들어, rHuGlyFabVEGFi) 벡터의 현탁액을 포함한다.
재조합 벡터의 치료적 유효 용량은 ≥ 0.1 mL 내지 ≤ 0.5 mL, 바람직하게는 0.1 내지 0.30 mL(100 - 300 μL) 범위의 부피로, 및 가장 바람직하게는 0.25 mL(250 μL)의 부피로 망막하로 및/또는 망막내로 투여(예를 들어, 경유리체 접근법을 통한 망막하 주사(외과적 수술), 또는 맥락막상 공간을 통한 망막하 투여에 의함)되어야 한다. 재조합 벡터의 치료적 유효 용량은 100 μL 이하의 부피로, 예를 들어 50-100 μL의 부피로 맥락막상으로 투여(예를 들어, 맥락막상 주사에 의함)되어야 한다. 재조합 벡터의 치료적 유효 용량은 500 μL 이하의 부피로, 예를 들어 500 μL 이하의 부피로, 예를 들어 10-20 μL, 20-50 μL, 50-100 μL, 100-200 μL, 200-300 μL, 300-400 μL, 또는 400-500 μL의 부피로 공막 외면에 투여되어야 한다. 망막하 주사는 국소 마취 하에서 대상체의 부분 유리체절제술 및 망막 내로 유전자 요법의 주사를 포함하는, 숙련된 망막 외과의에 의해 수행되는 외과적 수술이다. (예를 들어, 그 전체가 본원에 참고로 포함되는 Campochiaro et al., 2017, Hum Gen Ther 28(1):99-111 참고). 구체적 실시양태에서, 망막하 투여는 소형 바늘이 망막하 공간 내로 주사되는, 맥락막상 공간을 통해 후극으로 삽입되고 뚫릴 수 있는 카테터를 포함하는 망막하 약물 전달 장치를 사용하여 맥락막상 공간을 통해 수행된다(예를 들어, Baldassarre et al., 2017, Subretinal Delivery of Cells via the Suprachoroidal Space: Janssen Trial. In: Schwartz et al. (eds) Cellular Therapies for Retinal Disease, Springer, Cham; 국제 특허 출원 공개 WO 2016/040635 A1호 참고; 이들 각각은 그 전체가 본원에 참고로 포함됨). 맥락막상 투여 수술은 눈의 맥락막상 공간에 대한 약물의 투여를 포함하고, 보통 맥락막상 약물 전달 장치, 예컨대 미세바늘이 있는 미량주사기를 사용하여 수행된다(예를 들어, Hariprasad, 2016, Retinal Physician 13: 20-23; Goldstein, 2014, Retina Today 9(5): 82-87 참고; 이들 각각은 그 전체가 본원에 참고로 포함됨). 본원에 기재된 발명에 따라 맥락막상 공간 내에 발현 벡터를 배치하기 위해 사용될 수 있는 맥락막상 약물 전달 장치는, 비제한적으로, Clearside® Biomedical, Inc.에 의해 제조된 맥락막상 약물 전달 장치(예를 들어, Hariprasad, 2016, Retinal Physician 13: 20-23 참고)를 포함한다. 본원에 기재된 발명에 따라 맥락막상 공간을 통해 망막하 공간 내에 발현 벡터를 배치하기 위해 사용될 수 있는 망막하 약물 전달 장치는, 비제한적으로, Janssen Pharmaceuticals, Inc.에 의해 제조된 망막하 약물 전달 장치(예를 들어, 국제 특허 출원 공개 WO 2016/040635 A1호 참고)를 포함한다. 구체적 실시양태에서, 공막 외면에 대한 투여는 팁이 공막 표면에 대해 직접 병치로 삽입되고 유지될 수 있는 캐뉼라를 포함하는 공막옆 약물 전달 장치에 의해 수행된다. 상이한 방식의 투여의 더욱 상세내용은 섹션 5.3.2를 참고한다. 맥락막상, 망막하, 공막옆 및/또는 망막내 투여는 가용성 전이유전자 산물을 망막, 유리체 액, 및/또는 방수로 전달되게 해야 한다. 망막 세포, 예를 들어 간상, 원뿔, 망막 색소 상피, 수평, 양극, 아마크린, 신경절, 및/또는 뮬러 세포에 의한 전이유전자 산물(예를 들어, 코딩된 항-VEGF 항체)의 발현은 망막, 유리체 액 및/또는 방수에서 전이유전자 산물의 전달 및 유지를 야기한다. 유리체 액에서 적어도 0.330 ㎍/mL, 또는 방수(눈의 전방)에서 0.110 ㎍/mL의 Cmin에서 전이유전자 산물의 농도를 3 개월 동안 유지하는 용량이 바람직하며; 그 후, 1.70 내지 6.60 ㎍/mL 범위의 전이유전자 산물의 유리체 Cmin 농도, 및/또는 0.567 내지 2.20 ㎍/mL 범위의 방수 Cmin 농도가 유지되어야 한다. 그러나, 전이유전자 산물은 연속적으로 생산되므로, 더 낮은 농도의 유지가 효과적일 수 있다. 전이유전자 산물의 농도는 치료된 눈의 유리체 액 및/또는 전방으로부터의 방수의 환자 샘플에서 측정될 수 있다. 대안적으로, 유리체 액 농도는 전이유전자 산물의 환자의 혈청 농도를 측정함으로써 추정 및/또는 모니터링될 수 있다 - 전이유전자 산물에 대한 전신 대 유리체 노출의 비는 약 1:90,000이다. (예를 들어, 그 전체가 본원에 참고로 포함되는 Xu L, et al., 2013, Invest. Opthal. Vis. Sci. 54: 1616-1624, at p. 1621 및 Table 5 at p. 1623에서 보고된 라니비주맙의 유리체 액 및 혈청 농도 참고).
본 발명은 시간 경과에 따라 소멸되어 최고 및 최저 수준을 야기하는 VEGF 억제제의 고용량 볼루스의 반복되는 안구 주사를 포함하는 케어 치료의 표준에 비해 여러 이점을 갖는다. 항체를 반복적으로 주사하는 것과 반대로, 전이유전자 산물 항체의 지속적인 발현은 작용 부위에서 더욱 일관된 수준의 항체가 존재하도록 하며, 더 적은 주사가 필요하도록 하여 더 적은 의사 방문을 야기하므로 환자를 위해 덜 위험하고 더 편리하다. 일관된 단백질 생산은 망막에서 다시 튀어나오는 부종이 발생할 가능성이 더 적기 때문에 양호한 임상 결과를 야기할 수 있다. 또한, 전이유전자로부터 발현된 항체는 번역 동안 및 번역 후 존재하는 상이한 미세환경 때문에 직접적으로 주사되는 것과 상이한 방식으로 번역후 변형된다. 임의의 특정 이론에 구애됨 없이, 이는 상이한 확산, 생활성, 분포, 친화성, 약동학 및 면역원성 특징을 갖는 항체를 야기하여, 직접적으로 주사된 항체와 비교하여, 작용 부위에 전달된 항체가 "바이오베터"이도록 한다.
또한, 생체내에서 전이유전자로부터 발현된 항체는 단백질 응집 및 단백질 산화와 같은, 재조합 기술에 의해 생산된 항체와 연관된 분해 산물을 함유할 가능성이 적다. 응집은 높은 단백질 농도, 제조 장비 및 용기와의 표면 상호작용, 및 특정 버퍼 시스템을 이용한 정제로 인한 단백질 생산 및 저장과 연관된 문제이다. 응집을 촉진하는 이들 조건은 유전자 요법에서의 전이유전자 발현에서는 존재하지 않는다. 메티오닌, 트립토판, 및 히스티딘 산화와 같은 산화는 또한 단백질 생산 및 저장과 연관되며, 스트레스가 가해진 세포 배양 조건, 금속 및 공기 접촉, 및 버퍼와 부형제 내의 불순물에 의해 야기된다. 생체내에서 전이유전자로부터 발현된 단백질은 또한 스트레스가 가해진 조건에서 산화될 수 있다. 그러나, 인간 및 많은 다른 유기체는 항산화 방어 시스템을 구비하여, 산화 스트레스를 감소시킬 뿐만 아니라, 때로는 또한 산화를 회복 및/또는 역전시킨다. 따라서, 생체내에서 생산된 단백질은 산화된 형태로 있을 가능성이 적다. 응집 및 산화 둘 다는 역가, 약동학(소거) 및 면역원성에 영향을 줄 수 있다.
이론에 구애됨없이, 본원에서 제공되는 방법 및 조성물은 부분적으로 다음 원리를 기본으로 한다:
(i) 인간 망막 세포는 망막 세포에서 왕성한 과정인 당화 및 티로신-O-황산화를 비롯한, 분비된 단백질의 번역후 처리를 위한 세포 조직을 보유하는 분비 세포이다. (예를 들어, 망막 세포에 의한 당단백질의 생산을 보고하는 Wang et al., 2013, Analytical Biochem. 427: 20-28 및 Adamis et al., 1993, BBRC 193: 631-638; 및 망막 세포에 의해 분비되는 티로신-황산화된 당단백질의 생산을 보고하는 Kanan et al., 2009, Exp. Eye Res. 89: 559-567 및 Kanan & Al-Ubaidi, 2015, Exp. Eye Res. 133: 126-131을 참고하며, 이들 각각은 인간 망막 세포에 의해 이루어지는 번역후 변형에 대해 그 전체가 참고로 포함됨).
(ii) 당업계의 이해와 반대로, 라니비주맙과 같은 항-VEGF 항원-결합 단편(및 베바시주맙과 같은 전장 항-VEGF mAb의 Fab 도메인)은 사실상 N-연결 당화 부위를 보유한다. 예를 들어, 라니비주맙의 VH 도메인(Q115GT) 및 VL 도메인(TFQ100GT) 내의 당화 부위인 글루타민("Q") 잔기(및 베바시주맙의 Fab 내의 상응하는 부위)뿐만 아니라, CH 도메인(TVSWN165SGAL) 및 CL 도메인(QSGN158SQE) 내의 비-컨센서스 아스파라긴("N") 당화 부위를 확인하는 도 1을 참고한다. (예를 들어, Valliere-Douglass et al., 2009, J. Biol. Chem. 284: 32493-32506, 및 Valliere-Douglass et al., 2010, J. Biol. Chem. 285: 16012-16022를 참고하며, 이들 각각은 항체 내의 N-연결 당화 부위의 확인에 대해 그 전체가 참고로 포함됨).
(iii) 이러한 비-정규적인 부위가 보통 항체 집단의 낮은 수준 당화(예를 들어, 약 1-5%)를 야기하는 반면, 기능적 이익은 눈과 같은 면역학적특권을 가진 장기에서는 상당할 수 있다(예를 들어, van de Bovenkamp et al., 2016, J. Immunol. 196:1435-1441 참고). 예를 들어, Fab 당화는 항체의 안정성, 반감기, 및 결합 특징에 영향을 줄 수 있다. 그의 표적에 대한 항체의 친화성에 대한 Fab 당화의 효과를 결정하기 위해, 당업자에게 알려진 임의의 기술, 예를 들어 효소 연결 면역흡착 분석(ELISA), 또는 표면 플라즈몬 공명(SPR)이 사용될 수 있다. 항체의 반감기에 대한 Fab 당화의 효과를 결정하기 위해, 당업자에게 알려진 임의의 기술, 예를 들어 방사성라벨링된 항체가 투여된 대상체에서 혈액 또는 장기(예를 들어, 눈)에서의 방사성활성 수준의 측정이 이용될 수 있다. 항체의 안정성, 예를 들어 응집 또는 단백질 풀림의 수준에 대한 Fab 당화의 효과를 결정하기 위해, 당업자에게 알려진 임의의 기술, 예를 들어 시차 주사 열량계(DSC), 고성능 액체 크로마토그래피(HPLC), 예를 들어 크기 배제 고성능 액체 크로마토그래피(SEC-HPLC), 모세관 전기영동, 질량 분광법, 또는 탁도 측정이 사용될 수 있다. 본원에서 제공되는 HuPTMFabVEGFi, 예를 들어 HuGlyFabVEGFi, 전이유전자는 비-정규적인 부위에서 0.5%, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 또는 10% 이상 당화된 Fab의 생산을 야기한다. 특정 실시양태에서, Fab 집단으로부터의 0.5%, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 또는 10% 이상의 Fab가 비-정규적인 부위에서 당화된다. 특정 실시양태에서, 0.5%, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 또는 10% 이상의 비-정규적인 부위가 당화된다. 특정 실시양태에서, 이들 비-정규적인 부위에서 Fab의 당화는 HEK293 세포에서 생산된 Fab 내의 이들 비-정규적인 부위의 당화의 양에 비해 25%, 50%, 100%, 200%, 300%, 400%, 500% 이상 더 크다.
(iv) 당화 부위에 더하여, 라니비주맙(및 베바시주맙의 Fab)과 같은 항-VEGF Fab는 CDR 내에서 또는 그 근처에서 티로신("Y") 황산화 부위를 함유하며; 라니비주맙의 VH(EDTAVY94Y95) 및 VL(EDFATY86) 도메인 내의 티로신-O-황산화 부위(및 베바시주맙의 Fab 내의 상응하는 부위)를 확인하는 도 1을 참고한다. (예를 들어, 단백질 티로신 황산화를 거친 티로신 잔기 주변의 아미노산의 분석에 대해 그 전체가 참고로 포함되는 Yang et al., 2015, Molecules 20:2138-2164, 특히, p. 2154를 참고함. "규칙"은 다음과 같이 요약될 수 있음: Y의 +5 내지 -5 위치 이내에 E 또는 D를 가진 Y 잔기, 및 Y의 위치 -1은 중성 또는 산성 전하를 가진 아미노산이지만 황산화를 없애는 염기성 아미노산, 예를 들어, R, K, 또는 H는 아님). 인간 IgG 항체는 N-말단 변형, C-말단 변형, 아미노산 잔기의 분해 또는 산화, 시스테인 관련 변이체, 및 당화와 같은 많은 다른 번역후 변형을 나타낼 수 있다(예를 들어, Liu et al., 2014, mAbs 6(5):1145-1154 참고).
(v) 인간 망막 세포에 의한 라니비주맙 또는 베바시주맙의 Fab 단편과 같은, 항-VEGF Fab의 당화는 전이유전자 산물의 안정성, 반감기를 개선하고 원치않는 응집 및/또는 면역원성을 감소시킬 수 있는 글리칸의 추가를 야기할 것이다(예를 들어, Fab 당화의 드러난 중요성의 리뷰를 위해 Bovenkamp et al., 2016, J. Immunol. 196: 1435-1441을 참고). 중요하게도, 본원에서 제공되는 HuPTMFabVEGFi, 예를 들어 HuGlyFabVEGFi에 추가될 수 있는 글리칸은 2,6-시알산(예를 들어, HuPTMFabVEGFi, 예를 들어 HuGlyFabVEGFi 내로 통합될 수 있는 글리칸을 도시하는 도 2 참고) 및 양분 GlcNAc를 함유하지만 NGNA(N-글리콜릴뉴라민산, Neu5Gc)는 함유하지 않는 고도로 처리된 복합체-형 바이안테너리 N-글리칸이다. 이러한 글리칸은 라니비주맙(대장균에서 만들어지며 전혀 당화되지 않음)에서 또는 베바시주맙(이 번역후 변형을 만들기 위해 요구되는 2,6-시알릴트랜스퍼라제를 갖지 않으며, Neu5Ac(NANA) 대신에 인간에 대해 통상적이지 않은(또한 잠재적으로 면역원성인) 시알산으로서 Neu5Gc(NGNA)를 추가하지만 양분 GlcNAc를 생산하지 않는 CHO 세포에서 만들어짐)에서 존재하지 않는다. 예를 들어, Dumont et al., 2015, Crit. Rev. Biotechnol. (2015년 9월 18일에 온라인으로 조기 공개됨, pp. 1-13 at p. 5)를 참고한다. 또한, CHO 세포는 면역원성 글리칸인 α-Gal 항원을 생산할 수도 있으며, 이는 대부분의 개체에서 존재하는 항-α-Gal 항체와 반응하고, 높은 농도는 아나필락시스를 촉발시킬 수 있다. 예를 들어, Bosques, 2010, Nat Biotech 28: 1153-1156을 참고한다. 본원에서 제공되는 HuPTMFabVEGFi, 예를 들어 HuGlyFabVEGFi의 인간 당화 패턴은 전이유전자 산물의 면역원성을 감소시키고 효능을 개선해야 한다.
(vi) 라니비주맙 또는 베바시주맙의 Fab 단편과 같은 항-VEGF Fab의 티로신-황산화 - 인간 망막 세포에서 왕성한 번역후 과정 -는 VEGF에 대해 증가된 결합활성을 가진 전이유전자 산물을 야기할 수 있다. 사실상, 다른 표적에 대한 치료 항체의 Fab의 티로신-황산화는 항원에 대한 결합활성 및 활성을 극적으로 증가시키는 것으로 나타났다(예를 들어, Loos et al., 2015, PNAS 112: 12675-12680, 및 Choe et al., 2003, Cell 114: 161-170 참고). 이러한 번역후 변형은 라니비주맙(티로신-황산화를 위해 요구되는 효소를 보유하지 않는 대장균 숙주에서 만들어짐) 상에 존재하지 않으며, 기껏해야 베바시주맙 - CHO 세포 산물에서 불충분하게 나타난다. 인간 망막 세포와 달리, CHO 세포는 분비성 세포가 아니며 번역후 티로신-황산화를 위해 제한된 능력을 갖는다. (예를 들어, Mikkelsen & Ezban, 1991, Biochemistry 30: 1533-1537, 특히, p. 1537에서의 논의를 참고).
전술한 이유로, HuPTMFabVEGFi, 예를 들어 HuGlyFabVEGFi의 생산은 유전자 요법을 통해 - 예를 들어, 형질도입된 망막 세포에 의해 생산된 완전-인간 번역후 변형된, 예를 들어 인간-당화된, 황산화된 전이유전자 산물을 연속적으로 공급하는 영구적 저장소를 눈에서 생성하기 위하여, HuPTMFabVEGFi, 예를 들어 HuGlyFabVEGFi를 코딩하는 바이러스 벡터 또는 다른 DNA 발현 구조체를 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)로 진단된 환자(인간 대상)의 눈(들) 내의 맥락막상 공간, 망막하 공간, 또는 공막 외면에 투여함으로써(예를 들어, 맥락막상 주사, 경유리체 접근법을 통한 망막하 주사(외과적 수술), 맥락막상 공간을 통한 망막하 투여, 또는 후방 공막옆 데포 수술에 의함), 이루어진 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)의 치료를 위한 "바이오베터" 분자를 야기해야 한다. FabVEGFi를 위한 cDNA 구조체는 형질도입된 망막 세포에 의한 적절한 번역과 동시에 그리고 번역후 처리(당화 및 단백질 황산화)를 보장하는 시그널 펩티드를 포함해야 한다. 망막 세포에 의해 사용되는 이러한 시그널 서열은, 비제한적으로, 다음을 포함할 수 있다:
· MNFLLSWVHW SLALLLYLHH AKWSQA(VEGF-A 시그널 펩티드)
· MERAAPSRRV PLPLLLLGGL ALLAAGVDA(피부린-1 시그널 펩티드)
· MAPLRPLLIL ALLAWVALA(비트로넥틴 시그널 펩티드)
· MRLLAKIICLMLWAICVA(보체 인자 H 시그널 펩티드)
· MRLLAFLSLL ALVLQETGT(옵티신 시그널 펩티드)
· MKWVTFISLLFLFSSAYS(알부민 시그널 펩티드)
· MAFLWLLSCWALLGTTFG(키모트립시노겐 시그널 펩티드)
· MYRMQLLSCIALILALVTNS(인터루킨-2 시그널 펩티드)
· MNLLLILTFVAAAVA(트립시노겐-2 시그널 펩티드).
· 예를 들어, Stern et al., 2007, Trends Cell. Mol. Biol., 2:1-17 및 Dalton & Barton, 2014, Protein Sci, 23: 517-525를 참고하며, 이들 각각은 사용될 수 있는 시그널 펩티드에 대해 그 전체가 본원에 참고로 포함된다.
대안으로서, 또는 유전자 요법에 대한 추가적 치료로서, HuPTMFabVEGFi 산물, 예를 들어, HuGlyFabVEGFi 당단백질이 재조합 DNA 기술에 의해 인간 세포주에서 생산되고, 유리체내 주사에 의해 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)으로 진단된 환자에게 투여될 수 있다. HuPTMFabVEGFi 산물, 예를 들어, 당단백질은 또한 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)을 갖는 환자에게 투여될 수 있다. 이러한 재조합 당단백질 생산을 위해 사용될 수 있는 인간 세포주는 몇몇을 들자면, 비제한적으로, 인간 배아 신장 293 세포(HEK293), 섬유육종 HT-1080, HKB-11, CAP, HuH-7, 및 망막 세포주, PER.C6, 또는 RPE를 포함한다(예를 들어, HuPTMFabVEGFi 산물, 예를 들어, HuGlyFabVEGFi 당단백질의 재조합 생산을 위해 사용될 수 있는 인간 세포주의 리뷰를 위해 그 전체가 참고로 포함되는 Dumont et al., 2015, Crit. Rev. Biotechnol.(2015년 9월 18일에 온라인으로 조기 공개됨,, pp. 1-13) "Human cell lines for biopharmaceutical manufacturing: history, status, and future perspectives" 참고). 완전한 당화, 특히 시알화, 및 티로신-황산화를 보장하기 위하여, 생산을 위해 사용되는 세포주는 숙주 세포가 α-2,6-시알릴트랜스퍼라제(또는 α-2,3- 및 α-2,6-시알릴트랜스퍼라제 둘 다) 및/또는 망막 세포에서 티로신-O-황산화를 책임지는 TPST-1 및 TPST-2 효소를 공동-발현하도록 조작함으로써 향상될 수 있다.
다른 이용가능한 치료의 전달이 수반되는 눈/망막에 대한 HuPTMFabVEGFi, 예를 들어 HuGlyFabVEGFi의 전달의 조합이 본원에서 제공되는 방법에 의해 포함된다. 추가의 치료는 유전자 요법 치료 전에, 그와 동시에 또는 그에 이어서 투여될 수 있다. 본원에서 제공되는 유전자 요법과 조합될 수 있는 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)을 위해 이용가능한 치료는, 비제한적으로, 레이저 광응고법, 베르테포르핀을 이용한 광선역학적 요법, 및, 비제한적으로, 페갑타닙, 라니비주맙, 아플리베르셉트 또는 베바시주맙을 포함하는 항-VEGF 약제를 이용한 유리체내(IVT) 주사를 포함한다. 생물의약품과 같은 항-VEGF 약제를 이용한 추가 치료는 "구제" 요법으로서 지칭될 수 있다.
소분자 약물과 달리, 생물의약품은 보통 상이한 역가, 약동학, 및 안전성 프로파일을 갖는 상이한 변형 또는 형태를 가진 많은 변이체의 혼합물을 포함한다. 유전자 요법 또는 단백질 요법 접근에서 생산되는 모든 분자가 완전히 당화되고 황산화될 필요는 없다. 오히려, 생산된 당단백질 집단은 효능을 입증하기 위해 2,6-시알화 및 황산화를 비롯한, 충분한 당화(집단의 약 1% 내지 약 10%)를 가져야 한다. 본원에서 제공되는 유전자 요법 치료의 목표는 망막 변성의 진행을 늦추거나 정지시키고, 최소의 개입/침습성 수술을 이용하여 시력 손실을 늦추거나 예방하는 것이다. 효능은 BCVA(최고 교정 시력), 안압, 세극등 생체현미경검사, 간접적 검안, SD-OCT(SD-광간섭 단층촬영술), 망막전위도검사(ERG)를 측정함으로써 모니터링될 수 있다. 시력손실, 감염, 염증 및 망막 박리를 비롯한 다른 안전성 이벤트의 징후 또한 모니터링될 수 있다. 망막 두께는 본원에서 제공되는 치료의 효능을 결정하기 위해 모니터링될 수 있다. 임의의 특별한 이론에 구애됨 없이, 망막의 두께는 임상적 판독정보로서 사용될 수 있으며, 망막 두께에서 감소가 더 크거나 또는 망막이 두꺼워지기 전 기간이 더 길수록, 치료는 더 효과적이다. 망막 두께는 예를 들어, SD-OCT에 의해 결정될 수 있다. SD-OCT는 관심 물체로부터 반사된 후방산란된 광의 반사 시간 지연 및 양을 결정하기 위해 저-간섭성 간섭계를 사용하는 삼차원 영상화 기술이다. OCT는 3 내지 15 ㎛ 축방향 해상력으로 조직 샘플(예를 들어, 망막)의 층을 스캔하기 위해 사용될 수 있으며, SD-OCT는 이전 형태의 기술에 비해 축방향 해상력 및 스캔 속도를 개선한다(Schuman, 2008, Trans. Am. Opthamol. Soc. 106:426-458). 망막 기능은 예를 들어, ERG에 의해 결정될 수 있다. ERG는 인간에서의 사용을 위해 FDA에 의해 승인된, 망막 기능의 비-침습성 전기생리학적 시험이며, 눈의 광 민감성 세포(간상 및 원뿔), 및 이들의 연결 신경절 세포, 특히 플래쉬 자극에 대한 그들의 반응을 검사한다.
5.1 N-당화, 티로신 황산화, 및 O-당화
본원에 기재된 방법에서 사용되는 HuPTMFabVEGFi, 예를 들어 HuGlyFabVEGFi의 항-VEGF 항원-결합 단편의 아미노산 서열(일차 서열)은 N-당화 또는 티로신 황산화가 발생하는 적어도 하나의 부위를 포함한다. 특정 실시양태에서, 항-VEGF 항원-결합 단편의 아미노산 서열은 적어도 하나의 N-당화 부위 및 적어도 하나의 티로신 황산화 부위를 포함한다. 이러한 부위는 하기에서 상세히 기재된다. 특정 실시양태에서, 항-VEGF 항원-결합 단편의 아미노산 서열은 적어도 하나의 O-당화 부위를 포함하며, 이는 상기 아미노산 서열에 존재하는 1 이상의 N-당화 부위 및/또는 티로신 황산화 부위에 더하여 있을 수 있다.
5.1.1 N-당화
역(reverse) 당화 부위
정규적인 N-당화 서열은 Asn-X-Ser(또는 Thr)인 것으로 당업계에 알려져 있되, X는 Pro를 제외한 임의의 아미노산일 수 있다. 그러나, 최근에는 인간 항체의 아스파라긴(Asn) 잔기가 역 컨센서스 모티프, Ser(또는 Thr)-X-Asn의 맥락에서 당화될 수 있되, X는 Pro를 제외한 임의의 아미노산일 수 있음이 입증되었다. Valliere- Douglass et al., 2009, J. Biol. Chem. 284:32493-32506; 및 Valliere-Douglass et al., 2010, J. Biol. Chem. 285:16012-16022를 참고한다. 본원에 개시된 바와 같이, 그리고 최신 이해와 반대로, 본원에 기재된 방법에 따라 사용하기 위한 항-VEGF 항원-결합 단편, 예를 들어 라니비주맙은 이러한 역 컨센서스 서열 여러개를 포함한다. 따라서, 본원에 기재된 방법은 서열 Ser(또는 Thr)-X-Asn을 포함하는 적어도 하나의 N-당화 부위(또한, 본원에서 "역 N-당화 부위"로 지칭됨)를 포함하는 항-VEGF 항원-결합 단편의 사용을 포함하되, X는 Pro를 제외한 임의의 아미노산일 수 있다.
특정 실시양태에서, 본원에 기재된 방법은 서열 Ser(또는 Thr)-X-Asn을 포함하는 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 개, 또는 10 초과의 N-당화 부위를 포함하는 항-VEGF 항원-결합 단편의 사용을 포함하되, X는 Pro를 제외한 임의의 아미노산일 수 있다. 특정 실시양태에서, 본원에 기재된 방법은 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 개, 또는 10 초과의 역 N-당화 부위뿐 아니라, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 개, 또는 10 초과의 비-컨센서스 N-당화 부위(본원에서 하기에서 정의됨)를 포함하는 항-VEGF 항원-결합 단편의 사용을 포함한다.
구체적 실시양태에서, 본원에 기재된 방법에서 사용되는 1 이상의 역 N-당화 부위를 포함하는 항-VEGF 항원-결합 단편은 각각 서열번호 1과 2의 경쇄 및 중쇄를 포함하는 라니비주맙이다. 다른 구체적 실시양태에서, 본 방법에서 사용되는 1 이상의 역 N-당화 부위를 포함하는 항-VEGF 항원-결합 단편은 각각 서열번호 3과 4의 경쇄 및 중쇄를 포함하는, 베바시주맙의 Fab를 포함한다.
비-컨센서스 당화 부위
역 N-당화 부위에 더하여, 최근에는 인간 항체의 글루타민(Gln) 잔기가 비-컨센서스 모티프, Gln-Gly-Thr의 맥락에서 당화될 수 있음이 입증되었다. Valliere-Douglass et al., 2010, J. Biol. Chem. 285:16012-16022를 참고한다. 놀랍게도, 본원에 기재된 방법에 따라 사용하기 위한 항-VEGF 항원-결합 단편, 예를 들어 라니비주맙은 이러한 비-컨센서스 서열 여러개를 포함한다. 따라서, 본원에 기재된 방법은 서열 Gln-Gly-Thr를 포함하는 적어도 하나의 N-당화 부위(본원에서 "비-컨센서스 N-당화 부위"로도 지칭됨)를 포함하는 항-VEGF 항원-결합 단편의 사용을 포함한다.
특정 실시양태에서, 본원에 기재된 방법은 서열 Gln-Gly-Thr를 포함하는 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 개, 또는 10 초과의 N-당화 부위를 포함하는 항-VEGF 항원-결합 단편의 사용을 포함한다.
구체적 실시양태에서, 본원에 기재된 방법에서 사용되는 1 이상의 비-컨센서스 N-당화 부위를 포함하는 항-VEGF 항원-결합 단편은 (각각 서열번호 1과 2의 경쇄 및 중쇄를 포함하는) 라니비주맙이다. 다른 구체적 실시양태에서, 본 방법에서 사용되는 1 이상의 비-컨센서스 N-당화 부위를 포함하는 항-VEGF 항원-결합 단편은 (각각 서열번호 3과 4의 경쇄 및 중쇄를 포함하는) 베바시주맙의 Fab를 포함한다.
조작된 N-당화 부위
특정 실시양태에서, 항-VEGF 항원-결합 단편을 코딩하는 핵산은 정상적으로 HuGlyFabVEGFi와 연관되는 것보다(예를 들어, 그의 비변형 상태의 항-VEGF 항원-결합 단편과 연관된 N-당화 부위의 수에 비해) 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 개, 또는 그 이상의 N-당화 부위(정규적인 N-당화 컨센서스 서열, 역 N-당화 부위, 및 비-컨센서스 N-당화 부위를 포함함)를 포함하도록 변형된다. 구체적 실시양태에서, 당화 부위의 도입은, 상기 도입이 항원-결합 단편이 그의 항원인 VEGF에 결합하는 것에 영향을 주지 않는 한, 항원-결합 단편의 일차 구조 내의 어느 곳이든 N-당화 부위(정규적인 N-당화 컨센서스 서열, 역 N-당화 부위, 및 비-컨센서스 N-당화 부위를 포함함)를 삽입함으로써 이루어진다. 당화 부위의 도입은 예를 들어, 항원-결합 단편, 또는 항원-결합 단편이 유래되는 항체의 일차 구조에 새로운 아미노산을 첨가함으로써(즉, 전체적으로 또는 부분적으로 당화 부위가 첨가됨), 또는 N-당화 부위를 생성하기 위해 항원-결합 단편, 또는 항원-결합 단편이 유래되는 항체 내의 기존의 아미노산을 돌연변이시킴으로써(즉, 항원-결합 단편/항체에 아미노산이 추가되지 않지만, 항원-결합 단편/항체의 선택된 아미노산이 돌연변이되어 N-당화 부위를 형성함) 이루어질 수 있다. 당업자는 단백질의 아미노산 서열이 당업계에 알려진 접근법, 예를 들어 단백질을 코딩하는 핵산 서열의 변형을 포함하는 재조합 접근법을 사용하여 용이하게 변형될 수 있음을 인식할 것이다.
구체적 실시양태에서, 본원에 기재된 방법에서 사용되는 항-VEGF 항원-결합 단편은, 망막 세포에서 발현될 때, 초고당화될 수 있도록 변형된다. 그 전체가 본원에 참고로 포함되는 Courtois et al., 2016, mAbs 8:99-112를 참고한다. 구체적 실시양태에서, 상기 항-VEGF 항원-결합 단편은 (각각 서열번호 1과 2의 경쇄 및 중쇄를 포함하는) 라니비주맙이다. 다른 구체적 실시양태에서, 상기 항-VEGF 항원-결합 단편은 (각각 서열번호 3과 4의 경쇄 및 중쇄를 포함하는) 베바시주맙의 Fab를 포함한다.
항-VEGF 항원-결합 단편의 N-당화
소분자 약물과 달리, 생물의약품은 보통 상이한 역가, 약동학, 및 안전성 프로파일을 갖는 상이한 변형 또는 형태를 가진 많은 변이체의 혼합물을 포함한다. 유전자 요법 또는 단백질 요법 접근에서 생산되는 모든 분자가 완전히 당화되고 황산화될 필요는 없다. 오히려, 생산된 당단백질 집단은 효능을 입증하기 위해 (2,6-시알화를 비롯한) 충분한 당화 및 황산화를 가져야 한다. 본원에서 제공되는 유전자 요법 치료의 목표는 망막 변성의 진행을 늦추거나 정지시키고, 최소의 개입/침습성 수술을 이용하여 시력 손실을 늦추거나 예방하는 것이다.
구체적 실시양태에서, 본원에 기재된 방법에 따라 사용되는 항-VEGF 항원-결합 단편, 예를 들어 라니비주맙은 망막 세포에서 발현될 때, 이의 N-당화 부위의 100%에서 당화될 수 있다. 그러나, 당업자는 당화의 이익이 얻어지기 위해 항-VEGF 항원-결합 단편의 모든 N-당화 부위가 N-당화될 필요는 없음을 이해할 것이다. 오히려, 당화의 이익은 N-당화 부위의 단지 일정 %만이 당화될 때, 및/또는 발현된 항원-결합 단편의 단지 일정 %만이 당화될 때 실현될 수 있다. 따라서, 특정 실시양태에서, 본원에 기재된 방법에 따라 사용되는 항-VEGF 항원-결합 단편은 망막 세포에서 발현될 때, 이용가능한 N-당화 부위의 10% - 20%, 20% - 30%, 30% - 40%, 40% - 50%, 50% - 60%, 60% - 70%, 70% - 80%, 80% - 90%, 또는 90% - 100%에서 당화된다. 특정 실시양태에서, 망막 세포에서 발현될 때, 본원에 기재된 방법에 따라 사용되는 항-VEGF 항원-결합 단편의 10% - 20%, 20% - 30%, 30% - 40%, 40% - 50%, 50% - 60%, 60% - 70%, 70% - 80%, 80% - 90%, 또는 90% - 100%가 이들의 이용가능한 N-당화 부위 중 적어도 하나에서 당화된다.
구체적 실시양태에서, 항-VEGF 항원-결합 단편이 망막 세포에서 발현될 때, 본원에 기재된 방법에 따라 사용되는 항-VEGF 항원-결합 단편에 존재하는 N-당화 부위의 적어도 10%, 20% 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 또는 99%가 N-당화 부위에 존재하는 Asn 잔기(또는 다른 관련 잔기)에서 당화된다. 즉, 생성되는 HuGlyFabVEGFi의 N-당화 부위의 적어도 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 또는 99%가 당화된다.
다른 구체적 실시양태에서, 항-VEGF 항원-결합 단편이 망막 세포에서 발현될 때, 본원에 기재된 방법에 따라 사용되는 항-VEGF 항원-결합 단편에 존재하는 N-당화 부위의 적어도 10%, 20% 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 또는 99%가 N-당화 부위에 존재하는 Asn 잔기(또는 다른 관련 잔기)에 연결된 동일한 부착된 글리칸으로 당화된다. 즉, 생성되는 HuGlyFabVEGFi의 N-당화 부위의 적어도 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 또는 99%가 동일한 부착된 글리칸으로 당화된다.
본원에 기재된 방법에 따라 사용되는 항-VEGF 항원-결합 단편, 예를 들어 라니비주맙이 망막 세포에서 발현될 때, 항원-결합 단편의 N-당화 부위는 다양한 상이한 글리칸으로 당화될 수 있다. 항원-결합 단편의 N-글리칸은 당업계에서 특성규명되었다. 예를 들어, Bondt et al., 2014, Mol. & Cell. Proteomics 13.11:3029-3039(Fab-연관된 N-글리칸의 개시에 대해 그 전체가 본원에 참고로 포함됨)는 Fab와 연관된 글리칸을 규명하며, 항체의 Fab와 Fc 부분이 별개의 당화 패턴을 포함하며, Fab 글리칸이 갈락토실화, 시알화 및 양분(예를 들어, 양분 GlcNAc를 이용)에서 높지만 Fc 글리칸에 관하여 푸코실화에서는 낮음을 입증한다. Bondt와 같이, Huang et al., 2006, Anal. Biochem. 349:197-207(Fab-연관된 N-글리칸의 개시에 대해 그 전체가 본원에 참고로 포함됨)은 Fab의 대부분의 글리칸이 시알화됨을 밝혀내었다. 그러나, Huang에 의해 시험된 항체(뮤린 세포 배경에서 생산되었음)의 Fab에서는, 확인된 시알릭 잔기는 N-아세틸뉴라민산("Neu5Ac", 주된 인간 시알산) 대신에 N-글리콜일뉴라민산("Neu5Gc" 또는 "NeuGc")(인간에게는 자연적이지 않음)이었다. 또한, Song et al., 2014, Anal. Chem. 86:5661-5666(Fab-연관된 N-글리칸의 개시에 대해 그 전체가 본원에 참고로 포함됨)은 상업적으로 이용가능한 항체와 연관된 N-글리칸의 라이브러리를 기재한다.
중요하게도, 본원에 기재된 방법에 따라 사용되는 항-VEGF 항원-결합 단편, 예를 들어 라니비주맙이 인간 망막 세포에서 발현될 때, 원핵 숙주 세포(예를 들어, 대장균) 또는 진핵 숙주 세포(예를 들어, CHO 세포)에서 시험관내(in vitro) 생산의 필요가 피해진다. 대신에, 본원에 기재된 방법(예를 들어, 항-hVEGF 항원-결합 단편을 발현하기 위한 망막 세포의 사용)의 결과로서, 항-VEGF 항원-결합 단편의 N-당화 부위는 인간의 치료에 관련되며 이에 유익한 글리칸으로 유리하게 장식된다. 이러한 이점은 항체/항원-결합 단편 생산에서 CHO 세포 또는 대장균이 이용될 때 얻을 수 없으며, 이는 예를 들어, CHO 세포는 (1) 2,6 시알릴트랜스퍼라제를 발현하지 않으며 따라서 N-당화 동안 2,6 시알산을 추가할 수 없으며 (2) Neu5Ac 대신에 시알산으로서 Neu5Gc를 추가할 수 있기 때문에; 그리고 대장균은 N-당화에 필요한 성분을 자연적으로 함유하지 않기 때문이다. 따라서, 일 실시양태에서, 본원에 기재된 치료 방법에서 사용되는 HuGlyFabVEGFi를 생성시키기 위해 망막 세포에서 발현되는 항-VEGF 항원-결합 단편은, 단백질이 인간 망막 세포, 예를 들어, 망막 색소 세포에서 N-당화되는 방식으로 당화되지만, 단백질이 CHO 세포에서 당화되는 방식으로 당화되지는 않는다. 다른 실시양태에서, 본원에 기재된 치료 방법에서 사용되는 HuGlyFabVEGFi를 생성하기 위해 망막 세포에서 발현되는 항-VEGF 항원-결합 단편은, 단백질이 인간 망막 세포, 예를 들어, 망막 색소 세포에서 N-당화되는 방식으로 당화되며, 이러한 당화는 원핵 숙주 세포를 사용하여, 예를 들어, 대장균을 사용하여서는 자연적으로 가능하지 않다.
특정 실시양태에서, 본원에 기재된 방법에 따라 사용되는 HuGlyFabVEGFi, 예를 들어 라니비주맙은 인간 항체의 Fab와 연관된 1, 2, 3, 4, 5 개 또는 그 이상의 별개의 N-글리칸을 포함한다. 구체적 실시양태에서, 인간 항체의 Fab와 연관된 상기 N-글리칸은 Bondt et al., 2014, Mol. & Cell. Proteomics 13.11:3029-3039, Huang et al., 2006, Anal. Biochem. 349:197-207, 및/또는 Song et al., 2014, Anal. Chem. 86:5661-5666에서 기재된 것들이다. 특정 실시양태에서, 본원에 기재된 방법에 따라 사용되는 HuGlyFabVEGFi, 예를 들어, 라니비주맙은 검출가능한 NeuGc 및/또는 α-Gal 항원을 포함하지 않는다.
구체적 실시양태에서, 본원에 기재된 방법에 따라 사용되는 HuGlyFabVEGFi, 예를 들어 라니비주맙은 2,6-연결된 시알산을 포함하는 글리칸으로 주로 당화된다. 특정 실시양태에서, 2,6-연결된 시알산을 포함하는 HuGlyFabVEGFi는 폴리시알화되며, 즉 1 초과의 시알산을 함유한다. 특정 실시양태에서, 상기 HuGlyFabVEGFi의 각각의 N-당화 부위는 2,6-연결된 시알산을 포함하는 글리칸을 포함하며, 즉, 상기 HuGlyFabVEGFi의 N-당화 부위의 100%가 2,6-연결된 시알산을 포함하는 글리칸을 포함한다. 다른 구체적 실시양태에서, 본원에 기재된 방법에 따라 사용되는 HuGlyFabVEGFi의 N-당화 부위의 적어도 20%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 또는 99%가 2,6-연결된 시알산을 포함하는 글리칸으로 당화된다. 다른 구체적 실시양태에서, 본원에 기재된 방법에 따라 사용되는 HuGlyFabVEGFi의 N-당화 부위의 적어도 10% - 20%, 20% - 30%, 30% - 40%, 40% - 50%, 50% - 60%, 60% - 70%, 70% - 80%, 80% - 90%, 또는 90% - 99%가 2,6-연결된 시알산을 포함하는 글리칸으로 당화된다. 다른 구체적 실시양태에서, 본원에 기재된 방법에 따라 망막 세포에서 발현되는 항원-결합 단편(즉, HuGlyFabVEGFi, 예를 들어 라니비주맙을 생성시키는 항원-결합 단편)의 적어도 20%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 또는 99%가 2,6-연결된 시알산을 포함하는 글리칸으로 당화된다. 다른 구체적 실시양태에서, 본원에 기재된 방법에 따라 망막 세포에서 발현되는 항원-결합 단편(즉, HuGlyFabVEGFi, 예를 들어 라니비주맙을 생성시키는 Fab)의 적어도 10% - 20%, 20% - 30%, 30% - 40%, 40% - 50%, 50% - 60%, 60% - 70%, 70% - 80%, 80% - 90%, 또는 90% - 99%가 2,6-연결된 시알산을 포함하는 글리칸으로 당화된다. 다른 구체적 실시양태에서, 상기 시알산은 Neu5Ac이다. 이러한 실시양태에 따라, HuGlyFabVEGFi의 N-당화 부위의 단지 일정 %만이 2,6 시알화되거나 폴리시알화될 때, 나머지 N-당화는 별개의 N-글리칸을 포함하거나, N-글리칸을 전혀 포함하지 않을 수 있다(즉, 비-당화된채 남음).
HuGlyFabVEGFi가 2,6 폴리시알화될 때, 이는 다수의 시알산 잔기, 예를 들어, 2, 3, 4, 5, 6, 7, 8, 9, 10 개 또는 10 초과의 시알산 잔기를 포함한다. 특정 실시양태에서, HuGlyFabVEGFi가 폴리시알화될 때, 이는 2-5, 5-10, 10-20, 20-30, 30-40, 또는 40-50 개 시알산 잔기를 포함한다. 특정 실시양태에서, HuGlyFabVEGFi가 폴리시알화될 때, 이는 2,6-연결된 (시알산)n을 포함하되, n은 1-100의 임의의 수일 수 있다.
구체적 실시양태에서, 본원에 기재된 방법에 따라 사용되는 HuGlyFabVEGFi, 예를 들어 라니비주맙은 양분 GlcNAc를 포함하는 글리칸으로 주로 당화된다. 특정 실시양태에서, 상기 HuGlyFabVEGFi의 각각의 N-당화 부위는 양분 GlcNAc를 포함하는 글리칸을 포함하며, 즉 상기 HuGlyFabVEGFi의 N-당화 부위의 100%가 양분 GlcNAc를 포함하는 글리칸을 포함한다. 다른 구체적 실시양태에서, 본원에 기재된 방법에 따라 사용되는 HuGlyFabVEGFi의 N-당화 부위의 적어도 20%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 또는 99%가 양분 GlcNAc를 포함하는 글리칸으로 당화된다. 다른 구체적 실시양태에서, 본원에 기재된 방법에 따라 사용되는 HuGlyFabVEGFi의 N-당화 부위의 적어도 10% - 20%, 20% - 30%, 30% - 40%, 40% - 50%, 50% - 60%, 60% - 70%, 70% - 80%, 80% - 90%, 또는 90% - 99%가 양분 GlcNAc를 포함하는 글리칸으로 당화된다. 다른 구체적 실시양태에서, 본원에 기재된 방법에 따라 망막 세포에서 발현되는 항원-결합 단편(즉, HuGlyFabVEGFi, 예를 들어 라니비주맙을 생성시키는 항원-결합 단편)의 적어도 20%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 또는 99%가 양분 GlcNAc를 포함하는 글리칸으로 당화된다. 다른 구체적 실시양태에서, 본원에 기재된 방법에 따라 망막 세포에서 발현되는 항원-결합 단편(즉, HuGlyFabVEGFi, 예를 들어 라니비주맙을 생성시키는 항원-결합 단편)의 적어도 10% - 20%, 20% - 30%, 30% - 40%, 40% - 50%, 50% - 60%, 60% - 70%, 70% - 80%, 80% - 90%, 또는 90% - 99%가 양분 GlcNAc를 포함하는 글리칸으로 당화된다.
특정 실시양태에서, 본원에 기재된 방법에 따라 사용되는 HuGlyFabVEGFi, 예를 들어 라니비주맙은 초고당화되며, 즉 자연 발생 N-당화 부위로부터의 N-당화 생성물에 더하여, 상기 HuGlyFabVEGFi는 HuGlyFabVEGFi를 생성시키는 항원-결합 단편의 아미노산 서열에 존재하도록 조작된 N-당화 부위에서 글리칸을 포함한다. 특정 실시양태에서, 본원에 기재된 방법에 따라 사용되는 HuGlyFabVEGFi, 예를 들어 라니비주맙은 초고당화되지만 검출가능한 NeuGc 및/또는 α-Gal 항원을 포함하지 않는다.
항원-결합 단편을 비롯한 항체의 당화 패턴을 결정하기 위한 에세이는 당업계에 알려져 있다. 예를 들어, 하이드라진분해가 글리칸을 분석하기 위해 사용될 수 있다. 먼저, 다당류가 하이드라진과의 항온처리에 의해 이들의 연관된 단백질로부터 방출된다(Ludger Liberate Hydrazinolysis Glycan Release Kit, Oxfordshire, UK가 사용될 수 있음). 친핵체 하이드라진은 다당류와 담체 단백질 사이의 글리코시드 결합을 공격하고 부착된 글리칸을 방출시킨다. N-아세틸기는 이 처리 동안 손실되며 재-N-아세틸화에 의해 재구성되어야 한다. 글리칸은 또한 PNGase F 및 Endo H와 같은 글리코시다제 또는 엔도글리코시다제와 같은 효소를 이용하여 방출될 수 있으며, 이들은 하이드라진에 비해 적은 부반응으로 깨끗하게 절단한다. 유리 글리칸은 탄소 칼럼에서 정제되고 이어서 형광단 2-아미노 벤즈아미드를 이용하여 환원 말단에서 라벨링될 수 있다. 라벨링된 다당류는 Royle et al, Anal Biochem 2002, 304(1):70-90의 HPLC 프로토콜에 따라 GlycoSep-N 칼럼(GL Sciences)에서 분리될 수 있다. 생성되는 형광 크로마토그램은 다당류 길이 및 반복 단위의 수를 나타낸다. 구조적 정보는 개별 피크를 수집하고 이어서 MS/MS 분석을 수행함으로써 수집될 수 있다. 이에 의해 반복 단위의 단당류 조성 및 서열이 확인될 수 있으며 부가적으로 다당류 조성물의 균질성이 확인될 수 있다. 저 또는 고 분자량의 특이적 피크는 MALDI-MS/MS에 의해 분석될 수 있으며 그 결과는 글리칸 서열을 확인하기 위해 이용된다. 크로마토그램의 각각의 피크는 이의 특정 수의 반복 단위 및 단편, 예를 들어 당 잔기로 구성되는 중합체, 예를 들어 글리칸에 상응한다. 크로마토그램은 따라서 중합체, 예를 들어, 글리칸, 길이 분포를 측정하게 한다. 용리 시간은 중합체 길이에 대한 지표인 한편, 형광 강도는 각각의 중합체, 예를 들어 글리칸에 대한 몰 존재비와 상관된다. 항원-결합 단편과 연관된 글리칸을 평가하기 위한 다른 방법은 Bondt et al., 2014, Mol. & Cell. Proteomics 13.11:3029-3039, Huang et al., 2006, Anal. Biochem. 349:197-207, 및/또는 Song et al., 2014, Anal. Chem. 86:5661-5666에 의해 기재된 것들을 포함한다.
(항원-결합 단편을 비롯한) 항체와 연관된 글리칸 패턴의 균질성 또는 이질성은 글리칸 길이 또는 크기 및 당화 부위에 걸쳐서 존재하는 글리칸의 수 둘 다에 관련되므로, 당업계에 알려진 방법, 예를 들어 글리칸 길이 또는 크기 및 유체역학적 반경을 측정하는 방법을 사용하여 평가될 수 있다. 크기 배제, 정상 상, 역상, 및 음이온 교환 HPLC와 같은 HPLC뿐 아니라, 모세관 전기영동은 유체역학적 반경을 측정하게 한다. 단백질에서 더 높은 수의 당화 부위는 더 적은 당화 부위를 갖는 담체와 비교하여 유체역학적 반경에서 더 높은 변화를 야기한다. 그러나, 단일 글리칸 쇄가 분석될 때, 이들은 더욱 제어된 길이로 인해 더욱 균질할 수 있다. 글리칸 길이는 하이드라진분해, SDS PAGE, 및 모세관 젤 전기영동에 의해 측정될 수 있다. 또한, 균질성은 또한 특정 당화 부위 용법 패턴이 더 넓은/좁은 범위로 변함을 의미할 수 있다. 이들 인자는 글리코펩티드 LC-MS/MS에 의해 측정될 수 있다.
N-당화의 이익
N-당화는 본원에 기재된 방법에서 사용되는 HuGlyFabVEGFi에 많은 이익을 부여한다. 이러한 이익은, 대장균이 N-당화를 위해 필요한 성분을 자연적으로 보유하지 않으므로, 대장균에서의 항원-결합 단편의 생산에 의해 얻어질 수 없다. 또한, CHO 세포는 특정 글리칸(예를 들어, 2,6 시알산 및 양분 GlcNAc)의 추가를 위해 필요한 성분이 결핍되기 때문에 그리고 CHO 세포는 인간에게 통상적이지 않은 글리칸, 예를 들어 Neu5Gc를 추가할 수 있기 때문에, 일부 이익은, 예를 들어 CHO 세포에서의 항체 생산을 통해 얻어질 수 없다. 예를 들어, Song et al., 2014, Anal. Chem. 86:5661-5666을 참고한다. 따라서, 항-VEGF 항원-결합 단편, 예를 들어 라니비주맙이 비-정규적인 N-당화 부위(역 및 비-컨센서스 당화 부위 둘 다를 포함함)를 포함한다는 본원에 기재된 발견 덕분에, 이들의 당화(및 따라서 항원-결합 단편과 연관된 개선된 이익)를 야기하는 방식으로 이러한 항-VEGF 항원-결합 단편을 발현하는 방법이 실현되었다. 특히, 인간 망막 세포에서 항-VEGF 항원-결합 단편의 발현은, 그렇지 않으면 항원-결합 단편 또는 이들의 모 항체와 연관되지 않을 유익한 글리칸을 포함하는 HuGlyFabVEGFi(예를 들어, 라니비주맙)의 생산을 야기한다.
비-정규적인 당화 부위가 보통 항체 집단의 낮은 수준 당화(예를 들어, 약 1-5%)를 야기하는 반면, 기능적 이익은 눈과 같은 면역학적특권을 가진 장기에서는 상당할 수 있다(예를 들어, van de Bovenkamp et al., 2016, J. Immunol. 196:1435-1441 참고). 예를 들어, Fab 당화는 항체의 안정성, 반감기, 및 결합 특징에 영향을 줄 수 있다. 그의 표적에 대한 항체의 친화성에 대한 Fab 당화의 효과를 결정하기 위해, 당업자에게 알려진 임의의 기술, 예를 들어 효소 연결 면역흡착 분석(ELISA), 또는 표면 플라즈몬 공명(SPR)이 사용될 수 있다. 항체의 반감기에 대한 Fab 당화의 효과를 결정하기 위해, 당업자에게 알려진 임의의 기술, 예를 들어 방사성라벨링된 항체가 투여된 대상체에서 혈액 또는 장기(예를 들어, 눈)에서의 방사성활성 수준의 측정이 이용될 수 있다. 항체의 안정성, 예를 들어 응집 또는 단백질 풀림의 수준에 대한 Fab 당화의 효과를 결정하기 위해, 당업자에게 알려진 임의의 기술, 예를 들어 시차 주사 열량계(DSC), 고성능 액체 크로마토그래피(HPLC), 예를 들어 크기 배제 고성능 액체 크로마토그래피(SEC-HPLC), 모세관 전기영동, 질량 분광법, 또는 탁도 측정이 사용될 수 있다. 본원에서 제공되는 HuGlyFabVEGFi 전이유전자는 비-정규적인 부위에서 0.5%, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 또는 10% 이상 당화된 항원-결합 단편의 생산을 야기한다. 특정 실시양태에서, 항원-결합 단편 집단으로부터의 0.5%, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 또는 10% 이상의 항원-결합 단편이 비-정규적인 부위에서 당화된다. 특정 실시양태에서, 0.5%, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 또는 10% 이상의 비-정규적인 부위가 당화된다. 특정 실시양태에서, 이들 비-정규적인 부위에서 항원-결합 단편의 당화는 HEK293 세포에서 생산된 항원-결합 단편 내의 이들 비-정규적인 부위의 당화의 양에 비해 25%, 50%, 100%, 200%, 300%, 400%, 500% 이상 더 크다.
본원에 기재된 방법에서 사용되는 HuGlyFabVEGFi 상의 시알산의 존재는 HuGlyFabVEGFi의 소거율(clearance rate), 예를 들어 유리체 액으로부터의 소거율에 영향을 줄 수 있다. 따라서, HuGlyFabVEGFi의 시알산 패턴은 최적화된 소거율을 갖는 치료제를 생성하기 위해 사용될 수 있다. 항원-결합 단편 소거율을 평가하는 방법은 당업계에 알려져 있다. 예를 들어, Huang et al., 2006, Anal. Biochem. 349:197-207을 참고한다.
다른 구체적 실시양태에서, N-당화에 의해 부여되는 이익은 감소된 응집이다. 차지된 N-당화 부위는 응집하기 쉬운 아미노산 잔기를 차단하여, 응집 감소를 야기할 수 있다. 이러한 N-당화 부위는 본원에서 사용되는 항원-결합 단편에 본연적이거나, 또는 본원에 사용되는 항원-결합 단편 내로 조작되어, 발현될 때, 예를 들어 망막 세포에서 발현될 때, 응집이 덜한 HuGlyFabVEGFi를 야기한다. 항체의 응집을 평가하는 방법은 당업계에 알려져 있다. 예를 들어, 그 전체가 본원에 참고로 포함되는 Courtois et al., 2016, mAbs 8:99-112를 참고한다.
다른 구체적 실시양태에서, N-당화에 의해 부여된 이익은 감소된 면역원성이다. 이러한 N-당화 부위는 본원에서 사용되는 항원-결합 단편에 본연적이거나, 또는 본원에 사용되는 항원-결합 단편 내로 조작되어, 발현될 때, 예를 들어, 망막 세포에서 발현될 때, 면역원성이 덜한 HuGlyFabVEGFi를 야기한다.
다른 구체적 실시양태에서, N-당화에 의해 부여된 이익은 단백질 안정성이다. 단백질의 N-당화는 이들에게 안정성을 부여하는 것으로 잘 알려져 있으며, N-당화로부터 야기되는 단백질 안정성을 평가하는 방법은 당업계에 알려져 있다. 예를 들어, Sola and Griebenow, 2009, J Pharm Sci., 98(4): 1223-1245를 참고한다.
다른 구체적 실시양태에서, N-당화에 의해 부여된 이익은 변경된 결합 친화성이다. 항체의 가변 도메인 내의 N-당화 부위의 존재는 이의 항원에 대한 항체의 친화성을 증가시킬 수 있음이 당업계에 알려져 있다. 예를 들어, Bovenkamp et al., 2016, J. Immunol. 196:1435-1441을 참고한다. 항체 결합 친화성을 측정하기 위한 에세이는 당업계에 알려져 있다. 예를 들어, Wright et al., 1991, EMBO J. 10:2717-2723; 및 Leibiger et al., 1999, Biochem. J. 338:529-538을 참고한다.
5.1.2 티로신 황산화
티로신 황산화는 티로신(Y)의 +5 내지 -5 위치 이내에 글루타메이트(E) 또는 아스파테이트(D)를 가진 티로신(Y) 잔기에서 발생하며, Y의 위치 -1은 중성 또는 산성 전하를 가진 아미노산이지만, 황산화를 없애는 염기성 아미노산, 예를 들어, 아르기닌(R), 라이신(K), 또는 히스티딘(H)은 아니다. 놀랍게도, 본원에 기재된 방법에 따라 사용하기 위한 항-VEGF 항원-결합 단편, 예를 들어 라니비주맙은 티로신 황산화 부위를 포함한다(도 1 참고). 따라서, 본원에 기재된 방법은 적어도 하나의 티로신 황산화 부위를 포함하는 항-VEGF 항원-결합 단편, 예를 들어 HuPTMFabVEGFi의 용도를 포함하며, 이러한 항-VEGF 항원-결합 단편은 망막 세포에서 발현될 때, 티로신 황산화될 수 있다.
중요하게도, 티로신-황산화된 항원-결합 단편, 예를 들어 라니비주맙은 자연적으로는 티로신-황산화를 위해 요구되는 효소를 보유하지 않는 대장균에서는 생산될 수 없다. 또한, CHO 세포는 티로신 황산화에 대해 결함이 있으며-이들은 분비성 세포가 아니며 번역후 티로신-황산화에 대해 제한된 능력을 갖는다. 예를 들어, Mikkelsen & Ezban, 1991, Biochemistry 30: 1533-1537을 참고한다. 유리하게는, 본원에서 제공되는 방법은 망막 세포에서의 항-VEGF 항원-결합 단편, 예를 들어 HuPTMFabVEGFi, 예를 들어 라니비주맙의 발현을 필요로 하며, 망막 세포는 분비성이며 티로신 황산화를 위한 능력을 갖는다. 망막 세포에 의해 분비된 티로신-황산화된 당단백질의 생산을 보고하는 Kanan et al., 2009, Exp. Eye Res. 89: 559-567 및 Kanan & Al-Ubaidi, 2015, Exp. Eye Res. 133: 126-131을 참고한다.
티로신 황산화는 여러가지 이유로 유리하다. 예를 들어, 표적에 대한 치료 항체의 항원-결합 단편의 티로신-황산화는 항원에 대한 결합활성 및 활성을 극적으로 증가시키는 것으로 나타났다. 예를 들어, Loos et al., 2015, PNAS 112: 12675-12680, 및 Choe et al., 2003, Cell 114: 161-170을 참고한다. 티로신 황산화 검출을 위한 에세이는 당업계에 알려져 있다. 예를 들어, Yang et al., 2015, Molecules 20:2138-2164를 참고한다.
5.1.3 O-당화
O-당화는 효소에 의한 세린 또는 트레오닌 잔기에 대한 N-아세틸-갈락토스아민의 첨가를 포함한다. 항체의 힌지 영역에 존재하는 아미노산 잔기는 O-당화될 수 있는 것으로 입증되었다. 특정 실시양태에서, 본원에 기재된 방법에 따라 사용되는 항-VEGF 항원-결합 단편, 예를 들어 라니비주맙은 이들의 힌지 영역의 전부 또는 일부를 포함하며, 따라서 인간 망막 세포에서 발현될 때 O-당화될 수 있다. O-당화의 가능성은 예를 들어, 대장균에서 생산된 항원-결합 단편과 비교하여, 본원에서 제공되는 HuPTMFabVEGFi, 예를 들어 HuGlyFabVEGFi에 다른 이점을 부여하며, 이는 대장균이 자연적으로는 인간 O-당화에서 사용되는 것과 동등한 조직을 함유하지 않기 때문이다. (대신, 대장균에서의 O-당화는 세균이 특정 O-당화 조직을 함유하도록 변형될 때만 입증되었다. 예를 들어, Faridmoayer et al., 2007, J. Bacteriol. 189:8088-8098을 참고한다.) 글리칸을 보유함으로써, O-당화된 HuPTMFabVEGFi, 예를 들어 HuGlyFabVEGFi는 (상기에 논의된 바와 같이) N-당화된 HuGlyFabVEGFi와 유익한 특징을 공유한다.
5.2 구조체 및 제형
본원에서 제공되는 방법에서 사용하기 위해 항-VEGF 항원-결합 단편 또는 항-VEGF 항원-결합 단편의 초고당화된 유도체를 코딩하는 바이러스 벡터 또는 다른 DNA 발현 구조체가 제공된다. 본원에서 제공되는 바이러스 벡터 및 다른 DNA 발현 구조체는 표적 세포(예를 들어, 망막 색소 상피 세포)에 전이유전자를 전달하기 위한 임의의 적합한 방법을 포함한다. 전이유전자의 전달 수단은 바이러스 벡터, 리포솜, 다른 지질-함유 복합체, 다른 거대분자 복합체, 합성 변형 mRNA, 비변형 mRNA, 소분자, 비-생물학적 활성 분자(예를 들어, 금 입자), 중합된 분자(예를 들어, 덴드리머), 네이키드 DNA, 플라스미드, 파아지, 트랜스포존, 코스미드 또는 에피솜을 포함한다. 일부 실시양태에서, 벡터는 표적화된 벡터, 예를 들어 망막 색소 상피 세포에 표적화된 벡터이다.
일부 양태에서, 본 발명은 사용을 위한 핵산을 제공하며, 핵산은 거대세포바이러스(CMV) 프로모터, 라우스 육종 바이러스(Rous sarcoma virus)(RSV) 프로모터, MMT 프로모터, EF-1 알파 프로모터, UB6 프로모터, 닭 베타-액틴 프로모터, CAG 프로모터, RPE65 프로모터 및 옵신 프로모터로 이루어진 그룹으로부터 선택된 프로모터에 작동가능하게 연결된 HuPTMFabVEGFi, 예를 들어 HuGlyFabVEGFi를 코딩한다.
특정 실시양태에서, 본원은 1 이상의 핵산(예를 들어, 폴리뉴클레오티드)를 포함하는 재조합 벡터를 제공한다. 핵산은 DNA, RNA, 또는 DNA와 RNA의 조합을 포함할 수 있다. 특정 실시양태에서, DNA는 프로모터 서열, 관심 유전자(전이유전자, 예를 들어 항-VEGF 항원-결합 단편)의 서열, 비번역 영역, 및 종결 서열로 이루어진 그룹으로부터 선택된 서열 중 1 이상을 포함한다. 특정 실시양태에서, 본원에서 제공되는 바이러스 벡터는 관심 유전자에 작동가능하게 연결된 프로모터를 포함한다.
특정 실시양태에서, 본원에 개시된 핵산(예를 들어, 폴리뉴클레오티드) 및 핵산 서열은 예를 들어, 당업자에게 알려진 임의의 코돈-최적화 기술을 통해 코돈-최적화될 수 있다(예를 들어, Quax et al., 2015, Mol Cell 59:149-161에 의한 리뷰 참고).
구체적 실시양태에서, 본원에 기재된 구조체는 다음 성분을 포함한다: (1) 발현 카세트에 인접(flank)하는 AAV2 역위 말단 반복부; (2) a) CMV 인핸서/닭 β-액틴 프로모터를 포함하는 CB7 프로모터, b) 닭 β-액틴 인트론 및 c) 토끼 β-글로빈 폴리 A 시그널을 포함하는 제어 요소; 및 (3) 동일한 양의 중쇄 및 경쇄 폴리펩티드의 발현을 보장하는 자가-절단 푸린(furin)(F)/F2A 링커에 의해 분리된, 항-VEGF 항원-결합 단편의 중쇄 및 경쇄를 코딩하는 핵산 서열.
5.2.1 mRNA
특정 실시양태에서, 본원에서 제공되는 벡터는 관심 유전자(예를 들어, 전이유전자, 예를 들어 항-VEGF 항원-결합 단편 모이어티)를 코딩하는 변형 mRNA이다. 망막 색소 상피 세포에 대한 전이유전자의 전달을 위한 변형 및 비변형 mRNA의 합성은 예를 들어, 그 전체가 본원에 참고로 포함되는 Hansson et al., J. Biol. Chem., 2015, 290(9):5661-5672에서 교시된다. 특정 실시양태에서, 본원은 항-VEGF 항원-결합 단편 모이어티를 코딩하는 변형 mRNA를 제공한다.
5.2.2 바이러스 벡터
바이러스 벡터는 아데노바이러스, 아데노-연관 바이러스(AAV, 예를 들어 AAV8), 렌티바이러스, 헬퍼(helper)-의존성 아데노바이러스, 단순 포진 바이러스, 폭스바이러스, 일본의 헤마글루티닌 바이러스(hemagglutinin virus of Japan)(HVJ), 알파바이러스, 백시니아 바이러스, 및 레트로바이러스 벡터를 포함한다. 레트로바이러스 벡터는 뮤린 백혈병 바이러스(MLV)- 및 인간 면역결핍 바이러스(HIV)-계 벡터를 포함한다. 알파바이러스 벡터는 셈리키 삼림열 바이러스(semliki forest virus)(SFV) 및 신드비스(sindbis) 바이러스(SIN)를 포함한다. 특정 실시양태에서, 본원에서 제공되는 바이러스 벡터는 재조합 바이러스 벡터이다. 특정 실시양태에서, 본원에서 제공되는 바이러스 벡터는 이들이 인간에서 복제-결핍성이도록 변형된다. 특정 실시양태에서, 바이러스 벡터는 하이브리드 벡터, 예를 들어 "무력한(helpless)" 아데노바이러스 벡터 내에 위치된 AAV 벡터이다. 특정 실시양태에서, 본원은 제1 바이러스로부터의 바이러스 캡시드 및 제2 바이러스로부터의 바이러스 외피 단백질을 포함하는 바이러스 벡터를 제공한다. 구체적 실시양태에서, 제2 바이러스는 수포성 구내염 바이러스(VSV)이다. 더욱 구체적인 실시양태에서, 외피 단백질은 VSV-G 단백질이다.
특정 실시양태에서, 본원에서 제공되는 바이러스 벡터는 HIV계 바이러스 벡터이다. 특정 실시양태에서, 본원에서 제공되는 HIV-계 벡터는 적어도 2 개의 폴리뉴클레오티드를 포함하며, gag 및 pol 유전자는 HIV 게놈으로부터의 것이고 env 유전자는 다른 바이러스로부터의 것이다.
특정 실시양태에서, 본원에서 제공되는 바이러스 벡터는 단순 포진 바이러스-계 바이러스 벡터이다. 특정 실시양태에서, 본원에서 제공되는 단순 포진 바이러스-계 벡터는 이들이 1 이상의 즉시 초기(immediate early)(IE) 유전자를 포함하지 않아서 이들이 비-세포독성이도록 변형된다.
특정 실시양태에서, 본원에서 제공되는 바이러스 벡터는 MLV계 바이러스 벡터이다. 특정 실시양태에서, 본원에서 제공되는 MLV-계 벡터는 바이러스 유전자 대신 최대 8 kb의 이종 DNA를 포함한다.
특정 실시양태에서, 본원에서 제공되는 바이러스 벡터는 렌티바이러스-계 바이러스 벡터이다. 특정 실시양태에서, 본원에서 제공되는 렌티바이러스 벡터는 인간 렌티바이러스로부터 유래된다. 특정 실시양태에서, 본원에서 제공되는 렌티바이러스 벡터는 비-인간 렌티바이러스로부터 유래된다. 특정 실시양태에서, 본원에서 제공되는 렌티바이러스 벡터는 렌티바이러스 캡시드 내로 패키징된다. 특정 실시양태에서, 본원에서 제공되는 렌티바이러스 벡터는 다음 요소 중 1 이상을 포함한다: 긴 말단 반복, 프라이머 결합 부위, 폴리퓨린 트랙트(tract), att 부위, 및 이입(encapsidation) 부위.
특정 실시양태에서, 본원에서 제공되는 바이러스 벡터는 알파바이러스-계 바이러스 벡터이다. 특정 실시양태에서, 본원에서 제공되는 알파바이러스 벡터는 재조합, 복제-결함 알파바이러스이다. 특정 실시양태에서, 본원에서 제공되는 알파바이러스 벡터 내의 알파바이러스 레플리콘(replicon)은 이들의 비리온 표면 상에 기능성 이종 리간드를 디스플레이함으로써 특정 세포 유형에 표적화된다.
특정 실시양태에서, 본원에서 제공되는 바이러스 벡터는 AAV계 바이러스 벡터이다. 바람직한 실시양태에서, 본원에서 제공되는 바이러스 벡터는 AAV8계 바이러스 벡터이다. 특정 실시양태에서, 본원에서 제공되는 AAV8계 바이러스 벡터는 망막 세포에 대한 향성을 보유한다. 특정 실시양태에서, 본원에서 제공되는 AAV-계 벡터는 AAV rep 유전자(복제를 위해 필요함) 및/또는 AAV cap 유전자(캡시드 단백질의 합성을 위해 필요함)를 코딩한다. 다수의 AAV 혈청형이 확인되었다. 특정 실시양태에서, 본원에서 제공되는 AAV-계 벡터는 AAV의 1 이상의 혈청형으로부터의 성분을 포함한다. 특정 실시양태에서, 본원에서 제공되는 AAV계 벡터는 AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11, 또는 AAVrh10 중 1 이상으로부터의 캡시드 성분을 포함한다. 바람직한 실시양태에서, 본원에서 제공되는 AAV계 벡터는 AAV8, AAV9, AAV10, AAV11, 또는 AAVrh10 혈청형 중 1 이상으로부터의 성분을 포함한다.
특별한 실시양태에서, 본원은 조절 요소의 제어 하에 ITR에 인접한 전이유전자의 발현을 위한 발현 카세트 및 AAV8 캡시드 단백질의 아미노산 서열을 갖거나 AAV8 캡시드 단백질의 아미노산 서열(서열번호 48)과 적어도 95%, 96%, 97%, 98%, 99% 또는 99.9% 동일한 한편, AAV8 캡시드의 생물학적 기능을 보유한 바이러스 캡시드를 포함하는 바이러스 게놈을 포함하는 AAV8 벡터를 제공한다. 특정 실시양태에서, 코딩된 AAV8 캡시드는 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 또는 30 개의 아미노산 치환을 갖고 AAV8 캡시드의 생물학적 기능을 보유하는 서열번호 48의 서열을 갖는다. 도 18은 열 라벨링된 SUBS와의 비교를 기본으로 하여 정렬된 서열 내의 특정 위치에서 치환될 수 있는 잠재적 아미노산을 갖는 상이한 AAV 혈청형의 캡시드 단백질의 아미노산 서열의 비교 정렬을 제공한다. 따라서, 구체적 실시양태에서, AAV8 벡터는 천연 AAV8 서열 내의 위치에 존재하지 않는 도 18의 SUBS 열에서 확인된 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 또는 30 개의 아미노산 치환을 갖는 AAV8 캡시드 변이체를 포함한다.
특정 실시양태에서, 본원에 기재된 방법에서 사용되는 AAV는 그 전체가 참고로 포함되는 Zinn et al., 2015, Cell Rep. 12(6): 1056-1068에 기재된, Anc80 또는 Anc80L65이다. 특정 실시양태에서, 본원에 기재된 방법에서 사용되는 AAV는 다음 아미노산 삽입 중 하나를 포함한다: 각각 그 전체가 본원에 참고로 포함되는 미국 특허 9,193,956호; 9,458,517호; 및 9,587,282호 및 미국 특허 출원 공개 2016/0376323호에 기재된, LGETTRP 또는 LALGETTRP. 특정 실시양태에서, 본원에 기재된 방법에서 사용되는 AAV는 각각 그 전체가 본원에 참고로 포함되는 미국 특허 9,193,956호; 9,458,517호; 및 9,587,282호 및 미국 특허 출원 공개 2016/0376323호에 기재된, AAV.7m8이다. 특정 실시양태에서, 본원에 기재된 방법에서 사용되는 AAV는 미국 특허 제9,585,971호에 개시된 임의의 AAV, 예컨대 AAV-PHP.B이다. 특정 실시양태에서, 본원에 기재된 방법에서 사용되는 AAV는 각각 그 전체가 본원에 참고로 포함되는 다음 특허 및 특허 출원 중 임의의 것에 개시된 AAV이다: 미국 특허 7,906,111호; 8,524,446호; 8,999,678호; 8,628,966호; 8,927,514호; 8,734,809호; US 9,284,357호; 9,409,953호; 9,169,299호; 9,193,956호; 9,458,517호; 및 9,587,282호, 미국 특허 출원 공개 2015/0374803호; 2015/0126588호; 2017/0067908호; 2013/0224836호; 2016/0215024호; 2017/0051257호; 및 국제 특허 출원 PCT/US2015/034799호; PCT/EP2015/053335호.
AAV8-계 바이러스 벡터는 본원에 기재된 방법 중 일부에서 사용된다. AAV계 바이러스 벡터의 핵산 서열 및 재조합 AAV 및 AAV 캡시드를 제조하는 방법은 예를 들어, 각각 그 전체가 본원에 참고로 포함되는 미국 특허 7,282,199 B2호, 미국 특허 7,790,449 B2호, 미국 특허 8,318,480 B2호, 미국 특허 8,962,332 B2호 및 국제 특허 출원 PCT/EP2014/076466호에서 교시된다. 일 양태에서, 본원은 전이유전자(예를 들어, 항-VEGF 항원-결합 단편)를 코딩하는 AAV(예를 들어, AAV8)-계 바이러스 벡터를 제공한다. 구체적 실시양태에서, 본원은 항-VEGF 항원-결합 단편을 코딩하는 AAV8-계 바이러스 벡터를 제공한다. 더욱 구체적 실시양태에서, 본원은 라니비주맙을 코딩하는 AAV8-계 바이러스 벡터를 제공한다.
특정 실시양태에서, 단일-가닥 AAV(ssAAV)가 상기한 대로 사용될 수 있다. 특정 실시양태에서, 자기-상보성 벡터, 예를 들어, scAAV가 사용될 수 있다(예를 들어, 각각 그 전체가 본원에 참고로 포함되는 Wu, 2007, Human Gene Therapy, 18(2):171-82, McCarty et al, 2001, Gene Therapy, Vol 8, Number 16, Pages 1248-1254; 및 미국 특허 6,596,535호; 7,125,717호; 및 7,456,683호 참고).
특정 실시양태에서, 본원에 기재된 방법에서 사용되는 바이러스 벡터는 아데노바이러스계 바이러스 벡터이다. 재조합 아데노바이러스 벡터가 항-VEGF 항원-결합 단편에서의 전달을 위해 사용될 수 있다. 재조합 아데노바이러스는 E1 결실을 가지며, E3 결실이 있거나 없으며, 발현 카세트가 결실된 영역 내로 삽입된, 제1 세대 벡터일 수 있다. 재조합 아데노바이러스는 E2 및 E4 영역의 전체 또는 부분 결실을 함유하는 제2 세대 벡터일 수 있다. 헬퍼-의존성 아데노바이러스는 아데노바이러스 역위 말단 반복부 및 패키징 시그널(phi)만을 보유한다. 전이유전자는 게놈을 대략 36 kb의 야생형 크기에 가깝게 유지하기 위한 스터퍼 서열(stuffer sequence)이 있거나 없이, 패키징 시그널과 3'ITR 사이에 삽입된다. 아데노바이러스 벡터의 생산을 위한 예시적인 프로토콜은 그 전체가 본원에 참고로 포함되는 Alba et al., 2005, "Gutless adenovirus: last generation adenovirus for gene therapy," Gene Therapy 12:S18-S27에서 찾을 수 있다.
특정 실시양태에서, 본원에 기재된 방법에서 사용되는 바이러스 벡터는 렌티바이러스계 바이러스 벡터이다. 재조합 렌티바이러스 벡터가 항-VEGF 항원-결합 단편에서의 전달을 위해 사용될 수 있다. 구조체를 제조하기 위해 4 개 플라스미드가 사용된다: Gag/pol 서열 함유 플라스미드, Rev 서열 함유 플라스미드, 외피 단백질 함유 플라스미드(즉, VSV-G), 및 패키징 요소 및 항-VEGF 항원-결합 단편 유전자를 갖는 Cis 플라스미드.
렌티바이러스 벡터 생산을 위해, 4 개 플라스미드는 세포(즉, HEK293계 세포) 내로 공동-형질감염되며, 폴리에틸렌이민 또는 칼슘 포스페이트가 다른 것 중에서도 형질감염제로서 사용될 수 있다. 그 다음에, 렌티바이러스가 상등액에서 수집된다(렌티바이러스는 활성이 되기 위해 세포로부터 발아하는 것이 필요하여, 세포 수집이 필요하거나 이루어질 필요가 없음). 상등액이 여과되고(0.45 ㎛) 그 다음에 마그네슘 클로라이드 및 벤조나제가 첨가된다. 추가의 다운스트림 과정은 광범위하게 변할 수 있으며, 가장 GMP 양립성인 TFF 및 칼럼 크로마토그래피를 사용할 수 있다. 다른 것은 칼럼 크로마토그래피가 있거나 없이 초원심분리를 사용한다. 렌티바이러스 벡터의 생산을 위한 예시적인 프로토콜은 둘 다 그 전체가 본원에 참고로 포함되는 Lesch et al., 2011, "Production and purification of lentiviral vector generated in 293T suspension cells with baculoviral vectors," Gene Therapy 18:531-538, 및 Ausubel et al., 2012, "Production of CGMP-Grade Lentiviral Vectors," Bioprocess Int. 10(2):32-43에서 찾을 수 있다.
구체적 실시양태에서, 본원에 기재된 방법에서 사용하기 위한 벡터는 벡터가 관련 세포(예를 들어, 생체내 또는 시험관내의 망막 세포) 내로 도입시, 항-VEGF 항원-결합 단편의 당화된 및/또는 티로신 황산화된 변이체가 세포에 의해 발현되도록, 항-VEGF 항원-결합 단편(예를 들어, 라니비주맙)을 코딩하는 것이다. 구체적 실시양태에서, 발현된 항-VEGF 항원-결합 단편은 상기 섹션 5.1에 기재된 당화 및/또는 티로신 황산화 패턴을 포함한다.
5.2.3 프로모터 및 유전자 발현의 변형제
특정 실시양태에서, 본원에서 제공되는 벡터는 유전자 전달 또는 유전자 발현을 조절하는 성분(예를 들어, "발현 제어 요소")을 포함한다. 특정 실시양태에서, 본원에서 제공되는 벡터는 유전자 발현을 조절하는 성분을 포함한다. 특정 실시양태에서, 본원에서 제공되는 벡터는 세포에 대한 결합 또는 표적화에 영향을 주는 성분을 포함한다. 특정 실시양태에서, 본원에서 제공되는 벡터는 흡수 후 세포 내에서 폴리뉴클레오티드(예를 들어, 전이유전자)의 국소화에 영향을 주는 성분을 포함한다. 특정 실시양태에서, 본원에서 제공되는 벡터는 예를 들어, 폴리뉴클레오티드를 흡수한 세포를 검출하거나 선택하기 위해, 검출 가능하거나 선택가능한 마커로서 사용될 수 있는 성분을 포함한다.
특정 실시양태에서, 본원에서 제공되는 바이러스 벡터는 1 이상의 프로모터를 포함한다. 특정 실시양태에서, 프로모터는 구성적 프로모터이다. 특정 실시양태에서, 프로모터는 유도성 프로모터이다. 유도성 프로모터는 전이유전자 발현이 치료 효능을 위해 소망하는 대로 켜지고 꺼질 수 있도록 하는 것이 바람직할 수 있다. 이러한 프로모터는 예를 들어, 저산소증-유도된 프로모터 및 약물 유도성 프로모터, 예컨대 라파마이신 및 관련 약제에 의해 유도되는 프로모터를 포함한다. 저산소증-유도성 프로모터는 HIF 결합 부위를 갖는 프로모터를 포함하며, 예를 들어 각각 저산소증-유도성 프로모터의 교시를 위해 참고로 포함되는 , et al., 2011, Blood 117(23):e207-e217 및 Kenneth and Rocha, 2008, Biochem J. 414:19-29를 참고한다. 또한, 구조체에서 사용될 수 있는 저산소증-유도성 프로모터는 에립트로포이에틴 및 N-WASP 프로모터를 포함한다(둘 다 저산소증-유도된 프로모터의 교시를 위해 참고로 포함되는, 에립트로포이에틴 프로모터의 개시에 대한 Tsuchiya, 1993, J. Biochem. 113:395 및 N-WASP 프로모터의 개시에 대한 Salvi, 2017, Biochemistry and Biophysics Reports 9:13-21 참고). 대안적으로, 구조체는 약물 유도성 프로모터, 예를 들어 라파마이신 및 관련 유사체의 투여에 의해 유도될 수 있는 프로모터를 함유할 수 있다(예를 들어, 약물 유도성 프로모터의 이들의 개시에 대해 본원에 참고로 포함되는, 국제 특허 출원 공개 WO94/18317호, WO 96/20951호, WO 96/41865호, WO 99/10508호, WO 99/10510호, WO 99/36553호, 및 WO 99/41258호, 및 미국 특허 US 7,067,526호(라파마이신 유사체를 개시함) 참고). 특정 실시양태에서, 프로모터는 저산소증-유도성 프로모터이다. 특정 실시양태에서, 프로모터는 저산소증-유도성 인자(HIF) 결합 부위를 포함한다. 특정 실시양태에서, 프로모터는 HIF-1α 결합 부위를 포함한다. 특정 실시양태에서, 프로모터는 HIF-2α 결합 부위를 포함한다. 특정 실시양태에서, HIF 결합 부위는 RCGTG 모티프를 포함한다. HIF 결합 부위의 위치와 서열에 관한 상세내용에 대해서는, 예를 들어, 그 전체가 본원에 참고로 포함되는 , et al., Blood, 2011, 117(23):e207-e217을 참고한다. 특정 실시양태에서, 프로모터는 HIF 전사 인자 외의 저산소증 유도된 전사 인자에 대한 결합 부위를 포함한다. 특정 실시양태에서, 본원에서 제공되는 바이러스 벡터는 저산소증에서 우선적으로 번역되는 1 이상의 IRES 부위를 포함한다. 저산소증-유도성 유전자 발현 및 이에 관련된 인자에 관한 교시에 대해서는, 예를 들어, 그 전체가 본원에 참고로 포함되는 Kenneth and Rocha, Biochem J., 2008, 414:19-29를 참고한다.
특정 실시양태에서, 프로모터는 CB7 프로모터이다(그 전체가 본원에 참고로 포함되는 Dinculescu et al., 2005, Hum Gene Ther 16: 649-663 참고). 일부 실시양태에서, CB7 프로모터는 벡터에 의해 추진되는 전이유전자의 발현을 향상시키는 다른 발현 제어 요소를 포함한다. 특정 실시양태에서, 다른 발현 제어 요소는 닭 β-액틴 인트론 및/또는 토끼 β-글로빈 polA 시그널을 포함한다. 특정 실시양태에서, 프로모터는 TATA 박스를 포함한다. 특정 실시양태에서, 프로모터는 1 이상의 요소를 포함한다. 특정 실시양태에서, 1 이상의 프로모터 요소는 서로에 대하여 역위되거나 이동될 수 있다. 특정 실시양태에서, 프로모터의 요소는 협조적으로 기능하도록 위치된다. 특정 실시양태에서, 프로모터의 요소는 독립적으로 기능하도록 위치된다. 특정 실시양태에서, 본 발명에서 제공되는 바이러스 벡터는 인간 CMV 즉시 초기 유전자 프로모터, SV40 초기 프로모터, 라우스 육종 바이러스(RS) 긴 말단 반복부, 및 래트 인슐린 프로모터로 이루어지는 그룹으로부터 선택된 1 이상의 프로모터를 포함한다. 특정 실시양태에서, 본원에서 제공되는 벡터는 AAV, MLV, MMTV, SV40, RSV, HIV-1, 및 HIV-2 LTR로 이루어지는 그룹으로부터 선택된 1 이상의 긴 말단 반복부(LTR) 프로모터를 포함한다. 특정 실시양태에서, 본원에서 제공되는 벡터는 1 이상의 조직 특이적 프로모터(예를 들어, 망막 색소 상피 세포-특이적 프로모터)를 포함한다. 특정 실시양태에서, 본원에서 제공되는 바이러스 벡터는 RPE65 프로모터를 포함한다. 특정 실시양태에서, 본원에서 제공되는 벡터는 VMD2 프로모터를 포함한다.
특정 실시양태에서, 본원에서 제공되는 바이러스 벡터는 프로모터 외의 1 이상의 조절 요소를 포함한다. 특정 실시양태에서, 본원에서 제공되는 바이러스 벡터는 인핸서를 포함한다. 특정 실시양태에서, 본원에서 제공되는 바이러스 벡터는 억제자(repressor)를 포함한다. 특정 실시양태에서, 본원에서 제공되는 바이러스 벡터는 인트론 또는 키메라 인트론을 포함한다. 특정 실시양태에서, 본원에서 제공되는 바이러스 벡터는 폴리아데닐화 서열을 포함한다.
5.2.4 시그널 펩티드
특정 실시양태에서, 본원에서 제공되는 벡터는 단백질 전달을 조절하는 성분을 포함한다. 특정 실시양태에서, 본원에서 제공되는 바이러스 벡터는 1 이상의 시그널 펩티드를 포함한다. 시그널 펩티드는 또한 본원에서 "리더 서열" 또는 "리더 펩티드"로서 지칭될 수 있다. 특정 실시양태에서, 시그널 펩티드는 전이유전자 산물(예를 들어, 항-VEGF 항원-결합 단편 모이어티)이 세포에서 적절한 패키징(예를 들어, 당화)를 달성하게 한다. 특정 실시양태에서, 시그널 펩티드는 전이유전자 산물(예를 들어, 항-VEGF 항원-결합 단편 모이어티)이 세포에서 적절한 국소화를 달성하게 한다. 특정 실시양태에서, 시그널 펩티드는 전이유전자 산물(예를 들어, 항-VEGF 항원-결합 단편 모이어티)이 세포로부터 분비되게 한다. 본원에서 제공되는 벡터 및 전이유전자와 관련하여 사용될 시그널 펩티드의 예는 표 1에서 찾을 수 있다.
표 1. 본원에서 제공되는 벡터와 사용하기 위한 시그널 펩티드
5.2.5 폴리시스트론성 메세지 - IRES 및 F2A 링커
내부 리보솜 유입 부위. 단일 구조체는 절단가능한 링커 또는 IRES에 의해 분리된 중쇄 및 경쇄 둘 다를 코딩하여 분리된 중쇄 및 경쇄 폴리펩티드가 형질도입된 세포에 의해 발현되도록 조작될 수 있다. 특정 실시양태에서, 본원에서 제공되는 바이러스 벡터는 폴리시스트론성(polycistronic)(예를 들어, 바이시스트론성) 메세지를 제공한다. 예를 들어, 바이러스 구조체는 내부 리보솜 유입 부위(IRES) 요소(바이시스트론성 벡터를 생성하기 위한 IRES 요소의 사용의 예를 위하여, 예를 들어 그 전체가 본원에 참고로 포함되는 Gurtu et al., 1996, Biochem. Biophys. Res. Comm. 229(1):295-8 참고)에 의해 분리된 중쇄 및 경쇄를 코딩할 수 있다. IRES 요소는 리보솜 스캐닝 모델을 우회하고 내부 부위에서 번역을 시작한다. AAV에서 IRES의 사용은 예를 들어, 그 전체가 본원에 참고로 포함되는 Furling et al., 2001, Gene Ther 8(11): 854-73에 기재된다. 특정 실시양태에서, 바이시스트론성 메세지는 이의 폴리뉴클레오티드(들)의 크기에 대한 제한을 가지고 바이러스 벡터 내에 함유된다. 특정 실시양태에서, 바이시스트론성 메세지는 AAV 바이러스-계 벡터(예를 들어, AAV8-계 벡터) 내에 함유된다.
푸린-F2A 링커. 다른 실시양태에서, 본원에서 제공되는 바이러스 벡터는 자가-절단 푸린/F2A(F/F2A) 링커와 같은 절단가능한 링커에 의해 분리된 중쇄 및 경쇄를 코딩한다(각각 그 전체가 본원에 참고로 포함되는 Fang et al., 2005, Nature Biotechnology 23: 584-590, 및 Fang, 2007, Mol Ther 15: 1153-9 참고).
예를 들어, 푸린-F2A 링커는 중쇄 및 경쇄 코딩 서열을 분리하기 위해 발현 카세트내에 통합되어, 다음 구조를 가진 구조체를 야기할 수 있다:
리더 - 중쇄 - 푸린 부위 - F2A 부위 - 리더 - 경쇄 - 폴리A.
아미노산 서열 LLNFDLLKLAGDVESNPGP(서열번호 26)을 가진 F2A 부위는 자가-처리이어서, 최종 G 및 P 아미노산 잔기 사이에서 "절단"을 야기한다. 사용될 수 있는 추가의 링커는, 비제한적으로, 다음을 포함한다:
리보솜이 개방 판독 프레임 내의 F2A 서열을 만나면 펩티드 결합이 건너뛰어져서, 번역의 종결, 또는 다운스트림 서열(경쇄)의 계속된 번역을 야기한다. 이 자가-처리 서열은 중쇄의 C-말단의 단부에서 추가 아미노산의 스트링을 야기한다. 그러나, 이러한 추가 아미노산은 그 다음에 F2A 부위 직전에 그리고 중쇄 서열 후에 위치한 푸린 부위에서 숙주 세포 푸린에 의해 절단되고, 카르복시펩티다제에 의해 추가로 절단된다. 생성된 중쇄는 C-말단에 포함된 1, 2, 3 개, 또는 그 이상의 추가 아미노산을 가질 수 있거나, 이는 사용된 푸린 링커의 서열 및 생체내에서 링커를 절단하는 카르복시펩티다제에 따라, 이러한 추가 아미노산을 갖지 않을 수 있다(예를 들어, Fang et al., 17 April 2005, Nature Biotechnol. Advance Online Publication; Fang et al., 2007, Molecular Therapy 15(6):1153-1159; Luke, 2012, Innovations in Biotechnology, Ch. 8, 161-186 참고). 사용될 수 있는 푸린 링커는 4 개 염기성 아미노산의 시리즈, 예를 들어 RKRR, RRRR, RRKR, 또는 RKKR을 포함한다. 일단 이 링커가 카르복시펩티다제에 의해 절단되면, 추가 아미노산이 남아서, 추가의 0, 1, 2, 3, 또는 4 개 아미노산이 중쇄의 C-말단 상에 남을 수 있으며, 예를 들어 R, RR, RK, RKR, RRR, RRK, RKK, RKRR, RRRR, RRKR, 또는 RKKR이 남을 수 있다. 특정 실시양태에서, 하나의 링커가 카르복시펩티다제에 의해 절단되면, 추가 아미노산이 남지 않는다. 특정 실시양태에서, 본원에 기재된 방법에서 사용하기 위한 구조체에 의해 생산된 항체, 예를 들어 항원-결합 단편, 집단의 0.5%, 1%, 2%, 3%, 4%, 5%, 10%, 15%, 또는 20%, 또는 그 미만이지만 0% 초과가 절단 후 중쇄의 C-말단 상에 남은 1, 2, 3, 또는 4 개 아미노산을 갖는다. 특정 실시양태에서, 본원에 기재된 방법에서 사용하기 위한 구조체에 의해 생산된 항체, 예를 들어 항원-결합 단편, 집단의 0.5-1%, 0.5%-2%, 0.5%-3%, 0.5%-4%, 0.5%-5%, 0.5%-10%, 0.5%-20%, 1%-2%, 1%-3%, 1%-4%, 1%-5%, 1%-10%, 1%-20%, 2%-3%, 2%-4%, 2%-5%, 2%-10%, 2%-20%, 3%-4%, 3%-5%, 3%-10%, 3%-20%, 4%-5%, 4%-10%, 4%-20%, 5%-10%, 5%-20%, 또는 10%-20%가 절단 후 중쇄의 C-말단 상에 남은 1, 2, 3, 또는 4 개 아미노산을 갖는다. 특정 실시양태에서, 푸린 링커는 서열 R-X-K/R-R을 가져, 중쇄의 C-말단 상의 추가 아미노산은 R, RX, RXK, RXR, RXKR, 또는 RXRR이되, X는 임의의 아미노산, 예를 들어 알라닌(A)이다. 특정 실시양태에서, 중쇄의 C-말단 상에 추가 아미노산이 남지 않을 수 있다.
특정 실시양태에서, 본원에 기재된 발현 카세트는 이의 폴리뉴클레오티드(들)의 크기에 대해 제한을 가지고 바이러스 벡터 내에 함유된다. 특정 실시양태에서, 발현 카세트는 AAV 바이러스-계 벡터(예를 들어, AAV8-계 벡터) 내에 함유된다.
5.2.6 비번역 영역
특정 실시양태에서, 본원에서 제공되는 바이러스 벡터는 1 이상의 비번역 영역(UTR), 예를 들어 3' 및/또는 5' UTR을 포함한다. 특정 실시양태에서, UTR은 단백질 발현의 소망하는 수준을 위해 최적화된다. 특정 실시양태에서, UTR은 전이유전자의 mRNA 반감기를 위해 최적화된다. 특정 실시양태에서, UTR은 전이유전자의 mRNA의 안정성을 위해 최적화된다. 특정 실시양태에서, UTR은 전이유전자의 mRNA의 이차 구조를 위해 최적화된다.
5.2.7 역위 말단 반복부
특정 실시양태에서, 본원에서 제공되는 바이러스 벡터는 1 이상의 역위 말단 반복부(ITR) 서열을 포함한다. ITR 서열은 바이러스 벡터의 비리온 내로 재조합 유전자 발현 카세트를 패키징하기 위해 사용될 수 있다. 특정 실시양태에서, ITR은 AAV, 예를 들어 AAV8 또는 AAV2로부터의 것이다(예를 들어, 각각 그 전체가 본원에 참고로 포함되는 Yan et al., 2005, J. Virol., 79(1):364-379; 미국 특허 7,282,199 B2호, 미국 특허 7,790,449 B2호, 미국 특허 8,318,480 B2호, 미국 특허 8,962,332 B2호 및 국제 특허 출원 PCT/EP2014/076466호 참고).
5.2.8 전이유전자
전이유전자에 의해 코딩되는 HuPTMFabVEGFi, 예를 들어 HuGlyFabVEGFi는, 비제한적으로, 베바시주맙과 같은, VEGF에 결합하는 항체의 항원-결합 단편; 라니비주맙과 같은 항-VEGF Fab 모이어티; 또는 Fab 도메인 상에 추가 당화 부위를 함유하도록 조작된 이러한 베바시주맙 또는 라니비주맙 Fab 모이어티를 포함할 수 있다(예를 들어, 전장 항체의 Fab 도메인에서 초고당화되는 베바시주맙의 유도체의 설명을 위해 그 전체가 본원에 참고로 포함되는 Courtois et al., 2016, mAbs 8: 99-112 참고).
특정 실시양태에서, 본원에서 제공되는 벡터는 항-VEGF 항원-결합 단편 전이유전자를 코딩한다. 구체적 실시양태에서, 항-VEGF 항원-결합 단편 전이유전자는 망막 세포에서의 발현을 위하여 적절한 발현 제어 요소에 의해 제어되며: 특정 실시양태에서, 항-VEGF 항원-결합 단편 전이유전자는 경쇄 및 중쇄 cDNA 서열(각각 서열번호 10 및 11)의 베바시주맙 Fab 부분을 포함한다. 특정 실시양태에서, 항-VEGF 항원-결합 단편 전이유전자는 라니비주맙 경쇄 및 중쇄 cDNA 서열(각각 서열번호 12 및 13)을 포함한다. 특정 실시양태에서, 항-VEGF 항원-결합 단편 전이유전자는 각각 서열번호 3 및 4의 경쇄 및 중쇄를 포함하는, 베바시주맙 Fab를 코딩한다. 특정 실시양태에서, 항-VEGF 항원-결합 단편 전이유전자는 서열번호 3에 개시된 서열과 적어도 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% 또는 99% 동일한 아미노산 서열을 포함하는 경쇄를 포함하는 항원-결합 단편을 코딩한다. 특정 실시양태에서, 항-VEGF 항원-결합 단편 전이유전자는 서열번호 4에 개시된 서열과 적어도 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% 또는 99% 동일한 아미노산 서열을 포함하는 중쇄를 포함하는 항원-결합 단편을 코딩한다. 특정 실시양태에서, 항-VEGF 항원-결합 단편 전이유전자는 서열번호 3에 개시된 서열과 적어도 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% 또는 99% 동일한 아미노산 서열을 포함하는 경쇄 및 서열번호 4에 개시된 서열과 적어도 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% 또는 99% 동일한 아미노산 서열을 포함하는 중쇄를 포함하는 항원-결합 단편을 코딩한다. 특정 실시양태에서, 항-VEGF 항원-결합 단편 전이유전자는 각각 서열번호 1 및 2의 경쇄 및 중쇄를 포함하는, 초고당화된 라니비주맙을 코딩한다. 특정 실시양태에서, 항-VEGF 항원-결합 단편 전이유전자는 서열번호 1에 개시된 서열과 적어도 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% 또는 99% 동일한 아미노산 서열을 포함하는 경쇄를 포함하는 항원-결합 단편을 코딩한다. 특정 실시양태에서, 항-VEGF 항원-결합 단편 전이유전자는 서열번호 2에 개시된 서열과 적어도 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% 또는 99% 동일한 아미노산 서열을 포함하는 중쇄를 포함하는 항원-결합 단편을 코딩한다. 특정 실시양태에서, 항-VEGF 항원-결합 단편 전이유전자는 서열번호 1에 개시된 서열과 적어도 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% 또는 99% 동일한 아미노산 서열을 포함하는 경쇄 및 서열번호 2에 개시된 서열과 적어도 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% 또는 99% 동일한 아미노산 서열을 포함하는 중쇄를 포함하는 항원-결합 단편을 코딩한다.
특정 실시양태에서, 항-VEGF 항원-결합 단편 전이유전자는 다음 돌연변이 중 1 이상을 가진, 서열번호 3 및 4의 경쇄 및 중쇄를 포함하는, 초고당화된 베바시주맙 Fab를 코딩한다: L118N(중쇄), E195N(경쇄), 또는 Q160N 또는 Q160S(경쇄). 특정 실시양태에서, 항-VEGF 항원-결합 단편 전이유전자는 다음 돌연변이 중 1 이상을 가진, 서열번호 1 및 2의 경쇄 및 중쇄를 포함하는, 초고당화된 라니비주맙을 코딩한다: L118N(중쇄), E195N(경쇄), 또는 Q160N 또는 Q160S(경쇄). 항원-결합 단편 전이유전자 cDNA의 서열은 예를 들어, 표 2에서 찾을 수 있다. 특정 실시양태에서, 항원-결합 단편 전이유전자 cDNA의 서열은 표 1에 열거된 1 이상의 시그널 서열로 서열번호 10과 11 또는 서열번호 12와 13의 시그널 서열을 치환함으로써 얻어진다.
특정 실시양태에서, 항-VEGF 항원-결합 단편 전이유전자는 항원-결합 단편을 코딩하며 6 개 베바시주맙 CDR의 뉴클레오티드 서열을 포함한다. 특정 실시양태에서, 항-VEGF 항원-결합 단편 전이유전자는 항원-결합 단편을 코딩하며 6 개 라니비주맙 CDR의 뉴클레오티드 서열을 포함한다. 특정 실시양태에서, 항-VEGF 항원-결합 단편 전이유전자는 라니비주맙(서열번호 20, 18, 및 21)의 중쇄 CDR 1-3을 포함하는 중쇄 가변 영역을 포함하는 항원-결합 단편을 코딩한다. 특정 실시양태에서, 항-VEGF 항원-결합 단편 전이유전자는 라니비주맙(서열번호 14-16)의 경쇄 CDR 1-3을 포함하는 경쇄 가변 영역을 포함하는 항원-결합 단편을 코딩한다. 특정 실시양태에서, 항-VEGF 항원-결합 단편 전이유전자는 베바시주맙(서열번호 17-19)의 중쇄 CDR 1-3을 포함하는 중쇄 가변 영역을 포함하는 항원-결합 단편을 코딩한다. 특정 실시양태에서, 항-VEGF 항원-결합 단편 전이유전자는 베바시주맙(서열번호 14-16)의 경쇄 CDR 1-3을 포함하는 경쇄 가변 영역을 포함하는 항원-결합 단편을 코딩한다. 특정 실시양태에서, 항-VEGF 항원-결합 단편 전이유전자는 라니비주맙(서열번호 20, 18, 및 21)의 중쇄 CDR 1-3을 포함하는 중쇄 가변 영역 및 라니비주맙(서열번호 14-16)의 경쇄 CDR 1-3을 포함하는 경쇄 가변 영역을 포함하는 항원-결합 단편을 코딩한다. 특정 실시양태에서, 항-VEGF 항원-결합 단편 전이유전자는 베바시주맙(서열번호 17-19)의 중쇄 CDR 1-3을 포함하는 중쇄 가변 영역 및 베바시주맙(서열번호 14-16)의 경쇄 CDR 1-3을 포함하는 경쇄 가변 영역을 포함하는 항원-결합 단편을 코딩한다.
특정 실시양태에서, 항-VEGF 항원-결합 단편 전이유전자는 서열번호 14-16의 경쇄 CDR 1-3을 포함하는 경쇄 가변 영역을 포함하는 항원-결합 단편을 코딩하되, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는다. 구체적 실시양태에서, 항-VEGF 항원-결합 단편 전이유전자는 서열번호 14-16의 경쇄 CDR 1-3을 포함하는 경쇄 가변 영역을 포함하는 항원-결합 단편을 코딩하되, 경쇄 CDR1의 제8 및 제11 아미노산 잔기(즉, SASQDISNYLN(서열번호 14) 내의 2 개의 N) 각각은 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는다. 구체적 실시양태에서, 항-VEGF 항원-결합 단편 전이유전자는 서열번호 14-16의 경쇄 CDR 1-3을 포함하는 경쇄 가변 영역을 포함하는 항원-결합 단편을 코딩하되, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 아세틸화되지 않는다. 구체적 실시양태에서, 항-VEGF 항원-결합 단편 전이유전자는 서열번호 14-16의 경쇄 CDR 1-3을 포함하는 경쇄 가변 영역을 포함하는 항원-결합 단편을 코딩하되, 경쇄 CDR1의 제8 및 제11 아미노산 잔기(즉, SASQDISNYLN(서열번호 14) 내의 2 개의 N) 각각은 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 아세틸화되지 않는다. 바람직한 실시양태에서, 본원에 기재된 화학적 변형(들) 또는 (경우에 따라) 화학적 변형(들)의 결여는 질량 분광법에 의해 결정된다.
특정 실시양태에서, 항-VEGF 항원-결합 단편 전이유전자는 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하는 중쇄 가변 영역을 포함하는 항원-결합 단편을 코딩하되, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는다. 구체적 실시양태에서, 항-VEGF 항원-결합 단편 전이유전자는 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하는 중쇄 가변 영역을 포함하는 항원-결합 단편을 코딩하되, 중쇄 CDR1의 제9 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 M)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 중쇄 CDR2의 제3 아미노산 잔기(즉, WINTYTGEPTYAADFKR(서열번호 18) 내의 N)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하며, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는다. 구체적 실시양태에서, 항-VEGF 항원-결합 단편 전이유전자는 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하는 중쇄 가변 영역을 포함하는 항원-결합 단편을 코딩하되, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 아세틸화되지 않는다. 구체적 실시양태에서, 항-VEGF 항원-결합 단편 전이유전자는 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하는 중쇄 가변 영역을 포함하는 항원-결합 단편을 코딩하되, 중쇄 CDR1의 제9 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 M)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 중쇄 CDR2의 제3 아미노산 잔기(즉, WINTYTGEPTYAADFKR(서열번호 18) 내의 N)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하며, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 아세틸화되지 않는다. 바람직한 실시양태에서, 본원에 기재된 화학적 변형(들) 또는 (경우에 따라) 화학적 변형(들)의 결여는 질량 분광법에 의해 결정된다.
특정 실시양태에서, 항-VEGF 항원-결합 단편 전이유전자는 서열번호 14-16의 경쇄 CDR 1-3을 포함하는 경쇄 가변 영역 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하는 중쇄 가변 영역을 포함하는 항원-결합 단편을 코딩하되, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않고, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는다. 구체적 실시양태에서, 항-VEGF 항원-결합 단편 전이유전자는 서열번호 14-16의 경쇄 CDR 1-3을 포함하는 경쇄 가변 영역 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하는 중쇄 가변 영역을 포함하는 항원-결합 단편을 코딩하되, (1) 중쇄 CDR1의 제9 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 M)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 중쇄 CDR2의 제3 아미노산 잔기(즉, WINTYTGEPTYAADFKR(서열번호 18) 내의 N)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하며, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않고; (2) 경쇄 CDR1의 제8 및 제11 아미노산 잔기(즉, SASQDISNYLN(서열번호 14) 내의 2 개의 N) 각각은 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는다. 구체적 실시양태에서, 항-VEGF 항원-결합 단편 전이유전자는 서열번호 14-16의 경쇄 CDR 1-3을 포함하는 경쇄 가변 영역 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하는 중쇄 가변 영역을 포함하는 항원-결합 단편을 코딩하되, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 아세틸화되지 않고, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 아세틸화되지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 20의 중쇄 CDR1을 포함하되, (1) 중쇄 CDR1의 제9 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 M)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 중쇄 CDR2의 제3 아미노산 잔기(즉, WINTYTGEPTYAADFKR(서열번호 18) 내의 N)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하며, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 아세틸화되지 않고; (2) 경쇄 CDR1의 제8 및 제11 아미노산 잔기(즉, SASQDISNYLN(서열번호 14) 내의 2 개의 N) 각각은 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 아세틸화되지 않는다. 바람직한 실시양태에서, 본원에 기재된 화학적 변형(들) 또는 (경우에 따라) 화학적 변형(들)의 결여는 질량 분광법에 의해 결정된다.
특정 양태에서, 본원은 또한 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하는 항-VEGF 항원-결합 단편, 및 이러한 항원-VEGF 항원-결합 단편을 코딩하는 전이유전자를 제공하되, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 경쇄 CDR1의 제8 및 제11 아미노산 잔기(즉, SASQDISNYLN(서열번호 14) 내의 2 개의 N) 각각은 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 아세틸화되지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 경쇄 CDR1의 제8 및 제11 아미노산 잔기(즉, SASQDISNYLN(서열번호 14) 내의 2 개의 N) 각각은 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 아세틸화되지 않는다. 본원에서 제공되는 항-VEGF 항원-결합 단편 및 전이유전자는 본원에 기재된 발명에 따른 임의의 방법에서 사용될 수 있다. 바람직한 실시양태에서, 본원에 기재된 화학적 변형(들) 또는 (경우에 따라) 화학적 변형(들)의 결여는 질량 분광법에 의해 결정된다.
특정 양태에서, 본원은 또한 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하는 항-VEGF 항원-결합 단편, 및 이러한 항원-VEGF 항원-결합 단편을 코딩하는 전이유전자를 제공하되, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 중쇄 CDR1의 제9 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 M)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 중쇄 CDR2의 제3 아미노산 잔기(즉, WINTYTGEPTYAADFKR(서열번호 18) 내의 N)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하며, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 아세틸화되지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 중쇄 CDR1의 제9 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 M)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 중쇄 CDR2의 제3 아미노산 잔기(즉, WINTYTGEPTYAADFKR(서열번호 18) 내의 N)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하며, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 아세틸화되지 않는다. 본원에서 제공되는 항-VEGF 항원-결합 단편 및 전이유전자는 본원에 기재된 발명에 따른 임의의 방법에서 사용될 수 있다. 바람직한 실시양태에서, 본원에 기재된 화학적 변형(들) 또는 (경우에 따라) 화학적 변형(들)의 결여는 질량 분광법에 의해 결정된다.
특정 양태에서, 본원은 또한 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하는 항-VEGF 항원-결합 단편, 및 이러한 항원-VEGF 항원-결합 단편을 코딩하는 전이유전자를 제공하되, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않고, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, (1) 중쇄 CDR1의 제9 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 M)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 중쇄 CDR2의 제3 아미노산 잔기(즉, WINTYTGEPTYAADFKR(서열번호 18) 내의 N)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하며, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않고; (2) 경쇄 CDR1의 제8 및 제11 아미노산 잔기(즉, SASQDISNYLN(서열번호 14) 내의 2 개의 N) 각각은 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 아세틸화되지 않고, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 아세틸화되지 않는다. 구체적 실시양태에서, 항원-결합 단편은 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하되, (1) 중쇄 CDR1의 제9 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 M)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 중쇄 CDR2의 제3 아미노산 잔기(즉, WINTYTGEPTYAADFKR(서열번호 18) 내의 N)는 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하며, 중쇄 CDR1의 최종 아미노산 잔기(즉, GYDFTHYGMN(서열번호 20) 내의 N)는 아세틸화되지 않고; (2) 경쇄 CDR1의 제8 및 제11 아미노산 잔기(즉, SASQDISNYLN(서열번호 14) 내의 2 개의 N) 각각은 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 경쇄 CDR3의 제2 아미노산 잔기(즉, QQYSTVPWTF(서열번호 16) 내의 제2 Q)는 아세틸화되지 않는다. 본원에서 제공되는 항-VEGF 항원-결합 단편 및 전이유전자는 본원에 기재된 발명에 따른 임의의 방법에서 사용될 수 있다. 바람직한 실시양태에서, 본원에 기재된 화학적 변형(들) 또는 (경우에 따라) 화학적 변형(들)의 결여는 질량 분광법에 의해 결정된다.
표 2. 예시적인 전이유전자 서열
5.2.9 구조체
특정 실시양태에서, 본원에서 제공되는 바이러스 벡터는 다음 순서로 다음 요소: a) 구성적 또는 저산소증-유도성 프로모터 서열, 및 b) 전이유전자(예를 들어, 항-VEGF 항원-결합 단편 모이어티)를 코딩하는 서열을 포함한다. 특정 실시양태에서, 전이유전자를 코딩하는 서열은 IRES 요소에 의해 분리된 다수의 ORF를 포함한다. 특정 실시양태에서, ORF는 항-VEGF 항원-결합 단편의 중쇄 및 경쇄 도메인을 코딩한다. 특정 실시양태에서, 전이유전자를 코딩하는 서열은 F/F2A 서열에 의해 분리된 하나의 ORF 내의 다수의 서브유닛을 포함한다. 특정 실시양태에서, 전이유전자를 포함하는 서열은 F/F2A 서열에 의해 분리된 항-VEGF 항원-결합 단편의 중쇄 및 경쇄 도메인을 코딩한다. 특정 실시양태에서, 본원에서 제공되는 바이러스 벡터는 다음 순서로 다음 요소: a) 구성적 또는 저산소증-유도성 프로모터 서열, 및 b) 전이유전자(예를 들어, 항-VEGF 항원-결합 단편 모이어티)를 코딩하는 서열을 포함하되, 전이유전자는 VEGF의 시그널 펩티드(서열번호 5)를 포함하며, 전이유전자는 IRES 요소에 의해 분리된 경쇄 및 중쇄 서열을 코딩한다. 특정 실시양태에서, 본원에서 제공되는 바이러스 벡터는 다음 순서로 다음 요소: a) 구성적 또는 저산소증-유도성 프로모터 서열, 및 b) 전이유전자(예를 들어, 항-VEGF 항원-결합 단편 모이어티)를 코딩하는 서열을 포함하되, 전이유전자는 VEGF의 시그널 펩티드(서열번호 5)를 포함하며, 전이유전자는 절단가능한 F/F2A 서열에 의해 분리된 경쇄 및 중쇄 서열을 코딩한다.
특정 실시양태에서, 본원에서 제공되는 바이러스 벡터는 다음 순서로 다음 요소: a) 제1 ITR 서열, b) 제1 링커 서열, c) 구성적 또는 저산소증-유도성 프로모터 서열, d) 제2 링커 서열, e) 인트론 서열, f) 제3 링커 서열, g) 제1 UTR 서열, h) 전이유전자(예를 들어, 항-VEGF 항원-결합 단편 모이어티)를 코딩하는 서열, i) 제2 UTR 서열, j) 제4 링커 서열, k) 폴리 A 서열, l) 제5 링커 서열, 및 m) 제2 ITR 서열을 포함한다.
특정 실시양태에서, 본원에서 제공되는 바이러스 벡터는 다음 순서로 다음 요소: a) 제1 ITR 서열, b) 제1 링커 서열, c) 구성적 또는 저산소증-유도성 프로모터 서열, d) 제2 링커 서열, e) 인트론 서열, f) 제3 링커 서열, g) 제1 UTR 서열, h) 전이유전자(예를 들어, 항-VEGF 항원-결합 단편 모이어티)를 코딩하는 서열, i) 제2 UTR 서열, j) 제4 링커 서열, k) 폴리 A 서열, l) 제5 링커 서열, 및 m) 제2 ITR 서열을 포함하되, 전이유전자는 VEGF의 시그널 펩티드(서열번호 5)를 포함하며, 전이유전자는 절단가능한 F/F2A 서열에 의해 분리된 경쇄 및 중쇄 서열을 코딩한다.
5.2.10 벡터의 제조 및 시험
본원에서 제공되는 바이러스 벡터는 숙주 세포를 사용하여 제조될 수 있다. 본원에서 제공되는 바이러스 벡터는 포유동물 숙주 세포, 예를 들어 A549, WEHI, 10T1/2, BHK, MDCK, COS1, COS7, BSC 1, BSC 40, BMT 10, VERO, W138, HeLa, 293, Saos, C2C12, L, HT1080, HepG2, 일차 섬유아세포, 간세포, 및 근원 세포를 사용하여 제조될 수 있다. 본원에서 제공되는 바이러스 벡터는 인간, 원숭이, 마우스, 래트, 토끼, 또는 햄스터로부터의 숙주 세포를 사용하여 제조될 수 있다.
숙주 세포는 전이유전자를 코딩하는 서열 및 연관된 요소(즉, 벡터 게놈), 및 숙주 세포에서 바이러스를 생산하는 수단, 예를 들어 복제 및 캡시드 유전자(예를 들어, AAV의 rep 및 cap 유전자)로 안정하게 형질전환된다. AAV8 캡시드를 가진 재조합 AAV 벡터를 생산하는 방법에 대해서는, 그 전체가 본원에 참고로 포함되는 미국 특허 7,282,199 B2호의 상세한 설명의 섹션 IV를 참고한다. 상기 벡터의 게놈 카피 역가(titer)는 예를 들어, TAQMAN® 분석에 의해 결정될 수 있다. 비리온은 예를 들어, CsCl2 침강에 의해 회수될 수 있다.
시험관내 분석이, 예를 들어 세포 배양 에세이가 본원에 기재된 벡터로부터의 전이유전자 발현을 측정하여, 예를 들어 벡터의 역가(potency)를 나타내기 위해 사용될 수 있다. 예를 들어, 인간 배아 망막 세포로부터 유래된 세포주인 PER.C6® 세포주(Lonza), 또는 망막 색소 상피 세포, 예를 들어 망막 색소 상피 세포주 hTERT RPE-1(ATCC®로부터 이용가능함)이 전이유전자 발현을 평가하기 위해 사용될 수 있다. 일단 발현되면, 발현된 산물(즉, HuGlyFabVEGFi)의 특징이 결정될 수 있으며, HuGlyFabVEGFi와 연관된 당화 및 티로신 황산화 패턴의 결정을 포함한다. 당화 패턴 및 이를 결정하는 방법은 섹션 5.1.1에서 논의되는 한편, 티로신 황산화 패턴 및 이를 결정하는 방법은 섹션 5.1.2에서 논의된다. 또한, 세포-발현된 HuGlyFabVEGFi의 당화/황산화로부터 야기되는 이익이 당업계에 알려진 에세이, 예를 들어 섹션 5.1.1 및 5.1.2에 기재된 방법을 사용하여 결정될 수 있다.
5.2.11 조성물
본원에 기재된 전이유전자를 코딩하는 벡터 및 적합한 담체를 포함하는 조성물이 기재된다. 적합한 담체(예를 들어, 맥락막상, 망막하, 공막옆, 및/또는 망막내 투여를 위한 것)는 당업자가 용이하게 선택할 것이다.
5.3 유전자 요법
안구 질환, 특히 증가된 신혈관형성에 의해 야기된 안구 질환을 갖는 인간 대상체에 전이유전자 구조체의 치료적 유효량을 투여하기 위한 방법이 기재된다. 더욱 구체적으로, 특히 맥락막상, 망막하, 공막옆 및/또는 망막내 투여(예를 들어, 맥락막상 주사, 경유리체 접근법을 통한 망막하 주사(외과적 수술), 맥락막상 공간을 통한 망막하 투여, 또는 후방 공막옆 데포 수술에 의함)를 위한, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)을 갖는 환자에게 전이유전자 구조체의 치료적 유효량을 투여하기 위한 방법이 기재된다. 특별한 실시양태에서, 전이유전자 구조체의 치료적 유효량의 맥락막상, 망막하, 공막옆 및/또는 망막내 투여를 위한 이러한 방법은 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)을 갖는 환자를 치료하기 위해 사용될 수 있다(예를 들어, 맥락막상 주사, 경유리체 접근법을 통한 망막하 주사(외과적 수술), 맥락막상 공간을 통한 망막하 투여, 또는 후방 공막옆 데포 수술에 의함).
안구 질환, 특히 증가된 신혈관형성에 의해 야기된 안구 질환으로 진단된 환자에게 전이유전자 구조체의 치료적 유효량을 맥락막상, 망막하, 공막옆 및/또는 망막내 투여(예를 들어, 맥락막상 주사, 경유리체 접근법을 통한 망막하 주사(외과적 수술), 맥락막상 공간을 통한 망막하 투여, 또는 후방 공막옆 데포 수술에 의함)하기 위한 방법이 기재된다. 특별한 실시양태에서, 전이유전자 구조체의 치료적 유효량의 맥락막상, 망막하, 공막옆 및/또는 망막내 투여를 위한 이러한 방법은 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD); 그리고 특히 습성 AMD(신혈관 AMD), 또는 당뇨 망막병증으로 진단된 환자를 치료하기 위해 사용될 수 있다(예를 들어, 맥락막상 주사, 경유리체 접근법을 통한 망막하 주사(외과적 수술), 맥락막상 공간을 통한 망막하 투여, 또는 후방 공막옆 데포 수술에 의함).
전이유전자 구조체의 치료적 유효량의 맥락막상, 망막하, 공막옆 및/또는 망막내 투여(예를 들어, 맥락막상 주사, 경유리체 접근법을 통한 망막하 주사(외과적 수술), 맥락막상 공간을 통한 망막하 투여, 또는 후방 공막옆 데포 수술에 의함)를 위한 방법 및 전이유전자 구조체의 치료적 유효량의 망막 색소 상피에 대한 투여 방법이 또한 본원에서 제공된다.
5.3.1 표적 환자 집단
특정 실시양태에서, 본원에서 제공되는 방법은 안구 질환(예를 들어, 습성 AMD, 건성 AMD, 망막 정맥 폐쇄(RVO), 당뇨병성 황반부종(DME), 또는 당뇨 망막병증(DR)(특히, 습성 AMD)), 특히 증가된 신혈관형성에 의해 야기된 안구 질환으로 진단된 환자에게 투여하기 위한 것이다.
특정 실시양태에서, 본원에서 제공되는 방법은 심각한 AMD로 진단된 환자에게 투여하기 위한 것이다. 특정 실시양태에서, 본원에서 제공되는 방법은 약화된 AMD로 진단된 환자에게 투여하기 위한 것이다.
특정 실시양태에서, 본원에서 제공되는 방법은 심각한 습성 AMD로 진단된 환자에게 투여하기 위한 것이다. 특정 실시양태에서, 본원에서 제공되는 방법은 약화된 습성 AMD로 진단된 환자에게 투여하기 위한 것이다.
특정 실시양태에서, 본원에서 제공되는 방법은 심각한 당뇨 망막병증으로 진단된 환자에게 투여하기 위한 것이다. 특정 실시양태에서, 본원에서 제공되는 방법은 약화된 당뇨 망막병증으로 진단된 환자에게 투여하기 위한 것이다.
특정 실시양태에서, 본원에서 제공되는 방법은 항-VEGF 항체를 이용한 치료에 반응성으로 확인된, AMD로 진단된 환자에게 투여하기 위한 것이다.
특정 실시양태에서, 본원에서 제공되는 방법은 항-VEGF 항원-결합 단편을 이용한 치료에 반응성으로 확인된, AMD로 진단된 환자에게 투여하기 위한 것이다.
특정 실시양태에서, 본원에서 제공되는 방법은 유전자 요법을 이용한 치료 전에 유리체내로 주사된 항-VEGF 항원-결합 단편을 이용한 치료에 반응성으로 확인된, AMD로 진단된 환자에게 투여하기 위한 것이다.
특정 실시양태에서, 본원에서 제공되는 방법은 LUCENTIS®(라니비주맙), EYLEA®(아플리베르셉트), 및/또는 AVASTIN®(베바시주맙)을 이용한 치료에 반응성으로 확인된, AMD로 진단된 환자에게 투여하기 위한 것이다.
5.3.2 투여량 및 투여 방식
재조합 벡터의 치료적 유효 용량은 ≥0.1 mL 내지 ≤0.5 mL, 바람직하게는 0.1 내지 0.30 mL(100 - 300 μL) 범위의 부피로, 가장 바람직하게는, 0.25 mL(250 μL)의 부피로 망막하로, 및/또는 망막내로(예를 들어, 경유리체 접근법(외과적 수술)을 통한 망막하 주사에 의하거나, 맥락막상 공간을 통함) 투여되어야 한다. 재조합 벡터의 치료적 유효 용량은 100 μL 이하의 부피로, 예를 들어 50-100 μL의 부피로 맥락막상으로(예를 들어, 맥락막상 주사에 의해) 투여되어야 한다. 재조합 벡터의 치료적 유효 용량은 500 μL 이하의 부피로, 예를 들어 500 μL 이하의 부피로, 예를 들어 10-20 μL, 20-50 μL, 50-100 μL, 100-200 μL, 200-300 μL, 300-400 μL, 또는 400-500 μL의 부피로 공막의 외면에 투여되어야 한다.
특정 실시양태에서, 재조합 벡터는 맥락막상으로(예를 들어, 맥락막상 주사에 의해) 투여된다. 구체적 실시양태에서, 맥락막상 투여(예를 들어, 맥락막상 공간 내로의 주사)는 맥락막상 약물 전달 장치를 사용하여 수행된다. 맥락막상 약물 전달 장치는 보통 맥락막상 투여 수술에서 사용되며, 이는 눈의 맥락막상 공간에 대한 약물의 투여를 포함한다(예를 들어, 각각 그 전체가 본원에 참고로 포함되는 Hariprasad, 2016, Retinal Physician 13: 20-23; Goldstein, 2014, Retina Today 9(5): 82-87; Baldassarre et al., 2017 참고). 본원에 기재된 발명에 따라 망막하 공간 내에 발현 벡터를 배치하기 위해 사용될 수 있는 맥락막상 약물 전달 장치는, 비제한적으로, Clearside® Biomedical, Inc.에 의해 제조된 맥락막상 약물 전달 장치(예를 들어, Hariprasad, 2016, Retinal Physician 13: 20-23 참고) 및 MedOne 맥락막상 카테터를 포함한다.
구체적 실시양태에서, 맥락막상 약물 전달 장치는 1 mm 30 게이지 바늘을 갖는 시린지이다(도 24 참고). 이 장치를 사용한 주사 동안, 바늘은 공막의 기반을 뚫고 약물을 함유한 유체가 맥락막상 공간으로 들어가, 맥락막상 공간의 팽창을 야기한다. 결과적으로, 주사 동안 촉각 및 시각 피드백이 있다. 주사 후에, 유체는 후방으로 흐르고 맥락막 및 망막에서 주로 흡수된다. 이는 모든 망막 세포 층 및 맥락막 세포로부터 전이유전자 단백질의 생산을 야기한다. 이 유형의 장치 및 수술을 사용하는 것은 합병증의 낮은 위험을 갖는 신속하고 용이한 사무실내 수술을 허용한다. 100 μL의 최대 부피가 맥락막상 공간 내로 주사될 수 있다.
특정 실시양태에서, 재조합 벡터는 망막하 약물 전달 장치의 사용에 의해 맥락막상 공간을 통해 망막하로 투여된다. 특정 실시양태에서, 망막하 약물 전달 장치는 망막하 공간에 약물을 전달하기 위한 외과적 수술 동안 눈의 후방 주변으로 맥락막상 공간을 통해 삽입되고 뚫리는 카테터이다(도 25 참고). 이 수술은 유리체가 온전하게 유지되게 하므로, 합병증 위험이 거의 없고(유전자 요법 탈출, 및 망막 박리 및 황반 원공과 같은 합병증의 적은 위험), 유리체절제술 없이, 생성된 물집이 더욱 확산하여 분산되어, 망막의 더 큰 표면적이 작은 부피로 형질도입되게 할 수 있다. 이 수술 후 유도되는 백내장의 위험은 최소화되며, 이는 어린 환자를 위해 바람직하다. 또한, 이 수술은 중심와 하부의 물집을 표준 경유리체 접근법에 비해 더욱 안전하게 전달할 수 있으며, 이는 형질도입을 위한 표적 세포가 황반 내에 있는 중심 시력에 영향을 주는 유전된 망막 질환을 갖는 환자를 위해 바람직하다. 이 수술은 또한 다른 전달 경로(예컨대, 맥락막상 및 유리체내)에 영향을 줄 수 있는 전신 순환 내에 존재하는 AAV에 대한 중화 항체(Nab)를 갖는 환자에게 유리하다. 또한, 이 방법은 표준 경유리체 접근법에 비해 덜 탈출된 망막절개 부위를 갖는 물집을 생성하는 것으로 나타났다. 본래 Janssen Pharmaceuticals, Inc.에 의해 제조되고 현재는 Orbit Biomedical Inc.에 의해 제조되는 망막하 약물 전달 장치(예를 들어, Subretinal Delivery of Cells via the Suprachoroidal Space: Janssen Trial. In: Schwartz et al. (eds) Cellular Therapies for Retinal Disease, Springer, Cham; 국제 특허 출원 공개 WO 2016/040635 A1호 참고)가 이러한 목적을 위해 사용될 수 있다.
특정 실시양태에서, 재조합 벡터는 공막 외면에 투여된다(예를 들어, 팁이 공막 표면에 대해 직접 병치로 삽입되고 유지될 수 있는 캐뉼라를 포함하는 공막옆 약물 전달 장치의 사용에 의함). 구체적 실시양태에서, 공막 외면에 대한 투여는 후방 공막옆 데포 수술을 사용하여 수행되며, 이는 안구를 구멍 내지 않으면서 약물이 뭉툭한 팁의 곡선형 캐뉼라 내로 들어간 다음에, 공막 외면과 직접 접촉으로 전달되는 것을 포함한다. 특히, 공막 노출을 위한 작은 절개의 생성 후에, 캐뉼라 팁이 삽입된다(도 26a 참고). 캐뉼라 샤프트의 곡선형 부분이 삽입되고, 캐뉼라 팁을 공막 표면에 대해 직접 병치로 유지한다(도 26b-26d 참고). 캐뉼라의 완전 삽입(도 26d) 후, 약물이 천천히 주사되는 한편, 약한 압력이 살균 면봉을 이용하여 캐뉼라 샤프트의 상부 및 측면을 따라 유지된다. 이 전달 방법은 안구내 감염 및 망막 박리의 위험, 눈 내로 직접 치료제를 주사하는 것과 일반적으로 연관된 부작용을 회피한다.
유리체 액에서 적어도 0.330 ㎍/mL, 또는 방수(눈의 전방)에서 0.110 ㎍/mL의 Cmin에서 전이유전자 산물의 농도를 3 개월 동안 유지하는 용량이 바람직하며; 그 후, 1.70 내지 6.60 ㎍/mL 범위의 전이유전자 산물의 유리체 Cmin 농도, 및/또는 0.567 내지 2.20 ㎍/mL 범위의 방수 Cmin 농도가 유지되어야 한다. 그러나, 전이유전자 산물이 (구성적 프로모터의 제어 하에서 또는 저산소증-유도성 프로모터를 사용할 때 저산소성 조건에 의해 유도되어) 연속적으로 생산되기 때문에, 낮은 농도의 유지가 효과적일 수 있다. 유리체 액 농도는 유리체 액 또는 전방으로부터 수집된 유체의 환자 샘플에서 직접 측정되거나, 전이유전자 산물의 환자의 혈청 농도를 측정함으로써 추정 및/또는 모니터링될 수 있다 - 전이유전자 산물에 대한 전신 대 유리체 노출의 비는 약 1:90,000이다. (예를 들어, 그 전체가 본원에 참고로 포함되는 Xu L, et al., 2013, Invest. Opthal. Vis. Sci. 54: 1616-1624, at p. 1621 및 Table 5 at p. 1623에서 보고된 라니비주맙의 유리체 액 및 혈청 농도 참고).
특정 실시양태에서, 투여량은 환자의 눈에 투여된(예를 들어, 맥락막상으로, 망막하로, 공막옆으로 및/또는 망막내로(예를 들어, 맥락막상 주사, 경유리체 접근법을 통한 망막하 주사(외과적 수술), 맥락막상 공간을 통한 망막하 투여, 또는 후방 공막옆 데포 수술에 의함) 투여된) mL 당 게놈 카피 또는 게놈 카피의 수에 의해 측정된다. 특정 실시양태에서, 2.4 x 1011 게놈 카피/mL 내지 1 x1013 게놈 카피/mL가 투여된다. 구체적 실시양태에서, 2.4 x 1011 게놈 카피/mL 내지 5 x1011 게놈 카피/mL가 투여된다. 다른 구체적 실시양태에서, 5 x 1011 게놈 카피/mL 내지 1 x1012 게놈 카피/mL가 투여된다. 다른 구체적 실시양태에서, 1 x 1012 게놈 카피/mL 내지 5 x1012 게놈 카피/mL가 투여된다. 다른 구체적 실시양태에서, 5 x 1012 게놈 카피/mL 내지 1 x1013 게놈 카피/mL가 투여된다. 다른 구체적 실시양태에서, 약 2.4 x 1011 게놈 카피/mL가 투여된다. 다른 구체적 실시양태에서, 약 5 x 1011 게놈 카피/mL가 투여된다. 다른 구체적 실시양태에서, 약 1 x 1012 게놈 카피/mL가 투여된다. 다른 구체적 실시양태에서, 약 5 x 1012 게놈 카피/mL가 투여된다. 다른 구체적 실시양태에서, 약 1 x 1013 게놈 카피/mL가 투여된다. 특정 실시양태에서, 1 x 109 내지 1 x 1012 게놈 카피가 투여된다. 구체적 실시양태에서, 3 x 109 내지 2.5 x 1011 게놈 카피가 투여된다. 구체적 실시양태에서, 1 x 109 내지 2.5 x 1011 게놈 카피가 투여된다. 구체적 실시양태에서, 1 x 109 내지 1 x 1011 게놈 카피가 투여된다. 구체적 실시양태에서, 1 x 109 내지 5 x 109 게놈 카피가 투여된다. 구체적 실시양태에서, 6 x 109 내지 3 x 1010 게놈 카피가 투여된다. 구체적 실시양태에서, 4 x 1010 내지 1 x 1011 게놈 카피가 투여된다. 구체적 실시양태에서, 2 x 1011 내지 1 x 1012 게놈 카피가 투여된다. 구체적 실시양태에서, 약 3 x 109 게놈 카피가 투여된다(250 μL의 부피에서 약 1.2 x 1010 게놈 카피/mL에 상응함). 다른 구체적 실시양태에서, 약 1 x 1010 게놈 카피가 투여된다(250 μL의 부피에서 약 4 x 1010 게놈 카피/mL에 상응함). 다른 구체적 실시양태에서, 약 6 x 1010 게놈 카피가 투여된다(250 μL의 부피에서 약 2.4 x 1011 게놈 카피/mL에 상응함). 다른 구체적 실시양태에서, 약 1.6 x 1011 게놈 카피가 투여된다(250 μL의 부피에서 약 6.2 x 1011 게놈 카피/mL에 상응함). 다른 구체적 실시양태에서, 약 1.6 x 1011 게놈 카피가 투여된다(250 μL의 부피에서 약 6.4 x 1011 게놈 카피/mL에 상응함). 다른 구체적 실시양태에서, 약 2.5 x 1011 게놈 카피(250 μL의 부피에서 약 2.5 x 1010에 상응함)가 투여된다.
본원에 사용된 바에 있어서 달리 나타내지 않는 경우, 용어 "약"은 주어진 값 또는 범위의 플러스 또는 마이너스 10% 이내를 의미한다.
5.3.3 샘플링 및 효능의 모니터링
시각 장애에 대한 본원에 제공되는 치료 방법의 효과는 BCVA(최고 교정 시력), 안압, 세극등 현미경검사, 및/또는 간접적 검안에 의해 측정될 수 있다.
눈/망막에 대한 물리적 변화에 대한 본원에서 제공되는 치료 방법의 효과는 SD-OCT(SD-광간섭 단층촬영술)에 의해 측정될 수 있다.
효능은 망막전위도검사(ERG)에 의해 측정하여 모니터링될 수 있다.
본원에서 제공되는 치료 방법의 효과는 시력 손실, 감염, 염증 및 망막 박리를 비롯한 다른 안전성 이벤트의 징후를 측정함으로써 모니터링될 수 있다.
망막 두께는 본원에서 제공되는 치료의 효능을 결정하기 위해 모니터링될 수 있다. 임의의 특별한 이론에 구애됨 없이, 망막의 두께는 임상적 판독정보로서 사용될 수 있으며, 망막 두께에서 감소가 더 크거나 또는 망막이 두꺼워지기 전 기간이 더 길수록, 치료는 더 효과적이다. 망막 기능은 예를 들어, ERG에 의해 결정될 수 있다. ERG는 인간에서의 사용을 위해 FDA에 의해 승인된, 망막 기능의 비-침습성 전기생리학적 시험이며, 눈의 광 민감성 세포(간상 및 원뿔), 및 이들의 연결 신경절 세포, 특히 플래쉬 자극에 대한 그들의 반응을 검사한다. 망막 두께는 예를 들어, SD-OCT에 의해 결정될 수 있다. SD-OCT는 관심 물체로부터 반사된 후방산란된 광의 반사 시간 지연 및 양을 결정하기 위하여 저-간섭성 간섭계를 이용하는 삼차원 영상화 기술이다. OCT는 3 내지 15 ㎛ 축방향 해상력으로 조직 샘플(예를 들어, 망막)의 층을 스캔하기 위해 사용될 수 있으며, SD-OCT는 이전 형태의 기술에 비해 축방향 해상력 및 스캔 속도를 개선한다(Schuman, 2008, Trans. Am. Opthamol. Soc. 106:426-458).
5.4 병용 요법
본원에서 제공되는 치료 방법은 1 이상의 추가 요법과 조합될 수 있다. 일 양태에서, 본원에서 제공되는 치료 방법은 레이저 광응고법과 함께 투여된다. 일 양태에서, 본원에서 제공되는 치료 방법은 베르테포르핀을 이용한 광선역학적 요법과 함께 투여된다.
일 양태에서, 본원에서 제공되는 치료 방법은, 비제한적으로, HuPTMFabVEGFi, 예를 들어 인간 세포주에서 생산된 HuGlyFabVEGFi(상기 Dumont et al., 2015), 또는 페갑타닙, 라니비주맙, 아플리베르셉트, 또는 베바시주맙과 같은 다른 항-VEGF 약제를 포함하는 항-VEGF 약제를 이용한 유리체내(IVT) 주사와 함께 투여된다.
추가 요법은 유전자 요법 치료 전에, 그와 동시에 또는 그에 이어서 투여될 수 있다.
유전자 요법 치료의 효능은 케어 표준을 사용하는 구제 치료, 예를 들어, 비제한적으로, HuPTMFabVEGFi, 예를 들어 인간 세포주에서 생산된 HuGlyFabVEGFi, 또는 페갑타닙, 라니비주맙, 아플리베르셉트, 또는 베바시주맙과 같은 다른 항-VEGF 약제를 포함하는 항-VEGF 약제를 이용한 유리체내 주사의 제거 또는 그 수의 감소에 의해 나타날 수 있다.
표 3. 서열의 표
6. 실시예
6.1 구조체
6.1.1 실시예 1: 베바시주맙 Fab cDNA-계 벡터
경쇄 및 중쇄 cDNA 서열(각각 서열번호 10 및 11)의 베바시주맙 Fab 부분을 포함하는 전이유전자를 포함하는 베바시주맙 Fab cDNA-계 벡터를 제작한다. 전이유전자는 또한 표 1에 열거된 그룹으로부터 선택된 시그널 펩티드를 포함하는 핵산을 포함한다. 경쇄 및 중쇄를 코딩하는 뉴클레오티드 서열은 바이시스트론성 벡터를 생성하기 위해 IRES 요소 또는 2A 절단 부위에 의해 분리된다. 선택적으로, 벡터는 추가적으로 저산소증-유도성 프로모터를 포함한다.
6.1.2 실시예 2: 라니비주맙 cDNA-계 벡터
라니비주맙 Fab 경쇄 및 중쇄 cDNA(각각 시그널 펩티드를 코딩하지 않는 서열번호 12 및 13의 일부)를 포함하는 전이유전자를 포함하는 라니비주맙 Fab cDNA-계 벡터를 제작한다. 전이유전자는 또한 표 1에 열거된 그룹으로부터 선택된 시그널 펩티드를 포함하는 핵산을 포함한다. 경쇄 및 중쇄를 코딩하는 뉴클레오티드 서열은 바이시스트론성 벡터를 생성하기 위해 IRES 요소 또는 2A 절단 부위에 의해 분리된다. 선택적으로, 벡터는 추가적으로 저산소증-유도성 프로모터를 포함한다.
6.1.3 실시예 3: 초고당화된 베바시주맙 Fab cDNA-계 벡터
다음 돌연변이 중 1 이상을 코딩하는 서열로의 돌연변이를 갖는 경쇄 및 중쇄 cDNA 서열(각각 서열번호 10 및 11)의 베바시주맙 Fab 부분을 포함하는 전이유전자를 포함하는 초고당화된 베바시주맙 Fab cDNA-계 벡터를 제작한다: L118N(중쇄), E195N(경쇄), 또는 Q160N 또는 Q160S(경쇄). 전이유전자는 또한 표 1에 열거된 그룹으로부터 선택된 시그널 펩티드를 포함하는 핵산을 포함한다. 경쇄 및 중쇄를 코딩하는 뉴클레오티드 서열은 바이시스트론성 벡터를 생성하기 위해 IRES 요소 또는 2A 절단 부위에 의해 분리된다. 선택적으로, 벡터는 추가적으로 저산소증-유도성 프로모터를 포함한다.
6.1.4 실시예 4: 초고당화된 라니비주맙 cDNA-계 벡터
다음 돌연변이 중 1 이상을 코딩하는 서열로의 돌연변이를 갖는 라니비주맙 Fab 경쇄 및 중쇄 cDNA(각각 시그널 펩티드를 코딩하지 않는 서열번호 12 및 13의 일부)를 포함하는 전이유전자를 포함하는 초고당화된 라니비주맙 Fab cDNA-계 벡터를 제작한다: L118N(중쇄), E195N(경쇄), 또는 Q160N 또는 Q160S(경쇄). 전이유전자는 또한 표 1에 열거된 그룹으로부터 선택된 시그널 펩티드를 포함하는 핵산을 포함한다. 경쇄 및 중쇄를 코딩하는 뉴클레오티드 서열은 바이시스트론성 벡터를 생성하기 위해 IRES 요소 또는 2A 절단 부위에 의해 분리된다. 선택적으로, 벡터는 추가적으로 저산소증-유도성 프로모터를 포함한다.
6.1.5 실시예 5: 라니비주맙계 HuGlyFabVEGFi
라니비주맙 Fab cDNA-계 벡터(실시예 2 참고)가 AAV8 백그라운드에서 PER.C6® 세포주(Lonza)에서 발현된다. 생성되는 산물, 라니비주맙-계 HuGlyFabVEGFi는 안정적으로 생산되는 것으로 결정된다. HuGlyFabVEGFi의 N-당화는 하이드라진분해 및 MS/MS 분석에 의해 확인된다. 예를 들어, Bondt et al., Mol. & Cell. Proteomics 13.11:3029-3039를 참고한다. 글리칸 분석에 기초하여, HuGlyFabVEGFi는 N-당화되며, 2,6 시알산이 주요 변형인 것으로 확인된다. N-당화된 HuGlyFabVEGFi의 유리한 특성은 당업계에 알려진 방법을 사용하여 결정된다. HuGlyFabVEGFi는 증가된 안정성 및 이의 항원(VEGF)에 대한 증가된 친화성을 갖는 것으로 밝혀질 수 있다. 안정성 평가 방법에 대해서는 Sola and Griebenow, 2009, J Pharm Sci., 98(4): 1223-1245를 그리고 친화성 평가 방법에 대해서는 Wright et al., 1991, EMBO J. 10:2717-2723 및 Leibiger et al., 1999, Biochem. J. 338:529-538을 참고한다.
6.2 구조체를 이용한 치료
6.2.1 실시예 6: 라니비주맙계 HuGlyFabVEGFi를 이용한 습성 AMD의 치료
라니비주맙-계 HuGlyFabVEGFi의 유리한 특징의 결정에 기초하여(실시예 5 참고), 라니비주맙 Fab cDNA-계 벡터는 전이유전자로서 발현될 때, 습성 AMD의 치료를 위해 유용할 것으로 여겨진다. 습성 AMD를 나타내는 대상체에게 라니비주맙 Fab를 코딩하는 AAV8을, 3 개월 동안 유리체 액에서 적어도 0.330 ㎍/mL의 Cmin의 전이유전자 산물의 농도에 충분한 용량으로 투여한다. 치료 후, 대상체를 습성 AMD의 증상에서의 개선에 대해 평가한다.
6.3 마우스 연구
6.3.1 실시예 7: 단일 용량 망막하 투여는 트랜스제닉 Rho/VEGF 마우스에서 망막 신혈관형성을 감소시킨다.
이 연구는 nAMD를 갖는 인간의 망막에서의 신혈관 변화를 위한 모델인 유년기 트랜스제닉 Rho/VEGF 마우스(Tobe, 1998, IOVS 39(1):180-188)에서, 섹션 5.2에 기재된 HuPTMFabVEGFi 벡터의 단일 용량의 생체내 효능을 입증한다. Rho/VEGF 마우스는 출생 후 10 일차에 시작하여, 로돕신 프로모터가 광수용기에서 인간 VEGF165의 발현을 구성적으로 추진하여, 새로운 혈관이 망막의 깊은 모세혈관 상으로부터 생겨나서 망막하 공간 내로 자라게 하는 트랜스제닉 마우스이다. VEGF의 생산이 지속되며 따라서 새로운 혈관이 계속 성장하고 커지며, 신혈관 연령-관련 황반 변성을 갖는 인간에서 보이는 것과 유사한 망막하 공간 내의 큰 네트를 형성한다(상기 Tobe 1998).
이 연구에서 사용된 벡터(본원에서 "벡터 1"로 지칭됨)는 AAV2 역위 말단 반복부(ITR)에 의해 인접된, 인간 VEGF에 결합하고 억제하는 인간화 mAb 항원-결합 단편을 코딩하는 유전자 카세트를 함유하는 비-복제성 AAV8 벡터이다. 벡터 1 내의 중쇄 및 경쇄의 발현은 닭 β-액틴 프로모터 및 CMV 인핸서로 구성된 CB7 프로모터에 의해 제어되며, 벡터는 또한 닭 β-액틴 인트론, 및 토끼 β-글로빈 폴리A 시그널을 포함한다. 벡터 1에서, 항-VEGF Fab의 중쇄와 경쇄를 코딩하는 핵산 서열은 자가-절단 푸린 (F)/F2A 링커에 의해 분리된다. Rho/VEGF 마우스에게 벡터 1 또는 대조군(그룹 당 n=10-17)을 망막하로 주사하고 1 주 후 망막 신혈관형성의 양을 정량화하였다.
망막 신혈관형성의 총 면적은, 포스페이트 완충 염수(PBS) 또는 영 AAV8 벡터가 제공된 마우스와 비교하여, 벡터 1이 제공된 Rho/VEGF 마우스에서 용량-의존적 방식으로 상당히 감소되었다(p< 0.05). 유효성 기준은 망막 신혈관형성의 면적에서의 통계적으로 상당한 감소로서 설정하였다. 이 기준에서, 1 x 107 GC/눈의 벡터 1의 최소 용량이 인간 대상체에서의 nAMD를 위한 뮤린 트랜스제닉 Rho/VEGF 모델에서 망막 신혈관형성의 감소를 위해 효과적인 것으로 결정되었다(도 4).
6.3.2 실시예 8: 단일 용량 망막하 투여는 이중 트랜스제닉 Tet/옵신/VEGF 마우스에서 망막 박리를 감소시킨다.
이 연구는 인간 대상체에서의 안구 신혈관 질환의 트랜스제닉 마우스 모델 - Tet/옵신/VEGF 마우스 - 여기서는 VEGF의 유도성 발현이 심각한 망막병증 및 망막 박리를 야기함(Ohno-Matsui, 2002 Am. J. Pathol. 160(2):711-719)-에서 망막 박리를 예방하기 위한, 벡터 1의 단일 용량의 생체내 효능을 입증한다. Tet/옵신/VEGF 마우스는 광수용기에서 인간 VEGF165의 독시사이클린 유도성 발현을 가진 트랜스제닉 마우스이다. 이들 트랜스제닉 마우스는 음용수에 독시사이클린이 주어질 때까지 표현형적으로는 정상이다. 독시사이클린은 VEGF의 매우 높은 광수용기 발현을 유도하여, 대량 혈관 누수를 야기하고, 유도 4 일 이내에 마우스의 80-90%에서 총 삼출성 망막 박리로 끝나게 된다.
Tet/옵신/VEGF 마우스(그룹 당 10마리)에게 벡터 1 또는 대조군을 망막하로 주사하였다. 주사 후 10 일에, 독시사이클린을 음용수에 첨가하여 VEGF 발현을 유도하였다. 4 일 후, 각각의 눈의 안저를 영상화하고 치료 그룹에 대한 지식이 없는 개인에 의해 각각의 망막을 그대로, 부분 박리, 또는 총 박리로 스코어링하였다(scored).
이들 데이터(도 5에 나타냄)는 벡터 1을 이용한 치료가 Tet/옵신/VEGF 마우스-인간 대상체에서의 안구 신혈관 질환을 위한 동물 모델-에서 망막 박리의 발생 및 정도에서의 감소를 야기하였음을 입증한다.
6.3.3 실시예 9: 항-VEGF 단백질을 발현하는 AAV8 유전자 요법은 마우스 모델에서 망막하 신혈관형성 및 혈관 누수를 강하게 억제한다.
본 실시예에서는, 실시예 7과 8에 기재된 실험으로부터의 방법, 결과 및 결론을 요약한다.
방법. 로돕신 프로모터가 광수용기에서 VEGF165의 발현을 추진하는 트랜스제닉 마우스(rho/VEGF 마우스)에게 출생 후 14 일차(P14)에 한쪽 눈에 3 x 106-1 x 1010 게놈 카피(GC) 범위의 용량의 벡터 1, 1 x 1010 GC의 영 벡터, 또는 PBS(그룹 당 n=10)를 망막하 주사하였다. P21에, 망막하 신혈관형성의 면적(SNV)/눈을 측정하였다. 광수용기에서 VEGF165의 독시사이클린(DOX)-유도성 발현을 갖는 이중 트랜스제닉 마우스(Tet/옵신/VEGF 마우스)에게 한쪽 눈에서 1 x 108-1 x 1010 GC의 벡터 1을 망막하 주사하고 다른 눈에서는 주사하지 않거나 또는 한쪽 눈에서 1 x 1010 GC의 영 벡터를 주사하고 다른 눈에서는 PBS를 주사하였다. 주사 후 10 일에, 2 mg/mL의 DOX를 음용수에 첨가하고 4 일 후 총, 부분, 또는 무 망막 박리(RD)의 존재에 대해 안저 사진을 등급을 매겼다. 눈 파쇄액의 ELISA 분석에 의해 성체 마우스에서 1 x 108-1 x 1010 GC의 벡터 1의 망막하 주사 후 1 주에 벡터 1 전이유전자 산물 수준을 측정하였다.
결과. 영 벡터가 주사된 rho/VEGF 마우스의 눈과 비교하여, ≥1 x 107 GC의 벡터 1로 주사된 것들은 SNV의 평균 면적에서 상당한 감소를 가졌으며, ≤ 3 x 107으로 주사된 눈에서는 온건한 감소 그리고 ≥1 x 108 GC로 주사된 눈에서는 >50% 감소가 있었다. 3 x 109 또는 1 x 1010 GC로 주사된 눈은 SNV가 거의 완전히 제거되었다. Tet/옵신/VEGF 마우스에서는, 100%의 눈이 총 RD를 가진 영 벡터 그룹과 비교하여, ≥3 x 108 GC의 벡터 1이 주사된 눈에서는 삼출성 RD가 상당히 감소되었고 3 x 109 또는 1 x 1010 GC로 주사된 눈에서는 총 박리의 70-80% 감소가 있었다. ≤1 x 109 GC의 벡터 1로 주사된 눈의 대부분은 검출 한계 미만의 단백질 수준을 가졌으나, 3 x 109 또는 1 x 1010 GC로 주사된 모든 눈은 검출가능한 수준을 가져서 눈 당 평균 수준이 342.7 ng 및 286.2 ng이었다.
결론. 벡터 1의 망막하 주사에 의한 유전자 요법은 rho/VEGF 마우스에서 SNV의 용량 의존적 억제를 야기하였으며 3 x 109 또는 1 x 1010 GC의 용량에서 거의 완전한 억제가 있었다. 이들 동일한 용량은 Tet/옵신/VEGF 마우스에서 강한 단백질 산물 발현을 나타냈으며 주목할만하게 총 삼출성 RD를 감소시켰다.
6.4 인간 연구
6.4.1 실시예 10: 신혈관 AMD를 위한 유전자 요법: 신혈관 AMD(nAMD)를 갖는 대상체에서 벡터 1을 이용한 유전자 요법의 안전성과 내약성(tolerability)을 평가하기 위한 용량-점증(dose-escaltion) 연구
연구의 간단한 요약. 과잉의 혈관 내피 성장 인자(VEGF)는 신혈관 (습성) 연령-관련 황반 변성(nAMD)에서 신혈관형성 및 부종의 촉진에서 핵심 역할을 한다. 라니비주맙(LUCENTIS®, Genentech) 및 아플리베르셉트(EYLEA®, Regeneron)를 비롯한 VEGF 억제제(항-VEGF)는 nAMD의 치료에 안전하고 효과적인 것으로 나타났으며 시력 개선을 입증하였다. 그러나, 항-VEGF 요법은 유리체내 주사를 통해 빈번하게 투여되며 환자에게 상당한 부담일 수 있다. 벡터 1은 가용성 항-VEGF 단백질을 위한 코딩 서열을 보유한 재조합 아데노-연관 바이러스(AAV) 유전자 요법 벡터이다. nAMD에 대한 1 회 유전자 요법 치료 후 이 치료 단백질의 장기적이고 안정적인 전달은 현재 이용가능한 요법의 치료 부담을 감소시킬 수 있는 한편, 유리한 이익:위험 프로파일로 시력을 유지할 수 있다.
연구의 상세한 설명. 이 용량-점증 연구는 이전에 치료된 nAMD를 갖는 대상체에서 벡터 1 유전자 요법의 안전성과 내약성을 평가하기 위해 설계된다. 3 개 용량을 대략 18 명 대상체에서 연구할 것이다. 포함/배제 기준을 충족하며 초기 항 VEGF 주사에 대해 해부학적 반응을 갖는 대상체는 망막하 전달에 의해 단일 용량의 벡터 1을 투여받을 것이다. 벡터 1은 VEGF에 결합하고 그 활성을 중화하는 단클론 항체 단편을 코딩하는 유전자를 함유하는 AAV8 벡터를 사용한다. 안전성은 벡터 1 투여 후 처음 24 주 동안 주안점일 것이다(초기 연구 기간). 초기 연구 기간의 완료 후, 대상체는 벡터 1을 이용한 치료 후 104 주까지 계속 평가될 것이다.
투약. 3 개 용량을 사용할 것이다: 3 x 109 GC의 벡터 1, 1 x 1010 GC의 벡터 1, 및 6 x 1010 GC의 벡터 1.
평가 항목. 주요 평가 항목(primary outcome measure)은 26 주의 시간 프레임에 걸친 안전성 - 안구 및 비안구적 이상 반응(adverse event)(AE) 및 중대한 이상 반응(serious adverse event)(SAE)의 발생 - 일 것이다.
부차 평가 항목은 다음을 포함할 것이다:
106주의 시간 프레임에 걸친 안전성 - 안구 및 비안구적 AE 및 SAE의 발생.
106주의 시간 프레임에 걸친 최고 교정 시력(BCVA)에서의 변화.
106주의 시간 프레임에 걸친, SD-OCT에 의해 측정된, 중심 망막 두께(CRT)에서의 변화.
106주의 시간 프레임에 걸친 구제 주사 - 구제 주사의 평균 수.
106주의 시간 프레임에 걸친, 형광 혈관조영술(FA)에 의해 측정된, 맥락막 신혈관형성(CNV) 및 병변 크기에서의 변화 및 누수 면적 CNV 변화.
적격성 기준. 다음 적격성 기준이 연구에 적용된다:
최소 연령: 50 세
최고 연령: (없음)
성별: 모두
성별 기반: 없음
건강한 지원자 수용: 없음
포함 기준:
· 이전에 유리체내 항-VEGF 요법을 받은 연구 눈에서 AMD에 부차적인 중심와하(subfoveal) CNV의 진단을 받은 ≥ 50 세 환자.
· 각각의 코호트 내의 첫번째 환자에 대해 ≤20/63 및 ≥20/400 사이의 BCVA(≤63 및 ≥19 조기 치료 당뇨 망막병증 연구 [ETDRS] 글자), 이어서 코호트의 나머지에 대해 ≤20/20 및 ≥20/400 사이의 BCVA(≤73 및 ≥19 ETDRS 글자).
· 항-VEGF 요법에 대한 필요 및 반응의 이력.
· 시험 참여시 항-VEGF에 대한 반응(1 주차에 SD-OCT에 의해 평가됨).
· 연구 눈에서 인공수정체여야 함(백내장 수술 후 상태).
· 아스파테이트 아미노트랜스퍼라제/알라닌 아미노트랜스퍼라제(AST/ALT) <2.5 x 정상의 상한(ULN); 총 빌리루빈(TB) < 1.5 x ULN; 프로트롬빈 시간(PT) < 1.5 x ULN; 헤모글로빈(Hb) > 10 g/dL(남성) 및 > 9 g/dL(여성); 혈소판 > 100 x 103/μL; 추정 사구체 여과율(eGFR) > 30 mL/분/1.73 m2.
· 서명된 서면 사전 동의서를 제공할 의사가 있고 제공할 수 있어야 함.
배제 기준:
· AMD 이외의 임의의 원인에 부차적인 연구 눈에서 CNV 또는 황반 부종.
· 연구 눈에서 시력 개선을 막는 임의의 병태, 예를 들어 섬유증, 위축증, 또는 중심와의 중앙에서 망막 상피 찢어짐.
· 연구 눈에서 활성 망막 박리 또는 그 이력.
· 연구 눈에서 진행된 녹내장.
· 스크리닝 전 6 개월 내에, 항-VEGF 요법 이외의, 유리체내 스테로이드 주사 또는 임상시험용 의약품(investigational product)과 같은 연구 눈에서의 유리체내 요법의 이력.
· 스크리닝시 연구 눈에서의 임플란트의 존재(안구내 렌즈 제외).
· 과거 6 개월 이내에 심근 경색, 뇌혈관 장애, 또는 일과성 허혈 발작.
· 최대 의학적 치료에도 불구하고 제어되지 않는 고혈압(수축기 혈압 [BP] >180 mmHg, 이완기 BP >100 mmHg).
6.4.2 실시예 11: 인간 대상체의 치료를 위한 프로토콜
본 실시예는 신혈관(습성) 연령-관련 황반 변성(nAMD)을 갖는 환자를 위한 유전자 요법 치료에 관한 것이다. 본 실시예는 실시예 10의 업데이트된 버전이다. 본 실시예에서는, 가용성 항-VEGF Fab 단백질을 위한 코딩 서열을 보유한 복제 결함성 아데노-연관 바이러스 벡터 8(AAV8)인 벡터 1(실시예 7에 기재됨)이 nAMD를 갖는 환자에게 투여된다. 유전자 요법 치료의 목표는 망막 변성의 진행을 늦추거나 정지시키고 최소의 개입/침습성 수술을 이용하여 시력 손실을 늦추거나 예방하는 것이다.
투약 & 투여 경로. 250 μL 부피의 벡터 1을 치료를 필요로 하는 대상체의 눈에서 망막하 전달을 통해 단일 용량으로 투여한다. 대상체는 3 x 109 GC/눈, 1 x 1010 GC/눈, 또는 6 x 1010 GC/눈의 용량을 받는다.
망막하 전달은 국소 마취 하의 대상체에 대해 망막 외과의에 의해 수행된다. 수술은 코어 유리체절제술을 이용하는 표준 3-포트 평면부 유리체절제술(standard 3-port pars plana virectomy), 이어서 망막하 캐뉼라(38 게이지)에 의한 망막하 공간 내로 벡터 1의 망막하 전달을 포함한다. 상기 전달은 유리체절제술 조직을 통해 자동화되어, 망막하 공간에 250 μL를 전달한다. 주사 및 생성된 물집은 비디오 기록에 의해 및 외과의에 의해 그려진 도면에 의해 문서화된다.
유전자 요법은 습성 AMD의 치료를 위해 1 이상의 요법과 조합되어 투여될 수 있다. 예를 들어, 유전자 요법은 레이저 응고법, 베르테포르핀을 이용한 광선역학적 요법, 및 비제한적으로, 페갑타닙, 라니비주맙, 아플리베르셉트, 또는 베바시주맙을 포함하는 항-VEGF 약제를 이용한 유리체내 치료와 조합되어 투여된다.
벡터 1 투여 후 약 4 주에 시작하여, 환자는 치료하는 의사의 판단으로 발병 눈에서 유리체내 라니비주맙 구제 요법을 받을 수 있다.
환자 하위집단. 적합한 환자는 다음을 포함할 수 있다:
· nAMD의 진단을 가짐;
· 항-VEGF 요법에 반응성임;
· 항-VEGF 요법의 빈번한 주사를 필요로 함;
· 50세 이상의 남성 또는 여성;
· 발병 눈에서 BCVA ≤20/63 및 ≥20/400(≤63 및 ≥19 ETDRS 글자)를 가짐;
· ≤20/20 및 ≥20/400 사이의 BCVA(≤73 및 ≥19 ETDRS 글자)를 가짐;
· 발병 눈에서 AMD에 부차적인 중심와하 CNV의 기록된 진단을 가짐;
· 다음과 같은 CNV 병변 특징을 가짐: 10 디스크 면적 미만의 병변 크기(통상적 디스크 면적은 2.54 mm2임), 혈액<병변 크기의 50%;
· 치료 전 대략 8 개월(또는 그 미만) 내에 발병 눈에서 nAMD의 치료를 위해 항-VEGF 약제의 유리체내 주사를 적어도 4 회 받았으며, SD-OCT에서 해부학적 반응이 기록됨; 및/또는
· SD-OCT에서 입증되는, 발병 눈에 존재하는 망막하 또는 망막내 유체를 가짐.
치료 전에, 환자를 스크리닝하며 다음 기준 중 1 이상은 이 요법이 환자에 대해 적합하지 않음을 나타낼 수 있다:
· AMD 이외의 임의의 원인에 부차적인, 발병 눈에서의 CNV 또는 황반 부종;
· 발병 눈에서 AMD 병변의 ≥50%를 차지하는 혈액 또는 중심와 기저의 >1.0 mm2인 혈액;
· 발병 눈에서 VA 개선을 막는 임의의 병태, 예를 들어 섬유증, 위축증, 또는 중심와의 중앙에서 망막 상피 찢어짐;
· 발병 눈에서 활성 망막 박리 또는 그 이력;
· 발병 눈에서 진행된 녹내장;
· 대상체에 위험을 증가시키거나, 시력 손실을 예방하거나 치료하기 위해 의료적 또는 수술적 개입을 필요로 하거나, 연구 절차 또는 평가를 방해할 수 있는, 발병 눈에서의 임의의 병태;
· 스크리닝 전 12 주 이내에 발병 눈에서 안구내 수술의 이력(스크리닝 방문 전 >10 주에 수행되는 경우, 이트륨 알루미늄 석류석 수정체낭절개술은 허용될 수 있음);
· 스크리닝 전 6 개월 내에, 항-VEGF 요법 이외의, 유리체내 스테로이드 주사 또는 임상시험용 의약품과 같은 발병 눈에서의 유리체내 요법의 이력;
· 스크리닝시 발병 눈에서의 임플란트의 존재(안구내 렌즈 제외);
· 스크리닝 전 5 년 내에 화학요법 및/또는 방사선을 요구하는 종양의 이력(국소 기저 세포 암종은 허용될 수 있음);
· 망막 독성을 야기한 것으로 알려진 요법, 또는 시력에 영향을 줄 수 있거나 공지의 망막 독성을 가진 임의의 약물, 예를 들어 클로로퀸 또는 하이드록시클로로퀸을 이용한 병용 요법의 이력;
· 외과적 수술을 방해할 수 있는, 발병 눈에서의 안구 또는 안구주변 감염;
· 과거 6 개월 치료 이내에 심근 경색, 뇌혈관 장애, 또는 일과성 허혈 발작;
· 최대 의학적 치료에도 불구하고 제어되지 않는 고혈압(수축기 혈압 [BP] >180 mmHg, 이완기 BP >100 mmHg);
· 안구 외과적 수술 또는 치유 과정을 방해할 수 있는 임의의 병용 치료;
· 라니비주맙 또는 이의 성분 중 임의의 것에 대한 알려진 과민증 또는 벡터 1과 같은 약제에 대한 과거의 과민증;
· 조사자의 견해에서, 대상체의 안전성 또는 성공적 연구 참여를 훼손할 수 있는 임의의 심각하거나 불안정한 의학적 또는 심리학적 상태.
· 아스파테이트 아미노트랜스퍼라제(AST)/알라닌 아미노트랜스퍼라제(ALT) >2.5 x 정상의 상한(ULN)
· 대상체가 이전에 알려진 길버트 증후군(Gilbert's syndrome)의 이력, 및 총 빌리루빈의 <35%의 콘쥬게이트된 빌리루빈을 나타내는 분획화 빌리루빈을 갖지 않는 한, 총 빌리루빈 > 1.5 x ULN
· 프로트롬빈 시간(PT) >1.5 x ULN
· 남성 대상체에 대해서는 헤모글로빈 <10 g/dL 그리고 여성 대상체에 대해서는 헤모글로빈 <9 g/dL
· 혈소판 <100 x 103/μL
· 추정 사구체 여과율(GFR) <30 mL/분/1.73 m2
유전자 요법 투여 후 약 4 주에 시작하여, 환자는 다음 구제 기준 중 1 이상이 적용되는 경우, 질병 활성에 대해 발병 눈에서 치료하는 의사의 판단으로 유리체내 라니비주맙 구제 요법을 받을 수 있다:
· 스펙트럼 도메인 광간섭 단층촬영술(SD-OCT)에서의 망막 유체의 축적과 연관된 ≥5 글자(최고 교정 시력[BCVA] 당)의 시력 손실
· SD-OCT에서 맥락막 신혈관형성(CNV)-관련된 증가되거나, 새롭거나, 지속적인 망막하 또는 망막내 유체
· 새로운 안구 출혈
다음 발견 세트 중 하나가 발생하는 경우, 추가의 구제 주사는 치료하는 의사의 판단에 따라 연기될 수 있다:
· 시력이 20/20이거나 더 좋으며 중심 망막 두께가 SD-OCT에 의해 평가할 때 "정상"이거나, 또는
· 2 연속 주사 후 시력과 SD-OCT가 안정함.
주사가 연기되는 경우, 시력 또는 SD-OCT가 상기 기준에 따라 악화되면 주사는 재개될 것이다.
임상 목표의 측정. 일차 임상 목표는 망막 변성의 진행을 늦추거나 정지시키고 시력 손실을 늦추거나 예방하는 것을 포함한다. 임상 목표는 케어 표준을 사용하는 구제 치료, 예를 들어, 비제한적으로, 페갑타닙, 라니비주맙, 아플리베르셉트, 또는 베바시주맙을 포함하는 항-VEGF 약제를 이용한 유리체내 주사의 제거 또는 그 수의 감소에 의해 표시된다. 임상 목표는 또한 시력 손실의 감소 또는 예방 및/또는 망막 박리의 감소 또는 예방에 의해 표시된다.
임상 목표는 BCVA(최고 교정 시력), 안압, 세극등 현미경검사, 간접적 검안, 및/또는 SD-OCT(SD-광간섭 단층촬영술)를 측정함으로써 결정된다. 특히, 임상 목표는 시간 경과에 따라 BCVA에서 기준선으로부터의 평균 변화를 측정하는 것, BCVA에 따라 기준선과 비교하여 ≥15 글자의 이득 또는 손실을 측정하는 것, 시간 경과에 따라 SD-OCT에 의해 측정할 때 CRT에서 기준선으로부터의 평균 변화를 측정하는 것, 시간 경과에 따라 라니비주맙 구제 주사의 평균 수를 측정하는 것, 1st 구제 라니비주맙 주사까지의 시간을 측정하는 것, 시간 경과에 따라 FA에 기초한 CNV 및 병변 크기 및 누수 면적에서 기준선으로부터의 평균 변화를 측정하는 것, 시간 경과에 따라 수성 VEGF 단백질에서 기준선으로부터의 평균 변화를 측정하는 것, 혈청 및 소변에서 벡터 쉐딩 분석(vector shedding analysis)을 수행하는 것, 및/또는 벡터 1에 대한 면역원성을 측정하는 것, 즉 AAV에 대한 Nab를 측정하는 것, AAV에 대한 결합 항체를 측정하는 것, VEGF에 대한 항체를 측정하는 것, 및/또는 ELISpot을 수행하는 것에 의해 결정된다.
임상 목표는 또한 안저 자가형광(FAF) 당 지도형 위축의 면적에서 시간 경과에 따라 기준선으로부터의 평균 변화를 측정하는 것, (기준선에서 지도형 위축이 없는 대상체에서) FAF에 의해 지도형 위축의 새로운 면적의 발생을 측정하는 것, BCVA에 따라 기준선과 비교하여 ≥5 및 ≥10 글자를 각각 획득하거나 잃게 되는 대상체의 비율을 측정하는 것, 이전 해와 비교하여, 구제 주사에서 50%의 감소를 갖는 대상체의 비율을 측정하는 것, SD-OCT 상에 유체가 없는 대상체의 비율을 측정하는 것에 의해 결정된다.
벡터 1 투여로부터 야기되는 개선/효능은 약 4 주, 12 주, 6 개월, 12 개월, 24 개월, 36 개월, 또는 다른 소망하는 시점에서 시력 기준선에서의 소정의 평균 변화로서 평가될 수 있다. 벡터 1을 이용한 치료는 기준선으로부터 시력에서 5%, 10%, 15%, 20%, 30%, 40%, 50% 이상의 증가를 야기할 수 있다. 개선/효능은 4 주, 12 주, 6 개월, 12 개월, 24 개월, 및 36 개월에 스펙트럼 도메인 광간섭 단층촬영술(SD-OCT)에 의해 측정할 때 중심 망막 두께(CRT)에서 기준선으로부터의 평균 변화로서 평가될 수 있다. 벡터 1을 이용한 치료는 기준선으로부터 중심 망막 두께의 5%, 10%, 15%, 20%, 30%, 40%, 50% 이상의 증가를 야기할 수 있다.
6.4.3 실시예 12: 신혈관 AMD를 위한 유전자 요법: 신혈관 AMD(nAMD)를 갖는 대상체에서 벡터 1을 이용한 유전자 요법의 안전성과 내약성을 평가하기 위한 용량-점증 연구
연구의 간단한 요약. 과잉의 혈관 내피 성장 인자(VEGF)는 신혈관 (습성) 연령-관련 황반 변성(nAMD)에서 신혈관형성 및 부종의 촉진에서 핵심 역할을 한다. 라니비주맙((LUCENTIS®, Genentech) 및 아플리베르셉트(EYLEA®, Regeneron)를 비롯한 VEGF 억제제(항-VEGF)는 nAMD의 치료에 안전하고 효과적인 것으로 나타났으며 시력 개선을 입증하였다. 그러나, 항-VEGF 요법은 유리체내 주사를 통해 빈번하게 투여되며 환자에게 상당한 부담일 수 있다. 벡터 1은 가용성 항-VEGF 단백질을 위한 코딩 서열을 보유한 재조합 아데노-연관 바이러스(AAV) 유전자 요법 벡터이다. nAMD에 대한 1 회 유전자 요법 치료 후 이 치료 단백질의 장기적이고 안정적인 전달은 현재 이용가능한 요법의 치료 부담을 감소시킬 수 있는 한편, 유리한 이익:위험 프로파일로 시력을 유지할 수 있다.
연구의 상세한 설명. 이 용량-점증 연구는 이전에 치료된 nAMD를 갖는 대상체에서 벡터 1 유전자 요법의 안전성과 내약성을 평가하기 위해 설계된다. 5 개 용량을 대략 30 명 대상체에서 연구할 것이다. 대상체(들)가 망막하 공간 내로 전체 250 μL 용량을 받지 않는 경우, 추가 대상체가 등록될 수 있다. 포함/배제 기준을 충족하며 초기 항 VEGF 주사에 대해 해부학적 반응을 갖는 대상체는 망막하 전달에 의해 단일 용량의 벡터 1을 투여받을 것이다. 이 연구에서 망막하 전달은 혈관 통로 내의 중심와에 비해 뛰어난 영역에 표적화될 것이며, 이는 황반을 회피할 것이다. 벡터 1은 VEGF에 결합하고 그 활성을 중화하는 단클론 항체 단편을 코딩하는 유전자를 함유하는 AAV8 벡터를 사용한다. 안전성은 벡터 1 투여 후 처음 24 주 동안 주안점일 것이다(초기 연구 기간). 초기 연구 기간의 완료 후, 대상체는 벡터 1을 이용한 치료 후 104 주까지 계속 평가될 것이다.
투약. 250 μL 부피의 벡터 1의 5 개 용량이 사용될 것이다: 3 x 109 GC의 벡터 1(1.2 x 1010 GC/mL), 1 x 1010 GC의 벡터 1(4 x 1010 GC/mL), 6 x 1010 GC의 벡터 1(2.4 x 1011 GC/mL), 1.6 x 1011 GC의 벡터 1(6.2 x 1011 GC/mL), 및 2.5 x 1011 GC의 벡터 1(1 x 1012 GC/mL).
평가 항목. 주요 평가 항목은 26 주의 시간 프레임에 걸친 안전성 - 안구 및 비안구적 이상 반응(AE) 및 중대한 이상 반응(SAE)의 발생 - 일것이다.
부차 평가 항목은 다음을 포함할 것이다:
106주의 시간 프레임에 걸친 안전성 - 안구 및 비안구적 AE 및 SAE의 발생.
106주의 시간 프레임에 걸친 최고 교정 시력(BCVA)에서의 변화.
106주의 시간 프레임에 걸친, SD-OCT에 의해 측정된, 중심 망막 두께(CRT)에서의 변화.
106주의 시간 프레임에 걸친 구제 주사 - 구제 주사의 평균 수.
106주의 시간 프레임에 걸친, 형광 혈관조영술(FA)에 의해 측정된, 맥락막 신혈관형성(CNV) 및 병변 크기에서의 변화 및 누수 면적 CNV 변화.
적격성 기준. 다음 적격성 기준이 연구에 적용된다:
최소 연령: 50 세
최고 연령: 89 세
성별: 모두
성별 기반: 없음
건강한 지원자 수용: 없음
포함 기준:
· 이전에 유리체내 항-VEGF 요법을 받은 연구 눈에서 AMD에 부차적인 중심와하 CNV의 진단을 받은 ≥ 50 세 및 ≤ 89 세 환자.
· 각각의 코호트 내의 첫번째 환자에 대해 ≤20/63 및 ≥20/400 사이의 BCVA(≤63 및 ≥19 조기 치료 당뇨 망막병증 연구 [ETDRS] 글자), 이어서 코호트의 나머지에 대해 ≤20/20 및 ≥20/400 사이의 BCVA(≤73 및 ≥19 ETDRS 글자).
· 항-VEGF 요법에 대한 필요 및 반응의 이력.
· 시험 참여시 항-VEGF에 대한 반응(1 주차에 SD-OCT에 의해 평가됨).
· 연구 눈에서 인공수정체여야 함(백내장 수술 후 상태).
· 아스파테이트 아미노트랜스퍼라제/알라닌 아미노트랜스퍼라제(AST/ALT) <2.5 x 정상의 상한(ULN); 총 빌리루빈(TB) < 1.5 x ULN; 프로트롬빈 시간(PT) < 1.5 x ULN; 헤모글로빈(Hb) > 10 g/dL(남성) 및 > 9 g/dL(여성); 혈소판 > 100 x 103/μL; 추정 사구체 여과율(eGFR) > 30 mL/분/1.73 m2.
· 서명된 서면 사전 동의서를 제공할 의사가 있고 제공할 수 있어야 함.
배제 기준:
· AMD 이외의 임의의 원인에 부차적인 연구 눈에서 CNV 또는 황반 부종.
· 연구 눈에서 시력 개선을 막는 임의의 병태, 예를 들어 섬유증, 위축증, 또는 중심와의 중앙에서 망막 상피 찢어짐.
· 연구 눈에서 활성 망막 박리 또는 그 이력.
· 연구 눈에서 진행된 녹내장.
· 스크리닝 전 6 개월 내에, 항-VEGF 요법 이외의, 유리체내 스테로이드 주사 또는 임상시험용 의약품과 같은 연구 눈에서의 유리체내 요법의 이력.
· 스크리닝시 연구 눈에서의 임플란트의 존재(안구내 렌즈 제외).
· 과거 6 개월 이내에 심근 경색, 뇌혈관 장애, 또는 일과성 허혈 발작.
· 최대 의학적 치료에도 불구하고 제어되지 않는 고혈압(수축기 혈압 [BP] >180 mmHg, 이완기 BP >100 mmHg).
6.4.4 실시예 13: 인간 대상체의 치료를 위한 프로토콜
본 실시예는 신혈관 (습성) 연령-관련 황반 변성(nAMD)을 갖는 환자를 위한 유전자 요법 치료에 관한 것이다. 본 실시예는 실시예 12의 업데이트된 버전이다. 본 실시예에서는, 가용성 항-VEGF Fab 단백질을 위한 코딩 서열을 보유한 복제 결함성 아데노-연관 바이러스 벡터 8(AAV8)인 벡터 1(실시예 7에 기재됨)이 nAMD를 갖는 환자에게 투여된다. 유전자 요법 치료의 목표는 망막 변성의 진행을 늦추거나 정지시키고 최소의 개입/침습성 수술을 이용하여 시력 손실을 늦추거나 예방하는 것이다.
투약 & 투여 경로. 250 μL 부피의 벡터 1을 치료를 필요로 하는 대상체의 눈에서 망막하 전달을 통해 단일 용량으로 투여한다. 대상체는 3 x 109 GC(1.2 x 1010 GC/mL), 1 x 1010 GC(4 x 1010 GC/mL), 6 x 1010 GC(2.4 x 1011 GC/mL), 1.6 x 1011 GC(6.2 x 1011 GC/mL), 또는 2.5 x 1011 GC(1 x 1012 GC/mL)의 용량을 받는다.
망막하 전달은 국소 마취 하의 대상체에 대해 망막 외과의에 의해 수행된다. 수술은 코어 유리체절제술을 이용하는 표준 3-포트 평면부 유리체절제술, 이어서 망막하 캐뉼라(38 게이지)에 의한 망막하 공간 내로 벡터 1의 망막하 전달을 포함한다. 상기 전달은 유리체절제술 조직을 통해 자동화되어, 망막하 공간에 250 μL를 전달한다. 주사 및 생성된 물집은 비디오 기록에 의해 및 외과의에 의해 그려진 도면에 의해 문서화된다. 망막하 전달은 혈관 통로 내의 중심와에 비해 뛰어난 영역에 표적화될 것이며, 이는 황반을 회피할 것이다.
유전자 요법은 습성 AMD의 치료를 위해 1 이상의 요법과 조합되어 투여될 수 있다. 예를 들어, 유전자 요법은 레이저 응고법, 베르테포르핀을 이용한 광선역학적 요법, 및 비제한적으로, 페갑타닙, 라니비주맙, 아플리베르셉트, 또는 베바시주맙을 포함하는 항-VEGF 약제를 이용한 유리체내 치료와 조합되어 투여된다.
벡터 1 투여 후 약 4 주에 시작하여, 환자는 치료하는 의사의 판단으로 발병 눈에서 유리체내 라니비주맙 구제 요법을 받을 수 있다. 구제 요법은 치료하는 의사의 판단으로 라니비주맙에서 아플리베르셉트로 변경될 수 있다.
환자 하위집단. 적합한 환자는 다음을 포함할 수 있다:
· nAMD의 진단을 가짐;
· 항-VEGF 요법에 반응성임;
· 항-VEGF 요법의 빈번한 주사를 필요로 함;
· 50세 이상 및 89 세 이하의 남성 또는 여성;
· 발병 눈에서 BCVA ≤20/63 및 ≥20/400(≤63 및 ≥19 ETDRS 글자)를 가짐;
· ≤20/20 및 ≥20/400 사이의 BCVA(≤73 및 ≥19 ETDRS 글자)를 가짐;
· 발병 눈에서 AMD에 부차적인 중심와하 CNV의 기록된 진단을 가짐;
· 다음과 같은 CNV 병변 특징을 가짐: 10 디스크 면적 미만의 병변 크기(통상적 디스크 면적은 2.54 mm2임), 혈액<병변 크기의 50%;
· 치료 전 대략 8 개월(또는 그 미만) 내에 발병 눈에서 nAMD의 치료를 위해 항-VEGF 약제의 유리체내 주사를 적어도 4 회 받았으며, SD-OCT에서 해부학적 반응이 기록됨; 및/또는
· SD-OCT에서 입증되는, 발병 눈에 존재하는 망막하 또는 망막내 유체를 가짐.
치료 전에, 환자를 스크리닝하며 다음 기준 중 1 이상은 이 요법이 환자에 대해 적합하지 않음을 나타낼 수 있다:
· AMD 이외의 임의의 원인에 부차적인, 발병 눈에서의 CNV 또는 황반 부종;
· 발병 눈에서 AMD 병변의 ≥50%를 차지하는 혈액 또는 중심와 기저의 >1.0 mm2인 혈액;
· 발병 눈에서 VA 개선을 막는 임의의 병태, 예를 들어 섬유증, 위축증, 또는 중심와의 중앙에서 망막 상피 찢어짐;
· 발병 눈에서 활성 망막 박리 또는 그 이력;
· 발병 눈에서 진행된 녹내장;
· 대상체에 위험을 증가시키거나, 시력 손실을 예방하거나 치료하기 위해 의료적 또는 수술적 개입을 필요로 하거나, 연구 절차 또는 평가를 방해할 수 있는, 발병 눈에서의 임의의 병태;
· 스크리닝 전 12 주 이내에 발병 눈에서 안구내 수술의 이력(스크리닝 방문 전 >10 주에 수행되는 경우, 이트륨 알루미늄 석류석 수정체낭절개술은 허용될 수 있음);
· 스크리닝 전 6 개월 내에, 항-VEGF 요법 이외의, 유리체내 스테로이드 주사 또는 임상시험용 의약품과 같은 발병 눈에서의 유리체내 요법의 이력;
· 스크리닝시 발병 눈에서의 임플란트의 존재(안구내 렌즈 제외);
· 스크리닝 전 5 년 내에 화학요법 및/또는 방사선을 요구하는 종양의 이력(국소 기저 세포 암종은 허용될 수 있음);
· 망막 독성을 야기한 것으로 알려진 요법, 또는 시력에 영향을 줄 수 있거나 공지의 망막 독성을 가진 임의의 약물, 예를 들어 클로로퀸 또는 하이드록시클로로퀸을 이용한 병용 요법의 이력;
· 외과적 수술을 방해할 수 있는, 발병 눈에서의 안구 또는 안구주변 감염;
· 과거 6 개월 치료 이내에 심근 경색, 뇌혈관 장애 또는 일과성 허혈 발작;
· 최대 의학적 치료에도 불구하고 제어되지 않는 고혈압(수축기 혈압 [BP] >180 mmHg, 이완기 BP >100 mmHg);
· 안구 외과적 수술 또는 치유 과정을 방해할 수 있는 임의의 병용 치료;
· 라니비주맙 또는 이의 성분 중 임의의 것에 대한 알려진 과민증 또는 벡터 1과 같은 약제에 대한 과거의 과민증;
· 조사자의 견해에서, 대상체의 안전성 또는 모든 평가 및 추적을 완료할 능력을 훼손할 수 있는 임의의 심각하거나, 만성적이거나, 또는 불안정한 의학적 또는 심리학적 상태.
· 아스파테이트 아미노트랜스퍼라제(AST)/알라닌 아미노트랜스퍼라제(ALT) >2.5 x 정상의 상한(ULN)
· 대상체가 이전에 알려진 길버트 증후군의 이력, 및 총 빌리루빈의 <35%의 콘쥬게이트된 빌리루빈을 나타내는 분획화 빌리루빈을 갖지 않는 한, 총 빌리루빈 > 1.5 x ULN
· 프로트롬빈 시간(PT) >1.5 x ULN
· 남성 대상체에 대해서는 헤모글로빈 <10 g/dL 그리고 여성 대상체에 대해서는 헤모글로빈 <9 g/dL
· 혈소판 <100 x 103/μL
· 추정 사구체 여과율(GFR) <30 mL/분/1.73 m2
유전자 요법 투여 후 약 4 주에 시작하여, 환자는 다음 구제 기준 중 1 이상이 적용되는 경우, 질병 활성에 대해 발병 눈에서 치료하는 의사의 판단으로 유리체내 라니비주맙 구제 요법을 받을 수 있다:
· 스펙트럼 도메인 광간섭 단층촬영술(SD-OCT)에서의 망막 유체의 축적과 연관된 ≥5 글자(최고 교정 시력[BCVA] 당)의 시력 손실
· SD-OCT에서 맥락막 신혈관형성(CNV)-관련된 증가되거나, 새롭거나, 지속적인 망막하 또는 망막내 유체
· 새로운 안구 출혈
다음 발견 세트 중 하나가 발생하는 경우, 추가의 구제 주사는 치료하는 의사의 판단에 따라 연기될 수 있다:
· 시력이 20/20이거나 더 좋으며 중심 망막 두께가 SD-OCT에 의해 평가할 때 "정상"이거나, 또는
· 2 연속 주사 후 시력과 SD-OCT가 안정함.
주사가 연기되는 경우, 시력 또는 SD-OCT가 상기 기준에 따라 악화되면 주사는 재개될 것이다. 구제 요법은 치료하는 의사의 판단으로 라니비주맙에서 아플리베르셉트로 변경될 수 있다.
임상적 관찰의 측정. 일차 임상 목표는 망막 변성의 진행을 늦추거나 정지시키고 시력 손실을 늦추거나 예방하는 것을 포함한다. 임상 목표는 케어 표준을 사용하는 구제 치료, 예를 들어, 비제한적으로, 페갑타닙, 라니비주맙, 아플리베르셉트, 또는 베바시주맙을 포함하는 항-VEGF 약제를 이용한 유리체내 주사의 제거 또는 그 수의 감소에 의해 표시된다. 임상 목표는 또한 시력 손실의 감소 또는 예방 및/또는 망막 박리의 감소 또는 예방에 의해 표시된다.
임상 목표는 BCVA(최고 교정 시력), 안압, 세극등 현미경검사, 간접적 검안, 및/또는 SD-OCT(SD-광간섭 단층촬영술)를 측정함으로써 결정된다. 특히, 임상 목표는 시간 경과에 따라 BCVA에서 기준선으로부터의 평균 변화를 측정하는 것, BCVA에 따라 기준선과 비교하여 ≥15 글자의 이득 또는 손실을 측정하는 것, 시간 경과에 따라 SD-OCT에 의해 측정할 때 CRT에서 기준선으로부터의 평균 변화를 측정하는 것, 시간 경과에 따른 라니비주맙 구제 주사의 평균 수를 측정하는 것, 1st 구제 라니비주맙 주사까지의 시간을 측정하는 것, 시간 경과에 따라 FA에 기초한 CNV 및 병변 크기 및 누수 면적에서 기준선으로부터의 평균 변화를 측정하는 것, 시간 경과에 따라 수성 VEGF 단백질에서 기준선으로부터의 평균 변화를 측정하는 것, 혈청 및 소변에서 벡터 쉐딩 분석을 수행하는 것, 및/또는 벡터 1에 대한 면역원성을 측정하는 것, 즉 AAV에 대한 Nab를 측정하는 것, AAV에 대한 결합 항체를 측정하는 것, VEGF에 대한 항체를 측정하는 것, 및/또는 ELISpot을 수행하는 것에 의해 결정된다.
임상 목표는 또한 안저 자가형광(FAF) 당 지도형 위축의 면적에서 시간 경과에 따라 기준선으로부터의 평균 변화를 측정하는 것, (기준선에서 지도형 위축이 없는 대상체에서) FAF에 의해 지도형 위축의 새로운 면적의 발생을 측정하는 것, BCVA에 따라 기준선과 비교하여 ≥5 및 ≥10 글자를 각각 획득하거나 잃게 되는 대상체의 비율을 측정하는 것, 이전 해와 비교하여, 구제 주사에서 50%의 감소를 갖는 대상체의 비율을 측정하는 것, SD-OCT 상에 유체가 없는 대상체의 비율을 측정하는 것에 의해 결정된다.
벡터 1 투여로부터 야기되는 개선/효능은 약 4 주, 12 주, 6 개월, 12 개월, 24 개월, 36 개월, 또는 다른 소망하는 시점에서 시력 기준선에서의 소정의 평균 변화로서 평가될 수 있다. 벡터 1을 이용한 치료는 기준선으로부터 시력에서 5%, 10%, 15%, 20%, 30%, 40%, 50% 이상의 증가를 야기할 수 있다. 개선/효능은 4 주, 12 주, 6 개월, 12 개월, 24 개월, 및 36 개월에 스펙트럼 도메인 광간섭 단층촬영술(SD-OCT)에 의해 측정할 때 중심 망막 두께(CRT)에서 기준선으로부터의 평균 변화로서 평가될 수 있다. 벡터 1을 이용한 치료는 기준선으로부터 중심 망막 두께의 5%, 10%, 15%, 20%, 30%, 40%, 50% 이상의 증가를 야기할 수 있다.
6.5 실시예 14: 신혈관 AMD를 위한 AAV8-항VEGFfab
6.5.1 연구의 간단한 요약
이 연구에서, AAV8-항VEGFfab의 망막하 주사 후 항-인간 VEGF 항체 단편(항VEGFfab)의 발현이 입증된다. 망막에서 인간 VEGF를 발현하는 트랜스제닉 마우스(rho/VEGF 마우스)에서, ≥1x107 유전자 카피(gene copy)(GC)의 AAV8-항VEGFfab가 주사된 인간에서의 3 형 맥락막 신혈관형성(NV)에 대한 모델은 영 벡터가 주사된 눈과 비교하여, NV의 평균 면적에서 상당한 감소를 가졌다. 용량-의존적 반응은 ≤3x107로 NV의 온건한 감소, ≥1x108 GC로 >50% 감소, 및 3x109 또는 1x1010 GC로 NV의 거의 완전한 제거로 관찰되었다. 독시사이클린-유도된 VEGF의 높은 발현이 심각한 혈관 누수 및 삼출성 망막 박리(RD)를 야기하는 Tet/옵신/VEGF 마우스에서, 3x109 또는 1x1010 GC의 AAV8-항VEGFfab에 의해 70-80%의 총 RD의 감소가 발생하였다. 이들 데이터는 NVAMD를 갖는 환자에서 AAV8-항VEGFfab의 망막하 주사를 시험하는 임상 시험 개시를 강하게 지지한다.
6.5.2 도입
연령-관련 황반 변성(AMD)은 광수용기 및 망막 색소 상피(RPE) 세포의 사멸이 중심 시력의 점진적 손실을 야기하는 매우 일반적인 신경변성 질환이다. AMD를 갖는 환자의 10-15%의 하위그룹은 망막하 신혈관형성(NV)이 발생하여, 무능한 새로운 혈관으로부터의 혈장의 누수 및 망막 기능을 훼손하는, 망막 내부 및 하부에서 유체의 수집으로 인해 시력에서의 상대적으로 급격한 감소를 야기한다. 이 하위그룹은 신혈관 AMD(NVAMD)를 갖는 것으로 지칭된다.
혈관 내피 성장 인자(VEGF)는 망막하 NV 및 NV로부터의 과도한 누수의 발생에서 중심 역할을 하여, 시력을 감소시키는, 황반에서의 망막하 및/또는 망막내 유체를 야기한다. VEGF-중화 단백질의 안구내 주사는 누수를 감소시켜, 유체 재흡수 및 시력 개선을 허용한다(예를 들어, 각각 그 전체가 본원에 참고로 포함되는 Rosenfeld et al., 2006, Ranibizumab for Neovascular Age-Related Macular Degeneration, N Eng J Med 355: 1419-31; Brown et al., 2006, Ranibizumab Versus Verteporfin for Neovascular Age-Related Macular Degeneration, N Eng J Med 355: 1432-44 참고); 그러나, VEGF의 생산은 만성적이어서, VEGF-중화 단백질의 유리체 수준이 치료 수준 미만으로 떨어질 때, 누수 및 NV 성장이 재발한다. 초기 임상 시험에서, NVAMD가 최근 시작된 치료-미경험(treatment-) 대상체에게 VEGF-중화 단백질을 매달 유리체내 주사를 하였고, 34-40%의 대상체가 최고 교정 시력(BCVA)에서 적어도 15 글자 개선을 경험하였으며, 이는 2 년 동안 유지된 크고 임상적으로 의미 있는 이익이었다. 대상체가 3 개월마다 빈번하지 않게 내원하여 치료된 연장 연구에서, 거의 모든 시각적 이익이 손실되었다(예를 들어, 그 전체가 본원에 참고로 포함되는 Singer et al., 2012, Horizon: An Open-Label Extension Trial of Ranibizumab for Choroidal Neovascularization Secondary to Age-Related Macular Degeneration, Ophthalmology 119: 1175-83 참고). NVAMD를 갖는 대상체에서의 후속 연구에서, 기준선 BCVA로부터의 평균 개선은 망막내 또는 망막하 유체가 황반에 존재할 때에만, 매달 방문하여 주사받은 대상체와 비교하여, VEGF-중화 단백질 주사를 매달 받은 대상체에서 상당히 컸다(예를 들어, 그 전체가 본원에 참고로 포함되는 Martin et al., 2011, Ranibizumab and Bevacizumab for Neovascular Age-Related Macular Degeneration, N Eng J Med 364: 1897-908 참고). 이 치료 요법으로 시각적 이익은 2 년 동안 유지되었으며, 그 후에 대상체는 의사의 판단으로 치료되었고 3 년 후에, 시각적 이익은 손실되었으며 모든 그룹에서 평균 BCVA는 기준선에 비해 악화되었다(예를 들어, 그 전체가 본원에 참고로 포함되는 Maguire et al., 2016, Five-Year Outcomes with Anti-Vascular Endothelial Growth Factor Treatment of Neovascula Age-Related Macular Degeneration: The Comparison of Age-Related Macular Degeneration Treatment Trials, Ophthalmology 123: 1751-61 참고). 따라서, 시각적 이익을 최대화하고 유지하기 위해, NVAMD를 갖는 환자에서는 VEGF가 지속적으로 억제되는 빈번한 주사가 요구된다.
NVAMD를 갖는 환자에서 장기 이익을 제공하기 위한 하나의 전략은 망막에서 항-혈관신생 단백질을 계속 발현하기 위한 안구 유전자 전달이다. 이 접근법은 동물 모델에서 망막 또는 망막하 NV를 강하게 억제한다(예를 들어, 각각 그 전체가 본원에 참고로 포함되는 Honda et al., 2000, Experimental Subretinal Neovascularization is Inhibited by Adenovirus-Mediated Soluble VEGF.flt-1 Receptor Gene Rransfection, a Role of VEGF and Possible Treatment for SRN in Age-Related Macular Degeneration, Gene Ther 7: 978-85; Mori et al., 2001, Pigment Epithelium-Derived Factor Inhibits Retinal and Choroidal Neovascularization, J Cell Physiol 188: 253-63; Lai et al., 2001, Suppression of Choroidal Neovascularization by Adeno-Associated Virus Vector Expressing Angiostatin, Invest Ophthalmol Vis Sci 42: 2401-7; Mori et al., 2002, AAV-Mediated Gene Transfer of Pigment Epithelium-Derived Factor Inhibits Choroidal Neovascularization, Invest Ophthalmol Vis Sci 43: 1994-2000; Bainbridge et al., 2002, Inhibition of Retinal Neovascularization by Gene Transfer of Soluble VEGF Receptor sFlt-1, Gene Ther 9: 320-6; Takahashi et al., 2003, Intraocular Expression of Endostatin Reduces VEGF-Induced Retinal Vascular Permeability, Neovascularization, and Retinal Detachment, FASEB J 17: 896-8; Gehlbach et al., 2003, Periocular Injection of an Adenoviral Vector Encoding Pigment Epithelium-Derived Factor Inhibits Choroidal Neovascularization, Gene Ther 10: 637-46; Rota et al., 2004, Marked Inhibition of Retinal Neovascularization in Rats Following Soluble-flt-1 Gene Transfer, J Gene Med 6: 992-1002; Lai et al., 2005, Long-Term Evaluation of AAV-Mediated sFlt-1 Gene Therapy for Ocular Neovascularization in Mice and Monkeys, Mol Ther 12: 659-68 참고). 진행된 NVAMD를 갖는 대상체에서, 색소 상피-유래된 인자를 발현하는 아데노바이러스 벡터의 유리체내 주사는 진행된 NVAMD를 갖는 여러 환자에서 망막하 출혈 및 유체의 재흡수를 야기하였고, 이는 상기 접근법에 대한 개념의 증거를 제공한다(예를 들어, 그 전체가 본원에 참고로 포함되는 Campochiaro, et al., 2006, Adenoviral Vector-Delivered Pigment Epithelium-Derived Factor For Neovascular Age-Related Macular Degeneration, Results of a Phase I Clinical Trial, Hum Gene Ther 17: 167-76 참고). AAV 벡터는 매력적인 플랫폼이며, 이는 이들이 장기 전이유전자 발현을 제공하기 때문이다. 진행된 NVAMD를 갖는 대상체에서의 최근 1 상 임상 시험은 폴리글리신 9-mer에 의해 인간 IgG1-Fc에 연결된 Flt-1(VEGFR1)의 도메인 2로 구성된 VEGF 중화 단백질(sFLT01)의 발현을 추진하는 닭 베타 액틴(CBA) 프로모터를 함유하는 AAV2 벡터의 유리체내 주사를 시험하였다(예를 들어, 그 전체가 본원에 참고로 포함되는 Heier, et al., 2017, Intravitreous Injection of AAV2-sFLT01 in Patients with Advanced Neovascular Age-Related Macular Degeneration, a Phase 1, Open-Label Trial, The Lancet 389: May 17 참고). 전이유전자 발현은 최고 용량인 2x1010 게놈 카피(GC)가 주사된 10 개 눈 중 5 개에서 검출되었고, <2x1010 GC가 주사된 눈에서는 전혀 검출되지 않았다. 가역적인 것으로 판단된 기준선에서 망막내 또는 망막하 유체를 갖는 19 명 환자 중 11 명에서, 6 명은 상당한 유체 감소 및 시력에서의 개선을 나타낸 반면에, 5 명은 유체 감소를 나타내지 않았다. 따라서, 일부 생물학적 활성의 증거가 있었던 한편, 반응에 대해 환자 사이에 상당한 이질성이 있었다. 일반적으로, AAV2 벡터의 유리체내 주사와 비교하여, 망막하 주사는 상당히 높은 전이유전자 발현을 제공하고, 거대세포바이러스(CMV) 프로모터가 NVAMD를 갖는 대상체에서 천연 가용성 VEGFR1의 발현을 추진하는 AAV2 벡터(AAV2-sFlt-1)의 망막하 주사를 시험하는 1 상 시험은 양호한 안전성을 나타내었으며, 1x1010 또는 1x1011 GC의 AAV2.sFlt-1의 망막하 주사를 받은 6 명의 대상체 중 3 명은 망막내 유체의 일부 감소를 나타내었다(예를 들어, 그 전체가 본원에 참고로 포함되는 Rakoczy et al., 2015, Gene Therapy with Recombinant Adeno-Associated Vectors for Neovascular Age-Related Macular Degeneration, 1 year Follow-Up of a Phase 1 Randomized Clinical Trial, Lancet 386: 2395-403 참고). NVAMD를 갖는 32 명의 대상체의 2 상 시험에서, 21 명은 1x1011 GC의 AAV2.sFlt-1을 함유하는 100 μL의 망막하 주사에 무작위화되었고, 11 명은 재발성 망막내 또는 망막하 유체에 대해 필요에 따라 라니비주맙 주사에만 무작위화되었다(예를 들어, 그 전체가 본원에 참고로 포함되는 Constable, et al., 2016, Phase 2a Randomized Clinical Trial: Safety and Post Hoc Analysis of Subretinal rAAV.sFLT-1 for Wet Age-Related Macular Degeneration, EBioMedicine 14: 168-75 참고). 모든 대상체가 기준선 및 4 주차 및 그 후에 사전명시된 기준에 따라 라니비주맙 주사를 받았다. 상기 연구는 AAV2.sFlt-1의 발생을 계속하기 위한 충분한 효능을 입증하는데 실패하였다. sFlt-1의 수준은 보고되지 않았으며, 따라서 충분한 sFlt-1 발현의 결여는 연구에서 보이는 반응의 결여에서 잠재적 인자로서 배제될 수 없다.
공지의 AAV 혈청형에 대한 서열 상동성에 대한 PCR에 의한 붉은털 원숭이(rhesus monkey)로부터 얻은 조직의 스크리닝은 AAV7 및 AAV8의 확인을 야기하였다(예를 들어, 그 전체가 본원에 참고로 포함되는 Gao et al., 2002, Novel Adeno-Associated Viruses From Rhesus Monkeys as Vectors for Human Gene Therapy, Proc Natl Acad Sci USA 99: 11854-9 참고). AAV8 캡시드를 갖는 벡터를 생성하였으며, 간에서 전이유전자 발현은 AAV2와 같은 다른 혈청형의 캡시드를 갖는 AAV 벡터에 비해 10-100 배 높았다. AAV8에 대한 중화 항체는 인간 혈청에서 드물었으며, 다른 AAV 혈청형에 대한 항체는 AAV8 벡터-매개된 발현을 감소시키지 않았다(예를 들어, Gao et al., 2002, Novel Adeno-Associated Viruses From Rhesus Monkeys as Vectors for Human Gene Therapy, Proc Natl Acad Sci USA 99: 11854-9 참고). AAV2 및 AAV8 둘 다는 중간 또는 저용량의 망막하 주사 후에 RPE 세포를 형질변환하지만, AAV8이 광수용기 형질변환시 더욱 효과적이므로, 전체적으로 높은 발현 수준을 야기한다(그 전체가 본원에 참고로 포함되는 Vandenberghe et al., 2011, Dosage Thresholds for AAV2 and AAV8 Photorecepotr Gene Therapy in Monkey, Sci Trans Med 3: 1-9). 이 연구에서는, 인간 VEGF에 결합하는 인간화 항체 단편에 대한 발현 카세트를 함유하는 광범위한 용량의 AAV8 벡터의 망막하 주사의 효능을 시험하기 위해, 인간 VEGF165가 광수용기에서 발현되는 트랜스제닉 마우스 모델을 사용하였다.
6.5.3 재료 및 방법
AAV8-항VEGFfab의 구축.
AAV8-항VEGFfab는 AAV2 역위 말단 반복부(ITR)에 의해 인접된, 인간 VEGF에 결합하고 억제하는 인간화 단클론 항원-결합 단편을 코딩하는 유전자 카세트를 함유하는 비-복제성 AAV8 벡터이다. 중쇄 및 경쇄의 발현은 닭 β-액틴 프로모터 및 CMV 인핸서로 구성된 CB7 프로모터, 닭 β-액틴 인트론, 및 토끼 β-글로빈 폴리A 시그널에 의해 제어된다. 항VEGFfab의 중쇄 및 경쇄를 코딩하는 핵산 서열은 자가-절단 푸린 (F)/F2A 링커에 의해 분리된다. 발현된 단백질 산물은 라니비주맙과 유사하지만, 동일하지는 않다. 푸린-매개된 절단의 메커니즘으로 인해, 벡터-발현된 항VEGFfab는 라니비주맙에서 정상적으로 발견되는 모든 아미노산에 더하여, 중쇄의 최종 위치에서 무, 하나, 또는 그 이상의 추가 아미노산 잔기를 함유할 수 있다.
마우스.
모든 마우스를 안과 연구에서 동물의 사용에 대한 미국안과학회(Association for Research in Vision and Ophthalmology)의 성명(statement)에 따라 치료하였으며 프로토콜은 존스 홉킨스 대학 동물 실험 윤리 위원회(Johns Hopkins University Animal Care and Use Committee)가 검토 및 승인하였다. 로돕신 프로모터가 광수용기에서 VEGF165의 발현을 추진하는 트랜스제닉 마우스(rho/VEGF 마우스) 및 광수용기에서 VEGF의 유도성 발현을 갖는 이중 트랜스제닉 마우스(Tet/옵신/VEGF 마우스)를 이전에 기재하였다. 모든 트랜스제닉 마우스가 C57BL/6 백그라운드 내에 있었으며 실험에서 사용하기 전에 전이유전자의 존재를 확인하기 위해 유전자형화하였다. 야생형 C57BL/6 마우스를 Charles River(Frederick, MD, USA)로부터 구매하였다.
벡터의 망막하 주사.
마우스를 마취시키고 눈을 Zeiss 입체 해부 현미경(Stereo Dissecting Microscope)으로 시각화하였다. 인슐린 시린지 상의 30-게이지 바늘을 사용하여 공막에 작은 부분 두께 개구를 생성하였으며 Hamilton 시린지 상의 33-게이지 바늘을 공막 구멍 내로 삽입하고 나머지 공막 섬유를 관통해 망막하 공간 내로 천천히 진행시키고 AAV8-항VEGFfab 또는 공 AAV8 벡터를 함유한 비히클 1 μL를 주사하였다. 바늘이 제거될 때 면봉을 주사 부위에 적용하여 환류를 예방하였다.
망막에서 항VEGFfab 단백질의 발현.
야생형 C57BL/6 마우스에게 1x108, 3x108, 1x109, 3x109, 1x1010 GC의 AAV8-항VEGFfab 또는 1x1010 GC의 공 벡터의 단일 망막하 주사가 각각의 눈에 주어졌다. 주사 후 14 일에, 마우스를 안락사시켰으며, 눈을 제거하고 냉동하였다. 눈을 Qiagen Tissue Lyser를 사용하여 200 ul RIPA 버퍼에서 균질화하였다. 항VEGFfab 단백질의 농도를 공지의 농도의 라니비주맙을 사용한 ELISA에 의해 측정하여, 표준 곡선을 생성하였다. 간단하게는, ELISA 플레이트를 1 ㎍/mL의 인간 VEGF165로 밤새 4℃에서 코팅하였다. 웰을 200 μL 1% BSA로 1 시간 동안 실온에서 차단하였다. 샘플을 1:80으로 희석하고 100 μL를 첨가하여 웰을 복사하고, 1 시간 동안 37℃에서 항온처리한 다음에, 버퍼 항온처리를 이차 차단하였다. 세척 후에, 웰을 둘 다 비오틴으로 라벨링되고 사전-흡수된 1 mg/mL 염소 항-인간 IgG 중쇄 및 0.5 mg/mL 염소 항-인간 IgG 경쇄의 칵테일 100 μL 중에서 1 시간 동안 실온에서 항온처리하였다. 세척 후에, 웰을 스트렙타비딘-HRP의 1:30,000 희석액 100 μL 중에서 1 시간 동안 실온에서 항온처리하고, 세척하고, 0.1M NaOAc 시트레이트 버퍼(pH 6.0), 30% 과산화수소, 3,3',5,5'-테트라메틸벤지딘 ≥99%으로 구성된 150 μL TMB 검출액 중에서 암중의 실온에서 30 분 동안 항온처리하였으며, 그 후에 50 μL의 정지액(2N H2SO4)을 각각의 웰에 첨가하고 플레이트를 450 nm-540 nm에서 판독하였다.
Rho/VEGF 마우스에서 3 형 맥락막 NV에 대한 효과의 평가.
출생후 14 일차(P)에, rho/VEGF 마우스에게 3x106, 1x107, 3x107, 1x108, 3x108, 1x109, 3x109, 1x1010 GC의 AAV8-항VEGFfab 또는 1x1010 GC의 공 벡터 또는 PBS의 단일 망막하 주사가 한쪽 눈에 주어졌다. P21에, 마우스를 안락사시키고, 눈을 제거하고, 망막을 그대로 해부하고, FITC-콘쥬게이트된 GSA 렉틴(Vector Laboratories, Burlingame, CA)으로 염색하고, 광수용기 측이 상부를 대면하도록 평면-표본고정하였다. Zeiss Axioskop 형광 현미경으로 형광 이미지를 얻었으며 망막 당 3 형 맥락막 NV의 면적을 치료 그룹에 대해 가려진 조사자가 ImagePro Plus 소프트웨어를 사용한 이미지 분석에 의해 측정하였다.
심각한 VEGF-유도된 혈관 누수에 대한 효과의 평가.
10 주령 Tet/옵신/VEGF 마우스에게 1x108, 3x108, 1x109, 3x109, 1x1010 GC의 AAV8-항VEGFfab 또는 1x1010 GC의 공 벡터 또는 PBS의 단일 망막하 주사가 한쪽 눈에 주어졌다. 주사 후 10 일에, 2 mg/mL의 독시사이클린을 음용수에 첨가하고 4 일 후에, 마우스를 마취시키고, 동공을 확장시키고, 안저 사진을 Micron III 망막 영상화 현미경으로 얻었다. 이미지는 가려진 조사자에 의해 시험하였으며 무, 부분, 또는 총 삼출성 망막 박리를 나타내는 것으로 결정하였다. 총 망막 면적 및 박리된 망막의 면적을 치료 그룹에 대해 가려진 조사자가 ImagePro Plus 소프트웨어를 사용한 이미지 분석에 의해 측정하였다. % 망막 박리를 박리된 망막/총 망막의 면적으로서 계산하였다. 적은 수의 눈에서, 각막 또는 렌즈 선명도의 결여로 인해 선명한 안저 이미지를 얻을 수 없었으며, 이 경우에 마우스를 안락사시키고, 눈을 제거하고 냉동하고, 10 μm 연속 절편을 절단하였다. 절편을 4% 파라포름알데하이드에서 사후-고정하고, 훽스트로 염색하고 광 현미경에 의해 시험하여 삼출성 망막 박리의 존재 및 정도를 결정하였다.
장기 효과를 조사하기 위해, Tet/옵신/VEGF 마우스에게 3x109 GC의 AAV8-항VEGFfab 또는 3x109 GC의 공 벡터가 한쪽 눈에 주어졌다. 다른 눈은 미치료된 대조군으로서 제공되었다. 주사 후 1 개월에, 2 mg/mL의 독시사이클린을 음용수에 첨가하고 4 일 후에, 안저 사진을 상기 기재된 바와 같이 얻고 등급을 매겼다.
통계적 비교
스튜던트 t-검정(student's t-test)을 수행하여, 2 개의 실험군 사이의 평가 항목을 비교하였다. 3 이상의 실험군 사이의 비교를 위해, 본페로니 다중-비교 교정을 사용하여 다중 비교를 위해 조정된 분산의 일원 분석(ANOVA)을 수행하였다. 공 벡터 그룹에 대해 상이한 용량을 갖는 그룹 사이의 박리 유형을 비교하기 위해, p 값을 피셔 정확 검정을 사용하여 계산하였다. 모든 통계적 시험은 5% 통계적 유의성으로 수행하였다. 통계적 분석은 Stata 버전 14.2(College Station, Texas 77845)를 사용하여 수행하였다.
6.5.4 결과
VEGF 중화 단백질의 선택.
초기 실험에서, cDNA를 전장 항-VEGF 항체, 항-VEGF 항체 단편(항-VEGFfab), 및 가용성 VEGF 수용체-1(sFlt-1)에 대해 생성하였으며 이들을 CMV 프로모터를 함유한 발현 카세트 내에 삽입하고 AAV8 내에 패키징하였다. 각각의 벡터의 3x109 GC의 망막하 주사 후 14 일에, 눈 당 각각의 전이유전자의 총량을 ELISA에 의해 측정하였다. AAV8-CMV.항-VEGFfab가 주사된 눈은 높은 수준의 항-VEGFfab 단백질을 갖는 한편, AAV8-CMV.항-VEGF 전장 Ab가 주사된 눈은 상대적으로 낮은 수준의 전장 항-VEGF Ab를 가졌으며 AAV8-CMV.sFlt1이 주사된 눈은 매우 낮거나 검출 불가능한 수준의 sFlt1을 가졌다(도 6). 따라서, 항VEGFfab를 후속 실험을 위한 항-VEGF 중화 단백질로서 선택하였다.
AAV8-항VEGFfab의 구축 및 시험관내 시험.
항-VEGFfab에 대한 cDNA를 CB7 프로모터를 함유한 발현 카세트 내에 삽입하였다. AAV8-항VEGFfab(RGX-314)의 게놈의 도식을 도 7a에 나타내었다. CB7 프로모터는 항VEGFfab의 중쇄 및 경쇄 및 푸린-F2A 링커의 발현을 추진하여, 항VEGFfab의 번역후 조립을 야기한다.
마우스에서 AAV8-항VEGFfab의 망막하 주사 후 전이유전자 발현.
1x108-1x1010 GC 범위의 AAV8-항VEGFfab의 1 μL 용량의 망막하 주사 후 1 주에, 항VEGFfab 단백질의 수준을 눈 파쇄액에서 측정하였다. 벡터 용량이 증가함에 따라, 3x109 및 1x1010 GC의 용량에서 얻어진 피크 수준을 갖는 항VEGFfab의 증가가 있었다(도 7b).
rho/VEGF 마우스에서 망막하 NV의 AAV8-항VEGFfab 억제의 망막하 주사.
로돕신 프로모터가 인간 VEGF165의 발현을 추진하는 트랜스제닉 마우스는 대략 출생 후 14 일차에 시작하여, 깊은 모세혈관 상으로부터 새로운 혈관이 생겨나며 P21까지 광범위한 망막하 NV를 갖는다(예를 들어, 각각 그 전체가 본원에 참고로 포함되는 Okamoto et al., 1998, Evolution of Neovascularization in Mice with Overexpression of Vascular Endothelial Growth Factor in Photoreceptors, Invest Ophthalmol Vis Sci 39: 180-8; Tobe et al., 1998, Evolution of Neovascularization in Mice with Overexpression of Vascular Endothelial Growth Factor in Photoreceptors, Invest Ophthalmol Vis Sci 39: 180-8 참고). 이들 마우스는 인간에서 3 형 맥락막 NV로도 알려진 망막 혈관종 증식에 대한 모델을 제공한다(예를 들어, 그 전체가 본원에 참고로 포함되는 Yannuzzi, et al., 2001, Retinal Angiomatous Proliferation in Age-Related Macular Degeneration, Retina 21: 416-34 참고). P14에 PBS의 망막하 주사 후에, 혈관 세포를 선택적으로 염색하는 FITC-라벨링된 GSA 렉틴으로 염색되고 광수용기가 상부를 대면하도록 평면 표본고정된 rho/VEGF 마우스의 망막은 다수의 초형광점(hyperfluorescent spot)을 나타내었다(도 8a, 상부 열, 좌측 칼럼). 고배율에서, 공급 혈관은 백그라운드에서의 깊은 모세혈관 상으로부터 어두운 흑색 망막 색소 상피 세포에 의해 부분적으로 둘러싸인 망막하 NV의 싹으로 연장되는 것으로 나타났다(도 8b, 상부 열, 중간 칼럼). P14에 1x1010 GC의 공 AAV8 벡터가 주사된 마우스는 PBS-주사된 눈에서 나타난 바와 같이 P21에 유사한 양의 망막하 NV를 나타내었다(도 8a, 상부 열, 우측 칼럼). 1x1010, 3x109, 또는 1x109 GC의 AAV8-항VEGFfab의 망막하 주사가 주어진 Rho/VEGF 마우스는 P21에 매우 적은 망막하 NV를 나타낸 한편(도 8a, 중간 열), 3x108 또는 1x108 GC가 주사된 마우스(도 8a, 중간 및 하부 열)는 공 벡터가 주사된 마우스에 비해 다소 많지만, 여전히 상당히 적었다. 중간 양의 NV가 3x107 및 1x107 GC가 주사된 마우스에서 나타났으며 3x106 GC가 주사된 마우스는 공 벡터가 주사된 마우스와 유사한 것으로 나타났다(도 8a, 하부 열).
이제 도 8b를 참조하면, 이미지 분석에 의한 망막 당 NV의 평균 면적의 측정은 공-벡터-주사된 눈에서에 비해 1x1010 및 1x107 GC 사이의 AAV8-항VEGFfab 용량이 주사된 눈에서 상당히 적은 망막 당 NV의 평균 면적으로 망막 평면 표본고정의 육안 검사가 제시한 것과 유사한 용량 반응을 나타내었다.
AAV8-항VEGFfab의 망막하 주사는 VEGF-유도된 혈관 누수를 차단한다.
tet-온 시스템 및 로돕신 프로모터가 rho/VEGF 마우스의 망막에 존재하는 것에 비해 10 배 높은 수준의 VEGF165의 독시사이클린-유도성 발현을 제공하는 Tet/옵신/VEGF 이중 트랜스제닉 마우스는 음용수 중 독시사이클린 2 mg/mL로 출발한지 4 일 이내에 삼출성 망막 박리를 야기한다(예를 들어, 그 전체가 본원에 참고로 포함되는 Ohno-Matsui et al., 2002, Inducible Expression of Vascular Endothelial Growth Factor in Photoreceptors of Adult Mice Causes Severe Proliferative Retinopathy and Retinal Detachment, Am J Pathol 160: 711-9 참고). 1x108 또는 3x108 GC의 AAV8-항VEGFfab의 망막하 주사 후 10 일에, 75% 및 50%는 음용수 중 2 mg/mL 독시사이클린으로 출발한지 4 일 후 총 삼출성 망막 박리가 발생하였으며(도 9a, 좌측 2 개 패널) 이는 PBS 또는 1x1010 GC의 공 벡터의 망막하 주사가 주어진 독시사이클린-치료된 Tet/옵신/VEGF 마우스에서 나타난 것(도 9b)과 유사하였다. 도 9c는 삼출성 망막 박리를 나타내지 않는 3x109 GC의 AAV8-항VEGFfab가 주사된 눈으로부터의 안구 절편 및 총 망막 박리를 갖는 주사되지 않은 다른 눈을 나타낸다. 공 벡터의 망막하 주사가 주어진 10 개 눈 중 10 개는 독시사이클린 출발 후 4 일에 총 망막 박리를 가졌고, 1x1010 GC의 공 벡터의 망막하 주사가 주어진 10 개 눈 중 10 개는 총(7 개 눈) 또는 부분(3 개 눈) 망막 박리를 가졌다(도 9d). 공 벡터가 주사된 마우스와 비교하면, 총 망막 박리를 갖는 눈의 %는 3x108(50% 적음), 1x109(67% 적음), 3x109(80% 적음), 또는 1x1010(78% 적음) GC의 AAV8-항VEGFfab의 망막하 주사가 주어진 독시사이클린-치료된 Tet/옵신/VEGF 마우스에서 상당히 적었다. 박리된 망막의 %는 이미지 분석에 의해 측정하고 공 벡터가 주어진 눈과 비교하였으며, 평균 % 박리는 3x109 GC 또는 1x1010 GC의 AAV8-항VEGFfab가 주사된 눈에서 상당히 적었다(도 9e).
장기 효과를 평가하기 위해, Tet/옵신/VEGF 마우스를 한쪽 눈에 3x109 GC의 AAV8-항VEGFfab 또는 공 벡터의 망막하 주사 후 1 개월에 2mg/mL 독시사이클린으로 치료하였다. 대표적인 마우스는 AAV8-항VEGFfab-주사된 눈에서 무 박리 및 다른 눈에서 총 박리(도 10a, 좌측), 및 공 벡터-주사된 눈 및 다른 눈 둘 다에서 총 박리(도 10a, 우측)를 나타내었다. 2 개 그룹과 다른 마우스에서, 훽스트-염색된 안구 절편은 AAV8-항VEGFfab-주사된 눈에서 무 박리 및 다른 눈에서 총 박리, 및 공 벡터-주사된 눈 및 다른 눈에서 총 박리를 나타내었다(도 10b). AAV8-항VEGFfab가 주사된 10 개 눈 중 9 개는 무 망막 박리를 가졌으며, 이는 8 개 눈이 총 박리를 갖고 2 개 눈이 부분 박리를 갖는 동일한 마우스에서 주사되지 않은 다른 눈과 상당히 상이하였다(도 10c). 7 개의 총 박리 및 1 개의 부분 박리가 있었던 공 벡터가 주사된 8 개 눈과 비교하면, AAV8-항VEGFfab가 주사된 눈은 상당히 적은 박리를 나타내었다. 또한, AAV8-항VEGFfab가 주사된 눈에서의 평균 % 망막 박리는 동일한 마우스에서 주사되지 않은 다른 눈 또는 공 벡터가 주사된 눈에서의 것에 비해 상당히 적었다(도 10d).
6.5.5 논의
VEGF의 지속적인 억제는 시간 경과에 따라 시력을 최대로 개선하고 질환 진행 및 시력 손실을 예방하기 위해 NVAMD를 갖는 대부분의 환자에서 필요하다. 이 목표를 달성하기 위해 설계된 몇몇 전략을 시험하였다. VEGF-중화 단백질을 눈 내로 천천히 방출하는 재충전 가능한 저장소(reservoir)의 수술적 이식을 NVAMD를 갖는 환자에서 2 상 임상 시험으로 평가한다(Study of the Efficacy and Safety of the Ranibizumab Port Delivery System for Sustained Delivery of Ranibizumab in Participants With Subfoveal Neovascular Age-Related Macular Degeneration, ClinicalTrials.gov identifier: NCT02510794). 다른 접근법은 VEGF의 발현을 억제하는 HIF-1의 소분자 억제제를 생분해성 중합체 내에 포함시키고, 억제제를 지속적으로 방출시키는 미세입자를 제형화하고, 눈 내로 이들을 주사하는 것이다(예를 들어, 그 전체가 본원에 참고로 포함되는 Iwase et al., 2013, Sustained Delivery of a HIF-1 Antagonist for Ocular Neovascularization, J Control Release 172: 625-33 참고). 세번째 접근법은 눈에서 VEGF-중화 단백질 또는 다른 항혈관신생 단백질을 발현하기 위한 안구 유전자 전달이며, 임상 시험은 일부 유망한 시그널을 나타낸 한편(예를 들어, Campochiaro, et al., 2006, Adenoviral Vector-Delivered Pigment Epithelium-Derived Factor For Neovascular Age-Related Macular Degeneration, Results of a Phase I Clinical Trial, Hum Gene Ther 17: 167-76; Heier, et al., 2017, Intravitreous Injection of AAV2-sFLT01 in Patients with Advanced Neovascular Age-Related Macular Degeneration, a Phase 1, Open-Label Trial, The Lancet 389: May 17; Rakoczy et al., 2015, Gene Therapy with Recombinant Adeno-Associated Vectors for Neovascular Age-Related Macular Degeneration, 1 year Follow-Up of a Phase 1 Randomized Clinical Trial, Lancet 386: 2395-403; Constable, et al., 2016, Phase 2a Randomized Clinical Trial: Safety and Post Hoc Analysis of Subretinal rAAV.sFLT-1 for Wet Age-Related Macular Degeneration, EBioMedicine 14: 168-75 참고), 강한 항투과성 및 항혈관신생 활성을 갖는 일관되고, 지속적인 전이유전자 발현의 입증이 결여되어 있다.
이 연구에서, 1x109 내지 1x1010 GC의 AAV8-항VEGFfab의 망막하 주사가 rho/VEGF 마우스에서 3 형 맥락막 NV를 강하게 억제하였음이 밝혀졌다. 공 벡터의 망막하 주사와 비교하여 망막 당 망막하 NV의 평균 면적을 상당히 감소시킨 AAV8-항VEGFfab의 최소 유효 망막하 용량은 1x107 GC였다. 3x108 GC 만큼 낮은 AAV8-항VEGFfab 용량의 망막하 주사 후 10 일에, rho/VEGF 마우스에서의 것과 비교하여 적어도 10 배 높은 VEGF 용량의 독시사이클린-유도성 발현을 갖는 Tet/옵신/VEGF 이중 트랜스제닉 마우스에서는, 삼출성 망막 박리의 발생 및 심각성에서 상당한 감소가 있었다. 누수 억제는 3x109 또는 1x1010 GC의 주사 후 10 일에 특히 양호하였으며, 이는 평균 % 망막 박리에서의 상당한 감소, 및 시험된 최장 시점인 적어도 1 개월에 지속된 효과를 나타내었다. 1x108 GC 이상이 주사된 대부분의 눈은 3x109 또는 1x1010 GC의 주사 후 눈 당 60-80 ng의 피크 수준으로 항VEGFfab의 검출가능한 수준을 갖는다.
이들 데이터는 AAV8-항VEGFfab의 망막하 주사가 NVAMD에 대한 사전 유전자 전달 임상 시험에서 직면하는 일부 문제를 극복하는 것을 도울 수 있다는 것을 나타낸다. AAV2-sFLT01 연구에서, 방수 샘플을 sFLT01에 대해 에세이하였으며 2x108, 2x109, 또는 6x109 GC가 주사된 대상체로부터의 모든 샘플은 모든 시점에서 검출 하한 미만이었으나, 2x1010 GC가 주사된 10 명의 대상체 중 5 명은 26 주차에 32.7 내지 112.0 ng/mL(평균 73.7 ng/mL)로 피크였고 52 주차에 53.2 ng/mL의 평균으로 약간 감소된 검출가능한 수준을 가졌다(예를 들어, Heier, et al., 2017, Intravitreous Injection of AAV2-sFLT01 in Patients with Advanced Neovascular Age-Related Macular Degeneration, a Phase 1, Open-Label Trial, The Lancet 389: May 17 참고). 기존의 중화 항체는 비인간 영장류에서 유리체내 유전자 요법을 중화시키는 것으로 밝혀졌으며(예를 들어, 그 전체가 본원에 참고로 포함되는 Kotterman et al., 2014, Antibody Neutralization Poses a Barrier to Intravitreal Adeno-Associated Viral Vector Gene Delivery to Non-Human Primates, Gene Ther 22: 116-26 참고) 항-AAV2 혈청 항체는 이 시험에서 발현에서의 이 가변성을 설명할 수 있다. 검출가능한 sFLT01 수준을 갖는 5 명의 대상체 중 4 명은 기준선에서 항-AAV2 항체에 대해 음성이었고 다섯번째는 1:100 역가(titer)를 가진 반면에, 검출 불가능한 sFLT01을 갖는 5 명의 고용량 대상체 중 4 명은 ≥1:400인 역가를 가졌다. 일반 집단에서 항-AAV8 혈청 항체의 발생은 항-AAV2 항체의 발생에 비해 한참 적다(예를 들어, 그 전체가 본원에 참고로 포함되는 Calcedo, et al., 2009, Worldwide Epidemiology of Neutralizing Antibodies to Adeno-Associated Viruses, J Infectious Dis 199: 381-90 참고). 또한, AAV8의 망막하 주사는 벡터 비활성화로부터 보호 층을 완화시킬 수 있는 추가 인자를 제공할 가능성이 있으며, 이는 항-AAV2 혈청 항체가 이들이 유리체내 전달에서 하는 것과 같이 AAV2 벡터의 망막하 주사 후 전이유전자 발현을 예방하는 것으로 나타나지 않기 때문이다(예를 들어, Kotterman et al., 2014, Antibody Neutralization Poses a Barrier to 유리체내 Adeno-Associated Viral Vector Gene Delivery to Non-Human Primates, Gene Ther 22: 116-26 참고). 또한, 전이유전자 발현은 AAV 벡터의 유리체내 주사에 비해 망막하 후에 상당히 높고, 동등한 용량에서, 전이유전자 발현은 AAV2 벡터에 비해 AAV8의 망막하 주사가 더 크다(예를 들어, Okamoto et al., 1998, Evolution of Neovascularization in Mice with Overexpression of Vascular Endothelial Growth Factor in Photoreceptors, Invest Ophthalmol Vis Sci 39: 180-8 참고).
6.6 실시예 15: 샘플 대조군 및 샘플 망막 세포주에 대한 온전한 질량 분석, 젤-기반 펩티드 맵핑 및 용액-기반 펩티드 맵핑
6.6.1 샘플
6.6.2 목표
온전한 질량 분석 및 젤-기반 펩티드 맵핑을 양측 샘플에 대해 수행하였다. 용액-기반 펩티드 맵핑을 대조군에 대해 수행하였다. 표적 서열(서열번호 38 및 서열번호 39)을 도 11에 도시하였다.
6.6.3 실험 방법
(a) 샘플 제조
펩티드 맵핑 - 젤
4 x 2.5 ㎍의 샘플 대조군 및 망막 세포주를 SDS-PAGE를 사용하여 분리하였다. ~25 kD에서 밴드를 도 12에 도시된 바와 같이 여기시켰다.
트립신 분해를 다음 프로토콜로 로봇(ProGest, DigiLab)을 사용하여 수행하였다:
· 25 mM 암모늄 바이카보네이트 후 아세토니트릴로 세척함.
· 60℃의 10 mM 디티오트레이톨(dithiothreitol)로 환원시킨 후에 실온의 50 mM 요오도아세트아마이드로 알킬화함.
· 트립신(Promega)으로 37℃에서 4 시간 동안 분해시킴.
· 포름산으로 켄칭시키고 상등액을 추가 처리 없이 직접 분석함.
키모트립신 및 엘라스타제 분해를 다음 프로토콜로 수동으로 수행하였다:
· 25 mM 암모늄 바이카보네이트 후 아세토니트릴로 세척함.
· 60℃의 10 mM 디티오트레이톨로 환원시킨 후에 실온의 50 mM 요오도아세트아마이드로 알킬화함.
· 키모트립신/엘라스타제(Promega)로 37℃에서 12 시간 동안 분해시킴.
· 포름산으로 켄칭시키고 상등액을 추가 처리 없이 직접 분석함.
펩티드 맵핑 - 용액
나머지 대조군을 TCA 침전시키고, 세척하고, 55 μL의 8M 요소, 50mM 트리스 HCl, pH 8.0에 재현탁하였다. TCA 침전된 샘플을 Qubit 황광분석에 의해 정량화하였으며 이는 다음 값으로 보고되었다:
0.78 ㎍/μL x 50 μL = 39 ㎍ 회수.
10 ㎍의 샘플을 3중 세트(triplicate)로 분취하였다. 각각의 3중 세트를 11 mM DTT에서 1 시간 동안 실온에서 환원시키고, 12 mM 요오도아세트아마이드에서 1 시간 동안 알킬화하고, 트립신, 키모트립신, 및 엘라스타제로 37℃에서 밤새 분해하였다. 샘플을 Empore C18 SD 플레이트 상에서 SPE시켰다.
(b) 질량분석법
펩티드 맵핑
젤 분해를 ThermoFisher Q Exactive 인터페이스의 Waters NanoAcquity HPLC 시스템으로 나노 LC/MS/MS에 의해 분석하였다. 펩티드를 트랩핑(trapping) 칼럼 상에 로딩하고 75 μm 분석 칼럼에 걸쳐 350 nL/분으로 용출하고; 양측 칼럼을 Luna C18 수지(Phenomenex)로 포장하였다. 질량 분석기는 MS 및 MS/MS를 각각 70,000 FWHM 및 17,500 FWHM 해상도로 Orbitrap에서 수행하면서 데이터-의존 방식으로 작동시켰다. 15 가지 가장 풍부한 이온을 MS/MS 동안 선택하였다.
온전한 질량
10 pmol을 Q Exactive 질량 분석기 인터페이스의 C4 칼럼(Waters Symmetry C4 3.5 μm, 2.1 mm x 50 mm)을 사용하여 LC/MS에 의해 분석하였다. 데이터는 스펙트럼 당 3 회의 마이크로스캔으로 해상도 17,500 FWHM(m/z 400에서) 에서 m/z 600-2500으로부터 얻었다.
(c) 데이터 처리
펩티드 맵핑
데이터는 다음 파라미터로 마스코트(Mascot)의 국소 복제(local copy)를 사용하여 검색되었다:
효소: 반-트립신 또는 없음(엘라스타제 및 키모트립신에 대한 것)
데이터베이스: Swissprot Human(일반 오염물 및 표적 서열이 첨부된 정방향 및 역방향)
고정된 변형: 카바미도메틸(C)
가변적 변형: 산화(M), 아세틸(단백질 N-말단), 탈아미노화(NQ), Pyro Glu(N-말단 E)
질량 값: 단일동위원소
펩티드 질량 공차: 10 ppm
단편 질량 공차: 0.02 Da
최대 누락 절단: 2
샘플 당 불필요하지 않은 목록을 검증, 여과 및 생성하기 위해 마스코트 DAT 파일을 Scaffold 소프트웨어에서 분석하였다. 데이터를 99%의 최소 단백질 값, 50%의 최소 펩티드 값(프로펫(Prophet) 스코어)을 사용하고 단백질 당 적어도 2 개의 고유한 펩티드를 요구하여 여과하였다.
온전한 질량
온전한 질량 데이터를 MagTran v1.03 소프트웨어를 사용하여 처리하였다.
6.6.4 결과
(a) 샘플 대조군
펩티드 맵핑 - 젤
데이터를 도 13에 도시된 바와 같이 양측 서열(서열번호 38 및 서열번호 40)에 매칭시켰다.
경쇄 ("LC") - 1430 개 총 스펙트럼, 552 개 고유 펩티드 및 100% 서열 범위. N-말단 Met의 증거는 없었음을 주의한다. N-말단은 유리 아민 및 N-아세틸화 둘 다로서 존재한다. 7 개 N-아세틸화 스펙트럼 및 40 개 비-아세틸화 스펙트럼이 있었다.
중쇄 ("HC") - 1069 개 총 스펙트럼, 470 개 고유 펩티드 및 100% 서열 범위. N-말단 Met의 증거는 없었음을 주의한다. N-말단은 유리 아민 및 N-아세틸화 둘 다로서 존재한다. 7 개 N-아세틸화 스펙트럼 및 56 개 비-아세틸화 스펙트럼이 있었다.
HC C-말단 Leu 절단 - H231 C-말단 및 L232 C-말단에 상응하는 펩티드를 검출하였다. 2 개의 대표적인 펩티드에 대해 추출된 이온 크로마토그램 피크 면적을 상대 %와 함께 하기에 나타내었다. 2 개의 펩티드에 대한 반응 인자에서의 차이를 기본으로 한 이 측정에 오차 가능성이 있음을 주의한다:
펩티드 맵핑 - 용액
데이터를 도 14에 도시된 바와 같이 양측 서열(서열번호 38 및 서열번호 40)에 매칭시켰다.
LC - 1453 개 총 스펙트럼, 489 개 고유 펩티드 및 100% 서열 범위. N-말단 Met의 증거는 없었음을 주의한다. N-말단은 유리 아민 및 N-아세틸화 둘 다로서 존재한다. 3 개 N-아세틸화 스펙트럼 및 48 개 비-아세틸화 스펙트럼이 있었다.
HC - 985 개 총 스펙트럼, 423 개 고유 펩티드 및 100% 서열 범위. N-말단 Met의 증거는 없었음을 주의한다. N-말단은 유리 아민 및 N-아세틸화 둘 다로서 존재한다. 7 개 N-아세틸화 스펙트럼 및 76 개 비-아세틸화 스펙트럼이 있었다.
HC C-말단 Leu 절단 - C-말단 Leu 절단에 상응하는 펩티드는 검출되지 않았다.
온전한 질량
도 15를 참조하면, 관찰된 크로마토그램에서 주요 피크가 디콘볼루션을 위한 스펙트럼을 얻기 위해 요약된다(도 15a). 스펙트럼을 24,432.0 Da 및 24,956.0 Da 평균 질량의 2 개의 성분으로 디콘볼루팅시켰다. 디콘볼루팅된 스펙트럼 및 주석이 달린 미가공 데이터를 도 15b에 도시하였다.
(b) 샘플 망막 세포주
펩티드 맵핑 - 젤
데이터를 도 16에 도시된 바와 같이 양측 서열(서열번호 38 및 서열번호 39)에 매칭시켰다.
LC - 1107 개 총 스펙트럼, 442 개 고유 펩티드 및 100% 서열 범위. N-말단 Met의 증거는 없었음을 주의한다. N-말단은 유리 아민 및 N-아세틸화 둘 다로서 존재한다. 6 개 N-아세틸화 스펙트럼 및 27 개 비-아세틸화 스펙트럼이 있었다.
HC - 843 개 총 스펙트럼, 409 개 고유 펩티드 및 98% 서열 범위. N-말단 Met의 증거는 없었음을 주의한다. N-말단은 유리 아민 및 N-아세틸화 둘 다로서 존재한다. 1 개 N-아세틸화 스펙트럼 및 35 개 비-아세틸화 스펙트럼이 있었다.
HC C-말단 Leu 절단 - L232, R233, 및 R235 C-말단에 상응하는 펩티드를 검출하였다. R236의 증거는 없었다. 3 개의 대표적인 펩티드에 대해 추출된 이온 크로마토그램 피크 면적을 상대 %와 함께 하기에 나타내었다. 3 개의 펩티드에 대한 반응 인자에서의 차이를 기본으로 한 이 측정에 오차 가능성이 있음을 주의한다:
온전한 질량
도 17을 참조하면, 관찰된 크로마토그램에서 주요 피크가 디콘볼루션을 위한 스펙트럼을 얻기 위해 요약된다(도 17a). 스펙트럼을 24,428.0 Da 및 24,952.0 Da 평균 질량의 2 개의 성분으로 디콘볼루팅시켰다. 디콘볼루팅된 스펙트럼 및 주석이 달린 미가공 데이터를 도 17b에 도시하였다.
6.7 실시예 16: 래트 모델에서 AAV8.항VEGFfab의 맥락막상 주사
6.7.1 연구의 간단한 요약
다음 연구는 AAV8의 맥락막상 주사 후 눈에서 형질도입된 세포 유형 및 발현의 수준을 결정하기 위해 수행하였다. 결과는 AAV8.CB7.GFP의 맥락막상 주사 후 1 내지 2 주에 눈의 원주에 걸쳐 광범위한 전이유전자 발현을 나타내었다. 녹색 형광 단백질(GFP) 발현을 신경절 세포를 비롯한 망막 색소 상피(RPE)/맥락막 세포 및 모든 망막 층에서 검출하였다.
6.7.2 방법
노르웨이 브라운 래트(Norway Brown rat)(N=40)에게 각각의 눈에 7.2 x 108 또는 2.85 x 1010 게놈 카피(GC)의 AAV8.CB7.GFP를 함유한 3 μL의 맥락막상 또는 망막하 주사가 주어졌다. 주사는 2 단계로 수행하였다: 우선 예리한 바늘을 사용하여 공막의 3/4을 관통해 구멍을 낸 후에(예리한 팁 부분 두께 공막절개), 뭉툭한 바늘로 동일한 공막절개 부위에 주사하여 맥락막상 공간 내로만 주사하였다.
5 마리의 동물을 주사 후 1, 2, 4 및 8 주에 각각 안락사시켰다. 한쪽 눈을 효소-연결 면역흡착 분석(ELISA)에 의해 파쇄액에서의 GFP 발현에 대해 분석하고, 다른 눈을 면역형광법에 의해 분석되는 안구 냉동 절편을 위해 사용하였다.
6.7.3 결과
냉동 절편의 면역형광 분석은 맥락막상 주사 후 1 주에 광범위한 GFP 발현을 나타내었다. 적도의 10 μm 수평 냉동 절편은 눈의 원주의 반을 더욱 초과하여 연장된 망막 및 RPE/맥락막에서의 GFP 발현을 나타내었다. 고배율에서, GFP는 눈의 일부 영역 내의 맥락막 및 외과립층에서, 및 주로 신경절 세포층의 내과립층에서 검출되었다. RPE/맥락막 평면 표본고정은 모양체로부터 거의 시신경까지 후방으로 연장된 아이컵(eyecup)의 약 1/4에 걸쳐 GFP 발현을 나타내었다. 망막 평면 표본고정은 망막의 전방 모서리로부터 후방으로 적도까지 망막 면적의 약 1/5에 걸쳐 GFP를 나타내었다.
GFP의 발현 면적 및 형광 강도는 맥락막상 발현 후 1 내지 2 주에 증가하였다. 안구 절편의 면역형광 분석은 2 주에, GFP 발현이 신경절 세포를 비롯한 RPE/맥락막 세포 및 망막의 모든 세포에서 검출되었음을 드러냈다. 2 주에, 적도의 10 μm 수평 냉동 절편은 눈의 전체 외주를 둘러 연장된 망막 및 RPE/맥락막에서 GFP를 나타내었다. 고배율은 맥락막, 외절, 외과립층, 내과립층 및 신경절 세포층에서 GFP를 나타내었다. RPE/맥락막 평면 표본고정은 모양체로부터 거의 시신경까지 후방으로 연장된 아이컵의 약 1/3에 걸쳐 GFP를 나타내었다. 고배율 영역은 낮은 GFP-발현 RPE 세포에 비해 많은 더욱 높은 GFP-발현을 나타내었다. 망막 표본고정은 전방 모서리로부터 시신경 근처의 후방으로 망막의 약 1/4에서 GFP를 나타내었다.
4 및 8 주에, 형광 강도는 감소하였으며, 상기 감소는 생산된 단백질의 높은 수준에 반응한 염증 반응으로 인한 것으로 여겨진다.
GFP의 평균 발현 수준은 맥락막상 주사 후 1 및 2 주에 망막 및 RPE/맥락막의 파쇄액에서 높았다(도 19).
6.8 실시예 17: 래트 모델에서 AAV8.항VEGFfab의 맥락막상 및 망막하 주사의 비교
6.8.1 연구의 간단한 요약
다음 연구는 AAV8.항-VEGF의 망막하 주사에 대해 맥락막상 주사에 의해 달성된 발현을 비교하기 위해, 및 AAV8.항VEGFfab의 맥락막상 주사가 눈에서 VEGF-유도된 누수 및 신혈관형성을 감소시킬 수 있고 유사한 수준의 항-VEGF를 생산할 수 있는지 여부를 결정하기 위해 수행하였다. 결과는 동등하게 높은 수준의 항VEGFfab가 맥락막상 또는 망막하 AAV8.항VEGFfab가 주사된 눈에서 검출되었고, 항-VEGF 단백질의 분포가 망막 대 맥락막에서 유사하였으며, 맥락막상 주사가 VEGF-유도된 누수 및 신혈관형성에서 망막하 전달과 동등하게 효과적이었음을 나타내었다.
6.8.2 방법
노르웨이 브라운 래트에게 한쪽 눈에 2.85 x 1010 GC/눈(4 x 1010 GC/mL의 농도)의 AAV8.CB7.항VEGFfab를 함유한 3 μL의 맥락막상 또는 망막하 주사, 및 다른 눈에 7.2 x 108 GC의 AAV8.CB7.GFP를 함유한 3 μL의 맥락막상 또는 망막하 주사가 주어졌다. 2 주 후에, 200 ng의 VEGF를 유리체 내로 주사하였다. 2 주에 평가된 래트의 서브세트에서, 100 ng의 VEGF를 주사하였다.
6.8.3 결과
2 주에, VEGF 주사 후 24 시간에 촬영된 안저 사진은 AAV8.항VEGFfab-주사된 눈에서 정상 망막 및 망막 혈관 구경을 나타낸 반면에, AAV8.GFP-주사된 눈은 혈관 확장, 부종의 증거, 희미한 시신경 유두 가장자리 및 유백색 망막을 나타내었다.
혈관 누수는 ELISA에 의해 유리체 샘플에서 알부민의 측정에 의해 평가하였으며, 이는 맥락막상 AAV8.GFP가 주어진 다른 눈에 비해 AAV8.항VEGFfab의 맥락막상 주사가 주어진 눈에서 상당한 감소를 나타내었다. 그러나, 망막하 AAV8.항VEGFfab가 주어진 눈 대 망막하 AAV8.GFP가 주어진 다른 눈 사이에는 유리체 알부민에서 상당한 차이는 없었다(도 20a).
동등하게 높은 수준의 항VEGFfab를 맥락막상 또는 망막하 AAV8.항VEGFfab가 주사된 눈에서 검출하였으며(도 20b), 망막 대 맥락막에서의 분포는 유사하였다.
6.8.4 실시예 18: 맥락막상 AAV8-벡터 유전자 전달은 RPE 및 망막에서 광범위한 전이유전자 발현을 제공한다.
6.8.5 연구의 간단한 요약
유전된 망막 변성에 대한 유전자 치환 및 신혈관 연령-관련 황반 변성(NVAMD)에 대한 VEGF-중화 단백질의 유전자 전달에서 큰 진전이 있었다; 그러나, 망막 색소 상피(RPE) 및 망막에 대한 바이러스 벡터의 전달은 여전히 문제가 있을 수 있다. 전이유전자 발현은 망막하 주사가 대부분의 적용을 위한 바람직한 전달 경로이도록, AAV 벡터의 유리체내 주사가 광수용기 및 RPE에서 무 발현으로 제한된 후에 제한된다. 그러나, 망막하 주사는 RPE로부터 광수용기를 분리하고 중심와가 포함될 때, 원추 광수용기에 대한 손상이 발생하여 시각 잠재력을 제한할 수 있다. 또한, 망막하 주사는 수술실에서 유리체절제술에 이루어지며 수술-관련 이벤트의 높은 위험, 백내장 형성 및 1-2% 망막 박리 위험을 수반한다. 이 연구는 안구 유전자 전달에 대한 중요한 이점을 갖는 새로운 접근법인 AAV8 벡터의 맥락막상 주사를 보고한다. 래트에서 2.85 x1010 유전자 카피(GC)의 AAV8.GFP를 함유한 3 μL의 맥락막상 주사 후 2 주에, 거상연으로부터 후방으로 시신경에 인접한 영역까지 연장된 RPE/맥락막 평면 표면고정의 23%를 커버하는 강한 GFP 형광이 있었다. 안구 절편은 맥락막, RPE, 및 모든 망막 층에 걸쳐 눈의 적도의 전체 원주를 둘러 GFP 형광을 나타내었다. 2.85 x1010 유전자 카피(GC)의 AAV8.GFP를 함유한 3 μL의 2 회 맥락막상 주사는 RPE/맥락막 평면 표면고정 면적의 42%를 커버하는 GFP 형광을 야기하였다. 2.85 x1010 유전자 카피(GC)의 AAV8.항VEGFfab를 함유한 3 μL의 맥락막상 주사 후 2 주에, 망막 및 RPE/맥락막에서 항VEGFfab의 평균 수준은 각각 8.68 및 3.72 ng/mg 단백질이었으며, 이는 동일한 양의 벡터의 망막하 주사 후 나타난 것과 유의하게 상이하지 않았다. AAV8.항VEGF의 맥락막상 및 망막하 주사는 벡터 주사 후 2 및 7 주에 VEGF-유도된 망막 출혈, 망막 혈관의 확장, 및 혈관 누수를 예방하는데 동등하게 효과적이었다. 이들 데이터는 맥락막상 주사가 효능 및 안전성을 최대화할 수 있는 안구 유전자 전달을 위한 바람직한 경로를 제공할 수 있다는 것을 입증한다.
6.8.6 연구의 배경
AAV2.CMV-RPE65의 망막하 주사는 RPE65 유전자 내의 돌연변이로 인해 레베르 선천성 흑암시(Leber Congenital Amaurosis)(LCA)를 갖는 환자에서 이동성 개선을 야기하였다(Maguire et al., 2008, N. Eng. J. Med. 358 :2240-2248; Bainbridge et al., 2008, N. Eng. J. Med. 358: 2231-2239; Hauswirth et al., 2008, Hum. Gen. Ther. 19:979-990). 미국식품의약국에 의한 이 치료의 승인은 안구 유전자 치환의 최근 및 미래 잠재력의 중요한 확인을 나타낸다. 그러나, LCA 연구 집단에 대한 종합적인 이익에도 불구하고, 내안구염, 황반 원공, 및 시력 감소를 비롯해 일부 연구 환자에서 중심와 하의 주사로부터 심각한 합병증이 있었다(Jacobson et al., 2015, N. Eng. J. Med. 372 :1920-1926; Bennett et al., 2016, Lancet 388:661-672). 임의의 안구내 주사 또는 수술은 내안구염을 야기할 수 있으나, 수술이 길고 많이 관련될수록 내안구염의 위험이 더 크다. 망막하 주사는 망막 색소 상피(RPE)로부터 광수용기를 분리하며, 이는 정상 눈에서 광수용기를 훼손할 수 있으나, 유전된 망막 변성으로 손상된 광수용기를 갖는 눈에서 특히 위험할 수 있다(Hauswirth et al., 2008, Hum. Gen. Ther. 19:979-990). 이러한 눈은 망막하 물집을 생성하기 위해 큰 압력을 필요하게 하는 망막-RPE 접착을 증가시키는 망막하 섬유증을 갖고 중심와는 황반의 가장 얇은 부분이기 때문에, 가압된 망막하 유체는 중심와를 통해 탈출해, 황반 원공을 생성하고 망막하 공간 내의 벡터를 감소시킬 수 있다. 망막하 벡터 주사 후, 감염은 물집(광수용기 및 RPE가 벡터-함유 유체에 의해 분리되는 영역) 내의 세포로 제한되어, 물집의 크기 및 위치가 중요하지만, 이는 제어하기에 항상 용이하지 않으며, 이는 물집이 확산되는 방향을 결정하는 최소 저항 경로가 수술 시에 망막의 감염으로부터 예측 가능하지 않기 때문이다. 때로는 물집은 망막하 주사 부위로부터 대칭으로 연장되어 원을 야기하고 때로는 이는 한 방향으로 망막 주변부로 비대칭으로 확산되어 표적화된 후방 망막의 영역을 포함하지 못한다. 때로는 물집은 x 또는 y 축에 비해 z-축을 따라 더욱 연장되어, 망막 및 RPE의 상대적으로 작은 면적을 포함하는 높은 물집을 야기한다. 이 비예측성은 전이유전자 발현의 위치 및 양에서 가변성의 원인이 되어, 일부 환자에서의 결과에서의 가변성 및 잠재적으로 좋지 않은 결과를 야기할 수 있다. 다수의 망막하 주사는 망막 및 RPE의 표적화된 영역을 벡터에 노출되게 도울 수 있으나, 합병증의 위험을 증가시킬 것이다.
맥락막상 주사는 최근 안구 약물 전달을 위한 새로운 경로를 제공하는 것으로 입증되었다. 맥락막상 공간은 공막 내부에만 유체를 주사함으로써 확장될 수 있는 공막의 내부 공간을 따르는 잠재적 공간이다. 공막의 두께와 유사한 길이를 갖는 미세바늘의 개발은 맥락막상 주사를 용이하게 하였으나(Patel et al., 2011, Pharm. Res. 28:166-176), 이들은 표준 바늘을 사용하여 이루어질 수도 있다. 연곽 근처에 주사된 형광 라벨링된 입자는 눈 주위를 원형으로 흘러, 광범위한 노출 면적을 야기한다(Patel et al., 2012, Invest. Opthalmol. Vis. Sci. 53: 4433-4441). 대부분의 소분자는 맥락막상 공간에서 수 시간의 반감기를 갖지만, 트리암시놀론 아세토나이드와 같은 친유성 분자는 느리게 용해되는 침전물을 형성하여, 망막에 지속적인 전달을 제공한다(Patel et al., 2012, Invest. Opthalmol. Vis. Sci. 53: 4433-4441; Chen et al., 2015, J. Control. Release 203:109-117). 임상 시험은 트리암시놀론 아세토나이드의 맥락막상 주사 후 다중 질환 과정 중 황반 부종에서 연장된 개선을 입증하였다(Yeh et al., 2018 August 15, Retina epub: doi:10.1097/IAE.0000000000002279). 이 연구에서, AAV8 벡터의 맥락막상 주사의 잠재적 가치를 안구 유전자 전달에 대해 조사하였다.
6.8.7 재료 및 방법
(a) AAV8 벡터
AAV8 벡터는 REGENXBIO Inc.(Rockville, MD)에 의해 제공되었다. AAV8.GFP는 CB7 프로모터를 이용하여 GFP를 코딩하는 유전자 카세트를 함유한 비-복제성 AAV8 벡터이다. AAV8.항VEGFfab는 닭 β-액틴 프로모터 및 CMV 인핸서로 구성된 CB7 프로모터, 닭 β-액틴 인트론, 및 토끼 β-글로빈 폴리 A 시그널을 이용하여 인간 VEGF를 중화하는 인간화 단클론 항원-결합 단편을 코딩하는 유전자 카세트를 함유한 비-복제성 AAV8 벡터이다.
(b) 동물
모든 동물은 안과 연구에서 동물의 사용에 대한 미국안과학회에 따라 처치하였으며, 프로토콜은 존스 홉킨스 대학 동물 실험 윤리 위원회가 검토 및 승인하였다. 8 주령 노르웨이 브라운 래트를 Charles River(Frederick, MD, USA)로부터 구매하였다. 성체 더치 벨티드(Dutch Belted) 토끼를 Robinson Services Inc.(Mocksville, NC, USA)로부터 구매하였다. 성체 정상-시야 붉은털 원숭이를 존스 홉킨스 대학의 동물 시설에 수용하고 케어하였다.
(c) 래트, 토끼 및 원숭이에서 벡터의 맥락막상 주사
래트를 케타민/자일라진으로 마취시키고, 눈을 10X 배율을 갖는 Zeiss 입체 해부 현미경(Zeiss, Oberkochen, Germany)으로 시각화하였다. 1 mL 시린지 상의 30-게이지 바늘을 사용하여 연곽에 평행한 공막에 부분 두께 개구를 생성하였으며 Hamilton 시린지(Hamilton Company, Reno, NV) 상의 33-게이지 45 도 각도 바늘을 공막 구멍 내로 삽입하고 나머지 공막 섬유를 통해 맥락막상 공간 내로 천천히 진입시키고 2.85 x 1010 GC의 벡터를 함유한 3 μL를 주사하였다. 30 초 후에, 바늘을 빼내는 한편, 주사 부위 상에 면 팁의 도포기를 고정하고 항생제 연고(Moore Medical LLC, Farmington, CT)를 안구 표면에 투여하였다.
토끼 주사를 위해, 더치 벨티드 토끼를 케타민/자일라진으로 마취시키고, 눈을 Zeiss 수술 현미경 하에 노출시켰다. 27-게이지 바늘을 갖는 인슐린 시린지를 연곽 뒤 6 mm에 공막을 통해 접선으로 삽입하였다. 공막 내의 약 4-5 mm로 바늘을 밀고 손가락 끝에 빈 느낌이 들 때 50 μL의 벡터를 맥락막상 공간 내로 천천히 주사하였다. 30 초 후에, 바늘을 빼내는 한편, 주사 부위 상에 면 팁의 도포기를 고정하고 항생제 연고를 안구 표면에 투여하였다.
원숭이 주사를 위해, 3 마리의 AAV8 중화 항체 (-) 성체 붉은털 원숭이를 케타민 하이드로클로라이드(15-20 mg/kg)로 진정제 투여한 후에, 0.5% 프로파라카인(Akorn, IL, USA)을 사용하여 양측 눈을 국소 마취하였다. 5% 포비돈 요오드를 투여하여 수술 전에 안구 표면을 살균하였다. 수술은 토끼에서와 동일하였다.
(d) 래트에서 벡터의 망막하 주사
래트를 마취시키고 눈을 Zeiss 수술 현미경(Zeiss, Oberkochen, Germany) 및 20D 안저 레이저 렌즈(Ocular Instruments Inc, WA, USA)로 시각화하였다. 우선, 인슐린 시린지 상의 30-게이지 바늘을 접선으로 삽입하여 공막에 구멍을 뚫었다. 그 다음에, 5 μL 시린지 상의 33-게이지 Hamilton 바늘(Hamilton Company, Reno, NV)을 공막 구멍 내로 삽입하고 안구 층, 유리체 동공을 통해 외측의 망막하 공간 내로 부드럽게 밀었으며, 2.85 x 1010 GC의 벡터를 함유한 3 μL를 주사하였다. 항생제 연고를 수술 후에 안구 표면에 투여하였다.
(e) 조직 수집 및 조직학
혈액 샘플을 벡터 주사 전 및 안락사 전 3 주의 2 개의 상이한 시점에 진정제 투여 후 원숭이에서 수집하였다. 시신경 및 간 샘플을 얻었다. 래트 혈액 샘플을 또한 안락사 전에 수집하였다. 간 샘플을 사후에 얻었다.
안락사 후에, 눈을 제거하고 4% 포름알데하이드에서 고정하였다. 한쪽 눈은 전상엽구(anterior segment)를 가졌으며 유리체를 제거한 다음에 망막 및 RPE/맥락막을 단리시키고 별도로 평면 표면고정시켰다. 다른 눈은 최적 절단 온도 배지(Fisher Scientific Co.)에서 냉동하고 동결절단(10 μm)하였다. 훽스트 염색(Vector Laboratories, Burlingame, CA)을 수행하여 망막 층 및 RPE를 시각화하였다. 평면 표면고정 및 안구 절편 둘 다를 형광 현미경에 의해 시험하였다.
눈을 제거한 후에, 절개가 복벽에서 이루어져, 복막강에서 장기를 노출시켰다. 간을 수집하고 냉동하였다.
(f) RPE/맥락막 및 망막 파쇄액의 제조
래트 망막 및 아이컵 샘플을 해부 현미경 하에서 단리시키고 이를 프로테아제 억제제 칵테일(Roche, 68298 Mannheim, Germany)이 첨가된 RIPA 버퍼(Sigma Aldrich, Arlington, MA)에 넣었다. 샘플을 4-5 초 동안 초음파처리하였으며(sonicanized)(Sonic Dismembrator Model 300, Fisher Scientific, Walkersville, MD), 약 5 분 동안 얼음조(ice bath)에 놓아둔 다음에, 10 분 동안 14,000 rpm에서 원심분리(Eppendorf, Germany)하였다. 상등액을 단리시키고, -80℃에서 저장하였다.
(g) 망막 및 RPE/맥락막에서 GFP의 측정
래트 망막 및 맥락막 샘플로부터의 GFP 농도를 GFP SimpleStep ELISA 키트(ab171581, Abcam, Cambridge, MA)를 사용하여 측정하였다. 간단하게는, GFP 표준 및 샘플을 GFP 포획 항체와 함께 각각의 웰에 로딩시켰다. 플레이트를 실온에서 1 시간 동안 항온처리하였다. 5 회 세척 후에, 100 ul의 TMB 기질 용액을 각각의 웰에 첨가하고 플레이트를 암중에서 10 분 동안 항온처리한 다음에, 100 ul의 정지액을 각각의 웰에 첨가하였다. 450 nm 흡수를 Spectra Max Plus 384 마이크로플레이트 판독기(Molecular Devices, San Jose, California)에 의해 측정하였다. GFP 농도를 각각의 샘플의 총 단백질 농도에 의해 정규화하였다.
(h) 망막 및 RPE/맥락막에서 항VEGFfab의 측정
눈을 제거한 후에, 망막 및 RPE/맥락막을 분리하고 상기 기재된 바와 같이 균질화하였다. 제조사의 지시를 사용하여, 망막 및 RPE/맥락막 샘플에서 활성 루센티스의 정량화를 위해 루센티스(라니비주맙) 항-VEGF ELISA 키트(#200-880-LUG; Alpha Diagnostic Intl, San Antonio, TX)를 사용하였다. 플레이트를 450 nm 파장에서 Spectra Max Plus 384 마이크로플레이트 판독기(Molecular Devices, San Jose, California)에 의해 판독하였다.
(i) 유리체 샘플에서 알부민의 측정
유리체 액을 인슐린 시린지를 사용하여 수집하였다. 제조사의 지시를 사용하여, 표준 곡선 생성을 위해 래트 알부민 ELISA 키트(ab108790; Abcam, Cambridge, MA)를 사용하여, 1 μL의 희석된 유리체 액 및 알부민 샘플에서의 알부민 수준을 측정하였다. 플레이트를 450 nm 및 570 nm에서 Spectra Max Plus 384 마이크로플레이트 판독기(Molecular Devices, San Jose, California)에 의해 판독하였다.
6.8.8 결과
(a) AAV8.GFP의 맥락막상 주사는 망막, RPE, 및 맥락막에 걸친 GFP 발현을 야기한다.
브라운 노르웨이 래트에서 연곽 후방 1 mm에 2.85 x1010 유전자 카피(GC)의 AAV8.GFP를 함유한 3 μL의 맥락막상 주사 후 1 주에, 구체의 적도를 통한 10 μm 수평 냉동 절편은 눈의 원주의 거의 반으로 연장된 맥락막, RPE, 및 외망막에서의 녹색 형광을 나타내었다. 고배율 시야는 주사의 사분면에서 망막의 맥락막, RPE, 및 외과립층(ONL)에서 강한 형광 강도를 나타내었고, 주사 부위로부터 먼 망막에서의 형광은 주로 광수용기 내절에 있었다. 망막의 제거 후, 공막, 맥락막, 및 RPE를 함유한 아이컵의 평면 표면고정은 모양체의 경계로부터 시신경에 인접한 영역까지 후방으로 연장된 약 25%의 RPE에서 녹색 형광 시그널을 나타내었다. 고배율 시야는 이핵 RPE 세포에서 가변성 GFP 발현을 나타내었으며, 일부는 훽스트-염색된 핵을 모호하게 하는 강한 형광을 나타내고 다른 것들은 검출 가능한 형광을 나타내지 않았다. 망막 평면 표면고정은 망막의 전방 모서리로부터 후방으로 적도까지 RPE에서 나타난 것에 비해 다소 작은 망막의 약 1/5의 영역에 걸쳐 형광을 나타내었다. 고배율 시야는 망막 내의 다수의 세포 층으로 인해 좋지 않은 해상도의 형광 세포를 나타내었다.
브라운 노르웨이 래트에서 연곽 후방 1 mm에 2.85 x1010 GC의 AAV8.GFP를 함유한 3 μL의 맥락막상 주사 후 2 주에, 구체의 적도를 통한 10 μm 수평 냉동 절편은 눈의 전체 원주를 둘러 연장된 맥락막, RPE, 및 외망막에서 녹색 형광을 나타내었다. 고배율 시야는 맥락막, RPE, 외과립층(ONL), 내과립층(INL), 및 신경절 세포층(GCL)에서 녹색 형광을 나타내었다. 아이컵의 평면 표면고정은 모양체에 인접한 전방 경계로부터 시신경에 인접하여 후방으로 연장된 RPE의 약 1/3의 면적을 커버하는 녹색 형광을 나타내었다. 고배율 시야는 GFP 발현에서 상당한 이질성을 나타내었으나, 저-발현 RPE 세포에 비해 더 큰 %의 고-발현 RPE 세포를 나타내었다. 망막 평면 표면고정은 망막의 약 ¼에 걸쳐 강한 녹색 형광을 나타내었다. 도 19에서 나타낸 바와 같이, 2.85 x1010 GC의 AAV8.GFP를 함유한 3 μL의 맥락막상 주사 후 1 및 2 주에, RPE/맥락막 또는 망막의 파쇄액에서 GFP 단백질의 발현 수준은 20-40 ng/mg 단백질 범위로 매우 높았다.
(b) AAV8.GFP의 2 회 맥락막상 주사에 의한 GFP 발현의 향상
큰 면적의 RPE/맥락막 및 망막이 다수의 맥락막상 주사에 의해 감염될 수 있는지를 결정하기 위해, 래트에게 2.85 x1010 GC의 AAV8.GFP를 함유한 3 μL의 단일 맥락막상 주사 또는 2.85 x1010 GC의 AAV8.GFP를 함유한 3 μL의 2 회 주사가 3 일 간격으로 주어졌다. 첫번째 주사 후 2 주에, 2 회 주사를 받은 눈으로부터의 RPE/맥락막 평면 표면고정의 42.2%는 단일 주사 후 2 주의 눈으로부터의 RPE/맥락막 평면 표면고정의 22.9%와 비교하여 녹색 형광을 나타내었다. GFP 단백질 수준은 1 회 받은 것과 비교하여 2 회 맥락막상 주사를 받은 눈으로부터의 RPE/맥락막 파쇄액에서 상당히 컸다(도 21).
(c) AAV8.항VEGFfab의 맥락막상 주사는 VEGF-유도된 혈관확장 및 혈관 누수를 억제한다.
AAV8.GFP를 이용한 상기 실험은 AAV8 벡터의 맥락막상 주사가 RPE/맥락막 및 망막에서 광범위한 전이유전자 발현을 제공할 수 있으나, 잠재적 생물학적 효과에 대한 정보를 제공하지 않는다는 것을 나타낸다. 따라서, VEGF의 과잉발현이 과도한 혈관 누수 및 신혈관형성의 주요 추진자인 망막/맥락막 혈관 질환에서의 치료 효과를 위한 잠재력을 갖는 VEGF-중화 단백질을 발현하는 AAV8.항VEGFfab를 이용한 실험을 수행하였다(Liu et al., 2018, Mol. Ther. 26:542-549). 래트에게 한쪽 눈에 2.85 x1010 GC의 AAV8.항VEGFfab를 함유한 3 μL 및 다른 눈에 2.85 x1010 GC의 AAV8.GFP를 함유한 3 μL의 맥락막상 또는 망막하 주사가 주어졌다. 2 주 후에, 이들에게 각각의 눈에 200 ng의 재조합 VEGF165(VEGF)의 유리체내 주사가 주어졌고 비교를 위해 치료-나이브 래트에게 200 ng의 재조합 VEGF165의 주사가 또한 주어졌다. 24 시간 후에, 임의의 사전 치료를 받지 않은 VEGF-주사된 눈은 혈관 확장 및 출혈을 나타내었다. 반면에, 이전에 AAV8.항VEGFfab의 맥락막상 주사가 주어졌던 눈은 정상 망막 혈관 및 망막을 갖는 한편, AAV8.GFP의 맥락막상 주사를 받은 다른 눈은 통상적인 VEGF-유도된 표현형인 혈관 확장 및 출혈을 나타내었다. 유사하게는, 이전에 AAV8.항VEGFfab의 망막하 주사가 주어진 눈은 정상으로 보이는 안저를 갖는 한편, AAV8.GFP의 망막하 주사가 주어진 눈은 확장되고, 굽은 혈관을 가졌다. 장기 효과를 평가하기 위해, 100 ng의 VEGF의 유리체내 주사가 맥락막상 또는 망막하 벡터 주사 후 7 주에 이루어졌다. 이전에 미치료된 래트에서 VEGF 주사 후 24 시간에, 눈에서 혈관 확장 및 출혈이 있었다. 초기 시점과 유사하게, AAV8.항VEGFfab의 맥락막상 또는 망막하 주사가 주어진 눈은 정상 안저를 가졌으며 AAV8.GFP의 맥락막상 또는 망막하 주사가 주어진 눈은 혈관 확장 및 출혈을 가졌다. 유리체 내로 누수된 혈청 알부민의 측정은 망막 혈관 누수를 정량화하기 위한 가치 있는 기술을 제공한다(Fortmann et al., 2018, Sci. Rep. 8:6371). 미치료된 래트의 유리체에서 평균 알부민 수준은 0.6(±0.49)이었으며, 이는 이전의 보고와 일치한다. 200 ng의 VEGF의 유리체내 주사 후 24 시간의 유리체 알부민에서의 평균 증가는 1.04(±0.12)였으며, 유리체 알부민은 AAV8.GFP의 맥락막상 또는 망막하 주사 후 2 또는 7 주에 VEGF 주사를 받은 눈에서 유사하게 증가하였으나, 알부민에서의 증가는 2 또는 7 주 전에 AAV8.항VEGF의 맥락막상 또는 망막하 주사를 받은 눈에서 상당히 그리고 동등하게 감소하였다(도 22). 망막 및 RPE/맥락막에서 항VEGFfab 단백질의 평균 수준은 양측 시점에 AAV8.항VEGFfab의 맥락막상 또는 망막하 주사 후 유사하였다(도 23).
(d) 토끼에서의 맥락막상 주사
토끼에게 4.75 x1011 GC의 AAV8.GFP를 함유한 50 μL를 주사하였다. 1 또는 2 주 후에, RPE/맥락막 및 망막 평면 표면고정을 수행하였다. 높은 GFP 발현이 일부 RPE 세포에서 관찰되었으며 낮은 GFP 발현이 다른 것들에서 관찰되었다. 발현의 이질적 수준의 패턴은 래트에서 관찰된 것과 유사하였으나, 더욱 확연하였다. 고발현의 영역은 먼 주변부로부터 중간-주변부로 연장되었고, 래트에서 나타난 것만큼 후방이었다. 망막 평면 표면고정은 신경교세포로 구성된 시신경 주변의 말이집 줄기(myelinated streak)에서 가장 강한 GFP 발현을 나타내었으며, 이는 신경교세포의 형질도입이 특히 효과적일 수 있다는 것을 제시한다. 최고 발현이 말이집 줄기에서 관찰되었으나, 절편은 중간-주변부에서 망막의 전체 두께에 걸친 신경 망막 세포에 발현이 있었다는 것을 나타내었다.
(e) 원숭이에서의 맥락막상 주사
붉은털 원숭이에게 각각의 눈에 4.75 x1011GC의 AAV8.GFP를 함유한 50 μL의 맥락막상 주사가 주어졌으며 3 주 후에 한쪽 눈으로부터의 평면 표면고정 및 다른 눈으로부터의 냉동 안구 절편을 형광 현미경에 의해 시험하였다. 맥락막상 주사 후 3 주에 RPE/맥락막 평면 표면고정의 형광 현미경은 중간-주변부의 대략 1/3에 걸쳐 GFP의 강한 발현을 나타내었다.
평면 표면고정을 위해 사용된 3 개 눈은 매우 유사한 결과를 나타내었다. 맥락막상 주사 후 3 주에, 시신경 후방의 모든 경로의 주사의 사분면에서 RPE/맥락막 평면 표면고정의 고배율 시야 상에 나타난 GFP 발현이 있었다. 발현의 수준은 이질적이었으며(일부 RPE에서는 매우 높고, 다른 것들에서는 낮음), 래트에서 나타난 것과 유사하였다. 주사의 사분면에서 중간-주변부로부터의 RPE/맥락막 평면 표면고정은 일부 세포에서 강한 형광을 갖고 다른 것들에서는 거의 없는 이질적인 GFP 발현을 나타내었다(이는 RPE 세포의 육각형 형태를 또한 나타내는 고배율에서 더 잘 나타났음). 주사의 사분면에서 후방 망막으로부터의 RPE/맥락막 평면 표면고정은 덜 강하지만, 더욱 균일한 GFP 형광을 나타내었으며, 이는 형광에 의해 윤곽이 나타난 시신경(ON)의 거의 경계까지 연장되었다. 망막 평면 표면고정은 또한 시신경 후방의 모든 경로의 시신경으로부터 자유롭게 절단된 망막의 절단 모서리까지 후방으로 연장된 GFP 발현을 나타내었으며, 고배율에서 형광이 다층의 망막의 다양한 세포 내에 나타났다. 공막 평면 표면고정의 중간-주변부는 공막 섬유아세포 내에서 강한 형광을 나타내었고 모양체의 평면 표면고정은 방추형(spindle-shaped) 세포 내에서 강한 형광을 나타내었다. 모양체를 통한 절편은 섬모 과정을 포함하여 전체적으로 강한 형광을 나타내었다. 망막 절편은 맥락막으로부터 신경절 세포 및 신경 섬유층의 전체 두께에 걸친 모든 세포에서 강한 GFP 발현을 나타내었다. 중간-주변부 및 후방 망막으로부터의 안구 절편은 내망막 내의 망막 혈관 벽에서 강한 형광과 함께 망막의 외부로부터 내부 경계까지 모든 세포에서 강한 형광을 나타내었다. 시신경의 절편은 신경의 경계 주변의 피복 및 신경 다발을 분리하는 격막에서 GFP 발현을 나타내었다.
6.8.9 논의
눈은 유전자 전달을 위해 유리한 상대적으로 국한된 공간이며, 이는 적은 양의 벡터만이 필요하고 나머지 신체에 대한 노출이 제한되기 때문이다. 안구 유전자 전달을 위한 2 개의 주요 적용은 망막 변성 및 치료 단백질의 지속적인 발현을 야기하는 돌연변이 유전자의 치환이며, 상당한 진행이 이들 영역 각각에서 이루어졌다(Maguire et al., 2008, N. Eng. J. Med. 358 :2240-2248; Bainbridge et al., 2008, N. Eng. J. Med. 358: 2231-2239; Hauswirth et al., 2008, Hum. Gen. Ther. 19:979-990; MacLaren et al. , 2014, Lancet 383:1129-1137; Campochiaro et al., 2006, Hum. Gen. Ther. 17:167-176; Campochiaro et al., 2016, Hum. Gen. Ther. 28:99-111; Heier et al., 2017, The Lancet 389: 50-61). AAV 벡터는 안구 유전자 전달을 위해 가장 광범위하게 사용되는 벡터로서 알려졌으며 유리체내 주사 및 망막하 주사의 2 개의 전달 경로가 연구되었다. 유리체내 주사는 외래 진료소에서 이루어질 수 있으며 유리체 공동을 채운 모든 세포를 벡터에 노출시키지만, 망막에서의 발현은 중심와 및 편평부의 이행 상피 주변의 소집단의 신경절 세포에 제한된다. 이는 광수용기에서 유전자 치환을 위한 유리체내 전달을 불가능하게 하고 치료 단백질의 장기 발현을 위한 이의 용도를 심각하게 훼손한다. AAV 벡터의 망막하 주사는 주사에 의해 야기된 망막 박리 내의 RPE 및 광수용기에서 강한 전이유전자 발현을 야기한다. 이는 박리 영역 내의 광수용기 또는 RPE에서 돌연변이 유전자의 치환 능력을 제공하거나 전체 망막에 접속할 수 있는 가용성 치료 단백질을 강하게 발현한다. 벡터의 망막하 주사의 약점은 다음과 같다: 1) 이는 수술실에 가는 것 및 대부분의 환자에서 백내장을 유도하고 작은 %로 망막 박리에 의해 복잡해지는 유리체절제술을 수행하는 것을 필요로 하고, 2) 유전자 전달이 망막 박리의 경계를 이루는 망막 및 RPE의 상대적으로 적은 면적으로 제한되어, 유전자 치환을 위해 표적화될 대부분의 중요한 영역의 우선순위화를 필요로 하고 나머지 망막 및 RPE를 희생시키고, 3) 중심와가 최고 시각 잠재력을 갖기 때문에, 이는 유전자 치환에 대해 높은 우선권을 갖지만, 벡터의 망막하 주사로부터의 망막 박리에 의해 이미 훼손된 광수용기 및 RPE의 분리가 시력을 감소시키는 영구적 손상을 야기하여 곤경을 제공할 수 있다(Hauswirth et al., 2008, Hum. Gen. Ther. 19:979-990).
이 연구에서, AAV8 벡터-맥락막상 주사를 위한 새로운 전달 경로를 입증하였으며, 이는 다른 전달 경로에 비해 중요한 이점을 갖는다. 이는 유리체내 주사와 같은 외래환자 환경에서 이루어져, 수술실에 가는 불편함을 회피하지만, 더욱 중요하게는 유리체절제술을 동반하는 백내장 및 망막 박리의 위험을 회피할 수 있다. 이는 또한 중심 망막을 표적화하는 유전자 치환을 위한 망막하 주사의 주요 관심사인 중심와 내의 RPE로부터 광수용기를 분리하는 위험을 제거한다. 망막하 공간에서 벡터의 확산과 비교하면, 맥락막상 공간에서 더 많은 확산이 있어, RPE/맥락막 및 망막의 매우 큰 면적에 걸친 발현을 허용한다. GFP를 시각화하는 가장 민감한 방법인 망막 절편의 형광 현미경은 2.85 x1010 GC의 AAV8.GFP를 함유한 3 μL의 단일 맥락막상 주사 후 2 주에 적도에서 눈의 전체 원주를 둘러 연장된 발현을 나타내었다. 높은 수준의 GFP만이 RPE/맥락막 또는 망막 평면 표면고정의 형광 현미경에 의해 시각화될 수 있으며, 각각의 약 25-30%가 높은 발현을 나타내었다. 높은 GFP 발현의 면적은 일차 후 3 일에 이차 주사에 의해 증가되었다. 이는 AAV8 벡터의 다수의 맥락막상 주사를 사용하여 RPE/맥락막 및 망막의 대부분 또는 전부에 걸쳐 높은 수준의 발현을 달성하는 것을 가능하게 할 것이라는 것을 제시한다. 이는 눈의 4 개의 사분면 각각에서 맥락막상 주사를 수행하는 것, 안압이 각각의 주사 후 정상화되는 것을 기다리는 것 또는 전방 탭에 의한 정상화를 가속화하는 것에 의해 단일 임상 방문 동안 달성될 수 있다.
유전자 치환은 상대적으로 드문 유전된 망막 변성을 위해 잠재적으로 치유적인 치료이므로, 드문 병태를 갖는 환자를 위한 굉장한 잠재력을 갖는다. 치료 단백질의 유전자 전달은 일반적인 망막 및 맥락막 혈관 질환을 갖는 수백만의 환자의 관리를 혁신할 잠재력을 갖는다. 혈관 내피 성장 인자는 신혈관 연령-관련 황반 변성(NVAMD), 당뇨병성 황반부종(DME), 및 망막 정맥 폐쇄(RVO)에 대해 이차적인 황반 부종에서 결정적인 자극제이다(Campochiaro et al., 2016, Ophthalmology 123:S78-S88). 이들 병태 각각에서 최근의 접근법은 VEGF 중화 단백질의 유리체내 주사를 수행하는 것이며, 이는 혈관 누수를 감소시키고 시력을 개선하지만, 이들 질환은 만성적이며 대부분의 환자에서 빈번하고, 반복된 주사를 요구하는 VEGF의 지속적인 발현을 갖는다. 환자 및 의사에게는 많은 해에 걸쳐 최적의 주사 빈도를 유지하는 것이 어려워, 외부 임상 시험으로 치료된 NVAMD를 갖는 환자에서, 장기 시각 결과는 임상 시험에서 보고된 것에 비해 상당히 악화된다(HORIZON, SEVEN-UP, CATT 5 Year, Holz et al., 2015, Br. J. Ophthalmol. 99:220-226; Cohen et al., 2013, Retina 33:474-481; Finger et al., 2013, Acta Ophthalmol). VEGF-중화 단백질을 코딩하는 발현 구조체의 유전자 전달은 만성적으로 과잉-발현된 VEGF의 믿을 수 있고, 장기적인 억제를 제공하기 위한 양호한 전략을 제공한다. AAV2.sFLT01의 유리체내 주사의 효과를 시험하는 임상 시험은 최고 용량이 주어진 NVAMD를 갖는 AAV 항체가 없는 환자에서 검출가능한 발현을 나타내었으며 누수를 억제하여 일부 환자에서 항-VEGF 주사에 대한 필요성을 감소시켰으나, 대부분의 환자에서 안정성을 제공하기에 충분하였다(Heier et al., 2017, The Lancet 389: 50-61). 전임상 연구는 AAV8.항VEGFfab의 망막하 주사 후 VEGF(항VEGFfab)에 결합하는 항체 단편의 믿을 수 있는 높은 수준의 발현을 나타내었으며, 이는 NVAMD에 관련된 모델에서 인상적인 효능을 나타내었고(Liu et al., 2018, Mol. Ther. 26:542-549) 이는 최근에 임상 시험에서 시험되고 있다(ClinicalTrials.gov Identifier: NCT03066258). 이 연구에서, 2.85 x1010 GC의 AAV8.항VEGFfab를 함유한 3 μL의 망막하 주사와 비교하여, 동일한 양의 AAV8.항VEGFfab의 맥락막상 주사가 항VEGFfab의 유사한 발현 및 VEGF-유도된 혈관 누수의 유사한 억제를 제공하였음이 래트에서 입증되었다. 기존의 항-AAV 항체는 이들이 유리체내 전달로 이루어지는 것과 같이 AAV 벡터의 망막하 주사의 효능을 훼손하지 않는다. 이들 항체의 효과는 맥락막상에서 알려지지 않았다. AAV8.항VEGFfab의 맥락막상 주사는 항-AAV8 항체가 결여된 환자 중 망막 또는 맥락막 혈관 질환이 있는 환자에서 덜 침습적인 접근법으로서 고려될 수 있다.
유리체내 주사는, 맥락막상 주사와 같이, 상대적으로 비침습적이고 외래환자 환경에서 이루어질 수 있다. 감염 및 발현은 시험된 AAV2, AAV8, 또는 다른 야생형 AAV 벡터의 유리체내 주사 후에 제한되며, 이는 내경계막(ILM)이 물리적인 장벽을 제공하고 또한 AAV에 결합하기 때문이다. 온전한 ILM으로, 중심와 내의 세포만이 이 경로에 의해 형질도입될 수 있으나, 새로운 벡터는 ILM 차단을 피할 수 있다. ILM은 로덴트 내의 전체 망막에 걸쳐 얇아, AAV2의 유리체내 주사 후 망막 내로 깊게 연장된 망막 세포의 광범위한 면적을 감염시킨다. 그러나, ILM은 영장류에서 더욱 더 상당하고 AAV2.GFP의 유리체내 주사 후, GFP 발현은 중심와 주변 및 때로는 혈관을 따르는 신경절 세포로 제한된다(Pechan et al., 2009, Gen. Ther. 16:10-16). 유비퀴틴화와 관련된 표면 티로신 잔기가 페닐알라닌으로 치환된 돌연변이 AAV 벡터는 낮은 벡터 용량에서 벡터 변성 감소 및 전이유전자 발현 증가를 갖고, ILM을 침투하는 소량의 벡터의 효과성을 증가시킨다(Zhong et al., 2008, Proc. Natl. Acad. Sci. USA 105:7827-7832; Mowat et al., 2014, Gen. Ther. 21:96-105). 다양한 돌연변이 AAV 벡터 라이브러리 및 생체내 선택 프로토콜의 생성은 벡터의 확인을 야기하였으며, 이는 미래에 유용할 수 있는 영장류에서의 유리체내 주사 후 망막 세포의 더욱 광범위한 감염을 제공할 수 있다(Santiago-ORtiz et al., 2011, Gene Ther. 22:934-946). 벡터의 유리체내 주사의 적용을 확장하는 한편, 동시에 벡터의 맥락막상 주사를 탐구하도록 벡터를 계속 개선하여, 다양한 안구 질환에서 유전자 전달의 발생한 이득의 이점을 취하는 것이 중요하다.
6.9 실시예 18: 맥락막상 주사
환자는 신혈관(습성) 연령-관련 황반 변성(nAMD)을 나타낸다. 가용성 항-VEGF Fab 단백질(실시예 7에 기재됨)을 위한 코딩 서열을 보유한 복제 결함성 아데노-연관 바이러스 벡터 8(AAV8)을 맥락막상 약물 전달 장치(도 24에 나타냄)를 통해 환자의 눈 내의 맥락막상 공간에 투여한다. 환자는 OCT 상의 망막 두께, 시력 및 추가 주사에 대한 필요성과 같은 임상 평가에 의한 반응에 대해 투여 전, 그 동안, 및 그 후에 모니터링한다.
6.10 실시예 19: 맥락막상 공간을 통한 망막하 투여
환자는 신혈관(습성) 연령-관련 황반 변성(nAMD)을 나타낸다. 가용성 항-VEGF Fab 단백질(실시예 7에 기재됨)을 위한 코딩 서열을 보유한 복제 결함성 아데노-연관 바이러스 벡터 8(AAV8)을 소형 바늘이 망막하 공간 내로 주사되는, 후극을 향해 맥락막상 공간을 통해 삽입되고 뚫릴 수 있는 카테터를 포함하는 망막하 약물 전달 장치(도 25에 나타냄)의 사용에 의해 환자의 눈 내의 맥락막상 공간을 통해 환자의 눈 내의 망막하 공간에 투여한다. 환자는 OCT 상의 망막 두께, 시력 및 추가 주사에 대한 필요성과 같은 임상 평가에 의한 반응에 대해 투여 전, 그 동안, 및 그 후에 모니터링한다.
6.11 실시예 20: 후방 공막옆 데포 수술을 통한 주사
환자는 신혈관(습성) 연령-관련 황반 변성(nAMD)을 나타낸다. 가용성 항-VEGF Fab 단백질(실시예 7에 기재됨)을 위한 코딩 서열을 보유한 복제 결함성 아데노-연관 바이러스 벡터 8(AAV8)을 후방 공막옆 데포 수술(도 26에 나타냄)을 통해 환자의 눈 내의 공막 외면에 투여한다. 환자는 OCT 상의 망막 두께, 시력 및 추가 주사에 대한 필요성과 같은 임상 평가에 의한 반응에 대해 투여 전, 그 동안, 및 그 후에 모니터링한다.
균등물
본 발명이 그 구체적 실시양태에 관하여 상세히 기재되지만, 기능적으로 동등한 변형이 본 발명의 범위 이내임이 이해될 것이다. 사실상, 본원에서 나타나고 기재된 것에 더하여 다양한 본 발명의 변형이 전술한 설명과 첨부의 도면으로부터 당업자에게 자명할 것이다. 이러한 변형은 첨부의 청구범위의 범위 내에 속한다. 당업자는 일상적 실험을 이용하여 본원에 기재된 본 발명의 구체적 실시양태에 대한 많은 균등물을 인식하거나 확인할 수 있을 것이다. 이러한 균등물은 다음 청구범위에 의해 포함되는 것으로 의도된다.
본 명세서에서 언급된 모든 간행물, 특허 및 특허 출원은 각 개별 간행물, 특허 또는 특허 출원이 구체적으로 그리고 개별적으로 그 전체가 본원에 참고로 포함되는 것으로 나타난 것과 동일한 정도로 본 명세서 내에 참고로 포함된다.
SEQUENCE LISTING
<110> REGENXBIO Inc.
The Johns Hopkins University
<120> TREATMENT OF OCULAR DISEASES WITH FULLY-HUMAN
POST-TRANSLATIONALLY MODIFIED ANTI-VEGF Fab
<130> 12656-110-228
<140> TBA
<141>
<150> US 62/564,095
<151> 2017-09-27
<150> US 62/574,657
<151> 2017-10-19
<150> US 62/579,682
<151> 2017-10-31
<150> US 62/632,812
<151> 2018-02-20
<160> 51
<170> PatentIn version 3.5
<210> 1
<211> 214
<212> PRT
<213> Artificial Sequence
<220>
<223> Ranibizumab Fab Amino Acid Sequence - light chain
<400> 1
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Val Leu Ile
35 40 45
Tyr Phe Thr Ser Ser Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Thr Val Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 2
<211> 231
<212> PRT
<213> Artificial Sequence
<220>
<223> Ranibizumab Fab Amino Acid Sequence - heavy chain
<400> 2
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Asp Phe Thr His Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Ala Asp Phe
50 55 60
Lys Arg Arg Phe Thr Phe Ser Leu Asp Thr Ser Lys Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Tyr Pro Tyr Tyr Tyr Gly Thr Ser His Trp Tyr Phe Asp Val
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
195 200 205
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys
210 215 220
Ser Cys Asp Lys Thr His Leu
225 230
<210> 3
<211> 214
<212> PRT
<213> Artificial Sequence
<220>
<223> Bevacizumab Fab Amino Acid Sequence - Light chain
<400> 3
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Val Leu Ile
35 40 45
Tyr Phe Thr Ser Ser Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Thr Val Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 4
<211> 231
<212> PRT
<213> Artificial Sequence
<220>
<223> Bevacizumab Fab Amino Acid Sequence - Heavy chain
<400> 4
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Ala Asp Phe
50 55 60
Lys Arg Arg Phe Thr Phe Ser Leu Asp Thr Ser Lys Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Tyr Pro His Tyr Tyr Gly Ser Ser His Trp Tyr Phe Asp Val
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
195 200 205
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys
210 215 220
Ser Cys Asp Lys Thr His Leu
225 230
<210> 5
<211> 26
<212> PRT
<213> Artificial Sequence
<220>
<223> VEGF-A signal peptide
<400> 5
Met Asn Phe Leu Leu Ser Trp Val His Trp Ser Leu Ala Leu Leu Leu
1 5 10 15
Tyr Leu His His Ala Lys Trp Ser Gln Ala
20 25
<210> 6
<211> 29
<212> PRT
<213> Artificial Sequence
<220>
<223> Fibulin-1 signal peptide
<400> 6
Met Glu Arg Ala Ala Pro Ser Arg Arg Val Pro Leu Pro Leu Leu Leu
1 5 10 15
Leu Gly Gly Leu Ala Leu Leu Ala Ala Gly Val Asp Ala
20 25
<210> 7
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> Vitronectin signal peptide
<400> 7
Met Ala Pro Leu Arg Pro Leu Leu Ile Leu Ala Leu Leu Ala Trp Val
1 5 10 15
Ala Leu Ala
<210> 8
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Complement Factor H signal peptide
<400> 8
Met Arg Leu Leu Ala Lys Ile Ile Cys Leu Met Leu Trp Ala Ile Cys
1 5 10 15
Val Ala
<210> 9
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> Opticin signal peptide
<400> 9
Met Arg Leu Leu Ala Phe Leu Ser Leu Leu Ala Leu Val Leu Gln Glu
1 5 10 15
Thr Gly Thr
<210> 10
<211> 728
<212> DNA
<213> Artificial Sequence
<220>
<223> Bevacizumab cDNA - Light chain
<400> 10
gctagcgcca ccatgggctg gtcctgcatc atcctgttcc tggtggccac cgccaccggc 60
gtgcactccg acatccagat gacccagtcc ccctcctccc tgtccgcctc cgtgggcgac 120
cgggtgacca tcacctgctc cgcctcccag gacatctcca actacctgaa ctggtaccag 180
cagaagcccg gcaaggcccc caaggtgctg atctacttca cctcctccct gcactccggc 240
gtgccctccc ggttctccgg ctccggctcc ggcaccgact tcaccctgac catctcctcc 300
ctgcagcccg aggacttcgc cacctactac tgccagcagt actccaccgt gccctggacc 360
ttcggccagg gcaccaaggt ggagatcaag cggaccgtgg ccgccccctc cgtgttcatc 420
ttccccccct ccgacgagca gctgaagtcc ggcaccgcct ccgtggtgtg cctgctgaac 480
aacttctacc cccgggaggc caaggtgcag tggaaggtgg acaacgccct gcagtccggc 540
aactcccagg agtccgtgac cgagcaggac tccaaggact ccacctactc cctgtcctcc 600
accctgaccc tgtccaaggc cgactacgag aagcacaagg tgtacgcctg cgaggtgacc 660
caccagggcc tgtcctcccc cgtgaccaag tccttcaacc ggggcgagtg ctgagcggcc 720
gcctcgag 728
<210> 11
<211> 1440
<212> DNA
<213> Artificial Sequence
<220>
<223> Bevacizumab cDNA - heavy chain
<400> 11
gctagcgcca ccatgggctg gtcctgcatc atcctgttcc tggtggccac cgccaccggc 60
gtgcactccg aggtgcagct ggtggagtcc ggcggcggcc tggtgcagcc cggcggctcc 120
ctgcggctgt cctgcgccgc ctccggctac accttcacca actacggcat gaactgggtg 180
cggcaggccc ccggcaaggg cctggagtgg gtgggctgga tcaacaccta caccggcgag 240
cccacctacg ccgccgactt caagcggcgg ttcaccttct ccctggacac ctccaagtcc 300
accgcctacc tgcagatgaa ctccctgcgg gccgaggaca ccgccgtgta ctactgcgcc 360
aagtaccccc actactacgg ctcctcccac tggtacttcg acgtgtgggg ccagggcacc 420
ctggtgaccg tgtcctccgc ctccaccaag ggcccctccg tgttccccct ggccccctcc 480
tccaagtcca cctccggcgg caccgccgcc ctgggctgcc tggtgaagga ctacttcccc 540
gagcccgtga ccgtgtcctg gaactccggc gccctgacct ccggcgtgca caccttcccc 600
gccgtgctgc agtcctccgg cctgtactcc ctgtcctccg tggtgaccgt gccctcctcc 660
tccctgggca cccagaccta catctgcaac gtgaaccaca agccctccaa caccaaggtg 720
gacaagaagg tggagcccaa gtcctgcgac aagacccaca cctgcccccc ctgccccgcc 780
cccgagctgc tgggcggccc ctccgtgttc ctgttccccc ccaagcccaa ggacaccctg 840
atgatctccc ggacccccga ggtgacctgc gtggtggtgg acgtgtccca cgaggacccc 900
gaggtgaagt tcaactggta cgtggacggc gtggaggtgc acaacgccaa gaccaagccc 960
cgggaggagc agtacaactc cacctaccgg gtggtgtccg tgctgaccgt gctgcaccag 1020
gactggctga acggcaagga gtacaagtgc aaggtgtcca acaaggccct gcccgccccc 1080
atcgagaaga ccatctccaa ggccaagggc cagccccggg agccccaggt gtacaccctg 1140
cccccctccc gggaggagat gaccaagaac caggtgtccc tgacctgcct ggtgaagggc 1200
ttctacccct ccgacatcgc cgtggagtgg gagtccaacg gccagcccga gaacaactac 1260
aagaccaccc cccccgtgct ggactccgac ggctccttct tcctgtactc caagctgacc 1320
gtggacaagt cccggtggca gcagggcaac gtgttctcct gctccgtgat gcacgaggcc 1380
ctgcacaacc actacaccca gaagtccctg tccctgtccc ccggcaagtg agcggccgcc 1440
<210> 12
<211> 733
<212> DNA
<213> Artificial Sequence
<220>
<223> Ranibizumab cDNA (Light chain comprising a signal sequence)
<400> 12
gagctccatg gagtttttca aaaagacggc acttgccgca ctggttatgg gttttagtgg 60
tgcagcattg gccgatatcc agctgaccca gagcccgagc agcctgagcg caagcgttgg 120
tgatcgtgtt accattacct gtagcgcaag ccaggatatt agcaattatc tgaattggta 180
tcagcagaaa ccgggtaaag caccgaaagt tctgatttat tttaccagca gcctgcatag 240
cggtgttccg agccgtttta gcggtagcgg tagtggcacc gattttaccc tgaccattag 300
cagcctgcag ccggaagatt ttgcaaccta ttattgtcag cagtatagca ccgttccgtg 360
gacctttggt cagggcacca aagttgaaat taaacgtacc gttgcagcac cgagcgtttt 420
tatttttccg cctagtgatg aacagctgaa aagcggcacc gcaagcgttg tttgtctgct 480
gaataatttt tatccgcgtg aagcaaaagt gcagtggaaa gttgataatg cactgcagag 540
cggtaatagc caagaaagcg ttaccgaaca ggatagcaaa gatagcacct atagcctgag 600
cagcaccctg accctgagca aagcagatta tgaaaaacac aaagtgtatg cctgcgaagt 660
tacccatcag ggtctgagca gtccggttac caaaagtttt aatcgtggcg aatgctaata 720
gaagcttggt acc 733
<210> 13
<211> 779
<212> DNA
<213> Artificial Sequence
<220>
<223> Ranibizumab cDNA (Heavy chain comprising a signal sequence)
<400> 13
gagctcatat gaaatacctg ctgccgaccg ctgctgctgg tctgctgctc ctcgctgccc 60
agccggcgat ggccgaagtt cagctggttg aaagcggtgg tggtctggtt cagcctggtg 120
gtagcctgcg tctgagctgt gcagcaagcg gttatgattt tacccattat ggtatgaatt 180
gggttcgtca ggcaccgggt aaaggtctgg aatgggttgg ttggattaat acctataccg 240
gtgaaccgac ctatgcagca gattttaaac gtcgttttac ctttagcctg gataccagca 300
aaagcaccgc atatctgcag atgaatagcc tgcgtgcaga agataccgca gtttattatt 360
gtgccaaata tccgtattac tatggcacca gccactggta tttcgatgtt tggggtcagg 420
gcaccctggt taccgttagc agcgcaagca ccaaaggtcc gagcgttttt ccgctggcac 480
cgagcagcaa aagtaccagc ggtggcacag cagcactggg ttgtctggtt aaagattatt 540
ttccggaacc ggttaccgtg agctggaata gcggtgcact gaccagcggt gttcatacct 600
ttccggcagt tctgcagagc agcggtctgt atagcctgag cagcgttgtt accgttccga 660
gcagcagcct gggcacccag acctatattt gtaatgttaa tcataaaccg agcaatacca 720
aagtggataa aaaagttgag ccgaaaagct gcgataaaac ccatctgtaa tagggtacc 779
<210> 14
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Bevacizumab and Ranibizumab Light Chain CDR1
<400> 14
Ser Ala Ser Gln Asp Ile Ser Asn Tyr Leu Asn
1 5 10
<210> 15
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Bevacizumab and Ranibizumab Light Chain CDR2
<400> 15
Phe Thr Ser Ser Leu His Ser
1 5
<210> 16
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Bevacizumab and Ranibizumab Light Chain CDR3
<400> 16
Gln Gln Tyr Ser Thr Val Pro Trp Thr
1 5
<210> 17
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Bevacizumab Heavy Chain CDR1
<400> 17
Gly Tyr Thr Phe Thr Asn Tyr Gly Met Asn
1 5 10
<210> 18
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Bevacizumab Heavy Chain CDR2
<400> 18
Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Ala Asp Phe Lys
1 5 10 15
Arg
<210> 19
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> Bevacizumab Heavy Chain CDR3
<400> 19
Tyr Pro His Tyr Tyr Gly Ser Ser His Trp Tyr Phe Asp Val
1 5 10
<210> 20
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Ranibizumab Heavy Chain CDR1
<400> 20
Gly Tyr Asp Phe Thr His Tyr Gly Met Asn
1 5 10
<210> 21
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> Ranibizumab Heavy Chain CDR3
<400> 21
Tyr Pro Tyr Tyr Tyr Gly Thr Ser His Trp Tyr Phe Asp Val
1 5 10
<210> 22
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Albumin signal peptide
<400> 22
Met Lys Trp Val Thr Phe Ile Ser Leu Leu Phe Leu Phe Ser Ser Ala
1 5 10 15
Tyr Ser
<210> 23
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Chymotrypsinogen signal peptide
<400> 23
Met Ala Phe Leu Trp Leu Leu Ser Cys Trp Ala Leu Leu Gly Thr Thr
1 5 10 15
Phe Gly
<210> 24
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<223> Interleukin-2 signal peptide
<400> 24
Met Tyr Arg Met Gln Leu Leu Ser Cys Ile Ala Leu Ile Leu Ala Leu
1 5 10 15
Val Thr Asn Ser
20
<210> 25
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Trypsinogen-2 signal peptide
<400> 25
Met Asn Leu Leu Leu Ile Leu Thr Phe Val Ala Ala Ala Val Ala
1 5 10 15
<210> 26
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> F2A site
<400> 26
Leu Leu Asn Phe Asp Leu Leu Lys Leu Ala Gly Asp Val Glu Ser Asn
1 5 10 15
Pro Gly Pro
<210> 27
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Linker T2A
<400> 27
Gly Ser Gly Glu Gly Arg Gly Ser Leu Leu Thr Cys Gly Asp Val Glu
1 5 10 15
Glu Asn Pro Gly Pro
20
<210> 28
<211> 22
<212> PRT
<213> Artificial Sequence
<220>
<223> Linker P2A
<400> 28
Gly Ser Gly Ala Thr Asn Phe Ser Leu Leu Lys Gln Ala Gly Asp Val
1 5 10 15
Glu Glu Asn Pro Gly Pro
20
<210> 29
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> Linker E2A
<400> 29
Gly Ser Gly Gln Cys Thr Asn Tyr Ala Leu Leu Lys Leu Ala Gly Asp
1 5 10 15
Val Glu Ser Asn Pro Gly Pro
20
<210> 30
<211> 25
<212> PRT
<213> Artificial Sequence
<220>
<223> Linker F2A
<400> 30
Gly Ser Gly Val Lys Gln Thr Leu Asn Phe Asp Leu Leu Lys Leu Ala
1 5 10 15
Gly Asp Val Glu Ser Asn Pro Gly Pro
20 25
<210> 31
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<223> Furin linker
<400> 31
Arg Lys Arg Arg
1
<210> 32
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<223> Furin linker
<400> 32
Arg Arg Arg Arg
1
<210> 33
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<223> Furin linker
<400> 33
Arg Arg Lys Arg
1
<210> 34
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<223> Furin linker
<400> 34
Arg Lys Lys Arg
1
<210> 35
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<223> Furin linker
<220>
<221> MISC_FEATURE
<222> (2)..(2)
<223> X = any amino acid
<220>
<221> MISC_FEATURE
<222> (3)..(3)
<223> X = Lys or Arg
<400> 35
Arg Xaa Xaa Arg
1
<210> 36
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<223> Furin linker
<220>
<221> MISC_FEATURE
<222> (2)..(2)
<223> X = any amino acid
<400> 36
Arg Xaa Lys Arg
1
<210> 37
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<223> Furin linker
<220>
<221> MISC_FEATURE
<222> (2)..(2)
<223> X = any amino acid
<400> 37
Arg Xaa Arg Arg
1
<210> 38
<211> 215
<212> PRT
<213> Artificial Sequence
<220>
<223> Ranibizumab Fab Amino Acid Sequence - light chain
<400> 38
Met Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val
1 5 10 15
Gly Asp Arg Val Thr Ile Thr Cys Ser Ala Ser Gln Asp Ile Ser Asn
20 25 30
Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Val Leu
35 40 45
Ile Tyr Phe Thr Ser Ser Leu His Ser Gly Val Pro Ser Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln
65 70 75 80
Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Thr Val Pro
85 90 95
Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala
100 105 110
Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser
115 120 125
Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu
130 135 140
Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser
145 150 155 160
Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu
165 170 175
Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
180 185 190
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys
195 200 205
Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 39
<211> 236
<212> PRT
<213> Artificial Sequence
<220>
<223> Ranibizumab Fab Amino Acid Sequence - heavy chain
<400> 39
Met Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly
1 5 10 15
Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Asp Phe Thr His
20 25 30
Tyr Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp
35 40 45
Val Gly Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Ala Asp
50 55 60
Phe Lys Arg Arg Phe Thr Phe Ser Leu Asp Thr Ser Lys Ser Thr Ala
65 70 75 80
Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Lys Tyr Pro Tyr Tyr Tyr Gly Thr Ser His Trp Tyr Phe Asp
100 105 110
Val Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
115 120 125
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
130 135 140
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
145 150 155 160
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
165 170 175
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
180 185 190
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
195 200 205
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
210 215 220
Lys Ser Cys Asp Lys Thr His Leu Arg Lys Arg Arg
225 230 235
<210> 40
<211> 232
<212> PRT
<213> Artificial Sequence
<220>
<223> Ranibizumab Fab Amino Acid Sequence - heavy chain
<400> 40
Met Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly
1 5 10 15
Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Asp Phe Thr His
20 25 30
Tyr Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp
35 40 45
Val Gly Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Ala Asp
50 55 60
Phe Lys Arg Arg Phe Thr Phe Ser Leu Asp Thr Ser Lys Ser Thr Ala
65 70 75 80
Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Lys Tyr Pro Tyr Tyr Tyr Gly Thr Ser His Trp Tyr Phe Asp
100 105 110
Val Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
115 120 125
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
130 135 140
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
145 150 155 160
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
165 170 175
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
180 185 190
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
195 200 205
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
210 215 220
Lys Ser Cys Asp Lys Thr His Leu
225 230
<210> 41
<211> 736
<212> PRT
<213> Artificial Sequence
<220>
<223> AAV1
<400> 41
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Asp Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ala
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Thr Asn Asp Gly Val Thr Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Val Gln Val Phe Ser Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Thr Phe Ser Tyr Thr Phe
405 410 415
Glu Glu Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Asn Arg
435 440 445
Thr Gln Asn Gln Ser Gly Ser Ala Gln Asn Lys Asp Leu Leu Phe Ser
450 455 460
Arg Gly Ser Pro Ala Gly Met Ser Val Gln Pro Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Lys Thr Lys Thr Asp Asn
485 490 495
Asn Asn Ser Asn Phe Thr Trp Thr Gly Ala Ser Lys Tyr Asn Leu Asn
500 505 510
Gly Arg Glu Ser Ile Ile Asn Pro Gly Thr Ala Met Ala Ser His Lys
515 520 525
Asp Asp Glu Asp Lys Phe Phe Pro Met Ser Gly Val Met Ile Phe Gly
530 535 540
Lys Glu Ser Ala Gly Ala Ser Asn Thr Ala Leu Asp Asn Val Met Ile
545 550 555 560
Thr Asp Glu Glu Glu Ile Lys Ala Thr Asn Pro Val Ala Thr Glu Arg
565 570 575
Phe Gly Thr Val Ala Val Asn Phe Gln Ser Ser Ser Thr Asp Pro Ala
580 585 590
Thr Gly Asp Val His Ala Met Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asp Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly His Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys Asn Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asn Pro Pro Ala Glu Phe Ser Ala Thr Lys Phe Ala Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Val Gln Tyr Thr Ser Asn
690 695 700
Tyr Ala Lys Ser Ala Asn Val Asp Phe Thr Val Asp Asn Asn Gly Leu
705 710 715 720
Tyr Thr Glu Pro Arg Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 42
<211> 735
<212> PRT
<213> Artificial Sequence
<220>
<223> AAV2
<400> 42
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Thr Leu Ser
1 5 10 15
Glu Gly Ile Arg Gln Trp Trp Lys Leu Lys Pro Gly Pro Pro Pro Pro
20 25 30
Lys Pro Ala Glu Arg His Lys Asp Asp Ser Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Glu Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Arg Gln Leu Asp Ser Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Lys Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Pro Val Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu His Ser Pro Val Glu Pro Asp Ser Ser Ser Gly Thr Gly
145 150 155 160
Lys Ala Gly Gln Gln Pro Ala Arg Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ala Asp Ser Val Pro Asp Pro Gln Pro Leu Gly Gln Pro Pro
180 185 190
Ala Ala Pro Ser Gly Leu Gly Thr Asn Thr Met Ala Thr Gly Ser Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ser
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Met Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Gln Ser Gly Ala Ser Asn Asp Asn His Tyr
260 265 270
Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe His
275 280 285
Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn Trp
290 295 300
Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln Val
305 310 315 320
Lys Glu Val Thr Gln Asn Asp Gly Thr Thr Thr Ile Ala Asn Asn Leu
325 330 335
Thr Ser Thr Val Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro Tyr
340 345 350
Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala Asp
355 360 365
Val Phe Met Val Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly Ser
370 375 380
Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro Ser
385 390 395 400
Gln Met Leu Arg Thr Gly Asn Asn Phe Thr Phe Ser Tyr Thr Phe Glu
405 410 415
Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp Arg
420 425 430
Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg Thr
435 440 445
Asn Thr Pro Ser Gly Thr Thr Thr Gln Ser Arg Leu Gln Phe Ser Gln
450 455 460
Ala Gly Ala Ser Asp Ile Arg Asp Gln Ser Arg Asn Trp Leu Pro Gly
465 470 475 480
Pro Cys Tyr Arg Gln Gln Arg Val Ser Lys Thr Ser Ala Asp Asn Asn
485 490 495
Asn Ser Glu Tyr Ser Trp Thr Gly Ala Thr Lys Tyr His Leu Asn Gly
500 505 510
Arg Asp Ser Leu Val Asn Pro Gly Pro Ala Met Ala Ser His Lys Asp
515 520 525
Asp Glu Glu Lys Phe Phe Pro Gln Ser Gly Val Leu Ile Phe Gly Lys
530 535 540
Gln Gly Ser Glu Lys Thr Asn Val Asp Ile Glu Lys Val Met Ile Thr
545 550 555 560
Asp Glu Glu Glu Ile Arg Thr Thr Asn Pro Val Ala Thr Glu Gln Tyr
565 570 575
Gly Ser Val Ser Thr Asn Leu Gln Arg Gly Asn Arg Gln Ala Ala Thr
580 585 590
Ala Asp Val Asn Thr Gln Gly Val Leu Pro Gly Met Val Trp Gln Asp
595 600 605
Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His Thr
610 615 620
Asp Gly His Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu Lys
625 630 635 640
His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala Asn
645 650 655
Pro Ser Thr Thr Phe Ser Ala Ala Lys Phe Ala Ser Phe Ile Thr Gln
660 665 670
Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln Lys
675 680 685
Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn Tyr
690 695 700
Asn Lys Ser Val Asn Val Asp Phe Thr Val Asp Thr Asn Gly Val Tyr
705 710 715 720
Ser Glu Pro Arg Pro Ile Gly Thr Arg Tyr Leu Thr Arg Asn Leu
725 730 735
<210> 43
<211> 736
<212> PRT
<213> Artificial Sequence
<220>
<223> AAV3-3
<400> 43
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Val Pro Gln Pro
20 25 30
Lys Ala Asn Gln Gln His Gln Asp Asn Arg Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Gly Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Glu Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Ile Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Ala Ala Lys Thr Ala Pro Gly Lys Lys Gly
130 135 140
Ala Val Asp Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Val Gly
145 150 155 160
Lys Ser Gly Lys Gln Pro Ala Arg Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Ala Pro Thr Ser Leu Gly Ser Asn Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ser
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Gln Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Gln Ser Gly Ala Ser Asn Asp Asn His Tyr
260 265 270
Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe His
275 280 285
Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn Trp
290 295 300
Gly Phe Arg Pro Lys Lys Leu Ser Phe Lys Leu Phe Asn Ile Gln Val
305 310 315 320
Arg Gly Val Thr Gln Asn Asp Gly Thr Thr Thr Ile Ala Asn Asn Leu
325 330 335
Thr Ser Thr Val Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro Tyr
340 345 350
Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala Asp
355 360 365
Val Phe Met Val Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly Ser
370 375 380
Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro Ser
385 390 395 400
Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Ser Tyr Thr Phe Glu
405 410 415
Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp Arg
420 425 430
Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Asn Arg Thr
435 440 445
Gln Gly Thr Thr Ser Gly Thr Thr Asn Gln Ser Arg Leu Leu Phe Ser
450 455 460
Gln Ala Gly Pro Gln Ser Met Ser Leu Gln Ala Arg Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Leu Ser Lys Thr Ala Asn Asp Asn
485 490 495
Asn Asn Ser Asn Phe Pro Trp Thr Ala Ala Ser Lys Tyr His Leu Asn
500 505 510
Gly Arg Asp Ser Leu Val Asn Pro Gly Pro Ala Met Ala Ser His Lys
515 520 525
Asp Asp Glu Glu Lys Phe Phe Pro Met His Gly Asn Leu Ile Phe Gly
530 535 540
Lys Glu Gly Thr Thr Ala Ser Asn Ala Glu Leu Asp Asn Val Met Ile
545 550 555 560
Thr Asp Glu Glu Glu Ile Arg Thr Thr Asn Pro Val Ala Thr Glu Gln
565 570 575
Tyr Gly Thr Val Ala Asn Asn Leu Gln Ser Ser Asn Thr Ala Pro Thr
580 585 590
Thr Gly Thr Val Asn His Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asp Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly His Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Met Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asn Pro Pro Thr Thr Phe Ser Pro Ala Lys Phe Ala Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Asn Lys Ser Val Asn Val Asp Phe Thr Val Asp Thr Asn Gly Val
705 710 715 720
Tyr Ser Glu Pro Arg Pro Ile Gly Thr Arg Tyr Leu Thr Arg Asn Leu
725 730 735
<210> 44
<211> 734
<212> PRT
<213> Artificial Sequence
<220>
<223> AAV4-4
<400> 44
Met Thr Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser Glu
1 5 10 15
Gly Val Arg Glu Trp Trp Ala Leu Gln Pro Gly Ala Pro Lys Pro Lys
20 25 30
Ala Asn Gln Gln His Gln Asp Asn Ala Arg Gly Leu Val Leu Pro Gly
35 40 45
Tyr Lys Tyr Leu Gly Pro Gly Asn Gly Leu Asp Lys Gly Glu Pro Val
50 55 60
Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp Gln
65 70 75 80
Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala Asp
85 90 95
Ala Glu Phe Gln Gln Arg Leu Gln Gly Asp Thr Ser Phe Gly Gly Asn
100 105 110
Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro Leu
115 120 125
Gly Leu Val Glu Gln Ala Gly Glu Thr Ala Pro Gly Lys Lys Arg Pro
130 135 140
Leu Ile Glu Ser Pro Gln Gln Pro Asp Ser Ser Thr Gly Ile Gly Lys
145 150 155 160
Lys Gly Lys Gln Pro Ala Lys Lys Lys Leu Val Phe Glu Asp Glu Thr
165 170 175
Gly Ala Gly Asp Gly Pro Pro Glu Gly Ser Thr Ser Gly Ala Met Ser
180 185 190
Asp Asp Ser Glu Met Arg Ala Ala Ala Gly Gly Ala Ala Val Glu Gly
195 200 205
Gly Gln Gly Ala Asp Gly Val Gly Asn Ala Ser Gly Asp Trp His Cys
210 215 220
Asp Ser Thr Trp Ser Glu Gly His Val Thr Thr Thr Ser Thr Arg Thr
225 230 235 240
Trp Val Leu Pro Thr Tyr Asn Asn His Leu Tyr Lys Arg Leu Gly Glu
245 250 255
Ser Leu Gln Ser Asn Thr Tyr Asn Gly Phe Ser Thr Pro Trp Gly Tyr
260 265 270
Phe Asp Phe Asn Arg Phe His Cys His Phe Ser Pro Arg Asp Trp Gln
275 280 285
Arg Leu Ile Asn Asn Asn Trp Gly Met Arg Pro Lys Ala Met Arg Val
290 295 300
Lys Ile Phe Asn Ile Gln Val Lys Glu Val Thr Thr Ser Asn Gly Glu
305 310 315 320
Thr Thr Val Ala Asn Asn Leu Thr Ser Thr Val Gln Ile Phe Ala Asp
325 330 335
Ser Ser Tyr Glu Leu Pro Tyr Val Met Asp Ala Gly Gln Glu Gly Ser
340 345 350
Leu Pro Pro Phe Pro Asn Asp Val Phe Met Val Pro Gln Tyr Gly Tyr
355 360 365
Cys Gly Leu Val Thr Gly Asn Thr Ser Gln Gln Gln Thr Asp Arg Asn
370 375 380
Ala Phe Tyr Cys Leu Glu Tyr Phe Pro Ser Gln Met Leu Arg Thr Gly
385 390 395 400
Asn Asn Phe Glu Ile Thr Tyr Ser Phe Glu Lys Val Pro Phe His Ser
405 410 415
Met Tyr Ala His Ser Gln Ser Leu Asp Arg Leu Met Asn Pro Leu Ile
420 425 430
Asp Gln Tyr Leu Trp Gly Leu Gln Ser Thr Thr Thr Gly Thr Thr Leu
435 440 445
Asn Ala Gly Thr Ala Thr Thr Asn Phe Thr Lys Leu Arg Pro Thr Asn
450 455 460
Phe Ser Asn Phe Lys Lys Asn Trp Leu Pro Gly Pro Ser Ile Lys Gln
465 470 475 480
Gln Gly Phe Ser Lys Thr Ala Asn Gln Asn Tyr Lys Ile Pro Ala Thr
485 490 495
Gly Ser Asp Ser Leu Ile Lys Tyr Glu Thr His Ser Thr Leu Asp Gly
500 505 510
Arg Trp Ser Ala Leu Thr Pro Gly Pro Pro Met Ala Thr Ala Gly Pro
515 520 525
Ala Asp Ser Lys Phe Ser Asn Ser Gln Leu Ile Phe Ala Gly Pro Lys
530 535 540
Gln Asn Gly Asn Thr Ala Thr Val Pro Gly Thr Leu Ile Phe Thr Ser
545 550 555 560
Glu Glu Glu Leu Ala Ala Thr Asn Ala Thr Asp Thr Asp Met Trp Gly
565 570 575
Asn Leu Pro Gly Gly Asp Gln Ser Asn Ser Asn Leu Pro Thr Val Asp
580 585 590
Arg Leu Thr Ala Leu Gly Ala Val Pro Gly Met Val Trp Gln Asn Arg
595 600 605
Asp Ile Tyr Tyr Gln Gly Pro Ile Trp Ala Lys Ile Pro His Thr Asp
610 615 620
Gly His Phe His Pro Ser Pro Leu Ile Gly Gly Phe Gly Leu Lys His
625 630 635 640
Pro Pro Pro Gln Ile Phe Ile Lys Asn Thr Pro Val Pro Ala Asn Pro
645 650 655
Ala Thr Thr Phe Ser Ser Thr Pro Val Asn Ser Phe Ile Thr Gln Tyr
660 665 670
Ser Thr Gly Gln Val Ser Val Gln Ile Asp Trp Glu Ile Gln Lys Glu
675 680 685
Arg Ser Lys Arg Trp Asn Pro Glu Val Gln Phe Thr Ser Asn Tyr Gly
690 695 700
Gln Gln Asn Ser Leu Leu Trp Ala Pro Asp Ala Ala Gly Lys Tyr Thr
705 710 715 720
Glu Pro Arg Ala Ile Gly Thr Arg Tyr Leu Thr His His Leu
725 730
<210> 45
<211> 724
<212> PRT
<213> Artificial Sequence
<220>
<223> AAV5
<400> 45
Met Ser Phe Val Asp His Pro Pro Asp Trp Leu Glu Glu Val Gly Glu
1 5 10 15
Gly Leu Arg Glu Phe Leu Gly Leu Glu Ala Gly Pro Pro Lys Pro Lys
20 25 30
Pro Asn Gln Gln His Gln Asp Gln Ala Arg Gly Leu Val Leu Pro Gly
35 40 45
Tyr Asn Tyr Leu Gly Pro Gly Asn Gly Leu Asp Arg Gly Glu Pro Val
50 55 60
Asn Arg Ala Asp Glu Val Ala Arg Glu His Asp Ile Ser Tyr Asn Glu
65 70 75 80
Gln Leu Glu Ala Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala Asp
85 90 95
Ala Glu Phe Gln Glu Lys Leu Ala Asp Asp Thr Ser Phe Gly Gly Asn
100 105 110
Leu Gly Lys Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro Phe
115 120 125
Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Thr Gly Lys Arg Ile
130 135 140
Asp Asp His Phe Pro Lys Arg Lys Lys Ala Arg Thr Glu Glu Asp Ser
145 150 155 160
Lys Pro Ser Thr Ser Ser Asp Ala Glu Ala Gly Pro Ser Gly Ser Gln
165 170 175
Gln Leu Gln Ile Pro Ala Gln Pro Ala Ser Ser Leu Gly Ala Asp Thr
180 185 190
Met Ser Ala Gly Gly Gly Gly Pro Leu Gly Asp Asn Asn Gln Gly Ala
195 200 205
Asp Gly Val Gly Asn Ala Ser Gly Asp Trp His Cys Asp Ser Thr Trp
210 215 220
Met Gly Asp Arg Val Val Thr Lys Ser Thr Arg Thr Trp Val Leu Pro
225 230 235 240
Ser Tyr Asn Asn His Gln Tyr Arg Glu Ile Lys Ser Gly Ser Val Asp
245 250 255
Gly Ser Asn Ala Asn Ala Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr
260 265 270
Phe Asp Phe Asn Arg Phe His Ser His Trp Ser Pro Arg Asp Trp Gln
275 280 285
Arg Leu Ile Asn Asn Tyr Trp Gly Phe Arg Pro Arg Ser Leu Arg Val
290 295 300
Lys Ile Phe Asn Ile Gln Val Lys Glu Val Thr Val Gln Asp Ser Thr
305 310 315 320
Thr Thr Ile Ala Asn Asn Leu Thr Ser Thr Val Gln Val Phe Thr Asp
325 330 335
Asp Asp Tyr Gln Leu Pro Tyr Val Val Gly Asn Gly Thr Glu Gly Cys
340 345 350
Leu Pro Ala Phe Pro Pro Gln Val Phe Thr Leu Pro Gln Tyr Gly Tyr
355 360 365
Ala Thr Leu Asn Arg Asp Asn Thr Glu Asn Pro Thr Glu Arg Ser Ser
370 375 380
Phe Phe Cys Leu Glu Tyr Phe Pro Ser Lys Met Leu Arg Thr Gly Asn
385 390 395 400
Asn Phe Glu Phe Thr Tyr Asn Phe Glu Glu Val Pro Phe His Ser Ser
405 410 415
Phe Ala Pro Ser Gln Asn Leu Phe Lys Leu Ala Asn Pro Leu Val Asp
420 425 430
Gln Tyr Leu Tyr Arg Phe Val Ser Thr Asn Asn Thr Gly Gly Val Gln
435 440 445
Phe Asn Lys Asn Leu Ala Gly Arg Tyr Ala Asn Thr Tyr Lys Asn Trp
450 455 460
Phe Pro Gly Pro Met Gly Arg Thr Gln Gly Trp Asn Leu Gly Ser Gly
465 470 475 480
Val Asn Arg Ala Ser Val Ser Ala Phe Ala Thr Thr Asn Arg Met Glu
485 490 495
Leu Glu Gly Ala Ser Tyr Gln Val Pro Pro Gln Pro Asn Gly Met Thr
500 505 510
Asn Asn Leu Gln Gly Ser Asn Thr Tyr Ala Leu Glu Asn Thr Met Ile
515 520 525
Phe Asn Ser Gln Pro Ala Asn Pro Gly Thr Thr Ala Thr Tyr Leu Glu
530 535 540
Gly Asn Met Leu Ile Thr Ser Glu Ser Glu Thr Gln Pro Val Asn Arg
545 550 555 560
Val Ala Tyr Asn Val Gly Gly Gln Met Ala Thr Asn Asn Gln Ser Ser
565 570 575
Thr Thr Ala Pro Ala Thr Gly Thr Tyr Asn Leu Gln Glu Ile Val Pro
580 585 590
Gly Ser Val Trp Met Glu Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp
595 600 605
Ala Lys Ile Pro Glu Thr Gly Ala His Phe His Pro Ser Pro Ala Met
610 615 620
Gly Gly Phe Gly Leu Lys His Pro Pro Pro Met Met Leu Ile Lys Asn
625 630 635 640
Thr Pro Val Pro Gly Asn Ile Thr Ser Phe Ser Asp Val Pro Val Ser
645 650 655
Ser Phe Ile Thr Gln Tyr Ser Thr Gly Gln Val Thr Val Glu Met Glu
660 665 670
Trp Glu Leu Lys Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln
675 680 685
Tyr Thr Asn Asn Tyr Asn Asp Pro Gln Phe Val Asp Phe Ala Pro Asp
690 695 700
Ser Thr Gly Glu Tyr Arg Thr Thr Arg Pro Ile Gly Thr Arg Tyr Leu
705 710 715 720
Thr Arg Pro Leu
<210> 46
<211> 736
<212> PRT
<213> Artificial Sequence
<220>
<223> AAV6
<400> 46
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Asp Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Phe Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ala
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Thr Asn Asp Gly Val Thr Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Val Gln Val Phe Ser Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Thr Phe Ser Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Asn Arg
435 440 445
Thr Gln Asn Gln Ser Gly Ser Ala Gln Asn Lys Asp Leu Leu Phe Ser
450 455 460
Arg Gly Ser Pro Ala Gly Met Ser Val Gln Pro Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Lys Thr Lys Thr Asp Asn
485 490 495
Asn Asn Ser Asn Phe Thr Trp Thr Gly Ala Ser Lys Tyr Asn Leu Asn
500 505 510
Gly Arg Glu Ser Ile Ile Asn Pro Gly Thr Ala Met Ala Ser His Lys
515 520 525
Asp Asp Lys Asp Lys Phe Phe Pro Met Ser Gly Val Met Ile Phe Gly
530 535 540
Lys Glu Ser Ala Gly Ala Ser Asn Thr Ala Leu Asp Asn Val Met Ile
545 550 555 560
Thr Asp Glu Glu Glu Ile Lys Ala Thr Asn Pro Val Ala Thr Glu Arg
565 570 575
Phe Gly Thr Val Ala Val Asn Leu Gln Ser Ser Ser Thr Asp Pro Ala
580 585 590
Thr Gly Asp Val His Val Met Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asp Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly His Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asn Pro Pro Ala Glu Phe Ser Ala Thr Lys Phe Ala Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Val Gln Tyr Thr Ser Asn
690 695 700
Tyr Ala Lys Ser Ala Asn Val Asp Phe Thr Val Asp Asn Asn Gly Leu
705 710 715 720
Tyr Thr Glu Pro Arg Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 47
<211> 737
<212> PRT
<213> Artificial Sequence
<220>
<223> AAV7
<400> 47
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Asp Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asn Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Ala Lys Lys Arg
130 135 140
Pro Val Glu Pro Ser Pro Gln Arg Ser Pro Asp Ser Ser Thr Gly Ile
145 150 155 160
Gly Lys Lys Gly Gln Gln Pro Ala Arg Lys Arg Leu Asn Phe Gly Gln
165 170 175
Thr Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro
180 185 190
Pro Ala Ala Pro Ser Ser Val Gly Ser Gly Thr Val Ala Ala Gly Gly
195 200 205
Gly Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn
210 215 220
Ala Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val
225 230 235 240
Ile Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His
245 250 255
Leu Tyr Lys Gln Ile Ser Ser Glu Thr Ala Gly Ser Thr Asn Asp Asn
260 265 270
Thr Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg
275 280 285
Phe His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn
290 295 300
Asn Trp Gly Phe Arg Pro Lys Lys Leu Arg Phe Lys Leu Phe Asn Ile
305 310 315 320
Gln Val Lys Glu Val Thr Thr Asn Asp Gly Val Thr Thr Ile Ala Asn
325 330 335
Asn Leu Thr Ser Thr Ile Gln Val Phe Ser Asp Ser Glu Tyr Gln Leu
340 345 350
Pro Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro
355 360 365
Ala Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn
370 375 380
Gly Ser Gln Ser Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe
385 390 395 400
Pro Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Glu Phe Ser Tyr Ser
405 410 415
Phe Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu
420 425 430
Asp Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ala
435 440 445
Arg Thr Gln Ser Asn Pro Gly Gly Thr Ala Gly Asn Arg Glu Leu Gln
450 455 460
Phe Tyr Gln Gly Gly Pro Ser Thr Met Ala Glu Gln Ala Lys Asn Trp
465 470 475 480
Leu Pro Gly Pro Cys Phe Arg Gln Gln Arg Val Ser Lys Thr Leu Asp
485 490 495
Gln Asn Asn Asn Ser Asn Phe Ala Trp Thr Gly Ala Thr Lys Tyr His
500 505 510
Leu Asn Gly Arg Asn Ser Leu Val Asn Pro Gly Val Ala Met Ala Thr
515 520 525
His Lys Asp Asp Glu Asp Arg Phe Phe Pro Ser Ser Gly Val Leu Ile
530 535 540
Phe Gly Lys Thr Gly Ala Thr Asn Lys Thr Thr Leu Glu Asn Val Leu
545 550 555 560
Met Thr Asn Glu Glu Glu Ile Arg Pro Thr Asn Pro Val Ala Thr Glu
565 570 575
Glu Tyr Gly Ile Val Ser Ser Asn Leu Gln Ala Ala Asn Thr Ala Ala
580 585 590
Gln Thr Gln Val Val Asn Asn Gln Gly Ala Leu Pro Gly Met Val Trp
595 600 605
Gln Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro
610 615 620
His Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly
625 630 635 640
Leu Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro
645 650 655
Ala Asn Pro Pro Glu Val Phe Thr Pro Ala Lys Phe Ala Ser Phe Ile
660 665 670
Thr Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu
675 680 685
Gln Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser
690 695 700
Asn Phe Glu Lys Gln Thr Gly Val Asp Phe Ala Val Asp Ser Gln Gly
705 710 715 720
Val Tyr Ser Glu Pro Arg Pro Ile Gly Thr Arg Tyr Leu Thr Arg Asn
725 730 735
Leu
<210> 48
<211> 738
<212> PRT
<213> Artificial Sequence
<220>
<223> AAV8
<400> 48
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Gln Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Pro Ser Pro Gln Arg Ser Pro Asp Ser Ser Thr Gly Ile
145 150 155 160
Gly Lys Lys Gly Gln Gln Pro Ala Arg Lys Arg Leu Asn Phe Gly Gln
165 170 175
Thr Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro
180 185 190
Pro Ala Ala Pro Ser Gly Val Gly Pro Asn Thr Met Ala Ala Gly Gly
195 200 205
Gly Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser
210 215 220
Ser Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val
225 230 235 240
Ile Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His
245 250 255
Leu Tyr Lys Gln Ile Ser Asn Gly Thr Ser Gly Gly Ala Thr Asn Asp
260 265 270
Asn Thr Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn
275 280 285
Arg Phe His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn
290 295 300
Asn Asn Trp Gly Phe Arg Pro Lys Arg Leu Ser Phe Lys Leu Phe Asn
305 310 315 320
Ile Gln Val Lys Glu Val Thr Gln Asn Glu Gly Thr Lys Thr Ile Ala
325 330 335
Asn Asn Leu Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln
340 345 350
Leu Pro Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe
355 360 365
Pro Ala Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn
370 375 380
Asn Gly Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr
385 390 395 400
Phe Pro Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr
405 410 415
Thr Phe Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser
420 425 430
Leu Asp Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu
435 440 445
Ser Arg Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly
450 455 460
Phe Ser Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp
465 470 475 480
Leu Pro Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly
485 490 495
Gln Asn Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His
500 505 510
Leu Asn Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr
515 520 525
His Lys Asp Asp Glu Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile
530 535 540
Phe Gly Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val
545 550 555 560
Met Leu Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr
565 570 575
Glu Glu Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala
580 585 590
Pro Gln Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val
595 600 605
Trp Gln Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile
610 615 620
Pro His Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe
625 630 635 640
Gly Leu Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val
645 650 655
Pro Ala Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe
660 665 670
Ile Thr Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu
675 680 685
Leu Gln Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr
690 695 700
Ser Asn Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu
705 710 715 720
Gly Val Tyr Ser Glu Pro Arg Pro Ile Gly Thr Arg Tyr Leu Thr Arg
725 730 735
Asn Leu
<210> 49
<211> 736
<212> PRT
<213> Artificial Sequence
<220>
<223> hu31
<400> 49
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Thr Leu Ser
1 5 10 15
Glu Gly Ile Arg Gln Trp Trp Lys Leu Lys Pro Gly Pro Pro Pro Pro
20 25 30
Lys Pro Ala Glu Arg His Lys Asp Asp Ser Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Gly Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Lys Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Leu Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Ala Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ala Gly Ile Gly
145 150 155 160
Lys Ser Gly Ser Gln Pro Ala Lys Lys Lys Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Thr Glu Ser Val Pro Asp Pro Gln Pro Ile Gly Glu Pro Pro
180 185 190
Ala Ala Pro Ser Gly Val Gly Ser Leu Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Val Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser Ser
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Gln Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Asn Ser Thr Ser Gly Gly Ser Ser Asn Asp Asn
260 265 270
Ala Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg
275 280 285
Phe His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn
290 295 300
Asn Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile
305 310 315 320
Gln Val Lys Glu Val Thr Asp Asn Asn Gly Val Lys Thr Ile Ala Asn
325 330 335
Asn Leu Thr Ser Thr Val Gln Val Phe Thr Asp Ser Asp Tyr Gln Leu
340 345 350
Pro Tyr Val Leu Gly Ser Ala His Glu Gly Cys Leu Pro Pro Phe Pro
355 360 365
Ala Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asp
370 375 380
Gly Gly Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe
385 390 395 400
Pro Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Ser Tyr Glu
405 410 415
Phe Glu Asn Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu
420 425 430
Asp Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser
435 440 445
Lys Thr Ile Asn Gly Ser Gly Gln Asn Gln Gln Thr Leu Lys Phe Ser
450 455 460
Val Ala Gly Pro Ser Asn Met Ala Val Gln Gly Arg Asn Tyr Ile Pro
465 470 475 480
Gly Pro Ser Tyr Arg Gln Gln Arg Val Ser Thr Thr Val Thr Gln Asn
485 490 495
Asn Asn Ser Glu Phe Ala Trp Pro Gly Ala Ser Ser Trp Ala Leu Asn
500 505 510
Gly Arg Asn Ser Leu Met Asn Pro Gly Pro Ala Met Ala Ser His Lys
515 520 525
Glu Gly Glu Asp Arg Phe Phe Pro Leu Ser Gly Ser Leu Ile Phe Gly
530 535 540
Lys Gln Gly Thr Gly Arg Asp Asn Val Asp Ala Asp Lys Val Met Ile
545 550 555 560
Thr Asn Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Ser
565 570 575
Tyr Gly Gln Val Ala Thr Asn His Gln Ser Ala Gln Ala Gln Ala Gln
580 585 590
Thr Gly Trp Val Gln Asn Gln Gly Ile Leu Pro Gly Met Val Trp Gln
595 600 605
Asp Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Met
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Ala Phe Asn Lys Asp Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Asn Asn Val Glu Phe Ala Val Ser Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro Arg Pro Ile Gly Thr Arg Tyr Leu Thr Arg Asn Leu
725 730 735
<210> 50
<211> 736
<212> PRT
<213> Artificial Sequence
<220>
<223> hu32
<400> 50
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Thr Leu Ser
1 5 10 15
Glu Gly Ile Arg Gln Trp Trp Lys Leu Lys Pro Gly Pro Pro Pro Pro
20 25 30
Lys Pro Ala Glu Arg His Lys Asp Asp Ser Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Gly Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Lys Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Leu Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Ala Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ala Gly Ile Gly
145 150 155 160
Lys Ser Gly Ser Gln Pro Ala Lys Lys Lys Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Thr Glu Ser Val Pro Asp Pro Gln Pro Ile Gly Glu Pro Pro
180 185 190
Ala Ala Pro Ser Gly Val Gly Ser Leu Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Val Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser Ser
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Gln Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Asn Ser Thr Ser Gly Gly Ser Ser Asn Asp Asn
260 265 270
Ala Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg
275 280 285
Phe His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn
290 295 300
Asn Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile
305 310 315 320
Gln Val Lys Glu Val Thr Asp Asn Asn Gly Val Lys Thr Ile Ala Asn
325 330 335
Asn Leu Thr Ser Thr Val Gln Val Phe Thr Asp Ser Asp Tyr Gln Leu
340 345 350
Pro Tyr Val Leu Gly Ser Ala His Glu Gly Cys Leu Pro Pro Phe Pro
355 360 365
Ala Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asp
370 375 380
Gly Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe
385 390 395 400
Pro Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Ser Tyr Glu
405 410 415
Phe Glu Asn Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu
420 425 430
Asp Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser
435 440 445
Lys Thr Ile Asn Gly Ser Gly Gln Asn Gln Gln Thr Leu Lys Phe Ser
450 455 460
Val Ala Gly Pro Ser Asn Met Ala Val Gln Gly Arg Asn Tyr Ile Pro
465 470 475 480
Gly Pro Ser Tyr Arg Gln Gln Arg Val Ser Thr Thr Val Thr Gln Asn
485 490 495
Asn Asn Ser Glu Phe Ala Trp Pro Gly Ala Ser Ser Trp Ala Leu Asn
500 505 510
Gly Arg Asn Ser Leu Met Asn Pro Gly Pro Ala Met Ala Ser His Lys
515 520 525
Glu Gly Glu Asp Arg Phe Phe Pro Leu Ser Gly Ser Leu Ile Phe Gly
530 535 540
Lys Gln Gly Thr Gly Arg Asp Asn Val Asp Ala Asp Lys Val Met Ile
545 550 555 560
Thr Asn Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Ser
565 570 575
Tyr Gly Gln Val Ala Thr Asn His Gln Ser Ala Gln Ala Gln Ala Gln
580 585 590
Thr Gly Trp Val Gln Asn Gln Gly Ile Leu Pro Gly Met Val Trp Gln
595 600 605
Asp Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Met
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Ala Phe Asn Lys Asp Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Asn Asn Val Glu Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro Arg Pro Ile Gly Thr Arg Tyr Leu Thr Arg Asn Leu
725 730 735
<210> 51
<211> 736
<212> PRT
<213> Artificial Sequence
<220>
<223> AAV9
<400> 51
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Gln Pro
20 25 30
Lys Ala Asn Gln Gln His Gln Asp Asn Ala Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Gly Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Lys Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Leu Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Ala Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ala Gly Ile Gly
145 150 155 160
Lys Ser Gly Ala Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Thr Glu Ser Val Pro Asp Pro Gln Pro Ile Gly Glu Pro Pro
180 185 190
Ala Ala Pro Ser Gly Val Gly Ser Leu Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Val Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser Ser
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Gln Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Asn Ser Thr Ser Gly Gly Ser Ser Asn Asp Asn
260 265 270
Ala Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg
275 280 285
Phe His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn
290 295 300
Asn Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile
305 310 315 320
Gln Val Lys Glu Val Thr Asp Asn Asn Gly Val Lys Thr Ile Ala Asn
325 330 335
Asn Leu Thr Ser Thr Val Gln Val Phe Thr Asp Ser Asp Tyr Gln Leu
340 345 350
Pro Tyr Val Leu Gly Ser Ala His Glu Gly Cys Leu Pro Pro Phe Pro
355 360 365
Ala Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asp
370 375 380
Gly Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe
385 390 395 400
Pro Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Ser Tyr Glu
405 410 415
Phe Glu Asn Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu
420 425 430
Asp Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser
435 440 445
Lys Thr Ile Asn Gly Ser Gly Gln Asn Gln Gln Thr Leu Lys Phe Ser
450 455 460
Val Ala Gly Pro Ser Asn Met Ala Val Gln Gly Arg Asn Tyr Ile Pro
465 470 475 480
Gly Pro Ser Tyr Arg Gln Gln Arg Val Ser Thr Thr Val Thr Gln Asn
485 490 495
Asn Asn Ser Glu Phe Ala Trp Pro Gly Ala Ser Ser Trp Ala Leu Asn
500 505 510
Gly Arg Asn Ser Leu Met Asn Pro Gly Pro Ala Met Ala Ser His Lys
515 520 525
Glu Gly Glu Asp Arg Phe Phe Pro Leu Ser Gly Ser Leu Ile Phe Gly
530 535 540
Lys Gln Gly Thr Gly Arg Asp Asn Val Asp Ala Asp Lys Val Met Ile
545 550 555 560
Thr Asn Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Ser
565 570 575
Tyr Gly Gln Val Ala Thr Asn His Gln Ser Ala Gln Ala Gln Ala Gln
580 585 590
Thr Gly Trp Val Gln Asn Gln Gly Ile Leu Pro Gly Met Val Trp Gln
595 600 605
Asp Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Met
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Ala Phe Asn Lys Asp Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Asn Asn Val Glu Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro Arg Pro Ile Gly Thr Arg Tyr Leu Thr Arg Asn Leu
725 730 735
Claims (31)
- 항-인간 혈관 내피 성장 인자(anti-human vascular endothelial growth factor)(hVEGF) 항체를 코딩하는 발현 벡터를 인간 대상체의 눈 내의 맥락막상 공간에 투여하는 것을 포함하는, 신혈관 연령-관련 황반 변성(neovascular age-related macular degeneration)(nAMD)으로 진단된 인간 대상체를 치료하는 방법.
- 제1항에 있어서,
투여가 맥락막상 약물 전달 장치를 사용하여 맥락막상 공간 내로 발현 벡터를 주사하는 것에 의한 것인 방법. - 제1항 또는 제2항에 있어서,
맥락막상 약물 전달 장치가 미량주사기인 방법. - 인간 대상체의 눈 내의 맥락막상 공간을 통해 항-hVEGF 항체를 코딩하는 발현 벡터를 인간 대상체의 눈 내의 망막하 공간에 투여하는 것을 포함하는, nAMD로 진단된 인간 대상체를 치료하는 방법.
- 제4항에 있어서,
투여는 소형 바늘이 망막하 공간 내로 주사되는, 후극을 향해 맥락막상 공간을 통해 삽입되고 뚫릴 수 있는 카테터를 포함하는 망막하 약물 전달 장치의 사용에 의한 것인 방법. - 제5항에 있어서,
투여가 맥락막상 공간을 통해 망막하 약물 전달 장치의 카테터를 삽입하고 뚫는 것을 포함하는 것인 방법. - 항-hVEGF 항체를 코딩하는 발현 벡터를 인간 대상체의 눈 내의 공막 외면에 투여하는 것을 포함하는, nAMD로 진단된 인간 대상체를 치료하는 방법.
- 제7항에 있어서,
투여는 팁(tip)이 공막 표면에 대해 직접 병치(direct apposition)로 삽입되고 유지될 수 있는 캐뉼라를 포함하는 공막옆(juxtascleral) 약물 전달 장치의 사용에 의한 것인 방법. - 제8항에 있어서,
투여가 공막 표면에 대해 직접 병치로 캐뉼라의 팁을 삽입하고 유지하는 것을 포함하는 것인 방법. - 제1항 내지 제9항 중 어느 한 항에 있어서,
투여가 항-hVEGF 항체의 치료적 유효량을 상기 인간 대상체의 망막에 전달하는 것인 방법. - 제10항에 있어서,
항-hVEGF 항체의 치료적 유효량이 상기 인간 대상체의 인간 망막 세포에 의해 생산되는 것인 방법. - 제10항에 있어서,
항-hVEGF 항체의 치료적 유효량이 상기 인간 대상체의 외경계막 내의 인간 광수용기 세포, 수평 세포, 양극 세포, 아마크린 세포, 망막 신경절 세포, 및/또는 망막 색소 상피 세포에 의해 생산되는 것인 방법. - 제12항에 있어서,
인간 광수용기 세포가 원뿔 세포 및/또는 간상 세포인 방법. - 제1항 내지 제14항 중 어느 한 항에 있어서,
인간 대상체가 ≤20/20 및 ≥20/400인 최고 교정 시력(Best-Corrected Visual Acuity)(BCVA)을 갖는 것인 방법. - 제1항 내지 제14항 중 어느 한 항에 있어서,
인간 대상체가 ≤20/63 및 ≥20/400인 BCVA를 갖는 것인 방법. - 제15항 또는 제16항에 있어서,
BCVA가 인간 대상체에서 치료될 눈의 BCVA인 방법. - 제1항 내지 제17항 중 어느 한 항에 있어서,
항-hVEGF 항체가 항-hVEGF 항원-결합 단편인 방법. - 제18항에 있어서,
항원-결합 단편이 Fab인 방법. - 제18항에 있어서,
항원-결합 단편이 F(ab')2인 방법. - 제18항에 있어서,
항원-결합 단편이 단일쇄 가변 도메인(single chain variable domain)(scFv)인 방법. - 제1항 내지 제21항 중 어느 한 항에 있어서,
항-hVEGF 항체가 서열번호 1 또는 서열번호 3의 아미노산 서열을 포함하는 중쇄, 및 서열번호 2, 또는 서열번호 4의 아미노산 서열을 포함하는 경쇄를 포함하는 것인 방법. - 제1항 내지 제21항 중 어느 한 항에 있어서,
항-hVEGF 항체가 서열번호 14-16의 경쇄 CDR 1-3 및 서열번호 17-19 또는 서열번호 20, 18, 및 21의 중쇄 CDR 1-3을 포함하는 것인 방법. - 제22항에 있어서,
경쇄 CDR3의 제2 아미노산 잔기가 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyroglutamation)(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는 것인 방법. - 제23항에 있어서,
경쇄 CDR3의 제2 아미노산 잔기가 아세틸화되지 않는 것인 방법. - 제23항 또는 제24항에 있어서,
경쇄 CDR1의 제8 및 제11 아미노산 잔기 각각이 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하는 것인 방법. - 제22항 내지 제25항 중 어느 한 항에 있어서,
항-hVEGF 항체가 서열번호 20의 중쇄 CDR1을 포함하고 중쇄 CDR1의 최종 아미노산 잔기가 산화, 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하지 않는 것인 방법. - 제26항에 있어서,
중쇄 CDR1의 최종 아미노산 잔기가 아세틸화되지 않는 것인 방법. - 제26항 또는 제27항에 있어서,
중쇄 CDR1의 제9 아미노산 잔기가 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하고, 중쇄 CDR2의 제3 아미노산 잔기가 아세틸화, 탈아미노화, 및 피로글루탐산화(pyro Glu) 중 1 이상의 화학적 변형을 보유하는 것인 방법. - 제1항 내지 제29항 중 어느 한 항에 있어서,
발현 벡터가 AAV 벡터인 방법. - 제30항에 있어서,
발현 벡터가 AAV8 벡터인 방법.
Applications Claiming Priority (9)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201762564095P | 2017-09-27 | 2017-09-27 | |
| US62/564,095 | 2017-09-27 | ||
| US201762574657P | 2017-10-19 | 2017-10-19 | |
| US62/574,657 | 2017-10-19 | ||
| US201762579682P | 2017-10-31 | 2017-10-31 | |
| US62/579,682 | 2017-10-31 | ||
| US201862632812P | 2018-02-20 | 2018-02-20 | |
| US62/632,812 | 2018-02-20 | ||
| PCT/US2018/052855 WO2019067540A1 (en) | 2017-09-27 | 2018-09-26 | TREATMENT OF OCULAR DISEASES WITH A TOTALLY HUMAN POST-TRANSLATIONAL MODIFICATION ANTI-VEGF FAB |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20200060456A true KR20200060456A (ko) | 2020-05-29 |
Family
ID=65903176
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020207011989A KR20200060456A (ko) | 2017-09-27 | 2018-09-26 | 완전-인간 번역후 변형된 항-VEGF Fab를 이용한 안구 질환의 치료 |
Country Status (9)
| Country | Link |
|---|---|
| US (1) | US20200277364A1 (ko) |
| EP (1) | EP3687464A4 (ko) |
| JP (2) | JP2020535184A (ko) |
| KR (1) | KR20200060456A (ko) |
| AU (1) | AU2018342094A1 (ko) |
| CA (1) | CA3076905A1 (ko) |
| IL (1) | IL273403A (ko) |
| SG (1) | SG11202002396TA (ko) |
| WO (1) | WO2019067540A1 (ko) |
Families Citing this family (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9840553B2 (en) | 2014-06-28 | 2017-12-12 | Kodiak Sciences Inc. | Dual PDGF/VEGF antagonists |
| RU2744860C2 (ru) | 2015-12-30 | 2021-03-16 | Кодиак Сайенсиз Инк. | Антитела и их конъюгаты |
| US11197937B2 (en) | 2016-04-15 | 2021-12-14 | The Trustees Of The University Of Pennsylvania | Compositions for treatment of wet age-related macular degeneration |
| CA3086045A1 (en) | 2017-12-19 | 2019-06-27 | Akouos, Inc. | Aav-mediated delivery of therapeutic antibodies to the inner ear |
| WO2020161342A1 (en) * | 2019-02-08 | 2020-08-13 | Curevac Ag | Coding rna administered into the suprachoroidal space in the treatment of ophtalmic diseases |
| SG11202110789VA (en) * | 2019-04-03 | 2021-10-28 | Regenxbio Inc | Gene therapy for eye pathologies |
| CN110423281B (zh) * | 2019-07-31 | 2021-04-30 | 成都金唯科生物科技有限公司 | 用于治疗老年性黄斑变性的融合蛋白、病毒载体和药物 |
| JP2022545967A (ja) | 2019-08-26 | 2022-11-01 | リジェネックスバイオ インコーポレイテッド | 完全ヒト翻訳後修飾抗VEGF Fabを用いる糖尿病性網膜症の処置 |
| AU2020362119A1 (en) | 2019-10-07 | 2022-05-26 | Regenxbio Inc. | Adeno-associated virus vector pharmaceutical composition and methods |
| CA3157509A1 (en) | 2019-10-10 | 2021-04-15 | Kodiak Sciences Inc. | Methods of treating an eye disorder |
| WO2021188803A1 (en) * | 2020-03-19 | 2021-09-23 | Clearside Biomedical, Inc. | Compositions and methods for treating ocular disorders |
| EP4189098A1 (en) | 2020-07-27 | 2023-06-07 | Anjarium Biosciences AG | Compositions of dna molecules, methods of making therefor, and methods of use thereof |
| TW202228649A (zh) * | 2020-10-07 | 2022-08-01 | 美商銳進科斯生物股份有限公司 | 諸如形成聚集體之調配物之用於脈絡膜上投與之調配物 |
| BR112023015303A2 (pt) | 2021-02-01 | 2023-11-14 | Regenxbio Inc | Método para tratar doença cln2 devido a deficiência de tpp1 em um sujeito |
| WO2024073669A1 (en) | 2022-09-30 | 2024-04-04 | Regenxbio Inc. | Treatment of ocular diseases with recombinant viral vectors encoding anti-vegf fab |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20070202186A1 (en) * | 2006-02-22 | 2007-08-30 | Iscience Interventional Corporation | Apparatus and formulations for suprachoroidal drug delivery |
| EP2559443A1 (en) * | 2011-08-16 | 2013-02-20 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods and pharmaceutical compositions for the treatment of an ocular disease in a subject |
| TWI702955B (zh) * | 2012-05-15 | 2020-09-01 | 澳大利亞商艾佛蘭屈澳洲私營有限公司 | 使用腺相關病毒(aav)sflt-1治療老年性黃斑部退化(amd) |
| US10064752B2 (en) * | 2014-09-11 | 2018-09-04 | Orbit Biomedical Limited | Motorized suprachoroidal injection of therapeutic agent |
| JP2019501200A (ja) * | 2016-01-08 | 2019-01-17 | クリアサイド バイオメディカル,インコーポレイテッド | 後眼部障害をアフリベルセプトおよびその他の生物製剤で処置するための方法およびデバイス |
| US20210093734A1 (en) * | 2018-02-20 | 2021-04-01 | The Trustees Of The University Of Pennsylvania | Compositions for treatment of wet age-realted macular degeneration |
-
2018
- 2018-09-26 AU AU2018342094A patent/AU2018342094A1/en active Pending
- 2018-09-26 EP EP18862872.1A patent/EP3687464A4/en active Pending
- 2018-09-26 US US16/645,877 patent/US20200277364A1/en not_active Abandoned
- 2018-09-26 WO PCT/US2018/052855 patent/WO2019067540A1/en unknown
- 2018-09-26 CA CA3076905A patent/CA3076905A1/en active Pending
- 2018-09-26 SG SG11202002396TA patent/SG11202002396TA/en unknown
- 2018-09-26 KR KR1020207011989A patent/KR20200060456A/ko not_active Application Discontinuation
- 2018-09-26 JP JP2020517843A patent/JP2020535184A/ja active Pending
-
2020
- 2020-03-18 IL IL273403A patent/IL273403A/en unknown
-
2023
- 2023-05-09 JP JP2023077454A patent/JP2023113641A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| JP2023113641A (ja) | 2023-08-16 |
| EP3687464A1 (en) | 2020-08-05 |
| AU2018342094A1 (en) | 2020-04-02 |
| US20200277364A1 (en) | 2020-09-03 |
| EP3687464A4 (en) | 2021-09-29 |
| IL273403A (en) | 2020-05-31 |
| CA3076905A1 (en) | 2019-04-04 |
| SG11202002396TA (en) | 2020-04-29 |
| WO2019067540A1 (en) | 2019-04-04 |
| JP2020535184A (ja) | 2020-12-03 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20230057519A1 (en) | Treatment of Ocular Diseases with Fully-Human Post-Translationally Modified Anti-VEGF Fab | |
| KR20200060456A (ko) | 완전-인간 번역후 변형된 항-VEGF Fab를 이용한 안구 질환의 치료 | |
| US20220143221A1 (en) | Gene Therapy For Eye Pathologies | |
| AU2013263159B2 (en) | Treatment of amd using AAV sFlt-1 | |
| KR20210022524A (ko) | 습성 연령 관련 황반 변성의 치료를 위한 조성물 | |
| WO2016049183A1 (en) | Ve-ptp extracellular domain antibodies delivered by a gene therapy vector | |
| JP2021500071A (ja) | ヒト翻訳後修飾vegf−trapによる眼疾患および転移性大腸がんの処置 | |
| JP2019521989A (ja) | 眼性新血管形成を低減するための組成物および方法 | |
| US20220280608A1 (en) | Treatment of diabetic retinopathy with fully-human post-translationally modified anti-vegf fab | |
| CA3106078A1 (en) | Treatment of neuropathy with dna constructs expressing igf-1 isoforms | |
| NZ787275A (en) | Treatment of ocular diseases with fully-human post-translationally modified anti- | |
| IL308027A (en) | Compositions and methods for improving visual function |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E902 | Notification of reason for refusal |