KR20200038311A - 항-아펠린 항체 및 그의 용도 - Google Patents
항-아펠린 항체 및 그의 용도 Download PDFInfo
- Publication number
- KR20200038311A KR20200038311A KR1020207008305A KR20207008305A KR20200038311A KR 20200038311 A KR20200038311 A KR 20200038311A KR 1020207008305 A KR1020207008305 A KR 1020207008305A KR 20207008305 A KR20207008305 A KR 20207008305A KR 20200038311 A KR20200038311 A KR 20200038311A
- Authority
- KR
- South Korea
- Prior art keywords
- seq
- ser
- chain variable
- variable region
- gly
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/26—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against hormones ; against hormone releasing or inhibiting factors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/74—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving hormones or other non-cytokine intercellular protein regulatory factors such as growth factors, including receptors to hormones and growth factors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Molecular Biology (AREA)
- Organic Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Immunology (AREA)
- Urology & Nephrology (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Biomedical Technology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Hematology (AREA)
- Biochemistry (AREA)
- Endocrinology (AREA)
- Microbiology (AREA)
- Biotechnology (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Cell Biology (AREA)
- Food Science & Technology (AREA)
- Physics & Mathematics (AREA)
- Analytical Chemistry (AREA)
- Ophthalmology & Optometry (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- Vascular Medicine (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Epidemiology (AREA)
- Mycology (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
Abstract
항-아펠린 항체 및 그의 항원-결합 단편이 기재된다. 또한 기재되는 것은 항체를 인코딩하는 핵산, 항체를 포함하는 조성물, 및 항체를 생산하는 방법 및 항체를 사용하여 질환 예컨대 당뇨병성 망막병증 (DR), 예를 들어 증식성 당뇨병성 망막병증 (PDR) 및 비증식성 당뇨병성 망막병증 (NPDR), 연령관련 황반변성 (AMD), 당뇨병성 황반부종 (DME), 망막 정맥 폐쇄 (RVO) 후 황반부종, 망막변성, 근시 맥락막 혈관신생 (mCNV), 당뇨병성 신경병증, 만성 신장 질환 (CKD), 비알코올성 지방간염 (NASH), 간경화증, 경화반내 혈관신생, 홍채 홍색증, 신생혈관 녹내장, 각막 혈관신생 (CNV), 미숙아 망막병증 (ROP), 망막병증, 황반변성, 난소 과다자극 증후군 (OHSS), 자궁 출혈, 자궁내막증, 자궁내막 이상증식증 및 암, 자궁평활근종, 선근증, 암 (예를 들어, 고체 종양 및 혈액 악성종양), 섬유증, 및/또는 관련 합병증을 치료 또는 예방하는 방법이다.
Description
관련 출원에 대한 교차 참조
이 출원은 2017 년 8 월 24 일에 출원된 미국 가출원 No. 62/549,523; 2017 년 10 월 31 일에 출원된 미국 가출원 No. 62/579,287; 2018 년 4 월 12 일에 출원된 미국 가출원 No. 62/656,586; 및 2018 년 4 월 16 일에 출원된 미국 가출원 No. 62/658,111 에 대한 우선권을 주장한다. 각각의 공개는 그 전문이 본원에 참조로 포함된다.
본 발명의 분야
본 발명은 모노클로날 항-아펠린 항체, 항체를 인코딩하는 핵산 및 발현 벡터, 벡터를 포함하는 재조합 세포, 및 항체를 포함하는 조성물에 관한 것이다. 항체를 제조하는 방법, 항체를 진단 목적으로 혈액 및/또는 조직에서의 아펠린 수준을 측정하는데 사용하는 방법, 및 항체를 사용하여 질환, 예를 들어, 당뇨병성 망막병증 (DR; 예를 들어, 증식성 당뇨병성 망막병증 (PDR) 및 비증식성 당뇨병성 망막병증 (NPDR)), 연령관련 황반변성 (AMD), 당뇨병성 황반부종 (DME), 망막 정맥 폐쇄 (RVO) 후 황반부종, 망막변성, 근시 맥락막 혈관신생 (mCNV), 당뇨병성 신경병증, 만성 신장 질환 (CKD), 비알코올성 지방간염 (NASH), 간경화증, 경화반내 혈관신생, 홍채 홍색증, 신생혈관 녹내장, 각막 혈관신생 (CNV), 미숙아 망막병증 (ROP), 망막병증, 황반변성, 난소 과다자극 증후군 (OHSS), 자궁 출혈, 자궁내막증, 자궁내막 이상증식증 및 암, 자궁평활근종, 선근증, 암 (예를 들어, 고체 종양 및 혈액 악성종양), 섬유증 (예를 들어, 병리학적 및 생리학적 섬유증, 신장 섬유증, 심장 섬유증, 간 섬유증, 및 폐 섬유증), 및/또는 관련 합병증을 치료하는 방법이 또한 제공된다.
전자적으로 제출된 서열 목록에 대한 언급
이 출원은 EFS-Web 를 통해 파일명 "689204.1WO Sequence Listing" 및 작성일 2018 년 8 월 15 일의, 크기 88 kb 를 갖는 ASCII 포맷된 서열 목록으로서 전자적으로 제출되는 서열 목록을 포함한다. EFS-Web 를 통해 제출되는 서열 목록은 명세서의 일부이고 그 전부가 본원에 참조로 포함된다.
아펠린은 여러 내인성 형태를 갖는 자연적으로 발생하는 펩티드이다. 아펠린은 처음에 77-아미노산 전구체, 프리프로아펠린로서 생산되며, 이는 단백질가수분해로 아펠린-36 (또는 아펠린 36) (아펠린 전구체의 C-말단 36 개 아미노산을 함유함), 아펠린-17 (또는 아펠린 17) (프리프로아펠린의 C-말단 17 개 아미노산을 함유함; K17F) 및 아펠린-13 (또는 아펠린 13) (프리프로아펠린의 C-말단 13 개 아미노산을 함유함) 으로 가공된다 (Tatemoto et al., Biochem Biophys Res. Commun. 251(2):471-6 (1998); Habata et al., Biochim Biophys Acta 1452(1):25-35 (1999); Lee et al., J. Neurochem. 74(1):34-41 (2000)). 77-아미노산 전구체에서 유래하는 다른 형태의 아펠린이 또한 보고된 바 있다 (Mesmin et al., J Proteome Res. 10(11):5222-31 (2011); Shin et al., Biochim Biophys Acta. 1861(8):1901-12 (2017)). 아펠린 13 의 N-말단 글루타민 잔기는 파이로글루타밀화되어, 파이로글루타밀 형태의 아펠린 13 (pE13F) 을 생산할 수 있다. 아펠린은 아펠린 수용체 APJ (또한 아펠린R, AGTRL1, 또는 APLNR 로 명명됨) 의 내인성 리간드이다. APJ 은 G 단백질-커플링된 수용체 유전자 패밀리의 일원이다. 아펠린은 APJ 에 결합하여 활성화시키고, 포스콜린-유도되는 cAMP 생산의 하향조절 및 세포외 신호-조절되는 키나아제 (ERK), Akt, 및 p70 S6 키나아제의 인산화의 촉진을 포함하는, 광범위한 하류 신호전달 사건을 유발한다 (De Mota, Neuroendocrinology 72(6):400-7 (2000); Li et al., Front Biosci. 13:3786-92 (2008); Masri et al., Biochem Biophys Res Commun. 290(1):539-45 (2002); Liu et al., Biochem Biophys Res Commun. 468(4):617-21 (2015); Masri et al., FASEB J. 18(15):1909-11 (2004); O'Carroll et al., J Endocrinol. 219(1):R13-35 (2013)). K17F 및 pE13F 둘 모두는 APJ 수용체 내재화를 유도할 수 있다. K17F 는 APJ 에 대해 pE13F 보다 더 높은 친화도를 갖지만, 아펠린-36 은 pE13F 와 유사한 친화도를 갖는다 (Iturrioz et al., J Biol Chem. 285(42):32627-37 (2010); Medhurst et al., J Neurochem. 84(5):1162-72 (2003)). 아펠린 및 APJ 둘 모두는 중추신경계 및 말초 조직에서 발현된다 (O'Carroll et al., J Endocrinol. 219(1):R13-35 (2013)). 아펠린/APJ 축은 심장 수축성, 혈압, 심혈관 긴장도, 조직 혈관신행, 물 항상성, 위장관 생리학, 혈관 평활근 세포 (VSMC) 및 기타 세포 유형의 증식, 인간 탯줄 정맥 내피 세포에 대한 단핵구 부착, 심근경색후 심장 회복, 및 여러 조직 또는 기관에서의 병리학적 섬유증을 포함하는 많은 생리학적 기능을 조절한다 (O'Carroll et al., J Endocrinol. 219(1):R13-35 (2013)).
아펠린은 혈관신생 및 내피 세포 (EC) 의 세포 증식에서 중요한 역할을 수행한다 (Kalin et al., Dev Biol. 305(2):599-614 (2007); Kasai et al., Biochem Biophys Res Commun. 325(2):395-400 (2004)). 아펠린 및 APJ 둘 모두는 혈관신생 동안 새롭게 발달하는 혈관의 EC 상에서 발현되고 (Kidoya et al., EMBO J. 27(3):522-34 (2008); Saint-Geniez et al., Mech Dev. 110(1-2):183-6 (2002)), 아펠린의 발현은 저산소증에 의해 유도된다 (Kasai et al., Arterioscler Thromb Vasc Biol. 30(11):2182-7 (2010)). 아펠린 녹아웃 마우스는 손상된 망막 혈관화 및 안구 발달을 가지며 (Kasai et al., Arterioscler Thromb Vasc Biol. 28(10):1717-22 (2008)), 이는 망막 발달에서의 아펠린의 중요한 역할을 시사한다. 아펠린의 유리체 농도는 당뇨병이 없는 개체에서보다 증식성 당뇨병성 망막병증 (PDR) 이 있는 환자에서 더 높다 (Tao et al., Invest Ophthalmol Vis Sci. 51(8):4237-42 (2010)). 상승된 아펠린 수준은 강한 혈관신생 및 증식 효과를 발휘하고 당뇨병 및 기타 눈 질환의 망막에서 병리학적 변화를 초래할 수 있다. 아펠린-중화 모노클로날 항체 (mAb) 는 아펠린에 특이적으로 결합하여 아펠린 수용체 APJ 를 발현하는 세포에 대한 그것의 생물학적 활성을 차단할 수 있다; 그것은 또한 중화 활성을 갖는 항-아펠린 mAb 로 호칭될 수 있다. 아펠린-중화 mAb 와 같은 제제는 당뇨병성 망막병증 (DR), 연령관련 황반변성 (AMD), 및 당뇨병성 황반부종 (DME) 을 치료하는데 사용될 수 있다. 아펠린/APJ 축은 VEGF 경로와 협동하는 방ㅅ기으로 작용할 수 있으므로, 아펠린-중화 mAb 와 VEGF 차단제 예컨대 라니비주맙 (Lucentis®) 의 조합은 DR, DME, AMD, 및/또는 기타 눈 질환을 갖는 환자에서 상가적 또는 심지어는 상승적 치료적 효과를 가질 수 있다. 아펠린 및 VEGF 둘 모두를 표적화하는 이중특이적 항체는 유사한 효과를 가질 수 있다.
아펠린-13 은 유방암, 간세포암, 림프암, 폐암 및 난소암을 포함하는, 다양한 유형의 암에서 종양 증식을 촉진하는 것으로 밝혀졌다. 아펠린 및 APJ 발현은 다양한 종양에서 상향조절된다 (Sorli et al., Oncogene. 26(55):7692-9 (2007); Picault et al., Eur J Cancer. 50(3):663-74 (2014); Zuurbier et al., Oncotarget. 8(26):42949-42961 (2017); Muto et al., Anticancer Res. 34(10):5313-20 (2014)). 아펠린은 그것의 수용체 APJ 의 결합 및 활성화를 통한 종양 혈관신생 및 증식의 강력한 활성화인자이다 (Sorli et al., Drug Discov Today. 11(23-24):1100-6 (2006)). 따라서, 아펠린-중화 mAb 에 의한 아펠린 작용의 차단은 아펠린/APJ 축이 종양 부위 근처에서 암 세포 성장 및/또는 혈관신생에서 일정한 역할을 수행하는 다양한 암을 치료하는데 이용될 수 있다. 아펠린-중화 mAb 는 아바스틴(Avastin)® 또는 기타 항-VEGF 및/또는 항-혈관신생제와 조합되어 암 치료에서 상가적 또는 심지어는 상승적 효과를 달성할 수 있다. 추가로, 아펠린-중화 mAb 는 기타 항암제 예컨대 화학요법, 종양 성장의 저해 또는 면역-종양학 요법을 위한 것과 조합되어 더 큰 효능을 달성할 수 있다.
아펠린은 또한 간 질환과 관련된다. 그것은 간경변 랫트의 활성화된 간 성상 세포 (HSC) 에서 과발현되고, 이들 동물에서 혈관신생 및 섬유증 둘모두에서 중요한 역할을 수행한다 (Principe et al., Hepatology. 48(4):1193-201 (2008)). 아펠린은 또한 인간 간경변 간의 HSC 에서 과발현되며 (Melgar-Lesmes et al., Endocrinology. 151(11):5306-14 (2010)), APJ 도 그러하다 (Yokomori et al., J Gastroenterol. 46(2):222-31 (2011)). 다른 한편으로는, 저산소증 및 전염증성 인자 둘 모두는 인간 HSC 및 간세포에서 APJ 발현을 상향조절한다. 간경화증 환자는 아펠린의 상승된 혈청 수준을 갖는다. 더욱이, 혈청 아펠린 수준은 만성 간 질환의 중증도와 관련된다. 이들 발견은 아펠린이 간 질환 예컨대 비알코올성 지방간염 (NASH), 간 섬유증 및 간경화증의 발병기전에서 중요한 역할을 수행할 수 있다는 것을 시사한다. 아펠린-중화 mAb 는 이들 간 질환을 치료하는데 사용될 수 있다.
아펠린은 사구체 내피 세포의 투과성을 향상시키고 족세포 기능장애를 유도함으로써 설치류에서 당뇨병성 신경병증을 촉진하는 것으로 밝혀졌다 (Guo et al., J Cell Mol Med. 19(9):2273-85 (2015)). 그것은 또한 족세포에서 자가포식을 저해함으로써 당뇨병성 신경병증의 진행에서 관여되는 것으로 발견되었다 (Liu et al., Cell Death Dis. 8(8):e3006 (2017)). 따라서, 아펠린-중화 mAb 는 당뇨병성 신경병증 및 만성 신장 질환의 치료에서 사용될 수 있다.
하나의 일반적 양태에서, 본 발명은 아펠린에 특이적으로 결합하는 단리된 모노클로날 항체 또는 그의 항원-결합 단편에 관한 것이다.
제공되는 것은 하기의 폴리펩티드 서열을 갖는, 중쇄 상보성 결정 영역 1 (HCDR1), HCDR2, HCDR3, 경쇄 상보성 결정 영역 1 (LCDR1), LCDR2, 및 LCDR3 을 포함하는 단리된 모노클로날 항체 또는 그의 항원-결합 단편이다:
(1) SEQ ID NOs:168, 169, 170, 171, 102, 및 172, 각각;
(2) SEQ ID NOs:50, 51, 52, 110, 111, 및 112, 각각;
(3) SEQ ID NOs:173, 174, 175, 176, 114, 및 115, 각각;
(4) SEQ ID NOs:68, 177, 178, 128, 129, 및 130, 각각;
(5) SEQ ID NOs:74, 75, 76, 134, 135, 및 136, 각각;
(6) SEQ ID NOs:179, 78, 180, 137, 138, 및 139, 각각;
(7) SEQ ID NOs:83, 84, 85, 143, 144, 및 145, 각각;
(8) SEQ ID NOs:86, 87, 88, 146, 147, 및 148, 각각;
(9) SEQ ID NOs:89, 90, 91, 149, 150, 및 151, 각각;
(10) SEQ ID NOs:92, 93, 94, 152, 153, 및 154, 각각;
(11) SEQ ID NOs:95, 96, 97, 155, 156, 및 157, 각각; 또는
(12) SEQ ID NOs:98, 99, 100, 158, 159, 및 160, 각각;
여기에서 항체 또는 그의 항원-결합 단편은 아펠린, 바람직하게는 인간 아펠린에 특이적으로 결합한다. SEQ ID NO:168 은 아미노산 서열 X1NRX2S 로 표시되며, 여기에서 X1 은 S 또는 T 로부터 선택되는 아미노산이고, X2 은 M 또는 V 로부터 선택되는 아미노산이다. SEQ ID NO:169 은 아미노산 서열 SIGSSPWX1ASWAX2G 로 표시되며, 여기에서 X1 은 Y 또는 F 로부터 선택되는 아미노산이고, X2 는 Q 또는 L 로부터 선택된다. SEQ ID NO:170 은 아미노산 서열 GGYRPGX1SX2 로 표시되며, 여기에서 X1 은 A 또는 G 로부터 선택되는 아미노산이고, X2 는 V 또는 I 로부터 선택되는 아미노산이다. SEQ ID NO:171 은 아미노산 서열 QSSQSVYDNNDLX1 로 표시되며, 여기에서 X1 은 A 또는 G 로부터 선택되는 아미노산이다. SEQ ID NO:172 은 아미노산 서열 AGGYX1GDIYT 로 표시되며, 여기에서 X1 은 S 또는 N 로부터 선택되는 아미노산이다. SEQ ID NO:173 은 아미노산 서열 X1YAX2D 로 표시되며, 여기에서 X1 은 N 또는 S 로부터 선택되는 아미노산이고, X2 는 M 또는 I 로부터 선택되는 아미노산이다. SEQ ID NO:174 은 아미노산 서열 VIAPNX1X2TX3YPTWARG 로 표시되며, 여기에서 X1 은 R, G, 또는 H 로부터 선택되는 아미노산이고; X2 는 R, A, 또는 Y 로부터 선택되는 아미노산이고; X3 은 Y 또는 C 로부터 선택되는 아미노산이다. SEQ ID NO:175 은 아미노산 서열 YPIX1X2GX3NI 로 표시되며, 여기에서 X1 은 E 또는 D 로부터 선택되는 아미노산이고; X2 는 P, A, S, 또는 T 로부터 선택되는 아미노산이고; X3 은 A 또는 S 로부터 선택되는 아미노산이다. SEQ ID NO:176 은 아미노산 서열 QSSESVX1X2NNQLS 로 표시되며, 여기에서 X1 은 D 또는 G 로부터 선택되는 아미노산이고, X2 는 Y, N, 또는 M 로부터 선택되는 아미노산이다. SEQ ID NO:177 은 아미노산 서열 VIAPSX1TTYYPTWAKG 로 표시되며, 여기에서 X1 은 G 또는 S 로부터 선택되는 아미노산이다. SEQ ID NO:178 은 아미노산 서열 YPIDPGSNX1 로 표시되며, 여기에서 X1 은 I 또는 V 로부터 선택되는 아미노산이다. SEQ ID NO:179 은 아미노산 서열 X1X2AMD 로 표시되며, 여기에서 X1 은 N 또는 S 로부터 선택되는 아미노산이고, X2 은 Y 또는 H 로부터 선택되는 아미노산이다. SEQ ID NO:180 은 아미노산 서열 YPIDX1GANV 로 표시되며, 여기에서 X1 은 V 또는 A 로부터 선택되는 아미노산이다.
또한 제공되는 것은 하기를 포함하는 단리된 모노클로날 항체 또는 그의 항원-결합 단편이다:
a. SEQ ID NO:1 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:2 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
b. SEQ ID NO:3 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:4 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
c. SEQ ID NO:5 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:6 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
d. SEQ ID NO:7 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:8 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
e. SEQ ID NO:9 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:10 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
f. SEQ ID NO:11 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:12 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
g. SEQ ID NO:13 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:14 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
h. SEQ ID NO:15 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:16 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
i. SEQ ID NO:17 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:18 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
j. SEQ ID NO:19 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:20 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
k. SEQ ID NO:21 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:22 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
l. SEQ ID NO:23 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:24 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
m. SEQ ID NO:25 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:26 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
n. SEQ ID NO:27 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:28 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
o. SEQ ID NO:29 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:30 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
p. SEQ ID NO:31 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:32 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
q. SEQ ID NO:33 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:34 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
r. SEQ ID NO:35 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:36 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
s. SEQ ID NO:37 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:38 의 폴리펩티드 서열을 갖는 경쇄 가변 영역; 또는
t. SEQ ID NO:39 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:40 의 폴리펩티드 서열을 갖는 경쇄 가변 영역.
또한 제공되는 것은 SEQ ID NO:188 의 아미노산 서열을 포함하는 에피토프에 특이적으로 결합하는 아펠린에 대한 단리된 모노클로날 항체 또는 그의 항원-결합 단편이다. 단리된 모노클로날 항체 또는 그의 항원-결합 단편은, 예를 들어, 아펠린 활성을 저해할 수 있다. 단리된 모노클로날 항체 또는 그의 항원-결합 단편은, 예를 들어, 파이로-아펠린-13, 아펠린-13, 아펠린-17, 아펠린-36, 아펠린-55, 및/또는 아펠린-13 과 동일한 C-말단 단부를 공유하는 다른 형태의 아펠린에 특이적으로 결합할 수 있다.
또한 제공되는 것은 SEQ ID NO:204 의 아미노산 서열을 포함하는 에피토프에 특이적으로 결합하는 아펠린에 대한 단리된 모노클로날 항체 또는 그의 항원-결합 단편이다. 단리된 모노클로날 항체 또는 그의 항원-결합 단편은, 예를 들어, 아펠린 활성을 저해할 수 있다. 단리된 모노클로날 항체 또는 그의 항원-결합 단편은, 예를 들어, 아펠린-13 및 파이로-아펠린-13 에 특이적으로 결합할 수 있다.
특정 구현예에서, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 키메라이다.
특정 구현예에서, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 인간 또는 인간화된 것이다. 특정 구현예에서, 인간화된 모노클로날 항체 또는 그의 항원-결합 단편은 하기를 포함한다:
a. SEQ ID NO:211 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:215 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
b. SEQ ID NO:212 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:215 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
c. SEQ ID NO:213 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:215 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
d. SEQ ID NO:214 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:215 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
e. SEQ ID NO:213 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:216 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
f. SEQ ID NO:214 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:216 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
g. SEQ ID NO:217 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:219 의 폴리펩티드 서열을 갖는 경쇄 가변 영역; 또는
h. SEQ ID NO:218 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:220 의 폴리펩티드 서열을 갖는 경쇄 가변 영역.
또한 제공되는 것은 본원에 개시된 본 발명의 모노클로날 항체 또는 그의 항원-결합 단편을 인코딩하는 단리된 핵산이다.
또한 제공되는 것은 본 발명의 모노클로날 항체 또는 그의 항원-결합 단편을 인코딩하는 단리된 핵산을 포함하는 벡터이다.
또한 제공되는 것은 본 발명의 모노클로날 항체 또는 그의 항원-결합 단편을 인코딩하는 단리된 핵산을 포함하는 벡터를 포함하는 숙주 세포이다.
특정 구현예에서, 제공되는 것은 본 발명의 단리된 모노클로날 항체 또는 그의 항원-결합 단편 및 약학적으로 허용가능한 담체를 포함하는 약학적 조성물이다.
또한 제공되는 것은 필요로 하는 대상체에서 아펠린 수용체에 대한 아펠린의 결합을 차단하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법이다.
또한 제공되는 것은 필요로 하는 대상체에서 당뇨병성 망막병증 (DR) 을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법이다.
또한 제공되는 것은 필요로 하는 대상체에서 연령관련 황반변성 (AMD) 을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법이다.
또한 제공되는 것은 필요로 하는 대상체에서 당뇨병성 황반부종 (DME) 을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법이다.
또한 제공되는 것은 필요로 하는 대상체에서 망막 정맥 폐쇄 (RVO) 후 황반부종을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법이다.
또한 제공되는 것은 필요로 하는 대상체에서 망막변성을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법이다.
또한 제공되는 것은 필요로 하는 대상체에서 근시 맥락막 혈관신생 (mCNV) 을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법이다.
또한 제공되는 것은 필요로 하는 대상체에서 당뇨병성 신경병증을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법이다.
또한 제공되는 것은 필요로 하는 대상체에서 만성 신장 질환 (CKD) 을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법이다.
또한 제공되는 것은 필요로 하는 대상체에서 비알코올성 지방간염 (NASH) 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법이다.
또한 제공되는 것은 필요로 하는 대상체에서 조직 섬유증을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법이다.
또한 제공되는 것은 필요로 하는 대상체에서 간경화증을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법이다.
또한 제공되는 것은 필요로 하는 대상체에서 경화반내 혈관신생을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법이다.
또한 제공되는 것은 필요로 하는 대상체에서 홍채 홍색증을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법이다.
또한 제공되는 것은 필요로 하는 대상체에서 신생혈관 녹내장을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법이다.
또한 제공되는 것은 필요로 하는 대상체에서 각막 혈관신생 (CNV) 을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법이다.
또한 제공되는 것은 필요로 하는 대상체에서 미숙아 망막병증 (ROP) 을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법이다.
또한 제공되는 것은 필요로 하는 대상체에서 망막병증을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법이다.
또한 제공되는 것은 필요로 하는 대상체에서 황반변성을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법이다.
또한 제공되는 것은 필요로 하는 대상체에서 난소 과다자극 증후군 (OHSS) 을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법이다.
또한 제공되는 것은 필요로 하는 대상체에서 자궁 출혈을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법이다.
또한 제공되는 것은 필요로 하는 대상체에서 자궁내막증을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법이다.
또한 제공되는 것은 필요로 하는 대상체에서 자궁내막 이상증식증 및 암을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법이다.
또한 제공되는 것은 필요로 하는 대상체에서 자궁평활근종을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법이다.
또한 제공되는 것은 필요로 하는 대상체에서 선근증을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법이다.
또한 제공되는 것은 필요로 하는 대상체에서 암을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법이다. 암은 임의의 액체 또는 고체 암일 수 있으며, 예를 들어, 암은 폐암, 위암, 대장암, 간세포 암종, 신장 세포 암종, 방광요로상피암종, 담관암종, 전이성 흑색종, 유방암, 난소 암, 자궁경부암, 두경부암, 췌장암, 신경교종, 교모세포종, 및 기타 고체 종양, 및 비호지킨 림프종 (NHL), 급성 림프구성 백혈병 (ALL), 만성 림프구성 백혈병 (CLL), 만성 골수성 백혈병 (CML), 다발성 골수종 (MM), 급성 골수성 백혈병 (AML), 및 기타 액체 종양으로부터 선택될 수 있으나 그에 제한되지 않는다.
특정 구현예에서, 약학적 조성물은 이차 치료적 항암제를 추가로 포함한다. 이차 치료적 항암제는, 예를 들어, 항-VEGF 제일 수 있다. 항-VEGF 제는, 예를 들어, 아바스틴® 또는 베바시주맙 바이오시밀러제일 수 있다. 항-VEGF 제는, 예를 들어, VEGFR1 및/또는 VEGFR2 차단제일 수 있다.
또한 제공되는 것은 대상체에서 아펠린의 수준을 확인하는 방법이다. 방법은 하기를 포함한다: (a) 대상체로부터 샘플을 수득하는 단계; (b) 샘플을 본 발명의 항체 또는 그의 항원-결합 단편과 접촉시키는 단계; 및 (c) 대상체에서 아펠린의 수준을 확인하는 단계. 특정 구현예에서, 샘플은 조직 샘플이다. 조직 샘플은, 예를 들어, 암 조직 샘플, 간 조직 샘플, 또는 신장 조직 샘플일 수 있다.
또한 제공되는 것은 본 발명의 모노클로날 항체 또는 그의 항원-결합 단편을 생산하는 방법으로서, 모노클로날 항체 또는 항원-결합 단편을 인코딩하는 핵산을 포함하는 세포를 모노클로날 항체 또는 항원-결합 단편을 생산하는 조건 하에 배양하고, 항체 또는 항원-결합 단편을 세포 또는 배양물로부터 회수하는 것을 포함하는 방법이다.
또한 제공되는 것은 본 발명의 모노클로날 항체 또는 그의 항원-결합 단편을 포함하는 약학적 조성물을 생산하는 방법으로서, 모노클로날 항체 또는 항원-결합 단편을 약학적으로 허용가능한 담체와 조합하여 약학적 조성물을 얻는 것을 포함하는 방법이다.
상술한 요약, 뿐만 아니라 본 출원의 바람직한 구현예의 하기 상세한 설명은 첨부된 도면과 함께 읽을 때 더 잘 이해될 것이다. 그러나, 출원은 도면에 제시된 정확한 구현예에 제한되지는 않는다고 이해되어야 한다.
도 1A-1C 는 ELISA 에 의해 측정되는 다양한 비오틴일화된 아펠린 펩티드에 대한 항-아펠린 mAb 의 결합을 보여준다. 비오틴일화된 아펠린 펩티드를 뉴트라비딘으로 코팅된 ELISA 플레이트 상에 부동화시키고, 정제된 재조합 토끼 항-아펠린 mAb 를 플레이트 상의 펩티드에 대한 결합을 위해 첨가했다. 결합을 염소 항-토끼 IgG Fc (알칼리성 포스파타아제에 접합됨) 및 PNPP 기질을 첨가함으로써 검출하고, 405 ㎚ 에서 흡광도로서 측정했다. 도 1A 는 ELISA 에 의해 측정되는 다양한 비오틴일화된 아펠린 펩티드에 대한 항-아펠린 mAbs C5, C8, C17, C24, C25, C26, C27, C4 및 C9 의 결합을 입증하는 그래프를 보여준다. 도 1B 는 ELISA 에 의해 측정되는 다양한 비오틴일화된 아펠린 펩티드에 대한 항-아펠린 mAbs C1, C6, C7, C10, C12, 및 C16 의 결합을 입증하는 그래프를 보여준다. 도 1C 는 ELISA 에 의해 측정되는 다양한 비오틴일화된 아펠린 펩티드에 대한 항-아펠린 mAbs C11, C14, C22, C20, 및 C13 의 결합을 입증하는 그래프를 보여준다.
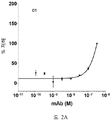
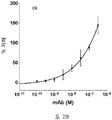
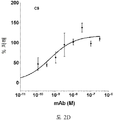
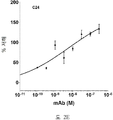
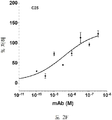
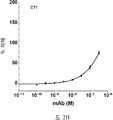
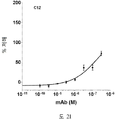
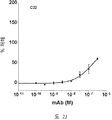
도 2A-2K 는 아펠린 활성에 관한 세포-기반 어세이에서 선택된 항-아펠린 mAb 의 중화 효과를 보여준다. 아펠린 활성을 cAMP Hunter™ CHO-K1 AGTRL1 Gi 세포 (DiscoverX #95-0147C2) 에서 포스콜린 (FSK)-유도되는 cAMP 생산을 하향조절하는 그것의 능력에 관해 평가했다. 각각의 mAb 를 소정의 희석률에서 트리플리케이트 (triplicate) 로 어세이했다. 소정의 농도에서 mAb 에 의한 % 저해를 계산하기 위해서, 0% 저해는 아펠린 치료를 받은 FSK-자극된 세포로부터의 신호로서 정의했고, 100% 저해는 아펠린 치료를 받지 않은 FSK-자극된 세포로부터의 신호로서 정의했다. % 저해를 mAb 의 증가하는 농도에 대해 플롯팅했다. 도 2A 는 항-아펠린 mAb C1 의 활성의 그래프를 보여준다. 도 2B 는 항-아펠린 mAb C6 의 활성의 그래프를 보여준다. 도 2C 는 항-아펠린 mAb C7 의 활성의 그래프를 보여준다. 도 2D 는 항-아펠린 mAb C8 의 활성의 그래프를 보여준다. 도 2E 는 항-아펠린 mAb C24 의 활성의 그래프를 보여준다. 도 2F 는 항-아펠린 mAb C25 의 활성의 그래프를 보여준다. 도 2G 는 항-아펠린 mAb C10 의 활성의 그래프를 보여준다. 도 2H 는 항-아펠린 mAb C11 의 활성의 그래프를 보여준다. 도 2I 는 항-아펠린 mAb C12 의 활성의 그래프를 보여준다. 도 2J 는 항-아펠린 mAb C22 의 활성의 그래프를 보여준다. 도 2K 는 항-아펠린 mAb C26 의 활성의 그래프를 보여준다.
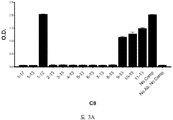
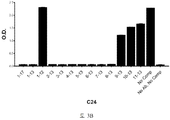
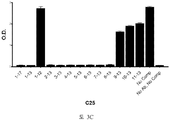
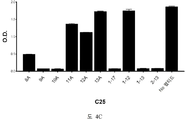
도 3A-3C 는 ELISA 에 의해 측정되는 표 7 에서의 경쟁 펩티드에 의한 항-아펠린 mAbs C8, C24 및 C25 에 대한 비오틴-아펠린-13 (SEQ ID NO:165) 결합의 저해를 입증하는 그래프를 보여준다. 염소-항-토끼 IgG 를 ELISA 플레이트 상에 부동화시켰다. 토끼 항-아펠린 mAb (C8, C24, 또는 C25) 및 경쟁 펩티드의 혼합물을 30 분 동안 실온에서 예비인큐베이션하고, 그 후 비오틴-아펠린-13 (SEQ ID NO:165) 을 첨가하고, 혼합하고, 최종 용액을 플레이트 상에 첨가했다. 부동화시킨 항-아펠린 mAb, C8 (도 3A), C24 (도 3B), 및 C25 (도 3C) 에 대한 비오틴-아펠린-13 (SEQ ID NO:165) 의 결합을, 스트렙타비딘 (알칼리성 포스파타아제에 접합됨) 및 PNPP 기질을 첨가함으로써 검출하고, 405 ㎚ 에서 흡광도로서 측정했다.
도 4A-4C 는 ELISA 에 의해 측정되는 에피토프 8-13 (KGPMPF (SEQ ID NO:188)) 에서 유래하는 알라닌 스캐닝 (scanning) 펩티드 (표 8) 에 의한 항-아펠린 mAbs C8, C24 및 C25 에 대한 비오틴-아펠린-13 (SEQ ID NO:165) 결합의 저해를 입증하는 그래프를 보여준다. 염소 항-토끼 IgG 를 ELISA 플레이트 상에 부동화시켰다. 토끼 항-아펠린 mAb (C8, C24, 또는 C25) 및 알라닌 스캐닝 펩티드의 혼합물을 30 분 동안 실온에서 예비인큐베이션하고, 그 후 비오틴-아펠린-13 (SEQ ID NO:165) 을 첨가하고, 혼합하고, 최종 용액을 플레이트 상에 첨가했다. 부동화시킨 항-아펠린 mAbs, C8 (도 4A), C24 (도 4B), 및 C25 (도 4C) 에 대한 비오틴-아펠린-13 (SEQ ID: 165) 의 결합을 스트렙타비딘 (알칼리성 포스파타아제에 접합됨) 및 PNPP 기질을 첨가함으로써 검출하고, 405 ㎚ 에서 흡광도로서 측정했다. 여러 경쟁 펩티드를 컨트롤로서 사용했다.
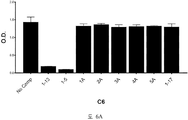
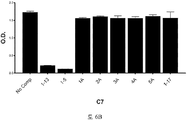
도 5A-5C 는 ELISA 에 의해 측정되는 표 9 에서의 경쟁 펩티드에 의한 항-아펠린 mAbs C1, C6 및 C7 에 대한 아펠린-13-비오틴 ((QRPRLSHKGPMPF-비오틴 (SEQ ID NO:165)) 결합의 저해를 입증하는 그래프를 보여준다. 염소-항-토끼 IgG 를 ELISA 플레이트 상에 부동화시켰다. 토끼 항-아펠린 mAb (C1, C6, 또는 C7) 및 경쟁 펩티드의 혼합물을 30 분 동안 실온에서 예비인큐베이션하고, 그 후 아펠린-13-비오틴 (SEQ ID NO:165) 을 첨가하고, 혼합하고, 최종 용액을 플레이트 상에 첨가했다. 부동화시킨 항-아펠린 mAbs, C1 (도 5A), C6 (도 5B), 및 C7 (도 5C) 에 대한 아펠린-13-비오틴 (SEQ ID NO:165) 의 결합을 스트렙타비딘 (알칼리성 포스파타아제에 접합됨) 및 PNPP 기질을 첨가함으로써 검출하고, 405 ㎚ 에서 흡광도로서 측정했다.
도 6A-6B 는 ELISA 에 의해 측정되는 에피토프 1-5 (QRPRL (SEQ ID NO: 204)) 에서 유래하는 알라닌 스캐닝 펩티드 (표 10) 에 의한 항-아펠린 mAbs C6 (도 6A) 및 C7 (도 6B) 에 대한 아펠린-13-비오틴 (SEQ ID NO:165) 결합의 저해를 입증하는 그래프를 보여준다.
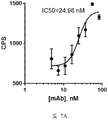
도 7A-7B 는 세포-기반 어세이에서 인간화된 항-아펠린 mAb A31 의 IC50 곡선을 보여준다. 아펠린 활성을 cAMP Hunter™ CHO-K1 AGTRL1 Gi 세포 (DiscoverX #95-0147C2) 에서 포스콜린 (FSK)-유도되는 cAMP 생산을 하향조절하는 그것의 능력에 관해 평가하고, 항-아펠린 mAb 의 활성을 아펠린의 저해 효과를 역전시키는 그것의 능력에 관해 평가했다. 도 7A 는 아펠린 13 (APL13) 이 어세이에서 사용되었을 때의 IC50 그래프를 보여준다. 도 7B 는 파이로-아펠린 13 (pyroAPL13) 이 어세이에서 사용되었을 때의 IC50 그래프를 보여준다. CPS, 초 당 카운트수.
도 8 은 이종이식 모델에서 종양 성장에 대한 인간화된 항-아펠린 mAb A31 의 효과를 보여준다. mAb 를 단독으로 또는 베바시주맙과의 조합으로 시험했다; 베바시주맙 단독을 또한 연구에 포함시켰다.
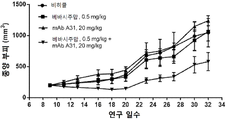
도 1A-1C 는 ELISA 에 의해 측정되는 다양한 비오틴일화된 아펠린 펩티드에 대한 항-아펠린 mAb 의 결합을 보여준다. 비오틴일화된 아펠린 펩티드를 뉴트라비딘으로 코팅된 ELISA 플레이트 상에 부동화시키고, 정제된 재조합 토끼 항-아펠린 mAb 를 플레이트 상의 펩티드에 대한 결합을 위해 첨가했다. 결합을 염소 항-토끼 IgG Fc (알칼리성 포스파타아제에 접합됨) 및 PNPP 기질을 첨가함으로써 검출하고, 405 ㎚ 에서 흡광도로서 측정했다. 도 1A 는 ELISA 에 의해 측정되는 다양한 비오틴일화된 아펠린 펩티드에 대한 항-아펠린 mAbs C5, C8, C17, C24, C25, C26, C27, C4 및 C9 의 결합을 입증하는 그래프를 보여준다. 도 1B 는 ELISA 에 의해 측정되는 다양한 비오틴일화된 아펠린 펩티드에 대한 항-아펠린 mAbs C1, C6, C7, C10, C12, 및 C16 의 결합을 입증하는 그래프를 보여준다. 도 1C 는 ELISA 에 의해 측정되는 다양한 비오틴일화된 아펠린 펩티드에 대한 항-아펠린 mAbs C11, C14, C22, C20, 및 C13 의 결합을 입증하는 그래프를 보여준다.
도 2A-2K 는 아펠린 활성에 관한 세포-기반 어세이에서 선택된 항-아펠린 mAb 의 중화 효과를 보여준다. 아펠린 활성을 cAMP Hunter™ CHO-K1 AGTRL1 Gi 세포 (DiscoverX #95-0147C2) 에서 포스콜린 (FSK)-유도되는 cAMP 생산을 하향조절하는 그것의 능력에 관해 평가했다. 각각의 mAb 를 소정의 희석률에서 트리플리케이트 (triplicate) 로 어세이했다. 소정의 농도에서 mAb 에 의한 % 저해를 계산하기 위해서, 0% 저해는 아펠린 치료를 받은 FSK-자극된 세포로부터의 신호로서 정의했고, 100% 저해는 아펠린 치료를 받지 않은 FSK-자극된 세포로부터의 신호로서 정의했다. % 저해를 mAb 의 증가하는 농도에 대해 플롯팅했다. 도 2A 는 항-아펠린 mAb C1 의 활성의 그래프를 보여준다. 도 2B 는 항-아펠린 mAb C6 의 활성의 그래프를 보여준다. 도 2C 는 항-아펠린 mAb C7 의 활성의 그래프를 보여준다. 도 2D 는 항-아펠린 mAb C8 의 활성의 그래프를 보여준다. 도 2E 는 항-아펠린 mAb C24 의 활성의 그래프를 보여준다. 도 2F 는 항-아펠린 mAb C25 의 활성의 그래프를 보여준다. 도 2G 는 항-아펠린 mAb C10 의 활성의 그래프를 보여준다. 도 2H 는 항-아펠린 mAb C11 의 활성의 그래프를 보여준다. 도 2I 는 항-아펠린 mAb C12 의 활성의 그래프를 보여준다. 도 2J 는 항-아펠린 mAb C22 의 활성의 그래프를 보여준다. 도 2K 는 항-아펠린 mAb C26 의 활성의 그래프를 보여준다.
도 3A-3C 는 ELISA 에 의해 측정되는 표 7 에서의 경쟁 펩티드에 의한 항-아펠린 mAbs C8, C24 및 C25 에 대한 비오틴-아펠린-13 (SEQ ID NO:165) 결합의 저해를 입증하는 그래프를 보여준다. 염소-항-토끼 IgG 를 ELISA 플레이트 상에 부동화시켰다. 토끼 항-아펠린 mAb (C8, C24, 또는 C25) 및 경쟁 펩티드의 혼합물을 30 분 동안 실온에서 예비인큐베이션하고, 그 후 비오틴-아펠린-13 (SEQ ID NO:165) 을 첨가하고, 혼합하고, 최종 용액을 플레이트 상에 첨가했다. 부동화시킨 항-아펠린 mAb, C8 (도 3A), C24 (도 3B), 및 C25 (도 3C) 에 대한 비오틴-아펠린-13 (SEQ ID NO:165) 의 결합을, 스트렙타비딘 (알칼리성 포스파타아제에 접합됨) 및 PNPP 기질을 첨가함으로써 검출하고, 405 ㎚ 에서 흡광도로서 측정했다.
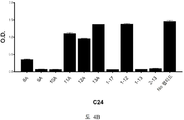
도 4A-4C 는 ELISA 에 의해 측정되는 에피토프 8-13 (KGPMPF (SEQ ID NO:188)) 에서 유래하는 알라닌 스캐닝 (scanning) 펩티드 (표 8) 에 의한 항-아펠린 mAbs C8, C24 및 C25 에 대한 비오틴-아펠린-13 (SEQ ID NO:165) 결합의 저해를 입증하는 그래프를 보여준다. 염소 항-토끼 IgG 를 ELISA 플레이트 상에 부동화시켰다. 토끼 항-아펠린 mAb (C8, C24, 또는 C25) 및 알라닌 스캐닝 펩티드의 혼합물을 30 분 동안 실온에서 예비인큐베이션하고, 그 후 비오틴-아펠린-13 (SEQ ID NO:165) 을 첨가하고, 혼합하고, 최종 용액을 플레이트 상에 첨가했다. 부동화시킨 항-아펠린 mAbs, C8 (도 4A), C24 (도 4B), 및 C25 (도 4C) 에 대한 비오틴-아펠린-13 (SEQ ID: 165) 의 결합을 스트렙타비딘 (알칼리성 포스파타아제에 접합됨) 및 PNPP 기질을 첨가함으로써 검출하고, 405 ㎚ 에서 흡광도로서 측정했다. 여러 경쟁 펩티드를 컨트롤로서 사용했다.
도 5A-5C 는 ELISA 에 의해 측정되는 표 9 에서의 경쟁 펩티드에 의한 항-아펠린 mAbs C1, C6 및 C7 에 대한 아펠린-13-비오틴 ((QRPRLSHKGPMPF-비오틴 (SEQ ID NO:165)) 결합의 저해를 입증하는 그래프를 보여준다. 염소-항-토끼 IgG 를 ELISA 플레이트 상에 부동화시켰다. 토끼 항-아펠린 mAb (C1, C6, 또는 C7) 및 경쟁 펩티드의 혼합물을 30 분 동안 실온에서 예비인큐베이션하고, 그 후 아펠린-13-비오틴 (SEQ ID NO:165) 을 첨가하고, 혼합하고, 최종 용액을 플레이트 상에 첨가했다. 부동화시킨 항-아펠린 mAbs, C1 (도 5A), C6 (도 5B), 및 C7 (도 5C) 에 대한 아펠린-13-비오틴 (SEQ ID NO:165) 의 결합을 스트렙타비딘 (알칼리성 포스파타아제에 접합됨) 및 PNPP 기질을 첨가함으로써 검출하고, 405 ㎚ 에서 흡광도로서 측정했다.
도 6A-6B 는 ELISA 에 의해 측정되는 에피토프 1-5 (QRPRL (SEQ ID NO: 204)) 에서 유래하는 알라닌 스캐닝 펩티드 (표 10) 에 의한 항-아펠린 mAbs C6 (도 6A) 및 C7 (도 6B) 에 대한 아펠린-13-비오틴 (SEQ ID NO:165) 결합의 저해를 입증하는 그래프를 보여준다.
도 7A-7B 는 세포-기반 어세이에서 인간화된 항-아펠린 mAb A31 의 IC50 곡선을 보여준다. 아펠린 활성을 cAMP Hunter™ CHO-K1 AGTRL1 Gi 세포 (DiscoverX #95-0147C2) 에서 포스콜린 (FSK)-유도되는 cAMP 생산을 하향조절하는 그것의 능력에 관해 평가하고, 항-아펠린 mAb 의 활성을 아펠린의 저해 효과를 역전시키는 그것의 능력에 관해 평가했다. 도 7A 는 아펠린 13 (APL13) 이 어세이에서 사용되었을 때의 IC50 그래프를 보여준다. 도 7B 는 파이로-아펠린 13 (pyroAPL13) 이 어세이에서 사용되었을 때의 IC50 그래프를 보여준다. CPS, 초 당 카운트수.
도 8 은 이종이식 모델에서 종양 성장에 대한 인간화된 항-아펠린 mAb A31 의 효과를 보여준다. mAb 를 단독으로 또는 베바시주맙과의 조합으로 시험했다; 베바시주맙 단독을 또한 연구에 포함시켰다.
발명의 상세한 설명
다양한 발행물, 논문 및 특허가 배경 및 명세서 전반에 걸쳐 인용되거나 기재되며; 이들 참고문헌 각각은 그 전문이 본원에 참조로 포함된다. 본 명세서에 포함된 문헌, 행위, 재료, 장치, 물품 등의 논의는 본 발명의 맥락을 제공하기 위한 것이다. 이러한 논의는 이들 사안 중 임의의 것 또는 전부가 개시되거나 청구된 임의의 발명과 관련하여 종래 기술의 일부를 형성한다는 것을 인정하는 것은 아니다.
다르게 정의하지 않으면, 본원에서 사용되는 모든 기술적 및 과학적 용어는, 본 발명이 적용되는 기술 분야의 당업자에게 통상적으로 이해되는 바와 동일한 의미를 갖는다. 다르게는, 본원에서 사용되는 특정 용어는 본 명세서에서 나타내는 바와 같은 의미를 갖는다.
본원 및 첨부된 청구범위에서 사용되는 바와 같이, 단수 형태의 "부정 관사" 및 "정관사" 는, 문맥이 다르게 명확하게 지시하지 않으면, 복수의 대상을 포함한다는 것에 유의해야 한다.
다르게 언급되지 않으면, 본원에 기재된 농도 또는 농도 범위와 같은 임의의 수치는 용어 "약" 에 의해 모든 경우에 변형되는 것으로서 이해되어야 한다. 따라서, 수치는 전형적으로 인용된 값의 ±10% 를 포함한다. 예를 들어, 1 ㎎/㎖ 의 농도는 0.9 ㎎/㎖ 내지 1.1 ㎎/㎖ 를 포함한다. 마찬가지로, 1% 내지 10% (w/v) 의 농도 범위는 0.9% (w/v) 내지 11% (w/v) 를 포함한다. 본원에서 사용되는 바와 같이, 수치 범위의 사용은 맥락상 명백하게 다르게 나타내지 않으면, 모든 가능한 하위범위, 그러한 범위 내의 정수 및 값의 분수를 포함하는 그 범위 내의 모든 개별 수치를 명시적으로 포함한다.
다르게 나타내지 않으면, 일련의 요소에 선행하는 용어 "적어도" 는 일련의 모든 요소를 지칭하는 것으로 이해되어야 한다. 당업자는 본원에 기재된 본 발명의 특정 구현예에 대한 많은 등가물을, 단지 일상적인 실험을 사용하여 인식하거나, 확인할 수 있을 것이다. 이러한 등가물은 본 발명에 포함되는 것으로 의도된다.
본원에서 사용되는, 용어 "망라하다", "망라하는", "포함하다", "포함하는", "갖다", "갖는", "함유하다" 또는 "함유하는" 또는 이의 임의의 다른 변형은, 언급된 정수 또는 정수의 군을 포함하나 임의의 다른 정수 또는 정수의 군을 배제하지는 않는 것으로 이해될 것이며, 비-배타적이거나 개방형인 것으로 의도된다. 예를 들어, 요소의 목록을 포함하는 조성물, 혼합물, 공정, 방법, 물품 또는 장치는 반드시 이들 요소에만 한정되는 것이 아니라, 이러한 조성물, 혼합물, 공정, 방법, 물품 또는 장치에 고유하지 않거나 명백하게 열거되지 않은 다른 요소를 포함할 수 있다. 또한, 반대로 명시적으로 언급되지 않으면, "또는" 은 포괄적인 것을 나타내거나 배타적이지 않은 것을 나타낸다. 예를 들어, 조건 A 또는 B 는 하기 중 어느 하나에 의해 충족된다: A 가 참 (또는 존재함) 이고 B 가 거짓 (또는 존재하지 않음), A 가 거짓 (또는 존재하지 않음) 이고 B 가 참 (또는 존재함), 그리고 A 와 B 둘 모두가 참 (또는 존재함).
본원에서 사용되는, 다수의 인용된 요소 사이의 결합 용어 "및/또는" 은 개별 및 조합된 옵션 둘 모두를 포함하는 것으로서 이해된다. 예를 들어, 두 요소가 "및/또는" 으로 결합되는 경우, 첫 번째 옵션은, 두 번째 요소가 없는 첫 번째 요소의 적용 가능성을 나타낸다. 두 번째 옵션은, 첫 번째 요소가 없는 두 번째 요소의 적용 가능성을 나타낸다. 세 번째 옵션은, 첫 번째 요소와 두 번째 요소 함께의 적용 가능성을 나타낸다. 이들 옵션 중 임의의 하나는 그 의미에 포함되는 것으로서 이해되며, 따라서 본원에서 사용되는 용어 "및/또는" 의 요건을 충족시킨다. 하나 이상의 옵션의 동시 적용 가능성 또한 그 의미에 속하는 것으로서 이해되며, 따라서 용어 "및/또는" 의 요건을 총족시킨다.
본원에서 사용되는, 명세서 및 청구범위 전반에 걸쳐 사용된 용어 "이루어지다", 또는 "~로 이루어지다" 또는 "~로 이루어지는" 과 같은 변형은 임의의 언급된 정수 또는 정수의 군을 포함하나, 추가 정수 또는 정수의 군은 명시된 방법, 구조 또는 조성물에 추가될 수 없다는 것을 나타낸다.
본원에서 사용되는, 명세서 및 청구범위 전반에 걸쳐 사용된 용어 "본질적으로 이루어지다", 또는 "~로 본질적으로 이루어지다" 또는 "~로 본질적으로 이루어지는" 과 같은 변형은 임의의 언급된 정수 또는 정수의 군을 포함하고, 명시된 방법, 구조 또는 조성물의 기본 또는 신규 특성을 실질적으로 변화시키지 않는 임의의 언급된 정수 또는 정수의 군을 선택적으로 포함한다는 것을 나타낸다. M.P.E.P. § 2111.03 을 참조한다.
본원에서 사용되는, "대상체" 는 임의의 동물, 바람직하게는 포유동물, 가장 바람직하게는 인간을 의미한다. 본원에서 사용되는 용어 "포유동물" 은 임의의 포유동물을 포함한다. 포유동물의 예는 소, 말, 양, 돼지, 고양이, 개, 마우스, 랫트, 토끼, 기니피그, 원숭이, 인간 등, 보다 바람직하게는 인간을 포함하지만, 이에 제한되지는 않는다.
단어 "우측", "좌측", "하측" 및 "상측" 은 참조하는 도면에서의 방향을 지정한다.
또한, 바람직한 발명의 성분의 치수 또는 특징을 나타낼 때 본원에서 사용되는 용어 "약", "대략", "일반적으로", "실질적으로" 및 유사한 용어는, 기재한 치수/특징이 엄격한 경계 또는 매개변수가 아니며 당업자에게 이해되는 바와 같이 기능적으로 동일하거나 유사한 작은 변형을 그로부터 배제하지 않는다는 것을 나타낸다는 것이 이해되어야 한다. 최소한, 수치 매개변수를 포함하는 이러한 참조는 당업계에서 허용되는 수학적 및 산업적 원리 (예를 들어, 반올림, 측정 또는 다른 계통 오차, 제작 공차 등) 를 사용하여 최하위 숫자를 변화시키지 않는 변형을 포함할 것이다.
둘 이상의 핵산 또는 폴리펩티드 서열 (예를 들어, 항-아펠린 항체, 아펠린 폴리펩티드 및 이를 인코딩하는 폴리뉴클레오티드) 의 맥락에서, 용어 "동일한" 또는 "동일성" % 는, 하기의 서열 비교 알고리즘 중 하나를 사용하거나 육안 검사에 의해 측정되는, 최대 상응성에 대해 비교되고 정렬될 때 동일한 아미노산 잔기 또는 뉴클레오티드의 명시된 % 를 갖거나 동일한, 둘 이상의 서열 또는 하위서열을 나타낸다.
서열 비교를 위해, 전형적으로 하나의 서열은 시험 서열을 그에 대해 비교하는 참조 서열로서 역할한다. 서열 비교 알고리즘을 사용하는 경우, 시험 및 참조 서열이 컴퓨터에 입력되고, 필요하다면 하위서열 좌표가 지정되며, 서열 알고리즘 프로그램 매개변수가 지정된다. 이후, 서열 비교 알고리즘은 지정된 프로그램 매개변수를 기반으로 하여, 참조 서열에 대한 시험 서열(들)의 서열 동일성 % 를 계산한다.
비교를 위한 서열의 최적 정렬은 예를 들어, Smith & Waterman, Adv. Appl. Math. 2:482 (1981) 의 국부적 상동성 알고리즘에 의해, Needleman & Wunsch, J. Mol. Biol. 48:443 (1970) 의 상동성 정렬 알고리즘에 의해, Pearson & Lipman, Proc. Nat'l. Acad. Sci. USA 85:2444 (1988) 의 유사성 방법에 대한 검색에 의해, 이들 알고리즘의 컴퓨터화된 구현 (Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Dr., Madison, WI 에서의 GAP, BESTFIT, FASTA 및 TFASTA) 에 의해, 또는 육안 검사에 의해 (일반적으로, Current Protocols in Molecular Biology, F.M. Ausubel et al., eds., Current Protocols, a joint venture between Greene Publishing Associates, Inc. and John Wiley & Sons, Inc., (1995 Supplement) (Ausubel) 참조) 실시할 수 있다.
서열 동일성 % 및 서열 유사성을 결정하기에 적합한 알고리즘의 예는 각각 Altschul et al. (1990) J. Mol. Biol. 215: 403-410 및 Altschul et al. (1997) Nucleic Acids Res. 25: 3389-3402 에 기재되는 BLAST 및 BLAST 2.0 알고리즘이다. BLAST 분석을 수행하기 위한 소프트웨어는 국립생물정보센터를 통해 공개적으로 입수가능하다. 이 알고리즘은, 첫 번째로, 데이터베이스 서열 중 동일한 길이의 워드 (word) 와 정렬될 때 매칭되거나 일부 양의 값인 역치 스코어 T 를 충족시키는, 질의 서열 내 길이 W 의 짧은 워드를 확인함으로써 고 스코어 서열 쌍 (HSP) 을 확인하는 것을 수반한다. T 는, 인접 워드 스코어 역치로서 지칭된다 (상기 Altschul et al.). 이와 같이 처음에 출현하는 인접 워드 히트 (word hit) 는, 이를 포함하는 더 긴 HSP 를 찾기 위한 검색을 개시하는 시드 (seed) 로서 역할한다. 워드 히트는, 누적 정렬 스코어가 증가할 수 있는 한, 각각의 서열을 따라서 양 방향으로 연장된다.
누적 스코어는, 뉴클레오티드 서열에 대해, 매개변수 M (매칭 잔기 쌍에 대한 보상 스코어; 항상 > 0) 및 N (미스매칭 잔기에 대한 패널티 스코어; 항상 < 0) 을 사용하여 계산된다. 아미노산 서열에 대해, 스코어링 매트릭스가 누적 스코어를 계산하기 위해 사용된다. 각 방향에서 단어 히트의 연장은 누적 정렬 스코어가 이의 최대 획득 값으로부터 X 분량만큼 떨어질 때; 하나 이상의 음-스코어 잔기 정렬의 축적으로 인해 누적 스코어가 0 이하가 될 때; 또는 어느 하나의 서열의 말단에 도달될 때 중단된다. BLAST 알고리즘 매개변수 W, T 및 X 는 정렬의 감도와 속도를 결정한다. (뉴클레오티드 서열용) BLASTN 프로그램은 워드 길이 (W) 11, 예상치 (E) 10, M = 5, N = -4 를 디폴트 값으로 사용하며, 두 가닥 모두를 비교한다. 아미노산 서열에 대해, BLASTP 프로그램은 워드 길이 (W) 3, 예상치 (E) 10 및 BLOSUM62 스코어링 매트릭스 (Henikoff & Henikoff, Proc. Natl. Acad. Sci. USA 89:10915 (1989) 참조) 를 디폴트 값으로서 사용한다.
서열 동일성 % 를 계산하는 것에 추가로, BLAST 알고리즘은 또한 2 개 서열 사이의 유사성의 통계적 분석을 수행한다 (예를 들어, Karlin & Altschul, Proc. Nat'l. Acad. Sci. USA 90:5873-5787 (1993) 참조). BLAST 알고리즘에 의해 제공되는 유사성에 관한 한 척도는 최소 확률 합 (P(N)) 이며, 이는 2 개 뉴클레오티드 또는 아미노산 서열 사이의 매칭이 우연히 일어날 확률의 표시를 제공한다. 예를 들어, 만약 기준 핵산에 대한 시험 핵산 비교시 최소 확률 합이 약 0.1 미만, 보다 바람직하게는 약 0.01 미만, 가장 바람직하게는 약 0.001 미만이라면, 해당 핵산은 기준 서열과 유사한 것으로 간주된다.
2 개의 핵산 서열 또는 폴리펩티드가 실질적으로 동일하다는 추가의 표시는, 하기 기재된 바와 같이, 제 1 핵산에 의해 인코딩된 폴리펩티드가 제 2 핵산에 의해 인코딩된 폴리펩티드와 면역학적으로 교차 반응성이라는 것이다. 따라서, 폴리펩티드는 전형적으로 예를 들어 2 개의 펩티드가 보존적 치환에 의해서만 상이한 제 2 폴리펩티드와 실질적으로 동일하다. 2 개의 핵산 서열이 실질적으로 동일하다는 또 다른 표시는, 2 개의 분자가 엄격한 조건 하에 서로 하이브리드화한다는 것이다.
본원에서 사용되는, 용어 "저해하다", "저해하는" 및 "저해" 는 활성, 반응, 병상, 질환 또는 기타 생물학적 매개변수를 감소시키는 것을 의미한다. 이는 활성, 반응, 병상 또는 질환의 완전한 제거를 포함할 수 있으나 이에 제한되는 것은 아니다. 이는 또한 예를 들어, 네이티브 또는 컨트롤 수준과 비교하여 활성, 반응, 병상 또는 질환의 10% 감소를 포함할 수 있다. 따라서, 감소는 네이티브 또는 컨트롤 수준과 비교하여 10, 20, 30, 40, 50, 60, 70, 80, 90, 100%, 또는 그 사이의 임의의 감소량일 수 있다. 비제한적인 예로서, 본 발명의 항체는 아펠린 단백질의 활성을 저해할 수 있다. 아펠린 단백질의 활성은 네이티브 아펠린 단백질 활성에 비해 감소되거나 제거될 수 있다.
항체
본 발명은 일반적으로 단리된 항-아펠린 항체, 항체를 인코딩하는 핵산 및 발현 벡터, 벡터를 포함하는 재조합 세포, 및 항체를 포함하는 조성물에 관한 것이다. 항체를 제조하는 방법, 및 항체를 사용하여 질환, 예를 들어, 당뇨병성 망막병증 (DR) (예를 들어, 증식성 당뇨병성 망막병증 (PDR) 및 비증식성 당뇨병성 망막병증 (NPDR)), 연령관련 황반변성 (AMD), 당뇨병성 황반부종 (DME), 망막 정맥 폐쇄 (RVO) 후 황반부종, 망막변성, 근시 맥락막 혈관신생 (mCNV), 당뇨병성 신경병증, 만성 신장 질환 (CKD), 비알코올성 지방간염 (NASH), 간경화증, 경화반내 혈관신생, 홍채 홍색증, 신생혈관 녹내장, 각막 혈관신생 (CNV), 미숙아 망막병증 (ROP), 망막병증, 황반변성, 난소 과다자극 증후군 (OHSS), 자궁 출혈, 자궁내막증, 자궁내막 이상증식증 및 암, 자궁평활근종, 선근증, 암 (예를 들어, 고체 종양 및 혈액 악성종양), 및 섬유증 (예를 들어, 병리학적 및 생리학적 섬유증, 신장 섬유증, 심장 섬유증, 간 섬유증, 및 폐 섬유증) 을 치료하는 방법이 또한 제공된다. 본 발명의 항체는 아펠린에 대한 높은-친화도 결합, 아펠린에 대한 높은 특이성, 및 아펠린 수용체에 대한 아펠린의 결합을 차단하는 능력을 포함하나 그에 제한되지 않는 하나 이상의 바람직한 기능적 특성을 보유한다.
일반적 양태에서, 본 발명은 아펠린에 특이적으로 결합하는 단리된 모노클로날 항체 또는 그의 항원-결합 단편에 관한 것이다.
본원에서 사용되는, 용어 "항체" 는 넓은 의미로 사용되며 인간, 인간화, 복합 및 키메라 항체, 및 항체 단편 (모노클로날 또는 폴리클로날) 을 포함하는 면역글로불린 및 항체 분자를 포함한다. 일반적으로, 항체는 특정 항원에 대한 결합 특이성을 나타내는 단백질 또는 펩티드 사슬이다. 항체 구조는 널리 공지되어 있다. 면역글로불린은 중쇄 불변 도메인 아미노산 서열에 따라 5 개 주요 클래스 (즉, IgA, IgD, IgE, IgG 및 IgM) 로 배정될 수 있다. IgA 및 IgG 는 아이소타입 IgA1, IgA2, IgG1, IgG2, IgG3 및 IgG4 로서 추가로 하위분류된다. 따라서, 본 발명의 항체는 5 개의 주요 클래스 중 어느 하나 또는 상응하는 서브클래스의 것일 수 있다. 바람직하게는, 본 발명의 항체는 IgG1, IgG2, IgG3 또는 IgG4 이다. 척추동물 종의 항체 경쇄는 그의 불변 도메인의 아미노산 서열에 기반하여, 2 개의 명확히 구별되는 유형, 즉 카파 및 람다 중 하나에 배정될 수 있다. 따라서, 본 발명의 항체는 카파 또는 람다 경쇄 불변 도메인을 함유할 수 있다. 특정 구현예에 따르면, 본 발명의 항체는 랫트 또는 인간 항체로부터의 중쇄 및/또는 경쇄 불변 영역을 포함한다. 중쇄 및 경쇄 불변 도메인에 추가로, 항체는 경쇄 가변 영역 및 중쇄 가변 영역로 구성되는 항원-결합 부위를 함유하며, 이의 각각은 3 개의 도메인을 포함한다 (즉, 상보성 결정 부위 1-3; (CDR1, CDR2 및 CDR3)). 경쇄 가변 영역 도메인은 대안적으로 LCDR1, LCDR2 및 LCDR3 으로 지칭되며, 중쇄 가변 영역 도메인은 대안적으로 HCDR1, HCDR2 및 HCDR3 으로 지칭된다.
본원에서 사용되는, 용어 "단리된 항체" 는 상이한 항원 특이성을 갖는 다른 항체가 실질적으로 없는 항체를 나타낸다 (예를 들어, 아펠린에 특이적으로 결합하는 단리된 항체에는 아펠린에 결합하지 않는 항체가 실질적으로 없음). 또한, 단리된 항체에는 다른 세포 물질 및/또는 화학 물질이 실질적으로 없다.
본원에서 사용되는, 용어 "모노클로날 항체" 는 실질적으로 균질한 항체의 모집단으로부터 수득되는 항체를 나타내며, 즉, 모집단을 포함하는 개별 항체는 소량으로 존재할 수 있는, 자연적으로 발생할 수 있는 돌연변이를 제외하고는, 동일하다. 본 발명의 모노클로날 항체는 하이브리도마 방법, 파지 디스플레이 기술, 단일 림프구 유전자 클로닝 기술 또는 재조합 DNA 방법에 의해 생성될 수 있다. 예를 들어, 모노클로날 항체는 인간 중쇄 이식 유전자 및 경쇄 이식 유전자를 포함하는 게놈을 갖는 트랜스제닉 마우스 또는 랫트와 같은 트랜스제닉 비인간 동물로부터 수득한 B 세포를 포함하는 하이브리도마에 의해 생산될 수 있다.
본원에서 사용되는, 용어 "항원-결합 단편" 은 항체 단편, 예를 들어, 디아바디, Fab, Fab', F(ab')2, Fv 단편, 디술피드 안정화 Fv 단편 (dsFv), (dsFv)2, 이중특이적 dsFv (dsFv-dsFv'), 디술피드 안정화 디아바디 (ds 디아바디), 단일 사슬 항체 분자 (scFv), 단일 도메인 항체 (sdab) scFv 이합체 (2가 디아바디), 하나 이상의 CDR 을 포함하는 항체의 일부로부터 형성된 다중특이적 항체, 카멜화 (camelized) 단일 도메인 항체, 나노바디, 도메인 항체, 2가 도메인 항체, 또는 항원에 결합하나 전체 항체 구조를 포함하지 않는 임의의 다른 항체 단편을 나타낸다. 항원-결합 단편은 모 항체 또는 모 항체 단편이 결합하는 동일한 항원에 결합할 수 있다. 특정 구현예에 따르면, 항원-결합 단편은 경쇄 가변 영역, 경쇄 불변 영역 및 중쇄의 Fd 세그먼트를 포함한다. 다른 특정 구현예에 따르면, 항원-결합 단편은 Fab 및 F(ab') 를 포함한다.
본원에서 사용되는, 용어 "단일 사슬 항체" 는 약 15 내지 약 20 개 아미노산의 짧은 펩티드에 의해 연결된 중쇄 가변 영역 및 경쇄 가변 영역을 포함하는, 당해 분야에서의 종래의 단일 사슬 항체를 나타낸다. 본원에서 사용되는, 용어 "단일 도메인 항체" 는 중쇄 가변 영역 및 중쇄 불변 영역을 포함하거나 중쇄 가변 영역만을 포함하는 당해 분야에서의 종래의 단일 도메인 항체를 나타낸다.
본원에서 사용되는, 용어 "인간 항체" 는 당업계에 공지된 임의의 기술을 사용하여 만들어진 인간에 의해 생성된 항체에 상응하는 아미노산 서열을 갖는 항체 또는 인간에 의해 생성된 항체를 나타낸다. 인간 항체의 이러한 정의는 온전한 또는 전장 항체, 이의 단편, 및/또는 적어도 하나의 인간 중쇄 및/또는 경쇄 폴리펩티드를 포함하는 항체를 포함한다.
본원에서 사용되는, 용어 "인간화된 항체" 는 항체의 항원-결합 특성이 유지되나 인체 내 그의 항원성이 감소되도록, 인간 항체에 대한 서열 상동성을 증가시키기 위해 변형되는 비인간 항체를 나타낸다.
본원에서 사용되는, 용어 "키메라 항체" 는 면역글로불린 분자의 아미노산 서열이 둘 이상의 종으로부터 유래되는 항체를 나타낸다. 경쇄 및 중쇄 둘 모두의 가변 영역은 종종, 원하는 특이성, 친화도 및 능력을 갖는 한 종의 포유동물 (예를 들어, 마우스, 랫트, 토끼 등) 로부터 유래된 항체의 가변 영역에 상응하는 한편, 불변 영역은 또 다른 종의 포유동물 (예를 들어, 인간) 로부터 유래된 항체의 서열에 상응하여, 그 종에서 면역 반응을 유발하는 것을 방지한다.
본원에서 사용되는, 용어 "다중특이적 항체" 는 복수의 면역글로불린 가변 도메인 서열을 포함하는 항체를 나타내며, 여기서 복수의 제 1 면역글로불린 가변 도메인 서열은 제 1 에피토프에 대한 결합 특이성을 가지고, 복수의 제 2 면역글로불린 가변 도메인 서열은 제 2 에피토프에 대한 결합 특이성을 갖는다. 한 구현예에서, 제 1 및 제 2 에피토프는 동일한 항원, 예를 들어 동일한 단백질 (또는 다합체성 단백질의 하위단위) 상에 있다. 한 구현예에서, 제 1 및 제 2 에피토프는 중첩되거나 실질적으로 중첩된다. 한 구현예에서, 제 1 및 제 2 에피토프는 중첩되지 않거나 실질적으로 중첩되지 않는다. 한 구현예에서, 제 1 및 제 2 에피토프는 상이한 항원, 예를 들어 상이한 단백질 (또는 상이한 다합체성 단백질의 하위단위) 상에 있다. 한 구현예에서, 다중특이적 항체는 제 3, 제 4 또는 제 5 면역글로불린 가변 도메인을 포함한다. 한 구현예에서, 다중특이적 항체는 이중특이적 항체 분자, 삼중특이적 항체 또는 사중특이적 항체 분자이다.
본원에서 사용된 바와 같은, 용어 "이중특이적 항체" 는 2 개 이하의 에피토프 또는 2 개의 항원에 결합하는 다중특이적 항체를 나타낸다. 이중특이적 항체는 제 1 에피토프에 대한 결합 특이성을 갖는 제 1 면역글로불린 가변 도메인 서열 및 제 2 에피토프에 대한 결합 특이성을 갖는 제 2 면역글로불린 가변 도메인 서열을 특징으로 한다. 하나의 구현예에서, 제 1 및 제 2 에피토프는 동일한 항원, 예를 들어 동일한 단백질 (또는 다합체성 단백질의 하위단위) 상에 있다. 하나의 구현예에서, 제 1 및 제 2 에피토프는 중첩되거나 실질적으로 중첩된다. 하나의 구현예에서, 제 1 및 제 2 에피토프는 상이한 항원, 예를 들어 상이한 단백질 (또는 상이한 다합체성 단백질의 하위단위) 상에 있다. 하나의 구현예에서, 이중특이적 항체는 제 1 에피토프에 대한 결합 특이성을 갖는 중쇄 가변 도메인 서열 및 경쇄 가변 도메인 서열, 및 제 2 에피토프에 대한 결합 특이성을 갖는 중쇄 가변 도메인 서열 및 경쇄 가변 도메인 서열을 포함한다. 하나의 구현예에서, 이중특이적 항체는 제 1 에피토프에 대한 결합 특이성을 갖는 하프 (half) 항체 또는 이의 단편, 및 제 2 에피토프에 대한 결합 특이성을 갖는 반-항체 또는 이의 단편을 포함한다. 하나의 구현예에서, 이중특이적 항체는 제 1 에피토프에 대한 결합 특이성을 갖는 scFv 또는 이의 단편, 및 제 2 에피토프에 대한 결합 특이성을 갖는 scFv 또는 이의 단편을 포함한다. 하나의 구현예에서, 제 1 에피토프는 아펠린 상에 위치하고, 제 2 에피토프는 VEGF, 안지오포이에틴-2 (ANG-2), 류신-풍부 알파-2-당단백질 1 (LRG1), PD-1, PD-L1, LAG-3, TIM-3, CTLA-4, HER-2, EGFR, CD19, CD73, CD47, CD20, CD33, DLL3, claudin18.2, TIP-1, CD3, PDGFβ, 콜라겐 유형 VI 수용체, TGF-베타 수용체, LOXL2, p75 뉴로트로핀 수용체 (NGFR p75), 및/또는 인슐린-유사 성장 인자 2 수용체 (IGF2R) 상에 위치한다. 특정 구현예에서, 본 발명의 항-아펠린 모노클로날 항체 또는 그의 항원-결합 단편 및 항-VEGF 항체 (예를 들어, 아바스틴® 또는 베바시주맙 바이오시밀러제) 또는 그의 항원-결합 단편은 아펠린 및 VEGF 둘 모두를 표적화하는 이중특이적 항체를 형성하도록 조작된다.
본원에서 사용되는, 용어 "아펠린" 은 프리프로아펠린으로 명명되는 77 아미노산 전구체 단백질, 및 그것의 가공된 아이소폼 (이는 아펠린-13, 아펠린-16, 아펠린-17, 아펠린-36, 아펠린-55, 및 77-아미노산 전구체에서 유래하는 기타 형태를 포함함) 을 나타낸다. 각각의 아이소폼은 구별되는 활성을 갖고, 클래스 A, 로돕신-유사, G-단백질 커플링된 수용체 (GPCR) 인 아펠린 수용체 APJ (또한 아펠린R, AGTRL1, 또는 APLNR 로 언급됨) 에 대한 리간드임으로써 작용한다. 아펠린 아이소폼의 수용체 결합 친화도는 상이하며, 이는 아펠린 수용체 APJ 의 세포내 신호전달을 유발함에 있어서의 상이한 효능을 설명할 수 있다. 아펠린/APJ 시스템은 혈압, 심장 수축성, 심혈관 긴장도, 조직 혈관신생, 물 항상성, 위장관 생리학, 대사 균형, 혈관 평활근 세포 (VSMC) 및 기타 세포 유형의 증식, 인간 탯줄 정맥 내피 세포에 대한 단핵구 부착, 심근경색후 심장 회복, 및 여러 조직 또는 기관에서의 병리학적 섬유증의 조절을 포함하나, 그에 제한되지 않는 많은 기관의 생리학 및 병리생리학에서 중요한 다양한 역할을 수행한다. 용어 "인간 아펠린" 은 인간으로부터 기원하는 아펠린을 나타낸다. 전구체 인간 아펠린의 예시적 아미노산 서열은 GenBank Accession No. AAF25815.1 (SEQ ID NO:221) 에 나타나 있다.
본원에서 사용되는, "아펠린에 특이적으로 결합하는" 항체는 아펠린, 바람직하게는 인간 아펠린에 KD 1×10-7 M 이하, 바람직하게는 1×10-8 M 이하, 보다 바람직하게는 5×10-9 M 이하, 1×10-9 M 이하, 5×10-10 M 이하, 또는 1×10-10 M 이하로 결합하는 항체를 나타낸다. 용어 "KD" 는 해리 상수를 나타내고, 이는 Kd 대 Ka 의 비 (즉, Kd/Ka) 로부터 수득되며 몰 농도 (M) 로 표시된다. 항체에 대한 KD 값은 본 개시물을 고려하여 당업계의 방법을 사용하여 결정될 수 있다. 예를 들어, 항체의 KD 는 표면 플라스몬 공명, 예컨대 바이오센서 시스템, 예를 들어 Biacore® 시스템을 사용하거나, 생체층 간섭계 기술, 예컨대 Octet RED96 시스템을 사용하여 결정될 수 있다.
항체의 KD 값이 작을수록, 항체가 표적 항원에 결합하는 친화도가 높아진다.
특정 양태에 따르면, 본 발명은 하기의 폴리펩티드 서열을 갖는, 중쇄 상보성 결정 영역 1 (HCDR1), HCDR2, HCDR3, 경쇄 상보성 결정 영역 1 (LCDR1), LCDR2, 및 LCDR3 을 포함하는 단리된 모노클로날 항체 또는 그의 항원-결합 단편에 관한 것이다:
(1) SEQ ID NOs:168, 169, 170, 171, 102, 및 172, 각각;
(2) SEQ ID NOs:50, 51, 52, 110, 111, 및 112, 각각;
(3) SEQ ID NOs:173, 174, 175, 176, 114, 및 115, 각각;
(4) SEQ ID NOs:68, 177, 178, 128, 129, 및 130, 각각;
(5) SEQ ID NOs:74, 75, 76, 134, 135, 및 136, 각각;
(6) SEQ ID NOs:179, 78, 180, 137, 138, 및 139, 각각;
(7) SEQ ID NOs:83, 84, 85, 143, 144, 및 145, 각각;
(8) SEQ ID NOs:86, 87, 88, 146, 147, 및 148, 각각;
(9) SEQ ID NOs:89, 90, 91, 149, 150, 및 151, 각각;
(10) SEQ ID NOs:92, 93, 94, 152, 153, 및 154, 각각;
(11) SEQ ID NOs:95, 96, 97, 155, 156, 및 157, 각각; 또는
(12) SEQ ID NOs:98, 99, 100, 158, 159, 및 160, 각각;
여기에서 항체 또는 그의 항원-결합 단편은 아펠린, 바람직하게는 인간 아펠린에 특이적으로 결합한다.
SEQ ID NO:168 은 아미노산 서열 X1NRX2S 로 표시되며, 여기에서 X1 은 S 또는 T 로부터 선택되는 아미노산이고, X2 은 M 또는 V 로부터 선택되는 아미노산이다.
SEQ ID NO:169 은 아미노산 서열 SIGSSPWX1ASWAX2G 로 표시되며, 여기에서 X1 은 Y 또는 F 로부터 선택되는 아미노산이고, X2 는 Q 또는 L 로부터 선택되는 아미노산이다.
SEQ ID NO:170 은 아미노산 서열 GGYRPGX1SX2 로 표시되며, 여기에서 X1 은 A 또는 G 로부터 선택되는 아미노산이고, X2 는 V 또는 I 로부터 선택되는 아미노산이다.
SEQ ID NO:171 은 아미노산 서열 QSSQSVYDNNDLX1 로 표시되며, 여기에서 X1 은 A 또는 G 로부터 선택되는 아미노산이다.
SEQ ID NO:172 은 아미노산 서열 AGGYX1GDIYT 로 표시되며, 여기에서 X1 은 S 또는 N 로부터 선택되는 아미노산이다.
SEQ ID NO:173 은 아미노산 서열 X1YAX2D 로 표시되며, 여기에서 X1 은 N 또는 S 로부터 선택되는 아미노산이고, X2 는 M 또는 I 로부터 선택되는 아미노산이다.
SEQ ID NO:174 은 아미노산 서열 VIAPNX1X2TX3YPTWARG 로 표시되며, 여기에서 X1 은 R, G, 또는 H 로부터 선택되는 아미노산이고; X2 는 R, A, 또는 Y 로부터 선택되는 아미노산이고; X3 은 Y 또는 C 로부터 선택되는 아미노산이다.
SEQ ID NO:175 은 아미노산 서열 YPIX1X2GX3NI 로 표시되며, 여기에서 X1 은 E 또는 D 로부터 선택되는 아미노산이고; X2 는 P, A, S, 또는 T 로부터 선택되는 아미노산이고; X3 은 A 또는 S 로부터 선택되는 아미노산이다.
SEQ ID NO:176 은 아미노산 서열 QSSESVX1X2NNQLS 로 표시되며, 여기에서 X1 은 D 또는 G 로부터 선택되는 아미노산이고, X2 는 Y, N, 또는 M 로부터 선택되는 아미노산이다.
SEQ ID NO:177 은 아미노산 서열 VIAPSX1TTYYPTWAKG 로 표시되며, 여기에서 X1 은 G 또는 S 로부터 선택되는 아미노산이다.
SEQ ID NO:178 은 아미노산 서열 YPIDPGSNX1 로 표시되며, 여기에서 X1 은 I 또는 V 로부터 선택되는 아미노산이다.
SEQ ID NO:179 은 아미노산 서열 X1X2AMD 로 표시되며, 여기에서 X1 은 N 또는 S 로부터 선택되는 아미노산이고, X2 은 Y 또는 H 로부터 선택되는 아미노산이다.
SEQ ID NO:180 은 아미노산 서열 YPIDX1GANV 로 표시되며, 여기에서 X1 은 V 또는 A 로부터 선택되는 아미노산이다.
또다른 특정 양태에 따르면, 본 발명은 SEQ ID NOs:1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37, 또는 39 중 하나와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 중쇄 가변 영역, 또는 SEQ ID NOs:2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 또는 40 중 하나와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함하는 단리된 모노클로날 항체 또는 그의 항원-결합 단편에 관한 것이다. 하나의 바람직한 구현예에 따르면, 본 발명의 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37, 또는 39 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 또는 40 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 경쇄 가변 영역 각각을 포함한다.
또다른 특정 양태에 따르면, 본 발명은 하기를 포함하는 본 발명의 단리된 모노클로날 항체 또는 그의 항원-결합 단편에 관한 것이다:
a. SEQ ID NO:1 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:2 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
b. SEQ ID NO:3 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:4 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
c. SEQ ID NO:5 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:6 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
d. SEQ ID NO:7 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:8 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
e. SEQ ID NO:9 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:10 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
f. SEQ ID NO:11 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:12 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
g. SEQ ID NO:13 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:14 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
h. SEQ ID NO:15 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:16 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
i. SEQ ID NO:17 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:18 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
j. SEQ ID NO:19 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:20 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
k. SEQ ID NO:21 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:22 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
l. SEQ ID NO:23 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:24 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
m. SEQ ID NO:25 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:26 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
n. SEQ ID NO:27 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:28 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
o. SEQ ID NO:29 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:30 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
p. SEQ ID NO:31 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:32 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
q. SEQ ID NO:33 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:34 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
r. SEQ ID NO:35 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:36 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
s. SEQ ID NO:37 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:38 의 폴리펩티드 서열을 갖는 경쇄 가변 영역; 또는
t. SEQ ID NO:39 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:40 의 폴리펩티드 서열을 갖는 경쇄 가변 영역.
하나의 구현예에서, 본 발명은, 각각, SEQ ID NOs:41, 42, 43, 101, 102, 및 103 의 폴리펩티드 서열을 갖는, HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 및 LCDR3 을 포함하는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편에 관한 것이다. 또다른 구현예에서, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:1 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:2 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다. 바람직하게는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:1 의 폴리펩티드 서열을 갖는 중쇄 가변 영역; 및 SEQ ID NO:2 의 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다.
하나의 구현예에서, 본 발명은, 각각, SEQ ID NOs:44, 45, 46, 104, 105, 및 106 의 폴리펩티드 서열을 갖는, HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 및 LCDR3 을 포함하는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편에 관한 것이다. 또다른 구현예에서, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:3 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:4 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다. 바람직하게는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:3 의 폴리펩티드 서열을 갖는 중쇄 가변 영역; 및 SEQ ID NO:4 의 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다.
하나의 구현예에서, 본 발명은, 각각, SEQ ID NOs:47, 48, 49, 107, 108, 및 109 의 폴리펩티드 서열을 갖는, HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 및 LCDR3 을 포함하는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편에 관한 것이다. 또다른 구현예에서, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:5 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:6 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다. 바람직하게는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:5 의 폴리펩티드 서열을 갖는 중쇄 가변 영역; 및 SEQ ID NO:6 의 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다.
하나의 구현예에서, 본 발명은, 각각, SEQ ID NOs:50, 51, 52, 110, 111, 및 112 의 폴리펩티드 서열을 갖는, HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 및 LCDR3 을 포함하는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편에 관한 것이다. 또다른 구현예에서, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:7 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:8 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다. 바람직하게는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:7 의 폴리펩티드 서열을 갖는 중쇄 가변 영역; 및 SEQ ID NO:8 의 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다.
하나의 구현예에서, 본 발명은, 각각, SEQ ID NOs:53, 54, 55, 113, 114, 및 115 의 폴리펩티드 서열을 갖는, HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 및 LCDR3 을 포함하는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편에 관한 것이다. 또다른 구현예에서, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:9 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:10 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다. 바람직하게는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:9 의 폴리펩티드 서열을 갖는 중쇄 가변 영역; 및 SEQ ID NO:10 의 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다.
하나의 구현예에서, 본 발명은, 각각, SEQ ID NOs:56, 57, 58, 116, 117, 및 118 의 폴리펩티드 서열을 갖는, HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 및 LCDR3 을 포함하는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편에 관한 것이다. 또다른 구현예에서, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:11 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:12 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다. 바람직하게는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:11 의 폴리펩티드 서열을 갖는 중쇄 가변 영역; 및 SEQ ID NO:12 의 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다.
하나의 구현예에서, 본 발명은, 각각, SEQ ID NOs:59, 60, 61, 119, 120, 및 121 의 폴리펩티드 서열을 갖는, HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 및 LCDR3 을 포함하는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편에 관한 것이다. 또다른 구현예에서, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:13 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:14 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다. 바람직하게는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:13 의 폴리펩티드 서열을 갖는 중쇄 가변 영역; 및 SEQ ID NO:14 의 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다.
하나의 구현예에서, 본 발명은, 각각, SEQ ID NOs:62, 63, 64, 122, 123, 및 124 의 폴리펩티드 서열을 갖는, HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 및 LCDR3 을 포함하는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편에 관한 것이다. 또다른 구현예에서, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:15 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:16 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다. 바람직하게는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:15 의 폴리펩티드 서열을 갖는 중쇄 가변 영역; 및 SEQ ID NO:16 의 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다.
하나의 구현예에서, 본 발명은, 각각, SEQ ID NOs:65, 66, 67, 125, 126, 및 127 의 폴리펩티드 서열을 갖는, HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 및 LCDR3 을 포함하는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편에 관한 것이다. 또다른 구현예에서, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:17 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:18 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다. 바람직하게는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:17 의 폴리펩티드 서열을 갖는 중쇄 가변 영역; 및 SEQ ID NO:18 의 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다.
하나의 구현예에서, 본 발명은, 각각, SEQ ID NOs:68, 69, 70, 128, 129, 및 130 의 폴리펩티드 서열을 갖는, HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 및 LCDR3 을 포함하는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편에 관한 것이다. 또다른 구현예에서, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:19 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:20 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다. 바람직하게는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:19 의 폴리펩티드 서열을 갖는 중쇄 가변 영역; 및 SEQ ID NO:20 의 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다.
하나의 구현예에서, 본 발명은, 각각, SEQ ID NOs:71, 72, 73, 131, 132, 및 133 의 폴리펩티드 서열을 갖는, HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 및 LCDR3 을 포함하는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편에 관한 것이다. 또다른 구현예에서, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:21 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:22 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다. 바람직하게는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:21 의 폴리펩티드 서열을 갖는 중쇄 가변 영역; 및 SEQ ID NO:22 의 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다.
하나의 구현예에서, 본 발명은, 각각, SEQ ID NOs:74, 75, 76, 134, 135, 및 136 의 폴리펩티드 서열을 갖는, HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 및 LCDR3 을 포함하는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편에 관한 것이다. 또다른 구현예에서, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:23 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:24 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다. 바람직하게는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:23 의 폴리펩티드 서열을 갖는 중쇄 가변 영역; 및 SEQ ID NO:24 의 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다.
하나의 구현예에서, 본 발명은, 각각, SEQ ID NOs:77, 78, 79, 137, 138, 및 139 의 폴리펩티드 서열을 갖는, HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 및 LCDR3 을 포함하는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편에 관한 것이다. 또다른 구현예에서, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:25 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:26 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다. 바람직하게는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:25 의 폴리펩티드 서열을 갖는 중쇄 가변 영역; 및 SEQ ID NO:26 의 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다.
하나의 구현예에서, 본 발명은, 각각, SEQ ID NOs:80, 81, 82, 140, 141, 및 142 의 폴리펩티드 서열을 갖는, HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 및 LCDR3 을 포함하는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편에 관한 것이다. 또다른 구현예에서, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:27 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:28 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다. 바람직하게는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:27 의 폴리펩티드 서열을 갖는 중쇄 가변 영역; 및 SEQ ID NO:28 의 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다.
하나의 구현예에서, 본 발명은, 각각, SEQ ID NOs:83, 84, 85, 143, 144, 및 145 의 폴리펩티드 서열을 갖는, HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 및 LCDR3 을 포함하는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편에 관한 것이다. 또다른 구현예에서, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:29 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:30 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다. 바람직하게는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:29 의 폴리펩티드 서열을 갖는 중쇄 가변 영역; 및 SEQ ID NO:30 의 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다.
하나의 구현예에서, 본 발명은, 각각, SEQ ID NOs:86, 87, 88, 146, 147, 및 148 의 폴리펩티드 서열을 갖는, HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 및 LCDR3 을 포함하는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편에 관한 것이다. 또다른 구현예에서, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:31 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:32 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다. 바람직하게는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:31 의 폴리펩티드 서열을 갖는 중쇄 가변 영역; 및 SEQ ID NO:32 의 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다.
하나의 구현예에서, 본 발명은, 각각, SEQ ID NOs:89, 90, 91, 149, 150, 및 151 의 폴리펩티드 서열을 갖는, HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 및 LCDR3 을 포함하는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편에 관한 것이다. 또다른 구현예에서, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:33 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:34 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다. 바람직하게는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:33 의 폴리펩티드 서열을 갖는 중쇄 가변 영역; 및 SEQ ID NO:34 의 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다.
하나의 구현예에서, 본 발명은, 각각, SEQ ID NOs:92, 93, 94, 152, 153, 및 154 의 폴리펩티드 서열을 갖는, HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 및 LCDR3 을 포함하는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편에 관한 것이다. 또다른 구현예에서, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:35 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:36 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다. 바람직하게는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:35 의 폴리펩티드 서열을 갖는 중쇄 가변 영역; 및 SEQ ID NO:36 의 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다.
하나의 구현예에서, 본 발명은, 각각, SEQ ID NOs:95, 96, 97, 155, 156, 및 157 의 폴리펩티드 서열을 갖는, HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 및 LCDR3 을 포함하는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편에 관한 것이다. 또다른 구현예에서, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:37 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:38 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다. 바람직하게는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:37 의 폴리펩티드 서열을 갖는 중쇄 가변 영역; 및 SEQ ID NO:38 의 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다.
하나의 구현예에서, 본 발명은, 각각, SEQ ID NOs:98, 99, 100, 158, 159, 및 160 의 폴리펩티드 서열을 갖는, HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 및 LCDR3 을 포함하는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편에 관한 것이다. 또다른 구현예에서, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:39 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:40 와 적어도 85%, 바람직하게는 90%, 더욱 바람직하게는 95% 동일한 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다. 바람직하게는, 단리된 모노클로날 항체 또는 그의 항원-결합 단편은 SEQ ID NO:39 의 폴리펩티드 서열을 갖는 중쇄 가변 영역; 및 SEQ ID NO:40 의 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함한다.
또다른 특정 양태에 따르면, 본 발명은 SEQ ID NO:188 의 아미노산 서열을 포함하는 에피토프에 특이적으로 결합하는 아펠린에 대한 단리된 모노클로날 항체 또는 그의 항원-결합 단편에 관한 것이다. 단리된 모노클로날 항체 또는 그의 항원-결합 단편은, 예를 들어, 아펠린 활성을 저해할 수 있다. 모노클로날 항체 또는 그의 항원-결합 단편은, 예를 들어, 파이로-아펠린-13, 아펠린-13, 아펠린-17, 아펠린-36, 아펠린-55, 및/또는 아펠린-13 과 동일한 C-말단 단부를 공유하는 다른 형태의 아펠린에 특이적으로 결합할 수 있다.
또다른 특정 양태에 따르면, 본 발명은 SEQ ID NO:204 의 아미노산 서열을 포함하는 에피토프에 특이적으로 결합하는 아펠린에 대한 단리된 모노클로날 항체 또는 그의 항원-결합 단편에 관한 것이다. 단리된 모노클로날 항체 또는 그의 항원-결합 단편은, 예를 들어, 아펠린 활성을 저해할 수 있다. 모노클로날 항체 또는 그의 항원-결합 단편은, 예를 들어, 아펠린-13 및/또는 파이로-아펠린-13 에 특이적으로 결합할 수 있다.
또다른 특정 양태에 따르면, 본 발명은 본 발명의 단리된 모노클로날 항체 또는 그의 항원-결합 단편에 관한 것이며, 여기에서 항체 또는 그의 항원-결합 단편은 키메라이다.
또다른 특정 양태에 따르면, 본 발명은 본 발명의 단리된 모노클로날 항체 또는 그의 항원-결합 단편에 관한 것이며, 여기에서 항체 또는 그의 항원-결합 단편은 인간 또는 인간화된 것이다.
또다른 특정 양태에 따르면, 본 발명은 단리된 인간화된 모노클로날 항체 또는 항원-결합 단편에 관한 것이며, 여기에서 단리된 인간화된 항체 또는 그의 항원-결합 단편은 하기를 포함한다:
a. SEQ ID NO:211 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:215 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
b. SEQ ID NO:212 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:215 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
c. SEQ ID NO:213 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:215 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
d. SEQ ID NO:214 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:215 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
e. SEQ ID NO:213 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:216 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
f. SEQ ID NO:214 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:216 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
g. SEQ ID NO:217 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:219 의 폴리펩티드 서열을 갖는 경쇄 가변 영역; 또는
h. SEQ ID NO:218 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:220 의 폴리펩티드 서열을 갖는 경쇄 가변 영역.
또다른 일반적 양태에서, 본 발명은 본 발명의 모노클로날 항체 또는 그의 항원-결합 단편을 인코딩하는 단리된 핵산에 관한 것이다. 단백질의 아미노산 서열을 변화시키지 않으면서 단백질의 코딩 서열이 변화 (예를 들어, 치환, 결실, 삽입 등) 될 수 있다는 것이 당업자에 의해 이해될 것이다. 따라서, 단백질의 아미노산 서열을 변화시키지 않으면서 본 발명의 모노클로날 항체 또는 그의 항원-결합 단편을 인코딩하는 핵산 서열이 변경될 수 있다는 것이 당업자에 의해 이해될 것이다.
또다른 일반적 양태에서, 본 발명은 본 발명의 모노클로날 항체 또는 그의 항원-결합 단편을 인코딩하는 단리된 핵산을 포함하는 벡터에 관한 것이다. 본 공개에 비추어 당업자에게 알려진 임의의 벡터, 예컨대 플라스미드, 코스미드, 파지 벡터 또는 바이러스 벡터가 사용될 수 있다. 일부 구현예에서, 벡터는 재조합 발현 벡터 예컨대 플라스미드이다. 벡터는 발현 벡터의 종래의 기능을 확립하기 위한 임의의 요소, 예를 들어 프로모터, 리보솜 결합 요소, 터미네이터, 인핸서, 선택 마커 및 복제 원점을 포함할 수 있다. 프로모터는 구성적, 유도성 또는 억제성 프로모터일 수 있다. 핵산을 세포에 전달할 수 있는 다수의 발현 벡터는 당업계에 공지되어 있으며, 세포에서 항체 또는 이의 항원-결합 단편의 생산을 위해 본원에서 사용될 수 있다. 종래의 클로닝 기법 또는 인공 유전자 합성을 사용하여 본 발명의 구현예에 따른 재조합 발현 벡터를 생성할 수 있다.
또다른 일반적 양태에서, 본 발명은 본 발명의 모노클로날 항체 또는 그의 항원-결합 단편을 인코딩하는 단리된 핵산을 포함하는 숙주 세포에 관한 것이다. 본 공개에 비추어 당업자에게 알려진 임의의 숙주 세포가 본 발명의 항체 또는 그의 항원-결합 단편의 재조합 발현을 위해 사용될 수 있다. 일부 구현예에서, 숙주 세포는 대장균 (E. coli) TG1 또는 BL21 세포 (예를 들어, scFv 또는 Fab 항체의 발현의 경우에), CHO-DG44 또는 CHO-K1 세포 또는 HEK293 세포 (예를 들어, 전장 IgG 항체의 경우에) 이다. 특정 구현예에 따르면, 재조합 발현 벡터는 화학적 트랜스펙션, 열 충격 또는 전기천공법과 같은 종래의 방법에 의해 숙주 세포 내로 형질전환되며, 재조합 발현 벡터는 재조합 핵산이 효과적으로 발현되도록 숙주 세포 게놈에 안정적으로 통합된다.
또다른 일반적 양태에서, 본 발명은 본 발명의 모노클로날 항체 또는 그의 항원-결합 단편을 생산하는 방법으로서, 모노클로날 항체 또는 그의 항원-결합 단편을 인코딩하는 핵산을 포함하는 세포를 본 발명의 모노클로날 항체 또는 그의 항원-결합 단편을 생산하는 조건 하에 배양하는 단계, 및 항체 또는 그의 항원-결합 단편을 세포 또는 세포 배양물로부터 (예를 들어, 상청액으로부터) 회수하는 단계를 포함하는 방법에 관한 것이다. 발현된 항체 또는 그의 항원-결합 단편은 당해 기술분야에 알려지고 본원에 기재된 바와 같은 종래의 기술에 따라 세포로부터 수확되고 정제될 수 있다.
약학적 조성물
또다른 일반적 양태에서, 본 발명은 본 발명의 단리된 모노클로날 항체 또는 그의 항원-결합 단편 및 약학적으로 허용가능한 담체를 포함하는 약학적 조성물에 관한 것이다. 본원에서 사용되는 용어 "약학적 조성물" 은 본 발명의 항체를 약학적으로 허용가능한 담체와 함께 포함하는 제품을 의미한다. 본 발명의 항체 및 이를 포함하는 조성물은 본원에서 언급된 치료적 응용을 위한 약제의 제조에서 또한 유용하다.
본원에서 사용되는, 용어 "담체" 는 임의의 부형제, 희석제, 충전제, 염, 완충제, 안정화제, 가용화제, 오일, 지질, 지질 함유 소포, 미소구체, 리포솜 캡슐화, 또는 약학 제형에서의 사용을 위해 당업계에 널리 공지된 다른 물질을 나타낸다. 담체, 부형제 또는 희석제의 특징이 특정 적용을 위한 투여 경로에 의존적일 것임이 이해될 것이다. 본원에서 사용되는, 용어 "약학적으로 허용가능한 담체" 는 본 발명에 따른 조성물의 효과 또는 본 발명에 따른 조성물의 생물학적 활성을 방해하지 않는 비-독성 물질을 나타낸다. 특정 구현예에 따르면, 본 개시물을 고려하여, 항체 약학 조성물에서 사용하기에 적합한 임의의 약학적으로 허용가능한 담체가 본 발명에서 사용될 수 있다.
약학적으로 허용가능한 담체를 갖는 약학적 활성 성분의 제형은 예를 들어 Remington: The Science and Practice of Pharmacy (예를 들어 21 판 (2005), 및 임의의 이후 판) 에서와 같이, 당업계에 공지되어있다. 추가적 성분의 비제한적 예는 완충제, 희석제, 용매, 등장성 조절제, 보존제, 안정화제 및 킬레이트제를 포함한다. 하나 이상의 약학적으로 허용가능한 담체가 본 발명의 약학 조성물을 제형화하는데 사용될 수 있다.
본 발명의 하나의 구현예에서, 약학 조성물은 액체 제형이다. 액체 제형의 바람직한 예는 수성 제형, 즉 물을 포함하는 제형이다. 액체 제형은 용액, 현탁액, 에멀젼, 마이크로에멀젼, 겔 등을 포함할 수 있다. 수성 제형은 전형적으로 적어도 50% w/w 의 물, 또는 적어도 60%, 70%, 75%, 80%, 85%, 90% w/w 또는 적어도 95% w/w 의 물을 포함한다.
하나의 구현예에서, 약학 조성물은 예를 들어 주사 장치 (예를 들어, 주사기 또는 주입 펌프) 를 통해 주사될 수 있는, 주사가능물질로서 제형화될 수 있다. 주사는 예를 들어 피하, 근육내, 복강내, 유리체강내 또는 정맥내로 전달될 수 있다.
또 다른 구현예에서, 약학 조성물은 고체 제형, 예를 들어, 동결 건조 또는 분무 건조된 조성물이며, 그대로 사용되거나, 의사 또는 환자가 사용 전에 이에 용매 및/또는 희석제를 첨가하여 사용될 수 있다. 고체 투약 형태는 정제, 예컨대 압축 정제 및/또는 코팅 정제, 및 캡슐 (예를 들어, 경질 또는 연질 젤라틴 캡슐) 을 포함할 수 있다. 약학 조성물은 또한 예를 들어 향낭, 드라제, 분말, 과립, 로젠지, 또는 재구성용 분말의 형태일 수 있다.
투약 형태는 수용성 또는 수분산성 담체를 포함할 수 있는 경우인 즉시 방출형일 수 있거나, 위장관 또는 피부 아래에서의 투약 형태의 용해 속도를 조절하는 수불용성 중합체를 포함할 수 있는 경우인 지연 방출, 지속 방출 또는 개량 방출일 수 있다.
다른 구현예에서, 약학 조성물은 비강내, 협내 또는 설하로 전달될 수 있다.
수성 제형 중의 pH 는 pH 3 내지 pH 10 일 수 있다. 본 발명의 하나의 구현예에서, 제형의 pH 는 약 7.0 내지 약 9.5 이다. 본 발명의 또 다른 구현예에서, 제형의 pH 는 약 3.0 내지 약 7.0 이다.
본 발명의 또 다른 구현예에서, 약학 조성물은 완충제를 포함한다. 완충제의 비제한적 예는 아르기닌, 아스파르트산, 비신, 시트레이트, 디소듐 히드로겐 포스페이트, 푸마르산, 글리신, 글리실글리신, 히스티딘, 리신, 말레산, 말산, 소듐 아세테이트, 소듐 카르보네이트, 소듐 디히드로겐 포스페이트, 소듐 포스페이트, 숙시네이트, 타르타르산, 트리신 및 트리스(히드록시메틸)-아미노메탄, 및 이의 혼합물을 포함한다. 완충제는 개별적으로 또는 합하여, 약 0.01 ㎎/㎖ 내지 약 50 ㎎/㎖, 예를 들어 약 0.1 ㎎/㎖ 내지 약 20 ㎎/㎖ 의 농도로 존재할 수 있다. 이러한 특정 완충제 중 각각을 포함하는 약학 조성물은 본 발명의 대안적인 구현예를 구성한다.
본 발명의 또 다른 구현예에서, 약학 조성물은 보존제를 포함한다. 보존제의 비제한적 예는 벤즈에토늄 클로라이드, 벤조산, 벤질 알코올, 브로노폴, 부틸 4-히드록시벤조에이트, 클로로부탄올, 클로로크레졸, 클로로헥시딘, 클로르페네신, o-크레졸, m-크레졸, p-크레졸, 에틸 4-히드록시벤조에이트, 이미드우레아, 메틸 4-히드록시벤조에이트, 페놀, 2-페녹시에탄올, 2-페닐에탄올, 프로필 4-히드록시벤조에이트, 소듐 데히드로아세테이트, 티오메로살, 및 이의 혼합물을 포함한다. 보존제는 개별적으로 또는 합하여, 약 0.01 ㎎/㎖ 내지 약 50 ㎎/㎖, 예를 들어 약 0.1 ㎎/㎖ 내지 약 20 ㎎/㎖ 의 농도로 존재할 수 있다. 이러한 특정 보존제 중 각각을 포함하는 약학 조성물은 본 발명의 대안적인 구현예를 구성한다.
본 발명의 또 다른 구현예에서, 약학 조성물은 등장화제를 포함한다. 구현예의 비제한적 예는 염 (예컨대 소듐 클로라이드), 아미노산 (예컨대 글리신, 히스티딘, 아르기닌, 리신, 이소류신, 아스파르트산, 트립토판 및 트레오닌), 알디톨 (예컨대 글리세롤, 1,2-프로판디올 프로필렌글리콜), 1,3-프로판디올 및 1,3-부탄디올), 폴리에틸렌글리콜 (예를 들어 PEG400), 및 이의 혼합물을 포함한다. 등장화제의 또 다른 예는 당을 포함한다. 당의 비제한적 예는 단당류, 이당류 또는 다당류, 또는 수용성 글루칸, 예를 들어 프룩토오스, 글루코오스, 만노오스, 소르보오스, 자일로오스, 말토오스, 락토오스, 수크로스, 트레할로오스, 덱스트란, 풀루란, 덱스트린, 시클로덱스트린, 알파 및 베타-HPCD, 가용성 전분, 히드록시에틸 전분 및 나트륨 카르복시메틸셀룰로오스일 수 있다. 등장화제의 또 다른 예는 당 알코올이며, 여기서 용어 "당 알코올" 은 적어도 하나의 -OH 기를 갖는 C(4-8) 탄화수소로서 정의된다. 당 알코올의 비제한적 예는 만니톨, 소르비톨, 이노시톨, 갈락티톨, 둘시톨, 자일리톨 및 아라비톨을 포함한다. 등장화제는 개별적으로 또는 합하여, 약 0.01 ㎎/㎖ 내지 약 50 ㎎/㎖, 예를 들어 약 0.1 ㎎/㎖ 내지 약 20 ㎎/㎖ 의 농도로 존재할 수 있다. 이러한 특정 등장화제 중 각각을 포함하는 약학 조성물은 본 발명의 대안적인 구현예를 구성한다.
본 발명의 또 다른 구현예에서, 약학 조성물은 킬레이트제를 포함한다. 킬레이트제의 비제한적 예는 시트르산, 아스파르트산, 에틸렌디아민테트라아세트산 (EDTA) 의 염, 및 이의 혼합물을 포함한다. 킬레이트제는 개별적으로 또는 합하여, 약 0.01 ㎎/㎖ 내지 약 50 ㎎/㎖, 예를 들어 약 0.1 ㎎/㎖ 내지 약 20 ㎎/㎖ 의 농도로 존재할 수 있다. 이러한 특정 킬레이트제 중 각각을 포함하는 약학 조성물은 본 발명의 대안적인 구현예를 구성한다.
본 발명의 또 다른 구현예에서, 약학 조성물은 안정화제를 포함한다. 안정화제의 비제한적 예는 하나 이상의 응집 억제제, 하나 이상의 산화 억제제, 하나 이상의 계면활성제 및/또는 하나 이상의 프로테아제 억제제를 포함한다.
본 발명의 또 다른 구현예에서, 약학 조성물은 안정화제를 포함하는데, 여기서 상기 안정화제는 카르복시-/히드록시셀룰로오스 및 이의 유도체 (예컨대 HPC, HPC-SL, HPC-L 및 HPMC), 시클로덱스트린, 2-메틸티오에탄올, 폴리에틸렌 글리콜 (예컨대 PEG 3350), 폴리비닐 알코올 (PVA), 폴리비닐 피롤리돈, 염 (예컨대 소듐 클로라이드), 황-함유 물질 예컨대 모노티오글리세롤, 또는 티오글리콜산이다. 안정화제는 개별적으로 또는 합하여, 약 0.01 ㎎/㎖ 내지 약 50 ㎎/㎖, 예를 들어 약 0.1 ㎎/㎖ 내지 약 20 ㎎/㎖ 의 농도로 존재할 수 있다. 이러한 특정 안정화제 중 각각을 포함하는 약학 조성물은 본 발명의 대안적인 구현예를 구성한다.
본 발명의 추가 구현예에서, 약학 조성물은 하나 이상의 계면활성제, 바람직하게는 계면활성제, 적어도 하나의 계면활성제, 또는 2 개의 상이한 계면활성제를 포함한다. 용어 "계면활성제" 는 수용성 (친수성) 부분 및 지용성 (친유성) 부분으로 구성되는 임의의 분자 또는 이온을 나타낸다. 계면활성제는 예를 들어, 음이온성 계면활성제, 양이온성 계면활성제, 비이온성 계면활성제 및/또는 양쪽이온성 계면활성제로 이루어지는 군에서 선택될 수 있다. 계면활성제는 개별적으로 또는 합하여, 약 0.1 ㎎/㎖ 내지 약 20 ㎎/㎖ 의 농도로 존재할 수 있다. 이러한 특정 계면활성제 중 각각을 포함하는 약학 조성물은 본 발명의 대안적인 구현예를 구성한다.
본 발명의 추가 구현예에서, 약학 조성물은 하나 이상의 프로테아제 억제제, 예를 들어, EDTA, 및/또는 벤자미딘 염산 (HCl) 을 포함한다. 프로테아제 억제제는 개별적으로 또는 합하여, 약 0.1 ㎎/㎖ 내지 약 20 ㎎/㎖ 의 농도로 존재할 수 있다. 이러한 특정 프로테아제 억제제 중 각각을 포함하는 약학 조성물은 본 발명의 대안적인 구현예를 구성한다.
또다른 일반적 양태에서, 본 발명은 본 발명의 모노클로날 항체 또는 그의 항원-결합 단편을 포함하는 약학적 조성물을 생산하는 방법으로서, 모노클로날 항체 또는 그의 항원-결합 단편을 약학적으로 허용가능한 담체와 조합하여 약학적 조성물을 얻는 것을 포함하는 방법에 관한 것이다.
사용 방법
또다른 일반적 양태에서, 본 발명은 아펠린 수용체에 대한 아펠린의 결합을 차단하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법에 관한 것이다.
아펠린에 결합하는 항체 및 그의 항원-결합 단편의 기능적 활성은 당해 기술분야에 알려지고 본원에 기재된 바와 같은 방법에 의해 특성분석될 수 있다. 아펠린에 결합하는 항체 및 그의 항원-결합 단편을 특성분석하는 방법은 친화도 및 특이성 어세이, 예를 들어, Biacore, ELISA, 및 OctetRed 분석; 아펠린 수용체에 대한 아펠린의 결합의 차단을 검출하는 수용체 리간드 결합 어세이; 아펠린-자극되는 세포내 신호전달에 대한 mAb 의 중화 활성을 검출하는 세포-기반 어세이를 포함하나, 그에 제한되지 않는다. 특정 구현예에 따르면, 아펠린에 결합하는 항체 및 그의 항원-결합 단편을 특성분석하는 방법은 아래 기재된 것들을 포함한다.
또다른 일반적 양태에서, 본 발명은 필요로 하는 대상체에서 당뇨병성 망막병증 (DR) 을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법에 관한 것이다.
또다른 일반적 양태에서, 본 발명은 필요로 하는 대상체에서 연령관련 황반변성 (AMD) 을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법에 관한 것이다.
또다른 일반적 양태에서, 본 발명은 필요로 하는 대상체에서 당뇨병성 황반부종 (DME) 을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법에 관한 것이다.
또다른 일반적 양태에서, 본 발명은 필요로 하는 대상체에서 망막 정맥 폐쇄 (RVO) 후 황반부종을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법에 관한 것이다.
또다른 일반적 양태에서, 본 발명은 필요로 하는 대상체에서 망막변성을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법에 관한 것이다.
또다른 일반적 양태에서, 본 발명은 필요로 하는 대상체에서 근시 맥락막 혈관신생 (mCNV) 을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법에 관한 것이다.
또다른 일반적 양태에서, 본 발명은 필요로 하는 대상체에서 당뇨병성 신경병증을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법에 관한 것이다.
또다른 일반적 양태에서, 본 발명은 필요로 하는 대상체에서 만성 신장 질환 (CKD) 을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법에 관한 것이다.
또다른 일반적 양태에서, 본 발명은 필요로 하는 대상체에서 비알코올성 지방간염 (NASH) 을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법에 관한 것이다.
또다른 일반적 양태에서, 본 발명은 필요로 하는 대상체에서 간경화증을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법에 관한 것이다.
또다른 일반적 양태에서, 본 발명은 필요로 하는 대상체에서 경화반내 혈관신생을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법에 관한 것이다.
또다른 일반적 양태에서, 본 발명은 필요로 하는 대상체에서 홍채 홍색증을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법에 관한 것이다.
또다른 일반적 양태에서, 본 발명은 필요로 하는 대상체에서 신생혈관 녹내장을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법에 관한 것이다.
또다른 일반적 양태에서, 본 발명은 필요로 하는 대상체에서 각막 혈관신생 (CNV) 을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법에 관한 것이다.
또다른 일반적 양태에서, 본 발명은 필요로 하는 대상체에서 미숙아 망막병증 (ROP) 을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법에 관한 것이다.
또다른 일반적 양태에서, 본 발명은 필요로 하는 대상체에서 망막병증을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법에 관한 것이다.
또다른 일반적 양태에서, 본 발명은 필요로 하는 대상체에서 황반변성을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법에 관한 것이다.
또다른 일반적 양태에서, 본 발명은 필요로 하는 대상체에서 난소 과다자극 증후군 (OHSS) 을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법에 관한 것이다.
또다른 일반적 양태에서, 본 발명은 필요로 하는 대상체에서 자궁 출혈을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법에 관한 것이다.
또다른 일반적 양태에서, 본 발명은 필요로 하는 대상체에서 자궁내막증을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법에 관한 것이다.
또다른 일반적 양태에서, 본 발명은 필요로 하는 대상체에서 자궁내막 이상증식증 및 암을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법에 관한 것이다.
또다른 일반적 양태에서, 본 발명은 필요로 하는 대상체에서 자궁평활근종을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법에 관한 것이다.
또다른 일반적 양태에서, 본 발명은 필요로 하는 대상체에서 선근증을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법에 관한 것이다.
또다른 일반적 양태에서, 본 발명은 필요로 하는 대상체에서 섬유증을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법에 관한 것이다. 섬유증은, 예를 들어, 병리학적 및 생리학적 섬유증, 신장 섬유증, 심장 섬유증, 간 섬유증, 또는 폐 섬유증으로부터 선택될 수 있다.
또다른 일반적 양태에서, 본 발명은 필요로 하는 대상체에서 암을 치료하는 방법으로서, 대상체에게 본 발명의 약학적 조성물을 투여하는 것을 포함하는 방법에 관한 것이다. 암은 임의의 액체 또는 고체 암일 수 있으며, 예를 들어, 암은 폐암, 위암, 대장암, 간세포 암종, 신장 세포 암종, 방광요로상피암종, 담관암종, 전이성 흑색종, 유방암, 난소 암, 자궁경부암, 두경부암, 췌장암, 신경교종, 교모세포종, 및 기타 고체 종양, 및 비호지킨 림프종 (NHL), 급성 림프구성 백혈병 (ALL), 만성 림프구성 백혈병 (CLL), 만성 골수성 백혈병 (CML), 다발성 골수종 (MM), 급성 골수성 백혈병 (AML), 및 기타 액체 종양으로부터 선택될 수 있으나 그에 제한되지 않는다.
특정 구현예에서, 약학적 조성물은 이차 치료적 항암제를 추가로 포함한다. 이차 치료적 항암제는, 예를 들어 항-VEGF 제일 수 있다. 항-VEGF 제는, 예를 들어, 아바스틴® 또는 베바시주맙 바이오시밀러제일 수 있다. 항-VEGF 제는, 예를 들어, VEGFR1 및/또는 VEFR2 차단제일 수 있다. 특정 구현예에서, 항-아펠린 모노클로날 항체 또는 그의 항원-결합 단편 및 이차 치료적 항암제는 별도의 제형으로 동시-투여된다. 특정 구현예에서, 항-아펠린 모노클로날 항체 또는 그의 항원-결합 단편 및 이차 치료적 항암제는 단일 제형으로 동시-투여된다. 특정 구현예에서, 항-아펠린 모노클로날 항체 또는 그의 항원-결합 단편 및 이차 치료적 항암제, 예를 들어, 항-VEGF 제, 예컨대 아바스틴® 은 VEGF 및 아펠린 둘 모두를 표적화하는 이중특이적 항체로 조작된다.
본 발명의 구현예에 따르면, 약학적 조성물은 치료적 유효량의 항-아펠린 항체 또는 그의 항원-결합 단편을 포함한다. 본원에서 사용되는, 용어 "치료적 유효량" 은 대상체에서 바람직한 생물학적 또는 의학적 반응을 유발하는 활성 요소 또는 성분의 양을 의미한다. 언급된 목적과 관련하여 치료적 유효량은 경험적으로 통상적 방식으로 확인될 수 있다.
항-아펠린 항체 또는 그의 항원-결합 단편을 언급할 때 본원에서 사용되는, 치료적 유효량은 필요로 하는 대상체에서 면역 반응을 조정하는 항-아펠린 항체 또는 그의 항원-결합 단편의 양을 의미한다. 항-아펠린 항체 또는 그의 항원-결합 단편을 언급할 때 본원에서 또한 사용되는, 치료적 유효량은 질환, 장애, 또는 병상의 치료를 초래하거나; 질환, 장애, 또는 병상의 진행을 방지 또는 둔화시키거나; 또는 질환, 장애, 또는 병상과 관련된 증상을 감소 또는 완전히 완화시키는 항-아펠린 항체 또는 그의 항원-결합 단편의 양을 의미한다.
특정 구현예에 따르면, 치료되는 질환, 장애 또는 병상은 당뇨병성 망막병증 (DR), 연령관련 황반변성 (AMD), 당뇨병성 황반부종 (DME), 망막 정맥 폐쇄 (RVO) 후 황반부종, 망막변성, 근시 맥락막 혈관신생 (mCNV), 당뇨병성 신경병증, 만성 신장 질환 (CKD), 비알코올성 지방간염 (NASH), 간경화증, 경화반내 혈관신생, 홍채 홍색증, 신생혈관 녹내장, 각막 혈관신생 (CNV), 미숙아 망막병증 (ROP), 망막병증, 황반변성, 난소 과다자극 증후군 (OHSS), 자궁 출혈, 자궁내막증, 자궁내막 이상증식증 및 암, 자궁평활근종, 선근증, 섬유증 (예를 들어, 병리학적 및 생리학적 섬유증, 신장 섬유증, 심장 섬유증, 간 섬유증, 및 폐 섬유증), 및/또는 관련 합병증이다. 다른 특정 구현예에 따르면, 치료되는 질환, 장애 또는 병상은 암, 바람직하게는 폐암, 위암, 대장암, 간세포 암종, 신장 세포 암종, 방광요로상피암종, 담관암종, 전이성 흑색종, 유방암, 난소 암, 자궁경부암, 두경부암, 췌장암, 신경교종, 교모세포종, 및 기타 고체 종양, 및 비호지킨 림프종 (NHL), 급성 림프구성 백혈병 (ALL), 만성 림프구성 백혈병 (CLL), 만성 골수성 백혈병 (CML), 다발성 골수종 (MM), 급성 골수성 백혈병 (AML), 및 기타 액체 종양으로 이루어지는 군으로부터 선택되는 암이다.
특정 구현예에 따르면, 치료적 유효량은 하기 효과 중 1 개, 2 개, 3 개, 4 개 또는 그 이상을 달성하기에 충분한 요법의 양을 나타낸다: (i) 치료할 질환, 장애 또는 병상, 또는 그와 연관된 증상의 중증도를 감소시키거나 완화시킴; (ii) 치료할 질환, 장애 또는 병상, 또는 그와 연관된 증상의 지속기간을 감소시킴; (iii) 치료할 질환, 장애 또는 병상, 또는 그와 연관된 증상의 진행을 방지함; (iv) 치료할 질환, 장애 또는 병상, 또는 그와 연관된 증상의 퇴행을 유발함; (v) 치료할 질환, 장애 또는 병상, 또는 그와 연관된 증상의 발전 또는 발병을 방지함; (vi) 치료할 질환, 장애 또는 병상, 또는 그와 연관된 증상의 재발을 방지함; (vii) 치료할 질환, 장애 또는 병상, 또는 그와 연관된 증상을 갖는 대상체의 입원을 감소시킴; (viii) 치료할 질환, 장애 또는 병상, 또는 그와 연관된 증상을 갖는 대상체의 입원 길이를 감소시킴; (ix) 치료할 질환, 장애 또는 병상, 또는 그와 연관된 증상을 갖는 대상체의 생존을 증가시킴; (xi) 치료할 질환, 장애 또는 병상, 또는 그와 연관된 증상을 억제 또는 감소시킴; 및/또는 (xii) 또 다른 요법의 예방 또는 치료 효과(들) 를 향상 또는 개선시킴.
치료적 유효량 또는 투약량은 치료할 질환, 장애 또는 병상, 투여 수단, 표적 부위, 대상체의 생리학적 상태 (예를 들어, 연령, 체중, 건강 포함), 대상체가 인간 또는 동물인지 여부, 투여되는 다른 약물, 및 치료가 예방 또는 치료인지 여부와 같은 다양한 인자에 따라 가변적일 수 있다. 안전성 및 효능을 최적화하기 위해 치료 투약량을 최적으로 적정한다.
특정 구현예에 따르면, 본원에 기재된 조성물은 대상체에 대해 의도된 투여 경로에 적합한 것으로 제형화된다. 예를 들어, 본원에 기재된 조성물은 정맥내, 피하 또는 근육내 투여에 적합한 것으로 제형화될 수 있다.
본원에서 사용되는, 용어 "치료하다", "치료하는" 및 "치료" 는 모두 암, 당뇨병성 망막병증 (DR) 질환, 장애 또는 병상, 연령관련 황반변성 (AMD) 질환, 장애 또는 병상, 당뇨병성 황반부종 (DME) 질환, 장애 또는 병상, 망막 정맥 폐쇄 (RVO) 후 황반부종 질환, 장애 또는 병상, 망막변성 질환, 장애 또는 병상, 근시 맥락막 혈관신생 (mCNV) 질환, 장애 또는 병상, 당뇨병성 신경병증 질환, 장애 또는 병상, 만성 신장 질환 (CKD), 장애 또는 병상, 비알코올성 지방간염 (NASH) 질환, 장애 또는 병상, 간경화증 질환, 장애 또는 병상, 경화반내 혈관신생 질환, 장애 또는 병상, 홍채 홍색증 질환, 장애 또는 병상, 신생혈관 녹내장 질환, 장애 또는 병상, 각막 혈관신생 (CNV) 질환, 장애 또는 병상, 미숙아 망막병증 (ROP) 질환, 장애 또는 병상, 망막병증 질환, 장애 또는 병상, 황반변성 질환, 장애 또는 병상, 난소 과다자극 증후군 (OHSS) 질환, 장애 또는 병상, 자궁 출혈 질환, 장애 또는 병상, 자궁내막증 질환, 장애 또는 병상, 자궁내막 이상증식증 및 암 질환, 장애 또는 병상, 자궁평활근종 질환, 장애 또는 병상, 선근증 질환, 장애 또는 병상, 및/또는 섬유증 질환, 대상에서 반드시 식별가능한 것은 아니나 대상에서 식별가능할 수 있는 장애 또는 병상과 관련된 적어도 하나의 측정가능한 물리적 파라미터의 개선 또는 역전을 나타내는 것으로 의도된다. 용어 "치료하다", "치료하는" 및 "치료" 는 또한, 퇴행을 일으키거나, 진행을 예방하거나, 적어도 질환, 장애 또는 병상의 진행을 늦추는 것을 나타낼 수 있다. 특정 구현예에서, "치료", "치료하는" 및 "치료" 는 종양 또는 보다 바람직하게는 암과 같은 질환, 장애 또는 병상과 연관된 하나 이상의 증상의 경감, 발전 또는 발병의 예방, 또는 지속기간의 감소를 나타낸다. 특정 구현예에서, "치료하다", "치료하는" 및 "치료" 는 질환, 장애 또는 병상의 재발의 예방을 나타낸다. 특정 구현예에서, "치료하다", "치료하는" 및 "치료" 는 질환, 장애 또는 병상을 갖는 대상의 생존 증가를 나타낸다. 특정 구현예에서, "치료하다", "치료하는" 및 "치료" 는 대상에서의 질환, 장애 또는 병상의 제거를 나타낸다.
특정 구현예에 따르면, 암, 당뇨병성 망막병증 (DR) 질환, 장애 또는 병상, 연령관련 황반변성 (AMD) 질환, 장애 또는 병상, 당뇨병성 황반부종 (DME) 질환, 장애 또는 병상, 망막 정맥 폐쇄 (RVO) 후 황반부종 질환, 장애 또는 병상, 망막변성 질환, 장애 또는 병상, 근시 맥락막 혈관신생 (mCNV) 질환, 장애 또는 병상, 당뇨병성 신경병증 질환, 장애 또는 병상, 만성 신장 질환 (CKD), 장애 또는 병상, 비알코올성 지방간염 (NASH) 질환, 장애 또는 병상, 간경화증 질환, 장애 또는 병상, 경화반내 혈관신생 질환, 장애 또는 병상, 홍채 홍색증 질환, 장애 또는 병상, 신생혈관 녹내장 질환, 장애 또는 병상, 각막 혈관신생 (CNV) 질환, 장애 또는 병상, 미숙아 망막병증 (ROP) 질환, 장애 또는 병상, 망막병증 질환, 장애 또는 병상, 황반변성 질환, 장애 또는 병상, 난소 과다자극 증후군 (OHSS) 질환, 장애 또는 병상, 자궁 출혈 질환, 장애 또는 병상, 자궁내막증 질환, 장애 또는 병상, 자궁내막 이상증식증 및 암 질환, 장애 또는 병상, 자궁평활근종 질환, 장애 또는 병상, 선근증 질환, 장애 또는 병상, 및/또는 섬유증 질환, 장애 또는 병상의 치료에서 사용되는 조성물은 또다른 치료와의 조합으로 사용될 수 있다. 암 치료를 위해, 조성물은 화학요법, VEGF/VEGFR1/VEGFR2 축을 차단하는 요법 예컨대 아바스틴®, 항-CD20 mAb, 항-CTLA-4 항체, 항-LAG-3 mAb, 항-EGFR mAb, 항-HER-2 mAb, 항-CD19 mAb, 항-CD33 mAb, 항-CD73 mAb, 항-CD47 mAb, 항-DLL-3 mAb, 항-아펠린 mAb, 항-TIP-1 mAb, 항-CLDN18.2 mAb, 항-FOLR1 mAb, 항-PD-L1 항체, 항-PD-1 항체, PD-1/PD-L1 요법, 또는 기타 면역종양학 약물, 표적화 요법, 항혈관신생제, 방사선 요법, 또는 기타 항암 약물을 포함하나, 그에 제한되지 않는 또다른 치료와의 조합으로 사용될 수 있다. 항-아펠린 항체를 사용하여 VEGF, 안지오포이에틴-2 (ANG-2), 류신-풍부 알파-2-당단백질 1 (LRG1), CD73, PD-1, PD-L1, LAG-3, TIM-3, CTLA-4, EGFR, HER-2, CD19, CD20, CD33, CD47, DLL3, claudin18.2, TIP-1, CD3, PDGFβ, 콜라겐 유형 VI 수용체, TGF-베타 수용체, LOXL2, p75 뉴로트로핀 수용체 (NGFR p75), 인슐린-유사 성장 인자 2 수용체 (IGF2R) 에 대항하는 파트너 mAb, 및/또는 암/종양을 치료하는 종양 표면 항원에 대한 기타 mAb 와 함께 이중특이적 항체를 구축할 수 있다. 당뇨병성 망막병증 (DR), 연령관련 황반변성 (AMD), 및/또는 당뇨병성 황반부종 (DME) 의 치료를 위해, 조성물은 VEGF 차단제 (예를 들어, 라니비주맙 (LUCENTIS®), 아플리베르셉트 (EYLEA®, 콘베르셉트) 또는 또다른 항-DR, 항-AMD, 및/또는 항-DME 약물을 포함하나, 그에 제한되지 않는 또다른 치료와의 조합으로 사용될 수 있다. 항-아펠린 항체를 사용하여 VEGF, ANG-2 에 대항하는 파트너 mAb, 및/또는 아펠린 및 특이적 DR, AMD, 및/또는 DME 항원 둘 모두를 발현하는 DR, AMD, 및/또는 DME 를 치료하는 DR, AMD, 및/또는 DME 특이적 항원에 대한 기타 mAb 와 함께 이중특이적 항체를 구축할 수 있다.
본원에서 사용되는, 대상체에게 둘 이상의 요법을 투여하는 맥락에서 용어 "조합으로" 는 하나 초과의 요법의 사용을 나타낸다. 용어 "조합으로" 의 사용은 요법이 대상체에게 투여되는 순서를 제한하지 않는다. 예를 들어, 제 1 요법 (예를 들어, 본원에 기재된 조성물) 은 제 2 요법을 대상체에게 투여하기 전 (예를 들어, 5 분, 15 분, 30 분, 45 분, 1 시간, 2 시간, 4 시간, 6 시간, 12 시간, 16 시간, 24 시간, 48 시간, 72 시간, 96 시간, 1 주, 2 주, 3 주, 4 주, 5 주, 6 주, 8 주, 또는 12 주 전), 제 2 요법을 대상체에게 투여하는 것과 동시에, 또는 제 2 요법을 대상체에게 투여한 후 (예를 들어, 5 분, 15 분, 30 분, 45 분, 1 시간, 2 시간, 4 시간, 6 시간, 12 시간, 16 시간, 24 시간, 48 시간, 72 시간, 96 시간, 1 주, 2 주, 3 주, 4 주, 5 주, 6 주, 8 주, 또는 12 주 후) 에 투여될 수 있다.
또다른 일반적 양태에서, 본 발명은 대상체에서 아펠린의 수준을 확인하는 방법에 관한 것이다. 방법은 (a) 대상체로부터 샘플을 수득하는 단계; (b) 샘플을 본 발명의 항체 또는 그의 항원-결합 단편과 접촉시키는 단계; 및 (c) 대상체에서 아펠린의 수준을 확인하는 단계를 포함한다.
본원에서 사용되는, "샘플" 은 대상으로부터 단리된 생물학적 샘플을 나타내며, 전혈, 혈청, 혈장, 혈구, 내피 세포, 조직 생검 (예를 들어, 암 조직, 간 조직 등), 림프액, 복수액, 간질액, 골수, 뇌척수액, 타액, 점액, 가래, 땀, 소변, 또는 임의의 기타 분비물, 배설물, 또는 기타 체액을 포함할 수 있으나 이에 제한되지는 않는다. "혈액 샘플" 은 혈구, 혈청 및 혈장을 포함하는, 전혈 또는 이의 임의의 분획물을 나타낸다.
특정 구현예에서, 대상체에서의 아펠린의 수준은 웨스턴 블롯 어세이, ELISA 어세이, 및/또는 방사면역어세이 (RIA) 로부터 선택되나 그에 제한되지 않는 어세이를 이용하여 확인될 수 있다. 상대 단백질 수준은 웨스턴 블롯 분석 및 면역조직화학 (IHC) 을 이용하여 확인될 수 있고, 절대 단백질 수준은 ELISA 어세이 또는 RIA 어세이를 이용하여 확인될 수 있다. 아펠린의 상대 수준을 확인할 때, 아펠린의 수준은 적어도 두 개의 샘플 사이에서, 예를 들어, 상이한 시점에 동일한 대상체로부터의 샘플 사이에서, 동일한 대상체에서 상이한 조직으로부터의 샘플 사이에서, 및/또는 상이한 대상체로부터의 샘플 사이에서 확인될 수 있다. 대안적으로, 예컨대 ELISA 어세이에 의해 아펠린의 절대 수준을 확인할 때, 샘플에서의 아펠린의 절대 수준은 샘플을 시험하기 전에 ELISA 어세이를 위한 표준을 생성함으로써 확인될 수 있고, RIA 어세이를 이용할 때, 샘플에서의 아펠린의 절대 수준은 샘플을 방사선표지된 아펠린 및 알려진 양의 본 발명의 항체 또는 그의 항원-결합 단편과 혼합하여 그들이 결합하는 것을 허용하고, 결합된 아펠린 (방사선표지된 및 네이티브 (native) 아펠린을 포함함) 을 유리 (미결합) 아펠린 (또한 방사선표지된 및 네이티브 아펠린을 포함함) 으로부터 분리하고, 유리 (미결합) 아펠린의 방사성을 측정함으로써 확인될 수 있다. 당업자는 본 발명의 항체 또는 그의 항원-결합 단편을 이용하여 대상체로부터의 샘플에서의 아펠린의 수준을 확인하기 위해 어떠한 분석 기술을 이용하는지를 이해할 것이다.
대상체로부터의 샘플에서의 아펠린의 수준을 확인하는 방법의 이용은 질환에서 비정상 (상승된, 감소된, 또는 불충분한) 아펠린 수준을 진단하고 적절한 치료적 결정을 내리는 것을 초래할 수 있다. 그러한 질환은 심혈관 질환, 심부전, 당뇨병, 비만증, 당뇨병성 망막병증 (DR), 연령관련 황반변성 (AMD), 당뇨병성 황반부종 (DME), 망막 정맥 폐쇄 (RVO) 후 황반부종, 망막변성, 근시 맥락막 혈관신생 (mCNV), 당뇨병성 신경병증, 만성 신장 질환 (CKD), 비알코올성 지방간염 (NASH), 간경화증, 경화반내 혈관신생, 홍채 홍색증, 신생혈관 녹내장, 각막 혈관신생 (CNV), 미숙아 망막병증 (ROP), 망막병증, 황반변성, 난소 과다자극 증후군 (OHSS), 자궁 출혈, 자궁내막증, 자궁내막 이상증식증 및 암, 자궁평활근종, 선근증, 섬유증 (예를 들어, 병리학적 및 생리학적 섬유증, 신장 섬유증, 심장 섬유증, 간 섬유증, 및 폐 섬유증), 및/또는 암으로부터 선택될 수 있으나, 그에 제한되지 않는다. 부가적으로, 대상체에서의 아펠린의 수준을 모니터링함으로써, 특정 질환에서 및/또는 특정 질환의 진행 동안 아펠린의 수준의 지식에 기초하여 위에서 명시된 바와 같은 질환을 발달시킬 위험이 확인될 수 있다.
구현예
본 발명은 또한 하기 비제한적 구현예를 제공한다.
구현예 1 은 하기의 폴리펩티드 서열을 갖는, 중쇄 상보성 결정 영역 1 (HCDR1), HCDR2, HCDR3, 경쇄 상보성 결정 영역 1 (LCDR1), LCDR2, 및 LCDR3 을 포함하는 단리된 모노클로날 항체 또는 그의 항원-결합 단편이다:
(1) SEQ ID NOs:168, 169, 170, 171, 102, 및 172, 각각;
(2) SEQ ID NOs:50, 51, 52, 110, 111, 및 112, 각각;
(3) SEQ ID NOs:173, 174, 175, 176, 114, 및 115, 각각;
(4) SEQ ID NOs:68, 177, 178, 128, 129, 및 130, 각각;
(5) SEQ ID NOs:74, 75, 76, 134, 135, 및 136, 각각;
(6) SEQ ID NOs:179, 78, 180, 137, 138, 및 139, 각각;
(7) SEQ ID NOs:83, 84, 85, 143, 144, 및 145, 각각;
(8) SEQ ID NOs:86, 87, 88, 146, 147, 및 148, 각각;
(9) SEQ ID NOs:89, 90, 91, 149, 150, 및 151, 각각;
(10) SEQ ID NOs:92, 93, 94, 152, 153, 및 154, 각각;
(11) SEQ ID NOs:95, 96, 97, 155, 156, 및 157, 각각; 또는
(12) SEQ ID NOs:98, 99, 100, 158, 159, 및 160, 각각;
여기에서 항체 또는 그의 항원-결합 단편은 아펠린, 바람직하게는 인간 아펠린에 특이적으로 결합한다.
구현예 2 는 SEQ ID NO:1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37, 또는 39 와 적어도 95% 동일한 폴리펩티드 서열을 갖는 중쇄 가변 영역, 또는 SEQ ID NO:2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 또는 40 와 적어도 95% 동일한 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함하는, 구현예 1 의 단리된 모노클로날 항체 또는 항원-결합 단편이다.
구현예 3 은 하기를 포함하는 구현예 1 또는 2 의 단리된 모노클로날 항체 또는 항원-결합 단편이다:
(a)
SEQ ID NO:1 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:2 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
(b)
SEQ ID NO:3 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, SEQ ID NO:4 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
(c)
SEQ ID NO:5 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, SEQ ID NO:6 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
(d)
SEQ ID NO:7 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, SEQ ID NO:8 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
(e)
SEQ ID NO:9 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, SEQ ID NO:10 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
(f)
SEQ ID NO:11 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, SEQ ID NO:12 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
(g)
SEQ ID NO:13 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, SEQ ID NO:14 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
(h)
SEQ ID NO:15 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, SEQ ID NO:16 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
(i)
SEQ ID NO:17 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, SEQ ID NO:18 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
(j)
SEQ ID NO:19 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, SEQ ID NO:20 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
(k)
SEQ ID NO:21 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, SEQ ID NO:22 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
(l)
SEQ ID NO:23 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, SEQ ID NO:24 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
(m) SEQ ID NO:25 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, SEQ ID NO:26 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
(n)
SEQ ID NO:27 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, SEQ ID NO:28 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
(o)
SEQ ID NO:29 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, SEQ ID NO:30 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
(p)
SEQ ID NO:31 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, SEQ ID NO:32 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
(q)
SEQ ID NO:33 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, SEQ ID NO:34 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
(r)
SEQ ID NO:35 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, SEQ ID NO:36 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
(s)
SEQ ID NO:37 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, SEQ ID NO:38 의 폴리펩티드 서열을 갖는 경쇄 가변 영역; 또는
(t)
SEQ ID NO:39 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, SEQ ID NO:40 의 폴리펩티드 서열을 갖는 경쇄 가변 영역.
구현예 4 는 SEQ ID NO:188 의 아미노산 서열을 포함하는 에피토프에 특이적으로 결합하는 아펠린에 대한 단리된 모노클로날 항체 또는 그의 항원-결합 단편이다.
구현예 5 는 SEQ ID NO:204 의 아미노산 서열을 포함하는 에피토프에 특이적으로 결합하는 아펠린에 대한 단리된 모노클로날 항체 또는 그의 항원-결합 단편이다.
구현예 6 은 구현예 4 또는 5 의 단리된 모노클로날 항체 또는 그의 항원-결합 단편이며, 여기에서 항체 또는 그의 항원-결합 단편은 아펠린 활성을 저해한다.
구현예 7 은 구현예 4 의 단리된 모노클로날 항체 또는 그의 항원-결합 단편이며, 여기에서 항체 또는 그의 항원-결합 단편은 파이로-아펠린-13, 아펠린-13, 아펠린-17, 아펠린-36, 아펠린-55, 및/또는 아펠린-13 과 동일한 C-말단 단부를 공유하는 다른 형태의 아펠린에 결합할 수 있다.
구현예 8 은 구현예 5 의 단리된 모노클로날 항체 또는 그의 항원-결합 단편이며, 여기에서 항체 또는 그의 항원-결합 단편은 아펠린-13 및/또는 파이로-아펠린-13 에 결합할 수 있다.
구현예 9 는 구현예 1 내지 8 중 어느 하나의 단리된 모노클로날 항체 또는 항원-결합 단편이며, 여기에서 항체 또는 그의 항원-결합 단편은 키메라이다.
구현예 10 은 구현예 1 내지 9 중 어느 하나의 단리된 모노클로날 항체 또는 항원-결합 단편이며, 여기에서 항체 또는 그의 항원-결합 단편은 인간 또는 인간화된 것이다.
구현예 11 은 구현예 10 의 단리된 모노클로날 항체 또는 항원-결합 단편이며, 여기에서 항체 또는 그의 항원-결합 단편은 하기를 포함한다:
a. SEQ ID NO:211 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:215 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
b. SEQ ID NO:212 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:215 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
c. SEQ ID NO:213 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:215 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
d. SEQ ID NO:214 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:215 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
e. SEQ ID NO:213 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:216 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
f. SEQ ID NO:214 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:216 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
g. SEQ ID NO:217 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:219 의 폴리펩티드 서열을 갖는 경쇄 가변 영역; 또는
h. SEQ ID NO:218 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:220 의 폴리펩티드 서열을 갖는 경쇄 가변 영역.
구현예 12 는 구현예 1 내지 11 중 어느 하나의 모노클로날 항체 또는 항원-결합 단편을 인코딩하는 단리된 핵산이다.
구현예 13 은 구현예 12 의 단리된 핵산을 포함하는 벡터이다.
구현예 14 는 구현예 13 의 벡터를 포함하는 숙주 세포이다.
구현예 15 는 구현예 1 내지 11 중 어느 하나의 단리된 모노클로날 항체 또는 항원-결합 단편 및 약학적으로 허용가능한 담체를 포함하는 약학적 조성물이다.
구현예 16 은 대상체에게 구현예 15 의 약학적 조성물을 투여하는 것을 포함하는, 필요로 하는 대상체에서 아펠린 수용체에 대한 아펠린의 결합을 차단하는 방법이다.
구현예 17 은 대상체에게 구현예 15 의 약학적 조성물을 투여하는 것을 포함하는, 필요로 하는 대상체에서 당뇨병성 망막병증 (DR) 을 치료하는 방법이다.
구현예 18 은 대상체에게 구현예 15 의 약학적 조성물을 투여하는 것을 포함하는, 필요로 하는 대상체에서 연령관련 황반변성 (AMD) 을 치료하는 방법이다.
구현예 19 은 대상체에게 구현예 15 의 약학적 조성물을 투여하는 것을 포함하는, 필요로 하는 대상체에서 당뇨병성 황반부종 (DME) 을 치료하는 방법이다.
구현예 20 은 대상체에게 구현예 15 의 약학적 조성물을 투여하는 것을 포함하는, 필요로 하는 대상체에서 망막 정맥 폐쇄 (RVO) 후 황반부종을 치료하는 방법이다.
구현예 21 은 대상체에게 구현예 15 의 약학적 조성물을 투여하는 것을 포함하는, 필요로 하는 대상체에서 망막변성을 치료하는 방법이다.
구현예 22 은 대상체에게 구현예 15 의 약학적 조성물을 투여하는 것을 포함하는, 필요로 하는 대상체에서 근시 맥락막 혈관신생 (mCNV) 을 치료하는 방법이다.
구현예 23 은 대상체에게 구현예 15 의 약학적 조성물을 투여하는 것을 포함하는, 필요로 하는 대상체에서 당뇨병성 신경병증을 치료하는 방법이다.
구현예 24 은 대상체에게 구현예 15 의 약학적 조성물을 투여하는 것을 포함하는, 필요로 하는 대상체에서 만성 신장 질환 (CKD) 을 치료하는 방법이다.
구현예 25 은 대상체에게 구현예 15 의 약학적 조성물을 투여하는 것을 포함하는, 필요로 하는 대상체에서 비알코올성 지방간염 (NASH) 을 치료하는 방법이다.
구현예 26 은 대상체에게 구현예 15 의 약학적 조성물을 투여하는 것을 포함하는, 필요로 하는 대상체에서 간경화증을 치료하는 방법이다.
구현예 27 은 대상체에게 구현예 15 의 약학적 조성물을 투여하는 것을 포함하는, 필요로 하는 대상체에서 경화반내 혈관신생을 치료하는 방법이다.
구현예 28 은 대상체에게 구현예 15 의 약학적 조성물을 투여하는 것을 포함하는, 필요로 하는 대상체에서 홍채 홍색증을 치료하는 방법이다.
구현예 29 은 대상체에게 구현예 15 의 약학적 조성물을 투여하는 것을 포함하는, 필요로 하는 대상체에서 신생혈관 녹내장을 치료하는 방법이다.
구현예 30 은 대상체에게 구현예 15 의 약학적 조성물을 투여하는 것을 포함하는, 필요로 하는 대상체에서 각막 혈관신생 (CNV) 을 치료하는 방법이다.
구현예 31 은 대상체에게 구현예 15 의 약학적 조성물을 투여하는 것을 포함하는, 필요로 하는 대상체에서 미숙아 망막병증 (ROP) 을 치료하는 방법이다.
구현예 32 은 대상체에게 구현예 15 의 약학적 조성물을 투여하는 것을 포함하는, 필요로 하는 대상체에서 망막병증을 치료하는 방법이다.
구현예 33 은 대상체에게 구현예 15 의 약학적 조성물을 투여하는 것을 포함하는, 필요로 하는 대상체에서 황반변성을 치료하는 방법이다.
구현예 34 은 대상체에게 구현예 15 의 약학적 조성물을 투여하는 것을 포함하는, 필요로 하는 대상체에서 난소 과다자극 증후군 (OHSS) 을 치료하는 방법이다.
구현예 35 은 대상체에게 구현예 15 의 약학적 조성물을 투여하는 것을 포함하는, 필요로 하는 대상체에서 자궁 출혈을 치료하는 방법이다.
구현예 36 은 대상체에게 구현예 15 의 약학적 조성물을 투여하는 것을 포함하는, 필요로 하는 대상체에서 자궁내막증을 치료하는 방법이다.
구현예 37 은 대상체에게 구현예 15 의 약학적 조성물을 투여하는 것을 포함하는, 필요로 하는 대상체에서 자궁내막 이상증식증 및 암을 치료하는 방법이다.
구현예 38 은 대상체에게 구현예 15 의 약학적 조성물을 투여하는 것을 포함하는, 필요로 하는 대상체에서 자궁평활근종을 치료하는 방법이다.
구현예 39 은 대상체에게 구현예 15 의 약학적 조성물을 투여하는 것을 포함하는, 필요로 하는 대상체에서 선근증을 치료하는 방법이다.
구현예 40 은 대상체에게 구현예 15 의 약학적 조성물을 투여하는 것을 포함하는, 필요로 하는 대상체에서 암을 치료하는 방법이다.
구현예 41 은 구현예 40 의 방법이며, 여기에서 약학적 조성물은 이차 항암제를 추가로 포함한다.
구현예 42 는 구현예 41 의 방법이며, 여기에서 이차 항암제는 항-VEGF 제이다.
구현예 43 은 구현예 42 의 방법이며, 여기에서 항-VEGF 제는 아바스틴® 또는 베바시주맙 바이오시밀러제이다.
구현예 44 는 구현예 42 의 방법이며, 여기에서 항-VEGF 제는 VEGFR1 및/또는 VEGFR2 차단제이다.
구현예 45 는 구현예 40 내지 44 중 어느 하나의 방법이며, 여기에서 암은 폐암, 위암, 대장암, 간세포 암종, 신장 세포 암종, 방광요로상피암종, 담관암종, 전이성 흑색종, 유방암, 난소 암, 자궁경부암, 두경부암, 췌장암, 신경교종, 교모세포종, 및 기타 고체 종양, 및 비호지킨 림프종 (NHL), 급성 림프구성 백혈병 (ALL), 만성 림프구성 백혈병 (CLL), 만성 골수성 백혈병 (CML), 다발성 골수종 (MM), 급성 골수성 백혈병 (AML), 및 기타 액체 종양으로 이루어지는 군으로부터 선택된다.
구현예 46 은 구현예 45 의 방법이며, 여기에서 암은 담관암종이다.
구현예 47 은 대상체에게 구현예 15 의 약학적 조성물을 투여하는 것을 포함하는, 필요로 하는 대상체에서 조직 섬유증을 치료하는 방법이다.
구현예 48 은 대상체에서 아펠린의 수준을 확인하는 방법으로서, (a) 대상체로부터 샘플을 수득하는 단계; (b) 샘플을 구현예 1 내지 11 중 어느 하나의 항체 또는 항원-결합 단편과 접촉시키는 단계; 및 (c) 대상체에서 아펠린의 수준을 확인하는 단계를 포함하는 방법이다.
구현예 49 는 구현예 48 의 방법이며, 여기에서 샘플은 조직 샘플이다.
구현예 50 은 구현예 49 의 방법이며, 여기에서 조직 샘플은 암 조직 샘플이다.
구현예 51 은 구현예 49 의 방법이며, 여기에서 조직 샘플은 간 조직 샘플이다.
구현예 52 는 구현예 49 의 방법이며, 여기에서 조직 샘플은 신장 조직 샘플이다.
구현예 53 은 모노클로날 항체 또는 항원-결합 단편을 인코딩하는 핵산을 포함하는 세포를 모노클로날 항체 또는 항원-결합 단편을 생산하는 조건 하에 배양하는 단계, 및 항체 또는 항원-결합 단편을 세포 또는 배양물로부터 회수하는 단계를 포함하는 구현예 1 내지 11 중 어느 하나의 모노클로날 항체 또는 항원-결합 단편을 생산하는 방법이다.
구현예 54 는 모노클로날 항체 또는 항원-결합 단편을 약학적으로 허용가능한 담체와 조합하여 약학적 조성물을 얻는 것을 포함하는, 구현예 1 내지 11 중 어느 하나의 모노클로날 항체 또는 항원-결합 단편을 포함하는 약학적 조성물을 생산하는 방법이다.
실시예
실시예 1: 항-아펠린 모노클로날 항체의 식별
토끼를 KLH 담체 단백질에 접합된 Cys-아펠린-17 (N-말단에 시스테인이 첨가됨; C-KFRRQRPRLSHKGPMPF (SEQ ID NO:161)) 및 pyr-아펠린-13-Cys (C-말단에 시스테인이 첨가된 아펠린-13 의 파이로글루타밀화된 형태; pE-RPRLSHKGPMPF-C (SEQ ID NO:162)) 펩티드로 면역화시켰다. 토끼 mAb 를 생성하기 위해서, 면역화된 토끼의 전혈로부터 PBMC 를 단리하고, 항원 특이적 B 세포를 96-웰 플레이트에서 성장시켰다. pyr-아펠린-13 (아펠린-13 의 파이로글루타밀화된 형태; pE-RPRLSHKGPMPF (SEQ ID NO:163))-반응성 항체를 분비하는 B 세포를 B 세포 배양물 상청액의 항원-결합 ELISA 스크리닝에 의해 식별했다. 높은 결합 ELISA 플레이트를 1 ㎍/㎖ 카르보네이트 코팅 버퍼 (pH 9.6) 중 pyr-아펠린-13 로 밤새 코팅했다. 플레이트를 TBS 중 1% BSA 로 차단한 후, 희석된 B 세포 배양물 상청액 (1 내지 10 희석률) 을 첨가하고, 플레이트를 실온에서 90 분 동안 인큐베이션했다. pyr-아펠린-13 에 대한 토끼 항체 결합 후에, 염소 항-토끼 IgG Fc (알칼리성 포스파타아제에 접합됨) 를 첨가하고, 항체-항원 결합을 PNPP 기질을 첨가하고 405 ㎚ 에서 ELISA 플레이트의 흡광도를 판독함으로써 검출했다. pyr-아펠린-13 에 대한 토끼 항체 결합을 pyr-아펠린-13-Cys (pE-RPRLSHKGPMPF-C (SEQ ID NO:162)), Cys-(Q) 아펠린-13 (CQRPRLSHKGPMPF (SEQ ID NO:164)) 및 Cys-아펠린-17 (CKFRRQRPRLSHKGPMPF (SEQ ID NO:161)) 펩티드에 대한 항체의 차등 결합에 의해 추가로 확인했다. 항-아펠린-13 토끼 모노클로날 항체를 클로닝하기 위해서, 토끼 IgG cDNA 를 식별된 B 세포로부터 제조된 총 RNA 로부터 제조하고, PCR 에 의해 증폭시키고, 그 후 발현 벡터 내로 클로닝했다.
중쇄 및 경쇄의 가변 영역을 서열분석했다. 항-아펠린 mAb 의 중쇄 및 경쇄 가변 영역의 서열이, 각각, 표 1 및 표 2 에 열거되어 있다. 이들 mAb 의 중쇄 및 경쇄 CDR 의 서열이, 각각, 표 3 및 표 4 에 열거되어 있다. 항-아펠린 mAb 에 대한 중쇄 및 경쇄 CDR 를 Kabat 방법을 이용하여 확인했다.
표 1: 항-아펠린 모노클로날 항체 (mAb) 에 관한 중쇄 가변 영역의 서열
VH: 중쇄 가변 영역
표 2: 항-아펠린 mAb 에 관한 경쇄 가변 영역의 서열
VL: 경쇄 가변 영역
표 3: 항-아펠린 mAb 에 관한 중쇄의 CDR 영역 1-3
HC: 중쇄; CDR: 상보성 결정 영역
항-아펠린 mAb 에 관한 HC CDR 을 IMGT 방법 (Lefranc, M.-P. et al., Nucleic Acids Res. 1999; 27:209-212) 을 이용하여 확인했다.
표 4: 항-아펠린 mAb 에 관한 경쇄의 CDR 영역 1-3
LC: 경쇄; CDR: 상보성 결정 영역
항-아펠린 mAb 에 관한 LC CDR 을 IMGT 방법 (Lefranc, M.-P. et al., Nucleic Acids Res. 1999; 27:209-212) 을 이용하여 확인했다.
실시예 2: 재조합 mAb 의 생산 및 정제
재조합 항-아펠린 토끼 mAb 를 수득하기 위해서, 토끼 IgG cDNA 를 함유하는 발현 벡터를 HEK293 세포 내로 일시적으로 트랜스펙션했다. 재조합 항체를 이들 HEK293 세포의 현탁액 중에서 생산하고, 단백질 A 친화도 크로마토그래피를 사용하여 정제했다.
실시예 3: 아펠린 펩티드에 대한 항-아펠린 mAb 의 특이적 결합의 평가
아펠린에 대한 재조합 토끼 mAb 의 특이적 결합을 하기 비오틴일화된 아펠린 펩티드: 비오틴-아펠린-13 (비오틴-QRPRLSHKGPMPF (SEQ ID NO:165)), 아펠린-13-비오틴 (QRPRLSHKGPMPF-비오틴 (SEQ ID NO:165)), pyr-아펠린-13-비오틴 (pE-RPRLSHKGPMPF-비오틴 (SEQ ID NO:163)), 비오틴-아펠린-17 (비오틴-KFRRQRPRLSHKGPMPF (SEQ ID NO:166)), 아펠린-17-비오틴 (KFRRQRPRLSHKGPMPF-비오틴 (SEQ ID NO:166)), 및 비오틴-아펠린-(27-14) (비오틴-GPGAWQGGRRKFRR (SEQ ID NO:167)) 를 사용하여 ELISA 로 확인했다. 결합 어세이를 위해, 카르보네이트 코팅 버퍼 중 뉴트라비딘을 높은 결합 ELISA 플레이트 상에 1 ㎍/㎖ 로 밤새 코팅했다. 플레이트를 TBS 중 1% BSA 로 차단한 후에 펩티드를 4 ㎍/㎖ 로 첨가했다. 플레이트를 실온에서 60 분 동안 인큐베이션한 후에, 플레이트를 세정하고, 그 후 정제된 재조합 토끼 항체를 200 ng/㎖ 로 첨가했다. 실온에서 90 분 동안 플레이트 상의 펩티드에 대한 토끼 항체 결합 후에, 염소 항-토끼 IgG Fc (알칼리성 포스파타아제에 접합됨) 를 첨가하고, 항체-항원 결합을 PNPP 기질을 첨가하고 405 ㎚ 에서 ELISA 플레이트의 흡광도를 판독함으로써 검출했다. 각각의 mAb 를 듀플리케이트 (duplicate) 로 어세이했다. 아펠린 펩티드에 대한 항-아펠린 mAb 의 결합이 도 1A-C 에 제시되어 있다 (비오틴-APL13, 비오틴-아펠린-13; APL13-비오틴, 아펠린-13-비오틴; pyrAPL13-비오틴, pyr-아펠린-13-비오틴; 비오틴-APL17, 비오틴-아펠린-17; APL17-비오틴, 아펠린-17-비오틴; 비오틴-APL27-14, 비오틴-아펠린-(27-14)). 도 1A 에서 특정 mAb 에 의한 아펠린 결합은 아펠린 펩티드의 C-말단의 비오틴일화에 의해 영향을 받으며, 이는 이들 mAb 에 의한 아펠린 결합에서 아펠린의 C-말단 단부가 중요하다는 것을 시사한다. 도 1B 에서 특정 mAb 에 의한 아펠린 결합은 아펠린-13 의 N-말단의 비오틴일화에 의해 영향을 받는다. 도 1C 에서 mAb 는 도 1A 및 1B 에서의 mAb 와 상이한 결합 프로파일을 갖는다.
실시예 4: 항-아펠린 mAb 의 중화 효과를 평가하는 세포-기반 어세이
HitHunter® cAMP 어세이를 cAMP Hunter™ CHO-K1 AGTRL1 Gi 세포주 (#95-0147C2) (DiscoverX; Fremont, CA; USA) 를 사용하여 수행했다. 세포를 384-웰 백색 조직 배양물-처리된 플레이트 (Corning # 3570) (Corning; Corning, NY; USA) 에 10,000 세포/웰로 시딩하고, 37℃ 에서 밤새 인큐베이션했다. 세포를 그 후 무혈청 배지로 3 회 세정하고, 그 후 37℃ 에서 15 분 동안 예비인큐베이션한 아펠린/mAb 혼합물과 함께 37℃ 에서 5 분 동안 인큐베이션했다. 세포와 인큐베이션된 최종 아펠린 농도는 이 단계에서 1.2 nM 이다. 포스콜린 (FSK) 을 각각의 웰에 첨가하여 최종 FSK 농도가 15 μM 이고 최종 아펠린 농도가 1 nM 이 되도록 했다. 30 분 동안 인큐베이션 후에, Biologics 에 관한 HITHUNTER® cAMP 어세이 키트 (DiscoverX # 90-0075LM10) 를 제조사의 프로토콜에 따라 사용하여 cAMP 수준을 측정했다. 화학발광 신호를 EnVision 플레이트 리더 (384 US Lum) (Perkin Elmer; Waltham, MA; USA) 에서 판독했다. 각각의 mAb 를 소정의 희석률에서 트리플리케이트로 어세이했다. 소정의 농도에서 mAb 에 의한 % 저해를 계산하기 위해서, 0% 저해는 아펠린 치료를 받은 FSK-자극된 세포로부터의 신호로서 정의했고, 100% 저해는 아펠린 치료를 받지 않은 FSK-자극된 세포로부터의 신호로서 정의했다. 선택된 항-아펠린 mAb 의 중화 효과가 도 2A-K 에 제시되어 있다.
실시예 5: 항-아펠린 mAb 의 친화도 분석
mAb 클론 C4, C5, C8, C9, C17, C24, C25, C26 및 C27 에 관한 KD 확인을 위해, 비오틴-아펠린-13 (비오틴-QRPRLSHKGPMPF (SEQ ID NO:165)) 을 CM5-SA (스트렙타비딘) 칩 (GE Lifesciences; Marlborough, MA) 표면 상에 부동화시켰다. 항-아펠린 mAb 를 네 가지 상이한 농도 (12.5 nM, 25 nM, 50 nM 및 100 nM) 로 칩 표면 상에 포획했다. 항체-항원 결합에 관한 온-레이트 (on-rate) 및 오프-레이트 (off-rate) 를 측정하고, 곡선을 핏팅하고, 계산했다. 데이타가 표 5 에 제시되어 있다.
mAb 클론 C1, C6, C7, C10, C11, C12, C14, C16, C20, 및 C22 에 관한 KD 확인을 위해, 아펠린-13-비오틴 (QRPRLSHKGPMPF-비오틴 (SEQ ID NO:165)) 및 pyr-아펠린-13-비오틴 (pE-RPRLSHKGPMPF-비오틴 (SEQ ID NO:163)) 을 위에 기재된 Biacore 어세이에서 사용했다. 데이타가 표 6 에 제시되어 있다.
표 5: Biacore 어세이로부터의 항-아펠린 mAb 에 관한 KD 값
표 6: Biacore 어세이에 의해 측정되는 아펠린 13 및 파이로-아펠린 13 둘 모두로 측정되는 항-아펠린 mAb 에 관한 KD 값
실시예 6: 항-아펠린 mAb 에 관한 에피토프 맵핑
항-아펠린 mAb C8, C24, 및 C25 에 관한 항체 결합 자리를 ELISA-기반 펩티드 경쟁 어세이를 사용하여 맵핑했다. 간략히, mAb 를 ELISA 플레이트 상에 포획시키고, mAb 에 대한 비오틴-아펠린-13 (SEQ ID NO:165) 결합을 측정했다. 각각의 경쟁 펩티드 (표 7) 를 mAb 에 대한 비오틴-아펠린-13 결합을 저해하는 그것의 능력에 관해 평가했다. 저해 신호는 용액 중 mAb 에 결합하는 경쟁 펩티드의 능력을 반영한다.
펩티드 경쟁 어세이를 위해, 카르보네이트 코팅 버퍼 중 염소 항-토끼 IgG 를 높은 결합 ELISA 플레이트 상에 1 ㎍/㎖ 로 밤새 코팅했다. 토끼 mAb (C8, C24, 또는 C25) 및 경쟁 펩티드 (표 7) 의 혼합물을 30 분 동안 실온에서 예비인큐베이션하고, 그 후 비오틴-아펠린-13 (SEQ ID NO:165) 을 첨가하고, 혼합하고, 최종 용액을 ELISA 플레이트 상에 첨가했다. 실온에서 60 분 동안 인큐베이션 후에, 플레이트를 세정하고, 그 후 스트렙타비딘 (알칼리성 포스파타아제에 접합됨) 을 첨가하고, 결합을 PNPP 기질을 첨가하고 405 ㎚ 에서 ELISA 플레이트의 흡광도를 판독함으로써 검출했다. 각각의 경쟁 펩티드 또는 컨트롤 샘플을 소정의 mAb 에 관해 듀플리케이트로 어세이했다. 경쟁 펩티드에 의한 항-아펠린 mAb 에 대한 비오틴-아펠린-13 (SEQ ID NO:165) 결합의 저해가 도 3A-3C 에 제시되어 있다. "No comp": 경쟁 펩티드를 첨가하지 않았다; "No Ab, No Comp": 경쟁 펩티드 및 항-아펠린 mAb 둘 모두를 첨가하지 않았다. 도 3A 에서 보여지는 바와 같이, 아펠린 13 의 C-말단으로부터 하나의 아미노산이 결실되었을 때, 펩티드는 C8 에 결합하지 않는다. 아펠린 13 의 N-말단 아미노산의 일련의 결실은 잔기 번호 8 이 결실되기 전까지는 C8 에 대한 그것의 결합에 대해 효과를 갖지 않는다. 맵핑 결과는 C8 이 아미노산 KGPMPF (SEQ ID NO:188) 을 포함하는 에피토프에 결합한다는 것을 시사한다. C24 및 C25 에서 동일한 결과가 관찰되었다. 그러므로, C8, C24, 및 C25 는 모두 아미노산 KGPMPF (SEQ ID NO:188) 을 포함하는 에피토프에 결합한다.
mAb C8, C14, 또는 C25 에 의한 에피토프의 결합에서 에피토프 8-13 (KGPMPF (SEQ ID NO:188)) 의 아미노산의 중요성을 추가로 이해하기 위해서, 알라닌 스캐닝 펩티드 (표 8) 를 생성하고, 위에 기재된 ELISA-기반 펩티드 경쟁 어세이를 사용하여 이들 mAb 에 대한 비오틴-아펠린-13 (SEQ ID NO:165) 의 결합을 저해하는 그들의 능력에 관해 평가했다. 알라닌 스캐닝 펩티드에 의한 항-아펠린 mAb C8, C24, 또는 C25 에 대한 비오틴-아펠린-13 (SEQ ID NO:165) 결합의 저해가 도 4A-4C 에 제시되어 있다. 각각의 펩티드 또는 컨트롤 샘플을 소정의 mAb 에 관해 듀플리케이트로 어세이했다. 도 4A 에서 보여지는 바와 같이, 펩티드 8A 는 C8 에 대한 비오틴-아펠린-13 (SEQ ID NO:165) 의 결합을 여전히 차단하지만, 아펠린 13 (펩티드 1-13), 9A, 또는 10A 에 비해 더 적은 정도로 차단한다. 펩티드 11A, 12A, 및 13A 는 C8 에 대한 비오틴-아펠린-13 (SEQ ID NO:165) 의 결합을 차단하는 능력을 크게 상실했다. 이들 데이타는 잔기 11, 12, 및 13 의 측쇄가 C8 에 대한 아펠린 결합에 요구되고, 잔기 8 의 측쇄는 C8 결합에서 일부 기여를 하고; 잔기 9 및 10 의 측쇄는 C8 결합에서 중요하지 않다는 것을 시사한다. C24 및 C25 에서 동일한 결과가 관찰되었으며, 도 4B 및 4C 에 제시되어 있다.
표 7: 항-아펠린 mAb C8, C24, 및 C25 에 관한 경쟁 어세이에서 사용된 아펠린 펩티드.
표 8: 항-아펠린 mAb C8, C24 및 C25 에 관한 경쟁 어세이에서 사용된 에피토프 8-13 에서 유래하는 알라닌 스캐닝 펩티드
항-아펠린 mAb C1, C6, 및 C7 에 관한 항체 결합 자리를 아펠린-13-비오틴 (QRPRLSHKGPMPF-비오틴 (SEQ ID NO:165)) 및 표 9 에 제시된 경쟁 펩티드를 사용하여 위에 기재된 ELISA-기반 펩티드 경쟁 어세이로 맵핑했다. 경쟁 펩티드에 의한 항-아펠린 mAbs C1, C6, 및 C7 에 대한 아펠린-13-비오틴 (SEQ ID NO:165) 결합의 저해가 도 5A-5C 에 제시되어 있다. 도 5A 에서 보여지는 바와 같이, 아펠린 13 의 N-말단으로부터 하나의 아미노산이 결실되었을 때, 펩티드는 C1 에 결합하지 않는다. 아펠린 13 의 C-말단 아미노산의 일련의 결실은 잔기 번호 5 이 결실되기 전까지는 C1 에 대한 그것의 결합에 대해 효과를 갖지 않는다. 흥미롭게도, C1 은 아펠린 17 (표 9 에서 펩티드 1-17) 에 결합하지 않으며, 이는 아펠린-13 의 유리 N-말단 단부가 C1 결합에 중요하다는 것을 시사한다. 맵핑 결과는 C1 이 아미노산 QRPRL (SEQ ID NO: 204) (표 9 에서 펩티드 1-5) 을 포함하는 에피토프에 결합한다는 것을 시사한다. C6 및 C7 에서 동일한 결과가 관찰되었다.
mAb C6 또는 C7 에 의한 에피토프의 결합에서 에피토프 1-5 (QRPRL (SEQ ID NO: 204)) 의 아미노산의 중요성을 추가로 이해하기 위해서, 알라닌 스캐닝 펩티드 (표 10) 를 생성하고, 위에 기재된 ELISA-기반 펩티드 경쟁 어세이를 사용하여 이들 mAb 에 대한 아펠린-13-비오틴 (SEQ ID NO:165) 의 결합을 저해하는 그들의 능력에 관해 평가했다. 알라닌 스캐닝 펩티드에 의한 항-아펠린 mAb C6 또는 C7 에 대한 아펠린-13-비오틴 (SEQ ID NO:165) 결합의 저해가 도 6A-6B 에 제시되어 있다. 각각의 펩티드 또는 컨트롤 샘플을 소정의 mAb 에 관해 듀플리케이트로 어세이했다. 도 6A 및 6B 에서 보여지는 바와 같이, 펩티드 1A, 2A, 3A, 4A 및 5A 는 C6 또는 C7 에 대한 아펠린-13-비오틴 (SEQ ID NO:165) 의 결합을 차단하는 능력을 상실했다. 이들 데이타는 잔기 1, 2, 3, 4, 및 5 의 측쇄가 C6 또는 C7 에 대한 아펠린 결합에 요구된다는 것을 시사한다.
표 9: 항-아펠린 mAb C1, C6 및 C7 에 관한 경쟁 어세이에서 사용되는 아펠린 펩티드
표 10: 항-아펠린 mAb C6 및 C7 에 관한 경쟁 어세이에서 사용되는 에피토프 1-5 에서 유래하는 알라닌 스캐닝 펩티드
실시예 7: 항-아펠린 mAb 의 인간화
토끼 항-아펠린 mAb C8 을 인간화시켜서, 인간 환자에서 사용될 때 면역원성의 잠재성을 감소시켰다. 중쇄 및 경쇄의 가변 영역 (VH 및 VL) 의 서열을 단백질 데이타 뱅크 (PDB) 데이타베이스의 인간 항체 서열과 비교했고, SWISS-모델링을 적용하여 상동성 모델을 개발했다. 토끼 mAb 의 중쇄 및 경쇄 둘 모두에서의 CDR 을 항원 결합에 아마도 요구되는 적절한 구조를 유지하는 가능성이 가장 높은 인간 프레임워크 내로 그래프팅했다. 인간 잔기로부터 토끼 잔기로의 역돌연변이를 필요에 따라 디자인했다. 인간화된 VH 및 VL 영역의 서열이, 각각, 표 11 및 표 12 에 제시되어 있다. 인간화된 VH 및 VL 영역을, 각각, 인간 IgG1 중쇄 및 카파 경쇄 불변 영역에 융합시켜 인간화된 mAb 를 생성했다. mAb 서열에 상응하는 구축물을 HEK 293 세포에서의 일시적 트랜스펙션에 사용했고, 상청액을 아펠린에 대한 각각의 인간화된 mAb 의 친화도에 관해 분석했다. 인간화된 mAb 의 KD 값을 비오틴-아펠린-13 (비오틴-QRPRLSHKGPMPF (SEQ ID NO:165)) 을 사용하여 Biacore 에서 확인했다. 데이타가 표 13 에 제시되어 있다.
두 가지 부가적 인간화된 mAb (B24 및 B25) 를 A31 상에서의 서열 변형으로 생성했다. 이들 세 가지 mAb (A31, B24, 및 B25) 를 인간 IgG4 백본 상에 클로닝하고, ELISA 어세이에서 시험했으며, 이 어세이에서 증가하는 농도의 항체를 플레이트 상에 부동화시키고, 비오틴-아펠린-13 (비오틴-QRPRLSHKGPMPF (SEQ ID NO:165)) 을 결합을 위해 첨가하고, 그에 뒤이어 스트렙타비딘 (알칼리성 포스파타아제에 접합됨) 과 결합시켰다. 그 후 PNPP 기질을 첨가하고 405 ㎚ 에서 ELISA 플레이트의 흡광도를 판독함으로써 결합을 검출했다. ELISA 결합 곡선에 관한 EC50 값이 표 14 에 제시되어 있다.
인간화된 항-아펠린 mAb A31 (인간 IgG1 백본 상에서) 의 IC50 곡선을 위에 기재된 세포-기반 어세이를 사용하여 생성했다. 아펠린 활성을 cAMP Hunter™ CHO-K1 AGTRL1 Gi 세포 (DiscoverX #95-0147C2) 에서 포스콜린 (FSK)-유도되는 cAMP 생산을 하향조절하는 그것의 능력에 관해 평가하고, 항-아펠린 mAb 의 활성을 아펠린의 저해 효과를 역전시키는 그것의 능력에 관해 평가했다. 도 7A 는 아펠린 13 (APL13) 을 어세이에서 사용했을 때의 IC50 그래프를 보여준다; 도 7B 는 파이로-아펠린 13 (pyroAPL13) 을 어세이에서 사용했을 때의 IC50 그래프를 보여준다. CPS, 초 당 카운트수.
종양 성장에 대한 항-아펠린 mAb A31 (인간 IgG1 백본 상에서) 의 효과를 마우스 이종이식 모델에서 시험했다. HUCCT1 세포 (1x107) 를 NOD/SCID 마우스에 이식하고, 종양이 150-200 ㎣ 에 도달할 때까지 성장시켰다. 무작위화 (군 당 n=3) 후에, 마우스에게 비히클, 0.5 ㎎/㎏ 베바시주맙, 20 ㎎/㎏ mAb A31, 또는 0.5 ㎎/㎏ 베바시주맙과 20 ㎎/㎏ mAb A31 의 조합을 투여했다. 투여물을 주 당 3 회 복강내 주사를 통해 제공하고, 종양 부피를 동일한 날에 측정했다. 도 8 은 연구 동안 상이한 군에서의 종양 부피를 보여준다. 데이타는 mAb A31 과 베바시주맙의 조합이 종양 성장에 대해 강한 저해 효과를 갖는다는 것을 시사한다.
표 11: 인간화된 항-아펠린 mAb 의 중쇄 가변 영역의 서열
VH: 중쇄 가변 영역
표 12: 인간화된 항-아펠린 mAb 의 경쇄 가변 영역의 서열
VL: 경쇄 가변 영역
표 13: Biacore 어세이로부터의 인간화된 항-아펠린 mAb 의 KD 값
표 14: 인간화된 mAb 에 관한 ELISA 결합 EC50 값
넓은 발명의 개념에서 벗어나지 않으면서 위에 기재된 구현예에 변화가 가해질 수 있다는 것이 당업자에 의해 이해될 것이다. 그러므로, 본 발명은 개시된 특별한 구현예에 제한되지 않는다고 이해되고, 본 명세서에서 정의되는 바와 같은 본 발명의 주제 및 범위 내에서의 변화를 포괄하는 것이 의도된다.
SEQUENCE LISTING
<110> Phanes Therapeutics, Inc.
<120> Anti-apelin Antibodies and Uses Thereof
<130> 689204.1WO
<150> 62/549,523
<151> 2017-08-24
<150> 62/579,287
<151> 2017-10-31
<150> 62/656,586
<151> 2018-04-12
<150> 62/658,111
<151> 2018-04-16
<160> 221
<170> PatentIn version 3.5
<210> 1
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> C8 Heavy Chain Variable Region
<400> 1
Gln Ser Val Glu Glu Ser Gly Gly Arg Leu Val Thr Pro Gly Thr Pro
1 5 10 15
Leu Thr Leu Thr Cys Thr Val Ser Gly Ile Asp Leu Tyr Ser Asn Arg
20 25 30
Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Ser Ile Gly Ser Ser Pro Trp Tyr Ala Ser Trp Ala Gln Gly Arg Phe
50 55 60
Thr Ile Ser Lys Thr Ser Ser Thr Thr Val Asn Leu Lys Ile Thr Ser
65 70 75 80
Pro Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Ala Lys Gly Gly Tyr
85 90 95
Arg Pro Gly Ala Ser Val Trp Gly Pro Gly Thr Leu Val Thr Val Ser
100 105 110
Ser
<210> 2
<211> 109
<212> PRT
<213> Artificial Sequence
<220>
<223> C8 Light Chain Variable Region
<400> 2
Gln Val Leu Thr Gln Thr Glu Ser Pro Val Ser Ala Pro Val Gly Gly
1 5 10 15
Thr Val Thr Ile Ala Cys Gln Ser Ser Gln Ser Val Tyr Asp Asn Asn
20 25 30
Asp Leu Ala Trp Tyr Gln Gln Lys Ala Gly Gln Thr Pro Lys Arg Leu
35 40 45
Ile Tyr Leu Ala Ser Ser Leu Asp Ser Gly Val Pro Ser Arg Phe Lys
50 55 60
Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Asp Leu Glu
65 70 75 80
Cys Asp Asp Ala Ala Thr Tyr Tyr Cys Ala Gly Gly Tyr Ser Gly Asp
85 90 95
Ile Tyr Thr Phe Gly Gly Gly Thr Glu Val Val Val Glu
100 105
<210> 3
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<223> C24 Heavy Chain Variable Region
<400> 3
Gln Ser Leu Glu Glu Ser Gly Gly Arg Leu Val Thr Pro Gly Thr Pro
1 5 10 15
Leu Thr Leu Thr Cys Thr Val Ser Gly Ile Asp Leu Tyr Thr Asn Arg
20 25 30
Val Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Asp Trp Ile Gly
35 40 45
Ser Ile Gly Ser Ser Pro Trp Tyr Ala Ser Trp Ala Gln Gly Arg Phe
50 55 60
Thr Ile Ser Lys Thr Ser Thr Thr Val Asn Leu Lys Ile Thr Ser Ser
65 70 75 80
Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Ala Lys Gly Gly Tyr Arg
85 90 95
Pro Gly Gly Ser Ile Trp Gly Pro Gly Thr Leu Val Thr Val Ser Ser
100 105 110
<210> 4
<211> 109
<212> PRT
<213> Artificial Sequence
<220>
<223> C24 Light Chain Variable Region
<400> 4
Gln Val Leu Thr Gln Ser Ala Ser Pro Val Ser Ala Ala Val Gly Asp
1 5 10 15
Ser Val Thr Ile Ala Cys Gln Ser Ser Gln Ser Val Tyr Asp Asn Asn
20 25 30
Asp Leu Gly Trp Tyr Gln Gln Lys Pro Gly Gln Thr Pro Lys Arg Leu
35 40 45
Ile Tyr Leu Ala Ser Ser Leu Asp Ser Gly Val Pro Ser Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Asp Leu Glu
65 70 75 80
Cys Asp Asp Ala Ala Thr Tyr Tyr Cys Ala Gly Gly Tyr Ser Gly Asp
85 90 95
Ile Tyr Thr Phe Gly Gly Gly Thr Glu Val Val Val Lys
100 105
<210> 5
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<223> C25 Heavy Chain Variable Region
<400> 5
Gln Ser Leu Glu Glu Ser Gly Gly Gly Leu Val Thr Pro Gly Thr Pro
1 5 10 15
Leu Thr Leu Thr Cys Thr Val Ser Gly Ile Asp Leu Tyr Thr Asn Arg
20 25 30
Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Ser Ile Gly Ser Ser Pro Trp Phe Ala Ser Trp Ala Leu Gly Arg Phe
50 55 60
Thr Ile Ser Lys Thr Ser Thr Thr Val Asn Leu Lys Ile Thr Ser Pro
65 70 75 80
Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Ala Lys Gly Gly Tyr Arg
85 90 95
Pro Gly Ala Ser Val Trp Gly Pro Gly Thr Leu Val Thr Val Ser Ser
100 105 110
<210> 6
<211> 109
<212> PRT
<213> Artificial Sequence
<220>
<223> C25 Light Chain Variable Region
<400> 6
Gln Val Leu Thr Gln Thr Glu Ser Pro Val Ser Ala Pro Val Gly Gly
1 5 10 15
Thr Val Thr Ile Ala Cys Gln Ser Ser Gln Ser Val Tyr Asp Asn Asn
20 25 30
Asp Leu Ala Trp Tyr Gln Gln Lys Ala Gly Gln Thr Pro Lys Arg Leu
35 40 45
Ile Phe Leu Ala Ser Ser Leu Asp Ser Gly Val Pro Ser Arg Phe Lys
50 55 60
Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Asp Leu Glu
65 70 75 80
Cys Asp Asp Ala Ala Thr Tyr Tyr Cys Ala Gly Gly Tyr Asn Gly Asp
85 90 95
Ile Tyr Thr Phe Gly Gly Gly Thr Glu Val Val Val Lys
100 105
<210> 7
<211> 115
<212> PRT
<213> Artificial Sequence
<220>
<223> C7 Heavy Chain Variable Region
<400> 7
Gln Ser Leu Glu Glu Ser Gly Gly Arg Leu Ala Lys Pro Asp Glu Thr
1 5 10 15
Leu Thr Leu Thr Cys Thr Val Ser Gly Ile Asp Leu Asn Ser His Ala
20 25 30
Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Val Ile Ala Pro Asp Thr Arg Thr Tyr Tyr Ala Thr Trp Ala Arg Gly
50 55 60
Arg Phe Thr Ile Ser Lys Thr Ser Ser Thr Ser Val Glu Leu Lys Met
65 70 75 80
Thr Ser Leu Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Ala Ala Tyr
85 90 95
Pro Ile Glu Pro Gly Ala Asn Ile Trp Gly Pro Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 8
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> C7 Light Chain Variable Region
<400> 8
Asp Pro Val Leu Thr Gln Thr Pro Ser Pro Val Ser Ala Pro Val Gly
1 5 10 15
Gly Thr Val Thr Ile Gly Cys Gln Ala Ser Glu Ser Val Asp Tyr Asn
20 25 30
Asn Gln Leu Ser Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Lys Arg
35 40 45
Leu Met Tyr Tyr Val Ser Thr Leu Asp Ser Gly Val Pro Ser Arg Phe
50 55 60
Lys Gly Ser Gly Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Asp Leu
65 70 75 80
Glu Cys Asp Asp Ala Ala Thr Tyr Tyr Cys Gln Gly Gly Tyr Pro Tyr
85 90 95
Asn Ile Tyr Pro Phe Gly Gly Gly Thr Glu Val Val Val Lys
100 105 110
<210> 9
<211> 115
<212> PRT
<213> Artificial Sequence
<220>
<223> C6 Heavy Chain Variable Region
<400> 9
Gln Ser Leu Glu Glu Ser Gly Gly Arg Leu Val Lys Pro Asp Glu Thr
1 5 10 15
Leu Thr Leu Thr Cys Thr Val Ser Gly Ile Asp Leu Ser Asn Tyr Ala
20 25 30
Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Val Ile Ala Pro Asn Arg Arg Thr Tyr Tyr Pro Thr Trp Ala Arg Gly
50 55 60
Arg Phe Thr Ile Ser Lys Thr Ser Ser Thr Thr Val Asp Leu Lys Met
65 70 75 80
Thr Ser Leu Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Ala Thr Tyr
85 90 95
Pro Ile Glu Pro Gly Ala Asn Ile Trp Gly Pro Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 10
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> C6 Light Chain Variable Region
<400> 10
Asp Pro Val Leu Thr Gln Thr Pro Ser Pro Val Ser Ala Pro Val Gly
1 5 10 15
Gly Thr Val Thr Ile Gly Cys Gln Ser Ser Glu Ser Val Asp Tyr Asn
20 25 30
Asn Gln Leu Ser Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Arg
35 40 45
Leu Met Tyr Tyr Val Ser Thr Leu Asp Ser Gly Val Pro Ser Arg Phe
50 55 60
Lys Gly Ser Gly Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Asp Leu
65 70 75 80
Glu Cys Asp Asp Ala Ala Thr Tyr Tyr Cys Gln Gly Gly Tyr Ile Ser
85 90 95
Asn Ile Tyr Pro Phe Gly Gly Gly Thr Glu Val Val Val Lys
100 105 110
<210> 11
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> C1 Heavy Chain Variable Region
<400> 11
Gln Ser Leu Glu Glu Ser Gly Gly Arg Leu Val Thr Pro Gly Gly Ser
1 5 10 15
Leu Thr Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Ser Tyr Ala
20 25 30
Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Val Ile Ala Pro Asn Gly Ala Thr Tyr Tyr Pro Thr Trp Ala Arg Gly
50 55 60
Arg Phe Thr Ile Ser Lys Thr Ser Thr Thr Val Asp Leu Lys Met Thr
65 70 75 80
Ser Leu Thr Ala Ala Asp Thr Ala Thr Tyr Phe Cys Ala Thr Tyr Pro
85 90 95
Ile Asp Ala Gly Ala Asn Ile Trp Gly Pro Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 12
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> C1 Light Chain Variable Region
<400> 12
Asp Pro Val Leu Thr Gln Thr Pro Ser Ser Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Gly Cys Gln Ser Ser Glu Ser Val Asp Asn Asn
20 25 30
Asn Gln Leu Ser Trp Tyr Gln Gln Lys Ser Gly Gln Pro Pro Lys Arg
35 40 45
Leu Met Tyr Tyr Val Ser Thr Leu Asp Ser Gly Val Pro Ser Arg Phe
50 55 60
Lys Gly Ser Gly Ser Gly Thr His Phe Thr Leu Thr Ile Ser Gly Val
65 70 75 80
Gln Cys Tyr Asp Ala Ala Thr Tyr Tyr Cys Gln Gly Gly Tyr Ile Ser
85 90 95
Asn Leu Tyr Pro Phe Gly Gly Gly Thr Glu Val Val Val Lys
100 105 110
<210> 13
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> C16 Heavy Chain Variable Region
<400> 13
Gln Ser Leu Glu Glu Ser Gly Gly Arg Leu Val Thr Pro Gly Gly Ser
1 5 10 15
Leu Thr Leu Thr Cys Thr Val Ser Gly Ile Asp Leu Asn Ser Tyr Ala
20 25 30
Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Val Ile Ala Pro Asn His Tyr Thr Tyr Tyr Pro Thr Trp Ala Arg Gly
50 55 60
Arg Phe Thr Ile Ser Lys Thr Ser Thr Thr Val Asp Leu Lys Met Thr
65 70 75 80
Arg Leu Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Ala Thr Tyr Pro
85 90 95
Ile Glu Ser Gly Ser Asn Ile Trp Gly Pro Gly Thr Leu Val Ile Val
100 105 110
Ser Ser
<210> 14
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> C16 Light Chain Variable Region
<400> 14
Asp Pro Val Leu Thr Gln Thr Pro Ser Ser Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Gly Cys Gln Ser Ser Glu Ser Val Gly Met Asn
20 25 30
Asn Gln Leu Ser Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Arg
35 40 45
Leu Met Tyr Tyr Val Ser Thr Leu Asp Ser Gly Val Pro Ser Arg Phe
50 55 60
Lys Gly Ser Gly Ser Gly Thr Gln Phe Ser Leu Thr Ile Ser Asp Leu
65 70 75 80
Glu Cys Asp Asp Ala Gly Thr Tyr Tyr Cys Gln Gly Gly Tyr Ile Ser
85 90 95
Asn Leu Tyr Pro Phe Gly Gly Gly Thr Glu Val Val Val Lys
100 105 110
<210> 15
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> C20 Heavy Chain Variable Region
<400> 15
Gln Ser Leu Glu Glu Ser Gly Gly Arg Leu Val Thr Pro Gly Gly Ser
1 5 10 15
Leu Thr Leu Thr Cys Thr Val Ser Gly Ile Asp Leu Asn Asn Tyr Ala
20 25 30
Ile Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Val Ile Ala Pro Asn His Tyr Thr Cys Tyr Pro Thr Trp Ala Arg Gly
50 55 60
Arg Phe Thr Ile Ser Lys Thr Ser Thr Thr Val Asp Leu Lys Met Thr
65 70 75 80
Ser Leu Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Ala Ala Tyr Pro
85 90 95
Ile Glu Thr Gly Ser Asn Ile Trp Gly Pro Gly Thr Leu Val Ile Val
100 105 110
Ser Ser
<210> 16
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> C20 Light Chain Variable Region
<400> 16
Asp Pro Met Leu Thr Gln Thr Pro Ser Ser Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Ser Cys Gln Ser Ser Glu Ser Val Asp Met Asn
20 25 30
Asn Gln Leu Ser Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Arg
35 40 45
Leu Met Tyr Tyr Val Ser Thr Leu Asp Ser Gly Val Pro Ser Arg Phe
50 55 60
Lys Gly Ser Gly Ser Gly Ile His Phe Ser Leu Thr Ile Ser Asp Leu
65 70 75 80
Glu Cys Ala Asp Ala Gly Thr Tyr Tyr Cys Gln Gly Gly Tyr Ile Ser
85 90 95
Asn Leu Tyr Pro Phe Gly Gly Gly Thr Glu Val Val Val Lys
100 105 110
<210> 17
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> C22 Heavy Chain Variable Region
<400> 17
Gln Ser Leu Glu Glu Ser Gly Gly Arg Leu Val Thr Pro Gly Gly Ser
1 5 10 15
Leu Thr Leu Thr Cys Thr Val Ser Gly Ile Asp Leu Asn Asn Tyr Ala
20 25 30
Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Val Ile Ala Pro Asn His Tyr Thr Tyr Tyr Pro Thr Trp Ala Arg Gly
50 55 60
Arg Phe Thr Ile Ser Lys Thr Ser Thr Thr Val Asp Leu Lys Met Thr
65 70 75 80
Ser Leu Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Ala Thr Tyr Pro
85 90 95
Ile Glu Thr Gly Ser Asn Ile Trp Gly Pro Gly Thr Leu Val Ile Val
100 105 110
Ser Ser
<210> 18
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> C22 Light Chain Variable Region
<400> 18
Asp Pro Val Leu Thr Gln Thr Pro Ser Ser Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Ser Cys Gln Ser Ser Glu Ser Val Asp Met Asn
20 25 30
Asn Gln Leu Ser Trp Tyr His Gln Lys Ser Gly Gln Pro Pro Lys Arg
35 40 45
Leu Met Tyr Tyr Val Ser Thr Leu Asp Ser Gly Val Pro Ser Arg Phe
50 55 60
Lys Gly Ser Gly Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val
65 70 75 80
Gln Cys Asp Asp Ala Gly Thr Tyr Tyr Cys Gln Gly Gly Tyr Ile Ser
85 90 95
Asn Leu Tyr Pro Phe Gly Gly Gly Thr Glu Val Val Val Lys
100 105 110
<210> 19
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> C10 Heavy Chain Variable Region
<400> 19
Gln Ser Leu Glu Glu Ser Gly Gly Arg Leu Val Thr Pro Gly Gly Ser
1 5 10 15
Leu Thr Leu Thr Cys Thr Val Ser Gly Ile Asp Leu Asn Ser Tyr Ala
20 25 30
Ile Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Val Ile Ala Pro Ser Gly Thr Thr Tyr Tyr Pro Thr Trp Ala Lys Gly
50 55 60
Arg Phe Thr Ile Ser Lys Thr Ser Thr Thr Val Asp Leu Lys Val Thr
65 70 75 80
Gly Leu Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Ala Ala Tyr Pro
85 90 95
Ile Asp Pro Gly Ser Asn Ile Trp Gly Pro Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 20
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> C10 Light Chain Variable Region
<400> 20
Asp Pro Val Leu Thr Gln Thr Pro Ser Ser Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Ala Thr Ile Gly Cys Gln Ser Ser Glu Ser Val Asp Tyr Gly
20 25 30
Asn Gln Leu Ser Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Arg
35 40 45
Leu Ala Tyr Tyr Val Ser Ile Leu Asp Ala Gly Val Pro Ser Arg Phe
50 55 60
Lys Gly Ser Gly Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Asp Leu
65 70 75 80
Glu Cys Asp Asp Ala Ala Thr Tyr Tyr Cys Gln Gly Gly Tyr Ile Ser
85 90 95
Asn Leu Tyr Pro Phe Gly Gly Gly Thr Glu Val Val Val Gln
100 105 110
<210> 21
<211> 115
<212> PRT
<213> Artificial Sequence
<220>
<223> C12 Heavy Chain Variable Region
<400> 21
Gln Ser Leu Glu Glu Ser Gly Gly Arg Leu Val Thr Pro Gly Gly Ser
1 5 10 15
Leu Thr Leu Thr Cys Thr Val Ser Gly Ile Asp Leu Ser Ser Tyr Ala
20 25 30
Ile Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Val Ile Ala Pro Ser Ser Thr Thr Tyr Tyr Pro Thr Trp Ala Lys Gly
50 55 60
Arg Phe Thr Ile Ser Lys Thr Ser Ser Thr Thr Val Asp Leu Lys Val
65 70 75 80
Ile Gly Leu Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Ala Ala Tyr
85 90 95
Pro Ile Asp Pro Gly Ser Asn Val Trp Gly Pro Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 22
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> C12 Light Chain Variable Region
<400> 22
Asp Pro Val Leu Thr Gln Thr Pro Ser Ser Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Gly Cys Gln Ser Ser Glu Ser Val Asp Tyr Gly
20 25 30
Asn Gln Leu Ser Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Arg
35 40 45
Leu Thr Tyr Tyr Val Ser Ile Leu Asp Ala Gly Val Pro Ser Arg Phe
50 55 60
Lys Gly Ser Gly Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Asp Leu
65 70 75 80
Glu Cys Asp Asp Ala Ala Thr Tyr Tyr Cys Gln Gly Gly Tyr Ile Ser
85 90 95
Asn Leu Tyr Pro Phe Gly Gly Gly Thr Glu Val Val Val Gln
100 105 110
<210> 23
<211> 115
<212> PRT
<213> Artificial Sequence
<220>
<223> C13 Heavy Chain Variable Region
<400> 23
Gln Ser Leu Glu Glu Ser Gly Gly Arg Leu Ala Lys Pro Gly Glu Thr
1 5 10 15
Leu Thr Leu Thr Cys Thr Val Ser Gly Ile Asp Leu Asn Ser His Ala
20 25 30
Val Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Val Ile Gly Pro Gly Gly Asn Thr Tyr Tyr Ala Ser Trp Ala Lys Gly
50 55 60
Arg Phe Thr Ile Ser Lys Thr Ser Ser Thr Thr Val Asp Leu Lys Met
65 70 75 80
Thr Ser Leu Thr Ala Glu Asp Thr Ala Thr Phe Phe Cys Ala Thr Tyr
85 90 95
Pro Ile Tyr Ser Gly Asp Asn Ile Trp Gly Pro Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 24
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> C13 Light Chain Variable Region
<400> 24
Asp Pro Val Leu Thr Gln Thr Pro Pro Ser Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Gln Ser Ser Glu Ser Val Asp Asn Asn
20 25 30
Asn Gln Leu Ser Trp Tyr Gln Gln Lys Val Gly Gln Pro Pro Lys Arg
35 40 45
Leu Met Tyr Tyr Ala Ser Thr Leu Asp Ser Gly Val Pro Ser Arg Phe
50 55 60
Lys Gly Gly Gly Ser Gly Thr His Phe Thr Leu Thr Ile Thr Asp Leu
65 70 75 80
Glu Cys Asp Asp Ala Ala Thr Tyr Tyr Cys Gln Gly Gly Thr Ala Thr
85 90 95
Asn Ile Tyr Pro Phe Gly Gly Gly Thr Glu Val Val Val Lys
100 105 110
<210> 25
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> C14 Heavy Chain Variable Region
<400> 25
Gln Ser Pro Glu Glu Ser Gly Gly Arg Leu Val Thr Pro Gly Gly Ser
1 5 10 15
Leu Thr Leu Thr Cys Lys Ile Ser Gly Val Asp Leu Ser Asn Tyr Ala
20 25 30
Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Val Ile Ala Pro Asn Asp Ala Thr Tyr Tyr Pro Thr Trp Ala Arg Gly
50 55 60
Arg Leu Thr Ile Ser Lys Thr Ser Thr Thr Val Asp Leu Lys Met Thr
65 70 75 80
Arg Leu Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Ala Ala Tyr Pro
85 90 95
Ile Asp Val Gly Ala Asn Val Trp Gly Pro Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 26
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> C14 Light Chain Variable Region
<400> 26
Asp Pro Met Leu Thr Gln Thr Ala Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Gln Ser Ser Glu Ser Val Asp Tyr Asn
20 25 30
Asn Gln Leu Ser Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Arg
35 40 45
Leu Met Tyr Tyr Val Ser Thr Leu Asp Ser Gly Val Pro Ser Arg Phe
50 55 60
Lys Gly Ser Gly Ser Gly Thr Gln Phe Ser Leu Thr Ile Ser Asp Leu
65 70 75 80
Glu Cys Asp Asp Ala Gly Thr Tyr Tyr Cys Gln Gly Gly Tyr Ile Ser
85 90 95
Asn Leu Tyr Pro Phe Gly Gly Gly Thr Glu Val Val Val Lys
100 105 110
<210> 27
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> C11 Heavy Chain Variable Region
<400> 27
Gln Ser Leu Glu Glu Ser Gly Gly Arg Leu Val Ser Pro Gly Gly Ser
1 5 10 15
Leu Thr Leu Thr Cys Thr Val Ser Gly Ile Asp Leu Ser Ser His Ala
20 25 30
Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Val Ile Ala Pro Asn Asp Ala Thr Tyr Tyr Pro Thr Trp Ala Arg Gly
50 55 60
Arg Phe Thr Ile Ser Lys Thr Ser Thr Thr Val Gly Leu Lys Met Thr
65 70 75 80
Arg Leu Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Ala Ala Tyr Pro
85 90 95
Ile Asp Ala Gly Ala Asn Val Trp Gly Pro Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 28
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> C11 Light Chain Variable Region
<400> 28
Asp Pro Met Leu Thr Gln Thr Ala Ser Pro Val Ser Ala His Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Gln Ser Ser Glu Ser Val Asp Tyr Asn
20 25 30
Asn Gln Leu Ser Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Arg
35 40 45
Leu Met Tyr Tyr Val Ser Thr Leu Asp Ser Gly Val Pro Ser Arg Phe
50 55 60
Lys Gly Ser Gly Ser Gly Thr Gln Phe Ser Leu Thr Ile Ser Asp Leu
65 70 75 80
Glu Cys Asp Asp Ala Gly Thr Tyr Tyr Cys Gln Gly Gly Tyr Ile Ser
85 90 95
Asn Leu Tyr Pro Phe Gly Gly Gly Thr Glu Val Val Val Lys
100 105 110
<210> 29
<211> 125
<212> PRT
<213> Artificial Sequence
<220>
<223> C4 Heavy Chain Variable Region
<400> 29
Gln Glu Gln Leu Glu Gln Ser Gly Gly Gly Ala Glu Gly Gly Leu Val
1 5 10 15
Lys Pro Gly Gly Ser Leu Glu Leu Cys Cys Lys Ala Ser Gly Phe Thr
20 25 30
Leu Ser Ser Ser Tyr Trp Ile Cys Trp Val Arg Gln Ala Pro Gly Lys
35 40 45
Gly Leu Glu Trp Ile Gly Cys Ile His Tyr Gly Ser Ser Gly Thr Ala
50 55 60
Tyr Tyr Ala Ser Trp Val Asn Gly Arg Phe Thr Leu Ser Arg Asp Ile
65 70 75 80
Asp Gln Ser Thr Gly Cys Leu Gln Leu Asn Ser Leu Thr Ala Ala Asp
85 90 95
Thr Ala Met Tyr Tyr Cys Ala Arg Phe Leu Ser Asp Met Tyr Tyr Tyr
100 105 110
Asn Leu Trp Gly Pro Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 30
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<223> C4 Light Chain Variable Region
<400> 30
Gln Val Leu Thr Gln Thr Pro Ala Ser Val Ser Ala Ala Val Gly Gly
1 5 10 15
Thr Val Thr Ile Asn Cys Gln Ala Ser Gln Ser Ile Tyr Asn Asn Asn
20 25 30
Gln Leu Ser Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu
35 40 45
Ile Tyr Tyr Ala Ser Thr Leu Ala Ser Gly Val Ser Ser Arg Phe Lys
50 55 60
Gly Ser Gly Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Gln
65 70 75 80
Cys Asp Asp Ala Ala Thr Tyr Tyr Cys Gln Gly Gln Phe Asn Cys Arg
85 90 95
Ser Ala Asp Cys His Ala Phe Gly Gly Gly Thr Glu Val Val Val Lys
100 105 110
<210> 31
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> C5 Heavy Chain Variable Region
<400> 31
Gln Ser Val Glu Glu Ser Gly Gly Arg Leu Val Thr Pro Gly Thr Pro
1 5 10 15
Leu Thr Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Gly Ala Trp
20 25 30
Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Val Val Ser Ser Asp Asp Asn Ile Tyr Tyr Ala Asp Trp Ala Lys Gly
50 55 60
Arg Phe Thr Ile Ser Lys Thr Ser Thr Thr Val Asp Leu Lys Leu Thr
65 70 75 80
Ser Pro Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Ala Arg Asn Leu
85 90 95
Gly Thr Ile Trp Gly Pro Gly Thr Leu Val Thr Val Ser Ser
100 105 110
<210> 32
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> C5 Light Chain Variable Region
<400> 32
Gln Val Leu Thr Gln Thr Glu Ser Pro Val Ser Ala Ala Val Gly Gly
1 5 10 15
Thr Val Thr Ile Asn Cys Gln Ser Ser Gln Ser Val Trp Ser Asn Tyr
20 25 30
Leu Ser Trp Phe Gln Gln Lys Pro Gly Gln Pro Pro Lys Val Leu Ile
35 40 45
Tyr Gly Thr Ser Lys Leu Pro Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Asn Asp Leu Glu Cys
65 70 75 80
Asp Asp Ala Ala Thr Tyr Tyr Cys Ala Gly Gly Tyr Ser Gly His Ile
85 90 95
Tyr Ser Phe Gly Gly Gly Thr Glu Val Val Val Lys
100 105
<210> 33
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<223> C9 Heavy Chain Variable Region
<400> 33
Gln Glu Gln Leu Glu Glu Ser Gly Gly Asp Leu Val Lys Pro Glu Gly
1 5 10 15
Ser Leu Thr Leu Thr Cys Thr Ala Ser Gly Phe Ser Phe Ser Ser Ser
20 25 30
Tyr Trp Ile Cys Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp
35 40 45
Ile Ala Cys Ile Tyr Gln Ser Gly Asp Gly Arg Thr Trp Tyr Ala Ser
50 55 60
Trp Ala Glu Gly Arg Phe Thr Ile Ser Lys Thr Ser Pro Thr Thr Val
65 70 75 80
Thr Leu Gln Met Ala Ser Leu Thr Ala Ala Asp Thr Ala Thr Tyr Phe
85 90 95
Cys Ala Arg Cys Pro His Asn Thr Tyr Ser His Phe Asp Leu Trp Gly
100 105 110
Pro Ser Thr Leu Val Thr Val Ser Ser
115 120
<210> 34
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> C9 Light Chain Variable Region
<400> 34
Ala Asp Ile Val Met Thr Gln Thr Pro Ala Ser Val Glu Ala Ala Val
1 5 10 15
Gly Gly Thr Val Thr Ile Lys Cys Gln Ala Ser Gln Ser Ile Asn Ser
20 25 30
Trp Leu Ser Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Pro Leu
35 40 45
Ile Tyr Gly Ala Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Lys
50 55 60
Gly Ser Gly Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Asp Leu Glu
65 70 75 80
Cys Ala Asp Ala Ala Thr Tyr Ser Cys Leu Gly Tyr Tyr Tyr Ser Ser
85 90 95
Tyr Asn Ser Val Gly Phe Trp Ala Phe Gly Gly Gly Thr Glu Val Val
100 105 110
Val Lys
<210> 35
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<223> C26 Heavy Chain Variable Region
<400> 35
Gln Glu Gln Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Pro Glu Gly
1 5 10 15
Ser Leu Thr Leu Thr Cys Thr Ala Ser Gly Phe Thr Leu Ser Asn Tyr
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Val Trp Ile
35 40 45
Gly Cys Ile Asp Ile Gly Ser Asp Asp Thr Tyr Tyr Ala Ser Trp Ala
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Thr Ser Ser Thr Thr Val Thr Leu
65 70 75 80
Gln Val Thr Ser Leu Thr Ala Ala Asp Thr Ala Thr Tyr Phe Cys Ala
85 90 95
Arg Ser Gly Gly Leu Trp Gly Pro Gly Thr Leu Val Thr Val Ser Ser
100 105 110
<210> 36
<211> 109
<212> PRT
<213> Artificial Sequence
<220>
<223> C26 Light Chain Variable Region
<400> 36
Gln Val Leu Thr Gln Thr Pro Ser Ser Thr Ser Ala Ala Val Gly Gly
1 5 10 15
Thr Val Thr Ile Asn Cys Gln Ala Ser Gln Ser Val Tyr Asn Asn Asn
20 25 30
Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Arg Leu
35 40 45
Ile Tyr Glu Ala Ser Lys Leu Ala Ser Gly Val Pro Ser Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Asp Leu Glu
65 70 75 80
Cys Asp Asp Ala Ala Thr Tyr Tyr Cys Ala Gly Gly Trp Ser Gly Asn
85 90 95
Phe Tyr Val Phe Gly Gly Gly Thr Glu Val Val Val Lys
100 105
<210> 37
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> C27 Heavy Chain Variable Region
<400> 37
Gln Ser Val Glu Glu Ser Gly Gly Arg Leu Val Thr Pro Gly Gly Ser
1 5 10 15
Leu Thr Leu Thr Cys Thr Val Ser Gly Ile Asp Leu Ile Asn Ala Trp
20 25 30
Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Thr Thr Thr Asp Asp Asp Thr Ile Tyr Tyr Ala Asn Trp Ala Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Thr Ser Thr Thr Val Asp Leu Lys Val Thr
65 70 75 80
Ser Leu Thr Ser Glu Asp Thr Ala Thr Tyr Phe Cys Ser Lys Gly Arg
85 90 95
Ile Trp Gly Pro Gly Thr Leu Val Thr Val Ser Leu
100 105
<210> 38
<211> 109
<212> PRT
<213> Artificial Sequence
<220>
<223> C27 Light Chain Variable Region
<400> 38
Gln Val Leu Thr Gln Thr Pro Ala Ser Val Ser Ala Ala Val Gly Gly
1 5 10 15
Thr Val Thr Ile Asn Cys Gln Ala Ser Gln Ser Val Tyr Asp Gly Asn
20 25 30
Trp Leu Cys Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Arg Leu
35 40 45
Ile Tyr Lys Ala Ser Thr Leu Glu Ser Gly Val Pro Ser Arg Phe Lys
50 55 60
Gly Ser Gly Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Asp Leu Glu
65 70 75 80
Cys Asp Asp Ala Ala Thr Tyr Tyr Cys Gln Gly Gly Phe Thr Ser Asn
85 90 95
Ile Tyr Pro Phe Ala Gly Gly Thr Glu Val Val Val Lys
100 105
<210> 39
<211> 109
<212> PRT
<213> Artificial Sequence
<220>
<223> C17 Heavy Chain Variable Region
<400> 39
Gln Ser Val Glu Glu Ser Gly Gly Arg Leu Val Lys Pro Asp Glu Thr
1 5 10 15
Leu Thr Leu Thr Cys Ala Val Ser Gly Ile Asp Leu Ser Ser Asn Ala
20 25 30
Met Asn Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Ile Gly
35 40 45
Ser Met Tyr Thr Asp Gly Thr Thr Tyr Tyr Ala Asn Trp Ala Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Ala Ser Ser Thr Thr Val Asp Leu Lys Met
65 70 75 80
Thr Ser Leu Thr Ala Ala Asp Thr Ala Thr Tyr Phe Cys Ala Arg Gly
85 90 95
Asp Ile Trp Gly Pro Gly Thr Leu Val Thr Val Ser Ser
100 105
<210> 40
<211> 109
<212> PRT
<213> Artificial Sequence
<220>
<223> C17 Light Chain Variable Region
<400> 40
Gln Val Leu Thr Gln Thr Ala Ser Pro Val Ser Ala Ala Val Gly Gly
1 5 10 15
Thr Val Thr Ile Ser Cys Gln Ser Ser Gln Ser Val Tyr Asn Asn Asn
20 25 30
Trp Leu Ala Trp Phe Gln Gln Lys Pro Gly Gln Pro Pro Lys Arg Leu
35 40 45
Ile Tyr Gly Thr Ser Glu Leu Ala Ser Gly Val Pro Ser Arg Phe Lys
50 55 60
Gly Ser Gly Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Gln
65 70 75 80
Cys Asp Asp Ala Ala Thr Tyr Tyr Cys Leu Gly Thr Tyr Ser Ser Asn
85 90 95
Ile His Val Phe Gly Gly Gly Thr Glu Val Val Val Lys
100 105
<210> 41
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> C8 HC CDR1
<400> 41
Ser Asn Arg Met Ser
1 5
<210> 42
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> C8 HC CDR2
<400> 42
Ser Ile Gly Ser Ser Pro Trp Tyr Ala Ser Trp Ala Gln Gly
1 5 10
<210> 43
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> C8 HC CDR3
<400> 43
Gly Gly Tyr Arg Pro Gly Ala Ser Val
1 5
<210> 44
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> C24 HC CDR1
<400> 44
Thr Asn Arg Val Ser
1 5
<210> 45
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> C24 HC CDR2
<400> 45
Ser Ile Gly Ser Ser Pro Trp Tyr Ala Ser Trp Ala Gln Gly
1 5 10
<210> 46
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> C24 HC CDR3
<400> 46
Gly Gly Tyr Arg Pro Gly Gly Ser Ile
1 5
<210> 47
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> C25 HC CDR1
<400> 47
Thr Asn Arg Met Ser
1 5
<210> 48
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> C25 HC CDR2
<400> 48
Ser Ile Gly Ser Ser Pro Trp Phe Ala Ser Trp Ala Leu Gly
1 5 10
<210> 49
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> C25 HC CDR3
<400> 49
Gly Gly Tyr Arg Pro Gly Ala Ser Val
1 5
<210> 50
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> C7 HC CDR1
<400> 50
Ser His Ala Met Asp
1 5
<210> 51
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> C7 HC CDR2
<400> 51
Val Ile Ala Pro Asp Thr Arg Thr Tyr Tyr Ala Thr Trp Ala Arg Gly
1 5 10 15
<210> 52
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> C7 HC CDR3
<400> 52
Tyr Pro Ile Glu Pro Gly Ala Asn Ile
1 5
<210> 53
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> C6 HC CDR1
<400> 53
Asn Tyr Ala Met Asp
1 5
<210> 54
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> C6 HC CDR2
<400> 54
Val Ile Ala Pro Asn Arg Arg Thr Tyr Tyr Pro Thr Trp Ala Arg Gly
1 5 10 15
<210> 55
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> C6 HC CDR3
<400> 55
Tyr Pro Ile Glu Pro Gly Ala Asn Ile
1 5
<210> 56
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> C1 HC CDR1
<400> 56
Ser Tyr Ala Met Asp
1 5
<210> 57
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> C1 HC CDR2
<400> 57
Val Ile Ala Pro Asn Gly Ala Thr Tyr Tyr Pro Thr Trp Ala Arg Gly
1 5 10 15
<210> 58
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> C1 HC CDR3
<400> 58
Tyr Pro Ile Asp Ala Gly Ala Asn Ile
1 5
<210> 59
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> C16 HC CDR1
<400> 59
Ser Tyr Ala Met Asp
1 5
<210> 60
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> C16 HC CDR2
<400> 60
Val Ile Ala Pro Asn His Tyr Thr Tyr Tyr Pro Thr Trp Ala Arg Gly
1 5 10 15
<210> 61
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> C16 HC CDR3
<400> 61
Tyr Pro Ile Glu Ser Gly Ser Asn Ile
1 5
<210> 62
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> C20 HC CDR1
<400> 62
Asn Tyr Ala Ile Asp
1 5
<210> 63
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> C20 HC CDR2
<400> 63
Val Ile Ala Pro Asn His Tyr Thr Cys Tyr Pro Thr Trp Ala Arg Gly
1 5 10 15
<210> 64
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> C20 HC CDR3
<400> 64
Tyr Pro Ile Glu Thr Gly Ser Asn Ile
1 5
<210> 65
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> C22 HC CDR1
<400> 65
Asn Tyr Ala Met Asp
1 5
<210> 66
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> C22 HC CDR2
<400> 66
Val Ile Ala Pro Asn His Tyr Thr Tyr Tyr Pro Thr Trp Ala Arg Gly
1 5 10 15
<210> 67
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> C22 HC CDR3
<400> 67
Tyr Pro Ile Glu Thr Gly Ser Asn Ile
1 5
<210> 68
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> C10 HC CDR1
<400> 68
Ser Tyr Ala Ile Asp
1 5
<210> 69
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> C10 HC CDR2
<400> 69
Val Ile Ala Pro Ser Gly Thr Thr Tyr Tyr Pro Thr Trp Ala Lys Gly
1 5 10 15
<210> 70
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> C10 HC CDR3
<400> 70
Tyr Pro Ile Asp Pro Gly Ser Asn Ile
1 5
<210> 71
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> C12 HC CDR1
<400> 71
Ser Tyr Ala Ile Asp
1 5
<210> 72
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> C12 HC CDR2
<400> 72
Val Ile Ala Pro Ser Ser Thr Thr Tyr Tyr Pro Thr Trp Ala Lys Gly
1 5 10 15
<210> 73
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> C12 HC CDR3
<400> 73
Tyr Pro Ile Asp Pro Gly Ser Asn Val
1 5
<210> 74
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> C13 HC CDR1
<400> 74
Ser His Ala Val Asp
1 5
<210> 75
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> C13 HC CDR2
<400> 75
Val Ile Gly Pro Gly Gly Asn Thr Tyr Tyr Ala Ser Trp Ala Lys Gly
1 5 10 15
<210> 76
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> C13 HC CDR3
<400> 76
Tyr Pro Ile Tyr Ser Gly Asp Asn Ile
1 5
<210> 77
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> C14 HC CDR1
<400> 77
Asn Tyr Ala Met Asp
1 5
<210> 78
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> C14 HC CDR2
<400> 78
Val Ile Ala Pro Asn Asp Ala Thr Tyr Tyr Pro Thr Trp Ala Arg Gly
1 5 10 15
<210> 79
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> C14 HC CDR3
<400> 79
Tyr Pro Ile Asp Val Gly Ala Asn Val
1 5
<210> 80
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> C11 HC CDR1
<400> 80
Ser His Ala Met Asp
1 5
<210> 81
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> C11 HC CDR2
<400> 81
Val Ile Ala Pro Asn Asp Ala Thr Tyr Tyr Pro Thr Trp Ala Arg Gly
1 5 10 15
<210> 82
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> C11 HC CDR3
<400> 82
Tyr Pro Ile Asp Ala Gly Ala Asn Val
1 5
<210> 83
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> C4 HC CDR1
<400> 83
Ser Ser Tyr Trp Ile Cys
1 5
<210> 84
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> C4 HC CDR2
<400> 84
Cys Ile His Tyr Gly Ser Ser Gly Thr Ala Tyr Tyr Ala Ser Trp Val
1 5 10 15
Asn Gly
<210> 85
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> C4 HC CDR3
<400> 85
Phe Leu Ser Asp Met Tyr Tyr Tyr Asn Leu
1 5 10
<210> 86
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> C5 HC CDR1
<400> 86
Gly Ala Trp Met Asn
1 5
<210> 87
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> C5 HC CDR2
<400> 87
Val Val Ser Ser Asp Asp Asn Ile Tyr Tyr Ala Asp Trp Ala Lys Gly
1 5 10 15
<210> 88
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> C5 HC CDR3
<400> 88
Asn Leu Gly Thr Ile
1 5
<210> 89
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> C9 HC CDR1
<400> 89
Ser Ser Tyr Trp Ile Cys
1 5
<210> 90
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> C9 HC CDR2
<400> 90
Cys Ile Tyr Gln Ser Gly Asp Gly Arg Thr Trp Tyr Ala Ser Trp Ala
1 5 10 15
Glu Gly
<210> 91
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> C9 HC CDR3
<400> 91
Cys Pro His Asn Thr Tyr Ser His Phe Asp Leu
1 5 10
<210> 92
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> C26 HC CDR1
<400> 92
Asn Tyr Trp Met Ser
1 5
<210> 93
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> C26 HC CDR2
<400> 93
Cys Ile Asp Ile Gly Ser Asp Asp Thr Tyr Tyr Ala Ser Trp Ala Lys
1 5 10 15
Gly
<210> 94
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<223> C26 HC CDR3
<400> 94
Ser Gly Gly Leu
1
<210> 95
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> C27 HC CDR1
<400> 95
Asn Ala Trp Met Asn
1 5
<210> 96
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> C27 HC CDR2
<400> 96
Thr Thr Thr Asp Asp Asp Thr Ile Tyr Tyr Ala Asn Trp Ala Lys Gly
1 5 10 15
<210> 97
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> C27 HC CDR3
<400> 97
Gly Arg Ile
1
<210> 98
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> C17 HC CDR1
<400> 98
Ser Asn Ala Met Asn
1 5
<210> 99
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> C17 HC CDR2
<400> 99
Ser Met Tyr Thr Asp Gly Thr Thr Tyr Tyr Ala Asn Trp Ala Lys Gly
1 5 10 15
<210> 100
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> C17 HC CDR3
<400> 100
Gly Asp Ile
1
<210> 101
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> C8 LC CDR1
<400> 101
Gln Ser Ser Gln Ser Val Tyr Asp Asn Asn Asp Leu Ala
1 5 10
<210> 102
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> C8 LC CDR2
<400> 102
Leu Ala Ser Ser Leu Asp Ser
1 5
<210> 103
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> C8 LC CDR3
<400> 103
Ala Gly Gly Tyr Ser Gly Asp Ile Tyr Thr
1 5 10
<210> 104
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> C24 LC CDR1
<400> 104
Gln Ser Ser Gln Ser Val Tyr Asp Asn Asn Asp Leu Gly
1 5 10
<210> 105
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> C24 LC CDR2
<400> 105
Leu Ala Ser Ser Leu Asp Ser
1 5
<210> 106
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> C24 LC CDR3
<400> 106
Ala Gly Gly Tyr Ser Gly Asp Ile Tyr Thr
1 5 10
<210> 107
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> C25 LC CDR1
<400> 107
Gln Ser Ser Gln Ser Val Tyr Asp Asn Asn Asp Leu Ala
1 5 10
<210> 108
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> C25 LC CDR2
<400> 108
Leu Ala Ser Ser Leu Asp Ser
1 5
<210> 109
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> C25 LC CDR3
<400> 109
Ala Gly Gly Tyr Asn Gly Asp Ile Tyr Thr
1 5 10
<210> 110
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> C7 LC CDR1
<400> 110
Gln Ala Ser Glu Ser Val Asp Tyr Asn Asn Gln Leu Ser
1 5 10
<210> 111
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> C7 LC CDR2
<400> 111
Tyr Val Ser Thr Leu Asp Ser
1 5
<210> 112
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> C7 LC CDR3
<400> 112
Gln Gly Gly Tyr Pro Tyr Asn Ile Tyr Pro
1 5 10
<210> 113
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> C6 LC CDR1
<400> 113
Gln Ser Ser Glu Ser Val Asp Tyr Asn Asn Gln Leu Ser
1 5 10
<210> 114
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> C6 LC CDR2
<400> 114
Tyr Val Ser Thr Leu Asp Ser
1 5
<210> 115
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> C6 LC CDR3
<400> 115
Gln Gly Gly Tyr Ile Ser Asn Ile Tyr Pro
1 5 10
<210> 116
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> C1 LC CDR1
<400> 116
Gln Ser Ser Glu Ser Val Asp Asn Asn Asn Gln Leu Ser
1 5 10
<210> 117
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> C1 LC CDR2
<400> 117
Tyr Val Ser Thr Leu Asp Ser
1 5
<210> 118
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> C1 LC CDR3
<400> 118
Gln Gly Gly Tyr Ile Ser Asn Leu Tyr Pro
1 5 10
<210> 119
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> C16 LC CDR1
<400> 119
Gln Ser Ser Glu Ser Val Gly Met Asn Asn Gln Leu Ser
1 5 10
<210> 120
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> C16 LC CDR2
<400> 120
Tyr Val Ser Thr Leu Asp Ser
1 5
<210> 121
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> C16 LC CDR3
<400> 121
Gln Gly Gly Tyr Ile Ser Asn Leu Tyr Pro
1 5 10
<210> 122
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> C20 LC CDR1
<400> 122
Gln Ser Ser Glu Ser Val Asp Met Asn Asn Gln Leu Ser
1 5 10
<210> 123
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> C20 LC CDR2
<400> 123
Tyr Val Ser Thr Leu Asp Ser
1 5
<210> 124
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> C20 LC CDR3
<400> 124
Gln Gly Gly Tyr Ile Ser Asn Leu Tyr Pro
1 5 10
<210> 125
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> C22 LC CDR1
<400> 125
Gln Ser Ser Glu Ser Val Asp Met Asn Asn Gln Leu Ser
1 5 10
<210> 126
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> C22 LC CDR2
<400> 126
Tyr Val Ser Thr Leu Asp Ser
1 5
<210> 127
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> C22 LC CDR3
<400> 127
Gln Gly Gly Tyr Ile Ser Asn Leu Tyr Pro
1 5 10
<210> 128
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> C10 LC CDR1
<400> 128
Gln Ser Ser Glu Ser Val Asp Tyr Gly Asn Gln Leu Ser
1 5 10
<210> 129
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> C10 LC CDR2
<400> 129
Tyr Val Ser Ile Leu Asp Ala
1 5
<210> 130
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> C10 LC CDR3
<400> 130
Gln Gly Gly Tyr Ile Ser Asn Leu Tyr Pro
1 5 10
<210> 131
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> C12 LC CDR1
<400> 131
Gln Ser Ser Glu Ser Val Asp Tyr Gly Asn Gln Leu Ser
1 5 10
<210> 132
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> C12 LC CDR2
<400> 132
Tyr Val Ser Ile Leu Asp Ala
1 5
<210> 133
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> C12 LC CDR3
<400> 133
Gln Gly Gly Tyr Ile Ser Asn Leu Tyr Pro
1 5 10
<210> 134
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> C13 LC CDR1
<400> 134
Gln Ser Ser Glu Ser Val Asp Asn Asn Asn Gln Leu Ser
1 5 10
<210> 135
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> C13 LC CDR2
<400> 135
Tyr Ala Ser Thr Leu Asp Ser
1 5
<210> 136
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> C13 LC CDR3
<400> 136
Gln Gly Gly Thr Ala Thr Asn Ile Tyr Pro
1 5 10
<210> 137
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> C14 LC CDR1
<400> 137
Gln Ser Ser Glu Ser Val Asp Tyr Asn Asn Gln Leu Ser
1 5 10
<210> 138
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> C14 LC CDR2
<400> 138
Tyr Val Ser Thr Leu Asp Ser
1 5
<210> 139
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> C14 LC CDR3
<400> 139
Gln Gly Gly Tyr Ile Ser Asn Leu Tyr Pro
1 5 10
<210> 140
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> C11 LC CDR1
<400> 140
Gln Ser Ser Glu Ser Val Asp Tyr Asn Asn Gln Leu Ser
1 5 10
<210> 141
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> C11 LC CDR2
<400> 141
Tyr Val Ser Thr Leu Asp Ser
1 5
<210> 142
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> C11 LC CDR3
<400> 142
Gln Gly Gly Tyr Ile Ser Asn Leu Tyr Pro
1 5 10
<210> 143
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> C4 LC CDR1
<400> 143
Gln Ala Ser Gln Ser Ile Tyr Asn Asn Asn Gln Leu Ser
1 5 10
<210> 144
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> C4 LC CDR2
<400> 144
Tyr Ala Ser Thr Leu Ala Ser
1 5
<210> 145
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> C4 LC CDR3
<400> 145
Gln Gly Gln Phe Asn Cys Arg Ser Ala Asp Cys His Ala
1 5 10
<210> 146
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> C5 LC CDR1
<400> 146
Gln Ser Ser Gln Ser Val Trp Ser Asn Tyr Leu Ser
1 5 10
<210> 147
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> C5 LC CDR2
<400> 147
Gly Thr Ser Lys Leu Pro Ser
1 5
<210> 148
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> C5 LC CDR3
<400> 148
Ala Gly Gly Tyr Ser Gly His Ile Tyr Ser
1 5 10
<210> 149
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> C9 LC CDR1
<400> 149
Gln Ala Ser Gln Ser Ile Asn Ser Trp Leu Ser
1 5 10
<210> 150
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> C9 LC CDR2
<400> 150
Gly Ala Ser Asn Leu Ala Ser
1 5
<210> 151
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> C9 LC CDR3
<400> 151
Leu Gly Tyr Tyr Tyr Ser Ser Tyr Asn Ser Val Gly Phe Trp Ala
1 5 10 15
<210> 152
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> C26 LC CDR1
<400> 152
Gln Ala Ser Gln Ser Val Tyr Asn Asn Asn Asp Leu Ala
1 5 10
<210> 153
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> C26 LC CDR2
<400> 153
Glu Ala Ser Lys Leu Ala Ser
1 5
<210> 154
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> C26 LC CDR3
<400> 154
Ala Gly Gly Trp Ser Gly Asn Phe Tyr Val
1 5 10
<210> 155
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> C27 LC CDR1
<400> 155
Gln Ala Ser Gln Ser Val Tyr Asp Gly Asn Trp Leu Cys
1 5 10
<210> 156
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> C27 LC CDR2
<400> 156
Lys Ala Ser Thr Leu Glu Ser
1 5
<210> 157
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> C27 LC CDR3
<400> 157
Gln Gly Gly Phe Thr Ser Asn Ile Tyr Pro
1 5 10
<210> 158
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> C17 LC CDR1
<400> 158
Gln Ser Ser Gln Ser Val Tyr Asn Asn Asn Trp Leu Ala
1 5 10
<210> 159
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> C17 LC CDR2
<400> 159
Gly Thr Ser Glu Leu Ala Ser
1 5
<210> 160
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> C17 LC CDR3
<400> 160
Leu Gly Thr Tyr Ser Ser Asn Ile His Val
1 5 10
<210> 161
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Cys-apelin-17
<400> 161
Cys Lys Phe Arg Arg Gln Arg Pro Arg Leu Ser His Lys Gly Pro Met
1 5 10 15
Pro Phe
<210> 162
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> pyr-apelin-13-Cys
<220>
<221> MISC_FEATURE
<222> (1)..(1)
<223> Glu is a pyroglutamic acid
<400> 162
Glu Arg Pro Arg Leu Ser His Lys Gly Pro Met Pro Phe Cys
1 5 10
<210> 163
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> pyr-apelin-13
<220>
<221> MISC_FEATURE
<222> (1)..(1)
<223> Glu is a pyroglutamic acid
<400> 163
Glu Arg Pro Arg Leu Ser His Lys Gly Pro Met Pro Phe
1 5 10
<210> 164
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> Cys(Q) apelin-13
<400> 164
Cys Gln Arg Pro Arg Leu Ser His Lys Gly Pro Met Pro Phe
1 5 10
<210> 165
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> biotin-apelin-13
<400> 165
Gln Arg Pro Arg Leu Ser His Lys Gly Pro Met Pro Phe
1 5 10
<210> 166
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> biotin-apelin-17
<400> 166
Lys Phe Arg Arg Gln Arg Pro Arg Leu Ser His Lys Gly Pro Met Pro
1 5 10 15
Phe
<210> 167
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> biotin-apelin-(27-14)
<400> 167
Gly Pro Gly Ala Trp Gln Gly Gly Arg Arg Lys Phe Arg Arg
1 5 10
<210> 168
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> HC CDR1
<220>
<221> MISC_FEATURE
<222> (1)..(1)
<223> Xaa is Ser or Thr
<220>
<221> MISC_FEATURE
<222> (4)..(4)
<223> Xaa is Met or Val
<400> 168
Xaa Arg Asn Xaa Ser
1 5
<210> 169
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> HC CDR2
<220>
<221> MISC_FEATURE
<222> (8)..(8)
<223> Xaa is Tyr or Phe
<220>
<221> MISC_FEATURE
<222> (13)..(13)
<223> Xaa is Lys or Gln
<400> 169
Ser Ile Gly Ser Ser Pro Trp Xaa Ala Ser Trp Ala Xaa Gly
1 5 10
<210> 170
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> HC CDR3
<220>
<221> MISC_FEATURE
<222> (7)..(7)
<223> Xaa is Ala and Gly
<220>
<221> MISC_FEATURE
<222> (9)..(9)
<223> Xaa is Val or Ile
<400> 170
Gly Gly Tyr Arg Pro Gly Xaa Ser Xaa
1 5
<210> 171
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> LC CDR1
<220>
<221> MISC_FEATURE
<222> (13)..(13)
<223> Xaa is Ala or Gly
<400> 171
Gln Ser Ser Gln Ser Val Tyr Asp Asn Asn Asp Leu Xaa
1 5 10
<210> 172
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> LC CDR3
<220>
<221> MISC_FEATURE
<222> (5)..(5)
<223> Xaa is Ser or Asn
<400> 172
Ala Gly Gly Tyr Xaa Gly Asp Ile Tyr Thr
1 5 10
<210> 173
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> HC CDR1
<220>
<221> MISC_FEATURE
<222> (1)..(1)
<223> Xaa is Asn or Ser
<220>
<221> MISC_FEATURE
<222> (4)..(4)
<223> Xaa is Met or Ile
<400> 173
Xaa Tyr Ala Xaa Asp
1 5
<210> 174
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> HC CDR2
<220>
<221> MISC_FEATURE
<222> (6)..(6)
<223> Xaa is Arg, Gly, or His
<220>
<221> MISC_FEATURE
<222> (7)..(7)
<223> Xaa is Arg, Ala, or Tyr
<220>
<221> MISC_FEATURE
<222> (9)..(9)
<223> Xaa is Tyr or Cys
<400> 174
Val Ile Ala Pro Asn Xaa Xaa Thr Xaa Tyr Pro Thr Trp Ala Arg Gly
1 5 10 15
<210> 175
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> HC CDR3
<220>
<221> MISC_FEATURE
<222> (4)..(4)
<223> Xaa is Glu or Asp
<220>
<221> MISC_FEATURE
<222> (5)..(5)
<223> Xaa is Pro, Ala, Ser, or Thr
<220>
<221> MISC_FEATURE
<222> (7)..(7)
<223> Xaa is Ala or Ser
<400> 175
Tyr Pro Ile Xaa Xaa Gly Xaa Asn Ile
1 5
<210> 176
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> LC CDR1
<220>
<221> MISC_FEATURE
<222> (7)..(7)
<223> Xaa is Asp or Gly
<220>
<221> MISC_FEATURE
<222> (8)..(8)
<223> Xaa is Tyr, Asn, or Met
<400> 176
Gln Ser Ser Glu Ser Val Xaa Xaa Asn Asn Gln Leu Ser
1 5 10
<210> 177
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> HC CDR2
<220>
<221> MISC_FEATURE
<222> (6)..(6)
<223> Xaa is Gly or Ser
<400> 177
Val Ile Ala Pro Ser Xaa Thr Thr Tyr Tyr Pro Thr Trp Ala Lys Gly
1 5 10 15
<210> 178
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> HC CDR2
<220>
<221> MISC_FEATURE
<222> (9)..(9)
<223> Xaa is Ile or Val
<400> 178
Tyr Pro Ile Asp Pro Gly Ser Asn Xaa
1 5
<210> 179
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> HC CDR1
<220>
<221> MISC_FEATURE
<222> (1)..(1)
<223> Xaa is Asn or Ser
<220>
<221> MISC_FEATURE
<222> (2)..(2)
<223> Xaa is Tyr or His
<400> 179
Xaa Xaa Ala Met Asp
1 5
<210> 180
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> HC CDR3
<220>
<221> MISC_FEATURE
<222> (5)..(5)
<223> Xaa is Val or Ala
<400> 180
Tyr Pro Ile Asp Xaa Gly Ala Asn Val
1 5
<210> 181
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Apelin Peptide 1-12
<400> 181
Gln Arg Pro Arg Leu Ser His Lys Gly Pro Met Pro
1 5 10
<210> 182
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Apelin Peptide 2-13
<400> 182
Arg Pro Arg Leu Ser His Lys Gly Pro Met Pro Phe
1 5 10
<210> 183
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Apelin Peptide 3-13
<400> 183
Pro Arg Leu Ser His Lys Gly Pro Met Pro Phe
1 5 10
<210> 184
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Apelin Peptide 4-13
<400> 184
Arg Leu Ser His Lys Gly Pro Met Pro Phe
1 5 10
<210> 185
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Apelin Peptide 5-13
<400> 185
Leu Ser His Lys Gly Pro Met Pro Phe
1 5
<210> 186
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Apelin Peptide 6-13
<400> 186
Ser His Lys Gly Pro Met Pro Phe
1 5
<210> 187
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Apelin Peptide 7-13
<400> 187
His Lys Gly Pro Met Pro Phe
1 5
<210> 188
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Apelin Peptide 8-13
<400> 188
Lys Gly Pro Met Pro Phe
1 5
<210> 189
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Apelin Peptide 9-13
<400> 189
Gly Pro Met Pro Phe
1 5
<210> 190
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<223> Apelin Peptide 10-13
<400> 190
Pro Met Pro Phe
1
<210> 191
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Apelin Peptide 11-13
<400> 191
Met Pro Phe
1
<210> 192
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide 8A
<400> 192
Ala Gly Pro Met Pro Phe
1 5
<210> 193
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide 9A
<400> 193
Lys Ala Pro Met Pro Phe
1 5
<210> 194
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide 10A
<400> 194
Lys Gly Ala Met Pro Phe
1 5
<210> 195
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide 11A
<400> 195
Lys Gly Pro Ala Pro Phe
1 5
<210> 196
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide 12A
<400> 196
Lys Gly Pro Met Ala Phe
1 5
<210> 197
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide 13A
<400> 197
Lys Gly Pro Met Pro Ala
1 5
<210> 198
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Apelin Peptide 1-11
<400> 198
Gln Arg Pro Arg Leu Ser His Lys Gly Pro Met
1 5 10
<210> 199
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Apelin Peptide 1-10
<400> 199
Gln Arg Pro Arg Leu Ser His Lys Gly Pro
1 5 10
<210> 200
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Apelin Peptide 1-9
<400> 200
Gln Arg Pro Arg Leu Ser His Lys Gly
1 5
<210> 201
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Apelin Peptide 1-8
<400> 201
Gln Arg Pro Arg Leu Ser His Lys
1 5
<210> 202
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Apelin Peptide 1-7
<400> 202
Gln Arg Pro Arg Leu Ser His
1 5
<210> 203
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Apelin Peptide 1-6
<400> 203
Gln Arg Pro Arg Leu Ser
1 5
<210> 204
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Apelin Peptide 1-5
<400> 204
Gln Arg Pro Arg Leu
1 5
<210> 205
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<223> Apelin Peptide 1-4
<400> 205
Gln Arg Pro Arg
1
<210> 206
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> 1A
<400> 206
Ala Arg Pro Arg Leu
1 5
<210> 207
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> 2A
<400> 207
Gln Ala Pro Arg Leu
1 5
<210> 208
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> 3A
<400> 208
Gln Arg Ala Arg Leu
1 5
<210> 209
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> 4A
<400> 209
Gln Arg Pro Ala Leu
1 5
<210> 210
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> 5A
<400> 210
Gln Arg Pro Arg Ala
1 5
<210> 211
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> Humanized VH
<400> 211
Gln Ser Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser
1 5 10 15
Leu Arg Leu Ser Cys Ala Val Ser Gly Ile Asp Leu Tyr Ser Asn Arg
20 25 30
Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser
35 40 45
Ser Ile Gly Ser Ser Pro Trp Tyr Ala Ser Trp Ala Gln Gly Arg Phe
50 55 60
Thr Ile Ser Arg Asp Asn Ser Asn Thr Leu Tyr Leu Gln Met Asn Ser
65 70 75 80
Leu Thr Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys Gly Gly Tyr
85 90 95
Arg Pro Gly Ala Ser Val Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser
<210> 212
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> Humanized VH
<400> 212
Gln Ser Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser
1 5 10 15
Leu Arg Leu Ser Cys Ala Val Ser Gly Ile Asp Leu Tyr Ser Asn Arg
20 25 30
Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser
35 40 45
Ser Ile Gly Ser Ser Pro Trp Tyr Ala Ser Trp Ala Gln Gly Arg Phe
50 55 60
Thr Ile Ser Arg Asp Asn Ser Asn Thr Val Tyr Leu Gln Met Asn Ser
65 70 75 80
Leu Thr Ala Glu Asp Thr Ala Thr Tyr Phe Cys Ala Lys Gly Gly Tyr
85 90 95
Arg Pro Gly Ala Ser Val Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser
<210> 213
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> Humanized VH
<400> 213
Gln Ser Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser
1 5 10 15
Leu Arg Leu Ser Cys Ala Val Ser Gly Ile Asp Leu Tyr Ser Asn Arg
20 25 30
Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Gly
35 40 45
Ser Ile Gly Ser Ser Pro Trp Tyr Ala Ser Trp Ala Gln Gly Arg Phe
50 55 60
Thr Ile Ser Arg Asp Asn Ser Asn Thr Val Tyr Leu Gln Met Asn Ser
65 70 75 80
Leu Thr Ala Glu Asp Thr Ala Thr Tyr Phe Cys Ala Lys Gly Gly Tyr
85 90 95
Arg Pro Gly Ala Ser Val Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser
<210> 214
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> Humanized VH
<400> 214
Gln Ser Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser
1 5 10 15
Leu Arg Leu Ser Cys Thr Val Ser Gly Ile Asp Leu Tyr Ser Asn Arg
20 25 30
Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Gly
35 40 45
Ser Ile Gly Ser Ser Pro Trp Tyr Ala Ser Trp Ala Gln Gly Arg Phe
50 55 60
Thr Ile Ser Arg Asp Asn Ser Asn Thr Val Tyr Leu Lys Met Asn Ser
65 70 75 80
Pro Thr Ala Glu Asp Thr Ala Thr Tyr Phe Cys Ala Lys Gly Gly Tyr
85 90 95
Arg Pro Gly Ala Ser Val Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser
<210> 215
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> Humanized VL
<400> 215
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ser Ser Gln Ser Ile Tyr Asp Asn
20 25 30
Asn Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Thr Pro Lys Arg
35 40 45
Leu Ile Tyr Leu Ala Ser Ser Leu Asp Ser Gly Val Pro Ser Arg Phe
50 55 60
Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu
65 70 75 80
Gln Pro Glu Asp Val Ala Thr Tyr Tyr Cys Ala Gly Gly Tyr Ser Gly
85 90 95
Asp Ile Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 216
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> Humanized VL
<400> 216
Ala Gln Val Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Ala Cys Gln Ser Ser Gln Ser Val Tyr Asp Asn
20 25 30
Asn Asp Leu Ala Trp Tyr Gln Gln Lys Ala Gly Gln Thr Pro Lys Arg
35 40 45
Leu Ile Tyr Leu Ala Ser Ser Leu Asp Ser Gly Val Pro Ser Arg Phe
50 55 60
Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu
65 70 75 80
Gln Cys Glu Asp Val Ala Thr Tyr Tyr Cys Ala Gly Gly Tyr Ser Gly
85 90 95
Asp Ile Tyr Thr Phe Gly Gly Gly Thr Glu Val Val Val Glu
100 105 110
<210> 217
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> B24 Heavy Chain Variable Region
<400> 217
Gln Ser Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser
1 5 10 15
Leu Arg Leu Ser Cys Thr Val Ser Gly Ile Asp Leu Tyr Thr Asn Arg
20 25 30
Val Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Gly
35 40 45
Ser Ile Gly Ser Ser Pro Trp Tyr Ala Ser Trp Ala Gln Gly Arg Phe
50 55 60
Thr Ile Ser Arg Asp Asn Ser Asn Thr Val Tyr Leu Lys Met Asn Ser
65 70 75 80
Pro Thr Ala Glu Asp Thr Ala Thr Tyr Phe Cys Ala Lys Gly Gly Tyr
85 90 95
Arg Pro Gly Gly Ser Ile Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser
<210> 218
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> B25 Heavy Chain Variable Region
<400> 218
Gln Ser Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser
1 5 10 15
Leu Arg Leu Ser Cys Thr Val Ser Gly Ile Asp Leu Tyr Thr Asn Arg
20 25 30
Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Gly
35 40 45
Ser Ile Gly Ser Ser Pro Trp Phe Ala Ser Trp Ala Leu Gly Arg Phe
50 55 60
Thr Ile Ser Arg Asp Asn Ser Asn Thr Val Tyr Leu Lys Met Asn Ser
65 70 75 80
Pro Thr Ala Glu Asp Thr Ala Thr Tyr Phe Cys Ala Lys Gly Gly Tyr
85 90 95
Arg Pro Gly Ala Ser Val Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser
<210> 219
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> B24 Light Chain Variable Region
<400> 219
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ser Ser Gln Ser Ile Tyr Asp Asn
20 25 30
Asn Asp Leu Gly Trp Tyr Gln Gln Lys Pro Gly Lys Thr Pro Lys Arg
35 40 45
Leu Ile Tyr Leu Ala Ser Ser Leu Asp Ser Gly Val Pro Ser Arg Phe
50 55 60
Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu
65 70 75 80
Gln Pro Glu Asp Val Ala Thr Tyr Tyr Cys Ala Gly Gly Tyr Ser Gly
85 90 95
Asp Ile Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 220
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> B25 Light Chain Variable Region
<400> 220
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ser Ser Gln Ser Ile Tyr Asp Asn
20 25 30
Asn Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Thr Pro Lys Arg
35 40 45
Leu Ile Tyr Leu Ala Ser Ser Leu Asp Ser Gly Val Pro Ser Arg Phe
50 55 60
Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu
65 70 75 80
Gln Pro Glu Asp Val Ala Thr Tyr Tyr Cys Ala Gly Gly Tyr Asn Gly
85 90 95
Asp Ile Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 221
<211> 77
<212> PRT
<213> Homo sapiens
<400> 221
Met Asn Leu Arg Leu Cys Val Gln Ala Leu Leu Leu Leu Trp Leu Ser
1 5 10 15
Leu Thr Ala Val Cys Gly Gly Ser Leu Met Pro Leu Pro Asp Gly Asn
20 25 30
Gly Leu Glu Asp Gly Asn Val Arg His Leu Val Gln Pro Arg Gly Ser
35 40 45
Arg Asn Gly Pro Gly Pro Trp Gln Gly Gly Arg Arg Lys Phe Arg Arg
50 55 60
Gln Arg Pro Arg Leu Ser His Lys Gly Pro Met Pro Phe
65 70 75
Claims (51)
- 하기의 폴리펩티드 서열을 갖는, 중쇄 상보성 결정 영역 1 (HCDR1), HCDR2, HCDR3, 경쇄 상보성 결정 영역 1 (LCDR1), LCDR2, 및 LCDR3 을 포함하는 단리된 모노클로날 항체 또는 그의 항원-결합 단편으로서, 아펠린, 바람직하게는 인간 아펠린에 특이적으로 결합하는 단리된 모노클로날 항체 또는 그의 항원-결합 단편:
(1) SEQ ID NOs:168, 169, 170, 171, 102, 및 172, 각각;
(2) SEQ ID NOs:50, 51, 52, 110, 111, 및 112, 각각;
(3) SEQ ID NOs:173, 174, 175, 176, 114, 및 115, 각각;
(4) SEQ ID NOs:68, 177, 178, 128, 129, 및 130, 각각;
(5) SEQ ID NOs:74, 75, 76, 134, 135, 및 136, 각각;
(6) SEQ ID NOs:179, 78, 180, 137, 138, 및 139, 각각;
(7) SEQ ID NOs:83, 84, 85, 143, 144, 및 145, 각각;
(8) SEQ ID NOs:86, 87, 88, 146, 147, 및 148, 각각;
(9) SEQ ID NOs:89, 90, 91, 149, 150, 및 151, 각각;
(10) SEQ ID NOs:92, 93, 94, 152, 153, 및 154, 각각;
(11) SEQ ID NOs:95, 96, 97, 155, 156, 및 157, 각각; 또는
(12) SEQ ID NOs:98, 99, 100, 158, 159, 및 160, 각각. - 제 1 항에 있어서, SEQ ID NO:1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37, 또는 39 와 적어도 95% 동일한 폴리펩티드 서열을 갖는 중쇄 가변 영역, 또는 SEQ ID NO:2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 또는 40 와 적어도 95% 동일한 폴리펩티드 서열을 갖는 경쇄 가변 영역을 포함하는 단리된 모노클로날 항체 또는 그의 항원-결합 단편.
- 제 1 항 또는 제 2 항에 있어서, 하기를 포함하는 단리된 모노클로날 항체 또는 그의 항원-결합 단편:
a. SEQ ID NO:1 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:2 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
b. SEQ ID NO:3 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:4 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
c. SEQ ID NO:5 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:6 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
d. SEQ ID NO:7 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:8 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
e. SEQ ID NO:9 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:10 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
f. SEQ ID NO:11 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:12 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
g. SEQ ID NO:13 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:14 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
h. SEQ ID NO:15 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:16 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
i. SEQ ID NO:17 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:18 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
j. SEQ ID NO:19 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:20 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
k. SEQ ID NO:21 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:22 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
l. SEQ ID NO:23 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:24 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
m. SEQ ID NO:25 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:26 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
n. SEQ ID NO:27 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:28 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
o. SEQ ID NO:29 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:30 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
p. SEQ ID NO:31 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:32 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
q. SEQ ID NO:33 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:34 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
r. SEQ ID NO:35 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:36 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
s. SEQ ID NO:37 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:38 의 폴리펩티드 서열을 갖는 경쇄 가변 영역; 또는
t. SEQ ID NO:39 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:40 의 폴리펩티드 서열을 갖는 경쇄 가변 영역. - SEQ ID NO:188 의 아미노산 서열을 포함하는 에피토프에 특이적으로 결합하는 아펠린에 대한 단리된 모노클로날 항체 또는 그의 항원-결합 단편.
- SEQ ID NO:204 의 아미노산 서열을 포함하는 에피토프에 특이적으로 결합하는 아펠린에 대한 단리된 모노클로날 항체 또는 그의 항원-결합 단편.
- 제 4 항 또는 제 5 항에 있어서, 항체 또는 그의 항원-결합 단편은 아펠린 활성을 저해하는 단리된 모노클로날 항체 또는 그의 항원-결합 단편.
- 제 4 항에 있어서, 항체 또는 그의 항원-결합 단편은 아펠린-13, 파이로-아펠린-13, 아펠린-17, 아펠린-36, 아펠린-55, 및/또는 아펠린-13 과 동일한 C-말단 단부를 공유하는 다른 형태의 아펠린에 결합할 수 있는 단리된 모노클로날 항체 또는 그의 항원-결합 단편.
- 제 5 항에 있어서, 항체 또는 그의 항원-결합 단편은 아펠린-13 및 파이로-아펠린-13 에 결합할 수 있는 단리된 모노클로날 항체 또는 그의 항원-결합 단편.
- 제 1 항 내지 제 8 항 중 어느 한 항에 있어서, 항체 또는 그의 항원-결합 단편은 키메라인 단리된 모노클로날 항체 또는 그의 항원-결합 단편.
- 제 1 항 내지 제 9 항 중 어느 한 항에 있어서, 항체 또는 그의 항원-결합 단편은 인간 또는 인간화된 것인 단리된 모노클로날 항체 또는 그의 항원-결합 단편.
- 제 10 항에 있어서, 항체 또는 그의 항원-결합 단편은 하기를 포함하는 단리된 모노클로날 항체 또는 그의 항원-결합 단편:
a. SEQ ID NO:211 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:215 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
b. SEQ ID NO:212 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:215 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
c. SEQ ID NO:213 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:215 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
d. SEQ ID NO:214 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:215 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
e. SEQ ID NO:213 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:216 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
f. SEQ ID NO:214 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:216 의 폴리펩티드 서열을 갖는 경쇄 가변 영역;
g. SEQ ID NO:217 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:219 의 폴리펩티드 서열을 갖는 경쇄 가변 영역; 또는
h. SEQ ID NO:218 의 폴리펩티드 서열을 갖는 중쇄 가변 영역, 및 SEQ ID NO:220 의 폴리펩티드 서열을 갖는 경쇄 가변 영역. - 제 1 항 내지 제 11 항 중 어느 한 항의 모노클로날 항체 또는 그의 항원-결합 단편을 인코딩하는 단리된 핵산.
- 제 12 항의 단리된 핵산을 포함하는 벡터.
- 제 13 항의 벡터를 포함하는 숙주 세포.
- 제 1 항 내지 제 11 항 중 어느 한 항의 단리된 모노클로날 항체 또는 그의 항원-결합 단편 및 약학적으로 허용가능한 담체를 포함하는 약학적 조성물.
- 필요로 하는 대상체에서 아펠린 수용체에 대한 아펠린의 결합을 차단하는 방법으로서, 대상체에게 제 15 항의 약학적 조성물을 투여하는 것을 포함하는 방법.
- 필요로 하는 대상체에서 당뇨병성 망막병증 (DR) 을 치료하는 방법으로서, 대상체에게 제 15 항의 약학적 조성물을 투여하는 것을 포함하는 방법.
- 필요로 하는 대상체에서 연령관련 황반변성 (AMD) 을 치료하는 방법으로서, 대상체에게 제 15 항의 약학적 조성물을 투여하는 것을 포함하는 방법.
- 필요로 하는 대상체에서 당뇨병성 황반부종 (DME) 을 치료하는 방법으로서, 대상체에게 제 15 항의 약학적 조성물을 투여하는 것을 포함하는 방법.
- 필요로 하는 대상체에서 망막 정맥 폐쇄 (RVO) 후 황반부종을 치료하는 방법으로서, 대상체에게 제 15 항의 약학적 조성물을 투여하는 것을 포함하는 방법.
- 필요로 하는 대상체에서 망막변성을 치료하는 방법으로서, 대상체에게 제 15 항의 약학적 조성물을 투여하는 것을 포함하는 방법.
- 필요로 하는 대상체에서 근시 맥락막 혈관신생 (mCNV) 을 치료하는 방법으로서, 대상체에게 제 15 항의 약학적 조성물을 투여하는 것을 포함하는 방법.
- 필요로 하는 대상체에서 당뇨병성 신경병증을 치료하는 방법으로서, 대상체에게 제 15 항의 약학적 조성물을 투여하는 것을 포함하는 방법.
- 필요로 하는 대상체에서 만성 신장 질환 (CKD) 을 치료하는 방법으로서, 대상체에게 제 15 항의 약학적 조성물을 투여하는 것을 포함하는 방법.
- 필요로 하는 대상체에서 비알코올성 지방간염 (NASH) 을 치료하는 방법으로서, 대상체에게 제 15 항의 약학적 조성물을 투여하는 것을 포함하는 방법.
- 필요로 하는 대상체에서 간경화증을 치료하는 방법으로서, 대상체에게 제 15 항의 약학적 조성물을 투여하는 것을 포함하는 방법.
- 필요로 하는 대상체에서 경화반내 혈관신생을 치료하는 방법으로서, 대상체에게 제 15 항의 약학적 조성물을 투여하는 것을 포함하는 방법.
- 필요로 하는 대상체에서 홍채 홍색증을 치료하는 방법으로서, 대상체에게 제 15 항의 약학적 조성물을 투여하는 것을 포함하는 방법.
- 필요로 하는 대상체에서 신생혈관 녹내장을 치료하는 방법으로서, 대상체에게 제 15 항의 약학적 조성물을 투여하는 것을 포함하는 방법.
- 필요로 하는 대상체에서 각막 혈관신생 (CNV) 을 치료하는 방법으로서, 대상체에게 제 15 항의 약학적 조성물을 투여하는 것을 포함하는 방법.
- 필요로 하는 대상체에서 미숙아 망막병증 (ROP) 을 치료하는 방법으로서, 대상체에게 제 15 항의 약학적 조성물을 투여하는 것을 포함하는 방법.
- 필요로 하는 대상체에서 망막병증을 치료하는 방법으로서, 대상체에게 제 15 항의 약학적 조성물을 투여하는 것을 포함하는 방법.
- 필요로 하는 대상체에서 황반변성을 치료하는 방법으로서, 대상체에게 제 15 항의 약학적 조성물을 투여하는 것을 포함하는 방법.
- 필요로 하는 대상체에서 난소 과다자극 증후군 (OHSS) 을 치료하는 방법으로서, 대상체에게 제 15 항의 약학적 조성물을 투여하는 것을 포함하는 방법.
- 필요로 하는 대상체에서 자궁 출혈을 치료하는 방법으로서, 대상체에게 제 15 항의 약학적 조성물을 투여하는 것을 포함하는 방법.
- 필요로 하는 대상체에서 자궁내막증을 치료하는 방법으로서, 대상체에게 제 15 항의 약학적 조성물을 투여하는 것을 포함하는 방법.
- 필요로 하는 대상체에서 자궁내막 이상증식증 및 암을 치료하는 방법으로서, 대상체에게 제 15 항의 약학적 조성물을 투여하는 것을 포함하는 방법.
- 필요로 하는 대상체에서 자궁평활근종을 치료하는 방법으로서, 대상체에게 제 15 항의 약학적 조성물을 투여하는 것을 포함하는 방법.
- 필요로 하는 대상체에서 선근증을 치료하는 방법으로서, 대상체에게 제 15 항의 약학적 조성물을 투여하는 것을 포함하는 방법.
- 필요로 하는 대상체에서 조직 섬유증을 치료하는 방법으로서, 대상체에게 제 15 항의 약학적 조성물을 투여하는 것을 포함하는 방법.
- 필요로 하는 대상체에서 암을 치료하는 방법으로서, 대상체에게 제 15 항의 약학적 조성물을 투여하는 것을 포함하는 방법.
- 제 41 항에 있어서, 약학적 조성물은 이차 항암제를 추가로 포함하는 치료 방법.
- 제 42 항에 있어서, 이차 항암제는 항-VEGF 제인 치료 방법.
- 제 43 항에 있어서, 항-VEGF 제는 아바스틴 또는 베바시주맙 바이오시밀러제인 치료 방법.
- 제 43 항에 있어서, 항-VEGF 제는 VEGFR1 및/또는 VEGFR2 차단제인 치료 방법.
- 대상체에서 아펠린의 수준을 확인하는 방법으로서, 하기를 포함하는 방법:
a. 대상체로부터 샘플을 수득하는 단계;
b. 샘플을 제 1 항 내지 제 11 항 중 어느 한 항의 항체 또는 항원-결합 단편과 접촉시키는 단계; 및
c. 대상체에서 아펠린의 수준을 확인하는 단계. - 제 46 항에 있어서, 샘플은 조직 샘플인 확인 방법.
- 제 47 항에 있어서, 조직 샘플은 암 조직 샘플인 확인 방법.
- 제 46 항에 있어서, 샘플은 혈액 샘플인 확인 방법.
- 제 1 항 내지 제 11 항 중 어느 한 항의 모노클로날 항체 또는 항원-결합 단편을 생산하는 방법으로서, 모노클로날 항체 또는 항원-결합 단편을 인코딩하는 핵산을 포함하는 세포를 모노클로날 항체 또는 항원-결합 단편을 생산하는 조건 하에 배양하고, 항체 또는 항원-결합 단편을 세포 또는 배양물로부터 회수하는 것을 포함하는 방법.
- 제 1 항 내지 제 11 항 중 어느 한 항의 모노클로날 항체 또는 항원-결합 단편을 포함하는 약학적 조성물을 생산하는 방법으로서, 모노클로날 항체 또는 항원-결합 단편을 약학적으로 허용가능한 담체와 조합하여 약학적 조성물을 얻는 것을 포함하는 방법.
Applications Claiming Priority (9)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201762549523P | 2017-08-24 | 2017-08-24 | |
| US62/549,523 | 2017-08-24 | ||
| US201762579287P | 2017-10-31 | 2017-10-31 | |
| US62/579,287 | 2017-10-31 | ||
| US201862656586P | 2018-04-12 | 2018-04-12 | |
| US62/656,586 | 2018-04-12 | ||
| US201862658111P | 2018-04-16 | 2018-04-16 | |
| US62/658,111 | 2018-04-16 | ||
| PCT/US2018/047144 WO2019040390A1 (en) | 2017-08-24 | 2018-08-21 | ANTI-APELIN ANTIBODIES AND USES THEREOF |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20200038311A true KR20200038311A (ko) | 2020-04-10 |
Family
ID=65440110
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020207008305A KR20200038311A (ko) | 2017-08-24 | 2018-08-21 | 항-아펠린 항체 및 그의 용도 |
Country Status (12)
| Country | Link |
|---|---|
| US (1) | US11365242B2 (ko) |
| EP (1) | EP3672987A4 (ko) |
| JP (1) | JP7219265B2 (ko) |
| KR (1) | KR20200038311A (ko) |
| CN (1) | CN111032689B (ko) |
| AU (1) | AU2018322452A1 (ko) |
| BR (1) | BR112020003584A2 (ko) |
| CA (1) | CA3072261A1 (ko) |
| IL (1) | IL272476A (ko) |
| MX (1) | MX2020002042A (ko) |
| SG (1) | SG11202000899PA (ko) |
| WO (1) | WO2019040390A1 (ko) |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN110655577A (zh) * | 2018-06-13 | 2020-01-07 | 鸿运华宁(杭州)生物医药有限公司 | APJ抗体及其与Elabela的融合蛋白质,以及其药物组合物和应用 |
| US20220220214A1 (en) * | 2019-06-19 | 2022-07-14 | Ab Initio Biotherapeutics, Inc. | Apj modulators and uses thereof |
| CN112442534B (zh) * | 2020-11-06 | 2022-03-15 | 温州医科大学 | 循环血外泌体miR-146a-5p作为视网膜静脉阻塞治疗及预后评估标志物中的应用 |
| CN114539415B (zh) * | 2020-11-24 | 2024-02-02 | 普米斯生物技术(珠海)有限公司 | 一种抗PD-L1/VEGF/TGF-β多特异性抗体及其用途 |
| CN112480267A (zh) * | 2020-12-04 | 2021-03-12 | 复旦大学附属华山医院 | 一种可特异性识别增殖状态内皮细胞的启动分子及工程细胞 |
| CN112546198B (zh) * | 2020-12-17 | 2022-03-25 | 温州医科大学慈溪生物医药研究院 | 一种用于治疗脑中风和急性脑梗的药物组合物 |
| CN114099642A (zh) * | 2021-11-12 | 2022-03-01 | 南通大学 | 基因Apln在制备治疗与细胞成血管有关疾病药物中的应用 |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8946382B2 (en) | 2009-02-27 | 2015-02-03 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Apelin peptides and methods of use |
| WO2013012855A1 (en) | 2011-07-18 | 2013-01-24 | Amgen Inc. | Apelin antigen-binding proteins and uses thereof |
| JP6181152B2 (ja) | 2012-04-11 | 2017-08-16 | アンスティチュ ナショナル ドゥ ラ サンテ エ ドゥ ラ ルシェルシュ メディカル | アペリン阻害剤としてのポリペプチドおよびその使用 |
| WO2014152955A1 (en) * | 2013-03-14 | 2014-09-25 | Regeneron Pharmaceuticals, Inc. | Apelin fusion proteins and uses thereof |
| EP3008087A4 (en) | 2013-06-10 | 2017-03-01 | Merck Sharp & Dohme Corp. | Cmv neutralizing antigen binding proteins |
-
2018
- 2018-08-21 KR KR1020207008305A patent/KR20200038311A/ko not_active Application Discontinuation
- 2018-08-21 AU AU2018322452A patent/AU2018322452A1/en not_active Abandoned
- 2018-08-21 MX MX2020002042A patent/MX2020002042A/es unknown
- 2018-08-21 CA CA3072261A patent/CA3072261A1/en active Pending
- 2018-08-21 SG SG11202000899PA patent/SG11202000899PA/en unknown
- 2018-08-21 US US16/639,808 patent/US11365242B2/en active Active
- 2018-08-21 WO PCT/US2018/047144 patent/WO2019040390A1/en unknown
- 2018-08-21 CN CN201880055019.2A patent/CN111032689B/zh active Active
- 2018-08-21 BR BR112020003584-0A patent/BR112020003584A2/pt not_active IP Right Cessation
- 2018-08-21 EP EP18848958.7A patent/EP3672987A4/en active Pending
- 2018-08-21 JP JP2020511350A patent/JP7219265B2/ja active Active
-
2020
- 2020-02-05 IL IL272476A patent/IL272476A/en unknown
Also Published As
| Publication number | Publication date |
|---|---|
| CN111032689B (zh) | 2024-02-27 |
| EP3672987A1 (en) | 2020-07-01 |
| US11365242B2 (en) | 2022-06-21 |
| BR112020003584A2 (pt) | 2020-09-01 |
| US20200362021A1 (en) | 2020-11-19 |
| JP7219265B2 (ja) | 2023-02-07 |
| WO2019040390A1 (en) | 2019-02-28 |
| AU2018322452A1 (en) | 2020-03-05 |
| CN111032689A (zh) | 2020-04-17 |
| SG11202000899PA (en) | 2020-03-30 |
| CA3072261A1 (en) | 2019-02-28 |
| MX2020002042A (es) | 2020-08-13 |
| JP2020536492A (ja) | 2020-12-17 |
| IL272476A (en) | 2020-03-31 |
| EP3672987A4 (en) | 2021-08-18 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR102646468B1 (ko) | 항-cd47 항체 및 이의 용도 | |
| AU2019231172B2 (en) | Anti-CD73 antibodies and uses thereof | |
| US11365242B2 (en) | Anti-apelin antibodies and uses thereof | |
| US12037391B2 (en) | Anti-DLL3 antibodies and uses thereof | |
| US11390679B2 (en) | Anti-LAG-3 antibodies and uses thereof | |
| US11214615B2 (en) | Anti-TIM-3 antibodies and uses thereof | |
| US11873335B2 (en) | Anti-folate receptor 1 antibodies and uses thereof | |
| EA043281B1 (ru) | Анти-cd47 антитела и их применение |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITB | Written withdrawal of application |