KR20190026003A - 중수소화 덱스트로메토르판의 합성 방법 - Google Patents
중수소화 덱스트로메토르판의 합성 방법 Download PDFInfo
- Publication number
- KR20190026003A KR20190026003A KR1020197003589A KR20197003589A KR20190026003A KR 20190026003 A KR20190026003 A KR 20190026003A KR 1020197003589 A KR1020197003589 A KR 1020197003589A KR 20197003589 A KR20197003589 A KR 20197003589A KR 20190026003 A KR20190026003 A KR 20190026003A
- Authority
- KR
- South Korea
- Prior art keywords
- compound
- formula
- dextromethorphan
- base
- rti
- Prior art date
Links
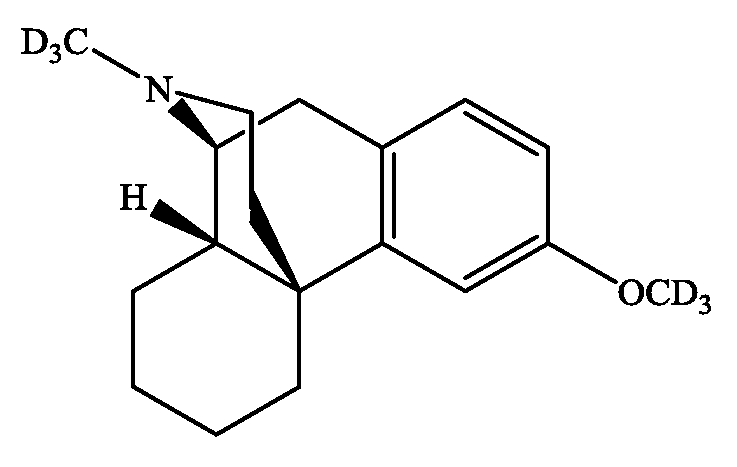
- MKXZASYAUGDDCJ-SZMVWBNQSA-N LSM-2525 Chemical class C1CCC[C@H]2[C@@]3([H])N(C)CC[C@]21C1=CC(OC)=CC=C1C3 MKXZASYAUGDDCJ-SZMVWBNQSA-N 0.000 title claims abstract description 99
- 238000001308 synthesis method Methods 0.000 title description 2
- 238000000034 method Methods 0.000 claims abstract description 106
- 150000003839 salts Chemical class 0.000 claims abstract description 52
- 230000008569 process Effects 0.000 claims abstract description 25
- 150000001875 compounds Chemical class 0.000 claims description 369
- 229960001985 dextromethorphan Drugs 0.000 claims description 99
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 claims description 54
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 claims description 45
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 claims description 44
- -1 dextromethorphan compound Chemical class 0.000 claims description 43
- INQOMBQAUSQDDS-FIBGUPNXSA-N trideuterio(iodo)methane Chemical compound [2H]C([2H])([2H])I INQOMBQAUSQDDS-FIBGUPNXSA-N 0.000 claims description 43
- 238000010520 demethylation reaction Methods 0.000 claims description 38
- 238000007069 methylation reaction Methods 0.000 claims description 33
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 claims description 32
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 claims description 32
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 claims description 27
- 229910000027 potassium carbonate Inorganic materials 0.000 claims description 22
- 235000011181 potassium carbonates Nutrition 0.000 claims description 22
- ZCSHNCUQKCANBX-UHFFFAOYSA-N lithium diisopropylamide Chemical compound [Li+].CC(C)[N-]C(C)C ZCSHNCUQKCANBX-UHFFFAOYSA-N 0.000 claims description 20
- 235000011121 sodium hydroxide Nutrition 0.000 claims description 18
- MKXZASYAUGDDCJ-QNNIAVNKSA-N deudextromethorphan Chemical compound C([C@@H]12)CCC[C@]11CCN(C([2H])([2H])[2H])[C@H]2CC2=CC=C(OC([2H])([2H])[2H])C=C21 MKXZASYAUGDDCJ-QNNIAVNKSA-N 0.000 claims description 17
- WQDUMFSSJAZKTM-UHFFFAOYSA-N Sodium methoxide Chemical compound [Na+].[O-]C WQDUMFSSJAZKTM-UHFFFAOYSA-N 0.000 claims description 16
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 claims description 15
- 235000011118 potassium hydroxide Nutrition 0.000 claims description 15
- 229910000029 sodium carbonate Inorganic materials 0.000 claims description 15
- 239000012312 sodium hydride Substances 0.000 claims description 15
- 229910000104 sodium hydride Inorganic materials 0.000 claims description 15
- QOPVNWQGBQYBBP-UHFFFAOYSA-N chloroethyl chloroformate Chemical compound CC(Cl)OC(Cl)=O QOPVNWQGBQYBBP-UHFFFAOYSA-N 0.000 claims description 14
- UIIMBOGNXHQVGW-DEQYMQKBSA-M Sodium bicarbonate-14C Chemical compound [Na+].O[14C]([O-])=O UIIMBOGNXHQVGW-DEQYMQKBSA-M 0.000 claims description 13
- 150000001412 amines Chemical class 0.000 claims description 13
- 238000002425 crystallisation Methods 0.000 claims description 10
- 230000008025 crystallization Effects 0.000 claims description 10
- 239000011736 potassium bicarbonate Substances 0.000 claims description 9
- 229910000028 potassium bicarbonate Inorganic materials 0.000 claims description 9
- 235000015497 potassium bicarbonate Nutrition 0.000 claims description 9
- TYJJADVDDVDEDZ-UHFFFAOYSA-M potassium hydrogencarbonate Chemical compound [K+].OC([O-])=O TYJJADVDDVDEDZ-UHFFFAOYSA-M 0.000 claims description 9
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 claims description 8
- 229910000024 caesium carbonate Inorganic materials 0.000 claims description 8
- 150000003512 tertiary amines Chemical class 0.000 claims description 8
- GVLGAFRNYJVHBC-UHFFFAOYSA-N hydrate;hydrobromide Chemical compound O.Br GVLGAFRNYJVHBC-UHFFFAOYSA-N 0.000 claims description 7
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 claims description 7
- 238000004519 manufacturing process Methods 0.000 abstract description 9
- 238000006243 chemical reaction Methods 0.000 description 144
- LOUPRKONTZGTKE-LHHVKLHASA-N quinidine Chemical group C([C@H]([C@H](C1)C=C)C2)C[N@@]1[C@H]2[C@@H](O)C1=CC=NC2=CC=C(OC)C=C21 LOUPRKONTZGTKE-LHHVKLHASA-N 0.000 description 124
- 239000000203 mixture Substances 0.000 description 108
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 102
- LOUPRKONTZGTKE-UHFFFAOYSA-N cinchonine Natural products C1C(C(C2)C=C)CCN2C1C(O)C1=CC=NC2=CC=C(OC)C=C21 LOUPRKONTZGTKE-UHFFFAOYSA-N 0.000 description 63
- 239000003960 organic solvent Substances 0.000 description 63
- 239000002585 base Substances 0.000 description 62
- 229960001404 quinidine Drugs 0.000 description 62
- 239000008194 pharmaceutical composition Substances 0.000 description 54
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 52
- 235000002639 sodium chloride Nutrition 0.000 description 52
- 239000003814 drug Substances 0.000 description 51
- 210000002381 plasma Anatomy 0.000 description 51
- 239000003153 chemical reaction reagent Substances 0.000 description 46
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 45
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 41
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 40
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 36
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 36
- 229940124597 therapeutic agent Drugs 0.000 description 34
- 239000000243 solution Substances 0.000 description 33
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 28
- 239000008213 purified water Substances 0.000 description 27
- 201000010099 disease Diseases 0.000 description 26
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 24
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 24
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 24
- 229910052805 deuterium Inorganic materials 0.000 description 22
- 230000002829 reductive effect Effects 0.000 description 22
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 19
- 239000012535 impurity Substances 0.000 description 19
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 18
- 239000002253 acid Substances 0.000 description 18
- 239000011541 reaction mixture Substances 0.000 description 18
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 16
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 16
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 16
- 238000001914 filtration Methods 0.000 description 16
- 239000012074 organic phase Substances 0.000 description 16
- 238000010791 quenching Methods 0.000 description 16
- 230000000171 quenching effect Effects 0.000 description 16
- 239000002904 solvent Substances 0.000 description 16
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 15
- 239000000543 intermediate Substances 0.000 description 15
- 238000003786 synthesis reaction Methods 0.000 description 15
- 230000000694 effects Effects 0.000 description 14
- GJHKWLSRHNWTAN-UHFFFAOYSA-N 1-ethoxy-4-(4-pentylcyclohexyl)benzene Chemical compound C1CC(CCCCC)CCC1C1=CC=C(OCC)C=C1 GJHKWLSRHNWTAN-UHFFFAOYSA-N 0.000 description 13
- 239000012848 Dextrorphan Substances 0.000 description 13
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 13
- 230000015572 biosynthetic process Effects 0.000 description 13
- JAQUASYNZVUNQP-PVAVHDDUSA-N dextrorphan Chemical compound C1C2=CC=C(O)C=C2[C@@]23CCN(C)[C@@H]1[C@H]2CCCC3 JAQUASYNZVUNQP-PVAVHDDUSA-N 0.000 description 13
- 229950006878 dextrorphan Drugs 0.000 description 13
- 208000035475 disorder Diseases 0.000 description 13
- 229940079593 drug Drugs 0.000 description 13
- 229960004482 quinidine sulfate Drugs 0.000 description 13
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 12
- 208000002193 Pain Diseases 0.000 description 12
- 239000000047 product Substances 0.000 description 12
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 12
- 238000009472 formulation Methods 0.000 description 11
- 239000012458 free base Substances 0.000 description 11
- 235000017550 sodium carbonate Nutrition 0.000 description 11
- JWUJQDFVADABEY-UHFFFAOYSA-N 2-methyltetrahydrofuran Chemical compound CC1CCCO1 JWUJQDFVADABEY-UHFFFAOYSA-N 0.000 description 10
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 9
- 238000010348 incorporation Methods 0.000 description 9
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 9
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 8
- 235000019270 ammonium chloride Nutrition 0.000 description 8
- 230000008901 benefit Effects 0.000 description 8
- 239000002552 dosage form Substances 0.000 description 8
- 238000010438 heat treatment Methods 0.000 description 8
- 230000036407 pain Effects 0.000 description 8
- 239000003495 polar organic solvent Substances 0.000 description 8
- 239000012453 solvate Substances 0.000 description 8
- 239000000725 suspension Substances 0.000 description 8
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical class Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 7
- 206010002026 amyotrophic lateral sclerosis Diseases 0.000 description 7
- 239000003795 chemical substances by application Substances 0.000 description 7
- 229910052739 hydrogen Inorganic materials 0.000 description 7
- 239000007788 liquid Substances 0.000 description 7
- 239000002808 molecular sieve Substances 0.000 description 7
- URGAHOPLAPQHLN-UHFFFAOYSA-N sodium aluminosilicate Chemical group [Na+].[Al+3].[O-][Si]([O-])=O.[O-][Si]([O-])=O URGAHOPLAPQHLN-UHFFFAOYSA-N 0.000 description 7
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 6
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 6
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 6
- OFBQJSOFQDEBGM-UHFFFAOYSA-N Pentane Chemical compound CCCCC OFBQJSOFQDEBGM-UHFFFAOYSA-N 0.000 description 6
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 6
- 239000004480 active ingredient Substances 0.000 description 6
- 239000008346 aqueous phase Substances 0.000 description 6
- 125000004429 atom Chemical group 0.000 description 6
- 210000004556 brain Anatomy 0.000 description 6
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 6
- 239000002274 desiccant Substances 0.000 description 6
- 239000001257 hydrogen Substances 0.000 description 6
- 230000000155 isotopic effect Effects 0.000 description 6
- BQJCRHHNABKAKU-KBQPJGBKSA-N morphine Chemical compound O([C@H]1[C@H](C=C[C@H]23)O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4O BQJCRHHNABKAKU-KBQPJGBKSA-N 0.000 description 6
- 239000011148 porous material Substances 0.000 description 6
- 238000002360 preparation method Methods 0.000 description 6
- 239000000126 substance Substances 0.000 description 6
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 6
- 206010054196 Affect lability Diseases 0.000 description 5
- 108010001237 Cytochrome P-450 CYP2D6 Proteins 0.000 description 5
- 206010012335 Dependence Diseases 0.000 description 5
- 239000002775 capsule Substances 0.000 description 5
- 239000000969 carrier Substances 0.000 description 5
- 238000011260 co-administration Methods 0.000 description 5
- 238000001816 cooling Methods 0.000 description 5
- 230000001965 increasing effect Effects 0.000 description 5
- 230000002401 inhibitory effect Effects 0.000 description 5
- 238000009521 phase II clinical trial Methods 0.000 description 5
- 229920001223 polyethylene glycol Polymers 0.000 description 5
- 239000000843 powder Substances 0.000 description 5
- 230000009467 reduction Effects 0.000 description 5
- 230000002194 synthesizing effect Effects 0.000 description 5
- 230000001225 therapeutic effect Effects 0.000 description 5
- 125000003944 tolyl group Chemical group 0.000 description 5
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 4
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 4
- 0 COc1cc([C@]2(CCCC3)[C@]3[C@](C3)C(*)CC2)c3cc1 Chemical compound COc1cc([C@]2(CCCC3)[C@]3[C@](C3)C(*)CC2)c3cc1 0.000 description 4
- RGHNJXZEOKUKBD-SQOUGZDYSA-N D-gluconic acid Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C(O)=O RGHNJXZEOKUKBD-SQOUGZDYSA-N 0.000 description 4
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 4
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 4
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 4
- FFFHZYDWPBMWHY-VKHMYHEASA-N L-homocysteine Chemical compound OC(=O)[C@@H](N)CCS FFFHZYDWPBMWHY-VKHMYHEASA-N 0.000 description 4
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 4
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 4
- 239000002202 Polyethylene glycol Substances 0.000 description 4
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 4
- 208000006289 Rett Syndrome Diseases 0.000 description 4
- 208000020764 Sensation disease Diseases 0.000 description 4
- 206010067672 Spasmodic dysphonia Diseases 0.000 description 4
- 208000006011 Stroke Diseases 0.000 description 4
- 150000001266 acyl halides Chemical class 0.000 description 4
- 239000011260 aqueous acid Substances 0.000 description 4
- 230000009286 beneficial effect Effects 0.000 description 4
- ILAHWRKJUDSMFH-UHFFFAOYSA-N boron tribromide Chemical compound BrB(Br)Br ILAHWRKJUDSMFH-UHFFFAOYSA-N 0.000 description 4
- 210000003169 central nervous system Anatomy 0.000 description 4
- FZFAMSAMCHXGEF-UHFFFAOYSA-N chloro formate Chemical compound ClOC=O FZFAMSAMCHXGEF-UHFFFAOYSA-N 0.000 description 4
- 238000000576 coating method Methods 0.000 description 4
- ZPUCINDJVBIVPJ-LJISPDSOSA-N cocaine Chemical compound O([C@H]1C[C@@H]2CC[C@@H](N2C)[C@H]1C(=O)OC)C(=O)C1=CC=CC=C1 ZPUCINDJVBIVPJ-LJISPDSOSA-N 0.000 description 4
- 239000003085 diluting agent Substances 0.000 description 4
- VYFYYTLLBUKUHU-UHFFFAOYSA-N dopamine Chemical compound NCCC1=CC=C(O)C(O)=C1 VYFYYTLLBUKUHU-UHFFFAOYSA-N 0.000 description 4
- 239000003937 drug carrier Substances 0.000 description 4
- 238000001035 drying Methods 0.000 description 4
- LNEPOXFFQSENCJ-UHFFFAOYSA-N haloperidol Chemical compound C1CC(O)(C=2C=CC(Cl)=CC=2)CCN1CCCC(=O)C1=CC=C(F)C=C1 LNEPOXFFQSENCJ-UHFFFAOYSA-N 0.000 description 4
- 150000004677 hydrates Chemical class 0.000 description 4
- 238000002347 injection Methods 0.000 description 4
- 239000007924 injection Substances 0.000 description 4
- 150000007529 inorganic bases Chemical class 0.000 description 4
- 229910017053 inorganic salt Inorganic materials 0.000 description 4
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 4
- 239000000463 material Substances 0.000 description 4
- 239000002207 metabolite Substances 0.000 description 4
- 150000007522 mineralic acids Chemical class 0.000 description 4
- 208000015122 neurodegenerative disease Diseases 0.000 description 4
- 229940127240 opiate Drugs 0.000 description 4
- 229920001983 poloxamer Polymers 0.000 description 4
- 229920000642 polymer Polymers 0.000 description 4
- 239000011591 potassium Substances 0.000 description 4
- 229910052700 potassium Inorganic materials 0.000 description 4
- 102000005962 receptors Human genes 0.000 description 4
- 108020003175 receptors Proteins 0.000 description 4
- 238000010992 reflux Methods 0.000 description 4
- QZAYGJVTTNCVMB-UHFFFAOYSA-N serotonin Chemical compound C1=C(O)C=C2C(CCN)=CNC2=C1 QZAYGJVTTNCVMB-UHFFFAOYSA-N 0.000 description 4
- MFRIHAYPQRLWNB-UHFFFAOYSA-N sodium tert-butoxide Chemical compound [Na+].CC(C)(C)[O-] MFRIHAYPQRLWNB-UHFFFAOYSA-N 0.000 description 4
- 201000002849 spasmodic dystonia Diseases 0.000 description 4
- 239000007858 starting material Substances 0.000 description 4
- 238000003756 stirring Methods 0.000 description 4
- LMBFAGIMSUYTBN-MPZNNTNKSA-N teixobactin Chemical compound C([C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(=O)N[C@H](CCC(N)=O)C(=O)N[C@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(=O)N[C@H]1C(N[C@@H](C)C(=O)N[C@@H](C[C@@H]2NC(=N)NC2)C(=O)N[C@H](C(=O)O[C@H]1C)[C@@H](C)CC)=O)NC)C1=CC=CC=C1 LMBFAGIMSUYTBN-MPZNNTNKSA-N 0.000 description 4
- GETQZCLCWQTVFV-UHFFFAOYSA-N trimethylamine Chemical compound CN(C)C GETQZCLCWQTVFV-UHFFFAOYSA-N 0.000 description 4
- 230000002485 urinary effect Effects 0.000 description 4
- 239000003981 vehicle Substances 0.000 description 4
- IYNWSQDZXMGGGI-NUEKZKHPSA-N 3-hydroxymorphinan Chemical compound C1CCC[C@H]2[C@H]3CC4=CC=C(O)C=C4[C@]21CCN3 IYNWSQDZXMGGGI-NUEKZKHPSA-N 0.000 description 3
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 3
- 208000024827 Alzheimer disease Diseases 0.000 description 3
- 206010003805 Autism Diseases 0.000 description 3
- 208000020706 Autistic disease Diseases 0.000 description 3
- WVDDGKGOMKODPV-UHFFFAOYSA-N Benzyl alcohol Chemical compound OCC1=CC=CC=C1 WVDDGKGOMKODPV-UHFFFAOYSA-N 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 3
- 206010010904 Convulsion Diseases 0.000 description 3
- 102100021704 Cytochrome P450 2D6 Human genes 0.000 description 3
- 206010012289 Dementia Diseases 0.000 description 3
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 3
- BDAGIHXWWSANSR-UHFFFAOYSA-N Formic acid Chemical class OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 3
- 241000282412 Homo Species 0.000 description 3
- 208000004454 Hyperalgesia Diseases 0.000 description 3
- 208000035154 Hyperesthesia Diseases 0.000 description 3
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 3
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 3
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 3
- 206010028980 Neoplasm Diseases 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 3
- 208000030886 Traumatic Brain injury Diseases 0.000 description 3
- 239000003929 acidic solution Substances 0.000 description 3
- 239000002671 adjuvant Substances 0.000 description 3
- 239000003963 antioxidant agent Substances 0.000 description 3
- 235000006708 antioxidants Nutrition 0.000 description 3
- 239000012298 atmosphere Substances 0.000 description 3
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 3
- 210000004369 blood Anatomy 0.000 description 3
- 239000008280 blood Substances 0.000 description 3
- AXCZMVOFGPJBDE-UHFFFAOYSA-L calcium dihydroxide Chemical compound [OH-].[OH-].[Ca+2] AXCZMVOFGPJBDE-UHFFFAOYSA-L 0.000 description 3
- 239000000920 calcium hydroxide Substances 0.000 description 3
- 229910001861 calcium hydroxide Inorganic materials 0.000 description 3
- 235000011116 calcium hydroxide Nutrition 0.000 description 3
- 201000011510 cancer Diseases 0.000 description 3
- 239000012067 demethylated product Substances 0.000 description 3
- 239000002270 dispersing agent Substances 0.000 description 3
- 239000012065 filter cake Substances 0.000 description 3
- 229940093915 gynecological organic acid Drugs 0.000 description 3
- 238000007918 intramuscular administration Methods 0.000 description 3
- 230000000670 limiting effect Effects 0.000 description 3
- 210000004185 liver Anatomy 0.000 description 3
- 230000037353 metabolic pathway Effects 0.000 description 3
- 230000004060 metabolic process Effects 0.000 description 3
- 238000002156 mixing Methods 0.000 description 3
- 150000004682 monohydrates Chemical group 0.000 description 3
- 229960005181 morphine Drugs 0.000 description 3
- 229910052757 nitrogen Inorganic materials 0.000 description 3
- 239000003921 oil Substances 0.000 description 3
- 210000000056 organ Anatomy 0.000 description 3
- 150000007524 organic acids Chemical class 0.000 description 3
- 235000005985 organic acids Nutrition 0.000 description 3
- 239000002245 particle Substances 0.000 description 3
- 230000037361 pathway Effects 0.000 description 3
- 239000000546 pharmaceutical excipient Substances 0.000 description 3
- 239000012071 phase Substances 0.000 description 3
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 3
- 230000003389 potentiating effect Effects 0.000 description 3
- 230000002265 prevention Effects 0.000 description 3
- 229930010796 primary metabolite Natural products 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- 238000006467 substitution reaction Methods 0.000 description 3
- 239000000375 suspending agent Substances 0.000 description 3
- 239000003826 tablet Substances 0.000 description 3
- 210000001519 tissue Anatomy 0.000 description 3
- 230000009529 traumatic brain injury Effects 0.000 description 3
- 210000002700 urine Anatomy 0.000 description 3
- PUPZLCDOIYMWBV-UHFFFAOYSA-N (+/-)-1,3-Butanediol Chemical compound CC(O)CCO PUPZLCDOIYMWBV-UHFFFAOYSA-N 0.000 description 2
- MXYUKLILVYORSK-UHFFFAOYSA-N (+/-)-allo-lobeline Natural products C1CCC(CC(=O)C=2C=CC=CC=2)N(C)C1CC(O)C1=CC=CC=C1 MXYUKLILVYORSK-UHFFFAOYSA-N 0.000 description 2
- SNICXCGAKADSCV-JTQLQIEISA-N (-)-Nicotine Chemical compound CN1CCC[C@H]1C1=CC=CN=C1 SNICXCGAKADSCV-JTQLQIEISA-N 0.000 description 2
- MXYUKLILVYORSK-HBMCJLEFSA-N (-)-lobeline Chemical compound C1([C@@H](O)C[C@H]2N([C@H](CCC2)CC(=O)C=2C=CC=CC=2)C)=CC=CC=C1 MXYUKLILVYORSK-HBMCJLEFSA-N 0.000 description 2
- SFLSHLFXELFNJZ-QMMMGPOBSA-N (-)-norepinephrine Chemical compound NC[C@H](O)C1=CC=C(O)C(O)=C1 SFLSHLFXELFNJZ-QMMMGPOBSA-N 0.000 description 2
- WRRSFOZOETZUPG-FFHNEAJVSA-N (4r,4ar,7s,7ar,12bs)-9-methoxy-3-methyl-2,4,4a,7,7a,13-hexahydro-1h-4,12-methanobenzofuro[3,2-e]isoquinoline-7-ol;hydrate Chemical class O.C([C@H]1[C@H](N(CC[C@@]112)C)C3)=C[C@H](O)[C@@H]1OC1=C2C3=CC=C1OC WRRSFOZOETZUPG-FFHNEAJVSA-N 0.000 description 2
- KWTSXDURSIMDCE-QMMMGPOBSA-N (S)-amphetamine Chemical compound C[C@H](N)CC1=CC=CC=C1 KWTSXDURSIMDCE-QMMMGPOBSA-N 0.000 description 2
- DURPTKYDGMDSBL-UHFFFAOYSA-N 1-butoxybutane Chemical compound CCCCOCCCC DURPTKYDGMDSBL-UHFFFAOYSA-N 0.000 description 2
- LJCZNYWLQZZIOS-UHFFFAOYSA-N 2,2,2-trichlorethoxycarbonyl chloride Chemical compound ClC(=O)OCC(Cl)(Cl)Cl LJCZNYWLQZZIOS-UHFFFAOYSA-N 0.000 description 2
- MFGOFGRYDNHJTA-UHFFFAOYSA-N 2-amino-1-(2-fluorophenyl)ethanol Chemical compound NCC(O)C1=CC=CC=C1F MFGOFGRYDNHJTA-UHFFFAOYSA-N 0.000 description 2
- ILNSWVUXAPSPEH-USXIJHARSA-N 3-methoxy-morphinan Chemical compound C1CCC[C@H]2[C@H]3CC4=CC=C(OC)C=C4[C@]21CCN3 ILNSWVUXAPSPEH-USXIJHARSA-N 0.000 description 2
- 201000004384 Alopecia Diseases 0.000 description 2
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 2
- 206010002091 Anaesthesia Diseases 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 201000001320 Atherosclerosis Diseases 0.000 description 2
- KXDHJXZQYSOELW-UHFFFAOYSA-N Carbamic acid Chemical group NC(O)=O KXDHJXZQYSOELW-UHFFFAOYSA-N 0.000 description 2
- 208000024172 Cardiovascular disease Diseases 0.000 description 2
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 2
- 208000000094 Chronic Pain Diseases 0.000 description 2
- 229920002261 Corn starch Polymers 0.000 description 2
- 206010011224 Cough Diseases 0.000 description 2
- 108010015742 Cytochrome P-450 Enzyme System Proteins 0.000 description 2
- 102000002004 Cytochrome P-450 Enzyme System Human genes 0.000 description 2
- RGHNJXZEOKUKBD-UHFFFAOYSA-N D-gluconic acid Natural products OCC(O)C(O)C(O)C(O)C(O)=O RGHNJXZEOKUKBD-UHFFFAOYSA-N 0.000 description 2
- 201000004624 Dermatitis Diseases 0.000 description 2
- 208000032131 Diabetic Neuropathies Diseases 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 208000010412 Glaucoma Diseases 0.000 description 2
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- GVGLGOZIDCSQPN-PVHGPHFFSA-N Heroin Chemical compound O([C@H]1[C@H](C=C[C@H]23)OC(C)=O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4OC(C)=O GVGLGOZIDCSQPN-PVHGPHFFSA-N 0.000 description 2
- 206010021143 Hypoxia Diseases 0.000 description 2
- 208000004404 Intractable Pain Diseases 0.000 description 2
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- 235000010643 Leucaena leucocephala Nutrition 0.000 description 2
- 240000007472 Leucaena leucocephala Species 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- 208000007101 Muscle Cramp Diseases 0.000 description 2
- 206010049816 Muscle tightness Diseases 0.000 description 2
- HOKKHZGPKSLGJE-GSVOUGTGSA-N N-Methyl-D-aspartic acid Chemical compound CN[C@@H](C(O)=O)CC(O)=O HOKKHZGPKSLGJE-GSVOUGTGSA-N 0.000 description 2
- 206010029350 Neurotoxicity Diseases 0.000 description 2
- 102000019315 Nicotinic acetylcholine receptors Human genes 0.000 description 2
- 108050006807 Nicotinic acetylcholine receptors Proteins 0.000 description 2
- 206010031009 Oral pain Diseases 0.000 description 2
- 229910019142 PO4 Inorganic materials 0.000 description 2
- 208000018737 Parkinson disease Diseases 0.000 description 2
- 240000002834 Paulownia tomentosa Species 0.000 description 2
- 235000010678 Paulownia tomentosa Nutrition 0.000 description 2
- 208000018262 Peripheral vascular disease Diseases 0.000 description 2
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 2
- LOUPRKONTZGTKE-WZBLMQSHSA-N Quinine Chemical compound C([C@H]([C@H](C1)C=C)C2)C[N@@]1[C@@H]2[C@H](O)C1=CC=NC2=CC=C(OC)C=C21 LOUPRKONTZGTKE-WZBLMQSHSA-N 0.000 description 2
- 201000001880 Sexual dysfunction Diseases 0.000 description 2
- 208000005392 Spasm Diseases 0.000 description 2
- 206010041415 Spastic paralysis Diseases 0.000 description 2
- 229930006000 Sucrose Natural products 0.000 description 2
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 2
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 2
- 208000009205 Tinnitus Diseases 0.000 description 2
- 206010044221 Toxic encephalopathy Diseases 0.000 description 2
- 206010044565 Tremor Diseases 0.000 description 2
- OKJPEAGHQZHRQV-UHFFFAOYSA-N Triiodomethane Natural products IC(I)I OKJPEAGHQZHRQV-UHFFFAOYSA-N 0.000 description 2
- 238000010521 absorption reaction Methods 0.000 description 2
- WETWJCDKMRHUPV-UHFFFAOYSA-N acetyl chloride Chemical compound CC(Cl)=O WETWJCDKMRHUPV-UHFFFAOYSA-N 0.000 description 2
- 239000012346 acetyl chloride Substances 0.000 description 2
- 230000002411 adverse Effects 0.000 description 2
- 231100000360 alopecia Toxicity 0.000 description 2
- 239000000908 ammonium hydroxide Substances 0.000 description 2
- 229940025084 amphetamine Drugs 0.000 description 2
- 230000037005 anaesthesia Effects 0.000 description 2
- 230000006907 apoptotic process Effects 0.000 description 2
- 239000000010 aprotic solvent Substances 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 229910052786 argon Inorganic materials 0.000 description 2
- 230000036983 biotransformation Effects 0.000 description 2
- 208000029028 brain injury Diseases 0.000 description 2
- GZUXJHMPEANEGY-FIBGUPNXSA-N bromo(trideuterio)methane Chemical compound [2H]C([2H])([2H])Br GZUXJHMPEANEGY-FIBGUPNXSA-N 0.000 description 2
- HUCVOHYBFXVBRW-UHFFFAOYSA-M caesium hydroxide Inorganic materials [OH-].[Cs+] HUCVOHYBFXVBRW-UHFFFAOYSA-M 0.000 description 2
- AOGYCOYQMAVAFD-UHFFFAOYSA-N chlorocarbonic acid Chemical class OC(Cl)=O AOGYCOYQMAVAFD-UHFFFAOYSA-N 0.000 description 2
- 239000011248 coating agent Substances 0.000 description 2
- 229960003920 cocaine Drugs 0.000 description 2
- 238000002648 combination therapy Methods 0.000 description 2
- 239000008120 corn starch Substances 0.000 description 2
- 230000001335 demethylating effect Effects 0.000 description 2
- 150000001975 deuterium Chemical group 0.000 description 2
- STTADZBLEUMJRG-CDZAPMPLSA-N dextromethorphan d6 hydrobromide monohydrate Chemical compound O.Br.C([C@@H]12)CCC[C@]11CCN(C([2H])([2H])[2H])[C@H]2CC2=CC=C(OC([2H])([2H])[2H])C=C21 STTADZBLEUMJRG-CDZAPMPLSA-N 0.000 description 2
- 229960002069 diamorphine Drugs 0.000 description 2
- 235000014113 dietary fatty acids Nutrition 0.000 description 2
- 230000029087 digestion Effects 0.000 description 2
- ZZVUWRFHKOJYTH-UHFFFAOYSA-N diphenhydramine Chemical compound C=1C=CC=CC=1C(OCCN(C)C)C1=CC=CC=C1 ZZVUWRFHKOJYTH-UHFFFAOYSA-N 0.000 description 2
- 229960000520 diphenhydramine Drugs 0.000 description 2
- 238000009826 distribution Methods 0.000 description 2
- 229960003638 dopamine Drugs 0.000 description 2
- 238000012377 drug delivery Methods 0.000 description 2
- 230000004064 dysfunction Effects 0.000 description 2
- 239000000839 emulsion Substances 0.000 description 2
- 230000002708 enhancing effect Effects 0.000 description 2
- 206010015037 epilepsy Diseases 0.000 description 2
- 208000028329 epileptic seizure Diseases 0.000 description 2
- RIFGWPKJUGCATF-UHFFFAOYSA-N ethyl chloroformate Chemical compound CCOC(Cl)=O RIFGWPKJUGCATF-UHFFFAOYSA-N 0.000 description 2
- 206010016256 fatigue Diseases 0.000 description 2
- 239000000194 fatty acid Substances 0.000 description 2
- 229930195729 fatty acid Natural products 0.000 description 2
- 150000004665 fatty acids Chemical class 0.000 description 2
- 239000001530 fumaric acid Substances 0.000 description 2
- 235000011087 fumaric acid Nutrition 0.000 description 2
- 125000000524 functional group Chemical group 0.000 description 2
- 230000007160 gastrointestinal dysfunction Effects 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 239000000174 gluconic acid Substances 0.000 description 2
- 235000012208 gluconic acid Nutrition 0.000 description 2
- 229930195712 glutamate Natural products 0.000 description 2
- 125000005456 glyceride group Chemical group 0.000 description 2
- JMANVNJQNLATNU-UHFFFAOYSA-N glycolonitrile Natural products N#CC#N JMANVNJQNLATNU-UHFFFAOYSA-N 0.000 description 2
- 239000008187 granular material Substances 0.000 description 2
- 229960003878 haloperidol Drugs 0.000 description 2
- 238000004128 high performance liquid chromatography Methods 0.000 description 2
- 150000002431 hydrogen Chemical class 0.000 description 2
- 230000001146 hypoxic effect Effects 0.000 description 2
- 230000005764 inhibitory process Effects 0.000 description 2
- 238000001990 intravenous administration Methods 0.000 description 2
- INQOMBQAUSQDDS-UHFFFAOYSA-N iodomethane Chemical compound IC INQOMBQAUSQDDS-UHFFFAOYSA-N 0.000 description 2
- INQOMBQAUSQDDS-BJUDXGSMSA-N iodomethane Chemical class I[11CH3] INQOMBQAUSQDDS-BJUDXGSMSA-N 0.000 description 2
- 150000002500 ions Chemical class 0.000 description 2
- 208000002551 irritable bowel syndrome Diseases 0.000 description 2
- 230000000302 ischemic effect Effects 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 210000004717 laryngeal muscle Anatomy 0.000 description 2
- 150000002632 lipids Chemical class 0.000 description 2
- 239000002502 liposome Substances 0.000 description 2
- AFRJJFRNGGLMDW-UHFFFAOYSA-N lithium amide Chemical compound [Li+].[NH2-] AFRJJFRNGGLMDW-UHFFFAOYSA-N 0.000 description 2
- YNESATAKKCNGOF-UHFFFAOYSA-N lithium bis(trimethylsilyl)amide Chemical compound [Li+].C[Si](C)(C)[N-][Si](C)(C)C YNESATAKKCNGOF-UHFFFAOYSA-N 0.000 description 2
- DLEDOFVPSDKWEF-UHFFFAOYSA-N lithium butane Chemical compound [Li+].CCC[CH2-] DLEDOFVPSDKWEF-UHFFFAOYSA-N 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 239000011976 maleic acid Substances 0.000 description 2
- 229960000485 methotrexate Drugs 0.000 description 2
- QPJVMBTYPHYUOC-UHFFFAOYSA-N methyl benzoate Chemical compound COC(=O)C1=CC=CC=C1 QPJVMBTYPHYUOC-UHFFFAOYSA-N 0.000 description 2
- 239000002480 mineral oil Substances 0.000 description 2
- 235000010446 mineral oil Nutrition 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 201000006417 multiple sclerosis Diseases 0.000 description 2
- 208000010125 myocardial infarction Diseases 0.000 description 2
- 208000004296 neuralgia Diseases 0.000 description 2
- 230000004770 neurodegeneration Effects 0.000 description 2
- 230000016273 neuron death Effects 0.000 description 2
- 208000021722 neuropathic pain Diseases 0.000 description 2
- 231100000228 neurotoxicity Toxicity 0.000 description 2
- 230000007135 neurotoxicity Effects 0.000 description 2
- 230000007935 neutral effect Effects 0.000 description 2
- 229960002715 nicotine Drugs 0.000 description 2
- SNICXCGAKADSCV-UHFFFAOYSA-N nicotine Natural products CN1CCCC1C1=CC=CN=C1 SNICXCGAKADSCV-UHFFFAOYSA-N 0.000 description 2
- 231100000252 nontoxic Toxicity 0.000 description 2
- 230000003000 nontoxic effect Effects 0.000 description 2
- 239000000346 nonvolatile oil Substances 0.000 description 2
- 229960002748 norepinephrine Drugs 0.000 description 2
- SFLSHLFXELFNJZ-UHFFFAOYSA-N norepinephrine Natural products NCC(O)C1=CC=C(O)C(O)=C1 SFLSHLFXELFNJZ-UHFFFAOYSA-N 0.000 description 2
- MRUNQKQTAMUPRF-PUTLROBFSA-N nuedexta Chemical compound Br.OS(O)(=O)=O.C([C@@H]12)CCC[C@]11CCN(C)[C@H]2CC2=CC=C(OC)C=C21.C1C([C@H](C2)C=C)CCN2[C@H]1[C@@H](O)C1=CC=NC2=CC=C(OC)C=C21.C1C([C@H](C2)C=C)CCN2[C@H]1[C@@H](O)C1=CC=NC2=CC=C(OC)C=C21 MRUNQKQTAMUPRF-PUTLROBFSA-N 0.000 description 2
- 235000019198 oils Nutrition 0.000 description 2
- 150000007530 organic bases Chemical class 0.000 description 2
- 239000012044 organic layer Substances 0.000 description 2
- XQYZDYMELSJDRZ-UHFFFAOYSA-N papaverine Chemical compound C1=C(OC)C(OC)=CC=C1CC1=NC=CC2=CC(OC)=C(OC)C=C12 XQYZDYMELSJDRZ-UHFFFAOYSA-N 0.000 description 2
- 239000003208 petroleum Substances 0.000 description 2
- 238000001050 pharmacotherapy Methods 0.000 description 2
- 235000021317 phosphate Nutrition 0.000 description 2
- AQHHHDLHHXJYJD-UHFFFAOYSA-N propranolol Chemical compound C1=CC=C2C(OCC(O)CNC(C)C)=CC=CC2=C1 AQHHHDLHHXJYJD-UHFFFAOYSA-N 0.000 description 2
- 230000003085 retinopathic effect Effects 0.000 description 2
- YGSDEFSMJLZEOE-UHFFFAOYSA-N salicylic acid Chemical compound OC(=O)C1=CC=CC=C1O YGSDEFSMJLZEOE-UHFFFAOYSA-N 0.000 description 2
- 229940076279 serotonin Drugs 0.000 description 2
- 231100000872 sexual dysfunction Toxicity 0.000 description 2
- 238000009097 single-agent therapy Methods 0.000 description 2
- 208000027765 speech disease Diseases 0.000 description 2
- 239000000021 stimulant Substances 0.000 description 2
- 238000007920 subcutaneous administration Methods 0.000 description 2
- 239000005720 sucrose Substances 0.000 description 2
- 230000002459 sustained effect Effects 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- 239000011975 tartaric acid Substances 0.000 description 2
- 235000002906 tartaric acid Nutrition 0.000 description 2
- 238000002560 therapeutic procedure Methods 0.000 description 2
- 231100000886 tinnitus Toxicity 0.000 description 2
- 238000011200 topical administration Methods 0.000 description 2
- 230000000699 topical effect Effects 0.000 description 2
- 231100000331 toxic Toxicity 0.000 description 2
- 230000002588 toxic effect Effects 0.000 description 2
- OIRDBPQYVWXNSJ-FIBGUPNXSA-N trideuteriomethyl trifluoromethanesulfonate Chemical compound [2H]C([2H])([2H])OS(=O)(=O)C(F)(F)F OIRDBPQYVWXNSJ-FIBGUPNXSA-N 0.000 description 2
- RKBCYCFRFCNLTO-UHFFFAOYSA-N triisopropylamine Chemical compound CC(C)N(C(C)C)C(C)C RKBCYCFRFCNLTO-UHFFFAOYSA-N 0.000 description 2
- 239000001993 wax Substances 0.000 description 2
- AHOUBRCZNHFOSL-YOEHRIQHSA-N (+)-Casbol Chemical compound C1=CC(F)=CC=C1[C@H]1[C@H](COC=2C=C3OCOC3=CC=2)CNCC1 AHOUBRCZNHFOSL-YOEHRIQHSA-N 0.000 description 1
- CEMAWMOMDPGJMB-UHFFFAOYSA-N (+-)-Oxprenolol Chemical compound CC(C)NCC(O)COC1=CC=CC=C1OCC=C CEMAWMOMDPGJMB-UHFFFAOYSA-N 0.000 description 1
- YQSHYGCCYVPRDI-UHFFFAOYSA-N (4-propan-2-ylphenyl)methanamine Chemical compound CC(C)C1=CC=C(CN)C=C1 YQSHYGCCYVPRDI-UHFFFAOYSA-N 0.000 description 1
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 1
- RTHCYVBBDHJXIQ-MRXNPFEDSA-N (R)-fluoxetine Chemical compound O([C@H](CCNC)C=1C=CC=CC=1)C1=CC=C(C(F)(F)F)C=C1 RTHCYVBBDHJXIQ-MRXNPFEDSA-N 0.000 description 1
- ZEUITGRIYCTCEM-KRWDZBQOSA-N (S)-duloxetine Chemical compound C1([C@@H](OC=2C3=CC=CC=C3C=CC=2)CCNC)=CC=CS1 ZEUITGRIYCTCEM-KRWDZBQOSA-N 0.000 description 1
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 1
- HCSBTDBGTNZOAB-UHFFFAOYSA-N 2,3-dinitrobenzoic acid Chemical compound OC(=O)C1=CC=CC([N+]([O-])=O)=C1[N+]([O-])=O HCSBTDBGTNZOAB-UHFFFAOYSA-N 0.000 description 1
- CHHHXKFHOYLYRE-UHFFFAOYSA-M 2,4-Hexadienoic acid, potassium salt (1:1), (2E,4E)- Chemical compound [K+].CC=CC=CC([O-])=O CHHHXKFHOYLYRE-UHFFFAOYSA-M 0.000 description 1
- JTXMVXSTHSMVQF-UHFFFAOYSA-N 2-acetyloxyethyl acetate Chemical compound CC(=O)OCCOC(C)=O JTXMVXSTHSMVQF-UHFFFAOYSA-N 0.000 description 1
- LEACJMVNYZDSKR-UHFFFAOYSA-N 2-octyldodecan-1-ol Chemical compound CCCCCCCCCCC(CO)CCCCCCCC LEACJMVNYZDSKR-UHFFFAOYSA-N 0.000 description 1
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 1
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 1
- PXACTUVBBMDKRW-UHFFFAOYSA-N 4-bromobenzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=C(Br)C=C1 PXACTUVBBMDKRW-UHFFFAOYSA-N 0.000 description 1
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 1
- 229930008281 A03AD01 - Papaverine Natural products 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- NIXOWILDQLNWCW-UHFFFAOYSA-M Acrylate Chemical compound [O-]C(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-M 0.000 description 1
- 241000416162 Astragalus gummifer Species 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- 102000004506 Blood Proteins Human genes 0.000 description 1
- 108010017384 Blood Proteins Proteins 0.000 description 1
- BIMSARJJHWIADM-QTHQDFPTSA-N CC1C(C2)(C3)[C@H]1[C@@H](CCCC1)[C@@]21c1c3ccc(OC)c1 Chemical compound CC1C(C2)(C3)[C@H]1[C@@H](CCCC1)[C@@]21c1c3ccc(OC)c1 BIMSARJJHWIADM-QTHQDFPTSA-N 0.000 description 1
- DYIPOUUDIVWPKX-FBDWYAHVSA-N CC1[C@@H]2[C@@H](CCCC3)C33c4cc(OC)ccc4CC2[C@@H]3C1 Chemical compound CC1[C@@H]2[C@@H](CCCC3)C33c4cc(OC)ccc4CC2[C@@H]3C1 DYIPOUUDIVWPKX-FBDWYAHVSA-N 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 235000001258 Cinchona calisaya Nutrition 0.000 description 1
- 208000007220 Cytochrome P-450 CYP2D6 Inhibitors Diseases 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- 206010012688 Diabetic retinal oedema Diseases 0.000 description 1
- 206010012735 Diarrhoea Diseases 0.000 description 1
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 1
- IAZDPXIOMUYVGZ-WFGJKAKNSA-N Dimethyl sulfoxide Chemical group [2H]C([2H])([2H])S(=O)C([2H])([2H])[2H] IAZDPXIOMUYVGZ-WFGJKAKNSA-N 0.000 description 1
- 206010061818 Disease progression Diseases 0.000 description 1
- 229920005682 EO-PO block copolymer Polymers 0.000 description 1
- 241000792859 Enema Species 0.000 description 1
- BDAGIHXWWSANSR-UHFFFAOYSA-M Formate Chemical compound [O-]C=O BDAGIHXWWSANSR-UHFFFAOYSA-M 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 239000001828 Gelatine Substances 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- AEMRFAOFKBGASW-UHFFFAOYSA-M Glycolate Chemical compound OCC([O-])=O AEMRFAOFKBGASW-UHFFFAOYSA-M 0.000 description 1
- 102000008100 Human Serum Albumin Human genes 0.000 description 1
- 108091006905 Human Serum Albumin Proteins 0.000 description 1
- 206010065952 Hyperpathia Diseases 0.000 description 1
- 206010021639 Incontinence Diseases 0.000 description 1
- OWYWGLHRNBIFJP-UHFFFAOYSA-N Ipazine Chemical compound CCN(CC)C1=NC(Cl)=NC(NC(C)C)=N1 OWYWGLHRNBIFJP-UHFFFAOYSA-N 0.000 description 1
- JVTAAEKCZFNVCJ-UHFFFAOYSA-M Lactate Chemical compound CC(O)C([O-])=O JVTAAEKCZFNVCJ-UHFFFAOYSA-M 0.000 description 1
- 206010024264 Lethargy Diseases 0.000 description 1
- JAQUASYNZVUNQP-USXIJHARSA-N Levorphanol Chemical compound C1C2=CC=C(O)C=C2[C@]23CCN(C)[C@H]1[C@@H]2CCCC3 JAQUASYNZVUNQP-USXIJHARSA-N 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-L Malonate Chemical compound [O-]C(=O)CC([O-])=O OFOBLEOULBTSOW-UHFFFAOYSA-L 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- 208000019695 Migraine disease Diseases 0.000 description 1
- 208000019430 Motor disease Diseases 0.000 description 1
- 208000008238 Muscle Spasticity Diseases 0.000 description 1
- 102000004868 N-Methyl-D-Aspartate Receptors Human genes 0.000 description 1
- 108090001041 N-Methyl-D-Aspartate Receptors Proteins 0.000 description 1
- RTHCYVBBDHJXIQ-UHFFFAOYSA-N N-methyl-3-phenyl-3-[4-(trifluoromethyl)phenoxy]propan-1-amine Chemical compound C=1C=CC=CC=1C(CCNC)OC1=CC=C(C(F)(F)F)C=C1 RTHCYVBBDHJXIQ-UHFFFAOYSA-N 0.000 description 1
- 206010028813 Nausea Diseases 0.000 description 1
- 102000008092 Norepinephrine Plasma Membrane Transport Proteins Human genes 0.000 description 1
- 108010049586 Norepinephrine Plasma Membrane Transport Proteins Proteins 0.000 description 1
- PHVGLTMQBUFIQQ-UHFFFAOYSA-N Nortryptiline Chemical compound C1CC2=CC=CC=C2C(=CCCNC)C2=CC=CC=C21 PHVGLTMQBUFIQQ-UHFFFAOYSA-N 0.000 description 1
- 239000005642 Oleic acid Substances 0.000 description 1
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 1
- 239000008896 Opium Substances 0.000 description 1
- IQPSEEYGBUAQFF-UHFFFAOYSA-N Pantoprazole Chemical compound COC1=CC=NC(CS(=O)C=2NC3=CC=C(OC(F)F)C=C3N=2)=C1OC IQPSEEYGBUAQFF-UHFFFAOYSA-N 0.000 description 1
- AHOUBRCZNHFOSL-UHFFFAOYSA-N Paroxetine hydrochloride Natural products C1=CC(F)=CC=C1C1C(COC=2C=C3OCOC3=CC=2)CNCC1 AHOUBRCZNHFOSL-UHFFFAOYSA-N 0.000 description 1
- 229920001214 Polysorbate 60 Polymers 0.000 description 1
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 description 1
- 102000007327 Protamines Human genes 0.000 description 1
- 108010007568 Protamines Proteins 0.000 description 1
- NCDNCNXCDXHOMX-UHFFFAOYSA-N Ritonavir Natural products C=1C=CC=CC=1CC(NC(=O)OCC=1SC=NC=1)C(O)CC(CC=1C=CC=CC=1)NC(=O)C(C(C)C)NC(=O)N(C)CC1=CSC(C(C)C)=N1 NCDNCNXCDXHOMX-UHFFFAOYSA-N 0.000 description 1
- 102000019208 Serotonin Plasma Membrane Transport Proteins Human genes 0.000 description 1
- 108010012996 Serotonin Plasma Membrane Transport Proteins Proteins 0.000 description 1
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 1
- BQCADISMDOOEFD-UHFFFAOYSA-N Silver Chemical compound [Ag] BQCADISMDOOEFD-UHFFFAOYSA-N 0.000 description 1
- 206010041349 Somnolence Diseases 0.000 description 1
- HVUMOYIDDBPOLL-XWVZOOPGSA-N Sorbitan monostearate Chemical compound CCCCCCCCCCCCCCCCCC(=O)OC[C@@H](O)[C@H]1OC[C@H](O)[C@H]1O HVUMOYIDDBPOLL-XWVZOOPGSA-N 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- LSNNMFCWUKXFEE-UHFFFAOYSA-N Sulfurous acid Chemical class OS(O)=O LSNNMFCWUKXFEE-UHFFFAOYSA-N 0.000 description 1
- 239000000150 Sympathomimetic Substances 0.000 description 1
- KLBQZWRITKRQQV-UHFFFAOYSA-N Thioridazine Chemical compound C12=CC(SC)=CC=C2SC2=CC=CC=C2N1CCC1CCCCN1C KLBQZWRITKRQQV-UHFFFAOYSA-N 0.000 description 1
- 229920001615 Tragacanth Polymers 0.000 description 1
- ZZXDRXVIRVJQBT-UHFFFAOYSA-M Xylenesulfonate Chemical compound CC1=CC=CC(S([O-])(=O)=O)=C1C ZZXDRXVIRVJQBT-UHFFFAOYSA-M 0.000 description 1
- BLGXFZZNTVWLAY-CCZXDCJGSA-N Yohimbine Natural products C1=CC=C2C(CCN3C[C@@H]4CC[C@@H](O)[C@H]([C@H]4C[C@H]33)C(=O)OC)=C3NC2=C1 BLGXFZZNTVWLAY-CCZXDCJGSA-N 0.000 description 1
- IPBVNPXQWQGGJP-UHFFFAOYSA-N acetic acid phenyl ester Natural products CC(=O)OC1=CC=CC=C1 IPBVNPXQWQGGJP-UHFFFAOYSA-N 0.000 description 1
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 239000008186 active pharmaceutical agent Substances 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 230000010933 acylation Effects 0.000 description 1
- 238000005917 acylation reaction Methods 0.000 description 1
- 230000006978 adaptation Effects 0.000 description 1
- 239000000556 agonist Substances 0.000 description 1
- 208000026935 allergic disease Diseases 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- PNEYBMLMFCGWSK-UHFFFAOYSA-N aluminium oxide Inorganic materials [O-2].[O-2].[O-2].[Al+3].[Al+3] PNEYBMLMFCGWSK-UHFFFAOYSA-N 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- CEGOLXSVJUTHNZ-UHFFFAOYSA-K aluminium tristearate Chemical compound [Al+3].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O CEGOLXSVJUTHNZ-UHFFFAOYSA-K 0.000 description 1
- 229940063655 aluminum stearate Drugs 0.000 description 1
- 229940035676 analgesics Drugs 0.000 description 1
- 230000008485 antagonism Effects 0.000 description 1
- 239000005557 antagonist Substances 0.000 description 1
- 239000000730 antalgic agent Substances 0.000 description 1
- 230000000561 anti-psychotic effect Effects 0.000 description 1
- 239000000935 antidepressant agent Substances 0.000 description 1
- 229940005513 antidepressants Drugs 0.000 description 1
- 230000003078 antioxidant effect Effects 0.000 description 1
- 239000003434 antitussive agent Substances 0.000 description 1
- 229940124584 antitussives Drugs 0.000 description 1
- 230000004596 appetite loss Effects 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 239000007900 aqueous suspension Substances 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 208000029560 autism spectrum disease Diseases 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 239000003637 basic solution Substances 0.000 description 1
- 235000013871 bee wax Nutrition 0.000 description 1
- 239000012166 beeswax Substances 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-M benzenesulfonate Chemical compound [O-]S(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-M 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 1
- 229940092714 benzenesulfonic acid Drugs 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- 235000019445 benzyl alcohol Nutrition 0.000 description 1
- BLGXFZZNTVWLAY-UHFFFAOYSA-N beta-Yohimbin Natural products C1=CC=C2C(CCN3CC4CCC(O)C(C4CC33)C(=O)OC)=C3NC2=C1 BLGXFZZNTVWLAY-UHFFFAOYSA-N 0.000 description 1
- 229920002988 biodegradable polymer Polymers 0.000 description 1
- 239000004621 biodegradable polymer Substances 0.000 description 1
- VAYGXNSJCAHWJZ-WFGJKAKNSA-N bis(trideuteriomethyl) sulfate Chemical compound [2H]C([2H])([2H])OS(=O)(=O)OC([2H])([2H])[2H] VAYGXNSJCAHWJZ-WFGJKAKNSA-N 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-M bisulphate group Chemical group S([O-])(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-M 0.000 description 1
- 230000008499 blood brain barrier function Effects 0.000 description 1
- 230000036765 blood level Effects 0.000 description 1
- 210000001218 blood-brain barrier Anatomy 0.000 description 1
- 150000001649 bromium compounds Chemical class 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 239000006172 buffering agent Substances 0.000 description 1
- RMRJXGBAOAMLHD-IHFGGWKQSA-N buprenorphine Chemical compound C([C@]12[C@H]3OC=4C(O)=CC=C(C2=4)C[C@@H]2[C@]11CC[C@]3([C@H](C1)[C@](C)(O)C(C)(C)C)OC)CN2CC1CC1 RMRJXGBAOAMLHD-IHFGGWKQSA-N 0.000 description 1
- 229960001736 buprenorphine Drugs 0.000 description 1
- SNPPWIUOZRMYNY-UHFFFAOYSA-N bupropion Chemical compound CC(C)(C)NC(C)C(=O)C1=CC=CC(Cl)=C1 SNPPWIUOZRMYNY-UHFFFAOYSA-N 0.000 description 1
- 229960001058 bupropion Drugs 0.000 description 1
- DQXBYHZEEUGOBF-UHFFFAOYSA-N but-3-enoic acid;ethene Chemical compound C=C.OC(=O)CC=C DQXBYHZEEUGOBF-UHFFFAOYSA-N 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 125000004432 carbon atom Chemical group C* 0.000 description 1
- 150000001722 carbon compounds Chemical class 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 239000004359 castor oil Substances 0.000 description 1
- 235000019438 castor oil Nutrition 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 210000004027 cell Anatomy 0.000 description 1
- 229940081733 cetearyl alcohol Drugs 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 239000013626 chemical specie Substances 0.000 description 1
- 150000001805 chlorine compounds Chemical class 0.000 description 1
- KVSASDOGYIBWTA-UHFFFAOYSA-N chloro benzoate Chemical compound ClOC(=O)C1=CC=CC=C1 KVSASDOGYIBWTA-UHFFFAOYSA-N 0.000 description 1
- VDHAWDNDOKGFTD-MRXNPFEDSA-N cinacalcet Chemical compound N([C@H](C)C=1C2=CC=CC=C2C=CC=1)CCCC1=CC=CC(C(F)(F)F)=C1 VDHAWDNDOKGFTD-MRXNPFEDSA-N 0.000 description 1
- 229960003315 cinacalcet Drugs 0.000 description 1
- 229940110456 cocoa butter Drugs 0.000 description 1
- 235000019868 cocoa butter Nutrition 0.000 description 1
- 229960004126 codeine Drugs 0.000 description 1
- OROGSEYTTFOCAN-DNJOTXNNSA-N codeine Natural products C([C@H]1[C@H](N(CC[C@@]112)C)C3)=C[C@H](O)[C@@H]1OC1=C2C3=CC=C1OC OROGSEYTTFOCAN-DNJOTXNNSA-N 0.000 description 1
- 239000008119 colloidal silica Substances 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 230000021615 conjugation Effects 0.000 description 1
- 238000013270 controlled release Methods 0.000 description 1
- 208000012839 conversion disease Diseases 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- GHVNFZFCNZKVNT-UHFFFAOYSA-M decanoate Chemical compound CCCCCCCCCC([O-])=O GHVNFZFCNZKVNT-UHFFFAOYSA-M 0.000 description 1
- GHVNFZFCNZKVNT-UHFFFAOYSA-N decanoic acid Chemical compound CCCCCCCCCC(O)=O GHVNFZFCNZKVNT-UHFFFAOYSA-N 0.000 description 1
- 230000007812 deficiency Effects 0.000 description 1
- 230000002950 deficient Effects 0.000 description 1
- 230000006735 deficit Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 230000002939 deleterious effect Effects 0.000 description 1
- 238000010511 deprotection reaction Methods 0.000 description 1
- 229960000633 dextran sulfate Drugs 0.000 description 1
- MKXZASYAUGDDCJ-NJAFHUGGSA-N dextromethorphan Chemical compound C([C@@H]12)CCC[C@]11CCN(C)[C@H]2CC2=CC=C(OC)C=C21 MKXZASYAUGDDCJ-NJAFHUGGSA-N 0.000 description 1
- 229960003782 dextromethorphan hydrobromide Drugs 0.000 description 1
- 201000011190 diabetic macular edema Diseases 0.000 description 1
- FSBVERYRVPGNGG-UHFFFAOYSA-N dimagnesium dioxido-bis[[oxido(oxo)silyl]oxy]silane hydrate Chemical compound O.[Mg+2].[Mg+2].[O-][Si](=O)O[Si]([O-])([O-])O[Si]([O-])=O FSBVERYRVPGNGG-UHFFFAOYSA-N 0.000 description 1
- VAYGXNSJCAHWJZ-UHFFFAOYSA-N dimethyl sulfate Chemical class COS(=O)(=O)OC VAYGXNSJCAHWJZ-UHFFFAOYSA-N 0.000 description 1
- 235000011180 diphosphates Nutrition 0.000 description 1
- ZPWVASYFFYYZEW-UHFFFAOYSA-L dipotassium hydrogen phosphate Chemical compound [K+].[K+].OP([O-])([O-])=O ZPWVASYFFYYZEW-UHFFFAOYSA-L 0.000 description 1
- 229910000396 dipotassium phosphate Inorganic materials 0.000 description 1
- 235000019797 dipotassium phosphate Nutrition 0.000 description 1
- 230000005750 disease progression Effects 0.000 description 1
- BNIILDVGGAEEIG-UHFFFAOYSA-L disodium hydrogen phosphate Chemical compound [Na+].[Na+].OP([O-])([O-])=O BNIILDVGGAEEIG-UHFFFAOYSA-L 0.000 description 1
- 208000002173 dizziness Diseases 0.000 description 1
- FGXWKSZFVQUSTL-UHFFFAOYSA-N domperidone Chemical compound C12=CC=CC=C2NC(=O)N1CCCN(CC1)CCC1N1C2=CC=C(Cl)C=C2NC1=O FGXWKSZFVQUSTL-UHFFFAOYSA-N 0.000 description 1
- 229960001253 domperidone Drugs 0.000 description 1
- 230000000857 drug effect Effects 0.000 description 1
- 230000036267 drug metabolism Effects 0.000 description 1
- 229940088679 drug related substance Drugs 0.000 description 1
- 230000008406 drug-drug interaction Effects 0.000 description 1
- 229960002866 duloxetine Drugs 0.000 description 1
- 239000003792 electrolyte Substances 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 239000008387 emulsifying waxe Substances 0.000 description 1
- 239000007920 enema Substances 0.000 description 1
- 229940095399 enema Drugs 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- CCIVGXIOQKPBKL-UHFFFAOYSA-M ethanesulfonate Chemical compound CCS([O-])(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-M 0.000 description 1
- BEFDCLMNVWHSGT-UHFFFAOYSA-N ethenylcyclopentane Chemical compound C=CC1CCCC1 BEFDCLMNVWHSGT-UHFFFAOYSA-N 0.000 description 1
- 239000005038 ethylene vinyl acetate Substances 0.000 description 1
- 230000002964 excitative effect Effects 0.000 description 1
- 238000011049 filling Methods 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 229960002464 fluoxetine Drugs 0.000 description 1
- 229960004038 fluvoxamine Drugs 0.000 description 1
- CJOFXWAVKWHTFT-XSFVSMFZSA-N fluvoxamine Chemical compound COCCCC\C(=N/OCCN)C1=CC=C(C(F)(F)F)C=C1 CJOFXWAVKWHTFT-XSFVSMFZSA-N 0.000 description 1
- 235000013355 food flavoring agent Nutrition 0.000 description 1
- 230000037406 food intake Effects 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 235000019253 formic acid Nutrition 0.000 description 1
- 210000001035 gastrointestinal tract Anatomy 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 229930182480 glucuronide Natural products 0.000 description 1
- 150000008134 glucuronides Chemical class 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- 150000004676 glycans Chemical class 0.000 description 1
- 235000011187 glycerol Nutrition 0.000 description 1
- ZEMPKEQAKRGZGQ-XOQCFJPHSA-N glycerol triricinoleate Natural products CCCCCC[C@@H](O)CC=CCCCCCCCC(=O)OC[C@@H](COC(=O)CCCCCCCC=CC[C@@H](O)CCCCCC)OC(=O)CCCCCCCC=CC[C@H](O)CCCCCC ZEMPKEQAKRGZGQ-XOQCFJPHSA-N 0.000 description 1
- 229960002449 glycine Drugs 0.000 description 1
- 230000005484 gravity Effects 0.000 description 1
- 239000003966 growth inhibitor Substances 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- MNWFXJYAOYHMED-UHFFFAOYSA-N heptanoic acid Chemical compound CCCCCCC(O)=O MNWFXJYAOYHMED-UHFFFAOYSA-N 0.000 description 1
- KKLGDUSGQMHBPB-UHFFFAOYSA-N hex-2-ynedioic acid Chemical compound OC(=O)CCC#CC(O)=O KKLGDUSGQMHBPB-UHFFFAOYSA-N 0.000 description 1
- 208000003906 hydrocephalus Diseases 0.000 description 1
- OROGSEYTTFOCAN-UHFFFAOYSA-N hydrocodone Natural products C1C(N(CCC234)C)C2C=CC(O)C3OC2=C4C1=CC=C2OC OROGSEYTTFOCAN-UHFFFAOYSA-N 0.000 description 1
- 239000000017 hydrogel Substances 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- 238000005984 hydrogenation reaction Methods 0.000 description 1
- 229940071870 hydroiodic acid Drugs 0.000 description 1
- BCGWQEUPMDMJNV-UHFFFAOYSA-N imipramine Chemical compound C1CC2=CC=CC=C2N(CCCN(C)C)C2=CC=CC=C21 BCGWQEUPMDMJNV-UHFFFAOYSA-N 0.000 description 1
- 229960004801 imipramine Drugs 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 229940102223 injectable solution Drugs 0.000 description 1
- 229940102213 injectable suspension Drugs 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 208000001286 intracranial vasospasm Diseases 0.000 description 1
- 150000004694 iodide salts Chemical class 0.000 description 1
- 230000007794 irritation Effects 0.000 description 1
- KQNPFQTWMSNSAP-UHFFFAOYSA-N isobutyric acid Chemical compound CC(C)C(O)=O KQNPFQTWMSNSAP-UHFFFAOYSA-N 0.000 description 1
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 1
- 230000003907 kidney function Effects 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 239000008141 laxative Substances 0.000 description 1
- 230000002475 laxative effect Effects 0.000 description 1
- 239000010410 layer Substances 0.000 description 1
- 239000000787 lecithin Substances 0.000 description 1
- 235000010445 lecithin Nutrition 0.000 description 1
- 229940067606 lecithin Drugs 0.000 description 1
- 229960003406 levorphanol Drugs 0.000 description 1
- 229910052744 lithium Inorganic materials 0.000 description 1
- WGOPGODQLGJZGL-UHFFFAOYSA-N lithium;butane Chemical compound [Li+].CC[CH-]C WGOPGODQLGJZGL-UHFFFAOYSA-N 0.000 description 1
- 230000003908 liver function Effects 0.000 description 1
- 208000019017 loss of appetite Diseases 0.000 description 1
- 235000021266 loss of appetite Nutrition 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 239000007937 lozenge Substances 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 239000000391 magnesium silicate Substances 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 229940099273 magnesium trisilicate Drugs 0.000 description 1
- 229910000386 magnesium trisilicate Inorganic materials 0.000 description 1
- 235000019793 magnesium trisilicate Nutrition 0.000 description 1
- 208000024714 major depressive disease Diseases 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-M mandelate Chemical compound [O-]C(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-M 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 230000010534 mechanism of action Effects 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 239000000155 melt Substances 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- 125000005341 metaphosphate group Chemical group 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- IZYBEMGNIUSSAX-UHFFFAOYSA-N methyl benzenecarboperoxoate Chemical compound COOC(=O)C1=CC=CC=C1 IZYBEMGNIUSSAX-UHFFFAOYSA-N 0.000 description 1
- 229940095102 methyl benzoate Drugs 0.000 description 1
- 230000001035 methylating effect Effects 0.000 description 1
- 230000011987 methylation Effects 0.000 description 1
- 206010027599 migraine Diseases 0.000 description 1
- 229940042472 mineral oil Drugs 0.000 description 1
- 238000011294 monotherapeutic Methods 0.000 description 1
- UMFJAHHVKNCGLG-UHFFFAOYSA-N n-Nitrosodimethylamine Chemical compound CN(C)N=O UMFJAHHVKNCGLG-UHFFFAOYSA-N 0.000 description 1
- DQCKKXVULJGBQN-XFWGSAIBSA-N naltrexone Chemical compound N1([C@@H]2CC3=CC=C(C=4O[C@@H]5[C@](C3=4)([C@]2(CCC5=O)O)CC1)O)CC1CC1 DQCKKXVULJGBQN-XFWGSAIBSA-N 0.000 description 1
- 229960003086 naltrexone Drugs 0.000 description 1
- KVBGVZZKJNLNJU-UHFFFAOYSA-N naphthalene-2-sulfonic acid Chemical compound C1=CC=CC2=CC(S(=O)(=O)O)=CC=C21 KVBGVZZKJNLNJU-UHFFFAOYSA-N 0.000 description 1
- 239000007922 nasal spray Substances 0.000 description 1
- 230000008693 nausea Effects 0.000 description 1
- 239000002858 neurotransmitter agent Substances 0.000 description 1
- 108010022541 nicotinic receptor alpha3beta4 Proteins 0.000 description 1
- 229960001158 nortriptyline Drugs 0.000 description 1
- 229940037869 nuedexta Drugs 0.000 description 1
- GLDOVTGHNKAZLK-UHFFFAOYSA-N octadecan-1-ol Chemical compound CCCCCCCCCCCCCCCCCCO GLDOVTGHNKAZLK-UHFFFAOYSA-N 0.000 description 1
- WWZKQHOCKIZLMA-UHFFFAOYSA-M octanoate Chemical compound CCCCCCCC([O-])=O WWZKQHOCKIZLMA-UHFFFAOYSA-M 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 229940005483 opioid analgesics Drugs 0.000 description 1
- 229960001027 opium Drugs 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 229960004570 oxprenolol Drugs 0.000 description 1
- 229960005019 pantoprazole Drugs 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-N papa-hydroxy-benzoic acid Natural products OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 1
- 229960001789 papaverine Drugs 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 229960002296 paroxetine Drugs 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 235000010603 pastilles Nutrition 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 238000009520 phase I clinical trial Methods 0.000 description 1
- 238000009523 phase IV clinical trial Methods 0.000 description 1
- DYUMLJSJISTVPV-UHFFFAOYSA-N phenyl propanoate Chemical compound CCC(=O)OC1=CC=CC=C1 DYUMLJSJISTVPV-UHFFFAOYSA-N 0.000 description 1
- WVDDGKGOMKODPV-ZQBYOMGUSA-N phenyl(114C)methanol Chemical compound O[14CH2]C1=CC=CC=C1 WVDDGKGOMKODPV-ZQBYOMGUSA-N 0.000 description 1
- 229940049953 phenylacetate Drugs 0.000 description 1
- WLJVXDMOQOGPHL-UHFFFAOYSA-N phenylacetic acid Chemical compound OC(=O)CC1=CC=CC=C1 WLJVXDMOQOGPHL-UHFFFAOYSA-N 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 150000003904 phospholipids Chemical class 0.000 description 1
- XNGIFLGASWRNHJ-UHFFFAOYSA-L phthalate(2-) Chemical compound [O-]C(=O)C1=CC=CC=C1C([O-])=O XNGIFLGASWRNHJ-UHFFFAOYSA-L 0.000 description 1
- 230000036470 plasma concentration Effects 0.000 description 1
- 231100000572 poisoning Toxicity 0.000 description 1
- 230000000607 poisoning effect Effects 0.000 description 1
- 229920001200 poly(ethylene-vinyl acetate) Polymers 0.000 description 1
- 229920000747 poly(lactic acid) Polymers 0.000 description 1
- 229920000058 polyacrylate Polymers 0.000 description 1
- 239000004632 polycaprolactone Substances 0.000 description 1
- 229920001610 polycaprolactone Polymers 0.000 description 1
- 239000004626 polylactic acid Substances 0.000 description 1
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 1
- 239000001818 polyoxyethylene sorbitan monostearate Substances 0.000 description 1
- 235000010989 polyoxyethylene sorbitan monostearate Nutrition 0.000 description 1
- 229920002503 polyoxyethylene-polyoxypropylene Polymers 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 229940113124 polysorbate 60 Drugs 0.000 description 1
- 229920000053 polysorbate 80 Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 239000004302 potassium sorbate Substances 0.000 description 1
- 235000010241 potassium sorbate Nutrition 0.000 description 1
- 229940069338 potassium sorbate Drugs 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- KCXFHTAICRTXLI-UHFFFAOYSA-N propane-1-sulfonic acid Chemical compound CCCS(O)(=O)=O KCXFHTAICRTXLI-UHFFFAOYSA-N 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- 229960003712 propranolol Drugs 0.000 description 1
- UORVCLMRJXCDCP-UHFFFAOYSA-M propynoate Chemical compound [O-]C(=O)C#C UORVCLMRJXCDCP-UHFFFAOYSA-M 0.000 description 1
- 229950008679 protamine sulfate Drugs 0.000 description 1
- 125000006239 protecting group Chemical group 0.000 description 1
- 229940035613 prozac Drugs 0.000 description 1
- 229960000948 quinine Drugs 0.000 description 1
- 239000002464 receptor antagonist Substances 0.000 description 1
- 229940044551 receptor antagonist Drugs 0.000 description 1
- 229940100618 rectal suppository Drugs 0.000 description 1
- 239000006215 rectal suppository Substances 0.000 description 1
- 210000000664 rectum Anatomy 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 230000000630 rising effect Effects 0.000 description 1
- 229960000311 ritonavir Drugs 0.000 description 1
- NCDNCNXCDXHOMX-XGKFQTDJSA-N ritonavir Chemical compound N([C@@H](C(C)C)C(=O)N[C@H](C[C@H](O)[C@H](CC=1C=CC=CC=1)NC(=O)OCC=1SC=NC=1)CC=1C=CC=CC=1)C(=O)N(C)CC1=CSC(C(C)C)=N1 NCDNCNXCDXHOMX-XGKFQTDJSA-N 0.000 description 1
- YGSDEFSMJLZEOE-UHFFFAOYSA-M salicylate Chemical compound OC1=CC=CC=C1C([O-])=O YGSDEFSMJLZEOE-UHFFFAOYSA-M 0.000 description 1
- 229960004889 salicylic acid Drugs 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 238000013515 script Methods 0.000 description 1
- 229940125723 sedative agent Drugs 0.000 description 1
- 239000000932 sedative agent Substances 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- VGKDLMBJGBXTGI-SJCJKPOMSA-N sertraline Chemical compound C1([C@@H]2CC[C@@H](C3=CC=CC=C32)NC)=CC=C(Cl)C(Cl)=C1 VGKDLMBJGBXTGI-SJCJKPOMSA-N 0.000 description 1
- 229960002073 sertraline Drugs 0.000 description 1
- 238000007493 shaping process Methods 0.000 description 1
- 229910052709 silver Inorganic materials 0.000 description 1
- 239000004332 silver Substances 0.000 description 1
- 239000012279 sodium borohydride Substances 0.000 description 1
- 229910000033 sodium borohydride Inorganic materials 0.000 description 1
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 1
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 230000003381 solubilizing effect Effects 0.000 description 1
- 235000010199 sorbic acid Nutrition 0.000 description 1
- 239000004334 sorbic acid Substances 0.000 description 1
- 229940075582 sorbic acid Drugs 0.000 description 1
- 239000001587 sorbitan monostearate Substances 0.000 description 1
- 235000011076 sorbitan monostearate Nutrition 0.000 description 1
- 229940035048 sorbitan monostearate Drugs 0.000 description 1
- 208000018198 spasticity Diseases 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 1
- LSNNMFCWUKXFEE-UHFFFAOYSA-L sulfite Chemical class [O-]S([O-])=O LSNNMFCWUKXFEE-UHFFFAOYSA-L 0.000 description 1
- BDHFUVZGWQCTTF-UHFFFAOYSA-M sulfonate Chemical compound [O-]S(=O)=O BDHFUVZGWQCTTF-UHFFFAOYSA-M 0.000 description 1
- 150000003467 sulfuric acid derivatives Chemical class 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 230000002889 sympathetic effect Effects 0.000 description 1
- 230000001975 sympathomimetic effect Effects 0.000 description 1
- 230000005062 synaptic transmission Effects 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- DOMXUEMWDBAQBQ-WEVVVXLNSA-N terbinafine Chemical compound C1=CC=C2C(CN(C\C=C\C#CC(C)(C)C)C)=CC=CC2=C1 DOMXUEMWDBAQBQ-WEVVVXLNSA-N 0.000 description 1
- 229960002722 terbinafine Drugs 0.000 description 1
- KKEYFWRCBNTPAC-UHFFFAOYSA-L terephthalate(2-) Chemical compound [O-]C(=O)C1=CC=C(C([O-])=O)C=C1 KKEYFWRCBNTPAC-UHFFFAOYSA-L 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- 229960002784 thioridazine Drugs 0.000 description 1
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 239000000196 tragacanth Substances 0.000 description 1
- 235000010487 tragacanth Nutrition 0.000 description 1
- 229940116362 tragacanth Drugs 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 238000000844 transformation Methods 0.000 description 1
- 230000036967 uncompetitive effect Effects 0.000 description 1
- 241000701161 unidentified adenovirus Species 0.000 description 1
- 230000002792 vascular Effects 0.000 description 1
- 235000013311 vegetables Nutrition 0.000 description 1
- 235000012431 wafers Nutrition 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 229940071104 xylenesulfonate Drugs 0.000 description 1
- BLGXFZZNTVWLAY-SCYLSFHTSA-N yohimbine Chemical compound C1=CC=C2C(CCN3C[C@@H]4CC[C@H](O)[C@@H]([C@H]4C[C@H]33)C(=O)OC)=C3NC2=C1 BLGXFZZNTVWLAY-SCYLSFHTSA-N 0.000 description 1
- 229960000317 yohimbine Drugs 0.000 description 1
- AADVZSXPNRLYLV-UHFFFAOYSA-N yohimbine carboxylic acid Natural products C1=CC=C2C(CCN3CC4CCC(C(C4CC33)C(O)=O)O)=C3NC2=C1 AADVZSXPNRLYLV-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/08—Bridged systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D221/00—Heterocyclic compounds containing six-membered rings having one nitrogen atom as the only ring hetero atom, not provided for by groups C07D211/00 - C07D219/00
- C07D221/02—Heterocyclic compounds containing six-membered rings having one nitrogen atom as the only ring hetero atom, not provided for by groups C07D211/00 - C07D219/00 condensed with carbocyclic rings or ring systems
- C07D221/22—Bridged ring systems
- C07D221/28—Morphinans
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B59/00—Introduction of isotopes of elements into organic compounds ; Labelled organic compounds per se
- C07B59/002—Heterocyclic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/485—Morphinan derivatives, e.g. morphine, codeine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/14—Antitussive agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/24—Antidepressants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B2200/00—Indexing scheme relating to specific properties of organic compounds
- C07B2200/05—Isotopically modified compounds, e.g. labelled
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B2200/00—Indexing scheme relating to specific properties of organic compounds
- C07B2200/07—Optical isomers
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B2200/00—Indexing scheme relating to specific properties of organic compounds
- C07B2200/13—Crystalline forms, e.g. polymorphs
Abstract
본원은 화학식 I의 중수소화 덱스트로메토르판을 제조하는 방법, 이러한 방법으로 제조된 중수소화 덱스트로메토르판, 및 이의 약제학적으로 허용되는 염을 기술한다.
[화학식 I]
[화학식 I]
Description
우선권
본원은 2016년 7월 4일자로 출원된 국제 특허 출원 제PCT/CN2016/088414호의 이익을 청구하며, 이것은 인용에 의해 본원에 포함된다.
분야
본 발명은 중수소화 덱스트로메토르판 화합물 및 이들의 약제학적으로 허용되는 염, 용매화물, 및 수화물의 제조방법을 제공한다. 본 발명은 또한 중수소화 덱스트로메토르판 화합물 및 이들의 약제학적으로 허용되는 염, 용매화물, 및 수화물에 관한 것이다. 본 발명은 또한 본 발명의 화합물을 포함하는 조성물, 및 덱스트로메토르판을 투여함으로써 유리하게 치료되는 질환 및 병태를 치료하는 방법에서의 상기 조성물의 용도를 제공한다.
덱스트로메토르판은 현재 가장 널리 사용되는 진해제 중의 하나이다. 화학명 (+)-3-메톡시-17-메틸-(9α,13α,14α)-모르피난으로도 알려져 있는, 덱스트로메토르판 하이드로브로마이드 및 퀴디닌 설페이트를 포함하는 제품 형태의 덱스트로메토르판이 상품명 Nuedexta™ 하에 감정 실금(pseudobulbar affect)의 치료를 위해 2010년 10월에 미국 식품 의약국에 의해 승인되었다[www.accessdata.fda.gov/scripts/cder/ob/docs/obdetail.cfm ?App l_No=021879&TABLE1=OB_Rx 참조]
코데인 유사체 레보르파놀의 비-오피오이드 d-이성체인 덱스트로메토르판(DM)은 처방전 없이 살 수 있는(OTC) 진해제로서 약 50년 동안 광범위하게 사용되어 왔다. DM은 복합적 약리학을 가지며, 여러 상이한 수용체에 대한 결합 친화도를 갖고, 중추 신경계(CNS)에서 주요 활성을 갖는다. DM은 항-글루타메이트 흥분성 활성에 대한 관련 가능성을 갖는 약한 비경쟁적 N-메틸-D-아스파르테이트(NMDA) 수용체 길항제로서의 이의 활성에 대해 널리 알려져 있다(Ki = 1500 nM)(Tortella et al. Trends Pharmacol Sci. 1989;10(12):501-7; Chou YC et al., Brain Res. 1999;821(2):516-9; Netzer R et al., Eur J Pharmacol. 1993;238(2-3):209-16; Jaffe DB et al., Neurosci Lett. 1989;105(1-2):227-32). DM은 또한 강력한 시그마-1 효능제이며(Zhou GZ et al., Eur J Pharmacol. 1991;206(4):261-9; Maurice T et al., Brain Res Brain Res Rev. 2001;37(1-3):116-32; Cobos EJ et al., Curr Neuropharmacol. 2008;6(4):344-66)(Ki = 200nM), 높은 친화도로 세로토닌 전달체에 결합한다(SERT; Ki = 40nM). DM은 노르에피네프린 전달체에 대해 단지 중간 정도의 친화도(Ki = 13μM)를 갖지만, 노르에피네프린의 흡수는 효과적으로 억제한다(Ki = 240nM)(Codd EE et al., J Pharmacol Exp Ther. 1995;274(3):1263-70). DM은 α3β4 니코틴성 아세틸콜린 수용체의 길항제이며, 보고된 IC50(50% 억제를 야기하는 농도) 값은 0.7μM이다(Damaj et al., J Pharmacol Exp Ther. 2005;312(2):780-5).
이러한 상호작용 중의 하나 이상의 결과로서, DM은 칼륨-자극된 글루타메이트 방출을 감소시키고(Annels SJ et al., Brain res. 1991;564(2):341-3), 모노아민(세로토닌, 노르에피네프린, 및 도파민) 신경전달을 조절한다(Codd EE et al., J Pharmacol Exp Ther. 1995;274(3):1263-70; Maurice T et al., Pharmacol Ther. 2009;124(2):195-206; Maurice T et al., Prog Neuropsychopharmacol Biol Psychiatry. 1997;21(1):69-102). DM의 α3β4 니코틴성 아세틸콜린 수용체 길항작용(Damaj MI et al., J Pharmacol Exp Ther. 2005;312(2):780-5)은 특정 CNS 운동 장애 및 중독에 영향을 미칠 수 있다(Silver AA et al., J Am Acad Child Adolesc Psychiatry. 2001;40(9):1103-10). 단독으로 투여되는 경우, DM은 간에서 주로 덱스트로르판(DX)으로 신속하게 대사되어 대단히 낮은 생체이용율을 초래하고 따라서 CNS 노출을 제한한다. DX가 주요 수용체에 대해 상이한 친화도로 DM과 동일한 수용체의 일부와 상호작용하기는 하지만, 이것은 신속한 글루쿠로니드 접합을 겪으며, 이것이 주로 혈액-뇌-장벽을 가로지르는 것을 방지하여, 처방 용량에서 CNS 작용을 감소시킨다(Church J et al., Eur J Pharmacol. 1985;111(2):185-90; Franklin PH et al., Mol Pharmacol. 1992;41(1):134-46).
덱스트로메토르판은 처방전 없이 살 수 있는 기침 억제제 제품에서 사용하기 위해 승인된다. 이것은 현재 음성 경련을 가진 대상체를 치료하기 위해 I 단계 임상 시험 중이고, 레트 증후군(RTT)을 치료하기 위해 II 단계 임상 연구 중이다(www.clinicaltrials.gov). 덱스트로메토르판은 또한 자폐 범주성 장애의 치료를 위해 II/III 단계 임상 시험 중이고, 당뇨병성 황반 부종의 치료를 위해, I/II 단계 임상 연구 중인 것으로 평가되고 있다(www.clinicaltrials.gov).
덱스트로메토르판은 걸프전 증상의 치료를 위해 II 단계 임상 시험에서 날트렉손과 조합하여, 및 급성 뇌혈관 발작 및 뇌수종의 치료를 위해 다른 약제(예를 들면, 디펜하이드라민, 판토프라졸, 파모티딘)와 II 단계 임상 연구에서 연구중에 있다(www.clinicaltrials.gov).
또한, 덱스트로메토르판 하이드로브로마이드와 퀴니딘 설페이트의 병용물이 현재 자폐증을 갖는 성인의 치료를 위해 II 단계 임상 시험 중이고, 치매, 뇌졸중, 및 외상성 뇌 손상과 같은 만연한 병태를 갖는 감정 실금 환자의 치료를 위해 IV 단계 임상 연구 중에 있다(www.clinicaltrials.gov). 이러한 병용물은 또한 근위축성 측삭 경화증을 갖는 환자의 치료를 위해, 치료-저항 주 우울증을 위해, 발작적 편두통에서 질환 진행의 방지 및 변경을 위해 II 단계 임상 시험 중이고, 현재 알츠하이머 질환을 갖는 환자에서 감정 실금의 치료를 위해 IV 단계 임상 시험 중이다(www.clinicaltrials.gov).
덱스트로메토르판은 간에서 대사된다. 분해는 O- 및 N-탈메틸화로 시작하여 일차 대사산물 덱스트로르판 및 3-메톡시-모르피난을 형성하며, 이들 둘 다는 3-하이드록시모르피난으로 각각 추가로 N- 및 O-탈메틸화된다(아래 덱스트로메토르판의 생물전환 경로 참조). 시토크롬 P450 효소 2D6(CPY2D6)이 덱스트로메토르판과 3-메톡시모르피난의 O-탈메틸화 반응을 책임진다. 덱스트로메토르판과 덱스트로르판의 N-탈메틸화는 관련된 CPY3A 계열의 효소에 의해 촉매된다. 덱스트로르판과 3-하이드록시모르피난의 접합체는 섭취한지 수 시간 내에 사람 혈장 및 뇨에서 검출될 수 있다.
수소 대신에 중수소를 선택적으로 혼입하는 것(중수소화)은, 생리학적 활성 화합물의 생화학적 효능 및 선택성을 보유하면서, 선택된 경우에, 이들의 전반적인 치료 프로파일에 상당한 이익(예를 들면, 이들의 대사율, 안전성, 효능, 치료제에 대한 내성에 긍정적인 영향을 미침)을 부여하는 것을 가능하게 하는 독특한 효과를 갖는다[참조; Harbeson & Tung, Medchem News No. 2, May 2014; Tung, Innovations in Pharmaceutical Technology Issue 32, 2010]. 약동학적 연구를 위해 97 내지 98%의 동위원소 농축을 갖는 중수소화 덱스트로메토르판 유도체의 합성이 볼스케이 등(Bolcskei et al.)에 의해 보고되었다(Bolcskei et al., ARKIVOC, 2008: 182-193). 덱스트로메토르판의 CD3O-유도체(즉, d3-DM)가 또한 알려져 있지만, 이의 합성은 공개되지 않았다(Bolcskei et al., ARKIVOC, 2008: 182-193, Eichold et al., J. Chromatogr B Biomed Sci Appl, 1997; 698: 147-154).
중수소화 덱스트로메토르판의 합성 방법은 아래에 나타내어져 있다(즉, 차세대 AVP-786 공정). 이 방법은 세 가지 상이한 중수소화 시약(중수소화 포름산, 중수소화붕소나트륨, 및 요오도메탄-D3)을 사용하며, 이것은, 특히 상업적 규모에서, 공급 사슬을 복잡하게 만든다. 그 결과로서, 공급 사슬을 간소화시키고 작동적으로 복잡하지 않은 공정 단계들을 제공하는 개선된 공정이 필요하다. 또한, 중간 스테이지들에서의 추가의 제어가 또한 약물 성분 순도가 이전의 공정과 같거나 더 양호하도록 보장할 것이다.
중수소화 덱스트로메토르판도, 이의 비중수소화 대응물처럼, 간에서 대사될 수 있다. d3-DM 및 d6-DM에 대한 주요 사람 대사 경로가 아래에 나타내어져 있다(중수소화 덱스트로메토르판의 생물전환 경로). 중수소화 덱스트로메토르판에 대한 대사 경로는 비중수소화 덱스트로메토르판에 대한 경로를 반영한다. 첫째, d3-DM 및/또는 d6-DM은 N-탈메틸화를 거쳐 일차 대사산물 d3-3-메톡시모르피난(d3-3MM)을 형성한다. 또한, d6-DM도 O-탈메틸화를 거쳐 일차 대사산물 d3-덱스트로르판(d3-DX)을 형성할 수 있다. 그후, d3-3MM 및 d3-DX 둘 다는 3-하이드록시모르피난으로 추가로 대사될 수 있다. 시토크롬 P450 효소 2D6(CPY2D6)은 d6-DM 및 d3-3MM의 O-탈메틸화 반응을 책임지는 반면, d3- 및 d6-DM 및 d3-DX의 N-탈메틸화는 관련 CPY3A 계열의 효소에 의해 촉매된다.
덱스트로메토르판 남용은 이의 활성 대사산물, 덱스트로르판과 연관되어 있다. 덱스트로메토르판에 기인하는 PCP-유사 효과는 덱스트로르판에 의해 보다 신뢰성 있게 생산되며, 따라서 사람에서 남용-가능성은 덱스트로르판으로의 덱스트로메토르판의 대사에 기인할 수 있다[참조; Miller, S C et al., Addict Biol, 2005, 10(4):325-7; Nicholson, K L et al., Psychopharmacology (Berl), 1999 Sep. 1, 146(1):49-59; Pender, E S et al., Pediatr Emerg Care, 1991, 7:163-7]. 덱스트로메토르판의 항정신성 효과에 대한 한 가지 연구에서는 신속 대사형(extensive metabolizer)이 지연 대사형(poor metabolizer)에 비해 더 큰 남용 가능성을 보고한 것으로 밝혀졌으며, 덱스트로르판이 덱스트로메토르판 남용 가능성에 기여한다는 증거를 제공하였다[참조; Zawertailo L A, et al., J Clin Psychopharmacol, 1998 August, 18(4):332-7].
인구의 상당수가 CYP2D6 효소에 기능적 결함을 갖는다. 따라서, 덱스트로메토르판에 대한 주요 대사 경로가 CYP2D6을 필요로 하기 때문에, 감소된 활성이 CYP2D6-결핍 대상체에서 훨씬 더 큰 작용 지속시간 및 더 큰 약물 효과를 야기한다. 고유한 기능적 결핍 이외에, 항우울제와 같은 특정 약물이 CYP2D6 효소의 강력한 억제제이다. 덱스트로메토르판은, 일부 사람들에서 이의 느린 대사로 인해, 특히 다른 약제(들)와 병용되는 경우, 심각한 유해 사건(adverse event)을 야기할 수 있다.
권장시간보다 더 긴 체내에서의 약물의 지속시간은 지속적인 유익한 효과를 제공할 수 있지만, 또한 바람직하지 않은 부작용을 생성하거나 연장시킬 수 있다. 덱스트로메토르판 요법에서의 권장 용량에서의 바람직하지 않은 부작용은 메스꺼움, 식욕 감퇴, 설사, 졸음, 현기증, 및 무기력을 포함한다.
따라서, 덱스트로메토르판의 유익한 활성을 가지며, 또한 다른 이익, 예를 들어, 저하된 대사 가능성(metabolic liability)으로 인한 유해한 부작용의 감소, 이의 약리학적 유효 수명을 더욱 연장시키는 이익, 대상체 순응을 향상시키는 이익, 잠재적으로, 집단 약동학적 변동성을 감소시키고/시키거나 위험한 약물-약물 상호작용에 대한 이의 잠재성을 감소시키거나, 덱스트로르판와 같은 대사산물의 형성으로 인한 덱스트로메토르판 남용의 가능성을 감소시키는 이익들을 가질 수 있는 화합물을 제공하는 것이 바람직하다.
덱스트로메토르판을 중수소화 덱스트로메토르판으로 전환시키기 위한 편리하면서도 경제적인 방법이 본원에 기술되어 있다. 하나의 양태에서, 상기 방법은 선행기술의 방법들에 비해 중간체에 대한 개선된 분리 수율과 순도 및 또한 최종 화합물에 대한 개선된 수율과 순도를 제공한다. 예를 들면, 몇몇 양태에서, 선행기술의 방법들에 비해 수율은 >70%이고 순도는 >90%이다. 그리고, 몇몇 양태에서, 선행기술의 방법들에 비해 수율은 약 75%이고 전형적인 순도는 ≥98%이다. 하나의 양태에서, 합성은 단일 중수소화 시약, 요오도메탄-D3을 사용한다. 몇몇 양태에서, 단일 중수소화 시약의 사용은 선행기술의 방법들에 비해 공급 사슬을 단순화시킨다. 하나의 양태에서, 하나 이상의 중간 스테이지들에서의 제어는 약물 물질 순도가 이전 공정들과 같거나 더 양호하도록 보장한다.
하나의 양태에서, 본 발명은 중수소화 덱스트로메토르판 화합물의 합성 방법을 제공한다. 하나의 양태에서, 본 발명은 화학식 I의 중수소화 덱스트로메토르판 화합물 또는 이의 약제학적으로 허용되는 염의 합성방법을 제공한다.
[화학식 I]
하나의 양태에서, 상기 방법은 (i) 화학식 II의 덱스트로메토르판 화합물의 3급 아민을 N-탈메틸화시키는 단계를 포함한다:
[화학식 II]
하나의 양태에서, 상기 방법은 (ii) 반응 (i)의 N-탈메틸화 생성물을 화학식 III의 화합물로 중수소화시키는 단계를 추가로 포함한다:
[화학식 III]
하나의 양태에서, 반응 (ii)의 중수소화 공정은 염기 및 요오도메탄-D3의 존재하에 N-메틸화를 포함한다. 하나의 양태에서, 반응 (ii)의 중수소화 공정은 -90℃ 이상 90℃ 이하의 범위의 온도에서 일어난다.
하나의 양태에서, 상기 방법은, 반응 (iii)에서, 화학식 III의 화합물의 메톡시 그룹을 O-탈메틸화시키는 단계를 추가로 포함한다.
하나의 양태에서, 상기 방법은, 반응 (iv)에서, 반응 (iii)의 O-탈메틸화 생성물을 화학식 I의 화합물로 중수소화시키는 단계를 추가로 포함한다. 하나의 양태에서, 중수소화 반응 (iv)는 염기 및 요오도메탄-D3의 존재하에 O-메틸화를 포함한다. 하나의 양태에서, 중수소화 반응 (iv)는 -10℃ 이상 10℃ 이하의 범위의 온도에서 일어난다.
하나의 양태에서, N-탈메틸화 반응 (i)은 1-클로로에틸 클로로포르메이트의 존재하에 수행된다. 하나의 양태에서, N-탈메틸화 반응 (i)은 N-탈메틸화 반응 (i)이 ≥93% 완료될 때 메탄올을 첨가하고 열을 적용함을 추가로 포함한다. 하나의 양태에서, N-탈메틸화 반응 (i)은 메탄올의 양이 최대 100ppm로 감소될 때까지 N-탈메틸화가 ≥98% 완료될 때 진공을 적용함을 추가로 포함한다. 하나의 양태에서, N-탈메틸화 반응 (i)은 진공을 적용하기 전에 톨루엔을 첨가함을 추가로 포함한다.
하나의 양태에서, 화학식 II의 화합물은 최대 2%로 존재한다.
하나의 양태에서, 반응 (i)의 N-탈메틸화 생성물을 N-메틸화시켜 화학식 III의 화합물로 중수소화시키기 위해 반응 (ii)에서 사용되는 염기는 탄산나트륨, 탄산세슘, 탄산칼륨, 중탄산나트륨, 중탄산칼륨, 수산화나트륨, 수산화칼륨, 칼륨 3급-부톡사이드, 수소화나트륨, n-부틸리튬, 리튬 디이소프로필아미드, 및 3급 유기 아민으로부터 선택된다. 하나의 양태에서, 반응 (ii)에서 사용되는 3급 유기 아민 염기는 트리에틸아민 또는 디이소프로필에틸아민이다. 하나의 양태에서, 반응 (ii)에서 사용되는 염기는 n-부틸리튬이다. 하나의 양태에서, 반응 (ii)에서 사용되는 온도는 -90℃ 이상 0℃ 이하의 범위다. 하나의 양태에서, 반응 (ii)에서 사용되는 온도는 -90℃ 이상 -50℃ 이하의 범위다. 하나의 양태에서, 반응 (ii)에서 사용되는 온도는 -90℃ 이상 -70℃ 이하의 범위다.
하나의 양태에서, O-탈메틸화 반응 (iii)은 브롬화수소산의 존재하에 수행된다.
하나의 양태에서, 반응 (iii)의 O-탈메틸화 화합물을 O-메틸화시켜 화학식 I의 화합물로 중수소화하기 위해 반응 (iv)에서 사용되는 염기는 탄산칼륨, 수소화나트륨, 나트륨 메톡사이드, 및 칼륨 t-부톡사이드로부터 선택된다. 하나의 양태에서, 반응 (iv)에서 사용되는 염기는 칼륨 t-부톡사이드이다. 하나의 양태에서, 반응 (iv)에서 사용되는 온도는 -3℃ 이상 -1℃ 이하의 범위다.
하나의 양태에서, 화학식 I의 화합물은 하이드로브로마이드 염이다. 하나의 양태에서, 하이드로브로마이드 염은 일수화물이다.
하나의 양태에서, 화합물에서 중수소로서 지정되지 않은 임의의 원자는 이들의 자연 동위원소 존재비로 존재한다.
하나의 양태에서, 본 발명은 (i) 화학식 II의 덱스트로메토르판 화합물의 메톡시 그룹을 화학식 VIII의 화합물로 O-탈메틸화시키는 단계를 포함하여, 화학식 I의 덱스트로메토르판 화합물의 합성 방법을 제공한다:
[화학식 VIII]
하나의 양태에서, 상기 방법은 (ii) 화학식 VIII의 O-탈메틸화 화합물을 O-메틸화시켜 화학식 VII의 화합물로 중수소화시키는 단계를 추가로 포함한다:
[화학식 VII]
하나의 양태에서, 중수소화 반응 (ii)은 염기 및 요오도메탄-D3의 존재하에 일어난다. 하나의 양태에서, 중수소화 반응 (ii)은 -10℃ 이상 10℃ 이하의 범위의 온도에서 일어난다. 하나의 양태에서, 상기 방법은 (iii) (ii)로부터의 화학식 VII의 덱스트로메토르판 화합물의 3급 아민을 화학식 IX의 화합물로 N-탈메틸화시키는 단계를 추가로 포함한다:
[화학식 IX]
하나의 양태에서, 상기 방법은 (iv) 화학식 IX의 N-탈메틸화 화합물을 N-메틸화시켜 화학식 I의 화합물로 중수소화시키는 단계를 추가로 포함한다. 하나의 양태에서, 중수소화 반응 (iv)은 염기 및 요오도메탄-D3의 존재하에 일어난다. 하나의 양태에서, 중수소화 반응 (iv)은 -90℃ 이상 90℃ 이하의 범위의 온도에서 일어난다.
하나의 양태에서, O-탈메틸화 반응 (i)은 브롬화수소산의 존재하에 수행된다.
하나의 양태에서, 반응 (i)의 O-탈메틸화 생성물을 O-메틸화시켜 중수소화시키기 위해 반응 (ii)에서 사용되는 염기는 탄산칼륨, 수소화나트륨, 나트륨 메톡사이드, 및 칼륨 t-부톡사이드로부터 선택된다. 하나의 양태에서, 반응 (ii)에서 사용되는 염기는 칼륨 t-부톡사이드이다. 하나의 양태에서, 반응 (ii)에서 사용되는 온도는 -3℃ 이상 -1℃ 이하의 범위다.
하나의 양태에서, N-탈메틸화 반응 (iii)은 1-클로로에틸 클로로포르메이트의 존재하에 수행된다. 하나의 양태에서, 반응 (iii)에 기술된 N-탈메틸화 반응은 N-탈메틸화 반응 (iii)이 ≥93% 완료될 때 메탄올을 첨가하고 열을 적용함을 추가로 포함한다. 하나의 양태에서, N-탈메틸화 반응 (iii)은 메탄올의 양이 최대 100ppm로 감소될 때까지 N-탈메틸화가 ≥98% 완료될 때 진공을 적용함을 추가로 포함한다. 하나의 양태에서, N-탈메틸화 반응 (iii)은 진공을 적용하기 전에 톨루엔을 첨가함을 추가로 포함한다. 하나의 양태에서, 화학식 VII의 화합물은 최대 2%로 존재한다.
하나의 양태에서, 반응 (iii)의 N-탈메틸화 화합물을 N-메틸화시켜 화학식 I의 화합물로 중수소화시키기 위해 반응 (iv)에서 사용되는 염기는 탄산나트륨, 탄산세슘, 탄산칼륨, 중탄산나트륨, 중탄산칼륨, 수산화나트륨, 수산화칼륨, 칼륨 3급-부톡사이드, 수소화나트륨, n-부틸리튬, 리튬 디이소프로필아미드, 및 3급 유기 아민으로부터 선택된다. 하나의 양태에서, 반응 (iv)에서 사용되는 3급 유기 아민 염기는 트리에틸아민 또는 디이소프로필에틸아민이다. 하나의 양태에서, 반응 (iv)에서 사용되는 염기는 n-부틸리튬이다. 하나의 양태에서, 반응 (iv)에서 사용되는 온도는 -90℃ 이상 0℃ 이하의 범위다. 하나의 양태에서, 반응 (iv)에서 사용되는 온도는 -90℃ 이상 -50℃ 이하의 범위다. 하나의 양태에서, 반응 (iv)에서 사용되는 온도는 -90℃ 이상 -70℃ 이하의 범위다.
하나의 양태에서, 본원에 제공된 방법들 중의 어느 것에 의해 제조된 화학식 I의 화합물을 브롬화수소산을 포함하는 용액을 사용하는 결정화에 의해 화학식 IV의 하이드로브로마이드 일수화물 염으로 전환시킴을 포함하여, 화학식 IV의 중수소화 덱스트로메토르판 화합물의 합성 방법이 제공된다:
[화학식 IV]
하나의 양태에서, 화학식 IV의 화합물은 하이드로브로마이드 염이다. 하나의 양태에서, 화학식 IV의 화합물의 하이드로브로마이드 염은 일수화물이다.
하나의 양태에서, 상기 방법은 유리하게는 선행기술의 방법들에 비해 더 저렴하고 더 간단한 방법에 의해 상당한 수율로 중수소화 덱스트로메토르판을 제조하는 방법을 제공한다. 하나의 양태에서, 중수소화 덱스트로메토르판의 수율은 이전에 개시된 방법들에 비해 개선된다. 하나의 양태에서, 상기 방법은 유리하게는, 공급 사실을 간소화시키는 단일 중수소화 시약, 요오도메탄-D3을 사용한다. 하나의 양태에서, 단일 중수소화 시약은 중수소화 디메틸 설폭사이드, 브로메탄-D3(메틸-d3 브로마이드), 메틸-D3 트리플레이트, 또는 중수소화 디메틸 설페이트이지만 이에 제한되지 않는다. 당업계의 통상의 숙련가는 또한 사용할 수 있는 표준 메틸화제의 다른 중수소화 시약을 인지할 것이다.
상기한 일반적인 설명 및 하기 상세한 설명 둘 다는 예시적이고 설명하기 위한 것이지만 청구한 대로 본 발명을 제한하지 않는 것으로 이해되어야 한다. 본 발명의 하나 이상의 양태의 특정한 세부사항은 하기 설명에 제시되어 있다. 당업계의 숙련가들은 본 발명의 범위에 의해 포함되는 본 발명의 수많은 변화 및 개질이 있음을 인지할 것이다. 본 기재내용의 다른 특징들 또는 이점들은 하기 대표적인 실시예로부터, 및 또한 첨부된 청구항으로부터 자명해질 것이다.
본원에서 사용되는 바와 같이, 유기 화합물을 포함한 화합물에 대한 명명법은, 명명법에 대한 통상적인 명칭, IUPAC, IUBMB, 또는 CAS 권고를 사용하여 제공될 수 있다. 당업계의 숙련가는 명칭이 주어진다면, 명명 규칙(naming convention)을 사용한 화합물 구조의 체계적 감소(systemic reduction)에 의해, 또는 CHEMDRAWTM(Cambridgesoft Corporation, U.S.A.)과 같은 상업적으로 이용 가능한 소프트웨어에 의해 화합물의 구조를 쉽게 알아낼 수 있다.
이러한 기재내용은 몇몇 수치를 포함한다. 본원에 개시된 각각의 값은 또한 값 자체에 더하여 "약" 그 특정 값으로서 본원에 개시되는 것으로 이해될 것이다. 예를 들면, 값 "10"이 개시된다면, "약 10"이 또한 개시된다. 또한, 개시된 범위에서 두 개의 특정 단위 사이의 각 단위가 또한 개시되는 것으로 이해된다. 예를 들면, 10-15의 범위가 개시된다면, 적어도 11, 12, 13, 및 14가 또한 개시된다.
덱스트로메토르판 및 이의 유사체의 화학은 문헌[Rodd, E. H., Ed., Chemistry of Carbon Compounds (Elsevier Publ., N.Y., 1960), Goodman and Gilman's Pharmacological Basis of Therapeutics, Choi Brain Res. 1987, 403: 333-336], 및 최(Choi)의 미국 특허 제4,806,543호와 같은 다양한 참고문헌에 기술되어 있다. 이의 화학 구조는 다음과 같다:
덱스트로메토르판(DM)은 (+)-3-메톡시-N-메틸모르피난에 대한 통칭이다. 이것은 모르핀-유사 오피오이드의 우선성 유사체인 분자 부류로부터의 한 가지 특정 분자이다. 용어 "오피에이트"는 모르핀 및 코데인과 같은, 아편으로부터 유도된 약물을 가리킨다. 본원에서 사용되는 바와 같이, 용어 "오피오이드"가 더 광범위하다. 이것은 오피에이트를 포함할 뿐만 아니라 포유동물에서 진통제 또는 진정제로서 작용하는 다른 천연 또는 합성 약물을 포함한다.
자연 동위원소 존재비의 일부 변화는 합성에 사용되는 화학 재료의 기원에 따라 합성된 화합물에서 일어나는 것으로 인지될 것이다. 따라서, 덱스트로메토르판의 제제는 본질적으로 소량의 중수소화 및/또는 13C-함유 이소토폴로그(isotopologue)를 함유할 것이다. 자연적으로 풍부한 안정한 수소 및 탄소 동위원소의 농도는, 이러한 변화에도 불구하고, 본 발명의 화합물의 안정한 동위원소 치환의 정도에 비해 작다[예를 들면, 참조; Wada E et al., Seikagaku 1994,66:15; Ganes L Z et al, Comp Biochem Physiol A Mol Integr Physiol 1998, 119:725]. 본 발명의 화합물에서, 특정 위치가 중수소를 갖는 것으로 지정되는 경우, 그 위치에서의 중수소의 존재비는 대략 0.015%인 중수소의 자연 존재비보다 상당히 더 큰 것으로 이해된다. 하나의 양태에서, 중수소를 갖는 것으로 지정된 위치는 상기 화합물에서 중수소로서 지정된 각 원자에서 적어도 3000(45% 중수소 혼입)의 최소 동위원소 농축 계수(minimum isotopic enrichment factor)를 갖는다.
본원에서 사용되는 바와 같이, 용어 "동위원소 농축 계수"는 동위원소 존재비와 명시된 동위원소의 자연 존재비 간의 비를 의미한다. 또 다른 양태에서, 본 발명의 화합물은 적어도 3500(각각의 지정된 중수소 원자에서 52.5% 중수소 혼입), 적어도 4000(60% 중수소 혼입), 적어도 4500(67.5% 중수소 혼입), 적어도 5000(75% 중수소 혼입), 적어도 5500(82.5% 중수소 혼입), 적어도 6000(90% 중수소 혼입), 적어도 6333.3(95% 중수소 혼입), 적어도 6466.7(97% 중수소 혼입), 적어도 6600(99% 중수소 혼입), 또는 적어도 6633.3(99.5% 중수소 혼입)이지만 이에 제한되지 않는 각각의 지정된 중수소 원자에 대한 동위원소 농축 계수를 갖는다.
본 발명의 화합물에서 특정 동위원소로서 특별히 지정되지 않은 임의의 원자는 그 원자의 임의의 안정한 동위원소를 나타냄을 의미한다. 달리 명시되지 않는 한, 위치가 "H" 또는 "수소"로서 구체적으로 지정되는 경우, 위치는 이의 자연 존재비 동위원소 조성으로 수소를 갖는 것으로 이해된다.
본원에서 사용되는 바와 같이, 용어 "이소토폴로그"는 하나 이상의 위치에서의 동위원소 조성을 제외하고는 본 발명의 특정 화합물과 동일한 화학 구조 및 화학식을 갖는 화학종, 예를 들어, H vs. D를 가리킨다. 따라서, 이소토폴로그는 이의 동위원소 조성에 있어서 본 발명의 특정 화합물과는 다르다.
용어 "화합물"은, 본원에서 사용되는 바와 같이, 또한 이의 임의의 염, 용매화물, 또는 수화물을 포함하는 것으로 의도된다.
본원에서 사용되는 바와 같이, 본 발명의 화합물의 염은 아미노 관능 그룹과 같은 화합물의 염기 그룹과 산, 또는 카복실 관능 그룹과 같은 화합물의 산성 그룹과 염기 사이에 형성된다. 또 다른 양태에 따르면, 화합물은 약제학적으로 허용되는 산 부가염이다.
본원에서 사용되는 바와 같이, 용어 "약제학적으로 허용되는"은, 건전한 의학적 판단 범위내에서, 과도한 독성, 자극, 알레르기 반응 등 없이 사람 및 다른 포유동물의 조직과 접촉하여 사용하기에 적합하고, 합당한 이익/위험 비를 갖는 성분을 가리킨다. "약제학적으로 허용되는 염"은, 수용자에게 투여시, 본 발명의 화합물을 직접 또는 간접적으로 제공할 수 있는 임의의 비독성 염을 의미한다. "약제학적으로 허용되는 짝이온"은 수용자에게 투여시 염으로부터 방출될 때 독성이 아닌 염의 이온 부분이다.
약제학적으로 허용되는 염을 형성하는데 통상적으로 사용되는 산은 이황화수소, 염산, 브롬화수소산, 요오드화수소산, 황산, 및 인산과 같은 무기 산, 및 파라-톨루엔설폰산, 살리실산, 타르타르산, 비타르타르산, 아스코르브산, 말레산, 베실산, 푸마르산, 글루콘산, 글루쿠론산, 포름산, 글루탐산, 메탄설폰산, 에탄설폰산, 벤젠설폰산, 락트산, 옥살산, 파라-브로모페닐설폰산, 탄산, 석신산, 시트르산, 벤조산, 및 아세트산과 같은 유기 산, 뿐만 아니라 관련 무기 및 유기 산을 포함하지만, 이에 제한되지 않는다. 따라서, 이러한 약제학적으로 허용되는 염은 설페이트, 피로설페이트, 비설페이트, 설파이트, 비설파이트, 포스페이트, 모노하이드로겐포스페이트, 디하이드로겐포스페이트, 메타포스페이트, 피로포스페이트, 클로라이드, 브로마이드, 요오다이드, 아세테이트, 프로피오네이트, 데카노에이트, 카프릴레이트, 아크릴레이트, 포르메이트, 이소부티레이트, 카프레이트, 헵타노에이트, 프로피올레이트, 옥살레이트, 말로네이트, 석시네이트, 수베레이트, 세바케이트, 포르메이트, 말레에이트, 부틴-1,4-디오에이트, 헥신-1,6-디오에이트, 벤조에이트, 클로로벤조에이트, 메틸벤조에이트, 디니트로벤조에이트, 하이드록시벤조에이트, 메톡시벤조에이트, 프탈레이트, 테레프탈레이트, 설포네이트, 크실렌 설포네이트, 페닐아세테이트, 페닐프로피오네이트, 페닐부티레이트, 시트레이트, 락테이트, 하이드록시부테레이트, 글리콜레이트, 말레에이트, 타르트레이트, 메탄설포네이트, 프로판설포네이트, 나프탈렌-1-설포네이트, 나프탈렌-2-설포네이트, 만델레이트, 및 기타 염을 포함하지만, 이에 제한되지 않는다.
하나의 양태에서, 약제학적으로 허용되는 산 부가염은 염산 및 브롬화수소산과 같은 무기 산으로 형성된 것들, 및 또한 말레산과 같은 유기 산으로 형성된 것들을 포함하지만, 이에 제한되지 않는다.
본원에서 사용되는 바와 같이, 용어 "수화물"은 비-공유 분자간 힘에 의해 결합된 화학양론적 또는 비-화학양론적 양의 물을 추가로 포함하는 화합물을 의미한다.
본원에서 사용되는 바와 같이, 용어 "용매화물"은 비-공유 분자간 힘에 의해 결합된 물, 아세톤, 에탄올, 메탄올, 디클로로메탄, 2-프로판올 등과 같은 화학양론적 또는 비-화학양론적 양의 용매를 추가로 포함하는 화합물을 의미한다.
본 발명의 화합물은, 예를 들면, 중수소 치환 또는 다른 것의 결과로서 비대칭 탄소원자를 함유할 수 있다. 이와 같이, 본 발명의 화합물은 개별 에난티오머, 또는 두 개의 에난티오머의 혼합물로서 존재할 수 있다. 따라서, 본 발명의 화합물은 라세미 혼합물, 및 또한 다른 가능한 입체이성체를 실질적으로 함유하지 않는 개별적인 각각의 입체이성체 둘 다를 포함할 것이다. 용어 "다른 입체이성체를 실질적으로 함유하지 않는"은 본원에서 사용되는 바와 같이 25% 미만의 다른 입체이성체, 10% 미만의 다른 입체이성체, 5% 미만의 다른 입체이성체, 2% 미만의 다른 입체이성체, 또는 "X"% 미만의 다른 입체이성체(여기서 X는 0 이상 100 이하의 모든 수이다)가 존재함을 의미한다. 주어진 화합물에 대한 개별 에난티오머를 수득하거나 합성하는 방법은 당업계에 널리 공지되어 있으며 실행 가능한 대로 최종 화합물에 또는 출발 물질 또는 중간체에 적용될 수 있다.
본원에서 사용되는 바와 같이, 용어 "안정한 화합물"은 본원에 상세하게 기술된 목적(예를 들어, 치료학적 제품으로의 제형화, 치료학적 화합물의 제조에 사용하기 위한 중간체, 분리 가능하거나 저장 가능한 중간체 화합물, 치료제에 반응성인 질환 또는 병태 치료)을 위해 유용한 충분한 시간 동안 화합물의 완전성을 유지하고 이들의 제조를 가능하게 하기에 충분한 안정성을 갖는 화합물을 가리킨다.
본원에서 사용되는 바와 같이, "D"는 중수소를 가리킨다.
본원에서 사용되는 바와 같이, 용어 "중수소화된 시약", "중수소 시약", 및 "중수소화 시약"은 적어도 하나의 중수소 원자가 수소 대신에 선택적으로 혼입(중수소화)되어 있는 시약을 나타내기 위해 상호교환 가능하게 사용된다.
본원에서 사용되는 바와 같이, "입체이성체"는 에난티오머 및 부분입체이성체 둘 다를 가리킨다.
본원에서 사용되는 바와 같이, 용어 "1당량"은 다른 물질 1몰과 반응하는 하나의 물질의 양을 가리킨다.
본 발명은 이의 약제학적으로 허용되는 염, 용매화물, 및 수화물을 포함한 화학식 I의 화합물을 제공한다.
[화학식 I]
하나의 양태에서, 화학식 I의 화합물은 분리되거나 정제되며, 예를 들어, 화학식 I의 화합물은 각각 존재하는 화학식 I의 이소토폴로그의 총량의 적어도 50중량%(예를 들어, 적어도 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98%, 98.5%, 99%, 99.5% 또는 99.9%)의 순도로 존재한다. 따라서, 하나의 양태에서, 화학식 I의 화합물을 포함하는 조성물은 이소토폴로그의 적어도 50중량%가 인용된 화합물인 한 화합물의 이소토폴로그의 분포를 포함할 수 있다.
하나의 양태에서, D를 갖는 것으로 지정된 화학식 I의 화합물의 임의의 위치는 화학식 I의 화합물의 지정된 위치(들)에 적어도 45%(예를 들어, 적어도 52.5%, 적어도 60%, 적어도 67.5%, 적어도 75%, 적어도 82.5%, 적어도 90%, 적어도 95%, 적어도 97%, 적어도 99%, 또는 적어도 99.5%)의 최소 중수소 혼입을 갖는다. 따라서, 하나의 양태에서, 화학식 I의 화합물을 포함하는 조성물은 이소토폴로그의 적어도 45중량%가 지정된 위치(들)에 D를 포함하는 한 화합물의 이소토폴로그의 분포를 포함할 수 있다.
하나의 양태에서, 화학식 I의 화합물은 화합물의 다른 이소토폴로그를 "실질적으로 함유하지 않으며", 예를 들어, 50% 미만, 25% 미만, 10% 미만, 5% 미만, 2% 미만, 1% 미만, 또는 0.5% 미만의 다른 이소토폴로그가 존재한다.
하나의 양태에서, 화합물에서 중수소로서 지정되지 않은 임의의 원자는 이의 자연 동위원소 존재비로 존재한다.
하나의 양태에서, 방법은 (i) 화학식 II의 덱스트로메토르판 화합물의 3급 아민 또는 이의 약제학적으로 허용되는 염을 탈메틸화시켜 화학식 V의 탈메틸화 화합물 또는 이의 약제학적으로 허용되는 염을 수득하는 단계를 포함한다:
[화학식 II]
[화학식 V]
예를 들면, 하나의 양태에서, 덱스트로메토르판 화합물의 N-탈메틸화 공정은 덱스트로메토르판 출발 물질을, 일수화물 염의 형태로 존재하는 경우, 염기로 처리하여 N-메틸화 출발 물질을 유리 염기로서 수득함을 포함한다. 하나의 양태에서, 염기는 무기 염기이다. 하나의 양태에서, 무기 염기는 수산화리튬, 수산화나트륨, 수산화칼륨, 중탄산나트륨, 중탄산칼륨, 탄산나트륨, 탄산칼륨, 또는 수산화칼슘 중 적어도 하나일 수 있지만, 이에 제한되지 않는다. 하나의 양태에서 염기는 수산화나트륨이다. 하나의 양태에서, 덱스트로메토르판 염의 용액을 유기 용매에 용해시키고 수성 염기성 용액과 혼합하고 교반한다. 하나의 양태에서, 유기 용매는 톨루엔, 헥산, 클로로포름, 에틸 아세테이트, 테트라하이드로푸란, 메틸렌 클로라이드, 또는 디에틸 에테르일 수 있지만, 이에 제한되지 않는다. 하나의 양태에서, 유기 용매는 톨루엔이다. 하나의 양태에서, 유기 층은 수성 층으로부터 분리되며, 그후 유기 층을 중성 pH로 되도록 물로 세척하고, 공비 건조시킨다.
하나의 양태에서, N-탈메틸화 공정은 시아노겐 할라이드, 아실 할라이드, 및 각종 클로로포르메이트와 같은 일반적으로 공지된 시약을 사용하여 수행된다. 하나의 양태에서, 아실 할라이드는 아세틸 클로라이드일 수 있지만, 이에 제한되지 않는다. 하나의 양태에서, 클로로포르메이트는 1-클로로에틸 클로로포르메이트, 에틸 클로로포르메이트, 또는 2,2,2-트리클로로에틸 클로로포르메이트 중 적어도 하나일 수 있지만, 이에 제한되지 않는다. 하나의 양태에서, 클로로포르메이트는 1-클로로에틸 클로로포르메이트이다. 하나의 양태에서, 반응 혼합물을 가열하고 화학식 V의 화합물 또는 이의 약제학적으로 허용되는 염이 수득될 때까지 메탄올을 가함으로써 카바메이트를 후속적으로 제거한다. 하나의 양태에서, N-탈메틸화 반응은 비-극단 온도, 예를 들면, 주위 온도 내지 반응 혼합물의 환류 온도 이하에서 수행된다. 하나의 양태에서, 주위 온도는 18℃ 이상 25℃ 이하의 범위다. 하나의 양태에서, 반응은 더욱 증가된 온도로, 예를 들면, 30℃ 이상 100℃ 이하로 진행된다. 하나의 양태에서, 온도 범위는 40℃ 이상 90℃ 이하이다. 하나의 양태에서, 온도 범위는 50℃ 이상 80℃ 이하이다. 하나의 양태에서, 온도 범위는 60℃ 이상 70℃ 이하이다.
하나의 양태에서, N-탈메틸화 반응은 습기-비함유 환경을 유지하기 위해, 예를 들면 질소이지만 이에 제한되지 않는 불활성 대기하에서 수행될 수 있다. 하나의 양태에서, 용매를 제거하여 중간체 카바메이트를 수득할 수 있다. 하나의 양태에서, 그후 카바메이트를 수용액으로 Zn 및 아세트산과 반응시킴으로써, 또는 메탄올을 가하고 반응 혼합물을 환류되도록 가열함으로써 가수분해시킨다.
하나의 양태에서, N-탈메틸화 반응 (i)은 반응이 ≥93% 완료될 때까지 1-클로로에틸 클로로포르메이트의 존재하에 수행된다. 하나의 양태에서, 그후 카바메이트 관능기를 메탄올 및 열을 사용하여 제거한다. 하나의 양태에서, 메탄올을 N-탈메틸화가 ≥98% 완료될 때까지 진공을 통해 제거한다. 하나의 양태에서, 남은 메탄올의 양은 최대 100ppm이다.
하나의 양태에서, 유기 용매를 반응 (i)에서 반응 혼합물에 다시 가하고 용매를 진공하에 제거한다. 하나의 양태에서, 유기 용매는 톨루엔이지만, 이에 제한되지 않는다. 하나의 양태에서, 이 과정은 메탄올의 양이 약 100ppm 이하로 될 때까지 반복한다.
하나의 양태에서, 알콜을 반응 (i)에서 반응 혼합물에 가하여 불순물을 표적 수준으로 감소시킨다. 하나의 양태에서, 알콜은 이소프로판올이지만, 이에 제한되지 않는다.
하나의 양태에서, 덱스트로메토르판에 대한 불순물 수준은 2.0% 이하로 감소된다. 하나의 양태에서, 덱스트로메토르판에 대한 불순물 수준은 2.5% 이하로 감소된다. 하나의 양태에서, 덱스트로메토르판에 대한 불순물 수준은 3% 이하로 감소된다. 하나의 양태에서, 덱스트로메토르판에 대한 불순물 수준은 3.5% 이하로 감소된다. 하나의 양태에서, 덱스트로메토르판에 대한 불순물 수준은 4% 이하로 감소된다. 하나의 양태에서, 덱스트로메토르판에 대한 불순물 수준은 4.5% 이하로 감소된다. 하나의 양태에서, 덱스트로메토르판에 대한 불순물 수준은 5% 이하로 감소된다. 하나의 양태에서, 덱스트로메토르판에 대한 불순물 수준은 5.5% 이하로 감소된다. 하나의 양태에서, 덱스트로메토르판에 대한 불순물 수준은 6% 이하로 감소된다. 하나의 양태에서, 덱스트로메토르판에 대한 불순물 수준은 6.5% 이하로 감소된다. 하나의 양태에서, 덱스트로메토르판에 대한 불순물 수준은 7% 이하로 감소된다. 하나의 양태에서, 추가의 이소프로판올을 반응 (i)에 가하여 불순물을 표적 수준으로 감소시킨다.
하나의 양태에서, 화학식 V의 화합물 또는 이의 약제학적으로 허용되는 염을 여과에 의해 분리하고 유기 용매로 세정한다. 하나의 양태에서, 유기 용매를 톨루엔이지만, 이에 제한되지 않는다. 하나의 양태에서, 그후 화학식 V의 화합물 또는 이의 약제학적으로 허용되는 염을 유기 용매의 수준이 ≤3%로 될 때까지 약 50℃에서 건조시킨다. 하나의 양태에서, 화학식 V의 화합물 또는 이의 약제학적으로 허용되는 염을 유기 용매의 수준이 ≤3%로 될 때까지 약 40℃에서 건조시킨다. 하나의 양태에서, 화학식 V의 화합물 또는 이의 약제학적으로 허용되는 염을 유기 용매의 수준이 ≤3%로 될 때까지 약 30℃에서 건조시킨다.
하나의 양태에서, 화학식 V의 화합물 또는 이의 약제학적으로 허용되는 염을 유기 용매의 수준이 ≤2%로 될 때까지 약 40℃에서 건조시킨다. 하나의 양태에서, 화학식 V의 화합물 또는 이의 약제학적으로 허용되는 염을 유기 용매의 수준이 ≤2%로 될 때까지 약 30℃에서 건조시킨다.
하나의 양태에서, 화학식 V의 화합물 또는 이의 약제학적으로 허용되는 염을 유기 용매의 수준이 ≤1%로 될 때까지 약 40℃에서 건조시킨다. 하나의 양태에서, 화학식 V의 화합물 또는 이의 약제학적으로 허용되는 염을 유기 용매의 수준이 ≤1%로 될 때까지 약 30℃에서 건조시킨다.
하나의 양태에서, 반응 (i)에서 생성물에 대한 수율은 >70%이고 순도는 약 >90%이다.
하나의 양태에서, 방법은 반응 (ii)에서 반응 (i)로부터의 화학식 V의 N-탈메틸화 화합물 또는 이의 약제학적으로 허용되는 염을 -90℃ 이상 90℃ 이하의 범위의 온도에서 염기 및 중수소화 시약의 존재하에 N-메틸화시켜 화학식 III의 화합물로 중수소화시킴을 추가로 포함한다:
[화학식 III]
하나의 양태에서, N-메틸화 반응은 습기-비함유 환경을 유지하기 위해 불활성 대기, 예를 들면 질소 또는 아르곤 하에서 수행될 수 있다.
하나의 양태에서, 반응 (ii)에서 사용되는 온도는 -80℃ 이상 80℃ 이하, -70℃ 이상 70℃ 이하, -60℃ 이상 60℃ 이하, -50℃ 이상 50℃ 이하, -40℃ 이상 40℃ 이하, -30℃ 이상 30℃ 이하, -20℃ 이상 20℃ 이하, 또는 -10℃ 이상 10℃ 이하의 범위다.
예를 들면, 하나의 양태에서, 반응 (ii)는 화학식 V의 화합물 또는 이의 약제학적으로 허용되는 염을 유기 용매에 용해시키고 용액을 냉각시킴을 포함한다. 하나의 양태에서, 유기 용매는 에테르(예를 들어, 디에틸 에테르, 디부틸 에테르, 메틸 3급-부틸 에테르), 메틸렌 클로라이드, 디옥산, 톨루엔, 펜탄, 또는 테트라하이드로푸란 중 적어도 하나이지만, 이에 제한되지 않는다. 하나의 양태에서, 유기 용매는 테트라하이드로푸란이다. 하나의 양태에서, 온도는 -90℃ 이상 0℃ 이하의 범위의 온도로 낮춘다. 하나의 양태에서, 온도는 -85℃ 이상 -5℃ 이하, -75℃ 이상 -15℃ 이하, -65℃ 이상 -25℃ 이하, -55℃ 이상 -35℃ 이하, 또는 -45℃ 이상 -40℃ 이하의 범위의 온도로 낮춘다.
하나의 양태에서, 그후 염기를 반응 (ii)에 가한 다음 중수소화 시약을 첨가한다.
하나의 양태에서, 중수소화 시약은 요오도메탄-D3, 디메틸 설페이트-D6, 또는 메틸-d3 트리플레이트일 수 있지만, 이에 제한되지 않는다. 하나의 양태에서, 중수소화 시약은 요오도메탄-D3이다. 하나의 양태에서, 반응은 적합한 염기 중에서 수행된다. 하나의 양태에서, 적합한 염기는 유기 염기(예를 들어, 트리에틸아민, 디이소프로필에틸아민) 또는 무기 염기(예를 들어, 탄산나트륨, 수산화나트륨, 수산화칼륨)일 수 있지만, 이에 제한되지 않는다.
하나의 양태에서, 반응 (ii)에서 사용되는 염기는 탄산나트륨, 탄산세슘, 탄산칼륨, 중탄산나트륨, 중탄산칼륨, 수산화나트륨, 수산화칼륨, 칼륨 3급-부톡사이드, 수소화나트륨, 알킬리튬(예를 들어, n-부틸리튬, s-부틸리튬, t-부틸리튬, n-헥실리튬), 리튬 아미드(예를 들어, 리튬 디이소프로필아미드, 리튬 헥사메틸데실라지드), 및 3급 유기 아민(예를 들어, 트리메틸아민, 트리에틸아민, 트리이소프로필아민, 디이소프로필에틸아민)로부터 선택될 수 있지만, 이에 제한되지 않는다.
하나의 양태에서, 3급 유기 아민은 트리에틸아민 또는 디이소프로필에틸아민이다. 하나의 양태에서, 알킬리튬은 n-부틸리튬이다. 하나의 양태에서, 리튬 아미드는 리튬 디이소프로필아미드이다.
하나의 양태에서, 반응 (ii)에서 선택된 염기는 n-부틸리튬이다.
하나의 양태에서, 반응 (ii)에서 사용되는 염기는 유효량, 즉 교환 반응 (ii)를 촉진시키거나 용이하게 하는 임의의 적합한 양 또는 농도로 사용될 수 있다. 예를 들면, 하나의 양태에서, 염기는 0.9 내지 10당량의 양으로 사용된다. 하나의 양태에서, 염기는 2 내지 8당량, 3 내지 7당량, 또는 4 내지 6당량의 양으로 사용된다. 하나의 양태에서, 염기는 1.5 내지 2.5당량의 양으로 사용된다. 하나의 양태에서, 염기는 0.9 내지 1.3당량의 양으로 사용된다.
하나의 양태에서, 반응 (ii)에서 사용되는 중수소화 시약은 요오도메탄-D3이지만, 이에 제한되지 않는다.
하나의 양태에서, 반응 (ii)로부터의 반응 혼합물을 목적하는 전환을 달성하도록 모니터링한다. 하나의 양태에서, 남아있는 d6-DM-J(반응식 1, 반응 (ii) 참조) 수준에 따라 추가 분획의 중수소화 시약을 첨가한다.
하나의 양태에서, 반응 (ii)는 목적하는 N-메틸화가 진행될 수 있도록 하는 임의의 적합한 온도에서 수행된다.
하나의 양태에서, 반응 (ii)의 온도 범위는 -90℃ 이상 90℃ 이하이다.
하나의 양태에서, 반응 (ii)에서 사용되는 온도는 -90℃ 이상 0℃ 이하의 범위다.
하나의 양태에서, 반응 (ii)에서 사용되는 온도는 -90℃ 이상 -50℃ 이하의 범위다.
하나의 양태에서, 반응 (ii)에서 사용되는 온도는 -80℃ 이상 -70℃ 이하의 범위다.
하나의 양태에서, 그후 반응 (ii) 혼합물을 켄칭 시약의 첨가에 의해 켄칭시킨다. 하나의 양태에서, 켄칭제는 약산성 용액이다. 하나의 양태에서, 켄칭 시약은 유기 용매이다. 하나의 양태에서, 유기 용매는 메탄올 또는 에탄올일 수 있지만, 이에 제한되지 않는다. 하나의 양태에서, 켄칭 시약은 수성 산이다. 하나의 양태에서, 수성 산은 염산, 황산, 시트르산, 또는 아세트산일 수 있지만, 이에 제한되지 않는다. 하나의 양태에서, 켄칭 시약은 무기 염이다. 하나의 양태에서, 무기 염은 염화암모늄, 중탄산나트륨, 또는 포스페이트 염일 수 있지만, 이에 제한되지 않는다. 하나의 양태에서, 켄칭 시약은 수성 염화암모늄이다. 하나의 양태에서, 켄칭 시약은 물이다. 하나의 양태에서, 수성 염화암모늄을 반응 (ii) 혼합물에 가하고 반응 혼합물을 감압하에 가온시켜 임의의 남아있는 요오도메탄-D3을 제거한다. 하나의 양태에서, 미반응 요오도메탄-D3을 -50℃ 이상 -40℃ 이하의 범위의 온도에서 진공하에 증발시킨다. 하나의 양태에서, 정제수를 반응 (ii) 혼합물에 가한다. 하나의 양태에서, 그후 유기 상을 분리한다. 하나의 양태에서, 수성 상을 유기 용매로 추출한다. 하나의 양태에서, 유기 용매는 디에틸 에테르, 또는 메틸-t-부틸 에테르일 수 있지만, 이에 제한되지 않는다. 하나의 양태에서, 유기 용매는 메틸-t-부틸 에테르이다. 하나의 양태에서, 합한 유기 상을 진공하에 농축시키고 용매를 적합한 알콜로 교체한다. 하나의 양태에서, 알콜은 메탄올, 에탄올, 또는 이소프로판올 중 적어도 하나이지만, 이에 제한되지 않는다. 하나의 양태에서, 알콜은 메탄올이다. 하나의 양태에서, 정제수를 서서히 가하고 혼합물을 냉각시킨다. 하나의 양태에서, 화학식 III의 화합물을 여과에 의해 분리하고, 정제수로 세척하고, 건조시킨다.
하나의 양태에서, 반응이 반응 (ii) 혼합물에 대해 완료된 경우, 추가의 n-부틸리튬을 가하여 과량의 요오도메탄-D3을 소모시킨다. 하나의 양태에서, 그후 반응 (ii) 혼합물을 켄칭 시약의 첨가에 의해 켄칭시킨다. 하나의 양태에서, 켄칭 시약은 약산성 용액이다. 하나의 양태에서, 켄칭 시약은 유기 용매이다. 하나의 양태에서, 유기 용매는 메탄올 또는 에탄올일 수 있지만, 이에 제한되지 않는다. 하나의 양태에서, 켄칭 시약은 수성 산이다. 하나의 양태에서, 수성 산은 염산, 황산, 시트르산, 또는 아세트산일 수 있지만, 이에 제한되지 않는다. 하나의 양태에서, 켄칭 시약은 무기 염이다. 하나의 양태에서, 무기 염은 염화암모늄, 중탄산나트륨, 또는 포스페이트 염일 수 있지만, 이에 제한되지 않는다. 하나의 양태에서, 켄칭 시약은 수성 염화암모늄이다. 하나의 양태에서, 그후 정제수를 반응 (ii) 혼합물에 가한다. 하나의 양태에서, 그후 유기 상을 분리한다. 하나의 양태에서, 수성 상을 유기 용매로 추출한다. 하나의 양태에서, 유기 용매는 디에틸 에테르, 또는 메틸-t-부틸 에테르일 수 있지만, 이에 제한되지 않는다. 하나의 양태에서, 유기 용매는 메틸-t-부틸 에테르이다. 하나의 양태에서, 합한 유기 상을 진공하에 농축시키고 용매를 적합한 알콜로 교체한다. 하나의 양태에서, 알콜은 메탄올, 에탄올, 또는 이소프로판올 중 적어도 하나이지만, 이에 제한되지 않는다. 하나의 양태에서, 알콜은 메탄올이다. 하나의 양태에서, 정제수를 서서히 가하고 혼합물을 냉각시킨다. 하나의 양태에서, 화학식 III의 화합물을 여과에 의해 분리하고, 정제수로 세척하고, 건조시킨다.
하나의 양태에서, 화학식 III의 화합물을 메탄올/물로부터 재결정화한다. 하나의 양태에서, 수율은 >70%이고 순도는 >90%이다.
하나의 양태에서, 화학식 III의 화합물은 하이드로브로마이드 염이다.
하나의 양태에서, 화학식 III의 화합물의 하이드로브로마이드 염은 일수화물이다.
하나의 양태에서, 방법은, 반응 (iii)에서, 반응 (ii)로부터의 화학식 III의 O-메틸화 화합물을 화학식 VI의 화합물로 탈메틸화시킴을 추가로 포함한다.
[화학식 VI]
예를 들면, 하나의 양태에서, 화학식 III의 화합물을 적합한 산과 혼합하고 d6-DM-J 수준이 ≤1%로 될 때까지 가열한다. 하나의 양태에서, 화학식 III의 화합물을 적합한 산과 혼합하고 d6-DM-J 수준이 ≤1.5%로 될 때까지 가열한다. 하나의 양태에서, 화학식 III의 화합물을 적합한 산과 혼합하고 d6-DM-J 수준이 ≤2%로 될 때까지 가열한다. 하나의 양태에서, 화학식 III의 화합물을 적합한 산과 혼합하고 d6-DM-J 수준이 ≤2.5%로 될 때까지 가열한다. 하나의 양태에서, 화학식 III의 화합물을 적합한 산과 혼합하고 d6-DM-J 수준이 ≤3%로 될 때까지 가열한다. 하나의 양태에서, 화학식 III의 화합물을 적합한 산과 혼합하고 d6-DM-J 수준이 ≤3.5%로 될 때까지 가열한다. 하나의 양태에서, 화학식 III의 화합물을 적합한 산과 혼합하고 d6-DM-J 수준이 ≤4%로 될 때까지 가열한다. 하나의 양태에서, 화학식 III의 화합물을 적합한 산과 혼합하고 d6-DM-J 수준이 ≤4.5%로 될 때까지 가열한다. 하나의 양태에서, 화학식 III의 화합물을 적합한 산과 혼합하고 d6-DM-J 수준이 ≤5%로 될 때까지 가열한다.
하나의 양태에서, 산은 삼브롬화붕소, 또는 브롬화수소산이지만, 이에 제한되지 않는다. 하나의 양태에서 산은 브롬화수소산이다.
하나의 양태에서, 그후 반응 (iii) 혼합물을 냉각시키고 적합한 염기와 혼합한다. 하나의 양태에서, 염기는 수산화나트륨, 수산화칼륨, 중탄산나트륨, 중탄산칼륨, 탄산나트륨, 탄산칼륨, 수산화칼슘, 탄산이나트륨, 또는 수산화암모늄 중 적어도 하나이지만, 이에 제한되지 않는다. 하나의 양태에서, 염기는 탄산칼륨이다. 하나의 양태에서, 그후 유기 용매를 반응 혼합물에 가한다. 하나의 양태에서, 유기 용매는 메틸렌 클로라이드, 에틸렌 아세테이트, 디에틸 에테르, 테트라하이드로푸란, 또는 2-메틸테트라하이드로푸란 중 적어도 하나이지만, 이에 제한되지 않는다. 하나의 양태에서, 유기 용매는 2-메틸테트라하이드로푸란이다. 하나의 양태에서, 그후 유기 상을 분리하고 정제수로 세척한다. 하나의 양태에서, 합한 수성 상을 유기 용매로 추가로 추출한다. 하나의 양태에서, 유기 용매는 메틸렌 클로라이드, 에틸 아세테이트, 디에틸 에테르, 테트라하이드로푸란, 또는 2-메틸테트라하이드로푸란 중 적어도 하나이지만, 이에 제한되지 않는다. 하나의 양태에서, 유기 용매는 2-메틸테트라하이드로푸란이다. 하나의 양태에서, 그후 합한 유기 상을 진공하에 농축시키고 용매를 비-극성 유기 용매로 교체한다. 하나의 양태에서, 비-극성 유기 용매는 펜탄, 헥산, n-헵탄, 톨루엔, 1,4-디옥산, 또는 디에틸 에테르 중 적어도 하나이지만, 이에 제한되지 않는다. 하나의 양태에서, 비-극성 유기 용매는 n-헵탄이다. 하나의 양태에서, 혼합물을 냉각시키고, 여과하고, 비-극성 유기 용매로 세척하고, 건조시킨다.
하나의 양태에서, 화학식 VI의 화합물에 대한 수율은 >70%이고 순도는 >96%이다.
하나의 양태에서, 방법은, 반응 (iv)에서, 반응 (iii)으로부터의 화학식 VI의 O-탈메틸화 화합물을 -10℃ 이상 10℃ 이하의 범위의 온도에서 염기 및 중수소화 시약의 존재하에 화학식 I의 화합물로 O-메틸화시킴을 추가로 포함한다.
예를 들면, 하나의 양태에서, 화학식 VI의 화합물을 유기 용매와 혼합하고 생성된 용액을 수분 함량에 대해 시험한다. 하나의 양태에서 유기 용매는 비양성자성 용매(예를 들어 디옥산, 디에틸 에테르, 메틸렌 클로라이드)일 수 있지만, 이에 제한되지 않는다. 하나의 양태에서, 유기 용매는 메틸렌 클로라이드, 디옥산, 테트라하이드로푸란, 아세토니트릴, 디메틸 설폭사이드, 디에틸 에테르, 또는 디메틸포름아미드 중 적어도 하나이지만, 이에 제한되지 않는다. 하나의 양태에서, 유기 용매는 디메틸포름아미드이다. 하나의 양태에서, 수분 함량이 >0.05%이면, 건조제를 혼합물에 가하고 교반 후 여과에 의해 제거한다. 하나의 양태에서, 건조제는 상이한 기공 크기를 갖는 분자체이지만, 이에 제한되지 않는다. 하나의 양태에서, 분자체는 3Å 내지 5Å의 기공 크기를 갖는다. 하나의 양태에서, 건조제는 4Å의 기공 크기를 갖는 분자체 분말이다.
하나의 양태에서, O-메틸화는 -10℃ 이상 10℃ 이하의 범위의 온도에서 염기 및 요오도메탄-D3의 존재하에 수행된다. 하나의 양태에서, 염기는 수산화세슘, 수산화나트륨, 수산화칼륨, 탄산나트륨, 탄산칼륨, 수소화나트륨, 나트륨 메톡사이드, 나트륨 t-부톡사이드, 또는 칼륨 t-부톡사이드 중 적어도 하나일 수 있지만, 이에 제한되지 않는다.
하나의 양태에서, O-메틸화는 -3℃ 이상 -1℃ 이하의 범위의 온도에서 염기 및 요오도메탄-D3의 존재하에 수행된다.
하나의 양태에서, 반응 (iv)에서 염기는 탄산칼륨, 수소화나트륨, 나트륨 메톡사이드, 및 칼륨 t-부톡사이드로부터 선택될 수 있다.
하나의 양태에서, 반응 (iv)에서 선택된 염기는 칼륨 t-부톡사이드이다.
하나의 양태에서, O-메틸화는 칼륨 t-부톡사이드의 존재하에 수행된다. 하나의 양태에서, 칼륨 t-부톡사이드를 반응 혼합물 용액에 가하고, 교반 후, 디메틸포름아미드 중의 요오도메탄-D3의 용액을 가한다. 하나의 양태에서, 반응은 화학식 VI의 화합물의 ≤5%가 잔류할 때까지 계속하지만, 더 높은 수준도 허용될 수 있다. 하나의 양태에서, 정제수를 가하고 화학식 I의 화합물을 여과에 의해 분리한다. 하나의 양태에서, 필터 케이크를 물로 세척하고 건조시켜 화학식 I의 화합물을 제공한다.
하나의 양태에서, 화학식 I의 화합물에 대한 수율은 >70%이고 순도는 >96%이다.
하나의 양태에서, 반응 (iv)에서 사용되는 온도는 -10℃ 이상 10℃ 이하의 범위다.
하나의 양태에서, 반응 (iv)에서 사용되는 온도는 -3℃ 이상 -1℃ 이하의 범위다.
하나의 양태에서, 방법의 반응 (v)는 화학식 I의 화합물을 약제학적으로 허용되는 염으로 전환시키는 단계를 추가로 포함한다. 하나의 양태에서, 염은 화학식 IV의 하이드로브로마이드 일수화물 염이다. 하나의 양태에서, 염은 브롬화수소산을 포함하는 용액을 사용하는 결정화에 의해 형성된다.
하나의 양태에서, 반응 (v)에서, 하나 이상의 용액을 0.45㎛ 필터를 사용하여 여과하며 하나 이상의 작업은 Class 100,000 클린룸에서 수행된다. 하나의 양태에서, 정제수 및 화학식 I의 화합물을 반응기에서 혼합한다. 하나의 양태에서, 브롬화수소산 용액을 가한 다음 정제수를 가한다. 하나의 양태에서, 생성된 혼합물을 용액이 형성될 때까지 가열한 다음 결정화가 일어나도록 냉각시킨다. 하나의 양태에서, 혼합물을 입자 크기를 최적화하도록 수 회 사이클을 통해 가열 및 냉각시킨 다음 주위 온도로 냉각시킨다. 하나의 양태에서, 생성물을 여과에 의해 분리하고, 정제수로 세척하고, 건조시켜 화학식 IV의 화합물을 제공한다. 하나의 양태에서, 건조는 30 내지 50℃에서 수행한다. 하나의 양태에서, 건조는 40 내지 45℃에서 수행한다.
하나의 양태에서, 화학식 IV의 화합물에 대한 수율은 약 75%이고 순도는 ≥98%이다.
하나의 양태에서, 본 발명은 또한 다음의 단계를 포함하여 화학식 I의 중수소화 덱스트로메토르판 또는 이의 약제학적으로 허용되는 염의 합성 방법을 제공한다:
(i) 화학식 II의 덱스트로메토르판 화합물의 메톡시 그룹을 화학식 VIII의 화합물로 되도록 O-탈메틸화시킴으로써 화학식 II의 덱스트로메토르판 화합물을 화학식 VII의 화합물로 중수소화시키는 단계;
[화학식 II]
[화학식 VII]
[화학식 VIII]
(ii) -10℃ 이상 10℃ 이하의 범위의 온도에서 염기 및 중수소화 시약의 존재하에 O-메틸화시켜 (i)의 O-탈메틸화 반응 생성물을 화학식 VII의 화합물로 중수소화시키는 단계;
(iii) 화학식 VII의 덱스트로메토르판 화합물의 3급 아민을 화학식 IX의 화합물로 N-탈메틸화시키는 단계; 및
[화학식 IX]
(iv) -90℃ 이상 90℃ 이하의 범위의 온도에서 염기 및 중수소화 시약의 존재하에 N-메틸화시켜 (iii)의 N-탈메틸화 반응 생성물을 화학식 I의 화합물로 중수소화시키는 단계.
하나의 양태에서, 상기 방법은 (i) 화학식 II의 O-메틸화 화합물을 화학식 VIII의 화합물로 O-탈메틸화시킴을 포함한다.
예를 들면, 하나의 양태에서, 화학식 II의 화합물을 적합한 산과 혼합하고 출발 물질(즉, 화학식 II의 화합물) 수준이 ≤1%로 될 때까지 가열한다. 하나의 양태에서, 산은 삼브롬화붕소, 또는 브롬화수소산이지만, 이에 제한되지 않는다. 하나의 양태에서 산은 브롬화수소산이다.
하나의 양태에서, 그후 반응 (i) 혼합물을 냉각시키고 적합한 염기와 혼합한다. 하나의 양태에서, 염기는 수산화나트륨, 수산화칼륨, 중탄산나트륨, 중탄산칼륨, 탄산나트륨, 탄산칼륨, 수산화칼슘, 탄산이나트륨, 또는 수산화암모늄 중 적어도 하나이지만, 이에 제한되지 않는다. 하나의 양태에서, 염기는 탄산칼륨이다. 하나의 양태에서, 그후 유기 용매를 반응 혼합물에 가한다. 하나의 양태에서, 유기 용매는 메틸렌 클로라이드, 에틸 아세테이트, 디에틸 에테르, 테트라하이드로푸란, 또는 2-메틸테트라하이드로푸란 중 적어도 하나이지만, 이에 제한되지 않는다. 하나의 양태에서, 유기 용매는 2-메틸테트라하이드로푸란이다. 하나의 양태에서, 그후 유기 상을 분리하고 정제수로 세척한다. 하나의 양태에서, 합한 유기 상을 유기 용매로 추가로 추출한다. 하나의 양태에서, 유기 용매는 메틸렌 클로라이드, 에틸 아세테이트, 디에틸 에테르, 테트라하이드로푸란, 또는 2-메틸테트라하이드로푸란 중 적어도 하나이지만, 이에 제한되지 않는다. 하나의 양태에서, 유기 용매는 2-메틸테트라하이드로푸란이다. 하나의 양태에서, 그후 합한 유기 상을 진공하에 농축시키고 용매를 유기 용매로 교체한다. 하나의 양태에서, 유기 용매는 비-극성 유기 용매이다. 하나의 양태에서, 비-극성 유기 용매는 펜탄, 헥산, n-헵탄, 톨루엔, 1,4-디옥산, 또는 디에틸 에테르 중 적어도 하나이지만, 이에 제한되지 않는다. 하나의 양태에서, 비-극성 유기 용매는 n-헵탄이다. 하나의 양태에서, 혼합물을 냉각시키고, 여과하고, 비-극성 유기 용매로 세척하고, 건조시켜 화학식 VIII의 화합물을 수득한다. 하나의 양태에서, 화학식 VIII의 화합물에 대한 수율은 >70%이고 순도는 >96%이다.
하나의 양태에서, 상기 방법은 -10℃ 이상 10℃ 이하의 범위의 온도에서 염기 및 중수소화 시약의 존재하에 반응 (i)로부터의 화학식 VIII의 O-탈메틸화 화합물을 화학식 VII의 화합물로 O-메틸화시키는 반응 (ii)를 포함한다.
예를 들면, 하나의 양태에서, 화학식 VIII의 화합물을 유기 용매와 혼합하고 생성된 용액을 수분 함량에 대해 시험한다. 하나의 양태에서 유기 용매는 비양성자성 용매(예를 들어 디옥산, 디에틸 에테르, 메틸렌 클로라이드)일 수 있지만, 이에 제한되지 않는다. 하나의 양태에서, 유기 용매는 메틸렌 클로라이드, 디옥산, 테트라하이드로푸란, 아세토니트릴, 디메틸 설폭사이드, 디에틸 에테르, 또는 디메틸포름아미드 중 적어도 하나이지만, 이에 제한되지 않는다. 하나의 양태에서, 유기 용매는 디메틸포름아미드이다. 하나의 양태에서, 혼합물의 수분 함량이 >0.05%인 경우, 건조제를 혼합물에 첨가하고 교반 후 여과에 의해 제거한다. 하나의 양태에서, 건조제는 상이한 기공 크기를 갖는 분자체이지만, 이에 제한되지 않는다. 하나의 양태에서, 분자체는 3Å 내지 5Å의 기공 크기를 갖는다. 하나의 양태에서, 건조제는 4Å의 기공 크기를 갖는 분자체 분말이다.
하나의 양태에서, O-메틸화 반응은 -10℃ 이상 10℃ 이하의 범위의 온도에서 염기 및 요오도메탄-D3의 존재하에 수행된다. 하나의 양태에서, 염기는 수산화세슘, 수산화나트륨, 수산화칼륨, 탄산나트륨, 탄산칼륨, 수소화나트륨, 나트륨 메톡사이드, 나트륨 t-부톡사이드, 또는 칼륨 t-부톡사이드 중 적어도 하나일 수 있지만, 이에 제한되지 않는다.
하나의 양태에서, O-메틸화 반응은 -3℃ 이상 -1℃ 이하의 범위의 온도에서 염기 및 중수소화 시약의 존재하에 수행된다.
하나의 양태에서, O-메틸화 반응 (ii)에서 사용되는 중수소화 시약은 요오도메탄-D3이다.
하나의 양태에서, 반응 (ii)에서 염기는 탄산칼륨, 수소화나트륨, 나트륨 메톡사이드, 및 칼륨 t-부톡사이드로부터 선택될 수 있다.
하나의 양태에서, 반응 (ii)에 대해 선택된 염기는 칼륨 t-부톡사이드이다.
하나의 양태에서, O-메틸화 반응은 칼륨 t-부톡사이드의 존재하에 수행된다. 하나의 양태에서, 칼륨 t-부톡사이드를 반응 혼합물 용액에 가하고, 교반 후, 디메틸포름아미드 중의 요오도메탄-D3의 용액을 가한다. 하나의 양태에서, 반응은 ≤5%의 화학식 VIII의 화합물이 잔류할 때까지 계속하지만, 더 높은 수준도 허용될 수 있다. 하나의 양태에서, 정제수를 가하고 화학식 VII의 화합물을 여과에 의해 분리한다. 하나의 양태에서, 필터 케이크를 물로 세척하고 건조시켜 화학식 VII의 화합물을 제공한다. 하나의 양태에서, 화학식 VII의 화합물에 대한 수율은 >70%이고 순도는 >96%이다.
하나의 양태에서, 반응 (ii)에서 사용되는 온도는 -10℃ 이상 10℃ 이하의 범위다.
하나의 양태에서, 반응 (ii)에서 사용되는 온도는 -3℃ 이상 -1℃ 이하의 범위다.
하나의 양태에서, N-탈메틸화 반응 (iii)은 시아노겐 할라이드, 아실 할라이드, 및 각종 클로로포르메이트와 같지만 이에 제한되지 않는 일반적으로 알려진 시약을 사용하여 수행될 수 있다. 하나의 양태에서, 아실 할라이드는 아세틸 클로라이드일 수 있지만, 이에 제한되지 않는다. 하나의 양태에서, 클로로포르메이트는 1-클로로에틸 클로로포르메이트, 에틸 클로로포르메이트, 또는 2,2,2-트리클로로에틸 클로로포르메이트 중 적어도 하나일 수 있지만, 이에 제한되지 않는다. 하나의 양태에서, 클로로포르메이트는 1-클로로에틸 클로로포르메이트이다. 하나의 양태에서, 반응 혼합물을 가열하고 화학식 IX의 화합물 또는 이의 약제학적으로 허용되는 염이 수득될 때까지 메탄올을 가함으로써 카바메이트를 후속적으로 제거한다. 하나의 양태에서, N-탈메틸화 반응은 비-극단 온도, 예를 들면, 주위 온도 내지 반응 혼합물의 환류 온도 이하에서 수행된다. 하나의 양태에서, 반응은 더욱 증가된 온도로, 예를 들면, 30℃ 이상 100℃ 이하로 진행될 수 있다. 하나의 양태에서, 온도 범위는 40℃ 이상 90℃ 이하이다. 하나의 양태에서, 온도 범위는 50℃ 이상 80℃ 이하이다. 하나의 양태에서, 온도 범위는 60℃ 이상 70℃ 이하이다.
하나의 양태에서, N-탈메틸화 반응은 습기-비함유 환경을 유지하기 위해 불활성 대기, 예를 들면 질소 또는 아르곤 하에서 수행될 수 있다. 하나의 양태에서, 용매를 제거하여 중간체 카바메이트를 수득할 수 있다. 그후, 이것을 수용액으로 Zn 및 아세트산과 반응시킴으로써 또는 메탄올을 가하고 반응 혼합물을 환류될 때까지 가열함으로써 가수분해시킨다.
하나의 양태에서, N-탈메틸화 반응 (iii)은 반응이 ≥93% 완료될 때까지 1-클로로에틸 클로로포르메이트의 존재하에 수행된다. 하나의 양태에서, 그후 카바메이트 관능기를 메탄올 및 열을 사용하여 제거한다. 하나의 양태에서, N-탈메틸화가 ≥98% 완료될 때 메탄올을 진공을 통해 제거한다. 하나의 양태에서, 남아있는 메탄올의 양은 최대 100ppm이다.
하나의 양태에서, 유기 용매를 반응 (iii) 혼합물에 다시 가하고 용매를 진공하에 제거한다. 하나의 양태에서, 유기 용매는 톨루엔이지만, 이에 제한되지 않는다. 하나의 양태에서, 이러한 과정을 메탄올의 양이 약 100ppm 이하로 될 때까지 반복한다.
하나의 양태에서, 알콜을 반응 (iii) 혼합물에 가하여 불순물을 표적 수준으로 감소시킨다. 하나의 양태에서, 알콜은 이소프로판올이지만, 이에 제한되지 않는다. 하나의 양태에서, 화학식 VII의 화합물의 불순물의 수준은 HPLC에 의해 결정된다.
하나의 양태에서, 화학식 VII의 화합물에 대한 불순물의 표적 수준은 단지 0.5%로 감소된다.
하나의 양태에서, 화학식 VII의 화합물에 대한 불순물 수준은 단지 2.0%로 감소된다.
하나의 양태에서, 추가의 이소프로판올을 반응 (iii)의 생성물에 가하여 불순물을 표적 수준으로 감소시킨다.
하나의 양태에서, 화학식 IX의 화합물 또는 이의 약제학적으로 허용되는 염을 여과에 의해 분리하고 유기 용매로 세정한다. 하나의 양태에서, 유기 용매는 톨루엔이지만, 이에 제한되지 않는다. 하나의 양태에서, 그후 화학식 IX의 화합물 또는 이의 약제학적으로 허용되는 염을 유기 용매의 수준이 ≤3%로 될 때까지 약 50℃에서 건조시킨다. 하나의 양태에서, 화학식 IX의 화합물 또는 이의 약제학적으로 허용되는 염을 유기 용매의 수준이 ≤3%로 될 때까지 약 40℃에서 건조시킨다. 하나의 양태에서, 화학식 IX의 화합물 또는 이의 약제학적으로 허용되는 염을 유기 용매의 수준이 ≤3%로 될 때까지 약 30℃에서 건조시킨다.
하나의 양태에서, 화학식 IX의 화합물 또는 이의 약제학적으로 허용되는 염을 유기 용매의 수준이 ≤2%로 될 때까지 약 40℃에서 건조시킨다. 하나의 양태에서, 화학식 IX의 화합물 또는 이의 약제학적으로 허용되는 염을 유기 용매의 수준이 ≤2%로 될 때까지 약 30℃에서 건조시킨다.
하나의 양태에서, 화학식 IX의 화합물 또는 이의 약제학적으로 허용되는 염을 유기 용매의 수준이 ≤1%로 될 때까지 약 40℃에서 건조시킨다. 하나의 양태에서, 화학식 IX의 화합물 또는 이의 약제학적으로 허용되는 염을 유기 용매의 수준이 ≤1%로 될 때까지 약 30℃에서 건조시킨다.
하나의 양태에서, 반응 (iii)에서 수득된 생성물에 대한 수율은 >70%이고 순도는 약 >90%이다.
하나의 양태에서, 방법은 반응 (iv)에서 반응 (iii)으로부터의 화학식 IX의 N-탈메틸화 화합물 또는 이의 약제학적으로 허용되는 염을 -90℃ 이상 90℃ 이하의 범위의 온도에서 염기 및 중수소화 시약의 존재하에 N-메틸화시켜 화학식 I의 화합물로 중수소화시킴을 포함한다.
하나의 양태에서, 반응 (iv)에서 사용되는 온도는 -80℃ 이상 80℃ 이하, -70℃ 이상 70℃ 이하, -60℃ 이상 60℃ 이하, -50℃ 이상 50℃ 이하, -40℃ 이상 40℃ 이하, -30℃ 이상 30℃ 이하, -20℃ 이상 20℃ 이하, 또는 -10℃ 이상 10℃ 이하의 범위다.
예를 들면, 하나의 양태에서, 반응 (iv)는 화학식 IX의 화합물 또는 이의 약제학적으로 허용되는 염을 유기 용매에 용해시키고 용액을 냉각시킴을 포함한다. 하나의 양태에서, 유기 용매는 에테르(예를 들어, 디에틸 에테르, 디부틸 에테르, 메틸 3급-부틸 에테르), 메틸렌 클로라이드, 디옥산, 또는 테트라하이드로푸란 중 적어도 하나이지만, 이에 제한되지 않는다. 하나의 양태에서, 유기 용매는 테트라하이드로푸란이다. 하나의 양태에서, 저온은 -90℃ 이상 0℃ 이하의 범위다. 하나의 양태에서, 저온은 -85℃ 이상 -5℃ 이하, -75℃ 이상 -15℃ 이하, -65℃ 이상 -25℃ 이하, -55℃ 이상 -35℃ 이하, 또는 -45℃ 이상 -40℃ 이하의 범위다.
하나의 양태에서, 그후 염기를 반응 (iv)에서 가한 다음 중수소화 시약을 가한다.
하나의 양태에서, 중수소화 시약은 요오도메탄-D3일 수 있지만, 이에 제한되지 않는다. 하나의 양태에서, 반응은 적합한 염기 중에서 수행된다. 하나의 양태에서, 적합한 염기는 유기 염기(예를 들어, 트리에틸아민, 디이소프로필에틸아민) 또는 무기 염기(예를 들어, 탄산나트륨, 수산화나트륨, 수산화칼륨)일 수 있지만, 이에 제한되지 않는다.
하나의 양태에서, 반응 (iv)를 위한 염기는 탄산나트륨, 탄산세슘, 탄산칼륨, 중탄산나트륨, 중탄산칼륨, 수산화나트륨, 수산화칼륨, 칼륨 3급-부톡사이드, 수소화나트륨, 알킬리튬(예를 들어, n-부틸리튬, s-부틸리튬, t-부틸리튬, n-헥실리튬), 리튬 아미드(예를 들어, 리튬 디이소프로필아미드, 리튬 헥사메틸데실라지드), 및 3급 유기 아민(예를 들어, 트리메틸아민, 트리에틸아민, 트리이소프로필아민, 디이소프로필에틸아민)으로부터 선택될 수 있지만, 이에 제한되지 않는다.
하나의 양태에서, 반응 (iv)에서 사용되는 3급 유기 아민은 트리에틸아민 또는 디이소프로필에틸아민이다. 하나의 양태에서, 반응 (iv)에서 사용되는 알킬리튬 염기는 n-부틸리튬이다. 하나의 양태에서, 리튬 아미드 염기는 리튬 디이소프로필아미드이다.
하나의 양태에서, 반응 (iv)에서 선택되는 염기는 n-부틸리튬이다.
하나의 양태에서, 반응 (iv)에서 사용되는 염기는 유효량, 즉 단계 (iv)에서 교환 반응을 촉진시키거나 용이하게 하는 임의의 적합한 양 또는 농도로 사용될 수 있다. 예를 들면, 하나의 양태에서, 염기는 0.9 내지 10당량의 양으로 사용된다. 하나의 양태에서, 염기는 2 내지 8당량, 3 내지 7당량, 또는 4 내지 6당량의 양으로 사용된다. 하나의 양태에서, 염기는 1.5 내지 2.5당량의 양으로 사용된다. 하나의 양태에서, 염기는 0.9 내지 1.3당량의 양으로 사용된다.
하나의 양태에서, 반응 (iv)에서 사용되는 중수소화 시약은 요오도메탄-D3이다.
하나의 양태에서, 반응 (iv) 혼합물을 목적하는 전환을 달성하도록 모니터링한다. 하나의 양태에서, 추가 분획의 중수소화 시약을 가하여 출발 물질을 소모시킨다.
하나의 양태에서, 반응 (iv)는 목적하는 N-메틸화가 진행되도록 하는 임의의 적합한 온도에서 수행된다.
하나의 양태에서, 단계 (iv)에서의 온도 범위는 -90℃ 이상 90℃ 이하이다.
하나의 양태에서, 반응 (iv)에서 사용되는 온도는 -90℃ 이상 0℃ 이하의 범위다.
하나의 양태에서, 반응 (iv)에서 사용되는 온도는 -90℃ 이상 -50℃ 이하의 범위다.
하나의 양태에서, 반응 (iv)에서 사용되는 온도는 -80℃ 이상 -70℃ 이하의 범위다.
하나의 양태에서, 그후 반응 (iv)에서 반응 혼합물을 켄칭 시약의 첨가에 의해 켄칭시킨다. 하나의 양태에서, 켄칭 시약은 약산성 용액이다. 하나의 양태에서, 켄칭 시약은 수성 염화암모늄이지만, 이에 제한되지 않는다. 하나의 양태에서, 반응 (iv)에서 수성 염화암모늄을 가하고 혼합물을 감압하에 가온시켜 임의의 남아있는 요오도메탄-D3을 제거한다. 하나의 양태에서, 미반응 요오도메탄-D3을 -50℃ 이상 -40℃ 이하의 범위의 온도에서 진공하에 증발시킨다. 하나의 양태에서, 정제수를 반응 (iv) 혼합물에 가한다. 하나의 양태에서, 그후 유기 상을 분리한다. 하나의 양태에서, 수성 상을 유기 용매로 추출한다. 하나의 양태에서, 유기 용매는 디에틸 에테르, 또는 메틸-t-부틸 에테르일 수 있지만, 이에 제한되지 않는다. 하나의 양태에서, 유기 용매는 메틸-t-부틸 에테르이다. 하나의 양태에서, 합한 유기 상을 진공하에 농축시키고 용매를 적합한 알콜로 교체한다. 하나의 양태에서, 알콜은 메탄올, 에탄올, 또는 이소프로판올 중 적어도 하나이지만, 이에 제한되지 않는다. 하나의 양태에서, 알콜은 메탄올이다. 하나의 양태에서, 정제수를 서서히 가하고 혼합물을 냉각시킨다. 하나의 양태에서, 화학식 I의 화합물을 여과에 의해 분리하고, 정제수로 세척하고, 건조시킨다.
하나의 양태에서, 화학식 I의 화합물을 메탄올/물로부터 재결정화시킨다. 하나의 양태에서, 수율은 >70%이고 순도는 >90%이다.
하나의 양태에서, 방법은 반응 (v)에서 화학식 I의 화합물을 약제학적으로 허용되는 염으로 전환시킴을 포함한다. 하나의 양태에서, 염은 화학식 IV의 하이드로브로마이드 일수화물 염이다. 하나의 양태에서, 염은 브롬화수소산을 포함하는 용액을 사용하는 결정화에 의해 형성된다.
하나의 양태에서, 반응 (v)에서, 하나 이상의 용액을 0.45㎛ 필터를 사용하여 여과하고 하나 이상의 작업을 Class 100,000 클린룸에서 수행한다. 하나의 양태에서, 정제수 및 화학식 I의 화합물을 반응기에서 혼합한다. 하나의 양태에서, 브롬화수소산 용액을 가한 다음 정제수를 가한다. 하나의 양태에서, 생성된 혼합물을 용액이 형성될 때까지 가열한 다음 결정화가 일어나도록 냉각시킨다. 하나의 양태에서, 혼합물을 입자 크기를 최적화하도록 수 회 사이클을 통해 가열 및 냉각시킨 다음 주위 온도로 냉각시킨다. 하나의 양태에서, 생성물을 여과에 의해 분리하고, 정제수로 세척하고, 건조시켜 화학식 IV의 화합물을 제공한다. 하나의 양태에서, 건조는 30 내지 50℃에서 수행한다. 하나의 양태에서, 건조는 40 내지 45℃에서 수행한다.
하나의 양태에서, 화학식 IV의 화합물에 대한 수율은 약 75%이고 순도는 ≥98%이다.
반응식 1 및 2는 화학식 I의 중수소화 덱스트로메토르판로의 예시적인 경로를 보여준다. 반응식 3은 화학식 IV의 화합물로의 예시적인 경로를 보여준다. 반응식 1에 나타낸 바와 같이, 덱스트로메토르판 하이드로브로마이드 일수화물을 초기에 반응 (i)에서 수산화나트륨으로 처리한 다음 1-클로로에틸 클로로포르메이트를 사용하여 아민을 아실화시키고, 이어서 반응 혼합물을 가열하고 d6-DM-J HCl이 수득될 때까지 메탄올을 가함으로써 카바메이트를 제거한다. 그후, 반응 (ii)에서 화합물 d6-DM-J HCl을 n-BuLi의 존재하에 적절하게 중수소화된 요오도메탄으로 N-메틸화시켜 d6-DM-F 또는 화학식 III의 화합물을 수득한다. 반응 (iii)에서 화합물 d6-DM-F 또는 화학식 III의 화합물을 브롬화수소산을 사용하여 O-탈메틸화시켜 알콜 d6-DM-H 또는 화학식 VI의 화합물을 수득한다. 그후, 화합물 d6-DM-H 또는 화학식 VI의 화합물을 반응 (iv)에서, 칼륨 t-부톡사이드의 존재하에, 적절하게 중수소화된 요오도메탄으로 처리하여 d6-DM 유리 염기 또는 화학식 I의 화합물을 수득한다.
반응식 2에 나타낸 바와 같이, 반응 (i)에서 화학식 II의 화합물을 브롬화수소산을 사용하여 O-탈메틸화시켜 화학식 VIII의 알콜을 수득한다. 화학식 VIII의 화합물을 반응 (ii)에서, 칼륨 t-부톡사이드의 존재하에, 적절하게 중수소화된 요오도메탄으로 O-메틸화시켜 화학식 VII의 화합물을 수득한다. 그후, 화학식 VII의 화합물을 반응 (iii)에서 1-클로로에틸 클로로포르메이트를 사용하여 N-아실화한 다음 후속적으로 반응 혼합물을 가열하고 화학식 IX의 화합물이 수득될 때까지 메탄올을 가함으로써 카바메이트를 제거한다. 그후, 반응 (iv)에서 화학식 IX의 화합물을 n-BuLi의 존재하에, 적절하게 중수소화된 요오도메탄으로 N-메틸화시켜 화학식 I의 화합물을 수득한다.
화학식 IV의 화합물의 제조는 반응식 1 또는 2에 나타낸 바와 같이 수득될 수 있는 화학식 I의 화합물을 사용하여 반응식 3을 통해 달성된다. d6-DM 유리 염기의 화합물 또는 화학식 I의 화합물을 물 및 브롬화수소산 용액으로 처리한 다음 가열 및 냉각을 반복하여 d6-DM 하이드로브로마이드 일수화물 또는 화학식 IV의 화합물을 수득한다.
화학식 I의 화합물의 합성을 위한 예시적인 경로가 반응식 1에 나타내어져 있다.
[반응식 1]
화학식 I의 화합물의 합성을 위한 예시적인 또 다른 경로가 반응식 2에 나타내어져 있다.
[반응식 2]
화학식 IV의 화합물의 합성을 위한 예시적인 경로가 반응식 3에 나타내어져 있다.
[반응식 3]
위에 나타낸 특정한 접근법 및 화합물은 제한하는 것으로 의도되지 않는다. 화학식 I 및 IV의 화합물 및 본원의 반응식에 명확히 나타내지 않은 경로내에 있는 것들을 포함한 이들의 합성 전구체를 합성하는 추가의 방법들은 당업계의 통상의 숙련된 화학자들의 의미 내에 있다. 적용 가능한 화합물을 합성하는데 유용한 합성 화학 변환 및 보호 그룹 방법론(보호 및 탈보호)은 당업계에 공지되어 있으며, 예를 들면, 문헌[참조; Larock R, Comprehensive Organic Transformations, VCH Publishers (1989); Greene T W et al., Protective Groups in Organic Synthesis, 3rd Ed., John Wiley and Sons (1999); Fieser L et al., Fieser and Fiesre's Reagents for 유기 Synthesis, John WIley and SOns (1994); and Paquette L, ed., Encyclopedia of Reagents for Organic Synthesis, John Wiley and Sons (1995) 및 이의 후속 판]에 기술된 것들을 포함한다.
조성물
본 발명은 또한 화학식 I의 화합물, 또는 상기 화합물의 약제학적으로 허용되는 염, 용매화물, 또는 수화물을 포함하는 조성물을 제공한다. 하나의 양태에서, 본 발명의 조성물은 약제학적 사용을 위해 제형화되며("약제학적 조성물"), 여기서, 조성물은 약제학적으로 허용되는 담체를 포함한다. 담체(들)는 제형의 다른 성분들과 상용성이며 약제에서 사용되는 양에서 이의 수용자에게 유해하지 않다는 의미에서 "약제학적으로 허용 가능하다". 하나의 양태에서, 조성물은 아주반트를 포함할 수 있다. 하나의 양태에서, 조성물은 비히클을 포함할 수 있다.
하나의 양태에서, 본 발명의 약제학적 조성물에서 사용될 수 있는 약제학적으로 허용되는 담체, 아주반트, 및 비히클은 이온 교환체, 알루미나, 알루미늄 스테아레이트, 레시틴, 혈청 단백질, 예를 들어 사람 혈청 알부민, 완충 물질, 예를 들어 포스페이트, 글리신, 소르브산, 칼륨 소르베이트, 포화 식물성 지방산의 부분 글리세라이드 혼합물, 물, 염 또는 전해질, 예를 들어 프로타민 설페이트, 인산수소이나트륨, 인산수소칼륨, 염화나트륨, 아연 염, 콜로이드성 실리카, 마그네슘 트리실리케이트, 폴리비닐 피롤리돈, 셀룰로스계 물질, 폴리에틸렌 글리콜, 나트륨 카복시메틸셀룰로스, 폴리아크릴레이트, 왁스, 폴리에틸렌-폴리옥시프로필렌-블럭 중합체, 폴리에틸렌 글리콜, 및 라놀린을 포함하지만, 이에 제한되지 않는다.
하나의 양태에서, 경우에 따라, 약제학적 조성물에서 본 발명의 화합물의 용해도 및 생체이용율은 당업계에 널리 공지된 방법에 의해 증진될 수 있다. 한 가지 방법은 제형에서의 지질 부형제의 사용을 포함한다[참조; "Oral Lipid-Based Formulations: Enhancing the Bioavailability of Poorly Water-Soluble Drugs (Drugs and the Pharmaceutical Sciences)," David J. Hauss, ed. Informa Healthcare, 2007; and "Role of Lipid Excipients in Modifying Oral and Parenteral Drug Delivery: Basic Principles and Biological Examples," Kishor M. Wasan, ed. Wiley-Inter-science, 2006].
하나의 양태에서, 생체이용율을 증진시키는 또 다른 공지된 방법은 폴록사머, 예를 들어 LUTROL™ 및 PLURONIC™(BASF Corporation), 또는 에틸렌 옥사이드와 프로필렌 옥사이드의 블럭 공중합체로 임의로 제형화된 본 발명의 화합물의 무정형 형태의 사용이다[미국 특허 제7,014,866호; 및 미국 특허 공보 제2006/0094744호 및 제2006/0079502호 참조].
하나의 양태에서, 본 발명의 약제학적 조성물은 경구(예를 들어, 정제, 서방출 캡슐제, 및 리포솜으로), 직장, 비강, 국소(구강 및 설하 포함), 질, 또는 비경구(피하, 근육내, 정맥내 및 피내 포함) 투여에 적합한 것들을 포함한다. 하나의 양태에서, 본원의 화학식의 화합물은 (예를 들어, 경피 패치 또는 이온영동 기법을 사용하여) 경피 투여된다. 또 다른 제형은 편리하게는 단위 투여형으로 존재할 수 있으며, 약학 분야에 널리 알려진 임의의 방법으로 제조될 수 있다[예를 들면, 참조; Remington's Pharmaceutical Sciences, Mack Publishing Company, Philadelphia, Pa. (17th ed. 1985)].
하나의 양태에서, 이러한 제조방법은 투여하고자 하는 성분을 약제학적으로 허용되는 담체와 같은 분자와 연합시키는 단계를 포함한다. 하나의 양태에서, 조성물은 활성 성분들을 하나 이상의 액체 담체, 리포솜, 또는 미분된 고체 담체와 균일하고 긴밀하게 연합시킨 다음, 경우에 따라, 생성물을 성형함으로써 제조된다.
하나의 양태에서, 화합물은 경구 투여된다. 경구 투여에 적합한 본 발명의 조성물은 예비결정된 양의 활성 성분을 각각 함유하는 캡슐제, 사쉐제, 또는 정제; 산제 또는 과립제; 수성 액체, 또는 비-수성 액체 중의 용액 또는 현탁액; 수중유 액체 에멀젼; 유중수 액체 에멀젼; 리포솜에 충전; 또는 농축괴 등과 같지만 이에 제한되지 않는 이산 단위로서 존재할 수 있다. 하나의 양태에서, 연질 젤라틴 캡슐제는 이러한 현탁액을 담기 위해 유용할 수 있으며, 이것은 화합물 흡수 속도를 유익하게 증가시킬 수 있다.
경구 사용을 위한 정제의 경우에, 일반적으로 사용되는 담체는 락토스 및 옥수수 전분을 포함하지만, 이에 제한되지 않는다. 마그네슘 스테아레이트와 같지만 이에 제한되지 않는 윤활제가 또한 전형적으로 첨가된다. 캡슐 형태로의 경구 투여를 위해, 유용한 희석제는 락토스 및 건조된 옥수수전분을 포함하지만, 이에 제한되지 않는다. 수성 현탁액이 경구 투여되는 경우, 활성 성분은 전형적으로 유화제 및 현탁제와 배합된다. 하나의 양태에서, 경우에 따라, 특정 감미제 및/또는 방향제 및/또는 착색제가 첨가될 수 있다. 하나의 양태에서, 경구 투여에 적합한 조성물은 풍미가 있는 기재, 통상적으로 수크로스 및 아카시아 또는 트라가칸트 중의 성분을 포함하는 로젠지; 및 젤라틴 및 글리세린, 또는 수크로스 및 아카시아와 같은 불활성 기재 중의 활성 성분을 포함하는 캔디(pastille)를 포함하지만, 이에 제한되지 않는다.
하나의 양태에서, 비경구 투여에 적합한 조성물은 산화방지제, 완충제, 세균 발육 저지제 및 제형을 의도된 수용자의 혈액과 등장성으로 만드는 용질을 함유할 수 있는 수성 및 비수성 멸균 주사 용액; 및 현탁제 및 증점제를 포함할 수 있는 수성 및 비수성 멸균 현탁액을 포함하지만, 이에 제한되지 않는다. 하나의 양태에서, 제형은 단위-용량 또는 다중-용량 용기, 예를 들면, 밀봉된 앰풀 및 바이알로 존재할 수 있으며, 사용 직전에 단지 멸균 액체 담체, 예를 들면 주사용수의 첨가를 필요로 하는 동결 건조된(냉동건조된) 조건에서 저장될 수 있다. 하나의 양태에서, 즉석 주사 용액 및 현탁액은 멸균 산제, 과립제 및 정제로부터 제조될 수 있다.
하나의 양태에서, 이러한 주사 용액은, 예를 들면, 멸균 주사 가능한 수성 또는 유성 현탁액의 형태일 수 있다. 이러한 현탁액은 적합한 분산제 또는 습윤제(예를 들면, Tween 80와 같은) 및 현탁제를 사용하여 당업계에 공지된 기술에 따라 제형화될 수 있다. 하나의 양태에서, 멸균 주사 가능한 제제는 또한, 예를 들면, 1,3-부탄디올 중의 용액으로서 비독성의 비경구적으로 허용되는 희석제 또는 용매 중의 멸균 주사 가능한 용액 또는 현탁액일 수 있다. 하나의 양태에서, 사용될 수 있는 허용 가능한 비히클 및 용매 중에는 만니톨, 물, 링거 용액, 및 등장성 염화나트륨 용액이 있지만, 이에 제한되지 않는다. 또한, 멸균 고정유가 용매 또는 현탁 매질로서 통상적으로 사용된다. 이러한 목적을 위해, 합성 모노- 또는 디글리세라이드를 포함하지만, 이에 제한되지 않는 임의의 완하성 고정유가 사용될 수 있다. 지방산, 예를 들어 올레산 및 이의 글리세라이드 유도체는 특히 이들의 폴리옥시에틸화 버전에서, 올리브유 또는 피마자유와 같지만 이에 제한되지 않는 천연의 약제학적으로-허용되는 오일로서, 주사제의 제조에 유용하다. 하나의 양태에서, 이러한 오일 용액 또는 현탁액은 또한 장쇄 알콜 희석제 또는 분산제를 함유할 수 있다.
하나의 양태에서, 본 발명의 약제학적 조성물은 직장 투여를 위해 좌제 형태로 투여될 수 있다. 이러한 조성물은 본 발명의 화합물을 실온에서는 고체이지만 직장 온도에서는 액체여서 직장에서 용융되어 활성 성분을 방출하는 적합한 비자극성 부형제와 혼합함으로써 제조될 수 있다. 이러한 물질은 코코아 버터, 밀납, 및 폴리에틸렌 글리콜을 포함하지만, 이에 제한되지 않는다.
하나의 양태에서, 본 발명의 약제학적 조성물은 비강 에어로졸 또는 흡입에 의해 투여될 수 있다. 이러한 조성물은 약제학적 제형의 분야에 널리 공지된 기술에 따라 제조되며, 벤질 알콜 또는 다른 적합한 보존제, 생체이용율을 증진시키는 흡수 촉진제, 플루오로카본, 및/또는 당업계에 공지된 기타 가용화제 또는 분산제를 사용하여, 염수 중의 용액으로서 제조될 수 있다[예를 들어, 참조: Rabinowitz J D and Zaffaroni A C, Alexza Molecular Delivery Corporation에 양도된 미국 특허 제6,803,031호].
하나의 양태에서, 본 발명의 약제학적 조성물의 국소 투여는 목적하는 치료가 국소 적용에 의해 용이하게 이용 가능한 부위 또는 장기를 포함하는 경우에 사용될 수 있다. 피부에 국소 적용하기 위해, 약제학적 조성물은 담체에 현탁되거나 용해된 활성 성분을 함유하는 적합한 연고로 제형화될 수 있다. 본 발명의 화합물의 국소 투여용 담체는 광유, 액화 석유, 백색 석유, 프로필렌 글리콜, 폴리옥시에틸렌 폴리옥시프로필렌 화합물, 유화 왁스, 및 물을 포함하지만, 이에 제한되지 않는다. 하나의 양태에서, 약제학적 조성물은 담체에 현탁되거나 용해된 활성 화합물을 함유하는 적합한 로션 또는 크림으로 제형화될 수 있다. 하나의 양태에서, 적합한 담체는 광유, 소르비탄 모노스테아레이트, 폴리소르베이트 60, 세틸 에스테르 왁스, 세테아릴 알콜, 2-옥틸도데칸올, 벤질 알콜, 및 물을 포함하지만, 이에 제한되지 않는다. 본 발명의 약제학적 조성물은 또한 직장 좌제 제형에 의해 또는 적합한 관장 제형으로 하부 장관에 국소 적용될 수 있다. 국소-경피 패치 및 이온영동 투여가 또한 본 발명에 포함된다.
하나의 양태에서, 본 치료제의 적용은 관심 부위에 투여되도록 국소일 수 있다. 주사, 카테터, 투관침, 발사체, 플루로닉 겔, 스텐트, 약물 서방출 중합체, 또는 내부 접근을 제공하는 기타 장치의 사용과 같은 다양한 기술들이 관심 부위에 본 조성물을 제공하기 위해 사용될 수 있다.
따라서, 하나의 양태에 따르면, 본 발명의 화합물은 보철, 인공 판막, 혈관 이식편, 스텐트, 또는 카테터와 같은 이식 가능한 의료 장비를 피복하기 위해 조성물에 혼입될 수 있다. 하나의 양태에서, 적합한 피막 및 피복된 이식 가능한 장비의 일반적인 제조는 당업계에 공지되어 있으며 미국 특허 제6,099,562호; 제5,886,026호; 및 제5,304,121호에 예시되어 있다. 피막은 전형적으로 하이드로겔 중합체, 폴리메틸디실록산, 폴리카프로락톤, 폴리에틸렌 글리콜, 폴리락트산, 에틸렌 비닐 아세테이트, 및 이들의 혼합물과 같은 생체적합성 중합체 물질이다. 피막은 임의로, 조성물에 제어 방출 특성을 부여하기 위해 플루오로실리콘, 다당류, 폴리에틸렌 글리콜, 인지질 또는 이들의 조합의 적합한 탑코트에 의해 추가로 덮힐 수 있다. 침습성 장비용 피막은 이들 용어들이 본원에서 사용되는 바와 같이 약제학적으로 허용되는 담체, 아주반트, 또는 비히클의 정의 내에 포함되는 것으로 한다.
하나의 양태에서, 본 발명은 본 발명의 화합물이 하기 장치로부터 방출되고 치료학적으로 활성이 되게 본 발명의 화합물 또는 화합물을 포함하는 조성물로 함입되거나 함유하는 이식 가능한 약물 방출 장치를 제공한다. 이식 가능한 약물 방출 장치는 생분해성 중합체 캡슐 또는 탄환, 비-분해성, 확산성 중합체 캡슐, 및 생분해성 중합체 웨이퍼를 포함하지만, 이에 제한되지 않는다.
하나의 양태에서, 본 발명은 본 발명의 화합물이 치료학적으로 활성이 되는 본 발명의 화합물 또는 화합물을 포함하는 조성물로 피복된 이식 가능한 의료 장비를 제공한다.
대상체로부터의 제거 때문에 장기 또는 조직이 이용 가능한 경우, 이러한 장기 또는 조직을 본 발명의 조성물을 함유하는 매질에 담글 수 있거나, 본 발명의 조성물을 장기 상에 페인팅할 수 있거나, 본 발명의 조성물을 임의의 다른 통상의 방식으로 적용할 수 있다.
하나의 양태에서, 본 발명의 조성물은 제2 치료제를 추가로 포함한다. 제2 치료제는 덱스트로메토르판과 동일한 작용 메카니즘을 갖는 화합물과 투여되는 경우 유리한 특성을 갖는 것으로 알려지거나 이를 입증하는 임의의 화합물 또는 치료제로부터 선택될 수 있다. 하나의 양태에서, 이러한 제제는 미국 특허 제4,316,888호; 제4,446,140호; 제4,694,010호; 제4,898,860호; 제5,166,207호; 제5,336,980호; 제5,350,756호; 제5,366,980호; 제5,863,927호; 제RE38,115호; 제6,197,830호; 제6,207,164호; 제6,583,152호; 및 제7,114,547호; 뿐만 아니라 미국 특허 공보 제2001/0044446호; 제2002/0103109호; 제2004/0087479호; 제2005/0129783호; 제2005/0203125호; 및 제2007/0191411호에 기술된 것들을 포함하지만 이에 제한되지 않는, 덱스트로메토르판과 조합하여 유용한 것으로 지시된 것들을 포함한다.
하나의 양태에서, 제2 치료제는 정서 불안정; 감정 실금; 자폐증; 예를 들어, 치매, 근위축성 측삭 경화증(ALS, 루게릭병으로도 알려져 있음), 알츠하이머병, 파킨슨병, 및 다발성 경화증과 같은 신경성 장애 및 신경변성 질환; 의식 장애 질환; 예를 들어, 뇌졸중, 외상성 뇌 손상, 허혈성 사건, 저산소 사건, 및 신경세포사와 같은 뇌 손상; 예를 들어, 말초 혈관 질환, 심근 경색, 및 죽상경화증과 같은 심혈관 질환; 녹내장; 지발성 안면마비; 당뇨병성 신경병성; 망막병증 질환; 호모시스테인-유도된 아폽토시스에 의해 유발되는 질환 또는 장애; 증가된 수준의 호모시스테인에 의해 유발되는 질환 또는 장애; 만성 통증; 난치성 통증; 신경병성 통증; 교감신경 매개된 통증, 예를 들어 이질통증, 통각과민(hyperpathia), 통각과민증(hyperalgesia), 감각장애, 감각이상, 구심로차단 통증, 및 무감각 통증; 예를 들어, 과민성 대장 증후군을 포함한 위장 기능부전과 관련된 통증; 입 통증; 간질 발작; 이명; 성기능 장애; 난치성 기침; 피부염; 예를 들어, 흥분제, 니코틴, 모르핀, 헤로인, 다른 오피에이트, 암페타민, 코카인, 및 알콜에 대한 중독 또는 의존증과 같은 중독 장애; RTT; 예를 들어, 외전근 경련성 발성장애, 내전근 경련성 발성장애, 근 장력 발성장애, 및 음성 떨림을 포함한 조절되지 않은 후두 근육 경련으로 인한 음성 장애; 메토트렉세이트 신경독증; 및 암에 의해 유발된 피로로부터 선택되지만 이에 제한되지 않는 질환 또는 병태의 치료 또는 예방에 유용한 제제이다.
하나의 양태에서, 제2 치료제는 퀴니딘이다. 퀴니딘 공동-투여는 적어도 두 가지 별개의 유익한 효과를 갖는다. 첫째, 이것은 혈중 순환하는 덱스트로메토르판의 양을 크게 증가시킨다. 게다가, 이것은 또한 보다 지속적이고 예측 가능한 덱스트로메토르판 농도를 생성한다. 덱스트로메토르판 또는 퀴니딘과 덱스트로메토르판의 공동-투여, 및 혈중 혈장 농도에 대한 퀴니딘의 효과에 관한 연구가 특허 문헌에 기술되어 있다(예를 들어, 미국 특허 제5,166,207호, 미국 특허 제5,863,927호, 미국 특허 제5,366,980호, 미국 특허 제5,206,248호, Smith의 미국 특허 제5,350,756호 참조).
퀴니딘이 공동투여를 위해 가장 흔하게 사용되기는 하지만, 문헌[참조; Inaba et al., Drug Metabolism and Disposition. 1985;13:443-447, Forme-Pfister et al., Biochem. Pharmacol. 1988;37:3829-3835, and Broly et al., Biochem. Pharmacol. 1990;39:1045-1053]에 기술된 것들과 같지만 이에 제한되지 않는 다른 제제가 또한 이의 대사를 감소시키기 위해 덱스트로메토르판과 공동-투여될 수 있다. Inaba 등에 보고된 바와 같이, 50 마이크로몰 이하의 Ki 값(미카엘-멘톤 억제 값; Michaelis-Menton inhibition value)을 갖는 CYP2D6 억제제는 노르트립틸린, 클로르프로마진, 돔페리돈, 할로페리돌, 피팜페론, 라베탈롤, 메타프롤롤, 옥스프레놀롤, 프로프라놀롤, 티몰롤, 멕실레틴, 퀴닌, 디펜하이드라민, 아지말린, 로벨린, 파파베린, 및 요힘빈을 포함한다. 특히 강력한 억제 활성을 갖는 화합물은 4 내지 0.33μM 범위의 Ki 값을 갖는 요힘빈, 할로페리돌, 아지말린, 로벨린, 및 피팜페론을 포함한다. 상기 보고된 제제 이외에, Eli Lilly and Co.에 의해 상품명 프로작(Prozac) 하에 판매되는 플루옥세틴이 일부 사람의 혈액에서 덱스트로메토르판 농도를 증가시키는데 효과적인 것으로 또한 밝혀졌다. 게다가, 하기 화합물들 중의 어느 것이 CYP2D6을 억제시키는데 사용될 수 있다: 테르비나핀, 시나칼셋, 부프레노르핀, 이미프라민, 부프로피온, 리토나비르, 세르트랄린, 둘록세틴, 티오리다진, 메토클로프라미드, 파록세틴, 또는 플루복사민. 다른 산화방지제의 투여량은 산화방지제에 따라 다를 것이며, 개별적으로 결정된다.
하나의 양태에서, 본 발명은 본 발명의 화합물 및 상기한 제2 치료제 중의 임의의 하나 이상의 별도의 투여형을 제공하며, 여기서 화합물 및 제2 치료제의 투여형은 서로 연관된다. 용어 "서로 연관된"은 본원에서 사용되는 바와 같이 별도의 투여형이 함께 포장되거나, 별도의 투여형이 판매되어 (서로 24시간 미만 내에, 연속해서 또는 동시에) 함께 투여됨이 쉽게 확인되도록 달리 서로 부착됨을 의미한다. 또 다른 양태에서, 본 발명의 화합물 및 상기한 제2 치료제 중의 임의의 하나 이상은 단일 투여형으로 제공된다.
본 발명의 약제학적 조성물에서, 본 발명의 화합물은 유효량으로 존재한다. 본원에서 사용되는 바와 같이, 용어 "유효량"은, 적절한 투여 섭생으로 투여되는 경우, 치료되는 장애의 중증도, 지속기간, 또는 진행을 감소 또는 개량시키거나, 치료되는 장애의 발달을 예방하거나, 치료되는 장애의 퇴행을 야기하거나, 다른 치료법의 예방적 또는 치료적 효과(들)를 증진 또는 개선시키기에 충분한 양을 가리킨다.
(체표면 제곱 미터당 밀리그램을 기초로 하여) 동물 및 사람에 대한 투여량의 연관성이 문헌[참조; Freireich et al., (1966) Cancer Chemother. Rep 50: 219]에 기술되어 있다. 체표면적은 대상체의 키와 체중으로부터 대략적으로 결정될 수 있다[예를 들어, 참조; Scientific Tables, Geigy Pharmaceuticals, Ardsley, N.Y., 1970, 537].
하나의 양태에서, 본 발명의 화합물의 유효량은 0.4mg 이상 400mg 이하, 4.0mg 이상 350mg 이하, 10mg 이상 90mg 이하, 또는 30mg 이상 45mg 이하에 이를 수 있다. 몇몇 양태에서, 본 발명의 화합물의 유효량은 약 45mg, 34mg, 30mg, 28mg, 24mg, 23mg, 20mg, 18mg, 15mg, 또는 10mg이다.
유효 용량은 또한, 당업계의 숙련가들에 의해 인지되는 바와 같이, 치료되는 질환, 질환의 중증도, 투여의 경로, 대상체의 성별, 연령, 및 일반적인 건강 상태, 부형제 용법, 다른 제제들의 사용과 같은 다른 치료학적 치료와의 공동-용법의 가능성 및 치료 담당의의 판단에 따라 다를 것이다. 하나의 양태에서, 예를 들면, 유효 용량을 선택하기 위한 지침은 덱스트로메토르판에 대한 처방 정보를 참고로 하여 결정될 수 있다.
본 발명의 화합물 및 이를 포함하는 약제학적 조성물은 몰 기준으로 동량의 덱스트로메토르판을 포함하는 약제학적 조성물("몰 등가 덱스트로메토르판 조성물")에 비해 투여한지 12시간 후 보다 긴 소거(clearance)를 입증하고 보다 높은 혈장 노출 수준을 생산한다. 따라서, 하나의 양태에서, 본 발명은 대상체에 대한 투여가 동일 투여 섭생을 사용하여 투여되는 몰 등가 덱스트로메토르판 조성물의 혈장 노출 수준보다 더 큰 혈장 노출 수준을 야기하는, 유효량의 화학식 I의 화합물을 포함하는 약제학적 조성물을 제공한다.
하나의 양태에서, 혈장 노출 수준은 등가 대상체에게 투여되는 몰 등가 덱스트로메토르판 조성물에 의해 생성되는 덱스트로메토르판의 혈장 노출 수준의 적어도 110%, 115%, 120%, 125%, 130%, 135%, 140%, 145%, 또는 그 이상이다.
하나의 양태에서, 본 발명은 10 내지 60mg의 화학식 I의 화합물을 포함하는 약제학적 조성물을 제공하며, 여기서 대상체에 대한 약제학적 조성물의 투여는 250 내지 750나노그램(ng)-시간(h)/mL(AUC) 범위의 혈장 노출 수준을 야기한다.
하나의 양태에서, 본 발명은 10 내지 60mg의 화학식 I의 화합물을 포함하는 약제학적 조성물을 제공하며, 여기서 대상체에 대한 약제학적 조성물의 투여는 400 내지 1600ng-h/mL(AUC) 범위의 혈장 노출 수준을 야기한다.
하나의 양태에서, 본 발명은 10 내지 60mg의 화학식 I의 화합물을 포함하는 약제학적 조성물을 제공하며, 여기서 대상체에 대한 약제학적 조성물의 투여는 500 내지 1500ng-h/mL(AUC) 범위의 혈장 노출 수준을 야기한다.
하나의 양태에서, 본 발명은 10 내지 60mg의 화학식 I의 화합물을 포함하는 약제학적 조성물을 제공하며, 여기서 대상체에 대한 약제학적 조성물의 투여는 1000 내지 1500ng-h/mL(AUC) 범위의 혈장 노출 수준을 야기한다.
하나의 양태에서, 본 발명은 대상체에 대한 투여가 동일 투여 섭생을 사용하여 투여되는 몰 등가 덱스트로메토르판 조성물에 비해 대사산물 생산의 속도 및 양에 있어 감소를 야기하는, 유효량의 화학식 I의 화합물을 포함하는 약제학적 조성물을 제공한다.
하나의 양태에서, 본 발명은 대상체에 대한 투여가 1000ng-h/mL 이하의 중수소화 덱스트로르판 이소토폴로그의 혈장 노출 수준을 야기하는, 10 내지 60mg의 화학식 I의 화합물을 포함하는 약제학적 조성물을 제공한다.
하나의 양태에서, 본 발명은 대상체에 대한 투여가 750ng-h/mL 이하의 중수소화 덱스트로르판 이소토폴로그의 혈장 노출 수준을 야기하는, 10 내지 60mg의 화학식 I의 화합물을 포함하는 약제학적 조성물을 제공한다.
하나의 양태에서, 본 발명은 대상체에 대한 투여가 500ng-h/mL 이하의 중수소화 덱스트로르판 이소토폴로그의 혈장 노출 수준을 야기하는, 10 내지 60mg의 화학식 I의 화합물을 포함하는 약제학적 조성물을 제공한다.
하나의 양태에서, 본 발명은, 대상체에 대한 투여가 동일 투여 섭생으로 투여되는 몰 등가 덱스트로메토르판 조성물로부터 생산된 덱스트로메토르판 및 덱스트로르판의 혈장 노출 수준에 비해 화학식 I의 화합물의 혈장 노출 수준의 증가 및 덱스트로메토르판 대사산물 이소토폴로그, 특히 중수소화 덱스트로르판 이소토폴로그의 혈장 노출 수준의 감소 둘 다를 야기하는, 유효량의 화학식 I의 화합물을 포함하는 약제학적 조성물을 제공한다.
하나의 양태에서, 본 발명은 정상-상태 조건을 통해 12시간마다 대상체에게 반복 투여 후 약 1750 내지 약 250ng-h/mL의 화학식 I의 화합물의 혈장 노출 수준을 제공하는, 10 내지 60mg의 화학식 I의 화합물을 포함하는 약제학적 조성물을 제공한다.
하나의 양태에서, 제2 치료제를 포함하는 약제학적 조성물에 대해, 제2 치료제의 유효량은 바로 그 제제를 사용한 단일요법 섭생에서 정상적으로 사용되는 투여량의 약 0.01% 내지 100% 사이이다. 이러한 제2 치료제의 통상의 단일요법적 투여량은 당업계에 널리 공지되어 있으며[예를 들어, 참조; Wells et al., eds., Pharmacotherapy Handbook, 2nd Edition, Appleton and Lange, Stamford, Conn. (2000); PDR Pharmacopoeia, Tarascon Pocket Pharmacopoeia 2000, Deluxe Edition, Tarascon Publishing, Lorna Linda, Calif. (2000)], 상기 문헌 각각은 전문이 본원에 참고로 포함된다.
하나의 양태에서, 상기 인용된 제2 치료제 중의 일부는 본 발명의 화합물과 상승 작용할 것으로 기대된다. 이것이 일어나는 경우, 제2 치료제 및/또는 본 발명의 화합물의 유효 투여량을 단일요법에서 필요한 양으로부터 감소시키는 것이 가능해질 것이다. 이것은 제2 치료제 또는 본 발명의 화합물의 독성 부작용을 최소화시키고, 효능의 상승작용적 개선, 개선된 투여 또는 사용의 용이성 및/또는 화합물 제조 또는 제형화의 전체 비용 절감의 이점을 갖는다.
따라서, 하나의 양태에서, 본 발명은 대상체에서 화학식 I의 화합물의 정상-상태 조건을 통해 12 내지 24시간마다 반복 투여 후 약 1750 내지 약 250ng-h/mL의 최대 혈장 노출 수준을 제공하는 10 내지 60mg의 화학식 I의 화합물 및 2.5 내지 30mg의 퀴니딘을 포함하는 약제학적 조성물을 제공하며, 여기서 대상체에의 상기 조성물의 투여는 퀴니딘 없이 투여된 동일 몰량의 화학식 I의 화합물에 비해 중수소화 덱스트로르판 이소토폴로그의 혈장 노출 수준의 감소를 야기한다.
하나의 양태에서, 본 발명은 대상체에서 화학식 I의 화합물의 정상-상태 조건을 통해 12 내지 24시간마다 반복 투여 후 약 1750 내지 약 250ng-h/mL의 최대 혈장 노출 수준을 제공하는 10 내지 60mg의 화학식 I의 화합물 및 2.5 내지 20mg의 퀴니딘을 포함하는 약제학적 조성물을 제공하며, 여기서 대상체에의 상기 조성물의 투여는 퀴니딘 없이 투여된 동일 몰량의 화학식 I의 화합물에 비해 중수소화 덱스트로르판 이소토폴로그의 혈장 노출 수준의 감소를 야기한다.
하나의 양태에서, 본 발명은 대상체에서 화학식 I의 화합물의 정상-상태 조건을 통해 12 내지 24시간마다 반복 투여 후 약 1750 내지 약 250ng-h/mL의 최대 혈장 노출 수준을 제공하는 10 내지 60mg의 화학식 I의 화합물 및 2.5 내지 10mg의 퀴니딘을 포함하는 약제학적 조성물을 제공하며, 여기서 대상체에의 상기 조성물의 투여는 퀴니딘 없이 투여된 동일 몰량의 화학식 I의 화합물에 비해 중수소화 덱스트로르판 이소토폴로그의 혈장 노출 수준의 감소를 야기한다.
하나의 양태에서, 본 발명은 대상체에서 화학식 I의 화합물의 정상-상태 조건을 통해 12 내지 24시간마다 반복 투여 후 약 1750 내지 약 250ng-h/mL의 최대 혈장 노출 수준을 제공하는 15 내지 45mg의 화학식 I의 화합물 및 2.5 내지 30mg의 퀴니딘을 포함하는 약제학적 조성물을 제공하며, 여기서 대상체에의 상기 조성물의 투여는 퀴니딘 없이 투여된 동일 몰량의 화학식 I의 화합물에 비해 중수소화 덱스트로르판 이소토폴로그의 혈장 노출 수준의 감소를 야기한다.
하나의 양태에서, 본 발명은 대상체에서 화학식 I의 화합물의 정상-상태 조건을 통해 12 내지 24시간마다 반복 투여 후 약 1750 내지 약 250ng-h/mL의 최대 혈장 노출 수준을 제공하는 20 내지 35mg의 화학식 I의 화합물 및 2.5 내지 30mg의 퀴니딘을 포함하는 약제학적 조성물을 제공하며, 여기서 대상체에의 상기 조성물의 투여는 퀴니딘 없이 투여된 동일 몰량의 화학식 I의 화합물에 비해 중수소화 덱스트로르판 이소토폴로그의 혈장 노출 수준의 감소를 야기한다.
하나의 양태에서, 본 발명은 동량의 퀴니딘을 추가로 포함하고 동일 투여 섭생에 따라 투여되는 몰 등가 덱스트로메토르판 조성물의 투여로부터 야기되는 등가 대상체에서의 덱스트로메토르판 및 덱스트로르판의 뇨 농도에 비해 대상체에서 더 낮은 화학식 I의 화합물의 뇨 농도 및 더 높은 중수소화 덱스트로르판 이소토폴로그의 뇨 농도를 제공하는, 화학식 I의 화합물 및 퀴니딘을 포함하는 약제학적 조성물을 제공한다.
하나의 양태에서, 화학식 I의 화합물 및 퀴니딘은 조합된 용량으로, 또는 별도의 용량으로 투여된다. 별도의 용량은 실질적으로 동시에 투여될 수 있다. 하나의 양태에서, 화학식 I의 화합물 대 퀴니딘의 중량비는 약 1:1 또는 그 미만이다. 몇몇 양태에서, 중량비는 약 1:1, 1:0.95, 1:0.9, 1:0.85, 1:0.8, 1:0.75, 1:0.7, 1:0.65, 1:0.6, 1:0.55 또는 1:0.5 또는 그 미만이다. 마찬가지로, 특정 양태에서, 투여량은 약 1:0.5 미만, 예를 들면, 약 1:0.45, 1:0.4, 1:0.35, 1:0.3, 1:0.25, 1:0.2, 1:0.15, 또는 1:0.1, 1:0.09, 1:0.08, 1:0.07, 1:0.06, 1:0.05, 1:0.04, 1:0.03, 1:0.02, 또는 1:0.01, 또는 그 미만의 화학식 I의 화합물 대 퀴니딘의 중량비를 갖는다. 중량비는, 예를 들면, 약 1:0.75, 약 1:0.68, 약 1:0.6, 약 1:0.56, 약 1:0.5, 약 1:0.44, 약 1:0.39, 약 1:0.38, 약 1:0.31, 약 1:0.30, 약 1:0.29, 약 1:0.28, 약 1:0.27, 약 1:0.26, 약 1:0.25, 약 1:0.24, 약 1:0.23, 약 1:0.22, 약 1:0.21, 약 1:0.20, 약 1:0.19, 약 1:0.18, 약 1:0.17, 1:0.16, 약 1:0.15, 약 1:0.14, 약 1:0.13, 약 1:0.12, 약 1:0.11 및 약 1:0.10일 수 있다. 몇몇 양태에서, 화학식 I의 화합물의 유리 염기 대 퀴니딘의 유리 염기에 대한 중량비는 약 1:0.68, 약 1:0.56, 약 1:0.44, 약 1:0.38이다. 또 다른 양태에서, 화학식 I의 화합물의 유리 염기 대 퀴니딘의 유리 염기에 대한 중량비는 약 1:0.30, 약 1:0.22, 약 1:0.19, 약 1:0.18, 약 1:0.16, 및 약 1:0.15이다.
특정 양태에서, 화학식 I의 화합물 및 퀴니딘이 1:1 또는 그 미만의 중량비로 투여되는 경우, 50mg 미만의 퀴니딘이 임의의 시간에 투여된다. 예를 들면, 특정 양태에서, 퀴니딘은 약 30, 25, 또는 20mg 또는 그 미만으로 투여된다. 또 다른 양태에서, 퀴니딘은 약 15, 10, 9.5, 9.0, 8.5, 8.0, 7.5, 7.0, 6.5, 6.0, 5.5, 5.0, 또는 그 미만으로 투여된다. 또 다른 양태에서, 퀴니딘은 약 5.00, 4.95, 4.90, 4.85, 4.80, 4.75, 4.70, 4.65, 4.60, 4.55, 4.50, 4.45, 4.40, 4.35, 4.30, 4.25, 4.20, 4.15, 4.10, 4.05, 4.00, 3.95, 3.90, 3.85, 3.80, 3.75, 3.70, 3.65, 3.60, 3.55, 3.50, 3.45, 3.40, 3.35, 3.30, 3.25, 3.20, 3.15, 3.10, 3.05, 3.00, 2.95, 2.90, 2.85, 2.80, 2.75, 2.70, 2.65, 2.60, 2.55, 2.50, 2.45, 2.40, 2.35, 2.30, 2.25, 2.20, 2.15, 2.10, 2.05, 2.00, 1.95, 1.90, 1.85, 1.80, 1.75, 1.70, 1.65, 1.60, 1.55, 1.50, 1.45, 1.40, 1.35, 1.30, 1.25, 1.20, 1.15, 1.10, 1.05, 1.00, 0.95, 0.90, 0.85, 0.80, 0.75, 0.70, 0.65, 0.60, 0.55, 0.50, 0.45, 0.40, 0.35, 0.30, 0.25, 0.20, 0.15, 0.10, 또는 0.05, 또는 그 미만으로 투여된다.
몇몇 양태에서, 1:1 또는 그 미만의 중량비의 조합된 용량(또는 동시에 투여되는 별도의 용량)은 대상체에게 1일당 특정 투여량 수준을 제공하도록 1일 1회, 1일 2회, 1일 3회, 1일 4회, 또는 더 빈번하게 투여되며, 예를 들면: 1일당 60mg의 퀴니딘 및 60mg의 화학식 I의 화합물이 2회 용량으로 제공되며, 각 용량은 30mg의 퀴니딘 및 30mg의 화학식 I의 화합물을 함유하거나; 1일당 50mg의 퀴니딘 및 50mg의 화학식 I의 화합물이 2회 용량으로 제공되며, 각 용량은 25mg의 퀴니딘 및 25mg의 화학식 I의 화합물을 함유하거나; 1일당 40mg의 퀴니딘 및 40mg의 화학식 I의 화합물이 2회 용량으로 제공되며, 각 용량은 20mg의 퀴니딘 및 20mg의 화학식 I의 화합물을 함유하거나; 1일당 30mg의 퀴니딘 및 30mg의 화학식 I의 화합물이 2회 용량으로 제공되며, 각 용량은 15mg의 퀴니딘 및 15mg의 화학식 I의 화합물을 함유하거나; 또는 1일당 20mg의 퀴니딘 및 20mg의 화학식 I의 화합물이 2회 용량으로 제공되며, 각 용량은 10mg의 퀴니딘(즉, 약 9mg의 퀴니딘 유리 염기) 및 10mg의 화학식 I의 화합물을 함유한다. 몇몇 양태에서, 조합된 용량 중의 화학식 I의 화합물 및 퀴니딘의 총 양은 1:1 또는 그 미만의 중량비를 유지하면서 적합한 1일 총 투여량을 대상체에게 제공하도록 1일당 투여되는 용량의 횟수에 따라 조절될 수 있다.
몇몇 양태에서, 화학식 I의 화합물 및 퀴니딘의 1일 용량은 30mg의 화학식 IV의 화합물 및 30mg의 퀴니딘 설페이트이다. 또 다른 투여량은, 예를 들면, 15mg의 화학식 IV의 화합물 및 9mg의 퀴니딘 설페이트(대략 11mg의 화학식 I의 화합물 및 대략 7.5mg의 퀴니딘에 상응함); 23mg의 화학식 IV의 화합물 및 9mg의 퀴니딘 설페이트(대략 17mg의 화학식 I의 화합물 및 대략 7.5mg의 퀴니딘에 상응함); 20mg의 화학식 IV의 화합물 및 10mg의 퀴니딘 설페이트(대략 15mg의 화학식 I의 화합물 및 8.3mg의 퀴니딘에 상응함); 30mg의 화학식 IV의 화합물 및 10mg의 퀴니딘 설페이트(대략 22mg의 화학식 I의 화합물 및 8.3mg의 퀴니딘에 상응함)를 포함한다.
30mg의 (분자식 C18H19D6NO.HBr.H2O의) 화학식 IV의 화합물 및 30mg (분자식 (C20H24N2O2)2.H2SO4.2H2O의) 퀴니딘 설페이트의 용량이 투여되거나 사용될 수 있다(대략 22.22mg의 화학식 I의 화합물 및 25mg의 퀴니딘에 상응함). 화학식 I 또는 화학식 IV의 화합물에 대한 또 다른 투여량은, 예를 들면, 24mg의 화학식 IV의 화합물 및 4.75mg의 퀴니딘 설페이트(대략 18mg의 화학식 I의 화합물 및 대략 3.96mg의 퀴니딘에 상응함); 34mg의 화학식 IV의 화합물 및 4.75mg의 퀴니딘 설페이트(대략 25.18mg의 화학식 I의 화합물 및 대략 3.96mg의 퀴니딘에 상응함); 18mg의 화학식 IV의 화합물 및 4.9mg의 퀴니딘 설페이트(대략 13.33mg의 화학식 I의 화합물 및 4.08mg의 퀴니딘에 상응함); 24mg의 화학식 IV의 화합물 및 4.9mg의 퀴니딘 설페이트(대략 17.78mg의 화학식 I의 화합물 및 4.08mg의 퀴니딘에 상응함); 28mg의 화학식 IV의 화합물 및 4.9mg의 퀴니딘 설페이트(대략 20.74mg의 화학식 I의 화합물 및 4.08mg의 퀴니딘에 상응함); 30mg의 화학식 IV의 화합물 및 4.9mg의 퀴니딘 설페이트(대략 22.22mg의 화학식 I의 화합물 및 4.08mg의 퀴니딘에 상응함); 34mg의 화학식 IV의 화합물 및 4.9mg의 퀴니딘 설페이트(대략 25.18mg의 화학식 I의 화합물 및 4.08mg의 퀴니딘에 상응함)를 포함한다.
몇몇 양태에서, 치료법은 더 낮은 일일 용량, 예를 들면 약 1일당 약 2.5 내지 10mg의 퀴니딘과 함께 18 또는 30mg의 화학식 I의 화합물로 시작하며, 대상체의 전반적인 반응에 따라, 약 10 내지 20mg의 퀴니딘, 또는 그 이상의 퀴니딘과 함께 화학식 I의 화합물 약 90mg까지로 증가시킨다. 몇몇 양태에서, 유아, 아동, 65세 이상의 대상체, 및 손상된 신장 또는 간 기능을 갖는 대상체는 초기에 낮은 용량을 제공받으며, 이것은 개별 반응(들) 및 혈액 수준(들)에 기초하여 적정될 수 있다. 일반적으로, 18 내지 90mg의 화학식 I의 화합물 및 4.75 내지 20mg의 퀴니딘의 1일 투여량이 대부분의 대상체에 의해 잘 받아들여진다.
당업계의 숙련가들에게 자명한 바와 같이, 이러한 개시된 범위 외의 투여량이 몇몇 경우에 투여될 수 있다. 또한, 통상의 숙련된 임상의 또는 치료 담당의는 개별 반응을 고려하여 어떻게 및 언제 치료법을 중단, 조절, 또는 종료할지를 알 것임을 주지한다.
치료 방법
하나의 양태에서, 본 발명은 세포를 하나 이상의 화학식 I의 화합물과 접촉시킴을 포함하여, 세포에서 σ2 수용체, N-메틸-D-아스파르테이트(NDMA)의 활성, 또는 α3β4 니코틴성 수용체의 활성을 조절하는 방법을 제공한다.
하나의 양태에서, 본 발명은 화학식 I의 화합물을 투여함으로써, 뇌에서 활성화 수용체로부터 글루타메이트와 같은 신경전달물질을 억제하고/억제하거나 도파민 및 세로토닌의 흡수를 억제하는 방법을 제공한다.
하나의 양태에서, 본 발명은 유효량의 화학식 I의 화합물 또는 이러한 화합물을 포함하는 조성물을 하기 대상체에게 투여하는 단계를 포함하여, 덱스트로메토르판에 의해 유익하게 치료되는 질환을 앓고 있거나 질환에 걸리기 쉬운 대상체를 치료하는 방법을 제공한다. 이러한 질환은 당업계에 널리 공지되어 있으며, 미국 특허 제4,316,888호; 제4,446,140호; 제4,694,010호; 제4,898,860호; 제5,166,207호; 제5,336,980호; 제5,350,756호; 제5,366,980호; 제5,863,927호; 제RE38,115호; 제6,197,830호; 제6,207,164호; 제6,583,152호; 및 제7,114,547호; 뿐만 아니라 미국 특허 공보 제2001/0044446호; 제2002/0103109호; 제2004/0087479호; 제2005/0129783호; 제2005/0203125호; 및 제2007/0191411호에 기술된 것들에 개시되어 있지만, 이에 제한되지 않는다.
하나의 양태에서, 이러한 질환은 정서 불안정; 감정 실금; 자폐증; 예를 들어, 치매, 근위축성 측삭 경화증(ALS, 루게릭병으로도 알려져 있음), 알츠하이머병, 파킨슨병, 및 다발성 경화증과 같은 신경성 장애 및 신경변성 질환; 의식 장애 질환; 예를 들어, 뇌졸중, 외상성 뇌 손상, 허혈성 사건, 저산소 사건, 및 신경세포사와 같은 뇌 손상; 예를 들어, 말초 혈관 질환, 뇌졸중, 심근 경색, 및 죽상경화증과 같은 심혈관 질환; 녹내장; 지발성 안면마비; 당뇨병성 신경병성; 망막병증 질환; 호모시스테인-유도된 아폽토시스에 의해 유발되는 질환 또는 장애; 증가된 수준의 호모시스테인에 의해 유발되는 질환 또는 장애; 만성 통증; 난치성 통증; 신경병성 통증; 교감신경 매개된 통증, 예를 들어 이질통증, 통각과민, 통각과민증, 감각장애, 감각이상, 구심로차단 통증, 및 무감각 통증; 예를 들어, 과민성 대장 증후군을 포함한 위장 기능부전과 관련된 통증; 입 통증; 간질 발작; 이명; 성기능 장애; 난치성 기침; 피부염; 예를 들어, 흥분제, 니코틴, 모르핀, 헤로인, 다른 오피에이트, 암페타민, 코카인, 및 15 알콜에 대한 중독 또는 의존증과 같은 중독 장애; RTT; 예를 들어, 외전근 경련성 발성장애, 내전근 경련성 발성장애, 근 장력 발성장애, 및 음성 떨림을 포함한 조절되지 않은 후두 근육 경련으로 인한 음성 장애; 메토트렉세이트 신경독증; 및 암에 의해 유발된 피로를 포함하지만, 이에 제한되지 않는다.
하나의 양태에서, 본원에 기술된 치료방법은 또한 대상체가 특정의 명시된 치료를 필요로 하는 것으로 확인되는 것을 포함한다. 이러한 치료를 필요로 하는 대상체를 확인하는 것은 대상체 또는 건강 관리 전문가의 판단으로 이루어질 수 있으며, 주관적(예를 들어 의견) 또는 객관적(예를 들어 검사 또는 진단법에 의해 측정 가능함)일 수 있다.
본원에 기술된 치료방법에서는, 유효량의 화학식 I의 화합물을 포함하는 약제학적 조성물이 대상체에게 투여되어, 동일 투여 섭생을 사용하여 투여되는 몰 등가 덱스트로메토르판 조성물의 혈장 노출 수준보다 큰 혈장 노출 수준을 야기한다. 혈장 노출 수준은 등가 대상체에 투여되는 몰 등가 덱스트로메토르판 조성물에 의해 야기되는 덱스트로메토르판의 혈장 노출 수준의 적어도 110%, 115%, 120%,` 125%, 130%, 135%, 140%, 145%, 또는 그 이상이다.
하나의 양태에서, 본 발명은 10 내지 60mg의 화학식 I의 화합물을 포함하는 약제학적 조성물을 대상체에게 투여함을 포함하여, 이러한 치료를 필요로 하는 대상체에서 질환을 치료하는 방법을 제공하며, 여기서 대상체에 대한 약제학적 조성물의 투여는 250 내지 750 나노그램(ng)-시간(h)/mL(AUC) 범위의 혈장 노출 수준을 야기한다.
하나의 양태에서, 본 발명은 10 내지 60mg의 화학식 I의 화합물을 포함하는 약제학적 조성물을 대상체에게 투여함을 포함하여, 이러한 치료를 필요로 하는 대상체에서 질환을 치료하는 방법을 제공하며, 여기서 대상체에 대한 약제학적 조성물의 투여는 400 내지 1600ng-h/mL(AUC) 범위의 혈장 노출 수준을 야기한다.
하나의 양태에서, 본 발명은 10 내지 60mg의 화학식 I의 화합물을 포함하는 약제학적 조성물을 대상체에게 투여함을 포함하여, 이러한 치료를 필요로 하는 대상체에서 질환을 치료하는 방법을 제공하며, 여기서 대상체에 대한 약제학적 조성물의 투여는 500 내지 1500ng-h/mL(AUC) 범위의 혈장 노출 수준을 야기한다.
하나의 양태에서, 본 발명은 10 내지 60mg의 화학식 I의 화합물을 포함하는 약제학적 조성물을 대상체에게 투여함을 포함하여, 이러한 치료를 필요로 하는 대상체에서 질환을 치료하는 방법을 제공하며, 여기서 대상체에 대한 약제학적 조성물의 투여는 1000 내지 1500ng-h/mL(AUC) 범위의 혈장 노출 수준을 야기한다.
하나의 양태에서, 본 발명은 동일 투여 섭생을 사용하여 투여되는 몰 등가 덱스트로메토르판 조성물에 비해 대사산물 생산의 속도 및 양을 감소시키기에 효과적인 양의 화학식 I의 화합물을 포함하는 약제학적 조성물을 대상체에게 투여함을 포함하여, 이러한 치료를 필요로 하는 대상체에서 질환을 치료하는 방법을 제공한다.
하나의 양태에서, 본 발명은 대상체에 대한 투여가 1000ng-h/mL 이하의 중수소화 덱스트로르판 이소토폴로그의 혈장 노출 수준을 야기하는, 10 내지 60mg의 화학식 I의 화합물을 포함하는 약제학적 조성물을 대상체에게 투여함을 포함하여, 이러한 치료를 필요로 하는 대상체에서 질환을 치료하는 방법을 제공한다.
하나의 양태에서, 본 발명은 대상체에 대한 투여가 750ng-h/mL 이하의 중수소화 덱스트로르판 이소토폴로그의 혈장 노출 수준을 야기하는, 10 내지 60mg의 화학식 I의 화합물을 포함하는 약제학적 조성물을 대상체에게 투여함을 포함하여, 이러한 치료를 필요로 하는 대상체에서 질환을 치료하는 방법을 제공한다.
하나의 양태에서, 본 발명은 대상체에 대한 투여가 500ng-h/mL 이하의 중수소화 덱스트로르판 이소토폴로그의 혈장 노출 수준을 야기하는, 10 내지 60mg의 화학식 I의 화합물을 포함하는 약제학적 조성물을 대상체에게 투여함을 포함하여, 이러한 치료를 필요로 하는 대상체에서 질환을 치료하는 방법을 제공한다.
하나의 양태에서, 본 발명은 대상체에 대한 투여가 동일 투여 섭생으로 투여되는 몰 등가 덱스트로메토르판 조성물로부터 야기된 덱스트로메토르판 및 덱스트로르판의 혈장 노출 수준에 비해 화학식 I의 화합물의 혈장 노출 수준의 증가, 및 덱스트로메토르판 대사산물 이소토폴로그, 특히 중수소화 덱스트로르판 이소토폴로그의 혈장 노출 수준의 감소 둘 다를 야기하는, 10 내지 60mg의 화학식 I의 화합물을 포함하는 약제학적 조성물을 대상체에게 투여함을 포함하여, 이러한 치료를 필요로 하는 대상체에서 질환을 치료하는 방법을 제공한다.
하나의 양태에서, 본 발명은 정상-상태 조건을 통해 12시간마다 대상체에게 반복 투여 후 약 1750 내지 약 250ng-h/mL의 화학식 I의 화합물의 혈장 노출 수준을 제공하는, 10 내지 60mg의 화학식 I의 화합물을 포함하는 약제학적 조성물을 대상체에게 투여함을 포함하여, 이러한 치료를 필요로 하는 대상체에서 질환을 치료하는 방법을 제공한다.
하나의 양태에서, 상기 치료방법 중의 어느 것은 대상체에게 하나 이상의 제2 치료제를 공동-투여하는 추가의 단계를 포함한다. 제2 치료제의 선택은 덱스트로메토르판과의 공동-투여를 위해 유용한 것으로 알려진 임의의 제2 치료제로부터 이루어질 수 있다. 제2 치료제의 선택은 또한 치료하고자 하는 특정 질환 또는 병태에 따라 좌우된다. 본 발명의 방법에서 사용될 수 있는 제2 치료제의 예는 본 발명의 화합물 및 제2 치료제를 포함하는 병용 조성물에서 사용하기 위해 위에 제시된 것들이다.
하나의 양태에서, 본 발명의 병용요법은 화학식 I의 화합물, 또는 이러한 화합물, 및 퀴니딘 설페이트를 포함하는 조성물을 이를 필요로 하는 대상체에게 공동-투여함을 포함한다.
용어 "공동-투여되는"은 본원에서 사용되는 바와 같이 제2 치료제가 (상기한 바와 같은 본 발명의 화합물 및 제2 치료제를 포함하는 본 발명의 조성물과 같은) 단일 투여형의 일부로서 또는 별도의, 다중 투여형으로서 본 발명의 화합물과 함께 투여될 수 있음을 의미한다. 하나의 양태에서, 추가의 제제는 본 발명의 화합물의 투여 전에, 연속해서, 또는 투여 후에 투여될 수 있다. 이러한 병용요법 치료에서, 본 발명의 화합물과 제2 치료제(들) 둘 다는 통상의 방법으로 투여된다. 대상체에게 본 발명의 화합물 및 제2 치료제 둘 다를 포함하는 본 발명의 조성물의 투여는 동일한 그 치료제, 임의의 다른 제2 치료제, 또는 임의의 본 발명의 화합물을 치료 과정 동안 다른 시간에 상기 대상체에게 별도 투여함을 배제하지 않는다.
이러한 제2 치료제의 유효량은 당업계의 숙련가들에게 널리 공지되어 있으며 투약에 대한 지침은 본원에 참고된 특허 및 공개 특허 출원, 뿐만 아니라 문헌[참조; Wells et al., eds., Pharmacotherapy Handbook, 2nd Edition, Appleton and Lange, Stamford, Conn. (2000); PDR Pharmacopoeia, Tarascon Pocket Pharmacopoeia 2000, Deluxe Edition, Tarascon Publishing, Lorna Linda, Calif. (2000), 및 다른 의학 교재]에서 찾아볼 수 있다. 그러나, 제2 치료제의 최적 유효량 범위를 결정하는 것은 당업계의 숙련가의 권한 내에 있다.
본 발명의 하나의 양태에서, 제2 치료제가 대상체에게 투여되는 경우, 본 발명의 화합물의 유효량은 제2 치료제가 투여되지 않는 경우의 이의 유효량보다 적다. 또 다른 양태에서, 제2 치료제의 유효량은 본 발명의 화합물이 투여되지 않는 경우 이의 유효량보다 적다. 이러한 방식으로, 어느 하나의 제제의 고 용량과 관련된 원치않는 부작용이 최소화될 수 있다. 다른 가능한 이점(개선된 투여 섭생 및/또는 약물 비용 절감을 포함하지만 이에 제한되지 않음)은 당업계의 숙련가들에게 자명할 것이다.
하나의 양태에서, 본 발명은 화학식 I의 화합물 단독 또는 상기한 제2 치료제 중의 하나 이상과 함께 대상체에서 상기 제시된 질환, 장애, 또는 증상의 치료 또는 예방을 위한 단일 조성물로서 또는 별도의 투여형으로서의 약제의 제조에 있어서의 용도를 제공한다. 하나의 양태에서, 본 발명은 대상체에서 본원에 기술된 질환, 장애, 또는 증상의 치료 또는 예방을 위한 화학식 I의 화합물의 용도를 제공한다.
따라서, 하나의 양태에서, 본 발명은 조성물이 정상-상태 조건을 통해 12 내지 24시간마다 반복 투여 후 대상체에서 약 1750 내지 약 250ng-h/mL의 화학식 I의 화합물의 최대 혈장 노출 수준을 제공하도록, 10 내지 60mg의 화학식 I의 화합물 및 2.5 내지 30mg의 퀴니딘을 공동-투여함을 포함하여, 이러한 치료를 필요로 하는 대상체에서 질환을 치료하는 방법을 제공하며, 여기서 대상체에의 상기 조성물의 투여는 퀴니딘 없이 투여되는 동일 몰량의 화학식 I의 화합물에 비해 중수소화 덱스트로르판 이소토폴로그의 혈장 노출 수준의 감소를 야기한다.
따라서, 하나의 양태에서, 본 발명은 조성물이 정상-상태 조건을 통해 12 내지 24시간마다 반복 투여 후 대상체에서 약 1750 내지 약 250ng-h/mL의 화학식 I의 화합물의 최대 혈장 노출 수준을 제공하도록, 10 내지 60mg의 화학식 I의 화합물 및 2.5 내지 20mg의 퀴니딘을 공동-투여함을 포함하여, 이러한 치료를 필요로 하는 대상체에서 질환을 치료하는 방법을 제공하며, 여기서 대상체에의 상기 조성물의 투여는 퀴니딘 없이 투여되는 동일 몰량의 화학식 I의 화합물에 비해 중수소화 덱스트로르판 이소토폴로그의 혈장 노출 수준의 감소를 야기한다.
따라서, 하나의 양태에서, 본 발명은 조성물이 정상-상태 조건을 통해 12 내지 24시간마다 반복 투여 후 대상체에서 약 1750 내지 약 250ng-h/mL의 화학식 I의 화합물의 최대 혈장 노출 수준을 제공하도록, 10 내지 60mg의 화학식 I의 화합물 및 2.5 내지 10mg의 퀴니딘을 공동-투여함을 포함하여, 이러한 치료를 필요로 하는 대상체에서 질환을 치료하는 방법을 제공하며, 여기서 대상체에의 상기 조성물의 투여는 퀴니딘 없이 투여되는 동일 몰량의 화학식 I의 화합물에 비해 중수소화 덱스트로르판 이소토폴로그의 혈장 노출 수준의 감소를 야기한다.
따라서, 하나의 양태에서, 본 발명은 조성물이 정상-상태 조건을 통해 12 내지 24시간마다 반복 투여 후 대상체에서 약 1750 내지 약 250ng-h/mL의 화학식 I의 화합물의 최대 혈장 노출 수준을 제공하도록, 15 내지 45mg의 화학식 I의 화합물 및 2.5 내지 30mg의 퀴니딘을 공동-투여함을 포함하여, 이러한 치료를 필요로 하는 대상체에서 질환을 치료하는 방법을 제공하며, 여기서 대상체에의 상기 조성물의 투여는 퀴니딘 없이 투여되는 동일 몰량의 화학식 I의 화합물에 비해 중수소화 덱스트로르판 이소토폴로그의 혈장 노출 수준의 감소를 야기한다.
따라서, 하나의 양태에서, 본 발명은 조성물이 정상-상태 조건을 통해 12 내지 24시간마다 반복 투여 후 대상체에서 약 1750 내지 약 250ng-h/mL의 화학식 I의 화합물의 최대 혈장 노출 수준을 제공하도록, 20 내지 35mg의 화학식 I의 화합물 및 2.5 내지 30mg의 퀴니딘을 공동-투여함을 포함하여, 이러한 치료를 필요로 하는 대상체에서 질환을 치료하는 방법을 제공하며, 여기서 대상체에의 상기 조성물의 투여는 퀴니딘 없이 투여되는 동일 몰량의 화학식 I의 화합물에 비해 중수소화 덱스트로르판 이소토폴로그의 혈장 노출 수준의 감소를 야기한다.
따라서, 하나의 양태에서, 본 발명은 조성물이 동량의 퀴니딘을 추가로 포함하고 동일 투여 섭생에 따라 투여되는 몰 등가 덱스트로메토르판 조성물의 투여로부터 야기되는 등가 대상체에서의 덱스트로메토르판 및 덱스트로르판의 뇨 농도에 비해 대상체에서 더 낮은 화학식 I의 화합물의 뇨 농도 및 더 높은 중수소화 덱스트로르판 이소토폴로그의 뇨 농도를 제공하도록, 화학식 I의 화합물 및 퀴니딘을 공동-투여함을 포함하여, 이러한 치료를 필요로 하는 대상체에서 질환을 치료하는 방법을 제공한다.
본 발명은 하기 실시예를 참고로 하여 추가로 이해될 수 있다. 본원에 제공된 교시사항에 접근할 수 있는 당업계의 통상의 숙련가들은 본 발명의 범위내에 드는 등가물의 추가의 개질, 적용, 양태, 및 치환을 인지할 것이다. 하기 실시예는 단지 예시 목적을 위해 의도되며 어떠한 방식으로든 본 발명의 범위를 제한하는 것으로 해석되어서는 안된다. 게다가, 본원에 사용된 섹션 제목은 단지 조직적 목적을 위한 것이며 기술된 주제를 제한하는 것으로 해석되어서는 안된다.
실시예
1
화학식 I의 화합물의 합성. 아래에 기술된 각각의 반응들 및 번호가 붙은 중간체들은 위의 반응식 1에서 상응하는 반응 및 중간체를 가리킨다.
반응 (i) (중간체 d6-DM-J 하이드로클로라이드 ): 톨루엔(13.2L, 12v) 중의 데트로메토르판 하이드로브로마이드(1.1kg, 2.97mol, 1.0eq)의 용액을 수성 수산화나트륨(1M 농도)과 혼합하였다. 교반 후, 유기 상을 분리하고, 중성 pH로 되도록 물로 세척하고, 공비 건조시켰다. 1-클로로에틸 클로로포르메이트(0.552kg, 3.86mol, 1.3eq)를 용액에 가하고 혼합물을 전환이 ≥93%로 될 때까지 교반하였다. 혼합물을 65 내지 70℃로 가열하고 메탄올(2.09kg, 1.9kg/kg)을 서서히 도입하였다. 가열을 반응 전환이 ≥98%로 될 때까지 계속하였다. 반응 혼합물을 냉각시키고 메탄올 수준이 NMT 100ppm으로 감소될 때까지 진공하에 농축시켰다. 톨루엔(4.0L, 3.6v)을 가하고 혼합물을 다시 진공하에 농축시켰다. 이 과정을 잔류 메탄올 수준이 약 100ppm 이하로 될 때까지 계속하였다. 이소프로판올을 가하고 혼합물을 가열하고 냉각시켰다. 불순물 d6-DM-JA 및 덱스트로메토르판의 수준은 HPLC에 의해 측정하였다(표적 수준은 d6-DM-JA의 경우 NMT 0.5% 및 덱스트로메토르판의 경우 NMT 2.0%이었다). 고체 d6-DM-J HCl을 여과에 의해 분리하고 톨루엔의 분획으로 세정하였다. d6-DM-J HCl을 톨루엔 수준이 ≤1%로 될 때까지 약 40℃에서 건조시켰다. 화합물 d6-DM-J HCl을 98.2%의 순도로 84.2% 수율로 수득하였다.
반응 (ii) (중간체 d6-DM-F): d6-DM-J 하이드로클로라이드(500g, 1.702mol, 1.0eq)를 테트라하이드로푸란에 용해시키고 -80 내지 -70℃로 냉각시켰다. 2.5M n-부틸리튬(1174.5g, 2.5eq)을 가한 다음 요오도메탄-D3(271.3g, 1.872mol, 1.1eq)을 가하였다. 반응 완료를 모니터링하고 d6-DM-J가 소모될 때까지 추가 분획의 요오도메탄-D3(29.6g, 0.204mol, 0.12eq)을 가하였다. 수성 염화암모늄(3000g, 6.0g/g, 20% 농도)을 가하고 혼합물을 감압하에 가온시켜 남은 요오도메탄-D3을 제거하였다. 정제수(1L, 2v)를 가하고, 유기 상을 분리하고, 수성 상을 메틸-t-부틸 에테르로 추출하였다. 합한 유기 상을 진공하에 농축시키고 용매를 메탄올(1L, 2v)로 교체하였다. 정제수(3.5L, 7v)를 서서히 가하고 혼합물을 냉각시켰다. d6-DM-F를 여과에 의해 분리하고, 정제수로 세척하고, 건조시켜 화학식 III의 화합물을 제공하였다. d6-DM-F를 메탄올/물로부터 재결정화하였다. 수득된 수율은 84.5%이고 순도는 98.9%이었다.
반응 (iii) (중간체 d6 -DM-H): d6-DM-F(2576g, wt=83.0%, 7.791mol, 1.0eq)를 브롬화수소산(9608g, 3.73g/g)과 혼합하고 d6-DM-F 수준이 ≤1%로 될 때까지 90 내지 95℃로 가열하였다. 냉각된 혼합물을 수성 탄산칼륨(20% 농도)과 혼합하고 2-메틸테트라하이드로푸란(38.6L, 15v)을 가하였다. 유기 상을 분리하고 정제수로 세척하였다. 합한 수성 상을 2-메틸 테트라하이드로푸란으로 추출하였다. 합한 유기 상을 진공하에 농축시키고 용매를 n-헵탄으로 교체하였다. 혼합물을 냉각시키고, 여과하고, n-헵탄으로 세척하고, 건조시켰다. 화합물 d6-DM-H를 78.8% 수율로 99.0%의 순도로 수득하였다.
반응 (iv) (중간체 d6 -DM 유리 염기): d6-DM-H(748.7g, wt=93.5%, 2.6883mol, 1.0eq)를 디메틸포름아미드(8.12L, 11.6v)와 혼합하고 생성된 용액을 수분 함량에 대해 시험하였다. 수분 함량이 >0.05%이면, 분자체 분말(4A)을 가하고 교반 후 여과에 의해 제거하였다. 칼륨 t-부톡사이드(362.0g, 3.226mol, 1.2eq)를 용액에 가하고 교반 후, 디메틸포름아미드 중의 요오도메탄-D3(448.1g, 3.092mol, 1.15eq)의 용액을 가하였다. ≤5%의 d6-DM-H가 남을 때까지 반응을 계속하였다. 정제수를 가하고 d6-DM 유리 염기를 여과에 의해 분리하였다. 필터 케이크를 물로 세척하고 건조시켜 화학식 I의 화합물을 제공하였다. 화학식 I의 화합물을 78.9% 수율로 99.3%의 순도로 수득하였다.
실시예 2
화학식 IV의 화합물의 합성. 아래에 기술된 각각의 반응들 및 번호가 붙은 중간체들은 위의 반응식 3에서 상응하는 반응 및 중간체를 가리킨다.
반응 (v) (d6-DM 하이드로브로마이드 일수화물 ): 모든 용액을 0.45μm 필터를 사용하여 여과하고 모든 작업을 Class 100,000 클린룸에서 수행하였다. 정제수(1.1L, 4v) 및 d6-DM 유리 염기(277.4g, 1.00mol)를 반응기에서 혼합하였다. 브롬화수소산 용액(48% 농도, 177.0g, 1.05mol)을 가한 다음 정제수(0.28L, 1v)를 가하였다. 생성된 혼합물을 용액이 형성될 때까지 65 내지 70℃로 가열한 다음 냉각시켜 결정화가 일어나도록 하였다. 혼합물을 입자 크기를 최적화하도록 수 회 사이클을 통해 가열 및 냉각시킨 다음 주위 온도로 냉각시켰다. 생성물을 여과에 의해 분리하고, 정제수로 세척하고, 40 내지 45℃에서 건조시켜 화학식 IV의 화합물을 제공하였다. 화학식 IV의 화합물을 85.0% 수율로 99.6%의 순도로 수득하였다.
Claims (25)
- (i) 화학식 II의 덱스트로메토르판 화합물을, N-탈메틸화시킨 후에, -90℃ 이상 90℃ 이하의 범위의 온도에서 염기 및 요오도메탄-D3의 존재하에 N-메틸화시켜, 화학식 III의 화합물로 중수소화시키는 단계:
[화학식 II]
[화학식 III]
; 및
(ii) 상기 화학식 III의 화합물을, O-탈메틸화시킨 후에, -10℃ 이상 10℃ 이하의 범위의 온도에서 염기 및 요오도메탄-D3의 존재하에 O-메틸화시켜, 화학식 I의 화합물로 중수소화시키는 단계를 포함하는, 화학식 I의 중수소화 덱스트로메토르판 또는 이의 약제학적으로 허용되는 염의 합성 방법.
[화학식 I]
- 제1항에 있어서, 단계 (i)에서 사용되는 상기 염기가 탄산나트륨, 탄산세슘, 탄산칼륨, 중탄산나트륨, 중탄산칼륨, 수산화나트륨, 수산화칼륨, 칼륨 3급-부톡사이드, 수소화나트륨, n-부틸리튬, 리튬 디이소프로필아미드, 및 3급 유기 아민으로부터 선택되는, 방법.
- (i) 화학식 II의 덱스트로메토르판 화합물을, N-탈메틸화시킨 후에, -90℃ 이상 90℃ 이하의 범위의 온도에서 염기 및 요오도메탄-D3의 존재하에 N-메틸화시켜, 화학식 III의 화합물로 중수소화시키는 단계:
[화학식 II]
[화학식 III]
; 및
(ii) 상기 화학식 III의 화합물을, O-탈메틸화시킨 후에, -10℃ 이상 10℃ 이하의 범위의 온도에서 염기 및 요오도메탄-D3의 존재하에 O-메틸화시켜, 화학식 I의 화합물로 중수소화시키는 단계를 포함하는 방법에 의해 제조되는, 99% 이상의 순도를 갖는 고순도 d6-덱스트로메토르판(d6-DM).
[화학식 I]
- (i) 화학식 II의 덱스트로메토르판 화합물의 3급 아민을 N-탈메틸화시켜 화학식 V의 N-탈메틸화 화합물을 수득하는 단계:
[화학식 II]
[화학식 V]
;
(ii) 상기 화학식 V의 N-탈메틸화 화합물을 -90℃ 이상 90℃ 이하의 범위의 온도에서 염기 및 요오도메탄-D3의 존재하에 N-메틸화시켜 화학식 III의 화합물로 중수소화시키는 단계:
[화학식 III]
;
(iii) 상기 화학식 III의 화합물의 메톡시 그룹을 화학식 VI의 화합물로 되도록 O-탈메틸화시키는 단계:
[화학식 VI]
; 및
(iv) 상기 화학식 VI의 O-탈메틸화 화합물을 -10℃ 이상 10℃ 이하의 범위의 온도에서 염기 및 요오도메탄-D3의 존재하에 O-메틸화시켜 화학식 I의 화합물로 중수소화시키는 단계를 포함하는, 화학식 I의 중수소화 덱스트로메토르판의 합성 방법.
[화학식 I]
- 제5항에 있어서, 단계 (i)의 상기 N-탈메틸화가 1-클로로에틸 클로로포르메이트의 존재하에 수행되는, 방법.
- 제5항에 있어서, 단계 (iii)의 O-탈메틸화가 브롬화수소산의 존재하에 수행되는, 방법.
- 제5항에 있어서, 단계 (ii)에서 사용되는 상기 염기가 탄산나트륨, 탄산세슘, 탄산칼륨, 중탄산나트륨, 중탄산칼륨, 수산화나트륨, 수산화칼륨, 칼륨 3급-부톡사이드, 수소화나트륨, n-부틸리튬, 리튬 디이소프로필아미드, 및 3급 유기 아민으로부터 선택되는, 방법.
- (i) 화학식 II의 덱스트로메토르판 화합물의 3급 아민을 N-탈메틸화시켜 화학식 V의 N-탈메틸화 화합물을 수득하는 단계:
[화학식 II]
[화학식 V]
;
(ii) 상기 화학식 V의 N-탈메틸화 화합물을 -90℃ 이상 90℃ 이하의 범위의 온도에서 염기 및 요오도메탄-D3의 존재하에 N-메틸화시켜 화학식 III의 화합물로 중수소화시키는 단계:
[화학식 III]
;
(iii) 상기 화학식 III의 화합물의 메톡시 그룹을 화학식 VI의 화합물로 되도록 O-탈메틸화시키는 단계:
[화학식 VI]
; 및
(iv) 상기 화학식 VI의 O-탈메틸화 화합물을 -10℃ 이상 10℃ 이하의 범위의 온도에서 염기 및 요오도메탄-D3의 존재하에 O-메틸화시켜 화학식 I의 화합물로 중수소화시키는 단계를 포함하는 방법에 의해 제조되는, 99% 이상의 순도를 갖는 고순도 d6-덱스트로메토르판(d6-DM). - 제11항에 있어서, 단계 (i)에서 사용되는 염기가 탄산칼륨, 수소화나트륨, 나트륨 메톡사이드, 및 칼륨 t-부톡사이드로부터 선택되는, 방법.
- 제12항에 있어서, 염기가 칼륨 t-부톡사이드인, 방법.
- 제13항에 있어서, 단계 (i)에서 사용되는 온도가 -3℃ 이상 -1℃ 이하의 범위인, 방법.
- 제11항에 있어서, 단계 (ii)에서 사용되는 염기가 탄산나트륨, 탄산세슘, 탄산칼륨, 중탄산나트륨, 중탄산칼륨, 수산화나트륨, 수산화칼륨, 칼륨 3급-부톡사이드, 수소화나트륨, n-부틸리튬, 리튬디이소프로필아미드, 및 3급 유기 아민으로부터 선택되는, 방법.
- 제11항에 있어서, 상기 N-탈메틸화가 1-클로로에틸 클로로포르메이트의 존재하에 수행되는, 방법.
- (i) 화학식 II의 덱스트로메토르판 화합물을, O-탈메틸화시킨 후에, -10℃ 이상 10℃ 이하의 범위의 온도에서 염기 및 요오도메탄-D3의 존재하에 O-메틸화시켜, 화학식 VII의 화합물로 중수소화시키는 단계:
[화학식 II]
[화학식 VII]
; 및
(ii) 상기 화학식 VII의 화합물을 N-탈메틸화시킨 후에, -90℃ 이상 90℃ 이하의 범위의 온도에서 염기 및 요오도메탄-D3의 존재하에 N-메틸화시켜, 화학식 I의 화합물로 중수소화시키는 단계를 포함하는 방법에 의해 제조되는, 99% 이상의 순도를 갖는 고순도 d6-덱스트로메토르판(d6-DM).
[화학식 I]
- (i) 화학식 II의 덱스트로메토르판 화합물의 메톡시 그룹을 화학식 VIII의 화합물로 되도록 O-탈메틸화시키는 단계:
[화학식 II]
[화학식 VIII]
;
(ii) 상기 화학식 VIII의 O-탈메틸화 화합물을 -10℃ 이상 10℃ 이하의 범위의 온도에서 염기 및 요오도메탄-D3의 존재하에 O-메틸화시켜 화학식 VII의 화합물로 중수소화시키는 단계:
[화학식 VII]
;
(iii) 상기 화학식 VII의 덱스트로메토르판 화합물의 3급 아민을 화학식 IX의 화합물로 되도록 N-탈메틸화시키는 단계:
[화학식 IX]
; 및
(iv) 상기 화학식 IX의 N-탈메틸화 화합물을 -90℃ 이상 90℃ 이하의 범위의 온도에서 염기 및 요오도메탄-D3의 존재하에 N-메틸화시켜, 화학식 I의 화합물로 중수소화시키는 단계를 포함하는, 화학식 I의 중수소화 덱스트로메토르판의 합성 방법.
[화학식 I]
- 제19항에 있어서, 단계 (iii)의 상기 N-탈메틸화가 1-클로로에틸 클로로포르메이트의 존재하에 수행되는, 방법.
- 제19항에 있어서, 단계 (i)의 상기 O-탈메틸화가 브롬화수소산의 존재하에 수행되는, 방법.
- 제19항에 있어서, 단계 (iv)에서 사용되는 상기 염기가 탄산나트륨, 탄산세슘, 탄산칼륨, 중탄산나트륨, 중탄산칼륨, 수산화나트륨, 수산화칼륨, 칼륨 3급-부톡사이드, 수소화나트륨, n-부틸리튬, 리튬 디이소프로필아미드, 및 3급 유기 아민으로부터 선택되는, 방법.
- 제19항에 있어서, 단계 (ii)에서 사용되는 상기 염기가 탄산칼륨, 수소화나트륨, 나트륨 메톡사이드, 및 칼륨 t-부톡사이드로부터 선택되는, 방법.
- (i) 화학식 II의 덱스트로메토르판 화합물의 메톡시 그룹을 화학식 VIII의 화합물로 되도록 O-탈메틸화시키는 단계:
[화학식 II]
[화학식 VIII]
;
(ii) 상기 화학식 VIII의 O-탈메틸화 화합물을 -10℃ 이상 10℃ 이하의 범위의 온도에서 염기 및 요오도메탄-D3의 존재하에 O-메틸화시켜 화학식 VII의 화합물로 중수소화시키는 단계:
[화학식 VII]
;
(iii) 상기 화학식 VII의 덱스트로메토르판 화합물의 3급 아민을 화학식 IX의 화합물로 되도록 N-탈메틸화시키는 단계:
[화학식 IX]
; 및
(iv) 상기 화학식 IX의 N-탈메틸화 화합물을 -90℃ 이상 90℃ 이하의 범위의 온도에서 염기 및 요오도메탄-D3의 존재하에 N-메틸화시켜 화학식 I의 화합물로 중수소화시키는 단계를 포함하는 방법에 의해 제조되는, 99% 이상의 순도를 갖는 고순도 d6-덱스트로메토르판(d6-DM).
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020237002014A KR20230017361A (ko) | 2016-07-04 | 2017-07-03 | 중수소화 덱스트로메토르판의 합성 방법 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN2016088414 | 2016-07-04 | ||
| CNPCT/CN2016/088414 | 2016-07-04 | ||
| PCT/US2017/040623 WO2018009488A1 (en) | 2016-07-04 | 2017-07-03 | Methods for the synthesis of deuterated dextromethorphan |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020237002014A Division KR20230017361A (ko) | 2016-07-04 | 2017-07-03 | 중수소화 덱스트로메토르판의 합성 방법 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20190026003A true KR20190026003A (ko) | 2019-03-12 |
| KR102491214B1 KR102491214B1 (ko) | 2023-01-26 |
Family
ID=59351125
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020247001612A KR20240013845A (ko) | 2016-07-04 | 2017-07-03 | 중수소화 덱스트로메토르판의 합성 방법 |
| KR1020237002014A KR20230017361A (ko) | 2016-07-04 | 2017-07-03 | 중수소화 덱스트로메토르판의 합성 방법 |
| KR1020197003589A KR102491214B1 (ko) | 2016-07-04 | 2017-07-03 | 중수소화 덱스트로메토르판의 합성 방법 |
Family Applications Before (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020247001612A KR20240013845A (ko) | 2016-07-04 | 2017-07-03 | 중수소화 덱스트로메토르판의 합성 방법 |
| KR1020237002014A KR20230017361A (ko) | 2016-07-04 | 2017-07-03 | 중수소화 덱스트로메토르판의 합성 방법 |
Country Status (8)
| Country | Link |
|---|---|
| US (5) | US10730841B2 (ko) |
| EP (4) | EP3478664B1 (ko) |
| JP (4) | JP7061079B2 (ko) |
| KR (3) | KR20240013845A (ko) |
| CN (2) | CN115215801A (ko) |
| ES (2) | ES2840078T3 (ko) |
| PT (2) | PT3478664T (ko) |
| WO (1) | WO2018009488A1 (ko) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN114340608B (zh) * | 2020-07-20 | 2023-10-31 | 深圳信立泰药业股份有限公司 | 一种药物组合物及其应用 |
| CN112358446B (zh) * | 2020-11-30 | 2022-09-20 | 天津阿尔塔科技有限公司 | 一种稳定同位素标记的盐酸曲托喹酚的合成方法 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2008137474A1 (en) * | 2007-05-01 | 2008-11-13 | Concert Pharmaceuticals Inc. | Morphinan compounds |
Family Cites Families (31)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4316888A (en) | 1980-04-15 | 1982-02-23 | Nelson Research & Development Co. | Method and composition of reducing pain |
| US4446140A (en) | 1981-12-10 | 1984-05-01 | Nelson Research & Development Company | Method and composition for treating mouth pain |
| US4694010A (en) | 1985-08-16 | 1987-09-15 | New York University | Anticonvulsant compositions and method |
| US4898860A (en) | 1985-08-16 | 1990-02-06 | New York University | Anticonvulsant composition and method |
| US4806543A (en) | 1986-11-25 | 1989-02-21 | Board Of Trustees Of The Leland Stanford Junior University | Method and compositions for reducing neurotoxic injury |
| US5304121A (en) | 1990-12-28 | 1994-04-19 | Boston Scientific Corporation | Drug delivery system making use of a hydrogel polymer coating |
| US5206248A (en) | 1992-03-27 | 1993-04-27 | Smith Richard A | Method for reducing emotional lability |
| US5350756A (en) | 1991-06-17 | 1994-09-27 | Smith Richard A | Use of a cytochrome oxidase inhibitor to increase the cough-suppressing activity of dextromorphan |
| US5366980A (en) | 1991-06-17 | 1994-11-22 | Smith Richard A | Use of dextromethorphan and an oxidase inhibitor to treat dermatitis |
| US5166207A (en) | 1991-06-17 | 1992-11-24 | Neurotherapeutics, Inc. | Method for enhancing the systemic delivery of dextromethorphan for the treatment of neurological disorders |
| US5336980A (en) | 1992-12-10 | 1994-08-09 | Leopold Kostal Gmbh & Co. | Apparatus and method for controlling a windshield wiping system |
| US5716981A (en) | 1993-07-19 | 1998-02-10 | Angiogenesis Technologies, Inc. | Anti-angiogenic compositions and methods of use |
| AU8071894A (en) | 1994-09-22 | 1996-04-09 | Jonathan M Licht | Compositions useful for the preparation of medicines for treating a variety of intractable disorders |
| US6099562A (en) | 1996-06-13 | 2000-08-08 | Schneider (Usa) Inc. | Drug coating with topcoat |
| US6197830B1 (en) | 1995-09-22 | 2001-03-06 | Bruce M. Frome | Method for achieving relief from sympathetically mediated pain |
| CH690817A5 (de) | 1996-09-03 | 2001-01-31 | Flachsmann Ag Emil | Verfahren zur Herstellung eines stabilen, homogenen, von Folgeprodukten freien oder nahezu freien Extraktes. |
| GB9925962D0 (en) | 1999-11-02 | 1999-12-29 | Novartis Ag | Organic compounds |
| AU4517201A (en) | 1999-12-08 | 2001-06-18 | Vanderbilt University | Modulation of in vivo glutamine and glycine levels in the treatment of autism |
| US20050129783A1 (en) | 2001-04-19 | 2005-06-16 | Mccleary Edward L. | Composition and method for treatment of neurophysiological conditions and maintenance of neurophysiological health |
| US6780871B2 (en) | 2001-01-29 | 2004-08-24 | Albany Medical College | Methods and compositions for treating addiction disorders |
| US6583152B2 (en) | 2001-04-30 | 2003-06-24 | Dexgen Pharmaceuticals, Inc. | Composition for reducing the risk or progression of cardiovascular diseases |
| US20040087479A1 (en) | 2001-04-30 | 2004-05-06 | Sosnowski Robert E. | Composition and method for reducing the risk or progression of cardiovascular, glaucoma, tardive dyskinesia and other diseases |
| IL158306A0 (en) | 2001-05-03 | 2004-05-12 | Hoffmann La Roche | Pharmaceutical dosage form of amorphous nelfinavir mesylate |
| US6737042B2 (en) | 2001-05-24 | 2004-05-18 | Alexza Molecular Delivery Corporation | Delivery of drug esters through an inhalation route |
| TWI326214B (en) | 2002-07-17 | 2010-06-21 | Avanir Pharmaceuticals Inc | Pharmaceutical compositions comprising dextromethorphan and quinidine for the treatment of neurological disorders |
| US20060094744A1 (en) | 2004-09-29 | 2006-05-04 | Maryanoff Cynthia A | Pharmaceutical dosage forms of stable amorphous rapamycin like compounds |
| US20070191411A1 (en) | 2004-10-07 | 2007-08-16 | Smith Richard A | Enhancement of impaired motor and mental functions, using dextromethorphan and oxidase enzyme inhibitor |
| US7114547B2 (en) | 2005-01-11 | 2006-10-03 | Sullivan Michael R | Casting ring |
| GB2438400A (en) * | 2006-05-25 | 2007-11-28 | Alpharma Aps | N-Demethylation of 14-hydroxy morphinans with alpha-chloroethyl chloroformate |
| CN102197037B (zh) * | 2008-09-19 | 2015-02-18 | 康塞特医药品公司 | 吗啡喃(morphinan)化合物 |
| WO2010062692A1 (en) * | 2008-10-30 | 2010-06-03 | Concert Pharmaceuticals Inc. | Combination of morphinan compounds and antidepressant for the treatment of pseudobulbar affect, neurological diseases, intractable and chronic pain and brain injury |
-
2017
- 2017-07-03 EP EP17740223.7A patent/EP3478664B1/en active Active
- 2017-07-03 EP EP22181650.7A patent/EP4122919A1/en active Pending
- 2017-07-03 PT PT177402237T patent/PT3478664T/pt unknown
- 2017-07-03 KR KR1020247001612A patent/KR20240013845A/ko active Application Filing
- 2017-07-03 CN CN202210796632.8A patent/CN115215801A/zh active Pending
- 2017-07-03 EP EP24151458.7A patent/EP4335500A2/en active Pending
- 2017-07-03 JP JP2018568436A patent/JP7061079B2/ja active Active
- 2017-07-03 WO PCT/US2017/040623 patent/WO2018009488A1/en unknown
- 2017-07-03 US US16/312,439 patent/US10730841B2/en active Active
- 2017-07-03 PT PT202037040T patent/PT3825307T/pt unknown
- 2017-07-03 ES ES17740223T patent/ES2840078T3/es active Active
- 2017-07-03 ES ES20203704T patent/ES2925277T3/es active Active
- 2017-07-03 CN CN201780052018.8A patent/CN109641849B/zh active Active
- 2017-07-03 EP EP20203704.0A patent/EP3825307B1/en active Active
- 2017-07-03 KR KR1020237002014A patent/KR20230017361A/ko active Application Filing
- 2017-07-03 KR KR1020197003589A patent/KR102491214B1/ko active IP Right Grant
-
2020
- 2020-06-24 US US16/910,353 patent/US10865187B2/en active Active
- 2020-11-11 US US17/095,026 patent/US11845731B2/en active Active
-
2022
- 2022-02-04 JP JP2022016351A patent/JP7312284B2/ja active Active
-
2023
- 2023-07-07 JP JP2023112142A patent/JP2023123851A/ja active Pending
- 2023-11-08 US US18/388,041 patent/US20240067608A1/en active Pending
- 2023-12-26 US US18/395,979 patent/US20240124402A1/en active Pending
-
2024
- 2024-01-15 JP JP2024003725A patent/JP2024029239A/ja active Pending
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2008137474A1 (en) * | 2007-05-01 | 2008-11-13 | Concert Pharmaceuticals Inc. | Morphinan compounds |
Also Published As
| Publication number | Publication date |
|---|---|
| ES2925277T3 (es) | 2022-10-14 |
| EP3478664A1 (en) | 2019-05-08 |
| EP4335500A2 (en) | 2024-03-13 |
| JP7061079B2 (ja) | 2022-04-27 |
| EP4122919A1 (en) | 2023-01-25 |
| US10865187B2 (en) | 2020-12-15 |
| US10730841B2 (en) | 2020-08-04 |
| JP7312284B2 (ja) | 2023-07-20 |
| JP2022058905A (ja) | 2022-04-12 |
| US20210061765A1 (en) | 2021-03-04 |
| US20240124402A1 (en) | 2024-04-18 |
| EP3825307B1 (en) | 2022-08-03 |
| US11845731B2 (en) | 2023-12-19 |
| CN115215801A (zh) | 2022-10-21 |
| JP2024029239A (ja) | 2024-03-05 |
| EP3478664B1 (en) | 2020-12-02 |
| US20200317618A1 (en) | 2020-10-08 |
| EP3825307A1 (en) | 2021-05-26 |
| CN109641849B (zh) | 2022-06-14 |
| US20240067608A1 (en) | 2024-02-29 |
| JP2019523239A (ja) | 2019-08-22 |
| US20190241525A1 (en) | 2019-08-08 |
| ES2840078T3 (es) | 2021-07-06 |
| KR102491214B1 (ko) | 2023-01-26 |
| KR20230017361A (ko) | 2023-02-03 |
| WO2018009488A1 (en) | 2018-01-11 |
| PT3825307T (pt) | 2022-08-26 |
| PT3478664T (pt) | 2020-12-28 |
| KR20240013845A (ko) | 2024-01-30 |
| JP2023123851A (ja) | 2023-09-05 |
| CN109641849A (zh) | 2019-04-16 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP2522667B1 (en) | Morphinan compounds | |
| US20240124402A1 (en) | Methods for the synthesis of deuterated dextromethorphan | |
| US9447108B2 (en) | Deuterated morphine derivatives | |
| EP3357923B1 (en) | Morphinan compounds | |
| EP3632916B1 (en) | Morphinan compounds | |
| AU2018204333A1 (en) | Morphinan compounds |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant |