KR20180002618A - 항균 펩티드 및 이의 사용방법 - Google Patents
항균 펩티드 및 이의 사용방법 Download PDFInfo
- Publication number
- KR20180002618A KR20180002618A KR1020177030183A KR20177030183A KR20180002618A KR 20180002618 A KR20180002618 A KR 20180002618A KR 1020177030183 A KR1020177030183 A KR 1020177030183A KR 20177030183 A KR20177030183 A KR 20177030183A KR 20180002618 A KR20180002618 A KR 20180002618A
- Authority
- KR
- South Korea
- Prior art keywords
- antimicrobial
- amino acid
- composition according
- lys
- pharmaceutical composition
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/10—Peptides having 12 to 20 amino acids
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/10—Antimycotics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
- A61P33/02—Antiprotozoals, e.g. for leishmaniasis, trichomoniasis, toxoplasmosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/04—Linear peptides containing only normal peptide links
- C07K7/06—Linear peptides containing only normal peptide links having 5 to 11 amino acids
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/04—Linear peptides containing only normal peptide links
- C07K7/08—Linear peptides containing only normal peptide links having 12 to 20 amino acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Epidemiology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Gastroenterology & Hepatology (AREA)
- Communicable Diseases (AREA)
- Oncology (AREA)
- Immunology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Tropical Medicine & Parasitology (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Peptides Or Proteins (AREA)
- Medicinal Preparation (AREA)
- Materials For Medical Uses (AREA)
Abstract
본 발명의 양상들은 항균 활성을 가지는 펩티드에 관한 것이다. 특정 양상들에서, 본 발명은 효능있는 항균 활성, 광범위한 항균 활성, 및/또는 그 외 항생제-내성 미생물, 또는 균막에 의해 보호되는 미생물을 사멸시키는 능력을 가지는 펩티드에 관한 것이다.
Description
관련 출원에 대한 상호 참조
35 U.S.C. § 119 (e)에 따라, 본 출원은 2015년 3월 23일 출원된 미국 가특허 출원 제 62/137,206호에 대한 우선권의 이익을 주장하며, 이 출원 내용은 본 출원에 온전히 참고문헌으로 포함된다.
발명의 분야
본 발명은 일반적으로 항균 활성을 가진 펩티드에 관한 것이다. 보다 특히, 본 발명은 효능있는 항균 활성, 광범위한 항-균 활성, 및/또는 그 외 항생제-내성 세균, 또는 균막에 의해 보호되는 세균을 사멸시키는 능력을 가지는 펩티드에 관한 것이다.
발명의 배경
항생제 내성은 주요한 건강 문제이다. 이는 어느 정도는 의약 분야에서 뿐만 아니라 농업 및 축산업 분야에서의 광범위한 항생제 사용에 기인한다. 이러한 남용은, 감염되기 쉬운 유기체들을 사멸시키지만 또한 항생제 내성 세균에 대한 편향된 선택을 강하게 생성하여 왔다. 생성된 균주들은 면역체계가 약화된 개인들에게 특수한 문제를 야기시킨다. 또한, 이들 균주들은 입원 중인 환자들에게 더욱더 심각한 문제를 나타낸다.
알려져있는 많은 세균 균주들은 유전된 항생제 내성을 나타내는 것 이외에도, 균막으로 공지되어 있는 복합체 연합으로 존재할 수 있다. 균막의 구조는 항생제 노출에 대한 물리적 장벽을 구성한다. 균막은 조직, 특히, 만성 상처 그리고 의학적 이식물, 가령, 유치 카테터, 인공 장기 등의 내부에서 그리고 조직 상에서 형성할 수 있는데, 여기서 균막은 과감한 치료를 요하는 전신 감염을 유발할 가능성이 있다. 자유(free) 형태 및 균막 형태 모두에서 항생제에 내성인 유기체에 대해 활성인 물질이 시급히 필요하다.
세균에 대한 유기체의 자연 방어의 일부로서, 곤충, 양서류, 포유류, 및 인간을 비롯한 많은 유기체들은 항균 펩티드를 생성한다. 이러한 펩티드는 화학적으로 다양하다. 일부는 세균 세포막을 침투하여 이를 파괴함으로써 작용하는 것으로 보인다. 그 외에는 세균의 세포 과정들에 영향을 미친다. 많은 펩티드에서 숙주 세포들에 우선하여 세균을 표적으로 하는 상당한 선택성이 관찰된다. 유감스럽게도, 항균 펩티드를 생성한 숙주는 많은 항생제 내성 세균 균주들을 비롯한 광범위한 미생물 제제를 효과적으로 제거할 수 없다. 그러므로 숙주의 항균 방어를 증가시킬 수 있는 항균 펩티드가 바람직하다.
발명의 요약
특정 구체예들에서, 본 발명은 항균 펩티드를 제공한다. 이러한 펩티드는 항-세균, 항-진균, 및/또는 항-원충 활성을 가질 수 있다. 이 펩티드는 종래의 항생제에 내성을 띠는 미생물 균주들을 사멸시키는 능력을 가질 수 있다. 특정 구체예들에서, 본 발명의 항균 펩티드는 미생물 균막으로서 성장하는 미생물 (예컨대, 세균)을 사멸시킬 수 있다.
특정 구체예들에서, 본 발명의 항균 펩티드는 특정한 미생물 막 구역들에 대한 친화도를 생성하는 전체 양이온 전하, 소수성, 부피, 및 질량과 결부된 양친매성 구조를 가진다. 그러므로 항균 펩티드는 최소한 하나의 양친매성 구역을 포함할 수 있다. 양친매성 구역은 세균막에 결합하기에 적합한 양이온 표면을 포함할 수 있다. 항균 펩티드는 두 개의 양친매성 구역들을 포함할 수 있는데, 이 구역들은 세번째 구역, 가령, 버블(bubble) 구역 또는 베타-턴(beta-turn)에 의해 함께 결합되어 있다. 특정 구체예들에서, 이러한 두 개의 양친매성 구역들은 이종이량체 또는 동종이량체로서 이량체화할 수 있다. 활성, 약물역학 또는 임상적 응용에 중요한 유사 특성들을 개선시키기 위해 본 발명에서는 하나의 펩티드 내지 또다른 펩티드간의 다양한 도메인 교환 또는 펩티드 내 도메인들의 중복을 고려한다.
본 발명의 항균 펩티드는 아미노산 잔기들을 포함한다. 특정 구체예들에서, 아미노산 잔기들은 천연 L-아미노산 잔기들이다. 일부 구체예들에서, 항균 펩티드 내 하나 이상의 아미노산 잔기들은 비-천연 아미노산 잔기, D-아미노산 잔기, 및/또는 베타 아미노산 잔기일 수 있다. 특정 구체예들에서, 본 발명의 항균 펩티드는 단백질분해에 내성을 띠는 서열을 가진다. 예를 들어, 펩티드는 단백질분해효소 내성을 제공하는, 천연 또는 비-천연의 아미노산 잔기들을 포함할 수 있다.
특정 구체예들에서, 항균 펩티드는 비-포유동물 세포들에 대한 특이성을 가진다. 예를 들어, 펩티드는 숙주 포유동물 (예컨대, 인간) 세포들을 사멸하는 것에 비해 표적 미생물 세포들을 사멸함에 102, 103, 104, 105 배 또는 그 이상 효과적일 수 있다. 본 발명의 일부 항균 펩티드는 한 유형의 미생물 유기체에 대해서는 활성이지만 기타 유형에 대해서는 활성이 아니므로, 항균 선택성을 제공한다. 예를 들어, 본 발명의 특정 펩티드는 항생제-내성인 표적 세균을 사멸시킬 수 있으나 그 외 세균의 균주들, 특히, 공생 세균 (예컨대, 포유류, 가령, 인간의 장 내강에 통상적으로 살고 있는 세균)에 대해서는 최소한의 영향을 미칠 수 있다.
일부 구체예들에서, 본 발명은 조성물, 특히, 제약학적 조성물을 제공하는데, 이는 하나 이상의 본 발명의 항균 펩티드를 포함한다. 이러한 조성물은 경구 투여, 비경구 투여, 국소 투여용으로 제형화될 수 있다. 경구 전달용으로 제형화된 조성물은, 예를 들어, 장용 코팅을 포함할 수 있는데, 이러한 장용 코팅은 그 안에 내포된 항균 펩티드를 장 그리고 그보다 멀리까지 도달하게 한다. 국소 전달용으로 제형화된 조성물은 내부에 내포된 항균 펩티드의 작용 기간을 연장시키기 위해, 예를 들어, 겔 또는 크림으로 현탁되거나 붕대에 주입될 수 있다. 대안적으로, 본 발명의 항균 펩티드는 감염 예방 수단으로서 의학 장치, 가령, 외과용 기구 및 내재용 의학 장치 (예컨대, 심박조율기, 카테터, 인공 관절 등)의 표면에 코팅될 수 있다.
일부 구체예들에서, 본 발명은 미생물 감염을 치료, 또는 이러한 감염을 예방적으로 방지하는 방법을 제공한다. 이 방법은 하나 이상의 본 발명의 항균 펩티드를 내포하는 조성물을 투여하는 것을 포함할 수 있다. 조성물은 경구, 비경구, 국소 등으로 투여될 수 있다. 경구 또는 비경구 투여는 예를 들어, 전신 감염을 치료하기 위해 사용될 수 있다. 국소 투여는 예를 들어, 상처 또는 화상을 치료하기 위해 사용될 수 있다. 내재용 의학 장치, 가령, 카테터 또는 인공 관절을 필요로하는 환자의 치료를 위해, 치료는 의학 장치를 환자 안에 삽입하기 이전에 하나 이상의 항균 펩티드를 의학 장치에 도포하는 것을 포함할 수 있다. 이 방법은 임의의 광범위한 동물들, 특히 포유류, 가령, 인간, 가축들, 경작용 동물들, 동물원 동물들, 야생 동물들 등을 치료하기 위하여 사용될 수 있다.
도면의 간단한 설명
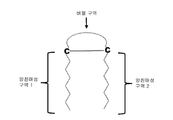
도 1은 본 발명의 한 양상에 따른 헤어핀 펩티드의 그림을 보여준다.
도 2는 병원 감염과 관련하여 선택된 미생물 유기체들에 대한 본 발명의 두 가지 펩티드 ("RP-439" 및 "RP-442"로 표시됨; 각각 서열 번호: 18 및 21)의 활성에 관한 데이터를 항생제 반코마이신과 비교하여 보여준다. 테스트된 병원 감염과 관련된 유기체들은 스타필루코쿠스 아우레우스(Staphylococcus aureus), 슈도모나스 아에루지노사(Pseudomonas Aeruginosa), 및 클로스트리디움 디피실레(Clostridium difficile) 였다.
도 1은 본 발명의 한 양상에 따른 헤어핀 펩티드의 그림을 보여준다.
도 2는 병원 감염과 관련하여 선택된 미생물 유기체들에 대한 본 발명의 두 가지 펩티드 ("RP-439" 및 "RP-442"로 표시됨; 각각 서열 번호: 18 및 21)의 활성에 관한 데이터를 항생제 반코마이신과 비교하여 보여준다. 테스트된 병원 감염과 관련된 유기체들은 스타필루코쿠스 아우레우스(Staphylococcus aureus), 슈도모나스 아에루지노사(Pseudomonas Aeruginosa), 및 클로스트리디움 디피실레(Clostridium difficile) 였다.
발명의 상세한 설명
상기 논의된 바와 같이, 본 명세서에 개시된 발명은 항균 폴리펩티드 및 이러한 항균 폴리펩티드를 미생물 감염을 예방 또는 치료하기 위해 피험체에 투여하는 방법에 관한 것이다.
본 발명을 더욱 상세히 기재하기에 앞서, 본 발명은 기재된 특정 구체예들에 제한되지 않으며, 이러한 구체예들은 물론 변화가능함을 이해하여야 한다. 본 명세서에서 사용되는 용어는 특정 구체예들을 오직 설명하기 위한 것이며, 제한을 하고자 하는 것이 아니므로, 본 발명의 범위는 첨부된 청구범위에 의해서만 제한될 것임을 또한 이해하여야 한다.
수치 범위가 제공될 경우, 내용상 명백히 달리 언급이 없는 한 상기 범위의 상한과 하한 사이의 각 수치는 하한 단위의 10분의 1까지, 그리고 상기 언급된 범위 내의 다른 임의의 언급된 또는 그 사이의 수치는 본 발명에 포함됨을 이해하여야 한다. 이러한 보다 작은 범위들의 상한과 하한은 독립적으로 보다 작은 범위들에 포함될 수 있으며, 또한 언급된 범위에서 한도 값이 명시적으로 제외됨을 조건으로 본 발명에 포함된다. 언급된 범위가 한도값 중 하나 또는 둘 모두를 포함하는 경우, 포함되는 이들 한도값들 중 하나 또는 둘 모두를 제외한 범위 또한 본 발명에 포함된다.
특정 범위들이 본 명세서에 제시되어 있으며 수치 값들에는 용어 "약"이 선행된다. 용어 "약"은 본 명세서에서 이 용어가 선행하는 정확한 숫자, 뿐만 아니라 이 용어가 선행하는 숫자에 근사한 숫자 또는 대략적으로 이러한 숫자에 대한 문언적 뒷받침을 제공하기 위해 사용된다. 한 숫자가 구체적으로 언급된 숫자에 근사한지 또는 대략적으로 그러한 숫자인지를 결정함에 있어서, 언급되지 않은 근사한 또는 대략적인 숫자는, 그 숫자가 제공되는 내용에 있어서, 구체적으로 언급된 숫자의 실질적 균등예를 제공하는 숫자가 될 수 있다.
달리 정의되지 않는 한, 본 명세서에서 사용되는 모든 기술 및 과학 용어는 본 발명이 속하는 해당 분야의 기술자에 의해 일반적으로 이해되는 바와 동일한 의미를 가진다. 본 명세서에는 예시적인 방법들 및 재료들이 기재되어 있으나, 본 명세서에 기재된 것들과 유사하거나 균등한 방법들 및 재료들 또한 본 발명을 실시 또는 테스트함에 사용될 수 있다.
본 명세서에서 인용된 모든 문헌들 및 특허들은 각 개개의 문헌 또는 특허가 구체적으로 그리고 개별적으로 참고문헌으로 포함되는 것으로 기재된 것과 같이 본 명세서에 참고문헌으로 포함되며, 인용되는 문헌들과 관련된 방법들 및/또는 재료들을 개시 및 기재하기 위하여 참고문헌으로 본 명세서에 포함된다. 임의의 문헌 인용은 본 출원의 출원일 이전에 그 문헌의 개시를 알리고자 함이며, 본 발명이 이러한 개시내용을 선행 발명보다 선행시키는 것에 대한 자격이 없음을 인정하는 것으로 해석되어서는 안된다. 또한, 제공된 문헌의 공개일자는 실제 공개 일자와 상이할 수 있으며 따로 확인할 필요가 있을 수 있다.
본 명세서 및 첨부된 청구범위에서 사용되는, 단수형 "하나" 및 "그것"은 문맥에서 달리 명확히 언급이 없는 한 복수형을 포함함을 유념하여야 한다. 또한 청구범위는 임의의 선택적 요소를 제외시키도록 작성될 수 있음을 유념하여야 한다. 그러므로 이러한 표현은 청구범위 구성들을 언급하는 것과 관련하여 "단독으로", "오직" 등과 같은 제외 의미의 용어를 사용하기 위한 또는 "부정적" 제한를 사용하기 위한 선행사로서의 기능을 한다.
본 명세서를 읽었을 때 해당 분야의 숙련된 기술자에게 명확해지는 바와 같이, 본 명세서에 기재되고 설명된 개개의 구체예들 각각은 별개의 요소들 및 특징들을 가지는데, 이들은 본 발명의 범위 또는 사상에서 벗어나지 않고 다른 몇가지 임의의 구체예들의 특징들과 용이하게 분리되거나 조합될 수 있다. 언급된 임의의 방법은 언급되는 사건들의 순서로 또는 논리적으로 가능한 임의의 다른 순서로 실시될 수 있다.
용어 "펩티드" 및 "폴리펩티드"는 아미노산 잔기들로 구성된 중합체를 의미하기 위해 본 명세서에서 같은 뜻으로 사용된다.
본 명세서에서 사용되는 용어 "아미노산 잔기"는 임의의 천연 아미노산 (L 또는 D 형태), 비-천연 아미노산, 또는 아미노산 모방체 (가령, 펩토이드 단량체)를 의미한다.
폴리펩티드의 "길이"는 한줄로 연결된, 폴리펩티드를 구성하는 아미노산 잔기들의 수이며, 폴리펩티드가 내포할 수 있는 임의의 비-펩티드 링커 및/또는 변형부를 제외한다.
"링커" 또는 "링커 서열"은 두 개의 펩티드 서열들을 함께 연결하는 임의의 모이어티일 수 있다. 일부 구체예들에서, 링커는 함께 연결되는 펩티드 서열들과 동일 선상에 있는 아미노산 서열인 반면, 그 외 다른 구체예들에서 링커는 두 개의 펩티드 서열들에, 예컨대, 공유 결합을 통해 부착되는 별도의 모이어티이다. 링커는 아미노산 서열 또는 비-아미노산 모이어티일 수 있다. 특정 구체예들에서, 링커는 두 개의 양친매성 구역들의 이량체화를 용이하게 하기 위해 사용된다.
소수성 아미노산 잔기들은 두드러지게 비-극성인 화학적 성질을 가지는 작용기 ("측쇄")로 특징된다. 이러한 소수성 아미노산 잔기들은 천연 (L 또는 D 형태) 또는 비-천연일 수 있다. 대안적으로, 소수성 아미노산 잔기들은 두드러지게 비-극성인 화학적 성질을 가지는 작용기 ("측쇄")로 특징되는 아미노산 모방체들일 수 있다. 역으로, 친수성 아미노산 잔기들은 두드러지게 극성인 (하전된 또는 하전되지 않은) 화학적 성질을 가지는 작용기 ("측쇄")로 특징된다. 이러한 친수성 아미노산 잔기들은 천연 (L 또는 D 형태) 또는 비-천연일 수 있다. 대안적으로, 친수성 아미노산 잔기들은 두드러지게 극성인 (하전된 또는 하전되지 않은) 화학적 성질을 가지는 작용기 ("측쇄")로 특징되는 아미노산 모방체일 수 있다. 친수성 및 소수성 아미노산 잔기들의 예들이 하기 표 1에 나타나있다. 적합한 비-천연 아미노산 잔기 및 아미노산 모방체들은 해당 분야에 공지이다. 예컨대, Liang 등의 문헌 (2013), "An Index for Characterization of Natural and Non-Natural Amino Acids for Peptidomimetics," PLoS ONE 8(7): e67844를 보라.
대부분의 아미노산 잔기들은 소수성 또는 친수성으로 고려될 수 있지만, 일부는, 그 내부 구성에 따라, 소수성 또는 친수성으로 작용할 수 있다. 예를 들어, 비교적 약한 비-극성 특성으로 인해, 글리신, 프롤린, 및/또는 시스테인은 종종 친수성 아미노산 잔기들로서 기능할 수 있다. 역으로, 히스티딘 및 아르기닌은 부피가 큰, 약간 소수성 측쇄임으로 인해 종종 소수성 아미노산 잔기들로서 기능할 수 있다.
표 1: 소수성 및 친수성 아미노산 잔기들
하기 보다 상세히 설명하는 바와 같이, 본 발명의 양상들은 특정한 양이온 전하도를 가지는 최소한 하나의 양친매성 구역을 보유하는 항균 펩티드를 포함한다. 특정 구체예들에서, 항균 펩티드는 꼬리 구역 (예컨대, 소수성 꼬리 서열)을 포함한다. 특정 구체예들에서, 항균 펩티드 (또는 펩티드 제제)는 둘 이상의 양친매성 구역들을 포함한다. 이러한 구체예들에서, 항균 펩티드 (또는 펩티드 제제)의 두 개의 양친매성 구역들은 이량체의 형태이며, 여기서 두 개의 양친매성 구역들은 동일하거나 상이한 아미노산 서열들을 가질 수 있다 (즉, 동종이량체 또는 이종이량체임). 특정 구체예들에서, 두 개 (또는 그 이상)의 양친매성 구역들은 링커에 의해 연결된다. 링커는 사용자의 필요에 따라 인접한 (또는 일직선상의) 아미노산 서열 또는 비-아미노산 모이어티 일 수 있다. 링커는, 예컨대, 버블 구역 또는 베타-턴 구역일 수 있다. 특정 구체예들에서, 항균 펩티드는 폴리프롤린 나선 구조를 포함한다.
예시적인 항균 펩티드 서열들을 아래 나타낸다. 또 다른 항균 펩티드는 해당 분야의 숙련된 기술자가 예시 항균 펩티드의 상이한 구역들을 본 명세서에 기재된 바와 같은 상이한 방식으로 조합함으로써 용이하게 고안될 수 있다.
양친매성 구역
양친매성 구역은 소수성 및 친수성 요소들 또는 특성들 모두를 보유하는 펩티드 구역, 예를 들어, 친수성 표면 및 소수성 표면을 보유하는 펩티드 구역을 의미한다. 펩티드 구역은 양친매성 특성을 나타낼 경우 양친매성 형태로 존재한다고 하는데, 이는 종종 펩티드가 만들어졌던 및/또는 펩티드가 거쳤던 조건들에 따라 달라진다. 양친매성으로 고려되기 위해, 펩티드 서열 (또는 이의 일부)이 항상 양친매성 형태이어야 할 필요는 없다. 그보다는, 양친매성 형태가 최소한 50%, 60%, 70%, 80%, 또는 그 이상의 시간으로 존재하면 충분하다.
특정 구체예들에서, 본 발명의 항균 펩티드의 양친매성 구역은 5 내지 35개 아미노산 잔기 길이일 수 있으며, 양친매성 구역의 아미노산 서열 중 최소한 25% (예컨대, 30%, 40%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 또는 그 이상)가 양친매성을 나타낸다. 특정 구체예들에서, 양친매성 구역은 1 내지 3개 소수성 그리고 1 내지 3개 친수성 아미노산 잔기들의 교호 서열을 포함할 수 있다. 그러므로 양친매성 구역은 구조식 (X1-3Y1-3)n으로 나타낼 수 있으며, 여기서 X는 친수성 아미노산 잔기를 나타내고, Y는 소수성 아미노산 잔기를 나타내며, n은 2 내지 15의 정수이다. 예를 들어, 양친매성 구역은 다음과 같은 구조식 1, 구조식 2 (구조식 1의 역), 또는 구조식 3에 따른 서열을 가질 수 있다:
구조식 1:
XYYXXYYXXYXXYYXXYY
구조식 2:
YYXXYYXXYXXYYXXYYX
구조식 3:
XYXYXYXYXYXYXYX
각각의 소수성 아미노산 잔기 Y는 천연 소수성 아미노산, 비-천연 소수성 아미노산, 및 소수성 아미노산 모방체로 구성된 그룹에서 선택된다. 각각의 친수성 아미노산 잔기 X는 천연 친수성 아미노산, 비-천연 친수성 아미노산, 및 친수성 아미노산 모방체로 구성된 그룹에서 선택된다. 종종, 양친매성 형태는 특정한 2차 구조, 가령, 나선 구조와 관련될 것이다. 그러므로 항균 폴리펩티드의 양친매성 구역은 양친매성 310-나선 형태, 양친매성 α-나선 형태, 양친매성 π-나선 형태, 또는 양친매성 폴리프롤린 나선 형태를 가질 수 있다. 대안적으로, 항균 폴리펩티드의 양친매성 구역은 양친매성 β-가닥 형태를 가질 수 있다.
특정 구체예들에서, 본 발명의 양상들에 따른 항균 펩티드의 양친매성 구역은 하나 이상의 (예컨대, 2, 3, 4, 5, 6, 7, 8, 9, 10 또는 그 이상) 대형 소수성 아미노산 잔기들을 포함한다. 대형 소수성 아미노산 잔기들의 예에는 트립토판, 페닐알라닌, 및 티로신이 포함된다. 또한, 특정 환경하에서, 히스티딘 또는 아르기닌은 대형 소수성 아미노산 잔기로 고려될 수 있다. 특정 구체예들에서, 본 발명의 양상들에 따른 항균 펩티드의 양친매성 구역은 하나 이상의 (예컨대, 2, 3, 4, 5, 6, 7, 8, 9, 10 또는 그 이상) 소형 소수성 아미노산 잔기들을 포함한다. 소형 소수성 잔기들의 예에는 글리신, 알라닌, 세린, 시스테인, 발린, 트레오닌, 및 프롤린이 포함된다. 특정 구체예들에서, 항균 폴리펩티드는 대형 및 소형 소수성 잔기들의 조합을 포함하는 양친매성 구역을 가진다.
양친매성 구역들의 구체적인 예들은 다음을 포함한다:
RVFKKAFRKFKKLFKRAF (서열 번호: 1);
FARKFLKKFKRFAKKFVR
(서열 번호: 2); 및
FKRKIKAKLRFKAKVRLK
(서열 번호: 3).
양이온 전하/표면
본 발명의 양상들에 따른 항균 폴리펩티드는 양이온 표면을 가지는 양친매성 구역을 포함한다. 특정 구체예들에서, 양친매성 구역은 양이온 전하 (즉, 전하 > 0, 예컨대, +1, +2, +3, +4, +5, +6, +7, +8, +9, +10 또는 그 이상)를 가진다. 그러므로 특정 구체예들에서, 본 명세서에 개시된 펩티드의 양친매성 구역은 하나 이상의 극성 양이온 아미노산 잔기들을 내포한다 (즉, 양으로 하전된 측쇄들을 가짐). 양으로 하전된 부속 그룹을 가지는 아미노산 잔기들의 예 (생리학적 조건을 가정)에는 리신, 전형적으로 아르기닌, 그리고 종종 히스티딘이 포함된다. 따라서 항균 폴리펩티드는 1 내지 20개의 양이온 아미노산 잔기들을 포함하는 양친매성 구역을 가질 수 있다. 그러므로 본 발명의 항균 펩티드는 극성의 아미노산 잔기들을 포함할 수 있으며, 이들 아미노산 잔기들의 최소한 40% (예컨대, 50%, 60%, 70%, 80%, 90%, 또는 100%)는 양이온으로 하전되어 있다 (예컨대, Arg, Lys, His).
꼬리 구역
특정 구체예들에서, 항균 펩티드는 꼬리 구역을 포함한다. 본 발명의 항균 펩티드의 꼬리 구역은 3 내지 15개 길이의 아미노산 잔기일 수 있으며, 이러한 꼬리 구역의 아미노산 잔기 중 최소한 50% (예컨대, 60%, 70%, 75%, 80%, 85%, 90%, 또는 그 이상)는 소수성이다. 꼬리 구역은 항균 펩티드의 N-말단, C-말단, 또는 두 말단 모두에 배치될 수 있다. 특정 구체예들에서, 꼬리 구역은 매 6개 아미노산 마다 하나의 극성 아미노산을 포함한다. 꼬리 구역 서열의 예는 구조식 4에 나타나 있는데, 여기서 Y는 소수성 아미노산 잔기들을 나타낸다.
구조식 4:
YYYYY
서열 FAFAF(서열 번호: 4)를 가지는 꼬리 구역을 포함하는 본 발명의 양상들에 따른 항균 펩티드의 구체적인 예들에는 다음이 포함된다 (꼬리 구역에 밑줄):
FAFAFRVFKKAFRKFKKLFKRAF
(서열 번호: 5); 및
FARKFLKKFKRFAKKFVRFAFAF
(서열 번호: 6).
버블 구역
특정 구체예들에서, 항균 펩티드는 버블 구역을 포함한다. 본 발명의 항균 펩티드의 "버블" 구역은 각 단부에서 시스테인 잔기 (C)에 의해 측면에 위치되는 아미노산 잔기들의 신장(stretch)부를 구성한다 (도 1). 시스테인 잔기들 사이에 있는 아미노산 잔기들의 신장부는 2 내지 10개 길이의 아미노산 잔기일 수 있으며, 소수성 및 친수성 아미노산들의 임의의 조합으로 구성될 수 있다. 버블 구역들은 두 개의 양친매성 구역들을 결합시킬 수 있으며 항균 펩티드에 의한 헤어핀 2차 구조 형성의 원인이 된다 (도 1을 보라). 그러므로 이 구역은 (본 명세서의 다른 부분에 기재되어 있는 그 외 다른 구역들처럼) "링커 구역" 유형으로 분류될 수 있다. 특정 구체예들에서, 헤어핀 2차 구조는 항균 활성을 현저하게 개선시킬 수 있다.
버블 구역은, 예를 들어, 구조식 5에 나타낸 서열을 가질 수 있는데, 여기서 Y는 소수성 아미노산 잔기들을 나타내고 X는 친수성 아미노산 잔기들을 나타낸다.
구조식 5: C(Y/X)(Y/X)(Y/X)(Y/X)C
서열 CLGRFC (서열 번호: 7)를 가지는 버블 구역을 포함하는 본 발명의 항균 펩티드의 구체적인 예들은 다음을 포함한다:
KIRAKLCLGRFCIRAKLR
(서열 번호: 8); 및
KIKARLCLGKFCIKARLK
(서열 번호: 9).
이량체화
본 발명의 항균 펩티드의 효능은, 상당 부분, 펩티드 이량체화 및 표적 미생물 (예컨대, 세균 세포)의 세포막 상에서의 군집화에 따라 달라지는 것으로 생각되나, 이를 이론으로 제한하고자 하는 것은 아니다. 이량체들은 세포막을 침투하여 궁극적으로 용해시킴에 있어 보다 효과적인 것으로 생각된다. 이러한 이량체들의 형성은, 펩티드가, 예컨대, 링커 구역들을 사용하여 서로 물리적으로 연결될 때 열역학적으로 보다 바람직할 수 있다. 링커 구역들은 (예컨대, 상기 설명한 버블 구역과 같은) 또 다른 아미노산 잔기들을 포함하거나 비-아미노산-내포 링커 모이어티들이 될 수 있다.
베타 턴 구역
β-턴 서열은 개별적인 단량체들을 물리적으로 연결시켜, 분자내 상호작용들이 보다 쉽게 일어날 수 있도록 하기 위하여 사용될 수 있다. 이는 양친매성의 용해성 펩티드에 있어 특히 중요한 것으로 보이는데, 왜냐하면 베타 턴 서열이 이러한 펩티드의 소수성 표면을 수성 상으로부터 보호할 수 있게 하기 때문이다. β-턴 서열은 두 개의 사슬 내 양친매성 구역들이 역평행 배향으로 이량체를 형성하는 것을 가능하게 한다. 그러므로 이 구역은 (본 명세서의 다른 부분에 기재되어 있는 그 외 다른 구역들처럼) "링커 구역" 유형으로 분류될 수 있다. 예를 들어, 서열 번호: 6 (상기 참고)의 단량체는 1.26 μM의 농도에서 스타필루코쿠스 아우레우스를 2 로그값 보다 많이 사멸시켰던 반면, 서열 번호: 12 (상기 참고)의 이량체는 0.156 μM 미만의 농도에서 동일한 세균을 2 로그값 보다 많이 사멸시켰다 (실시예 5 참고).
β-턴 서열은 해당 분야에 공지된 임의의 β-턴 서열이 될 수 있다. β-턴 서열은, 예를 들어, 서열 번호: 10에 나타낸 서열을 가질 수 있으며, 여기서 Y는 소수성 아미노산 잔기들을 나타내고 X는 친수성 아미노산 잔기들 (즉, 임의의 아미노산 잔기)을 나타낸다.
(Y/X)GPGR(Y/X)
(서열 번호: 10)
서열 FGPGRF (서열 번호: 11)를 가지는 β-턴 서열을 포함하는 본 발명의 항균 펩티드의 구체적인 예들은 다음을 포함한다:
FAFAFKAFKKAFKKFKKAFKKAFGPGRFAKKFAKKFKKFAKKFAKFAFAF (서열 번호: 12)
폴리프롤린 나선 2차 구조
더 일반적인 1회전 당 3.6개 아미노산 잔기인 경우 보다 1회전 당 대략 3.0개 아미노산 잔기를 생성하는, 프롤린 잔기가 반복되는 나선 구조는 생성된 펩티드의 반감기를 연장시킬 수 있는 것으로 생각되나 이를 이론으로 제한하고자 하는 것은 아니다. 이러한 나선들은 양친매성 구역, 양이온 전하, 및 선택적으로 꼬리 구역을 포함한 상기 설명한 중요한 구조적 특징들을 유지시키면서 형성될 수 있다.
항균 펩티드의 예
본 발명의 양상들에 따른 항균 펩티드의 예들이 하기 표 2에 제공된다. 이 예들은 대표적인 것이며 본 발명의 범위로 한정하고자 하는 것이 아니다. 하기 나열된 서열에서 "O" 잔기들은 아미노산 오르니틴을 나타낸다.
표 2: 항균 펩티드의 예
따라서 본 발명은 또한 본 명세서에 개시된 (예컨대, 표 xx에 나타낸) 항균 폴리펩티드 중 임의의 하나와 최소한 50% 동일한 (예컨대, 최소한 60%, 70%, 80%, 90%, 95%, 98%, 99% 또는 그 이상 동일한) 아미노산 서열을 포함하면서도 최소한 하나의 항균 성질을 보유하는 폴리펩티드를 제공한다. 특정 구체예에서, 이러한 폴리펩티드 서열들은 상기 상세하게 설명한 양이온 전하를 가지는 양친매성 구역을 포함한다. 더욱이, 이러한 폴리펩티드는 다음을 포함하는, 본 명세서에 기재된 추가적인 구조적 특징들을 포함할 수 있다: 버블 구역, 베타-턴 구역, 폴리프롤린 나선 구조, 꼬리, 양친매성 구역 이량체 등.
그리하여, 특정 구체예들에서, 본 발명은 본 명세서에 개시된 (예컨대, 표 xx에 제시된) 항균 폴리펩티드 중 임의의 하나와 1 내지 10개 아미노산 차이 (예컨대, 10개 미만, 9개 미만, 8개 미만, 7개 미만, 6개 미만, 5개 미만, 4개 미만, 3개 미만, 2개 미만, 또는 1개 아미노산 차이)를 가지는 아미노산 서열을 포함하면서도 최소한 하나의 항균 성질을 보유하는 폴리펩티드를 제공한다. 본 명세서에서 사용되는 "아미노산 차이"는 다음을 포함한다: 아미노산 치환, 아미노산 삽입, 말단 아미노산 부가, 아미노산 결실, 말단 아미노산 절두, 또는 이의 임의의 조합. 치환된 아미노산 잔기 (또는 잔기들)는 대체되는 아미노산 잔기와 관련없는 것이거나 (예컨대, 용어 또는 소수성/친수성, 크기, 전하, 극성 등에 있어 관련없는 것), 치환된 아미노산 잔기는 유사한, 보존적인, 또는 매우 보존적인 아미노산 치환을 구성할 수 있다. 본 명세서에서 사용되는 "유사한", "보존적인" 및 "매우 보존적인" 아미노산 치환은 하기 표 3에서와 같이 정의된다. 아미노산 잔기 치환이 유사한지, 보존적인지 또는 매우 보존적인지 여부의 결정은 하기 논의되는 바와 같이 오직 아미노산 잔기의 측쇄만을 근거로 하며 펩티드 안정성을 증가시키기 위해 개질될 수 있는 펩티드 골격은 근거로 하지 않는다.
표 3: 아미노산 치환의 분류
*"O"는 오르니틴을 나타낸다.
조성물
본 발명은 본 명세서에 기재된 항균 폴리펩티드를 포함하는 조성물을 제공한다. 예를 들어, 항균 폴리펩티드는 항균 활성을 보유하는 표 2에 나열된 폴리펩티드 또는 이의 단편 또는 변이체 중 어느 하나가 될 수 있다. 특정 구체예들에서, 본 발명의 조성물에 포함되는 항균 폴리펩티드는 (예컨대, 화학적 합성에 의해 제조되거나 및/또는 재조합하여 생성된) 합성 폴리펩티드 일 것이다.
본 발명의 조성물은 단일 항균 폴리펩티드, 또는 상이한 항균 폴리펩티드들의 조합을 포함할 수 있다. 본 조성물은 실질적으로 단백질 및 다른 폴리펩티드가 없을 수 있다. 본 명세서에서 사용되는 용어 "실질적으로 단백질 및 다른 폴리펩티드가 없는"은 조성물의 단백질 함량의 5% 미만이 단백질 그리고 본 발명의 항균 폴리펩티드가 아닌 다른 폴리펩티드로 이루어짐을 의미한다. 실질적으로 본 발명의 비-항균 폴리펩티드가 없는 조성물은 4%, 3%, 2%, 1%, 0.5%, 0.1%, 0.05%, 0.01% 미만, 또는 그 미만의 다른 비-항균 폴리펩티드를 가질 수 있다.
특정 구체예들에서 본 발명의 조성물은 인간 또는 다른 포유류 또는 동물에서 자연적으로 발견되지 않는 항균 폴리펩티드를 내포한다.
본 발명의 조성물은 최소한 1 mg (예컨대, 최소한 5, 10, 20, 30, 40, 50, 75, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1000 mg, 또는 그 이상)의 항균 폴리펩티드를 포함할 수 있다. 그러므로 예를 들어, 조성물은 약 1 mg 내지 약 1000 mg (예컨대, 약 5 mg 내지 약 900 mg, 약 5 mg 내지 약 800 mg, 약 5 mg 내지 약 700 mg, 약 5 mg 내지 약 600 mg, 약 10 mg 내지 약 500 mg, 약 10 mg 내지 약 400 mg, 약 10 mg 내지 약 300 mg, 약 10 mg 내지 약 250 mg, 약 10 mg 내지 약 200 mg, 약 10 mg 내지 약 150 mg, 약 10 mg 내지 약 100 mg, 약 50 mg 내지 약 500 mg, 약 50 mg 내지 약 400 mg, 약 50 mg 내지 약 300 mg, 약 50 mg 내지 약 250 mg, 약 50 mg 내지 약 200 mg, 약 50 mg 내지 약 150 mg, 약 50 mg 내지 약 100 mg, 약 75 mg 내지 약 500 mg, 약 75 mg 내지 약 400 mg, 약 75 mg 내지 약 300 mg, 약 75 mg 내지 약 250 mg, 약 75 mg 내지 약 200 mg, 약 75 mg 내지 약 150 mg, 약 75 mg 내지 약 100 mg, 약 100 mg 내지 약 500 mg, 약 100 mg 내지 약 400 mg, 약 100 mg 내지 약 300 mg, 약 100 mg 내지 약 250 mg, 약 100 mg 내지 약 200 mg, 또는 상기 한도값들 중 두 개를 포함하는 임의의 다른 범위)와 동일한 양의 항균 폴리펩티드를 포함할 수 있다.
본 발명의 조성물은 최소한 1 mg/ml (예컨대, 최소한 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100 mg/ml 또는 그 이상)의 항균 폴리펩티드를 내포하는 용액을 포함할 수 있다. 그러므로 예를 들어, 조성물은 약 1 mg/ml 내지 약 1000 mg/ml (예컨대, 약 5 mg/ml 내지 약 900 mg/ml, 약 5 mg/ml 내지 약 800 mg/ml, 약 5 mg/ml 내지 약 700 mg/ml, 약 5 mg/ml 내지 약 600 mg/ml, 약 5 mg/ml 내지 약 500 mg/ml, 약 10 mg/ml 내지 약 500 mg/ml, 약 10 mg/ml 내지 약 400 mg/ml, 약 10 mg/ml 내지 약 300 mg/ml, 약 10 mg/ml 내지 약 250 mg/ml, 약 10 mg/ml 내지 약 200 mg/ml, 약 10 mg/ml 내지 약 150 mg/ml, 약 10 mg/ml 내지 약 100 mg/ml, 약 50 mg/ml 내지 약 500 mg/ml, 약 50 mg/ml 내지 약 400 mg/ml, 약 50 mg/ml 내지 약 300 mg/ml, 약 50 mg/ml 내지 약 250 mg/ml, 약 50 mg/ml 내지 약 200 mg/ml, 약 50 mg/ml 내지 약 150 mg/ml, 약 50 mg/ml 내지 약 100 mg/ml, 약 75 mg/ml 내지 약 500 mg/ml, 약 75 mg/ml 내지 약 400 mg/ml, 약 75 mg/ml 내지 약 300 mg/ml, 약 75 mg/ml 내지 약 250 mg/ml, 약 75 mg/ml 내지 약 200 mg/ml, 약 75 mg/ml 내지 약 150 mg/ml, 약 75 mg/ml 내지 약 100 mg/ml, 약 100 mg/ml 내지 약 500 mg/ml, 약 100 mg/ml 내지 약 400 mg/ml, 약 100 mg/ml 내지 약 300 mg/ml, 약 100 mg/ml 내지 약 250 mg/ml, 약 100 mg/ml 내지 약 200 mg/ml, 약 10 mg/ml 내지 약 150 mg/ml, 또는 상기 한도값들 중 두 개를 포함하는 임의의 다른 범위)의 항균 폴리펩티드 농도를 가지는 용액을 포함할 수 있다.
본 발명의 조성물은 제약학적 조성물을 포함한다. 이러한 제약학적 조성물은 하나 이상의 항균 폴리펩티드 및 제약상 허용가능한 담체를 포함할 수 있다. 제약학적 조성물은 본 발명의 항균 폴리펩티드 이외의 활성 성분을 추가로 포함할 수 있다. 다른 활성 성분은 치료/항균 제제, 가령, 종래의 항생제일 수 있다. 종래의 항생제는 항균 성질 또는 본 발명의 항균 폴리펩티드가 증가시키거나 본 발명의 항균 폴리펩티드에 의해 증가되는 다른 성질들을 가질 수 있다. 특정 구체예들에서 제약학적 조성물은 담체, 예컨대, 담체 단백질, 가령, 혈청 알부민 (예컨대, HAS, BSA 등)을 포함하며, 이는 정제되거나 재조합하여 생성될 수 있다. 이러한 제약학적 조성물 내 항균 폴리펩티드(들)를 혈청 알부민과 혼합함으로써, 항균 폴리펩티드는 혈청 알부민 상에 효과적으로 "부하"될 수 있고, 이는 더 많은 양의 항균 폴리펩티드가 감염 부위에 성공적으로 전달될 수 있게 한다. 본 발명의 제약학적 조성물은 경구 투여, 비경구 투여, 국소 투여 등을 위해 제형화될 수 있다. 경구 전달용으로 제형화된 조성물은, 예를 들어, 장용 코팅을 포함할 수 있는데, 이러한 장용 코팅은 그 안에 내포된 항균 펩티드를 장 그리고 그보다 멀리까지 도달하게 한다. 국소 전달용으로 제형화된 조성물은 내부에 내포된 항균 펩티드의 작용 기간을 연장시키기 위해, 예를 들어, 겔 또는 크림으로 현탁되거나 붕대에 주입될 수 있다. 대안적으로, 본 발명의 항균 펩티드는 감염 예방 수단으로서 의학 장치, 가령, 외과용 기구 및 내재용 의학 장치 (예컨대, 심박조율기, 카테터, 인공 관절 등)의 표면에 코팅될 수 있다.
방법
본 발명의 항균 폴리펩티드는 피험체에서 미생물 감염을 치료 또는 예방하기 위한 강력한 툴을 제공한다. 따라서 본 발명은 피험체에서 최소한 하나의 미생물 유기체의 복제를 제거, 유기체 수를 감소 또는 유기체 복제를 현저히 감소시키는 방법을 제공한다. 피험체는 임의의 동물, 가령, 가축 (예컨대, 말, 소, 돼지, 염소, 양, 토끼, 닭, 칠면조, 오리 등), 애완동물 (예컨대, 개, 고양이, 토끼, 햄스터, 게르빌루스쥐, 새, 생선 등), 실험용 동물 (예컨대, 마우스, 래트, 원숭이, 침팬지, 부엉이, 생선 등), 동물원 동물 (예컨대, 고릴라, 오랑우탄, 침팬지, 원숭이, 코끼리, 낙타, 얼룩말, 야생돼지, 사자, 호랑이, 기린, 곰, 새 등), 야생 동물 (예컨대, 사슴, 늑대, 퓨마, 새 등), 또는 인간 피험체 (예컨대, 환자)가 될 수 있다.
항균 폴리펩티드(들)은 동물 유형, 동물 크기, 및 치료되는 병태에 따라 다른 용량 및 빈도로 투여될 수 있다. 전형적으로, 항균 폴리펩티드는 매일 (또는 격일로, 또는 매주), 약 1 mg 내지 약 1000 mg (예컨대, 약 5 mg 내지 약 900 mg, 약 5 mg 내지 약 800 mg, 약 5 mg 내지 약 700 mg, 약 5 mg 내지 약 600 mg, 약 10 mg 내지 약 500 mg, 약 10 mg 내지 약 400 mg, 약 10 mg 내지 약 300 mg, 약 10 mg 내지 약 250 mg, 약 10 mg 내지 약 200 mg, 약 10 mg 내지 약 150 mg, 약 10 mg 내지 약 100 mg, 약 50 mg 내지 약 500 mg, 약 50 mg 내지 약 400 mg, 약 50 mg 내지 약 300 mg, 약 50 mg 내지 약 250 mg, 약 50 mg 내지 약 200 mg, 약 50 mg 내지 약 150 mg, 약 50 mg 내지 약 100 mg, 약 75 mg 내지 약 500 mg, 약 75 mg 내지 약 400 mg, 약 75 mg 내지 약 300 mg, 약 75 mg 내지 약 250 mg, 약 75 mg 내지 약 200 mg, 약 75 mg 내지 약 150 mg, 약 75 mg 내지 약 100 mg, 약 100 mg 내지 약 500 mg, 약 100 mg 내지 약 400 mg, 약 100 mg 내지 약 300 mg, 약 100 mg 내지 약 250 mg, 약 100 mg 내지 약 200 mg, 상기 한도값들 중 두 개를 포함하는 임의의 다른 범위)의 양으로 투여된다. 일일 용량은 하루 한번 투여되거나, 보다 작은 용량으로 나누어 하루 동안 복수의 시점에 섭취될 수 있다. 인간 (및 그 외 유사한 크기의 포유류)에 대해, 격일에 5mg/kg의 용량을 투여할 수 있다. 항균 폴리펩티드는 고정된 시기 동안 (예컨대, 2-3 주간), 간격을 두고 (예컨대, 2-3 주간 폴리펩티드 투여, 2-3주 대기, 이후 주기 반복), 또는 미생물 유기체가 제거되거나 현저히 감소되거나, 미생물 감염의 증상들이 개선되었거나, 잠재적인 미생물 감염 위험이 감소되었거나 제거되었다 (예컨대, 상처가 치유되었다)고 판단될 때까지 투여될 수 있다.
전술한 방법들 중 어느 하나와 함께 항균 폴리펩티드 (또는 이러한 폴리펩티드를 포함하는 제약학적 조성물)의 투여는 이식가능한 지점에 의해, 나노입자-기반 전달 시스템, 마이크로니들 패치, 미세구, 비드, 삼투적 또는 기계적 펌프, 및/또는 그 외 기계적 수단들을 사용하여 정맥내, 복강내, 비경구, 정위(orthotopically), 피하, 국소, 비강, 경구, 설하, 안구내로 실시될 수 있다.
전술한 방법들 중 어느 하나와 함께, 항균 폴리펩티드 (이러한 폴리펩티드를 포함하는 제약학적 조성물)는 또 다른 약제, 예컨대, 항생제, 항바이러스제, 항진균제, 항원충제, 항말라리아제, 또는 비-감염성 질병 또는 그 외 병태를 치료하기 위한 약제와 병용 투여될 수 있다. 특정 구체예들에서, 다른 약제는 질병/미생물 감염 증상을 감소 (예컨대, 열을 내리거나 예방하는 것, 구역질을 치료하거나 예방하는 것 등)시킬 수 있는 약제이다. 각 경우에, 항균 폴리펩티드는 다른 약제의 투여 이전, 투여와 동시에, 또는 투여 이후에 투여될 수 있다.
실시예
다음의 실시예들은 본 발명을 제조하는 방법 및 사용하는 방법을 해당 분야의 숙련된 기술자들에게 완전하게 개시하고 설명하기 위하여 제시되며, 발명자들이 자신의 발명이라고 간주하는 것의 범위를 제한하고자 하는 것은 아니며 또한 다음의 실험들이 실시되는 모든 실험들임을 또는 단 하나의 실험임을 나타내고자 하는 것도 아니다. 사용되는 값들 (예컨대, 양, 온도, 등)에 관하여 정확도를 보장하기 위하여 노력을 하였으나, 어느 정도 실험 오차 및 편차를 고려하여야 한다. 달리 언급이 없는 한, 부분은 중량부이고, 분자량은 평균 분자량이며, 온도는 섭씨 온도이고, 그리고 압력은 대기압 또는 대기압 근방이다.
실시예 1: 플랑크톤 그람-음성 및 그람-양성 세균에 대한 활성
무산소 세균의 항균 감수성 테스트에 관한 M11-A8E CLSI 표준에 의해 다음과 같은 검사 유기체에 대하여 펩티드를 테스트 하였다: 엔테로코쿠스 파에시움 ATCC 700221; 엔테로박터 아에로겐스 ATCC 13048; 스타필루코쿠스 아우레우스 MRSA ATCC 33591; 스트렙토코쿠스 뉴모니에 ATCC 49619; 슈도모나스 아에루지노사 ATCC 27853; 아시네토박터 바우만니 ATCC 17978D-5; 슈도모나스 아에루지노사 ATCC 19660; 및 스타필로코쿠스 에피더미디스 ATCC 51625. 샘플 희석은 초기 샘플 내지 1:2048의 범위였다. 열한개(11) 농도들을 MQA Laboratories의 96 웰 플레이트에서 2번씩 테스트하였다. 결과들을 최소 살균 농도 (MBC)로 표 4에 나타내는데, 이는 8개 검사 유기체 각각에 대해 99.9% 치사율을 생성하는데 필요한 각 펩티드의 농도이다. (표 4의 농도들은 테스트한 모든 세균에 걸친 μM 단위의 MBC 평균이다).
표 4
실시예 2: 균막 세균에 대한 활성
최소 균막 박멸 농도 (MBEC) 분석이 사용되었다. MBEC 값들은 균막 세균을 사멸시키는데 필요한 항균 생성물의 농도에 대한 추정치를 제공한다. 96개 페그(peg)를 포함하는 리드 상에 균막을 형성시키기 위해 캘거리 균막 장치 (Calgary Biofilm Device, CBD) 플레이트를 사용하였다. 세균 배양액을 트립틱 소이 브로스 (TSB)에서 성장시키고 대략 1 x 107 CFU/mL로 희석시킨 후 CBD 플레이트를 접종시킨 다음, 이 플레이트를 35℃에서 24 시간 동안 125 rpm의 진탕기에서 배양시켰다.
균막을 내포하는 페그 리드를 먼저 PBS에서 헹구어 플랑크톤 세포들을 제거하고 테스트 대상군과 대조군을 35℃에서 하룻밤 동안 2-배 연속 희석 처리하였다. 페그 리드를 PBS에서 두 번 헹군 다음 새로운 배지에서 음파파쇄하여 페그에 부착된 균막을 파괴시켰다. 그 후 성장을 평가하기 위하여 플레이트를 하룻밤동안 배양시켰다. 650 nm에서의 흡광도 (A650)를 측정하여 세균 정량을 실시하였다. 정의하자면, 0.1 미만의 A650 판독결과는 균막 박멸을 나타낸다. 결과를 표 5에 나타낸다.
표 5
실시예 3: 생물위협 세균 (
B. 타일란덴시스
)에 대한 활성
테스트 대상군 및 비교대상 항생제 (세프타지딤)의 시험관내 활성을 다음과 같이 테스트하였다: 멸균 96-웰 플레이트에서, 세균 웰 당 1x105 CFU를 항생제 (대조군) 및 10 mM 인산염 완충액 중의 펩티드의 연속 희석액과 함께 배양시켰다 (3 h, 37℃). 멸균 PBS 중의 각 펩티드 농도에서의 연속 희석에 의해 세균 생존을 결정하였다. 희석액들을 영양 한천배지에서 3개씩 도말하고 37℃에서 24 h 동안 배양시켰다; 그 후 콜로니들을 계수하여 생존을 결정하였다. 세균 생존을 임의의 항균 펩티드가 없는 대조군 플레이트에서의 평균 콜로니 수에 대한 각 실험 플레이트에서의 콜로니 수의 비율로 계산하였다. B. 타일란덴시스 를 50% 사멸시키는데 필요한 항균 펩티드 농도 (EC50)를 생존 백분율 대 펩티드 농도 로그값으로 그래프를 그려 결정하였다. 표준 S자 모양의 용량-반응 곡선에 데이터를 적합시켜 EC50 를 결정하였다. 각 실험을 세 번씩 반복하여 실시하였다. 표 6은 테스트한 각 펩티드 및 항생제 세프타지딤에 대한 EC50 결과를 보여준다.
표 6
실시예 4: 선택된 펩티드의 항세균 및 항진균 활성 (IC50 값)
항균 및 항-진균 활성 측정은 표준 마이크로미터 희석법으로 결정하였다. 요약하자면, 세포들을 각 균주들로 특이화시킨 배지에서 하룻밤동안 성장시키고 동일한 배지에서 희석시켰다. 펩티드의 연속 희석액을 50μl 부피의 마이크로적정 플레이트에 부가한 후, 50μl의 세균 또는 진균, 5x105 CFU/ml를 부가하였다. 플레이트들을 37도에서 24시간 동안 배양시키고 최소 억제 농도 (MIC)를 세균 성장을 50% 억제한 최저 펩티드 농도로 결정하였다. 표 7은 테스트한 각 세균 분리주에 대한 IC50을 μM로 보여주며, 표 8은 테스트한 각 진균에 대한 IC50을 μM로 보여준다.
표 7: 세균 세포 결과
표 8: 진균 세포 결과
실시예 5:
시험관내
살균 활성에 관한 펩티드 선별.
테스트한 세균은 버크홀데리아 세파시아 균주 토론토 (Burkholderia cepacia strain Toronto) (B.c.), 포르피로모나스 진지발리스(Porphyromonas gingivalis) 균주들 A7436 및 HG405, 악티노바실루스 악티노마이세템코미탄스 (Actinobacillus actinomycetemcomitans) 균주 A7154 (A.a.), 푸소박테리움 뉴클레아툼 (Fusobacterium nucleatum) 균주 1594 (F.n.), 에스체리치아 콜리(Escherichia coli) 균주 (E.c.), 스타필루코쿠스 아우레우스 ATCC 균주 29213 (S.a.), 및 슈도모나스 아에루지노사 균주 (P.a.)를 포함하였다. 모든 세균을 적절한 대기하에 적절한 배지에서 초기 지수증식기까지 성장시켰다. 수확 전 최소 5배의 배가 되도록 하는 용량의 세균으로 배지를 접종하였다. 배양물을 식염수에서 원심분리로 2회 세척하고 적합한 농도의 식염수에 재현탁시켰다. 초기 선별에서, 모든 펩티드들은 660nm에서의 광학 밀도로 추정하여 106 CFU/ml의 표적 세균을 보유하는, 식염수에서의 10μM 최종 농도로 사용되었다. 대조군들을 동일한 부피의 식염수로 처리하였다. 현탁액을 37℃의 주변 대기에서 배양시키고, 콜로니 형성 유닛의 정량적 회수를 위해 분취시료를 일시적으로 (0 내지 2시간) 제거하였다. 이는 상이한 세균 균주들을 이용하여 개개 펩티드의 사멸 동역학을 결정하게 하였다. 일반적으로, 식염수 대조군에서 2시간 테스트 기간에 걸쳐 다양한 균주들의 생존력에 있어 거의 또는 전혀 손실이 없었다. 그러나 푸소박테리움 뉴클레아툼(Fusobacterium nucleatum) 및 악티노바실루스 악티노마이세템코르니탄스 (Actinobacillus actinomycetemcomitans) 모두의 대조군들에서 상기 시기 내에 생존력이 현저히 감소되었으나(>1 log10), 30분 후가 될 때까지 감소가 전혀 검출되지 않았다. 식염수-처리된 대조군에 비해 펩티드-처리된 군의 회복가능한 CFU에 있어서의 감소가 1-로그값보다 더 컸던 경우 사멸이 현저한 것으로 고려되었다. 10μM에서 사멸시키기 못했던 펩티드들은 불활성인 것으로 고려되었다. 2 로그값 보다 크게 감소시켰던 임의의 펩티드는 106 CFU/ml의 표적 세균으로 테스트하기 이전에 2배, 5배, 또는 10배 희석하여 적정하였다. 종점 적정은 식염수-처리된 대조군에 비해 회복가능한 CFU에 있어 2-로그값 보다 크게 감소시키는 펩티드의 최종 농도(μM) ("2-로그 감소 농도")로 결정된다. 테스트한 각 세균에 관한 서열 번호: 12 및 6에 대한 이러한 2-로그 감소 농도를, 모든 세균에 걸친 평균 값(마지막 열)과 함께 표 9에 나타낸다.
표 9
실시예 6: 항생제 내성 세균의 사멸
스타필루코쿠스 아우레우스, 슈도모나스 아에루지노사, 및 클로스트리디움 디피실레를 RP-439 및 RP-442 (각각 서열 번호: 18 및 21)에 대한 이들의 감수성에 관해 테스트하였다. 이들 유기체들은 병원 감염과 관련된다. 실시예 5에 기재된 바와 같이 실험들을 실시하였다. 도 2는 지시된 펩티드 또는 반코마이신 부가 후 1시간 시점에서 측정한 결과들을 보여준다. 도 2에서 명확히 나타나있는 바와 같이, S. 아우레우스는 반코마이신과 유사한 수준에서 두 가지 펩티드 모두에 의해 효과적으로 사멸되었다. 그러나 이들 펩티드는 이러한 종래의 항생제보다 넓은 범위의 효능을 보였음이 밝혀졌다. 구체적으로, RP-439 및 RP-442는 P. 아에루지노사 및 C. 디피실레 모두를 사멸함에 효과적이었던 반면, 반코마이신은 이들 미생물 유기체들에 대해 효과적이지 않았다. 세균들이 단일 세포 형태로 노출되었든 (도 2에 도시됨) 또는 균막 형태로 노출되었든 (전술한 실시예들에서 기재; RP-442에 관한 S. 아우레우스 및 P. 아에루지노사 에 대해 상기 나타낸 균막 데이터; C. 디피실레 및 펩티드 RP-439에 관한 균막 데이터는 나타내지 않음) 간에 유사한 결과들이 수득되었다.
실시예들에서 제공된 결과들은 의학적으로 중요한 인간 감염을 유발하는 미생물 유기체들을 비롯한 광범위한 미생물 유기체들을 사멸시킴에 있어서 본 발명의 항균 펩티드의 효능을 입증한다.
구체예
본 발명의 양상들을 예시적으로 제공하기 위해 하기 비-제한적 구체예들이 제공된다.
1.
서열 번호: 23, 25, 17, 12, 13, 27, 1 내지 6, 8, 9, 14 내지16, 18 내지 22, 24, 26, 및 28 내지 30 중 어느 하나에 최소한 60% 서열 동일성을 가지는 아미노산 서열을 포함하는 항균 펩티드를 포함하는 항균 조성물.
2.
구체예 1에 있어서, 항균 펩티드는 세균, 진균 또는 원충 유기체 중 최소한 하나를 사멸시킴에 효과적인 항균 조성물.
3.
구체예 2에 있어서, 상기 유기체는 다음으로 구성된 그룹에서 선택된 속으로 분류된 종인 항균 조성물: 아시네토박터(Acinetobacter), 악티노바실루스(Actinobacillus), 버크홀데리아(Burkholderia), 칸디다(Candida), 클로스트리디움(Clostridium), 엔테로박터(Enterobacter), 엔테로코쿠스(Enterococcus), 에스체리치아(Escherichia), 푸소박테리움(Fusobacterium), 포르피로모나스(Porphyromonas), 슈도모나스(Pseudomonas), 스타필로코쿠스(Staphylococcus), 및 스트렙토코쿠스(Streptococcus). 일부 구체예들에서, 유기체는 하나 이상의 종래의 항생제에 대해 내성을 띤다 (예컨대, MRSA 유기체).
4.
구체예 3에 있어서, 유기체는 다음으로 구성된 그룹에서 선택되는 항균 조성물: 아시네토박터 바우만니(Acinetobacter baumannii), 악티노바실루스 악티노마이세템코미탄스 (Actinobacillus actinomycetemcomitans), 버크홀데리아 세파시아(Burkholderia cepacia), 버크홀데리아 타일란덴시스(Burkholderia thailandensis), 칸디다 알비칸스(Candida albicans), 칸디다 크루세이(Candida krusei), 칸디다 트로피칼리스 (Candida tropicalis), 클로스트리디움 디피실레(Clostridium difficile), 엔테로박터 아에로겐스(Enterobacter aerogens), 엔테로박터 클로아카 (Enterobacter cloaca), 엔테로코쿠스 파에시움(Enterococcus faecium), 에스체리치아 콜리 (Escherichia coli), 푸소박테리움 뉴클레아툼 (Fusobacterium nucleatum), 포르피로모나스 진지발리스(Porphyromonas gingivalis), 슈도모나스 아에루지노사(Pseudomonas aeruginosa), 슈도모나스 아에루지노사(Pseudomonas aeruginosa), 슈도모나스 아에루지노사(Pseudomonas aeruginosa), 스타필루코쿠스 아우레우스(Staphylococcus aureus), 스타필루코쿠스 아우레우스(Staphylococcus aureus), 스타필로코쿠스 에피더미디스(Staphylococcus epidermidis), 및 스트렙토코쿠스 뉴모니에(Streptococcus pneumoniae).
5.
구체예 2 내지 4 중 어느 하나에 있어서, 항균 펩티드는 미생물 균막으로서 성장하는 미생물을 사멸시킴에 효과적인 항균 조성물.
6.
전술한 구체예들 중 어느 하나에 있어서, 항균 펩티드는 미생물 병원체의 막에 결합하는 양이온 표면을 가지는 양친매성 구역을 포함하는 항균 조성물.
7.
전술한 구체예 중 어느 하나에 있어서, 항균 펩티드는 폴리프롤린 나선 구조를 포함하는 항균 조성물.
8.
전술한 구체예 중 어느 하나에 있어서, 항균 펩티드는 N-말단, C-말단, 또는 이 둘 모두에 소수성 꼬리 구역을 포함하고, 소수성 꼬리 구역은 4 내지 10개의 소수성 아미노산 서열을 가지는 항균 조성물.
9.
구체예 8에 있어서, 소수성 꼬리 구역은 서열 번호: 4에 제시된 아미노산 서열을 가지는 항균 조성물.
10.
전술한 구체예 중 어느 하나에 있어서, 항균 펩티드는 두 개의 양친매성 구역들을 포함하는 항균 조성물.
11.
구체예 10에 있어서, 두 개의 양친매성 구역들은 링커에 의해 함께 결합되는 항균 조성물.
12.
구체예 11에 있어서, 링커는 버블 구역 또는 베타 턴을 포함하는 항균 조성물.
13.
구체예 10 내지 12 중 어느 하나에 있어서, 두 개의 양친매성 구역들은 이량체 구조를 형성하는 항균 조성물.
14.
구체예 10 내지 13 중 어느 하나에 있어서, 두 개의 양친매성 구역들은 동일한 아미노산 서열을 가지는 항균 조성물.
15.
구체예 10 내지 13 중 어느 하나에 있어서, 두 개의 양친매성 구역들은 상이한 아미노산 서열들을 가지는 항균 조성물.
16.
전술한 구체예 중 어느 하나에 있어서, 항균 펩티드는 다음으로 구성된 그룹에서 선택된 아미노산 서열을 포함하는 항균 조성물: 서열 번호: 23, 25, 17, 12, 13, 27, 1 to 6, 8, 9, 14 내지 16, 18 내지 22, 24, 26, 28 내지 30; 서열 번호: 23, 25, 17, 12, 13, 27, 1 내지 6, 8, 9, 14 내지 16, 18 내지 22, 24, 26, 28 내지 30 중 어느 하나와 5 또는 그 미만의 아미노산 차이를 가지는 아미노산 서열; 및 링커에 의해 연결되는 이의 동종이량체 또는 이종이량체.
17.
구체예 1 내지 16 중 어느 하나의 항균 조성물 및 제약상 허용가능한 담체를 포함하는 제약학적 조성물.
18.
구체예 17에 있어서, 조성물은 경구 투여, 비경구 투여, 또는 국소 투여용으로 제형화되는 제약학적 조성물.
19.
구체예 18에 있어서, 조성물은 경구 투여용으로 제형화되며 장용 코팅을 추가로 포함하는 제약학적 조성물.
20.
구체예 18에 있어서, 조성물은 국소 전달용으로 다음으로 이루어진 그룹에서 선택된 형태로 제형화되는 제약학적 조성물: 겔 현탁액, 크림, 마이크로니들, 및 붕대 또는 국소 패치로 주입.
21.
구체예 17 내지 20 중 어느 하나에 있어서, 부가적 생물활성 제제를 추가로 포함하는 제약학적 조성물.
22.
구체예 21에 있어서, 부가적 생물활성 제제는 다음으로 구성된 그룹에서 선택되는 제약학적 조성물: 항균 제제, 항-염증 약제, 항-구역질 약제, 항-통증 약제, 및 이의 조합.
23.
구체예 17에 있어서, 조성물은 이식 의학 장치 표면 위에 코팅되도록 제형화되는 제약학적 조성물.
24.
구체예 23에 있어서, 의학 장치는 다음으로 구성된 그룹에서 선택되는 제약학적 조성물: 외과용 기구 및 내재용 의학 장치.
25.
구체예 17 내지 24 중 어느 하나에 따른 제약학적 조성물을 피험체에 투여하는 것을 포함하는, 이를 필요로 하는 피험체에서 미생물 감염의 치료 또는 예방 방법.
26.
구체예 25에 있어서, 제약학적 조성물은 피험체에 경구로, 비경구로, 국소로 투여되는 치료 또는 예방 방법.
27.
구체예 25에 있어서, 제약학적 조성물은 의학 장치를 피험체에 삽입하기 전 의학 장치 표면에 조성물을 도포함으로써 피험체에 투여되는 치료 또는 예방 방법.
28.
구체예 25 내지 27 중 어느 하나에 있어서, 피험체는 다음으로 구성된 그룹에서 선택되는 치료 또는 예방 방법: 인간, 가축, 경작용 동물, 및 동물원 동물.
또한 해당 기술 분야의 숙련된 기술자는, 본 발명이 바람직한 구체예들과 관련하여 상기 설명되었으나, 이러한 구체예들에 한정되지 않음을 알게될 것이다. 상기 설명된 본 발명의 다양한 특징들 및 양상들은 개별적으로 또는 결합하여 사용될 수 있다. 또한, 본 발명은 특정 환경에서의 구현 내용으로 설명되었으나, 특정 분야에 있어서 해당 분야의 숙련된 기술자는, 본 발명의 유용성이 상기 구현 내용에 제한되는 것은 아니며 본 발명은 임의의 수많은 환경들 및 구현 내용들에서 유익하게 사용될 수 있음을 알게 될 것이다. 따라서 하기 제시된 청구범위는 본 명세서에 개시된 본 발명의 전 범위 및 사상을 고려하여 해석되어야 한다.
SEQUENCE LISTING
<110> Riptide Bioscience, Inc.
Jaynes, Jesse
Clemens, L. Edward
Lopez, Henry Wilfred
<120> Antimicrobial Peptides and Methods of Use Thereof
<130> RIPT-002WO
<140> PCT/US2016/023801
<141> 2016-03-23
<150> US62/137,206
<151> 2015-03-23
<160> 30
<170> PatentIn version 3.5
<210> 1
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic polypeptide
<400> 1
Arg Val Phe Lys Lys Ala Phe Arg Lys Phe Lys Lys Leu Phe Lys Arg
1 5 10 15
Ala Phe
<210> 2
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic polypeptide
<400> 2
Phe Ala Arg Lys Phe Leu Lys Lys Phe Lys Arg Phe Ala Lys Lys Phe
1 5 10 15
Val Arg
<210> 3
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic polypeptide
<400> 3
Phe Lys Arg Lys Ile Lys Ala Lys Leu Arg Phe Lys Ala Lys Val Arg
1 5 10 15
Leu Lys
<210> 4
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic polypeptide
<400> 4
Phe Ala Phe Ala Phe
1 5
<210> 5
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic polypeptide
<400> 5
Phe Ala Phe Ala Phe Arg Val Phe Lys Lys Ala Phe Arg Lys Phe Lys
1 5 10 15
Lys Leu Phe Lys Arg Ala Phe
20
<210> 6
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic polypeptide
<400> 6
Phe Ala Arg Lys Phe Leu Lys Lys Phe Lys Arg Phe Ala Lys Lys Phe
1 5 10 15
Val Arg Phe Ala Phe Ala Phe
20
<210> 7
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic polypeptide
<400> 7
Cys Leu Gly Arg Phe Cys
1 5
<210> 8
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic polypeptide
<400> 8
Lys Ile Arg Ala Lys Leu Cys Leu Gly Arg Phe Cys Ile Arg Ala Lys
1 5 10 15
Leu Arg
<210> 9
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic polypeptide
<400> 9
Lys Ile Lys Ala Arg Leu Cys Leu Gly Lys Phe Cys Ile Lys Ala Arg
1 5 10 15
Leu Lys
<210> 10
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic polypeptide
<220>
<221> VARIANT
<222> 1, 6
<223> Xaa is any naturally occurring amino acid
<400> 10
Xaa Gly Pro Gly Arg Xaa
1 5
<210> 11
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic polypeptide
<400> 11
Phe Gly Pro Gly Arg Phe
1 5
<210> 12
<211> 50
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic polypeptide
<400> 12
Phe Ala Phe Ala Phe Lys Ala Phe Lys Lys Ala Phe Lys Lys Phe Lys
1 5 10 15
Lys Ala Phe Lys Lys Ala Phe Gly Pro Gly Arg Phe Ala Lys Lys Phe
20 25 30
Ala Lys Lys Phe Lys Lys Phe Ala Lys Lys Phe Ala Lys Phe Ala Phe
35 40 45
Ala Phe
50
<210> 13
<211> 50
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic polypeptide
<400> 13
Phe Ala Lys Lys Phe Ala Lys Lys Phe Lys Lys Phe Ala Lys Lys Phe
1 5 10 15
Ala Lys Phe Ala Phe Ala Phe Gly Pro Gly Arg Phe Ala Phe Ala Phe
20 25 30
Lys Ala Phe Lys Lys Ala Phe Lys Lys Phe Lys Lys Ala Phe Lys Lys
35 40 45
Ala Phe
50
<210> 14
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic polypeptide
<400> 14
Met Gly Phe Lys Leu Arg Ala Lys Ile Lys Val Arg Leu Arg Ala Lys
1 5 10 15
Ile Lys Leu
<210> 15
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic polypeptide
<220>
<221> VARIANT
<222> 3, 8
<223> Xaa is ornithine
<400> 15
Cys Val Xaa Leu Phe Pro Val Xaa Leu Phe Pro Cys
1 5 10
<210> 16
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic polypeptide
<400> 16
Cys Lys Leu Arg Phe Arg Gly Pro Gly Arg Ile Lys Val Arg Leu Cys
1 5 10 15
<210> 17
<211> 26
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic polypeptide
<400> 17
Cys Pro Gly Phe Ala Lys Lys Phe Ala Lys Lys Phe Lys Lys Phe Ala
1 5 10 15
Lys Lys Phe Ala Lys Phe Ala Phe Ala Phe
20 25
<210> 18
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic polypeptide
<400> 18
Lys Ile Arg Ala Lys Leu Cys Leu Gly Arg Phe Cys Ile Arg Ala Lys
1 5 10 15
Leu Arg
<210> 19
<211> 26
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic polypeptide
<400> 19
Lys Lys Lys Pro Lys Pro Pro Tyr Leu Pro Lys Pro Lys Pro Pro Pro
1 5 10 15
Phe Phe Pro Pro Lys Leu Pro Pro Lys Ile
20 25
<210> 20
<211> 26
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic polypeptide
<400> 20
Phe Ala Phe Ala Phe Lys Ala Phe Lys Lys Ala Phe Lys Lys Phe Lys
1 5 10 15
Lys Ala Phe Lys Lys Ala Phe Gly Pro Cys
20 25
<210> 21
<211> 22
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic polypeptide
<400> 21
Phe Ala Phe Ala Phe Ala Phe Lys Lys Ala Phe Lys Lys Phe Lys Lys
1 5 10 15
Ala Phe Lys Lys Ala Phe
20
<210> 22
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic polypeptide
<220>
<221> VARIANT
<222> 6, 9, 10, 13, 14, 16, 17, 20, 21
<223> Xaa is ornithine
<400> 22
Phe Ala Phe Ala Phe Xaa Ala Phe Xaa Xaa Ala Phe Xaa Xaa Phe Xaa
1 5 10 15
Xaa Ala Phe Xaa Xaa Ala Phe
20
<210> 23
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic polypeptide
<220>
<221> VARIANT
<222> 3, 4, 7, 8, 10, 11, 14, 15, 18
<223> Xaa is ornithine
<400> 23
Phe Ala Xaa Xaa Phe Ala Xaa Xaa Phe Xaa Xaa Phe Ala Xaa Xaa Phe
1 5 10 15
Ala Xaa Phe Ala Phe Ala Phe
20
<210> 24
<211> 22
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic polypeptide
<400> 24
Phe Ala Lys Lys Phe Ala Lys Lys Phe Lys Lys Phe Ala Lys Lys Phe
1 5 10 15
Ala Phe Ala Phe Ala Phe
20
<210> 25
<211> 31
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic polypeptide
<220>
<221> VARIANT
<222> 11, 12, 15, 16, 18, 19, 22, 23, 26
<223> Xaa is ornithine
<400> 25
Arg Leu Ala Arg Ile Val Gly Gly Phe Ala Xaa Xaa Phe Ala Xaa Xaa
1 5 10 15
Phe Xaa Xaa Phe Ala Xaa Xaa Phe Ala Xaa Phe Ala Phe Ala Phe
20 25 30
<210> 26
<211> 33
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic polypeptide
<220>
<221> VARIANT
<222> 13, 14, 17, 18, 20, 21, 24, 25, 28
<223> Xaa is ornithine
<400> 26
Cys Arg Leu Ala Arg Ile Val Cys Gly Gly Phe Ala Xaa Xaa Phe Ala
1 5 10 15
Xaa Xaa Phe Xaa Xaa Phe Ala Xaa Xaa Phe Ala Xaa Phe Ala Phe Ala
20 25 30
Phe
<210> 27
<211> 24
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic polypeptide
<220>
<221> VARIANT
<222> 2, 4, 6, 13, 19, 21, 23
<223> Xaa is ornithine
<400> 27
Phe Xaa Ile Xaa Ala Xaa Leu Gly Gly Cys Leu Gly Xaa Phe Cys Gly
1 5 10 15
Gly Ile Xaa Ala Xaa Leu Xaa Phe
20
<210> 28
<211> 26
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic polypeptide
<220>
<221> VARIANT
<222> 1, 3, 11, 13, 14, 15, 16, 18, 20, 21, 22, 26
<223> Xaa is ornithine
<400> 28
Xaa Leu Xaa Ser Leu Leu Lys Thr Leu Ser Xaa Ala Xaa Xaa Xaa Xaa
1 5 10 15
Leu Xaa Thr Xaa Xaa Xaa Ala Ile Ser Xaa
20 25
<210> 29
<211> 27
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic polypeptide
<220>
<221> VARIANT
<222> 7, 8, 9, 12, 14, 16
<223> Xaa is ornithine
<400> 29
Ala Leu Trp Met Thr Leu Xaa Xaa Xaa Val Leu Xaa Ala Xaa Ala Xaa
1 5 10 15
Ala Leu Asn Ala Val Leu Val Gly Ala Asn Ala
20 25
<210> 30
<211> 27
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic polypeptide
<220>
<221> VARIANT
<222> 7, 8, 9, 12, 14, 16
<223> Xaa is ornithine
<400> 30
Ala Phe Ala Phe Thr Ala Xaa Xaa Xaa Phe Ala Xaa Phe Xaa Ala Xaa
1 5 10 15
Phe Ala Asn Phe Ala Phe Ala Gly Phe Asn Ala
20 25
Claims (28)
- 서열 번호: 23, 25, 17, 12, 13, 27, 1 내지 6, 8, 9, 14 내지16, 18 내지 22, 24, 26, 및 28 내지 30 중 어느 하나에 최소한 60% 서열 동일성을 가지는 아미노산 서열을 포함하는 항균 펩티드를 포함하는 항균 조성물.
- 청구항 1에 있어서, 항균 펩티드는 세균, 진균 또는 원충 유기체 중 최소한 하나를 사멸시킴에 효과적임을 특징으로 하는 항균 조성물.
- 청구항 2에 있어서, 상기 유기체는 다음으로 구성된 그룹에서 선택된 속으로 분류된 종임을 특징으로 하는 항균 조성물: 아시네토박터(Acinetobacter), 악티노바실루스(Actinobacillus), 버크홀데리아(Burkholderia), 칸디다(Candida), 클로스트리디움(Clostridium), 엔테로박터(Enterobacter), 엔테로코쿠스(Enterococcus), 에스체리치아(Escherichia), 푸소박테리움(Fusobacterium), 포르피로모나스(Porphyromonas), 슈도모나스(Pseudomonas), 스타필로코쿠스(Staphylococcus), 및 스트렙토코쿠스(Streptococcus).
- 청구항 3에 있어서, 유기체는 다음으로 구성된 그룹에서 선택됨을 특징으로 하는 항균 조성물: 아시네토박터 바우만니(Acinetobacter baumannii), 악티노바실루스 악티노마이세템코미탄스 (Actinobacillus actinomycetemcomitans), 버크홀데리아 세파시아(Burkholderia cepacia), 버크홀데리아 타일란덴시스(Burkholderia thailandensis), 칸디다 알비칸스(Candida albicans), 칸디다 크루세이(Candida krusei), 칸디다 트로피칼리스 (Candida tropicalis), 클로스트리디움 디피실레(Clostridium difficile), 엔테로박터 아에로겐스(Enterobacter aerogens), 엔테로박터 클로아카 (Enterobacter cloaca), 엔테로코쿠스 파에시움(Enterococcus faecium), 에스체리치아 콜리 (Escherichia coli), 푸소박테리움 뉴클레아툼 (Fusobacterium nucleatum), 포르피로모나스 진지발리스(Porphyromonas gingivalis), 슈도모나스 아에루지노사(Pseudomonas aeruginosa), 슈도모나스 아에루지노사(Pseudomonas aeruginosa), 슈도모나스 아에루지노사(Pseudomonas aeruginosa), 스타필루코쿠스 아우레우스(Staphylococcus aureus), 스타필루코쿠스 아우레우스(Staphylococcus aureus), 스타필로코쿠스 에피더미디스(Staphylococcus epidermidis), 및 스트렙토코쿠스 뉴모니에(Streptococcus pneumoniae).
- 청구항 2 내지 4 중 어느 한 항에 있어서, 항균 펩티드는 미생물 균막(microbial biofilm)으로서 성장하는 미생물을 사멸시킴에 효과적임을 특징으로 하는 항균 조성물.
- 전술한 청구항 중 어느 한 항에 있어서, 항균 펩티드는 미생물 병원체의 막에 결합하는 양이온 표면을 가지는 양친매성 구역(amphipathic region)을 포함함을 특징으로 하는 항균 조성물.
- 전술한 청구항 중 어느 한 항에 있어서, 항균 펩티드는 폴리프롤린 나선 구조를 포함함을 특징으로 하는 항균 조성물.
- 전술한 청구항 중 어느 한 항에 있어서, 항균 펩티드는 N-말단, C-말단, 또는 이 둘 모두에 소수성 꼬리 구역을 포함하고, 소수성 꼬리 구역은 4 내지 10개의 소수성 아미노산의 서열을 가짐을 특징으로 하는 항균 조성물.
- 청구항 8에 있어서, 소수성 꼬리 구역은 서열 번호: 4에 제시된 아미노산 서열을 가짐을 특징으로 하는 항균 조성물.
- 전술한 청구항 중 어느 한 항에 있어서, 항균 펩티드는 두 개의 양친매성 구역들을 포함함을 특징으로 하는 항균 조성물.
- 청구항 10에 있어서, 두 개의 양친매성 구역들은 링커에 의해 함께 결합됨을 특징으로 하는 항균 조성물.
- 청구항 11에 있어서, 링커는 버블 구역 (bubble region) 또는 베타 턴 (beta turn)을 포함함을 특징으로 하는 항균 조성물.
- 청구항 10 내지 12 중 어느 한 항에 있어서, 두 개의 양친매성 구역들은 이량체 구조를 형성함을 특징으로 하는 항균 조성물.
- 청구항 10 내지 13 중 어느 한 항에 있어서, 두 개의 양친매성 구역들은 동일한 아미노산 서열을 가짐을 특징으로 하는 항균 조성물.
- 청구항 10 내지 13 중 어느 한 항에 있어서, 두 개의 양친매성 구역들은 상이한 아미노산 서열들을 가짐을 특징으로 하는 항균 조성물.
- 전술한 청구항 중 어느 한 항에 있어서, 항균 펩티드는 다음으로 구성된 그룹에서 선택된 아미노산 서열을 포함함을 특징으로 하는 항균 조성물: 서열 번호: 23, 25, 17, 12, 13, 27, 1 내지 6, 8, 9, 14 내지 16, 18 내지 22, 24, 26, 28 내지 30; 서열 번호: 23, 25, 17, 12, 13, 27, 1 내지 6, 8, 9, 14 내지 16, 18 내지 22, 24, 26, 28 내지 30 중 어느 하나와 5개 또는 그 미만의 아미노산 차이를 가지는 아미노산 서열; 및 링커에 의해 연결되는 이의 동종이량체 또는 이종이량체.
- 청구항 1 내지 16 중 어느 한 항의 항균 조성물 및 제약상 허용가능한 담체를 포함하는 제약학적 조성물.
- 청구항 17에 있어서, 조성물은 경구 투여, 비경구 투여, 또는 국소 투여용으로 제형화됨을 특징으로 하는 제약학적 조성물.
- 청구항 18에 있어서, 조성물은 경구 투여용으로 제형화되며 장용 코팅을 추가로 포함함을 특징으로 하는 제약학적 조성물.
- 청구항 18에 있어서, 조성물은 국소 전달용으로 다음으로 이루어진 그룹에서 선택된 형태로 제형화됨을 특징으로 하는 제약학적 조성물: 겔 현탁액, 크림, 마이크로니들 (microneedle), 및 붕대 또는 국소 패치로 주입.
- 청구항 17 내지 20 중 어느 한 항에 있어서, 부가적 생물활성 제제를 추가로 포함함을 특징으로 하는 제약학적 조성물.
- 청구항 21에 있어서, 부가적 생물활성 제제는 다음으로 구성된 그룹에서 선택됨을 특징으로 하는 제약학적 조성물: 항균 제제, 항-염증 약제, 항-구역질 약제, 항-통증 약제, 및 이의 조합.
- 청구항 17에 있어서, 조성물은 이식가능한 의학 장치 표면 위에 코팅되도록 제형화됨을 특징으로 하는 제약학적 조성물.
- 청구항 23에 있어서, 의학 장치는 다음으로 구성된 그룹에서 선택됨을 특징으로 하 제약학적 조성물: 외과용 기구 및 내재용 (indwelling) 의학 장치.
- 청구항 17 내지 24 중 어느 한 항에 따른 제약학적 조성물을 피험체에 투여하는 것을 포함하는, 이를 필요로 하는 피험체에서 미생물 감염의 치료 또는 예방 방법.
- 청구항 25에 있어서, 제약학적 조성물은 피험체에 경구로, 비경구로, 국소로 투여됨을 특징으로 하는 치료 또는 예방 방법.
- 청구항 25에 있어서, 제약학적 조성물은 의학 장치를 피험체에 삽입하기 전 의학 장치 표면에 조성물을 도포함으로써 피험체에 투여됨을 특징으로 하는 치료 또는 예방 방법.
- 청구항 25 내지 27 중 어느 한 항에 있어서, 피험체는 다음으로 구성된 그룹에서 선택됨을 특징으로 하는 치료 또는 예방 방법: 인간, 가축, 경작용 동물, 및 동물원 동물.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562137206P | 2015-03-23 | 2015-03-23 | |
| US62/137,206 | 2015-03-23 | ||
| PCT/US2016/023801 WO2016154328A2 (en) | 2015-03-23 | 2016-03-23 | Antimicrobial peptides and methods of use thereof |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20180002618A true KR20180002618A (ko) | 2018-01-08 |
Family
ID=56978879
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020177030183A KR20180002618A (ko) | 2015-03-23 | 2016-03-23 | 항균 펩티드 및 이의 사용방법 |
Country Status (8)
| Country | Link |
|---|---|
| US (2) | US10017542B2 (ko) |
| EP (2) | EP3903823A3 (ko) |
| JP (2) | JP6964577B2 (ko) |
| KR (1) | KR20180002618A (ko) |
| CN (2) | CN107614004B (ko) |
| AU (2) | AU2016235147B2 (ko) |
| CA (1) | CA2981705A1 (ko) |
| WO (1) | WO2016154328A2 (ko) |
Families Citing this family (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20180002618A (ko) * | 2015-03-23 | 2018-01-08 | 립타이드 바이오사이언스, 인코포레이티드 | 항균 펩티드 및 이의 사용방법 |
| GB201812980D0 (en) * | 2018-08-09 | 2018-09-26 | Univ Oxford Innovation Ltd | Cell-penetrating peptides |
| US10413584B1 (en) | 2018-08-29 | 2019-09-17 | Riptide Bioscience, Inc. | Peptides having immunomodulatory properties |
| AU2018438604A1 (en) * | 2018-08-29 | 2021-03-18 | Riptide Bioscience, Inc. | Peptides having immunomodulatory properties |
| US20200102356A1 (en) * | 2018-10-01 | 2020-04-02 | NMC Inc. | Compositions and Methods for the Treatment of Huanglongbing (HLB) aka Citrus Greening in Citrus Plants |
| WO2020081097A1 (en) * | 2018-10-19 | 2020-04-23 | Riptide Bioscience, Inc. | Antimicrobial peptides and methods of using the same |
| US10548944B1 (en) * | 2018-10-19 | 2020-02-04 | Riptide Bioscience, Inc. | Antimicrobial peptides and methods of using the same |
| CN114072481B (zh) * | 2019-04-04 | 2023-06-30 | 台湾海洋大学 | 碳量子点及其用途 |
| CN110305193B (zh) * | 2019-07-18 | 2021-10-08 | 河南科技大学 | 一种抗牙龈卟啉单胞菌多肽及应用 |
| CN114989254B (zh) * | 2022-06-17 | 2023-11-03 | 中山大学 | 一种多肽及其设计方法和在制备抑制具核梭杆菌产品或预防结直肠癌药物中的应用 |
Family Cites Families (19)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR900701295A (ko) * | 1988-05-27 | 1990-12-01 | 원본미기재 | 양극성 펩타이드류와 그것에 관한 용도 |
| DE69034085T2 (de) * | 1989-04-10 | 2004-05-27 | Helix BioMedix, Inc., Bothell | Lytsche und proliferative Peptide und deren Verwendung als Pharmaka und Phytopharmaka |
| US5561107A (en) * | 1993-06-04 | 1996-10-01 | Demeter Biotechnologies, Ltd. | Method of enhancing wound healing by stimulating fibroblast and keratinocyte growth in vivo, utilizing amphipathic peptides |
| IL114697A0 (en) * | 1994-07-22 | 1995-11-27 | Demeter Biotech Ltd | Polypeptides comprising ubiquitin-lytic peptide fusion protein products deriving therefrom their preparation and use |
| JPH08134075A (ja) * | 1994-11-02 | 1996-05-28 | Yamanouchi Pharmaceut Co Ltd | 新規なカルバペネム誘導体 |
| KR19990082383A (ko) * | 1996-02-16 | 1999-11-25 | 스티븐슨 린다 에스. | 항균성 펩티드 및 이의 사용법 |
| EP0932413A1 (en) * | 1996-10-04 | 1999-08-04 | Demegen, Inc. | Method for treatment of immunodeficiency virus infection |
| US6680058B1 (en) * | 1997-09-03 | 2004-01-20 | Board Of Supervisors Of Louisiana State University And Agricultural And Mechanical College | Compositions and methods for contraception in or sterilization of mammals |
| JP2003509010A (ja) * | 1999-05-31 | 2003-03-11 | ノボザイムス アクティーゼルスカブ | ペプチドのスクリーニング方法 |
| US6432415B1 (en) * | 1999-12-17 | 2002-08-13 | Axrix Laboratories, Inc. | Pharmaceutical gel and aerosol formulations and methods to administer the same to skin and mucosal surfaces |
| WO2004033715A1 (en) * | 2002-10-09 | 2004-04-22 | Novozymes A/S | A method for screening for an antimicrobial polypeptide |
| WO2007072037A1 (en) * | 2005-12-22 | 2007-06-28 | Novabiotics Limited | Cyclic antimicrobial peptides |
| AU2007229275B2 (en) * | 2006-03-23 | 2013-02-07 | Agriculture Victoria Services Pty Ltd | Antimicrobial protein |
| BRPI0711470A2 (pt) * | 2006-05-16 | 2011-11-16 | Dermagen Ab | peptìdeo antimicrobiano, composição antimicrobiana/ farmacêutica, produto, uso do peptìdeo antimicrobiano, da composição farmacêutica ou do produto, e, método para tratar um mamìfero apresentando uma infecção ou doença microbiana para tratamento profilático |
| US7288622B1 (en) * | 2006-09-19 | 2007-10-30 | Issar Pharmaceuticals Pvt Ltd | Composition for treatment of burns and wounds |
| US7803755B2 (en) * | 2006-12-21 | 2010-09-28 | Jesse Jaynes | Molecules for the treatment and prevention of fungal diseases |
| US9163066B2 (en) * | 2010-06-29 | 2015-10-20 | Agromed Llc | Antimicrobial lytic peptides |
| EP2468856A1 (en) * | 2010-12-23 | 2012-06-27 | Lysando Aktiengesellschaft | Antimicrobial Agents |
| KR20180002618A (ko) * | 2015-03-23 | 2018-01-08 | 립타이드 바이오사이언스, 인코포레이티드 | 항균 펩티드 및 이의 사용방법 |
-
2016
- 2016-03-23 KR KR1020177030183A patent/KR20180002618A/ko unknown
- 2016-03-23 CN CN201680025771.3A patent/CN107614004B/zh active Active
- 2016-03-23 AU AU2016235147A patent/AU2016235147B2/en not_active Ceased
- 2016-03-23 CN CN202211040273.XA patent/CN115475232A/zh active Pending
- 2016-03-23 WO PCT/US2016/023801 patent/WO2016154328A2/en active Application Filing
- 2016-03-23 EP EP20197578.6A patent/EP3903823A3/en not_active Withdrawn
- 2016-03-23 EP EP16769619.4A patent/EP3274472B1/en active Active
- 2016-03-23 JP JP2018502035A patent/JP6964577B2/ja active Active
- 2016-03-23 US US15/078,794 patent/US10017542B2/en active Active
- 2016-03-23 CA CA2981705A patent/CA2981705A1/en not_active Abandoned
-
2018
- 2018-06-05 US US16/000,709 patent/US20190071470A1/en not_active Abandoned
-
2019
- 2019-08-30 AU AU2019222918A patent/AU2019222918B2/en active Active
-
2020
- 2020-12-15 JP JP2020207711A patent/JP7267251B2/ja active Active
Also Published As
| Publication number | Publication date |
|---|---|
| JP2018512454A (ja) | 2018-05-17 |
| JP6964577B2 (ja) | 2021-11-10 |
| CN115475232A (zh) | 2022-12-16 |
| US20160296594A1 (en) | 2016-10-13 |
| US10017542B2 (en) | 2018-07-10 |
| WO2016154328A2 (en) | 2016-09-29 |
| JP2021054842A (ja) | 2021-04-08 |
| AU2016235147B2 (en) | 2019-09-19 |
| CA2981705A1 (en) | 2016-09-29 |
| US20190071470A1 (en) | 2019-03-07 |
| AU2019222918A1 (en) | 2019-09-19 |
| CN107614004B (zh) | 2022-12-06 |
| EP3903823A3 (en) | 2022-02-23 |
| CN107614004A (zh) | 2018-01-19 |
| JP7267251B2 (ja) | 2023-05-01 |
| EP3274472A4 (en) | 2018-12-05 |
| AU2016235147A1 (en) | 2017-10-26 |
| EP3903823A2 (en) | 2021-11-03 |
| EP3274472B1 (en) | 2020-09-23 |
| AU2019222918B2 (en) | 2021-10-21 |
| EP3274472A2 (en) | 2018-01-31 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7267251B2 (ja) | 抗菌組成物及び医薬組成物 | |
| Narayana et al. | Antimicrobial peptides: possible anti-infective agents | |
| US12115209B2 (en) | ROMO1-derived antimicrobial peptides including lysine substitution and variants thereof | |
| Mirski et al. | Utilisation of peptides against microbial infections–a review | |
| US9562085B2 (en) | Antimicrobial peptide | |
| US10174081B2 (en) | Antimicrobial peptides and uses therefore | |
| CA2076529A1 (en) | Compositions and methods for treating infections caused by organisms sensitive to beta-lactam antibiotics | |
| Rajasekaran et al. | The design of a cell-selective fowlicidin-1-derived peptide with both antimicrobial and anti-inflammatory activities | |
| CA2451310C (en) | Antimicrobial peptides | |
| CN111171159A (zh) | 抗浮游菌和胞内菌感染的抗菌肽tat-kr-12及其制备方法与应用 | |
| US20190352337A1 (en) | Antimicrobial peptides with wound healing activity | |
| KR102492397B1 (ko) | 흰점박이꽃무지 유충으로부터 분리한 프로테티아마이신-4 펩타이드 및 이의 용도 | |
| KR102511151B1 (ko) | 왕지네 유래 펩타이드 스콜로펜드라신-13을 포함하는 항균 조성물 | |
| Umnyakova et al. | Peptides and antibiotic resistance | |
| Chrom | Combinatorial efficacy of antimicrobial peptides and silver ions | |
| KR20180022007A (ko) | 바퀴벌레에서 유래한 항균 펩타이드 페리플라네타신-4 및 그의 조성물 |