KR20170082537A - Vegf 길항제에 대한 반응 예측 - Google Patents
Vegf 길항제에 대한 반응 예측 Download PDFInfo
- Publication number
- KR20170082537A KR20170082537A KR1020177013270A KR20177013270A KR20170082537A KR 20170082537 A KR20170082537 A KR 20170082537A KR 1020177013270 A KR1020177013270 A KR 1020177013270A KR 20177013270 A KR20177013270 A KR 20177013270A KR 20170082537 A KR20170082537 A KR 20170082537A
- Authority
- KR
- South Korea
- Prior art keywords
- cancer
- patient
- expression
- tumor
- level
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/337—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having four-membered rings, e.g. taxol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/4164—1,3-Diazoles
- A61K31/4188—1,3-Diazoles condensed with other heterocyclic ring systems, e.g. biotin, sorbinil
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/4738—Quinolines; Isoquinolines ortho- or peri-condensed with heterocyclic ring systems
- A61K31/4745—Quinolines; Isoquinolines ortho- or peri-condensed with heterocyclic ring systems condensed with ring systems having nitrogen as a ring hetero atom, e.g. phenantrolines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/513—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim having oxo groups directly attached to the heterocyclic ring, e.g. cytosine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/519—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/555—Heterocyclic compounds containing heavy metals, e.g. hemin, hematin, melarsoprol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7028—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages
- A61K31/7034—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages attached to a carbocyclic compound, e.g. phloridzin
- A61K31/704—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages attached to a carbocyclic compound, e.g. phloridzin attached to a condensed carbocyclic ring system, e.g. sennosides, thiocolchicosides, escin, daunorubicin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7042—Compounds having saccharide radicals and heterocyclic rings
- A61K31/7052—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides
- A61K31/706—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom
- A61K31/7064—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom containing condensed or non-condensed pyrimidines
- A61K31/7068—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom containing condensed or non-condensed pyrimidines having oxo groups directly attached to the pyrimidine ring, e.g. cytidine, cytidylic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K33/00—Medicinal preparations containing inorganic active ingredients
- A61K33/24—Heavy metals; Compounds thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K33/00—Medicinal preparations containing inorganic active ingredients
- A61K33/24—Heavy metals; Compounds thereof
- A61K33/243—Platinum; Compounds thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/19—Cytokines; Lymphokines; Interferons
- A61K38/21—Interferons [IFN]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/19—Cytokines; Lymphokines; Interferons
- A61K38/21—Interferons [IFN]
- A61K38/212—IFN-alpha
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/39558—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against tumor tissues, cells, antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/22—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against growth factors ; against growth regulators
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
- C07K16/3069—Reproductive system, e.g. ovaria, uterus, testes, prostate
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
- G01N33/57407—Specifically defined cancers
- G01N33/57449—Specifically defined cancers of ovaries
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/577—Immunoassay; Biospecific binding assay; Materials therefor involving monoclonal antibodies binding reaction mechanisms characterised by the use of monoclonal antibodies; monoclonal antibodies per se are classified with their corresponding antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/705—Assays involving receptors, cell surface antigens or cell surface determinants
- G01N2333/70596—Molecules with a "CD"-designation not provided for elsewhere in G01N2333/705
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/705—Assays involving receptors, cell surface antigens or cell surface determinants
- G01N2333/71—Assays involving receptors, cell surface antigens or cell surface determinants for growth factors; for growth regulators
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/52—Predicting or monitoring the response to treatment, e.g. for selection of therapy based on assay results in personalised medicine; Prognosis
Abstract
본 발명은 베바시주맙과 같은 VEGF 길항제에 대한 환자 이점 또는 반응성을 측정하기 위한 선택 기준으로서의, 높은 CD31 및/또는 종양 VEGFA의 용도를 기술한다. 본 발명은 또한 베바시주맙과 같은 VEGF 길항제에 의해 화학요법 및/또는 항암 치료 레지멘을 받고 있는 난소암 환자와 같은 암을 갖는 환자를 치료하기 위한 선별 기준으로서의, 높은 CD31 및/또는 종양 VEGFA의 용도를 기술한다.
Description
기술분야
본 발명은 VEGF 길항제, 예를 들어 항-VEGF 항체로 치료함으로써 이점을 얻을 수 있는 환자를 식별하는 방법에 관한 것이다.
혈관형성은 암 발생에 필수적이며 원발성 종양의 크기와 성장을 조절할 뿐만 아니라 침습성 및 전이성에 영향을 준다. 따라서, 혈관형성 과정을 매개하는 기전이 방향성 항암 요법의 잠재적 표적으로 연구되어왔다. 혈관형성 조절자의 연구 초기에, 혈관 내피 성장 인자(VEGF) 신호 전달 경로가 여러 암 유형에서 혈관형성 활성을 조절하는 것으로 밝혀졌으며 이러한 경로를 여러 지점에서 조절하기 위해 다양한 치료법이 개발되었다. 진료소에서 혈관형성 억제제의 사용이 성공을 거뒀지만, 모든 환자가 이러한 치료에 반응하거나 완전히 반응한 것은 아니다. 이러한 불완전한 반응의 기초가 되는 기전은 알려지지 않았다. 따라서, 항-혈관형성 암 치료에 민감하거나 반응하는 환자 하위그룹에 대한 식별이 필요하다.
베바시주맙(Avastin®)은 VEGF의 생물학적 효과에 특이적으로 결합하고 그 생물학적 효과를 차단하는 재조합 인간화 단일클론 IgG1 항체이다. 베바시주맙은 매년 총 250만 명이 넘는 사망자를 발생케 한 결장직장암, 유방암, 비소세포폐암(NSCLC), 난소암 및 신장암과 같은 5가지 일반적인 유형의 암의 진행 단계의 치료를 위해 유럽에서 승인되었다. 미국에서는 베바시주맙이 FDA 승인을 받은 최초의 항-혈관형성 요법이었으며 현재는 결장직장암, NSCLC, 뇌암(아교모세포종), 신장암(신장 세포 암종) 및 자궁 경부암과 같은 5가지 종양 유형의 치료를 위해 승인되었다. 지금까지 50만 명이 넘는 환자가 베바시주맙으로 치료를 받았고, 450가지 이상의 임상 시험을 포함한 포괄적인 임상 프로그램이 다양한 환경(예를 들어, 진행 또는 초기 단계 질병)에서 다양한 종류의 암 유형(결장직장암, 유방암, NSCLC, 뇌, 위암, 난소암 및 전립선암 등)을 치료할 수 있는 베바시주맙의 추가적인 사용법을 연구하고 있다.
베바시주맙은 광범위한 화학요법 및 기타 항암 치료와 병용할 때 효능을 나타내는 병용-치료제로서의 공산을 보여주었다. 예를 들어, 3상 연구는 표준 화학치료 레지멘과 베바시주맙의 병용에 유익한 효과가 있음을 보여주었다(참고: 예를 들어, Saltz et al., 2008, J. Clin. Oncol., 26:2013-2019; Yang et al., 2008, Clin. Cancer Res., 14:5893-5899; Hurwitz et al., 2004, N. Engl. J. Med., 350:2335-2342). 그러나 혈관형성 억제제에 대한 종래 연구에서와 같이, 3상 연구의 일부에서는 베바시주맙을 화학치료 레지멘에 추가하면 일부 환자가 불완전한 반응을 보였다.
따라서, 혈관형성 억제제(예를 들어, 베바시주맙)뿐만 아니라 혈관형성 억제제(예를 들어, 베바시주맙)를 포함하는 병용 요법에 반응하거나 반응이 개선될 공산이 있는 환자를 식별하는 방법이 필요하다.
본 발명의 요약
일 양태에서, 본 발명은 암을 갖는 환자를 치료하는 방법을 특징으로 하며, 상기 방법은 치료적 유효량의 VEGF 길항제를 환자에게 투여하는 단계를 포함하고, 여기서, 상기 환자의 암은 암 유형에서 각각 CD31 발현 및/또는 종양 VEGFA 발현의 중간 수준 초과의 수준에서 CD31 및/또는 종양 VEGFA를 발현하는 것으로 측정되었다. 관련 양태에서, 본 발명은 암을 갖는 환자를 치료하는 방법에 사용하기 위한 VEGF 길항제를 특징으로 하며, 여기서, 상기 환자의 암은 암 유형에서 각각 CD31 발현 및/또는 종양 VEGFA 발현의 중간 수준 초과의 수준에서 CD31 및/또는 종양 VEGFA를 발현하는 것으로 측정되었고, 상기 방법은 치료적 유효량의 VEGF 길항제를 환자에게 투여하는 단계를 포함한다.
제2 양태에서, 본 발명은 VEGF 길항제의 투여로부터 이점을 얻을 수 있는 암을 앓고 있는 환자를 식별하는 방법을 특징으로 하며, 상기 방법은: a) 환자로부터 수득한 샘플에서 CD31 발현 및/또는 종양 VEGFA 발현 수준을 측정하는 단계로서, 여기서, 암 유형에서 각각 CD31 발현 및/또는 종양 VEGFA 발현의 중간 수준 초과의 수준에서 CD31 발현 및/또는 종양 VEGFA 발현이 환자가 VEGF 길항제의 투여로부터 이점을 얻을 수 있음을 나타내는 단계, 및 임의로 b) 환자에게 치료적 유효량의 VEGF 길항제를 투여하는 단계를 포함한다.
제3 양태에서, 본 발명은 암 치료를 위한 VEGF 길항제의 투여에 대한 환자의 반응성을 예측하는 방법을 특징으로 하며, 상기 방법은, a) 환자로부터 수득한 샘플에서 CD31 발현 및/또는 종양 VEGFA 발현 수준을 측정하는 단계로서, 여기서, 암 유형에서 각각 CD31 발현 및/또는 종양 VEGFA 발현의 중간 수준 초과의 수준에서 CD31 발현 및/또는 종양 VEGFA 발현이 환자가 VEGF 길항제의 투여에 더욱 반응성일 공산이 높다는 것을 나타내는, 단계, 및 임의로 b) 환자에게 치료적 유효량의 VEGF 길항제를 투여하는 단계를 포함한다.
특정 구현예에서, 샘플은 종양 조직 샘플이다. 다른 구현예에서, 상기 샘플은 선행보조 요법 또는 보조 요법 전에 수득된다.
추가의 구현예에서, 환자의 암은 암 유형에서 CD31 발현의 중간 수준 초과의 수준에서 CD31을 발현하는 것으로 측정되었다. 상기 구현예의 특정 양태에서, 환자의 암은 암 유형에서 CD31 발현에 대해 75번째 백분위수(percentile) 초과의 수준에서 CD31을 발현하는 것으로 측정되었다.
또 다른 구현예에서, 환자의 암은 암 유형에서 종양 VEGFA 발현에 대해 중간 수준 초과의 수준에서 종양 VEGFA를 발현하는 것으로 측정되었다. 상기 구현예의 특정 양태에서, 환자의 암은 암 유형에서 종양 VEGFA 발현에 대해 75번째 백분위수 초과의 수준에서 종양 VEGFA를 발현하는 것으로 측정되었다.
하나의 특정 구현예에서, VEGF 길항제의 투여는 환자에서 무진행 생존율(progression free survival; PFS)을 개선한다. 제2 특정 구현예에서, VEGF 길항제의 투여는 환자의 전체 생존율(overall survival; OS)을 개선한다. 제3 특정 구현예에서, VEGF 길항제는 화학요법 레지멘에서 하나 이상의 추가의 화학치료제와 조합하여 투여된다.
일부 구현예에서, 하나 이상의 추가의 화학치료제는 화학치료제, HER 항체, 종양 관련 항원에 대한 항체, 항-호르몬 화합물, 심장 보호제, 시토카인, EGFR-표적 약물, 항-혈관형성제, 티로신 키나아제, 억제제, COX 억제제, 비-스테로이드성 항-염증제, 파르네실 전달효소 억제제, 종양태아성 단백질 CA 125에 결합하는 항체, Her2 백신, HER 표적화 치료, Raf 또는 ras 억제제, 리포좀성 독소루비신, 토포테칸, 탁산, 이중 티로신 키나아제 억제제, TLK286, EMD-7200, 구토 치료 약제, 피부 발진이나 표준 여드름 치료를 예방하거나 치료하는 약제, 설사를 치료하거나 예방하는 약제, 체온 감소 약제 및 조혈 성장 인자로 이루어진 군으로부터 선택된다. 일부 바람직한 구현예에서, 화학치료제는 젬시타빈, 카보플라틴, 옥살리플라틴, 이리노테칸, 플루오로피리미딘(예를 들어, 5-FU), 파클리탁셀(예를 들어, nab-파클리탁셀), 도세탁셀, 토포테칸, 카페시타빈, 레코보린, 테모졸로마이드, 인터페론-알파 또는 리포좀성 독소루비신(예를 들어, 페길화 리포좀성 독소루비신)이다.
특정 구현예에서, 화학요법 레지멘은 카보플라틴 및 파클리탁셀; 카보플라틴 및 젬시타빈; 또는 파클리탁셀, 토포테칸 또는 페길화 리포좀성 독소루비신의 투여를 포함한다. 다른 구현예에서, 화학요법 레지멘은 카페시타빈 및 파클리탁셀; 또는 카페시 타빈 및 도세탁셀의 투여를 포함한다. 또 다른 구현예에서, 화학요법 레지멘은 테모졸로마이드 및 임의로 방사성요법의 투여를 포함한다. 추가의 구현예에서, 화학요법 레지멘은 플루로피리미딘, 이리노테칸, 시스플라틴, 플루로피리미딘 및 옥살리플라틴; 플루로피리미딘 및 이리노테칸; 플루로피리미딘, 레코보린 및 옥살리플라틴; 또는 아이로노테칸, 플루오로피리미딘 및 류코보린의 투여를 포함한다. 또 다른 구현예에서, 화학요법 레지멘은 파클리탁셀 및 토포테칸; 또는 파클리탁셀 및 시스플라틴의 투여를 포함한다. 최종 구현예에서, 화학요법 레지멘은 인터페론-알파2a의 투여를 포함한다.
제4 양태에서, 본 발명은 암을 앓고 있는 환자의 예후를 위한 방법을 특징으로 하며, 이 방법은, a) 환자로부터 수득된 샘플에서 CD31의 발현 수준을 측정하는 단계, b) CD31의 발현 수준을 암 유형의 CD31에 대한 중간 수준과 비교하는 단계, 및 c) 환자에 대한 예후를 측정하는 단계를 포함하고, 여기서, CD31의 발현이 CD31 발현의 중간 수준 초과인 경우 예후가 불량하다.
특정 양태에서, 본 방법은 환자가 생존율이 불량한 것으로 측정되는 경우 VEGF 길항제의 투여로부터 이점을 얻을 공산이 있는 환자를 식별하는 단계를 추가로 포함한다. 또 다른 양태에서, 상기 방법은 환자가 불량한 예후를 갖는 것으로 측정되면, 치료적 유효량의 VEGF 길항제를 환자에게 투여하는 단계를 추가로 포함한다. 일부 구현예에서, 상기 VEGF 길항제는 항-VEGF 항체이다. 바람직한 구현예에서, 상기 항-VEGF 항체는 베바시주맙이다.
한 구현예에서, 상기 방법은 생존의 예비-투여 예후를 제공하기 위해 항암제를 투여하기 전에 수행된다. 제2 구현예에서, 생존률은 무진행 생존율 또는 전체 생존율이다.
제5 양태에서, 본 발명은 암을 갖는 환자를 치료하는 방법을 특징으로 하며, 이 방법은, 환자에게 VEGF 길항제 이외의 치료적 유효량의 치료제를 투여하는 단계를 포함하고, 여기서, 환자의 암은 암 유형에서 각각 CD31 발현 및/또는 종양 VEGFA 발현의 중간 수준 미만의 수준에서 CD31 및/또는 종양 VEGFA를 발현하는 것으로 측정되었다. 관련된 양태에서, 본 발명은 암을 갖는 환자를 치료하는 방법에 사용하기 위한 VEGF 길항제 이외의 치료제를 특징으로 하며, 여기서, 환자의 암은 암 유형에서 각각 CD31 발현 및/또는 종양 VEGFA 발현에 대한 중간 수준 미만의 수준에서 CD31 및/또는 종양 VEGFA를 발현하는 것으로 측정되었고, 상기 방법은 VEGF 길항제 이외의 치료적 유효량의 치료제를 환자에게 투여하는 단계를 포함한다.
한 구현예에서, 환자의 암은 암 유형에서 CD31 발현에 대한 중간 수준 미만의 수준에서 CD31을 발현하는 것으로 측정되었다. 상기 구현예의 특정 양태에서, 환자의 암은 암 유형에서 CD31 발현에 대한 25번째 백분위수 미만의 수준에서 CD31을 발현하는 것으로 측정되었다.
또 다른 구현예에서, 환자의 암은 암 유형에서 종양 VEGFA 발현에 대한 중간 수준 미만의 수준에서 종양 VEGFA를 발현하는 것으로 측정되었다. 상기 구현예의 특정 양태에서, 환자의 암은 암 유형에서 종양 VEGFA 발현에 대해 25번째 백분위수 미만의 수준에서 종양 VEGFA를 발현하는 것으로 측정되었다.
본 발명의 특정 구현예에서, 암은 결장 결장직장암, 유방암, 비소세포 폐암(NSCLC), 신장암(신장 세포 암종) 또는 뇌암(아교모세포종)으로 이루어진 군으로부터 선택된다. 본 발명의 다른 특정 구현예에서, 암은 난소암, 복막암, 난관암, 자궁 경부암, 자궁 내막암, 질암 및 외음부 암으로 이루어진 군으로부터 선택되는 산부인과계 암이다. 바람직한 구현예에서, 산부인과계 암은 난소암이다. 본 발명의 또 다른 구현예에서, 암은 백금-내성, 백금-민감성, 진행성, 난치성 또는 재발성이다.
추가의 구현예에서, 환자의 샘플에서 검출된 CD31 발현 수준은 환자의 암에서 CD31 미세혈관 구조(CD31 MVD)의 밀도를 측정하는 데 사용되며, 임의로 환자의 샘플의 CD31 MVD가 암 유형에서 CD31 MVD의 중간 수준과 비교된다. 일부 특정 구현예에서, CD31 발현 및/또는 종양 VEGFA 발현은 면역조직화학적(IHC) 방법에 의해 검출된다.
일부 바람직한 구현예에서, 상기 VEGF 길항제는 항-VEGF 항체이다. 특정 바람직한 구현예에서, 상기 항-VEGF 항체는 베바시주맙이다.
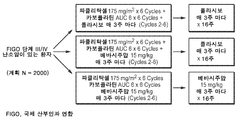
도 1은 III/IV기 난소암 치료를 위한 카보플라틴-파클리탁셀 화학요법에 베바시주맙을 첨가한 효과를 평가하기 위한 3상 시험 설계를 나타내는 개략도이다.
도 2는 샘플 환자군에서 CD31 발현의 분포를 보여주는 그래프이다.
도 3은 특정 컷오프(cutoff)에서 종양 세포 바이오마커 하위그룹에 따른 대조군(파클리탁셀-카보플라틴-플라시보(CPP)) 대 베바시주맙 유지군(파클리탁셀-카보플라틴-베바시주맙(CPB15+))에 대한 통계 분석 및 무진행 생존(PFS)의 포레스트(Forest) 플롯의 결과를 보여주는 표이다.
도 4는 CPP 대 CPB15+를 비교하는 CD31 높고 낮은 발현자(expressor)(50% 컷오프에서 이분화된)에 대한 PFS의 카플란 마이어(Kaplan Meier) 곡선을 나타낸다.
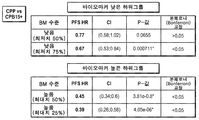
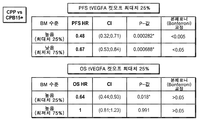
도 5는 CD31 발현의 25%, 50% 및 75% 컷오프에서 이분화된 CD31 하위그룹에 따른 CPP 대 CPB15+에 대한 PFS의 통계 분석 및 포레스트 플롯의 결과를 보여주는 표이다.
도 6은 환자의 수행 상태, 질환 단계 및 감축술 결과에 대해 조정된, 제시된 CD31 하위그룹 내 PFS 처리 효과에 대한 위험율(HR) 추정치를 나타내는 표이다.
도 7은 특정 컷오프에서 종양 세포 표지자 하위그룹에 따른 CPP 대 CPB15+에 대한 전체 생존율(OS)의 통계 분석 및 포레스트 플롯의 결과를 보여주는 표이다.
도 8은 CD31 발현의 25%, 50% 및 75% 컷오프에서 이분화된 CD31 하위그룹에 따른 CPP 대 CPB15+에 대한 OS의 통계 분석 및 포레스트 플롯의 결과를 보여주는 표이다.
도 9a는 CPP 대 CPB15+를 비교한, CD31 높고 낮은 발현자(50% 컷오프에서 이분화된)에 대한 OS의 카플란 마이어 곡선을 도시한다.
도 9b는 CPP 대 CPB15+를 비교한, CD31 높고 낮은 발현자(75% 컷오프에서 이분화된)에 대한 OS의 카플란 마이어 곡선을 나타낸다.
도 10은 환자의 수행 상태, 질환 단계 및 감축술 결과에 대해 조정된, 제시된 하위그룹 내의 OS 치료 효과에 대한 HR 추정치를 나타내는 표이다.
도 11은 치료군(CPP 대 CPB15+) 간의 PFS(좌측 그래프) 및 OS(우측 그래프)를 비교한 하위그룹 처리 효과 패턴 플롯(STEPP) 분석이다 (CD31 수준에 기초한 미리 한정된 환자 하위그룹 내). 중앙 실선형 곡선(solid curve) 위의 각 점은 모집단의 25%를 나타낸다.
도 12는 CPP 대 CPB15+를 비교한 종양 VEGFA 높고 낮은 발현자(75% 컷오프에서 이분화된)에 대한 PFS의 카플란 마이어 곡선을 나타낸다.
도 13은 CPP 대 CPB15+를 비교한 종양 VEGFA 높고 낮은 발현자(75% 컷오프에서 이분화된)에 대한 PFS의 카플란 마이어 곡선을 나타낸다.
도 14는 환자의 수행 상태, 질환 단계 및 감축술 결과에 대해 조정된, 제시된 치료군 내 PFS 및 OS 치료 효과에 대한 HR 추정치를 나타내는 표이다.
도 15는 종양 VEGFA 발현에 대해 25%, 50% 및 75% 컷오프에서 이분화된 VEGF 하위그룹에 따른 CPP 대 CPB15+에 대한 PFS의 통계 분석 및 포레스트 플롯의 결과를 나타내는 표이다.
도 16은 종양 VEGFA 발현의 25%, 50% 및 75% 컷오프에서 이분화된 종양 VEGFA 하위그룹에 따른 CPP 대 CPB15+에 대한 OS의 통계 분석 및 포레스트 플롯의 결과를 나타내는 표이다.
도 17은 종양 VEGFA 수준에 기초한 미리 한정된 환자 하위그룹 내에서 치료군(CPP 대 CPB15+) 간의 PFS(좌측 그래프) 및 OS(우측 그래프)를 비교한 하위그룹 처리 효과 패턴 플롯(STEPP) 분석이다. 중앙 실선 위의 각 점은 모집단의 25%를 나타낸다.
도 2는 샘플 환자군에서 CD31 발현의 분포를 보여주는 그래프이다.
도 3은 특정 컷오프(cutoff)에서 종양 세포 바이오마커 하위그룹에 따른 대조군(파클리탁셀-카보플라틴-플라시보(CPP)) 대 베바시주맙 유지군(파클리탁셀-카보플라틴-베바시주맙(CPB15+))에 대한 통계 분석 및 무진행 생존(PFS)의 포레스트(Forest) 플롯의 결과를 보여주는 표이다.
도 4는 CPP 대 CPB15+를 비교하는 CD31 높고 낮은 발현자(expressor)(50% 컷오프에서 이분화된)에 대한 PFS의 카플란 마이어(Kaplan Meier) 곡선을 나타낸다.
도 5는 CD31 발현의 25%, 50% 및 75% 컷오프에서 이분화된 CD31 하위그룹에 따른 CPP 대 CPB15+에 대한 PFS의 통계 분석 및 포레스트 플롯의 결과를 보여주는 표이다.
도 6은 환자의 수행 상태, 질환 단계 및 감축술 결과에 대해 조정된, 제시된 CD31 하위그룹 내 PFS 처리 효과에 대한 위험율(HR) 추정치를 나타내는 표이다.
도 7은 특정 컷오프에서 종양 세포 표지자 하위그룹에 따른 CPP 대 CPB15+에 대한 전체 생존율(OS)의 통계 분석 및 포레스트 플롯의 결과를 보여주는 표이다.
도 8은 CD31 발현의 25%, 50% 및 75% 컷오프에서 이분화된 CD31 하위그룹에 따른 CPP 대 CPB15+에 대한 OS의 통계 분석 및 포레스트 플롯의 결과를 보여주는 표이다.
도 9a는 CPP 대 CPB15+를 비교한, CD31 높고 낮은 발현자(50% 컷오프에서 이분화된)에 대한 OS의 카플란 마이어 곡선을 도시한다.
도 9b는 CPP 대 CPB15+를 비교한, CD31 높고 낮은 발현자(75% 컷오프에서 이분화된)에 대한 OS의 카플란 마이어 곡선을 나타낸다.
도 10은 환자의 수행 상태, 질환 단계 및 감축술 결과에 대해 조정된, 제시된 하위그룹 내의 OS 치료 효과에 대한 HR 추정치를 나타내는 표이다.
도 11은 치료군(CPP 대 CPB15+) 간의 PFS(좌측 그래프) 및 OS(우측 그래프)를 비교한 하위그룹 처리 효과 패턴 플롯(STEPP) 분석이다 (CD31 수준에 기초한 미리 한정된 환자 하위그룹 내). 중앙 실선형 곡선(solid curve) 위의 각 점은 모집단의 25%를 나타낸다.
도 12는 CPP 대 CPB15+를 비교한 종양 VEGFA 높고 낮은 발현자(75% 컷오프에서 이분화된)에 대한 PFS의 카플란 마이어 곡선을 나타낸다.
도 13은 CPP 대 CPB15+를 비교한 종양 VEGFA 높고 낮은 발현자(75% 컷오프에서 이분화된)에 대한 PFS의 카플란 마이어 곡선을 나타낸다.
도 14는 환자의 수행 상태, 질환 단계 및 감축술 결과에 대해 조정된, 제시된 치료군 내 PFS 및 OS 치료 효과에 대한 HR 추정치를 나타내는 표이다.
도 15는 종양 VEGFA 발현에 대해 25%, 50% 및 75% 컷오프에서 이분화된 VEGF 하위그룹에 따른 CPP 대 CPB15+에 대한 PFS의 통계 분석 및 포레스트 플롯의 결과를 나타내는 표이다.
도 16은 종양 VEGFA 발현의 25%, 50% 및 75% 컷오프에서 이분화된 종양 VEGFA 하위그룹에 따른 CPP 대 CPB15+에 대한 OS의 통계 분석 및 포레스트 플롯의 결과를 나타내는 표이다.
도 17은 종양 VEGFA 수준에 기초한 미리 한정된 환자 하위그룹 내에서 치료군(CPP 대 CPB15+) 간의 PFS(좌측 그래프) 및 OS(우측 그래프)를 비교한 하위그룹 처리 효과 패턴 플롯(STEPP) 분석이다. 중앙 실선 위의 각 점은 모집단의 25%를 나타낸다.
I. 도입
본 발명은 암, 특히 산부인과계 암 예를 들어 난소암을 갖는 환자의 주어진 모집단에서의 발현 수준과 비교하여, 주어진 환자에서의 CD31 및/또는 종양 VEGFA의 종양 발현 수준이 화학요법과 함께 혈관형성 억제제를 투여한 환자에서의 치료 효과와 관련이 있다는 발견에 부분적으로 기초한다. 특히, 더 높은 미세혈관 밀도 수준(㎟당 CD31 혈관 구조의 수에 의해 측정됨) 및/또는 종양 VEGFA의 변화는 카보플라틴-파클리탁셀 화학치료 레지멘에 베바시주맙을 첨가하는 것에 대한 반응으로 난소암을 갖는 환자들의 무진행 생존율(PFS)의 개선 및 전체 생존율(OS)의 개선을 위한 후보 마커/예측 인자로 식별되었다. 이러한 화학치료 레지멘에 베바시주맙을 첨가하는 것에 대한 반응이나 민감성을 보이는 환자는 암으로 진단되거나 암을 가진 주어진 환자 모집단, 특히 산부인과계 암, 예를 들어 난소암에서의 발현 수준에 비해 CD31 발현 및/또는 종양 VEGFA 발현이 증가한 것으로 식별되었다. 본 발명에 따르면, 초과의 베바시주맙 치료 효과는 종양 세포에서 높은 CD31 미세혈관 밀도(CD31 MVD) 발현 및/또는 높은 종양 VEGFA 발현과 관련 있다는 것이 발견되었다.
따라서, 본 발명은 VEGF 길항제(예컨대, 베바시주맙과 같은 항-VEGF 항체)를 환자에게 투여함으로써 암을 갖는 환자(예를 들어, 산부인과계 암(예컨대, 난소, 복막, 난관, 자궁경부, 자궁내막, 질 또는 외음부 암) 또는 유방암(예컨대, 전이성 유방암(MBC); 하기 참조))를 치료하는 방법을 제공하며, 여기서, 환자의 암은 암 유형에서 중간 수준 초과의 수준에서 CD31 MVD 및/또는 종양 VEGFA를 발현시키는 것으로 측정된 경우이다. 본 발명은 또한 임의로 다른 항암 요법에 추가하여 VEGF 길항제(예를 들어, 베바시주맙과 같은 항-VEGF 항체)의 투여로부터 이점을 얻을 수 있는 암을 갖는 환자(예를 들어, 산부인과계 암(예컨대, 난소, 복막, 난관, 자궁경부, 자궁내막, 질 또는 외음부 암) 또는 유방암(예컨대, 전이성 유방암(MBC); 하기 참조))를 식별하거나, 또는 환자의 종양 샘플에서 CD31 발현 및/또는 종양 VEGFA 발현 수준을 측정함으로써 VEGF 길항제(예를 들어, 베바시주맙과 같은 항-VEGF 항체)에 의해 치료에 보다 반응할 수 있는 환자를 식별하는 방법을 제공하며, 이때, 암 유형에서의 CD31 MVD 및/또는 종양 VEGFA의 발현이 CD31 MVD 및/또는 종양 VEGFA 발현에 대한 중간 수준 초과의 수준인 경우에 VEGF 길항제(예컨대, 베바시주맙과 같은 항-VEGF 항체)를 투여한다.
II. 정의
단백질 "발현"은 유전자 내 암호화된 정보의 메신저 RNA (mRNA)로의, 이후 단백질로의 전환을 지칭한다.
목적 단백질(예컨대, CD31 및/또는 종양 VEGFA)을 "발현하는" 샘플 또는 세포는 단백질 또는 단백질 단편을 포함하는 단백질을 암호화하는 mRNA가 샘플 또는 세포에 존재하는 것으로 측정된 것이다.
암의 유형에서 CD31 MVD 및/또는 종양 VEGFA 발현의 중간 수준 초과의 수준에서 CD31 MVD 및/또는 종양 VEGFA를 "발현하거나" 또는 "발현시키는 것으로 측정된" 샘플, 세포, 종양 또는 암은 CD31 MVD 및/또는 종양 VEGFA 발현 수준이 상기 암의 유형에 대해 당업자에게 "고 CD31 MVD 및/또는 종양 VEGFA 수준"으로 간주되는 것이다. 일반적으로, 이러한 수준은 동일한 암 유형의 샘플, 세포, 종양 또는 암의 집단에서 CD31 MVD 및/또는 종양 VEGFA 수준에 비해 약 50% 내지 약 100%(예를 들어, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% 또는 95%)의 범위일 것이다. 예를 들어, 중간 발현 수준에 도달하는 데 사용되는 모집단은 화학요법-내성 난소암, 백금-내성 난소암뿐만 아니라 진행성, 난치성 또는 재발성 난소암과 같은 난소암 샘플 또는 이의 하위그룹일 수 있다. 본원의 실시예는 중간 발현 수준을 측정할 수 있는 방법에 대해 설명한다. 이것은 발현의 절대값을 구성할 수 있다. 따라서, 도 5 및 8을 참조하면, CD31 MVD를 높은 수준에서 발현하는 것으로 생각되는 난소암을 갖는 환자의 경우 컷오프는 약 17.78 이상(25번째 백분위수), 약 25.19 이상(50번째 백분위수), 약 35.8 이상(75번째 백분위수) 등이 될 수 있다. 이러한 절대값은 예를 들어 본원에 개시된 바와 같은 면역조직화학적(IHC) 방법 및 가장 바람직하게는 실시예 1에서와 같은 IHC 분석과 같은 특정 분석 조건 하에서의 분석에서 정량화될 것이다. 바람직하게는, CD31 MVD 및/또는 종양 VEGFA 발현 수준은 50번째 백분위수(예컨대, 50번째, 55번째, 60번째, 65번째, 68번째 또는 70번째 백분위수) 이상이며, 가장 바람직하게는 75번째 백분위수(예컨대, 75번째, 76번째, 78번째, 80번째, 85번째, 90번째 또는 95번째 백분위 수) 이상이다. 특정 바이오마커(예컨대, CD31 및/또는 종양 VEGFA)에 대해 사용되는 "암이 있거나 발현이 측정되는" 또는 "암이 발현하는"은, 진단 테스트를 사용하여 측정되는 바와 같이, 바이오마커(예컨대, CD31 및/또는 종양 VEGFA)의 발현을 의미하거나, 본원에 기술된 임의의 검출 방법 또는 이와 유사한 것을 의미한다. CD31의 경우, 발현은 암 또는 종양 조직 내의 혈관 내피세포에서 일어나며, VEGFA 발현은 암 또는 종양 세포에서 일어난다. 또한, CD31과 관련해서는, 본 발명의 방법에서, 환자 샘플에서 검출된 CD31 발현 수준을 사용하여 환자의 암에서의 CD31 미세혈관 구조(CD31 MVD)의 밀도를 측정할 수 있고, 임의로 환자의 샘플의 CD31 MVD를 암 유형에서 CD31 MVD의 중간 수준과 비교할 수 있다.
"조직 또는 세포 샘플"은 대상체 또는 환자의 조직으로부터 수득된 세포의 집합을 의미한다. 조직 또는 세포 샘플의 공급원은 신선, 냉동 및/또는 보존 장기 또는 조직 샘플 또는 생검 또는 흡입액에서 유래된 것과 같은 고체 조직; 혈액 또는 모든 혈액 구성성분; 체액, 예컨대 뇌척수액, 양수, 복막액 또는 세포간질액; 개체의 임신 또는 발달 중 어느 시점에서 유래된 세포일 수 있다. 조직 샘플은 또한 원발성 또는 배양된 세포 또는 세포주일 수 있다. 임의로, 조직 또는 세포 샘플은 암 조직/기관으로부터 얻어진다. 상기 조직 샘플은 자연적으로 상기 조직과 혼합되지 않는 화합물, 예컨대 보존제, 항응고제, 완충용액, 고정액, 영양분, 항생제 등을 함유할 수 있다. 본원에서의 목적을 위해, 조직 샘플의 “분획”은 조직 샘플의 단일부 또는 조각, 예를 들어, 조직 샘플로부터 절단된 조직 또는 세포의 얇은 슬라이스를 의미한다.
본원에서 "종양 샘플"은 환자의 종양으로부터 유래된 또는 종양 세포를 포함하는 샘플이다. 본원의 종양 샘플의 예에는, 비제한적으로, 종양 생검, 순환하는 종양 세포, 순환하는 혈장 단백질, 복수액, 종양에서 유도되었거나 또는 종양과 같은 특성을 보이는 1차 세포 배양액 또는 세포주뿐만 아닐, 보존된 종양 샘플, 예컨대 포르말린-고정, 파라핀-포매 종양 샘플 또는 냉동 종양 샘플이 포함된다. 종양 세포 외에도, 종양 샘플에는 혈관이 포함될 수 있다.
"상관관계가 있다" 또는 "상관관계가 있는"은 모든 방식으로 첫 번째 분석 또는 프로토콜의 성과 및/또는 결과를 두 번째 분석 또는 프로토콜의 성과 및/또는 결과와 비교하는 것을 의미한다. 예를 들어, 두 번째 프로토콜을 수행할 때 첫 번째 분석 또는 프로토콜의 결과를 사용하거나 및/또는 두 번째 분석 또는 프로토콜이 수행되어야 하는지 여부를 측정하기 위해 첫 번째 분석 또는 프로토콜의 결과를 사용할 수 있다. 유전자 발현 분석 또는 프로토콜의 구현예와 관련하여, 특정 치료 레지멘이 수행되어야 하는지 여부를 측정하기 위해 유전자 발현 분석 또는 프로토콜의 결과를 사용할 수 있다.
본원에 사용된 용어 "바이오마커"는 일반적으로 유전자, 단백질, 탄수화물 구조 또는 당지질을 포함하는 분자를 지칭하며, 포유동물 조직 또는 세포에서의 또는 포유동물 조직 또는 세포상에서의 발현은 표준 방법(또는 본원에 개시된 방법)에 의해 검출될 수 있고, 예를 들어 VEGF-특이적 억제제(예컨대, 베비시주맙과 같은 항-VEGF 항체)와 같은 항-혈관형성제를 사용하는 혈관형성의 억제에 기초한 치료 방식에 대한 포유동물 세포 또는 조직의 감수성에 대해 예측하고, 진단하고/하거나 예후적이다. 임의로, 이러한 바이오마커의 발현은 대조군/참조 조직 또는 세포 샘플에서 관찰된 것보다 높게 측정된다. 이러한 바이오마커의 발현은 룰스 베이스드 메시딘 인코포레이티드(Rules Based Medicine, Inc.) 또는 메조 스케일 디스커버리(Meso Scale Discovery)로부터 상업적으로 입수할 수 있는 고-처리량 다중 면역 측정법을 사용하여 측정할 수 있다. 바이오마커의 발현은 또한 예를 들어 PCR 또는 FACS 분석, 면역조직화학적 분석 또는 유전자 칩-기반 분석을 사용하여 측정될 수 있다.
"VEGF 길항제" 또는 "VEGF-특이적 길항제"는 VEGF에 결합하거나, VEGF 발현 수준을 감소시키거나, 또는 예를 들어, 비-제한적으로, 하나 이상의 VEGF 수용체에 결합하는 VEGF, VEGF 신호 전달 및 VEGF 매개 혈관형성 및 내피 세포 생존 또는 증식을 비롯한 VEGF 생물학적 활성을 중화, 차단, 억제, 폐기, 감소 또는 저해할 수 있는 분자를 의미한다. 예를 들어, VEGF 생물학적 활성을 중화, 차단, 억제, 폐기, 감소 또는 저해할 수 있는 분자는 하나 이상의 VEGF 수용체(VEGFR)(예컨대, VEGFR1, VEGFR2, VEGFR3, 막-결합 VEGF 수용체(mbVEGFR) 또는 가용성 VEGF 수용체(sVEGFR))에 결합함으로써 그 효과를 발휘할 수 있다. 본 발명의 방법에 유용한 VEGF-특이적 길항제로서 포함되는 것은, VEGF에 특이적으로 결합하여 하나 이상의 수용체, 융합 단백질(예컨대, VEGF-트랩(Trap)(리제네론(Regeneron)) 및 VEGF121-겔로닌(gelonin)(페레그린(Peregrine))과의 결합을 격리시키는 VEGF, 항-VEGF 항체 및 이들의 항원-결합 단편에 특이적으로 결합하는 폴리펩티드이다. VEGF-특이적 길항제는 또한 VEGF 폴리펩티드의 길항제 변이체, VEGF 폴리펩티드를 암호화하는 핵산 분자의 적어도 단편에 상보적인 안티센스 핵염기 올리고머; VEGF 폴리펩티드를 암호화하는 핵산 분자의 적어도 단편에 상보적인 작은 RNA; VEGF를 표적으로 하는 리보자임; VEGF에 대한 펩티바디; 및 VEGF 압타머를 포함한다. VEGF 길항제는 또한 VEGFR, 항-VEGFR 항체 및 이들의 항원-결합 단편에 결합하는 폴리펩티드, VEGFR에 결합하여 VEGF 생물학적 활성(예컨대, VEGF 신호 전달)을 차단, 억제, 폐기, 감소 또는 저해하는 유도체, 또는 융합 단백질을 포함한다. VEGF-특이적 길항제는 또한 VEGF 또는 VEGFR에 결합하고 VEGF 생물학적 활성을 차단, 억제, 폐기, 감소 또는 저해할 수 있는 비-펩티드성 소분자를 포함한다. 따라서, 용어 "VEGF 활성"은 특히 VEGF가 매개하는 VEGF의 생물학적 활성을 포함한다. 특정 구현예에서, VEGF 길항제는 VEGF의 발현 수준 또는 생물학적 활성을, 적어도 약 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% 또는 그 이상 만큼 감소시키거나 억제한다. 일부 구현예에서, VEGF-특이적 길항제에 의해 저해되는 VEGF는 VEGF(8-109), VEGF(1-109) 또는 VEGF165이다.
본원에 사용된 VEGF 길항제는 비-제한적으로 항-VEGFR2 항체 및 관련 분자(예컨대, 라뮤키루맙, 타니비루맙, 아플리버셉트), 항-VEGFR1 항체 및 관련 분자(예컨대, 이크루쿠맙, 아플리버셉트(VEGF 트랩-아이(Trap-Eye); 아일리(EYLEA®) 및 지브-아플리버셉트(VEGF 트랩; 잘트랩(ZALTRAP®)), 이중특이적 VEGF 항체(예컨대, MP-0250, 바누시주맙(VEGF-ANG2), 및 US 2001/0236388에 개시된 이중특이적 항체), 항-VEGF, 항-VEGFR1 및 항-VEGFR2 암(arm), 항-VEGFA 항체(예컨대, 베바시주맙, 세바시주맙), 항-VEGFB 항체, 항-VEGFC 항체(예컨대, VGX-100), 항-VEGFD 항체 및 비-펩티드성 소분자 VEGF 길항제(예컨대, 파조파닙, 악시티닙, 반데타닙, 스티바르가, 카보잔티닙, 렌바티닙, 닌테다닙, 오란티닙, 텔라티닙, 도비티닉, 세디라닙, 모테사닙, 설파티닙, 아파티닙, 포레티닙, 파미티닙 및 티보자닙) 중 2개 이상의 조합을 포함하는 이중특이적 항체를 포함할 수 있다.
"항-VEGF 항체"는 충분한 친화도 및 특이성이 있는 VEGF와 결합하는 항체이다. 특정 구현예에서, 항체는 일반적으로 VEGF에 대한 충분히 강한 결합 친화도를 가질 것이며, 예를 들어, 상기 항체는 100 nM 내지 1 pM 사이의 Kd 값을 갖는 hVEGF와 결합할 수 있다. 항체 친화도는, 예를 들면 표면 플라즈몬 공명 기반 분석(예컨대 PCT 출원 공보 번호 WO2005/012359에 기재된 BIAcore 분석); 효소-결합 면역흡착제 분석(ELISA); 및 경쟁 분석(예를 들면 RIA)에 의해 측정될 수 있다.
특정 구현예에서, 항-VEGF 항체는 질병 또는 질환을 표적으로 삼을 때 및 저해할 때 치료제로서 사용될 수 있되, VEGF 활성이 수반된다. 또한 상기 항체는 예컨대, 치료로서 효과성을 평가하기 위해 기타 생물학적 활성 분석을 받을 수 있다. 이와 같은 분석은 당해기술에 알려져 있고 표적 항원 및 상기 항체에 대한 의도된 사용에 의존한다. 예에는 HUVEC 억제 분석; 종양 세포 성장 억제 분석(예를 들어 WO 89/06692에 기술된 바와 같음); 항체-의존 세포 세포독성(ADCC) 및 보체-매개 세포독성(CDC) 분석(미국 특허 번호 5,500,362); 및 길항(agonistic) 활성 또는 조혈 분석(WO 95/27062 참조). 항-VEGF 항체는 일반적으로 다른 VEGF 동족체, 예컨대 VEGF-B 또는 VEGF-C, 또는 기타 다른 성장 인자, 예컨대 P1GF, PDGF 또는 bFGF와 결합하지 않는다. 일 구현예에서, 항-VEGF 항체는 혼성세포(hybridoma) ATCC HB 10709에 의해 생산된 단클론성 항-VEGF 항체 A4.6.1과 동일한 에피토프에 결합하는 단클론성 항체이다. 또 다른 구현예에서, 항-VEGF 항체는 하기에 따라 생성된 재조합 인간화 항-VEGF 단클론성 항체이다: (1997) Cancer Res. 57:4593-4599 (베바시주맙 (BV; AVASTIN®)으로도 공지된 항체를 비제한적으로 포함).
"rhuMAb VEGF" 또는 "AVASTIN®"으로도 공지된 항-VEGF 항체 "베바시주맙(BV)"은 하기에 따라 산출된 재조합 인간화 항-VEGF 단클론성 항체이다: Presta et al. (1997) Cancer Res. 57:4593-4599. 이는 그 수용체에 대한 인간 VEGF의 결합을 차단하는 쥣과 항-hVEGF 단클론성 항체 A.4.6.1로부터의 항원-결합 상보성-결정 영역 및 돌연변이된 인간 IgG1 프레임워크 영역을 포함한다. 대부분의 프레임워크 영역을 포함하는 베바시주맙 아미노산 서열의 대략 93%는 인간 IgG1에서 유도되며, 서열의 약 7%는 쥣과 항체 A4.6.1에서 유도된다. 베바시주맙은 약 149,000 달톤의 분자량을 가지며 당화된다. 베바시주맙과 기타 인간화된 항-VEGF 항체는 2005년 2월 26일에 발행된 미국 특허 제6,884,879호에 추가로 기술되었으며, 이의 전체 개시내용이 본원에 참고로 명시적으로 편입된다. 추가 바람직한 항체는 하기를 포함한다: G6 또는 B20 시리즈 항체 (예컨대, G6-31, B20-4.1) (PCT 출원 공보 번호 WO 2005/012359에 기술됨). 추가 바람직한 항체에 대하여, 하기를 참고한다: 미국 특허 번호 7,060,269, 6,582,959, 6,703,020; 6,054,297; WO98/45332; WO 96/30046; WO94/10202; EP 0666868B1; 미국 특허 출원 공보 번호 2006009360, 20050186208, 20030206899, 20030190317, 20030203409, 및 20050112126; 및 Popkov et al., Journal of Immunological Methods 288:149-164 (2004). 기타 바람직한 항체는 잔기 F17, M18, D19, Y21, Y25, Q89, 191, K101, E103, 및 C104를 포함하거나, 대안적으로 잔기 F17, Y21, Q22, Y25, D63, 183 및 Q89를 포함하는 인간 VEGF 상에서 기능적 에피토프에 결합하는 것들을 포함한다.
용어 "항체"는 광범위한 의미로 사용되며, 구체적으로는 단클론성 항체 (전장 단클론성 항체 포함), 다클론성 항체, 다중특이적 항체 (예를 들면, 이중특이적 항체), 및 원하는 생물학적 활성을 나타내기만 한다면 항체 단편을 포함한다.
"차단" 항체 또는 "길항제" 항체는, 그것이 결합되는 항원의 생물학적 활성을 억제시키거나 또는 감소시키는 것이다. 예를 들어, VEGF-특이적 길항제 항체는 VEGF를 결합시키고 VEGF가 혈관 내피 세포 증식을 유도하는 능력을 억제한다. 바람직한 차단 항체 또는 길항제 항체는 항원의 생물학적 활성을 완전히 억제한다.
달리 명시하지 않는 한, 본 명세서 전반에 걸쳐 "다가 항체(multivalent antibody)"라는 표현은 3개 이상의 항원 결합 부위를 포함하는 항체를 나타내기 위해 사용된다. 다가 항체는 바람직하게는 3개 이상의 항원 결합 부위를 갖도록 가공되고 일반적으로 천연 서열 IgM 또는 IgA 항체가 아니다.
"Fv” 단편은 완전한 항원 결합-인식 부위 및 -결합 부위를 함유하는 항체 단편이다. 이러한 영역은 긴밀한 연관성에서 하나의 중쇄 및 경쇄 가변 도메인의 이량체로 이루어져 있으며, 예를 들어 scFv와 같이 본질적으로 공유적일 수 있다. VH-VL 이량체의 표면에 항원-결합 부위를 정의하기 위해 각 가변 도메인의 3개의 CDR이 상호 작용하는 것이 이 입체배치에 있다. 종합적으로, 6개의 CDR 또는 이의 서브세트는 항체에 항원-결합 특이성을 부여한다. 그러나, 보통 전체 결합 부위에 비해 더 낮은 친화도에서지만, 단일 가변 도메인(또는 항원에 대해 특이적인 3 개의 CDR만을 포함하는 Fv의 절반)도 항원을 인식하고 결합하는 능력을 갖는다.
본원에서 사용된 용어 "단클론성 항체"는 실질적으로 균질 항체 집단으로부터 수득된 항체를 나타낸다, 즉 집단을 이루는 개별 항체는 소량 존재할 수 있는 가능한 천연 발생 돌연변이를 제외하고 동일하다. 단클론성 항체는 매우 특이적으로, 단일 항원성 부위에 대해 지향된다. 더구나, 상이한 측정부위(에피토프)에 대해 지향된 상이한 항체를 통상적으로 포함하는 종래의 (다중클론) 항체 제제와 반대로, 각각의 단일클론 항체는 항원 상의 단일 측정부위에 대해 지향된다. 수식어 "단클론성"은 항체의 실질적으로 균질한 집단으로부터 수득되는 항체의 특징을 시사하며, 임의의 특정한 방법에 의한 항체의 생산을 필요로 하는 것으로 해석되어서는 안 된다. 예를 들어, 본 발명에 따라 사용되는 단일클론 항체는 우선 문헌[Kohler et al., Nature 256:495 (1975)]에 의해 기재된 혼성세포 방법에 의해 제조될 수 있거나, 재조합 DNA 방법(예를 들어, 미국 특허 제4,816,567호 참조)에 의해 제조될 수 있다. 단클론성 항체는 또한 예를 들면 하기에 기재된 기술을 사용하여 파아지 항체 라이브러리로부터 단리될 수 있다: Clackson et al., Nature 352:624-628 (1991) 및 Marks et al., J. Mol . Biol . 222:581-597 (1991).
본원의 단클론성 항체는 구체적으로 중쇄 및/또는 경쇄 부분이 특정 종으로부터 유래되거나 특정 항체 부류 또는 하위부류에 속하는 항체에서 상응하는 서열과 동일하거나 상동성이고 나머지 쇄(들)은 또 다른 종으로부터 유래되거나 또 다른 항체 부류 또는 하위부류에 속하는 항체에서 상응하는 서열과 동일하거나 상동성인 “키메라” 항체 (면역글로불린), 및 이들이 목적하는 생물학적 활성을 나타내는 한 상기 항체의 단편들을 포함한다 (미국 특허 번호 4,816,567; 및 Morrison et al., Proc . Natl . Acad . Sci . USA 81:6851-6855 (1984)).
비-인간(예를 들면, 뮤린) 항체의 "인간화" 형태는 비-인간 면역글로불린에서 유도된 최소 서열을 포함하는 키메라성 항체이다. 대개, 인간화된 항체는 수령체의 초가변성 영역으로부터의 잔기가 원하는 특이성, 친화도, 및 수용력을 가지는 비-인간 종 (공여체 항체) 예컨대 마우스, 랫트, 토끼 또는 비인간 영장류의 초가변성 영역으로부터의 잔기로 대체된 인간 면역글로불린 (수령체 항체)이다. 일부 예에서, 인간 면역글로불린의 Fv 프레임워크 영역 (FR) 잔기는 상응하는 비-인간 잔기로 대체된다. 더구나, 인간화 항체는 수혜자 항체 또는 공여자 항체에서 발견되지 않는 잔기를 포함할 수 있다. 이들 변형은 항체 성능을 더욱 개선하기 위해 만들어졌다. 일반적으로, 인간화 항체는 적어도 1개, 및 통상적으로 2개의 가변 도메인의 실질적으로 모두를 포함할 것이고, 초가변 루프의 모두 또는 실질적으로 모두는 비인간 면역글로불린의 것에 상응하고, FR 영역의 모두 또는 실질적으로 모두는 인간 면역글로불린 서열의 것이다. 인간화된 항체는 임의로 또한 면역글로불린 불변 영역 (Fc)의 적어도 일부, 전형적으로 인간 면역글로불린의 부분을 포함할 것이다. 추가 세부사항에 대해서는, 하기를 참고한다: Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-329 (1988); 및 Presta, Curr. Op. Struct . Biol . 2:593-596 (1992).
"인간 항체"는 인간에 의해 생성된 항체에 대응하고/하거나 본원에서 개시된 바와 같은 인간 항체를 제조하기 위한 임의의 기술을 이용해서 제조된 아미노산 서열을 보유하는 것이다. 인간 항체의 이러한 정의는 특히 비-인간 항원-결합 잔기를 포함하는 인간화 항체를 배제한다. 인간 항체는 당업계에 공지된 다양한 기술을 사용하여 제조될 수 있다. 일 구현예에서, 인간 항체는 파지 라이브러이에서 선택될 수 있고, 여기서 파지 라이브러리는 인간 항체를 발현한다 (Vaughan et al. Nature Biotechnology 14:309-314 (1996): Sheets et al. Proc . Natl . Acad . Sci . 95:6157-6162 (1998)); Hoogenboom and Winter, J. Mol . Biol ., 227:381 (1991); Marks et al., J. Mol . Biol ., 222:581 (1991)). 인간 항체는 내인성 면역글로불린 유전자가 부분적으로 또는 완전히 불활성화되는 형질전환 동물, 예를 들면, 마우스에 인간 면역글로불린 유전자좌를 도입함으로써 제조될 수 있다. 유발 상에서, 인간 항체 생산이 관찰되며, 이는 유전자 재배열, 조립, 및 항체 레퍼토리를 포함한, 모든 양태에서 인간 내에서 보여지는 것과 밀접하게 유사하다. 상기 접근법은 하기에 기술된다: 예를 들어, 미국 특허 번호 5,545,807; 5,545,806; 5,569,825; 5,625,126; 5,633,425; 5,661,016, 및 하기 학문적 출판물: Marks et al., Bio/Technology 10: 779-783 (1992); Lonberg et al., Nature 368: 856-859 (1994); Morrison, Nature 368:812-13 (1994); Fishwild et al., Nature Biotechnology 14: 845-51 (1996); Neuberger, Nature Biotechnology 14: 826 (1996); Lonberg and Huszar, Intern. Rev. Immunol . 13:65-93 (1995). 대안적으로, 인간 항체는 표적 항원에 관련된 항체를 생산하는 인간 B 림프구 불멸화를 통해 생산될 수 있다 (상기 B 림프구는 개체로부터 회수될 수 있거나 또는 시험관내 면역화될 수 있다). 참고: 예를 들면, Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p. 77 (1985); Boerner et al., J. Immunol ., 147 (1):86-95 (1991); 및 미국 특허 번호 5,750,373.
"단리된" 폴리펩티드 또는 “단리된” 항체는 자연 환경의 성분으로부터 식별되고 분리되고 및/또는 회수된 것이다. 자연 환경의 오염체 성분은 상기 폴리펩티드 또는 항체에 대한 진단적 또는 치료적 이용을 저해하는 물질이고, 그리고 효소, 호르몬, 그리고 다른 단백질성 또는 비단백질성 용질을 포함할 수 있다. 바람직한 구현예에서, 폴리펩티드 또는 항체는 (1) Lowry 방법에 의해 측정된 것으로 폴리펩티드 또는 항체의 95중량 % 초과, 가장 바람직하게는 99중량 % 이상으로, (2) 스피닝 컵 시쿼네이터의 사용에 의해 N-말단 또는 내부 아미노산 서열의 적어도 15 잔기를 얻기에 충분한 정도로, 또는 (3) 쿠마씨 청색 또는, 바람직하게는, 은 염색을 사용하여 환원 또는 비환원 조건 하에서 SDS-PAGE에 의한 균일성으로 정제될 것이다. 단리된 폴리펩티드 또는 항체는 재조합 세포 내에서 원지에서 폴리펩티드 또는 항체를 포함하는데, 그 이유는 폴리펩티드의 자연 환경의 최소한 하나의 성분이 존재하지 않을 것이기 때문이다. 그러나, 통상적으로, 단리된 폴리펩티드 또는 항체는 적어도 하나의 정제 단계에 의해 제조될 것이다.
본원에 사용된 바와 같이, "치료"는 치료받는 개체 또는 세포의 자연스러운 과정을 변경하려는 시도에서의 임상적 개입을 나타내며, 예방을 위해 또는 임상 병리 경과 동안 수행될 수 있다. 바람직한 치료 효과에는 하기를 포함한다: 질환 발생 또는 재발의 방지, 증상의 완화, 질환의 임의의 직접적 또는 간접적 병리 결과의 약화, 질환 진행 속도의 감소, 질환 상태의 개선 또는 경감, 및 차도 또는 향상된 예후. 일부 구현예에서, 본 발명의 방법 및 조성물은 질환 또는 장애의 발병을 지연시키는 시도에 유용하다.
용어 "치료적 유효량” 또는 “유효량”은 환자에서 암을 치료하는데 유효한 약물의 양을 지칭한다. 유효량의 약물은 암 세포수를 감소시키고/시키거나; 종양 크기를 감소시키고/시키거나; 말초 장기로의 암 세포 침윤을 억제(즉, 어느 정도 느리게 하거나 바람직하게는 정지)하고/하거나; 종양 전이를 억제(즉, 어느 정도 느리게 하거나 바람직하게는 정지)하고/하거나; 종양 성장을 어느 정도로 억제하고/하거나; 암과 관련된 하나 이상의 증상을 어느 정도로 완화시킬 수 있다. 약물이 현존하는 암세포를 성장을 방지 및/또는 죽일 수 있는 정도에서, 이것은 세포증식억제성 및/또는 세포독성일 수 있다. 유효한 양은 (예를 들면 고형 종양, RECIST, 또는 CA-125 변화에 대하여 반응 평가 기준에 의해 측정된 바와 같이) 무진행 생존을 연장할 수 있고, 객관적 반응을 초래할 수 있고/있거나 (부분 반응, PR, 또는 완전 반응, CR을 포함), (예를 들면 FOSI에 의해 평가된 바와 같이) 암의 하나 이상의 증상을 개선할 수 있다. 가장 바람직하게는, 치료적 유효량의 약물은 무진행 생존율(PFS) 및/또는 전체 생존율(OS)을 개선시키는 데 효과적이다.
"생존율"은 살아남은 상기 환자를 가리키며, 전체 생존율뿐만 아니라 무진행 생존율을 포함한다.
“전체 생존”은 환자가 규정된 시기 동안, 진단 또는 치료 시부터 1 년, 5 년 등, 생존을 유지하는 것을 나타낸다.
본 발명의 문맥에서 "무진행 생존율"이라는 문구는 치료하는 의사 또는 조사자의 평가에 따라 환자의 질병이 악화되지 않는, 즉 진행하지 않는, 치료 중 및 치료 후 시간의 길이를 의미한다. 당업자가 알 수 있듯이, 환자가 유사한 상황에 있는 환자 대조군의 평균 무진행 생존율과 비교하여 질병이 진행되지 않는 더 긴 시간의 길이를 경험하는 경우, 환자의 무진행 생존율은 개선되거나 향상된다.
"생존율 연장"이란 미치료 환자 대비(즉, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙)로 치료받지 않은 환자 대비), 또는 지정된 수치로 또는 CD31 또는 종양 VEGFA를 발현하지 않는 환자 대비, 및/또는 승인된 항-종양 제제 (예컨대 토포테칸 또는 리포좀 독소루비신 (여기서 암은 난소암임))로 치료 받은 환자 대비, 치료 받은 환자에서 전체 또는 무진행 생존율 증가를 의미한다.
본원에서 치료제의 "고정된" 또는 "변동없는" 용량은 환자의 중량 (WT) 또는 체표면적 (BSA)을 고려하지 않고 인간 환자에 투여된 용량을 지칭한다. 고정된 또는 변동없는 용량은 따라서 mg/kg 용량 또는 mg/m2 용량으로서 제공되지 않지만, 오히려 치료제의 절대적인 양으로서 제공된다.
"부하" 용량은 본원에서 일반적으로 환자에 투여된 치료제의 초기 용량을 포함하고, 그 다음 그의 하나 이상의 유지 용량(들)이다. 일반적으로, 단일 부하 용량이 투여되지만, 다중 부하 용량이 본원에서 고려된다. 보통, 투여된 부하 용량(들)의 양은 투여된 유지 용량(들)의 양을 초과하고/하거나 부하 용량(들)은 유지 용량(들) 보다 더 자주 투여되어, 유지 용량(들)로 달성될 수 있는 것보다 더 초기에 치료제의 원하는 정상상태 농도를 달성한다.
본원에서의 "유지” 투여 또는 “연장된” 투여는 치료 시기에 걸쳐 환자에 투여되는 치료제의 하나 이상의 투여를 지칭한다. 보통, 상기 유지 용량은 치료 간격을 두고, 예컨대 대략 1주, 대략 2주, 대략 3주, 또는 대략 4주 간격으로 투여된다.
본 발명의 문맥에서 "반응적"이라는 문구는 암(예를 들어, 산부인과계 암(예컨대, 난소, 복막, 난관, 자궁 경부, 자궁 내막, 질 또는 외음부 암) 또는 유방암(예컨대, MBC, 하기 참조))을 앓고 있거나, 고통을 겪고 있는 것으로 의심되거나 또는 암에 걸리기 쉬운 대상체/환자는 항-VEGF 항체 예를 들어 베바시주맙과 같은 항-VEGF 제제의 첨가를 포함하는 화학요법 레지멘에 대해 반응을 보이는 것을 나타낸다. 딩업자는 항-VEGF 항체 예를 들어 본 발명의 방법에 따른 베바시주맙과 같은 항-VEGF 제제로 치료된 사람이 반응을 나타내는지를 용이하게 측정할 위치에 있을 것이다. 예를 들어, 반응은 종양 성장의 감소 및/또는 정지, 종양 크기의 감소 및/또는 난소암의 하나 이상의 증상(예컨대, 난소암 출혈, 통증, 빈혈)의 개선과 같은 난소암으로 인한 고통의 감소에 의해 반영될 수 있다. 바람직하게는, 반응은 암 또는 암의 지수의 전이성 전환의 지표의 감소 또는 완화, 예를 들어 전이의 형성의 예방 또는 전이의 수 또는 크기의 감소에 의해 반영될 수 있다.
본 발명에 따른 "를 앓는 환자"라는 문구는 암(예를 들어, 산부인과계 암(예컨대, 난소, 복막, 난관, 자궁 경부, 자궁 내막, 질 또는 외음부 암) 또는 유방암(예컨대, 전이성 MBC; 하기 참조))의 임상 징후를 나타내는 환자를 가리킨다. 암의 맥락에서 "민감성" 또는 "~ 하기 쉬운"이라는 문구는 예를 들어 가능한 유전적 소인, 유해 및/또는 발암성 화합물에 대한 사전 또는 최종 노출, 또는 방사선과 같은 발암성 물리적 위험에 대한 노출에 기초한 환자의 징후 질환을 의미한다.
본원에 사용된 용어 "투여"는 치료용 항체의 투여를 위한 당업계에 공지된 임의의 적합한 수단에 의해 치료적 또는 의학적 개입을 필요로 하는 환자에게 혈관형성 억제제 예를 들어 베바시주맙과 같은 항-VEGF 항체 및/또는 혈관형성 억제제 예를 들어 베바시주맙과 같은 항-VEGF 항체를 포함하는 약제학적 조성물/치료 레지멘을 투여하는 것을 의미한다. 비-제한적인 투여 경로로는 경구, 정맥내, 복강내, 피하, 근육내, 국소, 피내, 비강내 또는 기관지내 투여(예를 들어, 흡입에 의해 수행되는)가 포함된다. 본 발명과 관련하여 특히 바람직한 것은 비경구 투여 예를 들어 정맥내 투여이다. 결장직장암 치료를 위한 베바시주맙과 관련하여, EMEA에 따른 바람직한 투여량은 2주에 1회 5 mg/kg 체중 또는 10 mg/kg 체중 또는 3주에 1회 7.5 mg/kg 체중 또는 15 mg/kg 체중이다. NSCLC의 치료를 위해, 바람직한 투여량은 카보플라틴 및 파클리탁셀과 함께 주입하여 3주에 1회 15 mg/kg 체중이다. 신장 세포 암종의 치료를 위해, 바람직한 투여량은 인터페론 α-2a를 주입하거나 단독 요법으로 2주에 1회 10 mg/kg 체중이다. 자궁 경부암의 치료를 위해, 바람직한 투여량은 주입에 의해 3주에 1회 15 mg/kg이고 다음의 화학요법 레지멘 중 하나와 병용 투여된다: 파클리탁셀 및 시스플라틴 또는 파클리탁셀 및 토포테칸. 아교모세포종의 치료를 위해, 바람직한 투여량은 주입에 의해 2주에 1회 10 mg/kg이다.
용어들 "암" 및 "암성"은 전형적으로 조절되지 않은 세포 성장에 의해 특징되는 포유동물의 생리 조건을 언급하거나 설명한다. 본 정의에는 양성 및 악성 암이 포함된다. 암의 예에는 비제한적으로, 암종, 림프종, 아세포종, 육종, 및 백혈병이 포함된다. 상기 암의 더욱 특정한 예시는 하기를 포함한다: 편평상피 세포 암, 폐암(소세포 폐암, 비-소세포 폐암, 폐의 선암종, 및 폐의 편평상피 암종 포함), 복막암, 간세포 암, 위 암 또는 위암(위장관 암 포함), 췌장암, 교모세포종, 자궁경부암, 난소암, 자궁경부암, 간암, 방광암, 간세포암, 유방암. 결장암, 결장직장암, 자궁내막 또는 자궁 암종, 타액샘 암종, 신장암 또는 신장 암, 간암, 전립선암, 외음부 암, 갑상샘암, 간 암종 및 다양한 유형의 두경부 암뿐만 아니라 B-세포 림프종(저등급/난포성 비-호지킨 림프종(NHL); 소 림프구(SL) NHL; 중간 등급/난포성 NHL; 중간 등급 확산성 NHL; 고등급 면역아세포성 NHL; 고등급 림프아세포성 NHL; 고등급 소형 비-절단 세포 NHL; 대부피 질환 NHL; 외투 세포 림프종; AIDS-관련 림프종; 및 발덴스트롬 거대글로불린혈증 포함); 만성 림프구성 백혈병(CLL); 급성 림프아세포성 백혈병(ALL); 모발 세포 백혈병; 만성적 골수아세포성 백혈병; 및 이식후 림프증식성 장애(PTLD)뿐만 아니라 모반증에 관련된 비정상 혈관 증식, 부종(예컨대 뇌종양에 관련된 부종), 및 메이그 증후군이 포함된다.
"VEGF 길항제에 반응할 수 있는 암 유형"은 VEGF 길항제 예를 들어 VEGF 항체(예컨대, 베바시주맙) 또는 소분자 억제제로 치료하는 경우, 본원에서 정교하게 만든 것을 포함하여 숙련된 종양 전문의가 알고 있는 치료 효과에 대한 임의의 기준에 따라, 특히 무진행 생존율(PFS) 및/또는 전체 생존율(OS)을 포함하는 생존률 양태에서 환자에게 치료적으로 유효한 이점을 보여준다. 바람직하게는, 암은 산부인과계 암(예컨대, 난소암, 복막암, 난관암, 자궁 경부암, 자궁암, 질암 및 외음부 암), 유방암(예컨대, MBC), 비소세포 폐암(NSCLC), 전립선암 및 결장직장암으로부터 선택된다. 가장 바람직하게는, 암은 산부인과계 암(예를 들어, 난소, 복막, 난관, 자궁 경부, 자궁 내막, 질 및 외음부 암, 예컨대 상기 암의 백금-내성 형태를 포함함) 또는 유방암 및/또는 이의 진행성, 난치성 또는 재발성 형태이다.
"진전된" 암은, 국부 침습 또는 전이에 의해, 태생의 부위 또는 장기 외부로 확산하는 것이다.
"난치성" 암은 화학치료제와 같은 항-종양제가 암을 갖는 환자에게 투여되고 있음에도 불구하고 진행되는 암이다. 난치성 암의 예로는 백금 불응성인 암이 있다.
"재발성" 암은, 초기 요법에 대한 반응 이후, 초기 부위 또는 먼 부위에서, 재성장한 것이다.
본원에서 "환자"는 인간 환자이다. 상기 환자는 "암을 갖는 환자" 즉, 암의 하나 또는 그 이상의 증상을 앓거나 또는 앓을 위험이 있는 사람일 수 있다.
VEGF 길항제가 "단일 항-종양제"로서 투여되는 경우, VEGF 길항제는 암을 치료하기 위해 투여되는 유일한 항-종양제이며, 즉 화학요법과 같은 다른 항-종양제와 병용 투여되지 않는다.
본원에서 "치료 표준"은 암의 특정 형태를 치료하기 위해 일상적으로 사용되는 항-종양제를 의미한다. 예를 들어, 백금-내성 난소암의 경우, 치료 표준은 토포테칸 또는 리포좀성 독소루비신이다.
“화학치료제”는 암의 치료에 유용한 화학적 화합물이다. 화학치료제의 예는 하기를 포함한다: 에를로티닙 (TARCEVA®, Genentech/OSI Pharm.), 보르테조밉 (VELCADE®, Millennium Pharm.), 디설피람, 에피갈로카테킨 갈레이트 , 살리노스포라미드 A, 카필조밉, 17-AAG (겔다나마이신), 라디시콜, 락테이트 탈수소효소 A (LDH-A), 풀베스트란트 (FASLODEX®, AstraZeneca), 서니팁 (SUTENT®, Pfizer/Sugen), 레트로졸 (FEMARA®, Novartis), 이마티닙 메실레이트 (GLEEVEC®, Novartis), 피나서네이트 (VATALANIB®, Novartis), 옥살리플라틴 (ELOXATIN®, Sanofi), 5-FU (5-플루오로우라실), 류코보린, 라파마이신 (시롤리무스, RAPAMUNE®, Wyeth), 라파티닙 (TYKERB®, GSK572016, Glaxo Smith Kline), 로나파밉 (SCH 66336), 소라페닙 (NEXAVAR®, Bayer Labs), 제피티닙 (IRESSA®, AstraZeneca), AG1478, 알킬화제 예컨대 티오테파 및 CYTOXAN® 사이클로포스파마이드; 알킬 설포네이트 예컨대 부설판, 임프로설판 및 피포설판; 아지리딘 예컨대 벤조도파, 카보쿠온, 메투레도파, 및 우레도파; 에틸렌이민 및 메틸라멜라민 (알트레타민, 트리에틸렌멜라민 포함), 트리에틸렌포스포르아미드, 트리에틸렌티오포스포르아미드 및 트리메틸로멜라민; 아세토게닌 (특히 불라타신 및 불라타시논); 캄프토테신 (토포테칸 및 이리노테칸 포함); 브리오스타틴; 칼리스타틴; CC1065 (이의 아도젤레신, 카르젤레신 및 바이젤레신 합성 유사체 포함); 크립토파이신 (특히 크립토파이신 1 및 크립토파이신 8); 아데노코르티코이드 (포함 프레드니손 및 프레드니솔론); 시프로테론 아세테이트; 5α-환원효소 포함 피나스테라이드 및 두타스테라이드); 보리노스타트, 로미뎁신, 파노비노스태트, 발프로산, 모세티노스타트 돌라스타틴; 알데스류킨, 탈크 듀오카르마이신 (합성 유사체, KW-2189 및 CB1-TM1 포함); 엘류테로빈; 판크라티스타틴; 사르코딕티인; 스폰지스타틴; 질소 머스타드 예컨대 클로르암부실, 클로마파진, 클로로포스파마이드, 에스트라무스틴, 이포스파마이드, 메클로레타민, 메클로레타민 옥사이드 하이드로클로라이드, 멜팔란, 노벰비친, 펜에스테린, 프레드니무스틴, 트로포스파마이드, 우라실 머스타드; 니트로소우레아 예컨대 카르무스틴, 클로로조토신, 포테무스틴, 로무스틴, 니무스틴, 및 라님무스틴; 항생제 예컨대 엔디인 항생제 (예컨대, 칼리키아마이신, 특히 칼리키아마이신 γ1I 및 칼리키아마이신 ω1I (Angew Chem. Intl. Ed. Engl. 1994 33:183-186); 다이네마이신 (다이네마이신 A 포함); 비스포스포네이트, 예컨대 클로드로네이트; 에스페라마이신; 뿐만 아니라 네오카르지노스타틴 발색단 및 관련 색소단백질 엔디인 항생 발색단), 아클라시노마이신, 악티노마이신, 오트라마이신, 아자세린, 블레오마이신, 칵티노마이신, 카라비신, 카미노마이신, 카르지노필린, 크로모마이시니스, 닥티노마이신, 다우노루비신, 데토루비신, 6-디아조-5-옥소-L-노르류신, ADRIAMYCIN® (독소루비신), 모르폴리노-독소루비신, 시아노모폴리노-독소루비신, 2-피롤리노-독소루비신 및 데옥시독소루비신), 에피루비신, 에소루비신, 아이다루비신, 마르셀로마이신, 미토마이신 예컨대 미토마이신 C, 마이코페놀산, 노갈라마이신, 올리보마이신, 페플로마이신, 포르피로마이신, 퓨로마이신, 쿠엘라마이신, 로도루비신, 스트렙토니그린, 스트렙토조신, 투베르시딘, 우베니멕스, 지노스타틴, 조루비신; 항-대사물질 예컨대 메토트렉세이트 및 5-플루오로우라실 (5-FU); 엽산 유사체 예컨대 데노프테린, 메토트렉세이트, 프테로프테린, 트리메트렉세이트; 퓨린 유사체 예컨대 플루다라빈, 6-머캅토퓨린, 티아미프린, 티오구아닌; 피리미딘 유사체 예컨대 안시타빈, 아자시티딘, 6아자우리딘, 카모푸르, 사이타라빈, 디데옥시우리딘, 독시플루리딘, 에노시타빈, 플록수리딘; 안드로겐 예컨대 칼루스테론, 드로모스타놀론 프로피오네이트, 에피티오스탄올, 메피티오스탄, 테스토락톤; 항-부신제 예컨대 아미노글루테티마이드, 미토탄, 트릴로스탄; 엽산 보충물 예컨대 프롤린산; 아세글라톤; 알도포스파마이드 글리코사이드; 아미노레벌린산; 에닐우라실; 암사크린; 베스트라부실; 비스안트렌; 에다트락세이트; 데포파민; 데메콜신; 디아지쿠온; 엘포미틴; 엘립티늄 아세테이트; 에포틸론; 에토글루시드; 갈륨 니트레이트; 하이드록시우레아; 렌티난; 로니다이닌; 메이탄시노이드 예컨대 메이탄신 및 안사미토신; 미토구아존; 미톡산트론; 모피담놀; 니트라에린; 펜토스타틴; 페나메트; 피라루비신; 로속산트론; 포도필린산; 2-에틸하이드라자이드; 프로카바진; PSK® 다당류 착물 (JHS Natural Products, Eugene, Oreg.); 라족산; 라이족신; 시조푸란; 스피로게르마늄; 테누아존산; 트리아지쿠온; 2,2',2''-트리클로로트리에틸아민; 트리코테센 (특히 T-2 독소, 베라쿠린 A, 로리딘 A 및 안구이딘); 우레탄; 빈데신; 다카바진; 만노무스틴; 미토브로니톨; 미토락톨; 피포브로만; 가시토신; 아라바이노사이드 ("Ara-C"); 사이클로포스파미드; 티오테파; 탁소이드, 예컨대, 탁솔(TAXOL) (파클리탁셀; Bristol-Myers Squibb Oncology, Princeton, N.J.), ABRAXANE® (크레모포어-없음), 파클리탁셀의 알부민-가공 나노입자 제형 (American Pharmaceutical Partners, Schaumberg, Ill.), 및 TAXOTERE® (도세탁셀, 독세탁셀; Sanofi-Aventis); 클로르람부실; GEMZAR® (젬시타빈); 6-티오구아닌; 머캅토퓨린; 메토트렉세이트; 백금 유사체 예컨대 시스플라틴 및 카보플라틴; 빈블라스틴; 에토포사이드 (VP-16); 이포스파마이드; 미톡산트론; 빈크리스틴; NAVELBINE® (비노렐빈); 노반트론; 테니포사이드; 에다트렉세이트; 다우노마이신; 아미노프테린; 카페시타빈 (XELODA®); 이반드로네이트; CPT-11; 토포이소머라제 억제제 RFS 2000; 디플루오로메틸오르니틴 (DMFO); 레티노이드 예컨대 레티노산; 및 상기 중 임의의 약제학적으로 허용가능한 염, 산 및 유도체.
화학치료제는 또한 하기를 포함한다: (i) 하기를 포함하는, 항-에스트로겐 및 선택적 에스트로겐 수용체 조절인자 (SERM)와 같이 종양에 대한 호르몬 작용을 조절하거나 억제하는 작용을 하는 항호르몬제: 예를 들어, 타목시펜 (NOLVADEX®; 타목시펜 시트레이트 포함), 랄록시펜, 드롤록시펜, 아이오독시펜, 4-하이드록시타목시펜, 트리옥시펜, 케옥시펜, LY117018, 오나프리스톤, 및 FARESTON® (토레미핀 시트레이트); (ii) 하기와 같은, 부신에서 에스트로겐 생산을 조절하는 효소 방향화효소를 억제하는 방향화효소 억제제: 예를 들어, 4(5)-이미다졸, 아미노글루테트이미드, MEGASE® (메게스트롤 아세테이트), AROMASIN® (엑세메스탄; Pfizer), 포르메스타니, 파드로졸, RIVISOR® (보로졸), FEMARA® (레트로졸; Novartis), 및 ARIMIDEX® (아나스트로졸; AstraZeneca); (iii) 항-안드로겐 예컨대 플루타미드, 닐루타미드, 비칼루타미드, 류프롤리드 및 고세렐린; 부세렐린, 트립테레린, 메드록시프로게스테론 아세테이트, 디에틸스틸베스트롤, 프레마린, 플루옥시메스테론, 모든 트랜스레티온산, 펜레티나이드, 뿐만 아니라 트록사시타빈 (1,3-디옥솔란 뉴클레오시드 시토신 유사체); (iv) 단백질 키나아제 억제제; (v) 지질 키나아제 억제제; (vi) 안티센스 올리고뉴클레오티드, 특히 비정상적인 세포 증식에서 연루된 신호전달 경로에서 유전자의 발현을 억제하는 것들, 예컨대, 예를 들어, PKC-알파, Ralf 및 H-Ras; (vii) 리보자임 예컨대 VEGF 발현 억제제 (예컨대, ANGIOZYME®) 및 HER2 발현 억제제; (viii) 백신 예컨대 유전자 요법 백신, 예를 들어, ALLOVECTIN®, LEUVECTIN®, 및 VAXID®; PROLEUKIN®, rIL-2; 토포이소머라제 1 억제제 예컨대 LURTOTECAN®; ABARELIX® rmRH; 및 (ix) 상기 중 임의의 약제학적으로 허용가능한 염, 산 및 유도체.
화학치료제는 또한 하기를 포함한다: 알렘투주맙(캄파스(Campath)), 베바시주맙(AVASTIN®, Genentech); 세툭시맙(ERBITUX®, Imclone); 파니투무맙(VECTIBIX®, Amgen), 리툭시맙(RITUXAN®, Genentech/Biogen Idec), 퍼투주맙(OMNITARG®, 2C4, Genentech), 트라스투주맙(HERCEPTIN®, Genentech), 토시투모맙(Bexxar, Corixia) 및 항체 약물 컨쥬게이트, 젬투주맙 오조가미신(MYLOTARG®, Wyeth). 본 발명의 화합물과 조합된 제제로서 치료적 잠재력을 갖는 추가의 인간화된 단클론성 항체는 하기를 포함한다: 아폴리주맙, 아셀리주맙, 아틀리주맙, 바피뉴주맙, 비바투주맙 메르탄신, 칸투주맙 메르탄신, 세델리주맙, 세르톨리주맙 페골, 시드푸시투주맙, 시드투주맙, 다클리주맙, 에쿨리주맙, 에팔리주맙, 에프라투주맙, 에를리주맙, 펠비주맙, 폰톨리주맙, 젬투주맙 오조가미신, 이노투주맙 오조가미신, 이필리무맙, 라베투주맙, 린투주맙, 마투주맙, 메폴리주맙, 모타비주맙, 모토비주맙, 나탈리주맙, 니모투주맙, 놀로비주맙, 누마비주맙, 오크렐리주맙, 오말리주맙, 팔리비주맙, 파스콜리주맙, 펙푸시투주맙, 펙투주맙, 펙셀리주맙, 랄리비주맙, 라니비주맙, 레슬리비주맙, 레슬리주맙, 레시비주맙, 로벨리주맙, 루플리주맙, 시브로투주맙, 시플리주맙, 손투주맙, 타카투주맙 테트락세탄, 타도시주맙, 탈리주맙, 테피바주맙, 토실리주맙, 토랄리주맙, 트라스투주맙, 투코투주맙 셀모류킨, 투쿠시투주맙, 우마비주맙, 유르톡사주맙, 우스테키누맙 및 비실리주맙, 항-인터류킨-12 (예컨대, ABT-874/J695, Wyeth Research and Abbott Laboratories (인터류킨-12 p40 단백질을 인식하기 위하여 유전적으로 변형된 재조합 배타적 인간-서열, 전장 IgG1 λ 항체).
화학치료제는 또한 하기를 포함한다: “EGFR 억제제,” (EGFR에 결합하거나, 달리는 이에 직접 상호작용하고, 이의 신호전달 활성을 예방 또는 감소시키는 화합물로 지칭되고, 대안적으로 “EGFR 길항제”로 지칭됨). 상기 제제의 예시는 EGFR에 결합하는 항체 및 소분자를 포함한다. EGFR에 결합하는 항체의 예시는 하기를 포함한다: MAb 579 (ATCC CRL HB 8506), MAb 455 (ATCC CRL HB8507), MAb 225 (ATCC CRL 8508), MAb 528 (ATCC CRL 8509) (참고: US 특허 번호 4,943, 533, Mendelsohn et al.) 및 이의 변이체, 예컨대 키메라화된 225 (C225 또는 세툭시맙; ERBUTIX®) 및 재형상화된 인간 225 (H225) (참고: WO 96/40210, Imclone Systems Inc.); IMC-11F8, 완전 인간, EGFR-표적 항체 (Imclone); 유형 II 돌연변이체 EGFR에 결합하는 항체 (US 특허 번호 5,212,290); US 특허 번호 5,891,996에 기재된, EGFR에 결합하는 인간화되고 키메라성인 항체; 및 EGFR에 결합하는 인간 항체, 예컨대 파니투무맙의 ABX-EGF (참고: WO98/50433, Abgenix/Amgen); EMD 55900 (Stragliotto et al. Eur. J. Cancer 32A:636-640 (1996)); EMD7200 (마투주맙) EGFR 결합 (EMD/Merck)을 위하여 EGF 및 TGF-알파 둘 모두와 경쟁하는 EGFR에 대하여 지향된, 인간화된 EGFR 항체; 및 인간 EGFR 항체, HuMax-EGFR (GenMab); 완전 인간 항체 (하기로 공지됨: E1.1, E2.4, E2.5, E6.2, E6.4, E2.11, E6 3 및 E7.6. 3 그리고 하기에 기술됨: US 6,235,883); MDX-447 (Medarex Inc); 및 mAb 806 또는 인간화된 mAb 806 (Johns et al., J. Biol. Chem. 279(29):30375-30384 (2004)). 항-EGFR 항체는 세포독성 제제와 콘주게이트되어 이로써 면역콘주게이트체를 생성할 수 있다 (참고: 예를 들어 EP659,439A2, Merck Patent GmbH). EGFR 길항제는 하기를 포함한다: 하기에 기술된 화합물과 같은 소분자: 5,616,582, 5,457,105, 5,475,001, 5,654,307, 5,679,683, 6,084,095, 6,265,410, 6,455,534, 6,521,620, 6,596,726, 6,713,484, 5,770,599, 6,140,332, 5,866,572, 6,399,602, 6,344,459, 6,602,863, 6,391,874, 6,344,455, 5,760,041, 6,002,008, 및 5,747,498, 뿐만 아니라 하기의 PCT 공보: WO98/14451, WO98/50038, WO99/09016, 및 WO99/24037. 특정한 소분자 EGFR 길항제는 하기를 포함한다: OSI-774 (CP-358774, 에를로티닙, 타르세바® Genentech/OSI 의약품); PD 183805 (CI 1033, 2-프로펜아미드, N-[4-[(3-클로로-4-플루오로페닐)아미노]-7-[3-(4-모폴리닐)프로폭시]-6-퀴나졸리닐]-, 디하이드로클로라이드, Pfizer Inc.); ZD1839, 게피티닙 (IRESSA®) 4-(3’-클로로-4’-플루오로아닐리노)-7-메톡시-6-(3-모폴리노프로폭시)퀴나졸린, AstraZeneca); ZM 105180 ((6-아미노-4-(3-메틸페닐-아미노)-퀴나졸린, Zeneca); BIBX-1382 (N8-(3-클로로-4-플루오로-페닐)-N2-(1-메틸-피페리딘-4-일)-피리미도[5,4-d]피리미딘-2,8-디아민, Boehringer Ingelheim); PKI-166 ((R)-4-[4-[(1-페닐에틸)아미노]-1H-피롤로[2,3-d]피리미딘-6-일]-페놀); (R)-6-(4-하이드록시페닐)-4-[(1-페닐에틸)아미노]-7H-피롤로[2,3-d]피리미딘); CL-387785 (N-[4-[(3-브로모페닐)아미노]-6-퀴나졸리닐]-2-부틴아미드(butynamide); EKB-569 (N-[4-[(3-클로로-4-플루오로페닐)아미노]-3-시아노-7-에톡시-6-퀴놀리닐]-4-(디메틸아미노)-2-부텐아미드) (Wyeth); AG1478 (Pfizer); AG1571 (SU 5271; Pfizer); 이중 EGFR/HER2 티로신 키나아제 억제제 예컨대 라파티닙 (TYKERB®, GSK572016 또는 N-[3-클로로-4-[(3 플루오로페닐)메톡시]페닐]-6[5[[[2메틸설포닐)에틸]아미노]메틸]-2-푸라닐]-4-퀴나졸린아민).
화학치료제는 또한 하기를 포함할 수 있다: 티로신 키나아제 억제제 (선행 단락에 주지된 EGFR-표적화된 약물 포함); 소분자 HER2 티로신 키나아제 억제제 예컨대 TAK165 (Takeda로부터 이용가능함); CP-724,714, ErbB2 수용체 티로신 키나아제의 경구 선택적 억제제 (Pfizer 및 OSI); 이중-HER 저해제 예컨대 EKB-569 (Wyeth로부터 이용가능함) (EGFR에 우선적으로 결합하지만 HER2 및 EGFR-과발현 세포 둘 모두를 억제함); 라파티닙 (GSK572016; Glaxo-SmithKline로부터 이용가능함), 경구 HER2 및 EGFR 티로신 키나아제 억제제; PKI-166 (Novartis로부터 이용가능함); 팬(pan)-HER 억제제 예컨대 카네르티닙 (CI-1033; Pharmacia); Raf-1 억제제 예컨대 안티센스 제제 ISIS-5132 (Raf-1 신호전달을 억제하는 ISIS 의약품으로부터 이용가능함); 비-HER 표적화된 TK 억제제 예컨대 이마티닙 메실레이트 (GLEEVEC®, Glaxo SmithKline로부터 이용가능함); 다중-표적화된 티로신 키나아제 저해제 예컨대 수니티닙 (SUTENT®, Pfizer로부터 이용가능함); VEGF 수용체 티로신 키나아제 저해제 예컨대 바탈라닙 (PTK787/ZK222584, Novartis/Schering AG로부터 이용가능함); MAPK 세포외 조절된 키나아제 I 저해제 CI-1040 (Pharmacia로부터 이용가능함); 퀴나졸린, 예컨대 PD 153035,4-(3-클로로아닐리노) 퀴나졸린; 피리도피리미딘; 피리미도피리미딘; 피롤로피리미딘, 예컨대 CGP 59326, CGP 60261 및 CGP 62706; 피라졸로피리미딘, 4-(페닐아미노)-7H-피롤로[2,3-d] 피리미딘; 쿠르쿠민 (디페룰로일 메탄, 4,5-비스 (4-플루오로아닐리노)프탈이미드); 타이르포스틴 (니트로티오펜 모이어티 함유); PD-0183805 (Warner-Lamber); 안티센스 분자 (예를 들면, HER-암호화 핵산에 결합하는 것들); 퀴녹살린 (US 특허 번호 5,804,396); 트리포스틴 (US 특허 번호 5,804,396); ZD6474 (Astra Zeneca); PTK-787 (Novartis/Schering AG); 팬(pan)-HER 억제제 예컨대 CI-1033 (Pfizer); 아피니탁 (ISIS 3521; Isis/Lilly); 이마티닙 메실레이트 (GLEEVEC®); PKI 166 (Novartis); GW2016 (Glaxo SmithKline); CI-1033 (Pfizer); EKB-569 (Wyeth); 세막시닙 (Pfizer); ZD6474 (AstraZeneca); PTK-787 (Novartis/Schering AG); INC-1C11 (Imclone), 라파마이신 (시롤리무스, RAPAMUNE®); 또는 하기 특허 공보 중 임의의 것에 기재된 것들: US 특허 번호 5,804,396; WO 1999/09016 (American Cyanamid); WO 1998/43960 (American Cyanamid); WO 1997/38983 (Warner Lambert); WO 1999/06378 (Warner Lambert); WO 1999/06396 (Warner Lambert); WO 1996/30347 (Pfizer, Inc); WO 1996/33978 (Zeneca); WO 1996/3397 (Zeneca) 및 WO 1996/33980 (Zeneca).
화학치료제로는 덱사메타손, 인터페론, 콜히친, 메토프린, 사이클로스포린, 암포테리신, 메트로니다졸, 알렘투주맙, 알리트레티노인, 알로푸리놀, 아미포스틴, 삼산화비소, 아스파라기나제, BCG 생균, 베바쿠지맙, 베사로틴, 클라드리빈, 클로파라빈, 다베포에틴 알파, 데니류킨, 덱스라족산, 에포에틴 알파, 엘로티닙, 필그라스팀, 히스트렐린 아세테이트, 이브리투모맙, 인터페론 알파-2a, 인터페론 알파-2b, 레날리도미드, 레바미졸, 메스나, 메톡살렌, 난드롤론, 넬라라빈, 노페투모맙, 오프렐베킨, 팔리페르민, 파미드로네이트, 페가데마제, 페가스파가제, 페그필그라스팀, 페메트렉세드 디소듐, 플리카마이신, 포르피머 소듐, 퀴나크린, 라스부리카제, 사르그라모스팀, 테모졸로마이드, VM-26, 6-TG, 토레미펜, 트레티노인, ATRA, 발루비신, 졸레드로네이트 및 졸레드론산 및 이들의 약학적으로 허용가능한 염을 포함한다.
"백금-계 화학치료제" 또는 "플라틴"은 백금의 배위 착물인 항암제를 의미한다. 백금-계 화학치료제의 예로는 카보플라틴, 시스플라틴 및 옥살리플래티넘이 있다.
"백금-계 화학요법"은 임의로 하나 이상의 다른 화학치료제와 병용되는 하나 이상의 백금-계 화학치료제를 사용한 요법을 의미한다.
"화학요법-내성" 암은 환자가 화학요법 레지멘을 받는 동안 진행되었거나(즉, 환자가 "화학요법 난치성") 또는 환자가 화학요법 레지멘을 완료한 후 12개월 이내(예컨대, 6개월 이내)에 진행된 환자의 암을 의미한다.
"백금-내성" 암은 백금-계 화학요법 레지멘을 받는 동안 진행되었거나(즉, 환자가 "백금 난치성") 또는 환자가 백금-계 화학요법 레지멘을 완료한 후 12개월 이내(예컨대, 6개월 이내)에 진행된 환자의 암을 의미한다.
"방사성요법"은 세포를 정상적으로 작용하도록 하거나 세포를 파괴하는 것을 함께 제한하기 위하여 세포에 충분한 손상을 유도하기 위하여 지시된 감마선 또는 베타선의 사용을 의미한다. 치료의 투여량 또는 기간을 측정하기 위하여 본 분야에서 많은 방법이 있을 것이라는 것이 고려된다. 전형적인 치료를 1회성 투여로 실시하였으며, 전형적인 투여량은 1일 당 10 내지 200 단위 (Grays)의 범위이다.
용어 "이점"은 가장 넓은 의미로 사용되며 바람직한 효과를 나타내며 특히 본원에서 정의된 임상적 이점을 포함한다. 임상적 이점은, 예를 들어, 감속 및 완전 정지를 포함하여 질병 진행의 어느 정도 억제; 질병 발병 및/또는 증상의 수 감소; 병변 크기의 감소; 인접한 말초 기관 및/또는 조직으로의 질병 세포 침윤의 저해(즉, 감소, 감속 또는 완전 정지); 질병 전파의 억제(즉, 감소, 감속 또는 완전 정지); 병변의 퇴행 또는 절제를 초래할 수 있지만 그럴 필요가 없는 자가-면역 반응의 감소; 장애와 관련된 하나 이상의 증상의 어느 정도 완화; 치료 후 무병 상태의 표현의 길이 예를 들어 무진행 생존율의 증가; 전체 생존율 증가; 높은 반응 속도; 및/또는 치료 후 주어진 시점에서의 사망률 감소와 같은 다양한 종말점을 평가함으로써 측정될 수 있다.
III. 방법
A. 치료의 방법
본 발명은 VEGF 길항제(예를 들어, 베바시주맙과 같은 항-VEGF 항체)에 반응할 수 있는 유형의 암을 갖는 환자를 치료하는 방법을 제공하며, 이 방법은 치료적 유효량의 길항제를 환자에게 투여하는 단계를 포함하고, 여기서, 환자의 암은 암 유형에서 CD31 MVD 및/또는 종양 VEGFA 발현의 중간 수준 초과의 수준에서 CD31 MVD 및/또는 종양 VEGFA를 발현하는 것으로 측정되었다. 바람직하게는 환자의 암은 50번째 백분위수 이상, 가장 바람직하게는 암 유형에서 CD31 발현 및/또는 종양 VEGFA 발현에 대해 75번째 백분위수 초과의 수준에서 CD31 MVD 및/또는 종양 VEGFA를 발현하는 것으로 측정되었다.
특정 구현예에서, 본 발명은 산부인과계 암(예를 들어, 난소, 복막, 난관, 자궁 경부, 자궁 내막, 질 또는 외음부 암) 또는 유방암(예를 들어, MBC)을 갖는 환자를 치료하는 방법을 제공하며, 이 방법은 치료적 효과량의 VEGF 길항제(예를 들어, 베바시주맙과 같은 항-VEGF 항체)를 환자에게 투여하는 단계를 포함하고, 여기서, 상기 환자의 암은 상기 암에서의 CD31 MVD 발현의 중간 수준 초과의 수준에서 CD31 MVD를 발현하는 것으로 측정되었고, 및/또는 상기 환자의 암 샘플은 상기 암의 CD31 발현을 위한 75번째 백분위수 초과의 수준에서 CD31 MVD를 발현하고/발현하거나 상기 중간 수준 초과의 수준에서 종양 VEGFA를 발현하는 것으로 측정되었고, 및/또는 상기 환자의 암 샘플은 암에서 종양 VEGFA 발현에 대해 75번째 백분위수 초과의 수준에서 종양 VEGFA를 발현하는 것으로 측정되었다. 임의로, 이들 방법은 하기에 추가로 기술되는 바와 같이 VEGF 길항제와 하나 이상의 추가의 화학치료제(예를 들어, 카보플라틴 및/또는 파클리탁셀)의 병용 투여를 포함한다.
또 다른 양태에서, 본 발명은, 임의로 하나 이상의 추가적인 화학치료제와 함께, VEGF 길항제(예를 들어, 베바시주맙과 같은 항-VEGF 항체)의 투여에 반응할 수 있는 유형의 암을 갖는 환자를 위한 치료법을 선택하는 방법을 제공하며, 이 방법은, 환자의 암 샘플에서 CD31 MVD 및/또는 종양 VEGFA 발현을 측정하는 단계; 및 암 샘플이 암 유형에서 CD31 MVD 및/또는 종양 VEGFA 발현에 대한 중간 수준 초과의 수준에서 CD31 MVD 및/또는 종양 VEGFA를 갖는 것으로 측정된 경우, VEGF 길항제(예를 들어, 베바시주맙과 같은 항-VEGF 항체)를 선택하는 단계를 포함한다. 이 구현예에서, 바람직하게는, 상기 암 유형은 산부인과계 암(예컨대, 난소, 복막, 난관, 자궁 경부, 자궁 내막, 질 또는 외음부 암) 또는 유방암(예컨대, MBC)이고, 이의 백금-내성 및/또는 진행성, 난치성 및/또는 재발성을 포함한다. 화학치료제(들)는 임의로 카보플라틴 및/또는 파클리탁셀일 수 있다.
VEGF 길항제(예를 들어, 베바시주맙과 같은 항-VEGF 항체)로 치료할 수 있는 다양한 암 유형의 예는 상기 정의 섹션에 열거되어 있다.바람직한 암 유형은 산부인과계 암(예컨대, 난소, 복막, 난관, 자궁 경부, 자궁 내막, 질 및 외음부 암)을 포함한다. 다양한 구현예에서, 치료되는 암은 진행성, 난치성, 재발성, 화학요법-내성 및/또는 백금-내성 암이다.
임의로 하나 이상의 화학치료제(예를 들어, 카보플라틴 및/또는 파클리탁셀)와 조합된 VEGF 길항제(예를 들어, 베바시주맙과 같은 항-VEGF 항체)로 치료하는 것은 바람직하게는 무진행 생존율(PFS) 및/또는 전체 생존율(OS)을 비롯해 생존률을 연장 및/또는 개선한다. 일 구현예에서, VEGF 길항제(예를 들어, 베바시주맙과 같은 항-VEGF 항체)로 치료하는 것은 치료받고 있는 암에 대해 승인된 항-종양제 또는 치료 표준을 투여함으로써 생존률을 적어도 약 20% 이상 연장시킨다. 바람직한 구현예에서, 환자는 산부인과계 암(예컨대, 난소, 복막, 난관, 자궁 경부, 자궁 내막, 질 또는 외음부 암) 또는 유방암(예컨대, MBC)을 갖는다. 환자는 임의로 진행성, 난치성, 재발성, 화학요법-내성 및/또는 백금-내성 형태의 암을 가질 수 있다.
임의로 하나 이상의 화학치료제(예컨대, 카보플라틴 및/또는 파클리탁셀)와 조합된 VEGF 길항제(예컨대, 베바시주맙과 같은 항-VEGF 항체)는 공지된 방법 예를 들어 정맥내 투여 예컨대 볼루스(bolus) 또는 일정 기간 동안의 연속 주입에 의하거나, 근육내, 복강내, 뇌척수내, 피하, 관절내, 활액낭내, 경막내, 경구, 국소 또는 흡입 경로에 따라 인간 환자에게 투여된다. 항체의 정맥 투여가 바람직하다.
암의 예방 또는 치료를 위해, BVEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및/또는 화학치료제의 적절한 용량은 상기 정의한 바와 같은 치료할 암의 형태, 항체가 예방학적 또는 치료학적 목적으로 투여되든지 간에, 질환의 중증정도 및 과정, 선행 치료법, 환자의 임상적 히스토리 및 약물에 대한 반응과, 주치의 판단에 따라 좌우될 것이다. 일 구현예에서, VEGF 길항제(예컨대, 베바시주맙)는 2주에 1회 5 mg/kg 체중, 2주에 1회 10 mg/kg 체중, 3주에 1회 7.5 mg/kg 체중, 또는 3주에 1회 15 mg/kg 체중으로 투여된다.
일 구현예에서, 고정 투여량의 VEGF 길항제가 투여된다. 고정 투여는 한 번에 또는 일련의 치료에 걸쳐 환자에 적절히 투여될 수 있다. 고정 투여량이 투여되는 경우, 이는 바람직하게는 약 20 mg 내지 약 2000 mg 범위의 억제제이다. 고정 투여량은 예를 들어 약 420 mg, 약 525 mg, 약 840 mg 또는 약 1050 mg의 억제제(예를 들어, 베바시주맙과 같은 항-VEGF 항체)일 수 있다. 일련의 투여가 투여될 경우, 이들은 예를 들어, 대략 1주 마다, 대략 2주 마다, 대략 3주 마다, 또는 대략 4주 마다, 그러나 바람직하게는 대략 3주 마다 투여될 수 있다. 고정 투여량은 예를 들어 의사가 측정한 질병의 진행, 이상 반응 또는 다른 시간이 될 때까지 계속 투여할 수 있다. 예를 들어, 약 2, 3 또는 4회 내지 약 17회 또는 그 이상의 고정 투여량이 투여될 수 있다.
일 구현예에서, VEGF 길항제(예를 들어, 베바시주맙과 같은 항-VEGF 항체)의 하나 이상의 로딩 투여량이 투여되고, 이어서 하나 이상의 유지 용량(들)이 투여된다. 또 다른 구현예에서, 상동한 용량의 다수가 환자에게 투여된다. 본 발명의 하나의 바람직한 구현예에 따르면, 약 840 mg(로딩 용량)의 고정 투여량의 VEGF 길항제(예를 들어, 베바시주맙과 같은 항-VEGF 항체)를 투여한 다음, 하나 이상의 용량의 약 420 mg(유지 용량)의 길항제를 투여한다. 유지 용량은 바람직하게는 약 3주마다, 총 2회 이상, 최대 17회 또는 그 이상으로 투여된다.
본 발명의 또 다른 바람직한 구현예에 따르면, 약 1050 mg의 VEGF 길항제(예를 들어, 베바시주맙과 같은 항-VEGF 항체)의 하나 이상의 고정 용량은 예를 들어 3주마다 투여된다. 이 구현예에 따르면, 1회, 2회 또는 그 이상의 고정 용량은 예를 들어 1년까지(17 사이클) 원하는 만큼 길게 투여한다.
또 다른 구현예에서, 약 1050 mg의 VEGF 길항제(예를 들어, 베바시주맙과 같은 항-VEGF 항체)의 고정 용량은 로딩 용량으로 투여한 다음, 약 525 mg의 하나 이상의 유지 용량을 투여한다. 이 구현예에 따라 약 1회, 2회 또는 그 이상의 유지 용량이 매 3주마다 환자에게 투여될 수 있다.
VEGF 길항제(예를 들어, 베바시주맙과 같은 항-VEGF 항체) 또는 화학치료제를 단일 항-종양제로서 투여할 수 있지만, 환자는 임의로 억제제(또는 화학치료제)와 하나 이상의 (추가적인) 화학치료제(들)의 조합으로 치료한다. 본원에서 예시적인 화학치료제는 젬시타빈, 카보플라틴, 옥살리플라틴, 이리노테칸, 플루오로피리미딘(예컨대, 5-FU), 파클리탁셀(예컨대, nab-파클리탁셀), 도세탁셀, 토포테칸, 카페시타빈, 테모졸로마이드, 인터페론-알파 및/또는 리포좀성 독소루비신(예컨대, 페길화 리포좀성 독소루비신)을 포함한다. 일부 구현예에서, 화학치료제 중 적어도 하나는 카보플라틴 또는 파클리탁셀이다. 조합된 투여에는 별도 제형 또는 단일 약제학적 제형을 이용한 공-투여 또는 동시-투여, 및 어느 순서로든 연속적인 투여가 포함되며, 여기서 바람직하게는 두(또는 모든) 활성제가 이들의 생물학적 활성을 동시에 발휘하는 시기가 있다. 따라서, 화학치료제는 VEGF 길항제(예를 들어, 베바시주맙과 같은 항-VEGF 항체)의 투여 전에 또는 투여 후에 투여될 수 있다. 이 구현예에서, 화학치료제의 적어도 1회 투여와 VEGF 길항제(예를 들어, 베바시주맙과 같은 항-VEGF 항체)의 적어도 1회 투여 사이의 기간은 바람직하게는 약 1개월 이하, 가장 바람직하게는 약 2주 이하이다. 대안적으로, 화학치료제 및 억제제는 환자에게 단일 제형 또는 별도의 제형으로 동시에 투여된다. 화학치료제(예컨대, 카보플라틴 및/또는 파클리탁셀)와 VEGF 길항제(예컨대, 베바시주맙과 같은 항-VEGF 항체)의 병용 치료는 환자에게 시너지 효과가 있거나 더 큰 부가적인 치료 효과를 가져올 수 있다.
특히 예를 들어 난소암 치료를 위한 VEGF 길항제(예를 들어, 베바시주맙과 같은 항-VEGF 항체)와 조합하기 위한 바람직한 화학치료제는 화학치료제 예컨대 백금 화합물(예컨대, 카보플라틴), 탁솔 예컨대 파클리탁셀 또는 도세탁셀, 토포테칸, 또는 리포좀성 독소루비신을 포함한다.
특히 예를 들어 진행된 상피성 난소암, 난관암 또는 원발성 복막암의 치료를 위해 VEGF 길항제(예를 들어, 베바시주맙과 같은 항-VEGF 항체)와 조합하기 위한 바람직한 화학치료제는 카보플라틴 및 파클리탁셀과 같은 화학치료제를 포함한다.
특히 예를 들어 백금-민감성 상피성 난소암, 난관암 또는 원발성 복막암의 치료를 위해 VEGF 길항제(예를 들어, 베바시주맙과 같은 항-VEGF 항체)와 조합하기 위한 바람직한 화학치료제는 카보플라틴 및 젬시타빈과 같은 화학치료제를 포함한다.
특히 예를 들어 백금-내성 재발성 상피성 난소암, 난관암 또는 원발성 복막암의 치료를 위해 VEGF 길항제(예를 들어, 베바시주맙과 같은 항-VEGF 항체)와 조합하기 위한 바람직한 화학치료제는 파클리탁셀, 토포테칸 또는 페길화 리포좀성 독소루비신과 같은 화학치료제를 포함한다.
특히 예를 들어 유방암의 치료를 위해 VEGF 길항제(예를 들어, 베바시주맙과 같은 항-VEGF 항체)와 조합하기 위한 바람직한 화학치료제는 카페시타빈 및 탁솔 예를 들어 파클리탁셀(예컨대, nab-파클리탁셀) 또는 도세탁셀과 같은 화학치료제를 포함한다.
특히 예를 들어 아교모세포종의 치료를 위해 VEGF 길항제(예를 들어, 베바시주맙과 같은 항-VEGF 항체)와 조합하기 위한 바람직한 화학치료제는 임의로 방사성요법과 병용되는 테모졸로마이드와 같은 화학치료제를 포함한다.
특히 예를 들어 결장직장암 치료를 위해 VEGF 길항제(예를 들어, 베바시주맙과 같은 항-VEGF 항체)와 조합하기 위한 바람직한 화학치료제는 다음을 포함한다: 화학치료제 예를 들어 플루오로피리미딘(예컨대, 5-FU), 파클리탁셀, 시스플라틴, 토포테칸, 이리노테칸, 플루오로피리미딘-옥살리플라틴, 플루오로피리미딘-이리노테칸, FOLFOX4(5-FU, 레코보린, 옥살리플라틴) 및 IFL(이로노테칸, 5-FU, 류코보린).
특히 예를 들어 신장 세포 암종 치료를 위해 VEGF 길항제(예를 들어, 베바시주맙과 같은 항-VEGF 항체)와 조합하기 위한 바람직한 화학치료제는 다음을 포함한다: 화학치료제 예컨대 인터페론-알파2a.
특히 예를 들어 자궁경부암 치료를 위해 VEGF 길항제(예를 들어, 베바시주맙과 같은 항-VEGF 항체)와 조합하기 위한 바람직한 화학치료제는 다음을 포함한다: 화학치료제 예컨대 파클리탁셀, 시스플라틴, 토포테칸, 시스플라틴과 조합한 파클리탁셀, 및 토포테칸과 조합한 파클리탁셀.
화학치료제를 투여하는 경우, 이는 통상적으로 공지된 투여량으로 투여되거나, 임의로 약제의 병용 작용 또는 화학치료제의 투여에 기인하는 부작용으로 인해 낮아진다. 그와 같은 화학치료제에 대한 제조 및 투여 일정은 제조자의 설명서에 따라 또는 당업자에 의해 실험적으로 측정된 바에 따라 사용될 수 있다. 화학치료제가 파클리탁셀인 경우, 바람직하게는 이는 약 130 mg/㎡ 내지 200 mg/㎡(예를 들어, 약 175 mg/㎡)의 투여량으로 예를 들어 3시간에 걸쳐 3주에 1회 투여된다. 화학치료제가 카보플라틴인 경우, 바람직하게는 이는 환자의 기존 신장 기능 또는 신장 기능 및 원하는 혈소판 천저에 기초한 칼버트(Calvert) 식을 사용하여 카보플라틴의 투여량을 계산함으로써 투여된다. 신장 배설은 카보플라틴의 주요 제거 경로이다. 체표면적을 기준으로 한 경험적 용량 계산과 비교하여, 상기 투약 공식을 사용하면, 그렇지 않은 경우에 과소 투여(평균 신장 기능 이상인 환자에서) 또는 과다 투여(신장 기능 장애가 있는 환자에서)로 나타날 수 있는 전처리 신장 기능의 환자 편차를 보상할 수 있다. 단일 약제 카보플라틴을 사용한 4 내지 6 mg/mL/min의 목표 AUC는 이전에 치료받은 환자에서 가장 적절한 용량 범위를 제공하는 것으로 보인다.
VEGF 길항제(예를 들어, 베바시주맙과 같은 항-VEGF 항체) 및 화학치료제 외에, 다른 치료 레지멘을 이와 병용할 수 있다. 예를 들어 제2(제3, 제3 등) 화학치료제가 투여될 수 있고, 여기서, 제2 화학치료제는 항-대사물질 화학치료제 또는 항-대사물질이 아닌 화학치료제이다. 예를 들어, 제2 화학치료제는 탁산(예컨대, 파클리탁셀 또는 도세탁셀), 카페시타빈 또는 백금-계 화학치료제(예컨대, 카보플라틴, 시스플라틴 또는 옥살리플라틴), 안트라사이클린(예컨대, 독소루비신 예컨대 리포좀성 독소루비신), 토포테칸, 페메트렉세드, 빈카 알칼로이드(예컨대, 비노렐빈) 및 TLK 286일 수 있다. 상이한 화학치료제의 "칵테일"이 투여될 수 있다.
VEGF 길항제(예를 들어, 베바시주맙과 같은 항-VEGF 항체) 및/또는 화학치료제와 조합될 수 있는 다른 치료제는 다음 중 임의의 하나 이상을 포함한다: HER 억제제, HER 이량체화 억제제(예를 들어, 트라스투주맙과 같은 성장 억제 HER2 항체 또는 HER2 과발현 세포의 아폽토시스를 유도하는 HER2 항체, 예컨대 7C2,7F3 또는 이의 인간화된 변형체); EGFR, HER3, HER4와 같은 상이한 종양 관련 항원에 대해 유도된 항체; 항-호르몬 화합물 예를 들어 타목시펜과 같은 항-에스트로겐 화합물 또는 방향화효소 억제제; 심장보호제(치료와 관련된 임의의 심근 기능 장애를 예방 또는 감소시키기 위해); 시토카인; EGFR-표적 약물(예컨대, 타르세바(TARCEVA®) 이레사(IRESSA®) 또는 세툭시맙); 티로신 키나아제 억제제; COX 억제제(예를 들어, COX-1 또는 COX-2 억제제); 비-스테로이드성 항-염증성 약물인 셀레콕시브(셀레브렉스(CELEBREX®); 파네실 전달효소 억제제(예컨대, 존슨 앤드 존슨(Johnson and Johnson)로부터 입수할 수 있는 티피파닙/자네스트라(ZARNESTRA®) R115777 또는 쉐링-플라우(Schering-Plough)로부터 입수할 수 있는 로나파닙(SCH66336)); 오레고보맙(MoAb B43.13)과 같은 양태자 단백질 CA125에 결합하는 항체; HER2 백신(파멕시아(Pharmexia)의 HER2AutoVac 백신 또는 덴드레온(Dendreon)의 APC8024 단백질 백신, 또는 GSK/코릭사의 HER2 펩티드 백신); 또 다른 HER 표적 치료(예컨대, 트라스투주맙, 세툭시맙, ABX-EGF, EMD7200, 게피티닙, 에를로티닙, CP724714, CI1033, GW572016, IMC-11F8, TAK165 등); Raf 및/또는 ras 억제제(예를 들어, WO 2003/86467 참조); 독소루비신 HCl 리포좀 주입(DOXIL®); 토포테칸과 같은 토포 아이소머라제 1 억제제; 탁산; 라파티닙/GW572016과 같은 HER2 및 EGFR 이중 티로신 키나아제 억제제; TLK286(TELCYTA®); EMD-7200; 세로토닌 길항제, 스테로이드 또는 벤조디아제핀과 같은 메스꺼움을 치료하는 약제; 국소용 또는 경구용 항생제를 포함한 피부 발진이나 표준 여드름 치료를 예방 또는 치료하는 약제; 설사를 치료 또는 예방하는 약제; 아세트아미노펜, 디펜하이드라민 또는 메페리딘과 같은 체온-저하 약제; 조혈 성장 인자 등.
임의의 상기 공-투여된 제제의 적합한 투여량은 현재 사용되는 것들이며, 제제 및 억제제의 조합된 작용(상승효과)로 인해 낮아질 수 있다.
상기 치료법 이외에, 환자는 종양 및/또는 암세포의 외과적 제거 및/또는 방사선 요법으로 처리할 수 있다.
VEGF 길항제가 항체(예컨대, 베바시주맙)인 경우, 바람직하게는 투여된 항체는 네이키드(naked) 항체이다. 투여된 VEGF 길항제(예를 들어, 베바시주맙과 같은 항-VEGF 항체)는 세포독성제와 컨쥬게이션될 수 있다. 바람직하게는, 이것이 결합된 콘주게이트된 항체 및/또는 항원은 세포에 의해 내재화되어 이것이 결합하는 암 세포의 사멸에서 콘주게이트의 증가된 치료적 효능을 야기한다. 바람직한 구현예에서, 세포독성제는 암 세포에서 핵산을 표적으로 하거나 이를 저해할 수 있다. 그와 같은 세포독성제의 예에는 메이탄시노이드, 칼리키아마이신, 리보뉴클레아제 및 DNA 엔도뉴클레아제가 포함된다.
VEGF 길항제(예를 들어, 베바시주맙과 같은 항-VEGF 항체)는 유전자 요법으로 투여될 수 있다. 예를 들어, 세포내 항체를 생성시키는 유전자 요법의 사용에 관한 1996년 3월 14일자로 공개된 WO 96/07321 참조. 생체내 및 생체외로 환자의 세포 내로 핵산(임의로 벡터에 함유됨)을 얻기 위한 2 개의 주요 접근법이 존재한다. 생체내 전달을 위해, 핵산은 보통 항체가 필요한 부위에서 환자 내로 직접적으로 주사된다. 생체외 치료를 위해, 환자의 세포가 제거되고, 핵산이 이들 단리된 세포 내로 도입되고, 개질된 세포가 직접적으로 환자에게 투여되거나, 예를 들면, 환자 내로 이식되는 다공성 막 내로 캡슐화된다(예를 들면, 미국 특허 번호 4,892,538 및 5,283,187 참고). 생활성 세포 내로 핵산을 도입하기 위해 이용 가능한 다양한 기술이 존재한다. 기술은 핵산이 의도된 숙주의 세포에서 시험관내 또는 생체내 배양 세포 내로 전달되는지 여부에 따라 변한다. 시험관내 포유동물 세포 내로의 핵산 전달에 적당한 기술에는 리포좀, 전기천공, 미세주입, 세포 융합, DEAE-덱스트란, 칼슘 포스페이트 침전 방법 등의 이용이 포함된다. 유전자의 생체외 전달을 위해 통상적으로 사용되는 벡터는 레트로바이러스이다. 현재 바람직한 생체내 핵산 전달 기술에는 바이러스 벡터(예컨대 아데노바이러스, 단순 포진 I 바이러스, 또는 아데노-관련된 바이러스) 및 지질-기반 시스템(유전자의 지질-매개된 전달에 유용한 지질은, 예를 들면 DOTMA, DOPE 및 DC-Chol)을 이용한 형질감염이 포함된다. 일부 상황에서, 핵산 공급원에 세포 표면 막 단백질 또는 표적 세포에 특이적인 항체, 표적 세포 상의 수용체에 대한 리간드 등과 같은 표적 세포를 표적으로 하는 약제를 제공하는 것이 바람직하다. 리포좀이 사용되는 경우, 엔도시토시스와 관련된 세포 표면 막 단백질에 결합하는 단백질은 예를 들어 특정 세포 유형에 대한 캡시드 단백질 또는 이의 단편, 순환 내 내재화를 겪는 단백질에 대한 항체, 및 세포내 국지화를 표적으로 하고 세포내 반감기를 증진시키는 단백질을 표적화 및/또는 섭취를 용이하게 하는 데 사용될 수 있다. 수용체-매개 엔도시토시스의 기술은 예를 들어 하기에 기재되어 있다: Wu et al., J. Biol . Chem . 262:44294432 (1987); 및 Wagner et al., Proc . Natl . Acad . Sci . USA 87:3410-3414 (1990). 현재까지 공지된 유전자 마킹 및 유전자 치료 프로토콜의 검토를 위해서는 문헌[Anderson et al., Science 256:808-813 (1992)] 참고한다. 또한, WO 93/25673 및 여기에 인용된 문헌을 참고한다.
B. 예후, 진단 및 검출 방법
본 발명은, 임의로 화학요법과 병행하여, VEGF 길항제(예를 들어, 베바시주맙과 같은 항-VEGF 항체)로 치료함으로써, 암(예를 들어, 산부인과계 암(예를 들어, 난소, 복막, 난관, 자궁 경부, 자궁 내막, 질 또는 외음부 암) 또는 유방암(예를 들어, MBC; 하기 참조))으로 고통받는 환자의 무진행 생존율(PFS) 및 전체 생존율(OS)을 개선시키는 방법을 제공한다. 본 발명은, 임의로 화학요법과 병행하여, VEGF 길항제(예를 들어, 베바시주맙과 같은 항-VEGF 항체)의 투여로부터 이점을 받을 수 있는 암(예를 들어, 산부인과계 암(예를 들어, 난소, 복막, 난관, 자궁 경부, 자궁 내막, 질 또는 외음부 암) 또는 유방암(예를 들어, MBC; 하기 참조))으로 고통받는 환자를 식별하는 방법을 제공한다. 이들 방법은 CD31 발현 및/또는 종양 VEGFA 발현 수준을 측정하고 이들을 암 유형의 중간 수준과 비교하는 것을 포함하며, 여기서, CD31 및/또는 종양 VEGFA의 암 유형에서의 발현에 대한 중간 수준 초과의 수준에서의 발현은 환자가, 임의로 다른 항암 요법(예를 들어, 화학요법(예컨대, 카보플라틴 및/또는 파클리탁셀))과 함께, VEGF 길항제(예를 들어, 베바시주맙과 같은 항-VEGF 항체)의 투여로부터 이점을 얻을 수 있음을 나타낸다.
본 발명은 또한 암(예를 들어, 산부인과계 암(예컨대, 난소, 복막, 난관, 자궁 경부, 자궁 내막, 질 또는 외음부 암) 또는 유방암(예컨대, 전이성 유방암(MBC); 하기 참조))으로 진단된 환자의 대조군 수준에 대한 하나 이상의 CD31 발현 및/또는 종양 VEGFA 발현 수준을 측정함으로써, 임의로 화학요법과 함께, VEGF 길항제(예를 들어, 베바시주맙과 같은 항-VEGF 항체)에 대한 환자의 감수성 또는 반응성을 평가하는 방법을 제공한다.
본 발명은 또한 환자로부터 수득한 샘플에서 CD31 발현 및/또는 종양 VEGFA 발현 수준을 측정하고, CD31 MVD 및/또는 종양 발현 VEGFA의 수준을 각각 암 유형의 CD31 MVD 및/또는 종양 VEGFA 발현의 중간 수준과 비교하고, 환자에 대한 예측을 측정함으로써, 암(예를 들어, 산부인과계 암(예를 들어, 난소, 복막, 난관, 자궁 경부, 자궁 내막, 질 또는 외음부 암) 또는 유방암(예를 들어, 전이성 유방암(MBC); 하기 참조))을 앓고 있는 환자에 대한 예측 방법을 제공한다. 불량한 예후는 CD31 MVD 및/또는 종양 VEGFA의 발현이 CD31 발현 및/또는 종양 VEGFA 발현의 중간 수준 초과의 수준에 있을 때이다. 상기 방법은 임의로, 환자의 생존율에 대한 예후가 좋지 않은 것으로 측정되는 경우 VEGF 길항제(예컨대, 베바시주맙과 같은 항-VEGF 항체)의 투여로부터 이점을 얻을 수 있을 것 같은 환자를 식별하는 단계를 포함하며, 임의로, 환자의 예후가 좋지 않다고 측정되면, 치료적 유효량의 VEGF 길항제(예컨대, 베바시주맙과 같은 항-VEGF 항체)를 환자에게 투여하는 단계를 더 포함한다.
따라서, 본 발명은, 임의로 카보플라틴-계 화학요법과 같은 화학치료 레지멘과 병용하여, 혈관 형성 억제제 예를 들어 VEGF 길항제(예컨대, 베바시주맙과 같은 항-VEGF 항체)에 대한 감수성 또는 반응성과 관련된 암(예를 들어, 산부인과계 암(예컨대, 난소, 복막, 난관, 자궁 경부, 자궁 내막, 질 또는 외음부 암) 또는 유방암(예를 들어, MBC; 하기 참조)의 바이오마커의 동정, 선택 및 용도에 관한 것이다. 이와 관련하여, 본 발명은, (a) 암(예를 들어, 산부인과계 암(예컨대, 난소, 복막, 난관, 자궁 경부, 자궁 내막, 질 또는 외음부 암) 또는 유방암(예를 들어, MBC; 하기 참조))으로 진단된 환자에서 확립된 대조군(예컨대, 중앙값)에 대한 하나 이상의 CD31 및/또는 종양 VEGFA의 종양 특이적 발현 프로파일을 VEGF 길항제(예를 들어, 베바시주맙과 같은 항-VEGF 항체)와 같은 혈관형성 억제제의 첨가에 민감하거나 반응하는 환자를 표준 화학요법으로 식별하는 것에 사용하는 것에 관한 것이다. 본 발명은 또한 (a) 암(예를 들어, 산부인과계 암(예컨대, 난소, 복막, 난관, 자궁 경부, 자궁 내막, 질 또는 외음부 암) 또는 유방암(예를 들어, MBC; 하기 참조))으로 진단된 환자에서 대조군(예컨대, 중앙값)에 대한 하나 이상의 CD31 및/또는 종양 VEGFA 종양 특이적 발현 수준을 측정함으로써, 예를 들어 VEGF 길항제(예컨대, 베바시주맙과 같은 항-VEGF 항체)를 표준 화학요법(예컨대, 카보플라틴- 및/또는 파클리탁셀-계 화학요법)에 첨가에 의해 암(예를 들어, 산부인과계 암(예컨대, 난소, 복막, 난관, 자궁 경부, 자궁 내막, 질 또는 외음부 암) 또는 유방암(예를 들어, MBC; 하기 참조))을 앓고 있는 환자의 PFS 및/또는 OS를 개선시키는 방법에 관한 것이다.
CD31 발현 및/또는 종양 VEGFA 발현 수준은 환자 샘플에서 특정 단백질 수준의 측정에 적합한 당업계에 공지된 임의의 방법에 의해 평가될 수 있고, 바람직하게는 CD31 및/또는 종양 VEGFA에 특이적인 항체를 사용하는 면역조직화학적("IHC") 방법에 의해 측정된다. 이러한 방법은 당업계에 널리 공지되어 있고 통상적으로 실시되며, 상응하는 상업적 항체 및/또는 키트가 용이하게 입수가능하다. 예를 들어, VEGFA 및 CD31에 대한 상업적으로 입수가능한 항체/테스트 키트는 클론 SP28로서 앱캡 인코포레이티드(Abcam, Inc.)(미국 메사추세츠주 캠브리지)로부터 그리고 클론 JC70A로서 다코 에이에스(Dako A/S)(덴마크 글로스트룹)으로부터 입수할 수 있다. 바람직하게는, 본 발명의 마커/표지자 단백질의 발현 수준은 항체 또는 키트 제조자의 시약 및/또는 프로토콜 권고를 사용하여 평가한다. 당업자는 또한 IHC 방법에 의해 CD31 발현 및/또는 종양 VEGFA 발현 수준을 측정하기 위한 추가적인 수단을 인식할 것이다. 따라서, 본 발명의 마커/표지자 중 하나 이상의 발현 수준은 과도한 부담없이 당업자에 의해 일상적으로 그리고 재현가능하게 측정될 수 있다. 그러나 정확하고 재현성 있는 결과를 보장하기 위해, 본 발명은 또한 시험 절차의 검증을 보장할 수 있는 전문 실험실에서의 환자 샘플의 시험을 포함한다.
바람직하게는, CD31 발현 및/또는 종양 VEGFA 발현 수준은 암세포를 함유하거나 또는 암세포를 함유할 것으로 의심되는 생물학적 샘플에서 평가된다. 샘플은 예를 들어 난소 조직 절제술, 난소 조직 생검, 또는 암(예컨대, 산부인과계 암, 특히 난소암)으로 고통받거나 의심되거나 상기 암으로 진단받은 환자에서 얻은 전이성 병변일 수 있다. 바람직하게는, 샘플은 난소 조직 샘플, 난소 종양의 절제 또는 생검, 알려 졌거나 의심되는 전이성 난소암 병변 또는 절편, 또는 순환하는 암세포 예를 들어 난소 암세포를 포함하는 것으로 알려지거나 또는 의심되는 혈액 샘플 예를 들어 말초 혈액 샘플이다. 샘플은 암세포, 즉 종양 세포 및 비-암성 세포 모두를 포함할 수 있으며, 특정 구현예에서는 암세포 및 비-암성 세포 모두를 포함한다. 샘플(이하의 예 참조)에서 혈관 수의 측정을 포함하는 본 발명의 양태에서, 샘플은 내피세포인 암/종양 세포 및 비-암성 세포 모두를 포함한다. 숙련된 기술자, 예를 들어 병리학자는 내피세포 마커 예컨대 CD31의 검출을 위해 샘플을 염색함으로써 샘플 내에서 혈관 수를 측정할 뿐만 아니라 비-암성, 예를 들어 내피세포로부터 암세포를 용이하게 식별할 수 있다. 혈관 수의 직접 측정에 대한 대안 또는 추가로서, 하나 이상의 내피세포 마커, 예를 들어 CD31의 발현 수준이 또한 측정될 수 있으며, 이 수준은 혈관 수와 서로 관련이 있다. 조직 절제, 생검 및 체액, 예를 들어 암/종양 세포를 포함하는 혈액 샘플을 포함하는 생물학적 샘플을 수득하는 방법은 당업계에 잘 알려져 있다. 일부 구현예에서, 환자로부터 수득된 샘플은 임의의 화학 치료 레지멘 또는 치료, 예를 들어 암의 치료 또는 이의 증상의 관리 또는 개선을 위한 치료를 시작하기 전에 수집된다. 따라서, 일부 구현예에서, 샘플은 화학요법의 투여 또는 화학요법의 시작 전에 수집된다.
상기 기술된 방법 이외에, 본 발명은 또한 웨스턴 블롯팅 및 ELISA-기반 검출에 의해 하나 이상의 종양 CD31 발현 및/또는 종양 VEGFA 발현 수준을 평가하기 위한 추가의 면역조직화학적 방법을 포함한다. 하나 이상의 내피세포 마커, 예를 들어, CD31의 종양 특이적 발현 수준의 측정을 포함하여, 혈관 수의 측정을 위한 대안적 방법 또는 추가적인 방법에서 유사한 방법을 사용할 수 있다. 당해 기술 분야에서 이해되는 바와 같이, 본 발명의 마커/표지자 단백질의 발현 수준은 또한 노던 블롯팅, 실시간 PCR 및 RT PCR과 같은 당업계에 공지된 임의의 적합한 방법에 의해 mRNA 수준에서 평가될 수 있다. 면역조직화학 및 mRNA-기반 검출 방법 및 시스템은 당업계에 잘 공지되어 있으며, 문헌[Lottspeich (Bioanalytik, Spektrum Akademisher Verlag, 1998)] 또는 [Sambrook and Russell (Molecular Cloning: A Laboratory Manual, CSH Press, Cold Spring Harbor, NY, USA, 2001)] 등의 표준 교과서로부터 유추할 수 있다. A Laboratory Manual, CSH Press, Cold Spring Harbor, N.Y., U.S.A., 2001). 상기 기술된 방법은 암(예를 들어, 난소암과 같은 산부인과계 암)의 진행 단계로 진단된 모집단으로 확립된 대조군 수준에 비해 환자 또는 환자군의 CD31 발현 및/또는 종양 VEGFA 발현 수준을 측정하는 데 특히 유용하다.
하나 이상의 VEGFA 및/또는 하나 이상의 내피세포 마커, 예를 들어 CD31의 발현 수준은 또한 면역 응고, 면역 침강(예컨대, 면역 확산, 면역 전기영동, 면역 고정), 웨스턴 블롯팅 기법(예컨대, (동일계내(in situ) 면역 조직화학법, (동일계내) 면역 세포화학 법, 친화성 크로마토그래피, 효소 면역법) 등을 이용함으로써 단백질 수준에서 측정될 수 있다. 용액 중의 정제된 폴리펩티드의 양은 또한 물리적 방법, 예를 들면, 측광에 의해 측정될 수 있다. 혼합물에서 특정 폴리펩티드를 정량하는 방법은 대개 예를 들면 항체의 특이적 결합에 의존한다.
상기한 바와 같이, 본 발명에 따른 마커/표지자 단백질의 발현 수준은 또한 본원에 기술된 혈관 수를 측정하기 위한 VEGFA 및/또는 하나 이상의 내피세포 마커, 예를 들어, CD31를 암호화하는 상응하는 유전자(들)의 발현 감소에 반영될 수 있다. 따라서, 상응하는 유전자(들)의 발현을 평가하기 위해, 번역 이전의 유전자 산물(예를 들어, 스플라이싱되거나 스플라이싱되지 않거나 또는 부분적으로 스플라이싱된 mRNA)의 정량적 평가가 수행될 수 있다. 당업자는 이 문맥에서 사용되는 표준 방법을 알고 있거나 표준 교과서(예컨대, 문헌[Sambrook, 2001, loc. cit.])로부터 이들 방법을 유추해 낼 수 있다. 예를 들어, 본원에 기술된 혈관 수의 측정을 위한 하나 이상의 VEGFA 및/또는 하나 이상의 내피세포 마커, 예를 들어 CD31을 암호화하는 mRNA의 각각의 농도/양에 대한 정량적 데이터는 노던 블롯, 실시간 PCR 등에 의해 얻을 수 있다.
본원에 기술된 검출 방법에 사용하기 위해, 당업자는 본 발명에 포함되는 폴리펩티드 또는 올리고뉴클레오티드를 표지할 수 있는 능력을 갖는다. 당업계에서 일상적으로 실시되는 바와 같이, IHC 방법에 사용하기 위해 mRNA 수준 및/또는 항체 또는 항체 단편을 검출하는 데 사용하기 위한 하이브리드화 프로브는 당업계에 공지된 표준 방법에 따라 표지되고 시각화될 수 있다. 통상적으로 사용되는 시스템의 비-제한적인 예는 방사성 표지, 효소 표지, 형광 태그, 비오틴-아비딘 복합체, 화학 발광 등의 사용을 포함한다.
본원에 기술된 방법에 따른 하나 이상의 CD31 및 종양 VEGFA의 발현 수준의 측정에 대한 대안 또는 추가로서, (a) 암(예를 들어, 산부인과계 암(예컨대, 난소, 복막, 난관, 자궁경부, 자궁내막, 질 또는 외음부 암) 또는 유방암(예컨대, MBC; 하기 참조))을 가진 환자에서 확립된 대조군 수준(들)에 대한 종양 샘플에서의 혈관 수는, 임의로 표준 화학요법에 추가하여, 혈관형성 억제제 예를 들면 VEGF 길항제(예를 들어, 베바시주맙과 같은 항-VEGF 항체)에 민감하거나 반응하는 환자의 지표 또는 바이오마커로서 측정될 수 있다.
실시예
1차 줄기 난소암에서의 개선된 베바시주맙 효과를 위한 예측 바이오마커로서의 CD31 및 종양 VEGFA: 종양 조직 후향적 분석
A.샘플 및 대상체
종양 조직 샘플은 새로 진단된, 이전에 치료되지 않은, 차선 단계의 상피성 난소암 및 원발성 복막암을 갖는 환자에게서 수집되었으며, 카보플라틴 및 파클리탁셀 + 위약(CPP) 대 카보플라틴 및 파클리탁셀 + 동시 베바시주맙에 이어서 위약(CPB15) 대 카보플라틴 및 파클리탁셀 + 동시 및 확장 베바시주맙(CPT15+)의 3상 임상 시험에 참여한 환자로부터 수집되었다(도 1). 의도된 치료(ITT) 모집단 분석에는 1,852명의 환자가 포함되었고 BEP(biomarker evaluable population) 모집단 분석에는 1,438명의 환자가 포함되었다.
B. 분석 방법
이 연구의 분석 결과는 표준화된 통계 도구를 사용하여 생성되어 다음과 같은 질문을 해결했다:
1.) 바이오마커 모집단의 대표성: 주요 기준 인구 통계 및 예후 특성(성층 변수 및 공지된 예후적 유의도를 갖는 임의의 변수 포함)과 효능 결과를 치료 그룹별로 요약하고 바이오마커와 ITT 모집단을 비교하여 바이오마커의 유용성과 관련된 임의의 잠재적인 선택 편향을 조사했다.
2.) 바이오마커 특성: 기준에서의 바이오마커의 전반적인 분포가 그려졌고 기술적 통계(평균, 표준 편차 및 범위)가 환자 모집단의 기준 바이오마커 값을 요약하는 데 사용되었다. 바이오마커와 주요 인구학적 예후 변수 사이의 관계는 이변량 플롯(bivariate plot)을 사용하여 조사되었다. 바이오마커의 예후적 특성은 대조군에서의 임상 효능의 측정에 의해 평가되었으며, 이에 상응하는 95% 신뢰 구간이 도표화되었다.
3.) 바이오마커의 예측 특성: 기준에서 측정된 바이오마커의 예측 효과는 탐색 그래픽을 사용하여 평가되었다. 연속 바이오마커에 대한 STEPP(하위그룹 치료 효과 패턴 플롯)와 사전 지정된 컷오프(4 분위수)에서의 포레스트 플롯이 컷오프 선택을 탐구하는 1차 산출물이었다.
4.) 하위그룹 분석: 일단 컷오프가 측정되면, 기준에서 측정된 바이오마커의 예측 효과가 상호 작용 항을 갖는 통계 모델을 사용하여 평가되고, 바이오마커의 사전 지정된 값으로 정의된 두 그룹의 환자에서의 치료 효과를 비교함으로써 평가된다. 카플란-마이어 곡선과 포레스트 플롯에 대한 표준 출력이 제공되었다. 또한, 바이오마커의 높은 또는 낮은 그룹 내의 치료군 간의 선택 편견을 평가했다.
C.결과
환자 인구통계
주어진 바이오마커의 경우, BEP 모집단은 기준에서 랜덤화되고 바이오마커 데이터가 누락되지 않은 모든 대상체를 포함한다. 비-바이오마커 모집단은 바이오마커 평가 모집단의 보완물로 정의된다. 이 연구에서 BEP에는 CD31 RNA 데이터가 누락되지 않은 환자가 포함된다. 주요 인구통계 및 기준 특성(층화 변수 및 예후 인자가 알려진 모든 변수)과 효능 결과를 치료 그룹별로 요약하고, 바이오마커와 치료하고자 하는(ITT) 집단을 비교하여, 바이오마커의 누락된 상태와 관련된 임의의 잠재적인 선택 편향을 조사했다. 이번 연구에서 ITT(N = 1852)와 BEP(N = 1438) 모집단 간의 무진행 생존율(PFS)과 전체 생존율(OS)은 비슷했다. ITT 및 BEP 모집단의 환자 인구통계에 대한 세부 정보가 표 1에 도시되어 있다.
표
1. ITT
대
BEP
환자 인구통계
CD31 면역조직화학적 방법
CD31의 면역조직화학 염색은 혈관 검출에 사용되었다. CD31은 림프관 및 간 정현 내피세포를 비롯한 여러 종류의 혈관으로부터 내피를 오염시킨다. CD31-염색 구조의 형태는 실-유사 모양(종단면 모세관)으로부터 단일 세포-유사(횡단면 모세관)까지 다양하다. CD31(PECAM-1)의 면역조직화학적 검출은 벤타나 벤치마크(Ventana Benchmark®) XT 플랫폼(미국 애리조나주 툭산 소재 벤타나)을 사용하여 수행되었다. CD31의 검출은 벤타나의 마우스 단일클론 항체(클론 1A10)를 사용하여 전개되었다. 면역조직화학은 조직 내 표적 항원(예컨대, CD31), 이 경우에는 포르말린-고정된 파라핀-내장 조직의 존재 또는 부재를 검출하는 데 사용된 반-정량적 방법이다. 요컨대, 울트라 뷰(ultra view ™) 유니버셜 DAB 검출 키트를 사용하는 프로토콜 번호 91이 사용되었다. 탈-파라핀화 및 재수화(rehydration) 후, 항원 검색은 37℃에서 32분의 항-CD31 항체 배양으로 수행되었다. 각각의 IHC 분석에 대해 정확성, 특이성, 선형성 및 정밀도(재현성 및 반복성)를 보여주는 유효성 식별 보고서를 만들었다. 외부 대조 슬라이드 및 고유 대조 요소에 대한 염색을 기록했다. 이와 같은 방법이 하기에 좀 더 상세히 기술되었다.
CD31 혈관 염색은 고정된 조직 샘플에서 혈관 수(㎟ 당 #) 및 혈관 부피 분율(%)을 측정하여 평가하였다. 일반적으로, CD31 염색에 대해 점수를 매기 위해 체계적으로 균일한 랜덤 표본 추출을 위해 입체-기반의 방법을 사용했다. 20x 배율 또는 40x 배율에서 최소 3개의 관심 영역(ROI)을 최대 15개의 ROI와 함께 선택했다.
눈금을 이미지상에 배치하여 평가할 수 있도록 하였다. 그런 다음, 선택된 ROI 이미지를 사전 정의된 격자점과 결합하였다. 부피 분율은 조직, 세포 또는 관심 구조의 상단에 떨어지는 계수 격자점의 교차 선에 의해 형성된 격자점 포인트를 계산하여 추정하였다. 이 분획은 조직, 세포 또는 관심 구조의 부피 밀도를 나타낸다. 전형적으로, 교차(또는 격자점)의 오른쪽 상단 모서리만 고려했다. 명백한 조직 파열이나 종양 조직 외부에 있는 격자점 포인트는 계산되지 않았다. 종양 구조 내의 작은 괴사 부위는 종양의 일부로 간주되었기 때문에 계산되었다. 혈관 내강에 있는 격자점도 계산하였다. 영역의 75% 초과가 조직으로 이루어진 격자점(예컨대, 25개 격자점 포인트 중 19개 이상 또는 81개 격자점 포인트 중 61개 이상)만 분석했다. 그렇지 않은 경우, 그 영역은 분석에서 제외했다.
염색된 내피세포 또는 혈관 루멘이 오른쪽 상단 격자점 모서리에 있는 것으로 밝혀졌을 때 혈관에 대한 격자점(혈관을 나타내는 격자점의 양)을 계산했다. 큰 혈관의 단일 내피세포만 염색된 경우, 이 혈관을 구성하는 다른 모든 내피세포는 격자점의 오른쪽 상단 모서리가 채워질 때 혈관에 대해 계산되었다. 염색된 세포 또는 관심 구조가 오른쪽 상단 격자점 모서리를 가득 채웠을 때 격자점은 V(다른 세포 모집단 또는 구조를 나타내는 격자점의 양)에 대해 계산되었다. 관심 있는 다른 세포 집단 또는 구조는 염색에 따라 달라질 수 있으므로 V에 대해 계산된 다른 세포 또는 구조는 채점 형태로 정의되었다.
N(혈관 수)의 추정을 위해, 부피 분율의 측정에 대한 것과 동일한 격자점을 사용했다. 래스터 격자점의 바깥쪽 테두리는 주어진 영역이 있는 계산 챔버를 나타낸다. 격자점의 왼쪽 또는 아래 선을 가로지르는 혈관 구조는 계수하지 않았다. 격자점 내에서만 염색되었지만 혈관이 경계를 넘은 혈관 구조인 경우에는 계수하지 않았다. 조직 절편에서, 명확한 루멘을 가진 혈관을 계수하였다. 혈관은 보이나 루미나가 없는 염색된 구조를 또한 계수하였다. 일부 염색 검사에는 약한 염색 세기와 강한 염색 세기 사이의 구별이 더 필요했다.
종양
VEGFA
면역조직화학적 방법
종양 VEGFA의 면역조직화학 검출은 오토스테이너(Autostainer) 및 PT-모듈 기구를 사용하여 수행되었다. 종양 VEGFA를 검출하는 데 사용된 일차 항체는 R547(앱캠(abcam)-ab27620(HGX-R547))이었다. 상기 항체는 인간 VEGFA의 N-말단 부분에 대해 키운 사전-희석된 토끼 단일클론 항체(SP28)이다. 사용된 면역원 서열은 VEGF-B, VEGF-C 및 VEGF-D를 비롯한 다른 VEGF 이소 형(isoform)과 약 30 내지 40%의 동일성을 공유한다. 파라핀 내장된 조직을 히스토젠엑스(HistoGeneX) 염색 프로토콜을 따라 종양 VEGFA에 대해 염색하였다. 검출/점수화된 가장 낮은 양성율(positivity)은 특정 점수화 시스템에 의해 측정된 사전-설정된 검출 한계이며, 이하에서 추가로 기술되는 가장 약한 염색 세기 1+로 염색한 세포의 1%로 설정하였다. 염색이 선형 영역에서 수행되었는지 식별하기 위해, 실험은 다른 농도의 원발성 항체로 수행되지 않았다. 다코(Dako)의 N-유니버셜 음성 대조군 토끼 IgG(N1699)를 음성 대조군으로 사용하였다. IgG 대조군은 VEGFA 면역 반응성에 대해 식별하고 VEGFA 음성인 반면, 양성 샘플은 종양 세포 및 인간 태반의 동시분화영양막 세포에서 명확하고 강한 세포질 VEGFA 양성을 보였다. 염색 작업당 하나의 음성 대조군만이 수행되었다.
종양 VEGFA 염색은 막, 세포질 또는 핵 염색을 나타내는 세포의 백분율을 염색 세기와 함께 점수화하는 시스템을 사용하여 평가하였다. 최종 결과는 점수화 매트릭스에서 추출하여 기록하였다. 프로토콜에 따라, 예를 들어, 종양의 침윤성 부분, 종양 전체, 동일계내 암종 등을 평가할 필요가 있는 조직의 부분을 측정하였다. 또한, 프로토콜에 따라, 점수화할 필요가 있는 세포 구획(예컨대, 막, 세포질 또는 핵)을 측정하였다. 일반적으로, 세포 구획은 별도로 점수화되었다.
점수화는 염색의 세기 및 임의의 세기에서 양성 염색된 세포의 비율의 평가를 포함하였다. 막 염색의 경우, 전체 기준외측부(basolateral) 또는 완전 염색의 패턴도 기록하였다. 염색 신호는 4가지 상이한 세기 범주로 나누어진다: 0 = 염색 없음; 1+ = 약한 염색(고출력 배율에서 보임); 2+ = 중급(또는 보통) 염색(저출력 배율에서 보임); 3+ = 강한 얼룩(저출력 배율에서도 두드러짐).
각각의 세기에 대해, 염색의 비율(백분율)을 점수화했다. 모든 세기의 최대 백분율(즉, 모든 세기에서의 모든 백분율의 합)은 100%이어야 한다. 일반적으로, 염색의 세기와 백분율을 할당하는 경험 법칙은 다음과 같다: a) 가장 우세한 염색 세기를 식별하고 그것에 특정 %를 할당한다; b) 가장 낮은 염색의 %를 정의한다; c) 가장 낮은 카테고리와 가장 높은 카테고리 사이의 나머지 %를 나눈다; d) 염색 양성률이 0에서 10% 사이일 때 1%의 정확도가 권장된다; e) 양성 염색이 10% 이상일 때, 5%의 정확도가 권장된다. 점수화된 영역 수(ROI)는 최적으로 선택되었으며(대형 조직 샘플의 경우, 최소 10 ROI 권장) 입체-기반 랜덤 표본 방법에 따라 체계적으로 균일한 랜덤으로 선택되었다. 막 염색, 세포질 염색 및 핵 염색을 각각 나타내는 종양 세포의 백분율을 0, 1+, 2+, 3+ 척도를 사용하여 점수화했고 합계 100%로 계산했다. 특정 프로토콜에 따라, 염색 패턴의 특성화를 위한 추가적인 점수, 예를 들어 막 염색의 완전성도 사용되었다. 막의 백분율을 점수화한 경우, 전체 기준외측부 또는 완전 막 염색의 백분율을 각각의 세기에 대해 측정하였다. 전체 기준외측부 염색은 잘-분화된 선암종에서만 보인다. 전체 기준외측부 염색은 베이스 염색과 세포들의 두 양태 염색을 의미한다.
최종 데이터 세트는 위에서 요약된 관찰 결과를 기준으로 했다. 다른 목적을 위해, 최종 데이터에서 다시 계산하여 H-점수, IRS-점수 또는 올레드(Allred) 점수를 생성할 수 있다. 이들 점수화 시스템은 비율과 세기 점수를 조합하여 치료의 효과를 해석하기위한 카테고리를 만든다. 이러한 다양한 점수화 방법의 재계산은 다음과 같으며 데이터베이스에 포함될 수 있다:
H 점수: H-점수의 경우, 백분율에 염색 세기를 곱한다. 생성된 최고 H-점수는 300이다. 그런 다음, 양성율은 다음과 같이 해석되는 네 가지 부류로 분류된다: 0 내지 50 = 음성; 51 내지 100 = 약한 양성; 101 내지 200 = 중간 양성; 201 내지 300 = 강한 양성.
IRS 점수: IRS-점수는 관찰된 양성율의 가장 높은 백분율과 그 염색 세기의 점수를 곱한 값의 합이다. 가장 높은 IRS-점수는 12점이다. 그런 다음, 양성율은 다음과 같이 해석되는 다섯 가지 부류로 분류된다: 0 내지 1 = 음성; 2 내지 3 = 약한 양성; 4 내지 8 = 중간 양성; 9 내지 12 = 강한 양성.
올레드(Allred) 점수/퀵(Quick)-점수: 올레드-점수 또는 퀵-점수는 가장 높은 양성 백분율을 가진 점수와 그 염색 세기 점수를 합한 것이다. 가장 높은 올레드-점수 또는 퀵-점수는 8점이다. 그런 다음, 해석은 올레드 점수에 대해 두 가지 부류로 분류된다: 0 내지 2 = 음성; 3 내지 8 = 양성 및 퀵-점수에 대해 4가지 등급: 0 내지 1 = 음성; 2 내지 3 = 약한 양성; 4 내지 6 = 중간 양성; 7 내지 8 = 강한 양성.
바이오마커의
특성
혈관형성 및 종양 형성과 관련된 종양 조직 면역조직화학적(IHC) 바이오마커에 대한 조사가 표 2에 요약되어 있다. 평가된 IHC 마커는 두 가지 특정 바이오마커인 CD31과 종양 VEGFA의 발현 수준 증가가 카보플라틴과 파클리탁셀 외에 확장된 베바시주맙을 병용 투여한 환자의 개선된 결과와 상관 관계가 있음을 보여주었다.
표
2. 평가된
IHC
마커
기준에서의 CD31의 전반적인 분포를 플로팅하고 환자 모집단에 대한 기준 바이오마커 값을 요약하기 위해 기술적인 통계(예컨대, 평균, 표준 편차, 중앙값 및 범위)를 사용했다(도 2). 특정 컷오프에서 CD31 및 다른 바이오마커의 종양 세포 바이오마커 발현에 따라 환자의 하위그룹의 PFS의 통계 분석 및 포레스트 플롯은 도 3에 도시하였다. 특정 컷오프에서의 CD31 및 다른 바이오마커의 종양 세포 바이오마커 발현에 따른 환자 하위그룹에서의 OS의 통계 분석 및 포레스트 플롯은 도 7에 나타내었다. 바이오마커 하위그룹 내의 PFS에 대한 치료 효과의 연관성과 관련하여, 위험율는 모든 환자 하위그룹이 베바시주맙 치료로부터 이점을 얻었음을 나타낸다(도 3). CD31 및 종양 VEGFA 바이오마커 하위그룹 내의 OS에 대한 치료 효과의 관련성과 관련하여, 위험율는 CD31 및/또는 종양 VEGFA의 높은 수치(즉, 중간값 이상 또는 50% 컷오프 이상)를 갖는 환자 하위그룹이 베바시주맙 치료로부터 이점을 얻었음을 나타내며, 여기서, 낮은 수준의 CD31 및/또는 종양 VEGFA(즉, 중간값 미만 또는 50% 컷오프 미만)를 갖는 환자 하위그룹은 베바시주맙의 첨가로 이점을 얻지 못했다(도 7).
치료 및 CD31
바이오마커
효과
BEP 모집단 내의 CD31의 발현을 추가로 분석하고 도 4 내지 6 및 8 내지 11에 나타내었다. CD31 바이오마커 하위그룹에서 PFS 효과에 대해 도 3에서 보여준 결과와 일치되게, % 컷오프에 기초한 환자 하위그룹의 사분위 분석 결과, CD31 발현 수준이 증가함에 따라 PFS가 또한 베바시주맙 치료(예컨대, 위험율로 표시됨)로 개선됨을 식별했다(도 5 및 6). 50% 컷오프에서 CD31 하위그룹에 대한 PFS의 확률에 대한 카플란-마이어 곡선을 도 4에 도시하였다. 높은 CD31 수준을 나타내는 환자는 베바시주맙 치료에서 최대 PFS 이점을 보였으나, 카보플라틴-파클리탁셀 화학요법 레지멘으로 단독으로 치료한 동일한 환자군에서는 PFS 예후가 최악인 것으로 나타났다. 낮은 CD31 수준을 나타내는 환자들은 카보플라틴-파클리탁셀을 단독으로 치료한 낮은 CD31 수준을 나타내는 환자들에 비해 베바시주맙에 의한 일부 PFS 이점을 나타냈다. 유사하게, CD31 바이오마커 하위그룹에서의 OS 효과에 대한 도 7에 도시된 결과와 일치되게, % 컷오프에 기초한 환자 하위그룹의 사분위 분석 결과, CD31 발현 수준이 증가함에 따라 베바시주맙 치료(도 8 및 도 10)가 OS의 현저한 개선을 나타내면서 75% 컷오프에서 가장 큰 효과를 나타내는 것으로 식별되었다. 8 및 도 10)가 OS의 현저한 개선을 나타내면서 50%(도 9a) 및 75% (도 9b) 컷오프에 의해 정의된 CD31 하위그룹에 대한 생존 확률에 대한 카플란-마이어 곡선은 75% 컷오프에서 높은 CD31을 발현하는 환자에서 보인 향상된 베바시주맙 치료 효과를 식별한다(도 9b).
도 11에 도시된 STEPP 분석은 슬라이드 윈도우 방식을 사용하여 CD31 발현 수준과 PFS 및 OS에 대한 위험율의 관련성을 입증한다. PFS의 경우, 각 하위그룹에 포함된 환자의 위험율(중간 실선으로 표시됨)는 1.0 미만이었으며, 이는 모든 환자가 베바시주맙 치료로부터 약간의 이점을 얻었음을 나타낸다. 그러나 높은 수준의 CD31(CD31 발현의 상위 50%)을 발현하는 환자는 베바시주맙 치료에서 더 큰 이점을 얻었다. OS와 관련하여, CD31 발현 범위의 75% 이상 환자에 대한 위험율(중간 실선으로 표시됨)는 1.0 미만이었으며, 이는 CD31 발현 범위의 약 75% 이상의 환자에서만 더 큰 효과가 있었음을 나타낸다. 또한, 이러한 결과는 베바시주맙 치료 환자에서 초과의 CD31 수준(즉, CD31 발현 범위의 중간값 또는 50% 초과)이 더 긴 PFS 및 OS와 관련된다는 것을 시사한다. 따라서 데이터는 난소암에서의 개선된 PFS 및 OS에 대한 예측 바이오마커로서 그리고 베바시주맙 효과를 증가시키는 예측 바이오마커로서 CD31을 지지한다.
치료 및 종양
VEGFA
바이오마커
효과
BEP 모집단 내의 종양 VEGFA의 발현이 추가로 분석되었고, 도 12 내지 17에 상세히 나타내었다. 관찰된 이점이 50% 컷오프(즉, CD31 발현 범위의 상위 50%)에서 관찰되는 CD31 바이오마커 효과와는 대조적으로, 베바시주맙 치료에서 관찰된 PFS 및 OS의 이점은 VEGFA 발현에 대한 75% 컷오프(즉, 종양 VEGFA 발현 범위의 상위 25%)에서 나타났다. 따라서, 높은 수준의 VEGFA(즉, 50% 컷오프 초과, 특히 75% 컷오프 초과)를 나타내는 환자는 베바시주맙 치료로부터 최대 PFS 및 OS를 나타냈다(도 12 내지 14). % 컷오프에 기초한 환자 하위그룹에서의 PFS에 대한 치료 효과의 사분위 분석에 따르면, 일반적으로, 종양 VEGFA 발현 수준이 높은(즉, 특정 % 컷오프 초과인) 환자는 베바시주맙 치료로부터 이점을 얻었다(도 15). % 컷오프에 기초한 환자 하위그룹에서 OS에 대한 치료 효과의 사분위 분석은 베바시주맙으로 치료했을 때 OS의 현저한 개선을 가져오는 특히 50% 및 75% 컷오프에서의 높은 수준의 종양 VEGFA 발현을 보였다(도 16).
도 17에 도시된 STEPP 분석은 종양 VEGFA 발현 수준과 PFS 및 OS에 대한 위험율의 연관성을 설명하기 위해 슬라이드 윈도우 방식을 사용한다. PFS의 경우, 중간 실선으로 표시된 각 하위그룹에 포함된 환자의 위험율는 1.0 미만이었으며, 이는 모든 환자가 베바시주맙 치료에서 약간의 이점을 얻었음을 나타낸다. OS와 관련하여, 종양 VEGFA 발현 범위(중간 실선으로 표시됨)의 75% 초과의 환자에 대한 위험율는 1.0 미만이었고, 이는 종양 VEGFA 발현 범위의 약 75% 초과의 이점을 나타낸다(도 17). 또한, 슬라이드 윈도우 분석은 OS보다 PFS에 대한 종양 VEGFA 컷오프가 더 높음을 나타냈다. 또한, 이러한 결과는 종양 VEGFA가 난소암에서 개선된 PFS 및 OS 및 증가된 베바시주맙 효능에 대한 예측 바이오마커로서 작용할 수 있음을 시사한다.
전술된 발명은 이해의 명료성을 위해 예시 및 예에 의해 일부 상세하게 설명되었지만, 설명 및 실시예는 본 발명의 범주를 제한하는 것으로 해석되지 않아야 한다. 본원에서 언급된 모든 특허, 특허 출원, 과학적 참조문헌의 개시내용은 각각의 특허, 특허 출원, 과학적 참조문헌이 구체적으로 및 개별적으로 참고로 편입된 것과 같이 모든 목적에 대해 그 전체가 참고로 명시적으로 편입된다.
Claims (61)
- 암을 갖는 환자의 치료 방법으로서,
치료적 유효량의 VEGF 길항제를 환자에게 투여하는 단계를 포함하고,
상기 환자의 암은, CD31 및/또는 종양 VEGFA를, 상기 암 유형에서 각각, CD31 발현 및/또는 종양 VEGFA 발현에 대한 중간 수준 초과의 수준에서 발현하는 것으로 측정된, 방법. - 청구항 1에 있어서, 상기 환자의 암은 상기 암 유형에서 CD31 발현에 대한 중간값 초과의 수준에서 CD31을 발현시키는 것으로 측정된, 방법.
- 청구항 1 또는 2에 있어서, 상기 환자의 암은 상기 암 유형에서 CD31 발현에 대해 75번째 백분위수 초과의 수준에서 CD31을 발현시키는 것으로 측정된, 방법.
- 청구한 1 내지 3 중 어느 한 항에 있어서, 상기 환자의 암은 상기 암 유형에서 종양 VEGFA 발현의 중간 수준 초과의 수준에서 종양 VEGFA를 발현시키는 것으로 측정된, 방법.
- 청구항 1 내지 4 중 어느 한 항에 있어서, 상기 환자의 암은 암 유형에서 종양 VEGFA 발현에 대해 75번째 백분위수 초과의 수준에서 종양 VEGFA를 발현시키는 것으로 측정된, 방법.
- 청구항 1 내지 5 중 어느 한 항에 있어서, 상기 암은 결장직장암, 유방암, 비소세포폐암(NSCLC), 신장암(신장 세포 암종) 또는 뇌암(아교모세포종)으로 이루어진 군으로부터 선택되는, 방법.
- 청구항 1 내지 6 중 어느 한 항에 있어서, 상기 암은 난소암, 복막암, 난관암, 자궁 경부암, 자궁 내막암, 질암 및 외음부 암으로 구성된 군으로부터 선택되는 산부인과계 암인, 방법.
- 청구항 7에 있어서, 상기 산부인과계 암이 난소암인, 방법.
- 청구항 1 내지 8 중 어느 한 항에 있어서, 상기 암은 백금-내성, 백금-민감성, 진행성, 난치성, 또는 재발성인, 방법.
- 청구항 1 내지 9 중 어느 한 항에 있어서, 상기 VEGF 길항제의 투여가 환자의 무진행 생존률(PFS)을 개선시키는, 방법.
- 청구항 1 내지 10 중 어느 한 항에 있어서, 상기 VEGF 길항제의 투여가 환자의 전체 생존률(OS)을 개선시키는, 방법.
- 청구항 1 내지 11 중 어느 한 항에 있어서, 상기 VEGF 길항제는 화학요법 레지멘에서 하나 이상의 추가의 화학치료제와 조합하여 투여되는, 방법.
- 청구항 12에 있어서, 상기 하나 이상의 추가의 화학치료제는 화학치료제, HER 항체, 종양 관련 항원에 대한 항체, 항-호르몬 화합물, 심장 보호제, 시토카인, EGFR-표적 약물, 항-혈관형성제, 티로신 키나아제, 억제제, COX 억제제, 비-스테로이드성 항-염증제, 파르네실 전달효소 억제제, 종양태아성 단백질 CA 125에 결합하는 항체, Her2 백신, HER 표적화 치료, Raf 또는 ras 억제제, 리포좀성 독소루비신, 토포테칸, 탁산, 이중 티로신 키나아제 억제제, TLK286, EMD-7200, 구토 치료 약제, 피부 발진이나 표준 여드름 치료를 예방하거나 치료하는 약제, 설사를 치료하거나 예방하는 약제, 체온 감소 약제 및 조혈 성장 인자로 이루어진 군으로부터 선택되는, 방법.
- 청구항 12에 있어서, 상기 화학치료제는 젬시타빈, 카보플라틴, 옥살리플라틴, 이리노테칸, 플루오로피리미딘(예컨대, 5-FU), 파클리탁셀(예컨대, nab-파클리탁셀), 도세탁셀, 토포테칸, 카페시타빈, 레코보린, 테모졸로마이드, 인터페론-알파 또는 리포좀성 독소루비신(예컨대, 페길화 리포좀성 독소루비신)인, 방법.
- 청구항 12에 있어서, 상기 화학요법 레지멘은 카보플라틴 및 파클리탁셀; 카보플라틴 및 젬시타빈; 또는 파클리탁셀, 토포테칸 또는 페길화 리포좀성 독소루비신의 투여를 포함하는, 방법.
- 청구항 12에 있어서, 상기 화학요법 레지멘은 카페시타빈 및 파클리탁셀; 또는 카페시타빈 및 도세탁셀의 투여를 포함하는, 방법.
- 청구항 12에 있어서, 상기 화학요법 레지멘은 테모졸로마이드 및 임의로 방사성요법의 투여를 포함하는, 방법.
- 청구항 12에 있어서, 상기 화학요법 레지멘은 플루로피리미딘, 이리노테칸, 시스플라틴, 플루로피리미딘 및 옥살리플라틴; 플루로피리미딘 및 이리노테칸; 플루로피리미딘, 레코보린 및 옥살리플라틴; 또는 이로노테칸, 플루오로피리미딘 및 류코보린의 투여를 포함하는, 방법.
- 청구항 12에 있어서, 상기 화학요법 레지멘은 파클리탁셀 및 토포테칸; 또는 파클리탁셀 및 시스플라틴의 투여를 포함하는, 방법.
- 청구항 12에 있어서, 상기 화학요법 레지멘은 인터페론-알파2a의 투여를 포함하는, 방법.
- 청구항 1 내지 20 중 어느 한 항에 있어서, 상기 VEGF 길항제는 항-VEGF 항체인, 방법.
- 청구항 21에 있어서, 상기 항-VEGF 항체가 베바시주맙인, 방법.
- 청구항 1 내지 22 중 어느 한 항에 있어서, CD31 발현 및/또는 종양 VEGFA 발현이 면역조직화학적(IHC) 방법에 의해 검출되는, 방법.
- 청구항 1 내지 23 중 어느 한 항에 있어서, 상기 환자의 상기 암에서 검출된 CD31 발현 수준은 상기 환자의 상기 암에서 CD31 미세혈관 구조(CD31 MVD)의 밀도를 측정하는 데 사용되며, 그리고 임의로, 상기 환자의 암의 CD31 MVD는 상기 암 유형에서 CD31 MVD의 중간 수준과 비교되는, 방법.
- VEGF 길항제의 투여로부터 이점을 얻을 수 있는 암을 앓고 있는 환자를 식별하는 방법으로서,
a) 상기 환자로부터 수득한 샘플에서 CD31 발현 및/또는 종양 VEGFA 발현 수준을 측정하는 단계로서, 상기 암 유형에서 각각 CD31 발현 및/또는 종양 VEGFA 발현의 중간 수준 초과의 수준에서의 CD31 발현 및/또는 종양 VEGFA 발현은, 상기 환자가 VEGF 길항제의 투여로부터 이점을 얻을 수 있음을 나타내는, 상기 측정 단계, 및 임의로
b) 상기 환자에게 치료적 유효량의 상기 VEGF 길항제를 투여하는 단계를 포함하는, 방법. - 암 치료를 위한 VEGF 길항제의 투여에 대한 환자의 반응성을 예측하는 방법으로서,
a) 상기 환자로부터 수득한 샘플에서 CD31 발현 및/또는 종양 VEGFA 발현 수준을 측정하는 단계로서, 상기 암 유형에서 각각 CD31 발현 및/또는 종양 VEGFA 발현의 중간 수준 초과의 수준에서의 CD31 발현 및/또는 종양 VEGFA 발현이 상기 환자가 VEGF 길항제의 투여에 더욱 반응성일 공산이 높다는 것을 나타내는, 단계, 및 임의로
b) 상기 환자에게 치료적 유효량의 상기 VEGF 길항제를 투여하는 단계를 포함하는, 방법. - 청구항 25 또는 26에 있어서, 상기 환자의 암은 상기 암 유형에서 CD31 발현의 중간 수준 초과의 수준에서 CD31을 발현시키는 것으로 측정된, 방법.
- 청구항 25 내지 27 중 어느 한 항에 있어서, 상기 환자의 암은 상기 암 유형에서 CD31 발현에 대해 75번째 백분위수(percentile) 초과의 수준에서 CD31을 발현시키는 것으로 측정된, 방법.
- 청구항 25 내지 28 중 어느 한 항에 있어서, 상기 환자의 암은 상기 암 유형에서 종양 VEGFA 발현에 대해 중간 수준 초과의 수준에서 종양 VEGFA를 발현시키는 것으로 측정된, 방법.
- 청구항 25 내지 29 중 어느 한 항에 있어서, 상기 환자의 암은 상기 암 유형에서 종양 VEGFA 발현에 대해 75번째 백분위수 초과의 수준에서 종양 VEGFA를 발현시키는 것으로 측정된, 방법.
- 청구항 25 내지 30 중 어느 한 항에 있어서, 상기 암은 난소암, 복막암, 난관암, 자궁 경부암, 자궁 내막암, 질암 및 외음부 암으로 구성된 군으로부터 선택되는 산부인과계 암인, 방법.
- 청구항 31에 있어서, 상기 산부인과계 암이 난소암인, 방법.
- 청구항 25 내지 32 중 어느 한 항에 있어서, 상기 암은 백금-내성, 백금-민감성, 진행성, 난치성, 또는 재발성인, 방법.
- 청구항 25 내지 33 중 어느 한 항에 있어서, 상기 샘플이 종양 조직 샘플인, 방법.
- 청구항 25 내지 34 중 어느 한 항에 있어서, 상기 샘플이 선행보조 요법 또는 보조 요법 전에 수득되는, 방법.
- 청구항 25 내지 35 중 어느 한 항에 있어서, CD31 발현 및/또는 종양 VEGFA 발현은 면역조직화학적(IHC) 방법에 의해 검출되는, 방법.
- 청구항 25 내지 36 중 어느 한 항에 있어서, 상기 VEGF 길항제는 화학요법 레지멘에서 하나 이상의 추가의 화학치료제와 조합하여 투여되는, 방법.
- 청구항 37에 있어서, 상기 하나 이상의 추가의 화학치료제는 화학치료제, HER 항체, 종양 관련 항원에 대한 항체, 항-호르몬 화합물, 심장 보호제, 시토카인, EGFR-표적 약물, 항-혈관형성제, 티로신 키나아제, 억제제, COX 억제제, 비-스테로이드성 항-염증제, 파르네실 전달효소 억제제, 종양태아성 단백질 CA 125에 결합하는 항체, Her2 백신, HER 표적화 치료, Raf 또는 ras 억제제, 리포좀성 독소루비신, 토포테칸, 탁산, 이중 티로신 키나아제 억제제, TLK286, EMD-7200, 구토 치료 약제, 피부 발진이나 표준 여드름 치료를 예방하거나 치료하는 약제, 설사를 치료하거나 예방하는 약제, 체온 감소 약제 및 조혈 성장 인자로 이루어진 군으로부터 선택되는, 방법.
- 청구항 37에 있어서, 상기 화학요법 레지멘은 카보플라틴 및 파클리탁셀의 투여를 포함하는, 방법.
- 청구항 25 내지 39 중 어느 한 항에 있어서, 상기 VEGF 길항제는 항-VEGF 항체인, 방법.
- 청구항 40에 있어서, 상기 항-VEGF 항체가 베바시주맙인, 방법.
- 청구항 25 내지 41 중 어느 한 항에 있어서, 상기 환자의 상기 샘플에서 검출된 CD31 발현 수준은, 상기 환자의 상기 암에서 CD31 미세혈관 구조(CD31 MVD)의 밀도를 측정하는 데 사용되며, 임의로 상기 환자의 샘플의 CD31 MVD는 상기 암 유형에서 CD31 MVD의 중간 수준과 비교되는, 방법.
- 암을 앓고 있는 환자의 예후를 위한 방법으로서,
a) 상기 환자로부터 수득된 샘플에서 CD31의 발현 수준을 측정하는 단계,
b) CD31의 상기 발현 수준을 상기 암 유형에서의 CD31에 대한 중간 수준과 비교하는 단계, 및
c) 상기 환자에 대한 예후를 측정하는 단계를 포함하고, CD31의 발현이 CD31 발현의 중간 수준 초과에서의 것일 경우, 예후가 불량한 것인, 상기 측정 단계를 포함하는, 방법. - 청구항 43에 있어서, 상기 방법은 생존의 예비-투여 예후(pre-administration prognosis of survival)를 제공하기 위해 항암제를 투여하기 전에 수행되는, 방법.
- 청구항 43 또는 44에 있어서, 상기 환자가 생존율이 불량한 예후를 갖는 것으로 측정되는 경우에 VEGF 길항제의 투여로부터 이점을 얻을 공산이 있는 환자를 식별하는 단계를 추가로 포함하는, 방법.
- 청구항 43 내지 45 중 어느 한 항에 있어서, 상기 환자가 불량한 예후를 갖는 것으로 측정되는 경우, 치료적 유효량의 VEGF 길항제를 상기 환자에게 투여하는 단계를 추가로 포함하는, 방법.
- 청구항 43 내지 46 중 어느 한 항에 있어서, 상기 생존이 무진행 생존 또는 전체 생존인, 방법.
- 청구항 43 내지 47 중 어느 한 항에 있어서, 상기 VEGF 길항제는 항-VEGF 항체인, 방법.
- 청구항 48에 있어서, 상기 항-VEGF 항체가 베바시주맙인, 방법.
- 청구항 43 내지 49 중 어느 한 항에 있어서, 상기 환자의 상기 샘플에서 검출된 CD31 발현의 상기 수준은, 상기 환자의 상기 암에서 CD31 미세혈관 구조(CD31 MVD)의 밀도를 측정하는 데 사용되며, 그리고 임의로 상기 환자의 샘플의 CD31 MVD는 상기 암 유형에서 CD31 MVD의 중간 수준과 비교되는, 방법.
- 암을 갖는 환자의 치료 방법으로서,
상기 환자에게 VEGF 길항제 이외의 치료적 유효량의 치료제를 투여하는 단계를 포함하고,
상기 환자의 암은 상기 암 유형에서 각각 CD31 발현 및/또는 종양 VEGFA 발현의 중간 수준 미만의 수준에서 CD31 및/또는 종양 VEGFA를 발현시키는 것으로 측정된, 방법. - 청구항 51에 있어서, 상기 환자의 암은 상기 암 유형에서의 CD31 발현에 대해 중간 수준 미만의 수준에서 CD31을 발현시키는 것으로 측정된, 방법.
- 청구항 52에 있어서, 상기 환자의 암은 상기 암 유형에서의 CD31 발현에 대해 25번째 백분위수 미만의 수준에서 CD31을 발현시키는 것으로 측정된, 방법.
- 청구항 51에 있어서, 상기 환자의 암은 상기 암 유형에서의 종양 VEGFA 발현에 대해 중간 수준 미만의 수준에서 종양 VEGFA를 발현시키는 것으로 측정된, 방법.
- 청구항 54에 있어서, 상기 환자의 암은 상기 암 유형에서의 종양 VEGFA 발현에 대해 25번째 백분위수 미만의 수준에서 종양 VEGFA를 발현시키는 것으로 측정된, 방법.
- 청구항 51 내지 55 중 어느 한 항에 있어서, 상기 암은 결장직장암, 유방암, 비소세포폐암(NSCLC), 신장암(신장 세포 암종) 또는 뇌암(아교모세포종)으로 이루어진 군으로부터 선택되는, 방법.
- 청구항 51 내지 55 중 어느 한 항에 있어서, 상기 암은 난소암, 복막암, 난관암, 자궁 경부암, 자궁 내막암, 질암 및 외음부 암으로 구성된 군으로부터 선택되는 산부인과계 암인, 방법.
- 청구항 57에 있어서, 상기 산부인과계 암이 난소암인, 방법.
- 청구항 51 내지 58 중 어느 한 항에 있어서, 상기 환자의 상기 샘플에서 검출된 CD31 발현의 상기 수준은, 상기 환자의 상기 암에서 CD31 미세혈관 구조(CD31 MVD)의 밀도를 측정하는 데 사용되며, 그리고 임의로 상기 환자의 샘플의 CD31 MVD는 상기 암 유형에서 CD31 MVD의 중간 수준과 비교되는, 방법.
- 암을 갖는 환자를 치료하는 방법에 사용하기 위한 VEGF 길항제로서,
상기 환자의 암은 상기 암 유형에서 각각 CD31 발현 및/또는 종양 VEGFA 발현에 대한 중간 수준 초과의 수준에서 CD31 및/또는 종양 VEGFA를 발현하는 것으로 측정되고, 그리고 상기 방법은 VEGF 길항제의 치료적 유효량을 상기 환자에게 투여하는 단계를 포함하는, 방법. - 암을 갖는 환자를 치료하는 방법에 사용하기 위한 VEGF 길항제 이외의 치료제로서,
상기 환자의 암은 상기 암 유형에서 각각 CD31 발현 및/또는 종양 VEGFA 발현에 대한 중간 수준 미만의 수준에서 CD31 및/또는 종양 VEGFA를 발현하는 것으로 측정되고, 그리고 상기 방법은 VEGF 길항제 이외의 치료적 유효량의 상기 치료제를 상기 환자에게 투여하는 단계를 포함하는, 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201462079787P | 2014-11-14 | 2014-11-14 | |
| US62/079,787 | 2014-11-14 | ||
| PCT/US2015/059733 WO2016077227A2 (en) | 2014-11-14 | 2015-11-09 | Predicting response to a vegf antagonist |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20170082537A true KR20170082537A (ko) | 2017-07-14 |
Family
ID=54754748
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020177013270A KR20170082537A (ko) | 2014-11-14 | 2015-11-09 | Vegf 길항제에 대한 반응 예측 |
Country Status (15)
| Country | Link |
|---|---|
| US (1) | US20170226198A1 (ko) |
| EP (1) | EP3218401B1 (ko) |
| JP (1) | JP2017535548A (ko) |
| KR (1) | KR20170082537A (ko) |
| CN (1) | CN107106688A (ko) |
| AR (1) | AR102647A1 (ko) |
| AU (1) | AU2015346652A1 (ko) |
| BR (1) | BR112017009633A2 (ko) |
| CA (1) | CA2966216A1 (ko) |
| HK (1) | HK1242996A1 (ko) |
| IL (1) | IL251947A0 (ko) |
| MX (1) | MX2017006201A (ko) |
| RU (1) | RU2017120388A (ko) |
| SG (1) | SG11201703744VA (ko) |
| WO (1) | WO2016077227A2 (ko) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN108753984B (zh) * | 2018-08-28 | 2021-07-13 | 北京市神经外科研究所 | 预测或诊断脑恶性胶质瘤术后复发的生物标志物组合及其应用和试剂盒 |
| KR20220153615A (ko) * | 2020-03-12 | 2022-11-18 | 도레이 카부시키가이샤 | 암의 치료 및/또는 예방을 위한 의약품 |
| WO2024028846A1 (en) * | 2022-08-05 | 2024-02-08 | Geistlich Pharma Ag | Combination therapy for treating cancers |
Family Cites Families (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1392360B1 (en) * | 2001-06-01 | 2011-11-30 | Cornell Research Foundation, Inc. | Modified antibodies to prostate-specific membrane antigen and uses thereof |
| US20040191218A1 (en) * | 2001-09-26 | 2004-09-30 | Emlen James W | Pharmaceutical compositions and methods for treating cancer |
| AU2004215133B2 (en) * | 2003-02-27 | 2010-10-14 | Yeda Research And Development Co. Ltd. | Nucleic acid molecules, polypeptides, antibodies and compositions containing same useful for treating and detecting influenza virus infection |
| WO2005123104A2 (en) * | 2004-06-10 | 2005-12-29 | Regeneron Pharmaceuticals, Inc. | Use of vegf inhibitors for the treatment of human cancer |
| SG10201500479XA (en) * | 2010-01-19 | 2015-03-30 | Hoffmann La Roche | Tumor Tissue Based Biomarkers For Bevacizumab Combination Therapies |
| AU2011221229B2 (en) * | 2010-02-23 | 2015-06-18 | F. Hoffmann-La Roche Ag | Anti-angiogenesis therapy for the treatment of ovarian cancer |
| SG187018A1 (en) * | 2010-07-19 | 2013-02-28 | Hoffmann La Roche | Method to identify a patient with an increased likelihood of responding to an anti-cancer therapy |
| JP2014501918A (ja) * | 2010-12-09 | 2014-01-23 | エフ・ホフマン−ラ・ロシュ・アクチェンゲゼルシャフト | ベバシズマブ併用療法のためのマーカーとしてのagtr1 |
| US20140066393A1 (en) * | 2011-03-01 | 2014-03-06 | The United States Of America, As Represented By The Secretary, Dept. Of Health And Human Servic | Method of selecting cancer patients for anti-angiogenesis therapy in combination with chemotherapy |
-
2015
- 2015-11-09 JP JP2017525946A patent/JP2017535548A/ja active Pending
- 2015-11-09 CN CN201580070085.3A patent/CN107106688A/zh active Pending
- 2015-11-09 EP EP15802244.2A patent/EP3218401B1/en active Active
- 2015-11-09 RU RU2017120388A patent/RU2017120388A/ru not_active Application Discontinuation
- 2015-11-09 SG SG11201703744VA patent/SG11201703744VA/en unknown
- 2015-11-09 BR BR112017009633A patent/BR112017009633A2/pt not_active IP Right Cessation
- 2015-11-09 WO PCT/US2015/059733 patent/WO2016077227A2/en active Application Filing
- 2015-11-09 AU AU2015346652A patent/AU2015346652A1/en not_active Abandoned
- 2015-11-09 CA CA2966216A patent/CA2966216A1/en not_active Abandoned
- 2015-11-09 KR KR1020177013270A patent/KR20170082537A/ko unknown
- 2015-11-09 MX MX2017006201A patent/MX2017006201A/es unknown
- 2015-11-13 AR ARP150103707A patent/AR102647A1/es unknown
-
2017
- 2017-04-26 IL IL251947A patent/IL251947A0/en unknown
- 2017-04-28 US US15/581,448 patent/US20170226198A1/en not_active Abandoned
-
2018
- 2018-02-22 HK HK18102570.4A patent/HK1242996A1/zh unknown
Also Published As
| Publication number | Publication date |
|---|---|
| EP3218401B1 (en) | 2020-03-04 |
| EP3218401A2 (en) | 2017-09-20 |
| RU2017120388A3 (ko) | 2019-05-30 |
| BR112017009633A2 (pt) | 2017-12-19 |
| AU2015346652A1 (en) | 2017-05-18 |
| RU2017120388A (ru) | 2018-12-14 |
| IL251947A0 (en) | 2017-06-29 |
| HK1242996A1 (zh) | 2018-07-06 |
| AR102647A1 (es) | 2017-03-15 |
| CN107106688A (zh) | 2017-08-29 |
| WO2016077227A2 (en) | 2016-05-19 |
| US20170226198A1 (en) | 2017-08-10 |
| JP2017535548A (ja) | 2017-11-30 |
| MX2017006201A (es) | 2017-07-31 |
| WO2016077227A3 (en) | 2016-07-07 |
| CA2966216A1 (en) | 2016-05-19 |
| SG11201703744VA (en) | 2017-06-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2710735C2 (ru) | Композиции и способы лечения и диагностики резистентного к химиотерапии рака | |
| US20220298576A1 (en) | Methods and compositions for prognosis and treatment of cancers | |
| TWI457135B (zh) | 治療鉑敏感性復發性晚期上皮卵巢癌、輸卵管癌或原發性腹膜癌之卡鉑、吉西他濱與抗vegf抗體之組合 | |
| KR20130055647A (ko) | 항암요법에 반응할 가능성이 증가된 환자를 확인하는 방법 | |
| US20110033482A1 (en) | Her3 as a determinant for the prognosis of melanoma | |
| JP2020040959A (ja) | 抗egfr薬を用いた胃癌の処置のための、egfrバイオマーカーの使用 | |
| KR20130126576A (ko) | 항암요법에 반응할 가능성이 증가된 환자를 확인하는 방법 | |
| US20170226198A1 (en) | Predicting response to a vegf antagonist | |
| US20230375553A1 (en) | A ratio between plgf and sflt1 is predictive for neural invasion in patients suffering from pancreatic cancer |