KR20160130380A - 생체분자를 서열화하기 위한 디바이스, 시스템 및 방법 - Google Patents
생체분자를 서열화하기 위한 디바이스, 시스템 및 방법 Download PDFInfo
- Publication number
- KR20160130380A KR20160130380A KR1020167023002A KR20167023002A KR20160130380A KR 20160130380 A KR20160130380 A KR 20160130380A KR 1020167023002 A KR1020167023002 A KR 1020167023002A KR 20167023002 A KR20167023002 A KR 20167023002A KR 20160130380 A KR20160130380 A KR 20160130380A
- Authority
- KR
- South Korea
- Prior art keywords
- nano
- biomolecule
- electrodes
- channel
- gap electrodes
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6869—Methods for sequencing
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N27/00—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means
- G01N27/26—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means by investigating electrochemical variables; by using electrolysis or electrophoresis
- G01N27/416—Systems
- G01N27/447—Systems using electrophoresis
- G01N27/44704—Details; Accessories
- G01N27/44717—Arrangements for investigating the separated zones, e.g. localising zones
- G01N27/4473—Arrangements for investigating the separated zones, e.g. localising zones by electric means
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N27/00—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means
- G01N27/26—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means by investigating electrochemical variables; by using electrolysis or electrophoresis
- G01N27/416—Systems
- G01N27/447—Systems using electrophoresis
- G01N27/44756—Apparatus specially adapted therefor
- G01N27/44791—Microapparatus
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/483—Physical analysis of biological material
- G01N33/487—Physical analysis of biological material of liquid biological material
- G01N33/48707—Physical analysis of biological material of liquid biological material by electrical means
- G01N33/48721—Investigating individual macromolecules, e.g. by translocation through nanopores
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
- G01N33/6803—General methods of protein analysis not limited to specific proteins or families of proteins
- G01N33/6818—Sequencing of polypeptides
-
- G06F19/22—
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2563/00—Nucleic acid detection characterized by the use of physical, structural and functional properties
- C12Q2563/116—Nucleic acid detection characterized by the use of physical, structural and functional properties electrical properties of nucleic acids, e.g. impedance, conductivity or resistance
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2563/00—Nucleic acid detection characterized by the use of physical, structural and functional properties
- C12Q2563/157—Nanotubes or nanorods
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2565/00—Nucleic acid analysis characterised by mode or means of detection
- C12Q2565/60—Detection means characterised by use of a special device
- C12Q2565/631—Detection means characterised by use of a special device being a biochannel or pore
Abstract
본 발명은 샘플에 함유된 생체분자가 나노-갭 전극의 세트 근위로 통과할 때 전류가 흐르도록 배열된 나노-갭 전극의 적어도 하나의 세트, 나노-갭 전극의 세트의 전극들 간에 생체분자를 이동시키기 위해 전계를 형성시키기 위한 전기영동 전극 쌍, 나노-갭 전극 쌍 쪽 방향으로 샘플을 흐르게 하기 위한 유로, 나노-갭 전극 쌍으로부터 떨어지는 방향으로 샘플을 흐르게 하기 위한 유로, 형성된 전계와 함께 생체분자가 나노-갭 전극 쌍의 전극들 사이로 진행할 때 발생된 터널 전류를 측정하도록 구성된 측정 유닛, 및 생체분자를 서열화하도록 구성된 동정 유닛을 포함하는 생체분자 서열화 디바이스를 제공한다.
Description
본 발명은 생체분자를 서열화하는 디바이스, 시스템, 및 방법에 관한 것이다.
통상적으로, 서열화(sequencing)는 생물학적 분자, 특히 생체고분자를 구성하는 모노머, 예를 들어, 단백질을 구성하는 아미노산 서열, 핵산을 구성하는 뉴클레오티드 서열, 당 사슬을 구성하는 단당류 서열, 등의 순서를 결정하기 위해 사용되고 있다. 예를 들어, 단백질 서열은 고성능 액체 크로마토그래피(HPLC), 질량 분석법(mass spectrometry), X-선 결정 구조 분석, 에드만 분해(Edman degradation), 등을 이용하여 결정되는데, 이는 효소 분해를 기반으로 할 수 있다.
터널 전류를 사용하여 단일 분자를 동정하기 위한 단일 분자 전기적 측정 방법은 샘플 분자의 상태의 국소적 밀도를 직접적으로 측정함으로써 단일 분자를 동정하는 방법이다. 그러나, 여기에서 이러한 전기적 측정 방법과 관련하여 다양한 한계가 인식되고 있다. 통상적인 단일 분자 전기적 측정 방법에서 샘플 분자 도입 방법에서와 같이, 샘플 분자의 자연 확산(natural diffusion)을 기반으로 한 방법과 관련하여, 대부분의 샘플 분자는 샘플 분자와 관련된 신호의 측정 중간에 감지 전극을 통과시키지 않으면서 코스(course) 또는 방향을 확산적으로 변경시킬 수 있다. 이는 잘못된 결과 및 비효율적인 서열화를 야기시킬 수 있다. 하나의 문제점(issue)은 핵산 염기, 당 사슬, 펩티드 사슬 등을 갖는 생체고분자를 서열화시키기 위해 필수적일 수 있는 긴 리드(long read)를 수행하기 어려워서, 서열 판독(sequence reading)이 짧은 리드(short read)로 제한되며 감지 전극들 사이에 분자들의 통과 횟수가 적다는 문제점이 존재하고, 이에 따라 분자 검출의 정확성이 낮다는 것이다.
용매에 용해된 샘플 분자를 도입하기 위하여, 펌핑 압력 또는 전기-삼투 흐름(electro-osmotic flow)을 이용한 도입 방법이 존재한다. 그러나, 이러한 방법은 분자 스케일에서 제어될 수 있는 정류(steady flow)를 도입하지 못할 수 있다. 전기영동 제어 시스템에서, 분자는 채널 용적(channel volume) 전반에 걸쳐 균일하게 이동할 수 있다. 이에 따라, 감지 전극들 사이로 분자의 통과 횟수를 간단하게 증가시키는 것은 불충분하다. 이에 따라, 이러한 방법이 단지 재서열화 시에 사용 가능하고 고농도의 순수한 샘플 용액이 입수 가능하다는 것과 같은, 터널링 전류를 이용하여 몇몇 통상적인 단일 분자 전기적 측정 방법을 사용하는데 있어서 단점이 존재한다.
본 발명은 현재 이용 가능한 방법 및 시스템이 갖는 다양한 문제점들을 해소할 수 있는 생체분자를 서열화하기 위한 디바이스, 방버, 및 시스템을 제공한다. 본원에서, 방법 및 시스템은 현재 이용 가능한 다른 방법 및 시스템과 비교하여 실질적으로 높은 정확성 및 높은 처리량으로 생체분자를 서열화할 수 있다. 본 발명의 방법 및 시스템은 비교적 큰 리드(read) 길이를 서열화할 수 있는데, 이는 다른 방법 및 시스템의 서열화의 실질적인 향상을 제공할 수 있다.
일 양태에서, 생체분자 서열화 디바이스는 샘플에 함유된 하나 이상의 생체분자(들)가 나노갭 전극 쌍의 전극들 사이를 통과할 때, 터널 전류가 흐를 수 있도록 배열된 전극들을 갖는 적어도 하나의 나노-갭 전극 쌍으로서, 생체분자는 적어도 한 부류의 연결된 단일 모노머들로 형성되는 나노-갭 전극 쌍; 나노-갭 전극 쌍의 전극들 사이로 생체분자를 이동시키기 위해 전계를 형성시키기 위한 적어도 하나의 전기영동 전극 쌍; 하나 이상의 나노-채널 중 나노-갭 전극 쌍 쪽 방향으로 및 이들 사이로 샘플의 적어도 일부를 흐르게 하기 위한 제1 유로; 및 하나 이상의 나노-갭 전극 쌍을 함유한 하나 이상의 나노-채널에 대한 입구를 지나는 방향으로 샘플의 적어도 일부를 흐르게 하기 위한 제2 유로를 포함한다. 생체분자 서열화 디바이스는 전기영동 전극 쌍을 가로지르는 전압의 인가에 의해 이동 방향에서 상기 생체분자를 이동시키기 위해 형성된 전계를 사용하는 제1 유로를 통해 나노-갭 전극 쌍의 전극들 간에 생체분자가 진행할 때 발생된 터널 전류를 측정하도록 구성된 하나 이상의 유닛; 및 부류가 공지된 적어도 하나의 부류의 모노머의 기준 물리적 양, 및 측정 유닛에 의해 측정된 터널 전류로부터 얻어진 검출된 물리적 양 둘 모두를 기초로 하여 생체분자를 포함하는 적어도 한 부류의 모노머를 동정하도록 구성된 동정 유닛을 추가로 포함할 수 있다.
본 발명에 따르면, 생체분자 서열화 디바이스는 하나 이상의 전기영동 전극 쌍, 나노-채널 중 하나 이상의 나노-갭 전극 쌍 쪽 방향으로 그리고 이들 사이로 샘플의 적어도 일부를 흐르게 하기 위한 제1 유로, 및 하나 이상의 나노-갭 전극 쌍을 함유한 나노-채널(들)에 대한 입구를 지나는 방향으로 샘플의 적어도 일부를 흐르게 하기 위한 제2 유로를 포함할 수 있다. 이에 따라, 나노-갭 전극들 사이로 단일 분자를 이동시키는 효능은 샘플 분자 상에 영향을 미치는 전계의 증가 결과로서 개선될 수 있다. 또한, 이는 높은 정확성 및 높은 처리량으로 모노머를 동정할 수 있다.
생체분자 서열화 디바이스는 샘플의 흐름을 유도하도록 구성된 흐름 디렉터(director)를 포함할 수 있으며, 이러한 샘플은 제1 유로 및 제2 유로가 형성될 수 있고, 유체 소통이 제1 경로와 제2 경로 사이에서 일어날 수 있도록 유체 샘플일 수 있다.
흐름 디렉터는 나노-채널(들)에 함유된 임의 유체 및 다른 분자 내에서, 그리고 이와 전기적으로 소통하는, 하나 이상의 나노-갭 전극 쌍을 갖는 나노-채널(들)에 대한 입구 쪽으로 연장하는 절연체일 수 있다.
나노-갭 전극 쌍 및 전기영동 전극 쌍은 생체분자 이동 방향에 대해 교차하거나 수직인 방향으로 연장하도록 평행하게 배열될 수 있다. 일 예에서, 채널의 각 측면 상의 나노-갭 전극 및 전기영동 전극은 서로 평행하다.
나노-갭 전극 쌍은 나노-채널에서 생체분자의 이동 방향을 교차하는 방향으로 연장하도록 배치될 수 있으며, 전기영동 전극 쌍은 절연체 상에 배치될 수 있다.
긴 생체분자는 자체적으로 얽혀져서 자가-나노채널에서 또는 나노갭 전극에서 잠재적으로 막힘을 야기시킬 수 있다. 다수의 필러들은 생체분자가 진행할 수 있고 생체분자 고분자를 선형화시키기 위해 사용될 수 있는 간격으로 제1 유로 및 제2 유로에 제공될 수 있다. 일부 구체예에서, 필러는 나노 채널 내에 생체분자 고분자를 선형화시키거나 선형화를 유지시키기 위해 하나 이상의 나노채널 내에 제공될 수 있다. 예를 들어, 단일 가닥 DNA 분절은 25 밀리-몰(mM) NaCl 중 3 나노미터(nm)의 지속 길이(persistence length)를 가질 수 있어, 폭, 높이 또는 직경 중 하나 이상에 대해 100 nm 최소 치수를 갖는 나노채널 내에서 중요한 구조(significant structure)를 개선시킬 수 있으며, 이러한 2차 구조는 심지어 20 nm 이하의 최소 피쳐 크기를 갖는 나노채널에서 개선시킬 수 있고, 이에 따라, 나노채널 내에서 선형화를 유지시킬 필요성을 재형성시킬 수 있다.
전극간 거리에 있어서 상이할 수 있는 복수의 나노-갭 전극 쌍이 존재할 수 있다.
본 발명은 생체분자 서열화 디바이스에 의해 수행될 수 있는 생체분자 서열화 방법으로서, 생체분자 서열화 디바이스가 샘플에 함유된 생체분자가 전극들 사이로 진행할 때, 터널 전류가 증가하도록 배열된 전극들을 갖는 하나 이상의 나노-갭 전극 쌍으로서, 생체분자는 적어도 한 부류의 연결된 단일 모노머들로 형성되는 나노-갭 전극 쌍; 나노-갭 전극 쌍의 전극들 사이로 생체분자를 이동시키기 위해 전계를 형성시키기 위한 적어도 하나의 전기영동 전극 쌍; 하나 이상의 나노-채널 중 나노-갭 전극 쌍 쪽 방향으로 및 이들 사이로 샘플의 적어도 일부를 흐르게 하기 위한 제1 유로; 및 하나 이상의 나노-갭 전극 쌍을 함유한 하나 이상의 나노-채널에 대한 입구를 지나는 방향으로 샘플의 적어도 일부를 흐르게 하기 위한 제2 유로를 포함하며, 전기영동 전극 쌍을 가로지르는 전압의 인가에 의해 생체분자를 이동시키기 위해 형성된 전계와 함께 제1 유로를 통해 나노-갭 전극 쌍의 전극들 사이로 생체분자가 진행할 때 발생되는 터널 전류를 측정하고; 부류가 알려진 적어도 한 부류의 모노머의 기준 물리적 양 및 측정 유닛에 의해 측정된 터널 전류로부터 얻어진 검출된 물리적 양 둘 모두를 기초로 하여 생체분자를 포함하는 적어도 한 부류의 모노머의 부류를 동정하는 것을 포함하는, 생체분자 서열화 디바이스에 의해 수행될 수 있는 생체분자 서열화 방법을 제공한다.
본 발명은 또한, 컴퓨터를 본 발명의 생체분자 서열화 디바이스의 측정 유닛 및 동정 유닛으로서 기능하게 하는 생체분자 서열화 프로그램을 제공한다.
본 발명의 생체분자를 서열화하기 위한 디바이스, 방법, 및 프로그램에 따르면, 생체분자를 구성하는 모노머는 높은 정확성으로 동정될 수 있다.
다른 양태에서, 본 발명은 나노-채널을 통해 생체분자를 함유한 샘플을 이동시키는 나노-채널; 나노-채널 중 나노-갭 전극의 복수의 세트로서, 샘플에 함유된 생체분자가 나노-채널을 통해 그리고 나노-갭 전극의 복수의 세트 근위로 통과할 때 각각이 전류를 검출하도록 구성되며, 나노-갭 전극의 복수의 세트들 중 적어도 두 개의 세트가 나노-채널의 폭을 따라 상이한 전극간 거리를 갖는 나노-갭 전극의 복수의 세트; 및 나노-채널을 통해 그리고 나노-채널 중 나노-갭 전극의 복수의 세트 근위로 생체분자를 이동시키도록 전계를 제공하는 전기영동 전극 세트를 포함하는, 생체분자 서열화 디바이스를 제공한다.
본원에 제공된 양태들 중 일부 구체예에서, 생체분자 서열화 디바이스는 나노-갭 전극의 복수의 세트의 각각과 소통하는 측정 유닛으로서, 생체분자가 나노-갭 전극의 복수의 세트 근위로 통과할 때 발생된 전류를 측정하도록 구성된 측정 유닛; 및 측정 유닛과 소통하는 동정 유닛(identification unit)으로서, 생체분자 또는 이의 부분을 동정하도록 구성된 동정 유닛을 추가로 포함한다.
본원에 제공된 양태들 중 일부 구체예에서, 생체분자는 복수의 모노머를 포함하며, 서열화는 하나 이상의 공지된 타입의 모노머의 기준 물리적 양 및 단계 (b)에서 검출된 전류로부터 얻어진 물리적 양을 기초로 하여 복수의 모노머를 동정하는 것을 포함한다. 본원에 제공된 양태들 중 일부 구체예에서, 생체분자 서열화 디바이스는 나노-채널과 유체 소통하는 제1 유로 및 제2 유로를 형성시키도록 구성된 흐름 디렉터를 추가로 포함하며, 여기서 흐름 디렉터는 샘플의 일부를 제1 유로에서 나노-채널로, 그리고 나머지 샘플을 제1 유로에서 제2 유로로 유도한다. 본원에 제공된 양태들 중 일부 구체예에서, 흐름 디렉터는 나노-채널을 통한 샘플의 이동 방향을 따라 나노-갭 전극의 복수의 세트 쪽으로 연장하는 절연체이다. 본원에 제공된 양태들 중 일부 구체예에서, 생체분자 서열화 디바이스는 생체분자를 선형화시키기 위한 제1 유로 및/또는 제2 유로 중의 하나 이상의 필러를 추가로 포함한다. 본원에 제공된 양태들 중 일부 구체예에서, 하나 이상의 필러는 복수의 필러를 포함한다. 본원에 제공된 양태들 중 일부 구체예에서, 제1 유로, 제2 유로 및 나노-채널은 실질적으로 동일한 평면에 존재한다. 본원에 제공된 양태들 중 일부 구체예에서, 전류는 터널링 전류를 포함한다. 본원에 제공된 양태들 중 일부 구체예에서, 나노-갭 전극의 복수의 세트들 중 제공된 세트는 적어도 두 개의 전극을 갖는다. 본원에 제공된 양태들 중 일부 구체예에서, 전기영동 전극 세트는 적어도 두 개의 전극을 갖는다. 본원에 제공된 양태들 중 일부 구체예에서, 나노-갭 전극의 복수의 세트 및 전기영동 전극 세트는 일체형 유닛으로서 통합된다. 본원에 제공된 양태들 중 일부 구체예에서, 나노-갭 전극의 복수의 세트들 중 제공된 세트의 전극은 적어도 하나의 고체 상태 절연체에 의해 전기영동 전극으로부터 분리된다. 본원에 제공된 양태들 중 일부 구체예에서, 생체분자 서열화 디바이스는 생체분자를 선형화하기 위해 나노-채널 중 하나 이상의 필러를 추가로 포함한다. 본원에 제공된 양태들 중 일부 구체예에서, 하나 이상의 필러는 복수의 필러를 포함한다. 본원에 제공된 양태들 중 일부 구체예에서, 나노-채널은 나노-갭 전극의 복수의 세트 쪽으로 점점 가늘어진다. 본원에 제공된 양태들 중 일부 구체예에서, 나노-갭 전극의 복수의 세트 중 제공된 세트는 생체분자의 분자 직경 이하인 전극간 거리를 갖는다.
본 발명의 다른 양태는 나노-채널을 통해 생체분자를 함유한 샘플을 이동시키는 나노-채널; 나노-채널 중의 나노-갭 전극의 하나 이상의 세트로서, 샘플에 함유된 생체분자가 나노-채널을 통해 그리고 나노-갭 전극의 세트 근위로 통과할 때 전류를 검출하도록 구성되며, 나노-채널이 나노-갭 전극의 세트 쪽으로 점점 가늘어지며, 나노-갭 전극의 세트가 생체분자의 분자 직경 이하인 전극간 거리를 갖는 나노-갭 전극의 세트; 및 나노-채널을 통해 그리고 나노-채널 중의 나노-갭 전극의 세트 근위로 생체분자를 이동시키기 위해 전계를 제공하는 전기영동 전극 세트를 포함하는, 생체분자 서열화 디바이스를 제공한다.
본 발명의 다른 양태는 나노-채널을 통해 생체분자를 함유한 샘플을 이동시키는 나노-채널; 나노-채널 중의 나노-갭 전극의 하나 이상의 세트로서, 샘플에 함유된 생체분자가 나노-채널을 통해 그리고 나노-갭 전극의 세트 근위로 통과할 때 전류를 검출하도록 구성된 나노-갭 전극의 세트; 나노-채널을 통해 그리고 나노-채널 중 나노-갭 전극의 세트 근위로 생체분자를 이동시키기 위해 전계를 제공하는 전기영동 전극 세트; 및 나노-채널 중의 또는 근위의 하나 이상의 필러로서, 나노-갭 전극의 세트에 의한 전류 검출을 이용하여 생체분자의 개개의 서브유닛을 동정하기 이해 생체분자를 선형화하는 하나 이상의 필러를 포함하는, 생체분자 서열화 디바이스를 제공한다.
본 발명의 다른 양태는 (a) 생체분자 서열화 디바이스의 나노-채널로 또는 통해 생체분자를 흐르게 하는 단계로서, 생체분자 서열화 디바이스가 (i) 나노-채널 중의 나노-갭 전극의 복수의 세트로서, 나노-갭 전극의 복수의 세트 각각이 샘플에 함유된 생체분자가 나노-채널을 통해 그리고 나노-갭 전극의 복수의 세트 근위로 통과할 때 전류를 검출하도록 구성되며, 나노-갭 전극의 복수의 세트들 중 둘 이상의 세트가 나노-채널의 폭을 따라 상이한 전극간 거리를 갖는 나노-갭 전극의 복수의 세트, 및 (ii) 나노-채널로 또는 이를 통해, 그리고 나노-채널 중 나노-갭 전극의 복수의 세트 근위로 생체분자를 이동시키기 위해 전계를 제공하는 전기영동 전극 세트를 포함하는 단계; (b) 나노-갭 전극의 복수의 세트로, 나노-채널을 통해 그리고 나노-갭 전극의 복수의 세트 근위로 생체분자가 흐르는 동안 발생되는 전류를 검출하는 단계; 및 (c) 생체분자 또는 이의 부분을 단계 (b)에서 검출된 전류로 서열화하는 단계를 포함하는, 생체분자를 서열화하는 방법을 제공한다.
본원에 제공된 양태들 중 일부 구체예에서, 생체분자는 복수의 모노머를 포함하며, 서열화는 하나 이상의 공지된 타입의 모노머의 기준 물리적 양 및 단계 (b)에서 검출된 전류로부터 얻어진 물리적 양을 기초로 하여 복수의 모노머를 동정하는 것을 포함한다. 본원에 제공된 양태들 중 일부 구체예에서, 생체분자 서열화 디바이스는 나노-채널과 유체 소통하는 제1 유로 및 제2 유로를 형성시키도록 구성된 흐름 디렉터를 추가로 포함하며, 단계 (a)는 샘플의 일부를 제1 유로에서 나노-채널로 그리고, 나머지 샘플을 제1 유로에서 제2 유로로 흐르게 하는 것을 포함한다. 본원에 제공된 양태들 중 일부 구체예에서, 본 방법은 생체분자를 선형화하는 나노-채널 중의 하나 이상의 필러를 추가로 포함한다. 본원에 제공된 양태들 중 일부 구체예에서, 전류는 터널링 전류를 포함한다. 본원에 제공된 양태들 중 일부 구체예에서, 본 방법은 생체분자를 선형화하는 나노-채널 중의 하나 이상의 필러를 추가로 포함한다. 본원에 제공된 양태들 중 일부 구체예에서, 나노-채널은 나노-갭 전극의 복수의 세트 쪽으로 점점 가늘어진다. 본원에 제공된 양태들 중 일부 구체예에서, 생체분자는 폴리뉴클레오티드 또는 폴리펩티드이다.
본 발명의 다른 양태는 (a) 생체분자 서열화 디바이스의 나노-채널로 또는 이를 통해 흐르게 하기 위해 생체분자를 유도하는 단계로서, 생체분자 서열화 디바이스가 (i) 나노-채널 중의 나노-갭 전극의 하나 이상의 세트로서, 샘플에 함유된 생체분자가 나노-채널을 통해 그리고 나노-갭 전극의 세트 근위로 통과할 때 전류를 검출하도록 구성되며, 나노-채널이 나노-갭 전극의 세트 쪽으로 점점 가늘어지며, 나노-갭 전극의 세트가 생체분자의 분자 직경 이하인 전극간 거리를 갖는 나노-갭 전극의 하나 이상의 세트, 및 (ii) 나노-채널로 또는 이를 통해, 그리고 나노-채널 중 나노-갭 전극의 세트 근위로 생체분자를 이동시키기 위해 전계를 제공하는 전기영동 전극 세트를 포함하는 단계; (b) 나노-갭 전극의 세트로, 나노-채널을 통해 그리고 나노-갭 전극의 세트 근위로 생체분자가 흐르는 동안 발생되는 전류를 검출하는 단계; 및 (c) 생체분자 또는 이의 부분을 단계 (b)에서 검출된 전류로 서열화하는 단계를 포함하는, 생체분자를 서열화하는 방법을 제공한다.
본 발명의 다른 양태는 (a) 생체분자 서열화 디바이스의 나노-채널로 또는 이를 통해 흐르게 하기 위해 생체분자를 유도하는 단계로서, 생체분자 서열화 디바이스가 (i) 나노-채널 중의 나노-갭 전극의 하나 이상의 세트로서, 샘플에 함유된 생체분자가 나노-채널을 통해 그리고 나노-갭 전극의 세트 근위로 통과할 때 전류를 검출하도록 구성된 이상의 나노-갭 전극의 세트, (ii) 나노-채널로 또는 이를 통해, 그리고 나노-채널 중 나노-갭 전극의 세트 근위로 생체분자를 이동시키기 위해 전계를 제공하는 전기영동 전극 세트, 및 (iii) 나노-채널 중 또는 이의 근위에서의 하나 이상의 필러로서, 나노-갭 전극의 세트에 의한 전류 검출을 이용하여 생체분자의 개개 서브유닛을 동정하기 위해 생체분자를 선형화하는 하나 이상의 필러를 포함하는 단계; (b) 나노-갭 전극의 세트로, 나노-채널을 통해 그리고 나노-갭 전극의 세트 근위로 생체분자가 흐르는 동안 발생되는 전류를 검출하는 단계; 및 (c) 생체분자 또는 이의 부분을 단계 (b)에서 검출된 전류로 서열화하는 단계를 포함하는, 생체분자를 서열화하는 방법을 제공한다.
본 발명의 다른 양태는 하나 이상의 컴퓨터 프로세서에 의한 실행 시에, 생체분자를 서열화하는 방법을 수행하는, 기계 실행 코드를 포함하는 컴퓨터 판독 가능한 매체로서, (a) 생체분자 서열화 디바이스의 나노-채널로 또는 통해 흐르게 하기 위해 생체분자를 유도하는 단계로서, 생체분자 서열화 디바이스가 (i) 나노-채널 중의 나노-갭 전극의 복수의 세트로서, 샘플에 함유된 생체분자가 나노-채널을 통해 그리고 나노-갭 전극의 복수의 세트 근위로 통과할 때 전류를 검출하도록 구성되며, 나노-갭 전극의 복수의 세트들 중 둘 이상의 세트가 나노-채널의 폭을 따라 상이한 전극간 거리를 갖는 나노-갭 전극의 복수의 세트, 및 (ii) 나노-채널로 또는 이를 통해, 그리고 나노-채널 중 나노-갭 전극의 복수의 세트 근위로 생체분자를 이동시키기 위해 전계를 제공하는 전기영동 전극 세트를 포함하는 단계; (b) 나노-갭 전극의 복수의 세트로, 나노-채널을 통해 그리고 나노-갭 전극의 복수의 세트 근위로 생체분자가 흐르는 동안 발생되는 전류를 검출하는 단계; 및 (c) 생체분자 또는 이의 부분을 단계 (b)에서 검출된 전류로 서열화하는 단계를 포함하는, 컴퓨터 판독 가능한 매체를 제공한다.
본 발명의 다른 양태는 하나 이상의 컴퓨터 프로세서에 의한 실행 시에, 생체분자를 서열화하는 방법을 수행하는, 기계 실행 코드를 포함하는 컴퓨터 판독 가능한 매체로서, (a) 생체분자 서열화 디바이스의 나노-채널로 또는 이를 통해 흐르게 하기 위해 생체분자를 유도하는 단계로서, 생체분자 서열화 디바이스가 (i) 나노-채널 중의 나노-갭 전극의 하나 이상의 세트로서, 샘플에 함유된 생체분자가 나노-채널을 통해 그리고 나노-갭 전극의 세트 근위로 통과할 때 전류를 검출하도록 구성되며, 나노-채널이 나노-갭 전극의 세트 쪽으로 점점 가늘어지며, 나노-갭 전극의 세트가 생체분자의 분자 직경 이하인 전극간 거리를 갖는 나노-갭 전극의 하나 이상의 세트, 및 (ii) 나노-채널로 또는 이를 통해, 그리고 나노-채널 중 나노-갭 전극의 세트 근위로 생체분자를 이동시키기 위해 전계를 제공하는 전기영동 전극 세트를 포함하는 단계; (b) 나노-갭 전극의 세트로, 나노-채널을 통해 그리고 나노-갭 전극의 세트 근위로 생체분자가 흐르는 동안 발생되는 전류를 검출하는 단계; 및 (c) 생체분자 또는 이의 부분을 단계 (b)에서 검출된 전류로 서열화하는 단계를 포함하는, 컴퓨터 판독 가능한 매체를 제공한다.
본 발명의 다른 양태는 하나 이상의 컴퓨터 프로세서에 의한 실행 시에, 생체분자를 서열화하는 방법을 수행하는, 기계 실행 코드를 포함하는 컴퓨터 판독 가능한 매체로서, (a) 생체분자 서열화 디바이스의 나노-채널로 또는 이를 통해 흐르게 하기 위해 생체분자를 유도하는 단계로서, 생체분자 서열화 디바이스가 (i) 나노-채널 중의 나노-갭 전극의 하나 이상의 세트로서, 샘플에 함유된 생체분자가 나노-채널을 통해 그리고 나노-갭 전극의 세트 근위로 통과할 때 전류를 검출하도록 구성된 이상의 나노-갭 전극의 세트, (ii) 나노-채널로 또는 이를 통해, 그리고 나노-채널 중 나노-갭 전극의 세트 근위로 생체분자를 이동시키기 위해 전계를 제공하는 전기영동 전극 세트, 및 (iii) 나노-채널 중 또는 이의 근위에서의 하나 이상의 필러로서, 나노-갭 전극의 세트에 의한 전류 검출을 이용하여 생체분자의 개개 서브유닛을 동정하기 위해 생체분자를 선형화하는 하나 이상의 필러를 포함하는 단계; (b) 나노-갭 전극의 세트로, 나노-채널을 통해 그리고 나노-갭 전극의 세트 근위로 생체분자가 흐르는 동안 발생되는 전류를 검출하는 단계; 및 (c) 생체분자 또는 이의 부분을 단계 (b)에서 검출된 전류로 서열화하는 단계를 포함하는, 컴퓨터 판독 가능한 매체를 제공한다.
본 개시내용의 추가 양상들 및 장점들은 하기의 상세한 설명으로부터 당업자들에게 쉽게 명백해질 것이고, 여기서는 본 개시내용의 단지 예시적 실시예들만이 도시되고 설명된다. 인식될 바와 같이, 본 개시내용은 다른 그리고 상이한 실시예들이 가능할 수 있고, 그 몇몇 상세사항들은, 모두 본 개시내용을 벗어남 없이, 다양하고 명확한 측면들에서 변형들이 가능하다. 따라서, 도면들 및 설명은, 제한적인 것이 아니라, 당연히 예시적인 것으로 간주되어야 한다.
본 발명의 신규한 특징들은 첨부된 청구항들에서 상세히 설명된다. 본 발명의 원리들이 활용되는 예시적 실시예들을 설명하는 하기 상세한 설명, 및 첨부 도면들(또는 본원에서 도("figure" 및 "FIG."))을 참조로 본 발명의 특징들 및 장점들의 더 잘 이해될 것이다.
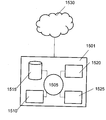
도 1은 생체분자 서열화 디바이스를 예시한 개략도이다.
도 2는 도 1의 나노-갭 전극 쌍의 평면도를 도시한 확대도이다.
도 3은 도 2의 일부를 도시한 확대도이다.
도 4는 제어 유닛의 기능적 구성을 예시한 블록 다이아그램이다.
도 5는 생체분자 서열화 공정을 도시한 흐름도이다.
도 6은 전기영동 전극 쌍이 제공되지 않았을 때 검출된 신호의 파형을 도시한 데이타이다.
도 7은 전기영동 전극 쌍이 제공되었을 때 검출된 신호의 파형을 도시한 데이타이다.
도 8은 신호 주파수를 도시한 그래프이다.
도 9는 전기영동 전극 쌍이 제공되고 사용될 때 그리고 전기영동 전극 쌍이 제공되지 않았을 때, 리드(read)의 수를 도시한 그래픽 예시이다.
도 10은 전기영동 전극 쌍이 제공되고 사용될 때 그리고 전기영동 전극 쌍이 제공되지 않았을 때, 리드의 수의 그래픽 예시이다.
도 11은 전기영동 전극 쌍의 배열의 변형예를 예시한 것이다.
도 12는 가변적 이격된 나노-갭을 갖는 생체분자 서열화 디바이스의 구조를 예시한 개략도이다.
도 13은 가변적으로 이격된 나노-갭을 갖는 사용 가능한 제어 유닛의 기능적 구성의 흐름도를 예시한 블록 다이아그램이다.
도 14는 가변적으로 이격된 나노-갭을 갖는 사용 가능한 생체분자 서열화 공정을 도시한 흐름도이다.
도 15는 본 발명의 디바이스, 시스템 및 방법을 수행하도록 프로그래밍되거나 달리 구성된 컴퓨터 제어 시스템을 개략적으로 예시한 것이다.
도 1은 생체분자 서열화 디바이스를 예시한 개략도이다.
도 2는 도 1의 나노-갭 전극 쌍의 평면도를 도시한 확대도이다.
도 3은 도 2의 일부를 도시한 확대도이다.
도 4는 제어 유닛의 기능적 구성을 예시한 블록 다이아그램이다.
도 5는 생체분자 서열화 공정을 도시한 흐름도이다.
도 6은 전기영동 전극 쌍이 제공되지 않았을 때 검출된 신호의 파형을 도시한 데이타이다.
도 7은 전기영동 전극 쌍이 제공되었을 때 검출된 신호의 파형을 도시한 데이타이다.
도 8은 신호 주파수를 도시한 그래프이다.
도 9는 전기영동 전극 쌍이 제공되고 사용될 때 그리고 전기영동 전극 쌍이 제공되지 않았을 때, 리드(read)의 수를 도시한 그래픽 예시이다.
도 10은 전기영동 전극 쌍이 제공되고 사용될 때 그리고 전기영동 전극 쌍이 제공되지 않았을 때, 리드의 수의 그래픽 예시이다.
도 11은 전기영동 전극 쌍의 배열의 변형예를 예시한 것이다.
도 12는 가변적 이격된 나노-갭을 갖는 생체분자 서열화 디바이스의 구조를 예시한 개략도이다.
도 13은 가변적으로 이격된 나노-갭을 갖는 사용 가능한 제어 유닛의 기능적 구성의 흐름도를 예시한 블록 다이아그램이다.
도 14는 가변적으로 이격된 나노-갭을 갖는 사용 가능한 생체분자 서열화 공정을 도시한 흐름도이다.
도 15는 본 발명의 디바이스, 시스템 및 방법을 수행하도록 프로그래밍되거나 달리 구성된 컴퓨터 제어 시스템을 개략적으로 예시한 것이다.
본 발명의 다양한 실시예들이 본원에서 도시되고 설명되었지만, 이러한 실시예들은 단지 예로써 제공되는 것임이 당업자들에게는 명백할 것이다. 다수의 변동들, 변경들 및 치환들은 본 발명을 이탈하지 않고 당업자들에게 상기될 수 있다. 본원에 설명되는 본 발명의 실시예들에 대한 다양한 대안들이 채용될 수 있음을 이해해야 한다.
본원에서 이용되는 용어 "갭"은 일반적으로 물체내에 또는 두 개의 물체 사이의 파열(break) 또는 홀(hole)을 지칭한다. 물체는 기판 또는 전극과 같은 고체 상태 물체일 수 있다. 갭은 감지 회로 또는 감지 회로에 커플링되는 전극에 인접하게 또는 가까이에 배치될 수 있다. 일부 예들에서, 갭은 대략 0.1 nm(nanometers) 내지 약 1000 nm의 특징 폭 또는 직경을 갖는다. 몇 나노미터 폭을 갖는 갭은 "나노갭(nanogap)"(또한 본원에서 "나노 채널)으로 지칭될 수 있다. 일부 상황들에서, 나노갭은 약 0.1 nm(nanometers) 내지 50 nm, 0.5 nm 내지 30 nm, 또는 0.5 nm 내지 10 nm, 0.5 nm 내지 5 nm, 또는 0.5 nm 내지 2 nm, 또는 2 nm 이하, 1 nm, 0.9 nm, 0.8 nm, 0.7 nm, 0.6 nm, 또는 0.5 nm인 폭을 갖는다. 일부 경우들에서, 나노갭은 적어도 약 0.5 nm, 0.6 nm, 0.7 nm, 0.8 nm, 0.9 nm, 1 nm, 2 nm, 3 nm, 4 nm, 또는 5 nm인 폭을 갖는다. 일부 경우들에서, 나노-갭의 폭은 생체분자 또는 생체분자의 서브유닛(예를 들어, 모노머)의 분자 직경(예를 들어, 평균 분자 직경) 이하일 수 있다.
본원에서 사용되는 용어 "채널"은 일반적으로, 물질에서 형성되거나 달리 제공되는 기공, 통로 또는 도관을 지칭한다. 물질은 고체 상태 물질, 예를 들어, 기판일 수 있다. 일부 예에서, 채널은 0.1 나노미터(nm) 내지 약 1000 nm 정도의 특징적인 폭 또는 직경을 갖는다. 나노미터 수준의 폭을 갖는 채널은 "나노채널" 또는 "나노-채널"로서 지칭된다. 일부 상황에서, 나노-채널은 약 0.1 나노미터(nm) 내지 50 nm, 0.5 nm 내지 30 nm, 또는 0.5 nm 또는 10 nm, 0.5 nm 내지 5 nm, 또는 0.5 nm 내지 2 nm, 또는 2 nm 이하, 1 nm, 0.9 nm, 0.8 nm, 0.7 nm, 0.6 nm, 또는 0.5 nm인 폭을 갖는다. 일부 경우에, 나노-채널은 적어도 약 0.5 nm, 0.6 nm, 0.7 nm, 0.8 nm, 0.9 nm, 1 nm, 2 nm, 3 nm, 4 nm, 또는 5 nm인 폭을 갖는다. 일부 경우에, 나노-채널 또는 나노-채널의 일부(예를 들어, 나노-채널의 점점 가늘어진 부분)의 폭은 생체분자 또는 생체분자의 서브유닛(예를 들어, 모노머)의 분자 직경(예를 들어, 평균 분자 직경) 이하일 수 있다.
본원에서 이용되는 용어 "전류"는 일반적으로 전기 전류를 지칭한다. 몇 마이크로 또는 나노 암페어인 전류는 "나노 전류"(또한, 본원에서 "나노전류")로 지칭될 수 있다. 일부 예들에서, 전류는 터널링 전류이거나 이를 포함한다.
본원에서 이용되는 용어 "전극"은 일반적으로 전기 전류를 측정하는데 이용될 수 있는 재료를 지칭한다. 전극은 다른 전극으로의 또는 다른 전극으로부터의 전기 전류를 측정하는데 이용될 수 있다. 일부 상황들에서, 전극들은 채널(예를 들어, 나노갭)에 배치될 수 있고 채널에 걸쳐 전류를 측정하는데 이용될 수 있다. 전류는 터널링 전류일 수 있다. 이러한 전류는 나노갭을 통해 생체분자(예를 들어, 단백질)의 흐름을 검출할 때 검출될 수 있다. 일부 경우들에서, 전극들에 커플링되는 감지 회로는 전극들에 걸쳐 인가 전압을 제공하여 전류를 발생시킨다. 대안적으로 또는 부가로, 전극들은 생체분자(예를 들어, 아미노산 서브유닛 또는 단백질의 모노머)와 연관된 전기 컨덕턴스를 측정하고 그리고/또는 동정하는데 이용될 수 있다. 이러한 경우에, 터널링 전류는 전기 컨덕턴스와 관련될 수 있다.
본원에서 사용되는 용어 "생체분자"는 일반적으로 나노-갭 전극을 가로질러 전기 전류 및/또는 전위로 서로 정보를 얻을 수 있는 임의 생물학적 물질을 지칭한다. 생체분자는 핵산 분자, 단백질, 또는 탄수화물일 수 있다. 생체분자는 하나 이사의 서브유닛, 예를 들어, 뉴클레오티드 또는 아미노산을 포함할 수 있다. 생체분자는 데옥시리보핵산(DNA) 또는 리보핵산(RNA), 또는 이의 유도체일 수 있다. 생체분자는 보다 큰 분자의 분절, 예를 들어, 보다 큰 DNA 샘플의 DNA 분절일 수 있다.
본원에서 이용되는 용어 "핵산"은 일반적으로 하나 또는 그 초과의 핵산 서브유닛들 또는 모노머들을 포함하는 분자를 지칭한다. 핵산은 아데노신(A), 시토신(C), 구아닌(G), 티민(T) 및 우라실(U), 또는 이들의 변이체로부터 선택된 하나 또는 그 초과의 서브유닛들을 포함할 수 있다. 뉴클레오티드는 A, C, G, T 또는 U, 또는 이들의 변이체를 포함할 수 있다. 뉴클레오티드는 신장 핵산 스트랜드(growing nucleic acid strand)에 통합될 수 있는 임의의 서브유닛을 포함할 수 있다. 이러한 서브유닛은 A, C, G, T, 또는 U, 또는 하나 또는 그 초과의 상보적 A, C, G, T 또는 U, 또는 상보적 퓨린(즉, A 또는 G, 또는 이들의 변이체) 또는 피리미딘(즉, C, T 또는 U, 또는 이들의 변이체)에 특정된 임의의 다른 서브유닛일 수 있다. 서브유닛은 개별 핵산 염기들 또는 염기들의 그룹들(예를 들어, AA, TA, AT, GC, CG, CT, TC, GT, TG, AC, CA, 또는 이들의 우라실-대응부들)이 분해될 수 있게 할 수 있다. 일부 예들에서, 핵산은 DNA(deoxyribonucleic acid) 또는 RNA(ribonucleic acid) 또는 이들의 유도체들이다. 핵산은 싱글-스트랜딩(single-stranded) 또는 더블 스트랜딩(double stranded)될 수 있다.
본원에서 이용되는 용어 "단백질"은 일반적으로 하나 또는 그 초과의 아미노산 모노머들, 서브유닛들 또는 잔기들(residues)을 갖는 생물학적 분자(biological molecule), 또는 고분자(macromolecule)를 지칭한다. 예를 들어, 50 또는 더 적은 아미노산들을 함유하는 단백질은 "펩티드(peptide)"로 지칭될 수 있다. 아미노산 모노머들은, 예를 들어, 20, 21, 또는 22 천연 발생(naturally occurring) 아미노산들과 같은 임의의 천연 발생 및/또는 합성 아미노산 모노머로부터 선택될 수 있다. 일부 경우들에서, 20 아미노산들은 대상물(subject)의 유전자 코드(genetic code)로 인코딩된다. 일부 단백질들은 약 500 천연 발생 및 비-천연 발생 아미노산들로부터 선택되는 아미노산들을 포함할 수 있다. 일부 상황들에서, 단백질은 이소류신(isoleucine), 류신(leucine), 리신(lysine), 메티오닌(methionine), 페닐알라닌(phenylalanine), 트레오닌(threonine), 트립토판(tryptophan) 및 발린(valine), 아르기닌(arginine), 히스티딘(histidine), 알라닌(alanine), 아스파라긴(asparagine), 아스파르트 산(aspartic acid), 시스테인(cysteine), 글루타민(glutamine), 글루탐산(glutamic acid), 글리신(glycine), 프롤린(proline), 세린(serin) 및 티로신(tyrosine)으로부터 선택된 하나 또는 그 초과의 아미노산들을 포함할 수 있다.
본원에서 사용되는 용어 "세트(set)"는 일반적으로 원소들의 그룹 또는 집합(collection)을 지칭한다. 세트는 복수의 구성요소들을 포함할 수 있다. 세트는 하나의 "쌍" 또는 두 개를 포함할 수 있다. 예를 들어, 전극 세트는 적어도 2, 3, 4, 5, 6, 7, 8, 9, 또는 10개의 전극을 포함할 수 있다.
본원에서 사용되는 용어 "서열화(sequencing)"는 일반적으로, 생체분자의 서열, 예를 들어, 하나 이상의 폴리뉴클레오티드에서 뉴클레오티드 염기의 서열, 또는 폴리펩티드에서 아미노산의 서열을 결정하기 위한 방법 및 기술을 지칭한다.
본원에서 사용되는 용어 "리드(read)"는 일반적으로 서열화 디바이스 또는 시스템에 의해 형성된 바와 같은 생체분자 또는 생체분자의 일부의 서열을 지칭한다. 이러한 서열은 예를 들어, 염색체 또는 게놈 영역 또는 유전자 상의 소정 위치에 정렬될 수 있는, 보다 큰 서열 또는 영역을 동정하기 위해 사용될 수 있는 충분한 길이(예를 들어, 적어도 약 30개의 염기쌍(bp))을 가질 수 있다.
서열화 디바이스 및 시스템
본 발명은 생체분자를 서열화하기 위한 디바이스를 제공한다. 서열화 디바이스는 적어도 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 100, 1000, 또는 10000개의 채널을 포함할 수 있다. 채널은 채널에서 적어도 1, 2, 3, 4, 5, 6, 7, 8, 9, 또는 10개의 나노-갭 전극의 세트를 포함할 수 있다. 채널은 나노-채널일 수 있다. 나노-갭 전극의 세트의 전극은 채널에서 마주하게 위치될 수 있다.
생체분자(예를 들어, 단일 가닥 DNA 또는 RNA, 이중 가닥 DNA 또는 RNA, 또는 단백질)는 채널 안에서 또는 이를 통해 흐르게 할 수 있으며, 채널, 일부 경우에 터널링 전류는 제공된 나노-갭 전극의 세트의 전극을 이용하여 채널을 가로질러 측정될 수 있다. 전류는 터널링 전류일 수 있거나 이를 포함할 수 있다. 생체분자는 적어도 1, 2, 3, 4, 5, 6, 7, 8, 9, 또는 10개의 전기영동 전극 세트에 의해 제공된 전계를 이용하여 채널 안에서 또는 이를 통해 흐르게 할 수 있게 한다.
채널은 나노기공의 일부일 수 있다. 나노기공은 멤브레인, 예를 들어, 고체 상태 멤브레인에 형성될 수 있다.
나노-갭 전극의 세트는, 생체분자가 채널을 통해 그리고 나노-갭 전극의 세트 근위에서 진행할 때 전류를 검출하도록 구성될 수 있다. 나노-갭 전극의 세트는 상이한 전극간 거리를 가질 수 있다.
전기영동 전극 세트는 생체분자를 나노-채널을 통해 그리고 나노-채널에서 나노-갭 전극의 복수의 세트 근위에서 이동하게 하기 위해 전계를 제공할 수 있다. 전계는 전기영동 전극에 전압 또는 전압 펄스의 인가 시에 발생될 수 있다. 일부 예에서, 전계는 쿨롱(coulomb(C)) 당 약 0.1 뉴톤(N) 내지 5000 N/C, 또는 1 N/C 내지 250 N/C, 또는 10 N/C 내지 50 N/C의 세기를 갖는다.
전기영동 전극 세트는 채널에 대해 외부에 위치될 수 있다. 대안적으로, 전기영동 전극 세트 및 나노-갭 전극의 세트는 일체형 유닛(single-piece unit)으로서 통합될 수 있다. 예를 들어, 나노-갭 전극들 중 하나의 전극은 적어도 하나의 고체 상태 절연체에 의해 전기영동 전극 세트들 중 전기영동 전극으로부터 분리될 수 있다.
생체분자는 컴퓨터 제어 유닛을 이용하여 동정되거나 서열화될 수 있다. 컴퓨터 제어 유닛은 서열화 디바이스, 또는 서열화 디바이스를 포함하는 서열화 시스템의 일부일 수 있다. 컴퓨터 제어 유닛은 나노-갭 전극의 세트와 소통하는 측정 유닛을 포함할 수 있다. 측정 유닛은, 생체분자가 나노-갭 전극의 복수의 세트 근위로 통과할 때 발생되는 전류를 측정하도록 구성된다. 컴퓨터 제어 유닛은 측정 유닛과 소통하는 동정 유닛을 추가로 포함할 수 있다. 동정 유닛은 생체분자 또는 이의 일부를 동정하도록 구성된다.
일부 경우에, 생체분자는 복수의 모노머(또는 서브유닛)를 포함한다. 동정 유닛은 적어도 하나의 공지된 타입의 모노머의 기준 물리적 양 및 측정 유닛에 의해 측정된 전류로부터 얻어진 물리적 양을 기초로 하여 복수의 모노머를 동정하도록 구성될 수 있다.
서열화 디바이스는 채널과 유체 소통하는 적어도 제1 유로 및 제2 유로를 형성시키도록 구성된 흐름 디렉터를 포함할 수 있다. 흐름 디렉터는 샘플의 일부를 제1 유로에서 채널로, 그리고 나머지 샘플을 제1 유로에서 제2 유로로 유도할 수 있다. 흐름 디렉터는 나노-채널을 통한 샘플의 이동의 유도와 함께 나노-갭 전극의 세트 쪽으로 연장하는 절연체일 수 있다.
서열화 디바이스는 적어도 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 또는 100개의 필러를 포함할 수 있다. 필러는 채널 안에 또는 채널에 대해 외부에, 예를 들어, 제1 유로 및/또는 제2 유로에 존재할 수 있다. 필러는 생체분자의 선형화를 가능하게 할 수 있는데, 이는 생체분자 또는 이의 일부(예를 들어, 서브유닛)를 효과적으로 서열화하거나 동정하는데 도움을 줄 수 있다.
제1 유로, 제2 유로 및 나노-채널은 실질적으로 동일한 평면(즉, 동일평면(coplanar))에 존재할 수 있다. 대안예로서, 제1 유로, 제2 유로 및 나노-채널은 동일한 평면에 존재하지 않는다.
채널은 적어도 1, 2, 3, 4, 5, 6, 7, 8, 9, 또는 10개의 점점 가늘어진 부분(tapered portion)을 포함할 수 있다. 이러한 가늘어짐(tapering)은 나노-갭 전극의 세트에 또는 이에 인접하여 있는 채널의 일부에 존재할 수 있다.
나노-갭 전극의 세트는 적어도 2, 3, 4, 5, 6, 7, 8, 9, 또는 10개의 전극을 포함할 수 있다. 전극은 0.1 나노미터(nm) 내지 50 nm, 0.5 nm 내지 30 nm, 또는 0.5 nm 또는 10 nm, 0.5 nm 내지 5 nm, 또는 0.5 nm 내지 2 nm, 또는 2 nm, 1 nm, 0.9 nm, 0.8 nm, 0.7 nm, 0.6 nm, 또는 0.5 nm 이하의 전극간 간격(또는 거리)을 가질 수 있다. 일부 경우에, 간격은 적어도 약 0.5 nm, 0.6 nm, 0.7 nm, 0.8 nm, 0.9 nm, 1 nm, 2 nm, 3 nm, 4 nm, 또는 5 nm이다. 일부 예에서, 간격은 생체분자의 분자 직경 이하이다.
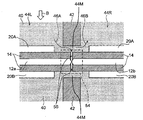
도 1은 일부 구체예에서 생체분자 서열화 디바이스(10)를 도시한 것으로서, 이는 나노-갭 전극 쌍(12)(12A 및 12B), 측정 전력 공급 디바이스(18), 전기영동을 위한 전극 쌍(본원에서, "전기영동 전극 쌍"으로서 지칭됨)(20)(20A 및 20B), 전기영동을 위한 전력 공급 디바이스(22), 전류계(24), 및 시스템 제어 유닛(26)을 포함할 수 있다. 각 부품들은 하기에 기술될 것이다.
나노-갭 전극 쌍(12)은 한 쌍의 마주하는 나노-갭 전극(12a 및 12b)을 포함할 수 있다. 나노-갭 전극(12a 및 12b)은 샘플(50)에 함유된 생체분자의 모노머(52)가 전극들 사이를 진행할 때 이들 사이의 터널 전류 흐름이 증가하게 하는 거리에 배열될 수 있다. 여기에서, 생체분자는 단백질, 펩티드, 핵산, 당 사슬, 등을 포함한다. 생체분자가 포함하는 모노머는 단백질 또는 펩티드가 포함하는 아미노산, 핵산이 포함하는 뉴클레오티드, 다당류 또는 당 사슬이 포함하는 단당류, 등을 포함할 수 있지만, 이로 제한되지 않는다.
한 쌍의 나노-갭 전극(12a 및 12b)이 도시되고 기술되어 있지만, 디바이스(10)는 두 개 초과의 전극을 포함할 수 있다. 예를 들어, 디바이스(10)는 나노-갭 전극의 세트를 포함할 수 있으며, 이러한 세트는 적어도 2, 3, 4, 5, 6, 7, 8, 9, 또는 10개의 전극을 포함한다.
전극간 거리가 단일 분자(52)의 분자 직경 보다 훨씬 더 길때, 터널 전류는 나노-갭 전극 쌍(12)의 전극들 사이로 용이하게 흐르지 않을 수 있거나, 둘 이상의 단일 분자(52)는 동시에 나노-갭 전극 쌍(12) 사이에 진입할 수 있다. 반대로, 전극간 거리가 단일 분자(52)의 분자 직경 보다 훨씬 짧을 때, 단일 분자(52)는 나노-갭 전극 쌍(12)의 전극들 사이에 진입하지 못할 수 있다.
전극간 거리가 단일 분자(52)의 분자 직경 보다 훨씬 더 길거나 훨씬 더 짧을 때, 단일 분자(52)를 통해 진행하는 터널 전류를 검출하는 것은 어려울 수 있다. 이에 따라, 전극간 거리는 바람직하게 단일 분자(52)의 분자 직경 보다 약간 더 짧거나, 동일하거나 ,약간 더 길게 만들 수 있다. 예를 들어, 전극간 거리는 단일 분자(52)의 분자 직경의 0.5배 내지 2배의 길이일 수 있으며, 전극간 거리는 임의적으로 분자 직경의 0.5 내지 1배의 길이로 설정되고, 임의적으로 분자 직경의 0.7 내지 0.9배의 길이로 설정된다.
나노-갭 전극(12)을 제작하는 특정 방법은 특별히 제한되지 않는다. 이러한 제작 방법의 예는 하기에 기술될 것이다.
상기 언급된 한 쌍의 나노-갭 전극(12)은 공지된 나노제작된 기계적으로 제어 가능한 브레이크 접합 방법(nanofabricated mechanically controllable break junction method)을 이용하여 제작될 수 있다. 나노제작된 기계적으로 제어 가능한 브레이크 접합 방법은 피코미터-수준 또는 보다 미세한 해상도에서 우수한 기계적 안정성을 갖는, 전극간 거리를 제어할 수 있는 우수한 방법이다. 나노제작된 기계적으로 제어 가능한 브레이크 접합 방법을 이용한 전극 쌍에 대한 제작 방법은 예를 들어, 문헌[T. M. van Ruitenbeek, A. Alvarez, I. Pineyro, C. Grahmann, P. Joyez, M. H. Devoret, D. Esteve, C. Urbina, Rev. Sci. Instrum. 67, 108 (1996), 및 M. Tsutsui, K. Shoji, M. Taniguchi, T. Kawai, Nano Lett. 8, 345 (2008)]에 기술되어 있다. 전극 물질은 임의 적절한 금속, 예를 들어, 금, 백금, 은, 팔라듐, 텅스텐, 및 적절한 합금 또는 복합체를 포함한다.
예를 들어, 나노-갭 전극 쌍(12)은 하기 절차를 이용하여 제작될 수 있다.
첫째로, 전자빔 리소그래피(electron beam lithography) 및 리프트-오프 기술(lift-off technology)을 이용하여, 나노스케일 금 접합은 전자빔 리소그래피 디바이스(예를 들어, JEOL Ltd., 카탈로그 번호: JSM6500F)를 이용하여 폴리이미드 코팅된 가요성 금속 기판 상에 패턴화될 수 있다. 이후에, 접합 하의 폴리이미드는 에칭 공정, 예를 들어, 반응성 이온 에칭 공정을 이용한 에칭에 의해 제거될 수 있으며, 이러한 공정은 예를 들어, 반응성 이온 에칭 디바이스(예를 들어, Samco Inc., 카탈로그 번호: lONR)를 사용하여 수행될 수 있다.
이후에, 3-포인트 구부러진 구조를 갖는 나노스케일 금 브릿지 구조는 기판을 구부림으로써 제작될 수 있다. 이때에, 전극 쌍의 전극간 거리는 압전 작동기(CEDRAT, 카탈로그 번호: APA 150M)를 이용하여 기판의 정밀한 구부림을 제어함으로써 피코미터-수준 또는 보다 미세한 해상도로 제어될 수 있다.
일부 구체예에서, 이러한 제작 방법 및 공정을 이용함으로써, 실질적으로 평면인 디바이스가 달성될 수 있다. 하나 이상의 나노-채널은, 나노-채널(들)이 기판 상에 또는 그 위에서 제작될 수 있도록 제작될 수 있다. 중간 영역(들)(44M)은, 하나 이상의 나노-채널의 단부에서, 중간 영역(들)(44M)의 바닥이 하나 이상의 나노-채널의 바닥과 기판 위의 동일한 또는 실질적으로 동일한 수직 거리에 존재할 수 있도록 위치될 수 있으며, 여기서, 상기 하나 이상의 나노-채널의 단부는 상기 중간 영역에 바로 인접하여 있다.
다른 구체예에서, 중간 영역(들)(44M)은 하나 이상의 나노-채널의 단부에서, 중간 영역(들)(44M)의 상단이 하나 이상의 나노-채널의 상단과 기판 위의 동일한 또는 실질적으로 동일한 수직 거리에 존재할 수 있도록 위치될 수 있으며, 여기서, 상기 하나 이상의 나노-채널의 단부는 상기 중간 영역에 바로 인접하여 있다.
일부 구체예에서, 수직 치수는 달리 치수가 정확하게 동일할 수 있는 제작 허용 오차 내에 있는 경우에 동일하거나, 실질적으로 동일하거나, 동일평면상일 수 있다.
다른 구체예에서, 하나 이상의 나노-채널은 나노-채널의 개방 단부가 하나 이상의 나노-채널의 단부에서 중간 영역(들)과 교차하는 경우에 동일하거나, 실질적으로 동일하거나, 동일평면상인 것으로 고려될 수 있는 수직 치수를 갖는 것으로 여겨질 수 있으며, 여기서, 나노-채널의 전체 수직 치수는 중간 영역의 수직 치수 내에 포함된다.
추가 구체예에서, 하나 이상의 나노-채널은 나노-채널의 개방 단부가 하나 이상의 나노-채널의 단부에서 중간 영역(들)과 교차하는 경우에 동일하거나, 실질적으로 동일하거나, 동일평면상인 것으로 고려될 수 있는 수직 치수를 갖는 것으로 여겨질 수 있으며, 여기서, 나노-채널의 수직 치수 중 적어도 절반은 중간 영역의 수직 치수 내에 포함된다.
결과적으로, 이에 따라 제공된 브릿지는 브릿지가 일부 파괴될 수 있도록 당겨질 수 있다. 브릿지는 추가로 당겨질 수 있으며, 파괴로 인해 일어나는 나노-갭의 크기(전극간 거리)는 타겟 단일 분자(52)의 검출에 해당하는 요망되는 길이로 셋팅될 수 있다. 예를 들어, 단일 분자(52)가 생체분자인 단백질을 특정 길이로 분열시킴으로써 얻어진 펩티드를 구성하는 아미노산 분자인 경우에, 단일 분자(52)의 모노머의 측쇄의 길이는 약 0.3 nm 내지 1 nm일 수 있다. 이러한 경우에, 전극 쌍의 전극간 거리는 자가-파괴 기술(self-breaking technology)을 이용하여 브릿지 풀링(bridge pulling)을 조정함으로써 정확하게 제어될 수 있다[예를 들어, 문헌[M. Tsutsui, K. Shoji, M. Taniguchi, T. awai, Nano Lett. 8, 345 (2008) 및 M. Tsutsui, M. Taniguchi, T. Kawai, Appl. Phys. Lett. 93, 1631 15 (2008)] 참조].
상세하게, 0.1 V, 또는 0.050 V 내지 0.4 V의 DC 바이어스 전압(Vb)은 10 kQ의 직렬 저항을 이용하여 브릿지에 인가될 수 있으며, 금 나노접합은 프로그래밍된 접합 스트레칭 속도로 풀링되며, 이에 의해 저항 피드백 방법을 이용하여, 예를 들어, 데이타 획득 보드(National Instruments Corporation, 카탈로그 번호: NI PCIe-6321)를 이용하여 브릿지를 파괴한다[문헌[M. Tsutsui, K. Shoji, M. Taniguchi, T. Kawai, Nano Lett. 8, 345 (2008), and M. Tsutsui, M. Taniguchi, T. Kawai, Appl. Phys. Lett. 93, 1631 15 (2008)] 참조]. 브릿지는 추가로 풀링될 수 있으며, 파괴로 인해 일어나는 나노-갭의 크기(전극간 거리)는 의도된 길이로 셋팅될 수 있다. 이에 따라, 나노-갭 전극 쌍(12)이 형성될 수 있다.
전압은 측정 전력 공급 디바이스(18)에 의해 나노-갭 전극 쌍(12)을 가로질러 인가될 수 있다. 측정 전력 공급 디바이스(18)에 의해 나노-갭 전극 쌍(12)에 인가될 수 있는 전압은 특별히 제한되지 않고, 예를 들어, 0.25V 내지 0.75V, 또는 0.1 V 내지 0.4V, 또는 0.050V 내지 0.02V일 수 있다. 측정 전력 공급 디바이스(18)의 특별한 구성으로 특별히 제한되지 않으며, 적절한 공지된 전력 공급 디바이스가 사용될 수 있다.
전기영동 전극 쌍(20)은 한 쌍의 전기영동 전극(20A 및 20B)을 포함할 수 있다. 전기영동 전극(20A 및 20B)은 전계가 샘플(50)에 함유된 단일 분자(52)가 이동될 수 있는 방향(도 1에서 블록 화살표 A에 의해 지시된 방향)으로 형성될 수 있도록 배열될 수 있다. 일부 구체예에서, 일 예로서, 전기영동 전극(20A 및 20B)은 샘플 분자가 나노-갭 전극 쌍(12)에 대해 이동될 수 있도록 배치될 수 있으며, 절연체(14)는 이들 사이에 샌드위칭되어 있다. 절연체(14)의 폭은 전기영동 전극 쌍(20)을 가로질러 흐르는 전류와 나노-갭 전극 쌍(12)을 가로질러 흐르는 전류 사이에서 간섭이 일어나지 않기에 충분한 폭(예를 들어, 약 300 nm)로 셋팅될 수 있다.
도 1의 예에서, 전기영동 전극(20A)은 두 개의 분리된 전극들로 이루어질 수 있지만, 이는 반드시 분리될 필요는 없고, 단일 전극일 수 있다. 이는 또한 전기영동 전극(20B)에 적용될 수 있다.
전계가 전기영동 전극(20A)과 전기영동 전극(20B) 사이에 형성될 때, 단일 분자(52)는 전기영동 및 또는 전기침투에 의한 전계에 의해 이동될 수 있다. 다시 말해서, 단일 분자(52)는 나노-갭 전극 쌍(12)의 전극들 사이로 진행하게 하기 위해 이동할 수 있다.
전압은 전기영동 전력 공급 디바이스(22)에 의해 전기영동 전극 쌍(20)을 가로질러 인가될 수 있다. 전기영동 전력 공급 디바이스(22)에 의해 전기영동 전극 쌍(20)에 인가되는 전압은 특별히 제한되지 않으며, 단일 분자(52)가 나노-갭 전극 쌍(12)의 전극들 사이오 진행하는 속도를 제어할 수 있는 전압은 적절하게 셋팅될 수 있다. 전기영동 전력 공급(22)은 전기영동 전극 쌍(20)의 전극들 사이에 형성된 전계의 방향이 샌드위칭될 수 있도록 전기영동 전극 쌍(20)에 전압을 인가할 수 있다. 이에 따라, 전기영동 전극 쌍(20)의 전극들 사이로 이동하는 단일 분자(52)의 이동 방향은 변경될 수 있다. 전기영동 전력 공급 디바이스(22)의 특별한 구성으로 특별히 제한되지 않으며, 적절한 공지된 전력 공급 디바이스가 사용될 수 있다.
전류계(24)는 전압이 측정 전력 공급 디바이스(18)에 의해 인가되는 나노-갭 전극 쌍(12)의 전극들 사이로 모노머(52)가 진행할 때 발생되는 터널링 전류의 증가를 측정할 수 있다. 전류계(24)의 특정 구성으로 특별히 제한되지 않으며, 적절한 공지된 전류 측정 디바이스, 예를 들어, 트랜스임피던스 증폭기가 사용될 수 있다.
다음으로, 생체분자 서열화 디바이스(10)의 나노-갭 전극 쌍(12) 및 전기영동 전극 쌍(20)과 관련된 특정 구성이 기술될 것이다.
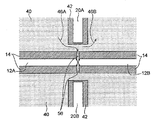
도 2는 나노-갭 전극 쌍(12) 및 전기영동 전극 쌍(20)의 주변부를 도시한 확대도이다. 도 2에 예시된 바와 같이, 다수의 나노-필러(40)는, 단일 분자(52)가 나노-필러 둘레로 진행하여 나노-갭 전극 쌍(들)(12) 및 전기영동 전극 쌍(20)에 이르게 할 수 있는 간격으로 제공될 수 있다. 본원에서 사용되는 "나노 필러"는 직경 또는 폭에 있어서 나노미터 이하의 스케일의 필러일 수 있다.
샘플(50)은 왼쪽 영역(44L)으로부터 가이딩될 수 있으며, 여기서, 나노-필러(40)가 제공될 수 있으며, 이는 도 2의 죄측상단에서 화살표 B에 의해 지시된 영역에서 확인될 수 있다. 샘플(50)은 전기영동, 전기침투, 압력, 표면 장력, 확산 및 이들의 조합들 중 하나에 의해 이동될 수 있다. 샘플(50)에 함유된 복잡하게 얽혀진 생체분자, 예를 들어, DNA, 등은 숲에서 대나무 줄기와 같이 배열되는 상당한 수의 나노-필러(40)에 의해 얽혀지거나 선형화된 다른 DNA 분자로부터 분리될 수 있다.
일부 구체예에서, 유체 샘플일 수 있는 샘플은 디바이스에, 모세관 작용이 상기 샘플을 예를 들어, 좌측 영역(44L)에서 중간 영역(44M)으로 그리고 이를 통해, 우측 영역(44R)으로 배출시킬 수 있는 방식으로 도입될 수 있다. 물론, 샘플은 우측 영역(44R)으로부터 도입되고 모세관 작용에 의해 중간 영역(44M)으로 그리고 이후에 좌측 영역(44L)으로 배출될 수 있다.
일부 구체예에서, 제2 유체는 샘플이 도입될 수 있는 것과 마주하는 하나 이상의 나노-채널의 단부에서 라벨링되지 않은 영역에 유사하게 위치된 영역의 한 측면에 유사하게 도입될 수 있고, 모세관 작용에 의해 상응하는 중간 영역으로 배출될 수 있고, 이후에 모세관 작용에 의해, 상기 제2 유체가 도입되는 영역과 마주하는 측면 상의 영역으로 배출될 수 있다.
일부 구체예에서, 샘플은 제2 유체의 도입 이전에 도입될 수 있으며, 이에 따라, 상기 샘플은 하나 이상의 나노-채널의 제1 단부로부터 그리고 상기 하나 이상의 나노-채널의 제2 단부로 배출될 수 있다. 이후에 제2 유체는 하나 이상의 나노채널의 제2 단부와 교차하는 중간 영역에 인접한 영역에 적용될 수 있다. 이러한 방식으로, 공기 갭 또는 버블은 유체가 나노채널의 양 단부에 동시에 적용되는 경우에 일어날 수 있는 바와 같이, 하나 이상의 나노-채널에서 샘플과 제2 유체 사이에 형성되는 것을 방지할 수 있으며, 이에 따라, 하나 이상의 나노-채널을 통한 유체 접근을 가능하게 한다. 유사하게, 제2 유체가 먼저 제공되고, 샘플 유체의 도입 이전에 모세관 작용에 의해 나노-채널을 통해 배출될 수 있다.
이러한 공기 갭 또는 버블의 형성은 나노-채널(들)의 단부들 간의 거리가 폭, 높이 또는 직경, 또는 나노-채널(들)의 단면과 관련된 다른 측정에 비해 길 때, 더욱 일어나기 쉬울 수 있다. 일부 구체예에서, 나노-채널(들)의 길이는 단면의 최소 치수의 10배일 수 있으며, 이러한 치수는 나노-채널(들)의 높이, 폭 또는 직경일 수 있다. 추가 구체예에서, 나노-채널(들)의 길이는 단면의 최소 치수의 100배일 수 있으며, 이러한 치수는 나노-채널(들)의 높이, 폭 또는 직경일 수 있다.
추가 구체예에서, 나노-채널의 길이는 상기 샘플 DNA 올리고가 상기 나노-채널(들) 내에 완전히 고정될 수 있도록 샘플 DNA 올리고 보다 더욱 길 수 있으며, 여기서, 상기 샘플 DNA 올리고는 100 내지 200개 염기의 길이를 가질 수 있거나, 150 내지 500개 염기의 길이를 가질 수 있거나, 300 내지 1000개 염기의 길이를 가질 수 있거나, 800 내지 4000개 염기의 길이를 가질 수 있거나, 3000 내지 10,000개 염기의 길이를 가질 수 있거나, 8,000 내지 100,000개 염기의 길이를 가질 수 있거나, 100,000개 초과의 염기의 길이를 가질 수 있다.
또한, 하나 이상의 흐름 디렉터(42)가 제공되는데, 여기에서, 각각은 채널의 폭이 나노-채널(들)(52)에 바로 인접한 채널의 구역의 영역에서 감소되어 임의적으로 나노-채널(들)(52)의 단부(들)에서 흐름 디렉터를 제공할 수 있되, 흐름 디렉터(42)가 마주보게 배열되도록 나노-갭 전극 쌍(12)이 위치될 수 있도록, 나노-채널(들)에 대한 입구 쪽으로 연장할 수 있거나, 나노채널의 한 단부가 흐름 제어기의 절연(insulation)의 관련된 피스를 가지고 다른 단부가 이러한 특징을 가지지 않을 수 있도록 배열될 수 있다. 흐름 디렉터(들)(42)는 보다 높은 백분율의 샘플 분자들을 상기 나노-채널(들)에 도입하게 하기 위해 샘플 분자가 나노-채널(들)의 한 단부에 가까워질 수 있고 상기 샘플 분자가 더욱 빠르게 도입될 수 있도록 흐름을 유도하기 위해 제공될 수 있다. 이와 같이, 샘플(50)에 대한 두 개의 유로가 형성되는데, 즉 유로(46A)는 왼쪽 영역(44L)에서 나노-갭 전극 쌍(12)의 전극간 영역으로 연장하며, 유로(46B)는 왼쪽 영역(44L)에서 도 2에 도시된 바와 같이 나노-필러(40)를 포함하는 상부 오른쪽 영역으로 연장한다. 다시 말해서, 흐름 디렉터(들)는 샘플(50)을 나노-갭 전극 쌍(12) 쪽 방향으로 흐르게 하기 위한 유로(46A) 및 샘플(50)을 나노-갭 전극 쌍(12)으로부터 멀어지는 방향으로 흐르게 하기 위한 유로(46B)를 포함하는, 다양한 유로를 형성시킴으로써 샘플(50)의 이동을 유도하기 위해 제공될 수 있다.
일부 구체예에서, 나노-채널(들), 제1 채널 및 제2 채널, 필러, 및 나노전극 쌍(들)은 실질적으로 동일한 평면 상에 리소그래픽으로 생성될 수 있다.
통상적으로, 이러한 흐름 디렉터(들)(42)가 존재하지 않을 때, 샘플(50)의 유로는 단지 화살표 B 방향으로 유도되며, 즉, 나노-갭 전극 쌍(12) 쪽 방향으로 유도된다. 이에 따라, 샘플(50)은 유로가 좁아지는 나노-갭 전극 쌍(12) 부근의 영역에서 축적할 것이다. 반대로, 일부 구체예에서, 두 개의 유로(46A 및 46B)는 흐름 디렉터(들)(42)를 배치시킴으로써 형성되며, 이에 따라, 과량의 샘플(50)이 유로(46B)를 통해 영역(44R)으로 흐를 수 있게 한다. 이러한 방식으로, 나노-갭 전극 쌍(12) 부근에서의 샘플(50)의 막힘이 감소될 수 있으며, 이에 따라, 단일 분자(52)의 높은 정확성의 동정이 가능하다.
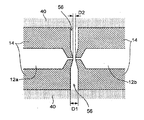
도 3은 도 2에서 파선에 의해 도시된 영역(54)의 확대도이다. 도 3에 예시된 바와 같이, 나노-채널(들)(56)은 하나 이상의 절연체(14) 부근에 그리고 중간 영역(44M)에 바로 인접하게 형성될 수 있으며, 이는 나노-채널(들)(52)의 마주하는 단부들 상에 존재하도록 구성될 수 있다. 나노-채널(들)(56)은 나노-필러(40)가 제공될 수 있는 중간 영역(44M)으로부터 나노-갭 전극 쌍(12) 쪽으로 점점 가늘어지는 형태를 가질 수 있다. 이러한 가늘어짐(tapering)은 생체분자를 나노-채널(들)(56)을 통한 흐름 시에 선형화시킬 수 있다. 중간 영역(44M)에 더욱 가까운 위치에서 나노-채널(들)(56)의 폭(Dl)은 일 예로서, 약 120 nm일 수 있지만, 임의 적합한 폭, 예를 들어, 20 nm 내지 100 nm, 50 nm 내지 250nm, 또는 200 nm 내지 1000 nm일 수 있다. 상술된 바와 같이, 가늘어지는 포인트(tapering point)에서 나노-채널(들)(56)의 폭, 즉 나노-갭 전극 쌍(12)의 전극간 거리(D2)가 단일 분자(52)의 분자 직경 보다 약간 짧거나, 동일하거나, 약간 길 수 있다는 것이 요망될 수 있다. 일 예로서, 단일 분자는 수백 피코미터(pm)에서 1.0 nm 이상의 분자 직경을 가질 수 있다.
도 2에 예시된 바와 같이, 전기영동 전극 쌍(20)은 나노-채널(들)(56)과 유체 소통하게 배치될 수 있다. 이는 각 단일 분자에 대한 일정한 전기영동 이동성을 가능하게 하고 높은 정확성 및 높은 처리량으로 단일 분자의 동정을 가능하게 한다.
시스템 제어 유닛(26)은 생체분자 서열화 디바이스(10)의 개개 부품들을 제어할 수 있고, 측정된 터널링 신호의 변화에 따른 신호를 기초로 하여 타겟 단일 분자(52)의 부류(또는 타입)을 동정할 수 있다.
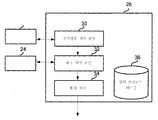
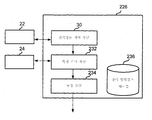
시스템 제어 유닛(26)은 생체분자 서열화 프로그램을 저장할 수 있는, 랜덤 액세스 메모리(RAM) 또는 리드 온리 메모리(ROM)) 및 중앙 처리 장치(CPU) 등을 포함하는 컴퓨터를 포함할 수 있다. 시스템 제어 유닛(26)은 도 15 및 상응하는 텍스트에서와 같이, 본원의 다른 곳에 기술된 바와 같을 수 있다. 시스템 제어 유닛(26)은 컴퓨터일 수 있고, 기능적 관점에서, 전기영동 제어 유닛(30), 측정 제어 유닛(32) 및 동정 유닛(34)을 포함하는 것으로서 나타낼 수 있다. 하기에서, 개개 부품들은 상세히 기술될 것이다.
전기영동 제어 유닛(30)은, 단일 분자(52)가 나노-갭 전극 쌍(12)의 전극들 사이를 통과할 수 있도록 하나 이상의 전기영동 전력 공급 디바이스(22)에 의한 전압의 인가를 제어할 수 있다.
측정 제어 유닛(32)은, 전류계(24)가 나노-갭 전극 쌍(12)의 전극들 사이를 흐르는 터널링 전류를 측정할 수 있게, 전류계(24)를 제어하도록 구성될 수 있다. 터널링 전류를 측정하는데 활용되는 시간이 제한되는 것은 아니지만, 이의 가능한 수치는 10분, 20분, 30분, 40분, 50분, 1, 2, 3, 4시간 이상이다. 측정 시간은 다른 인자들 중에서, 단일 분자(52)의 길이, 서열화될 단일 분자의 수, 서열화의 오차율, 단일 분자를 서열화하기 위한 범위, 나노-채널의 수, 및 서열화를 위해 사용되는 센서에 따라 적절하게 셋팅될 수 있다.
또한, 측정 제어 유닛(32)은 전류계(24)에 의해 측정되는 터널링 전류의 전류 값들을 획득하고, 그리고 획득된 전류 값을 이용하여 컨덕턴스를 계산하고, 컨덕턴스-시간 프로파일을 형성시킬 수 있다. 컨덕턴스는 터널 전류가 측정될 때 나노-갭 전극 쌍(12)을 가로 질러 인가된 전압(V)에 의해 터널 전류의 전류 값을 나눔으로써 계산될 수 있다. 컨덕턴스의 이용으로, 나노-갭 전극 쌍(12)의 전극들 사이에 인가되는 전압이 상이한 측정에 대해 상이하더라도, 통일된 기준(unified reference)을 갖는 프로파일들이 획득될 수 있다. 나노-갭 전극 쌍(12)을 가로질러 인가되는 전압 값이 각 측정에 대해 일정하게 이루어질 때, 터널 전류 및 컨덕턴스의 전류 값들은 동일한 방식으로 처리될 수 있다.
측정 제어 유닛(32)은 전류계(24)에 의해 측정된 터널링 전류를 증폭시키고 이에 따라 증폭된 터널링 전류를 얻기 위해 전류 증폭기를 사용할 수 있다. 전류 증폭기를 사용함으로써, 약한 터널링 전류 값의 증폭을 가능하게 한다. 이에 따라, 터널링 전류가 고감도(high sensitivity)로 측정될 수 있다. 예를 들어, 상업적으로 입수 가능한 가변 고속 전류 증폭기(Femto GmbH 제조, 카달로그 번호 DHPCA-100)가 전류 증폭기로 이용될 수 있다.
동정 유닛(34)은 상대 컨덕턴스 테이블(36)에 저장된, 부류(또는 타입)가 알려진 단일 분자(52)에서의 모노머머들에 대해, 상대 컨덕턴스를 사용하여 측정 제어 유닛(32)에 의해 제조된 컨덕턴스-시간 프로파일로부터 얻어진 검출된 물리적 양(들)을 비교할 수 있고, 이에 의해 단일 분자(52)에서 타겟 모노머의 부류를 동정할 수 있다. 일부 구체예에서, 검출된 물리적 양은 측정 제어 유닛(32)에 의해 제조된 컨덕턴스-시간 프로파일의 각 측정 포인트에 대한 컨덕턴스일 수 있다. 본원에서 사용되는 바와 같이, 상대 컨덕턴스는 부류가 알려진 단일 분자(52)에서 모노머를 측정함으로써 얻어진 단일 분자에서의 모노머의 각 부류에 대한 컨덕턴스이다. 상대 컨덕턴스는 단일 분자(52)의 각 모노머와 관련된 측정된 컨덕턴스를 단일 분자(52)에서 모든 모노머에 대해 측정된 최대 측정 컨덕턴스 값으로 나눔으로써 계산될 수 있다. 일부 구체예에서, 측정된 컨덕턴스는 최대 또는 모달 컨덕턴스일 수 있다.
일부 구체예에서, 동정될 적어도 하나의 단일 분자(52)는 용매 중에 용해될 수 있다. 용매는 특별히 제한되지 않는다. 예를 들어, 초순수(ultrapure water)가 사용될 수 있다. 초순수는 예를 들어, EMD Millipore Corporation(Milli-Q? Integral 3/5/10/15 (카탈로그 번호))에 의해 제조된 Milli-Q? Integral 3(디바이스 명칭)을 이용하여 생산될 수 있다. 용액 중 단일 분자(52)의 농도는 특별히 제한되지 않지만, 이는 예를 들어, 0.01 내지 1.0 μΜ, 또는 0.5 내지 5.0 μΜ, 또는 2 내지 20 μΜ, 또는 10 내지 100 μΜ일 수 있다.
이후에, 나노-갭 전극 쌍(들)(12)은 샘플에 함침될 수 있으며, 측정 전력 공급 디바이스(들)(18)는 나노-갭 전극 쌍(들)(12)을 가로질러 전압을 인가하기 위해 사용될 수 있으며, 전기영동 전력 공급 디바이스(들)(22)는 전기영동 전극 쌍(들)(20)을 가로질러 전압을 인가하기 위해 사용될 수 있다. 컴퓨터의 CPU는 ROM 또는 다른 비휘발성 저장장치에 저장된 생체분자 서열화 프로그램을 판독하고 실행시킬 수 있는 제어 유닛을 구성한다. 이는 도 5에 예시된 바와 같이 생체분자 서열화 디바이스(10)가 생체분자 서열화 공정을 실행할 수 있게 한다.
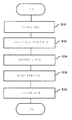
단계 S10에서, 측정 제어 유닛(32)은 전류계(24)가 단일 분자(52)가 나노-갭 전극 쌍(12)의 전극들 사이를 통과할 때 발생되는 터널링 전류를 측정하게 하기 위해 전류계(24)를 제어할 수 있다.
단계 S12에서, 측정 제어 유닛(32)은 측정된 터널링 전류의 전류값을 획득하고, 각 측정 포인트에 대한 컨덕턴스를 계산하고, 컨덕턴스-시간 프로파일을 형성시킨다.
단계 S14에서, 동정 유닛(34)은 상대 컨덕턴스 테이블(36)로부터 타겟 단일 분자(52)의 상이한 분자들의 상대 컨덕턴스를 획득한다.
단계 S16에서, 동정 유닛(34)은 상기 단계 S14에서 획득된 상대 컨덕턴스와 상기 단계 S12에서 형성된 컨덕턴스-시간 프로파일을 비교하고, 각 신호에 의해 지시된 모노머의 부류를 동정할 수 있다. 단계 S18에서, 동정 유닛(34)은 동정 결과를 출력할 수 있다. 이에 따라, 단일 분자에 대한 모노머 동정 공정이 완료될 수 있다.
상술된 바와 같이, 상기에 기술된 바와 같은 생체분자 서열화 디바이스의 일부 구체예에서, 전기영동 전극 쌍(20)은 나노-채널(56), 및 샘플(50)을 나노-채널(들)(56)을 통해 나노-갭 전극 쌍(들)(12) 쪽 방향으로 이동시키기 위한 유로(46A), 및 하나 이상의 나노-갭 전극 쌍(들)(120을 함유할 수 있는 나노-채널(들)(56)에 대한 입구를 지나는 방향으로 샘플(50)을 흐르게 하기 위한 유로(46B) 부근에 배치될 수 있다.
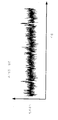
이는 터널링 전류의 측정을 기초로 하여 높은 신호 주파수를 나노-갭 전극 쌍(들)(12)의 전극들 사이를 진행시킬 수 있다. 도 6은 전기영동 전극 쌍(20)이 통상적인 방식으로 제공되지 않는 디바이스에 의해 검출되는 신호 파형을 예시한 것으로서, 이에 따라, 단지 브라운 운동을 사용되며, 도 7은 일부 본 구체예에서 생체분자 서열화 디바이스(10)에서와 같이 전기영동 전극 쌍(20)이 제공된 디바이스에 의해 검출된 신호 파형을 예시한 것이다. 도 6 및 도 7은 컨덕턴스 및 시간 둘 모두에 대해 동일한 스케일로 도시되어 있다. 알 수 있는 바와 같이, 도 7은 컨덕턴스가 증가함에 따라 보다 큰 시간(펄스)을 갖는다. 증가된 컨덕턴스는 나노-전극 쌍 갭에서 DNA의 존재와 관련이 있다. 도 6 및 도 7에서 알 수 있는 바와 같이, 일부 구체예에서, 생체분자 서열화 디바이스(10)가 통상적인 방식과 비교하여 높은 신호 주파수를 나타내는 것으로 이해된다.
도 8은 전기영동 전극 쌍(20)에 인가된 전압과 초당 검출된 신호의 수(신호 주파수) 간의 관계의 측정 결과를 도시한 그래프이다. 도 8에서 알 수 있는 바와 같이, 이러한 예시적인 구성에서, 전기영동 전극 쌍(20)에 인가된 전압이 약 0.7 V까지 증가할 때까지, 전기영동 전압이 증가함에 따라 신호 주파수가 증가하는 것으로 이해된다.
도 9는 전압이 인가된 전기영동 전극 쌍(20)이 제공될 때, 그리고 전기영동 전극 쌍(20)이 제공되지 않을 때, 복수의 상이한 부류의 단일 분자에 대한 상이한 분절 리드 길이의 분절 리드의 수의 측정 결과를 도시한 것이다. 도 9로부터 알 수 있는 바와 같이, 전압이 인가된 전기영동 전극 쌍(20)이 제공될 때 리드의 수가 전기영동 전극 쌍(20)이 제공되지 않을 때와 비교하여 큰 것으로 이해된다.
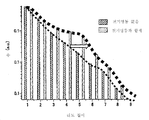
도 10은 전기영동 전극 쌍(20)이 제공되지 않을 때(NE) 그리고 전압이 인가된 전기영동 전극 쌍(20)이 제공될 때(N), 상이한 리드 길이의 리드의 수를 측정 결과를 도시한 것이다. 도 10으로부터 알 수 있는 바와 같이, 전압이 인가된 전기영동 전극 쌍(20)이 제공될 때 리드의 수가 전기영동 전극 쌍이 1.0 ms/베이스 이하 범위로 공급되지 않은(NE) 시스템과 비교하여 더욱 큰 것으로 이해된다.
하기 표 1은 단일 분자에 대한 리드의 평균 수 및 리드의 최대 수, 단일 주파수, 및 샘플의 필수 용적의 측정 결과를 나타낸 것이다. 단일 주파수는 샘플(50) 농도가 10-7 M(mole)일 때 측정된 것이다.
[표 1]
표 1에 나타낸 바와 같이, 본 발명이 통상적인 분야와 비교하여, 단일 분자에 대한 리드의 평균 및 최대 수, 신호 주파수, 및 요구되는 샘플의 용량의 하한치 모두에서 우수한 것으로 이해된다.
상술된 바와 같이, 일부 구체예에서 생체분자 서열화 디바이스는 전기영동 전극 쌍(20)이 나노-갭 전극 쌍(12), 및 샘플(50)을 나노-채널(들)(56)에서 나노-갭 전극 쌍(들)(12) 쪽 방향으로 흐르게 하기 위한 유로(46A) 및 샘플(50)을 나노-갭 전극 쌍(들)(12)을 함유할 수 있는 나노-채널(들)(56)을 지나는 방향으로 흐르게 하기 위한 유로(46B) 부근에 배치될 수 있도록 구성될 수 있으며, 이에 따라, 단일 분자(52) 상에 인가되는 전계의 증가가 개선될 수 있도록 한다. 이는 하나 이상의 나노-전극 쌍(들)에 대해 단일 분자의, 브라운 운동에 대한 통과 속도의 보다 큰 안정화를 가능하게 할 수 있다. 이는 단일 분자의 보다 긴 리드 및 높은 정확성 및 높은 처리량으로 동정을 가능하게 한다.
일부 구체예에서, 전기영동 전극 쌍(20)이 나노-갭 전극 쌍(12)과 평행하게 배열된 구조가 설명된다. 그러나, 도 11에 예시된 바와 같이, 전기영동 전극 쌍(20)은 이의 전극이 흐름 디렉터(들)(42) 상에 또는 이에 바로 인접하게 배치되도록 배치될 수 있다. 다시 말해서, 전기영동 전극 쌍(20)은 샘플(50)을 도입하는 방향을 따라 전극 쌍(들)(12)을 함유할 수 있는 나노-채널(들)(56)에 밀접하게 연장될 수 있다. 이러한 경우에, 전기영동 전극 쌍(20)의 전극은 나노-채널(들)(56) 바로 위 및 바로 아래에 각각 배치될 수 있다. 이는 단일 분자(52) 상에 인가된 전계의 추가 증가를 가능하게 하고, 높은 정확성 및 높은 처리량으로 단일 분자의 모노머의 동정을 개선시킨다.
다음으로, 다수의 상이한 나노-갭 간격이 사용될 수 있는 본 발명의 추가적인 구체예가 기술될 것이다. 도 1의 생체분자 서열화 디바이스(10)에 해당하거나 이와 유사한 부품 또는 부분은 동일한 참조 숫자에 의해 명시되며, 이의 설명은 생략될 것이다.
도 12에 예시된 바와 같이, 일부 구체예에 따른 생체분자 서열화 디바이스(210)는 나노-갭 전극 쌍(12A, 12B 및 12C), 측정을 위한 하나 이상의 측정 전력 공급 디바이스(18), 하나 이상의 전기영동 전극 쌍(20), 전기영동을 위한 하나 이상의 전기영동 전력 공급 디바이스(22), 전류계(24), 및 하나 이상의 시스템 제어 유닛(226)을 포함한다.
나노-갭 전극 쌍(12A, 12B 및 12C)의 구조는 도 1과 관련하여 기술되는 바와 동일한 나노-갭 전극 쌍(들)(12)의 구조일 수 있다. 각 나노-갭 전극 쌍(12A, 12B 및 12C)의 전극은 전극 쌍들 간의 중심 라인이 동일한 축 상에 정렬될 수 있도록 정렬될 수 있다. 다시 말해서, 단일 분자(52)가 진행하는 단일 경로는 나노-갭 전극 쌍(12A, 12B 및 12C))의 전극간 공간에 의해 일부 규정될 수 있다. 나노-갭 전극 쌍(12A)의 전극간 거리는 d1일 수 있으며, 나노-갭 전극 쌍(12B)의 전극간 거리는 d2일 수 있으며, 나노-갭 전극 쌍(12C)의 전극간 거리(d3)는 서로 다를 수 있다. 도 12에 예시된 예에서, 이의 관계는 d1>d2>d3이다. 예를 들어, 이러한 거리는 d1= 1.0 nm, d2=0.7 nm, d3=0.5 nm일 수 있지만, 적용을 위해 요망되는 경우에 임의 거리일 수 있으며, 예를 들어, 아미노산을 측정하기 위해 요망되는 경우에, 하나의 전극간 거리는 0.25 nm일 수 있으며, 다른 전극간 거리는 1.0 nm 초과일 수 있으며, 각각은 상이한 아미노산에 대한 측쇄에 대한 분자량 보다 20% 이하이다. 일부 구체예에서, 전극간 거리 중 일부는 동일하거나 실질적으로 동일할 수 있다.
도 13에 예시된 바와 같이, 시스템 제어 유닛(226)은 전기영동 제어 유닛(30), 측정 제어 유닛(232), 및 동정 유닛(234)을 포함하는 시스템으로서 나타낼 수 있다.
측정 제어 유닛(232)은 전류계(24)가 나노-갭 전극 쌍(12A, 12B, 및 12C) 사이에서 발생된 각 터널링 전류를 측정하게 하기 위해 전류계(24)를 제어할 수 있다. 측정 제어 유닛(232)은 또한, 전류계(24)에 의해 측정된 각 전극간 저리에 대해 터널링 전류의 전류값을 획득하고, 컨덕턴스를 계산하고, 각 전극간 거리에 대해 컨덕턴스-시간 프로파일을 형성시킬 수 있다.
동정 유닛(234)은 부류가 알려진 단일 분자(52)의 모노머와 관련하여, 상대 컨덕턴스 테이블(236)에 저장된, 상대 컨덕턴스와 측정 제어 유닛(32)에 의해 결정된 바와 같은 각 전극간 거리에 대한 컨덕턴스-시간 프로파일로부터 획득된 검출된 물리적 양을 비교할 수 있으며, 이에 의해, 타겟 단일 분자(52)의 모노머의 부류를 동정할 수 있다.
일부 구체예에서, 동정될 적어도 하나의 단일 분자(52)는 상기에 기술된 바와 같은 용매에 용해될 수 있다. 이후에, 나노-갭 전극 쌍(12A, 12B 및 12C)은 샘플에 함침될 수 있으며, 측정 전력 공급 디바이스(들)(18)는 나노-갭 전극 쌍(12A, 12B 및 12C) 각각을 가로질러 전압을 인가하기 위해 사용될 수 있으며, 전기영동 전력 공급 디바이스(들)(22)는 전기영동 전극 쌍(20A 및 20B)을 가로질러 전압을 인가하기 위해 사용될 수 있다. 시스템 제어 유닛(226)을 구성하는 컴퓨터의 CPU는 ROM 또는 다른 비휘발성 메모리에 저장될 수 있는 생체분자 서열화 프로그램을 판독하고 실행할 수 있다. 이는 생체분자 서열화 디바이스(210)가 도 14에 예시된 바와 같은 생체분자 서열화 공정을 실행시키게 할 수 있다.
나노-갭 전극 쌍(12A, 12B 및 12C)은 상이한 갭 크기를 가질 수 있다. 갭 크기는 생체분자의 상이한 타입의 모노머(또는 서브유닛)의 동정을 가능하게 하도록 선택될 수 있다. 예를 들어, 나노-갭 전극 쌍(12A)은 한 타입의 뉴클레오티드(예를 들어, 아데노신)의 동정을 가능하게 하도록 선택된 폭을 가질 수 있으며, 나노-갭 전극 쌍(12B)은 다른 타입의 뉴클레오티드(예를 들어, 티민)의 동정을 가능하게 하도록 선택된 폭을 가질 수 있다.
나노-갭 전극 쌍(12A, 12B 및 12C)은 나노-채널에 위치될 수 있다. 나노-채널은 임의 수의 나노-갭 전극 쌍, 예를 들어, 적어도 2, 3, 4, 5, 6, 7, 8, 9, 또는 10개의 나노-갭 전극 쌍을 포함할 수 있다. 나노-갭 전극 쌍들 중 적어도 일부 또는 전부는 상이한 폭을 가질 수 있다.
단계 S20에서, 측정 제어 유닛(232)은 단일 분자(52)가 나노-갭 전극 쌍(12A, 12B 및 12C)의 전극들 사이에 일부 형성된 나노-채널(들)(56)로 통과할 때 형성되는 터닐링 전류를 전류계(24)가 측정하게 하기 위해 전류계(24)를 제어한다.
단계 S22에서, 측정 제어 유닛(232)은 측정된 터널링 전류의 전류값을 획득하고, 각 측정 포인트에 대한 컨덕턴스를 계산하고, 각 전극간 거리에 대한 컨덕턴스-시간 프로파일을 형성시킬 수 있다.
단계 S24에서, 동정 유닛(234)은 "i" 값을 1로 셋팅할 수 있다.
단계 S26에서, 동정 유닛(234)은 전극간 거리(d)에 해당하는 단일 분자(52)의 모노머의 상대 컨덕턴스, 즉 전극간 거리(dj)로 동정될 수 있는 타겟 단일 분자(52)의 모노머의 상대 컨덕턴스를 획득할 수 있다.
단계 S28에서, 동정 유닛(234)은 상기 단계 S26에서 획득된 상대 컨덕턴스 값과 상기 단계 S22에서 형성된 전극간 거리(dj)의 컨덕턴스-시간 프로파일을 비교하고, 각 신호에 의해 지시된 단일 분자의 모노머의 부류를 동정한다.
단계 S30에서, 동정 유닛(234)은 공정이 모든 전극간 거리(dj)에 대해 완료되었는 지의 여부를 결정할 수 있다. 처리되지 않은 전극간 거리(dj)가 존재하는 경우에, 공정은 단계 S32로 진행하며, "i"는 1까지 증가하며, 단계 S26으로 되돌아간다. 공정이 모든 전극간 거리(di)에 대해 완료되었을 때, 공정은 단계 S34로 진행하며, 동정 유닛(234)은 동정 결과를 출력하며, 생체분자 서열화 공정은 완료된다.
상기에 기술된 바와 같이, 일부 구체예에서, 전극간 거리가 상이한 복수의 나노-갭 전극 쌍들 사이에서 발생된 전류(예를 들어, 터널링 전류)를 사용하여 획득되는 컨덕턴스가 사용된다. 이에 따라, 단일 나노-갭 전극 쌍 또는 동일한 또는 본질적으로 유사한 나노-갭 간격을 갖는 수 개의 나노-갭 전극 쌍의 사용에 의해 유발되는 유리한 장점 이외에, 보다 정확한 동정이 가능하다. 전극간 거리가 상이한 복수의 나노-갭 전극 쌍의 구조, 뿐만 아니라 단일 나노-갭 전극 쌍의 전극간 거리가 변경될 수 있는 구조가 가능하다.
본원에 기술된 바와 같은 일부 구체예에서, 복수의 나노-갭 전극 쌍이 전극간 거리에 있어서 상이한 경우만이 설명된다. 그러나, 단일 나노-갭 전극 쌍에 대한 전극간 거리가 변경되는 구조는 가능하다. 예를 들어, 전극간 거리는 레버리지(leverage)의 원리를 이용하여, 활동 포인트, 피봇 포인트 및 로드 포인트의 기하학적 배열을 조정함으로써 변경될 수 있다. 더욱 상세하게, 전극간 거리는 압전 부재를 사용하여 나노-갭 전극 쌍의 일부를 누름으로써 로드의 포인트로서 제공하는 전극의 단부를 이동시킴으로써 변경될 수 있다. 이러한 경우에, 전극간 거리는 요망되는 경우에 압전 부재(들)에 의해 눌려지는 거리와 전극간 거리 간의 유사성 관계를 기초로 하여 셋팅될 수 있다.
생체분자 서열화 디바이스는, 전기영동 전극 쌍(20)이 나노-갭 전극 쌍(12), 및 나노-채널(들)(56)에서 나노-갭 전극 쌍(들)(12) 쪽 방향으로 샘플(50)을 흐르게 하기 위한 유로(46A) 및 나노-갭 전극 쌍(12)이 제공될 수 있는 나노-채널(들)(56)을 지나는 방향으로 샘플(50)을 흐르게 하기 위한 유로(46B) 둘 모두 부근에 배치될 수 있도록 구성될 수 있으며, 이에 따라, 단일 분자(52)에 의해 나타나는 전계의 증가가 개선될 수 있게 한다. 이는 높은 정확성 및 높은 처리량으로 단일 분자의 동정을 가능하게 한다. 또한, 일부 구체예에서, 생체분자 서열화 디바이스는 단백체 시퀀서(proteomic sequencer)로서 사용될 수 있고, 공중 위생, 안전성, 보안, 및 환경의 분야에서 사용되는, 예를 들어, 알레르겐 시험, 질병 질단 등에, 고속, 높은 민감성, 및 저비용으로 적용될 수 있다.
본 발명이 나노-갭 전극의 "쌍"을 언급하고 있지만, 본 발명의 디바이스 및 시스템이 임의 수의 나노-갭 전극을 포함할 수 있는 것으로 인식될 것이다. 예를 들어, 디바이스는 나노-갭 전극의 세트를 포함할 수 있으며, 이러한 세트는 적어도 2, 3, 4, 5, 6, 7, 8, 9, 또는 10개의 전극을 포함한다.
컴퓨터 제어 시스템
본 개시내용은 본 개시내용의 방법들을 구현하도록 프로그램된 컴퓨터 제어 시스템들을 제공한다. 도 15는 단백질과 같은 생체분자를 서열화하도록 프로그래밍되거나 아니면 이를 위해 구성된 컴퓨터 시스템(1501)을 도시한다. 컴퓨터 시스템(1501)은 본원 어딘가에서 설명되는 제어 유닛들(26 및 226)일 수 있다. 컴퓨터 시스템(1501)은 중앙 처리 장치(CPU, 또한 본원에서 "프로세서" 및 "컴퓨터 프로세서")(1505)를 포함하며, 이는 싱글 코어 또는 멀티 코어 프로세서, 또는 병렬 프로세싱을 위한 복수의 프로세서들일 수 있다. 컴퓨터 시스템(1501)은 또한 메모리 또는 메모리 로케이션(1510)(예를 들어, 랜덤-액세스 메모리, 리드-온리 메모리, 플래시 메모리), 전자 저장 유닛(1515)(예를 들어, 하드 디스크), 하나 또는 그 초과의 다른 시스템들과의 통신을 위한 통신 인터페이스(1520)(예를 들어, 네트워크 어댑터) 및 주변 디바이스들(1525), 예컨대 캐시, 다른 메모리, 데이터 저장소 및/또는 전자 디스플레이 어댑터들을 포함한다. 메모리(1510), 저장 유닛(1515), 인터페이스(1520) 및 주변 디바이스들(1525)은 통신 버스(실선들)를 통해 CPU(1505), 예컨대 마더보드와 통신한다. 저장 유닛(1515)은 데이터를 저장하기 위한 데이터 저장 유닛(또는 데이터 저장소)일 수 있다. 컴퓨터 시스템(1501)은 통신 인터페이스(1520)의 보조로 컴퓨터 네트워크("네트워크")(1530)에 동작가능하게 커플링될 수 있다. 네트워크(1530)는 인터넷, 인터넷 및/또는 엑스트라넷, 또는 인터넷과 통신하는 인트라넷 및/또는 엑스트라넷일 수 있다. 일부 경우들에서 네트워크(1530)는 원격통신 및/또는 데이터 네트워크이다. 네트워크(1530)는, 분산형 컴퓨팅, 예컨대 클라우드 컴퓨팅을 가능하게 할 수 있는 하나 또는 그 초과의 컴퓨터 서버들을 포함할 수 있다. 일부 경우들에서 컴퓨터 시스템(1501)의 보조로, 네트워크(1530)는 피어-투-피어 네트워크(peer-to-peer network)를 구현할 수 있으며, 이는 클라이언트 또는 서버로서 거동하도록 디바이스들이 컴퓨터 시스템(1501)에 커플링되게 할 수 있다.
CPU(1505)는 프로그램 또는 소프트웨어에 내장될 수 있는 기계-판독가능한 명령들의 시퀀스를 실행할 수 있다. 명령들은 메모리 로케이션, 예컨대 메모리(1510)에 저장될 수 있다. 본 개시내용의 방법들을 구현하도록 추후 프로그래밍되거나 아니면 이를 위해 CPU(1505)를 구성할 수 있는 명령들이 CPU(1505)로 지향될 수 있다. CPU(1505)에 의해 수행되는 동작들의 예들은, 페치, 디코드, 실행 및 라이트백(writeback)을 포함할 수 있다.
CPU(1505)는 집적회로와 같은 회로의 일부일 수 있다. 시스템(1501)의 하나 또는 그 초과의 다른 컴포넌트들이 회로에 포함될 수 있다. 일부 경우들에서, 회로는 ASIC(application specific integrated circuit)이다.
저장 유닛(1515)은, 파일들, 예컨대 드라이버들, 라이브러리들 및 저장된 프로그램들을 저장한다. 저장 유닛(1515)은 이용자 데이터, 예를 들어 이용자 선호도(preferences) 및 이용자 프로그램들을 저장할 수 있다. 일부 경우들에서 컴퓨터 시스템(1501)은, 예컨대 인트라넷 또는 인터넷을 통해 컴퓨터 시스템(1501)과 통신하는 원격 서버에 로케이팅되는, 컴퓨터 시스템(1501) 외부에 있는 하나 또는 그 초과의 추가 데이터 저장 유닛들을 포함할 수 있다.
컴퓨터 시스템(1501)은 네트워크(1530)를 통해 하나 또는 그 초과의 원격 컴퓨터 시스템들과 통신할 수 있다. 예컨대, 컴퓨터 시스템(1501)은 이용자의 원격 컴퓨터 시스템과 통신할 수 있다. 이용자는 네트워크(1530)를 통해 컴퓨터 시스템(1501)에 액세스할 수 있다.
본원에서 설명된 것과 같은 방법들은, 컴퓨터 시스템(1501)의 전자 저장 로케이션, 예컨대, 예를 들어 메모리(1510) 또는 전자 저장 유닛(1515) 상에 저장되는 기계(예를 들어, 컴퓨터 프로세서) 실행가능한 코드에 의해 구현될 수 있다. 기계 실행가능한 또는 기계 판독가능한 코드는 소프트웨어의 형태로 제공될 수 있다. 이용 동안, 코드는 프로세서(1505)에 의해 실행될 수 있다. 일부 경우들에서, 코드는 저장 유닛(1515)으로부터 리트리브될 수 있고 프로세서(1505)에 의한 쉬운 액세스를 위해 메모리(1510) 상에 저장될 수 있다. 일부 상황들에서, 전자 저장 유닛(1515)은 배제될 수 있고, 기계-실행가능한 명령들은 메모리(1510)에 저장된다.
코드는 코드를 실행하도록 적응되는 프로세서를 갖는 기계에서의 이용을 위해 사전-컴파일링되고 구성될 수 있고, 또는 실행시간(runtime) 동안 컴파일링될 수 있다. 코드는 사전-컴파일링 또는 에즈-컴파일링(as-compiled) 방식으로 코드가 실행될 수 있도록 선택될 수 있는 프로그래밍 언어로 공급될 수 있다.
본원에 제공되는 시스템들 및 방법들의 양상들, 예컨대 컴퓨터 시스템(1501)이 프로그래밍으로 구체화될 수 있다. 기술의 다양한 양상들은 통상적으로 일 타입의 기계 판독가능한 매체 상에 보유되거나 또는 이로 구체화되는 기계(또는 프로세서) 실행가능한 코드 및/또는 연관된 데이터의 형태의 "제조 물품들" 또는 "물건들"로 간주될 수 있다. 기계-실행가능한 코드는 전자 저장 유닛, 예컨대 메모리(예를 들어, 리드-온리 메모리, 랜덤-액세스 메모리, 플래시 메모리) 또는 하드 디스크에 저장될 수 있다. "저장" 타입 매체는 컴퓨터들, 프로세서들 등의 유형의 메모리, 또는 이들과 연관된 모듈들, 예컨대 다양한 반도체 메모리들, 테입 드라이브들, 디스크 드라이브들 등 중 일부 또는 전부를 포함할 수 있으며, 이들은 소프트웨어 프로그래밍을 위해 임의의 시간에 비-일시적 저장을 제공할 수 있다. 소프트웨어의 전부 또는 부분들은 때로 인터넷 또는 다양한 다른 원격통신 네트워크들을 통해 통신할 수 있다. 예를 들어, 이러한 통신들은, 하나의 컴퓨터 또는 프로세서로부터 다른 컴퓨터 또는 프로세서로, 예를 들어, 관리 서버 또는 호스트 컴퓨터로부터 애플리케이션 서버의 컴퓨터 플랫폼으로 소프트웨어의 로딩을 가능하게 할 수 있다. 따라서, 소프트웨어 엘리먼트들을 보유(bear)할 수 있는 다른 타입의 매체는, 예컨대 유선 또는 광학적 랜드라인 네트워크들을 통해 그리고 다양한 에어-링크들을 통해, 로컬 디바이스들 사이의 물리적 인터페이스들에 걸쳐 이용되는 광학적, 전기적 및 전자기적 파들을 포함한다. 이러한 파들을 보유하는 물리적 엘리먼트들, 예컨대 유선 또는 무선 링크들, 광학 링크들 등이 또한, 소프트웨어를 보유하는 매체로 간주될 수 있다. 본원에서 이용되는 것처럼, 비-일시적, 유형의 "저장" 매체로 제한되는 것을 아니지만, 예컨대 컴퓨터 또는 기계 "판독가능한 매체"란 용어는 실행을 위해 프로세서에 명령들을 제공하는데 참여하는 임의의 매체를 지칭한다.
따라서, 기계(또는 컴퓨터) 판독가능한 매체, 예컨대 컴퓨터-실행가능한 코드(또는 컴퓨터 프로그램)는, 유형의 저장 매체, 반송파 매체 또는 물리적 송신 매체를 포함하지만 이로 제한되는 것은 아닌 다수의 형태들을 취할 수 있다. 비-휘발성 저장 매체는, 예컨대 도면들에 도시된 데이터베이스들 등을 구현하는데 이용될 수 있는 예를 들어, 광학 또는 자기 디스크들(disks), 예컨대 임의의 컴퓨터(들)의 임의의 저장 디바이스들 등을 포함한다. 휘발성 저장 매체는, 동적 메모리, 예컨대 컴퓨터 플랫폼의 메인 메모리를 포함한다. 유형의 송신 매체는, 컴퓨터 시스템내의 버스를 포함하는 와이어들을 비롯한, 동축 케이블들, 구리 와이어 및 광섬유를 포함한다. 반송파 송신 매체는 전자 또는 전자기 신호들, 또는 무선 주파수(RF) 및 적외선(IR) 데이터 통신들 동안 발생되는 것들과 같은 전기 또는 전자기 신호들, 음향 또는 광 파들의 형태를 취할 수 있다. 따라서, 컴퓨터-판독가능한 매체의 일반적 형태들은, 예를 들어, 플로피 디스크, 플렉시블 디스크, 하드 디스크, 자기 테입, 임의의 다른 자기 매체, CD-ROM, DVD 또는 DVD-ROM, 임의의 다른 광학 매체, 펀치 카드들, 페이퍼 테입, 홀들의 패턴들을 갖는 임의의 다른 물리적 저장 매체, RAM, ROM, PROM 및 EPROM, FLASH-EPROM, 임의의 다른 메모리 칩 또는 카트리지, 데이터 또는 명령들을 전송하는 반송파, 이러한 반송파를 전송하는 케이블들 또는 링크들, 또는 컴퓨터가 프로그래밍 코드 및/또는 데이터를 판독할 수 있는 임의의 다른 매체를 포함한다. 이러한 다수의 형태들의 컴퓨터 판독가능한 매체는 실행을 위해 프로세서에 하나 또는 그 초과의 명령들의 하나 또는 그 초과의 시퀀스들을 보유하는데 수반될 수 있다.
상기에 기술된 바와 같이, 일부 구체예에서, 본 발명의 생체분자 서열화 시스템은 사전설치된 프로그램을 포함하는 것으로 기술된다. 그러나, 외부 메모리 또는 외부 기록 매체, 등에 저장된 프로그램은 실행을 위한 임의 시간에 판독되거나 인터넷을 통해 다운로딩될 수 있다. 또한, 이러한 프로그램은 컴퓨터 판독 가능한 기록 매체에 저장된 상태로 제공될 수 있다.
본 발명의 바람직한 실시예들이 본원에 도시되고 설명되지만, 이러한 실시예들이 단지 예로써 제공되는 것임이 당업자들에게는 명백할 것이다. 본 발명이 명세서 내에 제공되는 특정 예들로 제한되게 의도되는 것은 아니다. 본 발명은 앞서 언급된 명세서를 참조로 설명되었지만, 본원의 실시예들의 설명들 및 예시들이 제한적 의미로 해석되는 것을 의미하는 것 아니다. 다양한 변화들, 변경들, 및 치환들이 이제 본 발명을 벗어남 없이 당업자들에게서 이루어질 것이다. 또한, 본 발명의 모든 양상들은 다양한 조건들 및 변수들에 의존하는 본원에 설명된 특정한 묘사들, 구성들 또는 관련 부분들로 제한되지 않는다는 것이 이해될 것이다. 본원에 설명된 본 발명의 실시예들에 대한 다양한 대체들이 본 발명을 실행하는데 채용될 수 있음이 이해될 것이다. 따라서, 본 발명은 이러한 임의의 대안들, 변경들, 변화들 또는 등가물들을 또한 커버하는 것으로 고려된다. 하기의 청구항들이 본 발명의 범위를 정의하고 이들 청구항들 및 이들의 등가물들의 범위 내의 방법들 및 구조들이 이에 의해 커버되는 것으로 의도된다.
본 출원은 2014년 1월 24일에 출원된 일본 특허 출원번호 제2014-011430호를 우선권으로 주장하며, 이러한 문헌은 전체적으로 본원에 참고로 포함된다.
본 명세서에 언급된 모든 공개문, 특허, 및 특허출원은 본원에서 각 개별 공개문, 특허, 또는 특허출원이 참고로 포함되도록 상세하게 및 개별적으로 명시된 경우와 동일한 범위로 참고로 포함된다.
Claims (32)
- 나노-채널(nano-channel)을 통해 생체분자를 함유한 샘플을 이동시킬 수 있는 나노-채널;
나노-채널에서의 나노-갭 전극의 복수의 세트로서, 샘플에 함유된 생체분자가 나노-채널을 통해 그리고 나노-갭 전극의 복수의 세트 근위로 통과할 때 복수의 나노-갭 전극의 각 세트가 전류를 검출하도록 구성되며, 나노-갭 전극의 복수의 세트들 중 둘 이상의 세트가 나노-채널의 폭을 따라 상이한 전극간 거리를 갖는, 나노-갭 전극의 복수의 세트; 및
나노-채널을 통해 그리고 나노-채널에서 나노-갭 전극의 복수의 세트 근위로 생체분자를 이동시키기 위해 전계를 제공하는 전기영동 전극 세트를 포함하는, 생체분자 서열화 디바이스. - 제1항에 있어서, 나노-갭 전극의 복수의 세트 각각과 소통하는 측정 유닛으로서, 생체분자가 나노-갭 전극의 복수의 세트 근위로 통과할 때 발생된 전류를 측정하도록 구성된 측정 유닛; 및
측정 유닛과 소통하는 동정 유닛(identification unit)으로서, 생체분자 또는 이의 부분을 동정하도록 구성된 동정 유닛을 추가로 포함하는, 생체분자 서열화 디바이스. - 제2항에 있어서, 생체분자가 복수의 모노머를 포함하며, 동정 유닛이 하나 이상의 공지된 타입의 모노머의 기준 물리적 양 및 측정 유닛에 의해 측정된 전류로부터 얻어진 물리적 양을 기초로 하여 복수의 모노머를 동정하도록 구성된, 생체분자 서열화 디바이스.
- 제1항에 있어서, 나노-채널과 유체 소통하는 제1 유로 및 제2 유로를 형성시키도록 구성된 흐름 디렉터(flow director)를 추가로 포함하며, 흐름 디렉터가 샘플의 일부를 제1 유로에서 나노-채널로, 그리고 나머지 샘플을 제1 유로에서 제2 유로로 유도하는, 생체분자 서열화 디바이스.
- 제4항에 있어서, 흐름 디렉터가 나노-채널을 통한 샘플의 이동 방향을 따라 나노-갭 전극의 복수의 세트 쪽으로 연장하는 절연체인, 생체분자 서열화 디바이스.
- 제4항에 있어서, 생체분자를 선형화(linearization)시키는 것을 가능하게 하기 위해 제1 유로 및/또는 제2 유로에 하나 이상의 필러(pillar)를 추가로 포함하는, 생체분자 서열화 디바이스.
- 제6항에 있어서, 하나 이상의 필러가 복수의 필러를 포함하는, 생체분자 서열화 디바이스.
- 제4항에 있어서, 제1 유로, 제2 유로, 및 나노-채널이 실질적으로 동일한 평면에 존재하는, 생체분자 서열화 디바이스.
- 제1항에 있어서, 전류가 터널링 전류(tunneling current)를 포함하는, 생체분자 서열화 디바이스.
- 제1항에 있어서, 나노-갭 전극의 복수의 세트 중 제공된 세트가 두 개 이상의 전극을 갖는, 생체분자 서열화 디바이스.
- 제1항에 있어서, 전기영동 전극 세트가 두 개 이상의 전극을 갖는, 생체분자 서열화 디바이스.
- 제1항에 있어서, 나노-갭 전극의 복수의 세트 및 전기영동 전극 세트가 일체형 유닛(single-piece unit)으로서 통합되는, 생체분자 서열화 디바이스.
- 제12항에 있어서, 나노-갭 전극의 복수의 세트 중 제공된 세트의 전극들이 하나 이상의 고체 상태 절연체에 의해 전기영동 전극으로부터 분리되어 있는, 생체분자 서열화 디바이스.
- 제1항에 있어서, 나노-채널에 생체분자를 선형화시키기 위한 하나 이상의 필러를 추가로 포함하는, 생체분자 서열화 디바이스.
- 제14항에 있어서, 하나 이상의 필러가 복수의 필러를 포함하는, 생체분자 서열화 디바이스.
- 제1항 내지 제15항 중 어느 한 항에 있어서, 나노-채널이 나노-갭 전극의 복수의 세트 쪽으로 점점 가늘어지는, 생체분자 서열화 디바이스.
- 제1항에 있어서, 나노-갭 전극의 복수의 세트 중 제공된 세트가 생체분자의 분자 직경 이하인 전극간 거리를 갖는, 생체분자 서열화 디바이스.
- 나노-채널을 통해 생체분자를 함유한 샘플을 이동시키는 나노-채널;
나노-채널 중의 나노-갭 전극의 하나 이상의 세트로서, 나노-갭 전극의 세트가 샘플에 함유된 생체분자가 나노-채널을 통해 그리고 나노-갭 전극의 세트 근위로 통과할 때 전류를 검출하도록 구성되며, 나노-채널이 나노-갭 전극의 세트 쪽으로 점점 가늘어지며, 나노-갭 전극의 세트가 생체분자의 분자 직경 이하인 전극간 거리를 갖는 나노-채널 중의 나노-갭 전극의 하나 이상의 세트; 및
나노-채널을 통해 그리고 나노-채널 중의 나노-갭 전극의 세트 근위로 생체분자를 이동시키기 위해 전계를 제공하는 전기영동 전극 세트를 포함하는, 생체분자 서열화 디바이스. - 나노-채널을 통해 생체분자를 함유한 샘플을 이동시키는 나노-채널;
나노-채널 중의 나노-갭 전극의 하나 이상의 세트로서, 샘플에 함유된 생체분자가 나노-채널을 통해 그리고 나노-갭 전극의 세트 근위로 통과할 때 전류를 검출하도록 구성된 나노-갭 전극의 하나 이상의 세트;
나노-채널을 통해 그리고 나노-채널 중의 나노-갭 전극의 세트 근위로 생체분자를 이동시키기 위해 전계를 제공하는 전기영동 전극 세트; 및
나노-채널 중의 또는 근위의 하나 이상의 필러로서, 나노-갭 전극의 세트에 의한 전류 검출을 이용하여 생체분자의 개개의 서브유닛을 동정하기 위해 생체분자를 선형화하는 하나 이상의 필러를 포함하는, 생체분자 서열화 디바이스. - (a) 생체분자 서열화 디바이스의 나노-채널로 또는 이를 통해 흐르게 하기 위해 생체분자를 유도하는 단계로서, 생체분자 서열화 디바이스가 (i) 나노-채널 중의 나노-갭 전극의 복수의 세트로서, 샘플에 함유된 생체분자가 나노-채널을 통해 그리고 나노-갭 전극의 복수의 세트 근위로 통과할 때 전류를 검출하도록 구성되며, 나노-갭 전극의 복수의 세트들 중 둘 이상의 세트가 나노-채널의 폭을 따라 상이한 전극간 거리를 갖는 나노-갭 전극의 복수의 세트, 및 (ii) 나노-채널로 또는 이를 통해, 그리고 나노-채널 중의 나노-갭 전극의 복수의 세트 근위로 생체분자를 이동시키기 위해 전계를 제공하는 전기영동 전극 세트를 포함하는 단계;
(b) 나노-갭 전극의 복수의 세트로, 나노-채널을 통해 그리고 나노-갭 전극의 복수의 세트 근위로 생체분자가 흐르는 동안 발생되는 전류를 검출하는 단계; 및
(c) 생체분자 또는 이의 부분을 단계 (b)에서 검출된 전류로 서열화하는 단계를 포함하는, 생체분자를 서열화하는 방법. - 제20항에 있어서, 생체분자가 복수의 모노머를 포함하며, 서열화가 하나 이상의 공지된 타입의 모노머의 기준 물리적 양 및 단계 (b)에서 검출된 전류로부터 얻어진 물리적 양을 기초로 하여 복수의 모노머를 동정하는 것을 포함하는 방법.
- 제20항에 있어서, 생체분자 서열화 디바이스가 나노-채널과 유체 소통하는 제1 유로 및 제2 유로를 형성시키도록 구성된 흐름 디렉터를 추가로 포함하며, 단계 (a)가 샘플의 일부를 제1 유로에서 나노-채널로 그리고, 나머지 샘플을 제1 유로에서 제2 유로로 흐르게 하는 것을 포함하는 방법.
- 제22항에 있어서, 제1 유로 및/또는 제2 유로에 생체분자를 선형화시키는 것을 가능하게 하기 위한 하나 이상의 필러를 추가로 포함하는 방법.
- 제20항에 있어서, 전류가 터널링 전류를 포함하는 방법.
- 제20항에 있어서, 나노-채널에 생체분자를 선형화시키는 하나 이상의 필러를 추가로 포함하는 방법.
- 제20항에 있어서, 나노-채널이 나노-갭 전극의 복수의 세트 쪽으로 점점 가늘어지는 방법.
- 제20항에 있어서, 생체분자가 폴리뉴클레오티드 또는 폴리펩티드인 방법.
- (a) 생체분자 서열화 디바이스의 나노-채널로 또는 이를 통해 흐르게 하기 위해 생체분자를 유도하는 단계로서, 생체분자 서열화 디바이스가 (i) 나노-채널 중의 나노-갭 전극의 하나 이상의 세트로서, 나노-갭 채널의 세트가 샘플에 함유된 생체분자가 나노-채널을 통해 그리고 나노-갭 전극의 세트 근위로 통과할 때 전류를 검출하도록 구성되며, 나노-채널이 나노-갭 전극의 세트 쪽으로 점점 가늘어지며, 나노-갭 전극의 세트가 생체분자의 분자 직경 이하인 전극간 거리를 갖는 나노-갭 전극의 하나 이상의 세트, 및 (ii) 나노-채널로 또는 이를 통해, 그리고 나노-채널 중 나노-갭 전극의 세트 근위로 생체분자를 이동시키기 위해 전계를 제공하는 전기영동 전극 세트를 포함하는 단계;
(b) 나노-갭 전극의 세트로, 나노-채널을 통해 그리고 나노-갭 전극의 세트 근위로 생체분자가 흐르는 동안 발생되는 전류를 검출하는 단계; 및
(c) 생체분자 또는 이의 부분을 단계 (b)에서 검출된 전류로 서열화하는 단계를 포함하는, 생체분자를 서열화하는 방법. - (a) 생체분자 서열화 디바이스의 나노-채널로 또는 이를 통해 흐르게 하기 위해 생체분자를 유도하는 단계로서, 생체분자 서열화 디바이스가 (i) 나노-채널 중의 나노-갭 전극의 하나 이상의 세트로서, 나노-갭 전극의 세트가 샘플에 함유된 생체분자가 나노-채널을 통해 그리고 나노-갭 전극의 세트 근위로 통과할 때 전류를 검출하도록 구성된 나노-갭 전극의 하나 이상의 세트, (ii) 나노-채널로 또는 이를 통해, 그리고 나노-채널 중 나노-갭 전극의 세트 근위로 생체분자를 이동시키기 위해 전계를 제공하는 전기영동 전극 세트, 및 (iii) 나노-채널 중 또는 이의 근위에서의 하나 이상의 필러로서, 나노-갭 전극의 세트에 의한 전류 검출을 이용하여 생체분자의 개개 서브유닛을 동정하기 위해 생체분자를 선형화하는 하나 이상의 필러를 포함하는 단계;
(b) 나노-갭 전극의 세트로, 나노-채널을 통해 그리고 나노-갭 전극의 세트 근위로 생체분자가 흐르는 동안 발생되는 전류를 검출하는 단계; 및
(c) 생체분자 또는 이의 부분을 단계 (b)에서 검출된 전류로 서열화하는 단계를 포함하는, 생체분자를 서열화하는 방법. - 하나 이상의 컴퓨터 프로세서에 의한 실행 시에,
(a) 생체분자 서열화 디바이스의 나노-채널로 또는 이를 통해 흐르게 하기 위해 생체분자를 유도하는 단계로서, 생체분자 서열화 디바이스가 (i) 나노-채널 중의 나노-갭 전극의 복수의 세트로서, 복수의 나노-갭 전극의 각 세트가 샘플에 함유된 생체분자가 나노-채널을 통해 그리고 나노-갭 전극의 복수의 세트 근위로 통과할 때 전류를 검출하도록 구성되며, 나노-갭 전극의 복수의 세트들 중 둘 이상의 세트가 나노-채널의 폭을 따라 상이한 전극간 거리를 갖는 나노-갭 전극의 복수의 세트, 및 (ii) 나노-채널로 또는 이를 통해, 그리고 나노-채널 중 나노-갭 전극의 복수의 세트 근위로 생체분자를 이동시키기 위해 전계를 제공하는 전기영동 전극 세트를 포함하는 단계;
(b) 나노-갭 전극의 복수의 세트로, 나노-채널을 통해 그리고 나노-갭 전극의 복수의 세트 근위로 생체분자가 흐르는 동안 발생되는 전류를 검출하는 단계; 및
(c) 생체분자 또는 이의 부분을 단계 (b)에서 검출된 전류로 서열화하는 단계를 포함하는 생체분자를 서열화하는 방법을 수행하는, 기계 실행 코드를 포함하는 컴퓨터 판독 가능한 매체. - 하나 이상의 컴퓨터 프로세서에 의한 실행 시에,
(a) 생체분자 서열화 디바이스의 나노-채널로 또는 이를 통해 흐르게 하기 위해 생체분자를 유도하는 단계로서, 생체분자 서열화 디바이스가 (i) 나노-채널 중의 나노-갭 전극의 하나 이상의 세트로서, 나노-갭 전극의 세트가 샘플에 함유된 생체분자가 나노-채널을 통해 그리고 나노-갭 전극의 세트 근위로 통과할 때 전류를 검출하도록 구성되며, 나노-채널이 나노-갭 전극의 세트 쪽으로 점점 가늘어지며, 나노-갭 전극의 세트가 생체분자의 분자 직경 이하인 전극간 거리를 갖는 나노-갭 전극의 하나 이상의 세트, 및 (ii) 나노-채널로 또는 이를 통해, 그리고 나노-채널 중 나노-갭 전극의 세트 근위로 생체분자를 이동시키기 위해 전계를 제공하는 전기영동 전극 세트를 포함하는 단계;
(b) 나노-갭 전극의 세트로, 나노-채널을 통해 그리고 나노-갭 전극의 세트 근위로 생체분자가 흐르는 동안 발생되는 전류를 검출하는 단계; 및
(c) 생체분자 또는 이의 부분을 단계 (b)에서 검출된 전류로 서열화하는 단계를 포함하는 생체분자를 서열화하는 방법을 수행하는, 기계 실행 코드를 포함하는 컴퓨터 판독 가능한 매체. - 하나 이상의 컴퓨터 프로세서에 의한 실행 시에,
(a) 생체분자 서열화 디바이스의 나노-채널로 또는 이를 통해 흐르게 하기 위해 생체분자를 유도하는 단계로서, 생체분자 서열화 디바이스가 (i) 나노-채널 중의 나노-갭 전극의 하나 이상의 세트로서, 나노-갭 전극의 세트가 샘플에 함유된 생체분자가 나노-채널을 통해 그리고 나노-갭 전극의 세트 근위로 통과할 때 전류를 검출하도록 구성된 이상의 나노-갭 전극의 세트, (ii) 나노-채널로 또는 이를 통해, 그리고 나노-채널 중 나노-갭 전극의 세트 근위로 생체분자를 이동시키기 위해 전계를 제공하는 전기영동 전극 세트, 및 (iii) 나노-채널 중 또는 이의 근위에서의 하나 이상의 필러로서, 나노-갭 전극의 세트에 의한 전류 검출을 이용하여 생체분자의 개개 서브유닛을 동정하기 위해 생체분자를 선형화하는 하나 이상의 필러를 포함하는 단계;
(b) 나노-갭 전극의 세트로, 나노-채널을 통해 그리고 나노-갭 전극의 세트 근위로 생체분자가 흐르는 동안 발생되는 전류를 검출하는 단계; 및
(c) 생체분자 또는 이의 부분을 단계 (b)에서 검출된 전류로 서열화하는 단계를 포함하는 생체분자를 서열화하는 방법을 수행하는, 기계 실행 코드를 포함하는 컴퓨터 판독 가능한 매체.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JPJP-P-2014-011430 | 2014-01-24 | ||
| JP2014011430 | 2014-01-24 | ||
| PCT/JP2015/052601 WO2015111760A1 (en) | 2014-01-24 | 2015-01-23 | Devices, systems and methods for sequencing biomolecules |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20160130380A true KR20160130380A (ko) | 2016-11-11 |
Family
ID=52469259
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020167023002A KR20160130380A (ko) | 2014-01-24 | 2015-01-23 | 생체분자를 서열화하기 위한 디바이스, 시스템 및 방법 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US20160377591A1 (ko) |
| EP (1) | EP3097412A1 (ko) |
| JP (1) | JP6636455B2 (ko) |
| KR (1) | KR20160130380A (ko) |
| CN (1) | CN106414767A (ko) |
| WO (1) | WO2015111760A1 (ko) |
Families Citing this family (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2011108540A1 (ja) | 2010-03-03 | 2011-09-09 | 国立大学法人大阪大学 | ヌクレオチドを識別する方法および装置、ならびにポリヌクレオチドのヌクレオチド配列を決定する方法および装置 |
| EP3578987A1 (en) | 2013-09-18 | 2019-12-11 | Quantum Biosystems Inc. | Biomolecule sequencing devices, systems and methods |
| JP2015077652A (ja) | 2013-10-16 | 2015-04-23 | クオンタムバイオシステムズ株式会社 | ナノギャップ電極およびその製造方法 |
| US10438811B1 (en) | 2014-04-15 | 2019-10-08 | Quantum Biosystems Inc. | Methods for forming nano-gap electrodes for use in nanosensors |
| JP2018533935A (ja) * | 2015-10-08 | 2018-11-22 | クオンタムバイオシステムズ株式会社 | 核酸配列決定の装置、システム、及び方法 |
| WO2018025887A1 (en) * | 2016-08-02 | 2018-02-08 | Quantum Biosystems Inc. | Devices and methods for creation and calibration of a nanoelectrode pair |
| AU2018269362B2 (en) * | 2017-05-16 | 2023-07-27 | University Of Chicago | System and method for en masse patterning of molecule structures |
| WO2019000158A1 (zh) * | 2017-06-26 | 2019-01-03 | 武汉科技大学 | 一种基于隧道识别技术的纳米检测装置及方法 |
| EP3688464A2 (en) | 2017-09-29 | 2020-08-05 | Palogen, Inc. | Nanopore device and method of manufacturing same |
| US11740226B2 (en) | 2017-10-13 | 2023-08-29 | Analog Devices International Unlimited Company | Designs and fabrication of nanogap sensors |
| JP2021038923A (ja) * | 2017-11-02 | 2021-03-11 | 株式会社Screenホールディングス | 基板 |
| WO2019133998A1 (en) | 2017-12-31 | 2019-07-04 | Biothlon, Inc. | Nanopore device and methods of electrical array addressing and sensing |
| WO2020095844A1 (ja) * | 2018-11-06 | 2020-05-14 | 株式会社Screenホールディングス | 電極基板 |
| US11779918B2 (en) | 2019-12-05 | 2023-10-10 | International Business Machines Corporation | 3D nanochannel interleaved devices |
| CN113390940B (zh) * | 2021-06-03 | 2022-10-21 | 浙江大学 | 一种集成纳米孔的分子隧穿检测装置 |
Family Cites Families (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6762059B2 (en) * | 1999-08-13 | 2004-07-13 | U.S. Genomics, Inc. | Methods and apparatuses for characterization of single polymers |
| AU6771100A (en) * | 1999-08-13 | 2001-03-13 | U.S. Genomics, Inc. | Methods and apparatuses for stretching polymers |
| WO2001063273A2 (en) * | 2000-02-22 | 2001-08-30 | California Institute Of Technology | Development of a gel-free molecular sieve based on self-assembled nano-arrays |
| US8232582B2 (en) * | 2000-04-24 | 2012-07-31 | Life Technologies Corporation | Ultra-fast nucleic acid sequencing device and a method for making and using the same |
| CN103203256B (zh) * | 2006-07-19 | 2015-09-23 | 博纳基因技术有限公司 | 纳米口装置阵列:它们的制备以及在大分子分析中的应用 |
| US8969090B2 (en) * | 2010-01-04 | 2015-03-03 | Life Technologies Corporation | DNA sequencing methods and detectors and systems for carrying out the same |
| US8986524B2 (en) * | 2011-01-28 | 2015-03-24 | International Business Machines Corporation | DNA sequence using multiple metal layer structure with different organic coatings forming different transient bondings to DNA |
| WO2012120387A1 (en) * | 2011-03-09 | 2012-09-13 | Abionic Sa | Rapid quantification of biomolecules in a selectively functionalized nanofluidic biosensor and method thereof |
| JP2013090576A (ja) * | 2011-10-24 | 2013-05-16 | Hitachi Ltd | 核酸分析デバイス及びそれを用いた核酸分析装置 |
-
2015
- 2015-01-23 KR KR1020167023002A patent/KR20160130380A/ko not_active Application Discontinuation
- 2015-01-23 EP EP15704104.7A patent/EP3097412A1/en not_active Withdrawn
- 2015-01-23 CN CN201580011297.4A patent/CN106414767A/zh active Pending
- 2015-01-23 WO PCT/JP2015/052601 patent/WO2015111760A1/en active Application Filing
- 2015-01-23 JP JP2016565939A patent/JP6636455B2/ja active Active
-
2016
- 2016-07-22 US US15/217,821 patent/US20160377591A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| WO2015111760A1 (en) | 2015-07-30 |
| CN106414767A (zh) | 2017-02-15 |
| US20160377591A1 (en) | 2016-12-29 |
| JP2017509899A (ja) | 2017-04-06 |
| EP3097412A1 (en) | 2016-11-30 |
| JP6636455B2 (ja) | 2020-01-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20160130380A (ko) | 생체분자를 서열화하기 위한 디바이스, 시스템 및 방법 | |
| US10557167B2 (en) | Biomolecule sequencing devices, systems and methods | |
| US10413903B2 (en) | Devices, systems and methods for linearization of polymers | |
| US20190071720A1 (en) | Devices, systems and methods for nucleic acid sequencing | |
| US8003319B2 (en) | Systems and methods for controlling position of charged polymer inside nanopore | |
| Talaga et al. | Single-molecule protein unfolding in solid state nanopores | |
| JP2019164142A (ja) | ナノギャップ電極およびその製造方法 | |
| Lathrop et al. | Monitoring the escape of DNA from a nanopore using an alternating current signal | |
| Hoogerheide et al. | Pressure–voltage trap for DNA near a solid-state nanopore | |
| JP2019525766A (ja) | ナノ電極対の作製及び較正のためのデバイス及び方法 | |
| Jin et al. | Structural destabilization of DNA duplexes containing single-base lesions investigated by nanopore measurements | |
| US20170306396A1 (en) | Electrodes for biomolecular sequencing device, and biomolecular sequencing device, method, and program | |
| WO2017087908A1 (en) | Nanochannel devices and methods for analysis of molecules | |
| Taniguchi | Single-molecule analysis methods using nanogap electrodes and their application to DNA sequencing technologies | |
| Cao et al. | Enhanced resolution of low molecular weight poly (ethylene glycol) in nanopore analysis | |
| Al Sulaiman et al. | Length-dependent, single-molecule analysis of short double-stranded DNA fragments through hydrogel-filled nanopores: A potential tool for size profiling cell-free DNA | |
| Lin et al. | Selective Capture and Manipulation of DNA through Double Charged Nanopores | |
| Hu et al. | Identifying Oligomers and Lipid Vesicles Effects during α-Synuclein Fibril Formation through a Solid-State Nanopore |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |