KR20150141972A - 지방 감소를 위한 비마토프로스트, 비마토프로스트 유사체, 프로스타미드 및 프로스타글란딘의 서방출 - Google Patents
지방 감소를 위한 비마토프로스트, 비마토프로스트 유사체, 프로스타미드 및 프로스타글란딘의 서방출 Download PDFInfo
- Publication number
- KR20150141972A KR20150141972A KR1020157029970A KR20157029970A KR20150141972A KR 20150141972 A KR20150141972 A KR 20150141972A KR 1020157029970 A KR1020157029970 A KR 1020157029970A KR 20157029970 A KR20157029970 A KR 20157029970A KR 20150141972 A KR20150141972 A KR 20150141972A
- Authority
- KR
- South Korea
- Prior art keywords
- composition
- fat
- sustained
- bimatoprost
- release
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/557—Eicosanoids, e.g. leukotrienes or prostaglandins
- A61K31/5575—Eicosanoids, e.g. leukotrienes or prostaglandins having a cyclopentane, e.g. prostaglandin E2, prostaglandin F2-alpha
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/16—Amides, e.g. hydroxamic acids
- A61K31/165—Amides, e.g. hydroxamic acids having aromatic rings, e.g. colchicine, atenolol, progabide
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/38—Heterocyclic compounds having sulfur as a ring hetero atom
- A61K31/381—Heterocyclic compounds having sulfur as a ring hetero atom having five-membered rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/557—Eicosanoids, e.g. leukotrienes or prostaglandins
- A61K31/559—Eicosanoids, e.g. leukotrienes or prostaglandins having heterocyclic rings containing hetero atoms other than oxygen
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/10—Alcohols; Phenols; Salts thereof, e.g. glycerol; Polyethylene glycols [PEG]; Poloxamers; PEG/POE alkyl ethers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/32—Macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. carbomers, poly(meth)acrylates, or polyvinyl pyrrolidone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/34—Macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyesters, polyamino acids, polysiloxanes, polyphosphazines, copolymers of polyalkylene glycol or poloxamers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/36—Polysaccharides; Derivatives thereof, e.g. gums, starch, alginate, dextrin, hyaluronic acid, chitosan, inulin, agar or pectin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
- A61K9/0024—Solid, semi-solid or solidifying implants, which are implanted or injected in body tissue
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0048—Eye, e.g. artificial tears
- A61K9/0051—Ocular inserts, ocular implants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/06—Ointments; Bases therefor; Other semi-solid forms, e.g. creams, sticks, gels
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1629—Organic macromolecular compounds
- A61K9/1641—Organic macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyethylene glycol, poloxamers
- A61K9/1647—Polyesters, e.g. poly(lactide-co-glycolide)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1629—Organic macromolecular compounds
- A61K9/1652—Polysaccharides, e.g. alginate, cellulose derivatives; Cyclodextrin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/19—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles lyophilised, i.e. freeze-dried, solutions or dispersions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/08—Solutions
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Inorganic Chemistry (AREA)
- Dermatology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Neurosurgery (AREA)
- Biomedical Technology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Ophthalmology & Optometry (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Diabetes (AREA)
- Child & Adolescent Psychology (AREA)
- Hematology (AREA)
- Obesity (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicinal Preparation (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Materials For Medical Uses (AREA)
Abstract
본 발명은 국소 지방 감소를 야기시키는 화합물의 서방출을 위한 지방 침착물에 주사하기 위한 조성물 및 방법에 관한 것이다.
Description
관련 출원에 대한 상호 참조
본 출원은 2013년 4월 12일에 출원된 미국 가특허출원 일련 번호 제61/811,682호의 이익을 청구하며, 이러한 문헌의 전체 개시내용은 본원에 참고로 편입된다.
발명의 요약
본 발명은 국소 지방 감소를 포함하는 지방 감소의 목적을 위한 주사가능한 및 이식가능한 데포(depot)로부터의 비마토프로스트(bimatoprost), 비마토프로스트 유사체, 비마토프로스트 전구약물, 프로스타미드, 프로스타글란딘, 프로스타글란딘 유사체 및 프로스타글란딘 유도체의 서방출을 위한 조성물 및 방법에 관한 것이다.
국소 비마토프로스트(topical bimatoprost)는 국소 투여 후 동물 모델에서 지방세포 형성 및 성숙을 효과적으로 방지하고 지방세포(adipocyte)를 위축시키는 것으로 나타났다. 또한, 비마토프로스트의 국소 투여 후 지방 감소의 임상적 증거는 보고되었다. 본 발명은 국소 지방 감소를 위한 비마토프로스트, 비마토프로스트 유사체, 비마토프로스트 전구약물, 프로스타미드, 프로스타글란딘, 프로스타글란딘 유사체 및 유도체 및 프로스타글란딘 유사체, 예컨대 라타노프로스트(latanoprost) 및 트라보프로스트(travoprost)의 서방출 방법 및 제형에 관한 것이다.
도면의 간단한 설명
도 1은 주사가능한 PLGA 임플란트로의 비마토프로스트의 시험관내 방출 프로파일을 도시한 것이다.
도 2는 주사가능한 SynBiosys 임플란트로의 비마토프로스트의 시험관내 방출 프로파일을 도시한 것이다.
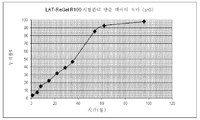
도 3a 및 3b는 100일 ReGel 100 또는 ReGel B 방출 데이타를 도시한 것이다.
도 4a 내지 4c는 ReGel 100 또는 ReGel B 전달 시스템의 라타노프로스트 방출 데이타의 비교를 도시한 것이다.
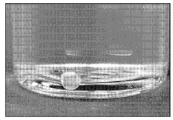
도 5는 각 다리에서 MGL 및 MGM 근육 그룹을 나타내기 위한 비복근 근육(gastrocnemius muscle)을 통해 세로로 배향된 주사하고 40분 후의 2-D MR 이미지를 도시한 것이다. 우측 다리에는 HA/알부민-가돌리늄이 주사되었으며, 왼쪽 다리에는 알부민-가돌리늄이 단독으로 주사되었다.
도 6a는 20% 비마토프로스트, 45% R203s, 20% RG752s, 10% R202H, 5% PEG-3350의 제형에서 비마토프로스트의 방출 속도를 도시한 것이다.
도 6b는 도 6b의 하부에 도시된 제형에서 비마토프로스트의 방출 속도를 도시한 것이다.
도 6c는 표 I의 제형의 화합물 #1의 방출 속도를 도시한 것이다.
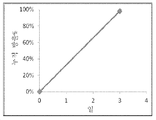
도 7a는 국소 지방 감소를 위한 비마토프로스트의 서방출을 위해 사용될 수 있는 비마토프로스트 미소구체를 도시한 것이다.
도 7b는 라타노프로스트 미소구체로부터의 비마토프로스트의 방출 속도를 도시한 것이다.
도 8a 및 8b는 디에틸 글리콜 디벤조에이트(gel)에서 10% 비마토프로스트를 도시한 것이다.
도 8c는 디에틸 글리콜 디벤조에이트 데포(gel)에서 10% 비마토프로스트로부터의 비마토프로스트 방출의 일 예를 도시한 것이다.
본 발명의 일부 구현예는 하기 단락에 포함된다:
1) 비마토프로스트, 비마토프로스트 유사체, 비마토프로스트 전구약물, 프로스타미드, 프로스타글란딘, 프로스타글란딘 유사체, 라타노프로스트 및 트라보프로스트 및 프로스타글란딘 유도체 및 이들의 혼합물로 이루어진 군으로부터 선택된 화합물의 서방출 제형을 지방 침착물(fat deposit)에 주사하는 것을 포함하는 지방을 감소시키는 방법.
2) 단락 1에 있어서, 상기 화합물이 비마토프로스트, 라타노프로스트, 트라보프로스트 및 화합물 # 1 및 이들의 혼합물로 이루어진 군으로부터 선택되는 방법.
3) 단락 1에 있어서, 상기 서방출 제형이 주사가능한 데포, 겔 현탁액, ReGel 전달 시스템, 히알루론산 방출 플랫폼(hyaluronic acid release platform), 임플란트, 미소구체, 거대구체(macrosphere) 및 주사가능한 용매로 이루어진 군으로부터 선택되는 방법.
4) 단락 2 또는 3에 있어서, 상기 화합물이 비마토프로스트인 방법.
5) 단락 1 내지 4에 있어서, 상기 서방출 제형이 지방 침착물에 직접적으로 주사되는 방법.
6) 단락 1에 있어서, 상기 지방 감소가 주사 부위에서 그리고 주사 부위 둘레에서의 국소 지방 감소인 방법.
7) 단락 1 또는 3에 있어서, 상기 서방출 제형이 약 20% 비마토프로스트, 약 45% R203s, 약 20% RG752s, 약 10% R202H 및 약 5% PEG-3350의 제형을 갖는 임플란트인 방법.
8) 단락 1 또는 3에 있어서, 상기 방법이 갈색 및 백색 지방세포 둘 모두의 위축증을 초래하고 국소 지방 감소를 초래하는 방법.
9) 단락 7에 있어서, 상기 임플란트가 100일 이상의 기간 동안 지방 침착물에서 비마토프로스트를 방출시키는 방법.
10) 단락 1에 있어서, 상기 서방출 제형이 서방출 제형의 위치가 아닌 신체에서의 위치 또는 도달하기 어려운 구역에 지방 침착물을 타겟화하기 위해 화합물을 전신으로 방출시키는 방법.
11) 단락 1 또는 10에 있어서, 상기 서방출 제형이 비-제한적인 예로서 복부 지방 침착물, 내장 지방 침착물, 심외막 지방 침착물, 피하 지방 침착물 및 이소성 지방 침착물의 감소를 가능하게 하는 위치에서 주사되거나 이식되는 방법.
12) 국소 지방 감소에서 사용하기 위한 조성물로서, 상기 조성물이 주사가능한 데포, 겔 현탁액, ReGel 전달 시스템, 히알루론산 기반 플랫폼, 임플란트, 미소구체, 거대구체 및 주사가능한 용매로 이루어진 군으로부터 선택된 서방출 조성물인 조성물.
13) 단락 12에 있어서, 상기 조성물이 비마토프로스트, 비마토프로스트 유사체, 비마토프로스트 전구약물, 프로스타미드, 프로스타글란딘, 프로스타글란딘 유사체, 라타노프로스트 및 트라보프로스트 및 프로스타글란딘 유도체로 이루어진 군으로부터 선택된 화합물을 추가로 포함하는 조성물.
14) 단락 12 및 13에 있어서, 상기 서방출 조성물이 Regel 전달 시스템이며, 상기 화합물이 비마토프로스트인 조성물.
15) 단락 14에 있어서, 상기 조성물이 국소 지방 침착물에 주사되는 조성물.
16) 단락 15에 있어서, 상기 조성물이 단일 국소 지방 침착물에 다중 주사 부위로 주사되는 조성물.
17) 단락 15에 있어서, 상기 조성물이 100일 이상의 기간 동안에 국소 지방 침착물에 비마토프로스트를 방출시키는 조성물.
18) 단락 12 또는 13에 있어서, 상기 서방출 제형이 약 20% 비마토프로스트, 약 45% R203s, 약 20% RG752s, 약 10% R202H 및 약 5% PEG-3350으로 이루어진 임플란트인 조성물.
19) 단락 18에 있어서, 상기 조성물이 복부 지방 침착물, 내장 지방 침착물, 심외막 지방 침착물, 피하 지방 침착물 및 이소성 지방 침착물로 이루어진 군으로부터 선택된 적어도 하나에 주사되는 조성물.
20) 단락 18에 있어서, 조성물의 주사가 국소 지방 침착물에서의 지방세포의 위축증 및 국소 지방의 감소를 초래하는 조성물.
21) 단락 12 또는 13에 있어서, 상기 서방출 제형이 폴리(d,l-락타이드-co-글리콜라이드), 폴리 (d,l-락타이드), 폴리(카프로락톤), 폴리(디옥사논), 폴리(에틸렌 글리콜), 폴리(오르토-에스테르), 폴리에스테르, 폴리(포스파진), 폴리 (포스페이트 에스테르), 폴리카프로락톤, 실리콘, 천연 폴리머, 예컨대 라텍스, 젤라틴 또는 콜라겐, 또는 폴리머 블렌드로 이루어진 군으로부터 선택된 적어도 하나의 폴리머로 이루어진 임플란트이며, 상기 화합물이 비마토프로스트, 라타노프로스트, 트라보프로스트 및 이들의 혼합물로 이루어진 군으로부터 선택되는 조성물.
22) 단락 12 또는 13에 있어서, 상기 서방출 제형이 나트륨 히알루로네이트, 가교결합된 히알루론산, 콘드로이틴 설페이트, 셀룰로오스 물질, 젤라틴, 콜라겐, 글리코사미노글리칸, 또는 다른 합성 또는 천연 발생 다당류로 이루어진 군으로부터 선택된 적어도 하나의 화합물로 이루어진 겔 현탁액이며, 상기 화합물이 비마토프로스트, 라타노프로스트, 트라보프로스트 및 이들의 혼합물로 이루어진 군으로부터 선택되는 조성물.
23) 단락 22에 있어서, 상기 겔 현탁액이 열적 겔화 전달 시스템인 조성물.
24) 단락 22에 있어서, 상기 열적 겔화 시스템이 A-B-A 또는 B-A-B 트리블록 공중합체 또는 B-A 블록 공중합체의 용액으로 이루어진 조성물.
25) 단락 12 또는 13에 있어서, 상기 서방출 제형이 DMSO, NMP 및 DMAC 또는 이들의 혼합물로 이루어진 군으로부터 선택된 생체적합성 용매를 갖는 주사가능한 데포인 조성물.
발명의 상세한 설명
비마토프로스트 및 다른 화합물은 겔에, 생분해성 고체 임플란트에, 또는 생체적합성 용매 함유 용매화된 폴리머에 용해되거나 분산될 수 있는데, 이는 주사 시에 고체 데포(solid depot)를 형성할 수 있다. 추가적으로, 비마토프로스트의 열적 겔화 전달 시스템이 또한 이용될 수 있다. 서방출을 위한 고체 임플란트는 폴리(d,l-락타이드-co-글리콜라이드), 폴리(d,l-락타이드), 폴리(카프로락톤), 폴리(디옥사논), 폴리(에틸렌 글리콜), 폴리(오르토-에스테르), 폴리에스테르, 폴리(포스파진), 폴리(포스페이트 에스테르), 폴리카프로락톤, 실리콘, 천연 폴리머, 예컨대 라텍스, 젤라틴 또는 콜라겐, 또는 폴리머 블렌드로 이루어질 수 있다. 겔 현탁액은 나트륨 히알루로네이트, 가교된 히알루론산, 콘드로이틴 설페이트, 셀룰로오스 물질, 젤라틴, 콜라겐, 글리코사미노글리칸, 또는 다른 합성 또는 천연 발생 다당류를 함유할 수 있다. 데포를 인시튜로 형성하는 주사용 생체적합성 용매는 DMSO (디메틸 설폭사이드), NMP (N-메틸피롤리돈), DMAC (디메틸아세트아미드), 또는 주사용 다른 비-수성 용매를 포함한다.
비마토프로스트 전달 시스템 및 다른 화합물을 위한 전달 시스템은 임플란트 또는 주사가능한 데포의 주사 또는 이식을 통해 지방 조직의 감소를 위해 투여될 수 있다. 그와 같은 전달 시스템은 국소 지방 조직, 예를 들어 피하 지방의 감소를 위해 및/또는 임플란트 또는 주사의 국소 투여에 의해 쉽게 도달되지 않는 내장 지방 및 다른 지방 패드 침착, 예컨대 심장주위 지방 침착의 감소를 달성하기 위한 지속된 전신 전달을 위한 방법으로서 사용될 수 있다. 비마토프로스트는 저 용융 화합물이며, 다중 전달 플랫폼으로부터의 이의 방출을 지속시키는 능력은 놀라운 것이다. 특정 전달 플랫폼은 비제한적으로 주사가능한 비마토프로스트 전달 데포, 인시튜 형성 비마토프로스트 데포, 히알루론산 데포, 고체 형태 비마토프로스트 임플란트, 비마토프로스트 미소구체 및 주사가능한 용매 데포를 포함한다.
본 발명의 전달 시스템은 피하 지방 침착물 및 지방 조직, 예컨대 복부 지방, 내장 지방, 심외막 지방, 턱밑 지방, 안와주위 지방 및 이소성 지방 패드의 감소를 달성하기 위해 소정 위치에 주사되거나 이식될 수 있다.
실시예
I
주사가능한
데포
(Injectable Depot)
PLGA 및 다중블록 폴리머는 데포 형성 시에 비마토프로스트를 방출시키는 것으로 나타났다. 폴리머 및 약물을 둘 모두에 대한 생체적합성 용매, 예컨대 N-메틸피롤리디논, 디-메틸 아세트아미드 또는 DMSO에 용해시켰다. 제형을 멸균을 위해 멸균 여과시키거나, 오토클레이브시키거나, 조사하였다.
용액을 멸균 바이알 또는 단위 용량 주사기에 충전하였다. 주사 후에, 생체적합성 용매는 데포로부터 확산하여, 단단한 프로스타미드 또는 프로스타글란딘 로딩된 임플란트가 남는다. 데포는 폴리머 바이오에로데스(polymer bioerodes)로서, 수 일, 수 주, 또는 수 개월 동안 비마토프로스트, 프로스타미드 또는 프로스타글란딘을 방출시킨다. 용액 중의 약물 적재량은 0.1% 내지 50% 범위일 수 있다. 용액 중의 폴리머 적재량은 15% 내지 50%의 범위일 수 있다. 부형제는 폴리(에틸렌 글리콜), 단쇄 지방산, 왁스, 콜레스테롤, 지방족 알코올, 보조용매, 또는 데포의 소수성을 조정하는 다른 화합물들을 포함할 수 있다.
PLGA 및 SynBiosys 비마토프로스트 둘 모두를 함유한 주사가능한 데포를 이용하여, 약물은 도 1 및 도 2에 도시된 바와 같이 적어도 1개월 동안 연속적으로 방출되었다. 약물 적재량, 폴리머 농도, 폴리머 특성, 제형 부형제, 또는 임플란트 제조를 위해 사용되는 DMSO 부피를 변화시킴으로써 방출 동력학을 추가로 최적화하는 것이 가능하다.
실시예
II
ReGel
전달 시스템
다양한 자극들에 응하여 상 전이를 일으키는 폴리머 시스템이 또한 사용될 수 있다. 이러한 상 전이는 시스템에서 유의미한 용적 및 또는 점도 변화를 야기시킨다. 시스템은 pH, 이온성 환경, 온도, 생물학적 촉발제(biologic trigger) 뿐만 아니라 다른 화학적 및 물리적 촉발제에 응할 수 있다. 시스템은 상-전이가 용적 또는 점도 증가를 초래하게 하기 위해 상호작용할 수 있는 하나 이상의 폴리머를 포함한다. 폴리머의 예는 폴리아크릴산 및 폴리에틸렌 옥사이드 공중합체를 포함한다. 시스템의 다른 성분들은 당업자에게 공지된 부형제들을 포함한다.
시스템은 국소 조직으로 치료학적 활성제의 조절된 및 서방출을 제공하는 추가 이점을 갖는다. 약물은 공유 결합, 수소 결합, 이온성 상호작용, 반 데르 발스력 또는 소수성 상호작용에 의해 물리적으로 갇히거나 화학적으로 결합될 수 있다. 약물의 방출은 전이된 겔에서 활성 화합물의 물리적 갇힘에 의해 조절될 수 있다. 화합물은 또한 상 전이 겔을 포함하는 폴리머에 물리적으로 또는 화학적으로 결합될 수 있다. 겔의 상 전이는 약물 전달을 위한 데포를 생성시키기 위해 제공된다.
본 발명의 구체적인 예는 A-B-A 또는 B-A-B 트리블록 공중합체 또는 B-A 블록 공중합체 (여기서, A = 폴리락타이드-co-글리콜라이드 (PLGA/ PLA) 및 B = 폴리에틸렌 옥사이드 (PEO) 및 라타노프로스트)의 용액으로 이루어진 열적 겔화 비마토프로스트 전달제 전달 시스템의 사용을 교시한다. 이들 폴리머는 Regel 인시튜(in situ) 겔화 전달 시스템을 구성한다. 이의 수용액은 온도가 증가함에 따라 졸-대-겔 전이 거동을 갖는 것으로 나타낸다. 약물 전달 적용을 위하여, 생리학적으로 관련된 온도(예를 들면, 37℃)에서의 겔화가 특히 중요하고, 의료 및 약물 전달 목적을 위한 시스템의 유용성의 근거를 형성한다.
구체적인 예에서, 라타노프로스트는 ReGel 100 또는 ReGel B에 3% 적재량으로, 즉 100 ㎕ 겔에서 3 mg 약물로 적재되었다. 시스템은 라타노프로스트의 파열 없이 열적 겔화 후 서방출을 나타내었다. 이것은 매우 놀랍게 라타노프로스트의 비교적 낮은 용융점 및 용해도를 제공한다. 즉, 느린 방출, 파열 없음을 제공한다. 겔은 도 3a 및 3b에 도시된 바와 같이 100일 보다 더욱 긴 시간 동안 잔류하였다. 추가의 변형은 다른 폴리머, 예를 들어 CMC, 아가로스 및 전분을 시스템에 첨가함으로써 이루어질 수 있다.
실시예
III
히알루론산
가교결합된 히알루론산은 주사 시에 국소화하여 잠재적 서방출 플랫폼을 제공하는 것으로 나타났다. 약물은 가교결합된 히알루론산에 도입되거나 서방출을 위해 비히클에 콘주게이션될 수 있다. 전자의 경우에, 플랫폼의 방출 및 침식은 겔의 다공성, 가교결합제의 길이 및 가교결합 밀도에 의해 조절될 수 있다. 대안적으로, 후자의 경우에, 비마토프로스트 또는 프로스타미드 유사체는 당해 분야에 공지된 몇 개의 링커(linker) 중 하나를 통해 히알루론 골격에 공유적으로 또는 이온적으로 결합될 수 있다. 마지막으로, 약물은 또 하나의 서방출 양식, 예컨대 미소구체에 도입되고, 이후에 히알루론산에 도입되고(가교결합되거나 비-가교결합된), 전달 플랫폼으로서 주사될 수 있다.
도 5는 각 다리에 MGL (3회우상 외측 비복근) 및 MGM (단우상 비복근 내측) 근육 그룹을 나타내기 위해 비복근 근육을 통해 세로로 배향된 주사하고 40분 후 2-D MR 이미지를 도시한 것이다. 우측 다리에 HA/알부민-가돌리늄을 주사하고, 좌측 다리에 알부민-가돌리늄을 단독으로 주사하였다. 좌측 다리는 MGL 근육 전반에 걸쳐 및 인접한 MGM 근육에 대한 크로스오버(crossover)로 알부민-가돌리늄(청색)의 확산 분포를 나타낸 것이다. 이러한 데이타는, 가교결합된 HA 데포가 국소화될 수 있고 지방 감소를 위한 프로스타글란딘 또는 프로스타미드의 국소 서방출을 위한 플랫폼을 제공하는 것으로 나타난다.
실시예
IV
임플란트
비마토프로스트는 피하로, 내장 지방에 또는 기관과 직접 동격으로 주사되거나 이식될 수 있는 임플란트에 제형화된다. 일 예는 하기 제형이다: 20% 비마토프로스트, 45% R203s, 20% RG752s, 10% R202H, 5% PEG-3350. 그리고, 도 6a는 이러한 제형으로부터 비마토프로스트의 방출 속도를 도시한 것이다(R203S는 에스테르 말단-캡핑된 PLA이며, R202H는 산 말단 그룹 PLA이며, RG752S는 에스테르 말단 기를 갖는 75:25 PLGA이며, PEG_3350은 3350의 분자량을 갖는 폴리에틸렌 글리콜이다). 다른 임플란트 제형 및 이의 방출 속도는 도 6b에 도시되어 있다.
지방 감소를 위해 유용할 수 있는 또 하나의 화합물 (화합물 #1)은 하기에 기술된다:
화합물 #1을 갖는 임플란트 제형 및 이의 특성은 하기 표 I에에 기술되어 있다:
실시예
V
미소구체
비마토프로스트 및 라타노프로스트는 또한, 라타노프로스트의 경우 도 7a 및 7b에 도시된 바와 같이 PLGA 미소구체 및 거대구체의 사용을 통해 지속될 수 있다. 라타노프로스트 미소구체는 하기 표에 기술된 바와 같이 PLA 및 PLGA 폴리머로부터 제조되었다. 미소구체는 0.8 ml 에틸 아세테이트에 20 mg의 라타노프로스트 및 100 mg 폴리머를 용해시킴으로써 제조되었다. 최소량의 디클로로메탄은 폴리머의 완벽한 용해를 위해 첨가될 수 있다. 이러한 용액은 균질기로 고전단, 3000 rpm에서 5분 동안 혼합하면서 마이크로-피펫을 통해 40 mL 1% 폴리비닐 알코올 수용액에 첨가된다.
전단 후에, 우유빛 백색 에멀젼이 형성되며, 이는 용매를 증발시키기 위하여 가스배출 후드(fume hood)에서 3 내지 5시간 동안 온화하게 교반된다. 이러한 분산물은 이후에 상청액을 제거하기 위해 2000 rpm에서 15분 동안 원심분리되며, 그 다음에 미소구체를 재구성하기 위해 10 mL 물이 첨가된다. 최종 재구성된 미소구체는 동결건조된다. 미소구체에서 등장성 포스페이트 완충된 염수로의 라타노프로스트의 방출은 도 7b에 도시된다.
실시예
VI
주사가능한
용매
다른 부형제, 예컨대 다른 것들 중에서 수크로오스 아세테이트 이소부티레이트, 에틸 벤조에이트, 벤질 벤조에이트, 트리프로피오닌, 디에틸 글리콜 디벤조에이트는 피하로 또는 지방으로 직접 주사를 위해 사용될 수 있다. 도 8a 및 8b는 디에틸 글리콜 디벤조에이트 중의 10% 비마토프로스트(겔)를 도시한 것이며, 도 8c는 디에틸 글리콜 디벤조에이트 중 10% 비마토프로스트(겔)로부터 비마토프로스트 방출의 예를 도시한 것이다.
Claims (20)
- 비마토프로스트(bimatoprost), 비마토프로스트 유사체, 비마토프로스트 전구약물, 프로스타미드(prostamide), 프로스타글란딘(prostaglandin), 프로스타글란딘 유사체, 라타노프로스트(latanoprost) 및 트라보프로스트(travoprost) 및 프로스타글란딘 유도체 및 이들의 혼합물로 이루어진 군으로부터 선택된 화합물의 서방출 제형을 지방 침착물(fat deposit)에 주사하는 것을 포함하는 지방을 감소시키는 방법.
- 제1항에 있어서, 상기 화합물이 비마토프로스트, 라타노프로스트, 트라보프로스트 및 화합물 # 1 및 이들의 혼합물로 이루어진 군으로부터 선택된 방법.
- 제1항에 있어서, 상기 서방출 제형이 주사가능한 데포(injectable depot), 겔 현탁액, ReGel 전달 시스템, 히알루론산 방출 플랫폼, 임플란트, 미소구체, 거대구체 및 주사가능한 용매로 이루어진 군으로부터 선택된 방법.
- 제3항에 있어서, 상기 화합물이 비마토프로스트인 방법.
- 제1항에 있어서, 상기 서방출 제형이 지방 침착물에 직접적으로 주사되는 방법.
- 제1항에 있어서, 상기 지방 감소가 주사 부위에서의 그리고 주사 부위 둘레에서의 국소 지방 감소인 방법.
- 제3항에 있어서, 상기 서방출 제형이 약 20% 비마토프로스트, 약 45% R203s, 약 20% RG752s, 약 10% R202H 및 약 5% PEG-3350의 제형을 갖는 임플란트인 방법.
- 제1항에 있어서, 상기 방법이 갈색 지방세포 및 백색 지방세포 둘 모두의 위축증(atrophy)을 초래하고 국소 지방 감소를 초래하는 방법.
- 제7항에 있어서, 상기 임플란트가 100일 이상의 기간 동안 지방 침착물에서 비마토프로스트를 방출시키는 방법.
- 제1항에 있어서, 상기 서방출 제형이 서방출 제형의 위치가 아닌 신체에서의 위치에서 지방 침착물을 타겟화하기 위해 화합물을 전신으로 방출시키는 방법.
- 제1항 또는 제10항에 있어서, 상기 서방출 제형이 복부 지방 침착물, 내장 지방 침착물, 심외막 지방 침착물, 피하 지방 침착물 및 이소성 지방 침착물의 감소를 가능하게 하는 위치에 주사되거나 이식되는 방법.
- 국소 지방 감소에서 사용하기 위한 조성물로서, 상기 조성물이 주사가능한 데포, 겔 현탁액, ReGel 전달 시스템, 히알루론산 기반 플랫폼, 임플란트, 미소구체, 거대구체 및 주사가능한 용매로 이루어진 군으로부터 선택된 서방출 조성물인 조성물.
- 제12항에 있어서, 상기 조성물이 비마토프로스트, 비마토프로스트 유사체, 비마토프로스트 전구약물, 프로스타미드, 프로스타글란딘, 프로스타글란딘 유사체, 라타노프로스트 및 트라보프로스트 및 프로스타글란딘 유도체로 이루어진 군으로부터 선택된 화합물을 추가로 포함하는 조성물.
- 제12항에 있어서, 상기 서방출 조성물이 Regel 전달 시스템 및 상기 화합물이 비마토프로스트인 조성물.
- 제14항에 있어서, 상기 조성물이 국소 지방 침착물에 주사되는 조성물.
- 제15항에 있어서, 상기 조성물이 단일 국소 지방 침착물에 다중 주사 부위로 주사되는 조성물.
- 제15항에 있어서, 상기 조성물이 100일 이상의 기간 동안 국소 지방 침착물에 비마토프로스트를 방출시키는 조성물.
- 제12항 또는 제13항에 있어서, 상기 서방출 제형이 약 20% 비마토프로스트, 약 45% R203s, 약 20% RG752s, 약 10% R202H 및 약 5% PEG-3350으로 이루어진 임플란트인 조성물.
- 제18항에 있어서, 상기 조성물이 복부 지방 침착물, 내장 지방 침착물, 심외막 지방 침착물, 피하 지방 침착물 및 이소성 지방 침착물로 이루어진 군으로부터 선택된 적어도 하나에 주사되는 조성물.
- 제18항에 있어서, 상기 조성물의 주사가 국소 지방 침착물에서의 지방세포의 위축증 및 국소 지방의 감소를 초래하는 조성물.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361811682P | 2013-04-12 | 2013-04-12 | |
| US61/811,682 | 2013-04-12 | ||
| PCT/US2014/033558 WO2014169075A1 (en) | 2013-04-12 | 2014-04-09 | Sustained release of bimatoprost, bimatoprost analogs, prostamides and prostaglandins for fat reduction |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20150141972A true KR20150141972A (ko) | 2015-12-21 |
Family
ID=51686960
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020157029970A KR20150141972A (ko) | 2013-04-12 | 2014-04-09 | 지방 감소를 위한 비마토프로스트, 비마토프로스트 유사체, 프로스타미드 및 프로스타글란딘의 서방출 |
Country Status (19)
| Country | Link |
|---|---|
| US (2) | US20140308354A1 (ko) |
| EP (2) | EP2983663B1 (ko) |
| JP (1) | JP2016520561A (ko) |
| KR (1) | KR20150141972A (ko) |
| CN (2) | CN105101962A (ko) |
| AU (2) | AU2014250937A1 (ko) |
| BR (1) | BR112015025915A8 (ko) |
| CA (1) | CA2908731A1 (ko) |
| CL (1) | CL2015003023A1 (ko) |
| DK (1) | DK2983663T3 (ko) |
| ES (1) | ES2785382T3 (ko) |
| HK (1) | HK1221406A1 (ko) |
| IL (1) | IL242006B (ko) |
| MX (1) | MX2015014320A (ko) |
| MY (1) | MY187802A (ko) |
| RU (1) | RU2015143859A (ko) |
| SG (2) | SG10201701938PA (ko) |
| WO (1) | WO2014169075A1 (ko) |
| ZA (1) | ZA201507217B (ko) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU2016254208B2 (en) * | 2015-04-30 | 2021-07-15 | Allergan, Inc. | Cosmetic method and therapeutic use for fat reduction |
| US11452703B2 (en) | 2020-05-21 | 2022-09-27 | Peregrine Ophthalmic PTE LTD. | Methods and compositions for reducing adipocyte numbers |
| CA3184991A1 (en) * | 2020-07-21 | 2022-01-27 | Alazar N. Ghebremeskel | Intraocular implant with high loading of a prostamide |
Family Cites Families (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2218424A (en) * | 1931-05-07 | 1940-10-15 | Teleregister Corp | Transmitter and code translator |
| US4525359A (en) * | 1982-12-10 | 1985-06-25 | Greenway Frank L Iii | Treatment for selective weight control |
| US6124344A (en) * | 1993-12-28 | 2000-09-26 | Allergan Sales, Inc. | Cyclopentane heptan(ene)oic acid, 2-heteroarylalkenyl derivatives as therapeutic agents |
| WO1996036599A1 (en) * | 1995-05-18 | 1996-11-21 | Allergan | Cyclopentane heptan(ene)oic acid, 2-heteroarylalkenyl derivatives as therapeutic agents for the treatment of ocular hypertension |
| WO2004037268A1 (en) | 2002-10-23 | 2004-05-06 | Sucampo Ag | Prostaglandin compounds for the treatment of obesity |
| WO2004050060A1 (ja) * | 2002-12-04 | 2004-06-17 | Santen Pharmaceutical Co., Ltd. | 結膜下デポによるドラッグデリバリーシステム |
| WO2005063205A2 (en) * | 2003-12-22 | 2005-07-14 | Aventis Pharmaceuticals Inc. | Injectable phosphatidylcholine preparations |
| US20080038316A1 (en) | 2004-10-01 | 2008-02-14 | Wong Vernon G | Conveniently implantable sustained release drug compositions |
| US7666912B2 (en) * | 2006-03-23 | 2010-02-23 | Massachusetts Eye And Ear Infirmary | Compositions and methods for reducing body fat |
| EP2077830B1 (en) * | 2006-10-17 | 2012-11-07 | Lithera, Inc. | Methods, compositions, and formulations for the treatment of thyroid eye disease |
| US8969415B2 (en) * | 2006-12-01 | 2015-03-03 | Allergan, Inc. | Intraocular drug delivery systems |
| US9095506B2 (en) * | 2008-11-17 | 2015-08-04 | Allergan, Inc. | Biodegradable alpha-2 agonist polymeric implants and therapeutic uses thereof |
| US20100247606A1 (en) * | 2009-03-25 | 2010-09-30 | Allergan, Inc. | Intraocular sustained release drug delivery systems and methods for treating ocular conditions |
| WO2011109384A2 (en) * | 2010-03-02 | 2011-09-09 | Allergan, Inc. | Biodegradable polymers for lowering intraocular pressure |
| EP2595604B1 (en) | 2010-07-21 | 2016-03-30 | Allergan, Inc. | Method of controlling initial drug release of sirna from sustained-release implants |
| TWI631961B (zh) * | 2013-03-15 | 2018-08-11 | 美商歐樂根公司 | 含有前列醯胺之眼內植入物 |
| AU2016254208B2 (en) | 2015-04-30 | 2021-07-15 | Allergan, Inc. | Cosmetic method and therapeutic use for fat reduction |
-
2014
- 2014-04-09 SG SG10201701938PA patent/SG10201701938PA/en unknown
- 2014-04-09 KR KR1020157029970A patent/KR20150141972A/ko not_active Application Discontinuation
- 2014-04-09 CN CN201480020790.8A patent/CN105101962A/zh active Pending
- 2014-04-09 US US14/248,898 patent/US20140308354A1/en not_active Abandoned
- 2014-04-09 AU AU2014250937A patent/AU2014250937A1/en not_active Abandoned
- 2014-04-09 SG SG10202109919P patent/SG10202109919PA/en unknown
- 2014-04-09 EP EP14725582.2A patent/EP2983663B1/en active Active
- 2014-04-09 CN CN201910977574.7A patent/CN110840899A/zh active Pending
- 2014-04-09 DK DK14725582.2T patent/DK2983663T3/da active
- 2014-04-09 WO PCT/US2014/033558 patent/WO2014169075A1/en active Application Filing
- 2014-04-09 CA CA2908731A patent/CA2908731A1/en not_active Abandoned
- 2014-04-09 JP JP2016507645A patent/JP2016520561A/ja active Pending
- 2014-04-09 ES ES14725582T patent/ES2785382T3/es active Active
- 2014-04-09 RU RU2015143859A patent/RU2015143859A/ru not_active Application Discontinuation
- 2014-04-09 MX MX2015014320A patent/MX2015014320A/es unknown
- 2014-04-09 EP EP20152147.3A patent/EP3656375A1/en not_active Withdrawn
- 2014-04-09 MY MYPI2015002531A patent/MY187802A/en unknown
- 2014-04-09 BR BR112015025915A patent/BR112015025915A8/pt active Search and Examination
-
2015
- 2015-09-29 ZA ZA2015/07217A patent/ZA201507217B/en unknown
- 2015-10-09 CL CL2015003023A patent/CL2015003023A1/es unknown
- 2015-10-11 IL IL242006A patent/IL242006B/en active IP Right Grant
-
2016
- 2016-04-21 US US15/134,792 patent/US10682361B2/en active Active
- 2016-08-11 HK HK16109568.5A patent/HK1221406A1/zh unknown
-
2019
- 2019-05-08 AU AU2019203214A patent/AU2019203214B2/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| ES2785382T3 (es) | 2020-10-06 |
| HK1221406A1 (zh) | 2017-06-02 |
| EP2983663A1 (en) | 2016-02-17 |
| BR112015025915A8 (pt) | 2020-01-14 |
| WO2014169075A1 (en) | 2014-10-16 |
| RU2015143859A3 (ko) | 2018-03-05 |
| DK2983663T3 (da) | 2020-04-20 |
| ZA201507217B (en) | 2017-09-27 |
| AU2019203214B2 (en) | 2020-10-29 |
| SG10201701938PA (en) | 2017-04-27 |
| CL2015003023A1 (es) | 2016-06-10 |
| AU2014250937A1 (en) | 2015-10-22 |
| US10682361B2 (en) | 2020-06-16 |
| EP2983663B1 (en) | 2020-01-22 |
| EP3656375A1 (en) | 2020-05-27 |
| US20160339039A1 (en) | 2016-11-24 |
| CN110840899A (zh) | 2020-02-28 |
| SG10202109919PA (en) | 2021-10-28 |
| BR112015025915A2 (pt) | 2017-07-25 |
| IL242006B (en) | 2020-04-30 |
| MY187802A (en) | 2021-10-26 |
| AU2019203214A1 (en) | 2019-05-30 |
| CA2908731A1 (en) | 2014-10-16 |
| NZ712804A (en) | 2021-02-26 |
| JP2016520561A (ja) | 2016-07-14 |
| CN105101962A (zh) | 2015-11-25 |
| US20140308354A1 (en) | 2014-10-16 |
| MX2015014320A (es) | 2015-12-08 |
| RU2015143859A (ru) | 2017-05-16 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Kempe et al. | In situ forming implants—an attractive formulation principle for parenteral depot formulations | |
| Yu et al. | Poly (lactic acid-co-glycolic acid)–poly (ethylene glycol)–poly (lactic acid-co-glycolic acid) thermogel as a novel submucosal cushion for endoscopic submucosal dissection | |
| Kim et al. | Stimuli-responsive injectable in situ-forming hydrogels for regenerative medicines | |
| US7767656B2 (en) | Blends of temperature sensitive and anionic polymers for drug delivery | |
| JP5248492B2 (ja) | 低分子量アルギネートを含むヒドロゲルおよびそれから製造されたバイオ構造物 | |
| JP2005538107A5 (ja) | 注入可能な多モードポリマーのデポ組成物及びその使用 | |
| AU2019203214B2 (en) | Sustained release of bimatoprost, bimatoprost analogs, prostamides and prostaglandins for fat reduction | |
| US20100226985A1 (en) | Viscoelastic aqueous gels comprising microspheres | |
| AU2016211457B2 (en) | Joint fat pad formulations, and methods of use thereof | |
| Zewail et al. | Synergistic and receptor-mediated targeting of arthritic joints via intra-articular injectable smart hydrogels containing leflunomide-loaded lipid nanocarriers | |
| KR20100017904A (ko) | 마이크로입자 중에 소마토스타틴 유도체를 포함하는 연장-방출 조성물 | |
| JP2016522169A (ja) | 生理活性薬剤の制御された送達のための組成物 | |
| JP2016520561A5 (ko) | ||
| P Venkatesh et al. | In situ gels based drug delivery systems | |
| EP3986491B1 (en) | Crosslinkable hydrogel compositions | |
| US10293051B2 (en) | FGF-18 formulation in xyloglucan gels | |
| NZ712804B2 (en) | Sustained release of bimatoprost, bimatoprost analogs, prostamides and prostaglandins for fat reduction | |
| KR20230022737A (ko) | 주사용 사전-제형 및 이를 이용한 도네페질 초기방출 억제형 키트 | |
| CA3237526A1 (en) | Solid forms of resiquimod and formulations thereof |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |