KR20150099779A - 기체 생성 미생물 콜로니를 검출하는 방법 - Google Patents
기체 생성 미생물 콜로니를 검출하는 방법 Download PDFInfo
- Publication number
- KR20150099779A KR20150099779A KR1020157018847A KR20157018847A KR20150099779A KR 20150099779 A KR20150099779 A KR 20150099779A KR 1020157018847 A KR1020157018847 A KR 1020157018847A KR 20157018847 A KR20157018847 A KR 20157018847A KR 20150099779 A KR20150099779 A KR 20150099779A
- Authority
- KR
- South Korea
- Prior art keywords
- image
- bubbles
- culture apparatus
- bubble
- region
- Prior art date
Links
Images
Classifications
-
- G06K9/00134—
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06V—IMAGE OR VIDEO RECOGNITION OR UNDERSTANDING
- G06V20/00—Scenes; Scene-specific elements
- G06V20/60—Type of objects
- G06V20/69—Microscopic objects, e.g. biological cells or cellular parts
- G06V20/698—Matching; Classification
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06V—IMAGE OR VIDEO RECOGNITION OR UNDERSTANDING
- G06V20/00—Scenes; Scene-specific elements
- G06V20/60—Type of objects
- G06V20/69—Microscopic objects, e.g. biological cells or cellular parts
- G06V20/693—Acquisition
-
- G06K9/0014—
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06T—IMAGE DATA PROCESSING OR GENERATION, IN GENERAL
- G06T7/00—Image analysis
- G06T7/10—Segmentation; Edge detection
- G06T7/149—Segmentation; Edge detection involving deformable models, e.g. active contour models
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06T—IMAGE DATA PROCESSING OR GENERATION, IN GENERAL
- G06T7/00—Image analysis
- G06T7/60—Analysis of geometric attributes
- G06T7/62—Analysis of geometric attributes of area, perimeter, diameter or volume
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06T—IMAGE DATA PROCESSING OR GENERATION, IN GENERAL
- G06T7/00—Image analysis
- G06T7/70—Determining position or orientation of objects or cameras
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06V—IMAGE OR VIDEO RECOGNITION OR UNDERSTANDING
- G06V20/00—Scenes; Scene-specific elements
- G06V20/60—Type of objects
- G06V20/69—Microscopic objects, e.g. biological cells or cellular parts
- G06V20/695—Preprocessing, e.g. image segmentation
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06T—IMAGE DATA PROCESSING OR GENERATION, IN GENERAL
- G06T2207/00—Indexing scheme for image analysis or image enhancement
- G06T2207/10—Image acquisition modality
- G06T2207/10016—Video; Image sequence
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06T—IMAGE DATA PROCESSING OR GENERATION, IN GENERAL
- G06T2207/00—Indexing scheme for image analysis or image enhancement
- G06T2207/10—Image acquisition modality
- G06T2207/10056—Microscopic image
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06T—IMAGE DATA PROCESSING OR GENERATION, IN GENERAL
- G06T2207/00—Indexing scheme for image analysis or image enhancement
- G06T2207/10—Image acquisition modality
- G06T2207/10141—Special mode during image acquisition
- G06T2207/10152—Varying illumination
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06T—IMAGE DATA PROCESSING OR GENERATION, IN GENERAL
- G06T2207/00—Indexing scheme for image analysis or image enhancement
- G06T2207/20—Special algorithmic details
- G06T2207/20112—Image segmentation details
- G06T2207/20124—Active shape model [ASM]
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06T—IMAGE DATA PROCESSING OR GENERATION, IN GENERAL
- G06T2207/00—Indexing scheme for image analysis or image enhancement
- G06T2207/30—Subject of image; Context of image processing
- G06T2207/30242—Counting objects in image
Landscapes
- Engineering & Computer Science (AREA)
- Physics & Mathematics (AREA)
- Theoretical Computer Science (AREA)
- General Physics & Mathematics (AREA)
- Computer Vision & Pattern Recognition (AREA)
- Life Sciences & Earth Sciences (AREA)
- Health & Medical Sciences (AREA)
- Biomedical Technology (AREA)
- General Health & Medical Sciences (AREA)
- Molecular Biology (AREA)
- Multimedia (AREA)
- Geometry (AREA)
- Software Systems (AREA)
- Apparatus Associated With Microorganisms And Enzymes (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Investigating Or Analysing Materials By Optical Means (AREA)
- Image Input (AREA)
Abstract
제1 방법은 이미징 장치를 사용하여 배양 장치의 복수의 이미지를 생성하는 단계, 제1 이미지를 분석하여 제1 위치에서 미생물 콜로니를 식별하는 단계, 제2 이미지를 분석하여 제2 위치에서 기포를 식별하는 단계, 및 제1 위치가 제2 위치에 근접해 있는지를 판정하는 단계를 포함한다. 제2 방법은 배양 장치의 이미지를 분석하여 기포를 검출하는 단계, 및 기포를 기포들 각각과 연관된 크기 파라미터에 따라 분류하는 단계를 포함한다. 제3 방법은 배양 장치의 이미지의 제1 영역을 분석하여 기포의 제1 개수를 검출하는 단계, 이미지의 제2 영역을 분석하여 기포의 제2 개수를 검출하는 단계, 및 기포의 제1 개수를 기포의 제2 개수와 비교하는 단계를 포함한다.
Description
관련 출원의 상호 참조
본 출원은 2012년 12월 20일자로 출원된 미국 가특허 출원 제61/739,789호에 대한 우선권을 주장하며, 상기 출원의 개시내용은 전체적으로 본 명세서에 참고로 포함된다.
생물학적 안전은 현대 사회에서 주요한 관심사이다. 음식 또는 다른 재료에서의 생물학적 오염에 대한 검사가 식품의 개발자 및 판매자에게 중요한 그리고 종종 의무적인 요건이 되었다. 생물학적 검사는 또한 내과 환자로부터 채취된 혈액 샘플과 같은 실험실 샘플, 실험 목적으로 개발된 실험실 샘플, 및 다른 타입의 생물학적 샘플 내의 세균 또는 다른 병원체를 식별하는 데 사용된다. 다양한 기술 및 장치가 생물학적 검사를 개선하는 데, 그리고 생물학적 검사 과정을 능률화하고 표준화하는 데 이용될 수 있다.
매우 다양한 배양 장치가 개발되었다. 하나의 예로서, 배양 장치들이 미국 미네소타주 세인트 폴 소재의 쓰리엠 컴퍼니(3M Company)(이하, "쓰리엠(3M)")에 의해 개발되었다. 특히, 배양 장치들이 상표명 페트리필름(PETRIFILM) 플레이트로 쓰리엠에 의해 판매된다. 배양 장치는, 예를 들어, 호기성 세균(aerobic bacteria), 대장균(E. coli), 대장균형(coliform), 장내세균(enterobacteria), 효모균, 곰팡이, 황색포도상구균(Staphylococcus aureus), 리스테리아(Listeria), 캄필로박터(Campylobacter) 등을 비롯한, 보통 음식 오염과 연관된 미생물의 빠른 증식 및 검출을 용이하게 하는 데 이용될 수 있다. 페트리필름 플레이트 또는 다른 증식 배지의 사용은 음식 샘플의 세균 검사를 단순화할 수 있다.
배양 장치는 세균을 수측정(enumeration)하거나 그의 존재를 식별하는 데 사용될 수 있어서, (음식 검사의 경우에) 정확한 측정이 수행될 수 있게 하거나 (의료 용도의 경우에) 적절한 진단이 이루어질 수 있게 한다. 다른 응용에서, 배양 장치는, 예를 들어 실험 목적으로, 실험실 샘플 내의 미생물을 빠르게 증식시키는 데 사용될 수 있다.
생물학적 스캐닝 유닛은 미생물 콜로니(microbial colony)를 스캔하고/하거나 계수하는 데 사용되는 장치를 지칭한다. 예를 들어, 음식 샘플 또는 실험실 샘플이 배양 장치 상에 놓일 수 있고, 이어서 플레이트가 배양 챔버(incubation chamber) 내로 삽입될 수 있다. 배양 후에, 세균 증식의 자동화된 검출 및 수측정을 위해 배양 장치가 생물학적 스캐닝 유닛 내에 넣어질 수 있다. 이러한 방식으로, 생물학적 스캐닝 유닛은 배양 장치 내의 미생물 콜로니의 검출 및 수측정을 자동화하고, 이에 의해 인적 오류(human error)를 감소시킴으로써 생물학적 검사 과정을 개선한다.
일반적으로, 본 발명은 스캔된 이미지 내의 대상을 구별하기 위한 기술에 관한 것이다. 특히, 본 기술은 배양 장치의 이미지 내에 존재하는 기체 생성 미생물 콜로니를 식별하는 데 사용되며, 배양 장치는 2개의 기재(substrate) 사이에 빈 공간 없이 배치된 배양 배지를 포함한다. 또한, 본 기술은 추가로 배양 장치의 스캔된 이미지 내의 기체 생성 미생물 콜로니의 개수를 계수하는 데 사용될 수 있다. 콜로니를 계수하기 위해, 배양 배지를 포함하는 배양 장치가 스캐닝 유닛 내로 삽입된다. 배양 장치의 삽입 시에, 스캐닝 유닛이 배양 장치의 이미지를 생성한다. 이어서, 스캐닝 유닛 내에서, 또는 데스크톱 컴퓨터, 워크스테이션 등과 같은 외부 컴퓨팅 장치에 의해 수행되는 이미지 처리 및 분석 루틴을 사용하여, 기체 생성 미생물 콜로니의 개수가 계수되거나 달리 결정될 수 있다. 본 발명에 따르면, 기체 생성 콜로니를 구별하는 방법이 기술된다. 본 방법은 스캔된 이미지 내의 미생물 콜로니의 자동화된 계수의 기존 방법에 비해 정확도를 개선하는 데 사용될 수 있다.
하나의 태양에서, 본 발명은 방법을 제공한다. 본 방법은 이미징 장치를 사용하여 박막 배양 장치의 제1 이미지를 생성하는 단계를 포함할 수 있으며, 배양 장치는 투명 막 커버 시트를 갖는 전면(front side), 및 반투명 기재를 갖는 배면(back side)을 갖는다. 제1 이미지는 장치의 전면에 조명을 제공하는 동안 생성된다. 배양 장치는 미생물에 의해, 제1 색상에 의해 관찰가능한 제1 생성물로 변환되는 지표 화합물(indicator compound)을 포함한다. 배양 장치는 제1 타입의 미생물에 의해 기체로 변환될 수 있는 영양분을 포함한다. 본 방법은 이미징 장치를 사용하여 박막 배양 장치의 제2 이미지를 생성하는 단계 - 제2 이미지는 장치의 배면에 조명을 제공하는 동안 생성됨 -; 제1 이미지를 분석하여 배양 장치 내의 제1 위치에서 미생물 콜로니를 식별하는 단계; 제2 이미지를 분석하여 배양 장치 내의 제2 위치에서 제1 기포를 식별하는 단계; 및 제1 위치가 제2 위치로부터 사전결정된 거리 내에 있는지를 판정하는 단계를 추가로 포함할 수 있다.
임의의 실시예에서, 제1 이미지는 전면 조명:배면 조명의 제1 비(ratio)로 장치를 조명하는 동안 생성될 수 있고, 제2 이미지는 제1 비보다 낮은, 전면 조명:배면 조명의 제2 비로 장치를 조명하는 동안 생성될 수 있다. 상기의 실시예들 중 임의의 것에서, 제1 기포는 제1 주연부(perimeter)를 포함할 수 있으며, 제2 이미지를 분석하여 기포를 식별하는 단계는 제1 주연부와 연관된 암 환형부(dark annulus)를 식별하는 단계를 포함할 수 있다. 상기의 실시예들 중 임의의 것에서, 제2 이미지를 분석하여 제1 기포를 식별하는 단계는 제1 기포의 크기 파라미터를 계산하는 단계를 포함할 수 있다. 상기의 실시예들 중 임의의 것에서, 본 방법은 제1 기포의 크기 파라미터를 제2 기포의 크기 파라미터와 비교하는 단계를 추가로 포함할 수 있다. 상기의 실시예들 중 임의의 것에서, 본 방법은 제1 이미지를 사용하여 배양 장치 내의 미생물 콜로니의 개수를 계수하는 단계를 추가로 포함할 수 있다. 상기의 실시예들 중 임의의 것에서, 본 방법은 제1 이미지 및 제2 이미지를 사용하여 영양분을 기체로 변환시키지 않는 미생물 콜로니의 개수를 계수하는 단계를 추가로 포함할 수 있다.
다른 태양에서, 본 발명은 컴퓨터 판독가능 명령어들을 포함하는 컴퓨터 판독가능 매체를 제공한다. 컴퓨터 판독가능 명령어들은, 프로세서에 의해 실행될 때, 프로세서를 포함하는 이미지 분석 시스템으로 하여금 박막 배양 장치의 제1 이미지를 분석하게 할 수 있으며, 배양 장치는 전면 및 전면 반대편의 배면을 갖는다. 제1 이미지는 장치의 전면에 조명을 제공하는 동안 생성된다. 제1 이미지를 분석하는 것은 배양 장치 내의 제1 위치에서 미생물 콜로니를 식별하는 것을 포함한다. 컴퓨터 판독가능 명령어들은, 프로세서에 의해 실행될 때, 추가로 프로세서로 하여금 박막 배양 장치의 제2 이미지를 분석하게 할 수 있으며, 여기서 제2 이미지는 장치의 배면에 조명을 제공하는 동안 생성된다. 제2 이미지를 분석하는 것은 배양 장치 내의 제2 위치에서 기포를 식별하는 것을 포함한다. 컴퓨터 판독가능 명령어들은, 프로세서에 의해 실행될 때, 추가로 프로세서로 하여금 제1 위치가 제2 위치로부터 사전결정된 거리 내에 있는지를 판정하게 할 수 있다.
컴퓨터 판독가능 매체의 상기의 실시예들 중 임의의 것에서, 제2 이미지를 분석하여 기포의 제2 위치를 식별하는 것은 기포를 둘러싸는 암 환형부를 식별하는 것을 포함할 수 있다. 상기의 실시예들 중 임의의 것에서, 컴퓨터 판독가능 매체는, 프로세서에서 실행될 때, 시스템으로 하여금 제1 이미지를 사용하여 배양 장치 내의 미생물 콜로니의 개수를 계수하게 할 수 있는 명령어들을 추가로 포함한다. 상기의 실시예들 중 임의의 것에서, 컴퓨터 판독가능 매체는, 프로세서에서 실행될 때, 시스템으로 하여금 제1 이미지 및 제2 이미지를 사용하여 배양 장치 내의 기체 생성 미생물 콜로니의 개수를 계수하게 할 수 있는 명령어들을 추가로 포함한다.
또 다른 태양에서, 본 발명은 방법을 제공한다. 본 방법은 박막 배양 장치의 증식 영역의 이미지를 분석하여 기포를 검출하는 단계, 및 복수의 기포를 분류하는 단계를 포함할 수 있으며, 여기서 복수의 기포를 분류하는 단계는 각각의 기포를 복수의 기포 각각과 연관된 크기 파라미터에 따라 제1 그룹 또는 제2 그룹에 할당하는 단계를 포함한다. 임의의 실시예에서, 기포를 제1 그룹 및 제2 그룹으로 분류하는 것은 기포들의 제1 서브세트(subset)를 제1 자연발생 기포 의심 그룹(suspect abiogenic bubble group)으로 분류하는 것을 포함할 수 있고, 본 방법은 제1 자연발생 기포 의심 그룹에 대한 크기 파라미터 값 상한을 할당하는 단계를 추가로 포함할 수 있다. 임의의 실시예에서, 기포를 제1 그룹 및 제2 그룹으로 분류하는 것은 기포들의 제2 서브세트를 생물기원 기포 의심 그룹(suspect biogenic bubble group)으로 분류하는 것을 포함할 수 있고, 본 방법은 생물기원 기포 의심 그룹에 대한 크기 파라미터 값 하한을 할당하는 단계를 추가로 포함할 수 있다.
또 다른 태양에서, 본 발명은 컴퓨터 판독가능 매체를 제공한다. 컴퓨터 판독가능 매체는, 프로세서에 의해 실행될 때, 프로세서를 포함하는 이미지 분석 시스템으로 하여금, 박막 배양 장치의 증식 영역의 이미지를 분석하여 기포를 검출하고, 복수의 기포를 분류하게 할 수 있는 컴퓨터 판독가능 명령어들을 포함하며, 여기서 복수의 기포를 분류하는 것은 각각의 기포를 복수의 기포 각각과 연관된 크기 파라미터에 따라 제1 그룹 또는 제2 그룹에 할당하는 것을 포함한다. 임의의 실시예에서, 기포를 제1 그룹 및 제2 그룹으로 분류하는 것은 기포들의 제1 서브세트를 제1 자연발생 기포 의심 그룹으로 분류하는 것을 포함할 수 있고, 컴퓨터 판독가능 명령어들은 추가로 프로세서로 하여금 제1 자연발생 기포 의심 그룹에 대한 크기 파라미터 값 상한을 할당하게 할 수 있다. 임의의 실시예에서, 기포를 제1 그룹 및 제2 그룹으로 분류하는 것은 기포들의 제2 서브세트를 생물기원 기포 의심 그룹으로 분류하는 것을 포함할 수 있고, 컴퓨터 판독가능 명령어들은 추가로 프로세서로 하여금 생물기원 기포 의심 그룹에 대한 크기 파라미터 값 하한을 할당하게 할 수 있다.
또 다른 태양에서, 본 발명은 방법을 제공한다. 본 방법은 박막 배양 장치의 증식 영역의 이미지의 제1 영역을 분석하여 제1 영역 내의 기포의 제1 개수를 검출하는 단계, 이미지의 제2 영역을 분석하여 제2 영역 내의 기포의 제2 개수를 검출하는 단계, 및 기포의 제1 개수를 기포의 제2 개수와 비교하는 단계를 포함할 수 있다. 임의의 실시예에서, 본 방법은 이미지의 제3 영역을 분석하여 제3 영역 내의 기포의 제3 개수를 검출하는 단계, 및 기포의 제1 개수 또는 기포의 제2 개수를 기포의 제3 개수와 비교하는 단계를 추가로 포함할 수 있다. 임의의 실시예에서, 본 방법은 이미지를 분석하여 배양 장치의 증식 영역 내의 기포를 검출하는 단계, 및 복수의 기포를 분류하는 단계를 추가로 포함할 수 있으며, 여기서 복수의 기포를 분류하는 단계는 각각의 기포를 복수의 기포 각각과 연관된 크기 파라미터에 따라 제1 그룹 또는 제2 그룹에 할당하는 단계를 포함한다. 일부 실시예에서, 본 방법은 제1 영역, 제2 영역, 또는 제3 영역 중 임의의 영역 내의 기포가 제1 그룹에 할당되는지 또는 제2 그룹에 할당되는지를 판정하는 단계를 추가로 포함할 수 있다.
또 다른 태양에서, 본 발명은 컴퓨터 판독가능 매체를 제공한다. 컴퓨터 판독가능 매체는, 프로세서에 의해 실행될 때, 프로세서를 포함하는 이미지 분석 시스템으로 하여금, 박막 배양 장치의 증식 영역의 이미지의 제1 영역을 분석하여 제1 영역 내의 기포의 제1 개수를 검출하고, 이미지의 제2 영역을 분석하여 제2 영역 내의 기포의 제2 개수를 검출하고, 기포의 제1 개수를 기포의 제2 개수와 비교하게 할 수 있는 컴퓨터 판독가능 명령어들을 포함한다. 임의의 실시예에서, 컴퓨터 판독가능 명령어들은 추가로 프로세서로 하여금 이미지의 제3 영역을 분석하여 제3 영역 내의 기포의 제3 개수를 검출하고, 기포의 제1 개수 또는 기포의 제2 개수를 기포의 제3 개수와 비교하게 할 수 있다. 임의의 실시예에서, 컴퓨터 판독가능 명령어들은 추가로 프로세서로 하여금 이미지를 분석하여 배양 장치의 증식 영역 내의 기포를 검출하고, 복수의 기포를 분류하게 할 수 있으며, 여기서 복수의 기포를 분류하는 것은 각각의 기포를 복수의 기포 각각과 연관된 크기 파라미터에 따라 제1 그룹 또는 제2 그룹에 할당하는 것을 포함한다. 임의의 실시예에서, 컴퓨터 판독가능 명령어들은 추가로 프로세서로 하여금 제1 영역, 제2 영역, 또는 제3 영역 중 임의의 영역 내의 기포가 제1 그룹에 할당되는지 또는 제2 그룹에 할당되는지를 판정하게 할 수 있다.
본 발명의 다양한 태양은 다수의 이점을 제공할 수 있다. 예를 들어, 본 발명은 배양 장치 상의 미생물 콜로니의 자동화된 계수의 정확도를 개선할 수 있다. 특히, 본 명세서에 기술된 계수 규칙은 흔히 일어나는, 그리고 그렇지 않으면 배양 장치 내의 미생물 콜로니의 자동화된 계수의 정확도를 훼손시킬 수 있는 문제에 대처할 수 있다.
이들 및 다른 실시예의 추가의 상세사항이 첨부 도면 및 하기의 설명에 기술된다. 다른 특징, 목적 및 이점이 설명 및 도면으로부터, 그리고 청구범위로부터 명확해질 것이다.
도 1은 스캐닝 장치에 의해 생성된 이미지의 이미징 분석을 수행하는 외부 컴퓨터에 결합된 스캐닝 장치를 포함하는 예시적인 시스템의 사시도.
도 2는 도 1에 예시된 시스템에 대응할 수 있는 생물학적 스캐닝 시스템의 블록 다이어그램.
도 3은 미생물 배양 장치의 자동화된 분석의 과정을 예시하는 흐름도.
도 4는 본 발명에 따른, 미생물 배양 장치를 분석하는 방법의 일 실시예의 블록 다이어그램.
도 5는 본 발명에 따른, 기체 생성 미생물 콜로니를 구별하기 위한 계수 규칙의 흐름도.
도 6은 박막 배양 장치의 일부분의 흑백 이미지이며, 여기서 이미지는 배양 장치의 배면만을 조명하는 동안 획득되었음.
도 7은 도 6의 박막 배양 장치의 일부분의 흑백 이미지이며, 여기서 이미지는 배양 장치의 전면만을 조명하는 동안 획득되었음.
도 8은 도 6의 라인 스캔(line scan)에서의 픽셀의, 각각, 적색 성분, 녹색 성분, 및 청색 성분의 상대 강도의 그래프.
도 9는 도 7의 라인 스캔에서의 픽셀의, 각각, 적색 성분, 녹색 성분, 및 청색 성분의 상대 강도의 그래프.
도 10a는 기체 생성 및 비-기체 생성 미생물 콜로니를 보여주는 박막 배양 장치의 일부분의 흑백 이미지이며, 여기서 이미지는 배양 장치의 배면만을 조명하는 동안 획득되었음.
도 10b는 이미지의 제1 마스킹된 영역을 보여주는, 도 10a의 흑백 이미지.
도 10c는 이미지의 제2 마스킹된 영역을 보여주는, 도 10a의 흑백 이미지.
도 10d는 이미지의 제3 마스킹된 영역을 보여주는, 도 10a의 흑백 이미지.
도 2는 도 1에 예시된 시스템에 대응할 수 있는 생물학적 스캐닝 시스템의 블록 다이어그램.
도 3은 미생물 배양 장치의 자동화된 분석의 과정을 예시하는 흐름도.
도 4는 본 발명에 따른, 미생물 배양 장치를 분석하는 방법의 일 실시예의 블록 다이어그램.
도 5는 본 발명에 따른, 기체 생성 미생물 콜로니를 구별하기 위한 계수 규칙의 흐름도.
도 6은 박막 배양 장치의 일부분의 흑백 이미지이며, 여기서 이미지는 배양 장치의 배면만을 조명하는 동안 획득되었음.
도 7은 도 6의 박막 배양 장치의 일부분의 흑백 이미지이며, 여기서 이미지는 배양 장치의 전면만을 조명하는 동안 획득되었음.
도 8은 도 6의 라인 스캔(line scan)에서의 픽셀의, 각각, 적색 성분, 녹색 성분, 및 청색 성분의 상대 강도의 그래프.
도 9는 도 7의 라인 스캔에서의 픽셀의, 각각, 적색 성분, 녹색 성분, 및 청색 성분의 상대 강도의 그래프.
도 10a는 기체 생성 및 비-기체 생성 미생물 콜로니를 보여주는 박막 배양 장치의 일부분의 흑백 이미지이며, 여기서 이미지는 배양 장치의 배면만을 조명하는 동안 획득되었음.
도 10b는 이미지의 제1 마스킹된 영역을 보여주는, 도 10a의 흑백 이미지.
도 10c는 이미지의 제2 마스킹된 영역을 보여주는, 도 10a의 흑백 이미지.
도 10d는 이미지의 제3 마스킹된 영역을 보여주는, 도 10a의 흑백 이미지.
미생물의 검출 및 계수는 많은 다양한 분야에서 보편적인 문제이다. 미생물은 거의 모든 음식에, 물에, 공기에, 그리고 사람들이 접촉하는 수많은 표면 및 물질에 존재한다. 그러한 미생물은 종종 해롭고 이에 따라 측정 및 제어되어야 한다.
물질(예컨대, 음식, 물, 환경 잔류물) 내의 미생물의 존재를 검출하기 위한 널리 사용되는 실무는, 적합하게 준비된 검사할 물질의 샘플을 배양 장치 내에 배치하고, 미생물이 콜로니로 증식하도록 허용하는 것이다. 그러한 배지에서 배양된 때, 콜로니가 눈에 보이게 되고, 계수될 수 있다. 각각의 보이는 콜로니는 하나의 원래의 미생물에 대응한다. 본 발명의 방법은 미생물 콜로니를 증식시키고 계수하기 위한 그러한 배양 장치를 사용하여 수행된다. 배양 장치는 개별 콜로니들의 분리를 유지하기 위해 매트릭스(matrix)(예컨대, 예를 들어, 한천, 구아 검, 또는 펙틴과 같은 겔화제) 중에 분포된 수성 배양액(aqueous nutrient medium)을 포함한다. 많은 배양 장치는 본 명세서에 논의된 바와 같은 지표 화합물을 추가로 포함한다. 본 발명에 따라 기체 생성 미생물 콜로니를 증식시키고 검출하기에 적합한 배양 장치는 2개의 기재 사이에 배치된 배양 배지를 포함하는 배양 장치를 포함한다. 즉, 배양 배지는, 배양 배지와 2개의 기재 중 어느 하나 사이에 빈 공간 없이, 2개의 기재 사이에 개재된다.
본 발명의 방법에 사용하기에 적합한 배양 장치는, 예를 들어, 쓰리엠 컴퍼니에 의해 상표명 페트리필름으로 판매되는 박막 배양 장치를 포함한다. 페트리필름 박막 배양 장치는, 예를 들어, 미국 특허 제5,364,766호; 제5,601,998호; 및 제5,681,712호를 비롯한 수많은 간행물에 개시되어 있으며, 이들 문헌은 모두 전체적으로 본 명세서에 참고로 포함된다.
전형적인 한천 배양 배지, 및 페트리필름 플레이트에서 사용되는 배양 배지를 비롯한 많은 배양 배지는 미생물의 존재를 나타내는 지표 화합물을 포함한다. 지표 화합물은, 예를 들어, pH 지표, 발색성 효소 기질, 및 산화환원 지표를 포함한다. 지표 화합물은, 생성물로 직접적으로 또는 간접적으로 변환된 때, 전형적으로 미생물 콜로니 및/또는 콜로니 주위의 배양 배지에 색상 변화를 부여한다. 색상 변화는 종종 배양 배지 내의 미생물 콜로니의 존재를 검출하는 것을 더 용이하게 만들고(예컨대, 그것은 콜로니와 배양 배지 사이의 색상 대비를 개선함), 색상 변화는 또한 특정 지표 화합물과 반응하는 특정 콜로니를, 그 지표 화합물과 반응하지 않는 다른 미생물 콜로니와 구분하는 역할을 할 수 있다.
미생물을 증식시키고 구분하기 위한 많은 타입의 배양 배지는 2개 이상의 지표 화합물들을 포함한다. 예를 들어, 페트리필름 대장균 계수 플레이트(PETRIFILM E. coli Count Plate) 내의 배양 배지는, 수성 완충액 및/또는 샘플로 수화될 때, 산화환원 지표(트라이페닐테트라졸륨 클로라이드, 이하, "TTC") 및 발색성 효소 기질(5-브로모-4-클로로-3-인돌릴-β-D-글루쿠로나이드, 이하, "X-gluc")을 함유한다. TTC는 미생물 세포와 반응하여, 그램-네거티브(Gram-negative) 선택적 증식 배지에서 증식하는 임의의 세균 콜로니의 세포괴(cell mass)를 착색하는 불그스름한 색의 포르마잔을 형성한다. 대조적으로, X-gluc은, 선택적 증식 배지에서 증식할 수 있는 것에 더하여, β-D-글루쿠로니다아제 효소 활성을 갖는 세균(예컨대, β-D-글루쿠로니다아제 효소 활성을 갖는 대장균 균주)과만 반응한다. X-gluc의 가수분해는 남색 염료의 형성을 야기하며, 이는 콜로니의 세포괴를 청색으로 착색하고, β-D-글루쿠로니다아제 효소 활성을 갖는 콜로니를 둘러싸는 덜 강렬한 청색 할로(halo)를 형성한다.
본 발명의 방법은 미생물 콜로니들을, 복수의 지표 화합물 중 하나 이상과의 그들의 반응에 기초하여 그리고 그들 각자의 기체 생성 또는 그것의 결여에 의해 구별하는 데 사용될 수 있다고 생각된다. 미생물 콜로니는 하나 이상의 지표 화합물과 반응하여, 미생물의 존재를 나타내는 착색된 또는 형광 생성물을 생성할 수 있다. 또한, 미생물 콜로니와 연관된 기포의 존재는 그 콜로니가 배양 장치 내에 존재하는 영양분을 기체 상태의 최종 생성물(예컨대, 이산화탄소)로 대사시킬 수 있는 미생물들의 그룹에 속한다는 것을 나타낸다.
따라서, 본 발명에 따른 방법에 사용되는 배양 장치는 (예컨대, 발효에 의해) 기체 상태의 최종 생성물(예컨대, 이산화탄소)로 변환될 수 있는 유효량의 영양분을 포함한다. 배양 장치는 또한 특유의 구조(즉, 수화 겔이 2개의 실질적으로 평면형인 층들 사이에 개재됨)를 가져서, 미생물 활동에 의해 생성되는 기포가 배양 장치 내에 포집되어 수화 겔의 일부를 실질적으로 대체하며, 이로써 평면형 층들 사이에 광학적으로 검출가능한 공극(void) 공간을 형성한다. 임의의 실시예에서, 영양분은, 예를 들어, 글루코오스, 수크로오스, 락토오스, 또는 상기 탄수화물들 중 임의의 2개 이상의 탄수화물의 조합과 같은 탄수화물일 수 있다. 당업자는, 미생물 활동에 의해 기체 상태의 최종 생성물로 변환되고, 본 발명에 따라 기체 생성 콜로니를 식별하기 위해 배양 배지에 사용될 수 있는 다양한 영양분을 인식할 것이다.
본 발명의 방법에 사용되는 배양 배지는, 그것이 다른 타입의 미생물에 비해 하나의 타입의 미생물의 증식에 유리하도록 선택될 수 있다. 예를 들어, 배양 배지는 소정의 미생물(예컨대, 그램-네거티브(Gram-negative) 세균)의 증식을 억제하고/하거나 다른 미생물의 증식에 유리한 선택적 성분(예컨대, 항생물질, 염화나트륨, 담즙염, 예를 들어, 크리스털 바이올렛(crystal violet)과 같은 염료)을 포함할 수 있다. 당업자는 본 발명의 방법에 따라 사용되는 배양 장치 내에서의 소정의 미생물의 증식을 촉진하는 데 사용될 수 있는 다양한 선택적 제제를 인식할 것이다.
본 발명의 방법에 따르면, 당업계에 주지된 절차에 따라, 샘플이 준비되고, 배양 장치에 접종되고, 배양된다. 샘플 준비는 선택적으로 샘플을 배양 장치 내의 영양 배지 내로(예컨대, 포어-플레이팅(pour-plating)) 또는 영양 배지 상으로(예컨대, 서피스-플레이팅(surface-plating)) 도입하기 전에 샘플로부터 비-미생물 부스러기를 감소시키거나 제거하기 위해 희석, 효소 소화, 여과, 및/또는 침전을 포함할 수 있다.
샘플 내에 존재할 것으로 의심되는 미생물의 증식에 적합한 온도에서의 충분한 배양 기간 후에, 이미징 시스템을 사용하여 배양 장치 내의 미생물 콜로니의 이미지를 캡처하고 다양한 이미지 분석 방식을 적용하여, 미생물 콜로니가 검출되고 계수될 수 있다. 배양 장치 내의 미생물 콜로니를 계수하고/하거나 구분하는 데 사용되는 이미징 시스템의 예가 국제 공개 WO 98/59314호; 및 미국 특허 제7,298,885호; 제8,094,916호; 및 제7,496,225호에서 확인될 수 있으며, 이들 문헌은 전체적으로 본 명세서에 참고로 포함된다. 배양 장치 내의 미생물 콜로니를 검출하고/하거나 수측정하는 데 사용되는 이미지 분석 방식의 예가 미국 특허 제6,058,209호 및 제6,243,486호에서 확인될 수 있으며, 이들 문헌은 전체적으로 본 명세서에 참고로 포함된다.
본 발명은 배양 장치(예컨대, 박막 배양 장치)의 이미지 내의 미생물 콜로니를 계수하기 위한 기술에 관한 것이다. 이 기술은 배양 장치 내의 미생물 콜로니의 자동화된 계수의 정확도를 개선하는 데 사용될 수 있다. 본 명세서에 개시된 계수 규칙은 개별적으로 사용될 수 있거나, 다른 계수 규칙, 이를테면, 예를 들어, 국제 특허 공개 WO 2005/062744호에 그리고 2012년 12월 20일자로 출원되고 발명의 명칭이 "이미지 내의 미생물 콜로니를 구분하는 방법(METHOD OF DIFFERENTIATING MICROBIAL COLONIES IN AN IMAGE)"인 미국 가특허 출원 제61/739,786호에 개시된 계수 규칙과 조합되어 사용될 수 있으며, 이들 문헌 둘 모두는 전체적으로 본 명세서에 참고로 포함된다.
본 명세서에 개시된 계수 규칙은 전형적으로 컴퓨터 실행가능 소프트웨어 명령어들로서 저장되고, 생물학적 스캐닝 시스템 또는 이미지 분석 시스템(선택적으로 스캐닝 장치에 결합된, 프로세서 및 이미지 분석 소프트웨어) 내의 프로세서에 의해 실행된다. 대안적으로, 이 규칙은 주문형 집적 회로(ASIC), 필드 프로그래머블 게이트 어레이(FPGA), 또는 당업계에 공지된 다양한 하드웨어 컴포넌트와 같은 하드웨어로 구현될 수 있다. 본 명세서에 기술된 규칙은, 스캔되는 증식 배지에 따라, 개별적으로 또는 다른 계수 규칙과의 임의의 조합으로 적용될 수 있다. 어느 경우에서도, 본 명세서에 기술된 규칙을 적용함으로써, 배양 장치(예컨대, 박막 배양 장치) 상의 미생물 콜로니의 자동화된 계수의 정확도가 개선될 수 있다.
임의의 실시예에서, 본 발명의 방법은 배양 장치 내의 미생물 콜로니를 검출하고 계수하기 위한 시스템을 채용한다. 배양 장치 내의 미생물 콜로니를 검출하고 계수하기 위한 시스템이, 예를 들어, 국제 특허 공개 WO 96/18720호, WO 96/18167호, WO 2005/062744호에 기술되어 있으며, 이들 문헌은 모두 전체적으로 본 명세서에 참고로 포함된다.
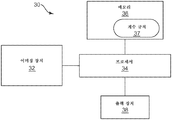
도 1은 배양 장치 내의 미생물 콜로니를 검출하고 계수하기 위한 시스템(20)의 일 실시예의 사시도를 도시한다. 시스템(20)은 스캐너(21)를 포함하며, 이 스캐너는 스캐너에 의해 생성된 이미지의 이미징 분석을 수행하는 외부 컴퓨터(22)에 결합된다. 외부 컴퓨터(22)는, 예를 들어, 배양 장치(24)의 이미지 분석을 위해 프로그래밍된 마이크로프로세서를 포함할 수 있다. 외부 컴퓨터(22)는 개인용 컴퓨터(PC), 데스크톱 컴퓨터, 랩톱 컴퓨터, 핸드헬드(handheld) 컴퓨터, 워크스테이션, 태블릿 개인 컴퓨팅 장치, 모바일 장치 등을 포함할 수 있다. 예를 들어, 스캐너(21)에 의해 생성된 배양 장치(24)의 이미지의 이미지 분석을 용이하게 하기 위해 소프트웨어 프로그램이 외부 컴퓨터(22)에 로딩될 수 있다.
스캐너(21)는 인터페이스(25)를 통해 외부 컴퓨터(22)에 결합된다. 인터페이스(25)는, 예를 들어, 범용 직렬 버스(USB) 인터페이스, 범용 직렬 버스 2(USB2) 인터페이스, IEEE 1394 파이어 와이어 인터페이스, 소형 컴퓨터 시스템 인터페이스(SCSI) 인터페이스, 어드밴스 테크놀로지 어태치먼트(ATA) 인터페이스, 직렬 ATA 인터페이스, 페리페럴 컴포넌트 인터커넥트(PCI) 인터페이스, 종래의 직렬 또는 병렬 인터페이스, 무선 연결 등을 포함할 수 있다.
배양 장치(24)는 선택적으로 배양 장치(24)를 식별하는 데 사용되는 바코드 또는 다른 타입의 식별 마킹과 같은 표지(29)를 포함할 수 있다. RFID 태그, 2차원 광학 검출가능 코드 등이 또한 표지로서 사용될 수 있다. 어느 경우에서도, 표지(29)는 배양 장치(24) 상에서 증식 및 검사되는 미생물의 타입을 식별하게 할 수 있다. 스캐너(21)는 배양 장치(24)를 스캐너(21) 내로 제1 위치로 끌어당겨 표지(29)의 이미지를 생성하고, 이어서 배양 장치(24)를 제2 위치로 끌어당겨 증식 영역(27)의 이미지를 생성하도록 설계될 수 있다. 이러한 방식으로, 배양 장치의 표지(29) 및 증식 영역(27)의 이미지가 시스템(20)에 의해 생성될 수 있다. 대안적으로, 단일의 이미지가 표지(29) 및 증식 영역(27) 둘 모두를 캡처할 수 있다. 어느 경우에서도, 표지(29)의 스캐닝은 사용되는 플레이트의 타입의 식별을 용이하게 할 수 있어서, 하나 이상의 바람직한 계수 규칙이 자동화된 방식으로 적용될 수 있게 한다.
예로서, 배양 장치(24)는 쓰리엠에 의해 상표명 페트리필름 플레이트로 판매되는 박막 배양 장치를 포함할 수 있다. 배양 장치(24)는, 예를 들어, 대장균, 대장균형 세균, 장내세균, 살모넬라 등을 비롯한 기체 생성 미생물에 의한 음식 오염과 보통 연관된 미생물의 빠른 증식 및 검출을 용이하게 하는 데 이용될 수 있다. 배양 장치는 일반적으로 생물학적 증식과 세균 검출 및 수측정에 보통 사용되는 증식 배지의 타입을 포함한다. 그러나, 본 발명은 또한 본 명세서에 논의된 바와 같은 다른 타입의 증식 배지에서 적용될 수 있다.
임의의 실시예에서, 박막 배양 장치는 투명 막 커버 시트를 포함하는 전면, 및 반투명 기재, 이를테면, 예를 들어, 페트리필름 대장균/대장균형 계수 플레이트, 페트리필름 대장균형 계수 플레이트, 및 페트리필름 엔테로박테리아세아에(Enterobacteriaceae) 계수 플레이트를 포함하는 배면을 가질 수 있다. 이론에 의해 구애됨이 없이, 반투명 막과 투명 막 사이에 배치된 비교적 얇은(예컨대, 대략 1 내지 2 mm 두께) 배양 배지의 조합이 본 발명에 따라 기체 생성 콜로니를 구별하는 데 이로운 광학 조건을 제공하는 것으로 여겨진다.
배양 장치 상의 미생물 콜로니의 자동화된 계수의 정확도를 개선하기 위해, 본 발명의 방법의 다양한 태양은 이미지 처리 동안 적용될 수 있는 규칙을 확립한다. 다시 말해서, 하기에 보다 상세히 기술되는 규칙은 시스템(20)에서, 또는 이미징 장치로부터 직접 이미지를 수신하지 않는 이미지 분석 시스템(도시되지 않음)에서 실행되는 콜로니 계수 알고리즘의 일부를 이룰 수 있다. 이 규칙은, 스캔되는 증식 배지의 타입 및 직면할 수 있는 문제에 따라, 개별적으로 또는 다른 이미지 분석 규칙(국제 특허 공개 WO 2005/062744호에 기술된 계수 규칙)과의 임의의 조합으로 사용될 수 있다. 계수 규칙들 중 하나 이상을 적용하는 것은, 예를 들어, 박막 배양 장치 등과 같은 증식 배지 상의 미생물 콜로니의 자동화된 계수의 정확도를 개선함으로써 시스템(20)과 같은 생물학적 스캐닝 시스템을 개선할 수 있다.
도 2는 시스템(20)(도 1)에 대응할 수 있는 생물학적 스캐닝 시스템(30)의 블록 다이어그램이다. 시스템(30)은, 증식 배지의 하나 이상의 이미지를 생성하고 이 이미지를 프로세서(34)에 제공하는 이미징 장치(32)를 포함한다. 프로세서(34)는 메모리(36)에 결합된다. 메모리(36)는 이미징 장치(32)에 의해 생성된 이미지의 이미지 분석을 용이하게 하는 다양한 프로세서 실행가능 소프트웨어 명령어들을 저장한다. 특히, 메모리(36)는 배양 장치 상의 미생물 콜로니의 자동화된 계수의 정확도를 개선하기 위해 이미지 분석 동안 적용되는 하나 이상의 계수 규칙(37)을 저장한다. 출력 장치(38)는 프로세서(34)에 의해 결정된 결과를 수신하고 이 결과를 사용자에게 제공한다.
예로서, 이미징 장치(32)는 배양 장치의 하나 이상의 이미지를 생성하기 위한 2차원 단색 카메라를 포함할 수 있다. 다양한 조명기(도시되지 않음)가 배양 장치의 전면 및 배면을 조명하는 데 사용될 수 있다. 예를 들어, 조명기는 하나 이상의 색상으로 배양 장치를 조명할 수 있고, 배양 장치의 하나 이상의 이미지가 이미징 장치(32)에 의해 생성될 수 있다. 또한, 제어기(도시되지 않음)가 배양 장치의 각각의 이미지에 대해 전면 조명:배면 조명의 비를 제어할 수 있다. 박막 배양 장치를 이미징하는 데 사용될 수 있는, 선택적으로 복수의 조명 색상으로, 전면 및 배면 조명을 제공하는 이미징 장치의 비제한적인 예가 미국 특허 제8,094,916호에 기술되어 있으며, 이 문헌은 전체적으로 본 명세서에 참고로 포함된다.
본 발명에 따른 이미지를 분석하는 방법은 배양 장치의 하나 이상의 이미지를 사용하는 단계를 수반한다. 선택적으로, 본 방법은 2개의 이미지를 사용할 수 있으며; 각각의 이미지는, 기체 생성 미생물 콜로니를 보다 정확하게 구별하기 위해, 배양 장치를 조명하는 데 상이한 조건을 사용하여 획득된다. 제1 이미지가 배양 장치의 "전면"(즉, 이미징 장치를 향하는 배양 장치의 면)을 조명하는 동안 획득될 수 있다. 박막 배양 장치의 전면은 투명 커버 시트를 갖는 면이다. 제2 이미지가 배양 장치의 "배면"을 조명하는 동안 획득될 수 있다. 박막 배양 장치의 배면은 커버 시트 반대편의 면이다. 기체 생성 미생물 콜로니를 검출하도록 구성된 많은 페트리필름 플레이트(예컨대, 페트리필름 대장균/대장균형 계수 플레이트, 페트리필름 대장균형 계수 플레이트, 페트리필름 신속 대장균형 계수 플레이트, 및 페트리필름 엔테로박테리아세아에 계수 플레이트)에서, 박막 배양 장치의 배면은 반투명 중합체 필름을 포함한다.
배양 장치의 "전면"을 조명하는 단계는, 장치의 전면을 조명하는 조명기로부터 나오는 조명에 배양 장치를 노출시키는 단계를 포함할 수 있다. 실시예에서, 제1 이미지는 배양 장치의 전면을 조명하는 조명기로부터 나오는 조명의 100% 및 배양 장치의 배면을 조명하는 조명기로부터 나오는 조명의 0%를 사용하여 획득될 수 있다. 다른 실시예에서, 예를 들어, 제1 이미지는 배양 장치의 전면을 조명하는 조명기로부터 나오는 조명의 80% 및 배양 장치의 배면을 조명하는 조명기로부터 나오는 조명의 20%를 사용하여 획득될 수 있다. 전면 조명:배면 조명의 비는 배양 장치 내의 특정의 타입의 영양 배지에 대한 최적의 대비를 제공하도록 선택될 수 있다.
본 방법의 임의의 실시예에서, 제1 이미지는 전면 조명:배면 조명의 제1 비(예컨대, 100%:0%)로 장치를 조명하는 동안 생성되고, 제2 이미지는 제1 비보다 낮은, 전면 조명:배면 조명의 제2 비(예컨대, 0%:100%)로 장치를 조명하는 동안 생성된다. 임의의 실시예에서, 제1 비는 1:1보다 클 수 있다. 임의의 실시예에서, 제2 비는 1:1보다 작을 수 있다.
"제1 이미지"는, 본 명세서에 사용된 바와 같이, 배양 장치가 주로 플레이트의 전면으로부터 조명을 받는 동안 획득되는 이미지를 말하고 "제2 이미지"는, 본 명세서에 사용된 바와 같이, 배양 장치가 주로 플레이트의 배면으로부터 조명을 받는 동안 획득되는 이미지를 말한다는 것에 유의해야 한다. 용어 "제1 이미지" 및 "제2 이미지"의 사용에 의해 이미지들을 획득하는 암시된 시간적 순서가 의도되지 않는다. 따라서, 배양 장치의 제1 이미지가 배양 장치의 제2 이미지 전에 또는 그 후에 획득될 수 있다. 또한, 이미지들 중 하나(예컨대, 각각, 제1 이미지 또는 제2 이미지)가 다른 이미지(예컨대, 각각, 제2 이미지 또는 제1 이미지)를 획득한 직후에 배양 장치를 이미징함으로써 획득될 필요는 없다. 제1 이미지 및 제2 이미지가 이미지 취득들 사이의 개재하는 시간 동안 상당한 생물학적 변화(예컨대, 증식 또는 효소 활성) 또는 물리적 변화(예컨대, 탈수)가 일어날 가능성을 배제하기에 충분히 시간 면에서 근접하게 획득되는 것이 추천된다. 따라서, 바람직한 실시예에서, 제1 이미지는 제2 이미지가 획득되는 시간으로부터 약 30초 이내에 획득된다.
당업자는, 이미징 장치가 배양 장치의 전면을 향하여 위치되고 조명기가 또한 조명이 배양 장치의 전면으로 지향되도록 위치된 시스템에서, 이미징 장치에 의해 생성되는 이미지는 배양 장치 및 그의 내용물로부터 반사되는 광을 실질적으로 포함한다는 것을 인식할 것이다. 또한, 당업자는, 이미징 장치가 배양 장치의 전면을 향하여 위치되고 조명기가 또한 조명이 배양 장치의 배면으로 지향되도록 위치된 시스템에서, 이미징 장치에 의해 생성되는 이미지는 배양 장치 및 그의 내용물에 의해 투과되고/되거나 굴절되는 광을 실질적으로 포함한다는 것을 또한 인식할 것이다.
배양 장치의 "배면"을 조명하는 단계는, 장치의 배면을 조명하는 조명기로부터 나오는 조명에 배양 장치를 노출시키는 단계를 포함할 수 있다. 실시예에서, 제2 이미지는 배양 장치의 배면을 조명하는 조명기로부터 나오는 조명의 100% 및 배양 장치의 전면을 조명하는 조명기로부터 나오는 조명의 0%를 사용하여 획득될 수 있다. 다른 실시예에서, 예를 들어, 제2 이미지는 배양 장치의 배면을 조명하는 조명기로부터 나오는 조명의 80% 및 배양 장치의 전면을 조명하는 조명기로부터 나오는 조명의 20%를 사용하여 획득될 수 있다. 전면 조명:배면 조명의 비는 배양 장치 내의 특정의 타입의 영양 배지에 대한 최적의 대비를 제공하도록 선택될 수 있다.
본 발명의 방법의 임의의 실시예에서, 배면 조명으로 획득된 이미지 또는 전면 조명으로 사용된 이미지만을 사용하는 것이 바람직할 수 있다. 도 6 및 도 7에 예시되고 하기에 논의되는 바와 같이, 배면 조명은 박막 배양 장치 내의 배양 배지와 기포(예컨대, 기포의 주연부) 사이의 특히 향상된 대비를 제공할 수 있다.
이 이미지들은 프로세서(34)에 제공되며, 또한 메모리(36)에 저장될 수 있다. 어느 경우에서도, 배양 장치 상의 세균 총수를 결정하기 위해 계수 규칙(37)을 적용함으로써 이미지들이 분석된다. 이미징 장치(32)의 해상도는 대략 155 픽셀/센티미터일 수 있다. 그 경우에, 이미지 내의 1 센티미터 라인은 길이가 155 픽셀이다.
프로세서(34)는 메모리(36)에 저장된 소프트웨어를 실행하는 범용 마이크로프로세서를 포함할 수 있다. 대안적으로, 프로세서(34)는 주문형 집적 회로(ASIC) 또는 다른 특별히 설계된 프로세서를 포함할 수 있다. 어느 경우에서도, 프로세서(34)는 배양 장치 상의 미생물 콜로니의 자동화된 계수의 정확도를 개선하도록 다양한 계수 규칙(37)을 실행한다.
메모리(36)는 프로세서(34)에 의해 적용되는 프로세서 실행가능 소프트웨어 명령어들을 저장하는 컴퓨터 판독가능 매체의 일 예이다. 예로서, 메모리(36)는 랜덤 액세스 메모리(RAM), 판독 전용 메모리(ROM), 비-휘발성 랜덤 액세스 메모리(NVRAM), 전기적 소거가능 프로그래밍 가능 판독 전용 메모리(EEPROM), 플래시 메모리 등을 포함할 수 있다. 하기에 기술되는 것과 같은 계수 규칙(37)은 메모리(36)에 저장되며, 이미지 분석을 위해 사용되는 더 큰 소프트웨어 프로그램의 일부를 이룰 수 있다.
출력 장치(38)는 전형적으로 결과를 사용자에게 전달하는 데 사용되는 디스플레이 스크린을 포함한다. 그러나, 출력 장치(38)는 또한 프린터 등과 같은 다른 타입의 장치를 포함할 수 있다. 출력 장치(38)는 디스플레이(도시되지 않음)와 같은, 스캐닝 유닛의 일부를 이룰 수 있거나, 외부 컴퓨터(22)(도 1)의 디스플레이 스크린과 같이, 스캐닝 유닛에 대해 외부에 있을 수 있다.
도 3은 자동화된 배양 장치 분석의 과정을 예시하는 흐름도이다. 도 3에 도시된 바와 같이, 프로세서(34)는 배양 장치의 하나 이상의 이미지를 수신한다(단계 41). 프로세서(34)는 메모리(36)로부터 다양한 소프트웨어 루틴을 호출하여 배양 장치 상의 미생물 콜로니를 식별한다(단계 42). 예를 들어, 세균 콜로니들은 영양 배지 내의 하나 이상의 지표 화합물과 반응(즉, 직접적으로 또는 간접적으로)한 후에 그들이 생성하는 특성 색상에 따라 식별될 수 있다. 콜로니 인식의 다른 태양이 본 명세서에서 논의된다. 프로세서(34)에 의해 실행되는 소프트웨어는 배양 장치 상의 증식 영역의 식별, 및 배양 동안 콜로니가 증식한 증식 영역에서의 색상 변화에 기초한 세균 콜로니의 자동화된 계수를 허용할 수 있다. 선택적으로, 프로세서는 식별된 미생물 콜로니를 계수하기 위해 루틴을 호출할 수 있다. 기체 생성 콜로니는 배양 장치 내에서 기체를 생성하지 않는 콜로니의 총수와는 별개인 총수로 분리될 수 있다.
본 발명의 방법에 따르면, 프로세서(34)는 하나 이상의 규칙을 적용하여 증식 배지 상의 미생물 콜로니의 개수의 정확도를 개선한다(단계 43). 분석되는 배양 장치의 타입에 따라, 규칙들이 개별적으로 적용될 수 있거나 규칙들의 다양한 조합이 사용될 수 있다. 규칙들은 메모리(36)로부터 개별적으로 호출될 수 있거나, 더 큰 이미지 분석 소프트웨어 프로그램의 서브루틴을 이룰 수 있다. 규칙들은 개별적으로 적용될 수 있거나, 규칙들의 다양한 세트가 적용될 수 있다. 한 세트의 규칙들이 사용되는 경우, 규칙들이 적용되는 순서는 하나 이상의 이미지를 획득하기 위해 스캔되는 플레이트의 타입에 기초하여 선택될 수 있다. 규칙들의 적용을 위한 선택된 순서는 최종 결과에 영향을 미칠 수 있다. 규칙들의 다양한 서브세트가 또한 임의의 순서로 적용될 수 있고, 규칙들의 서브세트에 대한 선택된 순서가 또한 최종 결과에 영향을 미칠 수 있다.
도 4는 본 발명에 따른 방법(100)의 일 실시예를 도시한다. 본 방법은 배양 장치의 전면을 조명하는 동안 제1 이미지를 획득하는 단계 51, 및 배양 장치의 배면을 조명하는 동안 제2 이미지를 획득하는 단계 52를 포함한다. 배양 장치의 전면 및 배면은 본 명세서에 개시된 바와 같은 이미징 시스템으로 조명될 수 있다. 방법(100)은 제1 이미지를 분석하여 배양 장치 내의 미생물 콜로니의 위치를 식별하는 단계 53을 추가로 포함한다. 방법(100)은 제2 이미지를 분석하여 배양 장치 내의 기포의 위치를 식별하는 단계 54를 추가로 포함한다.
제2 이미지를 분석하여 기포의 위치를 식별하는 단계는, 기포를 배양 장치 내의 배양 배지와 구별가능한 (이미지 내의) 대상으로서 식별하는 단계를 포함할 수 있다. 기포를 배양 배지와 구별가능한 대상으로서 식별하는 단계는, 바이스(Weiss)(미국 특허 제6,381,353호)에 의해 개시된 이미지 분석 기술을 적용함으로써 행해질 수 있다. 이미지를 분석하는 것은 RGB(적색/녹색/청색) 이미지 처리 알고리즘을 포함할 수 있다. 대안적으로, 또는 부가적으로, 이미지를 분석하는 것은 HSI(색조, 채도, 및 강도), HSL(색조, 채도, 및 밝기), HSV(색조, 채도, 및 명도) 알고리즘, 또는 이들의 조합을 포함할 수 있다. 기체 생성 콜로니에 의해 생성되는 기포가 종종 박막 배양 장치의 커버 시트와 기재 사이에 배치된 배양 배지의 일부 또는 전부를 대체하기 때문에, 기포는 주위의 배양 배지 및/또는 미생물 콜로니보다 실질적으로 더 적은 색상을 갖는 이미지 내의 영역으로서 검출될 수 있다. 그러나, 박막 배양 장치의 특유의 구성은 대안적인 접근법이 이미지 내의 기포의 존재를 검출하도록 허용한다 - 기포를 둘러싸는 상대적으로 어두운 환형부를 검출함 -.
이론에 의해 구애됨이 없이, 배양 배지와 접촉하는 기포의 에지는 기포 전체에 걸쳐 광의 투과를 허용하는 렌즈로서의 역할을 할 수 있다. 또한, 에지는 투과된 광의 이미지를 반사시키는 거울로서의 역할을 할 수 있다. 따라서, 배양 배지 및 콜로니가 전형적으로 착색되고 그 색상은 전형적으로 박막 배양 장치의 배면을 형성하는 기재보다 어둡기 때문에, 배양 배지 및/또는 콜로니의 투과된(및 반사된) 이미지는 기포의 상대적으로 밝은 색상의 중심 부분을 둘러싸는 상대적으로 어두운 색상의 환형부를 형성한다. 이러한 암 환형부는 배양 배지 및 미생물 콜로니 - 도 6에 도시되고 예 1에 기술된 바와 같이, 전형적으로 배양 배지보다 어두움 - 와 쉽게 구별가능한 뚜렷한 색상 및/또는 밝기 변화로서 검출될 수 있다.
제1 이미지 및 제2 이미지는 이미지 내의 대상을 하나 이상의 색상의 음영으로 규정하기 위해 획득된다. 따라서, 제1 이미지 및/또는 제2 이미지를 분석하여 각각의 이미지 내의 미생물 콜로니를 식별하는 단계는, 당업계에 주지된 이미지 분석 방법에 따라 이미지 내의 대상을 콜로니로서 식별하는 단계를 포함할 수 있다. 예를 들어, 바이스는 대상 크기, 가시성, 색상, 표면 품질, 및 형상을 비롯한 하나 이상의 기준에 기초하여 이미지 내의 대상(예컨대, 미생물 콜로니)을 식별하는 기술을 기술한다(미국 특허 제6,243,486호, 이 문헌은 전체적으로 본 명세서에 참고로 포함됨). 상기에 논의된 바와 같이, TTC를 포함하는 지표 화합물과 반응하는 미생물 콜로니를 검출하는 방법은 적색의 음영을 검출하도록 구성될 수 있고, 5-브로모-4-클로로-3-인돌릴-β-D-글루쿠로나이드를 포함하는 지표 화합물과 반응하는 미생물 콜로니를 검출하는 방법은 청색의 음영을 검출하도록 구성될 수 있다.
제1 이미지 및/또는 제2 이미지를 분석하여 이미지 내의 미생물 콜로니를 식별하는 단계는, 이미지 내에서 검출된 임의의 콜로니의 위치를 식별하는 단계를 포함한다. 배양 장치 내의 콜로니의 위치는 콜로니의 위치를 배양 장치 내의 기포의 위치와 비교하는 데 사용된다. 콜로니 또는 기포의 위치는 이미지 내의 X-Y 좌표에 의해 식별될 수 있다. 따라서, 바람직한 실시예에서, 제1 이미지 및 제2 이미지 둘 모두가, 제1 이미지가 획득된 후에 그러나 제2 이미지가 획득되기 전에 배양 장치를 이동시키거나 달리 취급함이 없이, 획득된다. 대안적으로, 정합 랜드마크(registration landmark)(예컨대, 페트리필름 플레이트의 2개 이상의 모서리, 또는 임의의 배양 장치 상에 형성된 정합 마크)가 제1 이미지 및 제2 이미지 내의 대상(예를 들어, 콜로니, 기포)의 위치를 결정하고 비교하기 위해 이미지들을 적절히 배향시키는 데 사용될 수 있다.
제1 이미지 및 제2 이미지를 분석하여 배양 장치 내의 미생물 콜로니 및 기포의 위치를 식별한 후에, 방법(100)은 미생물 콜로니 및 기포의 위치를 비교하는 단계 55를 추가로 포함한다. 위치를 비교하는 단계는, 특정 미생물 콜로니와 그 콜로니에 근접한 하나 이상의 기포 사이의 거리(예컨대, 픽셀 단위)를 계산하는 단계를 포함할 수 있다. 이러한 거리는 기포가 특정 콜로니와 연관되는지를 판정하고, 이로써, 특정 콜로니는 기체 생성 미생물 콜로니이다는 결론을 내리는 데 사용될 수 있다.
페트리필름 대장균/대장균형 계수 플레이트와 함께 사용하기 위한, 제조사에 의해 제공되는 해석 가이드(Interpretation Guide)는 기포가 특정 콜로니와 연관되는지의 판정에 관한 지침을 제공한다. 부분적으로, 그 지침은 미생물 콜로니에 대한 기포의 근접도에 관한 것이다. 일반적으로, 특정 미생물 콜로니와 접촉하는 기포는 그 콜로니와 연관(즉, 그에 의해 생성)되는 것으로 간주된다. 또한, 약 3개의 콜로니 직경과 동일한 거리 내에 위치된 기포는 그 콜로니와 연관(즉, 그에 의해 생성)되는 것으로 간주된다. 따라서, 본 발명에 따라 이미지(예컨대, 본 명세서에 개시된 제1 이미지 또는 제2 이미지)를 분석하여 기체 생성 미생물의 존재 또는 위치를 식별하는 단계는, 이미지를 분석하여 하나 이상의 기포의 존재 또는 위치를 식별하는 단계를 포함한다. 임의의 근접한 미생물 콜로니에 대한 기포의 위치는, 그 기포가 콜로니를 형성하는 미생물에 의해 생성되었는지를 판정하는 데 사용된다.
이미지(예컨대, 본 명세서에 개시된 제1 이미지 또는 제2 이미지)를 분석하여 하나 이상의 기포의 존재 또는 위치를 식별하는 단계는, 이미지를 분석하여 이미지 내의 하나 이상의 기포의 크기 파라미터(예컨대, 반경, 직경, 및/또는 면적)를 결정하는 단계를 추가로 포함할 수 있다. 크기 파라미터는, 예를 들어, 기포의 반경, 직경, 또는 면적 내의 픽셀의 개수를 계산함으로써 결정될 수 있다. 복수의 기포가 이미지 내에서 관찰되는 경우, 복수의 기포 각각에 대한 크기 파라미터가, 예를 들어, 히스토그램에서 비교될 수 있다. 히스토그램은 이미지에서 발견된 기포의 크기(예컨대, 반경, 직경, 또는 면적)의 분포를 나타낼 수 있다. 또한, 히스토그램은 기포의 크기 분포에 있어서의 갭(gap)을 나타낼 수 있다. 이들 갭은 자연발생 기포를 생물기원 기포와 구분하는 데 사용될 수 있다.
전체적으로 본 명세서에 참고로 포함되는, 국제 특허 공개 제WO2012/012104호는 박막 배양 장치에서 관찰될 수 있는 작은 자연발생 기포의 존재를 기술한다. 이 출원은 또한 미생물 콜로니가 발달함에 따라 미생물 콜로니를 둘러싸는 영역 내의 자연발생 기포가 감소하거나 사라짐을 개시한다. 자연발생 기포, 및 미생물 콜로니를 둘러싸는 영역(즉, 자연발생 기포가 없는 영역)을 하기에 기술되는 도 6에서 명확히 볼 수 있다. 따라서, 본 발명의 방법의 임의의 실시예는 콜로니를 둘러싸는 영역 내의 기포의 개수를 계산하는 단계를 추가로 포함할 수 있다. 콜로니를 둘러싸는 영역의 면적은, 예를 들어, 콜로니의 면적의 약 5배 이하일 수 있다. 본 방법은, 선택적으로, 미생물 콜로니에 근접한 영역 내의 관찰가능 기포의 개수를, 콜로니를 포함하지 않는 배양 장치 내의 영양 배지의 다른 영역(예컨대, "대조" 영역) 내의 관찰가능 기포의 개수와 비교하는 단계를 포함할 수 있다. 이러한 비교가 행해질 때, 미생물 콜로니에 근접한 영역 내의 관찰가능 기포의 개수가 대조 영역 내의 관찰가능 기포의 개수보다 상당히 낮은 경우, 미생물 콜로니에 근접한 제1 기포의 존재는, 제1 기포의 크기에 무관하게, 미생물 콜로니가 기체 생성 미생물 콜로니이다는 것을 나타낼 수 있다.
임의의 실시예에서, 본 발명의 방법은 제1 기포의 크기 파라미터를 제2 기포의 크기 파라미터와 비교하는 단계를 추가로 포함할 수 있다. 복수의 기포가 이미지 내에 존재하는 경우, 제1 기포의 크기 파라미터를 제2 기포의 크기 파라미터와 비교하는 단계는, 복수의 기포 각각에 대한 크기 파라미터 값의 히스토그램을 생성하는 단계를 포함할 수 있다. 크기 파라미터 값(예컨대, 반경, 직경, 또는 면적)의 분포는 유사한 크기의 기포들의 클러스터(cluster)들을 나타낼 수 있다. 클러스터들은 하나 이상의 그룹으로 나누어질 수 있다.
히스토그램은 기체 생성 미생물에 의해 생성되는 제1 기포를, 기체 생성 미생물에 의해 생성되지 않는 제2 기포와 구별하는 데 사용되는 (예컨대, 기포 반경, 직경, 또는 면적에 대한) 임계 크기 파라미터 값 또는 크기 파라미터 범위를 결정하는 데 사용될 수 있다. 유리하게도, 배양 장치에서 관찰되는 복수의 기포의 크기를 비교하는 것은, 상대적으로 균일한 크기를 갖는 경향이 있는 자연발생 기포를, 흔히 자연발생 기포보다 큰, 미생물 콜로니에 의해 생성되는 기포와 구별하는 데 사용될 수 있다.
페트리필름 대장균/대장균형 계수 플레이트와 함께 사용하기 위한, 제조사에 의해 제공되는 해석 가이드는 기포가 특정 콜로니와 연관되는지의 판정에 관한 추가의 지침을 제공한다. 일반적으로, 기포가 특정 미생물 콜로니에 근접하고 기포가 근접 콜로니의 직경과 대략 동일하거나 그보다 더 큰 직경을 갖는 경우, 기포는 그 콜로니와 연관(즉, 그에 의해 생성)되는 것으로 간주된다. 그러나, 당업자는, 기체 생성 콜로니와 연관된 기포가, 그것이 연관되는 기체 생성 미생물 콜로니보다 작은 크기 파라미터 값(예컨대, 직경)을 가질 수 있는 경우(예컨대, 샘플 및/또는 배양 장치가 미생물 기체 생성을 억제하는 영양분을 포함할 때)가 있을 수 있음을 인식할 것이다.
도 5는 본 발명에 따른, 콜로니들을 복수의 콜로니 타입으로 구분하기 위한 규칙을 예시하는 흐름도이다. 도 2에 예시된 바와 같이, 프로세서(34)는 제1 이미지 및 제2 이미지 내의 콜로니 및 기포의 위치를 식별하고 맵핑하기 위해 메모리(36)에 저장된 소프트웨어를 호출한다(단계 61). 특히, 프로세서(34)는 제1 이미지를 사용하여 식별되고 위치확인된 콜로니가 제2 이미지를 사용하여 식별되고 위치확인된 기포에 근접한 위치에 맵핑되는지를 판정한다(단계 62). 제1 이미지 및 제2 이미지를 분석할 때 기포에 근접한 콜로니가 발견되는 경우, 프로세서(34)는 근접도 인자를 적용하여 기포가 근접 콜로니와 연관(즉, 그에 의해 생성)되는지를 결정한다. 상기에 논의된 바와 같이, 기포가 콜로니로부터 사전결정된 거리 내에(예컨대, 약 3개의 콜로니 직경의 동등물 내에) 있는 경우, 배양 장치 내의 콜로니는 제1 타입(예컨대, "기체 생성"; 도 5의 단계 63 참조)으로서 계수된다. 상기에 논의된 바와 같이, 기포가 콜로니로부터 사전결정된 거리 내에 있지 않은(예컨대, 약 3개의 콜로니 직경의 동등물보다 더 멀리 떨어져 있는) 경우, 배양 장치 내의 콜로니는 제2 타입(예컨대, "비-기체 생성"; 도 5의 단계 64 참조)으로서 계수된다.
선택적으로, 추가 단계(도시되지 않음)가 도 5에 예시된 계수 규칙에 추가될 수 있다. 추가 단계는 단계 61 이후 그리고 단계 63 또는 단계 64 이전의 임의의 시점에서 단계들의 시퀀스에 삽입될 수 있다. 제1 추가 단계는 각각의 기포의 맵 위치를 이미지 내의 기포의 크기(예컨대, 직경 또는 면적)와 관련시킨다. 제2 추가 단계는 기포의 크기를 사전결정된 크기 값(또는 사전결정된 크기 값들의 범위)과 비교하여, 특정 기포의 크기가 사전결정된 크기 값보다 작은지, 그보다 큰지 또는 그와 동일한지를 판정하거나, 특정 기포의 크기가 사전결정된 범위 내에 있는지를 판정한다. 따라서, 추가 단계를 포함하는 계수 규칙은 각각의 기포와 연관된 2개의 파라미터(즉, 기포의 크기, 및 콜로니에 대한 기포의 근접도)를 이용하여, 기포가 미생물 활동과 연관되는지의 판정을 행한다(즉, 미생물 콜로니가 기체 생성 미생물 콜로니로서 계수되어야 하는지를 판정한다).
본 방법의 일부 실시예에서, 미생물 콜로니를 기체 생성 미생물 콜로니로서 식별하는 것은, 작업자가 콜로니 내의 미생물이 속하는 특정 부류 또는 그룹을 식별하도록 허용할 수 있다. 예를 들어, 배양 배지가 그램-네거티브 장내 세균의 증식을 촉진하는 영양분 및 선택적 제제를 포함하고, 배양 배지 내의 발효성 영양분이 락토오스인 경우, 미생물은 추정적으로 대장균류(coliform bacteria)로 알려진 세균의 그룹에 속하는 것으로서 식별될 수 있다. 다른 예에서, 배양 배지가 그램-네거티브 장내 세균의 증식을 촉진하는 영양분 및 선택적 제제를 포함하고, 배양 배지 내의 발효성 영양분이 글루코오스인 경우, 미생물은 추정적으로 엔테로박테리아세아에로 알려진 세균의 군(family)에 속하는 것으로서 식별될 수 있다.
도 6은 박막 배양 장치의 증식 영역의 일부분의 흑백 이미지를 도시한다. 이미지는, 예 1에 기술된 바와 같이, 배양 장치의 배면만을 조명하는 동안 획득되었다. 복수의 미생물 콜로니(71 내지 73)가 증식 영역 내에 있다. 복수의 기포(81 내지 84)가 또한 도 6에 도시된다. 기포(81 내지 83)는 기포에 근접한(즉, 약 3개의 콜로니 직경 이하의 거리 내에 있는) 하나 이상의 미생물 콜로니(예컨대, 콜로니(71))보다 큰 면적을 갖는 것이 관찰될 수 있다. 따라서, 본 발명의 방법에 따르면, 3개의 기포(기포(81 내지 83)) 모두가 "생물기원" 기포로 간주될 것이다(즉, 그들은 샘플 내의 미생물에 의해 생성되었음). 대조적으로, 배양 장치의 증식 영역 내에 배양 배지 전체에 걸쳐 분포된 많은 매우 작은 기포(84)가 있다. 이들 기포(즉, 기포(84))는 배양 장치가 접종된 직후에(즉, 미생물 콜로니가 배양 장치에서 나타나기 몇 시간 전에) 배양 장치 내에서 눈에 띄기 때문에, 그리고 기포의 면적(체적)이 장기간 배양 후에 증가하지 않기 때문에(예컨대, 일반적으로, 그들은 전형적인 미생물 콜로니 직경보다 상당히 더 작은 채로 유지됨), 그들은, 상기에 논의된 바와 같이, "자연발생" 기포로 간주된다(즉, 그들은 샘플 내의 미생물에 의해 생성되지 않음). 배양 장치의 증식 영역의 일부분의 라인 스캔의 경로(90)가 또한 도 6에 도시된다. 경로(90)는 기포(82)를 포함하는 이미지의 일부분을 횡단한다.
기포의 면적을 결정하기 위해 도 6에 도시된 이미지의 더 큰 부분을 분석했을 때, 이러한 이미지에 대해, 대략 90개의 자연발생 기포(즉, 기포(84))의 평균 면적이 50 픽셀 이하인 것으로 관찰되었다(즉, 약 50 픽셀의 면적이 상대적으로 작은 자연발생 기포의 크기 상한을 나타냄). 대조적으로, 도 6의 2차원 이미지 내의 생물기원(즉, 미생물 활동과 연관됨) 기포(81 내지 83) 각각의 개별 면적은, 각각, 대략 625 픽셀, 1125 픽셀, 및 875 픽셀이었다. 따라서, 자연발생 기포(즉, 약 50 픽셀 이하의 면적을 갖는 기포)들의 상대적으로 조밀한 클러스터와, 생물기원 기포(즉, 약 500 픽셀 이상의 면적을 갖는 기포)들의 상대적으로 성긴 클러스터 사이의 크기에 있어서의 갭은, 특정 이미지 내의 생물기원 기포를 지정하는 데 사용될 수 있는 더 낮은 임계값(예컨대, 약 75 픽셀, 약 100 픽셀, 약 200 픽셀, 또는 약 250 픽셀)을 설정하는 데 사용될 수 있다. 임의의 실시예에서, 이러한 임계치는 동적 계산(즉, 특정 배양 장치의 특정 이미지의 기포 집단에 기초하여 계산됨)을 사용하여 설정될 수 있는데, 이 동적 계산은 자연발생 기포 그룹의 최대 크기 파라미터 값의 설정된 퍼센트(예컨대, 약 125%, 약 200%, 약 300%, 약 400%)를 그 임계치의 근거로 한다.
따라서, 본 발명의 방법에 따르면, 기포는 다음의 2개 이상의 그룹으로 분류될 수 있다; 약 50 픽셀 이하의 2차원 면적을 갖는 제1 그룹, 및 약 50 픽셀 초과의 2차원 면적을 갖는 제2 그룹. 따라서, (예컨대, 크기에 따라) 제1 그룹으로 분류된 기포는 자연발생 기포로 의심되는 것(즉, 아마도 미생물과 연관되지 않음)으로서 식별될 수 있다. 반대로, (예컨대, 크기에 따라) 제2 그룹으로 분류된 기포는 생물기원 기포로 의심되는 것(즉, 아마도 미생물과 연관됨)으로서 식별될 수 있다. 본 방법의 임의의 실시예에서, 크기 하한이 제2 그룹에 대해 할당될 수 있다. 예를 들어, 제2 그룹에 대한 크기 하한은 자연발생 기포의 추정된 크기 상한보다 50% 이상 더 큰, 100% 이상 더 큰, 또는 150% 이상 더 큰 크기 파라미터 값일 수 있다. 본 방법에 따르면, 제1 그룹의 크기 상한과 제2 그룹의 크기 하한 사이에 속하는 크기 파라미터 값을 갖는 기포를 갖는 임의의 배양 장치는 선택적으로 기술자에 의한 검토를 위해 플래깅(flagging)될 수 있다.
본 방법의 일부 실시예에서, 생물기원 기포로 의심되는 것에 대한 크기 상한이 (예컨대, 주어진 미생물에 대한 생물기원 기포의 최대 크기를 확립하기 위해 대조 배양 장치를 운영함으로써) 할당될 수 있다. 이들 실시예에서, 제2 그룹의 크기 상한을 초과하는 기포는 제3 그룹으로 분류될 것이다. 제3 그룹은, 예를 들어, 접종 동안 배양 장치 내로 도입되었을 수 있는 상대적으로 큰 자연발생 기포를 포함하며, 이는 작업자 사용 문제를 나타낼 수 있다. 크기 상한을 초과하는 기포가 이미지에서 관찰될 때, 주의 메시지가 작업자에게 포스팅(posting)될 수 있다.
도 7은 도 6에 도시된 박막 배양 장치의 동일한 부분의 흑백 이미지를 도시한다. 이미지는, 예 1에 기술된 바와 같이, 배양 장치의 전면만을 조명하는 동안 획득되었다. 생물기원 기포(즉, 도 6의 기포(81 내지 83))가 보이지만, 배양 배지와 생물기원 기포 사이의 대비가 상당히 더 낮다. 또한, 기포의 외측 에지는 도 6의 배면 조명 이미지에서처럼 도 7의 이미지에서 명확하게 그려져 있지 않다. 도 6에 도시된 증식 영역의 부분의 라인 스캔의 경로(91)가 또한 도 7에 도시된다. 경로(91)는 도 6의 경로(90)에서의 것들과 동일한 픽셀들에 대응한다.
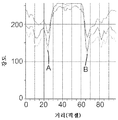
배면 조명된 이미지 내의 콜로니의 존재 및 위치를 식별하고, 전면 조명된 이미지 내의 미생물 콜로니의 존재 및 위치를 식별하기 위해, 이미지 분석 알고리즘이 종종 디지털 이미지 내의 픽셀들을 라인별로 분석하여, 제1 픽셀 또는 제1 픽셀 그룹의 색조 및/또는 색상 강도를, 제1 픽셀에 근접한 제2 픽셀 또는 제1 픽셀 그룹에 근접한 제2 픽셀 그룹의 색조 및/또는 색상 강도와 비교한다. 이러한 타입의 비교는 알고리즘이 이미지 내의 미생물 콜로니, 기포, 또는 다른 대상의 에지를 나타낼 수 있는 색상 및/또는 강도 변화를 인식할 수 있게 한다. 도 8은 도 6의 배면 조명된 이미지 내의 라인(90)을 따른 픽셀들로부터의 적색, 녹색, 및 청색에 대한 투과된 색상 강도의 그래프를 도시한다. 기포의 주연부의 대향 에지들과 연관된 암 환형부에 의해 입증된 바와 같은, 기포의 선명한 경계는 그래프에서 첨예한 네거티브 피크(negative peak)(각각, A 및 B)로서 보여질 수 있다. 도 9는 도 7의 전면 조명된 이미지 내의 라인(91)을 따른 픽셀들로부터 획득된 적색, 녹색, 및 청색에 대한 반사된 픽셀 강도의 그래프를 도시한다.
이미지를 분석하여 박막 배양 장치 내의 기포의 존재 및 개별 크기를 식별하는 방법을 제공하는 것에 더하여, 본 발명은 또한 이미지를 분석하여 박막 배양 장치 내의 특정 기포(예컨대, "제1" 기포)의 2차원 상황(two dimensional context)을 식별하는 방법을 제공한다. 제1 기포의 "2차원 상황"은 제1 기포에 근접한 사전규정된 영역 내의 다른 기포의 존재 또는 부존재를 말한다. 근접 기포의 존재 및 개수는, 제1 기포가 생물기원 기포로 의심되는 것인지(즉, 아마도 미생물 활동과 연관됨) 또는 자연발생 기포로 의심되는 것인지(즉, 아마도 미생물 활동과 연관되지 않음)를 판정하는 데 사용될 수 있다.
예로서, 도 10a는 도 6의 이미지에 도시된 박막 배양 장치의 더 큰 부분의 이미지를 도시한다. 도 10a에서, 미생물 콜로니(71, 72, 73, 74, 75)는 배양 배지 내에 존재하는 발색성 지표와의 그들의 상호작용에 의해 명백하다. 자연발생 기포(84) 및 생물기원 기포(81, 82, 83, 85, 86, 87)가 또한 도 10a에서 명백하다. 일 태양에서, 생물기원 기포(81 내지 83, 85 내지 87)는, 본 명세서에 기술된 바와 같이, 그들 각자의 크기 및/또는 미생물 콜로니에 대한 근접도에 기초하여 생물기원인 것으로서 식별될 수 있다. 다른 태양에서, 생물기원 기포는 그의 2차원 상황에 기초하여 식별될 수 있다. 도 10a는, 자연발생 기포가 미생물 콜로니를 포함하지 않는 배양 배지의 영역에 실질적으로 균일하게 분산되어 있지만(도 10b 참조), 자연발생 기포의 크기가 실질적으로 더 작거나, 자연발생 기포가 하나 이상의 미생물 콜로니를 포함하는 배양 배지의 영역(예컨대, 도 10a의 영역(101, 102, 103))에는 실질적으로 부존재함을 보여준다. 이러한 관찰된 현상은, 특정 의심 기포에 근접한 미생물 콜로니를 관찰할 필요 없이, 생물기원 기포로 의심되는 것을 식별하는 데 사용될 수 있다.
박막 배양 장치의 이미지 내의 특정 기포의 2차원 상황을 분석하기 위한 하나의 기술은 배양 장치의 증식 영역의 이미지를 복수의 소구역(subdivision)으로 나누고 - 각각의 소구역은 균일한 사전결정된 크기 및 형상을 가짐 -, 각각의 소구역 내의 기포의 개수를 계수하는 것이다. 이는, 예를 들어, 이미지 분석 분야에 공지된 마스킹 기술에 의해 행해질 수 있다. 도 10b 내지 도 10d는 균일한 크기 및 형상의 마스크 또는 프레임에 의해 둘러싸인 표시된 영역(각각, 영역 A1, 영역 A2, 영역 A3)을 갖는 도 10a의 이미지를 도시한다. 어떤 미생물 콜로니도 포함하지 않는 영역 A1이 대략 34개의 상대적으로 작은, 실질적으로 균일하게 분포된 자연발생 기포를 포함한다는 것이 관찰될 수 있다. 대조적으로, 2개 이상의 미생물 콜로니를 포함하는 영역 A2(도 10c)는 영역 A2에 실질적으로 균일하게 분포되지 않은 총 대략 7개의 기포를 포함한다. 또한, 하나의 미생물 콜로니를 포함하는 영역 A3(도 10d)은 총 약 25개의 상대적으로 작은, 실질적으로 균일하게 분포된 자연발생 기포를 포함한다.
본 발명의 방법에 따르면, 박막 배양 장치의 이미지를 분석하는 단계는, 복수의 영역을 분석하여 그 영역 내에 존재하는 기포의 개수를 검출하는 단계를 포함할 수 있다. 임의의 실시예에서, 영역들 중 2개 이상이 겹칠 수 있다. 실시예에서, 각각의 영역을 분석하는 데 사용되는 마스크는 이웃하는 영역들 사이의 차이를 관찰하고, 이로써 미생물 콜로니를 포함할 수 있는 (이미지 내의) 특정 관심 영역을 식별하기 위해 이미지를 가로질러 라인별로 래스터(raster)될 수 있다. 관심 영역(예컨대, 도 10a의 영역(101, 102, 103))은 이미지 내의 다른 영역(예컨대, 유사한 크기의 영역)에 비한, 관심 영역 내의 기포의 더 낮은 개수에 의해 식별될 수 있다.
본 발명의 방법에 따르면, 이미지를 분석하는 단계는 이미지의 의심 영역(예컨대, 전술된 관심 영역들 중 하나 이상)을 식별하는 단계를 추가로 포함할 수 있으며, 여기서 의심 영역은 이미지의 다른 부분에 비해 상당히 감소된 기포 개수를 갖는다. 이들 경우에, 의심 영역의 일부분(예컨대, 의심 영역의 중심 부분) 내의 기포의 존재는 미생물 활동과 연관된 생물기원 기포의 존재를 나타낼 수 있다. 이러한 상황이 검출된 때, 의심 영역 내에서 검출된 기포의 크기는 의심 영역 내의 기포가 생물기원 기포임을 확인시켜 줄 수 있다. 의심 영역 내의 기포의 크기가 이미지의 다른 영역 내에서 검출된 자연발생 기포보다 큰 경우, 이는 기포가 생물기원임을 강하게 나타낸다. 그의 크기에 무관하게, 의심 영역(즉, 이미지 내의 배양 배지의 다른 영역보다 상당히 더 적은 기포를 갖는 이미지의 영역) 내에 위치된 미생물 콜로니에 근접한 기포는 생물기원 기포일 수 있고, 배양 장치는 기체 생성 미생물에 대해 양성인 것으로서 보고될 수 있다. 대안적으로 또는 부가적으로, 이미지는 작업자에 의한 검토를 위해 플래깅될 수 있다.
박막 배양 장치의 이미지 내의 기포 및/또는 미생물 콜로니를 구분하기 위한 계수 규칙을 갖는 스캐닝 시스템 및/또는 이미지 분석 시스템의 사용이 기술되었다. 계수 규칙은 배양 장치 상의 미생물 콜로니의 자동화된 계수의 정확도를 개선하기 위해 스캐닝 시스템에서 사용될 수 있다.
박막 배양 장치의 이미지를 분석하기 위한 전술된 기술은, 박막 배양 장치에 접종된 샘플 내의 미생물의 존재 또는 부존재를 검출하기 위한 방법에서 사용될 수 있다. 하나의 태양에서, 본 방법은 박막 배양 장치의 증식 영역의 이미지를 분석하여 기포를 검출하는 단계, 및 복수의 기포를 분류하는 단계를 포함하며, 여기서 복수의 기포를 분류하는 단계는 각각의 기포를 복수의 기포 각각과 연관된 크기 파라미터에 따라 제1 그룹 또는 제2 그룹에 할당하는 단계를 포함한다. 본 명세서에 기술된 바와 같이, 증식 영역의 이미지는 기포를 검출하기 위해 분석될 수 있다. 본 명세서에 개시된 바와 같이, 기포는 크기 파라미터에 따라 분류될 수 있고, 각각의 그룹에 대한 크기 상한 및/또는 크기 하한이 할당될 수 있다. 임의의 실시예에서, 기포를 제1 그룹 및 제2 그룹으로 분류하는 것은 기포들의 제1 서브세트를 제1 자연발생 기포 의심 그룹으로 분류하는 것을 포함할 수 있다. 이들 실시예에서, 본 방법은, 본 명세서에 기술된 바와 같이, 제1 자연발생 기포 의심 그룹에 대한 크기 파라미터 값 상한을 할당하는 단계를 추가로 포함한다. 임의의 실시예에서, 기포를 제1 그룹 및 제2 그룹으로 분류하는 것은 기포들의 제2 서브세트를 생물기원 기포 의심 그룹으로 분류하는 것을 포함할 수 있다. 이들 실시예에서, 본 방법은, 본 명세서에 기술된 바와 같이, 생물기원 기포 의심 그룹에 대한 크기 파라미터 값 하한을 할당하는 단계를 추가로 포함한다.
다른 태양에서, 본 방법은 박막 배양 장치의 증식 영역의 이미지의 제1 영역을 분석하여 제1 영역 내의 기포의 제1 개수를 검출하는 단계, 이미지의 제2 영역을 분석하여 제2 영역 내의 기포의 제2 개수를 검출하는 단계, 및 기포의 제1 개수를 기포의 제2 개수와 비교하는 단계를 포함한다. 제1 영역 및 제2 영역을 분석하는 단계는 이미지 마스크를 사용하여 제1 영역 및 제2 영역 내의 기포의 개수를 계수하는 단계를 포함할 수 있으며, 여기서 이미지 마스크는, 본 명세서에 기술된 바와 같이, 영역의 지정된 크기 및 형상을 한정한다. 임의의 실시예에서, 본 방법은 이미지의 제3 영역을 분석하여 제3 영역 내의 기포의 제3 개수를 검출하는 단계, 및 기포의 제1 개수 또는 기포의 제2 개수를 기포의 제3 개수와 비교하는 단계를 추가로 포함할 수 있다. 제1 영역, 제2 영역, 및/또는 제3 영역은 서로 이격될 수 있거나, 영역들 중 적어도 2개가 부분적으로 겹칠 수 있다.
또 다른 태양에서, 본 명세서에 기술된 방법들 중 2개 이상이 박막 배양 장치 내의 미생물의 존재 또는 부존재를 검출하기 위해 단일의 방법으로 조합될 수 있다. 예를 들어, 본 방법은 박막 배양 장치의 증식 영역의 이미지의 제1 영역을 분석하여 제1 영역 내의 기포의 제1 개수를 검출하는 단계, 이미지의 제2 영역을 분석하여 제2 영역 내의 기포의 제2 개수를 검출하는 단계, 기포의 제1 개수를 기포의 제2 개수와 비교하는 단계, 이미지를 분석하여 배양 장치의 증식 영역 내의 기포를 검출하는 단계, 및 복수의 기포를 분류하는 단계를 포함할 수 있으며, 여기서 복수의 기포를 분류하는 단계는 각각의 기포를 복수의 기포 각각과 연관된 크기 파라미터에 따라 제1 그룹 또는 제2 그룹에 할당하는 단계를 포함한다. 일부 실시예에서, 본 방법은 제1 영역, 제2 영역, 또는 제3 영역 중 임의의 영역 내의 기포가 제1 그룹에 할당되는지 또는 제2 그룹에 할당되는지를 판정하는 단계를 추가로 포함할 수 있다. 유리하게도, 이러한 실시예에서, 특정 기포의 크기가 그에 근접해 있는 기포의 개수 및 크기를 고려하는 상황에서 분석되며, 이로써 특정 기포가 생물기원인지 또는 자연발생인지를 확인하기 위해 2개의 별개의 기준을 사용한다.
기술들이 소프트웨어 구현되는 것으로 기술되었다. 그 경우에, 컴퓨터 판독가능 매체가 상기에 기술된 규칙들 중 하나 이상을 구현하는 프로세서 실행가능 명령어들을 저장한다. 예를 들어, 컴퓨터 판독가능 매체는 비-일시적 컴퓨터 판독가능 매체, 예를 들어 랜덤 액세스 메모리(RAM), 판독 전용 메모리(ROM), 비-휘발성 랜덤 액세스 메모리(NVRAM), 전기적 소거가능 프로그래밍 가능 판독 전용 메모리(EEPROM), 플래시 메모리 등을 포함할 수 있다. 컴퓨터 판독가능 매체는 또한 소프트웨어를 고객에게 전달하는 데 사용되는 CD-ROM과 같은 비-휘발성 메모리를 포함할 수 있다. 또한, 컴퓨터 판독가능 매체는, 예컨대, 인터넷과 같은 네트워크를 통해 소프트웨어를 전달하기 위한, 전자기 반송파를 포함할 수 있다.
그러나, 동일한 기술이 또한 하드웨어로 구현될 수 있다. 예시적인 하드웨어 구현은 주문형 집적 회로(ASIC), 필드 프로그래머블 게이트 어레이(FPGA), 특별히 설계된 하드웨어 컴포넌트, 또는 이들의 임의의 조합 내에서의 구현을 포함한다. 또한, 본 명세서에 기재된 기술들 중 하나 이상은 하드웨어, 소프트웨어 또는 펌웨어로 부분적으로 실행될 수 있다.
따라서, 본 발명은 박막 배양 장치 내의 미생물의 존재 또는 부존재를 검출하기 위한 컴퓨터 판독가능 명령어들을 포함하는 컴퓨터 판독가능 매체를 제공한다. 하나의 태양에서, 컴퓨터 판독가능 명령어들은, 프로세서에 의해 실행될 때, 프로세서를 포함하는 이미지 분석 시스템으로 하여금 박막 배양 장치의 제1 이미지를 분석하게 하며, 배양 장치는 전면 및 전면 반대편의 배면을 가지며; 여기서 제1 이미지는 본 명세서에 기술된 바와 같이 장치의 전면에 조명을 제공하는 동안 생성된다. 제1 이미지를 분석하는 것은 배양 장치 내의 제1 위치에서 미생물 콜로니를 식별하는 것을 포함한다. 컴퓨터 판독가능 명령어들은, 프로세서에 의해 실행될 때, 추가로 프로세서로 하여금 박막 배양 장치의 제2 이미지를 분석하게 하며; 여기서 제2 이미지는 장치의 배면에 조명을 제공하는 동안 생성된다. 제2 이미지를 분석하는 것은, 본 명세서에 기술된 바와 같이, 배양 장치 내의 제2 위치에서 기포를 식별하는 것을 포함한다. 컴퓨터 판독가능 명령어들은, 프로세서에 의해 실행될 때, 추가로 프로세서로 하여금 제1 위치가 제2 위치로부터 사전결정된 거리 내에 있는지를 판정하게 한다.
다른 태양에서, 컴퓨터 판독가능 명령어들은, 프로세서에 의해 실행될 때, 프로세서를 포함하는 이미지 분석 시스템으로 하여금 박막 배양 장치의 증식 영역의 이미지를 분석하여 기포를 검출하고, 복수의 기포를 분류하게 한다. 복수의 기포를 분류하는 것은, 본 명세서에 기술된 바와 같이, 각각의 기포를 복수의 기포 각각과 연관된 크기 파라미터에 따라 제1 그룹 또는 제2 그룹에 할당하는 것을 포함한다. 임의의 실시예에서, 기포를 제1 그룹 및 제2 그룹으로 분류하는 것은 기포들의 제1 서브세트를 제1 자연발생 기포 의심 그룹으로 분류하는 것을 포함할 수 있으며, 여기서 컴퓨터 판독가능 명령어들은 추가로 프로세서로 하여금 제1 자연발생 기포 의심 그룹에 대한 크기 파라미터 값 상한을 할당하게 한다. 임의의 실시예에서, 기포를 제1 그룹 및 제2 그룹으로 분류하는 것은 기포들의 제2 서브세트를 생물기원 기포 의심 그룹으로 분류하는 것을 포함할 수 있으며, 여기서 컴퓨터 판독가능 명령어들은 추가로 프로세서로 하여금 생물기원 기포 의심 그룹에 대한 크기 파라미터 값 하한을 할당하게 한다.
다른 태양에서, 컴퓨터 판독가능 명령어들은, 프로세서에 의해 실행될 때, 프로세서를 포함하는 이미지 분석 시스템으로 하여금, 박막 배양 장치의 증식 영역의 이미지의 제1 영역을 분석하여 제1 영역 내의 기포의 제1 개수를 검출하고, 이미지의 제2 영역을 분석하여 제2 영역 내의 기포의 제2 개수를 검출하고, 기포의 제1 개수를 기포의 제2 개수와 비교하게 한다. 임의의 실시예에서, 컴퓨터 판독가능 명령어들은 추가로 프로세서로 하여금 이미지의 제3 영역을 분석하여 제3 영역 내의 기포의 제3 개수를 검출하고, 기포의 제1 개수 또는 기포의 제2 개수를 기포의 제3 개수와 비교하게 한다. 임의의 실시예에서, 컴퓨터 판독가능 명령어들은 추가로 프로세서로 하여금 이미지를 분석하여 배양 장치의 증식 영역 내의 기포를 검출하고, 복수의 기포를 분류하게 하며, 여기서 복수의 기포를 분류하는 것은, 본 명세서에 기술된 바와 같이, 각각의 기포를 복수의 기포 각각과 연관된 크기 파라미터에 따라 제1 그룹 또는 제2 그룹에 할당하는 것을 포함한다. 일부 실시예에서, 컴퓨터 판독가능 명령어들은 추가로 프로세서로 하여금 제1 영역, 제2 영역, 또는 제3 영역 중 임의의 영역 내의 기포가 제1 그룹에 할당되는지 또는 제2 그룹에 할당되는지를 판정하게 한다.
임의의 실시예에서, 컴퓨터 판독가능 명령어들을 포함하는 컴퓨터 판독가능 매체는 본 명세서에 기술된 방법들 중 2개 이상을 포함하는 명령어들을 포함할 수 있다. 2개 이상의 방법은 기체 생성 미생물 콜로니의 검출의 정확도를 개선하기 위해 개별적으로 또는 조합되어 사용될 수 있다.
실시예
실시예 A는,
이미징 장치를 사용하여 박막 배양 장치의 제1 이미지를 생성하는 단계 - 배양 장치는 투명 막 커버 시트를 갖는 전면, 및 반투명 기재를 갖는 배면을 가지며,
제1 이미지는 장치의 전면에 조명을 제공하는 동안 생성되고,
배양 장치는 미생물에 의해, 제1 색상에 의해 관찰가능한 제1 생성물로 변환되는 지표 화합물을 포함하며,
배양 장치는 제1 타입의 미생물에 의해 기체로 변환될 수 있는 영양분을 포함함 -;
이미징 장치를 사용하여 박막 배양 장치의 제2 이미지를 생성하는 단계 - 제2 이미지는 장치의 배면에 조명을 제공하는 동안 생성됨 -;
제1 이미지를 분석하여 배양 장치 내의 제1 위치에서 미생물 콜로니를 식별하는 단계;
제2 이미지를 분석하여 배양 장치 내의 제2 위치에서 제1 기포를 식별하는 단계; 및
제1 위치가 제2 위치로부터 사전결정된 거리 내에 있는지를 판정하는 단계를 포함하는, 방법이다.
실시예 B는, 제1 이미지는 전면 조명:배면 조명의 제1 비로 장치를 조명하는 동안 생성되고, 제2 이미지는 제1 비보다 낮은, 전면 조명:배면 조명의 제2 비로 장치를 조명하는 동안 생성되는, 실시예 A의 방법이다.
실시예 C는, 제1 비는 약 100%:0%인, 실시예 B의 방법이다.
실시예 D는, 제2 비는 약 0%:100%인, 실시예 B 또는 실시예 C의 방법이다.
실시예 E는, 제1 기포는 제1 주연부를 포함하고, 제2 이미지를 분석하여 제1 기포를 식별하는 단계는 제1 주연부와 연관된 암 환형부를 식별하는 단계를 포함하는, 실시예 A 내지 실시예 D 중 어느 한 실시예의 방법이다.
실시예 F는, 제2 이미지를 분석하여 제1 기포를 식별하는 단계는 제1 기포의 크기 파라미터를 계산하는 단계를 포함하는, 실시예 A 내지 실시예 E 중 어느 한 실시예의 방법이다.
실시예 G는, 크기 파라미터는 반경, 직경, 또는 면적인, 실시예 F의 방법이다.
실시예 H는, 제2 이미지를 분석하여 제1 기포를 식별하는 단계는 제1 기포를 둘러싸는 제1 사전결정된 영역을 분석하여 제2 기포를 검출하는 단계를 포함하는, 실시예 A 내지 실시예 G 중 어느 한 실시예의 방법이다.
실시예 I는, 제1 사전결정된 영역은 미생물 콜로니를 포함하고, 상기 방법은 제1 사전결정된 영역 내의 기포의 개수를 제2 사전결정된 영역 내의 기포의 개수와 비교하는 단계를 추가로 포함하며, 제2 사전결정된 영역은 미생물 콜로니를 포함하지 않는, 실시예 H의 방법이다.
실시예 J는, 제1 기포의 크기 파라미터를 제2 기포의 크기 파라미터와 비교하는 단계를 추가로 포함하는, 실시예 F 내지 실시예 I 중 어느 한 실시예의 방법이다.
실시예 K는, 제1 이미지를 사용하여 배양 장치 내의 미생물 콜로니의 개수를 계수하는 단계를 추가로 포함하는, 실시예 A 내지 실시예 J 중 어느 한 실시예의 방법이다.
실시예 L은, 제1 이미지 및 제2 이미지를 사용하여 영양분을 기체로 변환시키는 미생물 콜로니의 개수를 계수하는 단계를 추가로 포함하는, 실시예 K의 방법이다.
실시예 M은, 제1 이미지 및 제2 이미지를 사용하여 영양분을 기체로 변환시키지 않는 미생물 콜로니의 개수를 계수하는 단계를 추가로 포함하는, 실시예 A 내지 실시예 L 중 어느 한 실시예의 방법이다.
실시예 N은, 지표 화합물은 테트라졸륨 염료를 포함하는, 실시예 A 내지 실시예 M 중 어느 한 실시예의 방법이다.
실시예 O는, 영양분은 탄수화물을 포함하는, 실시예 A 내지 실시예 N 중 어느 한 실시예의 방법이다.
실시예 P는, 탄수화물은 글루코오스, 수크로오스, 락토오스, 또는 상기 탄수화물들 중 임의의 2개 이상의 탄수화물의 조합으로 이루어진 군으로부터 선택되는, 실시예 O의 방법이다.
실시예 Q는 컴퓨터 판독가능 명령어들을 포함하는 컴퓨터 판독가능 매체로서, 컴퓨터 판독가능 명령어들은, 프로세서에 의해 실행될 때, 프로세서를 포함하는 이미지 분석 시스템으로 하여금:
박막 배양 장치의 제1 이미지를 분석하고 - 배양 장치는 전면 및 전면 반대편의 배면을 가지며,
제1 이미지는 장치의 전면에 조명을 제공하는 동안 생성되고,
제1 이미지를 분석하는 것은 배양 장치 내의 제1 위치에서 미생물 콜로니를 식별하는 것을 포함함 -;
박막 배양 장치의 제2 이미지를 분석하고 -
제2 이미지는 장치의 배면에 조명을 제공하는 동안 생성되고,
제2 이미지를 분석하는 것은 배양 장치 내의 제2 위치에서 기포를 식별하는 것을 포함함 -;
제1 위치가 제2 위치로부터 사전결정된 거리 내에 있는지를 판정하게 하는, 컴퓨터 판독가능 매체이다.
실시예 R은, 제2 이미지를 분석하여 기포의 제2 위치를 식별하는 것은 기포를 둘러싸는 암 환형부를 식별하는 것을 포함하는, 실시예 Q의 컴퓨터 판독가능 매체이다.
실시예 S는, 프로세서에서 실행될 때, 시스템으로 하여금 제1 이미지를 사용하여 배양 장치 내의 미생물 콜로니의 개수를 계수하게 하는 컴퓨터 판독가능 명령어들을 추가로 포함하는, 실시예 Q 또는 실시예 R의 컴퓨터 판독가능 매체이다.
실시예 T는, 프로세서에서 실행될 때, 시스템으로 하여금 제1 이미지 및 제2 이미지를 사용하여 배양 장치 내의 기체 생성 미생물 콜로니의 개수를 계수하게 하는 컴퓨터 판독가능 명령어들을 추가로 포함하는, 실시예 Q 또는 실시예 R의 컴퓨터 판독가능 매체이다.
실시예 U는,
박막 배양 장치의 증식 영역의 이미지를 분석하여 기포를 검출하는 단계; 및
복수의 기포를 분류하는 단계를 포함하며, 복수의 기포를 분류하는 단계는 각각의 기포를 복수의 기포 각각과 연관된 크기 파라미터에 따라 제1 그룹 또는 제2 그룹에 할당하는 단계를 포함하는, 방법이다.
실시예 V는, 기포를 제1 그룹 및 제2 그룹으로 분류하는 것은 기포들의 제1 서브세트를 제1 자연발생 기포 의심 그룹으로 분류하는 것을 포함하고, 상기 방법은 제1 자연발생 기포 의심 그룹에 대한 크기 파라미터 값 상한을 할당하는 단계를 추가로 포함하는, 실시예 T의 방법이다.
실시예 W는, 기포를 제1 그룹 및 제2 그룹으로 분류하는 것은 기포들의 제2 서브세트를 생물기원 기포 의심 그룹으로 분류하는 것을 포함하고, 상기 방법은 생물기원 기포 의심 그룹에 대한 크기 파라미터 값 하한을 할당하는 단계를 추가로 포함하는, 실시예 U 또는 실시예 V의 방법이다.
실시예 X는, 생물기원 기포 의심 그룹에 대한 크기 파라미터 값 하한은 제1 자연발생 기포 의심 그룹에 대한 크기 파라미터 값 상한보다 약 2배 이상 큰, 실시예 W의 방법이다.
실시예 Y는 컴퓨터 판독가능 명령어들을 포함하는 컴퓨터 판독가능 매체로서, 컴퓨터 판독가능 명령어들은, 프로세서에 의해 실행될 때, 프로세서를 포함하는 이미지 분석 시스템으로 하여금:
박막 배양 장치의 증식 영역의 이미지를 분석하여 기포를 검출하고;
복수의 기포를 분류하게 하며, 복수의 기포를 분류하는 것은 각각의 기포를 복수의 기포 각각과 연관된 크기 파라미터에 따라 제1 그룹 또는 제2 그룹에 할당하는 것을 포함하는, 컴퓨터 판독가능 매체이다.
실시예 Z는, 기포를 제1 그룹 및 제2 그룹으로 분류하는 것은 기포들의 제1 서브세트를 제1 자연발생 기포 의심 그룹으로 분류하는 것을 포함하고, 컴퓨터 판독가능 명령어들은 추가로 프로세서로 하여금 제1 자연발생 기포 의심 그룹에 대한 크기 파라미터 값 상한을 할당하게 하는, 실시예 Y의 컴퓨터 판독가능 매체이다.
실시예 AA는, 기포를 제1 그룹 및 제2 그룹으로 분류하는 것은 기포들의 제2 서브세트를 생물기원 기포 의심 그룹으로 분류하는 것을 포함하고, 컴퓨터 판독가능 명령어들은 추가로 프로세서로 하여금 생물기원 기포 의심 그룹에 대한 크기 파라미터 값 하한을 할당하게 하는, 실시예 Y 또는 실시예 Z의 컴퓨터 판독가능 매체이다.
실시예 BB는,
박막 배양 장치의 증식 영역의 이미지의 제1 영역을 분석하여 제1 영역 내의 기포의 제1 개수를 검출하는 단계;
이미지의 제2 영역을 분석하여 제2 영역 내의 기포의 제2 개수를 검출하는 단계; 및
기포의 제1 개수를 기포의 제2 개수와 비교하는 단계를 포함하는, 방법이다.
실시예 CC는,
이미지의 제3 영역을 분석하여 제3 영역 내의 기포의 제3 개수를 검출하는 단계; 및
기포의 제1 개수 또는 기포의 제2 개수를 기포의 제3 개수와 비교하는 단계를 추가로 포함하는, 실시예 BB의 방법이다.
실시예 DD는,
이미지를 분석하여 배양 장치의 증식 영역 내의 기포를 검출하는 단계; 및
복수의 기포를 분류하는 단계를 추가로 포함하며, 복수의 기포를 분류하는 단계는 각각의 기포를 복수의 기포 각각과 연관된 크기 파라미터에 따라 제1 그룹 또는 제2 그룹에 할당하는 단계를 포함하는, 실시예 BB 또는 실시예 CC의 방법이다.
실시예 EE는,
제1 영역, 제2 영역, 또는 제3 영역 중 임의의 영역 내의 기포가 제1 그룹에 할당되는지 또는 제2 그룹에 할당되는지를 판정하는 단계를 추가로 포함하는, 실시예 DD의 방법이다.
실시예 FF는 컴퓨터 판독가능 명령어들을 포함하는 컴퓨터 판독가능 매체로서, 컴퓨터 판독가능 명령어들은, 프로세서에 의해 실행될 때, 프로세서를 포함하는 이미지 분석 시스템으로 하여금:
박막 배양 장치의 증식 영역의 이미지의 제1 영역을 분석하여 제1 영역 내의 기포의 제1 개수를 검출하고;
이미지의 제2 영역을 분석하여 제2 영역 내의 기포의 제2 개수를 검출하고;
기포의 제1 개수를 기포의 제2 개수와 비교하게 하는, 컴퓨터 판독가능 매체이다.
실시예 GG는, 컴퓨터 판독가능 명령어들은 추가로 프로세서로 하여금:
이미지의 제3 영역을 분석하여 제3 영역 내의 기포의 제3 개수를 검출하고;
기포의 제1 개수 또는 기포의 제2 개수를 기포의 제3 개수와 비교하게 하는, 실시예 FF의 컴퓨터 판독가능 매체이다.
실시예 HH는, 컴퓨터 판독가능 명령어들은 추가로 프로세서로 하여금:
이미지를 분석하여 배양 장치의 증식 영역 내의 기포를 검출하고;
복수의 기포를 분류하게 하며, 복수의 기포를 분류하는 것은 각각의 기포를 복수의 기포 각각과 연관된 크기 파라미터에 따라 제1 그룹 또는 제2 그룹에 할당하는 것을 포함하는, 실시예 FF 또는 실시예 GG의 컴퓨터 판독가능 매체이다.
실시예 II는, 컴퓨터 판독가능 명령어들은 추가로 프로세서로 하여금 제1 영역, 제2 영역, 또는 제3 영역 중 임의의 영역 내의 기포가 제1 그룹에 할당되는지 또는 제2 그룹에 할당되는지를 판정하게 하는, 실시예 HH의 컴퓨터 판독가능 매체이다.
예
예
1. 기체
생성
콜로니를
검출하기 위한 방법
TSB(Tryptic Soy Broth, 카탈로그 # K89)를 하디 다이어그노스틱스(Hardy Diagnostics)(미국 캘리포니아주 산타 마리아 소재)로부터 입수하였다. 미생물 균주들 대장균(ATCC 25922), 대장균(3M-FR4), 살모넬라 엔테리카(Salmonella enterica)(ATCC 51812) 및 엔테로박터 암니지너스(Enterobacter amnigenus)(ATCC 51898)를 마이크로바이오로직스 인크(Microbiologics Inc)(미국 미네소타주 세인트 클라우드 소재)로부터 입수하였다. 하룻밤 TSB 배양을 각각의 미생물 균주에 대해 준비하였다. 박막 배양 장치(쓰리엠 페트리필름 대장균/대장균형 계수(EC) 플레이트) 및 버터필드스 포스페이트 버퍼(Butterfield's Phosphate Buffer) 둘 모두를 쓰리엠 컴퍼니(미국 미네소타주 세인트 폴 소재)로부터 입수하였다.
각각의 균주의 하룻밤 배양으로부터의 희석물을 버터필드스 포스페이트 버퍼에서 준비하여 대략 25 CFU(colony-forming unit)/mL를 산출하였다. 투명 막 커버 시트를 들어올리고, 1 mL의 희석된 샘플을 코팅된 하부 막의 중심에 피펫팅하고, 커버 시트를 제자리에 내려놓음으로써, 쓰리엠 페트리필름 플레이트에 접종하였다. 제조사(쓰리엠)에 의해 제공되는 스프레딩(spreading) 장치를 사용하여 샘플을 원하는 표면적(대략 20 ㎠)으로 균일하게 스프레딩하였다. 접종된 플레이트를 35℃에서 24시간 동안 배양하였다.
배양 장치 이미징 시스템을 사용하여 페트리필름 배양 플레이트 상의 콜로니를 이미징하고 식별하였다. 이미징 시스템은 배양 플레이트의 배치를 위한 플랫폼으로서의 역할을 하는 중앙에 위치된 유리 플래튼(백색 플래시드 오팔 유리(White Flashed Opal Glass))을 포함하였다. 발광 다이오드들의 2개의 별개의 세트(각각의 세트는 2개의 적색 LED, 2개의 녹색 LED, 및 2개의 청색 LED를 포함함)를 사용하여 배양 플레이트를 조명하였다. 하나의 세트를 배양 플레이트의 (종방향 차원에 대해) 좌측 위쪽에 위치시키고, 다른 세트를 (배양 플레이트의 종방향 차원에 대해) 우측 위쪽에 위치시켰다. 배양 장치 위쪽에 위치된 LED로부터의 광은 배양 장치로부터 멀어지는 쪽으로 그리고 광-확산 반사성 표면 내로 지향되었으며, 이 광-확산 반사성 표면은 실질적으로 균일한 조명 패턴을 배양 플레이트의 전면 상에 지향시켰다. 유사하게, 발광 다이오드들의 2개의 별개의 세트(각각의 세트는 2개의 적색 LED, 2개의 녹색 LED, 및 2개의 청색 LED를 포함함)를 사용하여 배양 플레이트를 배면에서 조명하였다. 하나의 세트를 배양 플레이트의 (종방향 차원에 대해) 좌측 아래쪽에 위치시키고, 다른 세트를 (배양 플레이트의 종방향 차원에 대해) 우측 아래쪽에 위치시켰다. 배양 장치 아래쪽에 위치된 LED로부터의 광은 배양 장치로부터 멀어지는 쪽으로 그리고 광-확산 반사성 표면 내로 지향되었으며, 이 광-확산 반사성 표면은 실질적으로 균일한 조명 패턴을 (상기에 기술된) 유리 플래튼의 배면 상으로 지향시키고, 배양 플레이트의 배면 상에 균일한 조명 패턴을 생성하였다.
앱티나(Aptina) 모델 MT9P031 CMOS 이미징 센서(앱티나 이미징(Aptina Imaging), 미국 캘리포니아주 산호세 소재)를 플랫폼 위쪽에 직교로 위치시키고, 배양 플레이트의 이미지를 취득하도록 위치시켰다. 배양 플레이트가 센서의 초점면(focal plane) 내에 위치되도록 이미징 센서 및 플랫폼을 조정하였다. 배양 플레이트의 전면(투명 막 측)이 이미징 센서를 향하도록 배양 플레이트를 플랫폼 상에 배향시켰다. 흑색 커버를 사용하여 이미징 장치를 실내 광으로부터 격리시켰다. 취득된 이미지에서, 이미지 픽셀들 전부의 히스토그램에서 픽셀들 중 약 10% 미만이 포화되도록 이미지 노출을 선택하였다. 배양 플레이트의 전면으로부터의 조명만을 사용하여 제1 이미지를 취득하였고, 배양 플레이트의 배면으로부터의 조명만을 사용하여 제2 이미지를 취득하였다. 배양 플레이트가 플랫폼 상의 정확히 동일한 위치에 유지되는 상태에서 둘 모두의 이미지를 취득하였다(즉, 둘 모두의 이미지가 취득될 때까지 플레이트는 플랫폼으로부터 이동되지 않았음). 이는 대응하는 X-Y 좌표 위치들을 정합시킴으로써 2개의 이미지 내의 일치하는 콜로니의 식별을 허용하였다.
이미지프로 플러스(ImagePro Plus) 소프트웨어(미디어 사이버네틱스(Media Cybernetics), 미국 메릴랜드주 로크빌 소재)를 사용하여 2개의 이미지를 분석하였다. 개별 콜로니의 크기를, 제1 배양 플레이트 이미지(100% 전면 조명)로부터 결정하였다. 이미징 프로그램은 의심 콜로니의 이미지의 가장 긴 차원을 포함하는 픽셀들의 라인을 따라 관찰된 적색, 녹색, 및 청색 픽셀 강도의 변화에 대해 분석하였다. 국부 배경에 대한 강도의 변화를 규정한 픽셀 위치를 사용하여, 콜로니 이미지의 가장자리를 마킹하고, 콜로니 직경을 측정하였다(직경 거리는 콜로니 가장자리를 마킹하는 픽셀 포인트들 사이에 위치된 픽셀의 개수로서 보고되었음).
기포의 직경을, 제2 배양 플레이트 이미지(100% 배면 조명)를 사용하여 결정하였다. 이미징 프로그램은 기포 이미지의 가장 긴 차원을 포함하는 픽셀들의 라인을 따라 관찰된 픽셀 색상 강도의 변화에 대해 분석하였다. RGB(적색/녹색/청색) 이미지 처리 기술을 사용하였으며, 이때 녹색 채널이 이러한 배양 장치에 사용되는 특정한 증식 배지 내의 기포를 식별하도록 가장 큰 대비를 제공하였다. 국부 배경 색상 강도에 비한 픽셀 색상 강도에 있어서 급격한 감소가 발생한 픽셀 위치를 식별하였고, 기포의 주연부에 암 환형부를 한정하는 위치로서 마킹하였다. 기포의 직경은, 2개의 식별된 픽셀 위치 사이의 픽셀의 개수를 계수함으로써 측정하였다.
다음 단계에서, 이미징 프로그램은 (제2 배양 플레이트 이미지로부터 획득된) 기포 이미지의 크기 및 근접도 둘 모두를 (제1 배양 플레이트 이미지로부터 획득된) 가장 가까운 콜로니 이미지의 크기 및 위치와 비교하였고, 상기에 기술된 기포 크기 및 근접도 기준을 적용하였다. 이 기준에 따르면, 도 6의 기포(81, 82, 83)가 모두 콜로니(71)와 연관되고, 또한, 적어도 기포(81)가 콜로니(73)와 연관된다고 결론을 내릴 수 있다. 도 6의 콜로니(72)와 연관된 생물기원 기포는 없는 것으로 또한 결론을 내릴 수 있다.
어느 경우에서도, 본 발명의 사상 및 범주를 벗어남이 없이 다양한 변경이 이루어질 수 있다. 예를 들어, 본 명세서에 기술된 규칙들 중 하나 이상이 다른 규칙과 함께 또는 다른 규칙 없이도 사용될 수 있으며, 규칙들의 다양한 서브세트가, 원하는 구현에 따라, 임의의 순서로 적용될 수 있다. 이들 및 다른 실시예는 하기의 청구범위의 범주 내에 있다.
Claims (20)
- 이미징 장치를 사용하여 박막 배양 장치의 제1 이미지를 생성하는 단계 - 상기 배양 장치는 투명 막 커버 시트를 갖는 전면(front side), 및 반투명 기재(substrate)를 갖는 배면(back side)을 가지며, 상기 제1 이미지는 상기 장치의 상기 전면에 조명을 제공하는 동안 생성되고, 상기 배양 장치는 미생물에 의해, 제1 색상에 의해 관찰가능한 제1 생성물로 변환되는 지표 화합물(indicator compound)을 포함하며, 상기 배양 장치는 제1 타입의 미생물에 의해 기체로 변환될 수 있는 영양분을 포함함 -;
상기 이미징 장치를 사용하여 상기 박막 배양 장치의 제2 이미지를 생성하는 단계 - 상기 제2 이미지는 상기 장치의 상기 배면에 조명을 제공하는 동안 생성됨 -;
상기 제1 이미지를 분석하여 상기 배양 장치 내의 제1 위치에서 미생물 콜로니(microorganism colony)를 식별하는 단계;
상기 제2 이미지를 분석하여 상기 배양 장치 내의 제2 위치에서 제1 기포를 식별하는 단계; 및
상기 제1 위치가 상기 제2 위치로부터 사전결정된 거리 내에 있는지를 판정하는 단계를 포함하는, 방법. - 제1항에 있어서, 상기 제1 이미지는 전면 조명:배면 조명의 제1 비(ratio)로 상기 장치를 조명하는 동안 생성되고, 상기 제2 이미지는 상기 제1 비보다 낮은, 전면 조명:배면 조명의 제2 비로 상기 장치를 조명하는 동안 생성되는, 방법.
- 제1항 또는 제2항에 있어서, 상기 제1 기포는 제1 주연부(perimeter)를 포함하고, 상기 제2 이미지를 분석하여 제1 기포를 식별하는 단계는 상기 제1 주연부와 연관된 암 환형부(dark annulus)를 식별하는 단계를 포함하는, 방법.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 상기 제2 이미지를 분석하여 제1 기포를 식별하는 단계는 상기 제1 기포의 크기 파라미터를 계산하는 단계를 포함하는, 방법.
- 제1항 내지 제4항 중 어느 한 항에 있어서, 상기 제2 이미지를 분석하여 제1 기포를 식별하는 단계는 상기 제1 기포를 둘러싸는 제1 사전결정된 영역을 분석하여 제2 기포를 검출하는 단계를 포함하는, 방법.
- 제5항에 있어서, 상기 제1 사전결정된 영역은 미생물 콜로니를 포함하고, 상기 방법은 상기 제1 사전결정된 영역 내의 기포의 개수를 제2 사전결정된 영역 내의 기포의 개수와 비교하는 단계를 추가로 포함하며, 상기 제2 사전결정된 영역은 미생물 콜로니를 포함하지 않는, 방법.
- 제4항 내지 제6항 중 어느 한 항에 있어서, 상기 제1 기포의 상기 크기 파라미터를 제2 기포의 크기 파라미터와 비교하는 단계를 추가로 포함하는, 방법.
- 제1항 내지 제7항 중 어느 한 항에 있어서, 상기 제1 이미지를 사용하여 상기 배양 장치 내의 미생물 콜로니의 개수를 계수하는 단계를 추가로 포함하는, 방법.
- 제8항에 있어서, 상기 제1 이미지 및 상기 제2 이미지를 사용하여 상기 영양분을 기체로 변환시키는 미생물 콜로니의 개수를 계수하는 단계를 추가로 포함하는, 방법.
- 컴퓨터 판독가능 명령어들을 포함하는 컴퓨터 판독가능 매체로서, 상기 컴퓨터 판독가능 명령어들은, 프로세서에 의해 실행될 때, 상기 프로세서를 포함하는 이미지 분석 시스템으로 하여금:
박막 배양 장치의 제1 이미지를 분석하고 - 상기 배양 장치는 전면 및 상기 전면 반대편의 배면을 가지며, 상기 제1 이미지는 상기 장치의 상기 전면에 조명을 제공하는 동안 생성되고, 상기 제1 이미지를 분석하는 것은 상기 배양 장치 내의 제1 위치에서 미생물 콜로니를 식별하는 것을 포함함 -;
상기 박막 배양 장치의 제2 이미지를 분석하고 - 상기 제2 이미지는 상기 장치의 상기 배면에 조명을 제공하는 동안 생성되고, 상기 제2 이미지를 분석하는 것은 상기 배양 장치 내의 제2 위치에서 기포를 식별하는 것을 포함함 -;
상기 제1 위치가 상기 제2 위치로부터 사전결정된 거리 내에 있는지를 판정하게 하는, 컴퓨터 판독가능 매체. - 제10항에 있어서, 상기 제2 이미지를 분석하여 기포의 제2 위치를 식별하는 것은 상기 기포를 둘러싸는 암 환형부를 식별하는 것을 포함하는, 컴퓨터 판독가능 매체.
- 박막 배양 장치의 증식 영역의 이미지를 분석하여 기포를 검출하는 단계; 및
복수의 상기 기포를 분류하는 단계를 포함하며, 상기 복수의 기포를 분류하는 단계는 각각의 기포를 상기 복수의 기포 각각과 연관된 크기 파라미터에 따라 제1 그룹 또는 제2 그룹에 할당하는 단계를 포함하는, 방법. - 제12항에 있어서, 상기 기포를 제1 그룹 및 제2 그룹으로 분류하는 것은 기포들의 제1 서브세트(subset)를 제1 자연발생 기포 의심 그룹(suspect abiogenic bubble group)으로 분류하는 것을 포함하고, 상기 방법은 상기 제1 자연발생 기포 의심 그룹에 대한 크기 파라미터 값 상한을 할당하는 단계를 추가로 포함하는, 방법.
- 제12항 또는 제13항에 있어서, 상기 기포를 제1 그룹 및 제2 그룹으로 분류하는 것은 기포들의 제2 서브세트를 생물기원 기포 의심 그룹(suspect biogenic bubble group)으로 분류하는 것을 포함하고, 상기 방법은 상기 생물기원 기포 의심 그룹에 대한 크기 파라미터 값 하한을 할당하는 단계를 추가로 포함하는, 방법.
- 컴퓨터 판독가능 명령어들을 포함하는 컴퓨터 판독가능 매체로서, 상기 컴퓨터 판독가능 명령어들은, 프로세서에 의해 실행될 때, 상기 프로세서를 포함하는 이미지 분석 시스템으로 하여금:
박막 배양 장치의 증식 영역의 이미지를 분석하여 기포를 검출하고;
복수의 상기 기포를 분류하게 하며, 상기 복수의 기포를 분류하는 것은 각각의 기포를 상기 복수의 기포 각각과 연관된 크기 파라미터에 따라 제1 그룹 또는 제2 그룹에 할당하는 것을 포함하는, 컴퓨터 판독가능 매체. - 박막 배양 장치의 증식 영역의 이미지의 제1 영역을 분석하여 상기 제1 영역 내의 기포의 제1 개수를 검출하는 단계;
상기 이미지의 제2 영역을 분석하여 상기 제2 영역 내의 기포의 제2 개수를 검출하는 단계; 및
상기 기포의 제1 개수를 상기 기포의 제2 개수와 비교하는 단계를 포함하는, 방법. - 제16항에 있어서,
상기 이미지의 제3 영역을 분석하여 상기 제3 영역 내의 기포의 제3 개수를 검출하는 단계; 및
상기 기포의 제1 개수 또는 상기 기포의 제2 개수를 상기 기포의 제3 개수와 비교하는 단계를 추가로 포함하는, 방법. - 제16항 또는 제17항에 있어서,
상기 이미지를 분석하여 상기 배양 장치의 상기 증식 영역 내의 기포를 검출하는 단계; 및
복수의 상기 기포를 분류하는 단계를 추가로 포함하며, 상기 복수의 기포를 분류하는 단계는 각각의 기포를 상기 복수의 기포 각각과 연관된 크기 파라미터에 따라 제1 그룹 또는 제2 그룹에 할당하는 단계를 포함하는, 방법. - 제18항에 있어서,
상기 제1 영역, 상기 제2 영역, 또는 상기 제3 영역 중 임의의 영역 내의 기포가 상기 제1 그룹에 할당되는지 또는 상기 제2 그룹에 할당되는지를 판정하는 단계를 추가로 포함하는, 방법. - 컴퓨터 판독가능 명령어들을 포함하는 컴퓨터 판독가능 매체로서, 상기 컴퓨터 판독가능 명령어들은, 프로세서에 의해 실행될 때, 상기 프로세서를 포함하는 이미지 분석 시스템으로 하여금,
박막 배양 장치의 증식 영역의 이미지의 제1 영역을 분석하여 상기 제1 영역 내의 기포의 제1 개수를 검출하고;
상기 이미지의 제2 영역을 분석하여 상기 제2 영역 내의 기포의 제2 개수를 검출하고;
상기 기포의 제1 개수를 상기 기포의 제2 개수와 비교하게 하는, 컴퓨터 판독가능 매체.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201261739789P | 2012-12-20 | 2012-12-20 | |
| US61/739,789 | 2012-12-20 | ||
| PCT/US2013/074887 WO2014099644A1 (en) | 2012-12-20 | 2013-12-13 | Method of detecting gas-producing microbial colonies |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20150099779A true KR20150099779A (ko) | 2015-09-01 |
Family
ID=49958660
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020157018847A KR20150099779A (ko) | 2012-12-20 | 2013-12-13 | 기체 생성 미생물 콜로니를 검출하는 방법 |
Country Status (7)
| Country | Link |
|---|---|
| US (3) | US9684816B2 (ko) |
| EP (1) | EP2936387A1 (ko) |
| JP (1) | JP6366604B2 (ko) |
| KR (1) | KR20150099779A (ko) |
| CN (1) | CN104871177B (ko) |
| BR (1) | BR112015014821A2 (ko) |
| WO (1) | WO2014099644A1 (ko) |
Families Citing this family (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE102011086099A1 (de) * | 2011-11-10 | 2013-05-16 | Krones Aktiengesellschaft | Inspektion und Rückführung von Behältern |
| CN104871177B (zh) * | 2012-12-20 | 2018-03-27 | 3M创新有限公司 | 检测产气微生物菌落的方法 |
| FR3028867B1 (fr) * | 2014-11-26 | 2016-12-09 | Intelligence Artificielle Applications | Procede et dispositif de detection d'ensemencement et installation automatisee d'ensemencement equipee d'un tel dispositif de detection |
| KR102645495B1 (ko) * | 2015-04-29 | 2024-03-07 | 쓰리엠 이노베이티브 프로퍼티즈 컴파니 | 혐기성 미생물용 배양 장치 |
| WO2017100143A1 (en) | 2015-12-07 | 2017-06-15 | 3M Innovative Properties Company | Method of enumerating coliform colonies |
| CN109564681A (zh) * | 2016-05-27 | 2019-04-02 | 生物梅里埃有限公司 | 用于检测试样容器中的泡沫的方法和设备 |
| JP2018054356A (ja) * | 2016-09-27 | 2018-04-05 | 株式会社日本マイクロニクス | ガス検知用フィルム、ガス検知装置、及びガス検知方法 |
| CN110475869B (zh) * | 2017-04-03 | 2024-01-16 | 3M创新有限公司 | 在薄膜培养装置中快速检测大肠杆菌 |
| EP3628086A1 (en) * | 2017-05-05 | 2020-04-01 | Zymergen, Inc. | Microbial engineering methods and systems for optimizing microbe fitness |
| JP7011904B2 (ja) | 2017-07-31 | 2022-01-27 | 株式会社日立ハイテク | 装置、試料における気泡の状態の判別方法、及び分析システム |
| AU2019325508A1 (en) | 2018-08-22 | 2021-03-04 | Biomerieux, Inc. | Detection instruments with automated cell location selection for newly intaken specimen containers and related methods |
| CN109598739B (zh) * | 2018-12-14 | 2019-07-26 | 广州海洋地质调查局 | 一种水体中渗漏气泡数目的统计方法及处理终端 |
| US11403760B2 (en) * | 2019-02-21 | 2022-08-02 | Medtronic Navigation, Inc. | Method and apparatus for magnetic resonance imaging thermometry |
| US11426229B2 (en) | 2019-02-21 | 2022-08-30 | Medtronic Navigation, Inc. | Method and apparatus for magnetic resonance imaging thermometry |
| US11276174B2 (en) | 2019-02-21 | 2022-03-15 | Medtronic Navigation, Inc. | Method and apparatus for magnetic resonance imaging thermometry |
| CN111830216A (zh) * | 2019-04-18 | 2020-10-27 | 中国食品发酵工业研究院有限公司 | 一种快速预测食醋“涨(胀)气”的方法 |
| US11536621B2 (en) | 2020-03-31 | 2022-12-27 | Toyota Research Institute, Inc. | Methods and systems for calibrating deformable sensors using camera |
| EP4015617A1 (en) * | 2020-11-02 | 2022-06-22 | Airamatrix Private Limited | A device and a method for lighting, conditioning and capturing image(s) of organic sample(s) |
| CN112501241A (zh) * | 2020-12-03 | 2021-03-16 | 云南中烟工业有限责任公司 | 一种唾液产气微生物的分离方法 |
| CN118261910B (zh) * | 2024-05-29 | 2024-07-26 | 南昌千麦医学检验实验室有限公司 | 一种基于图像识别的菌株检测方法及系统 |
Family Cites Families (31)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4565783A (en) | 1981-01-27 | 1986-01-21 | Minnesota Mining And Manufacturing Company | Dry culture media |
| US5089413A (en) | 1989-05-19 | 1992-02-18 | Minnesota Mining And Manufacturing Company | Method and apparatus for culturing with microbiological dry culture medium |
| US6058209A (en) | 1991-09-27 | 2000-05-02 | E. I. Du Pont De Nemours And Company | Method for resolving redundant identifications of an object |
| US5364766A (en) | 1993-05-14 | 1994-11-15 | Minnesota Mining And Manufacturing Company | Culture medium for rapid count of coliform bacteria |
| EP0698084B1 (en) * | 1993-05-14 | 1998-06-24 | Minnesota Mining And Manufacturing Company | Method for rapid quantification of microorganism growth |
| US5723308A (en) * | 1993-05-14 | 1998-03-03 | Minnesota Mining And Manufacturing Company | Culture medium for rapid count of coliform bacteria |
| US5601998A (en) | 1994-08-18 | 1997-02-11 | Minnesota Mining & Mfg | Culture medium and device for detection and enumeration of enterobacteriaceae |
| US5694478A (en) | 1994-12-15 | 1997-12-02 | Minnesota Mining And Manufacturing Company | Method and apparatus for detecting and identifying microbial colonies |
| US5681712A (en) | 1995-06-02 | 1997-10-28 | Minnesota Mining And Manufacturing Company | Surface colony counting device and method of use |
| US6381353B1 (en) * | 1996-08-30 | 2002-04-30 | Marvin Weiss | System for counting colonies of micro-organisms in petri dishes and other culture media |
| US6002789A (en) | 1997-06-24 | 1999-12-14 | Pilot Industries, Inc. | Bacteria colony counter and classifier |
| US6251624B1 (en) * | 1999-03-12 | 2001-06-26 | Akzo Nobel N.V. | Apparatus and method for detecting, quantifying and characterizing microorganisms |
| US20040092001A1 (en) * | 2001-03-01 | 2004-05-13 | 3M Innovative Properties Company | Automated imaging and harvesting of colonies on thin film culture devices |
| US7298885B2 (en) * | 2002-11-27 | 2007-11-20 | 3M Innovative Properties Company | Biological growth plate scanner with automated image processing profile selection |
| KR100966399B1 (ko) * | 2002-11-27 | 2010-06-28 | 쓰리엠 이노베이티브 프로퍼티즈 컴파니 | 생물학적 성장판 스캐너 |
| US20040102903A1 (en) * | 2002-11-27 | 2004-05-27 | Graessle Josef A. | Biological growth plate scanner |
| US20040253660A1 (en) * | 2003-06-12 | 2004-12-16 | Giles Scientific, Inc. | Automated microbiological testing apparatus and method |
| US7496225B2 (en) | 2003-09-04 | 2009-02-24 | 3M Innovative Properties Company | Biological growth plate scanner with automated intake |
| US7298886B2 (en) | 2003-09-05 | 2007-11-20 | 3M Innovative Properties Company | Counting biological agents on biological growth plates |
| WO2005066372A2 (en) * | 2003-12-31 | 2005-07-21 | Applera Corporation | Quantitative amplification and detection of small numbers of target polynucleotides |
| US7247423B2 (en) * | 2004-09-10 | 2007-07-24 | Synergy Biosystems Ltd | Method to measure the effect of topically applied agents using skin maintained in organ culture |
| BRPI0705417B1 (pt) * | 2006-12-20 | 2016-08-16 | Unilever Nv | produto alimentício aerado e processos para a produção de um produto alimentício aerado |
| JP5420566B2 (ja) * | 2007-12-21 | 2014-02-19 | スリーエム イノベイティブ プロパティズ カンパニー | 微生物系及び流体試料分析の方法 |
| JP5430122B2 (ja) * | 2008-10-30 | 2014-02-26 | 栄研化学株式会社 | 微生物の検出方法、装置およびプログラム |
| US8741595B2 (en) * | 2008-12-31 | 2014-06-03 | 3M Innovative Properties Company | Coliform detection process and kit for use therein |
| WO2010147918A2 (en) * | 2009-06-15 | 2010-12-23 | 3M Innovative Properties Company | Detection of acid-producing bacteria |
| WO2012012104A1 (en) | 2010-06-30 | 2012-01-26 | 3M Innovative Properties Company | Microbial detection system and methods |
| NO336049B1 (no) * | 2010-10-22 | 2015-04-27 | Seabox As | Teknisk system, fremgangsmåte og anvendelse for online måling og overvåking av partikkelinnholdet i en injeksjonsvannstrøm i en undervannsledning |
| EP2520923A1 (en) * | 2011-05-06 | 2012-11-07 | bioMérieux | Bio-imaging method and system |
| BR112015014817A2 (pt) | 2012-12-20 | 2017-07-11 | 3M Innovative Properties Co | método e mídia legível por computador |
| CN104871177B (zh) * | 2012-12-20 | 2018-03-27 | 3M创新有限公司 | 检测产气微生物菌落的方法 |
-
2013
- 2013-12-13 CN CN201380066457.6A patent/CN104871177B/zh not_active Expired - Fee Related
- 2013-12-13 BR BR112015014821A patent/BR112015014821A2/pt not_active IP Right Cessation
- 2013-12-13 WO PCT/US2013/074887 patent/WO2014099644A1/en active Application Filing
- 2013-12-13 US US14/652,379 patent/US9684816B2/en active Active
- 2013-12-13 EP EP13821540.5A patent/EP2936387A1/en not_active Withdrawn
- 2013-12-13 KR KR1020157018847A patent/KR20150099779A/ko not_active Application Discontinuation
- 2013-12-13 JP JP2015549506A patent/JP6366604B2/ja active Active
-
2017
- 2017-05-12 US US15/593,583 patent/US9916491B2/en not_active Expired - Fee Related
-
2018
- 2018-01-29 US US15/882,222 patent/US10614286B2/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| EP2936387A1 (en) | 2015-10-28 |
| WO2014099644A1 (en) | 2014-06-26 |
| CN104871177B (zh) | 2018-03-27 |
| CN104871177A (zh) | 2015-08-26 |
| US9916491B2 (en) | 2018-03-13 |
| US20180150680A1 (en) | 2018-05-31 |
| JP6366604B2 (ja) | 2018-08-01 |
| BR112015014821A2 (pt) | 2017-07-11 |
| JP2016510211A (ja) | 2016-04-07 |
| US20150339510A1 (en) | 2015-11-26 |
| US10614286B2 (en) | 2020-04-07 |
| US9684816B2 (en) | 2017-06-20 |
| US20170249499A1 (en) | 2017-08-31 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US10614286B2 (en) | Method of detecting gas-producing microbial colonies | |
| US9809836B2 (en) | Method of differentiating microbial colonies in an image | |
| CN107580715B (zh) | 用于自动计数微生物菌落的方法和系统 | |
| CN104903914B (zh) | 用于定义细胞培养皿中感兴趣的对象周围的隔离区的方法 | |
| ES2826400T3 (es) | Recolección de contraste de colonias | |
| RU2126962C1 (ru) | Способ обнаружения микроорганизмов в образце, способ определения чувствительности микроорганизмов к антибиотику и система для реализации таких способов | |
| KR20130038345A (ko) | 미생물 검출 시스템 및 방법 | |
| CN106462730B (zh) | 用于检测样品的琼脂糖培养基或膜上生长的微群落的方法和无菌试验装置 | |
| CN111263817B (zh) | 用于自动化评估抗生素敏感性的方法和系统 | |
| US20220383550A1 (en) | Method for assessing assessment targets, image processing device, system for assessing assessment targets | |
| JP7534955B2 (ja) | 細菌のグラムタイプを識別するための方法およびシステム | |
| CN111492064A (zh) | 一种鉴别酵母或细菌的方法 | |
| CN115210753A (zh) | 用于菌落计数的图像中的强度差异补偿 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |