KR20150099588A - 암의 치료와 관련된 방법 및 조성물 - Google Patents
암의 치료와 관련된 방법 및 조성물 Download PDFInfo
- Publication number
- KR20150099588A KR20150099588A KR1020157019739A KR20157019739A KR20150099588A KR 20150099588 A KR20150099588 A KR 20150099588A KR 1020157019739 A KR1020157019739 A KR 1020157019739A KR 20157019739 A KR20157019739 A KR 20157019739A KR 20150099588 A KR20150099588 A KR 20150099588A
- Authority
- KR
- South Korea
- Prior art keywords
- isc
- cetuximab
- cancer
- combination
- prodrug
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/095—Sulfur, selenium, or tellurium compounds, e.g. thiols
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7028—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2863—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against receptors for growth factors, growth regulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Immunology (AREA)
- Molecular Biology (AREA)
- Organic Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Mycology (AREA)
- Endocrinology (AREA)
- Microbiology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Saccharide Compounds (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
Abstract
본 발명의 개시 태양에 따라 이를 필요로하는 개체의 암 치료를 위한 조합 제제로서 또는 분리 제제로서 제공되는 세툭시맙 및 ISC-4 모두를 포함하는 조성물 및 방법이 제공된다. 본 발명의 개시 태양에 따라 제공되는 이를 필요로하는 개체의 암 치료 방법에서, 상기 개체는 야생형 KRAS인 것을 특징으로 하는 암을 갖고 있고 상기 방법은 세툭시맙 및 ISC-4를 조합 제제로서 또는 분리하여 투여하는 단계를 포함하고, 상기 세툭시맙 및 ISC-4의 조합 투여는 상승적 항암 효과, 암의 치료를 제공한다.
Description
본 발명의 일반적 태양에 따라 이를 필요로하는 개체의 암 치료를 위한 방법 및 조성물이 제공된다. 세툭시맙 및 ISC-4 모두를 조합 제제 또는 분리 제제로서 투여하는 단계를 포함하는 본 발명의 특정 태양에 따라 이를 필요로하는 개체의 암 치료를 위한 방법 및 조성물이 제공된다.
본 발명은 국립 보건원에 의해 수여된 Grant No. CA143999의 후원 하에 정부와 함께 발명되었다. 정부는 본 발명에 있어 일정 권리를 갖는다.
본 출원 청구항은 2012년 12월 20일에 출원된 미국 가 특허 출원번호 61/740,126의 우선권을 주장하며, 본원에 전체로서 참고문헌으로 포함된다.
이를 필요로하는 개체의 암 치료를 위한 방법 및 조성물에 대한 지속적인 요구가 있다. 본 발명에 따라 이러한 방법 및 조성물이 제공된다.
본 발명의 태양에 따라 세툭시맙 및 ISC-4의 조합을 조합 제제로서 또는 분리 제제로서 투여하는 단계를 포함하는 이를 필요로하는 개체의 암 치료 방법이 제공된다.
본 발명의 태양에 따라 세툭시맙 및 ISC-4의 조합을 조합 제제로서 또는 분리 제제로서 투여하는 단계를 포함하는 이를 필요로하는 개체의 암 치료 방법이 제공되며, 여기에서 상기 암은 야생형 KRAS인 것을 특징으로 한다.
본 발명의 태양에 따라 세툭시맙 및 ISC-4의 조합을 조합 제제로서 또는 분리 제제로서 투여하는 단계를 포함하는 이를 필요로하는 개체의 암 치료 방법이 제공되며, 여기에서 상기 암은 야생형 KRAS가 활성 KRAS 돌연변이를 가지지 않는 야생형 KRAS인 것을 특징으로 한다.
본 발명의 태양에 따라 세툭시맙 및 ISC-4의 조합을 조합 제제로서 또는 분리 제제로서 투여하는 단계를 포함하는 이를 필요로하는 개체의 암 치료 방법이 제공되며, 여기에서 상기 암은 야생형 KRAS가 인간 KRAS를 기준으로 12, 13 또는 61 코돈에 활성 KRAS 돌연변이를 가지지 않는 야생형 KRAS인 것을 특징으로 한다.
본 발명의 태양에 따라 세툭시맙 및 ISC-4의 조합을 조합 제제로서 또는 분리 제제로서 투여하는 단계를 포함하는 이를 필요로하는 개체의 암 치료 방법이 제공되며, 여기에서 상기 암은 야생형 KRAS가 인간 KRAS를 기준으로 활성 KRAS 돌연변이 Q61H, G12S, G12V, G12A 또는 G13D를 가지지 않는 야생형 KRAS인 것을 특징으로 한다.
본 발명에 따라서 세툭시맙 및 ISC-4의 조합을 조합 제제로서 또는 분리하여 투여하는 단계를 포함하는 이를 필요로하는 개체의 암 치료 방법이 제공되며, 여기에서 상기 암은 야생형 KRAS인 것을 특징으로 하는 대장암이다.
본 발명에 태양에 따라 세툭시맙 및 ISC-4의 조합을 조합 제제로서 또는 분리하여 투여하는 단계를 포함하는 이를 필요로하는 개체의 대장암 치료 방법이 제공되며, 여기에서 상기 대장암은 야생형 KRAS가 활성 KRAS 돌연변이를 가지지 않는 야생형 KRAS인 것을 특징으로 한다.
본 발명의 태양에 따라 세툭시맙 및 ISC-4의 조합을 조합 제제로서 또는 분리하여 투여하는 단계를 포함하는 이를 필요로하는 개체의 암 치료 방법이 제공되며, 여기에서 상기 암은 야생형 KRAS가 인간 KRAS를 기준으로 12, 13 또는 61 코돈에 활성 KRAS 돌연변이를 가지지 않는 야생형 KRAS인 것을 특징으로 하는 대장암이다.
본 발명의 태양에 따라 세툭시맙 및 ISC-4의 조합을 조합 제제로서 또는 분리하여 투여하는 단계를 포함하는 이를 필요로하는 개체의 암 치료 방법이 제공되며, 여기에서 상기 암은 야생형 KRAS가 인간 KRAS를 기준으로 활성 KRAS 돌연변이 Q61H, G12S, G12V, G12A 또는 G13D를 가지지 않는 야생형 KRAS인 것을 특징으로 하는 대장암이다.
본 발명의 태양에 따라 세툭시맙 및 ISC-4의 조합을 투여하기 전 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 첫번째 시료를 얻는 단계; 세툭시맙 및 ISC-4의 조합을 조합 제제로서 또는 분리하여 투여하는 단계, 세툭시맙 및 ISC-4의 조합을 투여한 후 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 두번째 시료를 얻는 단계; 및 상기 첫번째 및 두번째 시료에서 하나 또는 그 이상의 아폽토시스 마커를 측정하는 단계, 여기에서 상기 첫번째 시료에 비하여 두번째 시료에서 증가된 아폽토시스는 상기 투여된 세툭시맙 및 ISC-4의 치료적 활성을 나타내며, 그렇게 함으로써 세툭시맙 및 ISC-4의 조합 투여의 유효성을 모니터링하는 단계를 포함하는 이를 필요로하는 개체의 암 치료 방법이 제공된다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS가 활성 KRAS 돌연변이를 가지지 않는 것을 특징으로 한다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS가 인간 KRAS를 기준으로 12, 13 또는 61 코돈에 활성 KRAS 돌연변이를 가지지 않는 야생형 KRAS인 것을 특징으로 한다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS가 인간 KRAS를 기준으로 활성 KRAS 돌연변이 Q61H, G12S, G12V, G12A 또는 G13D를 가지지 않는 야생형 KRAS인 것을 특징으로 한다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS가 활성 KRAS 돌연변이를 가지지 않는 야생형 KRAS인 것을 특징으로 하는 대장암이다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS가 인간 KRAS를 기준으로 12, 13 또는 61 코돈에 활성 KRAS 돌연변이를 가지지 않는 야생형 KRAS인 것을 특징으로 하는 대장암이다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS가 인간 KRAS를 기준으로 활성 KRAS 돌연변이 Q61H, G12S, G12V, G12A 또는 G13D를 가지지 않는 야생형 KRAS인 것을 특징으로 하는 대장암이다.
본 발명의 태양에 따라 세툭시맙 및 ISC-4의 조합을 투여하기 전 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 첫번째 시료를 얻는 단계; 세툭시맙 및 ISC-4의 조합을 조합 제제로서 또는 분리하여 투여하는 단계; 세툭시맙 및 ISC-4의 조합을 투여한 후 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 두번째 시료를 얻는 단계; 및 상기 첫번째 및 두번째 시료에서 인산화-Akt를 측정하는 단계, 여기에서 상기 첫번째 시료에 비하여 두번째 시료에서 감소된 인산화-Akt는 상기 투여된 세툭시맙 및 ISC-4의 치료적 활성을 나타내며, 그렇게 함으로써 세툭시맙 및 ISC-4의 조합 투여의 유효성을 모니터링하는 단계를 포함하는 이를 필요로하는 개체의 암 치료 방법이 제공된다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS인 것을 특징으로 하고, 상기 야생형 KRAS는 활성 KRAS 돌연변이를 가지지 않는다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS가 인간 KRAS를 기준으로 12, 13 또는 61 코돈에 활성 KRAS 돌연변이를 가지지 않는 야생형 KRAS인 것을 특징으로 한다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS가 인간 KRAS를 기준으로 활성 KRAS 돌연변이 Q61H, G12S, G12V, G12A 또는 G13D를 가지지 않는 야생형 KRAS인 것을 특징으로 한다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS가 활성 KRAS 돌연변이를 가지지 않는 야생형 KRAS인 것을 특징으로 하는 대장암이다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS가 인간 KRAS를 기준으로 12, 13 또는 61 코돈에 활성 KRAS 돌연변이를 가지지 않는 야생형 KRAS인 것을 특징으로 하는 대장암이다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS가 인간 KRAS를 기준으로 활성 KRAS 돌연변이 Q61H, G12S, G12V, G12A 또는 G13D를 가지지 않는 야생형 KRAS인 것을 특징으로 하는 대장암이다.
본 발명의 암 치료 방법의 태양에 따르면, 상기 세툭시맙 및 ISC-4는 동시에 또는 순차적으로 투여된다. 제한되지 않는 실시예에서, 상기 세툭시맙 및 ISC-4는 1시간, 2시간, 4시간, 8시간, 12시간 및 24시간으로부터 선택된 시간 내에 순차적으로 투여된다.
본 발명의 태양에 따라 세툭시맙 및 ISC-4 모두를 포함하는 약학적 조성물이 제공된다.
본 발명의 태양에 따라 세툭시맙 및 ISC-4를 포함하는 상용 패키지가 제공되고, 여기에서 상기 세툭시맙 및 ISC-4는 단일 약학적 제제 또는 분리 약학적 제제로서 제공된다.
본 발명에 의해 세툭시맙 및 ISC-4 전구약물의 조합을 조합 또는 분리하여 투여하는 단계를 포함하는 이를 필요로하는 개체의 암 치료 방법이 제공된다.
본 발명의 태양에 따라 세툭시맙 및 ISC-4 전구약물의 조합을 조합 또는 분리하여 투여하는 단계를 포함하는 이를 필요로하는 개체의 암 치료 방법이 제공되고, 여기에서 상기 암은 야생형 KRAS인 것을 특징으로 한다.
본 발명의 태양에 따라 세툭시맙 및 ISC-4 전구약물의 조합을 조합 제제로서 또는 분리하여 투여하는 단계를 포함하는 이를 필요로하는 개체의 암 치료 방법이 제공되고, 여기에서 상기 암은 야생형 KRAS가 활성 KRAS 돌연변이를 가지지 않는 야생형 KRAS인 것을 특징으로 한다.
본 발명의 태양에 따라 세툭시맙 및 ISC-4 전구약물의 조합을 조합 제제로서 또는 분리하여 투여하는 단계를 포함하는 이를 필요로하는 개체의 암 치료 방법이 제공되고, 여기에서 상기 암은 야생형 KRAS가 인간 KRAS를 기준으로 12, 13 또는 61 코돈에 활성 KRAS 돌연변이를 가지지 않는 야생형 KRAS인 것을 특징으로 한다.
본 발명의 태양에 따라 세툭시맙 및 ISC-4 전구약물의 조합을 조합 제제로서 또는 분리하여 투여하는 단계를 포함하는 이를 필요로하는 개체의 암 치료 방법이 제공되고, 여기에서 상기 암은 야생형 KRAS가 인간 KRAS를 기준으로 활성 KRAS 돌연변이 Q61H, G12S, G12V, G12A 또는 G13D를 가지지 않는 야생형 KRAS인 것을 특징으로 하는 대장암이다.
본 발명의 태양에 따라 세툭시맙 및 ISC-4 전구약물의 조합을 조합 또는 분리하여 투여하는 단계를 포함하는 이를 필요로 하는 개체의 대장암 치료 방법이 제공되고, 여기에서 상기 암은 야생형 KRAS인 것을 특징으로 하는 대장암이다.
본 발명의 태양에 따라 세툭시맙 및 ISC-4 전구약물의 조합을 조합 제제로서 또는 분리하여 투여하는 단계를 포함하는 이를 필요로 하는 개체의 대장암 치료 방법이 제공되고, 상기 대장암은 야생헝 KRAS가 활성 KRAS 돌연변이를 가지지 않는 야생형 KRAS인 것을 특징으로 한다.
본 발명의 태양에 따라 세툭시맙 및 ISC-4 전구약물의 조합을 조합 제제로서 또는 분리하여 투여하는 단계를 포함하는 이를 필요로하는 개체의 암 치료 방법이 제공되고, 여기에서 상기 암은 야생형 KRAS가 인간 KRAS를 기준으로 12, 13 또는 61 코돈에 활성 KRAS 돌연변이를 가지지 않는 야생형 KRAS인 것을 특징으로 하는 대장암이다.
본 발명의 태양에 따라 세툭시맙 및 ISC-4 전구약물의 조합을 조합 제제로서 또는 분리하여 투여하는 단계를 포함하는 이를 필요로하는 개체의 암 치료 방법이 제공되고, 여기에서 상기 암은 야생형 KRAS가 인간 KRAS를 기준으로 활성 KRAS 돌연변이 Q61H, G12S, G12V, G12A 또는 G13D를 가지지 않는 야생형 KRAS인 것을 특징으로 하는 대장암이다.
본 발명의 태양에 따라 세툭시맙 및 ISC-4 전구약물의 조합을 투여하기 전 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 첫번째 시료를 얻는 단계; 세툭시맙 및 ISC-4전구약물의 조합을 조합 또는 분리하여 투여하는 단계; 세툭시맙 및 ISC-4 전구약물의 조합을 투여한 후 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 두번째 시료를 얻는 단계; 및 상기 첫번째 및 두번째 시료에서 하나 또는 그 이상의 아폽토시스 마커를 측정하는 단계, 여기에서 상기 첫번째 시료에 비하여 두번째 시료에서 증가된 아폽토시스는 상기 투여된 세툭시맙 및 ISC-4 전구약물의 치료적 활성을 나타내며, 그렇게 함으로써 세툭시맙 및 ISC-4 전구약물의 조합 투여의 유효성을 모니터링하는 단계를 포함하는 이를 필요로하는 개체의 암 치료 방법이 제공된다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS가 활성 KRAS 돌연변이를 가지지 않는 것을 특징으로 한다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS가 인간 KRAS를 기준으로 12, 13 또는 61 코돈에 활성 KRAS 돌연변이를 가지지 않는 야생형 KRAS인 것을 특징으로 한다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS가 인간 KRAS를 기준으로 활성 KRAS 돌연변이 Q61H, G12S, G12V, G12A 또는 G13D를 가지지 않는 야생형 KRAS인 것을 특징으로 한다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS가 활성 KRAS 돌연변이를 가지지 않는 야생형 KRAS인 것을 특징으로 하는 대장암이다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS가 인간 KRAS를 기준으로 12, 13 또는 61 코돈에 활성 KRAS 돌연변이를 가지지 않는 야생형 KRAS인 것을 특징으로 하는 대장암이다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS가 인간 KRAS를 기준으로 활성 KRAS 돌연변이 Q61H, G12S, G12V, G12A 또는 G13D를 가지지 않는 야생형 KRAS인 것을 특징으로 하는 대장암이다.
본 발명의 태양에 따라 세툭시맙 및 ISC-4 전구약물의 조합을 투여하기 전 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 첫번째 시료를 얻는 단계; 세툭시맙 및 ISC-4 전구약물의 조합을 조합 또는 분리하여 투여하는 단계, 세툭시맙 및 ISC-4 전구약물의 조합을 투여한 후 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 두번째 시료를 얻는 단계; 및 상기 첫번째 및 두번째 시료에서 인산화-Akt를 측정하는 단계, 여기에서 상기 첫번째 시료에 비하여 두번째 시료에서 감소된 아폽토시스는 상기 투여된 세툭시맙 및 ISC-4 전구약물의 치료적 활성을 나타내며, 그렇게 함으로써 세툭시맙 및 ISC-4 전구약물의 조합 투여의 유효성을 모니터링하는 단계를 포함하는 이를 필요로하는 개체의 암 치료 방법이 제공된다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS는 활성 KRAS 돌연변이를 가지지 않는 것을 특징으로 한다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS가 인간 KRAS를 기준으로 12, 13 또는 61 코돈에 활성 KRAS 돌연변이를 가지지 않는 야생형 KRAS인 것을 특징으로 한다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS가 인간 KRAS를 기준으로 활성 KRAS 돌연변이 Q61H, G12S, G12V, G12A 또는 G13D를 가지지 않는 야생형 KRAS인 것을 특징으로 한다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS가 활성 KRAS 돌연변이를 가지지 않는 야생형 KRAS인 것을 특징으로 하는 대장암이다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS가 인간 KRAS를 기준으로 12, 13 또는 61 코돈에 활성 KRAS 돌연변이를 가지지 않는 야생형 KRAS인 것을 특징으로 하는 대장암이다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS가 인간 KRAS를 기준으로 활성 KRAS 돌연변이 Q61H, G12S, G12V, G12A 또는 G13D를 가지지 않는 야생형 KRAS인 것을 특징으로 하는 대장암이다.
본 발명의 암 치료 방법의 태양에 따르면, 상기 세툭시맙 및 ISC-4 전구약물은 동시에 또는 순차적으로 투여된다. 제한되지 않는 실시예에서, 상기 세툭시맙 및 ISC-4 전구약물은 1시간, 2시간, 4시간, 8시간, 12시간 및 24시간으로부터 선택된 시간 내에 순차적으로 투여된다.
본 발명의 태양에 따라 세툭시맙 및 ISC-4 전구약물의 조합을 조합 또는 분리하여 투여하는 단계를 포함하는 이를 필요로하는 개체의 암 치료 방법이 제공되고, 여기에서 상기 ISC-4 전구약물은 ISC-4 글루코시놀레이트 전구약물 또는 이의 약학적으로 허용가능한 염이다. 상기 ISC-4 글루코시놀레이트 전구약물은 하기의 구조를 갖는다
본 발명의 태양에 따라 세툭시맙 및 ISC-4 전구약물의 조합을 조합 또는 분리하여 투여하는 단계를 포함하는 이를 필요로하는 개체의 암 치료 방법을 제공하며, 여기에서 상기 암은 야생형 KRAS인 것을 특징으로 하고 상기 ISC-4 전구약물은 ISC-4 글루코시놀레이트 전구약물 또는 이의 약학적으로 허용가능한 염이다. 이러한 방법의 태양에 따르면, 상기 암은 인간 KRAS를 기준으로 야생형 KRAS가 활성 KRAS 돌연변이를 가지지 않는 것을 특징으로 한다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS가 인간 KRAS를 기준으로 12, 13 또는 61 코돈에 활성 KRAS 돌연변이를 가지지 않는 야생형 KRAS인 것을 특징으로 한다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS가 인간 KRAS를 기준으로 활성 KRAS 돌연변이 Q61H, G12S, G12V, G12A 또는 G13D를 가지지 않는 야생형 KRAS인 것을 특징으로 한다.
본 발명의 태양에 따라 세툭시맙 및 ISC-4 전구약물의 조합을 조합 또는 분리하여 투여하는 단계를 포함하는 이를 필요로하는 개체의 암 치료 방법을 제공하며, 여기에서 상기 암은 야생형 KRAS인 것을 특징으로 하는 대장암이고 상기 ISC-4 전구약물은 ISC-4 글루코시놀레이트 전구약물 또는 이의 약학적으로 허용가능한 염이다. 이러한 방법의 태양에 따르면, 상기 대장암은 인간 KRAS를 기준으로 야생형 KRAS가 활성 KRAS 돌연변이를 가지지 않는 것을 특징으로 하는 야생형 KRAS이다. 이러한 방법의 태양에 따르면, 상기 대장암은 야생형 KRAS가 인간 KRAS를 기준으로 12, 13 또는 61 코돈에 활성 KRAS 돌연변이를 가지지 않는 야생형 KRAS인 것을 특징으로 한다. 이러한 방법의 태양에 따르면, 상기 대장암은 야생형 KRAS가 인간 KRAS를 기준으로 활성 KRAS 돌연변이 Q61H, G12S, G12V, G12A 또는 G13D를 가지지 않는 야생형 KRAS인 것을 특징으로 한다.
본 발명의 태양에 따라 세툭시맙 및 ISC-4 전구약물의 조합을 투여하기 전 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 첫번째 시료를 얻는 단계, 여기에서 ISC-4 전구약물은 ISC-4 글루코시놀레이트 전구약물 또는 이의 약학적으로 허용가능한 염이다; 세툭시맙 및 ISC-4 글루코시놀레이트 전구약물 또는 이의 약학적으로 허용가능한 염의 조합을 조합 또는 분리하여 투여하는 단계; 세툭시맙 및 ISC-4 글루코시놀레이트 전구약물 또는 이의 약학적으로 허용가능한 염의 조합을 투여한 후 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 두번째 시료를 얻는 단계; 및 상기 첫번째 및 두번째 시료에서 하나 또는 그 이상의 아폽토시스 마커를 측정하는 단계, 그렇게 함으로써 세툭시맙 및 ISC-4 전구약물의 조합 투여의 유효성을 모니터링하는 단계를 포함하는 이를 필요로하는 개체의 암 치료 방법이 제공된다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS가 활성 KRAS 돌연변이를 가지지 않는 것을 특징으로 한다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS가 인간 KRAS를 기준으로 12, 13 또는 61 코돈에 활성 KRAS 돌연변이를 가지지 않는 야생형 KRAS인 것을 특징으로 한다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS가 인간 KRAS를 기준으로 활성 KRAS 돌연변이 Q61H, G12S, G12V, G12A 또는 G13D를 가지지 않는 야생형 KRAS인 것을 특징으로 한다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS가 활성 KRAS 돌연변이를 가지지 않는 야생형 KRAS인 것을 특징으로 하는 대장암이다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS가 인간 KRAS를 기준으로 12, 13 또는 61 코돈에 활성 KRAS 돌연변이를 가지지 않는 야생형 KRAS인 것을 특징으로 하는 대장암이다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS가 인간 KRAS를 기준으로 활성 KRAS 돌연변이 Q61H, G12S, G12V, G12A 또는 G13D를 가지지 않는 야생형 KRAS인 것을 특징으로 하는 대장암이다.
본 발명의 태양에 따라 세툭시맙 및 ISC-4 전구약물의 조합을 투여하기 전 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 첫번째 시료를 얻는 단계, 여기서 ISC-4 전구약물은 ISC-4 글루코시놀레이트 전구약물 또는 이의 약학적으로 허용가능한 염이다; 세툭시맙 및 ISC-4 글루코시놀레이트 전구약물 또는 이의 약학적으로 허용가능한 염의 조합을 조합 또는 분리하여 투여하는 단계; 세툭시맙 및 ISC-4 글루코시놀레이트 전구약물 또는 이의 약학적으로 허용가능한 염의 조합을 투여한 후 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 두번째 시료를 얻는 단계; 및 상기 첫번째 및 두번째 시료에서 인산화-Akt를 측정하는 단계, 그렇게 함으로써 세툭시맙 및 ISC-4 전구약물의 조합 투여의 유효성을 모니터링하는 단계를 포함하는 이를 필요로하는 개체의 암 치료 방법이 제공된다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS가 활성 KRAS 돌연변이를 가지지 않는 것을 특징으로 한다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS가 인간 KRAS를 기준으로 12, 13 또는 61 코돈에 활성 KRAS 돌연변이를 가지지 않는 야생형 KRAS인 것을 특징으로 한다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS가 인간 KRAS를 기준으로 활성 KRAS 돌연변이 Q61H, G12S, G12V, G12A 또는 G13D를 가지지 않는 야생형 KRAS인 것을 특징으로 한다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS가 활성 KRAS 돌연변이를 가지지 않는 야생형 KRAS인 것을 특징으로 하는 대장암이다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS가 인간 KRAS를 기준으로 12, 13 또는 61 코돈에 활성 KRAS 돌연변이를 가지지 않는 야생형 KRAS인 것을 특징으로 하는 대장암이다. 이러한 방법의 태양에 따르면, 상기 암은 야생형 KRAS가 인간 KRAS를 기준으로 활성 KRAS 돌연변이 Q61H, G12S, G12V, G12A 또는 G13D를 가지지 않는 야생형 KRAS인 것을 특징으로 하는 대장암이다.
본 발명의 암 치료 방법의 태양에 따르면, 상기 세툭시맙 및 상기 ISC-4 글루코시놀레이트 전구약물 또는 이의 약학적으로 허용가능한 염은 동시에 또는 순차적으로 투여된다.
제한되지 않는 예에서, 상기 세툭시맙, 및 상기 ISC-4 글루코시놀레이트 전구약물 또는 이의 약학적으로 허용가능한 염은 1시간, 2시간, 4시간, 8시간, 12시간 및 24시간으로부터 선택된 시간 내에 순차적으로 이루어진다.
본 발명의 태양에 따른 약학적 조성물은 세툭시맙, 및 상기 ISC-4 글루코시놀레이트 전구약물 또는 이의 약학적으로 허용가능한 염을 포함한다.
본 발명의 태양에 따른 상용 패키지는 세툭시맙 및 상기 ISC-4 글루코시놀레이트 전구약물 또는 이의 약학적으로 허용가능한 염을 포함한다.
본 발명의 태양에 따른 상용 패키지는 세툭시맙, 및 상기 ISC-4 글루코시놀레이트 전구약물 또는 이의 약학적으로 허용가능한 염을 모두 포함하는 단일 약학적 제제를 포함한다.
본 발명의 태양에 따른 상용 패키지는 세툭시맙 및 상기 ISC-4 글루코시놀레이트 전구약물 또는 이의 약학적으로 허용가능한 염을 포함하고, 여기서 상기 세툭시맙은 상기 상용 패키지에 첫번째 약학적 제제로서 제공되고 상기 ISC-4 글루코시놀레이트 전구약물 또는 이의 약학적으로 허용가능한 염은 분리된 두번째 약학적 제제로서 제공된다.
본 발명의 태양에 따른 조성물은 하기의 구조식을 갖는 ISC-4 글루코시놀레이트 전구약물
또는 이의 약학적으로 허용가능한 염을 포함한다.
본 발명의 태양에 따라 세툭시맙 및 ISC-4를 함께 또는 분리 투여하기 전 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 첫번째 시료를 얻는 단계; 상기 세툭시맙 및 ISC-4을 투여한 후 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 두번째 시료를 얻는 단계; 및 상기 첫번째 및 두번째 시료에서 하나 또는 그 이상의 아폽토시스 마커를 측정 및/또는 상기 첫번째 및 두번째 시료에서 인산화-Akt를 측정하는 단계, 여기서 하나 또는 그 이상의 아폽토시스 마커의 증가 및 인산화-Akt의 감소는 세툭시맙 및 ISC-4의 조합을, 함께 또는 따로 투여하는 단계의 치료적 활성의 지표이며, 그렇게 함으로써 상기 세툭시맙 및 ISC-4의 조합 투여의 효능을 모니터링하는 단계: 를 포함하는 암 치료의 효능 평가 방법이 제공된다.
본 발명의 태양에 따라 세툭시맙 및 ISC-4를 함께 또는 따로 투여하기 전 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 첫번째 시료를 얻는 단계; 상기 세툭시맙 및 상기 ISC-4 전구약물을 투여한 후 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 두번째 시료를 얻는 단계; 및 상기 첫번째 및 두번째 시료에서 하나 또는 그 이상의 아폽토시스 마커를 측정 및/또는 상기 첫번째 및 두번째 시료에서 인산화-Akt를 측정하는 단계, 여기서 하나 또는 그 이상의 아폽토시스 마커의 증가 및 인산화-Akt의 감소는 세툭시맙 및 상기 ISC-4 전구약물의 조합을, 함께 또는 따로 투여하는 단계의 치료적 활성의 지표이며 그렇게 함으로써 상기 세툭시맙 및 상기 ISC-4 전구약물의 조합 투여의 효능을 모니터링하는 단계: 를 포함하는 암 치료의 효능 평가 방법이 제공된다.
본 발명의 태양에 따라 세툭시맙, 및 ISC-4 글루코시놀레이트 전구약물 또는 이의 약학적으로 허용가능한 염을 함께 또는 따로 투여하기 전 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 첫번째 시료를 얻는 단계; 상기 세툭시맙 및 상기 ISC-4 글루코시놀레이트 전구약물 또는 이의 약학적으로 허용가능한 염을 투여한 후 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 두번째 시료를 얻는 단계; 및 상기 첫번째 및 두번째 시료에서 하나 또는 그 이상의 아폽토시스 마커를 측정 및/또는 상기 첫번째 및 두번째 시료에서 인산화-Akt를 측정하는 단계, 여기서 하나 또는 그 이상의 아폽토시스 마커의 증가 및 인산화-Akt의 감소는 세툭시맙 및 상기 ISC-4 글루코시놀레이트 전구약물 또는 이의 약학적으로 허용가능한 염의 조합을, 함께 또는 따로 투여하는 단계의 치료적 활성의 지표이며 그렇게 함으로로써 상기 세툭시맙 및 상기 ISC-4 글루코시놀레이트 전구약물 또는 이의 약학적으로 허용가능한 염의 조합 투여의 효능을 모니터링하는 단계: 를 포함하는 암 치료의 효능 평가 방법이 제공된다.
도 1a는 제시된 ISC-4 또는 DMSO로 처리된 표시된 세포주의 세포 생존력 분석법의 결과 및 계산된 EC50 값의 결과를 나타낸 그래프이고;
도 1b는 동시적 및 비동시적인 HCT116 세포의 세포 주기 프로파일에 대한 ISC-4 처리의 효과를 나타낸 그래프이고;
도 1c는 동시적 및 비동시적인 HT-29 세포의 세포 주기 프로파일에 대한 ISC-4 처리의 효과를 나타낸 그래프이고;
도 1d는 0, 1, 2, 4, 8, 또는 16 μM의 ISC-4 로 처리된 후 표시된 대장암 세포주의 sub-G1 함량을 나타낸 그래프이고;
도 2는 ISC-4 (1, 2, 또는 4 μM) 및 추정적인 EC12.5, EC25, 및 EC50 단독 및 조합으로서 표시된 치료로 처리된 SW480 및 RKO 대장암 세포주의 세포 생존력 분석법의 결과를 나타내고;
도 3a는 표시된 용량으로 72시간 동안 ISC-4 및 세툭시맙으로 처리된 인간 대장암 세포주 HT-29의 세포 생존력 분석법의 결과를 나타내고;
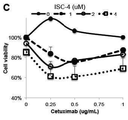
도 3b는 표시된 용량으로 72시간 동안 ISC-4 및 세툭시맙으로 처리된 인간 대장암 세포주 RKO의 세포 생존력 분석법의 결과를 나타내고;
도 3c는 표시된 용량으로 72시간 동안 ISC-4 및 세툭시맙으로 처리된 인간 대장암 세포주 HCT116의 세포 생존력 분석법의 결과를 나타내고;
도 3d는 표시된 용량으로 72시간 동안 ISC-4 및 세툭시맙으로 처리된 인간 대장암 세포주 DLD-1의 세포 생존력 분석법의 결과를 나타내고;
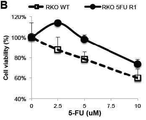
도 3e는 표시된 용량으로 72시간 동안 5-FU로 처리된 야생형 및 5-FU-저항성 RKO 세포의 세포 생존력 분석법의 결과를 나타내고;
도 3f는 24시간 동안 ISC-4 (2 μM) 및 세툭시맙 (1 μg/mL)으로 처리된 5-FU-저항성 RKO 세포의 결과를 나타내고;
도 4a는 ISC-4 (2 μM) 및 세툭시맙 (1 μg/mL) 단독 또는 조합으로 표시된 기간 동안 처리된 RKO 세포의 세포 생존력 분석법의 결과를 나타내고;
도 4b는 도 4a에 있는 것처럼 12시간 동안 처리된 RKO 세포의 DAPI 염색의 결과를 나타내고;
도 4c는 12시간 동안 ISC-4 (2 μM) 및 세툭시맙 (1 μg/mL) 단독 또는 조합으로 처리된 RKO 세포의 sub-G1 함량을 나타내고;
도 4d는 세툭시맙 (0, 0.25, 0.5, 또는 1μg/mL)과 조합하여 ISC-4 (2 μM)로 24시간 동안 처리된 후에 RKO 세포의 Caspase-Glo 분석법의 결과, 상단, 및 ISC-4 (2μM) 및 세툭시맙 (1μg/mL)의 정량 결과, 하단을 나타내고;
도 5a는 ISC-4 (2 μM) 및 세툭시맙 (1 μg/mL) 단독 또는 조합으로 24시간 동안 처리된 RKO 세포의 웨스턴 블롯 분석의 결과를 나타내고;
도 5b는 ISC-4 (2 μM) 및 세툭시맙 (1 μg/mL) 단독 또는 조합으로 표시된 기간 동안 처리된 RKO 세포의 웨스턴 블롯 분석의 결과를 나타내고;
도 5c는 ISC-4 (2 μM) 및 세툭시맙 (1 μg/mL)의 조합으로 (Rx) 8시간 동안 처리된 표시된 인간 대장암 세포주의 웨스턴 블롯 분석의 결과를 나타내고, 대조군에 비하여 *P<0.05;
도 6a는 단일 용량의 ISC-4 (3 mg/kg, 복강내), 세툭시맙 (10 mg/kg, 정맥내), 또는 상기 조합("combo")의 처리 4일 후에 5-FU-저항성 RKO 이종 이식의 상대적인 종양 크기를 나타낸 그래프이고;
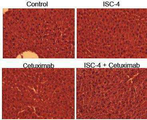
도 6b는 처리 24시간 후에 채취한 이종 이식 종양의 헤마톡실린 및 에오신 (H&E) 염색 및 TUNEL 염색의 결과를 나타내고;
도 6c는 구축된 HT-29 이종 이식 종양을 가지는 무흉선의 암컷 누드 마우스에 ISC-4 (3 mg/kg, 정맥내), 세툭시맙 (10 mg/kg, 정맥내), 상기 조합, 또는 세툭시맙 및 5-FU (25 mg/kg, 정맥내)를 0 일에 시작하여 일주일에 한번씩 처리한 결과를 나타내고;
도 7a는 ISC-4 (2 μM) 및 세툭시맙 (1 μg/mL) 단독 또는 조합으로 12시간 동안 처리된 RKO 세포의 위상차 이미지를 나타내고;
도 7b는 ISC-4 (2 μM) 및 세툭시맙 (1 μg/mL) 단독 또는 조합으로 처리된 RKO 세포에서 Ki-67 발현의 유세포 분석 결과를 나타내고;
도 7c는 ISC-4 (2 μM) 및 세툭시맙 (1 μg/mL) 단독 또는 조합으로 처리된 RKO 세포에서 Ki-67 발현의 웨스턴 블롯 분석의 결과를 나타내고;
도 7d는 ISC-4 (2 μM) 및 세툭시맙 (1 μg/mL) 단독 또는 조합으로 24시간 동안 처리된 RKO 세포의 웨스턴 블롯 분석의 결과를 나타내고;
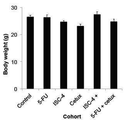
도 8a는 ISC-4 (3 mg/kg, 복강내), 세툭시맙 (10 mg/kg, 정맥내), 또는 상기 조합을 2주동안 일주일에 두번씩 받도록 한 마우스의 체중 변화를 나타낸 그래프이고 (n≥5);
도 8b는 ISC-4 (3 mg/kg, 복강내), 세툭시맙 (10 mg/kg, 정맥내), 또는 상기 조합을 처리 24시간 후에 마우스로부터 채취한 간 조직의 H&E 염색 결과를 나타내고;
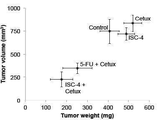
도 8c는 도 6c에 기술된 HT-29 이종 이식의 최종 종양 부피 및 종양 무게를 나타내는 그래프이고; 및
도 8d는 마지막 용량 후 3일인 최종 지점에서 마우스의 체중을 나타낸 그래프이고 (n≥8), 오차 바는 반복의 SEM을 나타낸다.
도 1b는 동시적 및 비동시적인 HCT116 세포의 세포 주기 프로파일에 대한 ISC-4 처리의 효과를 나타낸 그래프이고;
도 1c는 동시적 및 비동시적인 HT-29 세포의 세포 주기 프로파일에 대한 ISC-4 처리의 효과를 나타낸 그래프이고;
도 1d는 0, 1, 2, 4, 8, 또는 16 μM의 ISC-4 로 처리된 후 표시된 대장암 세포주의 sub-G1 함량을 나타낸 그래프이고;
도 2는 ISC-4 (1, 2, 또는 4 μM) 및 추정적인 EC12.5, EC25, 및 EC50 단독 및 조합으로서 표시된 치료로 처리된 SW480 및 RKO 대장암 세포주의 세포 생존력 분석법의 결과를 나타내고;
도 3a는 표시된 용량으로 72시간 동안 ISC-4 및 세툭시맙으로 처리된 인간 대장암 세포주 HT-29의 세포 생존력 분석법의 결과를 나타내고;
도 3b는 표시된 용량으로 72시간 동안 ISC-4 및 세툭시맙으로 처리된 인간 대장암 세포주 RKO의 세포 생존력 분석법의 결과를 나타내고;
도 3c는 표시된 용량으로 72시간 동안 ISC-4 및 세툭시맙으로 처리된 인간 대장암 세포주 HCT116의 세포 생존력 분석법의 결과를 나타내고;
도 3d는 표시된 용량으로 72시간 동안 ISC-4 및 세툭시맙으로 처리된 인간 대장암 세포주 DLD-1의 세포 생존력 분석법의 결과를 나타내고;
도 3e는 표시된 용량으로 72시간 동안 5-FU로 처리된 야생형 및 5-FU-저항성 RKO 세포의 세포 생존력 분석법의 결과를 나타내고;
도 3f는 24시간 동안 ISC-4 (2 μM) 및 세툭시맙 (1 μg/mL)으로 처리된 5-FU-저항성 RKO 세포의 결과를 나타내고;
도 4a는 ISC-4 (2 μM) 및 세툭시맙 (1 μg/mL) 단독 또는 조합으로 표시된 기간 동안 처리된 RKO 세포의 세포 생존력 분석법의 결과를 나타내고;
도 4b는 도 4a에 있는 것처럼 12시간 동안 처리된 RKO 세포의 DAPI 염색의 결과를 나타내고;
도 4c는 12시간 동안 ISC-4 (2 μM) 및 세툭시맙 (1 μg/mL) 단독 또는 조합으로 처리된 RKO 세포의 sub-G1 함량을 나타내고;
도 4d는 세툭시맙 (0, 0.25, 0.5, 또는 1μg/mL)과 조합하여 ISC-4 (2 μM)로 24시간 동안 처리된 후에 RKO 세포의 Caspase-Glo 분석법의 결과, 상단, 및 ISC-4 (2μM) 및 세툭시맙 (1μg/mL)의 정량 결과, 하단을 나타내고;
도 5a는 ISC-4 (2 μM) 및 세툭시맙 (1 μg/mL) 단독 또는 조합으로 24시간 동안 처리된 RKO 세포의 웨스턴 블롯 분석의 결과를 나타내고;
도 5b는 ISC-4 (2 μM) 및 세툭시맙 (1 μg/mL) 단독 또는 조합으로 표시된 기간 동안 처리된 RKO 세포의 웨스턴 블롯 분석의 결과를 나타내고;
도 5c는 ISC-4 (2 μM) 및 세툭시맙 (1 μg/mL)의 조합으로 (Rx) 8시간 동안 처리된 표시된 인간 대장암 세포주의 웨스턴 블롯 분석의 결과를 나타내고, 대조군에 비하여 *P<0.05;
도 6a는 단일 용량의 ISC-4 (3 mg/kg, 복강내), 세툭시맙 (10 mg/kg, 정맥내), 또는 상기 조합("combo")의 처리 4일 후에 5-FU-저항성 RKO 이종 이식의 상대적인 종양 크기를 나타낸 그래프이고;
도 6b는 처리 24시간 후에 채취한 이종 이식 종양의 헤마톡실린 및 에오신 (H&E) 염색 및 TUNEL 염색의 결과를 나타내고;
도 6c는 구축된 HT-29 이종 이식 종양을 가지는 무흉선의 암컷 누드 마우스에 ISC-4 (3 mg/kg, 정맥내), 세툭시맙 (10 mg/kg, 정맥내), 상기 조합, 또는 세툭시맙 및 5-FU (25 mg/kg, 정맥내)를 0 일에 시작하여 일주일에 한번씩 처리한 결과를 나타내고;
도 7a는 ISC-4 (2 μM) 및 세툭시맙 (1 μg/mL) 단독 또는 조합으로 12시간 동안 처리된 RKO 세포의 위상차 이미지를 나타내고;
도 7b는 ISC-4 (2 μM) 및 세툭시맙 (1 μg/mL) 단독 또는 조합으로 처리된 RKO 세포에서 Ki-67 발현의 유세포 분석 결과를 나타내고;
도 7c는 ISC-4 (2 μM) 및 세툭시맙 (1 μg/mL) 단독 또는 조합으로 처리된 RKO 세포에서 Ki-67 발현의 웨스턴 블롯 분석의 결과를 나타내고;
도 7d는 ISC-4 (2 μM) 및 세툭시맙 (1 μg/mL) 단독 또는 조합으로 24시간 동안 처리된 RKO 세포의 웨스턴 블롯 분석의 결과를 나타내고;
도 8a는 ISC-4 (3 mg/kg, 복강내), 세툭시맙 (10 mg/kg, 정맥내), 또는 상기 조합을 2주동안 일주일에 두번씩 받도록 한 마우스의 체중 변화를 나타낸 그래프이고 (n≥5);
도 8b는 ISC-4 (3 mg/kg, 복강내), 세툭시맙 (10 mg/kg, 정맥내), 또는 상기 조합을 처리 24시간 후에 마우스로부터 채취한 간 조직의 H&E 염색 결과를 나타내고;
도 8c는 도 6c에 기술된 HT-29 이종 이식의 최종 종양 부피 및 종양 무게를 나타내는 그래프이고; 및
도 8d는 마지막 용량 후 3일인 최종 지점에서 마우스의 체중을 나타낸 그래프이고 (n≥8), 오차 바는 반복의 SEM을 나타낸다.
본원에 사용된 과학적이고 기술적인 용어는 당업자에 의하여 보통으로 이해되는 뜻을 의미한다. 이러한 용어는 J. Sambrook and D.W. Russell, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press; 3rd Ed., 2001; F.M. Ausubel, Ed., Short Protocols in Molecular Biology, Current Protocols; 5th Ed., 2002; B. Alberts et al., Molecular Biology of the Cell, 4th Ed., Garland, 2002; D.L. Nelson and M.M. Cox, Lehninger Principles of Biochemistry, 4th Ed., W.H. Freeman & Company, 2004; Engelke, D.R., RNA Interference (RNAi): Nuts and Bolts of RNAi Technology, DNA Press LLC, Eagleville, PA, 2003; Herdewijn, P. (Ed.), Oligonucleotide Synthesis: Methods and Applications, Methods in Molecular Biology, Humana Press, 2004; A. Nagy, M. Gertsenstein, K. Vintersten, R. Behringer, Manipulating the Mouse Embryo: A Laboratory Manual, 3rd edition, Cold Spring Harbor Laboratory Press; December 15, 2002, ISBN-10: 0879695919; Kursad Turksen (Ed.), Embryonic stem cells: methods and protocols in Methods Mol Biol. 2002;185, Humana Press; Current Protocols in Stem Cell Biology, ISBN: 9780470151808을 예시적으로 포함하는 다양한 표준 참고문헌의 설명되어있는 문맥에서 사용되고 정의된다.
단수 "a", "an", 및 "the"는 제한하기 위함이 아니며 명확히 달리 설명되거나 문맥에서 명확히 다른 지시가 없는 한 복수 대상물을 포함한다.
세툭시맙의 및 ISC-4의 투여를 포함하는 조합 치료의 상승 효과는 본원에 기술된 바와 같이 예상외의 발견이다.
본 발명에 따르면 세툭시맙 및 ISC-4의 조합을 조합 제제로서 또는 분리하여 투여하는 단계를 포함하는 이를 필요로하는 개체의 암 치료 방법이 제공되고, 여기에서 상기 조합의 투여는 상승 효과를 제공한다.
상기 용어 "ISC-4"는 하기의 구조식을 갖는 화합물을 지칭한다:
상기 화합물 ISC-4는 예를 들어, Sharma, A.K., et al., J. of Med. Chem., 2008, 51(24):7820-7826에 기술된 바와 같은 표준 화학 합성 방법론을 이용하여 합성될 수 있다.
본원에 기술된 방법 및 조성물을 이용하여 치료되는 암은, 이에 제한되지 않으나 종양 발현전의 과다증식(pre-neoplastic hyperproliferation), in-situ 암, 신생세포 및 전이를 포함하는, 비정상적인 세포 증식이라는 특징이 있다.
본 발명의 태양에 따르면 세툭시맙 및 ISC-4의 조합을 조합 제제로서 또는 분리하여 투여하는 단계를 포함하며, 여기에서 상기 조합의 투여는 상승 효과를 제공하는, 야생형 KRAS인 것을 특징으로 하는 암을 가지고 있거나, 가질 위험이 있는 개체의 치료 방법이 제공된다.
GTPase KRas 및 V-Ki-ras2 Kirsten 랫트 육종 바이러스성 종양 유전자 호모로그(homolog)로도 불리는 KRAS는, 과활성화된 KRAS 및 암과 연관되어 KRAS의 돌연변이와 함께 당업계에 잘 알려져있다, S.M. Anderson, Expert Review of Molecular Diagnostics, 2011, 11(6):635-642; Schimanski et al., Cancer Res, 1999, 59:5169-5175; Chang et al., BMC Cancer 9:179, 2009; and Jan妖k et al., Clinical Relevance of KRAS in Human Cancers, Journal of Biomedicine and Biotechnology, 2010, Article ID 150960, Epub Jun 7, 2010 참조.
인간 KRAS를 기준으로 활성 KRAS 돌연변이는 잘 알려져 있으며, 이에 제한되지 않으나 12 코돈, 및 13 그리고 61 코돈에 위치하는 것을 포함한다. 잘 알려진 활성 KRAS 돌연변이의 예는 인간 KRAS를 기준으로 제한 없이 Q61H, G12S, G12V, G12A 및 G13D를 포함한다. 이러한 그리고 다른 잘 알려진 활성 KRAS 돌연변이는 S.M. Anderson, Expert Review of Molecular Diagnostics, 2011, 11(6):635-642; Schimanski et al., Cancer Res, 1999, 59:5169-5175; Chang et al., BMC Cancer 9:179, 2009; and Jancik et al., Clinical Relevance of KRAS in Human Cancers, Journal of Biomedicine and Biotechnology, 2010, Article ID 150960, Epub Jun 7, 2010에 기술되어있다.
상기 KRAS의 돌연변이 상태는 개체로부터 얻은 시험 시료에서 측정될 수 있다.
시험 시료는 암 세포 또는 암 세포로부터 유래된 순환 DNA를 포함하거나 포함하는 것으로 의심되는 개체의 임의의 생물학적 액체, 세포 또는 조직일 수 있으며, 혈액, 혈장, 혈청, 소변, 침, 복수, 뇌척수액, 뇌실액, 흉수, 폐 및 기관지 세척액 시료, 점액, 땀, 눈물, 정액, 방광 세척액 시료, 양수, 림프, 복막액, 활액, 골수 흡입, 종양 세포 또는 조직, 기관 세포 또는 조직 예컨대 생검 시료를 포함한다.
상기 KRAS의 돌연변이 상태는, 단백질 또는 팹티드 시퀀싱, 핵산 분석법 및 면역분석법을 포함하나 이에 제한되지 않는, 임의의 다양한 방법론에 의하여 측정될 수 있다. 상기 KRAS의 돌연변이 상태를 결정하기 위한 예시적인 방법은 S.M. Anderson, Expert Review of Molecular Diagnostics, 2011, 11(6):635-642; Schimanski et al., Cancer Res, 1999, 59:5169-5175; Chang et al., BMC Cancer 9:179, 2009; and Jancik et al., Clinical Relevance of KRAS in Human Cancers, Journal of Biomedicine and Biotechnology, 2010, Article ID 150960, Epub Jun 7, 2010에 기술되어있다.
KRAS 핵산, 특히 mRNA 또는 cDNA를 검출하기 위한 분석법은 시퀀싱; RT-PCR과 같은 PCR(polymersase chain reaction); 돗 블롯(dot blot); 인 시추(in situ) 혼성화; 노던 블롯; 및 RNase 보호(RNAse protection)를 포함하나 이에 제한되지 않는다.
ELISA(enzyme-linked immunosorbent assay), ELIFA(enzyme-linked immunofiltration assay), 유세포 분석, 면역 블롯, 면역침강반응, 면역조직화학, 면역세포화학, LIA(luminescent immunoassay), FIA(fluorescent immunoassay), 및 방사선면역분석법을 포함하나 이에 제한되지 않는 면역분석법은 시료의 KRAS 돌연변이의 상태 분석에 사용될 수 있다.
본 발명의 태양에 따라 세툭시맙 및 ISC-4의 조합을 조합 제제로서 또는 분리하여 투여하는 단계를 포함하는 5-플루오로우라실에 저항성이 있는 것을 특징으로 하는 암을 가지거나 가질 위험이 있는 개체의 치료 방법이 제공되며, 여기에서 상기 조합의 투여는 상승 효과를 제공한다.
본 발명의 태양에 따라 세툭시맙 및 ISC-4의 조합을 조합 제제로서 또는 분리하여 투여하는 단계를 포함하는 야생형 KRAS인 것을 특징으로 하는 대장암을 가지거나 가질 위험이 있는 개체의 치료 방법이 제공되며, 여기에서 상기 조합의 투여는 상승 효과를 제공한다.
본 발명의 방법 및 조성물은 암의 신호 및/또는 증상의 예방 뿐만 아니라 개선을 위해 사용될 수 있다. 용어 "치료하는" 및 "치료"는 예방, 개체의 암의 저해 또는 개선, 예컨대 암의 진행 지연 및/또는 암의 증상의 감소 또는 개선: 을 포함하는 개체의 암 치료를 지칭하기 위해 사용된다.
본 발명의 조합 치료로서 투여되는 세툭시맙 및 ISC-4의 치료적으로 유효한 양은 치료받는 개체에게 유익한 효과를 주는 양이다. 종양 발현전의 과다증식, 암 in-situ, 신생세포, 전이, 종양, 양성 성장 또는 본 발명의 조성물에 반응하는 다른 조건을 포함하나 이에 제한되지 않는 비정상적인 세포 증식을 특징으로 하는 조건과 같이, 암을 가지고 있거나 가질 위험이 있는 개체에서 본 발명의 치료적으로 유효한 양의 조성물은 하나 또는 그 이상의 상기 조건의 신호 및/또는 증상을 개선 또는 예방하는데 효과적이다.
본 발명의 조합 치료로서 투여되는 세툭시맙 및 ISC-4의 치료적으로 유효한 양은 검출가능하게 아폽토시스를 증가시키고 및/또는 암 세포 증식을 감소시키는데 효과적이다. 본 발명의 조합 치료로서 투여되는 세툭시맙 및 ISC-4의 치료적으로 유효한 양은 암 세포에서 인산화-Akt를 검출가능하게 감소시키는데 효과적이다.
본 발명의 방법에 따라 치료되며 본 발명의 조성물을 사용하는 개체는 포유류 또는 비-포유류일 수 있다. 포유류 개체는 인간; 비-인간 영장류; 마우스, 랫트, 또는 기니 피그와 같은 설치류; 고양이 또는 개와 같은 애완동물; 말, 소, 돼지, 양, 염소, 또는 토끼를 포함하나 이에 제한되지 않는 임의의 포유동물일 수 있다. 비-포유류 개체는 오리, 거위, 닭, 또는 칠면조와 같은 조류를 포함하나 이에 제한되지 않는 임의의 비-포유동물일 수 있다. 개체는 어떠한 성 또는 임의의 나이를 가질 수 있다. 개체에게 발명의 약학적 조성물의 투여를 포함하는 방법의 태양에서, 상기 개체는 인간이다. 상기 용어 "개체" 및 "환자"는 본원에서 혼용되어 사용된다.
본 발명의 태양에 따라 세툭시맙, ISC-4 및 하나 또는 그 이상의 추가적인 치료적 물질의 조합이 투여된다.
본원에서 상기 용어 "추가적인 치료적 물질"은 화학적 화합물, 화학적 화합물의 혼합물, 생물학적 고분자 (핵산, 항체, 단백질 또는 이의 부분 즉 펩티드), 또는 박테리아, 식물, 곰팡이, 또는 동물 (특히 포유동물)의 세포 또는 조직으로부터의 추출물을 지칭하며, 개체에서 국부적으로 또는 전신성으로 작용하는 생물학적, 생리학적, 또는 약학적인 활성 물질 (또는 물질들)이다.
본 발명의 방법 및 조성물의 태양에 따라 포함되는 추가적인 치료적 물질은 항생제, 항바이러스제, 항종양제, 진통제, 해열제, 항우울제, 항정신병약, 항암제, 항히스타민제, 항골다공증제, 항골괴사제, 항염증제, 항불안제, 화학요법치료제, 이뇨제, 성장 인자, 호르몬, 비스테로이드성 항염증제, 스테로이드 및 혈관수축제를 포함하나 이에 제한되지 않는다.
ISC-4 및 세툭시맙의 투여를 포함하는 조합 치료는 상승 효과를 보인다.
본 발명의 태양에 따르면, 조합 치료는 (1) 단일 약학적 조성물로 조제된 ISC-4 및 세툭시맙을 포함하는 약학적 조합 조성물을 포함하는 약학적 조성물; 및/또는 (2) ISC-4 및 세툭시맙이 동일 조성물로 조제되지 않은 경우 ISC-4 및 세툭시맙의 동시 투여: 를 포함한다. 분리 제제를 사용하는 경우 ISC-4 는 세툭시맙에 대하여 동시에, 단속적으로, 시차를 두고, 먼저, 다음에, 또는 이의 조합으로 투여될 수 있다.
본 발명의 태양에 따르면, 조합 치료는 (1) 하나 또는 그 이상의 추가적인 치료적 물질과 함께 단일 약학적 조성물로 조제된 ISC-4 및 세툭시맙을 포함하는 약학적 조합 조성물을 포함하는 약학적 조성물; (2) ISC-4, 세툭시맙 및 하나 또는 그 이상의 추가적인 치료적 물질이 동시 투여되고 여기서 ISC-4, 세툭시맙 및 하나 또는 그 이상의 추가적인 치료적 물질은 동일 조성물로 조제되지 않은 것이며; 및/또는 (3) ISC-4, 세툭시맙 및 하나 또는 그 이상의 추가적인 치료적 물질이 동시 투여, 여기서 두개 또는 그 이상이나 전부는 아닌 ISC-4, 세툭시맙 및 상기 하나 또는 그 이상의 추가적인 치료적 물질은 동일 조성물로 조제된 것이다: 를 포함한다. ISC-4, 세툭시맙 및 하나 또는 그 이상의 추가적인 약학적 물질 각각의 분리 제제를 사용할 경우 각각은 상기 다른 성분에 대하여 동시에, 단속적으로, 시차를 두고, 먼저, 다음에, 또는 이의 조합으로 투여될 수 있다.
조합 치료는 ISC-4 및 세툭시맙을 포함하는 상기 약학적 조성물의 유효 용량을 감소하게 하며 치료적 지수(index)를 증가하게 한다.
본 발명의 태양에 따른 추가적인 약학적 물질은 항암제이다.
항암제는, 예를 들어, Goodman et al., Goodman and Gilman's The Pharmacological Basis of Therapeutics, 8th Ed., Macmillan Publishing Co., 1990에 기술되어 있다.
항암제는 예시적으로 아시비신(acivicin), 아클라루비신(aclarubicin), 아코다졸(acodazole), 아크로닌(acronine), 아도제레신(adozelesin), 알데스루킨(aldesleukin), 알리트레티노인(alitretinoin), 알루푸리놀(allopurinol), 알트레타민(altretamine), 암보마이신(ambomycin), 아메탄트론(ametantrone), 아미포스틴(amifostine), 아미노글루테티미드(aminoglutethimide), 암사크린(amsacrine), 아나스트로졸(anastrozole), 안트라마이신(anthramycin), 삼산화 비소(arsenic trioxide), 아스파라기나제(asparaginase), 아스페린(asperlin), 아자시티딘(azacitidine), 아제테파(azetepa), 아조토마이신(azotomycin), 바티마스타트(batimastat), 벤조데파(benzodepa), 베바시주맙(bevacizumab), 바이칼루타마이드(bicalutamide), 비산트렌(bisantrene), 비스나피드 디메실레이트(bisnafide dimesylate), 비젤레신(bizelesin), 블레오마이신(bleomycin), 브레퀴나(brequinar), 브로피리민(bropirimine), 부슬판(busulfan), 칵티노마이신(cactinomycin), 칼루스테론(calusterone), 카페시타빈(capecitabine), 카라세마이드(caracemide), 카베티머(carbetimer), 카보플라틴(carboplatin), 카무스틴(carmustin), 카루비신(carubicin), 카젤레신(carzelesin), 세데핀골(cedefingol), 세레콕시브(cerecoxib), 클로람부실(chlorambucil), 시로레마이신(cirolemycin), 시스플라틴(cisplatin), 클라드리빈(cladribine), 크리스나톨 메실레이트(crisnatol mesylate), 시클로포스파미드(cyclophosphamide), 시타라빈(cytarabine), 다카바진(dacarbazine), 닥티노마이신(dactinomycin), 다우노루비신(daunorubicin), 데시타빈(decitabine), 엑소마플라틴(dexormaplatin), 데자구아닌(dezaguanine), 데자구아닌 메실레이트(dezzaguanine mesylate), 다이아지콘(diaziquone), 도세탁셀(docetaxel), 독소루비신(doxorubicin), 드롤록시펜(droloxifene), 드로모스타놀론(dromostanolone), 두아조마이신(duazomycin), 에다프렉사트(edatrexate), 이플로미틴(eflomithine), 엘사미트루신(elsamitrucin), 엔로플라틴(enloplatin), 엔프로메이트(enpromate), 에피프로피딘(epipropidine), 에피루비신(epirubicin), 에부로졸(erbulozole), 에소루비신(esorubicin), 에스트라무스틴(estramustine), 에타타니다졸(etanidazole), 에토포시드(etoposide), 에토프린(etoprine), 파드로졸(fadrozole), 파자라빈(fazarabine), 펜레티니드(fenretinide), 플록수리딘(floxuridine), 플루다라빈(fludarabine), 플루오로우라실(fluorouracil), 프플루로시타빈(flurocitabine), 포스퀴돈(fosquidone), 포스트리신(fostriecin), 플베스트런트(fulvestrant), 젬시타빈(gemcitabine), 하이드록시우레아(hydroxyurea), 이다루비신(idarubicin), 이포스프아미드(ifosfamide), 일모포신(ilmofosine), 인터루킨 Ⅱ(interleukin II ,재조합 인터루킨 Ⅱ 또는 rIL2를 포함하는 IL-2), 인터페론 알파-2a(interferon alfa-2a), 인터페론 알파-2b(interferon alfa-2b), 인터페론 알파-n1(interferon alfa-n1), 인터페론 알파-n3(interferon alfa-n3), 인터페론 베타Ⅰa(interferon beta-Ia), 인터페론 감마-Ⅰb(interferon gamma-Ib), 이프로플라틴(iproplatin), 이리노테칸(irinotecan), 란레오티드(lanreotide), 레트로졸(letrozole), 루프로리드(leuprolide), 리아로졸(liarozole), 로메드렉솔(lometrexol), 로무스틴(lomustine), 로속산트론(losoxantrone), 마소프로콜(masoprocol), 마이탄신(maytansine), 메클로레타민 하이드로클로라이드(mechlorethamine hydrochlride), 메게스트롤(megestrol), 메렌레스트롤 아세테이트(mekengestrol acetate), 멜팔란(melphalan), 메노가릴(menogaril), 머캅토푸린(mercaptopurine), 메토트렉세이트(methotrexate), 메토프린(metoprine), 메투레데파(meturedepa), 미틴도미드(mitindomide), 미토카신(mitocarcin), 미토크로민(mitocromin), 미토길린(mitogillin), 미토말신(mitomalcin), 미토마이신(mitomycin), 미토스퍼(mitosper), 미토탄(mitotane), 미토삭트론(mitoxantrone), 미코페놀산(mycophenolic acid), 넬라라빈(nelarabine), 노도다졸(nocodazole), 노갈라마이신(nogalamycin), 옴나플라틴(ormnaplatin), 옥시수란(oxisuran), 파클리탁셀(paclitaxel), 페가스파가제(pegaspargase), 펠리로마이신(peliomycin), 펜타무스틴(pentamustine), 페플로마이신(peplomycin), 퍼포스파미드(perfosfamide), 피포브로만(pipobroman), 피포설판(piposulfan), 피록산트론 파이드로클로라이드(piroxantrone hydrochloride), 플리카마이신(plicamycin), 플로메스탄(plomestane), 포르피머(porfimer), 포르피로마이신(propiromycin), 프리드니무스틴(prednimustine), 프로카바진(procarbazine), 퓨로마이신(puromycin), 피라조푸린(pyrazofurin), 리보프린(riboprine), 로글레티미드(rogletimide), 사핑골(safingol), 세무스틴(semustine), 심트라젠(simtrazene), 스파르포세이트(sparfosate), 스파르소마이신(sparsomycin), 스피로게르마늄(spirogermanium), 스피로무스틴(spiromustine), 스피로플라틴(spiroplatin), 스트렙토니그린(streptonigrin), 스트렙토조신(streptozocin), 수로페너(sulofenur), 탈리소마이신(talisomycin), 타목시펜(tamoxifen), 테코갈란(tecogalan), 테가푸르(tegafur), 텔록사트론(teloxantrone), 테모포르핀(temoporfin), 테니포시드(teniposide), 테록시론(teroxirone), 테스토락톤(testolactone), 티아미프린(thiamiprine), 티오구아닌(thiohuanine), 티오테파(thiotepa), 티아조푸린(tiazofurin), 트리아파자민(tirapazamine), 토포테칸(topotecan), 토레미펜(toremifene), 트레스톨론(trestolone), 트리시리빈(triciribine), 트리메트렉세이트(trimetrexate), 트립토렐린(triptorelin), 트부로졸(tubulozole), 우라실 머스타드(uracil mustard), 우레데파(uredepa), 바프레오티드(vapreotide), 베르테포르핀(verteporfin), 빈블라스틴(vinblastine), 빈크리스틴 설페이트(vincristine sulfate), 빈데신(vindesine), 비네피딘(vinepidine), 빈글리시네이트(vinglycinate), 빈루로신(vinleurosine), 비노렐빈(vinorelbine), 빈로시딘(vinrosidine), 빈조리틴(vinzolidine), 보로졸(vorozole), 제니플라틴(zeniplatin), 지노스타틴(zinostatin), 졸레드로네이트(zoledronate), 및 조루비신(zorubicin)을 포함한다.
본 발명의 태양에 따르면, 본 발명의 조합 치료로서 그것이 필요한 개체의 암의 치료를 위해 투여된 세툭시맙 및 ISC-4의 치료적 활성과 상관관계가 있는 하나 또는 그 이상의 바이오마커는 개체의 암 치료를 평가하기 위하여 측정된다. 따라서, 예를 들어, 상기 인산화-Akt 수준은 본 발명의 조합 치료로서 그것이 필요한 개체의 암의 치료를 위해 투여된 세툭시맙 및 ISC-4의 치료적 활성과 상관관계가 있는 바이오마커이며 암 세포에서 인산화-Akt의 감소는 본 발명의 조합 치료로서 그것이 필요한 개체의 암의 치료를 위해 투여된 세툭시맙 및 ISC-4의 효능의 표지이다. 인산화-Akt 수준은 예를 들어 본원에 기술된 것과 같은 표준 방법론에 따라 측정된다. 아폽토시스의 바이오마커는 본 발명의 조합 치료로서 그것이 필요한 개체의 암의 치료를 위해 투여된 세툭시맙 및 ISC-4의 치료적 활성과 상관관계가 있는 바이오마커이며 암 세포에서 하나 또는 그 이상의 아폽토시스의 바이오마커 증가는 본 발명의 조합 치료로서 그것이 필요한 개체의 암의 치료를 위해 투여된 세툭시맙 및 ISC-4의 효능의 표지이다. 아폽토시스의 바이오마커는 DNA 절편의 검출, 괴사와 구별되는 특징적인 형태상의 변화 및 카스파아제-3(caspase-3)의 활성을 포함하나 이에 제한되지 않는다. 아폽토시스의 바이오마커는 예를 들어 본원에 기술된 것과 같은 표준 방법론에 따라 측정된다.
본 발명의 태양에 따르면, 세툭시맙 및 ISC-4를 이용한 조합 치료의 효능 분석은 개체를 관찰하기 위하여 사용된다. 따라서, 예를 들어, 시험 시료는 본 발명의 방법에 따른 치료 이전의 개체로부터 및 상기 치료의 효과를 평가하기 위해 치료 동안 및/또는 치료 후 한번 또는 그 이상 개체로부터 얻는다. 또다른 예에서, 시험 시료는 다양한 시간에 상기 과정 또는 질환의 진행 또는 치료를 평가하기 위하여 상기 개체로부터 얻는다.
특정 태양에서, 본 발명의 약학적 조성물에 의한 치료 관찰을 돕기 위해 개체로부터 얻은 시험 시료에서 하나 또는 그 이상의 추가적인 바이오마커가 측정된다. 예를 들어, 암 세포의 하나 또는 그 이상의 인산화-Akt 및/또는 아폽토시스 검출은 본 발명의 약학적 조성물에 의한 치료 관찰을 돕기 위해 개체로부터 얻은 시험 시료에서 측정된다.
경우에 따라서는, 그것이 필요한 개체의 암 치료 방법은 부가적 항암 치료를 더 포함한다. 부가적 항암 치료는 개체 또는 개체 신체의 환부의 방사선 치료일 수 있다.
세툭시맙, ISC-4 및 임의의 경우에 따른 추가적인 치료적 물질의 투여량은 예컨대 투여 경로; 상기 조성물이 투여되는 상기 개체의 연령, 건강, 성, 및 체중; 상기 특성 및 개체의 증상의 정도, 및 존재한다면, 필요한 효과와 같으나 이에 제한되지 않는 요인에 기초하여 다양할 것이다. 용량은 치료가 급성 또는 만성 여부에 의존하여 조절될 수 있다. 당업자는 이들 및 의료 업무에 있어 전형적인 다른 조건을 고려해서 약학적으로 유효한 양을 결정할 수 있다.
보통 세툭시맙, ISC-4 및 임의의 경우에 따른 추가적인 치료적 물질의 1일 투여량은 개체의 체중 kg 당 약 0.001 내지 100 mg의 범위이다. 1일 투여량은 필요한 효과를 얻기 위해서 두개 또는 그 이상으로 나누어진 용량으로서 투여될 수 있다. 임의의 하나 또는 그 이상의 세툭시맙, ISC-4 및 임의의 경우에 따른 추가적인 치료적 물질: 을 포함하는 치료적 조성물은, 필요한 결과를 얻기 위하여 서방형으로도 조제될 수 있다.
본 발명의 특정 태양에서, 상기 부가적 항암 치료 및/또는 투여되는 항암제의 양은 ISC-4 및 세툭시맙의 투여를 포함하는 본 발명의 조합 치료 없이 투여할 경우에 치료적 효과를 얻기 위하여 필요한 부가적 항암 치료 및/또는 항암제의 양보다 적다. 따라서, 본 발명의 특정 태양에서, 투여되는 항암 치료 및/또는 투여되는 항암제의 양은 5% 이상, 10% 이상, 15% 이상, 20% 이상, 25% 이상, 30% 이상, 35% 이상, 40% 이상, 50% 이상, 55% 이상, 60% 이상, 65% 이상, 70% 이상, 75% 이상, 80% 이상, 85% 이상, 또는 90% 이상이고, ISC-4 및 세툭시맙의 투여를 포함하는 본 발명의 조합 치료 없이 투여할 경우에 치료적 효과를 얻기 위하여 필요한 부가적 항암 치료 및/또는 항암제의 양보다 적다.
본 발명의 방법은 경구, 직장, 코, 폐, 경막외, 눈, 귀, 동맥내, 심장내, 뇌실, 피내, 정맥내, 근육내, 복강내, 골내, 척추강내, 방광내, 피하, 국부, 경피, 및 점막 관통, 예컨대 설하, 볼, 질, 및 흡입을 포함하나 이에 제한되지 않는 투여 경로에 의한 본 발명의 약학적 조성물의 투여를 포함한다.
전구약물
본 발명의 태양에 따라 ISC-4의 하나 또는 그 이상의 전구약물은 세툭시맙과 조합한 ISC-4 투여의 이익을 얻기 위하여 세툭시맙과 조합하여 투여된다. ISC-4 전구약물은 경우에 따라서 ISC-4 및 세툭시맙과 조합하여 투여된다. ISC-4 전구약물은 본원에 기술된 치료 방법 또는 조성물의 ISC-4를 대신하거나 본원에 기술된 치료 방법 또는 조성물의 ISC-4에 추가하여 사용될 수 있다.
ISC-4 전구약물은 ISC-4를 생산하는 상기 ISC-4 전구약물로부터 방출된 모이어티(moiety), 또는 모이어티들에 공유 결합된 ISC-4 형태이다. 전구약물 형태의 예는 Sloan, K. B., Prodrugs, M. Dekker, New York, 1992; 및 Testa, B. and Mayer, J. M., Hydrolysis in drug and prodrug metabolism: chemistry, biochemistry, and enzymology, Wiley-VCH, Zurich, 2003에 기술되어있다.
특정 ISC-4 전구약물은 ISC-4의 글루코시놀레이트 전구약물이다. 상기 ISC-4 글루코시놀레이트 전구약물은 하기의 반응식에 간단히 나타낸 바와 같이 합성될 것이다. 시험관내 또는 생체내에서 미로시나제(myrosinase)와 상호작용하는 이 ISC-4 글루코시놀레이트 전구약물은, 활성 ISC-4를 방출할 것이다. 상기 ISC-4의 글루시놀레이트 전구약물은 수용성인 것으로 예상된다.
본 발명의 태양에 따라 ISC-4 글루코시놀레이트 전구약물 (I)은 세툭시맙과 조합 투여된 ISC-4의 이익을 얻기 위하여세툭시맙과 조합하여 투여된다. ISC-4 글루코시놀레이트 전구약물 (I)은 경우에 따라서 ISC-4 및 세툭시맙과 조합하여 투여될 수 있다.
(I)에 따른 ISC-4 글루코시놀레이트 전구약물은 경우에 따라서 약학적으로 허용가능한 염으로서 제공된다
상기 구조 (I)의 ISC-4 전구약물의 약학적으로 허용가능한 염 제제는 보통의도된 수신인에게 무독성이며 상기 구조 (I) ISC-4 전구약물의 활성 또는 상기 조성물에 포함된 다른 활성제를 유의적으로 저해하지 않는 임의의 염 형태일 수 있다.
조합 약학적 조성물
본 발명에 따른 ISC-4 및 세툭시맙 모두를 포함하는 조합 약학적 조성물은 보통 약 0.1-99%의 ISC-4, 약 0.1-99%의 세툭시맙 및 약학적으로 허용가능한 담체를 포함한다.
본 발명에 따른 세툭시맙 및 ISC-4 및/또는 ISC-4 글루코시놀레이트 전구약물 (I)을 포함하는 조합 약학적 조성물은 보통 약 0.1-99%의 ISC-4 및 또는 ISC-4의 전구약물, 약 0.1-99%의 세툭시맙; 및 약학적으로 허용가능한 담체를 포함한다.
본 발명에 따른 세툭시맙 및 ISC-4 및/또는 ISC-4 글루코시놀레이트 전구약물 (I)을 포함하는 조합 약학적 조성물은 보통 약 0.1-99%의 ISC-4 및/또는 ISC-4 글루코시놀레이트 전구약물 (I), 약 0.1-99%의 세툭시맙; 및 약학적으로 허용가능한 담체를 포함한다.
본 발명의 약학적 조성물은 개체에 투여되기 위해 적합한 임의의 투여 형태, 예시적으로 고체, 반-고체 및 액체의 투여 형태 예컨대 정제(tablet), 캡슐제, 분말, 과립, 좌약, 정제(pill), 액제, 현탁액, 연고, 로션, 크림, 겔, 페이스트, 스프레이 및 에어졸을 포함한다. 리포좀 및 에멀전은 약학적 물질, 특히 소수성 약학적 물질을 전달하기 위해 사용될 수 있는 잘 알려진 유형의 약학적 제제이다. 본 발명의 약학적 조성물은 보통 부형제, 희석액 및/또는 비히클(vehivle)과 같은 약학적으로 허용가능한 담체를 포함한다. 고체 소수성 중합체의 반투과성 매트리스와 같은 조성물의 지연된 방출 제제 및 지연된 방출 시스템이 사용될 수 있다.
본 발명의 조성물의 약학적 제제는 약학적으로 허용가능한 담체를 포함할 수 있다. 상기 용어 "약학적으로 허용가능한 담체"는 과도한 독성 또는 통증 없이 개체에게 사용하기에 적합한 담체를 지칭하며 약학적 조성물에 포함된 다른 성분과 양립할 수 있다.
약학적으로 허용가능한 담체, 약학적 조성물의 제조를 위한 방법 및 다양한 투여 형태 뿐만 아니라 투여 모드는 당업계에서 예를 들어 Pharmaceutical Dosage Forms: Tablets, eds. H. A. Lieberman et al., New York: Marcel Dekker, Inc., 1989; and in L.V. Allen, Jr. et al., Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems, 8th Ed., Philadelphia, PA: Lippincott, Williams & Wilkins, 2004; A. R. Gennaro, Remington: The Science and Practice of Pharmacy, Lippincott Williams & Wilkins, 21st ed., 2005, particularly chapter 89; and J. G. Hardman et al., Goodman & Gilman's The Pharmacological Basis of Therapeutics, McGraw-Hill Professional, 10th ed., 2001에 잘 알려져있다.
투여 또는 투여 전 액체에 현탁하기 위한 고체 투여 형태는 예시적으로 캡슐제, 정제, 분말, 및 과립을 포함한다. 이러한 고체 투여 형태에서, 하나 또는 그 이상의 활성제는, 예를 들어 구연산 나트륨 또는 예시적으로 인산 나트륨, 인산 칼륨, 및 인산 칼슘을 포함하는 알칼리 금속 인산염과 같은 완충액; 예를 들어 전분, 락토오스, 수크로오스, 글루코오스, 만니톨, 및 규산(silicic acid)과 같은 충전제; 예를 들어 카복시메틸셀룰로오스, 알지네이트(alignate), 젤라틴, 폴리비닐피롤리돈, 수크로오스, 및 아카시아와 같은 결합제; 예를 들어 글리세롤과 같은 보습제; 예를 들어 아가-아가, 탄산 칼슘, 감자 또는 타피오카 전분과 같은 식물 전분, 알긴산(alginic acid), 특정 복합 규산염(certain complex silicate), 및 탄산 나트륨과 같은 붕해제; 예를 들어 파라핀과 같은 용해 억제제; 예를 들어 사차 암모늄 화합물과 같은 흡수 촉진제; 예를 들어 세틸 알코올, 글리세롤 모노스테아린산염, 및 글리콜과 같은 습윤제; 고령토 및 벤토나이트(bentonite)와 같은 흡수제; 예를 들어 활석, 스테아린산 칼슘, 스테아린산 마그네슘, 고체 폴리에틸렌 글리콜 또는 라우릴 황산 나트륨과 같은 윤활유; 예를 들어 소르브산(sorbic acid), 젠타마이신 및 페놀과 같은 항박테리아제 및 항곰팡이제와 같은 방부제; 및 예를 들어 수크로오스, EDTA, EGTA, 및 항산화제와 같은 안정제를 포함하는 하나 이상의 예시적인 담체와 함께 혼합된다.
고체 투여 형태는 경우에 따라서 장용성 코팅과 같은 코팅을 포함한다. 상기 장용성 코팅은 전형적으로 고분자 물질이다. 바람직한 장용성 코팅 물질은 생물학적으로 침식 가능하고, 서서히 가수분해 및/또는 서서히 물에 녹는 고분자인 특징을 가진다. 고체 투여에 적용되는 상기 장용성 코팅 물질의 양은 보통 섭취 및 약물 방출 사이의 시간 간격을 지시한다. 적용된 코팅은 전체 코팅 투여가 위산과 관련된 위장관액이 pH 3 이하인 경우는 녹지 않으나 pH 3 이상인 소장 환경에서는 녹는 두께를 가진다. pH-의존적 수용성 프로파일을 보이는 임의의 음이온성 고분자는 이미 본 발명의 업계에서 상기 활성제가 위장관을 낮추기 위해 전달되기 위하여 사용될 것으로 기대된다. 상기 특정 장용성 코팅 물질의 선택은 위에서의 분해에 대한 저항성; 위액에 대한 불침투성 및 위에 있는 동안에 활성제의 확산; 무독성; 및 적용의 용이성과 같은 특징에 의존한다.
적절한 장용성 코팅 물질은 예시적으로 하이드록시프로필 셀룰로오스, 하이드록시에틸 셀룰로오스, 하이드록시프로필 메틸 셀룰로오스, 메틸 셀룰로오스, 에틸 셀룰로오스, 셀룰로오스 아세테이트, 셀룰로오스 아세테이트 프탈레이트, 셀룰로오스 아세테이트 트리멜리테이트, 하이드록시프로필메틸 셀룰로오스 프탈레이트, 하이드록시프로필메틸 셀룰로오스 숙시네이트 및 카복시메틸렐술로오스 소듐; 아크릴산 중합체 및 공중합체, 바람직하게는 아크릴산, 메타크릴산, 아세트산 메틸, 아크릴산메틸 암모늄, 아크릴산 에틸, 메타크릴산 메틸 및/또는 에틸; 폴리비닐 피롤리돈 아세트산 폴리비닐, 폴리비닐아세트산 프탈레이트, 아세테이트산비닐 크로톤산 공중합체, 및 에틸렌-비닐 아세트산 공중합체; 셸락; 및 이의 조합과 같은 셀룰로오스 중합체를 포함한다. 특정 장용성 코팅 물질은 예를 들어 미국 특허 번호 6,136,345에 기술되어 있는 아크릴산 중합체 및 공중합체를 포함한다.
상기 장용성 코팅은 위액이 상기 고체 투여 형태 안으로 침투하게 하는 구멍 및 균열의 형성을 방지하기 위해 경우에 따라서 가소제를 포함한다. 적절한 가소제는 예시적으로 트리에틸 아세테이트 (Citroflex 2), 트리아세틴 (글리세릴 트리아세테이트), 아세틸 트리에틸 시트레이트 (Citroflec A2), Carbowax 400 (폴리에틸렌 글리콜 400), 디에틸 프탈레이트, 트리뷰틸 시트레이트, 아세틸레화 모노글리세라이드, 글리세롤, 지방산 에스터, 프로필렌 글리콜, 및 디뷰틸 프탈레이트를 포함한다. 특히, 음이온성 카복실 아크릴 중합체의 구성은 전형적으로 약 10% 내지 25% 중량부의 가소제, 특히 디뷰틸 프탈레이트, 폴리에틸렌 글리콜, 트리에틸 시트레이트 및 트리아세틴을 포함한다. 상기 코팅은 또한 코팅 물질의 용해도를 높이거나 분산시키기 위하여, 그리고 코팅 및 이의 생성물의 성능의 향상을 위하여 다른 코팅 부형제 예컨대 디택키파이어(detackifier), 항기포제, 윤활유 (예컨대 스테아르산 마그네슘), 및 안정제 (예컨대 하이드록시프로필셀룰로오스, 산 또는 염기)를 포함한다.
경구 투여를 위한 액체 투여 형태는 하나 또는 그 이상의 활성제 및 에멀전, 액체, 현탁액, 시럽, 또는 부형제로서 조제된 약학적으로 허용가능한 담체를 포함한다. 본 발명의 조성물의 액체 투여 형태는 착색제, 안정제, 습윤제, 유화제, 서스펜션화제, 감미료, 방향제, 또는 향기제를 포함할 수 있다.
예를 들어, 비경구적 투여를 위한 조성물은 주사액으로서 조제될 수 있다. 적절한 수성 및 수성이 아닌 담체는 물, 에탄올, 폴리올 예컨대 프로필렌 글리콜, 폴리에틸렌 글리콜, 글리세롤 및, 적절한 이들의 혼합물; 올리브 오일과 같은 식물성 기름; 및 올레산에틸과 같은 주사 가능한 유기 에스터를 포함한다. 적절한 유동성은 예를 들어 레시틴과 같은 코팅의 사용, 확산의 경우 적절한 입자 크기의 유지, 및/또는 라우릴 황산 나트륨과 같은 계면활성제의 사용에 의하여 유지될 수 있다. 안정제는 경우에 따라서 예를 들어 루크로오스, EDTA, EGTA, 및 항산화제에 포함될 수 있다.
국부 투여를 위하여, 조성물은 국소 효과를 위해 피부에 투여하기 위하여 및/또는 경피 전달을 위한 "패치" 제형으로서 조제될 수 있다. 국부 투여에 적절한 약학적 제형은 예를 들어 연고, 로션, 크림, 겔, 페이스트, 스프레이 및 분말을 포함한다. 연고, 로션, 크림, 겔 및 페이스트는 하나 또는 그 이상의 활성제, 흡수 염기, 물-제거 염기, 수용성 염기, 유지성 염기와 같은 염기 및 농조화제, 겔화제, 착색제 안정제, 유화제, 서스펜션화제, 감미료, 방향제, 또는 향기제와 같은 부형제를 더하여 포함할 수 있다.
경피 제형은 아세톤, azone, 디메틸 아세트아미드, 디메틸 포름아마이드, 이메틸 설폭사이드, 에탄올, 올레산, 폴리에틸렌 글리콜, 프로필렌 글리콜 및 라우릴 황산 나트륨과 같은 경피 흡수 개선제를 포함할 수 있다. ionotophoresis 및/또는 sonophoresis는 경피 전달을 개선시키기 위해 사용될 수 있다.
하나 또는 그 이상의 활성제의 국부 투여를 위한 분말 및 스프레이는 활석, 락토오스 및 하나 또는 그 이상의 규산과 같은 부형제를 포함할 수 있다. 스프레이는 불화계 탄화수소 압축가스, 이산화탄소, 또는 적절한 가스 등의 약학적인 압축가스를 포함할 수 있다. 대안으로서, 스프레이는 압축가스가 필요하지 않은 펌프-유형 스프레이 장치로부터 전달될 수 있다. 스프레이 장치는 예를 들어 전달된 양의 조절을 위한 밸브를 이용하여 본원에 포함된 조성물의 정량을 전달한다.
하나 또는 그 이상의 활성제의 안과용 제형은 방부제, 완충제 및 농조화제와 같은 성분을 포함할 수 있다.
본 발명의 약학적 조성물에서 약학적으로 허용가능한 담체 또는 부형제로서 유용한 적절한 계면활성제는 좋은 유화, 확산 및/또는 습윤 특성을 가지는 비이온성, 양이온성 및/또는 음이온성 계면활성제를 포함한다. 적절한 음이온성 계면활성제는 수용성 비누 및 수용성 합성 계면활성제를 모두 포함한다. 적절한 비누는 예를 들어 올레산 또는 스테아르산, 또는 코코넛 오일 또는 공업용 우지로부터 얻을 수 있는 형태인 천연 지방산 혼합물의 나트륨 또는 칼륨 염인 알칼리 또는 알칼리토금속염, 비치환된 또는 치환된 고급지방산(C10-C22)의 암모늄염이다. 합성 계면활성제는 폴리아크릴산의 나트륨 또는 칼슘 염; 지방 설포네이트 및 설페이트; 설폰화된 벤즈이미다졸 유도체 및 알킬아릴설포네이트를 포함한다. 지방 설포네이트 또는 설페이트는 예를 들어 리그노설폰산 또는 도데실설폰산 또는 천연 지방산으로부터 얻은 지방 알코올 설페이트 혼합의 나트륨 또는 칼슘염, (예컨대 라우릴 황산) 황산 또는 설폰산 에스터의 알칼리 또는 알칼리토금속염 보통 알칼리 또는 알칼리토금속염 및 지방 알코올/에틸렌 옥사이드 부산물의 설폰산인 비치환된 암모늄염 또는 8 내지 22개의 탄소를 가진 알킬 또는 아실 라디칼로 치환된 암모늄염의 형태이다. 적절한 설폰화된 벤즈이미다졸 유도체는 바람직하게는 8 내지 22개의 탄소 원자를 포함한다. 알킬아릴설포네이트의 예는 나트륨, 칼슘 또는 도데실벤젠 설폰산의 알카놀아민 염 또는 디뷰틸-나프탈렌설폰산 또는 나프탈렌-설폰산/포름알데히드 농축 생성물이다. 또한 적절하고 부합하는 인산화제는 예컨대 인산 에스터 및 p-노닐페놀과 에틸렌 및/또는 프로필렌 옥사이드, 또는 인지질의 부산물이다. 본 목적을 위한 적절한 인지질은 예를 들어 포스파티딜에탄올아민, 포스파디딜세린, 포스파티딜글리세린, 리소레시틴, 사디오리핀, 디올타닐포스파티딜콜린, 디팔미토일포스파티딜-콜린 및 그들의 혼합물과 같은 세팔린 또는 레시틴 유형인 자연의(동물 또는 식물 세포로부터 유래) 또는 합성의 인지질이다.
본 발명의 약학적 조성물에서 약학적으로 허용가능한 담체 또는 부형제로서 유용한 적절한 비이온성 계면활성제는 폴리에톡시화 및 폴리프로폭시화된 알킬페놀의 유도체, 지방 알코올, 지방산, 분자내 12개 이상의 탄소를 포함하는 지방족 아민 또는 아마이드, 알킬아렌설포네이트 및 디알킬설포숙기네이트, 지방족 폴리글리콜 에터 유도체 및 고리지방족알코올, 포화 및 불포화 지방산 및 알킬페놀, 바람직하게는 3 내지 10 글리콜 에터기 및 (지방족) 탄화수소 모이어티에서 8 내지 20 탄소 원자 및 알킬페놀의 알킬 모이어티에 6 내지 18 탄소 원자를 갖는 상기 유도체를 포함한다. 또다른 적절한 비이온성 계면활성제는 폴리데틸렌 옥사이드와 폴리프로필렌 글리콜, 알킬 가지에 1 내지 10 탄소 원자를 포함하는 에틸렌디아미노폴리프로필렌 글리콜의 수용성 부산물이며, 부산물은 20 내지 250 에틸렌글리콜 에터기 및/또는 10 내지 100 프로필렌글리콜 에터기를 포함한다. 이러한 화합물은 보통 1 내지 5의 프로필렌글리콜 단위 당 에틸렌글리콜 단위를 포함한다. 비이온성 계면활성제의 대표적인 예는 노닐페놀-폴리에톡시에탄올, 피자마유 폴리글리콜 에터, 폴리프로필렌/ 폴리에틸렌 옥사이드 부산물, 트리뷰틸페녹시폴리에톡시에탄올, 폴리에틸렌글리콜 및 옥틸페녹시폴리에톡시에탄올이다. (예컨대 폴리옥시에틸렌 소르비탄 트리올리에이트) 폴리에틸렌 소르비탄의 폴리에틸렌 지방산 에스터, 글리세롤, 소르비탄, 수크로오스 및 펜타에리트리톨은 또한 적절한 비이온성 계면활성제이다.
본 발명의 약학적 조성물에서 약학적으로 허용가능한 담체 또는 부형제로서 유용한 적절한 양이온성 계면활성제는 사차암모늄염, 바람직하게는 4개의 탄화수소 라디칼을 가지고 경우에 따라서는 할로겐, 페닐기로 치환되고, 페닐기 또는 하이드록시기로 치환된 할로겐화물; 예를 들어 N-치환기로서 C8-C20 이상의 알킬 라디칼(예를 들어 및, 또다른 서브-치환기, 치환되지 않거나 할로겐화된 lower 알킬, 벤질 및/또는 하이드록시-lower 알킬 라디칼을 포함하는 사차암모늄염을 포함한다.
본 목적을 위한 적절한 계면활성제의 더욱 자세한 기술은 예를 들어 "McCutcheon's Detergents and Emlusifiers Annual " (MC Publishing Crop., Ridgewood, New Jersey, 1981), "Tensid-Taschenbuch", 2nd ed. (Hanser Verlag, Vienna, 1981) 및 "Encyclopaedia of Surfactants (Chemical Publishing Co., New York, 1981)에서 찾을 수 있다.
구조-형성제, 농조화제 또는 겔-형성제는 상기 약학적 조성물 및 본 발명의 조합 제제에 포함될수 있다. 적절한 이러한 물질은 특히 상품명 Aerosil로 상업적으로 이용가능한 생성물; 벤토나이트; 각각의 알킬기는 1 내지 20 탄소 원자를 포함하는 montmorillonite의 테트라알킬 암모늄염(예를 들어 상품명 Bentone으로 상업적으로 이용가능한 생성물); 세토스테아릴 알코올 및 변형된 피자마유 생성물 (예를 들어 상품명 Antisettle로 상업적으로 이용가능한 생성물)으로서 규산에 잘 확산된다.
특정 태양에서, 약학적으로 허용가능한 담체는 리포솜, 미셀, 단일라멜라 또는 다중라멜라 소포(vesicle)를 포함하는 지질 입자와 같은 입자 담체; 하이드로겔 입자, 폴리글리콜산 입자 또는 폴리젖산 입자와 같은 고분자 입자; 예를 들어 미국 특허 번호 5,648,097에 기술된 것과 같은 인산칼슘 입자와 같은 무기 입자; 및 미국 특허 번호 6,630,486에 기술된 것과 같은 무기/유기 입자이다.
약학적으로 허용가능한 입자 담체는 지질 입자, 고분자 입자; 무기 입자; 및 무기/유기 입자로부터 선택될 수 있다. 입자 유형의 혼합물은 또한 약학적으로 허용가능한 입자 담체로서 포함될 수 있다.
입자 담체는 전형적으로 약 1 nm - 10 micron인 범위의 평균 입자 크기를 갖도록 조제된다. 특정 태양에서, 입자 담체는 약 1 nm - 100 nm인 범위의 평균 입자 크기를 갖도록 조제된다.
투여 형태를 제조하기 위한 관습적인 성분, 장비 및 방법에 관한 자세한 정보는 Pharmaceutical Dosage Forms: Tablets, eds. H. A. Lieberman et al., New York: Marcel Dekker, Inc., 1989; and in L.V. Allen, Jr. et al., Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems, 8th Ed., Philadelphia, PA: Lippincott, Williams & Wilkins, 2004; A. R. Gennaro, Remington: The Science and Practice of Pharmacy, Lippincott Williams & Wilkins, 21st ed., 2005, particularly chapter 89; 및 J. G. Hardman et al., Goodman & Gilman's The Pharmacological Basis of Therapeutics, McGraw-Hill Professional, 10th ed., 2001에서 찾을 수 있다.
본 발명의 태양에 따른 상용 패키지는 조합으로서 또는 분리하여 조제된 세툭시맙 및 ISC-4를 포함한다. 상기 세툭시맙 및 ISC-4의 투여를 위한 지시는 본 발명의 태양에 따라 포함된다. 하나 또는 그 이상의 보조적 요소는 경우에 따라서 완충액 또는 희석액으로서 본 발명의 상용 패키지에 포함된다.
발명의 조성물 및 방법의 태양은 하기의 실시예에서 설명된다. 이러한 실시예는 예시적인 목적으로 제공되며 발명의 조성물 및 방법의 범위의 제한으로 고려되는 것은 아니다.
실시예
세포 배양, 세포 생존력 분석법, 및 시약
세포주는 ATCC로부터 얻었고 ATCC-추천된 배지에서 5% CO2 및 37℃의 습식 배양기에서 배양하였다. 세포 생존력 분석법을 위해서, 세포는 96-웰의 검은 웰 플레이트에 1×105 세포 / mL 농도로 신선한 배지에 웰 당 100μL 부피가 되도록 접종했다. 세포를 하룻밤동안 부착되게 하였고 다음날 표시된 바와 같이 처리하였다. 종점에서, CellTiter-Glo (Promega) 분석법을 제조업자의 프로토콜에 따라 수행하였고, 생물 발광 해독(bioluminescent readout)은 IVIS imaging system (Xenogen)으로 기록하였다. 세포 동기화를 위하여, 세포를 처리 전 200 ng/mL의 노코다졸과 함께 16시간동안 배양하였다. 클로로퀸(Chloroquine)을 Sigma로부터 얻었다. zVAD-fmk 을 Promega로부터 얻었고 25 μM 농도로 사용하였다. ISC-4는 Sharma, A.K., et al., J. of Med. Chem., 2008, 51(24):7820-7826에 기술된 바와 같이 합성하였다.
유세포 분석
sub-G1 DNA 함량 분석을 위하여, 세포를 상기 표시된 시점에서 트립신화하였고 80%의 에탄올에 4℃에서 최소한 30분동안 고정시켰다. 다음 고정된 세포를 RNase의 존재 하에 프로피듐 요오드화물로 염색하였고 Epics Elite flow cytometer (Beckman Coulter)로 분석하였다. Ki-67 발현을 위하여, 상기 기술된 바와 같이, 세포를 에탄올 고정시켰고 1:500으로 30분 동안 항-Ki-67 항체 (Sigma)로 면역염색하였다. 그 후 세포를 1:500로 Alexafluor 488-접합된 항체와 함께 PBS에서 30분 동안 배양하였고 분석을 위해 PBS에 재현탁하였다.
웨스턴 블롯 분석법
세포를 대수 증식기에서 처리하였고, 세포 스크래핑에 의해 채취하고, 원심분리 하였으며, 얼음에서 세포-용해 완충액으로 2시간 동안 용해하였다. 상기 상청액을 원심분리하여 수집하였고, 단백질 농도를 Bio-Rad protein assay (Bio-Rad Laboratories)를 이용하여 결정했다. 시료를 환원 조건 하 NuPAGE 4-12% Bis-Tris gels (Invitrogen)에서 전기영동하였고, PVDF에 이동시켰으며, 10% 무지방 우유 및 TBST로 1시간 동안 차단하였다. 그 후 막을 Cell Signaling으로부터 얻은 1차 항체와 함께 배양하였고 1:1000로 2% 무지방 우유 및 TBST로 4℃에서 밤새 배양하였다. 막을 TBST로 세척하고, 적절한 HRP-접합된 2차 항체 (Thermo-Scientific)로 한시간 동안 배양하였으며, TBST로 세척하고, ECL-Plus (Amersham) 및 X-Ray film (Thermo-Scientific)을 이용하여 시각화하였다.
생체내(in vivo) 연구
무흉선 암컷 누드 마우스(Charles River Laboratories)에 1×106의 5-FU-저항성 RKO 또는 HT-29 세포를 각각 뒤 옆구리에 1:1 Matrigel (BD):PBS의 현탁액으로서 200μL 접종하였다. 종양의 평균 부피가 ~1650 mm3에 도달하면 처리를 시작하였고, 복강내 또는 정맥내 주사는 DMSO로 총 부피 200 μL가 되도록 하였다. 조직 분석을 위해서, 안락사시킨 마우스로부터 조직을 채취하고 PBS내 4% 파라포름알데히드로 48시간 동안 고정시켰다. 조직을 파라핀-잠기게 하고 절단하였다. H&E 염색 (Daiko) 및 TUNEL 염색 (Millipore)을 제조업자의 프로토콜에 따라 수행하였다. 혈청 화학 분석을 위해, 좌심실의 말단심장천자에 의해 마취된 마우스로부터 1mL의 혈액을 채취하였다. 혈청 화학을 위해, 마이크로퓨지 튜브에 500 μL를 넣고 30분 동안 상온에서 혈전이 생기도록 둔 후 원심분리하였다. 혈청을 제거하고, 분석 전 임의의 추가적인 잔여물을 제거하기 위해 다시 원심분리하였다.
통계
Microsoft Excel에서 Student's two-tailed t-test 에 의하여 이원 비교(pariwise comparison)를 수행하였다. 조합 표지(combination index)를 Chou, T.-C., Pharmacological Reviews, 2006, 58(3):621-681에 기술된 Chou-Talalay 방법을 이용하여 CalcuSyn software (BioSoft)로 계산하였다.
ISC-4의 시험관내 활성 프로파일의 정의
이것의 활성 스펙트럼을 특징짓기 위하여 ISC-4의 시험관내 활성을 인간 암 세포주의 패널에서 시험하였다.
도 1a는 ISC-4 또는 DMSO (72 시간, n=3)으로 처리된 세포 생존력 분석법의 결과 및 표시된 세포주의 EC50 값을 나타낸다. 도 1a에 나타낸 바와 같이 상기 시험된 세포주들 중, EC50 값의 측면에서 인간 림포종 세포주 Daudi 및 Granta가 가장 민감했고, 인간 전립선암 세포주 PC3 및 DU145는 가장 덜 민감했다. HT-29를 제외하고는, 인간 대장암 세포주는 ISC-4 처리에 대해 중간 정도로 민감했다. 등질(isogenic) HCT116 세포주는 ISC-4 활성이 p53- 및 Bax-비의존적일 것임을 나타낸다.
세포 주기 프로파일에 있어서, 동시적(synchronous) 및 비동시적(asynchronous)인 HCT116 (도 1b) 및 HT-29 세포주 (도 1c)의 ISC-4 처리의 효과를 나타내었다. ISC-4-처리된 동시화된 HCT-116 및 HT-29 인간 대장암 세포주의 세포 주기 분석은 도 1b에 나타낸 바와 같이 sub-G1 함량의 중간 정도의 증가 및 세포 주기 진행의 감소를 나타냈다. ISC-4-유도된 sub-G1 함량은 용량-의존적이고 도 1c에 나타낸 바와 같이 보통 8 μM 이상에서 분명해진다. 따라서, ISC-4는 인간 대장암 세포에 대하여 세포 사멸 및 증식의 감소를 야기함으로써 중간 정도의 단일 물질 활성을 가진다. 도 1d는 0, 1, 2, 4, 8, 또는 16 μM의 ISC-4 처리 후에 표시된 대장암 세포주의 sub-G1 함량을 나타낸다.
상승적인 약물 조합의 동정
SW480 및 RKO 인간 대장암 세포주를 그들의 이종성 발암성 유전적 변화에 기초하여 최초의 프로파일링에 사용하였다. SW480은 돌연변이 p53, 돌연변이 KRAS, 및 야생형 BRAF를 가지는 반면 RKO는 야생형 p53, 야생형 KRAS, 및 돌연변이 BRAF 유전자를 가진다, Ikediobi, O.N., et al., Molecular Cancer Therapeutics, 2006, 5(11):2606-2612 참조. 도 2는 ISC-4 (1, 2, 또는 4 μM)로 처리된 SW480 및 RKO 대장암 세포주에서의 세포 생존력 분석 결과 및 추정상의 EC12.5, EC25, 및 EC50 단독 및 조합에서의 표시된 치료의 결과를 나타낸다 (n=3). 사용한 투여량을 표 I에 나타내었다. 도 2, 표 I 및 표 Ⅱ에 나타낸 바와 같이 상기 시험 패널의 화학 요법 및 표적 중에서, 조합적 활성은 ISC-4을 소라페닙(sorafenib), 제피티닙(gefitinib), 젬시타빈(gemcitabine), 시스플라틴(cisplatin), 보르테조마이브(bortezomib), 이마티닙(imatinib), 또는 세툭시맙과 조합한 경우에 하나 이상의 세포주에서 관찰되었다.
표 I: 승인된 항종양제와 ISC-4의 조합을 위해 선택된 투여량. EC12.5, EC25, 및 EC50 값은 문헌으로부터 추정하였고 실시예에서 투여량으로 이용하고 그 결과를 도 2에 나타내었다.
표 I
표 Ⅱ는 ISC-4와 승인된 항종양제의 조합적 효과에 대한 요약을 나타낸다. ISC-4 및 목록에 있는 각각의 약물의 조합적 활성을 세포 생존력 분석법에 의해 각 약물 단일의 단일물질 활성과 비교하였고 비상호협력적 (-), 상호협력적 (+), 상승적 (*), 또는 알 수 없는 (?) 으로 결정하였다. 하나 이상의 세포주에서 ISC-4와 협조적 활성을 보인 약물 조합은 소라페닙, 젠피티닙, 젬시타빈, 시스플라틴, 보르테조마이브 및 이마티닙인 반면 세툭시맙 및 ISC-4의 조합은 상승을 보였다.
표 Ⅱ
ISC-4 및 세툭시맙의 조합은 상기 시험 조건 하에서 유일하게 관찰된 상승적 조합 치료이다. 또한, 이러한 상승은 야생형 KRAS를 가지는 RKO 세포주에서 관찰되고, KRASG12V를 가지는 SW480 세포주에서는 관찰되지 않았다. 이러한 관찰은 Lievre, A., et al., Cancer Res, 2006, 66(8):3992-3995; 및 Karapetis, C.S., et al., New England Journal of Medicine, 2008, 359(17):1757-1765에 기술된 바와 같은 대장암에서 세툭시맙의 임상적 효능을 위한 야생형 KRAS의 필요성에 부합한다.
ISC-4 및 세툭시맙은 상승적으로 야생형 KRAS 종양 세포 증식을 저해한다
본 실시예에서 상기 ISC-4 및 세툭시맙의 상승 활성을 몇몇의 인간 대장암 세포주에서 측정하였다. 도 3a-3d, 3e 및 3f는 ISC-4 및 세툭시맙이 5-FU 민감도에 비의존적으로 야생형 KRAS 유전자를 갖는 인간 대장암 세포에서 상승 효과를 보임을 나타낸다. 도 3a-3d는 표시된 용량으로 72시간 동안 ISC-4 및 세툭시맙으로 처리된 인간 대장암 세포주의 세포 생존력 분석법의 결과를 나타낸다 (n=3).
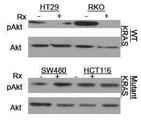
도 3a-3d; 및 표 Ⅲ에 나타낸 바와 같이 야생형 KRAS 유전자를 가지는 HT-29 및 RKO 세포주에서 상승 효과가 관찰되고, 돌연변이 KRAS 유전자를 가지는 HCT116, DLD-1, 및 다른 대장암 세포주에서는 관찰되지 않는다.
표 Ⅲ: 야생형 KRAS 인간 대장암 세포주에서 ISC-4 및 세툭시맙을 위한 조합 지표, RKO 및 HT-29 세포주에서의 조합 활성을 정량화하여 도 3a-3d에 나타내었고 Chou-Talalay 방법에 의해 측정하여 결과를 표 Ⅲ에 나타내었다.
표 Ⅲ
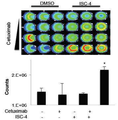
임상적으로 관련된 하나의 유형에서 이러한 조합 활성을 측정하기 위해서, 상기 ISC-4 및 세툭시맙의 상승 효능을 향상된 5-FU 저항성을 가지는 RKO 클론에서 시험하였다. 도 3e 및 3f에 나타낸 바와 같이 대장암 세포에서 상기 ISC-4 및 세툭시맙의 상승 활성은 5-FU-저항성이 획득되었음에도 불구하고 유지되었다. 도 3e는 24시간 동안 제시된 것과 같이 5-FU로 처리된 야생형 및 5-FU-저항성 RKO 세포의 세포 생존력 분석법 결과를 나타낸다 (n=3). 도 3f는 ISC-4 (2μM) 및 세툭시맙 (1μg/mL)로 24시간 동안 처리된 5-FU-저항성 RKO 세포의 결과를 나타낸다 (n=3).
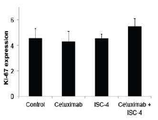
도 4a에 나타낸 바와 같이 ISC-4 및 세툭시맙 처리의 상기 상승 효능의 역학을 결정하였고 이러한 활성은 처리 후 8시간만에 발견되었고, 12시간 후에는 더 큰 상승이 발견되었다. 도 4a는 ISC-4 (2 μM) 및 세툭시맙 (1 μg/mL) 단독 또는 조합으로 표시된 시간 간격으로 처리한 RKO 세포의 세포 생존력 분석법의 결과를 나타낸다 (n=3). 이러한 발견은 ISC-4 및 세툭시맙의 상기 상승 활성이 아마도 세포 증식을 억제하는 것보다는 세포 독성이 있음을 시사한다. 도 4b 및 도 7a에 나타낸 바와 같이 처리된 세포의 세포 형태의 변화, 및 DNA의 형광 표지의 변화는 ISC-4 및 세툭시맙 조합 치료가 분명히 DNA 절단을 야기함을 나타낸다. 도 4b는 도 4a와 같이 12시간 동안 처리된 RKO 세포의 DAPI 염색 결과를 나타낸다. 하얀색 화살표는 절단된 DNA를 가진 세포를 나타낸다. 도 7a는 ISC-4 (2μM) 및 세툭시맙 (1μg/mL) 단독 또는 조합으로 12시간 동안 처리된 RKO 세포의 위상차현미경을 나타낸다.
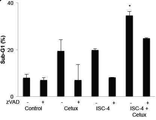
또다른 분석은 ISC-4 단독 또는 세툭시맙 단독과 각각 비교해서 ISC-4 및 세툭시맙의 상기 조합이 상호협력적이고 sub-G1 함량을 유의적으로 증가시킴을 나타내었으나, 상기 조합적 sub-G1 함량은 도 4c에 나타낸 바와 같이 관찰된 상기 상승을 완전히 설명하기에 충분하지 않다. 도 4c는 ISC-4 (2μM) 및 세툭시맙 (1μg/mL) 단독 또는 조합으로 12시간 동안 처리된 RKO 세포의 sub-G1 함량을 나타낸다 (n=3). Student's two-tailed t test에 의하여 모든 처리군에 비하여 *P<0.05. ISC-4-유발된 sub-G1 함량은 pan-카스파아제 저해제 zVAD-fmk와의 공동-배양에 의해 유의적으로 저해되고, 이것은 상기 ISC-4 세툭시맙의 조합이 카스파아제-의존적 아폽토시스를 유도함을 시사한다. 이러한 발견에 부합하여, 상기 ISC-4 및 세툭시맙의 조합은 카스파아제-3 활성을 도 4d에 나타낸 바와 같이 상승적으로 유도한다. 도 4d는 세툭시맙 (0, 0.25, 0.5, 또는 1 μg/mL) 과 조합하여 ISC-4 (2μM)이 처리된 후 24시간에 RKO 세포의 Caspase-Glo 분석법의 결과를 나타낸다 (n=3).
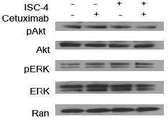
도 5a에 나타낸 바와 같이 웨스턴 불롯 분석은 세툭시맙과 조합된 ISC-4가 상호협력적으로 인산화-ERK가 아닌 인산화-Akt 수준을 처리 24시간 후에 매우 보통의 수준으로 감소시킴을 나타낸다. 도 5a는 ISC-4 (2μM) 및 세툭시맙 (1μg/mL)을 단독 또는 조합하여 24시간 동안 처리된 RKO 세포의 웨스턴 블롯 분석 결과를 나타낸다. 도 5b에 나타낸 바와 같이 시간 과정 분석은 상기 조합의 처리 4시간 후 만에 상호협력적으로 인산화-Akt 수준을 제거함을 나타낸다. 도 5b는 표시된 기간 동안 ISC-4 (2 μM) 및 세툭시맙 (1 μg/mL)을 단독 또는 조합하여 처리된 RK0 세포의 웨스턴 블롯 분석 결과를 나타낸다. Ran을 로딩 대조군으로서 나타내었다. 도 5c에 나타낸 바와 같이 ISC-4 및 세툭시맙에 대하여 상승적 반응을 나타내는 인간 대장암 세포주는 또한 인산-Akt에서 유의적인 감소를 나타낸다. 도 5c는 상기 ISC-4 (2 μM) 및 세툭시맙 (1 μg/mL)의 조합 (Rx)을 8시간 동안 처리한 후의 표시된 인간 대장암 세포주의 웨스턴 블롯 분석법의 결과를 나타낸다. 대조군에 비하여 *P<0.05.
돌연변이 KRAS를 가지는 조합 치료에 상승적인 반응을 나타내지 않는 인간 대장암 세포는 치료에 대한 반응에서의 인산화-Akt 수준의 변화에 있어서 어떠한 변화도 나타내지 않았다. 따라서, 인산화-Akt 수준은 ISC-4 및 세툭시맙에 대한 상기 항종양 반응과 연관된다.
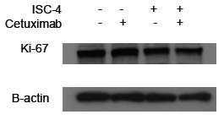
도 7b, 7c 및 7d에 나타낸 바와 같이 조합이 자식 작용(autophage)의 마커인 Ki-67 발현 또는 LC3B 절단에 대한 효과가 없음을 발견했다. 도 7b는 ISC-4 (2μM) 및 세툭시맙 (1μg/mL) 단독 또는 조합하여 처리한 RKO세포에서 Ki-67 발현의 유세포 분석 결과를 나타낸다. 도 7c는 ISC-4 (2 μM) 및 세툭시맙 (1μg/mL)이 단독 또는 조합하여 처리된 RKO세포에서 Ki-67 발현의 웨스턴 블롯 분석 결과를 나타낸다. 도 7d는 ISC-4 (2 μM) 및 세툭시맙 (1 μg/mL)을 단독 또는 조합하여 24시간 동안 처리한 RKO 세포의 웨스턴 블롯 분석 결과를 나타낸다. 클로로퀸 (C; 10 μM)을 자식 작용을 위한 양성 대조군으로서 포함하였다. 베타 액틴을 로딩 대조군으로서 나타내었다.
이러한 발견은 세툭시맙과 조합한 ISC-4가 인산화-Akt 및 세포 생존력에 있어 상호협력적으로 감소를 유도함을 나타내고, 이는 증가된 아폽토시스를 동반한다.
ISC-4 및 세툭시맙은 생체내에서 독성 없이 항-종양 효과를 나타낸다.
본 실시예에서 5-FU-저항성 RKO를 피하에 이종이식하기 전 ISC-4의 상기 항-종양 효능을 세툭시맙과 조합하여 시험하였다. 도 6a에 나타낸 바와 같이 ISC-4 및 세툭시맙의 조합 치료는 종양 진행에 대해 초기에 상승 효과를 가지고 치료의 첫째주에 종양 정체를 야기한다. 도 6a는 단일 용량의 ISC-4 (3 mg/kg, 복강내), 세툭시맙 (10 mg/kg, 정맥내), 또는 상기 조합 ("combo")로 처리한 후 4일에 5-FU-저항성 RKO 이종 이식의 상대적 종양 크기를 나타낸다 (n≥5). 개별적 종양은 0일에 측정된 그들의 기초 크기로 표준화하였다, Student's two-tailed t test를 이용하여 모든 처리군에 비하여 *P<0.05. 도 6b에 나타낸 바와 같이 조직 분석은 조직학 및 TUNEL 염색에 의한 아톱토시스에 의하여 상기 ISC-4 및 세툭시맙의 조합 치료를 받은 이종 이식은 ISC-4 단독 또는 세툭시맙 단독을 받은 이종 이식에 비하여 더 높은 수준의 괴사를 나타낸다. 도 6b는 처리 후 24시간에 채취된 이종 이식 종양의 헤마토톡실린 및 에오신 (H&E) 염색 및 TUNEL 염색의 결과를 나타낸다. 도 8a 및 8b에 나타낸 바와 같이 본 연구에서 이용된 치료적 투약 처방은 수용적이고 마우스의 체중 또는 간 조직학에 변화를 나타내지 않는다. 도 8a는 ISC-4 (3 mg/kg, 복강내), 세툭시맙 (10 mg/kg, 정맥내), 또는 상기 조합을 2주동안 일주일에 두번씩 받은 마우스의 체중 변화를 나타낸다 (n≥5). 체중 변화는 0일에 처리되기 전 각각의 마우스의 체중과 비교하여 나타냈다 (n≥3). 도 8b는 ISC-4 (3 mg/kg, 복강내), 세툭시맙 (10 mg/kg, 정맥내), 또는 상기 조합의 투여 후 24시간에 마우스로부터 채취한 간 조직의 H&E 염색 결과를 나타낸다.
HT-29 이종 이식 마우스에서 ISC-4 단독, 세툭시맙 단독 및 세툭시맙 및 5-FU 조합과 비교하여 상기 ISC-4 및 세툭시맙의 조합을 측정하였다. 도 6c 및 도 8c에 나타낸 바와 같이 ISC-4 및 세툭시맙의 조합 처리는 매주 정맥내 투여량을 받을 경우, ISC-4 단독 또는 세툭시맙 단독 처리와는 달리, 종양 부피 및 종양 무게 측정에 의하여 매우 뚜렷한 것처럼 종양 진행을 강하게 감소시킨다. 도 6c는 구축된 HT-29 이종 이식 종양을 가지는 무흉선 암컷 누드 마우스에 0일에 시작하여 일주일에 한번씩 ISC-4 (3 mg/kg, 정맥내), 세툭시맙 (10 mg/kg, 정맥내), 상기 조합, 또는 세툭시맙 및 5-FU (25 mg/kg, 정맥내)를 처리한 결과를 나타내고 (n≥8), 오차 바는 반복의 SEM을 나타낸다, 대조군에 비하여 *P<0.05. 도 8c는 도 6c에 나타낸 바와 같은 HT-29 이종 이식의 최종 종양 부피 및 종양 무게를 나타낸다. 치료 집단은 ISC-4 (3 mg/kg, 정맥내), 세툭시맙 (10 mg/kg, 정맥내), 상기 조합, 또는 세툭시맙 및 5-FU (25 mg/kg, 정맥내)의 일주일에 한번 처리를 포함한다 (n≥8).
ISC-4 및 세툭시맙의 상기 조합은 5-FU 및 세툭시맙의 조합에 비해서 우수한 항종양 활성을 보인다. 도 8d에 나타낸 바와 같이 ISC-4 및세툭시맙의 상기 조합 치료는 매우 수용적이다. 도 8d 마지막날 투여 3일 후인 최종 지점에서의 마우스 체중을 나타내고 (n≥8), 오차 바는 반복의 SEM을 나타낸다. 표 Ⅳ에 타나낸 바와 같이 혈청 화학 분석은 통상적 투여량으로는 전해질, 간 기능, 또는 신장 또는 심장의 독성에 관련된 다른 분자적 마커의 유의적 변화가 없음을 나타낸다.
표 Ⅳ는 ISC-4 및 세툭시맙 조합 치료를 받은 마우스의 혈청 화학 프로파일을 나타낸다. 무흉선의, 8주 된 암컷 누드 마우스를 ISC-4 (3 mg/kg, 복강내), 세툭시맙 (10 mg/kg,정맥내), 또는 상기 조합을 2주동안 일주일에 두번씩 받게 하였다 (n≥5). 혈청을 마지막 용량 2일 후에 채취하였다.
표 Ⅳ
본 명세서에 언급된 임의의 특허 또는 간행물은 본원에 각각의 간행물이 구체적인 것과 같은 정도로 참고 문헌으로서 포함되며 각각은 참고 문헌으로서 포함되는 것으로 나타내어진다.
아이템 목록 1
아이템 1: 세툭시맙 및 ISC-4의 조합을 조합 제제로서 또는 분리하여 투여하는 단계: 를 포함하는 이를 필요로 하는 개체의 암 치료 방법, 여기에서 상기 조합의 투여는 상승 효과를 제공한다.
아이템 2: 아이템 1에 있어서, 상기 암은 야생형 KRAS인 것을 특징으로 하는 암 치료 방법.
아이템 3: 아이템 1 또는 아이템 2에 있어서, 상기 암은 야생형 KRAS인 것을 특징으로 하는 대장암인 암 치료 방법.
아이템 4: 아이템 1-3에 있어서, 세툭시맙 및 ISC-4의 조합을 투여하기 전 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 첫번째 시료를 얻는 단계; 세툭시맙 및 ISC-4의 조합을 투여한 후 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 두번째 시료를 얻는 단계; 및 상기 첫번째 및 두번째 시료에서 하나 또는 그이상의 아폽토시스(apoptosis) 마커를 측정함으로써 세툭시맙 및 ISC-4의 조합 투여의 유효성을 모니터링하는 단계: 를 더 포함하는 암 치료 방법.
아이템 5: 아이템 1-3에 있어서, 세툭시맙 및 ISC-4의 조합을 투여하기 전 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 첫번째 시료를 얻는 단계; 세툭시맙 및 ISC-4의 조합을 투여한 후 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 두번째 시료를 얻는 단계; 및 상기 첫번째 및 두번째 시료의 인산화-Akt(phospho-Akt)를 측정함으로써 세툭시맙 및 ISC-4의 조합 투여의 유효성을 모니터링하는 단계: 를 더 포함하는 암 치료 방법.
아이템 6: 아이템 1-5에 있어서, 상기 세툭시맙 및 ISC-4는 동시에 투여되는 것인 암 치료 방법.
아이템 7: 아이템 1-5에 있어서, 상기 세툭시맙 및 ISC-4는 순차적으로 투여되는 것인 암 치료 방법.
아이템 8: 아이템 7에 있어서, 상기 세툭시맙 및 ISC-4는 1시간, 2시간, 4시간, 8시간, 12시간 및 24시간: 으로부터 선택된 시간 내에 순차적으로 투여되는 것인 암 치료 방법.
아이템 9: 세툭시맙 및 ISC-4를 포함하는 약학적 조성물.
아이템 10: 세툭시맙 및 ISC-4를 포함하는 상용 패키지.
아이템 11: 아이템 10에 있어서, 상기 세툭시맙 및 ISC-4는 단일 약학적 제제로서 제공되는 것인 상용 패키지.
아이템 12: 아이템 10에 있어서, 상기 세툭시맙 및 ISC-4는 분리 약학적 제제로서 제공되는 것인 상용 패키지.
아이템 13: 본원에 기술된 바에 따른 실질적인 암 치료 방법.
아이템 14: 본원에 기술된 바에 따른 실질적인 약학적 조성물.
아이템 15: 본원에 기술된 바에 따른 실질적인 상용 패키지.
아이템 16: 세툭시맙 및 ISC-4 전구약물의 조합을 조합 제제로서 또는 분리하여 투여하는 단계: 를 포함하는 이를 필요로 하는 개체의 암 치료 방법, 여기에서 상기 조합의 투여는 상승 효과를 제공한다.
아이템 17: 아이템 16에 있어서, 상기 암은 야생형 KRAS인 것을 특징으로 하는 암 치료 방법.
아이템 18: 아이템 16 또는 17에 있어서, 상기 암은 야생형 KRAS인 것을 특징으로 하는 대장암인 암 치료 방법.
아이템 19: 아이템 16-18 중 어느 하나에 있어서, 세툭시맙 및 ISC-4 전구약물의 조합을 투여하기 전 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 첫번째 시료를 얻는 단계; 세툭시맙 및 ISC-4 전구약물의 조합을 투여한 후 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 두번째 시료를 얻는 단계; 및 상기 첫번째 및 두번째 시료에서 하나 또는 그이상의 아폽토시스(apoptosis) 마커를 측정함으로써 세툭시맙 및 ISC-4 전구약물의 조합 투여의 유효성을 모니터링하는 단계: 를 더 포함하는 암 치료 방법.
아이템 20: 아이템 16-18 중 어느 하나에 있어서, 세툭시맙 및 ISC-4 전구약물의 조합을 투여하기 전 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 첫번째 시료를 얻는 단계; 세툭시맙 및 ISC-4 전구약물의 조합을 투여한 후 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 두번째 시료를 얻는 단계; 및 상기 첫번째 및 두번째 시료에서 인산화-Akt(phospho-Akt)를 측정함으로써 세툭시맙 및 ISC-4 전구약물의 조합 투여의 유효성을 모니터링하는 단계: 를 더 포함하는 암 치료 방법.
아이템 21: 아이템 16-20 중 어느 하나에 있어서, 상기 세툭시맙 및 ISC-4 전구약물은 동시에 투여되는 것인 암 치료 방법.
아이템 22: 아이템 16-20 중 어느 하나에 있어서, 상기 세툭시맙 및 ISC-4 전구약물은 순차적으로 투여되는 것인 암 치료 방법.
아이템 23: 아이템 22에 있어서, 상기 세툭시맙 및 ISC-4 전구약물은 1시간, 2시간, 4시간, 8시간, 12시간 및 24시간: 으로부터 선택된 시간 내에 순차적으로 투여되는 것인 암 치료 방법.
또는 이의 약학적으로 허용가능한 염인 암 치료 방법.
아이템 25: 세툭시맙 및 하기의 구조식을 갖는 ISC-4 글루코시놀레이트 전구약물
또는 이의 약학적으로 허용가능한 염을 포함하는 약학적 조성물.
아이템 26: 세툭시맙 및 하기의 구조식을 갖는 ISC-4 글루코시놀레이트 전구약물
또는 이의 약학적으로 허용가능한 염을 포함하는 상용 패키지.
아이템 27: 아이템 26에 있어서, 상기 세툭시맙 및 상기 ISC-4 글루코시놀레이트 전구약물 또는 이의 약학적으로 허용가능한 염은 단일 약학적 제제로서 제공되는 것인 상용 패키지.
아이템 28: 아이템 26에 있어서, 상기 세툭시맙 및 상기 ISC-4 글루코시놀레이트 전구약물 또는 이의 약학적으로 허용가능한 염은 분리 약학적 제제로서 제공되는 것인 상용 패키지.
아이템 29: 하기의 구조식을 갖는 ISC-4 글루코시놀레이트 전구약물
또는 이의 약학적으로 허용가능한 염: 을 포함하는 조성물.
아이템 목록 2
아이템 30: 세툭시맙 및 ISC-4의 조합을 조합 제제 또는 분리하여 투여하는 단계: 를 포함하는 이를 필요로 하는 개체의 암 치료 방법.
아이템 31: 제 30항에 있어서, 상기 조합의 투여는 상승 효과를 제공하는 것인 방법.
아이템 32: 제 30 또는 31항에 있어서, 상기 암은 야생형 KRAS인 것을 특징으로 하는 암 치료 방법.
아이템 33: 제 30-32항 중 어느 한 항에 있어서, 상기 암은 야생형 KRAS인 것을 특징으로 하는 대장암인 암 치료 방법.
아이템 34: 제 30-33항 중 어느 한 항에 있어서, 세툭시맙 및 ISC-4의 조합을 투여하기 전 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 첫번째 시료를 얻는 단계; 세툭시맙 및 ISC-4의 조합을 투여한 후 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 두번째 시료를 얻는 단계; 및 상기 첫번째 및 두번째 시료에서 하나 또는 그 이상의 아폽토시스(apoptosis) 마커를 측정함으로써 세툭시맙 및 ISC-4의 조합 투여의 유효성을 모니터링하는 단계: 를 더 포함하는 암 치료 방법.
아이템 35: 제 30-34항 중 어느 한 항에 있어서, 세툭시맙 및 ISC-4의 조합을 투여하기 전 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 첫번째 시료를 얻는 단계; 세툭시맙 및 ISC-4의 조합을 투여한 후 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 두번째 시료를 얻는 단계; 및 상기 첫번째 및 두번째 시료의 인산화-Akt(phospho-Akt)를 측정함으로써 세툭시맙 및 ISC-4의 조합 투여의 유효성을 모니터링하는 단계: 를 더 포함하는 암 치료 방법.
아이템 36: 제 30-35항 중 어느 한 항에 있어서, 상기 세툭시맙 및 ISC-4는 동시에 투여되는 것인 암 치료 방법.
아이템 37: 제 30-35항 중 어느 한 항에 있어서, 상기 세툭시맙 및 ISC-4는 순차적으로 투여되는 것인 암 치료 방법.
아이템 38: 제 30-35 및 37항 중 어느 한 항에 있어서, 상기 세툭시맙 및 ISC-4는 1시간, 2시간, 4시간, 8시간, 12시간 및 24시간: 으로부터 선택된 시간 내에 순차적으로 투여되는 것인 암 치료 방법.
아이템 39: 세툭시맙 및 ISC-4 전구약물의 조합을 조합 제제 또는 분리하여 투여하는 단계: 를 포함하는 이를 필요로 하는 개체의 암 치료 방법.
아이템 40: 제 39항에 있어서, 상기 조합의 투여는 상승 효과를 제공하는 것인 암 치료 방법.
아이템 41: 제 39 또는 40항 중 어느 한 항에 있어서, 상기 암은 야생형 KRAS인 것을 특징으로 하는 암 치료 방법.
아이템 42: 제 39-41항 중 어느 한 항에 있어서, 상기 암은 야생형 KRAS인 것을 특징으로 하는 대장암인 암 치료 방법.
아이템 43: 제 39-42항 중 어느 한 항에 있어서, 세툭시맙 및 ISC-4 전구약물의 조합을 투여하기 전 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 첫번째 시료를 얻는 단계; 세툭시맙 및 ISC-4 전구약물의 조합을 투여한 후 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 두번째 시료를 얻는 단계; 및 상기 첫번째 및 두번째 시료에서 하나 또는 그이상의 아폽토시스(apoptosis) 마커를 측정함으로써 세툭시맙 및 ISC-4 전구약물의 조합 투여의 유효성을 모니터링하는 단계: 를 더 포함하는 암 치료 방법.
아이템 44: 제 39-43항 중 어느 한 항에 있어서, 세툭시맙 및 ISC-4 전구약물의 조합을 투여하기 전 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 첫번째 시료를 얻는 단계; 세툭시맙 및 ISC-4 전구약물의 조합을 투여한 후 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 두번째 시료를 얻는 단계; 및 상기 첫번째 및 두번째 시료에서 인산화-Akt(phospho-Akt)를 측정함으로써 세툭시맙 및 ISC-4 전구약물의 조합 투여의 유효성을 모니터링하는 단계: 를 더 포함하는 암 치료 방법.
아이템 45: 제 39-44항 중 어느 한 항에 있어서, 상기 세툭시맙 및 상기 ISC-4 전구약물은 동시에 투여되는 것인 암 치료 방법.
아이템 46: 제 39-44항 중 어느 한 항에 있어서, 상기 세툭시맙 및 상기 ISC-4 전구약물은 순차적으로 투여되는 것인 암 치료 방법.
아이템 47: 제39-44 및 46항 중 어느 한 항에 있어서, 상기 세툭시맙 및 ISC-4 전구약물은 1시간, 2시간, 4시간, 8시간, 12시간 및 24시간: 으로부터 선택된 시간 내에 순차적으로 투여되는 것인 암 치료 방법.
아이템 48: 제 39-47항 중 어느 한 항에 있어서, 상기 ISC-4 전구약물은 하기의 구조식을 갖는 ISC-4 글루코시놀레이트 전구약물
또는 이의 약학적으로 허용가능한 염인 암 치료 방법.
아이템 49: 제 30-48항 중 어느 한 항에 있어서, 상기 암은 5-플루오로우라실에 저항성이 있는 것인 암 치료 방법.
아이템 50: 제 30-49항 중 어느 한 항에 있어서, 상기 암은 5-플루오로우라실에 저항성이 있는 대장암인 것인 암 치료 방법.
아이템 51: 제 30-50항 중 어느 한 항에 있어서, 상기 암은 5-플루오로우라실에 저항성이 있으며 야생형 KRAS인 것을 특징으로 하는 암 치료 방법.
아이템 52: 제 30-51항 중 어느 한 항에 있어서, 상기 암은 5-플루오로우라실에 저항성을 가지며 야생형 KRAS는 인간 KRAS를 기준으로 12, 13 또는 61 코돈에 활성 KRAS 돌연변이(activating KRAS mutation)을 가지지 않는 야생형 KRAS인 것을 특징으로 하는 암 치료 방법.
아이템 53: 제 30-52항 중 어느 한 항에 있어서, 상기 암은 5-플루오로우라실에 저항성을 가지며 야생형 KRAS는 인간 KRAS를 기준으로 활성 KRAS 돌연변이 Q61H, G12S, G12V, G12A 또는 G13D를 가지지 않는 야생형 KRAS인 것을 특징으로 하는 암 치료 방법.
본원에 기술된 상기 조성물 및 방법은 현재 바람직한 실시예, 예의 대표이고, 본 발명의 범위에 제한을 의도하는 것은 아니다. 그 속에서 변형 및 다른 이용은 당업자에게 발생할 수 있다. 이러한 변형 및 다른 이용은 본 청구항에 제시된 것과 같은 본 발명의 범위로부터 벗어날 수는 없다.
Claims (37)
- 세툭시맙(cetuximab) 및 ISC-4; 또는 세툭시맙 및 ISC-4 전구약물: 을 포함하는 약학적 조성물.
- 세툭시맙 및 ISC-4; 또는 세툭시맙 및 ISC-4 전구약물을 포함하는 상용 패키지.
- 제3항에 있어서, 상기 세툭시맙 및 ISC-4는 단일 약학적 제제로서 제공되는 것인 상용 패키지.
- 제3항에 있어서, 상기 세툭시맙 및 ISC-4는 분리 약학적 제제로서 제공되는 것인 상용 패키지.
- 제3항 또는 제4항에 있어서, 상기 세툭시맙; 및 상기 ISC-4 전구약물은 단일 약학적 제제로서 제공되는 것인 상용 패키지.
- 제3항 또는 제4항에 있어서, 상기 세툭시맙; 및 상기 ISC-4 전구약물은 분리 약학적 제제로서 제공되는 것인 상용 패키지.
- 세툭시맙 및 ISC-4의 조합을 조합 제제로서 또는 분리하여 투여하는 단계:
를 포함하는, 이를 필요로하는 개체의 암 치료 방법.
- 제10항에 있어서, 상기 조합의 투여는 상승 효과를 제공하는 것인 방법.
- 제10항 또는 제11항에 있어서, 상기 암은 야생형 KRAS인 것을 특징으로 하는 암 치료 방법.
- 제10항 내지 제12항 중 어느 한 항에 있어서, 상기 암은 야생형 KRAS인 것을 특징으로 하는 대장암인 암 치료 방법.
- 제10항 내지 제13항 중 어느 한 항에 있어서,
세툭시맙 및 ISC-4의 조합을 투여하기 전 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 첫번째 시료를 얻는 단계;
세툭시맙 및 ISC-4의 조합을 투여한 후 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 두번째 시료를 얻는 단계; 및
상기 첫번째 및 두번째 시료에서 하나 또는 그 이상의 아폽토시스(apoptosis) 마커를 측정함으로써 세툭시맙 및 ISC-4의 조합 투여의 유효성을 모니터링하는 단계: 를 더 포함하는 암 치료 방법.
- 제10항 내지 제14항 중 어느 한 항에 있어서,
세툭시맙 및 ISC-4의 조합을 투여하기 전 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 첫번째 시료를 얻는 단계;
세툭시맙 및 ISC-4의 조합을 투여한 후 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 두번째 시료를 얻는 단계; 및
상기 첫번째 및 두번째 시료의 인산화-Akt(phospho-Akt)를 측정함으로써 세툭시맙 및 ISC-4의 조합 투여의 유효성을 모니터링하는 단계: 를 더 포함하는 암 치료 방법.
- 제10항 내지 제15항 중 어느 한 항에 있어서, 상기 세툭시맙 및 ISC-4는 동시에 투여되는 것인 암 치료 방법.
- 제10항 내지 제15항 중 어느 한 항에 있어서, 상기 세툭시맙 및 ISC-4는 순차적으로 투여되는 것인 암 치료 방법.
- 제10항 내지 제15항 및 제17항 중 어느 한 항에 있어서, 상기 세툭시맙 및 ISC-4는 1시간, 2시간, 4시간, 8시간, 12시간 및 24시간: 으로부터 선택된 시간 내에 순차적으로 투여되는 것인 암 치료 방법.
- 세툭시맙 및 ISC-4 전구약물의 조합을 조합 제제로서 또는 분리하여 투여하는 단계: 를 포함하는, 이를 필요로하는 개체의 암 치료 방법.
- 제19항에 있어서, 상기 조합 투여는 상승 효과를 제공하는 것인 방법.
- 제19항 또는 제20항에 있어서, 상기 암은 야생형 KRAS인 것을 특징으로 하는 암 치료 방법.
- 제19항 내지 제21항 중 어느 한 항에 있어서, 상기 암은 야생형 KRAS인 것을 특징으로 하는 대장암인 암 치료 방법.
- 제19항 내지 제22항 중 어느 한 항에 있어서,
세툭시맙 및 ISC-4 전구약물의 조합을 투여하기 전 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 첫번째 시료를 얻는 단계;
세툭시맙 및 ISC-4 전구약물의 조합을 투여한 후 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 두번째 시료를 얻는 단계; 및
상기 첫번째 및 두번째 시료에서 하나 또는 그 이상의 아폽토시스 마커를 측정함으로써 세툭시맙 및 ISC-4 전구약물의 조합 투여의 유효성을 모니터링하는 단계: 를 더 포함하는 암 치료 방법.
- 제19항 내지 제23항 중 어느 한 항에 있어서,
세툭시맙 및 ISC-4 전구약물의 조합을 투여하기 전 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 첫번째 시료를 얻는 단계;
세툭시맙 및 ISC-4 전구약물의 조합을 투여한 후 개체로부터 암 세포를 포함하거나 포함하는 것으로 의심되는 두번째 시료를 얻는 단계; 및
상기 첫번째 및 두번째 시료의 인산화-Akt를 측정함으로써 세툭시맙 및 ISC-4 전구약물의 조합 투여의 유효성을 모니터링하는 단계: 를 더 포함하는 암 치료 방법.
- 제19항 내지 제24항 중 어느 한 항에 있어서, 상기 세툭시맙 및 ISC-4 전구약물은 동시에 투여되는 것인 암 치료 방법.
- 제19항 내지 제24항 중 어느 한 항에 있어서, 상기 세툭시맙 및 ISC-4 전구약물은 순차적으로 투여되는 것인 암 치료 방법.
- 제19항 내지 제24항 및 제26항 중 어느 한 항에 있어서, 상기 세툭시맙 및 ISC-4 전구약물은 1시간, 2시간, 4시간, 8시간, 12시간 및 24시간: 으로부터 선택된 시간 내에 순차적으로 투여되는 것인 암 치료 방법.
- 제10항 내지 제28항 중 어느 한 항에 있어서, 상기 암은 5-플루오로우라실(5-fluorouracil)에 저항성이 있는 것인 암 치료 방법.
- 제10항 내지 제29항 중 어느 한 항에 있어서, 상기 암은 5-플로오로우라실에 저항성이 있으며 야생형 KRAS인 것을 특징으로 하는 암 치료 방법.
- 제10항 내지 제30항 중 어느 한 항에 있어서, 상기 암은 5-플루오로우라실에 저항성이 있으며 상기 야생형 KRAS는 인간 KRAS를 기준으로 12, 13 또는 61 코돈에 활성 KRAS 돌연변이(activating KRAS mutation)를 가지지 않는 야생형 KRAS인 것을 특징으로 하는 암 치료 방법.
- 제10항 내지 제31항 중 어느 한 항에 있어서, 상기 암은 5-플루오로우라실에 저항성이 있으며 상기 야생형 KRAS는 인간 KRAS를 기준으로 활성 KRAS 돌연변이 Q61H, G12S, G12V, G12A 또는 G13D를 가지지 않는 야생형 KRAS인 것을 특징으로 하는 암 치료 방법.
- 암 치료용 세툭시맙 및 ISC-4 또는 세툭시맙 및 ISC-4 전구약물.
- 약제용 세툭시맙 및 ISC-4 또는 세툭시맙 및 ISC-4 전구약물의 조합.
- 본원에 기술된 바에 따른 실질적인 개체의 암 치료 방법.
- 본원에 기술된 바에 따른 실질적인 약학적 조성물.
- 본원에 기술된 바에 따른 실질적인 상용 패키지.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201261740126P | 2012-12-20 | 2012-12-20 | |
| US61/740,126 | 2012-12-20 | ||
| PCT/US2013/076869 WO2014100565A1 (en) | 2012-12-20 | 2013-12-20 | Methods and compositions relating to treatment of cancer |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20150099588A true KR20150099588A (ko) | 2015-08-31 |
Family
ID=49950064
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020157019739A KR20150099588A (ko) | 2012-12-20 | 2013-12-20 | 암의 치료와 관련된 방법 및 조성물 |
Country Status (10)
| Country | Link |
|---|---|
| US (1) | US20150328310A1 (ko) |
| EP (1) | EP2934583A1 (ko) |
| JP (1) | JP2016503063A (ko) |
| KR (1) | KR20150099588A (ko) |
| CN (1) | CN105007940B (ko) |
| AU (1) | AU2013361164A1 (ko) |
| CA (1) | CA2894547A1 (ko) |
| RU (1) | RU2015129366A (ko) |
| SG (1) | SG11201504779YA (ko) |
| WO (1) | WO2014100565A1 (ko) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN115054586B (zh) * | 2016-06-29 | 2024-08-02 | 普林斯匹亚生物制药公司 | 改性的释放制剂 |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB9407386D0 (en) | 1994-04-14 | 1994-06-08 | Smithkline Beecham Plc | Pharmaceutical formulation |
| US5648097A (en) | 1995-10-04 | 1997-07-15 | Biotek, Inc. | Calcium mineral-based microparticles and method for the production thereof |
| US6391336B1 (en) | 1997-09-22 | 2002-05-21 | Royer Biomedical, Inc. | Inorganic-polymer complexes for the controlled release of compounds including medicinals |
| WO2008128189A1 (en) * | 2007-04-13 | 2008-10-23 | The Penn State Research Foundation | Anti-cancer compositions and methods |
-
2013
- 2013-12-20 RU RU2015129366A patent/RU2015129366A/ru not_active Application Discontinuation
- 2013-12-20 CN CN201380073538.9A patent/CN105007940B/zh not_active Expired - Fee Related
- 2013-12-20 SG SG11201504779YA patent/SG11201504779YA/en unknown
- 2013-12-20 EP EP13819149.9A patent/EP2934583A1/en not_active Withdrawn
- 2013-12-20 JP JP2015549772A patent/JP2016503063A/ja active Pending
- 2013-12-20 CA CA2894547A patent/CA2894547A1/en not_active Abandoned
- 2013-12-20 US US14/652,363 patent/US20150328310A1/en not_active Abandoned
- 2013-12-20 KR KR1020157019739A patent/KR20150099588A/ko not_active Application Discontinuation
- 2013-12-20 AU AU2013361164A patent/AU2013361164A1/en not_active Abandoned
- 2013-12-20 WO PCT/US2013/076869 patent/WO2014100565A1/en active Application Filing
Also Published As
| Publication number | Publication date |
|---|---|
| CN105007940A (zh) | 2015-10-28 |
| AU2013361164A1 (en) | 2015-07-02 |
| CA2894547A1 (en) | 2014-06-26 |
| US20150328310A1 (en) | 2015-11-19 |
| CN105007940B (zh) | 2017-08-25 |
| JP2016503063A (ja) | 2016-02-01 |
| RU2015129366A (ru) | 2017-01-25 |
| WO2014100565A1 (en) | 2014-06-26 |
| SG11201504779YA (en) | 2015-07-30 |
| EP2934583A1 (en) | 2015-10-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US12036223B2 (en) | Small molecule trail gene induction by normal and tumor cells as an anticancer therapy | |
| JP2023060196A5 (ko) | ||
| Riccioni et al. | The cancer stem cell selective inhibitor salinomycin is a p-glycoprotein inhibitor | |
| Kowalczyk et al. | The GD2-specific 14G2a monoclonal antibody induces apoptosis and enhances cytotoxicity of chemotherapeutic drugs in IMR-32 human neuroblastoma cells | |
| KR20160094861A (ko) | 알데히드 억제제 및 비구아나이드 계열 화합물을 포함하는 암 줄기세포의 성장 억제용 약학적 조성물 | |
| CN102628080B (zh) | Pcdh17基因的应用 | |
| KR20150099588A (ko) | 암의 치료와 관련된 방법 및 조성물 | |
| CN103800919A (zh) | Tuft1在制备肝癌诊断和治疗制剂中的应用 | |
| US11655298B2 (en) | Composition for treating fulminant acute pneumonia including CD69 antagonist | |
| JP2019501959A (ja) | 腫瘍の診断および治療におけるAkt2の使用 | |
| UA97504C2 (uk) | Спосіб зниження ризику виникнення або відстрочення виникнення раку у суб'єкта із застосуванням анти-vegf антитіла | |
| CN109303919B (zh) | Akt抑制剂在制备增强石蒜碱的抗肝癌活性药物中的应用 | |
| JP2022028749A (ja) | 腫瘍の診断および治療におけるAkt2の使用 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |