KR20150010953A - 경구 투여를 위한 폴리펩티드 로딩된 poca 나노입자 - Google Patents
경구 투여를 위한 폴리펩티드 로딩된 poca 나노입자 Download PDFInfo
- Publication number
- KR20150010953A KR20150010953A KR20147031771A KR20147031771A KR20150010953A KR 20150010953 A KR20150010953 A KR 20150010953A KR 20147031771 A KR20147031771 A KR 20147031771A KR 20147031771 A KR20147031771 A KR 20147031771A KR 20150010953 A KR20150010953 A KR 20150010953A
- Authority
- KR
- South Korea
- Prior art keywords
- nanoparticles
- nanoparticle
- peptide
- exendin
- metabolic
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/51—Nanocapsules; Nanoparticles
- A61K9/5107—Excipients; Inactive ingredients
- A61K9/513—Organic macromolecular compounds; Dendrimers
- A61K9/5138—Organic macromolecular compounds; Dendrimers obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyvinyl pyrrolidone, poly(meth)acrylates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/22—Hormones
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0053—Mouth and digestive tract, i.e. intraoral and peroral administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/51—Nanocapsules; Nanoparticles
- A61K9/5192—Processes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
Abstract
본 개시내용은 생물학적 활성 폴리펩티드, 특히 대사성 펩티드, 예컨대 엑센딘-4를 경구 투여하기 위한 폴리(옥틸시아노아크릴레이트)를 포함하는 나노입자에 관한 것이다. 또한, 상기 나노입자의 생성 방법, 상기 나노입자를 포함하는 제약 조성물, 및 상기 나노입자를 사용하여 대사 장애, 예컨대 비만을 치료하는 방법이 개시되어 있다.
Description
대부분의 생물제약, 특히 단백질 및 펩티드 치료제는 비경구 경로에 의해, 예를 들어 정맥내 또는 피하 주사에 의해 투여된다. 이들 투여 경로는 종종, 특히 하루에 여러 차례 주사해야만 하는 경우에는 환자의 치료 순응도를 저하시킬 정도로 고통스럽고 불편할 수 있다. 이는 비용이 많이 들 수도 있다 (예를 들어, 정맥내 주입을 통해 투여받기 위해서는 의료 센터를 방문해야 한다).
생물제약을 경구 투여하면, 이들 단점 중 많은 것들이 극복될 것이지만, 자신의 문제를 갖고 있다. 이러한 분자는 정상적으로는 경구로 생체이용가능하지 않은데, 이는 단백질 및 펩티드가 위와 장의 프로테아제 풍부 환경 하에서 단백질 분해되기 쉽기 때문이다. 기타 장애물로는 위장 (GI) 관의 영역에서 부딪히는 산성 조건 하에서의 분자의 안정성 문제; GI 관에 유입되는 약물과 그의 표적에 도달하는 약물 간의 시간 지연 문제; 및 전신 노출을 요구하는 단백질 또는 펩티드 치료제의 경우, 장 점막과 같은 생체 막을 관통한 약물의 침투성 문제가 있다 (문헌 [Goldberg and Gomez-Orellana, Nat Rev Drug Discov (2003) 2(4): 289-295] 참조). 이러한 이유들로 인해, 특이한 11개 아미노산 시클릭 펩티드 시클로스포린을 제외하고는, 현재 시중에 나와 있는 경구 전달용 생물제약은 없다. 시클로스포린은 이것이 수불용성이고, 시클릭 펩티드이고, 비-리보솜성 펩티드이고, 단일 D-아미노산 (자연에서 거의 발생하지 않음)을 함유한다는 점에서 대표적인 펩티드가 아니다.
활성 단백질 또는 펩티드를 보호하고 이것이 소화관 벽을 통하여 흡수되게 하기 위해서는, 대사 과정을 우회하고 무손상 및 기능적 생물제약을 보존하는 데에 정교한 약물 전달 방법이 요구된다 (문헌 [Hamman J. H., EnslinG. M., Kotz A. F. (2005), Oral Delivery of Peptide Drugs, Biodrugs 165-177] 참조).
미립자 담체, 예컨대 마이크로구체, 리포솜 및 다양한 나노입자가 생물제약의 경구 전달을 위해 검토되었다. 그러나, 이러한 기술은 그들의 크기, 위/GI 관 내에서의 불안정성 및 낮은 약물 로딩으로 인해 경구 전달용으로 적합하지 않을 수 있다.
대사 질환 및 장애, 예컨대 비만은 증가하고 있다. 비만은 선진국 인구에 영향을 미치는 새로운 글로벌 문제일 뿐만 아니라 지금은 저소득 및 중간 소득 국가에서 점점 더 우세해지고 있다. 비만 및 비만 관련 질환을 치료하고 식이 영양분을 공급하기 위한 글로벌 지출은 지속적으로 증가하고 있다 (문헌 [World Health Organisation (2011), Obesity and overweight, Factsheet no. 311 (updated March 2011)]; [James P. T., Leach R., Kalamara E., Shayeghi M. (2001), Worldwide Obesity Epidemic, Obesity Research 9(4): 228S-233S] 참조). 비만에 대한 치료 선택권은 한계가 있고, 주로 외과 수술로 제한되므로, 실행가능한 약물에 의거한 치료 선택권을 규명할 임상적 필요가 명백히 있다. 천연 GLP-1 보다 더 강력한 효력을 지닌 비-인간 인크레틴(incretin) 모방체인 엑센딘(Exendin)-4가 제2형 당뇨병의 치료를 위해 최근에 허가되었고 (BYETTA( TM ), BYDUREON( TM )), 이는 또한, 비만을 치료하기 위한 수많은 임상 시험에서 연구중에 있다. 그러나, 개발 중인 것으로 공지된 거의 모든 말기 대사성 펩티드, 예컨대 엑센딘-4는 주사 투여해야 한다.
본 개시내용의 개요
달리 POCA로서 공지된 폴리(옥틸시아노아크릴레이트)를 포함하는, 생물학적 활성 폴리펩티드를 포함하는 나노입자가 특히 경구 투여용으로 제공된다.
본 개시내용의 나노입자를 포함하고, 나노입자 수의 적어도 90%가 동적 광 산란 기술에 의해 측정시 10 nm 내지 200 nm 이내의 유체역학적 직경을 갖는 것인, 나노입자 집단이 또한 제공된다.
본 개시내용은 추가로,
a) 옥틸시아노아크릴레이트 (OCA)를 유기 용매에 용해시켜 단량체 용액을 형성하는 단계;
b) 단계 (a)로부터의 단량체 용액을 산성 수용액에 첨가하여, 수성 상 중 유기 액적의 에멀젼을 형성하는 단계; 및 이와 동시에 또는 순차적으로,
c) 생물학적 활성 폴리펩티드의 수용액을 단계 (b)로부터의 에멀젼에 첨가하고, 상기 단량체를 중합시키는 단계; 및
d) 유기 상을 증발시킴으로써, 상기 폴리펩티드를 함유하는 폴리(옥틸아크릴레이트) (POCA) 나노입자의 수현탁액을 수득하는 단계
를 포함하는, 나노입자의 생성 방법을 제공한다.
본 개시내용의 나노입자를 포함하는 제약 조성물이 또한 제공된다.
상승된 글루코스 수준과 연관된 장애, 당뇨병 (제1형 또는 제2형 또는 임신성), 대사 증후군, 고혈당증, 글루코스 내성 장애, 베타 세포 결핍증, 및 과식을 특징으로 하거나 과식과 연관된 질환, 예컨대 비만인 대사 질환 중 어느 하나 이상을 치료하기 위한, 대사성 펩티드를 포함하는 본 개시내용의 나노입자의 용도가 추가로 제공된다.
또한, 치료 유효량의 본 개시내용에 따른 나노입자를 투여함으로써 상승된 글루코스 수준과 연관된 장애, 당뇨병 (제1형 또는 제2형 또는 임신성), 대사 증후군, 고혈당증, 글루코스 내성 장애, 베타 세포 결핍증, 및 과식을 특징으로 하거나 과식과 연관된 질환, 예컨대 비만인 대사 질환 중 하나 이상을 갖는 대상체를 치료하는 방법이 제공된다.
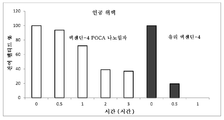
도 1은 인공 위액에서 다양한 시점 하에 엑센딘-4 POCA 나노입자 및 유리 엑센딘-4의 안정성을 보여주는 막대 차트이다.
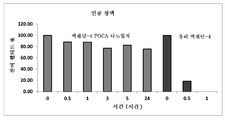
도 2는 인공 장액에서 다양한 시점 하에 엑센딘-4 POCA 나노입자 및 유리 엑센딘-4의 안정성을 보여주는 막대 차트이다.
도 3은 엑센딘-4 POCA 나노입자, 유리 엑센딘-4 또는 염수 대조군 중 어느 하나를 정맥내 투여한 C57BL/6 마우스에서 다양한 시점 (투여하기 이전, 및 투여 후 0.5, 1, 2, 3, 4 및 8시간) 하에 혈액 글루코스 수준의 변화 비율(%)을 도시한 것이다.
도 4는 엑센딘-4 POCA 나노입자 또는 유리 엑센딘-4 중 어느 하나를 경구 투여하였거나 또는 유리 엑센딘-4를 피하 투여한 C57/BL6 급식 마우스에서 투여 후 12, 24 및 36시간 시점 하에 물 대조군과 비교한 음식물 섭취의 감소 비율(%)을 도시한 것이다.
도 5는 용량-범위 연구에 관한 것이고, 20 mg/kg, 10 mg/kg, 5 mg/kg 또는 2.5 mg/kg 엑센딘-4 POCA 나노입자, 또는 20 mg/kg 유리 엑센딘-4를 경구 투여한 C57/BL6 급식 마우스에서 투여 후 12, 24 및 36시간 시점 하에 물 대조군과 비교한 음식물 섭취의 감소 비율(%)을 도시한 것이다.
도 6은 용량-범위 연구에 관한 것이고, 20 mg/kg, 10 mg/kg, 5 mg/kg 또는 2.5 mg/kg 엑센딘-4 POCA 나노입자, 또는 20 mg/kg 유리 엑센딘-4를 경구 투여한 C57/BL6 급식 마우스에서 투여 후 12, 24 및 36시간 시점 하에 물 대조군과 비교한 체중의 감소 비율(%)을 도시한 것이다.
도 2는 인공 장액에서 다양한 시점 하에 엑센딘-4 POCA 나노입자 및 유리 엑센딘-4의 안정성을 보여주는 막대 차트이다.
도 3은 엑센딘-4 POCA 나노입자, 유리 엑센딘-4 또는 염수 대조군 중 어느 하나를 정맥내 투여한 C57BL/6 마우스에서 다양한 시점 (투여하기 이전, 및 투여 후 0.5, 1, 2, 3, 4 및 8시간) 하에 혈액 글루코스 수준의 변화 비율(%)을 도시한 것이다.
도 4는 엑센딘-4 POCA 나노입자 또는 유리 엑센딘-4 중 어느 하나를 경구 투여하였거나 또는 유리 엑센딘-4를 피하 투여한 C57/BL6 급식 마우스에서 투여 후 12, 24 및 36시간 시점 하에 물 대조군과 비교한 음식물 섭취의 감소 비율(%)을 도시한 것이다.
도 5는 용량-범위 연구에 관한 것이고, 20 mg/kg, 10 mg/kg, 5 mg/kg 또는 2.5 mg/kg 엑센딘-4 POCA 나노입자, 또는 20 mg/kg 유리 엑센딘-4를 경구 투여한 C57/BL6 급식 마우스에서 투여 후 12, 24 및 36시간 시점 하에 물 대조군과 비교한 음식물 섭취의 감소 비율(%)을 도시한 것이다.
도 6은 용량-범위 연구에 관한 것이고, 20 mg/kg, 10 mg/kg, 5 mg/kg 또는 2.5 mg/kg 엑센딘-4 POCA 나노입자, 또는 20 mg/kg 유리 엑센딘-4를 경구 투여한 C57/BL6 급식 마우스에서 투여 후 12, 24 및 36시간 시점 하에 물 대조군과 비교한 체중의 감소 비율(%)을 도시한 것이다.
상세한 설명
생물제약을 경구 투여하는 데 효율적이면서도 효과적인 수단에 대한 강력한 필요성이 있다. 특히, 단백질/펩티드 안정성 및 활성은 유지하면서도, 목적하는 방출 역학과 전신 생체이용률을 달성시켜 주는 생물제약의 경구 투여 수단을 발견하는 것이 바람직할 것이다.
본 개시내용은 이러한 문제점들에 대한 해결책을 제공해준다. 본 개시내용은 생물학적 활성 폴리펩티드, 특히 대사성 펩티드, 예컨대 엑센딘-4를 경구 투여하기 위한 폴리(옥틸시아노아크릴레이트)를 포함하는 나노입자를 제공한다. 본 발명자들은 본 개시내용의 나노입자를 이용하여 엑센딘-4 펩티드를 경구 투여하였으며, 혈액 글루코스 수준 저하, 음식물 섭취 감소 및 체중 감소를 포함한 유의적인 생물학적 효과를 달성하였는데, 이는 본 개시내용의 대사성 펩티드 로딩된 나노입자의 치료적 잠재력을 나타낸다. 따라서, 본 개시내용의 나노입자는 경구 경로에 의해 투여된 생물학적 활성 폴리펩티드의 전신 전달을 달성시킬 수 있다. 본 개시내용의 나노입자는 또한, 생물학적 활성 폴리펩티드를 위장 (GI) 관 부위로 국소 전달할 수 있게 해준다.
특정 실시양태에서, 나노입자는 300 nm 이하의 유체역학적 직경을 갖는다. 또 다른 실시양태에서, 나노입자 수의 적어도 90%가 동적 광 산란 기술에 의해 측정시 10 nm 내지 200 nm 이내의 유체역학적 직경을 갖는 것인 나노입자 집단이 제공된다.
본 개시내용의 나노입자 제제는 또한, 올리고프룩토스 (OFS)를 추가로 포함할 수 있다.
본 개시내용은 또한, 상기 나노입자의 생성 방법, 상기 나노입자를 포함하는 제약 조성물, 및 상기 나노입자를 사용하여 대사 장애, 예컨대 비만을 치료하는 방법을 포괄한다.
본 개시내용은
a) 옥틸시아노아크릴레이트 (OCA)를 유기 용매에 용해시켜 단량체 용액을 형성하는 단계;
b) 단계 (a)로부터의 단량체 용액을 산성 수용액에 첨가하여, 수성 상 중 유기 액적의 에멀젼을 형성하는 단계; 및 이와 동시에 또는 순차적으로,
c) 생물학적 활성 폴리펩티드의 수용액을 단계 (b)로부터의 에멀젼에 첨가하고, 상기 단량체를 중합시키는 단계; 및
d) 유기 상을 증발시킴으로써, 상기 폴리펩티드를 함유하는 폴리(옥틸아크릴레이트) (POCA) 나노입자의 수현탁액을 수득하는 단계
를 포함하는, 나노입자의 생성 방법을 제공한다.
특정 실시양태에서, 유기 용매는 에틸아세테이트, 디클로로메탄 및 클로로포름으로 이루어진 군으로부터 선택된다. 기타 수불혼화성 용매가 사용될 수도 있다.
특정 실시양태에서, 단계 (b)에서 사용된 산성 수용액을 생성시키기 위해 사용된 산은 염산, 황산, 질산 및 시트르산으로 이루어진 군으로부터 선택된다. 특별한 실시양태에서, 사용된 산은 염산이다.
특정 실시양태에서, 단계 (b)에서 사용된 수용액의 pH는 1 내지 3.5, 또는 2 내지 3.5의 범위이다. 특정 실시양태에서, 사용된 pH는 약 2이다.
특정 실시양태에서, 단계 (b)의 수용액은 계면활성제 및/또는 안정화제를 포함한다. 계면활성제는 폴록사머, 폴리소르베이트 (예를 들어, TWEEN( TM )) 계면활성제, 마크로골 에테르 (예를 들어, BRIJ( TM )) 계면활성제, 폴리비닐 알콜 (PVA) 및 폴리비닐피롤리돈 (PVP)으로 이루어진 군으로부터 선택된 어느 하나일 수 있다. 안정화제는 덱스트란, 키토산, 푸코이단, 펙틴, 글리코겐, 아밀라제 및 아밀로펙틴으로 이루어진 군으로부터 선택된 어느 하나일 수 있다.
특정 실시양태에서, 단계 (c)와 (d) 사이에 에멀젼을 중화시키는 단계가 포함된다. 이러한 에멀젼은 수산화나트륨을 사용하여 중화시킬 수 있다.
단량체에 대한 폴리펩티드의 비는 0.1 내지 25% w/w의 범위 내일 수 있다. 특정 실시양태에서, 단량체에 대한 폴리펩티드의 비는 1 내지 10% w/w이다.
유기 상을 증발시키는 것은 수동적이거나 능등적일 수 있다. 예를 들어, 능동적 증발은 열을 사용하는 것일 수 있다.
또 다른 한편, 리퀴디아 테크놀로지(Liquidia Tecnologies) PRINT( TM ) 기술과 같은 공지된 기술 (US7976759 및 WO2007024323에 기재된 바와 같음)을 사용하여 본 개시내용의 나노입자를 제제화할 수 있다.
본 개시내용의 제약 조성물은 올리고프룩토스 (OFS)를 추가로 포함할 수 있다.
본원에 사용된 바와 같은 "나노입자"는 서브마이크로미터 크기의 입자, 예컨대 예를 들어 1 내지 1,000 nm의 입자이다. 200 nm 미만의 직경을 갖는 나노입자가 전신 노출을 위한 경구 투여에 특히 적합하다. 특정 실시양태에서, 전신 노출을 위한 경구 투여용 나노입자는 직경이 5 내지 100 nm이다.
본원에 사용된 바와 같은 "전신 노출"은 생물학적 활성제, 예를 들어 펩티드 또는 단백질을, GI 관 상피 및/또는 파이어 패치(Peyer's patch)를 통하여 흡수시킴으로써 전신계 (예를 들어, 혈류)에 전달하는 것을 의미한다.
폴리알킬 시아노아크릴레이트 (PACA) 나노입자는 생체적합성이고, 생분해성이며, 인공 위액 및 장액 내에서 안정적이다. PACA 나노입자는 또한, 상이한 길이 알킬 쇄 및 크기의 미립자, 및 상이한 제조 조건 및 방법을 이용하여, 캡슐화된 분자의 방출 프로파일을 조정하기 위해 사용될 수 있다. 본 발명자들은 생물학적 활성 폴리펩티드 로딩된 폴리(옥틸시아노아크릴레이트) (POCA) 나노입자가 경구 투여된 경우에, 폴리펩티드 안정성과 활성을 유지하면서도 바람직한 전신 약리학적 반응을 제공한다는 사실을 밝혀내었다.
본원에 사용된 바와 같은 "경구 투여"는 본 개시내용의 나노입자 및 조성물을 입으로 투여하는 것을 지칭한다. 본 개시내용의 나노입자 및 조성물은 전형적으로, 삼킨 다음, 위장 (GI) 관을 통하여 이동하는데, 여기서 이들은 장 점막을 가로질러 전신 작용을 위해 순환계 내로 흡수된다. 흡수는 입 (구강) 및 위에서 시작할 수 있지만, 통상적으로는 소장에서 일어난다.
"위장 (GI) 관"은 상부 GI 관, 즉 입, 인두, 식도 및 위; 및 하부 GI 관, 즉 소장, 십이지장, 공장, 회장, 대장 (맹장, 결장 - 상행 결장, 횡행 결장, 하행 결장 및 S자 결장 포함), 직장 및 항문; 뿐만 아니라 담낭, 간 및 췌장을 포함한다. 본 개시내용의 나노입자는 GI 관의 전술된 영역 중 어느 하나 이상을 표적으로 할 수 있다.
본원에 사용된 바와 같은 용어 "생물학적 활성제"는 분자가 목적 표적에 도달한 경우에 적어도 일부 생물학적 활성을 나타낼 수 있어야만 한다는 것을 표시하기 위해 사용된 용어이다. 의심을 피하기 위하여, 본 명세서 전반에 걸쳐 사용된 바와 같은 용어 "생물학적 활성제" 및 용어 "생물학적 활성 분자"는 동일한 의미를 갖는 것으로서 의도되고, 상호교환적으로 사용된다. 생물학적 활성제는 단백질, 펩티드 및 올리고뉴클레오티드를 포함한다. "올리고뉴클레오티드"는 mRNA, 안티센스 RNA 및 DNA, siRNA, miRNA 효능제 및 길항제, 및 RNA 및 DNA 압타머(aptamer)를 포함한다. 특별한 실시양태에서, 본 개시내용의 생물학적 활성제는 "생물학적 활성 단백질" 및 "생물학적 활성 펩티드" 둘 다를 포괄하는 "생물학적 활성 폴리펩티드"이다. 특정 실시양태에서, 생물학적 활성 폴리펩티드는 크기가 20 kDa 이하, 특히 18 kDa 이하, 15 kDa 이하, 12 kDa 이하, 또는 10 kDa 이하인 폴리펩티드이다. 특정 실시양태에서, 생물학적 활성 폴리펩티드는 70개 이하의 아미노산 잔기를 포함한다. 구체적 실시양태에서, 생물학적 활성 폴리펩티드는 대사성 폴리펩티드를 포함하거나 이로 이루어진다.
가장 광범위한 의미에서 "폴리펩티드"는 펩티드 결합에 의해 함께 연결된 아미노산의 중합체이다. 폴리펩티드는 단백질 및 펩티드 둘 다를 포함한다.
본 명세서 전반에 걸쳐 사용된 바와 같은 용어 "단백질"은 적어도 11 kDa, 또는 적어도 12 kDa, 또는 적어도 50 kDa, 또는 적어도 100 kDa, 또는 적어도 150 kDa 또는 적어도 200kDa의 분자량을 갖는 폴리펩티드를 포함한다. 캡슐화하기 위한 단백질은 또한, 상당한 길이일 수 있는데, 예컨대 길이가 70개 이상의 아미노산, 또는 길이가 100개 이상의 아미노산, 또는 길이가 150개 이상의 아미노산, 또는 길이가 200개 이상의 아미노산일 수 있다.
본 명세서 전반에 걸쳐 사용된 바와 같은 용어 "펩티드"는 2개 이상의 아미노산 잔기를 포함하는 분자를 지칭하고, 약 10 kDa 이하, 또는 약 8 kDa 이하, 또는 약 5 kDa 이하, 또는 약 2 kDa 이하, 또는 약 1 kDa 이하, 또는 1 kDa 미만의 분자량을 갖는 아미노산의 보다 짧은 서열 (단백질과 비교해서)을 포함한다. 특정 실시양태에서, 캡슐화하기 위한 펩티드는 길이가 70개 이하의 아미노산, 또는 길이가 60개 이하의 아미노산, 또는 길이가 50개 이하의 아미노산, 또는 길이가 40개 이하의 아미노산, 또는 길이가 30개 이하의 아미노산, 또는 길이가 20개 이하의 아미노산, 또는 길이가 10개 이하의 아미노산이다.
본원에 사용된 바와 같은 "대사성 펩티드"는 모든 내분비/신경내분비 기관으로부터 분비된 모든 에너지 조절성 호르몬이다. 대사성 펩티드는 인슐린분비자극 펩티드, 인크레틴 및 다양한 소화관 펩티드를 포함한다. 예를 들어, 대사성 펩티드는 GLP-1 효능제 분자 (GLP-1 및 엑센딘 분자 포함), 아디포넥틴(Adiponectin), 아드레노모둘린(Adrenomodulin), 아드로핀(Adropin), 아펠린(Apelin), 아밀린(Amylin), 봄베신(Bombesin), 칼시토닌(Calcitonin) 및 칼시토닌 유전자 관련 펩티드 (CGRP), 코카인- 및 암페타민-조절된 전사체 (CART), 콜레시스토키닌(Cholecystokinin) (CCK), 데스-아실-그렐린(Des-acyl-ghrelin), 엔테로스타틴(Enterostatin), 엔도텔린(Endothelin), 갈라닌(Galanin)-유사 펩티드 (GALP), 가스트린-방출성 펩티드 (GRP), 글리센틴(Glicentin), 글루카곤, 글루코스-의존성 인슐린분비자극 펩티드 (GIP), 글루카곤-유사 펩티드-2 (GLP-2), 인슐린, 인테르메딘(intermedin), 렙틴(leptin), 모틸린(motilin), 멜라노코르틴(Melanocortin) 효능제 펩티드 (MTII), 뉴로메딘(Neuromedin) B, 뉴로텐신(Neurotensin), 뉴로메딘 U (NMU), 오베스타틴(Obestatin), 오렉신(Orexin) A, 오렉신 B, 옥신토모둘린(oxyntomodulin) (OXM), 옥시토신(oxytocin), 뇌하수체 아데닐레이트 시클라제 활성화 폴리펩티드 (PACAP-38), 췌장 폴리펩티드 (PP), PYY (PYY1-36, PYY3-36 또는 PYY13-36), 펩티드 W, 세크레틴(secretin), 스트레스코핀(stresscopin), 갑상선 자극 호르몬-방출성 호르몬 (TRH), 우로코르틴(Urocortin), 혈관활성 장 펩티드 (VIP) 및 크세닌(Xenin)을 포함하지만, 이에 제한되지 않는다. 특정 실시양태에서, 대사성 펩티드는 인슐린분비자극 펩티드 또는 인크레틴이다. 특정 실시양태에서, 대사성 펩티드는 GLP-1 효능제, PYY, NMU, 또는 CCK이다. 특별한 실시양태에서, 대사성 펩티드는 엑센딘-4이다.
본원에 사용된 바와 같은 용어 "인슐린분비자극제"는 호르몬 인슐린을 자극할 수 있거나, 또는 이러한 호르몬의 자극, 합성 또는 발현, 또는 활성을 야기시킬 수 있는 화합물을 의미한다. 인슐린분비자극제의 공지된 예는 글루코스, GIP, GLP-1, 엑센딘 분자 및 OXM을 포함하지만, 이에 제한되지 않는다.
본원에 사용된 바와 같은 용어 "인크레틴"은 글루코스 수준이 정상인 경우 또는 특히 글루코스 수준이 상승된 경우에 방출되는 인슐린의 양을 증가시켜 주는 위장 호르몬 유형을 의미한다. 예를 들어, 이는 GLP-1, GIP, OXM, PYY (예를 들어, PYY 3-36), VIP, 및 PP를 포함한다.
본원에 사용된 바와 같은 "GLP-1 효능제 분자"는 GLP-1 수용체를 작동시킬 수 있는 어느 분자를 의미한다. 이는 적어도 한 가지의 GLP-1 활성을 지닌 어느 폴리펩티드를 포함하지만, 이에 제한되지 않는데, 이는 GLP-1, 엑센딘-3, 엑센딘-4, 옥신토모둘린, 및 생물학적 활성인 그의 단편 및/또는 변이체 및/또는 접합체, 예를 들어 GLP-1(7-37)을 포함한다. 특정 실시양태에서, GLP-1 효능제 분자는 GLP-1(7-37)이다. 특정 실시양태에서, GLP-1 효능제 분자는 GLP-1(7-37) A8G이다. 특정 실시양태에서, GLP-1 효능제 분자는 GLP-1(3-36)이다. 특정 실시양태에서, GLP-1 효능제 분자는 GLP-1(7-36)이다. 특정 실시양태에서, GLP-1 효능제 분자는 신크리아(Syncria)™ [알비글루티드(albiglutide)]이다. 또 다른 실시양태에서, GLP-1 효능제 분자는 빅토자(Victoza)™ [리라글루티드(liraglutide)]이다.
WO05/027978에는 장기적인 작용 프로파일을 갖는 GLP-1 유도체가 개시되어 있다. WO02/46227에는 GLP-1 또는 유사체와 융합된 폴리펩티드 (예를 들어, 알부민)를 포함하는 이종 융합 단백질이 개시되어 있고, 이러한 GLP-1 유사체가 본 개시내용에 사용될 수 있다. WO05/003296, WO03/060071, WO03/059934에는 호르몬의 반감기를 증가시키려는 시도로 GLP-1을 알부민과 융합시킨 아미노 융합 단백질이 개시되어 있다.
국제 특허 출원 번호 WO 91/11457 [북클레이 (Buckley) 등]에는 본 개시내용에 따른 GLP-1 효능제 분자로서 유용할 수도 있는, 활성 GLP-1 펩티드 7-34, 7-35, 7-36, 및 7-37의 유사체가 개시되어 있다.
본원에 사용된 바와 같은 "엑센딘 분자"는 엑센딘-3과 엑센딘-4 둘 다, 및 엑센딘 관련 분자를 포함한다.
본원에 사용된 바와 같은 용어 "엑센딘-4"는 엑센딘-4 (1-39), 엑센딘-4 유사체, 엑센딘-4 펩티드의 단편, 엑센딘-4 유도체, 또는 엑센딘-4 유사체의 유도체를 의미한다. 엑센딘-4 (1-39)의 서열은 HGEGTFTSDLSKQMEEEAVRLFIEWLKNGGPSSGAPPPS (서열 1)이다.
본 개시내용에 유용한 엑센딘-유사체는 PCT 특허 공개공보 WO 99/25728 [빌레이(Beeley) 등], WO 99/25727 [빌레이 등], WO 98/05351 [영(Young) 등], WO 99/40788 [영 등], WO 99/07404 [빌레이 등], 및 WO 99/43708 [크누센(Knudsen) 등]에 기재되어 있다. 특정 실시양태에서, 대사성 펩티드는 엑센딘-4, 예를 들어 BYETTA( TM ) [엑세나티드(exenatide)]이다.
본 개시내용에 유용한 추가의 엑센딘-유사체는 PCT 특허 공개공보 WO 99/25728 [빌레이 등], WO 99/25727 [빌레이 등], WO 98/05351 [영 등], WO 99/40788 [영 등], WO 99/07404 [빌레이 등], 및 WO 99/43708 [크누센 등]에 기재되어 있다.
본원에 사용된 바와 같은 "생물학적 활성제 로딩된 나노입자"는 생물학적 활성제, 예를 들어 대사성 펩티드, 예컨대 엑센딘-4가 나노입자의 표면 위에 존재하거나, 나노입자 내에 존재하거나, 또는 나노입자의 표면 위와 나노입자 내에 둘 다 존재하는 나노입자를 지칭한다. 예를 들어, 생물학적 활성제는 중합 공정 동안에 나노입자 내로 혼입시킬 수 있는데, 예를 들어 생물학적 활성제를 중합 매질에 용해시키거나, 또는 일단 중합이 완료되면, 생물학적 활성제를 나노입자 상으로 및 나노입자 내로 수착시킴으로써(sorption) 혼입시킬 수 있다.
본 개시내용의 생물학적 활성제는 안정성을 개선시키도록 조작할 수 있는데, 예를 들면 프로테아제 저항성 단백질이 있다.
본 개시내용의 생물학적 활성제는 또한, 반감기를 증가시키기 위하여, 다른 작용제, 예를 들어 폴리에틸렌 글리콜 (PEG)과 접합시킬 수 있다.
특정 아미노산 치환이 "보존적"인 것으로 간주된다는 것은 당업계에 널리 인식되어 있다. 아미노산은 공통의 측쇄 특성을 기준으로 하여 여러 군으로 나눠지고, 항원 결합성 단백질의 모든 또는 실질적으로 모든 결합 친화성을 유지시켜 주는 군 내에서의 치환은 보존적 치환으로서 간주된다 (다음 표 1 참조).
본원에 사용된 바와 같은 용어 "광 산란 기술"은 용액 중의 소 입자의 크기 분포 프로파일을 결정하기 위해 사용된 수단인데, 광 산란 기술의 한 가지 예는 나노입자를 측정하기 위해 사용될 수 있는 동적 광 산란이고, 광 산란의 또 다른 예는 마이크로구체를 측정하기 위해 사용될 수 있는 정적 광 산란 또는 저각도 광 산란이다.
본원에 사용된 바와 같은 용어 "동적 광 산란" (DLS)은 입자 크기에 대한 정보를 이끌어내기 위해 입자 분산에 의해 산란된 광을 활용하는 방법이다. 동적 광 산란은 액체 현탁액 중에서, 입자의 브라운 운동이 입자 크기에 좌우된다는 사실과, 입자의 브라운 운동으로 인해 입자 샘플로부터 산란된 광 세기가 변동된다는 사실에 좌우된다. 입자 직경은 상관 함수를 이용하여 이들 변동을 분석함으로써 얻는다. 이어서, 스톡스-아인슈타인(Stokes-Einstein) 방정식을 적용하여 입자의 평균 유체역학적 직경을 산출한다. 다중 지수 분석으로 크기 분포도를 산출할 수 있는데, 이는 샘플 내부의 상이한 종의 존재에 대한 통찰력을 제공해준다. DLS는 나노입자를 분석하는 데 일반적으로 용인된다.
본 개시내용의 나노입자 및/또는 조성물 내에 캡슐화된 생물학적 활성제는 나노입자로부터, 예를 들어 전신 순환계 내로의 방출시, 적어도 일부 생물학적 활성을, 예를 들어 50%, 60%, 70%, 80% 또는 90% 보유하고 있다. 예를 들어, 상기 활성제가 대사성 펩티드인 경우, 조성물 중의 상기 활성제의 일정 비율은 그의 표적 수용체/이펙터 분자와 결합할 수 있는 능력을 적어도 일부 보유하고 있고, 일단 나노입자로부터 방출되면 생물학적 반응을 유발시킨다. 특이적 표적 수용체/이펙터와의 결합성을 측정하는 경우, 이러한 결합성은 적합한 생물학적 결합 검정 (이는 ELISA 및 BIACORE™을 포함하지만, 이에 제한되지 않음)으로 측정할 수 있다. 특정 실시양태에서, 상기 활성제는 생물학적 결합 검정에 의해 측정하는 경우, 나노입자로부터의 방출시 표적에 대한 그의 친화성의 50% 이상, 또는 그의 친화성의 70% 이상 또는 90% 이상 (예를 들어, 평형 해리 상수 KD에 의해 측정된 바와 같음)을 보유하고 있다. 조성물은 이것이 투여되는 대상체에게서 치료적 효과를 유발시킬 수 있을 것이다. 본 개시내용의 조성물의 생물학적 활성은 캡슐화된 생물학적 활성 분자의 활성을 측정해주는 모든 적합한 검정에 의해 측정할 수 있는데, 예를 들어 생물학적 활성 분자가 대사성 펩티드, 예컨대 엑센딘-4인 경우에는, 예를 들어 실시예 3 내지 5에 기재된 바와 같은, 혈액 글루코스 수준, 음식물 섭취 및/또는 체중의 감소를 측정하는 방법을 사용할 수 있다.
본 개시내용의 방법에 사용하기 적합한 유기 용매의 예는 수불혼화성 에스테르, 예컨대 에틸 아세테이트, 이소프로필 아세테이트, n-프로필 아세테이트, 이소부틸 아세테이트, n-부틸 아세테이트, 이소부틸 이소부티레이트, 2-에틸헥실 아세테이트, 에틸렌 글리콜 디아세테이트; 수불혼화성 케톤, 예컨대 메틸 에틸 케톤, 메틸 이소부틸 케톤, 메틸 이소아밀 케톤, 메틸 n-아밀 케톤, 디이소부틸 케톤; 수불혼화성 알데히드, 예컨대 아세트알데히드, n-부티르알데히드, 크로톤알데히드, 2-에틸헥스알데히드, 이소부틸알데히드 및 프로피온알데히드; 수불혼화성 에테르 에스테르, 예컨대 에틸 3-에톡시프로피오네이트; 수불혼화성 방향족 탄화수소, 예컨대 톨루엔 크실렌 및 벤젠; 수불혼화성 할로탄화수소, 예컨대 1,1,1-트리클로로에탄; 수불혼화성 글리콜 에테르 에스테르, 예컨대 프로필렌 글리콜 모노메틸 에테르 아세테이트, 에틸렌 글리콜 모노에틸 에테르 아세테이트, 에틸렌 글리콜 모노부틸 에테르 아세테이트, 디에틸렌 글리콜 모노부틸 에테르 아세테이트; 수불혼화성 프탈레이트 가소제, 예컨대 디부틸 프탈레이트, 디에틸 프탈레이트, 디메틸 프탈레이트, 디옥틸 프탈레이트, 디옥틸 테레프탈레이트, 부틸 옥틸 프탈레이트, 부틸 벤질 프탈레이트, 알킬 벤질 프탈레이트; 수불혼화성 가소제, 예컨대 디옥틸 아디페이트, 트리에틸렌 글리콜 디-2-에틸헥사노에이트, 트리옥틸 트리멜리테이트, 글리세릴 트리아세테이트, 글리세릴/트리프로피오닌, 2,2,4-트리메틸-1,3-펜탄디올 디이소부티레이트, 메틸렌 클로라이드, 에틸아세테이트 또는 디메틸술폭시드, 사염화탄소, 클로로포름, 시클로헥산, 1,2-디클로로에탄, 디클로로메탄, 디에틸 에테르, 디메틸 포름아미드, 헵탄, 헥산 및 기타 탄화수소, 메틸-tert-부틸 에테르, 펜탄, 톨루엔, 2,2,4-트리메틸펜탄, 1-옥탄올 및 그의 이성체, 또는 벤질 알콜을 포함하지만, 이에 제한되지 않는다. 특정 실시양태에서, 유기 용매는 에틸아세테이트, 디클로로메탄 및 클로로포름으로 이루어진 군으로부터 선택된다. 특정 실시양태에서, 유기 용매는 에틸아세테이트이다. 특정 실시양태에서, 유기 용매는 수불혼화성 용매이다.
본 개시내용에 적합한 계면활성제의 예는 소듐 콜레이트, 폴록사머 188 [플루로닉(pluronic) F68™, 또는 F127], 폴리비닐 알콜, 폴리비닐 피롤리돈, 폴리소르베이트 80, 덱스트란, 폴록사머, 폴록사민, 다관능성 알콜의 카르복실산 에스테르, 알콕실화 에테르, 알콕실화 에스테르, 알콕실화 모노-, 디 및 트리글리세리드, 알콕실화 페놀 및 디페놀, 에톡실화 에테르, 에톡실화 에스테르, 에톡실화 트리글리세리드, 게나폴R(GenapolR™) 및 바우키R(BaukiR™) 시리즈의 물질, 지방산의 금속 염, 카르복실산의 금속 염, 알콜 술페이트의 금속 염, 및 지방 알콜 술페이트의 금속 염 및 술포숙시네이트의 금속 염, 및 상기 물질의 2가지 이상의 혼합물을 포함하지만, 이에 제한되지 않는다. 특정 실시양태에서, 계면활성제는 폴록사머, 예컨대 PLURONIC( TM ) F68, 폴리소르베이트 (예를 들어, TWEEN(TM)) 계면활성제, 마크로골 에테르 (예를 드어, BRIJ( TM )) 계면활성제, 폴리비닐 알콜 (PVA), 및 폴리비닐피롤리돈 (PVP)으로 이루어진 군으로부터 선택된다.
본 개시내용에 적합한 안정화제의 예는 폴리사카라이드, 예컨대 덱스트란, 키토산, 푸코이단, 펙틴, 글리코겐, 아밀라제, 아밀로펙틴을 포함하지만, 이에 제한되지 않는다.
이눌린(inulin)은 말단 α1-2 연결된 d-글루코스와의 β201 결합에 의해 접속된 d-프룩토스 분자 쇄로 이루어진, 비-분해성의 발효 가능한 가용성 폴리사카라이드 섬유이다. 이눌린 쇄 길이는 고도로 가변적이고, 10개 내지 60개 프룩토스 분자 ("10 내지 60의 중합도 또는 DP")의 범위일 수 있다. 이눌린은 예루살렘 아티초크(Jerusalem artichokes), 치커리, 양파, 마늘 및 아스파라거스를 포함한 광범위한 식물에서 발견된다. 올리고프룩토스 (OFS)는 중간쇄 분자와 단쇄 분자의 혼합물을 생성시키기 위해 추가로 가수분해시켰던 이눌린이다. 일부 경우에, 단쇄 또는 중간쇄를 형성하기 위해 보다 작은 당 분자로부터 효소적으로 합성되는 분자가 또한, OFS로서 지칭된다. 프룩토-올리고사카라이드 (FOS)는 일반적으로 훨씬 더 짧은 프룩토스-쇄 분자를 지칭하는 용어이지만, 이는 종종 OFS와 상호교환적으로 사용된다.
본원에 기재된 바와 같은 생물학적 활성 폴리펩티드 또는 펩티드 로딩된 나노입자의 정제된 제제를, 본원에 기재된 인간 질환, 장애 및 병태를 치료하는 데 사용하기 위한 제약 조성물 내로 혼입시킬 수 있다. 용어 질환, 장애 및 병태는 상호교환적으로 사용된다.
제약 제제는 본원에 기재된 바와 같은 나노입자를 제약상 허용되는 담체와 함께 포함할 수 있다. 이러한 나노입자는 단독으로 투여할 수 있거나, 또는 제약 조성물의 일부로서 투여할 수 있다. 올리고프룩토스 (OFS)가 제약 조성물에 포함될 수 있다.
전형적으로, 이러한 조성물은 허용되는 제약 실행으로써 요구되고 공지된 바와 같은 제약상 허용되는 담체를 포함한다 (예를 들어, 문헌 [Remingtons Pharmaceutical Sciences, 16th edition (1980) Mack Publishing Co.] 참조). 이러한 담체의 예는 5 내지 8의 범위 내의 pH가 되도록 적합한 완충제로 임의로 완충시킨, 멸균된 담체, 예컨대 염수 또는 덱스트로스 용액을 포함한다.
특정 실시양태에서, 본 개시내용의 제약 조성물은 경구로 투여해야 한다. 액체 (용액, 현탁액 (수성 또는 유성) 및 에멀젼), 반고체 (페이스트), 필름 및 고체 (정제, 로젠지, 캡슐, 분말, 결정 및 과립)를 포함한 다양한 투여 형태가 고려된다. 한 측면에서, 상기 조성물은, 예를 들어 비만 치료를 위해 체중 감소용 음료로서 시판되고 있는 음료로서 투여할 수 있다.
경구 투여용 액체 분산액은 시럽, 에멀젼 및 현탁액일 수 있다. 시럽은 담체로서, 예를 들어 사카로스, 또는 글리세린 및/또는 만니톨 및/또는 소르비톨을 수반한 사카로스를 함유할 수 있다.
현탁액 및 에멀젼은 담체로서, 예를 들어 천연 검, 한천, 알긴산나트륨, 펙틴, 메틸셀룰로스, 카르복시메틸셀룰로스, 또는 폴리비닐 알콜을 함유할 수 있다. 근육내 주사용 현탁액 또는 용액은 제약상 허용되는 담체, 예를 들어 멸균수, 올리브 오일, 에틸 올레에이트를 활성 화합물과 함께 함유할 수 있다.
본 개시내용은 본 개시내용에 따른 나노입자를 포함하는 조성물, 특히 제약 조성물을 제공한다. 특정 실시양태에서, 나노입자 수의 적어도 약 90%는 동적 광 산란 기술을 이용하여 측정시, 약 1 nm 내지 약 400 nm, 또는 약 1 nm 내지 약 300 nm, 또는 약 1 nm 내지 약 280 nm, 또는 약 1 nm 내지 약 250 nm, 또는 약 1 nm 내지 약 200 nm, 또는 약 1 nm 내지 약 150 nm, 또는 약 10 nm 내지 약 300 nm, 또는 약 10 nm 내지 약 250 nm, 또는 약 100 nm 내지 약 300 nm, 또는 약 40 nm 내지 약 150 nm, 또는 약 100 nm 내지 약 300 nm, 또는 약 100 nm 내지 약 200 nm, 또는 약 100 nm 내지 약 150 nm의 범위 내의 유체역학적 직경을 갖는다. 특별한 실시양태에서, 나노입자 수의 적어도 약 90%는 약 10 nm 내지 약 300 nm의 범위 내의 유체역학적 직경을 갖는다. 특별한 실시양태에서, 나노입자 수의 적어도 약 90%는 약 10 nm 내지 약 200 nm의 범위 내의 유체역학적 직경을 갖는다. 특별한 실시양태에서, 나노입자 수의 적어도 약 90%는 약 10 nm 내지 약 150 nm의 범위 내의 유체역학적 직경을 갖는다.
생물학적 활성 폴리펩티드를 투여하는 데 유효한 용량 및 치료 요법은 일반적으로, 실험적으로 결정되며, 환자의 연령, 체중 및 건강 상태, 및 치료받고자 하는 질환 또는 장애와 같은 요인들에 좌우될 수 있다. 이러한 요인은 주치의의 권한 내에 있다.
대사성 펩티드 (예를 들어, GLP-1, 엑센딘-4, 또는 PYY)에 대한 투여량 범위는 0.1 mg 내지 100 mg일 수 있다.
제약 조성물은 기타 의약과 함께, 임의로 사용 지침서와 함께, 본원에 기재된 바와 같은 생물학적 활성 폴리펩티드 로딩된 나노입자의 일부의 키트를 포함할 수 있다. 편의상, 상기 키트는 예정된 양의 시약을 사용 지침서와 함께 포함할 수 있다.
본 개시내용의 나노입자 및 관련 제약 조성물을 사용하여, 그 안에 로딩된 생물학적 활성 폴리펩티드에 따라서, 광범위한 질환 및 병태를 치료할 수 있다. 특히, 대사성 펩티드를 사용하여 대사 장애, 예를 들어 상승된 글루코스 수준과 연관된 장애, 당뇨병 (제1형 또는 제2형 또는 임신성), 대사 증후군, 고혈당증, 글루코스 내성 장애, 베타 세포 결핍증, 및 과식을 특징으로 하거나 과식과 연관된 질환, 예컨대 비만을 치료할 수 있다. 특별한 실시양태에서, 엑센딘-4 로딩된 나노입자를 사용하여 비만을 치료한다.
둘 이상의 대사성 펩티드의 조합물을 본 개시내용의 치료 요법에 투여할 수 있다. 특정 실시양태에서, 제1 대사성 펩티드를 포함하는 나노입자 집단을 제2 대사성 펩티드를 포함하는 나노입자 집단과 조합하여 투여할 수 있다. 예를 들어, 비만을 치료하기 위해, 엑센딘-4를 포함하는 나노입자 집단을 PYY를 포함하는 나노입자 집단과 조합하여 투여할 수 있다. 추가의 조합물은 NMU와 엑센딘-4, 및 CCK와 엑센딘-4를 포함한다.
본 개시내용은 상기 언급된 질환의 치료를 필요로 하는 환자에게 본 개시내용의 나노입자, 또는 치료 유효량의 로딩된 생물학적 활성 폴리펩티드를 포함하는 본 개시내용의 제약 조성물을 투여하는 단계를 포함하는, 상기 언급된 질환의 치료 방법을 제공한다.
본 개시내용은 또한, 본원에 열거된 질환 및 장애를 치료하기 위한 의약을 제조하는 데 있어서, 본원에 기재된 바와 같은 본 개시내용의 나노입자, 또는 본원에 기재된 바와 같은 본 개시내용의 제약 조성물의 용도를 제공한다.
용어 "개체", "대상체" 및 "환자"는 본원에서 상호교환적으로 사용된다. 대상체는 전형적으로 인간이다. 대상체는 또한, 포유동물, 예컨대 마우스, 래트 또는 영장류 (예를 들어, 마모셋 또는 원숭이)일 수 있다. 대상체는 비-인간 동물일 수 있다.
치료는 치유적, 예방적 또는 방지적일 수 있다. 대상체는 치료를 필요로 하는 것일 것이다. 치료를 필요로 하는 대상체는 미래에 특별한 의료 질환이 발생할 수도 있는 개체 이외에도, 이미 상기 질환으로 인해 고통받고 있는 개체를 포함할 수 있다.
본 명세서 내에서, 명확하고 간결한 명세서가 기록될 수 있도록 하는 방식으로, 실시양태를 참조로 하여 본 개시내용이 기재되었다. 실시양태들은 본 개시내용으로부터 벗어나지 않으면서 다양하게 조합되거나 분리될 수 있다는 것을 인지해야 한다.
실시예
실시예
1:
엑센딘
-4가
로딩된
POCA
나노입자의 제조
나노입자 제조 공정의 요약:
a) 옥틸시아노아크릴레이트 (OCA)를 유기 용매에 용해시켜 단량체 용액을 형성하는 단계;
b) 상기 단량체 용액을 자기 교반 하에 계면활성제 및 안정화제를 함유하는 산성 수용액에 첨가하여, 수성 상 중 유기 액적의 에멀젼을 형성하는 단계;
c) 펩티드의 수용액을 상기 에멀젼에 첨가하는 단계;
d) 중합 반응의 완료시 상기 에멀젼을 중화시키는 단계;
e) 유기 상을 증발시킴으로써, 상기 펩티드를 함유하는 폴리(옥틸시아노아크릴레이트) (POCA) 나노입자의 수현탁액을 수득하는 단계.
상세한 방법론
폴리
(
옥틸시아노아크릴레이트
) 나노입자에
엑센딘
-4를
로딩함
.
엑센딘-4를 함유하는 폴리(옥틸시아노아크릴레이트) 나노입자를 다음과 같이 제조하였다:
유기 및 수성 상의 제조:
수성 상: 다음을 혼합함으로써 제조된, pH 2.0, 0.5% w/v 덱스트란, 1.0% w/v PLURONIC( TM ) F68 수용액:
8.5 ml H2O (2 M HCl을 이용하여 pH 2.0으로 조정됨)
1 ml PLURONIC( TM ) F68 (10% 원액)
엘. 메센테로이데스 (L. Mesenteroides)로부터의 500 ㎕ 덱스트란 (수중 10% w/v 원액).
상기 용액을 실온 하에 20 ml 유리 섬광 바이알을 첨가하고, 자기 교반 막대 (12 mm x 8 mm, 8각형)를 800 rpm으로 사용하여 교반시켰다.
유기 상: 다음을 혼합함으로써 제조된, 에틸 아세테이트 중의 100 mg/ml 옥틸시아노아크릴레이트:
100 ㎕ 옥틸 시아노아크릴레이트
1 ml 에틸 아세테이트.
상기 단량체를 기타 유기 용매 (예를 들어, 디클로로메탄, 아세톤 및 테트라히드로푸란)에 용해시킬 수 있긴 하지만, 에틸 아세테이트는 가장 작고 가장 재현 가능한 입자 크기를 제공해 주고 전체로서는 3개 용매가 디클로로메탄 보다 독성이 덜한 것으로 밝혀졌다.
에멀젼의
형성
:
액체의 표면 아래에서, GILSON( TM ) 피펫을 이용하여 1 ml의 유기 상을 10 ml의 수성 상 내로 서서히 첨가하였다.
펩티드 용액: 다음을 혼합함으로써 제조된 수중 10 mg/ml 엑센딘-4:
1 mg 엑센딘-4 펩티드
100 ㎕ H2O.
옥틸시아노아크릴레이트 용액을 첨가한지 60분 후에, GILSON( TM ) 피펫을 신속하게 이용하여 상기 100 ㎕를 에멀젼 내로 첨가하였다.
단량체를 첨가한지 60분 후에, 상기 펩티드를 반응물 내로 첨가하였는데, 이로써 목적하는 방출 특징을 지닌 나노입자가 생성되었다. 본 발명자들은 60분까지의 어느 시점에 펩티드를 반응물에 첨가하였고, 나노입자를 성공적으로 제조하였지만, 60분 초과 시점에서는 연구 조사하지 않았다.
100 mg의 단량체당 1 mg의 엑센딘-4를 첨가하였다 (즉, 단량체를 기준으로 하여 1% w/w 펩티드). 펩티드 로딩량이 10% w/w 이하인 폴리(옥틸시아노아크릴레이트) 나노입자를 성공적으로 제조하였다.
이 용액을 6시간 동안 아무것도 덮지 않은 채 반응하게 두었다.
용액을 중화시킴:
옥틸시아노아크릴레이트를 6시간 중합시켜 폴리(옥틸시아노아크릴레이트) 나노입자를 형성시킨 후, 수산화나트륨 (0.1 M)을 이용하여 현탁액을 pH 6으로 중화시켰다.
유기 상을, 500 rpm 하에 지속적으로 교반시키면서 통기 월(fume cupboard)에서 밤새 증발시켰다.
나노입자의 정제:
진공 여과 (소결 필터 - 번호 3)를 이용하여 나노입자 현탁액을 여과시켜, 크기가 큰 어떠한 중합체 응집체도 제거하였다. VIVASPIN( TM ) 20 농축기 (300 K MWCO, 4000 g 하에서 120분)를 이용하여 원심분리시킴으로써 여과물을 회수 및 세척하였다.
상기 언급된 과정을 이용하여 제조된 나노입자는 입자 크기를 측정해 주는 동적 광 산란을 이용하고 로딩된 펩티드의 양을 정량화해주는 SDS PAGE를 이용하여 명확히 특징규명하였다. POCA 나노입자의 유체역학적 반경은 100 내지 150 nm의 범위였는데, 평균 126 nm였다. 나노입자에 대한 다분산도 값은 0.016 내지 0.208의 범위였는데; 이는 샘플 중의 입자 크기 범위가 얼마나 광범위한지의 척도이다.
입자 내로 로딩된 엑센딘-4의 양은 (100 ㎍/ml의 펩티드 입력으로부터) 63 내지 100 ㎍/ml의 범위였다. SDS PAGE 검정과 함께 사용된 정량화 방법은 대략 10% 이하 정도로 가변적이었으므로, 수득된 일부 결과는 100 ㎍/ml 초과였다. 용량을 계산할 목적으로, 이들 배치는 100 ㎍/ml 엑센딘-4를 함유하는 것으로 추정되었다.
나노입자의 특징규명:
DLS
나노입자의 크기는 브룩해븐 인스트루먼츠 코포레이션(Brookhaven Instruments corporation) 입자 크기 분석기 (BIC 90플러스)를 사용하여 상기 제조사에 의해 제공된 표준 과정에 따라서 동적 광 산란 (DLS)을 이용하여 측정하였다. 나노입자 현탁액을, 표준 크기 산정 파라미터 (온도 25℃, 레이저 빔 각도 90°, 레이저 파장 658 nm)를 이용하여 크기 산정된 여과 수에 10배 희석시켰다. 각 기간 동안 1분의 크기 산정 수행을 10회 수행함으로써 상기 입자를 분석하였다.
SDS
PAGE
나노입자 내로 로딩된 펩티드의 양은 SDS PAGE 분석을 이용하여 정량화하였다. 간략하게 언급하면, 나노입자 현탁액을 37℃ 하에 1시간 동안 0.1 M 수산화나트륨과 함께 인큐베이션하여 중합체를 해리시키고 펩티드를 방출시켰다. 이어서, 상기 용액 샘플을 로딩 완충제와 함께 5분 동안 80℃로 가열하였다. 이 샘플을 제조된 표준 및 분자량 마커와 함께, NUPAGE( TM ) NOVEX( TM ) 4-12% 비스트리스(BisTris) 겔 상으로 로딩하였다. 겔 리그(rig)를 1 x MES 수행 완충액에서 25분 동안 200 V (400 mA)로 설정하였고, 1시간 동안 인스턴트 블루로 염색함으로써 단백질 밴드를 가시화하였다. 이로써 생성된 밴드의 밀도측정은, 샘플 중의 펩티드를 정량화하기 위해 공지된 펩티드 표준을 이용하는 오디세이(Odyssey) LI-COR( TM ) 겔 영상화 시스템을 사용하여 수행하였다.
실시예
2:
POCA
나노입자의 안정성
캡슐화된 펩티드가 위장관에서 분해되지 못하게 할 수 있는, 실시예 1의 방법에 의해 생성된 POCA 나노입자의 능력은 TNO-TIM( TM ) 소화관 모델 시스템을 기준으로 하여, 다음과 같이 배합된 인공 위액과 장액 중에서 나노입자를 인큐베이션함으로써 입증되었다:
인공 위액 (
SGF
):
정제수를 이용하여 총 1,020 g (+/- 10 g) 이하가 되도록 만든, 31 g (+/- 0.5 g) 염화나트륨, 11 g (+/- 0.2 g) 염화칼륨, 1.5 g (+/- 0.03 g) 염화칼슘 탈수화물을 이용하고 위 염이 반드시 용해되게 함으로써, 위 염 용액 (10X 농축됨)을 제조하였다.
이어서, 정제수를 이용하여 500 ml (+/- 0.5 g) 이하가 되도록 만든, 3.58 g (+/- 0.05 g) 1 M 중탄산나트륨 및 51 g (+/- 0.5 g) 위 염 용액 (10X 농축됨)을 이용하여 위 염 용액을 제조하였다.
1 M HCl을 이용하여 pH 5.0이 되도록 산성화시킨 위 염 용액 150 g을 이용하여 위 효소 용액을 신선하게 제조하였다. 이어서, 1,125 단위의 리파제 및 18,000 단위의 펩신을 서서히 교반시킴으로써 상기 위 염 용액에 용해시키고, 이 용액을 얼음 위에 저장하였다.
그 다음, 100 g의 위 염 용액을 170 g 수돗물 및 30 g의 0.1 M 시트르산나트륨 완충제 (pH 7)와 함께 혼합하고, 1 M HCl을 이용하여 pH 2가 되도록 상기 용액을 산성화시킴으로써 SGF를 제조하였다. 이어서, 5 g (+/- 0.2 g)의 위 효소 용액을 5 g (+/- 0.2 g)의 물과 혼합하고, 상기 혼합물에 첨가하며 상기 pH를 재확인하였다. 이어서, 상기 용액을 다음 제법에 즉시 사용하였다.
인공 장액 (
SIF
):
2.0 g (+/- 0.02 g)의 담즙 분말을 청정한 용액이 수득될 때까지 250 g (+/- 5 g)의 정제수 내로 지속적으로 교반시키면서 서서히 가함으로써 담즙 용액을 제조하였다.
2.1 g (+/- 0.2 g)의 판크레아틴(pancreatin) 분말을 150 g (+/- 3 g)의 정제수에 가함으로써 판크레아틴 용액을 제조하였다. 교반기를 사용하였고, 발포를 최소화하도록 주의하였다. 일단 균질한 혼합물이 수득되면, 상기 용액을 20분 동안 3,500 rpm으로 교반시킨 다음, 상청액을 얼음 위에 저장하였다.
정제수를 250 g (+/- 5 g) 염화나트륨, 30 g (+/- 0.5 g) 염화칼륨 및 15 g (+/- 0.3 g) 염화칼슘 탈수화물에 첨가하여 총 2,174 g이 되도록 함으로써 소장 전해질 용액 (SIES) 25% (농축됨)를 제조하였다. 일단 상기 염이 용해되면, 1 M 수산화나트륨을 이용하여 pH 7.0 (+/- 0.5)이 되도록 pH를 조정하였다.
이어서, 총 중량 1,000 g이 되도록 정제수에 부가된 43.5 g (+/- 1 g) SIES 농축물을 이용하여 SIES 희석액을 제조하였다.
200 mg (+/- 5 mg)의 트립신을 100 g (+/- 2 g)의 SIES 희석액에 용해시킴으로써 트립신 용액을 제조하였다. 이어서, 상기 용액을 1.5 ml 에펜도르프(eppendorf) 튜브 내로 피펫팅하고 (튜브당 1 ml) -20℃ 하에 냉동시켰다.
그 다음, 25 g (+/- 0.3 g)의 담즙 용액, 12.5 g (+/- 0.3 g) 판크레아틴 용액 및 12.5 g(+/- 0.5 g)의 SIES 희석액 (2:1:1 비의 담즙/판크레아틴/SIES 희석물)을 혼합함으로써 SIF를 제조하였다. 이어서, 상기 용액을 즉시 사용하기에 앞서 1 ml의 트립신 용액을 첨가하였다.
150 ㎍/ml 엑센딘-4를 함유하는 농축된 나노입자의 일부를 유리 펩티드 샘플과 비교해서 인공 위액이나 장액에서 37℃ 하에 인큐베이션하였다. 샘플을 다양한 시점 하에 꺼내고, SDS PAGE를 이용하여 펩티드를 정량화하였다. 잔여 펩티드의 양을 도 1 및 2에 도시된 바와 같이 펩티드의 초기 양과 비교하였다. 인공 위액에서는 (도 1), 펩티드의 37%가 3시간 후에도 온전한 채로 유지되었다. 인공 장액에서는 (도 2), 펩티드의 76%가 24시간 후에도 온전한 채로 유지되었다.
데이터는 200 nm 미만의 폴리(옥틸시아노아크릴레이트) 나노입자가 재생 가능하게 제조될 수 있다는 것을 입증해준다. 이러한 크기의 입자는 GI 관을 통하여 전신 순환계 내로 흡수될 수 있는 잠재력을 지니고 있으므로, 이들 입자가 펩티드의 경구 전달을 위해 사용될 수 있었다.
상기 입자에 적어도 63 ㎍/ml의 엑센딘-4를 지속적으로 로딩할 수 있고, 안정성 연구 결과, 이러한 중합체 나노입자는 펩티드가 위액 및 장액에서 효소적으로 분해되지 못하게 하여 경구 전달될 수 있도록 하는 것으로 밝혀졌다.
실시예
3:
엑센딘
-4가
로딩된
POCA
나노입자의
생체내
분석 (
정맥내
투여): 혈액
글루코스
수준의 감소
엑센딘-4의 혈액 글루코스 조절 특성을 활용함으로써, 혈류 내로의 유입시 실시예 1의 방법에 의해 생성된, POCA 나노입자로부터 기능적 엑센딘-4의 방출을 입증하기 위한 생체내 연구를 수행하였다. C57BL/6 마우스에게 단일 정맥내 용량의 엑센딘-4 로딩된 POCA 나노입자 (2 ㎍ 펩티드/100 ㎕에 등가임), 캡슐화되지 않은 (유리) 엑센딘-4 펩티드 (1 ㎍ 펩티드/100 ㎕에 등가임) 또는 대조군으로서 염수를 제공하였다. 혈액 글루코스 수준를 모니터링하기 위해, 투여하기 전, 및 투여 후 0.5, 1, 2, 3, 4 및 8시간에 2 내지 3 ㎕ 혈액 샘플을 각 동물의 말초 꼬리 정맥으로부터 취하였다. 소형 글루코스 모니터 (BAYER ASCENSIA BREEZE 2( TM ))를 이용하여 각 샘플을 분석하였다. 값은 기준선으로부터의 글루코스 수준의 변화 비율(%)로서 표현하였고, 그 결과가 도 3에 도시되어 있다.
기준선으로부터 혈액 글루코스 수준의 상당한 감소가, 캡슐화된 형태의 엑센딘-4와 캡슐화되지 않은 형태의 엑센딘-4 둘 다가 투여된 동물에게서 관찰되었다 (투여 후 2시간까지 약 30% 변화됨). 이러한 혈액 글루코스 수준의 감소는 투여 후 8시간까지는 상기 나노입자 처리된 군에서 유지된 반면, 캡슐화되지 않은 펩티드가 투여된 군에서는 글루코스 수준이 이 시점까지 기준선으로 복귀되었다. 이는 상기 나노입자를 통하여 전달된 펩티드로부터 보다 장기간의 효과를 시사하는데, 지속적인 방출을 표시한다.
실시예
4:
엑센딘
-4가
로딩된
POCA
나노입자의
생체내
분석 (경구 투여): 급식 마우스 모델에서 음식물 섭취의 감소
식욕 저해로 인한 음식물 섭취의 감소를 입증하기 위하여, 급식 동물과 금식 동물 둘 다에서 음식물 섭취 억제의 뮤린 모델에서 연구를 수행하였다. 이러한 연구에서는, 실시예 1의 방법에 의해 생성된 엑센딘-4 로딩된 POCA 나노입자를 경구 투여한 직후에 동물에게 음식물을 공급하였다. 본 실시예에서 입증된 데이터는 단지 급식 마우스 모델에 관한 것이지만, 금식 동물을 이용한 연구에서 수행된 관찰을 대표한다.
단독으로 사육한 8 내지 10주령 수컷 C57/BL6 마우스의 체중을 측정하고 순위를 매겼다. 모든 군 전반에 걸쳐 균일한 체중 분포가 달성되도록 동물을 처리 군에 배정하였다. 저녁 광 주기의 시작 직전에, 동물에게 단일 용량의 다음 처리 중 하나를 제공하였다: 물 (경구), 캡슐화되지 않은 (유리) 엑센딘-4 (20 mg/kg 경구), POCA 나노입자 중의 엑센딘-4 (20 mg/kg 경구), 또는 캡슐화되지 않은 엑센딘-4 (0.3 mg/kg 피하). 처리를 수행한 직후, 모든 음식물을 제거하고, 이를 측정량의 표준 식이 (대략 100 g)로 대체하였다. 12시간 암 주기 후, 잔여 식이의 중량을 기록하고, 동물에게 돌려주었다. 이러한 과정을 투여 후 24 및 36시간 후에 반복하였다. 그 결과가 도 4에 도시되어 있고, 이는 물 대조군과 비교해서 음식물 섭취의 감소 비율(%)로서 표현한다.
그 결과는 펩티드를 상기 캡슐화된 형태로 경구 경로에 의해 전달하는 것의 이점을 명백하게 입증해준다. 등가 용량의 캡슐화되지 않은 펩티드와 비교해서, 고려된 모든 시점에서 음식물 섭취의 상당한 감소가 있었다 (p=<0.001). 이러한 음식물 섭취 억제 수준이 피하 경로로 투여된 펩티드에 대해서는 유의적인 것으로 보여지지 않지만, 모니터링된 36시간에 걸친 반응의 프로파일은 나노입자로부터의 펩티드의 지속된 방출을 시사한다.
실시예
5:
엑센딘
-4가
로딩된
POCA
나노입자의
생체내
분석 (경구 투여): 급식 마우스 모델에서 음식물 섭취 및 체중의 감소 - 용량 범위 연구
실시예 4에 기재된 바와 같은 급식 마우스 모델을 사용하였다. 그러나, 본 연구에서는 동물에게 POCA 나노입자 중의 20, 10, 5, 2.5 mg/kg의 단일 경구 용량 (위관영양)의 엑센딘-4, 또는 20 mg/kg의 단일 경구 용량 (위관영양)의 캡슐화되지 않은 (유리) 엑센딘-4를 제공하였다. 투여 후 24 및 36시간에 동물 체중을 또한 기록하였다. 음식물 섭취 결과가 도 5에 도시되어 있고, 체중 결과는 도 6에 도시되어 있다.
상기 실시예 4 및 본 실시예에서 입증된 바와 같이, 엑센딘-4를 POCA 중에 캡슐화시키면, 경구 경로에 의해 제공된 경우에 캡슐화되지 않은 물질에 비해 명백하게 보호를 제공해준다. 본 실시예에서 (도 5), 20 mg/kg 초과 용량으로 제공된 경우에도, 또한 음식물 섭취에 있어서 명백하게 상당한 감소가 있었다 (0 내지 12시간에는 p=<0.001이고, 12 내지 24시간 및 24 내지 36시간에는 p=<0.0001임).
도 6의 결과는 또한, 단일 용량의 엑센딘-4 로딩된 POCA 나노입자를 20 mg/kg으로 투여한 후의 체중 손실이, 투여 후 24시간 후 (평균 체중 손실은 5.5%였다 (p=<0.0001)) 및 투여 후 36시간 후 (평균 체중 손실은 4%였다 (p=<0.001))에 고도로 유의적이었다는 사실을 나타낸다. 상기 펩티드를 POCA 나노입자 중에서 10 mg/kg으로 투여한 경우, 24시간 후에 상당한 체중 손실이 관찰되었다 (3%, p=<0.01).
실시예
1 내지 5의 요약
본 실시예에서 보고된 생체내 연구는 엑센딘-4의 경우에, 혈류 내로의 유입시 POCA 나노입자로부터의 기능적 펩티드의 방출을 입증해주었다. 더우기, 이들 나노입자를 경구 투여하면, 유리 엑센딘-4와 비교해서 음식물 섭취 억제의 급식 뮤린 모델과 금식 뮤린 모델 둘 다에서 음식물 소비 및 체중의 상당한 감소가 초래되었다. 따라서, 이들 실시예는 요법에 있어서의 경구 투여된 펩티드 로딩된 POCA 나노입자의 용도, 특히 대사 장애, 예컨대 비만을 치료하기 위한 엑센딘-4 로딩된 POCA 나노입자의 용도를 지지해준다.
서열 참조목록
SEQUENCE LISTING
<110> GLAXO GROUP LIMITED
<120> Polypeptide Loaded POCA Nanoparticles
for Oral Administration
<130> PB65120
<150> PCT/IB2013/000964
<151>
<160> 1
<170> FastSEQ for Windows Version 4.0
<210> 1
<211> 39
<212> PRT
<213> Artificial Sequence
<220>
<223> Exendin-4 (1-39)
<400> 1
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu
1 5 10 15
Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro Ser
20 25 30
Ser Gly Ala Pro Pro Pro Ser
35
Claims (23)
- 폴리(옥틸시아노아크릴레이트)를 포함하는, 생물학적 활성 폴리펩티드를 포함하는 나노입자.
- 제1항에 있어서, 경구 투여되는 나노입자.
- 제1항 또는 제2항에 있어서, 생물학적 활성 폴리펩티드가 70개 이하의 아미노산 잔기를 포함하는 것인 나노입자.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 생물학적 활성 폴리펩티드가 대사성 펩티드를 포함하는 것인 나노입자.
- 제4항에 있어서, 대사성 펩티드가 인슐린분비자극 펩티드 또는 인크레틴인 나노입자.
- 제4항에 있어서, 대사성 펩티드가 GLP-1 효능제 펩티드, PYY, NMU 및 CCK로 이루어진 군으로부터 선택되는 것인 나노입자.
- 제4항 내지 제6항 중 어느 한 항에 있어서, 대사성 펩티드가 엑센딘-4인 나노입자.
- 제1항 내지 제7항 중 어느 한 항에 있어서, 300 nm 이하의 유체역학적 직경을 갖는 나노입자.
- 제1항 내지 제8항 중 어느 한 항에 따른 나노입자를 포함하고, 나노입자 수의 적어도 90%가 동적 광 산란 기술에 의해 측정시 10 nm 내지 200 nm 이내의 유체역학적 직경을 갖는 것인, 나노입자 집단.
- a) 옥틸시아노아크릴레이트를 유기 용매에 용해시켜 단량체 용액을 형성하는 단계;
b) 단계 (a)로부터의 단량체 용액을 산성 수용액에 첨가하여, 수성 상 중 유기 액적의 에멀젼을 형성하는 단계; 및 이와 동시에 또는 순차적으로,
c) 생물학적 활성 폴리펩티드의 수용액을 단계 (b)로부터의 에멀젼에 첨가하고, 상기 단량체를 중합시키는 단계; 및
d) 유기 상을 증발시킴으로써, 상기 폴리펩티드를 함유하는 폴리(옥틸아크릴레이트) 나노입자의 수현탁액을 수득하는 단계
를 포함하는, 나노입자의 생성 방법. - 제10항에 있어서, 유기 용매가 에틸아세테이트, 디클로로메탄 및 클로로포름으로 이루어진 군으로부터 선택되는 것인 방법.
- 제10항 또는 제11항에 있어서, 단계 (b)의 수용액이 계면활성제를 포함하는 것인 방법.
- 제10항 내지 제12항 중 어느 한 항에 있어서, 단계 (b)의 수용액이 안정화제를 포함하는 것인 방법.
- 제12항 또는 제13항에 있어서, 계면활성제가 폴록사머, 폴리소르베이트 계면활성제, 마크로골 에테르 계면활성제, 폴리비닐 알콜 및 폴리비닐피롤리돈으로 이루어진 군으로부터 선택된 어느 하나인 방법.
- 제13항에 있어서, 안정화제가 덱스트란, 키토산, 푸코이단, 펙틴, 글리코겐, 아밀라제 및 아밀로펙틴으로 이루어진 군으로부터 선택된 어느 하나인 방법.
- 제10항 내지 제15항 중 어느 한 항에 있어서, 단계 (c)와 (d) 사이에 에멀젼을 중화시키는 단계가 포함되는 것인 방법.
- 제16항에 있어서, 에멀젼이 수산화나트륨을 사용하여 중화되는 것인 방법.
- 제11항 내지 제17항 중 어느 한 항에 있어서, 단량체에 대한 폴리펩티드의 비가 1 내지 10% w/w인 방법.
- 제1항 내지 제10항 중 어느 한 항에 따른 나노입자, 또는 제11항 내지 제18항 중 어느 한 항의 방법에 의해 생성된 나노입자를 포함하는 제약 조성물.
- 제19항에 있어서, 올리고프룩토스를 추가로 포함하는 제약 조성물.
- 상승된 글루코스 수준과 연관된 장애, 당뇨병 (제1형 또는 제2형 또는 임신성), 대사 증후군, 고혈당증, 글루코스 내성 장애, 베타 세포 결핍증, 및 과식을 특징으로 하거나 과식과 연관된 질환, 예컨대 비만인 대사 장애 중 어느 하나 이상을 치료하기 위한 것이며, 생물학적 활성 폴리펩티드가 대사성 펩티드인, 제1항 내지 제8항 중 어느 한 항에 따른 나노입자, 제9항에 따른 나노입자 집단 또는 제19항 또는 제20항에 따른 제약 조성물의 용도.
- 제21항에 있어서, 비만을 치료하기 위한 것이며, 대사성 펩티드가 엑센딘-4인, 나노입자, 나노입자 집단 또는 제약 조성물의 용도.
- 상승된 글루코스 수준과 연관된 장애, 당뇨병 (제1형 또는 제2형 또는 임신성), 대사 증후군, 고혈당증, 글루코스 내성 장애, 베타 세포 결핍증, 및 과식을 특징으로 하거나 과식과 연관된 질환, 예컨대 비만인 대사 장애 중 어느 하나 이상을 갖는 대상체에게 치료 유효량의 제9항에 따른 나노입자 집단 또는 제19항 또는 제20항에 따른 제약 조성물을 투여함으로써 상기 대상체를 치료하는 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201261647633P | 2012-05-16 | 2012-05-16 | |
| US61/647,633 | 2012-05-16 | ||
| PCT/IB2013/000964 WO2013171570A1 (en) | 2012-05-16 | 2013-05-16 | Polypeptide loaded poca nanoparticles for oral administration |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20150010953A true KR20150010953A (ko) | 2015-01-29 |
Family
ID=48577784
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR20147031771A KR20150010953A (ko) | 2012-05-16 | 2013-05-16 | 경구 투여를 위한 폴리펩티드 로딩된 poca 나노입자 |
Country Status (10)
| Country | Link |
|---|---|
| US (1) | US20150342897A1 (ko) |
| EP (1) | EP2849775A1 (ko) |
| JP (1) | JP2015523332A (ko) |
| KR (1) | KR20150010953A (ko) |
| CN (1) | CN104411321A (ko) |
| AU (1) | AU2013261214A1 (ko) |
| CA (1) | CA2873536A1 (ko) |
| IN (1) | IN2014DN09297A (ko) |
| RU (1) | RU2014150850A (ko) |
| WO (1) | WO2013171570A1 (ko) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN104799440B (zh) * | 2014-01-23 | 2016-06-08 | 香港纺织及成衣研发中心有限公司 | 改善代谢综合症的功能服及其制造方法 |
| CN105342999A (zh) * | 2014-08-18 | 2016-02-24 | 山东绿叶制药有限公司 | 艾塞那肽口服纳米粒 |
| CN109675020B (zh) * | 2019-01-11 | 2021-05-04 | 浙江大学 | 一种口服glp-1多肽类纳米制剂及其制备方法和应用 |
Family Cites Families (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE69129226T2 (de) | 1990-01-24 | 1998-07-30 | Douglas I Buckley | Glp-1-analoga verwendbar in der diabetesbehandlung |
| IE80468B1 (en) * | 1995-04-04 | 1998-07-29 | Elan Corp Plc | Controlled release biodegradable nanoparticles containing insulin |
| DE69739172D1 (de) | 1996-08-08 | 2009-01-29 | Amylin Pharmaceuticals Inc | Regulation gastrointestinaler beweglichkeit |
| AU749914B2 (en) | 1997-08-08 | 2002-07-04 | Amylin Pharmaceuticals, Inc. | Novel exendin agonist compounds |
| NZ504258A (en) | 1997-11-14 | 2002-12-20 | Amylin Pharmaceuticals Inc | Exendin 3 and 4 agonist compounds for the treatment of diabetes |
| CA2309356C (en) | 1997-11-14 | 2010-09-21 | Amylin Pharmaceuticals, Inc. | Novel exendin agonist compounds |
| AU759058C (en) | 1998-02-13 | 2005-09-15 | Amylin Pharmaceuticals, Inc. | Inotropic and diuretic effects of exendin and GLP-1 |
| EP1056775B1 (en) | 1998-02-27 | 2010-04-28 | Novo Nordisk A/S | Glp-1 derivatives of glp-1 and exendin with protracted profile of action |
| US7271149B2 (en) | 2000-12-07 | 2007-09-18 | Eli Lilly And Company | GLP-1 fusion proteins |
| WO2003059934A2 (en) | 2001-12-21 | 2003-07-24 | Human Genome Sciences, Inc. | Albumin fusion proteins |
| ES2500918T3 (es) | 2001-12-21 | 2014-10-01 | Human Genome Sciences, Inc. | Proteínas de fusión de albúmina e interferón beta |
| CA2513213C (en) | 2003-01-22 | 2013-07-30 | Human Genome Sciences, Inc. | Albumin fusion proteins |
| CA2539253A1 (en) | 2003-09-19 | 2005-03-31 | Novo Nordisk A/S | Albumin-binding derivatives of therapeutic peptides |
| US7456254B2 (en) * | 2004-04-15 | 2008-11-25 | Alkermes, Inc. | Polymer-based sustained release device |
| MX2007016039A (es) | 2005-06-17 | 2008-10-27 | Univ North Carolina | Metodos, sistemas y materiales de fabricacion de nanoparticulas. |
| US20080138418A1 (en) * | 2006-12-07 | 2008-06-12 | Tong Shen Enterprise Co., Ltd. | Nanoparticles composed of alkyl-cyanoacrylate polymers |
| CN103660089B (zh) | 2007-10-12 | 2017-04-12 | 流体科技公司 | 用于生产颗粒和图案化膜的系统和方法 |
-
2013
- 2013-05-16 CN CN201380031679.4A patent/CN104411321A/zh active Pending
- 2013-05-16 JP JP2015512144A patent/JP2015523332A/ja active Pending
- 2013-05-16 US US14/401,333 patent/US20150342897A1/en not_active Abandoned
- 2013-05-16 KR KR20147031771A patent/KR20150010953A/ko not_active Application Discontinuation
- 2013-05-16 WO PCT/IB2013/000964 patent/WO2013171570A1/en active Application Filing
- 2013-05-16 CA CA2873536A patent/CA2873536A1/en not_active Abandoned
- 2013-05-16 EP EP13727643.2A patent/EP2849775A1/en not_active Withdrawn
- 2013-05-16 RU RU2014150850A patent/RU2014150850A/ru not_active Application Discontinuation
- 2013-05-16 AU AU2013261214A patent/AU2013261214A1/en not_active Abandoned
- 2013-05-16 IN IN9297DEN2014 patent/IN2014DN09297A/en unknown
Also Published As
| Publication number | Publication date |
|---|---|
| RU2014150850A (ru) | 2016-07-10 |
| WO2013171570A1 (en) | 2013-11-21 |
| JP2015523332A (ja) | 2015-08-13 |
| CN104411321A (zh) | 2015-03-11 |
| CA2873536A1 (en) | 2013-11-21 |
| IN2014DN09297A (ko) | 2015-07-10 |
| AU2013261214A1 (en) | 2014-11-20 |
| US20150342897A1 (en) | 2015-12-03 |
| EP2849775A1 (en) | 2015-03-25 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7077237B2 (ja) | グルカゴン受容体選択的ポリペプチド及びその使用方法 | |
| Simos et al. | Trends of nanotechnology in type 2 diabetes mellitus treatment | |
| Lau et al. | Discovery of the once-weekly glucagon-like peptide-1 (GLP-1) analogue semaglutide | |
| Suzuki et al. | Long-term oral administration of Exendin-4 to control type 2 diabetes in a rat model | |
| Finan et al. | Emerging opportunities for the treatment of metabolic diseases: glucagon-like peptide-1 based multi-agonists | |
| Araujo et al. | In vivo dual-delivery of glucagon like peptide-1 (GLP-1) and dipeptidyl peptidase-4 (DPP4) inhibitor through composites prepared by microfluidics for diabetes therapy | |
| CN102686741B (zh) | 基本稳态药物递送的快速建立和/或终止 | |
| Wong et al. | The role of chitosan on oral delivery of peptide-loaded nanoparticle formulation | |
| Cai et al. | Long-acting preparations of exenatide | |
| Wong | Design of oral insulin delivery systems | |
| EP2036539A1 (en) | Stable formulations of amylin and its analogues | |
| EP3250191B1 (en) | Tablets comprising glp-1 agonist and enteric coating | |
| Seo et al. | Sustained release of exendin 4 using injectable and ionic-nano-complex forming polymer hydrogel system for long-term treatment of type 2 diabetes mellitus | |
| US20220062184A1 (en) | Pharmaceutical Composition for Oral GLP-1 Administration Comprising a Tablet Core and Immediate Release Coating | |
| Han et al. | Micellar nanomedicine of novel fatty acid modified Xenopus glucagon-like peptide-1: improved physicochemical characteristics and therapeutic utilities for type 2 diabetes | |
| Petersen et al. | Designing poly-agonists for treatment of metabolic diseases: challenges and opportunities | |
| KR20150010953A (ko) | 경구 투여를 위한 폴리펩티드 로딩된 poca 나노입자 | |
| Son et al. | Mono-lithocholated exendin-4-loaded glycol chitosan nanoparticles with prolonged antidiabetic effects | |
| Reboredo et al. | Oral administration of zein-based nanoparticles reduces glycemia and improves glucose tolerance in rats | |
| Kwak et al. | Efficacy of a new sustained-release microsphere formulation of exenatide, DA-3091, in Zucker diabetic fatty (ZDF) rats | |
| Jakhar et al. | Fat fighting liraglutide based nano-formulation to reverse obesity: Design, development and animal trials | |
| M Ramesan et al. | Recent advances in the oral delivery of insulin | |
| Icart et al. | Polymeric microparticle systems for modified release of glucagon-like-peptide-1 receptor agonists | |
| Icart et al. | Sustained release and pharmacologic effects of human glucagon-like peptide-1 and liraglutide from polymeric microparticles | |
| Reboredo-Fuentes et al. | Oral administration of zein-based nanoparticles reduces glycemia and improves glucose tolerance in rats |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |