KR20140130495A - 고셰병 치료용 경구형 단위 투약 형태 및 이의 용도 - Google Patents
고셰병 치료용 경구형 단위 투약 형태 및 이의 용도 Download PDFInfo
- Publication number
- KR20140130495A KR20140130495A KR20147026336A KR20147026336A KR20140130495A KR 20140130495 A KR20140130495 A KR 20140130495A KR 20147026336 A KR20147026336 A KR 20147026336A KR 20147026336 A KR20147026336 A KR 20147026336A KR 20140130495 A KR20140130495 A KR 20140130495A
- Authority
- KR
- South Korea
- Prior art keywords
- gcd
- cells
- plant
- units
- unit dosage
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/46—Ingredients of undetermined constitution or reaction products thereof, e.g. skin, bone, milk, cotton fibre, eggshell, oxgall or plant extracts
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K36/00—Medicinal preparations of undetermined constitution containing material from algae, lichens, fungi or plants, or derivatives thereof, e.g. traditional herbal medicines
- A61K36/18—Magnoliophyta (angiosperms)
- A61K36/185—Magnoliopsida (dicotyledons)
- A61K36/23—Apiaceae or Umbelliferae (Carrot family), e.g. dill, chervil, coriander or cumin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/43—Enzymes; Proenzymes; Derivatives thereof
- A61K38/46—Hydrolases (3)
- A61K38/47—Hydrolases (3) acting on glycosyl compounds (3.2), e.g. cellulases, lactases
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0053—Mouth and digestive tract, i.e. intraoral and peroral administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/06—Antianaemics
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/14—Hydrolases (3)
- C12N9/24—Hydrolases (3) acting on glycosyl compounds (3.2)
- C12N9/2402—Hydrolases (3) acting on glycosyl compounds (3.2) hydrolysing O- and S- glycosyl compounds (3.2.1)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y302/00—Hydrolases acting on glycosyl compounds, i.e. glycosylases (3.2)
- C12Y302/01—Glycosidases, i.e. enzymes hydrolysing O- and S-glycosyl compounds (3.2.1)
- C12Y302/01045—Glucosylceramidase (3.2.1.45), i.e. beta-glucocerebrosidase
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/5005—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells
- G01N33/5008—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics
- G01N33/5082—Supracellular entities, e.g. tissue, organisms
- G01N33/5088—Supracellular entities, e.g. tissue, organisms of vertebrates
Abstract
본 발명은 고셰병 치료가 필요한 개체에서 고셰병을 치료하는 방법을 제공한다. 본 방법은 식물 세포에 포함된 재조합 글루코세레브로시다제(glucocerebrosidase; GCD)를 치료적 유효량으로 개체에게 경구 투여하는 단계를 포함하며, 상기 GCD의 치료적 유효량은 1 내지 1920 단위/Kg/14 days이고, 이에 의해 고셰병을 치료한다. 본 발명은 또한, 식물 세포에 포함된 글루코세레브로시다제(GCD)를 포함하는 단위 투약 형태를 제공한다.
Description
본 발명은, 이의 일부 구현예에서, 고셰병(Gaucher disease) 치료용 경구형 단위 투약 형태 및 이의 용도에 관한 것이다.
단백질계 약물 및 펩타이드계 약물을 전달하는 가장 보편적인 방법은 주사 및 주입과 같은 침습적인 약물 전달 방법이다. 이들 방법은 전신 질환용 거대분자 약물의 기본적인(primary) 투여 방식이지만, 환자 및 의사에게는 최소로 바람직한 것이기도 하다. 이러한 전달 방법의 명백한 단점은 환자의 동의 및 순응도(patient acceptance and compliance)로서, 대부분의 거대분자의 개발을, 침습적인 투여 경로가 사용되어야 하는 필요성보다 이와 관련된 비용이나 불편함이 더 크지 않아야 할 것으로 제한한다. 약물의 전신 전달을 위한 비-침습적인 방법으로는 경구 투여가 많은 이점을 제공하는데, 이러한 이점으로는 사용의 용이성 및 편리성, 광범위한 체적의 흡수성 표면에 대한 접근성, 불활성의 비-대사된(non-metabolized) 성분들의 자연적인 제거 등을 포함한다.
그렇지만, 거대분자 약제의 경구 투여에 대한 조사에서, 이 경로가 가지는 잠재성과 일치하는 충분한 수준의 효율성은 확인되지 않았다. 일부 난관들은 알약 및 기타 고체 제형의 섭취의 어려움, 위장관(GIT)에서의 생물학적 활성 거대분자의 불안정성, 점막에서의 생물학적 활성제의 농도, 및 생물학적 활성 거대분자에 대한 GI 막의 투과성이다.
생물학적 활성 물질의 경구 투여 경로는, 위장(stomach) 및 상부 위장관(upper GI tract)에서의 높은 산도 및 효소적 분해(enzymatic degradation)로 인해, 생물학적 활성 거대분자는 이들이 원하는 표적 조직에 도달하기도 전에 불활성화되거나 또는 파괴될 수 있으므로, 까다롭다. 또한, 넓은 체적의 위장관에서는 생물학적 거대분자의 유효 농도가 달성되기 어렵다. 따라서, 유효성을 유지하기 위해서는, 대부분의 약물이 상부 위장관에서의 분해 및/또는 환경으로부터 보호된 다음, 소장이나 결장으로 즉시(abruptly) 방출되어야 한다. 단백질과 같은 치료용 거대분자의 경구 투여 또는 장 투여(enteral administration)와 관련된 문제점들을 극복하기 위해 다양한 전략들이 제약 산업에 사용되고 있다. 이들 전략으로는, 위장 및 상부 위장관과 같은 까다로운 조건에서 활성 물질의 방출을 서행시키거나 또는 방지하도록 설계된, 담체, 코팅제 및 제형(pH 감수성 코팅제, 폴리머 및 다층(multi-layered) 코팅제, 캡슐화제, 서방성 제형, 생체접착성 시스템, 삼투성 조절형 전달 시스템 등)에의 공유 결합을 포함한다. 그러나, 이러한 제형에서의 생물학적 활성제의 조제물은 복잡할 뿐만 아니라 고비용의 공정을 필요로 한다. 또한, 점막에서의 흡수 증가를 위한 점막 접착제 및 침투 증강제(penetration enhancer)(살리실레이트, 지질-담즙산염-혼합형 미쉘(micell), 글리세라이드, 아실카르니틴(acylcarnitine) 등)가 사용된다. 그러나, 이들 중 일부는 국소 자극, 상피층의 상해 및 조직 염증과 같은 중증이면서도 국소적인 독성 문제를 야기할 수 있다. 경구 전달을 향상시키기 위한 다른 전략으로는, 생물학적 활성제를 아프로티닌(aprotinin)과 같은 프로테아제 저해제, 대두 트립신 저해제, 및 아마스타틴(amastatin)과 혼합하는 것을 포함하나, 효소 저해제는 선택성이 없으며 내인성 거대분자를 저해시키기도 하여 바람직하지 못한 부작용을 야기하기 한다. 따라서, 현재의 생물학적 활성 분자의 경구 투여 방법으로는 표적 조직에서 의도하는 생물학적 활성을 효율적으로 전달할 수 없다.
고셰병은 가장 보편적인 리소좀 축적 질환(lysosomal storage disorder)이다. 이 병은, 글리코스핑고지질 글루코세레브로사이드(글루코실세라마이드, GlcCer)의 글루코스 및 세라마이드로의 가수분해를 촉매하는 막결합 리소좀 효소이자 글루코실세라미다제로도 알려져 있는 글루코세레브로시다제의 결핍을 초래하는 열성 유전 질환(염색체 1 q21-q31)이다. 고셰병은 hGCD(인간 글루코세레브로시다제) 유전자(GBA)에서의 점돌연변이로 인해 대식세포의 리소좀에서 GlcCer가 축적됨으로써 발병된다. 고셰 세포라고 하는 저장 세포의 특징은 간, 비장 및 골수에서 확인된다. 관련된 임상적 증상으로는, 중증 간비종대증(hepatosplenomegaly), 빈혈, 혈소판감소증(thrombocytopenia) 및 골격 악화(skeletal deterioration)를 포함한다.
1960년대에, 상실된(missing) 리소좀 효소를 외인성 생물학적 활성 효소로 대체하는 방법이 리소좀 축적 질환의 치료를 위한 실현가능한 방법으로서 제안된 바 있다. 그때부터, 여러 가지 연구들은, 효소 대체 요법이 다양한 리소좀 축적 질환의 치료에 유익할 수 있다고 제안하고 있다. 최상의 성공적인 결과는, 정제된 태반 GCD(CeredaseTM) 또는 보다 최근에는 재조합으로 생성된 GCD(Genzyme Inc., Shire plc., 및 Protalix Biotherapeutics로부터 입수가능함)로 우선 치료한 I형 고셰병 환자에서 확인되었다. 이들 약물은 모두 정맥 투여된다.
WO2004/096978 및 WO2007/010533은, 자연적으로 캡슐화된 식물 세포 형태의 GCD의 경구 투여를 통한 고셰병의 치료에 대해 교시하고 있다.
본 발명의 일부 구현예의 일 측면에 따라, 고셰병의 치료가 필요한 개체에서 고셰병을 치료하는 방법을 제공하며, 본 방법은 식물 세포에 포함된 재조합 글루코세레브로시다제(GCD)를 치료적 유효량으로 상기 개체에게 경구 투여하는 단계를 포함하고, 상기 GCD의 치료적 유효량은 1 내지 1920 단위/Kg/14 days에 상응하고, 이에 의해 고셰병을 치료한다.
본 발명의 일부 구현예의 일 측면에 따라, 고셰병의 치료가 필요한 개체에서 고셰병을 치료하는 방법을 제공하며, 본 방법은 식물 세포에 포함된 재조합 글루코세레브로시다제(GCD)를 치료적 유효량으로 상기 개체에게 경구 투여하는 단계를 포함하고, 상기 GCD의 단위의 양(an amount in units)은 정맥내(I.V.) 주사에 의해 투여되는 GCD 단위의 양보다 최대 16배 더 많고, 이에 의해 고셰병을 치료한다.
본 발명의 일부 구현예의 일 측면에 따라, 고셰병의 치료가 필요한 개체에서 고셰병을 치료하는 방법을 제공하며, 본 방법은 식물 세포에 포함된 재조합 글루코세레브로시다제(GCD)를 치료적 유효량으로 상기 개체에게 경구 투여하는 단계를 포함하고, 상기 투여하는 단계는 위장의 pH가 2보다 높도록 식전 또는 가벼운 식사 후에 수행되고, 이에 의해 고셰병을 치료한다.
본 발명의 일부 구현예에 따르면, 투여하는 단계는 매일 수행된다.
본 발명의 일부 구현예에 따르면, 투여하는 단계는 식전에 수행된다.
본 발명의 일부 구현예에 따르면, 투여하는 단계는 개체의 위장의 pH가 2보다 높도록 가벼운 식사 후에 수행된다.
본 발명의 일부 구현예에 따르면, 투여하는 단계는 40 내지 1920 단위/Kg의 투약량으로 수행된다.
본 발명의 일부 구현예에 따르면, 투여하는 단계는 100 내지 1200 단위/Kg의 투약량으로 수행된다.
본 발명의 일부 구현예에 따르면, 투여하는 단계는 100 내지 1200 단위/Kg의 투약량으로 수행된다.
본 발명의 일부 구현예에 따르면, 투여하는 단계는 120 내지 960 단위/Kg의 투약량으로 수행된다.
본 발명의 일부 구현예에 따르면, 투여하는 단계는 300 내지 600 단위/Kg의 투약량으로 수행된다.
본 발명의 일부 구현예에 따르면, 투여하는 단계는 1 내지 1000 단위/Kg의 투약량으로 수행된다.
본 발명의 일부 구현예에 따르면, 투여하는 단계는 1 내지 500 단위/Kg의 투약량으로 수행된다.
본 발명의 일부 구현예에 따르면, 투여하는 단계는 1 내지 400 단위/Kg의 투약량으로 수행된다.
본 발명의 일부 구현예에 따르면, 투여하는 단계는 1 내지 300 단위/Kg의 투약량으로 수행된다.
본 발명의 일부 구현예에 따르면, 투여하는 단계는 1 내지 200 단위/Kg의 투약량으로 수행된다.
본 발명의 일부 구현예에 따르면, 투여하는 단계는 1 내지 100 단위/Kg의 투약량으로 수행된다.
본 발명의 일부 구현예에 따르면, 투여하는 단계는 1 내지 80 단위/Kg의 투약량으로 수행된다.
본 발명의 일부 구현예에 따르면, 투여하는 단계는 1 내지 60 단위/Kg의 투약량으로 수행된다.
본 발명의 일부 구현예에 따르면, 투여하는 단계는 1 내지 50 단위/Kg의 투약량으로 수행된다.
본 발명의 일부 구현예에 따르면, 투여하는 단계는 1 내지 40 단위/Kg의 투약량으로 수행된다.
본 발명의 일부 구현예에 따르면, 투여하는 단계는 1 내지 30 단위/Kg의 투약량으로 수행된다.
본 발명의 일부 구현예에 따르면, 투여하는 단계는 1 내지 20 단위/Kg의 투약량으로 수행된다.
본 발명의 일부 구현예에 따르면, 투여하는 단계는 1 내지 10 단위/Kg의 투약량으로 수행된다.
본 발명의 일부 구현예에 따르면, 투여하는 단계는 매일 수행된다.
본 발명의 일부 구현예의 일 측면에 따라, 단위 투약 형태는 식물 세포에 포함된 1 내지 6450 단위의 재조합 GCD를 포함한다.
본 발명의 일부 구현예에 따르면, 단위 투약 형태는 식물 세포에 포함된 525 내지 6450 단위의 재조합 GCD를 포함한다.
본 발명의 일부 구현예에 따르면, 단위 투약 형태는 식물 세포에 포함된 375 내지 7725 단위의 재조합 GCD를 포함한다.
본 발명의 일부 구현예에 따르면, 단위 투약 형태는 식물 세포에 포함된 1575 내지 3325 단위의 재조합 GCD를 포함한다.
본 발명의 일부 구현예에 따르면, 단위 투약 형태는 식물 세포에 포함된 1275 내지 3900 단위의 재조합 GCD를 포함한다.
본 발명의 일부 구현예에 따르면, 단위 투약 형태는 식물 세포에 포함된 600 내지 5175 단위의 재조합 GCD를 포함한다.
본 발명의 일부 구현예에 따르면, 단위 투약 형태는 식물 세포에 포함된 1 내지 3000 단위의 재조합 GCD를 포함한다.
본 발명의 일부 구현예에 따르면, 단위 투약 형태는 식물 세포에 포함된 1 내지 2000 단위의 재조합 GCD를 포함한다.
본 발명의 일부 구현예에 따르면, 단위 투약 형태는 식물 세포에 포함된 1 내지 1000 단위의 재조합 GCD를 포함한다.
본 발명의 일부 구현예에 따르면, 단위 투약 형태는 식물 세포에 포함된 1 내지 500 단위의 재조합 GCD를 포함한다.
본 발명의 일부 구현예에 따르면, 단위 투약 형태는 식물 세포에 포함된 1 내지 100 단위의 재조합 GCD를 포함한다.
본 발명의 일부 구현예에 따르면, 단위 투약 형태는 분말로서 제형화된다.
본 발명의 일부 구현예에 따르면, 단위 투약 형태는 액체로서 제형화된다.
본 발명의 일부 구현예에 따르면, 단위 투약 형태는 고체로서 제형화된다.
본 발명의 일부 구현예에 따르면, 단위 투약 형태는 정제, 캡슐, 당제, 트로키제, 경구 현탁액, 경구 분산액 및 시럽으로서 제형화된다.
본 발명의 일부 구현예에 따르면, 단위 투약 형태는 완전한 식사, 용해용 분말, 용액 또는 식품에 분산된 형태로서 제형화된다.
본 발명의 일부 구현예에 따르면, 식품은 제과 제품, 시리얼 바, 낙농제품 바, 스낵-식품, 수프, 아침용 시리얼, 뮤즐리, 캔디 및 낙농 제품으로 이루어진 군으로부터 선택된다.
본 발명의 일부 구현예에 따르면, 세포는 당근 세포를 포함한다.
본 발명의 일부 구현예에 따르면, 세포는 담배 세포를 포함한다.
본 발명의 일부 구현예에 따르면, 담배 세포는 BY-2 세포를 포함한다.
본 발명의 일부 구현예에 따르면, 세포는 분리된 세포이다.
본 발명의 일부 구현예에 따르면, 투여하는 단계는 1일 1회 수행된다.
본 발명의 일부 구현예에 따르면, 투여하는 단계는 1일 2회 수행된다.
본 발명의 일부 구현예에 따르면, 투여하는 단계는 1일 4회 수행된다.
본 발명의 일부 구현예에 따르면, 식물 세포는 동결건조된 식물 세포를 포함한다.
본 발명의 일부 구현예에 따르면, 글루코세레브로시다제는 인간 글루코세레브로시다제이다.
본 발명의 일부 구현예에 따르면, 글루코세레브로시다제는 서열 번호: 4, 10, 11, 13 또는 14로 표시된다.
본 발명의 일부 구현예에 따르면, 인간 글루코세레브로시다제 단백질은 이의 N 말단에서 소포체 신호 펩타이드에 연결된다.
본 발명의 일부 구현예에 따르면, 소포체 신호 펩타이드는 서열 번호: 1 또는 12로 표시된다.
본 발명의 일부 구현예에 따르면, 인간 글루코세레브로시다제 단백질은 이의 C 말단에서 액포 신호 펩타이드에 연결된다.
본 발명의 일부 구현예에 따르면, 액포 신호 펩타이드는 서열 번호: 2로 표시된다.
본 발명의 일부 구현예에 따르면, 글루코세레브로시다제는, 대식세포에 대한 친화성 및 흡수가, 포유류 세포에서 생성되는 재조합 인간 글루코세레브로시다제 단백질의 상응하는 친화성 및 흡수와 비교해 증가해 있으며 글루코세레브로시다제 촉매 활성을 가진다.
본 발명의 일부 구현예에 따르면, 식물 세포의 글루코세레브로시다제의 주요 글리칸 구조는 연결성 분석으로 측정 시, 하나 이상의 자일로스 잔기 및 하나 이상의 노출형 만노스 잔기를 포함한다.
본 발명의 일부 구현예의 일 측면에 따라, 식물 세포에 포함된 경구 투여되는 GCD의 상대 생체이용률(relative bioavailability)을 결정하는 방법을 제공하며, 상기 방법은,
(i) 식물 세포에 포함된 경구 투여되는 GCD;
(ii) 정맥 투여되는 가용성 GCD의 약리역학적 인자 또는 약동학적 인자의 측정 단계를 포함하고,
상기(i) 및 (ii)의 비율은 식물 세포에 포함된 경구 투여되는 GCD의 상대 생체이용률을 나타낸다.
본 발명의 일부 구현예에 따르면, 상기 방법은 동물 개체에서 수행된다.
본 발명의 일부 구현예에 따르면, 상기 방법은 인간 개체에서 수행된다.
본 발명의 일부 구현예에 따르면, 인간 개체는 고셰병을 앓고 있다.
본 발명의 일부 구현예의 일 측면에 따라, 고셰병을 앓고 있는 개체를 치료하는 방법을 제공하며, 상기 방법은,
(a) 식물 세포에 포함된 경구 투여되는 GCD의 상대 생체이용률을 상기 개체에서 결정하는 단계; 및
(b) 생체이용률(F)에 따라 상기 개체에 대한 경구 치료 투약 계획을 설계하는 단계를 포함한다.
본 발명의 일부 구현예의 일 측면에 따라, 고셰병을 앓고 있는 개체에 대한 개인맞춤형 치료(personalized therapy)의 방법을 제공하며, 상기 방법은 개체에서 정맥 투여되는 가용성 GCD의 치료적 유효량을 결정하는 단계, 및 최대 16배의 상기 치료적 유효량에 기초하여 개체에서 경구 투여되는 GCD에 대한 치료 투약 계획을 설계하는 단계를 포함한다.
달리 정의되지 않는 한, 본원에서 사용되는 모든 기술적 및/또는 과학적인 용어는, 본 발명이 속한 기술분야의 당업자가 보편적으로 이해하는 것과 동일한 의미를 가진다. 본원에서 기술되는 것과 유사하거나 또는 동일한 방법 및 물질이 본 발명의 구현예의 수행 또는 검사에 사용될 수 있지만, 실례의 방법 및/또는 물질은 후술된다. 상충하는 경우, 정의를 비롯하여 본 명세서가 통제할 것이다. 또한, 물질, 방법 및 실시예는 단지 예시적일 뿐 본질적으로 한정하려는 의도가 아니다.
본 발명의 일부 구현예는 첨부된 도면을 참조로 예시로써 본원에 기술되어 있다. 이하, 도면을 구체적으로 상세히 참조하는데, 도시된 특정사항들은 예로 든 것이며, 본 발명의 구현예를 예시로써 설명하기 위한 것임을 주지한다. 이러한 면에서, 도면과 더불어 상세한 설명을 통해, 당해 기술분야의 당업자는 본 발명의 구현예가 수행될 수 있는 방법을 알게 될 것이다.
도면에서:
도 1은, 일회(bolus) 정맥 주사(실선) 또는 매일의 경구 투여(점선)로 수행한 효소 대체 요법의 효능을 이론적으로 추정한 것을 예시한 것이다. 주어진 표준 IV 치료는, 2주간의 GCD 기질(글루코실세라마이드)의 축적, 및 이를 기저 수준(basic level)으로 떨어뜨리는 일회 투약을 토대로 한다. 이론으로 결부시키고자 하는 것은 아니지만, 효소의 경구 투여하는 단계는 매일의 치료를 가능하게 할 것이며, 기질을 이의 기저 수준으로 유지시킬 것으로 생각된다.
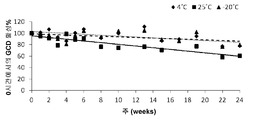
도 2는, -20℃, 4℃ 및 25℃에서 식물 재조합(pr)GCD의 경시적인 안정성을 도시한 것으로서, 상기 식물 재조합(pr)GCD는 이를 발현하는 동결건조된 당근 세포로부터 유래된다.
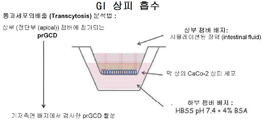
도 3a 내지 3b는, prGCD가 창자벽(intestinal barrier)을 통과할 수 있음을 도시한 것이다. 도 3a는, prGCD를 이용한 통과세포외배출 (transcytosis) 분석법을 도시한 도면이다. 본 분석법은 장에서의 전위(intestinal translocation)를 흉내낸다. 도 3b는, prGCD는 모방(simulated) 소장 배지에서 챔버 정단부(apical chamber)에 6.8 단위/ml의 속도로 첨가된다. 통과세포외배출은 37℃에서 일정한 시간이 경과한 후, 기저측면의 배지(basolateral medium)에서 측정한다. 명백하게도, prGCD는 모방 상피세포 장벽(epithelial barrier)을 1.39·10-7 cm/sec의 겉보기 투과 계수(apparent permeability coefficient)로 통과한다.
도 4a 내지 4d는, GIT를 통과하는 당근 세포 및 prGCD의 활성을 시간별로 나타낸 표를 도시한 사진 및 그래프이다(숫자는 급식 후 시간을 시(hour)로 표시한 것임). 도 4a 내지 4b는, 급식한 당근 세포로 채워진 위장의 사진(도 4a)과, 동일한 시간 동안의 위장의 중량(gr) 감소를 도시한 것이다. 도 4c 내지 4d는, 래트의 GIT 내용물에서의 prGCD의 활성(위장 및 결장, 단위: mUnits/gr 조직)(도 4c) 및 장기(organ) 내용물에서의 prGCD의 활성(혈장 및 간, 단위: mUnits/gr 조직, 도 4d)을 도시한 그래프이다.
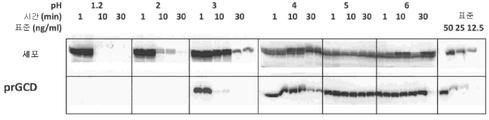
도 5는, 모방 위액의 극한 환경에서, 정제된 형태의 prGCD 및 세포에서의 prGCD의 생존율을 도시한 것이다. 세포에서의 prGCD의 활성은 보다 넓은 pH 범위를 견디는 점에 주목한다.
도 6은, 단식 조건 및 급식 조건을 모방하는 모방 장 배지(simulated intestinal media)를 세포에 처리한 후, prGCD를 포함하는 배지 및 prGCD를 포함하는 세포에서의 prGCD의 활성을 도시한 막대 그래프이다.
도 7a 내지 7c는, prGCD 주사와 대비해, 래트에서 급식 후 활성 prGCD가 표적 기관(비장 및 간)에서 확인된다는 것을 보여주는 막대 그래프이다. 도 7a는, prGCD와 당근 세포를 급식하거나 또는 prGCD 없이 당근 세포를 급식(대조군 -) 한 후, 간 및 비장에서의 prGCD의 활성(평균 베이스라인에 대한 배수 증가(fold increase))을 도시한 것이다. 도 7b 내지 7c는, 표적 기관에서 측정된, 총 급식 GCD에 대한 prGCD의 활성%(도 7b)를, 표적 기관에서 측정된, 총 주사 GCD에 대한 prGCD의 활성%(도 7c)를 도시한 것이다.
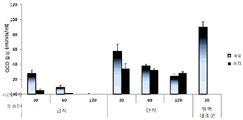
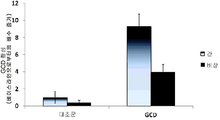
도 8a 내지 8b는, 인간 재조합 GCD를 발현하는 당근 세포를 급식한 래트에서, 전혈의 백혈구 및 간에서의 GCD의 활성을 도시한 그래프이다. 래트(n=21)에게 당근 세포를 6시간씩 간격을 두고 2회 급식하였다. 전혈 샘플을 정해진 시점에서 채취하고, 적혈구를 파쇄하여 제거하였다. 백혈구를 추출하고, 이들의 GCD 활성을 검사하였다(도 8a). 그런 다음, 래트를 안락사시키고, 이들의 간을 적출한 다음, GCD 활성을 네이브(naive) 래트와 비교 검사하였다(n=3, 도 8b).
도 9a 내지 9b는, 인간 재조합 GCD를 발현하는 당근 세포를 급식한 돼지에서, 혈장(도 9a) 또는 간(도 9b)에서의 GCD의 활성을 도시한 그래프이다. 돼지(n=3)에게 당근 세포를 1회 급식하였다. 혈장 샘플을 정해진 시점에서 채취하고, 이들의 GCD 활성을 검사하였다(도 9a). 그런 다음, 돼지를 안락사시키고, 이들의 간을 적출한 다음, GCD 활성을 네이브 돼지와 비교 검사하였다(n=5, 도 9b).
도면에서:
도 1은, 일회(bolus) 정맥 주사(실선) 또는 매일의 경구 투여(점선)로 수행한 효소 대체 요법의 효능을 이론적으로 추정한 것을 예시한 것이다. 주어진 표준 IV 치료는, 2주간의 GCD 기질(글루코실세라마이드)의 축적, 및 이를 기저 수준(basic level)으로 떨어뜨리는 일회 투약을 토대로 한다. 이론으로 결부시키고자 하는 것은 아니지만, 효소의 경구 투여하는 단계는 매일의 치료를 가능하게 할 것이며, 기질을 이의 기저 수준으로 유지시킬 것으로 생각된다.
도 2는, -20℃, 4℃ 및 25℃에서 식물 재조합(pr)GCD의 경시적인 안정성을 도시한 것으로서, 상기 식물 재조합(pr)GCD는 이를 발현하는 동결건조된 당근 세포로부터 유래된다.
도 3a 내지 3b는, prGCD가 창자벽(intestinal barrier)을 통과할 수 있음을 도시한 것이다. 도 3a는, prGCD를 이용한 통과세포외배출 (transcytosis) 분석법을 도시한 도면이다. 본 분석법은 장에서의 전위(intestinal translocation)를 흉내낸다. 도 3b는, prGCD는 모방(simulated) 소장 배지에서 챔버 정단부(apical chamber)에 6.8 단위/ml의 속도로 첨가된다. 통과세포외배출은 37℃에서 일정한 시간이 경과한 후, 기저측면의 배지(basolateral medium)에서 측정한다. 명백하게도, prGCD는 모방 상피세포 장벽(epithelial barrier)을 1.39·10-7 cm/sec의 겉보기 투과 계수(apparent permeability coefficient)로 통과한다.
도 4a 내지 4d는, GIT를 통과하는 당근 세포 및 prGCD의 활성을 시간별로 나타낸 표를 도시한 사진 및 그래프이다(숫자는 급식 후 시간을 시(hour)로 표시한 것임). 도 4a 내지 4b는, 급식한 당근 세포로 채워진 위장의 사진(도 4a)과, 동일한 시간 동안의 위장의 중량(gr) 감소를 도시한 것이다. 도 4c 내지 4d는, 래트의 GIT 내용물에서의 prGCD의 활성(위장 및 결장, 단위: mUnits/gr 조직)(도 4c) 및 장기(organ) 내용물에서의 prGCD의 활성(혈장 및 간, 단위: mUnits/gr 조직, 도 4d)을 도시한 그래프이다.
도 5는, 모방 위액의 극한 환경에서, 정제된 형태의 prGCD 및 세포에서의 prGCD의 생존율을 도시한 것이다. 세포에서의 prGCD의 활성은 보다 넓은 pH 범위를 견디는 점에 주목한다.
도 6은, 단식 조건 및 급식 조건을 모방하는 모방 장 배지(simulated intestinal media)를 세포에 처리한 후, prGCD를 포함하는 배지 및 prGCD를 포함하는 세포에서의 prGCD의 활성을 도시한 막대 그래프이다.
도 7a 내지 7c는, prGCD 주사와 대비해, 래트에서 급식 후 활성 prGCD가 표적 기관(비장 및 간)에서 확인된다는 것을 보여주는 막대 그래프이다. 도 7a는, prGCD와 당근 세포를 급식하거나 또는 prGCD 없이 당근 세포를 급식(대조군 -) 한 후, 간 및 비장에서의 prGCD의 활성(평균 베이스라인에 대한 배수 증가(fold increase))을 도시한 것이다. 도 7b 내지 7c는, 표적 기관에서 측정된, 총 급식 GCD에 대한 prGCD의 활성%(도 7b)를, 표적 기관에서 측정된, 총 주사 GCD에 대한 prGCD의 활성%(도 7c)를 도시한 것이다.
도 8a 내지 8b는, 인간 재조합 GCD를 발현하는 당근 세포를 급식한 래트에서, 전혈의 백혈구 및 간에서의 GCD의 활성을 도시한 그래프이다. 래트(n=21)에게 당근 세포를 6시간씩 간격을 두고 2회 급식하였다. 전혈 샘플을 정해진 시점에서 채취하고, 적혈구를 파쇄하여 제거하였다. 백혈구를 추출하고, 이들의 GCD 활성을 검사하였다(도 8a). 그런 다음, 래트를 안락사시키고, 이들의 간을 적출한 다음, GCD 활성을 네이브(naive) 래트와 비교 검사하였다(n=3, 도 8b).
도 9a 내지 9b는, 인간 재조합 GCD를 발현하는 당근 세포를 급식한 돼지에서, 혈장(도 9a) 또는 간(도 9b)에서의 GCD의 활성을 도시한 그래프이다. 돼지(n=3)에게 당근 세포를 1회 급식하였다. 혈장 샘플을 정해진 시점에서 채취하고, 이들의 GCD 활성을 검사하였다(도 9a). 그런 다음, 돼지를 안락사시키고, 이들의 간을 적출한 다음, GCD 활성을 네이브 돼지와 비교 검사하였다(n=5, 도 9b).
본 발명은, 이의 일부 구현예에서, 고셰병의 치료를 위한 경구형 단위 투약 형태 및 이의 용도에 관한 것이다.
본 발명의 하나 이상의 구현예를 상세히 설명하기에 앞서, 본 발명은 본질적으로, 이의 적용에서 하기의 상세한 설명에서 설명되거나 또는 실시예로 예시된 상세사항으로 한정되는 것이 아님을 이해해야 한다. 본 발명은 그외의 구현예를 다양한 방식으로 수행 또는 수행할 수 있게 한다.
고셰병은 효소 GCD의 돌연변이 또는 결핍에 의해 발병되는 선천성 유전성 리소좀 축적 질환이다. 이 질환은 비장, 간, 폐 및 뇌에서 지질의 유해한 축적을 유발하며, 환자의 뼈 및 골수에 영향을 미친다. 고셰병 치료를 위한 경구 GCD는, GCD 효소를 발현하도록 유전자 조작된 당근 세포 내에서 자연적으로 캡슐화된, 식물 세포로 발현된 형태의 GCD를 지칭한다(WO2004/096978 및 WO2007/010533 참조).
본 발명자들은, 식물 세포에서 발현되는 GCD는, 임의의 정제 단계 없이 세포 형태로 동물에게 경구 투여되었을 때 장(intestine)의 상피세포 장벽을 통과할 수 있을 뿐만 아니라, GI 관의 극한 환경을 견딜 수 있음을 확인하였다. 활성의 식물 재조합(pr)GCD는 간 및 비장에서 분석 시, 표적 기관에서 발견된다. 상기 효소를 발현하는 세포는 빈 위장에 투여될 수 있고, 가벼운 식사 형태로도 제공될 수 있으며, 위장의 pH를 높이고 췌장의 효소를 활성화시켜, 재조합 효소를 식물 세포로부터 방출시킬 수 있다. 마지막으로, 약리역학적 분석을 통해, 급식 후 60분 이내에 prGCD가 혈장에서 증가한다는 것을 확인하였다. 본 발명자들은, 식물 세포에 포함된 경구 투여되는 GCD의 상대 생체이용률을 정맥 투여되는 GCD(가용성)와 비교해 계산하였으며, 이로써 경구 투여되는 GCD에 대한 새로운 치료 투약 계획을 설계할 수 있다.
따라서, 본 발명의 일 측면에 따라, 고셰병의 치료가 필요한 개체에서 고셰병을 치료하는 방법을 제공하며, 상기 방법은 식물 세포에 포함된 재조합 글루코세레브로시다제(GCD)를 치료적 유효량으로 상기 개체에게 경구 투여하는 단계를 포함하며, 상기 GCD의 치료적 유효량은 1 내지 1920 단위/Kg/14 days, 예를 들어, 40 내지 1920 단위/Kg/14 days에 상응하고, 이에 의해 고셰병을 치료한다.
본원에서, 용어 "~에 상응한다"는, 2주의 기간 동안 투여되는 총 투약량을 지칭한다. 투여는 저 빈도의 일회 투여(예를 들어, 격주)일 수 있다. 다른 예로, 투여는 저 투약량에서 고 빈도로 수행된다. 따라서, 상기 효소 투약량의 투여는 매일, 격일로, 3일마다 수행되거나, 1주에 2회 수행될 수 있다. 식물 세포 내 GCD의 포함 및 경구 투여는 서방성-유사 효과를 유도하며, 이로써 효소는(소화-의존적인) 순환계로 서서히 방출됨으로써, 혈중 효소 농도가 본질적으로 일정하게 유지되는 것으로 이해될 것이다. (정맥 경로에 비해) 고 빈도의 투여는 순환중인 효소의 농도를 유효 수준으로 유지시킨다. 따라서, 식물 세포 형태의 효소 투여, 고 빈도 투여 또는 이들의 조합은 투여되는 효소의 총 투약량을(즉, 정맥 투여되는 투약량에 비해) 감소시킬 수 있다.
추가적인 또는 다른 측면에 따라, 고셰병의 치료가 필요한 개체에서 고셰병을 치료하는 방법을 제공하며, 상기 방법은 식물 세포에 포함된 재조합 글루코세레브로시다제(GCD)를 치료적 유효량으로 상기 개체에게 경구 투여하는 단계를 포함하며, 상기 GCD의 단위의 양은 정맥내(I.V.) 주사로 투여되는 GCD의 단위의 양보다 최대 16배, 예를 들어 4배 내지 16배 더 많고, 이에 의해 고셰병을 치료한다.
추가적인 또는 다른 측면에 따라, 고셰병의 치료가 필요한 개체에서 고셰병을 치료하는 방법을 제공하며, 상기 방법은 식물 세포에 포함된 재조합 글루코세레브로시다제(GCD)를 치료적 유효량으로 상기 개체에게 경구 투여하는 단계를 포함하며, 상기 투여하는 단계는, 위장의 pH가 2, 4 또는 6보다 높게, 예를 들어 4보다 높도록 식전이나 또는 가벼운 식사 후에 수행된다. 특정한 구현예에 따르면, pH는 4보다 높은데, 예를 들면, 4 내지 7.5(식염수 pH)이다.
투여 전에 가벼운 식사(예를 들어, 우유 한잔 또는 샌드위치)를 하는 것은 위장의 pH를 높이고; 췌장의 효소를 활성화하는 데 유익할 수 있다. 다른 예로, 완충제와 같은 기타 수단들을 사용하여, 위장의 pH를 2보다 높게 만들 수 있다.
상부 창자(upper intestine)에서 췌장에 의한 효소적 분해를 방지하기 위해서는 중금속을 피해야 한다. 또한, 투여 전에 세포를 손상시킬 만한 성분들, 예를 들어 셀룰로스를 분해하는 효소가 함유된 쥬스나 요구르트 등도 피해야 한다.
이러한 면에서, 특정 구현예에 따르면, 경구 제형의 삼투성은(식염수와 유사한) 생리학적 삼투성, 즉, 250 mosM 내지 300 mosM과 유사해야 한다.
본원에서, "식물 세포에 포함된 재조합 글루코세레브로시다제(GCD)"는 GCD를 외인성으로 발현하도록 유전자 조작된 식물 세포를 지칭한다.
"외인성으로"는, 식물 세포에 본래 존재하지 않는 단백질의 발현을 지칭한다.
본원에서, "고셰씨병" 또는 "고셰병"은 세포 및 소정의 장기에 지방 성분(지질)이 축적되는 유전 질환을 지칭한다. 고셰병은 리소좀 축적 질환의 가장 보편적인 형태이다. 글루코세레브로시다제 효소(산 β-글루코시다제로도 알려져 있음)의 유전적인 결핍에 의해 발병된다. 상기 효소는 지방 성분인 글루코세레브로사이드(글루코실세라마이드로도 알려져 있음)에 작용한다. 상기 효소가 결함된 경우, 글루코세레브로사이드는 축적되는데, 특히 백혈구(단핵성 백혈구)에 축적된다. 글루코세레브로사이드는 비장, 간, 신장, 폐, 뇌 및 골수에 축적될 수 있다.
고셰병에는 3가지 보편적인 임상적 아형(subtype)이 존재한다.
I형(또는 비-신경병증 유형)은 상기 질병의 가장 보편적인 형태로서, 50,000명의 신생아 중 약 1명에게서 발병한다. 아슈케나지 유대인계(Ashkenazi Jewish heritage) 사람들에게서 가장 자주 발병한다. 증상은 어렸을 때 또는 성인이 되어서 시작될 수 있으며, 간 비대 및 비장 비대 (통틀어서 간비종대증)를 포함하며; 비장은 파열하여 추가적인 합병증을 유발할 수 있다. 비장 비대 및 골수 대체는 빈혈, 혈소판감소증 및 백혈구감소증을 유발한다. 골격 약화(Skeletal weakness) 및 골 질환은 광범위할 수 있다. 뇌는 병리학적으로 영향을 받지 않지만, 폐 손상 및 드물게는 신장 손상이 있을 수 있다. 이 그룹에 속하는 환자는 통상적으로(혈소판 농도가 낮아) 멍이 잘 들며 적혈구 수가 적어 쉽게 피로해진다. 질환의 발병 및 중증도에 따라, 1형 환자는 성인이 될 때까지 잘 생존할 수 있다. 일부 환자는 경미한 형태의 질환을 앓거나 또는 어떠한 증상도 나타내지 않을 수 있다.
II형(또는 급성 소아 신경병증 고셰병)은 전형적으로 생후 6개월 이내에 시작되며 발병률은 신생아 100,000명 중 약 1명이다. 증상은 간 및 비장 비대, 광범위하고 진행성인 뇌손상, 안구 운동 장애, 경직(spasticity), 발작, 사지 강직(limb rigidity), 및 불량한 빨고 삼키는 능력(poor ability to suck and swallow)을 포함한다. 병에 걸린 어린이는 통상 2살때 사망한다.
III형(만성 신경병증 형태)은 아동기 또는 심지어 성인기 중 어느 때든 시작될 수 있으며, 100,000명의 신생아 중 약 1명에게서 발병한다. III형은 느리게 진행되지만, 급성 또는 2형 버전에 비해 보다 경미한 신경학적 증상을 특징으로 한다. 주요 증상으로는, 비장 및/또는 간 비대, 발작, 불량한 공동 작용(poor coordination), 골격 이상(skeletal irregularity), 안구 운동 장애, 빈혈을 비롯한 혈액 장애, 및 호흡기 문제를 포함한다. 환자는 종종 10대 초기 및 성인때까지 생존한다.
본원에서, "글루코세레브로시다제" 또는 "GCD"는, 당지질 대사의 중간산물인 글루코세레브로사이드 화학물질의 베타-글루코시드 결합을 가수분해에 의해 절단하는데 필요한 글루코실세라미다제 활성을 가진 효소(EC 3.2.1.45)를 지칭한다.
본원에서, "이를 필요로 하는 개체"는, 고셰병을 진단받은 개체와 같이, GCD 대체 요법을 이용한 치료로부터 이익을 받을 수 있는 개체를 지칭한다.
특정 구현예에 따르면, 개체는 인간이다. 개체는 유아, 아동, 청소년 및 성인을 비롯한 임의의 연령대의 개체일 수 있다. 즉, 특정 구현예에 따르면, 본 교시는, 체중이 0.6-200 Kg, 1-200 Kg, 3-150 Kg, 5-80 Kg, 50-80 Kg, 15-40 Kg, 3-14 Kg 또는 3-110 Kg인 개체의 치료에 관한 것이다.
특정 구현예에 따르면, 글루코세레브로시다제는 인간 효소, 예를 들어, 서열 번호: 4 또는 13이다.
본원에서, "식물 세포"란, 생물학적 활성 재조합(외인성) GCD를 외인성으로 발현하는 식물 전체, 이의 일부(예를 들어, 잎, 뿌리, 과일, 씨앗) 또는 이로부터 분리된 세포(세포의 동종 또는 이종성 집단)를 지칭한다.
본원에서, "분리된 식물 세포"란, 분해된 식물 세포 조직 또는 식물 세포 배양물로부터 유래되는 식물 세포를 지칭한다.
본원에서, "식물 세포 배양물"이란, 임의의 유형의 천연(자연적으로 존재하는) 식물 세포, 식물 세포주 및 유전자 조작된 식물 세포를 지칭하며, 이는 조립 시 완전한 식물을 형성하지 않아 식물의 생물학적 구조가 하나 이상 존재하지 않는다. 선택적으로, 본 발명의 이러한 측면에서 식물 세포 배양물은 특정 유형의 식물 세포 또는 복수의 서로 다른 유형의 식물 세포를 포함할 수 있다. 선택적으로, 특정 유형의 식물 세포를 특징으로 하는 식물 배양물은 본래 복수의 서로 다른 유형의 이러한 식물 세포로부터 유래될 수 있음을 주지해야 한다.
특정 구현예에 따르면, 본 발명의 식물 세포는 온전한 세포막 및/또는 세포벽을 포함하며, 이는 효소의 전달을 위해서는 투여 전에 이러한 구조물들이 의도적으로 손상되지 않아야 함을 의미한다. 따라서, 특정 구현예에 따르면, 투여되는 세포 중 적어도 30%, 40%, 50%, 60%, 70%, 80%, 90% 또는 100% 세포는 본질적으로 온전한 세포막 및/또는 세포벽을 포함한다.
본 발명의 식물 세포는 식물(또는 이의 일부), 바람직하게는 식용 및/또는 무독성 식물로부터 유래되며, 유전자 조작을 받기 쉬워서 재조합 단백질을 발현할 수 있다.
본 발명의 이러한 측면에 따라 사용될 수 있는 식물의 예로는, 이끼, 조류, 외떡잎 식물 또는 쌍떡잎 식물, 뿐만 아니라 그외 식물을 포함하지만, 이들로 한정되는 것은 아니다. 예로는, 잎 작물(leafy crops), 기름감작물(oil crop), 알팔라(alfalfa), 담배, 토마토, 바나나, 당근, 상추, 옥수수, 오이, 멜론, 감자, 포도 및 횐토끼풀(white clover)을 포함하지만, 이들로 한정되는 것은 아니다.
식물 세포는 선택적으로, 식물 뿌리 세포(즉, 식물 뿌리로부터 유래되거나, 수득되거나 또는 본래 이를 토대로 하는 세포), 보다 바람직하게는 셀러리(celery) 세포, 생강 세포, 호스래디쉬(horseradish) 세포 및 당근 세포로 이루어진 군으로부터 선택되는 식물 뿌리 세포와 같은 임의의 유형의 식물 세포일 수 있다.
특정 구현예에 따르면, 식물 세포는 당근 세포이다.
특정 구현예에 따르면, 식물 세포는 담배 세포이다. 특정 구현예에 따르면, 식물 세포는 BY-2 세포 또는 니코티아나 벤타미아나(Nicotiana Benthamiana) 세포이다.
뿌리 이외의 식물 기관 구조물로부터 유래되는 식물 세포 배양물은 예를 들어 아그로박테리움 리조게네스(Agrobacterium rhizogenes)로 형질전환시킴으로써 수염(hairy) 뿌리로도 알려져 있는 신생물 구조를 유도하여 이를 배양물에 사용할 수 있는 것으로 이해될 것이며(예를 들어, Strobel 등의 미국 특허 4,588,693 참조), 하기에서 상세히 설명된다. 따라서, 전술한 바와 같이 그리고 이하 실시예 부문에서 기술되는 바와 같이, 식물 뿌리 세포는 아그로박테리움 리조게네스로 형질전환된 뿌리 세포일 수 있다.
특정 구현예에 따르면, 식물 세포는 동결건조된 식물 세포이다.
표적 세포 내 리소좀에 도달하기 위해, GCD는 말단 노출형 만노스를 포함하도록 변형된다. WO2004/096978 및 미국 특허 7,951,557은 식물 세포에서 생물학적 활성 GCD를 발현하는 구축물 및 방법을 교시하고 있다(이의 교시는 원용에 의해 본 명세서에 포함되어 있음). 따라서, 특정 구현예에 따르면, GCD는 이의 N 말단에서 소포체 신호 펩타이드에 연결되어 있으며 이의 C-말단에서 액포 신호 펩타이드에 연결되어 있다(예를 들어, 서열 번호: 13 또는 14 참조). 특정 구현예에 따르면, 신호 펩타이드의 부착은 링커(linker)를 사용하지 않고 GCD의 아미노산 서열에 직접 이루어진다.
특정 구현예에 따르면, 소포체 신호 펩타이드는 서열 번호: 1 또는 12로 표시된다.
특정 구현예에 따르면, 액포 신호 펩타이드는 서열 번호: 2로 표시된다.
특정 구현예에 따르면, 식물 세포의 글루코세레브로시다제의 주요 글리칸 구조는 연결성 분석으로 측정 시, 하나 이상의 자일로스 잔기 및 하나 이상의 노출형 만노스 잔기를 포함한다.
특정 구현예에 따르면, 글루코세레브로시다제는, 대식세포에 대한 친화성 및 흡수가, 포유류 세포에서 생성되는 재조합 인간 글루코세레브로시다제 단백질의 상응하는 친화성 및 흡수와 비교해 증가되어 있으며 글루코세레브로시다제 촉매 활성을 가진다.
본 발명의 이러한 측면에 따라 바람직하게는 현탁액 배양물이 사용되지만, 캘러스 배양물(callus culture) 또한 멸균성이 유지되는 한 사용될 수 있다.
전술한 식물 세포 배양물의 세포에서 본 발명의 이러한 측면의 생물학적 활성 재조합 단백질이 발현되는 것은, 이를 발현하는 핵산 서열(서열 번호: 15)을 식물 발현에 적절한 핵산 구축물에 연결함으로써 이루어진다. 또한, 전술한 식물 세포 배양물의 세포에서 본 발명의 이러한 측면의 생물학적 활성 단백질이 발현되는 것은 식물 유전자의 과발현을 유도하는 핵산 서열을 연결함으로써 이루어진다.
이러한 핵산 구축물은, 세포에서 폴리뉴클레오타이드 서열의 전사를 구성적인(constitutive) 방식 또는 유도적인(inducible) 방식으로 유도하기 위한 프로모터 서열과 같은 cis-작용 조절 영역을 포함한다. 프로모터는 형질전환된 식물/세포에 대해 동종성 또는 이종성일 수 있다. 또는 다른 예로, 이러한 핵산 구축물은 식물 유전자의 부근에서 식물 게놈에 삽입되는(즉, 낙-인(konck-in)) 인핸서/프로모터 요소를 포함한다.
프로모터는, 식물 세포 및 식물과 같은 숙주 세포에서 연결된 서열(linked sequence)의 전사를 높은 수준으로 유도할 수 있는 식물 프로모터 또는 비-식물 프로모터일 수 있다. 프로모터는 구성적 또는 유도성일 수 있다. 예를 들어, 한정적이지 않으면서, 유도성 프로모터는, 식물, 식물 조직 또는 식물 세포의 기계적인 유전자 활성화(mechanical gene activation; MGA) 후, 리소좀 효소 뉴클레오타이드 서열의 발현 또는 발현 증가를 촉진하는 프로모터일 수 있다.
구성적 식물 프로모터의 예로는, CaMV35S 및 CaMV19S 프로모터, FMV34S 프로모터, 사탕수수 바실리포름 바드나바이러스(bacilliform badnavirus) 프로모터, CsVMV 프로모터, 아라비듭시스(Arabidpsis) ACT2/ACT8 액틴 프로모터, 아라비듭시스 유비퀴틴 UBQ 1 프로모터, 보리 잎 티오닌 BTH6 프로모터, 쌀 액틴 프로모터, rbcS, 엽록소 a/b 결합 단백질에 대한 프로모터, AdhI, NOS 및 HMG2 또는 이들의 변형체 또는 유도체를 포함하지만, 이들로 한정되는 것은 아니다.
유도성 프로모터는 예를 들어, 빛, 온도, 화학물질, 가뭄, 고 염도, 삼투압 충격(osmotic shock), 산화 조건 또는 병원성의 경우 등의 스트레스 조건과 같은 특정한 자극에 의해 유도되는 프로모터이다. 통상, 프로모터는 식물이 수집되기 전에 유도되며, 따라서 수집-전(pre-harvest) 프로모터로 지칭된다. 유도성 수집-전 프로모터로는, 완두콩 rbcS 유전자 유래의 광-유도성 프로모터, 알팔라 rbcS 유전자 유래의 프로모터, 가뭄 시 활성화되는 DRE, MYC 및 MYB 프로모터; 고 염도 및 삼투압 스트레스에서 활성화되는 INT, INPS, prxEa, Ha hsp17.7G4 및 RD21 프로모터, 및 병원성 스트레스에서 활성화되는 hsr2O3J 및 str246C 프로모터를 포함하지만, 이들로 한정되는 것은 아니다.
본 발명의 숙주 세포를 형질감염시키거나 또는 형질전환시키는 데 사용되는 발현 벡터는, 식물 또는 식물 세포에서 이종성 유전자의 발현을 증대시키거나 또는 최적화하기 위한, 당해 기술분야의 당업자에게 공지된 방법에 따라 부가적으로 변형될 수 있다. 이러한 변형으로는, 프로모터 강도를 증가시키거나 또는 관심의 단백질을 변화시키기 위해 DNA 조절 요소를 돌연변이화할 뿐만 아니라 코돈 사용빈도(codon usage)를 최적화하는 것을 포함하지만, 이들로 한정되는 것은 아니다. 코돈 사용빈도의 변화에 의한 합성 유전자의 구축은 예를 들어 PCT 특허 출원 93/07278에 기술되어 있다.
핵산 구축물은 예를 들어, 플라스미드, 박미드(bacmid), 파지미드(phagemid), 코스미드(cosmid), 파지, 바이러스 또는 인공 염색체일 수 있다. 바람직하게는, 본 발명의 핵산 구축물은 플라스미드 벡터, 보다 바람직하게는 바이너리 벡터(binary vector)이다.
"바이너리 벡터"란, Ti 플라스미드 유래의 변형된 T-영역을 가지며; 이. 콜라이(E. coli) 및 아그로박테리움 세포 둘 다에서 증대(multiplied)될 수 있으며, 식물 형질전환을 위한 리포터 유전자(들)를 2개의 보다 광범위한 영역들 사이에 통상 포함하는, 발현 벡터를 지칭한다. 본 발명에 적절한 바이너리 벡터는 pBI2113, pBI121, pGA482, pGAH, pBIG, pBI101(Clonetech), pPI 또는 이들의 변형을 포함한다.
일부 구현예에서, 활성 폴리펩타이드의 생성은 일련의 서열을 포함하여 폴리펩타이드의 발현과 뒤이어 번역-후 변형, 예를 들어, 글리코실화, 이량체화, 메틸화 및 설필화(sulfhylation), 하이드록실화를 수행하는 것으로 이해될 것이다.
식물이 올바른 위치에서 인간 단백질을 글리코실화할 수 있더라도, 완전히 처리된(processed) 복합 식물 글리칸의 조성물은 포유류 N-연결된 글리칸과 상이하다. 식물 글리칸은 동물 글리칸에 보편적인 말단 시알산(sialic acid) 잔기나 갈락토스 잔기를 가지지 않으며, 일반적으로 포유류에서는 발견되지 않는 연결(linkage)을 가지는 자일로스 또는 푸코스 잔기를 종종 함유한다(Jenkins et al., 14 Nature Biotech 975-981(1996); Chrispeels and Faye in transgenic plants pp. 99-114(Owen, M. and Pen, J. eds. Wiley & Sons, N.Y. 1996; Russell 240 Curr. Top. Microbio. Immunol.(1999).
본 발명의 핵산 구축물은 식물 세포를 안정하게 또는 일시적으로 형질전환시키는 데 이용될 수 있다. 안정한 형질전환에서, 본 발명의 핵산 분자는 식물 게놈에 병합되며, 그로 인해, 안정하며 유전된(inherited) 특성을 나타낸다. 일시적인 형질전환에서, 핵산 분자는 형질전환된 세포에 의해 발현되지만 게놈에 병합되지 않으므로, 특정 단백질을 일시적으로 발현시킨다.
외래 유전자를 단자엽 식물 및 쌍자엽 식물 모두에 도입하는 방법들은 여러 가지 존재한다(Potrykus, I.(1991). Annu Rev Plant Physiol Plant Mol Biol 42, 205-225; Shimamoto, K. et al.(1989). Fertile transgenic rice plants regenerated from transformed protoplasts. Nature(1989) 338, 274-276).
외인성 DNA의 식물 게놈 DNA로의 안정한 병합을 위한 기본적인 방법은 2가지 주요한 전략을 포함한다:
(i) 아그로박테리움-매개의 유전자 트랜스퍼. Klee, H. J. et al.(1987). Annu Rev Plant Physiol 38, 467-486; Klee, H. J. and Rogers, S. G.(1989). Cell Culture and Somatic Cell Genetics of Plants, Vol. 6, Molecular Biology of Plant Nuclear Genes, pp. 2-25, J. Schell and L. K. Vasil, eds., Academic Publishers, San Diego, Cal.; and Gatenby, A. A.(1989). Regulation and Expression of Plant Genes in Microorganisms, pp. 93-112, Plant Biotechnology, S. Kung and C. J. Arntzen, eds., Butterworth Publishers, Boston, Mass를 참조한다. 이는 특히, 뿌리 세포가 숙주 세포로서 사용되는 경우 바람직하다.
(ii) 직접적인 DNA 흡수. 예를 들어, Paszkowski, J. et al.(1989). Cell Culture and Somatic Cell Genetics of Plants, Vol. 6, Molecular Biology of Plant Nuclear Genes, pp. 52-68, J. Schell and L. K. Vasil, eds., Academic Publishers, San Diego, Cal.; 및 Toriyama, K. et al.(1988). Bio/Technol 6, 1072-1074(DNA의 원생동물로의 직접적인 흡수 방법)를 참조한다. 또한, Zhang et al.(1988). Plant Cell Rep 7, 379-384; 및 Fromm, M. E. et al.(1986). Stable transformation of maize after gene transfer by electroporation. Nature 319, 791-793(식물 세포의 간단한 전기 쇼크에 의해 유도되는 DNA 흡수)를 참조한다. 또한, Klein et al.(1988). Bio/Technology 6, 559-563; McCabe, D. E. et al.(1988). Stable transformation of soybean(Glycine max) by particle acceleration. Bio/Technology 6, 923-926; 및 Sanford, J. C.(1990). Biolistic plant transformation. Physiol Plant 79, 206-209(입자 충격(particle bombardment)에 의한 DNA의 식물 세포 또는 조직으로의 주사)를 참조한다. 또한, Neuhaus, J. M. et al.(1987). Theor Appl Genet 75, 30-36; 및 Neuhaus, J. M. and Spangenberg, G. C.(1990). Physiol Plant 79, 213-217(마이크로파이펫 시스템 이용)를 참조한다. 미국 특허 5,464,765(세포 배양물, 배아 또는 캘러스(callus) 조직의 유리 섬유 또는 규소 카바이드 휘스커(whisker) 형질전환)를 참조한다. 또한, DeWet, J. M. J. et al.(1985). "Exogenous gene transfer in maize(Zea mays) using DNA-treated pollen," Experimental Manipulation of Ovule Tissue, G. P. Chapman et al., eds., Longman, New York-London, pp. 197-209; 및 Ohta, Y.(1986). High-Efficiency Genetic Transformation of Maize by a Mixture of Pollen and Exogenous DNA. Proc Natl Acad Sci USA 83, 715-719(DNA와 발아 꽃가루(germinating pollen)의 직접적인 인큐베이션)를 참조한다.
아그로박테리움-매개의 시스템은, 식물 게놈 DNA에 병합되는 정해진(defined) DNA 분절을 함유하는 플라스미드 벡터의 사용을 포함한다. 식물 조직의 주입(inoculation) 방법은 식물 종(species) 및 아그로박테리움 전달 시스템에 따라 다양하다. 광범위하게 사용되는 방법은 잎-디스크 과정(leaf-disc procedure)으로서, 전체-식물 분화의 개시를 위한 양호한 소스(source)를 제공하는 임의의 조직 이식으로 수행될 수 있다(Horsch, R. B. et al.(1988). "Leaf disc transformation." Plant Molecular Biology Manual A5, 1-9, Kluwer Academic Publishers, Dordrecht). 보조 방법은 진공 여과와 함께 아그로박테리움 전달 시스템을 이용한다. 아그로박테리움 시스템은 특히, 유전자도입 쌍자엽 식물의 제조에 유용하다.
식물 세포로의 직접적인 DNA 트랜스퍼를 위한 방법은 여러 가지가 존재한다. 전기천공에서, 원생동물은 단순히 강한 전기장에 노출되어, 미니-포어(mini-pore)를 개방하여 DNA가 들어갈 수 있게 한다. 마이크로주입(microinjection)에서, DNA는 마이크로파이펫을 사용해 세포에 직접 기계적으로 주입한다. 마이크로입자 충격에서, DNA는 마그네슘 설페이트 결정 또는 텅스텐 입자와 같은 미세투사물(microprojectile) 상에 흡수되고, 미세투사물은 세포 또는 식물 조직에 물리적으로 가속화된다(accelerated).
현재로서는 안정한 형질전환이 바람직하지만, 예를 들어, 잎 세포, 분열조직 세포 또는 전체 식물의 일시적인 형질전환 또한 본 발명에 고려된다. 그러나, 이 경우, 조절을 위한 바이러스 서열 또는 선별 유전자(예를 들어, 항생제 내성)를 배제하기 위한 조치를 취한다.
일시적인 형질전환은 전술한 직접적인 DNA 트랜스퍼 방법 또는 변형된 식물 바이러스를 사용한 바이러스 감염에 의해 수행될 수 있다.
식물 숙주의 형질전환에 유용한 것으로 보이는 바이러스로는 꽃양배추 모자이크 바이러스(cauliflower mosaic virus; CaMV), 담배 모자이크 바이러스(TMV), 및 바큘로바이러스(baculovirus; BV)를 포함한다. 식물 바이러스를 사용한 식물의 형질전환은 예를 들어, 미국 특허 4,855,237(콩 황색증 모자이크 바이러스(bean golden mosaic virus), BGMV); EPA 67,553(TMV); 일본 공개 출원 63-14693(TMV); EPA 194,809(BV); EPA 278,667(BV); 및 Gluzman, Y. et al.(1988). Communications in Molecular Biology: Viral Vectors, Cold Spring Harbor Laboratory, New York, pp. 172-189에 기술되어 있다. 식물을 비롯한 다수의 숙주에서 외래 DNA를 발현하는 슈도바이러스(pseudovirus) 입자의 사용은 WO 87/06261에 기술되어 있다.
식물에서 비-바이러스성 외인성 핵산 서열의 도입 및 발현을 위한 식물 RNA 바이러스의 구축은 전술한 참조문헌 뿐만 아니라 Dawson, W. O. et al.(1989). A tobacco mosaic virus-hybrid expresses and loses an added gene. Virology 172, 285-292; French, R. et al.(1986) Science 231, 1294-1297; 및 Takamatsu, N. et al.(1990). Production of enkephalin in tobacco protoplasts using tobacco mosaic virus RNA vector. FEBS Lett 269, 73-76에 기술되어 있다.
형질전환 바이러스가 DNA 바이러스인 경우, 당해 기술분야의 당업자는 바이러스 자체에 적절한 변형을 줄 수 있다. 다른 예로, 바이러스는, 외래 DNA를 포함하는 목적하는 바이러스 벡터의 구축을 용이하게 하기 위해, 박테리아 플라스미드에 먼저 클로닝될 수 있다. 그런 다음, 바이러스는 플라스미드로부터 절단(excised)될 수 있다. 바이러스가 DNA 바이러스인 경우, 박테리아 복제 기원이 바이러스 DNA에 부착될 수 있으며, 그런 다음, 박테리아에 의해 복제된다. DNA의 전사 및 번역을 통해 코트(coat) 단백질이 생성될 것이며, 이 코트 단백질은 바이러스 DNA를 캡슐화할 것이다. 바이러스가 RNA 바이러스인 경우, 바이러스는 일반적으로 cDNA로서 클로닝되며 플라스미드에 삽입된다. 그런 다음, 플라스미드는 식물 유전자 구축물을 모두 제조하는 데 사용된다. 이후, RNA 바이러스는 플라스미드의 바이러스 서열로부터 전사된 다음, 바이러스 유전자가 번역되어, 바이러스 RNA를 캡슐화하는 코트 단백질이 생성된다.
본 발명의 구축물에 포함되는 것들과 같이 식물에서 비-바이러스성 외인성 핵산 서열의 도입 및 발현을 위한 식물 RNA 바이러스의 구축은 상기 참조문헌 및 미국 특허 5,316,931에 기술되어 있다.
일 구현예에서, 바이러스 핵산 유래의 천연 코트 단백질 코딩 서열, 비-천연(외래) 식물 바이러스 코트 단백질 코딩 서열, 및 비-천연 프로모터, 바람직하게는 비-천연 코트 단백질 코딩 서열의 서브게놈 프로모터의 결실을 포함하며, 식물 숙주에서의 발현을 가능하게 하며, 재조합 식물 바이러스 핵산의 포장, 및 재조합 식물 바이러스 핵산에 의한 숙주의 전신 감염을 가능하게 하는, 식물 바이러스 핵산의 삽입을 제공한다. 다른 예로, 천연 코트 단백질 코딩 서열은, 비-천연 단백질이 생성되도록, 비-천연 핵산 서열을 삽입함으로써 비-전사성(non-transcribable)으로 될 수 있다. 재조합 식물 바이러스 핵산 구축물은 부가적인 비-천연 서브게놈 프로모터를 하나 이상 포함할 수 있다. 각각의 비-천연 서브게놈 프로모터는 인접한 유전자 또는 핵산 서열을 식물 숙주에서 전사 또는 발현시키고, 서로간의 재조합이나 천연 서브게놈 프로모터와의 재조합은 불가능하게 할 수 있다. 또한, 재조합 식물 바이러스 핵산 구축물은 인핸서와 같은 cis-작용 조절 요소를 하나 이상 포함할 수 있으며, 이는 trans-작용 조절인자(regulator)에 결합하여 이로부터 하류에 위치해 있는 코딩 서열의 전사를 조절한다. 비-천연 핵산 서열은, 핵산 서열이 2개 이상 포함되는 경우, 천연 식물 바이러스 서브게놈 프로모터 또는 천연 식물 바이러스 서브게놈 프로모터 및 비-천연 식물 바이러스 서브게놈 프로모터에 인접하게 삽입될 수 있다. 비-천연 핵산 서열은 서브게놈 프로모터(들)의 조절 하에 숙주 식물에서 전사 또는 발현되어, 목적하는 산물이 생성된다.
제2 구현예에서, 재조합 식물 바이러스 핵산 구축물은, 천연 코트 단백질 코딩 서열이 비-천연 코트 단백질 코딩 서열에 인접해서 위치하는 대신, 비-천연 코트 단백질 서브게놈 프로모터 중 하나에 인접해서 위치하는 점을 제외하고는, 제1 구현예에서와 같이 제공된다.
제3 구현예에서, 재조합 식물 바이러스 핵산 구축물은, 천연 코트 단백질 유전자를 이의 서브게놈 프로모터, 및 바이러스 핵산 구축물에 삽입된 하나 이상의 비-천연 서브게놈 프로모터에 인접해서 위치시키도록 제공된다. 삽입된 비-천연 서브게놈 프로모터는 식물 숙주에서 인접한 유전자를 전사 또는 발현시킬 수 있으며, 서로간의 재조합 및 천연 서브게놈 프로모터와의 재조합은 불가능하게 할 수 있다. 비-천연 핵산 서열은, 상기 서열이 서브게놈 프로모터의 조절 하에 숙주 식물에서 전사 또는 발현되어 목적하는 산물을 생성하도록, 비-천연 서브게놈 식물 바이러스 프로모터에 인접해서 삽입될 수 있다.
제4 구현예에서, 재조합 식물 바이러스 핵산 구축물은, 천연 코트 단백질 코딩 서열이 비-천연 코트 단백질 코딩 서열에 의해 대체되는 점을 제외하고는, 제3 구현예에서와 같이 제공된다.
바이러스 벡터는, 전술한 재조합 식물 바이러스 핵산 구축물에 의해 코딩되는 발현된 코트 단백질에 의해 캡슐화되어, 재조합 식물 바이러스가 생성된다. 재조합 식물 바이러스 핵산 구축물 또는 재조합 식물 바이러스를 사용하여, 적절한 숙주 식물을 감염시킨다. 재조합 식물 바이러스 핵산 구축물은, 숙주에서의 복제, 상기 숙주에서의 전신 분포(systemic spread), 및 상기 숙주에서의 하나 이상의 외래 유전자(분리된 핵산)의 전사 또는 발현을 가능하게 하여, 목적하는 단백질을 생성할 수 있다.
또 다른 구현예에서, 형질전환 비히클은 RNA 의존성 RNA 중합효소(RdRp), 서브게놈 프로모터 및/또는 부분적인 또는 완전한 이동 단백질 서열을 포함하는, 바이러스 유래의 서열을 포함하며, 여기서, 상기 핵산 분절들은 모두 바이너리 벡터에 클로닝된다(Gleba et al, Current Opinion in Plant Biology 2004, 7:182-188). 이 외에도, 본 발명의 핵산 분자는 또한, 엽록체 게놈에 도입되어 엽록체를 발현시킬 수도 있다.
외인성 핵산 서열을 엽록체의 게놈에 도입하는 기술은 공지되어 있다. 이러한 기술은 하기의 절차를 포함한다. 먼저, 식물 세포를 화학적으로 처리하여, 세포 당 엽록체의 수를 약 1개로 줄인다. 그런 다음, 외인성 핵산을 바람직하게는 입자 충격을 통해 세포에 도입함으로써, 하나 이상의 외인성 핵산 분자를 엽록체에 도입한다. 본래 엽록체에 존재하는 효소에 의해 용이하게 수행되는 동종성 재조합을 통해 엽록체의 게놈에 병합시킬 수 있는 외인성 핵산은 당해 기술분야의 당업자에 의해 선별된다. 이를 위해, 외인성 핵산은 관심의 유전자 외에도, 엽록체 게놈 유래의 핵산 서열을 하나 이상 포함한다. 또한, 외인성 핵산은 선별 마커를 포함하며, 이러한 선별 마커는 엽록체 게놈의 복사체(copy)가 모두 또는 실질적으로 모두 외인성 핵산을 포함한다는 것을 당업자가 순차적인 선별 절차에 의해 확인할 수 있도록 작용한다. 이러한 기술과 관련된 추가적인 상세한 설명은 미국 특허 4,945,050 및 5,693,507에서 확인되며, 이들은 원용에 의해 본 명세서에 포함되어 있다. 따라서, 폴리펩타이드는 엽록체의 단백질 발현 시스템에 의해 생성되며 엽록체 내막에 병합되게 된다.
이용되는 방법과는 무관하에, 형질전환 후, 식물 번식(plant propagation)이 발생한다. 이 경우, 미소대량번식(micropropagation)은 초기 조직 배양; 및 조직 배양물 배가(multiplication)를 포함하도록 수행되어, 차후 사용될 세포가 충분한 수로 수득된다.
식물 세포의 배양 방법은 당해 기술분야에 잘 알려져 있다. 배양 조건(예를 들어, 배양 배지, 온도, 기체 환경, 및 생물반응기(bioreactor))은 사용되는 식물 세포 및 발현되는 단백질에 따라 조정되어 최적의 발현이 달성될 수 있다. 전형적으로, 배양은 임의의 통상적인 식물 배양 배지를 사용해 표준 식물 세포 배양 조건 하에 수행된다. 식물 배양 배지로는 수성 배지, 및 물이 첨가되어 식물 세포 배양용 수성 배지가 생성될 수 있는 건조 농축 배지를 둘 다 포함하는 것으로 생각될 것이다(예를 들어, 미국 특허 6,020,169 및 6,589,765 참조).
본 발명에 따라 사용될 수 있는 식물 배양 배지의 예로는 아래의 잘 공지된 배지를 포함하지만, 이들로 한정되는 것은 아니다: Anderson(Anderson, In Vitro 14:334, 1978; Anderson, Act. Hort., 112:13, 1980), Chee and Pool(Sci. Hort. 32:85, 1987), CLC/Ipomoea(CP)(Chee et al., J. Am. Soc. Hort. Sci. 117:663, 1992), Chu(N.sub.6)(Chu et al., Scientia Sinic. 18:659, 1975; Chu, Proc. Symp. Plant Tiss. Cult., Peking 43, 1978), DCR(Gupta and Durzan, Plant Cell Rep. 4:177, 1985), DKW/Juglans(Driver and Kuniyuki, HortScience 19:507, 1984; McGranahan et al., in: Bonga and Durzan, eds., Cell and Tissue Cluture in Forestry, Martinus Nijhoff, Dordrecht, 1987), De Greef and Jacobs(De Greef and Jacobs, Plant Sci. Lett. 17:55, 1979), Eriksson(ER)(Eriksson, Physiol. Plant. 18:976, 1965), Gamborg's B-5(Gamborg et al., Exp. Cell Res. 50:151, 1968), Gresshoff and Doy(DBM2)(Gresshoff and Doy, Z Pflanzenphysiol. 73:132, 1974), Heller(Heller, Ann. Sci. Nat. Bot. Biol. Veg. 11th Ser. 14:1, 1953), Hoagland's(Hoagland and Arnon, Circular 347, Calif. Agr. Exp. Stat., Berkeley, 1950), Kao and Michayluk(Kao and Michayluk, Planta 126:105, 1975), Linsmaier and Skoog(Linsmaier and Skoog, Physiol. Plant. 18:100, 1965), Litvay's(LM)(Litvay et al., Plant Cell Rep. 4:325, 1985), McCown's Woody Plant medium(Lloyd and McCown, Proc. Int. Plant Prop. Soc. 30:421, 1981), Murashige and Skoog 및 이의 다양한 잘 알려진 변형(Murashige and Skoog, Physiol. Plant. 15:473, 1962), Nitsch and Nitsch(Nitsch and Nitsch, Science 163:85, 1969), Quoirin and Lepoivre(Quoirin et al., C. R. Res. Sta. Cult. Fruit Mar., Gembloux 93, 1977), Schenk and Hildebrandt(Schenk and Hildebrandt, Can. J. Bot. 50:199, 1972), White's(White, The Cultivation of Animal and Plant Cells, Ronald Press, NY, 1963) 등. 이러한 식물 배양 배지 다수는 Sigma(St. Louis, Mo.) 및 기타 공급업체들로부터 예를 들어, 건조(분말형) 배지 및 건조 기본 염(basal salt) 혼합물로서 시중적으로 입수가능하다.
바람직하게는, 배양은, 배양물에서 생물학적 활성 펩타이드 및 폴리펩타이드의 생성에 효과적인 것으로 나타난 고수율의 1회용 식물 배양 장치를 사용해 수행된다(그 전체가 원용에 의해 본 명세서에 포함된 WO98/13469 및 WO08/135991 참조).
특정 구현예에 따르면, 전술한 재조합 단백질을 발현하는 식물 세포가 일단 수득되면, 이들은 동결건조되며, 그렇지만 신선한(비-동결건조된 세포) 상태로 사용되는 것도 본원에서 고려된다.
동결건조 전에, 세포를 세정하여, 성장 배지 중에 존재할 수 있는 임의의 세포 찌꺼기를 제거할 수 있다.
세포가 동결건조용으로 제조되기 때문에, 세포를 보존 배지에서 인큐베이션하여 세포의 대사 과정을 저하시키는 것이 종종 바람직하다.
전처리(필수적이지 않음)는 실온 또는 식물 세포가 전형적으로 배양되는 온도에서 수행될 수 있다. 전처리는 취급의 용이성을 위해 그리고 대부분의 식물 세포가 실온에서 꽤 안정하기 때문에 약 실온에서(20℃) 수행된다. 안정화제는 배지에 직접 첨가되며 전처리 과정 동안에 필요한 대로 보충될 수 있다.
전처리는 또한, 1종 이상의 삼투성제의 존재 하에 세포를 인큐베이션하는 단계를 또한 포함할 수 있다. 유용한 삼투성제의 예로는, 당류 및 당류 유도체와 같은 당, 프롤린 및 프롤린 유도체와 같은 아미노산 또는 이미노산 또는 이들 제제의 조합을 포함한다. 보다 유용한 당 및 당 유도체 중 일부는 프룩토스, 글루코스, 말토스, 만니톨, 소르비톨, 수크로스 및 트레할로스이다. 삼투성제는 후속한 동결건조용 세포를 제조하는 농도로 이용된다.
동결건조는 진공 증발에 의해 세포의 수분량을 줄이기 위한 것이다. 진공 증발은 세포를 감압의 환경에 두는 것을 포함한다. 바람직한 수분 제거 속도에 따라, 약 -30℃ 내지 -50℃의 온도에서 조작하는 감소된 주위 압력은 100 torr, 1 torr, 0.01 torr 또는 그 이하일 수 있다. 특정 구현예에 따르면, 세포는 -40℃로 동결시킨 다음 진공을 0.1 mbar의 압력에 밤새 적용함으로써 동결건조된다. 그런 다음, 세포를 -10℃로 가열하면, 얼음 내용물이 모두 승화 및 증발될 것이다. 감압 조건 하에, 수분 증발 속도는 세포 내 수분 중 최대 60% 내지 95%가 제거될 수 있도록 증가된다.
특정 구현예에 따르면, 동결건조는 수분 60%, 70%, 80% 또는 구체적으로는 90%, 91%, 92%, 93%, 94%, 95% 또는 98%를 세포로부터 제거한다. 특정 구현예에 따르면, 최종 수분 함량은 약 5-10%, 5-8% 또는 6-7%이다.
특정한 동결건조 프로토콜은 하기의 실시예 부문에 제공된다. 도 2에 도시된 바와 같이, 동결건조된 당근 세포 내 prGCD는 실온에서 수개월(약 6개월) 동안 실질적인 활성을 유지한다(25℃, 0시간째의 활성의 70% 이상).
본 발명자들은 처음에, 식물 세포에 포함된 경구 투여되는 GCD의 생체이용률 인자를 결정할 수 있었다. 하기의 실시예 부문의 실시예 10을 참조한다.
즉, 본 발명의 일 측면에 따라, 식물 세포에 포함된 경구 투여되는 GCD의 상대 생체이용률을 결정하는 방법을 제공한다.
본 방법은 하기(i), (ii)의 약리역학적 인자 또는 약동학적 인자를 측정하는 단계를 포함하며:
(i) 식물 세포에 포함된 경구 투여되는 GCD;
(ii) 정맥 투여되는 가용성 GCD,
여기서,(i) 및 (ii)의 비율은 식물 세포에 포함된 경구 투여되는 GCD의 상대 생체이용률을 나타낸다.
"생체이용률"은 전신 순환에 투입되는 약물의 속도 및 정도(extent)를 지칭하며, 이는 온전한 채로 흡수하며 활성을 유지하는 투여된 투약량의 비율(fraction) 또는 백분율로서 측정된다.
"상대 생체이용률(F)"은, 정맥내로 주입된 가용성 GCD와 비교 시, 식물 세포에 포함된 경구 GCD의 생체이용률(AUC로 측정됨)을 측정한다.
생체이용률은 약리역학적 인자 또는 약동학적 인자를 결정함으로써 측정될 수 있다. 특정 구현예에 따르면, 생체이용률은 혈청 또는 혈액 백혈구에서의 효소의 활성으로서 결정된다.
특정 구현예에 따르면, 생체이용률은 제형이 투여되는 래트 및 돼지와 같은 동물 개체에서 결정된다.
생체이용률 또는 상대 생체이용률은 또한 고셰병 환자와 같은 인간에서 결정될 수도 있다. 즉, 본 교시는, 이미글루세라제(imiglucerase)(Genzyme Inc.) 벨라글루세라제 알파(velaglucerase alfa)(Shire Inc.) 또는 탈리글루세라제 알파(taliglucerase alfa)(Protalix Ltd.)와 같은 주입형 GCD로 치료되는 인간에서, 식물 세포에 포함된 경구 투여되는 GCD의 최적 투약량을 개인별로 결정하는 데 이용될 수 있다.
따라서, 일 측면에 따라, 고셰병을 앓고 있는 개체를 치료하거나 또는 상기 개체를 위한 치료 투약 계획을 설계하는 방법을 제공하며, 본 방법은,
(a) 식물 세포에 포함된 경구 투여되는 GCD의 상대 생체이용률을 상기 개체에서 결정하는 단계(전술한 바와 같음); 및
(b) 상기 개체에 대한 경구 치료 투약 계획을 생체이용률(F)에 따라 설계하는 단계를 포함한다.
다른 예로 또는 부가적으로, 고셰병을 앓고 있는 개체를 위한 개인맞춤형 치료 방법을 제공하며, 본 방법은, 정맥 투여되는 가용성 GCD의 치료적 유효량을 상기 개체에서 결정하는 단계, 및 최대 16, 예를 들어, 4-16, 예를 들어, 10 배의 치료적 유효량에 기초하여 개체에서 경구 투여되는 GCD의 치료 투약 계획을 설계하는 단계를 포함한다.
이들 교시를 토대로, 본 발명자들은 식물 세포에 포함된 경구 투여되는 GCD의 상대 생체이용률을 밝혀내었다. 본 발명자들은 어려운 실험을 통해, 식물 세포에 포함된 경구 투여되는 GCD의 상대 생체이용률이 정맥내(I.V.) 주사에 의해 투여되는 GCD의 단위의 양보다 최대 16배, 예를 들어 4-16배 더 많다는 것을 확인하였다.
전술한 바와 같이, GCD를 식물 세포에 도입하고 이를 경구 투여하면, 서방성 유사 효과가 나타나므로, 이로써 효소는 순환계에 서서히(소화-의존적으로) 방출되어 혈중 효소의 농도를 본질적으로 일정한 수준으로 유지시킨다. (정맥내 경로에 비해) 고 빈도의 투여는 순환중인 효소의 농도를 높게 유지시킨다. 따라서, 식물 세포에서 효소의 투여, 고 빈도의 투여 또는 이들의 조합은 투여되는 효소의 총 투약량을(즉, 정맥 투여되는 투약량과 비교해) 감소시킬 수 있다.
따라서, 특정 구현예에 따르면, 경구 투여의 경우, 본원에서 정의되는 바와 같은 상대 생체이용률은 정맥 주사의 경우보다 1.5-16배, 2-16배, 3-16배, 4-16배, 4-12배, 6-15배, 6-12배, 8-12배, 9-11배 또는 구체적으로는 10배 더 높다.
정맥내 치료의 경우 투약량은 전형적으로 30 내지 60 단위/Kg/14 days이며, 상기 투약량은 10 내지 120 단위/Kg/14 days의 범위에서 치료 경과 동안 조정된다.
하기 표 1은 단위/Kg/14 days으로 표현되는 단위 투약량의 비-한정적인 예를 제공한다.
| 정맥내 | 경구 F=1-16 |
경구 F=4-16 |
경구 F=10 |
경구 F=8-12 |
| 30-60 | 30-960 | 120-960 | 300-600 | 240-720 |
| 10-120 | 10-1920 | 40-1920 | 100-1200 | 80-1440 |
본 발명의 일부 구현예에 따르면, 투여는 40-1920 단위/Kg의 투약량으로 수행된다.
본 발명의 일부 구현예에 따르면, 투여는 100-1200 단위/Kg의 투약량으로 수행된다.
본 발명의 일부 구현예에 따르면, 투여는 600-1200 단위/Kg의 투약량으로 수행된다.
본 발명의 일부 구현예에 따르면, 투여는 100-1200 단위/Kg의 투약량으로 수행된다.
본 발명의 일부 구현예에 따르면, 투여는 120-960 단위/Kg의 투약량으로 수행된다.
본 발명의 일부 구현예에 따르면, 투여는 300-600 단위/Kg의 투약량으로 수행된다.
본 발명의 일부 구현예에 따르면, 투여는 1-1000 단위/Kg의 투약량으로 수행된다.
본 발명의 일부 구현예에 따르면, 투여는 1-500 단위/Kg의 투약량으로 수행된다.
본 발명의 일부 구현예에 따르면, 투여는 1-400 단위/Kg의 투약량으로 수행된다.
본 발명의 일부 구현예에 따르면, 투여는 1-300 단위/Kg의 투약량으로 수행된다.
본 발명의 일부 구현예에 따르면, 투여는 1-200 단위/Kg의 투약량으로 수행된다.
본 발명의 일부 구현예에 따르면, 투여는 1-100 단위/Kg의 투약량으로 수행된다.
본 발명의 일부 구현예에 따르면, 투여는 1-80 단위/Kg의 투약량으로 수행된다.
본 발명의 일부 구현예에 따르면, 투여는 1-60 단위/Kg의 투약량으로 수행된다.
본 발명의 일부 구현예에 따르면, 투여는 1-50 단위/Kg의 투약량으로 수행된다.
본 발명의 일부 구현예에 따르면, 투여는 1-40 단위/Kg의 투약량으로 수행된다.
본 발명의 일부 구현예에 따르면, 투여는 1-30 단위/Kg의 투약량으로 수행된다.
본 발명의 일부 구현예에 따르면, 투여는 1-20 단위/Kg의 투약량으로 수행된다.
본 발명의 일부 구현예에 따르면, 투여는 1-10 단위/Kg의 투약량으로 수행된다.
본원에서, 용어 단위는 37℃에서 분 당 합성 기질인 파라-니트로페닐-베타-D-글루코피라노사이드(pNP-Glc) 1 μmol의 가수분해를 촉매하는 GCD의 양을 지칭한다.
투여 방식이 경구 방식이기 때문에, 투여는 상기 투약량을 14 이상으로 나눔으로써 매일 수행할 수 있다.
특정 구현예에 따르면, 투여는 매일, 즉 매일매일 수행된다.
추가적인 특정 구현예에 따르면, 투여는 1일 1회 수행된다.
추가적인 특정 구현예에 따르면, 투여는 1일 2회 수행된다.
추가적인 특정 구현예에 따르면, 투여는 1일 3회 매일 수행된다.
추가적인 특정 구현예에 따르면, 투여는 1일 4회 매일 수행된다.
특정 구현예에 따르면, 투여는 격일로 수행된다.
추가적인 특정 구현예에 따르면, 투여는 2일에 1회 수행된다.
추가적인 특정 구현예에 따르면, 투여는 2일에 2회 수행된다.
추가적인 특정 구현예에 따르면, 투여는 2일마다 1일 3회 수행된다.
추가적인 특정 구현예에 따르면, 투여는 2일마다 1일 4회 수행된다.
다른 예로, 투여는 1주에 2회(1일 1회, 2회, 3회 또는 4회) 수행된다.
일부 구현예에서, 각 투여 시 섭취되는 세포의 부피를 최소화하는 것이 바람직하며, 따라서 투약량은, 보다 높은 빈도로 투여되는 소 부피의 투약량으로 나누어진다. 예를 들어, 세포 내 GCD의 조성물은 500 ml와 같은 단일 부피로 제조될 수 있거나 또는 다른 예로, 세포 내 GCD의 동일한 투약량은 하루 동안 각각 2회, 3회, 4회 또는 5회로 투여되는 투약량의 각각 2회분, 3회분, 4회분 또는 5회분으로 제조될 수 있다. 따라서, 투약량의 부피는 치료 투약 계획 및 환자의 요구와 선호도의 개별 요건에 따라 다양할 수 있다.
기타 투여 방식들이 또한 고려된다. 2주 동안 실현되는 효소의 총량은 원하는 투약 계획에 따라 나누어진다.
치료는 임상 징후(clinical manifestation), 즉 질환의 중증도에 따라 조정될 수 있는 것으로 생각될 것이다. 당업자는 고셰병의 임상 징후(혈장에서의 효소 활성, 간 크기 등)를 확인하는 방법을 알 것이다.
또한, 식물 세포에서 GCD의 경구 투여의 경우, 개체의 위장관의 온전성(integrity)은 투약량의 결정 시 유의한 인자일 수 있는 것으로 이해될 것이다. 따라서, 본 발명의 투약량 및/또는 투약량 투약 계획 및/또는 조성은 식품 알레르기, GI 염증 장애 등과 같은 위장관의 건강 인자에 따라 조정될 수 있다. 예를 들어, 민감한 개체는, GI 민감성을 나타내지 않는 개체보다 적은 투약량으로 보다 빈번하게 투여받을 수 있거나 또는 대안적인 제형으로 투여받을 수 있다. 당업자는 위장 질환 또는 장애의 임상 징후(변비, 설사 등)를 확인하는 방법을 알 것이다.
특정 구현예에 따르면, 개체는 고셰병과 직접적으로 관련이 없는 GI 장애를 나타내지 않는 것으로 선택된다. GI 장애는 흡수에 영향을 미치는 위장관의 임의의 일부에 존재할 수 있다. 이러한 GI 장애의 예로는, 염증성 위장 장애, 기능성 위장 장애, 감염성(예를 들어, 바이러스, 박테리아, 기생충) 위장 장애, 위장암(1차 또는 2차) 또는 위장 장애들의 조합을 포함하지만, 이들로 한정되는 것은 아니다. 염증성 위장 장애의 예로는, 궤양성 대장염, 크론병 또는 이들의 조합을 포함하지만, 이들로 한정되는 것은 아니다. 기능성 위장 장애의 예로는, 과민성 장 질환을 포함하지만, 이들로 한정되는 것은 아니다. 감염성 위장 장애의 예로는, 바이러스 위장염, 아메바증, 기아디아(giardia), 촌충(tapeworm), 회충(ascaris) 등을 포함하지만, 이들로 한정되는 것은 아니다.
하기 표 2는 1일 1회 경구 투여 시 단위 투약량에 대한 비-한정적인 예를 제공한다(단위/Kg/day).
| 일일 정맥내 | 경구 F=1-16 |
경구 F=4-16 |
경구 F=10 |
경구 F=8-12 |
| 30-60/14 | 2-69 | 8-69 | 21-43 | 17-52 |
| 10-120/14 | 0.5-138 | 2-138 | 7-86 | 5-103 |
투여는 예컨대 매 식사시마다 수행될 수 있다. 투여는 격일로 수행될 수 있으며, 이때 선행 숫자는 2로 곱해진다.
본 교시는 또한, 식물 세포에 포함된 경구 GCD 및 주사에 의해 투여되는 정맥내 GCD(예컨대 전술한 것)를 사용해 순차적으로 또는 동시에 치료되는, 조합된 투여 방식을 고려하는 것으로 또한, 생각될 것이다.
재조합 GCD를 발현하는 세포(예를 들어, 동결건조된 식물 세포를 포함하는 분말)는 경구 영양보충제 형태 또는 약학 조성물로서 제형되는 단위 투약 형태에서 포장될 수 있다. 후자의 경우, 투약 형태는(복용량 제한(volume constraint)으로 인해) 주로 어린이에게 사용하기 위한 것으로 생각될 것이다.
따라서, 본 발명의 일 측면에 따라, 식물 세포에 포함된 1 내지 11,000 단위의 재조합 GCD를 포함하는 단위 투약 형태를 제공한다. 이 범위는, 체중이 2-75 Kg인 환자에서 1일 4회 투여되는 최소의 일일 투약량 내지 최대 일일 투약량(1일 1회)인 것으로 생각될 것이다.
일 구현예에 따르면, 단위 투약 형태는 식물 세포에 포함된 4 내지 11000 단위의 재조합 GCD를 포함한다.
일 구현예에 따르면, 단위 투약 형태는 식물 세포에 포함된 14 내지 6450 단위의 재조합 GCD를 포함한다.
일 구현예에 따르면, 단위 투약 형태는 식물 세포에 포함된 10 내지 175 단위의 재조합 GCD를 포함한다.
일 구현예에 따르면, 단위 투약 형태는 식물 세포에 포함된 32 내지 175 단위의 재조합 GCD를 포함한다.
일 구현예에 따르면, 단위 투약 형태는 식물 세포에 포함된 42 내지 225 단위의 재조합 GCD를 포함한다.
일 구현예에 따르면, 단위 투약 형태는 식물 세포에 포함된 34-3900 단위의 재조합 GCD를 포함한다.
일 구현예에 따르면, 단위 투약 형태는 식물 세포에 포함된 214 내지 11000 단위의 재조합 GCD를 포함한다.
일 구현예에 따르면, 단위 투약 형태는 식물 세포에 포함된 525 내지 6450 단위 재조합 GCD를 포함한다.
일 구현예에 따르면, 단위 투약 형태는 식물 세포에 포함된 375 내지 7725 단위의 재조합 GCD를 포함한다.
일 구현예에 따르면, 단위 투약 형태는 식물 세포에 포함된 600 내지 -5175 단위의 재조합 GCD를 포함한다.
일 구현예에 따르면, 단위 투약 형태는 식물 세포에 포함된 1575 내지 3325 단위의 재조합 GCD를 포함한다.
일 구현예에 따르면, 단위 투약 형태는 식물 세포에 포함된 1275 내지 3900 단위의 재조합 GCD를 포함한다.
본 발명의 일부 구현예에 따르면, 단위 투약 형태는 식물 세포에 포함된 1 내지 3000 단위의 재조합 GCD를 포함한다.
본 발명의 일부 구현예에 따르면, 단위 투약 형태는 식물 세포에 포함된 700 내지 1500 단위의 재조합 GCD를 포함한다.
본 발명의 일부 구현예에 따르면, 단위 투약 형태는 식물 세포에 포함된 1 내지 2000 단위의 재조합 GCD를 포함한다.
본 발명의 일부 구현예에 따르면, 단위 투약 형태는 식물 세포에 포함된 1 내지 1000 단위의 재조합 GCD를 포함한다.
본 발명의 일부 구현예에 따르면, 단위 투약 형태는 식물 세포에 포함된 1 내지 500 단위의 재조합 GCD를 포함한다.
본 발명의 일부 구현예에 따르면, 단위 투약 형태는 식물 세포에 포함된 1 내지 100 단위의 재조합 GCD를 포함한다.
이들 숫자는, 투여가 보다 저 빈도(예를 들어, 2-3일마다)로 수행되거나 또는 투여가 1일 2회 이상(예를 들어, 1일 2회, 3회 또는 4회) 수행되는 경우, 곱해지거나 또는 나누어질 수 있는 것으로 생각될 것이다.
세포는 고체, 액체 또는 분말로서 제형화될 수 있다. 일부 구현예에서, 세포는 재현탁화되는 동결건조된 세포이다.
따라서, 경구 투약 형태는 경구 영양보조 형태(예를 들어, 단백질이 37℃보다 높게 가열 및 압축을 포함하는 변성 조건에 노출되지 않는 한), 완전한 식사, 용해용 분말, 예를 들어 건강 음료, 용액, 레디-메이드(ready-made) 음료, 선택적으로 저 칼로리의 음료, 예컨대 쥬스, 밀크-쉐이크, 요구르트 음료, 스무디 또는 콩계 음료를 비롯한 소프트 드링크, 바(bar) 또는 임의의 종류의 식품에 분산되는 형태, 예컨대 제과 제품, 시리얼 바, 낙농제품 바, 스낵-식품, 아침용 시리얼, 뮤즐리, 캔디, 탭(tab), 쿠키, 비스킷, 크래커(예컨대 쌀 크래커), 초콜렛, 및 낙농 제품으로서 제공될 수 있다.
하기 표 3은 서로 다른 컨시스턴시(consistency)가 동결건조된 세포 10 gr에 도달한 것을 제공한다. 당업자는 하기의 수치를 효소의 바람직한 투약량 및 세포의 상응하는 양과 함께 적용하는 방법을 알 것이다.
| 동결건조된 세포: 액체의 부피(부(parts)) | 컨시스턴시 |
| 1: 0.5 | 단단한 도우(dough) |
| 1:1 | 부드러운 도우 |
| 1:5 | 퓌레(puree) |
| 1:7.5 | 요구르트 |
| 1:15 | 쉐이크 |
| 1:22.5 | 과일(불투명한) 쥬스 |
다른 예로, 본 발명의 세포는 적절한 담체 또는 부형제와 혼합되는 약학 조성물로 개체에 투여될 수 있다.
본원에서, "약학 조성물"은, 생리학적으로 적절한 담체 및 부형제와 같은 기타 화학적 구성분을 포함하는, GCD 발현 세포의 조제물을 지칭한다. 약학 조성물의 목적은 화합물의 유기체로의 투여를 촉진하는 것이다.
본원에서, 용어 "활성 물질"은 의도하는 생물학적 효과에 기여하는 GCD 발현 세포를 지칭한다.
이하, "생리학적으로 허용가능한 담체" 및 "약제학적으로 허용가능한 담체"는 상호교환적으로 사용될 수 있으며, 유기체에 유의한 자극을 유발하지 않으며 투여 화합물의 생물학적 활성 및 특성을 상실시키지 않는 담체 또는 희석제를 지칭한다. 보조제(adjuvant)는 이들 용어 하에 포함된다. 바람직하게는, 사용되는 담체는 비-면역원성 담체이며, 보다 바람직하게는 소화관-관련 림프 조직을 자극하지 않는다.
본원에서, 용어 "부형제"는 활성 물질의 투여를 추가로 촉진하기 위해 약학 조성물에 첨가되는 불활성 성분을 지칭한다. 부형제의 예로는, 칼슘 카르보네이트, 칼슘 포스페이트, 다양한 당 및 전분 유형, 셀룰로스 유도체, 젤라틴, 식물성 오일, 및 폴리에틸렌 글리콜을 포함하지만, 이들로 한정되는 것은 아니다.
약물의 제형 및 투여를 위한 기술은 "Remington's Pharmaceutical Sciences," Mack Publishing Co., Easton, PA의 최신판에 설명되어 있으며, 이는 원용에 의해 본 명세서에 포함된다.
따라서, 본 발명에 따라 사용하기 위한 약학 조성물은, 활성 물질을 약학적으로 사용될 수 있는 조제물로 처리하는 것을 촉진하는 부형제 및 보조제를 포함하는 1종 이상의 생리학적으로 허용가능한 담체를 사용하여 통상적인 방식으로 제형화될 수 있다.
경구 투여 시, 약학 조성물은 활성 화합물을 당해 기술분야에 잘 공지된 약제학적으로 허용가능한 담체와 조합함으로써 쉽게 제형화될 수 있다. 이러한 담체는 약학 조성물이 환자에 의한 경구 섭취용의 정제, 알약, 당제, 캡슐, 액체, 젤, 시럽, 슬러리, 현탁액 등으로서 제형화될 수 있게 한다. 경구 사용을 위한 약리학적 조제물은 필요하다면 적절한 보조제를 첨가한 후 고체 부형제를 사용하고, 선택적으로 결과적인 혼합물을 분쇄하고, 과립 혼합물을 처리하여 정제 또는 당제 코어(core)를 수득하여 제조될 수 있다. 적절한 부형제는 특히, 락토스, 수크로스, 만니톨 또는 소르비톨을 비롯한 당과 같은 충전제; 옥수수 전분, 밀 전분, 쌀 전분, 감자 전분, 젤라틴, 검 트라가칸트, 메틸 셀룰로스, 하이드록시프로필메틸-셀룰로스, 및 소듐 카르보메틸셀룰로스와 같은 셀룰로스 조제물; 및/또는 폴리비닐피롤리돈(PVP)과 같은 생리학적으로 허용가능한 폴리머이다. 바람직하다면, 붕괴제, 예컨대 가교된 폴리비닐 피롤리돈, 아가(agar) 또는 알긴산 또는 이의 염, 예컨대 소듐 알기네이트가 사용될 수 있다.
당제 코어는 적절한 코팅제와 함께 제공된다. 이를 위해, 농축된 당 용액이, 검 아라빅, 탈크, 폴리비닐 피롤리돈, 카르보폴 젤, 폴리에틸렌 글리콜, 티타늄 다이옥사이드, 래커(lacquer) 용액, 및 적절한 유기 용매 또는 용매 혼합물을 선택적으로 포함할 수 있도록 사용될 수 있다. 활성 화합물 투약량의 서로 다른 조합을 확인하거나 또는 특징화하기 위해 정제 또는 당제 코팅제에 색소 또는 안료가 첨가될 수 있다.
경구로 사용될 수 있는 약학 조성물은 젤라틴으로 제조된 푸쉬-핏(push-fit) 캡슐, 뿐만 아니라 젤라틴 및 글리세롤 또는 소르비톨과 같은 가소화제로 제조된 연질의, 밀봉 캡슐을 포함한다. 푸쉬-핏 캡슐은 활성 물질을 락토스와 같은 충전제, 전분과 같은 결합제, 탈크 또는 마그네슘 스테아레이트와 같은 윤활제, 및 선택적으로 안정화제와 혼합하여 포함할 수 있다. 연질 캡슐에서, 활성 물질은 지방 오일, 액체 파라핀 또는 액체 폴리에틸렌 글리콜과 같은 적절한 액체에 용해 또는 현탁될 수 있다. 또한, 안정화제가 첨가될 수 있다.
투약량 형태는 칼슘, 마그네슘, 철, 아연, 인, 비타민 D 및 비타민 K 중 1종 이상과 같은 첨가제를 포함할 수 있다. 적절한 일일 함량은 0.1 mg 내지 3.6 g 칼슘, 바람직하게는 320 mg 내지 530 mg이다. 일반적으로, 본 발명의 영양분 제형 또는 의약 내 비타민 및 미네랄의 일일 투약량은 건강 당국에 의해 권고되는 투약량의 25 중량% 내지 100 중량%이다. 식이성 섬유는 또한 본 발명의 조성물의 구성분일 수도 있다. 보조제의 추가적인 구성분은 건강상 이점, 특히 신체적 성능을 개선시키는 이점을 가지는 것으로 알려진 임의의 생물활성 화합물 또는 추출물을 포함할 수 있다.
일반적으로 단위 투약 형태는 항산화제를 추가로 포함할 수 있으며, 예시적인 구현예는 상기에 제공되어 있다. 또 다른 구현예에서, 항산화제는 약제학적으로 허용가능한 항산화제이다. 또 다른 구현예에서, 항산화제는 비타민 E, 슈퍼옥사이드 디스뮤타제(SOD), 오메가-3, 및 베타-카로텐으로 이루어진 군으로부터 선택된다.
또 다른 구현예에서, 단위 투약 형태는 생물학적 활성 단백질 또는 펩타이드의 인핸서를 추가로 포함한다. 또 다른 구현예에서, 단위 투약 형태는 생물학적 활성 단백질 또는 펩타이드의 보조인자를 추가로 포함한다.
또 다른 구현예에서, 본 발명의 단위 투약 형태는 약제학적-등급의 계면활성제를 추가로 포함한다. 계면활성제는 당해 기술분야에 잘 공지되어 있는데, 즉, Handbook of Pharmaceutical Excipients(eds. Raymond C Rowe, Paul J Sheskey, and Sian C Owen, copyright Pharmaceutical Press, 2005)에 기술되어 있다. 또 다른 구현예에서, 계면활성제는 당해 기술분야에 공지된 임의의 기타 계면활성제이다.
또 다른 구현예에서, 본 발명의 단위 투약 형태는 약제학적-등급의 유화제 또는 에멀게이터(emulgator)(유연제(emollient))를 추가로 포함한다. 유화제 및 에멀게이터는 당해 기술분야에 잘 공지되어 있는데, 즉, Handbook of Pharmaceutical Excipients(ibid)에 기술되어 있다. 유화제 및 에멀게이터의 비-한정적인 예는 유멀긴(eumulgin), Eumulgin B1 PH, Eumulgin B2 PH, 수소화된 피마자유 세토스테아릴 알코올, 및 세틸 알코올이다. 또 다른 구현예에서, 유화제 또는 에멀게이터는 당해 기술분야에 공지된 임의의 기타 유화제 또는 에멀게이터이다.
또 다른 구현예에서, 본 발명의 단위 투약 형태는 약제학적-등급의 안정화제를 추가로 포함한다. 안정화제는 당해 기술분야에 잘 공지되어 있는데, 즉, Handbook of Pharmaceutical Excipients(ibid)에 기술되어 있다. 또 다른 구현예에서, 안정화제는 당해 기술분야에 공지된 임의의 기타 안정화제이다.
또 다른 구현예에서, 본 발명의 단위 투약 형태는 아르기닌, 라이신, 아스파테이트, 글루타메이트, 및 히스티딘으로 이루어진 군으로부터 선택되는 아미노산을 추가로 포함한다. 또 다른 구현예에서, 아르기닌, 라이신, 아스파테이트, 글루타메이트 및 히스티딘의 유사체 및 변형된 형태는 용어 "아르기닌," "라이신," "아스파테이트", "글루타메이트" 및 "히스티딘"에 각각 포함된다. 또 다른 구현예에서, 아미노산은 리보뉴클레아제 또는 기타 활성 분자의 부가적인 보호를 제공한다. 또 다른 구현예에서, 아미노산은 생물학적 활성 단백질 또는 펩타이드와 표적 세포와의 상호작용을 촉진한다. 또 다른 구현예에서, 아미노산은 단위 투약 형태의 오일 구성분에 포함된다.
또 다른 구현예에서, 본 발명의 단위 투약 형태는 1종 이상의 약제학적으로 허용가능한 부형제를 포함할 수 있으며, 여기에 매트릭스 담체 단위 투약 형태가 혼합된다. 또 다른 구현예에서, 부형제는 1종 이상의 부가적인 다당류를 포함한다. 또 다른 구현예에서, 부형제는 1종 이상의 왁스를 포함한다. 또 다른 구현예에서, 부형제는 단위 투약 형태에 원하는 맛을 제공한다. 또 다른 구현예에서, 부형제는 약물 컨시스턴시, 및 젤 캡슐 또는 경성 젤라틴 캡슐과 같은 최종적인 투약량 형태에 영향을 미친다.
부형제의 비-한정적인 예로는, 소포제(다이메티콘(dimethicone), 시메티콘(simethicone)); 항균 보존제(벤즈알코늄 클로라이드, 벤젤토늄(benzelthonium) 클로라이드, 부틸파라벤, 세틸피리디늄 클로라이드, 클로로부탄올, 클로로크레졸, 크레졸, 에틸파라벤, 메틸파라벤, 메틸파라벤 소듐, 페놀, 페닐에틸 알코올, 페닐머큐릭 아세테이트, 페닐머큐릭 니트레이트, 포타슘 벤조에이트, 포타슘 소르베이트, 프로필파라벤, 프로필파라벤 소듐, 소듐 벤조에이트, 소듐 데하이드로아세테이트, 소듐 프로피오네이트, 소르브산, 티메로살(thimerosal), 타이몰(thymol)); 킬레이트화제(에데테이트 다이소듐, 에틸렌다이아민테트라아세트산 및 염, 에데트산); 코팅제(소듐 카르복시메틸-셀룰로스, 셀룰로스 아세테이트, 셀룰로스 아세테이트 프탈레이트, 에틸셀룰로스, 젤라틴, 약제학적 글레이즈(pharmaceutical glaze), 하이드록시프로필 셀룰로스, 하이드록시프로필 메틸셀룰로스, 하이드록시프로필 메틸셀룰로스 프탈레이트, 메타크릴산 코폴리머, 메틸셀룰로스, 폴리에틸렌 글리콜, 폴리비닐 아세테이트 프탈레이트, 셸락(shellac), 수크로스, 티타늄 다이옥사이드, 카나우바 왁스, 미세결정질 왁스, 제인(zein)); 착색제(카라멜, 레드, 옐로우, 블랙 또는 블렌드, 산화 제2철(ferric oxide)); 착화제(complexing agent)(에틸렌다이아민테트라아세트산 및 염(EDTA), 에데트산, 겐티스산 에탄올마이드(ethanolmaide), 옥시퀴놀린 설페이트); 건조제(칼슘 클로라이드, 칼슘 설페이트, 규소 다이옥사이드); 유화제 및/또는 가용화제(아카시아, 콜레스테롤, 다이에탄올아민(부가물(adjunct)), 글리세릴 모노스테아레이트, 라놀린 알코올, 레시틴, 모노-글리세라이드 및 다이-글리세라이드, 모노에탄올아민(부가물), 올레산(부가물), 올레일 알코올(안정화제), 폴록사머, 폴리옥시에틸렌 50 스테아레이트, 폴리옥실 35 피마자유, 폴리옥실 40 수소화된 피마자유, 폴리옥실 10 올레일 에테르, 폴리옥실 20 세토스테아릴 에테르, 폴리옥실 40 스테아레이트, 폴리소르베이트 20, 폴리소르베이트 40, 폴리소르베이트 60, 폴리소르베이트 80, 프로필렌 글리콜 다이아세테이트, 프로필렌 글리콜 모노스테아레이트, 소듐 라우릴 설페이트, 소듐 스테아레이트, 소르비탄 모노라우레이트, 소르비탄 모노올레에이트, 소르비탄 모노팔미테이트, 소르비탄 모노스테아레이트, 스테아르산, 트롤아민, 유화제 왁스); 풍미제 및 향제(flavors and perfume)(아네톨(anethole), 벤즈알데하이드, 에틸 바닐린, 멘톨, 메틸 살리실레이트, 모노소듐 글루타메이트, 오렌지 플라워 오일, 페퍼민트, 페퍼민트 오일, 페퍼민트 스프리트(sprit), 로즈 오일, 강한 장미 워터(stronger rose water), 타이몰, 톨루 발삼 팅크(tolu balsam tincture), 바닐라, 바닐라 팅크, 바닐린); 습윤제(글리세린, 헥실렌 글리콜, 프로필렌 글리콜, 소르비톨); 폴리머(예를 들어, 셀룰로스 아세테이트, 알킬 셀룰로스, 하이드록시알킬셀룰로스, 아크릴 폴리머 및 코폴리머); 현탁화제 및/또는 점도-증가제(아카시아, 아가, 알긴산, 알루미늄 모노스테아레이트, 벤토나이트, 정제된 벤토나이트, 마그마 벤토나이트, 카르보머 934p, 카르복시메틸셀룰로스 칼슘, 카르복시메틸셀룰로스 소듐, 카르복시메틸셀룰로스 소듐 12, 카라기닌, 미세결정질 및 카르복시메틸셀룰로스 소듐 셀룰로스, 덱스트린, 젤라틴, 구아 검, 하이드록시에틸 셀룰로스, 하이드록시프로필 셀룰로스, 하이드록시프로필 메틸셀룰로스, 마그네슘 알루미늄 실리케이트, 메틸셀룰로스, 펙틴, 폴리에틸렌 옥사이드, 폴리비닐 알코올, 포비돈, 프로필렌 글리콜 알기네이트, 규소 다이옥사이드, 콜로이드 규소 다이옥사이드, 소듐 알기네이트, 트라가칸트, 잔탄검); 감미제(아스파르탐(aspartame), 덱스트레이트, 덱스트로스, 부형제 덱스트로스, 프룩토스, 만니톨, 사카린, 칼슘 사카린, 소듐 사카린, 소르비톨, 용액 소르비톨, 수크로스, 압축성(compressible) 당, 가루 설탕(confectioner's sugar), 시럽)을 포함하지만, 이들로 한정되는 것은 아니며; 이 목록은 배제적이지 않으며, 대신 본 발명의 경구 투약량 단위 투약 형태에 사용될 수 있는 부형제 및 특정 부형제의 부류를 단순히 대표하는 것이다.
보존제, 킬레이트화제, 발포제(effervescing agent), 천연 감미제 또는 인공 감미제, 풍미제, 착색제, 맛 가림제, 산성제(acidulant), 유화제, 증점제, 현탁화제, 분산제 또는 습윤제, 항산화제 등으로부터 선택되는 것들 중 임의의 것을 포함하는 통상적인 첨가제가 본 발명의 조성물에 포함될 수 있다. 풍미제는 용량 투약 계획에 부응하는 것을 보조하기 위해 본 발명의 조성물에 첨가될 수 있다. 전형적인 풍미제로는, 오렌지, 레몬, 민트, 베리, 초콜렛, 바닐라, 멜론 및 파인애플의 천연 에센스 또는 합성 에센스, 오일 및/또는 추출물을 포함하지만, 이들로 한정되는 것은 아니다. 일부 구현예에서, 조성물은 파인애플 향이 난다.
본원에서, 용어 "약"은 ±10%를 지칭한다.
용어 "~을 포함하다", "~을 포함하는", "~을 수반하다", "~을 수반하는", "~을 가지는" 및 이들의 활용형태는 "~을 포함하지만, 이들로 한정되는 것은 아닌"을 의미한다.
용어 "~으로 이루어진"은 "~을 포함하며 이들로 한정되는"을 의미한다.
용어 "본질적으로 ~으로 이루어진"은, 조성물, 방법 또는 구조가 부가적인 성분, 단계 및/또는 파트(part)를 포함할 수 있지만, 상기 부가적인 성분, 단계 및/또는 파트가 청구의 조성물, 방법 또는 구조의 기본적이며 새로운 특징들을 실질적으로 변경시키지 않아야 함을 의미한다.
본원에서, 단수형("a", "an" 및 "the")은 문맥상 달리 명시하지 않는 한, 복수형을 포함한다. 예를 들어, 용어 "화합물" 또는 "1종 이상의 화합물"은 이의 혼합물을 비롯하여 복수의 화합물을 포함할 수 있다.
본 출원 전체에서, 본 발명의 다양한 구현예들은 범위 포맷(range format)으로 존재할 수 있다. 범위 포맷의 설명은 단지 편의상 그리고 간략화를 위한 것이며 발명의 범위에 변경할 수 없는 제한으로서 생각해서는 안됨을 이해해야 한다. 즉, 범위에 관한 설명은 모든 가능한 하위범위 뿐만 아니라 그 범위 내의 개별 수치를 구체적으로 개시하는 것으로 생각해야 한다. 예를 들어, 1 내지 6과 같은 범위에 관한 설명은 1 내지 3, 1 내지 4, 1 내지 5, 2 내지 4, 2 내지 6, 3 내지 6 등과 같은 구체적으로 개시된 하위범위, 뿐만 아니라 1, 2, 3, 4, 5 및 6과 같이 해당 범위 내의 개별 수치를 가지는 것으로 생각해야 한다. 이는 그 범위의 폭과는 무관하게 적용된다.
수치 범위가 본원에 명시되는 경우, 명시된 범위 내에서 언급되는 임의의 수치(분수 또는 정수)를 포함하는 것으로 의미된다. 첫 번째 명시 수치와 두 번째 명시 수치 "사이에 이르는/범위" 및 첫 번째 명시 수치 "내지" 두 번째 명시 수치 "에 이르는/범위"는 본원에서 상호교환적으로 사용되며, 첫 번째 수치와 두 번째 수치 및 그 사이의 모든 분수 및 정수를 포함하는 것으로 의미된다.
본원에서, 용어 "방법"은 주어진 과제를 달성하기 위한 방식, 수단, 기술 및 절차를 지칭하며, 화학적, 약리학적, 생물학적, 생화학적 및 의학적 분야의 종사자에게 공지되어 있거나 또는 이들에 의해 공지된 방식, 수단, 기술 및 절차로 용이하게 개발되는 것들을 포함하지만, 이들로 한정되는 것은 아니다.
본원에서, 용어 "~을 치료하는"은 병태의 진행을 없애거나, 실질적으로 저해하거나, 늦추거나 또는 역행시키는 것, 병태의 임상적이거나 또는 심미학적인 증상을 실질적으로 완화하는 것 또는 병태의 임상적이거나 또는 심미학적인 증상의 출현을 실질적으로 예방하는 것을 포함한다.
명확성을 위해 개별 구현예의 맥락에서 기술되는 본 발명의 소정의 특징들은 단일 구현예와 조합하여 제공될 수도 있는 것으로 생각된다. 반대로, 명확성을 위해 단일 구현예의 맥락에서 기술되는 본 발명의 다양한 특징들은 개별적으로 또는 임의의 적절한 하위조합으로 또는 본 발명의 임의의 다른 기술된 구현예에서 적절하게 제공될 수도 있다. 다양한 구현예들의 맥락에서 기술되는 소정의 특징은, 구현예가 이들 요소 없이 작동이 불가능하지 않는 한, 이들 구현예의 필수적인 특징으로 간주되지 않아야 한다.
전술되어 있으며 청구항 부문에서 청구된 바와 같은 본 발명의 다양한 구현예 및 측면은 하기 실시예에서 실험적인 지지를 받는다.
실시예
이하, 하기의 실시예를 참조하며, 이는 상기의 설명과 함께 본 발명의 일부 구현예를 비-한정적인 방식으로 예시한다.
일반적으로, 본원에서 사용되는 명명법 및 본 발명에 이용되는 실험 절차는 분자적, 생화학적, 미생물학적 및 재조합 DNA 기술을 포함한다. 이러한 기술은 문헌에서 완전히 설명되어 있다. 예를 들어, "Molecular Cloning: A laboratory Manual" Sambrook et al.,(1989); "Current Protocols in Molecular Biology" Volumes I-III Ausubel, R. M., ed.(1994); Ausubel et al., "Current Protocols in Molecular Biology", John Wiley and Sons, Baltimore, Maryland(1989); Perbal, "A Practical Guide to Molecular Cloning", John Wiley & Sons, New York(1988); Watson et al., "Recombinant DNA", Scientific American Books, New York; Birren et al.(eds) "Genome Analysis: A Laboratory Manual Series", Vols. 1-4, Cold Spring Harbor Laboratory Press, New York(1998); 미국 특허 4,666,828; 4,683,202; 4,801,531; 5,192,659 및 5,272,057에 기술된 바와 같은 방법론; "Cell Biology: A Laboratory Handbook", Volumes I-III Cellis, J. E., ed.(1994); "Current Protocols in Immunology" Volumes I-III Coligan J. E., ed.(1994); Stites et al.(eds), "Basic and Clinical Immunology"(8th Edition), Appleton & Lange, Norwalk, CT(1994); Mishell and Shiigi(eds), "Selected Methods in Cellular Immunology", W. H. Freeman and Co., New York(1980); 이용가능한 면역분석법은 특허 및 과학적 문헌에 광범위하게 기술되어 있으며, 예를 들어, 미국 특허 3,791,932; 3,839,153; 3,850,752; 3,850,578; 3,853,987; 3,867,517; 3,879,262; 3,901,654; 3,935,074; 3,984,533; 3,996,345; 4,034,074; 4,098,876; 4,879,219; 5,011,771 및 5,281,521을 참조하며; "Oligonucleotide Synthesis" Gait, M. J., ed.(1984); "Nucleic Acid Hybridization" Hames, B. D., and Higgins S. J., eds.(1985); "Transcription and Translation" Hames, B. D., and Higgins S. J., Eds.(1984); "Animal Cell Culture" Freshney, R. I., ed.(1986); "Immobilized Cells and Enzymes" IRL Press,(1986); "A Practical Guide to Molecular Cloning" Perbal, B.,(1984) and "Methods in Enzymology" Vol. 1-317, Academic Press; "PCR Protocols: A Guide To Methods And Applications", Academic Press, San Diego, CA(1990); Marshak et al., "Strategies for Protein Purification and Characterization - A Laboratory Course Manual" CSHL Press(1996)를 참조하며; 이들 모두는 완전히 본원에 기술된 것처럼 원용에 의해 본 명세서에 포함되어 있다. 다른 일반적인 참조문헌들도 본 문서 전체에 제공된다. 참조문헌의 절차들은 당해 기술분야에 잘 공지되어 있는 것으로 여겨지며, 독자들의 편의를 위해 제공된다. 참조문헌에 포함된 정보는 모두 원용에 의해 본 명세서에 포함된다.
실시예
1
일회
정맥 주사 또는 매일의 경구 투여를 통한 효소 투여 후,
글루코실세라마이드
농도의 혈장 농도
현재의 고셰병 치료는 2주마다 정맥내(i.v.) 일회 주사하는 것을 토대로 한다. 도 1은 이러한 투여 방식이 2주 동안 GCD 기질(글루코실세라마이드)의 축적에 미치는 영향을 이론적으로 가정한 것을 도시한 것이다. 투여 후, 기질의 수준은 기저 수준까지 떨어진다. 이론으로 결부시키고자 하는 것은 아니지만, 경구 투여는 기질을 이의 기저 수준으로 유지시키는 매일 치료를 최적으로 허용한다. 일일 투약량으로 제공되는 경우, 효소가 세포로부터 GIT로 방출된 다음 펄스-유사 투여 방식과는 대조적으로 연속적인 방식으로 순환계로 흡수되어, 표적 기관에 도달하는 효소가 모두 이의 기질에 노출되는 방식에 의해, 보다 적은 단위가 치료 효과를 달성할 수 있는 것으로 사료된다.
실시예
2
동결건조된 식물 세포는 실온에서 수개월 동안 발현되는 식물 재조합
GCD(prGCD
)의 실질적인 활성을 유지한다.
당근 세포에서의 prGCD의 발현은 그 전체가 원용에 의해 본 명세서에 포함된 WO2008/132743에 상세히 기술되어 있다.
세포는 -40℃로 냉동시킴으로써 동결건조시켰다. 진공을 0.1 mbar의 압력에서 밤새 적용하였다. 세포를 -10℃로 72시간 동안 가열한 다음, 20℃로 가열하였다. 동결건조 과정의 종료 시, 수분량은 6.7%였다. 그런 다음, 세포를 작은 분취물(small aliquot)로 칭량하고 이를 실온, 4℃ 또는 25℃에서 24주 동안 습도 조절 하에 유지시켰다. 매 시점에서, 세포를 건조기로부터 수합하고, 10 x W/V 추출 완충제(0.125% 소듐 타우로콜레이트; 60 mM 포스페이트 시트레이트 완충제 pH 6.0; 0.15% Triton-X100; pH 5.5)에서 재구성한 다음, TissueLyser(Retsch MM400; Haan, Germany)를 사용해 단백질을 추출하였다. 그 후, 인공 기질인 p-니트로페닐-β-D-글루코피라노사이드(PNP)(카탈로그 번호 N7006, Sigma-aldrich)를 사용한 열량 측정법(calorimetric method)에 의해 추출물을 GCD 활성에 대해 시험하였다.
결과
prGCD를 발현하는 동결건조된 당근 세포를 건조기(-20℃, 4℃ 또는 25℃)에서 유지시켰다. 세포로부터 재조합 단백질을 추출한 다음, 이의 활성을 시험하였다. 도 2에 도시한 바와 같이, 동결건조된 당근 세포 내의 prGCD는 실온, 4℃ 또는 -20℃에서 수개월 동안 실질적인 활성을 유지한다.
실시예
3
prGCD
는 시험관 내 모델에서 상피세포 장벽을 통과할 수 있다.
prGCD가 상피세포 장벽을 통과하는 능력을 시험관 내 Caco2 모델(상피 흡수의 경우 도 3a에 기술되어 있음)에서 시험하였다. GCD의 통과세포외배출은 전술한 바와 같이 3가지 독립적인 단일층을 사용해 삼중으로 수행하였다(Tzaban et al., 2009, J Cell Biol. 185(4):673-84). 간단히 말하자면, 세포는 10 mM Hepes, pH 7.4를 포함하는 Hank's 완충제 염 용액(HBSS)으로 세정한 다음, pH 6.0에서 단식 상태의 장액(intestinal fluid)을 모방하는 HBSS와 함께 10분간 인큐베이션하였다. prGCD를 37℃에서 연속적인 흡수를 위해 챔버 정단면에 첨가하였다. 정해진 시점이 지난 후 챔버의 기저측면에 있는 배지를 수집하고, 전술한 바와 같이 열량 측정법을 이용해 prGCD의 활성을 시험하였다.
겉보기 투과 계수(Papp) 계산식은 하기와 같다:
결과
prGCD를 6.8 단위/ml의 속도로, 모방된 장 배지(intestinal medium)에 있는 챔버 정단면에 첨가하였다. 37℃에서 일정한 시간이 지난 후 기저측면 배지에서 통과세포외배출을 측정하였다. 기저측면에서의 활성 증가는, prGCD가 1.39*10-7 cm/sec의 Papp로 상피세포 장벽을 통과할 수 있음을 의미한다(도 3b).
실시예
4
위장을 통과하는 당근 세포의 시간표
그룹 당 3마리의 래트에게 prGCD를 발현하는 당근 세포를 위관 영양법으로 급식하였다. 급식 후 1시간 내지 24시간 동안 서로 다른 시점에서 각 그룹을 안락사시켰다. GIT의 내용물을 수집하고, 총 내용물의 중량 및 prGCD의 활성을 시험하였다. 혈장 및 간도 이들의 GCD 활성에 대해 시험하였다.
결과
도 4a 내지 4b는, GCD를 발현하는 당근 세포를 위관 영양 급식한 후 위장의 총 내용물을 그램(g)으로 도시한 것이다. 래트의 위장은 4시간 내지 6시간 후 이의 내용물 중 절반을 소실한다. 도 4c는 위장 및 결장에서 GIT의 비움(emptying)과 prGCD의 활성 간의 상관관계를 도시한 것이다. prGCD의 활성은 4시간 후 위장에서 저하되어 있으며, 동일한 활성이 4시간 내지 8시간째에 결장에서도 검출된다. 따라서, 도 4d는 GCD 발현 세포의 급식 후 혈장 및 간에서의 외인성 GCD의 활성을 도시한 것이다. GCD 활성의 피크는 혈장 및 간에서 급식 후 각각 6시간 및 8시간째에 도달한다. 도 4c 내지 4d는 체내에서 GIT를 통과하는 당근 세포의 이동과 GCD 활성 간의 상관관계를 도시한 것이다. GCD는 간에서 분석한 바와 같이, GI 관을 따라 표적 기관에서 활성이다. 도면은, 처음의 당근 세포의 서방성 특징이 일회 정맥 주사로부터 나타나는 외삽된(extrapolated) 투약량보다 낮은 투약량으로 경구 투여할 수 있게 한다는 것을 나타낸다.
실시예
5
prGCD
의 활성은
네이키드(naked
) 효소에
비해 보다 광범위한
pH
범위 하에
당근 세포에서 유지된다.
상기의 관찰들을 토대로, 본 발명자들은 위액의 극한 환경에 대한 prGCD의 내성을 분석하였다. 당근 세포의 정제된 prGCD 및 prGCD를 하기 1 내지 3으로 처리하였다:
1. 모방 위액(소듐 클로라이드 70 mM, 포타슘 클로라이드 50 mM, D-글루코스 2.2 mM, 펩신 0.14 mM, 락트산 1.1 mM, 티오시아네이트 1.5 mM 및 카테킨(catechin) 0.14 mM)
2. pH 구배(1.2-6.0)
3. 37℃에서 1분, 10분, 30분 동안 격렬히 흔듦.
그런 다음, 세포를 추출하고,(전술한 바와 같이) 래빗에서 수득한 항-prGCD 항체를 이용하는 웨스턴 블롯 분석에 의해 이들의 prGCD 존재를 평가하였다.
결과
도 5는 내성을 부여함에 있어서 식물 세포가 우세함(superiority)을 도시한 것이다. 분명한 것은, prGCD를 과발현하는 당근 세포가 공복의 위장에 투여될 수 있지만, 가벼운 식사 후에 투여하는 것이 유리할 수 있다.
실시예
6
prGCD
는 췌장 효소를 포함하는 모방 장액 배지에 노출되는 경우,
세포로부터 방출된다.
prGCD를 발현하는 당근 세포에 pH 4의 모방 위액(전술한 바와 같음)을 10분간 처리하고, 37℃에서 흔든 다음, 배지를 제거하고, 단식 또는 식사 후에, 세포를 모방 장액 배지로 처리하였다(정확한 성분은 하기 표 4에 제시됨). 세포를 30분, 60분 또는 120분간 격렬하게 흔들었다. 그런 다음, 세포를 배지로부터 분리하고, 배지와 세포 모두에 대해 GCD 활성을 시험하였다.
모방 장액은 하기 표 4에 열거한 성분들을 포함하였다:
| 모방 장액 | 단식 상태 | 급식 상태 |
| 모노베이직 포타슘 포스페이트 | 0.049 M | 0.049 M |
| 소듐 하이드록사이드 | 0.0154 M | 0.0154 M |
| KCl | 0.2 M | 0.2 M |
| 소듐 타우로콜레이트 | 3 mM | 1.5 mM |
| 레시틴 | 1.5 mM | 1.5 mM |
| 판크레아틴(효소) | 70 mg | 1 gr |
| pH | 6.0 | 6.8 |
결과
도 6은, GCD가 급식 상태의 장액과 단식 상태의 장액 둘 다에 노출된 후 배지로부터 방출되지만, 가벼운 식사를 한 경우에 상응하는 판크레아틴-불량 배지에서는 분해로부터 보호된다는 것을 보여준다.
실시예
7
prGCD
는
래트에서
급식 후 표적 기관에 도달한다.
실험 절차는 하기 표 5에 나타나 있다. 급식 투약량은 각각의 래트에서 개별적으로 측정한 소모된 GCD 단위의 총 양의 평균값이다.
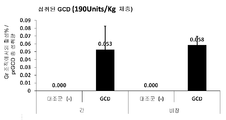
| 그룹 | N | 화합물 | GCD 투약량 | 투여 | 종료 시점 |
| 1 | 6 | 동결건조된 당근(-) 세포 |
0 | 6시간 이내에 2회 급식 | 2번째 급식 후 2시간째 |
| 2 | 6 | 동결건조된 당근(prGCD) 세포 |
190 단위/Kg 체중 | 6시간 이내에 2회 급식 | 2번째 급식 후 2시간째 |
| 3 | 6 | prGCD | 170 단위/Kg 체중 | 주사 | 주사 후 1시간째 |
결과
도 7a는, 급식 후 2시간째에 비장 및 간과 같은 표적 기관에서 활성 prGCD가 검출될 수 있음을 보여준다.
경구 투여되는 prGCD와 정맥 주사되는 prGCD를 비교하기 위해, 소모되거나 또는 투여된 총 GCD로부터 표적 기관에 도달한 활성 prGCD의 백분율을 급식 후 2시간째 또는 주사 후 1시간째에 측정하였다. 그 결과를 하기 도 7b 내지 7c 및 표 6에 나타낸다. 결과는 활성 prGCD 급식량(도 7b) 또는 활성 prGCD 주사량(도 7c)에 대해 정상화(normalization)하였다.
| 비장 | 주사 | 급식 |
| 제공량 | 170 단위/Kg 체중 | 190 단위/Kg 체중 |
| 비장에서 측정 | 0.6% | 0.06% |
| 간에서 측정 | 0.3% | 0.05% |
이들 결과는, 급식의 경우 주사로 투여할 때 필요한 것보다 10배 이상 더 많은 GCD가 필요함을 나타낸다.
실시예
8
설치류에서 경구 투여되는
prGCD
의 약리학적 연구
래트(n=21)에게 6시간 간격을 두고 당근 세포를 2회 급식하였다. 급식 후 0시간 내지 12시간 동안 다양한 시점에서 전혈(200 ul)을 샘플링하였다. 동일한 시점에서 서로 다른 래트로부터 수득한 3개의 샘플을 풀링(pooling)하였다. 적혈구는 얼음 상에서 염 완충제 용액(150 mM NH4Cl, 10 mM NH4HCO3, 0.1 mM EDTA) 1.2 ml을 사용해 10분간 파쇄하였다. 백혈구는 염 완충제 용액으로 2회 세정한 다음, GCD 활성 완충제(0.125% 소듐 타우로콜레이트, 60 mM 포스페이트 시트레이트, 0.15% Triton-X100) 150 ㎕를 사용해, 1개의 라지 비드(large bead)를 이용해 TissueLyzer II(Qiagen)에서 10분간, 이어서, 13,500 rpm에서 10분간 원심분리하여, 추출한다. 백혈구 추출물은, 4-메틸엄벨리페릴 β-D-글루코피라노사이드(4-MU, Sigma, M3633) 분석법(ref: Urban DJ et al, Comb Chem High Throughput Screen. 2008 Dec;11(10):817-24)에 의해 GCD 활성을 시험하고, 브래드포드 분석법(Bradford assay)에 의해 시험한 총 가용성 단백질에 대해 정상화하였다(도 8, 패널 A). 그런 다음, 래트를 안락사시키고, 이들의 간을 적출한 다음, GCD 활성을 네이브 래트와 비교해 분석하였다(n=3, 도 8b).
실시예
9
돼지에서
경구 투여되는
prGCD
의 약리학 연구
돼지(n=3)에게 당근 세포를 1회 급식하였다. 급식 후 지시한 바와 같이 0시간 내지 9시간 동안 다양한 시점에서 혈장 샘플(2 ml)을 수집하였다. 그런 다음, 혈장에 대해 4-메틸엄벨리페릴 β-D-글루코피라노사이드(4-MU, Sigma, M3633) 분석법(ref: Urban DJ et al, Comb Chem High Throughput Screen. 2008 Dec;11(10):817-24)에 의해 GCD 활성을 분석하고, 브래드포드 분석법에 의해 시험한 총 가용성 단백질에 대해 정상화하였다(도 9a). 그런 다음, 돼지를 안락사시키고, 이들의 간을 적출한 다음, GCD 활성을 네이브 돼지와 비교해 분석하였다(n=5, 도 9b).
실시예
10
세포에서 필요한
GCD
투약량의 계산:
경구 투약량(U)은 정맥내 투약량(Ziv)으로부터 계산하고, 당근 세포에서의 prGCD 발현율(X)과 생체이용률 측정값(F)에 대해 조정한다. 경구 투약량은 g 세포/kg 체중으로 표시한다.
1. 정맥내 투여의 AUC(예측성(prophetic)) 수득 방법
래트 또는 돼지의 꼬리 정맥에 1, 2.5, 10, 15, 30, 60, 100 및 120 단위/Kg 체중의 양으로 정맥 주사한다. 주사 후 예를 들어, 1분, 2분, 5분, 10분, 30분, 60분, 90분, 120분 및 240분과 같이 다양한 시점에서 전혈(200 ul)을 샘플링한다. 동일한 시점에서 서로 다른 래트로부터 수득한 3개의 샘플을 풀링한다. 적혈구는 얼음 상에서 염 완충제 용액(150 mM NH4Cl, 10 mM NH4HCO3, 0.1 mM EDTA) 1.2 ml을 사용해 10분간 파쇄하였다. 백혈구는 염 완충제 용액으로 2회 세정한 다음, GCD 활성 완충제(0.125% 소듐 타우로콜레이트, 60 mM 포스페이트 시트레이트, 0.15% Triton-X100) 150 ㎕를 사용해, 1개의 라지 비드를 이용해 TissueLyzer II(Qiagen)에서 10분간, 이어서, 13,500 rpm에서 10분간 원심분리하여, 추출한다. 백혈구 추출물은, 4-메틸엄벨리페릴 β-D-글루코피라노사이드(4-MU, Sigma, M3633) 분석법(ref: Urban DJ et al, Comb Chem High Throughput Screen. 2008 Dec;11(10):817-24)에 의해 GCD 활성을 시험한다. 총 가용성 단백질은 추출을 정상화하여 분석하고, 브래드포드 분석법에 의해 시험하였다.
2. 경구 투여의 AUC(예측성)를 수득하는 방법
래트 또는 돼지에게 0.2, 0.5, 0.75, 1, 1.5, 2, 3, 4, 5 gr GCD 발현 당근 세포/Kg 체중으로 1시간 동안 1회 급식한다. 주사 후 예를 들어, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 14, 16, 18, 24시간과 같이 다양한 시점에서 전혈(200 ul)을 샘플링한다. 동일한 시점에서 서로 다른 동물로부터 수득한 3개의 샘플을 풀링한다. 그런 다음, 혈액을 정맥 주사에서와 동일하게 처리하고 시험한다.
3. 각각의 투약량의 정맥 투여 및 경구 투여로부터 수득한 데이터를 GCD 활성 대 시간으로서 플롯(plot)하고, 곡선 아래 면적(Area Under the Curve; AUC)을 계산한다.
4. 생체이용률 계산
생체이용률은 전신 순환으로 투입되는 약물의 속도 및 정도로서 정의되는데, 즉, 투여되는 투약량의 분획 또는 백분율은(정맥내 투여와 비교해) 온전하게 흡수한다(참조문헌: Clinical Pharmacokintetics Concepts and Applications. Malcolm Rowland and Thomas N. Tozer third edition Lippincott Williams and Wilkins, 1995]).
경구 투여되는 GCD의 생체이용률은 정맥 투여되는 GCD의 흡수율에 대해 계산한다:
약리역학적 연구로부터 수득되는 곡선 아래 면적
5. 경구 투여에 필요한 단위의 계산
Ziv- 정맥 투여 시 필요한 단위:(단위/Kg 체중/day)
Z경구 - 경구 투여 시 필요한 단위(단위/Kg 체중 /day)
F=생체이용률
6. 필요한 GCD 단위 경구 투약량에 도달하는 데 요구되는 세포의 질량 계산:
U= 계산된 경구 투약량(gr 세포/Kg 체중)
· 1일 2회 이상 제공될 필요가 있는 경우, U는 파트별로 더 나누어질 수 있다(U/2 - 1일 2회의 경우, U/4 - 1일 4회의 경우 등).
· 투약량은 예를 들어, 고농도의 초기 투약량을 제공한 다음 장기간의 보다 낮은 투약량들을 제공함으로써 개별적으로 조정될 수 있다.
· 경구 경로를 통한 효소의 흡수와 매일의 소량 투여의 조합(고농도로 격주 투여 대비)은 서방성 투약 계획의 기전에 보다 근접하다. 즉, 이러한 투약 계획은 잠재적으로는, 치료 효과를 달성하는 데 있어 보다 적은 양의 효소를 필요로 할 것이다.
· 환자별 개인맞춤형 의약 - 각각의 환자는 경구로 투여되는 경우 투약 계획을 용이하게 조정할 수 있다.
실시예
11
임상적 맥락에서 세포에
GCD
의 투여:
세포 내 식물 재조합 GCD의 경구 투여의 안전성을 알아보고, 고셰병 환자에서 세포 내 GCD의 경구 투여 후 식물 재조합 GCD의 약리역학적 파라미터를 평가하기 위해, 세포 내 GCD의 경구 투약량을 임상적 설정에서 고셰병 환자에게 제공한다.
연구 유형 : 오픈 라벨, 단일 그룹 지정 안전성 연구(Open label, Single group Assignment Safety study).
본 연구에 참여시키기 위한 포함 기준 은 18세 이상의 고셰병을 진단받은 이력이 있는 남성 및 여성으로서, 대조군 범위에서의 백혈구 GCD 활성의 평균의 30% 이하이며(3 nMol/mg/hour의 백혈구 GCD 활성과 같거나 낮음), 최초 스크리닝 방문하기 전 적어도 6개월 동안 금연을 하고, 체질량지수(BMI)가 19-25 kg/m2(종점 포함)이며,(병력, 활력 징후 및 신체 검사에 따른) 전체적인 건강 상태가 양호하며, 스크리닝 시점에서 B형 간염 또는 C형 간염에 대한 혈청 검사에서 음성 반응이 나타났으며, 서면상의 피험자 동의서(written informed consent form)를 제공할 권한을 가진 개체를 포함한다. 가임 연령의 여성 또는 가임 연령의 여성 파트너가 있는 남성은 한 가지 차단 피임법(남성 또는 여성용 콘돔)과, 호르몬 제품 및 자궁내 피임 기구로부터 선택되는 또 다른 피임법을 포함하는 2가지 피임법의 이용에 동의할 것이다.
본 연구에 배제하기 위한 배제 기준 은, 최근 12개월 이내에 효소 대체 요법(ERT) 또는 기질 대체 요법(SRT)을 제공받음, 고셰병 이외의 임의의 공존이환(co-morbidity),(GI 설문지에 따른) 위장 질환 또는 임상적으로 유의하게 여겨지는 위장-관련 징후(symptomatology)의 존재, 약물에 대한 알레르기 반응 또는 식품 알레르기와 같이 임상적으로 유의한 알레르기의 이력, 알코올 남용 또는 약물 남용의 이력, 최근 3개월 이내의 수혈 경험, 연구 전 6개월 이내에 혈액 또는 혈장 유도체를 제공받음, 스크리닝 또는 세포 내 GCD의 투약 3개월 이내에 임의의 시험용 약물을 사용한 경험, 양호한 의사소통의 불능(즉, 언어 문제, 불량한 정신 발달 또는 손상된 뇌기능), 동의서에 사인하는 것에 비협조적이거나 및/또는 사인할 의향이 없음, 임산부 또는 수유중인 여성 또는 연구 기간 동안 임신할 계획이 있는 여성, 약물 투여 7일 이내에 약물, 차, 식품 보조제 또는 변비나 설사 보조제(파라세타몰(paracetamol) 제외)를 사용한 경험, 및 연구자의 판단 하에 연구의 필요 조건을 준수하는 데 있어서 방해가 될 것으로 생각되는 임의의 의학적, 정서적, 행동적 또는 정신적 병태의 존재를 포함한다.
세포 중 GCD 의 투약 : 적절한 비히클 내에서의 재현탁된 GCD 발현 당근 세포 250 ml이라는 단일 투약량을 연구 참가자들에게 경구 투여한다. 초기 투약 후, 안전성 및 약리역학저 파라미터를 개체의 혈액 샘플에서 평가한다. 그런 다음, 초기 투약 후 평가 결과에 따라 3일간 연속해서 매일 투약을 반복한다. 재현탁된, 동결건조된 GCD 발현 당근 세포를 풍미, 예를 들어, 파인애플향이 첨가된 비히클에 제공하여 개체의 순응도를 돕는다.
안전성 평가 : 자발적으로 보고되거나 또는 신체 검사나 임상적인 실험실 검사를 통해 확인되는 부작용은 세포 중 GCD의 투약 후 최대 3일간 모니터링한다. 부작용의 모니터링은 최초 투약 후 또는 나중의 투약 후 수행될 수 있다.
약리역학적 연구 : 백혈구 GCD 활성은, GCD 정맥 투여에 대해 기술된 분석법에 따라, 투여 시작부터 투여후 30시간까지의 기간 동안 선정된 시간 간격(예를 들어, 10분, 20분, 30분, 45분, 1시간, 2시간, 3시간, 4시간 또는 그 이상)에서 채취한 개체의 혈액 샘플에서 측정한다(본원의 실시예 10 참조). 약리역학적 모니터링은 최초 투약 후 또는 나중의 투약 후 수행될 수 있다. 평가되는 약리역학적 파라미터로는, 혈청 샘플 내 GCD 농도에 대한 곡선 아래 면적인 "AUC"(실시예 10 참조)(AUC0-30 hours), 투여시부터 투여후 30시간까지 혈청 샘플 내 GCD의 최대 농도(Cmax), 및 세포 중 prGCD의 투여시부터 투여후 30시간까지 세포 중 식물 재조합 GCD의 최대 농도에 도달하는 시간(Tmax)을 포함한다.
안전성 평가의 결과, 및 개체로부터 수집한 약리역학적 데이터에 따라, 후속한 조사를 위해 서로 다른 투약량 또는 투약량 투약 계획이 선별될 수 있다.
본 발명이 이의 구체적인 구현예와 함께 기술되긴 하였지만, 당해 기술분야의 당업자는 여러 가지 변경, 변형 및 변화를 알게 될 것임이 명백하다. 이에, 이러한 변경, 변형 및 변화는 모두 첨부된 청구항의 사상 및 광범위한 범주에 속하도록 포함되는 것으로 의도된다.
본 명세서에서 언급되는 모든 공개, 특허 및 특허 출원은, 각각의 개별적인 공개, 특허 또는 특허 출원이 원용에 의해 본 명세서에 구체적으로 그리고 개별적으로 포함되는 것과 동일한 범위로, 그 전체가 원용에 의해 본 명세서에 포함되어 있다. 또한, 본 출원에서 임의의 참조문헌에 대한 언급이나 확인은, 이러한 참조문헌이 본 발명에 대한 선행 기술로서 이용가능하다는 허락으로서 간주해서는 안 된다. 섹션 헤딩(section heading)이 사용되는 한, 이들은 본질적으로 한정적인 것으로 간주되어서는 안 된다.
Claims (46)
- 고셰병(Gaucher's disease) 치료가 필요한 개체에서 고셰병을 치료하는 방법으로서,
식물 세포에 포함된 재조합 글루코세레브로시다제(GCD)를 치료적 유효량으로 개체에게 경구 투여하는 단계를 포함하고, 상기 GCD의 치료적 유효량은 1 내지 1920 단위/Kg/14 days에 상응하며, 이에 의해 고셰병을 치료하는, 방법. - 고셰병 치료가 필요한 개체에서 고셰병을 치료하는 방법으로서,
식물 세포에 포함된 재조합 글루코세레브로시다제(GCD)를 치료적 유효량으로 개체에게 경구 투여하는 단계를 포함하고, 상기 GCD의 단위의 양은 정맥내(I.V.) 주사에 의해 투여된 GCD의 단위의 양보다 최대 16배 더 많고, 이에 의해 개체에서 고셰병을 치료하는, 방법. - 고셰병 치료가 필요한 개체에서 고셰병을 치료하는 방법으로서,
식물 세포에 포함된 재조합 글루코세레브로시다제(GCD)를 치료적 유효량으로 개체에게 경구 투여하는 단계를 포함하고, 상기 투여하는 단계는 위장의 pH(stomach pH)가 2보다 높도록 식전(preprandially)이나 또는 가벼운 식사 후에 수행되고, 이에 의해 고셰병을 치료하는, 방법. - 제1항, 제2항 또는 제3항에 있어서,
상기 투여하는 단계는 매일 수행되는, 방법. - 제1항 또는 제2항에 있어서,
상기 투여하는 단계는 식전에 수행되는, 방법. - 제1항 또는 제2항에 있어서,
상기 투여하는 단계는 상기 개체의 위장의 pH가 2보다 높도록 가벼운 식사 후에 수행되는, 방법. - 제3항에 있어서,
상기 투여하는 단계는 1 내지 1920 단위/Kg의 투약량으로 수행되는, 방법. - 제1항, 제2항 또는 제7항에 있어서,
상기 투여하는 단계는 100 내지 1200 단위/Kg의 투약량으로 수행되는, 방법. - 제8항에 있어서,
상기 투여하는 단계는 100 내지 1200 단위/Kg의 투약량으로 수행되는, 방법. - 제8항에 있어서,
상기 투여하는 단계는 120 내지 960 단위/Kg의 투약량으로 수행되는, 방법. - 제8항에 있어서,
상기 투여하는 단계는 300 내지 600 단위/Kg의 투약량으로 수행되는, 방법. - 제7항, 제8항, 제9항, 제10항 또는 제11항에 있어서,
상기 투여하는 단계는 매일 수행되는, 방법. - 식물 세포에 포함된 1 내지 6450 단위의 재조합 GCD를 포함하는 단위 투약 형태.
- 제13항에 있어서,
식물 세포에 포함된 525 내지 6450 단위의 재조합 GCD를 포함하는, 단위 투약 형태. - 제13항에 있어서,
식물 세포에 포함된 375 내지 7725 단위의 재조합 GCD를 포함하는, 단위 투약 형태. - 제13항에 있어서,
식물 세포에 포함된 1575 내지 3325 단위의 재조합 GCD를 포함하는, 단위 투약 형태. - 제13항에 있어서,
식물 세포에 포함된 1275 내지 3900 단위의 재조합 GCD를 포함하는, 단위 투약 형태. - 제13항에 있어서,
식물 세포에 포함된 600 내지 5175 단위의 재조합 GCD를 포함하는, 단위 투약 형태. - 제13항 내지 제18항에 있어서,
분말로서 제형화되는, 단위 투약 형태. - 제13항 내지 제18항에 있어서,
액체로서 제형화되는, 단위 투약 형태. - 제13항 내지 제18항에 있어서,
고체로서 제형화되는, 단위 투약 형태. - 제13항 내지 제18항에 있어서,
정제, 캡슐, 당제(dragee), 트로키제(lozenge), 경구 현탁액, 경구 분산액 및 시럽으로서 제형화되는, 단위 투약 형태. - 제13항 내지 제18항에 있어서,
완전한 식사(complete meal), 용해용 분말, 용액 또는 식품에 분산된 형태로서 제형화되는, 단위 투약 형태. - 제23항에 있어서,
상기 식품이 제과 제품, 시리얼 바(cereal bar), 낙농제품 바(dairy bar), 스낵-식품, 수프, 아침용 시리얼, 뮤즐리(muesli), 캔디 및 낙농 제품으로 이루어진 군으로부터 선택되는, 단위 투약 형태. - 제1항, 제2항, 제3항 또는 제13항에 있어서,
상기 세포가 당근 세포를 포함하는, 방법 또는 단위 투약 형태. - 제1항, 제2항, 제3항 또는 제13항에 있어서,
상기 세포가 담배 세포를 포함하는, 방법 또는 단위 투약 형태. - 제25항에 있어서,
상기 담배 세포가 BY-2 세포를 포함하는, 방법 또는 단위 투약 형태. - 제1항, 제2항, 제3항 또는 제13항에 있어서,
상기 세포가 분리된 세포인, 방법 또는 단위 투약 형태. - 제1항, 제2항, 제3항 또는 제4항에 있어서,
상기 투여하는 단계는 1일 1회 수행되는, 방법. - 제1항, 제2항, 제3항 또는 제4항에 있어서,
상기 투여하는 단계는 1일 2회 수행되는, 방법. - 제1항, 제2항, 제3항 또는 제4항에 있어서,
상기 투여하는 단계는 1일 4회 수행되는, 방법. - 제1항, 제2항, 제3항 또는 제13항에 있어서,
상기 식물 세포가 동결건조된 식물 세포를 포함하는, 방법 또는 단위 투약 형태. - 제1항, 제2항, 제3항 또는 제13항에 있어서,
상기 글루코세레브로시다제가 인간 글루코세레브로시다제인, 방법 또는 단위 투약 형태. - 제1항, 제2항, 제3항 또는 제13항에 있어서,
상기 글루코세레브로시다제가 서열 번호: 4 또는 13으로 표시되는, 방법 또는 단위 투약 형태. - 제1항, 제2항, 제3항 또는 제13항에 있어서,
상기 인간 글루코세레브로시다제 단백질이 이의 N 말단에서 소포체 신호 펩타이드에 연결되어 있는, 방법 또는 단위 투약 형태. - 제1항, 제2항, 제3항 또는 제13항에 있어서,
상기 소포체 신호 펩타이드가 서열 번호: 1 또는 12로 표시되는, 방법 또는 단위 투약 형태. - 제1항, 제2항, 제3항, 제13항, 제25항, 제35항 또는 제36항에 있어서,
상기 인간 글루코세레브로시다제 단백질이 이의 C 말단에서 액포(vacuolar) 신호 펩타이드에 연결되어 있는, 방법 또는 단위 투약 형태. - 제1항, 제2항, 제3항, 제13항, 제25항, 제35항 또는 제36항에 있어서,
상기 액포 신호 펩타이드가 서열 번호: 2로 표시되는, 방법 또는 단위 투약 형태. - 제1항, 제2항, 제3항 또는 제13항에 있어서,
상기 글루코세레브로시다제는, 대식세포에 대한 친화성 및 흡수성(uptake)이, 포유류 세포에서 생성되는 재조합 인간 글루코세레브로시다제 단백질의 상응하는 친화성 및 흡수성에 비해 증가되어 있으며, 글루코세레브로시다제 촉매 활성을 가지는 것인, 방법 또는 단위 투약 형태. - 제1항, 제2항, 제3항 또는 제13항에 있어서,
상기 식물 세포의 상기 글루코세레브로시다제의 주요 글리칸 구조는 연결성 분석(linkage analysis)으로 측정 시, 하나 이상의 자일로스(xylose) 잔기 및 하나 이상의 노출형(exposed) 만노스 잔기를 포함하는, 방법 또는 단위 투약 형태. - 식물 세포에 포함된 경구 투여되는 GCD의 상대 생체이용률을 결정하는 방법으로서,
(i) 식물 세포에 포함된 경구 투여되는 GCD;
(ii) 정맥 투여되는 가용성 GCD의 약리역학적(pharmacokinetic) 인자 또는 약동학적(pharmacodynamic) 인자를 측정하는 단계를 포함하고,
(i) 및 (ii)의 비율은 식물 세포에 포함된 경구 투여되는 GCD의 상대 생체이용률을 나타내는, 방법. - 제41항에 있어서,
동물에서 수행되는, 방법. - 제41항에 있어서,
인간에서 수행되는, 방법. - 제43항에 있어서,
상기 인간이 고셰병을 앓고 있는, 방법. - 고셰병을 앓고 있는 개체를 치료하는 방법으로서,
(a) 식물 세포에 포함된 경구 투여되는 GCD의 상대 생체이용률을 개체에서 결정하는 단계; 및
(b) 상기 생체이용률(F)에 따라 상기 개체에 대한 경구 치료 투약 계획을 설계하는 단계를 포함하는, 방법. - 고셰병을 앓고 있는 개체의 개인맞춤형 치료의 방법으로서, 개체에서 정맥 투여되는 가용성 GCD의 치료적 유효량을 결정하는 단계, 및 최대 16배의 상기 치료적 유효량에 기초하여 개체에서 경구 투여되는 GCD에 대한 치료 투약 계획을 설계하는 단계를 포함하는, 방법.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201261600651P | 2012-02-19 | 2012-02-19 | |
| US61/600,651 | 2012-02-19 | ||
| US201261736059P | 2012-12-12 | 2012-12-12 | |
| US61/736,059 | 2012-12-12 | ||
| PCT/IB2013/051346 WO2013121405A1 (en) | 2012-02-19 | 2013-02-19 | Oral unit dosage forms and uses of same for the treatment of gaucher disease |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20140130495A true KR20140130495A (ko) | 2014-11-10 |
Family
ID=48040380
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR20147026336A KR20140130495A (ko) | 2012-02-19 | 2013-02-19 | 고셰병 치료용 경구형 단위 투약 형태 및 이의 용도 |
Country Status (11)
| Country | Link |
|---|---|
| US (1) | US20150023929A1 (ko) |
| EP (1) | EP2814838A1 (ko) |
| KR (1) | KR20140130495A (ko) |
| CN (1) | CN104245725A (ko) |
| AU (1) | AU2013220005A1 (ko) |
| BR (1) | BR112014021067A2 (ko) |
| CA (1) | CA2863829A1 (ko) |
| IL (1) | IL234093A0 (ko) |
| IN (1) | IN2014MN01806A (ko) |
| RU (1) | RU2014137404A (ko) |
| WO (1) | WO2013121405A1 (ko) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20170101633A1 (en) | 2014-02-10 | 2017-04-13 | Protalix Ltd. | Method of maintaining disease stability in a subject having gaucher's disease |
| JPWO2015156397A1 (ja) * | 2014-04-10 | 2017-04-13 | コンパニー ゼネラール デ エタブリッスマン ミシュラン | タイヤ用トレッド及びタイヤ |
| AU2019276882A1 (en) * | 2018-05-27 | 2021-01-14 | Bioasis Technolgies Inc. | Treatment of gaucher disease |
Family Cites Families (41)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| NL154600B (nl) | 1971-02-10 | 1977-09-15 | Organon Nv | Werkwijze voor het aantonen en bepalen van specifiek bindende eiwitten en hun corresponderende bindbare stoffen. |
| NL154598B (nl) | 1970-11-10 | 1977-09-15 | Organon Nv | Werkwijze voor het aantonen en bepalen van laagmoleculire verbindingen en van eiwitten die deze verbindingen specifiek kunnen binden, alsmede testverpakking. |
| NL154599B (nl) | 1970-12-28 | 1977-09-15 | Organon Nv | Werkwijze voor het aantonen en bepalen van specifiek bindende eiwitten en hun corresponderende bindbare stoffen, alsmede testverpakking. |
| US3901654A (en) | 1971-06-21 | 1975-08-26 | Biological Developments | Receptor assays of biologically active compounds employing biologically specific receptors |
| US3853987A (en) | 1971-09-01 | 1974-12-10 | W Dreyer | Immunological reagent and radioimmuno assay |
| US3867517A (en) | 1971-12-21 | 1975-02-18 | Abbott Lab | Direct radioimmunoassay for antigens and their antibodies |
| NL171930C (nl) | 1972-05-11 | 1983-06-01 | Akzo Nv | Werkwijze voor het aantonen en bepalen van haptenen, alsmede testverpakkingen. |
| US3850578A (en) | 1973-03-12 | 1974-11-26 | H Mcconnell | Process for assaying for biologically active molecules |
| US3935074A (en) | 1973-12-17 | 1976-01-27 | Syva Company | Antibody steric hindrance immunoassay with two antibodies |
| US3996345A (en) | 1974-08-12 | 1976-12-07 | Syva Company | Fluorescence quenching with immunological pairs in immunoassays |
| US4034074A (en) | 1974-09-19 | 1977-07-05 | The Board Of Trustees Of Leland Stanford Junior University | Universal reagent 2-site immunoradiometric assay using labelled anti (IgG) |
| US3984533A (en) | 1975-11-13 | 1976-10-05 | General Electric Company | Electrophoretic method of detecting antigen-antibody reaction |
| US4098876A (en) | 1976-10-26 | 1978-07-04 | Corning Glass Works | Reverse sandwich immunoassay |
| US4879219A (en) | 1980-09-19 | 1989-11-07 | General Hospital Corporation | Immunoassay utilizing monoclonal high affinity IgM antibodies |
| CA1192510A (en) | 1981-05-27 | 1985-08-27 | Lawrence E. Pelcher | Rna plant virus vector or portion thereof, a method of construction thereof, and a method of producing a gene derived product therefrom |
| US4588693A (en) | 1983-02-28 | 1986-05-13 | Research And Development Institute, Inc. At Montana State University | Development of plant roots |
| JPS6054684A (ja) | 1983-09-05 | 1985-03-29 | Teijin Ltd | 新規dνa及びハイブリツドdνa |
| US5011771A (en) | 1984-04-12 | 1991-04-30 | The General Hospital Corporation | Multiepitopic immunometric assay |
| US4666828A (en) | 1984-08-15 | 1987-05-19 | The General Hospital Corporation | Test for Huntington's disease |
| US4945050A (en) | 1984-11-13 | 1990-07-31 | Cornell Research Foundation, Inc. | Method for transporting substances into living cells and tissues and apparatus therefor |
| CA1288073C (en) | 1985-03-07 | 1991-08-27 | Paul G. Ahlquist | Rna transformation vector |
| US4683202A (en) | 1985-03-28 | 1987-07-28 | Cetus Corporation | Process for amplifying nucleic acid sequences |
| US4801531A (en) | 1985-04-17 | 1989-01-31 | Biotechnology Research Partners, Ltd. | Apo AI/CIII genomic polymorphisms predictive of atherosclerosis |
| GB8608850D0 (en) | 1986-04-11 | 1986-05-14 | Diatech Ltd | Packaging system |
| JPS6314693A (ja) | 1986-07-04 | 1988-01-21 | Sumitomo Chem Co Ltd | 植物ウイルスrnaベクタ− |
| DE3850683T2 (de) | 1987-02-09 | 1994-10-27 | Lubrizol Genetics Inc | Hybrides RNS-Virus. |
| US5316931A (en) | 1988-02-26 | 1994-05-31 | Biosource Genetics Corp. | Plant viral vectors having heterologous subgenomic promoters for systemic expression of foreign genes |
| US5693507A (en) | 1988-09-26 | 1997-12-02 | Auburn University | Genetic engineering of plant chloroplasts |
| US5272057A (en) | 1988-10-14 | 1993-12-21 | Georgetown University | Method of detecting a predisposition to cancer by the use of restriction fragment length polymorphism of the gene for human poly (ADP-ribose) polymerase |
| US5302523A (en) | 1989-06-21 | 1994-04-12 | Zeneca Limited | Transformation of plant cells |
| US5192659A (en) | 1989-08-25 | 1993-03-09 | Genetype Ag | Intron sequence analysis method for detection of adjacent and remote locus alleles as haplotypes |
| UA48104C2 (uk) | 1991-10-04 | 2002-08-15 | Новартіс Аг | Фрагмент днк, який містить послідовність,що кодує інсектицидний протеїн, оптимізовану для кукурудзи,фрагмент днк, який забезпечує направлену бажану для серцевини стебла експресію зв'язаного з нею структурного гена в рослині, фрагмент днк, який забезпечує специфічну для пилку експресію зв`язаного з нею структурного гена в рослині, рекомбінантна молекула днк, спосіб одержання оптимізованої для кукурудзи кодуючої послідовності інсектицидного протеїну, спосіб захисту рослин кукурудзи щонайменше від однієї комахи-шкідника |
| US5281521A (en) | 1992-07-20 | 1994-01-25 | The Trustees Of The University Of Pennsylvania | Modified avidin-biotin technique |
| WO1997004122A1 (en) | 1995-07-20 | 1997-02-06 | Washington State University Research Foundation | Production of secreted foreign polypeptides in plant cell culture |
| IL119310A (en) | 1996-09-26 | 1999-07-14 | Metabogal Ltd | Cell/tissue culturing device and method |
| IL155588A0 (en) * | 2003-04-27 | 2003-11-23 | Metabogal Ltd | Methods for expression of enzymatically active recombinant lysosomal enzymes in transgenic plant root cells and vectors used thereby |
| KR100266448B1 (ko) | 1997-06-26 | 2000-09-15 | 박종헌 | 식물세포 배양 중의 온도변화에 의한 택솔의 대량생산 방법 |
| US7951557B2 (en) * | 2003-04-27 | 2011-05-31 | Protalix Ltd. | Human lysosomal proteins from plant cell culture |
| WO2007010533A2 (en) * | 2005-07-18 | 2007-01-25 | Protalix Ltd. | Mucosal or enteral administration of biologically active macromolecules |
| EP3366762B1 (en) | 2007-05-07 | 2020-07-08 | Protalix Ltd. | Large scale disposable bioreactor |
| US9024110B2 (en) * | 2010-03-23 | 2015-05-05 | Zhang Yang | Methods for glyco-engineering plant cells for controlled human O-glycosylation |
-
2013
- 2013-02-19 AU AU2013220005A patent/AU2013220005A1/en not_active Abandoned
- 2013-02-19 RU RU2014137404A patent/RU2014137404A/ru unknown
- 2013-02-19 US US14/379,547 patent/US20150023929A1/en not_active Abandoned
- 2013-02-19 CN CN201380020238.4A patent/CN104245725A/zh active Pending
- 2013-02-19 BR BR112014021067A patent/BR112014021067A2/pt not_active IP Right Cessation
- 2013-02-19 EP EP13713245.2A patent/EP2814838A1/en not_active Withdrawn
- 2013-02-19 WO PCT/IB2013/051346 patent/WO2013121405A1/en active Application Filing
- 2013-02-19 KR KR20147026336A patent/KR20140130495A/ko not_active Application Discontinuation
- 2013-02-19 IN IN1806MUN2014 patent/IN2014MN01806A/en unknown
- 2013-02-19 CA CA2863829A patent/CA2863829A1/en not_active Abandoned
-
2014
- 2014-08-13 IL IL234093A patent/IL234093A0/en unknown
Also Published As
| Publication number | Publication date |
|---|---|
| WO2013121405A1 (en) | 2013-08-22 |
| AU2013220005A1 (en) | 2014-09-04 |
| IN2014MN01806A (ko) | 2015-07-03 |
| CN104245725A (zh) | 2014-12-24 |
| CA2863829A1 (en) | 2013-08-22 |
| BR112014021067A2 (pt) | 2018-10-30 |
| US20150023929A1 (en) | 2015-01-22 |
| IL234093A0 (en) | 2014-09-30 |
| RU2014137404A (ru) | 2016-04-10 |
| EP2814838A1 (en) | 2014-12-24 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| ES2446965T3 (es) | Producción de glucocerebrosidasa humana con alto contenido de manosa en cultivo vegetal | |
| CN105164151B (zh) | TNFα抑制剂多肽、编码多肽的多核苷酸、表达多肽的细胞和生成多肽的方法 | |
| US20130195802A1 (en) | Cellular Constituents From Bacteroides, Compositions Thereof, and Therapeutic Methods Employing Bacteroides or Cellular Constituents Thereof | |
| JP2010525806A (ja) | 植物培養での高マンノース型タンパク質の製造 | |
| JP2009501784A (ja) | 生物学的に活性な高分子の粘膜投与または経腸投与 | |
| JP6622591B2 (ja) | TNFαポリペプチド阻害薬を発現する植物細胞の、治療法における使用 | |
| EP3626827A1 (en) | Influenza virus-like particle production in plants | |
| JP2009513572A (ja) | 腸管障害及び/又は下痢用の経口組成物 | |
| EP2760882B1 (en) | Increasing virus-like particle yield in plants | |
| EP3319618B1 (en) | Process for producing egg yolk with high content of af-16 | |
| KR20140130495A (ko) | 고셰병 치료용 경구형 단위 투약 형태 및 이의 용도 | |
| US20170101633A1 (en) | Method of maintaining disease stability in a subject having gaucher's disease | |
| US20220162281A1 (en) | Recombinant irisin gene optimized for expression in plants and method for producing recombinant irisin protein using same | |
| KR20130079281A (ko) | 라저스트로에미아 오바리폴리아 추출물 또는 이의 분획물을 유효성분으로 포함하는 염증성 질환 또는 천식의 예방 또는 치료용 약학적 조성물 | |
| US20230404124A1 (en) | Development of amyloglucosidase as a medicinal food or dietary supplement | |
| TW201139672A (en) | Immunization of fish with plant-expressed recombinant proteins | |
| US8765115B2 (en) | Method of treatment of gastrointestinal disorders with IL-10 | |
| KR20190124756A (ko) | 경구 단백질 전달을 위한 수단 및 방법 | |
| US11390878B2 (en) | Increasing protein yield in plants | |
| US20220145317A1 (en) | Influenza virus-like particle production in plants | |
| CN117567649A (zh) | 融合蛋白、dna片段、表达载体与口服免疫治疗药物 | |
| CA2858379A1 (en) | Osteopontin variants for use in suppression or prevention of tumor growth and compositions containing such osteopontin variants | |
| WO2022251166A2 (en) | Bacterial compositions comprising soy hemoglobin | |
| CA2917377A1 (en) | Methods and oral formulations for enzyme replacement therapy of human lysosomal and metabolic diseases | |
| New | Plant-made oral vaccines evaluation of capsules |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |