KR20140063747A - 전염증성 상태를 치료 및 예방하기 위한 hdl-관련 분자의 용도 - Google Patents
전염증성 상태를 치료 및 예방하기 위한 hdl-관련 분자의 용도 Download PDFInfo
- Publication number
- KR20140063747A KR20140063747A KR1020147008207A KR20147008207A KR20140063747A KR 20140063747 A KR20140063747 A KR 20140063747A KR 1020147008207 A KR1020147008207 A KR 1020147008207A KR 20147008207 A KR20147008207 A KR 20147008207A KR 20140063747 A KR20140063747 A KR 20140063747A
- Authority
- KR
- South Korea
- Prior art keywords
- hdl
- cells
- apoa
- hif
- treated
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/775—Apolipopeptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/1703—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- A61K38/1709—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P39/00—General protective or antinoxious agents
- A61P39/06—Free radical scavengers or antioxidants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
Abstract
전-염증성 상태의 치료 및 예방에 사용하기 위한 분자 및 조성물이 기술된다. ApoA-I, 소 HDL 및 HDL 모방체를 포함하는 HDL-관련 분자는 특히 피부 세포에서 UV-유도된 세포 사멸 및 산화적 스트레스를 예방하고 다양한 암에서 종양 성장 및 발달을 억제하는 것으로 증명된다. HDL-관련 분자는 항-염증성 피부 상태와 알츠하이머병 및 다양한 암을 포함하는 전신성 항염증성 상태의 예방 및 치료를 위한 경구 보충물로서, 그리고 다른 조성물 중에 사용될 수 있다.
Description
본 출원은 각각의 전체 내용이 참조로서 본 명세서에 포함된, 미국 가특허 출원으로 2012년 5월 14일자로 출원된 제61/646,772호, 2012년 4월 15일자로 출원된 제61/624,333호, 및 2011년 8월 29일자로 출원된 제61/528,447호의 이익을 청구한다.
본 출원은 2010년 10월 4일자로 출원된 미국 가특허 출원 제61/389,618호와 2005년 4월 25일자로 출원된 미국 가특허 출원 제60/674,489호 및 2004년 7월 14일자로 출원된 제60/588,007호의 이익을 청구하는, 2005년 7월 14일자로 출원된 PCT/US2005/024985의 35 U.S.C.§371 하의 국내 단계 출원인, 현재 특허 제7,670,792호인 2007년 7월 18일자로 출원된 미국특허 출원 제11/571,986호의 분할인, 2009년 12월 3일자로 출원된 미국특허 출원 제12/630,458호의 일부 계속 출원인 2010년 8월 20일자로 출원된 미국 특허 출원 제12/860,293호에 관한 것이며, 이들 각각의 전체는 참조로서 본 명세서에 포함되어 있다.
본 출원 전반에 다양한 공보가 참조된다. 이들 공보의 개시내용은 그 전체로서 본 발명이 속하는 당해 분야의 상태를 더욱 자세히 설명하기 위해 본 출원에 참조로서 포함된다.
본 발명은 일반적으로 HDL-관련 분자를 사용하여 염증 상태 및 암을 예방 및 치료하는 것에 관한 것이다. 본 발명은 더욱 구체적으로 피부 및 전신성 전염증성 상태, 특히 상피암 뿐만 아니라 알츠하이머병, 염증성 피부병, 염증성 장질환, 및 노화와 관련된 염증성 질환을 포함하는 전염증성 상태를 예방 및 치료하기 위한 아포지질단백질 A-I(ApoA-I), HDL, 및 HDL 모방체, 및 이들의 용도에 관한 것이다. 이들 표적의 발현 및/또는 기능을 조절 및/또는 모방하는 전장 ApoA-I 단백질, HDL, 항체 및 안티센스/간섭 뉴클레오티드를 포함하는 분자는 단독으로 또는 다른 항산화제와 병용하여, 다양한 상태를 치료하기 위한 경구 보충물, 백신 및 약학 조성물로 사용될 수 있다.
전염증(proinflammation)은 스트레스와 관련이 강한 널리 알려진 현상이며, 다양한 질환과 연관된다. 일반적으로 전염증 활성은 잠재적으로 유해한 생물학적 제제(박테리아, 바이러스, 기생충 등)의 감염 또는 침입을 극복하기 위해 개시된다. 침입에 대항하는 동안, 전염증은 이롭고 악화되는 능력을 가지며 해로운 효과를 끼칠 수 있다. 불균형의 전신성 염증 반응의 후유증은 미소순환(microcirculation)의 교란, 쇼크, 장기 내의 삼출 및 응집의 결함을 포함한다. 불균형의 전신성 보상적 항염증 반응은 흔히 무력증 및 면역억제를 초래한다.
전염증성 피부 상태와 상피암을 포함하는 전염증성 상태를 예방 및 치료하기 위한 개선된 방법에 대한 필요가 여전히 존재한다.
본 발명은 전염증성 상태 및 암을 치료 또는 예방하기 위한 HDL-관련 분자 및, 이를 이용한 방법을 제공한다. HDL-관련 분자는 ApoA-I, 소 HDL, 및 HDL 모방체를 포함한다. 하기에 더 상세하게 기술되는 바와 같이, 천연적 상태에서 전장 형태의 ApoA-I은 UV-유도된 세포 사멸 및 산화적 스트레스를 예방할 수 있다. HDL 모방체인 ApoA-I 및 HDL(bHDL)이 다양한 암의 치료 및 예방을 위해 사용될 수 있다는 예상밖의 발견이 또한 하기에 더 상세히 설명된다.
일 실시양태에서, 본 발명은 종양 성장을 억제하는 방법을 제공한다. 방법은 HDL 모방 펩티드(예컨대, 서열번호 1, 3-9, 12, 14 또는 26-28로 나타냄), 소 HDL, 및 ApoA-I로 구성되는 군으로부터 선택되는 HDL-관련 분자와 종양 세포를 접촉시키는 것을 포함한다. 다른 실시양태는 개체에서 암을 치료 또는 예방하는 방법을 제공한다. 방법은 HDL 모방 펩티드(예컨대, 서열번호 1, 3-9, 12, 14 또는 26-28로 나타냄), 소 HDL, 및 ApoA-I로 구성되는 군으로부터 선택되는 HDL-관련 분자를 개체에게 투여하는 것을 포함한다. 본 발명의 또 다른 실시양태에서, 산화적 스트레스에 노출된 상피 세포에서 사멸 및/또는 산화적 스트레스를 감소시키는 방법이 제공된다. 방법은 HDL 모방 펩티드(예컨대, 서열번호 1, 3-9, 12, 14 또는 26-28로 나타냄), 소 HDL, 및 ApoA-I로 구성되는 군으로부터 선택되는 HDL-관련 분자와 상피 세포를 접촉시키는 것을 포함한다. 일 실시양태에서, 접촉은 산화적 스트레스에 노출되기 전에 발생한다. 전형적 실시양태에서, 접촉은 산화적 스트레스에 노출되기, 적어도 12-24 시간 전에 발생한다. 산화적 스트레스는 예를 들면, 자외선 복사에 노출되는 것을 포함할 수 있다.
HDL-관련 분자는 선택적으로 경구 보충물로서 투여될 수 있다. 본 발명의 방법으로 치료되는 개체는 예를 들면, 표유동물 개체, 전형적으로 인간 개체일 수 있다.
본 발명의 방법에서 사용하는 경우, ApoA-I은 재조합 ApoA-I 및/또는 비변형 형태로 투여될 수 있는 전장 단백질일 수 있다. 일 실시형태에서, ApoA-I은 천연, 전장, 비변형 ApoA-I이다.
제1항 내지 제6항 중 어느 한 항의 방법은 HDL 모방 펩티드가 서열번호 1, 3-9, 12, 14 및 26-28로 구성되는 군으로부터 선택된다.
일 실시양태에서, 본 발명은 상피 세포에서 암 치료, 종양 성장 억제, 및/또는 사멸 및/또는 산화적 스트레스를 감소시키기 위한 HDL-관련 분자를 제공한다. HDL-관련 분자는 HDL 모방 펩티드(서열번호 1, 3-9, 12, 14 또는 26-28), 소 HDL, 및 ApoA-I로 구성되는 군으로부터 선택된다. 일 실시양태에서, 본 발명은 서열번호 1, 3-9, 12, 14 또는 26-28로 표시되는 아미노산 서열을 갖는 것을 포함하는 신규한 HDL 모방 펩티드를 제공한다. 전형적인 실시양태에서, 펩티드는 서열번호 1로 나타내거나 서열번호 3-9로 나타낸 것 중 임의의 서열로 표시되는 아미노산 서열로 구성된다.
도 1. UV에 노출된 NIH3T3 세포에 대한 세포 생존력의 분석 결과를 플롯팅한 막대 그래프로 ApoA-I 처리의 예방적 효과를 보여줌.
도 2. 세포 생존력을 플롯팅한 막대 그래프로 ApoA-I 전-처리(10 ㎍/㎖)가 UV-유도된 세포 사멸로부터 NIH3T3 세포를 보호하는(상부 패널) 반면에, ApoA-I과 같은 HDL과 또한 관련된 단백질인 ApoA-II이 NIH3T3 세포의 UV-유도된 세포 사멸을 예방하지 못함을(하부 패널) 보여줌.
도 3. 인간 가족성 선종성 용종증에 대한 마우스 모델인 APCmin /+ 마우스에서 bHDL로의 처리 및 비히클 대조군으로의 처리를 비교하는, 폐 무게 및 종양 용적의 그래프 및 디지털 현미경사진 묘사.
도 4A-4E. L-4F 및 L-4F2로 처리한 마우스와 비교하여 sc-4F로 처리한 BALB/c 마우스에서 측부 종양 무게 및 용적에 대한 효과의 그래프 및 디지털 현미경사진 묘사. 도 4A 및 4B는 각각 종양 무게 및 용적을 보여준다. 도 4C 및 4D는 3개의 그룹 각각에 대한 무게 및 용적 각각의 점수(100%로서 대조군)의 백분율 분포를 보여준다. 3개의 그룹으로부터의 측부 종양의 대표 사진은 도 4E에 나타낸다.
도 5A-5E. 측부에 피하로 CT26 세포가 주사되었고 28AA 및 28AA-2 펩티드로 처리로 BALB/c 마우스에서 측부 종양 무게 및 용적에 대한 효과의 그래프 및 디지털 현미경사진 묘사. 마우스는 CT26 세포가 주사되는 부위로부터 먼 부위에 15일 동안 매일 피하 주사로 10mg/kg의 비히클(n=12) 또는 28AA(n=10) 또는 28AA-2(n=11)를 처리하였다. 도 5A 및 5B는 각각 종양 무게 및 용적을 보여준다. 도 5C 및 5D는 3개의 그룹 각각에 대한 무게 및 용적 각각의 점수(100%로서 대조군)의 백분율 분포를 보여준다. 3개의 그룹으로부터의 측부 종양의 대표 사진은 도 5E에 나타낸다.
도 6A 및 6B는 MTS 세포 생존력 분석의 결과를 표시한다. CT26 세포를 L-4F, L-4F2, 28AA 또는 28AA-2 펩티드(10 ㎍/㎖)로 처리하고, 대조군(도 6A)과 비교하였다. 모든 4개의 펩티드로 처리된 NIH3T3 세포의 생존력을 또한 시험관내에서 측정하였다. NIH3T3 세포의 생존력은 4개 펩티드 중 어느 것에도 영향을 받지 않았다(도 6B).
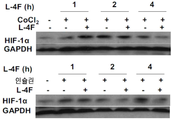
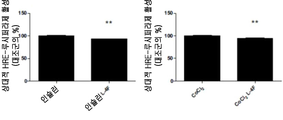
도 7A-7D. ApoA-I 모방 펩티드 L-4F가 생체내 및 시험관내에서 HIF-1α 발현을 억제하는 것을 보여주는 디지털 현미경사진 묘사. 도 7A, apoA-I 모방 펩티드인 L-4F는 생체내에서 HIF-1α 발현 및 혈관신생을 억제한다. 측부 종양은 실시예 4에서 기술된 바와 같은 야생형 C57BL/6J 마우스에서 확립되었다. 종양 성장 2주 후, 마우스를 3주 동안 스크램블드 펩티드(sc-4F) 또는 L-4F(10 mg/kg s.c., 매일 주사)로 처리하였다. 절개된 종양으로부터의 냉동 절단면(5 ㎛)을 헤마톡실린 및 에오신(H&E) 염색(좌측), HIF-1α 염색(중앙), 및 CD31 염색(오른쪽)에 적용시켰다. 슬라이드 당 무작위로 선택된 4개의 필드로부터 분석을 수행하였다(그룹당 n=4 마우스). 대표도를 400X 배율로 나타낸다. 화살표는 HIF-1α-양성 염색을 나타낸다. 도 7B, L-4F의 전처리는 인간 난소암 세포주에서 CoCl2- 및 인슐린-유도된 HIF-1α 발현을 억제한다. 세포를 1시간 동안 비히클 또는 상이한 농도의 L-4F(1, 3, 및 10 ㎍/㎖)로 처리하고, 지시된 자극제를 추가의 4시간 동안 첨가하였다. 왼쪽, L-4F의 전처리는 OV2008 세포에서 CoCl2- 및 인슐린-유도된 HIF-1α 발현을 억제한다. 오른쪽, L-4F의 전처리는 CAOV-3 세포에서 CoCl2- 및 인슐린-유도된 HIF-1α 발현을 억제한다. 도 7C 및 도 7D, L-4F는 OV2008 세포에서 CoCl2-유도된(도 7C) 및 인슐린-유도된(도 7D) HIF-1α의 핵 발현을 감소시킨다. 세포를 마우스 모노클론 항-HIF-1α 일차 항체 및 이차 항체로서 Alexa Fluor 568(적색 형광)으로 표지된 염소 항-마우스 IgG로 면역염색하였다. DAPI를 사용하여 핵(상응하는 공개 문헌에서 파란색)을 염색하였다. 이미지는 200X의 본래 배율로 나타낸다. 점선 및 박스는 확대된 이미지가 유래한 영역을 보여준다. 유사한 결과를 갖는 2개의 독립적인 실험의 대표도를 나타낸다. 사용된 자극제의 농도는 CoCl2가 100 μM이고, 인슐린이 200 nM이었다.
도 8A-8D. HIF-1α 표적 유전자 발현이 OV2008 세포에서 L-4F에 의해 억제되는 것을 보여주는 막대 그래프. 도 8A, CoCl2-자극된 HRE 수용체 유전자 전사가 L-4F의 전처리에 의해 억제된다. OV2008 세포를 pGL3-Epo-HRE-Luc 플라스미드로 형질감염시키고 24시간 동안 완전 성장 배지에서 키웠다. 밤새 단식시킨 후, 세포를 처음으로 1시간 동안 L-4F(10 ㎍/㎖)로 처리한 후, 6시간 더 CoCl2(100 μM)로 처리하였다. 루시퍼라제 활성은 실시예 4에서 기술된 바와 같이 측정하였다. 도 8B, L-4F는 CoCl2-표적된 세포에서 HIF-1α의 발현을 억제한다. 밤새 혈청 단식시킨 후, OV2008 세포를 1시간 동안 L-4F(10 ㎍/㎖)로 처리한 후, 6시간 더 CoCl2(100 μM)로 처리하였다. 총 RNA를 단리하고, VEGF, 글루코스 트랜스포터 1(GLUT1)의 발현, 및 알돌라제-A(ALDO-A) mRNA 수준을 실시간 RT-PCR로 측정하였다. GAPDH를 정상화를 위해 사용하였다. 도 8C, 인슐린-자극된 HRE 리포터 유전자 전사는 L-4F의 전처리에 의해 억제된다. OV2008 세포를 pGL3-Epo-HRE-Luc 플라스미드로 형질감염시키고, 24시간 동안 완전 성장 배지에서 키웠다. 밤새 단식시킨 후, 세포를 1시간 동안 L-4F(10 ㎍/㎖)로 처리한 후, 16시간 더 인슐린(200 nM)으로 처리하였다. 루시퍼라제 활성은 실시예 4에 기술된 바와 같이 측정하였다. 도 8D, L-4F는 인슐린-처리된 세포에서 HIF-1α 표적 유전자의 발현을 억제한다. 혈청 단식시킨 후, OV2008 세포를 1시간 동안 L-4F(10 ㎍/㎖)로 처리한 후, 16시간 더 인슐린(200 nM)으로 처리하였다. 총 RNA를 단리하고, VEGF, 글루코스 트랜스포터 1(GLUT1)의 발현, 및 알돌라제-A(ALDO-A) mRNA 수준을 실시간 RT-PCR로 측정하였다. GAPDH를 정상화를 위해 사용하였다. #, p < 0.05, 상응하는 대조군 그룹과 비교함. ##, p < 0.01, 상응하는 대조군 그룹과 비교함. *, p < 0.05, 상응하는 CoCl2- 또는 인슐린-처리된 그룹과 비교함. **, p < 0.01, CoCl2- 또는 인슐린-처리된 그룹과 비교함. 각 그룹에 대해 n = 3.
도 9A-9D. L-4F의 후-처리는 CoCl2- 및 인슐린-처리된 OV2008 세포에서 HIF-1α 단백질 수준 및 활성을 감소시킨다. 세포를 24시간 동안 CoCl2(100 μM) 또는 인슐린(200 nM)로 처리한 후, 추가의 1, 2, 또는 4시간 동안 비히클 또는 L-4F(10 ㎍/㎖)로 처리하였다. 도 9A, 10 ㎍/㎖로 L-4F의 후-처리는 CoCl2- 및 인슐린-처리된 OV2008 세포에서 HIF-1α 단백질 수준을 감소시킨다. 도 9B, 4시간 동안 10 ㎍/㎖로 L-4F의 후-처리는 OV2008 세포에서 HIF-1α의 핵 수준의 CoCl2- 및 인슐린-유도된 증가를 감소시킨다. 세포를 마우스 모노클론 항-HIF-1α 일차 항체 및 이차 항체로서 Alexa Fluor 568(적색 형광)으로 표지된 염소 항-마우스 IgG로 면역염색하였다. DAPI를 사용하여 핵(상응하는 공개 문헌에서 파란색)을 염색하였다. 이미지는 400X의 본래 배율로 나타낸다. 유사한 결과를 갖는 2개의 독립적인 실험의 대표도를 나타낸다. 도 9C 및 도 9D, L-4F의 후-처리에 의해 CoCl2- 및 인슐린-처리된 세포에서 HRE 리포터 유전자 전사의 억제. OV2008 세포를 pGL3-Epo-HRE-Luc 플라스미드로 처리하고, 24시간 동안 완전 성장 배지에서 키웠다. 밤새 단식시킨 후, 세포를 24시간 동안 CoCl2(100 μM) 또는 인슐린(200 nM)으로 처리한 후, L-4F(10 ㎍/㎖)로 4시간 동안 더(도 9C) 또는 24시간 더(도 9D) 처리하였다. 루시퍼라제 활성은 실시예 4에서 기술된 바와 같이 측정하였다. **, p < 0.01, 상응하는 CoCl2- 또는 인슐린-처리한 그룹과 비교함. 각 그룹에 대한 n = 3.
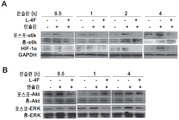
도 10A-10B. OV2008 세포에서 하류 시그널링 분자의 인슐린-자극된 활성화에 대한 L-4F의 효과. 밤새 단식시킨 후, OV2008 세포를 1시간 동안 L-4F(10 ㎍/㎖)로 처리하고, 인슐린을 200 nM의 최종 농도로 추가하였다. 세포 용해물을 다양한 시점에서 수집하고, 웨스턴 블럿 분석을 위해 적용하였다. 도 10A, L-4F는 OV2008 세포에서 p70s6 키나제의 인슐린-자극된 인산화 및 이후의 HIF-1α 발현을 억제한다. 도 10B, OV2008 세포에서 ERK1/2 및 Akt의 인슐린 자극된 인산화에 대한 L-4F의 효과.
도 11A-11B. OV2008 세포에서 HIF-1α 단백질 안정성에 대한 L-4F의 효과. 도 11A, 왼쪽, L-4F의 전처리는 OV2008 세포에서 HIF-1α 분해를 촉진한다. 밤새 단식시킨 후, OV2008 세포를 3시간 동안 인슐린(200 nM)으로, 1시간 동안 L-4F(10 ㎍/㎖)로, 다양한 기간 동안 CHX(20 ㎍/㎖)로 처리하였다. 세포 용해물을 수집하고 웨스턴 블럿 분석을 위해 적용하였다. 유사한 결과를 갖는 3개의 독립적인 실험으로부터의 대표적인 데이터를 나타낸다. 오른쪽, L-4F 처리는 OV2008 세포에서 HIF-1α 분해를 촉진한다. 밤새 단식시킨 후, OV2008 세포를 3시간 동안 인슐린(200 nM)로 처리한 후, 동일한 시간 동안 L-4F(10 ㎍/㎖) 및 CHX(20 ㎍/㎖)로 처리하였다. 세포 용해물을 다양한 시점에서 수집하고, 웨스턴 블럿 분석을 위해 적용하였다. 유사한 결과를 갖는 3개의 실험으로부터의 대표적인 데이터를 나타낸다. 도11B, 인슐린-처리된 OV2008 세포에서 HIF-1α의 프로테아좀-매개된 분해에 대한 L-4F의 전처리의 효과. 밤새 단식시킨 후, OV2008 세포를 3시간 동안 MG-132(10 μM), 1시간 동안 L-4F(10 ㎍/㎖), 및 4시간 동안 더 인슐린(200 nM)으로 처리하였다. 세포 용해물을 수집하고 웨스턴 블럿 분석을 위해 적용하였다. 유사한 결과를 갖는 3개의 독립적인 실험으로부터의 대표적인 데이터를 나타낸다.
도 12A-12B. CoCl2- 및 인슐린-자극된 ROS 생성에 대한 L-4F의 효과. OV2008 세포를 1시간 동안 L-4F(10 ㎍/㎖)로 전처리한 후, 30분 동안 인슐린(200 nM)/ CoCl2(100 μM) 및 DCFH-DA(10 μM)으로 처리하였다. 세포를 PBS로 2회 세척한 후, 세포의 이미지를 형광 현미경으로 캡쳐하였다. 대표도는 본래 배율의 200X로 나타낸다. 도 12A, L-4F는 OV2008 세포에서 인슐린-자극된 ROS 생성을 억제한다. 도 12B, L-4F는 OV2008 세포에서 CoCl2-자극된 ROS 생성을 억제한다.
도 13A-13F. CT26 세포-매개된 폐 종양 및 측부 종양은 피하로 HDL 모방체, L-4F로 처리된 BALB/c 마우스에서 현저하게 감소된다. 폐 종양을 실시예 5에서 기술된 바와 같이 BALB/c 마우스(그룹 당 n = 11)에서 확립하였다. 마우스를 CT26 세포를 꼬리 정맥 주사에 의해 투여한 후 3주째 희생시켰다. 폐를 수거하고, 무게를 측정하였다. 폐 종양을 계수하였다. 도 13A, 나타낸 데이터는 sc-4F 또는 L-4F 10 mg/kg를 매일 피하로 투여받은 마우스에 대한 폐 무게이다. P < 0.01. 도 13B, 나타낸 데이터는 2 그룹의 마우스로부터 폐 표면 상에서 계수된 종양의 수이다. P < 0.001. 도 13C, 폐 표면 상에 종양 결절을 보이는 2 그룹의 마우스로부터의 대표적 종양. 도 13D 및 도 13E, 측부 종양을 실시예 5에서 기술된 바와 같은 BALB/c 마우스에서 확립하였다. 마우스를 CT26 세포를 피하 투여 15일 후에 희생시키고, 종양 무게를 측정하였다. 도 13D, 나타낸 데이터는 10 mg/kg sc-4F 또는 L-4F를 피하로 투여받은 마우스에 대한 종양 무게이다. P < 0.05. 도 13E, 대표적인 종양은 2 그룹의 마우스로부터 나타낸다. w/sc-4F, sc-4F로 처리한 마우스; w/L-4F, L-4F로 처리한 마우스. F, A에서 나타낸 실험으로부터의 혈장 IL-6 수준. P < 0.05.
도 14A-14D. CT26 세포-매개된 폐 종양은 마우스 사료를 투여받은 L-4F로 처리된 BALB/c 마우스에서 현저히 감소하였다. 폐 종양은 실시예 5에서 기술된 바와 같이 BALB/c 마우스에서 확립하였다. 마우스를 CT26 세포를 꼬리 정맥 주사로 투여 3주 후에 희생시켰다. 폐를 수거하고 무게를 측정하였다. 폐 종양을 계수하였다. 도 14A, 나타낸 데이터는 100 mg/kg/d(2 mg/마우스/d)로 사료 식이 내로 혼합된 sc-4F(n = 12) 또는 L-4F(n = 9)를 투여받은 마우스에 대한 폐 무게이다. P < 0.05. 도 14B, 나타낸 데이터는 2 그룹의 마우스로부터 폐 표면 상에서 계수한 종양 수이다. P < 0.0001. 도 14C, 폐 표면으로부터의 종양 조직을 절단하고, CD31 면역염색을 미세혈관 내의 내피세포의 검출을 위한 항-CD31 항체를 이용해 수행하였다. 적색 염색은 CD31 염색을 나타낸다. w/sc-4F, sc-4F로 처리한 마우스; w/L-4F, L-4F로 처리한 마우스. 도 14D, 혈장 LPA 수준은 실시예 5에 기술된 바와 같이 측정하였다. P < 0.01.
도 15A-15C. C57BL/6J-APCmin /+ 마우스의 장관(intestinal tract)에서 종양 수 및 크기에 대한 사료 중에 L-4F 처리의 효과. APCmin /+ 마우스를 실시예 5에 기술된 바와 같은 마우스 사료 중에 투여된 sc-4F 또는 L-4F로 처리 8주 후에 희생시켰다. 도 15A, 대조군(즉, sc-4F로 처리한 마우스)의 백분율로서 나타낸, 8주 동안 마우스 식이 중에 투여된 L-4F로 처리한 후 장관에서의 총 종양 수, P < 0.05. 도 15B, 상이한 크기 분류에 있어 종양 수는 mm 단위의 종양 지름으로 정의하였다. w/sc-4F, sc-4F로 처리한 마우스; w/L-4F, L-4F로 처리한 마우스. 도 15C, 혈장 LPA 수준은 대조군 마우스와 비교하여 L-4F로 처리된 C57BL/6J- APCmin /+ 마우스에서 현저히 감소(>50%)한다. P < 0.01.
도 16A-16D. HDL 모방체, L-4F는 생존력을 감소시키고, 증식을 억제하며, CT26 세포에서 세포 주기 및 사이클린 단백질에 영향을 미친다. CT26 세포를 실시예 5에서 기술된 바와 같이 배양하고, 10 mg/mL 농도의 비히클(대조군) 또는 L-4F와 함께 인큐베이션시켰다. 도 16A, 세포를 MTS 분석 키트를 사용해 생존력에 대해 분석하였다. P< 0.001. 도 16B, BrdUrd 도입은 실시예 5에 기술된 바와 같이 분석하였다. P < 0.001. 도 16C, 세포 주기 내의 상이한 기(phase) 중에 세포의 분석. 데이터는 대조군 세포의 백분율의 평균 ± SD로 나타낸다. 도 16D, 사이클린 D1 및 사이클린 A의 발현. 모든 실험은 3회 반복 수행하고 각각의 분석은 4회 반복 수행하였다.
도 17A-17B. HDL 모방체, L-4F는 세포 배양 배지에서 CT26 세포의 LPA 유도된 생존력을 억제하고 세포 배양 배지에서 LPA 수준을 감소시킨다. 도 17A, CT26 세포는 실시예 5에 기술된 바와 같이 배양하고, 10 mg/mL의 L-4F 또는 5, 10, 20 mmol/L 농도의 LPA로 인큐베이션시키거나, 세포를 48시간 동안 L-4F 및 LPA 둘 모두로 처리하였다. 모든 실험은 3회 반복 수행하였고, 각각의 분석은 4회 반복 수행하였다. 데이터는 대조군 세포의 백분율의 평균 ± SD로 나타낸다. 도 17B, LPA 수준을 치료의 48시간 후 세포 배양 배지에서 측정하였다.
도 18A-18E. G*(L-[113-122]apoJ) 펩티드는 생체내 및 시험관내에서 L-4F와 유사한 효과를 가진다. 폐 종양을 실시예 5에서 기술된 바와 같은 BALB/c에서 확립하였다. 마우스를 CT26 세포를 꼬리 정맥 내로 주사한 3주 후 희생시켰다. 폐를 수거하고, 무게를 측정하였다. 폐 종양을 계수하였다. 도 18A, 나타낸 데이터는 마우스 사료에 투여된 100 mg/kg/d(2 mg/마우스/d)의 sc-4F(n 12), G* 펩티드(n 12)을 투여받은 마우스에 대한 폐 무게이다. P < 0.05. 도 18B, 나타낸 데이터는 A의 2 그룹 마우스로부터의 폐 표면 상에 종양 수이다. P < 0.0001. 도 18C, 세포는 MTS 분석을 사용해 생존력에 대해 분석하였다. P < 0.05. 도 18A 및 18B에 기술된 마우스로부터의 D, 혈청 LPA 수준은 실시예 5에 기술된 바와 같이 측정하였다. 도 18E, 웨스턴 블럿에 의한 사이클린 D1 및 사이클린 A의 발현. w/sc-4F, sc-4F로 처리한 마우스; w/G*, G* 펩티드로 처리한 마우스.
도 19. 다양한 HDL 모방 펩티드로 시험관내 처리된 CT26 세포는 비히클-처리된 대조군과 비교할 때, 처리 48시간 이내에 감소된(MTS 분석 당) 세포 생존력을 나타낸다. 분석된 HDL 모방체는 L-4F, L-4F2, K4,15-4F, K4,15-4F2, 및 ApoE 및 G*, 로부터 형성된 20개 아미노산 펩티드, LRKLRKRLLR LVGRQLEEFL(서열번호 1)였다.
도 20. CT26 세포의 피하 측부 주사를 투여받고 이후에 피하 HDL 모방 펩티드로 처리된 BALB/c 마우스는 종양 무게(좌측 패널) 및 종양 용적(오른쪽 패널)에서 현저한 감소를 보였다.
도 2. 세포 생존력을 플롯팅한 막대 그래프로 ApoA-I 전-처리(10 ㎍/㎖)가 UV-유도된 세포 사멸로부터 NIH3T3 세포를 보호하는(상부 패널) 반면에, ApoA-I과 같은 HDL과 또한 관련된 단백질인 ApoA-II이 NIH3T3 세포의 UV-유도된 세포 사멸을 예방하지 못함을(하부 패널) 보여줌.
도 3. 인간 가족성 선종성 용종증에 대한 마우스 모델인 APCmin /+ 마우스에서 bHDL로의 처리 및 비히클 대조군으로의 처리를 비교하는, 폐 무게 및 종양 용적의 그래프 및 디지털 현미경사진 묘사.
도 4A-4E. L-4F 및 L-4F2로 처리한 마우스와 비교하여 sc-4F로 처리한 BALB/c 마우스에서 측부 종양 무게 및 용적에 대한 효과의 그래프 및 디지털 현미경사진 묘사. 도 4A 및 4B는 각각 종양 무게 및 용적을 보여준다. 도 4C 및 4D는 3개의 그룹 각각에 대한 무게 및 용적 각각의 점수(100%로서 대조군)의 백분율 분포를 보여준다. 3개의 그룹으로부터의 측부 종양의 대표 사진은 도 4E에 나타낸다.
도 5A-5E. 측부에 피하로 CT26 세포가 주사되었고 28AA 및 28AA-2 펩티드로 처리로 BALB/c 마우스에서 측부 종양 무게 및 용적에 대한 효과의 그래프 및 디지털 현미경사진 묘사. 마우스는 CT26 세포가 주사되는 부위로부터 먼 부위에 15일 동안 매일 피하 주사로 10mg/kg의 비히클(n=12) 또는 28AA(n=10) 또는 28AA-2(n=11)를 처리하였다. 도 5A 및 5B는 각각 종양 무게 및 용적을 보여준다. 도 5C 및 5D는 3개의 그룹 각각에 대한 무게 및 용적 각각의 점수(100%로서 대조군)의 백분율 분포를 보여준다. 3개의 그룹으로부터의 측부 종양의 대표 사진은 도 5E에 나타낸다.
도 6A 및 6B는 MTS 세포 생존력 분석의 결과를 표시한다. CT26 세포를 L-4F, L-4F2, 28AA 또는 28AA-2 펩티드(10 ㎍/㎖)로 처리하고, 대조군(도 6A)과 비교하였다. 모든 4개의 펩티드로 처리된 NIH3T3 세포의 생존력을 또한 시험관내에서 측정하였다. NIH3T3 세포의 생존력은 4개 펩티드 중 어느 것에도 영향을 받지 않았다(도 6B).
도 7A-7D. ApoA-I 모방 펩티드 L-4F가 생체내 및 시험관내에서 HIF-1α 발현을 억제하는 것을 보여주는 디지털 현미경사진 묘사. 도 7A, apoA-I 모방 펩티드인 L-4F는 생체내에서 HIF-1α 발현 및 혈관신생을 억제한다. 측부 종양은 실시예 4에서 기술된 바와 같은 야생형 C57BL/6J 마우스에서 확립되었다. 종양 성장 2주 후, 마우스를 3주 동안 스크램블드 펩티드(sc-4F) 또는 L-4F(10 mg/kg s.c., 매일 주사)로 처리하였다. 절개된 종양으로부터의 냉동 절단면(5 ㎛)을 헤마톡실린 및 에오신(H&E) 염색(좌측), HIF-1α 염색(중앙), 및 CD31 염색(오른쪽)에 적용시켰다. 슬라이드 당 무작위로 선택된 4개의 필드로부터 분석을 수행하였다(그룹당 n=4 마우스). 대표도를 400X 배율로 나타낸다. 화살표는 HIF-1α-양성 염색을 나타낸다. 도 7B, L-4F의 전처리는 인간 난소암 세포주에서 CoCl2- 및 인슐린-유도된 HIF-1α 발현을 억제한다. 세포를 1시간 동안 비히클 또는 상이한 농도의 L-4F(1, 3, 및 10 ㎍/㎖)로 처리하고, 지시된 자극제를 추가의 4시간 동안 첨가하였다. 왼쪽, L-4F의 전처리는 OV2008 세포에서 CoCl2- 및 인슐린-유도된 HIF-1α 발현을 억제한다. 오른쪽, L-4F의 전처리는 CAOV-3 세포에서 CoCl2- 및 인슐린-유도된 HIF-1α 발현을 억제한다. 도 7C 및 도 7D, L-4F는 OV2008 세포에서 CoCl2-유도된(도 7C) 및 인슐린-유도된(도 7D) HIF-1α의 핵 발현을 감소시킨다. 세포를 마우스 모노클론 항-HIF-1α 일차 항체 및 이차 항체로서 Alexa Fluor 568(적색 형광)으로 표지된 염소 항-마우스 IgG로 면역염색하였다. DAPI를 사용하여 핵(상응하는 공개 문헌에서 파란색)을 염색하였다. 이미지는 200X의 본래 배율로 나타낸다. 점선 및 박스는 확대된 이미지가 유래한 영역을 보여준다. 유사한 결과를 갖는 2개의 독립적인 실험의 대표도를 나타낸다. 사용된 자극제의 농도는 CoCl2가 100 μM이고, 인슐린이 200 nM이었다.
도 8A-8D. HIF-1α 표적 유전자 발현이 OV2008 세포에서 L-4F에 의해 억제되는 것을 보여주는 막대 그래프. 도 8A, CoCl2-자극된 HRE 수용체 유전자 전사가 L-4F의 전처리에 의해 억제된다. OV2008 세포를 pGL3-Epo-HRE-Luc 플라스미드로 형질감염시키고 24시간 동안 완전 성장 배지에서 키웠다. 밤새 단식시킨 후, 세포를 처음으로 1시간 동안 L-4F(10 ㎍/㎖)로 처리한 후, 6시간 더 CoCl2(100 μM)로 처리하였다. 루시퍼라제 활성은 실시예 4에서 기술된 바와 같이 측정하였다. 도 8B, L-4F는 CoCl2-표적된 세포에서 HIF-1α의 발현을 억제한다. 밤새 혈청 단식시킨 후, OV2008 세포를 1시간 동안 L-4F(10 ㎍/㎖)로 처리한 후, 6시간 더 CoCl2(100 μM)로 처리하였다. 총 RNA를 단리하고, VEGF, 글루코스 트랜스포터 1(GLUT1)의 발현, 및 알돌라제-A(ALDO-A) mRNA 수준을 실시간 RT-PCR로 측정하였다. GAPDH를 정상화를 위해 사용하였다. 도 8C, 인슐린-자극된 HRE 리포터 유전자 전사는 L-4F의 전처리에 의해 억제된다. OV2008 세포를 pGL3-Epo-HRE-Luc 플라스미드로 형질감염시키고, 24시간 동안 완전 성장 배지에서 키웠다. 밤새 단식시킨 후, 세포를 1시간 동안 L-4F(10 ㎍/㎖)로 처리한 후, 16시간 더 인슐린(200 nM)으로 처리하였다. 루시퍼라제 활성은 실시예 4에 기술된 바와 같이 측정하였다. 도 8D, L-4F는 인슐린-처리된 세포에서 HIF-1α 표적 유전자의 발현을 억제한다. 혈청 단식시킨 후, OV2008 세포를 1시간 동안 L-4F(10 ㎍/㎖)로 처리한 후, 16시간 더 인슐린(200 nM)으로 처리하였다. 총 RNA를 단리하고, VEGF, 글루코스 트랜스포터 1(GLUT1)의 발현, 및 알돌라제-A(ALDO-A) mRNA 수준을 실시간 RT-PCR로 측정하였다. GAPDH를 정상화를 위해 사용하였다. #, p < 0.05, 상응하는 대조군 그룹과 비교함. ##, p < 0.01, 상응하는 대조군 그룹과 비교함. *, p < 0.05, 상응하는 CoCl2- 또는 인슐린-처리된 그룹과 비교함. **, p < 0.01, CoCl2- 또는 인슐린-처리된 그룹과 비교함. 각 그룹에 대해 n = 3.
도 9A-9D. L-4F의 후-처리는 CoCl2- 및 인슐린-처리된 OV2008 세포에서 HIF-1α 단백질 수준 및 활성을 감소시킨다. 세포를 24시간 동안 CoCl2(100 μM) 또는 인슐린(200 nM)로 처리한 후, 추가의 1, 2, 또는 4시간 동안 비히클 또는 L-4F(10 ㎍/㎖)로 처리하였다. 도 9A, 10 ㎍/㎖로 L-4F의 후-처리는 CoCl2- 및 인슐린-처리된 OV2008 세포에서 HIF-1α 단백질 수준을 감소시킨다. 도 9B, 4시간 동안 10 ㎍/㎖로 L-4F의 후-처리는 OV2008 세포에서 HIF-1α의 핵 수준의 CoCl2- 및 인슐린-유도된 증가를 감소시킨다. 세포를 마우스 모노클론 항-HIF-1α 일차 항체 및 이차 항체로서 Alexa Fluor 568(적색 형광)으로 표지된 염소 항-마우스 IgG로 면역염색하였다. DAPI를 사용하여 핵(상응하는 공개 문헌에서 파란색)을 염색하였다. 이미지는 400X의 본래 배율로 나타낸다. 유사한 결과를 갖는 2개의 독립적인 실험의 대표도를 나타낸다. 도 9C 및 도 9D, L-4F의 후-처리에 의해 CoCl2- 및 인슐린-처리된 세포에서 HRE 리포터 유전자 전사의 억제. OV2008 세포를 pGL3-Epo-HRE-Luc 플라스미드로 처리하고, 24시간 동안 완전 성장 배지에서 키웠다. 밤새 단식시킨 후, 세포를 24시간 동안 CoCl2(100 μM) 또는 인슐린(200 nM)으로 처리한 후, L-4F(10 ㎍/㎖)로 4시간 동안 더(도 9C) 또는 24시간 더(도 9D) 처리하였다. 루시퍼라제 활성은 실시예 4에서 기술된 바와 같이 측정하였다. **, p < 0.01, 상응하는 CoCl2- 또는 인슐린-처리한 그룹과 비교함. 각 그룹에 대한 n = 3.
도 10A-10B. OV2008 세포에서 하류 시그널링 분자의 인슐린-자극된 활성화에 대한 L-4F의 효과. 밤새 단식시킨 후, OV2008 세포를 1시간 동안 L-4F(10 ㎍/㎖)로 처리하고, 인슐린을 200 nM의 최종 농도로 추가하였다. 세포 용해물을 다양한 시점에서 수집하고, 웨스턴 블럿 분석을 위해 적용하였다. 도 10A, L-4F는 OV2008 세포에서 p70s6 키나제의 인슐린-자극된 인산화 및 이후의 HIF-1α 발현을 억제한다. 도 10B, OV2008 세포에서 ERK1/2 및 Akt의 인슐린 자극된 인산화에 대한 L-4F의 효과.
도 11A-11B. OV2008 세포에서 HIF-1α 단백질 안정성에 대한 L-4F의 효과. 도 11A, 왼쪽, L-4F의 전처리는 OV2008 세포에서 HIF-1α 분해를 촉진한다. 밤새 단식시킨 후, OV2008 세포를 3시간 동안 인슐린(200 nM)으로, 1시간 동안 L-4F(10 ㎍/㎖)로, 다양한 기간 동안 CHX(20 ㎍/㎖)로 처리하였다. 세포 용해물을 수집하고 웨스턴 블럿 분석을 위해 적용하였다. 유사한 결과를 갖는 3개의 독립적인 실험으로부터의 대표적인 데이터를 나타낸다. 오른쪽, L-4F 처리는 OV2008 세포에서 HIF-1α 분해를 촉진한다. 밤새 단식시킨 후, OV2008 세포를 3시간 동안 인슐린(200 nM)로 처리한 후, 동일한 시간 동안 L-4F(10 ㎍/㎖) 및 CHX(20 ㎍/㎖)로 처리하였다. 세포 용해물을 다양한 시점에서 수집하고, 웨스턴 블럿 분석을 위해 적용하였다. 유사한 결과를 갖는 3개의 실험으로부터의 대표적인 데이터를 나타낸다. 도11B, 인슐린-처리된 OV2008 세포에서 HIF-1α의 프로테아좀-매개된 분해에 대한 L-4F의 전처리의 효과. 밤새 단식시킨 후, OV2008 세포를 3시간 동안 MG-132(10 μM), 1시간 동안 L-4F(10 ㎍/㎖), 및 4시간 동안 더 인슐린(200 nM)으로 처리하였다. 세포 용해물을 수집하고 웨스턴 블럿 분석을 위해 적용하였다. 유사한 결과를 갖는 3개의 독립적인 실험으로부터의 대표적인 데이터를 나타낸다.
도 12A-12B. CoCl2- 및 인슐린-자극된 ROS 생성에 대한 L-4F의 효과. OV2008 세포를 1시간 동안 L-4F(10 ㎍/㎖)로 전처리한 후, 30분 동안 인슐린(200 nM)/ CoCl2(100 μM) 및 DCFH-DA(10 μM)으로 처리하였다. 세포를 PBS로 2회 세척한 후, 세포의 이미지를 형광 현미경으로 캡쳐하였다. 대표도는 본래 배율의 200X로 나타낸다. 도 12A, L-4F는 OV2008 세포에서 인슐린-자극된 ROS 생성을 억제한다. 도 12B, L-4F는 OV2008 세포에서 CoCl2-자극된 ROS 생성을 억제한다.
도 13A-13F. CT26 세포-매개된 폐 종양 및 측부 종양은 피하로 HDL 모방체, L-4F로 처리된 BALB/c 마우스에서 현저하게 감소된다. 폐 종양을 실시예 5에서 기술된 바와 같이 BALB/c 마우스(그룹 당 n = 11)에서 확립하였다. 마우스를 CT26 세포를 꼬리 정맥 주사에 의해 투여한 후 3주째 희생시켰다. 폐를 수거하고, 무게를 측정하였다. 폐 종양을 계수하였다. 도 13A, 나타낸 데이터는 sc-4F 또는 L-4F 10 mg/kg를 매일 피하로 투여받은 마우스에 대한 폐 무게이다. P < 0.01. 도 13B, 나타낸 데이터는 2 그룹의 마우스로부터 폐 표면 상에서 계수된 종양의 수이다. P < 0.001. 도 13C, 폐 표면 상에 종양 결절을 보이는 2 그룹의 마우스로부터의 대표적 종양. 도 13D 및 도 13E, 측부 종양을 실시예 5에서 기술된 바와 같은 BALB/c 마우스에서 확립하였다. 마우스를 CT26 세포를 피하 투여 15일 후에 희생시키고, 종양 무게를 측정하였다. 도 13D, 나타낸 데이터는 10 mg/kg sc-4F 또는 L-4F를 피하로 투여받은 마우스에 대한 종양 무게이다. P < 0.05. 도 13E, 대표적인 종양은 2 그룹의 마우스로부터 나타낸다. w/sc-4F, sc-4F로 처리한 마우스; w/L-4F, L-4F로 처리한 마우스. F, A에서 나타낸 실험으로부터의 혈장 IL-6 수준. P < 0.05.
도 14A-14D. CT26 세포-매개된 폐 종양은 마우스 사료를 투여받은 L-4F로 처리된 BALB/c 마우스에서 현저히 감소하였다. 폐 종양은 실시예 5에서 기술된 바와 같이 BALB/c 마우스에서 확립하였다. 마우스를 CT26 세포를 꼬리 정맥 주사로 투여 3주 후에 희생시켰다. 폐를 수거하고 무게를 측정하였다. 폐 종양을 계수하였다. 도 14A, 나타낸 데이터는 100 mg/kg/d(2 mg/마우스/d)로 사료 식이 내로 혼합된 sc-4F(n = 12) 또는 L-4F(n = 9)를 투여받은 마우스에 대한 폐 무게이다. P < 0.05. 도 14B, 나타낸 데이터는 2 그룹의 마우스로부터 폐 표면 상에서 계수한 종양 수이다. P < 0.0001. 도 14C, 폐 표면으로부터의 종양 조직을 절단하고, CD31 면역염색을 미세혈관 내의 내피세포의 검출을 위한 항-CD31 항체를 이용해 수행하였다. 적색 염색은 CD31 염색을 나타낸다. w/sc-4F, sc-4F로 처리한 마우스; w/L-4F, L-4F로 처리한 마우스. 도 14D, 혈장 LPA 수준은 실시예 5에 기술된 바와 같이 측정하였다. P < 0.01.
도 15A-15C. C57BL/6J-APCmin /+ 마우스의 장관(intestinal tract)에서 종양 수 및 크기에 대한 사료 중에 L-4F 처리의 효과. APCmin /+ 마우스를 실시예 5에 기술된 바와 같은 마우스 사료 중에 투여된 sc-4F 또는 L-4F로 처리 8주 후에 희생시켰다. 도 15A, 대조군(즉, sc-4F로 처리한 마우스)의 백분율로서 나타낸, 8주 동안 마우스 식이 중에 투여된 L-4F로 처리한 후 장관에서의 총 종양 수, P < 0.05. 도 15B, 상이한 크기 분류에 있어 종양 수는 mm 단위의 종양 지름으로 정의하였다. w/sc-4F, sc-4F로 처리한 마우스; w/L-4F, L-4F로 처리한 마우스. 도 15C, 혈장 LPA 수준은 대조군 마우스와 비교하여 L-4F로 처리된 C57BL/6J- APCmin /+ 마우스에서 현저히 감소(>50%)한다. P < 0.01.
도 16A-16D. HDL 모방체, L-4F는 생존력을 감소시키고, 증식을 억제하며, CT26 세포에서 세포 주기 및 사이클린 단백질에 영향을 미친다. CT26 세포를 실시예 5에서 기술된 바와 같이 배양하고, 10 mg/mL 농도의 비히클(대조군) 또는 L-4F와 함께 인큐베이션시켰다. 도 16A, 세포를 MTS 분석 키트를 사용해 생존력에 대해 분석하였다. P< 0.001. 도 16B, BrdUrd 도입은 실시예 5에 기술된 바와 같이 분석하였다. P < 0.001. 도 16C, 세포 주기 내의 상이한 기(phase) 중에 세포의 분석. 데이터는 대조군 세포의 백분율의 평균 ± SD로 나타낸다. 도 16D, 사이클린 D1 및 사이클린 A의 발현. 모든 실험은 3회 반복 수행하고 각각의 분석은 4회 반복 수행하였다.
도 17A-17B. HDL 모방체, L-4F는 세포 배양 배지에서 CT26 세포의 LPA 유도된 생존력을 억제하고 세포 배양 배지에서 LPA 수준을 감소시킨다. 도 17A, CT26 세포는 실시예 5에 기술된 바와 같이 배양하고, 10 mg/mL의 L-4F 또는 5, 10, 20 mmol/L 농도의 LPA로 인큐베이션시키거나, 세포를 48시간 동안 L-4F 및 LPA 둘 모두로 처리하였다. 모든 실험은 3회 반복 수행하였고, 각각의 분석은 4회 반복 수행하였다. 데이터는 대조군 세포의 백분율의 평균 ± SD로 나타낸다. 도 17B, LPA 수준을 치료의 48시간 후 세포 배양 배지에서 측정하였다.
도 18A-18E. G*(L-[113-122]apoJ) 펩티드는 생체내 및 시험관내에서 L-4F와 유사한 효과를 가진다. 폐 종양을 실시예 5에서 기술된 바와 같은 BALB/c에서 확립하였다. 마우스를 CT26 세포를 꼬리 정맥 내로 주사한 3주 후 희생시켰다. 폐를 수거하고, 무게를 측정하였다. 폐 종양을 계수하였다. 도 18A, 나타낸 데이터는 마우스 사료에 투여된 100 mg/kg/d(2 mg/마우스/d)의 sc-4F(n 12), G* 펩티드(n 12)을 투여받은 마우스에 대한 폐 무게이다. P < 0.05. 도 18B, 나타낸 데이터는 A의 2 그룹 마우스로부터의 폐 표면 상에 종양 수이다. P < 0.0001. 도 18C, 세포는 MTS 분석을 사용해 생존력에 대해 분석하였다. P < 0.05. 도 18A 및 18B에 기술된 마우스로부터의 D, 혈청 LPA 수준은 실시예 5에 기술된 바와 같이 측정하였다. 도 18E, 웨스턴 블럿에 의한 사이클린 D1 및 사이클린 A의 발현. w/sc-4F, sc-4F로 처리한 마우스; w/G*, G* 펩티드로 처리한 마우스.
도 19. 다양한 HDL 모방 펩티드로 시험관내 처리된 CT26 세포는 비히클-처리된 대조군과 비교할 때, 처리 48시간 이내에 감소된(MTS 분석 당) 세포 생존력을 나타낸다. 분석된 HDL 모방체는 L-4F, L-4F2, K4,15-4F, K4,15-4F2, 및 ApoE 및 G*, 로부터 형성된 20개 아미노산 펩티드, LRKLRKRLLR LVGRQLEEFL(서열번호 1)였다.
도 20. CT26 세포의 피하 측부 주사를 투여받고 이후에 피하 HDL 모방 펩티드로 처리된 BALB/c 마우스는 종양 무게(좌측 패널) 및 종양 용적(오른쪽 패널)에서 현저한 감소를 보였다.
본 발명은 HDL-관련 분자가 전염증성 상태를 치료 및 예방하는데 사용될 수 있다는 발견에 기초한다. HDL-관련 분자는 ApoA-I, 소 HDL, 및 HDL 모방체를 포함한다. 하기에 더 상세하게 기술되는 바와 같이, 천연적 상태에서 전장 형태의 ApoA-I은 UV-유도된 세포 사멸 및 산화적 스트레스를 예방할 수 있다. HDL 모방체인 ApoA-I 및 HDL(bHDL)이 다양한 암의 치료 및 예방을 위해 사용할 수 있다는 예상밖의 발견이 또한 하기에 더 상세히 설명된다. ApoA-I 및 다른 HDL-관련 분자는 피부 상태, 및 암 및 알츠하이머병과 같은 다른 질환을 포함하는 전신성 전염증성 상태를 포함하는 전염증성 상태를 치료 및 예방하기 위한 강력하고 효과적인 제제를 제공한다. 치료되는 암에는 질, 외음부, 난소, 자궁경부, 자궁, 전립선, 결장, 유방, 췌장, 폐, 피부(예컨대, 흑색종), 뇌(예컨대, 교모세포종)의 암과 같은 상피암, 및 위암이 포함된다. 본 명세서에 기술된 HDL-관련 분자는 또한 노화 과정을 지연시키고, 산화적 스트레스를 감소 또는 제거하는데 사용될 수 있기 때문에,항-노화 치료에 사용될 수 있고, 황반 변성, 망막색소 변성증과 같은 눈 상태, 및 관절염과 같은 자가면역 질환의 치료에 사용될 수 있다.
본 발명은 산화적 스트레스에 노출된 상피 세포에서 사멸 및/또는 산화적 스트레스를 감소시키는 방법을 제공한다. 방법은 산화적 스트레스에 노출되기 전에 HDL-관련 분자와 상피 세포를 접촉시키는 것을 포함한다. 일부 실시양태에서, 산화적 스트레스는 자외선 복사에의 노출을 포함한다. 전형적인 실시양태에서, 접촉은 산화적 스트레스에 노출되기, 적어도 12-24시간 전에 발생한다.
정의
본 출원에서 사용된 모든 과학 및 기술 용어는 다르게 명시되지 않는 한 당해 기술 분야에서 통상적으로 사용되는 의미를 가진다. 본 출원에서 사용된 바와 같이, 다음의 단어 또는 어구는 명시된 의미를 가진다.
본 명세서에 기술된 바와 같이, "HDL-관련 분자"는 펩티드 및 합성 분자를 포함하는 ApoA-I, 소 HDL, 및 HDL 모방체를 의미한다.
본 명세서에 기술된 바와 같이, "ApoA-I"는 문맥이 명확히 다르게 지시하지 않는 한 전장 및 비변형된 ApoA-I를 나타낸다. 예를 들면, "ApoA-I 펩티드"는 전장 ApoA-I의 작은 부분을 나타낸다. 전형적으로 ApoA-I은 244개 아미노산의 28.2 kDa 단백질인 인간 ApoA-I이다.
본 명세서에 기술된 바와 같이, "HDL 모방체"는 전형적으로 강화된 효능을 갖는 HDL-관련 분자를 제공하는, HDL의 기능을 모방하는 변형된 아포지질단백질을 나타낸다. 전형적으로, 아포지질단백질은 하나 이상의 아미노산을 변경 또는 치환함으로써, 및/또는 키메라 HDL-관련 분자를 형성하기 위해 둘 이상의 HDL 펩티드를 결합함으로써 변형된다.
본 명세서에 기술된 바와 같이, "폴리펩티드"는 천연 근원으로부터 분리된 것, 재조합 기술에 의해 생산된 것 또는 화학적으로 합성되어진 것인지에 상관없는 단백질, 단백질 단편, 펩티드를 포함한다. 본 발명의 폴리펩티드는 전형적으로 적어도 약 6개 아미노산을 포함한다. 더 짧은 폴리펩티드, 예컨대 길이가 약 50개 아미노산보다 짧은 폴리펩티드가 "펩티드"로서 전형적으로 지칭된다.
본 명세서에 기술된 바와 같이, "벡터"는 숙주 세포에서 하나 이상의 관심 유전자(들) 또는 서열(들)을 전달, 및 바람직하게는 발현할 수 있는 구조물을 의미한다. 벡터의 예에는, 이들로 제한되는 것은 아니지만, 바이러스 벡터, 네이키드 DNA 또는 RNA 발현 벡터, 플라스미드, 코스미드 또는 파지 벡터, 양이온성 축합제와 연관된 DNA 또는 RNA 발현 벡터, 리포솜 내에 캡슐화된 DNA 또는 RNA 발현 벡터, 및 생산자 세포와 같은 특정한 진핵세포가 포함된다.
본 명세서에 기술된 바와 같이, "발현 조절 서열"은 핵산의 전사를 지시하는 핵산 서열을 의미한다. 발현 조절 서열은 구성적 또는 유도성 프로모터, 또는 인핸서와 같은 프로모터일 수 있다. 발현 조절 서열은 전사될 핵산 서열에 작동가능하게 연결된다.
용어 "핵산" 또는 "폴리뉴클레오티드"는 단일 또는 이중 가닥 형태의 데옥시리보뉴클레오티드 또는 리보뉴클레오티드 중합체를 나타내며, 다르게 제한되지 않는다면, 천연적으로 발생하는 뉴클레오티드와 유사한 방식으로 핵산에 혼성화하는 천연 뉴클레오티드의 공지된 유사체를 포함한다.
본 명세서에 사용된 바와 같이, "약학적으로 허용가능한 담체" 또는 "부형제"는 활성 성분과 결합하는 경우, 성분이 생물학적 활성을 유지하도록 허용하고, 개체의 면역 시스템과 비반응성인 임의의 물질을 포함한다. 예로는 인산염 완충된 식염수, 물, 오일/물 에멀전과 같은 에멀전, 및 다양한 종류의 습윤제가 포함된다. 에어로솔 또는 비경구 투여를 위해 바람직한 희석제는 인산염 완충된 식염수 또는 생리 식염수(0.9%)이다.
이러한 담체를 포함하는 조성물은 공지된 통상의 방법(예를 들면, 문헌 [Remington's Pharmaceutical Sciences, 18th edition, A. Gennaro, ed., Mack Publishing Co., Easton, PA, 1990]을 참조)에 의해 제형화된다.
본 명세서에 사용된 바와 같이, "하나(a 또는 an)"는 명확히 다르게 지시되지 않는 한 적어도 하나를 의미한다.
HDL
모방체
본 발명은 HDL 모방체로서 또한 작용하는 HDL 펩티드의 키메라 및 변형 및/또는 합성된 분자를 포함하는 HDL 모방체를 제공한다. 일 실시양태에서, 공지된 HDL 모방 펩티드에서 α-아미노이소부티르산(Aib)으로의 알라닌의 치환은 신규한 HDL 모방체(NHM)를 생성한다. 전형적인 실시양태에서, 키메라는 ApoA-I, ApoE 및 ApoJ로부터 선택되는 2개의 HDL 펩티드를 포함한다. 일 실시양태에서, HDL 모방체는 본 명세서의 하기에 기술되는 NHM 1-7을 생성하기 위해 Apo E의 10개 아미노산 펩티드로 키메라화된 ApoA-I의 18개 아미노산 펩티드에서 α-아미노이소부티르산(Aib)으로의 알라닌의 치환을 통해 수득된다. 다른 실시양태에서, HDL 모방체는 예를 들면, 신규한 HDL 모방체 LRKLRKRLLR LVGRQLEEFL(서열번호 1)을 생성하기 위해 ApoE 및 ApoJ(G*)를 결합함으로써 수득된다.
E18A(ref)에서 알라닌에 대한 Aib의 치환은 일련의 7개 NHM을 생성한다.
E18A 펩티드(ref)= LRKLRKRLLRDWLKAFYDKVAEKLKEAF(서열번호 2)
NHMs:
NHM1 = LRKLRKRLLRDWLKAibFYDKVAEKLKEAF(서열번호 3)
NHM2 = LRKLRKRLLRDWLKAFYDKVAibEKLKEAF (서열번호 4)
NHM3 = LRKLRKRLLRDWLKAFYDKVAEKLKEAibF(서열번호 5)
NHM4 - LRKLRKRLLRDWLKAibFYDKVAibEKLKEAF (서열번호 6)
NHM5 = LRKLRKRLLRDWLKAFYDKVAibEKLKEAibF(서열번호 7)
NHM6 = LRKLRKRLLRDWLKAibFYDKVAEKLKEAibF(서열번호 8)
NHM7 = LRKLRKRLLRDWLKAibFYDKVAibEKLKEAibF(서열번호 9)
참조: Oleg F Sharifov, et al., 2011, Apolipopritein E Mimetics and Cholesterol Lowering Properties, American Journal of Cardiovascular Drugs 11(6):371-381.
놀랍게도, 단독으로 또는 다른 항산화제와 병용하여, 본 명세서에 기술된 신규한 HDL 모방 펩티드는 전염증성 피부 및 암을 포함하는 전신성 전염증성 상태의 예방 및 치료를 위해 사용될 수 있다. 이들 분자는 전염증성 피부 및 암을 포함하는 전신성 전염증성 상태의 예방 및 치료를 위한 강하고 효과적인 항산화제를 제공한다. 이는 세포 배양 모델을 사용하는 원리에서 증명되었고, 동물 모델에서 종양 발달을 억제하기 위한 생체내 연구를 통해 밝혀졌다.
소
HDL
본 명세서에 기술된 바와 같은 소 HDL(bHDL)은 천연 단백질을 포함하고, 이종성 서열이 존재할 수 있다. 전형적으로, bHDL은 그의 천연, 전장, 비변형된 형태로 사용된다. 소 HDL은 전형적으로 혈청으로부터 정제되고, 예를 들면 Biomedical Technologies, Inc.(Stoughton, MA)로부터 구입할 수 있다. 소 HDL은 그의 높은 수준의 ApoA-I 및 높은 혈청 수준, 뿐만 아니라 인간에 투여하는 경우 적합성으로 인해 다른 종의 HDL에 비해 장점이 있다.
ApoA
-I 폴리펩티드
본 명세서에 기술된 바와 같이 ApoA-I 폴리펩티드는 천연 단백질을 포함하고, 이종성 서열이 존재할 수 있다. 전형적으로, ApoA-I은 그의 천연, 전장, 비변형되고 성숙한 형태로 사용되는 인간 ApoA-I이다.
NCBI 참조 서열: NP_000030.1(서열번호 10):
상기 서열에서, 시그널 펩티드는 아미노산 1-18이고, 성숙한 프로단백질은 아미노산 19-267이며, 성숙한 ApoA-I 단백질은 아미노산 25-267이다:
ApoA-I 펩티드, 및 특히 ApoA-I 모방 펩티드가 동일 영역에서의 사용을 위해 전장 ApoA-I 단백질과 비교하여, 유사한 기능 및/또는 생산의 용이성을 갖는 분자를 확인하기 위한 노력으로 개발되었지만, ApoA-I 모방 펩티드의 변형(예컨대, 알파-나선형 펩티드)은 이들을 천연 ApoA-I과 완전히 다르게 만든다. 사실상, 모방 펩티드는 전장 ApoA-I 단백질 분자와 어떠한 구조적 유사성도 공유하지 않는다. 게다가, 심혈관 치료 분야에서, 모방 펩티드는 덜 효과적이며 더 많은 양이 요구되므로 이들 펩티드의 치료적 사용은 비현실적이다. 흥미롭게도, 용어 모방 펩티드는 20년 전에 개발된 용어로서, 전장 ApoA-I 단백질과 일부 기능적 특성을 공유할 수 있는 구조적으로 유사하지 않은 분자를 확인하기 위한 시도를 나타낸다; 이들 알파-나선 펩티드와 전장 ApoA-I 분자 사이에는 어떠한 유사한 구조도 존재하지 않는다. 따라서, 용어 "모방 펩티드"는, 문맥 내에서, 미스노머(misnomer)인데, 이는 ApoA-I 전장 단백질이 그의 모방 펩티드와 구조적인 공통성을 전혀 공유하지 않기 때문이다. ApoA-I 모방 펩티드는 ApoA-I 전장 단백질 기능의 단지 일부 특성만을 모사하려고 시도된다.
변이체
폴리펩티드
본 발명의 폴리펩티드는 천연 단백질의 변이체를 포함할 수 있다. 본 명세서에 사용된 바와 같이 폴리펩티드 "변이체"는 폴리펩티드의 치료적 효능이 실질적으로 감소되지 않도록, 천연 단백질과 하나 이상의 치환, 결실, 부가 및/또는 삽입에서 상이한 폴리펩티드이다. 달리 말하면, 효능이 천연 단백질에 비해 강화 또는 불변할 수 있거나, 천연 단백질과 비교할 때, 50% 미만, 및 바람직하게는 20% 미만으로 감소될 수 있다. 바람직한 변이체는 N-말단 리더 서열과 같은 하나 이상의 부분이 제거된 것들을 포함한다. 다른 바람직한 변이체는 적은 부분(예컨대, 1-30개 아미노산, 바람직하게는 5-15개 아미노산)이 성숙한 단백질의 N- 및/또는 C-말단으로부터 제거되는 변이체를 포함한다. 폴리펩티드 변이체는 확인된 폴리펩티드에 대해 바람직하게는 적어도 약 70%, 더욱 바람직하게는 적어도 약 90% 및 가장 바람직하게는 적어도 약 95% 동일성(상기 기술된 바와 같이 결정됨)을 나타낸다.
바람직하게는, 변이체는 보존적 치환을 포함한다. "보존적 치환"은 펩티드 화학의 당업자가 실질적으로 변화되지 않을 이차 구조 및 폴리펩티드의 수치요법적(hydrophathic) 성질을 예측할 수 있도록, 아미노산이 유사한 특성을 갖는 다른 아미노산으로 치환되는 것이다. 아미노산 치환은 일반적으로 잔기의 극성, 전하, 용해도, 소수성, 친수성 및/또는 양친매성 성질을 기초로 하여 이루어질 수 있다. 예를 들면, 음성적으로 하전된 아미노산은 아스파르트산 및 글루탐산을 포함한다; 양성적으로 하전된 아미노산은 리신 및 아르기닌을 포함한다; 그리고 유사한 친수성 값을 갖는 비변화된 극성 헤드 그룹을 갖는 아미노산은 류신, 이소류신 및 발린; 글리신 및 알라닌; 아스파라긴 및 글루타민; 및 세린, 트레오닌, 페닐알라닌 및 티로신을 포함한다. 보존적 변화를 나타낼 수 있는 아미노산의 다른 그룹은 하기를 포함한다: (1) ala, pro, gly, glu, asp, gln, asn, ser, thr; (2) cys, ser, tyr, thr;(3) val, ile, leu, met, ala, phe; (4) lys, arg, his; 및 (5) phe, tyr, trp, his. 변이체는, 또한 또는 대안적으로, 비보존적 변화를 포함한다. 바람직한 실시양태에서, 변이체 폴리펩티드는 5개 아미노산 이하의 치환, 결실 또는 부가에 의해 천연 서열과 상이하다. 변이체는 또한(또는 대안적으로) 예를 들면 폴리펩티드의 면역원성, 이차 구조 및 수치요법적 성질에 대하여 최소의 영향을 미치는 아미노산의 결실 또는 부가에 의해 변형될 수 있다.
폴리펩티드의 제조
폴리펩티드는 단백질의 전이를 공동-번역 또는 번역-후 지시하는 단백질의 N-말단에서 시그널(또는 리더) 서열을 포함할 수 있다. 폴리펩티드는 또한 폴리펩티드의 합성, 정제 또는 확인의 용이성을 위해 링커 또는 다른 서열에 접합될 수 있다.
폴리펩티드는 혈청과 같은 천연 근원으로부터 정제될 수 있다. 일부 실시양태에서, 폴리펩티드는 조성물이 투여될 개체와 동일한 개체로부터 정제된다. 다른 실시양태에서, 폴리펩티드는 인간에게 투여하기 위해 소 HDL 또는 ApoA-I과 같은 이종성 종으로부터 정제된다.
본 명세서에 기술된 바와 같은 DNA 서열에 의해 인코딩된 재조합 폴리펩티드는 당업자에게 알려진 다양한 발현 벡터를 사용해 DNA 서열로부터 용이하게 제조될 수 있다. 발현은 재조합 폴리펩티드를 인코딩하는 DNA 분자를 함유하는 발현 벡터로 형질전환 또는 형질감염된 임의의 적합한 숙주 세포에서 달성될 수 있다. 적합한 숙주 세포는 원핵생물, 효모 및 더 고등의 진핵 세포를 포함한다. 바람직하게는, 적용되는 숙주 세포는 대장균, 효모, 곤충 세포 또는 포유동물 세포, 예컨대 COS 또는 CHO이다. 배양 배지 내로 재조합 단백질 또는 폴리펩티드를 분비하는 적절한 숙주/벡터 시스템으로부터의 상청액은 상업적으로 입수가능한 필터를 사용해 먼저 농축될 수 있다. 농축 후에, 농축물은 친화성 매트릭스 또는 이온 교환 수지와 같은 적절한 정제 매트릭스로 적용될 수 있다. 마지막으로, 하나 이상의 역상 HPLC 단계를 적용하여 재조합 폴리펩티드를 더 정제할 수 있다.
약 100개 아미노산 미만 및 일반적으로 약 50개 아미노산 미만을 갖는 부분 및 다른 변이체는 또한 당업자에게 잘 알려진 기술을 사용하는 합성 방식을 이용해 만들 수 있다. 예를 들면, 이러한 폴리펩티드는 Merrifield 고체상 합성 방법과 같은 상업적으로 입수가능한 임의의 고체상 기술을 사용해 합성될 수 있으며, 아미노산은 증가하는 아미노산 쇄에 연속적으로 첨가된다. 문헌 [Merrifield, J. Am. Chem. Soc. 85:2149-2146, 1963]를 참조하라. 폴리펩티드의 자동화 합성을 위한 장비는 Perkin Elmer/Applied BioSystems Division(Foster City, CA)과 같은 공급자로부터 상업적으로 입수가능하며, 제조자의 설명에 따라 작동될 수 있다.
폴리펩티드는 HPTU(O-벤조트리아졸N,N,N',N'-테트라메틸우로늄 헥사플루오로포스페이트) 활성을 갖는 FMOC 화학을 사용하여 Perkin Elmer/Applied Biosystems Division 430A 펩티드 합성기 상에서 합성될 수 있다. Gly-Cys-Gly 서열은 펩티드의 아미노 말단에 부착되어, 접합 방법, 고정된 표면에 결합, 또는 펩티드의 표지화를 제공할 수 있다. 고체 지지대로부터의 펩티드의 절단은 다음의 절단 혼합물을 사용해 수행될 수 있다: 트리플루오로아세트산:에탄디티올:사이오아니솔:물:페놀(40:1:2:2:3). 2시간 동안 절단 후, 펩티드를 차가운 메틸-t-부틸-에테르 중에 침전시킬 수 있다. 펩티드 펠렛은 그후 0.1% 트리플루오로아세트산(TFA)을 함유하는 물 중에 용해되고 동결건조된 후 C18 역상 HPLC에 의해 정제될 수 있다. 물 중에 0%-60% 구배의 아세토니트릴(0.1% TFA를 함유)이 펩티드를 용출하기 위해 사용될 수 있다. 순수한 분획의 동결건조 후, 펩티드는 전기분무 또는 다른 종류의 질량 분광분석법을 사용하고 아미노산 분석에 의해 특성화될 수 있다.
융합 단백질
일부 실시양태에서, 폴리펩티드는 본 명세서에 기술된 바와 같은 복합 폴리펩티드를 포함하거나, 본 명세서에 기술된 바와 같은 적어도 하나의 폴리펩티드 및 관련되지 않은 서열을 포함하는 융합 단백질이다. 일부 실시양태에서, 융합 단백질은 ApoA-I 폴리펩티드 및 면역원성 폴리펩티드를 포함한다. 면역원성 폴리펩티드는 예를 들면, 부가적인 단백질의 전부 또는 일부분을 포함할 수 있다.
부가적인 융합 파트너가 첨가될 수 있다. 융합 파트너는 예를 들면, 헬퍼 에피토프, 바람직하게는 인간에게 인식되는 T 헬퍼 에피토프의 지원(provision)을 보조함으로써 면역학적 융합 파트너로서 작용할 수 있다. 다른 예로서, 융합 파트너는 천연 재조합 단백질에 비해 더 높은 수율에서 단백질의 발현을 보조하는, 발현 인핸서로서 작용할 수 있다. 특정한 바람직한 융합 파트너는 면역학적 및 발현 강화 융합 파트너 둘 모두이다. 다른 융합 파트너는 단백질의 가용성을 증가시키거나 원하는 세포내 구획에 단백질이 표적되도록 만들기 위해 선택될 수 있다. 다른 추가적인 융합 파트너는 단백질의 정제를 촉진하는 친화성 태그를 포함한다.
융합 단백질은 일반적으로 화학적 접합을 포함하는 표준 기술을 사용해 제조될 수 있다. 바람직하게는, 융합 단백질은 발현 시스템에서 융합되지 않은 단백질에 비해, 증가된 수준의 생산을 허용하는 재조합 단백질로서 발현된다. 요약하면, 폴리펩티드 성분을 인코딩하는 DNA 서열은 개별적으로 조립될 수 있고, 적합한 발현 벡터 내로 결찰될 수 있다. 제1 폴리펩티드 성분을 인코딩하는 DNA 서열의 3' 말단은 제2 폴리펩티드 성분을 인코딩하는 DNA 서열의 5' 말단에 펩티드 링커와 함께 또는 펩티드 링커 없이 결찰되어, 서열의 리딩 프레임이 같은 위상에 있게 된다. 이는 성분 폴리펩티드 둘 모두의 생물학적 활성을 보유하는 단일 융합 단백질 내로의 번역을 허용한다.
펩티드 링커 서열은 각각의 폴리펩티드가 그의 2차 및 3차 구조 내로 접히도록 보장하기에 충분한 거리로 제1 및 제2 폴리펩티드 성분을 분리하기 위해 적용될 수 있다. 이러한 펩티드 링커 서열은 당해 분야에 잘 알려진 표준 기술을 사용해 융합 단백질 내로 통합된다. 적절한 펩티드 링커 서열은 다음의 인자를 기초로 하여 선택될 수 있다: (1) 유연하게 연장된 형태를 채택하기 위한 이들의 능력; (2) 제1 및 제2 폴리펩티드 상에 기능적 에피토프와 상호작용할 수 있는 이차 구조를 채택하기 위한 이들의 불능; 및 (3) 폴리펩티드 기능적 에피토프와 작용할 수 있는 소수성 또는 하전된 잔기의 부재. 바람직한 펩티드 링커 서열은 Gly, Asn 및 Ser 잔기를 함유한다. Thr 및 Ala와 같은 다른 인접 천연 아미노산이 또한 링커 서열에서 사용될 수 있다. 링커로서 유용하게 적용될 수 있는 아미노산 서열은 문헌 [Maratea et al., Gene 40:39-46, 1985; Murphy et al., Proc. Natl. Acad. Sci. USA 83:8258-8262, 1986; U.S. Patent No. 4,935,233 and U.S. Patent No. 4,751,180]에 개시된 것들을 포함한다. 일반적으로 길이가 1 내지 약 50개 아미노산일 수 있다. 제1 및 제2 폴리펩티드가 기능적 도메인을 분리하고 입체적 방해를 예방하기 위해 사용될 수 있는 비-필수적 N-말단 아미노산 영역을 갖는 경우 링커 서열이 필요하지 않다.
결찰된 DNA 서열은 적절한 전사 또는 번역 조절 요소에 작동적으로 연결된다. DNA 발현을 담당하는 조절 요소는 제1 폴리펩티드를 인코딩하는 DNA 서열에 대해 5'에 위치된다. 유사하게, 정지 코돈은 번역을 중지하도록 요구되고, 전사 종결 시그널을 제2 폴리펩티드를 인코딩하는 DNA 서열에 대해 3'에 존재한다.
융합 단백질은 또한 연관없는 면역원성 단백질과 함께 본 발명의 폴리펩티드를 포함하도록 제공된다. 바람직하게는 면역원성 단백질은 기억 반응을 이끌어낼 수 있다. 이런 단백질의 예에는 파상풍, 결핵 및 간염 단백질이 포함된다(예를 들면, 문헌 [Stoute et al., New Engl. J. Med. 336:86-91, 1997]을 참조하라).
바람직한 실시양태에서, 면역학적 융합 파트너는 그람-음성 박테리아 헤모필러스 인플루엔자 B(WO 91/18926)의 표면 단백질인 단백질 D로부터 유래한다. 바람직하게는, 단백질 D 유도체는 대략 단백질의 처음 3분의 1(예컨대, 처음 N-말단 100-110개 아미노산)을 포함하며, 단백질 D 유도체는 지질화될 수 있다. 다른 융합 파트너는 인플루엔자 바이러스, NS I(헤마글루티닌)로부터의 비-구조적 단백질을 포함한다. 전형적으로, 상이한 단편이 사용될 수 있는 T-헬퍼 에피토프를 포함한다고 하더라도, N-말달 81개 아미노산이 사용된다.
다른 실시양태에서, 면역학적 융합 파트너는 LYTA로서 공지된 단백질, 또는 이의 일부분(바람직하게는 C-말단 부분)이다. LYTA는 아미다제 LYTA(LytA 유전자에 의해 인코딩됨; Gene 43:265-292, 1986)로서 공지된 N-아세틸-L-알라닌 아미다제를 합성하는 스트렙토코커스 뉴모니아애( streptococcus pneumoniae )로부터 유래된다. LYTA는 펩티도글리칸 골격 내에 특정한 결합을 특이적으로 분해하는 자가분해효소이다. LYTA 단백질의 C-말단 도메인은 콜린 또는 DEAR과 같은 일부 콜린 유사체에 대한 친화성을 담당한다. 이러한 특성은 융합 단백질의 발현을 위해 유용한 플라스미드를 발현하는 대장균 C-LYTA의 개발에 이용되었다. 아미노 말단에 C-LYTA 단편을 함유하는 혼성화 단백질의 정제는 기술되었다(문헌 [Biotechnology 10:795-798, 1992]를 참조하라). 바람직한 실시양태에서, LYTA의 반복 부분은 융합 단백질 내로 포함될 수 있다. 반복 부분은 잔기 178에서 시작하는 C-말단 영역 내에서 발견될 수 있다. 특히 바람직한 반복 부분은 잔기 188-305를 포함한다.
일반적으로, 본 명세서에 기술된 바와 같은 (융합 단백질을 포함하는) 폴리펩티드 및 폴리뉴클레오펩티드는 단리된다. "단리된" 폴리펩티드 또는 폴리뉴클레오펩티드는 그의 본래 환경으로부터 제거되는 폴리펩티드 또는 폴리뉴클레오펩티드이다. 예를 들면, 천연적으로 발생하는 단백질은 천연 시스템에서 함께 존재하는 물질의 일부 또는 모두로부터 분리되는 경우 단리된다. 바람직하게는, 이러한 폴리펩티드는 적어도 약 90% 순수, 더욱 바람직하게는 적어도 약 95% 순수 및 가장 바람직하게는 적어도 99% 순수하다. 예를 들면, 폴레뉴클레오티드가 천연 환경의 일부가 아닌 벡터 내로 클로닝되는 경우, 폴리뉴클레오티드는 단리된 것으로 고려된다.
본 발명의 폴리뉴클레오티드
본 발명은 bHDL, ApoA-I 및 HDL 모방체를 포함하는 하나 이상의 HDL-관련 폴리뉴클레오티드를 인코딩하는 폴리뉴클레오티드를 제공한다. 임의의 이러한 서열에 완전히 상보적인 폴리뉴클레오티드가 또한 본 발명에 포함된다. 폴리뉴클레오티드는 단일-가닥(코딩 또는 안티센스) 또는 이중-가닥일 수 있고, siRNA를 포함하는(게놈, cDNA 또는 합성) DNA일 수 있다. RNA 분자는 인트론을 함유하고 일-대-일 방식으로 DNA 분자에 상응하는 HnRNA 분자, 및 인트론을 포함하지 않는 mRNA 분자를 포함한다. 추가적인 코딩 또는 비-코딩 서열은 본 발명의 폴리뉴클레오티드 내에 존재할 수 있으나, 필수적인 것은 아니며, 폴리뉴클레오티드는 다른 분자 및/또는 지지 물질에 연결될 수 있으나, 필수적인 것은 아니다. 이러한 폴리뉴클레오티드의 부분은 관련 분자의 증폭 및 검출을 위한 프라이머 및 프로브로서 유용할 수 있다.
폴리뉴클레오티드는 천연 서열(즉, HDL-관련 폴리펩티드 또는 이의 일부분을 인코딩하는 내인성 서열)을 포함할 수 있거나 이러한 서열의 변이체를 포함할 수 있다. 폴리뉴클레오티드 변이체는 천연 단백질에 비해 인코딩된 폴리뉴클레오티드의 면역원성이 저하되지 않도록 하나 이상의 치환, 부가, 결실 및/또는 삽입을 포함한다. 변이체는 천연 단백질 또는 이의 일부분을 인코딩하는 폴리뉴클레오티드 서열에 바람직하게는 적어도 약 70% 동일성, 더욱 바람직하게는 적어도 약 80% 동일성 및 가장 바람직하게는 적어도 약 90% 동일성을 나타낸다.
하기 기술된 바와 같이 최대 상응성을 위해 정렬되는 경우, 2개의 서열 내의 뉴클레오티드 또는 아미노산의 서열이 동일하다면, 2개의 폴리뉴클레오티드 또는 폴리펩티드 서열이 "동일한" 것이라고 여겨진다. 2개 서열 사이의 비교는 전형적으로 서열 유사성의 국소 부위를 확인하고 비교하기 위한 비교 윈도우에 걸쳐 비교함으로써 수행된다. 본 명세서에 사용된 바와 같은 "비교 윈도우(comparison window)"는 적어도 약 20개 인접 위치, 보통 30개 내지 약 75개 인접 위치, 40개 내지 약 50개 인접 위치의 분절을 나타내며, 서열은 2개의 서열이 최적 정렬된 후 동일한 수의 인접 위치의 참조 서열과 비교될 수 있다.
비교를 위한 서열의 최적 정렬은 디폴트 매개변수를 사용하는 생물정보학의 소프트웨어의 Lasergene suite(DNASTAR, Inc., Madison, WI) 내의 Megalign 프로그램을 사용해 수행될 수 있다. 이 프로그램은 다음의 참조에서 기술된 몇몇 정렬 방식을 포함한다: 문헌 [Dayhoff, M.O.(1978) A model of evolutionary change in proteins - Matrices for detecting distant relationships. In Dayhoff, M.O.(ed.) Atlas of Protein Sequence and Structure, National Biomedical Research Foundation, Washington DC Vol. 5, Suppl. 3, pp. 345-358; Hein J.(1990) Unified Approach to Alignment and Phylogenes pp. 626-645 Methods in Enzymology vol. 183, Academic Press, Inc., San Diego, CA; Higgins, D.G. and Sharp, P.M.(1989) CABIOS 5:151-153; Myers, E.W. and Muller W.(1988) CABIOS 4:11-17; Robinson, E.D.(1971) Comb. Theor. 11:105; Santou, N., Nes, M.(1987) Mol. Biol. Evol. 4:406-425; Sneath, P.H.A. and Sokal, R.R.(1973) Numerical Taxonomy the Principles and Practice of Numerical Taxonomy, Freeman Press, San Francisco, CA; Wilbur, W.J. and Lipman, D.J.(1983) Proc. Natl. Acad. Sci. USA 80:726-730].
바람직하게는, "서열 동일성 백분율"은 적어도 20개 위치의 비교 윈도우에 걸쳐 최적으로 정렬된 2개의 서열을 비교함으로써 결정되고, 비교 윈도우 내의 폴리뉴클레오티드 또는 폴리펩티드 서열의 부분은 2개 서열의 최적 정렬을 위한 참조 서열(부가 또는 결실을 포함하지 않음)과 비교하여, 20% 이하, 보통 5 내지 15% 이하, 또는 10 내지 12% 이하의 부가 또는 결실(즉, 갭)을 포함할 수 있다. 백분율은 위치의 수를 결정하여 계산하는데, 동일한 핵산 염기 또는 아미노산 잔기가 2개의 서열 모두에서 발생하여 부합된 위치의 수를 산출하고, 부합된 위치의 수를 참조 서열(즉, 비교 윈도우) 내의 위치의 총 수에 의해 나누고, 결과에 100을 곱하여 서열 동일성 백분율을 산출한다.
변이체는 또한, 또는 대안적으로, 천연 서열, 또는 이들의 부분 또는 보체와 실질적으로 상동성일 수 있다. 이러한 폴리뉴클레오티드 변이체는 천연 단백질(또는 상보성 서열)을 인코딩하는 DNA 서열을 천연적으로 발생시키는 온건한 엄중 상태 하에서 혼성화될 수 있다.
적합한 "온건한 엄중 상태"는 5 X SSC, 0.5% SDS, 1.0 mM EDTA(pH 8.0)의 용액 중에 예비세척; 밤새, 5 X SSC, 50℃-65℃에서 혼성화; 이어서 0.1% SDS를 함유하는 각각의 2X, 0.5X 및 0.2X SSC로 20분 동안 65℃에서 2회 세척하는 것을 포함한다.
본 명세서에 사용된 바와 같이, "고도의 엄중 조건" 또는 "고 엄중 조건"은 (1) 세척을 위해 저 이온 강도 및 고온을 적용, 예를 들면 50℃에서 0.015 M 나트륨 클로라이드/0.0015 M 시트르산 나트륨/0.1% 황산 도데실 나트륨; (2) 혼성화 동안 포름아미드와 같은 변성제 적용, 예를 들면, 42℃에서 750 mM 나트륨 클로라이드, 75 mM 시트르산 나트륨과 함께 0.1% 소 혈청 알부민/0.1% 피콜/0.1% 폴리비닐피롤리돈/50 mM 인산 나트륨 완충액을 포함하는 50%(v/v) 포름아미드; 또는 (3) 42℃에서 50% 포름아미드, 5 x SSC(0.75 M NaCl, 0.075 M 시트르산 나트륨), 50 mM 인산 나트륨(pH 6.8), 0.1% 피로인산 나트륨, 5 x Denhardt's 용액, 초음파처리된 연어 정액 DNA(50 ㎍/㎖), 0.1% SDS, 및 10% 황산 덱스트란을 적용, 42℃에서 0.2 x SSC(나트륨 클로라이드/시트르산 나트륨) 및 55℃에서 50% 포름아미드로의 세척, 이어서 55℃에서 EDTA를 함유하는 0.1 x SSC로 구성되는 고-엄중 세척을 적용하는 것이다. 당업자는 프로브 길이 등과 같은 인자를 제공하기에 필요한 바와 같은 온도, 이온 강도, 등을 조정하는 방법을 인식할 것이다.
당업자는 유전자 코드의 축퇴의 결과로서, 본 명세서에 기술된 바와 같은 폴리펩티드를 인코딩하는 많은 뉴클레오티드 서열이 존재하는 것을 이해할 것이다. 이들 폴리뉴클레오티드의 일부는 임의의 천연 유전자의 뉴클레오티드 서열과 최소 상동성을 가진다. 그럼에도 불구하고, 코돈 사용빈도에서의 차이로 인해 다양한 폴리뉴클레오티드가 본 발명에 특이적으로 포함된다. 추가로, 본 명세서에 제공된 폴리뉴클레오티드 서열을 포함하는 유전자의 대립유전자는 본 발명의 범주 이내이다. 대립유전자는 뉴클레오티드의 결실, 부가 및/또는 치환과 같은 하나 이상의 돌연변이의 결과로서 변형되는 내인성 유전자이다. 생성되는 mRNA 및 단백질은 변형된 구조 또는 기능을 가질 수 있으나, 필수적인 것은 아니다. 대립유전자는 표준 기술(예컨대, 혼성화, 증폭 및/또는 데이터베이스 서열 비교)을 이용해 확인될 수 있다.
폴리뉴클레오티드는 당해 분야에 알려진 임의의 다양한 기술을 사용해 제조될 수 있다. ApoA-I 단백질을 인코딩하는 DNA는 상응하는 mRNA를 발현하는 조직으로부터 제조된 cDNA 라이브러리로부터 수득될 수 있다. 따라서, 인간 ApoA-I DNA는 인간 조직으로부터 제조된 cDNA 라이브러리로부터 편리하게 수득될 수 있다. ApoA-I 단백질-인코딩 유전자는 또한 게놈 라이브러리로부터 또는 올리고뉴클레오티드 합성에 의해 수득될 수 있다. 라이브러리는 관심 유전자를 확인하기 위해 고안된 프로브(예컨대, ApoA-I 또는 적어도 약 20-80개 염기의 올리고뉴클레오티드에 대한 항체) 또는 프로브에 의해 인코딩된 단백질을 사용해 스크리닝될 수 있다. 선택된 프로브를 사용한 cDNA 또는 게놈 라이브러리의 스크리닝은 문헌 [Sambrook et al., Molecular Cloning : A Laboratory Manual(New York: Cold Spring Harbor Laboratory Press, 1989)]에 기술된 것과 같은 표준 절차를 사용해 수행될 수 있다. ApoA-I를 인코딩하는 유전자를 단리하기 위한 대안적인 방식은 PCR 방법론을 사용하는 것이다(Sambrook et al., supra; Dieffenbach et al., PCR Primer : A Laboratory Manual(Cold Spring Harbor Laboratory Press, 1995)).
프로브로서 선택되는 올리고뉴클레오티드 서열은 거짓 양성이 최소화되도록 충분히 길고 명백해야만 한다. 올리고뉴클레오티드는 바람직하게는 스크리닝되는 라이브러리 내에 DNA에 혼성화 시 검출될 수 있도록 표지된다. 표지시키는 방법은 당해 기술분야에 잘 알려져 있으며, 32P-표지된 ATP와 같은 방사성 동위원소의 사용, 바이오티닐화 또는 효소 표지화를 포함한다. 온건 엄중 및 고 엄중을 포함하는 혼성화 조건은 문헌 [Sambrook et al., supra]에 제공된다.
폴리뉴클레오티드 변이체는 일반적으로 예를 들면, 고체상 포스포라미디트 화학 합성에 의한 화학 합성을 포함하는 당해 기술분야의 알려진 임의의 방법을 사용해 제조될 수 있다. 폴리뉴클레오티드 서열 내의 변형은 또한 올리고뉴클레오티드-지시된 부위 특이적 돌연변이화와 같은 표준 돌연변이화 기술을 사용해 도입될 수 있다(문헌 [Adelman et al., DNA 2:183, 1983]을 참조하라). 대안적으로, RNA 분자는 DNA가 적절한 RNA 폴리머라제 프로모터(예컨대, T7 또는 SP6)를 사용해 벡터 내로 포함되는 경우, ApoA-I 단백질, 또는 이의 부분을 인코딩하는 DNA 서열의 시험관내 또는 생체내 전사에 의해 만들어질 수 있다. 특정 부분은 본 명세서에 기술된 바와 같은 인코딩된 폴리펩티드를 제조하기 위해 사용될 수 있다. 추가로, 또는 대안적으로, 일 부분은 인코딩된 폴리펩티드가 생체내에서 만들어지도록 환자에게 투여될 수 있다.
임의의 폴리뉴클레오티드는 생체내 안정성을 증가시키기 위해 더 변형될 수 있다. 가능한 변형은, 이들로 제한되는 것은 아니지만, 5' 및/또는 3' 말단에서 측부 서열의 부가; 백본에서 포스포디에스테라제 결합보다 포스포로티오에이트 또는 2' O-메틸의 사용; 및/또는 이노신, 퀘오신 및 와이부토신, 뿐만 아니라 아세틸-, 메틸-, 티오- 및 다른 변형된 형태의 아데닌, 시티딘, 구아닌, 티민 및 유리딘과 같은 비전형적 염기의 혼입을 포함한다.
뉴클레오티드 서열은 확립된 재조합 DNA 기술을 사용하는 다양한 다른 뉴클레오티드 서열에 연결될 수 있다. 예를 들면, 폴리뉴클레오티드는 플라스미드, 파지미드, 람다 파지 유도체 및 코스미드를 포함하는 다양한 클로닝 벡터 내로 클로닝될 수 있다. 특정 관심의 벡터에는 발현 벡터, 복제 벡터, 프로브 생성 벡터 및 서열화 벡터가 포함된다. 일반적으로, 벡터는 적어도 하나의 유기체에서 기능하는 복제 기원, 편리한 제한 엔도뉴클레아제 부위 및 하나 이상의 선택가능한 마커를 함유할 것이다. 다른 요소는 원하는 용도에 따라 달라질 것이며, 당업자에게 자명할 것이다.
특정한 실시양태에서, 폴리뉴클레오티드는 포유동물의 세포 내로 진입을 허용하고, 그 세포 내에서 발현을 허용하도록 제형화될 수 있다. 이러한 제형은 하기 기술되는 바와 같이, 치료 목적을 위해 특히 유용하다. 당업자는 표적 세포 내에서 폴리뉴클레오티드의 발현을 달성하는 많은 방법이 있고, 임의의 적절한 방법이 적용될 수 있다는 것을 이해할 것이다. 예를 들면, 폴리뉴클레오티드는, 이들로 제한되는 것은 아니지만, 아데노바이러스, 아데노-관련 바이러스, 레트로바이러스, 또는 백시니아 또는 다른 폭스 바이러스(예컨대, 조류 폭시 바이러스)와 같은 바이러스 벡터 내로 통합될 수 있다. 이러한 벡터 내로 DNA를 통합하기 위한 기술은 당업자에게 잘 알려져 있다. 레트로바이러스 벡터는 (형질유도된 세포의 확인 및 선택을 보조하기 위한) 선택가능한 마커, 및/또는 특이적 벡터 표적을 만들기 위해, 특이적 표적 세포 상의 수용체에 대한 리간드를 인코딩하는 유전자와 같은, 표적화 모이어티를 추가적으로 전이 또는 통합시킬 수 있다. 표적화는 또한 당업자에게 알려진 방법에 의해, 항체를 사용해 달성될 수 있다.
치료 목적을 위한 다른 제형은 거대분자 복합체, 나노캡슐, 미소구체, 비드와 같은 콜로이드성 분산 시스템, 및 에멀전, 미셀(micelle), 혼합 미셀, 및 리포솜을 포함하는 지질-기반 시스템을 포함한다. 시험관내 및 생체내에서 전달 비히클로서 사용하기에 바람직한 콜로이드성 시스템은 리포솜(즉, 인공 막 소포)이다. 이러한 시스템의 제조 및 사용은 당해 분야에 잘 알려져 있다.
약학 조성물
본 발명은 ApoA-I 폴리펩티드, 폴리뉴클레오티드, 및 약학 조성물 내로 포함되는 관련 분자를 제공한다. 전형적인 실시양태에서, 폴리펩티드는 천연, 전장, 비변형 형태의 ApoAI이다. 당해 분야에서 이해되는 바와 같이, ApoAI는 고-밀도 지질단백질(HDL)의 중요한 성분이다. 따라서, HDL을 투여함으로써 ApoAI가 투여될 수 있다.
약학 조성물은 하나 이상의 이러한 화합물, 및 선택적으로 생리학적으로 허용가능한 담체를 포함한다. ApoAI의 투여는 예컨대 미셀을 형성하기 위한, 불활성 지질을 이용한 제조에 의해 촉진된다. 전형적인 실시양태에서, ApoAI는 경구 보충물의 부분으로서 경구 투여된다. 대안적으로, ApoAI는 개체의 피부에 부착된 패치를 통해서와 같이 경피적으로 투여될 수 있다.
당업자에게 공지된 임의의 적절한 담체가 본 발명의 약학 조성물에 적용될 수 있지만, 담체의 종류는 투여 방식에 따라 달라질 것이다. 본 발명의 조성물은 예를 들면, 국부, 경구, 비강, 정맥내, 두개내, 복강내, 피하, 피내, 경피 또는 근육내 투여를 포함하는 임의의 적합한 투여 방식을 위해 제형화될 수 있다. 피하 주사와 같은 비경구 투여의 경우, 담체는 바람직하게는 지방, 및 선택적으로 물, 염수, 알코올, 왁스 또는 버터를 포함한다. 경구 투여의 경우, 임의의 상기 담체 또는 고체 담체, 예컨대 만니톨, 락토스, 전분, 스테아르산 마그네슘, 사카린 나트륨, 탈크, 셀룰로스, 글루코스, 수크로스, 및 탄산 마그네슘이 적용될 수 있다. 생분해성 미소구체(예컨대, 폴리락테이트 폴리글리콜레이트)가 또한 본 발명의 약학 조성물을 위한 담체로서 적용될 수 있다.
추가로, 담체는 제형의 pH, 삼투압, 점성, 선명도, 색, 무균도, 안정성, 용해율, 향을 변경 또는 유지하기 위한 다른 약학적으로-허용가능한 부형제를 함유할 수 있다. 유사하게, 담체는 안정성, 용해율, 방출, 또는 분자의 혈액-뇌 장벽을 관통하는 흡수 또는 통과를 변경 또는 유지하기 위한 또 다른 약학적으로-허용가능한 부형제를 함유할 수 있다. 이러한 부형제는 일반적 및 관례적으로 유닛 투여량 또는 복합-투여량 형태로 비경구 투여를 위해, 또는 이식된 펌프로부터 지속적이거나 주기적인 투입에 의해 CSF 내로 직접 투입을 위해 투여량을 제형화하기 위해 적용되는 것들이다.
이러한 조성물은 또한 완충액(예컨대, 중성 완충된 염수 또는 인산 완충 식염수), 탄수화물(예컨대, 글루코스, 만노스, 수크로스 또는 덱스트란), 만니톨, 단백질, 폴리펩티드 또는 글리신과 같은 아미노산, 항산화제, EDTA 또는 글루타티온과 같은 킬레이트제, 애쥬번트(예컨대, 수산화 알루미늄) 및/또는 보존제를 포함할 수 있다. 대안적으로, 본 발명의 조성물은 리오필리제이트(lyophilizate)로서 제형화될 수 있다. 화합물은 또한 잘 알려진 기술을 사용해 리포솜 내에서 캡슐화될 수 있다.
약학 조성물은 상기 기술된 바와 같이 하나 이상의 폴리펩티드를 인코딩하는 DNA를 함유하여, 폴리펩티드가 동일반응계(in situ)에서 만들어질 수 있다. 상기 언급한 바와 같이, DNA는 핵산 발현 시스템, 박테리아 및 바이러스 발현 시스템을 포함하는 당업자에게 공지된 다양한 전달 시스템 내에 존재할 수 있다. 수많은 유전자 전달 기술, 예컨대 문헌 [Rolland, Crit. Rev. Therap. Drug Carrier Systems 15:143-198, 1998], 및 그 문헌에서 인용된 참조문헌에 설명된 것들이, 당해 기술분야에 잘 알려져 있다. 적합한 핵산 발현 시스템은 환자에서 발현하기 위해 필수적인 DNA 서열(예컨대, 적절한 프로모터 및 종결 시그널)을 함유한다. 박테리아 전달 시스템은 박테리아 세포 표면 상에 폴리펩티드의 면역원성 부분을 발현하거나 에피토프 같은 것을 분비하는 박테리아(예컨대 Bacillus - Calmette - Guerrin )의 투여를 수반한다.
바람직한 실시양태에서, DNA는 비-병원성(결손), 복제 가능 바이러스의 사용과 관련될 수 있는 바이러스 발현 시스템(예컨대, 백시니아 또는 다른 폭스 바이러스, 레트로바이러스, 또는 아데노바이러스)을 사용해 도입될 수 있다. 적절한 시스템은 예를 들면, 문헌 [Fisher-Hoch et al., Proc. Natl. Acad. Sci. USA 86:317-321, 1989; Flexner et al., Ann. N. Y. Acad Sci. 569:86-103, 1989; Flexner et al., Vaccine 8:17-21, 1990; U.S. Patent Nos. 4,603,112, 4,769,330, and 5,017,487; WO 89/01973; U.S. Patent No. 4,777,127; GB 2,200,651; EP 0,345,242; WO 91/02805; Berkner-Biotechniques 6:616-627, 1988; Rosenfeld et al., Science 252:431-434, 1991; Kolls et al., Proc. Natl. Acad. Sci. USA 91:215-219, 1994; Kass-Eisler et al., Proc. Natl. Acad. Sci. USA 90:11498-11502, 1993; Guzman et al., Circulation 88:2838-2848, 1993; and Guzman et al., Cir. Res. 73:1202-1207, 1993]에 개시되어 있다. 이러한 발현 시스템 내로 DNA를 통합하기 위한 기술은 당업자에게 잘 알려져 있다. DNA는 또한 예를 들면, 문헌 [Ulmer et al., Science 259:1745-1749, 1993 and reviewed by Cohen, Science 259:1691-1692, 1993]에 기술된 바와 같이, "네이키드"일 수 있다. 네이키드 DNA의 흡수는, 세포 내로 효과적으로 이동되는, 생분해성 비드 상에 DNA를 코팅하여 증가될 수 있다.
임의의 다양한 애쥬번트가 본 발명의 조성물 중에 적용될 수 있다. 대부분의 애쥬번트는 수산화 알루미늄 또는 미네랄 오일과 같은 신속한 이화작용으로부터 펩티드를 보호하기 위해 고안된 물질, 예컨대 지질 A, 보르타델라 페르투시스( Bortadella pertussis ) 또는 마이크로박테리움 투베르큘로리스( Mycobacterium tuberculosis ) 유도된 단백질과 같은 면역 반응의 자극제를 함유한다. 적절한 애주번트는 예를 들면, 프로인트 불완전 애쥬번트(Freund's Incomplete Adjuvant) 및 완전 애쥬번트(Complete Adjuvant); 머크 애쥬번트(Merck Adjuvant) 65(Merck and Company, Inc., Rahway, NJ); 수산화 알루미늄 겔(alum) 또는 인산 알루미늄과 같은 알루미늄 염; 칼슘, 철 또는 아연의 염; 아실화된 티로신 아실화된 당의 불용성 현탁액; 양이온 또는 음이온적으로 유도체화된 폴리사카라이드; 폴리포스파젠 생분해성 미소구체; 모노포스포릴 지질 A 및 퀼(quil) A와 같이 상업적으로 입수가능한 것들이다. GM CSF 또는 인터루킨-2, -7, 또는 -12와 같은 사이토카인이 또한 애쥬번트로서 사용될 수 있다.
본 명세서에 기술된 조성물은 서방성 제형(즉, 투여 후 화합물의 느린 방출에 영향을 미치는 캡슐 또는 스폰지와 같은 제형)의 부분으로서 투여될 수 있다. 이러한 제형은 일반적으로 잘 알려진 기술을 사용해 제조될 수 있으며, 예를 들면 경구, 직장 또는 피하 이식에 의해 투여되거나, 종양의 외과적 절제 부위와 같은 원하는 표적 부위에 이식시킴으로써 투여될 수 있다. 서방성 제형은 속도 조절 막(rate controlling membrane)으로 둘러싸인 저장소 내에 함유되고/함유되거나 캐리어 매트릭스 내에 분산된 폴리펩티드, 폴리뉴클레오티드 또는 항체를 함유할 수 있다. 이러한 제형 내에서 사용하기 위한 담체는 생적합성이며, 또한 생분해성일 수 있으며; 바람직하게는 제형은 활성 성분 방출의 비교적 일정한 수준을 제공한다. 서방성 제형 내에 함유된 활성 화합물의 양은 이식 부위, 방출 속도 및 예상 시간과, 치료되거나 예방될 상태의 성질에 따라 달라질 것이다.
투여 및 투여랑
조성물은 임의의 적절한 방식으로, 종종 약학적으로 허용가능한 담체와 함께 또는 약학적으로 허용가능한 염의 형태로 투여된다. 본 발명의 문맥에서 ApoA-I를 개체에게 투여하는 적합한 방법이 이용가능하며, 하나 이상의 경로를 특정 조성물의 투여에 사용할 수 있다고 하더라도, 특정 경로는 종종 다른 경로보다 더 즉각적이고 더 효과적인 반응을 제공할 수 있다.
본 발명의 문맥에서, 환자에게 투여되는 투여량은 시간에 걸쳐 환자에서 치료 반응에 이로운 영향을 미치거나, 질환 진행을 억제하기에 충분해야만 한다. 따라서, 조성물은 질환으로부터의 증상 및/또는 합병증을 완화, 감소, 또는 치료 또는 적어도 부분적으로 중단시키기에 충분한 양으로 개체에게 투여된다. 이를 달성하기에 충분한 양은 "치료학적 유효량"으로서 정의된다. 일반적으로, 하나 이상의 폴리펩티드를 포함하는 약학 조성물의 경우, 각각의 폴리펩티드의 양은 숙주 kg 당 약 100 ㎍ 내지 5 mg 투여량 범위 내에 존재한다. 적절한 용적은 환자 크기에 따라 다양할 것이지만, 전형적으로 약 0.1 mL 내지 약 5 mL 범위일 것이다.
본 명세서에 개시된 치료 조성물의 투여의 경로 및 빈도, 뿐만 아니라 투여량은 개개인 마다 다양할 것이며, 표준 기술을 사용하여 용이하게 확립될 수 있다. 일반적으로, 약학 조성물은 주사(예컨대, 피내, 종양내, 근육내, 정맥내 또는 피하), 비강내(예컨대, 흡인) 또는 경구로 투여될 수 있다. 바람직하게는, 1 내지 10 투여량이 52주 기간을 통해 투여될 수 있다. 바람직하게는 6 투여량이 1개월 간격으로 투여되고, 그 후에 추가 접종(booster vaccination)이 주기적으로 제공될 수 있다. 대체 프로토콜은 개별 환자를 위해 적합할 것이다. 일 실시양태에서, 2 이상의 경구 보충물이 10일 간격으로 투여된다.
일반적으로, 적합한 투여량 및 치료 레지멘은 치료 및/또는 예방적 이익을 제공하기에 충분한 양의 활성 화합물(들)을 제공한다. 이러한 반응은 치료받지 않은 환자와 비교하여 치료받은 환자에서 개선된 임상 결과(예컨대, 더 흔한 완화, 완전하거나 부분적인, 또는 더 긴 무 질환 생존)를 확립함으로써 모니터링될 수 있다.
치료는 예방 및 요법을 포함한다. 예방 또는 요법은 단일 또는 복합 부위로 단일 시점 또는 복합 시점에서 단일 투여함으로써 달성될 수 있다. 투여는 또한 복합 부위로 거의 동시 투여될 수 있다. 환자 또는 개체는 인간, 소, 말, 개, 고양이, 돼지 및 양과 같은 포유동물을 포함한다. 전형적은 실시양태에서, 치료는 개체에게 천연, 비변형, 전장 형태의 ApoAI를 투여하는 것을 포함한다.
실시예
다음의 실시예는 본 발명을 설명하며, 본 발명을 구성하고 사용하는데 당업자를 보조하기 위해 나타낸다. 실시예는 본 발명의 범주를 다르게 제한하지 않는 임의의 방식으로 의도되지 않는다.
실시예
1:
ApoA
-I는
NIH
-3
T3
섬유아세포에서
UV
-유도된 세포 사멸 및
산화적
스트레스를 예방한다.
본 실시예는 ApoA-I이 NIH-3T3 섬유아세포(피부 세포)에서 UV-유도된 세포 사멸 및 산화적 스트레스를 예방함을 증명한다. NIH 3T3(1x106)세포를 4개의 개별 플레이트로 96 웰 플레이트 중에 접종하였다. 24시간 후, 세포를 밤새 단식시켰다. Apo A-I을 농도(10 ㎍/㎖)로 24시간 동안 세포에 처리하였다. 세포를 처리한 후 PBS로 세척하였다. 1개의 플레이트는 UV 없이 대조군으로서 사용하였다. 나머지 3개의 플레이트는 5, 10, 및 20 mJ/cm2에서 UV 처리에 사용하였다. UV 처리 후에, 세포를 완전 배지에 넣고 24시간 동안 더 배양하였다. 세포 생존력을 이전 기술된 바와 같이(문헌 [Ganapathy E, et al., 2011, D-4F, an apoA-l mimetic peptide inhibits proliferation and tumorigenicity of epithelial ovarian cancer cells by upregulating the antioxidant enzyme MnSOD, Int J Cancer 130:1071-1081]) 모든 플레이트에 대해 측정하였다.
결과는 UV 처리가 NIH3T3 세포에서 세포 생존력을 감소시켰음을 보여주었다(도 1). ApoA-I 처리(10 ㎍/㎖)는 UV-유도된 세포 사멸로부터 NIH3T3 세포를 보호한다(도 2). ApoA-I과 같이 HDL과 또한 관련된 단백질인 ApoA-II는 NIH3T3 세포의 UV-유도된 세포 사멸을 예방하지 않았다(도 2). 따라서, ApoA-I은 NIH-3T3 섬유아세포(피부 세포)에서 UV-유도된 세포 사멸 및 산화적 스트레스를 효과적으로 예방한다. ApoA-I은 전-염증성 피부 상태의 예방 및 치료에 잠재적인 역할을 한다.
실시예
2: 소
HDL
을 사용한 종양 성장 및 발달 억제
본 실시예는 bHDL(소 HDL)이 결장암 마우스 모델에서 종양 성장 및 발달과 같은 전-염증성 상태에 영향을 미침을 증명한다. bHDL은 피하 또는 경구 투여되는 경우, CT26 세포, 마우스 결장 선암 세포주의 생존력 및 증식을 감소시키고 BALB/c 마우스에서 CT26 세포-매개된 종양 부담(burden)을 저하시킨다. 결장암에 대한 혈청 바이오마커인 리소포스파티드산(LPA)의 혈장 수준은 bHDL 모방체가 투여된 마우스에서 현저하게 감소하였는데, 이는 전-염증성 지질의 결합 및 제거가 bHDL에 의한 종양 발달의 억제를 위한 잠재적인 기전임을 제안한다. 더욱이, bHDL은 인간 가족성 선종성 용종증에 대한 마우스 모델인 APCmin /+ 마우스에서 폴립의 크기 및 수를 현저하게 감소시켰다.
최근의 연구는 HDL 수준이 결장암 위험과 역비례하여 관련됨을 제안한다. 다양한 구조를 갖는 많은 펩티드 및 단백질로부터 구성된 HDL 모방체 또한 HDL을 연상시키는 항-염증 및 항산화 특성을 보유한다. 본 실시예에서 나타낸 결과는 bHDL 분자가 결장의 암과 같은 유도성 및 자발성 둘 모두의 전-염증 상태의 발달을 억제하는데 효과가 있음을 보여준다. 이들 결과는, 최초로, 결장암의 예방 및 치료로서 본 명세서에 예시된, 전-염증성 상태의 치료를 위한 신규한 치료 전략으로서의 bHDL을 확인한다.
마우스
로스앤젤레스의 캘리포니아 대학교의 동물 연구 위원회(Animal Research Committee at the University of California at Los Angeles)가 모든 마우스 프로토콜을 승인하였다. 6주령 BALB/c 암컷 및 6주령 C57BL/6J-APCMin /+ 숫컷 마우스는 Jackson Laboratory로부터 구입하였다.
bHDL
bHDL은 Biomedical Technologies Inc로부터 구입하였다. 식이 중에 bHDL의 투여를 위해, 본질적으로 웨스턴 식이를 위해 이전 기술된 바와 같은 기술을 사용하여 bHDL을 표준 마우스 사료(Ralston Purina) 내로 혼합하였다(18). 그러나, 본 명세서에 보고된 임의의 실험에서 웨스턴 식이를 투여하지는 않았으며; 마우스는 오로지 bHDL 함유 또는 비함유 표준 마우스 사료를 제공받았다.
세포-배양 실험
BALB/c 기원의 N-니트로소-N-메틸 우레탄-유도된 마우스 결장 암종 유래 CT26 세포주는 American Type Culture Collection(ATCC)로부터 구입하였다. 먼저 CT26 세포(웰당 2,000개 세포)를 96-웰 배양 플레이트에서 완전 배지 중에 배양하고, 24시간 후 배지를 무혈청 배지로 교체하였다. 밤새 인큐베이션시킨 후, 세포를 비히클(대조군)로 처리하거나, 10 ㎍/mL의 bHDL로 처리하였다. bHDL을 H2O 중에 용해시켰다. 세포를 48시간 더 인큐베이션시키고, 제조자의 프로토콜에 따라 MTS 분석 키트(Promega)를 사용해 생존력을 분석하였다. 증식 분석을 위해, 세포를 48시간 인큐베이션 중 마지막 4시간 동안 BrdU로 표지하였다. 이어서 세포를 세척하고, 고정시키고, 실온에서 1시간 동안 마우스 항-BrdU 항체로 인큐베이션시키고, 퍼옥시다제-결합된 염소 항-마우스 이차 항체(Calbiochem)에 의해 검출하였다. 흡광도는 이중 파장 450 및 540 nm을 사용해 측정하였다.
종양 부하(
Tumor
-
Load
) 연구
6주령 BALB/c 암컷 마우스에게 PBS 중에 단일 세포 현탁액으로서 제조한 1 x 106 CT26 세포 100 ㎕를 피하 주사하고, 마우스를 10 mg/kg bHDL 또는 BHDL로 15일 동안 매일 피하(SQ) 투여하여 처리하였다. 마우스를 희생시키고 종양 무게를 측정하였다.
생체내
폐전이{
Pulmonary
Metastasis
}
BALB/c 마우스에게 꼬리 정맥 주사를 통해 PBS 중에 100 ㎕의 2 x 104 CT26 세포를 정맥내 주사하고, 마우스를 3주 동안 10 mg/kg/일 bHDL로 SQ 투여하여 처리하거나; 또는 3주 동안 사료 식이 중에 100 mg/kg/일 bHDL로 투여하여 처리하였다. 3주 처리 후, 마우스를 희생시키고; 폐를 수확하여, 무게를 재고, Bouin 용액(Sigma)으로 고정시켰다. 폐 표면 상에 종양 결절을 계수하였다.
APC
Min
/+
마우스 연구
C57BL/6J 배경을 갖는 6주령 APC Min /+ 수컷 마우스를 사료 식이 중에 100 mg/kg/일 bHDL로 투여하여 처리하였다. 8주 처리 후, 마우스를 희생시켰다. 창자 전체를 즉시 제거하고, 포르말린 및 70% 에탄올 중에 고정시켰다. 창자를 개방하고 해부 현미경 하에서 검사하여 종양을 계수하고 측정하였다.
면역조직화학(
IHC
) 염색
폐 표면으로부터의 종양 조직을 고정시키고, 파라핀으로 포매하고, 5 ㎛ 두께로 절단하였다. 절단면을 자일렌으로 탈파라핀화하고, 100%, 90%, 70%, 및 50% 에탄올로 재수화하고, 30분 동안 20 ㎍/mL인 프로티나제 K로 처리하고, 내인성 퍼옥시다제를 억제하기 위해 실온에서 30분 동안 3% H2O2로 처리하고, 3시간 동안 10% 정상 염소 혈청 및 PBS 중에 제조한 4% BSA로 블로킹시킨 후, 4℃에서 밤새 1:50 랫트 항-마우스 모노클론 CD31 항체로 인큐베이션시켰다. 절단면을 상응하는 바이오티닐화된 이차 항체로 인큐베이션시키고, 이어서 Vectastain ABC Elite 시약으로 인큐베이션시켰다.
세포 주기 분석
CT26 세포를 밤새 6-웰 플레이트에서 배양시킨 후, 48시간 동안 혈청 결핍시켰다. 세포를 비히클(대조군)으로 처리하거나, BHDL 또는 G* bHDL 10 ㎍/mL로 처리하고, 48시간 더 인큐베이션시켰다. 세포를 수집하고 PBS로 세척하고, 4℃에서 얼음처럼 차가운 70% 메탄올로 밤새 고정시켰다. 고정된 세포를 원심분리로 수집하고, PBS로 세척하고, 40 ㎍/mL RNaseA 및 100 ㎍/mL 프로피디움 요오드화물을 함유하는 0.3 ㎖의 PBS 중에 재현탁시키고, BD Biosciences사의 FACScan에 의한 유동 세포계수 세포-주기 분석에 적용시켰다.
웨스턴
블롯
분석
50 mM Tris 완충액(pH 7.5) 중에 0.1 M NaCl, 5 mM EDTA, 50 mM 나트륨 오르소바나데이트(orthovanadate), 1% Triton X-100, 및 프로테아제 억제제 정제를 함유하는 세포 용해 완충액 중에 처리한 후 총 세포 단백질을 수집하였다. 20 ㎍의 총 단백질을 SDS-PAGE로 분리하고, 니트로셀룰로스 막으로 이동시키고, 이어서 5% 탈지유 및 0.1% 트윈-20 중에 4℃에서 일차 항체로 인큐베이션시켰다. 항-사이클린 D1 및 항-사이클린 A 토끼 폴리클론 항체를 1:1000 희석에서 사용하고, 항-β-액틴 모노클론 항체를 1:2000 희석에서 사용하였다.
ELISA
분석
IL-6 농도는 제조자(Invitrogen)의 프로토콜에 따라 경쟁 ELISA에 의해 혈장 중에서 측정하였다.
LPA
결합 친화성 및 혈청
LPA
수준
LPA(20:4)는 Avanti Polar Lipids로부터 구입하였다. LPA 수준은 이전 기술된 바와 같이 측정하였다(Murph et al., 2007, Methods Enzymol 433:1-25).
통계적 분석
데이터는 각 군에 대하여 평균±SD로서 나타낸다. 본 발명자들은 비짝지음(unpaired) t 검정을 통해 통계적 분석을 수행하였다. 모든 결과는 P < 0.05에서 통계적으로 유의미한 것으로 고려하였다.
결과
결과는 도 3에서 나타낸다. 폐 무게 및 종양 용적 둘 모두, 뿐만 아니라 시각적 검사의 평가는 bHDL이 인간 가족성 선종 용종증에 대한 마우스 모델인 APCmin /+ 마우스에서 폴립의 크기 및 수를 현저히 감소시킴을 보여주었다.
실시예
3:
HDL
모방체를
사용하는 종양 발달의 억제
본 실시예는 HDL 모방체가 결장암의 마우스 모델에서 종양 발달을 억제하기 위해 사용될 수 있음을 증명한다.
마우스
로스앤젤레스의 캘리포니아 대학교의 동물 연구 위원회가 모든 마우스 프로토콜을 승인하였다. 6주령 BALB/c 암컷은 Jackson Laboratory로부터 구입하였다.
펩티드
apoA-I 모방 펩티드 L-4F(Ac-D-W-F-K-A-F-Y-D-K-V-A-E-K-F-K-E-A-F-NH2; 서열번호 12) 및 4F 펩티드에서와 같은 동일한 아미노산을 함유하지만 클래스 A 양친매성 나선의 형성을 방지하는 서열(Ac-D-W-F-A-K-D-Y-F-K-K-A-F-V-E-E-F-A-K-NH2; 서열번호 13)로 배열되는 스크램블된 펩티드(sc-4F)는 모두 L-아미노산으로부터 합성하였다. 또한 A11 및 A17이 α-아미노이소부티르산(Aib)으로 치환된 L-4F2(Ac- D-W-F-K-A-F-Y-D-K-V-Aib-E-K-F-K-E-Aib-F-NH2; 서열번호 14)로 명명된 다른 펩티드도 시험하였다. 펩티드 Ac-hE18A-NH2(28AA)는 클래스 A 양친매성 나선형 펩티드인 18A에 apoE의 헤파린 결합 도메인 141-150(L-R-K-L-R-K-R-L-L-R; 서열번호 15)을 공유적으로 결합시킴으로써 유도된 이중 도메인을 갖는 아미노산 서열 L-R-K-L-R-K-R-L-L-R-D-W-L-K-A-F-Y-D-K-V-A-E-K-L-K-E-A-F(서열번호 2)을 갖는다. 펩티드 28AA-2는 A11 및 A17이 α-아미노이소부티르산(Aib)으로 치환된 L-R-K-L-R-K-R-L-L-R-D-W-L-K-A-F-Y-D-K-V-Aib-E-K-L-K-E-Aib-F(서열번호 7)를 갖는다. 모든 펩티드는 H2O 중에 용해시켰다.
세포-배양 실험
먼저 CT26 세포 및 NIH3T3 세포(웰 당 2,000개 세포)를 96-웰 배양 플레이트에서 완전 배지 중에 배양하고, 24시간 후 배지를 무혈청 배지로 교체하였다. 밤새 인큐베이션시킨 후, 세포를 비히클(대조군)로 처리하거나, 10 ㎍/mL의 L-4F 또는 L-4F2 또는 28AA 또는 28AA-2 펩티드로 처리하였다. 세포를 48시간 더 인큐베이션시키고, 제조자의 프로토콜에 따라 MTS 분석 키트(Promega)를 사용해 생존력을 분석하였다.
종양-부하 연구
6주령 BALB/c 암컷 마우스에게 PBS 중에 단일 세포 현탁액으로서 제조한 1 X 106 CT26 세포를 100 ㎕ 피하 주사하고, 마우스를 15일 동안 매일 10 mg/kg 펩티드로 피하(SQ) 투여하여 처리하였다. 마우스를 희생시키고 종양 무게를 측정하였다. 종양 무게는 식 V = 1/2(L x W 2)를 사용해 측정하였다.
LPA
결합 친화성 및 혈청
LPA
수준
LPA(20:4)는 Avanti Polar Lipids로부터 구입하였다. 혈청 LPA 수준은 이전 기술된 바와 같이 측정하였다(18).
통계적 분석
데이터는 각 군에 대하여 평균±SD로서 나타낸다. 본 발명자들은 비짝지음 t 검정을 통해 통계적 분석을 수행하였다. 모든 결과는 P < 0.05에서 통계적으로 유의미한 것으로 고려하였다.
펩티드는
BALB
/c 마우스에서
CT26
세포 주사 후에 종양 발달을 억제한다.
CT-26은 면역적격 BALB/c 마우스 내로 정맥내 도입되는 경우 전이성 폐 종양을 발달시키는 결장 선암 세포주이다. 본 발명자들은 측부에 피하로 1 X 106 CT26 세포를 주사한 BALB/c 마우스에서 측부 종양 형성에 대해 10 mg/kg/일 SQ 투여된 L-4F, L-4F2 및 sc-4F(4F 펩티드에서와 같은 동일한 아미노산을 함유하지만 클래스 A 양친매성 나선의 형성을 방지하는 서열로 배열된 스크램블드 펩티드)의 효과를 시험하였다. 마우스는 CT26 세포가 주사되는 부위로부터 먼 부위에 15일 동안 매일 피하 주사로 10 mg/kg의 sc-4F(n=9) 또는 L-4F(n=8) 또는 L-4F2(n=10)를 처리하였다. 측부 종양 무게 및 용적은 기대한 바와 같이, L-4F로 처리한 마우스와 비교할 때, sc-4F로 처리한 BALB/c 마우스에서 현저하게 더 컸다(273 mg 대 179 mg, P < 0.05; 555 mm3 대 313 mm3, P < 0.05. 도 4A, 4B); 또한 L-4F2로 처리한 마우스와 비교할 때, sc-4F로 처리한 마우스에서 현저하게 더 컸다(273 mg 대 118 mg, P < 0.001; 555 mm3 대 197 mm3, P < 0.001. 도 4A, 4B). L-4F2로 처리한 마우스로부터의 종양은 L-4F로 처리한 마우스와 비교할 때, 현저히 더 작았다(179 mg 대 118 mg, P < 0.05; 313 mm3 대 197 mm3. 도 4A, 4B). 3개 그룹으로부터의 측부 종양의 대표 사진은 도 4E에 나타낸다. 도 4C 및 4D는 3개 그룹 각각에 대한 무게 및 용적의 점수(100%로서 대조군)의 백분율 분포를 보여준다.
다음으로 본 발명자들은 28AA 및 28AA-2 펩티드 처리가 BALB/c 마우스의 측부에서 종양의 발달에 영향을 미치는지를 시험하였다. 6주령 BALB/c 암컷 마우스에게 측부에 피하로 1X106 CT26 세포를 주사하였다. 마우스를 CT26 세포가 주사되는 부위로부터 먼 부위에 15일 동안 매일 피하 주사하여 10 mg/kg의 비히클(n=12) 또는 28AA(n=10) 또는 28AA-2(n=11)로 처리하였다. 측부 종양 크기 및 무게는 28AA로 처리한 마우스와 비교할 때, 비히클로 처리한 BALB/c 마우스에서 현저하게 더 컸다(371 mg 대 188 mg, P < 0.05)(도 5A, 5B). 도 5C 및 5D는 3개 그룹 각각에 대한 무게 및 용적의 점수(100%로서 대조군)의 백분율 분포를 보여준다. 3개 그룹으로부터의 측부 종양의 대표 사진은 도 5E에 나타낸다.
펩티드는
시험관내에서
CT26
세포 생존력을 억제하지만,
NIH3T3
세포는 억제하지 못한다.
마우스에서 펩티드가 CT26 세포-매개된 종양 발달을 억제하는 기전을 조사하기 위해, CT26 세포 생존력에 대한 펩티드의 효과를 시험관내에서 측정하였다. 세포 생존력은 대조군과 비교하는 경우 L-4F(10 ㎍/㎖)로 처리된 CT 26 세포에서 20% 이상(P < 0.05) 감소되었고(도 6A), 또한 세포 생존력은 대조군과 비교할 때, L-4F2(10 ㎍/㎖)로 처리한 CT26 세포에서 30% 이상(P < 0.0001) 감소하였다(도 6A). 게다가, CT26 세포 생존력은 L-4F 처리와 비교할 때, L-4F2 처리한 경우에 현저하게 감소하였다(P < 0.05)(도 6A). CT26 세포 생존력을 28AA 및 28AA-2 펩티드로 처리하여 시험관내에서 측정하였다. 세포 생존력은 대조군과 비교하는 경우, 28AA 펩티드로 처리한 세포에서 70%(P < 0.0001) 감소되었고, 28AA-2로 처리한 세포에서 64% 감소되었다(P < 0.0001)(도 6A). NIH3T3 세포 생존력을 또한 모든 4개 펩티드로 처리하여 시험관내에서 측정하였다. NIH3T3 세포 생존력은 임의의 4개 펩티드에 의해 영향받지 않았다(도 6B).
실시예
4:
아포지질단백질
A-I 모방 펩티드는 인간 난소암 세포주 및 마우스 난소암 모델에서 저산소증-유도성 인자-1의 발현 및 활성의 억제.
본 실시예는 apoA-I 모방 펩티드가 혈관신생 인자 및 혈관신생의 생성에서 중요한 역할을 하는 저산소증-유발성 인자-1α(HIF-1α)의 발현 및 활성을 억제함을 증명한다. 면역조직화학 염색을 사용하여 종양 조직에서 HIF-1α의 발현을 시험하였다. 면역블럿팅, 실시간 중합효소 연쇄 반응, 면역형광법, 및 루시퍼라제 활성 분석을 사용하여 인간 난소암 세포주에서 HIF-1α의 발현 및 활성을 측정하였다. 면역조직화학 염색은 L-4F 처리가 마우스 난소 종양 조직에서 HIF-1α 발현을 현저하게 감소시켰음을 증명하였다. L-4F는 낮은 산소 농도, 염화 코발트(CoCl2, 저산소증 모방 화합물), 리소포스파티드산, 및 2개의 인간 난소암 세포주인 OV2008 및 CAOV-3에서 인슐린에 의해 유도된 HIF-1α의 발현 및 활성을 억제하였다. L-4F는 인슐린-유도된 Akt의 인산화에는 어떠한 영향도 미치지 않았지만, 세포외 시그널-조절된 키나제 및 p70s6 키나제의 활성을 억제하여, HIF-1α 합성의 억제를 유도하였다. L-4F로의 전처리는 인슐린 및 CoCl2-처리된 세포 둘 모두에서 HIF-1α의 프로테아좀-의존적 단백질 분해를 급격히 가속화시켰다. HIF-1α 발현에 대한 L-4F의 억제성 효과는 L-4F의 반응성 산소종 제거 효과에 의해 부분적으로 매개된다. ApoA-I 모방 펩티드는 생체내 및 시험관내 모델 둘 모두에서 HIF-1α의 발현 및 활성을 억제하였는데, HIF-1α의 억제가 apoA-I 모방 펩티드에 의한 종양 진행의 억제를 담당하는 중요한 기전일 수 있음을 제안한다.
종양 혈관신생은 난소암을 포함하는 고형 종양의 성장 및 진행에서 중요한 역할을 한다(Folkman, 1971; Hanahan and Folkman, 1996; Carmeliet and Jain, 2000; note that complete citations to REFERENCES throughout Example 4 can be found in Gao et al., 2012, J. Pharm . Exper . Ther. 342:255-262). 혈관신생 인자들 가운데, 혈관 내피세포 성장 인자(VEGF)는 내피세포의 증식, 이동, 침범, 관 형성을 포함하는 새로운 맥관 형성, 및 VEGF 수용체 1-양성 세포 및 내피세포 선조 세포를 포함하는 다양한 종류의 혈관신생-관련 세포의 보충의 모든 단계에 관여한다(Rafii et al., 2002; Adams and Alitalo, 2007; Ellis and Hicklin, 2008). 더욱 최근에, 본 발명자들은 종양 성장의 억제가, 적어도 부분적으로, VEGF의 생성 및 이후의 종양 혈관신생의 억제에 의해 매개되는 것을 밝혀냈다(Gao et al., 2011).
저산소증-유도성 인자 1(HIF-1)의 발현 및 활성은 종양 조직에서 VEGF의 생성 및 다른 혈관신생 인자에 관해 중요하다. HIF-1은 구성적으로 발현된 HIF-1α 및 유도성 α-서브유닛, HIF-1α로 구성된 이종이량체 전사 인자이다. 종양 조직이 과도성장하는 경우, 관맥으로부터 100 ㎛ 이상에 위치한 종양 세포는 저산소증 상태에 있게 된다. HIF-1α 분해의 산소-의존적 성질 때문에, 저 산소 농도는 단백질 분해의 저하를 유도하여, IF-1α 축적을 초래한다. 반면, 인슐린 및 리소포스파티드산(LPA)을 포함하는 일부 호르몬 및 성장 인자는 또한 정상산소(normoxic) 상태 하에서 다양한 시그널링 경로를 활성화함으로써 HIF-1α의 단백질 축적을 촉진한다(Cao et al., 2004; Lee et al., 2006, 2009). HIF-1α는 핵 내로 전이하는 HIF-1α에 결합하고, 하류 유전자의 전사적 활성, 혈관신생을 위해 필요한 단백질 산물(VEGF 및 안지오포이에틴을 포함함), 글루코스 수송, 및 세포 생존을 통해 종양형성에 기여한다(Semenza, 2003; Pouysse'gur and Mechta-Grigoriou, 2006; Pouyssegur et al., 2006). 본 실시예에서, 본 발명자들은 인간 난소암 세포주 및 마우스 난소 종양 조직에서 HIF-1α의 발현 및 활성에 대한 L-4F 및 L-5F의 효과를 시험하여 apoA-I 모방 펩티드의 항혈관신생 및 항종양형성 배후의 기전을 설명하였다.
세포, 세포 배양, 및 시약. OV2008 세포를 10% 소 태아 혈청, 페니실린(100 U/㎖), 스트렙토마이신(100 ㎍/㎖), 1 X 최소 필수 배지 비필수 아미노산 용액(Invitrogen, Carlsbad, CA), 및 인슐린(0.25 U/㎖)(Invitrogen)을 포함하는 RPMI 1640 배지 중에 배양하였다. CAOV-3 세포를 고 글루코스 및 L-글루타민(2 mM), 10% 소 태아 혈청, 페니실린(100 U/㎖), 스트렙토마이신(100 ㎍/㎖), 및 인슐린(0.02 U/㎖)을 갖는 둘베코 변형 이글 배지(Dulbecco's modified Eagle's medium)로 구성되는 완전 배지 중에 배양하였다. 저산소증 상태를 조성하기 위해, 세포를 저산소 챔버(모델 3130; Thermo Fisher Scientific, Waltham, MA)에 옮기고, 5% CO2, 1% O2, 및 94% N2를 함유하는 대기 중에 37℃에서 유지시켰다. L-4F(모두 L-아미노산으로부터 합성된 펩티드 Ac-D-W-F-K-A-F-Y-D-K-V-A-E-K-F-K-E-A-F-NH2(서열번호 12))를 1 mg/㎖로 물 중에 희석하고(매번 신선하게 제조함), 1 내지 10 ㎍/㎖를 사용하였다. Peptisyntha Inc.(Torrance, CA)에 의해 합성된 L-5F를 1 mg/㎖의 ABCT 완충액(50 mM 암모늄 중탄산염, pH 7.0, 0.1 mg/㎖ 트윈 20을 포함함)에 용해시키고, 이를 사용하기 전에 필요한 농도로 희석하였다. 염화 코발트(CoCl2), 인슐린, 사이클로헥사미드(CHX), 및 N-(벤질옥시카르보닐)류시닐류시닐류시날-Z-Leu-Leu-Leu-al(MG-132)는 Sigma-Aldrich(St. Louis, MO)로부터 구입하였다. 제조자에 의해 추천된 바와 같이 클로로포름 중에 LPA(Avanti Polar Lipids, Alabaster, AL)를 건조시키고, 스톡 용액으로서 20 mM인 농도의 에탄올 중에 용해시키고, 사용하기 전에 상응하는 세포 배양 배지 중에 필요한 농도로 희석하였다.
정량적 실시간 PCR . 총 RNA를 PureLink RNA Mini Kit(Invitrogen)를 사용해 세포로부터 추출하였다. RNA의 양 및 질은 SmartSpec 3000 Spectrophotometer(Bio-Rad Laboratories, Hercules, CA)를 사용해 평가하였다. cDNA는 제조자의 지시에 따라 High Capacity cDNA Reverse Transcription Kit(Applied Biosystems, Foster City, CA)를 사용하여 합성하였다. PCR은 CFX96 실시간 PCR 시스템(Applied Biosystems)을 사용해 수행하였다. 주기 조건은 다음과 같았다: 95℃에서 3분, 이어서 95℃, 10초; 60℃, 10초; 72℃, 30초의 40 주기, 그 이후에 10분 동안 72℃에서 최종 신장. 각각의 25 ㎕ 반응물은 0.4 ㎍의 cDNA, 12.5 ㎕의 SYBR Green qPCR SuperMix(Bio-Rad Laboratories), 및 뉴클레아제-비함유 물 중에 250 nM 정방향 및 역방향 프라이머를 함유하였다. 사용된 프라이머는 HIF-1α, 5'-TCC AGT TAC GTT CCT TCG ATC A-3'(서열번호 16) 및 5'-TTT GAG GAC TTG CGC TTT CA-3'(서열번호 17); VEGF, 5'-CGG CGA AGA GAA GAG ACA CA-3'(서열번호 18) 및 5'-GGA GGA AGG TCA ACC ACT CA-3'(서열번호 19); 글루코스 트랜스포터-1, 5'-CGG GCC AAG AGT GTG CTA AA-3'(서열번호 20) 및 5'-TGA CGA TAC CGG AGC CAA TG-3'(서열번호 21); 알돌라제-A, 5'-TGC TAC TAC CAG CAC CAT GC-3'(서열번호 22) 및 5'-ATG CTC CCA GTG GAC TCA TC-3'(서열번호 23); 및 GAPDH, 5'-GGA AGG TGA AGG TCG GAG TCA-3'(서열번호 24) 및 5'-GTC ATT GAT GGC AAC AAT ATC CAC T-3'(서열번호 25)이었다. 실험은 각각의 실험에서 3회 측정을 한번 반복하였다.
웨스턴 블럿 분석. 웨스턴 블럿 분석을 이전 기술된 바와 같이 수행하였다(Gao et al., 2011). 요약하면, 세포 용해물을 0.1 M NaCl, 5 mM EDTA, 50 ㎛ 나트륨 오르소바나데이트, 1% Triton X-100 및 pH 7.5인 50 mM Tris 완충액 중에 프로테아제 억제제 정제(Roche Diagnostics, Indianapolis, IN)를 함유하는 용해 완충액 중에서 수집하고, 4 내지 12% Bis-Tirs 겔(Invitrogen) 상에 로딩하고, 폴리비닐리덴 디플루오라이드 막으로 이동시키고, 적절한 항체와 함께 인큐베이션시켰다. 항-pThr202/Tyr204-Erk, 항-Erk, 항-pThr389-p70 S6 키나제, 항-p70 S6 키나제, 항-pSer473-Akt, 및 항-Akt 항체는 Cell Signaling Technology(Danvers, MA)로부터 구입하였고; 마우스 항-인간 HIF-1α 항체는 BD Pharmingen(San Diego, CA)로부터 구입하였고; 토끼 항-마우스 HIF-1α 항체는 Abcam Inc.(Cambridge, MA)로부터 구입하였으며; 항-GAPDH 항체는 Santa Cruz Biotechnology Inc.(Santa Cruz, CA)로부터 구입하였다.
세포 반응성 산소 종의 측정. 이전 기술된 바와 같이(Zhou et al., 2007; Lee et al., 2009), OV2008 세포를 24-웰 플레이트에서 웰 당 4 x 104 세포로 유리 슬립 상에 도말하고, 밤새 정상 배양 조건에서 배양하고, 밤새 항체-비함유 배지에서 금식시키고, 1시간 동안 L-4F(10 ㎍/㎖)로 처리하였다. 그후, 디클로로플루오레세인 디아세테이트(DCFHDA, 10 μM) 및 인슐린(200 nM)/CoCl2(100 μM)을 첨가하고, 0.5시간 더 세포와 함께 인큐베이션시켰다. 세포를 인산 완충 식염수(PBS)로 2회 세척하였다. 이미지는 형광 현미경(Olympus IX70; Olympus, Tokyo, Japan)으로 캡쳐하였다.
저산소증 반응 요소 리포터 분석. 요약하면, OV2008 세포를 6-웰 플레이트에서 웰 당 2 x 105 세포로 플레이팅하고, 밤새 완전 배지에서 성장시켰다. 그후, pGL3-Epo-저산소증 반응 요소(HRE)-Luc 플라스미드를 리포펙타민(Lipofectamine) 2000(Invitrogen)을 사용해 세포 내로 형질감염시켰다. 24시간 후, 세포를 밤새 금식시키고, 자극제의 존재 또는 부재하에서 L-4F 처리에 적용시켰다. 리포터 분석 시스템(Promega, Madison, WI)을 루시퍼라제 활성의 측정을 위해 사용하였다.
HIF -1α의 면역형광 염색. 면역형광 염색은 이전 기술된 바와 같이 수행하였다(Lee et al., 2006). 요약하면, OV2008 세포를 24-웰 플레이트에서 웰 당 4 x 104 세포를 유리 슬립(Thermo Fisher Scientific) 상에 도말하고, 밤새 완전 배지 에서 성장시켰다. 밤새 금식시킨 후, 세포를 자극제의 존재 또는 부재하에서 L-4F 처리로 적용하였다. 그후, 세포를 실온에서 25분 동안 4% 중성 완충 포름알데히드 중에 고정시키고, 10분 동안 PBS 중에 0.5% Triton X-100으로 투과시키고, 1시간 동안 10% 정상 염소 혈청, 1% 소 혈청 알부민, 및 PBS 중에 제조한 0.3 M 글리신으로 블로킹시켰다. 세포를 4℃에서 밤새 마우스 항-HIF-1α(1:200)와 함께 인큐베이션시키고, 1시간 동안 Alexa Fluor 568 항-마우스 IgG(Invitrogen)와 함께 인큐베이션시켰다. 최종적으로, 세포를 DAPI(Vector Laboratories, Burlingame, CA)를 함유하는 VectaMount 용액으로 덮고, 이미지를 형광 현미경(Olympus IX70)으로 캡쳐하였다.
생체내 종양 모델. 9주령 C57BL/6J 암컷 마우스에게 PBS 중에 단일 세포 현탁액으로서 제조된 5 x 106 ID8 세포 0.5 ㎖를 동일 용적의 차가운 Matrigel(BD Biosciences, San Jose, CA)에 혼합하여 피하 주사하였다. 2주 후, ID8 세포가 3주 동안 매일 주사되는 부위로부터 먼 부위에서 마우스에게 스크램블드 4F 펩티드(sc-4F) 또는 L-4F(10 mg/kg)를 피하 주사하기 시작했다. 3주 후, 마우스를 종양 수집 및 추가적 분석을 위해 희생시켰다.
면역조직화학 염색. 냉동된 종양 조직을 5 ㎛ 두께로 절단하고, -20℃에서 10분 동안 차가운 아세톤으로 고정시켰다. 절단면을 3시간 동안 PBS 중에 제조된 10% 정상 염소 혈청 및 4% 소 혈청 알부민으로 블로킹시키고, 즉시 토끼 항-마우스 폴리클로날 HIF-1α 항체(1:200)(Abcam Inc.) 또는 토끼 항-마우스 모노클로날 CD31 항체(1:25)(Abcam Inc.)로 4℃에서 밤새 인큐베이션시켰다. 그후, 절단면을 실온에서 30분 동안 상응하는 바이오티닐화된 이차 항체(Vector Laboratories)로 인큐베이션시키고, 그 이후에 Vectastain ABC Elite 시약(Vector Laboratories)과 함께 인큐베이션시켜, 염색을 가시화하였다. 최종적으로, 절단면을 헤마톡실린으로 가볍게 대비염색하고, 재수화하고, Vecta-Mount 용액(Vector Laboratories)으로 덮었다(coverslip).
통계. 데이터는 각 군에 대하여 평균±SD로서 나타낸다. 본 발명자들은 비짝지음 t 검정을 통해 통계적 분석을 수행하였다. 모든 결과는 P < 0.05인 경우 통계적으로 유의미한 것으로 고려하였다.
L-4F는
생체내에서
HIF
-1α 발현 및 혈관신생을 억제한다.
본 발명자들의 이전 데이터는 apoA-I 모방 펩티드 L-4F 및 L-5F가 상피암 세포주 ID8을 사용하는 난소암의 면역적격 마우스 모델에서 종양 성장 및 혈관신생을 억제하였음을 보여주었다(Gao et al., 2011). 종양 혈관신생에 연루된 중요한 성장 인자인 VEGF의 생성에서 HIF-1α의 중요성을 고려하여, 본 발명자들은 우선 동일한 모델에서 HIF-1α 발현에 대한 L-4F의 효과를 시험하였다. 면역조직화학 염색은 L-4F 처리가 대조군 펩티드(sc-4F)-처리된 그룹과 비교할 때, 종양 조직에서 HIF-1α 발현을 감소시켰음을 보여주었다(도 7A). 본 발명자들의 이전 보고와 일관되게(Gao et al., 2011), 본 발명자들은 대조군 그룹과 비교하여, L-4F-처리된 마우스에서 맥관의 수가 감소하였음을 관찰하였다(도 7A; 또한 온라인 버전인 [Gao et al., 2012, JPET 342:255-262]에 포함된 보충 자료 참조).
L-4F 및 L-5F는 세포 배양물에서 HIF -1α 발현을 억제한다. L-4F가 저산소 조건 하에 세포에서 HIF-1α 발현을 억제하는지 여부를 시험하기 위해, 저 산소 농도(1% O2) 및 저산소증 모방 화학물질인 CoCl2를 인간 난소암 세포주인 OV2008에서 HIF-1α 발현을 유도하기 위해 사용하였다. 웨스턴 블럿 분석은 저산소증-유도된 HIF-1α 단백질 발현이 L-4F 투여량에 의존적으로 억제되었음을 보여주었다(도 7B; 또한 온라인 버전에서 보충 자료 참조). 유사한 결과를 100 nM 및 200 nM의 인슐린(도 7B) 및 20 μM의 LPA(또한 보충 자료를 참조)로 처리한 경우 관찰하였다.
HIF-1α 발현에서 L-4F의 억제성 효과를 추가로 확인하기 위해, 2개의 다른 인간 난소암 세포주, CAOV-3 및 SKOV3를 연구하였다. OV2008 세포에 대한 데이터와 일관되게, CAOV-3 세포(도 7A) 및 SKOV3 세포 둘 모두에서 CoCl2- 및 인슐린-유도된 HIF-1α 발현이 L-4F 투여량에 의존적으로 억제되었다.
HIF-1α에 대한 억제성 효과가 L-4F에 특이적인지 여부를 시험하기 위해, 다른 apoA-I 모방 펩티드인 L-5F를 사용해 OV2008 세포를 처리하였다. L-4F 처리와 유사하게, 저 산소- 및 CoCl2-자극된 HIF-1α 발현은 L-5F 투여량 의존적으로 억제되었다(보충 자료 참조).
전사 인자로서, HIF-1α은 핵에서 기능하고 하류 유전자의 발현을 활성화시킨다. 면역형광 염색을 사용하여 HIF-1α 단백질의 핵 수준에 대한 L-4F의 효과를 시험하였다. CoCl2 및 인슐린 처리는 OV2008 세포의 핵에서 HIF-1α의 축적을 크게 증가시켰고, L-4F의 전처리는 이들 효과를 극적으로 역전시켰다(도 7, C 및 D).
L-4F에 의한 HIF -1α-의존적 유전자 전사의 억제. L-4F가 HIF-1α-구동된 유전자 전사를 억제하는지 여부를 결정하기 위해, OV2008 세포를 루시퍼라제 리포터 플라스미드를 함유하는 HRE로 형질감염시켰다. L-4F 처리는 루시퍼라제의 CoCl2- 및 인슐린-매개된 도입을 현저하게 억제하였다(도 8, A 및 C). 게다가, L-4F 처리는 VEGF, 글루코스 트랜스포터 1, 및 알돌라제-A를 포함하는 HIF-1α 표적 유전자의 mRNA 수준에서 CoCl2- 및 인슐린-유도된 증가를 제거하였는데(도 8, B 및 D), 이는 L-4F가 단백질 발현 및 활성 둘 모두를 억제함을 제안한다.
L-4F의 후처리는
CoCl
2
- 및 인슐린-처리된
OV2008
세포에서
HIF
-1α 단백질 수준 및 활성을 감소시킨다.
IF-1α 발현이 임상적으로 나타난 진행성 종양에서 증가하기 때문에, 본 발명자들은 다음으로 저산소증 또는 성장 인자 자극 후 L-4F 투여가 HIF-1α 발현을 억제하는지 여부를 시험하였다. OV2008 세포를 일단 3시간 동안(보충 자료 참조) 또는 24시간 동안(도 9) 인슐린으로 자극한 후, 다양한 기간 동안 L-4F로 처리하였다. L-4F의 후처리는 OV2008 세포에서 HIF-1α 발현을 현저하게 감소시켰다(도 9A; 또한 보충 자료 참조). 면역형광 분석은 L-4F의 후처리에 의한 HIF-1α의 감소된 핵 발현을 보여주었다(도 9B; 또한 보충 자료 참조). 게다가, 핵에서 HIF-1α 단백질의 하향조절은 하류 HIF-1α 표적 유전자의 전사의 억제와 관련이 있었다(도 9C; 또한 보충 자료 참조).
L-4F는
HIF
-1α 전사에 영향을 미치지 않는다.
L-4F가 전사적 수준에서 HIF-1α 합성에 영향을 미치는지 아닌지를 결정하기 위해서, 본 발명자들은 HIF-1α mRNA 수준에서의 변화가 단백질 수준에서의 변화에 선행하는지 여부를 결정하기 위해 HIF-1α mRNA 함량을 정량화하였다. 실시간 RT-PCR 분석은 L-4F가 HIF-1α mRNA의 기저 수준에 어떠한 영향도 미치지 않음을 나타냈다(보충 자료 참조). 게다가, 이전 보고와 일관되게(Semenza, 2003; Pouysse'gur et al., 2006; Lee et al., 2009), 저 산소 및 인슐린은 HIF-1α 유전자 전사에 영향을 미치지 않으며(보충 자료 참조), 이는 L-4F에 의한 HIF-1α 단백질 발현의 조절이 전사후 수준에서 발생함을 제안한다.
L-4F는
ERK
의존적 방식으로
S6
키나제
인산화를 억제한다.
S6 키나제의 활성화는 HIF-1α의 데-노보 합성에 중요하다(Semenza, 2003). L-4F에 의한 HIF-1α 억제의 분자적 기전을 결정하게 위해, 본 발명자들은 L-4F가 HIF-1α의 인슐린-자극된 단백질 합성에 영향을 미치는지 여부를 시험하였다. 본 발명자들의 데이터는 10 ㎍/㎖의 L-4F가 S6 키나제의 인산화를 방지함을 보여주였다(도 10A). S6 키나제 인산화는 하류 시그널링 분자 ERK 및 Akt의 활성화에 의해 조절된다. 도 10B에서 나타낸 바와 같이, L-4F는 ERK1/2의 활성화를 억제하였지만, 0.5시간에서를 제외하고는, Akt의 인산화에 대해서는 어떠한 영향도 미치지 않았는데, 이는 S6 키나제 활성화의 억제가 ERK 인산화 억제의 결과일 것이라는 것을 유력하게 제안한다. 본 발명자들이 ERK, Akt, 및 OV2009 세포에서 S6 키나제의 인산화에 대한 CoCl2의 효과에 대해 관찰하지 않았다는 것은 주목할만 하다. 이 결과는 놀랄만한 것이 아닌데, CoCl2 처리가 HIF-1α 단백질 분해의 저하를 유도하는 저산소증을 모방하기 때문이다(Pouysse' - gur and Mechta-Grigoriou, 2006).
L-4F 처리는
프로테아좀
-의존적 단백질 분해를 촉진한다.
본 발명자들은 다음으로 L-4F가 HIF-1α 단백질의 안정성을 변화시키는지 여부를 시험하였다. 새로운 단백질 합성을 예방하는 화합물인 CHX를 데 노보 HIF-1α 단백질 합성을 억제하기 위해 사용하였다. 본 발명자들의 데이터는 인슐린과 함께 CHX로 처리한 OV2008 세포가 시간의 함수로 HIF-1α의 점진적인 저하를 나타냈고, 동시적인 L-4F 처리는 HIF-1α 단백질의 분해를 가속화시켰음을 보였다(도 11A). 본 발명자들은 CoCl2-처리된 OV2008 세포에 대한 L-4F의 유사한 효과를 관찰하였다(보충 자료 참조). 또한, 프로테아좀 억제제인 MG-132는 인슐린-매개된 HIF-1α 발현에 대한 L-4F의 억제성 효과를 역전시켰다(도 11B). 이들 결과는 L-4F가, 부분적으로, HIF-1α 단백질의 분해를 가속화시킴으로써 난소암 세포에서 인슐린 및 CoCl2-유도된 HIF-1α 발현 및 활성을 억제함을 제안한다.
L-4F 처리에 의한 인슐린 및
CoCl
2
-유도된
ROS
생성의 억제.
인슐린 처리(Zhou et al., 2007; Lee et al., 2009) 및 CoCl2 처리(Chandel et al., 2000; Griguer et al., 2006)가 나중에 HIF-1α의 합성을 촉진하고 이의 분해를 억제하는 세포 ROS 수준을 현저하게 증가시키는 것으로 보고되었다. 디클로로플루오레세인 산화 분석(도 12)에 나타낸 바와 같이, 인슐린 및 CoCl2로의 처리는 OV2008 세포에서 세포 ROS 수준의 증가를 유도하였다. L-4F의 전처리는 인슐린 및 CoCl2에 의해 유도된 세포 ROS 생성을 극적으로 예방하였는데(도 12), 이는 HIF-1α 발현에 대한 L-4F의 억제성 역할이 ROS 축적 억제의 결과일 수 있음을 제안한다.
논의
HIF-1은 저산소증 하에서 주요한 세포 생존 단백질이며, 다양한 고형 종양에서 종양 진행 및 전이와 연관된다(Seeber et al., 2011). HIF-1α를 표적하는 것은 매력적인 항암 치료 전략일 수 있다(Se- menza, 2003; Belozerov and Van Meir, 2005; Seeber et al., 2011). HIF-1α의 발현은 저산소 및 비저산소 자극 둘 모두에 의해 증가된다. 저 산소 농도 또는 저산소 모방 화합물인 CoCl2로의 처리는 HIF-1α의 분해를 억제하고 HIF-1α 단백질 안정성 및 축적을 증가시킨다. 인슐린 및 LPA를 포함하는 일부 성장 인자는 또한 전사후 단백질 합성을 촉진하고 HIF-1α의 발현 및 활성을 상향조절한다(Semenza, 2003; Pouysse'gur and Mechta-Grigoriou, 2006; Pouysse'gur et al., 2006). 본 명세서에서, 본 발명자들은 다음을 증명한다: 1) L-4F는 마우스 종양 조직에서 HIF-1α 발현을 억제한다(도 7A); 2) L-4F 및 L-5F의 전처리 및 후처리는 인간 난소암 세포주에서 HIF-1α의 저 산소-, CoCl2-, 인슐린-, 및 LPA-유도된 발현 및 핵 수준을 감소시킨다(도 7 및 9; 또한 보충 자료 참조); 및 3) L-4F는 HRE-구동 리포터 유전자의 CoCl2- 및 인슐린-자극된 발현 및 HIF-1α 표적 유전자의 활성화를 억제한다(도 8 및 9; 또한 보충 자료 참조). 실시간 RT-PCR 분석은 L-4F가 OV2008 세포에서 HIF-1α 유전자에 대해 어떠한 효과도 없었으며(보충 자료 참조), 이는 L-4F에 의한 HIF-1α 단백질의 조절이 전사후 수준에서 발생함을 나타낸다.
ROS가 저산소증 뿐만 아니라 정상산소증 하에서 HIF-1α의 조절에 중요한 역할을 함에는 강력한 증거가 있다(Pouysse'gur and Mechta-Grigoriou, 2006). 이전 보고된 바와 같이, 저 산소 농도(Chandel et al., 2000; Guzy et al., 2005; Guzy and Schumacker, 2006), CoCl2(Chandel et al., 2000; Griguer et al., 2006), 인슐린(Zhou et al., 2007; Lee et al., 2009), 및 LPA(Chen et al., 1995; Saunders et al., 2010)로의 세포의 처리는 ROS 생성을 유도한다. ROS 생성은 세포에서 HIF-1α 발현에 중요하며, ROS의 제거는 저산소증 및 인슐린에 의해 유도된 HIF-1α 축적을 손상시킨다(Brunelle et al., 2005; Mansfield et al., 2005; Carnesecchi et al., 2006; Biswas et al., 2007). Ganapathy et al.(2012)는 apoA-I 모방 펩티드인 D-4F가 초과산화물 및 H2O2 생성을 감소시키고, ID8 세포에서 산화적 상태를 개선시키는 것을 보고하였다. 그러나, 펩티드 처리가 저산소증- 또는 성장 인자-매개된 ROS 생성에 영향을 미치는지 여부는 불명확하다. 본 발명에서, 본 발명자들은 L-4F 처리가 OV2008 세포에서 인슐린- 및 CoCl2-유도된 ROS 생성을 극적으로 억제함을 보고한다(도 12). 또한, L-4F가 인슐린 및 CoCl2에 노출된 암 세포에서 HIF-1α 분해를 가속화시켰다(도 11A; 또한 보충 자료 참조). 26S 프로테아좀 억제제인 MG-132는 인슐린-매개된 HIF-1α 발현에 대한 L-4F의 억제 효과를 역전시켰다(도 11B). 종합하면, 이들 데이터는 L-4F가 HIF-1α의 단백질 안정성을 감소시키고, 적어도 부분적으로 이의 ROS-제거 효과를 통해 전사적으로 활성인 HIF-1α의 축적을 억제함을 증명한다.
HIF-1α 억제의 분자적 기전을 밝혀내기 위한 노력으로, 본 발명자들은 L-4F가 HIF-1α 단백질 합성에 영향을 미치는지 여부를 결정하였다. 인슐린은 수용체 티로신 키나제 및 하류 시그널링 분자, 가장 중요하게는 S6 키나제를 활성화시켜, mRNA 번역 및 HIF-1α의 데 노보 합성을 증가시킨다(Treins et al., 2002; Semenza, 2003). L-4F는 다양한 시점에서 S6 키나제의 인슐린-자극된 인산화를 억제하여, HIF-1α 단백질 수준의 감소를 초래한다(도 10A). 추가적인 실험은 S6 키나제 활성의 하향-조절이 ERK1/2 활성의 억제의 결과일 수 있으나, Akt는 아니다(도 10B). ROS가 ERK1/2 및 S6 키나제의 인슐린-자극된 인산화와 관련되지만, Akt는 아니었는데(Zhou et al., 2007), ROS 제거는 또한 L-4F에 의한 HIF-1α의 데 노보 합성의 억제와 연관될 수 있다.
이전 보고는 D-4F(모든 D 아미노산으로 합성되었지만 L-4F와 동일한 ApoA-I 모방 펩티드)가 대조군 및 당뇨병 랫트로부터의 대동맥에서 2개의 항산화제 효소, 헴(heme) 옥시게나제 1 및 세포외 초과산화물 디스무타제(SOD)의 발현 및 활성을 증가시킴을 보여주었다(Kruger et al., 2005). 더욱 최근에, 본 발명자들은 또한 D-4F가 ID8 세포에서 항산화제 효소 Mn-SOD를 상향-조절하고, Mn-SOD의 녹다운이 마우스 난소암 모델에서 D-4F의 항종양형성 효과의 완전한 손실을 초래함을 증명하였다(Ganapathy et al., 2012). SOD 활성이 ROS 생성 및 세포 산화적 스트레스를 조절하기 때문에, SOD의 도입은 apoA-I 모방 펩티드의 작용 기전의 중요한 부분일 수 있다.
결론적으로, 본 발명자들의 데이터는 apoA-I 모방 펩티드가 생체내 및 세포 배양 내 둘 모두에서 HIF-1α의 발현 및 활성을 억제함을 증명한다. HIF-1α의 억제는 apoA-I 모방 펩티드에 의한 종양 진행의 억제를 담당하고 중요한 기전일 수 있다.
참조문헌
실시예 4에 걸쳐 제공된 참조문헌에 대한 인용의 완전한 열거는 문헌 [Gao et al., 2012, J. Pharm . Exper . Ther. 342:255-262]에서 확인할 수 있다. 이 문헌의 온라인 버전은 또한 실시예 4에서 참조된 보충자료를 포함한다.
실시예
5:
HDL
모방체는
결장암 유도 및 자발적인 마우스 모델 둘 모두에서 종양 발달을 억제한다.
본 실시예는 HDL 모방체, L-4F(아포지질단백질 A-I 모방 펩티드) 및 G*(아포지질단백질 J 모방 펩티드)가 결장암의 마우스 모델에서 종양 성장 및 발달에 영향을 미치는 것을 증명한다. HDL 모방체는 피하 또는 경구 투여되는 경우 BALB/c 마우스에서 마우스 결장 선암종 세포주인 CT26 세포의 생존력 및 증식을 감소시키고, CT26 세포-매개된 종양 부하를 저하시킨다. 결장암에 대한 혈청 바이오마커인 리소포스파티드산(LPA)의 혈장 수준은 HDL 모방체를 투여받은 마우스에서 현저하게 감소하였는데, 이는 전염증성 지질의 결합 및 제거가 HDL 모방체에 의한 종양 발달의 억제에 대한 잠재적 기전임을 제안한다. 또한, L-4F는 인간 가족성 선종성 용종증에 대한 마우스 모델인 APCmin /+ 마우스에서 폴립의 크기 및 수를 현저히 감소시켰는데, 이는 HDL 모방체가 결장의 유도성 및 자발성 암 모두의 발달을 억제하는데 효과적임을 제안한다. 이들 결과로부터 HDL 모방체가 결장암의 치료를 위한 신규한 치료 전략으로서 확인된다.
마우스
로스앤젤레스의 캘리포니아 대학교의 동물 연구 위원회(Animal Research Committee at the University of California at Los Angeles)가 모든 마우스 프로토콜을 승인하였다. 6주령 BALB/c 암컷 및 6주령 C57BL/6J-APC min /+ 숫컷 마우스는 Jackson Laboratory로부터 구입하였다.
펩티드
HDL 모방체인 apoA-I 펩티드 L-4F(Ac-D-W-F-K-A-F-Y-D-K-V-A-E-K-F-K-E-A-F-NH2; 서열번호 12) 및 4F 펩티드와 동일한 아미노산을 함유하지만 클래스 A 양친매성 나선의 형성을 방지하는 서열(Ac-D-W-F-A-K-D-Y-F-K-K-A-F-V-E-E-F-A-K-NH2; 서열번호 13)로 배열되는 스크램블드 펩티드(sc-4F), 및 G* 펩티드{apoJ(L-[113-122] apoJ)에서 아미노산 113 내지 122에 상응하는 Ac-L-V-G-R-Q-L-E-E-F-LNH2(서열번호 26)}로 명명된 apoJ 모방체는 모두 L-아미노산으로부터 합성하였다. 펩티드는 주사에 의한 투여를 위해 H2O 중에 용해시켰다. 식이 중에 펩티드의 투여를 위해, 본질적으로 웨스턴 식이에 대해 이전 기술된 바와 같은(18) 기술을 사용하여 펩티드를 표준 마우스 식이(Ralston Purina) 내로 혼합하였다. 그러나, 본 명세서에 보고된 임의의 실험에서 웨스턴 식이를 투여하지는 않았으며; 마우스는 오로지 펩티드 함유 또는 비함유 표준 마우스 사료를 제공받았다.
세포 배양 실험
BALB/c 기원의 N-니트로소-N-메틸 우레탄-유도된 마우스 결장 암종 유래 CT26 세포주는 American Type Culture Collection(ATCC)로부터 구입하였다. 먼저 CT26 세포(웰당 2,000개 세포)를 96-웰 배양 플레이트에서 완전 배지 중에 배양하고, 24시간 후 배지를 무혈청 배지로 교체하였다. 밤새 인큐베이션시킨 후, 세포를 비히클(대조군)으로 처리하거나, 10 ㎍/mL의 L-4F 또는 G* 펩티드로 처리하였다. 펩티드는 H2O 중에 용해시켰다. 세포를 48시간 더 인큐베이션시키고, 제조자의 프로토콜에 따라 MTS 분석 키트(Promega)를 사용해 생존력을 분석하였다. 증식 분석을 위해, 세포를 48시간 인큐베이션 중 마지막 4시간 동안 브로모데옥시유리딘(BrdUrd)으로 표지하였다. 세포를 나중에 세척하고, 고정시키고, 실온에서 1시간 동안 마우스 항-BrdUrd 항체로 인큐베이션시키고, 퍼옥시다제-결합된 염소 항-마우스 이차 항체(Calbiochem)에 의해 검출하였다. 흡광도는 이중 파장 450 및 540 nm을 사용해 측정하였다.
종양 부하 연구
6주령 BALB/c 암컷 마우스에게 PBS 중에 단일 세포 현탁액으로서 제조한 1 x 106 CT26 세포 100 ㎕를 피하 주사하고, 마우스를 10 mg/kg sc-4F 또는 L-4F로 15일 동안 매일 피하(SQ) 투여하여 처리하였다. 마우스를 희생시키고 종양 무게를 측정하였다.
생체내
폐전이
BALB/c 마우스에게 꼬리 정맥 주사를 통해 PBS 중에 100 ㎕의 2 x 104 CT26 세포를 정맥내 주사하고, 마우스를 3주 동안 L-4F 또는 sc-4F로 10 mg/kg/일 SQ 투여하여 처리하거나; 또는 3주 동안 사료 식이 중에 L-4F 또는 G* 펩티드로 100 mg/kg/일 투여하여 처리하였다. 3주 처리 후, 마우스를 희생시키고; 폐를 수확하여, 무게를 재고, Bouin 용액(Sigma)으로 고정시켰다. 폐 표면 상에 종양 결절을 계수하였다.
APC
min
/+
마우스 연구
C57BL/6J 배경에 대해 6주령 APC min /+ 수컷 마우스를 사료 식이 중에 L-4F 또는 sc-4F로 100 mg/kg/일 투여하여 처리하였다. 8주 처리 후, 마우스를 희생시켰다. 창자 전체를 즉시 제거하고, 포르말린 및 70% 에탄올 중에 고정시켰다. 창자를 개방하고 해부 현미경 하에 검사하여 종양을 계수하고 측정하였다.
면역조직화학 염색
폐 표면으로부터의 종양 조직을 고정시키고, 파라핀으로 포매하고, 5 mm 두께로 전달하였다. 절단면을 자일렌으로 탈파라핀화하고, 100%, 90%, 70%, 및 50% 에탄올로 재수화하고, 30분 동안 20 mg/mL인 프로티나제 K로 처리하고, 내인성 퍼옥시다제를 억제하기 위해 실온에서 30분 동안 3% H2O2로 처리하고, 3시간 동안 PBS 중에 제조한 10% 정상 염소 혈청 및 4% 소 혈청 알부민으로 블로킹시킨 후, 4℃에서 밤새 1:50 랫트 항-마우스 모노클론 CD31 항체로 인큐베이션시켰다. 절단면을 상응하는 바이오티닐화된 이차 항체로 인큐베이션시키고, 이어서 Vectastain ABC Elite 시약으로 인큐베이션시켰다.
세포 주기 분석
CT26 세포를 밤새 6-웰 플레이트에서 배양시킨 후, 48시간 동안 혈청 결핍시켰다. 세포를 비히클(대조군)으로 처리하거나, L-4F 또는 G* bHDL 10 ㎍/mL으로 처리하고, 48시간 더 인큐베이션시켰다. 세포를 수집하고 PBS로 세척하고, 4℃에서 얼음처럼 차가운 70% 메탄올로 밤새 고정시켰다. 고정된 세포를 원심분리로 수집하고, PBS로 세척하고, 40 ㎍/mL RNaseA 및 100 ㎍/mL 프로피디움 요오드화물을 함유하는 0.3 ㎖의 PBS 중에 재현탁시키고, BD Biosciences사의 FACScan에 의한 유동 세포계수 세포-주기 분석에 적용시켰다.
웨스턴
블롯
분석
50 mmol/L Tris 완충액(pH 7.5) 중에 0.1 mol/L NaCl, 5 mmol/L EDTA, 50 mL 나트륨 오르소바나데이트(orthovanadate), 1% Triton X-100, 및 프로테아제 억제제 정제를 함유하는 세포 용해 완충액 중에 처리한 후 총 세포 단백질을 수집하였다. 20 ㎍의 총 단백질을 SDS-PAGE로 분리하고, 니트로셀룰로스 막으로 이동시키고, 이어서 5% 탈지유 및 0.1% 트윈-20 중에 4℃에서 일차 항체로 인큐베이션시켰다. 항-사이클린 D1 및 항-사이클린 A 토끼 폴리클로날 항체를 1:1000 희석에서 사용하고, 항-β-액틴 모노클로날 항체를 1:2000 희석에서 사용하였다.
ELISA
분석
인터류킨(IL)-6 농도는 제조자(Invitrogen)의 프로토콜에 따라 경쟁 ELISA에 의해 혈장 중에서 측정하였다.
LPA
결합 친화성 및 혈청
LPA
수준
LPA(20:4)는 Avanti Polar Lipids로부터 구입하였다. LPA 수준은 이전 기술된 바와 같이 측정하였다(19).
통계적 분석
데이터는 각 군에 대하여 평균±SD로서 나타낸다. 본 발명자들은 비짝지음 t 검정을 통해 통계적 분석을 수행하였다. 모든 결과는 P < 0.05에서 통계적으로 유의미한 것으로 고려하였다.
HDL
모방체
L-4F는
BALB
/c 마우스에서
CT26
세포 주사 후 종양 발달을 억제한다.
CT26은 면역적격 BALB/c 마우스 내로 정맥주사로 도입되는 경우 전이성 폐 종양을 발달시키는 결장 선암 세포주이다(20-22). CT26 세포주는 마우스 모델에서 암에 대한 치료 적용을 연구하기 위해 동계 종양 모델로서 널리 사용되고 있으므로, 본 발명자들은 본 HDL 모방체 연구에서 결장암 연구를 위해 CT26 세포를 선택하였다. 본 발명자들은 일단 꼬리 정맥을 통해 2x104 CT26 세포가 주사된 BALB/c 마우스에서 폐 종양 형성에 대해 3주 동안 피하로 투여한 10 mg/kg/일 L-4F 및 sc-4F(4F 펩티드에서와 같은 동일한 아미노산을 함유하지만, 클래스 A 양친매성 나선의 형성을 방지하는 서열로 배치되는 스크램블드 펩티드)의 효과를 시험하였다. L-4F(그룹 당 n = 11)로 처리한 BALB/c 마우스에서 폐 무게(도 13A) 및 폐 표면 상에서 계수한 종양 수(도 13B)는 sc-4F로 처리한 마우스와 비교할 때, 현저히 감소하였다(280 대 225 mg, P < 0.01; 33 대 18, P < 0.001). 2 그룹으로부터의 폐 종양의 대표 사진은 도 13C에 나타낸다. 본 발명자들은 다음으로 L-4F 처리가 BALB/c 마우스의 측부에서 종양의 발달에 영향을 미치는지 여부를 시험하였다. 6주령BALB/c 암컷 마우스에게 측부에 피하로 1 x 106 CT26 세포를 주사하였다. 마우스를 CT26 세포가 주사되는 부위로부터 먼 부위에 15일 동안 매일 피하 주사하여 10 mg/kg의 sc-4F(n=9) 또는 L-4F(n=8)로 처리하였다. 측부 종양 무게는 L-4F로 처리한 마우스와 비교할 때, sc-4F로 처리한 BALB/c 마우스에서 현저하게 더 컸다(778 대 389 mg, P < 0.05; 도 13D). 2 그룹으로부터의 측부 종양의 대표 사진은 도 13E에 나타낸다. 본 발명자들은 또한 도 13A에 나타낸 시험으로부터 혈장 내의 IL-6 수준을 측정하였다. IL-6은 대조군 그룹과 비교할 때, L-4F로 처리한 마우스에서 현저히 감소하였다(도 13F).
CT26
세포 주사 후 종양 발달은 마우스 식이 중에 투여된 L-4F로 처리한 마우스에서 현저히 감소하였다.
본 발명자들은 4F가 피하로 투여되든 경구로 투여되든 죽상동맥경화증의 동물 모델에서 효과적임을 최근에 보고하였다(18). 경구적으로 투여되는 경우, L-4F가 종양 발달을 감소시킬 수 있는지 결정하기 위해, BALB/c 마우스에게 꼬리 정맥을 통해 2 x 104 CT26 세포를 주사하고, 3주 동안 사료 식이 중에 투여된 100 mg/kg/일 L-4F(n = 9) 또는 sc-4F(n = 12)로 처리하였다. sc-4F로 처리한 BALB/c 마우스에서 폐 무게(도 14A) 및 종양 수(도 14B)는 L-4F로 처리한 마우스와 비교할 때, 현저하게 더 컸다(296 대 238 mg, P < 0.05; 21 대 12, P < 0.0001). 본 발명자들은 L-4F가 생체내에서 혈관신생을 억제함을 이전에 보고하였다(23). 이 실험으로부터의 종양 항목의 면역조직화학 염색은 대조군 마우스와 비교할 때, L-4F로 처리한 마우스로부터 유래된 종양에서 CD31 발현이 현저하게 감소함을 보였다(도 14C). 또한, 혈장 LPA 수준은 L-4F 펩티드의 상응하는 대조군과 비교할 때, L-4F 펩티드를 제공받은 마우스에서 현저하게 감소하였다, (P < 0.01)(도 14D).
장관에서 종양 수 및 크기는 마우스 사료 중에 투여된 L-4F로 처리한 C57BL/6J-Apc
min
/+
마우스에서 현저히 감소하였다.
본 발명자들은 다음으로 HDL 모방체가 결장암의 자발적 모델에서 결장 종양에 영향을 미칠 수 있는지 여부를 시험하였다. APC min /+ 마우스는 결장암에 대한 확립된 마우스 모델이며, 인간에서 가족성 선종성 용종증의 발달을 반영한다(24, 25). 6주령 C57BL/6J-Apc min /+ 수컷 마우스를 8주 동안 마우스 식이 중에 투여된 100 mg/kg/일 L-4F(n = 5) 또는 sc-4F(n = 6)로 처리하였다. L-4F로 처리한 마우스로부터의 장관에서 종양 수 및 크기는 sc-4F로 처리한 마우스와 비교할 때, 현저히 감소하였다(100% 대 60%, P < 0.05; 1-3 mm: 56.5 대 36.8, P < 0.05; >3 mm: 12.8 vs. 5, P < 0.05; 도 15A 및 15B). 이 실험으로부터의 혈장 LPA 수준은 대조군 마우스와 비교할 때, L-4F 펩티드를 제공받은 마우스에서 현저하게 감소하였다, (P < 0.01)(도 15C).
L-4F는
시험관내에서
CT26
세포 생존력, 증식, 세포 주기, 및 세포-주기 관련 단백질의 발현을 변경시킨다.
HDL 모방체인 L-4F에 의해 마우스에서 CT26 세포-매개된 종양 발달을 억제하는 기전을 시험하기 위해, CT26 세포 생존력에 대한 L-4F의 효과를 시험관내에서 측정하였다. 세포 생존력은 대조군과 비교하는 경우 L-4F(10 mg/mL)로 처리된 CT26 세포에서 25%(P < 0.001) 이상 감소하였다. 게다가, L-4F는 BrdUrd 도입에 의해 측정된 바와 같이 CT26 세포의 증식을 현저히 억제하였다(P < 0.001)(도 16B). L-4F가 세포-주기 진행에서 변화를 통해 세포 증식을 억제하는지 여부를 조사하기 위해, 세포-주기 프로파일에 대한 L-4F의 효과를 CT26 세포에서 평가하였다. 세포-주기 분석은 48시간 동안 L-4F 처리가 G0/G1 기에서 증가 및 S 기에서 정지를 유도하였음을 보였다(도 16C). 또한, 웨스턴 블럿 분석은 세포-주기 단백질 사이클린 D1 및 사이클린 A의 발현이 L-4F로 처리한 세포에서 현저하게 더 낮았음을 보였다(도 16D).
HDL
모방 L-4F는
CT26
세포의
LPA
-유도된 생존력을 억제한다.
LPA는 인간에서 종양 발달, 진행, 및 전이의 중요한 매개자로서 확인되었다(26, 27). 본 발명자들은 이전에 apoAI 모방 펩티드가 IL8 세포의 LPA-유도된 생존력을 억제하고 ID8 세포로 주사된 마우스에서 혈청 LPA 수준을 감소시킴을 밝혔다(17). 예상한 바와 같이 L-4F는 LPA(10-20 mmol/L)를 결합하고(17), LPA는 CT26 세포 성장을 현저하게 개선시키고, L-4F는 시험한 모든 투여량에서 LPA-유도된 생존력을 현저히 감소시켰다, (P < 0.001)(도 17A). 본 발명자들은 액체 크로마토그래피-질량 분광분석법에 의해 세포 배양 배지 중에 LPA 수준을 측정하였고, LPA 16:0 및 18:0이 대조군 배지와 비교할 때, L-4F 처리로 현저하게 감소하였음을 확인하였다. LPA 20:4 및 18:1은 세포 배양 배지 중에 검출가능하지 않았다(도 17B).
HDL
모방체인 G* 펩티드(L-[113-122]
apoJ
)는
CT26
세포 성장 및
CT26
-
매개된
종양 발달을 억제한다.
G*(L-[113-122]apoJ) 펩티드를 사용하여 생체내 및 시험관내에서 연구를 반복하였다. CT26 세포 주사 후에 폐 종양 발달은 3주 동안 마우스 식이 중에 투여된 100 mg/kg/일 G* 펩티드로 처리한 마우스에서 현저히 감소하였다(폐 무게는 296 대 250 mg이었다, P < 0.05; 종양 수는 21 대 10이었다, P < 0.0001; 도 18A 및 18B). 세포 생존력은 비처리와 비교한 경우 G* 펩티드(10 mg/mL)로 처리된 CT26 세포에서 대략 40% 더 낮았다(도 18C). 도 18A 및 도 18B에서 나타낸 마우스 실험에서, 혈장 LPA 수준은 G* 펩티드의 상응하는 대조군 마우스와 비교할 때, G* 펩티드를 제공받은 마우스에서 현저하게 낮았다 (P < 0.05)(도 18D). 웨스턴 블럿은 사이클린 D1 및 사이클린 A의 발현이 비처리한 경우와 비교할 때, G* 펩티드 처리로 더 낮아졌음을 보였다(도 18E).
논의
지질 대사와 암 사이에는 유의미한 상관관계가 있으며, 염증성 산화 스트레스는 암의 병리생리학과 연관이 있는 것으로 오랫동안 고려되어 왔다(28-31). 지질 산화 및 결과로 초래된 산화된 지질-매개된 염증은 암을 포함하는 몇몇 질환의 발달에서 지질단백질에 대한 역할을 나타내는 많은 염증 질환의 공통적인 병인인 것 같다(31, 32). HDL은 선천적 면역 시스템의 필수적인 부분으로서 인식된다. HDL은 복잡한 거대 분자이며, 이의 기능적 레퍼토리는 항산화제, 항-염증, 및 항균 활성을 포함한다. LDL과 달리, HDL은 HDL의 구조 및 기능적 온전한 상태를 결정하는 단백질 및 지질의 이종성 혼합물이다. 인지질 전이 단백질, 콜레스테롤 에스테르 전이 단백질, 및 레시틴 콜레스테롤 아실 트랜스퍼라제를 포함하는 HDL의 몇몇 단백질/효소 구성성분은 HDL의 형성 및 성숙에 중요하지만, 아포지질단백질 A-I(apoA-I), apoJ, 및 파라옥소나제-1(PON1)과 같은 다른 단백질/효소 구성성분은 HDL에 대해 기능적 특성을 부여한다(33). 최근 10년에 걸쳐, HDL 모방체는 많은 전염증 질환의 전임상 연구에서 뛰어난 치료 가능성을 보여주었다(34-40).
본 발명자들은 최근에 L-4F 및 L-5F, 2 apoA-I 모방 펩티드가 피하 또는 경구 투여되는 경우, 마우스 난소암 세포주(ID-8 세포) 및 시스-플라티늄-저항성 인간 난소암 세포에서 생존력 및 증식을 감소시키고, C57BL/6J 마우스에서 ID-8 세포-매개된 종양 부하를 감소시킴을 밝혀냈다(17). 본 발명자들은 추가로 apoA-I 모방 펩티드가 (i) 혈관신생을 억제하고(23) (ii) MnSOD의 발현 및 활성을 유도(41)함으로써 종양형성을 억제함을 보여주었다. 혈관신생 및 산화환원 반응 경로가 많은 암의 공통 양상이기 때문에, 본 발명자들은 결장암의 발달 및 진행에서 2개의 HDL 모방체인, apoA-I 모방 펩티드 L-4F 및 apoJ 모방 펩티드 G*의 효과를 시험하였다(42). 본 발명자들의 가설과 일치하게, 본 발명의 결과는 면역적격 BALB/c 마우스 내로 CT26 세포를 주사하여 발생한 결장암의 발달을 억제함을 보여주었다. 더욱이, 본 발명자들은 FAP(APC min /+) HDL 모방체의 경구 투여가 마우스 모델에서 결장암의 자발적 발달을 억제할 수 있음을 FAP(APC min /+)의 마우스 모델을 사용하여 본 명세서에서 최초로 보여준다.
4F 펩티드를 사용하는 2 세트의 임상 시험이 진행되었다. Bloedon과 동료들은 4.3 및 7.14 mg/kg 투여량의 4F 경구 투여가 초저 혈장 농도(8-16 ng/mL)에도 불구하고, HDL 항-염증성 특성을 현저히 개선시킴을 밝혀냈다(43). Bloedon과 동료들은 또한 0.43 및 1.43 mg/kg의 펩티드 투여량의 투여가 효과적이지 않았음을 밝혀냈다(43). Watson과 동료들은 혈장 수준을 표적하였으며(44), L-4F는 관상동맥 심장 질환을 앓는 환자에서 28일 동안 피하 또는 7일 동안 정맥내 주입에 의해 매일 투여되었다. 0.43 mg/kg 투여량을 사용하여, Watsons과 동료들은 초고 혈장 농도를 달성하였으나, HDL 항-염증 특성에서는 어떠한 개선도 나타나지 않았다(44). 인간에서 HDL 기능을 개선하기 위해 필요한 투여량은 Watson과 동료들에 의해 사용된 투여량보다 훨씬 높으며(44), 적어도 Bloedon과 동료들에 의해 사용된 것 만큼 높아야 하는 것(43)으로 결론지어졌다. 최근에, Navab와 동료들은 달성된 혈장 수준이 아닌, 투여된 HDL 모방 펩티드 4F의 투여량이 효능을 결정하며, 장이 투여 경로에 상관없이 펩티드에 대한 주요 작용 부위일 것임을 보고하였다(45). 본 발명의 결과는 마우스 모델에 경구 또는 피하 투여에 상관없이 Bloedon과 동료들에 의해 사용된 투여량보다 더 큰 투여량이 효과적임을 보여준다(43). 마우스 결장암 모델에서 HDL 모방체를 이용한 본 발명자들의 결과 및 투여량이 효능을 결정하지만, 혈장 수준은 아니라는 것을 나타내는 Navab과 동료들의 결과(45)를 고려할 때, 임의의 장래의 임상 시험에서 본 명세서에서 사용된 고 투여량을 시험하는 것이 중요할 것이다.
HDL 모방체의 항-종양형성 활성의 일반적 기전에 대한 하류 표적 중 하나는,처리된 종양에서 CD31 염색에서의 감소에 의해 나타난 바와 같이, 혈관신생인 것 같다. LPA는 염증, 혈관신생, 및 암에서 중요한 역할을 하며, 치료법에 대한 유망한 표적이 되고 있다(46). 게다가, 본 발명의 이전 발견들(17, 23) 및 현재 발견과 일치하게, LPA와 같은 전염증/전혈관신생 지질의 결합 및 제거는 HDL 모방체에 대한 작용 기전의 주요한 부분일 수 있다.
결론적으로, 결과는 HDL 모방체가 마우스에서 유도성 및 자발성 결장암 모두의 발달을 억제함을 보여준다. HDL 모방 펩티드에 의한 전종양형성 지질의 결합 및 제거는 종양 관련된 혈관신생 뿐만아니라 종양의 증식 능력을 변화시킬 것 같다. 표적 지질(들)의 확인은 이들 HDL 모방체에 대한 특이적 작용 기전을 상술하기 위한 중요한 다음 단계이다.
참조문헌
실시예 5(괄호 안에 숫자로 확인됨)에 걸쳐 제공된 참조문헌에 대한 인용의 완전한 열거는 문헌 [Su et al., 2012, Mol . Cancer Ther. 11(6):1311-1319]에서 확인할 수 있다.
실시예
6: 추가적인
HDL
모방체는
결장암의 마우스 모델에서 종양 성장 및 발달을 억제한다.
본 실시예는 비히클-처리된 대조군과 비교할 때, 다양한 HDL 모방 펩티드로 처리한 CT26 세포가 처리 48시간 내에 감소된 세포 생존력(상기 기술된 MTS 분석 당)을 나타냄을 증명한다(도 19). 분석한 HDL 모방체는 L-4F(서열번호 12), L-4F2(서열번호 14), K4,15-4F(서열번호 27), K4,15-4F2(서열번호 28), 및 신규한 20개 아미노산 펩티드("20AA"), LRKLRKRLLR LVGRQLEEFL(서열번호 1)이었다. K4,15-4F(서열번호 27) 및 K4,15-4F(서열번호 28) 펩티드는 문헌[Nayyar et al., 2012, J. Lipid Res. 53(5):849-58]에 기술된 잔기 4 및 15에서 라이신이 아르기닌으로 치환된 K14,15 펩티드를 기초로 하였으며, 후자인 K4,15-4F2는 추가로 변형되어, 위치 11 및 17에서 알라닌에 대해 Aib 치환을 도입한다. 신규한 20개 아미노산 펩티드는 AoE 및 G*의 펩티드로부터 형성하여 펩티드 LRKLRKRLLR LVGRQLEEFL(서열번호 1)를 만들었다.
추가로, CT26 세포의 측부 주사를 피하에 제공받고 이후에 HDL 모방 펩티드로 피하 처리된 BALB/c 마우스는 종양 무게 및 종양 용적의 현저한 감소를 보였다(도 20). 이들 결과는 넓은 부류의 HDL 모방체가 암의 치료에서 사용될 수 있음을 확인해준다.
전술한 바로부터, 본 발명의 특정한 실시양태가 예시의 목적으로 본 명세서에 기술되었지만, 다양한 변형이 본 발명의 요지과 범주를 벗어나지 않으면서 이루어질 수 있음이 이해될 것이다. 따라서, 본 발명은 첨부된 특허청구범위에 의한 바를 제외하고는 제한되지 않는다.
<110> The Regents of the University of California
<120> USE OF HDL-RELATED MOLECULES TO TREAT AND PREVENT PROINFLAMMATORY CONDITIONS
<130> IPA140153-US
<150> US 61/528,447
<151> 2011-08-29
<150> US 61/624,333
<151> 2012-04-15
<150> US 61/646,772
<151> 2012-05-14
<160> 28
<170> KopatentIn 2.0
<210> 1
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide mimetic
<400> 1
Ser Tyr Asn Thr His Glu Thr Ile Cys Pro Glu Pro Thr Ile Asp Glu
1 5 10 15
Met Ile Met Glu Thr Ile Cys
20
<210> 2
<211> 28
<212> PRT
<213> Artificial
<220>
<223> synthetic peptide mimetic
<400> 2
Leu Arg Lys Leu Arg Lys Arg Leu Leu Arg Asp Trp Leu Lys Ala Phe
1 5 10 15
Tyr Asp Lys Val Ala Glu Lys Leu Lys Glu Ala Phe
20 25
<210> 3
<211> 28
<212> PRT
<213> Artifical
<220>
<221> MOD_RES
<222> (15)..(15)
<223> Aib
<400> 3
Leu Arg Lys Leu Arg Lys Arg Leu Leu Arg Asp Trp Leu Lys Ala Phe
1 5 10 15
Tyr Asp Lys Val Ala Glu Lys Leu Lys Glu Ala Phe
20 25
<210> 4
<211> 28
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide mimetic
<220>
<221> MOD_RES
<222> (21)..(21)
<220>
<221> MOD_RES
<222> (21)..(21)
<223> Aib
<400> 4
Leu Arg Lys Leu Arg Lys Arg Leu Leu Arg Asp Trp Leu Lys Ala Phe
1 5 10 15
Tyr Asp Lys Val Ala Glu Lys Leu Lys Glu Ala Phe
20 25
<210> 5
<211> 28
<212> PRT
<213> Artificial
<220>
<223> synthetic peptide mimetic
<220>
<221> MOD_RES
<222> (27)..(27)
<223> Aib
<400> 5
Leu Arg Lys Leu Arg Lys Arg Leu Leu Arg Asp Trp Leu Lys Ala Phe
1 5 10 15
Tyr Asp Lys Val Ala Glu Lys Leu Lys Glu Ala Phe
20 25
<210> 6
<211> 28
<212> PRT
<213> Artificial
<220>
<223> syntheitc peptide mimetic
<220>
<221> MOD_RES
<222> (15)..(15)
<223> Aib
<220>
<221> MOD_RES
<222> (21)..(21)
<223> Aib
<400> 6
Leu Arg Lys Leu Arg Lys Arg Leu Leu Arg Asp Trp Leu Lys Ala Phe
1 5 10 15
Tyr Asp Lys Val Ala Glu Lys Leu Lys Glu Ala Phe
20 25
<210> 7
<211> 28
<212> PRT
<213> Artificial
<220>
<223> synthetic peptide mimetic
<220>
<221> MOD_RES
<222> (21)..(21)
<223> Aib
<220>
<221> MOD_RES
<222> (27)..(27)
<223> Aib
<400> 7
Leu Arg Lys Leu Arg Lys Arg Leu Leu Arg Asp Trp Leu Lys Ala Phe
1 5 10 15
Tyr Asp Lys Val Ala Glu Lys Leu Lys Glu Ala Phe
20 25
<210> 8
<211> 28
<212> PRT
<213> Artificial
<220>
<223> synthetic peptide mimetic
<220>
<221> MOD_RES
<222> (15)..(15)
<223> Aib
<220>
<221> MOD_RES
<222> (27)..(27)
<223> Aib
<400> 8
Leu Arg Lys Leu Arg Lys Arg Leu Leu Arg Asp Trp Leu Lys Ala Phe
1 5 10 15
Tyr Asp Lys Val Ala Glu Lys Leu Lys Glu Ala Phe
20 25
<210> 9
<211> 28
<212> PRT
<213> Artificial
<220>
<223> synthetic peptide mimetic
<220>
<221> MOD_RES
<222> (15)..(15)
<223> Aib
<220>
<221> MOD_RES
<222> (21)..(21)
<223> Aib
<220>
<221> MOD_RES
<222> (27)..(27)
<223> Aib
<400> 9
Leu Arg Lys Leu Arg Lys Arg Leu Leu Arg Asp Trp Leu Lys Ala Phe
1 5 10 15
Tyr Asp Lys Val Ala Glu Lys Leu Lys Glu Ala Phe
20 25
<210> 10
<211> 267
<212> PRT
<213> Artificial
<220>
<223> synthetic peptide mimetic
<400> 10
Met Lys Ala Ala Val Leu Thr Leu Ala Val Ala Leu Gly Lys Gln Leu
1 5 10 15
Asn Leu Lys Leu Val Gln Pro Tyr Leu Asp Asp Phe Gln Lys Asp Ala
20 25 30
Leu Arg Thr His Leu Ala Pro Tyr Gly Leu Leu Pro Val Leu Glu Ser
35 40 45
Phe Lys Leu Phe Leu Thr Gly Ser Gln Ala Arg His Leu Asp Asn Trp
50 55 60
Asp Ser Val Thr Ser Thr Lys Trp Gln Glu Glu Met Glu Leu Tyr Arg
65 70 75 80
Ser Asp Glu Leu Arg Gln Arg Leu Ala Ala Val Ser Phe Leu Ser Ala
85 90 95
Leu Glu Glu Tyr Phe Trp Gln Gln Asp Glu Pro Pro Gln Ser Phe Ser
100 105 110
Lys Leu Arg Glu Gln Leu Gly Pro Gln Lys Val Glu Pro Leu Arg Ala
115 120 125
Glu Leu Arg Leu Glu Ala Leu Lys Glu Asn Gly Gly Thr Lys Lys Leu
130 135 140
Asn Thr Gln Pro Trp Asp Arg Val Lys Asp Leu Ala Thr Val Thr Gln
145 150 155 160
Glu Phe Trp Asp Asn Leu Glu Gln Glu Gly Ala Arg Gln Lys Leu His
165 170 175
Glu Ala Arg Leu Ala Glu Tyr His Ala Lys Ala Val Tyr Val Asp Val
180 185 190
Leu Lys Asp Ser Gly Lys Glu Thr Glu Gly Leu Arg Gln Glu Met Leu
195 200 205
Gln Glu Lys Leu Ser Pro Leu Gly Glu Thr Glu His Leu Ser Thr Leu
210 215 220
Ser Glu Lys Arg Asp Tyr Val Ser Gln Phe Glu Gly Ser Ser Lys Asp
225 230 235 240
Leu Glu Glu Val Lys Ala Lys Glu Met Arg Asp Arg Ala Arg Ala His
245 250 255
Val Ala Lys Pro Ala Leu Glu Asp Leu Arg Gln
260 265
<210> 11
<211> 243
<212> PRT
<213> Artificial
<220>
<223> synthetic peptide mimetic
<400> 11
Asp Glu Pro Pro Gln Ser Pro Trp Asp Arg Val Lys Asp Leu Ala Thr
1 5 10 15
Val Tyr Val Asp Val Leu Lys Asp Ser Gly Arg Asp Tyr Val Ser Gln
20 25 30
Phe Glu Gly Ser Ala Leu Gly Lys Gln Leu Asn Leu Lys Leu Leu Asp
35 40 45
Asn Trp Asp Ser Val Thr Ser Thr Phe Ser Lys Leu Arg Glu Gln Leu
50 55 60
Gly Pro Val Thr Gln Glu Phe Trp Asp Asn Leu Glu Lys Glu Thr Glu
65 70 75 80
Gly Leu Arg Gln Glu Met Ser Lys Asp Leu Glu Glu Val Lys Ala Lys
85 90 95
Val Gln Pro Tyr Leu Asp Asp Phe Gln Lys Lys Trp Gln Glu Glu Met
100 105 110
Glu Leu Tyr Arg Gln Lys Val Glu Pro Leu Arg Ala Glu Leu Gln Glu
115 120 125
Gly Ala Arg Gln Lys Leu His Glu Leu Gln Glu Lys Leu Ser Pro Leu
130 135 140
Gly Glu Glu Met Arg Asp Arg Ala Arg Ala His Val Asp Ala Leu Arg
145 150 155 160
Thr His Leu Ala Pro Tyr Ser Asp Glu Leu Arg Gln Arg Leu Ala Ala
165 170 175
Arg Leu Glu Ala Leu Lys Glu Asn Gly Gly Ala Arg Leu Ala Glu Tyr
180 185 190
His Ala Lys Ala Thr Glu His Leu Ser Thr Leu Ser Glu Lys Ala Lys
195 200 205
Pro Ala Leu Glu Asp Leu Arg Gln Gly Leu Leu Pro Val Leu Glu Ser
210 215 220
Phe Lys Val Ser Phe Leu Ser Ala Leu Glu Glu Tyr Thr Lys Lys Leu
225 230 235 240
Asn Thr Gln
<210> 12
<211> 18
<212> PRT
<213> Artificial
<220>
<223> synthetic peptide mimetic
<400> 12
Asp Trp Phe Lys Ala Phe Tyr Asp Lys Val Ala Glu Lys Phe Lys Glu
1 5 10 15
Ala Phe
<210> 13
<211> 18
<212> PRT
<213> Artificial
<220>
<223> synthetic peptide mimetic
<400> 13
Asp Trp Phe Ala Lys Asp Tyr Phe Lys Lys Ala Phe Val Glu Glu Phe
1 5 10 15
Ala Lys
<210> 14
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide mimetic
<220>
<221> MOD_RES
<222> (11)..(11)
<223> Aib
<220>
<221> MOD_RES
<222> (17)..(17)
<223> Aib
<400> 14
Asp Trp Phe Lys Ala Phe Tyr Asp Lys Val Ala Glu Lys Phe Lys Glu
1 5 10 15
Ala Phe
<210> 15
<211> 10
<212> PRT
<213> Artificial
<220>
<223> synthetic peptide mimetic
<400> 15
Leu Arg Lys Leu Arg Lys Arg Leu Leu Arg
1 5 10
<210> 16
<211> 22
<212> DNA
<213> Artificial
<220>
<223> primer
<400> 16
tccagttacg ttccttcgat ca 22
<210> 17
<211> 20
<212> DNA
<213> Artificial
<220>
<223> primer
<400> 17
tttgaggact tgcgctttca 20
<210> 18
<211> 20
<212> DNA
<213> Artificial
<220>
<223> primer
<400> 18
cggcgaagag aagagacaca 20
<210> 19
<211> 20
<212> DNA
<213> Artificial
<220>
<223> primer
<400> 19
ggaggaaggt caaccactca 20
<210> 20
<211> 20
<212> DNA
<213> Artificial
<220>
<223> primer
<400> 20
cgggccaaga gtgtgctaaa 20
<210> 21
<211> 20
<212> DNA
<213> Artificial
<220>
<223> primer
<400> 21
tgacgatacc ggagccaatg 20
<210> 22
<211> 20
<212> DNA
<213> Artificial
<220>
<223> primer
<400> 22
tgctactacc agcaccatgc 20
<210> 23
<211> 20
<212> DNA
<213> Artificial
<220>
<223> primer
<400> 23
atgctcccag tggactcatc 20
<210> 24
<211> 21
<212> DNA
<213> Artificial
<220>
<223> primer
<400> 24
ggaaggtgaa ggtcggagtc a 21
<210> 25
<211> 25
<212> DNA
<213> Artificial
<220>
<223> primer
<400> 25
gtcattgatg gcaacaatat ccact 25
<210> 26
<211> 10
<212> PRT
<213> Artificial
<220>
<223> synthetic peptide mimetic
<400> 26
Leu Val Gly Arg Gln Leu Glu Glu Phe Leu
1 5 10
<210> 27
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide mimetic
<400> 27
Asp Trp Phe Arg Ala Phe Tyr Asp Lys Val Ala Glu Lys Phe Arg Glu
1 5 10 15
Ala Phe
<210> 28
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide mimetic
<220>
<221> MOD_RES
<222> (11)..(11)
<223> Aib
<220>
<221> MOD_RES
<222> (17)..(17)
<223> Aib
<400> 28
Asp Trp Phe Arg Ala Phe Tyr Asp Lys Val Ala Glu Lys Phe Arg Glu
1 5 10 15
Ala Phe
Claims (15)
- HDL 모방 펩티드(서열번호 1, 3-9, 12, 14 또는 26-28), 소 HDL, 및 ApoA-I로 구성되는 군으로부터 선택되는 HDL-관련 분자와 종양 세포를 접촉시키는 것을 포함하는, 종양 성장을 억제하는 방법.
- HDL 모방 펩티드(서열번호 1, 3-9, 12, 14 또는 26-28), 소 HDL, 및 ApoA-I로 구성되는 군으로부터 선택되는 HDL-관련 분자를 개체에게 투여하는 것을 포함하는 개체에서 암을 치료 또는 예방하는 방법.
- HDL 모방 펩티드(서열번호 1, 3-9, 12, 14 또는 26-28), 소 HDL, 및 ApoA-I으로 구성되는 군으로부터 선택되는 HDL-관련 분자와 상피 세포를 접촉시키는 것을 포함하는, 산화적 스트레스에 노출된 상피 세포에서 사멸 및/또는 산화적 스트레스를 감소시키는 방법.
- 제3항에 있어서, 접촉이 산화적 스트레스에 노출되기 전에 발생하는 것인 방법.
- 제4항에 있어서, 접촉이 산화적 스트레스에 노출되기 적어도 12-24 시간 전에 발생하는 것인 방법.
- 제3항, 제4항 또는 제5항에 있어서, 산화적 스트레스가 자외선 복사에 노출되는 것을 포함하는 것인 방법.
- 제1항 내지 제6항 중 어느 한 항에 있어서, ApoA-I가 전장 단백질인 것인 방법.
- 제1항 내지 제7항 중 어느 한 항에 있어서, ApoA-I가 재조합 ApoA-I로서 투여되는 것인 방법.
- 제1항 내지 제8항 중 어느 한 항에 있어서, ApoA-I가 비변형 형태로 투여되는 것인 방법.
- 제1항 내지 제6항 중 어느 한 항에 있어서, HDL-관련 분자가 경구 보충물로서 투여되는 것인 방법.
- 제1항 내지 제6항 중 어느 한 항에 있어서, HDL 모방 펩티드가 서열번호 1, 3-9, 12, 14 및 26-28로 구성되는 군으로부터 선택되는 것인 방법.
- 제1항 내지 제11항 중 어느 한 항에 있어서, 개체가 포유동물인 것인 방법.
- 제12항에 있어서, 개체가 인간인 것인 방법.
- HDL-관련 분자가 HDL 모방 펩티드(서열번호 1, 3-9, 12, 14 또는 26-28), 소 HDL, 및 ApoA-I로 구성되는 군으로부터 선택되는 것인, 암의 치료를 위한 HDL-관련 분자.
- 서열번호 1, 또는 서열번호 3-9 중 어느 하나로 표시되는 아미노산 서열로 구성된 펩티드.
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161528447P | 2011-08-29 | 2011-08-29 | |
| US61/528,447 | 2011-08-29 | ||
| US201261624333P | 2012-04-15 | 2012-04-15 | |
| US61/624,333 | 2012-04-15 | ||
| US201261646772P | 2012-05-14 | 2012-05-14 | |
| US61/646,772 | 2012-05-14 | ||
| PCT/US2012/052925 WO2013033260A1 (en) | 2011-08-29 | 2012-08-29 | Use of hdl-related molecules to treat and prevent proinflammatory conditions |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20140063747A true KR20140063747A (ko) | 2014-05-27 |
Family
ID=47756845
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020147008207A KR20140063747A (ko) | 2011-08-29 | 2012-08-29 | 전염증성 상태를 치료 및 예방하기 위한 hdl-관련 분자의 용도 |
Country Status (8)
| Country | Link |
|---|---|
| US (2) | US9241976B2 (ko) |
| EP (1) | EP2751126B1 (ko) |
| JP (1) | JP6078067B2 (ko) |
| KR (1) | KR20140063747A (ko) |
| CN (1) | CN104039810A (ko) |
| AU (1) | AU2012301955A1 (ko) |
| CA (1) | CA2846865A1 (ko) |
| WO (1) | WO2013033260A1 (ko) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10426817B2 (en) | 2017-01-24 | 2019-10-01 | Macregen, Inc. | Treatment of age-related macular degeneration and other eye diseases with apolipoprotein mimetics |
| WO2018190896A1 (en) * | 2017-04-13 | 2018-10-18 | Lipimetix Development, Inc. | Apoe mimetic peptide compositions |
Family Cites Families (51)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4603112A (en) | 1981-12-24 | 1986-07-29 | Health Research, Incorporated | Modified vaccinia virus |
| US4769330A (en) | 1981-12-24 | 1988-09-06 | Health Research, Incorporated | Modified vaccinia virus and methods for making and using the same |
| US4751180A (en) | 1985-03-28 | 1988-06-14 | Chiron Corporation | Expression using fused genes providing for protein product |
| DK145385D0 (da) | 1985-03-29 | 1985-04-01 | Novo Industri As | Monoklonalt antistof til immunkemisk analyse |
| GB8508845D0 (en) | 1985-04-04 | 1985-05-09 | Hoffmann La Roche | Vaccinia dna |
| US4777127A (en) | 1985-09-30 | 1988-10-11 | Labsystems Oy | Human retrovirus-related products and methods of diagnosing and treating conditions associated with said retrovirus |
| US4935233A (en) | 1985-12-02 | 1990-06-19 | G. D. Searle And Company | Covalently linked polypeptide cell modulators |
| US5114863A (en) | 1986-09-30 | 1992-05-19 | Board Of Supervisors Of Louisiana State University & Agricultural & Mechanical College | Immunosorbant assay for α-1-antitrypsin, kit employing said assay, monoclonal antibody to α-1-antitrypsin, and hybridoma for producing said monoclonal antibody |
| GB8702816D0 (en) | 1987-02-07 | 1987-03-11 | Al Sumidaie A M K | Obtaining retrovirus-containing fraction |
| WO1989001973A2 (en) | 1987-09-02 | 1989-03-09 | Applied Biotechnology, Inc. | Recombinant pox virus for immunization against tumor-associated antigens |
| AP129A (en) | 1988-06-03 | 1991-04-17 | Smithkline Biologicals S A | Expression of retrovirus gag protein eukaryotic cells |
| EP0487587A1 (en) | 1989-08-18 | 1992-06-03 | Chiron Corporation | Recombinant retroviruses delivering vector constructs to target cells |
| SE8904007D0 (sv) | 1989-11-28 | 1989-11-28 | Ferring Ab | Monoklona antikroppar och diagnostiseringsmetod |
| SE466259B (sv) | 1990-05-31 | 1992-01-20 | Arne Forsgren | Protein d - ett igd-bindande protein fraan haemophilus influenzae, samt anvaendning av detta foer analys, vacciner och uppreningsaendamaal |
| RU2152787C2 (ru) * | 1994-06-02 | 2000-07-20 | Дан Рига | Лекарство против стресса, против снижения уровня активности и против старения и способ его получения |
| US20030027216A1 (en) | 2001-07-02 | 2003-02-06 | Kiernan Urban A. | Analysis of proteins from biological fluids using mass spectrometric immunoassay |
| US5891641A (en) | 1997-02-21 | 1999-04-06 | The Regents Of The University Of California | Assay for disease related conformation of a protein |
| US5955582A (en) | 1997-09-26 | 1999-09-21 | Beckman Coulter, Inc. | Antibody against a 3-aminophenylboronic-glycated protein complex and its use in an immunoassay |
| US7723303B2 (en) | 2000-08-24 | 2010-05-25 | The Regents Of The University Of California | Peptides and peptide mimetics to treat pathologies characterized by an inflammatory response |
| US20050214760A1 (en) | 2002-01-07 | 2005-09-29 | Johns Hopkins University | Biomarkers for detecting ovarian cancer |
| US6930085B2 (en) * | 2002-04-05 | 2005-08-16 | The Regents Of The University Of California | G-type peptides to ameliorate atherosclerosis |
| WO2004001010A2 (en) | 2002-06-21 | 2003-12-31 | Ptc Therapeutics, Inc. | METHODS FOR IDENTIFYING SMALL MOLECULES THAT MODULATE PREMATURE TRANSLATION TERMINATION AND NONSENSE MEDIATED mRNA DECAY |
| WO2004010106A2 (en) | 2002-07-24 | 2004-01-29 | Ptc Therapeutics, Inc. | METHODS FOR IDENTIFYING SMALL MOLEDULES THAT MODULATE PREMATURE TRANSLATION TERMINATION AND NONSENSE MEDIATED mRNA DECAY |
| EP1540010B8 (en) | 2002-08-06 | 2010-07-14 | The Johns Hopkins University | Use of biomarkers for detecting ovarian cancer |
| US7191068B2 (en) | 2003-03-25 | 2007-03-13 | Proteogenix, Inc. | Proteomic analysis of biological fluids |
| JP2007504840A (ja) | 2003-05-12 | 2007-03-08 | ザ・チルドレンズ・ホスピタル・オブ・フィラデルフィア | Grp94ベース組成物及びそれらの使用方法 |
| AU2003260457A1 (en) | 2003-08-25 | 2005-03-10 | Marc Ramael | A method and kit for the quantitative and/or qualitative detection of components in a sample |
| JP4660486B2 (ja) | 2004-01-09 | 2011-03-30 | モガム バイオテクノロジー リサーチ インスティチュート | ヒトアポリポ蛋白質(a)クリングルLK68またはLK8遺伝子を有効成分として含有する抗癌治療剤及びそれを使用した癌治療方法 |
| WO2005071058A2 (en) | 2004-01-27 | 2005-08-04 | Compugen Ltd. | Methods and systems for annotating biomolecular sequences |
| WO2005093413A2 (en) | 2004-03-22 | 2005-10-06 | Yale University | Diagnosis and treatment of preeclampsia |
| WO2012047930A2 (en) * | 2010-10-04 | 2012-04-12 | The Regents Of The University Of California | Compositions and methods for treatment of gynecologic cancers |
| EP1789805B1 (en) | 2004-07-14 | 2010-09-15 | The Regents of The University of California | Biomarker for early detection of ovarian cancer |
| US7670792B2 (en) | 2004-07-14 | 2010-03-02 | The Regents Of The University Of California | Biomarkers for early detection of ovarian cancer |
| US9488655B2 (en) | 2004-07-14 | 2016-11-08 | The Regents Of The University Of California | Biomarkers for detection of early- and late-stage endometrial cancer |
| CN104558200B (zh) * | 2004-09-02 | 2021-11-16 | 康石医药科技(上海)有限公司 | 改进的apo e类似物及其使用方法 |
| WO2006034427A2 (en) | 2004-09-20 | 2006-03-30 | Proteogenix, Inc. | Diagnosis of fetal aneuploidy |
| RU2414236C2 (ru) * | 2004-12-06 | 2011-03-20 | Зе Риджентс Оф Зи Юнивесити Оф Кэлифонье | Способ улучшения структуры и/или функций артериол |
| US7427662B2 (en) | 2005-02-01 | 2008-09-23 | Baord Of Supervisors Of Louisiana State University And Agricultural And Mechanical College | Inhibition of angiogenesis and destruction of angiogenic vessels by apolipoprotein A-I and high density lipoprotein |
| KR101310000B1 (ko) | 2005-03-11 | 2013-09-25 | 싸이퍼젠 바이오시스템즈, 인코포레이티드 | 난소암 및 자궁내막암에 대한 바이오마커 : 헵시딘 |
| US20080293639A1 (en) * | 2005-04-29 | 2008-11-27 | The Regents Of The University Of California | Peptides and peptide mimetics to treat pathologies characterized by an inflammatory response |
| MX2007013430A (es) * | 2005-04-29 | 2008-03-19 | Univ California | Peptidos y peptidos mimeticos para tratar patologias caracterizadas por una respuesta inflamatoria. |
| US7604948B2 (en) | 2005-05-05 | 2009-10-20 | The Regents Of The University Of California | Biomarkers for diagnosing an autism spectrum disorder |
| EP1896855A2 (en) | 2005-06-21 | 2008-03-12 | Jean-Paul Borg | Biomarkers for breast cancer |
| US7575876B2 (en) | 2005-10-27 | 2009-08-18 | The University Of Washington | Biomarkers for neurodegenerative disorders |
| CA2633255A1 (en) | 2005-12-16 | 2007-06-21 | Electrophoretics Limited | Diagnosis and prognosis of colorectal cancer |
| KR100725642B1 (ko) * | 2006-01-20 | 2007-06-07 | 충남대학교산학협력단 | 저밀도 지단백질에 대해 항산화성을 갖는 펩타이드 |
| US7723045B2 (en) | 2006-02-10 | 2010-05-25 | The Regents Of The University Of California | Assays to predict atherosclerosis and dysfunctional high-density lipoprotein |
| AU2008266753A1 (en) * | 2007-06-20 | 2008-12-24 | Istituto Di Recerche Di Biologia Molecolare P. Angeletti S.P.A. | ApoA-1 peptide mimetics |
| AU2008296478B9 (en) * | 2007-08-28 | 2015-03-19 | The Uab Research Foundation | Synthetic apolipoprotein E mimicking polypeptides and methods of use |
| EP2195340A4 (en) * | 2007-08-28 | 2011-05-11 | Uab Research Foundation | SYNTHETIC APOLIPOPROTEIN E-IMITATING POLYPEPTIDES AND METHOD OF USE |
| JP2009092440A (ja) | 2007-10-04 | 2009-04-30 | Shimadzu Corp | 卵巣癌の診断システム及び卵巣癌の診断方法 |
-
2012
- 2012-08-29 KR KR1020147008207A patent/KR20140063747A/ko not_active Application Discontinuation
- 2012-08-29 WO PCT/US2012/052925 patent/WO2013033260A1/en active Application Filing
- 2012-08-29 CA CA2846865A patent/CA2846865A1/en not_active Abandoned
- 2012-08-29 AU AU2012301955A patent/AU2012301955A1/en not_active Abandoned
- 2012-08-29 EP EP12826789.5A patent/EP2751126B1/en not_active Not-in-force
- 2012-08-29 CN CN201280052367.7A patent/CN104039810A/zh active Pending
- 2012-08-29 JP JP2014528563A patent/JP6078067B2/ja not_active Expired - Fee Related
- 2012-08-29 US US14/239,530 patent/US9241976B2/en not_active Expired - Fee Related
-
2016
- 2016-01-22 US US15/004,604 patent/US10208103B2/en not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| EP2751126A1 (en) | 2014-07-09 |
| US20170204160A1 (en) | 2017-07-20 |
| WO2013033260A1 (en) | 2013-03-07 |
| CN104039810A (zh) | 2014-09-10 |
| EP2751126B1 (en) | 2018-03-07 |
| EP2751126A4 (en) | 2015-11-04 |
| US9241976B2 (en) | 2016-01-26 |
| CA2846865A1 (en) | 2013-03-07 |
| US20140323410A1 (en) | 2014-10-30 |
| JP6078067B2 (ja) | 2017-02-08 |
| US10208103B2 (en) | 2019-02-19 |
| JP2014526440A (ja) | 2014-10-06 |
| AU2012301955A1 (en) | 2014-03-06 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5706818B2 (ja) | ApoEペプチドにより癌を治療する方法 | |
| US10889619B2 (en) | Methods for treating cancer | |
| WO2008008923A2 (en) | Compositions and methods for targeting cancer-specific transcription complexes | |
| JP2001502538A (ja) | ミニe1a遺伝子及び遺伝子産物 | |
| US20150087598A1 (en) | Treating muc1-expressing cancers with helicase inhibitors | |
| US9314497B2 (en) | E2F as a target of hormone refractory prostate cancer | |
| US9487575B2 (en) | Compositions and methods for treatment of gynecologic cancers | |
| US10208103B2 (en) | Use of HDL-related molecules to treat and prevent proinflammatory conditions | |
| KR20070011892A (ko) | Msx1 단백질 또는 이를 코딩하는 유전자를유효성분으로 포함하는 세포사멸유도제 | |
| KR20220051418A (ko) | 근위축성 측삭 경화증 치료제 | |
| WO2005004913A1 (ja) | デコイを含む薬学的組成物およびその使用方法 | |
| ES2825078T3 (es) | Tratamiento de enfermedades autoinmunitarias | |
| EP2582384B1 (en) | Compositions and methods for treating cancer | |
| US20030162736A1 (en) | Medicament comprising NK4 gene or recombinant NK4 protein | |
| WO2011071859A1 (en) | Method and composition to increase radiation-induced tumor therapeutic effects | |
| US20210322508A1 (en) | Peptides and compositions for targeted treatment and imaging | |
| WO2021223026A1 (en) | Ezh1/2 knockdown peptides, methods and uses thereof | |
| KR101401894B1 (ko) | Smg-1을 유효성분으로 함유하는 항암제 민감성 증진용 조성물 | |
| WO2012103163A2 (en) | Compositions and methods for treating cancer while preventing or reducing cardiotoxicity and/or cardiomyopathy | |
| JP2009159883A (ja) | 新規遺伝子治療薬 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Withdrawal due to no request for examination |