KR20130032897A - Production of alcohol esters and in situ product removal during alcohol fermentation - Google Patents
Production of alcohol esters and in situ product removal during alcohol fermentation Download PDFInfo
- Publication number
- KR20130032897A KR20130032897A KR1020137001251A KR20137001251A KR20130032897A KR 20130032897 A KR20130032897 A KR 20130032897A KR 1020137001251 A KR1020137001251 A KR 1020137001251A KR 20137001251 A KR20137001251 A KR 20137001251A KR 20130032897 A KR20130032897 A KR 20130032897A
- Authority
- KR
- South Korea
- Prior art keywords
- butanol
- carboxylic acid
- oil
- alcohol
- fatty acid
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N1/00—Microorganisms, e.g. protozoa; Compositions thereof; Processes of propagating, maintaining or preserving microorganisms or compositions thereof; Processes of preparing or isolating a composition containing a microorganism; Culture media therefor
- C12N1/38—Chemical stimulation of growth or activity by addition of chemical compounds which are not essential growth factors; Stimulation of growth by removal of a chemical compound
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C29/00—Preparation of compounds having hydroxy or O-metal groups bound to a carbon atom not belonging to a six-membered aromatic ring
- C07C29/74—Separation; Purification; Use of additives, e.g. for stabilisation
- C07C29/76—Separation; Purification; Use of additives, e.g. for stabilisation by physical treatment
- C07C29/86—Separation; Purification; Use of additives, e.g. for stabilisation by physical treatment by liquid-liquid treatment
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/88—Lyases (4.)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P7/00—Preparation of oxygen-containing organic compounds
- C12P7/02—Preparation of oxygen-containing organic compounds containing a hydroxy group
- C12P7/04—Preparation of oxygen-containing organic compounds containing a hydroxy group acyclic
- C12P7/06—Ethanol, i.e. non-beverage
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P7/00—Preparation of oxygen-containing organic compounds
- C12P7/02—Preparation of oxygen-containing organic compounds containing a hydroxy group
- C12P7/04—Preparation of oxygen-containing organic compounds containing a hydroxy group acyclic
- C12P7/16—Butanols
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y301/00—Hydrolases acting on ester bonds (3.1)
- C12Y301/01—Carboxylic ester hydrolases (3.1.1)
- C12Y301/01003—Triacylglycerol lipase (3.1.1.3)
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D21/00—Separation of suspended solid particles from liquids by sedimentation
- B01D21/26—Separation of sediment aided by centrifugal force or centripetal force
- B01D21/262—Separation of sediment aided by centrifugal force or centripetal force by using a centrifuge
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E50/00—Technologies for the production of fuel of non-fossil origin
- Y02E50/10—Biofuels, e.g. bio-diesel
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Health & Medical Sciences (AREA)
- Genetics & Genomics (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Health & Medical Sciences (AREA)
- Biochemistry (AREA)
- General Engineering & Computer Science (AREA)
- Biotechnology (AREA)
- Microbiology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Biomedical Technology (AREA)
- Medicinal Chemistry (AREA)
- Molecular Biology (AREA)
- Tropical Medicine & Parasitology (AREA)
- Virology (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Fats And Perfumes (AREA)
- Apparatus Associated With Microorganisms And Enzymes (AREA)
- Liquid Carbonaceous Fuels (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
- Fodder In General (AREA)
Abstract
발효 배지 중의 생성물 알코올과 카르복실산 (예를 들어, 지방산), 및 부탄올과 같은 생성물 알코올을 카르복실산으로 에스테르화하여 알코올 에스테르를 생성시킬 수 있는 촉매 (예를 들어, 리파제)의 에스테르화에 의한 알코올 에스테르의 생성을 포함하는 알코올 발효 프로세스 및 조성물. 알코올 에스테르는 발효 배지로부터 추출될 수 있으며, 생성물 알코올은 알코올 에스테르로부터 회수될 수 있다. 카르복실산은 또한 발효 배지로부터 알코올 에스테르를 제거하기 위한 추출제로서 작용할 수 있다.Esterification of a product (e.g., lipase) capable of esterifying a product alcohol and a carboxylic acid (e.g. fatty acid) and a product alcohol such as butanol to the carboxylic acid to produce an alcohol ester in a fermentation medium. Alcohol fermentation process and composition comprising the production of an alcohol ester. The alcohol ester can be extracted from the fermentation medium and the product alcohol can be recovered from the alcohol ester. The carboxylic acid can also serve as an extractant for removing the alcohol esters from the fermentation medium.
Description
본 출원은 모두 그 전체 내용이 본 명세서에 참조로 포함되는, 2010년 6월 18일자로 출원된 미국 가출원 제61/356,290호; 2010년 7월 28일자로 출원된 미국 가출원 제61/368,451호; 2010년 7월 28일자로 출원된 미국 가출원 제61/368,436호; 2010년 7월 28일자로 출원된 미국 가출원 제61/368,444호; 2010년 7월 28일자로 출원된 미국 가출원 제61/368,429호; 2010년 9월 2일자로 출원된 미국 가출원 제61/379,546호; 2011년 2월 7일자로 출원된 미국 가출원 제61/440,034호; 및 2011년 6월 15일자로 출원된 미국 특허 출원 제13/160,766호 의 이익을 주장한다.This application is incorporated by reference in US Provisional Application No. 61 / 356,290, filed June 18, 2010, the entire contents of which are incorporated herein by reference; US Provisional Application No. 61 / 368,451, filed July 28, 2010; US Provisional Application No. 61 / 368,436, filed July 28, 2010; US Provisional Application No. 61 / 368,444, filed July 28, 2010; US Provisional Application No. 61 / 368,429, filed July 28, 2010; US Provisional Application No. 61 / 379,546, filed September 2, 2010; US Provisional Application No. 61 / 440,034, filed February 7, 2011; And US patent application Ser. No. 13 / 160,766, filed June 15, 2011.
본 출원과 관련된 서열 목록은 EFS-Web를 통해 전자적 형태로 제출되어 있으며, 전체로서 본 명세서에 참조로 포함되어 있다.Sequence listings associated with this application are submitted in electronic form via EFS-Web, which is incorporated herein by reference in its entirety.
본 발명은 에탄올 및 부탄올을 비롯한 알코올의 발효 생산, 및 모든 관련 부산물, 및 원위치에서의 생성물 제거 방법을 이용하여 알코올 발효를 향상시키는 방법에 관한 것이다.The present invention relates to fermentation production of alcohols, including ethanol and butanol, and all related by-products, and methods of enhancing alcohol fermentation using in situ product removal methods.
알코올은 음료 (즉, 에탄올), 연료, 시약, 용매, 및 방부제와 같은 공업 및 과학에서의 다양한 용도를 갖고 있다. 예를 들어, 부탄올은 재생가능한 연료 첨가제로서의 사용, 플라스틱 업계에서의 공급원료 화학 약품으로서의 사용, 및 식품 및 향신료 업계에서의 식품 등급 추출제 (extractant)로서의 사용을 비롯한 다양한 용도를 갖는 중요한 공업 화학 물질 및 드롭인 (drop-in) 연료 성분인 알코올이다. 따라서, 부탄올과 같은 알코올, 및 효율적이고 환경 친화적인 생산 방법이 강하게 요구되고 있다.Alcohols have a variety of uses in industry and science, such as beverages (ie ethanol), fuels, reagents, solvents, and preservatives. Butanol, for example, is an important industrial chemical with a variety of uses, including use as a renewable fuel additive, as a feedstock chemical in the plastics industry, and as a food grade extractant in the food and spice industries. And alcohols which are drop-in fuel components. Therefore, there is a strong demand for alcohols such as butanol, and an efficient and environmentally friendly production method.
미생물에 의한 발효를 이용한 알코올의 생산은 하나의 이러한 환경 친화적인 생산 방법이다. 부탄올 생산에 있어서, 특히, 부탄올을 고 수율로 생산하는 몇몇 미생물은 또한 저 부탄올 독성 역치 (toxicity threshold)를 갖고 있다. 생산되어짐에 따라 발효 용기로부터 부탄올을 제거하는 것이 이러한 저 부탄올 독성 역치에 대처하는 수단이다. 따라서, 발효 배지에서의 부탄올 생성 미생물의 저 부탄올 독성 역치에도 불구하고 부탄올을 고 수율로 생성하는 효과적인 방법 및 시스템이 계속해서 요구된다.The production of alcohol using fermentation by microorganisms is one such environmentally friendly production method. In butanol production, in particular, some microorganisms that produce butanol in high yields also have a low butanol toxicity threshold. As it is produced, removing butanol from fermentation vessels is a means to cope with this low butanol toxicity threshold. Thus, there remains a continuing need for effective methods and systems for producing butanol in high yield despite the low butanol toxicity threshold of butanol producing microorganisms in fermentation broth.
원위치에서의 생성물 제거 (ISPR) (추출 발효로도 명명됨)는 생성됨에 따라 발효 용기로부터 부탄올 (또는 다른 발효 알코올)을 제거하는데 사용되어, 미생물이 부탄올을 고 수율로 생성할 수 있다. 당업계에 기재된 발효 알코올을 제거하기 위한 하나의 ISPR 방법은 액체-액체 추출 (미국 특허 출원 공개 제2009/0305370호)이다. 일반적으로, 부탄올 발효에 관해서는, 미생물을 포함하는 발효 배지는 부탄올 농도가 독성 레벨에 도달하기 전의 시점에 유기 추출제와 접촉된다. 유기 추출제와 발효 배지는 2상 (biphasic) 혼합물을 형성한다. 부탄올은 유기 추출제상으로 분배되어, 미생물을 함유하는 수성상 중의 부탄올의 농도가 감소되고, 그리하여 저해성 부탄올에의 미생물의 노출이 제한된다. 기술적으로 경제적으로 실행가능하게 하기 위해서는, 액체-액체 추출은 생성물 알코올의 추출제로의 효율적인 물질 이동을 위해 추출제와 발효 브로스 (broth) 사이의 접촉; 발효 브로스로부터의 추출제의 상분리 (발효 시 및/또는 발효 후); 추출제의 효율적인 회수 및 재순환; 및 장기 작업에 걸쳐서의 추출제의 분배 계수의 최소한의 감소를 필요로 한다.In-situ product removal (ISPR) (also referred to as extraction fermentation) is used to remove butanol (or other fermentation alcohol) from the fermentation vessel as it is produced so that the microorganisms can produce butanol in high yield. One ISPR method for removing fermented alcohols described in the art is liquid-liquid extraction (US Patent Application Publication 2009/0305370). In general, with regard to butanol fermentation, the fermentation medium containing the microorganism is contacted with the organic extractant at a point before the butanol concentration reaches the toxic level. The organic extractant and the fermentation medium form a biphasic mixture. Butanol is distributed into the organic extractant phase, whereby the concentration of butanol in the aqueous phase containing the microorganisms is reduced, thereby limiting the exposure of the microorganisms to inhibitory butanol. In order to be technically economically viable, liquid-liquid extraction can be achieved by contacting the extractant with the fermentation broth for efficient mass transfer of the product alcohol to the extractant; Phase separation of the extractant from the fermentation broth (on fermentation and / or after fermentation); Efficient recovery and recycling of extractant; And minimal reduction of the partition coefficient of the extractant over long periods of work.
추출제는 예를 들어, 가수분해성 전분의 공급원료로서 발효 용기로 공급되는 바이오매스에 존재하는 지질 축적 (build-up)에 의해 각 재순환 시에 시간 경과에 따라 오염될 수 있다. 일례로서, 글루코스의 부탄올로의 전환 시에, 30 wt% 건조 옥수수 고형물로 발효 용기에 로딩된 액화 옥수수 매시 (liquified corn mash)는 동시 당화 발효 (글루코스를 생성하기 위한 글루코아밀라제의 첨가에 의해 발효 시에 일어나는 액화 옥수수 매시의 당화와 함께)에 의해 생성되는 약 1.2 wt% 옥수수유를 함유하는 발효 브로스를 생성할 수 있다. ISPR 시에 추출제로서 작용하는 올레일 알코올 (OA)로의 옥수수유 지질의 용해에 의해, OA 중의 지질 농도가 각 OA 재순환에 따라 증가되기 때문에, 생성물 알코올의 분배 계수를 감소시키는 각 OA 재순환으로 지질 농도 증가를 초래할 수 있다.The extractant may be contaminated over time at each recycle by, for example, lipid build-up present in the biomass fed to the fermentation vessel as a feedstock of hydrolysable starch. As an example, upon conversion of glucose to butanol, liquified corn mash loaded into the fermentation vessel with 30 wt% dry corn solids is subjected to simultaneous saccharification fermentation (addition of glucoamylase to produce glucose). Fermentation broth containing about 1.2 wt% corn oil produced by the saccharification of the liquefied corn mash occurring in Dissolution of corn oil lipids into oleyl alcohol (OA), which acts as an extractant at ISPR, increases the lipid concentration in the OA with each OA recycle, thereby reducing the lipid in each OA recycle, which reduces the partition coefficient of the product alcohol. May result in increased concentration.
또한, 추출 발효 시의 불용성 고형물의 존재는 알코올 생성 효율에 악영향을 미칠 수 있다. 예를 들어, 불용성 고형물의 존재는 발효 용기 내의 물질 이동 계수를 저하시키고, 발효 용기 내의 상분리를 저해하며, 추출제 중의 불용성 고형물로 인한 옥수수유 축적에 의해 시간 경과에 따라 추출 효율 감소를 가져오고, 고형물에 트랩되어 결국은 건조주정박 (Dried Distillers' Grains with Solubles (DDGS))으로서 제거되며, 발효 브로스로부터의 추출제 드롭의 이탈을 더디게 하고/하거나 발효 용기의 부피 효율을 저하시킬 수 있다.In addition, the presence of insoluble solids in the extraction fermentation may adversely affect the alcohol production efficiency. For example, the presence of insoluble solids lowers the mass transfer coefficient in the fermentation vessel, inhibits phase separation in the fermentation vessel, and leads to a decrease in extraction efficiency over time by corn oil accumulation due to insoluble solids in the extractant, It can be trapped in solids and eventually removed as Dried Distillers' Grains with Solubles (DDGS), slowing the release of extractant drops from the fermentation broth and / or lowering the volumetric efficiency of the fermentation vessel.
추출 발효에 사용되는 추출제의 분배 계수 저하를 감소시키기 위한 여러가지 접근방법은 고형물의 습식 제분, 분별, 및 제거를 포함하고 있다. 습식 제분은 별도로 각 부산물로부터 가치를 얻기 위해 바이오매스 (예를 들어, 옥수수)를 이의 주요 성분 (배아, 과피 섬유, 전분, 및 글루텐)으로 분리하는 고가의 다단계 프로세스이다. 이러한 프로세스는 정제된 전분 스트림을 제공하나; 비용이 많이 들고, 바이오매스의 이의 비전분 성분으로의 분리를 포함하는데, 이는 발효 알코올 생성에 불필요하다. 분별에 의해, 섬유 및 통옥수수 가루 (ground whole corn)에 존재하는 다수의 지질을 함유하는 배아가 제거되어, 전분 (내배유) 함량이 높은 분별된 옥수수가 생산된다. 건식 분별에 의해서는 배아가 섬유로부터 분리되지 않으므로, 습식 제분보다 비용이 덜 든다. 그러나, 분별에 의해서는 섬유 또는 배아 전체가 제거되지 않으며, 고형물의 전소실을 초래하지 않는다. 게다가, 분별에 있어서 전분이 약간 손실된다. 옥수수의 습식 제분은 건식 분별보다 더 비용이 많이 들지만, 건식 분별은 미분별 (unfractionated) 옥수수의 건식 분쇄보다 더 비용이 많이 든다. 발효 시에 사용하기 전에 액화 매시로부터 지질을 함유하는 배아를 비롯한 고형물의 제거에 의해, 예를 들어, 동시 계류 중인, 2010년 6월 18일자로 출원된 공동 소유된 미국 가출원 제61/356,290호에 기재된 바와 같이, 실질적으로 불용성 고형물을 제거할 수 있다. 그러나, 분별이나 실질적으로 모든 불용성 고형물의 제거를 행하지 않아도, 지질에 의한 오염으로 인한 추출제의 분배 계수의 저하가 줄어들 수 있다면 유리할 것이다. 액화 매시에 존재하는 지질을, ISPR에 사용될 수 있는 추출제로 전환하는 것은 예를 들어, 동시 계류 중인, 모두 2010년 7월 28일자로 출원된 공동 소유된 미국 가출원 제61/368,436호 및 제61/368,444호에 기재된 바와 같이, 발효 용기로 공급되는 지질의 양을 감소시키는 또 하나의 방법이다.Several approaches for reducing the partition coefficient reduction of extractant used in extractive fermentation include wet milling, fractionation, and removal of solids. Wet milling is an expensive, multi-step process that separates biomass (eg, corn) into its main components (embryo, rind fiber, starch, and gluten) to gain value from each by-product separately. This process provides a purified starch stream; It is expensive and involves the separation of biomass into its non-starchy components, which is unnecessary for the production of fermentation alcohol. By fractionation, embryos containing a large number of lipids present in fiber and ground whole corn are removed, resulting in fractionated corn with a high starch (endosperm) content. Dry fractionation does not separate the embryos from the fibers and, therefore, is less expensive than wet milling. However, fractionation does not remove the entire fiber or embryo and does not result in loss of solids. In addition, starch is slightly lost in fractionation. Wet milling of corn is more expensive than dry fractionation, but dry fractionation is more expensive than dry grinding of unfractionated corn. Removal of solids, including lipid containing embryos, from liquefied mash prior to use in fermentation, for example, in co-owned US Provisional Application No. 61 / 356,290, filed June 18, 2010, co-pending. As described, substantially insoluble solids can be removed. However, it would be advantageous if the reduction in the partition coefficient of the extractant due to contamination by lipids could be reduced, even without fractionation or substantially all insoluble solids removed. The conversion of lipids present in the liquefied mash into extractants that can be used in ISPR is, for example, co-pending US Provisional Application Nos. 61 / 368,436 and 61 /, all filed on July 28, 2010, for example. As described in 368,444, another method is to reduce the amount of lipids fed to the fermentation vessel.
부탄올과 같은 생성물 알코올의 미생물에 대한 독성 효과를 감소시키는 수단으로서 발효 배지와 ISPR 추출제 사이의 생성물 알코올의 분배를 필요로 하지 않으며, 또한 발효 산물 추출제의 분배 계수의 저하를 줄일 수 있는 대체 추출 발효 방법이 계속해서 요구된다.Alternative extraction that does not require the distribution of product alcohol between the fermentation medium and the ISPR extractant as a means of reducing the toxic effects of product alcohols such as butanol on the microorganism, and can also reduce the drop in the partition coefficient of the fermentation product extractant. Fermentation methods continue to be required.
발명의 개요Summary of the Invention
발효 배지에서 미생물로부터 생산된 부탄올과 같은 알코올의, 미생물에 대한 독성이 덜한 물질로의 전환에 의해, 소정의 발효 용기 부피에 대해 부탄올과 같은 알코올의 생산을 증대시킬 수 있다. 알코올 에스테르는 발효 배지 중의 알코올을 카르복실산 (예를 들어, 지방산), 및 알코올을 카르복실산으로 에스테르화할 수 있는 촉매와 접촉시켜 생성될 수 있다. 또한, 카르복실산은 알코올 에스테르가 분배되는 ISPR 추출제로서 작용할 수 있다. 카르복실산은 발효 용기로 공급되고/되거나 발효성 탄소 공급물을 발효 용기로 공급하는 바이오매스로부터 유도될 수 있다. 공급원료에 존재하는 지질은 카르복실산으로 촉매적 가수분해될 수 있고, 동일한 촉매 (예를 들어, 효소)는 카르복실산을 알코올 (예를 들어, 부탄올)로 에스테르화할 수 있으며; 지질은 또한 촉매에 의해 직접 에스테르 교환되어, 알코올 에스테르를 생성시킬 수 있다. 촉매는 발효 전에 공급원료에 공급될 수 있거나, 공급원료의 공급 전 또는 이것과 동시에 발효 용기에 공급될 수 있다. 촉매가 발효 용기에 공급되는 경우에는, 알코올 에스테르는 지질의 카르복실산으로의 가수분해 및 카르복실산과 발효 용기에 존재하는 부탄올의 동시 에스테르화에 의해 얻어질 수 있으며; 지질은 또한 촉매에 의해 부탄올과 직접 에스테르 교환되어, 알코올 에스테르를 생성시킬 수 있다. 카르복실산 및/또는 공급원료로부터 유도되지 않는 천연 오일 (native oil)은 또한 발효 용기에 공급될 수 있으며, 천연 오일은 카르복실산으로 가수분해된다. 카르복실산 및/또는 공급원료로부터 유도되지 않는 천연 오일은 유기상 및 수성상을 포함하는 2상 혼합물이 생성되도록 충분한 양으로 발효 용기에 공급될 수 있다. 그리하여, 일부 실시 형태에서, 알코올로 에스테르화되지 않는 임의의 카르복실산은 ISPR 추출제로서 또는 이의 부분으로서 작용할 수 있다. 알코올 에스테르를 함유하는 추출제는 발효 배지로부터 분리될 수 있으며, 알코올은 추출제로부터 회수될 수 있다. 추출제는 발효 용기로 재순환될 수 있다. 따라서, 부탄올 생산의 경우에, 예를 들어, 부탄올의 에스테르로의 전환은 발효 배지 중의 유리 부탄올 농도가 감소되어, 부탄올 농도를 증가시키는 독성 효과로부터 미생물을 보호한다. 또한, 미분별 그레인은 그 내부에서 지질이 분리되지 않아도 공급원료로서 사용될 수 있는데, 지질이 카르복실산으로 촉매적 가수분해될 수 있으므로, ISPR 추출제 내의 지질 축적률을 감소시킬 수 있기 때문이다.The conversion of alcohols, such as butanol produced from microorganisms, into fermentation broth to substances that are less toxic to microorganisms, can increase the production of alcohols such as butanol for a given fermentation vessel volume. Alcohol esters may be produced by contacting an alcohol in a fermentation medium with a carboxylic acid (eg, a fatty acid) and a catalyst capable of esterifying the alcohol with a carboxylic acid. In addition, the carboxylic acid may act as an ISPR extractant to which the alcohol ester is dispensed. The carboxylic acid may be derived from a biomass that is fed into the fermentation vessel and / or feeds a fermentable carbon feed to the fermentation vessel. Lipids present in the feedstock can be catalytically hydrolyzed to carboxylic acids, and the same catalyst (eg, an enzyme) can esterify the carboxylic acid with an alcohol (eg, butanol); Lipids can also be transesterified directly with a catalyst to produce alcohol esters. The catalyst may be fed to the feedstock prior to fermentation, or may be fed to the fermentation vessel before or simultaneously with the feedstock feed. When the catalyst is fed to the fermentation vessel, the alcohol ester can be obtained by hydrolysis of the lipid to carboxylic acid and the simultaneous esterification of the carboxylic acid with butanol present in the fermentation vessel; Lipids may also be transesterified directly with butanol by means of catalysts to produce alcohol esters. Native oils that are not derived from carboxylic acids and / or feedstocks can also be supplied to fermentation vessels, which are hydrolyzed to carboxylic acids. Natural oils not derived from carboxylic acids and / or feedstock may be fed to the fermentation vessel in an amount sufficient to produce a biphasic mixture comprising an organic phase and an aqueous phase. Thus, in some embodiments, any carboxylic acid not esterified with alcohol may act as or as part of an ISPR extractant. Extractant containing alcohol esters can be separated from the fermentation medium, and alcohol can be recovered from the extractant. The extractant may be recycled to the fermentation vessel. Thus, in the case of butanol production, for example, conversion of butanol to esters reduces the free butanol concentration in the fermentation medium, protecting the microorganisms from the toxic effects of increasing butanol concentration. In addition, fine fractioned grains can be used as feedstock even if lipids are not separated therein, since the lipids can be catalytically hydrolyzed to carboxylic acids, thereby reducing the rate of lipid accumulation in the ISPR extractant.
본 발명은 발효 프로세스에서 생성된 부탄올을, 적어도 하나의 카르복실산 및 카르복실산을 부탄올로 에스테르화할 수 있는 적어도 하나의 촉매와 접촉시켜, 카르복실산의 부틸 에스테르를 생성하는 단계를 포함하며; 발효 프로세스에서의 카르복실산이 2상 혼합물을 생성하기에 충분한 농도로 존재하는, 부틸 에스테르를 생성하는 방법에 관한 것이다. 일 실시 형태에서, 부탄올 생성 및 부틸 에스테르 생성은 동시에 또는 연속적으로 일어난다. 일 실시 형태에서, 발효 프로세스에서의 공급원료는 하나 이상의 발효성 당을 포함한다. 다른 실시 형태에서, 발효 프로세스에서의 공급원료는 옥수수 낟알, 옥수수 속대, 옥수수 껍질과 같은 작물 잔류물, 옥수수 대, 풀, 밀, 호밀, 밀짚, 보리, 보릿짚, 건초, 볏짚, 지팽이풀 (switchgrass), 폐지, 사탕수수 찌꺼기, 수수, 사탕수수, 대두, 곡물의 제분으로부터 얻어진 성분, 셀룰로스계 물질, 리그노셀룰로스계 물질, 나무, 가지, 뿌리, 잎, 나뭇조각, 톱밥, 관목 및 덤불, 야채, 과일, 꽃, 동물 퇴비, 및 이들의 혼합물로부터 유래한 하나 이상의 발효성 당을 포함한다. 일 실시 형태에서, 상기 방법은 천연 오일을 제공하여, 천연 오일을 하나 이상의 효소와 접촉시켜 적어도 일부의 천연 오일을 카르복실산으로 전환시키는 단계를 추가로 포함한다. 일 실시 형태에서, 카르복실산은 지방산을 포함한다. 다른 실시 형태에서, 카르복실산은 12개 내지 22개의 탄소를 포함한다. 일 실시 형태에서, 카르복실산은 카르복실산의 혼합물이다. 다른 실시 형태에서, 카르복실산의 부틸 에스테르는 지방산의 부틸 에스테르이다. 일 실시 형태에서, 촉매는 카르복실산을 부탄올로 에스테르화하여, 카르복실산의 부틸 에스테르를 생성시킬 수 있는 효소이다. 다른 실시 형태에서, 효소는 에스테라제, 리파제, 포스포리파제, 또는 라이소포스포리파제이다.The present invention includes contacting butanol produced in the fermentation process with at least one carboxylic acid and at least one catalyst capable of esterifying the carboxylic acid with butanol to produce butyl esters of carboxylic acids; A method for producing butyl esters wherein the carboxylic acid in the fermentation process is present at a concentration sufficient to produce a biphasic mixture. In one embodiment, butanol production and butyl ester production occur simultaneously or sequentially. In one embodiment, the feedstock in the fermentation process includes one or more fermentable sugars. In another embodiment, the feedstock in the fermentation process may include crop residues such as corn kernels, corn cobs, corn husks, corn cobs, grass, wheat, rye, straw, barley, barley straw, hay, rice straw, switchgrass. , Waste paper, sugarcane waste, sorghum, sugarcane, soybean, ingredients obtained from milling of cereals, cellulosic substances, lignocellulosic substances, trees, branches, roots, leaves, wood chips, sawdust, shrubs and bushes, vegetables, One or more fermentable sugars derived from fruit, flower, animal compost, and mixtures thereof. In one embodiment, the method further comprises providing a natural oil to contact the natural oil with one or more enzymes to convert at least some natural oils to carboxylic acids. In one embodiment, the carboxylic acid comprises a fatty acid. In another embodiment, the carboxylic acid comprises 12 to 22 carbons. In one embodiment, the carboxylic acid is a mixture of carboxylic acids. In another embodiment, the butyl ester of carboxylic acid is butyl ester of fatty acid. In one embodiment, the catalyst is an enzyme capable of esterifying a carboxylic acid with butanol to produce a butyl ester of carboxylic acid. In another embodiment, the enzyme is an esterase, lipase, phospholipase, or lysophospholipase.
본 발명은 또한 (a) 공급원료를 제공하는 단계; (b) 공급원료를 액화하여, 올리고당을 포함하는 액화된 바이오매스를 생성하는 단계; (c) 공급원료 슬러리를 분리하여, 올리고당을 포함하는 수성 스트림, 오일 스트림, 및 고형물을 포함하는 생성물을 생성하는 단계; (d) 수성 스트림을 발효 브로스를 포함하는 발효 용기에 첨가하는 단계; (e) 수성 스트림의 올리고당을 당화시키는 단계; 및 (f) 수성 스트림에 존재하는 올리고당 당화 생성물을 발효시켜 부탄올을 생성하고, 동시에 부탄올을 적어도 하나의 카르복실산 및 카르복실산을 부탄올로 에스테르화할 수 있는 적어도 하나의 촉매와 접촉시켜, 카르복실산의 부틸 에스테르를 생성하는 단계 - 카르복실산은 2상 혼합물을 생성하기에 충분한 농도로 존재함 - 를 포함하며; 임의로 단계 (e) 및 (f)가 동시에 일어나는, 공급원료로부터 부탄올 및 부틸 에스테르를 생성하는 방법에 관한 것이다. 일 실시 형태에서, 상기 방법은 오일 스트림으로부터 오일을 얻어, 적어도 일부의 오일을 카르복실산으로 전환시키는 단계를 추가로 포함한다. 일 실시 형태에서, 공급원료 슬러리는 디캔터 볼 (decanter bowl) 원심분리, 트라이캔터 (tricanter) 원심분리, 디스크 스택 (disk stack) 원심분리, 여과 원심분리, 디캔터 원심분리, 여과, 진공 여과, 벨트 필터, 가압 여과, 스크린 여과, 스크린 분리, 그레이팅, 포러스 (porous) 그레이팅, 플로테이션 (flotation), 하이드로클론, 필터 프레스, 스크루 프레스, 중력 침강조 (gravity settler), 와류형 분리기 (vortex separator), 또는 이들의 조합에 의해 분리된다. 다른 실시 형태에서, 카르복실산은 지방산을 포함한다. 다른 실시 형태에서, 카르복실산은 12개 내지 22개의 탄소를 포함한다. 일 실시 형태에서, 상기 방법은 적어도 일부의 오일을 카르복실산으로 전환시키는 단계 전에, 오일을 발효 용기에 첨가하는 단계를 추가로 포함한다. 일 실시 형태에서, 상기 방법은 추가의 카르복실산을 발효 용기에 첨가하는 단계를 추가로 포함한다. 일 실시 형태에서, 오일은 추가의 카르복실산을 첨가하는 단계 후에 카르복실산으로 전환된다. 다른 실시 형태에서, 카르복실산은 옥수수유 지방산, 대두유 지방산, 또는 옥수수유 지방산과 대두유 지방산의 혼합물이다. 일 실시 형태에서, 오일 스트림으로부터 얻어진 오일은 글리세라이드를 포함하며, 하나 이상의 촉매는 글리세라이드를 지방산으로 가수분해한다. 다른 실시 형태에서, 카르복실산의 부틸 에스테르는 지방산의 부틸 에스테르이다. 일 실시 형태에서, 촉매는 카르복실산을 부탄올로 에스테르화하여, 카르복실산의 부틸 에스테르를 생성시킬 수 있는 효소이다. 다른 실시 형태에서, 효소는 에스테라제, 리파제, 포스포리파제, 또는 라이소포스포리파제이다. 일 실시 형태에서, 상기 방법은 고형물을 용매로 세정하는 단계를 추가로 포함한다. 일 실시 형태에서, 용매는 헥산, 아이소부탄올, 아이소헥산, 에탄올, 석유 에테르와 같은 석유 증류물, 또는 이들의 혼합물 중에서 선택된다. 다른 실시 형태에서, 고형물을 가공하여 동물 사료 생성물을 생성한다. 다른 실시 형태에서, 고형물을 가공하여 동물 사료 생성물을 생성한다. 일 실시 형태에서, 동물 사료 생성물은 하나 이상의 조단백질 (crude protein), 조지방 (crude fat), 트라이글리세라이드, 지방산, 지방산 아이소부틸 에스테르, 라이신, 중성 세제 불용성 섬유 (NDF), 및 내산성 섬유 (ADF)를 포함한다. 다른 실시 형태에서, 동물 사료 생성물은 하나 이상의 비타민, 무기질, 향미제, 또는 착색제를 추가로 포함한다. 일 실시 형태에서, 동물 사료 생성물은 조단백질 20 내지 35 wt%, 조지방 1 내지 20 wt%, 트라이글리세라이드 0 내지 5 wt%, 지방산 4 내지 10 wt%, 및 지방산 아이소부틸 에스테르 2 내지 6 wt%를 포함한다. 일 실시 형태에서, 고형물을 공급원료 슬러리로부터 분리하는 단계는 발효 브로스로부터 추출제로의 부탄올의 액체-액체 물질 이동 계수를 증가시켜 부탄올 생성 효율을 증가시키거나; 추출제를 사용하여 부탄올의 추출 효율을 증가시켜 부탄올 생성 효율을 증가시키거나; 발효 브로스와 추출제 사이의 상분리 속도를 증가시켜 부탄올 생성 효율을 증가시키거나; 추출제의 회수 및 재순환을 증가시켜 부탄올 생성 효율을 증가시키거나; 추출제의 유량을 감소시켜 부탄올 생성 효율을 증가시킨다.The invention also provides a method of preparing a feedstock comprising the steps of: (a) providing a feedstock; (b) liquefying the feedstock to produce a liquefied biomass comprising oligosaccharides; (c) separating the feedstock slurry to produce a product comprising an aqueous stream comprising oligosaccharides, an oil stream, and a solid; (d) adding the aqueous stream to a fermentation vessel comprising fermentation broth; (e) saccharifying oligosaccharides in the aqueous stream; And (f) fermenting the oligosaccharide saccharification product present in the aqueous stream to produce butanol, while simultaneously contacting butanol with at least one carboxylic acid and at least one catalyst capable of esterifying the carboxylic acid with butanol, thereby carboxyl Producing a butyl ester of an acid, wherein the carboxylic acid is present at a concentration sufficient to produce a biphasic mixture; A process for producing butanol and butyl esters from a feedstock, wherein optionally steps (e) and (f) occur simultaneously. In one embodiment, the method further comprises obtaining an oil from the oil stream and converting at least some oil into carboxylic acid. In one embodiment, the feedstock slurry is decanter bowl centrifuge, tricant centrifuge, disk stack centrifuge, filtration centrifuge, decanter centrifuge, filtration, vacuum filtration, belt filter. Pressure filtration, screen filtration, screen separation, grating, porous grating, floatation, hydroclone, filter press, screw press, gravity settler, vortex separator, or Separated by a combination thereof. In another embodiment, the carboxylic acid comprises a fatty acid. In another embodiment, the carboxylic acid comprises 12 to 22 carbons. In one embodiment, the method further comprises adding the oil to the fermentation vessel before converting at least some oil into the carboxylic acid. In one embodiment, the method further comprises adding additional carboxylic acid to the fermentation vessel. In one embodiment, the oil is converted to carboxylic acid after the step of adding additional carboxylic acid. In another embodiment, the carboxylic acid is corn oil fatty acid, soybean oil fatty acid, or a mixture of corn oil fatty acid and soybean oil fatty acid. In one embodiment, the oil obtained from the oil stream comprises glycerides and the one or more catalysts hydrolyze the glycerides into fatty acids. In another embodiment, the butyl ester of carboxylic acid is butyl ester of fatty acid. In one embodiment, the catalyst is an enzyme capable of esterifying a carboxylic acid with butanol to produce a butyl ester of carboxylic acid. In another embodiment, the enzyme is an esterase, lipase, phospholipase, or lysophospholipase. In one embodiment, the method further comprises washing the solid with a solvent. In one embodiment, the solvent is selected from petroleum distillates such as hexane, isobutanol, isohexane, ethanol, petroleum ether, or mixtures thereof. In another embodiment, the solids are processed to produce animal feed products. In another embodiment, the solids are processed to produce animal feed products. In one embodiment, the animal feed product is one or more crude protein, crude fat, triglycerides, fatty acids, fatty acid isobutyl esters, lysine, neutral detergent insoluble fiber (NDF), and acid resistant fiber (ADF) It includes. In another embodiment, the animal feed product further comprises one or more vitamins, minerals, flavors, or colorants. In one embodiment, the animal feed product contains 20 to 35 wt% crude protein, 1 to 20 wt% crude fat, 0 to 5 wt% triglycerides, 4 to 10 wt% fatty acids, and 2 to 6 wt% fatty acid isobutyl esters. Include. In one embodiment, separating the solids from the feedstock slurry may increase the butanol production efficiency by increasing the liquid-liquid mass transfer coefficient of butanol from the fermentation broth to the extractant; Use of an extractant to increase butanol extraction efficiency to increase butanol production efficiency; Increasing the rate of phase separation between the fermentation broth and the extractant to increase butanol production efficiency; Increased recovery and recycle of the extractant to increase butanol production efficiency; Reducing the flow rate of the extractant increases the butanol production efficiency.
본 발명은 또한 (a) 공급원료를 제공하는 단계; (b) 공급원료를 액화하여, 올리고당을 포함하는 액화된 바이오매스를 생성하는 단계; (c) 공급원료 슬러리를 분리하여, 올리고당 및 오일을 포함하는 스트림, 및 고형물을 생성하는 단계; (d) 스트림을 발효 브로스를 포함하는 발효 용기에 첨가하는 단계; (e) 스트림의 올리고당을 당화시키는 단계; 및 (f) 스트림에 존재하는 올리고당 당화 생성물을 발효시켜 부탄올을 생성하고, 동시에 부탄올을 적어도 하나의 카르복실산 및 카르복실산을 부탄올로 에스테르화할 수 있는 적어도 하나의 촉매와 접촉시켜, 카르복실산의 부틸 에스테르를 생성하는 단계 - 카르복실산은 2상 혼합물을 생성하기에 충분한 농도로 존재함 - 를 포함하며; 임의로 단계 (e) 및 (f)가 동시에 일어나는, 공급원료로부터 부탄올 및 부틸 에스테르를 생성하는 방법에 관한 것이다. 일 실시 형태에서, 상기 방법은 적어도 일부의 오일을 카르복실산으로 전환시키는 단계를 추가로 포함한다. 일 실시 형태에서, 공급원료 슬러리는 디캔터 볼 원심분리, 트라이캔터 원심분리, 디스크 스택 원심분리, 여과 원심분리, 디캔터 원심분리, 여과, 진공 여과, 벨트 필터, 가압 여과, 스크린 여과, 스크린 분리, 그레이팅, 포러스 그레이팅, 플로테이션, 하이드로클론, 필터 프레스, 스크루 프레스, 중력 침강조, 와류형 분리기, 또는 이들의 조합에 의해 분리된다. 다른 실시 형태에서, 카르복실산은 지방산을 포함한다. 다른 실시 형태에서, 카르복실산은 12개 내지 22개의 탄소를 포함한다. 일 실시 형태에서, 상기 방법은 오일을 발효 용기에 첨가하는 단계를 추가로 포함한다. 일 실시 형태에서, 상기 방법은 추가의 카르복실산을 발효 용기에 첨가하는 단계를 추가로 포함한다. 일 실시 형태에서, 오일은 추가의 카르복실산을 첨가하는 단계 후에 카르복실산으로 전환된다. 일 실시 형태에서, 카르복실산은 옥수수유 지방산, 대두유 지방산, 또는 옥수수유 지방산과 대두유 지방산의 혼합물이다. 일 실시 형태에서, 오일은 글리세라이드를 포함하며, 하나 이상의 촉매는 글리세라이드를 지방산으로 가수분해한다. 일 실시 형태에서, 카르복실산의 부틸 에스테르는 지방산의 부틸 에스테르이다. 일 실시 형태에서, 촉매는 카르복실산을 부탄올로 에스테르화하여, 카르복실산의 부틸 에스테르를 생성시킬 수 있는 효소이다. 다른 실시 형태에서, 효소는 에스테라제, 리파제, 포스포리파제, 또는 라이소포스포리파제이다. 일 실시 형태에서, 상기 방법은 고형물을 용매로 세정하는 단계를 추가로 포함한다. 일 실시 형태에서, 용매는 헥산, 아이소부탄올, 아이소헥산, 에탄올, 석유 에테르와 같은 석유 증류물, 또는 이들의 혼합물 중에서 선택된다. 다른 실시 형태에서, 고형물을 가공하여 동물 사료 생성물을 생성한다. 다른 실시 형태에서, 고형물을 가공하여 동물 사료 생성물을 생성한다. 일부 실시 형태에서, 동물 사료 생성물은 하나 이상의 조단백질, 조지방, 트라이글리세라이드, 지방산, 지방산 아이소부틸 에스테르, 라이신, 중성 세제 불용성 섬유 (NDF), 및 내산성 섬유 (ADF)를 포함한다. 일부 실시 형태에서, 동물 사료 생성물은 하나 이상의 비타민, 무기질, 향미제, 또는 착색제를 추가로 포함한다. 일부 실시 형태에서, 동물 사료 생성물은 조단백질 20 내지 35 wt%, 조지방 1 내지 20 wt%, 트라이글리세라이드 0 내지 5 wt%, 지방산 4 내지 10 wt%, 및 지방산 아이소부틸 에스테르 2 내지 6 wt%를 포함한다. 일부 실시 형태에서, 고형물을 공급원료 슬러리로부터 분리하는 단계는 발효 브로스로부터 추출제로의 부탄올의 액체-액체 물질 이동 계수를 증가시켜 부탄올 생성 효율을 증가시키거나; 추출제를 사용하여 부탄올의 추출 효율을 증가시켜 부탄올 생성 효율을 증가시키거나; 발효 브로스와 추출제 사이의 상분리 속도를 증가시켜 부탄올 생성 효율을 증가시키거나; 추출제의 회수 및 재순환을 증가시켜 부탄올 생성 효율을 증가시키거나; 추출제의 유량을 감소시켜 부탄올 생성 효율을 증가시킨다.The invention also provides a method of preparing a feedstock comprising the steps of: (a) providing a feedstock; (b) liquefying the feedstock to produce a liquefied biomass comprising oligosaccharides; (c) separating the feedstock slurry to produce a stream comprising oligosaccharides and oil, and a solid; (d) adding the stream to a fermentation vessel comprising fermentation broth; (e) saccharifying oligosaccharides of the stream; And (f) fermenting the oligosaccharide saccharification product present in the stream to produce butanol, while simultaneously contacting butanol with at least one carboxylic acid and at least one catalyst capable of esterifying the carboxylic acid with butanol, thereby Producing a butyl ester of a carboxylic acid present in a concentration sufficient to produce a biphasic mixture; A process for producing butanol and butyl esters from a feedstock, wherein optionally steps (e) and (f) occur simultaneously. In one embodiment, the method further comprises converting at least some oil into carboxylic acid. In one embodiment, the feedstock slurry is decanter ball centrifugation, tricanter centrifugation, disk stack centrifugation, filtration centrifugation, decanter centrifugation, filtration, vacuum filtration, belt filter, pressure filtration, screen filtration, screen separation, grating , By means of pore grating, floatation, hydroclone, filter press, screw press, gravity settling tank, vortex separator, or a combination thereof. In another embodiment, the carboxylic acid comprises a fatty acid. In another embodiment, the carboxylic acid comprises 12 to 22 carbons. In one embodiment, the method further comprises adding oil to the fermentation vessel. In one embodiment, the method further comprises adding additional carboxylic acid to the fermentation vessel. In one embodiment, the oil is converted to carboxylic acid after the step of adding additional carboxylic acid. In one embodiment, the carboxylic acid is corn oil fatty acid, soybean oil fatty acid, or a mixture of corn oil fatty acid and soybean oil fatty acid. In one embodiment, the oil comprises glycerides and the one or more catalysts hydrolyze the glycerides into fatty acids. In one embodiment, the butyl ester of carboxylic acid is butyl ester of fatty acid. In one embodiment, the catalyst is an enzyme capable of esterifying a carboxylic acid with butanol to produce a butyl ester of carboxylic acid. In another embodiment, the enzyme is an esterase, lipase, phospholipase, or lysophospholipase. In one embodiment, the method further comprises washing the solid with a solvent. In one embodiment, the solvent is selected from petroleum distillates such as hexane, isobutanol, isohexane, ethanol, petroleum ether, or mixtures thereof. In another embodiment, the solids are processed to produce animal feed products. In another embodiment, the solids are processed to produce animal feed products. In some embodiments, the animal feed product includes one or more crude protein, crude fat, triglycerides, fatty acids, fatty acid isobutyl esters, lysine, neutral detergent insoluble fiber (NDF), and acid resistant fiber (ADF). In some embodiments, the animal feed product further comprises one or more vitamins, minerals, flavors, or colorants. In some embodiments, the animal feed product contains 20 to 35 wt% crude protein, 1 to 20 wt% crude fat, 0 to 5 wt% triglycerides, 4 to 10 wt% fatty acids, and 2 to 6 wt% fatty acid isobutyl esters. Include. In some embodiments, separating the solids from the feedstock slurry may increase the butanol production efficiency by increasing the liquid-liquid mass transfer coefficient of butanol from the fermentation broth to the extractant; Use of an extractant to increase butanol extraction efficiency to increase butanol production efficiency; Increasing the rate of phase separation between the fermentation broth and the extractant to increase butanol production efficiency; Increased recovery and recycle of the extractant to increase butanol production efficiency; Reducing the flow rate of the extractant increases the butanol production efficiency.
본 발명은 또한 (a) 발효 프로세스에서 생성된 부탄올을, 적어도 하나의 카르복실산 및 카르복실산을 부탄올로 에스테르화할 수 있는 적어도 하나의 촉매와 접촉시켜, 카르복실산의 부틸 에스테르를 생성하는 단계 - 발효 프로세스에서의 카르복실산은 수성상 및 부틸 에스테르 함유 유기상을 포함하는 2상 혼합물을 생성하기에 충분한 농도로 존재함 - ; (b) 부틸 에스테르 함유 유기상을 수성상으로부터 분리하는 단계; 및 (c) 부탄올을 부틸 에스테르로부터 회수하는 단계를 포함하는, 부탄올을 생성하는 방법에 관한 것이다. 일부 실시 형태에서, 부탄올을 부틸 에스테르로부터 회수하는 단계는 에스테르를 카르복실산 및 부탄올로 가수분해하는 단계를 포함한다. 일부 실시 형태에서, 부틸 에스테르는 가수분해 촉매의 존재 하에 가수분해된다. 일부 실시 형태에서, 부틸 에스테르는 물의 존재 하에 가수분해되며, 가수분해 촉매는 산촉매, 유기산, 무기산, 수용성 산, 또는 불수용성 산을 포함한다. 일부 실시 형태에서, 가수분해 촉매는 부틸 에스테르를 가수분해하여 카르복실산 및 부탄올을 생성시킬 수 있는 효소를 포함한다. 일부 실시 형태에서, 효소는 에스테라제, 리파제, 포스포리파제, 또는 라이소포스포리파제이다. 일부 실시 형태에서, 효소 반응 조건은 에스테르화보다 효소 가수분해를 지지한다. 일부 실시 형태에서, 효소 반응 조건은 공용매를 포함한다. 일부 실시 형태에서, 지방산 부틸 에스테르, 지방산, 아이소부탄올, 및 물은 공용매에 용해되며, 유리 지방산은 공용매와 반응하지 않는다. 일부 실시 형태에서, 공용매는 아세톤, tert-부탄올, 2-Me-2-부탄올, 2-Me-2-펜탄올, 및 3-Me-3-펜탄올 중에서 선택된다. 일부 실시 형태에서, 효소 반응 조건은 최종 생성물 제거를 포함한다. 일부 실시 형태에서, 최종 생성물은 아이소부탄올 또는 지방산이다. 일부 실시 형태에서, 아이소부탄올은 진공 증류, 퍼베이퍼레이션 (pervaporartion), 선택 투과성 (permselective) 여과, 또는 기체 스파징에 의해 제거된다. 일부 실시 형태에서, 지방산은 침전, 선택 투과성 여과, 또는 전기 영동에 의해 제거된다. 일부 실시 형태에서, 가수분해 반응은 반응 용기에서 일어난다. 일부 실시 형태에서, 부탄올을 부틸 에스테르로부터 회수하는 단계는 부틸 에스테르를 부탄올 및 지방산 알킬 에스테르 또는 아실 글리세라이드로 에스테르 교환하는 단계를 포함한다. 일부 실시 형태에서, 지방산 알킬 에스테르는 지방산 메틸 에스테르, 지방산 에틸 에스테르, 또는 지방산 프로필 에스테르를 포함한다. 일부 실시 형태에서, 상기 방법은 천연 오일을 제공하여, 천연 오일을 하나 이상의 효소와 접촉시켜 적어도 일부의 천연 오일을 카르복실산으로 전환시키는 단계를 추가로 포함한다. 일부 실시 형태에서, 효소는 부틸 에스테르를 가수분해하거나 에스테르 교환하여, 부탄올을 생성시킬 수 있는 효소이다. 일부 실시 형태에서, 효소는 에스테라제, 리파제, 포스포리파제, 또는 라이소포스포리파제이다. 일부 실시 형태에서, 카르복실산은 지방산을 포함한다. 일부 실시 형태에서, 카르복실산은 탄소가 12개 내지 22개인 탄소 사슬 길이를 갖는다. 일부 실시 형태에서, 적어도 약 10%의 부탄올이 부틸 에스테르로부터 회수된다. 일부 실시 형태에서, 적어도 약 50%의 부탄올이 부틸 에스테르로부터 회수된다. 일부 실시 형태에서, 적어도 약 90%의 부탄올이 부틸 에스테르로부터 회수된다. 일부 실시 형태에서, 카르복실산이 부틸 에스테르로부터 회수된다. 일부 실시 형태에서, 상기 방법은 부탄올을 추출제 스트림으로서 발효 용기로부터 제거하는 단계; 및 추출제 스트림을 2개 이상의 증류탑에 첨가하는 단계를 추가로 포함한다. 일부 실시 형태에서, 증류탑은 스팀 가열된 리보일러를 갖는 초대기압 증류탑이다. 일부 실시 형태에서, 상기 방법은 물 및 용매를 증류탑으로부터 회수하는 단계; 및 물 및 용매를 재순환시키는 단계를 추가로 포함한다. 일부 실시 형태에서, 상기 방법은 열을 증류 프로세스로부터 회수하는 단계; 및 열을 재순환시켜 물을 증발시키는 단계를 추가로 포함한다.The invention also comprises the steps of (a) contacting butanol produced in the fermentation process with at least one carboxylic acid and at least one catalyst capable of esterifying the carboxylic acid with butanol to produce a butyl ester of carboxylic acid. The carboxylic acid in the fermentation process is present in a concentration sufficient to produce a biphasic mixture comprising an aqueous phase and a butyl ester containing organic phase; (b) separating the butyl ester containing organic phase from the aqueous phase; And (c) recovering butanol from the butyl ester. In some embodiments, recovering butanol from butyl esters includes hydrolyzing esters to carboxylic acids and butanol. In some embodiments, the butyl ester is hydrolyzed in the presence of a hydrolysis catalyst. In some embodiments, the butyl ester is hydrolyzed in the presence of water and the hydrolysis catalyst comprises an acid catalyst, organic acid, inorganic acid, water soluble acid, or water insoluble acid. In some embodiments, the hydrolysis catalyst includes enzymes that can hydrolyze butyl esters to produce carboxylic acids and butanol. In some embodiments, the enzyme is an esterase, lipase, phospholipase, or lysophospholipase. In some embodiments, enzymatic reaction conditions support enzymatic hydrolysis rather than esterification. In some embodiments, enzyme reaction conditions include a cosolvent. In some embodiments, the fatty acid butyl esters, fatty acids, isobutanol, and water are dissolved in the cosolvent, and the free fatty acids do not react with the cosolvent. In some embodiments, the cosolvent is selected from acetone, tert-butanol, 2-Me-2-butanol, 2-Me-2-pentanol, and 3-Me-3-pentanol. In some embodiments, enzymatic reaction conditions include final product removal. In some embodiments, the final product is isobutanol or fatty acid. In some embodiments, isobutanol is removed by vacuum distillation, pervaporartion, permselective filtration, or gas sparging. In some embodiments, fatty acids are removed by precipitation, selective permeation filtration, or electrophoresis. In some embodiments, the hydrolysis reaction occurs in a reaction vessel. In some embodiments, recovering butanol from butyl esters includes transesterifying butyl esters with butanol and fatty acid alkyl esters or acyl glycerides. In some embodiments, the fatty acid alkyl esters comprise fatty acid methyl esters, fatty acid ethyl esters, or fatty acid propyl esters. In some embodiments, the method further comprises providing a natural oil to contact the natural oil with one or more enzymes to convert at least some natural oils to carboxylic acids. In some embodiments, the enzyme is an enzyme that can hydrolyze or transesterify butyl esters to produce butanol. In some embodiments, the enzyme is an esterase, lipase, phospholipase, or lysophospholipase. In some embodiments, the carboxylic acid comprises a fatty acid. In some embodiments, the carboxylic acid has a carbon chain length of 12 to 22 carbons. In some embodiments, at least about 10% butanol is recovered from the butyl ester. In some embodiments, at least about 50% butanol is recovered from the butyl ester. In some embodiments, at least about 90% of butanol is recovered from the butyl esters. In some embodiments, the carboxylic acid is recovered from the butyl ester. In some embodiments, the method includes removing butanol from the fermentation vessel as an extractant stream; And adding the extractant stream to at least two distillation columns. In some embodiments, the distillation column is a superatmospheric distillation column having a steam heated reboiler. In some embodiments, the method includes recovering water and solvent from the distillation column; And recycling the water and the solvent. In some embodiments, the method further comprises recovering heat from the distillation process; And recycling the heat to evaporate the water.
본 발명은 또한 (a) 공급원료를 제공하는 단계; (b) 공급원료를 액화하여 공급원료 슬러리를 생성하는 단계; (c) 공급원료 슬러리를 분리하여, 수성 스트림, 오일 스트림, 및 고형물을 포함하는 생성물을 생성하는 단계; (d) 수성 스트림을 발효 브로스를 포함하는 발효 용기에 첨가하는 단계; (e) 수성 스트림을 당화하는 단계; (f) 당화된 수성 스트림을 발효시켜 부탄올을 생성하고, 동시에 부탄올을 적어도 하나의 카르복실산 및 카르복실산을 부탄올로 에스테르화할 수 있는 적어도 하나의 촉매와 접촉시켜, 카르복실산의 부틸 에스테르를 생성하는 단계 - 카르복실산은 2상 혼합물을 생성하기에 충분한 농도로 존재함 - ; (g) 부틸 에스테르 함유 유기상을 수성상으로부터 분리하는 단계; 및 (h) 부탄올을 부틸 에스테르로부터 회수하는 단계를 포함하며; 임의로 단계 (e) 및 (f)가 동시에 일어나는, 공급원료로부터 부탄올을 생성하는 방법에 관한 것이다. 일부 실시 형태에서, 상기 방법은 오일 스트림으로부터 오일을 얻어, 적어도 일부의 오일을 카르복실산으로 전환시키는 단계를 추가로 포함한다. 일부 실시 형태에서, 공급원료 슬러리는 원심분리, 여과, 또는 디캔테이션에 의해 분리된다. 일부 실시 형태에서, 카르복실산은 지방산을 포함한다. 일부 실시 형태에서, 카르복실산은 탄소가 12개 내지 22개인 탄소 사슬 길이를 갖는다. 일부 실시 형태에서, 상기 방법은 적어도 일부의 오일을 카르복실산으로 전환시키는 단계 전에, 오일을 발효 용기에 첨가하는 단계를 추가로 포함한다. 일부 실시 형태에서, 상기 방법은 추가의 카르복실산을 발효 용기에 첨가하는 단계를 추가로 포함한다. 일부 실시 형태에서, 오일은 추가의 카르복실산을 첨가하는 단계 후에 카르복실산으로 전환된다. 일부 실시 형태에서, 카르복실산은 옥수수유 지방산, 대두유 지방산, 또는 옥수수유 지방산과 대두유 지방산의 혼합물이다. 일부 실시 형태에서, 오일 스트림으로부터 얻어진 오일은 글리세라이드를 포함하며, 하나 이상의 촉매는 글리세라이드를 지방산으로 가수분해한다. 일부 실시 형태에서, 카르복실산의 부틸 에스테르는 지방산의 부틸 에스테르이다. 일부 실시 형태에서, 촉매는 카르복실산을 부탄올로 에스테르화하여, 카르복실산의 부틸 에스테르를 생성시킬 수 있는 효소이다. 일부 실시 형태에서, 효소는 에스테라제, 리파제, 포스포리파제, 또는 라이소포스포리파제이다. 일부 실시 형태에서, 고형물을 가공하여 동물 사료 생성물을 생성한다. 일부 실시 형태에서, 부탄올을 부틸 에스테르로부터 회수하는 단계는 에스테르를 카르복실산 및 부탄올로 가수분해하는 단계를 포함한다. 일부 실시 형태에서, 부틸 에스테르는 가수분해 촉매의 존재 하에 가수분해된다. 일부 실시 형태에서, 부틸 에스테르는 물의 존재 하에 가수분해되며, 가수분해 촉매는 산촉매, 유기산, 무기산, 수용성 산, 또는 불수용성 산을 포함한다. 일부 실시 형태에서, 가수분해 촉매는 부틸 에스테르를 가수분해하여 카르복실산 및 부탄올을 생성시킬 수 있는 효소를 포함한다. 일부 실시 형태에서, 효소는 에스테라제, 리파제, 포스포리파제, 또는 라이소포스포리파제이다. 일부 실시 형태에서, 가수분해 반응은 반응 용기에서 일어난다. 일부 실시 형태에서, 부탄올을 부틸 에스테르로부터 회수하는 단계는 부틸 에스테르를 부탄올 및 지방산 알킬 에스테르 또는 아실 글리세라이드로 에스테르 교환하는 단계를 포함한다. 일부 실시 형태에서, 지방산 알킬 에스테르는 지방산 메틸 에스테르, 지방산 에틸 에스테르, 또는 지방산 프로필 에스테르를 포함한다. 일부 실시 형태에서, 상기 방법은 천연 오일을 제공하여, 천연 오일을 하나 이상의 효소와 접촉시켜 적어도 일부의 천연 오일을 카르복실산으로 전환시키는 단계를 추가로 포함한다. 일부 실시 형태에서, 효소는 부틸 에스테르를 가수분해하거나 에스테르 교환하여, 부탄올을 생성시킬 수 있는 효소이다. 일부 실시 형태에서, 효소는 에스테라제, 리파제, 포스포리파제, 또는 라이소포스포리파제이다.The invention also provides a method of preparing a feedstock comprising the steps of: (a) providing a feedstock; (b) liquefying the feedstock to produce a feedstock slurry; (c) separating the feedstock slurry to produce a product comprising an aqueous stream, an oil stream, and a solid; (d) adding the aqueous stream to a fermentation vessel comprising fermentation broth; (e) saccharifying the aqueous stream; (f) fermenting the glycated aqueous stream to produce butanol, while simultaneously contacting butanol with at least one carboxylic acid and at least one catalyst capable of esterifying the carboxylic acid with butanol, thereby butyl ester of carboxylic acid Producing, the carboxylic acid is present at a concentration sufficient to produce a biphasic mixture; (g) separating the butyl ester containing organic phase from the aqueous phase; And (h) recovering butanol from the butyl ester; A process for producing butanol from a feedstock, optionally in which steps (e) and (f) occur simultaneously. In some embodiments, the method further comprises obtaining an oil from the oil stream and converting at least some oil into carboxylic acid. In some embodiments, the feedstock slurry is separated by centrifugation, filtration, or decantation. In some embodiments, the carboxylic acid comprises a fatty acid. In some embodiments, the carboxylic acid has a carbon chain length of 12 to 22 carbons. In some embodiments, the method further comprises adding the oil to the fermentation vessel before converting at least some oil into the carboxylic acid. In some embodiments, the method further comprises adding additional carboxylic acid to the fermentation vessel. In some embodiments, the oil is converted to carboxylic acid after the step of adding additional carboxylic acid. In some embodiments, the carboxylic acid is corn oil fatty acid, soybean oil fatty acid, or a mixture of corn oil fatty acid and soybean oil fatty acid. In some embodiments, the oil obtained from the oil stream comprises glycerides and the one or more catalysts hydrolyze the glycerides into fatty acids. In some embodiments, the butyl ester of carboxylic acid is butyl ester of fatty acid. In some embodiments, the catalyst is an enzyme capable of esterifying a carboxylic acid with butanol to produce a butyl ester of carboxylic acid. In some embodiments, the enzyme is an esterase, lipase, phospholipase, or lysophospholipase. In some embodiments, the solids are processed to produce animal feed products. In some embodiments, recovering butanol from butyl esters includes hydrolyzing esters to carboxylic acids and butanol. In some embodiments, the butyl ester is hydrolyzed in the presence of a hydrolysis catalyst. In some embodiments, the butyl ester is hydrolyzed in the presence of water and the hydrolysis catalyst comprises an acid catalyst, organic acid, inorganic acid, water soluble acid, or water insoluble acid. In some embodiments, the hydrolysis catalyst includes enzymes that can hydrolyze butyl esters to produce carboxylic acids and butanol. In some embodiments, the enzyme is an esterase, lipase, phospholipase, or lysophospholipase. In some embodiments, the hydrolysis reaction occurs in a reaction vessel. In some embodiments, recovering butanol from butyl esters includes transesterifying butyl esters with butanol and fatty acid alkyl esters or acyl glycerides. In some embodiments, the fatty acid alkyl esters comprise fatty acid methyl esters, fatty acid ethyl esters, or fatty acid propyl esters. In some embodiments, the method further comprises providing a natural oil to contact the natural oil with one or more enzymes to convert at least some natural oils to carboxylic acids. In some embodiments, the enzyme is an enzyme that can hydrolyze or transesterify butyl esters to produce butanol. In some embodiments, the enzyme is an esterase, lipase, phospholipase, or lysophospholipase.
다른 실시 형태에서, 발효 방법은: 바이오매스로부터 얻어진 수성 공급 스트림을 제공하는 단계 - 수성 공급 스트림은 물, 바이오매스로부터 유래된 발효성 탄소원, 및 오일을 포함함 - ; 수성 공급 스트림을 촉매와 접촉시켜, 적어도 일부의 오일이 유리 지방산으로 가수분해되어, 유리 지방산 및 촉매를 포함하는 촉매 처리된 공급 스트림을 생성하는 단계; 촉매 처리된 공급 스트림을 발효 용기에서 발효 브로스와 접촉시키는 단계; 발효 용기에서 발효성 탄소원을 발효시켜, 생성물 알코올을 생성하는 단계; 및 발효 용기에서 유리 지방산과 생성물 알코올의 에스테르화를 촉매하여 지방산의 알코올 에스테르를 생성시키도록 발효 시에 생성물 알코올을 유리 지방산 및 촉매와 접촉시키는 단계를 포함할 수 있다. 일부 실시 형태에서, 공급 스트림을 촉매 및 발효 브로스와 접촉시키는 단계, 및 발효 및 생성물 알코올을 유리 지방산 및 촉매와 접촉시키는 단계가 동시에 일어날 수 있다. 일부 실시 형태에서, 생성물 알코올은 부탄올이며, 지방산의 알코올 에스테르는 지방산의 부틸 에스테르이다.In another embodiment, the fermentation method comprises: providing an aqueous feed stream obtained from biomass, the aqueous feed stream comprising water, a fermentable carbon source derived from biomass, and an oil; Contacting the aqueous feed stream with a catalyst such that at least some of the oil is hydrolyzed to the free fatty acid to produce a catalyzed feed stream comprising the free fatty acid and the catalyst; Contacting the catalyzed feed stream with fermentation broth in a fermentation vessel; Fermenting the fermentable carbon source in a fermentation vessel to produce product alcohol; And contacting the product alcohol with the free fatty acid and the catalyst during fermentation to catalyze the esterification of the free fatty acid with the product alcohol in the fermentation vessel to produce an alcohol ester of the fatty acid. In some embodiments, contacting the feed stream with the catalyst and the fermentation broth and contacting the fermentation and product alcohol with the free fatty acid and the catalyst can occur simultaneously. In some embodiments, the product alcohol is butanol and the alcohol ester of fatty acids is butyl ester of fatty acids.
본 발명은 발효 배지에 알코올을 생성하는 미생물을 포함하는 발효 배지를 제공하는 단계; 및 발효 시에 발효 배지를 카르복실산, 및 알코올을 카르복실산으로 에스테르화하여 알코올 에스테르를 생성시킬 수 있는 촉매와 접촉시키는 단계를 포함하는, 발효 시에 발효 배지로부터 알코올을 제거하는 방법을 제공한다. 일부 실시 형태에서, 미생물에 의해 생성되는 알코올은 부탄올이며, 알코올 에스테르는 부틸 에스테르이다. 일부 실시 형태에서, 발효 배지는 발효 배지에서 실질적으로 용해되지 않는 카르복실산, 및 알코올을 카르복실산으로 에스테르화하여 알코올 에스테르를 생성시킬 수 있는 촉매와 접촉시킨다.The present invention provides a fermentation medium comprising a microorganism producing alcohol in the fermentation medium; And contacting the fermentation medium with a catalyst that can esterify the fermentation medium with a carboxylic acid and the alcohol with the carboxylic acid upon fermentation to produce an alcohol ester. do. In some embodiments, the alcohol produced by the microorganism is butanol and the alcohol ester is butyl ester. In some embodiments, the fermentation medium is contacted with a carboxylic acid that is substantially insoluble in the fermentation medium, and a catalyst that can esterify the alcohol with the carboxylic acid to produce an alcohol ester.
본 발명은 또한 알코올, 발효성 탄소원, 및 유리 지방산을 포함하는 발효 배지를 제공하는 단계; 및 유리 지방산을 알코올로 에스테르화할 수 있는 하나 이상의 효소와 발효 배지를 접촉시켜, 유리 지방산을 알코올로 에스테르화하여, 지방산의 알코올 에스테르를 생성하는 단계를 포함하는, 발효 프로세스 시에 지방산의 알코올 에스테르를 생성하는 방법을 제공한다. 일부 실시 형태에서, 발효성 탄소원은 바이오매스로부터 유래된다. 일부 실시 형태에서, 발효 배지의 미생물은 재조합 미생물이다. 일부 실시 형태에서, 알코올은 부탄올이며, 지방산의 알코올 에스테르는 지방산의 부틸 에스테르이다.The invention also provides a fermentation medium comprising an alcohol, a fermentable carbon source, and a free fatty acid; And contacting the fermentation medium with one or more enzymes capable of esterifying the free fatty acids with alcohols to esterify the free fatty acids with alcohols to produce alcohol esters of the fatty acids. Provides a way to create In some embodiments, the fermentable carbon source is derived from biomass. In some embodiments, the microorganisms in the fermentation medium are recombinant microorganisms. In some embodiments, the alcohol is butanol and the alcohol ester of fatty acids is butyl ester of fatty acids.
다른 실시 형태에서, 생성물 알코올을 생성하는 방법은 물, 발효성 탄소원, 및 오일 - 오일은 아실 글리세라이드를 포함함 - 을 포함하는 바이오매스 공급원료를 제공하는 단계; 바이오매스 공급원료를 액화하여, 올리고당을 포함하는 액화된 바이오매스를 생성하는 단계; 적어도 일부의 아실 글리세라이드를 유리 지방산으로 전환시켜, 유리 지방산이 추출제를 생성할 수 있는 하나 이상의 효소를 포함하는 조성물과 바이오매스 공급원료 또는 액화된 바이오매스를 접촉시키는 단계 - 하나 이상의 효소는 또한 유리 지방산을 생성물 알코올로 지방산의 알코올 에스테르로 에스테르화할 수 있음 - ; 올리고당을 발효성 당으로 전환할 수 있는 당화 효소와 액화된 바이오매스를 접촉시키는 단계; 발효성 당을 생성물 알코올로 전환시킬 수 있는 재조합 미생물과 액화된 바이오매스를 접촉시켜, 생성물 알코올을 포함하는 발효 산물을 생성하는 단계; 유리 지방산과 생성물 알코올의 에스테르화를 촉매하도록 생성물 알코올을 유리 지방산 및 하나 이상의 효소와 접촉시켜, 지방산의 알코올 에스테르를 생성하는 단계; 및 발효 산물을 추출제와 접촉시키는 단계를 포함할 수 있다. 실시 형태에서, 추출제와 접촉시키면, 수성상 및 추출제 상을 포함하는 2상 혼합물이 생성되고, 추출제 상으로의 지방산의 알코올 에스테르의 분배에 의해 에스테르 함유 추출제 상이 형성된다. 일부 실시 형태에서, 생성물 알코올은 부탄올이며, 지방산의 알코올 에스테르는 지방산의 부틸 에스테르이다.In another embodiment, a method of producing a product alcohol includes providing a biomass feedstock comprising water, a fermentable carbon source, and an oil, wherein the oil comprises acyl glycerides; Liquefying the biomass feedstock to produce a liquefied biomass comprising oligosaccharides; Converting at least some of the acyl glycerides into free fatty acids to contact the biomass feedstock or liquefied biomass with a composition comprising one or more enzymes from which the free fatty acids can produce an extractant, the one or more enzymes also Free fatty acids can be esterified with product alcohols with alcohol esters of fatty acids; Contacting the liquefied biomass with a saccharifying enzyme capable of converting the oligosaccharide into a fermentable sugar; Contacting the liquefied biomass with a recombinant microorganism capable of converting the fermentable sugar into a product alcohol, thereby producing a fermentation product comprising the product alcohol; Contacting the product alcohol with the free fatty acid and one or more enzymes to catalyze the esterification of the free fatty acid with the product alcohol to produce an alcohol ester of the fatty acid; And contacting the fermentation product with an extractant. In an embodiment, contact with an extractant produces a two-phase mixture comprising an aqueous phase and an extractant phase, and an ester containing extractant phase is formed by the distribution of the alcohol esters of fatty acids onto the extractant phase. In some embodiments, the product alcohol is butanol and the alcohol ester of fatty acids is butyl ester of fatty acids.
다른 실시 형태에서, 생성물 알코올을 생성하는 방법은 물, 발효성 탄소원, 및 오일 - 오일은 아실 글리세라이드를 포함함 - 을 포함하는 바이오매스 공급원료를 제공하는 단계; 바이오매스 공급원료를 액화하여, 올리고당을 포함하는 액화된 바이오매스를 생성하는 단계; 적어도 일부의 아실 글리세라이드를 유리 지방산으로 전환시킬 수 있는 하나 이상의 효소를 포함하는 조성물과 액화된 바이오매스를 접촉시키는 단계 - 하나 이상의 효소는 또한 유리 지방산을 생성물 알코올로 지방산의 알코올 에스테르로 에스테르화할 수 있음 - ; 올리고당을 발효성 당으로 전환할 수 있는 당화 효소와 액화된 바이오매스를 접촉시키는 단계; 발효 시에 발효성 당을 생성물 알코올로 전환시킬 수 있는 재조합 미생물과 당화 바이오매스를 접촉시켜, 생성물 알코올을 포함하는 발효 배지를 생성하는 단계; 및 발효 시에 발효 배지를 카르복실산 추출제와 접촉시키는 단계 - 발효 배지는 유리 지방산을 생성물 알코올로 에스테르화하여 지방산의 알코올 에스테르를 생성시킬 수 있는 하나 이상의 효소를 포함함 - 를 포함할 수 있다. 이러한 방법의 추가의 실시 형태에서, 발효 배지는 발효 배지에서 실질적으로 용해되지 않는 카르복실산, 및 알코올을 카르복실산으로 에스테르화하여 알코올 에스테르를 생성시킬 수 있는 촉매와 접촉된다. 이러한 방법의 다른 실시 형태에서, 미생물에 의해 생성되는 알코올은 부탄올이며, 알코올 에스테르는 부틸 에스테르이다.In another embodiment, a method of producing a product alcohol includes providing a biomass feedstock comprising water, a fermentable carbon source, and an oil, wherein the oil comprises acyl glycerides; Liquefying the biomass feedstock to produce a liquefied biomass comprising oligosaccharides; Contacting the liquefied biomass with a composition comprising one or more enzymes capable of converting at least some acyl glycerides into free fatty acids, wherein the one or more enzymes can also esterify the free fatty acids with the product alcohols with alcohol esters of fatty acids. has exist - ; Contacting the liquefied biomass with a saccharifying enzyme capable of converting the oligosaccharide into a fermentable sugar; Contacting recombinant microorganisms capable of converting fermentable sugars to product alcohols upon fermentation with saccharified biomass to produce a fermentation medium comprising product alcohols; And contacting the fermentation medium with a carboxylic acid extractant during fermentation, the fermentation medium comprising one or more enzymes capable of esterifying the free fatty acid with the product alcohol to produce an alcohol ester of the fatty acid. . In a further embodiment of this method, the fermentation medium is contacted with a carboxylic acid that is substantially insoluble in the fermentation medium, and a catalyst that can esterify the alcohol with the carboxylic acid to produce an alcohol ester. In another embodiment of this method, the alcohol produced by the microorganism is butanol and the alcohol ester is butyl ester.
본 발명은 또한 전분 또는 발효성 탄소원을 공급원료 중에서 액화시켜, 올리고당을 갖는 슬러리를 생성시키는 단계; 공급원료 슬러리를 원심분리시켜, (i) 올리고당을 포함하는 수성층, (ii) 오일층, 및 (iii) 고형물을 포함하는 원심분리 생성물을 생성하는 단계; 수성층을 발효 브로스를 포함하는 발효 용기에 공급하는 단계; 및 수성층을 발효시켜, 생성물 알코올을 생성하는 단계를 포함하는, 공급원료로부터 생성물 알코올을 생성하는 방법을 제공한다. 그 다음에, 생성물 알코올은 카르복실산 및 촉매와 접촉시켜, 카르복실산이 생성물 알코올로 에스테르하여 알코올 에스테르가 생성된다. 일부 실시 형태에서, 오일은 식물성 오일이다. 다른 실시 형태에서, 생성물 알코올은 부탄올이며, 카르복실산의 알코올 에스테르는 지방산의 부틸 에스테르이다.The invention also comprises liquefying a starch or fermentable carbon source in a feedstock to produce a slurry with oligosaccharides; Centrifuging the feedstock slurry to produce a centrifugation product comprising (i) an aqueous layer comprising oligosaccharides, (ii) an oil layer, and (iii) a solid; Supplying the aqueous layer to a fermentation vessel comprising fermentation broth; And fermenting the aqueous layer to produce product alcohol. The product alcohol is then contacted with the carboxylic acid and the catalyst so that the carboxylic acid esters with the product alcohol to produce an alcohol ester. In some embodiments, the oil is a vegetable oil. In another embodiment, the product alcohol is butanol and the alcohol ester of carboxylic acid is butyl ester of fatty acid.
일부 실시 형태에서, 생성물 알코올을 생성하는 방법은 물, 전분, 및/또는 발효성 탄소원, 및 바이오매스의 분별 후에 잔존하는 다만 잔류량의 오일을 포함하는 분별된 바이오매스 공급원료를 제공하는 단계 - 잔류 오일은 아실 글리세라이드를 포함함 - ; 분별된 바이오매스 공급원료를 액화하여, 올리고당을 포함하는 액화된 분별된 바이오매스를 생성하는 단계; 적어도 일부의 잔류 아실 글리세라이드를 유리 지방산으로 전환시킬 수 있는 하나 이상의 효소를 포함하는 조성물과 액화된 분별된 바이오매스를 접촉시키는 단계 - 하나 이상의 효소는 또한 유리 지방산을 생성물 알코올로 에스테르화하여 지방산의 알코올 에스테르를 생성시킬 수 있음 - ; 올리고당을 발효성 당으로 전환할 수 있는 당화 효소와 액화된 분별된 바이오매스를 접촉시키는 단계; 발효 시에 발효성 당을 생성물 알코올로 전환시킬 수 있는 재조합 미생물과 당화 바이오매스를 접촉시켜, 생성물 알코올을 포함하는 발효 배지를 생성하는 단계; 및 발효 시에 발효 배지를 카르복실산 추출제와 접촉시키는 단계 - 발효 배지는 유리 지방산을 생성물 알코올로 에스테르화하여 지방산의 알코올 에스테르를 생성시킬 수 있는 하나 이상의 효소를 포함함 - 를 포함할 수 있다. 이러한 발명의 추가의 실시 형태에서, 발효 배지는 발효 배지에서 카르복실산, 및 알코올을 카르복실산으로 에스테르화하여 알코올 에스테르를 생성시킬 수 있는 촉매와 접촉된다. 추가의 실시 형태에서, 카르복실산은 발효 배지에서 실질적으로 용해될 수 없다. 이러한 방법의 다른 실시 형태에서, 미생물에 의해 생성되는 알코올은 부탄올이며, 알코올 에스테르는 부틸 에스테르이다.In some embodiments, the method of producing the product alcohol comprises providing a fractionated biomass feedstock comprising water, starch, and / or fermentable carbon sources, and only residual amounts of oil remaining after fractionation of the biomass. Oils include acyl glycerides; Liquefying the fractionated biomass feedstock to produce a liquefied fractionated biomass comprising oligosaccharides; Contacting the liquefied fractionated biomass with a composition comprising one or more enzymes capable of converting at least some residual acyl glycerides into free fatty acids, wherein the one or more enzymes also esterify the free fatty acids with the product alcohols to May produce an alcohol ester; Contacting the liquefied fractionated biomass with a saccharifying enzyme capable of converting the oligosaccharide into a fermentable sugar; Contacting recombinant microorganisms capable of converting fermentable sugars to product alcohols upon fermentation with saccharified biomass to produce a fermentation medium comprising product alcohols; And contacting the fermentation medium with a carboxylic acid extractant during fermentation, the fermentation medium comprising one or more enzymes capable of esterifying the free fatty acid with the product alcohol to produce an alcohol ester of the fatty acid. . In a further embodiment of this invention, the fermentation medium is contacted with a catalyst which can esterify the carboxylic acid and the alcohol with the carboxylic acid in the fermentation medium to produce an alcohol ester. In further embodiments, the carboxylic acid is substantially insoluble in the fermentation medium. In another embodiment of this method, the alcohol produced by the microorganism is butanol and the alcohol ester is butyl ester.
본 발명은 또한 바이오매스로 형성되고, 물 및 발효성 당을 포함하는 매시; 유리 지방산을 알코올로 지방산 알킬 에스테르로 에스테르화할 수 있으며, 임의로 아실 글리세라이드를 유리 지방산으로 가수분해할 수 있는 촉매; 알코올; 유리 지방산; 및 촉매에 의한 유리 지방산과 알코올의 에스테르화로부터 원위치에 생성된 지방산 알코올 에스테르를 포함하는 조성물을 제공한다. 일부 실시 형태에서, 알코올은 부탄올이며, 지방산 알코올 에스테르는 지방산 부틸 에스테르이다.The invention also provides a mash formed from biomass and comprising water and fermentable sugars; Catalysts capable of esterifying free fatty acids with fatty acid alkyl esters and optionally hydrolyzing acyl glycerides to free fatty acids; Alcohol; Free fatty acids; And fatty acid alcohol esters produced in situ from esterification of free fatty acids with alcohols by a catalyst. In some embodiments, the alcohol is butanol and the fatty acid alcohol ester is a fatty acid butyl ester.
본 발명은 또한 알코올을 생성시킬 수 있는 재조합 미생물; 발효성 탄소원; 및 지방산 알코올 에스테르 - 지방산 알코올 에스테르는 발효 시에 생성됨 - 를 포함하는 발효 브로스를 제공한다. 일부 실시 형태에서, 재조합 미생물은 부탄올을 생성할 수 있다. 일부 실시 형태에서, 지방산 알코올 에스테르는 지방산 부틸 에스테르이다. 일부 실시 형태에서, 발효성 탄소원은 당을 포함한다. 일부 실시 형태에서, 발효성 탄소원은 메탄을 포함하고, 재조합 미생물은 메탄올을 생성할 수 있으며, 지방산 알코올 에스테르는 지방산 메틸 에스테르이다.The invention also relates to recombinant microorganisms capable of producing alcohols; Fermentable carbon source; And fatty alcohol esters, wherein the fatty alcohol esters are produced upon fermentation. In some embodiments, the recombinant microorganism can produce butanol. In some embodiments, the fatty acid alcohol ester is a fatty acid butyl ester. In some embodiments, the fermentable carbon source comprises a sugar. In some embodiments, the fermentable carbon source comprises methane, the recombinant microorganism can produce methanol and the fatty acid alcohol ester is a fatty acid methyl ester.
생성물 알코올의 생성에 유용한 재조합 효모 세포도 본 명세서에 제공된다. 실시 형태에서, 본 명세서에 개시된 재조합 숙주 세포는 유전자 변형 및 재조합 유전자 발현에 유용한 임의의 세균, 효모 또는 진균류 숙주일 수 있다. 다른 실시 형태에서, 재조합 숙주 세포는 클로스트리듐 (Clostridium) 속, 자이모모나스 (Zymomonas) 속, 대장균 (Escherichia) 속, 살모네라 (Salmonella) 속, 세라티아 (Serratia) 속, 에르비니아 (Erwinia ) 속, 클렙시엘라 (Klebsiella) 속, 시겔라 (Shigella) 속, 로도코커스 (Rhodococcus) 속, 슈도모나스 (Pseudomonas) 속, 바실러스 (Bacillus) 속, 락토바실러스 (Lactobacillus) 속, 장내 구균 (Enterococcus) 속, 알칼리게네스 (Alcaligenes) 속, 클렙시엘라속, 패니바실러스 (Paenibacillus) 속, 관절 포자균 (Arthrobacter) 속, 코리네박테리움 (Corynebacterium) 속, 브레비박테리움 (Brevibacterium) 속, 스키조사카로마이세스 (Schizosaccharomyces) 속, 클루이베로마이세스 (Kluyveromyces) 속, 야로위아 (Yarrowia) 속, 피치아 (Pichia) 속, 칸디다 (Candida) 속, 한세뉼라 (Hansenula) 속, 이사첸키아 (Issatchenkia) 속, 또는 사카로마이세스 (Saccharomyces) 속의 구성원일 수 있다. 다른 실시 형태에서, 숙주 세포는 사카로마이세스 세레비시아 (Saccharomyces cerevisiae), 스키조사카로마이세스 폼베 (Schizosaccharomyces pombe), 클루이베로마이세스 락티스 (Kluyveromyces lactis), 클루이베로마이세스 서모톨레란스 (Kluyveromyces thermotolerans), 클루이베로마이세스 마르시아누스 (Kluyveromyces marxianus), 칸디다 글라브라타 (Candida glabrata), 칸디다 알비칸스 (Candida albicans), 피키아 스티피티스 (Pichia stipitis), 야로위아 리폴리티카 (Yarrowia lipolytica), 대장균 (E. coli), 또는 락토바실러스 플란타룸 (L. plantarum)일 수 있다. 또 다른 실시 형태에서, 숙주 세포는 효모 숙주 세포이다. 일부 실시 형태에서, 숙주 세포는 사카로마이세스속의 구성원이다. 일부 실시 형태에서, 숙주 세포는 클루이베로마이세스 락티스, 칸디다 글라브라타 또는 스키조사카로마이세스 폼베이다. 일부 실시 형태에서, 숙주 세포는 사카로마이세스 세레비시아이다. 사카로마이세스 세레비시아 효모는 당업계에 공지되어 있으며, 아메리칸 타입 컬쳐 컬렉션 (American Type Culture Collection (미국 메릴랜드주 로크빌에 소재), 네덜란드의 왕립미생물자원센터 (Centraalbureau voor Schimmelcultures (CBS) Fungal Biodiversity Centre), 르사프 (LeSaffre), 게르트 스트랜드 에이비 (Gert Strand AB), 펌 솔루션즈 (Ferm Solutions), 노스 아메리칸 바이오프로덕츠 (North American Bioproducts), 마트렉스 (Martrex), 및 랄르망 (Lallemand)을 포함하나 이에 한정되지 않는 다양한 공급업체로부터 입수가능하다. 사카로마이세스 세레비시아는 BY4741, CEN.PK 113-7D, 에탄올 레드 (Ethanol Red)? 효모, 게르트 스트랜드 프레스티지 터보 (Gert Strand Prestige Turbo) 효모, 펌 프로 (Pro)™ 효모, 바이오-펌? XR 효모, 게르트 스트랜드 디스틸러즈 (Distillers) 효모, 퍼맥스 (FerMax)™ 그린 (Green) 효모, 퍼맥스™ 골드 (Gold) 효모, 서모사크 (Thermosacc)? 효모, BG-1, PE-2, CAT-1, CBS7959, CBS7960, 및 CBS7961을 포함하나 이에 한정되지 않는다.Also provided herein are recombinant yeast cells useful for the production of product alcohols. In an embodiment, a recombinant host cell disclosed herein can be any bacterial, yeast or fungal host useful for genetic modification and recombinant gene expression. In another embodiment, the recombinant host cell is Clostridium (C lostridium) inside, Xi thigh eggplant (Zymomonas) in Escherichia coli (Escherichia), A live Monera (Salmonella) genus, Serratia marcescens (Serratia), An El beanie O (Erwinia), A keulrep when Ella (Klebsiella) genus Shigella (Shigella) genus Rhodococcus (Rhodococcus) genus Pseudomonas (Pseudomonas) genus Bacillus (Bacillus) genus Lactobacillus bacteria (Lactobacillus), A enterococci (Enterococcus ) Genus, Alcaligenes genus, genus Klebsiella, genus Paenibacillus , genus Arthrobacter , genus Corynebacterium , genus Brevibacterium , ski irradiation Caro My process (Schizosaccharomyces), A Cluj Vero My process (Kluyveromyces) in, Yarrow subtotal (Yarrowia) in blood teeth (Pichia) genus Candida (Candida), A century nyulra (Hansenula), A director Chen Escherichia (Issatchenkia ), Or Saccharomyces genus. In another embodiment, the host cell is Saccharomyces cerevisiae , Schizosaccharomyces pombe ), Kluyveromyces lactis), Cluj Vero Mai Seth thermostat Toledo Lance (Kluyveromyces thermotolerans), Cluj Vero My Marcia Seth Augustine (Kluyveromyces marxianus), Candida glabrata (Candida glabrata ), Candida albicans ( Candida albicans ), Pichia stiphytis stipitis ), Yarrowia repolitica lipolytica ), E. coli , or L. plantarum . In another embodiment, the host cell is a yeast host cell. In some embodiments, the host cell is a member of the genus Saccharomyces. In some embodiments, the host cell is Kluyveromyces lactis, Candida glabrata or Schizocaromyces pombe. In some embodiments, the host cell is Saccharomyces cerevisiae. Saccharomyces cerevisiae yeasts are known in the art and include the American Type Culture Collection (Rockville, MD) and the Central Bureau voor Schimmelcultures (CBS) Fungal Biodiversity Centre, LeSaffre, Gert Strand AB, Ferm Solutions, North American Bioproducts, Martrex, and Lallemand Available from a variety of suppliers, including but not limited to Saccharomyces cerevisiae BY4741, CEN.PK 113-7D, Ethanol Red® Yeast, Gert Strand Prestige Turbo Yeast , Pro ™ Yeast, Bio-Perm® XR Yeast, Gert Strand Distillers Yeast, FerMax ™ Green Yeast, Permax Gold (Gold) yeast, Thermo Sacred (Thermosacc)? Yeast, BG-1, PE-2, CAT-1, CBS7959, including but not limited to CBS7960, CBS7961 and.
α-케토아이소발레레이트에서 아이소부티르알데히드로의 기질의 생성물로의 전환을 촉매하는 효소, 또는 아이소부티르알데히드에서 아이소부탄올로의 기질의 생성물로의 전환을 촉매하는 효소 중 적어도 하나가 염색체로 통합된 이종 폴리뉴클레오티드에 의해 인코딩되는 아이소부탄올 생합성 경로를 포함하는 재조합 숙주 세포를 제공하는 단계; 및 재조합 숙주 세포를 발효성 탄소원과 접촉시켜, 아이소부탄올이 생성되는 조건 하에 발효 브로스를 생성하는 단계를 포함하는, 아이소부탄올을 생성하는 방법도 제공된다. 일부 실시 형태에서, 상기 방법은 추출제를 첨가하여 2상 혼합물을 생성시키는 단계를 추가로 포함한다. 다른 실시 형태에서, 추출제는 카르복실산을 포함한다. 일부 실시 형태에서, 추출제는 지방산을 포함한다. 다른 실시 형태에서, 상기 방법은 아이소부탄올과 카르복실산의 에스테르화를 촉매할 수 있는 에스테르화 효소를 첨가하는 단계를 추가로 포함한다.At least one of the enzymes catalyzing the conversion of α-ketoisovalerate to the product of isobutyraldehyde to the substrate, or at least one enzyme catalyzing the conversion of isobutyraldehyde to the product of the substrate from isobutanol to the chromosome Providing a recombinant host cell comprising an isobutanol biosynthetic pathway encoded by an integrated heterologous polynucleotide; And contacting the recombinant host cell with a fermentable carbon source to produce a fermentation broth under conditions in which isobutanol is produced. In some embodiments, the method further comprises adding an extractant to produce a biphasic mixture. In another embodiment, the extractant comprises a carboxylic acid. In some embodiments, the extractant comprises a fatty acid. In another embodiment, the method further comprises adding an esterification enzyme capable of catalyzing the esterification of isobutanol with carboxylic acid.
본 명세서에는 생성물 알코올, 물, 발효성 탄소원, 및 생성물 알코올을 생성시키는 미생물을 포함하는 발효 배지를 제공하는 단계; 수성상 및 유기상을 포함하는 2상 혼합물을 생성시키도록 발효 시에 발효 배지를 추출제와 접촉시키는 단계; 및 발효 배지를 카르복실산, 및 카르복실산을 생성물 알코올로 에스테르화할 수 있는 효소와 접촉시키는 단계를 포함하는 방법도 제공된다. 일부 실시 형태에서, 추출제는 카르복실산을 포함한다. 일부 실시 형태에서, 카르복실산은 바이오매스 공급원료로부터의 오일의 가수분해에 의해 생성된다. 일부 실시 형태에서, 발효성 탄소 및 카르복실산은 동일한 바이오매스 공급원료 공급원으로부터 유래된다. 일부 실시 형태에서, 카르복실산은 12개 내지 22개의 탄소를 갖는 포화, 모노불포화, 폴리불포화 카르복실산, 및 이들의 혼합물을 포함한다. 일부 실시 형태에서, 발효 배지와, 추출제 및 카르복실산 및 효소의 접촉은 동시에 일어난다. 일부 실시 형태에서, 미생물은 유전자 변형 미생물 (예를 들어, 재조합 미생물 또는 숙주 세포, 예컨대 재조합 효모 세포)이다.Provided herein are fermentation media comprising product alcohol, water, fermentable carbon source, and microorganisms producing product alcohol; Contacting the fermentation medium with an extractant during fermentation to produce a biphasic mixture comprising an aqueous phase and an organic phase; And contacting the fermentation medium with a carboxylic acid and an enzyme capable of esterifying the carboxylic acid with a product alcohol. In some embodiments, the extractant comprises a carboxylic acid. In some embodiments, the carboxylic acid is produced by hydrolysis of oil from the biomass feedstock. In some embodiments, the fermentable carbon and carboxylic acid are from the same biomass feedstock source. In some embodiments, the carboxylic acid comprises saturated, monounsaturated, polyunsaturated carboxylic acids having 12 to 22 carbons, and mixtures thereof. In some embodiments, the contact of the fermentation medium with the extractant and the carboxylic acid and enzyme occurs simultaneously. In some embodiments, the microorganism is a genetically modified microorganism (eg, recombinant microorganism or host cell such as recombinant yeast cell).
본 명세서에는 PNY1504, PNY2205, 또는 재조합 숙주 세포; 추출제; 및 임의로 에스테르화 효소를 포함하는 조성물도 제공된다. 본 명세서에는 PNY1504, PNY2205, 또는 재조합 숙주 세포 및 부틸 에스테르를 포함하는 조성물도 제공된다.As used herein, PNY1504, PNY2205, or recombinant host cells; Extractant; And optionally an esterification enzyme. Also provided herein is a composition comprising PNY1504, PNY2205, or recombinant host cells and butyl esters.
본 명세서에는 PNY1504, PNY2205, 또는 다른 재조합 효모 세포, 및 아이소부탄올을 생성하기 위한 재조합 효모 세포를 포함하는 조성물의 용도가 추가로 제공된다.Further provided herein is the use of a composition comprising PNY1504, PNY2205, or other recombinant yeast cells, and recombinant yeast cells for producing isobutanol.
본 명세서에 포함되어 본 명세서의 일부를 형성하는 첨부 도면은 본 발명을 예시하기 위함이며, 또한 상세한 설명과 함께, 본 발명의 원리를 설명하고, 관련 분야의 숙련가에 의해 본 발명을 실시 및 사용할 수 있도록 제공된다.
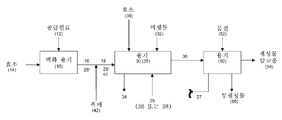
<도 1>
도 1은 알코올 에스테르화용 촉매가 카르복실산 및/또는 천연 오일과 함께 발효 용기에 공급되는, 본 발명의 예시적인 방법 및 시스템을 개략적으로 설명한다.
<도 2>
도 2는 천연 오일이 촉매를 사용하여 카르복실산으로 전환되고, 카르복실산 및 촉매가 발효 용기로 공급되는, 본 발명의 예시적인 방법 및 시스템을 개략적으로 설명한다.
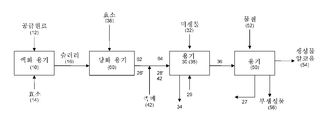
<도 3>
도 3은 액화된 바이오매스가 발효 전에 지질 가수분해용 촉매와 접촉되는, 본 발명의 예시적인 방법 및 시스템을 개략적으로 설명한다.
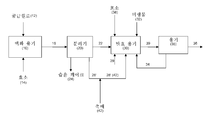
<도 4>
도 4는 액화 및 당화된 바이오매스가 발효 전에 지질 가수분해용 촉매와 접촉되는, 본 발명의 예시적인 방법 및 시스템을 개략적으로 설명한다.
<도 5>
도 5는 상당한 양의 지질 및 불용성 고형물이 발효 전에 액화된 바이오매스로부터 제거되고, 제거된 지질이 촉매를 사용하여 카르복실산으로 전환되며, 카르복실산 및 촉매가 발효 용기에 공급되는, 본 발명의 예시적인 방법 및 시스템을 개략적으로 설명한다.
<도 6>
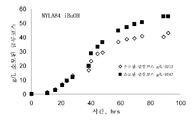
도 6은 탄소원으로서 수크로스를 사용한 발효에 의해 생성된 아이소부탄올의 수성상 및 용매상 농도를 나타낸다. 수성상 역가 (패널 A)는 g/L로 표시되고, 용매상 종류 (아이소부탄올, 패널 B 및 FABE로서의 아이소부탄올, 패널 C. 패널 D는 용매상 중의 총 아이소부탄올임)는 중량 퍼센트로 표시된다.
<도 7>
도 7은 시간 경과에 따른 아이소부탄올의 유효 역가, g/L를 나타낸다. 본 실시예의 유효 역가는 본 명세서에 설명된 바와 같이, 접종 후에 수성 발효 브로스의 초기 부피를 기준으로 계산되었다.
<도 8>
도 8은 시간 경과에 따른 글루코스 당량으로 표시된 당의 소모량을 나타낸다.The accompanying drawings, which are incorporated in and form a part of this specification, are intended to illustrate the invention, and together with the description serve to explain the principles of the invention and to practice and use the invention by those skilled in the art. To be provided.
≪ 1 >
1 schematically illustrates an exemplary method and system of the present invention wherein a catalyst for alcohol esterification is fed to a fermentation vessel together with carboxylic acid and / or natural oil.
2,
2 schematically illustrates an exemplary method and system of the present invention wherein natural oil is converted to carboxylic acid using a catalyst and the carboxylic acid and catalyst are fed to a fermentation vessel.
3,
3 schematically illustrates an exemplary method and system of the present invention wherein liquefied biomass is contacted with a catalyst for lipid hydrolysis prior to fermentation.
<Fig. 4>
4 schematically illustrates an exemplary method and system of the present invention wherein liquefied and glycated biomass is contacted with a catalyst for lipid hydrolysis prior to fermentation.
5,
FIG. 5 shows the present invention in which significant amounts of lipids and insoluble solids are removed from the liquefied biomass prior to fermentation, the removed lipids are converted to carboxylic acids using a catalyst, and the carboxylic acid and catalyst are fed to the fermentation vessel. An exemplary method and system of FIG.
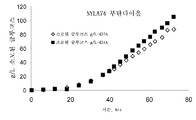
6,
6 shows the aqueous and solvent phase concentrations of isobutanol produced by fermentation using sucrose as carbon source. The aqueous phase titer (Panel A) is expressed in g / L and the solvent phase type (isobutanol, panel B and isobutanol as FABE, panel C. panel D is total isobutanol in the solvent phase) is expressed in weight percent. .
7,
7 shows the effective titers of isobutanol, g / L over time. The effective titer of this example was calculated based on the initial volume of aqueous fermentation broth after inoculation, as described herein.
8,
8 shows the consumption of sugars expressed in glucose equivalents over time.
달리 정의되지 않으면, 본 명세서에서 사용된 모든 기술 및 과학 용어는 본 발명이 속하는 기술 분야의 숙련자가 일반적으로 이해하는 것과 동일한 의미를 갖는다. 상충될 경우, 정의를 비롯하여 본 명세서가 좌우할 것이다. 또한, 문맥에 의해 다르게 필요로 하지 않는 한, 단수의 용어는 복수를 포함할 것이며, 복수의 용어는 단수를 포함할 것이다. 본 명세서에 언급된 모든 공개문헌, 특허 및 기타 참조문헌은 그 전체가 모든 목적을 위해 참조로 포함된다.Unless defined otherwise, all technical and scientific terms used herein have the same meaning as commonly understood by one of ordinary skill in the art to which this invention belongs. In case of conflict, the present specification, including definitions, will control. Also, unless otherwise required by context, a singular term will include the plural, and the plural terms will include the singular. All publications, patents, and other references mentioned herein are incorporated by reference in their entirety for all purposes.
달리 규정되지 않는 한, 하기 약어가 본 명세서에 사용되는 경우에는 약어는 하기 의미를 갖는다:Unless otherwise specified, where the following abbreviations are used herein, the abbreviations have the following meanings:
ADH 알코올 탈수소 효소ADH Alcohol Dehydrogenase
ALS 아세토락테이트 합성효소ALS acetolactate synthase
AQ 수성 분획AQ aqueous fraction
BuO-COFA 옥수수유 지방산(들)의 부틸 에스테르(들)Butyl ester (s) of BuO-COFA corn oil fatty acid (s)
CALB 칸디다 안타르크티카 (Candida antarctica) 리파제 BCALB Candida antarctica lipase B
COFA 옥수수유 지방산(들)COFA Corn Oil Fatty Acid (s)
DDGS 건조주정박DDGS dry berth
DG 다이글리세라이드(들)DG diglyceride (s)
DHAD 다이하이드록시산 탈수 효소DHAD Dihydroxy Acid Dehydratase
EOR 실행 종료End of EOR run
EtOH 에탄올EtOH Ethanol
EtO-COFA 옥수수유 지방산(들)의 에틸 에스테르(들)Ethyl Ester (s) of EtO-COFA Corn Oil Fatty Acid (s)
FABE 지방산 부틸 에스테르(들)FABE fatty acid butyl ester (s)
FAEE 지방산 에틸 에스테르(들)FAEE fatty acid ethyl ester (s)
FAME 지방산 메틸 에스테르(들)FAME fatty acid methyl ester (s)
FFA 유리 지방산(들)FFA free fatty acid (s)
FOA 플루오로오로트산FOA Fluoroorthoic Acid
HADH 말 간 (horse liver) 알코올 탈수소 효소HADH horse liver alcohol dehydrogenase
IBA 아이소부탄올IBA Isobutanol
i-BuOH 아이소부탄올i-BuOH isobutanol
i-BuO-COFA 옥수수유 지방산(들)의 아이소부틸 에스테르(들)isobutyl ester (s) of i-BuO-COFA corn oil fatty acid (s)
i-BuO-올레에이트 아이소부틸 올레에이트i-BuO-oleate isobutyl oleate
i-PrOH 아이소프로판올i-PrOH isopropanol
i-PrO-COFA 옥수수유 지방산(들)의 아이소프로필 에스테르(들)isopropyl ester (s) of i-PrO-COFA corn oil fatty acid (s)
ISPR 원위치에서의 생성물 제거Product removal in place of ISPR
KARI 케톨산 리덕토아이소메라제 (ketol-acid reductoisomerase)KARI Ketolic Acid Reductoisomerase
KivD 케토아이소발레레이트 데카르복실라제KivD Ketoisovalerate Decarboxylase
MAG 모노아실글리세라이드(들)MAG monoacylglyceride (s)
MeBOH 2-메틸-1-부탄올MeBOH 2-methyl-1-butanol
MeBO-COFA 옥수수유 지방산(들)의 2-메틸-1-부틸 에스테르(들)2-methyl-1-butyl ester (s) of MeBO-COFA corn oil fatty acid (s)
MeOH 메탄올MeOH Methanol
MeO-COFA 옥수수유 지방산(들)의 메틸 에스테르(들)Methyl ester (s) of MeO-COFA corn oil fatty acid (s)
MG 모노글리세라이드(들)MG monoglyceride (s)
n-BuOH n-부탄올n-BuOH n-butanol
OA 올레일 알코올OA Ole Alcohol
ORG 유기 분획ORG Organic Fraction
PenOH 1-펜탄올PenOH 1-pentanol
PenO-COFA 옥수수유 지방산(들)의 1-펜틸 에스테르(들)1-pentyl ester (s) of PenO-COFA corn oil fatty acid (s)
PrOH 1-프로판올PrOH 1-propanol
PrO-COFA 옥수수유 지방산(들)의 1-프로필 에스테르(들)1-propyl ester (s) of PrO-COFA corn oil fatty acid (s)
SOFA 대두유 지방산SOFA soybean oil fatty acid
SSF 동시 당화 발효SSF Simultaneous Saccharification Fermentation
t-BuOH tert-부틸 알코올 t- BuOH tert-butyl alcohol
TG 트라이글리세라이드(들)TG Triglyceride (s)
3M3P 3-Me-3-펜탄올3M3P 3-Me-3-pentanol
본 발명을 추가로 정의하기 위하여, 하기의 용어 및 정의가 본 명세서에 제공된다.To further define the present invention, the following terms and definitions are provided herein.
본 명세서에서 사용되는 용어 "구성하다", "구성하는", "포함하다", "포함하는", "가지다", "갖는", "함유하다" 또는 "함유하는" 또는 임의의 이들의 기타 변형체는 언급된 정수 또는 정수의 그룹을 포함하나, 임의의 다른 정수 또는 정수의 그룹을 배제하지 않음을 시사하는 것으로 이해될 것이다. 예를 들어, 요소들의 목록을 포함하는 조성물, 혼합물, 프로세스, 방법, 용품, 또는 장치는 반드시 그러한 요소만으로 제한되지는 않고, 명확하게 열거되지 않거나 그러한 조성물, 혼합물, 프로세스, 방법, 용품, 또는 장치에 내재적인 다른 요소를 포함할 수도 있다. 더욱이, 명백히 반대로 기술되지 않는다면, "또는"은 포괄적인 '또는'을 말하며 배타적인 '또는'을 말하는 것은 아니다. 예를 들어, 조건 A 또는 B는 하기 중 어느 하나에 의해 만족된다: A는 참 (또는 존재함)이고 B는 거짓 (또는 존재하지 않음), A는 거짓 (또는 존재하지 않음)이고 B는 참 (또는 존재함), A 및 B가 모두가 참 (또는 존재함).As used herein, the terms “comprise,” “comprising,” “comprise,” “comprising,” “having,” “having,” “containing,” or “comprising,” or any other variant thereof. Will be understood to include the integers or groups of integers mentioned, but not to exclude any other integers or groups of integers. For example, a composition, mixture, process, method, article, or device comprising a list of elements is not necessarily limited to such elements and is not specifically listed or such composition, mixture, process, method, article, or device It may also contain other elements inherent in the. Moreover, unless expressly stated to the contrary, "or" does not mean " comprehensive " or " exclusive " For example, condition A or B is satisfied by any of the following: A is true (or present) and B is false (or not present), A is false (or not present) and B is true (Or present), both A and B are true (or present).
또한, 본 발명의 요소 또는 성분 앞의 부정 관사 "a" 및 "an"는 그 요소 또는 성분의 경우, 즉, 존재의 수에 관해서는 비제한적인 것으로 의도된다. 따라서, 부정 관사 "a" 또는 "an"는 하나 또는 적어도 하나를 포함하는 것으로 판독되어야 하며, 요소 또는 성분의 단수형 단어는 그 수가 단수형을 명백하게 의미하는 것이 아니라면 복수형을 또한 포함한다.In addition, the indefinite articles "a" and "an" before an element or component of the present invention are intended to be non-limiting in the case of the element or component, ie, the number of beings. Thus, the indefinite article "a" or "an" should be read to include one or at least one, and the singular word of the element or component also includes the plural unless the number obviously means the singular.
본 명세서에서 사용되는 용어 "발명" 또는 "본 발명"은 비제한적인 용어이며, 특정 발명의 임의의 단일의 실시형태를 언급하는 것으로 의도되지 않고, 출원서에 기재된 바와 같은 모든 가능한 실시형태들을 포함한다.The term "invention" or "invention" as used herein is a non-limiting term and is not intended to refer to any single embodiment of a particular invention, and includes all possible embodiments as described in the application. .
본 명세서에서 사용되는, 채용된 발명의 성분 또는 반응물의 양을 수식하는 용어 "약"은, 예를 들어, 실제에서 농축물 또는 용액을 제조하는데 사용되는 통상적 측정 및 액체 취급 과정; 이들 과정에서의 우발적인 오차; 조성물을 제조하거나 방법을 실행하기 위해 채용된 성분의 제조, 공급원 또는 순도의 차이 등을 통해 일어날 수 있는 수량의 변화를 말한다. 용어 "약"은 또한 특정 초기 혼합물로부터 유발되는 조성물에 대한 상이한 평형 조건으로 인해 달라지는 양을 포함한다. 용어 "약"에 의한 수식 여부를 불문하고, 특허청구범위는 분량의 동등어를 포함한다. 일 실시 형태에서, 용어 "약"은 표시된 수치의 10% 이내, 아니면 표시된 수치의 5% 이내를 의미한다.As used herein, the term "about," which modifies the amount of a component or reactant of the invention employed, includes, for example, conventional measurement and liquid handling procedures used to prepare concentrates or solutions in practice; Accidental errors in these processes; A change in quantity that can occur through the manufacture of ingredients, differences in source or purity, etc. employed to prepare a composition or perform a method. The term “about” also includes amounts that vary due to different equilibrium conditions for the composition resulting from the particular initial mixture. The claims, whether or not modified by the term "about", include equivalents of the quantity. In one embodiment, the term "about" means within 10% of the indicated value, or within 5% of the indicated value.
본 명세서에서 사용되는 "바이오매스"는 천연 자원, 예컨대 옥수수, 사탕수수, 밀, 셀룰로스계 또는 리그노셀룰로스계 물질, 및 셀룰로스, 헤미셀룰로스, 리그닌, 전분, 올리고당, 이당류 및/또는 단당류를 포함하는 물질, 및 이들의 혼합물로부터 유래된 임의의 당 및 전분을 포함하는 발효성 당을 제공하는 가수분해성 다당류를 함유하는 천연 산물을 말한다. 바이오매스는 또한 단백질 및/또는 지질과 같은 추가의 성분을 포함할 수 있다. 바이오매스는 단일의 공급원으로부터 유래할 수 있거나, 바이오매스는 한 가지 초과의 공급원으로부터 유래된 혼합물을 포함할 수 있다. 예를 들어, 바이오매스는 옥수수 속대와 옥수수 대의 혼합물, 또는 풀과 잎의 혼합물을 포함할 수 있다. 바이오매스는 바이오에너지 작물, 농업 잔류물, 도시 고형 폐기물 (municipal solid waste), 산업 고형 폐기물, 제지 제조로부터의 슬러지, 마당 폐기물 (yard waste), 당 폐기물 (waste sugar), 목재 및 산림 폐기물을 포함하나 이에 한정되는 것은 아니다. 바이오매스의 예는 옥수수 낟알, 옥수수 속대, 옥수수 껍질과 같은 작물 잔류물, 옥수수 대, 풀, 밀, 호밀, 밀짚, 보리, 보릿짚, 건초, 볏짚, 지팽이풀, 폐지, 사탕수수 찌꺼기, 수수, 사탕수수, 대두, 곡물의 제분으로부터 얻어진 성분, 나무, 가지, 뿌리, 잎, 나뭇조각, 톱밥, 관목 및 덤불, 야채, 과일, 꽃, 동물 퇴비, 및 이들의 혼합물을 포함하나 이에 한정되는 것은 아니다. 예를 들어, 매시, 쥬스, 당밀, 또는 가수분해물은 발효 목적으로 바이오매스를 가공하기 위해 당업계에 공지된 임의의 가공, 예컨대 제분, 처리, 및/또는 액화에 의해 바이오매스로부터 생성될 수 있고, 발효성 당을 포함하며, 물을 포함할 수 있다. 예를 들어, 셀룰로스계 및/또는 리그노셀룰로스계 바이오매스는 당업자에게 공지된 임의의 방법에 의해 가공되어, 발효성 당을 함유하는 가수분해물이 얻어질 수 있다. 본 명세서에 참고로 포함되는 미국 특허 출원 공개 제2007/0031918A1호에 개시된 저 암모니아 전처리가 특히 유용하다. 셀룰로스계 및/또는 리그노셀룰로스계 바이오매스의 효소 당화는 전형적으로 글루코스, 자일로스, 및 아라비노스를 포함하는 당을 함유하는 가수분해물를 생성하도록 셀룰로스 및 헤미셀룰로스를 분해하기 위해 효소 컨소시엄 (consortium)을 이용한다. (셀룰로스계 및/또는 리그노셀룰로스계 바이오매스에 적합한 당화 효소는 문헌 [Lynd, et al., Microbiol. Mol. Biol. Rev. 66:506-577, 2002]에서 검토되어 있다).As used herein, "biomass" includes natural resources such as corn, sugar cane, wheat, cellulose or lignocellulosic materials, and cellulose, hemicellulose, lignin, starch, oligosaccharides, disaccharides and / or monosaccharides. It refers to a natural product containing hydrolyzable polysaccharides that provide a fermentable sugar comprising the substance and any sugars and starches derived from mixtures thereof. The biomass may also include additional components such as proteins and / or lipids. The biomass may be derived from a single source or the biomass may comprise a mixture derived from more than one source. For example, the biomass may comprise a mixture of corncobs and corncobs, or a mixture of grass and leaves. Biomass includes bioenergy crops, agricultural residues, municipal solid waste, industrial solid waste, sludge from papermaking, yard waste, waste sugar, wood and forest waste One is not limited thereto. Examples of biomass are corn residues, corn cobs, crop residues such as corn husks, corn stalks, grass, wheat, rye, straw, barley, barley straw, hay, rice straw, waxweed, waste paper, sugar cane waste, sorghum, candy Ingredients obtained from milling of sorghum, soybeans, grains, trees, branches, roots, leaves, wood chips, sawdust, shrubs and bushes, vegetables, fruits, flowers, animal compost, and mixtures thereof. For example, the mash, juice, molasses, or hydrolyzate can be produced from the biomass by any processing known in the art for processing the biomass for fermentation purposes, such as milling, processing, and / or liquefaction. And fermentable sugars, and may include water. For example, cellulosic and / or lignocellulosic biomass may be processed by any method known to those skilled in the art to obtain hydrolysates containing fermentable sugars. Particularly useful are the low ammonia pretreatments disclosed in US Patent Application Publication No. 2007 / 0031918A1, which is incorporated herein by reference. Enzymatic glycosylation of cellulosic and / or lignocellulosic biomass typically results in an enzyme consortium to degrade cellulose and hemicellulose to produce hydrolysates containing sugars including glucose, xylose, and arabinose. I use it. (Saccharification enzymes suitable for cellulose and / or lignocellulosic biomass are reviewed in Lynd, et al., Microbiol. Mol. Biol. Rev. 66: 506-577, 2002).
매시, 쥬스, 당밀, 또는 가수분해물은 본 명세서에 기재된 바와 같이, 공급원료 (12) 및 공급원료 슬러리 (16)를 포함할 수 있다. 수성 공급 스트림은 발효 목적으로 바이오매스를 가공하기 위해 당업계에 공지된 임의의 가공, 예컨대 제분, 처리, 및/또는 액화에 의해 바이오매스로부터 생성되거나 유래될 수 있고, 발효성 탄소 기질 (예를 들어, 당)을 포함하며, 물을 포함할 수 있다. 수성 공급 스트림은 본 명세서에 기재된 바와 같이, 공급원료 (12) 및 공급원료 슬러리 (16)를 포함할 수 있다.The mash, juice, molasses, or hydrolyzate may comprise
본 명세서에서 사용되는 "바이오매스 수율"은 생성된 탄소 기질 그램 당 생성된 바이오매스의 그램 수 (즉, 세포 바이오매스 생성량)를 말한다.As used herein, "biomass yield" refers to the number of grams of biomass produced per gram of carbon substrate produced (ie, cell biomass production).
본 명세서에서 사용되는 "공급원료"는 발효 프로세스의 공급물을 의미하며, 공급물은 불용성 고형물을 포함하거나 포함하지 않는 발효성 탄소원을 함유하며, 필요에 따라, 발효성 탄소원 전후에 발효성 탄소원을 함유하는 공급물은 전분으로부터 유리되거나, 추가의 가공, 예컨대 액화, 당화, 또는 다른 프로세스에 의해 복합 당류의 분해로부터 얻어진다. 공급원료는 바이오매스를 포함하거나 이로부터 유래된다. 적절한 공급원료는 호밀, 밀, 옥수수, 옥수수 매시, 사탕수수, 사탕수수 매시, 보리, 셀룰로스계 물질, 리그노셀룰로스계 물질, 또는 이들의 혼합물을 포함하나 이에 한정되지 않는다. "공급원료 오일"에 관하여 언급하는 경우, 이 용어는 소정의 공급원료로부터 생성된 오일을 포함하는 것으로 이해될 것이다.As used herein, "feedstock" means a feed of a fermentation process, the feed containing a fermentable carbon source, with or without insoluble solids, and optionally, before and after the fermentable carbon source, The containing feed is liberated from starch or obtained from the decomposition of complex sugars by further processing such as liquefaction, saccharification, or other processes. The feedstock includes or is derived from biomass. Suitable feedstocks include, but are not limited to, rye, wheat, corn, corn mash, sugar cane, sugar cane mash, barley, cellulosic material, lignocellulosic material, or mixtures thereof. When referring to "feedstock oil," this term will be understood to include oils produced from a given feedstock.
본 명세서에서 사용되는 "발효 배지"는 물, 당류, 용존 고형물, 임의로 알코올을 생성하는 미생물, 생성물 알코올, 및 발효 용기에 담긴 물질의 모든 다른 구성성분의 혼합물을 의미하며, 여기서, 생성물 알코올은 존재하는 미생물에 의한 알코올, 물 및 이산화탄소 (CO2)로의 당의 반응에 의해 제조된다. 때로는, 본 명세서에 사용되는 용어 "발효 브로스" 및 "발효 혼합물"은 "발효 배지"와 동의로 사용될 수 있다.As used herein, “fermentation medium” means a mixture of water, sugars, dissolved solids, optionally microorganisms that produce alcohol, product alcohols, and all other components of materials contained in fermentation vessels, where product alcohols are present Is prepared by the reaction of sugars with alcohol, water and carbon dioxide (CO 2 ) by microorganisms. Sometimes, the terms "fermentation broth" and "fermentation mixture" as used herein may be used synonymously with "fermentation medium".
본 명세서에서 사용되는 "발효성 탄소원" 또는 "발효성 탄소 기질"은 발효 알코올의 생성을 위해 본 명세서에 개시된 미생물에 의해 대사될 수 있는 탄소원을 의미한다. 적절한 발효성 탄소원은 단당류, 예컨대 글루코스 또는 프룩토스; 이당류, 예컨대 락토스 또는 수크로스; 올리고당류; 다당류, 예컨대 전분 또는 셀룰로스; C5 당, 예컨대 자일로스 및 아라비노스; 메탄을 포함하는 일 탄소 기질; 및 이들의 혼합물을 포함하나 이에 한정되지 않는다.As used herein, "fermentable carbon source" or "fermentable carbon substrate" means a carbon source that can be metabolized by the microorganisms disclosed herein for the production of fermentation alcohol. Suitable fermentable carbon sources include monosaccharides such as glucose or fructose; Disaccharides such as lactose or sucrose; Oligosaccharides; Polysaccharides such as starch or cellulose; C5 sugars such as xylose and arabinose; One carbon substrate comprising methane; And mixtures thereof.
본 명세서에서 사용되는 "발효성 당"은 발효 알코올의 생성을 위해 본 명세서에 개시된 미생물에 의해 대사될 수 있는 하나 이상의 당을 말한다.As used herein, "fermentable sugar" refers to one or more sugars that can be metabolized by the microorganisms disclosed herein for the production of fermentation alcohol.
본 명세서에서 사용되는 "발효 용기"는 생성물 알코올, 예컨대 부탄올이 당으로부터 생성되는 발효 반응이 행해지는 용기를 의미한다.As used herein, “fermentation vessel” means a vessel through which a fermentation reaction is conducted in which product alcohols such as butanol are produced from sugars.
본 명세서에서 사용되는 "액화 용기"는 액화가 행해지는 용기를 의미한다. 액화는 올리고당이 공급원료로부터 유리되는 프로세스이다. 일부 실시 형태에서 공급원료가 옥수수인 경우, 올리고당은 액화 시에 옥수수 전분 함량으로부터 유리된다.As used herein, "liquefied container" means a container in which liquefaction is performed. Liquefaction is the process by which oligosaccharides are liberated from the feedstock. In some embodiments where the feedstock is corn, the oligosaccharides are liberated from the corn starch content upon liquefaction.
본 명세서에서 사용되는 "당화 용기"는 당화 (즉, 올리고당의 단당류로의 분해)가 행해지는 용기를 의미한다. 발효 및 당화가 동시에 일어나는 경우에는, 당화 용기 및 발효 용기는 동일한 용기 중의 하나일 수 있다.As used herein, "glycosylation vessel" means a vessel in which glycosylation (ie, degradation of oligosaccharides into monosaccharides) is performed. When fermentation and saccharification occur simultaneously, the saccharification vessel and the fermentation vessel may be one of the same vessels.
본 명세서에서 사용되는 "당"은 올리고당, 이당류, 단당류, 및/또는 이들의 혼합물을 말한다. 용어 "당류"는 또한 전분, 덱스트란, 글리코겐, 셀룰로스, 펜토산, 및 당을 비롯한 탄수화물을 포함한다.As used herein, "sugar" refers to oligosaccharides, disaccharides, monosaccharides, and / or mixtures thereof. The term “saccharides” also includes carbohydrates including starch, dextran, glycogen, cellulose, pentosan, and sugars.
본 명세서에서 사용되는 "당화 효소"는 다당류 및/또는 올리고당, 예를 들어, 글리코겐 또는 전분의 알파-1,4-글루코사이드 결합을 가수분해할 수 있는 하나 이상의 효소를 의미한다. 당화 효소도 또한 셀룰로스계 또는 리그노셀룰로스계 물질을 가수분해할 수 있는 효소를 포함할 수 있다.As used herein, "glycosylation enzyme" refers to one or more enzymes capable of hydrolyzing the alpha-1, 4-glucoside linkages of polysaccharides and / or oligosaccharides such as glycogen or starch. Glycosylating enzymes may also include enzymes capable of hydrolyzing cellulose or lignocellulosic materials.
본 명세서에서 사용되는 "불용성 고형물"은 공급원료의 비발효성 부분, 예를 들어, 배아, 섬유, 및 글루텐을 의미한다. 예를 들어, 공급원료의 비발효성 부분은 고형물로서 남아있는 공급원료 부분을 포함하며, 발효 브로스로부터 액체를 흡수할 수 있다.As used herein, "insoluble solids" means the non-fermentable portions of the feedstock, such as embryos, fibers, and gluten. For example, the non-fermentable portion of the feedstock includes the feedstock portion that remains as a solid and can absorb liquid from the fermentation broth.
본 명세서에 사용되는 건조주정박 (DDGS)은 공급원료 또는 바이오매스의 발효 (예를 들어, 생성물 알코올을 생성하는 입자 또는 입자 혼합물의 발효)로부터의 부산물 또는 부생성물을 말한다. 일부 실시 형태에서, DDGS는 또한 생성물 알코올 (예를 들어, 부탄올, 아이소부탄올 등)의 제조 프로세스로부터 생성된 동물 사료 생성물을 지칭할 수 있다.Dry liquor (DDGS) as used herein refers to by-products or by-products from fermentation of feedstock or biomass (eg, fermentation of particles or particle mixtures that produce product alcohols). In some embodiments, DDGS may also refer to an animal feed product resulting from a process of producing product alcohols (eg, butanol, isobutanol, and the like).
본 명세서에서 사용되는 "생성물 알코올"은 발효성 탄소 기질의 공급원으로서 바이오매스를 이용하는 발효 프로세스에서 미생물에 의해 생성될 수 있는 임의의 알코올을 말한다. 생성물 알코올은 C1 내지 C8 알킬 알코올을 포함하나 이에 한정되지 않는다. 일부 실시 형태에서, 생성물 알코올은 C2 내지 C8 알킬 알코올이다. 다른 실시 형태에서, 생성물 알코올은 C2 내지 C5 알킬 알코올이다. C1 내지 C8 알킬 알코올이 메탄올, 에탄올, 프로판올, 부탄올, 및 펜탄올을 포함하나 이에 한정되지 않음을 인지할 것이다. 마찬가지로, C2 내지 C8 알킬 알코올은 에탄올, 프로판올, 부탄올, 및 펜탄올을 포함하나 이에 한정되지 않는다. "알코올"은 또한 생성물 알코올과 관련하여 본 명세서에 사용된다.As used herein, "product alcohol" refers to any alcohol that can be produced by a microorganism in a fermentation process using biomass as a source of fermentable carbon substrate. Product alcohols include, but are not limited to, C 1 to C 8 alkyl alcohols. In some embodiments, the product alcohol is C 2 to C 8 alkyl alcohol. In another embodiment, the product alcohol is C 2 to C 5 alkyl alcohol. It will be appreciated that C 1 to C 8 alkyl alcohols include, but are not limited to, methanol, ethanol, propanol, butanol, and pentanol. Likewise, C 2 to C 8 alkyl alcohols include, but are not limited to, ethanol, propanol, butanol, and pentanol. "Alcohol" is also used herein in connection with a product alcohol.
본 명세서에서 사용되는 "부탄올"은 특히 단독으로 또는 이들의 혼합물로서, 부탄올 이성질체 1-부탄올 (1-BuOH), 2-부탄올 (2-BuOH), tert-부탄올 (t-BuOH), 및/또는 아이소부탄올 (iBuOH, i-BuOH 또는 I-BUOH, 2-메틸-1-프로판올로도 공지됨)을 말한다. 종종, 부탄올의 에스테르를 언급하는 경우, 용어 "부틸 에스테르" 및 "부탄올 에스테르"는 상호교환적으로 사용될 수 있다.As used herein, “butanol” is used alone or as a mixture thereof, butanol isomer 1-butanol (1-BuOH), 2-butanol (2-BuOH), tert-butanol ( t -BuOH), and / or Isobutanol (also known as iBuOH, i-BuOH or I-BUOH, 2-methyl-1-propanol). Often when referring to esters of butanol, the terms "butyl ester" and "butanol ester" may be used interchangeably.
본 명세서에서 사용되는 "프로판올"은 프로판올 이성질체 아이소프로판올 또는 1-프로판올을 말한다.As used herein, "propanol" refers to the propanol isomeric isopropanol or 1-propanol.
본 명세서에서 사용되는 "펜탄올"은 펜탄올 이성질체 1-펜탄올, 3-메틸-1-부탄올, 2-메틸-1-부탄올, 2,2-다이메틸-1-프로판올, 3-펜탄올, 2-펜탄올, 3-메틸-2-부탄올, 또는 2-메틸-2-부탄올을 말한다."Pentanol" as used herein refers to pentanol isomer 1-pentanol, 3-methyl-1-butanol, 2-methyl-1-butanol, 2,2-dimethyl-1-propanol, 3-pentanol, 2-pentanol, 3-methyl-2-butanol, or 2-methyl-2-butanol.
본 명세서에 사용되는 용어 "알코올 당량"은 알코올 에스테르의 완전한 가수분해 및 알코올 에스테르 양으로부터의 알코올의 후속 회수에 의해 얻어지는 알코올의 중량을 말한다.The term "alcohol equivalent" as used herein refers to the weight of alcohol obtained by complete hydrolysis of the alcohol ester and subsequent recovery of the alcohol from the alcohol ester amount.
본 명세서에 사용되는 용어 "수성상 역가"는 발효 브로스 중의 특정한 알코올 (예를 들어, 부탄올)의 농도를 말한다.The term "aqueous phase titer" as used herein refers to the concentration of a particular alcohol (eg butanol) in fermentation broth.
본 명세서에 사용되는 용어 "유효 역가"는 발효 배지의 리터당 발효에 의해 생성되는 특정한 알코올 (예를 들어, 부탄올), 또는 알코올 에스테르화에 의해 생성되는 알코올 에스테르의 알코올 당량의 총량을 말한다. 예를 들어, 발효의 단위 부피 중의 부탄올의 유효 역가는 (i) 발효 배지 중의 부탄올의 양; (ii) 유기 추출제로부터 회수된 부탄올의 양; (iii) 가스 스트리핑 (stripping)이 사용되는 경우에 기상으로부터 회수되는 부탄올의 양; 및 (iv) 유기상 또는 수성상 중의 부틸 에스테르의 알코올 당량을 포함한다.As used herein, the term "effective titer" refers to the total amount of alcohol equivalent of a particular alcohol (eg, butanol) produced by fermentation, or alcohol esterification, per liter of fermentation medium. For example, the effective titer of butanol in the unit volume of fermentation is (i) the amount of butanol in the fermentation medium; (ii) the amount of butanol recovered from the organic extractant; (iii) the amount of butanol recovered from the gas phase when gas stripping is used; And (iv) alcohol equivalents of butyl ester in organic or aqueous phase.
본 명세서에 사용되는 용어 "유효율"은 발효 시간으로 나눈 유효 역가이다.As used herein, the term "efficiency" is the effective titer divided by the fermentation time.
본 명세서에 사용되는 용어 "유효 수율"은 소모된 글루코스의 그램 당 생성된 생성물 알코올의 총 그램수이다.As used herein, the term "effective yield" is the total number of grams of product alcohol produced per gram of glucose consumed.
본 명세서에서 사용되는 "원위치에서의 생성물 제거 (ISPR)"는 생성물이 생성됨에 따라 생물학적 프로세스에서의 생성물 농도를 조절하도록 발효와 같은 생물학적 프로세스로부터 특정 발효 산물을 선택적으로 제거하는 것을 의미한다.As used herein, "in situ product removal (ISPR)" means the selective removal of certain fermentation products from a biological process, such as fermentation, to adjust the product concentration in a biological process as the product is produced.
본 명세서에서 사용되는 "추출제" 또는 "ISPR 추출제"는 임의의 생성물 알코올, 예컨대 부탄올을 추출하는데 사용되거나, 생성물 알코올 및 카르복실산 또는 지질로부터 촉매에 의해 생성되는 임의의 생성물 알코올 에스테르를 추출하는데 사용되는 유기 용매를 의미한다. 종종, 본 명세서에 사용되는 용어 "용매"는 "추출제"와 동의로 사용될 수 있다. 본 명세서에 기술된 프로세스에 있어서, 추출제는 수불혼화성 (water-immiscible)을 나타낸다.As used herein, an "extractant" or "ISPR extractant" is used to extract any product alcohol, such as butanol, or extracts any product alcohol ester produced by the catalyst from the product alcohol and carboxylic acid or lipid. It means an organic solvent used to. Often, the term "solvent" as used herein may be used synonymously with "extractant". In the process described herein, the extractant is water-immiscible.
용어 "수불혼화성" 또는 "불수용성"은 하나의 액상을 형성하는 것과 같은 방식으로, 발효 브로스와 같은 수용액과 혼합될 수 없는 화학 성분, 예컨대 추출제 또는 용매를 말한다.The term "water immiscible" or "water insoluble" refers to a chemical component such as extractant or solvent that cannot be mixed with an aqueous solution, such as fermentation broth, in such a way as to form one liquid phase.
본 명세서에 사용되는 용어 "수성상"은 발효 브로스를 수불혼화성 유기 추출제와 접촉시켜 얻어진 2상 혼합물의 수성상을 지칭한다. 발효 추출을 포함하는 본 명세서에 기술된 프로세스의 실시 형태에서, 그 때 용어 "발효 브로스"는 구체적으로 2상 발효 추출에 있어서의 수성상을 지칭한다.The term "aqueous phase" as used herein refers to the aqueous phase of a biphasic mixture obtained by contacting fermentation broth with a water immiscible organic extractant. In an embodiment of the process described herein, including fermentation extraction, the term “fermentation broth” then specifically refers to the aqueous phase in biphasic fermentation extraction.
본 명세서에 사용되는 용어 "유기상"은 발효 브로스를 수불혼화성 유기 추출제와 접촉시켜 얻어진 2상 혼합물의 비수성상을 지칭한다.As used herein, the term "organic phase" refers to the non-aqueous phase of the biphasic mixture obtained by contacting the fermentation broth with a water immiscible organic extractant.
본 명세서에 사용되는 용어 "카르복실산"은 탄소 원자가 이중 결합으로 산소 원자에 결합되어 카르보닐기 (-C=O)를 형성하고, 단일 결합으로 하이드록실기 (-OH)에 결합되는 일반 화학식 -COOH를 갖는 임의의 유기 화합물을 말한다. 카르복실산은 프로톤화 카르복실산의 형태, 카르복실산 염의 형태 (예를 들어, 암모늄, 나트륨, 또는 칼륨 염), 또는 프로톤화 카르복실산과 카르복실산 염의 혼합물로 될 수 있다. 용어 "카르복실산"은 예를 들어, 바이오매스 유래의 지방산 에스테르 또는 트라이글리세라이드, 다이글리세라이드, 모노글리세라이드, 및 인지질의 가수분해에 의해 생성될 수 있는 것과 같은 카르복실산의 혼합물 또는 단일 화학종 (예를 들어, 올레산)을 나타낼 수 있다.As used herein, the term "carboxylic acid" refers to the general formula -COOH, wherein a carbon atom is bonded to an oxygen atom by a double bond to form a carbonyl group (-C = O), and to a hydroxyl group (-OH) by a single bond Any organic compound having The carboxylic acid may be in the form of a protonated carboxylic acid, in the form of a carboxylic acid salt (eg, ammonium, sodium, or potassium salt), or a mixture of protonated carboxylic acid and carboxylic acid salt. The term "carboxylic acid" refers to a mixture or single of a carboxylic acid, such as can be produced, for example, by hydrolysis of fatty acid esters or triglycerides, diglycerides, monoglycerides, and phospholipids derived from biomass. Chemical species (eg, oleic acid).
본 명세서에 사용되는 용어 "지방산"은 포화되거나 불포화된 C4 내지 C28 탄소 원자 (가장 흔히는 C12 내지 C24 탄소 원자)를 갖는 카르복실산 (예를 들어, 지방족 모노카르복실산)을 말한다. 지방산은 또한 분지상 또는 비분지상일 수 있다. 지방산은 동물성 또는 식물성 지방, 오일 또는 왁스로부터 유래되거나, 그 내에 에스테르화된 형태로 포함될 수 있다. 지방산은 유지 중의 글리세라이드 형태로 자연적으로 발생할 수 있거나, 지방의 가수분해 또는 합성에 의해 얻어질 수 있다. 용어 "지방산"은 단일 화학종 또는 지방산의 혼합물을 나타낼 수 있다. 또한, 용어 "지방산"은 또한 유리 지방산을 포함한다.The term "fatty acid" as used herein refers to carboxylic acids (eg, aliphatic monocarboxylic acids) having saturated or unsaturated C 4 to C 28 carbon atoms (most often C 12 to C 24 carbon atoms). Say. Fatty acids may also be branched or unbranched. Fatty acids may be derived from or included in animal or vegetable fats, oils or waxes. Fatty acids may occur naturally in the form of glycerides in fats or oils, or may be obtained by hydrolysis or synthesis of fats. The term "fatty acid" may refer to a single species or mixture of fatty acids. In addition, the term "fatty acid" also includes free fatty acids.
본 명세서에 사용되는 용어 "지방 알코올"은 포화되거나 불포화된, C4 내지 C22 탄소 원자의 지방족 사슬을 갖는 알코올을 말한다.The term "fatty alcohol" as used herein refers to an alcohol having an aliphatic chain of C 4 to C 22 carbon atoms, saturated or unsaturated.
본 명세서에 사용되는 용어 "지방 알데히드"는 포화되거나 불포화된, C4 내지 C22 탄소 원자의 지방족 사슬을 갖는 알데히드를 말한다.As used herein, the term "fatty aldehyde" refers to an aldehyde having an aliphatic chain of C 4 to C 22 carbon atoms, saturated or unsaturated.
본 명세서에 사용되는 용어 "지방 아미드"는 포화되거나 불포화된, C4 내지 C22 탄소 원자의 긴 지방족 사슬을 갖는 아미드를 말한다.The term "fatty amide" as used herein refers to an amide having a long aliphatic chain of C 4 to C 22 carbon atoms, saturated or unsaturated.
본 명세서에 사용되는 용어 "지방 에스테르"는 포화되거나 불포화된, C4 내지 C22 탄소 원자의 긴 지방족 사슬을 갖는 에스테르를 말한다.The term "fatty ester" as used herein refers to an ester having a long aliphatic chain of C 4 to C 22 carbon atoms, saturated or unsaturated.
본 명세서에 사용되는 "천연 오일"은 식물 (예를 들어, 바이오매스) 또는 동물로부터 얻어진 지질을 말한다. 본 명세서에 사용되는 "식물성 오일"은 특히 식물로부터 얻어진 지질을 말한다. 종종, "지질"은 "오일" 및 "아실 글리세라이드"와 동의로 사용될 수 있다. 천연 오일은 수지, 옥수수유, 캐놀라유, 카프릭/카프릴릭 트라이글리세라이드유, 피마자유, 코코넛유, 면실유, 어유, 호호바유, 라드유, 아마인유, 우각유 (neetsfoot oil), 오이티시카유, 팜유, 피넛유, 평지씨유, 쌀겨유, 홍화유, 대두유, 해바라기유, 동유, 자트로파유, 및 식물유 블렌드를 포함하나 이에 한정되지 않는다.As used herein, "natural oil" refers to a lipid obtained from a plant (eg, biomass) or an animal. As used herein, “vegetable oil” refers to lipids obtained in particular from plants. Often, "lipid" can be used synonymously with "oil" and "acyl glyceride". Natural oils include resins, corn oil, canola oil, capric / caprylic triglyceride oil, castor oil, coconut oil, cottonseed oil, fish oil, jojoba oil, lard oil, linseed oil, neatfoot oil, Ooty Cica oil, palm oil, peanut oil, rapeseed oil, rice bran oil, safflower oil, soybean oil, sunflower oil, tung oil, jatropha oil, and vegetable oil blends.
본 명세서에 사용되는 용어 "분리"는 "회수"와 동의어이며, 초기 혼합물 내의 화합물의 순도 또는 농도보다 더 큰 순도 또는 더 높은 농도의 화합물을 수득하기 위해 초기 혼합물로부터 상기 화합물을 제거하는 것을 말한다.As used herein, the term "separation" is synonymous with "recovery" and refers to the removal of the compound from the initial mixture to obtain a higher purity or higher concentration of the compound than the purity or concentration of the compound in the initial mixture.
본 명세서에 사용되는 용어 "부탄올 생합성 경로"는 1-부탄올, 2-부탄올, 또는 아이소부탄올을 생성하는 효소 경로를 말한다.The term “butanol biosynthetic pathway” as used herein refers to an enzyme pathway that produces 1-butanol, 2-butanol, or isobutanol.
본 명세서에 사용되는 용어 "1-부탄올 생합성 경로"는 아세틸 보효소 A (아세틸-CoA)로부터 1-부탄올을 생성하는 효소 경로를 말한다.The term "1-butanol biosynthetic pathway" as used herein refers to an enzyme pathway that produces 1-butanol from acetyl coenzyme A (acetyl-CoA).
본 명세서에 사용되는 용어 "2-부탄올 생합성 경로"는 피루베이트로부터 2-부탄올을 생성하는 효소 경로를 말한다.The term "2-butanol biosynthetic pathway" as used herein refers to an enzyme pathway that produces 2-butanol from pyruvate.
본 명세서에 사용되는 용어 "아이소부탄올 생합성 경로"는 피루베이트로부터 아이소부탄올을 생성하는 효소 경로를 말한다.The term “isobutanol biosynthetic pathway” as used herein refers to an enzyme pathway that produces isobutanol from pyruvate.
용어 "유전자"는 임의로, 코딩 서열에 앞서는 조절 서열 (5' 비코딩 서열) 및 뒤따르는 조절 서열 (3' 비코딩 서열)을 포함하는, 특정 단백질로 발현될 수 있는 핵산 단편을 말한다. "천연 유전자 (native gene)"는 그 자신의 조절 서열과 함께 자연에서 발견되는 유전자를 말한다. "키메라 유전자"는 자연에서 함께 발견되지 않는 조절 및 코딩 서열을 포함하는, 천연 유전자가 아닌 임의의 유전자 (즉, 이의 천연 상태 또는 다른 공급원으로부터 변형됨)를 말한다. 따라서, 키메라 유전자는 상이한 공급원으로부터 유래된 조절 서열과 코딩 서열 또는 동일한 공급원으로부터 유래되었지만, 자연에서 발견되는 것과 상이한 방식으로 배열된 조절 서열과 코딩 서열을 포함할 수 있다. "내인성 유전자"는 유기체의 게놈에서 그의 자연적 위치에 있는 천연 유전자를 말한다. "외래 유전자" 또는 "이종 유전자"는 숙주 유기체에서 천연 유전자로서 정상적으로 발견되지 않지만, 유전자 전달에 의해 숙주 유기체내로 도입된 유전자를 지칭한다. 외래 유전자는 비천연 유기체 내로 삽입된 천연 유전자 또는 키메라 유전자를 포함할 수 있다.The term “gene” refers to a nucleic acid fragment that can be expressed with a particular protein, optionally including a regulatory sequence (5 ′ noncoding sequence) followed by a coding sequence (3 ′ noncoding sequence). "Native gene" refers to a gene found in nature with its own regulatory sequence. A “chimeric gene” refers to any gene that is not a native gene (ie, modified from its natural state or other sources), including regulatory and coding sequences that are not found together in nature. Thus, chimeric genes may comprise regulatory sequences and coding sequences derived from different sources or regulatory sequences and coding sequences derived from the same source but arranged in a different manner than those found in nature. "Endogenous gene" refers to a natural gene at its natural location in the genome of an organism. A "foreign gene" or "heterologous gene" refers to a gene that is not normally found as a native gene in a host organism, but has been introduced into the host organism by gene transfer. Foreign genes may include native or chimeric genes inserted into non-natural organisms.
본 발명에 사용되는 용어 "코딩 영역"은 특정 아미노산 서열을 코딩하는 DNA 서열을 말한다. "적절한 조절 서열"은 코딩 서열의 상류 (5' 비코딩 서열), 이의 내부 또는 이의 하류 (3' 비코딩 서열)에 위치하고, 전사, RNA 프로세싱 또는 안정성, 또는 관련된 코딩 서열의 번역에 영향을 미치는 뉴클레오티드 서열을 말한다. 조절 서열은 프로모터, 번역 리더 서열 (translation leader sequence), 인트론, 폴리아데닐화 인식 서열, RNA 프로세싱 부위, 이펙터 (effector) 결합 부위 및 스템 루프 구조 (stem-loop structure)를 포함할 수 있다.As used herein, the term "coding region" refers to a DNA sequence encoding a particular amino acid sequence. An “appropriate regulatory sequence” is located upstream of a coding sequence (5 ′ noncoding sequence), inside or downstream thereof (3 ′ noncoding sequence) and affects transcription, RNA processing or stability, or translation of related coding sequences. Refers to a nucleotide sequence. Regulatory sequences may include promoters, translation leader sequences, introns, polyadenylation recognition sequences, RNA processing sites, effector binding sites, and stem-loop structures.
다양한 숙주의 형질전환을 위한 핵산 분자의 코딩 영역 또는 유전자와 관련된 용어 "코돈 최적화"는, DNA에 의해 인코딩되는 폴리펩티드를 변경하지 않으면서 숙주 유기체의 통상적인 코돈 사용 빈도를 반영하도록 핵산 분자의 코딩 영역 또는 유전자 내의 코돈을 변경함을 지칭한다. 코돈 최적화는 당해 기술 분야에 있어서의 통상의 기술 내에 있다.The term "codon optimization" associated with a coding region or gene of a nucleic acid molecule for transformation of various hosts refers to the coding region of a nucleic acid molecule to reflect the usual codon usage of the host organism without altering the polypeptide encoded by the DNA. Or altering codons in a gene. Codon optimization is within the ordinary skill in the art.
용어 "폴리뉴클레오티드"는 단수의 핵산뿐만 아니라 복수의 핵산을 포함하는 것으로 의도되며, 핵산 분자 또는 구축물, 예를 들어 메신저 RNA (mRNA) 또는 플라스미드 DNA (pDNA)를 말한다. 본 명세서에서 사용되는 "유전자"는 폴리뉴클레오티드이다. 폴리뉴클레오티드는 비번역 5' 및 3' 서열 및 코딩 서열을 포함하는, 전장 cDNA 서열 또는 그의 단편의 뉴클레오티드 서열을 포함할 수 있다. 폴리뉴클레오티드는 미변형 RNA 또는 DNA, 또는 변형 RNA 또는 DNA (예를 들어, 이종 DNA)일 수 있는 임의의 폴리리보뉴클레오티드 또는 폴리데옥시리보뉴클레오티드로 이루어질 수 있다. 예를 들어, 폴리뉴클레오티드는 단일- 및 이중 가닥 DNA, 단일- 및 이중 가닥 영역의 혼합물인 DNA, 단일- 및 이중 가닥 RNA, 및 단일- 및 이중 가닥 영역의 혼합물인 RNA, 단일-가닥 또는 더욱 전형적으로는 이중 가닥 또는 단일- 및 이중 가닥 영역의 혼합물일 수 있는 DNA 및 RNA를 포함하는 하이브리드 분자로 이루어질 수 있다. "폴리뉴클레오티드"는 화학적으로, 효소적으로 또는 대사적으로 변형된 형태를 포함한다.The term "polynucleotide" is intended to include a singular nucleic acid as well as a plurality of nucleic acids, and refers to a nucleic acid molecule or construct, such as messenger RNA (mRNA) or plasmid DNA (pDNA). As used herein, a "gene" is a polynucleotide. The polynucleotide may comprise the nucleotide sequence of a full length cDNA sequence or fragment thereof, including untranslated 5 'and 3' sequences and coding sequences. The polynucleotide may consist of any polyribonucleotide or polydeoxyribonucleotide that may be unmodified RNA or DNA, or modified RNA or DNA (eg, heterologous DNA). For example, polynucleotides may be single- and double stranded DNA, DNA that is a mixture of single- and double-stranded regions, single- and double-stranded RNA, and RNA, single-stranded or more typical, which is a mixture of single- and double-stranded regions. And may comprise a hybrid molecule comprising DNA and RNA, which may be double stranded or a mixture of single- and double stranded regions. "Polynucleotide" includes chemically, enzymatically or metabolically modified forms.
폴리뉴클레오티드 서열은 "단리된"으로 지칭될 수 있으며, 여기서, 이는 그의 자연 환경으로부터 제거된다. 예를 들어, 벡터에 함유된 다이하이드록시산 탈수효소 활성을 갖는 폴리펩티드 또는 폴리펩티드 단편을 인코딩하는 이종 폴리뉴클레오티드는 본 발명의 목적을 위해 단리된 것으로 고려된다. 단리된 폴리뉴클레오티드의 추가의 예는 이종 숙주 세포에 유지된 재조합 폴리뉴클레오티드 또는 용액 중의 정제된 (부분적으로 또는 실질적으로) 폴리뉴클레오티드를 포함한다. 본 발명에 따른 단리된 폴리뉴클레오티드 또는 핵산은 합성으로 생성된 이러한 분자를 추가로 포함한다. DNA의 폴리머 형태인 단리된 폴리뉴클레오티드 단편은 cDNA, 게놈 DNA 또는 합성 DNA의 하나 이상의 세그먼트로 이루어질 수 있다.A polynucleotide sequence may be referred to as "isolated" where it is removed from its natural environment. For example, heterologous polynucleotides encoding polypeptides or polypeptide fragments having dihydroxy acid dehydratase activity contained in a vector are considered isolated for the purposes of the present invention. Further examples of isolated polynucleotides include recombinant polynucleotides maintained in heterologous host cells or purified (partially or substantially) polynucleotides in solution. Isolated polynucleotides or nucleic acids according to the present invention further comprise such molecules produced synthetically. Isolated polynucleotide fragments in polymer form of DNA may consist of one or more segments of cDNA, genomic DNA or synthetic DNA.
본 명세서에서 사용되는 용어 "폴리펩티드"는 단수의 "폴리펩티드"뿐만 아니라 복수의 "폴리펩티드"를 포함하고자 하며, 아미드 결합 (또한 펩티드 결합으로도 공지됨)에 의해 선상으로 연결된 모노머 (아미노산)로 이루어진 분자를 지칭한다. 용어 "폴리펩티드"는 둘 이상의 아미노산의 임의의 사슬(들)를 말하며, 특정 길이의 생성물을 말하는 것은 아니다. 따라서, 둘 이상의 아미노산의 사슬(들)을 지칭하기 위해 사용되는 펩티드, 다이펩티드, 트라이펩티드, 올리고펩티드, "단백질", "아미노산 사슬" 또는 임의의 다른 용어는 "폴리펩티드"의 정의 내에 포함되며, 용어 "폴리펩티드"는 이러한 임의의 용어 대신에 또는 그와 상호교환가능하게 사용될 수 있다. 폴리펩티드는 천연의 생물학적 공급원으로부터 유래될 수 있거나, 또는 재조합 기법에 의해 생성될 수 있으나, 반드시 지정된 핵산 서열로부터 번역되지는 않는다. 이는 화학 합성에 의한 것을 비롯하여 임의의 방식으로 생성될 수 있다.As used herein, the term "polypeptide" is intended to include not only a single "polypeptide" but also a plurality of "polypeptides" and molecules consisting of monomers (amino acids) linearly linked by amide bonds (also known as peptide bonds). Refers to. The term "polypeptide" refers to any chain (s) of two or more amino acids, not a specific length of product. Thus, peptides, dipeptides, tripeptides, oligopeptides, "proteins", "amino acid chains" or any other term used to refer to the chain (s) of two or more amino acids are included within the definition of "polypeptide", The term “polypeptide” may be used instead of or interchangeably with any such term. Polypeptides may be derived from natural biological sources or may be produced by recombinant techniques, but are not necessarily translated from designated nucleic acid sequences. It can be produced in any way, including by chemical synthesis.
"단리된" 폴리펩티드, 또는 그의 단편, 변이체 또는 유도체는 그의 자연 환경에서는 존재하지 않는 폴리펩티드를 의도한다. 특정 정제 수준은 필요하지 않다. 예를 들어, 분리된 폴리펩티드는 그의 고유 또는 천연 환경으로부터 제거될 수 있다. 숙주 세포에서 발현되는 재조합으로 생성된 폴리펩티드 및 단백질은 임의의 적절한 기법에 의해 분리되거나, 분별되거나 또는 부분적으로 또는 상당히 정제되는 천연 또는 재조합 폴리펩티드와 같이, 본 발명의 목적을 위해 단리된 것으로 여겨진다.A “isolated” polypeptide, or fragment, variant or derivative thereof, is intended a polypeptide that does not exist in its natural environment. No specific level of purification is necessary. For example, an isolated polypeptide can be removed from its native or natural environment. Recombinantly produced polypeptides and proteins expressed in a host cell are considered to be isolated for the purposes of the present invention, such as natural or recombinant polypeptides that are isolated, fractionated or partially or significantly purified by any suitable technique.
본 명세서에서 사용되는 "재조합 미생물"은 예를 들어, 부탄올과 같은 알코올을 생성하는 생합성 경로와 같은 생합성 경로를 포함하도록 숙주 세포를 유전자 조작하여, 재조합 DNA 기술을 사용하여 변형되는 세균 또는 효모와 같은 미생물을 지칭한다.As used herein, a "recombinant microorganism" refers to a bacterium or yeast that is modified using recombinant DNA technology, for example, by genetically engineering the host cell to include a biosynthetic pathway, such as a biosynthetic pathway that produces an alcohol such as butanol. Refers to microorganisms.
본 발명은 생성물 알코올 (예컨대, 부탄올)의 미생물에 대한 독성 효과를 감소시키는 수단으로서 발효 배지와 ISPR 추출제 사이의 생성물 알코올의 분배를 필요로 하지 않는 대체 추출 발효 방법의 요구를 충족시킨다. 또한 생성물 알코올이 미생물에 대하여 덜 독성을 나타내는 알코올 에스테르로 전환되며, 동시에 발효 산물 추출제의 분배 계수의 저하가 줄어들어, 알코올 (발효 배지로부터의 분리 후에 알코올로 다시 전환될 수 있는 알코올 에스테르와 유리 알코올의 배합물로서)의 생성 수율이 향상되는, 부탄올과 같은 알코올의 생산 방법을 제공함으로써, 발효 산물 ISPR 추출제의 분배 계수의 저하를 줄이는 요구를 충족시킨다. 게다가, 본 발명은 본 명세서의 방법을 기존 프로세스 (예를 들어, 고형물 제거)와 조합하여, 경제적이고 환경적인 이점에서 생성물 제거 증가를 제공할 수 있도록 대체 알코올 생성물 제거 프로세스의 단점에 대한 해결책을 제공한다. 그리하여, 본 발명은 후술하는 실시 형태의 설명에 의해 명백한 바와 같이, 추가로 관련 이점을 제공한다.The present invention satisfies the need for alternative extractive fermentation methods that do not require the distribution of product alcohol between fermentation medium and ISPR extractant as a means of reducing the toxic effects of product alcohols (eg butanol) on microorganisms. In addition, the product alcohol is converted to alcohol esters which are less toxic to microorganisms, while at the same time the lowering of the partition coefficient of the fermentation product extractor is reduced, so that alcohol (alcohol esters and free alcohols which can be converted back to alcohol after separation from the fermentation medium) By providing a process for the production of alcohols such as butanol, in which the yield of the product) is improved, the demand for reducing the partition coefficient of the fermentation product ISPR extractant is met. In addition, the present invention provides a solution to the shortcomings of alternative alcohol product removal processes that can be combined with existing processes (eg solids removal) to provide increased product removal at economical and environmental advantages. do. Thus, the present invention further provides related advantages, as will be apparent from the description of the embodiments described below.
본 발명은 알코올을 카르복실산으로 에스테르화하여, 생성된 알코올 에스테르를 발효 배지로부터 추출하고, 그 후에 알코올을 알코올 에스테르로부터 회수할 수 있는, 알코올을 발효 배지로부터 제거하는 방법을 제공한다. 산은 유리 지방산으로서 발효 배지에 직접 첨가될 수 있거나, 오일로부터 유래될 수 있다. 본 발명은 또한 공급원료로부터 유래된 오일을, 알코올의 에스테르화에 사용되고/되거나 알코올 에스테르를 추출하기 위한 ISPR 추출제 또는 ISPR 추출제의 성분으로서 작용할 수 있는 카르복실산으로 가수분해함으로써, 알코올 발효 프로세스로부터 오일을 제거하거나 감소시키는 방법을 제공한다.The present invention provides a method of esterifying an alcohol with a carboxylic acid, thereby extracting the resulting alcohol ester from the fermentation medium, after which the alcohol can be recovered from the alcohol ester. The acid can be added directly to the fermentation medium as free fatty acid or can be derived from an oil. The present invention also provides an alcohol fermentation process by hydrolyzing an oil derived from a feedstock into a carboxylic acid that can be used for esterification of the alcohol and / or can serve as a component of an ISPR extractor or an ISPR extractant for extracting an alcohol ester. It provides a method for removing or reducing oil from oil.
반응계에 존재하는 물의 양을 감소시키거나, 다만 하나 이상의 비수성 용매를 사용하는 반응계를 사용하는 것이, 리파제와 같은 효소에 의해 촉매되는 경우에 카르복실산에 의한 알코올의 에스테르화에 통상적으로 필요하다. 리파제 효소가 발효성 탄소원의 발효 시에 생성물 알코올과 카르복실산의 에스테르화를 효과적으로 촉진시켜, 생성물 알코올을 생성시킬 수 있는 놀라운 발견이 본 명세서에 기술된다. 또한 발효 시의 생성물 알코올과 카르복실산의 에스테르화가 발효 성능 향상을 제공할 수 있다는 놀라운 발견이 본 명세서에 기술되어 있다. 예를 들어, 에스테르 형태로 생성된 생성물 알코올 (예를 들어, 부탄올)을 획득함으로써, 수성상 중의 생성물 알코올의 농도를 효과적으로 감소시키고, 그리하여 글루코스 소모 및 생성물 생산에 대한 생성물 알코올의 독성 효과를 경감시킨다.Reducing the amount of water present in the reaction system, or using a reaction system using only one or more non-aqueous solvents, is usually required for esterification of alcohols with carboxylic acids when catalyzed by enzymes such as lipases. . Described herein is a surprising discovery that lipase enzymes can effectively promote esterification of product alcohols and carboxylic acids upon fermentation of fermentable carbon sources, resulting in product alcohols. Also described herein is the surprising discovery that esterification of product alcohols with carboxylic acids during fermentation can provide fermentation performance improvements. For example, by obtaining product alcohols (eg butanol) produced in ester form, effectively reducing the concentration of product alcohols in the aqueous phase, thus alleviating the toxic effects of product alcohols on glucose consumption and product production. .
본 발명은 도면과 관련하여 설명될 것이다. 도 1은 본 발명의 실시 형태에 따른 에탄올 또는 부탄올과 같은 발효 알코올의 생산에 관한 예시적인 프로세스 흐름도를 설명한다. 도시된 바와 같이, 공급원료 (12)는 액화 용기 (10)의 인렛에 도입되고 액화되어, 공급원료 슬러리 (16)를 생성할 수 있다. 공급원료 (12)는 발효성 탄소 기질 (예를 들어, 글루코스와 같은 발효성 당)을 공급하는 가수분해성 다당류를 함유하고, 호밀, 밀, 사탕수수 또는 옥수수를 들 수 있으나 이에 한정되지 않는 바이오매스일 수 있거나, 그렇지 않으면 바이오매스로부터 유래될 수 있다. 일부 실시 형태에서, 공급원료 (12)는 분별 바이오매스의 하나 이상의 성분일 수 있으며, 다른 실시 형태에서, 공급원료 (12)는 제분된 미분별 바이오매스일 수 있다. 일부 실시 형태에서, 공급원료 (12)는 옥수수, 예컨대 건식 제분된 미분별 옥수수알일 수 있으며, 불용성 입자는 배아, 섬유, 및 글루텐을 포함할 수 있다. 불용성 고형물은 공급원료 (12)의 비발효성 부분이다. 도면에 도시된 실시 형태와 관련하여 본 명세서에서 검토를 진행시키기 위해, 공급원료 (12)는 종종 불용성 고형물이 이로부터 분리되지 않은 제분된 미분별 옥수수를 구성하는 것으로서 설명될 것이다. 그러나, 본 명세서에 기재된 예시적인 방법 및 시스템이 당업자에게 명백한 바와 같이, 분별 여부에 관계없이 상이한 공급원료로 변형될 수 있음을 알아야 한다. 게다가, 당업자가 인지할 수 있는 바와 같이, 공급원료 함량 (예를 들어, 옥수수 함량)을 최대화하는 것이 당 함량 및 생성물 역가를 최대화할 수 있다. 일부 실시 형태에서, 공급원료 (12)는 고올레산 옥수수일 수 있으므로, 이로부터 유래된 옥수수유는 올레산 함량이 적어도 약 55 wt% 올레산인 고올레산 옥수수유이다. 일부 실시 형태에서, 고올레산 옥수수유 중의 올레산 함량은 통상적인 옥수수유 중의 올레산 함량이 약 24 wt%인 것과 비교하여, 약 65 wt% 이하일 수 있다. 고올레산 오일은 오일의 가수분해가 발효 브로스와 접촉하기 위해 고올레산 함량을 갖는 유리 지방산을 제공하기 때문에, 본 발명의 방법에 사용하기에 몇몇 이점을 제공할 수 있다.The invention will be explained with reference to the drawings. 1 illustrates an exemplary process flow diagram for the production of fermentation alcohols such as ethanol or butanol in accordance with an embodiment of the present invention. As shown,
공급원료 (12)를 액화하는 프로세스는 공급원료 (12) 중의 다당류를, 예를 들어, 덱스트린 및 올리고당을 비롯한 당으로 가수분해하는 것을 포함하며, 이는 통상적인 프로세스이다. 산 프로세스, 산-효소 프로세스, 또는 효소 프로세스를 포함하나 이에 한정되지 않는 임의의 공지된 액화 프로세스 및 당업계에 통상적으로 사용되는 상응하는 액화 용기가 사용될 수 있다. 이러한 프로세스는 단독으로 또는 조합하여 사용될 수 있다. 일부 실시 형태에서, 효소 프로세스가 사용될 수 있으며, 적절한 효소 (14), 예를 들어, 알파-아밀라제가 액화 용기 (10)의 인렛에 도입된다. 물도 액화 용기 (10)에 도입될 수 있다. 일부 실시 형태에서, 당화 효소, 예를 들어, 글루코아밀라제도 액화 용기 (10)에 도입될 수 있다. 추가의 실시 형태에서, 리파제도 오일의 하나 이상의 성분의 유리 지방산으로의 전환을 촉매하도록 액화 용기 (10)에 도입될 수 있다.The process of liquefying
공급원료 (12)의 액화로부터 생성된 공급원료 슬러리 (16)는 발효성 탄소 기질 (예를 들어, 당), 오일, 및 공급원료로부터 유래된 불용성 고형물을 포함한다. 공급원료 슬러리 (16)는 액화 용기 (10)의 아웃렛으로부터 배출될 수 있다. 일부 실시 형태에서, 공급원료 (12)는 옥수수 또는 옥수수알이므로, 공급원료 슬러리 (16)는 옥수수 매시 슬러리이다. 일부 실시 형태에서, 공급원료 (12)는 리그노셀룰로스계 공급원료이므로, 공급원료 슬러리 (16)는 리그노셀룰로스계 가수분해물일 수 있다. 일부 실시 형태에서, 공급원료 (12)는 사탕수수이다.
공급원료 슬러리 (16)는 미생물 (32)과 함께 발효 용기 (30)에 도입된다 발효 용기 (30)는 슬러리 (16)를 발효시켜 알코올을 생성하도록 구성된다. 특히, 미생물 (32)은 슬러리 (16) 중의 발효성 당을 대사 작용시켜, 생성물 알코올을 배출시킨다. 미생물 (32)은 세균, 남세균, 사상균, 및 효모의 그룹 중에서 선택된다. 일부 실시 형태에서, 미생물 (32)은 대장균과 같은 세균일 수 있다. 일부 실시 형태에서, 미생물 (32)은 발효성 재조합 미생물일 수 있다. 슬러리는 예를 들어, 올리고당 형태의 당 및 물을 포함할 수 있고, 일부 실시 형태에서, 모노머 글루코스 약 20 g/L 미만, 약 10 g/L 미만, 또는 모노머 글루코스 약 5 g/L 미만을 포함할 수 있다. 모노머 글루코스의 양을 측정하는 적절한 방법은 당업계에 잘 알려져 있다. 당업계에 알려진 이러한 적절한 방법은 HPLC를 포함한다.
일부 실시 형태에서, 슬러리 (16)는 슬러리 (16) 중의 복합 당류 (예를 들어, 올리고당)를 미생물 (32)에 의해 용이하게 대사될 수 있는 단당류로 분해하도록 당화 프로세스에 처하게 된다. 산 프로세스, 산-효소 프로세스, 또는 효소 프로세스를 포함하나 이에 한정되지 않는 당업계에 통상적으로 사용되는 임의의 공지된 당화 프로세스가 사용될 수 있다. 일부 실시 형태에서, 동시 당화 발효 (SSF)는 도 1에 도시된 발효 용기 (30) 내부에서 일어날 수 있다. 일부 실시 형태에서, 글루코아밀라제와 같은 효소 (38)가, 전분 또는 올리고당을 미생물 (32)에 의해 대사될 수 있는 글루코스로 분해하도록 발효 용기 (30)의 인렛으로 도입될 수 있다.In some embodiments,
카르복실산 (28) 및/또는 천연 오일 (26)은 촉매 (42)와 함께 발효 용기 (30)에 도입된다. 촉매 (42)는 효소 (38) 도입 전, 후 또는 동시에 도입될 수 있다. 따라서, 일부 실시 형태에서, 효소 (38) 및 촉매 (42)의 첨가는 단계적일 수 있거나 (예를 들어, 촉매 (42), 그 다음에 효소 (38), 또는 그 반대의 경우), 실질적으로 동시일 수 있다 (즉, 사람 또는 머신이 첨가를 1행정으로 행하는데 걸리는 시간과 정확히 동일한 시기에, 또는 사람 또는 머신이 첨가를 2행정으로 행하는데 걸리는 시간에서와 같이 하나의 효소/촉매 직후에 다른 효소/촉매). 촉매 (42)는 생성물 알코올을 카르복실산 (28)으로 에스테르화하여 알코올 에스테르를 생성시킬 수 있다. 예를 들어, 부탄올 생산의 경우에는, 촉매 (42)는 부탄올을 카르복실산 (28)으로 에스테르화하여 부틸 에스테르를 생성시킬 수 있다.
천연 오일 (26)이 발효 용기 (30)에 공급되는 경우에는, 오일 (26) 중의 적어도 일부의 아실 글리세라이드는 오일 (26)을 촉매 (42)와 접촉시켜 카르복실산 (28)으로 가수분해될 수 있다. 오일 (26)의 가수분해로부터 생성된 산/오일 조성물은 전형적으로 적어도 약 17 wt% 카르복실산 (28) (유리 지방산으로서)이다. 일부 실시 형태에서, 오일 (26)의 가수분해로부터 생성된 산/오일 조성물은 적어도 약 20 wt% 카르복실산, 적어도 약 25 wt% 카르복실산, 적어도 약 30 wt% 카르복실산, 적어도 약 35 wt% 카르복실산, 적어도 약 40 wt% 카르복실산, 적어도 약 45 wt% 카르복실산, 적어도 약 50 wt% 카르복실산, 적어도 약 55 wt% 카르복실산, 적어도 약 60 wt% 카르복실산, 적어도 약 65 wt% 카르복실산, 적어도 약 70 wt% 카르복실산, 적어도 약 75 wt% 카르복실산, 적어도 약 80 wt% 카르복실산, 적어도 약 85 wt% 카르복실산, 적어도 약 90 wt% 카르복실산, 적어도 약 95 wt% 카르복실산, 또는 적어도 약 99 wt% 카르복실산이다. 일부 실시 형태에서, 생성된 산/오일 조성물은 오일 중의 아실 글리세라이드의 부분 가수분해로부터의 모노글리세라이드 및/또는 다이글리세라이드를 포함한다. 일부 실시 형태에서, 생성된 산/오일 조성물은 글리세롤, 아실 글리세라이드 가수분해의 부생성물을 포함한다. 일부 추가의 실시 형태에서, 생성된 산/오일 조성물은 오일 중의 인지질의 부분 가수분해로부터의 라이소포스포리피드를 포함한다.When
일부 실시 형태에서, 오일 (26) 중의 아실 글리세라이드의 가수분해 후에, 오일 (26)로부터의 잔류 아실 글리세라이드는 약 0 wt% 내지 적어도 약 2 wt%의 발효 브로스 조성물이다. 일부 추가의 실시 형태에서, 오일 (26) 중의 아실 글리세라이드의 가수분해 후에, 오일 (26)로부터의 잔류 아실 글리세라이드는 적어도 약 0.5 wt%의 발효 브로스 조성물이다. 따라서, 일부 실시 형태에서, 오일 (26)로부터의 아실 글리세라이드는 촉매 (42)를 사용하여 카르복실산 (28)으로 촉매적 가수분해될 수 있으며, 촉매 (42)는 또한 카르복실산 (28)을 생성물 알코올로 에스테르화할 수 있다. 일부 실시 형태에서, 제 2 촉매 (도시되지 않음)는 아실 글리세라이드의 가수분해를 위해 발효 용기에 도입될 수 있다. 또한, 공급원료 (12)로부터 유래되고 슬러리 (16)에 존재하는 오일 중의 아실 글리세라이드는 또한 카르복실산 (28') (예를 들어, 도 3의 실시 형태 참조)으로 가수분해될 수 있다. 일부 실시 형태에서, 발효 용기 중의 카르복실산 (예컨대, 지방산)의 농도는 수성상 중의 용해 한도를 초과하며, 유기상 및 수성상을 포함하는 2상 발효 혼합물을 형성한다. 일부 실시 형태에서, 발효 브로스 중의 카르복실산의 농도는 전형적으로 약 0.8 g/L 이하이며, 브로스 중의 카르복실산의 용해도에 의해 제한된다.In some embodiments, after hydrolysis of the acyl glycerides in
일부 실시 형태에서, 촉매 (42) 및 사용된다면, 제 2 촉매는 하나 이상의 효소, 예를 들어, 리파제 효소일 수 있다. 일부 실시 형태에서, 촉매 (42)는 하나 이상의 효소, 예를 들어, 하이드로라제 효소, 예컨대 리파제 효소일 수 있다. 사용되는 리파제 효소는 예를 들어, 압시디아 (Absidia), 아크로모박터 (Achromobacter), 에어로모나스 (Aeromonas), 알칼리게네스 (Alcaligenes), 알터나리아 (Alternaria), 아스페르길루스 (Aspergillus), 아크로모박터, 아우레오바시디움 (Aureobasidium), 바실러스, 브베리아 (Beauveria), 브로초스릭스 (Brochothrix), 칸디다, 크로모박터 (Chromobacter), 코프리누스 (Coprinus), 푸사리움 (Fusarium), 지오트리쿰 (Geotricum), 한세뉼라, 후미콜라 (Humicola), 하이포자이마 (Hyphozyma), 락토바실러스, 메타리지움 (Metarhizium), 무코르 (Mucor), 넥트리아 (Nectria), 뉴로스포라 (Neurospora), 패실로마이세스 (Paecilomyces), 페니실륨 (Penicillium), 슈도모나스, 리족토니아 (Rhizoctonia), 리조무코르 (Rhizomucor), 리조푸스 (Rhizopus), 로도스포리디움 (Rhodosporidium), 로도토룰라 (Rhodotorula), 사카로마이세스, 서스 (Sus), 스포로볼로마이세스 (Sporobolomyces), 서모마이세스 (Thermomyces), 티아로스포렐라 (Thiarosporella), 트리코데르마 (Trichoderma), 버티실리움 (Verticillium), 및/또는 야로위아 균주를 비롯한 임의의 공급원으로부터 유래될 수 있다. 바람직한 태양에서, 리파제의 공급원은 압시디아 블라케슬리나 (Absidia blakesleena), 압시디아 코림비페라 (Absidia corymbifera), 아크로모박터 아이오파구스 (Achromobacter iophagus), 알칼리게네스 스피시즈 (Alcaligenes sp .), 알터나리아 브라시키올라 (Alternaria brassiciola), 아스페르길루스 플라부스 (Aspergillus flavus), 아스페르길루스 니제르 (Aspergillus niger), 아스페르길루스 투빈제네시스 (Aspergillus tubingensis), 아우레오바시디움 풀룰란스 (Aureobasidium pullulans), 바실러스 푸미루스 (Bacillus pumilus), 바실러스 스테아로테르모필루스 (Bacillus strearothermophilus), 바실러스 서브틸리스 (Bacillus subtilis), 브로초스릭스 테르모소하타 (Brochothrix thermosohata), 칸디다 실린드라세아 (Candida cylindracea) (칸디다 루고사 (Candida rugosa)), 칸디다 파라리폴리티카 (Candida paralipolytica), 칸디다 안타르크티카 (Candida antarctica) 리파제 A, 칸디다 안타르크티카 리파제 B, 칸디다 에르노비이 (Candida ernobii), 칸디다 데포르만스 (Candida deformans), 크로모박터 비스코숨 (Chromobacter viscosum), 코프리누스 시네리우스 (Coprinus cinerius), 푸사리움 옥시스포룸 (Fusarium oxysporum), 푸사리움 솔라니 (Fusarium solani), 푸사리움 솔라니 피시 (Fusarium solani pisi), 푸사리움 로세움 쿨모룸 (Fusarium roseum culmorum), 지오트리쿰 페니실라툼 (Geotricum penicillatum), 한세뉼라 아노말라 (Hansenula anomala), 후미콜라 브레비스포라 (Humicola brevispora), 후미콜라 브레비스 배리언트 테르모이데아 (Humicola brevis var . thermoidea), 후미콜라 인솔렌스 (Humicola insolens), 락토바실러스 쿠르바투스 (Lactobacillus curvatus), 리조푸스 오리재 (Rhizopus oryzae), 페니실륨 사이클로피움 (Penicillium cyclopium), 페니실륨 크루스토숨 (Penicillium crustosum), 페니실륨 엑스판숨 (Penicillium expansum), 페니실륨 스피시즈 (Penicillium sp .) I, 페니실륨 스피시즈 (Penicillium sp .) II, 슈도모나스 에루지노사 (Pseudomonas aeruginosa), 슈도모나스 알칼리게네스 (Pseudomonas alcaligenes), 슈도모나스 세파시아 (Pseudomonas cepacia) (동의어: 버크홀데리아 세파시아 (Burkholderia cepacia)), 슈도모나스 플루오레센스 (Pseudomonas fluorescens), 슈도모나스 프라기 (Pseudomonas fragi), 슈도모나스 말토필리아 (Pseudomonas maltophilia), 슈도모나스 멘도시나 (Pseudomonas mendocina), 슈도모나스 메피티카 리폴리티카 (Pseudomonas mephitica lipolytica), 슈도모나스 알칼리게네스 (Pseudomonas alcaligenes), 슈도모나스 플란타리 (Pseudomonas plantari), 슈도모나스 슈도알칼리게네스 (Pseudomonas pseudoalcaligenes), 슈도모나스 푸티다 (Pseudomonas putida), 슈도모나스 스투체리 (Pseudomonas stutzeri), 및 슈도모나스 위스콘시넨시스 (Pseudomonas wisconsinensis), 리족토니아 솔라니 (Rhizoctonia solani), 리조무코르 미에헤이 (Rhizomucor miehei), 리조푸스 자포니쿠스 (Rhizopus japonicus), 리조푸스 마이크로스포러스 (Rhizopus microsporus), 리조푸스 노도수스 (Rhizopus nodosus), 로도스포리디움 토룰로이데스 (Rhodosporidium toruloides), 로도토룰라 글루티니스 (Rhodotorula glutinis), 사카로마이세스 세레비시아 (Saccharomyces cerevisiae), 스포로볼로마이세스 시바타누스 (Sporobolomyces shibatanus), 서스 스크로파 (Sus scrofa), 서모마이세스 라누기노서스 (Thermomyces lanuginosus) (이전에, 후미콜라 라누기노세 (Humicola lanuginose)), 티아로스포렐라 파세올리나 (Thiarosporella phaseolina), 트리코데르마 하르지아눔 (Trichoderma harzianum), 트리코데르마 리세이 (Trichoderma reesei), 및 야로위아 리폴리티카 (Yarrowia lipolytica)로 구성되는 그룹 중에서 선택된다. 추가의 바람직한 태양에서, 리파제는 서모마이세스 라누기노서스 (Thermomyces lanuginosus) 리파제, 아스페르길루스 스피시즈 (Aspergillus sp .) 리파제, 아스페르길루스 니제르 (Aspergillus niger) 리파제, 아스페르길루스 투빈제네시스 (Aspergillus tubingensis) 리파제, 칸디다 안타르크티카 (Candida antarctica) 리파제 B, 슈도모나스 스피시즈 (Pseudomonas sp .) 리파제, 페니실륨 로케포르티 (Penicillium roqueforti) 리파제, 페니실륨 카멤베르티 (Penicillium camembertii) 리파제, 무코르 자바니쿠스 (Mucor javanicus) 리파제, 버크홀데리아 세파시아 (Burkholderia cepacia) 리파제, 알칼리게네스 스피시즈 (Alcaligenes sp .) 리파제, 칸디다 루고사 (Candida rugosa) 리파제, 칸디다 파라프실로시스 (Candida parapsilosis) 리파제, 칸디다 데포르만스 (Candida deformans) 리파제, 지오트리쿰 칸디둠 (Geotrichum candidum)의 리파제 A 및 B, 뉴로스포라 크라사 (Neurospora crassa) 리파제, 넥트리아 하에마토코카 (Nectria haematococca) 리파제, 푸사리움 헤테로스포룸 (Fusarium heterosporum) 리파제, 리조푸스 델레마 (Rhizopus delemar) 리파제, 리조무코르 미에헤이 (Rhizomucor miehei) 리파제, 리조푸스 아르히주스 (Rhizopus arrhizus) 리파제, 및 리조푸스 오리재 (Rhizopus oryzae) 리파제로 구성되는 그룹 중에서 선택된다. 촉매 (42)로서 적합한 적절한 시판용 리파제 제제는 노보자임즈 (Novozymes)로부터 입수가능한 리폴라제 (Lipolase)? 100 L, 리펙스 (Lipex)? 100L, 리포클린 (Lipoclean)? 2000T, 리포자임 (Lipozyme)? CALB L, 노보자임 (Novozyme)? CALA L, 및 팔라타제 (Palatase) 20000L, 또는 시그마알드리치 (SigmaAldrich)로부터 입수가능한 슈도모나스 플루오레센스 (Pseudomonas fluorescens), 슈도모나스 세파시아 (Pseudomonas cepacia), 무코르 미에헤이 (Mucor miehei), 돼지 췌장 (hog pancreas), 칸디다 실린드라세아 (Candida cylindracea), 칸디다 루고사 (Candida rugosa), 리조푸스 니베우스 (Rhizopus niveus), 칸디다 안타르크티카 (Candida antarctica), 리조푸스 아르히주스 (Rhizopus arrhizus) 또는 아스페르길루스 (Aspergillus) 유래의 것을 포함하나 이에 한정되지 않는다.In some embodiments,
포스포리파제는 인지질의 에스테르 결합을 가수분해하는 효소이지만, 다수의 포스포리파제는 또한 트라이글리세라이드, 다이글리세라이드, 및 모노글리세라이드 (지질 아실 하이드로라제 (LAH) 활성)를 가수분해할 수 있다. 본 명세서에 사용되는 용어 "포스포리파제"는 예를 들어, 원유 또는 식물유와 같은 오일 중에서, 예를 들어 글리세롤포스페이트 에스테르 결합을 분해하는 (글리세롤포스페이트 에스테르 결합의 가수분해를 촉매하는) 임의의 포스포리파제 활성을 갖는 효소를 포함한다. 본 발명의 포스포리파제 활성은 물 추출성 (water extractable) 인산화 염기 및 다이글리세라이드를 생성할 수 있다. 포스포리파제 활성은 포스포리파제 C (PLC) 활성; PI-PLC 활성, 포스포리파제 A (PLA) 활성, 예컨대 포스포리파제 Al 또는 포스포리파제 A2 활성; 라이소포스포리파제 (LPL) 활성 및/또는 라이소포스포리파제- 트랜스아실라제 (LPT A) 활성을 비롯한 포스포리파제 B (PLB) 활성, 예컨대 포스포리파제 B1 또는 포스포리파제 B2 활성; 포스포리파제 D (PLD) 활성, 예컨대 포스포리파제 Dl 또는 포스포리파제 D2 활성; 및/또는 파타틴 활성 또는 이들의 임의의 조합을 포함할 수 있다.Phospholipases are enzymes that hydrolyze ester bonds of phospholipids, but many phospholipases can also hydrolyze triglycerides, diglycerides, and monoglycerides (lipid acyl hydrolase (LAH) activity). . As used herein, the term “phospholipase” refers to any phospho that catalyzes, for example, hydrolysis of glycerol phosphate ester bonds, in oils such as crude or vegetable oils, for example. Enzymes having lipase activity. The phospholipase activity of the present invention can produce water extractable phosphorylated bases and diglycerides. Phospholipase activity includes phospholipase C (PLC) activity; PI-PLC activity, phospholipase A (PLA) activity such as phospholipase Al or phospholipase A2 activity; Phospholipase B (PLB) activity, such as phospholipase B1 or phospholipase B2 activity, including lysophospholipase (LPL) activity and / or lysophospholipase-transacylase (LPT A) activity; Phospholipase D (PLD) activity, such as phospholipase Dl or phospholipase D2 activity; And / or patatin activity or any combination thereof.
용어 "포스포리파제"는 또한 라이소포스포리파제 활성을 갖는 효소를 포함하고, 이러한 효소의 2개의 기질은 2-라이소포스파티딜콜린 및 H20이며, 이의 2개의 생성물은 글리세로포스포콜린 및 카르복실레이트이다. 포스포리파제 Al (PLA1) 효소는 1 위치 지방산을 제거시켜, 유리 지방산 및 1-라이소-2-아실포스포리피드를 생성시킨다. 포스포리파제 A2 (PLA2) 효소는 2 위치 지방산을 제거시켜, 유리 지방산 및 1-아실-2-라이소포스포리피드를 생성시킨다. PLA1 및 PLA2 효소는 세포내- 또는 세포외, 막결합성 또는 가용성을 나타낼 수 있다. 포스포리파제 C (PLC) 효소는 포스페이트 부분을 제거시켜, 1,2-다이아실글리세롤 및 포스페이트 에스테르를 생성시킨다. 포스포리파제 D (PLD) 효소는 1,2-다이아실글리세로포스페이트 및 염기 기를 생성시킨다. 본 발명에 유용한 포스포리파제는 다양한 생물학적 공급원, 예를 들어, 푸사리움속 내의 사상 진균종, 예컨대 푸사리움 쿨모룸 (F. culmorum), 푸사리움 헤테로스포룸 (F. heterosporum), 푸사리움 솔라니 (F. solani), 또는 푸사리움 옥시스포룸 (F. oxysporum)의 균주; 또는 아스페르길루스속 내의 사상 진균종, 예컨대 아스페르길루스 아와모리 (Aspergillus awamori), 아스페르길루스 포에티두스 (Aspergillus foetidus), 아스페르길루스 자포니쿠스 (Aspergillus japonicus), 아스페르길루스 니제르 (Aspergillus niger) 또는 아스페르길루스 오리재 (Aspergillus oryzae)의 균주로부터 얻어질 수 있으나, 이에 한정되지 않는다. 서모마이세스 라누기노서스 (Thermomyces lanuginosus) 포스포리파제 변이체, 예컨대 시판용 제품 레시타제 (Lecitase)? 울트라 (덴마크에 소재하는 노보자임즈 A'S)도 본 발명에 유용하다. 하나 이상의 포스포리파제는 고정화되거나 수용액 중의 동결 건조 분말로서 적용될 수 있다.The term “phospholipase” also includes enzymes having lysophospholipase activity, two substrates of which are 2-lysophosphatidylcholine and H 2 O, the two products of which are glycerophosphocholine and carbohydrates. Is a carboxylate. The phospholipase Al (PLA1) enzyme removes the 1 position fatty acid, producing free fatty acids and 1-lyso-2-acylphospholipids. Phospholipase A2 (PLA2) enzymes remove the 2-position fatty acids, producing free fatty acids and 1-acyl-2-lysophospholipids. PLA1 and PLA2 enzymes may exhibit intra- or extracellular, membrane binding or solubility. Phospholipase C (PLC) enzymes remove the phosphate moiety to produce 1,2-diacylglycerol and phosphate esters. Phospholipase D (PLD) enzymes produce 1,2-diacylglycerophosphate and base groups. Phospholipases useful in the present invention include filamentous fungal species in various biological sources such as Fusarium, such as F. culmorum , F. heterosporum , Fusarium solanie ( F. solani ), or strains of F. oxysporum ; Or filamentous fungal species in the genus Aspergillus , such as Aspergillus awamori awamori ), Aspergillus poetidus foetidus ), Aspergillus japonicus , Aspergillus niger niger ) or Aspergillus duckbill ( Aspergillus) oryzae ) may be obtained from, but is not limited to. Thermomyces Lanuginus lanuginosus ) phospholipase variants, such as the commercial product Lecitase? Ultra (Novozymes A'S, Denmark) is also useful in the present invention. One or more phospholipases may be immobilized or applied as lyophilized powder in aqueous solution.
하나 이상의 발효성 당의 발효에 의해 생성되는 알코올 (예를 들어, 부탄올)은 카르복실산이 알코올로 에스테르화되는 효소 촉매 반응에 의해 카르복실산 에스테르로 전환될 수 있다. 리파제, 포스포리파제, 및 라이소포스포리파제와 같은 효소가 이러한 반응을 촉매시킬 수 있으나; 이러한 효소는 기체-액체 및 액체-액체 계면에서의 유체역학적 전단 또는 불활성화를 포함하나 이에 한정되지 않는 하나 이상의 인자로 인해 불활성화될 수 있다. 올리고당이 부가적으로 하나 이상의 발효성 당으로 전환되는 발효에서, 올리고당을 발효성 당으로 전환시키는 효소 (예를 들어, 글루코아밀라제)도 하나 이상의 이러한 동일 인자에 의해 불활성화될 수 있다.Alcohols (eg, butanol) produced by the fermentation of one or more fermentable sugars can be converted to carboxylic esters by enzymatic catalysis in which the carboxylic acid is esterified with alcohol. Enzymes such as lipase, phospholipase, and lysophospholipase can catalyze this reaction; Such enzymes may be inactivated due to one or more factors, including but not limited to hydrodynamic shear or inactivation at the gas-liquid and liquid-liquid interface. In fermentation where the oligosaccharides are additionally converted to one or more fermentable sugars, enzymes (eg, glucoamylases) that convert the oligosaccharides to fermentable sugars may also be inactivated by one or more such same factors.
발효 브로스의 통기 (aeration)로 인해 일어나고/일어나거나, 하나 이상의 발효성 당의 발효 시에 브로스 내의 기체상 이산화탄소의 발생에 의해 생성되는 기체-액체 계면에서의 효소의 불활성화 (예를 들어, 기포와 발효 브로스의 계면에서 일어날 수 있음)는 당업계에 공지되어 있다. 암탉 알 백색 라이소자임 및 아스페르길루스 오리재 (Aspergillus oryzae) (노보자임즈 리폴라제?)에서 생성되는 서모마이세스 라누기노서스 (Thermomyces lanuginosus) 리파제의 불활성화는 세가지의 상이한 반응기 형상으로 기체-액체 계면에서 관찰되었다: 기포탑, 배플을 갖는 교반 용기 (기체 스파징에 의한 통기 없음), 및 유하 박막 (falling film) (Ghadge, et al., Chem. Eng. Sci. 58:5125-5134, 2003). 배플형 교반 탱크 반응기 (baffled stirred-tank reactor) (기체 스파징에 의한 통기 없음) 중의 기체-액체 계면에서의 서모마이세스 라누기노서스 (Thermomyces lanuginosus) 리파제 (아스페르길루스 오리재 (Aspergillus oryzae)에서 생성됨; 노보자임즈 리폴라제 100L?)의 불활성화 메카니즘이 보고되어 있다 (Patil, et al., AIChE J. 46:1280-1283, 2000).Inactivation of enzymes at the gas-liquid interface (e.g., with bubbles and) that occurs due to aeration of the fermentation broth and / or is generated by the generation of gaseous carbon dioxide in the broth upon fermentation of one or more fermentable sugars. Which can occur at the interface of fermentation broth) is known in the art. Hen egg white lysozyme and aspergillus duckbill ( Aspergillus oryzae ) ( Thermomyces ranuginosas produced by Novozymes repolarase?) lanuginosus ) Inactivation of lipases was observed at the gas-liquid interface in three different reactor configurations: bubble column, stirred vessel with baffles (no aeration by gas sparging), and falling film (Ghadge, et. al., Chem. Eng. Sci. 58: 5125-5134, 2003). Thermomyces at the gas-liquid interface in a baffled stirred-tank reactor (no aeration by gas sparging) Thermomyces lanuginosus ) lipase ( Aspergillus duck) oryzae ); Inactivation mechanism of Novozymes repolarase 100L?) Has been reported (Patil, et al., AIChE J. 46: 1280-1283, 2000).
스타만 (Stahmann) 등 (Eur. J. Biochem. 244:220-225, 1997)은 애쉬뱌 고시피이 (Ashbya gossypii) 리파제가 기체/액체 또는 액체/액체 계면에서의 계면 불활성화로 인해 교반 기체/물, 트라이올레오일글리세롤/물 또는 올레산/물 혼합물에서 수분 이내에 불활성화된 것으로 보고하였다. 일라이어스 (Elias) 등 (Adv. Biochem. Engineering/Biotechnology 59:47-71, 1998)은 다음과 같이 보고하였다: (i) 일부의 효소는 기체-액체 계면의 부재에서도 유체역학적 전단으로 불활성화되고; (ii) 유체역학적 전단에 의해 불활성화된 효소의 경우, 불활성화 속도는 기체-액체 계면의 존재 하에 증가되며; (iii) 일부의 효소는 인가된 유체역학적 전단에 관계없이 기체-액체 계면의 부재 하에 불활성화되지 않고; (iv) 불활성화를 위해 기체-액체 계면을 필요로 하는 효소의 경우, 불활성화 속도는 유체역학적 전단 증가에 따라 증가한다. 로스 (Ross) 등 (J. Mol. Catal. B: Enzymatic 8:183-192, 2000)은 기포탑 장치에서 용매 액적을 효소 수용액을 통해 위쪽으로 통과시켜 다양한 수성/유기 용매 혼합물 중에서의 α-카이모트립신, β-카이모트립신, 파파인, 및 돼지 간 에스테라제의 계면 불활성화를 설명하였다. 교반 탱크 반응기에서의 칸디다 실린드라세아 (Candida cylindracea) 리파제의 전단 불활성화의 속도론 및 메카니즘도 보고되어 있으며, 불활성화 메카니즘은 전단 유도 기체-액체 계면 효과로 인한 것으로 밝혀졌다 (Lee, et al., Biotechnol. Bioeng. 33:183-190, 1989).Stahmann et al. (Eur. J. Biochem. 244: 220-225, 1997) reported that the Ashbya gossypii lipase was agitated due to the interfacial deactivation of the gas / liquid or liquid / liquid interface. It was reported to be inactivated in water, trioleoylglycerol / water or oleic acid / water mixture within minutes. Elias et al. (Adv. Biochem. Engineering / Biotechnology 59: 47-71, 1998) reported that: (i) some enzymes are inactivated by hydrodynamic shear in the absence of a gas-liquid interface; (ii) for enzymes inactivated by hydrodynamic shear, the inactivation rate is increased in the presence of a gas-liquid interface; (iii) some enzymes are not inactivated in the absence of a gas-liquid interface regardless of the applied hydrodynamic shear; (iv) For enzymes that require a gas-liquid interface for inactivation, the rate of inactivation increases with increasing hydrodynamic shear. Ross et al. (J. Mol. Catal. B: Enzymatic 8: 183-192, 2000) reported that α-Kamo in various aqueous / organic solvent mixtures by passing solvent droplets upward through an aqueous solution of enzyme in a bubble column apparatus. Interfacial inactivation of trypsin, β-chymotrypsin, papain, and porcine liver esterase has been described. Kinetics and mechanisms of shear inactivation of Candida cylindracea lipase in stirred tank reactors have also been reported, and the inactivation mechanism has been found to be due to the shear induced gas-liquid interfacial effect (Lee, et al., Biotechnol. Bioeng. 33: 183-190, 1989).
본 명세서에 기재된 일부 방법에 사용되는 발효 조건 하에, 유체역학적 전단 및 기체-액체 및 액체-액체 계면은 각각 발효 동안에 존재하며, 효소 불활성화를 일으킬 수 있다. 발효 시에 본 명세서에 기재된 조건 하에 2상 혼합물 (예를 들어, 발효 브로스 및 카르복실산)에 존재하는 하나 이상의 효소 (예를 들어, 글루코아밀라제, 리파제, 포스포리파제, 및 라이소포스포리파제)의 안정성 및 활성에 대한 이들 인자 각각의 잠재적인 효과는 종래 기술에 의거하여 예측할 수 없었을 것이다. 각각의 이들 인자가 발효 혼합물 중의 하나 이상의 효소의 불활성화를 초래할 수 있지만, 카르복실산에 의한 생성물 알코올의 에스테르화를 촉매시켜 카르복실산 에스테르를 생성하기 위한 충분한 효소 활성이 발효 동안에 유지되었다. 글루코아밀라제가 또한 발효 브로스와 카르복실산의 2상 발효 혼합물에 존재하는 반응에서, 충분한 효소 활성 (즉, 올리고당을 발효성 당으로 전환시키기 위한)이 또한 유지되었다.Under fermentation conditions used in some of the methods described herein, hydrodynamic shear and gas-liquid and liquid-liquid interfaces are present during fermentation, respectively, and can cause enzyme inactivation. At least one enzyme (eg, glucoamylase, lipase, phospholipase, and lysophospholipase) present in the biphasic mixture (eg, fermentation broth and carboxylic acid) under the conditions described herein upon fermentation. The potential effect of each of these factors on the stability and activity of P would not have been predictable based on the prior art. Each of these factors may result in inactivation of one or more enzymes in the fermentation mixture, but sufficient enzymatic activity was maintained during the fermentation to catalyze the esterification of the product alcohol with carboxylic acid to produce carboxylic acid esters. In the reaction where glucoamylase is also present in the biphasic fermentation mixture of fermentation broth and carboxylic acid, sufficient enzymatic activity (ie for converting oligosaccharides to fermentable sugars) was also maintained.
카르복실산 (28)은 생성물 알코올, 예컨대 부탄올 또는 에탄올로 에스테르화하여 카르복실산의 알코올 에스테르를 생성할 수 있는 임의의 카르복실산일 수 있다. 예를 들어, 일부 실시 형태에서, 카르복실산 (28)은 유리 지방산일 수 있으며, 일부 실시 형태에서, 카르복실산 또는 유리 지방산은 4개 내지 28개의 탄소, 다른 실시 형태에서 4개 내지 22개의 탄소, 다른 실시 형태에서 8개 내지 22개의 탄소, 다른 실시 형태에서 10개 내지 28개의 탄소, 다른 실시 형태에서 7개 내지 22개의 탄소, 다른 실시 형태에서 12개 내지 22개의 탄소, 다른 실시 형태에서 4개 내지 18개의 탄소, 다른 실시 형태에서 12개 내지 22개의 탄소, 및 또 다른 실시 형태에서 12개 18개의 탄소를 갖는다. 일부 실시 형태에서, 카르복실산 (28)은 하나 이상의 하기 지방산이다: 아젤라산, 카프르산, 카프릴산, 피마자유, 코코넛유 (즉, 예를 들어, 라우르산, 미리시트산, 팔미트산, 카프릴산, 카프르산, 스테아르산, 카프로산, 아라키드산, 올레산, 및 리놀레산을 비롯한 자연적으로 발생하는 지방산의 조합으로서), 아이소스테아르산, 라우르산, 아마인유, 미리스트산, 올레산, 팜유, 팔미트산, 팜핵유, 펠라르곤산, 리시놀레산, 세바크산, 대두유, 스테아르산, 톨유, 수지, 및 #12 하이드록시스테아르산. 일부 실시 형태에서, 카르복실산 (28)은 하나 이상의 이염기산이다.Carboxylic acid (28) can be any carboxylic acid that can be esterified with a product alcohol such as butanol or ethanol to produce an alcohol ester of carboxylic acid. For example, in some embodiments,
일부 실시 형태에서, 카르복실산 (28)은 2개 이상의 상이한 지방산의 혼합물일 수 있다. 일부 실시 형태에서, 카르복실산 (28)은 화학적 가수분해 또는 효소 가수분해를 비롯하여 당업계에 공지된 임의의 방법에 의해 아실 글리세라이드의 가수분해로부터 유래된 유리 지방산을 포함한다. 일부 실시 형태에서 상술한 바와 같이, 카르복실산 (28)은 촉매 (42)로서 효소를 오일 글리세라이드의 효소 가수분해에 의해 천연 오일 (26)로부터 유래될 수 있다. 일부 실시 형태에서, 지방산 또는 이들의 혼합물은 불포화 지방산을 포함한다. 불포화 지방산의 존재는 융점을 감소시켜, 핸들링을 위한 이점을 제공한다. 불포화 지방산 중, 즉, 단일 탄소-탄소 이중 결합을 갖는 모노불포화 지방산은 프로세스 고찰을 위해 적절한 열 및 산화 안정성을 떨어뜨리지 않고서 융점과 관련하여 이점을 제공할 수 있다.In some embodiments,
일부 실시 형태에서, 천연 오일 (26)은 수지, 옥수수유, 캐놀라유, 카프릭/카프릴릭 트라이글리세라이드유, 피마자유, 코코넛유, 면실유, 어유, 호호바유, 라드유, 아마인유, 우각유, 오이티시카유, 팜유, 피넛유, 평지씨유, 쌀겨유, 홍화유, 대두유, 해바라기유, 동유, 자트로파유, 호박유, 포도씨유, 및 식물유 블렌드 (또는 고 농도의 상이한 사슬 길이 및 불포화도 (즉, 18:1)로 정제될 수 있는 오일)일 수 있다. 일부 실시 형태에서, 천연 오일 (26)은 예를 들어, 팜유와 대두유의 혼합물과 같은 2개 이상의 천연 오일의 혼합물이다. 일부 실시 형태에서, 천연 오일 (26)은 식물성 오일이다. 일부 실시 형태에서, 식물성 오일은 반드시 그렇지는 않지만, 발효 프로세스에서 사용될 수 있는 바이오매스로부터 유래될 수 있다. 바이오매스는 공급원료 (12)가 얻어지는 동일하거나 상이한 공급원일 수 있다. 따라서, 예를 들어, 일부 실시 형태에서, 오일 (26)은 옥수수로부터 유래될 수 있는 반면에, 공급원료 (12)는 사탕수수일 수 있다. 예를 들어, 일부 실시 형태에서, 오일 (26)은 옥수수로부터 유래될 수 있고, 공급원료 (12)의 바이오매스 공급원도 옥수수이다. 당업자에게 명백한 바와 같이, 오일 (26) 대 공급원료 (12)에 대한 상이한 바이오매스 공급원의 임의의 가능한 조합이 사용될 수 있다. 일부 실시 형태에서, 오일 (26)은 발효 프로세스에 사용되는 바이오매스로부터 유래된다. 따라서, 일부 실시 형태에서, 도 3에 관하여 후술하는 바와 같이, 오일 (26)은 오일 (26')로서 공급원료 (12)로부터 직접 유래된다. 예를 들어, 공급원료 (12)가 옥수수이면, 오일 (26')은 공급원료의 구성 성분인 옥수수유이다.In some embodiments,
임의로, 에탄올 (33)은 발효 용기 (30)에 공급되어, 발효 브로스에 포함될 수 있다. 일부 실시 형태에서, 부탄올 생합성 경로 및/또는 피루베이트 데카르복실라제의 발현 감소 또는 제거를 갖는 재조합 미생물이 미생물 (32)로서 사용되는 경우, 미생물 (32)은 생존 및 성장을 위해 2-탄소 기질, 예를 들어, 에탄올의 보충을 필요로 할 수 있다. 따라서, 일부 실시 형태에서, 에탄올 (33)은 발효 용기 (30)에 공급될 수 있다.Optionally,
그러나, 놀랍게도, 지방산과 같은 카르복실산이 발효 용기에 존재하는 본 발명의 방법에 의해, 재조합 미생물의 활력을 손싱시키지 않고 전형적으로 소정의 재조합 미생물을 위해 공급되는 에탄올 (33)의 양을 감소시킬 수 있음을 알아냈다. 게다가, 본 발명의 방법의 일부 실시 형태에서, 에탄올 보충이 없는 알코올 (예를 들어, 부탄올) 생성률은 에탄올 (33)이 보충되는 경우에 실현될 수 있는 생성률과 필적할 수 있다. 하기 실시예 1 내지 14에 나타내는 비교예에 의해 추가로 입증되는 바와 같이, 지방산이지만 에탄올이 아닌 것이 발효 용기 내에 있는 경우의 부탄올 생성률은 지방산도 아니고 에탄올도 아닌 것이 발효 용기에 있는 경우의 부탄올 생성률에 필적하거나 그것보다 클 수 있다. 따라서, 일부 실시 형태에서, 에탄올 (33)의 보충량은 통상적인 프로세스와 비교하여 감소된다. 예를 들어, 2-탄소 기질의 보충을 필요로 하는 미생물을 위해 발효 용기에 첨가되는 에탄올의 통상적인 양은 약 5 g/L 무수 에탄올 (즉, 발효 배지 리터 당 무수 에탄올 5 g)이다. 일부 실시 형태에서, 발효는 임의의 에탄올 (33)에 의해 보충되지 않는다. 후자의 경우에는, 에탄올 (33)의 스트림은 완전히 발효 용기로부터 제외된다. 따라서, 본 발명의 일부 실시 형태에서, 보충의 에탄올 (33)과 관련된 비용, 및 생존 및 성장을 위해 2-탄소 기질의 보충을 필요로 할 수 있는 미생물을 사용하는 부탄올 발효 또는 다른 알코올 발효 시에 에탄올 (33)의 저장 통 및 상기 에탄올의 발효 용기로의 공급과 관련된 불편을 감소시키거나 제거할 수 있다.Surprisingly, however, the method of the present invention in which carboxylic acids, such as fatty acids, are present in a fermentation vessel, can reduce the amount of
게다가, 에탄올 보충에 관계없이, 일부 실시 형태에서, 본 발명의 방법은 발효 시에 지방산의 존재에 의해 미생물 (32)에 의한 고 글루코스 흡수율을 제공할 수 있다. 지방산은 공급된 오일 (26)로부터 가수분해되고/되거나 슬러리 (16)의 구성 성분 바이오매스 오일의 가수분해로부터 유래된 카르복실산 (28)으로서 발효 용기 (30)로 도입될 수 있다. 유리 지방산이 프로세스의 한 단계에서 생성되고, 미생물 성장 속도 및 글루코스 소모를 향상시키기 위해 발효 용기 중의 미생물 배양물과 접촉되는, 발효 프로세스로부터 생성물 알코올을 생성하는 방법은 그 전체 내용이 본 명세서에 참조로 포함되는, 동시 계류 중인, 2010년 7월 28일자로 출원된 공동 소유된 미국 가출원 제61/368,451호에 기재되어 있다.In addition, regardless of ethanol replenishment, in some embodiments, the methods of the present invention may provide high glucose uptake by
발효 용기 (30)에서, 미생물 (32)에 의해 생성된 알코올은 촉매 (42)를 사용하여 카르복실산 (28)으로 에스테르화하여 알코올 에스테르를 생성한다. 예를 들어, 부탄올 생산의 경우에는, 미생물 (32)에 의해 생성된 부탄올은 촉매 (42)를 사용하여 카르복실산 (28)으로 에스테르화하여 부틸 에스테르를 생성한다. 원위치에서의 생성물 제거 (ISPR)는 발효 브로스로부터 알코올 에스테르를 제거할 수 있다. 본 명세서에서 입증된 바와 같이, ISPR과 함께 에스테르를 형성하기 위해 촉매를 사용함으로써, 발효 성능을 향상시킬 수 있다. 일부 실시 형태에서, ISPR (예를 들어, 액체-액체 추출)과 함께 에스테르를 형성하기 위해 촉매를 사용함으로써, 에스테르를 생성하는 촉매없이 ISPR을 이용한 유사 발효의 유효 역가와 비교하여, 유효 역가를 적어도 약 10%, 적어도 약 20%, 적어도 약 30%, 적어도 약 40%, 적어도 약 50%, 적어도 약 60%, 적어도 약 70%, 적어도 약 80%, 적어도 약 90%, 또는 적어도 약 100% 증가시킬 수 있다. 유사하게는, 일부 실시 형태에서, ISPR (예를 들어, 액체-액체 추출)과 함께 에스테르를 형성하기 위해 촉매를 사용함으로써, 에스테르를 생성하는 촉매없이 ISPR을 이용한 유사 발효 (예를 들어, 실시예 9 및 11 내지 14, 표 3 참조)의 유효율과 비교하여, 유효율율 적어도 약 10%, 적어도 약 20%, 적어도 약 30%, 적어도 약 40%, 적어도 약 50%, 적어도 약 60%, 적어도 약 70%, 적어도 약 80%, 적어도 약 90%, 또는 적어도 약 100% 증가시킬 수 있다. 일부 실시 형태에서, 유효 수율은 적어도 약 10%, 적어도 약 20%, 적어도 약 30%, 적어도 약 40%, 또는 적어도 약 50% 증가된다. 일부 실시 형태에서, 알코올 에스테르화 후의 생성된 발효 브로스는 유리 (즉, 비에스테르화) 알코올을 포함할 수 있으며, 일부 실시 형태에서, 알코올 에스테르화 후의 발효 브로스 중의 유리 알코올의 농도는 생성물 알코올이 부탄올인 경우에 1, 3, 6, 10, 15, 20, 25, 30 25, 40, 45, 50, 55, 또는 60 g/L 이하이거나, 생성물 알코올이 에탄올인 경우에, 알코올 에스테르화 후의 발효 브로스 중의 유리 알코올의 농도는 15, 20, 25, 30 25, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 또는 100 g/L 이하이다. 일부 실시 형태에서, 발효 용기 중의 알코올 에스테르 대 알코올의 비는 약 1:1일 수 있다. 일부 실시 형태에서, 유효 역가가 적어도 약 20%, 적어도 약 30%, 적어도 약 40%, 적어도 약 50%, 적어도 약 60%, 적어도 약 70%, 적어도 약 80%, 또는 적어도 약 90%인 알코올은 알코올 에스테르로 전환된다.In the
일부 실시 형태에서, 적어도 약 50 g/L, 적어도 약 75 g/L, 또는 적어도 약 100 g/L의 최종 유효 역가를 달성하기 위한 충분한 농도에서의 물에 대한 그레인 로드 (grain load)는 부탄올과 같은 알코올을 생성할 수 있는 미생물을 포함하는 그레인 매시 발효에 사용될 수 있다. 다른 실시 형태에서, 그레인 매시 발효는 동시 당화 발효 (SSF)를 이용할 수 있고, 글루코스의 농도는 발효 동안에 발효 브로스 상에서 예를 들어, 적어도 약 75 g/L 글루코스로 비교적 낮게 유지될 수 있다.In some embodiments, the grain load for water at a sufficient concentration to achieve a final effective titer of at least about 50 g / L, at least about 75 g / L, or at least about 100 g / L is butanol and It can be used for grain mash fermentation, including microorganisms that can produce the same alcohol. In another embodiment, the grain mash fermentation can utilize simultaneous saccharification fermentation (SSF) and the concentration of glucose can be kept relatively low, eg, at least about 75 g / L glucose, on the fermentation broth during fermentation.
일부 실시 형태에서, 지방산은 발효 용기 부피의 약 70% 미만, 발효 용기 부피의 약 50% 미만, 또는 발효 용기 부피의 약 30% 미만인 양으로 발효 용기에 첨가될 수 있다. 발효 용기에 첨가되는 지방산의 양은 발효 시에 부탄올의 수성상 역가를 유지하기 위한 수단일 수 있다. 다른 실시 형태에서, 부탄올의 수성상 역가는 약 35 g/L (발효 브로스) 미만, 약 25 g/L (발효 브로스) 미만, 또는 약 20 g/L (발효 브로스) 미만의 레벨로 유지될 수 있다. 다른 실시 형태에서, 발효 브로스 중의 활성 에스테르화 효소의 양은 약 100 ppm 활성 효소 미만, 약 50 ppm 활성 효소 미만, 또는 약 10 ppm 활성 효소 미만일 수 있다. 일부 실시 형태에서, 발효 브로스에 사용되는 세포량 (cell mass)은 약 50 g dcw/L 미만, 약 20 g dcw/L 미만, 또는 약 10 g dcw/L 미만일 수 있다. 다른 실시 형태에서, 발효 프로세스는 적어도 약 30 시간 내지 적어도 약 100 시간, 적어도 약 40 시간 내지 적어도 약 80 시간, 또는 적어도 약 50 시간 내지 적어도 약 70 시간 행해질 수 있다.In some embodiments, the fatty acid may be added to the fermentation vessel in an amount that is less than about 70% of the fermentation vessel volume, less than about 50% of the fermentation vessel volume, or less than about 30% of the fermentation vessel volume. The amount of fatty acid added to the fermentation vessel may be a means for maintaining the aqueous phase titer of butanol upon fermentation. In another embodiment, the aqueous phase titer of butanol may be maintained at a level of less than about 35 g / L (fermentation broth), less than about 25 g / L (fermentation broth), or less than about 20 g / L (fermentation broth). have. In other embodiments, the amount of active esterase in the fermentation broth may be less than about 100 ppm active enzyme, less than about 50 ppm active enzyme, or less than about 10 ppm active enzyme. In some embodiments, the cell mass used in the fermentation broth may be less than about 50 g dcw / L, less than about 20 g dcw / L, or less than about 10 g dcw / L. In another embodiment, the fermentation process may be performed for at least about 30 hours to at least about 100 hours, at least about 40 hours to at least about 80 hours, or at least about 50 hours to at least about 70 hours.
일부 실시 형태에서, 발효 브로스 상 리터 당 적어도 약 30 g의 부탄올, 발효 브로스 상 리터 당 적어도 약 45 g의 부탄올, 또는 발효 브로스 상 리터 당 적어도 약 60 g의 부탄올의 최종 유효 역가를 달성하기 위한 충분한 농도에서의 물에 대한 브릭스는 부탄올을 생성할 수 있는 미생물을 포함하는 사탕수수 발효에 사용될 수 있다. 일부 실시 형태에서, 지방산은 발효 용기 부피의 약 70% 미만, 발효 용기 부피의 약 50% 미만, 또는 발효 용기 부피의 약 30% 미만인 양으로 발효 용기에 첨가될 수 있다. 발효 용기에 첨가되는 지방산의 양은 발효 시에 부탄올의 수성상 역가를 유지하기 위한 수단일 수 있다. 다른 실시 형태에서, 부탄올의 수성상 역가는 약 35 g/L (발효 브로스) 미만, 약 25 g/L (발효 브로스) 미만, 또는 약 15 g/L (발효 브로스) 미만의 레벨로 유지될 수 있다. 다른 실시 형태에서, 발효 브로스 중의 활성 에스테르화 효소의 양은 약 200 ppm 활성 효소 미만, 약 100 ppm 활성 효소 미만, 또는 약 20 ppm 활성 효소 미만일 수 있다. 일부 실시 형태에서, 발효 브로스에 사용되는 세포량은 초기에 발효 용기 부피의 적어도 약 30%를 차지하는 초기 주입량 중의 브로스 리터 당 적어도 약 100 g의 세포일 수 있다. 발효 3 내지 7 시간 후에, 세포량은 사탕수수 공급물의 첨가에 의해 발효 브로스 리터 당 적어도 약 25 g의 세포로 희석될 수 있다. 세포는 8 내지 15 시간의 총 발효 시간에 걸쳐서 발효 브로스 리터 당 적어도 약 30 g의 세포로 계속해서 성장될 수 있다.In some embodiments, sufficient to achieve a final effective titer of at least about 30 g butanol per liter of fermentation broth, at least about 45 g butanol per liter of fermentation broth, or at least about 60 g butanol per liter of fermentation broth. Briggs against water at concentrations can be used for sugar cane fermentation, including microorganisms that can produce butanol. In some embodiments, the fatty acid may be added to the fermentation vessel in an amount that is less than about 70% of the fermentation vessel volume, less than about 50% of the fermentation vessel volume, or less than about 30% of the fermentation vessel volume. The amount of fatty acid added to the fermentation vessel may be a means for maintaining the aqueous phase titer of butanol upon fermentation. In another embodiment, the aqueous phase titer of butanol may be maintained at a level of less than about 35 g / L (fermentation broth), less than about 25 g / L (fermentation broth), or less than about 15 g / L (fermentation broth). have. In another embodiment, the amount of active esterase in the fermentation broth may be less than about 200 ppm active enzyme, less than about 100 ppm active enzyme, or less than about 20 ppm active enzyme. In some embodiments, the cell volume used for the fermentation broth may be at least about 100 g of cells per liter of broth in the initial infusion amount that initially accounts for at least about 30% of the fermentation vessel volume. After 3-7 hours of fermentation, the cell mass can be diluted to at least about 25 g of cells per liter of fermentation broth by addition of sugarcane feed. The cells may continue to grow to at least about 30 g of cells per liter of fermentation broth over a total fermentation time of 8 to 15 hours.
일부 실시 형태에서, 발효 브로스는 발효 시에 추출제와 접촉하여, 수성상 및 유기상을 포함하는 2상 혼합물을 생성한다. 이러한 실시 형태에서, 액체-액체 추출을 비롯한 ISPR이 편리하게 행해질 수 있다. 액체-액체 추출은 그 전체 내용이 본 명세서에 포함되는 미국 특허 출원 공개 제2009/0305370호에 기재된 프로세스에 따라 행해질 수 있다. 미국 특허 출원 공개 제2009/0305370호는 발효 브로스를 수불혼화성 추출제와 접촉시켜 수성상 및 유기상을 포함하는 2상 혼합물을 생성시키는 단계를 포함하는, 액체-액체 추출을 이용하여 발효 브로스로부터 부탄올을 생성시키고 회수하는 방법을 기술하고 있다. 전형적으로, 추출제는 포화, 모노불포화, 폴리불포화 (및 이들의 혼합물) C12 내지 C22 지방 알코올, C12 내지 C22 지방산, C12 내지 C22 지방산의 에스테르, C12 내지 C22 지방 알데히드, C12 내지 C22 지방 아미드, 및 이들의 혼합물로 구성되는 그룹 중에서 선택되는 유기 추출제일 수 있다. 추출제는 또한 포화, 모노불포화, 폴리불포화 (및 이들의 혼합물) C4 내지 C22 지방 알코올, C4 내지 C28 지방산, C4 내지 C28 지방산의 에스테르, C4 내지 C22 지방 알데히드, 및 이들의 혼합물로 구성되는 그룹 중에서 선택되는 유기 추출제일 수 있다. 본 명세서에 기재된 프로세스에 사용하기 위한 ISPR용 추출제(들)는 카르복실산 (28)과 알코올 추출제의 촉매적 에스테르화에 의한 발효 용기 (30) 중의 카르복실산 (28)의 소모를 피하여, 생성물 알코올과의 에스테르화에 카르복실산이 덜 사용되도록, 전형적으로 무알코올 추출제이다. 예를 들어, 올레일 알코올이 ISPR 추출제로서 사용되면, 카르복실산의 올레일 알코올 에스테르는 하기 실시예 24에서 추가로 입증되는 바와 같이, 활성 촉매 (42)의 존재로 인해 발효 용기에서 생성될 수 있다.In some embodiments, the fermentation broth is contacted with the extractant during fermentation to produce a biphasic mixture comprising an aqueous phase and an organic phase. In such embodiments, ISPR, including liquid-liquid extraction, can be done conveniently. Liquid-liquid extraction can be performed according to the process described in US Patent Application Publication No. 2009/0305370, which is incorporated herein in its entirety. US Patent Application Publication 2009/0305370 discloses a butanol from fermentation broth using liquid-liquid extraction, comprising contacting the fermentation broth with a water immiscible extractant to produce a biphasic mixture comprising an aqueous phase and an organic phase. It describes how to generate and recover. Typically, the extractant is saturated, monounsaturated, polyunsaturated (and mixtures thereof) C 12 to C 22 fatty alcohols, C 12 to C 22 fatty acid, C acid ester, of 12 to C 22 fatty acids, C 12 to C 22 fat aldehyde , C 12 to C 22 fatty amides, and mixtures thereof. Extractants are also saturated, monounsaturated, polyunsaturated (and mixtures thereof) C 4 to C 22 fatty alcohols, C 4 to C 28 fatty acids, esters of C 4 to C 28 fatty acids, C 4 to C 22 fatty aldehydes, and Organic extractant selected from the group consisting of mixtures thereof. Extractor (s) for ISPR for use in the processes described herein avoids the consumption of
도 1의 실시 형태에 관해서는, 카르복실산 (28)은 또한 ISPR 추출제 (28) 또는 이의 성분으로서 작용할 수 있다. 상술한 바와 같이, 카르복실산 (28)은 공급될 수 있고/있거나, 천연 오일 (26)이 발효 용기 (30)에 공급되는 경우에 원위치에서 생성될 수 있고/있거나, 공급원료 (16)가 가수분해될 수 있는 오일을 포함하는 경우에 원위치에서 생성될 수 있다. 일부 실시 형태에서, ISPR 추출제 (28)는 유리 지방산을 포함한다. 일부 실시 형태에서, ISPR 추출제 (28)는 옥수수유 지방산 (COFA)을 포함한다. 일부 실시 형태에서, 오일 (26)은 옥수수유이므로, ISPR 추출제 (28)는 COFA이다. ISPR 추출제 (카르복실산) (28)는 발효 브로스와 접촉시켜, 수성상 (34) 및 유기상을 포함하는 2상 혼합물을 생성시킨다. 발효 용기에 생성된 생성물 알코올 에스테르는 우선적으로 유기상으로 분배되어, 에스테르 함유 유기상 (36)을 생성시킨다. 즉, 생성물 알코올 에스테르는 수성상 (34)에 존재하는 알코올 에스테르의 평형 농도를 초과하는 농도로 생성되므로, 우선적으로 유기상에 분배된다. 발효 브로스 중의 임의의 유리 생성물 알코올은 또한 우선적으로 에스테르 함유 유기상으로 분배된다. 2상 혼합물은 스트림 (39)으로서 발효 용기 (30)로부터 제거되어, 용기 (35)로 도입될 수 있으며, 여기서 에스테르 함유 유기상 (36)이 수성상 (34)으로부터 분리된다. 2상 혼합물 (39)의 에스테르 함유 유기상 (36) 및 수성상 (34)으로의 분리는 사이퍼닝 (siphoning), 흡인, 디캔테이션, 중력 침강조를 이용한 원심분리, 막을 이용한 분상 (membrane-assisted phase splitting), 하이드로사이클론 등을 포함하나 이에 한정되지 않는 당업계에 공지된 임의의 방법을 사용하여 달성될 수 있다. 수성상 (34) 전체 또는 그 일부는 발효 배지 (도시됨)로서 발효 용기 (30)로 재순환되거나, 아니면 폐기되어 신선한 배지로 교체되거나, 임의의 잔류 생성물 알코올의 제거를 위해 처리된 후에 발효 용기 (30)로 재순환될 수 있다.With regard to the embodiment of FIG. 1,
도 1에 관해서는, 에스테르 함유 유기상 (36)은 용기 (50)로 도입되며, 여기서 알코올 에스테르가 하나 이상의 물질 (52)과 반응하여 생성물 알코올 (54)이 회수된다. 생성물 알코올 (54)은 알코올 에스테르로부터 알코올을 얻기 위해 당업계에 공지된 임의의 방법을 사용하여 회수될 수 있다. 예를 들어, 일부 실시 형태에서, 생성물 알코올은 알코올 에스테르로부터 염기와의 가수분해, 이어서 산성화에 의해 회수될 수 있다. 다른 실시 형태에서, 생성물 알코올 에스테르는 물질 (52)로서 가수분해 촉매의 존재 하에 물에 의해 가수분해될 수 있다. 예를 들어, 일부 실시 형태에서, 생성물 알코올 에스테르의 알코올 및 카르복실산 (28) (예를 들어, 카르복실산 (28)이 지방산인 경우에는 지방산)으로의 가수분해는 물질 (52)로서 리파제, 수용성 산, 무기산, 유기산, 또는 고체산 촉매를 사용하여 달성될 수 있다. 예를 들어, 황산은 알코올 에스테르 가수분해를 위한 무기산 촉매로서 사용될 수 있다. 일부의 적절한 가수분해 촉매는 리파제 효소; 에스테라제 효소; 무기 강산, 예컨대 황산, 염산, 또는 인산; 유기 강산, 예컨대 톨루엔설폰산 또는 나프탈렌설폰산; 또는 고체산 촉매, 예컨대 앰버리스트 (Amberlyst)? 설폰화 폴리스티렌 수지, 또는 제올라이트이다. 일부 실시 형태에서, 알코올 에스테르의 가수분해는 물질 (52)로서 스팀을 사용하여 온도를 증가시키고/시키거나 압력을 가해 달성될 수 있다. 일부 실시 형태에서, 알코올 에스테르의 가수분해는 칼럼, 예를 들어 반응 증류탑에서 행해질 수 있다. 실시예 45 내지 54 및 56 내지 58은 알코올 에스테르로부터 생성물 알코올을 회수하는 몇 가지 방법을 입증한다. 일부 실시 형태에서, 부생성물 (56)은 생성물 알코올 (54)의 회수로부터 얻어진다. 부생성물 (56)은 알코올 에스테르의 가수분해로부터 회수될 수 있는 카르복실산 (28)을 포함하지 않는다.With regard to FIG. 1, ester containing
일부 실시 형태에서, 에스테르 함유 유기상 (36)에 존재하는 지방산의 알코올 에스테르의 생성물 알코올 및 유리 지방산으로의 가수분해는 약 10:1 내지 약 1:10의 지방산 대 물의 비로 일어나거나, 다른 실시 형태에서, 약 100:1 내지 약 1:100의 지방산 대 물의 비로 일어난다. 일부 실시 형태에서, 지방산의 알코올 에스테르는 약 100℃ 미만의 온도에서 물로 가수분해된다. 일부 실시 형태에서, 가수분해는 100℃ 초과, 150℃ 초과, 200℃ 초과, 또는 250℃ 초과의 온도에서 일어난다.In some embodiments, the hydrolysis of the fatty acid present in the ester containing
예를 들어, 일부 실시 형태에서, 알코올 에스테르는 에스테르 교환되어 생성물 알코올 (54)을 생성할 수 있으며, 일부 실시 형태에서, 제 2 알코올 에스테르 (56), 예를 들어, 지방산 알킬 에스테르는 또한 부생성물 (56)로서 생성될 수 있다. 이러한 에스테르 교환을 달성하기 위해, 알코올 에스테르는 알코올 에스테르를 에스테르 교환할 수 있는 촉매와 접촉하여 부탄올을 방출할 수 있다. 일부 실시 형태에서, 알코올 에스테르는 글리세롤을 사용하여 에스테르 교환하여, 생성물 알코올 (54) 및 부생성물 (56)로서의 아실 글리세라이드를 생성할 수 있다. 생성된 아실 글리세라이드는 모노- 및 다이아실글리세라이드를 포함할 수 있다. 에스테르 교환 반응을 위한 몇몇의 적절한 촉매는 예를 들어, 리파제 효소, 특히 제 2 알코올의 알콕사이드 염, 알킬 티타네이트, 가용성 무기산, 예컨대 황산 및 인산, 가용성 유기산, 예컨대 톨루엔설폰산 및 나프탈렌설폰산, 및 고체산, 예컨대 앰버리스트? 설폰화 폴리스티렌 수지, 또는 제올라이트이다. 에스테르 교환 또는 가수분해를 위한 적절한 리파제는 버크홀데리아 세파시아 (Burkholderia cepacia), 서모마이세스 라누기노사 (Thermomyces lanuginosa), 또는 칸디다 안타르크티카 (Candida antarctica)로부터 유래된 리파제를 포함하나 이에 한정되지 않는다. 일부 실시 형태에서, 리파제는 당업자에게 잘 알려진 방법을 사용하여 가용성 또는 불용성 지지체에 고정화된다 (예를 들어, Immobilization of Enzymes and Cells; Gordon F. Bickerstaff, Editor; Humana Press, Totowa, NJ, USA, 1997). 효소 고정화는 1) 공유결합성 담지 (covalent support), 물리 흡착, 정전기 결합, 또는 친화성 결합을 통한 효소의 다공성 또는 비다공성 담체 지지체에 대한 결합; 2) 이작용성 또는 다작용성 시약과의 가교 결합; 3) 겔 매트릭스, 폴리머, 에멀젼, 또는 임의의 형태의 막에서의 봉입 (entrapment); 및 4) 임의의 이들 방법의 조합을 비롯한 다양한 기술을 사용하여 행해질 수 있다. 다른 실시 형태에서, 리파제는 고정화될 수 없다. 일부 실시 형태에서, 리파제는 가용성을 나타낸다. 지방산 알킬 에스테르 (56)는 예를 들어, 지방산 메틸 에스테르를 포함할 수 있다. 다른 지방산 알킬 에스테르 (56)는 예를 들어, C2 내지 C12 직쇄상, 분지상, 및 환상 알코올 에스테르를 포함할 수 있다. 그 다음에, 생성물 알코올 (54)은 예를 들어, 증류와 같은 당업계에 공지된 임의의 분리 수단을 사용하여 부생성물 (56)을 포함하는 반응 혼합물로부터 분리될 수 있다. 다른 적절한 분리 메카니즘은 예를 들어, 추출 및 막 분리를 포함할 수 있다.For example, in some embodiments, the alcohol ester may be transesterified to produce the
일부 실시 형태에서, 적어도 약 5%, 적어도 약 10%, 적어도 약 20%, 적어도 약 30%, 적어도 약 40%, 적어도 약 50%, 적어도 약 60%, 적어도 약 70%, 적어도 약 80%, 적어도 약 90%, 또는 적어도 약 99%의 생성물 알코올이 알코올 에스테르로부터 회수된다.In some embodiments, at least about 5%, at least about 10%, at least about 20%, at least about 30%, at least about 40%, at least about 50%, at least about 60%, at least about 70%, at least about 80%, At least about 90%, or at least about 99% of product alcohol is recovered from the alcohol ester.
ISPR 추출제 (카르복실산) (28)는 생성물 알코올 (54)의 회수를 위한 알코올 에스테르의 반응 전에 알코올 에스테르로부터 분리될 수 있다. 대안적으로, ISPR 추출제 (28)는 알코올 에스테르의 반응 후에 생성물 알코올 및 임의의 부생성물로부터 분리될 수 있다. 그 다음에 생성된 회수된 지방이 없는 (lean) 추출제 (27)는 알코올 에스테르의 추가 생성 및/또는 추출을 위해 통상 신선한 보급 (make-up) 추출제 (28) (공급된다면, 오일 (26)로부터 유래될 수 있음)와 조합하여, 다시 발효 용기 (30)로 재순환될 수 있다. 대안적으로, 신선한 추출제 (28) (또는 오일 (26))는 2상 혼합물 스트림 (39)에서 제거된 추출제를 대체하도록 발효 용기에 연속적으로 첨가될 수 있다.ISPR extractant (carboxylic acid) 28 may be separated from the alcohol ester prior to reaction of the alcohol ester for the recovery of
일부 실시 형태에서, 촉매 (42)는 2상 혼합물 (39)로부터 회수되어, 생성물 알코올의 발효 자체 또는 회수에서와 같은 발효 프로세스의 한 단계에서 재사용될 수 있다.In some embodiments, the
일부 실시 형태에서, 하나 이상의 추가의 ISPR 추출제 (29) (도 2 참조)는 발효 용기 (30)에 도입되어 수성상 및 유기상을 포함하는 2상 혼합물을 생성시킬 수 있다. 이러한 실시 형태에서, ISPR 추출제 (29)는 외인성 유기 추출제, 예컨대 올레일 알코올, 베헤닐 알코올, 세틸 알코올, 라우릴 알코올, 미리스틸 알코올, 스테아릴 알코올, 1-운데칸올, 올레산, 라우르산, 미리스트산, 스테아르산, 메틸 미리스테이트, 메틸 올레에이트, 운데칸알, 라우릭 알데히드, 20-메틸운데칸알, 및 이들의 혼합물일 수 있다. 그러나, 상술한 이유로, ISPR 추출제 (29)는 바람직하게는 알코올이 아니다. 대신에, ISPR 추출제 (29)는 바람직하게는 카르복실산 (예를 들어, 유리 지방산)이다. 일부 실시 형태에서, ISPR 추출제 (29)는 COFA이다. 일부 실시 형태에서, ISPR 추출제 (29)는 아마인유 지방산, 대두유 지방산, 자트로파유 지방산, 또는 팜유, 피마자유, 올리브유, 코코넛유, 피넛유, 또는 임의의 종자유로부터 유래된 지방산이다. 일부 실시 형태에서, ISPR 추출제 (29)는 예를 들어, 본 명세서에 참조로 포함되는, 동시 계류 중인, 2010년 7월 28일자로 출원된 공동 소유된 미국 가출원 제61/368,436호에 기재된 바이오매스 지질과 같은 천연 오일의 화학적 전환으로부터 얻어진, 지방산, 지방 알코올, 지방 아미드, 지방 에스테르 (특히 알코올 부분에 1개 내지 8개의 탄소 원자를 포함하는 것, 예를 들어, 지방산 메틸 에스테르 및 지방산의 저급 알코올 에스테르), 지방산 글리콜 에스테르, 하이드록실화 트라이글리세라이드, 및 이들의 혼합물로 구성되는 그룹 중에서 선택되는 지방산 추출제일 수 있다. 일부 실시 형태에서, ISPR 추출제 (29)는 바이오매스 지질의 화학적 가수분해에 의해 얻어지는 유리 지방산이다. 일부 실시 형태에서, ISPR 추출제 (29)는 예를 들어, 본 명세서에 참조로 포함되는, 동시 계류 중인, 2010년 7월 28일자로 출원된 공동 소유된 미국 가출원 제61/368,444호에 기재된 바이오매스 지질과 같은 천연 오일의 효소 가수분해로부터 생성되는 유리 지방산일 수 있다.In some embodiments, one or more additional ISPR extractors 29 (see FIG. 2) may be introduced into
원위치에서의 생성물 제거는 발효 용기 (30)에서 배취 모드 또는 연속 모드로 행해질 수 있다. 원위치에서의 생성물 제거의 연속 모드에서, 생성물은 용기 (또는 반응기)로부터 연속적으로 제거된다. 원위치에서의 생성물 제거의 배취 모드에서, 다량의 유기 추출제가 발효 용기에 첨가되며, 추출제가 프로세스 동안에 제거되지 않는다. 원위치에서의 생성물 제거를 위해, 유기 추출제는 2상 발효 배지를 형성시키는 발효 개시 시에 발효 배지와 접촉할 수 있다. 대안적으로, 유기 추출제는 배양물의 광학 밀도를 측정함으로써 결정될 수 있는 원하는 양의 성장을 미생물이 달성한 후에 발효 배지와 접촉할 수 있다. 또한, 유기 추출제는 발효 배지 중의 생성물 알코올 레벨이 사전 선택된 레벨에 도달할 때에 발효 배지와 접촉할 수 있다. 본 발명의 일부 실시 형태에 따른 부탄올 생산의 경우에, 부탄올 농도가 독성 레벨에 도달하기 전의 시점에, 카르복실산 추출제는 발효 배지와 접촉하여, 부탄올을 카르복실산으로 에스테르화시켜, 부틸 에스테르를 생성시킬 수 있으며, 일부 실시 형태에서, 수성상 및 부틸 에스테르를 포함하는 유기상을 포함하는 2상 혼합물을 생성시킬 수 있다. 따라서, 부탄올의 농도는 발효 용기에서 감소되며, 그 결과, 미생물에 대한 부탄올의 독성 효과를 최소화한다. 그 후에 에스테르 함유 유기상은 부틸 에스테르의 원하는 유효 역가가 달성된 후에 발효 용기로부터 제거될 수 있다 (그리고 수성상을 구성하는 발효 브로스로부터 분리될 수 있음). 예를 들어, 일부 실시 형태에서, 에스테르 함유 유기상은 부틸 에스테르의 유효 역가가 약 10 g/㎏ 발효 브로스 초과가 된 후에, 발효 브로스로부터 분리될 수 있다. 다른 실시 형태에서, 에스테르 함유 유기상은 부틸 에스테르의 유효 역가가 약 230 g/㎏ (발효 브로스) 초과, 약 300 g/㎏ (발효 브로스) 초과, 약 400 g/㎏ (발효 브로스) 초과, 약 500 g/㎏ (발효 브로스) 초과, 또는 약 600 g/㎏ (발효 브로스) 초과가 된 후에, 발효 배지로부터 분리될 수 있다. 다른 실시 형태에서, 에스테르 함유 유기상은 COFA의 전환율 (%)이 적어도 약 10%, 적어도 약 25%, 적어도 약 50%, 적어도 약 75%, 또는 적어도 약 100%가 된 후에 발효 배지로부터 분리될 수 있다. 일부 실시 형태에서, 에스테르 함유 유기상은 발효 용기 중의 이용가능한 발효성 당의 발효가 실질적으로 완료된 후에, 수성상으로부터 분리된다.Product removal in situ may be done in batch mode or continuous mode in
도 1에 나타낸 실시 형태에서, 알코올 에스테르는 분리된 용기 (35)에서 일어나는 2상 혼합물 (39)의 분리와 함께, 원위치에서 발효 브로스로부터 추출된다. 일부 실시 형태에서, 2상 혼합물의 분리는 에스테르 함유 유기상 스트림 (36)이 발효 용기 (30)로부터 직접 빠져 나오는 후술되는 도 3 및 4의 실시 형태에 도시되는 바와 같이, 발효 용기에서 일어날 수 있다. 수성상 스트림 (34)은 또한 발효 용기 (30)로부터 직접 빠져 나오고, 임의의 잔류 알코올 에스테르 또는 생성물 알코올의 제거를 위해 처리되어 재순환되거나, 폐기되어 신선한 발효 배지로 교체될 수 있다. 유기 추출제에 의한 알코올 에스테르 및 생성물 알코올의 추출은 발효 브로스로부터의 미생물 (32)의 제거 유무에 관게없이 행해질 수 있다. 미생물 (32)은 여과 또는 원심분리를 포함하나 이에 한정되지 않는 당업계에 공지된 수단에 의해 발효 브로스로부터 제거될 수 있다. 예를 들어, 수성상 스트림 (34)은 효모와 같은 미생물 (32)을 포함할 수 있다. 미생물 (32)은 예를 들어, 원심분리기 (도시되지 않음)에서 수성상 스트림으로부터 용이하게 분리될 수 있다. 그 다음에, 미생물 (32)은 발효 용기 (30)로 재순환될 수 있으며, 시간 경과에 따라 알코올 생산의 생성률을 증가시켜, 알코올 생성 효율을 증가시킬 수 있다.In the embodiment shown in FIG. 1, the alcohol ester is extracted from the fermentation broth in situ, with the separation of the
일부 실시 형태에서, 도 1의 시스템 및 프로세스는 당업자에게 명백한 바와 같이, 발효 용기 (30)에서의 동시 당화 발효가 발효 용기 (30)에 앞서 분리된 당화 용기 (60)로 교체되도록 변경될 수 있다 (예를 들어, 도 4의 실시 형태 참조).In some embodiments, the system and process of FIG. 1 can be modified such that simultaneous saccharification fermentation in
또 다른 실시 형태에서, 예를 들어 도 2의 실시 형태에서, 천연 오일 (26) (발효 용기 (30)로 직접 공급되는 대신에)은 촉매 (42)가 또한 공급되는 용기 (40)로 공급되어, 오일 (26) 중의 적어도 일부의 아실 글리세라이드가 가수분해되어 카르복실산 (28)을 생성시킨다. 그 다음에, 카르복실산 (28) 및 촉매 (42)를 포함하는 용기 (40)로부터의 생성물 스트림은 발효 용기 (30)에 도입된다. 카르복실산 (28) 및 촉매 (42)는 도 1에 관하여 상술한 바와 동일한 방법으로, 발효 배지에 생성된 생성물 알코올과 접촉하여, 생성물 알코올의 알코올 에스테르가 카르복실산과 생성물 알코올의 촉매화된 에스테르화로 원위치에 생성된다. 카르복실산 (28)은 또한 ISPR 추출제로서 작용할 수 있으며, 일부 실시 형태에서, 충분한 카르복실산 (28) 및/또는 하나 이상의 추가의 ISPR 추출제 (29)는 발효 용기 (30)에 도입되어, 수성상 및 유기상을 포함하는 2상 혼합물을 생성시킬 수 있으며, 알코올 에스테르는 유기상으로 분배된다. 도 2의 실시 형태의 나머지 프로세스 작업은 도 1과 동일하므로, 다시 상세히 설명되지 않을 것이다.In another embodiment, for example in the embodiment of FIG. 2, natural oil 26 (instead of being fed directly into fermentation vessel 30) is fed into
예를 들어, 도 3의 실시 형태에 도시된 바와 같은 본 발명의 일부 실시 형태에서, 촉매 (42)는 공급원료 (12)를 형성하는 바이오매스로부터 유래된 오일 (26')을 포함하는 공급원료 슬러리 (16)에 첨가될 수 있다. 도시된 실시 형태에서, 촉매 (42)는 오일 (26') 중의 글리세라이드를 유리 지방산 (28')으로 가수분해시킬 수 있다. 따라서, 촉매 (42)를 공급원료 슬러리 (16)에 도입한 후에, 오일 (26') 중의 적어도 일부의 글리세라이드가 가수분해되어, 유리 지방산 (28') 및 촉매 (42)를 갖는 공급원료 슬러리 (18)를 생성시킨다. 예를 들어, 공급원료 (12)가 옥수수이면, 오일 (26')은 공급원료의 성분인 옥수수유이고, 유리 지방산 (28')은 옥수수유 지방산 (COFA)이다.For example, in some embodiments of the present invention as shown in the embodiment of FIG. 3, the
공급원료 슬러리 (18)는 알코올 생성 미생물 (32)과 함께 발효 용기 (30)에 도입되어 발효 배지에 포함된다. 일부 실시 형태에서, 글루코아밀라제와 같은 효소 (38)는 또한 발효 용기 (30) 내부에서의 슬러리 (18) 중의 당의 동시 당화 및 알코올의 발효를 위해 발효 용기에 도입될 수 있다. 발효 용기 중의 촉매 (42)의 존재 (슬러리 (18)를 통해 도입됨)는 도 1에 관하여 상술한 바와 동일한 방법으로, 알코올과 유리 지방산 (28') (슬러리 (18)를 통해 도입됨)의 에스테르화를 촉매하여, 원위치에서 지방산 알코올 에스테르를 생성시킨다. 일부 실시 형태에서, 부탄올 생산을 위해, 부탄올 생성 미생물 (32)은 공급원료 슬러리 (18)와 함께 발효 용기 (30)에 도입된다. 발효 용기 중의 촉매 (42) (슬러리 (18)를 통해 도입됨)는 부탄올과 유리 지방산 (28') (슬러리 (18)를 통해 도입됨)의 에스테르화를 촉매하여, 원위치에서 지방산 부틸 에스테르 (FABE)를 생성시킨다. 유리 지방산 (28')은 또한 ISPR 추출제로서 작용할 수 있다. 예를 들어, 유리 지방산 (28')이 COFA이면, COFA의 알코올 에스테르가 원위치에 생성되고, COFA가 ISPR 추출제 또는 그 일부로서 작용한다.The
일부 실시 형태에서, 하나 이상의 추가의 ISPR 추출제 (29)는 수성상으로부터 알코올 에스테르 (및 임의의 유리 알코올)를 우선적으로 분배하기 위해 발효 용기 (30)에 도입될 수 있다. 일부 실시 형태에서, ISPR 추출제 (29)는 도 1 및 2의 실시 형태에 관하여 기재된 카르복실산 (28)일 수 있다. 일부 실시 형태에서, ISPR 추출제 (29)는 오일 (26)로서 발효 용기 (30)에 도입된 다음에, 오일은 ISPR 추출제 (29)가 되도록 촉매 (42)에 의해 지방산으로 가수분해된다. 일부 실시 형태에서, 오일 (26)은 옥수수유이므로, ISPR 추출제 (29)는 COFA이다. 일부 실시 형태에서, ISPR 추출제 (29)는 도 1 및 2의 실시 형태에 관하여 상술한 바와 같이, 지방산, 지방 알코올, 지방 아미드, 지방 에스테르 (특히 알코올 부분에 1개 내지 8개의 탄소 원자를 포함하는 것, 예를 들어, 지방산 메틸 에스테르 및 지방산의 저급 알코올 에스테르), 지방산 글리콜 에스테르, 하이드록실화 트라이글리세라이드, 및 이들의 혼합물로 구성되는 그룹 중에서 선택되는 지방산 추출제일 수 있다. 또 다른 실시 형태에서, ISPR 추출제 (29)는 바이오매스 지질의 화학적 또는 효소 가수분해에 의해 얻어지는 유리 지방산일 수 있다. 이러한 실시 형태에서, 추출제 (29)를 생성하기 위한 바이오매스 지질은 공급원료 (12)가 얻어지는 동일하거나 상이한 바이오매스 공급원의 것일 수 있다. 예를 들어, 일부 실시 형태에서, 추출제 (29)를 생성하기 위한 바이오매스 지질은 대두로부터 유래될 수 있는 반면에, 공급원료 (12)의 바이오매스 공급원은 옥수수이다. 당업자에게 명백한 바와 같이, 추출제 (29) 대 공급원료 (12)에 대한 상이한 바이오매스 공급원의 임의의 가능한 조합이 사용될 수 있다. 도 2의 실시 형태의 나머지 프로세스 작업은 도 1과 동일하므로, 다시 상세히 설명되지 않을 것이다.In some embodiments, one or more additional ISPR extractants 29 may be introduced into
비한정적인 예언적 실시예로서, 도 3의 실시 형태에 관해서는, 명목상 약 4 wt%의 옥수수유를 함유할 수 있는 통옥수수 가루 (공급원료 (12)로서)의 수성 현탁액은 약 85℃ 내지 120℃에서 30분간 내지 2시간 동안 아밀라제 (액화 효소 (14)로서)로 처리되어, 생성된 액화 매시 (16)는 65℃ 내지 30℃로 냉각되고, 지질 중의 이용가능한 지방산 함량의 유리 지방산으로의 전환이 적어도 30% 내지 적어도 99%까지 이르기에 충분한 시간 동안 pH 4.5 내지 7.5 (일부 실시 형태에서, pH 5.5 내지 6.5)에서 리파제 (촉매 (42)로서) 0.1 ppm 내지 10 ppm (일부 실시 형태에서, 0.5 ppm 내지 1.0 ppm)으로 처리될 수 있다. 액화 및 리파제 처리된 매시 (18)는 약 30℃로 냉각되고 (예를 들어, 열교환기를 사용하여), 약 25 wt% 내지 30 wt% 건조 옥수수 고형물로 발효 용기 (30)에 로딩될 수 있다. 글루코아밀라제 (당화 효소 (38)로서)의 첨가에 의한 발효 시의 액화 매시 (18)의 당화로 글루코스를 생성할 수 있다. 생성된 발효 브로스는 리파제 (42)로 처리되지 않은 액화 매시를 사용한 브로스에 존재할 수 있는 옥수수유의 양 (예를 들어, 약 1.2 wt% 옥수수유)보다 훨씬 적게 함유할 수 있다. 특히, 리파제 처리 (42)에 의해, 옥수수유 지질 (26') (트라이글리세라이드 (TG))의 COFA (28') (및 약간의 다이글리세라이드 (DG) 또는 모노글리세라이드 (MG))의 전환을 가져올 수 있으며, COFA ISPR 추출 용매 (28' 또는 29) 중의 지질 (26')의 축적 속도를 감소시킬 수 있다. 리파제 처리 (42)에 의해, 또한 발효 시에 생성된 부탄올의 COFA의 부틸 에스테르로의 전환을 가져올 수 있으며, COFA의 부틸 에스테르는 액체-액체 추출 ISPR 동안에 COFA 상 (36)으로의 용해를 위해 고 분배 계수를 갖는다. 발효 종료 시에, COFA의 부틸 에스테르를 함유하는 COFA 상 (36)은 발효 브로스로부터 분리될 수 있으며 (용기 (30)/(35)에서), 부탄올 (54)은 부탄올 (54) 및 COFA (27)를 생성시키기 위해, 예를 들어, 리파제 (52), 고체산 촉매 (52), 또는 스팀 (52)을 이용하는 에스테르의 가수분해를 포함하나 이에 한정되지 않는 몇 가지 방법 중 한 가지를 이용하여 이러한 유기 혼합물 (36)로부터 회수될 수 있다 (용기 (50)에서).As a non-limiting prophetic example, with respect to the embodiment of FIG. 3, the aqueous suspension of whole cornmeal flour (as feedstock 12), which may nominally contain about 4 wt% of corn oil, is from about 85 ° C. to Treated with amylase (as liquefied enzyme 14) at 120 ° C. for 30 minutes to 2 hours, the resulting liquefied
예를 들어, 도 4의 실시 형태에 도시된 바와 같은 또 다른 실시 형태에서, 도 3의 시스템 및 프로세스는 발효 용기 (30)에서의 동시 당화 발효 (SSF)가 발효 용기 (30)에 우선하여 분리된 당화 용기 (60)로 교체되도록 변경될 수 있다. 효소 (38)를 수용하는 분리된 당화 용기 (60)를 포함하는 것을 제외하고는, 도 4는 도 3과 실질적으로 동일하며, 촉매 (42)는 액화된, 당화된 공급원료 스트림 (62)에 도입된다. 공급원료 슬러리 (16)는 글루코아밀라제와 같은 효소 (38)와 함께 당화 용기 (60)에 도입되어, 슬러리 (16) 중의 올리고당 형태의 당은 단당류로 분해될 수 있다. 액화된, 당화된 공급원료 스트림 (62)은 촉매 (42)가 도입되는 당화 용기 (60)를 빠져 나온다. 공급원료 스트림 (62)은 단당류, 및 공급원료로부터 유래된 오일 (26') 및 불용성 고형물을 포함한다. 오일 (26')은 촉매 (42)의 도입에 의해 가수분해되어, 유리 지방산 (28') 및 촉매 (42)를 갖는 액화된, 당화된 공급원료 슬러리 (64)를 생성한다.For example, in another embodiment as shown in the embodiment of FIG. 4, the system and process of FIG. 3 allows simultaneous glycosylation fermentation (SSF) in the
대안적으로, 일부 실시 형태에서, 촉매 (42)는 도 1의 실시 형태에서 SSF를 위해 발효 용기 (30)로 효소 (38)와 함께 촉매 (42)를 도입한 것과 동일한 방법으로, 당화 효소 (38)와 함께 첨가되어, 동시에 글루코스를 생성시키고 오일 지질 (26')을 유리 지방산 (28')으로 가수분해시킬 수 있다. 효소 (38) 및 촉매 (42)의 첨가는 단계적으로 (예를 들어, 촉매 (42), 그 다음에 효소 (38), 또는 그 반대의 경우) 또는 동시에 될 수 있다. 그러나, SSF 동안에 발효 용기 (30)로의 촉매 (42)의 첨가가 또한 실질적으로 동시에 생성물 알코올을 알코올 에스테르로 전환시키는 도 1의 실시 형태와는 대조적으로, 알코올 에스테르는 촉매 (42)를 함유하는 슬러리 (64)가 발효 용기 (30)로 도입될 때까지 생성되지 않는다. 대안적으로, 일부 실시 형태에서, 슬러리 (62)는 발효 용기 (30)에 도입될 수 있으며, 촉매 (42)는 발효 용기 (30)에 직접 첨가된다.Alternatively, in some embodiments, the
도 4의 실시 형태에서, 슬러리 (64)는 단당류를 대사시켜 생성물 알코올을 생성시키는 알코올 생성 미생물 (32)과 함께 발효 용기 (30)에 도입된다. 발효 용기 중의 촉매 (42)의 존재 (슬러리 (64)를 통해 도입됨)는 도 1에 관하여 상술한 바와 동일한 방법으로, 알코올과 유리 지방산 (28') (슬러리 (62)를 통해 도입됨)의 에스테르화를 촉매하여, 원위치에서 지방산 알코올 에스테르를 생성시킨다. 유리 지방산 (28')은 또한 수성상으로부터 알코올 에스테르 (및 임의의 유리 알코올)를 우선적으로 분배하기 위해 ISPR 추출제로서 작용할 수 있다. 일부 실시 형태에서, 하나 이상의 추가의 ISPR 추출제 (29)는 또한 도 3에 관하여 상술한 바와 같이 발효 용기 (30)로 도입될 수 있다. 도 4의 실시 형태의 나머지 프로세스 작업은 도 3과 동일하므로, 다시 상세히 설명되지 않을 것이다.In the embodiment of FIG. 4,
도 1 내지 4에 관한 임의의 상술한 실시 형태를 비롯하여 일부 실시 형태에서, 불용성 고형물은 발효 용기 (30)로 도입되기 전에 공급원료 슬러리 (16)로부터 제거될 수 있다. 예를 들어, 도 5의 실시 형태에 도시된 바와 같이, 공급원료 슬러리 (16)는 불용성 고형물을 고체상 또는 습윤 케이크 (24)으로서 배출하도록 구성된 분리기 (20)의 인렛으로 도입된다. 예를 들어, 일부 실시 형태에서, 분리기 (20)는 불용성 고형물을 공급원료 슬러리 (16)로부터 분리하기 위해 필터 프레스, 진공 여과, 기계적 가압 여과, 또는 원심분리기 (예를 들어, 디캔터 원심분리기)를 포함할 수 있다. 일부 실시 형태에서, 예를 들어, 디캔터 볼 원심분리기, 트라이캔터 원심분리기, 디스크 스택 원심분리기, 여과 원심분리기, 또는 디캔터 원심분리기를 비롯하여 업계에 사용되는 임의의 통상적인 원심분리기는 불용성 고형물을 분리하는데 사용될 수 있다. 일부 실시 형태에서, 공급원료 슬러리 (16)로부터의 불용성 고형물의 제거는 여과, 진공 여과, 벨트 필터, 가압 여과, 스크린을 이용한 여과, 스크린 분리, 그레이트 또는 그레이팅, 포러스 그레이팅, 플로테이션, 하이드로클론, 필터 프레스, 스크루 프레스, 중력 침강조, 와류형 분리기, 또는 액체로부터 고형물을 분리하는데 사용될 수 있는 임의의 방법에 의해 달성될 수 있다. 임의로, 일부 실시 형태에서, 분리기 (20)는 또한 공급원료 슬러리 (16)에 존재하는 오일 (26') 일부 또는 실질적으로 전체를 제거하도록 구성될 수 있다. 이러한 실시 형태에서, 분리기 (20)는 사이퍼닝, 디캔테이션, 중력 침강조를 이용한 원심분리, 막을 이용한 분상 등을 포함하나 이에 한정되지 않는, 수성 공급 스트림으로부터 오일을 제거하기 위해 당업계에 공지된 임의의 적절한 분리기일 수 있다. 당 및 물을 포함하는 잔류 공급원료는 수성 스트림 (22)으로서 발효 용기 (30)로 배출된다.In some embodiments, including any of the above described embodiments with respect to FIGS. 1-4, insoluble solids may be removed from
예를 들어, 일부 실시 형태에서, 분리기 (20)는 당 및 물을 함유하는 수성층 (즉, 스트림 (22)), 불용성 고형물을 함유하는 고형물층 (즉, 습윤 케이크 (24)), 및 오일층 (즉, 오일 스트림 (26'))을 포함하는 원심분리 생성물을 생성하도록 공급원료 슬러리 (16)를 교반시키거나 회전시키는 트라이캔터 원심분리기 (20)를 포함한다. 이러한 경우에는, 촉매 (42)는 제거된 오일 (26')과 접촉되어 유리 지방산 (28') 및 촉매 (42)의 스트림을 생성할 수 있다. 그 다음에 유리 지방산 (28') 및 촉매 (42)의 스트림은 도 1에 관하여 상술한 바와 동일한 방법으로, 발효 용기 (30)에 도입되어 발효 배지와 접촉되고, 이것에 의해 발효 배지 중의 생성물 알코올의 지방산 알코올 에스테르로의 촉매적 에스테르화가 원위치에서 달성될 수 있다.For example, in some embodiments,
유리 지방산 (28')은 또한 ISPR 추출제 (28')로서 작용할 수 있고, 하나 이상의 추가의 ISPR 추출제 (29)는 또한 발효 용기 (30)로 도입될 수 있다. 따라서, 공급원료 오일 (26')은 카르복실산으로 촉매적 가수분해되어, ISPR 추출제에 존재하는 지질의 양을 감소시키는 한편으로 ISPR 추출제도 생성시킬 수 있다. 에스테르 함유 유기상 (36)은 용기 (35)에서 2상 혼합물 (39)의 수성상 (34)으로부터 분리될 수 있으며, 생성물 알코올은 용기 (50)에서 알코올 에스테르로부터 회수될 수 있다 (도 1 참조). 도 5의 실시 형태의 나머지 프로세스 작업은 도 3과 동일하므로, 다시 상세히 설명되지 않을 것이다.The free fatty acid 28 'may also serve as the ISPR extractor 28' and one or more additional ISPR extractants 29 may also be introduced into the
습윤 케이크 (24)가 원심분리기 (20)를 통해 제거되는 경우, 일부 실시 형태에서, 공급원료가 옥수수인 경우에 옥수수유와 같은 공급원료 (12)로부터의 일부의 오일은 습윤 케이크 (24)에 잔류한다. 습윤 케이크 (24)는 일단 수용액 (22)이 원심분리기 (20)로부터 배출된다면, 원심분리기에서 추가의 물로 세정될 수 있다. 습윤 케이크 (24)의 세정에 의해 습윤 케이크에 존재하는 당 (예를 들어, 올리고당)을 회수할 것이며, 회수된 당 및 물은 액화 용기 (10)로 재순환될 수 있다. 세정 후에, 습윤 케이크 (24)는 가용분과 배합된 다음에, 건조되어, 임의의 적절한 공지된 프로세스를 통해 건조주정박 (DDGS)을 생성할 수 있다. 원심분리기 (20)에서 생성된 습윤 케이크 (24)로부터의 DDGS의 생성은 몇 가지 이점이 있다. 불용성 고형물이 발효 용기에 이르지 않기 때문에, DDGS는 봉입된 추출제 및/또는 생성물 알코올, 예컨대 부탄올을 가지지 않으며, 발효 용기의 조건에 처하지 않고, 발효 용기에 존재하는 미생물과 접촉하지 않는다. 이러한 모든 이점에 의해, DDGS를 예를 들어, 동물 사료로서 가공하여 판매하기가 더욱 용이하게 된다. 일부 실시 형태에서, 오일 (26')은 습윤 케이크 (24)로부터 별도로 배출되지 않으나, 오히려 오일 (26')은 습윤 케이크 (24)의 일부로서 포함되며, 결국 DDGS에 존재한다. 이러한 경우에는, 오일은 동일하거나 상이한 알코올 발효 프로세스에서 다음에 사용하기 위해 DDGS로부터 분리되어, ISPR 추출제 (29)로 전환될 수 있다. 원심분리를 통해 공급원료 슬러리 (16)로부터 불용성 고형물을 제거하기 위한 방법 및 시스템은 그 전체 내용이 본 명세서에 참조로 포함되는, 동시 계류 중인, 2010년 6월 18일자로 출원된 공동 소유된 미국 가출원 제61/356,290호에 상세히 기재되어 있다.When the
상술한 바와 같이, 오일 (26')은 예를 들어, 용매 추출 프로세스를 비롯한 임의의 적절한 공지된 프로세스를 사용하여 DDGS로부터 분리될 수 있다. 본 발명의 일 실시 형태에서, DDGS는 추출 용기에 로딩되고, 헥산과 같은 용매로 세정하여, 오일 (26')을 제거시킨다. 사용될 수 있는 다른 용매는 예를 들어, 아이소부탄올, 아이소헥산, 에탄올, 석유 에테르와 같은 석유 증류물, 또는 이들의 혼합물를 포함한다. 오일 (26') 추출 후에, DDGS는 임의의 잔류 용매를 제거시키도록 처리될 수 있다. 예를 들어, DDGS는 당업계에 공지된 임의의 방법을 사용하여 가열시켜 임의의 잔류 용매를 증발시킬 수 있다. 용매 제거 후에, DDGS는 건조 프로세스에 처해, 임의의 잔류수를 제거할 수 있다. 가공된 DDGS는 가금, 가축, 및 가정용 애완동물과 같은 동물용 사료 보충물로서 사용될 수 있다.As mentioned above, the oil 26 'may be separated from the DDGS using any suitable known process, including, for example, a solvent extraction process. In one embodiment of the present invention, DDGS is loaded into an extraction vessel and washed with a solvent such as hexane to remove oil 26 '. Other solvents that may be used include, for example, petroleum distillates such as isobutanol, isohexane, ethanol, petroleum ether, or mixtures thereof. After oil 26 'extraction, DDGS can be treated to remove any residual solvent. For example, DDGS can be heated using any method known in the art to evaporate any residual solvent. After solvent removal, DDGS can be subjected to a drying process to remove any residual water. The processed DDGS can be used as a feed supplement for animals such as poultry, livestock, and domestic pets.
DDGS로부터의 추출 후에, 생성된 오일 (26')과 용매의 혼합물은 용매로부터 오일 (26')의 분리를 위해 수집될 수 있다. 일 실시 형태에서, 오일 (26')/용매 혼합물은 증발에 의해 처리되어 용매는 증발되고, 오일은 수집되어 재순환될 수 있다. 회수된 오일은 동일하거나 상이한 알코올 발효 프로세스에서 다음에 사용하기 위해 ISPR 추출제 (29)로 전환될 수 있다.After extraction from DDGS, a mixture of the resulting oil 26 'and the solvent can be collected for separation of the oil 26' from the solvent. In one embodiment, the oil 26 '/ solvent mixture may be treated by evaporation so that the solvent is evaporated and the oil may be collected and recycled. The recovered oil may be converted to
고형물의 회수 이외에도, 발효 프로세스의 다른 부생성물을 회수하는 것이 요구될 수 있다. 일 실시 형태에서, 지방산 에스테르 (예를 들어, 지방산 아이소부틸 에스테르)는 예를 들어, 탄수화물의 생성물 알코올 (예를 들어, 부탄올)로의 수율을 증가시키도록 회수될 수 있다. 이것은 예를 들어, 몇몇의 부생성물 스트림을 배합 및 혼합하여, 배합 및 혼합 단계의 생성물을 건조시킴으로써 생성된 부생성물로부터 지방산 아이소부틸 에스테르를 추출하는 용매를 사용하여 달성될 수 있다. DDGS로부터 옥수수유 트라이글리세라이드를 회수하기 위한 이러한 용제형 추출계는 그 교시 내용이 본 명세서에 참조로 포함되는 미국 특허 출원 공개 제 2010/0092603호에 기술되어 있다.In addition to recovering solids, it may be desirable to recover other byproducts of the fermentation process. In one embodiment, fatty acid esters (eg, fatty acid isobutyl esters) may be recovered to increase the yield of carbohydrates, for example, to product alcohols (eg, butanol). This can be achieved using a solvent that extracts fatty acid isobutyl esters from the byproducts, for example, by combining and mixing several byproduct streams and drying the product of the blending and mixing steps. Such solvent type extraction systems for recovering corn oil triglycerides from DDGS are described in US Patent Application Publication No. 2010/0092603, the teachings of which are incorporated herein by reference.
지방산 에스테르의 용매 추출의 일 실시 형태에서, 고형물은 전 증류 폐액 (whole stillage) ("분리된 고형물")으로부터 분리될 수 있는데, 그 스트림이 단연코, 배합되지 않은 부생성물 스트림 중의 가장 큰 부분의 지방산 에스테르를 포함하기 때문이다. 그 다음에 이러한 분리된 고형물은 추출기에 넣어, 용매로 세정될 수 있다. 일 실시 형태에서, 분리된 고형물은 분리된 고형물의 모든 측면이 확실히 용매로 세정되게 하기 위해 적어도 1회 턴된다. 세정 후에, 미셀라로서 공지된, 지질과 용매의 생성된 혼합물은 용매로부터의 추출된 지질의 분리를 위해 수집된다. 예를 들어, 지질과 용매의 생성된 혼합물은 추가의 가공 처리를 위해 분리기에 퇴적될 수 있다. 추출 프로세스 시에, 용매가 분리된 고형물을 적시기 때문에, 용매는 지질을 용액으로 운반할 뿐만 아니라 고체 미립자를 수집한다. 이러한 "미립자"는 통상 미셀라 중의 바람직하지 않은 불순물이며, 일 실시 형태에서, 미셀라는 미셀라로부터 미립자를 분리하거나 스크러빙하는 장치를 통해 추출기 또는 분리기로부터 배출될 수 있다.In one embodiment of solvent extraction of fatty acid esters, the solids can be separated from the whole stillage (“separated solids”), where the stream is by far the largest portion of the fatty acids in the unmixed byproduct stream. It is because it contains ester. This separated solid may then be placed in an extractor and washed with a solvent. In one embodiment, the separated solids are turned at least once to ensure that all sides of the separated solids are washed with solvent. After washing, the resulting mixture of lipids and solvent, known as micelles, is collected for the separation of extracted lipids from the solvent. For example, the resulting mixture of lipids and solvent can be deposited in the separator for further processing. During the extraction process, because the solvent wets the separated solids, the solvent not only transports the lipids into solution but also collects the solid particulates. Such “particulates” are typically undesirable impurities in micelles, and in one embodiment, micelles can be discharged from the extractor or separator through a device that separates or scrubs the particulates from the micelles.
미셀라에 함유된 지질 및 용매를 분리하기 위해, 미셀라는 증류 단계로 이행될 수 있다. 이러한 단계에서, 미셀라는 예를 들어, 용매의 증발을 일으키기에 충분히 높지만, 추출된 지질에 악영향을 미치지 않거나 이를 증발시킬 정도로 충분히 높지 않은 온도로 미셀라를 가열시키는 증발기를 통해 처리될 수 있다. 용매가 증발됨에 따라, 예를 들어, 나중에 사용하기 위해 응축기에 수집되어 재순환될 수 있다. 미셀라로부터의 용매의 분리에 의해 조지질의 스톡을 얻어, 물, 지방산 에스테르 (예를 들어, 지방산 아이소부틸 에스테르), 지방산, 및 트라이글리세라이드를 분리하도록 추가로 처리될 수 있다.To separate the lipids and solvents contained in the micellar, the micellar can be transferred to a distillation step. In this step, the micellar can be treated, for example, via an evaporator that heats the micellar to a temperature that is high enough to cause evaporation of the solvent, but not high enough to adversely affect or evaporate the extracted lipids. As the solvent evaporates, it can be collected and recycled to a condenser, for example for later use. Separation of the solvent from the micelles yields a crude stock and can be further processed to separate water, fatty acid esters (eg fatty acid isobutyl esters), fatty acids, and triglycerides.
지질의 추출 후에, 고형물은 추출기 밖으로 운반되고, 잔류 용매를 제거하는 스트리핑 프로세스가 행해질 수 있다. 잔류 용매의 회수는 프로세스 경제성에 중요하다. 일 실시 형태에서, 습윤 고형물은 데솔벤타이저 (desolventizer)로 운반됨에 따라 습윤 고형물로부터 일시적으로 증발하는 용매를 보존하고 수집하기 위해 증기가 누설되지 않는 환경에 운반될 수 있다. 고형물이 데솔벤타이저에 주입됨에 따라, 고형물이 가열되어 잔류 용매를 증발시켜 제거시킬 수 있다. 고형물을 가열시키기 위해, 데솔벤타이저는 하나 이상의 트레이에 고형물을 분배하기 위한 메카니즘을 포함할 수 있으며, 고형물은 예를 들어, 가열 공기 또는 스팀과의 직접 접촉을 통해 직접적으로, 또는 예를 들어 식사를 운반하는 트레이를 가열함으로써 간접적으로 가열될 수 있다. 하나의 트레이에서 다른 트레이로의 고형물의 전달을 촉진시키기 위해, 고형물을 운반하는 트레이는 고형물이 하나의 트레이에서 다음 트레이로 통과할 수 있는 개구부를 포함할 수 있다. 데솔벤타이저로부터, 고형물은 임의로 혼합기로 운반될 수 있으며, 여기서 고형물은 건조기로 운반되기 전에 다른 부생성물과 혼합된다. 고형물 추출의 일례는 실시예 63에 기술되어 있다. 이러한 실시예에서, 고형물은 데솔벤타이저로 공급되며, 여기서 고형물은 스팀에 접촉된다. 일 실시 형태에서, 데솔벤타이저 내의 스팀류 및 고형물은 역류될 수 있다. 그 다음에 고형물은 데솔벤타이저를 빠져 나와서 건조기 또는 임의로 다양한 부생성물이 혼합될 수 있는 혼합기로 공급될 수 있다. 데솔벤타이저를 빠져 나온 증기는 응축되고 임의로 미셀라와 혼합된 다음에, 디캔터로 공급될 수 있다. 디캔터를 빠져 나온 물 풍부 상은 증류탑에 공급될 수 있으며, 여기서 헥산이 물 풍부 스트림으로부터 제거된다. 일 실시 형태에서, 헥산이 고갈된 물 풍부 스트림은 증류탑의 저부를 빠져 나와서, 발효 프로세스로 다시 재순환될 수 있으며, 예를 들어, 분쇄된 옥수수 고형물을 슬러리화하는데 사용될 수 있다. 다른 실시 형태에서, 오버헤드 및 저부 생성물은 발효 프로세스로 재순환될 수 있다. 예를 들어, 지질 풍부 저부 생성물은 가수분해 장치의 피드에 공급될 수 있다. 오버헤드 생성물은 예를 들어, 응축되어 디캔터로 공급될 수 있다. 이 디캔터를 빠져 나온 헥산 풍부 스트림은 임의로 추출기의 용매 공급물의 일부로서 사용될 수 있다. 이 디캔터를 빠져 나온 물 풍부 상은 헥산을 물로부터 스트리핑하는 칼럼으로 공급될 수 있다. 당업자가 인지할 수 있는 바와 같이, 본 발명의 방법은 부탄올과 같은 생성물 알코올의 생성을 위한 발효 프로세스를 최적화하기 위해 다양한 방법으로 변경될 수 있다.After extraction of the lipid, the solids are conveyed out of the extractor and a stripping process can be performed to remove residual solvent. Recovery of residual solvents is important for process economics. In one embodiment, the wet solids may be transported to a desolventizer in an environment where no vapor leaks to preserve and collect solvents that temporarily evaporate from the wet solids. As the solid is injected into the desolventizer, the solid can be heated to remove the residual solvent by evaporation. In order to heat the solids, the desolventizer may include a mechanism for dispensing the solids in one or more trays, which solids may be eaten directly or, for example, by direct contact with heated air or steam. It may be indirectly heated by heating the conveying tray. To facilitate the transfer of solids from one tray to another, the tray that carries the solids may include openings through which the solids can pass from one tray to the next. From the desolventizer, the solids can optionally be delivered to a mixer, where the solids are mixed with other byproducts before being delivered to the dryer. An example of solids extraction is described in Example 63. In this embodiment, the solids are fed to the desolventizer, where the solids are in contact with steam. In one embodiment, steams and solids in the desolventizer may be countercurrent. The solids can then exit the desolventizer and be fed to a dryer or a mixer into which the various byproducts can optionally be mixed. The vapor exiting the desolventizer can be condensed and optionally mixed with micelles and then fed to the decanter. The water rich phase exiting the decanter can be fed to a distillation column where hexane is removed from the water rich stream. In one embodiment, the hexane depleted water rich stream exits the bottom of the distillation column and can be recycled back to the fermentation process, for example, can be used to slurry the ground corn solids. In other embodiments, the overhead and bottom products can be recycled to the fermentation process. For example, the lipid rich bottoms product can be fed to a feed of a hydrolysis device. The overhead product can be condensed and fed to the decanter, for example. The hexane rich stream exiting this decanter can optionally be used as part of the solvent feed of the extractor. The water rich phase exiting this decanter can be fed to a column stripping hexane from water. As will be appreciated by those skilled in the art, the process of the present invention can be modified in various ways to optimize the fermentation process for the production of product alcohols such as butanol.
지방산 에스테르의 용매 추출의 다른 실시 형태에서, 고형물은 이종 혼합물로서 프리플래시 칼럼 (preflash column)으로 도입되기 전에 발효로부터 배출된 용매 및 비어로부터 분리될 수 있다. 이들 고형물의 습윤 케이크는 분리 장치, 예컨대 스크린 필터 또는 원심분리기를 사용하여 형성될 수 있다. 고형물의 스크린된 케이크는 함수 아이소부탄올을 사용하여 치환 세정하여, 습윤 고형물에 보유된 지방산 에스테르를 제거시킬 수 있다. 대안적으로, 고형물의 원심분리된 케이크는 함수 아이소부탄올에서 재펄프화 (re-pulp)되고 다시 분리되어, 습윤 고형물에 보유된 지방산 에스테르를 제거시킬 수 있다. 이러한 고형물 추출의 실시 형태의 일례는 실시예 63에 기술되어 있다.In another embodiment of solvent extraction of fatty acid esters, the solids may be separated from the solvent and beer drained from the fermentation prior to being introduced into the preflash column as a heterogeneous mixture. Wet cakes of these solids may be formed using separation devices such as screen filters or centrifuges. The screened cake of solids can be substituted and washed with hydrous isobutanol to remove fatty acid esters retained in the wet solids. Alternatively, the centrifuged cake of solids may be re-pulped in brine isobutanol and separated again to remove fatty acid esters retained in the wet solids. An example of an embodiment of such solids extraction is described in Example 63.
추가의 실시 형태에서, 부생성물 (또는 부산물)은 발효 프로세스에 사용되는 매시로부터 유래될 수 있다. 예를 들어, 옥수수유는 매시로부터 분리될 수 있고, 이러한 옥수수유는 트라이글리세라이드, 유리 지방산, 다이글리세라이드, 모노글리세라이드, 및 인지질을 함유할 수 있다 (예를 들어, 실시예 66 참조). 옥수수유는 임의로 상이한 속도로 다른 부생성물 (또는 부산물)에 첨가될 수 있으므로, 예를 들어, 생성된 부생성물 중의 트라이글리세라이드의 양을 변화시키는 능력을 나타낼 수 있다. 이런 식으로, 생성된 부생성물의 지방 함량은 예를 들어, 고지방 생성물과 비교하여 젖소의 요구에 더 잘 어울리는 저 지방, 고 단백질 동물 사료를 얻도록 조절될 수 있다.In further embodiments, byproducts (or byproducts) may be derived from the mash used in the fermentation process. For example, corn oil may be separated from the mash and such corn oil may contain triglycerides, free fatty acids, diglycerides, monoglycerides, and phospholipids (see, eg, Example 66). . Corn oil may optionally be added to other byproducts (or byproducts) at different rates, thus exhibiting, for example, the ability to vary the amount of triglycerides in the resulting byproducts. In this way, the fat content of the resulting byproduct can be adjusted to obtain a low fat, high protein animal feed, for example better suited to the needs of the cow compared to the high fat product.
일 실시 형태에서, 매시로부터 분리된 조옥수수유는 소비자 사용을 위해 식용유로 추가로 가공될 수 있거나, 또한 이의 고 트라이글리세라이드 함량으로 대사 에너지의 우수한 공급원이 되게 하기 때문에 동물 사료의 성분으로서 사용될 수 있다. 다른 실시 형태에서, 또한 바이오디젤 또는 재생가능한 디젤용 공급원료로서 사용될 수 있다.In one embodiment, crude corn oil isolated from the mash can be further processed into cooking oil for consumer use, or it can also be used as an ingredient in animal feed because its high triglyceride content makes it a good source of metabolic energy. have. In other embodiments, it may also be used as feedstock for biodiesel or renewable diesel.
일 실시 형태에서, 추출제 부생성물은 전체 또는 부분적으로, 동물 사료 부생성물의 성분으로서 사용될 수 있거나, 바이오디젤 또는 재생가능한 디젤용 공급원료로서 사용될 수 있다.In one embodiment, the extractant byproduct may be used, in whole or in part, as a component of the animal feed byproduct, or as a feedstock for biodiesel or renewable diesel.
추가의 실시 형태에서, 고형물은 매시로부터 분리될 수 있으며, 트라이글리세라이드 및 유리 지방산을 포함할 수 있다. 이러한 고형물 (또는 스트림)은 동물 사료로서 사용될 수 있으며, 이는 원심분리로부터 배출물로서 또는 건조 후에 회수된다. 고형물 (또는 습윤 케이크)은 이의 이용가능한 라이신 및 바이패스 또는 루멘 비분해성 단백질의 고함량 때문에, 특히 반추동물 (예를 들어, 젖소)용 사료로서 적합할 수 있다. 예를 들어, 이러한 고형물은 고 단백질, 저 지방 사료에서 특히 가치가 높을 수 있다. 다른 실시 형태에서, 이러한 고형물은 베이스로서 사용될 수 있으며, 즉, 시럽과 같은 다른 부생성물이 고형물에 첨가되어 동물 사료로서 사용될 수 있는 생성물을 생성할 수 있다. 다른 실시 형태에서, 상이한 양의 다른 부생성물은 생성된 생성물의 특성에 맞추도록 고형물에 첨가되어, 특정 동물종의 요구를 충족시킬 수 있다.In further embodiments, the solids can be separated from the mash and can include triglycerides and free fatty acids. Such solids (or streams) can be used as animal feed, which is recovered as centrifuge from the discharge or after drying. Solids (or wet cakes) may be particularly suitable as feed for ruminants (eg, dairy cows) because of their high content of available lysine and bypass or lumen non-degradable proteins. For example, such solids can be particularly valuable in high protein, low fat feeds. In other embodiments, such solids can be used as the base, that is, other byproducts such as syrup can be added to the solids to produce a product that can be used as animal feed. In other embodiments, different amounts of other byproducts can be added to the solids to suit the properties of the resulting product, to meet the needs of a particular animal species.
실시예 62에 기재된 바와 같은 전 증류 폐액으로부터 분리된 고형물의 조성물은 예를 들어, 조단백질, 지방산, 및 지방산 아이소부틸 에스테르를 포함할 수 있다. 일 실시 형태에서, 이러한 조성물 (또는 부생성물)은 예를 들어, 고 단백질 (예를 들어, 고 라이신), 저 지방, 및 고 섬유 함량이 요구되는 동물 사료로서 습윤 또는 건조 상태로 사용될 수 있다. 다른 실시 형태에서, 지방은 예를 들어, 고 지방, 저 섬유 동물 사료가 요구된다면, 다른 부생성물 스트림으로부터 이러한 조성물에 첨가될 수 있다. 일 실시 형태에서, 이러한 고 지방, 저 섬유 동물 사료는 돼지 또는 가금용으로 사용될 수 있다. 추가의 실시 형태에서, 응축주정박 (Condensed Distillers Solubles) (CDS) (예를 들어, 실시예 66 참조)의 비수성 조성물은 예를 들어, 단백질, 지방산, 및 지방산 아이소부틸 에스테르, 및 다른 용존 및 현탁 고형물, 예컨대 염 및 탄수화물을 포함할 수 있다. 이러한 CDS 조성물은 예를 들어, 고 단백질, 저 지방, 고 무기염 사료 성분이 요구되는 동물 사료로서 습윤 또는 건조 상태로 사용될 수 있다. 일 실시 형태에서, 이러한 조성물은 젖소 일량사료 (ration)의 성분으로서 사용될 수 있다.The composition of the solid separated from the total distillation waste liquid as described in Example 62 may comprise, for example, crude protein, fatty acid, and fatty acid isobutyl ester. In one embodiment, such compositions (or byproducts) can be used in wet or dry conditions, for example as animal feed requiring high protein (eg high lysine), low fat, and high fiber content. In other embodiments, fat may be added to such compositions, for example, from other byproduct streams, if a high fat, low fiber animal feed is desired. In one embodiment, such high fat, low fiber animal feed can be used for swine or poultry. In further embodiments, the non-aqueous composition of Condensed Distillers Solubles (CDS) (see, eg, Example 66) can be, for example, proteins, fatty acids, and fatty acid isobutyl esters, and other dissolved and Suspended solids such as salts and carbohydrates. Such CDS compositions can be used, for example, in wet or dry conditions as animal feed requiring high protein, low fat, high mineral salt feed ingredients. In one embodiment, such a composition can be used as a component of a dairy ration.
다른 실시 형태에서, 발효 프로세스로부터의 오일은 증발에 의해 회수될 수 있다. 이러한 비수성 조성물은 지방산 아이소부틸 에스테르 및 지방산 (예를 들어, 실시예 66 참조)을 포함할 수 있고, 이러한 조성물 (또는 스트림)은 가수분해 장치로 공급되어, 아이소부탄올 및 지방산을 회수할 수 있다. 추가의 실시 형태에서, 이러한 스트림은 바이오디젤 생산용 공급원료로서 사용될 수 있다.In another embodiment, oil from the fermentation process may be recovered by evaporation. Such non-aqueous compositions may include fatty acid isobutyl esters and fatty acids (see, eg, Example 66), and such compositions (or streams) may be fed to a hydrolysis device to recover isobutanol and fatty acids. . In a further embodiment, this stream can be used as feedstock for biodiesel production.
발효 프로세스를 통한 알코올 (예를 들어, 부탄올)의 생성에 의해 발생되는 다양한 스트림은 여러가지로 배합되어 많은 부산물을 생성할 수 있다. 예를 들어, 매시로부터의 조옥수수가 추출제로서 사용되도록 지방산을 생성시키는데 사용되고, 지질이 다른 용도로 증발기에 의해 추출되면, 잔류 스트림은 배합 및 가공되어, 조단백질, 조지방, 트라이글리세라이드, 지방산, 및 지방산 아이소부틸 에스테르를 포함하는 부산물 조성물을 생성시킬 수 있다. 일 실시 형태에서, 이러한 조성물은 조단백질 적어도 약 20 내지 35 wt%, 조지방 적어도 약 1 내지 20 wt%, 트라이글리세라이드 적어도 약 0 내지 5 wt%, 지방산 적어도 약 4 내지 10 wt%, 및 지방산 아이소부틸 에스테르 적어도 약 2 내지 6 wt%를 포함할 수 있다. 하나의 특정한 실시 형태에서, 부산물 조성물은 조단백질 약 25 wt%, 조지방 약 10 wt%, 트라이글리세라이드 약 0.5 wt%, 지방산 약 6 wt%, 및 지방산 아이소부틸 에스테르 약 4 wt%를 포함할 수 있다.The various streams generated by the production of alcohols (eg butanol) through the fermentation process can be combined in various ways to produce many byproducts. For example, chalcedony from mash is used to produce fatty acids for use as extractant, and when the lipids are extracted by an evaporator for other uses, the residual stream is blended and processed to yield crude protein, crude fat, triglycerides, fatty acids, And by-product compositions comprising fatty acid isobutyl esters. In one embodiment, such compositions comprise at least about 20 to 35 wt% crude protein, at least about 1 to 20 wt% crude fat, at least about 0 to 5 wt% triglycerides, at least about 4 to 10 wt% fatty acids, and fatty acid isobutyl Esters at least about 2 to 6 wt%. In one particular embodiment, the byproduct composition may comprise about 25 wt% crude protein, about 10 wt% crude fat, about 0.5 wt% triglycerides, about 6 wt% fatty acids, and about 4 wt% fatty acid isobutyl esters. .
다른 실시 형태에서, 지질은 증발기에 의해 추출되고, 지방산은 다른 용도로 사용되며, 매시로부터의 조옥수수 약 50 wt% 및 잔류 스트림은 배합 및 가공되며, 생성된 부산물 조성물은 조단백질, 조지방, 트라이글리세라이드, 지방산, 및 지방산 아이소부틸 에스테르를 포함할 수 있다. 일 실시 형태에서, 이러한 조성물은 조단백질 적어도 약 25 내지 31 wt%, 조지방 적어도 약 6 내지 10 wt%, 트라이글리세라이드 적어도 약 4 내지 8 wt%, 지방산 적어도 약 0 내지 2 wt%, 및 지방산 아이소부틸 에스테르 적어도 약 1 내지 3 wt%를 포함할 수 있다. 하나의 특정한 실시 형태에서, 부산물 조성물은 조단백질 약 28 wt%, 조지방 약 8 wt%, 트라이글리세라이드 약 6 wt%, 지방산 약 7 wt%, 및 지방산 아이소부틸 에스테르 약 1 wt%를 포함할 수 있다.In another embodiment, the lipid is extracted by an evaporator, the fatty acids are used for other purposes, about 50 wt% of crude corn from the mash and the residual stream is blended and processed, and the resulting byproduct composition is crude protein, crude fat, triglycerides. Rides, fatty acids, and fatty acid isobutyl esters. In one embodiment, such compositions comprise at least about 25 to 31 wt% crude protein, at least about 6 to 10 wt% crude fat, at least about 4 to 8 wt% triglycerides, at least about 0 to 2 wt% fatty acids, and fatty acid isobutyl Esters at least about 1 to 3 wt%. In one particular embodiment, the byproduct composition may comprise about 28 wt% crude protein, about 8 wt% crude fat, about 6 wt% triglycerides, about 7 wt% fatty acids, and about 1 wt% fatty acid isobutyl ester. .
다른 실시 형태에서, 전 증류 폐액 으로부터 분리된 고형물 및 매시로부터 추출된 옥수수유 50 wt%는 배합되며, 생성된 부산물 조성물은 조단백질, 조지방, 트라이글리세라이드, 지방산, 지방산 아이소부틸 에스테르, 라이신, 중성 세제 불용성 섬유 (NDF), 및 내산성 섬유 (ADF)를 포함할 수 있다. 일 실시 형태에서, 이러한 조성물`은 조단백질 적어도 약 26 내지 34 wt%, 조지방 적어도 약 15 내지 25 wt%, 트라이글리세라이드 적어도 약 12 내지 20 wt%, 지방산 적어도 약 1 내지 2 wt%, 지방산 아이소부틸 에스테르 적어도 약 2 내지 4 wt%, 라이신 적어도 약 1 내지 2 wt%, NDF 적어도 약 11 내지 23 wt%, 및 ADF 적어도 약 5 내지 11 wt%를 포함할 수 있다. 하나의 특정한 실시 형태에서, 부산물 조성물은 조단백질 약 29 wt%, 조지방 약 21 wt%, 트라이글리세라이드 약 16 wt%, 지방산 약 1 wt%, 지방산 아이소부틸 에스테르 약 3 wt%, 라이신 약 1 wt%, NDF 약 17 wt%, 및 ADF 약 8 wt%를 포함할 수 있다. 이러한 부산물 조성물의 고 지방, 트라이글리세라이드, 및 라이신 함량 및 저 섬유 함량은 돼지 및 가금용 사료로서 바람직할 수 있다.In another embodiment, 50 wt% of the solids separated from the total distillation waste and the corn oil extracted from the mash are combined and the resulting byproduct composition comprises crude protein, crude fat, triglycerides, fatty acids, fatty acid isobutyl esters, lysine, neutral detergents. Insoluble fibers (NDF), and acid resistant fibers (ADF). In one embodiment, such a composition` comprises at least about 26 to 34 wt% crude protein, at least about 15 to 25 wt% crude fat, at least about 12 to 20 wt% triglycerides, at least about 1 to 2 wt% fatty acids, isobutyl fatty acid Ester at least about 2-4 wt%, lysine at least about 1-2 wt%, NDF at least about 11-23 wt%, and ADF at least about 5-11 wt%. In one specific embodiment, the byproduct composition comprises about 29 wt% crude protein, about 21 wt% crude fat, about 16 wt% triglycerides, about 1 wt% fatty acid, about 3 wt% fatty acid isobutyl ester, about 1 wt% lysine. , About 17 wt% NDF, and about 8 wt% ADF. The high fat, triglyceride, and lysine content and low fiber content of such by-product compositions may be desirable as feed for pigs and poultry.
상술한 바와 같이, 발효 프로세스를 통한 알코올 (예를 들어, 부탄올)의 생성에 의해 발생되는 다양한 스트림은 여러가지로 배합되어, 조단백질, 조지방, 트라이글리세라이드, 지방산, 및 지방산 아이소부틸 에스테르를 포함하는 부산물 조성물을 생성할 수 있다. 예를 들어, 조지방 적어도 약 6% 및 조단백질 적어도 약 28%를 포함하는 조성물은 착유 동물용 동물 사료 생성물로서 사용될 수 있다. 조지방 적어도 약 6% 및 조단백질 적어도 약 26%를 포함하는 조성물은 사육장 가축용 동물 사료 생성물로서 사용될 수 있는 반면에, 조지방 적어도 약 1% 및 조단백질 적어도 약 27%를 포함하는 조성물은 월동 가축 (wintering cattle)용 동물 사료 생성물로서 사용될 수 있다. 조지방 적어도 약 13% 및 조단백질 적어도 약 27%를 포함하는 조성물은 가금용 동물 사료 생성물로서 사용될 수 있다. 조지방 적어도 약 18% 및 조단백질 적어도 약 22%를 포함하는 조성물은 단위 동물용 동물 사료 생성물로서 사용될 수 있다. 따라서, 다양한 스트림은 특정 동물종을 위한 사료 생성물로서 주문 제작되도록 배합될 수 있다.As mentioned above, the various streams generated by the production of alcohols (eg, butanol) through the fermentation process can be combined in various ways, by-product compositions comprising crude protein, crude fat, triglycerides, fatty acids, and fatty acid isobutyl esters. Can be generated. For example, a composition comprising at least about 6% crude fat and at least about 28% crude protein can be used as an animal feed product for milking animals. Compositions comprising at least about 6% crude fat and at least about 26% crude protein may be used as animal feed products for kennel livestock, while compositions comprising at least about 1% crude fat and at least about 27% crude protein may be used for wintering cattle. ) As an animal feed product. Compositions comprising at least about 13% crude fat and at least about 27% crude protein can be used as poultry animal feed products. Compositions comprising at least about 18% crude fat and at least about 22% crude protein can be used as animal feed products for unit animals. Thus, the various streams can be formulated to be customized as feed products for specific animal species.
일 실시 형태에서, 발효 프로세스를 통한 알코올 (예를 들어, 부탄올)의 생성에 의해 발생되는 하나 이상의 스트림은 여러가지로 배합되어, 바이오디젤과 같은 연료 공급원으로서 사용될 수 있는 COFA 적어도 약 90%를 포함하는 조성물을 생성할 수 있다.In one embodiment, the one or more streams generated by the production of alcohols (eg, butanol) through the fermentation process are in various combinations comprising at least about 90% COFA that can be used as a fuel source, such as biodiesel. Can be generated.
본 발명의 방법의 하나의 실시 형태의 일례로서, 제분된 곡물 (예를 들어, 해머 밀에 의해 가공된 옥수수) 및 하나 이상의 효소가 배합되어, 슬러리화된 곡물을 생성시킨다. 이러한 슬러리화된 곡물은 쿠킹하여, 액화시키고, 임의로 플래시 증기 (flash vapor)로 플래시하여, 쿠킹된 매시를 얻는다. 그 다음에, 쿠킹된 매시는 여과되어, 현탁 고형물을 제거시켜, 습윤 케이크 및 여과액을 형성시킨다. 여과는 여러 가지 방법, 예컨대 원심분리, 스크리닝, 또는 진공 여과에 의해 달성될 수 있으며, 이러한 여과 단계는 매시로부터의 현탁 고형물 적어도 약 80% 내지 적어도 약 99%를 제거할 수 있다.As an example of one embodiment of the method of the invention, milled grain (eg, corn processed by hammer mill) and one or more enzymes are combined to produce a slurried grain. This slurried grain is cooked, liquefied and optionally flashed with flash vapor to obtain a cooked mash. The cooked mash is then filtered to remove the suspended solids to form a wet cake and filtrate. Filtration can be accomplished by various methods, such as centrifugation, screening, or vacuum filtration, and this filtration step can remove at least about 80% to at least about 99% of the suspended solids from the mash.
습윤 케이크는 물로 리슬러리화되고, 재여과되어 추가의 전분이 제거되어, 세정된 필터 케이크를 생성시킨다. 리슬러리 프로세스는 수회, 예를 들어, 1회 내지 5회 반복될 수 있다. 습윤 케이크를 리슬러리화하는데 사용되는 물은 발효 프로세스 시에 발생된 물로 재순환될 수 있다. 리슬러리/재여과 프로세스에 의해 생성된 여과액은 초기 혼합 단계로 반송되어 제분된 곡물과 함께 슬러리를 생성할 수 있다. 여과액은 혼합 단계 전에 가열되거나 냉각될 수 있다.The wet cake is reslurried with water and refiltered to remove additional starch, resulting in a cleaned filter cake. The slurry process may be repeated several times, for example, one to five times. The water used to reslurry the wet cake can be recycled to the water generated during the fermentation process. The filtrate produced by the slurry and refiltration process can be returned to the initial mixing stage to produce a slurry with the milled grain. The filtrate can be heated or cooled before the mixing step.
세정된 필터 케이크는 생성 프로세스 시에 다수의 단계에서 비어로 리슬러리화될 수 있다. 예를 들어, 세정된 필터 케이크는 발효 용기 다음에, 프리플래시 칼럼 전에, 또는 주모 (distiller's grain) 건조기의 피드포인트에서 비어로 리슬러리화될 수 있다. 세정된 필터 케이크는 DDGS 또는 동물 사료 생성물을 생성하기 위해 다른 부생성물과 별도로 건조될 수 있거나 습윤 케이크로서 직접 사용될 수 있다.The cleaned filter cake may be reslurried into vias in a number of steps in the production process. For example, the cleaned filter cake may be reslurried into a beer after the fermentation vessel, before the preflash column, or at the feed point of a distiller's grain dryer. The cleaned filter cake can be dried separately from other byproducts to produce DDGS or animal feed products or can be used directly as a wet cake.
초기 혼합 단계의 결과로서 생성된 여과액은 본 명세서에 기술한 바와 같이 추가로 가공될 수 있다. 예를 들어, 여과액은 스팀 또는 프로세스간 열교환 (process to process heat exchange)으로 가열될 수 있다. 당화 효소는 여과액에 첨가될 수 있고, 여과액의 용해 전분은 부분적으로 또는 완전히 당화될 수 있다. 당화된 여과액은 다수의 수단, 예컨대 프로세스간 교환, 냉각수 (cooling water)를 이용한 교환, 또는 냉수 (chilled water)를 이용한 교환에 의해 냉각될 수 있다.The filtrate produced as a result of the initial mixing step can be further processed as described herein. For example, the filtrate can be heated by steam or process to process heat exchange. Saccharification enzymes can be added to the filtrate, and the dissolved starch of the filtrate can be partially or fully saccharified. The saccharified filtrate can be cooled by a number of means, such as interprocess exchange, exchange with cooling water, or exchange with chilled water.
그 다음에 냉각된 여과액은 발효 용기, 및 알코올 생산에 적합한 미생물, 예를 들어, 부탄올을 생성할 수 있는 재조합 효모에 첨가될 수 있다. 또한, 암모니아 및 재순환 스트림도 발효 용기에 첨가될 수 있다. 이러한 프로세스는 적어도 1개의 발효 용기, 적어도 2개의 발효 용기, 적어도 3개의 발효 용기, 또는 적어도 4개의 발효 용기를 포함할 수 있다. 발효 시에 발생된 이산화탄소는 공기 배출 (예를 들어, 부탄올 공기 배출)을 감소시키고 생성물 수율을 증가시키기 위해 스크러버로 통기될 수 있다.The cooled filtrate can then be added to the fermentation vessel and recombinant yeast capable of producing microorganisms suitable for alcohol production, such as butanol. In addition, ammonia and recycle stream may also be added to the fermentation vessel. Such a process may comprise at least one fermentation vessel, at least two fermentation vessels, at least three fermentation vessels, or at least four fermentation vessels. The carbon dioxide generated during fermentation can be vented to a scrubber to reduce air emissions (eg butanol air emissions) and increase product yield.
용매는 재생 루프를 통해 발효 용기에 첨가될 수 있거나 발효 용기에 직접 첨가될 수 있다. 용매는 알코올 (예를 들어, 부탄올)을 용해시키거나 이것과 반응할 수 있는 하나 이상의 유기 화합물일 수 있으며, 물에 대한 용해도가 한정될 수 있다. 용매는 단일 액체상 또는 2개의 액체상 물질로서 연속적으로 발효 용기로부터 취해질 수 있거나, 용매는 단일 또는 2개의 액체상 물질로서 배취식으로 회수될 수 있다.The solvent may be added to the fermentation vessel through a regeneration loop or may be added directly to the fermentation vessel. The solvent may be one or more organic compounds capable of dissolving or reacting with an alcohol (eg butanol) and solubility in water may be limited. The solvent may be taken from the fermentation vessel in succession as a single liquid phase or two liquid phase materials, or the solvent may be recovered batchwise as a single or two liquid phase materials.
비어는 탈가스될 수 있다. 비어는 예를 들어, 핫 매시를 이용한 프로세스간 교환 또는 프리플래시 칼럼 오버헤드 생성물을 이용한 프로세스간 교환에 의해, 탈가스 전에 가열될 수 있다. 증기는 응축기로 다음에, 스크러버로 통기될 수 있다. 탈가스된 비어는 추가로 예를 들어, 증류 영역 내의 다른 스트림을 이용한 프로세스간 열교환에 의해 가열될 수 있다.The vias may be degassed. The vias may be heated prior to degassing, for example, by inter-process exchange using hot mash or inter-process exchange using preflash column overhead product. The vapor may then be vented to a condenser and then to a scrubber. The degassed vias may further be heated by, for example, inter-process heat exchange with other streams in the distillation zone.
예열된 비어 및 용매는 통상적인 건식 분쇄 연료 에탄올 플랜트의 비어 칼럼으로부터 개조될 수 있는 프리플래시 칼럼에 주입될 수 있다. 이러한 칼럼은 증발기 트레인 또는 매시 쿠킹 단계로부터 취해진 수증기로 구동되는 부압 (sub-atmospheric pressure)으로 작동될 수 있다. 프리플래시 칼럼의 오버헤드 생성물은 냉각수의 몇몇 조합을 이용한 열교환, 및 프리플래시 칼럼 피드를 이용한 열교환을 비롯한 프로세스간 열교환에 의해 응축될 수 있다. 액체 응축물은 알코올/물 디캔터 (예를 들어, 부탄올/물 디캔터)로 진행될 수 있다.Preheated vias and solvents can be injected into a preflash column that can be retrofitted from the beer column of a conventional dry grinding fuel ethanol plant. This column can be operated with sub-atmospheric pressure driven by water vapor taken from an evaporator train or a mash cooking step. The overhead product of the preflash column may be condensed by interprocess heat exchange, including heat exchange with some combination of cooling water, and heat exchange with preflash column feed. The liquid condensate can be run with an alcohol / water decanter (eg, butanol / water decanter).
프리플래시 칼럼 저부 생성물은 용매 디캔터로 전진될 수 있다. 프리플래시 칼럼 저부 생성물은 실질적으로 유리 알코올 (예를 들어, 부탄올)을 스트리핑할 수 있다. 디캔터는 스틸 웰 (still well), 원심분리기, 또는 하이드로클론일 수 있다. 물은 실질적으로 이러한 디캔터 내의 용매상으로부터 분리되어, 수상을 형성한다. 현탁 및 용존 고형물을 포함하는 수상은 원심분리되어, 습윤 케이크 및 딘 스틸레지 (thin stillage)를 생성할 수 있다. 습윤 케이크는 다른 스트림과 배합되고 건조되어 DDGS를 생성할 수 있거나, 건조되어 DDGS를 생성하는 다른 스트림으로부터 분리되어 판매될 수 있거나, 습윤 케이크로서 판매될 수 있다. 수상은 부분적으로 상술한 필터 케이크를 리슬러리화하는데 사용되는 백세트 (backset)를 제공하도록 분할될 수 있다. 분할에 의해서도 딘 스틸레지를 제공하며, 이는 추가의 가공을 위해 증발기로 펌핑될 수 있다.The preflash column bottoms product can be advanced to a solvent decanter. The preflash column bottoms product can substantially strip free alcohol (eg, butanol). The decanter may be a still well, centrifuge, or hydroclonal. Water is substantially separated from the solvent phase in this decanter to form an aqueous phase. The aqueous phase, including suspended and dissolved solids, can be centrifuged to produce the wet cake and Dean stills. The wet cake may be combined with other streams and dried to produce DDGS, or may be sold separately from other streams which are dried to produce DDGS, or may be sold as a wet cake. The aqueous phase can be partially partitioned to provide a backset that is used to reslurry the filter cake described above. Dividing also provides Dean Stilage, which can be pumped to the evaporator for further processing.
용매 디캔터에서 생성된 유기상은 알코올 (예를 들어, 부탄올)의 에스테르일 수 있다. 용매는 반응성 용매를 재생하고, 추가의 알코올 (예를 들어, 부탄올)을 회수하기 위해 가수분해될 수 있다. 대안적으로, 유기상은 여과되어, 생성물로서 판매될 수 있다. 가수분해는 열에 의해 촉진되거나, 균일 촉매되거나, 또는 불균일 촉매될 수 있다. 가수분해는 또한 효소 반응에 의해 일어날 수 있다. 이러한 프로세스로의 열주입은 가열로, 핫 오일, 전기열 주입, 또는 고압 스팀일 수 있다. 가수분해를 촉진하기 위해 첨가되는 물은 재순환된 수류, 담수, 또는 스팀일 수 있다.The organic phase produced in the solvent decanter may be an ester of an alcohol (eg butanol). The solvent can be hydrolyzed to regenerate the reactive solvent and recover additional alcohol (eg butanol). Alternatively, the organic phase can be filtered and sold as product. Hydrolysis can be heat accelerated, homogeneously catalyzed, or heterogeneously catalyzed. Hydrolysis can also occur by enzymatic reactions. The heat injection into this process can be a heating furnace, hot oil, electric heat injection, or high pressure steam. The water added to promote hydrolysis may be recycled water stream, fresh water, or steam.
냉각된 가수분해 용매는 부압 용매 칼럼으로 펌핑될 수 있으며, 여기서 실질적으로 스팀으로 알코올 (예를 들어, 부탄올)을 스트리핑할 수 있다. 이러한 스팀은 증발기로부터의 수증기일 수 있거나, 매시 프로세스의 플래시 단계로부터의 스팀일 수 있거나, 보일러로부터의 스팀일 수 있다 (예를 들어, 본 명세서에 참조로 포함되는 미국 특허 출원 공개 제2009/0171129호 참조). 통상적인 건식 분쇄 연료 에탄올 플랜트의 정류탑은 용매 칼럼으로서 적합할 수 있다. 정류탑은 변경되어 용매 칼럼로서 작용할 수 있다. 용매 칼럼의 저부 생성물은 예를 들어, 냉각수 또는 프로세스간 열교환에 의해 냉각될 수 있다. 냉각된 저부 생성물은 디캔트되어 잔류수를 제거할 수 있으며, 이러한 물은 프로세스를 이용한 다른 단계로 재순환되거나 매시 단계로 재순환될 수 있다.The cooled hydrolysis solvent may be pumped into a negative pressure solvent column where substantially alcohol (eg, butanol) may be stripped with steam. Such steam may be water vapor from an evaporator, steam from the flash stage of the mash process, or steam from a boiler (eg, US Patent Application Publication No. 2009/0171129, incorporated herein by reference). Reference). The rectification column of a conventional dry grinding fuel ethanol plant may be suitable as a solvent column. The tower can be modified to act as a solvent column. The bottom product of the solvent column may be cooled by, for example, cooling water or interprocess heat exchange. The cooled bottom product may be decanted to remove residual water, which may be recycled to another step using the process or to a mash step.
용매 칼럼 오버헤드 생성물은 냉각수를 이용한 교환 또는 프로세스간 열교환에 의해 냉각될 수 있고, 응축물은 프리플래시 칼럼 오버헤드 생성물과 공유할 수 있는 통기된 알코올/물 디캔터 (예를 들어, 부탄올/물 디캔터)로 진행될 수 있다. 다른 혼합된 물 및 알코올 (예를 들어, 부탄올) 스트림은 스크러버 저부 생성물 및 탈가스 단계로부터의 응축물을 포함하는 이러한 디캔터에 첨가될 수 있다. 이산화탄소를 포함하는 통기구는 워터 스크러버로 향할 수 있다. 이러한 디캔터의 수성층은 용매 칼럼에 공급될 수 있거나 소형 전용 증류탑 중의 알코올 (예를 들어, 부탄올)을 스트리핑할 수 있다. 수성층은 프리플래시 칼럼 오버헤드 생성물, 용매 칼럼 오버헤드 생성물, 또는 용매 칼럼 저부 생성물을 이용한 프로세스간 교환에 의해 예열될 수 있다. 이러한 전용 칼럼은 통상적인 건식 분쇄 연료 에탄올 프로세스의 사이드 스트리퍼로부터 변경될 수 있다.The solvent column overhead product may be cooled by exchange with chilled water or by inter-process heat exchange, and the condensate may be shared with the preflash column overhead product (eg, butanol / water decanter) May be performed. Other mixed water and alcohol (eg butanol) streams may be added to this decanter including scrubber bottoms product and condensate from the degassing step. The vent containing carbon dioxide may be directed to the water scrubber. The aqueous layer of this decanter may be fed to a solvent column or may strip alcohol (eg butanol) in a small dedicated distillation column. The aqueous layer can be preheated by interprocess exchange using a preflash column overhead product, a solvent column overhead product, or a solvent column bottom product. This dedicated column can be modified from the side stripper of a conventional dry grinding fuel ethanol process.
알코올/물 디캔터 (예를 들어, 부탄올/물 디캔터)의 유기층은 알코올 (예를 들어, 부탄올) 칼럼에 펌핑될 수 있다. 이러한 칼럼은 초대기압 칼럼일 수 있으며, 리보일러 내의 스팀 응축에 의해 구동될 수 있다. 칼럼으로의 공급물은 칼럼을 작동시키는 에너지 수요를 감소시키기 위해 프로세스간 열교환에 의해 가열될 수 있다. 이러한 프로세스간 열교환기는 프리플래시 칼럼의 분축기, 용매 칼럼의 분축기, 가수분해 장치의 생성물, 증발기로부터의 수증기, 또는 부탄올 칼럼 저부 생성물을 포함할 수 있다. 알코올 (예를 들어, 부탄올) 칼럼 증기의 응축물은 냉각되어, 알코올/물 디캔터 (예를 들어, 부탄올/물 디캔터)로 반송될 수 있다. 알코올 (예를 들어, 부탄올) 칼럼 저부 생성물은 알코올 (예를 들어, 부탄올) 칼럼 공급물을 이용한 교환을 비롯한 프로세스간 열교환에 의해 냉각될 수 있고, 냉각수로 추가로 냉각될 수 있으며, 여과되어, 생성물 알코올 (예를 들어, 부탄올)로서 판매된다.The organic layer of alcohol / water decanter (eg butanol / water decanter) may be pumped to an alcohol (eg butanol) column. This column may be a superatmospheric column and may be driven by steam condensation in the reboiler. Feed to the column can be heated by inter-process heat exchange to reduce the energy demand to operate the column. Such interprocess heat exchangers may comprise a preflash column splitter, a solvent column splitter, a product of a hydrolysis device, water vapor from an evaporator, or a butanol column bottoms product. The condensate of the alcohol (eg butanol) column vapor can be cooled and returned to an alcohol / water decanter (eg butanol / water decanter). The alcohol (eg butanol) column bottoms product may be cooled by inter-process heat exchange, including exchange with an alcohol (eg butanol) column feed, further cooled with cooling water, filtered, It is sold as product alcohol (eg butanol).
상술한 프리플래시 칼럼 저부 생성물로부터 발생된 딘 스틸레지는 멀티플 이펙트 (multiple effect) 증발기로 진행될 수 있다. 이러한 증발기는 2개, 3개 또는 그 이상의 단계를 가질 수 있다. 증발기는 연료 에탄올 플랜트의 통상적인 디자인과 유사한 두 가지 이펙트에 의한 4개의 보디로 된 형태를 가질 수 있거나, 세 가지 이펙트에 의한 3개의 보디를 가질 수 있거나, 다른 형태를 가질 수 있다. 딘 스틸레지는 임의의 이펙트에서 인입될 수 있다. 제 1 이펙트 보디 중 적어도 하나는 초대기압 알코올 (예를 들어, 부탄올) 칼럼으로부터의 증기로 가열될 수 있다. 증기는 최저 압력 이펙트로부터 취해져서, 부압 프리플래시 칼럼 및 용매 칼럼으로 수증기 형태로 열을 제공할 수 있다. 증발기로부터의 시럽은 주모 건조기에 첨가될 수 있다.Dean stilges generated from the preflash column bottoms described above can be advanced to multiple effect evaporators. Such evaporators may have two, three or more stages. The evaporator may have a form of four bodies by two effects, similar to the conventional design of a fuel ethanol plant, or may have three bodies by three effects, or may have other forms. Dean Stilage can be imported in any effect. At least one of the first effect bodies may be heated with steam from a superatmospheric alcohol (eg butanol) column. The vapor can be taken from the lowest pressure effect, providing heat in the form of water vapor to the negative pressure preflash column and the solvent column. Syrup from the evaporator can be added to the hair dryer.
발효 용기, 탈가스기, 알코올/물 디캔터 (예를 들어, 부탄올/물 디캔터) 및 다른 공급원으로부터의 이산화탄소 배출량은 워터 스크러버로 진행될 수 있다. 이러한 스크러버의 상부에 공급된 물은 신선한 보급수이거나 재순환수일 수 있다. 재순환수는 휘발성 유기 화합물을 제거하도록 처리되어 (예를 들어, 생물학적 소화), 냉각될 수 있다. 스크러버 저부 생성물은 알코올/물 디캔터 (예를 들어, 부탄올/물 디캔터), 용매 칼럼으로 방출될 수 있거나, 다른 재순환수와 함께 사용되어, 상술한 습윤 케이크를 리슬러리화할 수 있다. 증발기로부터의 응축물은 혐기성 생물학적 소화 또는 다른 프로세스로 처리되어, 재순환되기 전에 물을 정제하여, 필터 케이크를 리슬러리화할 수 있다.Carbon dioxide emissions from fermentation vessels, degassers, alcohol / water decanters (eg butanol / water decanters) and other sources can be run with water scrubbers. The water supplied to the top of this scrubber may be fresh make-up water or recycle water. Recycled water can be treated to remove volatile organic compounds (eg, biological digestion) and cooled. The scrubber bottoms product can be released to an alcohol / water decanter (eg, butanol / water decanter), a solvent column, or used with other recycled water to reslurminate the wet cake described above. The condensate from the evaporator can be subjected to anaerobic biological digestion or other processes to purify the water before it is recycled to reslurry the filter cake.
옥수수가 제분된 곡물의 공급원으로서 사용되는 경우에는, 옥수수유는 몇몇 포인트 중 임의의 포인트에서 프로세스 스트림으로부터 분리될 수 있다. 예를 들어, 원심분리기는 쿠킹된 매시의 여과 후에 옥수수유 스트림을 생성하도록 작동될 수 있거나, 프리플래시 칼럼 수상 원심분리기는 옥수수유 스트림을 생성하도록 작동될 수 있다. 최종 시럽용 중간 농도 시럽은 원심분리되어 옥수수유 스트림을 생성할 수 있다.When corn is used as a source of milled grain, corn oil may be separated from the process stream at any of several points. For example, the centrifuge may be operated to produce a corn oil stream after filtration of the cooked mash, or the preflash column water centrifuge may be operated to produce a corn oil stream. Medium concentration syrup for the final syrup may be centrifuged to produce a corn oil stream.
본 발명의 방법의 실시 형태의 다른 예에서, 발효 용기로부터 배출된 물질은 원심분리기, 침강조, 하이드로클론 등, 및 이들의 조합과 같은 장치를 포함하는 분리 시스템에서 가공되어, 직접 또는 약간의 재생 후에 후속 발효 배취에서 재사용하기 위해 재순환될 수 있는 고 농도의 생 효모를 회수할 수 있다. 이러한 분리 시스템은 또한 발효로부터 생성되는 지방 에스테르 (예를 들어, 아이소부틸 지방 에스테르) 및 알코올 (예를 들어, 아이소부탄올)을 포함하는 유기 스트림 및 다만 미량의 불혼화성 유기물을 함유하는 수성 스트림을 생성할 수 있다. 이러한 수성 스트림은 알코올 (예를 들어, 아이소부탄올) 함량의 스트리핑 전후에, 액화 매시로부터 분리되어 세정된 저 전분 고형물을 재펄프화하여 펌핑하도록 사용될 수 있다. 이것은 이들 고형물을 긴 벨트 구동식 운반 시스템을 사용하여 액화 영역에서 곡물 건조 및 시럽 블렌드 영역으로 이송할 수 있었을 지도 모르는 일을 피할 수 있다는 이점이 있다. 게다가, 알코올 (예를 들어, 아이소부탄올)이 스트리핑된 후에 생성되는 이러한 전 증류 폐액은 기존 또는 새로운 분리 장치를 사용하여 딘 스틸레지 및 습윤 케이크 분획으로 분리될 필요가 있을 것이며, 이러한 딘 스틸레지는 부분적으로 발효성 매시의 새로운 배취를 제조하기 위해 쿡 워터 (cook water)와 배합하도록 반송되는 백세트를 형성할 것이다. 본 실시 형태의 또 하나의 이점은 액화 매시로부터 분리된 고형물의 수분에 보유된 임의의 잔류 용해 전분이 부분적으로 이러한 백세트를 통해 포획되어 회수될 수 있을 것이다는 것이다. 대안적으로, 고형물 스트림에 함유된 효모는 생존 불가능한 것으로 간주될 수 있으며, 수성 스트림, 및 발효로부터 잔류하는 임의의 알코올 (예를 들어, 부탄올) 함량의 증류된 이러한 배합된 스트림에 재분산될 수 있다. 생존 불가능한 유기체는 증식 프로세스의 영양소로서 사용하기 위해 추가로 분리될 수 있다.In another example of embodiment of the method of the present invention, the material discharged from the fermentation vessel is processed in a separation system comprising devices such as centrifuges, sedimentation baths, hydroclones, and the like, and combinations thereof, to directly or slight regeneration. High concentrations of live yeast can be recovered which can later be recycled for reuse in subsequent fermentation batches. This separation system also produces an organic stream comprising fatty esters (eg isobutyl fatty esters) and alcohols (eg isobutanol) resulting from fermentation and an aqueous stream containing only traces of immiscible organics. can do. This aqueous stream can be used to repulp and pump the low starch solids separated and rinsed from the liquefied mash before and after stripping of alcohol (eg isobutanol) content. This has the advantage that it may be possible to avoid transferring these solids from the liquefaction zone to the grain drying and syrup blend areas using a long belt driven conveying system. In addition, this pre-distillation wastewater produced after the alcohol (eg isobutanol) has been stripped will need to be separated into Dean Stilridge and wet cake fractions using existing or new separation equipment, which Dean Stilridge Partially backed bags will be formed to blend with cook water to produce a new batch of fermentable mash. Another advantage of this embodiment is that any residual dissolved starch retained in the water of the solid separated from the liquefied mash may be partially captured and recovered through this bagset. Alternatively, the yeast contained in the solids stream may be considered non-viable and may be redispersed in the aqueous stream, and this distilled combined stream of any alcohol (eg butanol) content remaining from the fermentation. have. Non-viable organisms can be further isolated for use as nutrients in the proliferation process.
다른 실시 형태에서, 다상 물질은 프리플래시 칼럼의 저부에 남겨질 수 있으며, 상술한 바와 같이 분리 시스템에서 처리될 수 있다. 농축 고형물은 수성 스트림에 재분산될 수 있으며, 이러한 배합된 스트림은 액화 매시로부터 분리되어 세정된 저 전분 고형물을 재펄프화하여 펌핑하도록 사용될 수 있다.In other embodiments, the multiphase material may be left at the bottom of the preflash column and treated in a separation system as described above. The concentrated solids can be redispersed in the aqueous stream and this combined stream can be used to repulp and pump the washed low starch solids separated from the liquefied mash.
상술한 프로세스 및 본 명세서에 기술된 다른 프로세스는 아스펜 모델링 (Aspen modeling)과 같은 수치 모델링을 사용하여 입증될 수 있다 (예를 들어, 미국 특허 제7,666,282호 참조). 예를 들어, 시판용 모델링 소프트웨어 아스펜 플러스 (Aspen Plus)? (미국 메사추세츠주 벌링턴에 소재하는 아스펜 테크놀러지, 인코포레이티드 (Aspen Technology, Inc.))는 통합적인 부탄올 발효, 정제, 및 물관리 프로세스용 아스펜 모델을 개발하기 위해, 미국 뉴욕주 뉴욕에 소재하는 아메리칸 인스티튜트 오브 케미컬 엔지니어즈, 인코포레이티드 (American Institute of Chemical Engineers, Inc.)로부터 입수가능한 DIPPR과 같은 물리적 특성 데이터베이스와 함께 사용될 수 있다. 이러한 프로세스 모델링은 다수의 기본적인 공학 계산, 예를 들어, 질량 및 에너지 균형, 증기/액체 평형, 및 반응 속도 계산을 수행할 수 있다. 아스펜 모델을 생성시키기 위해, 정보 입력은 예를 들어, 실험 데이터, 함수량 및 공급원료의 조성, 매시 쿠킹 및 플래싱을 위한 온도, 당화 조건 (예를 들어, 효소 공급, 전분 전환, 온도, 압력), 발효 조건 (예를 들어, 미생물 공급, 글루코스 전환, 온도, 압력), 탈가스 조건, 용매 칼럼, 프리플래시 칼럼, 응축기, 증발기, 원심분리기 등을 포함할 수 있다.The process described above and other processes described herein can be demonstrated using numerical modeling, such as Aspen modeling (see, eg, US Pat. No. 7,666,282). For example, commercial modeling software Aspen Plus? (Aspen Technology, Inc., Burlington, Mass.) Was developed in New York, NY, to develop an aspen model for integrated butanol fermentation, purification, and water management processes. It can be used with physical property databases, such as DIPPR, available from the American Institute of Chemical Engineers, Inc. Such process modeling can perform a number of basic engineering calculations, such as mass and energy balance, vapor / liquid equilibrium, and reaction rate calculations. In order to generate an aspen model, the input of information may include, for example, experimental data, water content and composition of the feedstock, temperature for mash cooking and flashing, glycosylation conditions (eg, enzyme feed, starch conversion, temperature, pressure), Fermentation conditions (eg, microbial feed, glucose conversion, temperature, pressure), degassing conditions, solvent columns, preflash columns, condensers, evaporators, centrifuges, and the like.
본 발명은 또한 발효를 통한 생성물 알코올과 같은 발효 산물을 생산하기 위한 시스템 및 방법, 및 바이오매스 가공 생산성 및 비용 효율성을 증가시키기 위한 시스템 및 방법을 제공한다. 일부 실시 형태에서, 생성물 알코올은 부탄올이다. 공급원료는 액화되어 공급원료 슬러리를 생성할 수 있으며, 공급원료 슬러리는 가용성 당 및 불용성 고형물을 포함한다. 공급원료 슬러리가 발효 용기에 직접 공급되는 경우에, 불용성 고형물은 발효 용기로부터의 부탄올과 같은 생성물 알코올의 효율적인 제거 및 회수를 방해할 수 있다. 특히, 액체-액체 추출이 발효 브로스로부터 부탄올을 추출하는데 사용되는 경우에, 불용성 미립자의 존재는 추출제와 발효 브로스 사이의 접촉을 방해하여 부탄올에서 추출제로의 물질 이동 속도를 감소시키는 것; 발효 용기에 에멀젼을 생성시켜, 추출제와 발효 브로스의 양호한 상분리를 방해하는 것; 적어도 일부의 추출제 및 부탄올이 결국 DDGS로서 제거되는 고형물에 "봉입"되기 때문에 추출제의 회수 및 재순환의 효율을 감소시키는 것; 고형물이 발효 용기의 부피를 차지하고 발효 브로스로부터 추출제가 보다 느리게 유리되기 때문에 발효 용기 부피 효율이 낮은 것; 및 옥수수유로 인한 오염에 의해 추출제의 라이프 사이클이 단축되는 것을 포함하나 이에 한정되지 않는 시스템 비효율성을 야기할 수 있다. 모든 이들 영향으로 인해, 높은 자본비 및 조업비를 초래한다. 또한, DDGS에 "봉입된" 추출제는 동물 사료로서의 판매를 위한 DDGS 가치 및 자격을 손상시킬 수 있다. 따라서, 이들 문제점을 피하고/피하거나 최소화하기 위해, 적어도 일부의 불용성 입자 (또는 고형물)가 공급원료 슬러리에 존재하는 당의 발효 용기로의 첨가 전에 공급원료 슬러리로부터 제거된다. 추출 활성 및 부탄올 생성 효율은 불용성 입자가 제거되지 않은 수용액을 함유하는 발효 브로스에서 행해지는 추출과 비교하여, 추출이 불용성 입자가 제거된 수용액을 함유하는 발효 브로스에서 행해지는 경우에 증가된다.The present invention also provides systems and methods for producing fermentation products such as product alcohols through fermentation, and systems and methods for increasing biomass processing productivity and cost efficiency. In some embodiments, the product alcohol is butanol. The feedstock may be liquefied to produce a feedstock slurry, the feedstock slurry comprising soluble sugars and insoluble solids. If the feedstock slurry is fed directly into the fermentation vessel, insoluble solids can interfere with the efficient removal and recovery of product alcohols such as butanol from the fermentation vessel. In particular, when liquid-liquid extraction is used to extract butanol from the fermentation broth, the presence of insoluble particulates interferes with the contact between the extractant and the fermentation broth to reduce the rate of mass transfer from butanol to the extractant; Creating an emulsion in the fermentation vessel, hindering good phase separation of the extractant and fermentation broth; Reducing the efficiency of recovery and recycling of the extractant since at least some extractant and butanol are “enclosed” in solids that are eventually removed as DDGS; Low fermentation vessel volume efficiency because the solids occupy the volume of the fermentation vessel and the extractant is released more slowly from the fermentation broth; And contamination with corn oil may cause system inefficiencies, including but not limited to shortening the life cycle of the extractant. All these effects result in high capital and operating costs. In addition, extractants "enclosed" in DDGS can impair DDGS value and eligibility for sale as animal feed. Thus, to avoid and / or minimize these problems, at least some insoluble particles (or solids) are removed from the feedstock slurry prior to addition of sugars present in the feedstock slurry to the fermentation vessel. The extraction activity and butanol production efficiency are increased when the extraction is done in a fermentation broth containing an aqueous solution from which insoluble particles have been removed, compared to the extraction carried out in a fermentation broth containing an aqueous solution from which insoluble particles have not been removed.
불용성 고형물이 존재하지 않는 추출 발효는 발효 브로스에서 추출제로의 생성물 알코올의 높은 물질 이동 속도, 발효 용기 내부 또는 외부의 발효로부터의 추출제의 우수한 상분리, 및 높은 추출제 액적 상승 속도의 결과로 추출제의 낮은 홀드업 (hold up)을 가져올 수 있다. 또한, 예를 들어, 발효 시에 발효 브로스에 홀드업된 추출제 액적은 보다 빠르게 보다 완전히 발효 브로스로부터 유리되어, 발효 브로스에 유리 추출제가 덜 존재하게 되므로, 프로세스에서 손실되는 추출제의 양을 감소시킬 수 있다. 또한, 예를 들어, 미생물은 재순환될 수 있으며, 예를 들어, 비어 칼럼 및/또는 전 증류 폐액 원심분리기 일부 또는 전체와 같은 다운스트림 처리에서의 추가 기기가 제거될 수 있다. 게다가, 예를 들어, 추출제가 DDGS에서 손실되는 가능성이 제거된다. 또한, 예를 들어, 미생물의 재순환 능력은 생성물 알코올의 전체 생성률을 증가시킬 수 있고, 전체 역가 필요량을 저하시킬 수 있고/있거나, 수성 역가 필요량을 저하시킬 수 있으므로, 보다 건강한 미생물 및 보다 높은 생성률을 가져올 수 있다. 또한, 예를 들어, 자본비를 저감하고; 추출제 홀드업이 최소화되고 불용성 고형물이 존재하지 않기 때문에 부피가 보다 효율적으로 사용되므로 발효 용기 생산성을 증가시키고/시키거나; 미개발 지역의 플랜트에 연속 발효 또는 소형 발효 용기를 사용하기 위해 발효 용기에서 교반기를 제거할 수 있다.Extractive fermentation in the absence of insoluble solids results in a high mass transfer rate of product alcohol from the fermentation broth to the extractant, good phase separation of the extractant from fermentation in or out of the fermentation vessel, and high extractant droplet ascent rate. This can result in a low hold up. Also, for example, the extractant droplets held up in the fermentation broth during fermentation are released more quickly from the fermentation broth more quickly, resulting in less free extractant in the fermentation broth, thus reducing the amount of extractant lost in the process. You can. Also, for example, the microorganisms can be recycled and additional equipment in downstream processing, such as, for example, some or all of the beer column and / or pre-distillation waste liquor centrifuges can be removed. In addition, for example, the possibility that the extractant is lost in the DDGS is eliminated. In addition, for example, the recycling capacity of microorganisms can increase the overall production rate of product alcohol, lower the overall titer requirement, and / or lower the aqueous titer requirement, resulting in healthier microorganisms and higher production rates. Can bring Furthermore, for example, the capital cost can be reduced; Increase fermentation vessel productivity as the volume is used more efficiently because extractant holdup is minimized and insoluble solids are not present; The stirrer can be removed from the fermentation vessel for use in continuous fermentation or small fermentation vessels in plants in undeveloped areas.
추출 효율 증가의 예로는 예를 들어, 안정화 분배 계수, 증가된 (예를 들어, 보다 빠르거나 더욱 완전한) 상분리, 액체-액체 물질 이동 계수 증가, 저 역가에서의 작업, 프로세스 스트림 재순환성 증가, 발효 부피 효율 증가, 공급원료 (예를 들어, 옥수수) 로드 공급 증가, 미생물 (예를 들어, 재조합 미생물)의 부탄올 역가 허용 범위 (titer tolerance) 증가, 물의 재순환, 에너지 절감, 추출제의 재순환 증가, 및/또는 미생물의 재순환을 포함할 수 있다.Examples of increased extraction efficiency include, for example, stabilization partition coefficients, increased (eg, faster or more complete) phase separation, increased liquid-liquid mass transfer coefficients, working at low titers, increased process stream recirculation, fermentation Increased volumetric efficiency, increased feedstock (e.g. corn) load supply, increased butanol titer tolerance of microorganisms (e.g. recombinant microorganisms), recycling water, saving energy, increasing recycling of extractant, and And / or recycling of microorganisms.
예를 들어, 고형물이 차지하는 발효 용기의 부피가 감소될 것이다. 따라서, 발효에 이용가능한 발효 용기의 유효 부피가 증가될 수 있다. 일부 실시 형태에서, 발효에 이용가능한 발효 용기의 부피는 적어도 약 10%로 증가된다.For example, the volume of the fermentation vessel occupied by the solids will be reduced. Thus, the effective volume of fermentation vessels available for fermentation can be increased. In some embodiments, the volume of fermentation vessel available for fermentation is increased to at least about 10%.
예를 들어, 분배 계수의 안정화가 이뤄질 수 있다. 발효 용기 중의 옥수수유가 발효 전에 공급원료 슬러리로부터 고형물을 제거함으로써 감소될 수 있기 때문에, 추출제는 추출제와 배합되는 옥수수유에 덜 접촉되며, 충분한 양으로 존재한다면 분배 계수를 저하시킬 수 있다. 따라서, 발효 용기에 도입되는 옥수수유의 감소로 발효 용기 중의 추출제 상의 보다 안정한 분배 계수가 유도된다. 일부 실시 형태에서, 분배 계수는 10회 발효 사이클에 대하여 약 10% 미만으로 감소된다.For example, stabilization of the distribution coefficients can be achieved. Since the corn oil in the fermentation vessel can be reduced by removing solids from the feedstock slurry prior to fermentation, the extractant is less in contact with the corn oil combined with the extractant and, if present in sufficient quantity, can lower the partition coefficient. Thus, the reduction of corn oil introduced into the fermentation vessel leads to a more stable partition coefficient of the extractant in the fermentation vessel. In some embodiments, the partition coefficient is reduced to less than about 10% for 10 fermentation cycles.
예를 들어, 발효 브로스로부터 추출제로의 생성물 알코올의 고 물질 이동 속도 (예를 들어, 고 물질 이동 계수의 형태)에 의해, 생성물 알코올의 생성 효율 증가를 가져올 것이기 때문에, 추출제를 사용한 부탄올의 추출 효율이 증가될 수 있다. 일부 실시 형태에서, 물질 이동 계수는 적어도 2배로 증가된다 (실시예 4 및 5 참조).Extraction of butanol with an extractant, for example, because the high mass transfer rate of the product alcohol from the fermentation broth to the extractant (eg, in the form of a high mass transfer coefficient) will result in an increased production efficiency of the product alcohol. Efficiency can be increased. In some embodiments, the mass transfer coefficient is increased at least twice (see Examples 4 and 5).
또한, 발효 브로스와 추출제 사이의 상분리가 증가될 수 있으며, 이는 에멀젼 형성 가능성을 줄이므로, 생성물 알코올의 생성 효율 증가를 가져온다. 예를 들어, 상분리는 보다 빠르게 일어날 수 있거나 더욱 완전하게 될 수 있다. 일부 실시 형태에서, 이전에 주목할 만한 상분리가 관찰되지 않은 상분리가 24 시간 내에 일어날 수 있다. 일부 실시 형태에서, 상분리는 고형물이 제거되지 않은 상분리 (실시예 6 및 7 참조)와 비교하여, 적어도 약 2배, 적어도 약 5배, 또는 적어도 약 10배의 속도로 일어난다.In addition, phase separation between the fermentation broth and the extractant may be increased, which reduces the likelihood of emulsion formation, resulting in an increased production efficiency of the product alcohol. For example, phase separation may occur faster or may be more complete. In some embodiments, phase separation may occur within 24 hours in which no previously noticeable phase separation has been observed. In some embodiments, phase separation occurs at a rate of at least about 2 times, at least about 5 times, or at least about 10 times compared to phase separation where solids have not been removed (see Examples 6 and 7).
게다가, 추출제의 회수 및 재순환이 증가될 수 있다. 추출제는 고형물에 "봉입"되지 않을 것이어서, 결국은 DDGS로서 제거될 수 있으므로, 생성물 알코올의 생성 효율 증가 (실시예 8 및 9 참조)를 가져올 수 있다. 또한, 옥수수유에 의한 추출제의 희석이 덜하게 되어, 추출제의 분해가 덜 일어날 수 있다 (실시예 10 참조).In addition, recovery and recycling of the extractant may be increased. The extractant will not be "enclosed" in the solids, and can eventually be removed as DDGS, resulting in increased production efficiency of the product alcohol (see Examples 8 and 9). In addition, less dilution of the extractant with corn oil may result in less degradation of the extractant (see Example 10).
또한, 추출제의 유량이 감소될 수 있어서, 조업비가 저하되어, 생성물 알코올의 생성 효율 증가를 가져올 것이다.In addition, the flow rate of the extractant can be reduced, which lowers the operating cost, resulting in an increase in the production efficiency of the product alcohol.
게다가, 추출제의 홀드업은 고 속도로 상승하는 추출제 액적의 결과로서 감소될 것이므로, 생성물 알코올의 생성 효율 증가를 가져올 것이다. 발효 용기 중의 불용성 고형물의 양의 감소도 생성물 알코올의 생성 효율 증가를 가져올 것이다.In addition, the holdup of the extractant will be reduced as a result of the extractant droplets rising at a high rate, resulting in an increase in the production efficiency of the product alcohol. Reducing the amount of insoluble solids in the fermentation vessel will also result in increased production efficiency of the product alcohol.
또한, 교반기는 더 이상 불용성 고형물을 현탁시킬 필요가 없기 때문에 발효 용기로부터 제거될 수 있으므로, 자본비 및 에너지가 절감되고, 생성물 알코올의 생성 효율이 증가된다.In addition, the stirrer can be removed from the fermentation vessel because it no longer needs to suspend insoluble solids, thus saving capital cost and energy, and increasing the production efficiency of the product alcohol.
도 1 내지 5는 알코올 에스테르가 원위치에 생성되고, 발효 배지로부터 추출되며, 반응하여 생성물 알코올을 회수하는 발효 프로세스를 포함하는 방법 및 시스템의 다양한 비한정적인 실시 형태를 제공한다. 도 1 내지 5는 또한 생성물 알코올로 에스테르화될 수 있고, 동시에 ISPR 추출제로서 작용할 수 있는 카르복실산을 사용하는 방법 및 시스템의 다양한 비한정적인 실시 형태를 제공한다. 도 1 내지 5는 또한 공급원료 중의 지질을, 생성물 알코올로 에스테르화될 수 있고, 동시에 ISPR 추출제로서 작용할 수 있는 카르복실산으로 전환시키는 방법 및 시스템의 다양한 비한정적인 실시 형태를 제공한다.1-5 provide various non-limiting embodiments of methods and systems that include a fermentation process in which alcohol esters are produced in situ, extracted from fermentation medium, and reacted to recover product alcohol. 1-5 also provide various non-limiting embodiments of methods and systems using carboxylic acids that can be esterified with product alcohols and can simultaneously act as ISPR extractant. 1-5 also provide various non-limiting embodiments of methods and systems for converting lipids in a feedstock into carboxylic acids that can be esterified with product alcohols and at the same time can act as an ISPR extractant.
도 1 내지 5에 관하여 기술된 임의의 상술한 실시 형태를 비롯한 일부 실시 형태에서, 발효 용기 (30) 중의 발효 브로스는 적어도 하나의 발효성 탄소원으로부터 생합성 경로를 통해 부탄올을 생성하기 위해 유전자 변형된 (즉, 유전자 조작된) 적어도 하나의 재조합 미생물 (32)을 포함한다. 특히, 재조합 미생물은 적절한 탄소 기질을 함유하는 발효 브로스에서 성장될 수 있다. 추가의 탄소 기질은 단당류, 예컨대 프룩토스 및 갈락토스; 올리고당, 예컨대 락토스, 말토스, 또는 수크로스; 다당류, 에컨대 전분 또는 셀룰로스; 또는 이들의 혼합물 및 재생가능한 공급원료로부터의 미정제 혼합물, 예컨대 치즈 유청 막투과액 (cheese whey permeate), 옥수수 침지액, 사탕무우 당밀, 및 보리 맥아를 포함할 수 있으나 이에 한정되지 않는다. 다른 탄소 기질은 에탄올, 락테이트, 석시네이트 또는 글리세롤을 포함할 수 있다.In some embodiments, including any of the above described embodiments described with respect to FIGS. 1-5, the fermentation broth in
게다가, 탄소 기질은 1 탄소 기질, 예를 들어, 이산화탄소, 또는 중요한 생화학적 중간체로의 대사적 전환이 입증된 메탄올일 수도 있다. 1 탄소 및 2 탄소 기질 이외에도, 메틸로트로픽 유기체 (methylotrophic organism)도 다수의 다른 탄소 함유 화합물, 예를 들어 메틸아민, 글루코사민 및 다양한 아미노산을 대사 활성에 이용하는 것으로 공지되어 있다. 예를 들어, 메틸로트로픽 효모는 메틸아민 유래의 탄소를 이용하여 트레할로스 또는 글리세롤을 형성하는 것으로 공지되어 있다 (Bellion, et al., Microb. Growth C1 Compd., [Int. Symp.], 7th (1993), 415-32, Editor(s): Murrell, J. Collin; Kelly, Don P. Publisher: Intercept, Andover, UK). 마찬가지로, 다양한 종의 칸디다는 알라닌 또는 올레산을 대사 작용할 것이다 (Sulter et al., Arch. Microbiol. 153:485-489, 1990). 따라서, 본 발명에서 이용되는 탄소원은 매우 다양한 탄소 함유 기질을 포함할 수 있으며, 단지 유기체의 선택에 의해 한정될 것으로 생각된다.In addition, the carbon substrate may be a single carbon substrate, for example carbon dioxide, or methanol, which has demonstrated metabolic conversion to important biochemical intermediates. In addition to mono and bi carbon substrates, methylotrophic organisms are also known to utilize a number of other carbon containing compounds such as methylamine, glucosamine and various amino acids for metabolic activity. For example, methyltropic yeast is known to form trehalose or glycerol using carbon derived from methylamine (Bellion, et al., Microb. Growth C1 Compd., [Int. Symp.], 7th ( 1993), 415-32, Editor (s): Murrell, J. Collin; Kelly, Don P. Publisher: Intercept, Andover, UK). Likewise, Candida of various species will metabolize alanine or oleic acid (Sulter et al., Arch. Microbiol. 153: 485-489, 1990). Thus, the carbon source used in the present invention may include a wide variety of carbon containing substrates, and is believed to be limited only by the choice of organism.
상술한 탄소 기질 및 이들의 혼합물 모두가 적합한 것으로 고려되지만, 몇몇 실시형태에서, 탄소 기질은 글루코스, 프룩토스 및 수크로스, 또는 C5 당을 사용하도록 변형된 효모 세포를 위한 자일로스 및/또는 아라비노스와 같은 C5 당과의 이들의 혼합물이다. 수크로스는 재생가능한 당 공급원, 이를 테면 사탕수수, 사탕무우, 카사바 (cassava), 단 수수 (sweet sorghum) 및 이들의 혼합물로부터 유래될 수 있다. 글루코스 및 덱스트로스는 옥수수, 밀, 호밀, 보리, 귀리 및 이들의 혼합물과 같은 곡물을 비롯한 전분계 공급원료의 당화를 통하여 재생가능한 곡물 공급원으로부터 유래될 수 있다. 또한, 발효성 당은 예를 들어, 본 명세서에 참고로 포함되는, 미국 특허 출원 공개 제2007/0031918 A1호에 기재된 바와 같이, 전처리 및 당화 프로세스를 통하여 재생가능한 셀룰로스계 또는 리그노셀룰로스계 바이오매스로부터 유래될 수 있다. 적절한 탄소원 (수성 스트림 (22)으로부터) 이외에도, 발효 브로스는 적절한 무기질, 염, 보조인자, 완충액 및 생성물 알코올의 생성을 위한 효소 경로의 촉진 및 배양 성장에 적합한, 당업자에게 공지된 다른 성분을 함유해야 한다.Although all of the aforementioned carbon substrates and mixtures thereof are considered suitable, in some embodiments, the carbon substrate is xylose and / or arabinose for yeast cells modified to use glucose, fructose and sucrose, or C5 sugars. And mixtures thereof with C5 sugars. Sucrose can be derived from renewable sugar sources such as sugar cane, sugar beet, cassava, sweet sorghum and mixtures thereof. Glucose and dextrose may be derived from renewable grain sources through saccharification of starch-based feedstocks, including grains such as corn, wheat, rye, barley, oats and mixtures thereof. Fermentable sugars are also cellulosic or lignocellulosic biomass that can be regenerated through pretreatment and saccharification processes, as described, for example, in US Patent Application Publication No. 2007/0031918 A1, which is incorporated herein by reference. Can be derived from. In addition to a suitable carbon source (from aqueous stream 22), the fermentation broth should contain other ingredients known to those skilled in the art, suitable for the growth of cultures and for the promotion of enzymatic pathways for the production of suitable minerals, salts, cofactors, buffers and product alcohols. do.
상기 논의와 실시예로부터, 당업자는 본 발명의 기본적인 특징을 확인할 수 있으며, 본 발명을 벗어나지 않고서도 본 발명의 다양한 변화와 변형을 이루어, 본 발명을 다양한 용도와 상태에 적응시킬 수 있다. 예를 들어, 일부 실시 형태에서, 본 발명에 따른 알코올 에스테르화 및 추출은 즉, 발효 용기 (30)에서의 발효에 앞서 미생물 (32)의 종배양 시의 전 발효 (pre-fermentation)로 이용될 수 있다. 전형적으로, 효모와 같은 미생물 (32)은 당업계에 공지된 바와 같이, 발효 용기 (30)에 수확되어 접종되기 전에 원하는 세포 농도로 종배양으로부터 성장될 수 있다.From the above discussion and examples, those skilled in the art can identify the basic features of the present invention, and various changes and modifications of the present invention can be made without departing from the present invention to adapt the present invention to various uses and conditions. For example, in some embodiments, alcohol esterification and extraction according to the present invention may be used for pre-fermentation during the cultivation of
탄소원 공급원료는 효모 생성과 같은 미생물 생성에 있어서 중요한 비용 인자이고, 따라서, 당에 대한 바이오매스 수율은 중요한 최적화 기준이다. 알코올 발효로부터의 ATP 수율이 호흡성 당의 이화 작용으로부터의 그것보다 훨씬 더 낮기 때문에, 알코올 발효의 발생은 바이오매스 수율에 악영향을 미치며, 효모 생성 (즉, 종배양) 시에 피하게 되도록 시도된다. 그럼에도 불구하고, 종배양 배지에서의 미생물의 배양에 의해 알코올을 비롯한 소정량의 발효 산물을 생성할 수 있다. 예를 들어, 사카로마이세스 세레비시아 효모에서, 알코올 발효 및 호흡은 비성장 속도 (specific growth rate) (μ) 및/또는 호기성 배양의 당 농도가 임계값을 초과할 때마다 동시에 일어난다 (예를 들어, van Hoek, et al., Biotechnol. Bioeng. 68:517-523, 2000 참조). 고 바이오매스 수율을 달성하기 위해, 효모 성장은 전형적으로 예를 들어, 종배양을 위한 유가식 (fed-batch) 발효 기술을 이용한 호흡 조건에 의해 조절된다. 예를 들어, 당은 저 속도로 공급되어, 배양에서의 당 농도 및 당 흡수 속도가 낮아서, 당 대사는 실질적으로 호흡기관에서 이뤄질 수 있다. 이러한 조건 하에, 고 바이오매스 수율이 얻어질 수 있고, 독성 산물의 축적이 최소화될 수 있다. 실제로, 대규모 유가식 산업 프로세스에서, 세포는 비효율적인 혼합으로 인해 농도 구배에 접하게 될 수 있다 (예를 들어, Enfors, et al., J. Biotechnol. 85:175-185, 2001 참조). 발효 부생성물의 생성 및 재동화 (reassimilation)는 실험실 규모와 비교하여, 대규모 생물반응기에서 글루코스 당 바이오매스 수율의 감소에 대한 이유 중 하나일 수 있다.Carbon source feedstock is an important cost factor in the production of microorganisms such as yeast production, so biomass yield for sugar is an important optimization criterion. Since ATP yield from alcohol fermentation is much lower than that from catabolism of respirable sugars, the occurrence of alcohol fermentation adversely affects biomass yield and is attempted to be avoided during yeast production (ie, cultivation). Nevertheless, the cultivation of microorganisms in a cultivation medium can produce a predetermined amount of fermentation products, including alcohol. For example, in Saccharomyces cerevisiae yeast, alcohol fermentation and respiration occur simultaneously whenever the specific growth rate (μ) and / or the sugar concentration in aerobic culture exceeds a threshold (eg See, for example, van Hoek, et al., Biotechnol. Bioeng. 68: 517-523, 2000). To achieve high biomass yields, yeast growth is typically controlled by respiratory conditions using, for example, fed-batch fermentation techniques for species culture. For example, sugars are fed at low rates, resulting in low sugar concentrations and low rates of sugar absorption in culture, so that sugar metabolism can occur substantially in the respiratory tract. Under these conditions, high biomass yields can be obtained and accumulation of toxic products can be minimized. Indeed, in large scale fed-batch industrial processes, cells may encounter concentration gradients due to inefficient mixing (see, eg, Enfors, et al., J. Biotechnol. 85: 175-185, 2001). The production and reassimilation of fermentation byproducts may be one of the reasons for the reduction of biomass yield per glucose in large scale bioreactors compared to laboratory scale.
그러나, 이러한 조건에서, 부탄올 생성 효모의 배양 시에, 예를 들어, 부탄올을 비롯한 발효 산물은 재동화될 수 없고, 배지에 축적될 수 있으므로, 고 농도에서 미생물에 유독할 수 있다. 생성물 축적이 임계 세포 성장 저해 농도 (예를 들어, 세포 성장은 공급에 의해 제한될 수 있는 성장보다 낮음)를 초과하면, 유가식 제어 손실이 일어날 수 있다. 본 발명에 따르면, 배지로부터 부탄올을 제거하기 위한 알코올 에스테르화 및 추출을 이용함으로써, 비효율적인 혼합 및 부탄올 독성의 문제에도 불구하고, 유가식 발효를 진행시킬 수 있다.However, under these conditions, fermentation products, including butanol, for example, in culture of butanol producing yeast may not be resynchronized and may accumulate in the medium and thus be toxic to microorganisms at high concentrations. If product accumulation exceeds a critical cell growth inhibitory concentration (eg, cell growth is lower than growth that can be limited by feeding), fed-batch control loss can occur. According to the present invention, by using alcohol esterification and extraction to remove butanol from the medium, fed-batch fermentation can be advanced despite the problems of inefficient mixing and butanol toxicity.
따라서, 일부 실시 형태에 따라, 종배양 배지는 촉매 (42) 및 카르복실산 (28)과 접촉되어, 생성물 알코올의 에스테르화에 의해 알코올 에스테르를 생성시키며, 궁극적으로 대규모 생물반응기에서 글루코스 당 바이오매스 수율을 향상시킬 수 있다. 게다가, 배지에서의 생성물 알코올의 농도는 알코올 에스테르화에 의해 제어되므로, 미생물에 대한 생성물 알코올의 유해 효과를 최소화하거나 피할 수 있다. 일부 실시 형태에서, 알코올 에스테르는 발효 용기 (30)로부터의 알코올 에스테르의 추출 및 생성물 알코올 (54)의 회수에 관하여 상술한 바와 동일한 방법으로 알코올 에스테르로부터 회수된 알코올 및 종배양 배지로부터 추출될 수 있다. 일부 실시 형태에서, 본 발명에 의한 알코올 에스테르화가 이용되어, 종배양 배지 및 발효 배지에서 생성물 알코올을 에스테르화할 수 있다. 이러한 실시 형태에서, 생성물 알코올의 고 수율은 전체적으로, 발효 배지로부터 알코올 에스테르 (및 유리 생성물 알코올)를 회수할 뿐만 아니라, 종배양 시에 생성된 알코올 에스테르를 회수 (예를 들어, 증식 탱크로부터 알코올 에스테르 및/또는 생성물 알코올을 회수)함으로써 발효 프로세스에 대하여 달성될 수 있다. 일부 실시 형태에서, 본 발명에 의한 알코올 에스테르화는 종배양 배지로부터의 알코올 제거를 위해 전 발효로 이용될 수 있지만, 생성물 알코올의 통상적인 ISPR은 발효 용기 (30)에서 발효 시에 생성물 알코올의 제거를 위해 이용될 수 있다.Thus, according to some embodiments, the culturing medium is contacted with
따라서, 본 발명에 의한 알코올 에스테르화 및 추출은 본 발명을 벗어나지 않고서 알코올 발효 프로세스에서 다양한 단계로 이용될 수 있다.Thus, alcohol esterification and extraction according to the present invention can be used at various stages in the alcohol fermentation process without departing from the present invention.
본 발명의 방법에 의해 생성된 알코올 생성물은 예를 들어, 시약, 용매, 및 연료로서의 다수의 용도를 갖는다. 청구범위의 방법에 의해 생성된 부탄올은 연료 (예를 들어, 바이오 연료), 연료 첨가제, 디젤 또는 바이오디젤 연료로서 사용될 수 있는 에스테르의 생성을 위해 사용되는 알코올, 플라스틱 공업에서의 공급원료 화학물, 화장품과 같은 제형화 제품의 성분, 및 화학 중간체로서 직접 사용될 수 있다. 부탄올은 또한 페인트, 코팅, 바니쉬, 수지, 검, 염료, 지방, 왁스, 수지, 셸락, 고무, 및 알칼로이드용 용매로서 사용될 수 있다. 따라서, 본 발명은 이러한 공업 화학 물질의 높은 수요를 지지할 수 있는, 부탄올을 비롯한 알코올을 생성하는 대체 방법을 제공한다.Alcohol products produced by the process of the invention have many uses, for example as reagents, solvents, and fuels. Butanol produced by the process of the claims is used for the production of fuels (eg biofuels), fuel additives, esters that can be used as diesel or biodiesel fuels, alcohols, feedstock chemicals in the plastics industry, It can be used directly as a component of formulated products such as cosmetics, and as chemical intermediates. Butanol can also be used as solvent for paints, coatings, varnishes, resins, gums, dyes, fats, waxes, resins, shellacs, rubbers, and alkaloids. Thus, the present invention provides an alternative method for producing alcohols including butanol that can support the high demand of such industrial chemicals.
재조합 미생물 및 부탄올 생합성 경로Recombinant Microorganisms and Butanol Biosynthetic Pathways
이론에 구속되는 것은 아니지만, 본 명세서에 기재된 프로세스는 이의 허용 범위를 초과하는 역가로 알코올을 생성하는 임의의 알코올 생성 미생물, 특히 재조합 미생물과 함께 유용한 것으로 여겨진다.Without wishing to be bound by theory, the processes described herein are believed to be useful with any alcohol producing microorganism, in particular recombinant microorganisms, which produce alcohol with titers exceeding their acceptable range.
알코올 생성 미생물은 당업계에 공지되어 있다. 예를 들어, 메탄 산화 (methanotrophic) 세균 (예를 들어, 메틸로시누스 트리코스포리움 (Methylosinus trichosporium))에 의한 메탄의 발효성 산화에 의해 메탄올을 생성시키며, 메탄올 (C1 알킬 알코올)을 카르복실산 및 카르복실산을 메탄올로 에스테르화할 수 있는 촉매와 접촉시켜 카복실산의 메탄올 에스테르를 생성시킨다. 효모 균주 CEN.PK113-7D (CBS 8340, the Centraal Buro voor Schimmelculture; van Dijken, et al., Enzyme Microb. Techno. 26:706-714, 2000)는 에탄올을 생성시킬 수 있으며, 에탄올을 카르복실산 및 카르복실산을 에탄올로 에스테르화할 수 있는 촉매와 접촉시켜 에틸 에스테르를 생성시킨다 (예를 들어, 실시예 36 참조).Alcohol producing microorganisms are known in the art. For example, methanol is produced by fermentative oxidation of methane by methanetrophic bacteria (e.g., Methylosinus trichosporium) and methanol (C 1 alkyl alcohol) The acid and the carboxylic acid are contacted with a catalyst capable of esterifying with methanol to produce a methanol ester of the carboxylic acid. Yeast strain CEN.PK113-7D (CBS 8340, the Centraal Buro voor Schimmelculture; van Dijken, et al., Enzyme Microb. Techno. 26: 706-714, 2000) can produce ethanol and ethanol to carboxylic acid And contacting the carboxylic acid with a catalyst capable of esterifying with ethanol to produce an ethyl ester (see, eg, Example 36).
알코올을 생성하는 재조합 미생물도 당업계에 공지되어 있다 (예를 들어, 본 명세서에 참조로 포함되는, Ohta, et al., Appl. Environ. Microbiol. 57:893-900, 1991; Underwood, et al., Appl. Environ. Microbiol. 68:1071-1081, 2002; Shen and Liao, Metab. Eng. 10:312-320, 2008; Hahnai, et al., Appl. Environ. Microbiol. 73:7814-7818, 2007; 미국 특허 제5,514,583호; 미국 특허 제5,712,133호; 국제 특허 출원 공개 제WO 1995/028476호; Feldmann, et al., Appl. Microbiol. Biotechnol. 38: 354-361, 1992; Zhang, et al., Science 267:240-243, 1995; 미국 특허 출원 공개 제2007/0031918 A1호; 미국 특허 제7,223,575호; 미국 특허 제7,741,119호; 미국 특허 출원 공개 제2009/0203099 A1호; 미국 특허 출원 공개 제2009/0246846 A1호; 및 국제 특허 출원 공개 제WO 2010/075241호).Recombinant microorganisms producing alcohols are also known in the art (eg, Ohta, et al., Appl. Environ. Microbiol. 57: 893-900, 1991; Underwood, et al. , Appl. Environ.Microbiol. 68: 1071-1081, 2002; Shen and Liao, Metab. Eng. 10: 312-320, 2008; Hahnai, et al., Appl. Environ.Microbiol. 73: 7814-7818, 2007; US Pat. No. 5,514,583; US Pat. No. 5,712,133; WO 1995/028476; Feldmann, et al., Appl. Microbiol. Biotechnol. 38: 354-361, 1992; Zhang, et al. , Science 267: 240-243, 1995; US Patent Application Publication No. 2007/0031918 A1; US Patent 7,223,575; US Patent 7,741,119; US Patent Application Publication 2009/0203099 A1; US Patent Application Publication 2009 / 0246846 A1 and International Patent Application Publication No. WO 2010/075241).
부탄올을 생성할 수 있는 적절한 재조합 미생물은 당업계에 공지되어 있으며, 부탄올을 생성할 수 있는 특정한 적절한 미생물은 본 명세서에 기재되어 있다. 생합성 경로를 통해 부탄올을 생성시키는 재조합 미생물은 클로스트리듐속, 자이모모나스속, 대장균속, 살모네라속, 세라티아속, 에르비니아속, 클렙시엘라속, 시겔라속, 로도코커스속, 슈도모나스속, 바실러스속, 락토바실러스속, 장내 구균속, 알칼리게네스속, 클렙시엘라속, 패니바실러스속, 관절 포자균속, 코리네박테리움속, 브레비박테리움속, 스키조사카로마이세스속, 클루이베로마이세스속, 야로위아속, 피키아속, 칸디다속, 한세뉼라속, 이사첸키아속, 또는 사카로마이세스속의 구성원을 포함할 수 있다. 일 실시 형태에서, 재조합 미생물은 대장균 (Escherichia coli), 락토바실러스 플란타룸 (Lactobacillus plantarum), 클루이베로마이세스 락티스 (Kluyveromyces lactis), 클루이베로마이세스 마르시아누스 (Kluyveromyces marxianus), 및 사카로마이세스 세레비시아 (Saccharomyces cerevisiae)로 구성되는 그룹 중에서 선택될 수 있다. 일 실시 형태에서, 재조합 미생물은 효모이다. 일 실시 형태에서, 재조합 미생물은 사카로마이세스, 자이고사카로마이세스 (Zygosaccharomyces), 스키조사카로마이세스, 덱케라 (Dekkera), 토룰롭시스 (Torulopsis), 브레타노마이세스 (Brettanomyces), 및 다수의 칸디다종 중에서 선택되는 크랩트리 양성 (crabtree-positive) 효모이다. 크랩트리 양성 효모 종은 사카로마이세스 세레비시아, 사카로마이세스 클루이베리 (Saccharomyces kluyveri), 스키조사카로마이세스 폼베, 사카로마이세스 바야누스 (Saccharomyces bayanus), 사카로마이세스 미키타에 (Saccharomyces mikitae), 사카로마이세스 파라독수스 (Saccharomyces paradoxus), 자이고사카로마이세스 룩시이 (Zygosaccharomyces rouxii), 및 칸디다 글라브라타 (Candida glabrata)를 포함하나, 이에 한정되지 않는다.Suitable recombinant microorganisms capable of producing butanol are known in the art and certain suitable microorganisms capable of producing butanol are described herein. Recombinant microorganisms that produce butanol through the biosynthetic pathway include Clostridium, Zymonas, E. coli, Salmonera, Serratia, Erbinia, Klebsiella, Shigella, Rhodococcus and Pseudomonas. , Genus Bacillus, Lactobacillus, Enterococci, Alkali genus, Klebsiella, Fanibacilli, Articular spores, Corynebacterium, Brevibacterium, Ski investigation caromyces, Klui Members of the genus Veromaises, Jarowia, Pichia, Candida, Hansenula, Ischenchenia, or Saccharomyces. In one embodiment, the recombinant microorganism is Escherichia coli , Lactobacillus plantarum ), Kluyveromyces lactis ), Kluyveromyces marxianus , and Saccharomyces cerevisiae ) can be selected from the group consisting of. In one embodiment, the recombinant microorganism is yeast. In one embodiment, the recombinant microorganism is my access to my process, Xi Kosaka a saccharide (Zygosaccharomyces), ski irradiation Caro My process, deck Mosquera (Dekkera), sat rulrop sheath (Torulopsis), Breda Gaetano My process (Brettanomyces), and Crabtree-positive yeast selected from a number of Candida species. Crabtree positive yeast species are Saccharomyces kluyveri , Saccharomyces kluyveri , Schicharomyces pombe , Saccharomyces bayanus , Saccharomyces bayanus and Saccharomyces mikitae . (Saccharomyces mikitae), my process to the saccharide's para doksu (Saccharomyces paradoxus), Zygosaccharomyces my process to look Shi Xi Kosaka (rouxii), and Candida glabrata (Candida glabrata ), but is not limited thereto.
일부 실시 형태에서, 숙주 세포는 사카로마이세스 세레비시아 (Saccharomyces cerevisiae)이다. 사카로마이세스 세레비시아 효모는 당업계에 공지되어 있으며, 아메리칸 타입 컬쳐 컬렉션 (미국 메릴랜드주 로크빌에 소재), 네덜란드의 왕립미생물자원센터 (Centraalbureau voor Schimmelcultures (CBS) Fungal Biodiversity Centre), 르사프, 게르트 스트랜드 에이비, 펌 솔루션즈, 노스 아메리칸 바이오프로덕츠, 마트렉스, 및 랄르망을 포함하나 이에 한정되지 않는 다양한 공급업체로부터 입수가능하다. 사카로마이세스 세레비시아는 BY4741, CEN.PK 113-7D, 에탄올 레드? 효모, 펌 프로™ 효모, 바이오-펌? XR 효모, 게르트 스트랜드 프레스티지 배취 터보 알코올 효모, 게르트 스트랜드 포트 (Pot) 디스틸러즈 효모, 게르트 스트랜드 디스틸러즈 터보 효모, 퍼맥스™ 그린 효모, 퍼맥스™ 골드 효모, 서모사크? 효모, BG-1, PE-2, CAT-1, CBS7959, CBS7960, 및 CBS7961을 포함하나, 이에 한정되지 않는다.In some embodiments, the host cell is Saccharomyces cerevisiae . Saccharomyces cerevisiae yeasts are known in the art and include the American Type Culture Collection (Rockville, MD), the Centraalbureau voor Schimmelcultures (CBS) Fungal Biodiversity Centre, Lesaf. , Gert Strand Abs, Firm Solutions, North American Bioproducts, Matrex, and Lall Mans are available from a variety of suppliers. Saccharomyces cerevisiae BY4741, CEN.PK 113-7D, Ethanol Red? Yeast, Firm Pro ™ Yeast, Bio-Perm? XR Yeast, Gert Strand Prestige Batch Turbo Alcohol Yeast, Gert Strand Pot Distillers Yeast, Gert Strand Distillers Turbo Yeast, Permax ™ Green Yeast, Permax ™ Gold Yeast, Thermosac? Yeast, BG-1, PE-2, CAT-1, CBS7959, CBS7960, and CBS7961.
미생물을 사용한 발효를 이용하는 부탄올 생성, 및 부탄올을 생성하는 미생물은 예를 들어, 본 명세서에 참조로 포함하는 미국 특허 출원 공개 제2009/0305370호에 개시되어 있다. 일부 실시 형태에서, 미생물은 부탄올 생합성 경로를 포함한다. 일부 실시 형태에서, 경로의 기질에서 생성물로의 전환을 촉매하는 적어도 1개, 적어도 2개, 적어도 3개, 또는 적어도 4개의 폴리펩티드는 미생물의 이종 폴리뉴클레오티드에 의해 인코딩된다. 일부 실시 형태에서, 경로의 기질에서 생성물의 전환을 촉매하는 모든 폴리펩티드는 미생물의 이종 폴리뉴클레오티드에 의해 인코딩된다. 일부 실시 형태에서, 미생물은 피루베이트 데카르복실라제 활성의 저하 또는 제거를 포함한다. 피루베이트 데카르복실라제 활성을 실질적으로 갖지 않는 미생물은 본 명세서에 참조로 포함되는 미국 특허 출원 공개 제2009/0305363호에 기재되어 있다. GPD2와 같은 NAD 의존성 글리세롤-3-포스페이트 탈수소 효소 활성을 갖는 효소를 실질적으로 갖지 않는 미생물도 본 명세서에 기재되어 있다.Butanol production using fermentation using microorganisms, and microorganisms that produce butanol, are disclosed, for example, in US Patent Application Publication No. 2009/0305370, which is incorporated herein by reference. In some embodiments, the microorganism comprises a butanol biosynthetic pathway. In some embodiments, at least one, at least two, at least three, or at least four polypeptides that catalyze the conversion of substrates to substrates of the pathway are encoded by heterologous polynucleotides of the microorganism. In some embodiments, all polypeptides that catalyze the conversion of products in substrates of the pathway are encoded by heterologous polynucleotides of the microorganism. In some embodiments, the microorganism comprises lowering or elimination of pyruvate decarboxylase activity. Microorganisms substantially free of pyruvate decarboxylase activity are described in US Patent Application Publication No. 2009/0305363, which is incorporated herein by reference. Microorganisms that are substantially free of enzymes with NAD dependent glycerol-3-phosphate dehydrogenase activity, such as GPD2, are also described herein.
부탄올의 생성에 적합한 생합성 경로는 당업계에 공지되어 있고, 특정한 적절한 경로는 본 명세서에 기재되어 있다. 일부 실시 형태에서, 부탄올 생합성 경로는 숙주 세포와 이종인 적어도 하나의 유전자를 포함한다. 일부 실시 형태에서, 부탄올 생합성 경로는 숙주 세포와 이종인 하나 초과의 유전자를 포함한다. 일부 실시 형태에서, 부탄올 생합성 경로는 생합성 경로의 매 단계에 상응하는 폴리펩티드를 인코딩하는 이종 유전자를 포함한다.Suitable biosynthetic pathways for the production of butanol are known in the art and certain suitable routes are described herein. In some embodiments, the butanol biosynthetic pathway comprises at least one gene that is heterologous to the host cell. In some embodiments, the butanol biosynthetic pathway comprises more than one gene that is heterologous to the host cell. In some embodiments, the butanol biosynthetic pathway comprises a heterologous gene encoding a polypeptide corresponding to every step of the biosynthetic pathway.
지시된 기질에서 생성물로의 전환을 촉매하는 능력이 있는 특정한 적절한 단백질은 본 명세서에 기재되어 있고, 다른 적절한 단백질은 당업계에 제공되어 있다. 예를 들어, 본 명세서에 참조로 포함되는 미국 특허 출원 공개 제2008/0261230호, 제2009/0163376호, 및 제2010/0197519호에는 아세토하이드록시산 아이소메로리덕타제 (isomeroreductase)가 기재되어 있고; 본 명세서에 참조로 포함되는 미국 특허 출원 공개 제2010/0081154호에는 다이하이드록시산 탈수 효소가 기재되어 있으며; 알코올 탈수소 효소는 본 명세서에 참조로 포함되는 미국 특허 출원 공개 제2009/0269823호에 기재되어 있다.Certain suitable proteins with the ability to catalyze the conversion of the indicated substrates to the products are described herein, and other suitable proteins are provided in the art. For example, US Patent Application Publication Nos. 2008/0261230, 2009/0163376, and 2010/0197519, which are incorporated herein by reference, describe acetohydroxy acid isomeroreductases; US Patent Application Publication No. 2010/0081154, which is incorporated herein by reference, describes dihydroxy acid dehydratase; Alcohol dehydrogenases are described in US Patent Application Publication No. 2009/0269823, which is incorporated herein by reference.
동일하거나 유사한 기능 또는 활성을 가지며, 본 명세서에 기재된 재조합 미생물에 사용하기에 적합한 폴리펩티드를 다른 종으로부터 규명함에 있어서 다수의 서열 동일성 레벨이 유용하다는 것이 당업자에게 주지되어 있다. 동일성 (%)의 유용한 예로는 75%, 80%, 85%, 90% 또는 95%가 포함되나 이에 한정되지 않거나, 75% 내지 100%의 임의의 정수 비율, 예컨대 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% 또는 99%가 본 발명을 기술하는데 유용할 수 있다.It is well known to those skilled in the art that multiple levels of sequence identity are useful in identifying polypeptides from other species that have the same or similar functions or activities and are suitable for use in the recombinant microorganisms described herein. Useful examples of percent identity include, but are not limited to, 75%, 80%, 85%, 90% or 95%, or any integer ratio of 75% to 100%, such as 75%, 76%, 77% , 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94 %, 95%, 96%, 97%, 98% or 99% may be useful in describing the present invention.
1-부탄올 생합성 경로1-butanol biosynthetic pathway
1-부탄올의 생성을 위한 생합성 경로, 및 사용될 수 있는 적절한 폴리펩티드 및 이러한 폴리펩티드를 인코딩하는 폴리뉴클레오티드는 본 명세서에 참조로 포함되는, 도날슨 (Donaldson) 등에 의한 미국 특허 출원 공개 제2008/0182308 A1호에 기재되어 있다. 이러한 생합성 경로는 하기의 기질에서 생성물로의 전환을 포함한다:Biosynthetic pathways for the production of 1-butanol, and suitable polypeptides that can be used and polynucleotides encoding such polypeptides are described in US Patent Application Publication No. 2008/0182308 A1 by Donaldson et al., Which is incorporated herein by reference. It is described. Such biosynthetic pathways include the conversion of the following substrates to products:
a) 예를 들어, 아세틸-CoA 아세틸트랜스페라제에 의해 촉매될 수 있는, 아세틸-CoA에서 아세토아세틸-CoA로의 전환;a) conversion of acetyl-CoA to acetoacetyl-CoA, which may be catalyzed by, for example, acetyl-CoA acetyltransferase;
b) 예를 들어, 3-하이드록시부티릴-CoA 탈수소 효소에 의해 촉매될 수 있는, 아세토아세틸-CoA에서 3-하이드록시부티릴-CoA로의 전환;b) acetoacetyl-CoA to 3-hydroxybutyryl-CoA, which can be catalyzed, for example, by 3-hydroxybutyryl-CoA dehydrogenase;
c) 예를 들어, 크로토나제에 의해 촉매될 수 있는, 3-하이드록시부티릴-CoA에서 크로토닐-CoA로의 전환;c) conversion of 3-hydroxybutyryl-CoA to crotonyl-CoA, which may be catalyzed by, for example, crotonase;
d) 예를 들어, 부티릴-CoA 탈수소 효소에 의해 촉매될 수 있는, 크로토닐-CoA에서 부티릴-CoA로의 전환;d) conversion of crotonyl-CoA to butyryl-CoA, which may be catalyzed, for example, by butyryl-CoA dehydrogenase;
e) 예를 들어, 부티르알데히드 탈수소 효소에 의해 촉매될 수 있는, 부티릴-CoA에서 부티르알데히드로의 전환; 및e) conversion of butyraldehyde to butyryl-CoA, which may be catalyzed, for example, by butyraldehyde dehydrogenase; And
f) 예를 들어, 1-부탄올 탈수소 효소에 의해 촉매될 수 있는, 부티르알데히드에서 1-부탄올로의 전환.f) conversion of butyraldehyde to 1-butanol, which may be catalyzed by, for example, 1-butanol dehydrogenase.
일부 실시 형태에서, 1-부탄올 생합성 경로는 효모 세포와 이종인 적어도 1개의 유전자, 적어도 2개의 유전자, 적어도 3개의 유전자, 적어도 4개의 유전자, 또는 적어도 5개의 유전자를 포함한다. 일부 실시 형태에서, 재조합 숙주 세포는 1-부탄올 생합성 경로의 각 기질에서 생성물로의 전환에 대한 이종 유전자를 포함한다.In some embodiments, the 1-butanol biosynthetic pathway comprises at least one gene, at least two genes, at least three genes, at least four genes, or at least five genes that are heterologous to yeast cells. In some embodiments, the recombinant host cell comprises a heterologous gene for conversion of each substrate of the 1-butanol biosynthetic pathway to a product.
2-부탄올 생합성 경로2-butanol biosynthetic pathway
2-부탄올의 생성을 위한 생합성 경로, 및 사용될 수 있는 적절한 폴리펩티드 및 이러한 폴리펩티드를 인코딩하는 폴리뉴클레오티드는 모두 본 명세서에 참조로 포함되는, 도날슨 (Donaldson) 등에 의한 미국 특허 출원 공개 제2007/0259410 A1호 및 제2007/0292927A1호, 및 국제 특허 출원 공개 제WO 2007/130521호에 기재되어 있다. 한 가지 2-부탄올 생합성 경로는 하기의 기질에서 생성물로의 전환을 포함한다:Biosynthetic pathways for the production of 2-butanol, and suitable polypeptides that can be used and polynucleotides encoding such polypeptides are all incorporated herein by reference in US Patent Application Publication No. 2007/0259410 A1 by Donaldson et al. And 2007 / 0292927A1, and WO 2007/130521. One 2-butanol biosynthetic pathway involves the conversion of the following substrates to products:
a) 예를 들어, 아세토락테이트 합성효소에 의해 촉매될 수 있는, 피루베이트에서 알파-아세토락테이트로의 전환;a) conversion of pyruvate to alpha-acetolactate, which may be catalyzed by, for example, acetolactate synthase;
b) 예를 들어, 아세토락테이트 데카르복실라제에 의해 촉매될 수 있는, 알파-아세토락테이트에서 아세토인으로의 전환;b) conversion of alpha-acetolactate to acetoin, which may be catalyzed by, for example, acetolactate decarboxylase;
c) 예를 들어, 부탄다이올 탈수소 효소에 의해 촉매될 수 있는, 아세토인에서 2,3-부탄다이올로의 전환;c) acetoin to 2,3-butanediol, which may be catalyzed, for example, by butanediol dehydrogenase;
d) 예를 들어, 부탄다이올 탈수 효소에 의해 촉매될 수 있는, 2,3-부탄다이올에서 2-부탄온으로의 전환; 및d) conversion of 2,3-butanediol to 2-butanone, which may be catalyzed, for example, by butanediol dehydratase; And
e) 예를 들어, 2-부탄올 탈수소 효소에 의해 촉매될 수 있는, 2-부탄온에서 2-부탄올로의 전환.e) Conversion of 2-butanone to 2-butanol, which may be catalyzed by, for example, 2-butanol dehydrogenase.
일부 실시 형태에서, 2-부탄올 생합성 경로는 효모 세포와 이종인 적어도 1개의 유전자, 적어도 2개의 유전자, 적어도 3개의 유전자, 또는 적어도 4개의 유전자를 포함한다. 일부 실시 형태에서, 재조합 숙주 세포는 2-부탄올 생합성 경로의 각 기질에서 생성물로의 전환에 대한 이종 유전자를 포함한다.In some embodiments, the 2-butanol biosynthetic pathway comprises at least one gene, at least two genes, at least three genes, or at least four genes that are heterologous to yeast cells. In some embodiments, the recombinant host cell comprises a heterologous gene for conversion of each substrate of the 2-butanol biosynthetic pathway to a product.
아이소부탄올 생합성 경로Isobutanol Biosynthesis Pathway
아이소부탄올의 생성을 위한 생합성 경로, 및 사용될 수 있는 적절한 폴리펩티드 및 이러한 폴리펩티드를 인코딩하는 폴리뉴클레오티드는 본 명세서에 참조로 포함되는, 미국 특허 출원 공개 제2007/0092957 A1호 및 국제 특허 출원 공개 제WO 2007/050671호에 기재되어 있다. 한 가지 아이소부탄올 생합성 경로는 하기의 기질에서 생성물로의 전환을 포함한다:Biosynthetic pathways for the production of isobutanol, and appropriate polypeptides that can be used and polynucleotides encoding such polypeptides are described in US Patent Application Publication No. 2007/0092957 A1 and International Patent Application Publication No. WO 2007 / 050671. One isobutanol biosynthetic pathway involves the conversion of the following substrates to products:
a) 예를 들어, 아세토락테이트 합성효소에 의해 촉매될 수 있는, 피루베이트에서 아세토락테이트로의 전환;a) conversion of pyruvate to acetolactate, which may be catalyzed by, for example, acetolactate synthase;
b) 예를 들어, 아세토하이드록시산 리덕토아이소메라제에 의해 촉매될 수 있는, 아세토락테이트에서 2,3-다이하이드록시아이소발레레이트로의 전환;b) acetolactate to 2,3-dihydroxyisovalerate, which can be catalyzed, for example, by acetohydroxy acid reductoisomerase;
c) 예를 들어, 아세토하이드록시산 탈수 효소에 의해 촉매될 수 있는, 2,3-다이하이드록시아이소발레레이트에서 α-케토아이소발레레이트로의 전환;c) conversion of 2,3-dihydroxyisovalerate to α-ketoisovalerate, which may be catalyzed by, for example, acetohydroxy acid dehydratase;
d) 예를 들어, 분지쇄 케토산 데카르복실라제에 의해 촉매될 수 있는, α-케토아이소발레레이트에서 아이소부티르알데히드로의 전환; 및d) conversion of isobutyraldehyde to a-ketoisovalerate, which may be catalyzed, for example, by branched keto acid decarboxylase; And
e) 예를 들어, 분지쇄 알코올 탈수소 효소에 의해 촉매될 수 있는, 아이소부티르알데히드에서 아이소부탄올로의 전환.e) Conversion of isobutyraldehyde to isobutanol, which can be catalyzed, for example, by branched chain alcohol dehydrogenase.
아이소부탄올 생합성 경로의 기질에서 생성물로의 전환을 촉매하는 효소를 인코딩하는 적절한 폴리펩티드 서열 및 지시된 경로 단계에 대한 적절한 효소에 상응하는 E.C. 번호는 표 AA 및 BB의 것들을 포함하나 이에 한정되지 않는다. 소정의 E.C. 번호와 관련된 적절한 효소는 예를 들어, 브렌다 (BRENDA) 데이터베이스 (http://www.brenda-enzymes.org/)를 통해 당업자가 용이하게 이용할 수 있을 것이다.E.C. corresponding to the appropriate polypeptide sequence encoding the enzyme catalyzing the conversion of the isobutanol biosynthetic pathway to the product and the appropriate enzyme for the indicated pathway step. Numbers include, but are not limited to, those of Tables AA and BB. Prescribed E.C. Suitable enzymes associated with numbers will be readily available to those skilled in the art, for example, via the BRENDA database (http://www.brenda-enzymes.org/).
[표 AA]TABLE AA
[표 BB]TABLE BB
단계 c)를 촉매하는 효소 및 단계 e)를 촉매하는 효소의 그룹 중에서 선택되는 효소 중 적어도 하나가 미생물의 염색체로 통합된 이종 폴리뉴클레오티드에 의해 인코딩되는 단계 a) 내지 e) (상기)를 포함하는 아이소부탄올 생합성 경로를 포함하는 재조합 미생물이 본 명세서에 제공된다. 일부 실시 형태에서, 단계 c)를 촉매하는 효소가 미생물의 염색체로 통합된 이종 폴리뉴클레오티드에 의해 인코딩되고, 단계 e)를 촉매하는 효소가 미생물의 염색체로 통합된 이종 폴리뉴클레오티드에 의해 인코딩된다.At least one of an enzyme catalyzing step c) and an enzyme selected from the group of enzymes catalyzing step e) is encoded by a heterologous polynucleotide integrated into a chromosome of a microorganism, comprising steps a) to e) (above) Provided herein are recombinant microorganisms comprising isobutanol biosynthetic pathways. In some embodiments, the enzyme catalyzing step c) is encoded by a heterologous polynucleotide integrated into the chromosome of the microorganism and the enzyme catalyzing step e) is encoded by a heterologous polynucleotide integrated into the chromosome of the microorganism.
아이소부탄올 생합성 경로와 같은 부탄올 생합성 경로를 포함하는 재조합 미생물에 적합한 폴리뉴클레오티드가 본 명세서에 제공된다. 이러한 폴리뉴클레오티드는 바실러스 서브틸리스 유래의 alsS 유전자의 코딩 영역 (서열 번호 1의 뉴클레오티드 위치 457-2172) 및 락토코커스 락티스 유래의 ilvC 유전자 (서열 번호 1의 뉴클레오티드 3634-4656), 및 어느 하나 또는 둘 다를 포함하는 플라스미드를 포함한다. 또한, ALS의 발현을 위해 효모 CUP1 프로모터 (서열 번호 1의 뉴클레오티드 2-449), 이어서 CYC1 터미네이터 (서열 번호 1의 뉴클레오티드 2181-2430)로부터 발현되는 바실러스 서브틸리스 유래의 alsS 유전자의 코딩 영역 (서열 번호 1의 뉴클레오티드 위치 457-2172)을 갖는 키메라 유전자 및 KARI의 발현을 위해 효모 ILV5 프로모터 (서열 번호 1의 2433-3626), 이어서 ILV5 터미네이터 (서열 번호 1의 뉴클레오티드 4682-5304)로부터 발현되는 락토코커스 락티스 유래의 ilvC 유전자의 코딩 영역 (서열 번호 1의 뉴클레오티드 3634-4656)을 갖는 키메라 유전자, 및 키메라 유전자 중 어느 하나 또는 둘 다를 포함하는 플라스미드가 적합하다.Provided herein are polynucleotides suitable for recombinant microorganisms that include butanol biosynthetic pathways such as isobutanol biosynthetic pathways. Such polynucleotides include the coding region of the alsS gene from Bacillus subtilis (nucleotide positions 457-2172 of SEQ ID NO: 1) and the ilvC gene from Lactococcus lactis (nucleotides 3634-4656 of SEQ ID NO: 1), and either or Plasmids comprising both. In addition, the coding region of the alsS gene from Bacillus subtilis expressed from the yeast CUP1 promoter (nucleotides 2-449 of SEQ ID NO: 1), followed by the CYC1 terminator (nucleotides 2181-2430 of SEQ ID NO: 1) for expression of ALS (SEQ ID NO: Lactococcus expressed from the yeast ILV5 promoter (2433-3626 of SEQ ID NO: 1), followed by the ILV5 terminator (nucleotide 4682-5304 of SEQ ID NO: 1) for expression of the chimeric gene having the nucleotide positions 457-2172) and KARI Suitable are chimeric genes having the coding region of the ilvC gene from Lactis (nucleotides 3634-4656 of SEQ ID NO: 1), and plasmids comprising either or both of the chimeric genes.
적절한 폴리뉴클레오티드는 스트렙토코커스 무탄스 유래의 ilvD 유전자의 코딩 영역 (서열 번호 2의 뉴클레오티드 위치 3313-4849), 코돈 최적화된 말 간 알코올 탈수소 효소의 코딩 영역 (서열 번호 2의 뉴클레오티드 6286-7413), 락토코커스 락티스 유래의 코돈 최적화된 kivD 유전자의 코딩 영역 (서열 번호 2의 뉴클레오티드 9249-10895), 및 임의의 것 또는 모두를 포함하는 플라스미드 또는 이들의 임의의 조합을 포함한다. 또한, DHAD의 발현을 위해 사카로마이세스 세레비시아 FBA1 프로모터 (서열 번호 2의 뉴클레오티드 2109 - 3105), 이어서 FBA1 터미네이터 (서열 번호 2의 뉴클레오티드 4858 - 5857)로부터 발현되는 스트렙토코커스 무탄스 유래의 ilvD 유전자의 코딩 영역 (서열 번호 2의 뉴클레오티드 위치 3313-4849)을 갖는 키메라 유전자; ADH의 발현을 위해 사카로마이세스 세레비시아 GPM1 프로모터 (서열 번호 2의 뉴클레오티드 7425-8181), 이어서 ADH1 터미네이터 (서열 번호 2의 뉴클레오티드 5962-6277)로부터 발현되는 코돈 최적화된 말 간 알코올 탈수소 효소의 코딩 영역 (서열 번호 2의 뉴클레오티드 6286-7413)을 갖는 키메라 유전자; 및 KivD의 발현을 위해 TDH3 프로모터 (서열 번호 2의 뉴클레오티드 10896-11918), 이어서 TDH3 터미네이터 (서열 번호 2의 뉴클레오티드 8237-9235)로부터 발현되는 락토코커스 락티스 유래의 코돈 최적화된 kivD 유전자의 코딩 영역 (서열 번호 2의 뉴클레오티드 9249-10895)을 갖는 키메라 유전자, 및 이러한 키메라 유전자 중 어느 하나, 모두, 또는 임의의 조합을 포함하는 플라스미드가 적합하다. 또한, 적절한 폴리뉴클레오티드는 규정된 코딩 영역 및 키메라 유전자와 적어도 약 75%의 동일성을 갖는 폴리뉴클레오티드, 및 이러한 폴리뉴클레오티드를 포함하는 플라스미드를 포함한다.Suitable polynucleotides include the coding region of the ilvD gene from Streptococcus mutans (nucleotide positions 3313-4849 of SEQ ID NO: 2), the coding region of codon optimized horse liver alcohol dehydrogenase (nucleotides 6286-7413 of SEQ ID NO: 2), lactose Plasmids comprising the coding region of the codon optimized kivD gene from Caucus lactis (nucleotides 9249-10895 of SEQ ID NO: 2), and any or all or any combination thereof. In addition, ilvD from Streptococcus mutans expressed from the Saccharomyces cerevisiae FBA1 promoter (nucleotides 2109-3105 of SEQ ID NO: 2), followed by the FBA1 terminator (nucleotides 4858-5857 of SEQ ID NO: 2) for expression of DHAD Chimeric genes having the coding region of the gene (nucleotide positions 3313-4849 of SEQ ID NO: 2); Of codon-optimized equine hepatic alcohol dehydrogenase expressed from Saccharomyces cerevisiae GPM1 promoter (nucleotides 7425-8181 of SEQ ID NO: 2) followed by ADH1 terminator (nucleotides 5962-6277 of SEQ ID NO: 2) for expression of ADH. Chimeric genes having a coding region (nucleotides nucleotide 6286-7413 of SEQ ID NO: 2); And the coding region of the codon optimized kivD gene from Lactococcus lactis expressed from the TDH3 promoter (nucleotides 10896-11918 of SEQ ID NO: 2) followed by the TDH3 terminator (nucleotides 8237-9235 of SEQ ID NO: 2) for expression of KivD ( Chimeric genes having nucleotides 9249-10895 of SEQ ID NO: 2, and plasmids comprising any, all, or any combination of these chimeric genes are suitable. Suitable polynucleotides also include polynucleotides having at least about 75% identity with defined coding regions and chimeric genes, and plasmids comprising such polynucleotides.
일부 실시 형태에서, 아이소부탄올 생합성 경로는 효모 세포와 이종인 적어도 1개의 유전자, 적어도 2개의 유전자, 적어도 3개의 유전자, 또는 적어도 4개의 유전자를 포함한다. 일부 실시 형태에서, 재조합 숙주 세포는 아이소부탄올 생합성 경로의 각 기질에서 생성물로의 전환에 대한 이종 유전자를 포함한다.In some embodiments, the isobutanol biosynthetic pathway comprises at least one gene, at least two genes, at least three genes, or at least four genes that are heterologous to yeast cells. In some embodiments, the recombinant host cell comprises a heterologous gene for the conversion of each substrate of the isobutanol biosynthetic pathway to a product.
적절한 균주는 본 명세서에 참조로 인용되고 포함되는 특정 출원서 및 2010년 9월 7일자로 출원된 미국 가출원 제61/380,563호에 기재된 균주를 포함한다. 실시예에 사용되는 균주를 비롯한 특정 적절한 균주의 구축이 본 명세서에 제공된다.Suitable strains include the specific applications cited and incorporated herein by reference and the strains described in US Provisional Application No. 61 / 380,563, filed September 7, 2010. Construction of certain suitable strains, including the strains used in the examples, is provided herein.
사카로마이세스 세레비시아 균주 BP1083 ("NGCI-070"; PNY1504)의 구축Construction of Saccharomyces cerevisiae strain BP1083 ("NGCI-070"; PNY1504)
균주 BP1064는 CEN.PK 113-7D (CBS 8340; 네덜란드의 왕립미생물자원센터 (Centraalbureau voor Schimmelcultures (CBS) Fungal Biodiversity Centre)로부터 유래되었으며, 하기의 유전자의 결실을 포함한다: URA3, HIS3, PDC1, PDC5, PDC6 및 GPD2. BP1064를 플라스미드 pYZ090 (서열 번호 1, 미국 가출원 제61/246,844호에 기재됨) 및 pLH468 (서열 번호 2)로 형질전환시켜, 균주 NGCI-070 (BP1083, PNY1504)를 생성하였다.Strain BP1064 is derived from CEN.PK 113-7D (CBS 8340; Central Bureau voor Schimmelcultures (CBS) Fungal Biodiversity Center) and includes deletions of the following genes: URA3, HIS3, PDC1, PDC5 BP1064 was transformed with plasmids pYZ090 (SEQ ID NO: 1, described in US Provisional Application No. 61 / 246,844) and pLH468 (SEQ ID NO: 2) to generate strain NGCI-070 (BP1083, PNY1504).
전체 코딩 서열이 완전히 제거되는 결실을 형질전환체의 선택을 위한 G418 내성 마커 또는 URA3 유전자 중 어느 하나, 및 표적 유전자의 상동성 업스트림 및 다운스트림의 영역을 포함하는 PCR 단편과의 상동성 재조합에 의해 생성하였다. loxP 부위가 플랭킹된 G418 내성 마커를 Cre 재조합효소 (recombinase)를 사용하여 제거하였다. URA3 유전자를 상동성 재조합에 의해 제거하여, 스카리스 (scarless) 결실을 생성하거나, loxP 부위가 플랭킹된다면, Cre 재조합효소를 사용하여 제거하였다.Deletion in which the entire coding sequence is completely removed by homologous recombination with a PCR fragment comprising either the G418 resistance marker or the URA3 gene for selection of the transformant and regions of homology upstream and downstream of the target gene. Generated. G418 resistance markers flanking the loxP site were removed using Cre recombinase. The URA3 gene was removed by homologous recombination to produce scarless deletions or, if the loxP site was flanked, using Cre recombinase.
스카리스 결실 절차를 문헌 [Akada et al., Yeast, 23:399-405 (2006)]으로부터 채용하였다. 일반적으로, 각각의 스카리스 결실을 위한 PCR 카세트를 중첩 PCR에 의하여 4개의 단편, 즉, A-B-U-C를 조합함으로써 만들었다. 프로모터 (URA3 유전자의 250 bp 업스트림) 및 터미네이터 (URA3 유전자의 150 bp 다운스트림)와 함께 고유 CEN.PK 113-7D URA3 유전자로 이루어진 PCR 카세트는 선택가능한/반대-선택가능한 마커, URA3 (단편 U)을 함유하였다. 각각 500 bp 길이의 단편 A 및 C는 표적 유전자의 500 bp 인접 업스트림 (단편 A) 및 표적 유전자의 3' 500 bp (단편 C)에 해당한다. 단편 A 및 C를 상동성 재조합에 의하여 염색체 내로의 카세트의 통합을 위하여 사용하였다. 단편 B (500 bp 길이)는 표적 유전자의 500 bp 인접 다운스트림에 해당하며, 단편 B에 해당하는 서열의 직접 반복이 염색체 내로의 카세트의 통합 시에 생성되었기 때문에, 상동성 재조합에 의한 염색체로부터의 URA3 마커 및 단편 C의 절제 (excision)를 위해 사용되었다. PCR 생성물 ABUC 카세트를 사용하여, URA3 마커를 먼저 상동성 재조합에 의하여 염색체 내로 통합시킨 다음, 염색체로부터 절제하였다. 초기의 통합에 의하여 3' 500 bp를 제외한 유전자가 결실되었다. 절제 시에, 유전자의 3' 500 bp 영역도 또한 결실되었다. 이러한 방법을 사용한 유전자의 통합을 위하여, 통합될 유전자는 단편 A와 B 사이의 PCR 카세트에 포함시켰다.Scarris deletion procedures were employed from Akada et al., Yeast, 23: 399-405 (2006). In general, PCR cassettes for each scarris deletion were made by combining four fragments, namely A-B-U-C, by overlapping PCR. The PCR cassette consisting of the native CEN.PK 113-7D URA3 gene, along with the promoter (250 bp upstream of the URA3 gene) and terminator (150 bp downstream of the URA3 gene), is a selectable / counter-selectable marker, URA3 (fragment U) It contained. Fragments A and C, each 500 bp in length, correspond to 500 bp upstream of the target gene (fragment A) and 3 '500 bp of the target gene (fragment C). Fragments A and C were used for integration of the cassette into the chromosome by homologous recombination. Fragment B (500 bp in length) corresponds to 500 bp adjacent downstream of the target gene, and since direct repetition of the sequence corresponding to fragment B was generated upon incorporation of the cassette into the chromosome, from homologous recombination chromosome Used for excision of the URA3 marker and fragment C. Using the PCR product ABUC cassette, the URA3 marker was first integrated into the chromosome by homologous recombination and then excised from the chromosome. Early integration resulted in the deletion of genes other than 3 '500 bp. Upon ablation, the 3 '500 bp region of the gene was also deleted. For integration of genes using this method, the gene to be integrated was included in a PCR cassette between fragments A and B.
URA3 결실URA3 fruition
내인성 URA3 코딩 영역을 결실시키기 위해, ura3::loxP-kanMX-loxP 카세트를 pLA54 주형 DNA (서열 번호 3)로부터 PCR 증폭시켰다. pLA54는 클루이베로마이세스 락티스 TEF1 프로모터 및 kanMX 마커를 함유하며, loxP 부위가 플랭킹되어, Cre 재조합효소를 사용한 재조합 및 마커의 제거를 가능하게 한다. 퓨전 (Phusion)? DNA 폴리메라제 (미국 매사추세츠주 입스위치에 소재하는 뉴 잉글랜드 바이오랩스 인코포레이티드 (New England BioLabs Inc.) 및 프라이머 BK505 및 BK506 (서열 번호 4 및 5)를 사용하여, PCR을 행하였다. URA3 프로모터의 5' 영역 업스트림 및 코딩 영역의 3' 영역 다운스트림으로부터 각각의 프라이머의 URA3 부분을 유도하여, loxP-kanMX-loxP 마커의 통합으로 인해 URA3 코딩 영역이 대체되도록 하였다. PCR 생성물을 표준 유전학적 기술 (문헌 [Methods in Yeast Genetics, 2005, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, pp. 201-202])을 사용하여 CEN.PK 113-7D 내로 형질전환시키고, 형질전환체를 30℃에서 G418 (100 ㎍/mL)을 함유하는 YPD에서 선택하였다. 형질전환체를 스크리닝하여, 프라이머 LA468 및 LA492 (각각 서열 번호 6 및 7)를 사용하여 PCR에 의해 정확한 통합을 입증하고, CEN.PK 113-7D Δura3::kanMX로 명명하였다.To delete the endogenous URA3 coding region, the ura3 :: loxP-kanMX-loxP cassette was PCR amplified from pLA54 template DNA (SEQ ID NO: 3). pLA54 contains the Kluyveromyces lactis TEF1 promoter and kanMX marker, and the loxP site is flanked to allow recombination using Cre recombinase and removal of the marker. Fusion? PCR was performed using DNA polymerase (New England BioLabs Inc., Ipswich, Mass., USA) and primers BK505 and BK506 (SEQ ID NOs: 4 and 5). The URA3 portion of each primer was derived from the 5 'region upstream of the promoter and 3' region downstream of the coding region to allow replacement of the URA3 coding region due to the integration of the loxP-kanMX-loxP markers. The technique (Methods in Yeast Genetics, 2005, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, pp. 201-202) was used to transform into CEN.PK 113-7D and transformants were 30 ° C. Were selected from YPD containing G418 (100 μg / mL) in. Transformants were screened to demonstrate correct integration by PCR using primers LA468 and LA492 (SEQ ID NOs: 6 and 7, respectively), and CEN.PK 113-7D It was named ura3 :: kanMX.
HIS3 결실HIS3 deletion
스카리스 HIS3 결실을 위한 PCR 카세트에 대한 4개의 단편을 퓨전? 하이 피델리티 PCR 마스터 믹스 (High Fidelity PCR Master Mix) (미국 매사추세츠주 입스위치에 소재하는 뉴 잉글랜드 바이오랩스 인코포레이티드) 및 젠트라 (Gentra)? 퓨어진 (Puregene)? 이스트/백트, 키트 (Yeast/Bact, kit) (미국 캘리포니아주 발렌시아에 소재하는 퀴아젠 (Qiagen))로 제조된 주형으로서의 CEN.PK 113-7D 게놈 DNA를 사용하여 증폭시켰다. HIS3 단편 A를, 프라이머 oBP452 (서열 번호 14) 및 HIS3 단편 B의 5' 말단에 대하여 상동성을 갖는 5' 테일 (tail)을 함유하는 프라이머 oBP453 (서열 번호 15)을 사용하여 증폭시켰다. HIS3 단편 B를, HIS3 단편 A의 3' 말단에 대하여 상동성을 갖는 5' 테일을 포함하는 프라이머 oBP454 (서열 번호 16) 및 HIS3 단편 U의 5' 말단에 대하여 상동성을 갖는 5' 테일을 포함하는 프라이머 oBP455 (서열 번호 17)를 사용하여 증폭시켰다. HIS3 단편 U를, HIS3 단편 B의 3' 말단에 대하여 상동성을 갖는 5' 테일을 포함하는 프라이머 oBP456 (서열 번호 18) 및 HIS3 단편 C의 5' 말단에 대하여 상동성을 갖는 5' 테일을 포함하는 프라이머 oBP457 (서열 번호 19)을 사용하여 증폭시켰다. HIS3 단편 C를, HIS3 단편 U의 3' 말단에 대하여 상동성을 갖는 5' 테일을 포함하는 프라이머 oBP458 (서열 번호 20) 및 프라이머 oBP459 (서열 번호 21)를 사용하여 증폭시켰다. PCR 생성물을 PCR 정제 키트 (미국 캘리포니아주 발렌시아에 소재하는 퀴아젠)로 정제하였다. HIS3 단편 AB를, HIS3 단편 A 및 HIS3 단편 B를 혼합하고, 프라이머 oBP452 (서열 번호 14) 및 oBP455 (서열 번호 17)를 사용하여 증폭시킴으로써 중첩 PCR에 의해 생성하였다. HIS3 단편 UC를, HIS3 단편 U 및 HIS3 단편 C를 혼합하고, 프라이머 oBP456 (서열 번호 18) 및 oBP459 (서열 번호 21)를 사용하여 증폭시킴으로써 중첩 PCR에 의해 생성하였다. 생성된 PCR 생성물을 아가로스 겔에서 정제하고, 이어서 겔 추출 키트 (미국 캘리포니아주 발렌시아에 소재하는 퀴아젠)로 정제하였다. HIS3 ABUC 카세트를, HIS3 단편 AB 및 HIS3 단편 UC를 혼합하고, 프라이머 oBP452 (서열 번호 14) 및 oBP459 (서열 번호 21)를 사용하여 증폭시킴으로써 중첩 PCR에 의해 생성하였다. PCR 생성물을 PCR 정제 키트 (미국 캘리포니아주 발렌시아에 소재하는 퀴아젠)로 정제하였다.Fusion of four fragments to a PCR cassette for Scaris HIS3 deletion? High Fidelity PCR Master Mix (New England Biolabs, Inc., Ipswich, Mass.) And Gentra? Puregene? Amplification was done using CEN.PK 113-7D genomic DNA as a template made from Yeast / Bact, kit (Qiagen, Valencia, Calif.). HIS3 fragment A was amplified using primer oBP452 (SEQ ID NO: 14) and primer oBP453 (SEQ ID NO: 15) containing a 5 'tail homologous to the 5' end of HIS3 fragment B. HIS3 fragment B comprises primer oBP454 (SEQ ID NO: 16) comprising a 5 'tail homologous to the 3' end of HIS3 fragment A and a 5 'tail homologous to the 5' end of HIS3 fragment U Was amplified using primers oBP455 (SEQ ID NO: 17). HIS3 fragment U comprises primer oBP456 (SEQ ID NO: 18) comprising a 5 'tail homologous to the 3' end of HIS3 fragment B and a 5 'tail homologous to the 5' end of HIS3 fragment C Was amplified using primers oBP457 (SEQ ID NO: 19). HIS3 fragment C was amplified using primers oBP458 (SEQ ID NO: 20) and primer oBP459 (SEQ ID NO: 21) comprising a 5 'tail homologous to the 3' end of HIS3 fragment U. PCR products were purified with a PCR Purification Kit (Qiagen, Valencia, CA). HIS3 fragment AB was generated by overlapping PCR by mixing HIS3 fragment A and HIS3 fragment B and amplifying with primers oBP452 (SEQ ID NO: 14) and oBP455 (SEQ ID NO: 17). HIS3 fragment UC was generated by overlapping PCR by mixing HIS3 fragment U and HIS3 fragment C and amplifying using primers oBP456 (SEQ ID NO: 18) and oBP459 (SEQ ID NO: 21). The resulting PCR product was purified on agarose gel and then purified by gel extraction kit (Qiagen, Valencia, CA). HIS3 ABUC cassettes were generated by overlapping PCR by mixing HIS3 fragments AB and HIS3 fragments UC and amplifying using primers oBP452 (SEQ ID NO: 14) and oBP459 (SEQ ID NO: 21). PCR products were purified with a PCR Purification Kit (Qiagen, Valencia, CA).
CEN.PK 113-7D Δura3::kanMX의 컴피턴트 (competent) 세포를 만들고, 프로즌-이지 이스트 트랜스포메이션 (Frozen-EZ Yeast Transformation) II™ 키트 (미국 캘리포니아주 어바인에 소재하는 자이모 리서치 코퍼레이션 (Zymo Research Corporation))를 사용하여 HIS3 ABUC PCR 카세트로 형질전환시켰다. 형질전환 혼합물을 30℃에서 2% 글루코스가 보충된 우라실이 결핍된 합성 완전 배지 상에 플레이팅하였다. his3 녹아웃 (knockout)이 있는 형질전환체를 젠트라? 퓨어진? 이스트/백트 키트 (미국 캘리포니아주 발렌시아에 소재하는 퀴아젠)로 제조한 게놈 DNA를 사용하여 프라이머 oBP460 (서열 번호 22) 및 oBP461 (서열 번호 23)을 사용하여 PCR로 스크리닝하였다. 정확한 형질전환체를 균주 CEN.PK 113-7D Δura3::kanMX Δhis3::URA3로 선택하였다.CEN.PK 113-7D Create competent cells of Δura3 :: kanMX and use the Frozen-EZ Yeast Transformation II ™ Kit (Zymo, Irvine, CA, USA) Research Corporation) was transformed with the HIS3 ABUC PCR cassette. Transformation mixtures were plated at 30 ° C. on synthetic complete medium lacking uracil supplemented with 2% glucose. Gentra for transformants with his3 knockout? Fuzzy? Genomic DNA prepared with the East / Bat Kit (Qiagen, Valencia, CA) was screened by PCR using primers oBP460 (SEQ ID NO: 22) and oBP461 (SEQ ID NO: 23). The correct transformants were selected with strain CEN.PK 113-7D Δura3 :: kanMX Δhis3 :: URA3.
Δura3 부위로부터의 KanMX 마커 제거 및 Δhis3 부위로부터의 URA3 마커 제거KanMX marker removal from Δura3 site and URA3 marker removal from Δhis3 site
프로즌-이지 이스트 트랜스포메이션 II™ 키트 (미국 캘리포니아주 어바인에 소재하는 자이모 리서치 코퍼레이션)를 사용하여 CEN.PK 113-7D Δura3::kanMX Δhis3::URA3를 pRS423::PGAL1-cre (서열 번호 66, 미국 가출원 제61/290,639호에 기재됨)로 형질전환시켜, 30℃에서 2% 글루코스가 보충된 히스티딘 및 우라실이 결핍된 합성 완전 배지 상에 플레이팅함으로써, KanMX 마커를 제거하였다. 형질전환체를 30℃에서 약 6시간 동안 1% 갈락토스가 보충된 YP에서 성장시켜, Cre 재조합효소 및 KanMX 마커 절제를 유도하고, 회수를 위해 30℃에서 YPD (2% 글루코스) 플레이트 상에 플레이팅하였다. 분리주를 YPD에서 하룻밤 동안 성장시키고, 30℃에서 5-플루오로오로트산 (5-FOA, 0.1%)을 함유하는 합성 완전 배지 상에 플레이팅하여, URA3 마커가 소실된 분리주를 선택하였다. 5-FOA 내성 분리주를 성장시키고, pRS423::PGAL1-cre 플라스미드의 제거를 위해 YPD 상에 플레이팅하였다. YPD+G418 플레이트, 우라실이 결핍된 합성 완전 배지 플레이트, 및 히스티딘이 결핍된 합성 완전 배지 플레이트 상의 성장을 분석함으로써, 분리주에 대하여 KanMX 마커, URA3 마커, 및 pRS423::PGAL1-cre 플라스미드의 손실을 체크하였다. G418에 대하여 감수성이 있으며, 우라실 및 히스티딘에 대한 영양요구성이 있는 정확한 분리주를 균주 CEN.PK 113-7D Δura3::loxP Δhis3로 선택하여, BP857로 명명하였다. 결실 및 마커 제거를 젠트라? 퓨어진? 이스트/백트 키트 (미국 캘리포니아주 발렌시아에 소재하는 퀴아젠)로 제조한 게놈 DNA를 사용하여 PCR에 의해, Δura3에 대해서는 프라이머 oBP450 (서열 번호 24) 및 oBP451 (서열 번호 25) 및 Δhis3에 대해서는 프라이머 oBP460 (서열 번호 22) 및 oBP461 (서열 번호 23)로 시퀀싱하여 확인하였다.The CEN.PK 113-7D Δura3 :: kanMX Δhis3 :: URA3 was replaced using the Frozen-Easy East Transformation II ™ Kit (Zymo Research Corporation, Irvine, CA) with pRS423 :: PGAL1-cre (SEQ ID NO: 66 KanMX markers were removed by plating on synthetic complete media lacking histidine and uracil supplemented with 2% glucose at 30 ° C., US Provisional Application No. 61 / 290,639. Transformants were grown in YP supplemented with 1% galactose for about 6 hours at 30 ° C. to induce Cre recombinase and KanMX marker ablation, and plated on YPD (2% glucose) plates at 30 ° C. for recovery. It was. The isolates were grown overnight in YPD and plated on synthetic complete medium containing 5-fluoroorroic acid (5-FOA, 0.1%) at 30 ° C. to select isolates that lacked the URA3 marker. 5-FOA resistant isolates were grown and plated on YPD for removal of the pRS423 :: PGAL1-cre plasmid. Growth loss on KanMX markers, URA3 markers, and pRS423 :: PGAL1-cre plasmids was checked for isolates by analyzing growth on YPD + G418 plates, synthetic complete media plates lacking uracil, and synthetic complete media plates lacking histidine. It was. The exact isolate, susceptible to G418 and nutritional to uracil and histidine, was selected as strain CEN.PK 113-7D Δura3 :: loxP Δhis3 and named BP857. Gentra for deletion and marker removal? Fuzzy? PCR using genomic DNA prepared with the East / Bat Kit (Qiagen, Valencia, Calif.), Primers oBP450 (SEQ ID NO: 24) and oBP451 (SEQ ID NO: 25) for Δura3 and primer oBP460 for Δhis3 (SEQ ID NO: 22) and oBP461 (SEQ ID NO: 23).
PDC6PDC6 결실 fruition
스카리스 PDC6 결실을 위한 PCR 카세트에 대한 4개의 단편을 퓨전? 하이 피델리티 PCR 마스터 믹스 (미국 매사추세츠주 입스위치에 소재하는 뉴 잉글랜드 바이오랩스 인코포레이티드) 및 젠트라? 퓨어진? 이스트/백트 키트 (미국 캘리포니아주 발렌시아에 소재하는 퀴아젠)로 제조된 주형으로서의 CEN.PK 113-7D 게놈 DNA를 사용하여 증폭시켰다. PDC6 단편 A를 프라이머 oBP440 (서열 번호 26) 및 PDC6 단편 B의 5' 말단에 대하여 상동성을 갖는 5' 테일을 포함하는 프라이머 oBP441 (서열 번호 27)을 사용하여 증폭시켰다. PDC6 단편 B를 PDC6 단편 A의 3' 말단에 대하여 상동성을 갖는 5' 테일을 포함하는 프라이머 oBP442 (서열 번호 28), 및 PDC6 단편 U의 5' 말단에 대하여 상동성을 갖는 5' 테일을 포함하는 프라이머 oBP443 (서열 번호 29)를 사용하여 증폭시켰다. PDC6 단편 U를 PDC6 단편 B의 3' 말단에 대하여 상동성을 갖는 5' 테일을 포함하는 프라이머 oBP444 (서열 번호 30), 및 PDC6 단편 C의 5' 말단에 대하여 상동성을 갖는 5' 테일을 포함하는 프라이머 oBP445 (서열 번호 31)를 사용하여 증폭시켰다. PDC6 단편 C를 PDC6 단편 U의 3' 말단에 대하여 상동성을 갖는 5' 테일을 포함하는 프라이머 oBP446 (서열 번호 32), 및 프라이머 oBP447 (서열 번호 33)을 사용하여 증폭시켰다. PCR 생성물을 PCR 정제 키트 (미국 캘리포니아주 발렌시아에 소재하는 퀴아젠)로 정제하였다. PDC6 단편 AB를, PDC6 단편 A 및 PDC6 단편 B를 혼합하고, 프라이머 oBP440 (서열 번호 26) 및 oBP443 (서열 번호 29)를 사용하여 증폭시킴으로써 중첩 PCR에 의해 생성하였다. PDC6 단편 UC를, PDC6 단편 U 및 PDC6 단편 C를 혼합하고, 프라이머 oBP444 (서열 번호 30) 및 oBP447 (서열 번호 33)을 사용하여 증폭시킴으로써 중첩 PCR에 의해 생성하였다. 생성된 PCR 생성물을 아가로스 겔에서 정제하고, 이어서 겔 추출 키트 (미국 캘리포니아주 발렌시아에 소재하는 퀴아젠)로 정제하였다. PDC6 ABUC 카세트를, PDC6 단편 AB 및 PDC6 단편 UC를 혼합하고, 프라이머 oBP440 (서열 번호 26) 및 oBP447 (서열 번호 33)을 사용하여 증폭시킴으로써 중첩 PCR에 의해 생성하였다. PCR 생성물을 PCR 정제 키트 (미국 캘리포니아주 발렌시아에 소재하는 퀴아젠)로 정제하였다.Fusion of four fragments to a PCR cassette for Scarris PDC6 deletion? High Fidelity PCR Master Mix (New England Biolabs, Inc., Ipswich, Mass.) And Gentra? Fuzzy? Amplification was done using CEN.PK 113-7D genomic DNA as a template made with the Yeast / Back kit (Qiagen, Valencia, CA). PDC6 fragment A was amplified using primer oBP440 (SEQ ID NO: 26) and primer oBP441 (SEQ ID NO: 27) comprising a 5 'tail homologous to the 5' end of PDC6 fragment B. PDC6 fragment B comprises primer oBP442 (SEQ ID NO: 28) comprising a 5 'tail homologous to the 3' end of PDC6 fragment A, and a 5 'tail homologous to the 5' end of PDC6 fragment U Was amplified using primers oBP443 (SEQ ID NO: 29). PDC6 fragment U comprises primer oBP444 (SEQ ID NO: 30) comprising a 5 'tail homologous to the 3' end of PDC6 fragment B, and a 5 'tail homologous to the 5' end of PDC6 fragment C Was amplified using primers oBP445 (SEQ ID NO: 31). PDC6 fragment C was amplified using primer oBP446 (SEQ ID NO: 32), and primer oBP447 (SEQ ID NO: 33) comprising a 5 'tail homologous to the 3' end of PDC6 fragment U. PCR products were purified with a PCR Purification Kit (Qiagen, Valencia, CA). PDC6 fragment AB was generated by overlapping PCR by mixing PDC6 fragment A and PDC6 fragment B and amplifying with primers oBP440 (SEQ ID NO: 26) and oBP443 (SEQ ID NO: 29). PDC6 fragment UC was generated by overlapping PCR by mixing PDC6 fragment U and PDC6 fragment C and amplifying using primers oBP444 (SEQ ID NO: 30) and oBP447 (SEQ ID NO: 33). The resulting PCR product was purified on agarose gel and then purified by gel extraction kit (Qiagen, Valencia, CA). PDC6 ABUC cassettes were generated by overlapping PCR by mixing PDC6 fragment AB and PDC6 fragment UC and amplifying using primers oBP440 (SEQ ID NO: 26) and oBP447 (SEQ ID NO: 33). PCR products were purified with a PCR Purification Kit (Qiagen, Valencia, CA).
CEN.PK 113-7D Δura3::loxP Δhis3의 컴피턴트 세포를 만들고, 프로즌-이지 이스트 트랜스포메이션 II™ 키트 (미국 캘리포니아주 어바인에 소재하는 자이모 리서치 코퍼레이션)를 사용하여 PDC6 ABUC PCR 카세트로 형질전환시켰다. 형질전환 혼합물을 30℃에서 2% 글루코스가 보충된 우라실이 결핍된 합성 완전 배지 상에 플레이팅하였다. pdc6 녹아웃이 있는 형질전환체를 젠트라? 퓨어진? 이스트/백트 키트 (미국 캘리포니아주 발렌시아에 소재하는 퀴아젠)로 제조한 게놈 DNA를 사용하여 프라이머 oBP448 (서열 번호 34) 및 oBP449 (서열 번호 35)을 사용하여 PCR로 스크리닝하였다. 정확한 형질전환체를 균주 CEN.PK 113-7D Δura3::loxP Δhis3 Δpdc6::URA3로 선택하였다.Competent cells of CEN.PK 113-7D Δura3 :: loxP Δhis3 were made and transformed with the PDC6 ABUC PCR cassette using the Frozen-Easy East Transformation II ™ Kit (Zymo Research Corporation, Irvine, CA). I was. Transformation mixtures were plated at 30 ° C. on synthetic complete medium lacking uracil supplemented with 2% glucose. Gentra for transformants with pdc6 knockout? Fuzzy? Genomic DNA prepared with the East / Bat Kit (Qiagen, Valencia, CA) was screened by PCR using primers oBP448 (SEQ ID NO: 34) and oBP449 (SEQ ID NO: 35). The correct transformants were selected with strain CEN.PK 113-7D Δura3 :: loxP Δhis3 Δpdc6 :: URA3.
CEN.PK 113-7D Δura3::loxP Δhis3 Δpdc6::URA3를 YPD에서 하룻밤 성장시키고, 30℃에서 5-플루오로-오로트산 (0.1%)을 함유하는 합성 완전 배지 상에 플레이팅하여, URA3 마커가 소실된 분리주를 선택하였다. 결실 및 마커 제거를 젠트라? 퓨어진? 이스트/백트 키트 (미국 캘리포니아주 발렌시아에 소재하는 퀴아젠)로 제조한 게놈 DNA를 사용하여 PCR에 의해, 프라이머 oBP448 (서열 번호 34) 및 oBP449 (서열 번호 35)로 시퀀싱하여 확인하였다. 분리주로부터의 PDC6 유전자의 부재를 PDC6의 코딩 서열에 대하여 특이적인 프라이머, oBP554 (서열 번호 36) 및 oBP555 (서열 번호 37)를 사용하여 음성 PCR 결과에 의해 입증하였다. 정확한 분리주를 균주 CEN.PK 113-7D Δura3::loxP Δhis3 Δpdc6으로 선택하여, BP891로 명명하였다.CEN.PK 113-7D Δura3 :: loxP Δhis3 Δpdc6 :: URA3 was grown overnight in YPD and plated on synthetic complete medium containing 5-fluoro-orotic acid (0.1%) at 30 ° C. Isolates with missing markers were selected. Gentra for deletion and marker removal? Fuzzy? It was confirmed by sequencing with primers oBP448 (SEQ ID NO: 34) and oBP449 (SEQ ID NO: 35) by PCR using genomic DNA prepared with the East / Bact kit (Qiagen, Valencia, CA). The absence of the PDC6 gene from the isolate was demonstrated by negative PCR results using primers specific for the coding sequence of PDC6, oBP554 (SEQ ID NO: 36) and oBP555 (SEQ ID NO: 37). The correct isolate was selected as strain CEN.PK 113-7D Δura3 :: loxP Δhis3 Δpdc6 and named BP891.
PDC1 결실 ilvDSm 통합PDC1 deletion ilvDSm integration
PDC1 유전자를 결실시키고, 스트렙토코커스 무탄스 ATCC 번호 700610로부터의 ilvD 코딩 영역으로 대체하였다. A 단편에 이은, PDC1 결실-ilvDSm 통합을 위한 PCR 카세트를 위한 스트렙토코커스 무탄스로부터의 ilvD 코딩 영역을 퓨전? 하이 피델리티 PCR 마스터 믹스 (미국 매사추세츠주 입스위치에 소재하는 뉴 잉글랜드 바이오랩스 인코포레이티드) 및 젠트라? 퓨어진? 이스트/백트 키트 (미국 캘리포니아주 발렌시아에 소재하는 퀴아젠)로 제조된 주형으로서의 NYLA83 게놈 DNA를 사용하여 증폭시켰다. NYLA83는 그 전체 내용이 본 명세서에 참조로 포함되는 미국 특허 출원 공개 제2009/0305363호에 기재된 PDC1 결실-ilvDSm 통합을 포함하는 균주 (그 전체 내용이 본 명세서에 참조로 포함되는 미국 특허 출원 공개 제2011/0124060호에 기재된 구축물)이다. PDC1 단편 A-ilvDSm (서열 번호 141)을 프라이머 oBP513 (서열 번호 38) 및 PDC1 단편 B의 5' 말단에 대하여 상동성을 갖는 5' 테일을 포함하는 프라이머 oBP515 (서열 번호 39)를 사용하여 증폭시켰다. PDC1 결실-ilvDSm 통합을 위한 PCR 카세트를 위한 B, U, 및 C 단편을 퓨전? 하이 피델리티 PCR 마스터 믹스 (미국 매사추세츠주 입스위치에 소재하는 뉴 잉글랜드 바이오랩스 인코포레이티드) 및 젠트라? 퓨어진? 이스트/백트 키트 (미국 캘리포니아주 발렌시아에 소재하는 퀴아젠)로 제조된 주형으로서의 CEN.PK 113-7D 게놈 DNA를 사용하여 증폭시켰다. PDC1 단편 B를 PDC1 단편 A-ilvDSm의 3' 말단에 대하여 상동성을 갖는 5' 테일을 포함하는 프라이머 oBP516 (서열 번호 40), 및 PDC1 단편 U의 5' 말단에 대하여 상동성을 갖는 5' 테일을 포함하는 프라이머 oBP517 (서열 번호 41)를 사용하여 증폭시켰다. PDC1 단편 U를 PDC1 단편 B의 3' 말단에 대하여 상동성을 갖는 5' 테일을 포함하는 프라이머 oBP518 (서열 번호 42), 및 PDC1 단편 C의 5' 말단에 대하여 상동성을 갖는 5' 테일을 포함하는 프라이머 oBP519 (서열 번호 43)를 사용하여 증폭시켰다. PDC1 단편 C를 PDC1 단편 U의 3' 말단에 대하여 상동성을 갖는 5' 테일을 포함하는 프라이머 oBP520 (서열 번호 44), 및 프라이머 oBP521 (서열 번호 45)을 사용하여 증폭시켰다. PCR 생성물을 PCR 정제 키트 (미국 캘리포니아주 발렌시아에 소재하는 퀴아젠)로 정제하였다. PDC1 단편 A-ilvDSm-B를, PDC1 단편 A-ilvDSm 및 PDC1 단편 B를 혼합하고, 프라이머 oBP513 (서열 번호 38) 및 oBP517 (서열 번호 41)을 사용하여 증폭시킴으로써 중첩 PCR에 의해 생성하였다. PDC1 단편 UC를, PDC1 단편 U 및 PDC1 단편 C를 혼합하고, 프라이머 oBP518 (서열 번호 42) 및 oBP521 (서열 번호 45)을 사용하여 증폭시킴으로써 중첩 PCR에 의해 생성하였다. 생성된 PCR 생성물을 아가로스 겔에서 정제하고, 이어서 겔 추출 키트 (미국 캘리포니아주 발렌시아에 소재하는 퀴아젠)로 정제하였다. PDC1 A-ilvDSm-BUC 카세트 (서열 번호 142)를 PDC1 단편 A-ilvDSm-B 및 PDC1 단편 UC를 혼합하고, 프라이머 oBP513 (서열 번호 38) 및 oBP521 (서열 번호 45)을 사용하여 증폭시킴으로써 중첩 PCR에 의해 생성하였다. PCR 생성물을 PCR 정제 키트 (미국 캘리포니아주 발렌시아에 소재하는 퀴아젠)로 정제하였다.The PDC1 gene was deleted and replaced with the ilvD coding region from Streptococcus mutans ATCC No. 700610. A fragment followed by fusion of the ilvD coding region from Streptococcus mutans for the PCR cassette for PDC1 deletion-ilvDSm integration? High Fidelity PCR Master Mix (New England Biolabs, Inc., Ipswich, Mass.) And Gentra? Fuzzy? Amplification was performed using NYLA83 genomic DNA as a template made with the East / Bat Kit (Qiagen, Valencia, CA). NYLA83 is a strain comprising the PDC1 deletion-ilvDSm integration described in US Patent Application Publication No. 2009/0305363, the entire contents of which are incorporated herein by reference (US Patent Application Publication No. 5, which is incorporated herein by reference in its entirety). Construct described in 2011/0124060). PDC1 fragment A-ilvDSm (SEQ ID NO: 141) was amplified using primer oBP513 (SEQ ID NO: 38) and primer oBP515 (SEQ ID NO: 39) comprising a 5 'tail homologous to the 5' end of PDC1 fragment B . Fusion of B, U, and C Fragments for PCR Cassettes for PDC1 Deletion-ilvDSm Integration? High Fidelity PCR Master Mix (New England Biolabs, Inc., Ipswich, Mass.) And Gentra? Fuzzy? Amplification was done using CEN.PK 113-7D genomic DNA as a template made with the Yeast / Back kit (Qiagen, Valencia, CA). Primer OBP516 (SEQ ID NO: 40) comprising a 5 'tail homologous to the 3' end of PDC1 fragment A-ilvDSm, and a 5 'tail homologous to the 5' end of PDC1 fragment U Amplified using a primer containing oBP517 (SEQ ID NO: 41). PDC1 fragment U comprises primer oBP518 (SEQ ID NO: 42) comprising a 5 'tail homologous to the 3' end of PDC1 fragment B, and a 5 'tail homologous to the 5' end of PDC1 fragment C Amplification using primers oBP519 (SEQ ID NO: 43). PDC1 fragment C was amplified using primer oBP520 (SEQ ID NO: 44), and primer oBP521 (SEQ ID NO: 45) comprising a 5 'tail homologous to the 3' end of PDC1 fragment U. PCR products were purified with a PCR Purification Kit (Qiagen, Valencia, CA). PDC1 fragment A-ilvDSm-B was generated by overlapping PCR by mixing PDC1 fragment A-ilvDSm and PDC1 fragment B and amplifying using primers oBP513 (SEQ ID NO: 38) and oBP517 (SEQ ID NO: 41). PDC1 fragment UC was generated by overlapping PCR by mixing PDC1 fragment U and PDC1 fragment C and amplifying using primers oBP518 (SEQ ID NO: 42) and oBP521 (SEQ ID NO: 45). The resulting PCR product was purified on agarose gel and then purified by gel extraction kit (Qiagen, Valencia, CA). Nested PCR by mixing the PDC1 A-ilvDSm-BUC cassette (SEQ ID NO: 142) with the PDC1 fragments A-ilvDSm-B and PDC1 fragment UC and amplifying using primers oBP513 (SEQ ID NO: 38) and oBP521 (SEQ ID NO: 45) Generated by PCR products were purified with a PCR Purification Kit (Qiagen, Valencia, CA).
CEN.PK 113-7D Δura3::loxP Δhis3 Δpdc6의 컴피턴트 세포를 만들고, 프로즌-이지 이스트 트랜스포메이션 II™ 키트 (미국 캘리포니아주 어바인에 소재하는 자이모 리서치 코퍼레이션)를 사용하여 PDC1 A-ilvDSm-BUC PCR 카세트로 형질전환시켰다. 형질전환 혼합물을 30℃에서 2% 글루코스가 보충된 우라실이 결핍된 합성 완전 배지 상에 플레이팅하였다. pdc1 녹아웃 ilvDSm 통합이 있는 형질전환체를 젠트라? 퓨어진? 이스트/백트 키트 (미국 캘리포니아주 발렌시아에 소재하는 퀴아젠)로 제조한 게놈 DNA를 사용하여 프라이머 oBP511 (서열 번호 46) 및 oBP512 (서열 번호 47)를 사용하여 PCR로 스크리닝하였다. 분리주로부터의 PDC1 유전자의 부재를 PDC1의 코딩 서열에 대하여 특이적인 프라이머, oBP550 (서열 번호 48) 및 oBP551 (서열 번호 49)을 사용하여 음성 PCR 결과에 의해 입증하였다. 정확한 형질전환체를 균주 CEN.PK 113-7D Δura3::loxP Δhis3 Δpdc6 Δpdc1::ilvDSm-URA3로 선택하였다.Competent cells of CEN.PK 113-7D Δura3 :: loxP Δhis3 Δpdc6 were made and PDC1 A-ilvDSm-BUC using the Frozen-Easy East Transformation II ™ Kit (Zymo Research Corporation, Irvine, CA). Transformed with a PCR cassette. Transformation mixtures were plated at 30 ° C. on synthetic complete medium lacking uracil supplemented with 2% glucose. Gentra transformants with pdc1 knockout ilvDSm integration? Fuzzy? Genomic DNA prepared with the East / Bat Kit (Qiagen, Valencia, Calif.) Was screened by PCR using primers oBP511 (SEQ ID NO: 46) and oBP512 (SEQ ID NO: 47). The absence of the PDC1 gene from the isolate was demonstrated by negative PCR results using primers specific for the coding sequence of PDC1, oBP550 (SEQ ID NO: 48) and oBP551 (SEQ ID NO: 49). The correct transformants were selected with strain CEN.PK 113-7D Δura3 :: loxP Δhis3 Δpdc6 Δpdc1 :: ilvDSm-URA3.
CEN.PK 113-7D Δura3::loxP Δhis3 Δpdc6 Δpdc1::ilvDSm-URA3를 YPD에서 하룻밤 동안 성장시키고, 30℃에서 5-플루오로-오로트산 (0.1%)을 함유하는 합성 완전 배지 상에 플레이팅시켜, URA3 마커가 소실된 분리주를 선택하였다. PDC1의 결실, ilvDSm의 통합, 및 마커 제거를 젠트라? 퓨어진? 이스트/백트 키트 (미국 캘리포니아주 발렌시아에 소재하는 퀴아젠)로 제조한 게놈 DNA를 사용하여 PCR에 의해, 프라이머 oBP511 (서열 번호 46) 및 oBP512 (서열 번호 47)로 시퀀싱하여 확인하였다. 정확한 분리주를 균주 CEN.PK 113-7D Δura3::loxP Δhis3 Δpdc6 Δpdc1::ilvDSm으로 선택하여, BP907로 명명하였다.CEN.PK 113-7D Δura3 :: loxP Δhis3 Δpdc6 Δpdc1 :: ilvDSm-URA3 were grown overnight in YPD and played on synthetic complete medium containing 5-fluoro-orotic acid (0.1%) at 30 ° C. To isolate the isolates with missing URA3 markers. Gentric deletion of PDC1, integration of ilvDSm, and marker removal? Fuzzy? It was confirmed by sequencing with primers oBP511 (SEQ ID NO: 46) and oBP512 (SEQ ID NO: 47) by PCR using genomic DNA prepared with the East / Bact kit (Qiagen, Valencia, CA). The correct isolate was selected as strain CEN.PK 113-7D Δura3 :: loxP Δhis3 Δpdc6 Δpdc1 :: ilvDSm and named BP907.
PDC5 결실 sadB 통합PDC5 deletion sadB integration
PDC5 유전자를 결실시키고, 아크로모박터 자일로족시단스로부터의 sadB 코딩 영역으로 대체하였다. 먼저, PDC5 결실-sadB 통합을 위한 PCR 카세트의 세그먼트를 플라스미드 pUC19-URA3MCS 내로 클로닝하였다.The PDC5 gene was deleted and replaced with the sadB coding region from Acromobacter xyloxidans. First, a segment of the PCR cassette for PDC5 deletion-sadB integration was cloned into the plasmid pUC19-URA3MCS.
pUC19-URA3MCS는 pUC19 기반의 것이며, 다중 클로닝 부위 (MCS) 내에 위치한 사카로마이세스 세레비시아로부터의 URA3 유전자의 서열을 함유한다. pUC19는 대장균에서의 복제 및 선택을 위한 베타-락타마제를 코딩하는 유전자 및 pMB1 레플리콘을 함유한다. URA3에 대한 코딩 서열 외에, 이러한 유전자의 업스트림 및 다운스트림으로부터의 서열을 효모에서의 URA3 유전자의 발현을 위해 포함시켰다. 벡터는 클로닝 목적을 위해 사용될 수 있으며, 효모 통합 벡터로서 사용될 수 있다.pUC19-URA3MCS is based on pUC19 and contains the sequence of the URA3 gene from Saccharomyces cerevisiae located within the multiple cloning site (MCS). pUC19 contains pMB1 replicon and a gene encoding beta-lactamase for replication and selection in E. coli. In addition to the coding sequences for URA3, sequences from upstream and downstream of these genes were included for expression of the URA3 gene in yeast. Vectors can be used for cloning purposes and can be used as yeast integration vectors.
사카로마이세스 세레비시아 CEN.PK 113-7D 게놈 DNA로부터의 URA3 코딩 영역의 250 bp 업스트림 및 150 bp 다운스트림과 함께 URA3 코딩 영역을 포함하는 DNA를 퓨전? 하이 피델리티 PCR 마스터 믹스 (미국 매사추세츠주 입스위치에 소재하는 뉴 잉글랜드 바이오랩스 인코포레이티드)를 사용하여, BamHI, AscI, PmeI, 및 FseI 제한 부위를 포함하는 프라이머 oBP438 (서열 번호 12), 및 XbaI, PacI, 및 NotI 제한 부위를 포함하는 프라이머 oBP439 (서열 번호 13)를 사용하여 증폭시켰다. 게놈 DNA를 젠트라? 퓨어진? 이스트/백트 키트 (미국 캘리포니아주 발렌시아에 소재하는 퀴아젠)를 사용하여 제조하였다. PCR 생성물 및 pUC19 (서열 번호 150)를 BamHI 및 XbaI로의 분해 후에 T4 DNA 리가제로 라이게이션시켜, 벡터 pUC19-URA3MCS를 생성하였다. 벡터를 PCR에 의해, 프라이머 oBP264 (서열 번호 10) 및 oBP265 (서열 번호 11)로 시퀀싱하여 확인하였다.Fusion of DNA comprising a URA3 coding region with 250 bp upstream and 150 bp downstream of the URA3 coding region from Saccharomyces cerevisiae CEN.PK 113-7D genomic DNA? Primer oBP438 (SEQ ID NO: 12), and XbaI, comprising the BamHI, AscI, PmeI, and FseI restriction sites, using a high fidelity PCR master mix (New England Biolabs, Ipswich, Mass.) Amplification was carried out using primers oBP439 (SEQ ID NO: 13) comprising PacI, and NotI restriction sites. Genome DNA Gentra? Fuzzy? Prepared using the Yeast / Back Kit (Qiagen, Valencia, CA). PCR product and pUC19 (SEQ ID NO: 150) were ligated with T4 DNA ligase after digestion with BamHI and XbaI to generate vector pUC19-URA3MCS. The vector was confirmed by sequencing by primers oBP264 (SEQ ID NO: 10) and oBP265 (SEQ ID NO: 11).
sadB의 코딩 서열 및 PDC5 단편 B를 pUC19-URA3MCS 내로 클로닝하여, PDC5 A-sadB-BUC PCR 카세트의 sadB-BU 부분을 생성하였다. sadB의 코딩 서열을 주형으로서 pLH468-sadB (서열 번호 67)를 사용하여 AscI 제한 부위를 포함하는 프라이머 oBP530 (서열 번호 50), 및 PDC5 단편 B의 5' 말단에 대하여 상동성을 갖는 5' 테일을 포함하는 프라이머 oBP531 (서열 번호 51)를 사용하여 증폭시켰다. PDC5 단편 B를 sadB의 3' 말단에 대하여 상동성을 갖는 5' 테일을 포함하는 프라이머 oBP532 (서열 번호 52), 및 PmeI 제한 부위를 포함하는 프라이머 oBP533 (서열 번호 53)를 사용하여 증폭시켰다. PCR 생성물을 PCR 정제 키트 (미국 캘리포니아주 발렌시아에 소재하는 퀴아젠)로 정제하였다. sadB-PDC5 단편 B를 sadB 및 PDC5 단편 B PCR 생성물을 혼합하고, 프라이머 oBP530 (서열 번호 50) 및 oBP533 (서열 번호 53)를 사용하여 증폭시킴으로써 중첩 PCR에 의해 생성하였다. 생성된 PCR 생성물을 AscI 및 PmeI로 분해하고, T4 DNA 리가제를 사용하여 적절한 효소에 의한 분해 후에 pUC19-URA3MCS의 상응하는 부위 내로 라이게이션시켰다. 생성된 플라스미드를 프라이머 oBP536 (서열 번호 54) 및 PDC5 단편 C의 5' 말단에 대하여 상동성을 갖는 5' 테일을 포함하는 프라이머 oBP546 (서열 번호 55)를 사용하여 sadB-단편 B-단편 U의 증폭을 위해 주형으로 사용하였다. PDC5 단편 C를 PDC5 sadB-단편 B-단편 U의 3' 말단에 대하여 상동성을 갖는 5' 테일을 포함하는 프라이머 oBP547 (서열 번호 56), 및 프라이머 oBP539 (서열 번호 57)를 사용하여 증폭시켰다. PCR 생성물을 PCR 정제 키트 (미국 캘리포니아주 발렌시아에 소재하는 퀴아젠)로 정제하였다. PDC5 sadB-단편 B-단편 U-단편 C를, PDC5 sadB-단편 B-단편 U 및 PDC5 단편 C를 혼합하고, 프라이머 oBP536 (서열 번호 54) 및 oBP539 (서열 번호 57)를 사용하여 증폭시킴으로써 중첩 PCR에 의해 생성하였다. 생성된 PCR 생성물을 아가로스 겔에서 정제하고, 이어서 겔 추출 키트 (미국 캘리포니아주 발렌시아에 소재하는 퀴아젠)로 정제하였다. PDC5 A-sadB-BUC 카세트 (서열 번호 143)를, PDC5 sadB-단편 B-단편 U-단편 C를 고유 PDC5 코딩 서열의 50개의 뉴클레오티드 인접 업스트림에 대하여 상동성을 갖는 5' 테일을 포함하는 프라이머 oBP542 (서열 번호 58), 및 프라이머 oBP539 (서열 번호 57)를 사용하여 증폭시킴으로써 생성하였다. PCR 생성물을 PCR 정제 키트 (미국 캘리포니아주 발렌시아에 소재하는 퀴아젠)로 정제하였다. The coding sequence of sadB and PDC5 fragment B were cloned into pUC19-URA3MCS to generate the sadB-BU portion of the PDC5 A-sadB-BUC PCR cassette. Using the coding sequence of sadB as a template, pLH468-sadB (SEQ ID NO: 67) was used to generate a primer oBP530 (SEQ ID NO: 50) containing an AscI restriction site, and a 5 'tail with homology to the 5' end of PDC5 fragment B. Amplification was carried out using the containing primer oBP531 (SEQ ID NO: 51). PDC5 fragment B was amplified using primer oBP532 (SEQ ID NO: 52) comprising a 5 'tail with homology to the 3' end of sadB, and primer oBP533 (SEQ ID NO: 53) comprising a PmeI restriction site. PCR products were purified with a PCR Purification Kit (Qiagen, Valencia, CA). sadB-PDC5 fragment B was generated by overlap PCR by mixing sadB and PDC5 fragment B PCR products and amplifying with primers oBP530 (SEQ ID NO: 50) and oBP533 (SEQ ID NO: 53). The resulting PCR product was digested with AscI and PmeI and ligated into the corresponding sites of pUC19-URA3MCS after digestion with appropriate enzymes using T4 DNA ligase. The resulting plasmid was amplified by sadB-fragment B-fragment U using primer oBP536 (SEQ ID NO: 54) and primer oBP546 (SEQ ID NO: 55) comprising a 5 'tail homologous to the 5' end of PDC5 fragment C. Used as a template for PDC5 fragment C was amplified using primer oBP547 (SEQ ID NO: 56), and primer oBP539 (SEQ ID NO: 57) comprising a 5 'tail homologous to the 3' end of PDC5 sadB-fragment B-fragment U. PCR products were purified with a PCR Purification Kit (Qiagen, Valencia, CA). Nested PCR by mixing PDC5 sadB-fragment B-fragment U-fragment C, PDC5 sadB-fragment B-fragment U and PDC5 fragment C and amplifying with primers oBP536 (SEQ ID NO: 54) and oBP539 (SEQ ID NO: 57) Produced by The resulting PCR product was purified on agarose gel and then purified by gel extraction kit (Qiagen, Valencia, CA). A primer oBP542 containing a 5 'tail with a PDC5 A-sadB-BUC cassette (SEQ ID NO: 143) and a PDC5 sadB-fragment B-fragment U-fragment C with homology to 50 nucleotide contiguous upstream of the native PDC5 coding sequence (SEQ ID NO: 58), and primers amplified using oBP539 (SEQ ID NO: 57). PCR products were purified with a PCR Purification Kit (Qiagen, Valencia, CA).
CEN.PK 113-7D Δura3::loxP Δhis3 Δpdc6 Δpdc1::ilvDSm의 컴피턴트 세포를 만들고, 프로즌-이지 이스트 트랜스포메이션 II™ 키트 (미국 캘리포니아주 어바인에 소재하는 자이모 리서치 코퍼레이션)를 사용하여 PDC5 A-sadB-BUC PCR 카세트로 형질전환시켰다. 형질전환 혼합물을 30℃에서 1% 에탄올을 보충한 (글루코스 없음) 우라실이 결핍된 합성 완전 배지 상에 플레이팅하였다. pdc5 녹아웃 sadB 통합이 있는 형질전환체를 젠트라? 퓨어진? 이스트/백트 키트 (미국 캘리포니아주 발렌시아에 소재하는 퀴아젠)로 제조한 게놈 DNA를 사용하여 프라이머 oBP540 (서열 번호 59) 및 oBP541 (서열 번호 60)을 사용하여 PCR로 스크리닝하였다. 분리주로부터의 PDC5 유전자의 부재를 PDC5의 코딩 서열에 대하여 특이적인 프라이머, oBP552 (서열 번호 61) 및 oBP553 (서열 번호 62)를 사용하여 음성 PCR 결과에 의해 입증하였다. 정확한 형질전환체를 균주 CEN.PK 113-7D Δura3::loxP Δhis3 Δpdc6 Δpdc1::ilvDSm Δpdc5::sadB-URA3로 선택하였다.Create competent cells of CEN.PK 113-7D Δura3 :: loxP Δhis3 Δpdc6 Δpdc1 :: ilvDSm and use the Frozen-Easy East Transformation II ™ Kit (Zymo Research Corporation, Irvine, CA) Transformed with -sadB-BUC PCR cassette. Transformation mixtures were plated on synthetic complete medium lacking uracil (without glucose) supplemented with 1% ethanol at 30 ° C. Gentra transformants with pdc5 knockout sadB integration? Fuzzy? Genomic DNA prepared with the East / Bat Kit (Qiagen, Valencia, Calif.) Was screened by PCR using primers oBP540 (SEQ ID NO: 59) and oBP541 (SEQ ID NO: 60). The absence of the PDC5 gene from the isolate was demonstrated by negative PCR results using primers specific for the coding sequence of PDC5, oBP552 (SEQ ID NO: 61) and oBP553 (SEQ ID NO: 62). The correct transformants were selected as strain CEN.PK 113-7D Δura3 :: loxP Δhis3 Δpdc6 Δpdc1 :: ilvDSm Δpdc5 :: sadB-URA3.
CEN.PK 113-7D Δura3::loxP Δhis3 Δpdc6 Δpdc1::ilvDSm Δpdc5::sadB-URA3를 YPE (1% 에탄올)에서 하룻밤 성장시키고, 30℃에서 에탄올을 보충하고 (글루코스 없음) 5-플루오로-오로트산 (0.1%)을 함유하는 합성 완전 배지 상에 플레이팅하여, URA3 마커가 소실된 분리주를 선택하였다. PDC5의 결실, sadB의 통합, 및 마커 제거를 젠트라? 퓨어진? 이스트/백트 키트 (미국 캘리포니아주 발렌시아에 소재하는 퀴아젠)로 제조한 게놈 DNA를 사용하여, 프라이머 oBP540 (서열 번호 59) 및 oBP541 (서열 번호 60)을 사용하여 PCR로 확인하였다. 정확한 분리주를 균주 CEN.PK 113-7D Δura3::loxP Δhis3 Δpdc6 Δpdc1::ilvDSm Δpdc5::sadB로 선택하여, BP913으로 명명하였다.CEN.PK 113-7D Δura3 :: loxP Δhis3 Δpdc6 Δpdc1 :: ilvDSm Δpdc5 :: sadB-URA3 was grown overnight in YPE (1% ethanol), supplemented with ethanol at 30 ° C. (without glucose) and 5-fluoro- Plated on synthetic complete medium containing orotic acid (0.1%) to select isolates that lacked the URA3 marker. Gentric deletion of PDC5, integration of sadB, and marker removal? Fuzzy? Genomic DNA prepared with the East / Bat Kit (Qiagen, Valencia, Calif.) Was confirmed by PCR using primers oBP540 (SEQ ID NO: 59) and oBP541 (SEQ ID NO: 60). The correct isolate was selected as strain CEN.PK 113-7D Δura3 :: loxP Δhis3 Δpdc6 Δpdc1 :: ilvDSm Δpdc5 :: sadB and named BP913.
GPD2 결실GPD2 Fruit
내인성 GPD2 코딩 영역을 결실시키기 위해, gpd2::loxP-URA3-loxP 카세트 (서열 번호 151)를 주형 DNA로서 loxP-URA3-loxP (서열 번호 68)를 사용하여 PCR 증폭시켰다. loxP-URA3-loxP는 loxP 재조합효소 부위가 플랭킹된 (ATCC 번호 77107) 유래의 URA3 마커를 함유한다. 퓨전? DNA 폴리메라제 (미국 매사추세츠주 입스위치에 소재하는 뉴 잉글랜드 바이오랩스 인코포레이티드) 및 프라이머 LA512 및 LA513 (서열 번호 8 및 9)를 사용하여, PCR을 행하였다. 각 프라이머의 GPD2 부분이 GPD2 코딩 영역의 5' 영역 업스트림 및 코딩 영역의 3' 영역 다운스트림으로부터 유래되어, loxP-URA3-loxP 마커의 통합에 의해 GPD2 코딩 영역이 대체되도록 하였다. PCR 생성물을 BP913 내로 형질전환시키고, 형질전환체를 1% 에탄올이 보충되고 (글루코스 없음) 우라실이 결핍된 합성 완전 배지 상에서 선택하였다. 형질전환체를 스크리닝하여, 프라이머 oBP582 및 AA270 (서열 번호 63 및 64)을 사용하여, PCR로 정확한 통합을 입증하였다.To delete the endogenous GPD2 coding region, the gpd2 :: loxP-URA3-loxP cassette (SEQ ID NO: 151) was PCR amplified using loxP-URA3-loxP (SEQ ID NO: 68) as template DNA. loxP-URA3-loxP contains URA3 markers from flanked loxP recombinase sites (ATCC No 77107). fusion? PCR was performed using DNA polymerase (New England Biolabs, Ipswich, Mass.) And primers LA512 and LA513 (SEQ ID NOs: 8 and 9). The GPD2 portion of each primer was derived from the 5 'region upstream of the GPD2 coding region and the 3' region downstream of the coding region so that the GPD2 coding region was replaced by the integration of the loxP-URA3-loxP marker. PCR products were transformed into BP913 and transformants were selected on synthetic complete medium supplemented with 1% ethanol (no glucose) and lacking uracil. Transformants were screened to demonstrate correct integration by PCR using primers oBP582 and AA270 (SEQ ID NOs 63 and 64).
URA3 마커를 pRS423::PGAL1-cre (서열 번호 66)로 형질전환시키고, 30℃에서 1% 에탄올이 보충되고 히스티딘이 결핍된 합성 완전 배지 상에 플레이팅함으로써 재순환시켰다. 형질전환체를 1% 에탄올이 보충되고, 5-플루오로-오로트산 (0.1%)을 함유하는 합성 완전 배지 상에 스트리킹하고, 30℃로 인큐베이션하여, URA3 마커가 소실된 분리주를 선택하였다. 5-FOA 내성 분리주를 pRS423::PGAL1-cre 플라스미드의 제거를 위하여 YPE (1% 에탄올)에서 성장시켰다. 결실 및 마커 제거를 프라이머 oBP582 (서열 번호 63) 및 oBP591 (서열 번호 65)를 사용하여 PCR로 확인하였다. 정확한 분리주를 균주 CEN.PK 113-7D Δura3::loxP Δhis3 Δpdc6 Δpdc1::ilvDSm Δpdc5::sadB Δgpd2::loxP로 선택하여, PNY1503 (BP1064)로 명명하였다.URA3 markers were transformed with pRS423 :: PGAL1-cre (SEQ ID NO: 66) and recycled by plating on synthetic complete medium supplemented with 1% ethanol and deficient in histidine at 30 ° C. Transformants were streaked on synthetic complete medium supplemented with 1% ethanol, containing 5-fluoro-orotic acid (0.1%) and incubated at 30 ° C. to select isolates that lacked the URA3 marker. 5-FOA resistant isolates were grown in YPE (1% ethanol) for removal of the pRS423 :: PGAL1-cre plasmid. Deletion and marker removal was confirmed by PCR using primers oBP582 (SEQ ID NO: 63) and oBP591 (SEQ ID NO: 65). The correct isolate was selected as strain CEN.PK 113-7D Δura3 :: loxP Δhis3 Δpdc6 Δpdc1 :: ilvDSm Δpdc5 :: sadB Δgpd2 :: loxP and named PNY1503 (BP1064).
BP1064를 플라스미드 pYZ090 (서열 번호 1) 및 pLH468 (서열 번호 2)로 형질전환시켜, 균주 NGCI-070 (BP1083; PNY1504)를 생성하였다.BP1064 was transformed with plasmids pYZ090 (SEQ ID NO: 1) and pLH468 (SEQ ID NO: 2) to generate strain NGCI-070 (BP1083; PNY1504).
사카로마이세스 세레비시아 균주 PNY2205의 구축Construction of Saccharomyces cerevisiae strain PNY2205
균주, PNY2205는 상술한 PNY1503 (BP1064)로부터 유래되었다.The strain, PNY2205 was derived from PNY1503 (BP1064) described above.
통상적으로 전체 코딩 서열이 제거된 결실을 형질전환체의 선택을 위한 URA3 유전자 및 표적 유전자의 상동성 업스트림 및 다운스트림의 영역을 포함하는 PCR 단편과의 상동성 재조합에 의해 형성하였다. URA3 유전자를 상동성 재조합에 의해 제거하여, 스카리스 결실을 형성하였다. 유전자 통합을 유사한 방법으로 형성하였다.Typically, deletions from which the entire coding sequence was removed were formed by homologous recombination with PCR fragments comprising regions of homology upstream and downstream of the URA3 gene and the target gene for selection of the transformants. The URA3 gene was removed by homologous recombination to form a scarris deletion. Gene integration was formed in a similar way.
스카리스 결실 절차를 문헌 [Akada et al., Yeast, 23:399, 2006]으로부터 채용하였다. 일반적으로, 각각의 스카리스 결실을 위한 PCR 카세트를 중첩 PCR에 의하여 4개의 단편, 즉, A-B-U-C를 조합함으로써 만들었다. 경우에 따라서는, 먼저 각각의 단편을 전체 카세트를 결실/통합 절차를 위해 PCR로 증폭하기 전에 플라스미드 내로 클로닝하였다. 프로모터 (URA3 유전자의 250 bp 업스트림) 및 터미네이터 (URA3 유전자의 150 bp 다운스트림) 영역과 함께, 고유 CEN.PK 113-7D URA3 유전자로 이루어진 PCR 카세트는 선택가능한/반대-선택가능한 마커, URA3 (단편 U)을 포함하였다. 각각 일반적으로 500 bp 길이의 단편 A 및 C는 표적 유전자의 500 bp 인접 업스트림 (단편 A) 및 표적 유전자의 3' 500 bp (단편 C)에 상응하였다. 단편 A 및 C를 상동성 재조합에 의하여 염색체 내로의 카세트의 통합을 위하여 사용하였다. 단편 B (500 bp 길이)는 표적 유전자의 500 bp 인접 다운스트림에 상응하며, 단편 B에 상응하는 서열의 직접 반복이 염색체 내로의 카세트의 통합 시에 생성되었기 때문에, 상동성 재조합에 의한 염색체로부터의 URA3 마커 및 단편 C의 절제를 위해 사용되었다.Scarris deletion procedures were employed from Akada et al., Yeast, 23: 399, 2006. In general, PCR cassettes for each scarris deletion were made by combining four fragments, namely A-B-U-C, by overlapping PCR. In some cases, each fragment was first cloned into a plasmid before the entire cassette was amplified by PCR for the deletion / integration procedure. Along with the promoter (250 bp upstream of the URA3 gene) and terminator (150 bp downstream of the URA3 gene) regions, the PCR cassette consisting of the native CEN.PK 113-7D URA3 gene provides a selectable / counter-selectable marker, URA3 (fragment). U). Fragments A and C, each generally 500 bp in length, corresponded to 500 bp contiguous upstream of the target gene (fragment A) and 3 '500 bp (fragment C) of the target gene. Fragments A and C were used for integration of the cassette into the chromosome by homologous recombination. Fragment B (500 bp in length) corresponds to 500 bp adjacent downstream of the target gene, and since direct repetition of the sequence corresponding to fragment B was generated upon incorporation of the cassette into the chromosome, homologous recombination from the chromosome Used for ablation of the URA3 marker and fragment C.
PCR 생성물 ABUC 카세트를 사용하여, URA3 마커를 먼저 상동성 재조합에 의하여 염색체 내로 통합시킨 다음, 염색체로부터 절제하였다. 초기의 통합에 의하여 3' 500 bp를 제외한 유전자가 결실되었다. 절제 시에, 유전자의 3' 500 bp 영역도 또한 결실되었다. 이러한 방법을 사용한 유전자의 통합을 위하여, 통합될 유전자는 단편 A와 B 사이의 PCR 카세트에 포함시켰다.Using the PCR product ABUC cassette, the URA3 marker was first integrated into the chromosome by homologous recombination and then excised from the chromosome. Early integration resulted in the deletion of genes other than 3 '500 bp. Upon ablation, the 3 '500 bp region of the gene was also deleted. For integration of genes using this method, the gene to be integrated was included in a PCR cassette between fragments A and B.
FRA2 결실FRA2 deletion
FRA2 결실을 설계하여, 코딩 서열의 3' 말단으로부터 250개 뉴클레오티드를 결실시켜 무손상 FRA2 코딩 서열의 처음 113개 뉴클레오티드를 남겼다. 인-프레임 종결 코돈은 결실의 7개 뉴클레오티드 다운스트림에 나타났다. 스카리스 FRA2 결실을 위한 PCR 카세트에 대한 4개의 단편을 퓨전? 하이 피델리티 PCR 마스터 믹스 (미국 매사추세츠주 입스위치에 소재하는 뉴 잉글랜드 바이오랩스 인코포레이티드) 및 젠트라? 퓨어진? 이스트/백트 키트 (미국 캘리포니아주 발렌시아에 소재하는 퀴아젠)로 제조된 주형으로서의 CEN.PK 113-7D 게놈 DNA를 사용하여 증폭시켰다. FRA2 단편 A를 프라이머 oBP594 (서열 번호 152) 및 FRA2 단편 B의 5' 말단에 대하여 상동성을 갖는 5' 테일을 포함하는 프라이머 oBP595 (서열 번호 153)을 사용하여 증폭시켰다. FRA2 단편 B를 FRA2 단편 A의 3' 말단에 대하여 상동성을 갖는 5' 테일을 포함하는 프라이머 oBP596 (서열 번호 154), 및 FRA2 단편 U의 5' 말단에 대하여 상동성을 갖는 5' 테일을 포함하는 프라이머 oBP597 (서열 번호 155)을 사용하여 증폭시켰다. FRA2 단편 U를 FRA2 단편 B의 3' 말단에 대하여 상동성을 갖는 5' 테일을 포함하는 프라이머 oBP598 (서열 번호 156), 및 FRA2 단편 C의 5' 말단에 대하여 상동성을 갖는 5' 테일을 포함하는 프라이머 oBP599 (서열 번호 157)를 사용하여 증폭시켰다. FRA2 단편 C를 FRA2 단편 U의 3' 말단에 대하여 상동성을 갖는 5' 테일을 포함하는 프라이머 oBP600 (서열 번호 158) 및 oBP601 (서열 번호 159)를 사용하여 증폭시켰다. PCR 생성물을 PCR 정제 키트 (미국 캘리포니아주 발렌시아에 소재하는 퀴아젠)로 정제하였다. FRA2 단편 AB를 FRA2 단편 A 및 FRA2 단편 B를 혼합하고, 프라이머 oBP594 (서열 번호 152) 및 oBP597 (서열 번호 155)을 사용하여 증폭시킴으로써 중첩 PCR에 의해 생성하였다. FRA2 단편 UC를 FRA2 단편 U 및 FRA2 단편 C를 혼합하고, 프라이머 oBP598 (서열 번호 156) 및 oBP601 (서열 번호 159)을 사용하여 증폭시킴으로써 중첩 PCR에 의해 생성하였다. 생성된 PCR 생성물을 아가로스 겔에서 정제하고, 이어서 겔 추출 키트 (미국 캘리포니아주 발렌시아에 소재하는 퀴아젠)로 정제하였다. FRA2 ABUC 카세트를 FRA2 단편 AB 및 FRA2 단편 UC를 혼합하고, 프라이머 oBP594 (서열 번호 152) 및 oBP601 (서열 번호 159)을 사용하여 증폭시킴으로써 중첩 PCR에 의해 생성하였다. PCR 생성물을 PCR 정제 키트 (미국 캘리포니아주 발렌시아에 소재하는 퀴아젠)로 정제하였다.The FRA2 deletion was designed to delete 250 nucleotides from the 3 'end of the coding sequence, leaving the first 113 nucleotides of the intact FRA2 coding sequence. In-frame termination codons appeared 7 nucleotides downstream of the deletion. Fusion of four fragments to a PCR cassette for Scarris FRA2 deletion? High Fidelity PCR Master Mix (New England Biolabs, Inc., Ipswich, Mass.) And Gentra? Fuzzy? Amplification was done using CEN.PK 113-7D genomic DNA as a template made with the Yeast / Back kit (Qiagen, Valencia, CA). FRA2 fragment A was amplified using primers oBP594 (SEQ ID NO: 152) and primer oBP595 (SEQ ID NO: 153) comprising a 5 'tail homologous to the 5' end of FRA2 fragment B. FRA2 fragment B comprises primer oBP596 (SEQ ID NO: 154) comprising a 5 'tail homologous to the 3' end of FRA2 fragment A, and a 5 'tail homologous to the 5' end of FRA2 fragment U Was amplified using primers oBP597 (SEQ ID NO: 155). FRA2 fragment U comprises a primer oBP598 (SEQ ID NO: 156) comprising a 5 'tail homologous to the 3' end of FRA2 fragment B, and a 5 'tail homologous to the 5' end of FRA2 fragment C Was amplified using primers oBP599 (SEQ ID NO: 157). FRA2 fragment C was amplified using primers oBP600 (SEQ ID NO: 158) and oBP601 (SEQ ID NO: 159) comprising a 5 'tail homologous to the 3' end of FRA2 fragment U. PCR products were purified with a PCR Purification Kit (Qiagen, Valencia, CA). FRA2 fragment AB was generated by overlapping PCR by mixing FRA2 fragment A and FRA2 fragment B and amplifying with primers oBP594 (SEQ ID NO: 152) and oBP597 (SEQ ID NO: 155). FRA2 fragment UC was generated by overlapping PCR by mixing FRA2 fragment U and FRA2 fragment C and amplifying using primers oBP598 (SEQ ID NO: 156) and oBP601 (SEQ ID NO: 159). The resulting PCR product was purified on agarose gel and then purified by gel extraction kit (Qiagen, Valencia, CA). FRA2 ABUC cassettes were generated by overlapping PCR by mixing FRA2 fragment AB and FRA2 fragment UC and amplifying with primers oBP594 (SEQ ID NO: 152) and oBP601 (SEQ ID NO: 159). PCR products were purified with a PCR Purification Kit (Qiagen, Valencia, CA).
PNY1503의 컴피턴트 세포를 만들고, 프로즌-이지 이스트 트랜스포메이션 II™ 키트 (미국 캘리포니아주 어바인에 소재하는 자이모 리서치 코퍼레이션)를 사용하여 FRA2 ABUC PCR 카세트로 형질전환시켰다. 형질전환 혼합물을 30℃에서 1% 에탄올을 보충한 우라실이 결핍된 합성 완전 배지 상에 플레이팅하였다. fra2 녹아웃이 있는 형질전환체를 젠트라? 퓨어진? 이스트/백트 키트 (미국 캘리포니아주 발렌시아에 소재하는 퀴아젠)로 제조한 게놈 DNA를 사용하여 프라이머 oBP602 (서열 번호 160) 및 oBP603 (서열 번호 161)을 사용하여 PCR로 스크리닝하였다. 정확한 형질전환체를 YPE (효모 추출물, 펩톤, 1% 에탄올)에서 성장시키고, 30℃에서 5-플루오로-오로트산 (0.1%)을 함유하는 합성 완전 배지 상에 플레이팅하여, URA3 마커가 소실된 분리주를 선택하였다. 결실 및 마커 제거를 젠트라? 퓨어진? 이스트/백트 키트 (미국 캘리포니아주 발렌시아에 소재하는 퀴아젠)를 사용하여 제조된 게놈 DNA를 사용하여 프라이머 oBP602 (서열 번호 160) 및 oBP603 (서열 번호 161)을 사용하여 PCR로 확인하였다. 분리주로부터의 FRA2 유전자의 부재를 FRA2의 결실된 코딩 서열에 대하여 특이적인 프라이머, oBP605 (서열 번호 162) 및 oBP606 (서열 번호 163)을 사용하여 음성 PCR 결과에 의해 입증하였다. 정확한 분리주를 균주 CEN.PK 113-7D MATa ura3Δ::loxP his3Δ pdc6Δ pdc1Δ::P[PDC1]-DHAD|ilvD_Sm-PDC1t pdc5Δ::P[PDC5]-ADH|sadB_Ax-PDC5t gpd2Δ::loxP fra2Δ로 선택하여, PNY1505 (BP1135)로 명명하였다.Competent cells of PNY1503 were made and transformed with the FRA2 ABUC PCR cassette using the Frozen-Easy East Transformation II ™ Kit (Zymo Research Corporation, Irvine, CA). Transformation mixtures were plated on synthetic complete medium lacking uracil supplemented with 1% ethanol at 30 ° C. Gentra for transformants with fra2 knockouts? Fuzzy? Genomic DNA prepared with the East / Bat Kit (Qiagen, Valencia, Calif.) Was screened by PCR using primers oBP602 (SEQ ID NO: 160) and oBP603 (SEQ ID NO: 161). The correct transformants were grown in YPE (yeast extract, peptone, 1% ethanol) and plated on synthetic complete medium containing 5-fluoro-orotic acid (0.1%) at 30 ° C. Lost isolates were selected. Gentra for deletion and marker removal? Fuzzy? Genomic DNA prepared using the East / Bact kit (Qiagen, Valencia, Calif.) Was identified by PCR using primers oBP602 (SEQ ID NO: 160) and oBP603 (SEQ ID NO: 161). The absence of the FRA2 gene from the isolate was demonstrated by negative PCR results using primers specific for the deleted coding sequence of FRA2, oBP605 (SEQ ID NO: 162) and oBP606 (SEQ ID NO: 163). Select the correct isolate with strain CEN.PK 113-7D MATa ura3Δ :: loxP his3Δ pdc6Δ pdc1Δ :: P [PDC1] -DHAD | ilvD_Sm-PDC1t pdc5Δ :: P [PDC5] -ADH | sadB_Ax-PDC5t gpd2Δ :: loxP fra2 It was named PNY1505 (BP1135).
ADH1 결실 및 kivD Ll(y) 통합ADH1 deletion and kivD Ll (y) integration
ADH1 유전자를 결실시키고, 사카로마이세스 세레비시아에서의 발현을 위해 코돈 최적화된 락토코커스 락티스로부터의 kivD 코딩 영역으로 대체하였다. 본 명세서에 참조로 포함되는 2010년 6월 18일자로 출원된 미국 가출원 제61/356,379호에 기술된 바와 같이, 먼저 ADH1 결실-kivD_Ll(y) 통합을 위한 스카리스 카세트를 플라스미드 pUC19-URA3MCS 내로 클로닝하였다. 벡터는 pUC19 기반의 것이며, 다중 클로닝 부위 (MCS) 내에 위치한 사카로마이세스 세레비시아 CEN.PK 113-7D로부터의 URA3 유전자의 서열을 포함한다. pUC19는 대장균에서의 복제 및 선택을 위한 베타-락타마제를 코딩하는 유전자 및 pMB1 레플리콘을 포함한다. URA3에 대한 코딩 서열 외에, 이러한 유전자의 업스트림 (250 bp) 및 다운스트림 (150 bp)으로부터의 서열은 효모 내의 URA3 유전자의 발현을 위해 존재한다.The ADH1 gene was deleted and replaced with a kivD coding region from codon optimized Lactococcus lactis for expression in Saccharomyces cerevisiae. As described in U.S. Provisional Application No. 61 / 356,379, filed Jun. 18, 2010, which is incorporated herein by reference, a cloris cassette for ADH1 deletion-kivD_Ll (y) integration is first cloned into plasmid pUC19-URA3MCS. It was. The vector is based on pUC19 and comprises the sequence of the URA3 gene from Saccharomyces cerevisiae CEN.PK 113-7D located within the multiple cloning site (MCS). pUC19 includes pMB1 replicon and a gene encoding beta-lactamase for replication and selection in E. coli. In addition to the coding sequences for URA3, sequences from upstream (250 bp) and downstream (150 bp) of these genes are present for expression of the URA3 gene in yeast.
사카로마이세스 세레비시아에서의 발현을 위해 코돈 최적화된 락토코커스 락티스로부터의 kivD 코딩 영역을 주형으로서 pLH468 (미국 가출원 제61/246,709호, 2009년 9월 29일자로 출원됨)을 사용하여 PmeI 제한 부위를 포함하는 프라이머 oBP562 (서열 번호 164), 및 ADH1 단편 B의 5' 말단에 대하여 상동성을 갖는 5' 테일을 포함하는 프라이머 oBP563 (서열 번호 165)로 증폭시켰다. ADH1 단편 B를 상기와 같이 제조한 게놈 DNA로부터, kivD_Ll(y)의 3' 말단에 대하여 상동성을 갖는 5' 테일을 포함하는 프라이머 oBP564 (서열 번호 166), 및 FseI 제한 부위를 포함하는 프라이머 oBP565 (서열 번호 167)로 증폭시켰다. PCR 생성물을 PCR 정제 키트 (미국 캘리포니아주 발렌시아에 소재하는 퀴아젠)로 정제하였다. kivD_Ll(y)-ADH1 단편 B를 kivD_Ll(y) 및 ADH1 단편 B PCR 생성물을 혼합하고, 프라이머 oBP562 (서열 번호 164) 및 oBP565 (서열 번호 167)를 사용하여 증폭시킴으로써 중첩 PCR에 의해 생성하였다. 생성된 PCR 생성물을 PmeI 및 FseI로 분해하고, T4 DNA 리가제를 사용하여 적절한 효소에 의한 분해 후에 pUC19-URA3MCS의 상응하는 부위 내로 라이게이션시켰다. ADH1 단편 A를 게놈 DNA로부터 SacI 제한 부위를 포함하는 프라이머 oBP505 (서열 번호 168), 및 AscI 제한 부위를 포함하는 프라이머 oBP506 (서열 번호 169)로 증폭시켰다. ADH1 단편 A PCR 생성물을 SacI 및 AscI로 분해하고, T4 DNA 리가제를 사용하여 kivD_Ll(y)-ADH1 단편 B를 포함하는 플라스미드의 상응하는 부위 내로 라이게이션시켰다. ADH1 단편 C를 게놈 DNA로부터 PacI 제한 부위를 포함하는 프라이머 oBP507 (서열 번호 170), 및 SalI 제한 부위를 포함하는 프라이머 oBP508 (서열 번호 171)을 사용하여 증폭시켰다. ADH1 단편 C PCR 생성물을 PacI 및 SalI로 분해하고, T4 DNA 리가제를 사용하여 ADH1 단편 A-kivD_Ll(y)-ADH1 단편 B를 포함하는 플라스미드의 상응하는 부위 내로 라이게이션시켰다. 하이브리드 프로모터 UAS(PGK1)-PFBA1를 벡터 pRS316-UAS(PGK1)-PFBA1-GUS (서열 번호 172)로부터 AscI 제한 부위를 포함하는 프라이머 oBP674 (서열 번호 173), 및 PmeI 제한 부위를 포함하는 프라이머 oBP675 (서열 번호 174)를 사용하여 증폭시켰다. UAS(PGK1)-PFBA1 PCR 생성물을 AscI 및 PmeI로 분해하고, T4 DNA 리가제를 사용하여 kivD_Ll(y)-ADH1 단편 ABC를 포함하는 플라스미드의 상응하는 부위 내로 라이게이션시켰다. 전체 통합 카세트를 생성된 플라스미드로부터 프라이머 oBP505 (서열 번호 168) 및 oBP508 (서열 번호 171)을 사용하여 증폭시켜, PCR 정제 키트 (미국 캘리포니아주 발렌시아에 소재하는 퀴아젠)로 정제하였다.KivD coding region from codon optimized Lactococcus lactis for expression in Saccharomyces cerevisiae using pLH468 (US Provisional Application No. 61 / 246,709, filed Sep. 29, 2009) as a template Amplified with primer oBP562 (SEQ ID NO: 164) comprising the PmeI restriction site, and primer oBP563 (SEQ ID NO: 165) comprising a 5 'tail homologous to the 5' end of ADH1 fragment B. From genomic DNA prepared as above, ADH1 fragment B, primer oBP564 (SEQ ID NO: 166) comprising a 5 'tail with homology to the 3' end of kivD_Ll (y), and primer oBP565 comprising a FseI restriction site (SEQ ID NO: 167). PCR products were purified with a PCR Purification Kit (Qiagen, Valencia, CA). kivD_Ll (y) -ADH1 fragment B was generated by overlapping PCR by mixing kivD_Ll (y) and ADH1 fragment B PCR products and amplifying with primers oBP562 (SEQ ID NO: 164) and oBP565 (SEQ ID NO: 167). The resulting PCR product was digested with PmeI and FseI and ligated into the corresponding sites of pUC19-URA3MCS after digestion with appropriate enzymes using T4 DNA ligase. ADH1 fragment A was amplified from genomic DNA with primer oBP505 (SEQ ID NO: 168) comprising a SacI restriction site, and primer oBP506 (SEQ ID NO: 169) comprising an AscI restriction site. The ADH1 fragment A PCR product was digested with SacI and AscI and ligated into the corresponding site of the plasmid containing kivD_Ll (y) -ADH1 fragment B using T4 DNA ligase. ADH1 fragment C was amplified from genomic DNA using primer oBP507 (SEQ ID NO: 170) comprising a PacI restriction site, and primer oBP508 (SEQ ID NO: 171) comprising a SalI restriction site. The ADH1 Fragment C PCR product was digested with PacI and SalI and ligated into the corresponding site of the plasmid containing ADH1 Fragment A-kivD_Ll (y) -ADH1 Fragment B using T4 DNA ligase. Primers oBP674 (SEQ ID NO: 173) comprising the AscI restriction site from the hybrid promoter UAS (PGK1) -P FBA1 from the vector pRS316-UAS (PGK1) -P FBA1- GUS (SEQ ID NO: 172), and a primer comprising the PmeI restriction site; Amplified using oBP675 (SEQ ID NO: 174). The UAS (PGK1) -P FBA1 PCR product was digested with AscI and PmeI and ligated into the corresponding site of the plasmid containing the kivD_Ll (y) -ADH1 fragment ABC using T4 DNA ligase. The whole integration cassette was amplified from the resulting plasmid using primers oBP505 (SEQ ID NO: 168) and oBP508 (SEQ ID NO: 171) and purified with a PCR purification kit (Qiagen, Valencia, CA).
PNY1505의 컴피턴트 세포를 만들고, 프로즌-이지 이스트 트랜스포메이션 II™ 키트 (미국 캘리포니아주 어바인에 소재하는 자이모 리서치 코퍼레이션)를 사용하여 상기에서 구축한 ADH1-kivD_Ll(y) PCR 카세트로 형질전환시켰다. 형질전환 혼합물을 30℃에서 1% 에탄올을 보충한 우라실이 결핍된 합성 완전 배지 상에 플레이팅하였다. 형질전환체를 YPE (1% 에탄올)에서 성장시키고, 30℃에서 5-플루오로-오로트산 (0.1%)을 함유하는 합성 완전 배지 상에 플레이팅하여, URA3 마커가 소실된 분리주를 선택하였다. ADH1의 결실 및 kivD_Ll(y)의 통합을, 젠트라? 퓨어진? 이스트/백트 키트 (미국 캘리포니아주 발렌시아에 소재하는 퀴아젠)를 사용하여 제조된 게놈 DNA를 사용하여 외부 프라이머 oBP495 (서열 번호 175) 및 oBP496 (서열 번호 176), 및 kivD_Ll(y) 특이적 프라이머 oBP562 (서열 번호 164) 및 외부 프라이머 oBP496 (서열 번호 176)로 PCR에 의해 확인하였다. 정확한 분리주를 균주 CEN.PK 113-7D MATa ura3Δ::loxP his3Δ pdc6Δ pdc1Δ::P[PDC1]-DHAD|ilvD_Sm-PDC1tpdc5Δ::P[PDC5]-ADH|sadB_Ax-PDC5t gpd2Δ::loxP fra2Δ adh1Δ::UAS(PGK1)P[FBA1]-kivD_Ll(y)-ADH1t로 선택하여, PNY1507 (BP1201)로 명명하였다. PNY1507을 아이소부탄올 경로 플라스미드 pYZ090 (서열 번호 1) 및 pBP915 (후술됨)로 형질전환시켰다.Competent cells of PNY1505 were made and transformed with the ADH1-kivD_Ll (y) PCR cassette constructed above using the Frozen-Easy East Transformation II ™ kit (Zymo Research Corporation, Irvine, CA). Transformation mixtures were plated on synthetic complete medium lacking uracil supplemented with 1% ethanol at 30 ° C. Transformants were grown in YPE (1% ethanol) and plated on synthetic complete medium containing 5-fluoro-orthoic acid (0.1%) at 30 ° C. to select isolates lacking the URA3 marker. . Deletion of ADH1 and integration of kivD_Ll (y), Gentra? Fuzzy? External primers oBP495 (SEQ ID NO: 175) and oBP496 (SEQ ID NO: 176), and kivD_Ll (y) specific primers oBP562 using genomic DNA prepared using the East / Back kit (Qiagen, Valencia, CA) (SEQ ID NO: 164) and external primer oBP496 (SEQ ID NO: 176) by PCR. The exact isolate was strain CEN.PK 113-7D MATa ura3Δ :: loxP his3Δ pdc6Δ pdc1Δ :: P [PDC1] -DHAD | ilvD_Sm-PDC1tpdc5Δ :: P [PDC5] -ADH | sadB_Ax-PDC5t gpd2Δ: Δ alodhP fra :: UAS (PGK1) P [FBA1] -kivD_Ll (y) -ADH1t was selected and named PNY1507 (BP1201). PNY1507 was transformed with isobutanol pathway plasmids pYZ090 (SEQ ID NO: 1) and pBP915 (described below).
pRS316-UAS(PGK1)-FBA1p-GUS 벡터의 구축Construction of the pRS316-UAS (PGK1) -FBA1p-GUS Vector
카세트 UAS(PGK1)-FBA1p (서열 번호 177)를 클로닝하기 위해, 먼저 602bp FBA1 프로모터 (FBA1p)를 CEN.PK의 게놈 DNA로부터 프라이머 T-FBA1(SalI) (서열 번호 178) 및 B-FBA1(SpeI) (서열 번호 179)를 사용하여 PCR 증폭시키고, PGK1p 프로모터가 플라스미드의 SalI/SpeI 분해로 제거된 후에 플라스미드 pWS358-PGK1p-GUS (서열 번호 180) 상의 SalI 및 SpeI 부위로 클로닝하여, pWS358-FBA1p-GUS를 생성하였다. PGK1p 및 베타-글루쿠로니다제 유전자 (GUS) DNA 단편을 pRS423 벡터로부터 유래된 pWS358의 다중 클로닝 부위로 삽입함으로써, pWS358-PGK1p-GUS 플라스미드를 생성시켰다 (Christianson, et al., Gene 110:119-122, 1992). 두 번째로, 생성된 pWS358-FBA1p-GUS 플라스미드를 SalI 및 SacI - FBA1p 프로모터, GUS 유전자, 및 겔 정제된 FBAt 터미네이터를 포함하는 DNA 단편 - 로 분해하고, pRS316 상의 SalI/SacI 부위로 클로닝하여 pRS316-FBA1p-GUS를 생성하였다. 세 번째로, 3-포스포글리세레이트 키나제 (PGK1) 오픈 리딩 프레임, 즉 UAS(PGK1)의 위치 -519 와 위치-402 업스트림 사이에 위치한 업스트림 활성화 서열 (UAS)을 포함하는 118 bp DNA 단편을 CEN.PK의 게놈 DNA로부터 프라이머 T-U/PGK1(KpnI) (서열 번호 181) 및 B-U/PGK1(SalI) (서열 번호 182)을 사용하여 PCR 증폭시켰다. PCR 생성물을 KpnI 및 SalI로 분해하고, pRS316-FBA1p-GUS 상의 KpnI/SalI 부위로 클로닝하여, pRS316-UAS(PGK1)-FBA1p-GUS를 생성하였다.To clone the cassette UAS (PGK1) -FBA1p (SEQ ID NO: 177), first 602 bp FBA1 promoter (FBA1p) was extracted from the genomic DNA of CEN.PK primers T-FBA1 (SalI) (SEQ ID NO: 178) and B-FBA1 (SpeI). (SEQ ID NO: 179), and the PGK1p promoter was removed by SalI / SpeI digestion of the plasmid and then cloned into the SalI and SpeI sites on plasmid pWS358-PGK1p-GUS (SEQ ID NO: 180), pWS358-FBA1p- GUS was generated. The pWS358-PGK1p-GUS plasmid was generated by inserting the PGK1p and beta-glucuronidase gene (GUS) DNA fragments into multiple cloning sites of pWS358 derived from the pRS423 vector (Christianson, et al., Gene 110: 119 -122, 1992). Secondly, the resulting pWS358-FBA1p-GUS plasmid was digested with a DNA fragment comprising SalI and SacI-FBA1p promoter, GUS gene, and gel purified FBAt terminator-cloned into the SalI / SacI site on pRS316 to pRS316- FBA1p-GUS was generated. Third, CEN 118 bp DNA fragment comprising an upstream activating sequence (UAS) located between the 3-phosphoglycerate kinase (PGK1) open reading frame, ie, position -519 and position-402 upstream of UAS (PGK1). PCR amplification from the genomic DNA of .PK using primers TU / PGK1 (KpnI) (SEQ ID NO: 181) and BU / PGK1 (SalI) (SEQ ID NO: 182). The PCR product was digested with KpnI and SalI and cloned into the KpnI / SalI site on pRS316-FBA1p-GUS to generate pRS316-UAS (PGK1) -FBA1p-GUS.
통합 벡터 pUC19-kan::pdc1::FBA-alsS::TRX1의 구축Construction of the unified vector pUC19-kan :: pdc1 :: FBA-alsS :: TRX1
1.7 kb BbvCI/PacI 단편을 pRS426::GPD::alsS::CYC (미국 특허 출원 공개 제2007/0092957호)로부터 pRS426::FBA::ILV5::CYC (미국 특허 출원 공개 제2007/0092957호, ILV5 유전자를 방출하도록 BbvCI/PacI로 사전에 분해됨)로 이동시켜, FBA-alsS-CYCt 카세트를 구축하였다. 라이게이션 반응물을 대장균 TOP10 세포로 형질전환시키고, 형질전환체를 프라이머 N98SeqF1 (서열 번호 183) 및 N99SeqR2 (서열 번호 184)를 사용하여 PCR로 스크리닝하였다. FBA-alsS-CYCt 카세트를 AflII 부위 (Klenow 단편은 라이게이션에 적합한 말단을 형성하도록 사용되었음)에서 pUC19-URA3::ilvD-TRX1 (본 명세서에 참조로 포함되는, 2010년 6월 18일자로 출원된 미국 가출원 제61/356,379호에 기재됨, 클론 "B")로 클로닝하기 위해 BglII 및 NotI를 사용하여 벡터로부터 분리하였다. 벡터의 두 배향에서 alsS 카세트를 포함하는 형질전환체를 얻고, 배열 "A" 에 대해서는 프라이머 N98SeqF4 (서열 번호 185) 및 N1111 (서열 번호 186) 및 배열 "B"에 대해서는 N98SeqF4 (서열 번호 185) 및 N1110 (서열 번호 187)를 사용하여 PCR로 확인하였다. 그 다음에, "A" 배열 벡터의 제네티신 선택성 버전을, URA3 유전자 (1.2 kb NotI/NaeI 단편)를 제거하고, 상술한 제네티신 카세트 (본 명세서에 참조로 포함되는, 2010년 6월 18일자로 출원된 미국 가출원 제61/356,379호의 서열 번호 655)를 첨가하여 만들었다. Klenow 단편을 사용하여 라이게이션에 적합한 모든 말단을 형성하고, 형질전환체를 프라이머 BK468 (서열 번호 188) 및 N160SeqF5 (서열 번호 189)를 사용하여 PCR로 스크리닝하여, 이전의 URA3 마커와 동일한 배향으로 제네티신 내성 유전자를 갖는 클론을 선택하였다. 생성된 클론을 pUC19-kan::pdc1::FBA-alsS::TRX1 (클론 A)(서열 번호 190)로 명먕하였다.1.7 kb BbvCI / PacI fragments were converted from pRS426 :: GPD :: alsS :: CYC (US Patent Application Publication No. 2007/0092957) to pRS426 :: FBA :: ILV5 :: CYC (US Patent Application Publication No. 2007/0092957, FBA-alsS-CYCt cassette was constructed, which was then digested with BbvCI / PacI to release the ILV5 gene. Ligation reactions were transformed with E. coli TOP10 cells and transformants were screened by PCR using primers N98SeqF1 (SEQ ID NO: 183) and N99SeqR2 (SEQ ID NO: 184). The FBA-alsS-CYCt cassette was filed on June 18, 2010 at pUC19-URA3 :: ilvD-TRX1 (incorporated herein by reference) at the AflII site (Klenow fragment was used to form suitable ends for ligation). US Pat. No. 61 / 356,379, which was isolated from the vector using BglII and NotI for cloning into clone “B”). Obtain a transformant comprising an alsS cassette in both orientations of the vector, primers N98SeqF4 (SEQ ID NO: 185) and N1111 (SEQ ID NO: 185) for array "A" and N98SeqF4 (SEQ ID NO: 185) for array "B" and Confirmed by PCR using N1110 (SEQ ID NO: 187). The geneticin selective version of the "A" array vector was then removed from the URA3 gene (1.2 kb NotI / NaeI fragment) and the Geneticin cassette described above (June 2010, incorporated herein by reference). (SEQ ID NO: 655 of US Provisional Application No. 61 / 356,379, filed on May 18). The Klenow fragment is used to form all the ends suitable for ligation, and the transformants are screened by PCR using primers BK468 (SEQ ID NO: 188) and N160SeqF5 (SEQ ID NO: 189) to give the same orientation as the previous URA3 marker. Clones with nettysin resistance genes were selected. The resulting clones were designated as pUC19-kan :: pdc1 :: FBA-alsS :: TRX1 (clone A) (SEQ ID NO: 190).
상술한 pUC19-kan::pdc1::FBA-alsS 통합 벡터를 PmeI로 선형화시키고, PNY1507 (상술함)로 형질전환시켰다. PmeI는 클로닝된 pdc1-TRX1 유전자간 영역 내의 벡터를 절단하여, 그 위치에서 표적화된 통합을 유도한다 (Rothstein, Methods Enzymol. 194:281-301, 1991). 형질전환체를 50 ㎍/ml G418을 더한 YPE에서 선택하였다. 패칭된 형질전환체를 프라이머 N160SeqF5 (서열 번호 189) 및 oBP512 (서열 번호 47)를 사용하여 통합 이벤트를 위해 PCR로 스크리닝하였다. 2개의 형질전환체를 아이소부탄올을 생성하는 균주 능력을 평가하여 아세토락테이트 합성효소 기능에 대하여 간접적으로 시험하였다. 이것을 행하기 위해, 추가의 아이소부탄올 경로 유전자를 대장균-효모 셔틀 벡터 (후술되는 pYZ090ΔalsS 및 pBP915) 상에 공급하였다. 하나의 클론, 균주 MATa ura3Δ::loxP his3Δ pdc6Δ pdc1Δ::P[PDC1]-DHAD|ilvD_Sm-PDC1t-pUC19-loxP-kanMX-loxP-P[FBA1]-ALS|alsS_Bs-CYC1t pdc5Δ::P[PDC5]-ADH|sadB_Ax-PDC5t gpd2Δ::loxP fra2Δ adh1Δ::UAS(PGK1)P [FBA1]-kivD_Ll(y)-ADH1t를 PNY2204로 명명하였다. PNY2205는 pYZ090ΔalsS 및 pBP915 플라스미드로 형질전환된 PNY2204이다.The pUC19-kan :: pdc1 :: FBA-alsS integration vector described above was linearized with PmeI and transformed with PNY1507 (described above). PmeI cleaves the vector in the cloned pdc1-TRX1 intergenic region, inducing targeted integration at that location (Rothstein, Methods Enzymol. 194: 281-301, 1991). Transformants were selected from YPE plus 50 μg / ml G418. Patched transformants were screened by PCR for integration events using primers N160SeqF5 (SEQ ID NO: 189) and oBP512 (SEQ ID NO: 47). Two transformants were indirectly tested for acetolactate synthase function by assessing the ability of the strain to produce isobutanol. To do this, additional isobutanol pathway genes were fed onto an E. coli-yeast shuttle vector (pYZ090ΔalsS and pBP915, described below). One clone, strain MATa ura3Δ :: loxP his3Δ pdc6Δ pdc1Δ :: P [PDC1] -DHAD | ilvD_Sm-PDC1t-pUC19-loxP-kanMX-loxP-P [FBA1] -ALS | alsS_Bs-CYC1t pdcP5Δ :: P ] -ADH | sadB_Ax-PDC5t gpd2Δ :: loxP fra2Δ adh1Δ :: UAS (PGK1) P [FBA1] -kivD_Ll (y) -ADH1t was designated PNY2204. PNY2205 is PNY2204 transformed with pYZ090ΔalsS and pBP915 plasmid.
아이소부탄올Isobutanol 경로 플라스미드 ( Path Plasmid ( pYZ090pYZ090 ΔΔ alsSalsS 및 And pBP915pBP915 ))
pYZ090 (서열 번호 1)을 SpeI 및 NotI로 분해하여, 대부분의 CUP1 프로모터 및 모든 alsS 코딩 서열 및 CYC 터미네이터를 제거하였다. 그 다음에, 벡터를 Klenow 단편으로 처리한 후에 셀프 라이게이션하여, 암피실린 내성을 위해 선택되는 대장균 Stbl3 세포로 형질전환시켰다. DNA 영역의 제거를 프라이머 N191 (서열 번호 191)을 사용하여 PCR로 라이게이션 정션 (ligation junction)을 통한 DNA 시퀀싱에 의해 2개의 독립 클론에 대하여 확인하였다. 생성된 플라스미드를 pYZ090ΔalsS (서열 번호 192)로 명명하였다.pYZ090 (SEQ ID NO: 1) was digested with SpeI and NotI to remove most of the CUP1 promoter and all alsS coding sequences and CYC terminators. Vectors were then self-ligated after treatment with Klenow fragments and transformed into E. coli Stbl3 cells selected for ampicillin resistance. Removal of the DNA region was confirmed for two independent clones by DNA sequencing via ligation junction by PCR using primers N191 (SEQ ID NO: 191). The resulting plasmid was named pYZ090ΔalsS (SEQ ID NO: 192).
pBP915를 pLH468 (서열 번호 2; 2009년 9월 29일자로 출원된 미국 가출원 제 61/246,709호)로부터 kivD 유전자 및 kivD의 TDH3 프로모터 업스트림의 957개의 염기쌍을 결실시켜 구축하였다. pLH468를 SwaI로 분해하고, 큰 단편 (12896 bp)을 아가로스 겔에서 정제하고, 이어서 겔 추출 키트 (미국 캘리포니아주 발렌시아에 소재하는 퀴아젠)로 정제하였다. 단리된 DNA 단편을 T4 DNA 리가제로 셀프 라이게이션하여, 일렉트로컴피턴트 (electrocompetent) TOP10 대장균 (미국 캘리포니아주 칼스배드에 소재하는 인비트로겐 (Invitrogen))을 형질전환시키도록 사용하였다. 형질전환체로부터의 플라스미드를 단리시키고, SwaI 제한 효소를 이용한 제한 분석에 의해 적절한 결실에 대하여 체크하였다. 분리주를 또한 결실 부위에 걸쳐서 프라이머 oBP556 (서열 번호 193) 및 oBP561 (서열 번호 194)로 시퀀싱하였다. 적절한 결실을 갖는 클론을 pBP915 (pLH468ΔkivD)(서열 번호 195)로 명명하였다.pBP915 was constructed by deleting 957 base pairs of the kivD gene and the TDH3 promoter upstream of kivD from pLH468 (SEQ ID NO: 2, US Provisional Application No. 61 / 246,709, filed Sep. 29, 2009). pLH468 was digested with SwaI and large fragments (12896 bp) were purified on agarose gels and then purified with a gel extraction kit (Qiagen, Valencia, CA). Isolated DNA fragments were self-ligated with T4 DNA ligase and used to transform the electrocompetent TOP10 Escherichia coli (Invitrogen, Carlsbad, Calif.). Plasmids from the transformants were isolated and checked for appropriate deletion by restriction analysis with SwaI restriction enzymes. Isolates were also sequenced with primers oBP556 (SEQ ID NO: 193) and oBP561 (SEQ ID NO: 194) over the deletion site. Clones with appropriate deletions were named pBP915 (pLH468ΔkivD) (SEQ ID NO: 195).
균주 NYLA74, NYLA83, 및 NYLA84의 구축Construction of Strains NYLA74, NYLA83, and NYLA84
사카로마이세스 세레비시아의 내인성 PDC1 및 PDC6 유전자의 삽입 불활성화 - PDC1, PDC5, 및 PDC6 유전자는 피루베이트 데카르복실라제의 세 가지 주요 아이소자임을 인코딩함 - 는 다음과 같이 설명된다:Insertion inactivation of endogenous PDC1 and PDC6 genes of Saccharomyces cerevisiae, PDC1, PDC5, and PDC6 genes encode three major isozymes of pyruvate decarboxylase, are described as follows:
pRS425::GPM-sadB의 구축Building the pRS425 :: GPM-sadB
아크로모박터 자일로속시단스 유래의 부탄올 탈수소 효소 (서열 번호 70)를 인코딩하는 DNA 단편 (미국 특허 출원 공개 제2009/0269823호에 개시됨)을 클로닝하였다. 이차 알코올 탈수소 효소에 대하여 sadB로 명명되는 이러한 유전자의 코딩 영역 (서열 번호 69)을 표준 조건을 사용하여, 그램 음성균에 대해 권고된 프로토콜에 따라 젠트라? 퓨어진? 키트 (미국 캘리포니아주 발렌시아에 소재하는 퀴아젠)를 사용하여 제조한 아크로모박터 자일로속시단스 게놈 DNA로부터, 각각 순방향 (forward) 및 역방향 (reverse) 프라이머 N473 및 N469 (서열 번호 74 및 75)를 사용하여 증폭시켰다. PCR 생성물을 pCR?4 BLUNT (미국 캘리포니아주 칼스배드에 소재하는 인비트로겐™) 내로 토포?-블런트 (TOPO?-Blunt) 클로닝하여, pCR4Blunt::sadB를 생성하고, 이를 대장균 마크-1 세포 (Mach-1 cell) 내로 형질전환시켰다. 이어서, 플라스미드를 4개의 클론으로부터 단리하고, 서열을 입증하였다.DNA fragments (disclosed in US Patent Application Publication No. 2009/0269823) encoding butanol dehydrogenase (SEQ ID NO: 70) from Acromobacter xyloxyxidans were cloned. The coding region (SEQ ID NO: 69) of these genes, named sadB for secondary alcohol dehydrogenase, was used in accordance with the recommended protocol for Gram-negative bacteria, using standard conditions? Fuzzy? From acromobacter xyloxyoxysidans genomic DNA prepared using the kit (Qiagen, Valencia, Calif.), Forward and reverse primers N473 and N469 (SEQ ID NOs: 74 and 75), respectively Amplified using. The PCR product was cloned into pCR? 4 BLUNT (Invitrogen ™, Carlsbad, Calif.) To generate TOPR? -Blunt to generate pCR4Blunt :: sadB, which was isolated from E. coli Mark-1 cells (Mach). -1 cells). The plasmid was then isolated from four clones and the sequence was verified.
sadB 코딩 영역을 pCR4Blunt::sadB로부터 PCR 증폭시켰다. PCR 프라이머는 효모 GPM1 프로모터 및 ADH1 터미네이터 (서열 번호 76 및 77로서 제공된 N583 및 N584)와 중첩하는 추가의 5' 서열을 포함하였다. 그 다음에 PCR 생성물을 사카로마이세스 세레비시아 (Ma, et al., Gene 58:201-216, 1987)에서 "간극 수복 (gap repair)" 방법을 이용하여 다음과 같이 클로닝하였다. GPM1 프로모터 (서열 번호 72), 락토코커스 락티스 유래의 kivD 코딩 영역 (서열 번호 71), 및 ADH1 터미네이터 (서열 번호 73) (미국 특허 출원 공개 제2007/0092957 A1호, 실시예 17에 기재됨)를 포함하는 효모-대장균 셔틀 벡터 pRS425::GPM::kivD::ADH를 BbvCI 및 PacI 제한 효소로 분해하여, kivD 코딩 영역을 유리시켰다. 약 1 ㎍의 남아있는 벡터 단편을 1 ㎍의 sadB PCR 생성물과 함께 사카로마이세스 세레비시아 균주 BY4741로 현질전환시켰다. 형질전환체를 류신이 결핍된 합성 완전 배지에서 선택하였다. pRS425::GPM-sadB를 생생하는 적절한 재조합 이벤트를 프라이머 N142 및 N459 (서열 번호 108 및 109)를 사용하여 PCR로 확인하였다.The sadB coding region was PCR amplified from pCR4Blunt :: sadB. PCR primers included an additional 5 'sequence that overlaps the yeast GPM1 promoter and ADH1 terminator (N583 and N584 provided as SEQ ID NOs: 76 and 77). PCR products were then cloned in Saccharomyces cerevisiae (Ma, et al., Gene 58: 201-216, 1987) using the "gap repair" method as follows. GPM1 promoter (SEQ ID NO: 72), kivD coding region from Lactococcus lactis (SEQ ID NO: 71), and ADH1 terminator (SEQ ID NO: 73) (described in US Patent Application Publication No. 2007/0092957 A1, Example 17) The yeast-E. Coli shuttle vector pRS425 :: GPM :: kivD :: ADH was digested with BbvCI and PacI restriction enzymes to free the kivD coding region. About 1 μg of the remaining vector fragment was transfected into Saccharomyces cerevisiae strain BY4741 with 1 μg sadB PCR product. Transformants were selected in synthetic complete medium lacking leucine. Appropriate recombination events producing pRS425 :: GPM-sadB were confirmed by PCR using primers N142 and N459 (SEQ ID NOs: 108 and 109).
pdc6:: PGPM1-sadB 통합 카세트의 구축 및 PDC6 결실:pdc6 :: Construction of PGPM1-sadB Integrated Cassette and PDC6 Deletion:
pRS425::GPM-sadB (서열 번호 78) 유래의 GPM-sadB-ADHt 세그먼트 (서열 번호 79)를 pUC19-URA3r 유래의 URA3r 유전자에 연결시켜, pdc6::PGPM1-sadB-ADH1t-URA3r 통합 카세트를 만들었다. pUC19-URA3r (서열 번호 80)은 75 bp 상동성 반복 서열에 의해 플랭킹된 pRS426 (ATCC No. 77107) 유래의 URA3 마커를 포함하여, URA3 마커의 제거 및 생체 내에서의 상동성 재조합을 허용한다. 퓨전? DNA 폴리메라제 (미국 매사추세츠주 입스위치에 소재하는 뉴 잉글랜드 바이오랩스 인코포레이티드), 및 프라이머 114117-11A 내지 114117A-11D (서열 번호 81, 82, 83, 및 84), 및 114117-13A 및 114117-13B (서열 번호 85 및 86)와 함께, 주형으로서 pRS425::GPM-sadB 및 pUC19-URA3r 플라스미드 DNA를 사용하여, SOE PCR (문헌 [Horton, et al., Gene 77:61-68, 1989]에 기재된 것)에 의해 2개의 DNA 세그먼트를 연결시켰다.The GPM-sadB-ADHt segment (SEQ ID NO: 79) from pRS425 :: GPM-sadB (SEQ ID NO: 78) was linked to the URA3r gene from pUC19-URA3r to create a pdc6 :: PGPM1-sadB-ADH1t-URA3r integration cassette. . pUC19-URA3r (SEQ ID NO: 80) includes a URA3 marker from pRS426 (ATCC No. 77107) flanked by a 75 bp homologous repeat sequence, allowing removal of the URA3 marker and homologous recombination in vivo. . fusion? DNA polymerase (New England Biolabs, Ipswich, Mass.), And primers 114117-11A through 114117A-11D (SEQ ID NOs: 81, 82, 83, and 84), and 114117-13A and SOE PCR (Horton, et al., Gene 77: 61-68, 1989) using pRS425 :: GPM-sadB and pUC19-URA3r plasmid DNA as templates, together with 114117-13B (SEQ ID NOs 85 and 86). The two DNA segments were linked to each other.
SOE PCR (114117-13A 및 114117-13B)을 위한 외부 프라이머에는 각각, PDC6 프로모터 및 터미네이타의 업스트림 및 다운스트림 영역과 상동성인 5' 및 3'의 약 50 bp 영역을 포함하였다. 완성한 카세트 PCR 단편을 BY4700 (ATCC No. 200866)으로 형질전환시키고, 형질전환체를 표준 유전학적 기술을 사용하여, 30℃에서 우라실이 결핍되고 2% 글루코스가 보충된 합성 완전 배지 상에 유지시켰다 (문헌 [Methods in Yeast Genetics, 2005, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, pp. 201-202]). 형질전환체를 프라이머 112590-34G 및 112590-34H (서열 번호 87 및 88), 및 112590-34F 및 112590-49E (서열 번호 89 및 90)를 사용하여 PCR에 의해 스크리닝하여, PDC6 코딩 영역이 결실된 PDC6 유전자좌의 통합을 입증하였다. 표준 프로토콜에 따라 30℃에서 2% 글루코스 및 5-FOA가 보충된 합성 완전 배지 상에 플레이팅시킴으로써 URA3r 마커를 재순환시켰다. 5-FOA 플레이트로부터 SD-URA 배지로 콜로니를 패칭하여 성장이 없음을 입증함으로써 마커 제거를 확인하였다. 생성된 동정된 균주는 다음의 유전자형을 갖는다: BY4700 pdc6::PGPM1-sadB-ADH1t.External primers for SOE PCR (114117-13A and 114117-13B) included a region of about 50 bp of 5 'and 3' homologous to the upstream and downstream regions of the PDC6 promoter and terminator, respectively. The completed cassette PCR fragment was transformed with BY4700 (ATCC No. 200866) and the transformants were maintained on synthetic complete medium supplemented with uracil and supplemented with 2% glucose at 30 ° C. using standard genetic techniques ( Methods in Yeast Genetics, 2005, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, pp. 201-202. Transformants were screened by PCR using primers 112590-34G and 112590-34H (SEQ ID NOs 87 and 88), and 112590-34F and 112590-49E (SEQ ID NOs 89 and 90) to delete the PDC6 coding region. The integration of the PDC6 locus was demonstrated. The URA3r markers were recycled by plating on synthetic complete medium supplemented with 2% glucose and 5-FOA at 30 ° C. according to standard protocols. Marker removal was confirmed by patching colonies from 5-FOA plates with SD-URA medium demonstrating no growth. The resulting identified strains have the following genotypes: BY4700 pdc6 :: PGPM1-sadB-ADH1t.
pdc1:: PPDC1-ilvD 통합 카세트의 구축 및 PDC1 결실:pdc1 :: Construction of PPDC1-ilvD Integration Cassette and PDC1 Deletion:
퓨전? DNA 폴리메라제 (미국 매사추세츠주 입스위치에 소재하는 뉴 잉글랜드 바이오랩스 인코포레이티드) 및 프라이머 114117-27A 내지 114117-27D (서열 번호 111, 112, 113, 및 114)와 함께, 주형으로서 pLH468 및 pUC19-URA3r 플라스미드 DNA를 사용하여, SOE PCR (문헌 [Horton, et al., Gene 77:61-68, 1989]에 기재된 것)에 의해, pLH468 (서열 번호 2) 유래의 ilvD-FBA1t 세그먼트 (서열 번호 91)를 pUC19-URA3r 유래의 URA3r 유전자에 연결시켜, pdc1:: PPDC1-ilvD-FBA1t-URA3r 통합 카세트를 만들었다.fusion? PLH468 and as a template, with DNA polymerase (New England Biolabs Inc., Ipswich, Mass.) And primers 114117-27A to 114117-27D (SEQ ID NOs: 111, 112, 113, and 114). ilvD-FBA1t segment from pLH468 (SEQ ID NO: 2) by SOE PCR (described in Horton, et al., Gene 77: 61-68, 1989) using pUC19-URA3r plasmid DNA (SEQ ID NO: 2) No. 91) was linked to the URA3r gene from pUC19-URA3r to make a pdc1 :: PPDC1-ilvD-FBA1t-URA3r integration cassette.
SOE PCR (114117-27A 및 114117-27D)을 위한 외부 프라이머에는 PDC1 프로모터의 다운스트림 영역 및 PDC1 코딩 서열의 다운스트림 영역과 상동성인 5' 및 3'의 약 50 bp 영역을 포함하였다. 완성한 카세트 PCR 단편을 BY4700 pdc6::PGPM1-sadB-ADH1t로 형질전환시키고, 형질전환체를 표준 유전학적 기술을 사용하여, 30℃ 에서 우라실이 결핍되고 2% 글루코스가 보충된 합성 완전 배지 상에 유지시켰다 (문헌 [Methods in Yeast Genetics, 2005, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, pp. 201-202]). 형질전환체를 프라이머 114117-36D 및 135 (서열 번호 92 및 93), 및 프라이머 112590-49E 및 112590-30F (서열 번호 90 및 94)를 사용하여 PCR에 의해 스크리닝하여, PDC1 코딩 서열이 결실된 PDC1 유전자좌의 통합을 입증하였다. 표준 프로토콜에 따라 30℃에서 2% 글루코스 및 5-FOA가 보충된 합성 완전 배지 상에 플레이팅시킴으로써 URA3r 마커를 재순환시켰다. 5-FOA 플레이트로부터 SD-URA 배지로 콜로니를 패칭하여 성장이 없음을 입증함으로써 마커 제거를 확인하였다. 생성된 동정된 균주 "NYLA67"는 다음의 유전자형을 갖는다: BY4700 pdc6:: PGPM1-sadB-ADH1t pdc1:: PPDC1-ilvD-FBA1t.External primers for SOE PCR (114117-27A and 114117-27D) included about 50 bp regions of 5 'and 3' homologous to the downstream region of the PDC1 promoter and the downstream region of the PDC1 coding sequence. The completed cassette PCR fragments were transformed with BY4700 pdc6 :: PGPM1-sadB-ADH1t and the transformants were maintained on synthetic complete medium at 30 ° C. deficient in uracil and supplemented with 2% glucose at 30 ° C. using standard genetic techniques. (Methods in Yeast Genetics, 2005, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, pp. 201-202). Transformants were screened by PCR using primers 114117-36D and 135 (SEQ ID NOs: 92 and 93), and primers 112590-49E and 112590-30F (SEQ ID NOs: 90 and 94) to identify PDC1 that lacked the PDC1 coding sequence. The integration of the locus was demonstrated. The URA3r markers were recycled by plating on synthetic complete medium supplemented with 2% glucose and 5-FOA at 30 ° C. according to standard protocols. Marker removal was confirmed by patching colonies from 5-FOA plates with SD-URA medium demonstrating no growth. The resulting identified strain “NYLA67” has the following genotype: BY4700 pdc6 :: PGPM1-sadB-ADH1t pdc1 :: PPDC1-ilvD-FBA1t.
HIS3 결실HIS3 deletion
내인성 HIS3 코딩 영역을 결실시키기 위해, his3::URA3r2 카세트를 URA3r2 주형 DNA (서열 번호 95)로부터 PCR 증폭시켰다. URA3r2은 500 bp 상동성 반복 서열에 의해 플랭킹된 pRS426 (ATCC No. 77107) 유래의 URA3 마커를 포함하여, URA3 마커의 제거 및 생체 내에서의 상동성 재조합을 허용한다. 퓨전? DNA 폴리메라제 (미국 매사추세츠주 입스위치에 소재하는 뉴 잉글랜드 바이오랩스 인코포레이티드) 및 프라이머 114117-45A 및 114117-45B (서열 번호 96 및 97)를 사용하여 PCR을 행하여, 약 2.3 kb PCR 생성물을 생성하였다. HIS3 프로모터의 5' 영역 업스트림, 및 코딩 영역의 3' 영역 다운스트림으로부터 각각의 프라이머의 HIS3 부분을 유도하여, URA3r2 마커의 통합으로 인해 HIS3 코딩 영역이 대체되도록 하였다. PCR 생성물을 표준 유전학적 기술 (문헌 [Methods in Yeast Genetics, 2005, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, pp. 201-202])을 사용하여 NYLA67 내로 형질전환시키고, 형질전환체를 30℃에서 2% 글루코스가 보충되고 우라실이 결핍된 합성 완전 배지 상에서 선택하였다. 형질전환체를 30℃에서 2% 글루코스가 보충되고 히스티딘이 결핍된 합성 완전 배지 상에서 레플리카 플레이팅함으로써 형질전환체를 스크리닝하여, 정확한 통합을 입증하였다. 표준 프로토콜에 따라 30℃에서 2% 글루코스 및 5-FOA가 보충된 합성 완전 배지 상에 플레이팅시킴으로써 URA3r 마커를 재순환시켰다. 5-FOA 플레이트로부터 SD-URA 배지로 콜로니를 패칭하여 성장이 없음을 입증함으로써 마커 제거를 확인하였다. NYLA73로 명명되는 생성된 동정된 균주는 다음의 유전자형을 갖는다: BY4700 pdc6:: PGPM1-sadB-ADH1t pdc1:: PPDC1-ilvD-FBA1t Δhis3.To delete the endogenous HIS3 coding region, the his3 :: URA3r2 cassette was PCR amplified from the URA3r2 template DNA (SEQ ID NO: 95). URA3r2 includes URA3 markers from pRS426 (ATCC No. 77107) flanked by 500 bp homologous repeat sequences, allowing removal of URA3 markers and homologous recombination in vivo. fusion? PCR was performed using DNA polymerase (New England Biolabs, Inc., Ipswich, Mass.) And primers 114117-45A and 114117-45B (SEQ ID NOs: 96 and 97) to yield approximately 2.3 kb PCR products. Produced. The HIS3 portion of each primer was derived upstream of the 5 'region of the HIS3 promoter and downstream of the 3' region of the coding region to allow replacement of the HIS3 coding region due to the integration of the URA3r2 marker. PCR products were transformed into NYLA67 using standard genetic techniques (Methods in Yeast Genetics, 2005, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, pp. 201-202) and transformants were 30 Selection was made on synthetic complete media supplemented with 2% glucose at 캜 and lacking uracil. Transformants were screened by replica plating on synthetic complete medium supplemented with 2% glucose at 30 ° C. and histidine deficient, demonstrating correct integration. The URA3r markers were recycled by plating on synthetic complete medium supplemented with 2% glucose and 5-FOA at 30 ° C. according to standard protocols. Marker removal was confirmed by patching colonies from 5-FOA plates with SD-URA medium demonstrating no growth. The resulting identified strain named NYLA73 has the following genotype: BY4700 pdc6 :: PGPM1-sadB-ADH1t pdc1 :: PPDC1-ilvD-FBA1t Δhis3.
pdc5::kanMX 통합 카세트의 구축 및 PDC5 결실:Construction of the pdc5 :: kanMX Integrated Cassette and PDC5 Deletion:
pdc5::kanMX4 카세트를 퓨전? DNA 폴리메라제 (미국 매사추세츠주 입스위치에 소재하는 뉴 잉글랜드 바이오랩스 인코포레이티드) 및 프라이머 PDC5::KanMXF 및 PDC5::KanMXR (서열 번호 98 및 99)을 사용하여 균주 YLR134W 염색체 DNA (ATCC No. 4034091)로부터 PCR 증폭시켜, 약 2.2 kb PCR 생성물을 생성하였다. PDC5 프로모터의 5' 영역 업스트림, 및 코딩 영역의 3' 영역 다운스트림으로부터 각각의 프라이머의 PDC5 부분을 유도하여, kanMX4 마커의 통합으로 인해 PDC5 코딩 영역이 대체되도록 하였다. PCR 생성물을 표준 유전학적 기술 (문헌 [Methods in Yeast Genetics, 2005, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, pp. 201-202])을 사용하여 NYLA73 내로 형질전환시키고, 형질전환체를 30℃에서 1% 에탄올 및 제네티신 (200 ㎍/mL)이 보충된 YP 배지 상에서 선택하였다. 형질전환체를 PCR로 스크리닝하여, 프라이머 PDC5kofor 및 N175 (서열 번호 100 및 101)를 사용하여 PDC5 코딩 영역이 대체된 PDC 유전자좌에서의 정확한 통합을 입증하였다. 동정된 정확한 형질전환체는 다음의 유전자형을 갖는다: BY4700 pdc6:: PGPM1-sadB-ADH1t pdc1:: PPDC1-ilvD-FBA1t Δhis3 pdc5::kanMX4. 균주를 NYLA74로 명명하였다.Fusion pdc5 :: kanMX4 cassette? Strain YLR134W chromosomal DNA (ATCC No) using DNA polymerase (New England Biolabs Inc., Ipswich, Mass.) And primers PDC5 :: KanMXF and PDC5 :: KanMXR (SEQ ID NOs: 98 and 99) 4034091) yielded approximately 2.2 kb PCR product. The PDC5 portion of each primer was derived upstream of the 5 'region of the PDC5 promoter and downstream of the 3' region of the coding region to allow replacement of the PDC5 coding region due to integration of the kanMX4 marker. PCR products were transformed into NYLA73 using standard genetic techniques (Methods in Yeast Genetics, 2005, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, pp. 201-202) and transformants were 30 Selection was made on YP medium supplemented with 1% ethanol and geneicin (200 μg / mL) at < RTI ID = 0.0 > Transformants were screened by PCR to demonstrate correct integration at the PDC locus where the PDC5 coding region was replaced using primers PDC5kofor and N175 (SEQ ID NOs: 100 and 101). The exact transformants identified have the following genotypes: BY4700 pdc6 :: PGPM1-sadB-ADH1t pdc1 :: PPDC1-ilvD-FBA1t Δhis3 pdc5 :: kanMX4. The strain was named NYLA74.
플라스미드 벡터 pRS423::CUP1-alsS+FBA-budA 및 pRS426::FBA-budC+GPM-sadB를 NYLA74 내로 형질전환시켜, 균주 (NGCI-047)를 생산하는 부탄다이올을 생성하였다.Plasmid vectors pRS423 :: CUP1-alsS + FBA-budA and pRS426 :: FBA-budC + GPM-sadB were transformed into NYLA74 to produce butanediol producing strain (NGCI-047).
플라스미드 벡터 pLH475-Z4B8 (서열 번호 140) 및 pLH468을 NYLA74 내로 형질전환시켜, 균주 (NGCI-049)를 생산하는 아이소부탄올을 생성하였다.Plasmid vectors pLH475-Z4B8 (SEQ ID NO: 140) and pLH468 were transformed into NYLA74 to produce isobutanol producing strain (NGCI-049).
HXK2 (헥소키나제 II)의 결실:Deletion of HXK2 (hexokinase II):
hxk2::URA3r 카세트를 퓨전? DNA 폴리메라제 (미국 매사추세츠주 입스위치에 소재하는 뉴 잉글랜드 바이오랩스 인코포레이티드) 및 프라이머 384 및 385 (서열 번호 102 및 103)을 사용하여 URA3r2 주형 (상술함)으로부터 PCR 증폭시켜, 약 2.3 kb PCR 생성물을 생성하였다. HXK2 프로모터의 5' 영역 업스트림, 및 코딩 영역의 3' 영역 다운스트림으로부터 각각의 프라이머의 HXK2 부분을 유도하여, URA3r2 마커의 통합으로 인해 HXK2 코딩 영역이 대체되도록 하였다. PCR 생성물을 표준 유전학적 기술 (문헌 [Methods in Yeast Genetics, 2005, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, pp. 201-202])을 사용하여 NYLA73 내로 형질전환시키고, 형질전환체를 30℃에서 2% 글루코스가 보충된 우라실이 결핍된 합성 완전 배지 상에서 선택하였다. 형질전환체를 PCR로 스크리닝하여, 프라이머 N869 및 N871 (서열 번호 104 및 105)을 사용하여 HXK2 코딩 영역이 대체된 HXK2 유전자좌에서의 정확한 통합을 입증하였다. 표준 프로토콜에 따라 30℃에서 2% 글루코스 및 5-FOA가 보충된 합성 완전 배지 상에 플레이팅시킴으로써 URA3r2 마커를 재순환시켰다. 5-FOA 플레이트로부터 SD-URA 배지로 콜로니를 패칭하여 성장이 없음을 입증함으로써 마커 제거를 확인하고, 프라이머 N946 및 N947 (서열 번호 106 및 107)를 사용하여 PCR로 정확한 마커 제거를 입증하였다. NYLA83로 명명되는 생성된 동정된 균주는 다음의 유전자형을 갖는다: BY4700 pdc6:: PGPM1-sadB-ADH1t pdc1:: PPDC1-ilvD-FBA1t Δhis3 Δhxk2.fusion hxk2 :: URA3r cassette? PCR amplification from the URA3r2 template (described above) using DNA polymerase (New England Biolabs Incorporated, Ipswich, Mass.) And primers 384 and 385 (SEQ ID NOs: 102 and 103), approximately 2.3 kb PCR product was generated. The HXK2 portion of each primer was derived upstream of the 5 'region of the HXK2 promoter and downstream of the 3' region of the coding region, allowing the integration of the URA3r2 marker to replace the HXK2 coding region. PCR products were transformed into NYLA73 using standard genetic techniques (Methods in Yeast Genetics, 2005, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, pp. 201-202) and transformants were 30 Selection was made on synthetic complete media lacking uracil supplemented with 2% glucose at ° C. Transformants were screened by PCR, using primers N869 and N871 (SEQ ID NOs: 104 and 105) to demonstrate correct integration at the HXK2 locus where the HXK2 coding region was replaced. URA3r2 markers were recycled by plating onto synthetic complete medium supplemented with 2% glucose and 5-FOA at 30 ° C. according to standard protocols. Marker removal was confirmed by patching colonies from 5-FOA plates with SD-URA medium, demonstrating no growth and correct marker removal by PCR using primers N946 and N947 (SEQ ID NOs: 106 and 107). The resulting identified strain named NYLA83 has the following genotype: BY4700 pdc6 :: PGPM1-sadB-ADH1t pdc1 :: PPDC1-ilvD-FBA1t Δhis3 Δhxk2.
pdc5::kanMX 통합 카세트의 구축 및 PDC5 결실:Construction of the pdc5 :: kanMX Integrated Cassette and PDC5 Deletion:
pdc5::kanMX4 카세트를 상술한 바와 같이 PCR 증폭시켰다. PCR 단편을 NYLA83 내로 형질전환시키고, 형질전환체를 상술한 바와 같이 선택하여 스크리닝하였다. NYLA84로 명명되는 동정된 정확한 형질전환체는 다음의 유전자형을 갖는다: BY4700 pdc6:: PGPM1-sadB-ADH1t pdc1:: PPDC1-ilvD-FBA1t Δhis3 Δhxk2 pdc5::kanMX4.The pdc5 :: kanMX4 cassette was PCR amplified as described above. PCR fragments were transformed into NYLA83 and transformants were selected and screened as described above. The correct transformant identified as NYLA84 has the following genotype: BY4700 pdc6 :: PGPM1-sadB-ADH1t pdc1 :: PPDC1-ilvD-FBA1t Δhis3 Δhxk2 pdc5 :: kanMX4.
플라스미드 벡터 pLH468 및 pLH532를 표준 유전학적 기술 (문헌 [Methods in Yeast Genetics, 2005, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY])을 사용하여 균주 NYLA84 (BY4700 pdc6::PGPM1-sadB-ADH1t pdc1::PPDC1-ilvD-FBA1t Δhis3 Δhxk2 pdc5::kanMX4) 내로 동시에 형질전환시키고, 생성된 "부타놀로젠 (butanologen) NYLA84"를 30℃에서 히스티딘 및 우라실이 결핍되고, 1% 에탄올이 보충된 합성 완전 배지 상에 유지시켰다.Plasmid vectors pLH468 and pLH532 were used as standard genetic techniques (Methods in Yeast Genetics, 2005, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY) to strain NYLA84 (BY4700 pdc6 :: PGPM1-sadB-ADH1t pdc1: (PPDC1-ilvD-FBA1t Δhis3 Δhxk2 pdc5 :: kanMX4) and simultaneously transformed the resulting “butanologen NYLA84” at 30 ° C. with synthetic histidine and uracil deficient and supplemented with 1% ethanol Kept in phase.
발현 벡터 Expression vector pLH468pLH468
pLH468 플라스미드 (서열 번호 2)를 효모에서 DHAD, KivD, 및 HADH의 발현을 위해 구축하였으며, 본 명세서에 참조로 포함되는 미국 특허 출원 공개 제2009/0305363호에 기재되어 있다. pLH486를 DHAD의 발현을 위해 사카로마이세스 세레비시아 FBA1 프로모터 (뉴클레오티드 2109 - 3105), 이어서 FBA1 터미네이터 (뉴클레오티드 4858 - 5857)로부터 발현되는 스트렙토코커스 무탄스 (뉴클레오티드 위치 3313-4849)로부터의 ilvD 유전자의 코딩 영역을 갖는 키메라 유전자; ADH의 발현을 위해 사카로마이세스 세레비시아 GPM1 프로모터 (뉴클레오티드 7425-8181), 이어서 ADH1 터미네이터 (뉴클레오티드 5962-6277)로부터 발현되는 코돈 최적화된 말 간 알코올 탈수소효소 (뉴클레오티드 6286-7413)의 코딩 영역을 갖는 키메라 유전자; 및 KivD의 발현을 위해 TDH3 프로모터 (뉴클레오티드 10896-11918), 이어서 TDH3 터미네이터 (뉴클레오티드 8237-9235)로부터 발현되는 락토코커스 락티스 (뉴클레오티드 9249-10895)로부터의 코돈-최적화된 kivD 유전자의 코딩 영역을 갖는 키메라 유전자를 포함하도록 구축하였다.pLH468 plasmid (SEQ ID NO: 2) was constructed for the expression of DHAD, KivD, and HADH in yeast and is described in US Patent Application Publication No. 2009/0305363, which is incorporated herein by reference. pLH486 was expressed from the Saccharomyces cerevisiae FBA1 promoter (nucleotides 2109-3105), followed by the ilvD gene from Streptococcus mutans (nucleotide positions 3313-4849) expressed from the FBA1 terminator (nucleotides 4858-5857) for expression of DHAD. A chimeric gene having a coding region of; Coding region of codon-optimized hepatic alcohol dehydrogenase (nucleotide 6286-7413) expressed from Saccharomyces cerevisiae GPM1 promoter (nucleotides 7425-8181) followed by ADH1 terminator (nucleotides 5962-6277) for expression of ADH. Chimeric genes having; And the coding region of the codon-optimized kivD gene from Lactococcus lactis (nucleotides 9249-10895) expressed from the TDH3 promoter (nucleotides 10896-11918) followed by the TDH3 terminator (nucleotides 8237-9235) for expression of KivD. It was constructed to contain chimeric genes.
락토코커스 락티스 케토아이소발레레이트 데카르복실라제 (KivD) 및 말 간 알코올 탈수소 효소 (HADH)에 대한 코딩 영역은 사카로마이세스 세레비시아 (각각, 서열 번호 71 및 118)에서의 발현을 위해 최적화되고, 플라스미드 pKivDy-DNA2.0 및 pHadhy-DNA2.0에 제공되었던 코돈을 기준으로 DNA2.0, 인코포레이티드 (미국 캘리포니아주 멘로 파크에 소재)에 의해 합성되었다. 인코딩된 단백질은 각각, 서열 번호 117 및 119이다. KivD 및 HADH에 대한 개개의 발현 벡터를 구축하였다. pLH467 (pRS426::PTDH3-kivDy-TDH3t)을 어셈블링하기 위해, 벡터 pNY8 (서열 번호 121; pRS426.GPD-ald-GPDt로도 명명됨, 본 명세서에 참조로 포함되는 미국 특허 출원 공개 제2008/0182308호, 실시예 17에 기재)을 AscI 및 SfiI 효소로 분해하여, GPD 프로모터 및 ald 코딩 영역을 절제하였다. pNY8로부터의 TDH3 프로모터 단편 (서열 번호 122)을 5' 프라이머 OT1068 및 3' 프라이머 OT1067 (서열 번호 123 및 124)을 사용하여 PCR 증폭시켜, 5' 말단에 AscI 부위 및 3' 말단에 SpeI 부위를 가하였다. AscI/SfiI로 분해된 pNY8 벡터 단편을 AscI 및 SpeI로 분해된 TDH3 프로모터 PCR 생성물 및 벡터 pKivD-DNA2.0로부터 단리된 코돈 최적화된 kivD 코딩 영역을 함유하는 SpeI-SfiI 단편과 라이게이션하였다. 3중 라이게이션으로 벡터 pLH467 (pRS426::PTDH3-kivDy-TDH3t)을 생성시켰다. pLH467을 제한 맵핑 (mapping) 및 시퀀싱에 의해 입증하였다.Coding regions for Lactococcus lactis ketoisovalate decarboxylase (KivD) and hepatic alcohol dehydrogenase (HADH) are optimized for expression in Saccharomyces cerevisiae (SEQ ID NOs: 71 and 118, respectively) And DNA2.0, Inc., Menlo Park, Calif., Based on the codons provided for the plasmids pKivDy-DNA2.0 and pHadhy-DNA2.0. The encoded proteins are SEQ ID NOs: 117 and 119, respectively. Individual expression vectors for KivD and HADH were constructed. To assemble pLH467 (pRS426 :: PTDH3-kivDy-TDH3t), the vector pNY8 (SEQ ID NO: 121; also designated pRS426.GPD-ald-GPDt, US Patent Application Publication No. 2008/0182308, incorporated herein by reference No., described in Example 17), was digested with AscI and SfiI enzymes to remove the GPD promoter and ald coding region. TDH3 promoter fragment (SEQ ID NO: 122) from pNY8 was PCR amplified using 5 'primer OT1068 and 3' primer OT1067 (SEQ ID NOs 123 and 124) to add an AscI site at the 5 'end and a SpeI site at the 3' end. It was. The pNY8 vector fragment digested with AscI / SfiI was ligated with the SpeI-SfiI fragment containing the TDH3 promoter PCR product digested with AscI and SpeI and the codon optimized kivD coding region isolated from the vector pKivD-DNA2.0. Triple ligation produced the vector pLH467 (pRS426 :: PTDH3-kivDy-TDH3t). pLH467 was verified by restriction mapping and sequencing.
pLH435 (pRS425::PGPM1-Hadhy-ADH1t)는 본 명세서에 참조로 포함되는 미국 가출원 제61/058,970호, 실시예 3에 기재된 벡터 pRS425::GPM-sadB (서열 번호 78)로부터 유래되었다. pRS425::GPM-sadB는 GPM1 프로모터 (서열 번호 72), 아크로모박터 자일로족시단스의 부탄올 탈수소 효소로부터의 코딩 영역 (sadB; DNA 서열 번호 69; 단백질 서열 번호 70: 미국 특허 출원 공개 제2009/0269823호에 개시), 및 ADH1 터미네이터 (서열 번호 73)를 함유하는 키메라 유전자를 갖는 pRS425 벡터 (ATCC No. 77106)이다. pRS425::GPMp-sadB는 각각, sadB 코딩 영역의 5' 및 3' 말단에 BbvI 및 PacI 부위를 함유한다. NheI 부위를 프라이머 OT1074 및 OT1075 (서열 번호 126 및 127)를 사용하여 위치 지정 돌연변이 (site-directed mutagenesis)에 의해 sadB 코딩 영역의 5' 말단에 가하여, 벡터 pRS425-GPMp-sadB-NheI를 생성하고, 시퀀싱에 의해 입증하였다. pRS425::PGPM1-sadB-NheI를 NheI 및 PacI로 분해하여, sadB 코딩 영역을 드롭 아웃 (drop out)하고, 벡터 pHadhy-DNA2.0로부터의 코돈 최적화된 HADH 코딩 영역을 함유하는 NheI-PacI 단편과 라이게이션시켜, pLH435를 생성하였다.pLH435 (pRS425 :: PGPM1-Hadhy-ADH1t) was derived from the vector pRS425 :: GPM-sadB (SEQ ID NO: 78) described in US Provisional Application No. 61 / 058,970, Example 3, which is incorporated herein by reference. pRS425 :: GPM-sadB is the coding region from the GPM1 promoter (SEQ ID NO: 72), butanol dehydrogenase of Acromobacter xyloxidans (sadB; DNA SEQ ID NO: 69; Protein SEQ ID NO: 70: US Patent Application Publication No. 2009 / 0269823), and a pRS425 vector (ATCC No. 77106) with a chimeric gene containing the ADH1 terminator (SEQ ID NO: 73). pRS425 :: GPMp-sadB contains BbvI and PacI sites at the 5 'and 3' ends of the sadB coding region, respectively. The NheI site was added to the 5 'end of the sadB coding region by site-directed mutagenesis using primers OT1074 and OT1075 (SEQ ID NOs 126 and 127) to generate vector pRS425-GPMp-sadB-NheI, Proven by sequencing. decomposing pRS425 :: PGPM1-sadB-NheI into NheI and PacI to drop out the sadB coding region, and to the NheI-PacI fragment containing the codon optimized HADH coding region from vector pHadhy-DNA2.0 Ligation resulted in pLH435.
단일 벡터에서 KivD 및 HADH 발현 카세트를 합하기 위하여, 효모 벡터 pRS411 (ATCC No. 87474)을 SacI 및 NotI로 분해하고, 3중 라이게이션 반응으로, PGPM1-Hadhy-ADH1t 카세트를 함유하는 pLH435로부터의 SalI-NotI 단편과 함께, PTDH3-kivDy-TDH3t 카세트를 함유하는 pLH467로부터의 SacI-SalI 단편과 라이게이션시켰다. 이로써, 벡터 pRS411::PTDH3-kivDy-PGPM1-Hadhy (pLH441)를 수득하였으며, 제한 맵핑에 의해 입증하였다.To combine KivD and HADH expression cassettes in a single vector, the yeast vector pRS411 (ATCC No. 87474) was digested with SacI and NotI, and in a triple ligation reaction, SalI from pLH435 containing the PGPM1-Hadhy-ADH1t cassette. Along with the -NotI fragment, the SacI-SalI fragment from pLH467 containing the PTDH3-kivDy-TDH3t cassette was ligated. This resulted in the vector pRS411 :: PTDH3-kivDy-PGPM1-Hadhy (pLH441) and was validated by restriction mapping.
하부의 아이소부탄올 경로에 있는 모든 세 가지 유전자인 ilvD, kivDy, 및 Hadhy에 대한 공동 발현 벡터를 발생시키기 위해, pRS423 FBA ilvD(Strep) (서열 번호 128)를 사용하였고, 이는 IlvD 유전자의 공급원으로서 미국 특허 출원 공개 제2010/0081154호에 기재되어 있다. 이 셔틀 벡터에는 대장균에서의 유지를 위한 F1 복제 기점 (뉴클레오티드 1423 내지 1879) 및 효모에서의 복제를 위한 2 마이크론 기점 (micron origin) (뉴클레오티드 8082 내지 9426)을 함유한다. 벡터는 FBA1 프로모터 (뉴클레오티드 2111 내지 3108; 서열 번호 120) 및 FBA 터미네이터 (뉴클레오티드 4861 내지 5860; 서열 번호 129)를 갖는다. 또한, 이는 효모에서의 선택을 위한 His 마커 (뉴클레오티드 504 내지 1163), 및 대장균에서의 선택을 위한 암피실린 내성 마커 (뉴클레오티드 7092 내지 7949)를 갖는다. 스트렙토코커스 무탄스 UA159 (ATCC No. 700610)로부터의 ilvD 코딩 영역 (뉴클레오티드 3116 내지 4828; 서열 번호 115; 단백질 서열 번호 116)은 발현을 위해 키메라 유전자를 형성하는 FBA 프로모터와 FBA 터미네이터 사이에 존재한다. 또한, ilvD 코딩 영역 (뉴클레오티드 4829-4849)에 융합된 루미오 태그 (lumio tag)가 존재한다.To generate co-expression vectors for all three genes in the lower isobutanol pathway, ilvD, kivDy, and Hadhy, pRS423 FBA ilvD (Strep) (SEQ ID NO: 128) was used, which was used as a source of IlvD genes in the United States. Patent Application Publication No. 2010/0081154. This shuttle vector contains an F1 origin of replication (nucleotides 1423-1879) for maintenance in E. coli and a 2 micron origin (nucleotides 8082-9426) for replication in yeast. The vector has an FBA1 promoter (nucleotides 2111 to 3108; SEQ ID NO: 120) and an FBA terminator (nucleotides 4861 to 5860; SEQ ID NO: 129). It also has His markers for selection in yeast (nucleotides 504-1163), and ampicillin resistance markers for selection in E. coli (nucleotides 7092-7949). The ilvD coding region (nucleotides 3116-4828; SEQ ID NO: 115; Protein SEQ ID NO: 116) from Streptococcus mutans UA159 (ATCC No. 700610) is present between the FBA promoter and the FBA terminator that form a chimeric gene for expression. There is also a lumio tag fused to the ilvD coding region (nucleotides 4829-4849).
제 1 단계는 pRS423 FBA ilvD(Strep) (pRS423-FBA(SpeI)-IlvD(스트렙토코커스 무탄스)-루미오라고도 함)를 SacI 및 SacII (T4 DNA 폴리메라제를 사용하여 SacII 부위가 블런트 말단화됨)를 사용하여 선형화하여, 총 길이가 9,482 bp인 벡터를 제공하는 것이었다. 제 2 단계는 SacI 및 KpnI (T4 DNA 폴리머라제를 사용하여 KpnI 부위가 블런트 말단화됨)를 사용하여 pLH441로부터 kivDy-hADHy 카세트를 단리하여, 6,063 bp 단편을 제공하는 것이었다. 이 단편을 pRS423-FBA(SpeI)-IlvD(스트렙토코터스 무탄스)-루미오 유래의 9,482 bp 벡터 단편과 라이게이션시켰다. 이로써, 벡터 pLH468 (pRS423::PFBA1-ilvD(Strep) Lumio-FBA1t-PTDH3-kivDy-TDH3t-PGPM1-hadhy-ADH1t)을 생성하였으며, 이를 제한 맵핑 및 시퀀싱에 의해 확인하였다.The first step consists of pac423 FBA ilvD (Strep) (also called pRS423-FBA (SpeI) -IlvD (Streptococcus mutans) -Rumio) blunt ended SacII sites using SacI and SacII (T4 DNA polymerase). To give a vector with a total length of 9,482 bp. The second step was to isolate the kivDy-hADHy cassette from pLH441 using SacI and KpnI (KpnI site blunt terminated using T4 DNA polymerase) to provide a 6,063 bp fragment. This fragment was ligated with a 9,482 bp vector fragment from pRS423-FBA (SpeI) -IlvD (Streptococcus mutans) -Lumio. This produced vector pLH468 (pRS423 :: PFBA1-ilvD (Strep) Lumio-FBA1t-PTDH3-kivDy-TDH3t-PGPM1-hadhy-ADH1t), which was confirmed by restriction mapping and sequencing.
pLH532 구축build pLH532
pLH532 플라스미드 (서열 번호 130)를 효모에서 ALS 및 KARI의 발현을 위해 구축하였다. pLH532는 하기 키메라 유전자를 함유하는 pHR81 벡터 (ATCC No. 87541)이다: 1) CUP1 프로모터 (서열 번호 139), 바실러스 서브틸리스 유래의 아세토락테이트 합성효소 코딩 영역 (AlsS; 서열 번호 137; 단백질 서열 번호 138) 및 CYC1 터미네이터2 (서열 번호 133); 2) ILV5 프로모터 (서열 번호 134), Pf5.IlvC 코딩 영역 (서열 번호 132) 및 ILV5 터미네이터 (서열 번호 135); 및 3) FBA1 프로모터 (서열 번호 136), 사카로마이세스 세레비시아 KARI 코딩 영역 (ILV5; 서열 번호 131); 및 CYC1 터미네이터.pLH532 plasmid (SEQ ID NO: 130) was constructed for expression of ALS and KARI in yeast. pLH532 is a pHR81 vector (ATCC No. 87541) containing the following chimeric genes: 1) CUP1 promoter (SEQ ID NO: 139), acetolactate synthase coding region from Bacillus subtilis (AlsS; SEQ ID NO: 137; protein sequence Number 138) and CYC1 terminator 2 (SEQ ID NO: 133); 2) ILV5 promoter (SEQ ID NO: 134), Pf5.IlvC coding region (SEQ ID NO: 132) and ILV5 terminator (SEQ ID NO: 135); And 3) FBA1 promoter (SEQ ID NO: 136), Saccharomyces cerevisiae KARI coding region (ILV5; SEQ ID NO: 131); And CYC1 terminator.
Pf5.IlvC 코딩 영역은 슈도모나스 플루오레센스 유래의 KARI를 인코딩하는 서열이며, 이는 본 명세서에 참조로 포함되는 미국 특허 출원 공개 제2009/0163376호에 기재되었다.The Pf5.IlvC coding region is a sequence encoding KARI from Pseudomonas fluorescens, which was described in US Patent Application Publication No. 2009/0163376, which is incorporated herein by reference.
Pf5.IlvC 코딩 영역은 사카로마이세스 세레비시아에서의 발현을 위해 최적화된 코돈을 기준으로 DNA2.0, 인코포레이티드 (미국 캘리포니아주 멘로 파크에 소재; 서열 번호 132))에 의해 합성되었다.The Pf5.IlvC coding region was synthesized by DNA2.0, Inc. (Menlo Park, CA; SEQ ID NO: 132) based on codons optimized for expression in Saccharomyces cerevisiae. .
pYZ090 구축pYZ090 build
pYZ090 (서열 번호 1)을 pHR81 (ATCC No. 87541) 골격을 기준으로 하여, ALS의 발현을 위해 효모 CUP1 프로모터 (뉴클레오티드 2-449), 이어서 CYC1 터미네이터 (뉴클레오티드 2181-2430)로부터 발현되는 바실러스 서브틸리스 (뉴클레오티드 위치 457-2172) 유래의 alsS 유전자의 코딩 영역을 갖는 키메라 유전자, 및 KARI의 발현을 위해 효모 ILV5 프로모터 (2433-3626), 이어서 ILV5 터미네이터 (뉴클레오티드 4682-5304)로부터 발현되는 락토코커스 락티스 유래의 ilvC 유전자의 코딩 영역 (뉴클레오티드 3634-4656)을 갖는 키메라 유전자를 함유하도록 구축하였다.pYZ090 (SEQ ID NO: 1) is based on the pHR81 (ATCC No. 87541) backbone, Bacillus subtilis expressed from the yeast CUP1 promoter (nucleotides 2-449) followed by the CYC1 terminator (nucleotides 2181-2430) for expression of ALS Lactococcus lock expressed from the yeast ILV5 promoter (2433-3626), followed by the ILV5 terminator (nucleotides 4682-5304) for the expression of the chimeric gene having the coding region of the alsS gene from the nucleotide (nucleotide positions 457-2172), and KARI It was constructed to contain a chimeric gene with the coding region (nucleotides 3634-4656) of the ilvC gene derived from TIS.
pYZ067 구축pYZ067 build
pYZ067을 하기 키메라 유전자를 함유하도록 구축하였다: 1) 다이하이드록시산 탈수 효소 (DHAD)의 발현을 위해 효모 FBA1 프로모터 (뉴클레오티드 1161-2250), 이어서 FBA 터미네이터 (뉴클레오티드 4005-4317)로부터 발현되는 스트렙토코커스 무탄스 UA159 (뉴클레오티드 위치 2260-3971)로부터의 ilvD 유전자의 코팅 영역, 2) 알코올 탈수소 효소의 발현을 위해 효모 GPM 프로모터 (뉴클레오티드 5819-6575), 이어서 ADH1 터미네이터 (뉴클레오티드 4356-4671)로부터 발현되는 말 간 ADH (뉴클레오티드 4680-5807)에 대한 코딩 영역, 및 3) 케토아이소발레레이트 데카르복실라제의 발현을 위해 효모 TDH3 프로모터 (뉴클레오티드 8830-9493), 이어서 TDH3 터미네이터 (뉴클레오티드 5682-7161)로부터 발현되는 락토코커스 락티스 (뉴클레오티드 7175-8821)로부터의 KivD 유전자의 코딩 영역.pYZ067 was constructed to contain the following chimeric genes: 1) Streptococcus expressed from yeast FBA1 promoter (nucleotides 1161-2250) followed by FBA terminator (nucleotides 4005-4317) for expression of dihydroxy acid dehydratase (DHAD) Coating region of ilvD gene from mutans UA159 (nucleotide positions 2260-3971), 2) horse expressed from yeast GPM promoter (nucleotides 5819-6575) followed by ADH1 terminator (nucleotides 4356-4671) for the expression of alcohol dehydrogenase Coding region for hepatic ADH (nucleotides 4680-5807), and 3) lactose expressed from the yeast TDH3 promoter (nucleotides 8830-9493) followed by the TDH3 terminator (nucleotides 5682-7161) for expression of ketoisovalerate decarboxylase Coding region of the KivD gene from Caucus lactis (nucleotides 7175-8821).
pRS423::CUP1-alsS+FBA-budA 및 pRS426::FBA-budC+GPM-sadB 및 pLH475-Z4B8 구축Constructing pRS423 :: CUP1-alsS + FBA-budA and pRS426 :: FBA-budC + GPM-sadB and pLH475-Z4B8
pRS423::CUP1-alsS+FBA-budA 및 pRS426::FBA-budC+GPM-sadB 및 pLH475-Z4B8의 구축은 본 명세서에 참조로 포함되는 미국 특허 출원 공개 제2009/0305363호에 기술되어 있다.The construction of pRS423 :: CUP1-alsS + FBA-budA and pRS426 :: FBA-budC + GPM-sadB and pLH475-Z4B8 is described in US Patent Application Publication No. 2009/0305363, which is incorporated herein by reference.
사카로마이세스 세레비시아 균주 PNY2242의 구축Construction of Saccharomyces cerevisiae strain PNY2242
균주 PNY2242를 PNY1507 (상술함)로부터 여러 단계에서 구축하였다. 먼저, 키메라 유전자를 FBA1 프로모터, alsS 코딩 영역으로 구성하였으며, CYC1 터미네이터를 염색체 XII, TRX1 유전자의 업스트림에 통합하였다. 변형된 유전자좌의 서열은 서열 번호 196로서 제공된다. 다음에, 말 간 알코올 탈수소 효소를 인코딩하는 유전자의 2개의 카피를 염색체 VII 및 XVI에 통합하였다. 염색체 VII 상에서, 키메라 유전자를 PDC1 프로모터, hADH 코딩 영역으로 구성하였으며, ADH1 터미네이터를 fra2Δ 유전자좌 (FRA2의 최초 결실은 상기에 기술됨)에 두었다. 변형된 유전자좌의 서열은 서열 번호 197로서 제공된다. 염색체 XVI 상에서, 키메라 유전자를 PDC5 프로모터, hADH 코딩 영역으로 구성하였으며, ADH1 터미네이터를 장기 반복 요소 (long term repeat element) YPRC델타 (delta)15에 의해 이전에 점유된 영역에 통합하였다. 변형된 유전자좌의 서열은 서열 번호 198로서 제공된다. 그 다음에, 고유 유전자 YMR226c 및 ALD6를 결실시켰다. YMR226c의 제거는 다만 코딩 영역의 스카리스 결실이었다. 변형된 유전자좌의 서열은 서열 번호 199로서 제공된다. 700 bp의 업스트림 서열을 더한 ALD6 코딩 영역을 CRE-lox 매개 마커 제거 (상술한 방법)을 사용하여 결실시켰으며, 따라서 생성된 유전자좌는 하나의 loxP 부위를 함유한다. 변형된 유전자좌의 서열은 서열 번호 200으로서 제공된다. 최종적으로, 플라스미드를 KARI (pLH702, 서열 번호 201) 및 DHAD (pYZ067DkivDDhADH, 서열 번호 202)의 발현을 위해 균주에 도입하여, 균주 PNY2242를 발생시켰다.Strain PNY2242 was constructed at various stages from PNY1507 (described above). First, the chimeric gene was composed of the FBA1 promoter, the alsS coding region, and the CYC1 terminator was integrated upstream of the chromosome XII and TRX1 genes. The sequence of the modified locus is provided as SEQ ID NO: 196. Next, two copies of the gene encoding the hepatic alcohol dehydrogenase were incorporated into chromosomes VII and XVI. On chromosome VII, the chimeric gene was composed of the PDC1 promoter, hADH coding region, and the ADH1 terminator was placed at the fra2Δ locus (the initial deletion of FRA2 is described above). The sequence of the modified locus is provided as SEQ ID NO: 197. On chromosome XVI, the chimeric genes consisted of the PDC5 promoter, hADH coding region, and the ADH1 terminator was integrated into the region previously occupied by the long term repeat element YPRCdelta15. The sequence of the modified locus is provided as SEQ ID NO: 198. The native genes YMR226c and ALD6 were then deleted. Removal of YMR226c was just a scarris deletion of the coding region. The sequence of the modified locus is provided as SEQ ID NO: 199. The ALD6 coding region plus 700 bp upstream sequence was deleted using CRE-lox mediated marker removal (method described above), and the resulting locus contained one loxP site. The sequence of the modified locus is provided as SEQ ID NO: 200. Finally, plasmids were introduced into strains for expression of KARI (pLH702, SEQ ID NO: 201) and DHAD (pYZ067DkivDDhADH, SEQ ID NO: 202), resulting in strain PNY2242.
재조합 미생물이 아이소부탄올을 생성하는 경우, 특정한 실시 형태 하에서, 미생물은 높은 비생산성 (specific productivity)을 나타낸다. 게다가, 부피비가 약 50%로 향상되었다.Where recombinant microorganisms produce isobutanol, under certain embodiments, the microorganisms exhibit high specific productivity. In addition, the volume ratio was improved to about 50%.
이론에 구속되는 것은 아니지만, 본 명세서에 기재된 방법이 생성물 알코올의 생성 효율이 향상된 추출 발효 방법을 제공하는 것으로 여겨진다. 상술한 바와 같이, 미생물에 의한 발효를 이용한 알코올 생산은 미생물의 알코올 독성 역치로 인해 비효율적일 수 있다. 일부 실시 형태에서, 본 명세서의 방법은 생성물 알코올을 미생물에 대하여 덜 독성인 물질로 전환시키는 수단을 제공한다. 예를 들어, 생성물 알코올은 알코올을 카르복실산으로 에스테르화하는 촉매의 존재 하에 카르복실산과 접촉됨으로써, 미생물에 대하여 덜 독성인 알코올 에스테르를 생성할 수 있다. 또한, 생성물 알코올로부터의 알코올 에스테르의 생성은 발효 배지에 저 농도의 생성물 알코올을 유도한다. 생성물 알코올의 농도 감소는 미생물에 대한 생성물 알코올의 독성 효과를 최소화하므로, 생성물 알코올의 생성 효율 향상을 유도한다.Without wishing to be bound by theory, it is believed that the methods described herein provide extractive fermentation methods with improved product alcohol production efficiency. As mentioned above, alcohol production using fermentation by microorganisms may be inefficient due to the alcohol toxicity threshold of the microorganisms. In some embodiments, the methods herein provide means for converting product alcohols into substances that are less toxic to microorganisms. For example, the product alcohol can be contacted with the carboxylic acid in the presence of a catalyst that esterifies the alcohol to the carboxylic acid, thereby producing an alcohol ester that is less toxic to microorganisms. In addition, the production of alcohol esters from product alcohols leads to low concentrations of product alcohols in the fermentation medium. Reducing the concentration of the product alcohol minimizes the toxic effect of the product alcohol on the microorganism, thus leading to an improvement in the production efficiency of the product alcohol.
카르복실산은 추출제로서 작용할 수 있으며, 알코올 에스테르는 추출제로 분배할 수 있다. 그러나, 추출제의 분배 계수는 지질 오염에 의해 저하될 수 있다. 추출제의 분배 계수의 저하를 감소시키기 위해, 발효 배지에 존재하는 지질은 추출제로 전환될 수 있고, 따라서, 지질 오염을 최소화한다. 일부 실시 형태에서, 본 명세서의 방법은 지질을 카르복실산으로 촉매적 가수분해함으로써 공급원료 또는 바이오매스에 존재하는 지질을 추출제로 전환시키는 수단을 제공한다. 이러한 가수분해에 의해 생성된 카르복실산은 추출제로서 작용할 수 있거나, 생성물 알코올로 에스테르화하여 알코올 에스테르를 생성할 수 있다. 따라서, 본 명세서에 기재된 방법은 추출제의 분배 계수를 유지하고 (예를 들어, 지질 가수분해), 생성물 알코올의 독성 효과를 최소화하는 (예를 들어, 생성물 알코올의 에스테르화) 수단을 제공한다.The carboxylic acid can act as an extractant and the alcohol ester can be partitioned into the extractant. However, the partition coefficient of the extractant may be lowered by lipid contamination. To reduce the lowering of the partition coefficient of the extractant, the lipid present in the fermentation medium can be converted to the extractant, thus minimizing lipid contamination. In some embodiments, the methods herein provide a means to convert lipids present in the feedstock or biomass into extractants by catalytic hydrolysis of the lipids to carboxylic acids. Carboxylic acids produced by such hydrolysis can act as extractants or can be esterified with product alcohols to produce alcohol esters. Thus, the methods described herein provide means for maintaining the partition coefficient of the extractant (eg, lipid hydrolysis) and minimizing the toxic effects of the product alcohol (eg, esterification of the product alcohol).
카르복실산은 발효 용기에 공급될 수 있거나, 가수분해에 의해 발효 용기에 공급된 지질 (예를 들어, 바이오매스)로부터 유도될 수 있다. 카르복실산의 양은 유기상 및 수성상을 포함하는 2상 혼합물을 형성하기에 충분해야 한다. 즉, 적절한 농도의 카르복실산 (즉, 추출제)을 발효 브로스와 접촉시켜 2상 혼합물을 형성시킨다. 발효 브로스에 생성된 알코올 에스테르는 이러한 에스테르가 수성상의 평형 농도를 초과하는 농도로 생성되기 때문에, 우선적으로 유기상으로 분배될 것이다. 알코올 에스테르 함유 유기상은 발효 브로스로부터 분리될 수 있고, 생성물 알코올은 유기상으로부터 회수될 수 있으며, 추출제는 발효 용기로 재순환될 수 있다.The carboxylic acid can be supplied to the fermentation vessel or can be derived from lipids (eg biomass) supplied to the fermentation vessel by hydrolysis. The amount of carboxylic acid should be sufficient to form a biphasic mixture comprising an organic phase and an aqueous phase. That is, an appropriate concentration of carboxylic acid (ie, extractant) is contacted with the fermentation broth to form a biphasic mixture. Alcohol esters produced in the fermentation broth will preferentially be distributed to the organic phase since these esters are produced at concentrations above the equilibrium concentration of the aqueous phase. The alcohol ester containing organic phase can be separated from the fermentation broth, the product alcohol can be recovered from the organic phase and the extractant can be recycled to the fermentation vessel.
게다가, 본 발명의 다양한 실시 형태가 상기에서 설명되었지만, 이들은 다만 일례로서 주어진 것으로 이들로 제한되지 않음은 당연하다. 형태 및 세부 사항에 있어서의 다양한 변화가 본 발명의 사상 및 범위를 벗어나지 않고서 이뤄질 수 있음이 당업자에게 명백할 것이다. 따라서, 본 발명의 폭 및 범위는 어떠한 상술한 예시적인 실시 형태에 의해서도 제한되어서는 안되지만, 다만 청구범위 및 이의 등가물에 의해 정의되어야 한다.In addition, although various embodiments of the present invention have been described above, it should be understood that these are given by way of example only and not limitation. It will be apparent to those skilled in the art that various changes in form and details may be made without departing from the spirit and scope of the invention. Accordingly, the breadth and scope of the present invention should not be limited by any of the above-described exemplary embodiments, but should be defined by the claims and their equivalents.
본 명세서에 언급된 모든 간행물, 특허, 및 특허 출원은 본 발명이 속하는 기술 분야의 숙련가의 숙련도를 나타내며, 각 개별 간행물, 특허 또는 특허 출원이 참조로 포함되도록 구체적으로 개별적으로 나타내어지는 경우와 동일한 정도로 참조로 본 명세서에 포함된다.All publications, patents, and patent applications mentioned in the specification are indicative of proficiency in the art to which the invention pertains, and to the same extent as if each individual publication, patent, or patent application was specifically indicated to be incorporated by reference. It is incorporated herein by reference.
실시예Example
하기 비한정적인 실시예는 본 발명을 더욱더 예시할 것이다. 하기 실시예가 공급원료로서 옥수수를, 카르복실산으로서 COFA를 포함하지만, 본 발명을 벗어나지 않고서, 다른 바이오매스 공급원이 공급원료로 사용될 수 있으며, COFA 이외의 산이 카르복실산으로서 제공될 수 있음을 이해해야 한다. 게다가, 하기 실시예가 부탄올 및 부틸 에스테르 생성을 포함하지만, 에탄올을 비롯한 다른 알코올, 및 알코올 에스테르가 본 발명을 벗어나지 않고서 생성될 수 있다.The following non-limiting examples will further illustrate the present invention. Although the following examples include corn as feedstock and COFA as carboxylic acid, it should be understood that other biomass sources may be used as feedstock, and acids other than COFA may be provided as carboxylic acids without departing from the present invention. do. In addition, although the following examples include butanol and butyl ester production, other alcohols, including ethanol, and alcohol esters can be produced without departing from the present invention.
본 명세서에 사용되는 바와 같이, 사용된 약어의 의미가 다음과 같았다: "g"은 그램(들)을 의미하고, "㎏"은 킬로그램(들)을 의미하며, "L"은 리터(들)를 의미하고, "mL"은 밀리리터(들)를 의미하며, "㎕"은 마이크로리터(들)를 의미하고, "mL/L"은 리터당 밀리리터(들)를 의미하며, "mL/min"은 분당 밀리리터(들)를 의미하고, "DI"는 탈이온화를 의미하며, "uM"은 마이크로미터(들)를 의미하고, "nm"은 나노미터(들)를 의미하며, "w/v"는 중량/부피를 의미하고, "OD"는 광학 밀도를 의미하며, "OD600"은 600 nM의 파장에서의 광학 밀도를 의미하고, "dcw"는 건조 세포 중량을 의미하며, "rpm"은 분당 회전수를 의미하고, "℃"는 섭씨온도(들)를 의미하며, "℃/min"은 분당 섭씨온도를 의미하고, "slpm"은 분당 표준리터(들)를 의미하며, "ppm"은 백만분의 1을 의미하고, "pdc"는 효소 번호가 뒤에 붙는 피루베이트 데카르복실라제 효소를 의미한다.As used herein, the meaning of the abbreviations used was as follows: "g" means gram (s), "kg" means kilogram (s), and "L" means liter (s) "ML" means milliliter (s), "μl" means microliter (s), "mL / L" means milliliter (s) per liter, and "mL / min" means Milliliter (s) per minute, "DI" means deionization, "uM" means micrometer (s), "nm" means nanometer (s), "w / v" Means weight / volume, "OD" means optical density, "OD 600 " means optical density at a wavelength of 600 nM, "dcw" means dry cell weight, and "rpm" Revolutions per minute, "° C" means degrees Celsius, "° C / min" means degrees Celsius per minute, "slpm" means standard liters (s) per minute, "ppm" Means one millionth and "pdc" is followed by the enzyme number Attached to pyruvate means bait Cartesian decarboxylase enzyme.
일반 방법General way
시드 플라스크 성장 (seed flask growth)Seed flask growth
pdc1 결실, pdc5 결실, 및 pdc6 결실을 갖는, 탄수화물 공급원으로부터 아이소부탄올을 생성하도록 유전자 조작된 사카로마이세스 세레비시아 균주를 동결 배양물로부터 시드 플라스크에서 0.55 내지 1.1 g/L dcw (OD600 1.3 내지 2.6 - 미국 매사추세츠주 월섬에 소재하는 서모 헬리오스 (Thermo Helios) α 서모 피셔 사이언티픽 인코포레이티드)로 성장시켰다. 배양물을 300 rpm으로 회전하는 인큐베이터에서 23 내지 26℃에서 성장시켰다. 동결 배양물을 미리 -80℃로 보관하였다. 제 1 시드 플라스크 배지의 조성은 다음과 같았다:Saccharomyces cerevisiae strains genetically engineered to produce isobutanol from a carbohydrate source, with pdc1 deletion, pdc5 deletion, and pdc6 deletion, were 0.55 to 1.1 g / L dcw (OD 600 1.3) in seed flasks from the freeze culture. To 2.6-Thermo Helios α Thermo Fisher Scientific Inc., Waltham, Mass., USA. Cultures were grown at 23-26 ° C. in an incubator rotating at 300 rpm. Frozen cultures were previously stored at -80 ° C. The composition of the first seed flask medium was as follows:
3.0 내지 5.0 g/L 덱스트로스3.0 to 5.0 g / L dextrose
3.0 내지 3.5 g/L 에탄올, 무수3.0 to 3.5 g / L ethanol, anhydrous
3.7 g/L 포미디엄 (ForMedium)™ 합성 완전 아미노산 (카이저 (Kaiser)) 드롭 아웃:3.7 g / L ForMedium ™ Synthetic Complete Amino Acids (Kaiser) Drop Out:
HIS 비함유, URA 비함유 (참조 번호 DSCK162CK)Without HIS, without URA (Reference number DSCK162CK)
6.7 g/L 아미노산 비함유 Difco 효모 질소 베이스 (base) (No. 291920).Difco yeast nitrogen base free of 6.7 g / L amino acid (No. 291920).
제 1 시드 플라스크 배양물 8 내지 12 밀리리터를 2 L 플라스크로 옮기고, 300 rpm으로 회전하는 인큐베이터에서 30℃에서 성장시켰다. 제 2 시드 플라스크는 하기 배지 220 mL를 갖는다:8-12 milliliters of the first seed flask culture was transferred to a 2 L flask and grown at 30 ° C. in an incubator rotating at 300 rpm. The second seed flask has 220 mL of the following medium:
30.0 g/L 덱스트로스30.0 g / L dextrose
5.0 g/L 에탄올, 무수5.0 g / L ethanol, anhydrous
3.7 g/L 포미디엄™ 합성 완전 아미노산 드롭 아웃:3.7 g / L Fordium ™ Synthetic Complete Amino Acid Dropout:
HIS 비함유, URA 비함유 (참조 번호 DSCK162CK)Without HIS, without URA (Reference number DSCK162CK)
6.7 g/L 아미노산 비함유 Difco 효모 질소 베이스 (No. 291920)6.7 g / L Amino Acid Free Difco Yeast Nitrogen Base (No. 291920)
pH 5.5 내지 6.0로 적정된 0.2 M MES 완충액.0.2 M MES buffer titrated to pH 5.5-6.0.
배양물을 0.55 내지 1.1 g/L dcw (OD600 1.3 내지 2.6)로 성장시켰다. 200 g/L 펩톤 및 100 g/L 효모 추출물을 함유하는 용액 30 mL의 첨가물을 이러한 세포 농도로 첨가하였다. 그 다음에, 0.2 uM 필터 살균된 HD 오세놀 (OCENOL)? 90/95 올레일 알코올 (독일 몬하임에 소재하는 코그니스 (Cognis)) 250 내지 300 mL의 첨가물을 플라스크에 첨가하였다. 배양물을 수확하여 발효에 첨가하기 전에 계속해서 > 4 g/L dcw (OD600 > 10)로 성장시킨다.Cultures were grown to 0.55 to 1.1 g / L dcw (OD 600 1.3 to 2.6). An addition of 30 mL of a solution containing 200 g / L peptone and 100 g / L yeast extract was added at this cell concentration. Then, 0.2 uM filter sterilized HD Osenol (OCENOL)? An addition of 250-300 mL of 90/95 oleyl alcohol (Cognis, Monheim, Germany) was added to the flask. The culture is continued to grow to> 4 g / L dcw (OD 600 > 10) before harvesting and adding to fermentation.
발효 제조Fermentation manufacturer
초기 발효 용기 제조Initial Fermentation Vessel Manufacturing
글래스 잭된 (jacked) 2 L 발효 용기 (독일 괴팅겐에 소재하는 사르토리우스 아게 (Sartorius AG))에 가정용수 (house water)를 주입하여 66%의 액화 중량으로 되게 하였다. pH 프로브 (해밀턴 이지펌 플러스 (Hamilton Easyferm Plus) K8, 부품 번호: 238627, 스위스 보나두츠에 소재하는 해밀톤 보나두츠 아게 (Hamilton Bonaduz AG))를 사르토리우스 DCU-3 컨트롤 타워 보정 (Control Tower Calibration) 메뉴를 통해 보정하였다. pH=7에서 영점 보정을 하였다. pH=4에서 스팬 (span) 보정을 하였다. 그 다음에, 프로브를 스텐레스강 헤드 플레이트를 통해 발효 용기 내로 주입하였다. 용존 산소 프로브 (pO2 프로브)를 또한 헤드 플레이트를 통해 발효 용기에 주입하였다. 영양소, 종배양액, 추출 용매, 및 염기를 운반하는데 사용되는 튜빙을 헤드 플레이트에 부착시키고, 단부를 포일처리하였다 (foiled). 전체 발효 용기를 스테리스 (미국 오하이오주 멘토에 소재하는 스테리스 코퍼레이션 (Steris Corporation)) 오토클레이브에 주입하여, 액체 사이클에서 30 분간 멸균시켰다.House water was injected into a glass jacked 2 L fermentation vessel (Sartorius AG, Göttingen, Germany) to a liquefied weight of 66%. The pH probe (Hamilton Easyferm Plus K8, Part No. 238627, Hamilton Bonaduz AG, Bonaduz, Switzerland) was used with the Sartorius DCU-3 Control Tower Calibration. Corrected through the menu. Zero calibration was performed at pH = 7. Span correction was performed at pH = 4. The probe was then injected into the fermentation vessel through a stainless steel head plate. Dissolved oxygen probe (pO 2 probe) was also injected into the fermentation vessel through the head plate. The tubing used to carry the nutrients, the cultivation solution, the extraction solvent, and the base was attached to the head plate and the ends were foiled. The entire fermentation vessel was injected into a Steris (Steris Corporation, Mentor, Ohio) autoclave and sterilized for 30 minutes in a liquid cycle.
발효 용기를 오토클레이브로부터 제거하여, 로드셀에 두었다. 재킷 워터 공급 및 회수 라인을 각각, 가정용수 및 청정 배수에 연결하였다. 응축기 냉각수 인라인 및 냉각수 아웃라인을 7℃에서 작동되는 6-L 재순환 온도욕에 연결시켰다. 가스를 발효 용기로부터 이송하는 벤트 라인을, 서모 (Thermo) 질량분석계 (프리마 (Prima) dB, 미국 매사추세츠주 월섬에 소재하는 서모 피셔 사이언티픽 인코포레이티드)에 연결된 트랜스퍼 라인에 연결시켰다. 스파저 라인을 가스 공급 라인에 연결시켰다. 영양소, 종배양액, 추출 용매, 및 염기를 첨가하기 위한 튜빙을 펌프를 통해 플러밍 (plumbing)하거나 클램핑 밀봉시켰다.The fermentation vessel was removed from the autoclave and placed in a load cell. The jacket water supply and return lines were connected to household water and clean drain, respectively. The condenser coolant inline and the coolant outline were connected to a 6-L recycle temperature bath operating at 7 ° C. The vent line, which transfers the gas from the fermentation vessel, was connected to a transfer line connected to a Thermo mass spectrometer (Prima dB, Thermo Fisher Scientific Inc., Waltham, Mass.). The sparger line was connected to the gas supply line. Tubing for addition of nutrients, cultivation fluid, extraction solvent, and base was plumbed or clamped through the pump.
발효 용기 온도를 열전대 및 가정용수 순환 루프로 55℃로 조절하였다. 습윤 옥수수알 (#2 황색 마치종 옥수수)을 1.0 ㎜ 스크린을 구비한 해머 밀을 사용하여 분쇄한 다음에, 얻어진 통옥수수 가루를 액화 반응물의 29 내지 30% (건조 옥수수 고형물 중량)가 되는 주입량으로 발효 용기에 첨가하였다.Fermentation vessel temperature was adjusted to 55 ° C. with a thermocouple and domestic water circulation loop. Wet corn kernels (# 2 yellow maize maize) were ground using a hammer mill with a 1.0 mm screen, and then the obtained whole cornmeal was fed at an injection amount of 29 to 30% (dry corn solids weight) of the liquefaction reactant. Added to fermentation vessel.
액화 전 (Before liquefaction ( prepre -- liquefactionliquefaction ) ) 리파제Lipase 처리 process
리파제 효소 원액을 10 ppm의 최종 리파제 농도가 되게 발효 용기에 첨가하였다. 발효 용기를 55℃, 300 rpm, 및 0.3 slpm N2 오버레이로 > 6 시간 동안 유지하였다. 리파제 처리를 완료한 후에, 액화를 후술하는 바와 같이 행하였다 (액화).Lipase enzyme stock was added to the fermentation vessel to a final lipase concentration of 10 ppm. The fermentation vessel was maintained at 55 ° C., 300 rpm, and 0.3 slpm N 2 overlay for> 6 hours. After the lipase treatment was completed, liquefaction was performed as described later (liquefaction).
액화liquefaction
발효 용기를 스파저를 통해 0.3 slpm으로 첨가된 무균 하우스 N2와 함께 300 내지 1200 rpm으로 혼합하는 동안에, 알파-아밀라제를 이의 사양서에 따라 발효 용기에 첨가하였다. 온도 설정값을 55℃에서 85℃로 변경하였다. 온도가 > 80℃가 되면, 액화 쿠킹 시간을 개시하여, 액화 사이클을 > 80℃에서 90 내지 120분간 유지하였다. 액화 사이클을 완료한 후에, 발효 용기 온도 설정값을 30℃의 발효 온도로 설정하였다. 화학 소포제의 첨가없이 기포 발생을 방지하도록, N2를 스파저로부터 헤드 스페이스로 다시 향하게 하였다.Alpha-amylase was added to the fermentation vessel according to its specification while the fermentation vessel was mixed at 300 to 1200 rpm with sterile house N 2 added at 0.3 slpm through a sparger. The temperature setpoint was changed from 55 ° C to 85 ° C. When the temperature reached> 80 ° C, the liquefaction cooking time was started and the liquefaction cycle was maintained at> 80 ° C for 90 to 120 minutes. After completion of the liquefaction cycle, the fermentation vessel temperature set point was set to a fermentation temperature of 30 ° C. N 2 was directed back from the sparger to the headspace to prevent bubble generation without the addition of a chemical antifoam.
액화 후 (After liquefaction ( postpost -- liquefactionliquefaction ) ) 리파제Lipase 처리 process
액화 사이클을 완료한 후에 (액화), 발효 용기 온도를 30℃ 대신에 55℃로 설정하였다. 필요 시에 산 또는 염기의 볼러스 (bolus) 첨가를 행하여, pH를 수동으로 pH=5.8로 조절하였다. 리파제 효소 원액을 10 ppm의 최종 리파제 농도가 되게 발효 용기에 첨가하였다. 발효 용기를 55℃, 300 rpm, 및 0.3 slpm N2 오버레이로 > 6 시간 동안 유지하였다. 리파제 처리를 완료한 후에, 발효 용기 온도를 30℃로 설정하였다.After completion of the liquefaction cycle (liquefaction), the fermentation vessel temperature was set to 55 ° C instead of 30 ° C. If necessary, a bolus addition of acid or base was performed to adjust the pH manually to pH = 5.8. Lipase enzyme stock was added to the fermentation vessel to a final lipase concentration of 10 ppm. The fermentation vessel was maintained at 55 ° C., 300 rpm, and 0.3 slpm N 2 overlay for> 6 hours. After the lipase treatment was completed, the fermentation vessel temperature was set to 30 ° C.
리파제 열불활성화 처리 (가열 살균 (heat kill) 처리 방법)Lipase heat inactivation treatment (heat kill treatment method)
리파제를 불활성화시키도록, 발효 용기 온도를 > 80℃로 > 15 분간 유지하였다. 열불활성화 처리를 완료한 후에, 발효 용기 온도를 30℃로 설정하였다.To inactivate the lipase, the fermentation vessel temperature was maintained at> 80 ° C for> 15 minutes. After the heat deactivation treatment was completed, the fermentation vessel temperature was set to 30 ° C.
접종 전 영양소 첨가Addition of nutrients before inoculation
에탄올 (7 mL/L, 접종 후 부피, 200 프루프, 무수)을 접종 바로 직전에 발효 용기에 첨가하였다. 접종 직전에 티아민을 20 ㎎/L의 최종 농도로 첨가하고, 100 ㎎/L 니코틴산도 첨가하였다.Ethanol (7 mL / L, volume after inoculation, 200 proof, anhydrous) was added to the fermentation vessel immediately before inoculation. Thiamine was added at a final concentration of 20 mg / L immediately before inoculation, and 100 mg / L nicotinic acid was also added.
접종 전 Before vaccination 올레일Orail 알코올 또는 옥수수유 지방산 첨가 Alcohol or Corn Oil Fatty Acids Added
접종 직후에 올레일 알코올 또는 옥수수유 지방산 1 L/L (접종 후 부피)를 첨가하였다.Immediately after inoculation, 1 L / L of oleyl alcohol or corn oil fatty acid (volume after inoculation) was added.
발효 조작Fermentation operation
발효 용기 접종Fermentation vessel inoculation
N2를 발효 용기로 첨가하면서, 발효 용기 pO2 프로브를 영점으로 보정하였다. 300 rpm으로 무균 공기 스파징하면서, 발효 용기 pO2 프로브를 이의 스팬으로 보정하였다. 발효 용기를 제 2 시드 플라스크 후에 > 4 g/L dcw로 접종시켰다. 진탕 플라스크를 인큐베이터/진탕기로부터 5 분간 제거하여, 올레일 알코올 상 및 수성상을 상분리하였다. 수성상 (110 mL)을 멸균 접종 용기에 옮겼다. 접종물을 연동 펌프를 통해 발효 용기에 주입하였다.The fermentation vessel pO 2 probe was calibrated to zero with N 2 added to the fermentation vessel. While sterile air sparging at 300 rpm, the fermentation vessel pO 2 probe was calibrated to its span. The fermentation vessel was inoculated at> 4 g / L dcw after the second seed flask. The shake flask was removed from the incubator / shaker for 5 minutes to separate the oleyl alcohol phase and the aqueous phase. The aqueous phase (110 mL) was transferred to a sterile inoculation vessel. The inoculum was injected into the fermentation vessel through a peristaltic pump.
발효 용기 조작 조건Fermentation vessel operating conditions
발효 용기를 전체 성장 및 생산 단계 동안에 30℃에서 조작하였다. pH를 어떠한 산도 첨가하지 않고도 5.7 내지 5.9의 pH를 5.2의 제어 설정값으로 떨어지게 할 수 있었다. pH를 남은 성장 및 생산 단계 동안에 수산화암모늄으로 pH=5.2로 제어하였다. 남은 성장 및 생산 단계 동안에 무균 공기를 스파저를 통해 0.3 slpm으로 발효 용기에 첨가하였다. pO2를 사르토리우스 DCU-3 제어 박스 PID 제어 루프에 의해, 다만 교반 제어를 사용하여 3.0%로 제어되게 되도록 설정하였으며, 교반기 최소값은 300 rpm으로 설정되고, 최대값은 2000 rpm으로 설정되었다. α-아밀라제 (글루코아밀라제)를 첨가하여, 글루코스를 액화 옥수수 매시의 동시 당화 발효를 통해 공급하였다. 전분을 당화에 이용할 수 있는 한, 글루코스를 과량 (1 내지 50 g/L)으로 유지하였다.Fermentation vessels were operated at 30 ° C. during the entire growth and production phase. It was possible to bring the pH of 5.7 to 5.9 down to a control setpoint of 5.2 without adding pH to any acid. The pH was controlled to pH = 5.2 with ammonium hydroxide during the remaining growth and production stages. Aseptic air was added to the fermentation vessel at 0.3 slpm through a sparger during the remaining growth and production stages. pO 2 was set to be controlled at 3.0% using the Statorius DCU-3 control box PID control loop, with only agitation control, the stirrer minimum set at 300 rpm and the maximum set at 2000 rpm. α-amylase (glucoamylase) was added to feed glucose through co-glycosylation fermentation of liquefied corn mash. Glucose was maintained in excess (1-50 g / L) as long as starch could be used for saccharification.
분석analysis
가스 분석Gas analysis
프로세스 공기를 서모 프리마 (미국 매사추세츠주 월섬에 소재하는 서모 피셔 사이언티픽 인코포레이티드) 질량분석계에서 분석하였다. 이것은 멸균된 다음에 각 발효 용기에 첨가되는 동일한 프로세스 공기이었다. 각 발효 용기의 오프가스를 동일한 질량분석계에서 분석하였다. 이러한 서모 프리마 dB에 대하여 매주 월요일 아침 오전 6:00시에 보정 체크를 한다. 보정 체크에 대하여, 질량분석계와 관련된 가스 워크스 (Gas Works) v1.0 (미국 매사추세츠주 월섬에 소재하는 서모 피셔 사이언티픽 인코포레이티드) 소프트웨어를 통해 스케줄을 짰다. 보정된 가스는 다음과 같았다:Process air was analyzed on a Thermo Prima (Thermo Fisher Scientific Incorporated, Waltham, Mass.) Mass spectrometer. This was the same process air that was sterilized and then added to each fermentation vessel. The offgas of each fermentation vessel was analyzed on the same mass spectrometer. These thermo prima dBs are calibrated at 6:00 AM every Monday morning. For calibration checks, a schedule was made through Gas Works v1.0 (Thermo Fisher Scientific, Inc., Waltham, Mass.) Software associated with the mass spectrometer. The calibrated gas was as follows:
이산화탄소를 다른 공지된 용기에 든 가스와 함께 보정 사이클 시에 5% 및 15%에서 체크하였다. 산소를 다른 공지된 용기에 든 가스와 함께 15%에서 체크하였다. 각 발효 용기의 오프가스의 분석에 의거하여, 스트리핑된 아이소부탄올, 소모된 산소, 및 오프가스 내로 호흡된 이산화탄소의 양을 질량분석계의 몰분율 분석 및 발효 용기로의 가스 유량 (질량 유량 제어기)을 이용하여 측정하였다. 시간 당 가스 처리 비율을 계산한 다음에, 발효 동안에 그 비율을 적산하였다.Carbon dioxide was checked at 5% and 15% during the calibration cycle along with the gas in other known containers. Oxygen was checked at 15% with gas in other known containers. Based on the off-gas analysis of each fermentation vessel, the amount of stripped isobutanol, consumed oxygen, and carbon dioxide breathed into the off-gas was determined using a mass spectrometry analysis of the mass spectrometer and gas flow to the fermentation vessel (mass flow controller). It was measured by. The gas treatment rate per hour was calculated and then added up during fermentation.
세포량 측정Cell mass measurement
NaCl (VWR BDH8721-0) 중의 0.4% 트립판 블루 (Trypan Blue)를 1X PBS로 1:5 희석하여 0.08% 트립판 블루 용액을 제조하였다. 1.0 mL 샘플을 발효 용기로부터 취해, 1.5 mL 에펜도르프 원심분리관에 주입하여, 에펜도르프, 5415C에서 14,000 rpm으로 5 분간 원심분리하였다. 원심분리 후에, 상부 용매층을 20 내지 200 ㎕ 바이오히트 피펫 팁을 갖는 m200 배리어블 채널 바이오히트 피펫 (Variable Channel BioHit pipette)를 사용하여 제거하였다. 용매층과 수성층 사이의 층을 제거하지 않도록 주의를 기울였다. 일단 용매층이 제거되면, 2700 rpm으로 설정된 볼텍스-제니 (Vortex-Genie)?를 사용하여 샘플을 재현탁시켰다.A 0.08% Trypan Blue solution was prepared by diluting 0.4% Trypan Blue in NaCl (VWR BDH8721-0) 1: 5 with 1 × PBS. A 1.0 mL sample was taken from the fermentation vessel and injected into a 1.5 mL Eppendorf centrifuge tube and centrifuged for 5 min at 14,000 rpm at Eppendorf, 5415C. After centrifugation, the upper solvent layer was removed using an m200 Variable Channel BioHit pipette with 20-200 μl Bioheat Pipette Tips. Care was taken not to remove the layer between the solvent layer and the aqueous layer. Once the solvent layer was removed, the samples were resuspended using Vortex-Genie® set at 2700 rpm.
혈구계 카운트를 위한 이상적인 농도를 준비하기 위해 일련의 희석물이 필요하였다. OD가 10인 경우에, 1:20 희석을 행하여 0.5 OD를 달성하였으며, 이는 평방당 카운트되는 세포의 이상적인 양, 20 내지 30을 제공할 것이다. 옥수수 고형물로 인한 희석에 있어서의 부정확성을 줄이기 위해, 절단된 100 내지 1000 ㎕ 바이오히트 피펫을 사용한 다중 희석을 필요로 하였다. 개구도를 증가시키도록 팁을 약 1 ㎝ 잘라내어, 팁이 클로깅되는 것을 방지하였다. 1:20 최종 희석을 위해, 발효 샘플과 0.9% NaCl 용액의 초기 1:1 희석물을 제조하였다. 그 다음에, 이전 용액의 1:1 희석물 (즉, 초기 1:1 희석물) 및 0.9% NaCl 용액 (제 2 희석물)을 생성시킨 후에, 제 2 희석물과 트립판 블루 용액의 1:5 희석물을 생성시켰다. 샘플을 각 희석물 사이에 와류시키고, 절단 팁을 0.9% NaCl 및 트립판 블루 용액으로 린스하였다.A series of dilutions was needed to prepare the ideal concentration for the hemocytometer count. When the OD is 10, a 1:20 dilution was performed to achieve 0.5 OD, which would give an ideal amount of cells, 20-30, counted per square. In order to reduce inaccuracies in dilution due to corn solids, multiple dilutions with cut 100-1000 μl bioheat pipettes were required. The tip was cut about 1 cm to increase the aperture, preventing the tip from clogging. For a 1:20 final dilution, an initial 1: 1 dilution of the fermentation sample and 0.9% NaCl solution was prepared. Next, a 1: 1 dilution of the previous solution (ie, an initial 1: 1 dilution) and a 0.9% NaCl solution (second dilution) were generated, followed by 1: 1 of the second dilution and trypan blue solution. Five dilutions were generated. Samples were swirled between each dilution and the cutting tips rinsed with 0.9% NaCl and trypan blue solution.
커버 슬립을 조심스럽게 혈구계 (Hausser Scientific Bright-Line 1492) 상부에 배치하였다. 2 내지 20 ㎕ 바이오히트 피펫 팁을 갖는 m20 배리어블 채널 바이오히트 피펫을 사용하여, 최종 트립판 블루 희석물로부터 분취량 (10 ㎕)을 취해, 혈구계에 주입하였다. 혈구계를 40x 배율의 제이스 악시오스코프 (Zeis Axioskop) 40 현미경에 놓았다. 센터 쿼드런트 (center quadrant)를 25개의 스퀘어로 분할하고, 그 다음에 두 챔버의 4개의 코너 및 센터 스퀘어를 카운트하여 기록하였다. 두 챔버를 카운트한 후에, 평균을 취해 희석계수 (20)를 곱한 다음에, 혈구계의 쿼드런트의 스퀘어의 수에 25를 곱한 후에, 0.0001 mL로 나누면, 카운트된 쿼드런트 부피이다. 이러한 계산의 합계는 mL당 세포수이다.The cover slip was carefully placed on top of the hemocytometer (Hausser Scientific Bright-Line 1492). Aliquots (10 μl) were taken from the final trypan blue dilution and injected into the hemocytometer using an m20 barrierable channel bioheat pipette with 2-20 μl bioheat pipette tips. The hemocytometer was placed on a
수성상Aqueous phase 중의 발효 산물의 Of fermentation products LCLC 분석 analysis
처리 준비가 될 때까지 샘플을 냉장 보관하였다. 샘플을 냉장 보관으로부터 제거하여, 실온에 이르게 하였다 (약 1 시간). 약 300 ㎕의 샘플을 100 내지 1000 ㎕ 바이오히트 피펫 팁을 갖는 m1000 배리어블 채널 바이오히트 피펫을 사용하여 0.2 um 원심분리기 필터 (나노셉 (Nanosep)? MF 변성 나일론 원심분리기 필터)에 옮긴 후에, 에펜도르프, 5415C를 사용하여 14,000 rpm으로 5 분간 원심분리하였다. 약 200 ㎕의 여과된 샘플을 폴리머 피트를 갖는 250 ㎕ 글래스 바이알 인서트를 구비한 1.8 오토 샘플러 바이알에 옮겼다. 2700 rpm으로 설정된 볼텍스-제니?를 사용하여 샘플을 와류시키기 전에, PTFE 격막을 갖는 스크루 캡을 사용하여 바이알을 캡핑하였다.Samples were refrigerated until ready for processing. Samples were removed from cold storage and brought to room temperature (about 1 hour). About 300 μl of sample was transferred to a 0.2 um centrifuge filter (Nanosep® MF modified nylon centrifuge filter) using an m1000 barrierable channel bioheat pipette with a 100 to 1000 μl bioheat pipette tip, followed by eppen Dorf, 5415C, was centrifuged for 5 minutes at 14,000 rpm. About 200 μl filtered sample was transferred to a 1.8 auto sampler vial with 250 μl glass vial insert with polymer pits. Prior to vortexing the sample using a Vortex-Genie® set at 2700 rpm, the vial was capped using a screw cap with a PTFE septum.
그 다음에, 샘플을 두 부분으로 이뤄진, 아이소크래틱 (isocratic) 펌프, 진공 탈가스기, 가열된 칼럼 컴파트먼트, 샘플러 냉각 시스템, UV DAD 검출기 및 RI 검출기를 갖춘 애질런트 (Agilent) 1200 시리즈 LC에서 유동시켰다. 사용된 칼럼은 바이오-라드 카티온 에이치 리필 (Bio-Rad Cation H refill), 30X4.6 가드 칼럼을 갖는 아미넥스 (Aminex) HPX-87H, 300 X 7.8이었다. 칼럼 온도는 40℃이며, 이동상은 40분간 0.6 mL/min의 유량의 0.01 N 황산이었다. 결과는 표 1에 나타나있다.The Agilent 1200 Series LC with a two-part sample, isocratic pump, vacuum degasser, heated column compartment, sampler cooling system, UV DAD detector and RI detector. It was flowed in. The column used was Bio-Rad Cation H refill, Aminex HPX-87H with a 30 × 4.6 guard column, 300 × 7.7. The column temperature was 40 ° C. and the mobile phase was 0.01 N sulfuric acid at a flow rate of 0.6 mL / min for 40 minutes. The results are shown in Table 1.
[표 1][Table 1]
용매상 중의 발효 산물의 GC 분석GC Analysis of Fermentation Products in Solvent Phase
처리 준비가 될 때까지 샘플을 냉장 보관하였다. 샘플을 냉장 보관으로부터 제거하여, 실온에 이르게 하였다 (약 1 시간). 약 150 ㎕의 샘플을 100 내지 1000 ㎕ 바이오히트 피펫 팁을 갖는 m1000 배리어블 채널 바이오히트 피펫을 사용하여, 폴리머 피트를 갖는 250 ㎕ 글래스 바이알 인서트를 구비한 1.8 오토 샘플러 바이알에 옮겼다. PTFE 격막을 갖는 스크루 캡을 사용하여 바이알을 캡핑하였다.Samples were refrigerated until ready for processing. Samples were removed from cold storage and brought to room temperature (about 1 hour). About 150 μl of sample was transferred to a 1.8 auto sampler vial with a 250 μl glass vial insert with polymer pits using an m1000 barrier channel bioheat pipette with 100 to 1000 μl bioheat pipette tips. The vial was capped using a screw cap with a PTFE septum.
그 다음에 샘플을 7683B 주입기 및 G2614A 오토 샘플러를 갖춘 애질런트 7890A GC에서 유동시켰다. 칼럼은 에이치피-이노왁스 (HP-InnoWax) 칼럼 (30 m x 0.32 ㎜ ID, 0.25 ㎛ 필름)이었다. 운반 기체는 일정한 헤드 압력 (head pressure)을 갖는, 45℃에서 측정된 1.5 mL/min의 유량의 헬륨이었고; 주입기 스플릿 (split)은 225℃에서 1:50이었으며; 오븐 온도는 29분간의 유동 시간 중 45℃에서 1.5분간, 10℃/min으로 45℃에서 160℃로 0분간, 그 다음에 35℃/min으로 230℃에서 14분간이었다. 260℃에서 40 mL/min 헬륨 구성 (makeup) 기체와 함께 불꽃 이온화 검출을 사용하였다. 결과는 표 2에 나타나있다.Samples were then flowed in an Agilent 7890A GC with 7683B injector and G2614A auto sampler. The column was an HP-InnoWax column (30 m × 0.32 mm ID, 0.25 μm film). The carrier gas was helium at a flow rate of 1.5 mL / min measured at 45 ° C. with a constant head pressure; The injector split was 1:50 at 225 ° C .; The oven temperature was 1.5 minutes at 45 ° C. for 1.5 minutes, 45 ° C. to 160 ° C. at 10 ° C./min, followed by 14 minutes at 230 ° C. at 35 ° C./min, during a 29 minute flow time. Flame ionization detection was used with 40 mL / min helium makeup gas at 260 ° C. The results are shown in Table 2.
[표 2][Table 2]
지방산 부틸 에스테르를 분석하기 위한 샘플을 7683B 주입기 및 G2614A 오토 샘플러를 갖춘 애질런트 6890 GC에서 유동시켰다. 칼럼은 HP-DB-FFAP 칼럼 (15 m x 0.53 ㎜ ID (Megabore), 1-마이크론 필름 두께 칼럼 (30 m x 0.32 ㎜ ID, 0.25 ㎛ 필름)이었다. 운반 기체는 일정한 헤드 압력을 갖는, 45℃에서 측정된 3.7 mL/min의 유량의 헬륨이었고; 주입기 스플릿은 225℃에서 1:50이었으며; 오븐 온도는 26분간의 유동 시간 중 100℃에서 2.0분간, 10℃/min으로 100℃에서 250℃로, 그 다음에 250℃에서 9분간이었다. 300℃에서 40 mL/min 헬륨 구성 기체와 함께 불꽃 이온화 검출을 사용하였다. 하기 GC 표준물질 (뉴-첵 프레프 (Nu-Chek Prep); 미국 미네소타주 엘시언에 소재)을 사용하여, 하기 지방산 아이소부틸 에스테르 생성물의 동일성을 확인하였다: 아이소부틸 팔미테이트, 아이소부틸 스테아레이트, 아이소부틸 올레에이트, 아이소부틸 리놀레에이트, 아이소부틸 리놀레네이트, 아이소부틸 아라키데이트.Samples for analyzing fatty acid butyl esters were flowed on an Agilent 6890 GC equipped with a 7683B injector and a G2614A auto sampler. The column was an HP-DB-FFAP column (15 mx 0.53 mm ID (Megabore), 1-micron film thickness column (30 mx 0.32 mm ID, 0.25 μm film). Carrier gas measured at 45 ° C. with constant head pressure. Helium at a flow rate of 3.7 mL / min; injector split 1:50 at 225 ° C .; oven temperature from 100 ° C. to 250 ° C. at 100 ° C. and 2.0 min at 100 ° C. during a 26 minute flow time. It was then 9 minutes at 250 ° C. Flame ionization detection was used with 40 mL / min helium constituent gas at 300 ° C. The following GC standards (Nu-Chek Prep; Elsyon, MN) , Isobutyl palmitate, isobutyl stearate, isobutyl oleate, isobutyl linoleate, isobutyl linoleate, isobutyl arachidate .
실시예 1 내지 14는 요구된 방법에 사용될 수 있는 다양한 발효 조건을 기재하고 있다. 일례로서, 일부의 발효에 대해서는 액화 전 리파제 처리를 행하고, 다른 것들에 대해서는 액화 후 리파제 처리를 행하였다. 다른 실시예에서, 발효에 대하여 열불활성화 처리를 행하였다. 발효 후에, 유효 아이소부탄올 역가 (Eff Iso Titer), 즉 수성상 부피 리터당 생성된 아이소부탄올의 총 그램수를 측정하였다. 결과는 표 3에 나타나있다.Examples 1 to 14 describe various fermentation conditions that can be used in the required method. As an example, some of the fermentations were subjected to lipase treatment before liquefaction, and others were lipase treatment after liquefaction. In another example, the thermal inactivation treatment was performed on the fermentation. After fermentation, the effective isobutanol titer (Eff Iso Titer), i.e. the total number of grams of isobutanol produced per liter of the aqueous phase, was determined. The results are shown in Table 3.
실시예 1 - (대조군)Example 1-(control)
실험 식별자 (identifier) 2010Y014는 다음을 포함하였다: 시드 플라스크 성장 방법, 초기 발효 용기 제조 방법, 액화 방법, 접종 전 영양소 첨가 방법, 발효 용기 접종 방법, 발효 용기 조작 조건 방법, 및 모든 분석 방법. 올레일 알코올을 접종 후에 0.1 내지 1.0시간에 단일 배취식으로 첨가하였다. 부타놀로젠은 NGCI-070이었다.Experimental identifier 2010Y014 included: seed flask growth method, initial fermentation vessel preparation method, liquefaction method, nutrient addition method before inoculation, fermentation vessel inoculation method, fermentation vessel operating condition method, and all analytical methods. Oleyl alcohol was added in a single batch 0.1-1.0 hours after inoculation. Butanologen was NGCI-070.
실시예 2Example 2
실험 식별자 2010Y015는 다음을 포함하였다: 시드 플라스크 성장 방법, 초기 발효 용기 제조 방법, 액화 방법, 액화 후 리파제 처리 방법, 접종 전 영양소 첨가 방법, 발효 용기 접종 방법, 발효 용기 조작 조건 방법, 및 모든 분석 방법. 올레일 알코올을 접종 후에 0.1 내지 1.0시간에 단일 배취식으로 첨가하였다. 부타놀로젠은 NGCI-070이었다.Experiment identifier 2010Y015 included: seed flask growth method, initial fermentation vessel preparation method, liquefaction method, liquefaction method after liquefaction, nutrient addition method before inoculation, fermentation vessel inoculation method, fermentation vessel operating condition method, and all analytical methods. . Oleyl alcohol was added in a single batch 0.1-1.0 hours after inoculation. Butanologen was NGCI-070.
실시예 3Example 3
실험 식별자 2010Y016은 다음을 포함하였다: 시드 플라스크 성장 방법, 초기 발효 용기 제조 방법, 액화 방법, 액화 후 리파제 처리 방법, 에탄올을 제외하는 것 외에는 접종 전 영양소 첨가 방법, 발효 용기 접종 방법, 발효 용기 조작 조건 방법, 및 모든 분석 방법. 올레일 알코올을 접종 후에 0.1 내지 1.0시간에 단일 배취식으로 첨가하였다. 부타놀로젠은 NGCI-070이었다.Experiment identifier 2010Y016 included: seed flask growth method, initial fermentation vessel preparation method, liquefaction method, liquefaction method after liquefaction, nutrient addition method before inoculation except ethanol, fermentation vessel inoculation method, fermentation vessel operating conditions Methods, and all analysis methods. Oleyl alcohol was added in a single batch 0.1-1.0 hours after inoculation. Butanologen was NGCI-070.
실시예 4Example 4
실험 식별자 2010Y017은 다음을 포함하였다: 시드 플라스크 성장 방법, 초기 발효 용기 제조 방법, 액화 방법, 액화 후 가열 살균 처리 방법, 에탄올을 제외하는 것 외에는 접종 전 영양소 첨가 방법, 발효 용기 접종 방법, 발효 용기 조작 조건 방법, 및 모든 분석 방법. 올레일 알코올을 접종 후에 0.1 내지 1.0시간에 단일 배취식으로 첨가하였다. 부타놀로젠은 NGCI-070이었다.Experiment identifier 2010Y017 included: seed flask growth method, initial fermentation vessel preparation method, liquefaction method, post-liquefaction heat sterilization method, nutrient addition method before inoculation except ethanol, fermentation vessel inoculation method, fermentation vessel operation Conditional methods, and all analytical methods. Oleyl alcohol was added in a single batch 0.1-1.0 hours after inoculation. Butanologen was NGCI-070.
실시예 5Example 5
실험 식별자 2010Y018은 다음을 포함하였다: 시드 플라스크 성장 방법, 초기 발효 용기 제조 방법, 액화 방법, 액화 후에 다만 7.2 ppm의 리파제를 첨가하는 것을 제외하고는 액화 후 리파제 처리 방법, 액화 후 가열 살균 처리 방법, 접종 전 영양소 첨가 방법, 발효 용기 접종 방법, 발효 용기 조작 조건 방법, 및 모든 분석 방법. 올레일 알코올을 접종 후에 0.1 내지 1.0시간에 단일 배취식으로 첨가하였다. 부타놀로젠은 NGCI-070이었다.Experimental identifier 2010Y018 included: seed flask growth method, initial fermentation vessel preparation method, liquefaction method, liquefaction method after liquefaction except for adding only 7.2 ppm of lipase after liquefaction, post-liquefaction heat sterilization method, Nutrient addition method before inoculation, fermentation vessel inoculation method, fermentation vessel operating condition method, and all analytical methods. Oleyl alcohol was added in a single batch 0.1-1.0 hours after inoculation. Butanologen was NGCI-070.
실시예 6 - (대조군)Example 6-(control)
실험 식별자 2010Y019는 다음을 포함하였다: 시드 플라스크 성장 방법, 초기 발효 용기 제조 방법, 액화 방법, 액화 후 가열 살균 처리 방법, 접종 전 영양소 첨가 방법, 발효 용기 접종 방법, 발효 용기 조작 조건 방법, 및 모든 분석 방법. 올레일 알코올을 접종 후에 0.1 내지 1.0시간에 단일 배취식으로 첨가하였다. 부타놀로젠은 NGCI-070이었다.Experiment identifier 2010Y019 included: seed flask growth method, initial fermentation vessel preparation method, liquefaction method, post-liquefaction heat sterilization method, nutrient addition method before inoculation, fermentation vessel inoculation method, fermentation vessel operating condition method, and all assays Way. Oleyl alcohol was added in a single batch 0.1-1.0 hours after inoculation. Butanologen was NGCI-070.
실시예 7 - (대조군)Example 7-(control)
실험 식별자 2010Y021은 다음을 포함하였다: 시드 플라스크 성장 방법, 초기 발효 용기 제조 방법, 액화 전 리파제 처리 방법, 액화 방법, 액화 시의 가열 살균 처리, 접종 전 영양소 첨가 방법, 발효 용기 접종 방법, 발효 용기 조작 조건 방법, 및 모든 분석 방법. 올레일 알코올을 접종 후에 0.1 내지 1.0시간에 단일 배취식으로 첨가하였다. 부타놀로젠은 NGCI-070이었다.Experiment identifier 2010Y021 included: seed flask growth method, initial fermentation vessel preparation method, lipase treatment method before liquefaction, liquefaction method, heat sterilization treatment during liquefaction, nutrient addition method before inoculation, fermentation vessel inoculation method, fermentation vessel operation Conditional methods, and all analytical methods. Oleyl alcohol was added in a single batch 0.1-1.0 hours after inoculation. Butanologen was NGCI-070.
실시예 8Example 8
실험 식별자 2010Y022는 다음을 포함하였다: 시드 플라스크 성장 방법, 초기 발효 용기 제조 방법, 액화 방법, 접종 전 영양소 첨가 방법, 발효 용기 접종 방법, 발효 용기 조작 조건 방법, 및 모든 분석 방법. 올레일 알코올을 접종 후에 0.1 내지 1.0시간에 단일 배취식으로 첨가하였다. 부타놀로젠은 NGCI-070이었다.Experiment identifier 2010Y022 included: seed flask growth method, initial fermentation vessel preparation method, liquefaction method, nutrient addition method before inoculation, fermentation vessel inoculation method, fermentation vessel operating condition method, and all analytical methods. Oleyl alcohol was added in a single batch 0.1-1.0 hours after inoculation. Butanologen was NGCI-070.
실시예 9Example 9
실험 식별자 2010Y023는 다음을 포함하였다: 시드 플라스크 성장 방법, 초기 발효 용기 제조 방법, 액화 방법, 액화 후 리파제 처리 방법, 비가열 살균 처리, 접종 전 영양소 첨가 방법, 발효 용기 접종 방법, 발효 용기 조작 조건 방법, 및 모든 분석 방법. 조옥수수유로 생성된 옥수수유 지방산을 접종 후에 0.1 내지 1.0시간에 단일 배취식으로 첨가하였다. 부타놀로젠은 NGCI-070이었다.Experiment identifier 2010Y023 included: seed flask growth method, initial fermentation vessel preparation method, liquefaction method, liquefaction method after liquefaction, non-heat sterilization treatment, nutrient addition method before inoculation, fermentation vessel inoculation method, fermentation vessel operating condition method , And all analytical methods. Corn oil fatty acid produced as crude corncob was added in a single batch 0.1-1.0 hours after inoculation. Butanologen was NGCI-070.
실시예 10Example 10
실험 식별자 2010Y024는 다음을 포함하였다: 시드 플라스크 성장 방법, 초기 발효 용기 제조 방법, 액화 전 리파제 처리 방법, 액화 방법, 액화 시의 가열 살균 처리, 에탄올을 첨가하지 않는 것을 제외하고는 접종 전 영양소 첨가 방법, 발효 용기 접종 방법, 발효 용기 조작 조건 방법, 및 모든 분석 방법. 올레일 알코올을 접종 후에 0.1 내지 1.0시간에 단일 배취식으로 첨가하였다. 부타놀로젠은 NGCI-070이었다.Experiment identifier 2010Y024 included: seed flask growth method, initial fermentation vessel preparation method, lipase treatment method before liquefaction, liquefaction method, heat sterilization during liquefaction, nutrient addition method before inoculation except no addition of ethanol Fermentation vessel inoculation method, fermentation vessel operating condition method, and all analytical methods. Oleyl alcohol was added in a single batch 0.1-1.0 hours after inoculation. Butanologen was NGCI-070.
실시예 11Example 11
실험 식별자 2010Y029는 다음을 포함하였다: 시드 플라스크 성장 방법, 초기 발효 용기 제조 방법, 액화 전 리파제 처리 방법, 액화 방법, 액화 시의 가열 살균 처리, 접종 전 영양소 첨가 방법, 발효 용기 접종 방법, 발효 용기 조작 조건 방법, 및 모든 분석 방법. 조옥수수유로 생성된 옥수수유 지방산을 접종 후에 0.1 내지 1.0시간에 단일 배취식으로 첨가하였다. 부타놀로젠은 NGCI-070이었다.Experiment identifier 2010Y029 included: seed flask growth method, initial fermentation vessel preparation method, lipase treatment method before liquefaction, liquefaction method, heat sterilization treatment during liquefaction, nutrient addition method before inoculation, fermentation vessel inoculation method, fermentation vessel operation Conditional methods, and all analytical methods. Corn oil fatty acid produced as crude corncob was added in a single batch 0.1-1.0 hours after inoculation. Butanologen was NGCI-070.
실시예 12Example 12
실험 식별자 2010Y030은 다음을 포함하였다: 시드 플라스크 성장 방법, 초기 발효 용기 제조 방법, 액화 전 리파제 처리 방법, 액화 방법, 액화 시의 가열 살균 처리, 에탄올을 첨가하지 않는 것을 제외하고는 접종 전 영양소 첨가 방법, 발효 용기 접종 방법, 발효 용기 조작 조건 방법, 및 모든 분석 방법. 조옥수수유로 생성된 옥수수유 지방산을 접종 후에 0.1 내지 1.0시간에 단일 배취식으로 첨가하였다. 부타놀로젠은 NGCI-070이었다.Experiment identifier 2010Y030 included: seed flask growth method, initial fermentation vessel preparation method, liquefaction method before liquefaction, liquefaction method, heat sterilization during liquefaction, nutrient addition method before inoculation except no addition of ethanol Fermentation vessel inoculation method, fermentation vessel operating condition method, and all analytical methods. Corn oil fatty acid produced as crude corncob was added in a single batch 0.1-1.0 hours after inoculation. Butanologen was NGCI-070.
실시예 13 - (대조군)Example 13-(Control)
실험 식별자 2010Y031은 다음을 포함하였다: 시드 플라스크 성장 방법, 초기 발효 용기 제조 방법, 액화 방법, 액화 후 리파제 처리 방법, 비가열 살균 처리, 에탄올을 첨가하지 않는 것을 제외하고는 접종 전 영양소 첨가 방법, 발효 용기 접종 방법, 발효 용기 조작 조건 방법, 및 모든 분석 방법. 조옥수수유로 생성된 옥수수유 지방산을 접종 후에 0.1 내지 1.0시간에 단일 배취식으로 첨가하였다. 부타놀로젠은 NGCI-070이었다.Experiment identifier 2010Y031 included: seed flask growth method, initial fermentation vessel preparation method, liquefaction method, liquefaction method after liquefaction, non-heat sterilization method, nutrient addition method before inoculation, except no addition of ethanol, fermentation Vessel inoculation method, fermentation vessel operating condition method, and all assay methods. Corn oil fatty acid produced as crude corncob was added in a single batch 0.1-1.0 hours after inoculation. Butanologen was NGCI-070.
실시예 14Example 14
실험 식별자 2010Y032는 다음을 포함하였다: 시드 플라스크 성장 방법, 초기 발효 용기 제조 방법, 액화 방법, 액화 후 리파제 처리 방법, 비가열 살균 처리, 접종 전 영양소 첨가 방법, 발효 용기 접종 방법, 발효 용기 조작 조건 방법, 및 모든 분석 방법. 조옥수수유로 생성된 옥수수유 지방산을 접종 후에 0.1 내지 1.0시간에 단일 배취식으로 첨가하였다. 부타놀로젠은 NGCI-070이었다.Experiment identifier 2010Y032 included: seed flask growth method, initial fermentation vessel preparation method, liquefaction method, liquefaction method after liquefaction, non-heat sterilization treatment, nutrient addition method before inoculation, fermentation vessel inoculation method, fermentation vessel operating condition method , And all analytical methods. Corn oil fatty acid produced as crude corncob was added in a single batch 0.1-1.0 hours after inoculation. Butanologen was NGCI-070.
[표 3][Table 3]
실시예 15 및 16은 액화 후 리파제 처리의 존재 및 부재 하에서의 발효 및 아이소부탄올 생성의 비교를 나타낸다. 결과는 표 4 및 5에 나타나있다.Examples 15 and 16 show a comparison of fermentation and isobutanol production in the presence and absence of lipase treatment after liquefaction. The results are shown in Tables 4 and 5.
실시예Example 15 15
실험 식별자 2010Y026은 다음을 포함하였다: 시드 플라스크 성장 방법, 초기 발효 용기 제조 방법, 액화 방법, 액화 후 리파제 처리 방법, 접종 전 영양소 첨가 방법, 발효 용기 접종 방법, 발효 용기 조작 조건 방법, 및 모든 분석 방법. 조옥수수유로 생성된 옥수수유 지방산을 접종 후에 0.1 내지 1.0시간에 단일 배취식으로 첨가하였다. 옥수수유 지방산 추출 용매를 브로스 부피와 동일한 부피로 첨가하였다. 부타놀로젠은 PNY2205이었다. 46시간 내지 61시간의 발효 시간에, 옥수수 매시로 생성된 글루코스가 거의 소모되었기 때문에, 50% w/w 멸균 글루코스 용액 274 g을 첨가하였다.Experimental identifier 2010Y026 included: seed flask growth method, initial fermentation vessel preparation method, liquefaction method, liquefaction method after liquefaction, nutrient addition method before inoculation, fermentation vessel inoculation method, fermentation vessel operating condition method, and all analytical methods . Corn oil fatty acid produced as crude corncob was added in a single batch 0.1-1.0 hours after inoculation. Corn oil fatty acid extraction solvent was added in the same volume as the broth volume. Butanologen was PNY2205. In the fermentation time of 46 hours to 61 hours, 274 g of 50% w / w sterile glucose solution was added because the glucose produced by the corn mash was almost consumed.
실시예 16Example 16
실험 식별자 2010Y027은 다음을 포함하였다: 시드 플라스크 성장 방법, 초기 발효 용기 제조 방법, 액화 방법, 접종 전 영양소 첨가 방법, 발효 용기 접종 방법, 발효 용기 조작 조건 방법, 및 모든 분석 방법. HD 오세놀? 90/95 (올레일 알코올, CAS No. 143-28-2, 독일 몬하임에 소재하는 코그니스)를 접종 후에 0.1 내지 1.0시간에 단일 배취식으로 첨가하였다. 올레일 알코올 추출 용매를 브로스 부피와 동일한 부피로 첨가하였다. 부타놀로젠은 PNY2205이었다.Experiment identifier 2010Y027 included: seed flask growth method, initial fermentation vessel preparation method, liquefaction method, nutrient addition method before inoculation, fermentation vessel inoculation method, fermentation vessel operating condition method, and all analytical methods. HD Ossenol? 90/95 (oleyl alcohol, CAS No. 143-28-2, Cognis, Monheim, Germany) was added in a single batch 0.1-1.0 hours after inoculation. Oleyl alcohol extraction solvent was added in the same volume as the broth volume. Butanologen was PNY2205.
[표 4][Table 4]
[표 5][Table 5]
실시예 17 내지 22는 발효 및 아이소부탄올 생성에 관한 신선한 추출제 대 재순환된 추출제의 효과의 비교를 나타낸다. 결과는 표 6에 나타나있다. 이들 실시예에 관해서는, 2 L 및 10 L 발효를 후술하는 바와 같이 제조하였다.Examples 17-22 show a comparison of the effects of fresh extract versus recycled extract on fermentation and isobutanol production. The results are shown in Table 6. For these examples, 2 L and 10 L fermentations were prepared as described below.
10 L 프리시드 플라스크 성장10 L preseed flask growth
pdc1 결실, pdc5 결실, 및 pdc6 결실을 갖는, 탄수화물 공급원으로부터 아이소부탄올을 생성하도록 유전자 조작된 사카로마이세스 세레비시아 균주 (상술한 균주 PNY2242)를 동결 배양물로부터 시드 플라스크 (125 mL 벤트형 (vented) 플라스크 중의 10 mL 합성 배지)에서 0.6 내지 0.7 g/L dcw (OD600 1.5 내지 2.5 - 미국 매사추세츠주 월섬에 소재하는 서모 헬리오스 α 서모 피셔 사이언티픽 인코포레이티드)로 성장시켰다. 배양물을 260 rpm으로 회전하는 인큐베이터에서 29 내지 31℃에서 성장시켰다. 동결 배양물을 미리 -80℃로 보관하였다. 합성 시드 플라스크 배지의 조성은 다음과 같았다:Saccharomyces cerevisiae strains (strain PNY2242 described above) genetically engineered to produce isobutanol from a carbohydrate source with pdc1 deletion, pdc5 deletion, and pdc6 deletion (see above strain PNY2242) from seed cultures (125 mL vented) vented) in a 10 mL synthetic medium in a flask) to 0.6-0.7 g / L dcw (OD 600 1.5-2.5-Thermo Helios α Thermo Fisher Scientific Inc., Waltham, Mass.). Cultures were grown at 29-31 ° C. in an incubator rotating at 260 rpm. Frozen cultures were previously stored at -80 ° C. The composition of the synthetic seed flask medium was as follows:
10.0 g/L 덱스트로스10.0 g / L dextrose
3.5 mL/L 에탄올, 무수3.5 mL / L ethanol, anhydrous
3.7 g/L 포미디엄™ 합성 완전 아미노산 드롭 아웃:3.7 g / L Fordium ™ Synthetic Complete Amino Acid Dropout:
HIS 비함유, URA 비함유 (참조 번호 DSCK162CK)Without HIS, without URA (Reference number DSCK162CK)
6.7 g/L 아미노산 비함유 Difco 효모 질소 베이스 (No. 291920)6.7 g / L Amino Acid Free Difco Yeast Nitrogen Base (No. 291920)
1:1::트윈 (Tween) 80:에탄올 중의 1% 에르고스테롤1: 1 :: Tween 80: 1% ergosterol in ethanol
제 1 시드 플라스크 배양물 2밀리리터를 250 mL 벤트형 플라스크 중 25 mL에 옮겨, 260 rpm으로 회전하는 인큐베이터에서 29 내지 31℃에서 성장시켰다. 제 2 시드 플라스크는 상기에서 사용한 것과 동일한 합성 배지를 사용한다.Two milliliters of the first seed flask culture was transferred to 25 mL in a 250 mL vented flask and grown at 29-31 ° C. in an incubator rotating at 260 rpm. The second seed flask uses the same synthetic medium as used above.
배양물을 0.6 내지 0.7 g/L dcw (OD600 1.0 내지 3.0)로 성장시켰다. 그 다음에, 이러한 제 2 플라스크 배양물 8 mL를 합성 배지 200 mL를 갖는 3개의 플라스크 (2 L, 벤트형, 배플형 플라스크)에 첨가하였다. 배양물을 29 내지 31℃에서 18 내지 24시간 동안 인큐베이터에서 성장시켰다. 3개의 시드 플라스크는 2개의 제 1 시드 플라스크에서 사용한 것과 동일한 합성 배지를 사용한다. 이들 3개의 플라스크 (플라스크 브로스 600 mL)를 사용하여, 6 L의 최종 수성상 부피로 증식 탱크를 접종시켰다.Cultures were grown to 0.6-0.7 g / L dcw (OD 600 1.0-3.0). 8 mL of this second flask culture was then added to three flasks (2 L, vented, baffle flasks) with 200 mL of synthetic medium. Cultures were grown in incubator at 29-31 ° C. for 18-24 hours. Three seed flasks use the same synthetic medium as used in the two first seed flasks. These three flasks (flask broth 600 mL) were used to inoculate the growth tank with a final aqueous phase volume of 6 L.
10 L 증식 탱크 액화10 L propagation tank liquefaction
10 L, B. 브라운 바이오스태트 (Braun BioStat) C 발효 용기를 사용하기 위해 제조하였다. 인라인 pH 프로브를 발효 용기에 주입하였다. pH=7에서 영점 보정을 하였다. pH=4에서 스팬 보정을 하였다. 그 다음에 프로브를 사이드 포트를 통해 발효 용기에 주입하였다. 용존 산소 프로브 (pO2 프로브)도 사이드 포트를 통해 발효 용기에 주입하였다. 영양소, 종배양액, 추출 용매, 및 염기를 운반하는데 사용되는 튜빙을 헤드 플레이트에 부착시키고, 단부를 포일처리하였다 (foiled). 수확 및 샘플링하기 위한 밸브를 > 121℃에서> 20분간 저 압력 스팀 및 스팀 트랩으로 멸균시켰다.10 L, prepared for use with B. Braun BioStat C fermentation vessels. Inline pH probes were injected into the fermentation vessel. Zero calibration was performed at pH = 7. Span correction was performed at pH = 4. The probe was then injected into the fermentation vessel through the side port. Dissolved oxygen probe (pO 2 probe) was also injected into the fermentation vessel through the side port. The tubing used to carry the nutrients, the cultivation solution, the extraction solvent, and the base was attached to the head plate and the ends were foiled. Valves for harvesting and sampling were sterilized with low pressure steam and steam traps at> 121 ° C for> 20 minutes.
발효 용기 온도를 열전대 및 가정용수 순환 루프로 30℃로 조절하였다. 습윤 옥수수알 (#2 황색 마치종 옥수수)을 1.0 ㎜ 스크린을 구비한 해머 밀을 사용하여 분쇄한 다음에, 얻어진 통옥수수 가루를 액화 반응물의 10 내지 20% (건조 옥수수 고형물 중량)가 되는 주입량으로 발효 용기에 첨가하였다. Difco 효모 추출물을 총 배취 중량의 0.5% w/w로 발효 용기에 첨가하였다.Fermentation vessel temperature was adjusted to 30 ° C. with a thermocouple and domestic water circulation loop. Wet corn kernels (# 2 yellow maize maize) were ground using a hammer mill with a 1.0 mm screen, and then the obtained whole cornmeal was fed at an injection amount of 10-20% (dry corn solids weight) of the liquefaction reactant. Added to fermentation vessel. Difco yeast extract was added to the fermentation vessel at 0.5% w / w of the total batch weight.
발효 용기를 스파저를 통해 1 내지 2 slpm으로 첨가된 무균 하우스 N2와 함께 300 내지 1500 rpm으로 혼합하는 동안에, 알파-아밀라제를 이의 사양서에 따라 발효 용기에 첨가하였다. 양호한 혼합을 확실히 하도록, 온도 설정값을 각 단계에서 5 내지 15분간 유지하면서 5℃ 단계 변화로 55℃에서 95℃로 변화시켰다. 온도가 > 90℃가 되면, 액화 쿠킹 시간이 개시되고, 액화 사이클이 > 90℃에서 60분간 유지되었다. 액화 사이클을 완료한 후에, 발효 용기 온도 설정값을 30℃의 발효 온도로 설정하였다. 화학 소포제의 첨가없이 기포 발생을 방지하도록, N2를 스파저로부터 헤드 스페이스로 다시 향하게 하였다.Alpha-amylase was added to the fermentation vessel according to its specification while the fermentation vessel was mixed at 300-1500 rpm with sterile house N 2 added at 1-2 slpm via a sparger. To ensure good mixing, the temperature setpoint was changed from 55 ° C. to 95 ° C. in a 5 ° C. step change while maintaining 5-15 minutes in each step. When the temperature reached> 90 ° C, the liquefaction cooking time was initiated and the liquefaction cycle was maintained at> 90 ° C for 60 minutes. After completion of the liquefaction cycle, the fermentation vessel temperature set point was set to a fermentation temperature of 30 ° C. N 2 was directed back from the sparger to the headspace to prevent bubble generation without the addition of a chemical antifoam.
10 L 증식 탱크 조작10L breeder tank operation
N2를 발효 용기로 첨가하면서, 발효 용기 pO2 프로브를 영점으로 보정하였다. 400 rpm으로 무균 공기 스파징하면서, 발효 용기 pO2 프로브를 이의 스팬으로 보정하였다. 발효 용기를 프리시드 플라스크 성장 단계의 최종 단계에서 접종시켰다. 3개의 진탕 플라스크를 인큐베이터/진탕기로부터 제거하여, 멸균 용기에 첨가하였다. 멸균 용기의 내용물을 증식 탱크 액화 방법 동안에 제조된 액화 매시 5.3 내지 5.5 L에 첨가하였다.The fermentation vessel pO 2 probe was calibrated to zero with N 2 added to the fermentation vessel. While sterile air sparging at 400 rpm, the fermentation vessel pO 2 probe was calibrated to its span. Fermentation vessels were inoculated at the end of the preseed flask growth stage. Three shake flasks were removed from the incubator / shaker and added to sterile containers. The contents of the sterilization vessel were added to 5.3-5.5 L of liquefaction mash prepared during the propagation tank liquefaction process.
발효 온도를 29 내지 31℃로 제어하였다. 교반 속도를 400 rpm으로 고정하였다. 공기를 전체 발효 동안에 2.0 slpm으로 스파징하였다. 발효 용기에 NH4OH 및 PID 제어 루프를 사용하여, pH를 5.4 내지 5.5로 제어하였다. 배압 제어 밸브를 제어하는 PID 루프에 의해 제어되는 발효 용기에 설정된 배압이 30 내지 50 ㎪ (0.3 내지 0.5 바)이었다.Fermentation temperature was controlled to 29-31 ° C. Stirring speed was fixed at 400 rpm. Air was sparged to 2.0 slpm during the entire fermentation. The pH was controlled between 5.4 and 5.5 using NH 4 OH and PID control loops in the fermentation vessel. The back pressure set in the fermentation vessel controlled by the PID loop controlling the back pressure control valve was 30 to 50 kPa (0.3 to 0.5 bar).
접종 후 16 내지 20시간에, 글루코아밀라제 (1.8 mL의 디스틸라제 (Distillase)? L-400, 미국 캘리포니아주 팰러앨토에 소재하는 제넨코 (Genencor))를 첨가하여 동시 당화 발효를 개시하여, 용해 전분으로부터 글루코스를 유리시켰다. 또한, 5.5 L의 HD 오세놀? 90/95 (올레일 알코올, 독일 몬하임에 소재하는 코그니스)를 발효 용기에 첨가하였다. 34 내지 36시간 후에, 교반기 속도를 100 rpm으로 감소시켰다. 10분 후에, 교반기를 끄고, 발효 용기에 대한 기류를 스파지 모드에서 오버레이 모드로 변경하였다.16-20 hours after inoculation, glucoamylase (1.8 mL of Distillase® L-400, Genencor, Palo Alto, Calif.) Was added to initiate simultaneous saccharification fermentation and dissolved. Glucose was released from starch. Also, the 5.5 L HD Osenol? 90/95 (oleyl alcohol, Cognis, Monheim, Germany) was added to the fermentation vessel. After 34 to 36 hours, the stirrer speed was reduced to 100 rpm. After 10 minutes, the stirrer was turned off and the air flow for the fermentation vessel was changed from sparge mode to overlay mode.
10 L 생산 탱크 액화10L production tank liquefied
10 L 생산 탱크 액화를 상술한 바와 같이 행하였다. 발효 용기 온도를 열전대 및 가정용수 순환 루프로 30℃로 제어하였다. 습윤 옥수수알 (#2 황색 마치종 옥수수)을 1.0 ㎜ 스크린을 구비한 해머 밀을 사용하여 분쇄하고, 얻어진 통옥수수 가루를 액화 반응물의 25 내지 35% (건조 옥수수 고형물 중량)가 되는 주입량으로 발효 용기에 첨가하였다. 100X 비타민 용액 (2 g/L 티아민 및 10 g/L 니코틴산) 75 mL를 발효 용기에 첨가하였다. 알파-아밀라제를 상술한 바와 같이 발효 용기에 첨가하였다. 또한, 발효 용기를 30℃로 되돌린 후에, 무수 에탄올 6 내지 7 mL/L를 발효 용기에 첨가하였다.10 L production tank liquefaction was performed as described above. The fermentation vessel temperature was controlled to 30 ° C. with thermocouples and domestic water circulation loops. Wet corn kernels (# 2 yellow maize maize) are ground using a hammer mill with a 1.0 mm screen and the resulting corncob flour is fermented with an injection amount of 25 to 35% (dry corn solids weight) of the liquefaction reactant. Was added. 75 mL of 100 × vitamin solution (2 g / L thiamine and 10 g / L nicotinic acid) was added to the fermentation vessel. Alpha-amylase was added to the fermentation vessel as described above. In addition, after returning the fermentation vessel to 30 ° C., 6-7 mL / L of absolute ethanol was added to the fermentation vessel.
10 L 생산 탱크 조작10L production tank operation
N2를 발효 용기에 첨가하면서, 발효 용기 pO2 프로브를 영점으로 보정하였다. 400 rpm으로 무균 공기 스파징하면서, 발효 용기 pO2 프로브를 이의 스팬으로 보정하였다. 발효 용기를 증식 탱크로 접종시켰다. 증식 탱크에서의 36시간의 성장 시간 후에 증식 탱크로부터 무균 이송을 행하고, 발효 교반을 > 10분간 멈추었다. 이로써 올레일 알코올 및 수성상의 상당한 분리가 이루어졌다. 무균 이송은 이러한 발효 용기의 저부에 위치하는, 증식 탱크의 수확 밸브로부터 행해졌다. 이송 후의 탱크의 최종 비용매 부피를 기준으로 약 10% v/v를 생산 탱크에 첨가하였다.The fermentation vessel pO 2 probe was calibrated to zero with N 2 added to the fermentation vessel. While sterile air sparging at 400 rpm, the fermentation vessel pO 2 probe was calibrated to its span. Fermentation vessels were inoculated into growth tanks. Aseptic transfer was performed from the growth tank after 36 hours of growth time in the growth tank and fermentation agitation was stopped for> 10 minutes. This resulted in a significant separation of the oleyl alcohol and the aqueous phase. Aseptic conveyance was done from the harvesting valve of the propagation tank, located at the bottom of this fermentation vessel. About 10% v / v was added to the production tank based on the final nonsolvent volume of the tank after transfer.
발효 온도를 29 내지 31℃로 제어하였다. 교반 속도를 400 rpm으로 고정하였다. 공기를 전체 발효 동안에 2.0 slpm으로 스파징하였다. 발효 용기에 NH4OH 및 PID 제어 루프를 사용하여, pH를 5.2 내지 5.3으로 제어하였다. 배압 제어 밸브를 제어하는 PID 루프에 의해 제어되는 발효 용기에 설정된 배압이 30 내지 50 ㎪ (0.3 내지 0.5 바)이었다.Fermentation temperature was controlled to 29-31 ° C. Stirring speed was fixed at 400 rpm. Air was sparged to 2.0 slpm during the entire fermentation. The pH was controlled between 5.2 and 5.3 using NH 4 OH and PID control loops in the fermentation vessel. The back pressure set in the fermentation vessel controlled by the PID loop controlling the back pressure control valve was 30 to 50 kPa (0.3 to 0.5 bar).
접종 직전에, 25 내지 35% v/v 코그니스 에머리 (Emery)? 610 대두 지방산을 발효 용기에 무균 첨가하였다. 발효 용기를 10 L 증식 탱크 조작 방법의 완료 후에 10% v/v 발효 브로스로 접종시켰다. 접종 직후에, 글루코아밀라제 (디스틸라제? L-400)를 첨가하여, 글루코스를 전분으로부터 유리시켰다. 글루코스 초과를 유지하기 위해 필요할 때에 추가의 글루코아밀라제 첨가를 행하였다. 접종 직후에, 리파제 (노보자임즈 리폴라제? 100L)를 4 내지 15 ppm으로 발효 용기에 첨가하였다.Immediately before inoculation, 25 to 35% v / v Cognis Emery? 610 soybean fatty acid was aseptically added to the fermentation vessel. Fermentation vessels were inoculated with 10% v / v fermentation broth after completion of the 10 L propagation tank operating method. Immediately after inoculation, glucoamylase (Distylase® L-400) was added to release glucose from starch. Additional glucoamylase additions were made when needed to maintain glucose excess. Immediately after inoculation, lipase (Novozymes repolarase-100L) was added to the fermentation vessel at 4-15 ppm.
2 L 프리시드 플라스크 성장2 L preseed flask growth
2 L 프리시드 플라스크 성장을 사카로마이세스 세레비시아 균주 (상술한 균주 PNY2242)를 사용하여 준비하고, 동결 배양물로부터 시드 플라스크 (125 mL 벤트형 플라스크 중의 10 mL 합성 배지)에서 0.6 내지 0.7 g/L dcw (OD600 1.5 내지 2.5 - 미국 매사추세츠주 월섬에 소재하는 서모 헬리오스 α 서모 피셔 사이언티픽 인코포레이티드)로 성장시켰다. 배양물을 260 rpm으로 회전하는 인큐베이터에서 29 내지 31℃에서 성장시켰다. 동결 배양물을 미리 -80℃로 보관하였다. 합성 시드 플라스크 배지의 조성은 다음과 같았다:2 L preseed flask growth was prepared using Saccharomyces cerevisiae strain (strain PNY2242 described above) and 0.6-0.7 g in seed flask (10 mL synthetic medium in 125 mL vented flask) from freeze culture. / L dcw (OD 600 1.5-2.5-Thermo Helios α Thermo Fisher Scientific Inc., Waltham, Mass.). Cultures were grown at 29-31 ° C. in an incubator rotating at 260 rpm. Frozen cultures were previously stored at -80 ° C. The composition of the synthetic seed flask medium was as follows:
10.0 g/L 덱스트로스10.0 g / L dextrose
3.5 mL/L 에탄올, 무수3.5 mL / L ethanol, anhydrous
3.7 g/L 포미디엄 합성 완전 아미노산 (카이저) 드롭 아웃:3.7g / L Fordium Synthetic Fully Amino Acid (Kaiser) Drop Out:
HIS 비함유, URA 비함유 (참조 번호 DSCK162CK)Without HIS, without URA (Reference number DSCK162CK)
6.7 g/L 아미노산 비함유 Difco 효모 질소 베이스 (No. 291920)6.7 g / L Amino Acid Free Difco Yeast Nitrogen Base (No. 291920)
1:1::트윈 80:에탄올 중의 1% 에르고스테롤1: 1 :: Twin 80: 1% ergosterol in ethanol
제 1 시드 플라스크 배양물 2밀리리터를 250 mL 벤트형 플라스크 중의 25 mL에 옮겨, 260 rpm으로 회전하는 인큐베이터에서 29 내지 31℃에서 성장시켰다. 제 2 시드 플라스크는 상기에서 사용한 것과 동일한 합성 배지를 사용한다.Two milliliters of the first seed flask culture was transferred to 25 mL in a 250 mL vented flask and grown at 29-31 ° C. in an incubator rotating at 260 rpm. The second seed flask uses the same synthetic medium as used above.
배양물을 0.6 내지 0.7 g/L dcw (OD600 1.0 내지 3.0)로 성장시켰다. 그 다음에 이러한 제 2 플라스크 배양물 4 mL를 2 L 플라스크 중의 옥수수 매시 센트레이트 (centrate) 100 mL에 첨가하였다. 배양물을 29 내지 31℃에서 18 내지 24시간 동안 인큐베이터에서 성장시켰다. 그 다음에 500 mL의 HD 오세놀? 90/95 (올레일 알코올, 독일 몬하임에 소재하는 코그니스)를 플라스크에 첨가하였다. 플라스크를 6 내지 8시간 동안 성장시켰다. 그 다음에 탈이온수 80 mL 중의 1.2 g 디스틸라제? L-400 (미국 캘리포니아주 팰러앨토에 소재하는 제넨코) 2 mL를 센트레이트에 첨가하여, 센트레이트 중의 용해 전분으로부터 글루코스를 유리시켰다. 배양물을 계속해서 18 내지 24시간 동안 성장시켰다. 최종 바이오매스 농도는 6 내지 12 g/L dcw이었다.Cultures were grown to 0.6-0.7 g / L dcw (OD 600 1.0-3.0). 4 mL of this second flask culture was then added to 100 mL of corn mash centrate in a 2 L flask. Cultures were grown in incubator at 29-31 ° C. for 18-24 hours. Then 500 mL of HD Osenol? 90/95 (oleyl alcohol, Cognis, Monheim, Germany) was added to the flask. The flask was grown for 6-8 hours. Then 1.2 g distilase in 80 mL of deionized water? 2 mL of L-400 (Genenco, Palo Alto, Calif.) Was added to the centrate to release glucose from the dissolved starch in the centrate. Cultures were continued to grow for 18 to 24 hours. Final biomass concentrations were 6-12 g / L dcw.
옥수수를 하기 레시피로 액화시켜 옥수수 매시 센트레이트를 제조하였다:Corn was liquefied with the following recipe to prepare corn mash centrate:
1150 g 수돗물1150 g tap water
340.5 g 1 ㎜ 스크리닝된 분쇄 옥수수340.5 g 1 mm screened ground maize
13.5 g 효모 추출물 (Difco No. 9102333, 낮은 더스팅 (dusting))13.5 g yeast extract (Difco No. 9102333, low dusting)
27 g 펩톤27 g peptone
4.1 g 우레아4.1 g urea
40.5 ㎎ 니코틴산40.5 mg nicotinic acid
40.5 ㎎ 티아민.40.5 mg thiamine.
그 다음에 물질을 소르발 (Sorval) RC5C 원심분리기에서 30분간 원심분리하였다. 상청액을 고형물 펠릿으로부터 분리하였다. 상청액을 스테리스 오토클레이브에서 5분간의 액체 사이클 동안에 가열하였으며, 이를 센트레이트로서 정의한다.The material was then centrifuged for 30 minutes in a Sorval RC5C centrifuge. Supernatants were separated from solid pellets. The supernatant was heated in a steric autoclave for 5 minutes of liquid cycle, which is defined as the centrate.
2 L 발효 제조2 L Fermentation Manufacture
2 L 초기 발효 용기 제조2 L initial fermentation vessel manufacturing
2 L 초기 발효 용기 제조를 상술한 바와 같이 제조하였다. 발효 용기 온도를 열전대 및 가정용수 순환 루프로 55℃로 제어하였다. 습윤 옥수수알 (#2 황색 마치종 옥수수)을 1.0 ㎜ 스크린을 구비한 해머 밀을 사용하여 분쇄하고, 얻어진 통옥수수 가루를 액화 반응물의 25 내지 30% (건조 옥수수 고형물 중량)가 되는 주입량으로 발효 용기에 첨가하였다. 또한, 액화를 상술한 바와 같이 계속하였다. 발효 용기를 스파저를 통해 0.3 slpm으로 첨가된 무균 하우스 N2와 함께 300 내지 1200 rpm으로 혼합하는 동안에, 알파-아밀라제를 이의 사양서에 따라 발효 용기에 첨가하였다.A 2 L initial fermentation vessel preparation was prepared as described above. The fermentation vessel temperature was controlled to 55 ° C. with thermocouple and domestic water circulation loops. Wet corn kernels (# 2 yellow maize maize) are ground using a hammer mill with a 1.0 mm screen and the resulting corncob meal is fermented in an amount of 25-30% (dry corn solids weight) of the liquefaction reactant. Was added. In addition, liquefaction was continued as mentioned above. Alpha-amylase was added to the fermentation vessel according to its specification while the fermentation vessel was mixed at 300 to 1200 rpm with sterile house N 2 added at 0.3 slpm through a sparger.
2 L 접종 전 첨가Add before 2 L inoculation
하기 영양소를 접종 후 부피 기준으로, 액화 후에 접종 전에 발효 용기에 첨가하였다:The following nutrients were added to the fermentation vessel after inoculation and on the basis of volume after inoculation:
30 ㎎/L 니코틴산30 mg / L nicotinic acid
30 ㎎/L 티아민30 mg / L Thiamine
1 mL/L 1:1:트윈 80:에탄올 중의 1% 에르고스테롤 w/v 용액1% ergosterol w / v solution in 1 mL / L 1: 1: Twin 80: ethanol
6.3 mL/L 에탄올6.3 mL / L ethanol
2 g/L 우레아.2 g / L urea.
2 L 발효 용기 접종2 L fermentation vessel inoculation
N2를 발효 용기에 첨가하면서, 발효 용기 pO2 프로브를 영점으로 보정하였다. 300 rpm으로 무균 공기 스파징하면서, 발효 용기 pO2 프로브를 이의 스팬으로 보정하였다. 발효 용기를 프리시드 플라스크 성장 단계의 최종 단계에서 접종시켰다. 진탕 플라스크를 인큐베이터/진탕기로부터 제거하여, 30분간 원심분리하였다. 액체 (올레일 알코올 및 수성 상청액)를 폐기하고, 세포 펠릿을 프리시드 플라스크 성장 배지 (합성 배지)에서 재현탁시켰다. 수성상 100 mL를 멸균 접종 용기에 옮겼다. 접종물을 연동 펌프를 통해 발효 용기에 주입하였다.The fermentation vessel pO 2 probe was calibrated to zero with N 2 added to the fermentation vessel. While sterile air sparging at 300 rpm, the fermentation vessel pO 2 probe was calibrated to its span. Fermentation vessels were inoculated at the end of the preseed flask growth stage. The shake flask was removed from the incubator / shaker and centrifuged for 30 minutes. The liquid (oleyl alcohol and aqueous supernatant) was discarded and the cell pellet was resuspended in preseed flask growth medium (synthetic medium). 100 mL of the aqueous phase was transferred to a sterile inoculation vessel. The inoculum was injected into the fermentation vessel through a peristaltic pump.
2 L 접종 후 리파제 첨가Lipase addition after 2 L inoculation
리폴라제? 용액 (100 L 원액)을 1.2 내지 1.4 ㎎/mL의 효소 농도로 제조하였다. 용액을 발효 용기를 접종시킨 후에 비용매 부피를 기준으로 원하는 ppm 농도로 발효물에 첨가하였다. 첨가 시간이 발효 용기를 접종시킨 후에 < 1시간에 이루어졌다.Repolarase? A solution (100 L stock) was prepared at an enzyme concentration of 1.2 to 1.4 mg / mL. The solution was inoculated into the fermentation vessel and then added to the fermentation at the desired ppm concentration based on the nonsolvent volume. The addition time was <1 hour after inoculation of the fermentation vessel.
2 L 대두유 지방산 첨가Add 2 L soybean oil fatty acid
발효 용기에, 버진 코그니스 에머리? 610 대두 지방산 또는 0 내지 30 중량% 지방산 부틸 에스테르를 함유하는 재생된 코그니스 에머리? 610 대두 지방산 0.1 내지 0.5 L/L (접종 후 부피)를 첨가하였다.In a fermentation vessel, Virgin Cognis Emery? 610 recycled cognis emery containing soy fatty acids or 0-30% by weight fatty acid butyl ester? 0.1-0.5 L / L (volume after inoculation) of 610 soy fatty acids were added.
2 L 발효 용기 조작 조건2L fermentation vessel operating conditions
발효 용기를 전체 성장 및 생산 단계 동안에 30℃에서 조작하였다. pH를 어떠한 산도 첨가하지 않고도 5.7 내지 5.9의 pH를 5.25의 제어 설정값으로 떨어지게 할 수 있었다. pH를 남은 성장 및 생산 단계 동안에 수산화암모늄으로 pH=5.2로 제어하였다. 남은 성장 및 생산 단계 동안에 무균 공기를 스파저를 통해 0.2 내지 0.3 slpm으로 발효 용기에 첨가하였다. pO2를 제어하지 않았다. 교반기를 300 rpm으로 고정된 rpm으로 설정하였다. 교반 축은 수성 레벨 아래의 2개의 러쉬톤 (Rushton) 임펠러 및 수성 레벨 위의 1개의 피칭된 블레이드 임펠러를 갖고 있다. 글루코아밀라제를 첨가하여, 글루코스를 액화 옥수수 매시의 동시 당화 발효를 통해 공급하였다. 전분을 당화에 이용할 수 있는 한, 글루코스 초과 (1 내지 50 g/L)로 유지하였다.Fermentation vessels were operated at 30 ° C. during the entire growth and production phase. It was possible to bring the pH of 5.7 to 5.9 down to a control setpoint of 5.25 without adding pH to any acid. The pH was controlled to pH = 5.2 with ammonium hydroxide during the remaining growth and production stages. Sterile air was added to the fermentation vessel through a sparger at 0.2-0.3 slpm during the remaining growth and production stages. pO 2 was not controlled. The stirrer was set to fixed rpm at 300 rpm. The stirring shaft has two Rushton impellers below the aqueous level and one pitched blade impeller above the aqueous level. Glucoamylase was added to feed glucose via co-glycosylation fermentation of liquefied corn mash. Starch was kept above glucose (1-50 g / L) as long as available for saccharification.
상술한 절차를 이용하여 세포량 측정을 위해, 5 내지 20 mL 샘플을 발효 용기로부터 취해, 원심분리관에 주입하여 원심분리하였다. 또한, 가스 분석과 같은 분석 방법, 및 수성상의 발효 산물의 LC 분석 및 용매상의 발효 산물의 GC 분석을 상술한 바와 같이 행하였다.For cell volume measurement using the procedure described above, 5-20 mL samples were taken from the fermentation vessel, injected into a centrifuge tube and centrifuged. In addition, analytical methods such as gas analysis and LC analysis of the fermentation product in the aqueous phase and GC analysis of the fermentation product in the solvent phase were performed as described above.
실시예 17 내지 22에 대한 발효 조건은 하기에 제공되며, 결과 요약 (버진 대두유 지방산 및 지방산 부틸 에스테르를 갖는 재생된 대두 지방산)은 표 6에 나타나있다.Fermentation conditions for Examples 17-22 are provided below and a summary of the results (regenerated soybean fatty acids with virgin soybean oil fatty acids and fatty acid butyl esters) are shown in Table 6.
실시예Example 17 17
실험 식별자 글노 (GLNOR)1050은 다음을 포함하였다: 10 L 프리시드 플라스크 성장, 10 L 증식 탱크 액화, 10 L 증식 탱크 조작, 10 L 생산 탱크 액화, 발효 용기에 첨가된 10 ppm 리폴라제? 100L (제넨코)을 이용한 10 L 생산 탱크 조작, 추출제: 버진 코그니스 에머리? 610 대두 지방산 (버진 대두유 지방산). 액체 용매 및 비용매 물질을 소르발 RC-12 원심분리기, 및 모든 분석 방법으로 분리하였다.Experimental identifier GLNOR1050 included: 10 L preseed flask growth, 10 L propagation tank liquefaction, 10 L propagation tank operation, 10 L production tank liquefaction, 10 ppm repolarase added to the fermentation vessel? 10L production tank operation with 100L (Genenco), extractant: Virgin Cognis Emery? 610 Soy Fatty Acids (Virgin Soybean Oil Fatty Acids). Liquid solvent and nonsolvent material were separated by Sorbal RC-12 centrifuge, and all analytical methods.
실시예 18Example 18
실험 식별자 글노1051은 다음을 포함하였다: 10 L 프리시드 플라스크 성장, 10 L 증식 탱크 액화, 10 L 증식 탱크 조작, 10 L 생산 탱크 액화, 발효 용기에 첨가된 4 ppm 리폴라제? 100L (제넨코)을 이용한 10 L 생산 탱크 조작, 추출제: 버진 코그니스 에머리? 610 대두 지방산 (버진 대두유 지방산). 액체 용매 및 비용매 물질을 소르발 RC-12 원심분리기, 및 모든 분석 방법으로 분리하였다.Experiment Identifier Glono 1051 included: 10 L presided flask growth, 10 L growth tank liquefaction, 10 L growth tank operation, 10 L production tank liquefaction, 4 ppm repolarase added to the fermentation vessel? 10L production tank operation with 100L (Genenco), extractant: Virgin Cognis Emery? 610 Soy Fatty Acids (Virgin Soybean Oil Fatty Acids). Liquid solvent and nonsolvent material were separated by Sorbal RC-12 centrifuge, and all analytical methods.
실시예 19Example 19
식별자 2011Y029는 다음을 포함하였다: 2 L 프리시드 플라스크 성장, 2 L 발효 제조, 2 L 액화, 2 L 접종 전 첨가, 2 L 발효 용기 접종, 10 ppm의 최종 농도로 2 L 접종 후 리파제 첨가, 2 L 재생된 대두유 지방산 첨가 (실시예 56A의 재생된 코그니스 에머리? 610 대두 지방산 및 지방산 부틸 에스테르 - 50% v/v 용매 로드), 2 L 발효 용기 조작 조건, 및 모든 분석 방법.Identifier 2011Y029 included: 2 L presided flask growth, 2 L fermentation preparation, 2 L liquefaction, addition before 2 L inoculation, 2 L fermentation vessel inoculation, lipase addition after 2 L inoculation to a final concentration of 10 ppm, 2 L Regenerated Soybean Oil Fatty Acid Addition (Regenerated Cognis Emery of Example 56A—610 Soybean Fatty Acid and Fatty Acid Butyl Ester—50% v / v Solvent Load), 2 L Fermentation Vessel Operating Conditions, and All Analytical Methods.
실시예 20Example 20
식별자 2011Y030은 다음을 포함하였다: 2 L 프리시드 플라스크 성장, 2 L 발효 제조, 2 L 액화, 2 L 접종 전 첨가, 2 L 발효 용기 접종, 10 ppm의 최종 농도로 2 L 접종 후 리파제 첨가, 20 내지 30% 지방산 부틸 에스테르를 포함한 0.4 L/L (접종 후 부피) 버진 코그니스 에머리? 610 대두 지방산 첨가, 2 L 발효 용기 조작 조건, 및 모든 분석 방법.Identifier 2011Y030 included: 2 L presided flask growth, 2 L fermentation preparation, 2 L liquefaction, addition before 2 L inoculation, 2 L fermentation vessel inoculation, lipase addition after 2 L inoculation to a final concentration of 10 ppm, 20 0.4 L / L (volume after inoculation) virgin cognis emery with 30% fatty acid butyl ester? 610 soybean fatty acid addition, 2 L fermentation vessel operating conditions, and all analytical methods.
실시예 21Example 21
식별자 2011Y031은 다음을 포함하였다: 2 L 프리시드 플라스크 성장, 2 L 발효 제조, 2 L 액화, 2 L 접종 전 첨가, 2 L 발효 용기 접종, 10 ppm의 최종 농도로 2 L 접종 후 리파제 첨가, 2 L 재생된 대두유 지방산 첨가 (실시예 56B의 재생된 코그니스 에머리? 610 대두 지방산 및 지방산 부틸 에스테르 - 10% v/v 용매 로드), 2 L 발효 용기 조작 조건, 및 모든 분석 방법.Identifier 2011Y031 included: 2 L presided flask growth, 2 L fermentation preparation, 2 L liquefaction, addition before 2 L inoculation, 2 L fermentation vessel inoculation, lipase addition after 2 L inoculation to a final concentration of 10 ppm, 2 L Regenerated Soybean Oil Fatty Acid Addition (Regenerated Cognis Emery of Example 56B—610 Soybean Fatty Acid and Fatty Acid Butyl Ester-10% v / v Solvent Load), 2 L Fermentation Vessel Operating Conditions, and All Analytical Methods.
실시예Example 22 22
식별자 2011Y032는 다음을 포함하였다: 2 L 프리시드 플라스크 성장, 2 L 발효 제조, 2 L 액화, 2 L 접종 전 첨가, 2 L 발효 용기 접종, 10 ppm의 최종 농도로 2 L 접종 후 리파제 첨가, 0.4 L/L (접종 후 부피) 버진 코그니스 에머리? 610 대두 지방산 첨가, 2 L 발효 용기 조작 조건, 및 모든 분석 방법.Identifier 2011Y032 included: 2 L presided flask growth, 2 L fermentation preparation, 2 L liquefaction, addition before 2 L inoculation, 2 L fermentation vessel inoculation, lipase addition after 2 L inoculation to a final concentration of 10 ppm, 0.4 L / L (volume after inoculation) Virgin Cognis Emery? 610 soybean fatty acid addition, 2 L fermentation vessel operating conditions, and all analytical methods.
[표 6]TABLE 6
실시예 23Example 23
하기 실시예는 발효성 탄소원으로서 수크로스를 사용한 발효에 의한 아이소부탄올의 생성을 설명한다.The following examples illustrate the production of isobutanol by fermentation using sucrose as fermentable carbon source.
바이오매스의 생성Generation of biomass
접종물: 아이소부타놀로젠의 성장을 개시하기 위해 시드 배지를 제조하였다. 시드 배지의 조성은 다음과 같았다: 황산암모늄, 5 g/L; 인산이수소칼륨, 3 g/L; 황산마그네슘 칠수화물, 0.5 g/L; 에탄올, 3.2 g/L; 효모 추출물 (BBL), 5 g/L; 글루코스, 10 g/L; MES 완충액, 150 mmol/L; 비오틴, 50 ㎍/L; 및 1 L 물 중에, 15 g EDTA, 4.5 g 황산아연 칠수화물, 0.8 g 염화망간 이수화물, 0.3 g 염화코발트 육수화물, 0.3 g 황산구리 오수화물, 0.4 g 이나트륨 몰리브덴 이수화물, 4.5 g 염화칼슘 이수화물, 3 g 황산철 칠수화물, 1 g 붕산, 0.1 g 요오드화칼륨을 함유하는 미량원소 용액, 1 mL/L. pH를 5.5로 조절한 다음에, 배지 필터를 0.22 μ 멸균 필터 장치를 통해 멸균시켰다.Inoculum: Seed medium was prepared to initiate growth of isobutanogen. The composition of the seed medium was as follows: ammonium sulfate, 5 g / L; Potassium dihydrogen phosphate, 3 g / L; Magnesium sulfate heptahydrate, 0.5 g / L; Ethanol, 3.2 g / L; Yeast extract (BBL), 5 g / L; Glucose, 10 g / L; MES buffer, 150 mmol / L; Biotin, 50 μg / L; And 1 L water, 15 g EDTA, 4.5 g zinc sulfate heptahydrate, 0.8 g manganese chloride dihydrate, 0.3 g cobalt chloride hexahydrate, 0.3 g copper sulfate pentahydrate, 0.4 g disodium molybdenum dihydrate, 4.5 g calcium chloride dihydrate , Microelement solution containing 3 g iron sulfate heptahydrate, 1 g boric acid, 0.1 g potassium iodide, 1 mL / L. After adjusting the pH to 5.5, the medium filter was sterilized through a 0.22 μ sterile filter device.
바이오매스 생성용 10 L 발효 용기의 제조Preparation of 10 L Fermentation Vessel for Biomass Production
아이소부타놀로젠 PNY2205의 단일 바이알을 30℃ 및 260 rpm의 진탕으로 하룻밤 동안 성장시키기 위해 125 mL 벤트형 플라스크의 15 mL 시드 배지에 무균 이송하였다. 배양물을 30℃ 및 260 rpm의 진탕으로 하룻밤 동안 성장시키기 위해 2 L 배플형, 벤트형 플라스크의 동일한 배지 500 mL에 무균 이송하고, 배양물이 OD600 7에 도달할 때에 제조된 10 L 사르토리우스 C 발효 용기 (독일 괴팅겐에 소재하는 사르토리우스 아게)에 이송하였다.A single vial of isobutanologen PNY2205 was aseptically transferred to a 15 mL seed medium in a 125 mL vented flask for overnight growth at 30 ° C. and 260 rpm shaking. The culture was aseptically transferred to 500 mL of the same medium in a 2 L baffle, vented flask to grow overnight with shaking at 30 ° C. and 260 rpm and 10 L Sarto prepared when the culture reached OD 600 7. Transfer to Rius C fermentation vessel (Sartorius AG, Göttingen, Germany).
10 L 사르토리우스 C 발효 용기를 6 L 초기 부피의 성장 배지로 제조하였다. 성장 배지 조성 및 제조는 다음과 같았다: 멸균 전에, 황산암모늄, 1 g/L; 인산이수소칼륨, 5 g/L; 황산마그네슘 칠수화물, 2 g/L; 효모 추출물 (암베렉스 (Amberex)™ 695), 2 g/L; 소포제 시그마 (Sigma) 204, 0.5 mL/L; 비오틴, 100 ㎍/L; 및 1 mL/L 미량원소 용액 (1 L 물로 제조됨: 15 g EDTA, 4.5 g 황산아연 칠수화물, 0.8 g 염화망간 이수화물, 0.3 g 염화코발트 육수화물, 0.3 g 황산구리 오수화물, 0.4 g 이나트륨 몰리브덴 이수화물, 4.5 g 염화칼슘 이수화물, 3 g 황산철 칠수화물, 1 g 붕산, 0.1 g 요오드화칼륨). 적당한 위치에서의 121℃의 스팀 멸균 후에, 용기를 냉각시키고, 60 g의 공급 배지를 첨가하였다. 공급 배지를 다음과 같이 제조하였다: 수크로스, 50% 용액, 2.97 L; 비오틴, 1.4 ㎎; 미량의 무기질 용액 34 mL; 5N 수산화나트륨으로 pH 7.5로 적정 및 스팀 멸균; 멸균 및 냉각 후, 130 mL 에탄올 및 효모 추출물 (암베렉스™ 695)의 20% (w/v) 필터 멸균 용액 320 mL를 첨가하였다. 그리하여, 10 L 발효 용기의 초기 당 농도는 3.7 g/L 수크로스, 0.8 g/L 글루코스, 및 0.8 g/L 프룩토스이었다.A 10 L Sartorius C fermentation vessel was prepared with 6 L initial volume of growth medium. Growth medium composition and preparation were as follows: prior to sterilization, ammonium sulfate, 1 g / L; Potassium dihydrogen phosphate, 5 g / L; Magnesium sulfate heptahydrate, 2 g / L; Yeast extract (Amberex ™ 695), 2 g / L; Antifoam Sigma 204, 0.5 mL / L; Biotin, 100 μg / L; And 1 mL / L trace element solution (prepared in 1 L water: 15 g EDTA, 4.5 g zinc sulfate heptahydrate, 0.8 g manganese chloride dihydrate, 0.3 g cobalt chloride hexahydrate, 0.3 g copper sulfate pentahydrate, 0.4 g disodium) Molybdenum dihydrate, 4.5 g calcium chloride dihydrate, 3 g iron sulfate heptahydrate, 1 g boric acid, 0.1 g potassium iodide). After steam sterilization at 121 ° C. at the appropriate location, the vessel was cooled and 60 g of feed medium was added. Feed medium was prepared as follows: sucrose, 50% solution, 2.97 L; Biotin, 1.4 mg; 34 mL of trace mineral solution; Titrated and steam sterilized to pH 7.5 with 5N sodium hydroxide; After sterilization and cooling, 320 mL of a 20% (w / v) filter sterile solution of 130 mL ethanol and yeast extract (Ambrex ™ 695) was added. Thus, the initial sugar concentrations of the 10 L fermentation vessel were 3.7 g / L sucrose, 0.8 g / L glucose, and 0.8 g / L fructose.
발효를 pH 5.5 (수산화암모늄 첨가로), 30℃, 분당 2.0 표준물질 리터의 기류, 교반 제어에 의한 30%의 용존 산소, 및 0.5 barg 배압으로 제어하였다. 접종 후에, 글루코스의 잔류 측정값이 0.1 g/L 미만이 될 때까지 당을 소모한 다음에, 공급 프로그램이 개시되었다; 이것은 11시간 경과된 발효 시간에 일어났다. 20 (약 8 g/L 건조 세포 중량)의 OD600이 달성될 때까지, 0.1/hr의 프로그램된 성장 속도로 수크로스 한계를 유지하도록 프로그램을 설정하였다. 본 실험에서 실제로 측정된 성장 속도는 0.18/hr이었다. 목표로 하는 OD600은 20시간의 발효 시간 후에 도달되었다.Fermentation was controlled at pH 5.5 (with ammonium hydroxide addition), 30 ° C., air flow at 2.0 standard liters per minute, 30% dissolved oxygen by stirring control, and 0.5 barg back pressure. After inoculation, the sugar was consumed until the residual measurement of glucose was less than 0.1 g / L, then the feeding program was started; This occurred at the fermentation time that elapsed 11 hours. The program was set to maintain the sucrose limit at a programmed growth rate of 0.1 / hr until an OD 600 of 20 (about 8 g / L dry cell weight) was achieved. The growth rate actually measured in this experiment was 0.18 / hr. The target OD 600 was reached after 20 hours of fermentation time.
일단 목표가 달성되면, 배양물을 무균 수확하여, 소르발 RC12BP 원심분리기에서 원심분리하였다. 생성된 펠릿을 후술하는 바와 같이, 아이소부탄올 생성 배지를 사용하여 300 mL의 최종 부피로 재현탁시켰다. 이러한 배양물을 아이소부탄올 생성 발효 용기용 접종물로서 사용하였다.Once the goal was achieved, the culture was harvested aseptically and centrifuged in a Sorbal RC12BP centrifuge. The resulting pellet was resuspended to a final volume of 300 mL using isobutanol production medium, as described below. This culture was used as inoculum for isobutanol producing fermentation vessels.
아이소부탄올 생성Isobutanol production
생성 발효 용기의 제조: 아이소부탄올 생성을 위해 사르토리우스 바이오스태트 B 플러스 트윈 컨트롤 유닛 (독일 괴팅겐에 소재하는 사르토리우스 아게)과 결합된 2개의 1리터 글래스 애플리콘 (네덜란드에 소재하는 애플리콘 인코포레이티드 (Applikon, Inc.)) 발효 용기를 사용하였다. 발효 용기를 1 L 탈이온수로 제조하여, 121℃에서 30분간 오토클레이빙하여 멸균시켰다. 일단 발효 용기가 냉각되면, 물을 무균 제거하여, 표 7에 나타낸 바와 같이, 필터 멸균된 생성 배지량을 첨가하였다. 이러한 생성 배지 조성은 다음과 같았다: 아미노산 비함유 효모 질소 베이스 (Difco), 6.7 g/L; 히스티딘, 류신, 트립토판, 및 우라실 (시그마)을 함유하지 않는 효모 합성 드롭 아웃 배지 보충물, 2.70 g/L; 트립토판, 1.6 ㎎/L; 류신, 8 ㎎/L; 에탄올, 2.8 g/L; 소포제 시그마 204, 0.2 mL/L; 수크로스, 25 g/L. 접종 직전에, 필터 멸균된 리파제 용액은 표 7에 나타낸 바와 같았다. 리폴라제? L100 (시그마)을 10 mM 인산칼륨 완충액, pH 7에 1.25 ㎎ 단백질/mL의 최종 농도로 희석하여 리파제 용액을 제조하였다. 발효 용기에 첨가하기 전에, 용액을 제조하여 5℃로 1일간 보관하였다.Preparation of Production Fermentation Vessel: Two 1 liter glass apples (Applicorn Inn, Netherlands) combined with Sartorius Biostat B Plus Twin Control Unit (Sartorius AG, Göttingen, Germany) for isobutanol production Corp. (Applikon, Inc.) fermentation vessel was used. Fermentation vessels were prepared with 1 L deionized water and sterilized by autoclaving at 121 ° C. for 30 minutes. Once the fermentation vessel was cooled down, the water was aseptically removed and the amount of filter sterilized product medium added, as shown in Table 7. This production medium composition was as follows: Amino acid free yeast nitrogen base (Difco), 6.7 g / L; Yeast synthetic drop out medium supplement, 2.70 g / L, containing no histidine, leucine, tryptophan, and uracil (Sigma); Tryptophan, 1.6 mg / L; Leucine, 8 mg / L; Ethanol, 2.8 g / L; Antifoam sigma 204, 0.2 mL / L; Sucrose, 25 g / L. Immediately before inoculation, the filter sterilized lipase solution was as shown in Table 7. Repolarase? Lipase solution was prepared by diluting L100 (Sigma) to a final concentration of 1.25 mg protein / mL in 10 mM potassium phosphate buffer, pH 7. Prior to addition to the fermentation vessel, the solution was prepared and stored at 5 ° C. for 1 day.
[표 7][Table 7]
발효 용기를 pH 5.2 (20% 수산화칼륨 첨가로), 30℃, 분당 0.2 표준물질 리터의 기류, 및 교반 제어에 의한 3%의 용존 산소로 제어하였다.The fermentation vessel was controlled with pH 5.2 (with 20% potassium hydroxide addition), 30 ° C., air flow of 0.2 standard liters per minute, and 3% dissolved oxygen by stirring control.
발효 용기를 각각, 초기 OD600 20 내지 25 (약 8 내지 10 g/L 건조 세포 중량)의 농축 바이오매스 40 mL로 접종시켰다. 표 7에 나타낸 필터 멸균된 대두유 지방산 (SOFA)의 부피대로, 필터 멸균된 비타민 용액 (티아민-HCl, 1 ㎎/mL; 수중의 니코틴산, 1 ㎎/mL)의 4 mL 첨가물을 접종 시에 첨가하였다. 샘플 (5 내지 10 mL)을 2 내지 3시간마다 꺼내어, YSI 셀렉트 바이오케미스트리 애널라이저 (Select Biochemistry Analyzer (미국 오하이오주 옐로 스프링스에 소재하는 와이에스아이, 인코포레이티드 (YSI, Inc.)))에 의해 글루코스 및 수크로스를 분석하였다. 수크로스가 소모됨에 따라, 50% 수크로스 (w/w)의 공급물을 첨가하여 5 내지 30 g/L의 농도를 유지하였다. 샘플의 수성상 및 유기상을 분리하여, 애질런트 1100 HPLC를 통해 상술한 HPLC 방법으로 분석하였다. 유기산 및 알코올의 분석을 위해, 쇼덱스 (Shodex)? 슈거 (Sugar) SH1011 칼럼을 0.01 N 황산 이동상과 함께 사용하였다. 수크로스, 글루코스, 및 프룩토스의 분석을 위해, 0.01 M Na2HPO4 (pH 8) 이동상을 갖는 바이오라드 아미넥스 (BioRad Aminex)? HPX-87N 칼럼을 사용하였다.Fermentation vessels were each inoculated with 40 mL of concentrated biomass at an initial OD 600 of 20-25 (about 8-10 g / L dry cell weight). In the volume of filter sterilized soybean oil fatty acid (SOFA) shown in Table 7, a 4 mL addition of filter sterilized vitamin solution (thiamine-HCl, 1 mg / mL; nicotinic acid in water, 1 mg / mL) was added at the time of inoculation. . Samples (5-10 mL) were taken out every 2 to 3 hours and placed in a YSI Select Biochemistry Analyzer (YSI, Inc., Yellow Springs, Ohio). Glucose and sucrose were analyzed by As sucrose was consumed, a feed of 50% sucrose (w / w) was added to maintain a concentration of 5 to 30 g / L. The aqueous and organic phases of the samples were separated and analyzed by the HPLC method described above via Agilent 1100 HPLC. For the analysis of organic acids and alcohols, Shodex? A Sugar SH1011 column was used with a 0.01 N sulfuric acid mobile phase. For analysis of sucrose, glucose, and fructose, BioRad Aminex with 0.01 M Na 2 HPO 4 (pH 8) mobile phase? HPX-87N column was used.
리파제가 첨가된 각각의 발효 용기는 저농도의 수성상 중의 아이소부탄올 및 용매상 중의 유리 아이소부탄올을 갖고 있었다. 아이소부탄올의 수성상 및 용매상 농도는 도 6에 나타나있다. 동일한 용매 로딩에서 더 많은 리파제를 첨가하였더니, 또한 더 낮은 아이소부탄올의 수성상 역가 및 더 낮은 용매 중의 유리 아이소부탄올, 및 더 많은 FABE로서의 아이소부탄올을 유도하였다.Each fermentation vessel to which lipase was added had isobutanol in the low concentration aqueous phase and free isobutanol in the solvent phase. The aqueous and solvent phase concentrations of isobutanol are shown in FIG. 6. Adding more lipase at the same solvent loading also led to lower aqueous phase titers of isobutanol and free isobutanol in lower solvents, and more isobutanol as FABE.
리파제를 포함한 배양물은 리파제를 함유하지 않은 제어 발효 용기보다 더 높은 아이소부탄올의 유효 역가를 유도하였다. 도 7은 아이소부탄올의 유효 역가를 나타낸다. 본 실시예에서, 접종 후에 발효 용기 중의 브로스의 초기 측정 중량 및 발효 용기에 주입된 용매의 초기 측정 중량을 기준으로 유효 역가를 계산하였다. 발효를 통해 용매 밀도를 0.88 g/mL, 수성 브로스 밀도를 1.00 g/mL인 것으로 가정하였다. 더 낮은 용매 로딩에서 더 많은 리파제를 첨가하면, 더 높은 아이소부탄올의 유효 역가를 유도하였으나 (D 대 C), 용매의 상대 부피 증가 정도는 아니었다 (C 대 B).Cultures containing lipase led to higher effective titers of isobutanol than control fermentation vessels containing no lipase. 7 shows the effective titers of isobutanol. In this example, effective titers were calculated based on the initial measured weight of the broth in the fermentation vessel and the initial measured weight of the solvent injected into the fermentation vessel after inoculation. Fermentation assumed a solvent density of 0.88 g / mL and an aqueous broth density of 1.00 g / mL. Addition of more lipase at lower solvent loading led to higher effective titers of isobutanol (D vs C), but not to the relative volume increase of solvent (C vs B).
글루코스 당량으로 계산된 소모된 당은 도 8에 나타낸 바와 같이, 리파제가 첨가된 발효 용기에서 더 높았다. 소모된 글루코스 당량은 발효 용기에 공급되어 남아있는 측정된 당으로부터 2몰의 글루코스로 카운트된 수크로스의 각 몰 및 1몰의 글루코스로 카운트된 프룩토스의 각 몰과 함께 계산된 다음에, 글루코스의 분자량에 의해 그램으로 환산된다. 소모된 글루코스 당량 농도는 또한 접종 후의 발효 브로스의 초기 부피를 기준으로 계산된다.The spent sugar, calculated as glucose equivalent, was higher in the fermentation vessel to which lipase was added, as shown in FIG. 8. The glucose equivalent consumed is calculated with each mole of sucrose counted to 2 moles of glucose and each mole of fructose counted to 1 mole of glucose from the remaining measured sugar supplied to the fermentation vessel, and then Converted to grams by molecular weight. The spent glucose equivalent concentration is also calculated based on the initial volume of fermentation broth after inoculation.
실시예 24Example 24
올레일Orail 알코올을 사용한 원위치에서의 생성물 제거를 이용한 동시 Simultaneous with in situ product removal with alcohol 당화Glycation 발효를 위한 액화 옥수수 Liquefied Corn for Fermentation 매시의Hourly 리파제Lipase 처리 process
실시예 1, 2, 및 3에서 상술한 바와 같이 실행된 발효로부터 취한 브로스 및 올레일 알코올의 샘플에 대하여, 문헌 [E. G. Bligh and W. J. Dyer (Canadian Journal of Biochemistry and Physiology, 37:911-17, 1959, 이하 참고 문헌 1이라 함)]에 의해 기재된 방법에 따라 wt% 지질 (지방산 메틸 에스테르, FAME로서 유도체화됨) 및 wt% 유리 지방산 (FFA, 지방산 메틸 에스테르, FAME로서 유도체화됨)을 분석하였다. 또한 각각의 세 가지 발효를 위해 제조된 액화 옥수수 매시에 대하여, 리폴라제? 100 L (노보자임즈) (30 wt% 분쇄 옥수수알을 함유하는 액화 반응물 ㎏ 당 10 ppm의 리폴라제? 총 가용성 단백질 (BCA 단백질 분석, 시그마 알드리치))로 처리한 후에 wt% 지질 및 wt% FFA를 분석하였다. 실시예 1 (대조군)의 액화 옥수수 매시에는 리파제가 첨가되지 않았으며, 리파제 (리파제가 열불활성화되지 않음)로 처리된 액화 옥수수 매시를 함유하는 실시예 2 및 3에 기재된 발효는 에탄올이 첨가되지 않은 것을 제외하고는 실시예 3에 기재된 발효와 동일하였다.For samples of broth and oleyl alcohols taken from the fermentation carried out as described above in Examples 1, 2 and 3, E. Wt% lipid (fatty acid methyl ester, derivatized as FAME) according to the method described by G. Bligh and WJ Dyer (Canadian Journal of Biochemistry and Physiology, 37: 911-17, 1959, hereinafter referred to as Ref. 1), and wt% free fatty acids (FFA, fatty acid methyl ester, derivatized as FAME) were analyzed. Also, for liquefied corn mash prepared for each of the three fermentations, repolarase? Wt% lipid and wt% after treatment with 100 L (Novozymes) (10 ppm of lipolase-total soluble protein (BCA protein assay, Sigma Aldrich) per kg liquefied reaction containing 30 wt% ground corn kernels) FFA was analyzed. The fermentation described in Examples 2 and 3 containing no lipase added to the liquefied corn mash of Example 1 (control), and containing the liquefied corn mash treated with lipase (lipase not thermally inactivated) did not add ethanol. Except that except for the fermentation described in Example 3.
실시예 2 및 3에 기재된 바와 같이 실행된 발효를 위해 제조된 리파제 처리된 액화 옥수수 매시 중의 % FFA는 리파제 미처리 (실시예 1)의 31 %와 비교하여, 각각 88% 및 89%이었다. 70시간 (실행 종료 (EOR))에서, 실시예 2 및 3 (활성 리파제 함유)에 기재된 바와 같이 실행된 발효의 OA 상 중의 FFA의 농도는 각각, 14% 및 20%이었고, 상응하는 지질 증가 (옥수수유 지방산 메틸 에스테르 유도체로서 측정됨)는 OA에 의한 COFA의 리파제 촉매 에스테르화로 인한 것으로 GC/MS로 측정되었으며 - COFA는 처음에 액화 옥수수 매시 중의 옥수수유의 리파제 촉매 가수분해에 의해 생성되었음 - ; 올레일 팔미테이트, 올레일 스테아레이트, 및 올레일 올레에이트의 생성은 GC/MS로 확인되었고, 제 4 에스테르는 올레일 리놀레에이트로서 잠정적으로 동정되었다. FFA 및 지질 분석에 대한 결과는 표 8에 나타나있다.The% FFA in the lipase treated liquefied corn mash prepared for the fermentation run as described in Examples 2 and 3 was 88% and 89%, respectively, compared to 31% of lipase untreated (Example 1). At 70 hours (end of run (EOR)), the concentrations of FFA in the OA phase of the fermentation run as described in Examples 2 and 3 (containing active lipase) were 14% and 20%, respectively, and the corresponding lipid increase ( Corn oil fatty acid methyl ester derivative) as measured by GC / MS due to lipase catalytic esterification of COFA by OA, which was initially produced by lipase catalytic hydrolysis of corn oil in liquefied corn mash; The production of oleyl palmitate, oleyl stearate, and oleyl oleate was confirmed by GC / MS, and the fourth ester was tentatively identified as oleyl linoleate. Results for FFA and lipid analysis are shown in Table 8.
[표 8][Table 8]
실시예 25Example 25
옥수수유 유리 지방산의 올레일 알코올 에스테르의 생성을 제한하기 위한 리파제 처리된 액화 옥수수 매시 중의 리파제의 열불활성화Thermal inactivation of lipase in lipase treated liquefied corn mash to limit the production of oleyl alcohol esters of corn oil free fatty acids
수돗물 (918.4 g)을 재킷형 2-L 수지 케틀에 첨가한 다음에, 통옥수수 가루 (해머 밀의 1.0 ㎜ 스크린) 474.6 g 습윤 중량 (417.6 g 건조 중량)을 교반하면서 첨가하였다. 혼합물을 300 rpm으로 교반하면서 55℃로 가열하고, pH를 2 N 황산을 사용하여 5.8로 조절하였다. 혼합물에, 스페자임 (Spezyme)?-FRED L (미국 캘리포니아주 팰러앨토에 소재하는 제넨코?) 0.672 g을 함유하는 수용액 14.0 g을 첨가하고, 혼합물의 온도를 600 rpm 및 pH 5.8에서의 교반 하에 85℃로 증가시켰다. 85℃에서 120분 후에, 혼합물을 50℃로 냉각시켜, 생성된 액화 옥수수 매시의 45.0 mL 분취량을 50-mL 폴리프로필렌 원심분리관에 옮기고 -80℃로 냉동 보관하였다.Tap water (918.4 g) was added to the jacketed 2-L resin kettle, followed by 474.6 g wet weight (417.6 g dry weight) of whole corn flour (1.0 mm screen of hammer mill) with stirring. The mixture was heated to 55 ° C. with stirring at 300 rpm and the pH was adjusted to 5.8 with 2 N sulfuric acid. To the mixture was added 14.0 g of an aqueous solution containing 0.672 g of Spezyme®-FRED L (Genenco, Palo Alto, Calif.) And the temperature of the mixture was stirred under stirring at 600 rpm and pH 5.8. Increased to 85 ° C. After 120 minutes at 85 ° C., the mixture was cooled to 50 ° C. and a 45.0 mL aliquot of the resulting liquefied corn mash was transferred to a 50-mL polypropylene centrifuge tube and stored frozen at −80 ° C.
제 1 반응에서, 85℃에서 1시간 동안의 리파제의 불활성화 없이, 상술한 바와 같이 제조된 액화 옥수수 매시 50 g을 10 ppm 리폴라제? 100 L (노보자임즈)과 55℃에서 6시간 동안 혼합하여, 혼합물을 30℃로 냉각하였다. 제 2 반응에서, 액화 옥수수 매시 50 g을 10 ppm 리폴라제?와 55℃에서 6시간 동안 혼합한 다음에, 85℃로 1시간 가열한 (리파제 불활성화) 후에, 30℃로 냉각하였다. 제 3 반응에서, 리파제 첨가없이 액화 옥수수 매시 50 g을 55℃에서 6시간 동안 혼합하고, 85℃에서 1시간 동안 가열하지 않으며, 혼합물을 30℃로 냉각시켜, 올레일 알코올 38 g을 첨가하여, 생성된 혼합물을 30℃에서 73시간 동안 교반하였다. 제 4 반응에서, 리파제 첨가없이 액화 옥수수 매시 50 g을 55℃에서 6시간 동안 혼합한 다음에, 85℃로 1시간 동안 가열한 후에, 30℃로 냉각시켰다. 4개의 반응 혼합물 각각을 6시간째에 샘플링한 다음에, 올레일 알코올 38 g을 첨가하고, 생성된 혼합물을 30℃로 교반하여, 25 및 73시간째에 샘플링하였다. 참고 문헌 1에 기재된 방법에 따라, 샘플 (액화 매시 및 올레일 알코올 (OA))에 대하여 wt% 지질 (지방산 메틸 에스테르, FAME로서 유도체화됨) 및 wt% 유리 지방산 (FFA, 지방산 메틸 에스테르, FAME로서 유도체화됨)을 분석하였다.In the first reaction, 50 g of liquefied corn mash prepared as described above was prepared with 10 ppm lipolase? Without inactivation of lipase for 1 hour at 85 ° C. 100 L (Novozymes) was mixed at 55 ° C. for 6 hours, and the mixture was cooled to 30 ° C. In the second reaction, 50 g of liquefied corn mash was mixed with 10 ppm lipolase for 6 hours at 55 ° C, then heated to 85 ° C for 1 hour (lipase inactivation) and then cooled to 30 ° C. In the third reaction, 50 g of liquefied corn mash are mixed at 55 ° C. for 6 hours without lipase addition, heated at 85 ° C. for 1 hour, and the mixture is cooled to 30 ° C., adding 38 g of oleyl alcohol, The resulting mixture was stirred at 30 ° C. for 73 h. In the fourth reaction, 50 g of liquefied corn mash was mixed at 55 ° C. for 6 hours without lipase addition, then heated to 85 ° C. for 1 hour and then cooled to 30 ° C. Each of the four reaction mixtures was sampled at 6 hours, then 38 g of oleyl alcohol were added and the resulting mixture was stirred at 30 ° C. and sampled at 25 and 73 hours. According to the method described in Reference 1, as a wt% lipid (fatty acid methyl ester, derivatized as FAME) and wt% free fatty acid (FFA, fatty acid methyl ester, FAME) on a sample (liquefied mash and oleyl alcohol (OA)) Derivatized).
OA 첨가 전에 리파제의 열불활성화와 함께 실행된 제 2 반응의 OA 상 중의 % FFA는 리파제 처리된 액화 옥수수 매시의 리파제가 열불활성화되지 않은 경우 (제 1 반응)에 25 및 73시간째에 40% FFA 및 21% FFA에 불과한 것과 비교하여, 각각 25시간째에 99%, 73시간째에 95%이었다. 리파제가 첨가되지 않은 2개의 대조군 반응에서는 % FFA에서 현저한 변화가 관찰되지 않았다. 결과는 표 9에 나타나있다.The% FFA in the OA phase of the second reaction run with thermal inactivation of the lipase prior to OA addition was 40% FFA at 25 and 73 hours when the lipase of the lipase treated liquefied corn mash was not thermally inactivated (first reaction). And 99% at 25 hours and 95% at 73 hours, respectively, compared to only 21% FFA. No significant change in% FFA was observed in the two control reactions without lipase addition. The results are shown in Table 9.
[표 9]TABLE 9
실시예 26Example 26
올레일 알코올을 사용한 원위치에서의 생성물 제거를 이용한 동시 당화 발효를 위한 리파제 처리된 액화 옥수수 매시의 리파제의 열불활성화Thermal Inactivation of Lipase in Lipase Treated Liquefied Corn Mash for Simultaneous Saccharification Fermentation with In Situ Product Removal with Oleyl Alcohol
3개의 발효를 실시예 4, 5, 및 6에서 상술한 바와 같이 실행하였다. 발효 전에 실시예 4 및 6에서 액화 옥수수 매시에 리파제를 첨가하지 않았고, 실시예 5에 기재된 발효에서 액화 옥수수 매시의 리파제 처리 (7.2 ppm의 리폴라제? 총 가용성 단백질 사용) 직후에 열불활성화 처리되고 (리파제를 완전히 불활성화하기 위해), 이어서 접종 전 영양소 첨가 및 발효가 행해졌다. 실시예 4 및 6에 기재된 바와 같이 실행된 발효에 대하여 리파제 처리없이 제조된 액화 옥수수 매시 중의 % FFA는 리파제 처리 (실시예 5)의 89 %와 비교하여, 각각 31% 및 34%이었다. 표 10에 기재된 발효 동안에, OA 상 중의 FFA의 농도가 열불활성화 리파제를 함유하는 것을 포함하여 3개의 발효 중 어떠한 것에서도 감소되지 않았다. 실시예 5 (발효 전에 리파제의 열불활성화)에 따라 실행된 발효의 OA 상 중의 % FFA는 액화 옥수수 매시가 리파제로 처리되지 않은 나머지 2개의 발효 (실시예 4 및 6)에서 33% FFA에 불과한 것과 비교하여, 70시간 (실행 종료 (EOR))에서 95%이었다. 결과는 표 10에 나타나있다.Three fermentations were performed as described above in Examples 4, 5, and 6. No lipase was added to the liquefied corn mash in Examples 4 and 6 prior to fermentation, and heat-inactivated immediately after the lipase treatment (using 7.2 ppm of repolarase? Total soluble protein) of the liquefied corn mash in the fermentation described in Example 5. (To completely inactivate the lipase), followed by nutrient addition and fermentation before inoculation. The% FFA in liquefied corn mash prepared without lipase treatment for the fermentation performed as described in Examples 4 and 6 was 31% and 34%, respectively, compared to 89% of the lipase treatment (Example 5). During the fermentation described in Table 10, the concentration of FFA in the OA phase was not reduced in any of the three fermentations, including those containing thermally inactivated lipases. The% FFA in the OA phase of the fermentation performed according to Example 5 (heat inactivation of lipase before fermentation) was equivalent to 33% FFA in the remaining two fermentations (Examples 4 and 6) where the liquefied corn mash was not treated with lipase. By comparison, it was 95% at 70 hours (end of run (EOR)). The results are shown in Table 10.
[표 10][Table 10]
실시예 27Example 27
액화 전의 통옥수수 가루의 리파제 처리Lipase treatment of whole cornmeal before liquefaction
수돗물 (1377.6 g)을 2개의 재킷형 2-L 수지 케틀 각각에 첨가한 다음에, 통옥수수 가루 (해머 밀의 1.0 ㎜ 스크린) 711.9 g 습윤 중량 (625.8 g 건조 중량)을 교반하면서 각 케틀에 첨가하였다. 각 혼합물을 300 rpm으로 교반하면서 55℃로 가열하고, pH를 2 N 황산을 사용하여 5.8로 조절하였다. 각 혼합물에, 스페자임?-FRED L (미국 캘리포니아주 팰러앨토에 소재하는 제넨코?) 1.008 g을 함유하는 수용액 21.0 g을 첨가하였다. 그 다음에 하나의 혼합물에, 리폴라제? 100L 솔루션 (Solution) 수용액 10.5 mL (21 ㎎ 총 가용성 단백질, 10 ppm 리파제 최종 농도)를 첨가하고, 또 하나의 혼합물에 리폴라제? 100L 솔루션 수용액 1.05 mL (2.1 ㎎ 총 가용성 단백질, 1.0 ppm 리파제 최종 농도)를 첨가하였다. 샘플을 55℃에서 1 h, 2 h, 4 h 및 6 h에서 각 반응 혼합물로부터 회수한 다음에, 혼합물의 온도를 600 rpm 및 pH 5.8에서의 교반 하에 85℃로 증가시키고, 혼합물이 처음 85℃에 도달할 때에 샘플을 취하였다. 85℃에서 120분 후에, 샘플을 취하고, 혼합물을 50℃로 냉각하며, 생성된 액화 옥수수 매시의 최종 샘플을 50-mL 폴리프로필렌 원심분리관에 옮기고; 모든 샘플을 -80℃로 냉동 보관하였다.Tap water (1377.6 g) was added to each of the two jacketed 2-L resin kettles, then 711.9 g wet weight (625.8 g dry weight) of whole corn flour (1.0 mm screen of hammer mill) was added to each kettle with stirring. . Each mixture was heated to 55 ° C. with stirring at 300 rpm and the pH was adjusted to 5.8 with 2 N sulfuric acid. To each mixture was added 21.0 g of an aqueous solution containing 1.008 g of Spezimme-FRED L (Genenco, Palo Alto, Calif.). Then in one mixture, repolarase? Add 10.5 mL (21 mg total soluble protein, 10 ppm lipase final concentration) in an aqueous 100L solution, and add lipolase to another mixture? 1.05 mL (2.1 mg total soluble protein, 1.0 ppm lipase final concentration) of 100 L solution solution was added. Samples were recovered from each reaction mixture at 55 ° C. at 1 h, 2 h, 4 h and 6 h, then the temperature of the mixture was increased to 85 ° C. under stirring at 600 rpm and pH 5.8, and the mixture was first 85 ° C. Samples were taken when they reached. After 120 minutes at 85 ° C., samples are taken, the mixture is cooled to 50 ° C. and the final sample of the resulting liquefied corn mash is transferred to a 50-mL polypropylene centrifuge tube; All samples were stored frozen at -80 ° C.
2개의 분리 반응에서, 상술한 바와 같이 제조된 10 ppm 리파제 처리된 액화 옥수수 매시의 50 g 샘플 또는 1.0 ppm 리파제 처리된 액화 옥수수 매시의 55 g 샘플을 30℃에서 20 h 동안 올레일 알코올 (OA) (38 g)과 혼합한 다음에, 각 반응 혼합물 중의 액화 매시 및 OA를 원심분리로 분리하여, 참고 문헌 1에 기재된 방법에 따라 각 상에 대하여 wt% 지질 (지방산 메틸 에스테르, FAME로서 유도체화됨) 및 wt% 유리 지방산 (FFA, 지방산 메틸 에스테르, FAME로서 유도체화됨)을 분석하였다. 액화 시에 10 ppm 리파제의 열불활성화를 이용하여 제조한 액화 매시/OA 혼합물의 OA 상 중의 % FFA는 액화 시에 1.0 ppm 리파제의 열불활성화를 이용하여 제조한 액화 매시/OA 혼합물의 OA 상 중의 62% FFA에 불과한 것과 비교하여, 20 h에서 98%이었다. 결과는 표 11에 나타나있다.In two separation reactions, 50 g samples of 10 ppm lipase treated liquefied corn mash prepared as described above or 55 g samples of 1.0 ppm lipase treated liquefied corn mash were oleyl alcohol (OA) at 30 ° C. for 20 h. (38 g), followed by centrifugation of the liquefied mash and OA in each reaction mixture, wt% lipid (fatty acid methyl ester, derivatized as FAME) for each phase according to the method described in Reference 1 And wt% free fatty acid (FFA, fatty acid methyl ester, derivatized as FAME). The% FFA in the OA phase of the liquefied mash / OA mixture prepared by thermal inactivation of 10 ppm lipase at liquefaction was 62 in the OA phase of the liquefied mash / OA mixture prepared by thermal deactivation of 1.0 ppm lipase at liquefaction. Compared to only% FFA, it was 98% at 20 h. The results are shown in Table 11.
[표 11]TABLE 11
실시예Example 28 28
액화 전의 통옥수수 가루의 처리를 위한 리파제 스크리닝Lipase screening for treatment of whole cornmeal before liquefaction
pH 5.8에서 수돗물 (67.9 g) 및 통옥수수 가루 (35.1 g 습윤 중량, 해머 밀을 사용하여 1.0 ㎜ 스크린으로 분쇄됨)를 함유하는 7개의 반응 혼합물을 스토퍼가 부착된 플라스크에서 55℃로 교반하였다. 3-mL 샘플 (t = 0 h)을 각 플라스크로부터 제거하여, 샘플을 드라이아이스에서 바로 냉동시킨 후에, 하기 리파제 (노보자임즈) 중 하나의 1 ㎎ 총 가용성 단백질 (반응 혼합물 중의 10 ppm 최종 농도)을 함유하는 10 mM 인산나트륨 완충액 (pH 7.0) 약 0.5 mL를 각 플라스크의 상기 샘플에 첨가하였다: 리폴라제? 100 L, 리펙스? 100L, 리포클린? 2000T, 리포자임? CALB L, 노보자임? CALA L, 및 팔라타제 20000L; 리파제를 제 7 플라스크에 첨가하지 않았다. 생성된 혼합물을 스토퍼가 부착된 플라스크에서 55℃로 교반하고, 3-mL 샘플을 1 h, 2 h, 4 h 및 6 h에서 각 반응 혼합물로부터 회수하여, 참고 문헌 1에 기재된 방법에 따라 wt% 지질 (지방산 메틸 에스테르, FAME로서 유도체화됨) 및 wt% 유리 지방산 (FFA, 지방산 메틸 에스테르, FAME로서 유도체화됨)을 분석할 때까지 드라이아이스에서 바로 냉동시키며, 유리 지방산 함량 퍼센트를 지질의 합한 총 농도에 관하여 계산하고, 유리 지방산을 각 샘플에 대하여 측정하였다. 결과는 표 12에 나타나있다.Seven reaction mixtures containing tap water (67.9 g) and whole corn flour (35.1 g wet weight, ground to 1.0 mm screen using a hammer mill) at pH 5.8 were stirred at 55 ° C. in a flask with a stopper. 3-mL samples (t = 0 h) were removed from each flask, and the samples were immediately frozen in dry ice, followed by 1 mg total soluble protein (10 ppm final concentration in the reaction mixture) of one of the following lipases (Novozymes) Approximately 0.5 mL of 10 mM sodium phosphate buffer, pH 7.0, was added to the sample in each flask: Lipolase? 100 L, Repex? 100L, lipoclin? 2000T, Lipozyme? CALB L, novozyme? CALA L, and palatase 20000L; Lipase was not added to the seventh flask. The resulting mixture was stirred at 55 ° C. in a stoppered flask, and 3-mL samples were recovered from each reaction mixture at 1 h, 2 h, 4 h and 6 h, wt% according to the method described in Reference 1 Lipids (fatty acid methyl esters, derivatized as FAME) and wt% free fatty acids (FFA, fatty acid methyl esters, derivatized as FAME) are frozen directly in dry ice until analysis, and the percentage of free fatty acid content is summed to the total total concentration of lipids. And free fatty acids were measured for each sample. The results are shown in Table 12.
[표 12][Table 12]
실시예 29Example 29
올레일 알코올을 사용하는 원위치에서의 생성물 제거를 이용한 동시 당화 발효 전의 통옥수수 가루의 리파제 처리Lipase Treatment of Whole Corn Flour Prior to Simultaneous Saccharification Fermentation Using In Situ Removal with Oleyl Alcohol
3개의 발효를 실시예 7, 8, 및 10에서 상술한 바와 같이 실행하였다. 실시예 7 및 10에 기재된 바와 같이 실행된 발효에 대하여, 리파제 (10 ppm의 리폴라제? 총 가용성 단백질)를 분쇄 옥수수의 현탁액에 첨가하고 액화 전에 55℃로 6 h 동안 가열하여, 열불활성화 리파제를 함유하는 액화 옥수수 매시를 생성하였다. 실시예 8에 기재된 발효를 위해 액화 옥수수 매시를 제조하는데 사용되는 분쇄 옥수수의 현탁액에 리파제를 첨가하지 않으나, 현탁액에 대하여 액화 전에 55℃에서의 동일한 가열 단계를 행하였다. 실시예 7 및 10에 기재된 바와 같이 실행된 발효를 위해 제조된 리파제 처리된 액화 옥수수 매시 중의 % FFA는 리파제 미처리 (실시예 8)의 41 %와 비교하여, 각각 83% 및 86%이었다. 발효 동안에, FFA의 농도가 열불활성화 리파제를 함유하는 것을 포함하여, 어떠한 발효에서도 감소되지 않았다. 실시예 7 및 10에 따라 실행된 발효 (발효 전의 리파제의 열불활성화)의 OA 상 중의 % FFA는 통옥수수 가루가 액화 전에 리파제로 처리되지 않은 실시예 8에 따라 실행된 발효의 49% FFA에 불과한 것과 비교하여, 각각 70 h (실행 종료 (EOR))에서 97%이었다. 결과는 표 13에 나타나있다.Three fermentations were performed as described above in Examples 7, 8, and 10. For the fermentation performed as described in Examples 7 and 10, lipase (10 ppm of lipolase—total soluble protein) was added to the suspension of ground corn and heated to 55 ° C. for 6 h before liquefaction, thereby making it thermally inactive lipase A liquefied corn mash containing was produced. No lipase was added to the suspension of ground corn used to prepare the liquefied corn mash for the fermentation described in Example 8, but the suspension was subjected to the same heating step at 55 ° C. before liquefaction. The% FFA in the lipase treated liquefied corn mash prepared for the fermentation run as described in Examples 7 and 10 was 83% and 86%, respectively, compared to 41% of lipase untreated (Example 8). During the fermentation, the concentration of FFA was not reduced in any fermentation, including containing thermally inactivated lipases. The% FFA in the OA phase of the fermentation carried out according to Examples 7 and 10 (heat inactivation of lipase before fermentation) was only 49% FFA of the fermentation performed according to Example 8 in which the cornmeal flour was not treated with lipase before liquefaction. As compared to 97% at 70 h (end of run (EOR)), respectively. The results are shown in Table 13.
[표 13][Table 13]
실시예 30Example 30
옥수수유 지방산 (COFA)을 사용하는 원위치에서의 생성물 제거를 이용한 동시 당화 발효를 위한 For Simultaneous Saccharification Fermentation Using In Situ Product Removal Using Corn Oil Fatty Acids (COFA) 통옥수수Whole corn 가루 또는 액화 옥수수 Flour or liquefied corn 매시의Hourly 리파제Lipase 처리 process
5개의 발효를 실시예 9, 11, 12, 13, 및 14에서 상술한 바와 같이 실행하였다. 실시예 9, 13, 및 14에 기재된 바와 같이 실행된 발효에 대하여, 리파제 (10 ppm의 리폴라제? 총 가용성 단백질)를 액화 후에 첨가하고, 리파제가 열불활성화되지 않았다. 실시예 9 및 14에 기재된 바와 같이 행해진 발효는 접종 전에 첨가된 에탄올이 5 g/L인 반면에, 실시예 13에 기재된 바와 같이 행해진 발효는 에탄올이 첨가되지 않았다. 실시예 11 및 12에 기재된 바와 같이 행해진 발효는 액화 전에 분쇄 옥수수의 현탁액에 10 ppm 리폴라제? 총 가용성 단백질을 첨가하여, 액화 시에 리파제의 열불활성화를 유도하였다. 실시예 11에 기재된 바와 같이 행해진 발효는 접종 전에 첨가된 에탄올이 5 g/L인 반면에, 실시예 12에 기재된 바와 같이 행해진 발효는 에탄올이 첨가되지 않았다. 활성 리파제를 함유하는 발효의 COFA 상에 존재하는 아이소부탄올 (i-BuOH)의 최종 총 그램수는 불활성 리파제를 함유하는 발효의 COFA 상에 존재하는 i-BuOH (FABE로서 존재하는 i-BuOH 포함)의 최종 총 그램수보다 상당히 컸다. 활성 리파제를 함유하는 발효 브로스 (수성상)에 존재하는 아이소부탄올 (i-BuOH)의 최종 총 그램수는 불활성 리파제를 함유하는 발효 브로스에 존재하는 i-BuOH의 최종 총 그램수보다 다만 약간 더 적었으므로, i-BuOH (유리 i-BuOH와 COFA의 아이소부틸 에스테르 (FABE)의 배합물로서)의 전체 생성량은 열불활성화 리파제 존재 하에 얻어진 것과 비교하여, 활성 리파제의 존재 하에서 상당히 더 높았다. 결과는 표 14 및 15에 나타나있다.Five fermentations were performed as described above in Examples 9, 11, 12, 13, and 14. For the fermentation performed as described in Examples 9, 13, and 14, lipase (10 ppm of lipolase-total soluble protein) was added after liquefaction and the lipase was not thermally inactivated. Fermentations performed as described in Examples 9 and 14 resulted in 5 g / L of ethanol added prior to inoculation, while fermentations performed as described in Example 13 had no ethanol added. The fermentation carried out as described in Examples 11 and 12 was carried out in a suspension of ground maize before the liquefaction of 10 ppm lipolase? Total soluble protein was added to induce heat inactivation of the lipase upon liquefaction. Fermentations performed as described in Example 11 resulted in 5 g / L of ethanol added prior to inoculation, while fermentations performed as described in Example 12 had no ethanol added. The final total grams of isobutanol (i-BuOH) present on the COFA of fermentation containing active lipase is i-BuOH present on the COFA of fermentation containing inactive lipase (including i-BuOH present as FABE) It was significantly larger than the final total grams of. The final total grams of isobutanol (i-BuOH) present in the fermentation broth containing the active lipase (aqueous phase) were only slightly less than the final total grams of i-BuOH present in the fermentation broth containing the inactive lipase. Therefore, the total production of i-BuOH (as a combination of free i-BuOH and isobutyl ester of FAFA) was significantly higher in the presence of active lipase compared to that obtained in the presence of thermally inactivated lipase. The results are shown in Tables 14 and 15.
[표 14][Table 14]
[표 15] [Table 15]
실시예 31Example 31
아이소부탄올과 옥수수유 지방산 (COFA)의 포스포리파제 촉매 반응에 의한 아이소부틸 COFA 에스테르의 생성Production of Isobutyl COFA Ester by Phospholipase Catalytic Reaction of Isobutanol with Corn Oil Fatty Acid (COFA)
2-(N-모르폴리노)에탄설폰산 수성 완충액 (0.20 M, pH 5.3), 아이소부탄올 (2-메틸-1-프로판올), 포스포리파제 (포스포리파제 A; 시그마알드리치, L3295-250) 및 옥수수유로부터 제조된 옥수수유 지방산을 함유하는 반응 혼합물을 30℃에서 교반하고 (표 16), 샘플을 소정 시간에 각 반응 혼합물로부터 회수하여, 바로 원심분리하고, 수성층 및 유기층을 분리하여, 아이소부탄올 (i-BuOH) 및 옥수수유 지방산의 아이소부틸 에스테르 (i-BuO-COFA)를 분석하였다 (표 17).2- (N-morpholino) ethanesulfonic acid aqueous buffer (0.20 M, pH 5.3), isobutanol (2-methyl-1-propanol), phospholipase (phospholipase A; sigma aldrich, L3295-250) And a reaction mixture containing corn oil fatty acid prepared from corn oil at 30 ° C. (Table 16), and the sample was recovered from each reaction mixture at a predetermined time, immediately centrifuged, the aqueous layer and the organic layer were separated, Butanol (i-BuOH) and isobutyl esters of corn oil fatty acids (i-BuO-COFA) were analyzed (Table 17).
[표 16][Table 16]
[표 17]TABLE 17
실시예 32Example 32
리파제 촉매 반응에서의 수성/COFA 비에 대한 아이소부틸-COFA 에스테르 농도의 의존도Dependence of Isobutyl-COFA Ester Concentration on Aqueous / COFA Ratio in Lipase Catalysis
2-(N-모르폴리노)에탄설폰산 수성 완충액 (0.20 M, pH 5.2), 아이소부탄올 (2-메틸-1-프로판올), 리파제 (리폴라제? 100 L; 노보자임즈) 및 옥수수유로부터 제조된 옥수수유 지방산을 함유하는 반응 혼합물 (표 18)을 30℃에서 교반하고, 샘플을 소정 시간에 각 반응 혼합물로부터 회수하여, 바로 원심분리하고, 수성층 및 유기층을 분리하여, 아이소부탄올 (i-BuOH) 및 옥수수유 지방산의 아이소부틸 에스테르 (i-BuO-COFA)를 분석하였다 (표 19).2- (N-morpholino) ethanesulfonic acid aqueous buffer (0.20 M, pH 5.2), isobutanol (2-methyl-1-propanol), lipase (lipolase-100 L; Novozymes) and corn oil The reaction mixture containing corn oil fatty acid prepared from (Table 18) was stirred at 30 ° C., and the sample was recovered from each reaction mixture at a predetermined time, immediately centrifuged, the aqueous layer and the organic layer were separated, and isobutanol (i -BuOH) and isobutyl esters of corn oil fatty acids (i-BuO-COFA) were analyzed (Table 19).
[표 18][Table 18]
[표 19]TABLE 19
실시예 33Example 33
리파제 촉매 반응에서의 에스테르화 알코올에 대한 부틸-COFA 에스테르 농도의 의존도Dependence of Butyl-COFA Ester Concentration on Ester Alcohols in Lipase Catalysis
2-(N-모르폴리노)에탄설폰산 수성 완충액 (0.20 M, pH 5.2), 아이소부탄올 (2-메틸-1-프로판올) 또는 n-부탄올, 리파제 (리폴라제? 100 L; 노보자임즈) 및 옥수수유로부터 제조된 옥수수유 지방산을 함유하는 반응 혼합물 (표 20)을 30℃에서 교반하고, 샘플을 소정 시간에 각 반응 혼합물로부터 회수하여, 바로 원심분리하고, 수성층 및 유기층을 분리하여, 아이소부탄올 (i-BuOH) 또는 n-부탄올 (n-BuOH) 및 옥수수유 지방산의 아이소부틸- 또는 부틸 에스테르 (BuO-COFA)를 분석하였다 (표 21).2- (N-morpholino) ethanesulfonic acid aqueous buffer (0.20 M, pH 5.2), isobutanol (2-methyl-1-propanol) or n-butanol, lipase (lipolase? 100 L; Novozymes ) And the reaction mixture containing corn oil fatty acid prepared from corn oil (Table 20) was stirred at 30 ° C., and the sample was recovered from each reaction mixture at a predetermined time, immediately centrifuged, the aqueous layer and the organic layer were separated, Isobutanol (i-BuOH) or n-butanol (n-BuOH) and isobutyl- or butyl esters (BuO-COFA) of corn oil fatty acids were analyzed (Table 21).
[표 20]TABLE 20
[표 21]TABLE 21
실시예Example 34 34
아이소부탄올과With isobutanol 올레산의 Oleic 리파제Lipase 촉매 반응에 의한 By catalytic reaction 아이소부틸Isobutyl 올레에이트의Oleate 생성 produce
2-(N-모르폴리노)에탄설폰산 수성 완충액 (0.20 M, pH 5.2), 아이소부탄올 (2-메틸-1-프로판올), 리파제 (0 ppm 또는 10 ppm 리폴라제? 100 L; 노보자임즈) 및 올레산 (알파 에이사 (Alfa Aesar))을 함유하는 반응 혼합물 (표 22)을 30℃에서 교반하고, 샘플을 소정 시간에 각 반응 혼합물로부터 회수하여, 바로 원심분리하고, 수성층 및 유기층을 분리하여, 아이소부탄올 (i-BuOH) 및 아이소부틸 올레에이트 (i-BuO-올레에이트)를 분석하였다 (표 23).2- (N-morpholino) ethanesulfonic acid aqueous buffer (0.20 M, pH 5.2), isobutanol (2-methyl-1-propanol), lipase (0 ppm or 10 ppm lipolase-100 L; novozyme And reaction mixture (Table 22) containing oleic acid (Alfa Aesar) at 30 ° C., the sample was recovered from each reaction mixture at a predetermined time, immediately centrifuged, and the aqueous and organic layers Separately, isobutanol (i-BuOH) and isobutyl oleate (i-BuO-oleate) were analyzed (Table 23).
[표 22]Table 22
[표 23]TABLE 23
실시예 35Example 35
아이소부탄올과 올레산의 리파제 촉매 반응에 의한 아이소부틸 올레에이트의 생성의 비교Comparison of the Production of Isobutyl Oleate by Lipase Catalysis of Isobutanol and Oleic Acid
2-(N-모르폴리노)에탄설폰산 수성 완충액 (MES, 0.20 M, pH 5.2), 아이소부탄올 (2-메틸-1-프로판올), 올레산 (알파 에이사), 및 리파제 (10 ppm) (노보자임즈로부터의 리폴라제? 100 L, 리펙스? 100L, 리포자임? CALB L, 노보자임? CALA L, 팔라타제?), 또는 리파제 (10 ppm) (시그마알드리치로부터의 슈도모나스 플루오레센스, 슈도모나스 세파시아, 무코르 미에헤이, 돼지 췌장, 칸디다 실린드라세아, 리조푸스 니베우스, 칸디다 안타르크티카, 리조푸스 아르히주스 또는 아스페르길루스)를 함유하는 반응 혼합물 (표 24)을 30℃에서 교반하고, 샘플을 소정 시간에 각 반응 혼합물로부터 회수하여, 바로 원심분리하고, 수성층 및 유기층을 분리하여, 아이소부탄올 (i-BuOH) 및 아이소부틸 올레에이트 (i-BuO-올레에이트)를 분석하였다 (표 25).2- (N-morpholino) ethanesulfonic acid aqueous buffer (MES, 0.20 M, pH 5.2), isobutanol (2-methyl-1-propanol), oleic acid (alpha Aisa), and lipase (10 ppm) ( Lipolase from Novozymes 100 L, Repex 100 L, Lipozyme CALB L, Novozyme CALA L, Palatase, or Lipase (10 ppm), Pseudomonas Fluoresence from Sigma Aldrich, The reaction mixture (Table 24) containing Pseudomonas Sephacia, Mucor Miehei, Porcine Pancreas, Candida Silindracea, Rizopus Niveus, Candida Antartica, Rizopus Arhijus or Aspergillus) After stirring, the sample was recovered from each reaction mixture at a predetermined time, immediately centrifuged, and the aqueous layer and the organic layer were separated to analyze isobutanol (i-BuOH) and isobutyl oleate (i-BuO-oleate). (Table 25).
[표 24]TABLE 24
[표 25]TABLE 25
실시예Example 36 36
에탄올과 옥수수유 지방산 (COFA)의 리파제 촉매 반응에 의한 에틸-COFA 에스테르의 생성Production of Ethyl-COFA Ester by Lipase Catalysis of Ethanol and Corn Oil Fatty Acid (COFA)
2-(N-모르폴리노)에탄설폰산 수성 완충액 (0.20 M, pH 5.5), 에탄올, 리파제 (리폴라제? 100 L 또는 리포자임? CALB L; 노보자임즈) 및 옥수수유로부터 제조된 옥수수유 지방산을 함유하는 반응 혼합물 (표 26)을 30℃에서 교반하고, 샘플을 소정 시간에 교반하면서 각 반응 혼합물로부터 회수하여, 바로 원심분리하고, 수성층 및 유기층을 분리하여, 에탄올 및 옥수수유 지방산의 에틸 에스테르 (EtO-COFA)를 분석하였다 (표 27).Corn prepared from 2- (N-morpholino) ethanesulfonic acid aqueous buffer (0.20 M, pH 5.5), ethanol, lipase (lipolase? 100 L or lipozyme? CALB L; Novozymes) and corn oil The reaction mixture containing milk fatty acid (Table 26) was stirred at 30 ° C., the sample was recovered from each reaction mixture with stirring at a predetermined time, centrifuged immediately, the aqueous layer and the organic layer were separated, and the ethanol and corn oil fatty acids were separated. Ethyl ester (EtO-COFA) was analyzed (Table 27).
[표 26]TABLE 26
[표 27]TABLE 27
실시예Example 37 37
효모 발효 시의 에탄올과 옥수수유 지방산 (COFA)의 리파제 촉매 반응에 의한 에틸-COFA 에스테르의 생성Production of Ethyl-COFA Ester by Lipase Catalytic Reaction of Ethanol and Corn Oil Fatty Acid (COFA) in Yeast Fermentation
야생형 효모 균주 CEN.PK113-7D를 아미노산 비함유 효모 질소 베이스 (6.7 g/L), 덱스트로스 (25 g/L), 및 MES 완충액 (pH 5.5에서 0.1 M)을 함유하는 배지 에서 하룻밤 동안 증식시켰다. 하룻밤 동안의 배양물을 신선한 배지로 희석하여, 600 nm에서의 얻어진 광학 밀도가 0.1이었다. 희석된 배양물을 1개의 플라스크당 25 mL를 6개의 250 mL 시일링된 캡 진탕 플라스크에 분취하였다. 배양물 중 4개를 2개의 리파제 효소 원액 (리포자임? CALB L 또는 리폴라제? 100L의 2 ㎎ 단백질/mL 10 mM 포스페이트 완충액 (pH 7.0))으로 보충하여,배지 중에 10 ppm의 최종 리파제 농도로 되게 하였다. 옥수수유 지방산 (COFA)을 플라스크 중 3개의 수성 배양액 (효소 미첨가, CALB L, 또는 리폴라제? 100L)에 1:1 부피비로 첨가하였다. 하나의 플라스크에는 보충하지 않았다. 배양물을 온도 제어된 진탕 인큐베이터에서 30℃ 및 250 rpm의 진탕 속도로 23시간 동안 성장시켰다. 세포량 측정을 위한 샘플을 15 mL 원추형 저부관에서 상분리시켰다. 600 nm에서의 샘플의 광학 밀도를 염수 중의 20배 희석물에서 측정하였다. 크로마토그래프 분석을 위한 샘플 (5 mL 수성 배양물 또는 10 mL 배양물/COFA 에멀젼)을 15 mL 원추형 저부관의 TX-400 진동하 물통 회전자 (swinging bucket rotor)에서 4000 rpm으로 5분간 바로 원심분리하였다. 수성 샘플에 대해서는, 분석에 앞서 0.22 ㎛ 스핀 필터를 사용하였다. 수성 샘플을 50℃ 및 분당 0.5 mL의 유량으로 0.01 M 황산 이동상을 사용하여 SH-G 가드 칼럼을 구비한 쇼덱스 SH1011 칼럼에서 분석하였다. 당 및 알코올을 굴절률 및 210 nm 흡수율로 검출하고, 표준 곡선을 사용하여 정량화를 행하였다. 샘플을 수성 배양물 (COFA 미첨가) 또는 배양물/COFA 에멀젼으로부터 취해, COFA의 에틸 에스테르에 대하여 이전의 실시예에 기재된 바와 같이 분석하였다. 결과는 표 28 및 29에 나타나있다.Wild-type yeast strain CEN.PK113-7D was grown overnight in medium containing amino acid free yeast nitrogen base (6.7 g / L), dextrose (25 g / L), and MES buffer (0.1 M at pH 5.5). . The overnight culture was diluted with fresh medium, resulting in an optical density of 0.1 at 600 nm. Diluted cultures were aliquoted into six 250 mL sealed cap shake flasks with 25 mL per flask. Four of the cultures were supplemented with two lipase enzyme stocks (Lipozyme® CALB L or Lipolase® 100L of 2 mg protein /
[표 28][Table 28]
[표 29][Table 29]
실시예 38Example 38
메탄올과 옥수수유 지방산 (COFA)의 리파제 촉매 반응에 의한 메틸-COFA 에스테르의 생성Production of Methyl-COFA Ester by Lipase Catalytic Reaction of Methanol with Corn Oil Fatty Acid (COFA)
2-(N-모르폴리노)에탄설폰산 수성 완충액 (0.20 M, pH 5.5), 메탄올, 리파제 (리폴라제? 100 L (노보자임즈), 리포자임? CALB L (노보자임즈), 리조푸스 아르히주스 리파제 (시그마알드리치), 및 칸디다 실린드라세아 리파제 (시그마알드리치) 및 옥수수유로부터 제조된 옥수수유 지방산을 함유하는 반응 혼합물 (표 30)을 30℃에서 교반하고, 샘플을 소정 시간에 교반하면서 각 반응 혼합물로부터 회수하여, 바로 원심분리하고, 수성층 및 유기층을 분리하여, 에탄올 및 옥수수유 지방산의 에틸 에스테르 (EtO-COFA)를 분석하였다 (표 31).2- (N-morpholino) ethanesulfonic acid aqueous buffer (0.20 M, pH 5.5), methanol, lipase (lipolase? 100 L (novovozymes), lipozyme? CALB L (novovozymes), lyso A reaction mixture containing Fus Arhijus lipase (Sigma Aldrich), and Candida silindrasia lipase (Sigma Aldrich) and corn oil fatty acids prepared from corn oil (Table 30) is stirred at 30 ° C. and the sample is stirred at a predetermined time. The mixture was recovered from each reaction mixture with stirring, centrifuged immediately, the aqueous and organic layers were separated, and the ethyl esters of ethanol and corn oil fatty acids (EtO-COFA) were analyzed (Table 31).
[표 30][Table 30]
[표 31][Table 31]
실시예 39Example 39
1-프로판올과 옥수수유 지방산 (COFA)의 리파제 촉매 반응에 의한 1-프로필-COFA 에스테르의 생성Production of 1-propyl-COFA Ester by Lipase Catalytic Reaction of 1-Propanol with Corn Oil Fatty Acid (COFA)
2-(N-모르폴리노)에탄설폰산 수성 완충액 (0.20 M, pH 5.5), 1-프로판올, 리파제 (리폴라제? 100 L (노보자임즈), 리포자임? CALB L (노보자임즈), 리조푸스 아르히주스 리파제 (시그마알드리치), 및 칸디다 실린드라세아 리파제 (시그마알드리치)) 및 옥수수유로부터 제조된 옥수수유 지방산을 함유하는 반응 혼합물 (표 32)을 30℃에서 교반하고, 샘플을 소정 시간에 교반하면서 각 반응 혼합물로부터 회수하여, 바로 원심분리하고, 수성층 및 유기층을 분리하여, 1-프로판올 및 옥수수유 지방산의 1-프로필 에스테르 (PrO-COFA)를 분석하였다 (표 33).2- (N-morpholino) ethanesulfonic acid aqueous buffer (0.20 M, pH 5.5), 1-propanol, lipase (lipolase? 100 L (Novozymes), lipozyme? CALB L (Novozymes) , A reaction mixture containing Rizopus arhijus lipase (Sigma Aldrich), and Candida silindrasia lipase (Sigma Aldrich)) and corn oil fatty acid prepared from corn oil (Table 32) was stirred at 30 ° C., and the sample was The mixture was recovered from each reaction mixture with stirring at a predetermined time, centrifuged immediately, the aqueous layer and the organic layer were separated and analyzed for 1-propyl ester (PrO-COFA) of 1-propanol and corn oil fatty acid (Table 33).
[표 32]Table 32
[표 33][Table 33]
실시예 40Example 40
1-펜탄올과 옥수수유 지방산 (COFA)의 리파제 촉매 반응에 의한 1-펜틸-COFA 에스테르의 생성Production of 1-pentyl-COFA Ester by Lipase Catalytic Reaction of 1-Pentanol with Corn Oil Fatty Acid (COFA)
2-(N-모르폴리노)에탄설폰산 수성 완충액 (0.20 M, pH 5.5), 1-펜탄올, 리파제 (리폴라제? 100 L (노보자임즈), 리포자임? CALB L (노보자임즈), 리조푸스 아르히주스 리파제 (시그마알드리치), 및 칸디다 실린드라세아 리파제 (시그마알드리치) 및 옥수수유로부터 제조된 옥수수유 지방산을 함유하는 반응 혼합물 (표 34)을 30℃에서 교반하고, 샘플을 소정 시간에 교반하면서 각 반응 혼합물로부터 회수하여, 바로 원심분리하고, 수성층 및 유기층을 분리하여, 1-펜탄올 및 옥수수유 지방산의 1-펜틸 에스테르 (PenO-COFA)를 분석하였다 (표 35).2- (N-morpholino) ethanesulfonic acid aqueous buffer (0.20 M, pH 5.5), 1-pentanol, lipase (lipolase? 100 L (Novozymes), lipozyme? CALB L (Novozymes) ), Rizopus arhijus lipase (Sigma Aldrich), and a reaction mixture containing Candida silindrasia lipase (Sigma Aldrich) and corn oil fatty acids prepared from corn oil (Table 34) were stirred at 30 ° C. and the samples were The mixture was recovered from each reaction mixture with stirring at a predetermined time, centrifuged immediately, the aqueous layer and the organic layer were separated and analyzed for 1-pentyl ester (PenO-COFA) of 1-pentanol and corn oil fatty acid (Table 35).
[표 34][Table 34]
[표 35][Table 35]
실시예 41Example 41
2-메틸-1-부탄올과 옥수수유 지방산 (COFA)의 리파제 촉매 반응에 의한 2-메틸-1-부틸-COFA 에스테르의 생성 Production of 2-methyl - 1 -butyl-COFA ester by lipase catalyzed reaction of 2-methyl - 1 -butanol with corn oil fatty acid (COFA)
2-(N-모르폴리노)에탄설폰산 수성 완충액 (0.20 M, pH 5.5), 2-메틸-1-부탄올, 리파제 (리폴라제? 100 L (노보자임즈), 리포자임? CALB L (노보자임즈), 리조푸스 아르히주스 리파제 (시그마알드리치), 및 칸디다 실린드라세아 리파제 (시그마알드리치) 및 옥수수유로부터 제조된 옥수수유 지방산을 함유하는 반응 혼합물 (표 36)을 30℃에서 교반하고, 샘플을 소정 시간에 교반하면서 각 반응 혼합물로부터 회수하여, 바로 원심분리하고, 수성층 및 유기층을 분리하여, 2-메틸-1-부탄올 및 옥수수유 지방산의 2-메틸-1-부틸 에스테르 (MeBO-COFA)를 분석하였다 (표 37).2- (N-morpholino) ethanesulfonic acid aqueous buffer (0.20 M, pH 5.5), 2-methyl-1-butanol, lipase (lipolase? 100 L (Novozymes), lipozyme? CALB L ( Novozymes), lycopus arhijus lipase (Sigma-Aldrich), and reaction mixture containing candida silindrasia lipase (Sigma-Aldrich) and corn oil fatty acid prepared from corn oil (Table 36) were stirred at 30 ° C and The sample was recovered from each reaction mixture with stirring at a predetermined time, immediately centrifuged, the aqueous layer and the organic layer were separated, and 2-methyl-1-butyl ester of 2-methyl-1-butanol and corn oil fatty acid (MeBO- COFA) was analyzed (Table 37).
[표 36][Table 36]
[표 37][Table 37]
실시예 42Example 42
아이소프로판올과 옥수수유 지방산 (COFA)의 리파제 촉매 반응에 의한 아이소프로필-COFA 에스테르의 생성Production of Isopropyl-COFA Ester by Lipase Catalytic Reaction of Isopropanol with Corn Oil Fatty Acid (COFA)
2-(N-모르폴리노)에탄설폰산 수성 완충액 (0.20 M, pH 5.5), 아이소프로판올 (2-프로판올), 리파제 (리폴라제? 100 L (노보자임즈), 리포자임? CALB L (노보자임즈), 리조푸스 아르히주스 리파제 (시그마알드리치), 및 칸디다 실린드라세아 리파제 (시그마알드리치) 및 옥수수유로부터 제조된 옥수수유 지방산을 함유하는 반응 혼합물 (표 38)을 30℃에서 교반하고, 샘플을 소정 시간에 교반하면서 각 반응 혼합물로부터 회수하여, 바로 원심분리하고, 수성층 및 유기층을 분리하여, 아이소프로판올 및 옥수수유 지방산의 아이소프로필 에스테르 (i-PrO-COFA)를 분석하였다 (표 39).2- (N-morpholino) ethanesulfonic acid aqueous buffer (0.20 M, pH 5.5), isopropanol (2-propanol), lipase (lipolase? 100 L (Novozymes), lipozyme? CALB L ( Novozymes), lycopus arhijus lipase (Sigma-Aldrich), and a reaction mixture containing candida silindrasia lipase (Sigma-Aldrich) and corn oil fatty acids prepared from corn oil (Table 38) were stirred at 30 ° C and The sample was recovered from each reaction mixture with stirring at a predetermined time, immediately centrifuged, the aqueous layer and the organic layer were separated and analyzed for isopropyl esters of isopropanol and corn oil fatty acid (i-PrO-COFA) (Table 39). ).
[표 38][Table 38]
[표 39][Table 39]
실시예 43Example 43
물과 추출제 사이의 아이소부탄올에 대한 분배 계수의 비교Comparison of partition coefficients for isobutanol between water and extractant
아이소부탄올 수용액 (30 g/L)을 옥수수유 지방산 (COFA), 또는 올레산 또는 옥수수유 트라이글리세라이드와 혼합하여, 이들의 측정된 분배 계수를 올레일 알코올에 대한 측정된 분배 계수와 비교하여 표에 기록하였다. 결과는 표 40에 나타나있다.Aqueous isobutanol solution (30 g / L) was mixed with corn oil fatty acid (COFA), or oleic acid or corn oil triglyceride, and their measured partition coefficient was compared to the measured partition coefficient for oleyl alcohol in the table. Recorded. The results are shown in Table 40.
[표 40][Table 40]
실시예 44Example 44
옥수수유 지방산의 생성Production of Corn Oil Fatty Acids
기계식 교반기, 열전대, 가열 맨틀, 응축기 및 질소 T자관 (nitrogen tee)이 부착된 5리터 (5L) 둥근 바닥 플라스크에, 조옥수수유 (비식품 등급, 에탄올 발효 설비로부터 회수됨) 750 g, 물 2112 g 및 50% 수산화나트륨 용액 285 g을 주입하였다. 혼합물을 90℃로 가열하여, 2시간 동안 유지하고, 그 동안에 하나의 두터운 에멀젼형 단일상으로 되었다. 이 시기의 끝에, TLC는 혼합물에 옥수수유가 잔류하지 않음을 나타낸다. 그 다음에, 혼합물을 74℃로 냉각시켜, 25% 황산 900 g을 첨가하여 혼합물을 산성화하였다. 그 후에 50℃로 냉각시켜, 수성층을 배출시켰다. 오일층을 40℃ 물 1500 mL로 2회, 그 후에 포화 염수 1리터로 1회 세정하였다. 황산마그네슘으로 건조시켜, 셀라이트 (Celite)를 통해 여과시켰다. 투명한 적색 오일 610 g을 수득하였다. AOCS 방법 Ca 5a-40을 통한 유리 지방산에 대한 적정은 올레산으로 나타낸 지방산 함량이 95%임을 나타낸다. 샘플 104 ㎎을 무수 피리딘 1 mL 중의 N-메틸-N-(트라이메틸실릴)트라이플루오로아세트아미드 100 uL과 반응시켜 샘플을 실란화하였다. 실란화된 생성물의 가스 크로마토그래피 질량분석법 (GCMS)으로 분석한 바, 16:0, 18:2, 18:1, 18:0, 및 20:0 산의 TMS 유도체가 존재함을 알 수 있다.In a 5-liter (5L) round bottom flask with a mechanical stirrer, thermocouple, heating mantle, condenser and nitrogen tee, crude corn (non food grade, recovered from an ethanol fermentation plant) 750 g, water 2112 g and 285 g of 50% sodium hydroxide solution were injected. The mixture was heated to 90 ° C. and maintained for 2 hours, during which time it became one thick emulsion-like single phase. At the end of this period, TLC indicates no corn oil remains in the mixture. The mixture was then cooled to 74 ° C. and the mixture acidified by adding 900 g of 25% sulfuric acid. Then, it cooled to 50 degreeC and discharged the aqueous layer. The oil layer was washed twice with 1500 mL of 40 ° C. water, then once with 1 liter of saturated brine. Dried over magnesium sulfate and filtered through Celite. 610 g of a clear red oil were obtained. AOCS method Titration to free fatty acids via Ca 5a-40 indicates that the fatty acid content, expressed in oleic acid, is 95%. The sample was silanized by reacting 104 mg of the sample with 100 uL of N-methyl-N- (trimethylsilyl) trifluoroacetamide in 1 mL of anhydrous pyridine. Gas chromatographic mass spectrometry (GCMS) of the silanized products reveals the presence of TMS derivatives of 16: 0, 18: 2, 18: 1, 18: 0, and 20: 0 acids.
실시예 45Example 45
FABE의 화학 합성Chemical Synthesis of FABE
3L 플라스크에는 기계식 교반기, 열전대, 질소 인렛, 가열 맨틀 및 응축기가 부착되어 있었다. 플라스크에 COFA (595 g) (실시예 44에서 제조됨), 아이소부탄올 (595 g), 및 황산 (12 g)을 주입하였다. 혼합물을 1.5시간 동안 환류시키고, 그 때 응축기를 제거하고 스틸 헤드로 교체하였다. 증류액을 90℃의 초기 헤드 온도 및 105℃의 최종 헤드 온도와 함께 3시간에 걸쳐서 수집하였다. 그 다음에 혼합물을 실온으로 냉각시켜, 탈이온수 500 mL를 첨가하였다. 층을 분리하여, 유기층을 탈이온수 500 mL로 5회 세정하였다. 그 다음에 10% 염화칼슘 용액 500 mL로 1회, 이어서 탈이온수 500 mL로 6회 세정하였다. 그 다음에 오일을 황산마그네슘으로 건조시켜 셀라이트 베드를 통해 여과하여, 투명한 적색 오일 601 g을 얻었다. GC 분석한 바, 아이소부탄올 0.36 wt%가 존재함을 알 수 있다. GC/MS 분석한 바, 아이소부틸 팔미테이트, 아이소부틸 스테아레이트, 아이소부틸 올레에이트, 아이소부틸 리놀레에이트, 및 아이소부틸 리놀레네이트가 존재함을 알 수 있다.The 3L flask was equipped with a mechanical stirrer, thermocouple, nitrogen inlet, heating mantle and condenser. The flask was charged with COFA (595 g) (prepared in Example 44), isobutanol (595 g), and sulfuric acid (12 g). The mixture was refluxed for 1.5 hours at which time the condenser was removed and replaced with a steel head. The distillate was collected over 3 hours with an initial head temperature of 90 ° C. and a final head temperature of 105 ° C. The mixture was then cooled to room temperature and 500 mL of deionized water was added. The layers were separated and the organic layer was washed five times with 500 mL of deionized water. It was then washed once with 500 mL of 10% calcium chloride solution followed by 6 times with 500 mL of deionized water. The oil was then dried over magnesium sulfate and filtered through a celite bed to give 601 g of a clear red oil. GC analysis showed that 0.36 wt% of isobutanol was present. GC / MS analysis shows that isobutyl palmitate, isobutyl stearate, isobutyl oleate, isobutyl linoleate, and isobutyl linoleate are present.
실시예 46Example 46
무기산 촉매를 이용한 부탄올의 회수Recovery of Butanol Using Inorganic Acid Catalyst
자석 교반기 및 상부에 스틸 헤드 및 질소 인렛이 설치된 라시히 링 (Rasching ring)으로 패킹된 30.5 ㎝ (12") 칼럼을 갖춘 1리터의 둥근 바닥 플라스크를 사용하였다. 플라스크에, 실시예 45에서 합성된 FABE 254 g, COFA 255 g, 물 100 mL, 및 황산 5 g을 주입하여, 93℃의 포트 온도로 가열하였다. 헤드 온도를 89.7℃로 평형화하였다. 제 1 컷을 헤드 온도를 89 내지 94℃로 유지시키는 환류비로 수집하였다.A 1 liter round bottom flask with a 30.5 cm (12 ") column packed with a magnetic stirrer and a Rasching ring with a steel head and nitrogen inlet on top was used. In the flask, synthesized in Example 45 254 g of FABE, 255 g of COFA, 100 mL of water, and 5 g of sulfuric acid were injected and heated to a pot temperature of 93 ° C. The head temperature was equilibrated to 89.7 ° C. The first cut was made to have a head temperature of 89 to 94 ° C. Collected at reflux ratio to maintain.
반응물을 냉각시켜, 3일간 실온으로 정치시켰다. 포트의 GC 분석으로, 포트에 아이소부탄올 총 1 g이 존재함을 알 수 있다. 증류를 다시 개시하여, 각각 25 mL의 컷을 3개 더 수집하였다. 백 (100) mL의 물을 컷 #2를 수집한 후에 포트에 첨가하였다. 4개의 컷을 수집하여, 표 41에 나타낸 결과로 분석하였다.The reaction was cooled down and left at room temperature for 3 days. GC analysis of the pot reveals a total of 1 g of isobutanol present in the pot. Distillation was started again and three more cuts of 25 mL each were collected. Bag (100) mL of water was added to the pot after collecting cut # 2. Four cuts were collected and analyzed with the results shown in Table 41.
GC 분석은 30m FFAP 칼럼을 이용한 휴렛 팩커드 (Hewlett Packard) 6890 GC를 사용하여 행해졌다. 샘플을 아이소프로판올에 용해시키고, 1-펜탄올을 내부 표준물질로서 첨가하였다. 표준 곡선을 아이소부탄올, 아이소부틸 팔미테이트, 아이소부틸 스테아레이트, 아이소부틸 올레에이트, 아이소부틸 리놀레에이트, 아이소부틸 리놀레네이트, 아이소부틸 아라키데이트, 팔미트산, 스테아르산, 올레산, 리놀레산 및 리놀렌산에 대하여 작성하였다. FABE 함량은 부틸 에스테르의 합계로, COFA 함량은 지방산의 합계로 나타낸다.GC analysis was done using Hewlett Packard 6890 GC using a 30m FFAP column. The sample was dissolved in isopropanol and 1-pentanol was added as internal standard. Standard curves are isobutanol, isobutyl palmitate, isobutyl stearate, isobutyl oleate, isobutyl linoleate, isobutyl linoleate, isobutyl arachidate, palmitic acid, stearic acid, oleic acid, linoleic acid and linolenic acid Written for. FABE content is the sum of butyl esters and COFA content is the sum of fatty acids.
[표 41][Table 41]
실시예 47Example 47
유기산 촉매를 이용한 부탄올의 회수Recovery of Butanol Using Organic Acid Catalyst
자석 교반기, 열전대, 첨가 깔때기 및 스틸 헤드가 부착된 1리터 삼구 둥근 바닥 플라스크를 사용하였다. 플라스크에, 실시예 45에서와 같이 합성된 100 g FABE, 100 g COFA, 5 g p-톨루엔설폰산, 및 25 mL 물을 주입하였다. 초기 포트의 아이소부탄올 분석에 의해, 1.1 g의 아이소부탄올 존재 (FABE의 오염 물질)함을 알 수 있다. 포트를 125℃로 가열하였다. 포트가 116℃에 이르면, 헤드 온도는 96℃이었으며, 125 mL 물을 2.5시간에 걸쳐서 첨가하였다. 6개의 컷을 물이 첨가되는 시간에 걸쳐서 수집하여, 실시예 46에서와 같이 GC로 분석하였다. 결과는 표 42에 제공된다.A 1 liter three neck round bottom flask with magnetic stirrer, thermocouple, addition funnel and steel head was used. To the flask was injected 100 g FABE, 100 g COFA, 5 g p-toluenesulfonic acid, and 25 mL water, synthesized as in Example 45. Isobutanol analysis of the initial pot reveals the presence of 1.1 g of isobutanol (contaminants of FABE). The pot was heated to 125 ° C. When the pot reached 116 ° C., the head temperature was 96 ° C. and 125 mL water was added over 2.5 hours. Six cuts were collected over the time water was added and analyzed by GC as in Example 46. The results are provided in Table 42.
[표 42][Table 42]
남아있는 스틸 포트의 부탄올 분석에 의해, 0.9 g의 유리 아이소부탄올이 존재함을 알 수 있다. 분석된 초기 COFA:FABE 혼합물은 45 wt% FABE이었다. 분석된 최종 포트는 32 wt% FABE이었다.Butanol analysis of the remaining steel pot reveals that 0.9 g of free isobutanol is present. The initial COFA: FABE mixture analyzed was 45 wt% FABE. The final pot analyzed was 32 wt% FABE.
실시예 48Example 48
고온에서의 물을 이용한 FABE의 가수분해Hydrolysis of FABE with Water at High Temperature
1리터 오토클레이브에, 실시예 45에서와 같이 합성된 FABE 300 mL 및 물 300 mL를 주입하였다. 밀봉시키고 질소로 퍼징하였다. 교반을 개시한 다음에, 45분간에 걸쳐서 250℃로 가열시키고, 샘플을 도달 온도 후에 매시간 마다 회수하였다. 샘플을 실시예 46에서와 같이 GC로 분석하였다. 오일상 샘플은 표 43에 나타낸 시간 함수로서 조성을 나타내었다.Into a 1 liter autoclave, 300 mL of FABE and 300 mL of water synthesized as in Example 45 were injected. Sealed and purged with nitrogen. Agitation was initiated and then heated to 250 ° C. over 45 minutes and samples were recovered every hour after the attainment temperature. Samples were analyzed by GC as in Example 46. The oil phase sample showed composition as a function of time shown in Table 43.
[표 43][Table 43]
실시예 49Example 49
고온에서의 묽은 산을 이용한 FABE의 가수분해Hydrolysis of FABE with Dilute Acid at High Temperature
1리터 오토클레이브에, 실시예 45에서와 같이 합성된 FABE와 COFA의 75/25 혼합물 450 g 및 2% 황산 150 g을 주입하였다. 밀봉시키고 질소로 퍼징하였다. 교반을 개시한 다음에, 45분간에 걸쳐서 225℃로 가열시키고, 샘플을 온도에 도달한 후에 매시간 마다 회수하였다. 샘플을 실시예 46에서와 같이 GC로 분석하였다. 오일상 샘플은 표 44에 나타낸 시간 함수로서 조성을 나타내었다.In a 1 liter autoclave, 450 g of a 75/25 mixture of FABE and COFA synthesized as in Example 45 and 150 g of 2% sulfuric acid were injected. Sealed and purged with nitrogen. Agitation was initiated and then heated to 225 ° C. over 45 minutes and the samples were recovered every hour after reaching the temperature. Samples were analyzed by GC as in Example 46. The oily sample showed composition as a function of time shown in Table 44.
[표 44][Table 44]
실시예 50Example 50
100℃에서의 용매 중의 황산을 이용한 FABE의 가수분해Hydrolysis of FABE with Sulfuric Acid in Solvent at 100 ° C
실시예 45에서와 같이 합성된 FABE 5 g, 25% 황산 5 g, 및 다이에틸렌글리콜 다이메틸 에테르 60 g의 용액을 준비하였다. 십 (10) g의 용액을 5개의 바이알 각각에 첨가한 다음에, 밀봉시켰다. 모든 바이알을 100℃로 가열시키고, 1개의 바이알을 히터로부터 제거하여 매시간 마다 분석하였다. 생성된 조성물을 GC로 측정하여 (실시예 46에 기재된 바와 같이), 표 45에 나타낸다.A solution of 5 g FABE synthesized as in Example 45, 5
[표 45]TABLE 45
실시예Example 51 51
반응 증류에 의한 FABE의 가수분해Hydrolysis of FABE by Reactive Distillation
12리터 플라스크에는 상부에 공급 인렛 및 스틸 헤드가 설치된 절연된 5.1 ㎝ x 76.2 ㎝ (2"x30") 칼럼이 부착되어 있었다. 칼럼을 1리터의 프로-팍 (Pro-pak)? (316 SS 0.41 ㎝ (0.16")) 스틸 패킹 및 500 g의 앰버리스트? 36 고체산 촉매 (다우 (Dow))로 랜덤하게 패킹하였다. 플라스크에 6리터의 물을 주입하여, 끓게 하였다. 열을 제어하여, 물 증류 속도가 약 1.8 mL/min이 되게 하였다. 실시예 45에 기재된 방법에 따라 합성된 FABE를 2 g/min의 속도로 칼럼의 상부에 첨가하였다. 공급을 총 60분간 계속하였다. 증류를 추가로 30분간 계속하였다. 총 194 g의 증류액을 수집하고, 이는 2.1 g의 아이소부탄올을 함유하였다. 공급된 FABE의 양을 기준으로, FABE의 부탄올로의 9% 전환을 나타낸다.The 12-liter flask was attached to an insulated 5.1 cm x 76.2 cm (2 "x 30") column with a feed inlet and steel head on top. 1 liter of a column Pro-Pak (Pro-pak)? (316 SS 0.41 ㎝ (0.16 " )) as Amberlist of steel packing and 500 g? 36 solid acid catalyst (Dow (Dow)) was packed at random. Injected to 6 liters of water to the flask, and stir. Heat Controlled to bring the water distillation rate to about 1.8 mL / min FAFA synthesized according to the method described in Example 45 was added to the top of the column at a rate of 2 g / min The feed was continued for a total of 60 minutes. The distillation was continued for an additional 30 minutes A total of 194 g of distillate was collected, which contained 2.1 g of isobutanol, indicating a 9% conversion of FABE to butanol based on the amount of FABE fed.
실시예 52Example 52
역류 스팀에 의한 FABE의 가수분해Hydrolysis of FABE by Countercurrent Steam
실시예 50에 기재된 바와 같은 장치를 스틸 칼럼에 감은 히트 테이프를 첨가하여 변형시켰다. 칼럼의 상반부의 온도를 115℃로 조절하고, 칼럼의 하반부의 온도를 104℃로 조절하였다. 포트를 끓게 하여, 물이 1.5 내지 2 mL/min의 속도로 증류될 때까지 포트 열을 조절하였다. 실시예 45에 기재된 방법에 따라 합성된 FABE (346 g)를 증류를 계속하면서 3시간에 걸쳐서 패킹된 칼럼의 상부에 공급하였다. 공급 기간 후에, 증류를 추가로 90분간 계속하였다. 총 486 g의 증류액을 수집하고, 이는 30.1 g의 아이소부탄올을 함유하였다. 이는 FABE의 아이소부탄올로의 39% 전환을 나타낸다.The device as described in Example 50 was modified by the addition of a heat tape wound around a steel column. The temperature of the upper half of the column was adjusted to 115 ° C and the temperature of the lower half of the column to 104 ° C. The pot was boiled and the pot heat was adjusted until the water distilled at a rate of 1.5-2 mL / min. FABE (346 g) synthesized according to the method described in Example 45 was fed to the top of the packed column over 3 hours with distillation continuing. After the feeding period, distillation was continued for an additional 90 minutes. A total of 486 g of distillate was collected, which contained 30.1 g of isobutanol. This represents a 39% conversion of FABE to isobutanol.
실시예 53Example 53
불수용성 유기산에 의해 촉매되는 가수분해Hydrolysis Catalyzed by Insoluble Organic Acids
오일욕, 기계식 교반기, 질소 인렛, 수면 하의 워터 인렛, 및 스틸 헤드가 부착된 1리터 삼구 둥근 바닥 플라스크에, FABE 150 g, 물 50 g, 및 도데실벤젠 설폰산 5 g을 주입하였다. 오일욕을 95 내지 100℃로 가열시키고, 느린 질소 스위프 (sweep)를 개시하였다. 증류액 컷을 총 5시간 동안 30분 마다 수집하였다. 3시간 후에, 물을 15 mL/hr의 속도로 스틸 포트에 공급하였다. 증류액 컷에 대하여 실시예 46에 기재된 GC 방법에 의해 아이소부탄올 함량을 분석하였으며, 결과는 표 46에 나타나있다. FABE에 함유된 아이소부탄올의 약 44%가 5시간에 걸쳐서 수집되었다.Into a 1 liter three necked round bottom flask equipped with an oil bath, a mechanical stirrer, a nitrogen inlet, a water inlet under water, and a steel head, 150 g of FABE, 50 g of water, and 5 g of dodecylbenzene sulfonic acid were injected. The oil bath was heated to 95-100 ° C. and a slow nitrogen sweep was initiated. Distillate cuts were collected every 30 minutes for a total of 5 hours. After 3 hours, water was fed to the steel pot at a rate of 15 mL / hr. Distillate cuts were analyzed for isobutanol content by the GC method described in Example 46, and the results are shown in Table 46. About 44% of isobutanol contained in FABE was collected over 5 hours.
[표 46]TABLE 46
실시예 54Example 54
고체산 촉매에 의해 촉매되는 가수분해Hydrolysis Catalyzed by Solid Acid Catalyst
오일욕, 기계식 교반기, 수면 하의 질소 인렛, 수면 하의 워터 인렛, 및 스틸 헤드가 부착된 1리터 삼구 둥근 바닥 플라스크에, FABE 150 g 및 건조 앰버리스트 15 고체산 촉매 50 g을 주입하였다. 플라스크를 오일욕으로 110℃로 가열하고, 물을 시린지 펌프를 통해 15 mL/hr의 속도로 첨가하였다. 증류 분획을 총 5시간 동안 30분 마다 수집하였다. 분획에 대하여 실시예 46에 기재된 GC 방법에 의해 아이소부탄올 함량을 분석하였으며, 결과는 표 47에 나타나있다. FABE에 함유된 아이소부탄올의 이론량의 약 44%가 5시간에 걸쳐서 수집되었다.Into a 1 liter three necked round bottom flask with oil bath, mechanical stirrer, nitrogen inlet under water, water inlet under water, and steel head, 150 g of FABE and 50 g of
[표 47]TABLE 47
실시예 55Example 55
수용성 유기산 촉매에 의해 촉매되는 가수분해Hydrolysis Catalyzed by Water Soluble Organic Acid Catalyst
기계식 교반기, 수면 하의 질소 인렛, 수면 하의 워터 인렛, 및 스틸 헤드가 부착된 1리터 플라스크에, FABE 200 g 및 p-톨루엔설폰산 10 g을 주입하였다. 플라스크를 교반하여, 오일욕으로 110℃로 가열시키고, 그 때에 물을 시린지 펌프를 통해 20 mL/hr의 속도로 첨가하였다. 스틸 분획을 총 3시간 동안 30분 마다 수집하였다. 분획에 대하여 실시예 46에 기재된 GC 방법에 의해 아이소부탄올 함량을 분석하였으며, 결과는 표 48에 나타나있다. FABE에 함유된 아이소부탄올의 이론량의 약 30%가 5시간에 걸쳐서 수집되었다.200 g of FABE and 10 g of p-toluenesulfonic acid were injected into a 1 liter flask with a mechanical stirrer, a nitrogen inlet under water, a water inlet under water, and a steel head. The flask was stirred and heated to 110 ° C. in an oil bath, at which time water was added via a syringe pump at a rate of 20 mL / hr. Still fractions were collected every 30 minutes for a total of 3 hours. The fractions were analyzed for isobutanol content by the GC method described in Example 46 and the results are shown in Table 48. About 30% of the theoretical amount of isobutanol contained in FABE was collected over 5 hours.
[표 48]TABLE 48
실시예 56Example 56
발효로부터의 용매상의 가수분해Hydrolysis of Solvent Phase from Fermentation
A. 용매상 1A. Solvent Phase 1
실시예 17에 나타낸 발효로부터의 용매상을 실시예 46에 나타낸 GC 방법에 의해 분석하였으며, 결과는 표 49에 나타나있다. 분석은 주로 FAEE와 일치하는 체류 시간을 갖는 소량의 물질과 함께 지방산 및 FABE를 나타낸다. 다만 부틸 에스테르 및 산의 분석은 62% FABE 및 39% 지방산의 비율을 나타낸다.The solvent phase from the fermentation shown in Example 17 was analyzed by the GC method shown in Example 46 and the results are shown in Table 49. The analysis shows fatty acids and FABE with small amounts of material with predominantly residence times consistent with FAEE. But analysis of butyl ester and acid shows the proportion of 62% FABE and 39% fatty acid.
용매상 (1.25리터, 1090 g) 및 물 1.25리터를 1갤런 오토클레이브에 주입하였다. 오토클레이브를 밀봉시키고, 250℃로 가열시켜, 4시간 동안 그 온도로 유지하였다. 그 다음에, 오토클레이브를 냉각시키고 개방하여, 에멀젼을 얻었다. 혼합물을 셀라이트 베드를 통해 여과시키고, 층을 분리하였다. 유기층을 물 1리터로 3회 세정하였다. 그 다음에, 샘플을 50℃로 가열시키고, 6시간 동안 질소로 퍼징하였다. GC 분석은 i-BuOH가 없으며, 33% FABE 및 67% 지방산의 비율을 보여준다. 호박색 오일 (993.9 g)을 얻었다. 실시예 17의 발효로부터의 최초 용매상 및 가수분해 후의 용매상의 상세한 조성 분석은 표 50에 나타나있다.Solvent phase (1.25 liters, 1090 g) and 1.25 liters of water were injected into a 1 gallon autoclave. The autoclave was sealed and heated to 250 ° C. and held at that temperature for 4 hours. The autoclave was then cooled and opened to give an emulsion. The mixture was filtered through a celite bed and the layers separated. The organic layer was washed three times with 1 liter of water. The sample was then heated to 50 ° C. and purged with nitrogen for 6 hours. GC analysis is free of i-BuOH and shows a ratio of 33% FABE and 67% fatty acids. Obtained amber oil (993.9 g). Detailed compositional analysis of the initial solvent phase from the fermentation of Example 17 and the solvent phase after hydrolysis are shown in Table 50.
B. 용매상 2B. Solvent Phase 2
실시예 18에 나타낸 발효로부터의 용매상을 실시예 46에 나타낸 GC 방법에 의해 분석하였으며, 결과는 표 49에 나타나있다. 분석은 주로 FAEE와 일치하는 체류 시간을 갖는 소량의 물질과 함께 지방산 및 FABE를 나타낸다. 다만 부틸 에스테르 및 산의 분석은 45% FABE 및 55% 지방산의 비율을 나타낸다.The solvent phase from the fermentation shown in Example 18 was analyzed by the GC method shown in Example 46 and the results are shown in Table 49. The analysis shows fatty acids and FABE with small amounts of material with predominantly residence times consistent with FAEE. Only the analysis of butyl ester and acid shows the proportion of 45% FABE and 55% fatty acid.
용매 (1.25리터, 1100 g) 및 물 1.25리터를 1갤런 오토클레이브에 주입하였다. 오토클레이브를 밀봉시키고, 250℃로 가열시켜, 4시간 동안 그 온도로 유지하였다. 그 다음에, 오토클레이브를 냉각시키고 개방하여, 에멀젼을 얻었다. 혼합물을 셀라이트 베드를 통해 여과시키고, 층을 분리하였다. 유기층을 물 1리터로 3회 세정하였다. 그 다음에, 샘플을 50℃로 가열시키고, 6시간 동안 질소로 퍼징하였다. GC 분석은 i-BuOH가 없으며, 28% FABE 및 72% 지방산의 비율을 보여준다. 호박색 오일 (720.5 g)을 얻었다.Solvent (1.25 liters, 1100 g) and 1.25 liters of water were injected into a 1 gallon autoclave. The autoclave was sealed and heated to 250 ° C. and held at that temperature for 4 hours. The autoclave was then cooled and opened to give an emulsion. The mixture was filtered through a celite bed and the layers separated. The organic layer was washed three times with 1 liter of water. The sample was then heated to 50 ° C. and purged with nitrogen for 6 hours. GC analysis is free of i-BuOH and shows a ratio of 28% FABE and 72% fatty acids. Obtained amber oil (720.5 g).
[표 49][Table 49]
[표 50]TABLE 50
실시예Example 57 57
생성물 알코올의 회수 - 리파제 촉매를 사용한 가수분해Recovery of Product Alcohols-Hydrolysis Using Lipase Catalysts
FABE를 실시예 44에 기재된 방법에 따라 옥수수유 지방산으로부터 합성하였다. 노보자임 435 (노보 435, 칸디다 안타르크티카 리파제 B, 아크릴 수지에 고정됨)를 시그마 알드리치 (미국 미주리주 세인트루이스에 소재)로부터 구입하였다. 칸디다 안타르크티카 리파제 B를 노보자임즈 (미국 노스캐롤라이나주 프랭클린톤에 소재)로부터 구입하였다. t-BuOH, 아세톤, 에탄올, 메탄올, 및 글리세롤을 모두 시그마 알드리치 (미국 미주리주 세인트루이스에 소재)로부터 구입하였다. 가스 크로마토그래피 (GC) 분석을 위해, 사용된 가스 크로마토그래프는 휴렛 팩커드 5890 시리즈 II GC 크로마토그램이었으며, 메틸 펜타데카노에이트를 내부 표준물질로서 사용하였다.FABE was synthesized from corn oil fatty acid according to the method described in Example 44. Novozyme 435 (Novo 435, Candida Antarkica Lipase B, fixed on acrylic resin) was purchased from Sigma Aldrich (St. Louis, MO). Candida Antarctica Lipase B was purchased from Novozymes (Franklinton, NC). t- BuOH, acetone, ethanol, methanol, and glycerol were all purchased from Sigma Aldrich (St. Louis, MO). For gas chromatography (GC) analysis, the gas chromatograph used was Hewlett Packard 5890 Series II GC chromatogram, methyl pentadecanoate was used as internal standard.
A. 대기압, 40℃A. atmospheric pressure, 40 ℃
2 mL FABE와 5 mL 물의 혼합물에, 40 ㎎ 노보자임 435를 첨가하여, 반응 혼합물을 20 mL 바이알에 주입하고, 회전식 진탕기 (300 rpm)에서 40℃로 인큐베이션하였다. 반응 혼합물을 24시간의 반응 동안에 GC를 이용하여 분석하여, 표 51에 나타낸 하기 % 전환 프로파일을 형성하였다:To a mixture of 2 mL FABE and 5 mL water, 40 mg Novozyme 435 was added, the reaction mixture was poured into 20 mL vials and incubated at 40 ° C. on a rotary shaker (300 rpm). The reaction mixture was analyzed using GC during the 24 hour reaction to form the following% conversion profiles shown in Table 51:
[표 51][Table 51]
B. 대기압, 40℃, 65℃ 및 80℃, 유기 용매 비함유B. Atmospheric pressure, 40 ° C., 65 ° C. and 80 ° C., without organic solvent
본 실시예의 파트 A와 함께, 이들 데이터는 평형이 온도에 따라 어떻게 변화하는지를 나타낸다.Together with Part A of this example, these data show how the equilibrium changes with temperature.
1 mL FABE와 2 mL 물의 혼합물에, 20 ㎎ 노보자임 435를 첨가하여, 반응 혼합물을 격막으로 캡핑된 (septum-capped) 6 mL 바이알에서 40℃에서 45 h 동안 회전시켰다. 반응 혼합물을 GC를 사용하여 분석한 바, 평형 시에 FABE의 18.2% 전환을 나타내었다.To a mixture of 1 mL FABE and 2 mL water, 20 mg Novozyme 435 was added and the reaction mixture was spun at 40 ° C. for 45 h in a septum-capped 6 mL vial. The reaction mixture was analyzed using GC to show 18.2% conversion of FABE at equilibrium.
1 g FABE와 2 mL 물의 혼합물에, 20 ㎎ 노보자임 435를 첨가하여, 반응 혼합물을 격막으로 캡핑된 6 mL 바이알에서 65℃에서 42 h 동안 회전시켰다. 반응 혼합물을 GC를 사용하여 분석한 바, 평형 시에 FABE의 19.8% 전환을 나타내었다.To a mixture of 1 g FABE and 2 mL water, 20 mg Novozyme 435 was added and the reaction mixture was spun at 65 ° C. for 42 h in a 6 mL vial capped with a septum. The reaction mixture was analyzed using GC to show 19.8% conversion of FABE at equilibrium.
1 g FABE와 2 mL 물의 혼합물에, 20 ㎎ 노보자임 435를 첨가하여, 반응 혼합물을 격막으로 캡핑된 6 mL 바이알에서 80℃에서 42 h 동안 회전시켰다. 반응 혼합물을 GC를 사용하여 분석한 바, 평형 시에 FABE의 21.4% 전환을 나타내었다.To a mixture of 1 g FABE and 2 mL water, 20 mg Novozyme 435 was added and the reaction mixture was spun at 80 ° C. for 42 h in a 6 mL vial capped with a septum. The reaction mixture was analyzed using GC, showing 21.4% conversion of FABE at equilibrium.
C. 평형에 대한 유기 용매 (t-C. Organic Solvents for Equilibrium (t- BuOHBuOH )의 효과를 나타내는 예Example showing the effect of
0.25 mL FABE, 0.75 mL t-BuOH, 및 0.1 내지 0.3 mL 물을 함유하는 3개의 반응 혼합물에, 20 ㎎ 노보자임 435를 첨가하여, 격막으로 캡핑된 6 mL 바이알 중의 혼합물을 하룻밤 동안 40℃에서 회전하게 두었으며, 그 때에 혼합물은 평형에 이르렀다. 반응 혼합물을 24 h의 반응 후에 GC를 사용하여 분석한 바, 표 52에 주어진 77 내지 82% FABE 전환을 일으켰다. 유사한 반응 조건 하에 t-BuOH를 3-Me-3-펜탄올로 치환하면, 70 내지 80%의 FABE 가수분해 수율을 얻었다.To three reaction mixtures containing 0.25 mL FABE, 0.75 mL t-BuOH, and 0.1-0.3 mL water, 20 mg novozyme 435 was added to rotate the mixture in a 6 mL vial capped with a septum at 40 ° C. overnight. The mixture was then equilibrated. The reaction mixture was analyzed using GC after 24 h of reaction, resulting in 77-82% FABE conversion given in Table 52. Substitution of t-BuOH with 3-Me-3-pentanol under similar reaction conditions yielded a FABE hydrolysis yield of 70-80%.
[표 52]Table 52
D. 용매로서의 아세톤D. Acetone as a Solvent
0.25 mL FABE, 0.75 mL 아세톤 및 0.1 내지 0.3 mL 물을 함유하는 3개의 반응 혼합물에, 20 ㎎ 노보자임 435를 첨가하여, 격막으로 캡핑된 6 mL 바이알 중의 혼합물을 하룻밤 동안 40℃에서 회전하게 두었으며, 그 때에 혼합물은 평형에 이르렀다. 반응 혼합물을 24 h의 반응 후에 GC를 사용하여 분석한 바, 표 53에 주어진 71 내지 78% FABE 전환을 나타내었다.To three reaction mixtures containing 0.25 mL FABE, 0.75 mL acetone and 0.1-0.3 mL water, 20 mg Novozyme 435 was added to leave the mixture in a septum capped 6 mL vial overnight at 40 ° C. At that time, the mixture reached equilibrium. The reaction mixture was analyzed using GC after 24 h of reaction showing 71-78% FABE conversion given in Table 53.
[표 53]Table 53
E. E. FABEFABE 전환에 대한 가수분해 시의 i- I- at hydrolysis to conversion BuOHBuOH 의 제거 효과를 나타내는 예 - 대기압 하에 질소 Showing the effect of elimination of nitrogen-nitrogen under atmospheric pressure 퍼징Purging
25 mL 둥근 바닥 플라스크에, 2 mL FABE, 5 mL 물, 및 40 ㎎ 노보자임 435를 주입하였다. 반응 혼합물을 95℃로 가열시키고, 반응 시에 생성되는 i-BuOH를 반응 혼합물을 통해 질소를 버블링하여 제거하였다. 반응 시에 혼합물로부터 샘플을 취해, 유기상을 GC를 사용하여 분석하였다. 표 54에 나타낸 바와 같이, 6 h 후에 94%의 전환을 달성하였다:In a 25 mL round bottom flask, 2 mL FABE, 5 mL water, and 40 mg novozyme 435 were injected. The reaction mixture was heated to 95 ° C. and i-BuOH produced during the reaction was removed by bubbling nitrogen through the reaction mixture. Samples were taken from the mixture during the reaction and the organic phase was analyzed using GC. As shown in Table 54, 94% conversion was achieved after 6 h:
[표 54][Table 54]
F. 전환-진공 증류에 대한 가수분해 시의 i-BuOH의 제거 효과를 나타내는 예F. Example showing removal effect of i-BuOH during hydrolysis on conversion-vacuum distillation
25 mL 둥근 바닥 플라스크에, 3 mL FABE, 7.5 mL 물, 및 60 ㎎ 노보자임 435를 주입하였다. 플라스크를 진공 증류 장치에 부착시켜, 압력을 12.1 ㎪ (91㎜ Hg)로 설정하였다. 그 다음에 반응 혼합물을 74℃로 가열시키고, 반응 시에 생성되는 i-BuOH를 증류하여 제거하였다. 반응 시에 혼합물로부터 샘플을 취해, 유기상을 GC를 사용하여 분석하였다. 표 55에 나타낸 바와 같이, 10h 후에 91%의 전환을 달성하였다.To a 25 mL round bottom flask was injected 3 mL FABE, 7.5 mL water, and 60 mg Novozyme 435. The flask was attached to a vacuum distillation apparatus and the pressure was set to 12.1 kPa (91 mm Hg). The reaction mixture was then heated to 74 ° C. and i-BuOH produced during the reaction was distilled off. Samples were taken from the mixture during the reaction and the organic phase was analyzed using GC. As shown in Table 55, a conversion of 91% was achieved after 10 h.
[표 55]TABLE 55
G. 전환-진공 증류예에 대한 가수분해 시의 i-BuOH의 제거 효과를 나타내는 예- FABE/COFA 출발비 변화: 23% G. Example showing removal effect of i-BuOH during hydrolysis on conversion-vacuum distillation example-FABE / COFA starting ratio change: 23% FABEFABE :77% : 77% COFACOFA v/v v / v
25 mL 둥근 바닥 플라스크에, 0.69 mL FABE, 2.31 mL COFA, 7.5 mL 물, 및 60 ㎎ 노보자임 435를 주입하였다. 플라스크를 진공 증류 장치에 부착시켜, 압력을 12.1 ㎪ (91㎜ Hg)로 설정하였다. 그 다음에 반응 혼합물을 74℃로 가열시키고, 반응 시에 생성되는 i-BuOH를 증류하여 제거하였다. 반응 시에 혼합물로부터 샘플을 취해, 유기상을 GC를 사용하여 분석하였다. 표 56에 나타낸 바와 같이, 10 h 후에 98%의 전환을 달성하였다.To a 25 mL round bottom flask was injected 0.69 mL FABE, 2.31 mL COFA, 7.5 mL water, and 60 mg Novozyme 435. The flask was attached to a vacuum distillation apparatus and the pressure was set to 12.1 kPa (91 mm Hg). The reaction mixture was then heated to 74 ° C. and i-BuOH produced during the reaction was distilled off. Samples were taken from the mixture during the reaction and the organic phase was analyzed using GC. As shown in Table 56, a 98% conversion was achieved after 10 h.
[표 56]TABLE 56
H. 전환-진공 증류예에 대한 가수분해 시의 i-BuOH의 제거 효과를 나타내는 예-FABE/COFA 출발비 변화: 70% FABE :30% COFA v/v H. Example showing removal effect of i-BuOH during hydrolysis on conversion-vacuum distillation example - FABE / COFA starting ratio change: 70% FABE : 30% COFA v / v
25 mL 둥근 바닥 플라스크에, 2.1 mL FABE, 0.9 mL COFA, 7.5 mL 물, 및 60 ㎎ 노보자임 435를 주입하였다. 플라스크를 진공 증류 장치에 부착시켜, 압력을 12.1 ㎪ (91㎜ Hg)로 설정하였다. 그 다음에 반응 혼합물을 74℃로 가열시키고, 반응 시에 생성되는 i-BuOH를 증류하여 제거하였다. 반응 시에 혼합물로부터 샘플을 취해, 유기상을 GC를 사용하여 분석하였다. 표 57에 나타낸 바와 같이, 10 h 후에 96%의 전환을 달성하였다:In a 25 mL round bottom flask was injected 2.1 mL FABE, 0.9 mL COFA, 7.5 mL water, and 60 mg Novozyme 435. The flask was attached to a vacuum distillation apparatus and the pressure was set to 12.1 kPa (91 mm Hg). The reaction mixture was then heated to 74 ° C. and i-BuOH produced during the reaction was distilled off. Samples were taken from the mixture during the reaction and the organic phase was analyzed using GC. As shown in Table 57, 96% conversion was achieved after 10 h:
[표 57]Table 57
I. 진공 증류 조건 하에서의 FABE 가수분해 시의 유리 Cal B 효소를 나타내는 예I. Example showing free Cal B enzyme during FABE hydrolysis under vacuum distillation conditions
2개의 둥근 바닥 플라스크에, 각각 3 mL (2.7 g) FABE 및 7.5 mL H2O를 주입하였다. 하나의 혼합물에 5.9 ㎎ 칸디다 안타르크티카 리파제 B를 첨가하고, 다른 것에 0.59 ㎎ 효소를 첨가하였다. 반응 플라스크를 별도로 증류 장치에 연결하여, 12.1 ㎪ (91 ㎜ Hg)의 압력에 노출시켰다. 반응 혼합물을 65 내지 68℃로 가열하였다. 10시간에 걸쳐서 샘플을 반응 혼합물로부터 취해, 가스 크로마토그래피를 사용하여 분석하였다. 최종 FABE 전환은 각각, 96 및 78%이었다. 실험으로부터, 효소 농도를 10배로 감소시키면, 속도 및 전환을 각각, 3x 및 18%로 감소시키는 것을 알 수 있다. 결과는 표 58에 나타나있다.Two round bottom flasks were charged with 3 mL (2.7 g) FABE and 7.5 mL H 2 O, respectively. 5.9 mg Candida antarctica lipase B was added to one mixture and 0.59 mg enzyme was added to the other. The reaction flask was separately connected to a distillation apparatus and exposed to a pressure of 12.1 kPa (91 mm Hg). The reaction mixture was heated to 65-68 ° C. Over 10 hours samples were taken from the reaction mixture and analyzed using gas chromatography. Final FABE conversion was 96 and 78%, respectively. From experiments, it can be seen that reducing the enzyme concentration by 10-fold reduces the rate and conversion to 3x and 18%, respectively. The results are shown in Table 58.
[표 58]TABLE 58
실시예 58Example 58
생성물 알코올의 회수 - 에스테르 교환Recovery of product alcohols-transesterification
FABE를 실시예 44에 기재된 방법에 따라 옥수수유 지방산으로부터 합성하였다; 노보자임 435 (칸디다 안타르크티카 리파제 B, 아크릴 수지에 고정됨)를 시그마 알드리치 (미국 미주리주 세인트루이스에 소재)로부터 구입하였다. 칸디다 안타르크티카 리파제 B를 노보자임즈 (미국 노스캐롤라이나주 프랭클린톤에 소재)로부터 구입하였다. t-BuOH, 아세톤, 에탄올, 메탄올, 및 글리세롤을 모두 시그마 알드리치 (미국 미주리주 세인트루이스에 소재)로부터 구입하였다. GC 분석을 위해, 사용된 가스 크로마토그래프는 휴렛 팩커드 5890 시리즈 II GC 크로마토그램이었으며, 메틸 펜타데카노에이트를 내부 표준물질로서 사용하였다.FABE was synthesized from corn oil fatty acid according to the method described in Example 44; Novozyme 435 (Candida antarctica lipase B, fixed in acrylic resin) was purchased from Sigma Aldrich (St. Louis, MO). Candida Antarctica Lipase B was purchased from Novozymes (Franklinton, NC). t-BuOH, acetone, ethanol, methanol, and glycerol were all purchased from Sigma Aldrich (St. Louis, MO). For GC analysis, the gas chromatograph used was Hewlett Packard 5890 Series II GC chromatogram, methyl pentadecanoate was used as internal standard.
A. 리파제 시험 - FABE에서 FAME로A. Lipase Test-FABE to FAME
사용된 시약은 t-BuOH (알드리치); MeOH (알드리치); 노보자임 435 (알드리치); PS30 (버크홀데리아 세파시아, 미국 일리노이주 엘진에 소재하는 아마노 엔자임즈, 인코포레이티드 (Amano Enzymes, Inc)); 리폴라제? 100T (서모마이세스 라누기노사, 실리카에 고정됨, 미국 노스캐롤라이나주 프랭클린톤에 소재하는 노보자임즈); 리폴라제? 100L (서모마이세스 라누기노사, 미국 노스캐롤라이나주 프랭클린톤에 소재하는 노보자임즈); 리포자임? TLIM (고정화 서모마이세스 라누기노사, 미국 노스캐롤라이나주 프랭클린톤에 소재하는 노보자임즈); 리포클린? 2000T (리파제의 고정화 혼합물; 미국 노스캐롤라이나주 프랭클린톤에 소재하는 노보자임즈); NZL-103-LYO (리조무코르 미에헤이 유래의 리파제, 미국 노스캐롤라이나주 프랭클린톤에 소재하는 노보자임즈)이었다.Reagents used were t-BuOH (Aldrich); MeOH (Aldrich); Novozyme 435 (Aldrich); PS30 (Amano Enzymes, Inc., Berkholderia Sephacia, Elgin, Ill.); Repolarase? 100T (thermomyses ranuginosa, fixed in silica, Novozymes, Franklinton, NC); Repolarase? 100L (Thermomysis ranuginosa, Novozymes, Franklinton, NC); Lipozyme? TLIM (Fixed Thermomyses ranuginosa, Novozymes, Franklinton, NC); Lipoclin? 2000T (immobilization mixture of lipase; Novozymes, Franklinton, NC); NZL-103-LYO (lipase from Rizomukor Miehei, Novozymes, Franklinton, NC).
6 mL 바이알에, 500 ㎎ FABE (1.48 mmol), 400 ㎕ t-BuOH, 60 ㎕ MeOH (1.48 mmol), 3 ㎕ 물, 및 2.5 ㎎ 리파제를 첨가하였다 (표 57 참조). 생성된 혼합물을 인큐베이터/진탕기에 주입하여, 40℃에서 하룻밤 동안 방치하였다. 반응 혼합물의 GC 분석은 9 내지 56%의 전환을 나타내었다. 결과는 표 59에 나타나있다.To a 6 mL vial, 500 mg FABE (1.48 mmol), 400 μl t-BuOH, 60 μl MeOH (1.48 mmol), 3 μl water, and 2.5 mg lipase were added (see Table 57). The resulting mixture was injected into an incubator / shaker and left overnight at 40 ° C. GC analysis of the reaction mixture showed 9 to 56% conversion. The results are shown in Table 59.
[표 59][Table 59]
B. FABE에서 FAME로의 변환 - 메탄올의 양의 최적화B. FABE to FAME Conversion-Optimizing the Amount of Methanol
6 mL 바이알에, 500 ㎎ FABE (1.48 mmol), 400 ㎕ t-BuOH, 60 내지 240 ㎕ MeOH (1.48 내지 5.92 mmol), 3 ㎕ 물, 및 2.5 ㎎ 노보자임 435를 첨가하였다. 생성된 혼합물을 인큐베이터/진탕기에 주입하여, 40℃에서 하룻밤 동안 방치하였다. 반응 혼합물의 GC 분석은 표 60에 나타낸 바와 같이, 53 내지 73%의 전환을 나타내었다.To a 6 mL vial, 500 mg FABE (1.48 mmol), 400 μl t-BuOH, 60-240 μl MeOH (1.48-5.92 mmol), 3 μl water, and 2.5 mg novozyme 435 were added. The resulting mixture was injected into an incubator / shaker and left overnight at 40 ° C. GC analysis of the reaction mixture showed a conversion of 53-73%, as shown in Table 60.
[표 60]TABLE 60
C. 효소의 양의 최적화 - FABE에서 FAME로C. Optimization of the amount of enzyme-from FABE to FAME
6 mL 바이알에, 500 ㎎ FABE (1.48 mmol), 400 ㎕ t-BuOH, 132 ㎕ MeOH (3.26 mmol), 및 5 내지 25 ㎎ 노보자임 435를 첨가하였다. 생성된 혼합물을 인큐베이터/진탕기에 주입하여, 40℃에서 하룻밤 동안 방치하였다. 반응 혼합물의 GC 분석은 표 61에 나타낸 바와 같이, 76 내지 79%의 전환을 나타내었다.To a 6 mL vial, 500 mg FABE (1.48 mmol), 400 μl t-BuOH, 132 μl MeOH (3.26 mmol), and 5-25 mg novozyme 435 were added. The resulting mixture was injected into an incubator / shaker and left overnight at 40 ° C. GC analysis of the reaction mixture showed 76-79% conversion, as shown in Table 61.
[표 61]TABLE 61
D. 용매 (t-D. Solvent (t- BuOHBuOH )의 양의 최소화 - Minimize the amount of)- FABEFABE 에서 in FAMEFAME 로in
6 mL 바이알에, 500 ㎎ FABE (1.48 mmol), 0 내지 300 ㎕ t-BuOH, 132 ㎕ MeOH (3.26 mmol), 및 10 ㎎ 노보자임 435를 첨가하였다. 생성된 혼합물을 인큐베이터/진탕기에 주입하여, 40℃에서 하룻밤 동안 방치하였다. 반응 혼합물의 GC 분석은 표 62에 나타낸 바와 같이, 30 내지 81%의 전환을 나타내었다.To a 6 mL vial, 500 mg FABE (1.48 mmol), 0-300 μl t-BuOH, 132 μl MeOH (3.26 mmol), and 10 mg novozyme 435 were added. The resulting mixture was injected into an incubator / shaker and left overnight at 40 ° C. GC analysis of the reaction mixture showed a conversion of 30-81%, as shown in Table 62.
[표 62][Table 62]
E. 용매 (3-Me-3-펜탄올)의 양의 최소화 - FABE에서 FAME로E. Minimization of the amount of solvent (3-Me-3-pentanol)-from FABE to FAME
6 mL 바이알에, 500 ㎎ FABE (1.48 mmol), 0 내지 300 ㎕ 3-Me-3-펜탄올, 132 ㎕ MeOH (3.26 mmol), 및 10 ㎎ 노보자임 435를 첨가하였다. 생성된 혼합물을 인큐베이터/진탕기에 주입하여, 40℃에서 하룻밤 동안 방치하였다. 반응 혼합물의 GC 분석은 표 63에 나타낸 바와 같이, 30 내지 78%의 전환을 나타내었다.To a 6 mL vial, 500 mg FABE (1.48 mmol), 0-300 μl 3-Me-3-pentanol, 132 μl MeOH (3.26 mmol), and 10 mg novozyme 435 were added. The resulting mixture was injected into an incubator / shaker and left overnight at 40 ° C. GC analysis of the reaction mixture showed a conversion of 30 to 78%, as shown in Table 63.
[표 63]Table 63
F. 용매없이 FABE에서 FAME로의 전환F. FABE to FAME Conversion without Solvent
FABE (500 ㎎, 1.48 mmol)와 메탄올 (0.13 ㎕, 3.25 mmol)의 혼합물에, 40 ㎎ 노보자임 435를 첨가하여, 반응 혼합물을 40℃에서 하룻밤 동안 교반하였다. 그 다음에 혼합물을 여과하여, GC로 분석한 바, 76% 전환을 나타내었다.To a mixture of FABE (500 mg, 1.48 mmol) and methanol (0.13 μl, 3.25 mmol), 40 mg novozyme 435 was added and the reaction mixture was stirred at 40 ° C. overnight. The mixture was then filtered and analyzed by GC showing 76% conversion.
G. 효소 재순환 - FABE에서 FAME로G. Enzyme Recycling-FABE to FAME
6 mL 바이알에, 500 ㎎ FABE (1.48 mmol), 400 ㎕ t-BuOH, 132 ㎕ MeOH (3.26 mmol), 및 10 ㎎ 노보자임 435를 첨가하였다. 생성된 혼합물을 인큐베이터/진탕기에 주입하여, 40℃에서 하룻밤 동안 방치하였다. 그 후에, 반응 혼합물을 여과하고, GC를 사용하여 전환을 분석하고, 고정화 효소를 함유하는 필터 케이크를 FABE에서 FAME로의 다른 전환을 위해 사용하였다. 프로세스를 10회 반복하였다 (표 64). 실험으로부터, 하룻밤 동안의 반응에서 전환 손실없이 효소를 10회 이하로 재순환할 수 있음을 알 수 있다.To a 6 mL vial, 500 mg FABE (1.48 mmol), 400 μl t-BuOH, 132 μl MeOH (3.26 mmol), and 10 mg novozyme 435 were added. The resulting mixture was injected into an incubator / shaker and left overnight at 40 ° C. Thereafter, the reaction mixture was filtered, the conversion was analyzed using GC, and a filter cake containing immobilized enzyme was used for another conversion from FABE to FAME. The process was repeated 10 times (Table 64). From the experiment, it can be seen that the enzyme can be recycled up to 10 times without loss of conversion in the overnight reaction.
[표 64][Table 64]
H. FABE에서 FAEE로의 전환H. FABE to FAEE Conversion
격막으로 캡핑된 6 mL 바이알에, 0.8 mL FABE (2.08 mmol) 및 0.2 mL EtOH (3.43 mmol)를 첨가하여, 단일상을 형성시켰다. 바이알에 효소를 첨가하지 않거나 20 ㎎ 노보자임 435를 첨가하였다. 그 다음에 바이알을 인큐베이터 진탕기 (300 rpm)에서 17 h 동안 25℃ 및 40℃로 인큐베이션하고, 그 후에 용액을 가스 크로마토그래피로 분석한 바, 표 65에 나타낸 함량 및 FABE에서 FAEE로의 % 전환을 제공하였다.To a 6 mL vial capped with a septum, 0.8 mL FABE (2.08 mmol) and 0.2 mL EtOH (3.43 mmol) were added to form a single phase. No enzyme was added to the vial or 20 mg Novozyme 435 was added. The vials were then incubated at 25 ° C. and 40 ° C. for 17 h in an incubator shaker (300 rpm), after which the solution was analyzed by gas chromatography to determine the contents shown in Table 65 and the percent conversion from FABE to FAEE. Provided.
[표 65]TABLE 65
실시예 59Example 59
FABE의 글리세롤 분해Glycerol Degradation of FABE
격막으로 캡핑된 6 mL 바이알에, 각각 0.75 mL t-BuOH, 0.25 mL FABE, 0.1 mL (0.126 g) 글리세롤 + 4 ㎕ H2O, 효소 20 ㎎을 첨가하여, 단일상을 형성하였다. 반응물을 300 rpm의 회전식 진탕기에서 40℃에서 다양한 리파제와 인큐베이션하였다. 20 h 후에, 샘플을 가스 크로마토그래피로 분석한 바, 표 66에 나타낸 함량을 얻었다. COFA 및 FABE 함량의 비교는 생성물이 i-BuOH, 및 COFA와 아실 글리세롤의 혼합물 (몰 기준으로 ~64% 아실 글리세롤/36% COFA)임을 나타낸다.To 6 mL vials capped with septum, 0.75 mL t-BuOH, 0.25 mL FABE, 0.1 mL (0.126 g) glycerol + 4 μl H 2 O, 20 mg enzyme, respectively, were formed to form a single phase. The reaction was incubated with various lipases at 40 ° C. on a rotary shaker at 300 rpm. After 20 h, the sample was analyzed by gas chromatography to obtain the contents shown in Table 66. Comparison of the COFA and FABE content indicates that the product is i-BuOH and a mixture of COFA and acyl glycerol (˜64% acyl glycerol / 36% COFA on a molar basis).
[표 66]TABLE 66
A. 물 및 글리세롤/A. Water and Glycerol / FABEFABE 의존도 Dependence
격막으로 캡핑된 6 mL 바이알에, 0.75 mL t-BuOH, 0.25 mL FABE, 0.1 또는 0.2 g 글리세롤 + 각 20 ㎎의 아마노 PS-30 또는 노보자임 435을 첨가하여, 단일상을 형성하였다. 물은 첨가하지 않았다. 반응물을 300 rpm의 회전식 진탕기에서 40℃로 인큐베이션하였다. 20 h 후에, 샘플을 가스 크로마토그래피로 분석한 바, 표 67에 나타낸 함량을 얻었다. COFA 및 FABE 함량의 비교는 생성물이 i-BuOH 및 주로 아실 글리세롤 (주로 모노글리세라이드)임을 나타낸다. 이전의 실시예와 관련하여, 아실 글리세롤 형태의 생성물의 비율은 물이 첨가되지 않고, 글리세롤/FABE가 증가되면 증가한다 (몰 기준으로 ~91% 아실 글리세롤/9% COFA, 1.6 글리세롤/FABE, mol/mol 사용, 및 몰 기준으로 ~95% 아실 글리세롤/5% COFA, 3.2 글리세롤/FABE, mol/mol 사용). 물이 첨가되지 않으면, 아마노 PS-30의 효소 활성이 제거된다. 그러나, 고정화되는 아크릴 수지 중에 물을 갖는 (~3% w/w) 노보자임 435는 여전히 활성을 나타낸다.To a 6 mL vial capped with a septum, 0.75 mL t-BuOH, 0.25 mL FABE, 0.1 or 0.2 g glycerol + 20 mg each of Amano PS-30 or Novozyme 435 was added to form a single phase. No water was added. The reaction was incubated at 40 ° C. on a 300 rpm rotary shaker. After 20 h, the sample was analyzed by gas chromatography to yield the contents shown in Table 67. Comparison of the COFA and FABE content indicates that the product is i-BuOH and mainly acyl glycerol (mainly monoglycerides). In relation to the previous examples, the proportion of the product in the form of acyl glycerol increases without water being added and increases with glycerol / FABE (˜91% acyl glycerol / 9% COFA, 1.6 glycerol / FABE, mol on a molar basis). / mol use, and ˜95% acyl glycerol / 5% COFA, 3.2 glycerol / FABE, mol / mol on a molar basis). If no water is added, the enzymatic activity of Amano PS-30 is removed. However, Novozyme 435 with water (~ 3% w / w) in the acrylic resin to be immobilized is still active.
[표 67]TABLE 67
B. 효소 농도 의존도B. Enzyme Concentration Dependency
격막으로 캡핑된 6 mL 바이알에, 0.75 mL t-BuOH, 0.25 mL FABE, 0.2 g 글리세롤 (글리세롤/FABE 3.2/1, mol/mol) + 2 또는 20 ㎎의 노보자임 435 (노보 435)를 첨가하였다. 물은 첨가하지 않았다. 반응물을 300 rpm의 회전식 진탕기에서 40℃로 인큐베이션하여, 반응물을 시간 함수로서 가스 크로마토그래피로 분석하였다. 수율은 표 68에 나타나있다. 반응한 FABE의 약 97%가 몰 기준으로 아실 글리세롤 (주로 모노글리세라이드)로 전환되었다.To a 6 mL vial capped with a septum, 0.75 mL t-BuOH, 0.25 mL FABE, 0.2 g glycerol (glycerol / FABE 3.2 / 1, mol / mol) + 2 or 20 mg of Novozyme 435 (Novo 435) was added. . No water was added. The reaction was incubated at 40 ° C. on a 300 rpm rotary shaker, and the reaction was analyzed by gas chromatography as a function of time. Yields are shown in Table 68. About 97% of the reacted FABEs were converted to acyl glycerol (mainly monoglycerides) on a molar basis.
[표 68]TABLE 68
반응 속도는 효소 농도에 대하여 직선적으로 변화하며, 2 및 20 ㎎의 노보자임 435에 대한 t1 /2가 각각, 208분 및 20분이다. 그러나, 반응물은 24 h 후에 거의 동일한 수율의 FABE 전환에 도달하였다.The reaction rate is linearly changed, and 2 and 20 ㎎ of Novozymes 435 to about 1 t / 2, respectively, 208 minutes and 20 minutes with respect to enzyme concentration. However, the reaction reached almost the same yield of FABE conversion after 24 h.
이러한 최후 반응은 0.75 mL의 t-BuOH 대신에 0.75 mL의 3-메틸-3-펜탄올을 사용하여 반복되었다. 24 h 후에 얻어진 FABE 가수분해 정도는 두 용매에 대하여 동일하였다. 3-메틸-3-펜탄올의 이점은 122℃의 비점으로, i-BuOH가 먼저 순수한 형태 (비점 108℃)로 증류될 수 있다는 것이다. 그 다음에 3-메틸-3-펜탄올이 증류되어, 가수분해 반응을 위해 재순환될 수 있으므로, FABE의 생성 시에 재사용을 위해 발효 탱크로 재순환되는 아실 글리세롤, COFA, 및 글리세롤이 농축물에 존재할 수 있다. 삼차 알코올은 단독으로 용매로서 작용하며, CALB의 존재 하에 지방산과 반응하여 지방산 알킬 에스테르를 생성하지 않는 이점을 갖는다.This final reaction was repeated using 0.75 mL of 3-methyl-3-pentanol instead of 0.75 mL of t-BuOH. The degree of FABE hydrolysis obtained after 24 h was the same for both solvents. The advantage of 3-methyl-3-pentanol is that with a boiling point of 122 ° C., i-BuOH can first be distilled into pure form (boiling point 108 ° C.). Since 3-methyl-3-pentanol can then be distilled and recycled for the hydrolysis reaction, acyl glycerol, COFA, and glycerol present in the concentrate are recycled to the fermentation tank for reuse in the production of FABE. Can be. Tertiary alcohols act alone as a solvent and have the advantage of not reacting with fatty acids in the presence of CALB to produce fatty acid alkyl esters.
C. C. 유기 공용매Organic cosolvent 부재 하에서의 In the absence FABEFABE 의 글리세롤 분해 (Glycerol breakdown ( FABEFABE 에서 in COFACOFA + 아실 글리세롤로) - 글리세롤 농도 의존도 + Acyl glycerol)-glycerol concentration dependence
1그램 (1 g)의 FABE를 2 mL의 50, 70, 90, 및 100% (w/w) 글리세롤과 혼합하여, 20 ㎎ 리포본드 (Lipobond) (이탈리아 트리에스테에 소재하는 스프린 테크놀러지즈 (Sprin Technologies))의 존재 하에 격막으로 캡핑된 6 mL 바이알에 주입하였다. 바이알을 62℃에서 24 h 동안 빙글빙글 회전시켜 텀블링시켰다. 수성상 중의 글리세롤 농도의 증가에 따라, 아실 글리세롤 형태의 생성물의 비율은 증가한다 (표 69, 주로 모노글리세라이드). 그러나, FABE 전환도는 글리세롤 농도 의존도를 나타내지 않는다.1 gram (1 g) of FABE was mixed with 2 mL of 50, 70, 90, and 100% (w / w) glycerol to obtain 20 mg Lipobond (Sprinkler Technologies, Trieste, Italy). Sprin Technologies)) into 6 mL vials capped with a septum. The vial was tumbled by spinning at 62 ° C. for 24 h. As the glycerol concentration in the aqueous phase increases, the proportion of product in the acyl glycerol form increases (Table 69, mainly monoglycerides). However, FABE conversion does not indicate glycerol concentration dependence.
[표 69]TABLE 69
실시예 60Example 60
COFACOFA 의 of FAEEFAEE 및 And 모노아실Monoacyl 글리세롤로의 전환 Conversion to glycerol
하기 실시예는 COFA가 고정화 효소를 사용하여 온화한 조건 하에 고 수율로 EtOH 또는 글리세롤로 에스테르화될 수 있음을 보여준다.The examples below show that COFA can be esterified with EtOH or glycerol in high yield under mild conditions using immobilized enzymes.
노보자임 435 (칸디다 안타르크티카 리파제 B, 아크릴 수지에 고정됨)를 시그마 알드리치 (미국 미주리주 세인트루이스에 소재)로부터 구입하였다. 아세톤, t-BuOH, 에탄올, 메탄올, 및 글리세롤을 모두 시그마 알드리치 (미국 미주리주 세인트루이스에 소재)로부터 구입하였다. GC 분석을 위해, 사용된 가스 크로마토그래프는 휴렛 팩커드 5890 시리즈 II GC 크로마토그램이었으며, 메틸 펜타데카노에이트를 내부 표준물질로서 사용하였다.Novozyme 435 (Candida antarctica lipase B, fixed in acrylic resin) was purchased from Sigma Aldrich (St. Louis, MO). Acetone, t-BuOH, ethanol, methanol, and glycerol were all purchased from Sigma Aldrich (St. Louis, MO). For GC analysis, the gas chromatograph used was Hewlett Packard 5890 Series II GC chromatogram, methyl pentadecanoate was used as internal standard.
A. 에탄올을 사용한 COFA에서 FAEE + i-BuOH로의 전환A. COFA to FAEE + i-BuOH Conversion with Ethanol
옥수수유 지방산 (COFA, 0.25 g)을 2.0 mL EtOH에 용해시켜 단일상을 형성하였다. 아크릴 수지 (노보자임 435)에 고정된 칸디다 안타르크티카 리파제 B (CALB) 20 ㎎을 첨가하여 (효소 1.7 ㎎ 함유), 현탁액을 회전식 진탕기 (300 rpm)에서 40℃에서 격막 캡으로 밀봉된 6 mL 글래스 바이알에서 24 h 동안 인큐베이션하였다. 반응은 COFA의 98%가 FAEE (지방산 에틸 에스테르)로 전환된 것으로 사실상 완료되었다. 24 h 후의 GC 분석은 표 70에 나타낸 바와 같이, COFA에서 지방산 에틸 에스테르로의 98% 전환을 나타내었다.Corn oil fatty acid (COFA, 0.25 g) was dissolved in 2.0 mL EtOH to form a single phase. By adding 20 mg of Candida antarctica lipase B (CALB) immobilized on acrylic resin (Novozyme 435) (containing 1.7 mg of enzyme), the suspension was sealed with a diaphragm cap at 40 ° C. on a rotary shaker (300 rpm). Incubate for 24 h in mL glass vials. The reaction was virtually complete with 98% of COFA converted to FAEE (fatty acid ethyl ester). GC analysis after 24 h showed 98% conversion from COFA to fatty acid ethyl esters, as shown in Table 70.
[표 70][Table 70]
B. 글리세롤을 사용한, COFA에서 모노아실글리세라이드 (MAG) + i-BuOH로의 전환B. Conversion of COFA to Monoacylglycerides (MAG) + i-BuOH with Glycerol
옥수수유 지방산 (COFA, 0.25 g) 및 0.325 g의 글리세롤을 2.0 mL 아세톤에 용해시켰다. 대부분의 성분이 용해되어 있는 큰 상부상 및 작은 잔류 글리세롤 함유상이 존재하였다. 아크릴 수지 (노보자임 435)에 고정된 칸디다 안타르크티카 리파제 B (CALB) 20 ㎎을 첨가하여 (효소 1.7 ㎎ 함유), 현탁액을 회전식 진탕기 (300 rpm)에서 40℃에서 격막 캡으로 밀봉된 6 mL 글래스 바이알에서 24 h 동안 인큐베이션하였다. 상부상의 GC는 87%의 COFA가 아실 글리세라이드로 전환되었음을 나타내었다 (주로 모노아실글리세라이드인 것으로 예상됨). 결과는 표 71에 나타나있다.Corn oil fatty acid (COFA, 0.25 g) and 0.325 g of glycerol were dissolved in 2.0 mL acetone. There was a large top phase and a small residual glycerol containing phase in which most components were dissolved. By adding 20 mg of Candida antarctica lipase B (CALB) immobilized on acrylic resin (Novozyme 435) (containing 1.7 mg of enzyme), the suspension was sealed with a diaphragm cap at 40 ° C. on a rotary shaker (300 rpm). Incubate for 24 h in mL glass vials. GC on the top indicated that 87% of COFA was converted to acyl glycerides (expected primarily to be monoacylglycerides). The results are shown in Table 71.
[표 71][Table 71]
실시예Example 61 61
COFA에서 FAME로의 전환COFA to FAME Conversion
하기 실시예는 COFA가 고정화 리파제를 사용하여 온화한 조건 하에 고 수율로 MeOH, EtOH 또는 글리세롤로 에스테르화될 수 있음을 보여준다.The following examples show that COFA can be esterified with MeOH, EtOH or glycerol in high yield under mild conditions using immobilized lipase.
A. 용매 없이 COFA에서 FAME로의 전환A. COFA to FAME Conversion without Solvent
6 mL 바이알에, 500 ㎎ COFA (1.48 mmol), 132 ㎕ MeOH (3.26 mmol), 및 10 ㎎ 노보자임 435를 첨가하였다. 생성된 혼합물을 인큐베이터/진탕기에 주입하여, 40℃에서 하룻밤 동안 방치하였다. 반응 혼합물의 GC 분석은 95% 전환을 나타내었다.To a 6 mL vial, 500 mg COFA (1.48 mmol), 132 μl MeOH (3.26 mmol), and 10 mg novozyme 435 were added. The resulting mixture was injected into an incubator / shaker and left overnight at 40 ° C. GC analysis of the reaction mixture showed 95% conversion.
B. COFA에서 FAME로의 반응의 경시 변화 측정B. Determining Changes Over Time of COFA to FAME Reactions
6 mL 바이알에, 500 ㎎ COFA (1.48 mmol), 132 ㎕ MeOH (3.26 mmol), 및 10 ㎎ 노보자임 435를 첨가하였다. 샘플을 인큐베이터/진탕기에서 40℃로 인큐베이션하고, 반응 동안에 시점을 취해 GC를 사용하여 분석하였다. 결과는 표 72에 나타나있다.To a 6 mL vial, 500 mg COFA (1.48 mmol), 132 μl MeOH (3.26 mmol), and 10 mg novozyme 435 were added. Samples were incubated at 40 ° C. in an incubator / shaker and time points were taken during the reaction and analyzed using GC. The results are shown in Table 72.
[표 72][Table 72]
C. COFA→FAME 반응에 더 많은 양의 MeOH의 첨가C. Addition of Higher MeOH to COFA → FAME Reaction
6 mL 바이알에, 500 ㎎ COFA (1.48 mmol), 180, 240, 300, 또는 1320 ㎕ MeOH (4.44, 5.92, 7.41, 및 14.82 mmol), 및 10 ㎎ 노보자임 435를 첨가하였다. 생성된 혼합물을 인큐베이터/진탕기에 주입하여, 40℃에서 하룻밤 동안 방치하였다. 반응 혼합물의 GC 분석은 96 내지 97% 전환을 나타내었다. 그 결과는 표 73에 나타나있다.To a 6 mL vial, 500 mg COFA (1.48 mmol), 180, 240, 300, or 1320 μl MeOH (4.44, 5.92, 7.41, and 14.82 mmol), and 10 mg novozyme 435 were added. The resulting mixture was injected into an incubator / shaker and left overnight at 40 ° C. GC analysis of the reaction mixture showed 96-97% conversion. The results are shown in Table 73.
[표 73][Table 73]
실시예 62Example 62
본 실시예는 증류 폐액으로부터의 고형물의 제거 및 고형물로부터 지방산, 에스테르, 및 트라이글리세라이드를 회수하기 위한 데솔벤타이저에 의한 추출을 예시하였다. 발효 시에, 고형물은 전 증류 폐액으로부터 분리되고, 데솔벤타이저로 공급되어, 스팀 997.9㎏/hr (1.1 톤/hr)과 접촉된다. 전 증류 폐액 습윤 케이크 (추출기 공급물), 용매, 추출기 미셀라, 및 추출기 배출 고형물의 유량은 표 74에 나타낸 바와 같다. 표의 값은 간략하게, 톤/hr이다.This example illustrates the removal of solids from distillation waste and extraction by desolventizers to recover fatty acids, esters, and triglycerides from solids. Upon fermentation, the solids are separated from the total distillation waste liquor and fed to the desolventizer and contacted with steam 997.9 kg / hr (1.1 tons / hr). The flow rates of the whole distillation waste liquid wet cake (extractor feed), solvent, extractor micellar, and extractor discharge solids are shown in Table 74. The values in the table are simply tons / hr.
[표 74][Table 74]
데솔벤타이저로부터 배출되는 고형물은 건조기에 공급된다. 데솔벤타이저로부터 배출되는 증기는 헥산 499.0 ㎏/hr (0.55 톤/hr) 및 물 999.7 ㎏/hr (1.102 톤/hr)을 함유한다. 이러한 스트림은 응축되어, 디캔터로 공급된다. 디캔터로부터 배출되는 물 풍부상은 헥산 약 360 ppm을 함유한다. 이러한 스트림은 증류탑에 공급되며, 여기서 헥산이 물 풍부 스트림으로부터 제거된다. 증류탑의 상부로부터 배출되는 헥산 풍부 스트림은 응축되어, 디캔터로 공급된다. 디캔터로부터 배출되는 유기물 풍부 스트림은 증류탑에 공급된다. 스팀 (9997.2 ㎏/hr (11.02 톤/hr))은 증류탑의 저부에 공급된다. 이러한 칼럼에 대한 오버헤드 및 저부 생성물의 농도는 표 75에 나타나있다. 표의 값은 톤/hr이다.Solids discharged from the desolventizer are fed to the dryer. The steam exiting the desolventizer contains 499.0 kg / hr (0.55 tons / hr) of hexane and 999.7 kg / hr (1.102 tons / hr) of water. This stream is condensed and fed to the decanter. The water rich phase exiting the decanter contains about 360 ppm of hexane. This stream is fed to a distillation column where hexane is removed from the water rich stream. The hexane rich stream exiting the top of the distillation column is condensed and fed to the decanter. The organic rich stream exiting the decanter is fed to the distillation column. Steam (9997.2 kg / hr (11.02 tons / hr)) is fed to the bottom of the distillation column. The overhead and bottom product concentrations for this column are shown in Table 75. The value in the table is tonnes / hr.
[표 75][Table 75]
실시예 63Example 63
고형물 추출Solid Extraction
함수 아이소부탄올의 제조Preparation of Isobutanol
100 mL 메스 플라스크에, 무수 시약 등급 아이소부탄올 (알드리치로부터 공급됨) 65 g을 증류수 10 g과 배합하여, 투명한 무색 균일상이 얻어질 때까지 진탕시켰다. 추가의 10 g의 증류수를 메스 플라스크에 첨가하여, 2개의 지속적인 투명한 무색 액체층을 얻도록 다시 진탕시켰다. 상부층은 전형적으로 20 wt% 수분을 함유하는 함수 아이소부탄올인 것으로 여겨지며, 저부층은 주로, 전형적으로 8 wt% 용해 알코올을 갖는 물이다.In a 100 mL volumetric flask, 65 g of anhydrous reagent grade isobutanol (supplied from Aldrich) was combined with 10 g of distilled water and shaken until a clear colorless uniform phase was obtained. An additional 10 g of distilled water was added to the measuring flask and shaken again to obtain two continuous clear colorless liquid layers. The top layer is typically considered to be hydrous isobutanol containing 20 wt% moisture and the bottom layer is mainly water, typically having 8 wt% dissolved alcohol.
스크린 여과를 이용한 추출 및 치환 세정Extraction and Substitution Cleaning Using Screen Filtration
재순환된 지방산을 사용하여 발효를 완료하였다 (실시예 19). 생성된 이종 혼합물을 나타내는 185 g 부분을 제거하여, 아래쪽의 약간의 진공 (-5.0 ㎪ (-20 (H2O)))을 이용하여 5분간에 걸쳐서 날젠 (Nalgene)? 플라스틱 필터 깔때기 내에 지지되어 밀봉된 80 메쉬 스크린 디쉬를 통과시켰다. 분산된 미분을 함유하나 침전 미립자를 함유하지 않는 50.9 g의 흐릿한 수성상 및 90.5 g의 적갈색 오일상으로, 여과액을 분배하였다. 습윤 케이크는 스크린 디쉬에 남아있었다. 이러한 미세정된 습윤 케이크 1.5 g의 샘플을 제거하여 공기 건조시켰다. 더 이상 액체 액적이 수집되지 않을 때까지 스크린 디쉬 아래쪽에 마일드한 진공을 유지하는 동안에, 함수 아이소부탄올 (23 g)을 메스 플라스크 내부의 상부층으로부터 빼내어, 5분간에 걸쳐서 습윤 케이크를 통과시켰다. 18 g의 총 여과액 질량은 소량의 불혼화성 저부 흐릿한 수성층 및 황색 투명한 함수 아이소부탄올층으로 구성되었다. 습윤 케이크를 스크린 디쉬로부터 제거하였으며, 38.4 g의 총 질량을 회수하였다. 이러한 세정된 습윤 케이크 1.5 g의 샘플을 제거하여 공기 건조시켰다. 미세정된 고형물의 건조 샘플을 분석한 바, 트라이글리세라이드 기준으로 53.35 wt%의 총 지방을 함유하는 것을 알아냈으며, 세정된 고형물의 건조 샘플을 분석한 바, 트라이글리세라이드 기준으로 15.9 wt%의 총 지방을 함유하는 것을 알아냈다.The fermentation was completed using the recycled fatty acid (Example 19). The 185 g portion representing the resulting heterogeneous mixture was removed and the Nalgene? Over 5 minutes using a slight vacuum (-5.0 kPa (-20 (H 2 O))) at the bottom. Passed through a sealed 80 mesh screen dish supported in a plastic filter funnel. The filtrate was partitioned into 50.9 g hazy aqueous phase and 90.5 g reddish brown oil phase, which contained dispersed fines but did not contain precipitated particulates. The wet cake remained in the screen dish. A sample of 1.5 g of this microscopic wet cake was removed and air dried. While maintaining a mild vacuum under the screen dish until no more liquid droplets were collected, the hydrous isobutanol (23 g) was withdrawn from the top layer inside the flask and passed through the wet cake over 5 minutes. The total filtrate mass of 18 g consisted of a small amount of immiscible bottom hazy aqueous layer and yellow clear hydrous isobutanol layer. The wet cake was removed from the screen dish and a total mass of 38.4 g was recovered. A sample of 1.5 g of this washed wet cake was removed and air dried. Analysis of the dry sample of the fine solids revealed that it contained 53.35 wt% of total fat on the basis of triglycerides, and 15.9 wt% of triglycerides on the basis of analysis of the dry sample of the washed solids. It was found to contain total fat.
원심분리 및 리슬러리 워시를 이용한 추출Extraction Using Centrifugation and Riesler Wash
재순환된 지방산을 사용하여 발효를 완료하였다 (실시예 19). 생성된 이종 혼합물을 나타내는 225 g 부분을 회수하여, 10,000 rpm으로 10분간 베크만 콜터 알레그라 (Beckman Coulter Allegra) 64R 머신을 이용하여 원심분리하였다. 67.2 g에 달하는 투명한 적갈색 오일상을 디캔트하였다. 잔류물질을 다시 원심분리하고, 95.1 g의 흐릿한 수성 센트레이트를 디캔트하였다. 습윤 고형물의 1.5 g 샘플을 제거하여 공기 건조시키고, 56.5 g을 회수하여 400 mL 비이커에 옮겼다. 메스 플라스크의 상부층으로부터 빼낸 함수 아이소부탄올 (20 g)을 비이커에 첨가하여, 습윤 고형물을 재펄프화하고, 교반을 5분간 행하였다. 32 g의 센트레이트와 함께 추가의 32 g의 함수 아이소부탄올을 첨가하고, 고형물을 정지 유기층 바로 아래의 수성 현탁액에서 5분간 교반하였다. 그 다음에, 혼합물을 10,000 rpm으로 10분간 원심분리하여, 투명한 황색 함수 아이소부탄올층을 디캔트하고, 세정된 습윤 고형물의 1.5 g 샘플을 분리하여 건조시키기 위해 다시 원심분리하였다. 미세정된 습윤 고형물의 건조 샘플을 분석한 바, 트라이글리세라이드 기준으로 21.6 wt%의 총 지방을 함유하는 것을 알아냈으며, 세정된 습윤 고형물의 건조 샘플을 분석한 바, 트라이글리세라이드 기준으로 4.04 wt%의 총 지방을 함유하는 것을 알아냈다.The fermentation was completed using the recycled fatty acid (Example 19). A 225 g portion representing the resulting heterogeneous mixture was recovered and centrifuged using a Beckman Coulter Allegra 64R machine at 10,000 rpm for 10 minutes. 67.2 g of the clear reddish brown oil phase was decanted. The residue was centrifuged again and 95.1 g of hazy aqueous centrate was decanted. A 1.5 g sample of wet solids was removed, air dried, 56.5 g recovered and transferred to a 400 mL beaker. Hydrated isobutanol (20 g) removed from the upper layer of the flask was added to the beaker, the wet solid was repulped and stirring was performed for 5 minutes. An additional 32 g of hydrous isobutanol was added with 32 g of centrate and the solid was stirred for 5 minutes in an aqueous suspension just below the stationary organic layer. The mixture was then centrifuged at 10,000 rpm for 10 minutes to decant the clear yellow hydrous isobutanol layer and again centrifuged to separate and dry a 1.5 g sample of the washed wet solid. Analysis of the dry sample of the microscopic wet solids revealed that it contained 21.6 wt% of total fat on the basis of triglycerides, and 4.04 wt on the basis of triglycerides when the dry sample of the washed wet solids was analyzed. Found to contain% total fat.
실시예Example 64 64
불용성 고형물의 제거에 의한 옥수수유의 제거Removal of Corn Oil by Removal of Insoluble Solids
약 1000 g의 액화 옥수수 매시를 1 L 글래스, 재킷형 수지 케틀에 준비하였다. 케틀을 기계식 교반, 온도 제어, 및 pH 제어로 셋업하였다. 하기 프로토콜을 사용하였다: 분쇄 옥수수를 수돗물과 혼합하고 (건조 기준으로 26 wt% 옥수수), 교반하면서 슬러리를 55℃로 가열하며, pH를 NaOH 또는 H2SO4로 5.8로 조절하고, 알파-아밀라제 (건조 옥수수 기준으로 0.02 wt%)를 첨가하며, 85℃로 연속 가열하고, pH를 5.8로 조절하며, pH를 5.8로 유지하면서 85℃에서 2시간 동안 유지하여, 25℃로 냉각시켰다. 사용된 옥수수는 파이오니어 (Pioneer (3335))의 황색 통옥수수알이었다. 1 ㎜ 스크린을 이용한 해머 밀에서 분쇄하였다. 분쇄 옥수수의 수분 함량은 약 11.7 wt%인 것으로 측정되었으며, 분쇄 옥수수의 전분 함량은 건조 옥수수 기준으로 약 71.4 wt%인 것으로 측정되었다. 알파-아밀라제 효소는 노보자임즈 (미국 노스캐롤라이나주 프랭클린톤에 소재)의 리쿼자임 (Liquozyme)? SC DS이었다. 사용된 성분의 총량은 294.5 g의 분쇄 옥수수 (11.7% 수분), 705.5 g의 수돗물, 및 0.059 g의 리쿼자임? SC DS이었다. H2O (4.3 g)를 첨가하여 효소를 희석시키고, 총 2.3 g의 20% NaOH 용액을 첨가하여 pH를 제어하였다. 약 952 g의 매시를 회수하였다. 케틀 및 CF 바틀의 벽에 매시가 부착되는 것으로 인해 손실이 있었음을 주목한다.About 1000 g of liquefied corn mash was prepared in a 1 L glass, jacketed resin kettle. The kettle was set up with mechanical stirring, temperature control, and pH control. The following protocol was used: the ground corn was mixed with tap water (26 wt% corn on a dry basis), the slurry was heated to 55 ° C. with stirring, the pH was adjusted to 5.8 with NaOH or H 2 SO 4 , and alpha-amylase (0.02 wt% on dry corn basis) was added, continuous heating to 85 ° C., pH adjusted to 5.8, maintained at 85 ° C. for 2 hours while maintaining pH at 5.8, and cooled to 25 ° C. The corn used was the yellow corncob from Pioneer (3335). Grinding in a hammer mill using a 1 mm screen. The moisture content of the ground corn was measured to be about 11.7 wt%, and the starch content of the ground corn was measured to be about 71.4 wt% on a dry corn basis. The alpha-amylase enzyme is Liquozyme from Novozymes (Franklinton, NC). SC DS. The total amount of ingredients used was 294.5 g of ground corn (11.7% moisture), 705.5 g of tap water, and 0.059 g of liquezyme? SC DS. H 2 O (4.3 g) was added to dilute the enzyme and a total of 2.3 g of 20% NaOH solution was added to control pH. About 952 g of mash were recovered. Note that there was a loss due to the mash being attached to the walls of the kettle and CF bottle.
액화 옥수수 매시를 5000 rpm (7260 g's)으로 30분간 40℃에서 원심분리하여 올리고당 수용액으로부터 불용성 고형물을 제거시켰다. 원심분리에 의한 고형물의 제거로, 수성상 상부의 분리된 유기 액체상으로서의 유리 옥수수유가 제거된다. 약 1.5 g의 옥수수유를 수성상 상부에 부유하는 유기층으로부터 회수하였다. 헥산 추출에 의해, 액화 매시를 생성하도록 사용된 분쇄 옥수수가 건조 옥수수 기준으로 약 3.5 wt%의 옥수수유를 함유한다는 것을 측정하였다. 이는 분쇄 옥수수와 함쎄 액화 프로세스에 공급되는 약 9 g의 옥수수유에 해당한다.The liquefied corn mash was centrifuged at 5000 rpm (7260 g's) for 30 minutes at 40 ° C to remove insoluble solids from the aqueous solution of oligosaccharides. By removing the solids by centrifugation, the free corn oil as the separated organic liquid phase on top of the aqueous phase is removed. About 1.5 g of corn oil was recovered from the organic layer suspended above the aqueous phase. By hexane extraction, it was determined that the ground corn used to produce the liquefied mash contained about 3.5 wt% corn oil on a dry corn basis. This corresponds to about 9 g of corn oil fed to the liquefaction process with ground corn.
약 1 g의 옥수수유를 수성상 상부에 부유하는 유기층으로부터 회수하였다. 약 617 g의 액화된 전분 용액을 회수한 바, 약 334 g의 습윤 케이크가 남았다. 습윤 케이크는 액화 매시에 존재하는 대부분의 불용성 고형물을 함유하였다. 액화된 전분 용액은 약 0.2 wt% 불용성 고형물을 함유하였다. 습윤 케이크는 약 21 wt% 불용성 고형물을 함유하였다. 습윤 케이크를 1000 g의 수돗물로 세정하여, 여전히 케이크에 있는 올리고당을 제거하였다. 이것은 케이크를 물과 혼합하여 슬러리를 형성함으로써 행해졌다. 그 다음에 슬러리를 세정된 고형물을 회수하기 위해 최초 매시를 원심분리하는데 사용되는 동일한 조건 하에 원심분리하였다. 원심분리에 의한 세정된 고형물의 제거로, 수성상 상부의 분리된 유기 액체상으로서의 추가의 유리 옥수수유가 제거되었다. 옥수수유를 수성상 상부에 부유하는 유기층으로부터 회수하였다.About 1 g of corn oil was recovered from the organic layer suspended above the aqueous phase. About 617 g of liquefied starch solution was recovered, leaving about 334 g of wet cake. The wet cake contained most of the insoluble solids present in the liquefied mash. The liquefied starch solution contained about 0.2 wt% insoluble solids. The wet cake contained about 21 wt% insoluble solids. The wet cake was washed with 1000 g of tap water to remove oligosaccharides still in the cake. This was done by mixing the cake with water to form a slurry. The slurry was then centrifuged under the same conditions used to centrifuge the original mash to recover the washed solids. Removal of the washed solids by centrifugation removed additional free corn oil as a separated organic liquid phase on top of the aqueous phase. Corn oil was recovered from the organic layer suspended above the aqueous phase.
실질적으로 모든 액화된 전분을 제거하기 위해, 습윤 고형물을 매회 1000 g의 수돗물을 사용하여 2회 더 세정하였다. 최종 세정된 고형물을 진공 오븐에서 하룻밤 동안 80℃ 및 약 67.7 ㎪ (20 인치 Hg) 진공에서 건조시켰다. 건조 고형물, 아마도 여전히 배아에 잔존하는 옥수수유의 양을 헥산 추출로 측정하였다. 비교적 건조한 고형물 (약 2 wt% 수분)의 3.60 g 샘플이 0.22 g의 옥수수유를 포함하는 것으로 측정되었다. 이러한 결과는 0.0624 g 옥수수유/g 건조 고형물에 해당한다. 이것은 세정된 고형물에 대한 것으로, 습윤 고형물에 잔류 올리고당이 없음을 의미한다. 유리 옥수수유층 및 올리고당 수용액을 습윤 케이크로부터 분리하기 위해 액화 옥수수 매시를 원심분리한 후에, 약 21 wt% 불용성 고형물을 함유하는 약 334 g의 습윤 케이크가 잔존하고 것으로 측정되었다. 이는 약 70.1 g의 불용성 고형물을 포함하는 습윤 케이크에 해당한다. 0.0624 g 옥수수유/g 건조 고형물에서, 습윤 케이크 중의 고형물은 약 4.4 g의 옥수수유를 함유해야 한다.To remove substantially all of the liquefied starch, the wet solid was washed two more times with 1000 g of tap water each time. The final washed solid was dried in a vacuum oven at 80 ° C. and about 67.7 kPa (20 inch Hg) vacuum overnight. The amount of corn oil remaining in the dry solids, perhaps embryos, was determined by hexane extraction. A 3.60 g sample of relatively dry solids (about 2 wt% moisture) was determined to contain 0.22 g of corn oil. This result corresponds to 0.0624 g corn oil / g dry solids. This is for the washed solids, meaning that the wet solids are free of residual oligosaccharides. After centrifuging the liquefied corn mash to separate the free corn oil layer and the aqueous oligosaccharide solution from the wet cake, it was determined that about 334 g of wet cake containing about 21 wt% insoluble solids remained. This corresponds to a wet cake containing about 70.1 g of insoluble solids. In 0.0624 g corn oil / g dry solids, the solids in the wet cake should contain about 4.4 g of corn oil.
실시예 65Example 65
지질 분석Lipid analysis
지질 분석을 에스테르 교환에 의한 다양한 지방산 함유 화합물류의 지방산 메틸 에스테르 ("FAME")로의 전환에 의해 행하였다. 글리세라이드 및 인지질은 메탄올에서 나트륨 메톡사이드를 사용하여 에스테르 교환되었다. 글리세라이드, 인지질, 및 유리 지방산은 메탄올에서 염화아세틸을 사용하여 에스테르 교환되었다. 생성된 FAME을, 톨루엔/헥산 (2:3)에서의 희석 후에 30-m X 0.25 ㎜ (i.d.) 오메가왁스 (OMEGAWAX)™ (수펠코 (Supelco), 미국 미주리주 세인트루이스에 소재하는 시그마 알드리치) 칼럼으로 조립된 애질런트 7890 GC를 사용하여 가스 크로마토그래피로 분석하였다. 오븐 온도를 5℃/min으로 160℃에서 200℃로, 다음에 10℃/min로 200℃에서 250℃ (10분간 유지)로 증가시켰다. GC 분석을 통해 기록된 FAME 피크는 공지된 메틸 에스테르 (ME)와 비교되는 경우에 이들의 체류 시간으로 동정되었으며, FAME 피크 면적을 기지량의 내부 표준물질 (C15:0 트라이글리세라이드, 샘플을 사용하여 에스테르 교환 절차를 통해 취해짐)의 것과 비교함으로써 정량화되었다. 따라서, 근사량 (㎎)의 임의의 지방산 FAME ("㎎ FAME")는 하기 식에 따라 계산된다: (특정 지방산에 대한 FAME 피크 면적 / 15:0 FAME 피크 면적) * (내부 표준물질 C15:0 FAME (㎎)). 그 다음에 FAME 결과는 1.052의 적절한 분자량 전환 계수로 나누어 상응하는 지방산의 ㎎으로 보정될 수 있다. 모든 내부 및 참조 표준물질은 뉴-첵 프레프, 인코포레이티드로부터 얻어진다.Lipid analysis was performed by conversion of various fatty acid containing compounds to fatty acid methyl esters ("FAME") by transesterification. Glycerides and phospholipids were transesterified using sodium methoxide in methanol. Glycerides, phospholipids, and free fatty acids were transesterified using acetyl chloride in methanol. The resulting FAME was subjected to 30-m × 0.25 mm (id) OMEGAWAX ™ (Supelco, Sigma-Aldrich, St. Louis, MO) column after dilution in toluene / hexane (2: 3). It was analyzed by gas chromatography using Agilent 7890 GC assembled. The oven temperature was increased from 160 ° C. to 200 ° C. at 5 ° C./min and then from 200 ° C. to 250 ° C. (10 min hold) at 10 ° C./min. FAME peaks recorded through GC analysis were identified by their retention time when compared to known methyl esters (ME), and the FAME peak area was determined using a known amount of internal standard (C15: 0 triglycerides, samples). And taken through a transesterification procedure). Thus, the approximate amount (mg) of any fatty acid FAME (“mg FAME”) is calculated according to the following formula: (FAME peak area / 15: 0 FAME peak area for a specific fatty acid) * (internal standard C15: 0 FAME (mg)). The FAME result can then be corrected for mg of the corresponding fatty acid by dividing by an appropriate molecular weight conversion factor of 1.052. All internal and reference standards are obtained from Nu-Jeop Prep, Inc.
메탄올에서 나트륨 메톡사이드를 사용하여 에스테르 교환된 샘플에 대하여 얻어진 지방산 결과는 1.045의 분자량 전환 계수를 곱해 상응하는 트라이글리세라이드 레벨로 전환된다. 트라이글리세라이드는 일반적으로 본 실시예에 대한 샘플 연구에서 글리세라이드의 약 80 내지 90%를 차지하며, 나머지는 다이글리세라이드이다. 모노글리세라이드 및 인지질 함량은 일반적으로 무시해도 될 정도이다. 메탄올에서 염화아세틸을 사용하여 에스테르 교환된 샘플에 대하여 얻어진 총 지방산 결과는 나트륨 메톡사이드 절차를 이용하여 동일한 샘플에 대하여 측정된 지방산을 감산함으로써 글리세라이드 함량이 보정된다. 그 결과는 샘플의 유리 지방산 함량이다.The fatty acid results obtained for the sample transesterified using sodium methoxide in methanol are converted to the corresponding triglyceride levels by multiplying the molecular weight conversion factor of 1.045. Triglycerides generally comprise about 80-90% of the glycerides in the sample studies for this example, with the remainder being diglycerides. Monoglycerides and phospholipid contents are generally negligible. The total fatty acid results obtained for the sample transesterified using acetyl chloride in methanol are corrected for glyceride content by subtracting the fatty acids measured for the same sample using the sodium methoxide procedure. The result is the free fatty acid content of the sample.
글리세라이드 함량 (모노글리세라이드, 다이글리세라이드, 트라이글리세라이드, 및 인지질)의 분포는 박층 크로마토그래피를 사용하여 측정된다. 6:1 클로로포름/메탄올에 용해된 오일 용액은 실리카 겔로 프리코팅된 글래스 플레이트의 저부 가까이에 스폿팅된다. 그 다음에 스폿은 70:30:1 헥산/다이에틸 에테르/아세트산 용매계를 사용하여 플레이트 위쪽에 크로마토그래피를 행한다. 그 다음에 모노글리세라이드, 다이글리세라이드, 트라이글리세라이드, 및 인지질에 상응하는 분리된 스폿은 플레이트를 요오드 증기로 염색하여 검출된다. 그 다음에 스폿은 메탄올 절차에서 염화아세틸을 사용하여 에스테르 교환된 플레이트에서 벗겨내어, 가스 크로마토그래피로 분석한다. 각 스폿에 대한 피크 면적 총계 대 모든 스폿에 대한 피크 면적 총계의 비는 다양한 글리세라이드의 분포이다.The distribution of glyceride content (monoglycerides, diglycerides, triglycerides, and phospholipids) is measured using thin layer chromatography. The oil solution dissolved in 6: 1 chloroform / methanol is spotted near the bottom of the glass plate precoated with silica gel. The spot is then chromatographed over the plate using a 70: 30: 1 hexane / diethyl ether / acetic acid solvent system. Separate spots corresponding to monoglycerides, diglycerides, triglycerides, and phospholipids are then detected by staining the plates with iodine vapor. The spot is then peeled off from the transesterified plate using acetyl chloride in the methanol procedure and analyzed by gas chromatography. The ratio of the sum of the peak areas for each spot to the sum of the peak areas for all the spots is the distribution of the various glycerides.
실시예Example 66 66
본 실시예는 매시로부터의 부생성물의 회수를 예시한다. 옥수수유를 하기 조건과 함께, 트라이캔터 원심분리기 (플롯베크 (Flottweg) Z23-4, 볼 직경 230 ㎜, 길이 대 직경 비 4:1)를 사용한 것을 제외하고는 실시예 64에 기재된 조건 하에 매시로부터 분리하였다:This example illustrates the recovery of byproducts from the mash. Corn oil was prepared from the mash under the conditions described in Example 64 except that a tricanter centrifuge (Flottweg Z23-4, ball diameter 230 mm, length to diameter ratio 4: 1) was used with the following conditions: Separated:
· 볼 속도: 5000 rpmBall speed: 5000 rpm
· 미분 속도: 10 rpmDifferential velocity: 10 rpm
· 공급 속도: 3 gpmFeed rate: 3 gpm
· 상분리기 디스크: 138 ㎜Phase separator disc: 138 mm
· 임펠러 세팅 144 ㎜.Impeller setting 144 mm.
분리한 옥수수유는 실시예 65에 기재된 방법 및 박층 크로마토그래피로 측정된 것으로서, 81% 트라이글리세라이드, 6% 유리 지방산, 4% 다이글리세라이드, 및 인지질과 모노글리세라이드의 합계 5%를 나타내었다.The separated corn oil measured 81% triglycerides, 6% free fatty acids, 4% diglycerides, and 5% of the total of phospholipids and monoglycerides as measured by the method and thin layer chromatography described in Example 65. .
상술한 조건 하에 매시로부터 분리된 고형물은 건조 시의 중량 손실에 의해 측정된 것으로서, 58%의 수분 함량을 나타내었으며, 실시예 65에 기재된 방법에 의해 측정된 것으로서, 1.2% 트라이글리세라이드 및 0.27% 유리 지방산을 나타내었다.Solids separated from the mash under the conditions described above had a moisture content of 58% as measured by weight loss upon drying and 1.2% triglycerides and 0.27% as measured by the method described in Example 65. Free fatty acids are shown.
표 78의 전 증류 폐액으로부터 분리된 고형물, 증발기 단계 사이에 추출된 오일, 부생성물 추출제 및 응축주정박 (CDS)의 조성을, 표 76에 나타낸 전 증류 폐액의 조성 및 표 77의 가정 (트라이캔터 원심분리기에서의 분리)을 전제로 하여 계산하였다. 표 75의 값을 아스펜 플러스? 모델 (미국 매사추세츠주 벌링턴에 소재하는 아스펜 테크놀로지, 인코포레이티드)로부터 구하였다. 이러한 모델은 옥수수유가 매시로부터 추출되지 않음을 가정한다. 건조 기준으로 세포, 용존 고형물, 및 현탁 고형물의 단백질 함량이 각각, 약 50%, 22%, 및 35.5%인 것으로 추정된다. 부생성물 추출제의 조성은 건조 기준으로 70.7% 지방산 및 29.3% 지방산 아이소부틸 에스테르인 것으로 추정된다.The composition of the solids separated from the total distillation waste in Table 78, the oil extracted between the evaporator stages, the byproduct extractant and the condensed liquor (CDS), the composition of the total distillation waste in Table 76 and the assumptions in Table 77 (Tricanter Calculations on the assumption of separation in a centrifuge). Aspen Plus values in Table 75? From the model (Aspen Technologies, Inc., Burlington, Mass., USA). This model assumes that corn oil is not extracted from the mash. On a dry basis, the protein content of the cells, dissolved solids, and suspended solids is estimated to be about 50%, 22%, and 35.5%, respectively. The composition of the byproduct extractant is estimated to be 70.7% fatty acid and 29.3% fatty acid isobutyl ester on a dry basis.
[표 76]Table 76
[표 77]Table 77
[표 78]Table 78
게다가, 본 발명의 다양한 실시 형태가 상술되었지만, 이들은 다만 일례로서 주어진 것으로 이들로 제한되지 않음은 당연하다. 형태 및 세부 사항에 있어서의 다양한 변화가 본 발명의 사상 및 범위를 벗어나지 않고서 이뤄질 수 있음을 당업자에게 명백할 것이다. 따라서, 본 발명의 폭 및 범위는 어떠한 상술한 예시적인 실시 형태에 의해서도 제한되어서는 안되지만, 다만 하기 청구범위 및 이의 등가물에 의해 정의되어야 한다.In addition, while various embodiments of the invention have been described above, it is obvious that these are given as examples only and are not limited to them. It will be apparent to those skilled in the art that various changes in form and details may be made without departing from the spirit and scope of the invention. Accordingly, the breadth and scope of the present invention should not be limited by any of the above-described exemplary embodiments, but should be defined by the following claims and their equivalents.
본 명세서에 언급된 모든 간행물, 특허, 및 특허 출원은 본 발명이 속하는 기술 분야의 숙련가의 숙련도를 나타내며, 각 개별 간행물, 특허 또는 특허 출원이 참조로 포함되도록 구체적으로 개별적으로 나타내어지는 경우와 동일한 정도로 참조로 본 명세서에 포함된다.All publications, patents, and patent applications mentioned in the specification are indicative of proficiency in the art to which the invention pertains, and to the same extent as if each individual publication, patent, or patent application was specifically indicated to be incorporated by reference. It is incorporated herein by reference.
SEQUENCE LISTING
<110> Butamax(TM) Advanced Biofuels
<120> PRODUCTION OF ALCOHOL ESTERS AND IN SITU PRODUCT REMOVAL DURING
ALCOHOL FERMENTATION
<130> CL5103
<150> US 61/368,429
<151> 2010-07-28
<150> US 61/356,290
<151> 2010-06-18
<150> US 61/368,451
<151> 2010-07-28
<150> US 61/368,436
<151> 2010-07-28
<150> US 61/368,444
<151> 2010-07-28
<150> US 13/160,766
<151> 2011-06-15
<150> US 61/440,034
<151> 2011-02-07
<150> US 61/379,546
<151> 2010-09-02
<160> 202
<170> PatentIn version 3.5
<210> 1
<211> 11856
<212> DNA
<213> Artificial sequence
<220>
<223> Plasmid
<400> 1
tcccattacc gacatttggg cgctatacgt gcatatgttc atgtatgtat ctgtatttaa 60
aacacttttg tattattttt cctcatatat gtgtataggt ttatacggat gatttaatta 120
ttacttcacc accctttatt tcaggctgat atcttagcct tgttactagt tagaaaaaga 180
catttttgct gtcagtcact gtcaagagat tcttttgctg gcatttcttc tagaagcaaa 240
aagagcgatg cgtcttttcc gctgaaccgt tccagcaaaa aagactacca acgcaatatg 300
gattgtcaga atcatataaa agagaagcaa ataactcctt gtcttgtatc aattgcatta 360
taatatcttc ttgttagtgc aatatcatat agaagtcatc gaaatagata ttaagaaaaa 420
caaactgtac aatcaatcaa tcaatcatcg ctgaggatgt tgacaaaagc aacaaaagaa 480
caaaaatccc ttgtgaaaaa cagaggggcg gagcttgttg ttgattgctt agtggagcaa 540
ggtgtcacac atgtatttgg cattccaggt gcaaaaattg atgcggtatt tgacgcttta 600
caagataaag gacctgaaat tatcgttgcc cggcacgaac aaaacgcagc attcatggcc 660
caagcagtcg gccgtttaac tggaaaaccg ggagtcgtgt tagtcacatc aggaccgggt 720
gcctctaact tggcaacagg cctgctgaca gcgaacactg aaggagaccc tgtcgttgcg 780
cttgctggaa acgtgatccg tgcagatcgt ttaaaacgga cacatcaatc tttggataat 840
gcggcgctat tccagccgat tacaaaatac agtgtagaag ttcaagatgt aaaaaatata 900
ccggaagctg ttacaaatgc atttaggata gcgtcagcag ggcaggctgg ggccgctttt 960
gtgagctttc cgcaagatgt tgtgaatgaa gtcacaaata cgaaaaacgt gcgtgctgtt 1020
gcagcgccaa aactcggtcc tgcagcagat gatgcaatca gtgcggccat agcaaaaatc 1080
caaacagcaa aacttcctgt cgttttggtc ggcatgaaag gcggaagacc ggaagcaatt 1140
aaagcggttc gcaagctttt gaaaaaggtt cagcttccat ttgttgaaac atatcaagct 1200
gccggtaccc tttctagaga tttagaggat caatattttg gccgtatcgg tttgttccgc 1260
aaccagcctg gcgatttact gctagagcag gcagatgttg ttctgacgat cggctatgac 1320
ccgattgaat atgatccgaa attctggaat atcaatggag accggacaat tatccattta 1380
gacgagatta tcgctgacat tgatcatgct taccagcctg atcttgaatt gatcggtgac 1440
attccgtcca cgatcaatca tatcgaacac gatgctgtga aagtggaatt tgcagagcgt 1500
gagcagaaaa tcctttctga tttaaaacaa tatatgcatg aaggtgagca ggtgcctgca 1560
gattggaaat cagacagagc gcaccctctt gaaatcgtta aagagttgcg taatgcagtc 1620
gatgatcatg ttacagtaac ttgcgatatc ggttcgcacg ccatttggat gtcacgttat 1680
ttccgcagct acgagccgtt aacattaatg atcagtaacg gtatgcaaac actcggcgtt 1740
gcgcttcctt gggcaatcgg cgcttcattg gtgaaaccgg gagaaaaagt ggtttctgtc 1800
tctggtgacg gcggtttctt attctcagca atggaattag agacagcagt tcgactaaaa 1860
gcaccaattg tacacattgt atggaacgac agcacatatg acatggttgc attccagcaa 1920
ttgaaaaaat ataaccgtac atctgcggtc gatttcggaa atatcgatat cgtgaaatat 1980
gcggaaagct tcggagcaac tggcttgcgc gtagaatcac cagaccagct ggcagatgtt 2040
ctgcgtcaag gcatgaacgc tgaaggtcct gtcatcatcg atgtcccggt tgactacagt 2100
gataacatta atttagcaag tgacaagctt ccgaaagaat tcggggaact catgaaaacg 2160
aaagctctct agttaattaa tcatgtaatt agttatgtca cgcttacatt cacgccctcc 2220
ccccacatcc gctctaaccg aaaaggaagg agttagacaa cctgaagtct aggtccctat 2280
ttattttttt atagttatgt tagtattaag aacgttattt atatttcaaa tttttctttt 2340
ttttctgtac agacgcgtgt acgcatgtaa cattatactg aaaaccttgc ttgagaaggt 2400
tttgggacgc tcgaaggctt taatttgcgg gcggccgcac ctggtaaaac ctctagtgga 2460
gtagtagatg taatcaatga agcggaagcc aaaagaccag agtagaggcc tatagaagaa 2520
actgcgatac cttttgtgat ggctaaacaa acagacatct ttttatatgt ttttacttct 2580
gtatatcgtg aagtagtaag tgataagcga atttggctaa gaacgttgta agtgaacaag 2640
ggacctcttt tgcctttcaa aaaaggatta aatggagtta atcattgaga tttagttttc 2700
gttagattct gtatccctaa ataactccct tacccgacgg gaaggcacaa aagacttgaa 2760
taatagcaaa cggccagtag ccaagaccaa ataatactag agttaactga tggtcttaaa 2820
caggcattac gtggtgaact ccaagaccaa tatacaaaat atcgataagt tattcttgcc 2880
caccaattta aggagcctac atcaggacag tagtaccatt cctcagagaa gaggtataca 2940
taacaagaaa atcgcgtgaa caccttatat aacttagccc gttattgagc taaaaaacct 3000
tgcaaaattt cctatgaata agaatacttc agacgtgata aaaatttact ttctaactct 3060
tctcacgctg cccctatctg ttcttccgct ctaccgtgag aaataaagca tcgagtacgg 3120
cagttcgctg tcactgaact aaaacaataa ggctagttcg aatgatgaac ttgcttgctg 3180
tcaaacttct gagttgccgc tgatgtgaca ctgtgacaat aaattcaaac cggttatagc 3240
ggtctcctcc ggtaccggtt ctgccacctc caatagagct cagtaggagt cagaacctct 3300
gcggtggctg tcagtgactc atccgcgttt cgtaagttgt gcgcgtgcac atttcgcccg 3360
ttcccgctca tcttgcagca ggcggaaatt ttcatcacgc tgtaggacgc aaaaaaaaaa 3420
taattaatcg tacaagaatc ttggaaaaaa aattgaaaaa ttttgtataa aagggatgac 3480
ctaacttgac tcaatggctt ttacacccag tattttccct ttccttgttt gttacaatta 3540
tagaagcaag acaaaaacat atagacaacc tattcctagg agttatattt ttttacccta 3600
ccagcaatat aagtaaaaaa ctgtttaaac agtatggcag ttacaatgta ttatgaagat 3660
gatgtagaag tatcagcact tgctggaaag caaattgcag taatcggtta tggttcacaa 3720
ggacatgctc acgcacagaa tttgcgtgat tctggtcaca acgttatcat tggtgtgcgc 3780
cacggaaaat cttttgataa agcaaaagaa gatggctttg aaacatttga agtaggagaa 3840
gcagtagcta aagctgatgt tattatggtt ttggcaccag atgaacttca acaatccatt 3900
tatgaagagg acatcaaacc aaacttgaaa gcaggttcag cacttggttt tgctcacgga 3960
tttaatatcc attttggcta tattaaagta ccagaagacg ttgacgtctt tatggttgcg 4020
cctaaggctc caggtcacct tgtccgtcgg acttatactg aaggttttgg tacaccagct 4080
ttgtttgttt cacaccaaaa tgcaagtggt catgcgcgtg aaatcgcaat ggattgggcc 4140
aaaggaattg gttgtgctcg agtgggaatt attgaaacaa cttttaaaga agaaacagaa 4200
gaagatttgt ttggagaaca agctgttcta tgtggaggtt tgacagcact tgttgaagcc 4260
ggttttgaaa cactgacaga agctggatac gctggcgaat tggcttactt tgaagttttg 4320
cacgaaatga aattgattgt tgacctcatg tatgaaggtg gttttactaa aatgcgtcaa 4380
tccatctcaa atactgctga gtttggcgat tatgtgactg gtccacggat tattactgac 4440
gaagttaaaa agaatatgaa gcttgttttg gctgatattc aatctggaaa atttgctcaa 4500
gatttcgttg atgacttcaa agcggggcgt ccaaaattaa tagcctatcg cgaagctgca 4560
aaaaatcttg aaattgaaaa aattggggca gagctacgtc aagcaatgcc attcacacaa 4620
tctggtgatg acgatgcctt taaaatctat cagtaaggcc ctgcaggcca gaggaaaata 4680
atatcaagtg ctggaaactt tttctcttgg aatttttgca acatcaagtc atagtcaatt 4740
gaattgaccc aatttcacat ttaagatttt ttttttttca tccgacatac atctgtacac 4800
taggaagccc tgtttttctg aagcagcttc aaatatatat attttttaca tatttattat 4860
gattcaatga acaatctaat taaatcgaaa acaagaaccg aaacgcgaat aaataattta 4920
tttagatggt gacaagtgta taagtcctca tcgggacagc tacgatttct ctttcggttt 4980
tggctgagct actggttgct gtgacgcagc ggcattagcg cggcgttatg agctaccctc 5040
gtggcctgaa agatggcggg aataaagcgg aactaaaaat tactgactga gccatattga 5100
ggtcaatttg tcaactcgtc aagtcacgtt tggtggacgg cccctttcca acgaatcgta 5160
tatactaaca tgcgcgcgct tcctatatac acatatacat atatatatat atatatatgt 5220
gtgcgtgtat gtgtacacct gtatttaatt tccttactcg cgggtttttc ttttttctca 5280
attcttggct tcctctttct cgagcggacc ggatcctccg cggtgccggc agatctattt 5340
aaatggcgcg ccgacgtcag gtggcacttt tcggggaaat gtgcgcggaa cccctatttg 5400
tttatttttc taaatacatt caaatatgta tccgctcatg agacaataac cctgataaat 5460
gcttcaataa tattgaaaaa ggaagagtat gagtattcaa catttccgtg tcgcccttat 5520
tccctttttt gcggcatttt gccttcctgt ttttgctcac ccagaaacgc tggtgaaagt 5580
aaaagatgct gaagatcagt tgggtgcacg agtgggttac atcgaactgg atctcaacag 5640
cggtaagatc cttgagagtt ttcgccccga agaacgtttt ccaatgatga gcacttttaa 5700
agttctgcta tgtggcgcgg tattatcccg tattgacgcc gggcaagagc aactcggtcg 5760
ccgcatacac tattctcaga atgacttggt tgagtactca ccagtcacag aaaagcatct 5820
tacggatggc atgacagtaa gagaattatg cagtgctgcc ataaccatga gtgataacac 5880
tgcggccaac ttacttctga caacgatcgg aggaccgaag gagctaaccg cttttttgca 5940
caacatgggg gatcatgtaa ctcgccttga tcgttgggaa ccggagctga atgaagccat 6000
accaaacgac gagcgtgaca ccacgatgcc tgtagcaatg gcaacaacgt tgcgcaaact 6060
attaactggc gaactactta ctctagcttc ccggcaacaa ttaatagact ggatggaggc 6120
ggataaagtt gcaggaccac ttctgcgctc ggcccttccg gctggctggt ttattgctga 6180
taaatctgga gccggtgagc gtgggtctcg cggtatcatt gcagcactgg ggccagatgg 6240
taagccctcc cgtatcgtag ttatctacac gacggggagt caggcaacta tggatgaacg 6300
aaatagacag atcgctgaga taggtgcctc actgattaag cattggtaac tgtcagacca 6360
agtttactca tatatacttt agattgattt aaaacttcat ttttaattta aaaggatcta 6420
ggtgaagatc ctttttgata atctcatgac caaaatccct taacgtgagt tttcgttcca 6480
ctgagcgtca gaccccgtag aaaagatcaa aggatcttct tgagatcctt tttttctgcg 6540
cgtaatctgc tgcttgcaaa caaaaaaacc accgctacca gcggtggttt gtttgccgga 6600
tcaagagcta ccaactcttt ttccgaaggt aactggcttc agcagagcgc agataccaaa 6660
tactgttctt ctagtgtagc cgtagttagg ccaccacttc aagaactctg tagcaccgcc 6720
tacatacctc gctctgctaa tcctgttacc agtggctgct gccagtggcg ataagtcgtg 6780
tcttaccggg ttggactcaa gacgatagtt accggataag gcgcagcggt cgggctgaac 6840
ggggggttcg tgcacacagc ccagcttgga gcgaacgacc tacaccgaac tgagatacct 6900
acagcgtgag ctatgagaaa gcgccacgct tcccgaaggg agaaaggcgg acaggtatcc 6960
ggtaagcggc agggtcggaa caggagagcg cacgagggag cttccagggg gaaacgcctg 7020
gtatctttat agtcctgtcg ggtttcgcca cctctgactt gagcgtcgat ttttgtgatg 7080
ctcgtcaggg gggcggagcc tatggaaaaa cgccagcaac gcggcctttt tacggttcct 7140
ggccttttgc tggccttttg ctcacatgtt ctttcctgcg ttatcccctg attctgtgga 7200
taaccgtatt accgcctttg agtgagctga taccgctcgc cgcagccgaa cgaccgagcg 7260
cagcgagtca gtgagcgagg aagcggaaga gcgcccaata cgcaaaccgc ctctccccgc 7320
gcgttggccg attcattaat gcagctggca cgacaggttt cccgactgga aagcgggcag 7380
tgagcgcaac gcaattaatg tgagttagct cactcattag gcaccccagg ctttacactt 7440
tatgcttccg gctcgtatgt tgtgtggaat tgtgagcgga taacaatttc acacaggaaa 7500
cagctatgac catgattacg ccaagctttt tctttccaat tttttttttt tcgtcattat 7560
aaaaatcatt acgaccgaga ttcccgggta ataactgata taattaaatt gaagctctaa 7620
tttgtgagtt tagtatacat gcatttactt ataatacagt tttttagttt tgctggccgc 7680
atcttctcaa atatgcttcc cagcctgctt ttctgtaacg ttcaccctct accttagcat 7740
cccttccctt tgcaaatagt cctcttccaa caataataat gtcagatcct gtagagacca 7800
catcatccac ggttctatac tgttgaccca atgcgtctcc cttgtcatct aaacccacac 7860
cgggtgtcat aatcaaccaa tcgtaacctt catctcttcc acccatgtct ctttgagcaa 7920
taaagccgat aacaaaatct ttgtcgctct tcgcaatgtc aacagtaccc ttagtatatt 7980
ctccagtaga tagggagccc ttgcatgaca attctgctaa catcaaaagg cctctaggtt 8040
cctttgttac ttcttctgcc gcctgcttca aaccgctaac aatacctggg cccaccacac 8100
cgtgtgcatt cgtaatgtct gcccattctg ctattctgta tacacccgca gagtactgca 8160
atttgactgt attaccaatg tcagcaaatt ttctgtcttc gaagagtaaa aaattgtact 8220
tggcggataa tgcctttagc ggcttaactg tgccctccat ggaaaaatca gtcaagatat 8280
ccacatgtgt ttttagtaaa caaattttgg gacctaatgc ttcaactaac tccagtaatt 8340
ccttggtggt acgaacatcc aatgaagcac acaagtttgt ttgcttttcg tgcatgatat 8400
taaatagctt ggcagcaaca ggactaggat gagtagcagc acgttcctta tatgtagctt 8460
tcgacatgat ttatcttcgt ttcctgcagg tttttgttct gtgcagttgg gttaagaata 8520
ctgggcaatt tcatgtttct tcaacactac atatgcgtat atataccaat ctaagtctgt 8580
gctccttcct tcgttcttcc ttctgttcgg agattaccga atcaaaaaaa tttcaaggaa 8640
accgaaatca aaaaaaagaa taaaaaaaaa atgatgaatt gaaaagcttg catgcctgca 8700
ggtcgactct agtatactcc gtctactgta cgatacactt ccgctcaggt ccttgtcctt 8760
taacgaggcc ttaccactct tttgttactc tattgatcca gctcagcaaa ggcagtgtga 8820
tctaagattc tatcttcgcg atgtagtaaa actagctaga ccgagaaaga gactagaaat 8880
gcaaaaggca cttctacaat ggctgccatc attattatcc gatgtgacgc tgcatttttt 8940
tttttttttt tttttttttt tttttttttt tttttttttt ttttttgtac aaatatcata 9000
aaaaaagaga atctttttaa gcaaggattt tcttaacttc ttcggcgaca gcatcaccga 9060
cttcggtggt actgttggaa ccacctaaat caccagttct gatacctgca tccaaaacct 9120
ttttaactgc atcttcaatg gctttacctt cttcaggcaa gttcaatgac aatttcaaca 9180
tcattgcagc agacaagata gtggcgatag ggttgacctt attctttggc aaatctggag 9240
cggaaccatg gcatggttcg tacaaaccaa atgcggtgtt cttgtctggc aaagaggcca 9300
aggacgcaga tggcaacaaa cccaaggagc ctgggataac ggaggcttca tcggagatga 9360
tatcaccaaa catgttgctg gtgattataa taccatttag gtgggttggg ttcttaacta 9420
ggatcatggc ggcagaatca atcaattgat gttgaacttt caatgtaggg aattcgttct 9480
tgatggtttc ctccacagtt tttctccata atcttgaaga ggccaaaaca ttagctttat 9540
ccaaggacca aataggcaat ggtggctcat gttgtagggc catgaaagcg gccattcttg 9600
tgattctttg cacttctgga acggtgtatt gttcactatc ccaagcgaca ccatcaccat 9660
cgtcttcctt tctcttacca aagtaaatac ctcccactaa ttctctaaca acaacgaagt 9720
cagtaccttt agcaaattgt ggcttgattg gagataagtc taaaagagag tcggatgcaa 9780
agttacatgg tcttaagttg gcgtacaatt gaagttcttt acggattttt agtaaacctt 9840
gttcaggtct aacactaccg gtaccccatt taggaccacc cacagcacct aacaaaacgg 9900
catcagcctt cttggaggct tccagcgcct catctggaag tggaacacct gtagcatcga 9960
tagcagcacc accaattaaa tgattttcga aatcgaactt gacattggaa cgaacatcag 10020
aaatagcttt aagaacctta atggcttcgg ctgtgatttc ttgaccaacg tggtcacctg 10080
gcaaaacgac gatcttctta ggggcagaca ttacaatggt atatccttga aatatatata 10140
aaaaaaaaaa aaaaaaaaaa aaaaaaaaat gcagcttctc aatgatattc gaatacgctt 10200
tgaggagata cagcctaata tccgacaaac tgttttacag atttacgatc gtacttgtta 10260
cccatcattg aattttgaac atccgaacct gggagttttc cctgaaacag atagtatatt 10320
tgaacctgta taataatata tagtctagcg ctttacggaa gacaatgtat gtatttcggt 10380
tcctggagaa actattgcat ctattgcata ggtaatcttg cacgtcgcat ccccggttca 10440
ttttctgcgt ttccatcttg cacttcaata gcatatcttt gttaacgaag catctgtgct 10500
tcattttgta gaacaaaaat gcaacgcgag agcgctaatt tttcaaacaa agaatctgag 10560
ctgcattttt acagaacaga aatgcaacgc gaaagcgcta ttttaccaac gaagaatctg 10620
tgcttcattt ttgtaaaaca aaaatgcaac gcgagagcgc taatttttca aacaaagaat 10680
ctgagctgca tttttacaga acagaaatgc aacgcgagag cgctatttta ccaacaaaga 10740
atctatactt cttttttgtt ctacaaaaat gcatcccgag agcgctattt ttctaacaaa 10800
gcatcttaga ttactttttt tctcctttgt gcgctctata atgcagtctc ttgataactt 10860
tttgcactgt aggtccgtta aggttagaag aaggctactt tggtgtctat tttctcttcc 10920
ataaaaaaag cctgactcca cttcccgcgt ttactgatta ctagcgaagc tgcgggtgca 10980
ttttttcaag ataaaggcat ccccgattat attctatacc gatgtggatt gcgcatactt 11040
tgtgaacaga aagtgatagc gttgatgatt cttcattggt cagaaaatta tgaacggttt 11100
cttctatttt gtctctatat actacgtata ggaaatgttt acattttcgt attgttttcg 11160
attcactcta tgaatagttc ttactacaat ttttttgtct aaagagtaat actagagata 11220
aacataaaaa atgtagaggt cgagtttaga tgcaagttca aggagcgaaa ggtggatggg 11280
taggttatat agggatatag cacagagata tatagcaaag agatactttt gagcaatgtt 11340
tgtggaagcg gtattcgcaa tattttagta gctcgttaca gtccggtgcg tttttggttt 11400
tttgaaagtg cgtcttcaga gcgcttttgg ttttcaaaag cgctctgaag ttcctatact 11460
ttctagagaa taggaacttc ggaataggaa cttcaaagcg tttccgaaaa cgagcgcttc 11520
cgaaaatgca acgcgagctg cgcacataca gctcactgtt cacgtcgcac ctatatctgc 11580
gtgttgcctg tatatatata tacatgagaa gaacggcata gtgcgtgttt atgcttaaat 11640
gcgtacttat atgcgtctat ttatgtagga tgaaaggtag tctagtacct cctgtgatat 11700
tatcccattc catgcggggt atcgtatgct tccttcagca ctacccttta gctgttctat 11760
atgctgccac tcctcaattg gattagtctc atccttcaat gctatcattt cctttgatat 11820
tggatcatat gcatagtacc gagaaactag aggatc 11856
<210> 2
<211> 15539
<212> DNA
<213> Artificial sequence
<220>
<223> Plasmid
<400> 2
tcgcgcgttt cggtgatgac ggtgaaaacc tctgacacat gcagctcccg gagacggtca 60
cagcttgtct gtaagcggat gccgggagca gacaagcccg tcagggcgcg tcagcgggtg 120
ttggcgggtg tcggggctgg cttaactatg cggcatcaga gcagattgta ctgagagtgc 180
accataaatt cccgttttaa gagcttggtg agcgctagga gtcactgcca ggtatcgttt 240
gaacacggca ttagtcaggg aagtcataac acagtccttt cccgcaattt tctttttcta 300
ttactcttgg cctcctctag tacactctat atttttttat gcctcggtaa tgattttcat 360
tttttttttt ccacctagcg gatgactctt tttttttctt agcgattggc attatcacat 420
aatgaattat acattatata aagtaatgtg atttcttcga agaatatact aaaaaatgag 480
caggcaagat aaacgaaggc aaagatgaca gagcagaaag ccctagtaaa gcgtattaca 540
aatgaaacca agattcagat tgcgatctct ttaaagggtg gtcccctagc gatagagcac 600
tcgatcttcc cagaaaaaga ggcagaagca gtagcagaac aggccacaca atcgcaagtg 660
attaacgtcc acacaggtat agggtttctg gaccatatga tacatgctct ggccaagcat 720
tccggctggt cgctaatcgt tgagtgcatt ggtgacttac acatagacga ccatcacacc 780
actgaagact gcgggattgc tctcggtcaa gcttttaaag aggccctagg ggccgtgcgt 840
ggagtaaaaa ggtttggatc aggatttgcg cctttggatg aggcactttc cagagcggtg 900
gtagatcttt cgaacaggcc gtacgcagtt gtcgaacttg gtttgcaaag ggagaaagta 960
ggagatctct cttgcgagat gatcccgcat tttcttgaaa gctttgcaga ggctagcaga 1020
attaccctcc acgttgattg tctgcgaggc aagaatgatc atcaccgtag tgagagtgcg 1080
ttcaaggctc ttgcggttgc cataagagaa gccacctcgc ccaatggtac caacgatgtt 1140
ccctccacca aaggtgttct tatgtagtga caccgattat ttaaagctgc agcatacgat 1200
atatatacat gtgtatatat gtatacctat gaatgtcagt aagtatgtat acgaacagta 1260
tgatactgaa gatgacaagg taatgcatca ttctatacgt gtcattctga acgaggcgcg 1320
ctttcctttt ttctttttgc tttttctttt tttttctctt gaactcgacg gatctatgcg 1380
gtgtgaaata ccgcacagat gcgtaaggag aaaataccgc atcaggaaat tgtaagcgtt 1440
aatattttgt taaaattcgc gttaaatttt tgttaaatca gctcattttt taaccaatag 1500
gccgaaatcg gcaaaatccc ttataaatca aaagaataga ccgagatagg gttgagtgtt 1560
gttccagttt ggaacaagag tccactatta aagaacgtgg actccaacgt caaagggcga 1620
aaaaccgtct atcagggcga tggcccacta cgtgaaccat caccctaatc aagttttttg 1680
gggtcgaggt gccgtaaagc actaaatcgg aaccctaaag ggagcccccg atttagagct 1740
tgacggggaa agccggcgaa cgtggcgaga aaggaaggga agaaagcgaa aggagcgggc 1800
gctagggcgc tggcaagtgt agcggtcacg ctgcgcgtaa ccaccacacc cgccgcgctt 1860
aatgcgccgc tacagggcgc gtccattcgc cattcaggct gcgcaactgt tgggaagggc 1920
gcggtgcggg cctcttcgct attacgccag ctggcgaaag ggggatgtgc tgcaaggcga 1980
ttaagttggg taacgccagg gttttcccag tcacgacgtt gtaaaacgac ggccagtgag 2040
cgcgcgtaat acgactcact atagggcgaa ttgggtaccg ggccccccct cgaggtcgac 2100
ggcgcgccac tggtagagag cgactttgta tgccccaatt gcgaaacccg cgatatcctt 2160
ctcgattctt tagtacccga ccaggacaag gaaaaggagg tcgaaacgtt tttgaagaaa 2220
caagaggaac tacacggaag ctctaaagat ggcaaccagc cagaaactaa gaaaatgaag 2280
ttgatggatc caactggcac cgctggcttg aacaacaata ccagccttcc aacttctgta 2340
aataacggcg gtacgccagt gccaccagta ccgttacctt tcggtatacc tcctttcccc 2400
atgtttccaa tgcccttcat gcctccaacg gctactatca caaatcctca tcaagctgac 2460
gcaagcccta agaaatgaat aacaatactg acagtactaa ataattgcct acttggcttc 2520
acatacgttg catacgtcga tatagataat aatgataatg acagcaggat tatcgtaata 2580
cgtaatagct gaaaatctca aaaatgtgtg ggtcattacg taaataatga taggaatggg 2640
attcttctat ttttcctttt tccattctag cagccgtcgg gaaaacgtgg catcctctct 2700
ttcgggctca attggagtca cgctgccgtg agcatcctct ctttccatat ctaacaactg 2760
agcacgtaac caatggaaaa gcatgagctt agcgttgctc caaaaaagta ttggatggtt 2820
aataccattt gtctgttctc ttctgacttt gactcctcaa aaaaaaaaat ctacaatcaa 2880
cagatcgctt caattacgcc ctcacaaaaa cttttttcct tcttcttcgc ccacgttaaa 2940
ttttatccct catgttgtct aacggatttc tgcacttgat ttattataaa aagacaaaga 3000
cataatactt ctctatcaat ttcagttatt gttcttcctt gcgttattct tctgttcttc 3060
tttttctttt gtcatatata accataacca agtaatacat attcaaacta gtatgactga 3120
caaaaaaact cttaaagact taagaaatcg tagttctgtt tacgattcaa tggttaaatc 3180
acctaatcgt gctatgttgc gtgcaactgg tatgcaagat gaagactttg aaaaacctat 3240
cgtcggtgtc atttcaactt gggctgaaaa cacaccttgt aatatccact tacatgactt 3300
tggtaaacta gccaaagtcg gtgttaagga agctggtgct tggccagttc agttcggaac 3360
aatcacggtt tctgatggaa tcgccatggg aacccaagga atgcgtttct ccttgacatc 3420
tcgtgatatt attgcagatt ctattgaagc agccatggga ggtcataatg cggatgcttt 3480
tgtagccatt ggcggttgtg ataaaaacat gcccggttct gttatcgcta tggctaacat 3540
ggatatccca gccatttttg cttacggcgg aacaattgca cctggtaatt tagacggcaa 3600
agatatcgat ttagtctctg tctttgaagg tgtcggccat tggaaccacg gcgatatgac 3660
caaagaagaa gttaaagctt tggaatgtaa tgcttgtccc ggtcctggag gctgcggtgg 3720
tatgtatact gctaacacaa tggcgacagc tattgaagtt ttgggactta gccttccggg 3780
ttcatcttct cacccggctg aatccgcaga aaagaaagca gatattgaag aagctggtcg 3840
cgctgttgtc aaaatgctcg aaatgggctt aaaaccttct gacattttaa cgcgtgaagc 3900
ttttgaagat gctattactg taactatggc tctgggaggt tcaaccaact caacccttca 3960
cctcttagct attgcccatg ctgctaatgt ggaattgaca cttgatgatt tcaatacttt 4020
ccaagaaaaa gttcctcatt tggctgattt gaaaccttct ggtcaatatg tattccaaga 4080
cctttacaag gtcggagggg taccagcagt tatgaaatat ctccttaaaa atggcttcct 4140
tcatggtgac cgtatcactt gtactggcaa aacagtcgct gaaaatttga aggcttttga 4200
tgatttaaca cctggtcaaa aggttattat gccgcttgaa aatcctaaac gtgaagatgg 4260
tccgctcatt attctccatg gtaacttggc tccagacggt gccgttgcca aagtttctgg 4320
tgtaaaagtg cgtcgtcatg tcggtcctgc taaggtcttt aattctgaag aagaagccat 4380
tgaagctgtc ttgaatgatg atattgttga tggtgatgtt gttgtcgtac gttttgtagg 4440
accaaagggc ggtcctggta tgcctgaaat gctttccctt tcatcaatga ttgttggtaa 4500
agggcaaggt gaaaaagttg cccttctgac agatggccgc ttctcaggtg gtacttatgg 4560
tcttgtcgtg ggtcatatcg ctcctgaagc acaagatggc ggtccaatcg cctacctgca 4620
aacaggagac atagtcacta ttgaccaaga cactaaggaa ttacactttg atatctccga 4680
tgaagagtta aaacatcgtc aagagaccat tgaattgcca ccgctctatt cacgcggtat 4740
ccttggtaaa tatgctcaca tcgtttcgtc tgcttctagg ggagccgtaa cagacttttg 4800
gaagcctgaa gaaactggca aaaaatgttg tcctggttgc tgtggttaag cggccgcgtt 4860
aattcaaatt aattgatata gttttttaat gagtattgaa tctgtttaga aataatggaa 4920
tattattttt atttatttat ttatattatt ggtcggctct tttcttctga aggtcaatga 4980
caaaatgata tgaaggaaat aatgatttct aaaattttac aacgtaagat atttttacaa 5040
aagcctagct catcttttgt catgcactat tttactcacg cttgaaatta acggccagtc 5100
cactgcggag tcatttcaaa gtcatcctaa tcgatctatc gtttttgata gctcattttg 5160
gagttcgcga ttgtcttctg ttattcacaa ctgttttaat ttttatttca ttctggaact 5220
cttcgagttc tttgtaaagt ctttcatagt agcttacttt atcctccaac atatttaact 5280
tcatgtcaat ttcggctctt aaattttcca catcatcaag ttcaacatca tcttttaact 5340
tgaatttatt ctctagctct tccaaccaag cctcattgct ccttgattta ctggtgaaaa 5400
gtgatacact ttgcgcgcaa tccaggtcaa aactttcctg caaagaattc accaatttct 5460
cgacatcata gtacaatttg ttttgttctc ccatcacaat ttaatatacc tgatggattc 5520
ttatgaagcg ctgggtaatg gacgtgtcac tctacttcgc ctttttccct actcctttta 5580
gtacggaaga caatgctaat aaataagagg gtaataataa tattattaat cggcaaaaaa 5640
gattaaacgc caagcgttta attatcagaa agcaaacgtc gtaccaatcc ttgaatgctt 5700
cccaattgta tattaagagt catcacagca acatattctt gttattaaat taattattat 5760
tgatttttga tattgtataa aaaaaccaaa tatgtataaa aaaagtgaat aaaaaatacc 5820
aagtatggag aaatatatta gaagtctata cgttaaacca cccgggcccc ccctcgaggt 5880
cgacggtatc gataagcttg atatcgaatt cctgcagccc gggggatcca ctagttctag 5940
agcggccgct ctagaactag taccacaggt gttgtcctct gaggacataa aatacacacc 6000
gagattcatc aactcattgc tggagttagc atatctacaa ttgggtgaaa tggggagcga 6060
tttgcaggca tttgctcggc atgccggtag aggtgtggtc aataagagcg acctcatgct 6120
atacctgaga aagcaacctg acctacagga aagagttact caagaataag aattttcgtt 6180
ttaaaaccta agagtcactt taaaatttgt atacacttat tttttttata acttatttaa 6240
taataaaaat cataaatcat aagaaattcg cttactctta attaatcaaa aagttaaaat 6300
tgtacgaata gattcaccac ttcttaacaa atcaaaccct tcattgattt tctcgaatgg 6360
caatacatgt gtaattaaag gatcaagagc aaacttcttc gccataaagt cggcaacaag 6420
ttttggaaca ctatccttgc tcttaaaacc gccaaatata gctcccttcc atgtacgacc 6480
gcttagcaac agcataggat tcatcgacaa attttgtgaa tcaggaggaa cacctacgat 6540
cacactgact ccatatgcct cttgacagca ggacaacgca gttaccatag tatcaagacg 6600
gcctataact tcaaaagaga aatcaactcc accgtttgac atttcagtaa ggacttcttg 6660
tattggtttc ttataatctt gagggttaac acattcagta gccccgacct ccttagcttt 6720
tgcaaatttg tccttattga tgtctacacc tataatcctc gctgcgcctg cagctttaca 6780
ccccataata acgcttagtc ctactcctcc taaaccgaat actgcacaag tcgaaccctg 6840
tgtaaccttt gcaactttaa ctgcggaacc gtaaccggtg gaaaatccgc accctatcaa 6900
gcaaactttt tccagtggtg aagctgcatc gattttagcg acagatatct cgtccaccac 6960
tgtgtattgg gaaaatgtag aagtaccaag gaaatggtgt ataggtttcc ctctgcatgt 7020
aaatctgctt gtaccatcct gcatagtacc tctaggcata gacaaatcat ttttaaggca 7080
gaaattaccc tcaggatgtt tgcagactct acacttacca cattgaggag tgaacagtgg 7140
gatcacttta tcaccaggac gaacagtggt aacaccttca cctatggatt caacgattcc 7200
ggcagcctcg tgtcccgcga ttactggcaa aggagtaact agagtgccac tcaccacatg 7260
gtcgtcggat ctacagattc cggtggcaac catcttgatt ctaacctcgt gtgcttttgg 7320
tggcgctact tctacttctt ctatgctaaa cggctttttc tcttcccaca aaactgccgc 7380
tttacactta ataactttac cggctgttga catcctcagc tagctattgt aatatgtgtg 7440
tttgtttgga ttattaagaa gaataattac aaaaaaaatt acaaaggaag gtaattacaa 7500
cagaattaag aaaggacaag aaggaggaag agaatcagtt cattatttct tctttgttat 7560
ataacaaacc caagtagcga tttggccata cattaaaagt tgagaaccac cctccctggc 7620
aacagccaca actcgttacc attgttcatc acgatcatga aactcgctgt cagctgaaat 7680
ttcacctcag tggatctctc tttttattct tcatcgttcc actaaccttt ttccatcagc 7740
tggcagggaa cggaaagtgg aatcccattt agcgagcttc ctcttttctt caagaaaaga 7800
cgaagcttgt gtgtgggtgc gcgcgctagt atctttccac attaagaaat ataccataaa 7860
ggttacttag acatcactat ggctatatat atatatatat atatatgtaa cttagcacca 7920
tcgcgcgtgc atcactgcat gtgttaaccg aaaagtttgg cgaacacttc accgacacgg 7980
tcatttagat ctgtcgtctg cattgcacgt cccttagcct taaatcctag gcgggagcat 8040
tctcgtgtaa ttgtgcagcc tgcgtagcaa ctcaacatag cgtagtctac ccagtttttc 8100
aagggtttat cgttagaaga ttctcccttt tcttcctgct cacaaatctt aaagtcatac 8160
attgcacgac taaatgcaag catgcggatc ccccgggctg caggaattcg atatcaagct 8220
tatcgatacc gtcgactggc cattaatctt tcccatatta gatttcgcca agccatgaaa 8280
gttcaagaaa ggtctttaga cgaattaccc ttcatttctc aaactggcgt caagggatcc 8340
tggtatggtt ttatcgtttt atttctggtt cttatagcat cgttttggac ttctctgttc 8400
ccattaggcg gttcaggagc cagcgcagaa tcattctttg aaggatactt atcctttcca 8460
attttgattg tctgttacgt tggacataaa ctgtatacta gaaattggac tttgatggtg 8520
aaactagaag atatggatct tgataccggc agaaaacaag tagatttgac tcttcgtagg 8580
gaagaaatga ggattgagcg agaaacatta gcaaaaagat ccttcgtaac aagattttta 8640
catttctggt gttgaaggga aagatatgag ctatacagcg gaatttccat atcactcaga 8700
ttttgttatc taattttttc cttcccacgt ccgcgggaat ctgtgtatat tactgcatct 8760
agatatatgt tatcttatct tggcgcgtac atttaatttt caacgtattc tataagaaat 8820
tgcgggagtt tttttcatgt agatgatact gactgcacgc aaatataggc atgatttata 8880
ggcatgattt gatggctgta ccgataggaa cgctaagagt aacttcagaa tcgttatcct 8940
ggcggaaaaa attcatttgt aaactttaaa aaaaaaagcc aatatcccca aaattattaa 9000
gagcgcctcc attattaact aaaatttcac tcagcatcca caatgtatca ggtatctact 9060
acagatatta catgtggcga aaaagacaag aacaatgcaa tagcgcatca agaaaaaaca 9120
caaagctttc aatcaatgaa tcgaaaatgt cattaaaata gtatataaat tgaaactaag 9180
tcataaagct ataaaaagaa aatttattta aatgcaagat ttaaagtaaa ttcacggccc 9240
tgcaggcctc agctcttgtt ttgttctgca aataacttac ccatcttttt caaaacttta 9300
ggtgcaccct cctttgctag aataagttct atccaataca tcctatttgg atctgcttga 9360
gcttctttca tcacggatac gaattcattt tctgttctca caattttgga cacaactctg 9420
tcttccgttg ccccgaaact ttctggcagt tttgagtaat tccacatagg aatgtcatta 9480
taactctggt tcggaccatg aatttccctc tcaaccgtgt aaccatcgtt attaatgata 9540
aagcagattg ggtttatctt ctctctaatg gctagtccta attcttggac agtcagttgc 9600
aatgatccat ctccgataaa caataaatgt ctagattctt tatctgcaat ttggctgcct 9660
agagctgcgg ggaaagtgta tcctatagat ccccacaagg gttgaccaat aaaatgtgat 9720
ttcgatttca gaaatataga tgaggcaccg aagaaagaag tgccttgttc agccacgatc 9780
gtctcattac tttgggtcaa attttcgaca gcttgccaca gtctatcttg tgacaacagc 9840
gcgttagaag gtacaaaatc ttcttgcttt ttatctatgt acttgccttt atattcaatt 9900
tcggacaagt caagaagaga tgatatcagg gattcgaagt cgaaattttg gattctttcg 9960
ttgaaaattt taccttcatc gatattcaag gaaatcattt tattttcatt aagatggtga 10020
gtaaatgcac ccgtactaga atcggtaagc tttacaccca acataagaat aaaatcagca 10080
gattccacaa attccttcaa gtttggctct gacagagtac cgttgtaaat ccccaaaaat 10140
gagggcaatg cttcatcaac agatgattta ccaaagttca aagtagtaat aggtaactta 10200
gtctttgaaa taaactgagt aacagtcttc tctaggccga acgatataat ttcatggcct 10260
gtgattacaa ttggtttctt ggcattcttc agactttcct gtattttgtt cagaatctct 10320
tgatcagatg tattcgacgt ggaattttcc ttcttaagag gcaaggatgg tttttcagcc 10380
ttagcggcag ctacatctac aggtaaattg atgtaaaccg gctttctttc ctttagtaag 10440
gcagacaaca ctctatcaat ttcaacagtt gcattctcgg ctgtcaataa agtcctggca 10500
gcagtaaccg gttcgtgcat cttcataaag tgcttgaaat caccatcagc caacgtatgg 10560
tgaacaaact taccttcgtt ctgcactttc gaggtaggag atcccacgat ctcaacaaca 10620
ggcaggttct cagcatagga gcccgctaag ccattaactg cggataattc gccaacacca 10680
aatgtagtca agaatgccgc agcctttttc gttcttgcgt acccgtcggc catataggag 10740
gcatttaact cattagcatt tcccacccat ttcatatctt tgtgtgaaat aatttgatct 10800
agaaattgca aattgtagtc acctggtact ccgaatattt cttctatacc taattcgtgt 10860
aatctgtcca acagatagtc acctactgta tacattttgt ttactagttt atgtgtgttt 10920
attcgaaact aagttcttgg tgttttaaaa ctaaaaaaaa gactaactat aaaagtagaa 10980
tttaagaagt ttaagaaata gatttacaga attacaatca atacctaccg tctttatata 11040
cttattagtc aagtagggga ataatttcag ggaactggtt tcaacctttt ttttcagctt 11100
tttccaaatc agagagagca gaaggtaata gaaggtgtaa gaaaatgaga tagatacatg 11160
cgtgggtcaa ttgccttgtg tcatcattta ctccaggcag gttgcatcac tccattgagg 11220
ttgtgcccgt tttttgcctg tttgtgcccc tgttctctgt agttgcgcta agagaatgga 11280
cctatgaact gatggttggt gaagaaaaca atattttggt gctgggattc tttttttttc 11340
tggatgccag cttaaaaagc gggctccatt atatttagtg gatgccagga ataaactgtt 11400
cacccagaca cctacgatgt tatatattct gtgtaacccg ccccctattt tgggcatgta 11460
cgggttacag cagaattaaa aggctaattt tttgactaaa taaagttagg aaaatcacta 11520
ctattaatta tttacgtatt ctttgaaatg gcagtattga taatgataaa ctcgaactga 11580
aaaagcgtgt tttttattca aaatgattct aactccctta cgtaatcaag gaatcttttt 11640
gccttggcct ccgcgtcatt aaacttcttg ttgttgacgc taacattcaa cgctagtata 11700
tattcgtttt tttcaggtaa gttcttttca acgggtctta ctgatgaggc agtcgcgtct 11760
gaacctgtta agaggtcaaa tatgtcttct tgaccgtacg tgtcttgcat gttattagct 11820
ttgggaattt gcatcaagtc ataggaaaat ttaaatcttg gctctcttgg gctcaaggtg 11880
acaaggtcct cgaaaatagg gcgcgcccca ccgcggtgga gctccagctt ttgttccctt 11940
tagtgagggt taattgcgcg cttggcgtaa tcatggtcat agctgtttcc tgtgtgaaat 12000
tgttatccgc tcacaattcc acacaacata cgagccggaa gcataaagtg taaagcctgg 12060
ggtgcctaat gagtgagcta actcacatta attgcgttgc gctcactgcc cgctttccag 12120
tcgggaaacc tgtcgtgcca gctgcattaa tgaatcggcc aacgcgcggg gagaggcggt 12180
ttgcgtattg ggcgctcttc cgcttcctcg ctcactgact cgctgcgctc ggtcgttcgg 12240
ctgcggcgag cggtatcagc tcactcaaag gcggtaatac ggttatccac agaatcaggg 12300
gataacgcag gaaagaacat gtgagcaaaa ggccagcaaa aggccaggaa ccgtaaaaag 12360
gccgcgttgc tggcgttttt ccataggctc cgcccccctg acgagcatca caaaaatcga 12420
cgctcaagtc agaggtggcg aaacccgaca ggactataaa gataccaggc gtttccccct 12480
ggaagctccc tcgtgcgctc tcctgttccg accctgccgc ttaccggata cctgtccgcc 12540
tttctccctt cgggaagcgt ggcgctttct catagctcac gctgtaggta tctcagttcg 12600
gtgtaggtcg ttcgctccaa gctgggctgt gtgcacgaac cccccgttca gcccgaccgc 12660
tgcgccttat ccggtaacta tcgtcttgag tccaacccgg taagacacga cttatcgcca 12720
ctggcagcag ccactggtaa caggattagc agagcgaggt atgtaggcgg tgctacagag 12780
ttcttgaagt ggtggcctaa ctacggctac actagaagaa cagtatttgg tatctgcgct 12840
ctgctgaagc cagttacctt cggaaaaaga gttggtagct cttgatccgg caaacaaacc 12900
accgctggta gcggtggttt ttttgtttgc aagcagcaga ttacgcgcag aaaaaaagga 12960
tctcaagaag atcctttgat cttttctacg gggtctgacg ctcagtggaa cgaaaactca 13020
cgttaaggga ttttggtcat gagattatca aaaaggatct tcacctagat ccttttaaat 13080
taaaaatgaa gttttaaatc aatctaaagt atatatgagt aaacttggtc tgacagttac 13140
caatgcttaa tcagtgaggc acctatctca gcgatctgtc tatttcgttc atccatagtt 13200
gcctgactcc ccgtcgtgta gataactacg atacgggagg gcttaccatc tggccccagt 13260
gctgcaatga taccgcgaga cccacgctca ccggctccag atttatcagc aataaaccag 13320
ccagccggaa gggccgagcg cagaagtggt cctgcaactt tatccgcctc catccagtct 13380
attaattgtt gccgggaagc tagagtaagt agttcgccag ttaatagttt gcgcaacgtt 13440
gttgccattg ctacaggcat cgtggtgtca cgctcgtcgt ttggtatggc ttcattcagc 13500
tccggttccc aacgatcaag gcgagttaca tgatccccca tgttgtgcaa aaaagcggtt 13560
agctccttcg gtcctccgat cgttgtcaga agtaagttgg ccgcagtgtt atcactcatg 13620
gttatggcag cactgcataa ttctcttact gtcatgccat ccgtaagatg cttttctgtg 13680
actggtgagt actcaaccaa gtcattctga gaatagtgta tgcggcgacc gagttgctct 13740
tgcccggcgt caatacggga taataccgcg ccacatagca gaactttaaa agtgctcatc 13800
attggaaaac gttcttcggg gcgaaaactc tcaaggatct taccgctgtt gagatccagt 13860
tcgatgtaac ccactcgtgc acccaactga tcttcagcat cttttacttt caccagcgtt 13920
tctgggtgag caaaaacagg aaggcaaaat gccgcaaaaa agggaataag ggcgacacgg 13980
aaatgttgaa tactcatact cttccttttt caatattatt gaagcattta tcagggttat 14040
tgtctcatga gcggatacat atttgaatgt atttagaaaa ataaacaaat aggggttccg 14100
cgcacatttc cccgaaaagt gccacctgaa cgaagcatct gtgcttcatt ttgtagaaca 14160
aaaatgcaac gcgagagcgc taatttttca aacaaagaat ctgagctgca tttttacaga 14220
acagaaatgc aacgcgaaag cgctatttta ccaacgaaga atctgtgctt catttttgta 14280
aaacaaaaat gcaacgcgag agcgctaatt tttcaaacaa agaatctgag ctgcattttt 14340
acagaacaga aatgcaacgc gagagcgcta ttttaccaac aaagaatcta tacttctttt 14400
ttgttctaca aaaatgcatc ccgagagcgc tatttttcta acaaagcatc ttagattact 14460
ttttttctcc tttgtgcgct ctataatgca gtctcttgat aactttttgc actgtaggtc 14520
cgttaaggtt agaagaaggc tactttggtg tctattttct cttccataaa aaaagcctga 14580
ctccacttcc cgcgtttact gattactagc gaagctgcgg gtgcattttt tcaagataaa 14640
ggcatccccg attatattct ataccgatgt ggattgcgca tactttgtga acagaaagtg 14700
atagcgttga tgattcttca ttggtcagaa aattatgaac ggtttcttct attttgtctc 14760
tatatactac gtataggaaa tgtttacatt ttcgtattgt tttcgattca ctctatgaat 14820
agttcttact acaatttttt tgtctaaaga gtaatactag agataaacat aaaaaatgta 14880
gaggtcgagt ttagatgcaa gttcaaggag cgaaaggtgg atgggtaggt tatataggga 14940
tatagcacag agatatatag caaagagata cttttgagca atgtttgtgg aagcggtatt 15000
cgcaatattt tagtagctcg ttacagtccg gtgcgttttt ggttttttga aagtgcgtct 15060
tcagagcgct tttggttttc aaaagcgctc tgaagttcct atactttcta gagaatagga 15120
acttcggaat aggaacttca aagcgtttcc gaaaacgagc gcttccgaaa atgcaacgcg 15180
agctgcgcac atacagctca ctgttcacgt cgcacctata tctgcgtgtt gcctgtatat 15240
atatatacat gagaagaacg gcatagtgcg tgtttatgct taaatgcgta cttatatgcg 15300
tctatttatg taggatgaaa ggtagtctag tacctcctgt gatattatcc cattccatgc 15360
ggggtatcgt atgcttcctt cagcactacc ctttagctgt tctatatgct gccactcctc 15420
aattggatta gtctcatcct tcaatgctat catttccttt gatattggat catactaaga 15480
aaccattatt atcatgacat taacctataa aaataggcgt atcacgaggc cctttcgtc 15539
<210> 3
<211> 4586
<212> DNA
<213> Artificial sequence
<220>
<223> Template
<400> 3
gggtaccgag ctcgaattca ctggccgtcg ttttacaacg tcgtgactgg gaaaaccctg 60
gcgttaccca acttaatcgc cttgcagcac atcccccttt cgccagctgg cgtaatagcg 120
aagaggcccg caccgatcgc ccttcccaac agttgcgcag cctgaatggc gaatggcgcc 180
tgatgcggta ttttctcctt acgcatctgt gcggtatttc acaccgcata tggtgcactc 240
tcagtacaat ctgctctgat gccgcatagt taagccagcc ccgacacccg ccaacacccg 300
ctgacgcgcc ctgacgggct tgtctgctcc cggcatccgc ttacagacaa gctgtgaccg 360
tctccgggag ctgcatgtgt cagaggtttt caccgtcatc accgaaacgc gcgagacgaa 420
agggcctcgt gatacgccta tttttatagg ttaatgtcat gataataatg gtttcttaga 480
cgtcaggtgg cacttttcgg ggaaatgtgc gcggaacccc tatttgttta tttttctaaa 540
tacattcaaa tatgtatccg ctcatgagac aataaccctg ataaatgctt caataatatt 600
gaaaaaggaa gagtatgagt attcaacatt tccgtgtcgc ccttattccc ttttttgcgg 660
cattttgcct tcctgttttt gctcacccag aaacgctggt gaaagtaaaa gatgctgaag 720
atcagttggg tgcacgagtg ggttacatcg aactggatct caacagcggt aagatccttg 780
agagttttcg ccccgaagaa cgttttccaa tgatgagcac ttttaaagtt ctgctatgtg 840
gcgcggtatt atcccgtatt gacgccgggc aagagcaact cggtcgccgc atacactatt 900
ctcagaatga cttggttgag tactcaccag tcacagaaaa gcatcttacg gatggcatga 960
cagtaagaga attatgcagt gctgccataa ccatgagtga taacactgcg gccaacttac 1020
ttctgacaac gatcggagga ccgaaggagc taaccgcttt tttgcacaac atgggggatc 1080
atgtaactcg ccttgatcgt tgggaaccgg agctgaatga agccatacca aacgacgagc 1140
gtgacaccac gatgcctgta gcaatggcaa caacgttgcg caaactatta actggcgaac 1200
tacttactct agcttcccgg caacaattaa tagactggat ggaggcggat aaagttgcag 1260
gaccacttct gcgctcggcc cttccggctg gctggtttat tgctgataaa tctggagccg 1320
gtgagcgtgg gtctcgcggt atcattgcag cactggggcc agatggtaag ccctcccgta 1380
tcgtagttat ctacacgacg gggagtcagg caactatgga tgaacgaaat agacagatcg 1440
ctgagatagg tgcctcactg attaagcatt ggtaactgtc agaccaagtt tactcatata 1500
tactttagat tgatttaaaa cttcattttt aatttaaaag gatctaggtg aagatccttt 1560
ttgataatct catgaccaaa atcccttaac gtgagttttc gttccactga gcgtcagacc 1620
ccgtagaaaa gatcaaagga tcttcttgag atcctttttt tctgcgcgta atctgctgct 1680
tgcaaacaaa aaaaccaccg ctaccagcgg tggtttgttt gccggatcaa gagctaccaa 1740
ctctttttcc gaaggtaact ggcttcagca gagcgcagat accaaatact gtccttctag 1800
tgtagccgta gttaggccac cacttcaaga actctgtagc accgcctaca tacctcgctc 1860
tgctaatcct gttaccagtg gctgctgcca gtggcgataa gtcgtgtctt accgggttgg 1920
actcaagacg atagttaccg gataaggcgc agcggtcggg ctgaacgggg ggttcgtgca 1980
cacagcccag cttggagcga acgacctaca ccgaactgag atacctacag cgtgagctat 2040
gagaaagcgc cacgcttccc gaagggagaa aggcggacag gtatccggta agcggcaggg 2100
tcggaacagg agagcgcacg agggagcttc cagggggaaa cgcctggtat ctttatagtc 2160
ctgtcgggtt tcgccacctc tgacttgagc gtcgattttt gtgatgctcg tcaggggggc 2220
ggagcctatg gaaaaacgcc agcaacgcgg cctttttacg gttcctggcc ttttgctggc 2280
cttttgctca catgttcttt cctgcgttat cccctgattc tgtggataac cgtattaccg 2340
cctttgagtg agctgatacc gctcgccgca gccgaacgac cgagcgcagc gagtcagtga 2400
gcgaggaagc ggaagagcgc ccaatacgca aaccgcctct ccccgcgcgt tggccgattc 2460
attaatgcag ctggcacgac aggtttcccg actggaaagc gggcagtgag cgcaacgcaa 2520
ttaatgtgag ttagctcact cattaggcac cccaggcttt acactttatg cttccggctc 2580
gtatgttgtg tggaattgtg agcggataac aatttcacac aggaaacagc tatgaccatg 2640
attacgccaa gcttgcatgc ctgcaggtcg actctagagg atccccgcat tgcggattac 2700
gtattctaat gttcagataa cttcgtatag catacattat acgaagttat ctagggattc 2760
ataaccattt tctcaatcga attacacaga acacaccgta caaacctctc tatcataact 2820
acttaatagt cacacacgta ctcgtctaaa tacacatcat cgtcctacaa gttcatcaaa 2880
gtgttggaca gacaactata ccagcatgga tctcttgtat cggttctttt ctcccgctct 2940
ctcgcaataa caatgaacac tgggtcaatc atagcctaca caggtgaaca gagtagcgtt 3000
tatacagggt ttatacggtg attcctacgg caaaaatttt tcatttctaa aaaaaaaaag 3060
aaaaattttt ctttccaacg ctagaaggaa aagaaaaatc taattaaatt gatttggtga 3120
ttttctgaga gttccctttt tcatatatcg aattttgaat ataaaaggag atcgaaaaaa 3180
tttttctatt caatctgttt tctggtttta tttgatagtt tttttgtgta ttattattat 3240
ggattagtac tggtttatat gggtttttct gtataacttc tttttatttt agtttgttta 3300
atcttatttt gagttacatt atagttccct aactgcaaga gaagtaacat taaaactcga 3360
gatgggtaag gaaaagactc acgtttcgag gccgcgatta aattccaaca tggatgctga 3420
tttatatggg tataaatggg ctcgcgataa tgtcgggcaa tcaggtgcga caatctatcg 3480
attgtatggg aagcccgatg cgccagagtt gtttctgaaa catggcaaag gtagcgttgc 3540
caatgatgtt acagatgaga tggtcagact aaactggctg acggaattta tgcctcttcc 3600
gaccatcaag cattttatcc gtactcctga tgatgcatgg ttactcacca ctgcgatccc 3660
cggcaaaaca gcattccagg tattagaaga atatcctgat tcaggtgaaa atattgttga 3720
tgcgctggca gtgttcctgc gccggttgca ttcgattcct gtttgtaatt gtccttttaa 3780
cagcgatcgc gtatttcgtc tcgctcaggc gcaatcacga atgaataacg gtttggttga 3840
tgcgagtgat tttgatgacg agcgtaatgg ctggcctgtt gaacaagtct ggaaagaaat 3900
gcataagctt ttgccattct caccggattc agtcgtcact catggtgatt tctcacttga 3960
taaccttatt tttgacgagg ggaaattaat aggttgtatt gatgttggac gagtcggaat 4020
cgcagaccga taccaggatc ttgccatcct atggaactgc ctcggtgagt tttctccttc 4080
attacagaaa cggctttttc aaaaatatgg tattgataat cctgatatga ataaattgca 4140
gtttcatttg atgctcgatg agtttttcta agtttaactt gatactacta gattttttct 4200
cttcatttat aaaatttttg gttataattg aagctttaga agtatgaaaa aatccttttt 4260
tttcattctt tgcaaccaaa ataagaagct tcttttattc attgaaatga tgaatataaa 4320
cctaacaaaa gaaaaagact cgaatatcaa acattaaaaa aaaataaaag aggttatctg 4380
ttttcccatt tagttggagt ttgcattttc taatagatag aactctcaat taatgtggat 4440
ttagtttctc tgttcgtttt tttttgtttt gttctcactg tatttacatt tctatttagt 4500
atttagttat tcatataatc tataacttcg tatagcatac attatacgaa gttatccagt 4560
gatgatacaa cgagttagcc aaggtg 4586
<210> 4
<211> 80
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 4
ttccggtttc tttgaaattt ttttgattcg gtaatctccg agcagaagga gcattgcgga 60
ttacgtattc taatgttcag 80
<210> 5
<211> 81
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 5
gggtaataac tgatataatt aaattgaagc tctaatttgt gagtttagta caccttggct 60
aactcgttgt atcatcactg g 81
<210> 6
<211> 38
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 6
gcctcgagtt ttaatgttac ttctcttgca gttaggga 38
<210> 7
<211> 31
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 7
gctaaattcg agtgaaacac aggaagacca g 31
<210> 8
<211> 90
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 8
gtattttggt agattcaatt ctctttccct ttccttttcc ttcgctcccc ttccttatca 60
gcattgcgga ttacgtattc taatgttcag 90
<210> 9
<211> 90
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 9
ttggttgggg gaaaaagagg caacaggaaa gatcagaggg ggaggggggg ggagagtgtc 60
accttggcta actcgttgta tcatcactgg 90
<210> 10
<211> 21
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 10
tcggtgcggg cctcttcgct a 21
<210> 11
<211> 21
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 11
aatgtgagtt agctcactca t 21
<210> 12
<211> 57
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 12
aattggatcc ggcgcgccgt ttaaacggcc ggccaatgtg gctgtggttt cagggtc 57
<210> 13
<211> 49
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 13
aatttctaga ttaattaagc ggccgcaagg ccatgaagct ttttctttc 49
<210> 14
<211> 24
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 14
ttctcgacgt gggccttttt cttg 24
<210> 15
<211> 49
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 15
tgcagcttta aataatcggt gtcactactt tgccttcgtt tatcttgcc 49
<210> 16
<211> 49
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 16
gagcaggcaa gataaacgaa ggcaaagtag tgacaccgat tatttaaag 49
<210> 17
<211> 49
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 17
tatggaccct gaaaccacag ccacattgta accaccacga cggttgttg 49
<210> 18
<211> 49
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 18
tttagcaaca accgtcgtgg tggttacaat gtggctgtgg tttcagggt 49
<210> 19
<211> 49
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 19
ccagaaaccc tatacctgtg tggacgtaag gccatgaagc tttttcttt 49
<210> 20
<211> 49
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 20
attggaaaga aaaagcttca tggccttacg tccacacagg tatagggtt 49
<210> 21
<211> 22
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 21
cataagaaca cctttggtgg ag 22
<210> 22
<211> 22
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 22
aggattatca ttcataagtt tc 22
<210> 23
<211> 23
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 23
ttcttggagc tgggacatgt ttg 23
<210> 24
<211> 22
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 24
tgatgatatt tcataaataa tg 22
<210> 25
<211> 23
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 25
atgcgtccat ctttacagtc ctg 23
<210> 26
<211> 22
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 26
tacgtacgga ccaatcgaag tg 22
<210> 27
<211> 49
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 27
aattcgtttg agtacactac taatggcttt gttggcaata tgtttttgc 49
<210> 28
<211> 49
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 28
atatagcaaa aacatattgc caacaaagcc attagtagtg tactcaaac 49
<210> 29
<211> 49
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 29
tatggaccct gaaaccacag ccacattctt gttatttata aaaagacac 49
<210> 30
<211> 49
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 30
ctcccgtgtc tttttataaa taacaagaat gtggctgtgg tttcagggt 49
<210> 31
<211> 49
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 31
taccgtaggc gtccttagga aagatagaag gccatgaagc tttttcttt 49
<210> 32
<211> 49
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 32
attggaaaga aaaagcttca tggccttcta tctttcctaa ggacgccta 49
<210> 33
<211> 21
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 33
ttattgtttg gcatttgtag c 21
<210> 34
<211> 22
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 34
ccaagcatct cataaaccta tg 22
<210> 35
<211> 22
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 35
tgtgcagatg cagatgtgag ac 22
<210> 36
<211> 17
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 36
agttattgat accgtac 17
<210> 37
<211> 19
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 37
cgagataccg taggcgtcc 19
<210> 38
<211> 24
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 38
ttatgtatgc tcttctgact tttc 24
<210> 39
<211> 49
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 39
aataattaga gattaaatcg ctcatttttt gccagtttct tcaggcttc 49
<210> 40
<211> 49
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 40
agcctgaaga aactggcaaa aaatgagcga tttaatctct aattattag 49
<210> 41
<211> 49
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 41
tatggaccct gaaaccacag ccacattttt caatcattgg agcaatcat 49
<210> 42
<211> 49
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 42
taaaatgatt gctccaatga ttgaaaaatg tggctgtggt ttcagggtc 49
<210> 43
<211> 49
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 43
accgtaggtg ttgtttggga aagtggaagg ccatgaagct ttttctttc 49
<210> 44
<211> 49
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 44
ttggaaagaa aaagcttcat ggccttccac tttcccaaac aacacctac 49
<210> 45
<211> 23
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 45
ttattgctta gcgttggtag cag 23
<210> 46
<211> 21
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 46
tttttggtgg ttccggcttc c 21
<210> 47
<211> 22
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 47
aaagttggca tagcggaaac tt 22
<210> 48
<211> 16
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 48
gtcattgaca ccatct 16
<210> 49
<211> 19
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 49
agagataccg taggtgttg 19
<210> 50
<211> 33
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 50
aattggcgcg ccatgaaagc tctggtttat cac 33
<210> 51
<211> 49
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 51
tgaatcatga gttttatgtt aattagctca ggcagcgcct gcgttcgag 49
<210> 52
<211> 49
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 52
atcctctcga acgcaggcgc tgcctgagct aattaacata aaactcatg 49
<210> 53
<211> 34
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 53
aattgtttaa acaagtaaat aaattaatca gcat 34
<210> 54
<211> 49
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 54
acacaataca ataacaagaa gaacaaaatg aaagctctgg tttatcacg 49
<210> 55
<211> 49
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 55
agcgtataca tctgttggga aagtagaagg ccatgaagct ttttctttc 49
<210> 56
<211> 49
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 56
ttggaaagaa aaagcttcat ggccttctac tttcccaaca gatgtatac 49
<210> 57
<211> 22
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 57
ttattgttta gcgttagtag cg 22
<210> 58
<211> 72
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 58
cataatcaat ctcaaagaga acaacacaat acaataacaa gaagaacaaa atgaaagctc 60
tggtttatca cg 72
<210> 59
<211> 21
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 59
taggcataat caccgaagaa g 21
<210> 60
<211> 21
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 60
aaaatggtaa gcagctgaaa g 21
<210> 61
<211> 17
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 61
agttgttaga actgttg 17
<210> 62
<211> 19
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 62
gacgatagcg tatacatct 19
<210> 63
<211> 22
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 63
cttagcctct agccatagcc at 22
<210> 64
<211> 23
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 64
ttagttttgc tggccgcatc ttc 23
<210> 65
<211> 21
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 65
cccattaata tactattgag a 21
<210> 66
<211> 7523
<212> DNA
<213> Artificial sequence
<220>
<223> Plasmid
<400> 66
ccagcttttg ttccctttag tgagggttaa ttgcgcgctt ggcgtaatca tggtcatagc 60
tgtttcctgt gtgaaattgt tatccgctca caattccaca caacatagga gccggaagca 120
taaagtgtaa agcctggggt gcctaatgag tgaggtaact cacattaatt gcgttgcgct 180
cactgcccgc tttccagtcg ggaaacctgt cgtgccagct gcattaatga atcggccaac 240
gcgcggggag aggcggtttg cgtattgggc gctcttccgc ttcctcgctc actgactcgc 300
tgcgctcggt cgttcggctg cggcgagcgg tatcagctca ctcaaaggcg gtaatacggt 360
tatccacaga atcaggggat aacgcaggaa agaacatgtg agcaaaaggc cagcaaaagg 420
ccaggaaccg taaaaaggcc gcgttgctgg cgtttttcca taggctccgc ccccctgacg 480
agcatcacaa aaatcgacgc tcaagtcaga ggtggcgaaa cccgacagga ctataaagat 540
accaggcgtt tccccctgga agctccctcg tgcgctctcc tgttccgacc ctgccgctta 600
ccggatacct gtccgccttt ctcccttcgg gaagcgtggc gctttctcat agctcacgct 660
gtaggtatct cagttcggtg taggtcgttc gctccaagct gggctgtgtg cacgaacccc 720
ccgttcagcc cgaccgctgc gccttatccg gtaactatcg tcttgagtcc aacccggtaa 780
gacacgactt atcgccactg gcagcagcca ctggtaacag gattagcaga gcgaggtatg 840
taggcggtgc tacagagttc ttgaagtggt ggcctaacta cggctacact agaaggacag 900
tatttggtat ctgcgctctg ctgaagccag ttaccttcgg aaaaagagtt ggtagctctt 960
gatccggcaa acaaaccacc gctggtagcg gtggtttttt tgtttgcaag cagcagatta 1020
cgcgcagaaa aaaaggatct caagaagatc ctttgatctt ttctacgggg tctgacgctc 1080
agtggaacga aaactcacgt taagggattt tggtcatgag attatcaaaa aggatcttca 1140
cctagatcct tttaaattaa aaatgaagtt ttaaatcaat ctaaagtata tatgagtaaa 1200
cttggtctga cagttaccaa tgcttaatca gtgaggcacc tatctcagcg atctgtctat 1260
ttcgttcatc catagttgcc tgactccccg tcgtgtagat aactacgata cgggagggct 1320
taccatctgg ccccagtgct gcaatgatac cgcgagaccc acgctcaccg gctccagatt 1380
tatcagcaat aaaccagcca gccggaaggg ccgagcgcag aagtggtcct gcaactttat 1440
ccgcctccat ccagtctatt aattgttgcc gggaagctag agtaagtagt tcgccagtta 1500
atagtttgcg caacgttgtt gccattgcta caggcatcgt ggtgtcacgc tcgtcgtttg 1560
gtatggcttc attcagctcc ggttcccaac gatcaaggcg agttacatga tcccccatgt 1620
tgtgcaaaaa agcggttagc tccttcggtc ctccgatcgt tgtcagaagt aagttggccg 1680
cagtgttatc actcatggtt atggcagcac tgcataattc tcttactgtc atgccatccg 1740
taagatgctt ttctgtgact ggtgagtact caaccaagtc attctgagaa tagtgtatgc 1800
ggcgaccgag ttgctcttgc ccggcgtcaa tacgggataa taccgcgcca catagcagaa 1860
ctttaaaagt gctcatcatt ggaaaacgtt cttcggggcg aaaactctca aggatcttac 1920
cgctgttgag atccagttcg atgtaaccca ctcgtgcacc caactgatct tcagcatctt 1980
ttactttcac cagcgtttct gggtgagcaa aaacaggaag gcaaaatgcc gcaaaaaagg 2040
gaataagggc gacacggaaa tgttgaatac tcatactctt cctttttcaa tattattgaa 2100
gcatttatca gggttattgt ctcatgagcg gatacatatt tgaatgtatt tagaaaaata 2160
aacaaatagg ggttccgcgc acatttcccc gaaaagtgcc acctgaacga agcatctgtg 2220
cttcattttg tagaacaaaa atgcaacgcg agagcgctaa tttttcaaac aaagaatctg 2280
agctgcattt ttacagaaca gaaatgcaac gcgaaagcgc tattttacca acgaagaatc 2340
tgtgcttcat ttttgtaaaa caaaaatgca acgcgagagc gctaattttt caaacaaaga 2400
atctgagctg catttttaca gaacagaaat gcaacgcgag agcgctattt taccaacaaa 2460
gaatctatac ttcttttttg ttctacaaaa atgcatcccg agagcgctat ttttctaaca 2520
aagcatctta gattactttt tttctccttt gtgcgctcta taatgcagtc tcttgataac 2580
tttttgcact gtaggtccgt taaggttaga agaaggctac tttggtgtct attttctctt 2640
ccataaaaaa agcctgactc cacttcccgc gtttactgat tactagcgaa gctgcgggtg 2700
cattttttca agataaaggc atccccgatt atattctata ccgatgtgga ttgcgcatac 2760
tttgtgaaca gaaagtgata gcgttgatga ttcttcattg gtcagaaaat tatgaacggt 2820
ttcttctatt ttgtctctat atactacgta taggaaatgt ttacattttc gtattgtttt 2880
cgattcactc tatgaatagt tcttactaca atttttttgt ctaaagagta atactagaga 2940
taaacataaa aaatgtagag gtcgagttta gatgcaagtt caaggagcga aaggtggatg 3000
ggtaggttat atagggatat agcacagaga tatatagcaa agagatactt ttgagcaatg 3060
tttgtggaag cggtattcgc aatattttag tagctcgtta cagtccggtg cgtttttggt 3120
tttttgaaag tgcgtcttca gagcgctttt ggttttcaaa agcgctctga agttcctata 3180
ctttctagag aataggaact tcggaatagg aacttcaaag cgtttccgaa aacgagcgct 3240
tccgaaaatg caacgcgagc tgcgcacata cagctcactg ttcacgtcgc acctatatct 3300
gcgtgttgcc tgtatatata tatacatgag aagaacggca tagtgcgtgt ttatgcttaa 3360
atgcgtactt atatgcgtct atttatgtag gatgaaaggt agtctagtac ctcctgtgat 3420
attatcccat tccatgcggg gtatcgtatg cttccttcag cactaccctt tagctgttct 3480
atatgctgcc actcctcaat tggattagtc tcatccttca atgctatcat ttcctttgat 3540
attggatcat ctaagaaacc attattatca tgacattaac ctataaaaat aggcgtatca 3600
cgaggccctt tcgtctcgcg cgtttcggtg atgacggtga aaacctctga cacatgcagc 3660
tcccggagac ggtcacagct tgtctgtaag cggatgccgg gagcagacaa gcccgtcagg 3720
gcgcgtcagc gggtgttggc gggtgtcggg gctggcttaa ctatgcggca tcagagcaga 3780
ttgtactgag agtgcaccat aaattcccgt tttaagagct tggtgagcgc taggagtcac 3840
tgccaggtat cgtttgaaca cggcattagt cagggaagtc ataacacagt cctttcccgc 3900
aattttcttt ttctattact cttggcctcc tctagtacac tctatatttt tttatgcctc 3960
ggtaatgatt ttcatttttt tttttcccct agcggatgac tctttttttt tcttagcgat 4020
tggcattatc acataatgaa ttatacatta tataaagtaa tgtgatttct tcgaagaata 4080
tactaaaaaa tgagcaggca agataaacga aggcaaagat gacagagcag aaagccctag 4140
taaagcgtat tacaaatgaa accaagattc agattgcgat ctctttaaag ggtggtcccc 4200
tagcgataga gcactcgatc ttcccagaaa aagaggcaga agcagtagca gaacaggcca 4260
cacaatcgca agtgattaac gtccacacag gtatagggtt tctggaccat atgatacatg 4320
ctctggccaa gcattccggc tggtcgctaa tcgttgagtg cattggtgac ttacacatag 4380
acgaccatca caccactgaa gactgcggga ttgctctcgg tcaagctttt aaagaggccc 4440
tactggcgcg tggagtaaaa aggtttggat caggatttgc gcctttggat gaggcacttt 4500
ccagagcggt ggtagatctt tcgaacaggc cgtacgcagt tgtcgaactt ggtttgcaaa 4560
gggagaaagt aggagatctc tcttgcgaga tgatcccgca ttttcttgaa agctttgcag 4620
aggctagcag aattaccctc cacgttgatt gtctgcgagg caagaatgat catcaccgta 4680
gtgagagtgc gttcaaggct cttgcggttg ccataagaga agccacctcg cccaatggta 4740
ccaacgatgt tccctccacc aaaggtgttc ttatgtagtg acaccgatta tttaaagctg 4800
cagcatacga tatatataca tgtgtatata tgtataccta tgaatgtcag taagtatgta 4860
tacgaacagt atgatactga agatgacaag gtaatgcatc attctatacg tgtcattctg 4920
aacgaggcgc gctttccttt tttctttttg ctttttcttt ttttttctct tgaactcgac 4980
ggatctatgc ggtgtgaaat accgcacaga tgcgtaagga gaaaataccg catcaggaaa 5040
ttgtaaacgt taatattttg ttaaaattcg cgttaaattt ttgttaaatc agctcatttt 5100
ttaaccaata ggccgaaatc ggcaaaatcc cttataaatc aaaagaatag accgagatag 5160
ggttgagtgt tgttccagtt tggaacaaga gtccactatt aaagaacgtg gactccaacg 5220
tcaaagggcg aaaaaccgtc tatcagggcg atggcccact acgtgaacca tcaccctaat 5280
caagtttttt ggggtcgagg tgccgtaaag cactaaatcg gaaccctaaa gggagccccc 5340
gatttagagc ttgacgggga aagccggcga acgtggcgag aaaggaaggg aagaaagcga 5400
aaggagcggg cgctagggcg ctggcaagtg tagcggtcac gctgcgcgta accaccacac 5460
ccgccgcgct taatgcgccg ctacagggcg cgtcgcgcca ttcgccattc aggctgcgca 5520
actgttggga agggcgatcg gtgcgggcct cttcgctatt acgccagctg gcgaaagggg 5580
gatgtgctgc aaggcgatta agttgggtaa cgccagggtt ttcccagtca cgacgttgta 5640
aaacgacggc cagtgagcgc gcgtaatacg actcactata gggcgaattg ggtaccgggc 5700
cccccctcga ggtattagaa gccgccgagc gggcgacagc cctccgacgg aagactctcc 5760
tccgtgcgtc ctcgtcttca ccggtcgcgt tcctgaaacg cagatgtgcc tcgcgccgca 5820
ctgctccgaa caataaagat tctacaatac tagcttttat ggttatgaag aggaaaaatt 5880
ggcagtaacc tggccccaca aaccttcaaa ttaacgaatc aaattaacaa ccataggatg 5940
ataatgcgat tagtttttta gccttatttc tggggtaatt aatcagcgaa gcgatgattt 6000
ttgatctatt aacagatata taaatggaaa agctgcataa ccactttaac taatactttc 6060
aacattttca gtttgtatta cttcttattc aaatgtcata aaagtatcaa caaaaaattg 6120
ttaatatacc tctatacttt aacgtcaagg agaaaaatgt ccaatttact gcccgtacac 6180
caaaatttgc ctgcattacc ggtcgatgca acgagtgatg aggttcgcaa gaacctgatg 6240
gacatgttca gggatcgcca ggcgttttct gagcatacct ggaaaatgct tctgtccgtt 6300
tgccggtcgt gggcggcatg gtgcaagttg aataaccgga aatggtttcc cgcagaacct 6360
gaagatgttc gcgattatct tctatatctt caggcgcgcg gtctggcagt aaaaactatc 6420
cagcaacatt tgggccagct aaacatgctt catcgtcggt ccgggctgcc acgaccaagt 6480
gacagcaatg ctgtttcact ggttatgcgg cggatccgaa aagaaaacgt tgatgccggt 6540
gaacgtgcaa aacaggctct agcgttcgaa cgcactgatt tcgaccaggt tcgttcactc 6600
atggaaaata gcgatcgctg ccaggatata cgtaatctgg catttctggg gattgcttat 6660
aacaccctgt tacgtatagc cgaaattgcc aggatcaggg ttaaagatat ctcacgtact 6720
gacggtggga gaatgttaat ccatattggc agaacgaaaa cgctggttag caccgcaggt 6780
gtagagaagg cacttagcct gggggtaact aaactggtcg agcgatggat ttccgtctct 6840
ggtgtagctg atgatccgaa taactacctg ttttgccggg tcagaaaaaa tggtgttgcc 6900
gcgccatctg ccaccagcca gctatcaact cgcgccctgg aagggatttt tgaagcaact 6960
catcgattga tttacggcgc taaggatgac tctggtcaga gatacctggc ctggtctgga 7020
cacagtgccc gtgtcggagc cgcgcgagat atggcccgcg ctggagtttc aataccggag 7080
atcatgcaag ctggtggctg gaccaatgta aatattgtca tgaactatat ccgtaacctg 7140
gatagtgaaa caggggcaat ggtgcgcctg ctggaagatg gcgattagga gtaagcgaat 7200
ttcttatgat ttatgatttt tattattaaa taagttataa aaaaaataag tgtatacaaa 7260
ttttaaagtg actcttaggt tttaaaacga aaattcttat tcttgagtaa ctctttcctg 7320
taggtcaggt tgctttctca ggtatagcat gaggtcgctc ttattgacca cacctctacc 7380
ggcatgccga gcaaatgcct gcaaatcgct ccccatttca cccaattgta gatatgctaa 7440
ctccagcaat gagttgatga atctcggtgt gtattttatg tcctcagagg acaacacctg 7500
tggtccgcca ccgcggtgga gct 7523
<210> 67
<211> 15456
<212> DNA
<213> Artificial sequence
<220>
<223> Template
<400> 67
aaagagtaat actagagata aacataaaaa atgtagaggt cgagtttaga tgcaagttca 60
aggagcgaaa ggtggatggg taggttatat agggatatag cacagagata tatagcaaag 120
agatactttt gagcaatgtt tgtggaagcg gtattcgcaa tattttagta gctcgttaca 180
gtccggtgcg tttttggttt tttgaaagtg cgtcttcaga gcgcttttgg ttttcaaaag 240
cgctctgaag ttcctatact ttctagagaa taggaacttc ggaataggaa cttcaaagcg 300
tttccgaaaa cgagcgcttc cgaaaatgca acgcgagctg cgcacataca gctcactgtt 360
cacgtcgcac ctatatctgc gtgttgcctg tatatatata tacatgagaa gaacggcata 420
gtgcgtgttt atgcttaaat gcgtacttat atgcgtctat ttatgtagga tgaaaggtag 480
tctagtacct cctgtgatat tatcccattc catgcggggt atcgtatgct tccttcagca 540
ctacccttta gctgttctat atgctgccac tcctcaattg gattagtctc atccttcaat 600
gctatcattt cctttgatat tggatcatac taagaaacca ttattatcat gacattaacc 660
tataaaaata ggcgtatcac gaggcccttt cgtctcgcgc gtttcggtga tgacggtgaa 720
aacctctgac acatgcagct cccggagacg gtcacagctt gtctgtaagc ggatgccggg 780
agcagacaag cccgtcaggg cgcgtcagcg ggtgttggcg ggtgtcgggg ctggcttaac 840
tatgcggcat cagagcagat tgtactgaga gtgcaccata aattcccgtt ttaagagctt 900
ggtgagcgct aggagtcact gccaggtatc gtttgaacac ggcattagtc agggaagtca 960
taacacagtc ctttcccgca attttctttt tctattactc ttggcctcct ctagtacact 1020
ctatattttt ttatgcctcg gtaatgattt tcattttttt ttttccacct agcggatgac 1080
tctttttttt tcttagcgat tggcattatc acataatgaa ttatacatta tataaagtaa 1140
tgtgatttct tcgaagaata tactaaaaaa tgagcaggca agataaacga aggcaaagat 1200
gacagagcag aaagccctag taaagcgtat tacaaatgaa accaagattc agattgcgat 1260
ctctttaaag ggtggtcccc tagcgataga gcactcgatc ttcccagaaa aagaggcaga 1320
agcagtagca gaacaggcca cacaatcgca agtgattaac gtccacacag gtatagggtt 1380
tctggaccat atgatacatg ctctggccaa gcattccggc tggtcgctaa tcgttgagtg 1440
cattggtgac ttacacatag acgaccatca caccactgaa gactgcggga ttgctctcgg 1500
tcaagctttt aaagaggccc taggggccgt gcgtggagta aaaaggtttg gatcaggatt 1560
tgcgcctttg gatgaggcac tttccagagc ggtggtagat ctttcgaaca ggccgtacgc 1620
agttgtcgaa cttggtttgc aaagggagaa agtaggagat ctctcttgcg agatgatccc 1680
gcattttctt gaaagctttg cagaggctag cagaattacc ctccacgttg attgtctgcg 1740
aggcaagaat gatcatcacc gtagtgagag tgcgttcaag gctcttgcgg ttgccataag 1800
agaagccacc tcgcccaatg gtaccaacga tgttccctcc accaaaggtg ttcttatgta 1860
gtgacaccga ttatttaaag ctgcagcata cgatatatat acatgtgtat atatgtatac 1920
ctatgaatgt cagtaagtat gtatacgaac agtatgatac tgaagatgac aaggtaatgc 1980
atcattctat acgtgtcatt ctgaacgagg cgcgctttcc ttttttcttt ttgctttttc 2040
tttttttttc tcttgaactc gacggatcta tgcggtgtga aataccgcac agatgcgtaa 2100
ggagaaaata ccgcatcagg aaattgtaag cgttaatatt ttgttaaaat tcgcgttaaa 2160
tttttgttaa atcagctcat tttttaacca ataggccgaa atcggcaaaa tcccttataa 2220
atcaaaagaa tagaccgaga tagggttgag tgttgttcca gtttggaaca agagtccact 2280
attaaagaac gtggactcca acgtcaaagg gcgaaaaacc gtctatcagg gcgatggccc 2340
actacgtgaa ccatcaccct aatcaagttt tttggggtcg aggtgccgta aagcactaaa 2400
tcggaaccct aaagggagcc cccgatttag agcttgacgg ggaaagccgg cgaacgtggc 2460
gagaaaggaa gggaagaaag cgaaaggagc gggcgctagg gcgctggcaa gtgtagcggt 2520
cacgctgcgc gtaaccacca cacccgccgc gcttaatgcg ccgctacagg gcgcgtccat 2580
tcgccattca ggctgcgcaa ctgttgggaa gggcgcggtg cgggcctctt cgctattacg 2640
ccagctggcg aaagggggat gtgctgcaag gcgattaagt tgggtaacgc cagggttttc 2700
ccagtcacga cgttgtaaaa cgacggccag tgagcgcgcg taatacgact cactataggg 2760
cgaattgggt accgggcccc ccctcgaggt cgacggcgcg ccactggtag agagcgactt 2820
tgtatgcccc aattgcgaaa cccgcgatat ccttctcgat tctttagtac ccgaccagga 2880
caaggaaaag gaggtcgaaa cgtttttgaa gaaacaagag gaactacacg gaagctctaa 2940
agatggcaac cagccagaaa ctaagaaaat gaagttgatg gatccaactg gcaccgctgg 3000
cttgaacaac aataccagcc ttccaacttc tgtaaataac ggcggtacgc cagtgccacc 3060
agtaccgtta cctttcggta tacctccttt ccccatgttt ccaatgccct tcatgcctcc 3120
aacggctact atcacaaatc ctcatcaagc tgacgcaagc cctaagaaat gaataacaat 3180
actgacagta ctaaataatt gcctacttgg cttcacatac gttgcatacg tcgatataga 3240
taataatgat aatgacagca ggattatcgt aatacgtaat agctgaaaat ctcaaaaatg 3300
tgtgggtcat tacgtaaata atgataggaa tgggattctt ctatttttcc tttttccatt 3360
ctagcagccg tcgggaaaac gtggcatcct ctctttcggg ctcaattgga gtcacgctgc 3420
cgtgagcatc ctctctttcc atatctaaca actgagcacg taaccaatgg aaaagcatga 3480
gcttagcgtt gctccaaaaa agtattggat ggttaatacc atttgtctgt tctcttctga 3540
ctttgactcc tcaaaaaaaa aaatctacaa tcaacagatc gcttcaatta cgccctcaca 3600
aaaacttttt tccttcttct tcgcccacgt taaattttat ccctcatgtt gtctaacgga 3660
tttctgcact tgatttatta taaaaagaca aagacataat acttctctat caatttcagt 3720
tattgttctt ccttgcgtta ttcttctgtt cttctttttc ttttgtcata tataaccata 3780
accaagtaat acatattcaa actagtatga ctgacaaaaa aactcttaaa gacttaagaa 3840
atcgtagttc tgtttacgat tcaatggtta aatcacctaa tcgtgctatg ttgcgtgcaa 3900
ctggtatgca agatgaagac tttgaaaaac ctatcgtcgg tgtcatttca acttgggctg 3960
aaaacacacc ttgtaatatc cacttacatg actttggtaa actagccaaa gtcggtgtta 4020
aggaagctgg tgcttggcca gttcagttcg gaacaatcac ggtttctgat ggaatcgcca 4080
tgggaaccca aggaatgcgt ttctccttga catctcgtga tattattgca gattctattg 4140
aagcagccat gggaggtcat aatgcggatg cttttgtagc cattggcggt tgtgataaaa 4200
acatgcccgg ttctgttatc gctatggcta acatggatat cccagccatt tttgcttacg 4260
gcggaacaat tgcacctggt aatttagacg gcaaagatat cgatttagtc tctgtctttg 4320
aaggtgtcgg ccattggaac cacggcgata tgaccaaaga agaagttaaa gctttggaat 4380
gtaatgcttg tcccggtcct ggaggctgcg gtggtatgta tactgctaac acaatggcga 4440
cagctattga agttttggga cttagccttc cgggttcatc ttctcacccg gctgaatccg 4500
cagaaaagaa agcagatatt gaagaagctg gtcgcgctgt tgtcaaaatg ctcgaaatgg 4560
gcttaaaacc ttctgacatt ttaacgcgtg aagcttttga agatgctatt actgtaacta 4620
tggctctggg aggttcaacc aactcaaccc ttcacctctt agctattgcc catgctgcta 4680
atgtggaatt gacacttgat gatttcaata ctttccaaga aaaagttcct catttggctg 4740
atttgaaacc ttctggtcaa tatgtattcc aagaccttta caaggtcgga ggggtaccag 4800
cagttatgaa atatctcctt aaaaatggct tccttcatgg tgaccgtatc acttgtactg 4860
gcaaaacagt cgctgaaaat ttgaaggctt ttgatgattt aacacctggt caaaaggtta 4920
ttatgccgct tgaaaatcct aaacgtgaag atggtccgct cattattctc catggtaact 4980
tggctccaga cggtgccgtt gccaaagttt ctggtgtaaa agtgcgtcgt catgtcggtc 5040
ctgctaaggt ctttaattct gaagaagaag ccattgaagc tgtcttgaat gatgatattg 5100
ttgatggtga tgttgttgtc gtacgttttg taggaccaaa gggcggtcct ggtatgcctg 5160
aaatgctttc cctttcatca atgattgttg gtaaagggca aggtgaaaaa gttgcccttc 5220
tgacagatgg ccgcttctca ggtggtactt atggtcttgt cgtgggtcat atcgctcctg 5280
aagcacaaga tggcggtcca atcgcctacc tgcaaacagg agacatagtc actattgacc 5340
aagacactaa ggaattacac tttgatatct ccgatgaaga gttaaaacat cgtcaagaga 5400
ccattgaatt gccaccgctc tattcacgcg gtatccttgg taaatatgct cacatcgttt 5460
cgtctgcttc taggggagcc gtaacagact tttggaagcc tgaagaaact ggcaaaaaat 5520
gttgtcctgg ttgctgtggt taagcggccg cgttaattca aattaattga tatagttttt 5580
taatgagtat tgaatctgtt tagaaataat ggaatattat ttttatttat ttatttatat 5640
tattggtcgg ctcttttctt ctgaaggtca atgacaaaat gatatgaagg aaataatgat 5700
ttctaaaatt ttacaacgta agatattttt acaaaagcct agctcatctt ttgtcatgca 5760
ctattttact cacgcttgaa attaacggcc agtccactgc ggagtcattt caaagtcatc 5820
ctaatcgatc tatcgttttt gatagctcat tttggagttc gcgattgtct tctgttattc 5880
acaactgttt taatttttat ttcattctgg aactcttcga gttctttgta aagtctttca 5940
tagtagctta ctttatcctc caacatattt aacttcatgt caatttcggc tcttaaattt 6000
tccacatcat caagttcaac atcatctttt aacttgaatt tattctctag ctcttccaac 6060
caagcctcat tgctccttga tttactggtg aaaagtgata cactttgcgc gcaatccagg 6120
tcaaaacttt cctgcaaaga attcaccaat ttctcgacat catagtacaa tttgttttgt 6180
tctcccatca caatttaata tacctgatgg attcttatga agcgctgggt aatggacgtg 6240
tcactctact tcgccttttt ccctactcct tttagtacgg aagacaatgc taataaataa 6300
gagggtaata ataatattat taatcggcaa aaaagattaa acgccaagcg tttaattatc 6360
agaaagcaaa cgtcgtacca atccttgaat gcttcccaat tgtatattaa gagtcatcac 6420
agcaacatat tcttgttatt aaattaatta ttattgattt ttgatattgt ataaaaaaac 6480
caaatatgta taaaaaaagt gaataaaaaa taccaagtat ggagaaatat attagaagtc 6540
tatacgttaa accacccggg ccccccctcg aggtcgacgg tatcgataag cttgatatcg 6600
aattcctgca gcccggggga tccactagtt ctagagcggc cgctctagaa ctagtaccac 6660
aggtgttgtc ctctgaggac ataaaataca caccgagatt catcaactca ttgctggagt 6720
tagcatatct acaattgggt gaaatgggga gcgatttgca ggcatttgct cggcatgccg 6780
gtagaggtgt ggtcaataag agcgacctca tgctatacct gagaaagcaa cctgacctac 6840
aggaaagagt tactcaagaa taagaatttt cgttttaaaa cctaagagtc actttaaaat 6900
ttgtatacac ttattttttt tataacttat ttaataataa aaatcataaa tcataagaaa 6960
ttcgcttact cttaattaat caggcagcgc ctgcgttcga gaggatgatc ttcatcgcct 7020
tctccttggc gccattgagg aatacctgat aggcgtgctc gatctcggcc agctcgaagc 7080
gatgggtaat catcttcttc aacggaagct tgtcggtcga ggcgaccttc atcagcatgg 7140
gcgtcgtgtt cgtgttcacc agtcccgtgg tgatcgtcag gttcttgatc cagagcttct 7200
gaatctcgaa gtcaaccttg acgccatgca cgccgacgtt ggcgatgtgc gcgccgggct 7260
tgacgatctc ctggcagatg tcccaagtcg ccggtatgcc caccgcctcg atcgcaacat 7320
cgactccctc tgccgcaatc ctatgcacgg cttcgacaac gttctccgtg ccggagttga 7380
tggtgtgcgt tgccccgagc tccttggcga gctggaggcg attctcgtcc atgtcgatca 7440
cgatgatggt cgagggggag tagaactggg cggtcaacag tacggacatg ccgacggggc 7500
ccgcgccgac aatagccacc gcatcgcccg gctggacatt cccatactgg acgccgattt 7560
cgtggccggt gggcaggatg tcgctcagca ggacggcgat ttcgtcgtca attgtctggg 7620
ggatcttgta gaggctgttg tcggcatgcg ggatgcggac gtattcggcc tgcacgccat 7680
cgatcatgta acccaggatc cacccgccgt cgcggcaatg ggagtaaagc tgcttcttgc 7740
agtagtcgca cgagccgcaa gaagtgacgc aggaaatcag gaccttgtcg cctttcttga 7800
actgcgtgac actctcgccc acttcctcga tgacgcctac cccttcatgg cccaggatgc 7860
gcccgtcggc gacctctgga ttcttgcctt tgtagatgcc gagatccgtg ccgcagatcg 7920
tggtcttcaa aacccgtact actacatccg tgggcttttg aagggtgggc ttgggcttgt 7980
cttcaagcga gatcttgtgg tcaccgtgat aaaccagagc tttcatcctc agctattgta 8040
atatgtgtgt ttgtttggat tattaagaag aataattaca aaaaaaatta caaaggaagg 8100
taattacaac agaattaaga aaggacaaga aggaggaaga gaatcagttc attatttctt 8160
ctttgttata taacaaaccc aagtagcgat ttggccatac attaaaagtt gagaaccacc 8220
ctccctggca acagccacaa ctcgttacca ttgttcatca cgatcatgaa actcgctgtc 8280
agctgaaatt tcacctcagt ggatctctct ttttattctt catcgttcca ctaacctttt 8340
tccatcagct ggcagggaac ggaaagtgga atcccattta gcgagcttcc tcttttcttc 8400
aagaaaagac gaagcttgtg tgtgggtgcg cgcgctagta tctttccaca ttaagaaata 8460
taccataaag gttacttaga catcactatg gctatatata tatatatata tatatatgta 8520
acttagcacc atcgcgcgtg catcactgca tgtgttaacc gaaaagtttg gcgaacactt 8580
caccgacacg gtcatttaga tctgtcgtct gcattgcacg tcccttagcc ttaaatccta 8640
ggcgggagca ttctcgtgta attgtgcagc ctgcgtagca actcaacata gcgtagtcta 8700
cccagttttt caagggttta tcgttagaag attctccctt ttcttcctgc tcacaaatct 8760
taaagtcata cattgcacga ctaaatgcaa gcatgcggat cccccgggct gcaggaattc 8820
gatatcaagc ttatcgatac cgtcgactgg ccattaatct ttcccatatt agatttcgcc 8880
aagccatgaa agttcaagaa aggtctttag acgaattacc cttcatttct caaactggcg 8940
tcaagggatc ctggtatggt tttatcgttt tatttctggt tcttatagca tcgttttgga 9000
cttctctgtt cccattaggc ggttcaggag ccagcgcaga atcattcttt gaaggatact 9060
tatcctttcc aattttgatt gtctgttacg ttggacataa actgtatact agaaattgga 9120
ctttgatggt gaaactagaa gatatggatc ttgataccgg cagaaaacaa gtagatttga 9180
ctcttcgtag ggaagaaatg aggattgagc gagaaacatt agcaaaaaga tccttcgtaa 9240
caagattttt acatttctgg tgttgaaggg aaagatatga gctatacagc ggaatttcca 9300
tatcactcag attttgttat ctaatttttt ccttcccacg tccgcgggaa tctgtgtata 9360
ttactgcatc tagatatatg ttatcttatc ttggcgcgta catttaattt tcaacgtatt 9420
ctataagaaa ttgcgggagt ttttttcatg tagatgatac tgactgcacg caaatatagg 9480
catgatttat aggcatgatt tgatggctgt accgatagga acgctaagag taacttcaga 9540
atcgttatcc tggcggaaaa aattcatttg taaactttaa aaaaaaaagc caatatcccc 9600
aaaattatta agagcgcctc cattattaac taaaatttca ctcagcatcc acaatgtatc 9660
aggtatctac tacagatatt acatgtggcg aaaaagacaa gaacaatgca atagcgcatc 9720
aagaaaaaac acaaagcttt caatcaatga atcgaaaatg tcattaaaat agtatataaa 9780
ttgaaactaa gtcataaagc tataaaaaga aaatttattt aaatgcaaga tttaaagtaa 9840
attcacggcc ctgcaggcct cagctcttgt tttgttctgc aaataactta cccatctttt 9900
tcaaaacttt aggtgcaccc tcctttgcta gaataagttc tatccaatac atcctatttg 9960
gatctgcttg agcttctttc atcacggata cgaattcatt ttctgttctc acaattttgg 10020
acacaactct gtcttccgtt gccccgaaac tttctggcag ttttgagtaa ttccacatag 10080
gaatgtcatt ataactctgg ttcggaccat gaatttccct ctcaaccgtg taaccatcgt 10140
tattaatgat aaagcagatt gggtttatct tctctctaat ggctagtcct aattcttgga 10200
cagtcagttg caatgatcca tctccgataa acaataaatg tctagattct ttatctgcaa 10260
tttggctgcc tagagctgcg gggaaagtgt atcctataga tccccacaag ggttgaccaa 10320
taaaatgtga tttcgatttc agaaatatag atgaggcacc gaagaaagaa gtgccttgtt 10380
cagccacgat cgtctcatta ctttgggtca aattttcgac agcttgccac agtctatctt 10440
gtgacaacag cgcgttagaa ggtacaaaat cttcttgctt tttatctatg tacttgcctt 10500
tatattcaat ttcggacaag tcaagaagag atgatatcag ggattcgaag tcgaaatttt 10560
ggattctttc gttgaaaatt ttaccttcat cgatattcaa ggaaatcatt ttattttcat 10620
taagatggtg agtaaatgca cccgtactag aatcggtaag ctttacaccc aacataagaa 10680
taaaatcagc agattccaca aattccttca agtttggctc tgacagagta ccgttgtaaa 10740
tccccaaaaa tgagggcaat gcttcatcaa cagatgattt accaaagttc aaagtagtaa 10800
taggtaactt agtctttgaa ataaactgag taacagtctt ctctaggccg aacgatataa 10860
tttcatggcc tgtgattaca attggtttct tggcattctt cagactttcc tgtattttgt 10920
tcagaatctc ttgatcagat gtattcgacg tggaattttc cttcttaaga ggcaaggatg 10980
gtttttcagc cttagcggca gctacatcta caggtaaatt gatgtaaacc ggctttcttt 11040
cctttagtaa ggcagacaac actctatcaa tttcaacagt tgcattctcg gctgtcaata 11100
aagtcctggc agcagtaacc ggttcgtgca tcttcataaa gtgcttgaaa tcaccatcag 11160
ccaacgtatg gtgaacaaac ttaccttcgt tctgcacttt cgaggtagga gatcccacga 11220
tctcaacaac aggcaggttc tcagcatagg agcccgctaa gccattaact gcggataatt 11280
cgccaacacc aaatgtagtc aagaatgccg cagccttttt cgttcttgcg tacccgtcgg 11340
ccatatagga ggcatttaac tcattagcat ttcccaccca tttcatatct ttgtgtgaaa 11400
taatttgatc tagaaattgc aaattgtagt cacctggtac tccgaatatt tcttctatac 11460
ctaattcgtg taatctgtcc aacagatagt cacctactgt atacattttg tttactagtt 11520
tatgtgtgtt tattcgaaac taagttcttg gtgttttaaa actaaaaaaa agactaacta 11580
taaaagtaga atttaagaag tttaagaaat agatttacag aattacaatc aatacctacc 11640
gtctttatat acttattagt caagtagggg aataatttca gggaactggt ttcaaccttt 11700
tttttcagct ttttccaaat cagagagagc agaaggtaat agaaggtgta agaaaatgag 11760
atagatacat gcgtgggtca attgccttgt gtcatcattt actccaggca ggttgcatca 11820
ctccattgag gttgtgcccg ttttttgcct gtttgtgccc ctgttctctg tagttgcgct 11880
aagagaatgg acctatgaac tgatggttgg tgaagaaaac aatattttgg tgctgggatt 11940
cttttttttt ctggatgcca gcttaaaaag cgggctccat tatatttagt ggatgccagg 12000
aataaactgt tcacccagac acctacgatg ttatatattc tgtgtaaccc gccccctatt 12060
ttgggcatgt acgggttaca gcagaattaa aaggctaatt ttttgactaa ataaagttag 12120
gaaaatcact actattaatt atttacgtat tctttgaaat ggcagtattg ataatgataa 12180
actcgaactg aaaaagcgtg ttttttattc aaaatgattc taactccctt acgtaatcaa 12240
ggaatctttt tgccttggcc tccgcgtcat taaacttctt gttgttgacg ctaacattca 12300
acgctagtat atattcgttt ttttcaggta agttcttttc aacgggtctt actgatgagg 12360
cagtcgcgtc tgaacctgtt aagaggtcaa atatgtcttc ttgaccgtac gtgtcttgca 12420
tgttattagc tttgggaatt tgcatcaagt cataggaaaa tttaaatctt ggctctcttg 12480
ggctcaaggt gacaaggtcc tcgaaaatag ggcgcgcccc accgcggtgg agctccagct 12540
tttgttccct ttagtgaggg ttaattgcgc gcttggcgta atcatggtca tagctgtttc 12600
ctgtgtgaaa ttgttatccg ctcacaattc cacacaacat acgagccgga agcataaagt 12660
gtaaagcctg gggtgcctaa tgagtgagct aactcacatt aattgcgttg cgctcactgc 12720
ccgctttcca gtcgggaaac ctgtcgtgcc agctgcatta atgaatcggc caacgcgcgg 12780
ggagaggcgg tttgcgtatt gggcgctctt ccgcttcctc gctcactgac tcgctgcgct 12840
cggtcgttcg gctgcggcga gcggtatcag ctcactcaaa ggcggtaata cggttatcca 12900
cagaatcagg ggataacgca ggaaagaaca tgtgagcaaa aggccagcaa aaggccagga 12960
accgtaaaaa ggccgcgttg ctggcgtttt tccataggct ccgcccccct gacgagcatc 13020
acaaaaatcg acgctcaagt cagaggtggc gaaacccgac aggactataa agataccagg 13080
cgtttccccc tggaagctcc ctcgtgcgct ctcctgttcc gaccctgccg cttaccggat 13140
acctgtccgc ctttctccct tcgggaagcg tggcgctttc tcatagctca cgctgtaggt 13200
atctcagttc ggtgtaggtc gttcgctcca agctgggctg tgtgcacgaa ccccccgttc 13260
agcccgaccg ctgcgcctta tccggtaact atcgtcttga gtccaacccg gtaagacacg 13320
acttatcgcc actggcagca gccactggta acaggattag cagagcgagg tatgtaggcg 13380
gtgctacaga gttcttgaag tggtggccta actacggcta cactagaaga acagtatttg 13440
gtatctgcgc tctgctgaag ccagttacct tcggaaaaag agttggtagc tcttgatccg 13500
gcaaacaaac caccgctggt agcggtggtt tttttgtttg caagcagcag attacgcgca 13560
gaaaaaaagg atctcaagaa gatcctttga tcttttctac ggggtctgac gctcagtgga 13620
acgaaaactc acgttaaggg attttggtca tgagattatc aaaaaggatc ttcacctaga 13680
tccttttaaa ttaaaaatga agttttaaat caatctaaag tatatatgag taaacttggt 13740
ctgacagtta ccaatgctta atcagtgagg cacctatctc agcgatctgt ctatttcgtt 13800
catccatagt tgcctgactc cccgtcgtgt agataactac gatacgggag ggcttaccat 13860
ctggccccag tgctgcaatg ataccgcgag acccacgctc accggctcca gatttatcag 13920
caataaacca gccagccgga agggccgagc gcagaagtgg tcctgcaact ttatccgcct 13980
ccatccagtc tattaattgt tgccgggaag ctagagtaag tagttcgcca gttaatagtt 14040
tgcgcaacgt tgttgccatt gctacaggca tcgtggtgtc acgctcgtcg tttggtatgg 14100
cttcattcag ctccggttcc caacgatcaa ggcgagttac atgatccccc atgttgtgca 14160
aaaaagcggt tagctccttc ggtcctccga tcgttgtcag aagtaagttg gccgcagtgt 14220
tatcactcat ggttatggca gcactgcata attctcttac tgtcatgcca tccgtaagat 14280
gcttttctgt gactggtgag tactcaacca agtcattctg agaatagtgt atgcggcgac 14340
cgagttgctc ttgcccggcg tcaatacggg ataataccgc gccacatagc agaactttaa 14400
aagtgctcat cattggaaaa cgttcttcgg ggcgaaaact ctcaaggatc ttaccgctgt 14460
tgagatccag ttcgatgtaa cccactcgtg cacccaactg atcttcagca tcttttactt 14520
tcaccagcgt ttctgggtga gcaaaaacag gaaggcaaaa tgccgcaaaa aagggaataa 14580
gggcgacacg gaaatgttga atactcatac tcttcctttt tcaatattat tgaagcattt 14640
atcagggtta ttgtctcatg agcggataca tatttgaatg tatttagaaa aataaacaaa 14700
taggggttcc gcgcacattt ccccgaaaag tgccacctga acgaagcatc tgtgcttcat 14760
tttgtagaac aaaaatgcaa cgcgagagcg ctaatttttc aaacaaagaa tctgagctgc 14820
atttttacag aacagaaatg caacgcgaaa gcgctatttt accaacgaag aatctgtgct 14880
tcatttttgt aaaacaaaaa tgcaacgcga gagcgctaat ttttcaaaca aagaatctga 14940
gctgcatttt tacagaacag aaatgcaacg cgagagcgct attttaccaa caaagaatct 15000
atacttcttt tttgttctac aaaaatgcat cccgagagcg ctatttttct aacaaagcat 15060
cttagattac tttttttctc ctttgtgcgc tctataatgc agtctcttga taactttttg 15120
cactgtaggt ccgttaaggt tagaagaagg ctactttggt gtctattttc tcttccataa 15180
aaaaagcctg actccacttc ccgcgtttac tgattactag cgaagctgcg ggtgcatttt 15240
ttcaagataa aggcatcccc gattatattc tataccgatg tggattgcgc atactttgtg 15300
aacagaaagt gatagcgttg atgattcttc attggtcaga aaattatgaa cggtttcttc 15360
tattttgtct ctatatacta cgtataggaa atgtttacat tttcgtattg ttttcgattc 15420
actctatgaa tagttcttac tacaattttt ttgtct 15456
<210> 68
<211> 1559
<212> DNA
<213> Artificial sequence
<220>
<223> Template
<400> 68
gcattgcgga ttacgtattc taatgttcag taccgttcgt ataatgtatg ctatacgaag 60
ttatgcagat tgtactgaga gtgcaccata ccaccttttc aattcatcat ttttttttta 120
ttcttttttt tgatttcggt ttccttgaaa tttttttgat tcggtaatct ccgaacagaa 180
ggaagaacga aggaaggagc acagacttag attggtatat atacgcatat gtagtgttga 240
agaaacatga aattgcccag tattcttaac ccaactgcac agaacaaaaa cctgcaggaa 300
acgaagataa atcatgtcga aagctacata taaggaacgt gctgctactc atcctagtcc 360
tgttgctgcc aagctattta atatcatgca cgaaaagcaa acaaacttgt gtgcttcatt 420
ggatgttcgt accaccaagg aattactgga gttagttgaa gcattaggtc ccaaaatttg 480
tttactaaaa acacatgtgg atatcttgac tgatttttcc atggagggca cagttaagcc 540
gctaaaggca ttatccgcca agtacaattt tttactcttc gaagacagaa aatttgctga 600
cattggtaat acagtcaaat tgcagtactc tgcgggtgta tacagaatag cagaatgggc 660
agacattacg aatgcacacg gtgtggtggg cccaggtatt gttagcggtt tgaagcaggc 720
ggcagaagaa gtaacaaagg aacctagagg ccttttgatg ttagcagaat tgtcatgcaa 780
gggctcccta tctactggag aatatactaa gggtactgtt gacattgcga agagcgacaa 840
agattttgtt atcggcttta ttgctcaaag agacatgggt ggaagagatg aaggttacga 900
ttggttgatt atgacacccg gtgtgggttt agatgacaag ggagacgcat tgggtcaaca 960
gtatagaacc gtggatgatg tggtctctac aggatctgac attattattg ttggaagagg 1020
actatttgca aagggaaggg atgctaaggt agagggtgaa cgttacagaa aagcaggctg 1080
ggaagcatat ttgagaagat gcggccagca aaactaaaaa actgtattat aagtaaatgc 1140
atgtatacta aactcacaaa ttagagcttc aatttaatta tatcagttat taccctatgc 1200
ggtgtgaaat accgcacaga tgcgtaagga gaaaataccg catcaggaaa ttgtaaacgt 1260
taatattttg ttaaaattcg cgttaaattt ttgttaaatc agctcatttt ttaaccaata 1320
ggccgaaatc ggcaaaatcc cttataaatc aaaagaatag accgagatag ggttgagtgt 1380
tgttccagtt tggaacaaga gtccactatt aaagaacgtg gactccaacg tcaaagggcg 1440
aaaaaccgtc tatcagggcg atggcccact acgtgaacca tcaccctaat caagataact 1500
tcgtataatg tatgctatac gaacggtacc agtgatgata caacgagtta gccaaggtg 1559
<210> 69
<211> 1047
<212> DNA
<213> Achromobacter xylosoxidans
<400> 69
atgaaagctc tggtttatca cggtgaccac aagatctcgc ttgaagacaa gcccaagccc 60
acccttcaaa agcccacgga tgtagtagta cgggttttga agaccacgat ctgcggcacg 120
gatctcggca tctacaaagg caagaatcca gaggtcgccg acgggcgcat cctgggccat 180
gaaggggtag gcgtcatcga ggaagtgggc gagagtgtca cgcagttcaa gaaaggcgac 240
aaggtcctga tttcctgcgt cacttcttgc ggctcgtgcg actactgcaa gaagcagctt 300
tactcccatt gccgcgacgg cgggtggatc ctgggttaca tgatcgatgg cgtgcaggcc 360
gaatacgtcc gcatcccgca tgccgacaac agcctctaca agatccccca gacaattgac 420
gacgaaatcg ccgtcctgct gagcgacatc ctgcccaccg gccacgaaat cggcgtccag 480
tatgggaatg tccagccggg cgatgcggtg gctattgtcg gcgcgggccc cgtcggcatg 540
tccgtactgt tgaccgccca gttctactcc ccctcgacca tcatcgtgat cgacatggac 600
gagaatcgcc tccagctcgc caaggagctc ggggcaacgc acaccatcaa ctccggcacg 660
gagaacgttg tcgaagccgt gcataggatt gcggcagagg gagtcgatgt tgcgatcgag 720
gcggtgggca taccggcgac ttgggacatc tgccaggaga tcgtcaagcc cggcgcgcac 780
atcgccaacg tcggcgtgca tggcgtcaag gttgacttcg agattcagaa gctctggatc 840
aagaacctga cgatcaccac gggactggtg aacacgaaca cgacgcccat gctgatgaag 900
gtcgcctcga ccgacaagct tccgttgaag aagatgatta cccatcgctt cgagctggcc 960
gagatcgagc acgcctatca ggtattcctc aatggcgcca aggagaaggc gatgaagatc 1020
atcctctcga acgcaggcgc tgcctga 1047
<210> 70
<211> 348
<212> PRT
<213> Achromobacter xylosoxidans
<400> 70
Met Lys Ala Leu Val Tyr His Gly Asp His Lys Ile Ser Leu Glu Asp
1 5 10 15
Lys Pro Lys Pro Thr Leu Gln Lys Pro Thr Asp Val Val Val Arg Val
20 25 30
Leu Lys Thr Thr Ile Cys Gly Thr Asp Leu Gly Ile Tyr Lys Gly Lys
35 40 45
Asn Pro Glu Val Ala Asp Gly Arg Ile Leu Gly His Glu Gly Val Gly
50 55 60
Val Ile Glu Glu Val Gly Glu Ser Val Thr Gln Phe Lys Lys Gly Asp
65 70 75 80
Lys Val Leu Ile Ser Cys Val Thr Ser Cys Gly Ser Cys Asp Tyr Cys
85 90 95
Lys Lys Gln Leu Tyr Ser His Cys Arg Asp Gly Gly Trp Ile Leu Gly
100 105 110
Tyr Met Ile Asp Gly Val Gln Ala Glu Tyr Val Arg Ile Pro His Ala
115 120 125
Asp Asn Ser Leu Tyr Lys Ile Pro Gln Thr Ile Asp Asp Glu Ile Ala
130 135 140
Val Leu Leu Ser Asp Ile Leu Pro Thr Gly His Glu Ile Gly Val Gln
145 150 155 160
Tyr Gly Asn Val Gln Pro Gly Asp Ala Val Ala Ile Val Gly Ala Gly
165 170 175
Pro Val Gly Met Ser Val Leu Leu Thr Ala Gln Phe Tyr Ser Pro Ser
180 185 190
Thr Ile Ile Val Ile Asp Met Asp Glu Asn Arg Leu Gln Leu Ala Lys
195 200 205
Glu Leu Gly Ala Thr His Thr Ile Asn Ser Gly Thr Glu Asn Val Val
210 215 220
Glu Ala Val His Arg Ile Ala Ala Glu Gly Val Asp Val Ala Ile Glu
225 230 235 240
Ala Val Gly Ile Pro Ala Thr Trp Asp Ile Cys Gln Glu Ile Val Lys
245 250 255
Pro Gly Ala His Ile Ala Asn Val Gly Val His Gly Val Lys Val Asp
260 265 270
Phe Glu Ile Gln Lys Leu Trp Ile Lys Asn Leu Thr Ile Thr Thr Gly
275 280 285
Leu Val Asn Thr Asn Thr Thr Pro Met Leu Met Lys Val Ala Ser Thr
290 295 300
Asp Lys Leu Pro Leu Lys Lys Met Ile Thr His Arg Phe Glu Leu Ala
305 310 315 320
Glu Ile Glu His Ala Tyr Gln Val Phe Leu Asn Gly Ala Lys Glu Lys
325 330 335
Ala Met Lys Ile Ile Leu Ser Asn Ala Gly Ala Ala
340 345
<210> 71
<211> 1644
<212> DNA
<213> artificial sequence
<220>
<223> codon optimized L. lactis kivD coding region for S. cerevisiae
expression
<400> 71
atgtatacag taggtgacta tctgttggac agattacacg aattaggtat agaagaaata 60
ttcggagtac caggtgacta caatttgcaa tttctagatc aaattatttc acacaaagat 120
atgaaatggg tgggaaatgc taatgagtta aatgcctcct atatggccga cgggtacgca 180
agaacgaaaa aggctgcggc attcttgact acatttggtg ttggcgaatt atccgcagtt 240
aatggcttag cgggctccta tgctgagaac ctgcctgttg ttgagatcgt gggatctcct 300
acctcgaaag tgcagaacga aggtaagttt gttcaccata cgttggctga tggtgatttc 360
aagcacttta tgaagatgca cgaaccggtt actgctgcca ggactttatt gacagccgag 420
aatgcaactg ttgaaattga tagagtgttg tctgccttac taaaggaaag aaagccggtt 480
tacatcaatt tacctgtaga tgtagctgcc gctaaggctg aaaaaccatc cttgcctctt 540
aagaaggaaa attccacgtc gaatacatct gatcaagaga ttctgaacaa aatacaggaa 600
agtctgaaga atgccaagaa accaattgta atcacaggcc atgaaattat atcgttcggc 660
ctagagaaga ctgttactca gtttatttca aagactaagt tacctattac tactttgaac 720
tttggtaaat catctgttga tgaagcattg ccctcatttt tggggattta caacggtact 780
ctgtcagagc caaacttgaa ggaatttgtg gaatctgctg attttattct tatgttgggt 840
gtaaagctta ccgattctag tacgggtgca tttactcacc atcttaatga aaataaaatg 900
atttccttga atatcgatga aggtaaaatt ttcaacgaaa gaatccaaaa tttcgacttc 960
gaatccctga tatcatctct tcttgacttg tccgaaattg aatataaagg caagtacata 1020
gataaaaagc aagaagattt tgtaccttct aacgcgctgt tgtcacaaga tagactgtgg 1080
caagctgtcg aaaatttgac ccaaagtaat gagacgatcg tggctgaaca aggcacttct 1140
ttcttcggtg cctcatctat atttctgaaa tcgaaatcac attttattgg tcaacccttg 1200
tggggatcta taggatacac tttccccgca gctctaggca gccaaattgc agataaagaa 1260
tctagacatt tattgtttat cggagatgga tcattgcaac tgactgtcca agaattagga 1320
ctagccatta gagagaagat aaacccaatc tgctttatca ttaataacga tggttacacg 1380
gttgagaggg aaattcatgg tccgaaccag agttataatg acattcctat gtggaattac 1440
tcaaaactgc cagaaagttt cggggcaacg gaagacagag ttgtgtccaa aattgtgaga 1500
acagaaaatg aattcgtatc cgtgatgaaa gaagctcaag cagatccaaa taggatgtat 1560
tggatagaac ttattctagc aaaggagggt gcacctaaag ttttgaaaaa gatgggtaag 1620
ttatttgcag aacaaaacaa gagc 1644
<210> 72
<211> 753
<212> DNA
<213> Saccharomyces cerevisiae
<400> 72
gcatgcttgc atttagtcgt gcaatgtatg actttaagat ttgtgagcag gaagaaaagg 60
gagaatcttc taacgataaa cccttgaaaa actgggtaga ctacgctatg ttgagttgct 120
acgcaggctg cacaattaca cgagaatgct cccgcctagg atttaaggct aagggacgtg 180
caatgcagac gacagatcta aatgaccgtg tcggtgaagt gttcgccaaa cttttcggtt 240
aacacatgca gtgatgcacg cgcgatggtg ctaagttaca tatatatata tatagccata 300
gtgatgtcta agtaaccttt atggtatatt tcttaatgtg gaaagatact agcgcgcgca 360
cccacacaca agcttcgtct tttcttgaag aaaagaggaa gctcgctaaa tgggattcca 420
ctttccgttc cctgccagct gatggaaaaa ggttagtgga acgatgaaga ataaaaagag 480
agatccactg aggtgaaatt tcagctgaca gcgagtttca tgatcgtgat gaacaatggt 540
aacgagttgt ggctgttgcc agggagggtg gttctcaact tttaatgtat ggccaaatcg 600
ctacttgggt ttgttatata acaaagaaga aataatgaac tgattctctt cctccttctt 660
gtcctttctt aattctgttg taattacctt cctttgtaat tttttttgta attattcttc 720
ttaataatcc aaacaaacac acatattaca ata 753
<210> 73
<211> 316
<212> DNA
<213> Saccharomyces cerevisiae
<400> 73
gagtaagcga atttcttatg atttatgatt tttattatta aataagttat aaaaaaaata 60
agtgtataca aattttaaag tgactcttag gttttaaaac gaaaattctt attcttgagt 120
aactctttcc tgtaggtcag gttgctttct caggtatagc atgaggtcgc tcttattgac 180
cacacctcta ccggcatgcc gagcaaatgc ctgcaaatcg ctccccattt cacccaattg 240
tagatatgct aactccagca atgagttgat gaatctcggt gtgtatttta tgtcctcaga 300
ggacaacacc tgtggt 316
<210> 74
<211> 30
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 74
ggaattcaca catgaaagct ctggtttatc 30
<210> 75
<211> 28
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 75
gcgtccaggg cgtcaaagat caggcagc 28
<210> 76
<211> 55
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 76
aaacaaacac acatattaca atagctgagg atgaaagctc tggtttatca cggtg 55
<210> 77
<211> 55
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 77
atcataagaa attcgcttac tcttaattaa tcaggcagcg cctgcgttcg agagg 55
<210> 78
<211> 8994
<212> DNA
<213> artificial sequence
<220>
<223> constructed plasmid
<400> 78
ctagttctag agcggccgcc accgcggtgg agctccagct tttgttccct ttagtgaggg 60
ttaattgcgc gcttggcgta atcatggtca tagctgtttc ctgtgtgaaa ttgttatccg 120
ctcacaattc cacacaacat aggagccgga agcataaagt gtaaagcctg gggtgcctaa 180
tgagtgaggt aactcacatt aattgcgttg cgctcactgc ccgctttcca gtcgggaaac 240
ctgtcgtgcc agctgcatta atgaatcggc caacgcgcgg ggagaggcgg tttgcgtatt 300
gggcgctctt ccgcttcctc gctcactgac tcgctgcgct cggtcgttcg gctgcggcga 360
gcggtatcag ctcactcaaa ggcggtaata cggttatcca cagaatcagg ggataacgca 420
ggaaagaaca tgtgagcaaa aggccagcaa aaggccagga accgtaaaaa ggccgcgttg 480
ctggcgtttt tccataggct ccgcccccct gacgagcatc acaaaaatcg acgctcaagt 540
cagaggtggc gaaacccgac aggactataa agataccagg cgtttccccc tggaagctcc 600
ctcgtgcgct ctcctgttcc gaccctgccg cttaccggat acctgtccgc ctttctccct 660
tcgggaagcg tggcgctttc tcatagctca cgctgtaggt atctcagttc ggtgtaggtc 720
gttcgctcca agctgggctg tgtgcacgaa ccccccgttc agcccgaccg ctgcgcctta 780
tccggtaact atcgtcttga gtccaacccg gtaagacacg acttatcgcc actggcagca 840
gccactggta acaggattag cagagcgagg tatgtaggcg gtgctacaga gttcttgaag 900
tggtggccta actacggcta cactagaagg acagtatttg gtatctgcgc tctgctgaag 960
ccagttacct tcggaaaaag agttggtagc tcttgatccg gcaaacaaac caccgctggt 1020
agcggtggtt tttttgtttg caagcagcag attacgcgca gaaaaaaagg atctcaagaa 1080
gatcctttga tcttttctac ggggtctgac gctcagtgga acgaaaactc acgttaaggg 1140
attttggtca tgagattatc aaaaaggatc ttcacctaga tccttttaaa ttaaaaatga 1200
agttttaaat caatctaaag tatatatgag taaacttggt ctgacagtta ccaatgctta 1260
atcagtgagg cacctatctc agcgatctgt ctatttcgtt catccatagt tgcctgactc 1320
cccgtcgtgt agataactac gatacgggag ggcttaccat ctggccccag tgctgcaatg 1380
ataccgcgag acccacgctc accggctcca gatttatcag caataaacca gccagccgga 1440
agggccgagc gcagaagtgg tcctgcaact ttatccgcct ccatccagtc tattaattgt 1500
tgccgggaag ctagagtaag tagttcgcca gttaatagtt tgcgcaacgt tgttgccatt 1560
gctacaggca tcgtggtgtc acgctcgtcg tttggtatgg cttcattcag ctccggttcc 1620
caacgatcaa ggcgagttac atgatccccc atgttgtgca aaaaagcggt tagctccttc 1680
ggtcctccga tcgttgtcag aagtaagttg gccgcagtgt tatcactcat ggttatggca 1740
gcactgcata attctcttac tgtcatgcca tccgtaagat gcttttctgt gactggtgag 1800
tactcaacca agtcattctg agaatagtgt atgcggcgac cgagttgctc ttgcccggcg 1860
tcaatacggg ataataccgc gccacatagc agaactttaa aagtgctcat cattggaaaa 1920
cgttcttcgg ggcgaaaact ctcaaggatc ttaccgctgt tgagatccag ttcgatgtaa 1980
cccactcgtg cacccaactg atcttcagca tcttttactt tcaccagcgt ttctgggtga 2040
gcaaaaacag gaaggcaaaa tgccgcaaaa aagggaataa gggcgacacg gaaatgttga 2100
atactcatac tcttcctttt tcaatattat tgaagcattt atcagggtta ttgtctcatg 2160
agcggataca tatttgaatg tatttagaaa aataaacaaa taggggttcc gcgcacattt 2220
ccccgaaaag tgccacctga acgaagcatc tgtgcttcat tttgtagaac aaaaatgcaa 2280
cgcgagagcg ctaatttttc aaacaaagaa tctgagctgc atttttacag aacagaaatg 2340
caacgcgaaa gcgctatttt accaacgaag aatctgtgct tcatttttgt aaaacaaaaa 2400
tgcaacgcga gagcgctaat ttttcaaaca aagaatctga gctgcatttt tacagaacag 2460
aaatgcaacg cgagagcgct attttaccaa caaagaatct atacttcttt tttgttctac 2520
aaaaatgcat cccgagagcg ctatttttct aacaaagcat cttagattac tttttttctc 2580
ctttgtgcgc tctataatgc agtctcttga taactttttg cactgtaggt ccgttaaggt 2640
tagaagaagg ctactttggt gtctattttc tcttccataa aaaaagcctg actccacttc 2700
ccgcgtttac tgattactag cgaagctgcg ggtgcatttt ttcaagataa aggcatcccc 2760
gattatattc tataccgatg tggattgcgc atactttgtg aacagaaagt gatagcgttg 2820
atgattcttc attggtcaga aaattatgaa cggtttcttc tattttgtct ctatatacta 2880
cgtataggaa atgtttacat tttcgtattg ttttcgattc actctatgaa tagttcttac 2940
tacaattttt ttgtctaaag agtaatacta gagataaaca taaaaaatgt agaggtcgag 3000
tttagatgca agttcaagga gcgaaaggtg gatgggtagg ttatataggg atatagcaca 3060
gagatatata gcaaagagat acttttgagc aatgtttgtg gaagcggtat tcgcaatatt 3120
ttagtagctc gttacagtcc ggtgcgtttt tggttttttg aaagtgcgtc ttcagagcgc 3180
ttttggtttt caaaagcgct ctgaagttcc tatactttct agagaatagg aacttcggaa 3240
taggaacttc aaagcgtttc cgaaaacgag cgcttccgaa aatgcaacgc gagctgcgca 3300
catacagctc actgttcacg tcgcacctat atctgcgtgt tgcctgtata tatatataca 3360
tgagaagaac ggcatagtgc gtgtttatgc ttaaatgcgt acttatatgc gtctatttat 3420
gtaggatgaa aggtagtcta gtacctcctg tgatattatc ccattccatg cggggtatcg 3480
tatgcttcct tcagcactac cctttagctg ttctatatgc tgccactcct caattggatt 3540
agtctcatcc ttcaatgcta tcatttcctt tgatattgga tcatactaag aaaccattat 3600
tatcatgaca ttaacctata aaaataggcg tatcacgagg ccctttcgtc tcgcgcgttt 3660
cggtgatgac ggtgaaaacc tctgacacat gcagctcccg gagacggtca cagcttgtct 3720
gtaagcggat gccgggagca gacaagcccg tcagggcgcg tcagcgggtg ttggcgggtg 3780
tcggggctgg cttaactatg cggcatcaga gcagattgta ctgagagtgc accatatcga 3840
ctacgtcgta aggccgtttc tgacagagta aaattcttga gggaactttc accattatgg 3900
gaaatgcttc aagaaggtat tgacttaaac tccatcaaat ggtcaggtca ttgagtgttt 3960
tttatttgtt gtattttttt ttttttagag aaaatcctcc aatatcaaat taggaatcgt 4020
agtttcatga ttttctgtta cacctaactt tttgtgtggt gccctcctcc ttgtcaatat 4080
taatgttaaa gtgcaattct ttttccttat cacgttgagc cattagtatc aatttgctta 4140
cctgtattcc tttactatcc tcctttttct ccttcttgat aaatgtatgt agattgcgta 4200
tatagtttcg tctaccctat gaacatattc cattttgtaa tttcgtgtcg tttctattat 4260
gaatttcatt tataaagttt atgtacaaat atcataaaaa aagagaatct ttttaagcaa 4320
ggattttctt aacttcttcg gcgacagcat caccgacttc ggtggtactg ttggaaccac 4380
ctaaatcacc agttctgata cctgcatcca aaaccttttt aactgcatct tcaatggcct 4440
taccttcttc aggcaagttc aatgacaatt tcaacatcat tgcagcagac aagatagtgg 4500
cgatagggtc aaccttattc tttggcaaat ctggagcaga accgtggcat ggttcgtaca 4560
aaccaaatgc ggtgttcttg tctggcaaag aggccaagga cgcagatggc aacaaaccca 4620
aggaacctgg gataacggag gcttcatcgg agatgatatc accaaacatg ttgctggtga 4680
ttataatacc atttaggtgg gttgggttct taactaggat catggcggca gaatcaatca 4740
attgatgttg aaccttcaat gtagggaatt cgttcttgat ggtttcctcc acagtttttc 4800
tccataatct tgaagaggcc aaaagattag ctttatccaa ggaccaaata ggcaatggtg 4860
gctcatgttg tagggccatg aaagcggcca ttcttgtgat tctttgcact tctggaacgg 4920
tgtattgttc actatcccaa gcgacaccat caccatcgtc ttcctttctc ttaccaaagt 4980
aaatacctcc cactaattct ctgacaacaa cgaagtcagt acctttagca aattgtggct 5040
tgattggaga taagtctaaa agagagtcgg atgcaaagtt acatggtctt aagttggcgt 5100
acaattgaag ttctttacgg atttttagta aaccttgttc aggtctaaca ctaccggtac 5160
cccatttagg accagccaca gcacctaaca aaacggcatc aaccttcttg gaggcttcca 5220
gcgcctcatc tggaagtggg acacctgtag catcgatagc agcaccacca attaaatgat 5280
tttcgaaatc gaacttgaca ttggaacgaa catcagaaat agctttaaga accttaatgg 5340
cttcggctgt gatttcttga ccaacgtggt cacctggcaa aacgacgatc ttcttagggg 5400
cagacatagg ggcagacatt agaatggtat atccttgaaa tatatatata tattgctgaa 5460
atgtaaaagg taagaaaagt tagaaagtaa gacgattgct aaccacctat tggaaaaaac 5520
aataggtcct taaataatat tgtcaacttc aagtattgtg atgcaagcat ttagtcatga 5580
acgcttctct attctatatg aaaagccggt tccggcctct cacctttcct ttttctccca 5640
atttttcagt tgaaaaaggt atatgcgtca ggcgacctct gaaattaaca aaaaatttcc 5700
agtcatcgaa tttgattctg tgcgatagcg cccctgtgtg ttctcgttat gttgaggaaa 5760
aaaataatgg ttgctaagag attcgaactc ttgcatctta cgatacctga gtattcccac 5820
agttaactgc ggtcaagata tttcttgaat caggcgcctt agaccgctcg gccaaacaac 5880
caattacttg ttgagaaata gagtataatt atcctataaa tataacgttt ttgaacacac 5940
atgaacaagg aagtacagga caattgattt tgaagagaat gtggattttg atgtaattgt 6000
tgggattcca tttttaataa ggcaataata ttaggtatgt ggatatacta gaagttctcc 6060
tcgaccgtcg atatgcggtg tgaaataccg cacagatgcg taaggagaaa ataccgcatc 6120
aggaaattgt aaacgttaat attttgttaa aattcgcgtt aaatttttgt taaatcagct 6180
cattttttaa ccaataggcc gaaatcggca aaatccctta taaatcaaaa gaatagaccg 6240
agatagggtt gagtgttgtt ccagtttgga acaagagtcc actattaaag aacgtggact 6300
ccaacgtcaa agggcgaaaa accgtctatc agggcgatgg cccactacgt gaaccatcac 6360
cctaatcaag ttttttgggg tcgaggtgcc gtaaagcact aaatcggaac cctaaaggga 6420
gcccccgatt tagagcttga cggggaaagc cggcgaacgt ggcgagaaag gaagggaaga 6480
aagcgaaagg agcgggcgct agggcgctgg caagtgtagc ggtcacgctg cgcgtaacca 6540
ccacacccgc cgcgcttaat gcgccgctac agggcgcgtc gcgccattcg ccattcaggc 6600
tgcgcaactg ttgggaaggg cgatcggtgc gggcctcttc gctattacgc cagctggcga 6660
aagggggatg tgctgcaagg cgattaagtt gggtaacgcc agggttttcc cagtcacgac 6720
gttgtaaaac gacggccagt gagcgcgcgt aatacgactc actatagggc gaattgggta 6780
ccgggccccc cctcgaggtc gacggtatcg ataagcttga tatcgaattc ctgcagcccg 6840
ggggatccgc atgcttgcat ttagtcgtgc aatgtatgac tttaagattt gtgagcagga 6900
agaaaaggga gaatcttcta acgataaacc cttgaaaaac tgggtagact acgctatgtt 6960
gagttgctac gcaggctgca caattacacg agaatgctcc cgcctaggat ttaaggctaa 7020
gggacgtgca atgcagacga cagatctaaa tgaccgtgtc ggtgaagtgt tcgccaaact 7080
tttcggttaa cacatgcagt gatgcacgcg cgatggtgct aagttacata tatatatata 7140
tatatatata tagccatagt gatgtctaag taacctttat ggtatatttc ttaatgtgga 7200
aagatactag cgcgcgcacc cacacacaag cttcgtcttt tcttgaagaa aagaggaagc 7260
tcgctaaatg ggattccact ttccgttccc tgccagctga tggaaaaagg ttagtggaac 7320
gatgaagaat aaaaagagag atccactgag gtgaaatttc agctgacagc gagtttcatg 7380
atcgtgatga acaatggtaa cgagttgtgg ctgttgccag ggagggtggt tctcaacttt 7440
taatgtatgg ccaaatcgct acttgggttt gttatataac aaagaagaaa taatgaactg 7500
attctcttcc tccttcttgt cctttcttaa ttctgttgta attaccttcc tttgtaattt 7560
tttttgtaat tattcttctt aataatccaa acaaacacac atattacaat agctagctga 7620
ggatgaaggc attagtttat catggggatc acaaaatttc gttagaagac aaaccaaaac 7680
ccactctgca gaaaccaaca gacgttgtgg ttagggtgtt gaaaacaaca atttgcggta 7740
ctgacttggg aatatacaaa ggtaagaatc ctgaagtggc agatggcaga atcctgggtc 7800
atgagggcgt tggcgtcatt gaagaagtgg gcgaatccgt gacacaattc aaaaaggggg 7860
ataaagtttt aatctcctgc gttactagct gtggatcgtg tgattattgc aagaagcaac 7920
tgtattcaca ctgtagagac ggtggctgga ttttaggtta catgatcgac ggtgtccaag 7980
ccgaatacgt cagaatacca catgctgaca attcattgta taagatcccg caaactatcg 8040
atgatgaaat tgcagtacta ctgtccgata ttttacctac tggacatgaa attggtgttc 8100
aatatggtaa cgttcaacca ggcgatgctg tagcaattgt aggagcaggt cctgttggaa 8160
tgtcagtttt gttaactgct caattttact cgcctagtac cattattgtt atcgacatgg 8220
acgaaaaccg tttacaatta gcgaaggagc ttggggccac acacactatt aactccggta 8280
ctgaaaatgt tgtcgaagct gtgcatcgta tagcagccga aggagtggat gtagcaatag 8340
aagctgttgg tatacccgca acctgggaca tctgtcagga aattgtaaaa cccggcgctc 8400
atattgccaa cgtgggagtt catggtgtta aggtggactt tgaaattcaa aagttgtgga 8460
ttaagaatct aaccatcacc actggtttgg ttaacactaa tactacccca atgttgatga 8520
aggtagcctc tactgataaa ttgcctttaa agaaaatgat tactcacagg tttgagttag 8580
ctgaaatcga acacgcatat caggttttct tgaatggcgc taaagaaaaa gctatgaaga 8640
ttattctatc taatgcaggt gccgcctaat taattaagag taagcgaatt tcttatgatt 8700
tatgattttt attattaaat aagttataaa aaaaataagt gtatacaaat tttaaagtga 8760
ctcttaggtt ttaaaacgaa aattcttatt cttgagtaac tctttcctgt aggtcaggtt 8820
gctttctcag gtatagcatg aggtcgctct tattgaccac acctctaccg gcatgccgag 8880
caaatgcctg caaatcgctc cccatttcac ccaattgtag atatgctaac tccagcaatg 8940
agttgatgaa tctcggtgtg tattttatgt cctcagagga caacacctgt ggta 8994
<210> 79
<211> 2145
<212> DNA
<213> artificial sequence
<220>
<223> constructed chimeric gene
<400> 79
gcatgcttgc atttagtcgt gcaatgtatg actttaagat ttgtgagcag gaagaaaagg 60
gagaatcttc taacgataaa cccttgaaaa actgggtaga ctacgctatg ttgagttgct 120
acgcaggctg cacaattaca cgagaatgct cccgcctagg atttaaggct aagggacgtg 180
caatgcagac gacagatcta aatgaccgtg tcggtgaagt gttcgccaaa cttttcggtt 240
aacacatgca gtgatgcacg cgcgatggtg ctaagttaca tatatatata tatatatata 300
tatagccata gtgatgtcta agtaaccttt atggtatatt tcttaatgtg gaaagatact 360
agcgcgcgca cccacacaca agcttcgtct tttcttgaag aaaagaggaa gctcgctaaa 420
tgggattcca ctttccgttc cctgccagct gatggaaaaa ggttagtgga acgatgaaga 480
ataaaaagag agatccactg aggtgaaatt tcagctgaca gcgagtttca tgatcgtgat 540
gaacaatggt aacgagttgt ggctgttgcc agggagggtg gttctcaact tttaatgtat 600
ggccaaatcg ctacttgggt ttgttatata acaaagaaga aataatgaac tgattctctt 660
cctccttctt gtcctttctt aattctgttg taattacctt cctttgtaat tttttttgta 720
attattcttc ttaataatcc aaacaaacac acatattaca atagctagct gaggatgaag 780
gcattagttt atcatgggga tcacaaaatt tcgttagaag acaaaccaaa acccactctg 840
cagaaaccaa cagacgttgt ggttagggtg ttgaaaacaa caatttgcgg tactgacttg 900
ggaatataca aaggtaagaa tcctgaagtg gcagatggca gaatcctggg tcatgagggc 960
gttggcgtca ttgaagaagt gggcgaatcc gtgacacaat tcaaaaaggg ggataaagtt 1020
ttaatctcct gcgttactag ctgtggatcg tgtgattatt gcaagaagca actgtattca 1080
cactgtagag acggtggctg gattttaggt tacatgatcg acggtgtcca agccgaatac 1140
gtcagaatac cacatgctga caattcattg tataagatcc cgcaaactat cgatgatgaa 1200
attgcagtac tactgtccga tattttacct actggacatg aaattggtgt tcaatatggt 1260
aacgttcaac caggcgatgc tgtagcaatt gtaggagcag gtcctgttgg aatgtcagtt 1320
ttgttaactg ctcaatttta ctcgcctagt accattattg ttatcgacat ggacgaaaac 1380
cgtttacaat tagcgaagga gcttggggcc acacacacta ttaactccgg tactgaaaat 1440
gttgtcgaag ctgtgcatcg tatagcagcc gaaggagtgg atgtagcaat agaagctgtt 1500
ggtatacccg caacctggga catctgtcag gaaattgtaa aacccggcgc tcatattgcc 1560
aacgtgggag ttcatggtgt taaggtggac tttgaaattc aaaagttgtg gattaagaat 1620
ctaaccatca ccactggttt ggttaacact aatactaccc caatgttgat gaaggtagcc 1680
tctactgata aattgccttt aaagaaaatg attactcaca ggtttgagtt agctgaaatc 1740
gaacacgcat atcaggtttt cttgaatggc gctaaagaaa aagctatgaa gattattcta 1800
tctaatgcag gtgccgccta attaattaag agtaagcgaa tttcttatga tttatgattt 1860
ttattattaa ataagttata aaaaaaataa gtgtatacaa attttaaagt gactcttagg 1920
ttttaaaacg aaaattctta ttcttgagta actctttcct gtaggtcagg ttgctttctc 1980
aggtatagca tgaggtcgct cttattgacc acacctctac cggcatgccg agcaaatgcc 2040
tgcaaatcgc tccccatttc acccaattgt agatatgcta actccagcaa tgagttgatg 2100
aatctcggtg tgtattttat gtcctcagag gacaacacct gtggt 2145
<210> 80
<211> 4280
<212> DNA
<213> artificial sequence
<220>
<223> vector
<400> 80
ggggatcctc tagagtcgac ctgcaggcat gcaagcttgg cgtaatcatg gtcatagctg 60
tttcctgtgt gaaattgtta tccgctcaca attccacaca acatacgagc cggaagcata 120
aagtgtaaag cctggggtgc ctaatgagtg agctaactca cattaattgc gttgcgctca 180
ctgcccgctt tccagtcggg aaacctgtcg tgccagctgc attaatgaat cggccaacgc 240
gcggggagag gcggtttgcg tattgggcgc tcttccgctt cctcgctcac tgactcgctg 300
cgctcggtcg ttcggctgcg gcgagcggta tcagctcact caaaggcggt aatacggtta 360
tccacagaat caggggataa cgcaggaaag aacatgtgag caaaaggcca gcaaaaggcc 420
aggaaccgta aaaaggccgc gttgctggcg tttttccata ggctccgccc ccctgacgag 480
catcacaaaa atcgacgctc aagtcagagg tggcgaaacc cgacaggact ataaagatac 540
caggcgtttc cccctggaag ctccctcgtg cgctctcctg ttccgaccct gccgcttacc 600
ggatacctgt ccgcctttct cccttcggga agcgtggcgc tttctcatag ctcacgctgt 660
aggtatctca gttcggtgta ggtcgttcgc tccaagctgg gctgtgtgca cgaacccccc 720
gttcagcccg accgctgcgc cttatccggt aactatcgtc ttgagtccaa cccggtaaga 780
cacgacttat cgccactggc agcagccact ggtaacagga ttagcagagc gaggtatgta 840
ggcggtgcta cagagttctt gaagtggtgg cctaactacg gctacactag aaggacagta 900
tttggtatct gcgctctgct gaagccagtt accttcggaa aaagagttgg tagctcttga 960
tccggcaaac aaaccaccgc tggtagcggt ggtttttttg tttgcaagca gcagattacg 1020
cgcagaaaaa aaggatctca agaagatcct ttgatctttt ctacggggtc tgacgctcag 1080
tggaacgaaa actcacgtta agggattttg gtcatgagat tatcaaaaag gatcttcacc 1140
tagatccttt taaattaaaa atgaagtttt aaatcaatct aaagtatata tgagtaaact 1200
tggtctgaca gttaccaatg cttaatcagt gaggcaccta tctcagcgat ctgtctattt 1260
cgttcatcca tagttgcctg actccccgtc gtgtagataa ctacgatacg ggagggctta 1320
ccatctggcc ccagtgctgc aatgataccg cgagacccac gctcaccggc tccagattta 1380
tcagcaataa accagccagc cggaagggcc gagcgcagaa gtggtcctgc aactttatcc 1440
gcctccatcc agtctattaa ttgttgccgg gaagctagag taagtagttc gccagttaat 1500
agtttgcgca acgttgttgc cattgctaca ggcatcgtgg tgtcacgctc gtcgtttggt 1560
atggcttcat tcagctccgg ttcccaacga tcaaggcgag ttacatgatc ccccatgttg 1620
tgcaaaaaag cggttagctc cttcggtcct ccgatcgttg tcagaagtaa gttggccgca 1680
gtgttatcac tcatggttat ggcagcactg cataattctc ttactgtcat gccatccgta 1740
agatgctttt ctgtgactgg tgagtactca accaagtcat tctgagaata gtgtatgcgg 1800
cgaccgagtt gctcttgccc ggcgtcaata cgggataata ccgcgccaca tagcagaact 1860
ttaaaagtgc tcatcattgg aaaacgttct tcggggcgaa aactctcaag gatcttaccg 1920
ctgttgagat ccagttcgat gtaacccact cgtgcaccca actgatcttc agcatctttt 1980
actttcacca gcgtttctgg gtgagcaaaa acaggaaggc aaaatgccgc aaaaaaggga 2040
ataagggcga cacggaaatg ttgaatactc atactcttcc tttttcaata ttattgaagc 2100
atttatcagg gttattgtct catgagcgga tacatatttg aatgtattta gaaaaataaa 2160
caaatagggg ttccgcgcac atttccccga aaagtgccac ctgacgtcta agaaaccatt 2220
attatcatga cattaaccta taaaaatagg cgtatcacga ggccctttcg tctcgcgcgt 2280
ttcggtgatg acggtgaaaa cctctgacac atgcagctcc cggagacggt cacagcttgt 2340
ctgtaagcgg atgccgggag cagacaagcc cgtcagggcg cgtcagcggg tgttggcggg 2400
tgtcggggct ggcttaacta tgcggcatca gagcagattg tactgagagt gcaccatatg 2460
cggtgtgaaa taccgcacag atgcgtaagg agaaaatacc gcatcaggcg ccattcgcca 2520
ttcaggctgc gcaactgttg ggaagggcga tcggtgcggg cctcttcgct attacgccag 2580
ctggcgaaag ggggatgtgc tgcaaggcga ttaagttggg taacgccagg gttttcccag 2640
tcacgacgtt gtaaaacgac ggccagtgaa ttcgagctcg gtacccccgg ctctgagaca 2700
gtagtaggtt agtcatcgct ctaccgacgc gcaggaaaag aaagaagcat tgcggattac 2760
gtattctaat gttcagcccg cggaacgcca gcaaatcacc acccatgcgc atgatactga 2820
gtcttgtaca cgctgggctt ccagtgtact gagagtgcac cataccacag cttttcaatt 2880
caattcatca tttttttttt attctttttt ttgatttcgg tttctttgaa atttttttga 2940
ttcggtaatc tccgaacaga aggaagaacg aaggaaggag cacagactta gattggtata 3000
tatacgcata tgtagtgttg aagaaacatg aaattgccca gtattcttaa cccaactgca 3060
cagaacaaaa acctgcagga aacgaagata aatcatgtcg aaagctacat ataaggaacg 3120
tgctgctact catcctagtc ctgttgctgc caagctattt aatatcatgc acgaaaagca 3180
aacaaacttg tgtgcttcat tggatgttcg taccaccaag gaattactgg agttagttga 3240
agcattaggt cccaaaattt gtttactaaa aacacatgtg gatatcttga ctgatttttc 3300
catggagggc acagttaagc cgctaaaggc attatccgcc aagtacaatt ttttactctt 3360
cgaagacaga aaatttgctg acattggtaa tacagtcaaa ttgcagtact ctgcgggtgt 3420
atacagaata gcagaatggg cagacattac gaatgcacac ggtgtggtgg gcccaggtat 3480
tgttagcggt ttgaagcagg cggcagaaga agtaacaaag gaacctagag gccttttgat 3540
gttagcagaa ttgtcatgca agggctccct atctactgga gaatatacta agggtactgt 3600
tgacattgcg aagagcgaca aagattttgt tatcggcttt attgctcaaa gagacatggg 3660
tggaagagat gaaggttacg attggttgat tatgacaccc ggtgtgggtt tagatgacaa 3720
gggagacgca ttgggtcaac agtatagaac cgtggatgat gtggtctcta caggatctga 3780
cattattatt gttggaagag gactatttgc aaagggaagg gatgctaagg tagagggtga 3840
acgttacaga aaagcaggct gggaagcata tttgagaaga tgcggccagc aaaactaaaa 3900
aactgtatta taagtaaatg catgtatact aaactcacaa attagagctt caatttaatt 3960
atatcagtta ttaccctatg cggtgtgaaa taccgcacag atgcgtaagg agaaaatacc 4020
gcatcaggaa attgtaaacg ttaatatttt gttaaaattc gcgttaaatt tttgttaaat 4080
cagctcattt tttaaccaat aggccgaaat cggcaaaatc ttcagcccgc ggaacgccag 4140
caaatcacca cccatgcgca tgatactgag tcttgtacac gctgggcttc cagtgatgat 4200
acaacgagtt agccaaggtg agcacggatg tctaaattag aattacgttt taatatcttt 4260
ttttccatat ctagggctag 4280
<210> 81
<211> 30
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 81
gcatgcttgc atttagtcgt gcaatgtatg 30
<210> 82
<211> 54
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 82
gaacattaga atacgtaatc cgcaatgcac tagtaccaca ggtgttgtcc tctg 54
<210> 83
<211> 54
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 83
cagaggacaa cacctgtggt actagtgcat tgcggattac gtattctaat gttc 54
<210> 84
<211> 28
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 84
caccttggct aactcgttgt atcatcac 28
<210> 85
<211> 100
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 85
ttttaagccg aatgagtgac agaaaaagcc cacaacttat caagtgatat tgaacaaagg 60
gcgaaacttc gcatgcttgc atttagtcgt gcaatgtatg 100
<210> 86
<211> 98
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 86
cccaattggt aaatattcaa caagagacgc gcagtacgta acatgcgaat tgcgtaattc 60
acggcgataa caccttggct aactcgttgt atcatcac 98
<210> 87
<211> 29
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 87
caaaagccca tgtcccacac caaaggatg 29
<210> 88
<211> 26
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 88
caccatcgcg cgtgcatcac tgcatg 26
<210> 89
<211> 28
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 89
tcggtttttg caatatgacc tgtgggcc 28
<210> 90
<211> 22
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 90
gagaagatgc ggccagcaaa ac 22
<210> 91
<211> 2745
<212> DNA
<213> artificial sequence
<220>
<223> constructed coding region-terminator segment
<400> 91
atgactgaca aaaaaactct taaagactta agaaatcgta gttctgttta cgattcaatg 60
gttaaatcac ctaatcgtgc tatgttgcgt gcaactggta tgcaagatga agactttgaa 120
aaacctatcg tcggtgtcat ttcaacttgg gctgaaaaca caccttgtaa tatccactta 180
catgactttg gtaaactagc caaagtcggt gttaaggaag ctggtgcttg gccagttcag 240
ttcggaacaa tcacggtttc tgatggaatc gccatgggaa cccaaggaat gcgtttctcc 300
ttgacatctc gtgatattat tgcagattct attgaagcag ccatgggagg tcataatgcg 360
gatgcttttg tagccattgg cggttgtgat aaaaacatgc ccggttctgt tatcgctatg 420
gctaacatgg atatcccagc catttttgct tacggcggaa caattgcacc tggtaattta 480
gacggcaaag atatcgattt agtctctgtc tttgaaggtg tcggccattg gaaccacggc 540
gatatgacca aagaagaagt taaagctttg gaatgtaatg cttgtcccgg tcctggaggc 600
tgcggtggta tgtatactgc taacacaatg gcgacagcta ttgaagtttt gggacttagc 660
cttccgggtt catcttctca cccggctgaa tccgcagaaa agaaagcaga tattgaagaa 720
gctggtcgcg ctgttgtcaa aatgctcgaa atgggcttaa aaccttctga cattttaacg 780
cgtgaagctt ttgaagatgc tattactgta actatggctc tgggaggttc aaccaactca 840
acccttcacc tcttagctat tgcccatgct gctaatgtgg aattgacact tgatgatttc 900
aatactttcc aagaaaaagt tcctcatttg gctgatttga aaccttctgg tcaatatgta 960
ttccaagacc tttacaaggt cggaggggta ccagcagtta tgaaatatct ccttaaaaat 1020
ggcttccttc atggtgaccg tatcacttgt actggcaaaa cagtcgctga aaatttgaag 1080
gcttttgatg atttaacacc tggtcaaaag gttattatgc cgcttgaaaa tcctaaacgt 1140
gaagatggtc cgctcattat tctccatggt aacttggctc cagacggtgc cgttgccaaa 1200
gtttctggtg taaaagtgcg tcgtcatgtc ggtcctgcta aggtctttaa ttctgaagaa 1260
gaagccattg aagctgtctt gaatgatgat attgttgatg gtgatgttgt tgtcgtacgt 1320
tttgtaggac caaagggcgg tcctggtatg cctgaaatgc tttccctttc atcaatgatt 1380
gttggtaaag ggcaaggtga aaaagttgcc cttctgacag atggccgctt ctcaggtggt 1440
acttatggtc ttgtcgtggg tcatatcgct cctgaagcac aagatggcgg tccaatcgcc 1500
tacctgcaaa caggagacat agtcactatt gaccaagaca ctaaggaatt acactttgat 1560
atctccgatg aagagttaaa acatcgtcaa gagaccattg aattgccacc gctctattca 1620
cgcggtatcc ttggtaaata tgctcacatc gtttcgtctg cttctagggg agccgtaaca 1680
gacttttgga agcctgaaga aactggcaaa aaatgttgtc ctggttgctg tggttaagcg 1740
gccgcgttaa ttcaaattaa ttgatatagt tttttaatga gtattgaatc tgtttagaaa 1800
taatggaata ttatttttat ttatttattt atattattgg tcggctcttt tcttctgaag 1860
gtcaatgaca aaatgatatg aaggaaataa tgatttctaa aattttacaa cgtaagatat 1920
ttttacaaaa gcctagctca tcttttgtca tgcactattt tactcacgct tgaaattaac 1980
ggccagtcca ctgcggagtc atttcaaagt catcctaatc gatctatcgt ttttgatagc 2040
tcattttgga gttcgcgatt gtcttctgtt attcacaact gttttaattt ttatttcatt 2100
ctggaactct tcgagttctt tgtaaagtct ttcatagtag cttactttat cctccaacat 2160
atttaacttc atgtcaattt cggctcttaa attttccaca tcatcaagtt caacatcatc 2220
ttttaacttg aatttattct ctagctcttc caaccaagcc tcattgctcc ttgatttact 2280
ggtgaaaagt gatacacttt gcgcgcaatc caggtcaaaa ctttcctgca aagaattcac 2340
caatttctcg acatcatagt acaatttgtt ttgttctccc atcacaattt aatatacctg 2400
atggattctt atgaagcgct gggtaatgga cgtgtcactc tacttcgcct ttttccctac 2460
tccttttagt acggaagaca atgctaataa ataagagggt aataataata ttattaatcg 2520
gcaaaaaaga ttaaacgcca agcgtttaat tatcagaaag caaacgtcgt accaatcctt 2580
gaatgcttcc caattgtata ttaagagtca tcacagcaac atattcttgt tattaaatta 2640
attattattg atttttgata ttgtataaaa aaaccaaata tgtataaaaa aagtgaataa 2700
aaaataccaa gtatggagaa atatattaga agtctatacg ttaaa 2745
<210> 92
<211> 27
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 92
gacttttgga agcctgaaga aactggc 27
<210> 93
<211> 20
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 93
cttggcagca acaggactag 20
<210> 94
<211> 26
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 94
ccaggccaat tcaacagact gtcggc 26
<210> 95
<211> 2347
<212> DNA
<213> artificial sequence
<220>
<223> constructed URA3 marker with flanking homologous repeat sequences
for HIS gene replacement and marker excision
<400> 95
gcattgcgga ttacgtattc taatgttcag gtgctggaag aagagctgct taaccgccgc 60
gcccagggtg aagatccacg ctactttacc ctgcgtcgtc tggatttcgg cggctgtcgt 120
ctttcgctgg caacgccggt tgatgaagcc tgggacggtc cgctctcctt aaacggtaaa 180
cgtatcgcca cctcttatcc tcacctgctc aagcgttatc tcgaccagaa aggcatctct 240
tttaaatcct gcttactgaa cggttctgtt gaagtcgccc cgcgtgccgg actggcggat 300
gcgatttgcg atctggtttc caccggtgcc acgctggaag ctaacggcct gcgcgaagtc 360
gaagttatct atcgctcgaa agcctgcctg attcaacgcg atggcgaaat ggaagaatcc 420
aaacagcaac tgatcgacaa actgctgacc cgtattcagg gtgtgatcca ggcgcgcgaa 480
tcaaaataca tcatgatgca cgcaccgacc gaacgtctgg atgaagtcat ggtacctact 540
gagagtgcac cataccacag cttttcaatt caattcatca tttttttttt attctttttt 600
ttgatttcgg tttctttgaa atttttttga ttcggtaatc tccgaacaga aggaagaacg 660
aaggaaggag cacagactta gattggtata tatacgcata tgtagtgttg aagaaacatg 720
aaattgccca gtattcttaa cccaactgca cagaacaaaa acctgcagga aacgaagata 780
aatcatgtcg aaagctacat ataaggaacg tgctgctact catcctagtc ctgttgctgc 840
caagctattt aatatcatgc acgaaaagca aacaaacttg tgtgcttcat tggatgttcg 900
taccaccaag gaattactgg agttagttga agcattaggt cccaaaattt gtttactaaa 960
aacacatgtg gatatcttga ctgatttttc catggagggc acagttaagc cgctaaaggc 1020
attatccgcc aagtacaatt ttttactctt cgaagacaga aaatttgctg acattggtaa 1080
tacagtcaaa ttgcagtact ctgcgggtgt atacagaata gcagaatggg cagacattac 1140
gaatgcacac ggtgtggtgg gcccaggtat tgttagcggt ttgaagcagg cggcagaaga 1200
agtaacaaag gaacctagag gccttttgat gttagcagaa ttgtcatgca agggctccct 1260
atctactgga gaatatacta agggtactgt tgacattgcg aagagcgaca aagattttgt 1320
tatcggcttt attgctcaaa gagacatggg tggaagagat gaaggttacg attggttgat 1380
tatgacaccc ggtgtgggtt tagatgacaa gggagacgca ttgggtcaac agtatagaac 1440
cgtggatgat gtggtctcta caggatctga cattattatt gttggaagag gactatttgc 1500
aaagggaagg gatgctaagg tagagggtga acgttacaga aaagcaggct gggaagcata 1560
tttgagaaga tgcggccagc aaaactaaaa aactgtatta taagtaaatg catgtatact 1620
aaactcacaa attagagctt caatttaatt atatcagtta ttaccctatg cggtgtgaaa 1680
taccgcacag atgcgtaagg agaaaatacc gcatcaggaa attgtaaacg ttaatatttt 1740
gttaaaattc gcgttaaatt tttgttaaat cagctcattt tttaaccaat aggccgaaat 1800
cggcaaaatc tctagagtgc tggaagaaga gctgcttaac cgccgcgccc agggtgaaga 1860
tccacgctac tttaccctgc gtcgtctgga tttcggcggc tgtcgtcttt cgctggcaac 1920
gccggttgat gaagcctggg acggtccgct ctccttaaac ggtaaacgta tcgccacctc 1980
ttatcctcac ctgctcaagc gttatctcga ccagaaaggc atctctttta aatcctgctt 2040
actgaacggt tctgttgaag tcgccccgcg tgccggactg gcggatgcga tttgcgatct 2100
ggtttccacc ggtgccacgc tggaagctaa cggcctgcgc gaagtcgaag ttatctatcg 2160
ctcgaaagcc tgcctgattc aacgcgatgg cgaaatggaa gaatccaaac agcaactgat 2220
cgacaaactg ctgacccgta ttcagggtgt gatccaggcg cgcgaatcaa aatacatcat 2280
gatgcacgca ccgaccgaac gtctggatga agtcatccag tgatgataca acgagttagc 2340
caaggtg 2347
<210> 96
<211> 80
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 96
cttcgaagaa tatactaaaa aatgagcagg caagataaac gaaggcaaag gcattgcgga 60
ttacgtattc taatgttcag 80
<210> 97
<211> 81
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 97
tatacacatg tatatatatc gtatgctgca gctttaaata atcggtgtca caccttggct 60
aactcgttgt atcatcactg g 81
<210> 98
<211> 26
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 98
gacttgaata atgcagcggc gcttgc 26
<210> 99
<211> 30
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 99
ccaccctctt caattagcta agatcatagc 30
<210> 100
<211> 25
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 100
aaaaattgat tctcatcgta aatgc 25
<210> 101
<211> 20
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 101
ctgcagcgag gagccgtaat 20
<210> 102
<211> 90
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 102
atggttcatt taggtccaaa aaaaccacaa gccagaaagg gttccatggc cgatgtgcca 60
gcattgcgga ttacgtattc taatgttcag 90
<210> 103
<211> 91
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 103
ttaagcaccg atgataccaa cggacttacc ttcagcaatt cttttttggg ccaaagcagc 60
caccttggct aactcgttgt atcatcactg g 91
<210> 104
<211> 24
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 104
ctaggatgag tagcagcacg ttcc 24
<210> 105
<211> 26
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 105
ccaattccgt gatgtctctt tgttgc 26
<210> 106
<211> 20
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 106
gtgaacgagt tcacaaccgc 20
<210> 107
<211> 22
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 107
gttcgttcca gaattatcac gc 22
<210> 108
<211> 28
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 108
ggatccgcat gcttgcattt agtcgtgc 28
<210> 109
<211> 20
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 109
gggatgcgga cgtattcggc 20
<210> 110
<211> 4506
<212> DNA
<213> Saccharomyces cerevisiae
<400> 110
atgtcgaata ccccttataa ttcatctgtg ccttccattg catccatgac ccagtcttcg 60
gtctcaagaa gtcctaacat gcatacagca actacgcccg gtgccaacac cagctctaac 120
tctccaccct tgcacatgtc ttcagattcg tccaagatca agaggaagcg taacagaatt 180
ccgctcagtt gcaccatttg tcggaaaagg aaagtcaaat gtgacaaact cagaccacac 240
tgccagcagt gcactaaaac tggggtagcc catctctgcc actacatgga acagacctgg 300
gcagaagagg cagagaaaga attgctgaag gacaacgaat taaagaagct tagggagcgc 360
gtaaaatctt tagaaaagac tctttctaag gtgcactctt ctccttcgtc taactccttg 420
aaaagttaca acactcccga gagcagcaac ctgtttatgg gtagcgatga acacaccacc 480
cttgttaatg caaatacagg ctctgcttcc tctgcctcgc atatgcatca gcaacaacag 540
caacagcagc aacaggaaca acaacaagac ttttccagaa gtgcgaacgc caacgcgaat 600
tcctcgtccc tttctatctc aaataaatat gacaacgatg agctggactt aactaaggac 660
tttgatcttt tgcatatcaa aagtaacgga accatccact taggtgccac ccactggttg 720
tctatcatga aaggtgaccc gtacctaaaa cttttgtggg gtcatatctt cgctatgagg 780
gaaaagttaa atgaatggta ctaccaaaaa aattcgtact ctaagctgaa gtcaagcaaa 840
tgtcccatca atcacgcgca agcgccgcct tctgccgctg ccgccgctac cagaaaatgt 900
cctgttgatc actccgcgtt ttcgtctggc atggtggccc caaaggagga gactcctctt 960
cctaggaaat gtccagttga ccacaccatg ttctcttcgg gaatgattcc tcccagagag 1020
gacacttcgt cccagaagag gtgtcccgtt gaccacacca tgtattccgc aggaatgatg 1080
ccgcccaagg acgagacacc ttccccattt tccactaaag ctatgataga ccataacaag 1140
catacaatga atccgcctca gtcaaaatgt cctgtggacc atagaaacta tatgaaggat 1200
tatccctctg acatggcaaa ttcttcttcg aacccggcaa gtcgttgccc cattgaccat 1260
tcaagcatga aaaatacagc ggccttacca gcttcaacgc acaataccat cccacaccac 1320
caaccacagt ccggatctca tgctcgttcg catcccgcac aaagcaggaa acatgattcc 1380
tacatgacag aatctgaagt cctcgcaaca ctttgtgaga tgttgccacc aaagcgcgtc 1440
atcgcattat tcatcgagaa attcttcaaa catttatacc ctgccattcc aatcttagat 1500
gaacagaatt tcaaaaatca cgtgaatcaa atgctttcgt tgtcttcgat gaatcccaca 1560
gttaacaact ttggtatgag catgccatct tcatctacac tagagaacca acccataaca 1620
caaatcaatc ttccaaaact ttccgattct tgtaacttag gtattctgat aataatcttg 1680
agattgacat ggctatccat accttctaat tcctgcgaag tcgacctggg agaagaaagt 1740
ggctcatttt tagtgcccaa cgaatctagc aatatgtctg catctgcatt gacctcgatg 1800
gctaaagaag aatcacttct gctaaagcat gagacaccgg tcgaggcact ggagctatgt 1860
caaaaatact tgattaaatt cgatgaactt tctagtattt ccaataacaa cgttaattta 1920
accacggtgc agtttgccat tttttacaac ttctatatga aaagtgcctc taatgatttg 1980
actaccttga caaataccaa caacactggc atggccaatc ctggtcacga ttccgagtct 2040
caccagatcc tattgtccaa tattactcaa atggccttta gttgtgggtt acacagagac 2100
cctgataatt ttcctcaatt aaacgctacc attccagcaa ccagccagga cgtgtctaac 2160
aacgggagca aaaaggcaaa ccctagcacc aatccaactt tgaataacaa catgtctgct 2220
gccactacca acagcagtag cagatctggc agtgctgatt caagaagtgg ttctaaccct 2280
gtgaacaaga aggaaaatca ggttagtatc gaaagattta aacacacttg gaggaaaatt 2340
tggtattaca ttgttagcat ggatgttaac caatctcttt ccctggggag ccctcgacta 2400
ctaagaaatc tgagggattt cagcgataca aagctaccaa gtgcgtcaag gattgattat 2460
gttcgcgata tcaaagagtt aatcattgtg aagaatttta ctcttttttt ccaaattgat 2520
ttgtgtatta ttgctgtatt aaatcacatt ttgaatgttt ctttagcaag aagcgtgaga 2580
aaatttgaac tggattcatt gattaattta ttgaaaaatc tgacctatgg tactgagaat 2640
gtcaatgatg tagtgagctc cttgatcaac aaagggttat taccaacttc ggaaggtggt 2700
tctgtagatt caaataatga tgaaatttac ggtctaccga aactacccga tattctaaac 2760
catggtcaac ataaccaaaa cttgtatgct gatggaagaa atacttctag tagtgatata 2820
gataagaaat tggaccttcc tcacgaatct acaacgagag ctctattctt ttccaagcat 2880
atgacaatta gaatgttgct gtacttattg aactacattt tgtttactca ttatgaacca 2940
atgggcagtg aagatcctgg tactaatatc ctagctaagg agtacgctca agaggcatta 3000
aattttgcca tggatggcta cagaaactgc atgattttct tcaacaatat cagaaacacc 3060
aattcactat tcgattacat gaatgttatc ttgtcttacc cttgtttgga cattggacat 3120
cgttctttac aatttatcgt ttgtttgatc ctgagagcta aatgtggccc attgactggt 3180
atgcgtgaat catcgatcat tactaatggt acatcaagtg gatttaatag ttcggtagaa 3240
gatgaggacg tcaaagttaa acaagaatct tctgatgaat tgaaaaaaga cgatttcatg 3300
aaagatgtaa atttggattc aggcgattca ttagcagaga ttctaatgtc aagaatgctg 3360
ctatttcaaa aactaacaaa acaactatca aagaagtaca actacgctat tcgtatgaac 3420
aaatccactg gattctttgt ctctttacta gatacacctt caaagaaatc agactcgaaa 3480
tcgggtggta gttcattcat gttgggtaat tggaaacatc caaaggtttc aaacatgagc 3540
ggatttcttg ctggtgacaa agaccaatta cagaaatgcc ccgtgtacca agatgcgctg 3600
gggtttgtta gtccaaccgg tgctaatgaa ggttctgctc cgatgcaagg catgtcctta 3660
cagggctcta ctgctaggat gggagggacc cagttgccac caattagatc atacaaacct 3720
atcacgtaca caagtagtaa tctacgtcgt atgaatgaaa cgggtgaggc agaagctaag 3780
agaagaagat ttaatgatgg ctatattgat aataatagta acaacgatat acctagagga 3840
atcagcccaa aaccttcaaa tgggctatca tcggtgcagc cactattatc gtcattttcc 3900
atgaaccagc taaacggggg taccattcca acggttccat cgttaaccaa cattacttca 3960
caaatgggag ctttaccatc tttagatagg atcaccacta atcaaataaa tttgccagac 4020
ccatctagag atgaagcatt tgacaactcc atcaagcaaa tgacgcctat gacaagtgca 4080
ttcatgaatg ctaatactac aattccaagt tcaactttaa acgggaatat gaacatgaat 4140
ggagctggaa ctgcgaatac agatacaagt gccaacggca gtgctttatc gacactgaca 4200
agcccacaag gctcagactt agcatccaat tctgctacac agtataaacc tgacttagaa 4260
gactttttga tgcaaaattc taactttaat gggctaatga taaatccttc cagtctggta 4320
gaagttgttg gtggatacaa cgatcctaat aaccttggaa gaaatgacgc ggttgatttt 4380
ctacccgttg ataatgttga aattgatggt gttggaataa aaatcaacta tcatctacta 4440
actagtattt acgttactag tatattatca tatacggtgt tagaagatga cgcaaatgat 4500
gagaaa 4506
<210> 111
<211> 99
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 111
tcctttctca attattattt tctactcata acctcacgca aaataacaca gtcaaatcaa 60
tcaaagtatg actgacaaaa aaactcttaa agacttaag 99
<210> 112
<211> 77
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 112
gaacattaga atacgtaatc cgcaatgctt ctttcttttc cgtttaacgt atagacttct 60
aatatatttc tccatac 77
<210> 113
<211> 45
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 113
aaacggaaaa gaaagaagca ttgcggatta cgtattctaa tgttc 45
<210> 114
<211> 88
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 114
tatttttcgt tacataaaaa tgcttataaa actttaacta ataattagag attaaatcgc 60
caccttggct aactcgttgt atcatcac 88
<210> 115
<211> 1713
<212> DNA
<213> Streptococcus mutans
<400> 115
atgactgaca aaaaaactct taaagactta agaaatcgta gttctgttta cgattcaatg 60
gttaaatcac ctaatcgtgc tatgttgcgt gcaactggta tgcaagatga agactttgaa 120
aaacctatcg tcggtgtcat ttcaacttgg gctgaaaaca caccttgtaa tatccactta 180
catgactttg gtaaactagc caaagtcggt gttaaggaag ctggtgcttg gccagttcag 240
ttcggaacaa tcacggtttc tgatggaatc gccatgggaa cccaaggaat gcgtttctcc 300
ttgacatctc gtgatattat tgcagattct attgaagcag ccatgggagg tcataatgcg 360
gatgcttttg tagccattgg cggttgtgat aaaaacatgc ccggttctgt tatcgctatg 420
gctaacatgg atatcccagc catttttgct tacggcggaa caattgcacc tggtaattta 480
gacggcaaag atatcgattt agtctctgtc tttgaaggtg tcggccattg gaaccacggc 540
gatatgacca aagaagaagt taaagctttg gaatgtaatg cttgtcccgg tcctggaggc 600
tgcggtggta tgtatactgc taacacaatg gcgacagcta ttgaagtttt gggacttagc 660
cttccgggtt catcttctca cccggctgaa tccgcagaaa agaaagcaga tattgaagaa 720
gctggtcgcg ctgttgtcaa aatgctcgaa atgggcttaa aaccttctga cattttaacg 780
cgtgaagctt ttgaagatgc tattactgta actatggctc tgggaggttc aaccaactca 840
acccttcacc tcttagctat tgcccatgct gctaatgtgg aattgacact tgatgatttc 900
aatactttcc aagaaaaagt tcctcatttg gctgatttga aaccttctgg tcaatatgta 960
ttccaagacc tttacaaggt cggaggggta ccagcagtta tgaaatatct ccttaaaaat 1020
ggcttccttc atggtgaccg tatcacttgt actggcaaaa cagtcgctga aaatttgaag 1080
gcttttgatg atttaacacc tggtcaaaag gttattatgc cgcttgaaaa tcctaaacgt 1140
gaagatggtc cgctcattat tctccatggt aacttggctc cagacggtgc cgttgccaaa 1200
gtttctggtg taaaagtgcg tcgtcatgtc ggtcctgcta aggtctttaa ttctgaagaa 1260
gaagccattg aagctgtctt gaatgatgat attgttgatg gtgatgttgt tgtcgtacgt 1320
tttgtaggac caaagggcgg tcctggtatg cctgaaatgc tttccctttc atcaatgatt 1380
gttggtaaag ggcaaggtga aaaagttgcc cttctgacag atggccgctt ctcaggtggt 1440
acttatggtc ttgtcgtggg tcatatcgct cctgaagcac aagatggcgg tccaatcgcc 1500
tacctgcaaa caggagacat agtcactatt gaccaagaca ctaaggaatt acactttgat 1560
atctccgatg aagagttaaa acatcgtcaa gagaccattg aattgccacc gctctattca 1620
cgcggtatcc ttggtaaata tgctcacatc gtttcgtctg cttctagggg agccgtaaca 1680
gacttttgga agcctgaaga aactggcaaa aaa 1713
<210> 116
<211> 571
<212> PRT
<213> Streptococcus mutans
<400> 116
Met Thr Asp Lys Lys Thr Leu Lys Asp Leu Arg Asn Arg Ser Ser Val
1 5 10 15
Tyr Asp Ser Met Val Lys Ser Pro Asn Arg Ala Met Leu Arg Ala Thr
20 25 30
Gly Met Gln Asp Glu Asp Phe Glu Lys Pro Ile Val Gly Val Ile Ser
35 40 45
Thr Trp Ala Glu Asn Thr Pro Cys Asn Ile His Leu His Asp Phe Gly
50 55 60
Lys Leu Ala Lys Val Gly Val Lys Glu Ala Gly Ala Trp Pro Val Gln
65 70 75 80
Phe Gly Thr Ile Thr Val Ser Asp Gly Ile Ala Met Gly Thr Gln Gly
85 90 95
Met Arg Phe Ser Leu Thr Ser Arg Asp Ile Ile Ala Asp Ser Ile Glu
100 105 110
Ala Ala Met Gly Gly His Asn Ala Asp Ala Phe Val Ala Ile Gly Gly
115 120 125
Cys Asp Lys Asn Met Pro Gly Ser Val Ile Ala Met Ala Asn Met Asp
130 135 140
Ile Pro Ala Ile Phe Ala Tyr Gly Gly Thr Ile Ala Pro Gly Asn Leu
145 150 155 160
Asp Gly Lys Asp Ile Asp Leu Val Ser Val Phe Glu Gly Val Gly His
165 170 175
Trp Asn His Gly Asp Met Thr Lys Glu Glu Val Lys Ala Leu Glu Cys
180 185 190
Asn Ala Cys Pro Gly Pro Gly Gly Cys Gly Gly Met Tyr Thr Ala Asn
195 200 205
Thr Met Ala Thr Ala Ile Glu Val Leu Gly Leu Ser Leu Pro Gly Ser
210 215 220
Ser Ser His Pro Ala Glu Ser Ala Glu Lys Lys Ala Asp Ile Glu Glu
225 230 235 240
Ala Gly Arg Ala Val Val Lys Met Leu Glu Met Gly Leu Lys Pro Ser
245 250 255
Asp Ile Leu Thr Arg Glu Ala Phe Glu Asp Ala Ile Thr Val Thr Met
260 265 270
Ala Leu Gly Gly Ser Thr Asn Ser Thr Leu His Leu Leu Ala Ile Ala
275 280 285
His Ala Ala Asn Val Glu Leu Thr Leu Asp Asp Phe Asn Thr Phe Gln
290 295 300
Glu Lys Val Pro His Leu Ala Asp Leu Lys Pro Ser Gly Gln Tyr Val
305 310 315 320
Phe Gln Asp Leu Tyr Lys Val Gly Gly Val Pro Ala Val Met Lys Tyr
325 330 335
Leu Leu Lys Asn Gly Phe Leu His Gly Asp Arg Ile Thr Cys Thr Gly
340 345 350
Lys Thr Val Ala Glu Asn Leu Lys Ala Phe Asp Asp Leu Thr Pro Gly
355 360 365
Gln Lys Val Ile Met Pro Leu Glu Asn Pro Lys Arg Glu Asp Gly Pro
370 375 380
Leu Ile Ile Leu His Gly Asn Leu Ala Pro Asp Gly Ala Val Ala Lys
385 390 395 400
Val Ser Gly Val Lys Val Arg Arg His Val Gly Pro Ala Lys Val Phe
405 410 415
Asn Ser Glu Glu Glu Ala Ile Glu Ala Val Leu Asn Asp Asp Ile Val
420 425 430
Asp Gly Asp Val Val Val Val Arg Phe Val Gly Pro Lys Gly Gly Pro
435 440 445
Gly Met Pro Glu Met Leu Ser Leu Ser Ser Met Ile Val Gly Lys Gly
450 455 460
Gln Gly Glu Lys Val Ala Leu Leu Thr Asp Gly Arg Phe Ser Gly Gly
465 470 475 480
Thr Tyr Gly Leu Val Val Gly His Ile Ala Pro Glu Ala Gln Asp Gly
485 490 495
Gly Pro Ile Ala Tyr Leu Gln Thr Gly Asp Ile Val Thr Ile Asp Gln
500 505 510
Asp Thr Lys Glu Leu His Phe Asp Ile Ser Asp Glu Glu Leu Lys His
515 520 525
Arg Gln Glu Thr Ile Glu Leu Pro Pro Leu Tyr Ser Arg Gly Ile Leu
530 535 540
Gly Lys Tyr Ala His Ile Val Ser Ser Ala Ser Arg Gly Ala Val Thr
545 550 555 560
Asp Phe Trp Lys Pro Glu Glu Thr Gly Lys Lys
565 570
<210> 117
<211> 548
<212> PRT
<213> Lactococcus lactis
<400> 117
Met Tyr Thr Val Gly Asp Tyr Leu Leu Asp Arg Leu His Glu Leu Gly
1 5 10 15
Ile Glu Glu Ile Phe Gly Val Pro Gly Asp Tyr Asn Leu Gln Phe Leu
20 25 30
Asp Gln Ile Ile Ser His Lys Asp Met Lys Trp Val Gly Asn Ala Asn
35 40 45
Glu Leu Asn Ala Ser Tyr Met Ala Asp Gly Tyr Ala Arg Thr Lys Lys
50 55 60
Ala Ala Ala Phe Leu Thr Thr Phe Gly Val Gly Glu Leu Ser Ala Val
65 70 75 80
Asn Gly Leu Ala Gly Ser Tyr Ala Glu Asn Leu Pro Val Val Glu Ile
85 90 95
Val Gly Ser Pro Thr Ser Lys Val Gln Asn Glu Gly Lys Phe Val His
100 105 110
His Thr Leu Ala Asp Gly Asp Phe Lys His Phe Met Lys Met His Glu
115 120 125
Pro Val Thr Ala Ala Arg Thr Leu Leu Thr Ala Glu Asn Ala Thr Val
130 135 140
Glu Ile Asp Arg Val Leu Ser Ala Leu Leu Lys Glu Arg Lys Pro Val
145 150 155 160
Tyr Ile Asn Leu Pro Val Asp Val Ala Ala Ala Lys Ala Glu Lys Pro
165 170 175
Ser Leu Pro Leu Lys Lys Glu Asn Ser Thr Ser Asn Thr Ser Asp Gln
180 185 190
Glu Ile Leu Asn Lys Ile Gln Glu Ser Leu Lys Asn Ala Lys Lys Pro
195 200 205
Ile Val Ile Thr Gly His Glu Ile Ile Ser Phe Gly Leu Glu Lys Thr
210 215 220
Val Thr Gln Phe Ile Ser Lys Thr Lys Leu Pro Ile Thr Thr Leu Asn
225 230 235 240
Phe Gly Lys Ser Ser Val Asp Glu Ala Leu Pro Ser Phe Leu Gly Ile
245 250 255
Tyr Asn Gly Thr Leu Ser Glu Pro Asn Leu Lys Glu Phe Val Glu Ser
260 265 270
Ala Asp Phe Ile Leu Met Leu Gly Val Lys Leu Thr Asp Ser Ser Thr
275 280 285
Gly Ala Phe Thr His His Leu Asn Glu Asn Lys Met Ile Ser Leu Asn
290 295 300
Ile Asp Glu Gly Lys Ile Phe Asn Glu Arg Ile Gln Asn Phe Asp Phe
305 310 315 320
Glu Ser Leu Ile Ser Ser Leu Leu Asp Leu Ser Glu Ile Glu Tyr Lys
325 330 335
Gly Lys Tyr Ile Asp Lys Lys Gln Glu Asp Phe Val Pro Ser Asn Ala
340 345 350
Leu Leu Ser Gln Asp Arg Leu Trp Gln Ala Val Glu Asn Leu Thr Gln
355 360 365
Ser Asn Glu Thr Ile Val Ala Glu Gln Gly Thr Ser Phe Phe Gly Ala
370 375 380
Ser Ser Ile Phe Leu Lys Ser Lys Ser His Phe Ile Gly Gln Pro Leu
385 390 395 400
Trp Gly Ser Ile Gly Tyr Thr Phe Pro Ala Ala Leu Gly Ser Gln Ile
405 410 415
Ala Asp Lys Glu Ser Arg His Leu Leu Phe Ile Gly Asp Gly Ser Leu
420 425 430
Gln Leu Thr Val Gln Glu Leu Gly Leu Ala Ile Arg Glu Lys Ile Asn
435 440 445
Pro Ile Cys Phe Ile Ile Asn Asn Asp Gly Tyr Thr Val Glu Arg Glu
450 455 460
Ile His Gly Pro Asn Gln Ser Tyr Asn Asp Ile Pro Met Trp Asn Tyr
465 470 475 480
Ser Lys Leu Pro Glu Ser Phe Gly Ala Thr Glu Asp Arg Val Val Ser
485 490 495
Lys Ile Val Arg Thr Glu Asn Glu Phe Val Ser Val Met Lys Glu Ala
500 505 510
Gln Ala Asp Pro Asn Arg Met Tyr Trp Ile Glu Leu Ile Leu Ala Lys
515 520 525
Glu Gly Ala Pro Lys Val Leu Lys Lys Met Gly Lys Leu Phe Ala Glu
530 535 540
Gln Asn Lys Ser
545
<210> 118
<211> 1125
<212> DNA
<213> artificial sequence
<220>
<223> horse ADH coding region codon optimized for S. cerevisiae
expression
<400> 118
atgtcaacag ccggtaaagt tattaagtgt aaagcggcag ttttgtggga agagaaaaag 60
ccgtttagca tagaagaagt agaagtagcg ccaccaaaag cacacgaggt tagaatcaag 120
atggttgcca ccggaatctg tagatccgac gaccatgtgg tgagtggcac tctagttact 180
cctttgccag taatcgcggg acacgaggct gccggaatcg ttgaatccat aggtgaaggt 240
gttaccactg ttcgtcctgg tgataaagtg atcccactgt tcactcctca atgtggtaag 300
tgtagagtct gcaaacatcc tgagggtaat ttctgcctta aaaatgattt gtctatgcct 360
agaggtacta tgcaggatgg tacaagcaga tttacatgca gagggaaacc tatacaccat 420
ttccttggta cttctacatt ttcccaatac acagtggtgg acgagatatc tgtcgctaaa 480
atcgatgcag cttcaccact ggaaaaagtt tgcttgatag ggtgcggatt ttccaccggt 540
tacggttccg cagttaaagt tgcaaaggtt acacagggtt cgacttgtgc agtattcggt 600
ttaggaggag taggactaag cgttattatg gggtgtaaag ctgcaggcgc agcgaggatt 660
ataggtgtag acatcaataa ggacaaattt gcaaaagcta aggaggtcgg ggctactgaa 720
tgtgttaacc ctcaagatta taagaaacca atacaagaag tccttactga aatgtcaaac 780
ggtggagttg atttctcttt tgaagttata ggccgtcttg atactatggt aactgcgttg 840
tcctgctgtc aagaggcata tggagtcagt gtgatcgtag gtgttcctcc tgattcacaa 900
aatttgtcga tgaatcctat gctgttgcta agcggtcgta catggaaggg agctatattt 960
ggcggtttta agagcaagga tagtgttcca aaacttgttg ccgactttat ggcgaagaag 1020
tttgctcttg atcctttaat tacacatgta ttgccattcg agaaaatcaa tgaagggttt 1080
gatttgttaa gaagtggtga atctattcgt acaattttaa ctttt 1125
<210> 119
<211> 375
<212> PRT
<213> Equus caballus
<400> 119
Met Ser Thr Ala Gly Lys Val Ile Lys Cys Lys Ala Ala Val Leu Trp
1 5 10 15
Glu Glu Lys Lys Pro Phe Ser Ile Glu Glu Val Glu Val Ala Pro Pro
20 25 30
Lys Ala His Glu Val Arg Ile Lys Met Val Ala Thr Gly Ile Cys Arg
35 40 45
Ser Asp Asp His Val Val Ser Gly Thr Leu Val Thr Pro Leu Pro Val
50 55 60
Ile Ala Gly His Glu Ala Ala Gly Ile Val Glu Ser Ile Gly Glu Gly
65 70 75 80
Val Thr Thr Val Arg Pro Gly Asp Lys Val Ile Pro Leu Phe Thr Pro
85 90 95
Gln Cys Gly Lys Cys Arg Val Cys Lys His Pro Glu Gly Asn Phe Cys
100 105 110
Leu Lys Asn Asp Leu Ser Met Pro Arg Gly Thr Met Gln Asp Gly Thr
115 120 125
Ser Arg Phe Thr Cys Arg Gly Lys Pro Ile His His Phe Leu Gly Thr
130 135 140
Ser Thr Phe Ser Gln Tyr Thr Val Val Asp Glu Ile Ser Val Ala Lys
145 150 155 160
Ile Asp Ala Ala Ser Pro Leu Glu Lys Val Cys Leu Ile Gly Cys Gly
165 170 175
Phe Ser Thr Gly Tyr Gly Ser Ala Val Lys Val Ala Lys Val Thr Gln
180 185 190
Gly Ser Thr Cys Ala Val Phe Gly Leu Gly Gly Val Gly Leu Ser Val
195 200 205
Ile Met Gly Cys Lys Ala Ala Gly Ala Ala Arg Ile Ile Gly Val Asp
210 215 220
Ile Asn Lys Asp Lys Phe Ala Lys Ala Lys Glu Val Gly Ala Thr Glu
225 230 235 240
Cys Val Asn Pro Gln Asp Tyr Lys Lys Pro Ile Gln Glu Val Leu Thr
245 250 255
Glu Met Ser Asn Gly Gly Val Asp Phe Ser Phe Glu Val Ile Gly Arg
260 265 270
Leu Asp Thr Met Val Thr Ala Leu Ser Cys Cys Gln Glu Ala Tyr Gly
275 280 285
Val Ser Val Ile Val Gly Val Pro Pro Asp Ser Gln Asn Leu Ser Met
290 295 300
Asn Pro Met Leu Leu Leu Ser Gly Arg Thr Trp Lys Gly Ala Ile Phe
305 310 315 320
Gly Gly Phe Lys Ser Lys Asp Ser Val Pro Lys Leu Val Ala Asp Phe
325 330 335
Met Ala Lys Lys Phe Ala Leu Asp Pro Leu Ile Thr His Val Leu Pro
340 345 350
Phe Glu Lys Ile Asn Glu Gly Phe Asp Leu Leu Arg Ser Gly Glu Ser
355 360 365
Ile Arg Thr Ile Leu Thr Phe
370 375
<210> 120
<211> 643
<212> DNA
<213> Saccharomyces cerevisiae
<400> 120
gaaatgaata acaatactga cagtactaaa taattgccta cttggcttca catacgttgc 60
atacgtcgat atagataata atgataatga cagcaggatt atcgtaatac gtaatagttg 120
aaaatctcaa aaatgtgtgg gtcattacgt aaataatgat aggaatggga ttcttctatt 180
tttccttttt ccattctagc agccgtcggg aaaacgtggc atcctctctt tcgggctcaa 240
ttggagtcac gctgccgtga gcatcctctc tttccatatc taacaactga gcacgtaacc 300
aatggaaaag catgagctta gcgttgctcc aaaaaagtat tggatggtta ataccatttg 360
tctgttctct tctgactttg actcctcaaa aaaaaaaaat ctacaatcaa cagatcgctt 420
caattacgcc ctcacaaaaa cttttttcct tcttcttcgc ccacgttaaa ttttatccct 480
catgttgtct aacggatttc tgcacttgat ttattataaa aagacaaaga cataatactt 540
ctctatcaat ttcagttatt gttcttcctt gcgttattct tctgttcttc tttttctttt 600
gtcatatata accataacca agtaatacat attcaaatct aga 643
<210> 121
<211> 9089
<212> DNA
<213> artificial sequence
<220>
<223> constructed plasmid
<400> 121
tcgcgcgttt cggtgatgac ggtgaaaacc tctgacacat gcagctcccg gagacggtca 60
cagcttgtct gtaagcggat gccgggagca gacaagcccg tcagggcgcg tcagcgggtg 120
ttggcgggtg tcggggctgg cttaactatg cggcatcaga gcagattgta ctgagagtgc 180
accataccac agcttttcaa ttcaattcat catttttttt ttattctttt ttttgatttc 240
ggtttctttg aaattttttt gattcggtaa tctccgaaca gaaggaagaa cgaaggaagg 300
agcacagact tagattggta tatatacgca tatgtagtgt tgaagaaaca tgaaattgcc 360
cagtattctt aacccaactg cacagaacaa aaacctgcag gaaacgaaga taaatcatgt 420
cgaaagctac atataaggaa cgtgctgcta ctcatcctag tcctgttgct gccaagctat 480
ttaatatcat gcacgaaaag caaacaaact tgtgtgcttc attggatgtt cgtaccacca 540
aggaattact ggagttagtt gaagcattag gtcccaaaat ttgtttacta aaaacacatg 600
tggatatctt gactgatttt tccatggagg gcacagttaa gccgctaaag gcattatccg 660
ccaagtacaa ttttttactc ttcgaagaca gaaaatttgc tgacattggt aatacagtca 720
aattgcagta ctctgcgggt gtatacagaa tagcagaatg ggcagacatt acgaatgcac 780
acggtgtggt gggcccaggt attgttagcg gtttgaagca ggcggcagaa gaagtaacaa 840
aggaacctag aggccttttg atgttagcag aattgtcatg caagggctcc ctatctactg 900
gagaatatac taagggtact gttgacattg cgaagagcga caaagatttt gttatcggct 960
ttattgctca aagagacatg ggtggaagag atgaaggtta cgattggttg attatgacac 1020
ccggtgtggg tttagatgac aagggagacg cattgggtca acagtataga accgtggatg 1080
atgtggtctc tacaggatct gacattatta ttgttggaag aggactattt gcaaagggaa 1140
gggatgctaa ggtagagggt gaacgttaca gaaaagcagg ctgggaagca tatttgagaa 1200
gatgcggcca gcaaaactaa aaaactgtat tataagtaaa tgcatgtata ctaaactcac 1260
aaattagagc ttcaatttaa ttatatcagt tattacccta tgcggtgtga aataccgcac 1320
agatgcgtaa ggagaaaata ccgcatcagg aaattgtaaa cgttaatatt ttgttaaaat 1380
tcgcgttaaa tttttgttaa atcagctcat tttttaacca ataggccgaa atcggcaaaa 1440
tcccttataa atcaaaagaa tagaccgaga tagggttgag tgttgttcca gtttggaaca 1500
agagtccact attaaagaac gtggactcca acgtcaaagg gcgaaaaacc gtctatcagg 1560
gcgatggccc actacgtgaa ccatcaccct aatcaagttt tttggggtcg aggtgccgta 1620
aagcactaaa tcggaaccct aaagggagcc cccgatttag agcttgacgg ggaaagccgg 1680
cgaacgtggc gagaaaggaa gggaagaaag cgaaaggagc gggcgctagg gcgctggcaa 1740
gtgtagcggt cacgctgcgc gtaaccacca cacccgccgc gcttaatgcg ccgctacagg 1800
gcgcgtcgcg ccattcgcca ttcaggctgc gcaactgttg ggaagggcga tcggtgcggg 1860
cctcttcgct attacgccag ctggcgaaag ggggatgtgc tgcaaggcga ttaagttggg 1920
taacgccagg gttttcccag tcacgacgtt gtaaaacgac ggccagtgag cgcgcgtaat 1980
acgactcact atagggcgaa ttgggtaccg ggccccccct cgaggtcgac tggccattaa 2040
tctttcccat attagatttc gccaagccat gaaagttcaa gaaaggtctt tagacgaatt 2100
acccttcatt tctcaaactg gcgtcaaggg atcctggtat ggttttatcg ttttatttct 2160
ggttcttata gcatcgtttt ggacttctct gttcccatta ggcggttcag gagccagcgc 2220
agaatcattc tttgaaggat acttatcctt tccaattttg attgtctgtt acgttggaca 2280
taaactgtat actagaaatt ggactttgat ggtgaaacta gaagatatgg atcttgatac 2340
cggcagaaaa caagtagatt tgactcttcg tagggaagaa atgaggattg agcgagaaac 2400
attagcaaaa agatccttcg taacaagatt tttacatttc tggtgttgaa gggaaagata 2460
tgagctatac agcggaattt ccatatcact cagattttgt tatctaattt tttccttccc 2520
acgtccgcgg gaatctgtgt atattactgc atctagatat atgttatctt atcttggcgc 2580
gtacatttaa ttttcaacgt attctataag aaattgcggg agtttttttc atgtagatga 2640
tactgactgc acgcaaatat aggcatgatt tataggcatg atttgatggc tgtaccgata 2700
ggaacgctaa gagtaacttc agaatcgtta tcctggcgga aaaaattcat ttgtaaactt 2760
taaaaaaaaa agccaatatc cccaaaatta ttaagagcgc ctccattatt aactaaaatt 2820
tcactcagca tccacaatgt atcaggtatc tactacagat attacatgtg gcgaaaaaga 2880
caagaacaat gcaatagcgc atcaagaaaa aacacaaagc tttcaatcaa tgaatcgaaa 2940
atgtcattaa aatagtatat aaattgaaac taagtcataa agctataaaa agaaaattta 3000
tttaaatgca agatttaaag taaattcacg gccctgcagg ccctaacctg ctaggacaca 3060
acgtctttgc ctggtaaagt ttctagctga cgtgattcct tcacctgtgg atccggcaat 3120
tgtaaaggtt gtgaaaccct cagcttcata accgacacct gcaaatgact ttgcattctt 3180
aacaaagata gttgtatcaa tttcacgttc gaatctatta aggttatcga tgttcttaga 3240
ataaatgtag gcggaatgtt ttctattctg ctcagctatc ttggcgtatt taatggcttc 3300
atcaatgtcc ttcactctaa ctataggcaa aattggcatc atcaactccg tcataacgaa 3360
cggatggttt gcgttgactt cacaaataat acactttaca ttacttggtg actctacatc 3420
tatttcatcc aaaaacagtt tagcgtcctt accaacccac ttcttattaa tgaaatattc 3480
ttgagtttca ttgttctttt gaagaacaag gtctatcagc ttggatactt ggtcttcatt 3540
gataatgacg gcgttgtttt tcaacatgtt agagatcaga tcatctgcaa cgttttcaaa 3600
cacgaacact tctttttccg cgatacaagg aagattgttg tcaaacgaac aaccttcaat 3660
aatgcttctg ccggccttct cgatatctgc tgtatcgtct acaataaccg gaggattacc 3720
cgcgccagct ccgatggcct ttttaccaga attaagaagg gtttttacca tacccgggcc 3780
acccgtaccg cacaacaatt ttatggatgg atgtttgata atagcgtcta aactttccat 3840
agttgggttc tttatagtag tgacaaggtt ttcaggtcca ccacagctaa ttatggcttt 3900
gtttatcatt tctactgcga aagcgacaca ctttttggcg catgggtgac cattaaatac 3960
aactgcattc cccgcagcta tcatacctat agaattgcag ataacggttt ctgttggatt 4020
cgtgcttgga gttatagcgc cgataactcc gtatggactc atttcaacca ctgttagtcc 4080
attatcgccg gaccatgctg ttgttgtcag atcttcagtg cctggggtat acttggccac 4140
taattcatgt ttcaagattt tatcctcata ccttcccatg tgggtttcct ccaggatcat 4200
tgtggctaag acctctttat tctgtaatgc ggcttttctt atttcggtga ttattttctc 4260
tctttgttcc tttgtgtagt gtagggaaag aatcttttgt gcatgtactg cagaagaaat 4320
ggcattctca acattttcaa atactccaaa acatgaagag ttatctttgt aattctttaa 4380
gttgatgttt tcaccattag tcttcacttt caagtctttg gtggttggga ttaaggtatc 4440
tttatccatg gtgtttgttt atgtgtgttt attcgaaact aagttcttgg tgttttaaaa 4500
ctaaaaaaaa gactaactat aaaagtagaa tttaagaagt ttaagaaata gatttacaga 4560
attacaatca atacctaccg tctttatata cttattagtc aagtagggga ataatttcag 4620
ggaactggtt tcaacctttt ttttcagctt tttccaaatc agagagagca gaaggtaata 4680
gaaggtgtaa gaaaatgaga tagatacatg cgtgggtcaa ttgccttgtg tcatcattta 4740
ctccaggcag gttgcatcac tccattgagg ttgtgcccgt tttttgcctg tttgtgcccc 4800
tgttctctgt agttgcgcta agagaatgga cctatgaact gatggttggt gaagaaaaca 4860
atattttggt gctgggattc tttttttttc tggatgccag cttaaaaagc gggctccatt 4920
atatttagtg gatgccagga ataaactgtt cacccagaca cctacgatgt tatatattct 4980
gtgtaacccg ccccctattt tgggcatgta cgggttacag cagaattaaa aggctaattt 5040
tttgactaaa taaagttagg aaaatcacta ctattaatta tttacgtatt ctttgaaatg 5100
gcagtattga taatgataaa ctcgaactga aaaagcgtgt tttttattca aaatgattct 5160
aactccctta cgtaatcaag gaatcttttt gccttggcct ccgcgtcatt aaacttcttg 5220
ttgttgacgc taacattcaa cgctagtata tattcgtttt tttcaggtaa gttcttttca 5280
acgggtctta ctgatgaggc agtcgcgtct gaacctgtta agaggtcaaa tatgtcttct 5340
tgaccgtacg tgtcttgcat gttattagct ttgggaattt gcatcaagtc ataggaaaat 5400
ttaaatcttg gctctcttgg gctcaaggtg acaaggtcct cgaaaatagg gcgcgcccca 5460
ccgcggtgga gctccagctt ttgttccctt tagtgagggt taattgcgcg cttggcgtaa 5520
tcatggtcat agctgtttcc tgtgtgaaat tgttatccgc tcacaattcc acacaacata 5580
ggagccggaa gcataaagtg taaagcctgg ggtgcctaat gagtgaggta actcacatta 5640
attgcgttgc gctcactgcc cgctttccag tcgggaaacc tgtcgtgcca gctgcattaa 5700
tgaatcggcc aacgcgcggg gagaggcggt ttgcgtattg ggcgctcttc cgcttcctcg 5760
ctcactgact cgctgcgctc ggtcgttcgg ctgcggcgag cggtatcagc tcactcaaag 5820
gcggtaatac ggttatccac agaatcaggg gataacgcag gaaagaacat gtgagcaaaa 5880
ggccagcaaa aggccaggaa ccgtaaaaag gccgcgttgc tggcgttttt ccataggctc 5940
cgcccccctg acgagcatca caaaaatcga cgctcaagtc agaggtggcg aaacccgaca 6000
ggactataaa gataccaggc gtttccccct ggaagctccc tcgtgcgctc tcctgttccg 6060
accctgccgc ttaccggata cctgtccgcc tttctccctt cgggaagcgt ggcgctttct 6120
catagctcac gctgtaggta tctcagttcg gtgtaggtcg ttcgctccaa gctgggctgt 6180
gtgcacgaac cccccgttca gcccgaccgc tgcgccttat ccggtaacta tcgtcttgag 6240
tccaacccgg taagacacga cttatcgcca ctggcagcag ccactggtaa caggattagc 6300
agagcgaggt atgtaggcgg tgctacagag ttcttgaagt ggtggcctaa ctacggctac 6360
actagaagga cagtatttgg tatctgcgct ctgctgaagc cagttacctt cggaaaaaga 6420
gttggtagct cttgatccgg caaacaaacc accgctggta gcggtggttt ttttgtttgc 6480
aagcagcaga ttacgcgcag aaaaaaagga tctcaagaag atcctttgat cttttctacg 6540
gggtctgacg ctcagtggaa cgaaaactca cgttaaggga ttttggtcat gagattatca 6600
aaaaggatct tcacctagat ccttttaaat taaaaatgaa gttttaaatc aatctaaagt 6660
atatatgagt aaacttggtc tgacagttac caatgcttaa tcagtgaggc acctatctca 6720
gcgatctgtc tatttcgttc atccatagtt gcctgactcc ccgtcgtgta gataactacg 6780
atacgggagg gcttaccatc tggccccagt gctgcaatga taccgcgaga cccacgctca 6840
ccggctccag atttatcagc aataaaccag ccagccggaa gggccgagcg cagaagtggt 6900
cctgcaactt tatccgcctc catccagtct attaattgtt gccgggaagc tagagtaagt 6960
agttcgccag ttaatagttt gcgcaacgtt gttgccattg ctacaggcat cgtggtgtca 7020
cgctcgtcgt ttggtatggc ttcattcagc tccggttccc aacgatcaag gcgagttaca 7080
tgatccccca tgttgtgcaa aaaagcggtt agctccttcg gtcctccgat cgttgtcaga 7140
agtaagttgg ccgcagtgtt atcactcatg gttatggcag cactgcataa ttctcttact 7200
gtcatgccat ccgtaagatg cttttctgtg actggtgagt actcaaccaa gtcattctga 7260
gaatagtgta tgcggcgacc gagttgctct tgcccggcgt caatacggga taataccgcg 7320
ccacatagca gaactttaaa agtgctcatc attggaaaac gttcttcggg gcgaaaactc 7380
tcaaggatct taccgctgtt gagatccagt tcgatgtaac ccactcgtgc acccaactga 7440
tcttcagcat cttttacttt caccagcgtt tctgggtgag caaaaacagg aaggcaaaat 7500
gccgcaaaaa agggaataag ggcgacacgg aaatgttgaa tactcatact cttccttttt 7560
caatattatt gaagcattta tcagggttat tgtctcatga gcggatacat atttgaatgt 7620
atttagaaaa ataaacaaat aggggttccg cgcacatttc cccgaaaagt gccacctgaa 7680
cgaagcatct gtgcttcatt ttgtagaaca aaaatgcaac gcgagagcgc taatttttca 7740
aacaaagaat ctgagctgca tttttacaga acagaaatgc aacgcgaaag cgctatttta 7800
ccaacgaaga atctgtgctt catttttgta aaacaaaaat gcaacgcgag agcgctaatt 7860
tttcaaacaa agaatctgag ctgcattttt acagaacaga aatgcaacgc gagagcgcta 7920
ttttaccaac aaagaatcta tacttctttt ttgttctaca aaaatgcatc ccgagagcgc 7980
tatttttcta acaaagcatc ttagattact ttttttctcc tttgtgcgct ctataatgca 8040
gtctcttgat aactttttgc actgtaggtc cgttaaggtt agaagaaggc tactttggtg 8100
tctattttct cttccataaa aaaagcctga ctccacttcc cgcgtttact gattactagc 8160
gaagctgcgg gtgcattttt tcaagataaa ggcatccccg attatattct ataccgatgt 8220
ggattgcgca tactttgtga acagaaagtg atagcgttga tgattcttca ttggtcagaa 8280
aattatgaac ggtttcttct attttgtctc tatatactac gtataggaaa tgtttacatt 8340
ttcgtattgt tttcgattca ctctatgaat agttcttact acaatttttt tgtctaaaga 8400
gtaatactag agataaacat aaaaaatgta gaggtcgagt ttagatgcaa gttcaaggag 8460
cgaaaggtgg atgggtaggt tatataggga tatagcacag agatatatag caaagagata 8520
cttttgagca atgtttgtgg aagcggtatt cgcaatattt tagtagctcg ttacagtccg 8580
gtgcgttttt ggttttttga aagtgcgtct tcagagcgct tttggttttc aaaagcgctc 8640
tgaagttcct atactttcta gagaatagga acttcggaat aggaacttca aagcgtttcc 8700
gaaaacgagc gcttccgaaa atgcaacgcg agctgcgcac atacagctca ctgttcacgt 8760
cgcacctata tctgcgtgtt gcctgtatat atatatacat gagaagaacg gcatagtgcg 8820
tgtttatgct taaatgcgta cttatatgcg tctatttatg taggatgaaa ggtagtctag 8880
tacctcctgt gatattatcc cattccatgc ggggtatcgt atgcttcctt cagcactacc 8940
ctttagctgt tctatatgct gccactcctc aattggatta gtctcatcct tcaatgctat 9000
catttccttt gatattggat catactaaga aaccattatt atcatgacat taacctataa 9060
aaataggcgt atcacgaggc cctttcgtc 9089
<210> 122
<211> 1023
<212> DNA
<213> Saccharomyces cerevisiae
<400> 122
caccgcggtg gggcgcgccc tattttcgag gaccttgtca ccttgagccc aagagagcca 60
agatttaaat tttcctatga cttgatgcaa attcccaaag ctaataacat gcaagacacg 120
tacggtcaag aagacatatt tgacctctta acaggttcag acgcgactgc ctcatcagta 180
agacccgttg aaaagaactt acctgaaaaa aacgaatata tactagcgtt gaatgttagc 240
gtcaacaaca agaagtttaa tgacgcggag gccaaggcaa aaagattcct tgattacgta 300
agggagttag aatcattttg aataaaaaac acgctttttc agttcgagtt tatcattatc 360
aatactgcca tttcaaagaa tacgtaaata attaatagta gtgattttcc taactttatt 420
tagtcaaaaa attagccttt taattctgct gtaacccgta catgcccaaa atagggggcg 480
ggttacacag aatatataac atcgtaggtg tctgggtgaa cagtttattc ctggcatcca 540
ctaaatataa tggagcccgc tttttaagct ggcatccaga aaaaaaaaga atcccagcac 600
caaaatattg ttttcttcac caaccatcag ttcataggtc cattctctta gcgcaactac 660
agagaacagg ggcacaaaca ggcaaaaaac gggcacaacc tcaatggagt gatgcaacct 720
gcctggagta aatgatgaca caaggcaatt gacccacgca tgtatctatc tcattttctt 780
acaccttcta ttaccttctg ctctctctga tttggaaaaa gctgaaaaaa aaggttgaaa 840
ccagttccct gaaattattc ccctacttga ctaataagta tataaagacg gtaggtattg 900
attgtaattc tgtaaatcta tttcttaaac ttcttaaatt ctacttttat agttagtctt 960
ttttttagtt ttaaaacacc aagaacttag tttcgaataa acacacataa actagtaaac 1020
aaa 1023
<210> 123
<211> 21
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 123
caaaagctga gctccaccgc g 21
<210> 124
<211> 44
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 124
gtttactagt ttatgtgtgt ttattcgaaa ctaagttctt ggtg 44
<210> 125
<400> 125
000
<210> 126
<211> 39
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 126
cacacatatt acaatagcta gctgaggatg aaagctctg 39
<210> 127
<211> 39
<212> DNA
<213> artificial sequence
<220>
<223> primer
<400> 127
cagagctttc atcctcagct agctattgta atatgtgtg 39
<210> 128
<211> 9491
<212> DNA
<213> artificial sequence
<220>
<223> constructed plasmid
<400> 128
tcgcgcgttt cggtgatgac ggtgaaaacc tctgacacat gcagctcccg gagacggtca 60
cagcttgtct gtaagcggat gccgggagca gacaagcccg tcagggcgcg tcagcgggtg 120
ttggcgggtg tcggggctgg cttaactatg cggcatcaga gcagattgta ctgagagtgc 180
accataaatt cccgttttaa gagcttggtg agcgctagga gtcactgcca ggtatcgttt 240
gaacacggca ttagtcaggg aagtcataac acagtccttt cccgcaattt tctttttcta 300
ttactcttgg cctcctctag tacactctat atttttttat gcctcggtaa tgattttcat 360
tttttttttt cccctagcgg atgactcttt ttttttctta gcgattggca ttatcacata 420
atgaattata cattatataa agtaatgtga tttcttcgaa gaatatacta aaaaatgagc 480
aggcaagata aacgaaggca aagatgacag agcagaaagc cctagtaaag cgtattacaa 540
atgaaaccaa gattcagatt gcgatctctt taaagggtgg tcccctagcg atagagcact 600
cgatcttccc agaaaaagag gcagaagcag tagcagaaca ggccacacaa tcgcaagtga 660
ttaacgtcca cacaggtata gggtttctgg accatatgat acatgctctg gccaagcatt 720
ccggctggtc gctaatcgtt gagtgcattg gtgacttaca catagacgac catcacacca 780
ctgaagactg cgggattgct ctcggtcaag cttttaaaga ggccctactg gcgcgtggag 840
taaaaaggtt tggatcagga tttgcgcctt tggatgaggc actttccaga gcggtggtag 900
atctttcgaa caggccgtac gcagttgtcg aacttggttt gcaaagggag aaagtaggag 960
atctctcttg cgagatgatc ccgcattttc ttgaaagctt tgcagaggct agcagaatta 1020
ccctccacgt tgattgtctg cgaggcaaga atgatcatca ccgtagtgag agtgcgttca 1080
aggctcttgc ggttgccata agagaagcca cctcgcccaa tggtaccaac gatgttccct 1140
ccaccaaagg tgttcttatg tagtgacacc gattatttaa agctgcagca tacgatatat 1200
atacatgtgt atatatgtat acctatgaat gtcagtaagt atgtatacga acagtatgat 1260
actgaagatg acaaggtaat gcatcattct atacgtgtca ttctgaacga ggcgcgcttt 1320
ccttttttct ttttgctttt tctttttttt tctcttgaac tcgacggatc tatgcggtgt 1380
gaaataccgc acagatgcgt aaggagaaaa taccgcatca ggaaattgta aacgttaata 1440
ttttgttaaa attcgcgtta aatttttgtt aaatcagctc attttttaac caataggccg 1500
aaatcggcaa aatcccttat aaatcaaaag aatagaccga gatagggttg agtgttgttc 1560
cagtttggaa caagagtcca ctattaaaga acgtggactc caacgtcaaa gggcgaaaaa 1620
ccgtctatca gggcgatggc ccactacgtg aaccatcacc ctaatcaagt tttttggggt 1680
cgaggtgccg taaagcacta aatcggaacc ctaaagggag cccccgattt agagcttgac 1740
ggggaaagcc ggcgaacgtg gcgagaaagg aagggaagaa agcgaaagga gcgggcgcta 1800
gggcgctggc aagtgtagcg gtcacgctgc gcgtaaccac cacacccgcc gcgcttaatg 1860
cgccgctaca gggcgcgtcg cgccattcgc cattcaggct gcgcaactgt tgggaagggc 1920
gatcggtgcg ggcctcttcg ctattacgcc agctggcgaa agggggatgt gctgcaaggc 1980
gattaagttg ggtaacgcca gggttttccc agtcacgacg ttgtaaaacg acggccagtg 2040
agcgcgcgta atacgactca ctatagggcg aattgggtac cgggcccccc ctcgaggtcg 2100
acggcgcgcc actggtagag agcgactttg tatgccccaa ttgcgaaacc cgcgatatcc 2160
ttctcgattc tttagtaccc gaccaggaca aggaaaagga ggtcgaaacg tttttgaaga 2220
aacaagagga actacacgga agctctaaag atggcaacca gccagaaact aagaaaatga 2280
agttgatgga tccaactggc accgctggct tgaacaacaa taccagcctt ccaacttctg 2340
taaataacgg cggtacgcca gtgccaccag taccgttacc tttcggtata cctcctttcc 2400
ccatgtttcc aatgcccttc atgcctccaa cggctactat cacaaatcct catcaagctg 2460
acgcaagccc taagaaatga ataacaatac tgacagtact aaataattgc ctacttggct 2520
tcacatacgt tgcatacgtc gatatagata ataatgataa tgacagcagg attatcgtaa 2580
tacgtaatag ttgaaaatct caaaaatgtg tgggtcatta cgtaaataat gataggaatg 2640
ggattcttct atttttcctt tttccattct agcagccgtc gggaaaacgt ggcatcctct 2700
ctttcgggct caattggagt cacgctgccg tgagcatcct ctctttccat atctaacaac 2760
tgagcacgta accaatggaa aagcatgagc ttagcgttgc tccaaaaaag tattggatgg 2820
ttaataccat ttgtctgttc tcttctgact ttgactcctc aaaaaaaaaa aatctacaat 2880
caacagatcg cttcaattac gccctcacaa aaactttttt ccttcttctt cgcccacgtt 2940
aaattttatc cctcatgttg tctaacggat ttctgcactt gatttattat aaaaagacaa 3000
agacataata cttctctatc aatttcagtt attgttcttc cttgcgttat tcttctgttc 3060
ttctttttct tttgtcatat ataaccataa ccaagtaata catattcaaa ctagtatgac 3120
tgacaaaaaa actcttaaag acttaagaaa tcgtagttct gtttacgatt caatggttaa 3180
atcacctaat cgtgctatgt tgcgtgcaac tggtatgcaa gatgaagact ttgaaaaacc 3240
tatcgtcggt gtcatttcaa cttgggctga aaacacacct tgtaatatcc acttacatga 3300
ctttggtaaa ctagccaaag tcggtgttaa ggaagctggt gcttggccag ttcagttcgg 3360
aacaatcacg gtttctgatg gaatcgccat gggaacccaa ggaatgcgtt tctccttgac 3420
atctcgtgat attattgcag attctattga agcagccatg ggaggtcata atgcggatgc 3480
ttttgtagcc attggcggtt gtgataaaaa catgcccggt tctgttatcg ctatggctaa 3540
catggatatc ccagccattt ttgcttacgg cggaacaatt gcacctggta atttagacgg 3600
caaagatatc gatttagtct ctgtctttga aggtgtcggc cattggaacc acggcgatat 3660
gaccaaagaa gaagttaaag ctttggaatg taatgcttgt cccggtcctg gaggctgcgg 3720
tggtatgtat actgctaaca caatggcgac agctattgaa gttttgggac ttagccttcc 3780
gggttcatct tctcacccgg ctgaatccgc agaaaagaaa gcagatattg aagaagctgg 3840
tcgcgctgtt gtcaaaatgc tcgaaatggg cttaaaacct tctgacattt taacgcgtga 3900
agcttttgaa gatgctatta ctgtaactat ggctctggga ggttcaacca actcaaccct 3960
tcacctctta gctattgccc atgctgctaa tgtggaattg acacttgatg atttcaatac 4020
tttccaagaa aaagttcctc atttggctga tttgaaacct tctggtcaat atgtattcca 4080
agacctttac aaggtcggag gggtaccagc agttatgaaa tatctcctta aaaatggctt 4140
ccttcatggt gaccgtatca cttgtactgg caaaacagtc gctgaaaatt tgaaggcttt 4200
tgatgattta acacctggtc aaaaggttat tatgccgctt gaaaatccta aacgtgaaga 4260
tggtccgctc attattctcc atggtaactt ggctccagac ggtgccgttg ccaaagtttc 4320
tggtgtaaaa gtgcgtcgtc atgtcggtcc tgctaaggtc tttaattctg aagaagaagc 4380
cattgaagct gtcttgaatg atgatattgt tgatggtgat gttgttgtcg tacgttttgt 4440
aggaccaaag ggcggtcctg gtatgcctga aatgctttcc ctttcatcaa tgattgttgg 4500
taaagggcaa ggtgaaaaag ttgcccttct gacagatggc cgcttctcag gtggtactta 4560
tggtcttgtc gtgggtcata tcgctcctga agcacaagat ggcggtccaa tcgcctacct 4620
gcaaacagga gacatagtca ctattgacca agacactaag gaattacact ttgatatctc 4680
cgatgaagag ttaaaacatc gtcaagagac cattgaattg ccaccgctct attcacgcgg 4740
tatccttggt aaatatgctc acatcgtttc gtctgcttct aggggagccg taacagactt 4800
ttggaagcct gaagaaactg gcaaaaaatg ttgtcctggt tgctgtggtt aagcggccgc 4860
gttaattcaa attaattgat atagtttttt aatgagtatt gaatctgttt agaaataatg 4920
gaatattatt tttatttatt tatttatatt attggtcggc tcttttcttc tgaaggtcaa 4980
tgacaaaatg atatgaagga aataatgatt tctaaaattt tacaacgtaa gatattttta 5040
caaaagccta gctcatcttt tgtcatgcac tattttactc acgcttgaaa ttaacggcca 5100
gtccactgcg gagtcatttc aaagtcatcc taatcgatct atcgtttttg atagctcatt 5160
ttggagttcg cgattgtctt ctgttattca caactgtttt aatttttatt tcattctgga 5220
actcttcgag ttctttgtaa agtctttcat agtagcttac tttatcctcc aacatattta 5280
acttcatgtc aatttcggct cttaaatttt ccacatcatc aagttcaaca tcatctttta 5340
acttgaattt attctctagc tcttccaacc aagcctcatt gctccttgat ttactggtga 5400
aaagtgatac actttgcgcg caatccaggt caaaactttc ctgcaaagaa ttcaccaatt 5460
tctcgacatc atagtacaat ttgttttgtt ctcccatcac aatttaatat acctgatgga 5520
ttcttatgaa gcgctgggta atggacgtgt cactctactt cgcctttttc cctactcctt 5580
ttagtacgga agacaatgct aataaataag agggtaataa taatattatt aatcggcaaa 5640
aaagattaaa cgccaagcgt ttaattatca gaaagcaaac gtcgtaccaa tccttgaatg 5700
cttcccaatt gtatattaag agtcatcaca gcaacatatt cttgttatta aattaattat 5760
tattgatttt tgatattgta taaaaaaacc aaatatgtat aaaaaaagtg aataaaaaat 5820
accaagtatg gagaaatata ttagaagtct atacgttaaa ccaccgcggt ggagctccag 5880
cttttgttcc ctttagtgag ggttaattgc gcgcttggcg taatcatggt catagctgtt 5940
tcctgtgtga aattgttatc cgctcacaat tccacacaac ataggagccg gaagcataaa 6000
gtgtaaagcc tggggtgcct aatgagtgag gtaactcaca ttaattgcgt tgcgctcact 6060
gcccgctttc cagtcgggaa acctgtcgtg ccagctgcat taatgaatcg gccaacgcgc 6120
ggggagaggc ggtttgcgta ttgggcgctc ttccgcttcc tcgctcactg actcgctgcg 6180
ctcggtcgtt cggctgcggc gagcggtatc agctcactca aaggcggtaa tacggttatc 6240
cacagaatca ggggataacg caggaaagaa catgtgagca aaaggccagc aaaaggccag 6300
gaaccgtaaa aaggccgcgt tgctggcgtt tttccatagg ctccgccccc ctgacgagca 6360
tcacaaaaat cgacgctcaa gtcagaggtg gcgaaacccg acaggactat aaagatacca 6420
ggcgtttccc cctggaagct ccctcgtgcg ctctcctgtt ccgaccctgc cgcttaccgg 6480
atacctgtcc gcctttctcc cttcgggaag cgtggcgctt tctcatagct cacgctgtag 6540
gtatctcagt tcggtgtagg tcgttcgctc caagctgggc tgtgtgcacg aaccccccgt 6600
tcagcccgac cgctgcgcct tatccggtaa ctatcgtctt gagtccaacc cggtaagaca 6660
cgacttatcg ccactggcag cagccactgg taacaggatt agcagagcga ggtatgtagg 6720
cggtgctaca gagttcttga agtggtggcc taactacggc tacactagaa ggacagtatt 6780
tggtatctgc gctctgctga agccagttac cttcggaaaa agagttggta gctcttgatc 6840
cggcaaacaa accaccgctg gtagcggtgg tttttttgtt tgcaagcagc agattacgcg 6900
cagaaaaaaa ggatctcaag aagatccttt gatcttttct acggggtctg acgctcagtg 6960
gaacgaaaac tcacgttaag ggattttggt catgagatta tcaaaaagga tcttcaccta 7020
gatcctttta aattaaaaat gaagttttaa atcaatctaa agtatatatg agtaaacttg 7080
gtctgacagt taccaatgct taatcagtga ggcacctatc tcagcgatct gtctatttcg 7140
ttcatccata gttgcctgac tccccgtcgt gtagataact acgatacggg agggcttacc 7200
atctggcccc agtgctgcaa tgataccgcg agacccacgc tcaccggctc cagatttatc 7260
agcaataaac cagccagccg gaagggccga gcgcagaagt ggtcctgcaa ctttatccgc 7320
ctccatccag tctattaatt gttgccggga agctagagta agtagttcgc cagttaatag 7380
tttgcgcaac gttgttgcca ttgctacagg catcgtggtg tcacgctcgt cgtttggtat 7440
ggcttcattc agctccggtt cccaacgatc aaggcgagtt acatgatccc ccatgttgtg 7500
caaaaaagcg gttagctcct tcggtcctcc gatcgttgtc agaagtaagt tggccgcagt 7560
gttatcactc atggttatgg cagcactgca taattctctt actgtcatgc catccgtaag 7620
atgcttttct gtgactggtg agtactcaac caagtcattc tgagaatagt gtatgcggcg 7680
accgagttgc tcttgcccgg cgtcaatacg ggataatacc gcgccacata gcagaacttt 7740
aaaagtgctc atcattggaa aacgttcttc ggggcgaaaa ctctcaagga tcttaccgct 7800
gttgagatcc agttcgatgt aacccactcg tgcacccaac tgatcttcag catcttttac 7860
tttcaccagc gtttctgggt gagcaaaaac aggaaggcaa aatgccgcaa aaaagggaat 7920
aagggcgaca cggaaatgtt gaatactcat actcttcctt tttcaatatt attgaagcat 7980
ttatcagggt tattgtctca tgagcggata catatttgaa tgtatttaga aaaataaaca 8040
aataggggtt ccgcgcacat ttccccgaaa agtgccacct gaacgaagca tctgtgcttc 8100
attttgtaga acaaaaatgc aacgcgagag cgctaatttt tcaaacaaag aatctgagct 8160
gcatttttac agaacagaaa tgcaacgcga aagcgctatt ttaccaacga agaatctgtg 8220
cttcattttt gtaaaacaaa aatgcaacgc gagagcgcta atttttcaaa caaagaatct 8280
gagctgcatt tttacagaac agaaatgcaa cgcgagagcg ctattttacc aacaaagaat 8340
ctatacttct tttttgttct acaaaaatgc atcccgagag cgctattttt ctaacaaagc 8400
atcttagatt actttttttc tcctttgtgc gctctataat gcagtctctt gataactttt 8460
tgcactgtag gtccgttaag gttagaagaa ggctactttg gtgtctattt tctcttccat 8520
aaaaaaagcc tgactccact tcccgcgttt actgattact agcgaagctg cgggtgcatt 8580
ttttcaagat aaaggcatcc ccgattatat tctataccga tgtggattgc gcatactttg 8640
tgaacagaaa gtgatagcgt tgatgattct tcattggtca gaaaattatg aacggtttct 8700
tctattttgt ctctatatac tacgtatagg aaatgtttac attttcgtat tgttttcgat 8760
tcactctatg aatagttctt actacaattt ttttgtctaa agagtaatac tagagataaa 8820
cataaaaaat gtagaggtcg agtttagatg caagttcaag gagcgaaagg tggatgggta 8880
ggttatatag ggatatagca cagagatata tagcaaagag atacttttga gcaatgtttg 8940
tggaagcggt attcgcaata ttttagtagc tcgttacagt ccggtgcgtt tttggttttt 9000
tgaaagtgcg tcttcagagc gcttttggtt ttcaaaagcg ctctgaagtt cctatacttt 9060
ctagagaata ggaacttcgg aataggaact tcaaagcgtt tccgaaaacg agcgcttccg 9120
aaaatgcaac gcgagctgcg cacatacagc tcactgttca cgtcgcacct atatctgcgt 9180
gttgcctgta tatatatata catgagaaga acggcatagt gcgtgtttat gcttaaatgc 9240
gtacttatat gcgtctattt atgtaggatg aaaggtagtc tagtacctcc tgtgatatta 9300
tcccattcca tgcggggtat cgtatgcttc cttcagcact accctttagc tgttctatat 9360
gctgccactc ctcaattgga ttagtctcat ccttcaatgc tatcatttcc tttgatattg 9420
gatcatctaa gaaaccatta ttatcatgac attaacctat aaaaataggc gtatcacgag 9480
gccctttcgt c 9491
<210> 129
<211> 1000
<212> DNA
<213> Saccharymoces cerevisiae
<400> 129
gttaattcaa attaattgat atagtttttt aatgagtatt gaatctgttt agaaataatg 60
gaatattatt tttatttatt tatttatatt attggtcggc tcttttcttc tgaaggtcaa 120
tgacaaaatg atatgaagga aataatgatt tctaaaattt tacaacgtaa gatattttta 180
caaaagccta gctcatcttt tgtcatgcac tattttactc acgcttgaaa ttaacggcca 240
gtccactgcg gagtcatttc aaagtcatcc taatcgatct atcgtttttg atagctcatt 300
ttggagttcg cgattgtctt ctgttattca caactgtttt aatttttatt tcattctgga 360
actcttcgag ttctttgtaa agtctttcat agtagcttac tttatcctcc aacatattta 420
acttcatgtc aatttcggct cttaaatttt ccacatcatc aagttcaaca tcatctttta 480
acttgaattt attctctagc tcttccaacc aagcctcatt gctccttgat ttactggtga 540
aaagtgatac actttgcgcg caatccaggt caaaactttc ctgcaaagaa ttcaccaatt 600
tctcgacatc atagtacaat ttgttttgtt ctcccatcac aatttaatat acctgatgga 660
ttcttatgaa gcgctgggta atggacgtgt cactctactt cgcctttttc cctactcctt 720
ttagtacgga agacaatgct aataaataag agggtaataa taatattatt aatcggcaaa 780
aaagattaaa cgccaagcgt ttaattatca gaaagcaaac gtcgtaccaa tccttgaatg 840
cttcccaatt gtatattaag agtcatcaca gcaacatatt cttgttatta aattaattat 900
tattgatttt tgatattgta taaaaaaacc aaatatgtat aaaaaaagtg aataaaaaat 960
accaagtatg gagaaatata ttagaagtct atacgttaaa 1000
<210> 130
<211> 16387
<212> DNA
<213> Artificial sequence
<220>
<223> Plasmid
<400> 130
gatcctctag tttctcggta ctatgcatat gatccaatat caaaggaaat gatagcattg 60
aaggatgaga ctaatccaat tgaggagtgg cagcatatag aacagctaaa gggtagtgct 120
gaaggaagca tacgataccc cgcatggaat gggataatat cacaggaggt actagactac 180
ctttcatcct acataaatag acgcatataa gtacgcattt aagcataaac acgcactatg 240
ccgttcttct catgtatata tatatacagg caacacgcag atataggtgc gacgtgaaca 300
gtgagctgta tgtgcgcagc tcgcgttgca ttttcggaag cgctcgtttt cggaaacgct 360
ttgaagttcc tattccgaag ttcctattct ctagaaagta taggaacttc agagcgcttt 420
tgaaaaccaa aagcgctctg aagacgcact ttcaaaaaac caaaaacgca ccggactgta 480
acgagctact aaaatattgc gaataccgct tccacaaaca ttgctcaaaa gtatctcttt 540
gctatatatc tctgtgctat atccctatat aacctaccca tccacctttc gctccttgaa 600
cttgcatcta aactcgacct ctacattttt tatgtttatc tctagtatta ctctttagac 660
aaaaaaattg tagtaagaac tattcataga gtgaatcgaa aacaatacga aaatgtaaac 720
atttcctata cgtagtatat agagacaaaa tagaagaaac cgttcataat tttctgacca 780
atgaagaatc atcaacgcta tcactttctg ttcacaaagt atgcgcaatc cacatcggta 840
tagaatataa tcggggatgc ctttatcttg aaaaaatgca cccgcagctt cgctagtaat 900
cagtaaacgc gggaagtgga gtcaggcttt ttttatggaa gagaaaatag acaccaaagt 960
agccttcttc taaccttaac ggacctacag tgcaaaaagt tatcaagaga ctgcattata 1020
gagcgcacaa aggagaaaaa aagtaatcta agatgctttg ttagaaaaat agcgctctcg 1080
ggatgcattt ttgtagaaca aaaaagaagt atagattctt tgttggtaaa atagcgctct 1140
cgcgttgcat ttctgttctg taaaaatgca gctcagattc tttgtttgaa aaattagcgc 1200
tctcgcgttg catttttgtt ttacaaaaat gaagcacaga ttcttcgttg gtaaaatagc 1260
gctttcgcgt tgcatttctg ttctgtaaaa atgcagctca gattctttgt ttgaaaaatt 1320
agcgctctcg cgttgcattt ttgttctaca aaatgaagca cagatgcttc gttaacaaag 1380
atatgctatt gaagtgcaag atggaaacgc agaaaatgaa ccggggatgc gacgtgcaag 1440
attacctatg caatagatgc aatagtttct ccaggaaccg aaatacatac attgtcttcc 1500
gtaaagcgct agactatata ttattataca ggttcaaata tactatctgt ttcagggaaa 1560
actcccaggt tcggatgttc aaaattcaat gatgggtaac aagtacgatc gtaaatctgt 1620
aaaacagttt gtcggatatt aggctgtatc tcctcaaagc gtattcgaat atcattgaga 1680
agctgcattt tttttttttt tttttttttt tttttttata tatatttcaa ggatatacca 1740
ttgtaatgtc tgcccctaag aagatcgtcg ttttgccagg tgaccacgtt ggtcaagaaa 1800
tcacagccga agccattaag gttcttaaag ctatttctga tgttcgttcc aatgtcaagt 1860
tcgatttcga aaatcattta attggtggtg ctgctatcga tgctacaggt gttccacttc 1920
cagatgaggc gctggaagcc tccaagaagg ctgatgccgt tttgttaggt gctgtgggtg 1980
gtcctaaatg gggtaccggt agtgttagac ctgaacaagg tttactaaaa atccgtaaag 2040
aacttcaatt gtacgccaac ttaagaccat gtaactttgc atccgactct cttttagact 2100
tatctccaat caagccacaa tttgctaaag gtactgactt cgttgttgtt agagaattag 2160
tgggaggtat ttactttggt aagagaaagg aagacgatgg tgatggtgtc gcttgggata 2220
gtgaacaata caccgttcca gaagtgcaaa gaatcacaag aatggccgct ttcatggccc 2280
tacaacatga gccaccattg cctatttggt ccttggataa agctaatgtt ttggcctctt 2340
caagattatg gagaaaaact gtggaggaaa ccatcaagaa cgaattccct acattgaaag 2400
ttcaacatca attgattgat tctgccgcca tgatcctagt taagaaccca acccacctaa 2460
atggtattat aatcaccagc aacatgtttg gtgatatcat ctccgatgaa gcctccgtta 2520
tcccaggctc cttgggtttg ttgccatctg cgtccttggc ctctttgcca gacaagaaca 2580
ccgcatttgg tttgtacgaa ccatgccatg gttccgctcc agatttgcca aagaataagg 2640
tcaaccctat cgccactatc ttgtctgctg caatgatgtt gaaattgtca ttgaacttgc 2700
ctgaagaagg taaagccatt gaagatgcag ttaaaaaggt tttggatgca ggtatcagaa 2760
ctggtgattt aggtggttcc aacagtacca ccgaagtcgg tgatgctgtc gccgaagaag 2820
ttaagaaaat ccttgcttaa aaagattctc tttttttatg atatttgtac aaaaaaaaaa 2880
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aatgcagcgt cacatcggat 2940
aataatgatg gcagccattg tagaagtgcc ttttgcattt ctagtctctt tctcggtcta 3000
gctagtttta ctacatcgcg aagatagaat cttagatcac actgcctttg ctgagctgga 3060
tcaatagagt aacaaaagag tggtaaggcc tcgttaaagg acaaggacct gagcggaagt 3120
gtatcgtaca gtagacggag tatactagag tcgacctgca ggcatgcaag cttttcaatt 3180
catcattttt tttttattct tttttttgat ttcggtttcc ttgaaatttt tttgattcgg 3240
taatctccga acagaaggaa gaacgaagga aggagcacag acttagattg gtatatatac 3300
gcatatgtag tgttgaagaa acatgaaatt gcccagtatt cttaacccaa ctgcacagaa 3360
caaaaacctg caggaaacga agataaatca tgtcgaaagc tacatataag gaacgtgctg 3420
ctactcatcc tagtcctgtt gctgccaagc tatttaatat catgcacgaa aagcaaacaa 3480
acttgtgtgc ttcattggat gttcgtacca ccaaggaatt actggagtta gttgaagcat 3540
taggtcccaa aatttgttta ctaaaaacac atgtggatat cttgactgat ttttccatgg 3600
agggcacagt taagccgcta aaggcattat ccgccaagta caatttttta ctcttcgaag 3660
acagaaaatt tgctgacatt ggtaatacag tcaaattgca gtactctgcg ggtgtataca 3720
gaatagcaga atgggcagac attacgaatg cacacggtgt ggtgggccca ggtattgtta 3780
gcggtttgaa gcaggcggca gaagaagtaa caaaggaacc tagaggcctt ttgatgttag 3840
cagaattgtc atgcaagggc tccctatcta ctggagaata tactaagggt actgttgaca 3900
ttgcgaagag cgacaaagat tttgttatcg gctttattgc tcaaagagac atgggtggaa 3960
gagatgaagg ttacgattgg ttgattatga cacccggtgt gggtttagat gacaagggag 4020
acgcattggg tcaacagtat agaaccgtgg atgatgtggt ctctacagga tctgacatta 4080
ttattgttgg aagaggacta tttgcaaagg gaagggatgc taaggtagag ggtgaacgtt 4140
acagaaaagc aggctgggaa gcatatttga gaagatgcgg ccagcaaaac taaaaaactg 4200
tattataagt aaatgcatgt atactaaact cacaaattag agcttcaatt taattatatc 4260
agttattacc cgggaatctc ggtcgtaatg atttttataa tgacgaaaaa aaaaaaattg 4320
gaaagaaaaa gcttggcgta atcatggtca tagctgtttc ctgtgtgaaa ttgttatccg 4380
ctcacaattc cacacaacat acgagccgga agcataaagt gtaaagcctg gggtgcctaa 4440
tgagtgagct aactcacatt aattgcgttg cgctcactgc ccgctttcca gtcgggaaac 4500
ctgtcgtgcc agctgcatta atgaatcggc caacgcgcgg ggagaggcgg tttgcgtatt 4560
gggcgctctt ccgcttcctc gctcactgac tcgctgcgct cggtcgttcg gctgcggcga 4620
gcggtatcag ctcactcaaa ggcggtaata cggttatcca cagaatcagg ggataacgca 4680
ggaaagaaca tgtgagcaaa aggccagcaa aaggccagga accgtaaaaa ggccgcgttg 4740
ctggcgtttt tccataggct ccgcccccct gacgagcatc acaaaaatcg acgctcaagt 4800
cagaggtggc gaaacccgac aggactataa agataccagg cgtttccccc tggaagctcc 4860
ctcgtgcgct ctcctgttcc gaccctgccg cttaccggat acctgtccgc ctttctccct 4920
tcgggaagcg tggcgctttc tcatagctca cgctgtaggt atctcagttc ggtgtaggtc 4980
gttcgctcca agctgggctg tgtgcacgaa ccccccgttc agcccgaccg ctgcgcctta 5040
tccggtaact atcgtcttga gtccaacccg gtaagacacg acttatcgcc actggcagca 5100
gccactggta acaggattag cagagcgagg tatgtaggcg gtgctacaga gttcttgaag 5160
tggtggccta actacggcta cactagaaga acagtatttg gtatctgcgc tctgctgaag 5220
ccagttacct tcggaaaaag agttggtagc tcttgatccg gcaaacaaac caccgctggt 5280
agcggtggtt tttttgtttg caagcagcag attacgcgca gaaaaaaagg atctcaagaa 5340
gatcctttga tcttttctac ggggtctgac gctcagtgga acgaaaactc acgttaaggg 5400
attttggtca tgagattatc aaaaaggatc ttcacctaga tccttttaaa ttaaaaatga 5460
agttttaaat caatctaaag tatatatgag taaacttggt ctgacagtta ccaatgctta 5520
atcagtgagg cacctatctc agcgatctgt ctatttcgtt catccatagt tgcctgactc 5580
cccgtcgtgt agataactac gatacgggag ggcttaccat ctggccccag tgctgcaatg 5640
ataccgcgag acccacgctc accggctcca gatttatcag caataaacca gccagccgga 5700
agggccgagc gcagaagtgg tcctgcaact ttatccgcct ccatccagtc tattaattgt 5760
tgccgggaag ctagagtaag tagttcgcca gttaatagtt tgcgcaacgt tgttgccatt 5820
gctacaggca tcgtggtgtc acgctcgtcg tttggtatgg cttcattcag ctccggttcc 5880
caacgatcaa ggcgagttac atgatccccc atgttgtgca aaaaagcggt tagctccttc 5940
ggtcctccga tcgttgtcag aagtaagttg gccgcagtgt tatcactcat ggttatggca 6000
gcactgcata attctcttac tgtcatgcca tccgtaagat gcttttctgt gactggtgag 6060
tactcaacca agtcattctg agaatagtgt atgcggcgac cgagttgctc ttgcccggcg 6120
tcaatacggg ataataccgc gccacatagc agaactttaa aagtgctcat cattggaaaa 6180
cgttcttcgg ggcgaaaact ctcaaggatc ttaccgctgt tgagatccag ttcgatgtaa 6240
cccactcgtg cacccaactg atcttcagca tcttttactt tcaccagcgt ttctgggtga 6300
gcaaaaacag gaaggcaaaa tgccgcaaaa aagggaataa gggcgacacg gaaatgttga 6360
atactcatac tcttcctttt tcaatattat tgaagcattt atcagggtta ttgtctcatg 6420
agcggataca tatttgaatg tatttagaaa aataaacaaa taggggttcc gcgcacattt 6480
ccccgaaaag tgccacctga cgtctaagaa accattatta tcatgacatt aacctataaa 6540
aataggcgta tcacgaggcc ctttcgtctc gcgcgtttcg gtgatgacgg tgaaaacctc 6600
tgacacatgc agctcccgga gacggtcaca gcttgtctgt aagcggatgc cgggagcaga 6660
caagcccgtc agggcgcgtc agcgggtgtt ggcgggtgtc ggggctggct taactatgcg 6720
gcatcagagc agattgtact gagagtgcac cataaaattg taaacgttaa tattttgtta 6780
aaattcgcgt taaatttttg ttaaatcagc tcatttttta accaatagac cgaaatcggc 6840
aaaatccctt ataaatcaaa agaatagccc gagatagagt tgagtgttgt tccagtttgg 6900
aacaagagtc cactattaaa gaacgtggac tccaacgtca aagggcgaaa aaccgtctat 6960
cagggcgatg gcccactacg tgaaccatca cccaaatcaa gttttttggg gtcgaggtgc 7020
cgtaaagcac taaatcggaa ccctaaaggg agcccccgat ttagagcttg acggggaaag 7080
ccggcgaacg tggcgagaaa ggaagggaag aaagcgaaag gagcgggcgc taaggcgctg 7140
gcaagtgtag cggtcacgct gcgcgtaacc accacacccg ccgcgcttaa tgcgccgcta 7200
cagggcgcgt actatggttg ctttgacgta tgcggtgtga aataccgcac agatgcgtaa 7260
ggagaaaata ccgcatcagg cgccattcgc cattcaggct gcgcaactgt tgggaagggc 7320
gatcggtgcg ggcctcttcg ctattacgcc agctggcgaa agggggatgt gctgcaaggc 7380
gattaagttg ggtaacgcca gggttttccc agtcacgacg ttgtaaaacg acggccagtg 7440
aattcgagct ccaccgcgga tagatctgaa atgaataaca atactgacag tactaaataa 7500
ttgcctactt ggcttcacat acgttgcata cgtcgatata gataataatg ataatgacag 7560
caggattatc gtaatacgta atagttgaaa atctcaaaaa tgtgtgggtc attacgtaaa 7620
taatgatagg aatgggattc ttctattttt cctttttcca ttctagcagc cgtcgggaaa 7680
acgtggcatc ctctctttcg ggctcaattg gagtcacgct gccgtgagca tcctctcttt 7740
ccatatctaa caactgagca cgtaaccaat ggaaaagcat gagcttagcg ttgctccaaa 7800
aaagtattgg atggttaata ccatttgtct gttctcttct gactttgact cctcaaaaaa 7860
aaaaaatcta caatcaacag atcgcttcaa ttacgccctc acaaaaactt ttttccttct 7920
tcttcgccca cgttaaattt tatccctcat gttgtctaac ggatttctgc acttgattta 7980
ttataaaaag acaaagacat aatacttctc tatcaatttc agttattgtt cttccttgcg 8040
ttattcttct gttcttcttt ttcttttgtc atatataacc ataaccaagt aatacatatt 8100
caaatctaga gctgaggatg ttgaagcaaa tcaacttcgg tggtactgtt gaaaccgtct 8160
acgaaagagc tgactggcca agagaaaagt tgttggacta cttcaagaac gacacttttg 8220
ctttgatcgg ttacggttcc caaggttacg gtcaaggttt gaacttgaga gacaacggtt 8280
tgaacgttat cattggtgtc cgtaaagatg gtgcttcttg gaaggctgcc atcgaagacg 8340
gttgggttcc aggcaagaac ttgttcactg ttgaagatgc tatcaagaga ggtagttacg 8400
ttatgaactt gttgtccgat gccgctcaat cagaaacctg gcctgctatc aagccattgt 8460
tgaccaaggg taagactttg tacttctccc acggtttctc cccagtcttc aaggacttga 8520
ctcacgttga accaccaaag gacttagatg ttatcttggt tgctccaaag ggttccggta 8580
gaactgtcag atctttgttc aaggaaggtc gtggtattaa ctcttcttac gccgtctgga 8640
acgatgtcac cggtaaggct cacgaaaagg cccaagcttt ggccgttgcc attggttccg 8700
gttacgttta ccaaaccact ttcgaaagag aagtcaactc tgacttgtac ggtgaaagag 8760
gttgtttaat gggtggtatc cacggtatgt tcttggctca atacgacgtc ttgagagaaa 8820
acggtcactc cccatctgaa gctttcaacg aaaccgtcga agaagctacc caatctctat 8880
acccattgat cggtaagtac ggtatggatt acatgtacga tgcttgttcc accaccgcca 8940
gaagaggtgc tttggactgg tacccaatct tcaagaatgc tttgaagcct gttttccaag 9000
acttgtacga atctaccaag aacggtaccg aaaccaagag atctttggaa ttcaactctc 9060
aacctgacta cagagaaaag ctagaaaagg aattagacac catcagaaac atggaaatct 9120
ggaaggttgg taaggaagtc agaaagttga gaccagaaaa ccaataatta attaatcatg 9180
taattagtta tgtcacgctt acattcacgc cctcccccca catccgctct aaccgaaaag 9240
gaaggagtta gacaacctga agtctaggtc cctatttatt tttttatagt tatgttagta 9300
ttaagaacgt tatttatatt tcaaattttt cttttttttc tgtacagacg cgtgtacgca 9360
tgtaacatta tactgaaaac cttgcttgag aaggttttgg gacgctcgaa ggctttaatt 9420
tgcgggcggc cgctctagag agttgttagc aaccttttgt ttcttttgag ctggttcaga 9480
cattatgtac acgtatatgt gacgagttcg agaagtattt tactatcgta ctaaatttta 9540
cctgaaaaat tatatactcg agaaagagga agccaagaat tgagaaaaaa gaaaaacccg 9600
cgagtaagga aattaaatac aggtgtacac atacacgcac acatatatat atatatatat 9660
atgtatatgt gtatatagga agcgcgcgca tgttagtata tacgattcgt tggaaagggg 9720
ccgtccacca aacgtgactt gacgagttga caaattgacc tcaatatggc tcagtcagta 9780
atttttagtt ccgctttatt cccgccatct ttcaggccac gagggtagct cataacgccg 9840
cgctaatgcc gctgcgtcac agcaaccagt agctcagcca aaaccgaaag agaaatcgta 9900
gctgtcccga tgaggactta tacacttgtc accatctaaa taaattattt attcgcgttt 9960
cggttcttgt tttcgattta attagattgt tcattgaatc ataataaata tgtaaaaaat 10020
atatatattt gaagctgctt cagaaaaaca gggcttccta gtgtacagat gtatgtcgga 10080
tgaaaaaaaa aaaatcttaa atgtgaaatt gggtcaattc aattgactat gacttgatgt 10140
tgcaaaaatt ccaagagaaa aagtttccag cacttgatat tattttcctc tttaattttt 10200
cgccttgtct acgatcttat tagcaccgat ccagggcatc atagacctta actgttcacc 10260
aataatttcg ataccatgtg ctgcattgtt tcttctttta gcagtcatac tcgggtaacc 10320
cgtagcgcct tcacttatga acatcttagc gtattcaccg tcctggatac gtttcaaggc 10380
atttctcatg gcttgtcttg attctgcgtt aatgacttca ggtccggtga catactcacc 10440
atattctgca ttatttgaaa tggaatagtt catattagct ataccacctt catacattaa 10500
gtctactatc aacttcaatt catgtagaca ttcgaagtat gccatttcgg gagcgtaccc 10560
tgcttcgaca agcgtctcaa agcctgcttt aaccaattca acagttcctc cgcacagaac 10620
cgcttgttct ccaaataaat ctgtctcagt ctcgtcttta aaagtggttt ctattatacc 10680
cgttctcccg ccaccaactc ctgctgcgta gcttaaagct acattcttag cgtttccgct 10740
tgcgtcttgg tatatagcga tcaaatctgg aataccacca cccttaacaa attcgctcct 10800
aacagtatgc cccggagcct taggtgcaat cataataacg tccaaatctg ccctggggac 10860
tacttgattg taatgaatgg caaatccatg actgaaggcc aaggtagcgc ccttcttaat 10920
gtttggttct atttcatttt tgtacaattg cgattgaaat tcatctggcg ttaaaatcat 10980
gactaaatca gcgccggcaa cagccgctgc aacatctgtg actttcaagc catgtgcttc 11040
agcctttgca acggtagcac taccttttct cagacctact gtcacgtcga ccccagaatc 11100
tttcaagtta caggcttgtg cgtgtccttg ggaaccatat cctataatag caaccttctt 11160
tccctggatg atgctcagat cgcagtcttt atcgtaaaac accttcatgt tttatttttt 11220
acttatattg ctggtagggt aaaaaaatat aactcctagg aataggttgt ctatatgttt 11280
ttgtcttgct tctataattg taacaaacaa ggaaagggaa aatactgggt gtaaaagcca 11340
ttgagtcaag ttaggtcatc ccttttatac aaaatttttc aatttttttt ccaagattct 11400
tgtacgatta attatttttt ttttgcgtcc tacagcgtga tgaaaatttc cgcctgctgc 11460
aagatgagcg ggaacgggcg aaatgtgcac gcgcacaact tacgaaacgc ggatgagtca 11520
ctgacagcca ccgcagaggt tctgactcct actgagctct attggaggtg gcagaaccgg 11580
taccggagga gaccgctata accggtttga atttattgtc acagtgtcac atcagcggca 11640
actcagaagt ttgacagcaa gcaagttcat cattcgaact agccttattg ttttagttca 11700
gtgacagcga actgccgtac tcgatgcttt atttctcacg gtagagcgga agaacagata 11760
ggggcagcgt gagaagagtt agaaagtaaa tttttatcac gtctgaagta ttcttattca 11820
taggaaattt tgcaaggttt tttagctcaa taacgggcta agttatataa ggtgttcacg 11880
cgattttctt gttatgtata cctcttctct gaggaatggt actactgtcc tgatgtaggc 11940
tccttaaatt ggtgggcaag aataacttat cgatattttg tatattggtc ttggagttca 12000
ccacgtaatg cctgtttaag accatcagtt aactctagta ttatttggtc ttggctactg 12060
gccgtttgct attattcaag tcttttgtgc cttcccgtcg ggtaagggag ttatttaggg 12120
atacagaatc taacgaaaac taaatctcaa tgattaactc catttaatcc ttttttgaaa 12180
ggcaaaagag gtcccttgtt cacttacaac gttcttagcc aaattcgctt atcacttact 12240
acttcacgat atacagaagt aaaaacatat aaaaagatgt ctgtttgttt agccatcaca 12300
aaaggtatcg cagtttcttc tataggcctc tactctggtc ttttggcttc cgcttcattg 12360
attacatcta ctactccact agaggtttta acaggatctc taaaaacatc gatatcgtct 12420
ctgcgttcca atcctacggt gaatatattt ccaagcaatt cactgaagaa gaaagagaag 12480
atgttgtgga acatgcatgc ccaggtcctg gttcttgtgg tggtatgtat actgccaaca 12540
caatggcttc tgccgctgaa gtgctaggtt tgaccattcc aaactcctct tccttcccag 12600
ccgtttccaa ggagaagtta gctgagtgtg acaacattgg tgaatacatc aagaagacaa 12660
tggaattggg tattttacct cgtgatatcc tcacaaaaga ggcttttgaa aacgccatta 12720
cttatgtcgt tgcaaccggt gggtccacta atgctgtttt gcatttggtg gctgttgctc 12780
actctgcggg tgtcaagttg tcaccagatg atttccaaag aatcagtgat actacaccat 12840
tgatcggtga cttcaaacct tctggtaaat acgtcatggc cgatttgatt aacgttggtg 12900
gtacccaatc tgtgattaag tatctatatg aaaacaacat gttgcacggt aacacaatga 12960
ctgttaccgg tgacactttg gcagaacgtg caaagaaagc accaagccta cctgaaggac 13020
aagagattat taagccactc tcccacccaa tcaaggccaa cggtcacttg caaattctgt 13080
acggttcatt ggcaccaggt ggagctgtgg gtaaaattac cggtaaggaa ggtacttact 13140
tcaagggtag agcacgtgtg ttcgaagagg aaggtgcctt tattgaagcc ttggaaagag 13200
gtgaaatcaa gaagggtgaa aaaaccgttg ttgttatcag atatgaaggt ccaagaggtg 13260
caccaggtat gcctgaaatg ctaaagcctt cctctgctct gatgggttac ggtttgggta 13320
aagatgttgc attgttgact gatggtagat tctctggtgg ttctcacggg ttcttaatcg 13380
gccacattgt tcccgaagcc gctgaaggtg gtcctatcgg gttggtcaga gacggcgatg 13440
agattatcat tgatgctgat aataacaaga ttgacctatt agtctctgat aaggaaatgg 13500
ctcaacgtaa acaaagttgg gttgcacctc cacctcgtta cacaagaggt actctatcca 13560
agtatgctaa gttggtttcc aacgcttcca acggttgtgt tttagatgct tgattaatta 13620
agagtaagcg aatttcttat gatttatgat ttttattatt aaataagtta taaaaaaaat 13680
aagtgtatac aaattttaaa gtgactctta ggttttaaaa cgaaaattct tattcttgag 13740
taactctttc ctgtaggtca ggttgctttc tcaggtatag catgaggtcg ctcttattga 13800
ccacacctct accggcatgc cgagcaaatg cctgcaaatc gctccccatt tcacccaatt 13860
gtagatatgc taactccagc aatgagttga tgaatctcgg tgtgtatttt atgtcctcag 13920
aggacaacac ctgtggtact agttctagag cggccgcccg caaattaaag ccttcgagcg 13980
tcccaaaacc ttctcaagca aggttttcag tataatgtta catgcgtaca cgcgtctgta 14040
cagaaaaaaa agaaaaattt gaaatataaa taacgttctt aatactaaca taactataaa 14100
aaaataaata gggacctaga cttcaggttg tctaactcct tccttttcgg ttagagcgga 14160
tgtgggggga gggcgtgaat gtaagcgtga cataactaat tacatgatta attaactaga 14220
gagctttcgt tttcatgagt tccccgaatt ctttcggaag cttgtcactt gctaaattaa 14280
tgttatcact gtagtcaacc gggacatcga tgatgacagg accttcagcg ttcatgcctt 14340
gacgcagaac atctgccagc tggtctggtg attctacgcg caagccagtt gctccgaagc 14400
tttccgcata tttcacgata tcgatatttc cgaaatcgac cgcagatgta cggttatatt 14460
ttttcaattg ctggaatgca accatgtcat atgtgctgtc gttccataca atgtgtacaa 14520
ttggtgcttt tagtcgaact gctgtctcta attccattgc tgagaataag aaaccgccgt 14580
caccagagac agaaaccact ttttctcccg gtttcaccaa tgaagcgccg attgcccaag 14640
gaagcgcaac gccgagtgtt tgcataccgt tactgatcat taatgttaac ggctcgtagc 14700
tgcggaaata acgtgacatc caaatggcgt gcgaaccgat atcgcaagtt actgtaacat 14760
gatcatcgac tgcattacgc aactctttaa cgatttcaag agggtgcgct ctgtctgatt 14820
tccaatctgc aggcacctgc tcaccttcat gcatatattg ttttaaatca gaaaggattt 14880
tctgctcacg ctctgcaaat tccactttca cagcatcgtg ttcgatatga ttgatcgtgg 14940
acggaatgtc accgatcaat tcaagatcag gctggtaagc atgatcaatg tcagcgataa 15000
tctcgtctaa atggataatt gtccggtctc cattgatatt ccagaatttc ggatcatatt 15060
caatcgggtc atagccgatc gtcagaacaa catctgcctg ctctagcagt aaatcgccag 15120
gctggttgcg gaacaaaccg atacggccaa aatattgatc ctctaaatct ctagaaaggg 15180
taccggcagc ttgatatgtt tcaacaaatg gaagctgaac ctttttcaaa agcttgcgaa 15240
ccgctttaat tgcttccggt cttccgcctt tcatgccgac caaaacgaca ggaagttttg 15300
ctgtttggat ttttgctatg gccgcactga ttgcatcatc tgctgcagga ccgagttttg 15360
gcgctgcaac agcacgcacg tttttcgtat ttgtgacttc attcacaaca tcttgcggaa 15420
agctcacaaa agcggcccca gcctgccctg ctgacgctat cctaaatgca tttgtaacag 15480
cttccggtat attttttaca tcttgaactt ctacactgta ttttgtaatc ggctggaata 15540
gcgccgcatt atccaaagat tgatgtgtcc gttttaaacg atctgcacgg atcacgtttc 15600
cagcaagcgc aacgacaggg tctccttcag tgttcgctgt cagcaggcct gttgccaagt 15660
tagaggcacc cggtcctgat gtgactaaca cgactcccgg ttttccagtt aaacggccga 15720
ctgcttgggc catgaatgct gcgttttgtt cgtgccgggc aacgataatt tcaggtcctt 15780
tatcttgtaa agcgtcaaat accgcatcaa tttttgcacc tggaatgcca aatacatgtg 15840
tgacaccttg ctccactaag caatcaacaa caagctccgc ccctctgttt ttcacaaggg 15900
atttttgttc ttttgttgct tttgtcaaca tcctcagcga tgattgattg attgattgta 15960
cagtttgttt ttcttaatat ctatttcgat gacttctata tgatattgca ctaacaagaa 16020
gatattataa tgcaattgat acaagacaag gagttatttg cttctctttt atatgattct 16080
gacaatccat attgcgttgg tagtcttttt tgctggaacg gttcagcgga aaagacgcat 16140
cgctcttttt gcttctagaa gaaatgccag caaaagaatc tcttgacagt gactgacagc 16200
aaaaatgtct ttttctaact agtaacaagg ctaagatatc agcctgaaat aaagggtggt 16260
gaagtaataa ttaaatcatc cgtataaacc tatacacata tatgaggaaa aataatacaa 16320
aagtgtttta aatacagata catacatgaa catatgcacg tatagcgccc aaatgtcggt 16380
aatggga 16387
<210> 131
<211> 1188
<212> DNA
<213> Saccharomyces cerevisiae
<400> 131
atgttgagaa ctcaagccgc cagattgatc tgcaactccc gtgtcatcac tgctaagaga 60
acctttgctt tggccacccg tgctgctgct tacagcagac cagctgcccg tttcgttaag 120
ccaatgatca ctacccgtgg tttgaagcaa atcaacttcg gtggtactgt tgaaaccgtc 180
tacgaaagag ctgactggcc aagagaaaag ttgttggact acttcaagaa cgacactttt 240
gctttgatcg gttacggttc ccaaggttac ggtcaaggtt tgaacttgag agacaacggt 300
ttgaacgtta tcattggtgt ccgtaaagat ggtgcttctt ggaaggctgc catcgaagac 360
ggttgggttc caggcaagaa cttgttcact gttgaagatg ctatcaagag aggtagttac 420
gttatgaact tgttgtccga tgccgctcaa tcagaaacct ggcctgctat caagccattg 480
ttgaccaagg gtaagacttt gtacttctcc cacggtttct ccccagtctt caaggacttg 540
actcacgttg aaccaccaaa ggacttagat gttatcttgg ttgctccaaa gggttccggt 600
agaactgtca gatctttgtt caaggaaggt cgtggtatta actcttctta cgccgtctgg 660
aacgatgtca ccggtaaggc tcacgaaaag gcccaagctt tggccgttgc cattggttcc 720
ggttacgttt accaaaccac tttcgaaaga gaagtcaact ctgacttgta cggtgaaaga 780
ggttgtttaa tgggtggtat ccacggtatg ttcttggctc aatacgacgt cttgagagaa 840
aacggtcact ccccatctga agctttcaac gaaaccgtcg aagaagctac ccaatctcta 900
tacccattga tcggtaagta cggtatggat tacatgtacg atgcttgttc caccaccgcc 960
agaagaggtg ctttggactg gtacccaatc ttcaagaatg ctttgaagcc tgttttccaa 1020
gacttgtacg aatctaccaa gaacggtacc gaaaccaaga gatctttgga attcaactct 1080
caacctgact acagagaaaa gctagaaaag gaattagaca ccatcagaaa catggaaatc 1140
tggaaggttg gtaaggaagt cagaaagttg agaccagaaa accaataa 1188
<210> 132
<211> 1014
<212> DNA
<213> Pseudomonas fluorescens
<400> 132
atgaaagttt tctacgataa agactgcgac ctgtcgatca tccaaggtaa gaaagttgcc 60
atcatcggct acggttccca gggccacgct caagcatgca acctgaagga ttccggcgta 120
gacgtgactg ttggcctgcg taaaggctcg gctaccgttg ccaaggctga agcccacggc 180
ttgaaagtga ccgacgttgc tgcagccgtt gccggtgccg acttggtcat gatcctgacc 240
ccggacgagt tccagtccca gctgtacaag aacgaaatcg agccgaacat caagaagggc 300
gccactctgg ccttctccca cggcttcgcg atccactaca accaggttgt gcctcgtgcc 360
gacctcgacg tgatcatgat cgcgccgaag gctccaggcc acaccgtacg ttccgagttc 420
gtcaagggcg gtggtattcc tgacctgatc gcgatctacc aggacgcttc cggcaacgcc 480
aagaacgttg ccctgtccta cgccgcaggc gtgggcggcg gccgtaccgg catcatcgaa 540
accaccttca aggacgagac tgaaaccgac ctgttcggtg agcaggctgt tctgtgtggc 600
ggtaccgtcg agctggtcaa agccggtttc gaaaccctgg ttgaagctgg ctacgctcca 660
gaaatggcct acttcgagtg cctgcacgaa ctgaagctga tcgttgacct catgtacgaa 720
ggcggtatcg ccaacatgaa ctactcgatc tccaacaacg ctgaatacgg cgagtacgtg 780
actggtccag aagtcatcaa cgccgaatcc cgtcaggcca tgcgcaatgc tctgaagcgc 840
atccaggacg gcgaatacgc gaagatgttc atcagcgaag gcgctaccgg ctacccatcg 900
atgaccgcca agcgtcgtaa caacgctgct cacggtatcg aaatcatcgg cgagcaactg 960
cgctcgatga tgccttggat cggtgccaac aaaatcgtcg acaaagccaa gaac 1014
<210> 133
<211> 250
<212> DNA
<213> Saccharomyces cerevisiae
<400> 133
ccgcaaatta aagccttcga gcgtcccaaa accttctcaa gcaaggtttt cagtataatg 60
ttacatgcgt acacgcgtct gtacagaaaa aaaagaaaaa tttgaaatat aaataacgtt 120
cttaatacta acataactat aaaaaaataa atagggacct agacttcagg ttgtctaact 180
ccttcctttt cggttagagc ggatgtgggg ggagggcgtg aatgtaagcg tgacataact 240
aattacatga 250
<210> 134
<211> 1181
<212> DNA
<213> Saccharomyces cerevisiae
<400> 134
taaaacctct agtggagtag tagatgtaat caatgaagcg gaagccaaaa gaccagagta 60
gaggcctata gaagaaactg cgataccttt tgtgatggct aaacaaacag acatcttttt 120
atatgttttt acttctgtat atcgtgaagt agtaagtgat aagcgaattt ggctaagaac 180
gttgtaagtg aacaagggac ctcttttgcc tttcaaaaaa ggattaaatg gagttaatca 240
ttgagattta gttttcgtta gattctgtat ccctaaataa ctcccttacc cgacgggaag 300
gcacaaaaga cttgaataat agcaaacggc cagtagccaa gaccaaataa tactagagtt 360
aactgatggt cttaaacagg cattacgtgg tgaactccaa gaccaatata caaaatatcg 420
ataagttatt cttgcccacc aatttaagga gcctacatca ggacagtagt accattcctc 480
agagaagagg tatacataac aagaaaatcg cgtgaacacc ttatataact tagcccgtta 540
ttgagctaaa aaaccttgca aaatttccta tgaataagaa tacttcagac gtgataaaaa 600
tttactttct aactcttctc acgctgcccc tatctgttct tccgctctac cgtgagaaat 660
aaagcatcga gtacggcagt tcgctgtcac tgaactaaaa caataaggct agttcgaatg 720
atgaacttgc ttgctgtcaa acttctgagt tgccgctgat gtgacactgt gacaataaat 780
tcaaaccggt tatagcggtc tcctccggta ccggttctgc cacctccaat agagctcagt 840
aggagtcaga acctctgcgg tggctgtcag tgactcatcc gcgtttcgta agttgtgcgc 900
gtgcacattt cgcccgttcc cgctcatctt gcagcaggcg gaaattttca tcacgctgta 960
ggacgcaaaa aaaaaataat taatcgtaca agaatcttgg aaaaaaaatt gaaaaatttt 1020
gtataaaagg gatgacctaa cttgactcaa tggcttttac acccagtatt ttccctttcc 1080
ttgtttgtta caattataga agcaagacaa aaacatatag acaacctatt cctaggagtt 1140
atattttttt accctaccag caatataagt aaaaaactag t 1181
<210> 135
<211> 759
<212> DNA
<213> Saccharomyces cerevisiae
<400> 135
ggccctgcag gcctatcaag tgctggaaac tttttctctt ggaatttttg caacatcaag 60
tcatagtcaa ttgaattgac ccaatttcac atttaagatt tttttttttt catccgacat 120
acatctgtac actaggaagc cctgtttttc tgaagcagct tcaaatatat atatttttta 180
catatttatt atgattcaat gaacaatcta attaaatcga aaacaagaac cgaaacgcga 240
ataaataatt tatttagatg gtgacaagtg tataagtcct catcgggaca gctacgattt 300
ctctttcggt tttggctgag ctactggttg ctgtgacgca gcggcattag cgcggcgtta 360
tgagctaccc tcgtggcctg aaagatggcg ggaataaagc ggaactaaaa attactgact 420
gagccatatt gaggtcaatt tgtcaactcg tcaagtcacg tttggtggac ggcccctttc 480
caacgaatcg tatatactaa catgcgcgcg cttcctatat acacatatac atatatatat 540
atatatatat gtgtgcgtgt atgtgtacac ctgtatttaa tttccttact cgcgggtttt 600
tcttttttct caattcttgg cttcctcttt ctcgagtata taatttttca ggtaaaattt 660
agtacgatag taaaatactt ctcgaactcg tcacatatac gtgtacataa tgtctgaacc 720
agctcaaaag aaacaaaagg ttgctaacaa ctctctaga 759
<210> 136
<211> 643
<212> DNA
<213> Saccharomyces cerevisiae
<400> 136
gaaatgaata acaatactga cagtactaaa taattgccta cttggcttca catacgttgc 60
atacgtcgat atagataata atgataatga cagcaggatt atcgtaatac gtaatagttg 120
aaaatctcaa aaatgtgtgg gtcattacgt aaataatgat aggaatggga ttcttctatt 180
tttccttttt ccattctagc agccgtcggg aaaacgtggc atcctctctt tcgggctcaa 240
ttggagtcac gctgccgtga gcatcctctc tttccatatc taacaactga gcacgtaacc 300
aatggaaaag catgagctta gcgttgctcc aaaaaagtat tggatggtta ataccatttg 360
tctgttctct tctgactttg actcctcaaa aaaaaaaaat ctacaatcaa cagatcgctt 420
caattacgcc ctcacaaaaa cttttttcct tcttcttcgc ccacgttaaa ttttatccct 480
catgttgtct aacggatttc tgcacttgat ttattataaa aagacaaaga cataatactt 540
ctctatcaat ttcagttatt gttcttcctt gcgttattct tctgttcttc tttttctttt 600
gtcatatata accataacca agtaatacat attcaaatct aga 643
<210> 137
<211> 1716
<212> DNA
<213> Bacillus subtilis
<400> 137
atgttgacaa aagcaacaaa agaacaaaaa tcccttgtga aaaacagagg ggcggagctt 60
gttgttgatt gcttagtgga gcaaggtgtc acacatgtat ttggcattcc aggtgcaaaa 120
attgatgcgg tatttgacgc tttacaagat aaaggacctg aaattatcgt tgcccggcac 180
gaacaaaacg cagcattcat ggcccaagca gtcggccgtt taactggaaa accgggagtc 240
gtgttagtca catcaggacc gggtgcctct aacttggcaa caggcctgct gacagcgaac 300
actgaaggag accctgtcgt tgcgcttgct ggaaacgtga tccgtgcaga tcgtttaaaa 360
cggacacatc aatctttgga taatgcggcg ctattccagc cgattacaaa atacagtgta 420
gaagttcaag atgtaaaaaa tataccggaa gctgttacaa atgcatttag gatagcgtca 480
gcagggcagg ctggggccgc ttttgtgagc tttccgcaag atgttgtgaa tgaagtcaca 540
aatacgaaaa acgtgcgtgc tgttgcagcg ccaaaactcg gtcctgcagc agatgatgca 600
atcagtgcgg ccatagcaaa aatccaaaca gcaaaacttc ctgtcgtttt ggtcggcatg 660
aaaggcggaa gaccggaagc aattaaagcg gttcgcaagc ttttgaaaaa ggttcagctt 720
ccatttgttg aaacatatca agctgccggt accctttcta gagatttaga ggatcaatat 780
tttggccgta tcggtttgtt ccgcaaccag cctggcgatt tactgctaga gcaggcagat 840
gttgttctga cgatcggcta tgacccgatt gaatatgatc cgaaattctg gaatatcaat 900
ggagaccgga caattatcca tttagacgag attatcgctg acattgatca tgcttaccag 960
cctgatcttg aattgatcgg tgacattccg tccacgatca atcatatcga acacgatgct 1020
gtgaaagtgg aatttgcaga gcgtgagcag aaaatccttt ctgatttaaa acaatatatg 1080
catgaaggtg agcaggtgcc tgcagattgg aaatcagaca gagcgcaccc tcttgaaatc 1140
gttaaagagt tgcgtaatgc agtcgatgat catgttacag taacttgcga tatcggttcg 1200
cacgccattt ggatgtcacg ttatttccgc agctacgagc cgttaacatt aatgatcagt 1260
aacggtatgc aaacactcgg cgttgcgctt ccttgggcaa tcggcgcttc attggtgaaa 1320
ccgggagaaa aagtggtttc tgtctctggt gacggcggtt tcttattctc agcaatggaa 1380
ttagagacag cagttcgact aaaagcacca attgtacaca ttgtatggaa cgacagcaca 1440
tatgacatgg ttgcattcca gcaattgaaa aaatataacc gtacatctgc ggtcgatttc 1500
ggaaatatcg atatcgtgaa atatgcggaa agcttcggag caactggctt gcgcgtagaa 1560
tcaccagacc agctggcaga tgttctgcgt caaggcatga acgctgaagg tcctgtcatc 1620
atcgatgtcc cggttgacta cagtgataac attaatttag caagtgacaa gcttccgaaa 1680
gaattcgggg aactcatgaa aacgaaagct ctctag 1716
<210> 138
<211> 571
<212> PRT
<213> Bacillus subtilis
<400> 138
Met Leu Thr Lys Ala Thr Lys Glu Gln Lys Ser Leu Val Lys Asn Arg
1 5 10 15
Gly Ala Glu Leu Val Val Asp Cys Leu Val Glu Gln Gly Val Thr His
20 25 30
Val Phe Gly Ile Pro Gly Ala Lys Ile Asp Ala Val Phe Asp Ala Leu
35 40 45
Gln Asp Lys Gly Pro Glu Ile Ile Val Ala Arg His Glu Gln Asn Ala
50 55 60
Ala Phe Met Ala Gln Ala Val Gly Arg Leu Thr Gly Lys Pro Gly Val
65 70 75 80
Val Leu Val Thr Ser Gly Pro Gly Ala Ser Asn Leu Ala Thr Gly Leu
85 90 95
Leu Thr Ala Asn Thr Glu Gly Asp Pro Val Val Ala Leu Ala Gly Asn
100 105 110
Val Ile Arg Ala Asp Arg Leu Lys Arg Thr His Gln Ser Leu Asp Asn
115 120 125
Ala Ala Leu Phe Gln Pro Ile Thr Lys Tyr Ser Val Glu Val Gln Asp
130 135 140
Val Lys Asn Ile Pro Glu Ala Val Thr Asn Ala Phe Arg Ile Ala Ser
145 150 155 160
Ala Gly Gln Ala Gly Ala Ala Phe Val Ser Phe Pro Gln Asp Val Val
165 170 175
Asn Glu Val Thr Asn Thr Lys Asn Val Arg Ala Val Ala Ala Pro Lys
180 185 190
Leu Gly Pro Ala Ala Asp Asp Ala Ile Ser Ala Ala Ile Ala Lys Ile
195 200 205
Gln Thr Ala Lys Leu Pro Val Val Leu Val Gly Met Lys Gly Gly Arg
210 215 220
Pro Glu Ala Ile Lys Ala Val Arg Lys Leu Leu Lys Lys Val Gln Leu
225 230 235 240
Pro Phe Val Glu Thr Tyr Gln Ala Ala Gly Thr Leu Ser Arg Asp Leu
245 250 255
Glu Asp Gln Tyr Phe Gly Arg Ile Gly Leu Phe Arg Asn Gln Pro Gly
260 265 270
Asp Leu Leu Leu Glu Gln Ala Asp Val Val Leu Thr Ile Gly Tyr Asp
275 280 285
Pro Ile Glu Tyr Asp Pro Lys Phe Trp Asn Ile Asn Gly Asp Arg Thr
290 295 300
Ile Ile His Leu Asp Glu Ile Ile Ala Asp Ile Asp His Ala Tyr Gln
305 310 315 320
Pro Asp Leu Glu Leu Ile Gly Asp Ile Pro Ser Thr Ile Asn His Ile
325 330 335
Glu His Asp Ala Val Lys Val Glu Phe Ala Glu Arg Glu Gln Lys Ile
340 345 350
Leu Ser Asp Leu Lys Gln Tyr Met His Glu Gly Glu Gln Val Pro Ala
355 360 365
Asp Trp Lys Ser Asp Arg Ala His Pro Leu Glu Ile Val Lys Glu Leu
370 375 380
Arg Asn Ala Val Asp Asp His Val Thr Val Thr Cys Asp Ile Gly Ser
385 390 395 400
His Ala Ile Trp Met Ser Arg Tyr Phe Arg Ser Tyr Glu Pro Leu Thr
405 410 415
Leu Met Ile Ser Asn Gly Met Gln Thr Leu Gly Val Ala Leu Pro Trp
420 425 430
Ala Ile Gly Ala Ser Leu Val Lys Pro Gly Glu Lys Val Val Ser Val
435 440 445
Ser Gly Asp Gly Gly Phe Leu Phe Ser Ala Met Glu Leu Glu Thr Ala
450 455 460
Val Arg Leu Lys Ala Pro Ile Val His Ile Val Trp Asn Asp Ser Thr
465 470 475 480
Tyr Asp Met Val Ala Phe Gln Gln Leu Lys Lys Tyr Asn Arg Thr Ser
485 490 495
Ala Val Asp Phe Gly Asn Ile Asp Ile Val Lys Tyr Ala Glu Ser Phe
500 505 510
Gly Ala Thr Gly Leu Arg Val Glu Ser Pro Asp Gln Leu Ala Asp Val
515 520 525
Leu Arg Gln Gly Met Asn Ala Glu Gly Pro Val Ile Ile Asp Val Pro
530 535 540
Val Asp Tyr Ser Asp Asn Ile Asn Leu Ala Ser Asp Lys Leu Pro Lys
545 550 555 560
Glu Phe Gly Glu Leu Met Lys Thr Lys Ala Leu
565 570
<210> 139
<211> 448
<212> DNA
<213> Saccharomyces cerevisiae
<400> 139
cccattaccg acatttgggc gctatacgtg catatgttca tgtatgtatc tgtatttaaa 60
acacttttgt attatttttc ctcatatatg tgtataggtt tatacggatg atttaattat 120
tacttcacca ccctttattt caggctgata tcttagcctt gttactagtt agaaaaagac 180
atttttgctg tcagtcactg tcaagagatt cttttgctgg catttcttct agaagcaaaa 240
agagcgatgc gtcttttccg ctgaaccgtt ccagcaaaaa agactaccaa cgcaatatgg 300
attgtcagaa tcatataaaa gagaagcaaa taactccttg tcttgtatca attgcattat 360
aatatcttct tgttagtgca atatcatata gaagtcatcg aaatagatat taagaaaaac 420
aaactgtaca atcaatcaat caatcatc 448
<210> 140
<211> 16387
<212> DNA
<213> artificial sequence
<220>
<223> plasmid construct
<400> 140
tcccattacc gacatttggg cgctatacgt gcatatgttc atgtatgtat ctgtatttaa 60
aacacttttg tattattttt cctcatatat gtgtataggt ttatacggat gatttaatta 120
ttacttcacc accctttatt tcaggctgat atcttagcct tgttactagt tagaaaaaga 180
catttttgct gtcagtcact gtcaagagat tcttttgctg gcatttcttc tagaagcaaa 240
aagagcgatg cgtcttttcc gctgaaccgt tccagcaaaa aagactacca acgcaatatg 300
gattgtcaga atcatataaa agagaagcaa ataactcctt gtcttgtatc aattgcatta 360
taatatcttc ttgttagtgc aatatcatat agaagtcatc gaaatagata ttaagaaaaa 420
caaactgtac aatcaatcaa tcaatcatcg ctgaggatgt tgacaaaagc aacaaaagaa 480
caaaaatccc ttgtgaaaaa cagaggggcg gagcttgttg ttgattgctt agtggagcaa 540
ggtgtcacac atgtatttgg cattccaggt gcaaaaattg atgcggtatt tgacgcttta 600
caagataaag gacctgaaat tatcgttgcc cggcacgaac aaaacgcagc attcatggcc 660
caagcagtcg gccgtttaac tggaaaaccg ggagtcgtgt tagtcacatc aggaccgggt 720
gcctctaact tggcaacagg cctgctgaca gcgaacactg aaggagaccc tgtcgttgcg 780
cttgctggaa acgtgatccg tgcagatcgt ttaaaacgga cacatcaatc tttggataat 840
gcggcgctat tccagccgat tacaaaatac agtgtagaag ttcaagatgt aaaaaatata 900
ccggaagctg ttacaaatgc atttaggata gcgtcagcag ggcaggctgg ggccgctttt 960
gtgagctttc cgcaagatgt tgtgaatgaa gtcacaaata cgaaaaacgt gcgtgctgtt 1020
gcagcgccaa aactcggtcc tgcagcagat gatgcaatca gtgcggccat agcaaaaatc 1080
caaacagcaa aacttcctgt cgttttggtc ggcatgaaag gcggaagacc ggaagcaatt 1140
aaagcggttc gcaagctttt gaaaaaggtt cagcttccat ttgttgaaac atatcaagct 1200
gccggtaccc tttctagaga tttagaggat caatattttg gccgtatcgg tttgttccgc 1260
aaccagcctg gcgatttact gctagagcag gcagatgttg ttctgacgat cggctatgac 1320
ccgattgaat atgatccgaa attctggaat atcaatggag accggacaat tatccattta 1380
gacgagatta tcgctgacat tgatcatgct taccagcctg atcttgaatt gatcggtgac 1440
attccgtcca cgatcaatca tatcgaacac gatgctgtga aagtggaatt tgcagagcgt 1500
gagcagaaaa tcctttctga tttaaaacaa tatatgcatg aaggtgagca ggtgcctgca 1560
gattggaaat cagacagagc gcaccctctt gaaatcgtta aagagttgcg taatgcagtc 1620
gatgatcatg ttacagtaac ttgcgatatc ggttcgcacg ccatttggat gtcacgttat 1680
ttccgcagct acgagccgtt aacattaatg atcagtaacg gtatgcaaac actcggcgtt 1740
gcgcttcctt gggcaatcgg cgcttcattg gtgaaaccgg gagaaaaagt ggtttctgtc 1800
tctggtgacg gcggtttctt attctcagca atggaattag agacagcagt tcgactaaaa 1860
gcaccaattg tacacattgt atggaacgac agcacatatg acatggttgc attccagcaa 1920
ttgaaaaaat ataaccgtac atctgcggtc gatttcggaa atatcgatat cgtgaaatat 1980
gcggaaagct tcggagcaac tggcttgcgc gtagaatcac cagaccagct ggcagatgtt 2040
ctgcgtcaag gcatgaacgc tgaaggtcct gtcatcatcg atgtcccggt tgactacagt 2100
gataacatta atttagcaag tgacaagctt ccgaaagaat tcggggaact catgaaaacg 2160
aaagctctct agttaattaa tcatgtaatt agttatgtca cgcttacatt cacgccctcc 2220
ccccacatcc gctctaaccg aaaaggaagg agttagacaa cctgaagtct aggtccctat 2280
ttattttttt atagttatgt tagtattaag aacgttattt atatttcaaa tttttctttt 2340
ttttctgtac agacgcgtgt acgcatgtaa cattatactg aaaaccttgc ttgagaaggt 2400
tttgggacgc tcgaaggctt taatttgcgg gcggccgctc tagaactagt accacaggtg 2460
ttgtcctctg aggacataaa atacacaccg agattcatca actcattgct ggagttagca 2520
tatctacaat tgggtgaaat ggggagcgat ttgcaggcat ttgctcggca tgccggtaga 2580
ggtgtggtca ataagagcga cctcatgcta tacctgagaa agcaacctga cctacaggaa 2640
agagttactc aagaataaga attttcgttt taaaacctaa gagtcacttt aaaatttgta 2700
tacacttatt ttttttataa cttatttaat aataaaaatc ataaatcata agaaattcgc 2760
ttactcttaa ttaatcaagc atctaaaaca caaccgttgg aagcgttgga aaccaactta 2820
gcatacttgg atagagtacc tcttgtgtaa cgaggtggag gtgcaaccca actttgttta 2880
cgttgagcca tttccttatc agagactaat aggtcaatct tgttattatc agcatcaatg 2940
ataatctcat cgccgtctct gaccaacccg ataggaccac cttcagcggc ttcgggaaca 3000
atgtggccga ttaagaaccc gtgagaacca ccagagaatc taccatcagt caacaatgca 3060
acatctttac ccaaaccgta acccatcaga gcagaggaag gctttagcat ttcaggcata 3120
cctggtgcac ctcttggacc ttcatatctg ataacaacaa cggttttttc acccttcttg 3180
atttcacctc tttccaaggc ttcaataaag gcaccttcct cttcgaacac acgtgctcta 3240
cccttgaagt aagtaccttc cttaccggta attttaccca cagctccacc tggtgccaat 3300
gaaccgtaca gaatttgcaa gtgaccgttg gccttgattg ggtgggagag tggcttaata 3360
atctcttgtc cttcaggtag gcttggtgct ttctttgcac gttctgccaa agtgtcaccg 3420
gtaacagtca ttgtgttacc gtgcaacatg ttgttttcat atagatactt aatcacagat 3480
tgggtaccac caacgttaat caaatcggcc atgacgtatt taccagaagg tttgaagtca 3540
ccgatcaatg gtgtagtatc actgattctt tggaaatcat ctggtgacaa cttgacaccc 3600
gcagagtgag caacagccac caaatgcaaa acagcattag tggacccacc ggttgcaacg 3660
acataagtaa tggcgttttc aaaagcctct tttgtgagga tatcacgagg taaaataccc 3720
aattccattg tcttcttgat gtattcacca atgttgtcac actcagctaa cttctccttg 3780
gaaacggctg ggaaggaaga ggagtttgga atggtcaaac ctagcacttc agcggcagaa 3840
gccattgtgt tggcagtata cataccacca caagaaccag gacctgggca tgcatgttcc 3900
acaacatctt ctctttcttc ttcagtgaat tgcttggaaa tatattcacc gtaggattgg 3960
aacgcagaga cgatatcgat gtttttagag atcctgttaa aacctctagt ggagtagtag 4020
atgtaatcaa tgaagcggaa gccaaaagac cagagtagag gcctatagaa gaaactgcga 4080
taccttttgt gatggctaaa caaacagaca tctttttata tgtttttact tctgtatatc 4140
gtgaagtagt aagtgataag cgaatttggc taagaacgtt gtaagtgaac aagggacctc 4200
ttttgccttt caaaaaagga ttaaatggag ttaatcattg agatttagtt ttcgttagat 4260
tctgtatccc taaataactc ccttacccga cgggaaggca caaaagactt gaataatagc 4320
aaacggccag tagccaagac caaataatac tagagttaac tgatggtctt aaacaggcat 4380
tacgtggtga actccaagac caatatacaa aatatcgata agttattctt gcccaccaat 4440
ttaaggagcc tacatcagga cagtagtacc attcctcaga gaagaggtat acataacaag 4500
aaaatcgcgt gaacacctta tataacttag cccgttattg agctaaaaaa ccttgcaaaa 4560
tttcctatga ataagaatac ttcagacgtg ataaaaattt actttctaac tcttctcacg 4620
ctgcccctat ctgttcttcc gctctaccgt gagaaataaa gcatcgagta cggcagttcg 4680
ctgtcactga actaaaacaa taaggctagt tcgaatgatg aacttgcttg ctgtcaaact 4740
tctgagttgc cgctgatgtg acactgtgac aataaattca aaccggttat agcggtctcc 4800
tccggtaccg gttctgccac ctccaataga gctcagtagg agtcagaacc tctgcggtgg 4860
ctgtcagtga ctcatccgcg tttcgtaagt tgtgcgcgtg cacatttcgc ccgttcccgc 4920
tcatcttgca gcaggcggaa attttcatca cgctgtagga cgcaaaaaaa aaataattaa 4980
tcgtacaaga atcttggaaa aaaaattgaa aaattttgta taaaagggat gacctaactt 5040
gactcaatgg cttttacacc cagtattttc cctttccttg tttgttacaa ttatagaagc 5100
aagacaaaaa catatagaca acctattcct aggagttata tttttttacc ctaccagcaa 5160
tataagtaaa aaactagtat gaaggtgttt tacgataaag actgcgatct gagcatcatc 5220
cagggaaaga aggttgctat tataggatat ggttcccaag gacacgcaca agccttgaac 5280
ttgaaagatt ctggggtcga cgtgacagta ggtctgtata aaggtgctgc tgatgcagca 5340
aaggctgaag cacatggctt taaagtcaca gatgttgcag cggctgttgc tggcgctgat 5400
ttagtcatga ttttaattcc agatgaattt caatcgcaat tgtacaaaaa tgaaatagaa 5460
ccaaacatta agaagggcgc taccttggcc ttcagtcatg gatttgccat tcattacaat 5520
caagtagtcc ccagggcaga tttggacgtt attatgattg cacctaaggc tccggggcat 5580
actgttagga gcgaatttgt taagggtggt ggtattccag atttgatcgc tatataccaa 5640
gacgttagcg gaaacgctaa gaatgtagct ttaagctacg cagcaggagt tggtggcggg 5700
agaacgggta taatagaaac cacttttaaa gacgagactg agacagattt atttggagaa 5760
caagcggttc tgtgcggagg aactgttgaa ttggttaaag caggctttga gacgcttgtc 5820
gaagcagggt acgctcccga aatggcatac ttcgaatgtc tacatgaatt gaagttgata 5880
gtagacttaa tgtatgaagg tggtatagct aatatgaact attccatttc aaataatgca 5940
gaatatggtg agtatgtcac cggacctgaa gtcattaacg cagaatcaag acaagccatg 6000
agaaatgcct tgaaacgtat ccaggacggt gaatacgcta agatgttcat aagtgaaggc 6060
gctacgggtt acccgagtat gactgctaaa agaagaaaca atgcagcaca tggtatcgaa 6120
attattggtg aacagttaag gtctatgatg ccctggatcg gtgctaataa gatcgtagac 6180
aaggcgaaaa attaaggccc tgcaggccta tcaagtgctg gaaacttttt ctcttggaat 6240
ttttgcaaca tcaagtcata gtcaattgaa ttgacccaat ttcacattta agattttttt 6300
tttttcatcc gacatacatc tgtacactag gaagccctgt ttttctgaag cagcttcaaa 6360
tatatatatt ttttacatat ttattatgat tcaatgaaca atctaattaa atcgaaaaca 6420
agaaccgaaa cgcgaataaa taatttattt agatggtgac aagtgtataa gtcctcatcg 6480
ggacagctac gatttctctt tcggttttgg ctgagctact ggttgctgtg acgcagcggc 6540
attagcgcgg cgttatgagc taccctcgtg gcctgaaaga tggcgggaat aaagcggaac 6600
taaaaattac tgactgagcc atattgaggt caatttgtca actcgtcaag tcacgtttgg 6660
tggacggccc ctttccaacg aatcgtatat actaacatgc gcgcgcttcc tatatacaca 6720
tatacatata tatatatata tatatgtgtg cgtgtatgtg tacacctgta tttaatttcc 6780
ttactcgcgg gtttttcttt tttctcaatt cttggcttcc tctttctcga gtatataatt 6840
tttcaggtaa aatttagtac gatagtaaaa tacttctcga actcgtcaca tatacgtgta 6900
cataatgtct gaaccagctc aaaagaaaca aaaggttgct aacaactctc tagagcggcc 6960
gcccgcaaat taaagccttc gagcgtccca aaaccttctc aagcaaggtt ttcagtataa 7020
tgttacatgc gtacacgcgt ctgtacagaa aaaaaagaaa aatttgaaat ataaataacg 7080
ttcttaatac taacataact ataaaaaaat aaatagggac ctagacttca ggttgtctaa 7140
ctccttcctt ttcggttaga gcggatgtgg ggggagggcg tgaatgtaag cgtgacataa 7200
ctaattacat gattaattaa ttattggttt tctggtctca actttctgac ttccttacca 7260
accttccaga tttccatgtt tctgatggtg tctaattcct tttctagctt ttctctgtag 7320
tcaggttgag agttgaattc caaagatctc ttggtttcgg taccgttctt ggtagattcg 7380
tacaagtctt ggaaaacagg cttcaaagca ttcttgaaga ttgggtacca gtccaaagca 7440
cctcttctgg cggtggtgga acaagcatcg tacatgtaat ccataccgta cttaccgatc 7500
aatgggtata gagattgggt agcttcttcg acggtttcgt tgaaagcttc agatggggag 7560
tgaccgtttt ctctcaagac gtcgtattga gccaagaaca taccgtggat accacccatt 7620
aaacaacctc tttcaccgta caagtcagag ttgacttctc tttcgaaagt ggtttggtaa 7680
acgtaaccgg aaccaatggc aacggccaaa gcttgggcct tttcgtgagc cttaccggtg 7740
acatcgttcc agacggcgta agaagagtta ataccacgac cttccttgaa caaagatctg 7800
acagttctac cggaaccctt tggagcaacc aagataacat ctaagtcctt tggtggttca 7860
acgtgagtca agtccttgaa gactggggag aaaccgtggg agaagtacaa agtcttaccc 7920
ttggtcaaca atggcttgat agcaggccag gtttctgatt gagcggcatc ggacaacaag 7980
ttcataacgt aactacctct cttgatagca tcttcaacag tgaacaagtt cttgcctgga 8040
acccaaccgt cttcgatggc agccttccaa gaagcaccat ctttacggac accaatgata 8100
acgttcaaac cgttgtctct caagttcaaa ccttgaccgt aaccttggga accgtaaccg 8160
atcaaagcaa aagtgtcgtt cttgaagtag tccaacaact tttctcttgg ccagtcagct 8220
ctttcgtaga cggtttcaac agtaccaccg aagttgattt gcttcaacat cctcagctct 8280
agatttgaat atgtattact tggttatggt tatatatgac aaaagaaaaa gaagaacaga 8340
agaataacgc aaggaagaac aataactgaa attgatagag aagtattatg tctttgtctt 8400
tttataataa atcaagtgca gaaatccgtt agacaacatg agggataaaa tttaacgtgg 8460
gcgaagaaga aggaaaaaag tttttgtgag ggcgtaattg aagcgatctg ttgattgtag 8520
attttttttt tttgaggagt caaagtcaga agagaacaga caaatggtat taaccatcca 8580
atactttttt ggagcaacgc taagctcatg cttttccatt ggttacgtgc tcagttgtta 8640
gatatggaaa gagaggatgc tcacggcagc gtgactccaa ttgagcccga aagagaggat 8700
gccacgtttt cccgacggct gctagaatgg aaaaaggaaa aatagaagaa tcccattcct 8760
atcattattt acgtaatgac ccacacattt ttgagatttt caactattac gtattacgat 8820
aatcctgctg tcattatcat tattatctat atcgacgtat gcaacgtatg tgaagccaag 8880
taggcaatta tttagtactg tcagtattgt tattcatttc agatctatcc gcggtggagc 8940
tcgaattcac tggccgtcgt tttacaacgt cgtgactggg aaaaccctgg cgttacccaa 9000
cttaatcgcc ttgcagcaca tccccctttc gccagctggc gtaatagcga agaggcccgc 9060
accgatcgcc cttcccaaca gttgcgcagc ctgaatggcg aatggcgcct gatgcggtat 9120
tttctcctta cgcatctgtg cggtatttca caccgcatac gtcaaagcaa ccatagtacg 9180
cgccctgtag cggcgcatta agcgcggcgg gtgtggtggt tacgcgcagc gtgaccgcta 9240
cacttgccag cgccttagcg cccgctcctt tcgctttctt cccttccttt ctcgccacgt 9300
tcgccggctt tccccgtcaa gctctaaatc gggggctccc tttagggttc cgatttagtg 9360
ctttacggca cctcgacccc aaaaaacttg atttgggtga tggttcacgt agtgggccat 9420
cgccctgata gacggttttt cgccctttga cgttggagtc cacgttcttt aatagtggac 9480
tcttgttcca aactggaaca acactcaact ctatctcggg ctattctttt gatttataag 9540
ggattttgcc gatttcggtc tattggttaa aaaatgagct gatttaacaa aaatttaacg 9600
cgaattttaa caaaatatta acgtttacaa ttttatggtg cactctcagt acaatctgct 9660
ctgatgccgc atagttaagc cagccccgac acccgccaac acccgctgac gcgccctgac 9720
gggcttgtct gctcccggca tccgcttaca gacaagctgt gaccgtctcc gggagctgca 9780
tgtgtcagag gttttcaccg tcatcaccga aacgcgcgag acgaaagggc ctcgtgatac 9840
gcctattttt ataggttaat gtcatgataa taatggtttc ttagacgtca ggtggcactt 9900
ttcggggaaa tgtgcgcgga acccctattt gtttattttt ctaaatacat tcaaatatgt 9960
atccgctcat gagacaataa ccctgataaa tgcttcaata atattgaaaa aggaagagta 10020
tgagtattca acatttccgt gtcgccctta ttcccttttt tgcggcattt tgccttcctg 10080
tttttgctca cccagaaacg ctggtgaaag taaaagatgc tgaagatcag ttgggtgcac 10140
gagtgggtta catcgaactg gatctcaaca gcggtaagat ccttgagagt tttcgccccg 10200
aagaacgttt tccaatgatg agcactttta aagttctgct atgtggcgcg gtattatccc 10260
gtattgacgc cgggcaagag caactcggtc gccgcataca ctattctcag aatgacttgg 10320
ttgagtactc accagtcaca gaaaagcatc ttacggatgg catgacagta agagaattat 10380
gcagtgctgc cataaccatg agtgataaca ctgcggccaa cttacttctg acaacgatcg 10440
gaggaccgaa ggagctaacc gcttttttgc acaacatggg ggatcatgta actcgccttg 10500
atcgttggga accggagctg aatgaagcca taccaaacga cgagcgtgac accacgatgc 10560
ctgtagcaat ggcaacaacg ttgcgcaaac tattaactgg cgaactactt actctagctt 10620
cccggcaaca attaatagac tggatggagg cggataaagt tgcaggacca cttctgcgct 10680
cggcccttcc ggctggctgg tttattgctg ataaatctgg agccggtgag cgtgggtctc 10740
gcggtatcat tgcagcactg gggccagatg gtaagccctc ccgtatcgta gttatctaca 10800
cgacggggag tcaggcaact atggatgaac gaaatagaca gatcgctgag ataggtgcct 10860
cactgattaa gcattggtaa ctgtcagacc aagtttactc atatatactt tagattgatt 10920
taaaacttca tttttaattt aaaaggatct aggtgaagat cctttttgat aatctcatga 10980
ccaaaatccc ttaacgtgag ttttcgttcc actgagcgtc agaccccgta gaaaagatca 11040
aaggatcttc ttgagatcct ttttttctgc gcgtaatctg ctgcttgcaa acaaaaaaac 11100
caccgctacc agcggtggtt tgtttgccgg atcaagagct accaactctt tttccgaagg 11160
taactggctt cagcagagcg cagataccaa atactgttct tctagtgtag ccgtagttag 11220
gccaccactt caagaactct gtagcaccgc ctacatacct cgctctgcta atcctgttac 11280
cagtggctgc tgccagtggc gataagtcgt gtcttaccgg gttggactca agacgatagt 11340
taccggataa ggcgcagcgg tcgggctgaa cggggggttc gtgcacacag cccagcttgg 11400
agcgaacgac ctacaccgaa ctgagatacc tacagcgtga gctatgagaa agcgccacgc 11460
ttcccgaagg gagaaaggcg gacaggtatc cggtaagcgg cagggtcgga acaggagagc 11520
gcacgaggga gcttccaggg ggaaacgcct ggtatcttta tagtcctgtc gggtttcgcc 11580
acctctgact tgagcgtcga tttttgtgat gctcgtcagg ggggcggagc ctatggaaaa 11640
acgccagcaa cgcggccttt ttacggttcc tggccttttg ctggcctttt gctcacatgt 11700
tctttcctgc gttatcccct gattctgtgg ataaccgtat taccgccttt gagtgagctg 11760
ataccgctcg ccgcagccga acgaccgagc gcagcgagtc agtgagcgag gaagcggaag 11820
agcgcccaat acgcaaaccg cctctccccg cgcgttggcc gattcattaa tgcagctggc 11880
acgacaggtt tcccgactgg aaagcgggca gtgagcgcaa cgcaattaat gtgagttagc 11940
tcactcatta ggcaccccag gctttacact ttatgcttcc ggctcgtatg ttgtgtggaa 12000
ttgtgagcgg ataacaattt cacacaggaa acagctatga ccatgattac gccaagcttt 12060
ttctttccaa tttttttttt ttcgtcatta taaaaatcat tacgaccgag attcccgggt 12120
aataactgat ataattaaat tgaagctcta atttgtgagt ttagtataca tgcatttact 12180
tataatacag ttttttagtt ttgctggccg catcttctca aatatgcttc ccagcctgct 12240
tttctgtaac gttcaccctc taccttagca tcccttccct ttgcaaatag tcctcttcca 12300
acaataataa tgtcagatcc tgtagagacc acatcatcca cggttctata ctgttgaccc 12360
aatgcgtctc ccttgtcatc taaacccaca ccgggtgtca taatcaacca atcgtaacct 12420
tcatctcttc cacccatgtc tctttgagca ataaagccga taacaaaatc tttgtcgctc 12480
ttcgcaatgt caacagtacc cttagtatat tctccagtag atagggagcc cttgcatgac 12540
aattctgcta acatcaaaag gcctctaggt tcctttgtta cttcttctgc cgcctgcttc 12600
aaaccgctaa caatacctgg gcccaccaca ccgtgtgcat tcgtaatgtc tgcccattct 12660
gctattctgt atacacccgc agagtactgc aatttgactg tattaccaat gtcagcaaat 12720
tttctgtctt cgaagagtaa aaaattgtac ttggcggata atgcctttag cggcttaact 12780
gtgccctcca tggaaaaatc agtcaagata tccacatgtg tttttagtaa acaaattttg 12840
ggacctaatg cttcaactaa ctccagtaat tccttggtgg tacgaacatc caatgaagca 12900
cacaagtttg tttgcttttc gtgcatgata ttaaatagct tggcagcaac aggactagga 12960
tgagtagcag cacgttcctt atatgtagct ttcgacatga tttatcttcg tttcctgcag 13020
gtttttgttc tgtgcagttg ggttaagaat actgggcaat ttcatgtttc ttcaacacta 13080
catatgcgta tatataccaa tctaagtctg tgctccttcc ttcgttcttc cttctgttcg 13140
gagattaccg aatcaaaaaa atttcaagga aaccgaaatc aaaaaaaaga ataaaaaaaa 13200
aatgatgaat tgaaaagctt gcatgcctgc aggtcgactc tagtatactc cgtctactgt 13260
acgatacact tccgctcagg tccttgtcct ttaacgaggc cttaccactc ttttgttact 13320
ctattgatcc agctcagcaa aggcagtgtg atctaagatt ctatcttcgc gatgtagtaa 13380
aactagctag accgagaaag agactagaaa tgcaaaaggc acttctacaa tggctgccat 13440
cattattatc cgatgtgacg ctgcattttt tttttttttt tttttttttt tttttttttt 13500
tttttttttt tttttttgta caaatatcat aaaaaaagag aatcttttta agcaaggatt 13560
ttcttaactt cttcggcgac agcatcaccg acttcggtgg tactgttgga accacctaaa 13620
tcaccagttc tgatacctgc atccaaaacc tttttaactg catcttcaat ggctttacct 13680
tcttcaggca agttcaatga caatttcaac atcattgcag cagacaagat agtggcgata 13740
gggttgacct tattctttgg caaatctgga gcggaaccat ggcatggttc gtacaaacca 13800
aatgcggtgt tcttgtctgg caaagaggcc aaggacgcag atggcaacaa acccaaggag 13860
cctgggataa cggaggcttc atcggagatg atatcaccaa acatgttgct ggtgattata 13920
ataccattta ggtgggttgg gttcttaact aggatcatgg cggcagaatc aatcaattga 13980
tgttgaactt tcaatgtagg gaattcgttc ttgatggttt cctccacagt ttttctccat 14040
aatcttgaag aggccaaaac attagcttta tccaaggacc aaataggcaa tggtggctca 14100
tgttgtaggg ccatgaaagc ggccattctt gtgattcttt gcacttctgg aacggtgtat 14160
tgttcactat cccaagcgac accatcacca tcgtcttcct ttctcttacc aaagtaaata 14220
cctcccacta attctctaac aacaacgaag tcagtacctt tagcaaattg tggcttgatt 14280
ggagataagt ctaaaagaga gtcggatgca aagttacatg gtcttaagtt ggcgtacaat 14340
tgaagttctt tacggatttt tagtaaacct tgttcaggtc taacactacc ggtaccccat 14400
ttaggaccac ccacagcacc taacaaaacg gcatcagcct tcttggaggc ttccagcgcc 14460
tcatctggaa gtggaacacc tgtagcatcg atagcagcac caccaattaa atgattttcg 14520
aaatcgaact tgacattgga acgaacatca gaaatagctt taagaacctt aatggcttcg 14580
gctgtgattt cttgaccaac gtggtcacct ggcaaaacga cgatcttctt aggggcagac 14640
attacaatgg tatatccttg aaatatatat aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 14700
tgcagcttct caatgatatt cgaatacgct ttgaggagat acagcctaat atccgacaaa 14760
ctgttttaca gatttacgat cgtacttgtt acccatcatt gaattttgaa catccgaacc 14820
tgggagtttt ccctgaaaca gatagtatat ttgaacctgt ataataatat atagtctagc 14880
gctttacgga agacaatgta tgtatttcgg ttcctggaga aactattgca tctattgcat 14940
aggtaatctt gcacgtcgca tccccggttc attttctgcg tttccatctt gcacttcaat 15000
agcatatctt tgttaacgaa gcatctgtgc ttcattttgt agaacaaaaa tgcaacgcga 15060
gagcgctaat ttttcaaaca aagaatctga gctgcatttt tacagaacag aaatgcaacg 15120
cgaaagcgct attttaccaa cgaagaatct gtgcttcatt tttgtaaaac aaaaatgcaa 15180
cgcgagagcg ctaatttttc aaacaaagaa tctgagctgc atttttacag aacagaaatg 15240
caacgcgaga gcgctatttt accaacaaag aatctatact tcttttttgt tctacaaaaa 15300
tgcatcccga gagcgctatt tttctaacaa agcatcttag attacttttt ttctcctttg 15360
tgcgctctat aatgcagtct cttgataact ttttgcactg taggtccgtt aaggttagaa 15420
gaaggctact ttggtgtcta ttttctcttc cataaaaaaa gcctgactcc acttcccgcg 15480
tttactgatt actagcgaag ctgcgggtgc attttttcaa gataaaggca tccccgatta 15540
tattctatac cgatgtggat tgcgcatact ttgtgaacag aaagtgatag cgttgatgat 15600
tcttcattgg tcagaaaatt atgaacggtt tcttctattt tgtctctata tactacgtat 15660
aggaaatgtt tacattttcg tattgttttc gattcactct atgaatagtt cttactacaa 15720
tttttttgtc taaagagtaa tactagagat aaacataaaa aatgtagagg tcgagtttag 15780
atgcaagttc aaggagcgaa aggtggatgg gtaggttata tagggatata gcacagagat 15840
atatagcaaa gagatacttt tgagcaatgt ttgtggaagc ggtattcgca atattttagt 15900
agctcgttac agtccggtgc gtttttggtt ttttgaaagt gcgtcttcag agcgcttttg 15960
gttttcaaaa gcgctctgaa gttcctatac tttctagaga ataggaactt cggaatagga 16020
acttcaaagc gtttccgaaa acgagcgctt ccgaaaatgc aacgcgagct gcgcacatac 16080
agctcactgt tcacgtcgca cctatatctg cgtgttgcct gtatatatat atacatgaga 16140
agaacggcat agtgcgtgtt tatgcttaaa tgcgtactta tatgcgtcta tttatgtagg 16200
atgaaaggta gtctagtacc tcctgtgata ttatcccatt ccatgcgggg tatcgtatgc 16260
ttccttcagc actacccttt agctgttcta tatgctgcca ctcctcaatt ggattagtct 16320
catccttcaa tgctatcatt tcctttgata ttggatcata tgcatagtac cgagaaacta 16380
gaggatc 16387
<210> 141
<211> 2237
<212> DNA
<213> Artificial sequence
<220>
<223> Fragment
<400> 141
ttatgtatgc tcttctgact tttcgtgtga tgaggctcgt ggaaaaaatg aataatttat 60
gaatttgaga acaattttgt gttgttacgg tattttacta tggaataatc aatcaattga 120
ggattttatg caaatatcgt ttgaatattt ttccgaccct ttgagtactt ttcttcataa 180
ttgcataata ttgtccgctg cccctttttc tgttagacgg tgtcttgatc tacttgctat 240
cgttcaacac caccttattt tctaactatt ttttttttag ctcatttgaa tcagcttatg 300
gtgatggcac atttttgcat aaacctagct gtcctcgttg aacataggaa aaaaaaatat 360
ataaacaagg ctctttcact ctccttgcaa tcagatttgg gtttgttccc tttattttca 420
tatttcttgt catattcctt tctcaattat tattttctac tcataacctc acgcaaaata 480
acacagtcaa atcaatcaaa atgactgaca aaaaaactct taaagactta agaaatcgta 540
gttctgttta cgattcaatg gttaaatcac ctaatcgtgc tatgttgcgt gcaactggta 600
tgcaagatga agactttgaa aaacctatcg tcggtgtcat ttcaacttgg gctgaaaaca 660
caccttgtaa tatccactta catgactttg gtaaactagc caaagtcggt gttaaggaag 720
ctggtgcttg gccagttcag ttcggaacaa tcacggtttc tgatggaatc gccatgggaa 780
cccaaggaat gcgtttctcc ttgacatctc gtgatattat tgcagattct attgaagcag 840
ccatgggagg tcataatgcg gatgcttttg tagccattgg cggttgtgat aaaaacatgc 900
ccggttctgt tatcgctatg gctaacatgg atatcccagc catttttgct tacggcggaa 960
caattgcacc tggtaattta gacggcaaag atatcgattt agtctctgtc tttgaaggtg 1020
tcggccattg gaaccacggc gatatgacca aagaagaagt taaagctttg gaatgtaatg 1080
cttgtcccgg tcctggaggc tgcggtggta tgtatactgc taacacaatg gcgacagcta 1140
ttgaagtttt gggacttagc cttccgggtt catcttctca cccggctgaa tccgcagaaa 1200
agaaagcaga tattgaagaa gctggtcgcg ctgttgtcaa aatgctcgaa atgggcttaa 1260
aaccttctga cattttaacg cgtgaagctt ttgaagatgc tattactgta actatggctc 1320
tgggaggttc aaccaactca acccttcacc tcttagctat tgcccatgct gctaatgtgg 1380
aattgacact tgatgatttc aatactttcc aagaaaaagt tcctcatttg gctgatttga 1440
aaccttctgg tcaatatgta ttccaagacc tttacaaggt cggaggggta ccagcagtta 1500
tgaaatatct ccttaaaaat ggcttccttc atggtgaccg tatcacttgt actggcaaaa 1560
cagtcgctga aaatttgaag gcttttgatg atttaacacc tggtcaaaag gttattatgc 1620
cgcttgaaaa tcctaaacgt gaagatggtc cgctcattat tctccatggt aacttggctc 1680
cagacggtgc cgttgccaaa gtttctggtg taaaagtgcg tcgtcatgtc ggtcctgcta 1740
aggtctttaa ttctgaagaa gaagccattg aagctgtctt gaatgatgat attgttgatg 1800
gtgatgttgt tgtcgtacgt tttgtaggac caaagggcgg tcctggtatg cctgaaatgc 1860
tttccctttc atcaatgatt gttggtaaag ggcaaggtga aaaagttgcc cttctgacag 1920
atggccgctt ctcaggtggt acttatggtc ttgtcgtggg tcatatcgct cctgaagcac 1980
aagatggcgg tccaatcgcc tacctgcaaa caggagacat agtcactatt gaccaagaca 2040
ctaaggaatt acactttgat atctccgatg aagagttaaa acatcgtcaa gagaccattg 2100
aattgccacc gctctattca cgcggtatcc ttggtaaata tgctcacatc gtttcgtctg 2160
cttctagggg agccgtaaca gacttttgga agcctgaaga aactggcaaa aaatgagcga 2220
tttaatctct aattatt 2237
<210> 142
<211> 4420
<212> DNA
<213> Artificial sequence
<220>
<223> Cassette
<400> 142
ttatgtatgc tcttctgact tttcgtgtga tgaggctcgt ggaaaaaatg aataatttat 60
gaatttgaga acaattttgt gttgttacgg tattttacta tggaataatc aatcaattga 120
ggattttatg caaatatcgt ttgaatattt ttccgaccct ttgagtactt ttcttcataa 180
ttgcataata ttgtccgctg cccctttttc tgttagacgg tgtcttgatc tacttgctat 240
cgttcaacac caccttattt tctaactatt ttttttttag ctcatttgaa tcagcttatg 300
gtgatggcac atttttgcat aaacctagct gtcctcgttg aacataggaa aaaaaaatat 360
ataaacaagg ctctttcact ctccttgcaa tcagatttgg gtttgttccc tttattttca 420
tatttcttgt catattcctt tctcaattat tattttctac tcataacctc acgcaaaata 480
acacagtcaa atcaatcaaa atgactgaca aaaaaactct taaagactta agaaatcgta 540
gttctgttta cgattcaatg gttaaatcac ctaatcgtgc tatgttgcgt gcaactggta 600
tgcaagatga agactttgaa aaacctatcg tcggtgtcat ttcaacttgg gctgaaaaca 660
caccttgtaa tatccactta catgactttg gtaaactagc caaagtcggt gttaaggaag 720
ctggtgcttg gccagttcag ttcggaacaa tcacggtttc tgatggaatc gccatgggaa 780
cccaaggaat gcgtttctcc ttgacatctc gtgatattat tgcagattct attgaagcag 840
ccatgggagg tcataatgcg gatgcttttg tagccattgg cggttgtgat aaaaacatgc 900
ccggttctgt tatcgctatg gctaacatgg atatcccagc catttttgct tacggcggaa 960
caattgcacc tggtaattta gacggcaaag atatcgattt agtctctgtc tttgaaggtg 1020
tcggccattg gaaccacggc gatatgacca aagaagaagt taaagctttg gaatgtaatg 1080
cttgtcccgg tcctggaggc tgcggtggta tgtatactgc taacacaatg gcgacagcta 1140
ttgaagtttt gggacttagc cttccgggtt catcttctca cccggctgaa tccgcagaaa 1200
agaaagcaga tattgaagaa gctggtcgcg ctgttgtcaa aatgctcgaa atgggcttaa 1260
aaccttctga cattttaacg cgtgaagctt ttgaagatgc tattactgta actatggctc 1320
tgggaggttc aaccaactca acccttcacc tcttagctat tgcccatgct gctaatgtgg 1380
aattgacact tgatgatttc aatactttcc aagaaaaagt tcctcatttg gctgatttga 1440
aaccttctgg tcaatatgta ttccaagacc tttacaaggt cggaggggta ccagcagtta 1500
tgaaatatct ccttaaaaat ggcttccttc atggtgaccg tatcacttgt actggcaaaa 1560
cagtcgctga aaatttgaag gcttttgatg atttaacacc tggtcaaaag gttattatgc 1620
cgcttgaaaa tcctaaacgt gaagatggtc cgctcattat tctccatggt aacttggctc 1680
cagacggtgc cgttgccaaa gtttctggtg taaaagtgcg tcgtcatgtc ggtcctgcta 1740
aggtctttaa ttctgaagaa gaagccattg aagctgtctt gaatgatgat attgttgatg 1800
gtgatgttgt tgtcgtacgt tttgtaggac caaagggcgg tcctggtatg cctgaaatgc 1860
tttccctttc atcaatgatt gttggtaaag ggcaaggtga aaaagttgcc cttctgacag 1920
atggccgctt ctcaggtggt acttatggtc ttgtcgtggg tcatatcgct cctgaagcac 1980
aagatggcgg tccaatcgcc tacctgcaaa caggagacat agtcactatt gaccaagaca 2040
ctaaggaatt acactttgat atctccgatg aagagttaaa acatcgtcaa gagaccattg 2100
aattgccacc gctctattca cgcggtatcc ttggtaaata tgctcacatc gtttcgtctg 2160
cttctagggg agccgtaaca gacttttgga agcctgaaga aactggcaaa aaatgagcga 2220
tttaatctct aattattagt taaagtttta taagcatttt tatgtaacga aaaataaatt 2280
ggttcatatt attactgcac tgtcacttac catggaaaga ccagacaaga agttgccgac 2340
agtctgttga attggcctgg ttaggcttaa gtctgggtcc gcttctttac aaatttggag 2400
aatttctctt aaacgatatg tatattcttt tcgttggaaa agatgtcttc caaaaaaaaa 2460
accgatgaat tagtggaacc aaggaaaaaa aaagaggtat ccttgattaa ggaacactgt 2520
ttaaacagtg tggtttccaa aaccctgaaa ctgcattagt gtaatagaag actagacacc 2580
tcgatacaaa taatggttac tcaattcaaa actgccagcg aattcgactc tgcaattgct 2640
caagacaagc tagttgtcgt agatttctac gccacttggt gcggtccatg taaaatgatt 2700
gctccaatga ttgaaaaatg tggctgtggt ttcagggtcc ataaagcttt tcaattcatc 2760
tttttttttt ttgttctttt ttttgattcc ggtttctttg aaattttttt gattcggtaa 2820
tctccgagca gaaggaagaa cgaaggaagg agcacagact tagattggta tatatacgca 2880
tatgtggtgt tgaagaaaca tgaaattgcc cagtattctt aacccaactg cacagaacaa 2940
aaacctgcag gaaacgaaga taaatcatgt cgaaagctac atataaggaa cgtgctgcta 3000
ctcatcctag tcctgttgct gccaagctat ttaatatcat gcacgaaaag caaacaaact 3060
tgtgtgcttc attggatgtt cgtaccacca aggaattact ggagttagtt gaagcattag 3120
gtcccaaaat ttgtttacta aaaacacatg tggatatctt gactgatttt tccatggagg 3180
gcacagttaa gccgctaaag gcattatccg ccaagtacaa ttttttactc ttcgaagaca 3240
gaaaatttgc tgacattggt aatacagtca aattgcagta ctctgcgggt gtatacagaa 3300
tagcagaatg ggcagacatt acgaatgcac acggtgtggt gggcccaggt attgttagcg 3360
gtttgaagca ggcggcggaa gaagtaacaa aggaacctag aggccttttg atgttagcag 3420
aattgtcatg caagggctcc ctagctactg gagaatatac taagggtact gttgacattg 3480
cgaagagcga caaagatttt gttatcggct ttattgctca aagagacatg ggtggaagag 3540
atgaaggtta cgattggttg attatgacac ccggtgtggg tttagatgac aagggagacg 3600
cattgggtca acagtataga accgtggatg atgtggtctc tacaggatct gacattatta 3660
ttgttggaag aggactattt gcaaagggaa gggatgctaa ggtagagggt gaacgttaca 3720
gaaaagcagg ctgggaagca tatttgagaa gatgcggcca gcaaaactaa aaaactgtat 3780
tataagtaaa tgcatgtata ctaaactcac aaattagagc ttcaatttaa ttatatcagt 3840
tattacccgg gaatctcggt cgtaatgatt tctataatga cgaaaaaaaa aaaattggaa 3900
agaaaaagct tcatggcctt ccactttccc aaacaacacc tacggtatct ctcaagtctt 3960
atggggttcc attggtttca ccactggtgc taccttgggt gctgctttcg ctgctgaaga 4020
aattgatcca aagaagagag ttatcttatt cattggtgac ggttctttgc aattgactgt 4080
tcaagaaatc tccaccatga tcagatgggg cttgaagcca tacttgttcg tcttgaacaa 4140
cgatggttac accattgaaa agttgattca cggtccaaag gctcaataca acgaaattca 4200
aggttgggac cacctatcct tgttgccaac tttcggtgct aaggactatg aaacccacag 4260
agtcgctacc accggtgaat gggacaagtt gacccaagac aagtctttca acgacaactc 4320
taagatcaga atgattgaaa tcatgttgcc agtcttcgat gctccacaaa acttggttga 4380
acaagctaag ttgactgctg ctaccaacgc taagcaataa 4420
<210> 143
<211> 3521
<212> DNA
<213> Artificial sequence
<220>
<223> Cassette
<400> 143
aaggaaataa agcaaataac aataacacca ttattttaat tttttttcta ttactgtcgc 60
taacacctgt atggttgcaa ccaggtgaga atccttctga tgcatacttt atgcgtttat 120
gcgttttgcg ccccttggaa aaaaattgat tctcatcgta aatgcatact acatgcgttt 180
atgggaaaag cctccatatc caaaggtcgc gtttctttta gaaaaactaa tacgtaaacc 240
tgcattaagg taagattata tcagaaaatg tgttgcaaga aatgcattat gcaatttttt 300
gattatgaca atctctcgaa agaaatttca tatgatgaga cttgaataat gcagcggcgc 360
ttgctaaaag aacttgtata taagagctgc cattctcgat caatatactg tagtaagtcc 420
tttcctctct ttcttattac acttatttca cataatcaat ctcaaagaga acaacacaat 480
acaataacaa gaagaacaaa atgaaagctc tggtttatca cggtgaccac aagatctcgc 540
ttgaagacaa gcccaagccc acccttcaaa agcccacgga tgtagtagta cgggttttga 600
agaccacgat ctgcggcacg gatctcggca tctacaaagg caagaatcca gaggtcgccg 660
acgggcgcat cctgggccat gaaggggtag gcgtcatcga ggaagtgggc gagagtgtca 720
cgcagttcaa gaaaggcgac aaggtcctga tttcctgcgt cacttcttgc ggctcgtgcg 780
actactgcaa gaagcagctt tactcccatt gccgcgacgg cgggtggatc ctgggttaca 840
tgatcgatgg cgtgcaggcc gaatacgtcc gcatcccgca tgccgacaac agcctctaca 900
agatccccca gacaattgac gacgaaatcg ccgtcctgct gagcgacatc ctgcccaccg 960
gccacgaaat cggcgtccag tatgggaatg tccagccggg cgatgcggtg gctattgtcg 1020
gcgcgggccc cgtcggcatg tccgtactgt tgaccgccca gttctactcc ccctcgacca 1080
tcatcgtgat cgacatggac gagaatcgcc tccagctcgc caaggagctc ggggcaacgc 1140
acaccatcaa ctccggcacg gagaacgttg tcgaagccgt gcataggatt gcggcagagg 1200
gagtcgatgt tgcgatcgag gcggtgggca taccggcgac ttgggacatc tgccaggaga 1260
tcgtcaagcc cggcgcgcac atcgccaacg tcggcgtgca tggcgtcaag gttgacttcg 1320
agattcagaa gctctggatc aagaacctga cgatcaccac gggactggtg aacacgaaca 1380
cgacgcccat gctgatgaag gtcgcctcga ccgacaagct tccgttgaag aagatgatta 1440
cccatcgctt cgagctggcc gagatcgagc acgcctatca ggtattcctc aatggcgcca 1500
aggagaaggc gatgaagatc atcctctcga acgcaggcgc tgcctgagct aattaacata 1560
aaactcatga ttcaacgttt gtgtattttt ttacttttga aggttataga tgtttaggta 1620
aataattggc atagatatag ttttagtata ataaatttct gatttggttt aaaatatcaa 1680
ctattttttt tcacatatgt tcttgtaatt acttttctgt cctgtcttcc aggttaaaga 1740
ttagcttcta atattttagg tggtttatta tttaatttta tgctgattaa tttatttact 1800
tgtttaaacg gccggccaat gtggctgtgg tttcagggtc cataaagctt ttcaattcat 1860
cttttttttt tttgttcttt tttttgattc cggtttcttt gaaatttttt tgattcggta 1920
atctccgagc agaaggaaga acgaaggaag gagcacagac ttagattggt atatatacgc 1980
atatgtggtg ttgaagaaac atgaaattgc ccagtattct taacccaact gcacagaaca 2040
aaaacctgca ggaaacgaag ataaatcatg tcgaaagcta catataagga acgtgctgct 2100
actcatccta gtcctgttgc tgccaagcta tttaatatca tgcacgaaaa gcaaacaaac 2160
ttgtgtgctt cattggatgt tcgtaccacc aaggaattac tggagttagt tgaagcatta 2220
ggtcccaaaa tttgtttact aaaaacacat gtggatatct tgactgattt ttccatggag 2280
ggcacagtta agccgctaaa ggcattatcc gccaagtaca attttttact cttcgaagac 2340
agaaaatttg ctgacattgg taatacagtc aaattgcagt actctgcggg tgtatacaga 2400
atagcagaat gggcagacat tacgaatgca cacggtgtgg tgggcccagg tattgttagc 2460
ggtttgaagc aggcggcgga agaagtaaca aaggaaccta gaggcctttt gatgttagca 2520
gaattgtcat gcaagggctc cctagctact ggagaatata ctaagggtac tgttgacatt 2580
gcgaagagcg acaaagattt tgttatcggc tttattgctc aaagagacat gggtggaaga 2640
gatgaaggtt acgattggtt gattatgaca cccggtgtgg gtttagatga caagggagac 2700
gcattgggtc aacagtatag aaccgtggat gatgtggtct ctacaggatc tgacattatt 2760
attgttggaa gaggactatt tgcaaaggga agggatgcta aggtagaggg tgaacgttac 2820
agaaaagcag gctgggaagc atatttgaga agatgcggcc agcaaaacta aaaaactgta 2880
ttataagtaa atgcatgtat actaaactca caaattagag cttcaattta attatatcag 2940
ttattacccg ggaatctcgg tcgtaatgat ttctataatg acgaaaaaaa aaaaattgga 3000
aagaaaaagc ttcatggcct tctactttcc caacagatgt atacgctatc gtccaagtct 3060
tgtggggttc cattggtttc acagtcggcg ctctattggg tgctactatg gccgctgaag 3120
aacttgatcc aaagaagaga gttattttat tcattggtga cggttctcta caattgactg 3180
ttcaagaaat ctctaccatg attagatggg gtttgaagcc atacattttt gtcttgaata 3240
acaacggtta caccattgaa aaattgattc acggtcctca tgccgaatat aatgaaattc 3300
aaggttggga ccacttggcc ttattgccaa cttttggtgc tagaaactac gaaacccaca 3360
gagttgctac cactggtgaa tgggaaaagt tgactcaaga caaggacttc caagacaact 3420
ctaagattag aatgattgaa gttatgttgc cagtctttga tgctccacaa aacttggtta 3480
aacaagctca attgactgcc gctactaacg ctaaacaata a 3521
<210> 144
<211> 571
<212> PRT
<213> Bacillus subtilis
<400> 144
Met Leu Thr Lys Ala Thr Lys Glu Gln Lys Ser Leu Val Lys Asn Arg
1 5 10 15
Gly Ala Glu Leu Val Val Asp Cys Leu Val Glu Gln Gly Val Thr His
20 25 30
Val Phe Gly Ile Pro Gly Ala Lys Ile Asp Ala Val Phe Asp Ala Leu
35 40 45
Gln Asp Lys Gly Pro Glu Ile Ile Val Ala Arg His Glu Gln Asn Ala
50 55 60
Ala Phe Met Ala Gln Ala Val Gly Arg Leu Thr Gly Lys Pro Gly Val
65 70 75 80
Val Leu Val Thr Ser Gly Pro Gly Ala Ser Asn Leu Ala Thr Gly Leu
85 90 95
Leu Thr Ala Asn Thr Glu Gly Asp Pro Val Val Ala Leu Ala Gly Asn
100 105 110
Val Ile Arg Ala Asp Arg Leu Lys Arg Thr His Gln Ser Leu Asp Asn
115 120 125
Ala Ala Leu Phe Gln Pro Ile Thr Lys Tyr Ser Val Glu Val Gln Asp
130 135 140
Val Lys Asn Ile Pro Glu Ala Val Thr Asn Ala Phe Arg Ile Ala Ser
145 150 155 160
Ala Gly Gln Ala Gly Ala Ala Phe Val Ser Phe Pro Gln Asp Val Val
165 170 175
Asn Glu Val Thr Asn Thr Lys Asn Val Arg Ala Val Ala Ala Pro Lys
180 185 190
Leu Gly Pro Ala Ala Asp Asp Ala Ile Ser Ala Ala Ile Ala Lys Ile
195 200 205
Gln Thr Ala Lys Leu Pro Val Val Leu Val Gly Met Lys Gly Gly Arg
210 215 220
Pro Glu Ala Ile Lys Ala Val Arg Lys Leu Leu Lys Lys Val Gln Leu
225 230 235 240
Pro Phe Val Glu Thr Tyr Gln Ala Ala Gly Thr Leu Ser Arg Asp Leu
245 250 255
Glu Asp Gln Tyr Phe Gly Arg Ile Gly Leu Phe Arg Asn Gln Pro Gly
260 265 270
Asp Leu Leu Leu Glu Gln Ala Asp Val Val Leu Thr Ile Gly Tyr Asp
275 280 285
Pro Ile Glu Tyr Asp Pro Lys Phe Trp Asn Ile Asn Gly Asp Arg Thr
290 295 300
Ile Ile His Leu Asp Glu Ile Ile Ala Asp Ile Asp His Ala Tyr Gln
305 310 315 320
Pro Asp Leu Glu Leu Ile Gly Asp Ile Pro Ser Thr Ile Asn His Ile
325 330 335
Glu His Asp Ala Val Lys Val Glu Phe Ala Glu Arg Glu Gln Lys Ile
340 345 350
Leu Ser Asp Leu Lys Gln Tyr Met His Glu Gly Glu Gln Val Pro Ala
355 360 365
Asp Trp Lys Ser Asp Arg Ala His Pro Leu Glu Ile Val Lys Glu Leu
370 375 380
Arg Asn Ala Val Asp Asp His Val Thr Val Thr Cys Asp Ile Gly Ser
385 390 395 400
His Ala Ile Trp Met Ser Arg Tyr Phe Arg Ser Tyr Glu Pro Leu Thr
405 410 415
Leu Met Ile Ser Asn Gly Met Gln Thr Leu Gly Val Ala Leu Pro Trp
420 425 430
Ala Ile Gly Ala Ser Leu Val Lys Pro Gly Glu Lys Val Val Ser Val
435 440 445
Ser Gly Asp Gly Gly Phe Leu Phe Ser Ala Met Glu Leu Glu Thr Ala
450 455 460
Val Arg Leu Lys Ala Pro Ile Val His Ile Val Trp Asn Asp Ser Thr
465 470 475 480
Tyr Asp Met Val Ala Phe Gln Gln Leu Lys Lys Tyr Asn Arg Thr Ser
485 490 495
Ala Val Asp Phe Gly Asn Ile Asp Ile Val Lys Tyr Ala Glu Ser Phe
500 505 510
Gly Ala Thr Gly Leu Arg Val Glu Ser Pro Asp Gln Leu Ala Asp Val
515 520 525
Leu Arg Gln Gly Met Asn Ala Glu Gly Pro Val Ile Ile Asp Val Pro
530 535 540
Val Asp Tyr Ser Asp Asn Ile Asn Leu Ala Ser Asp Lys Leu Pro Lys
545 550 555 560
Glu Phe Gly Glu Leu Met Lys Thr Lys Ala Leu
565 570
<210> 145
<211> 340
<212> PRT
<213> Lactococcus lactis
<400> 145
Met Ala Val Thr Met Tyr Tyr Glu Asp Asp Val Glu Val Ser Ala Leu
1 5 10 15
Ala Gly Lys Gln Ile Ala Val Ile Gly Tyr Gly Ser Gln Gly His Ala
20 25 30
His Ala Gln Asn Leu Arg Asp Ser Gly His Asn Val Ile Ile Gly Val
35 40 45
Arg His Gly Lys Ser Phe Asp Lys Ala Lys Glu Asp Gly Phe Glu Thr
50 55 60
Phe Glu Val Gly Glu Ala Val Ala Lys Ala Asp Val Ile Met Val Leu
65 70 75 80
Ala Pro Asp Glu Leu Gln Gln Ser Ile Tyr Glu Glu Asp Ile Lys Pro
85 90 95
Asn Leu Lys Ala Gly Ser Ala Leu Gly Phe Ala His Gly Phe Asn Ile
100 105 110
His Phe Gly Tyr Ile Lys Val Pro Glu Asp Val Asp Val Phe Met Val
115 120 125
Ala Pro Lys Ala Pro Gly His Leu Val Arg Arg Thr Tyr Thr Glu Gly
130 135 140
Phe Gly Thr Pro Ala Leu Phe Val Ser His Gln Asn Ala Ser Gly His
145 150 155 160
Ala Arg Glu Ile Ala Met Asp Trp Ala Lys Gly Ile Gly Cys Ala Arg
165 170 175
Val Gly Ile Ile Glu Thr Thr Phe Lys Glu Glu Thr Glu Glu Asp Leu
180 185 190
Phe Gly Glu Gln Ala Val Leu Cys Gly Gly Leu Thr Ala Leu Val Glu
195 200 205
Ala Gly Phe Glu Thr Leu Thr Glu Ala Gly Tyr Ala Gly Glu Leu Ala
210 215 220
Tyr Phe Glu Val Leu His Glu Met Lys Leu Ile Val Asp Leu Met Tyr
225 230 235 240
Glu Gly Gly Phe Thr Lys Met Arg Gln Ser Ile Ser Asn Thr Ala Glu
245 250 255
Phe Gly Asp Tyr Val Thr Gly Pro Arg Ile Ile Thr Asp Glu Val Lys
260 265 270
Lys Asn Met Lys Leu Val Leu Ala Asp Ile Gln Ser Gly Lys Phe Ala
275 280 285
Gln Asp Phe Val Asp Asp Phe Lys Ala Gly Arg Pro Lys Leu Ile Ala
290 295 300
Tyr Arg Glu Ala Ala Lys Asn Leu Glu Ile Glu Lys Ile Gly Ala Glu
305 310 315 320
Leu Arg Gln Ala Met Pro Phe Thr Gln Ser Gly Asp Asp Asp Ala Phe
325 330 335
Lys Ile Tyr Gln
340
<210> 146
<211> 571
<212> PRT
<213> Streptococcus mutans
<400> 146
Met Thr Asp Lys Lys Thr Leu Lys Asp Leu Arg Asn Arg Ser Ser Val
1 5 10 15
Tyr Asp Ser Met Val Lys Ser Pro Asn Arg Ala Met Leu Arg Ala Thr
20 25 30
Gly Met Gln Asp Glu Asp Phe Glu Lys Pro Ile Val Gly Val Ile Ser
35 40 45
Thr Trp Ala Glu Asn Thr Pro Cys Asn Ile His Leu His Asp Phe Gly
50 55 60
Lys Leu Ala Lys Val Gly Val Lys Glu Ala Gly Ala Trp Pro Val Gln
65 70 75 80
Phe Gly Thr Ile Thr Val Ser Asp Gly Ile Ala Met Gly Thr Gln Gly
85 90 95
Met Arg Phe Ser Leu Thr Ser Arg Asp Ile Ile Ala Asp Ser Ile Glu
100 105 110
Ala Ala Met Gly Gly His Asn Ala Asp Ala Phe Val Ala Ile Gly Gly
115 120 125
Cys Asp Lys Asn Met Pro Gly Ser Val Ile Ala Met Ala Asn Met Asp
130 135 140
Ile Pro Ala Ile Phe Ala Tyr Gly Gly Thr Ile Ala Pro Gly Asn Leu
145 150 155 160
Asp Gly Lys Asp Ile Asp Leu Val Ser Val Phe Glu Gly Val Gly His
165 170 175
Trp Asn His Gly Asp Met Thr Lys Glu Glu Val Lys Ala Leu Glu Cys
180 185 190
Asn Ala Cys Pro Gly Pro Gly Gly Cys Gly Gly Met Tyr Thr Ala Asn
195 200 205
Thr Met Ala Thr Ala Ile Glu Val Leu Gly Leu Ser Leu Pro Gly Ser
210 215 220
Ser Ser His Pro Ala Glu Ser Ala Glu Lys Lys Ala Asp Ile Glu Glu
225 230 235 240
Ala Gly Arg Ala Val Val Lys Met Leu Glu Met Gly Leu Lys Pro Ser
245 250 255
Asp Ile Leu Thr Arg Glu Ala Phe Glu Asp Ala Ile Thr Val Thr Met
260 265 270
Ala Leu Gly Gly Ser Thr Asn Ser Thr Leu His Leu Leu Ala Ile Ala
275 280 285
His Ala Ala Asn Val Glu Leu Thr Leu Asp Asp Phe Asn Thr Phe Gln
290 295 300
Glu Lys Val Pro His Leu Ala Asp Leu Lys Pro Ser Gly Gln Tyr Val
305 310 315 320
Phe Gln Asp Leu Tyr Lys Val Gly Gly Val Pro Ala Val Met Lys Tyr
325 330 335
Leu Leu Lys Asn Gly Phe Leu His Gly Asp Arg Ile Thr Cys Thr Gly
340 345 350
Lys Thr Val Ala Glu Asn Leu Lys Ala Phe Asp Asp Leu Thr Pro Gly
355 360 365
Gln Lys Val Ile Met Pro Leu Glu Asn Pro Lys Arg Glu Asp Gly Pro
370 375 380
Leu Ile Ile Leu His Gly Asn Leu Ala Pro Asp Gly Ala Val Ala Lys
385 390 395 400
Val Ser Gly Val Lys Val Arg Arg His Val Gly Pro Ala Lys Val Phe
405 410 415
Asn Ser Glu Glu Glu Ala Ile Glu Ala Val Leu Asn Asp Asp Ile Val
420 425 430
Asp Gly Asp Val Val Val Val Arg Phe Val Gly Pro Lys Gly Gly Pro
435 440 445
Gly Met Pro Glu Met Leu Ser Leu Ser Ser Met Ile Val Gly Lys Gly
450 455 460
Gln Gly Glu Lys Val Ala Leu Leu Thr Asp Gly Arg Phe Ser Gly Gly
465 470 475 480
Thr Tyr Gly Leu Val Val Gly His Ile Ala Pro Glu Ala Gln Asp Gly
485 490 495
Gly Pro Ile Ala Tyr Leu Gln Thr Gly Asp Ile Val Thr Ile Asp Gln
500 505 510
Asp Thr Lys Glu Leu His Phe Asp Ile Ser Asp Glu Glu Leu Lys His
515 520 525
Arg Gln Glu Thr Ile Glu Leu Pro Pro Leu Tyr Ser Arg Gly Ile Leu
530 535 540
Gly Lys Tyr Ala His Ile Val Ser Ser Ala Ser Arg Gly Ala Val Thr
545 550 555 560
Asp Phe Trp Lys Pro Glu Glu Thr Gly Lys Lys
565 570
<210> 147
<211> 548
<212> PRT
<213> Lactococcus lactis
<400> 147
Met Tyr Thr Val Gly Asp Tyr Leu Leu Asp Arg Leu His Glu Leu Gly
1 5 10 15
Ile Glu Glu Ile Phe Gly Val Pro Gly Asp Tyr Asn Leu Gln Phe Leu
20 25 30
Asp Gln Ile Ile Ser His Lys Asp Met Lys Trp Val Gly Asn Ala Asn
35 40 45
Glu Leu Asn Ala Ser Tyr Met Ala Asp Gly Tyr Ala Arg Thr Lys Lys
50 55 60
Ala Ala Ala Phe Leu Thr Thr Phe Gly Val Gly Glu Leu Ser Ala Val
65 70 75 80
Asn Gly Leu Ala Gly Ser Tyr Ala Glu Asn Leu Pro Val Val Glu Ile
85 90 95
Val Gly Ser Pro Thr Ser Lys Val Gln Asn Glu Gly Lys Phe Val His
100 105 110
His Thr Leu Ala Asp Gly Asp Phe Lys His Phe Met Lys Met His Glu
115 120 125
Pro Val Thr Ala Ala Arg Thr Leu Leu Thr Ala Glu Asn Ala Thr Val
130 135 140
Glu Ile Asp Arg Val Leu Ser Ala Leu Leu Lys Glu Arg Lys Pro Val
145 150 155 160
Tyr Ile Asn Leu Pro Val Asp Val Ala Ala Ala Lys Ala Glu Lys Pro
165 170 175
Ser Leu Pro Leu Lys Lys Glu Asn Ser Thr Ser Asn Thr Ser Asp Gln
180 185 190
Glu Ile Leu Asn Lys Ile Gln Glu Ser Leu Lys Asn Ala Lys Lys Pro
195 200 205
Ile Val Ile Thr Gly His Glu Ile Ile Ser Phe Gly Leu Glu Lys Thr
210 215 220
Val Thr Gln Phe Ile Ser Lys Thr Lys Leu Pro Ile Thr Thr Leu Asn
225 230 235 240
Phe Gly Lys Ser Ser Val Asp Glu Ala Leu Pro Ser Phe Leu Gly Ile
245 250 255
Tyr Asn Gly Thr Leu Ser Glu Pro Asn Leu Lys Glu Phe Val Glu Ser
260 265 270
Ala Asp Phe Ile Leu Met Leu Gly Val Lys Leu Thr Asp Ser Ser Thr
275 280 285
Gly Ala Phe Thr His His Leu Asn Glu Asn Lys Met Ile Ser Leu Asn
290 295 300
Ile Asp Glu Gly Lys Ile Phe Asn Glu Arg Ile Gln Asn Phe Asp Phe
305 310 315 320
Glu Ser Leu Ile Ser Ser Leu Leu Asp Leu Ser Glu Ile Glu Tyr Lys
325 330 335
Gly Lys Tyr Ile Asp Lys Lys Gln Glu Asp Phe Val Pro Ser Asn Ala
340 345 350
Leu Leu Ser Gln Asp Arg Leu Trp Gln Ala Val Glu Asn Leu Thr Gln
355 360 365
Ser Asn Glu Thr Ile Val Ala Glu Gln Gly Thr Ser Phe Phe Gly Ala
370 375 380
Ser Ser Ile Phe Leu Lys Ser Lys Ser His Phe Ile Gly Gln Pro Leu
385 390 395 400
Trp Gly Ser Ile Gly Tyr Thr Phe Pro Ala Ala Leu Gly Ser Gln Ile
405 410 415
Ala Asp Lys Glu Ser Arg His Leu Leu Phe Ile Gly Asp Gly Ser Leu
420 425 430
Gln Leu Thr Val Gln Glu Leu Gly Leu Ala Ile Arg Glu Lys Ile Asn
435 440 445
Pro Ile Cys Phe Ile Ile Asn Asn Asp Gly Tyr Thr Val Glu Arg Glu
450 455 460
Ile His Gly Pro Asn Gln Ser Tyr Asn Asp Ile Pro Met Trp Asn Tyr
465 470 475 480
Ser Lys Leu Pro Glu Ser Phe Gly Ala Thr Glu Asp Arg Val Val Ser
485 490 495
Lys Ile Val Arg Thr Glu Asn Glu Phe Val Ser Val Met Lys Glu Ala
500 505 510
Gln Ala Asp Pro Asn Arg Met Tyr Trp Ile Glu Leu Ile Leu Ala Lys
515 520 525
Glu Gly Ala Pro Lys Val Leu Lys Lys Met Gly Lys Leu Phe Ala Glu
530 535 540
Gln Asn Lys Ser
545
<210> 148
<211> 375
<212> PRT
<213> Equus caballus
<400> 148
Met Ser Thr Ala Gly Lys Val Ile Lys Cys Lys Ala Ala Val Leu Trp
1 5 10 15
Glu Glu Lys Lys Pro Phe Ser Ile Glu Glu Val Glu Val Ala Pro Pro
20 25 30
Lys Ala His Glu Val Arg Ile Lys Met Val Ala Thr Gly Ile Cys Arg
35 40 45
Ser Asp Asp His Val Val Ser Gly Thr Leu Val Thr Pro Leu Pro Val
50 55 60
Ile Ala Gly His Glu Ala Ala Gly Ile Val Glu Ser Ile Gly Glu Gly
65 70 75 80
Val Thr Thr Val Arg Pro Gly Asp Lys Val Ile Pro Leu Phe Thr Pro
85 90 95
Gln Cys Gly Lys Cys Arg Val Cys Lys His Pro Glu Gly Asn Phe Cys
100 105 110
Leu Lys Asn Asp Leu Ser Met Pro Arg Gly Thr Met Gln Asp Gly Thr
115 120 125
Ser Arg Phe Thr Cys Arg Gly Lys Pro Ile His His Phe Leu Gly Thr
130 135 140
Ser Thr Phe Ser Gln Tyr Thr Val Val Asp Glu Ile Ser Val Ala Lys
145 150 155 160
Ile Asp Ala Ala Ser Pro Leu Glu Lys Val Cys Leu Ile Gly Cys Gly
165 170 175
Phe Ser Thr Gly Tyr Gly Ser Ala Val Lys Val Ala Lys Val Thr Gln
180 185 190
Gly Ser Thr Cys Ala Val Phe Gly Leu Gly Gly Val Gly Leu Ser Val
195 200 205
Ile Met Gly Cys Lys Ala Ala Gly Ala Ala Arg Ile Ile Gly Val Asp
210 215 220
Ile Asn Lys Asp Lys Phe Ala Lys Ala Lys Glu Val Gly Ala Thr Glu
225 230 235 240
Cys Val Asn Pro Gln Asp Tyr Lys Lys Pro Ile Gln Glu Val Leu Thr
245 250 255
Glu Met Ser Asn Gly Gly Val Asp Phe Ser Phe Glu Val Ile Gly Arg
260 265 270
Leu Asp Thr Met Val Thr Ala Leu Ser Cys Cys Gln Glu Ala Tyr Gly
275 280 285
Val Ser Val Ile Val Gly Val Pro Pro Asp Ser Gln Asn Leu Ser Met
290 295 300
Asn Pro Met Leu Leu Leu Ser Gly Arg Thr Trp Lys Gly Ala Ile Phe
305 310 315 320
Gly Gly Phe Lys Ser Lys Asp Ser Val Pro Lys Leu Val Ala Asp Phe
325 330 335
Met Ala Lys Lys Phe Ala Leu Asp Pro Leu Ile Thr His Val Leu Pro
340 345 350
Phe Glu Lys Ile Asn Glu Gly Phe Asp Leu Leu Arg Ser Gly Glu Ser
355 360 365
Ile Arg Thr Ile Leu Thr Phe
370 375
<210> 149
<211> 348
<212> PRT
<213> Achromobacter xylosoxidans
<400> 149
Met Lys Ala Leu Val Tyr His Gly Asp His Lys Ile Ser Leu Glu Asp
1 5 10 15
Lys Pro Lys Pro Thr Leu Gln Lys Pro Thr Asp Val Val Val Arg Val
20 25 30
Leu Lys Thr Thr Ile Cys Gly Thr Asp Leu Gly Ile Tyr Lys Gly Lys
35 40 45
Asn Pro Glu Val Ala Asp Gly Arg Ile Leu Gly His Glu Gly Val Gly
50 55 60
Val Ile Glu Glu Val Gly Glu Ser Val Thr Gln Phe Lys Lys Gly Asp
65 70 75 80
Lys Val Leu Ile Ser Cys Val Thr Ser Cys Gly Ser Cys Asp Tyr Cys
85 90 95
Lys Lys Gln Leu Tyr Ser His Cys Arg Asp Gly Gly Trp Ile Leu Gly
100 105 110
Tyr Met Ile Asp Gly Val Gln Ala Glu Tyr Val Arg Ile Pro His Ala
115 120 125
Asp Asn Ser Leu Tyr Lys Ile Pro Gln Thr Ile Asp Asp Glu Ile Ala
130 135 140
Val Leu Leu Ser Asp Ile Leu Pro Thr Gly His Glu Ile Gly Val Gln
145 150 155 160
Tyr Gly Asn Val Gln Pro Gly Asp Ala Val Ala Ile Val Gly Ala Gly
165 170 175
Pro Val Gly Met Ser Val Leu Leu Thr Ala Gln Phe Tyr Ser Pro Ser
180 185 190
Thr Ile Ile Val Ile Asp Met Asp Glu Asn Arg Leu Gln Leu Ala Lys
195 200 205
Glu Leu Gly Ala Thr His Thr Ile Asn Ser Gly Thr Glu Asn Val Val
210 215 220
Glu Ala Val His Arg Ile Ala Ala Glu Gly Val Asp Val Ala Ile Glu
225 230 235 240
Ala Val Gly Ile Pro Ala Thr Trp Asp Ile Cys Gln Glu Ile Val Lys
245 250 255
Pro Gly Ala His Ile Ala Asn Val Gly Val His Gly Val Lys Val Asp
260 265 270
Phe Glu Ile Gln Lys Leu Trp Ile Lys Asn Leu Thr Ile Thr Thr Gly
275 280 285
Leu Val Asn Thr Asn Thr Thr Pro Met Leu Met Lys Val Ala Ser Thr
290 295 300
Asp Lys Leu Pro Leu Lys Lys Met Ile Thr His Arg Phe Glu Leu Ala
305 310 315 320
Glu Ile Glu His Ala Tyr Gln Val Phe Leu Asn Gly Ala Lys Glu Lys
325 330 335
Ala Met Lys Ile Ile Leu Ser Asn Ala Gly Ala Ala
340 345
<210> 150
<211> 2686
<212> DNA
<213> Artificial sequence
<220>
<223> Plasmid
<400> 150
tcgcgcgttt cggtgatgac ggtgaaaacc tctgacacat gcagctcccg gagacggtca 60
cagcttgtct gtaagcggat gccgggagca gacaagcccg tcagggcgcg tcagcgggtg 120
ttggcgggtg tcggggctgg cttaactatg cggcatcaga gcagattgta ctgagagtgc 180
accatatgcg gtgtgaaata ccgcacagat gcgtaaggag aaaataccgc atcaggcgcc 240
attcgccatt caggctgcgc aactgttggg aagggcgatc ggtgcgggcc tcttcgctat 300
tacgccagct ggcgaaaggg ggatgtgctg caaggcgatt aagttgggta acgccagggt 360
tttcccagtc acgacgttgt aaaacgacgg ccagtgaatt cgagctcggt acccggggat 420
cctctagagt cgacctgcag gcatgcaagc ttggcgtaat catggtcata gctgtttcct 480
gtgtgaaatt gttatccgct cacaattcca cacaacatac gagccggaag cataaagtgt 540
aaagcctggg gtgcctaatg agtgagctaa ctcacattaa ttgcgttgcg ctcactgccc 600
gctttccagt cgggaaacct gtcgtgccag ctgcattaat gaatcggcca acgcgcgggg 660
agaggcggtt tgcgtattgg gcgctcttcc gcttcctcgc tcactgactc gctgcgctcg 720
gtcgttcggc tgcggcgagc ggtatcagct cactcaaagg cggtaatacg gttatccaca 780
gaatcagggg ataacgcagg aaagaacatg tgagcaaaag gccagcaaaa ggccaggaac 840
cgtaaaaagg ccgcgttgct ggcgtttttc cataggctcc gcccccctga cgagcatcac 900
aaaaatcgac gctcaagtca gaggtggcga aacccgacag gactataaag ataccaggcg 960
tttccccctg gaagctccct cgtgcgctct cctgttccga ccctgccgct taccggatac 1020
ctgtccgcct ttctcccttc gggaagcgtg gcgctttctc atagctcacg ctgtaggtat 1080
ctcagttcgg tgtaggtcgt tcgctccaag ctgggctgtg tgcacgaacc ccccgttcag 1140
cccgaccgct gcgccttatc cggtaactat cgtcttgagt ccaacccggt aagacacgac 1200
ttatcgccac tggcagcagc cactggtaac aggattagca gagcgaggta tgtaggcggt 1260
gctacagagt tcttgaagtg gtggcctaac tacggctaca ctagaaggac agtatttggt 1320
atctgcgctc tgctgaagcc agttaccttc ggaaaaagag ttggtagctc ttgatccggc 1380
aaacaaacca ccgctggtag cggtggtttt tttgtttgca agcagcagat tacgcgcaga 1440
aaaaaaggat ctcaagaaga tcctttgatc ttttctacgg ggtctgacgc tcagtggaac 1500
gaaaactcac gttaagggat tttggtcatg agattatcaa aaaggatctt cacctagatc 1560
cttttaaatt aaaaatgaag ttttaaatca atctaaagta tatatgagta aacttggtct 1620
gacagttacc aatgcttaat cagtgaggca cctatctcag cgatctgtct atttcgttca 1680
tccatagttg cctgactccc cgtcgtgtag ataactacga tacgggaggg cttaccatct 1740
ggccccagtg ctgcaatgat accgcgagac ccacgctcac cggctccaga tttatcagca 1800
ataaaccagc cagccggaag ggccgagcgc agaagtggtc ctgcaacttt atccgcctcc 1860
atccagtcta ttaattgttg ccgggaagct agagtaagta gttcgccagt taatagtttg 1920
cgcaacgttg ttgccattgc tacaggcatc gtggtgtcac gctcgtcgtt tggtatggct 1980
tcattcagct ccggttccca acgatcaagg cgagttacat gatcccccat gttgtgcaaa 2040
aaagcggtta gctccttcgg tcctccgatc gttgtcagaa gtaagttggc cgcagtgtta 2100
tcactcatgg ttatggcagc actgcataat tctcttactg tcatgccatc cgtaagatgc 2160
ttttctgtga ctggtgagta ctcaaccaag tcattctgag aatagtgtat gcggcgaccg 2220
agttgctctt gcccggcgtc aatacgggat aataccgcgc cacatagcag aactttaaaa 2280
gtgctcatca ttggaaaacg ttcttcgggg cgaaaactct caaggatctt accgctgttg 2340
agatccagtt cgatgtaacc cactcgtgca cccaactgat cttcagcatc ttttactttc 2400
accagcgttt ctgggtgagc aaaaacagga aggcaaaatg ccgcaaaaaa gggaataagg 2460
gcgacacgga aatgttgaat actcatactc ttcctttttc aatattattg aagcatttat 2520
cagggttatt gtctcatgag cggatacata tttgaatgta tttagaaaaa taaacaaata 2580
ggggttccgc gcacatttcc ccgaaaagtg ccacctgacg tctaagaaac cattattatc 2640
atgacattaa cctataaaaa taggcgtatc acgaggccct ttcgtc 2686
<210> 151
<211> 1685
<212> DNA
<213> Artificial sequence
<220>
<223> Cassette
<400> 151
gtattttggt agattcaatt ctctttccct ttccttttcc ttcgctcccc ttccttatca 60
gcattgcgga ttacgtattc taatgttcag ataacttcgt atagcataca ttatacgaag 120
ttatgcagat tgtactgaga gtgcaccata ccacagcttt tcaattcaat tcatcatttt 180
ttttttattc ttttttttga tttcggtttc tttgaaattt ttttgattcg gtaatctccg 240
aacagaagga agaacgaagg aaggagcaca gacttagatt ggtatatata cgcatatgta 300
gtgttgaaga aacatgaaat tgcccagtat tcttaaccca actgcacaga acaaaaacct 360
gcaggaaacg aagataaatc atgtcgaaag ctacatataa ggaacgtgct gctactcatc 420
ctagtcctgt tgctgccaag ctatttaata tcatgcacga aaagcaaaca aacttgtgtg 480
cttcattgga tgttcgtacc accaaggaat tactggagtt agttgaagca ttaggtccca 540
aaatttgttt actaaaaaca catgtggata tcttgactga tttttccatg gagggcacag 600
ttaagccgct aaaggcatta tccgccaagt acaatttttt actcttcgaa gacagaaaat 660
ttgctgacat tggtaataca gtcaaattgc agtactctgc gggtgtatac agaatagcag 720
aatgggcaga cattacgaat gcacacggtg tggtgggccc aggtattgtt agcggtttga 780
agcaggcggc agaagaagta acaaaggaac ctagaggcct tttgatgtta gcagaattgt 840
catgcaaggg ctccctatct actggagaat atactaaggg tactgttgac attgcgaaga 900
gcgacaaaga ttttgttatc ggctttattg ctcaaagaga catgggtgga agagatgaag 960
gttacgattg gttgattatg acacccggtg tgggtttaga tgacaaggga gacgcattgg 1020
gtcaacagta tagaaccgtg gatgatgtgg tctctacagg atctgacatt attattgttg 1080
gaagaggact atttgcaaag ggaagggatg ctaaggtaga gggtgaacgt tacagaaaag 1140
caggctggga agcatatttg agaagatgcg gccagcaaaa ctaaaaaact gtattataag 1200
taaatgcatg tatactaaac tcacaaatta gagcttcaat ttaattatat cagttattac 1260
cctatgcggt gtgaaatacc gcacagatgc gtaaggagaa aataccgcat caggaaattg 1320
taaacgttaa tattttgtta aaattcgcgt taaatttttg ttaaatcagc tcatttttta 1380
accaataggc cgaaatcggc aaaatccctt ataaatcaaa agaatagacc gagatagggt 1440
tgagtgttgt tccagtttgg aacaagagtc cactattaaa gaacgtggac tccaacgtca 1500
aagggcgaaa aaccgtctat cagggcgatg gcccactacg tgaaccatca ccctaatcaa 1560
gataacttcg tatagcatac attatacgaa gttatccagt gatgatacaa cgagttagcc 1620
aaggtgacac tctccccccc cctccccctc tgatctttcc tgttgcctct ttttccccca 1680
accaa 1685
<210> 152
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer oBP594
<400> 152
agctgtctcg tgttgtgggt tt 22
<210> 153
<211> 49
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer oBP595
<400> 153
cttaataata gaacaatatc atcctttacg ggcatcttat agtgtcgtt 49
<210> 154
<211> 49
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer oBP596
<400> 154
gcgccaacga cactataaga tgcccgtaaa ggatgatatt gttctatta 49
<210> 155
<211> 49
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer oBP597
<400> 155
tatggaccct gaaaccacag ccacattgca acgacgacaa tgccaaacc 49
<210> 156
<211> 49
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer oBP598
<400> 156
tccttggttt ggcattgtcg tcgttgcaat gtggctgtgg tttcagggt 49
<210> 157
<211> 49
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer oBP599
<400> 157
atcctctcgc ggagtccctg ttcagtaaag gccatgaagc tttttcttt 49
<210> 158
<211> 49
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer oBP600
<400> 158
attggaaaga aaaagcttca tggcctttac tgaacaggga ctccgcgag 49
<210> 159
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer oBP601
<400> 159
tcataccaca atcttagacc at 22
<210> 160
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer oBP602
<400> 160
tgttcaaacc cctaaccaac c 21
<210> 161
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer oBP603
<400> 161
tgttcccaca atctattacc ta 22
<210> 162
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer oBP605
<400> 162
tactgaacag ggactccgcg a 21
<210> 163
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer oBP606
<400> 163
tcataccaca atcttagacc a 21
<210> 164
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer oBP562
<400> 164
aattgtttaa acatgtatac agtaggtgac tatc 34
<210> 165
<211> 49
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer oBP563
<400> 165
aatcataaat cataagaaat tcgcttatca gctcttgttt tgttctgca 49
<210> 166
<211> 49
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer oBP564
<400> 166
ttatttgcag aacaaaacaa gagctgataa gcgaatttct tatgattta 49
<210> 167
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer oBP565
<400> 167
aattggccgg ccaaaaaaag catgcacgta taca 34
<210> 168
<211> 32
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer oBP505
<400> 168
aattgagctc actgtagccc tagacttgat ag 32
<210> 169
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer oBP506
<400> 169
aattggcgcg cctgtatatg agatagttga ttgta 35
<210> 170
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer oBP507
<400> 170
aattttaatt aagtctaggt tctttggctg ttcaa 35
<210> 171
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer oBP508
<400> 171
aattgtcgac tttagaagtg tcaacaacgt atc 33
<210> 172
<211> 8366
<212> DNA
<213> Artificial Sequence
<220>
<223> pRS316-UAS(PGK1)-PFBA1-GUS
<400> 172
tcgcgcgttt cggtgatgac ggtgaaaacc tctgacacat gcagctcccg gagacggtca 60
cagcttgtct gtaagcggat gccgggagca gacaagcccg tcagggcgcg tcagcgggtg 120
ttggcgggtg tcggggctgg cttaactatg cggcatcaga gcagattgta ctgagagtgc 180
accacgcttt tcaattcaat tcatcatttt ttttttattc ttttttttga tttcggtttc 240
tttgaaattt ttttgattcg gtaatctccg aacagaagga agaacgaagg aaggagcaca 300
gacttagatt ggtatatata cgcatatgta gtgttgaaga aacatgaaat tgcccagtat 360
tcttaaccca actgcacaga acaaaaacct gcaggaaacg aagataaatc atgtcgaaag 420
ctacatataa ggaacgtgct gctactcatc ctagtcctgt tgctgccaag ctatttaata 480
tcatgcacga aaagcaaaca aacttgtgtg cttcattgga tgttcgtacc accaaggaat 540
tactggagtt agttgaagca ttaggtccca aaatttgttt actaaaaaca catgtggata 600
tcttgactga tttttccatg gagggcacag ttaagccgct aaaggcatta tccgccaagt 660
acaatttttt actcttcgaa gacagaaaat ttgctgacat tggtaataca gtcaaattgc 720
agtactctgc gggtgtatac agaatagcag aatgggcaga cattacgaat gcacacggtg 780
tggtgggccc aggtattgtt agcggtttga agcaggcggc agaagaagta acaaaggaac 840
ctagaggcct tttgatgtta gcagaattgt catgcaaggg ctccctatct actggagaat 900
atactaaggg tactgttgac attgcgaaga gcgacaaaga ttttgttatc ggctttattg 960
ctcaaagaga catgggtgga agagatgaag gttacgattg gttgattatg acacccggtg 1020
tgggtttaga tgacaaggga gacgcattgg gtcaacagta tagaaccgtg gatgatgtgg 1080
tctctacagg atctgacatt attattgttg gaagaggact atttgcaaag ggaagggatg 1140
ctaaggtaga gggtgaacgt tacagaaaag caggctggga agcatatttg agaagatgcg 1200
gccagcaaaa ctaaaaaact gtattataag taaatgcatg tatactaaac tcacaaatta 1260
gagcttcaat ttaattatat cagttattac cctgcggtgt gaaataccgc acagatgcgt 1320
aaggagaaaa taccgcatca ggaaattgta aacgttaata ttttgttaaa attcgcgtta 1380
aatttttgtt aaatcagctc attttttaac caataggccg aaatcggcaa aatcccttat 1440
aaatcaaaag aatagaccga gatagggttg agtgttgttc cagtttggaa caagagtcca 1500
ctattaaaga acgtggactc caacgtcaaa gggcgaaaaa ccgtctatca gggcgatggc 1560
ccactacgtg aaccatcacc ctaatcaagt tttttggggt cgaggtgccg taaagcacta 1620
aatcggaacc ctaaagggag cccccgattt agagcttgac ggggaaagcc ggcgaacgtg 1680
gcgagaaagg aagggaagaa agcgaaagga gcgggcgcta gggcgctggc aagtgtagcg 1740
gtcacgctgc gcgtaaccac cacacccgcc gcgcttaatg cgccgctaca gggcgcgtcg 1800
cgccattcgc cattcaggct gcgcaactgt tgggaagggc gatcggtgcg ggcctcttcg 1860
ctattacgcc agctggcgaa ggggggatgt gctgcaaggc gattaagttg ggtaacgcca 1920
gggttttccc agtcacgacg ttgtaaaacg acggccagtg aattgtaata cgactcacta 1980
tagggcgaat tggagctcca ccgcggtggt ttaacgtata gacttctaat atatttctcc 2040
atacttggta ttttttattc acttttttta tacatatttg gtttttttat acaatatcaa 2100
aaatcaataa taattaattt aataacaaga atatgttgct gtgatgactc ttaatataca 2160
attgggaagc attcaaggat tggtacgacg tttgctttct gataattaaa cgcttggcgt 2220
ttaatctttt ttgccgatta ataatattat tattaccctc ttatttatta gcattgtctt 2280
ccgtactaaa aggagtaggg aaaaaggcga agtagagtga cacgtccatt acccagcgct 2340
tcataagaat ccatcaggta tattaaattg tgatgggaga acaaaacaaa ttgtactatg 2400
atgtcgagaa attggtgaat tctttgcagg aaagttttga cctggattgc gcgcaaagtg 2460
tatcactttt caccagtaaa tcaaggagca atgaggcttg gttggaagag ctagagaata 2520
aattcaagtt aaaagatgat gttgaacttg atgatgtgga aaatttaaga gccgaaattg 2580
acatgaagtt aaatatgttg gaggataaag taagctacta tgaaagactt tacaaagaac 2640
tcgaagagtt ccagaatgaa ataaaaatta aaacagttgt gaataacaga agacaatcgc 2700
gaactccaaa atgagctatc aaaaacgata gatcgattag gatgactttg aaatgactcc 2760
gcagtggact ggccgttaat ttcaagcgtg agtaaaatag tgcatgacaa aagatgagct 2820
aggcttttgt aaaaatatct tacgttgtaa aattttagaa atcattattt ccttcatatc 2880
attttgtcat tgaccttcag aagaaaagag ccgaccaata atataaataa ataaataaaa 2940
ataatattcc attatttcta aacagattca atactcatta aaaaactata tcaattaatt 3000
tgaattaacg cggccgctct agttaattaa tcattgtttg cctccctgct gcggtttttc 3060
accgaagttc atgccagtcc agcgtttttg cagcagaaaa gccgccgact tcggtttgcg 3120
gtcgcgagtg aagatccctt tcttgttacc gccaacgcgc aatatgcctt gcgaggtcgc 3180
aaaatcggcg aaattccata cctgttcacc gacgacggcg ctgacgcgat caaagacgcg 3240
gtgatacata tccagccatg cacactgata ctcttcactc cacatgtcgg tgtacattga 3300
gtgcagcccg gctaacgtat ccacgccgta ttcggtgatg ataatcggct gatgcagttt 3360
ctcctgccag gccagaagtt ctttttccag taccttctct gccgtttcca aatcgccgct 3420
ttggacatac catccgtaat aacggttcag gcacagcaca tcaaagagat cgctgatggt 3480
atcggtgtga gcgtcgcaga acattacatt gacgcaggtg atcggacgcg tcgggtcgag 3540
tttacgcgtt gcttccgcca gtggcgcgaa atattcccgt gcaccttgcg gacgggtatc 3600
cggttcgttg gcaatactcc acatcaccac gcttgggtgg tttttgtcac gcgctatcag 3660
ctctttaatc gcctgtaagt gcgcttgctg agtttccccg ttgactgcct cttcgctgta 3720
cagttctttc ggcttgttgc ccgcttcgaa accaatgcct aaagagaggt taaagccgac 3780
agcagcagtt tcatcaatca ccacgatgcc atgttcatct gcccagtcga gcatctcttc 3840
agcgtaaggg taatgcgagg tacggtagga gttggcccca atccagtcca ttaatgcgtg 3900
gtcgtgcacc atcagcacgt tatcgaatcc tttgccacgc aagtccgcat cttcatgacg 3960
accaaagcca gtaaagtaga acggtttgtg gttaatcagg aactgttcgc ccttcactgc 4020
cactgaccgg atgccgacgc gaagcgggta gatatcacac tctgtctggc ttttggctgt 4080
gacgcacagt tcatagagat aaccttcacc cggttgccag aggtgcggat tcaccacttg 4140
caaagtcccg ctagtgcctt gtccagttgc aaccacctgt tgatccgcat cacgcagttc 4200
aacgctgaca tcaccattgg ccaccacctg ccagtcaaca gacgcgtggt tacagtcttg 4260
cgcgacatgc gtcaccacgg tgatatcgtc cacccaggtg ttcggcgtgg tgtagagcat 4320
tacgctgcga tggattccgg catagttaaa gaaatcatgg aagtaagact gctttttctt 4380
gccgttttcg tcggtaatca ccattcccgg cgggatagtc tgccagttca gttcgttgtt 4440
cacacaaacg gtgatacgta cacttttccc ggcaataaca tacggcgtga catcggcttc 4500
aaatggagta tagccgccct gatgctccat cacttcctga ttattgaccc acactttgcc 4560
gtaatgagtg accgcatcga aacgcagcac gatacgctgg cctgcccaac ctttcggtat 4620
aaagacttcg cgctgatacc agacgttgcc cgcataatta cgaatatctg catcggcgaa 4680
ctgatcgtta aaactgcctg gcacagcaat tgcccggctt tcttgtaacg cgctttccca 4740
ccaacgctga tcaattccac agttttcgcg atccagactg aatgcccaca ggccgtcgag 4800
ttttttgatt tcacgggttg gggtttctac aggacgtacc atactagttt gaatatgtat 4860
tacttggtta tggttatata tgacaaaaga aaaagaagaa cagaagaata acgcaaggaa 4920
gaacaataac tgaaattgat agagaagtat tatgtctttg tctttttata ataaatcaag 4980
tgcagaaatc cgttagacaa catgagggat aaaatttaac gtgggcgaag aagaaggaaa 5040
aaagtttttg tgagggcgta attgaagcga tctgttgatt gtagattttt tttttttgag 5100
gagtcaaagt cagaagagaa cagacaaatg gtattaacca tccaatactt ttttggagca 5160
acgctaagct catgcttttc cattggttac gtgctcagtt gttagatatg gaaagagagg 5220
atgctcacgg cagcgtgact ccaattgagc ccgaaagaga ggatgccacg ttttcccgac 5280
ggctgctaga atggaaaaag gaaaaataga agaatcccat tcctatcatt atttacgtaa 5340
tgacccacac atttttgaga ttttcaacta ttacgtatta cgataatcct gctgtcatta 5400
tcattattat ctatatcgac gtatgcaacg tatgtgaagc caagtaggcg tcgacaggac 5460
cttgttgtgt gacgaaattg gaagctgcaa tcaataggaa gacaggaagt cgagcgtgtc 5520
tgggtttttt cagttttgtt ctttttgcaa acaaatcacg agcgacggta attggtaccc 5580
agcttttgtt ccctttagtg agggttaatt ccgagcttgg cgtaatcatg gtcatagctg 5640
tttcctgtgt gaaattgtta tccgctcaca attccacaca acataggagc cggaagcata 5700
aagtgtaaag cctggggtgc ctaatgagtg aggtaactca cattaattgc gttgcgctca 5760
ctgcccgctt tccagtcggg aaacctgtcg tgccagctgc attaatgaat cggccaacgc 5820
gcggggagag gcggtttgcg tattgggcgc tcttccgctt cctcgctcac tgactcgctg 5880
cgctcggtcg ttcggctgcg gcgagcggta tcagctcact caaaggcggt aatacggtta 5940
tccacagaat caggggataa cgcaggaaag aacatgtgag caaaaggcca gcaaaaggcc 6000
aggaaccgta aaaaggccgc gttgctggcg tttttccata ggctcggccc ccctgacgag 6060
catcacaaaa atcgacgctc aagtcagagg tggcgaaacc cgacaggact ataaagatac 6120
caggcgttcc cccctggaag ctccctcgtg cgctctcctg ttccgaccct gccgcttacc 6180
ggatacctgt ccgcctttct cccttcggga agcgtggcgc tttctcaatg ctcacgctgt 6240
aggtatctca gttcggtgta ggtcgttcgc tccaagctgg gctgtgtgca cgaacccccc 6300
gttcagcccg accgctgcgc cttatccggt aactatcgtc ttgagtccaa cccggtaaga 6360
cacgacttat cgccactggc agcagccact ggtaacagga ttagcagagc gaggtatgta 6420
ggcggtgcta cagagttctt gaagtggtgg cctaactacg gctacactag aaggacagta 6480
tttggtatct gcgctctgct gaagccagtt accttcggaa aaagagttgg tagctcttga 6540
tccggcaaac aaaccaccgc tggtagcggt ggtttttttg tttgcaagca gcagattacg 6600
cgcagaaaaa aaggatctca agaagatcct ttgatctttt ctacggggtc tgacgctcag 6660
tggaacgaaa actcacgtta agggattttg gtcatgagat tatcaaaaag gatcttcacc 6720
tagatccttt taaattaaaa atgaagtttt aaatcaatct aaagtatata tgagtaaact 6780
tggtctgaca gttaccaatg cttaatcagt gaggcaccta tctcagcgat ctgtctattt 6840
cgttcatcca tagttgcctg actgcccgtc gtgtagataa ctacgatacg ggagggctta 6900
ccatctggcc ccagtgctgc aatgataccg cgagacccac gctcaccggc tccagattta 6960
tcagcaataa accagccagc cggaagggcc gagcgcagaa gtggtcctgc aactttatcc 7020
gcctccatcc agtctattaa ttgttgccgg gaagctagag taagtagttc gccagttaat 7080
agtttgcgca acgttgttgc cattgctaca ggcatcgtgg tgtcacgctc gtcgtttggt 7140
atggcttcat tcagctccgg ttcccaacga tcaaggcgag ttacatgatc ccccatgttg 7200
tgaaaaaaag cggttagctc cttcggtcct ccgatcgttg tcagaagtaa gttggccgca 7260
gtgttatcac tcatggttat ggcagcactg cataattctc ttactgtcat gccatccgta 7320
agatgctttt ctgtgactgg tgagtactca accaagtcat tctgagaata gtgtatgcgg 7380
cgaccgagtt gctcttgccc ggcgtcaata cgggataata ccgcgccaca tagcagaact 7440
ttaaaagtgc tcatcattgg aaaacgttct tcggggcgaa aactctcaag gatcttaccg 7500
ctgttgagat ccagttcgat gtaacccact cgtgcaccca actgatcttc agcatctttt 7560
actttcacca gcgtttctgg gtgagcaaaa acaggaaggc aaaatgccgc aaaaaaggga 7620
ataagggcga cacggaaatg ttgaatactc atactcttcc tttttcaata ttattgaagc 7680
atttatcagg gttattgtct catgagcgga tacatatttg aatgtattta gaaaaataaa 7740
caaatagggg ttccgcgcac atttccccga aaagtgccac ctgggtcctt ttcatcacgt 7800
gctataaaaa taattataat ttaaattttt taatataaat atataaatta aaaatagaaa 7860
gtaaaaaaag aaattaaaga aaaaatagtt tttgttttcc gaagatgtaa aagactctag 7920
ggggatcgcc aacaaatact accttttatc ttgctcttcc tgctctcagg tattaatgcc 7980
gaattgtttc atcttgtctg tgtagaagac cacacacgaa aatcctgtga ttttacattt 8040
tacttatcgt taatcgaatg tatatctatt taatctgctt ttcttgtcta ataaatatat 8100
atgtaaagta cgctttttgt tgaaattttt taaacctttg tttatttttt tttcttcatt 8160
ccgtaactct tctaccttct ttatttactt tctaaaatcc aaatacaaaa cataaaaata 8220
aataaacaca gagtaaattc ccaaattatt ccatcattaa aagatacgag gcgcgtgtaa 8280
gttacaggca agcgatccgt cctaagaaac cattattatc atgacattaa cctataaaaa 8340
taggcgtatc acgaggccct ttcgtc 8366
<210> 173
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer oBP674
<400> 173
aattggcgcg ccaattaccg tcgctcgtga tttg 34
<210> 174
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer oBP675
<400> 174
aattgtttaa acttgaatat gtattacttg gtta 34
<210> 175
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer oBP495
<400> 175
ggagatatac aatagaacag at 22
<210> 176
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer oBP496
<400> 176
tagcaatggg gtttttttca gt 22
<210> 177
<211> 725
<212> DNA
<213> Artificial Sequence
<220>
<223> UAS(PGK1)-FBA1p
<400> 177
aattaccgtc gctcgtgatt tgtttgcaaa aagaacaaaa ctgaaaaaac ccagacacgc 60
tcgacttcct gtcttcctat tgattgcagc ttccaatttc gtcacacaac aaggtcctgt 120
cgacgcctac ttggcttcac atacgttgca tacgtcgata tagataataa tgataatgac 180
agcaggatta tcgtaatacg taatagttga aaatctcaaa aatgtgtggg tcattacgta 240
aataatgata ggaatgggat tcttctattt ttcctttttc cattctagca gccgtcggga 300
aaacgtggca tcctctcttt cgggctcaat tggagtcacg ctgccgtgag catcctctct 360
ttccatatct aacaactgag cacgtaacca atggaaaagc atgagcttag cgttgctcca 420
aaaaagtatt ggatggttaa taccatttgt ctgttctctt ctgactttga ctcctcaaaa 480
aaaaaaaatc tacaatcaac agatcgcttc aattacgccc tcacaaaaac ttttttcctt 540
cttcttcgcc cacgttaaat tttatccctc atgttgtcta acggatttct gcacttgatt 600
tattataaaa agacaaagac ataatacttc tctatcaatt tcagttattg ttcttccttg 660
cgttattctt ctgttcttct ttttcttttg tcatatataa ccataaccaa gtaatacata 720
ttcaa 725
<210> 178
<211> 47
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer T-FBA1(SalI)
<400> 178
attctacgta cgtcgacgcc tacttggctt cacatacgtt gcatacg 47
<210> 179
<211> 49
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer B-FBA1(SpeI)
<400> 179
gtatcaaata ctagtttgaa tatgtattac ttggttatgg ttatatatg 49
<210> 180
<211> 10494
<212> DNA
<213> Artificial Sequence
<220>
<223> pWS358-PGK1p-GUS
<400> 180
tcgcgcgttt cggtgatgac ggtgaaaacc tctgacacat gcagctcccg gagacggtca 60
cagcttgtct gtaagcggat gccgggagca gacaagcccg tcagggcgcg tcagcgggtg 120
ttggcgggtg tcggggctgg cttaactatg cggcatcaga gcagattgta ctgagagtgc 180
accataaatt cccgttttaa gagcttggtg agcgctagga gtcactgcca ggtatcgttt 240
gaacacggca ttagtcaggg aagtcataac acagtccttt cccgcaattt tctttttcta 300
ttactcttgg cctcctctag tacactctat atttttttat gcctcggtaa tgattttcat 360
tttttttttt cccctagcgg atgactcttt ttttttctta gcgattggca ttatcacata 420
atgaattata cattatataa agtaatgtga tttcttcgaa gaatatacta aaaaatgagc 480
aggcaagata aacgaaggca aagatgacag agcagaaagc cctagtaaag cgtattacaa 540
atgaaaccaa gattcagatt gcgatctctt taaagggtgg tcccctagcg atagagcact 600
cgatcttccc agaaaaagag gcagaagcag tagcagaaca ggccacacaa tcgcaagtga 660
ttaacgtcca cacaggtata gggtttctgg accatatgct agggattcat aaccattttc 720
tcaatcgaat tacacagaac acaccgtaca aacctctcta tcataactac ttaatagtca 780
cacacgtact cgtctaaata cacatcatcg tcctacaagt tcatcaaagt gttggacaga 840
caactatacc agcatggatc tcttgtatcg gttcttttct cccgctctct cgcaataaca 900
atgaacactg ggtcaatcat agcctacaca ggtgaacaga gtagcgttta tacagggttt 960
atacggtgat tcctacggca aaaatttttc atttctaaaa aaaaaaagaa aaatttttct 1020
ttccaacgct agaaggaaaa gaaaaatcta attaaattga tttggtgatt ttctgagagt 1080
tccctttttc atatatcgaa ttttgaatat aaaaggagat cgaaaaaatt tttctattca 1140
atctgttttc tggttttatt tgatagtttt tttgtgtatt attattatgg attagtactg 1200
gtttatatgg gtttttctgt ataacttctt tttattttag tttgtttaat cttattttga 1260
gttacattat agttccctaa ctgcaagaga agtaacatta aaactcgaga tgggtaagga 1320
aaagactcac gtttcgaggc cgcgattaaa ttccaacatg gatgctgatt tatatgggta 1380
taaatgggct cgcgataatg tcgggcaatc aggtgcgaca atctatcgat tgtatgggaa 1440
gcccgatgcg ccagagttgt ttctgaaaca tggcaaaggt agcgttgcca atgatgttac 1500
agatgagatg gtcagactaa actggctgac ggaatttatg cctcttccga ccatcaagca 1560
ttttatccgt actcctgatg atgcatggtt actcaccact gcgatccccg gcaaaacagc 1620
attccaggta ttagaagaat atcctgattc aggtgaaaat attgttgatg cgctggcagt 1680
gttcctgcgc cggttgcatt cgattcctgt ttgtaattgt ccttttaaca gcgatcgcgt 1740
atttcgtctc gctcaggcgc aatcacgaat gaataacggt ttggttgatg cgagtgattt 1800
tgatgacgag cgtaatggct ggcctgttga acaagtctgg aaagaaatgc ataagctttt 1860
gccattctca ccggattcag tcgtcactca tggtgatttc tcacttgata accttatttt 1920
tgacgagggg aaattaatag gttgtattga tgttggacga gtcggaatcg cagaccgata 1980
ccaggatctt gccatcctat ggaactgcct cggtgagttt tctccttcat tacagaaacg 2040
gctttttcaa aaatatggta ttgataatcc tgatatgaat aaattgcagt ttcatttgat 2100
gctcgatgag tttttctaag tttaacttga tactactaga ttttttctct tcatttataa 2160
aatttttggt tataattgaa gctttagaag tatgaaaaaa tccttttttt tcattctttg 2220
caaccaaaat aagaagcttc ttttattcat tgaaatgatg aatataaacc taacaaaaga 2280
aaaagactcg aatatcaaac attaaaaaaa aataaaagag gttatctgtt ttcccattta 2340
gttggagttt gcattttcta atagatagaa ctctcaatta atgtggattt agtttctctg 2400
ttcgctgcag catacgatat atatacatgt gtatatatgt atacctatga atgtcagtaa 2460
gtatgtatac gaacagtatg atactgaaga tgacaaggta atgcatcatt ctatacgtgt 2520
cattctgaac gaggcgcgct ttcctttttt ctttttgctt tttctttttt tttctcttga 2580
actcgacgga tctatgcggt gtgaaatacc gcacagatgc gtaaggagaa aataccgcat 2640
caggaaattg taaacgttaa tattttgtta aaattcgcgt taaatttttg ttaaatcagc 2700
tcatttttta accaataggc cgaaatcggc aaaatccctt ataaatcaaa agaatagacc 2760
gagatagggt tgagtgttgt tccagtttgg aacaagagtc cactattaaa gaacgtggac 2820
tccaacgtca aagggcgaaa aaccgtctat cagggcgatg gcccactacg tgaaccatca 2880
ccctaatcaa gttttttggg gtcgaggtgc cgtaaagcac taaatcggaa ccctaaaggg 2940
agcccccgat ttagagcttg acggggaaag ccggcgaacg tggcgagaaa ggaagggaag 3000
aaagcgaaag gagcgggcgc tagggcgctg gcaagtgtag cggtcacgct gcgcgtaacc 3060
accacacccg ccgcgcttaa tgcgccgcta cagggcgcgt cgcgccattc gccattcagg 3120
ctgcgcaact gttgggaagg gcgatcggtg cgggcctctt cgctattacg ccagctggcg 3180
aaagggggat gtgctgcaag gcgattaagt tgggtaacgc cagggttttc ccagtcacga 3240
cgttgtaaaa cgacggccag tgagcgcgcg taatacgact cactataggg cgaattgggt 3300
accgggcccc ccctcgaggt cgacgtgagt aaggaaagag tgaggaacta tcgcatacct 3360
gcatttaaag atgccgattt gggcgcgaat cctttatttt ggcttcaccc tcatactatt 3420
atcagggcca gaaaaaggaa gtgtttccct ccttcttgaa ttgatgttac cctcataaag 3480
cacgtggcct cttatcgaga aagaaattac cgtcgctcgt gatttgtttg caaaaagaac 3540
aaaactgaaa aaacccagac acgctcgact tcctgtcttc ctattgattg cagcttccaa 3600
tttcgtcaca caacaaggtc ctagcgacgg ctcacaggtt ttgtaacaag caatcgaagg 3660
ttctggaatg gcgggaaagg gtttagtacc acatgctatg atgcccactg tgatctccag 3720
agcaaagttc gttcgatcgt actgttactc tctctctttc aaacagaatt gtccgaatcg 3780
tgtgacaaca acagcctgtt ctcacacact cttttcttct aaccaagggg gtggtttagt 3840
ttagtagaac ctcgtgaaac ttacatttac atatatataa acttgcataa attggtcaat 3900
gcaagaaata catatttggt cttttctaat tcgtagtttt tcaagttctt agatgctttc 3960
tttttctctt ttttacagat catcaaggaa gtaattatct actttttaca acaaatataa 4020
aacaactagt atggtacgtc ctgtagaaac cccaacccgt gaaatcaaaa aactcgacgg 4080
cctgtgggca ttcagtctgg atcgcgaaaa ctgtggaatt gatcagcgtt ggtgggaaag 4140
cgcgttacaa gaaagccggg caattgctgt gccaggcagt tttaacgatc agttcgccga 4200
tgcagatatt cgtaattatg cgggcaacgt ctggtatcag cgcgaagtct ttataccgaa 4260
aggttgggca ggccagcgta tcgtgctgcg tttcgatgcg gtcactcatt acggcaaagt 4320
gtgggtcaat aatcaggaag tgatggagca tcagggcggc tatactccat ttgaagccga 4380
tgtcacgccg tatgttattg ccgggaaaag tgtacgtatc accgtttgtg tgaacaacga 4440
actgaactgg cagactatcc cgccgggaat ggtgattacc gacgaaaacg gcaagaaaaa 4500
gcagtcttac ttccatgatt tctttaacta tgccggaatc catcgcagcg taatgctcta 4560
caccacgccg aacacctggg tggacgatat caccgtggtg acgcatgtcg cgcaagactg 4620
taaccacgcg tctgttgact ggcaggtggt ggccaatggt gatgtcagcg ttgaactgcg 4680
tgatgcggat caacaggtgg ttgcaactgg acaaggcact agcgggactt tgcaagtggt 4740
gaatccgcac ctctggcaac cgggtgaagg ttatctctat gaactgtgcg tcacagccaa 4800
aagccagaca gagtgtgata tctacccgct tcgcgtcggc atccggtcag tggcagtgaa 4860
gggcgaacag ttcctgatta accacaaacc gttctacttt actggctttg gtcgtcatga 4920
agatgcggac ttgcgtggca aaggattcga taacgtgctg atggtgcacg accacgcatt 4980
aatggactgg attggggcca actcctaccg tacctcgcat tacccttacg ctgaagagat 5040
gctcgactgg gcagatgaac atggcatcgt ggtgattgat gaaactgctg ctgtcggctt 5100
taacctctct ttaggcattg gtttcgaagc gggcaacaag ccgaaagaac tgtacagcga 5160
agaggcagtc aacggggaaa ctcagcaagc gcacttacag gcgattaaag agctgatagc 5220
gcgtgacaaa aaccacccaa gcgtggtgat gtggagtatt gccaacgaac cggatacccg 5280
tccgcaaggt gcacgggaat atttcgcgcc actggcggaa gcaacgcgta aactcgaccc 5340
gacgcgtccg atcacctgcg tcaatgtaat gttctgcgac gctcacaccg ataccatcag 5400
cgatctcttt gatgtgctgt gcctgaaccg ttattacgga tggtatgtcc aaagcggcga 5460
tttggaaacg gcagagaagg tactggaaaa agaacttctg gcctggcagg agaaactgca 5520
tcagccgatt atcatcaccg aatacggcgt ggatacgtta gccgggctgc actcaatgta 5580
caccgacatg tggagtgaag agtatcagtg tgcatggctg gatatgtatc accgcgtctt 5640
tgatcgcgtc agcgccgtcg tcggtgaaca ggtatggaat ttcgccgatt ttgcgacctc 5700
gcaaggcata ttgcgcgttg gcggtaacaa gaaagggatc ttcactcgcg accgcaaacc 5760
gaagtcggcg gcttttctgc tgcaaaaacg ctggactggc atgaacttcg gtgaaaaacc 5820
gcagcaggga ggcaaacaat gattaattaa ctagagcggc cgcgttaatt caaattaatt 5880
gatatagttt tttaatgagt attgaatctg tttagaaata atggaatatt atttttattt 5940
atttatttat attattggtc ggctcttttc ttctgaaggt caatgacaaa atgatatgaa 6000
ggaaataatg atttctaaaa ttttacaacg taagatattt ttacaaaagc ctagctcatc 6060
ttttgtcatg cactatttta ctcacgcttg aaattaacgg ccagtccact gcggagtcat 6120
ttcaaagtca tcctaatcga tctatcgttt ttgatagctc attttggagt tcgcgattgt 6180
cttctgttat tcacaactgt tttaattttt atttcattct ggaactcttc gagttctttg 6240
taaagtcttt catagtagct tactttatcc tccaacatat ttaacttcat gtcaatttcg 6300
gctcttaaat tttccacatc atcaagttca acatcatctt ttaacttgaa tttattctct 6360
agctcttcca accaagcctc attgctcctt gatttactgg tgaaaagtga tacactttgc 6420
gcgcaatcca ggtcaaaact ttcctgcaaa gaattcacca atttctcgac atcatagtac 6480
aatttgtttt gttctcccat cacaatttaa tatacctgat ggattcttat gaagcgctgg 6540
gtaatggacg tgtcactcta cttcgccttt ttccctactc cttttagtac ggaagacaat 6600
gctaataaat aagagggtaa taataatatt attaatcggc aaaaaagatt aaacgccaag 6660
cgtttaatta tcagaaagca aacgtcgtac caatccttga atgcttccca attgtatatt 6720
aagagtcatc acagcaacat attcttgtta ttaaattaat tattattgat ttttgatatt 6780
gtataaaaaa accaaatatg tataaaaaaa gtgaataaaa aataccaagt atggagaaat 6840
atattagaag tctatacgtt aaaccaccgc ggtggagctc cagcttttgt tccctttagt 6900
gagggttaat tgcgcgcttg gcgtaatcat ggtcatagct gtttcctgtg tgaaattgtt 6960
atccgctcac aattccacac aacataggag ccggaagcat aaagtgtaaa gcctggggtg 7020
cctaatgagt gaggtaactc acattaattg cgttgcgctc actgcccgct ttccagtcgg 7080
gaaacctgtc gtgccagctg cattaatgaa tcggccaacg cgcggggaga ggcggtttgc 7140
gtattgggcg ctcttccgct tcctcgctca ctgactcgct gcgctcggtc gttcggctgc 7200
ggcgagcggt atcagctcac tcaaaggcgg taatacggtt atccacagaa tcaggggata 7260
acgcaggaaa gaacatgtga gcaaaaggcc agcaaaaggc caggaaccgt aaaaaggccg 7320
cgttgctggc gtttttccat aggctccgcc cccctgacga gcatcacaaa aatcgacgct 7380
caagtcagag gtggcgaaac ccgacaggac tataaagata ccaggcgttt ccccctggaa 7440
gctccctcgt gcgctctcct gttccgaccc tgccgcttac cggatacctg tccgcctttc 7500
tcccttcggg aagcgtggcg ctttctcata gctcacgctg taggtatctc agttcggtgt 7560
aggtcgttcg ctccaagctg ggctgtgtgc acgaaccccc cgttcagccc gaccgctgcg 7620
ccttatccgg taactatcgt cttgagtcca acccggtaag acacgactta tcgccactgg 7680
cagcagccac tggtaacagg attagcagag cgaggtatgt aggcggtgct acagagttct 7740
tgaagtggtg gcctaactac ggctacacta gaaggacagt atttggtatc tgcgctctgc 7800
tgaagccagt taccttcgga aaaagagttg gtagctcttg atccggcaaa caaaccaccg 7860
ctggtagcgg tggttttttt gtttgcaagc agcagattac gcgcagaaaa aaaggatctc 7920
aagaagatcc tttgatcttt tctacggggt ctgacgctca gtggaacgaa aactcacgtt 7980
aagggatttt ggtcatgaga ttatcaaaaa ggatcttcac ctagatcctt ttaaattaaa 8040
aatgaagttt taaatcaatc taaagtatat atgagtaaac ttggtctgac agttaccaat 8100
gcttaatcag tgaggcacct atctcagcga tctgtctatt tcgttcatcc atagttgcct 8160
gactccccgt cgtgtagata actacgatac gggagggctt accatctggc cccagtgctg 8220
caatgatacc gcgagaccca cgctcaccgg ctccagattt atcagcaata aaccagccag 8280
ccggaagggc cgagcgcaga agtggtcctg caactttatc cgcctccatc cagtctatta 8340
attgttgccg ggaagctaga gtaagtagtt cgccagttaa tagtttgcgc aacgttgttg 8400
ccattgctac aggcatcgtg gtgtcacgct cgtcgtttgg tatggcttca ttcagctccg 8460
gttcccaacg atcaaggcga gttacatgat cccccatgtt gtgcaaaaaa gcggttagct 8520
ccttcggtcc tccgatcgtt gtcagaagta agttggccgc agtgttatca ctcatggtta 8580
tggcagcact gcataattct cttactgtca tgccatccgt aagatgcttt tctgtgactg 8640
gtgagtactc aaccaagtca ttctgagaat agtgtatgcg gcgaccgagt tgctcttgcc 8700
cggcgtcaat acgggataat accgcgccac atagcagaac tttaaaagtg ctcatcattg 8760
gaaaacgttc ttcggggcga aaactctcaa ggatcttacc gctgttgaga tccagttcga 8820
tgtaacccac tcgtgcaccc aactgatctt cagcatcttt tactttcacc agcgtttctg 8880
ggtgagcaaa aacaggaagg caaaatgccg caaaaaaggg aataagggcg acacggaaat 8940
gttgaatact catactcttc ctttttcaat attattgaag catttatcag ggttattgtc 9000
tcatgagcgg atacatattt gaatgtattt agaaaaataa acaaataggg gttccgcgca 9060
catttccccg aaaagtgcca cctgaacgaa gcatctgtgc ttcattttgt agaacaaaaa 9120
tgcaacgcga gagcgctaat ttttcaaaca aagaatctga gctgcatttt tacagaacag 9180
aaatgcaacg cgaaagcgct attttaccaa cgaagaatct gtgcttcatt tttgtaaaac 9240
aaaaatgcaa cgcgagagcg ctaatttttc aaacaaagaa tctgagctgc atttttacag 9300
aacagaaatg caacgcgaga gcgctatttt accaacaaag aatctatact tcttttttgt 9360
tctacaaaaa tgcatcccga gagcgctatt tttctaacaa agcatcttag attacttttt 9420
ttctcctttg tgcgctctat aatgcagtct cttgataact ttttgcactg taggtccgtt 9480
aaggttagaa gaaggctact ttggtgtcta ttttctcttc cataaaaaaa gcctgactcc 9540
acttcccgcg tttactgatt actagcgaag ctgcgggtgc attttttcaa gataaaggca 9600
tccccgatta tattctatac cgatgtggat tgcgcatact ttgtgaacag aaagtgatag 9660
cgttgatgat tcttcattgg tcagaaaatt atgaacggtt tcttctattt tgtctctata 9720
tactacgtat aggaaatgtt tacattttcg tattgttttc gattcactct atgaatagtt 9780
cttactacaa tttttttgtc taaagagtaa tactagagat aaacataaaa aatgtagagg 9840
tcgagtttag atgcaagttc aaggagcgaa aggtggatgg gtaggttata tagggatata 9900
gcacagagat atatagcaaa gagatacttt tgagcaatgt ttgtggaagc ggtattcgca 9960
atattttagt agctcgttac agtccggtgc gtttttggtt ttttgaaagt gcgtcttcag 10020
agcgcttttg gttttcaaaa gcgctctgaa gttcctatac tttctagaga ataggaactt 10080
cggaatagga acttcaaagc gtttccgaaa acgagcgctt ccgaaaatgc aacgcgagct 10140
gcgcacatac agctcactgt tcacgtcgca cctatatctg cgtgttgcct gtatatatat 10200
atacatgaga agaacggcat agtgcgtgtt tatgcttaaa tgcgtactta tatgcgtcta 10260
tttatgtagg atgaaaggta gtctagtacc tcctgtgata ttatcccatt ccatgcgggg 10320
tatcgtatgc ttccttcagc actacccttt agctgttcta tatgctgcca ctcctcaatt 10380
ggattagtct catccttcaa tgctatcatt tcctttgata ttggatcatc taagaaacca 10440
ttattatcat gacattaacc tataaaaata ggcgtatcac gaggcccttt cgtc 10494
<210> 181
<211> 43
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer T-U/PGK1(KpnI)
<400> 181
actacagatg gtaccaatta ccgtcgctcg tgatttgttt gca 43
<210> 182
<211> 45
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer B-U/PGK1(SalI)
<400> 182
agcatccttg tcgacaggac cttgttgtgt gacgaaattg gaagc 45
<210> 183
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer N98SeqF1
<400> 183
cgtgttagtc acatcaggac 20
<210> 184
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer N99SeqR2
<400> 184
catcgactgc attacgcaac tc 22
<210> 185
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer N98SeqF4
<400> 185
ggtttctgtc tctggtgacg 20
<210> 186
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer N1111
<400> 186
tatttgtatc gaggtgtcta gtcttctatt 30
<210> 187
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer N1110
<400> 187
gcgatttaat ctctaattat tagttaaagt 30
<210> 188
<211> 38
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer BK468
<400> 188
gcctcgagtt ttaatgttac ttctcttgca gttaggga 38
<210> 189
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer N160SeqF5
<400> 189
cctgaagtct aggtccctat tt 22
<210> 190
<211> 7589
<212> DNA
<213> Artificial Sequence
<220>
<223> pUC19-kan::pdc1::FBA-alsS::TRX1 (clone A)
<400> 190
tatttgtatc gaggtgtcta gtcttctatt acactaatgc agtttcaggg ttttggaaac 60
cacactgttt aaacagtgtt ccttaatcaa ggatacctct ttttttttcc ttggttccac 120
taattcatcg gttttttttt tggaagacat cttttccaac gaaaagaata tacatatcgt 180
ttaagagaaa ttctccaaat ttgtaaagaa gcggacccag acttaaggcc gcccgcaaat 240
taaagccttc gagcgtccca aaaccttctc aagcaaggtt ttcagtataa tgttacatgc 300
gtacacgcgt ctgtacagaa aaaaaagaaa aatttgaaat ataaataacg ttcttaatac 360
taacataact ataaaaaaat aaatagggac ctagacttca ggttgtctaa ctccttcctt 420
ttcggttaga gcggatgtgg ggggagggcg tgaatgtaag cgtgacataa ctaattacat 480
gattaattaa ctagagagct ttcgttttca tgagttcccc gaattctttc ggaagcttgt 540
cacttgctaa attaatgtta tcactgtagt caaccgggac atcgatgatg acaggacctt 600
cagcgttcat gccttgacgc agaacatctg ccagctggtc tggtgattct acgcgcaagc 660
cagttgctcc gaagctttcc gcatatttca cgatatcgat atttccgaaa tcgaccgcag 720
atgtacggtt atattttttc aattgctgga atgcaaccat gtcatatgtg ctgtcgttcc 780
atacaatgtg tacaattggt gcttttagtc gaactgctgt ctctaattcc attgctgaga 840
ataagaaacc gccgtcacca gagacagaaa ccactttttc tcccggtttc accaatgaag 900
cgccgattgc ccaaggaagc gcaacgccga gtgtttgcat accgttactg atcattaatg 960
ttaacggctc gtagctgcgg aaataacgtg acatccaaat ggcgtgcgaa ccgatatcgc 1020
aagttactgt aacatgatca tcgactgcat tacgcaactc tttaacgatt tcaagagggt 1080
gcgctctgtc tgatttccaa tctgcaggca cctgctcacc ttcatgcata tattgtttta 1140
aatcagaaag gattttctgc tcacgctctg caaattccac tttcacagca tcgtgttcga 1200
tatgattgat cgtggacgga atgtcaccga tcaattcaag atcaggctgg taagcatgat 1260
caatgtcagc gataatctcg tctaaatgga taattgtccg gtctccattg atattccaga 1320
atttcggatc atattcaatc gggtcatagc cgatcgtcag aacaacatct gcctgctcta 1380
gcagtaaatc gccaggctgg ttgcggaaca aaccgatacg gccaaaatat tgatcctcta 1440
aatctctaga aagggtaccg gcagcttgat atgtttcaac aaatggaagc tgaacctttt 1500
tcaaaagctt gcgaaccgct ttaattgctt ccggtcttcc gcctttcatg ccgaccaaaa 1560
cgacaggaag ttttgctgtt tggatttttg ctatggccgc actgattgca tcatctgctg 1620
caggaccgag ttttggcgct gcaacagcac gcacgttttt cgtatttgtg acttcattca 1680
caacatcttg cggaaagctc acaaaagcgg ccccagcctg ccctgctgac gctatcctaa 1740
atgcatttgt aacagcttcc ggtatatttt ttacatcttg aacttctaca ctgtattttg 1800
taatcggctg gaatagcgcc gcattatcca aagattgatg tgtccgtttt aaacgatctg 1860
cacggatcac gtttccagca agcgcaacga cagggtctcc ttcagtgttc gctgtcagca 1920
ggcctgttgc caagttagag gcacccggtc ctgatgtgac taacacgact cccggttttc 1980
cagttaaacg gccgactgct tgggccatga atgctgcgtt ttgttcgtgc cgggcaacga 2040
taatttcagg tcctttatct tgtaaagcgt caaataccgc atcaattttt gcacctggaa 2100
tgccaaatac atgtgtgaca ccttgctcca ctaagcaatc aacaacaagc tccgcccctc 2160
tgtttttcac aagggatttt tgttcttttg ttgcttttgt caacatcctc agctctagat 2220
ttgaatatgt attacttggt tatggttata tatgacaaaa gaaaaagaag aacagaagaa 2280
taacgcaagg aagaacaata actgaaattg atagagaagt attatgtctt tgtcttttta 2340
taataaatca agtgcagaaa tccgttagac aacatgaggg ataaaattta acgtgggcga 2400
agaagaagga aaaaagtttt tgtgagggcg taattgaagc gatctgttga ttgtagattt 2460
tttttttttg aggagtcaaa gtcagaagag aacagacaaa tggtattaac catccaatac 2520
ttttttggag caacgctaag ctcatgcttt tccattggtt acgtgctcag ttgttagata 2580
tggaaagaga ggatgctcac ggcagcgtga ctccaattga gcccgaaaga gaggatgcca 2640
cgttttcccg acggctgcta gaatggaaaa aggaaaaata gaagaatccc attcctatca 2700
ttatttacgt aatgacccac acatttttga gattttcaac tattacgtat tacgataatc 2760
ctgctgtcat tatcattatt atctatatcg acgtatgcaa cgtatgtgaa gccaagtagg 2820
caattattta gtactgtcag tattgttatt catttcagat cttaagccta accaggccaa 2880
ttcaacagac tgtcggcaac ttcttgtctg gtctttccat ggtaagtgac agtgcagtaa 2940
taatatgaac caatttattt ttcgttacat aaaaatgctt ataaaacttt aactaataat 3000
tagagattaa atcgcaaacg gccgactcta gaggatcccc caccttggct aactcgttgt 3060
atcatcactg gataacttcg tatagcatac attatacgaa gttatctagg gattcataac 3120
cattttctca atcgaattac acagaacaca ccgtacaaac ctctctatca taactactta 3180
atagtcacac acgtactcgt ctaaatacac atcatcgtcc tacaagttca tcaaagtgtt 3240
ggacagacaa ctataccagc atggatctct tgtatcggtt cttttctccc gctctctcgc 3300
aataacaatg aacactgggt caatcatagc ctacacaggt gaacagagta gcgtttatac 3360
agggtttata cggtgattcc tacggcaaaa atttttcatt tctaaaaaaa aaaagaaaaa 3420
tttttctttc caacgctaga aggaaaagaa aaatctaatt aaattgattt ggtgattttc 3480
tgagagttcc ctttttcata tatcgaattt tgaatataaa aggagatcga aaaaattttt 3540
ctattcaatc tgttttctgg ttttatttga tagttttttt gtgtattatt attatggatt 3600
agtactggtt tatatgggtt tttctgtata acttcttttt attttagttt gtttaatctt 3660
attttgagtt acattatagt tccctaactg caagagaagt aacattaaaa ctcgagatgg 3720
gtaaggaaaa gactcacgtt tcgaggccgc gattaaattc caacatggat gctgatttat 3780
atgggtataa atgggctcgc gataatgtcg ggcaatcagg tgcgacaatc tatcgattgt 3840
atgggaagcc cgatgcgcca gagttgtttc tgaaacatgg caaaggtagc gttgccaatg 3900
atgttacaga tgagatggtc agactaaact ggctgacgga atttatgcct cttccgacca 3960
tcaagcattt tatccgtact cctgatgatg catggttact caccactgcg atccccggca 4020
aaacagcatt ccaggtatta gaagaatatc ctgattcagg tgaaaatatt gttgatgcgc 4080
tggcagtgtt cctgcgccgg ttgcattcga ttcctgtttg taattgtcct tttaacagcg 4140
atcgcgtatt tcgtctcgct caggcgcaat cacgaatgaa taacggtttg gttgatgcga 4200
gtgattttga tgacgagcgt aatggctggc ctgttgaaca agtctggaaa gaaatgcata 4260
agcttttgcc attctcaccg gattcagtcg tcactcatgg tgatttctca cttgataacc 4320
ttatttttga cgaggggaaa ttaataggtt gtattgatgt tggacgagtc ggaatcgcag 4380
accgatacca ggatcttgcc atcctatgga actgcctcgg tgagttttct ccttcattac 4440
agaaacggct ttttcaaaaa tatggtattg ataatcctga tatgaataaa ttgcagtttc 4500
atttgatgct cgatgagttt ttctaagttt aacttgatac tactagattt tttctcttca 4560
tttataaaat ttttggttat aattgaagct ttagaagtat gaaaaaatcc ttttttttca 4620
ttctttgcaa ccaaaataag aagcttcttt tattcattga aatgatgaat ataaacctaa 4680
caaaagaaaa agactcgaat atcaaacatt aaaaaaaaat aaaagaggtt atctgttttc 4740
ccatttagtt ggagtttgca ttttctaata gatagaactc tcaattaatg tggatttagt 4800
ttctctgttc gataacttcg tatagcatac attatacgaa gttatctgaa cattagaata 4860
cgtaatccgc aatgcggggc cgcttaatta atctagagtc gacctgcagg catgcaagct 4920
tggcgtaatc atggtcatag ctgtttcctg tgtgaaattg ttatccgctc acaattccac 4980
acaacatacg agccggaagc ataaagtgta aagcctgggg tgcctaatga gtgagctaac 5040
tcacattaat tgcgttgcgc tcactgcccg ctttccagtc gggaaacctg tcgtgccagc 5100
tgcattaatg aatcggccaa cgcgcgggga gaggcggttt gcgtattggg cgctcttccg 5160
cttcctcgct cactgactcg ctgcgctcgg tcgttcggct gcggcgagcg gtatcagctc 5220
actcaaaggc ggtaatacgg ttatccacag aatcagggga taacgcagga aagaacatgt 5280
gagcaaaagg ccagcaaaag gccaggaacc gtaaaaaggc cgcgttgctg gcgtttttcc 5340
ataggctccg cccccctgac gagcatcaca aaaatcgacg ctcaagtcag aggtggcgaa 5400
acccgacagg actataaaga taccaggcgt ttccccctgg aagctccctc gtgcgctctc 5460
ctgttccgac cctgccgctt accggatacc tgtccgcctt tctcccttcg ggaagcgtgg 5520
cgctttctca tagctcacgc tgtaggtatc tcagttcggt gtaggtcgtt cgctccaagc 5580
tgggctgtgt gcacgaaccc cccgttcagc ccgaccgctg cgccttatcc ggtaactatc 5640
gtcttgagtc caacccggta agacacgact tatcgccact ggcagcagcc actggtaaca 5700
ggattagcag agcgaggtat gtaggcggtg ctacagagtt cttgaagtgg tggcctaact 5760
acggctacac tagaaggaca gtatttggta tctgcgctct gctgaagcca gttaccttcg 5820
gaaaaagagt tggtagctct tgatccggca aacaaaccac cgctggtagc ggtggttttt 5880
ttgtttgcaa gcagcagatt acgcgcagaa aaaaaggatc tcaagaagat cctttgatct 5940
tttctacggg gtctgacgct cagtggaacg aaaactcacg ttaagggatt ttggtcatga 6000
gattatcaaa aaggatcttc acctagatcc ttttaaatta aaaatgaagt tttaaatcaa 6060
tctaaagtat atatgagtaa acttggtctg acagttacca atgcttaatc agtgaggcac 6120
ctatctcagc gatctgtcta tttcgttcat ccatagttgc ctgactcccc gtcgtgtaga 6180
taactacgat acgggagggc ttaccatctg gccccagtgc tgcaatgata ccgcgagacc 6240
cacgctcacc ggctccagat ttatcagcaa taaaccagcc agccggaagg gccgagcgca 6300
gaagtggtcc tgcaacttta tccgcctcca tccagtctat taattgttgc cgggaagcta 6360
gagtaagtag ttcgccagtt aatagtttgc gcaacgttgt tgccattgct acaggcatcg 6420
tggtgtcacg ctcgtcgttt ggtatggctt cattcagctc cggttcccaa cgatcaaggc 6480
gagttacatg atcccccatg ttgtgcaaaa aagcggttag ctccttcggt cctccgatcg 6540
ttgtcagaag taagttggcc gcagtgttat cactcatggt tatggcagca ctgcataatt 6600
ctcttactgt catgccatcc gtaagatgct tttctgtgac tggtgagtac tcaaccaagt 6660
cattctgaga atagtgtatg cggcgaccga gttgctcttg cccggcgtca atacgggata 6720
ataccgcgcc acatagcaga actttaaaag tgctcatcat tggaaaacgt tcttcggggc 6780
gaaaactctc aaggatctta ccgctgttga gatccagttc gatgtaaccc actcgtgcac 6840
ccaactgatc ttcagcatct tttactttca ccagcgtttc tgggtgagca aaaacaggaa 6900
ggcaaaatgc cgcaaaaaag ggaataaggg cgacacggaa atgttgaata ctcatactct 6960
tcctttttca atattattga agcatttatc agggttattg tctcatgagc ggatacatat 7020
ttgaatgtat ttagaaaaat aaacaaatag gggttccgcg cacatttccc cgaaaagtgc 7080
cacctgacgt ctaagaaacc attattatca tgacattaac ctataaaaat aggcgtatca 7140
cgaggccctt tcgtctcgcg cgtttcggtg atgacggtga aaacctctga cacatgcagc 7200
tcccggagac ggtcacagct tgtctgtaag cggatgccgg gagcagacaa gcccgtcagg 7260
gcgcgtcagc gggtgttggc gggtgtcggg gctggcttaa ctatgcggca tcagagcaga 7320
ttgtactgag agtgcaccat atgcggtgtg aaataccgca cagatgcgta aggagaaaat 7380
accgcatcag gcgccattcg ccattcaggc tgcgcaactg ttgggaaggg cgatcggtgc 7440
gggcctcttc gctattacgc cagctggcga aagggggatg tgctgcaagg cgattaagtt 7500
gggtaacgcc agggttttcc cagtcacgac gttgtaaaac gacggccagt gaattcgagc 7560
tcggtacccg gggatccggc gcgccgttt 7589
<210> 191
<211> 38
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer N191
<400> 191
atccgcggat agatctccca ttaccgacat ttgggcgc 38
<210> 192
<211> 9593
<212> DNA
<213> Artificial Sequence
<220>
<223> pYZ090 alsS
<400> 192
ggccgcacct ggtaaaacct ctagtggagt agtagatgta atcaatgaag cggaagccaa 60
aagaccagag tagaggccta tagaagaaac tgcgatacct tttgtgatgg ctaaacaaac 120
agacatcttt ttatatgttt ttacttctgt atatcgtgaa gtagtaagtg ataagcgaat 180
ttggctaaga acgttgtaag tgaacaaggg acctcttttg cctttcaaaa aaggattaaa 240
tggagttaat cattgagatt tagttttcgt tagattctgt atccctaaat aactccctta 300
cccgacggga aggcacaaaa gacttgaata atagcaaacg gccagtagcc aagaccaaat 360
aatactagag ttaactgatg gtcttaaaca ggcattacgt ggtgaactcc aagaccaata 420
tacaaaatat cgataagtta ttcttgccca ccaatttaag gagcctacat caggacagta 480
gtaccattcc tcagagaaga ggtatacata acaagaaaat cgcgtgaaca ccttatataa 540
cttagcccgt tattgagcta aaaaaccttg caaaatttcc tatgaataag aatacttcag 600
acgtgataaa aatttacttt ctaactcttc tcacgctgcc cctatctgtt cttccgctct 660
accgtgagaa ataaagcatc gagtacggca gttcgctgtc actgaactaa aacaataagg 720
ctagttcgaa tgatgaactt gcttgctgtc aaacttctga gttgccgctg atgtgacact 780
gtgacaataa attcaaaccg gttatagcgg tctcctccgg taccggttct gccacctcca 840
atagagctca gtaggagtca gaacctctgc ggtggctgtc agtgactcat ccgcgtttcg 900
taagttgtgc gcgtgcacat ttcgcccgtt cccgctcatc ttgcagcagg cggaaatttt 960
catcacgctg taggacgcaa aaaaaaaata attaatcgta caagaatctt ggaaaaaaaa 1020
ttgaaaaatt ttgtataaaa gggatgacct aacttgactc aatggctttt acacccagta 1080
ttttcccttt ccttgtttgt tacaattata gaagcaagac aaaaacatat agacaaccta 1140
ttcctaggag ttatattttt ttaccctacc agcaatataa gtaaaaaact gtttaaacag 1200
tatggcagtt acaatgtatt atgaagatga tgtagaagta tcagcacttg ctggaaagca 1260
aattgcagta atcggttatg gttcacaagg acatgctcac gcacagaatt tgcgtgattc 1320
tggtcacaac gttatcattg gtgtgcgcca cggaaaatct tttgataaag caaaagaaga 1380
tggctttgaa acatttgaag taggagaagc agtagctaaa gctgatgtta ttatggtttt 1440
ggcaccagat gaacttcaac aatccattta tgaagaggac atcaaaccaa acttgaaagc 1500
aggttcagca cttggttttg ctcacggatt taatatccat tttggctata ttaaagtacc 1560
agaagacgtt gacgtcttta tggttgcgcc taaggctcca ggtcaccttg tccgtcggac 1620
ttatactgaa ggttttggta caccagcttt gtttgtttca caccaaaatg caagtggtca 1680
tgcgcgtgaa atcgcaatgg attgggccaa aggaattggt tgtgctcgag tgggaattat 1740
tgaaacaact tttaaagaag aaacagaaga agatttgttt ggagaacaag ctgttctatg 1800
tggaggtttg acagcacttg ttgaagccgg ttttgaaaca ctgacagaag ctggatacgc 1860
tggcgaattg gcttactttg aagttttgca cgaaatgaaa ttgattgttg acctcatgta 1920
tgaaggtggt tttactaaaa tgcgtcaatc catctcaaat actgctgagt ttggcgatta 1980
tgtgactggt ccacggatta ttactgacga agttaaaaag aatatgaagc ttgttttggc 2040
tgatattcaa tctggaaaat ttgctcaaga tttcgttgat gacttcaaag cggggcgtcc 2100
aaaattaata gcctatcgcg aagctgcaaa aaatcttgaa attgaaaaaa ttggggcaga 2160
gctacgtcaa gcaatgccat tcacacaatc tggtgatgac gatgccttta aaatctatca 2220
gtaaggccct gcaggccaga ggaaaataat atcaagtgct ggaaactttt tctcttggaa 2280
tttttgcaac atcaagtcat agtcaattga attgacccaa tttcacattt aagatttttt 2340
ttttttcatc cgacatacat ctgtacacta ggaagccctg tttttctgaa gcagcttcaa 2400
atatatatat tttttacata tttattatga ttcaatgaac aatctaatta aatcgaaaac 2460
aagaaccgaa acgcgaataa ataatttatt tagatggtga caagtgtata agtcctcatc 2520
gggacagcta cgatttctct ttcggttttg gctgagctac tggttgctgt gacgcagcgg 2580
cattagcgcg gcgttatgag ctaccctcgt ggcctgaaag atggcgggaa taaagcggaa 2640
ctaaaaatta ctgactgagc catattgagg tcaatttgtc aactcgtcaa gtcacgtttg 2700
gtggacggcc cctttccaac gaatcgtata tactaacatg cgcgcgcttc ctatatacac 2760
atatacatat atatatatat atatatgtgt gcgtgtatgt gtacacctgt atttaatttc 2820
cttactcgcg ggtttttctt ttttctcaat tcttggcttc ctctttctcg agcggaccgg 2880
atcctccgcg gtgccggcag atctatttaa atggcgcgcc gacgtcaggt ggcacttttc 2940
ggggaaatgt gcgcggaacc cctatttgtt tatttttcta aatacattca aatatgtatc 3000
cgctcatgag acaataaccc tgataaatgc ttcaataata ttgaaaaagg aagagtatga 3060
gtattcaaca tttccgtgtc gcccttattc ccttttttgc ggcattttgc cttcctgttt 3120
ttgctcaccc agaaacgctg gtgaaagtaa aagatgctga agatcagttg ggtgcacgag 3180
tgggttacat cgaactggat ctcaacagcg gtaagatcct tgagagtttt cgccccgaag 3240
aacgttttcc aatgatgagc acttttaaag ttctgctatg tggcgcggta ttatcccgta 3300
ttgacgccgg gcaagagcaa ctcggtcgcc gcatacacta ttctcagaat gacttggttg 3360
agtactcacc agtcacagaa aagcatctta cggatggcat gacagtaaga gaattatgca 3420
gtgctgccat aaccatgagt gataacactg cggccaactt acttctgaca acgatcggag 3480
gaccgaagga gctaaccgct tttttgcaca acatggggga tcatgtaact cgccttgatc 3540
gttgggaacc ggagctgaat gaagccatac caaacgacga gcgtgacacc acgatgcctg 3600
tagcaatggc aacaacgttg cgcaaactat taactggcga actacttact ctagcttccc 3660
ggcaacaatt aatagactgg atggaggcgg ataaagttgc aggaccactt ctgcgctcgg 3720
cccttccggc tggctggttt attgctgata aatctggagc cggtgagcgt gggtctcgcg 3780
gtatcattgc agcactgggg ccagatggta agccctcccg tatcgtagtt atctacacga 3840
cggggagtca ggcaactatg gatgaacgaa atagacagat cgctgagata ggtgcctcac 3900
tgattaagca ttggtaactg tcagaccaag tttactcata tatactttag attgatttaa 3960
aacttcattt ttaatttaaa aggatctagg tgaagatcct ttttgataat ctcatgacca 4020
aaatccctta acgtgagttt tcgttccact gagcgtcaga ccccgtagaa aagatcaaag 4080
gatcttcttg agatcctttt tttctgcgcg taatctgctg cttgcaaaca aaaaaaccac 4140
cgctaccagc ggtggtttgt ttgccggatc aagagctacc aactcttttt ccgaaggtaa 4200
ctggcttcag cagagcgcag ataccaaata ctgttcttct agtgtagccg tagttaggcc 4260
accacttcaa gaactctgta gcaccgccta catacctcgc tctgctaatc ctgttaccag 4320
tggctgctgc cagtggcgat aagtcgtgtc ttaccgggtt ggactcaaga cgatagttac 4380
cggataaggc gcagcggtcg ggctgaacgg ggggttcgtg cacacagccc agcttggagc 4440
gaacgaccta caccgaactg agatacctac agcgtgagct atgagaaagc gccacgcttc 4500
ccgaagggag aaaggcggac aggtatccgg taagcggcag ggtcggaaca ggagagcgca 4560
cgagggagct tccaggggga aacgcctggt atctttatag tcctgtcggg tttcgccacc 4620
tctgacttga gcgtcgattt ttgtgatgct cgtcaggggg gcggagccta tggaaaaacg 4680
ccagcaacgc ggccttttta cggttcctgg ccttttgctg gccttttgct cacatgttct 4740
ttcctgcgtt atcccctgat tctgtggata accgtattac cgcctttgag tgagctgata 4800
ccgctcgccg cagccgaacg accgagcgca gcgagtcagt gagcgaggaa gcggaagagc 4860
gcccaatacg caaaccgcct ctccccgcgc gttggccgat tcattaatgc agctggcacg 4920
acaggtttcc cgactggaaa gcgggcagtg agcgcaacgc aattaatgtg agttagctca 4980
ctcattaggc accccaggct ttacacttta tgcttccggc tcgtatgttg tgtggaattg 5040
tgagcggata acaatttcac acaggaaaca gctatgacca tgattacgcc aagctttttc 5100
tttccaattt tttttttttc gtcattataa aaatcattac gaccgagatt cccgggtaat 5160
aactgatata attaaattga agctctaatt tgtgagttta gtatacatgc atttacttat 5220
aatacagttt tttagttttg ctggccgcat cttctcaaat atgcttccca gcctgctttt 5280
ctgtaacgtt caccctctac cttagcatcc cttccctttg caaatagtcc tcttccaaca 5340
ataataatgt cagatcctgt agagaccaca tcatccacgg ttctatactg ttgacccaat 5400
gcgtctccct tgtcatctaa acccacaccg ggtgtcataa tcaaccaatc gtaaccttca 5460
tctcttccac ccatgtctct ttgagcaata aagccgataa caaaatcttt gtcgctcttc 5520
gcaatgtcaa cagtaccctt agtatattct ccagtagata gggagccctt gcatgacaat 5580
tctgctaaca tcaaaaggcc tctaggttcc tttgttactt cttctgccgc ctgcttcaaa 5640
ccgctaacaa tacctgggcc caccacaccg tgtgcattcg taatgtctgc ccattctgct 5700
attctgtata cacccgcaga gtactgcaat ttgactgtat taccaatgtc agcaaatttt 5760
ctgtcttcga agagtaaaaa attgtacttg gcggataatg cctttagcgg cttaactgtg 5820
ccctccatgg aaaaatcagt caagatatcc acatgtgttt ttagtaaaca aattttggga 5880
cctaatgctt caactaactc cagtaattcc ttggtggtac gaacatccaa tgaagcacac 5940
aagtttgttt gcttttcgtg catgatatta aatagcttgg cagcaacagg actaggatga 6000
gtagcagcac gttccttata tgtagctttc gacatgattt atcttcgttt cctgcaggtt 6060
tttgttctgt gcagttgggt taagaatact gggcaatttc atgtttcttc aacactacat 6120
atgcgtatat ataccaatct aagtctgtgc tccttccttc gttcttcctt ctgttcggag 6180
attaccgaat caaaaaaatt tcaaggaaac cgaaatcaaa aaaaagaata aaaaaaaaat 6240
gatgaattga aaagcttgca tgcctgcagg tcgactctag tatactccgt ctactgtacg 6300
atacacttcc gctcaggtcc ttgtccttta acgaggcctt accactcttt tgttactcta 6360
ttgatccagc tcagcaaagg cagtgtgatc taagattcta tcttcgcgat gtagtaaaac 6420
tagctagacc gagaaagaga ctagaaatgc aaaaggcact tctacaatgg ctgccatcat 6480
tattatccga tgtgacgctg catttttttt tttttttttt tttttttttt tttttttttt 6540
tttttttttt ttttgtacaa atatcataaa aaaagagaat ctttttaagc aaggattttc 6600
ttaacttctt cggcgacagc atcaccgact tcggtggtac tgttggaacc acctaaatca 6660
ccagttctga tacctgcatc caaaaccttt ttaactgcat cttcaatggc tttaccttct 6720
tcaggcaagt tcaatgacaa tttcaacatc attgcagcag acaagatagt ggcgataggg 6780
ttgaccttat tctttggcaa atctggagcg gaaccatggc atggttcgta caaaccaaat 6840
gcggtgttct tgtctggcaa agaggccaag gacgcagatg gcaacaaacc caaggagcct 6900
gggataacgg aggcttcatc ggagatgata tcaccaaaca tgttgctggt gattataata 6960
ccatttaggt gggttgggtt cttaactagg atcatggcgg cagaatcaat caattgatgt 7020
tgaactttca atgtagggaa ttcgttcttg atggtttcct ccacagtttt tctccataat 7080
cttgaagagg ccaaaacatt agctttatcc aaggaccaaa taggcaatgg tggctcatgt 7140
tgtagggcca tgaaagcggc cattcttgtg attctttgca cttctggaac ggtgtattgt 7200
tcactatccc aagcgacacc atcaccatcg tcttcctttc tcttaccaaa gtaaatacct 7260
cccactaatt ctctaacaac aacgaagtca gtacctttag caaattgtgg cttgattgga 7320
gataagtcta aaagagagtc ggatgcaaag ttacatggtc ttaagttggc gtacaattga 7380
agttctttac ggatttttag taaaccttgt tcaggtctaa cactaccggt accccattta 7440
ggaccaccca cagcacctaa caaaacggca tcagccttct tggaggcttc cagcgcctca 7500
tctggaagtg gaacacctgt agcatcgata gcagcaccac caattaaatg attttcgaaa 7560
tcgaacttga cattggaacg aacatcagaa atagctttaa gaaccttaat ggcttcggct 7620
gtgatttctt gaccaacgtg gtcacctggc aaaacgacga tcttcttagg ggcagacatt 7680
acaatggtat atccttgaaa tatatataaa aaaaaaaaaa aaaaaaaaaa aaaaaaatgc 7740
agcttctcaa tgatattcga atacgctttg aggagataca gcctaatatc cgacaaactg 7800
ttttacagat ttacgatcgt acttgttacc catcattgaa ttttgaacat ccgaacctgg 7860
gagttttccc tgaaacagat agtatatttg aacctgtata ataatatata gtctagcgct 7920
ttacggaaga caatgtatgt atttcggttc ctggagaaac tattgcatct attgcatagg 7980
taatcttgca cgtcgcatcc ccggttcatt ttctgcgttt ccatcttgca cttcaatagc 8040
atatctttgt taacgaagca tctgtgcttc attttgtaga acaaaaatgc aacgcgagag 8100
cgctaatttt tcaaacaaag aatctgagct gcatttttac agaacagaaa tgcaacgcga 8160
aagcgctatt ttaccaacga agaatctgtg cttcattttt gtaaaacaaa aatgcaacgc 8220
gagagcgcta atttttcaaa caaagaatct gagctgcatt tttacagaac agaaatgcaa 8280
cgcgagagcg ctattttacc aacaaagaat ctatacttct tttttgttct acaaaaatgc 8340
atcccgagag cgctattttt ctaacaaagc atcttagatt actttttttc tcctttgtgc 8400
gctctataat gcagtctctt gataactttt tgcactgtag gtccgttaag gttagaagaa 8460
ggctactttg gtgtctattt tctcttccat aaaaaaagcc tgactccact tcccgcgttt 8520
actgattact agcgaagctg cgggtgcatt ttttcaagat aaaggcatcc ccgattatat 8580
tctataccga tgtggattgc gcatactttg tgaacagaaa gtgatagcgt tgatgattct 8640
tcattggtca gaaaattatg aacggtttct tctattttgt ctctatatac tacgtatagg 8700
aaatgtttac attttcgtat tgttttcgat tcactctatg aatagttctt actacaattt 8760
ttttgtctaa agagtaatac tagagataaa cataaaaaat gtagaggtcg agtttagatg 8820
caagttcaag gagcgaaagg tggatgggta ggttatatag ggatatagca cagagatata 8880
tagcaaagag atacttttga gcaatgtttg tggaagcggt attcgcaata ttttagtagc 8940
tcgttacagt ccggtgcgtt tttggttttt tgaaagtgcg tcttcagagc gcttttggtt 9000
ttcaaaagcg ctctgaagtt cctatacttt ctagagaata ggaacttcgg aataggaact 9060
tcaaagcgtt tccgaaaacg agcgcttccg aaaatgcaac gcgagctgcg cacatacagc 9120
tcactgttca cgtcgcacct atatctgcgt gttgcctgta tatatatata catgagaaga 9180
acggcatagt gcgtgtttat gcttaaatgc gtacttatat gcgtctattt atgtaggatg 9240
aaaggtagtc tagtacctcc tgtgatatta tcccattcca tgcggggtat cgtatgcttc 9300
cttcagcact accctttagc tgttctatat gctgccactc ctcaattgga ttagtctcat 9360
ccttcaatgc tatcatttcc tttgatattg gatcatatgc atagtaccga gaaactagag 9420
gatctcccat taccgacatt tgggcgctat acgtgcatat gttcatgtat gtatctgtat 9480
ttaaaacact tttgtattat ttttcctcat atatgtgtat aggtttatac ggatgattta 9540
attattactt caccaccctt tatttcaggc tgatatctta gccttgttac tag 9593
<210> 193
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer oBP556
<400> 193
tattttcgag gaccttgtca cc 22
<210> 194
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer oBP561
<400> 194
tggccattaa tctttcccat attag 25
<210> 195
<211> 12896
<212> DNA
<213> Artificial Sequence
<220>
<223> pBP915
<400> 195
tcgcgcgttt cggtgatgac ggtgaaaacc tctgacacat gcagctcccg gagacggtca 60
cagcttgtct gtaagcggat gccgggagca gacaagcccg tcagggcgcg tcagcgggtg 120
ttggcgggtg tcggggctgg cttaactatg cggcatcaga gcagattgta ctgagagtgc 180
accataaatt cccgttttaa gagcttggtg agcgctagga gtcactgcca ggtatcgttt 240
gaacacggca ttagtcaggg aagtcataac acagtccttt cccgcaattt tctttttcta 300
ttactcttgg cctcctctag tacactctat atttttttat gcctcggtaa tgattttcat 360
tttttttttt ccacctagcg gatgactctt tttttttctt agcgattggc attatcacat 420
aatgaattat acattatata aagtaatgtg atttcttcga agaatatact aaaaaatgag 480
caggcaagat aaacgaaggc aaagatgaca gagcagaaag ccctagtaaa gcgtattaca 540
aatgaaacca agattcagat tgcgatctct ttaaagggtg gtcccctagc gatagagcac 600
tcgatcttcc cagaaaaaga ggcagaagca gtagcagaac aggccacaca atcgcaagtg 660
attaacgtcc acacaggtat agggtttctg gaccatatga tacatgctct ggccaagcat 720
tccggctggt cgctaatcgt tgagtgcatt ggtgacttac acatagacga ccatcacacc 780
actgaagact gcgggattgc tctcggtcaa gcttttaaag aggccctagg ggccgtgcgt 840
ggagtaaaaa ggtttggatc aggatttgcg cctttggatg aggcactttc cagagcggtg 900
gtagatcttt cgaacaggcc gtacgcagtt gtcgaacttg gtttgcaaag ggagaaagta 960
ggagatctct cttgcgagat gatcccgcat tttcttgaaa gctttgcaga ggctagcaga 1020
attaccctcc acgttgattg tctgcgaggc aagaatgatc atcaccgtag tgagagtgcg 1080
ttcaaggctc ttgcggttgc cataagagaa gccacctcgc ccaatggtac caacgatgtt 1140
ccctccacca aaggtgttct tatgtagtga caccgattat ttaaagctgc agcatacgat 1200
atatatacat gtgtatatat gtatacctat gaatgtcagt aagtatgtat acgaacagta 1260
tgatactgaa gatgacaagg taatgcatca ttctatacgt gtcattctga acgaggcgcg 1320
ctttcctttt ttctttttgc tttttctttt tttttctctt gaactcgacg gatctatgcg 1380
gtgtgaaata ccgcacagat gcgtaaggag aaaataccgc atcaggaaat tgtaagcgtt 1440
aatattttgt taaaattcgc gttaaatttt tgttaaatca gctcattttt taaccaatag 1500
gccgaaatcg gcaaaatccc ttataaatca aaagaataga ccgagatagg gttgagtgtt 1560
gttccagttt ggaacaagag tccactatta aagaacgtgg actccaacgt caaagggcga 1620
aaaaccgtct atcagggcga tggcccacta cgtgaaccat caccctaatc aagttttttg 1680
gggtcgaggt gccgtaaagc actaaatcgg aaccctaaag ggagcccccg atttagagct 1740
tgacggggaa agccggcgaa cgtggcgaga aaggaaggga agaaagcgaa aggagcgggc 1800
gctagggcgc tggcaagtgt agcggtcacg ctgcgcgtaa ccaccacacc cgccgcgctt 1860
aatgcgccgc tacagggcgc gtccattcgc cattcaggct gcgcaactgt tgggaagggc 1920
gcggtgcggg cctcttcgct attacgccag ctggcgaaag ggggatgtgc tgcaaggcga 1980
ttaagttggg taacgccagg gttttcccag tcacgacgtt gtaaaacgac ggccagtgag 2040
cgcgcgtaat acgactcact atagggcgaa ttgggtaccg ggccccccct cgaggtcgac 2100
ggcgcgccac tggtagagag cgactttgta tgccccaatt gcgaaacccg cgatatcctt 2160
ctcgattctt tagtacccga ccaggacaag gaaaaggagg tcgaaacgtt tttgaagaaa 2220
caagaggaac tacacggaag ctctaaagat ggcaaccagc cagaaactaa gaaaatgaag 2280
ttgatggatc caactggcac cgctggcttg aacaacaata ccagccttcc aacttctgta 2340
aataacggcg gtacgccagt gccaccagta ccgttacctt tcggtatacc tcctttcccc 2400
atgtttccaa tgcccttcat gcctccaacg gctactatca caaatcctca tcaagctgac 2460
gcaagcccta agaaatgaat aacaatactg acagtactaa ataattgcct acttggcttc 2520
acatacgttg catacgtcga tatagataat aatgataatg acagcaggat tatcgtaata 2580
cgtaatagct gaaaatctca aaaatgtgtg ggtcattacg taaataatga taggaatggg 2640
attcttctat ttttcctttt tccattctag cagccgtcgg gaaaacgtgg catcctctct 2700
ttcgggctca attggagtca cgctgccgtg agcatcctct ctttccatat ctaacaactg 2760
agcacgtaac caatggaaaa gcatgagctt agcgttgctc caaaaaagta ttggatggtt 2820
aataccattt gtctgttctc ttctgacttt gactcctcaa aaaaaaaaat ctacaatcaa 2880
cagatcgctt caattacgcc ctcacaaaaa cttttttcct tcttcttcgc ccacgttaaa 2940
ttttatccct catgttgtct aacggatttc tgcacttgat ttattataaa aagacaaaga 3000
cataatactt ctctatcaat ttcagttatt gttcttcctt gcgttattct tctgttcttc 3060
tttttctttt gtcatatata accataacca agtaatacat attcaaacta gtatgactga 3120
caaaaaaact cttaaagact taagaaatcg tagttctgtt tacgattcaa tggttaaatc 3180
acctaatcgt gctatgttgc gtgcaactgg tatgcaagat gaagactttg aaaaacctat 3240
cgtcggtgtc atttcaactt gggctgaaaa cacaccttgt aatatccact tacatgactt 3300
tggtaaacta gccaaagtcg gtgttaagga agctggtgct tggccagttc agttcggaac 3360
aatcacggtt tctgatggaa tcgccatggg aacccaagga atgcgtttct ccttgacatc 3420
tcgtgatatt attgcagatt ctattgaagc agccatggga ggtcataatg cggatgcttt 3480
tgtagccatt ggcggttgtg ataaaaacat gcccggttct gttatcgcta tggctaacat 3540
ggatatccca gccatttttg cttacggcgg aacaattgca cctggtaatt tagacggcaa 3600
agatatcgat ttagtctctg tctttgaagg tgtcggccat tggaaccacg gcgatatgac 3660
caaagaagaa gttaaagctt tggaatgtaa tgcttgtccc ggtcctggag gctgcggtgg 3720
tatgtatact gctaacacaa tggcgacagc tattgaagtt ttgggactta gccttccggg 3780
ttcatcttct cacccggctg aatccgcaga aaagaaagca gatattgaag aagctggtcg 3840
cgctgttgtc aaaatgctcg aaatgggctt aaaaccttct gacattttaa cgcgtgaagc 3900
ttttgaagat gctattactg taactatggc tctgggaggt tcaaccaact caacccttca 3960
cctcttagct attgcccatg ctgctaatgt ggaattgaca cttgatgatt tcaatacttt 4020
ccaagaaaaa gttcctcatt tggctgattt gaaaccttct ggtcaatatg tattccaaga 4080
cctttacaag gtcggagggg taccagcagt tatgaaatat ctccttaaaa atggcttcct 4140
tcatggtgac cgtatcactt gtactggcaa aacagtcgct gaaaatttga aggcttttga 4200
tgatttaaca cctggtcaaa aggttattat gccgcttgaa aatcctaaac gtgaagatgg 4260
tccgctcatt attctccatg gtaacttggc tccagacggt gccgttgcca aagtttctgg 4320
tgtaaaagtg cgtcgtcatg tcggtcctgc taaggtcttt aattctgaag aagaagccat 4380
tgaagctgtc ttgaatgatg atattgttga tggtgatgtt gttgtcgtac gttttgtagg 4440
accaaagggc ggtcctggta tgcctgaaat gctttccctt tcatcaatga ttgttggtaa 4500
agggcaaggt gaaaaagttg cccttctgac agatggccgc ttctcaggtg gtacttatgg 4560
tcttgtcgtg ggtcatatcg ctcctgaagc acaagatggc ggtccaatcg cctacctgca 4620
aacaggagac atagtcacta ttgaccaaga cactaaggaa ttacactttg atatctccga 4680
tgaagagtta aaacatcgtc aagagaccat tgaattgcca ccgctctatt cacgcggtat 4740
ccttggtaaa tatgctcaca tcgtttcgtc tgcttctagg ggagccgtaa cagacttttg 4800
gaagcctgaa gaaactggca aaaaatgttg tcctggttgc tgtggttaag cggccgcgtt 4860
aattcaaatt aattgatata gttttttaat gagtattgaa tctgtttaga aataatggaa 4920
tattattttt atttatttat ttatattatt ggtcggctct tttcttctga aggtcaatga 4980
caaaatgata tgaaggaaat aatgatttct aaaattttac aacgtaagat atttttacaa 5040
aagcctagct catcttttgt catgcactat tttactcacg cttgaaatta acggccagtc 5100
cactgcggag tcatttcaaa gtcatcctaa tcgatctatc gtttttgata gctcattttg 5160
gagttcgcga ttgtcttctg ttattcacaa ctgttttaat ttttatttca ttctggaact 5220
cttcgagttc tttgtaaagt ctttcatagt agcttacttt atcctccaac atatttaact 5280
tcatgtcaat ttcggctctt aaattttcca catcatcaag ttcaacatca tcttttaact 5340
tgaatttatt ctctagctct tccaaccaag cctcattgct ccttgattta ctggtgaaaa 5400
gtgatacact ttgcgcgcaa tccaggtcaa aactttcctg caaagaattc accaatttct 5460
cgacatcata gtacaatttg ttttgttctc ccatcacaat ttaatatacc tgatggattc 5520
ttatgaagcg ctgggtaatg gacgtgtcac tctacttcgc ctttttccct actcctttta 5580
gtacggaaga caatgctaat aaataagagg gtaataataa tattattaat cggcaaaaaa 5640
gattaaacgc caagcgttta attatcagaa agcaaacgtc gtaccaatcc ttgaatgctt 5700
cccaattgta tattaagagt catcacagca acatattctt gttattaaat taattattat 5760
tgatttttga tattgtataa aaaaaccaaa tatgtataaa aaaagtgaat aaaaaatacc 5820
aagtatggag aaatatatta gaagtctata cgttaaacca cccgggcccc ccctcgaggt 5880
cgacggtatc gataagcttg atatcgaatt cctgcagccc gggggatcca ctagttctag 5940
agcggccgct ctagaactag taccacaggt gttgtcctct gaggacataa aatacacacc 6000
gagattcatc aactcattgc tggagttagc atatctacaa ttgggtgaaa tggggagcga 6060
tttgcaggca tttgctcggc atgccggtag aggtgtggtc aataagagcg acctcatgct 6120
atacctgaga aagcaacctg acctacagga aagagttact caagaataag aattttcgtt 6180
ttaaaaccta agagtcactt taaaatttgt atacacttat tttttttata acttatttaa 6240
taataaaaat cataaatcat aagaaattcg cttactctta attaatcaaa aagttaaaat 6300
tgtacgaata gattcaccac ttcttaacaa atcaaaccct tcattgattt tctcgaatgg 6360
caatacatgt gtaattaaag gatcaagagc aaacttcttc gccataaagt cggcaacaag 6420
ttttggaaca ctatccttgc tcttaaaacc gccaaatata gctcccttcc atgtacgacc 6480
gcttagcaac agcataggat tcatcgacaa attttgtgaa tcaggaggaa cacctacgat 6540
cacactgact ccatatgcct cttgacagca ggacaacgca gttaccatag tatcaagacg 6600
gcctataact tcaaaagaga aatcaactcc accgtttgac atttcagtaa ggacttcttg 6660
tattggtttc ttataatctt gagggttaac acattcagta gccccgacct ccttagcttt 6720
tgcaaatttg tccttattga tgtctacacc tataatcctc gctgcgcctg cagctttaca 6780
ccccataata acgcttagtc ctactcctcc taaaccgaat actgcacaag tcgaaccctg 6840
tgtaaccttt gcaactttaa ctgcggaacc gtaaccggtg gaaaatccgc accctatcaa 6900
gcaaactttt tccagtggtg aagctgcatc gattttagcg acagatatct cgtccaccac 6960
tgtgtattgg gaaaatgtag aagtaccaag gaaatggtgt ataggtttcc ctctgcatgt 7020
aaatctgctt gtaccatcct gcatagtacc tctaggcata gacaaatcat ttttaaggca 7080
gaaattaccc tcaggatgtt tgcagactct acacttacca cattgaggag tgaacagtgg 7140
gatcacttta tcaccaggac gaacagtggt aacaccttca cctatggatt caacgattcc 7200
ggcagcctcg tgtcccgcga ttactggcaa aggagtaact agagtgccac tcaccacatg 7260
gtcgtcggat ctacagattc cggtggcaac catcttgatt ctaacctcgt gtgcttttgg 7320
tggcgctact tctacttctt ctatgctaaa cggctttttc tcttcccaca aaactgccgc 7380
tttacactta ataactttac cggctgttga catcctcagc tagctattgt aatatgtgtg 7440
tttgtttgga ttattaagaa gaataattac aaaaaaaatt acaaaggaag gtaattacaa 7500
cagaattaag aaaggacaag aaggaggaag agaatcagtt cattatttct tctttgttat 7560
ataacaaacc caagtagcga tttggccata cattaaaagt tgagaaccac cctccctggc 7620
aacagccaca actcgttacc attgttcatc acgatcatga aactcgctgt cagctgaaat 7680
ttcacctcag tggatctctc tttttattct tcatcgttcc actaaccttt ttccatcagc 7740
tggcagggaa cggaaagtgg aatcccattt agcgagcttc ctcttttctt caagaaaaga 7800
cgaagcttgt gtgtgggtgc gcgcgctagt atctttccac attaagaaat ataccataaa 7860
ggttacttag acatcactat ggctatatat atatatatat atatatgtaa cttagcacca 7920
tcgcgcgtgc atcactgcat gtgttaaccg aaaagtttgg cgaacacttc accgacacgg 7980
tcatttagat ctgtcgtctg cattgcacgt cccttagcct taaatcctag gcgggagcat 8040
tctcgtgtaa ttgtgcagcc tgcgtagcaa ctcaacatag cgtagtctac ccagtttttc 8100
aagggtttat cgttagaaga ttctcccttt tcttcctgct cacaaatctt aaagtcatac 8160
attgcacgac taaatgcaag catgcggatc ccccgggctg caggaattcg atatcaagct 8220
tatcgatacc gtcgactggc cattaatctt tcccatatta gatttcgcca agccatgaaa 8280
gttcaagaaa ggtctttaga cgaattaccc ttcatttctc aaactggcgt caagggatcc 8340
tggtatggtt ttatcgtttt atttctggtt cttatagcat cgttttggac ttctctgttc 8400
ccattaggcg gttcaggagc cagcgcagaa tcattctttg aaggatactt atcctttcca 8460
attttgattg tctgttacgt tggacataaa ctgtatacta gaaattggac tttgatggtg 8520
aaactagaag atatggatct tgataccggc agaaaacaag tagatttgac tcttcgtagg 8580
gaagaaatga ggattgagcg agaaacatta gcaaaaagat ccttcgtaac aagattttta 8640
catttctggt gttgaaggga aagatatgag ctatacagcg gaatttccat atcactcaga 8700
ttttgttatc taattttttc cttcccacgt ccgcgggaat ctgtgtatat tactgcatct 8760
agatatatgt tatcttatct tggcgcgtac atttaatttt caacgtattc tataagaaat 8820
tgcgggagtt tttttcatgt agatgatact gactgcacgc aaatataggc atgatttata 8880
ggcatgattt gatggctgta ccgataggaa cgctaagagt aacttcagaa tcgttatcct 8940
ggcggaaaaa attcatttgt aaactttaaa aaaaaaagcc aatatcccca aaattattaa 9000
gagcgcctcc attattaact aaaatttcac tcagcatcca caatgtatca ggtatctact 9060
acagatatta catgtggcga aaaagacaag aacaatgcaa tagcgcatca agaaaaaaca 9120
caaagctttc aatcaatgaa tcgaaaatgt cattaaaata gtatataaat tgaaactaag 9180
tcataaagct ataaaaagaa aatttattta aatcttggct ctcttgggct caaggtgaca 9240
aggtcctcga aaatagggcg cgccccaccg cggtggagct ccagcttttg ttccctttag 9300
tgagggttaa ttgcgcgctt ggcgtaatca tggtcatagc tgtttcctgt gtgaaattgt 9360
tatccgctca caattccaca caacatacga gccggaagca taaagtgtaa agcctggggt 9420
gcctaatgag tgagctaact cacattaatt gcgttgcgct cactgcccgc tttccagtcg 9480
ggaaacctgt cgtgccagct gcattaatga atcggccaac gcgcggggag aggcggtttg 9540
cgtattgggc gctcttccgc ttcctcgctc actgactcgc tgcgctcggt cgttcggctg 9600
cggcgagcgg tatcagctca ctcaaaggcg gtaatacggt tatccacaga atcaggggat 9660
aacgcaggaa agaacatgtg agcaaaaggc cagcaaaagg ccaggaaccg taaaaaggcc 9720
gcgttgctgg cgtttttcca taggctccgc ccccctgacg agcatcacaa aaatcgacgc 9780
tcaagtcaga ggtggcgaaa cccgacagga ctataaagat accaggcgtt tccccctgga 9840
agctccctcg tgcgctctcc tgttccgacc ctgccgctta ccggatacct gtccgccttt 9900
ctcccttcgg gaagcgtggc gctttctcat agctcacgct gtaggtatct cagttcggtg 9960
taggtcgttc gctccaagct gggctgtgtg cacgaacccc ccgttcagcc cgaccgctgc 10020
gccttatccg gtaactatcg tcttgagtcc aacccggtaa gacacgactt atcgccactg 10080
gcagcagcca ctggtaacag gattagcaga gcgaggtatg taggcggtgc tacagagttc 10140
ttgaagtggt ggcctaacta cggctacact agaagaacag tatttggtat ctgcgctctg 10200
ctgaagccag ttaccttcgg aaaaagagtt ggtagctctt gatccggcaa acaaaccacc 10260
gctggtagcg gtggtttttt tgtttgcaag cagcagatta cgcgcagaaa aaaaggatct 10320
caagaagatc ctttgatctt ttctacgggg tctgacgctc agtggaacga aaactcacgt 10380
taagggattt tggtcatgag attatcaaaa aggatcttca cctagatcct tttaaattaa 10440
aaatgaagtt ttaaatcaat ctaaagtata tatgagtaaa cttggtctga cagttaccaa 10500
tgcttaatca gtgaggcacc tatctcagcg atctgtctat ttcgttcatc catagttgcc 10560
tgactccccg tcgtgtagat aactacgata cgggagggct taccatctgg ccccagtgct 10620
gcaatgatac cgcgagaccc acgctcaccg gctccagatt tatcagcaat aaaccagcca 10680
gccggaaggg ccgagcgcag aagtggtcct gcaactttat ccgcctccat ccagtctatt 10740
aattgttgcc gggaagctag agtaagtagt tcgccagtta atagtttgcg caacgttgtt 10800
gccattgcta caggcatcgt ggtgtcacgc tcgtcgtttg gtatggcttc attcagctcc 10860
ggttcccaac gatcaaggcg agttacatga tcccccatgt tgtgcaaaaa agcggttagc 10920
tccttcggtc ctccgatcgt tgtcagaagt aagttggccg cagtgttatc actcatggtt 10980
atggcagcac tgcataattc tcttactgtc atgccatccg taagatgctt ttctgtgact 11040
ggtgagtact caaccaagtc attctgagaa tagtgtatgc ggcgaccgag ttgctcttgc 11100
ccggcgtcaa tacgggataa taccgcgcca catagcagaa ctttaaaagt gctcatcatt 11160
ggaaaacgtt cttcggggcg aaaactctca aggatcttac cgctgttgag atccagttcg 11220
atgtaaccca ctcgtgcacc caactgatct tcagcatctt ttactttcac cagcgtttct 11280
gggtgagcaa aaacaggaag gcaaaatgcc gcaaaaaagg gaataagggc gacacggaaa 11340
tgttgaatac tcatactctt cctttttcaa tattattgaa gcatttatca gggttattgt 11400
ctcatgagcg gatacatatt tgaatgtatt tagaaaaata aacaaatagg ggttccgcgc 11460
acatttcccc gaaaagtgcc acctgaacga agcatctgtg cttcattttg tagaacaaaa 11520
atgcaacgcg agagcgctaa tttttcaaac aaagaatctg agctgcattt ttacagaaca 11580
gaaatgcaac gcgaaagcgc tattttacca acgaagaatc tgtgcttcat ttttgtaaaa 11640
caaaaatgca acgcgagagc gctaattttt caaacaaaga atctgagctg catttttaca 11700
gaacagaaat gcaacgcgag agcgctattt taccaacaaa gaatctatac ttcttttttg 11760
ttctacaaaa atgcatcccg agagcgctat ttttctaaca aagcatctta gattactttt 11820
tttctccttt gtgcgctcta taatgcagtc tcttgataac tttttgcact gtaggtccgt 11880
taaggttaga agaaggctac tttggtgtct attttctctt ccataaaaaa agcctgactc 11940
cacttcccgc gtttactgat tactagcgaa gctgcgggtg cattttttca agataaaggc 12000
atccccgatt atattctata ccgatgtgga ttgcgcatac tttgtgaaca gaaagtgata 12060
gcgttgatga ttcttcattg gtcagaaaat tatgaacggt ttcttctatt ttgtctctat 12120
atactacgta taggaaatgt ttacattttc gtattgtttt cgattcactc tatgaatagt 12180
tcttactaca atttttttgt ctaaagagta atactagaga taaacataaa aaatgtagag 12240
gtcgagttta gatgcaagtt caaggagcga aaggtggatg ggtaggttat atagggatat 12300
agcacagaga tatatagcaa agagatactt ttgagcaatg tttgtggaag cggtattcgc 12360
aatattttag tagctcgtta cagtccggtg cgtttttggt tttttgaaag tgcgtcttca 12420
gagcgctttt ggttttcaaa agcgctctga agttcctata ctttctagag aataggaact 12480
tcggaatagg aacttcaaag cgtttccgaa aacgagcgct tccgaaaatg caacgcgagc 12540
tgcgcacata cagctcactg ttcacgtcgc acctatatct gcgtgttgcc tgtatatata 12600
tatacatgag aagaacggca tagtgcgtgt ttatgcttaa atgcgtactt atatgcgtct 12660
atttatgtag gatgaaaggt agtctagtac ctcctgtgat attatcccat tccatgcggg 12720
gtatcgtatg cttccttcag cactaccctt tagctgttct atatgctgcc actcctcaat 12780
tggattagtc tcatccttca atgctatcat ttcctttgat attggatcat actaagaaac 12840
cattattatc atgacattaa cctataaaaa taggcgtatc acgaggccct ttcgtc 12896
<210> 196
<211> 3015
<212> DNA
<213> Artificial Sequence
<220>
<223> FBA1-alsS- CYCt in Chr. XII; Upstream region = nt 1-154; FBA1
promoter = nt 155-802; alsS CDS = nt; CYC1 terminator = nt
2534-2788; Downstream region = nt 2790-3015
<400> 196
gcgatttaat ctctaattat tagttaaagt tttataagca tttttatgta acgaaaaata 60
aattggttca tattattact gcactgtcac ttaccatgga aagaccagac aagaagttgc 120
cgacagtctg ttgaattggc ctggttaggc ttaagatctg aaatgaataa caatactgac 180
agtactaaat aattgcctac ttggcttcac atacgttgca tacgtcgata tagataataa 240
tgataatgac agcaggatta tcgtaatacg taatagttga aaatctcaaa aatgtgtggg 300
tcattacgta aataatgata ggaatgggat tcttctattt ttcctttttc cattctagca 360
gccgtcggga aaacgtggca tcctctcttt cgggctcaat tggagtcacg ctgccgtgag 420
catcctctct ttccatatct aacaactgag cacgtaacca atggaaaagc atgagcttag 480
cgttgctcca aaaaagtatt ggatggttaa taccatttgt ctgttctctt ctgactttga 540
ctcctcaaaa aaaaaaaatc tacaatcaac agatcgcttc aattacgccc tcacaaaaac 600
ttttttcctt cttcttcgcc cacgttaaat tttatccctc atgttgtcta acggatttct 660
gcacttgatt tattataaaa agacaaagac ataatacttc tctatcaatt tcagttattg 720
ttcttccttg cgttattctt ctgttcttct ttttcttttg tcatatataa ccataaccaa 780
gtaatacata ttcaaatcta gagctgagga tgttgacaaa agcaacaaaa gaacaaaaat 840
cccttgtgaa aaacagaggg gcggagcttg ttgttgattg cttagtggag caaggtgtca 900
cacatgtatt tggcattcca ggtgcaaaaa ttgatgcggt atttgacgct ttacaagata 960
aaggacctga aattatcgtt gcccggcacg aacaaaacgc agcattcatg gcccaagcag 1020
tcggccgttt aactggaaaa ccgggagtcg tgttagtcac atcaggaccg ggtgcctcta 1080
acttggcaac aggcctgctg acagcgaaca ctgaaggaga ccctgtcgtt gcgcttgctg 1140
gaaacgtgat ccgtgcagat cgtttaaaac ggacacatca atctttggat aatgcggcgc 1200
tattccagcc gattacaaaa tacagtgtag aagttcaaga tgtaaaaaat ataccggaag 1260
ctgttacaaa tgcatttagg atagcgtcag cagggcaggc tggggccgct tttgtgagct 1320
ttccgcaaga tgttgtgaat gaagtcacaa atacgaaaaa cgtgcgtgct gttgcagcgc 1380
caaaactcgg tcctgcagca gatgatgcaa tcagtgcggc catagcaaaa atccaaacag 1440
caaaacttcc tgtcgttttg gtcggcatga aaggcggaag accggaagca attaaagcgg 1500
ttcgcaagct tttgaaaaag gttcagcttc catttgttga aacatatcaa gctgccggta 1560
ccctttctag agatttagag gatcaatatt ttggccgtat cggtttgttc cgcaaccagc 1620
ctggcgattt actgctagag caggcagatg ttgttctgac gatcggctat gacccgattg 1680
aatatgatcc gaaattctgg aatatcaatg gagaccggac aattatccat ttagacgaga 1740
ttatcgctga cattgatcat gcttaccagc ctgatcttga attgatcggt gacattccgt 1800
ccacgatcaa tcatatcgaa cacgatgctg tgaaagtgga atttgcagag cgtgagcaga 1860
aaatcctttc tgatttaaaa caatatatgc atgaaggtga gcaggtgcct gcagattgga 1920
aatcagacag agcgcaccct cttgaaatcg ttaaagagtt gcgtaatgca gtcgatgatc 1980
atgttacagt aacttgcgat atcggttcgc acgccatttg gatgtcacgt tatttccgca 2040
gctacgagcc gttaacatta atgatcagta acggtatgca aacactcggc gttgcgcttc 2100
cttgggcaat cggcgcttca ttggtgaaac cgggagaaaa agtggtttct gtctctggtg 2160
acggcggttt cttattctca gcaatggaat tagagacagc agttcgacta aaagcaccaa 2220
ttgtacacat tgtatggaac gacagcacat atgacatggt tgcattccag caattgaaaa 2280
aatataaccg tacatctgcg gtcgatttcg gaaatatcga tatcgtgaaa tatgcggaaa 2340
gcttcggagc aactggcttg cgcgtagaat caccagacca gctggcagat gttctgcgtc 2400
aaggcatgaa cgctgaaggt cctgtcatca tcgatgtccc ggttgactac agtgataaca 2460
ttaatttagc aagtgacaag cttccgaaag aattcgggga actcatgaaa acgaaagctc 2520
tctagttaat taatcatgta attagttatg tcacgcttac attcacgccc tccccccaca 2580
tccgctctaa ccgaaaagga aggagttaga caacctgaag tctaggtccc tatttatttt 2640
tttatagtta tgttagtatt aagaacgtta tttatatttc aaatttttct tttttttctg 2700
tacagacgcg tgtacgcatg taacattata ctgaaaacct tgcttgagaa ggttttggga 2760
cgctcgaagg ctttaatttg cgggcggcct taagtctggg tccgcttctt tacaaatttg 2820
gagaatttct cttaaacgat atgtatattc ttttcgttgg aaaagatgtc ttccaaaaaa 2880
aaaaccgatg aattagtgga accaaggaaa aaaaaagagg tatccttgat taaggaacac 2940
tgtttaaaca gtgtggtttc caaaaccctg aaactgcatt agtgtaatag aagactagac 3000
acctcgatac aaata 3015
<210> 197
<211> 2900
<212> DNA
<213> Artificial Sequence
<220>
<223> fra2delta::PDC1-hADH-ADHt; Upstream region = nt 1-300; PDC1
promoter = nt 309-1178; hADH coding region = nt 1179-2306; ADH1
terminator = nt 2315-2630;Downstream region = nt 2639-2900
<400> 197
gttagcatcc acagcttctt gagcaactga cttcgtgagg tctacagtca aaaggacctt 60
tgttttagcg tttgcatcgg cagtggtgac ttgtgcagtg gaacaatcga tgagaagacc 120
cgtattgtcc cagctcttgt ctgcgtactt ttgagggtag aacttggtaa tgctacgcac 180
aagtttgtcc aattgtgctc tagtaatagc tctgctcatt gcgtttcggt ggactcttgt 240
tctgtttcct tccgactgtg tattggaata agtttttcgg tgttatatat atacatatat 300
ggcgcgcccc gcacgccgaa atgcatgcaa gtaacctatt caaagtaata tctcatacat 360
gtttcatgag ggtaacaaca tgcgactggg tgagcatatg ttccgctgat gtgatgtgca 420
agataaacaa gcaaggcaga aactaacttc ttcttcatgt aataaacaca ccccgcgttt 480
atttacctat ctctaaactt caacacctta tatcataact aatatttctt gagataagca 540
cactgcaccc ataccttcct taaaaacgta gcttccagtt tttggtggtt ccggcttcct 600
tcccgattcc gcccgctaaa cgcatatttt tgttgcctgg tggcatttgc aaaatgcata 660
acctatgcat ttaaaagatt atgtatgctc ttctgacttt tcgtgtgatg aggctcgtgg 720
aaaaaatgaa taatttatga atttgagaac aattttgtgt tgttacggta ttttactatg 780
gaataatcaa tcaattgagg attttatgca aatatcgttt gaatattttt ccgacccttt 840
gagtactttt cttcataatt gcataatatt gtccgctgcc cctttttctg ttagacggtg 900
tcttgatcta cttgctatcg ttcaacacca ccttattttc taactatttt ttttttagct 960
catttgaatc agcttatggt gatggcacat ttttgcataa acctagctgt cctcgttgaa 1020
cataggaaaa aaaaatatat aaacaaggct ctttcactct ccttgcaatc agatttgggt 1080
ttgttccctt tattttcata tttcttgtca tattcctttc tcaattatta ttttctactc 1140
ataacctcac gcaaaataac acagtcaaat caatcaaaat gtcaacagcc ggtaaagtta 1200
ttaagtgtaa agcggcagtt ttgtgggaag agaaaaagcc gtttagcata gaagaagtag 1260
aagtagcgcc accaaaagca cacgaggtta gaatcaagat ggttgccacc ggaatctgta 1320
gatccgacga ccatgtggtg agtggcactc tagttactcc tttgccagta atcgcgggac 1380
acgaggctgc cggaatcgtt gaatccatag gtgaaggtgt taccactgtt cgtcctggtg 1440
ataaagtgat cccactgttc actcctcaat gtggtaagtg tagagtctgc aaacatcctg 1500
agggtaattt ctgccttaaa aatgatttgt ctatgcctag aggtactatg caggatggta 1560
caagcagatt tacatgcaga gggaaaccta tacaccattt ccttggtact tctacatttt 1620
cccaatacac agtggtggac gagatatctg tcgctaaaat cgatgcagct tcaccactgg 1680
aaaaagtttg cttgataggg tgcggatttt ccaccggtta cggttccgca gttaaagttg 1740
caaaggttac acagggttcg acttgtgcag tattcggttt aggaggagta ggactaagcg 1800
ttattatggg gtgtaaagct gcaggcgcag cgaggattat aggtgtagac atcaataagg 1860
acaaatttgc aaaagctaag gaggtcgggg ctactgaatg tgttaaccct caagattata 1920
agaaaccaat acaagaagtc cttactgaaa tgtcaaacgg tggagttgat ttctcttttg 1980
aagttatagg ccgtcttgat actatggtaa ctgcgttgtc ctgctgtcaa gaggcatatg 2040
gagtcagtgt gatcgtaggt gttcctcctg attcacaaaa tttgtcgatg aatcctatgc 2100
tgttgctaag cggtcgtaca tggaagggag ctatatttgg cggttttaag agcaaggata 2160
gtgttccaaa acttgttgcc gactttatgg cgaagaagtt tgctcttgat cctttaatta 2220
cacatgtatt gccattcgag aaaatcaatg aagggtttga tttgttaaga agtggtgaat 2280
ctattcgtac aattttaact ttttgattaa ttaagagtaa gcgaatttct tatgatttat 2340
gatttttatt attaaataag ttataaaaaa aataagtgta tacaaatttt aaagtgactc 2400
ttaggtttta aaacgaaaat tcttattctt gagtaactct ttcctgtagg tcaggttgct 2460
ttctcaggta tagcatgagg tcgctcttat tgaccacacc tctaccggca tgccgagcaa 2520
atgcctgcaa atcgctcccc atttcaccca attgtagata tgctaactcc agcaatgagt 2580
tgatgaatct cggtgtgtat tttatgtcct cagaggacaa cacctgtggt gtttaaacaa 2640
aggatgatat tgttctatta ttaagtttcg aaaggagacg gcattgaatc tttttggcat 2700
agacgatttt gctttcttac gttatttaca tcggagagta tgtatttgtg tagttatgta 2760
cttagatatg taacttaatt taatgatatg gtggggggct atcctccatg ccccatttcc 2820
agttatttga aggttcttgc gagttcaaac ctatgaagta aaacggtttc tttttagatg 2880
tatctttctt ggagtccaaa 2900
<210> 198
<211> 2656
<212> DNA
<213> Artificial Sequence
<220>
<223> yprcdelta15delta ::PDC5-hADH-ADHt; Upstream region = nt 1-150;
PDC5 promoter = nt 159-696; hADH coding region = nt 697-1824;
ADH1 terminator = nt 1833-2148; Downstream region = nt 2157-2656
<400> 198
ccaaaaggaa tattgggtca gatgaatgga cgcgaatgca agacagaagt ccaaatcacg 60
tcaagacaaa gaaagaaaga aagaaaaact aacacattaa tgtagtttta aaatttcaaa 120
tccgaacaac agagcatagg gtttcgcaaa ggcgcgccta tttgtaatac gtatacgaat 180
tccttcaaca aaggccaagg aaataaagca aataacaata acaccattat tttaattttt 240
tttctattac tgtcgctaac acctgtatgg ttgcaaccag gtgagaatcc ttctgatgca 300
tactttatgc gtttatgcgt tttgcgcccc ttggaaaaaa attgattctc atcgtaaatg 360
catactacat gcgtttatgg gaaaagcctc catatccaaa ggtcgcgttt cttttagaaa 420
aactaatacg taaacctgca ttaaggtaag attatatcag aaaatgtgtt gcaagaaatg 480
cattatgcaa ttttttgatt atgacaatct ctcgaaagaa atttcatatg atgagacttg 540
aataatgcag cggcgcttgc taaaagaact tgtatataag agctgccatt ctcgatcaat 600
atactgtagt aagtcctttc ctctctttct tattacactt atttcacata atcaatctca 660
aagagaacaa cacaatacaa taacaagaag aacaaaatgt caacagccgg taaagttatt 720
aagtgtaaag cggcagtttt gtgggaagag aaaaagccgt ttagcataga agaagtagaa 780
gtagcgccac caaaagcaca cgaggttaga atcaagatgg ttgccaccgg aatctgtaga 840
tccgacgacc atgtggtgag tggcactcta gttactcctt tgccagtaat cgcgggacac 900
gaggctgccg gaatcgttga atccataggt gaaggtgtta ccactgttcg tcctggtgat 960
aaagtgatcc cactgttcac tcctcaatgt ggtaagtgta gagtctgcaa acatcctgag 1020
ggtaatttct gccttaaaaa tgatttgtct atgcctagag gtactatgca ggatggtaca 1080
agcagattta catgcagagg gaaacctata caccatttcc ttggtacttc tacattttcc 1140
caatacacag tggtggacga gatatctgtc gctaaaatcg atgcagcttc accactggaa 1200
aaagtttgct tgatagggtg cggattttcc accggttacg gttccgcagt taaagttgca 1260
aaggttacac agggttcgac ttgtgcagta ttcggtttag gaggagtagg actaagcgtt 1320
attatggggt gtaaagctgc aggcgcagcg aggattatag gtgtagacat caataaggac 1380
aaatttgcaa aagctaagga ggtcggggct actgaatgtg ttaaccctca agattataag 1440
aaaccaatac aagaagtcct tactgaaatg tcaaacggtg gagttgattt ctcttttgaa 1500
gttataggcc gtcttgatac tatggtaact gcgttgtcct gctgtcaaga ggcatatgga 1560
gtcagtgtga tcgtaggtgt tcctcctgat tcacaaaatt tgtcgatgaa tcctatgctg 1620
ttgctaagcg gtcgtacatg gaagggagct atatttggcg gttttaagag caaggatagt 1680
gttccaaaac ttgttgccga ctttatggcg aagaagtttg ctcttgatcc tttaattaca 1740
catgtattgc cattcgagaa aatcaatgaa gggtttgatt tgttaagaag tggtgaatct 1800
attcgtacaa ttttaacttt ttgattaatt aagagtaagc gaatttctta tgatttatga 1860
tttttattat taaataagtt ataaaaaaaa taagtgtata caaattttaa agtgactctt 1920
aggttttaaa acgaaaattc ttattcttga gtaactcttt cctgtaggtc aggttgcttt 1980
ctcaggtata gcatgaggtc gctcttattg accacacctc taccggcatg ccgagcaaat 2040
gcctgcaaat cgctccccat ttcacccaat tgtagatatg ctaactccag caatgagttg 2100
atgaatctcg gtgtgtattt tatgtcctca gaggacaaca cctgtggtgt ttaaacaatg 2160
gaaggtcggg atgagcatat acaagcacta agaagaacaa tacagaactc tacacggtat 2220
tattgtgcta caagctcgag taaaaccgag tgttttgacg atactaacgt tgttaagaaa 2280
gtaacttgtt atcaaactca ttaccaactt gtgattaatt ggtgaataat atgataattg 2340
tcgaaattcc attgttggta aagcctataa tattatgtat acagattata ctagaaattc 2400
tctcgagaat ataagaatcc ccaaaattga atcggtattt ctacatacta atattaccat 2460
tacttctcct ttcgttttat atgtttcatt cctattacat tatcgatctt tgcatttcag 2520
cttccattat atttgatgtc tgttttatgt ccccacgtta caccgcatgt gacagtatac 2580
tagtaacatg agtgctaccg aatagatgac attttagact ttcattccaa caacttggtt 2640
gacagaatgt tacgta 2656
<210> 199
<211> 451
<212> DNA
<213> Artificial Sequence
<220>
<223> ymr226c delta; Upstream region = nt 1-250; Downstream region = nt
251-451
<400> 199
gatgatgcta tttggtgcag agggtgatga gtaagttctc tttatcatct atatattact 60
cttatacact atacgactct actctatgac gtatagcatt gatatatatt aaggcacgac 120
accgattttt cttatcggag cgatataaaa agctgaagaa aggaggatag atgaaacagc 180
atggcgcata gaaagtgttc aagctcacta gtaaaggcgg gaaatagaac attgagaacg 240
tattttgata acctagctaa actaagtaaa tctgtatact ttttatacat gtaagacttt 300
ttagctattt cattcttccc tgaaccgttt tgcgcgattc tacggaatat accggcgaaa 360
taaaagagat aaacttatgg atcctcaaat agaggatgaa cagatgtgaa gaagaaacga 420
gcttaattat atcttcgcca tgataactaa a 451
<210> 200
<211> 1128
<212> DNA
<213> Artificial Sequence
<220>
<223> ald6 delta::loxP; Upstream region = nt 1-500; loxP site = nt
551-584; Downstream region = nt 678-1128
<400> 200
tgatctgatg cgctttgcat atctcatatt ccttcactag cataaaaatc caaaaaaaaa 60
gaatatttag gccgaatgga attattcgta acgtcatacg aaaaaagttt caattcgtac 120
aatgcctggc atgttcattc gaatataagg ccgccgcctt ccagtcaggg tagccaaaag 180
tataatcccg ggtggaaact aaactaaaaa ccgtactcac aactttccgc ggacgctaac 240
agacaaatag acacactatc aggtcaggaa ctgccgtcac atacgacact gcccctcacg 300
taagggcatg atagaattgg attatgtaaa aggtgaagat accattgtag aagcaaccag 360
cacgtcgccg tggctgatga ggtctcctct tgcccgggcc gcagaaaaga ggggcagtgg 420
cctgtttttc gacataaatg aggggcatgg ccagcaccga gacgtcattg ttgcatatgg 480
cgtatccaag ccgaaacggc ggtaccgcaa gggcgaattc accttggcta actcgttgta 540
tcatcactgg ataacttcgt ataatgtatg ctatacgaag ttatctgaac attagaatac 600
gtaatccgca atgcggatcc tctagagtcg acctgcaggc atgctcgagc ggccgccagt 660
gtgatggata tctgcagaat tcgcccttgc cgatcgtgta ccaacctgca tttctttccg 720
tcatatacac aaaatacttt catataaact tacttggtct tacgtcataa ataaatatgt 780
atacatataa attaaaaaat ttggttttat atttttacaa aaagaatcgt ttacttcatt 840
tctccctttt aagcgataca atccatgaaa aaagagaaaa agagagaaca ggcttgtgcc 900
ttctttaaaa catcccacac aaaatcatat tgaattgaat tttacatctt aagctagtgt 960
acaacaactg ctatatccaa agaaaactaa cgtggaccgc ttttagagtt gagaaaaagg 1020
tttgaaaaaa atagcaatac aaagacttgt ttcatatata aaatacaggg agcacattga 1080
gctaatataa cataaacact gcgaaccaat tccaatcaaa aggtacac 1128
<210> 201
<211> 9612
<212> DNA
<213> Artificial Sequence
<220>
<223> pLH702
<400> 201
aaacagtatg gaagaatgta agatggctaa gatttactac caagaagact gtaacttgtc 60
cttgttggat ggtaagacta tcgccgttat cggttacggt tctcaaggtc acgctcatgc 120
cctgaatgct aaggaatccg gttgtaacgt tatcattggt ttatacgaag gtgctaagga 180
ttggaaaaga gctgaagaac aaggtttcga agtctacacc gctgctgaag ctgctaagaa 240
ggctgacatc attatgatct tgatcaacga tgaaaagcag gctaccatgt acaaaaacga 300
catcgaacca aacttggaag ccggtaacat gttgatgttc gctcacggtt tcaacatcca 360
tttcggttgt attgttccac caaaggacgt tgatgtcact atgatcgctc caaagggtcc 420
aggtcacacc gttagatccg aatacgaaga aggtaaaggt gtcccatgct tggttgctgt 480
cgaacaagac gctactggca aggctttgga tatggctttg gcctacgctt tagccatcgg 540
tggtgctaga gccggtgtct tggaaactac cttcagaacc gaaactgaaa ccgacttgtt 600
cggtgaacaa gctgttttat gtggtggtgt ctgcgctttg atgcaggccg gttttgaaac 660
cttggttgaa gccggttacg acccaagaaa cgcttacttc gaatgtatcc acgaaatgaa 720
gttgatcgtt gacttgatct accaatctgg tttctccggt atgcgttact ctatctccaa 780
cactgctgaa tacggtgact acattaccgg tccaaagatc attactgaag ataccaagaa 840
ggctatgaag aagattttgt ctgacattca agatggtacc tttgccaagg acttcttggt 900
tgacatgtct gatgctggtt cccaggtcca cttcaaggct atgagaaagt tggcctccga 960
acacccagct gaagttgtcg gtgaagaaat tagatccttg tactcctggt ccgacgaaga 1020
caagttgatt aacaactgat attttcctct ggccctgcag gcctatcaag tgctggaaac 1080
tttttctctt ggaatttttg caacatcaag tcatagtcaa ttgaattgac ccaatttcac 1140
atttaagatt tttttttttt catccgacat acatctgtac actaggaagc cctgtttttc 1200
tgaagcagct tcaaatatat atatttttta catatttatt atgattcaat gaacaatcta 1260
attaaatcga aaacaagaac cgaaacgcga ataaataatt tatttagatg gtgacaagtg 1320
tataagtcct catcgggaca gctacgattt ctctttcggt tttggctgag ctactggttg 1380
ctgtgacgca gcggcattag cgcggcgtta tgagctaccc tcgtggcctg aaagatggcg 1440
ggaataaagc ggaactaaaa attactgact gagccatatt gaggtcaatt tgtcaactcg 1500
tcaagtcacg tttggtggac ggcccctttc caacgaatcg tatatactaa catgcgcgcg 1560
cttcctatat acacatatac atatatatat atatatatat gtgtgcgtgt atgtgtacac 1620
ctgtatttaa tttccttact cgcgggtttt tcttttttct caattcttgg cttcctcttt 1680
ctcgagcgga ccggatcctc cgcggtgccg gcagatctat ttaaatggcg cgccgacgtc 1740
aggtggcact tttcggggaa atgtgcgcgg aacccctatt tgtttatttt tctaaataca 1800
ttcaaatatg tatccgctca tgagacaata accctgataa atgcttcaat aatattgaaa 1860
aaggaagagt atgagtattc aacatttccg tgtcgccctt attccctttt ttgcggcatt 1920
ttgccttcct gtttttgctc acccagaaac gctggtgaaa gtaaaagatg ctgaagatca 1980
gttgggtgca cgagtgggtt acatcgaact ggatctcaac agcggtaaga tccttgagag 2040
ttttcgcccc gaagaacgtt ttccaatgat gagcactttt aaagttctgc tatgtggcgc 2100
ggtattatcc cgtattgacg ccgggcaaga gcaactcggt cgccgcatac actattctca 2160
gaatgacttg gttgagtact caccagtcac agaaaagcat cttacggatg gcatgacagt 2220
aagagaatta tgcagtgctg ccataaccat gagtgataac actgcggcca acttacttct 2280
gacaacgatc ggaggaccga aggagctaac cgcttttttg cacaacatgg gggatcatgt 2340
aactcgcctt gatcgttggg aaccggagct gaatgaagcc ataccaaacg acgagcgtga 2400
caccacgatg cctgtagcaa tggcaacaac gttgcgcaaa ctattaactg gcgaactact 2460
tactctagct tcccggcaac aattaataga ctggatggag gcggataaag ttgcaggacc 2520
acttctgcgc tcggcccttc cggctggctg gtttattgct gataaatctg gagccggtga 2580
gcgtgggtct cgcggtatca ttgcagcact ggggccagat ggtaagccct cccgtatcgt 2640
agttatctac acgacgggga gtcaggcaac tatggatgaa cgaaatagac agatcgctga 2700
gataggtgcc tcactgatta agcattggta actgtcagac caagtttact catatatact 2760
ttagattgat ttaaaacttc atttttaatt taaaaggatc taggtgaaga tcctttttga 2820
taatctcatg accaaaatcc cttaacgtga gttttcgttc cactgagcgt cagaccccgt 2880
agaaaagatc aaaggatctt cttgagatcc tttttttctg cgcgtaatct gctgcttgca 2940
aacaaaaaaa ccaccgctac cagcggtggt ttgtttgccg gatcaagagc taccaactct 3000
ttttccgaag gtaactggct tcagcagagc gcagatacca aatactgttc ttctagtgta 3060
gccgtagtta ggccaccact tcaagaactc tgtagcaccg cctacatacc tcgctctgct 3120
aatcctgtta ccagtggctg ctgccagtgg cgataagtcg tgtcttaccg ggttggactc 3180
aagacgatag ttaccggata aggcgcagcg gtcgggctga acggggggtt cgtgcacaca 3240
gcccagcttg gagcgaacga cctacaccga actgagatac ctacagcgtg agctatgaga 3300
aagcgccacg cttcccgaag ggagaaaggc ggacaggtat ccggtaagcg gcagggtcgg 3360
aacaggagag cgcacgaggg agcttccagg gggaaacgcc tggtatcttt atagtcctgt 3420
cgggtttcgc cacctctgac ttgagcgtcg atttttgtga tgctcgtcag gggggcggag 3480
cctatggaaa aacgccagca acgcggcctt tttacggttc ctggcctttt gctggccttt 3540
tgctcacatg ttctttcctg cgttatcccc tgattctgtg gataaccgta ttaccgcctt 3600
tgagtgagct gataccgctc gccgcagccg aacgaccgag cgcagcgagt cagtgagcga 3660
ggaagcggaa gagcgcccaa tacgcaaacc gcctctcccc gcgcgttggc cgattcatta 3720
atgcagctgg cacgacaggt ttcccgactg gaaagcgggc agtgagcgca acgcaattaa 3780
tgtgagttag ctcactcatt aggcacccca ggctttacac tttatgcttc cggctcgtat 3840
gttgtgtgga attgtgagcg gataacaatt tcacacagga aacagctatg accatgatta 3900
cgccaagctt tttctttcca attttttttt tttcgtcatt ataaaaatca ttacgaccga 3960
gattcccggg taataactga tataattaaa ttgaagctct aatttgtgag tttagtatac 4020
atgcatttac ttataataca gttttttagt tttgctggcc gcatcttctc aaatatgctt 4080
cccagcctgc ttttctgtaa cgttcaccct ctaccttagc atcccttccc tttgcaaata 4140
gtcctcttcc aacaataata atgtcagatc ctgtagagac cacatcatcc acggttctat 4200
actgttgacc caatgcgtct cccttgtcat ctaaacccac accgggtgtc ataatcaacc 4260
aatcgtaacc ttcatctctt ccacccatgt ctctttgagc aataaagccg ataacaaaat 4320
ctttgtcgct cttcgcaatg tcaacagtac ccttagtata ttctccagta gatagggagc 4380
ccttgcatga caattctgct aacatcaaaa ggcctctagg ttcctttgtt acttcttctg 4440
ccgcctgctt caaaccgcta acaatacctg ggcccaccac accgtgtgca ttcgtaatgt 4500
ctgcccattc tgctattctg tatacacccg cagagtactg caatttgact gtattaccaa 4560
tgtcagcaaa ttttctgtct tcgaagagta aaaaattgta cttggcggat aatgccttta 4620
gcggcttaac tgtgccctcc atggaaaaat cagtcaagat atccacatgt gtttttagta 4680
aacaaatttt gggacctaat gcttcaacta actccagtaa ttccttggtg gtacgaacat 4740
ccaatgaagc acacaagttt gtttgctttt cgtgcatgat attaaatagc ttggcagcaa 4800
caggactagg atgagtagca gcacgttcct tatatgtagc tttcgacatg atttatcttc 4860
gtttcctgca ggtttttgtt ctgtgcagtt gggttaagaa tactgggcaa tttcatgttt 4920
cttcaacact acatatgcgt atatatacca atctaagtct gtgctccttc cttcgttctt 4980
ccttctgttc ggagattacc gaatcaaaaa aatttcaagg aaaccgaaat caaaaaaaag 5040
aataaaaaaa aaatgatgaa ttgaaaagct tgcatgcctg caggtcgact ctagtatact 5100
ccgtctactg tacgatacac ttccgctcag gtccttgtcc tttaacgagg ccttaccact 5160
cttttgttac tctattgatc cagctcagca aaggcagtgt gatctaagat tctatcttcg 5220
cgatgtagta aaactagcta gaccgagaaa gagactagaa atgcaaaagg cacttctaca 5280
atggctgcca tcattattat ccgatgtgac gctgcatttt tttttttttt tttttttttt 5340
tttttttttt tttttttttt ttttttttgt acaaatatca taaaaaaaga gaatcttttt 5400
aagcaaggat tttcttaact tcttcggcga cagcatcacc gacttcggtg gtactgttgg 5460
aaccacctaa atcaccagtt ctgatacctg catccaaaac ctttttaact gcatcttcaa 5520
tggctttacc ttcttcaggc aagttcaatg acaatttcaa catcattgca gcagacaaga 5580
tagtggcgat agggttgacc ttattctttg gcaaatctgg agcggaacca tggcatggtt 5640
cgtacaaacc aaatgcggtg ttcttgtctg gcaaagaggc caaggacgca gatggcaaca 5700
aacccaagga gcctgggata acggaggctt catcggagat gatatcacca aacatgttgc 5760
tggtgattat aataccattt aggtgggttg ggttcttaac taggatcatg gcggcagaat 5820
caatcaattg atgttgaact ttcaatgtag ggaattcgtt cttgatggtt tcctccacag 5880
tttttctcca taatcttgaa gaggccaaaa cattagcttt atccaaggac caaataggca 5940
atggtggctc atgttgtagg gccatgaaag cggccattct tgtgattctt tgcacttctg 6000
gaacggtgta ttgttcacta tcccaagcga caccatcacc atcgtcttcc tttctcttac 6060
caaagtaaat acctcccact aattctctaa caacaacgaa gtcagtacct ttagcaaatt 6120
gtggcttgat tggagataag tctaaaagag agtcggatgc aaagttacat ggtcttaagt 6180
tggcgtacaa ttgaagttct ttacggattt ttagtaaacc ttgttcaggt ctaacactac 6240
cggtacccca tttaggacca cccacagcac ctaacaaaac ggcatcagcc ttcttggagg 6300
cttccagcgc ctcatctgga agtggaacac ctgtagcatc gatagcagca ccaccaatta 6360
aatgattttc gaaatcgaac ttgacattgg aacgaacatc agaaatagct ttaagaacct 6420
taatggcttc ggctgtgatt tcttgaccaa cgtggtcacc tggcaaaacg acgatcttct 6480
taggggcaga cattacaatg gtatatcctt gaaatatata taaaaaaaaa aaaaaaaaaa 6540
aaaaaaaaaa atgcagcttc tcaatgatat tcgaatacgc tttgaggaga tacagcctaa 6600
tatccgacaa actgttttac agatttacga tcgtacttgt tacccatcat tgaattttga 6660
acatccgaac ctgggagttt tccctgaaac agatagtata tttgaacctg tataataata 6720
tatagtctag cgctttacgg aagacaatgt atgtatttcg gttcctggag aaactattgc 6780
atctattgca taggtaatct tgcacgtcgc atccccggtt cattttctgc gtttccatct 6840
tgcacttcaa tagcatatct ttgttaacga agcatctgtg cttcattttg tagaacaaaa 6900
atgcaacgcg agagcgctaa tttttcaaac aaagaatctg agctgcattt ttacagaaca 6960
gaaatgcaac gcgaaagcgc tattttacca acgaagaatc tgtgcttcat ttttgtaaaa 7020
caaaaatgca acgcgagagc gctaattttt caaacaaaga atctgagctg catttttaca 7080
gaacagaaat gcaacgcgag agcgctattt taccaacaaa gaatctatac ttcttttttg 7140
ttctacaaaa atgcatcccg agagcgctat ttttctaaca aagcatctta gattactttt 7200
tttctccttt gtgcgctcta taatgcagtc tcttgataac tttttgcact gtaggtccgt 7260
taaggttaga agaaggctac tttggtgtct attttctctt ccataaaaaa agcctgactc 7320
cacttcccgc gtttactgat tactagcgaa gctgcgggtg cattttttca agataaaggc 7380
atccccgatt atattctata ccgatgtgga ttgcgcatac tttgtgaaca gaaagtgata 7440
gcgttgatga ttcttcattg gtcagaaaat tatgaacggt ttcttctatt ttgtctctat 7500
atactacgta taggaaatgt ttacattttc gtattgtttt cgattcactc tatgaatagt 7560
tcttactaca atttttttgt ctaaagagta atactagaga taaacataaa aaatgtagag 7620
gtcgagttta gatgcaagtt caaggagcga aaggtggatg ggtaggttat atagggatat 7680
agcacagaga tatatagcaa agagatactt ttgagcaatg tttgtggaag cggtattcgc 7740
aatattttag tagctcgtta cagtccggtg cgtttttggt tttttgaaag tgcgtcttca 7800
gagcgctttt ggttttcaaa agcgctctga agttcctata ctttctagag aataggaact 7860
tcggaatagg aacttcaaag cgtttccgaa aacgagcgct tccgaaaatg caacgcgagc 7920
tgcgcacata cagctcactg ttcacgtcgc acctatatct gcgtgttgcc tgtatatata 7980
tatacatgag aagaacggca tagtgcgtgt ttatgcttaa atgcgtactt atatgcgtct 8040
atttatgtag gatgaaaggt agtctagtac ctcctgtgat attatcccat tccatgcggg 8100
gtatcgtatg cttccttcag cactaccctt tagctgttct atatgctgcc actcctcaat 8160
tggattagtc tcatccttca atgctatcat ttcctttgat attggatcat atgcatagta 8220
ccgagaaact agaggatctc ccattaccga catttgggcg ctatacgtgc atatgttcat 8280
gtatgtatct gtatttaaaa cacttttgta ttatttttcc tcatatatgt gtataggttt 8340
atacggatga tttaattatt acttcaccac cctttatttc aggctgatat cttagccttg 8400
ttactagtca ccggtggcgg ccgcacctgg taaaacctct agtggagtag tagatgtaat 8460
caatgaagcg gaagccaaaa gaccagagta gaggcctata gaagaaactg cgataccttt 8520
tgtgatggct aaacaaacag acatcttttt atatgttttt acttctgtat atcgtgaagt 8580
agtaagtgat aagcgaattt ggctaagaac gttgtaagtg aacaagggac ctcttttgcc 8640
tttcaaaaaa ggattaaatg gagttaatca ttgagattta gttttcgtta gattctgtat 8700
ccctaaataa ctcccttacc cgacgggaag gcacaaaaga cttgaataat agcaaacggc 8760
cagtagccaa gaccaaataa tactagagtt aactgatggt cttaaacagg cattacgtgg 8820
tgaactccaa gaccaatata caaaatatcg ataagttatt cttgcccacc aatttaagga 8880
gcctacatca ggacagtagt accattcctc agagaagagg tatacataac aagaaaatcg 8940
cgtgaacacc ttatataact tagcccgtta ttgagctaaa aaaccttgca aaatttccta 9000
tgaataagaa tacttcagac gtgataaaaa tttactttct aactcttctc acgctgcccc 9060
tatctgttct tccgctctac cgtgagaaat aaagcatcga gtacggcagt tcgctgtcac 9120
tgaactaaaa caataaggct agttcgaatg atgaacttgc ttgctgtcaa acttctgagt 9180
tgccgctgat gtgacactgt gacaataaat tcaaaccggt tatagcggtc tcctccggta 9240
ccggttctgc cacctccaat agagctcagt aggagtcaga acctctgcgg tggctgtcag 9300
tgactcatcc gcgtttcgta agttgtgcgc gtgcacattt cgcccgttcc cgctcatctt 9360
gcagcaggcg gaaattttca tcacgctgta ggacgcaaaa aaaaaataat taatcgtaca 9420
agaatcttgg aaaaaaaatt gaaaaatttt gtataaaagg gatgacctaa cttgactcaa 9480
tggcttttac acccagtatt ttccctttcc ttgtttgtta caattataga agcaagacaa 9540
aaacatatag acaacctatt cctaggagtt atattttttt accctaccag caatataagt 9600
aaaaaactgt tt 9612
<210> 202
<211> 7938
<212> DNA
<213> Artificial Sequence
<220>
<223> pYZ067DkivDDhADH
<400> 202
tcgcgcgttt cggtgatgac ggtgaaaacc tctgacacat gcagctcccg gagacggtca 60
cagcttgtct gtaagcggat gccgggagca gacaagcccg tcagggcgcg tcagcgggtg 120
ttggcgggtg tcggggctgg cttaactatg cggcatcaga gcagattgta ctgagagtgc 180
accataaatt cccgttttaa gagcttggtg agcgctagga gtcactgcca ggtatcgttt 240
gaacacggca ttagtcaggg aagtcataac acagtccttt cccgcaattt tctttttcta 300
ttactcttgg cctcctctag tacactctat atttttttat gcctcggtaa tgattttcat 360
tttttttttt ccacctagcg gatgactctt tttttttctt agcgattggc attatcacat 420
aatgaattat acattatata aagtaatgtg atttcttcga agaatatact aaaaaatgag 480
caggcaagat aaacgaaggc aaagatgaca gagcagaaag ccctagtaaa gcgtattaca 540
aatgaaacca agattcagat tgcgatctct ttaaagggtg gtcccctagc gatagagcac 600
tcgatcttcc cagaaaaaga ggcagaagca gtagcagaac aggccacaca atcgcaagtg 660
attaacgtcc acacaggtat agggtttctg gaccatatga tacatgctct ggccaagcat 720
tccggctggt cgctaatcgt tgagtgcatt ggtgacttac acatagacga ccatcacacc 780
actgaagact gcgggattgc tctcggtcaa gcttttaaag aggccctagg ggccgtgcgt 840
ggagtaaaaa ggtttggatc aggatttgcg cctttggatg aggcactttc cagagcggtg 900
gtagatcttt cgaacaggcc gtacgcagtt gtcgaacttg gtttgcaaag ggagaaagta 960
ggagatctct cttgcgagat gatcccgcat tttcttgaaa gctttgcaga ggctagcaga 1020
attaccctcc acgttgattg tctgcgaggc aagaatgatc atcaccgtag tgagagtgcg 1080
ttcaaggctc ttgcggttgc cataagagaa gccacctcgc ccaatggtac caacgatgtt 1140
ccctccacca aaggtgttct tatgtagtga caccgattat ttaaagctgc agcatacgat 1200
atatatacat gtgtatatat gtatacctat gaatgtcagt aagtatgtat acgaacagta 1260
tgatactgaa gatgacaagg taatgcatca ttctatacgt gtcattctga acgaggcgcg 1320
ctttcctttt ttctttttgc tttttctttt tttttctctt gaactcgacg gatctatgcg 1380
gtgtgaaata ccgcacagat gcgtaaggag aaaataccgc atcaggaaat tgtaagcgtt 1440
aatattttgt taaaattcgc gttaaatttt tgttaaatca gctcattttt taaccaatag 1500
gccgaaatcg gcaaaatccc ttataaatca aaagaataga ccgagatagg gttgagtgtt 1560
gttccagttt ggaacaagag tccactatta aagaacgtgg actccaacgt caaagggcga 1620
aaaaccgtct atcagggcga tggcccacta cgtggccggc ttcacatacg ttgcatacgt 1680
cgatatagat aataatgata atgacagcag gattatcgta atacgtaata gctgaaaatc 1740
tcaaaaatgt gtgggtcatt acgtaaataa tgataggaat gggattcttc tatttttcct 1800
ttttccattc tagcagccgt cgggaaaacg tggcatcctc tctttcgggc tcaattggag 1860
tcacgctgcc gtgagcatcc tctctttcca tatctaacaa ctgagcacgt aaccaatgga 1920
aaagcatgag cttagcgttg ctccaaaaaa gtattggatg gttaatacca tttgtctgtt 1980
ctcttctgac tttgactcct caaaaaaaaa aatctacaat caacagatcg cttcaattac 2040
gccctcacaa aaactttttt ccttcttctt cgcccacgtt aaattttatc cctcatgttg 2100
tctaacggat ttctgcactt gatttattat aaaaagacaa agacataata cttctctatc 2160
aatttcagtt attgttcttc cttgcgttat tcttctgttc ttctttttct tttgtcatat 2220
ataaccataa ccaagtaata catattcaaa cacgtgagta tgactgacaa aaaaactctt 2280
aaagacttaa gaaatcgtag ttctgtttac gattcaatgg ttaaatcacc taatcgtgct 2340
atgttgcgtg caactggtat gcaagatgaa gactttgaaa aacctatcgt cggtgtcatt 2400
tcaacttggg ctgaaaacac accttgtaat atccacttac atgactttgg taaactagcc 2460
aaagtcggtg ttaaggaagc tggtgcttgg ccagttcagt tcggaacaat cacggtttct 2520
gatggaatcg ccatgggaac ccaaggaatg cgtttctcct tgacatctcg tgatattatt 2580
gcagattcta ttgaagcagc catgggaggt cataatgcgg atgcttttgt agccattggc 2640
ggttgtgata aaaacatgcc cggttctgtt atcgctatgg ctaacatgga tatcccagcc 2700
atttttgctt acggcggaac aattgcacct ggtaatttag acggcaaaga tatcgattta 2760
gtctctgtct ttgaaggtgt cggccattgg aaccacggcg atatgaccaa agaagaagtt 2820
aaagctttgg aatgtaatgc ttgtcccggt cctggaggct gcggtggtat gtatactgct 2880
aacacaatgg cgacagctat tgaagttttg ggacttagcc ttccgggttc atcttctcac 2940
ccggctgaat ccgcagaaaa gaaagcagat attgaagaag ctggtcgcgc tgttgtcaaa 3000
atgctcgaaa tgggcttaaa accttctgac attttaacgc gtgaagcttt tgaagatgct 3060
attactgtaa ctatggctct gggaggttca accaactcaa cccttcacct cttagctatt 3120
gcccatgctg ctaatgtgga attgacactt gatgatttca atactttcca agaaaaagtt 3180
cctcatttgg ctgatttgaa accttctggt caatatgtat tccaagacct ttacaaggtc 3240
ggaggggtac cagcagttat gaaatatctc cttaaaaatg gcttccttca tggtgaccgt 3300
atcacttgta ctggcaaaac agtcgctgaa aatttgaagg cttttgatga tttaacacct 3360
ggtcaaaagg ttattatgcc gcttgaaaat cctaaacgtg aagatggtcc gctcattatt 3420
ctccatggta acttggctcc agacggtgcc gttgccaaag tttctggtgt aaaagtgcgt 3480
cgtcatgtcg gtcctgctaa ggtctttaat tctgaagaag aagccattga agctgtcttg 3540
aatgatgata ttgttgatgg tgatgttgtt gtcgtacgtt ttgtaggacc aaagggcggt 3600
cctggtatgc ctgaaatgct ttccctttca tcaatgattg ttggtaaagg gcaaggtgaa 3660
aaagttgccc ttctgacaga tggccgcttc tcaggtggta cttatggtct tgtcgtgggt 3720
catatcgctc ctgaagcaca agatggcggt ccaatcgcct acctgcaaac aggagacata 3780
gtcactattg accaagacac taaggaatta cactttgata tctccgatga agagttaaaa 3840
catcgtcaag agaccattga attgccaccg ctctattcac gcggtatcct tggtaaatat 3900
gctcacatcg tttcgtctgc ttctagggga gccgtaacag acttttggaa gcctgaagaa 3960
actggcaaaa aatgttgtcc tggttgctgt ggttaagcgg ccgcgttaat tcaaattaat 4020
tgatatagtt ttttaatgag tattgaatct gtttagaaat aatggaatat tatttttatt 4080
tatttattta tattattggt cggctctttt cttctgaagg tcaatgacaa aatgatatga 4140
aggaaataat gatttctaaa attttacaac gtaagatatt tttacaaaag cctagctcat 4200
cttttgtcat gcactatttt actcacgctt gaaattaacg gccagtccac tgcggagtca 4260
tttcaaagtc atcctaatcg atctatcgtt tttgatagct cattttggag ttcgcgagga 4320
tcccagcttt tgttcccttt agtgagggtt aattgcgcgc ttggcgtaat catggtcata 4380
gctgtttcct gtgtgaaatt gttatccgct cacaattcca cacaacatac gagccggaag 4440
cataaagtgt aaagcctggg gtgcctaatg agtgagctaa ctcacattaa ttgcgttgcg 4500
ctcactgccc gctttccagt cgggaaacct gtcgtgccag ctgcattaat gaatcggcca 4560
acgcgcgggg agaggcggtt tgcgtattgg gcgctcttcc gcttcctcgc tcactgactc 4620
gctgcgctcg gtcgttcggc tgcggcgagc ggtatcagct cactcaaagg cggtaatacg 4680
gttatccaca gaatcagggg ataacgcagg aaagaacatg tgagcaaaag gccagcaaaa 4740
ggccaggaac cgtaaaaagg ccgcgttgct ggcgtttttc cataggctcc gcccccctga 4800
cgagcatcac aaaaatcgac gctcaagtca gaggtggcga aacccgacag gactataaag 4860
ataccaggcg tttccccctg gaagctccct cgtgcgctct cctgttccga ccctgccgct 4920
taccggatac ctgtccgcct ttctcccttc gggaagcgtg gcgctttctc atagctcacg 4980
ctgtaggtat ctcagttcgg tgtaggtcgt tcgctccaag ctgggctgtg tgcacgaacc 5040
ccccgttcag cccgaccgct gcgccttatc cggtaactat cgtcttgagt ccaacccggt 5100
aagacacgac ttatcgccac tggcagcagc cactggtaac aggattagca gagcgaggta 5160
tgtaggcggt gctacagagt tcttgaagtg gtggcctaac tacggctaca ctagaagaac 5220
agtatttggt atctgcgctc tgctgaagcc agttaccttc ggaaaaagag ttggtagctc 5280
ttgatccggc aaacaaacca ccgctggtag cggtggtttt tttgtttgca agcagcagat 5340
tacgcgcaga aaaaaaggat ctcaagaaga tcctttgatc ttttctacgg ggtctgacgc 5400
tcagtggaac gaaaactcac gttaagggat tttggtcatg agattatcaa aaaggatctt 5460
cacctagatc cttttaaatt aaaaatgaag ttttaaatca atctaaagta tatatgagta 5520
aacttggtct gacagttacc aatgcttaat cagtgaggca cctatctcag cgatctgtct 5580
atttcgttca tccatagttg cctgactccc cgtcgtgtag ataactacga tacgggaggg 5640
cttaccatct ggccccagtg ctgcaatgat accgcgagac ccacgctcac cggctccaga 5700
tttatcagca ataaaccagc cagccggaag ggccgagcgc agaagtggtc ctgcaacttt 5760
atccgcctcc atccagtcta ttaattgttg ccgggaagct agagtaagta gttcgccagt 5820
taatagtttg cgcaacgttg ttgccattgc tacaggcatc gtggtgtcac gctcgtcgtt 5880
tggtatggct tcattcagct ccggttccca acgatcaagg cgagttacat gatcccccat 5940
gttgtgcaaa aaagcggtta gctccttcgg tcctccgatc gttgtcagaa gtaagttggc 6000
cgcagtgtta tcactcatgg ttatggcagc actgcataat tctcttactg tcatgccatc 6060
cgtaagatgc ttttctgtga ctggtgagta ctcaaccaag tcattctgag aatagtgtat 6120
gcggcgaccg agttgctctt gcccggcgtc aatacgggat aataccgcgc cacatagcag 6180
aactttaaaa gtgctcatca ttggaaaacg ttcttcgggg cgaaaactct caaggatctt 6240
accgctgttg agatccagtt cgatgtaacc cactcgtgca cccaactgat cttcagcatc 6300
ttttactttc accagcgttt ctgggtgagc aaaaacagga aggcaaaatg ccgcaaaaaa 6360
gggaataagg gcgacacgga aatgttgaat actcatactc ttcctttttc aatattattg 6420
aagcatttat cagggttatt gtctcatgag cggatacata tttgaatgta tttagaaaaa 6480
taaacaaata ggggttccgc gcacatttcc ccgaaaagtg ccacctgaac gaagcatctg 6540
tgcttcattt tgtagaacaa aaatgcaacg cgagagcgct aatttttcaa acaaagaatc 6600
tgagctgcat ttttacagaa cagaaatgca acgcgaaagc gctattttac caacgaagaa 6660
tctgtgcttc atttttgtaa aacaaaaatg caacgcgaga gcgctaattt ttcaaacaaa 6720
gaatctgagc tgcattttta cagaacagaa atgcaacgcg agagcgctat tttaccaaca 6780
aagaatctat acttcttttt tgttctacaa aaatgcatcc cgagagcgct atttttctaa 6840
caaagcatct tagattactt tttttctcct ttgtgcgctc tataatgcag tctcttgata 6900
actttttgca ctgtaggtcc gttaaggtta gaagaaggct actttggtgt ctattttctc 6960
ttccataaaa aaagcctgac tccacttccc gcgtttactg attactagcg aagctgcggg 7020
tgcatttttt caagataaag gcatccccga ttatattcta taccgatgtg gattgcgcat 7080
actttgtgaa cagaaagtga tagcgttgat gattcttcat tggtcagaaa attatgaacg 7140
gtttcttcta ttttgtctct atatactacg tataggaaat gtttacattt tcgtattgtt 7200
ttcgattcac tctatgaata gttcttacta caattttttt gtctaaagag taatactaga 7260
gataaacata aaaaatgtag aggtcgagtt tagatgcaag ttcaaggagc gaaaggtgga 7320
tgggtaggtt atatagggat atagcacaga gatatatagc aaagagatac ttttgagcaa 7380
tgtttgtgga agcggtattc gcaatatttt agtagctcgt tacagtccgg tgcgtttttg 7440
gttttttgaa agtgcgtctt cagagcgctt ttggttttca aaagcgctct gaagttccta 7500
tactttctag agaataggaa cttcggaata ggaacttcaa agcgtttccg aaaacgagcg 7560
cttccgaaaa tgcaacgcga gctgcgcaca tacagctcac tgttcacgtc gcacctatat 7620
ctgcgtgttg cctgtatata tatatacatg agaagaacgg catagtgcgt gtttatgctt 7680
aaatgcgtac ttatatgcgt ctatttatgt aggatgaaag gtagtctagt acctcctgtg 7740
atattatccc attccatgcg gggtatcgta tgcttccttc agcactaccc tttagctgtt 7800
ctatatgctg ccactcctca attggattag tctcatcctt caatgctatc atttcctttg 7860
atattggatc atactaagaa accattatta tcatgacatt aacctataaa aataggcgta 7920
tcacgaggcc ctttcgtc 7938
SEQUENCE LISTING
<110> Butamax (TM) Advanced Biofuels
<120> PRODUCTION OF ALCOHOL ESTERS AND IN SITU PRODUCT REMOVAL DURING
ALCOHOL FERMENTATION
<130> CL5103
<150> US 61 / 368,429
<151> 2010-07-28
<150> US 61 / 356,290
<151> 2010-06-18
<150> US 61 / 368,451
<151> 2010-07-28
<150> US 61 / 368,436
<151> 2010-07-28
<150> US 61 / 368,444
<151> 2010-07-28
<150> US 13 / 160,766
<151> 2011-06-15
<150> US 61 / 440,034
<151> 2011-02-07
<150> US 61 / 379,546
<151> 2010-09-02
<160> 202
<170> PatentIn version 3.5
<210> 1
<211> 11856
<212> DNA
<213> Artificial sequence
<220>
<223> Plasmid
<400> 1
tcccattacc gacatttggg cgctatacgt gcatatgttc atgtatgtat ctgtatttaa 60
aacacttttg tattattttt cctcatatat gtgtataggt ttatacggat gatttaatta 120
ttacttcacc accctttatt tcaggctgat atcttagcct tgttactagt tagaaaaaga 180
catttttgct gtcagtcact gtcaagagat tcttttgctg gcatttcttc tagaagcaaa 240
aagagcgatg cgtcttttcc gctgaaccgt tccagcaaaa aagactacca acgcaatatg 300
gattgtcaga atcatataaa agagaagcaa ataactcctt gtcttgtatc aattgcatta 360
taatatcttc ttgttagtgc aatatcatat agaagtcatc gaaatagata ttaagaaaaa 420
caaactgtac aatcaatcaa tcaatcatcg ctgaggatgt tgacaaaagc aacaaaagaa 480
caaaaatccc ttgtgaaaaa cagaggggcg gagcttgttg ttgattgctt agtggagcaa 540
ggtgtcacac atgtatttgg cattccaggt gcaaaaattg atgcggtatt tgacgcttta 600
caagataaag gacctgaaat tatcgttgcc cggcacgaac aaaacgcagc attcatggcc 660
caagcagtcg gccgtttaac tggaaaaccg ggagtcgtgt tagtcacatc aggaccgggt 720
gcctctaact tggcaacagg cctgctgaca gcgaacactg aaggagaccc tgtcgttgcg 780
cttgctggaa acgtgatccg tgcagatcgt ttaaaacgga cacatcaatc tttggataat 840
gcggcgctat tccagccgat tacaaaatac agtgtagaag ttcaagatgt aaaaaatata 900
ccggaagctg ttacaaatgc atttaggata gcgtcagcag ggcaggctgg ggccgctttt 960
gtgagctttc cgcaagatgt tgtgaatgaa gtcacaaata cgaaaaacgt gcgtgctgtt 1020
gcagcgccaa aactcggtcc tgcagcagat gatgcaatca gtgcggccat agcaaaaatc 1080
caaacagcaa aacttcctgt cgttttggtc ggcatgaaag gcggaagacc ggaagcaatt 1140
aaagcggttc gcaagctttt gaaaaaggtt cagcttccat ttgttgaaac atatcaagct 1200
gccggtaccc tttctagaga tttagaggat caatattttg gccgtatcgg tttgttccgc 1260
aaccagcctg gcgatttact gctagagcag gcagatgttg ttctgacgat cggctatgac 1320
ccgattgaat atgatccgaa attctggaat atcaatggag accggacaat tatccattta 1380
gacgagatta tcgctgacat tgatcatgct taccagcctg atcttgaatt gatcggtgac 1440
attccgtcca cgatcaatca tatcgaacac gatgctgtga aagtggaatt tgcagagcgt 1500
gagcagaaaa tcctttctga tttaaaacaa tatatgcatg aaggtgagca ggtgcctgca 1560
gattggaaat cagacagagc gcaccctctt gaaatcgtta aagagttgcg taatgcagtc 1620
gatgatcatg ttacagtaac ttgcgatatc ggttcgcacg ccatttggat gtcacgttat 1680
ttccgcagct acgagccgtt aacattaatg atcagtaacg gtatgcaaac actcggcgtt 1740
gcgcttcctt gggcaatcgg cgcttcattg gtgaaaccgg gagaaaaagt ggtttctgtc 1800
tctggtgacg gcggtttctt attctcagca atggaattag agacagcagt tcgactaaaa 1860
gcaccaattg tacacattgt atggaacgac agcacatatg acatggttgc attccagcaa 1920
ttgaaaaaat ataaccgtac atctgcggtc gatttcggaa atatcgatat cgtgaaatat 1980
gcggaaagct tcggagcaac tggcttgcgc gtagaatcac cagaccagct ggcagatgtt 2040
ctgcgtcaag gcatgaacgc tgaaggtcct gtcatcatcg atgtcccggt tgactacagt 2100
gataacatta atttagcaag tgacaagctt ccgaaagaat tcggggaact catgaaaacg 2160
aaagctctct agttaattaa tcatgtaatt agttatgtca cgcttacatt cacgccctcc 2220
ccccacatcc gctctaaccg aaaaggaagg agttagacaa cctgaagtct aggtccctat 2280
ttattttttt atagttatgt tagtattaag aacgttattt atatttcaaa tttttctttt 2340
ttttctgtac agacgcgtgt acgcatgtaa cattatactg aaaaccttgc ttgagaaggt 2400
tttgggacgc tcgaaggctt taatttgcgg gcggccgcac ctggtaaaac ctctagtgga 2460
gtagtagatg taatcaatga agcggaagcc aaaagaccag agtagaggcc tatagaagaa 2520
actgcgatac cttttgtgat ggctaaacaa acagacatct ttttatatgt ttttacttct 2580
gtatatcgtg aagtagtaag tgataagcga atttggctaa gaacgttgta agtgaacaag 2640
ggacctcttt tgcctttcaa aaaaggatta aatggagtta atcattgaga tttagttttc 2700
gttagattct gtatccctaa ataactccct tacccgacgg gaaggcacaa aagacttgaa 2760
taatagcaaa cggccagtag ccaagaccaa ataatactag agttaactga tggtcttaaa 2820
caggcattac gtggtgaact ccaagaccaa tatacaaaat atcgataagt tattcttgcc 2880
caccaattta aggagcctac atcaggacag tagtaccatt cctcagagaa gaggtataca 2940
taacaagaaa atcgcgtgaa caccttatat aacttagccc gttattgagc taaaaaacct 3000
tgcaaaattt cctatgaata agaatacttc agacgtgata aaaatttact ttctaactct 3060
tctcacgctg cccctatctg ttcttccgct ctaccgtgag aaataaagca tcgagtacgg 3120
cagttcgctg tcactgaact aaaacaataa ggctagttcg aatgatgaac ttgcttgctg 3180
tcaaacttct gagttgccgc tgatgtgaca ctgtgacaat aaattcaaac cggttatagc 3240
ggtctcctcc ggtaccggtt ctgccacctc caatagagct cagtaggagt cagaacctct 3300
gcggtggctg tcagtgactc atccgcgttt cgtaagttgt gcgcgtgcac atttcgcccg 3360
ttcccgctca tcttgcagca ggcggaaatt ttcatcacgc tgtaggacgc aaaaaaaaaa 3420
taattaatcg tacaagaatc ttggaaaaaa aattgaaaaa ttttgtataa aagggatgac 3480
ctaacttgac tcaatggctt ttacacccag tattttccct ttccttgttt gttacaatta 3540
tagaagcaag acaaaaacat atagacaacc tattcctagg agttatattt ttttacccta 3600
ccagcaatat aagtaaaaaa ctgtttaaac agtatggcag ttacaatgta ttatgaagat 3660
gatgtagaag tatcagcact tgctggaaag caaattgcag taatcggtta tggttcacaa 3720
ggacatgctc acgcacagaa tttgcgtgat tctggtcaca acgttatcat tggtgtgcgc 3780
cacggaaaat cttttgataa agcaaaagaa gatggctttg aaacatttga agtaggagaa 3840
gcagtagcta aagctgatgt tattatggtt ttggcaccag atgaacttca acaatccatt 3900
tatgaagagg acatcaaacc aaacttgaaa gcaggttcag cacttggttt tgctcacgga 3960
tttaatatcc attttggcta tattaaagta ccagaagacg ttgacgtctt tatggttgcg 4020
cctaaggctc caggtcacct tgtccgtcgg acttatactg aaggttttgg tacaccagct 4080
ttgtttgttt cacaccaaaa tgcaagtggt catgcgcgtg aaatcgcaat ggattgggcc 4140
aaaggaattg gttgtgctcg agtgggaatt attgaaacaa cttttaaaga agaaacagaa 4200
gaagatttgt ttggagaaca agctgttcta tgtggaggtt tgacagcact tgttgaagcc 4260
ggttttgaaa cactgacaga agctggatac gctggcgaat tggcttactt tgaagttttg 4320
cacgaaatga aattgattgt tgacctcatg tatgaaggtg gttttactaa aatgcgtcaa 4380
tccatctcaa atactgctga gtttggcgat tatgtgactg gtccacggat tattactgac 4440
gaagttaaaa agaatatgaa gcttgttttg gctgatattc aatctggaaa atttgctcaa 4500
gatttcgttg atgacttcaa agcggggcgt ccaaaattaa tagcctatcg cgaagctgca 4560
aaaaatcttg aaattgaaaa aattggggca gagctacgtc aagcaatgcc attcacacaa 4620
tctggtgatg acgatgcctt taaaatctat cagtaaggcc ctgcaggcca gaggaaaata 4680
atatcaagtg ctggaaactt tttctcttgg aatttttgca acatcaagtc atagtcaatt 4740
gaattgaccc aatttcacat ttaagatttt ttttttttca tccgacatac atctgtacac 4800
taggaagccc tgtttttctg aagcagcttc aaatatatat attttttaca tatttattat 4860
gattcaatga acaatctaat taaatcgaaa acaagaaccg aaacgcgaat aaataattta 4920
tttagatggt gacaagtgta taagtcctca tcgggacagc tacgatttct ctttcggttt 4980
tggctgagct actggttgct gtgacgcagc ggcattagcg cggcgttatg agctaccctc 5040
gtggcctgaa agatggcggg aataaagcgg aactaaaaat tactgactga gccatattga 5100
ggtcaatttg tcaactcgtc aagtcacgtt tggtggacgg cccctttcca acgaatcgta 5160
tatactaaca tgcgcgcgct tcctatatac acatatacat atatatatat atatatatgt 5220
gtgcgtgtat gtgtacacct gtatttaatt tccttactcg cgggtttttc ttttttctca 5280
attcttggct tcctctttct cgagcggacc ggatcctccg cggtgccggc agatctattt 5340
aaatggcgcg ccgacgtcag gtggcacttt tcggggaaat gtgcgcggaa cccctatttg 5400
tttatttttc taaatacatt caaatatgta tccgctcatg agacaataac cctgataaat 5460
gcttcaataa tattgaaaaa ggaagagtat gagtattcaa catttccgtg tcgcccttat 5520
tccctttttt gcggcatttt gccttcctgt ttttgctcac ccagaaacgc tggtgaaagt 5580
aaaagatgct gaagatcagt tgggtgcacg agtgggttac atcgaactgg atctcaacag 5640
cggtaagatc cttgagagtt ttcgccccga agaacgtttt ccaatgatga gcacttttaa 5700
agttctgcta tgtggcgcgg tattatcccg tattgacgcc gggcaagagc aactcggtcg 5760
ccgcatacac tattctcaga atgacttggt tgagtactca ccagtcacag aaaagcatct 5820
tacggatggc atgacagtaa gagaattatg cagtgctgcc ataaccatga gtgataacac 5880
tgcggccaac ttacttctga caacgatcgg aggaccgaag gagctaaccg cttttttgca 5940
caacatgggg gatcatgtaa ctcgccttga tcgttgggaa ccggagctga atgaagccat 6000
accaaacgac gagcgtgaca ccacgatgcc tgtagcaatg gcaacaacgt tgcgcaaact 6060
attaactggc gaactactta ctctagcttc ccggcaacaa ttaatagact ggatggaggc 6120
ggataaagtt gcaggaccac ttctgcgctc ggcccttccg gctggctggt ttattgctga 6180
taaatctgga gccggtgagc gtgggtctcg cggtatcatt gcagcactgg ggccagatgg 6240
taagccctcc cgtatcgtag ttatctacac gacggggagt caggcaacta tggatgaacg 6300
aaatagacag atcgctgaga taggtgcctc actgattaag cattggtaac tgtcagacca 6360
agtttactca tatatacttt agattgattt aaaacttcat ttttaattta aaaggatcta 6420
ggtgaagatc ctttttgata atctcatgac caaaatccct taacgtgagt tttcgttcca 6480
ctgagcgtca gaccccgtag aaaagatcaa aggatcttct tgagatcctt tttttctgcg 6540
cgtaatctgc tgcttgcaaa caaaaaaacc accgctacca gcggtggttt gtttgccgga 6600
tcaagagcta ccaactcttt ttccgaaggt aactggcttc agcagagcgc agataccaaa 6660
tactgttctt ctagtgtagc cgtagttagg ccaccacttc aagaactctg tagcaccgcc 6720
tacatacctc gctctgctaa tcctgttacc agtggctgct gccagtggcg ataagtcgtg 6780
tcttaccggg ttggactcaa gacgatagtt accggataag gcgcagcggt cgggctgaac 6840
ggggggttcg tgcacacagc ccagcttgga gcgaacgacc tacaccgaac tgagatacct 6900
acagcgtgag ctatgagaaa gcgccacgct tcccgaaggg agaaaggcgg acaggtatcc 6960
ggtaagcggc agggtcggaa caggagagcg cacgagggag cttccagggg gaaacgcctg 7020
gtatctttat agtcctgtcg ggtttcgcca cctctgactt gagcgtcgat ttttgtgatg 7080
ctcgtcaggg gggcggagcc tatggaaaaa cgccagcaac gcggcctttt tacggttcct 7140
ggccttttgc tggccttttg ctcacatgtt ctttcctgcg ttatcccctg attctgtgga 7200
taaccgtatt accgcctttg agtgagctga taccgctcgc cgcagccgaa cgaccgagcg 7260
cagcgagtca gtgagcgagg aagcggaaga gcgcccaata cgcaaaccgc ctctccccgc 7320
gcgttggccg attcattaat gcagctggca cgacaggttt cccgactgga aagcgggcag 7380
tgagcgcaac gcaattaatg tgagttagct cactcattag gcaccccagg ctttacactt 7440
tatgcttccg gctcgtatgt tgtgtggaat tgtgagcgga taacaatttc acacaggaaa 7500
cagctatgac catgattacg ccaagctttt tctttccaat tttttttttt tcgtcattat 7560
aaaaatcatt acgaccgaga ttcccgggta ataactgata taattaaatt gaagctctaa 7620
tttgtgagtt tagtatacat gcatttactt ataatacagt tttttagttt tgctggccgc 7680
atcttctcaa atatgcttcc cagcctgctt ttctgtaacg ttcaccctct accttagcat 7740
cccttccctt tgcaaatagt cctcttccaa caataataat gtcagatcct gtagagacca 7800
catcatccac ggttctatac tgttgaccca atgcgtctcc cttgtcatct aaacccacac 7860
cgggtgtcat aatcaaccaa tcgtaacctt catctcttcc acccatgtct ctttgagcaa 7920
taaagccgat aacaaaatct ttgtcgctct tcgcaatgtc aacagtaccc ttagtatatt 7980
ctccagtaga tagggagccc ttgcatgaca attctgctaa catcaaaagg cctctaggtt 8040
cctttgttac ttcttctgcc gcctgcttca aaccgctaac aatacctggg cccaccacac 8100
cgtgtgcatt cgtaatgtct gcccattctg ctattctgta tacacccgca gagtactgca 8160
atttgactgt attaccaatg tcagcaaatt ttctgtcttc gaagagtaaa aaattgtact 8220
tggcggataa tgcctttagc ggcttaactg tgccctccat ggaaaaatca gtcaagatat 8280
ccacatgtgt ttttagtaaa caaattttgg gacctaatgc ttcaactaac tccagtaatt 8340
ccttggtggt acgaacatcc aatgaagcac acaagtttgt ttgcttttcg tgcatgatat 8400
taaatagctt ggcagcaaca ggactaggat gagtagcagc acgttcctta tatgtagctt 8460
tcgacatgat ttatcttcgt ttcctgcagg tttttgttct gtgcagttgg gttaagaata 8520
ctgggcaatt tcatgtttct tcaacactac atatgcgtat atataccaat ctaagtctgt 8580
gctccttcct tcgttcttcc ttctgttcgg agattaccga atcaaaaaaa tttcaaggaa 8640
accgaaatca aaaaaaagaa taaaaaaaaa atgatgaatt gaaaagcttg catgcctgca 8700
ggtcgactct agtatactcc gtctactgta cgatacactt ccgctcaggt ccttgtcctt 8760
taacgaggcc ttaccactct tttgttactc tattgatcca gctcagcaaa ggcagtgtga 8820
tctaagattc tatcttcgcg atgtagtaaa actagctaga ccgagaaaga gactagaaat 8880
gcaaaaggca cttctacaat ggctgccatc attattatcc gatgtgacgc tgcatttttt 8940
tttttttttt tttttttttt tttttttttt tttttttttt ttttttgtac aaatatcata 9000
aaaaaagaga atctttttaa gcaaggattt tcttaacttc ttcggcgaca gcatcaccga 9060
cttcggtggt actgttggaa ccacctaaat caccagttct gatacctgca tccaaaacct 9120
ttttaactgc atcttcaatg gctttacctt cttcaggcaa gttcaatgac aatttcaaca 9180
tcattgcagc agacaagata gtggcgatag ggttgacctt attctttggc aaatctggag 9240
cggaaccatg gcatggttcg tacaaaccaa atgcggtgtt cttgtctggc aaagaggcca 9300
aggacgcaga tggcaacaaa cccaaggagc ctgggataac ggaggcttca tcggagatga 9360
tatcaccaaa catgttgctg gtgattataa taccatttag gtgggttggg ttcttaacta 9420
ggatcatggc ggcagaatca atcaattgat gttgaacttt caatgtaggg aattcgttct 9480
tgatggtttc ctccacagtt tttctccata atcttgaaga ggccaaaaca ttagctttat 9540
ccaaggacca aataggcaat ggtggctcat gttgtagggc catgaaagcg gccattcttg 9600
tgattctttg cacttctgga acggtgtatt gttcactatc ccaagcgaca ccatcaccat 9660
cgtcttcctt tctcttacca aagtaaatac ctcccactaa ttctctaaca acaacgaagt 9720
cagtaccttt agcaaattgt ggcttgattg gagataagtc taaaagagag tcggatgcaa 9780
agttacatgg tcttaagttg gcgtacaatt gaagttcttt acggattttt agtaaacctt 9840
gttcaggtct aacactaccg gtaccccatt taggaccacc cacagcacct aacaaaacgg 9900
catcagcctt cttggaggct tccagcgcct catctggaag tggaacacct gtagcatcga 9960
tagcagcacc accaattaaa tgattttcga aatcgaactt gacattggaa cgaacatcag 10020
aaatagcttt aagaacctta atggcttcgg ctgtgatttc ttgaccaacg tggtcacctg 10080
gcaaaacgac gatcttctta ggggcagaca ttacaatggt atatccttga aatatatata 10140
aaaaaaaaaa aaaaaaaaaa aaaaaaaaat gcagcttctc aatgatattc gaatacgctt 10200
tgaggagata cagcctaata tccgacaaac tgttttacag atttacgatc gtacttgtta 10260
cccatcattg aattttgaac atccgaacct gggagttttc cctgaaacag atagtatatt 10320
tgaacctgta taataatata tagtctagcg ctttacggaa gacaatgtat gtatttcggt 10380
tcctggagaa actattgcat ctattgcata ggtaatcttg cacgtcgcat ccccggttca 10440
ttttctgcgt ttccatcttg cacttcaata gcatatcttt gttaacgaag catctgtgct 10500
tcattttgta gaacaaaaat gcaacgcgag agcgctaatt tttcaaacaa agaatctgag 10560
ctgcattttt acagaacaga aatgcaacgc gaaagcgcta ttttaccaac gaagaatctg 10620
tgcttcattt ttgtaaaaca aaaatgcaac gcgagagcgc taatttttca aacaaagaat 10680
ctgagctgca tttttacaga acagaaatgc aacgcgagag cgctatttta ccaacaaaga 10740
atctatactt cttttttgtt ctacaaaaat gcatcccgag agcgctattt ttctaacaaa 10800
gcatcttaga ttactttttt tctcctttgt gcgctctata atgcagtctc ttgataactt 10860
tttgcactgt aggtccgtta aggttagaag aaggctactt tggtgtctat tttctcttcc 10920
ataaaaaaag cctgactcca cttcccgcgt ttactgatta ctagcgaagc tgcgggtgca 10980
ttttttcaag ataaaggcat ccccgattat attctatacc gatgtggatt gcgcatactt 11040
tgtgaacaga aagtgatagc gttgatgatt cttcattggt cagaaaatta tgaacggttt 11100
cttctatttt gtctctatat actacgtata ggaaatgttt acattttcgt attgttttcg 11160
attcactcta tgaatagttc ttactacaat ttttttgtct aaagagtaat actagagata 11220
aacataaaaa atgtagaggt cgagtttaga tgcaagttca aggagcgaaa ggtggatggg 11280
taggttatat agggatatag cacagagata tatagcaaag agatactttt gagcaatgtt 11340
tgtggaagcg gtattcgcaa tattttagta gctcgttaca gtccggtgcg tttttggttt 11400
tttgaaagtg cgtcttcaga gcgcttttgg ttttcaaaag cgctctgaag ttcctatact 11460
ttctagagaa taggaacttc ggaataggaa cttcaaagcg tttccgaaaa cgagcgcttc 11520
cgaaaatgca acgcgagctg cgcacataca gctcactgtt cacgtcgcac ctatatctgc 11580
gtgttgcctg tatatatata tacatgagaa gaacggcata gtgcgtgttt atgcttaaat 11640
gcgtacttat atgcgtctat ttatgtagga tgaaaggtag tctagtacct cctgtgatat 11700
tatcccattc catgcggggt atcgtatgct tccttcagca ctacccttta gctgttctat 11760
atgctgccac tcctcaattg gattagtctc atccttcaat gctatcattt cctttgatat 11820
tggatcatat gcatagtacc gagaaactag aggatc 11856
<210> 2
<211> 15539
<212> DNA
<213> Artificial sequence
<220>
<223> Plasmid
<400> 2
tcgcgcgttt cggtgatgac ggtgaaaacc tctgacacat gcagctcccg gagacggtca 60
cagcttgtct gtaagcggat gccgggagca gacaagcccg tcagggcgcg tcagcgggtg 120
ttggcgggtg tcggggctgg cttaactatg cggcatcaga gcagattgta ctgagagtgc 180
accataaatt cccgttttaa gagcttggtg agcgctagga gtcactgcca ggtatcgttt 240
gaacacggca ttagtcaggg aagtcataac acagtccttt cccgcaattt tctttttcta 300
ttactcttgg cctcctctag tacactctat atttttttat gcctcggtaa tgattttcat 360
tttttttttt ccacctagcg gatgactctt tttttttctt agcgattggc attatcacat 420
aatgaattat acattatata aagtaatgtg atttcttcga agaatatact aaaaaatgag 480
caggcaagat aaacgaaggc aaagatgaca gagcagaaag ccctagtaaa gcgtattaca 540
aatgaaacca agattcagat tgcgatctct ttaaagggtg gtcccctagc gatagagcac 600
tcgatcttcc cagaaaaaga ggcagaagca gtagcagaac aggccacaca atcgcaagtg 660
attaacgtcc acacaggtat agggtttctg gaccatatga tacatgctct ggccaagcat 720
tccggctggt cgctaatcgt tgagtgcatt ggtgacttac acatagacga ccatcacacc 780
actgaagact gcgggattgc tctcggtcaa gcttttaaag aggccctagg ggccgtgcgt 840
ggagtaaaaa ggtttggatc aggatttgcg cctttggatg aggcactttc cagagcggtg 900
gtagatcttt cgaacaggcc gtacgcagtt gtcgaacttg gtttgcaaag ggagaaagta 960
ggagatctct cttgcgagat gatcccgcat tttcttgaaa gctttgcaga ggctagcaga 1020
attaccctcc acgttgattg tctgcgaggc aagaatgatc atcaccgtag tgagagtgcg 1080
ttcaaggctc ttgcggttgc cataagagaa gccacctcgc ccaatggtac caacgatgtt 1140
ccctccacca aaggtgttct tatgtagtga caccgattat ttaaagctgc agcatacgat 1200
atatatacat gtgtatatat gtatacctat gaatgtcagt aagtatgtat acgaacagta 1260
tgatactgaa gatgacaagg taatgcatca ttctatacgt gtcattctga acgaggcgcg 1320
ctttcctttt ttctttttgc tttttctttt tttttctctt gaactcgacg gatctatgcg 1380
gtgtgaaata ccgcacagat gcgtaaggag aaaataccgc atcaggaaat tgtaagcgtt 1440
aatattttgt taaaattcgc gttaaatttt tgttaaatca gctcattttt taaccaatag 1500
gccgaaatcg gcaaaatccc ttataaatca aaagaataga ccgagatagg gttgagtgtt 1560
gttccagttt ggaacaagag tccactatta aagaacgtgg actccaacgt caaagggcga 1620
aaaaccgtct atcagggcga tggcccacta cgtgaaccat caccctaatc aagttttttg 1680
gggtcgaggt gccgtaaagc actaaatcgg aaccctaaag ggagcccccg atttagagct 1740
tgacggggaa agccggcgaa cgtggcgaga aaggaaggga agaaagcgaa aggagcgggc 1800
gctagggcgc tggcaagtgt agcggtcacg ctgcgcgtaa ccaccacacc cgccgcgctt 1860
aatgcgccgc tacagggcgc gtccattcgc cattcaggct gcgcaactgt tgggaagggc 1920
gcggtgcggg cctcttcgct attacgccag ctggcgaaag ggggatgtgc tgcaaggcga 1980
ttaagttggg taacgccagg gttttcccag tcacgacgtt gtaaaacgac ggccagtgag 2040
cgcgcgtaat acgactcact atagggcgaa ttgggtaccg ggccccccct cgaggtcgac 2100
ggcgcgccac tggtagagag cgactttgta tgccccaatt gcgaaacccg cgatatcctt 2160
ctcgattctt tagtacccga ccaggacaag gaaaaggagg tcgaaacgtt tttgaagaaa 2220
caagaggaac tacacggaag ctctaaagat ggcaaccagc cagaaactaa gaaaatgaag 2280
ttgatggatc caactggcac cgctggcttg aacaacaata ccagccttcc aacttctgta 2340
aataacggcg gtacgccagt gccaccagta ccgttacctt tcggtatacc tcctttcccc 2400
atgtttccaa tgcccttcat gcctccaacg gctactatca caaatcctca tcaagctgac 2460
gcaagcccta agaaatgaat aacaatactg acagtactaa ataattgcct acttggcttc 2520
acatacgttg catacgtcga tatagataat aatgataatg acagcaggat tatcgtaata 2580
cgtaatagct gaaaatctca aaaatgtgtg ggtcattacg taaataatga taggaatggg 2640
attcttctat ttttcctttt tccattctag cagccgtcgg gaaaacgtgg catcctctct 2700
ttcgggctca attggagtca cgctgccgtg agcatcctct ctttccatat ctaacaactg 2760
agcacgtaac caatggaaaa gcatgagctt agcgttgctc caaaaaagta ttggatggtt 2820
aataccattt gtctgttctc ttctgacttt gactcctcaa aaaaaaaaat ctacaatcaa 2880
cagatcgctt caattacgcc ctcacaaaaa cttttttcct tcttcttcgc ccacgttaaa 2940
ttttatccct catgttgtct aacggatttc tgcacttgat ttattataaa aagacaaaga 3000
cataatactt ctctatcaat ttcagttatt gttcttcctt gcgttattct tctgttcttc 3060
tttttctttt gtcatatata accataacca agtaatacat attcaaacta gtatgactga 3120
caaaaaaact cttaaagact taagaaatcg tagttctgtt tacgattcaa tggttaaatc 3180
acctaatcgt gctatgttgc gtgcaactgg tatgcaagat gaagactttg aaaaacctat 3240
cgtcggtgtc atttcaactt gggctgaaaa cacaccttgt aatatccact tacatgactt 3300
tggtaaacta gccaaagtcg gtgttaagga agctggtgct tggccagttc agttcggaac 3360
aatcacggtt tctgatggaa tcgccatggg aacccaagga atgcgtttct ccttgacatc 3420
tcgtgatatt attgcagatt ctattgaagc agccatggga ggtcataatg cggatgcttt 3480
tgtagccatt ggcggttgtg ataaaaacat gcccggttct gttatcgcta tggctaacat 3540
ggatatccca gccatttttg cttacggcgg aacaattgca cctggtaatt tagacggcaa 3600
agatatcgat ttagtctctg tctttgaagg tgtcggccat tggaaccacg gcgatatgac 3660
caaagaagaa gttaaagctt tggaatgtaa tgcttgtccc ggtcctggag gctgcggtgg 3720
tatgtatact gctaacacaa tggcgacagc tattgaagtt ttgggactta gccttccggg 3780
ttcatcttct cacccggctg aatccgcaga aaagaaagca gatattgaag aagctggtcg 3840
cgctgttgtc aaaatgctcg aaatgggctt aaaaccttct gacattttaa cgcgtgaagc 3900
ttttgaagat gctattactg taactatggc tctgggaggt tcaaccaact caacccttca 3960
cctcttagct attgcccatg ctgctaatgt ggaattgaca cttgatgatt tcaatacttt 4020
ccaagaaaaa gttcctcatt tggctgattt gaaaccttct ggtcaatatg tattccaaga 4080
cctttacaag gtcggagggg taccagcagt tatgaaatat ctccttaaaa atggcttcct 4140
tcatggtgac cgtatcactt gtactggcaa aacagtcgct gaaaatttga aggcttttga 4200
tgatttaaca cctggtcaaa aggttattat gccgcttgaa aatcctaaac gtgaagatgg 4260
tccgctcatt attctccatg gtaacttggc tccagacggt gccgttgcca aagtttctgg 4320
tgtaaaagtg cgtcgtcatg tcggtcctgc taaggtcttt aattctgaag aagaagccat 4380
tgaagctgtc ttgaatgatg atattgttga tggtgatgtt gttgtcgtac gttttgtagg 4440
accaaagggc ggtcctggta tgcctgaaat gctttccctt tcatcaatga ttgttggtaa 4500
agggcaaggt gaaaaagttg cccttctgac agatggccgc ttctcaggtg gtacttatgg 4560
tcttgtcgtg ggtcatatcg ctcctgaagc acaagatggc ggtccaatcg cctacctgca 4620
aacaggagac atagtcacta ttgaccaaga cactaaggaa ttacactttg atatctccga 4680
tgaagagtta aaacatcgtc aagagaccat tgaattgcca ccgctctatt cacgcggtat 4740
ccttggtaaa tatgctcaca tcgtttcgtc tgcttctagg ggagccgtaa cagacttttg 4800
gaagcctgaa gaaactggca aaaaatgttg tcctggttgc tgtggttaag cggccgcgtt 4860
aattcaaatt aattgatata gttttttaat gagtattgaa tctgtttaga aataatggaa 4920
tattattttt atttatttat ttatattatt ggtcggctct tttcttctga aggtcaatga 4980
caaaatgata tgaaggaaat aatgatttct aaaattttac aacgtaagat atttttacaa 5040
aagcctagct catcttttgt catgcactat tttactcacg cttgaaatta acggccagtc 5100
cactgcggag tcatttcaaa gtcatcctaa tcgatctatc gtttttgata gctcattttg 5160
gagttcgcga ttgtcttctg ttattcacaa ctgttttaat ttttatttca ttctggaact 5220
cttcgagttc tttgtaaagt ctttcatagt agcttacttt atcctccaac atatttaact 5280
tcatgtcaat ttcggctctt aaattttcca catcatcaag ttcaacatca tcttttaact 5340
tgaatttatt ctctagctct tccaaccaag cctcattgct ccttgattta ctggtgaaaa 5400
gtgatacact ttgcgcgcaa tccaggtcaa aactttcctg caaagaattc accaatttct 5460
cgacatcata gtacaatttg ttttgttctc ccatcacaat ttaatatacc tgatggattc 5520
ttatgaagcg ctgggtaatg gacgtgtcac tctacttcgc ctttttccct actcctttta 5580
gtacggaaga caatgctaat aaataagagg gtaataataa tattattaat cggcaaaaaa 5640
gattaaacgc caagcgttta attatcagaa agcaaacgtc gtaccaatcc ttgaatgctt 5700
cccaattgta tattaagagt catcacagca acatattctt gttattaaat taattattat 5760
tgatttttga tattgtataa aaaaaccaaa tatgtataaa aaaagtgaat aaaaaatacc 5820
aagtatggag aaatatatta gaagtctata cgttaaacca cccgggcccc ccctcgaggt 5880
cgacggtatc gataagcttg atatcgaatt cctgcagccc gggggatcca ctagttctag 5940
agcggccgct ctagaactag taccacaggt gttgtcctct gaggacataa aatacacacc 6000
gagattcatc aactcattgc tggagttagc atatctacaa ttgggtgaaa tggggagcga 6060
tttgcaggca tttgctcggc atgccggtag aggtgtggtc aataagagcg acctcatgct 6120
atacctgaga aagcaacctg acctacagga aagagttact caagaataag aattttcgtt 6180
ttaaaaccta agagtcactt taaaatttgt atacacttat tttttttata acttatttaa 6240
taataaaaat cataaatcat aagaaattcg cttactctta attaatcaaa aagttaaaat 6300
tgtacgaata gattcaccac ttcttaacaa atcaaaccct tcattgattt tctcgaatgg 6360
caatacatgt gtaattaaag gatcaagagc aaacttcttc gccataaagt cggcaacaag 6420
ttttggaaca ctatccttgc tcttaaaacc gccaaatata gctcccttcc atgtacgacc 6480
gcttagcaac agcataggat tcatcgacaa attttgtgaa tcaggaggaa cacctacgat 6540
cacactgact ccatatgcct cttgacagca ggacaacgca gttaccatag tatcaagacg 6600
gcctataact tcaaaagaga aatcaactcc accgtttgac atttcagtaa ggacttcttg 6660
tattggtttc ttataatctt gagggttaac acattcagta gccccgacct ccttagcttt 6720
tgcaaatttg tccttattga tgtctacacc tataatcctc gctgcgcctg cagctttaca 6780
ccccataata acgcttagtc ctactcctcc taaaccgaat actgcacaag tcgaaccctg 6840
tgtaaccttt gcaactttaa ctgcggaacc gtaaccggtg gaaaatccgc accctatcaa 6900
gcaaactttt tccagtggtg aagctgcatc gattttagcg acagatatct cgtccaccac 6960
tgtgtattgg gaaaatgtag aagtaccaag gaaatggtgt ataggtttcc ctctgcatgt 7020
aaatctgctt gtaccatcct gcatagtacc tctaggcata gacaaatcat ttttaaggca 7080
gaaattaccc tcaggatgtt tgcagactct acacttacca cattgaggag tgaacagtgg 7140
gatcacttta tcaccaggac gaacagtggt aacaccttca cctatggatt caacgattcc 7200
ggcagcctcg tgtcccgcga ttactggcaa aggagtaact agagtgccac tcaccacatg 7260
gtcgtcggat ctacagattc cggtggcaac catcttgatt ctaacctcgt gtgcttttgg 7320
tggcgctact tctacttctt ctatgctaaa cggctttttc tcttcccaca aaactgccgc 7380
tttacactta ataactttac cggctgttga catcctcagc tagctattgt aatatgtgtg 7440
tttgtttgga ttattaagaa gaataattac aaaaaaaatt acaaaggaag gtaattacaa 7500
cagaattaag aaaggacaag aaggaggaag agaatcagtt cattatttct tctttgttat 7560
ataacaaacc caagtagcga tttggccata cattaaaagt tgagaaccac cctccctggc 7620
aacagccaca actcgttacc attgttcatc acgatcatga aactcgctgt cagctgaaat 7680
ttcacctcag tggatctctc tttttattct tcatcgttcc actaaccttt ttccatcagc 7740
tggcagggaa cggaaagtgg aatcccattt agcgagcttc ctcttttctt caagaaaaga 7800
cgaagcttgt gtgtgggtgc gcgcgctagt atctttccac attaagaaat ataccataaa 7860
ggttacttag acatcactat ggctatatat atatatatat atatatgtaa cttagcacca 7920
tcgcgcgtgc atcactgcat gtgttaaccg aaaagtttgg cgaacacttc accgacacgg 7980
tcatttagat ctgtcgtctg cattgcacgt cccttagcct taaatcctag gcgggagcat 8040
tctcgtgtaa ttgtgcagcc tgcgtagcaa ctcaacatag cgtagtctac ccagtttttc 8100
aagggtttat cgttagaaga ttctcccttt tcttcctgct cacaaatctt aaagtcatac 8160
attgcacgac taaatgcaag catgcggatc ccccgggctg caggaattcg atatcaagct 8220
tatcgatacc gtcgactggc cattaatctt tcccatatta gatttcgcca agccatgaaa 8280
gttcaagaaa ggtctttaga cgaattaccc ttcatttctc aaactggcgt caagggatcc 8340
tggtatggtt ttatcgtttt atttctggtt cttatagcat cgttttggac ttctctgttc 8400
ccattaggcg gttcaggagc cagcgcagaa tcattctttg aaggatactt atcctttcca 8460
attttgattg tctgttacgt tggacataaa ctgtatacta gaaattggac tttgatggtg 8520
aaactagaag atatggatct tgataccggc agaaaacaag tagatttgac tcttcgtagg 8580
gaagaaatga ggattgagcg agaaacatta gcaaaaagat ccttcgtaac aagattttta 8640
catttctggt gttgaaggga aagatatgag ctatacagcg gaatttccat atcactcaga 8700
ttttgttatc taattttttc cttcccacgt ccgcgggaat ctgtgtatat tactgcatct 8760
agatatatgt tatcttatct tggcgcgtac atttaatttt caacgtattc tataagaaat 8820
tgcgggagtt tttttcatgt agatgatact gactgcacgc aaatataggc atgatttata 8880
ggcatgattt gatggctgta ccgataggaa cgctaagagt aacttcagaa tcgttatcct 8940
ggcggaaaaa attcatttgt aaactttaaa aaaaaaagcc aatatcccca aaattattaa 9000
gagcgcctcc attattaact aaaatttcac tcagcatcca caatgtatca ggtatctact 9060
acagatatta catgtggcga aaaagacaag aacaatgcaa tagcgcatca agaaaaaaca 9120
caaagctttc aatcaatgaa tcgaaaatgt cattaaaata gtatataaat tgaaactaag 9180
tcataaagct ataaaaagaa aatttattta aatgcaagat ttaaagtaaa ttcacggccc 9240
tgcaggcctc agctcttgtt ttgttctgca aataacttac ccatcttttt caaaacttta 9300
ggtgcaccct cctttgctag aataagttct atccaataca tcctatttgg atctgcttga 9360
gcttctttca tcacggatac gaattcattt tctgttctca caattttgga cacaactctg 9420
tcttccgttg ccccgaaact ttctggcagt tttgagtaat tccacatagg aatgtcatta 9480
taactctggt tcggaccatg aatttccctc tcaaccgtgt aaccatcgtt attaatgata 9540
aagcagattg ggtttatctt ctctctaatg gctagtccta attcttggac agtcagttgc 9600
aatgatccat ctccgataaa caataaatgt ctagattctt tatctgcaat ttggctgcct 9660
agagctgcgg ggaaagtgta tcctatagat ccccacaagg gttgaccaat aaaatgtgat 9720
ttcgatttca gaaatataga tgaggcaccg aagaaagaag tgccttgttc agccacgatc 9780
gtctcattac tttgggtcaa attttcgaca gcttgccaca gtctatcttg tgacaacagc 9840
gcgttagaag gtacaaaatc ttcttgcttt ttatctatgt acttgccttt atattcaatt 9900
tcggacaagt caagaagaga tgatatcagg gattcgaagt cgaaattttg gattctttcg 9960
ttgaaaattt taccttcatc gatattcaag gaaatcattt tattttcatt aagatggtga 10020
gtaaatgcac ccgtactaga atcggtaagc tttacaccca acataagaat aaaatcagca 10080
gattccacaa attccttcaa gtttggctct gacagagtac cgttgtaaat ccccaaaaat 10140
gagggcaatg cttcatcaac agatgattta ccaaagttca aagtagtaat aggtaactta 10200
gtctttgaaa taaactgagt aacagtcttc tctaggccga acgatataat ttcatggcct 10260
gtgattacaa ttggtttctt ggcattcttc agactttcct gtattttgtt cagaatctct 10320
tgatcagatg tattcgacgt ggaattttcc ttcttaagag gcaaggatgg tttttcagcc 10380
ttagcggcag ctacatctac aggtaaattg atgtaaaccg gctttctttc ctttagtaag 10440
gcagacaaca ctctatcaat ttcaacagtt gcattctcgg ctgtcaataa agtcctggca 10500
gcagtaaccg gttcgtgcat cttcataaag tgcttgaaat caccatcagc caacgtatgg 10560
tgaacaaact taccttcgtt ctgcactttc gaggtaggag atcccacgat ctcaacaaca 10620
ggcaggttct cagcatagga gcccgctaag ccattaactg cggataattc gccaacacca 10680
aatgtagtca agaatgccgc agcctttttc gttcttgcgt acccgtcggc catataggag 10740
gcatttaact cattagcatt tcccacccat ttcatatctt tgtgtgaaat aatttgatct 10800
agaaattgca aattgtagtc acctggtact ccgaatattt cttctatacc taattcgtgt 10860
aatctgtcca acagatagtc acctactgta tacattttgt ttactagttt atgtgtgttt 10920
attcgaaact aagttcttgg tgttttaaaa ctaaaaaaaa gactaactat aaaagtagaa 10980
tttaagaagt ttaagaaata gatttacaga attacaatca atacctaccg tctttatata 11040
cttattagtc aagtagggga ataatttcag ggaactggtt tcaacctttt ttttcagctt 11100
tttccaaatc agagagagca gaaggtaata gaaggtgtaa gaaaatgaga tagatacatg 11160
cgtgggtcaa ttgccttgtg tcatcattta ctccaggcag gttgcatcac tccattgagg 11220
ttgtgcccgt tttttgcctg tttgtgcccc tgttctctgt agttgcgcta agagaatgga 11280
cctatgaact gatggttggt gaagaaaaca atattttggt gctgggattc tttttttttc 11340
tggatgccag cttaaaaagc gggctccatt atatttagtg gatgccagga ataaactgtt 11400
cacccagaca cctacgatgt tatatattct gtgtaacccg ccccctattt tgggcatgta 11460
cgggttacag cagaattaaa aggctaattt tttgactaaa taaagttagg aaaatcacta 11520
ctattaatta tttacgtatt ctttgaaatg gcagtattga taatgataaa ctcgaactga 11580
aaaagcgtgt tttttattca aaatgattct aactccctta cgtaatcaag gaatcttttt 11640
gccttggcct ccgcgtcatt aaacttcttg ttgttgacgc taacattcaa cgctagtata 11700
tattcgtttt tttcaggtaa gttcttttca acgggtctta ctgatgaggc agtcgcgtct 11760
gaacctgtta agaggtcaaa tatgtcttct tgaccgtacg tgtcttgcat gttattagct 11820
ttgggaattt gcatcaagtc ataggaaaat ttaaatcttg gctctcttgg gctcaaggtg 11880
acaaggtcct cgaaaatagg gcgcgcccca ccgcggtgga gctccagctt ttgttccctt 11940
tagtgagggt taattgcgcg cttggcgtaa tcatggtcat agctgtttcc tgtgtgaaat 12000
tgttatccgc tcacaattcc acacaacata cgagccggaa gcataaagtg taaagcctgg 12060
ggtgcctaat gagtgagcta actcacatta attgcgttgc gctcactgcc cgctttccag 12120
tcgggaaacc tgtcgtgcca gctgcattaa tgaatcggcc aacgcgcggg gagaggcggt 12180
ttgcgtattg ggcgctcttc cgcttcctcg ctcactgact cgctgcgctc ggtcgttcgg 12240
ctgcggcgag cggtatcagc tcactcaaag gcggtaatac ggttatccac agaatcaggg 12300
gataacgcag gaaagaacat gtgagcaaaa ggccagcaaa aggccaggaa ccgtaaaaag 12360
gccgcgttgc tggcgttttt ccataggctc cgcccccctg acgagcatca caaaaatcga 12420
cgctcaagtc agaggtggcg aaacccgaca ggactataaa gataccaggc gtttccccct 12480
ggaagctccc tcgtgcgctc tcctgttccg accctgccgc ttaccggata cctgtccgcc 12540
tttctccctt cgggaagcgt ggcgctttct catagctcac gctgtaggta tctcagttcg 12600
gtgtaggtcg ttcgctccaa gctgggctgt gtgcacgaac cccccgttca gcccgaccgc 12660
tgcgccttat ccggtaacta tcgtcttgag tccaacccgg taagacacga cttatcgcca 12720
ctggcagcag ccactggtaa caggattagc agagcgaggt atgtaggcgg tgctacagag 12780
ttcttgaagt ggtggcctaa ctacggctac actagaagaa cagtatttgg tatctgcgct 12840
ctgctgaagc cagttacctt cggaaaaaga gttggtagct cttgatccgg caaacaaacc 12900
accgctggta gcggtggttt ttttgtttgc aagcagcaga ttacgcgcag aaaaaaagga 12960
tctcaagaag atcctttgat cttttctacg gggtctgacg ctcagtggaa cgaaaactca 13020
cgttaaggga ttttggtcat gagattatca aaaaggatct tcacctagat ccttttaaat 13080
taaaaatgaa gttttaaatc aatctaaagt atatatgagt aaacttggtc tgacagttac 13140
caatgcttaa tcagtgaggc acctatctca gcgatctgtc tatttcgttc atccatagtt 13200
gcctgactcc ccgtcgtgta gataactacg atacgggagg gcttaccatc tggccccagt 13260
gctgcaatga taccgcgaga cccacgctca ccggctccag atttatcagc aataaaccag 13320
ccagccggaa gggccgagcg cagaagtggt cctgcaactt tatccgcctc catccagtct 13380
attaattgtt gccgggaagc tagagtaagt agttcgccag ttaatagttt gcgcaacgtt 13440
gttgccattg ctacaggcat cgtggtgtca cgctcgtcgt ttggtatggc ttcattcagc 13500
tccggttccc aacgatcaag gcgagttaca tgatccccca tgttgtgcaa aaaagcggtt 13560
agctccttcg gtcctccgat cgttgtcaga agtaagttgg ccgcagtgtt atcactcatg 13620
gttatggcag cactgcataa ttctcttact gtcatgccat ccgtaagatg cttttctgtg 13680
actggtgagt actcaaccaa gtcattctga gaatagtgta tgcggcgacc gagttgctct 13740
tgcccggcgt caatacggga taataccgcg ccacatagca gaactttaaa agtgctcatc 13800
attggaaaac gttcttcggg gcgaaaactc tcaaggatct taccgctgtt gagatccagt 13860
tcgatgtaac ccactcgtgc acccaactga tcttcagcat cttttacttt caccagcgtt 13920
tctgggtgag caaaaacagg aaggcaaaat gccgcaaaaa agggaataag ggcgacacgg 13980
aaatgttgaa tactcatact cttccttttt caatattatt gaagcattta tcagggttat 14040
tgtctcatga gcggatacat atttgaatgt atttagaaaa ataaacaaat aggggttccg 14100
cgcacatttc cccgaaaagt gccacctgaa cgaagcatct gtgcttcatt ttgtagaaca 14160
aaaatgcaac gcgagagcgc taatttttca aacaaagaat ctgagctgca tttttacaga 14220
acagaaatgc aacgcgaaag cgctatttta ccaacgaaga atctgtgctt catttttgta 14280
aaacaaaaat gcaacgcgag agcgctaatt tttcaaacaa agaatctgag ctgcattttt 14340
acagaacaga aatgcaacgc gagagcgcta ttttaccaac aaagaatcta tacttctttt 14400
ttgttctaca aaaatgcatc ccgagagcgc tatttttcta acaaagcatc ttagattact 14460
ttttttctcc tttgtgcgct ctataatgca gtctcttgat aactttttgc actgtaggtc 14520
cgttaaggtt agaagaaggc tactttggtg tctattttct cttccataaa aaaagcctga 14580
ctccacttcc cgcgtttact gattactagc gaagctgcgg gtgcattttt tcaagataaa 14640
ggcatccccg attatattct ataccgatgt ggattgcgca tactttgtga acagaaagtg 14700
atagcgttga tgattcttca ttggtcagaa aattatgaac ggtttcttct attttgtctc 14760
tatatactac gtataggaaa tgtttacatt ttcgtattgt tttcgattca ctctatgaat 14820
agttcttact acaatttttt tgtctaaaga gtaatactag agataaacat aaaaaatgta 14880
gaggtcgagt ttagatgcaa gttcaaggag cgaaaggtgg atgggtaggt tatataggga 14940
tatagcacag agatatatag caaagagata cttttgagca atgtttgtgg aagcggtatt 15000
cgcaatattt tagtagctcg ttacagtccg gtgcgttttt ggttttttga aagtgcgtct 15060
tcagagcgct tttggttttc aaaagcgctc tgaagttcct atactttcta gagaatagga 15120
acttcggaat aggaacttca aagcgtttcc gaaaacgagc gcttccgaaa atgcaacgcg 15180
agctgcgcac atacagctca ctgttcacgt cgcacctata tctgcgtgtt gcctgtatat 15240
atatatacat gagaagaacg gcatagtgcg tgtttatgct taaatgcgta cttatatgcg 15300
tctatttatg taggatgaaa ggtagtctag tacctcctgt gatattatcc cattccatgc 15360
ggggtatcgt atgcttcctt cagcactacc ctttagctgt tctatatgct gccactcctc 15420
aattggatta gtctcatcct tcaatgctat catttccttt gatattggat catactaaga 15480
aaccattatt atcatgacat taacctataa aaataggcgt atcacgaggc cctttcgtc 15539
<210> 3
<211> 4586
<212> DNA
<213> Artificial sequence
<220>
<223> Template
<400> 3
gggtaccgag ctcgaattca ctggccgtcg ttttacaacg tcgtgactgg gaaaaccctg 60
gcgttaccca acttaatcgc cttgcagcac atcccccttt cgccagctgg
Claims (197)
발효 프로세스에서의 카르복실산이 2상 혼합물을 생성하기에 충분한 농도로 존재하는, 부틸 에스테르를 생성하는 방법.Contacting butanol produced in the fermentation process with at least one carboxylic acid and at least one catalyst capable of esterifying the carboxylic acid with butanol to produce a butyl ester of carboxylic acid;
Wherein the carboxylic acid in the fermentation process is present at a concentration sufficient to produce a biphasic mixture.
(b) 공급원료를 액화하여, 올리고당을 포함하는 액화된 바이오매스를 생성하는 단계;
(c) 공급원료 슬러리를 분리하여, 올리고당을 포함하는 수성 스트림, 오일 스트림, 및 고형물을 포함하는 생성물을 생성하는 단계;
(d) 수성 스트림을 발효 브로스 (fermentation broth)를 포함하는 발효 용기에 첨가하는 단계;
(e) 수성 스트림의 올리고당을 당화시키는 단계; 및
(f) 수성 스트림에 존재하는 올리고당 당화 생성물을 발효시켜 부탄올을 생성하고, 동시에 부탄올을 적어도 하나의 카르복실산 및 카르복실산을 부탄올로 에스테르화할 수 있는 적어도 하나의 촉매와 접촉시켜, 카르복실산의 부틸 에스테르를 생성하는 단계 - 카르복실산은 2상 혼합물을 생성하기에 충분한 농도로 존재함 - 를 포함하며;
임의로 단계 (e) 및 (f)가 동시에 일어나는, 공급원료로부터 부탄올 및 부틸 에스테르를 생성하는 방법.(a) providing a feedstock;
(b) liquefying the feedstock to produce a liquefied biomass comprising oligosaccharides;
(c) separating the feedstock slurry to produce a product comprising an aqueous stream comprising oligosaccharides, an oil stream, and a solid;
(d) adding the aqueous stream to a fermentation vessel comprising fermentation broth;
(e) saccharifying oligosaccharides in the aqueous stream; And
(f) fermenting the oligosaccharide saccharification product present in the aqueous stream to produce butanol, while simultaneously contacting butanol with at least one carboxylic acid and at least one catalyst capable of esterifying the carboxylic acid with butanol, thereby Producing a butyl ester of a carboxylic acid present in a concentration sufficient to produce a biphasic mixture;
A process for producing butanol and butyl esters from a feedstock, wherein optionally steps (e) and (f) occur simultaneously.
추가의 카르복실산을 발효 용기에 첨가하는 단계를 추가로 포함하는 방법.13. The method of claim 12,
Adding further carboxylic acid to the fermentation vessel.
(b) 공급원료를 액화하여, 올리고당을 포함하는 액화된 바이오매스를 생성하는 단계;
(c) 공급원료 슬러리를 분리하여, 올리고당 및 오일을 포함하는 스트림, 및 고형물을 생성하는 단계;
(d) 스트림을 발효 브로스를 포함하는 발효 용기에 첨가하는 단계;
(e) 스트림의 올리고당을 당화시키는 단계; 및
(f) 스트림에 존재하는 올리고당 당화 생성물을 발효시켜 부탄올을 생성하고, 동시에 부탄올을 적어도 하나의 카르복실산 및 카르복실산을 부탄올로 에스테르화할 수 있는 적어도 하나의 촉매와 접촉시켜, 카르복실산의 부틸 에스테르를 생성하는 단계 - 카르복실산은 2상 혼합물을 생성하기에 충분한 농도로 존재함 - 를 포함하며;
임의로 단계 (e) 및 (f)가 동시에 일어나는, 공급원료로부터 부탄올 및 부틸 에스테르를 생성하는 방법.(a) providing a feedstock;
(b) liquefying the feedstock to produce a liquefied biomass comprising oligosaccharides;
(c) separating the feedstock slurry to produce a stream comprising oligosaccharides and oil, and a solid;
(d) adding the stream to a fermentation vessel comprising fermentation broth;
(e) saccharifying oligosaccharides of the stream; And
(f) fermenting the oligosaccharide saccharification product present in the stream to produce butanol, while simultaneously contacting butanol with at least one carboxylic acid and at least one catalyst capable of esterifying the carboxylic acid with butanol, Producing a butyl ester, wherein the carboxylic acid is present at a concentration sufficient to produce a biphasic mixture;
A process for producing butanol and butyl esters from a feedstock, wherein optionally steps (e) and (f) occur simultaneously.
적어도 일부의 오일을 카르복실산으로 전환시키는 단계를 추가로 포함하는 방법.34. The method of claim 33,
And converting at least some oil into carboxylic acids.
- 발효 프로세스에서 카르복실산은 수성상 및 부틸 에스테르 함유 유기상을 포함하는 2상 혼합물을 생성하기에 충분한 농도로 존재함 - ;
(b) 부틸 에스테르 함유 유기상을 수성상으로부터 분리하는 단계; 및
(c) 부탄올을 부틸 에스테르로부터 회수하는 단계를 포함하는, 부탄올을 생성 하는 방법.(a) contacting butanol produced in the fermentation process with at least one carboxylic acid and at least one catalyst capable of esterifying the carboxylic acid with butanol to produce a butyl ester of carboxylic acid
The carboxylic acid in the fermentation process is present at a concentration sufficient to produce a biphasic mixture comprising an aqueous phase and a butyl ester containing organic phase;
(b) separating the butyl ester containing organic phase from the aqueous phase; And
(c) recovering butanol from a butyl ester.
추출제 스트림을 2개 이상의 증류탑에 첨가하는 단계를 추가로 포함하는 방법.55. The method of claim 54, further comprising: removing butanol from the fermentation vessel as extractant stream; And
Adding the extractant stream to at least two distillation columns.
(b) 공급원료를 액화하여 공급원료 슬러리를 생성하는 단계;
(c) 공급원료 슬러리를 분리하여, 수성 스트림, 오일 스트림, 및 고형물을 포함하는 생성물을 생성하는 단계;
(d) 수성 스트림을 발효 브로스를 포함하는 발효 용기에 첨가하는 단계;
(e) 수성 스트림을 당화하는 단계;
(f) 당화된 수성 스트림을 발효시켜 부탄올을 생성하고, 동시에 부탄올을 적어도 하나의 카르복실산 및 카르복실산을 부탄올로 에스테르화할 수 있는 적어도 하나의 촉매와 접촉시켜, 카르복실산의 부틸 에스테르를 생성하는 단계 - 카르복실산은 2상 혼합물을 생성하기에 충분한 농도로 존재함 - ;
(g) 부틸 에스테르 함유 유기상을 수성상으로부터 분리하는 단계; 및
(h) 부탄올을 부틸 에스테르로부터 회수하는 단계를 포함하며;
임의로 단계 (e) 및 (f)가 동시에 일어나는, 공급원료로부터 부탄올을 생성하는 방법.(a) providing a feedstock;
(b) liquefying the feedstock to produce a feedstock slurry;
(c) separating the feedstock slurry to produce a product comprising an aqueous stream, an oil stream, and a solid;
(d) adding the aqueous stream to a fermentation vessel comprising fermentation broth;
(e) saccharifying the aqueous stream;
(f) fermenting the glycated aqueous stream to produce butanol, while simultaneously contacting butanol with at least one carboxylic acid and at least one catalyst capable of esterifying the carboxylic acid with butanol, thereby butyl ester of carboxylic acid Producing, the carboxylic acid is present at a concentration sufficient to produce a biphasic mixture;
(g) separating the butyl ester containing organic phase from the aqueous phase; And
(h) recovering butanol from the butyl ester;
A process for producing butanol from a feedstock, wherein optionally steps (e) and (f) occur simultaneously.
(b) 공급원료를 액화하여, 올리고당을 포함하는 액화된 바이오매스를 생성하는 단계;
(c) 공급원료 슬러리를 분리하여, 올리고당 및 오일을 포함하는 수성 스트림, 및 고형물을 생성하는 단계;
(d) 수성 스트림을 발효 브로스를 포함하는 발효 용기에 첨가하는 단계;
(e) 수성 스트림의 올리고당을 당화시키는 단계;
(f) 수성 스트림에 존재하는 올리고당 당화 생성물을 발효시켜 부탄올을 생성하고, 동시에 부탄올을 적어도 하나의 카르복실산 및 카르복실산을 부탄올로 에스테르화할 수 있는 적어도 하나의 촉매와 접촉시켜, 카르복실산의 부틸 에스테르를 생성하는 단계 - 카르복실산은 2상 혼합물을 생성하기에 충분한 농도로 존재함 - ;
(g) 부틸 에스테르 함유 유기상을 수성상으로부터 분리하는 단계; 및
(h) 부탄올을 부틸 에스테르로부터 회수하는 단계를 포함하며;
임의로 단계 (e) 및 (f)가 동시에 일어나는, 공급원료로부터 부탄올 및 부틸 에스테르를 생성하는 방법.(a) providing a feedstock;
(b) liquefying the feedstock to produce a liquefied biomass comprising oligosaccharides;
(c) separating the feedstock slurry to produce an aqueous stream comprising oligosaccharides and oils, and solids;
(d) adding the aqueous stream to a fermentation vessel comprising fermentation broth;
(e) saccharifying oligosaccharides in the aqueous stream;
(f) fermenting the oligosaccharide saccharification product present in the aqueous stream to produce butanol, while simultaneously contacting butanol with at least one carboxylic acid and at least one catalyst capable of esterifying the carboxylic acid with butanol, thereby Producing a butyl ester of carboxylic acid present in a concentration sufficient to produce a biphasic mixture;
(g) separating the butyl ester containing organic phase from the aqueous phase; And
(h) recovering butanol from the butyl ester;
A process for producing butanol and butyl esters from a feedstock, wherein optionally steps (e) and (f) occur simultaneously.
발효 프로세스에서의 카르복실산이 2상 혼합물을 생성하기에 충분한 농도로 존재하는, 알코올 에스테르를 생성하는 방법.Contacting the alcohol produced in the fermentation process with at least one carboxylic acid and at least one catalyst capable of esterifying the carboxylic acid with an alcohol to produce an alcohol ester of carboxylic acid;
Wherein the carboxylic acid in the fermentation process is present at a concentration sufficient to produce a biphasic mixture.
- 발효 프로세스에서의 카르복실산은 수성상 및 알코올 에스테르 함유 유기상을 포함하는 2상 혼합물을 생성하기에 충분한 농도로 존재함 - ;
(b) 알코올 에스테르 함유 유기상을 수성상으로부터 분리하는 단계; 및
(c) 알코올을 알코올 에스테르로부터 회수하는 단계를 포함하는, 알코올을 생성하는 방법.(a) contacting the alcohol produced in the fermentation process with at least one carboxylic acid and at least one catalyst capable of esterifying the carboxylic acid with an alcohol to produce an alcohol ester of carboxylic acid
The carboxylic acid in the fermentation process is present in a concentration sufficient to produce a biphasic mixture comprising an aqueous phase and an alcohol ester containing organic phase;
(b) separating the alcohol ester containing organic phase from the aqueous phase; And
(c) recovering the alcohol from the alcohol ester.
(b) 발효성 탄소 기질;
(c) 지방산을 생성물 알코올로 지방산 알코올 에스테르로 세포 외에서 에스테르화할 수있는 촉매; 및
(d) 지방산 알코올 에스테르 - 지방산 알코올 에스테르는 발효 시에 생성됨 - 를 포함하는 발효 브로스.(a) recombinant microorganisms capable of producing product alcohols;
(b) fermentable carbon substrates;
(c) a catalyst capable of extracellular esterification of fatty acids with fatty alcohol esters with product alcohols; And
(d) fatty acid alcohol esters, wherein fatty alcohol esters are produced upon fermentation.
i) 피루베이트에서 아세토락테이트로의 전환;
ii) 아세토락테이트에서 2,3-다이하이드록시아이소발레레이트로의 전환;
iii) 2,3-다이하이드록시아이소발레레이트에서 α-케토아이소발레레이트로의 전환;
iv) α-케토아이소발레레이트에서 아이소부티르알데히드로의 전환; 및
v) 아이소부티르알데히드에서 아이소부탄올로의 전환.At least one enzyme catalyzing the conversion of each of the following substrates to a product, wherein at least one of the enzymes of iii) or the enzymes of v) comprises an isobutanol biosynthetic pathway encoded by a heterologous polynucleotide integrated into a chromosome Recombinant yeast cells capable of producing isobutanol,
i) conversion of pyruvate to acetolactate;
ii) conversion of acetolactate to 2,3-dihydroxyisovalerate;
iii) conversion of 2,3-dihydroxyisovalerate to α-ketoisovalerate;
iv) conversion of isobutyraldehyde to α-ketoisovalerate; And
v) conversion of isobutyraldehyde to isobutanol.
(b) 유리 지방산을 알코올로 지방산 알킬 에스테르로 에스테르화할 수 있으며, 임의로 글리세라이드를 유리 지방산으로 가수분해할 수 있는 촉매;
(c) 알코올;
(d) 유리 지방산; 및
(e) 촉매를 사용한 유리 지방산과 알코올의 에스테르화로부터 원위치 (in situ)에 생성된 지방산 알코올 에스테르를 포함하는 발효 조성물.(a) fermentable carbon substrate;
(b) a catalyst capable of esterifying free fatty acids with alcohols and fatty acid alkyl esters and optionally hydrolyzing glycerides with free fatty acids;
(c) alcohols;
(d) free fatty acids; And
(e) A fermentation composition comprising a fatty alcohol ester produced in situ from esterification of an alcohol with free fatty acid using a catalyst.
Applications Claiming Priority (17)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US35629010P | 2010-06-18 | 2010-06-18 | |
| US61/356,290 | 2010-06-18 | ||
| US36845110P | 2010-07-28 | 2010-07-28 | |
| US36843610P | 2010-07-28 | 2010-07-28 | |
| US36844410P | 2010-07-28 | 2010-07-28 | |
| US36842910P | 2010-07-28 | 2010-07-28 | |
| US61/368,436 | 2010-07-28 | ||
| US61/368,444 | 2010-07-28 | ||
| US61/368,429 | 2010-07-28 | ||
| US61/368,451 | 2010-07-28 | ||
| US37954610P | 2010-09-02 | 2010-09-02 | |
| US61/379,546 | 2010-09-02 | ||
| US201161440034P | 2011-02-07 | 2011-02-07 | |
| US61/440,034 | 2011-02-07 | ||
| US13/160,766 | 2011-06-15 | ||
| US13/160,766 US9012190B2 (en) | 2011-06-15 | 2011-06-15 | Use of thiamine and nicotine adenine dinucleotide for butanol production |
| PCT/US2011/040856 WO2011159998A2 (en) | 2010-06-18 | 2011-06-17 | Production of alcohol esters and in situ product removal during alcohol fermentation |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20130032897A true KR20130032897A (en) | 2013-04-02 |
Family
ID=45348555
Family Applications (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020137001250A KR20130116858A (en) | 2010-06-18 | 2011-06-17 | Extraction solvents derived from oil for alcohol removal in extractive fermentation |
| KR1020137001251A KR20130032897A (en) | 2010-06-18 | 2011-06-17 | Production of alcohol esters and in situ product removal during alcohol fermentation |
| KR1020137001249A KR20130087014A (en) | 2010-06-18 | 2011-06-17 | Supplementation of fatty acids for improving alcohol productivity |
| KR1020137001247A KR20130045330A (en) | 2010-06-18 | 2011-06-17 | Methods and systems for removing undissolved solids prior to extractive fermentation in the production of butanol |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020137001250A KR20130116858A (en) | 2010-06-18 | 2011-06-17 | Extraction solvents derived from oil for alcohol removal in extractive fermentation |
Family Applications After (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020137001249A KR20130087014A (en) | 2010-06-18 | 2011-06-17 | Supplementation of fatty acids for improving alcohol productivity |
| KR1020137001247A KR20130045330A (en) | 2010-06-18 | 2011-06-17 | Methods and systems for removing undissolved solids prior to extractive fermentation in the production of butanol |
Country Status (13)
| Country | Link |
|---|---|
| EP (4) | EP2582823A1 (en) |
| JP (4) | JP2013528400A (en) |
| KR (4) | KR20130116858A (en) |
| CN (4) | CN103476936A (en) |
| AR (1) | AR083153A1 (en) |
| AU (4) | AU2011268169A1 (en) |
| BR (3) | BR112012032352A2 (en) |
| CA (4) | CA2800719A1 (en) |
| MX (4) | MX2012014683A (en) |
| NZ (3) | NZ603036A (en) |
| RU (1) | RU2013102308A (en) |
| WO (4) | WO2011159991A1 (en) |
| ZA (3) | ZA201208372B (en) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2018175481A1 (en) * | 2017-03-20 | 2018-09-27 | Lanzatech, Inc. | A process and system for product recovery and cell recycle |
Families Citing this family (30)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9175315B2 (en) * | 2010-06-18 | 2015-11-03 | Butamax Advanced Biofuels Llc | Production of alcohol esters and in situ product removal during alcohol fermentation |
| US20130040340A1 (en) * | 2011-02-07 | 2013-02-14 | E. I. Du Pont De Nemours And Company | Production of alcohol esters in situ using alcohols and fatty acids produced by microorganisms |
| US8765425B2 (en) | 2011-03-23 | 2014-07-01 | Butamax Advanced Biofuels Llc | In situ expression of lipase for enzymatic production of alcohol esters during fermentation |
| CA2829941A1 (en) * | 2011-03-23 | 2012-09-27 | Butamax(Tm) Advanced Biofuels Llc | In situ expression of lipase for enzymatic production of alcohol esters during fermentation |
| KR20140092759A (en) | 2011-03-24 | 2014-07-24 | 부타맥스 어드밴스드 바이오퓨얼스 엘엘씨 | Host cells and methods for production of isobutanol |
| JP2014516581A (en) * | 2011-06-17 | 2014-07-17 | ビュータマックス・アドバンスド・バイオフューエルズ・エルエルシー | Co-products from the biofuel manufacturing process and methods for manufacturing the same |
| US20130180164A1 (en) | 2011-07-28 | 2013-07-18 | Butamax(Tm) Advanced Biofuels Llc | Low sulfur fuel compositions having improved lubricity |
| AU2012362274A1 (en) * | 2011-12-30 | 2014-07-03 | Butamax (Tm) Advanced Biofuels Llc | Fermentative production of alcohols |
| ES2577052T3 (en) | 2012-04-25 | 2016-07-12 | Purac Biochem Bv | Fermentation process that includes the use of a hydrocyclone |
| MX2014013321A (en) | 2012-05-04 | 2015-02-10 | Butamax Advanced Biofuels Llc | Processes and systems for alcohol production and recovery. |
| JP6226286B2 (en) * | 2012-06-21 | 2017-11-08 | 月島機械株式会社 | Biomass processing apparatus and processing method |
| BR112014032741B1 (en) | 2012-07-04 | 2022-01-25 | Cooperatie Avebe U.A. | Method for selectively preparing a fatty acid alkyl ester |
| US20140024064A1 (en) * | 2012-07-23 | 2014-01-23 | Butamax(Tm) Advanced Biofuels Llc | Processes and systems for the production of fermentative alcohols |
| BR112015001433A2 (en) * | 2012-07-23 | 2018-08-28 | Butamax Advanced Biofuels Llc | method and system for the production of a fermentation product. |
| MX2015003073A (en) * | 2012-09-12 | 2015-07-14 | Butamax Advanced Biofuels Llc | Processes and systems for the production of fermentation products. |
| WO2014059273A1 (en) * | 2012-10-11 | 2014-04-17 | Butamax Advanced Biofuels Llc | Processes and systems for the production of fermentation products |
| AU2014225436B2 (en) * | 2013-03-07 | 2018-05-10 | Genomatica, Inc. | Downstream processing of fatty alcohol compositions produced by recombinant host cells |
| US9523104B2 (en) | 2013-03-12 | 2016-12-20 | Butamax Advanced Biofuels Llc | Processes and systems for the production of alcohols |
| WO2014144728A1 (en) * | 2013-03-15 | 2014-09-18 | Butamax Advanced Biofuels Llc | Method for production of butanol using extractive fermentation |
| JP2015037389A (en) * | 2013-08-19 | 2015-02-26 | 独立行政法人産業技術総合研究所 | Improved method of enzyme saccharifying reaction from lignocellulose biomass by supplementation of a lipolytic enzyme and nonionic surfactant and simultaneous saccharifying fermentation |
| RU2555537C2 (en) * | 2013-10-14 | 2015-07-10 | Федеральное государственное автономное образовательное учреждение высшего образования "Национальный исследовательский Томский государственный университет" | Method of removing acetone-butyl-alcohol fermentation inhibitors from hydrolysates of lignocellulose material |
| US20160326551A1 (en) * | 2013-12-31 | 2016-11-10 | Butamax Advanced Biofuels Llc | Isobutanol tolerance in yeast with an altered lipid profile |
| KR101485905B1 (en) * | 2014-10-06 | 2015-01-26 | 김준호 | Composition having reducing effect of carbon dioxideand manufacturing method of the composition |
| CA3021002A1 (en) | 2016-07-22 | 2018-01-25 | Vito Nv (Vlaamse Instelling Voor Technologisch Onderzoek Nv) | Method and system for producing products by fermentation |
| CN108265088A (en) * | 2017-01-03 | 2018-07-10 | 北京化工大学 | A kind of method for preparing ester type compound using lipase-catalyzed alcoholic fermentation product |
| EP3450564A1 (en) | 2017-09-05 | 2019-03-06 | Vito NV | Method of producing organic solvents in a bioreactor |
| US11484842B2 (en) | 2017-09-05 | 2022-11-01 | Vito Nv | Method and apparatus for in situ product recovery |
| CN108315359B (en) * | 2018-03-23 | 2021-07-27 | 安玉民 | Method for preparing alcohol and preparing feed by using potato straws |
| CN110645725A (en) * | 2019-09-29 | 2020-01-03 | 广东利人酒业有限公司 | Low-temperature freezing and filtering system |
| CN116508784B (en) * | 2023-05-11 | 2024-01-19 | 南京工业大学 | Application of palmitic acid in improving pseudomonas stutzeri in promoting plant growth and reducing nitrous oxide emission of farmland soil |
Family Cites Families (55)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS57152890A (en) * | 1981-03-16 | 1982-09-21 | Nippon Kagaku Kikai Seizo Kk | Alcoholic fermentation of syrup made from starch |
| JPS5992094A (en) * | 1982-11-18 | 1984-05-28 | Agency Of Ind Science & Technol | Anaerobic digestion of organic waste matter |
| JPS59216591A (en) * | 1983-05-23 | 1984-12-06 | Chiyoda Chem Eng & Constr Co Ltd | Production of butanol |
| JPS60172290A (en) * | 1984-02-17 | 1985-09-05 | Kao Corp | Preparation of butanol |
| JPS61173786A (en) * | 1985-01-28 | 1986-08-05 | Mitsui Eng & Shipbuild Co Ltd | Method of fermenting alcohol |
| ATE47884T1 (en) * | 1985-04-09 | 1989-11-15 | Voest Alpine Ag | PROCESS FOR THE SIMULTANEOUS PRODUCTION OF ALCOHOL AND PROTEIN-RICH FEED. |
| US4865973A (en) * | 1985-09-13 | 1989-09-12 | Queen's University At Kingston | Process for extractive fermentation |
| DE4230645C2 (en) | 1992-09-12 | 1996-03-07 | Bernd Hansen | ampoule |
| WO1995028476A1 (en) | 1994-04-15 | 1995-10-26 | Midwest Research Institute | Recombinant zymomonas for pentose fermentation |
| US5712133A (en) | 1994-04-15 | 1998-01-27 | Midwest Research Institute | Pentose fermentation by recombinant zymomonas |
| US5514583A (en) | 1994-04-15 | 1996-05-07 | Midwest Research Institute | Recombinant zymomonas for pentose fermentation |
| US7223575B2 (en) | 2000-05-01 | 2007-05-29 | Midwest Research Institute | Zymomonas pentose-sugar fermenting strains and uses thereof |
| JP2004208667A (en) * | 2003-01-06 | 2004-07-29 | Minoru Morita | Method for producing ethanol by utilizing biomass resource |
| CN1183238C (en) * | 2003-03-28 | 2005-01-05 | 刘阳 | Method of manufacturing vegetable oil methyl aliphate using biological enzyme method |
| US20070014905A1 (en) * | 2003-06-30 | 2007-01-18 | Purdue Research Foundation | Starchy material processed to produce one or more products comprising starch, ethanol, sugar syrup, oil, protein, fiber, gluten meal, and mixtures thereof |
| WO2005100582A2 (en) * | 2004-03-25 | 2005-10-27 | Novozymes Inc. | Methods for degrading or converting plant cell wall polysaccharides |
| TWI240384B (en) * | 2004-04-16 | 2005-09-21 | Powerchip Semiconductor Corp | Method of manufacturing non-volatile memory cell |
| CA2603128C (en) | 2005-04-12 | 2014-04-08 | E.I. Du Pont De Nemours And Company | Treatment of biomass to obtain fermentable sugars |
| US9297028B2 (en) | 2005-09-29 | 2016-03-29 | Butamax Advanced Biofuels Llc | Fermentive production of four carbon alcohols |
| US8945899B2 (en) | 2007-12-20 | 2015-02-03 | Butamax Advanced Biofuels Llc | Ketol-acid reductoisomerase using NADH |
| UA96928C2 (en) | 2005-10-26 | 2011-12-26 | Э.И. Дю Пон Де Немур Энд Компани | Fermentive production of four carbon alcohols |
| US7666282B2 (en) | 2005-12-28 | 2010-02-23 | E.I. Du Pont De Nemours And Company | Process for providing ethanol |
| JP2007245096A (en) * | 2006-03-17 | 2007-09-27 | Tokyo Electric Power Co Inc:The | Method for manufacturing useful material from biomass |
| CN101437948A (en) * | 2006-05-02 | 2009-05-20 | 纳幕尔杜邦公司 | Fermentive production of four carbon alcohols |
| US8962298B2 (en) | 2006-05-02 | 2015-02-24 | Butamax Advanced Biofuels Llc | Recombinant host cell comprising a diol dehydratase |
| DE102006040567A1 (en) * | 2006-08-30 | 2008-03-06 | Bayer Technology Services Gmbh | Process for the production of bioethanol |
| WO2008039859A2 (en) | 2006-09-26 | 2008-04-03 | Verasun Energy Corporation | Solvent extraction of oil from distillers dried grains and methods of using extraction products |
| US7741119B2 (en) | 2006-09-28 | 2010-06-22 | E. I. Du Pont De Nemours And Company | Xylitol synthesis mutant of xylose-utilizing zymomonas for ethanol production |
| WO2008052991A2 (en) * | 2006-10-31 | 2008-05-08 | Dsm Ip Assets B.V. | Butanol production in a eukaryotic cell |
| CN101595218A (en) * | 2006-10-31 | 2009-12-02 | 帝斯曼知识产权资产管理有限公司 | In eukaryotic cell, produce butanols |
| WO2008115564A2 (en) | 2007-03-19 | 2008-09-25 | Jump2Go | Interactive radio system and method |
| ES2426070T3 (en) | 2007-04-18 | 2013-10-21 | Butamax (Tm) Advanced Biofuels Llc | Fermentation production of isobutanol using highly active cetol-acid reductoisomerase enzymes |
| JP2008278825A (en) * | 2007-05-11 | 2008-11-20 | Chuo Kakoki Kk | Method for producing bioethanol |
| US8192968B2 (en) * | 2007-08-27 | 2012-06-05 | Iogen Energy Corporation | Method for the production of a fermentation product from a pretreated lignocellulosic feedstock |
| JP4707007B2 (en) * | 2007-10-05 | 2011-06-22 | 智浩 青戸 | Method and apparatus for producing ethanol from yacon |
| JP2009106258A (en) * | 2007-10-12 | 2009-05-21 | Nippon Steel Engineering Co Ltd | Method for producing ethanol |
| CA2704539C (en) | 2007-10-30 | 2014-12-23 | E. I. Du Pont De Nemours And Company | Zymomonas with improved ethanol production in medium containing concentrated sugars and acetate |
| US20110229942A1 (en) * | 2007-12-13 | 2011-09-22 | Glycos Biotechnologies, Incorporated | Microbial Conversion of Oils and Fatty Acids to High-Value Chemicals |
| EP2222841B1 (en) | 2007-12-20 | 2015-08-26 | Butamax (TM) Advanced Biofuels LLC | Ketol-acid reductoisomerase using nadh |
| EP2235193B1 (en) * | 2007-12-23 | 2015-11-25 | GEVO, Inc. | Yeast organism producing isobutanol at a high yield |
| EP2238098A4 (en) | 2007-12-27 | 2016-06-01 | Gevo Inc | Recovery of higher alcohols from dilute aqueous solutions |
| WO2009089030A1 (en) * | 2008-01-08 | 2009-07-16 | Integroextraction, Inc. | Dry-mill ethanol plant extraction enhancement |
| JP2009213449A (en) * | 2008-03-12 | 2009-09-24 | Tokyo Electric Power Co Inc:The | Method for producing monosaccharide and ethanol by using oil-based plant biomass residue as raw material |
| US7998722B2 (en) | 2008-03-27 | 2011-08-16 | E. I. Du Pont De Nemours And Company | Zymomonas with improved xylose utilization |
| US8188250B2 (en) | 2008-04-28 | 2012-05-29 | Butamax(Tm) Advanced Biofuels Llc | Butanol dehydrogenase enzyme from the bacterium Achromobacter xylosoxidans |
| EP2657344B1 (en) * | 2008-06-04 | 2016-04-27 | Butamax (TM) Advanced Biofuels LLC | Method for producing butanol using two-phase extractive fermentation |
| BRPI0909989A2 (en) | 2008-06-05 | 2021-06-22 | Butamax Advanced Biofuels Llc | recombinant yeast cell and method for producing a product |
| ES2521675T3 (en) | 2008-09-29 | 2014-11-13 | Butamax Advanced Biofuels Llc | Identification and use of [2Fe-2S] -dihydroxy acid-bacterial dehydratases |
| CN101418320B (en) * | 2008-12-10 | 2011-05-18 | 中国科学院微生物研究所 | Method for producing butanol |
| US8247208B2 (en) | 2008-12-22 | 2012-08-21 | Alliance For Sustainable Energy Llc | Zymomonas with improved xylose utilization in stress conditions |
| CN102439162A (en) * | 2009-04-13 | 2012-05-02 | 布特马斯先进生物燃料有限责任公司 | Method for producing butanol using extractive fermentation |
| US9260708B2 (en) | 2009-09-29 | 2016-02-16 | Butamax Advanced Biofuels Llc | Yeast production host cells |
| CA2779460A1 (en) * | 2009-11-23 | 2011-05-26 | Butamax(Tm) Advanced Biofuels Llc | Method for producing butanol using extractive fermentation with osmolyte addition |
| US9175315B2 (en) * | 2010-06-18 | 2015-11-03 | Butamax Advanced Biofuels Llc | Production of alcohol esters and in situ product removal during alcohol fermentation |
| US10079208B2 (en) | 2016-07-28 | 2018-09-18 | Globalfoundries Inc. | IC structure with interface liner and methods of forming same |
-
2011
- 2011-06-17 CN CN2011800396963A patent/CN103476936A/en active Pending
- 2011-06-17 MX MX2012014683A patent/MX2012014683A/en unknown
- 2011-06-17 BR BR112012032352A patent/BR112012032352A2/en not_active IP Right Cessation
- 2011-06-17 JP JP2013515550A patent/JP2013528400A/en active Pending
- 2011-06-17 JP JP2013515530A patent/JP2013531992A/en not_active Abandoned
- 2011-06-17 BR BR112012032166A patent/BR112012032166A2/en not_active IP Right Cessation
- 2011-06-17 AU AU2011268169A patent/AU2011268169A1/en not_active Abandoned
- 2011-06-17 NZ NZ603036A patent/NZ603036A/en not_active IP Right Cessation
- 2011-06-17 WO PCT/US2011/040842 patent/WO2011159991A1/en active Application Filing
- 2011-06-17 MX MX2012014784A patent/MX2012014784A/en unknown
- 2011-06-17 AU AU2011268215A patent/AU2011268215B2/en not_active Ceased
- 2011-06-17 CN CN201180030096.0A patent/CN102947457B/en active Active
- 2011-06-17 EP EP11727615.4A patent/EP2582823A1/en not_active Withdrawn
- 2011-06-17 WO PCT/US2011/040856 patent/WO2011159998A2/en active Application Filing
- 2011-06-17 BR BR112012032357A patent/BR112012032357A2/en not_active IP Right Cessation
- 2011-06-17 AU AU2011268244A patent/AU2011268244A1/en not_active Abandoned
- 2011-06-17 CA CA2800719A patent/CA2800719A1/en not_active Abandoned
- 2011-06-17 WO PCT/US2011/040899 patent/WO2011160030A2/en active Application Filing
- 2011-06-17 CN CN2011800298212A patent/CN102947456A/en active Pending
- 2011-06-17 KR KR1020137001250A patent/KR20130116858A/en not_active Application Discontinuation
- 2011-06-17 KR KR1020137001251A patent/KR20130032897A/en not_active Application Discontinuation
- 2011-06-17 KR KR1020137001249A patent/KR20130087014A/en not_active Application Discontinuation
- 2011-06-17 CA CA2800542A patent/CA2800542A1/en not_active Abandoned
- 2011-06-17 JP JP2013515540A patent/JP2013533742A/en not_active Abandoned
- 2011-06-17 KR KR1020137001247A patent/KR20130045330A/en not_active Application Discontinuation
- 2011-06-17 CN CN2011800301253A patent/CN103003436A/en active Pending
- 2011-06-17 MX MX2012014687A patent/MX2012014687A/en unknown
- 2011-06-17 CA CA2801209A patent/CA2801209A1/en not_active Abandoned
- 2011-06-17 JP JP2013515543A patent/JP2013535956A/en not_active Abandoned
- 2011-06-17 EP EP11727618.8A patent/EP2582825A1/en not_active Withdrawn
- 2011-06-17 AU AU2011268201A patent/AU2011268201A1/en not_active Abandoned
- 2011-06-17 EP EP11727620.4A patent/EP2582827A2/en not_active Withdrawn
- 2011-06-17 EP EP11727619.6A patent/EP2582826A2/en not_active Withdrawn
- 2011-06-17 CA CA2801498A patent/CA2801498A1/en not_active Abandoned
- 2011-06-17 WO PCT/US2011/040796 patent/WO2011159962A1/en active Application Filing
- 2011-06-17 NZ NZ603467A patent/NZ603467A/en not_active IP Right Cessation
- 2011-06-17 MX MX2012014551A patent/MX2012014551A/en active IP Right Grant
- 2011-06-17 NZ NZ603659A patent/NZ603659A/en not_active IP Right Cessation
- 2011-06-17 RU RU2013102308/10A patent/RU2013102308A/en not_active Application Discontinuation
- 2011-06-21 AR ARP110102142A patent/AR083153A1/en unknown
-
2012
- 2012-11-07 ZA ZA2012/08372A patent/ZA201208372B/en unknown
- 2012-11-19 ZA ZA2012/08676A patent/ZA201208676B/en unknown
- 2012-11-19 ZA ZA2012/08677A patent/ZA201208677B/en unknown
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2018175481A1 (en) * | 2017-03-20 | 2018-09-27 | Lanzatech, Inc. | A process and system for product recovery and cell recycle |
| EA037782B1 (en) * | 2017-03-20 | 2021-05-20 | Ланцатек, Инк. | Process and system for product recovery and cell recycle |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| AU2016203445B2 (en) | Integration of a polynucleotide encoding a polypeptide that catalyzes pyruvate to acetolactate conversion | |
| KR20130032897A (en) | Production of alcohol esters and in situ product removal during alcohol fermentation | |
| CN101939434B (en) | Dgat genes from yarrowia lipolytica for increased seed storage lipid production and altered fatty acid profiles in soybean | |
| KR20140099224A (en) | Keto-isovalerate decarboxylase enzymes and methods of use thereof | |
| KR102700050B1 (en) | Production of human milk oligosaccharides in microbial hosts with engineered introgression/extrogression | |
| CN101365788B (en) | Delta-9 elongases and their use in making polyunsaturated fatty acids | |
| KR20130087013A (en) | Extraction solvents derived from oil for alcohol removal in extractive fermentation | |
| KR20140092759A (en) | Host cells and methods for production of isobutanol | |
| KR102274445B1 (en) | Methods for genomic integration | |
| DK2663645T3 (en) | Yeast strains modified for the production of ETHANOL FROM GLYCEROL | |
| AU2023270322A1 (en) | Compositions and methods for modifying genomes | |
| DK2087105T3 (en) | DELTA 17 DESATURASE AND ITS USE IN THE MANUFACTURE OF MULTI-Saturated FAT ACIDS | |
| KR20210149060A (en) | RNA-induced DNA integration using TN7-like transposons | |
| KR20140113997A (en) | Genetic switches for butanol production | |
| KR20120099509A (en) | Expression of hexose kinase in recombinant host cells | |
| DK2324120T3 (en) | Manipulating SNF1 protein kinase OF REVISION OF OIL CONTENT IN OLEAGINOUS ORGANISMS | |
| DK2443248T3 (en) | IMPROVEMENT OF LONG-CHAIN POLYUM Saturated OMEGA-3 AND OMEGA-6 FATTY ACID BIOS SYNTHESIS BY EXPRESSION OF ACYL-CoA LYSOPHOSPHOLIPID ACYL TRANSFERASES | |
| KR20070085665A (en) | Docosahexaenoic acid producing strains of yarrowia lipolytica | |
| DK2576605T3 (en) | PREPARATION OF METABOLITES | |
| KR20100118973A (en) | Compositions and methods for producing isoprene | |
| IL236992A (en) | Genetically modified cyanobacteria producing ethanol | |
| CN108779480A (en) | The method for producing sphingosine and sphingolipid | |
| KR20110038087A (en) | Polymers of isoprene from renewable resources | |
| BRPI0806354A2 (en) | transgender oilseeds, seeds, oils, food or food analogues, medicinal food products or medicinal food analogues, pharmaceuticals, beverage formulas for babies, nutritional supplements, pet food, aquaculture feed, animal feed, whole seed products , mixed oil products, partially processed products, by-products and by-products | |
| KR20140146616A (en) | Acetate supplemention of medium for butanologens |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |