KR20120068889A - 뮤신 분비를 억제하기 위한 구아이페네신의 용도 - Google Patents
뮤신 분비를 억제하기 위한 구아이페네신의 용도 Download PDFInfo
- Publication number
- KR20120068889A KR20120068889A KR1020127007996A KR20127007996A KR20120068889A KR 20120068889 A KR20120068889 A KR 20120068889A KR 1020127007996 A KR1020127007996 A KR 1020127007996A KR 20127007996 A KR20127007996 A KR 20127007996A KR 20120068889 A KR20120068889 A KR 20120068889A
- Authority
- KR
- South Korea
- Prior art keywords
- composition
- administering
- effective amount
- guapefensin
- guipenesin
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/075—Ethers or acetals
- A61K31/085—Ethers or acetals having an ether linkage to aromatic ring nuclear carbon
- A61K31/09—Ethers or acetals having an ether linkage to aromatic ring nuclear carbon having two or more such linkages
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/04—Drugs for disorders of the respiratory system for throat disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/10—Expectorants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/12—Mucolytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
Landscapes
- Health & Medical Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Chemical & Material Sciences (AREA)
- Veterinary Medicine (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Pulmonology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Epidemiology (AREA)
- Pain & Pain Management (AREA)
- Rheumatology (AREA)
- Otolaryngology (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicinal Preparation (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
구아이페네신을 포함하는 조성물의 유효량을 투여하는 것을 포함하는 개인에서의 점액 분비를 억제하는 방법에 관한 것이다.
Description
본 발명은 개인에서 점액 분비를 억제하기 위한 약제학적 화합물의 용도에 관한 것이다. 특히, 본 발명은 점액 분비를 억제하기 위한 구아이페네신의 용도에 관한 것이다.
화학 명이 3-(2-메톡시페녹시)-1,2-프로판디올인 구아이페네신은 거담제이다. 거담제는 폐, 기관지(bronchi) 및 기관(trachea)으로부터 점액 및 다른 물질의 토하는 것을 도와주는 약물이다. 구아이페네신(guaifenesin)은 점액을 얇게 하고, 가래 및 기관지 분비물을 완화시키며 또한 자극된 기도(reapiratory tract)를 윤활시켜 작용하는 것으로 생각되어진다. 점액을 얇게 하여, 구아이페네신은 점액 분비물의 점성을 감소시키고, 결과로서, 기관 및 기관지로부터의 분비물을 제거하는데에 기침 반사 및 섬모 운동의 효율을 증가시킨다. 개인이 느끼는 효과는 건성 기침(nonproductive cough))이 보다 습성이되고(productive) 빈도가 적게 된다.
선행 기술에, 뮤신 억제 방법들이 개시되어 있다. 그러나, 이들 방법은 천식과 같은 만성 증상의 치료에 관한 것이다. WO 2004/043392에는 뮤신 합성의 조절 방법, 및 만성 기관지염, 및, 염증성 폐 질환, 천식, 낭포성섬유증 및 급성 또는 만성 호흡기 감염 질병을 포함하는 만성 폐쇄성 폐 질환(COPD)과 같은 질병과 관련된 뮤신 과생성을 적어도 두개의 방향족 고리를 갖는 정의된 식의 화합물을 사용하여 조절하는 화합물의 치료적 적용을 개시하고 있다.
본 출원인은 구아이페네신(guaifenesin)을 포함하는 조성물의 유효량을 투여하는 것을 포함하는, 개인에서 점액의 분비를 억제하는 방법을 개발하였다.
본 발명의 제 1 면에 따르면, 구아이페네신을 포함하는 조성물의 유효량을 투여하는 것을 포함하는, 개인에서 점액 분비를 억제하는 방법이 제공된다. 상기 조성물은 대략 600mg 내지 1200mg의 구아이페네신을 함유할 수 있다.
구아이페네신은 많은 적절한 형태, 예를 들어 정제, 분말, 캡슐, 액체 또는 리퀴젤(liquigel)로 투여될 수 있다. 구아이페네신은 경구적으로 투여될 수 있다.
뮤신은 개인의 상부 기도에서 생성될 수 있다.
조성물은 제한되는 것은 아니지만 진해제(antitussive), 예를 들어, 덱스트로메토르판 하이드로브로마이드, 충혈 완화제(decogestant), 예를 들어, 페닐에프린 하이드로클로라이드, 슈도에페드린 하이드로클로라이드 또는 에페드린, 항히스타민제(antihistamine), 예를 들어, 클로르페니라민 말리에이트, 브롬페니라민 말리에이트, 페닌다민 타르트레이트, 피릴아민 말리에이트, 독실아민 숙시네이트, 페닐톨록사민 시트레이트, 디페닐히드라민 하이드로클로라이드, 프로메타진, 및 클레마스틴 퓨메레이트, 펙소페나딘 또는 이들의 조합물을 포함하는 그룹으로부터 선택된 하나 이상의 추가의 활성제를 함유할 수 있다.
조성물은 점액 분비의 억제가 대략 12 시간 동안 치료적으로 달성되도록 속방(immediate release) 부분 및 서방(sustained release) 부분을 가질 수 있다.
구아이페네신의 1일 투여량은 2400mg일 수 있다.
본 발명의 제 2 면에 따르면, 본 발명의 제 1 면에서 기술된 바와 같이 구아이페네신을 포함하는 조성물의 유효량으로 증가된 뮤신 분비로 특징 지워지는 질병 또는 증상을 갖는 개인을 치료하는 방법이 제공된다.
감염성의 증가된 뮤신 분비에 의해 특징 지워지는 질병 또는 증상은 기도(airways)의 염증성 증상으로부터 선택될 수 있다.
본 발명의 예시적 실시형태들이 첨부된 도면을 참조로 하여 보다 상세히 기술될 것이다.
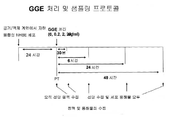
도 1은 치료 프로토콜을 예시한다.
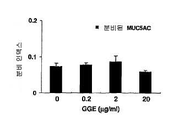
도 2는 MUC5AC 뮤신 분비에 대한 구아이페네신의 효과를 보여주는 그래프이다: 30분.
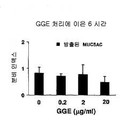
도 3a 및 도 3b는 MUC5AC 뮤신 분비에 대한 구아이페네신의 효과를 보여주는 그래프이다: 6 시간.
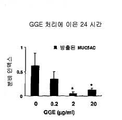
도 4a 및 4b는 MUC5AC 뮤신 분비에 대한 구아이페네신의 효과를 보여주는 그래프이다: 24시간.
도 5a 및 5b는 MUC5AC 뮤신 분비에 대한 구아이페네신의 효과를 보여주는 그래프이다: 48시간.
도 6은 점액섬모성소(mucociliary clearance)에 대한 구아이페네신의 효과를 보여주는 그래프이다.
도 7a 및 7b는 대사 활성을 보여주는 그래프이다.
도 8a, 8b 및 8c는 점액 유동학을 보여주는 그래프이다.
도 9a 및 9b는 시간과 투여량에 대한 점성과 탄성의 벡터 합계를 보여주는 그래프이다.
도 2는 MUC5AC 뮤신 분비에 대한 구아이페네신의 효과를 보여주는 그래프이다: 30분.
도 3a 및 도 3b는 MUC5AC 뮤신 분비에 대한 구아이페네신의 효과를 보여주는 그래프이다: 6 시간.
도 4a 및 4b는 MUC5AC 뮤신 분비에 대한 구아이페네신의 효과를 보여주는 그래프이다: 24시간.
도 5a 및 5b는 MUC5AC 뮤신 분비에 대한 구아이페네신의 효과를 보여주는 그래프이다: 48시간.
도 6은 점액섬모성소(mucociliary clearance)에 대한 구아이페네신의 효과를 보여주는 그래프이다.
도 7a 및 7b는 대사 활성을 보여주는 그래프이다.
도 8a, 8b 및 8c는 점액 유동학을 보여주는 그래프이다.
도 9a 및 9b는 시간과 투여량에 대한 점성과 탄성의 벡터 합계를 보여주는 그래프이다.
재료 및 방법
세포:
밀리포어 트랜스웰들(Milipore Transwells), 1 또는 4.2 cm2 표면적에서 성장한 에피에어웨이(EpiAirway) 배양물(정상 인간 기관지 상피) 세포. 세포들을 MatTek으로부터 구입하고, 사용하기 전 2주(점액 합성 및 분비) 또는 3주(점막섬모 운반 및 점액 유동학) 동안 공기-액체 계면에서 배양하였다.
구아이페네신
(
GGE
) 처리:
점액섬모성소(mucociliary clearance) 경우, 배양 배지 중의 2 mg/mL의 저장 구아이페네신 용액을 각 실험의 아침에 준비하고, 가온된 배지로 표적 농도 0.2, 2, 20 또는 200 ㎍/mL까지 희석될 때까지 냉각 상태로 유지한다. 각 배양물의 측저(basolateral) 구획에 있는 배지를 GGE-함유 배지로 대체하고, 배양물을 지시된 시간대들로 37℃, 5% CO2 인큐베이터로 되돌렸다. 실험은 독립적인 배양물에 3회 반복되었다.
시험관 실험에서 사용된 농도는 0.2 ㎍/mL 내지 20 mg/mL 범위이었고, 따라서 인간에서 사용된 임상적 투여량은 괄호로 묶었다.
뮤신
분비의 측정:
구아이페네신 용액은 세포를 처리하기 바로 전에 PBS(포스페이트 완충된 염수)에 용해시켜 제조되었다. MUC5AC 뮤신은 45M1 항체(Lavision, Fremont, CA)를 사용하는 ELISA에 의해 정량화했다. 공기/액체 계면에서 자란 융합성(confluent) 1 cm2 NHBE 세포를 200 ㎕ PBS로 선단 면(apical surface)으로부터 세척하고, 기저 챔버(basal chamber)에 첨가된 새로운 완전한 성장 배지와 함께 24 시간 배양했다. 배양물을 24 시간 동안 배양하고 배양물의 선단 면(apical surface)에 100 ㎕ PBS를 첨가하여 선단 유체(apical fluid)(예비 처리 샘플 또는 PT)를 수집했다. PBS를 첨가하여 표면상의 고 점성의 얇은 점액 층을 희석시켰다. 인서트(insert)의 작은 크기 때문에, PBS의 첨가 없이 약리학 및 유동학을 위한 점액의 충분한 양을 수집하는 것이 실행하기 어려웠다. 희석된 점액 샘플의(PT)의 100㎕를 수집한 후, 배양물을 세 그룹(6시간, 24 시간 및 48 시간)으로 나누고, 그룹당 16개 인서트(inserts)로 나누며, 각 투여량당 4 개 인서트로 해서 각 시간 그룹당 다양한 농도의 구아이페네신(0, 0.2, 2, 20 ㎍/mL)로 처리하였다. 따라서, 총 48 개의 인서트가 이 연구를 위해 사용되었다(4 개 인서트/투여량 x 4 개 투여량/시점(time point) x 3 시점). 구아이페네신이 뮤신의 "분비"에 영향을 끼치는지를 알아보기 위하여 선단 유체를 약물 처리에 이어 30분에서 모든 배양물로부터 수집하였다. 선단 점액 샘플을 두 단계-먼저 선단 면에 100 ㎕ PBS를 첨가하고(제 1 세척), 이어서 5 mM 디티오트레이톨(DTT)을 함유하는 100 ㎕ PBS를 첨가하여(제 2 세척) 수집하였다. 각 세척으로부터의 샘플을 MUC5AC 함량에 대해 분석하고, 두 값(제 1 및 제 2 세척)을 합하여 배양물의 "방출된 MUC5AC"로 표현했다. 세 개의 다른 시점(즉, 6, 24, 및 48시간)에서, 배양물을 세척하여 상기 기술된 바와 같은 선단 유체(방출된 뮤신")를 수집하고, 용해 버퍼(PBS, pH 7.2, 1 mM Triton X-100, 2 mM EDTA, 1 mM PSMF 및 5 mM DTT)("세포의 뮤신")를 사용하여 용해시켰다. 각 샘플 중의 뮤신(분비되거나, 방출되거나 또는 세포 용해물)의 양을 배양물 중의 편차를 보상하는 "분비 인덱스(secretory index)"를 얻기 위하여 같은 웰로부터 수집된 PT 샘플 중의 뮤신의 양으로 나누었다. 처리 프로토콜이 도 1에 도시되어 있다.
점액섬모성소(Mucociliary Clearance)의
측정:
배양물(4.2 cm2)을 측저(basolateral) 구아이페네신에 1 내지 6 시간 동안 노출시켰다. 배양물을 인큐베이터로부터 제거하고, 디지털 영상화 현미경 시스템의 스테이지(stage)에 위치시켰다. 비디오 데이터를 25x 대물 렌즈를 사용하여 10초 동안 수집하였다. 내생적 세포 조각의 이동 속도를, 조건당 30 내지 45개 사이의 총 측정 경우, 비디오 영상 상의 투명한 템플릿 오버레이(transparent template overlay) 및 각 배양물에서의 적어도 5개 입자를 측정하는 스톱워치를 사용하여 비디오 영상에서 분석하였다.
점액의 수집:
상기 성소(clearance)의 분석에 이어, 점액을 희석 없이 배양물의 선단 면으로부터 수확하였다.
생존성
:
이어서 배양물의 선단 면을 PBS로 세척하고, 생존성의 인디케이터인 대사 활성을 수용성 테트라졸리움(WST) 분석(Boehringer)을 사용하여 측정하였다.
유동학
(
Rheologic
) 측정:
선단 점액 분비물(20 ㎕)의 유동학적 성질을 평행한 플레이트 기하학을 이용하여 AR1000 조절된 스트레스 유동계(TA Instruments, New Castle, DE)를 사용함으로써 측정하였다. 동역학 선형 점탄성 행동(dynamic linear viscoelastic behavior)이 진동(oscillating) 스트레스에 대한 스트레인(strain) 반응으로 결정하고, 점성, '=G"/가 되도록 주파수 의 함수로서 저장 또는 탄성 모듈러스(G'), 손실 또는 점성(G") 모듈러스로 보고되었다. 유동적 데이터가 또한 점성 대 탄성의 비인 탄젠트 δ 및 점성과 탄성의 벡터 합계(기계적 임피던스)인 G*로서 벡터 표기법(vectorial notation)을 사용하여 제공될 수 있다. 선형 범위에서 스트레스가 물질을 평가하는데 사용될 때, 물성은 스트레스에 독립적이다.
0.1 내지 1000 rad/s의 주파수 스윕(sweep)을 수행하기 위하여, 본 발명자들은 0.5 Pa에서 2분 동안 크립(creep) 테스트를 사용하여 점탄성을 평가하였다. 스트레인 반응을 별개의 이완 스펙트럼에 맞추고, 지연 스펙트럼으로 변형시키며, 이어서 PI에 의해 개발된 방법을 사용하여, 주파수의 함수로서, 저장 및 손실 모둘러스로 변형시켰다. 본 발명자들은 1 및 100 rad/s에서 선형 점탄성을 평가하고, 비-선형 범위에서 거동을 평가하기 위하여 진동 스트레스 스윕 및 안정된(steady) 전단 유동 실험을 사용하였다. 진동 스윕 데이터를 G'와 G"가 가교된 스트레스를 관찰하여 분석하였다. 이 점은 물질이 리코일(recoil) 거동보다는 점성 거동(비가역성 변형 및 유동)을 보다 많이 나타내는 경우를 나타낸다.
모든 유동성 측정은 처리 그룹 기원에 블라인드된(blinded) 기술자들에 의해 실행되었다.
통계학:
뮤신 분비 경우, 대조군과 구아이페네신 처리 그룹 사이의 차이는 비쌍 샘플에 대한 스튜던츠 t-테스트를 사용하여 평균값을 비교하여 평가하고, p<0.05가 유의적으로 여겨진다. 도면에서의 모든 값은 달리 언급되지 않으면 4개 배양물의 평균±SEM을 나타낸다. *p,0.05, ** p<0.01.
점액섬모성소(mucociliary clearance) 경우, 대조군과 구아이페네신 처리 그룹 사이의 차이를 처리후 같은 시간에 시험된 대조군으로부터의 차이를 평가하는 본페로니(Bonferroni) 포스트-테스트와 함께 ANOVA를 사용하여 평균을 비교하여 평가하였다. <0.05의 p 값은 통계학적으로 유의적인 것으로 간주되었다.
유동학 실험 경우, 데이터는 StatViewTM 5 통계학 패키지를 사용하여 분석하였다. 가공되지 않은 데이터는 평균 주위에 정상적으로 분포되는 것으로 시각적으로 확인되었다. ANOVA는 상이한 농도의 구아이페네신으로 가래를 처리한 결과들을 비교하기 위하여 사용되었다. 피셔의(Fisher's)의 보호된 가장 적은 유의적인 차이 테스트를 다중 비교로 유의성을 결정하기 위하여 실시하였다. 데이터는 달리 나타내지 않는다면 그룹 평균± 1 표준 오차로서 나타내진다. 통상적으로, p<0.05는 통계학적으로 유의적으로 여겨진다.
결과
도 2에서, 에피에어웨이 배양물을 구아이페네신의 나타내진 농도로 30분 동안 처리하였다. 분비된 MUC5AC를 예비-처리 값들과 비교하였다.
30분 처리 동안, 대조군과 구아이페네신 처리 그룹 사이에는 유의적인 차이(p<0.05)가 없었다.
도 3a에서, 백색 박스는 세포와 결합된 뮤신의 양을 나타내고, 반면에, 흑색 박스는 소정의 처리기간 동안 방출된 뮤신의 양을 나타낸다. 그러므로, 백색 박스와 흑색 박스의 첨가는 소정의 기간 동안 생성된 뮤신의 총 양을 나타낸다. MUC5AC의 총 양들을 대조군(구아이페네신 없음)과 구아이페네신 그룹 사이의 통계학적 차이를 위하여 비교하였다.
NHBE 세포를 구아이페네신으로 6 시간 처리하는 것은 방출된 뮤신의 양들에 영향을 주지 않았다(도 3b). 그러나, 6 시간 처리 동안 생성된 뮤신의 총 양은 구아이페네신의 존재(2 ㎍/ml 및 20 ㎍/ml 모두)에 의해 유의적으로 억제되었다(p<0.01).
구아이페네신의 2 ㎍/ml 또는 20 ㎍/ml로 24 시간 처리는 뮤신 방출(도 4b) 및 뮤신 생성(도 4a)을 유의적으로 억제하였다.
구아이페네신(2 ㎍/ml 및 20 ㎍/ml)으로 48 시간 동안 처리는 뮤신의 생성(도 5a)을 유의적으로(p<0.01) 억제하였다. 그러나, 이 기간 동안 방출된 뮤신의 양은 유의적으로 영향받는 것으로 보이지 않았다.
점액점모성소에
대한
구아이페네신의
효과:
도 6에 나타난 바와 같이, 구아이페네신은 1시간 동안 처리된 배양물의 표면상의 세포 조각의 이동성을 증가시키는 것으로 나타났다. 그러나, 투여량-반응의 증거는 거의 없었고, 사실, 2 ㎍/ml의 효과만이 통계학적으로 유의하였다. 그러나, 6 시간 시점에서, 투여량 반응에 대한 강한 추세가 있었고, 시험된 모든 세 개의 농도 경우, 표면 물질의 이동이 도 6에 예시된 바와 같이 대조군 보다 유의적으로 빨랐다.
에피에어웨이(EpiAirway) 배양물을 구아이페네신의 나타내진 농도로 1 또는 6 시간 동안 처리하였다. 점액점모성소를 표면상의 내생적 조각의 이동 속도로 평가하였다. ***는 동시에 대조군 배양물과 유의적으로 차이가 난다는 것을 나타낸다(p<0.005).
생존성
(
viability
):
WST 분석에 의해 나타내진 바와 같이, 세포의 생존성에는 어떤 역 효과도 없었다. 사실, 구아이페네신으로 처리된 세포에서는 증가되는 대사 활성으로의 추세가 있는 것으로 보였다. 그러나, 이는 통계학적 유의성에 도달하지 않았다. 세 개의 반복된 실험 중 하나의 데이터가 하기에 나타난다.
도 7a 및 7b에 나타난 바와 같이, 에피에어웨이 배양물을 구아이페네신의 나타내진 농도로 1 또는 6 시간 동안 처리하였다. 대사 활성을 배양물의 선단 또는 기저 표면에 별개로 첨가된 WST 분석을 사용하여 평가하였다.
유동학
:
5개 세트의 실험으로부터의 총 96 개의 시료를 분석하였다. 처음 4 개의 실험으로부터의 점액은 주변 온도에서 얻었고, 이들 샘플의 유동학 분석은 극단의 이질성을 보였고, 얻어진 유동 스윕 곡선은 분해와 일치하였다. 도 7 및 8에 나타난 결과는 그러므로 배치(batch) 5로 부터 얻어진 22개 시료로부터 유래된다. 모든 시료는 비-뉴톤, 점탄성 겔이었다.
결과들은 1 rad/s 또는 대략 섬모 주파수에서 측정된 때 1 시간(p<0.05) 및 특히 6 시간(p<0.01)에서 시료의 점성, 탄성 및 복합 모듈러스(G*)에서 유의적인 구아이페네신 투여량-의존성 감소를 나타내나, 기침에 상응하는 100 rad/s에서는 유의적이지 않았다.
점액 유동학. 도 8a: G" 점도, 도 8b: G' 탄성, 도 8c: G* 기계적 임피던스(점성과 탄성의 벡터 합). 나타난 데이터는 조합된 1 및 6 시간 시점에서의 데이터의 평균 및 표준 오차이다.
G*: 시간 및 투여량에 의해 분리된 1 rad/s(도 9a) 및 100 rad/sec(도 9b)에서의 점성과 탄성의 벡터 합.
세 개 처리 시간 모두에서(6, 24 및 48 시간), 2 ㎍/ml 및 20 ㎍/ml 모두에서 구아이페네신은 공기/액체 계면에서 자란 NHBE 세포에 의한 뮤신 생성을 억제하였다. 마찬가지로, 24 시간 동안 구아이페네신의 2 ㎍/ml 및 20 ㎍/ml 모두로의 처리는 뮤신 방출에서 유의적인(p<0.05) 감소를 보였다.
점막섬모성소에 대한 구아이페네신의 효과를 구체적으로 알아보기(address) 위하여 점막섬모 운반 속도를 측정하였다. 이들 실험의 목적은 차별화된(differentiated) 1차 인간 기관(trancheo)-기관지 상피 세포의 구아이페네신에의 노출에 의해 유도된 점막섬모성소에서의 잠재적인 변경을 조사하기 위해서이다. 원래의 플랜은 네불라이저를 사용하여 배양물의 표면에 에어로졸 형태의 1 ㎛ 직경의 형광 마이크로스피어를 증착시키는 것이었다. 그러나, 불분명한 이유로, 마이크로스피어가 배양물 상에서 확인될 수 있지만, 내생적 세포 조작의 분명한 이동에도 불구하고, 매우 소수의 배양물에서만 이동이 있었다. 내생적 조각의 비데오를 수집하는 스위치가 만들어졌다.
점도(손실 모듈러스)는 유동 프로브 또는 적용된 스트레스로부터의 에너지 손실, 따라서 유동에 대한 저항을 의미한다. 탄성(저장 모듈러스)는 프로브로 재전달된 리코일(recoil) 에너지이다. 복합 모듈러스, G*는 또한 기계적 임피던스로 알려져 있다. 저장과 손실 모듈러스의 벡터 합으로서, G* 측정은 변형에 대한 내성을 나타낸다. 점탄성은 비-뉴톤 유체(겔)의 물성이다. 동력학 점탄성은 적용된 스트레스(stress)에 대한 점액의 스트레인(strain) 반응을 측정한다. 점액은 저 스트레스(섬모 비트) 및 고 스트레스(기침) 조건을 모두 거치기 때문에, 본 발명인들은 동역학 스트레스에 반응하여 발달된 스트레인을 측정한다.
이들 결과는 점액 겔인 차별화된 세포들로부터 취해진 분비물과 일치한다. 실험 1 내지 4로부터의 시료의 분해는 분해를 제시하는 불 일치하는 결과(요청시 모두 이용가능한 가공하지 않은 결과)를 생성했지만, 실험의 최종 세트로부터의 것들은 잘 보전되어 그 결과가 확고하였다. 점도의 손실(손실 모듈러스)과 평행하는 복합체 모듈러스에서의 감소는 증가된 섬모 운반과 일치할 것이다. 이들 시료의 유동적 특성은 탄성이 일반적으로 점성보다 큰 점막하선(submucosal gland) 분비물보다 탄성에 거의 동일한 점성을 갖는 배상 세포 기원을 제시했다. 이들 결과는 에피에어웨이 배양물의 보고된 구조와 일치한다. 이들 결과를 구아이페네신에 노출된 인간 조직 체외배양 조직(explants)과 비교하는 것은 유익할 것이다.
구아이페네신은 임상적으로 관련 있는 농도에서 시험관내 투여량-의존 방법으로 공기-액체 계면에서 자란 융합성 인간 기관지 상피 세포로부터의 뮤신 생성을 억제하였다. 점액 생성의 감소는 증가된 점막섬모 운반 및 점액의 감소된 점탄성과 상관관계가 있었다.
추가의 변형 및 개선이 본 명세서에 기술된 발명의 범위로부터 벗어남이 없이 가능하다.
Claims (35)
- 구아이페네신을 포함하는 조성물의 유효량을 투여하는 것을 포함하는 개체에서의 점액 분비를 억제하는 방법.
- 제 1 항에 있어서, 상기 조성물이 약 600mg 내지 1200 mg의 구아이페네신을 포함하는 것을 특징으로 하는 방법.
- 제 2 항에 있어서, 상기 조성물이 약 600 mg의 구아이페네신을 포함하는 것을 특징으로 하는 방법.
- 제 2 항에 있어서, 상기 조성물이 약 1200 mg의 구아이페네신을 포함하는 것을 특징으로 하는 방법.
- 제 1 항에 있어서, 구아이페네신을 포함하는 조성물의 유효량을 투여하는 것은 정제인 조성물을 투여하는 것을 포함하는 것을 특징으로 하는 방법.
- 제 1 항에 있어서, 구아이페네신을 포함하는 조성물의 유효량을 투여하는 것은 분말인 조성물을 투여하는 것을 포함하는 것을 특징으로 하는 방법.
- 제 1 항에 있어서, 구아이페네신을 포함하는 조성물의 유효량을 투여하는 것은 캡슐인 조성물을 투여하는 것을 포함하는 것을 특징으로 하는 방법.
- 제 1 항에 있어서, 구아이페네신을 포함하는 조성물의 유효량을 투여하는 것은 액체인 조성물을 투여하는 것을 포함하는 것을 특징으로 하는 방법.
- 제 1 항에 있어서, 구아이페네신을 포함하는 조성물의 유효량을 투여하는 것은 리퀴겔(liquigel)인 조성물을 투여하는 것을 포함하는 것을 특징으로 하는 방법.
- 제 1 항에서, 상기 점액 분비가 개인의 상부 기도에서 이루어지는 방법.
- 제 1 항에 있어서, 상기 조성물이 하나 이상의 활성제를 추가로 포함하는 것을 특징으로 하는 방법.
- 제 11 항에 있어서, 상기 하나 이상의 활성제는 진해제, 충혈완화제 및 항히스타민제로 구성되는 그룹으로부터 선택되는 것을 특징으로 하는 방법.
- 제 12 항에 있어서, 상기 진해제는 덱스트로메토르판 하이드로브로마이드를 포함하는 것을 특징으로 하는 방법.
- 제 12 항에 있어서, 상기 충혈완화제는 페닐에프린 하이드로클로라이드, 슈도에페드린 하이드로클로라이드 및 에페드린으로 구성되는 그룹으로부터 선택되는 것을 특징으로 하는 방법.
- 제 12 항에 있어서, 상기 항히스타민제는 클로르페니라민 말리에이트, 브롬페니라민 말리에이트, 페닌다민 타르트레이트, 피릴아민 말리에이트, 독실아민 숙시네이트, 페닐톨록사민 시트레이트, 디페닐히드라민 하이드로클로라이드, 프로메타진, 클레마스틴 퓨메레이트, 및 펙소페나딘으로 구성되는 그룹으로부터 선택되는 것을 특징으로 하는 방법.
- 제 1 항에 있어서, 상기 조성물이 점액 분비의 억제가 약 12 시간 동안 치료적으로 달성되도록 속방 부분 및 서방 부분을 포함하는 것을 특징으로 하는 방법.
- 구아이페네신을 포함하는 조성물의 유효량으로, 증가된 뮤신 분비를 특징으로 하는 질병 또는 증상을 갖는 개인을 치료하는 방법.
- 제 17 항에 있어서, 상기 조성물이 약 600 mg 내지 1200 mg의 구아이페네신을 포함하는 것을 특징으로 하는 방법.
- 제 18 항에 있어서, 상기 조성물이 약 600 mg의 구아이페네신을 포함하는 것을 특징으로 하는 방법.
- 제 18 항에 있어서, 상기 조성물이 약 1200 mg의 구아이페네신을 포함하는 것을 특징으로 하는 방법.
- 제 17 항에 있어서, 구아이페네신을 포함하는 조성물의 유효량을 투여하는 것은 정제인 조성물을 투여하는 것을 포함하는 것을 특징으로 하는 방법.
- 제 17 항에 있어서, 구아이페네신을 포함하는 조성물의 유효량을 투여하는 것은 분말인 조성물을 투여하는 것을 포함하는 것을 특징으로 하는 방법.
- 제 17 항에 있어서, 구아이페네신을 포함하는 조성물의 유효량을 투여하는 것은 캡슐인 조성물을 투여하는 것을 포함하는 것을 특징으로 하는 방법.
- 제 17 항에 있어서, 구아이페네신을 포함하는 조성물의 유효량을 투여하는 것은 액체인 조성물을 투여하는 것을 포함하는 것을 특징으로 하는 방법.
- 제 17 항에 있어서, 구아이페네신을 포함하는 조성물의 유효량을 투여하는 것은 리퀴겔(liquigel)인 조성물을 투여하는 것을 포함하는 것을 특징으로 하는 방법.
- 제 17 항에 있어서, 상기 점액 분비가 개인의 상부 기도에서 이루어지는 방법.
- 제 17 항에 있어서, 상기 조성물이 하나 이상의 활성제를 추가로 포함하는 것을 특징으로 하는 방법.
- 제 27 항에 있어서, 상기 하나 이상의 활성제는 진해제, 충혈완화제 및 항히스타민제로 구성되는 그룹으로부터 선택되는 것을 특징으로 하는 방법.
- 제 28 항에 있어서, 상기 진해제는 덱스트로메토르판 하이드로브로마이드를 포함하는 것을 특징으로 하는 방법.
- 제 28 항에 있어서, 상기 충혈완화제는 페닐에프린 하이드로클로라이드, 슈도에페드린 하이드로클로라이드 및 에페드린으로 구성되는 그룹으로부터 선택되는 것을 특징으로 하는 방법.
- 제 28 항에 있어서, 상기 항히스타민제는 클로르페니라민 말리에이트, 브롬페니라민 말리에이트, 페닌다민 타르트레이트, 피릴아민 말리에이트, 독실아민 숙시네이트, 페닐톨록사민 시트레이트, 디페닐히드라민 하이드로클로라이드, 프로메타진, 클레마스틴 퓨메레이트, 및 펙소페나딘으로 구성되는 그룹으로부터 선택되는 것을 특징으로 하는 방법.
- 제 17 항에 있어서, 상기 조성물이 점액 분비의 억제가 약 12 시간 동안 치료적으로 달성되도록 속방 부분 및 서방 부분을 포함하는 것을 특징으로 하는 방법.
- 제 17 항에 있어서, 구아이페네신의 1일 투여량은 2400mg인 것을 특징으로 하는 방법.
- 제 17 항에 있어서, 증가된 뮤신 분비를 특징으로 하는 상기 질병 또는 증상이 기도의 감염성 및 염증성 증상으로부터 선택되는 것을 특징으로 하는 방법.
- 제 1 항에 있어서, 구아이페네신의 1일 투여량이 2400mg인 것을 특징으로 하는 방법.
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US12/558,517 US20110065744A1 (en) | 2009-09-12 | 2009-09-12 | Method Of Inhibiting Mucin Secretion |
| US12/558,517 | 2009-09-12 | ||
| GB1002039.4 | 2010-02-09 | ||
| GBGB1002039.4A GB201002039D0 (en) | 2010-02-09 | 2010-02-09 | Method of inhibiting mucin secretion |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20120068889A true KR20120068889A (ko) | 2012-06-27 |
Family
ID=42941393
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020127007996A KR20120068889A (ko) | 2009-09-12 | 2010-09-13 | 뮤신 분비를 억제하기 위한 구아이페네신의 용도 |
Country Status (12)
| Country | Link |
|---|---|
| EP (1) | EP2475360A1 (ko) |
| JP (1) | JP2013504554A (ko) |
| KR (1) | KR20120068889A (ko) |
| CN (1) | CN102596189A (ko) |
| AU (1) | AU2010294008B2 (ko) |
| BR (1) | BR112012005517A2 (ko) |
| CA (1) | CA2773611A1 (ko) |
| MX (1) | MX2012003042A (ko) |
| MY (1) | MY161187A (ko) |
| RU (1) | RU2012114323A (ko) |
| WO (1) | WO2011030163A1 (ko) |
| ZA (1) | ZA201201822B (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20190102465A (ko) * | 2018-02-26 | 2019-09-04 | 대한민국(환경부 국립생물자원관장) | 개구리 배아를 이용한 기도 뮤신 분비 억제제의 스크리닝 방법 |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN104619321A (zh) * | 2012-04-06 | 2015-05-13 | Uab研究基金会 | 用于增加cftr活性的方法 |
Family Cites Families (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ZA963590B (en) * | 1995-05-10 | 1996-11-19 | Adcock Ingram Ltd | Pharmaceutical composition |
| US6846799B1 (en) * | 1998-08-18 | 2005-01-25 | The Regents Of The University Of California | Preventing airway mucus production by administration of EGF-R antagonists |
| US7985420B2 (en) * | 2000-04-28 | 2011-07-26 | Reckitt Benckiser Inc. | Sustained release of guaifenesin combination drugs |
| JP2005519923A (ja) * | 2002-02-04 | 2005-07-07 | ファルマシア・コーポレーション | シクロオキシゲナーゼ−2選択的阻害剤ならびに風邪および咳止め薬の組み合わせを用いる風邪および咳の治療ならびにそれらの組成物 |
| KR20060056444A (ko) * | 2003-06-19 | 2006-05-24 | 제내라 코포레이션 | 뮤신 합성 억제제 |
| US20050095288A1 (en) * | 2003-11-03 | 2005-05-05 | Andrx Labs, Llc | Decongestant and expectorant tablets |
| US20050266032A1 (en) * | 2003-12-17 | 2005-12-01 | Sovereign Pharmaceuticals, Ltd. | Dosage form containing multiple drugs |
| US20080014261A1 (en) * | 2006-07-12 | 2008-01-17 | Giordano John A | Non-narcotic biphasic release compositions and methods for treatment of coughing, sneezing, rhinorrhea, and/or nasal obstruction |
| US20090202633A1 (en) * | 2008-01-03 | 2009-08-13 | Siva Ramakrishna Velaga | Extended release formulations of guaifenesin |
-
2010
- 2010-09-13 MX MX2012003042A patent/MX2012003042A/es unknown
- 2010-09-13 WO PCT/GB2010/051525 patent/WO2011030163A1/en active Application Filing
- 2010-09-13 MY MYPI2012001112A patent/MY161187A/en unknown
- 2010-09-13 CN CN2010800492171A patent/CN102596189A/zh active Pending
- 2010-09-13 KR KR1020127007996A patent/KR20120068889A/ko not_active Application Discontinuation
- 2010-09-13 AU AU2010294008A patent/AU2010294008B2/en active Active
- 2010-09-13 BR BR112012005517A patent/BR112012005517A2/pt not_active Application Discontinuation
- 2010-09-13 RU RU2012114323/15A patent/RU2012114323A/ru unknown
- 2010-09-13 CA CA2773611A patent/CA2773611A1/en not_active Abandoned
- 2010-09-13 EP EP10757117A patent/EP2475360A1/en not_active Ceased
- 2010-09-13 JP JP2012528455A patent/JP2013504554A/ja active Pending
-
2012
- 2012-03-13 ZA ZA2012/01822A patent/ZA201201822B/en unknown
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20190102465A (ko) * | 2018-02-26 | 2019-09-04 | 대한민국(환경부 국립생물자원관장) | 개구리 배아를 이용한 기도 뮤신 분비 억제제의 스크리닝 방법 |
Also Published As
| Publication number | Publication date |
|---|---|
| MY161187A (en) | 2017-04-14 |
| BR112012005517A2 (pt) | 2016-04-19 |
| ZA201201822B (en) | 2013-05-29 |
| CA2773611A1 (en) | 2011-03-17 |
| RU2012114323A (ru) | 2013-10-20 |
| MX2012003042A (es) | 2012-05-29 |
| EP2475360A1 (en) | 2012-07-18 |
| JP2013504554A (ja) | 2013-02-07 |
| CN102596189A (zh) | 2012-07-18 |
| WO2011030163A1 (en) | 2011-03-17 |
| AU2010294008B2 (en) | 2014-08-14 |
| AU2010294008A1 (en) | 2012-04-05 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Zanasi et al. | A reappraisal of the mucoactive activity and clinical efficacy of bromhexine | |
| Ehre et al. | An improved inhaled mucolytic to treat airway muco-obstructive diseases | |
| Rogers | Mucociliary dysfunction in COPD: effect of current pharmacotherapeutic options | |
| Seagrave et al. | Effects of guaifenesin, N-acetylcysteine, and ambroxol on MUC5AC and mucociliary transport in primary differentiated human tracheal-bronchial cells | |
| Caldwell et al. | Mitochondrial abnormalities in non-alcoholic steatohepatitis | |
| Tam et al. | Estradiol increases mucus synthesis in bronchial epithelial cells | |
| Sommerhoff et al. | Mast cell chymase. A potent secretagogue for airway gland serous cells. | |
| Gizycki et al. | Effects of fluticasone propionate on inflammatory cells in COPD: an ultrastructural examination of endobronchial biopsy tissue | |
| Dalcin et al. | Cystic fibrosis in adults: diagnostic and therapeutic aspects | |
| Wen et al. | Denatonium inhibits growth and induces apoptosis of airway epithelial cells through mitochondrial signaling pathways | |
| Dekker et al. | Stress‐induced responses of human skin fibroblasts in vitro reflect human longevity | |
| Hu et al. | Dental pulp stem cell-derived exosomes revitalize salivary gland epithelial cell function in NOD mice via the GPER-mediated cAMP/PKA/CREB signaling pathway | |
| Martin et al. | Palate lung nasal clone (PLUNC), a novel protein of the tear film: three-dimensional structure, immune activation, and involvement in dry eye disease (DED) | |
| Zhang et al. | 18β-Glycyrrhetinic acid monoglucuronide (GAMG) alleviates single-walled carbon nanotubes (SWCNT)-induced lung inflammation and fibrosis in mice through PI3K/AKT/NF-κB signaling pathway | |
| Gao et al. | Interaction of N‐acetyl‐seryl‐aspartyl‐lysyl‐proline with the angiotensin‐converting enzyme 2–angiotensin‐(1–7)–Mas axis attenuates pulmonary fibrosis in silicotic rats | |
| Su et al. | Mitochondrial transplantation attenuates airway hyperresponsiveness by inhibition of cholinergic hyperactivity | |
| KR20120068889A (ko) | 뮤신 분비를 억제하기 위한 구아이페네신의 용도 | |
| Peng et al. | Adverse impact of ambient PM2. 5 on expression and trafficking of surfactant protein A through reactive oxygen species damage to lamellar bodies | |
| Todor et al. | Hypoxia-induced cleavage of caspase-3 and DFF45/ICAD in human failed cardiomyocytes | |
| Hande et al. | Evaluation of oral microbial flora in saliva of patients of oral submucous fibrosis | |
| Boulet et al. | Effect of salmeterol on allergen‐induced airway inflammation in mild allergic asthma | |
| Miyata et al. | Current opinion of muco-active drug research: strategies and problems | |
| Barac et al. | Chronic rhinosinusitis: association of recalcitrant nasal polyposis and fungal finding in polyp’s single-cell suspension | |
| US20110065744A1 (en) | Method Of Inhibiting Mucin Secretion | |
| Wu et al. | Paeoniflorin confers ferroptosis resistance by regulating the gut microbiota and its metabolites in diabetic cardiomyopathy |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |