KR20120047995A - 감소된 점도를 갖는 농축 폴리펩티드 제제 - Google Patents
감소된 점도를 갖는 농축 폴리펩티드 제제 Download PDFInfo
- Publication number
- KR20120047995A KR20120047995A KR1020127005604A KR20127005604A KR20120047995A KR 20120047995 A KR20120047995 A KR 20120047995A KR 1020127005604 A KR1020127005604 A KR 1020127005604A KR 20127005604 A KR20127005604 A KR 20127005604A KR 20120047995 A KR20120047995 A KR 20120047995A
- Authority
- KR
- South Korea
- Prior art keywords
- formulation
- polypeptide
- antibody
- antibodies
- dmso
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/08—Solutions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/16—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing nitrogen, e.g. nitro-, nitroso-, azo-compounds, nitriles, cyanates
- A61K47/18—Amines; Amides; Ureas; Quaternary ammonium compounds; Amino acids; Oligopeptides having up to five amino acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/20—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing sulfur, e.g. dimethyl sulfoxide [DMSO], docusate, sodium lauryl sulfate or aminosulfonic acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M5/00—Devices for bringing media into the body in a subcutaneous, intra-vascular or intramuscular way; Accessories therefor, e.g. filling or cleaning devices, arm-rests
- A61M5/178—Syringes
- A61M5/20—Automatic syringes, e.g. with automatically actuated piston rod, with automatic needle injection, filling automatically
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
- C07K16/249—Interferons
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/16—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing nitrogen, e.g. nitro-, nitroso-, azo-compounds, nitriles, cyanates
- A61K47/18—Amines; Amides; Ureas; Quaternary ammonium compounds; Amino acids; Oligopeptides having up to five amino acids
- A61K47/183—Amino acids, e.g. glycine, EDTA or aspartame
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/10—Immunoglobulins specific features characterized by their source of isolation or production
- C07K2317/14—Specific host cells or culture conditions, e.g. components, pH or temperature
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/21—Immunoglobulins specific features characterized by taxonomic origin from primates, e.g. man
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Engineering & Computer Science (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Immunology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Chemistry (AREA)
- Mycology (AREA)
- Microbiology (AREA)
- Biochemistry (AREA)
- Molecular Biology (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Heart & Thoracic Surgery (AREA)
- Hematology (AREA)
- Vascular Medicine (AREA)
- Biomedical Technology (AREA)
- Anesthesiology (AREA)
- Endocrinology (AREA)
- Gastroenterology & Hepatology (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicinal Preparation (AREA)
- Peptides Or Proteins (AREA)
Abstract
본 발명은 감소된 점도를 갖는 폴리펩티드 제제 및 감소된 점도를 갖는 폴리펩티드 제제의 제조 및 사용 방법에 관한 것이다.
Description
[관련 출원에 대한 상호 참조]
본원은 그 전체 개시문이 본원에 참고로 포함되는 2009년 8월 4일 출원된 미국 특허 가출원 번호 61/231,140을 우선권 주장한다.
[발명의 분야]
본 발명은 감소된 점도를 갖는 폴리펩티드 제제 및 감소된 점도를 갖는 폴리펩티드 제제의 제조 및 사용 방법에 관한 것이다.
고농축 상태에서 폴리펩티드 및 용액 거동을 연구하는 것은 본원 발명자들의 생물학적 치료제의 안정성, 안전성 및 효능의 이해에 중요하다. 최근에, 생물학적 치료제의 안정성 및 안전성에 대한 폴리펩티드 농도 증가의 효과가 생명공학 산업 및 미국 식품 의약품국 (FDA)으로부터 상당한 관심을 받고 있다. 생물학적 치료제의 물리화학적 안정성은 폴리펩티드 농도 증가에 의해 단순하게 부정적인 영향을 받을 수 있다. 화학적 불안정성은 전형적으로 농도와 관련하여 퍼스트-오더(first-order) 동역학을 따르지만, 물리적 불안정성은 복잡한 보다 높은 차원의 과정을 초래할 수 있다. 폴리펩티드 농도, 예컨대 IgG 농도 증가는 이들 분자의 자가 결합을 증가시켜 비-이상적인 용액 특성을 증가시키고, 점도 및 레올로지 거동에 유의한 영향을 미치는 것으로 나타났다.
고농도 생물학적 치료제의 피하 투여는 약제학자에게 주목할 만한 도전을 제공한다. 고용량 처방의 경우, 요구되는 폴리펩티드 농도는 종종 100 ㎎/㎖을 초과하여 잠재적으로 비-이상적인 용액 특성, 안정성 감소 및/또는 제조가능성 및 전달 감소를 초래한다. 이러한 제제의 개발에 있어 주요 도전은 이들의 높은 점도이다.
[발명의 간단한 개요]
본원에서 (a) 약 50 ㎎/㎖ 초과의 양의 폴리펩티드 및 (b) 제제의 약 0.1% 내지 약 50% v/v의 양의 디메틸 술폭시드 (DMSO) 또는 디메틸아세트아미드 (DMA)를 포함하는 액체 제제가 제공되며, 여기서 제제는 DMSO 또는 DMA의 부재하의 동일한 제제와 비교하여 감소된 점도를 갖는다.
또한 본원에서 (a) 약 50 ㎎/㎖ 초과의 양의 폴리펩티드 및 (b) 제제의 약 0.1% 내지 약 50% v/v의 양의 디메틸 술폭시드 (DMSO) 또는 디메틸아세트아미드 (DMA)를 조합하는 것을 포함하는, 상기 폴리펩티드 및 DMSO 또는 DMA를 포함하는 액체 제제의 제조 방법이 제공되며, 여기서 제제는 DMSO 또는 DMA의 부재하의 동일한 제제와 비교하여 감소된 점도를 갖는다.
본원에서 (a) 약 50 ㎎/㎖ 초과의 양의 폴리펩티드 및 (b) 제제의 약 0.1% 내지 약 50% v/v의 양의 디메틸 술폭시드 (DMSO) 또는 디메틸아세트아미드 (DMA)를 포함하는 액체 제제를 함유하는 용기를 포함하는 제조품이 제공되며, 여기서 제제는 DMSO 또는 DMA의 부재하의 동일한 제제와 비교하여 감소된 점도를 갖는다.
또한, 본원에서 (a) 약 50 ㎎/㎖ 초과의 양의 폴리펩티드 및 (b) 제제의 약 0.1% 내지 약 50% v/v의 양의 디메틸 술폭시드 (DMSO) 또는 디메틸아세트아미드 (DMA)를 포함하는 액체 제제를 질환 또는 장애의 치료를 필요로 하는 대상체에게 투여하는 것을 포함하며, 여기서 제제는 DMSO 또는 DMA의 부재하의 동일한 제제와 비교하여 감소된 점도를 갖는 것인, 질환 또는 장애를 치료하기 위해 상기 제제를 사용하는 방법이 제공된다.
또한, 본원에서 (a) 약 50 ㎎/㎖ 초과의 양의 폴리펩티드 및 (b) 제제의 약 0.1% 내지 약 50% v/v의 양의 디메틸 술폭시드 (DMSO) 또는 디메틸아세트아미드 (DMA)를 포함하는 액체 제제를 투여하는 것을 포함하며, 여기서 제제는 DMSO 또는 DMA의 부재하의 동일한 제제와 비교하여 감소된 점도를 갖는 것인, 상기 제제를 이를 필요로 하는 대상체에게 전달하는 방법이 제공된다.
임의의 제제, 방법 및 제조품의 일부 실시양태에서, 폴리펩티드는 2차 구조, 3차 구조, 및/또는 4차 구조를 형성할 수 있다. 일부 실시양태에서, 2차 구조는 β-시트이다.
임의의 제제, 방법 및 제조품의 일부 실시양태에서, 폴리펩티드는 소수성이다.
임의의 제제, 방법 및 제조품의 일부 실시양태에서, 폴리펩티드는 약 100개 아미노산 이상이다.
임의의 제제, 방법 및 제조품의 일부 실시양태에서, 폴리펩티드는 약 5,000 달톤 초과의 분자량을 갖는다.
임의의 제제, 방법 및 제조품의 일부 실시양태에서, 폴리펩티드는 치료 폴리펩티드이다.
임의의 제제, 방법 및 제조품의 일부 실시양태에서, 폴리펩티드는 항체이다. 일부 실시양태에서, 항체는 모노클로날 항체이다. 일부 실시양태에서, 모노클로날 항체는 키메라 항체, 인간화 항체 또는 인간 항체이다. 일부 실시양태에서, 모노클로날 항체는 IgG 모노클로날 항체이다. 일부 실시양태에서, 항체는 항원 결합 단편이다. 일부 실시양태에서, 항원 결합 단편은 Fab 단편, Fab' 단편, F(ab')2 단편, scFv, Fv 및 디아바디로 이루어진 군으로부터 선택된다.
임의의 제제, 방법 및 제조품의 일부 실시양태에서, 폴리펩티드는 하나 이상의 이러한 파라미터를 포함한다.
임의의 제제, 방법 및 제조품의 일부 실시양태에서, DMSO 또는 DMA는 제제의 약 1% 내지 약 10% v/v의 양으로 존재한다. 일부 실시양태에서, DMSO 또는 DMA는 제제의 약 1% 내지 약 5% v/v의 양으로 존재한다.
임의의 제제, 방법 및 제조품의 일부 실시양태에서, 제제는 추가로 히스티딘을 포함한다. 일부 실시양태에서, 히스티딘은 약 10 mM 내지 약 100 mM의 양으로 존재한다.
임의의 제제, 방법 및 제조품의 일부 실시양태에서, 제제는 추가로 아르기닌-HCl을 포함한다. 일부 실시양태에서, 아르기닌-HCl은 약 50 mM 내지 약 200 mM의 양으로 존재한다.
임의의 제제, 방법 및 제조품의 일부 실시양태에서, 폴리펩티드는 약 100 ㎎/㎖ 이상의 양으로 존재한다. 일부 실시양태에서, 폴리펩티드는 약 100 ㎎/㎖ 내지 약 300 ㎎/㎖의 양으로 존재한다.
임의의 제제, 방법 및 제조품의 일부 실시양태에서, 점도는 DMSO 또는 DMA의 부재하의 동일한 제제와 비교하여 약 1 내지 약 1000 cP 감소된다. 일부 실시양태에서, 점도는 DMSO 또는 DMA의 부재하의 동일한 제제와 비교하여 약 5 내지 약 100 cP 감소된다.
임의의 제제, 방법 및 제조품의 일부 실시양태에서, 점도는 DMSO 또는 DMA의 부재하의 동일한 제제와 비교하여 약 1.2 내지 및 약 10배 감소된다. 일부 실시양태에서, 점도는 DMSO 또는 DMA의 부재하의 동일한 제제와 비교하여 약 1.2 내지 약 5배 감소된다.
임의의 제제, 방법 및 제조품의 일부 실시양태에서, 점도는 약 50 cP 이하이다. 일부 실시양태에서, 점도는 약 25 cP 이하이다.
임의의 제제, 방법 및 제조품의 일부 실시양태에서, pH는 약 5 내지 약 8이다. 일부 실시양태에서, pH는 약 5 내지 약 6.5이다.
임의의 제제, 방법 및 제조품의 일부 실시양태에서, DMSO 또는 DMA는 DMSO이다. 일부 실시양태에서, DMSO 또는 DMA는 DMA이다.
임의의 제제, 방법 및 제조품의 일부 실시양태에서, 제제는 주사에 의한 투여를 위해 제제화된다. 일부 실시양태에서, 제제는 피하 주사에 의한 투여를 위해 제제화된다.
임의의 제제, 방법 및 제조품의 일부 실시양태에서, 용기는 주사기이다. 일부 실시양태에서, 주사기는 추가로 주사 장치 내에 포함된다. 일부 실시양태에서, 주사 장치는 자동주사기이다.
도 1은 변화하는 양의 DMSO 또는 DMA의 존재하의 145 ㎎/㎖ 항-IFNα 용액의 점도는 보여준다. 완충제 종류 및 농도는 히스티딘 클로라이드 (25, 50, 및 75 mM), pH 5.4이다.
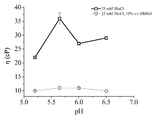
도 2는 pH의 함수로서 10% v/v DMSO의 존재 (적색 원형) 및 부재 (흑색 사각형)하의 140 ㎎/㎖ 항-IFNα, 25 mM 히스티딘 클로라이드 용액의 점도를 보여준다.
도 3은 변화하는 양의 아르기닌 클로라이드 및 공용매의 존재 및 부재하의 145 ㎎/㎖ 항-IFNα, 25 mM 히스티딘 클로라이드, pH 5.4의 점도를 보여준다.
도 2는 pH의 함수로서 10% v/v DMSO의 존재 (적색 원형) 및 부재 (흑색 사각형)하의 140 ㎎/㎖ 항-IFNα, 25 mM 히스티딘 클로라이드 용액의 점도를 보여준다.
도 3은 변화하는 양의 아르기닌 클로라이드 및 공용매의 존재 및 부재하의 145 ㎎/㎖ 항-IFNα, 25 mM 히스티딘 클로라이드, pH 5.4의 점도를 보여준다.
[발명의 상세한 설명]
I. 제제 및 제제의 제조 방법
본원에서 (a) 폴리펩티드 및 (b) 디메틸 술폭시드 (DMSO) 또는 디메틸아세트아미드 (DMA)를 포함하는 액체 제제가 제공되며, 여기서 제제는 DMSO 또는 DMA의 부재하의 (즉, 결여됨) 동일한 제제와 비교하여 감소된 점도를 갖는다. 또한, 본원에서 (a) 폴리펩티드 및 (b) 디메틸 술폭시드 (DMSO) 또는 디메틸아세트아미드 (DMA)를 조합하는 것을 포함하는, 상기 폴리펩티드 및 DMSO 또는 DMA를 포함하는 액체 제제의 제제를 제조하는 방법이 제공되며, 여기서 제제는 DMSO 또는 DMA의 부재하의 (즉, 결여됨) 동일한 제제와 비교하여 감소된 점도를 갖는다.
DMSO는 화학식 (CH3)2SO를 갖는 화학적 화합물이다. DMSO는 무색 액체이고, 극성 및 비극성 화합물 둘 모두를 용해시키는 중요한 극성 비양자성 용매이고, 물 뿐만 아니라 광범위한 유기 용매에서 혼화성이다. DMA는 화학식 CH3C(O)N(CH3)2를 갖는 유기 화합물이다. DMA는 무색, 수혼화성, 고융점 액체이고, 지방족 탄화수소에는 잘 용해되지 않으나 대부분의 다른 용매와 혼화성이다. 일부 실시양태에서, 폴리펩티드 제제에서 DMSO 또는 DMA는 제제의 약 0.1% 내지 2.5%, 0.1% 내지 5%, 0.1% 내지 7.5%, 0.1% 내지 10%, 1% 내지 2.5%, 1% 내지 5%, 1% 내지 7.5%, 1% 내지 10%, 1% 내지 15%, 1% 내지 20%, 1% 내지 25%, 1% 내지 30%, 1% 내지 40%, 또는 1% 내지 50% 중 어느 하나의 양으로 존재한다. 일부 실시양태에서, DMSO 또는 DMA를 포함하는 폴리펩티드 제제의 DMSO 또는 DMA는 약 1%, 1.5%, 2%, 2.5%, 3%, 3.5%, 4%, 4.5%, 5%, 6%, 7%, 8%, 9%, 또는 10% 중 어느 하나의 양으로 존재한다. 일부 실시양태에서, DMSO 또는 DMA는 DMSO이다. 일부 실시양태에서, DMSO 또는 DMA는 DMA이다. 일부 실시양태에서, DMSO 또는 DMA는 DMSO 및 DMA의 조합이다.
일부 실시양태에서, 점도는 전단 점도이다. 전단 점도는 적용된 응력이 전단 응력인 경우의 점도 계수이다 (비뉴톤 유체에 유효함). 전단 점도 = 전단 응력 / 전단 속도.
일부 실시양태에서, DMSO 또는 DMA를 포함하는 폴리펩티드 제제의 전단 점도는 DMSO 또는 DMA의 부재하의 (즉, 결여됨) 동일한 제제와 비교하여 약 1 cP 내지 1000 cP, 1 cP 내지 500 cP, 1 cP 내지 250 cP, 1 cP 내지 100 cP, 1 cP 내지 75 cP, 1 cP 내지 50 cP, 1 cP 내지 40 cP, 1 cP 내지 30 cP, 1 cP 내지 25 cP, 1 cP 내지 20 cP, 1 cP 내지 15 cP, 1 cP 내지 10 cP, 5 cP 내지 100 cP, 5 cP 내지 50 cP, 5 cP 내지 25 cP, 또는 5 cP 내지 15 cP 중 어느 하나만큼 감소된다. DMSO 또는 DMA를 포함하는 폴리펩티드 제제의 전단 점도는 일부 실시양태에서 DMSO 또는 DMA의 부재하의 (즉, 결여됨) 동일한 제제와 비교하여 약 1 cP, 5 cP, 10 cP, 15 cP, 20 cP, 25 cP, 50 cP, 100 cP, 250 cP, 500 cP, 또는 1000 cP 중 어느 하나를 초과하여 감소될 수 있다. DMSO 또는 DMA를 포함하는 폴리펩티드 제제의 전단 점도는 일부 실시양태에서 DMSO 또는 DMA의 부재하의 (즉, 결여됨) 동일한 제제와 비교하여 약 1 cP, 5 cP, 10 cP, 15 cP, 20 cP, 25 cP, 50 cP, 100 cP, 250 cP, 500 cP, 또는 1000 cP 중 어느 하나만큼 감소될 수 있다.
일부 실시양태에서, DMSO 또는 DMA를 포함하는 폴리펩티드 제제의 점도는 DMSO 또는 DMA의 부재하의 (즉, 결여됨) 동일한 제제와 비교하여 약 1.2배 내지 5배, 1.2배 내지 10배, 1.2배 내지 20배, 2배 내지 5배, 2배 내지 10배, 또는 2배 내지 20배 중 어느 하나만큼 감소된다. DMSO 또는 DMA를 포함하는 폴리펩티드 제제의 점도는 일부 실시양태에서 DMSO 또는 DMA의 부재하의 (즉, 결여됨) 동일한 제제와 비교하여 약 1.2배, 2배, 3배, 4배, 5배, 6배, 7배, 8배, 9배, 10배, 15배, 20배, 25배, 또는 50배 중 어느 하나를 초과하여 감소될 수 있다. 일부 실시양태에서, 점도는 전단 점도이다.
일부 실시양태에서, DMSO 또는 DMA를 포함하는 폴리펩티드 제제의 전단 점도는 약 100 cP 이하, 75 cP 이하, 50 cP 이하, 25 cP 이하, 20 cP 이하, 15 cP 이하, 또는 10 cP 이하 중 어느 하나이다. DMSO 또는 DMA를 포함하는 폴리펩티드 제제의 전단 점도는 일부 실시양태에서 약 5 cP 내지 30 cP, 10 cP 내지 30 cP, 10 cP 내지 25 cP, 또는 15 cP 내지 25 cP 중 어느 하나일 수 있다.
일부 실시양태에서, 제제에서 폴리펩티드는 약 50 ㎎/㎖, 75 ㎎/㎖, 100 ㎎/㎖, 110 ㎎/㎖, 120 ㎎/㎖, 130 ㎎/㎖, 140 ㎎/㎖, 150 ㎎/㎖, 160 ㎎/㎖, 170 ㎎/㎖, 180 ㎎/㎖, 190 ㎎/㎖, 200 ㎎/㎖, 250 ㎎/㎖, 또는 300 ㎎/㎖ 초과 중 어느 하나의 양으로 존재한다. 제제에서 폴리펩티드는 약 50 ㎎/㎖ 내지 300 ㎎/㎖, 50 ㎎/㎖ 내지 200 ㎎/㎖, 100 ㎎/㎖ 내지 300 ㎎/㎖, 100 ㎎/㎖ 내지 200 ㎎/㎖, 120 ㎎/㎖ 내지 300 ㎎/㎖, 140 ㎎/㎖ 내지 300 ㎎/㎖, 또는 160 ㎎/㎖ 내지 300 ㎎/㎖ 중 어느 하나의 양으로 존재할 수 있다. 일부 실시양태에서, 제제에서 폴리펩티드는 약 50 ㎎/㎖, 75 ㎎/㎖, 100 ㎎/㎖, 110 ㎎/㎖, 120 ㎎/㎖, 130 ㎎/㎖, 140 ㎎/㎖, 150 ㎎/㎖, 160 ㎎/㎖, 170 ㎎/㎖, 180 ㎎/㎖, 190 ㎎/㎖, 200 ㎎/㎖, 250 ㎎/㎖, 또는 300 ㎎/㎖ 중 어느 하나의 양으로 존재한다.
일부 실시양태에서 폴리펩티드 제제는 바람직한 정도의 순도를 갖는 폴리펩티드를 임의의 제약상 허용되는 담체, 부형제 또는 안정화제 (문헌 [Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)])와 혼합함으로써 동결건조된 제제 또는 수용액의 형태로 저장을 위해 제조될 수 있다.
본원에 사용된 "담체"는 사용되는 투여량 및 농도에서 그에 노출되는 세포 또는 포유동물에게 비독성인 제약상 허용되는 담체, 부형제 또는 안정화제를 포함한다. 종종, 생리학상 허용되는 담체는 수성 pH 완충 용액이다.
허용되는 담체, 부형제 또는 안정화제는 사용되는 투여량 및 농도에서 수용자에게 비독성이고, 완충제, 예컨대 포스페이트, 시트레이트, 및 다른 유기 산; 항산화제, 예를 들어 아스코르브산 및 메티오닌; 보존제 (예컨대, 옥타데실디메틸벤질 암모늄 클로라이드; 헥사메토늄 클로라이드; 벤즈알코늄 클로라이드, 벤즈에토늄 클로라이드; 페놀, 부틸 또는 벤질 알콜; 알킬 파라벤, 예컨대 메틸 또는 프로필 파라벤; 카테콜; 레조르시놀; 시클로헥산올; 3-펜탄올; 및 m-크레졸); 저분자량 (약 10개 미만의 잔기) 폴리펩티드; 단백질, 예컨대 혈청 알부민, 젤라틴 또는 이뮤노글로불린; 친수성 중합체, 예컨대 폴리비닐피롤리돈; 아미노산, 예컨대 글리신, 글루타민, 아스파라긴, 히스티딘, 아르기닌 또는 리신; 모노사카라이드, 디사카라이드 및 다른 탄수화물, 예를 들어 글루코스, 만노스 또는 덱스트린; 킬레이트화제, 예컨대 EDTA; 당, 예컨대 수크로스, 만니톨, 트레할로스 또는 소르비톨; 염-형성 반대이온, 예컨대 나트륨; 금속 착체 (예를 들어, Zn-단백질); 및/또는 비-이온성 계면활성제, 예컨대 트윈(TWEEN)TM, 플루로닉스(PLURONICS)TM 또는 폴리에틸렌 글리콜 (PEG)을 포함한다.
일부 실시양태에서, 폴리펩티드 제제는 추가로 히스티딘을 포함한다. 일부 실시양태에서, 히스티딘은 폴리펩티드 제제에 약 10 mM 내지 100 mM, 25 mM 내지 100 mM, 50 mM 내지 100 mM, 10 mM 내지 200 mM, 25 mM 내지 200 mM, 50 mM 내지 200 mM 또는 100 mM 내지 200 mM 중 어느 하나의 양으로 존재한다. 일부 실시양태에서, 폴리펩티드 제제는 추가로 아르기닌-HCl을 포함한다. 일부 실시양태에서, 아르기닌-HCl은 약 10 mM 내지 100 mM, 25 mM 내지 100 mM, 50 mM 내지 100 mM, 10 mM 내지 200 mM, 25 mM 내지 200 mM, 50 mM 내지 200 mM 또는 100 mM 내지 200 mM 중 어느 하나의 양으로 존재한다.
일부 실시양태에서, 폴리펩티드 제제의 pH는 약 5 내지 8, 5 내지 7, 5 내지 6.5, 5 내지 6 또는 5.5 내지 6 중 어느 하나이다.
일부 실시양태에서, 폴리펩티드 제제 내의 폴리펩티드는 기능적 활성을 유지한다.
생체내 투여에 사용될 제제는 멸균되어야 한다. 이는 멸균 여과 막을 통한 여과에 의해 쉽게 달성된다.
본원의 제제는 또한 치료할 특정 적응증에 필요한 경우에는 1종 초과의 활성 화합물, 바람직하게는 서로 유해한 영향을 미치지 않는 상보적 활성을 갖는 화합물을 함유할 수 있다. 예를 들어, 폴리펩티드 뿐만 아니라, 하나 제제, 추가의 폴리펩티드 (예를 들어, 항체)에서 포함하는 것은 바람직할지도 모른다. 대안적으로 또는 추가로, 상기 조성물은 화학요법제, 세포독성제, 시토카인, 성장 억제제, 항-호르몬제 및/또는 심장보호제를 추가로 포함할 수 있다. 이러한 분자는 의도된 목적에 유효한 양으로 조합되어 적합하게 존재한다.
본원에서 값 또는 파라미터에 대해 언급되는 "약"은 해당 값 또는 파라미터 자체에 대한 변화를 포함 (및 설명)한다. 예를 들어, "약 X"를 언급하는 기재는 "X"의 기재를 포함한다.
본원 및 첨부된 청구항에서 사용된 단수형은 문맥에 달리 정확하게 언급되지 않은 한 복수 언급을 포함한다. 본원에 기재된 본 발명의 측면 및 변형은 그러한 측면 및 변형으로 "이루어진" 및/또는 "본질적으로 이루어진" 것을 포함하는 것으로 이해된다.
II. 폴리펩티드
본원에서 본원에 기재된 감소된 점도를 갖는 폴리펩티드 제제 중 어느 하나에서 사용하기 위한 폴리펩티드 및 감소된 점도를 갖는 폴리펩티드 제제의 제조 방법이 제공된다.
(A) 폴리펩티드에 대한 정의
본원에 사용된 용어 "폴리펩티드"는 50개 아미노산 초과의 아미노산의 서열을 의미한다. 일부 실시양태에서, 폴리펩티드는 항체이다. 본원에 사용된 "아미노산"은 천연 발생 및 비-천연 발생 아미노산을 포함한다. 아미노산은 유사체, 예컨대 PEG화, 지질화 및/또는 독소 접합된 유사체를 포함한다.
"정제된" 폴리펩티드 (예를 들어, 항체)는 폴립펩티드가 이들이 그의 천연 환경에서 존재할 때보다 더 순수한 형태로 존재하도록 및/또는 실험실 조건하에 최초로 합성 및/또는 증폭되었을 때 순도가 증가한 것을 의미한다. 순도는 상대적 용어이고, 반드시 절대 순도를 의미하지는 않는다.
용어 "에피토프 태그가 부착된"이 본원에서 사용되는 경우, 이것은 "태그 폴리펩티드"에 융합된 폴리펩티드를 포함하는 키메라 폴리펩티드를 나타낸다. 태그 폴리펩티드는 항체가 생성될 수 있는 에피토프를 제공할 만큼 충분한 잔기를 갖지만 그와 융합될 폴리펩티드의 활성을 방해하지 않을 정도로 충분히 짧다. 또한, 태그 폴리펩티드는 항체가 다른 에피토프와는 실질적으로 교차반응하지 않도록 아주 독특한 것이 바람직하다. 일반적으로, 적합한 태그 폴리펩티드는 6개 이상의 아미노산 잔기, 통상적으로는 약 8개 내지 50개의 아미노산 잔기 (바람직하게는, 약 10개 내지 20개의 아미노산 잔기)를 갖는다.
본원에서의 목적을 위한 "활성인" 또는 "활성"은 천연 또는 천연-발생 폴리펩티드의 생물학적 및/또는 면역학적 활성을 유지하는 폴리펩티드의 형태(들)을 지칭하고, 이때 "생물학적" 활성은 천연 또는 천연-발생 폴리펩티드가 지니는 항원성 에피토프에 대한 항체의 생성을 유도하는 능력을 제외한, 천연 또는 천연-발생 폴리펩티드에 의해 야기된 생물학적 기능 (억제성 또는 자극성)을 지칭하고, "면역학적" 활성은 천연 또는 천연-발생 폴리펩티드가 지니는 항원성 에피토프에 대한 항체의 생성을 유도하는 능력을 나타낸다.
용어 "길항제"는 가장 넓은 의미로 사용되고, 천연 폴리펩티드의 생물학적 활성을 부분적으로 또는 완전히 차단, 억제 또는 중화하는 임의의 분자를 포함한다. 유사한 방식으로, 용어 "효능제"는 가장 넓은 의미로 사용되고, 천연 폴리펩티드의 생물학적 활성을 모방하는 임의의 분자를 포함한다. 적합한 효능제 또는 길항제 분자는 구체적으로 효능제 또는 길항제 항체 또는 항체 단편, 천연 폴리펩티드의 단편 또는 아미노산 서열 변이체 등을 포함한다. 폴리펩티드의 효능제 또는 길항제를 확인하기 위한 방법은 폴리펩티드를 후보 효능제 또는 길항제 분자와 접촉시키고, 폴리펩티드와 통상적으로 관련되는 하나 이상의 생물학적 활성의 검출가능한 변화를 측정하는 것을 포함할 수 있다.
"보체 의존성 세포독성" 또는 "CDC"는 보체의 존재하에 표적을 용해시키는 분자의 능력을 나타낸다. 보체 활성화 경로는 동족 항원과 복합체를 형성한 분자 (예를 들어, 폴리펩티드 (예를 들어, 항체))에 보체 시스템의 제1 성분 (C1q)이 결합함으로써 개시된다. 보체 활성화를 평가하기 위해, 예를 들어 문헌 [Gazzano-Santoro et al., J. Immunol. Methods 202:163 (1996)]에 기재되어 있는 바와 같은 CDC 검정을 수행할 수 있다.
관심있는 항원, 예를 들어 종양-관련 폴리펩티드 항원 표적에 "결합하는" 결합 폴리펩티드는 폴리펩티드가 항원을 발현하는 세포 또는 조직을 표적화하는 데에 있어서 진단제 및/또는 치료제로서 유용하기에 충분한 친화도로 항원에 결합하고, 다른 폴리펩티드와 유의하게 교차 반응하지 않는 것이다. 이러한 실시양태에서, "비-표적" 폴리펩티드에 대한 폴리펩티드의 결합 정도는 형광 활성화 세포 분류 (FACS) 분석 또는 방사성 면역침전 (RIA)으로 결정할 때 그의 특정 표적 폴리펩티드에 대한 폴리펩티드 결합의 약 10% 미만일 것이다.
표적 분자에 대한 폴리펩티드의 결합과 관련해서, 특정 폴리펩티드 또는 특정 폴리펩티드 표적 상의 에피토프와의 "특이적 결합" 또는 이것과 "특이적으로 결합" 또는 이에 대해 "특이적"이라는 용어는 비-특이적 상호 작용과 측정가능하게 상이한 결합을 의미한다. 특이적 결합은, 예를 들어 분자의 결합을 일반적으로 결합 활성을 보유하지 않는 유사한 구조의 분자인 대조군 분자의 결합과 비교하여 결정함으로써 측정할 수 있다. 예를 들어, 특이적 결합은 표적과 유사한 대조군 분자, 예를 들어 과량의 비표지 표적과의 경쟁에 의해 측정할 수 있다. 이 경우, 프로브에 대한 표지된 표적의 결합이 과량의 비표지 표적에 의해 경쟁적으로 억제된다면 특이적 결합이다.
본원에 사용된 바와 같이, 특정 폴리펩티드 또는 특정 폴리펩티드 표적 상의 에피토프와의 "특이적 결합" 또는 이것과 "특이적으로 결합" 또는 이에 대해 "특이적"이라는 용어는, 예를 들어 표적에 대한 Kd가 약 10-4 M 이상, 대안적으로 약 10-5 M 이상, 대안적으로 약 10-6 M 이상, 대안적으로 약 10-7 M 이상, 대안적으로 약 10-8 M 이상, 대안적으로 약 10-9 M 이상, 대안적으로 약 10-10 M 이상, 대안적으로 약 10-11 M 이상, 대안적으로 약 10-12 M 이상, 또는 이를 초과하는 분자로 나타낼 수 있다. 한 실시양태에서, 용어 "특이적 결합"은 분자가 특정 폴리펩티드 또는 특정 폴리펩티드상의 에피토프에 결합하고 임의의 다른 폴리펩티드 또는 폴리펩티드 에피토프에는 실질적으로 결합하지 않는 것을 나타낸다.
"종양 세포의 성장을 억제하는" 폴리펩티드 또는 "성장 억제" 폴리펩티드는 암 세포의 측정할 수 있는 성장 억제를 나타내는 것이다. 한 실시양태에서, 성장 억제는 세포 배양물 중 약 0.1 내지 약 30 ㎍/㎖ 또는 약 0.5 nM 내지 약 200 nM의 폴리펩티드 농도에서 측정할 수 있는데, 이때 성장 억제는 종양 세포를 폴리펩티드에 노출시키고 1일 내지 10일 후에 결정한다. 생체 내에서의 종양 세포의 성장 억제를 하기 실험 실시예 부분에 기재된 바와 같이 다양한 방식으로 결정할 수 있다. 폴리펩티드는 폴리펩티드를 약 1 ㎍/kg 내지 약 100 ㎎/kg 체중으로 투여할 때 종양 크기 또는 종양 세포 증식이 처음 폴리펩티드 투여시로부터 약 5일 내지 약 3개월 내에, 바람직하게는 약 5일 내지 약 30일 내에 감소하면 생체내에서 성장 억제성인 것이다.
"아폽토시스를 유도하는" 폴리펩티드는 아넥신 V의 결합, DNA의 단편화, 세포 수축, 소포체의 팽창, 세포 단편화 및/또는 막 베지클 (아폽토시스체로 칭함)의 형성에 의해 결정될 때 예정된 세포 사멸을 유도하는 것이다. 바람직하게는, 상기 세포는 종양 세포, 예를 들어, 전립선 종양 세포, 유방 종양 세포, 난소 종양 세포, 위 종양 세포, 자궁내막 종양 세포, 폐 종양 세포, 신장 종양 세포, 결장 종양 세포, 방광 종양 세포이다. 다양한 방법을 이용하여 아폽토시스와 연관된 세포 반응을 평가할 수 있다. 예를 들어, 포스파티딜 세린 (PS) 전위는 아넥신 결합에 의해 측정할 수 있고, DNA 단편화는 DNA 래더링 (laddering)을 통해 평가할 수 있으며, DNA 단편화와 함께 일어나는 핵/염색질 응집은 하이포디플로이드 (hypodiploid) 세포의 임의의 증가에 의해서 확인할 수 있다. 바람직하게는, 아폽토시스를 유도하는 폴리펩티드는 아넥신 결합 분석에서 비처리 세포에 비해 아넥신 결합의 유도를 약 2 내지 약 50배, 바람직하게는 약 5 내지 약 50배, 가장 바람직하게는 약 10배 내지 약 50배 초래하는 것이다.
"세포 사멸을 유도하는" 폴리펩티드는 생육성 세포를 비-생육성이게 하는 것이다. 바람직하게는, 세포는 암 세포, 예를 들어, 유방, 난소, 위, 자궁내막, 침샘, 폐, 신장, 결장, 갑상선, 췌장 또는 방광 세포이다. 시험관내 세포 사멸은 보체 및 면역 이펙터 세포의 부재하에 측정되어 항체-의존적 세포-매개 세포독성 (ADCC) 또는 보체-의존적 세포독성 (CDC)에 의해 유도되는 세포 사멸이 구별될 수 있다. 따라서, 세포 사멸 검정은 열-불활성화된 혈청 (즉, 보체의 부재하)을 사용하고 면역 이펙터 세포의 부재하에 수행될 수 있다. 폴리펩티드가 세포 사멸을 유도할 수 있는지를 결정하기 위해, 프로피듐 아이오다이드 (PI), 트리판 블루 (문헌 [Moore et al. Cytotechnology 17:1-11 (1995)] 참조) 또는 7AAD의 흡수에 의해 평가되는 막 통합성의 상실을 비처리 세포와 비교하여 평가할 수 있다.
(B) 폴리펩티드
본원에 감소된 점도를 갖는 임의의 폴리펩티드 제제에 사용하기 위한 폴리펩티드 및 감소된 점도를 갖는 폴리펩티드 제제의 제조 방법이 제공된다.
일부 실시양태에서, 폴리펩티드는 치료 폴리펩티드이다. 치료 폴리펩티드는 종양 세포의 성장을 억제하고/거나, 아폽토시스를 유도하고/거나 세포 사멸을 유도할 수 있다. 일부 실시양태에서, 폴리펩티드는 길항제이다. 일부 실시양태에서, 폴리펩티드는 효능제이다. 일부 실시양태에서, 폴리펩티드는 항체이다.
일부 실시양태에서, 폴리펩티드는 약 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 또는 1,000개 아미노산 중 어느 하나 초과이다. 일부 실시양태에서, 폴리펩티드는 약 5,000 달톤, 10,000 달톤, 15,000 달톤, 25,000 달톤, 50,000 달톤, 75,000 달톤, 100,000 달톤, 125,000 달톤, 또는 150,000 달톤 중 어느 하나를 초과하는 분자량을 갖는다. 폴리펩티드는 약 50,000 달톤 내지 200,000 달톤 또는 100,000 달톤 내지 200,000 달톤 중 어느 하나의 분자량을 가질 수 있다. 대안적으로, 본원에 사용하기 위한 폴리펩티드는 약 120,000 달톤 또는 약 25,000 달톤의 분자량을 가질 수 있다.
일부 실시양태에서, 폴리펩티드는 2차 구조, 3차 구조, 및/또는 4차 구조를 형성할 수 있다. 일부 실시양태에서, 폴리펩티드는 2차 구조를 포함하고, 여기서 2차 구조는 α-나선이다. 폴리펩티드는 약 75%, 50%, 40%, 30%, 25%, 20%, 또는 10% 중 어느 하나 미만의 α-나선 2차 구조를 포함할 수 있다. 일부 실시양태에서, 폴리펩티드는 2차 구조를 포함하고, 여기서 2차 구조는 β-시트이다. 폴리펩티드는 약 25%, 50%, 60%, 70%, 75%, 80%, 또는 90% 중 어느 하나 초과의 β-시트 2차 구조를 포함할 수 있다.
일부 실시양태에서, 폴리펩티드는 낮은 평균 친수성을 갖는다. 친수성은 문헌 [Hopp, T.P. and Woods, K.R. Proc. Natl. Acad. Sci. USA 78(6), 3824-382 (1981)]에서와 같이 정의된다. 친수성은 물과 바람직한 열역학적 상호작용과 관련된 특성이다. 호프(Hopp) 및 우즈(Woods)에 의해 결정된 개별 아미노산 친수성 값을 사용하여 상대적 친수성을 정량할 수 있다. 일반적으로, 양성 친수성 값은 대전된 및 극성 측쇄에서 관찰되고, 음성 값은 비극성 측쇄에서 관찰된다. 일부 실시양태에서, 폴리펩티드는 약 -3 내지 1, -3 내지 0, -2 내지 1, -2 내지 0, -1 내지 1 또는 -1 내지 0 중 어느 하나의 평균 친수성을 갖는다. 일부 실시양태에서, 폴리펩티드는 항체이고, 여기서 CDR 영역 중 하나 이상이 약 0, -1, -2, 또는 -3 중 어느 하나 미만의 평균 친수성을 갖는다. 일부 실시양태에서, 약 1, 2, 3, 4, 5 또는 6개 중 어느 하나 이상의 CDR 영역이 약 0, -1, -2, 또는 -3 중 어느 하나 미만의 평균 친수성을 갖는다. 일부 실시양태에서, 항체의 6개 CDR에 대한 평균 친수성은 약 0, -1, -2, 또는 -3 중 어느 하나 미만이다.
일부 실시양태에서, 폴리펩티드는 높은 소수성을 갖는다. 소수성은 문헌 [Kyte, J. and Doolittle, R.F., J. Mol. Bio. 157, 105-132 (1982)]에서와 같이 정의된다. 소수성은 용매와 강력하게 상호작용하지 않는 분자를 용매상 밖으로 구동하는 강력한 용매-용매 (물) 상호작용이 있는 경우에 나타난다. 소수성은 개별 아미노산을 수성상과 유기상 사이에 분할하여 측정할 수 있다. 이 분할 계수는 유기상에서의 분자의 몰 분획에 대한 수성상에서의 분자의 몰 분획으로 정의된다. 일반적으로, 양성 수치료 값은 비극성 측쇄에서 관찰되고, 음성 수치료 값은 극성 및 대전된 측쇄에서 관찰된다. 일부 실시양태에서, 폴리펩티드는 약 2 내지 -1, 2 내지 1, 2 내지 0, 또는 1 내지 -1 중 어느 하나의 평균 소수성에 대한 범위를 갖는다. 일부 실시양태에서, 폴리펩티드는 항체이고, 여기서 CDR 영역은 높은 평균 소수성을 갖는다. 일부 실시양태에서, CDR 영역은 약 0, 1 또는 2 중 어느 하나 초과의 평균 소수성을 갖는다. 일부 실시양태에서, 약 1, 2, 3, 4, 5, 또는 6개 중 어느 하나 이상의 CDR 영역은 약 0, 1, 또는 2 중 어느 하나 초과의 평균 소수성을 갖는다. 일부 실시양태에서, 항체의 6개 CDR의 평균 소수성은 약 0, 1 또는 2 중 어느 하나 초과이다.
일부 실시양태에서, 폴리펩티드는 소수의 대전된 아미노산 측쇄 기를 갖는다. 전하 분포 및 이종성이 중요할 수 있다. 전하 이종성, 양성 수치료 값은 비극성 측쇄에서 관찰되고, 음성 수치료 값은 극성 및 대전된 측쇄에서 관찰된다. 일부 실시양태에서, 폴리펩티드는 약 40%, 35%, 30%, 25%, 20%, 15% 또는 10% 중 어느 하나 미만의 대전된 아미노산 측쇄 기를 갖는다. 일부 실시양태에서, 폴리펩티드는 항체이고, 여기서 CDR 영역은 소수의 대전된 아미노산 측쇄 기를 갖는다. 일부 실시양태에서, CDR 영역은 약 40%, 35%, 30%, 25%, 20%, 15% 또는 10% 중 어느 하나 미만의 대전된 아미노산 측쇄 기를 갖는다.
제제의 일부 실시양태에서, 폴리펩티드는 하나 이상의 이들 파라미터를 포함한다. 일부 실시양태에서, 폴리펩티드는 소수의 대전된 아미노산 측쇄 및 높은 소수성을 갖는다. 일부 실시양태에서, 폴리펩티드는 소수의 대전된 아미노산 측쇄 및 낮은 평균 친수성을 갖는다. 일부 실시양태에서, 폴리펩티드는 높은 소수성 및 낮은 평균 친수성을 갖는다. 일부 실시양태에서, 폴리펩티드는 높은 소수성, 낮은 평균 친수성, 및 소수의 대전된 아미노산 측쇄를 갖는다.
본원에 기재된 제제 및 방법에 유용한 폴리펩티드의 예는 포유동물 폴리펩티드, 예컨대, 예를 들어 성장 호르몬, 예컨대 인간 성장 호르몬 및 소 성장 호르몬; 성장 호르몬 방출 인자; 부갑상선 호르몬; 갑상선 자극 호르몬; 지단백질; α-1-항트립신; 인슐린 A-쇄; 인슐린 B-쇄; 프로인슐린; 여포 자극 호르몬; 칼시토닌; 황체 호르몬; 글루카곤; 응고 인자, 예컨대 인자 VIIIC, 인자 IX, 조직 인자, 및 폰 빌레브란트(von Willebrands) 인자; 항-응고 인자, 예컨대 단백질 C; 심방 나트륨이뇨 인자; 폐 계면활성제; 플라스미노겐 활성화제, 예컨대 우로키나제 또는 조직-유형 플라스미노겐 활성화제 (t-PA, 예를 들어 ActivaseTM, TNKaseTM, RetevaseTM); 봄바진; 트롬빈; 종양 괴사 인자 인자-α 및 -β; 엔케팔리나제; RANTES (정상적으로 발현 및 분비된 T-세포 활성화에 대한 조절); 인간 대식세포 염증성 단백질 (MIP-1-α); 혈청 알부민, 예컨대 인간 혈청 알부민; 뮐러(mullerian)-억제 물질; 렐락신 A-쇄; 렐락신 B-쇄; 프로렐락신; 마우스 고나도트로핀-관련 펩티드; DNase; 인히빈; 액티빈; 혈관 내피 성장 인자 (VEGF); 호르몬 또는 성장 인자에 대한 수용체; 인테그린; 단백질 A 또는 D; 류마티스 인자; 신경영양 인자, 예컨대 골-유래 신경영양 인자 (BDNF), 뉴로트로핀-3, -4, -5, 또는 -6 (NT-3, NT-4, NT-5, 또는 NT-6), 또는 신경 성장 인자, 예컨대 NGF-β; 혈소판-유래 성장 인자 (PDGF); 섬유모세포 성장 인자, 예컨대 aFGF 및 bFGF; 표피 성장 인자 (EGF); 형질전환 성장 인자 (TGF), 예컨대 TGF-α 및 TGF-β, 예컨대 TGF-β1, TGF-β2, TGF-β3, TGF-β4 또는 TGF-β5; 인슐린-유사 성장 인자-I 및 -II (IGF-I 및 IGF-II); des(1-3)-IGF-I (뇌 IGF-I); 인슐린-유사 성장 인자 결합 단백질; CD 단백질, 예컨대 CD3, CD4, CD8, CD19 및 CD20; 에리트로포이에틴 (EPO); 트롬보포이에틴 (TPO); 골유도 인자; 면역독소; 골 형태형성 단백질 (BMP); 인터페론, 예컨대 인터페론-α -β, 및 -γ, 콜로니 자극 인자 (CSF), 예를 들어 M-CSF, GM-CSF, 및 G-CSF; 인터류킨 (IL), 예를 들어 IL-1 내지 IL-10; 수퍼옥시드 디스무타제; T-세포 수용체; 표면 막 단백질; 붕괴 가속화 인자 (DAF); 바이러스 항원, 예컨대, 예를 들어 AIDS 외피의 일부; 수송 단백질; 호밍(homing) 수용체; 어드레신; 조절 단백질; 이뮤노어드헤신; 항체; 및 임의의 상기-열거된 폴리펩티드의 생물학적 활성 단편 또는 변이체를 포함한다.
(C) 항체
일부 실시양태에서 감소된 점도를 갖는 임의의 폴리펩티드 제제 및 감소된 점도를 갖는 폴리펩티드 제제의 제조 방법에 사용하기 위한 폴리펩티드는 항체일 수 있다.
본 발명에 포함되는 항체에 대한 분자 표적은 CD 단백질 및 이들의 리간드, 예컨대 (i) CD3, CD4, CD8, CD19, CD20, CD22, CD34, CD40, CD79α (CD79a), 및 CD79β (CD79b); (ii) ErbB 수용체 부류의 구성원, 예컨대 EGF 수용체, HER2, HER3 또는 HER4 수용체; (iii) 세포 부착 분자, 예컨대 LFA-1, Mac1, p150,95, VLA-4, ICAM-1, VCAM 및 v/3 인테그린 (그의 알파 또는 베타 서브유닛 포함) (예를 들어, 항-CD11a, 항-CD18 또는 항-CD11b 항체); (iv) 성장 인자, 예컨대 VEGF; IgE; 혈액형 항원; flk2/flt3 수용체; 비만 (OB) 수용체; mpl 수용체; CTLA-4; 단백질 C, BR3, c-met, 조직 인자, 7 등; 및 (v) 세포 표면 및 막횡단 종양-관련 항원 (TAA), 예컨대 미국 특허 번호 7,521,541에 기재된 것을 포함하나 이에 제한되지는 않는다.
본 발명에 포함되는 다른 예시적인 항체는 항-에스트로겐 수용체 항체, 항-프로게스테론 수용체 항체, 항-p53 항체, 항-HER-2/neu 항체, 항-EGFR 항체, 항-카텝신 D 항체, 항-Bcl-2 항체, 항-E-카드헤린 항체, 항-CA125 항체, 항-CA15-3 항체, 항-CA19-9 항체, 항-c-erbB-2 항체, 항-P-당단백질 항체, 항-CEA 항체, 항-망막모세포종 단백질 항체, 항-ras 종양단백질 항체, 항-루이스(Lewis) X 항체, 항-Ki-67 항체, 항-PCNA 항체, 항-CD3 항체, 항-CD4 항체, 항-CD5 항체, 항-CD7 항체, 항-CD8 항체, 항-CD9/p24 항체, 항-CD10 항체, 항-CD11c 항체, 항-CD13 항체, 항-CD14 항체, 항-CD15 항체, 항-CD19 항체, 항-CD20 항체, 항-CD22 항체, 항-CD23 항체, 항-CD30 항체, 항-CD31 항체, 항-CD33 항체, 항-CD34 항체, 항-CD35 항체, 항-CD38 항체, 항-CD41 항체, 항-LCA/CD45 항체, 항-CD45RO 항체, 항-CD45RA 항체, 항-CD39 항체, 항-CD100 항체, 항-CD95/Fas 항체, 항-CD99 항체, 항-CD106 항체, 항-유비퀴틴 항체, 항-CD71 항체, 항-c-myc 항체, 항-시토케라틴 항체, 항-비멘틴 항체, 항-HPV 단백질 항체, 항-카파 경쇄 항체, 항-람다 경쇄 항체, 항-멜라닌소체 항체, 항-전립선 특이적 항원 항체, 항-S-100 항체, 항-tau 항원 항체, 항-피브린 항체, 항- 케라틴 항체 및 항-Tn-항원 항체로부터 선택된 것을 포함하고, 이에 제한되지는 않는다.
(i) 항체에 대한 정의
본원에서 용어 "항체"는 가장 넓은 의미로 사용되고, 구체적으로 모노클로날 항체, 폴리클로날 항체, 2개 이상의 무손상 항체로 형성된 다중특이적 항체 (예를 들어 이중특이적 항체) 및 목적하는 생물학적 활성을 보이는 항체 단편을 포함한다. 용어 "이뮤노글로불린" (Ig)은 본원에서 "항체"와 상호교환 가능하게 사용된다.
항체는 모두 이뮤노글로불린 폴드를 기재로 하는 다양한 구조를 갖는 천연 발생 이뮤노글로불린 분자이다. 예를 들어, IgG 항체는 디술피드-결합에 의해 기능성 항체를 형성하는 2개의 '중'쇄 및 2개의 '경'쇄를 갖는다. 각각의 중쇄 및 경쇄 자체는 "불변" (C) 및 "가변" (V) 영역을 포함한다. V 영역은 항체의 항원 결합 특이성을 결정하고, C 영역은 구조 지지체를 제공하고, 면역 이펙터와 비-항원-특이적 상호작용에서 기능한다. 항체 또는 항체의 항원-결합 단편의 항원 결합 특이성은 특정 항원에 특이적으로 결합하는 항체의 능력이다.
항체의 항원 결합 특이성은 V 영역의 구조적인 특성에 의해 결정된다. 가변성이 가변 도메인의 110개 아미노산 범위에 걸쳐 고르게 분포되어 있는 것은 아니다. 대신, V 영역은 "초가변 영역"이라 불리는 극단적인 가변성의 더 짧은 영역 (각각 9개 내지 12개 아미노산 길이)으로 분리된 프레임워크 영역 (FR) (15개 내지 30개 아미노산)이라 불리는 비교적 불변성의 스트레치로 이루어진다. 천연 중쇄 및 경쇄의 가변 도메인은 3개의 초가변 영역에 의해 연결되고 주로 β-시트 형태를 취하는 4개의 FR을 각각 포함하며, 이들 초가변 영역은 상기 β-시트 구조를 연결하고 일부 경우에는 그의 일부를 형성하는 루프를 형성한다. 각 쇄의 초가변 영역은 FR에 의해 서로 근접하게 위치하고, 다른 쇄의 초가변 영역과 함께 항체의 항원 결합 부위의 형성에 기여한다 (문헌 [Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)] 참조). 불변 도메인은 항원에 대한 항체 결합에 직접 관여하지는 않지만, 다양한 이펙터 기능, 예컨대 항체 의존적 세포 세포독성 (ADCC)에 있어서의 항체의 참여를 나타낸다.
각각의 V 영역은 전형적으로 3개의 상보성 결정 영역 ("CDR", 이들은 각각 "초가변 루프"을 함유함) 및 4개의 프레임워크 영역을 포함한다. 따라서, 항체 결합 부위 (특정한 목적하는 항원에 실질적인 친화도로 결합하는데 필요한 최소 구조 단위)는 전형적으로 3개의 CDR, 및 이들 사이에 배치된 3개 이상, 바람직하게는 4개의 프레임워크 영역 (CDR을 적절한 형태로 유지 및 존재하게 함)를 포함할 것이다. 고전적인 4개 쇄 항체는 협력하여 VH 및 VL 도메인에 의해 규정되는 항원 결합 부위를 갖는다. 특정 항체, 예컨대 낙타 및 상어 항체는 경쇄가 존재하지 않고, 오직 중쇄에 의해 형성된 결합 부위에 의존한다. 결합 부위가 VH와 VL 사이의 협력없이 중쇄 또는 경쇄만으로 형성된 단일 도메인 조작된 이뮤노글로불린을 제조할 수 있다.
달리 나타내지 않는 한, 본 명세서 및 특허청구범위 전반에 걸쳐, 이뮤노글로불린 중쇄 불변 도메인 잔기의 넘버링은 본원에 참고로 명백하게 포함되는 문헌 [Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)]에서와 같은 EU 지수의 넘버링이다. "카바트에서와 같은 EU 지수"는 인간 IgG1 EU 항체의 잔기 넘버링을 나타낸다. 순차적 또는 다른 넘버링 시스템을 구체적으로 표시하지 않는다면, V 영역의 잔기는 카바트 넘버링에 따라 번호가 매겨진다.
용어 "가변"은 가변 도메인의 특정 부분이 항체마다 서열에서 광범위하게 상이하고 각각의 특정 항체의 그의 특정 항원에 대한 결합 및 특이성과 관련하여 사용된다는 사실을 나타낸다. 그러나, 가변성이 항체 가변 도메인 전반에 걸쳐 고르게 분포되어 있는 것은 아니다. 이는 경쇄 가변 도메인과 중쇄 가변 도메인 둘 다 내에 초가변 영역이라 불리우는 3개의 절편에 집중되어 있다. 가변 도메인의 보다 고도로 보존된 부분은 프레임워크 영역 (FR)이라 불린다. 천연 중쇄 및 경쇄의 가변 도메인은 3개의 초가변 영역에 의해 연결되고 주로 β-시트 형태를 취하는 4개의 FR을 각각 포함하며, 이들 초가변 영역은 상기 β-시트 구조를 연결하고 일부 경우에는 그의 일부를 형성하는 루프를 형성한다. 각 쇄의 초가변 영역은 FR에 의해 서로 근접하게 위치하고, 다른 쇄의 초가변 영역과 함께 항체의 항원 결합 부위의 형성에 기여한다 (문헌 [Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)] 참조). 불변 도메인은 항원에 대한 항체 결합에 직접 관여하지는 않지만, 다양한 이펙터 기능, 예컨대 항체 의존적 세포 세포독성 (ADCC)에 있어서의 항체의 참여를 나타낸다.
용어 "초가변 영역"은 본원에서 사용될 때, 항원 결합을 담당하는 항체의 아미노산 잔기를 나타낸다. 초가변 영역은 "상보성 결정 영역" 또는 "CDR"로부터의 아미노산 잔기 (예를 들어, VL에서는 대략적으로 약 잔기 24-34 (L1), 50-56 (L2) 및 89-97 (L3), 및 VH에서는 대략적으로 약 31-35B (H1), 50-65 (H2) 및 95-102 (H3) (문헌 [Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)]) 및/또는 "초가변 루프"로부터의 아미노산 잔기 (예를 들어, VL에서는 잔기 26-32 (L1), 50-52 (L2) 및 91-96 (L3), 및 VH에서는 26-32 (H1), 52A-55 (H2) 및 96-101 (H3) (문헌 [Chothia and Lesk J. Mol. Biol. 196:901-917 (1987)])를 포함할 수 있다.
"프레임워크" 또는 "FR" 잔기는 본원에 정의된 바와 같은 초가변 영역 잔기 이외의 가변 도메인 잔기이다.
"항체 단편"은 바람직하게는 항원 결합 영역을 포함하는 무손상 항체의 일부를 포함한다. 항체 단편의 예는 Fab, Fab', F(ab')2 및 Fv 단편, 디아바디, 선형 항체, 단일-쇄 항체 분자, 및 항체 단편들로부터 형성된 다중특이적 항체를 포함한다.
항체를 파파인으로 분해시키면 "Fab" 단편이라고 불리는, 각각 단일 항원-결합 부위를 갖는 2개의 동일한 항원-결합 단편과, 나머지 "Fc" 단편이 생성되는데, Fc라는 명칭은 그의 쉽게 결정화되는 능력을 반영한 것이다. 펩신 처리는 2개의 항원-결합 부위를 갖고 여전히 항원을 가교시킬 수 있는 F(ab')2 단편을 생성시킨다.
"Fv"는 완전한 항원-인식 및 항원-결합 부위를 함유하는 최소 항체 단편이다. 이 영역은 긴밀하게 비-공유 회합된 1개의 중쇄 및 1개의 경쇄 가변 도메인의 이량체로 이루어진다. 이러한 형태에서는 각 가변 도메인의 3개의 초가변 영역이 상호작용하여 VH-VL 이량체 표면상의 항원-결합 부위를 한정한다. 집합적으로, 6개의 초가변 영역은 항체에 항원-결합 특이성을 부여한다. 그러나, 단일 가변 도메인 (또는 항원에 특이적인 초가변 영역을 단지 3개만 포함하는 Fv의 절반)일지라도 전체 결합 부위보다 친화도가 낮긴 하지만 항원을 인식하고 결합하는 능력을 갖고 있다.
Fab 단편은 또한 경쇄의 불변 도메인 및 중쇄의 제1 불변 도메인 (CH1)을 함유한다. Fab' 단편은 항체 힌지 영역으로부터의 하나 이상의 시스테인을 포함하는 중쇄 CH1 도메인의 카르복시 말단에 수개의 잔기가 부가되었다는 점에서 Fab 단편과 상이하다. 본원에서, Fab'-SH는 불변 도메인의 시스테인 잔기(들)이 하나 이상의 유리 티올기를 보유하는 Fab'의 명칭이다. F(ab')2 항체 단편은 본래 가운데에 힌지 시스테인을 갖는 Fab' 단편의 쌍으로 생성된다. 항체 단편의 다른 화학적 커플링이 또한 공지되어 있다.
임의의 척추동물 종으로부터의 항체 (이뮤노글로불린)의 "경쇄"는 불변 도메인의 아미노산 서열을 기초로 하여, 카파 (κ) 및 람다 (λ)로 칭해지는 명백하게 상이한 2가지 유형 중의 하나로 지정될 수 있다.
이들 중쇄의 불변 도메인의 아미노산 서열에 따라, 항체는 여러 클래스로 분류될 수 있다. 무손상 항체의 5가지 주요 클래스: IgA, IgD, IgE, IgG, 및 IgM이 존재하고, 이중 몇 가지는 하위클래스 (이소형), 예를 들어 IgG1, IgG2, IgG3, IgG4, IgA, 및 IgA2로 추가로 나뉠 수 있다. 상이한 클래스의 항체에 상응하는 중쇄 불변 도메인은 각각 α, δ, ε, γ 및 μ로 불린다. 상이한 클래스의 이뮤노글로불린의 서브유닛 구조 및 3차원 형상은 잘 공지되어 있다.
"단일쇄 Fv" 또는 "scFv" 항체 단편은 단일 폴리펩티드 쇄 내에 존재하는 항체의 VH 및 VL 도메인을 포함한다. 일부 실시양태에서, Fv 폴리펩티드는 scFv가 항원 결합을 위한 원하는 구조를 형성할 수 있도록 하는, VH와 VL 도메인 사이에 폴리펩티드 링커를 추가로 포함한다. scFv의 검토를 위해, 문헌 [Pluckthun in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994)]을 참조한다.
용어 "디아바디"는 2개의 항원 결합 부위를 갖는 작은 항체 단편을 나타내는데, 상기 단편은 경쇄 가변 도메인 (VL)에 연결된 중쇄 가변 도메인 (VH)을 동일 폴리펩티드 쇄 (VH-VL) 내에 포함한다. 동일 쇄 상의 2개의 도메인 사이에서 쌍 형성을 허용하기에는 지나치게 짧은 링커를 사용함으로써, 상기 도메인은 또 다른 쇄의 상보적 도메인과 쌍을 형성하게 되어 2개의 항원-결합 부위를 생성하게 된다. 디아바디는 예를 들어 EP 404,097; WO 93/11161; 및 문헌 [Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993)]에 보다 상세하게 기재되어 있다.
본원에 사용된 용어 "모노클로날 항체"는 실질적으로 동종인 항체 집단, 즉 집단을 차지하고 있는 개개의 항체가 모노클로날 항체의 생성 동안 유발될 수 있는 가능한 변이체 (이러한 변이체는 일반적으로 미량으로 존재함)를 제외하고는 동일하고/하거나 동일한 에피토프와 결합하는 집단으로부터 수득한 항체를 나타낸다. 전형적으로 상이한 결정자 (에피토프)에 대해 지시된 상이한 항체를 포함하는 폴리클로날 항체 제제와는 달리, 각각의 모노클로날 항체는 항원상의 단결정자에 대해 지시된다. 그의 특이성에 이외에도 모노클로날 항체는 다른 다른 이뮤노글로불린에 의해 오염되지 않는 점에서 유리하다. 수식어 "모노클로날"은 항체의 특징을 실질적으로 동종인 항체들의 집단으로부터 수득하였다는 것으로 표시하고, 임의의 특정한 방법을 통한 항체 생성이 필요하다는 것으로 해석되어서는 안된다. 예를 들어, 본원에 제공된 방법에 따라 사용될 모노클로날 항체는 문헌 [Kohler et al., Nature 256:495 (1975)]에 최초로 기재되었던 하이브리도마 방법으로 제조될 수 있거나, 또는 재조합 DNA 방법 (예를 들어, 미국 특허 번호 4,816,567 참조)으로 제조될 수 있다. "모노클로날 항체"는 또한 예를 들어 문헌 [Clackson et al., Nature 352:624-628 (1991)] 및 [Marks et al., J. Mol. Biol. 222:581-597 (1991)]에 기재된 기술을 사용하여 파지 항체 라이브러리로부터 단리할 수 있다.
구체적으로, 본원에서의 모노클로날 항체는 중쇄 및/또는 경쇄의 일부가 특정 종으로부터 유래되거나 특정 항체 클래스 또는 하위클래스에 속하는 항체의 상응하는 서열과 동일하거나 상동성이고, 쇄(들)의 나머지 부분은 또 다른 종으로부터 유래되거나 또 다른 항체 클래스 또는 하위클래스에 속하는 항체의 상응하는 서열과 동일하거나 상동성인 "키메라" 항체 (이뮤노글로불린), 뿐만 아니라 원하는 생물학적 활성을 나타내는 한은 이러한 항체의 단편을 포함한다 (미국 특허 번호4,816,567; 문헌 [Morrison et al., Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984)]). 본원에서의 관심 키메라 항체는 비-인간 영장류 (예를 들어, 구세계 원숭이(Old World Monkey), 예컨대 개코원숭이, 붉은털 원숭이 또는 사이노몰거스 원숭이)로부터 유래된 가변 도메인 항원-결합 서열 및 인간 불변 영역 서열을 포함하는 "영장류화" 항체를 포함한다 (미국 특허 번호 5,693,780).
비-인간 (예를 들어, 뮤린) 항체의 "인간화" 형태는 비-인간 이뮤노글로불린에서 유래된 최소 서열을 함유하는 키메라 항체이다. 대부분의 경우, 인간화 항체는 수용자의 초가변 영역의 잔기가 원하는 특이성, 친화도 및 능력을 보유하는 마우스, 래트, 토끼 또는 비-인간 영장류와 같은 비-인간 종 (공여자 항체)의 초가변 영역의 잔기로 치환된 인간 이뮤노글로불린 (수용자 항체)이다. 일부 예에서, 인간 이뮤노글로불린의 프레임워크 영역 (FR) 잔기를 상응하는 비인간 잔기로 대체한다. 추가로, 인간화 항체는 수용자 항체 또는 공여자 항체에서는 발견되지 않는 잔기를 포함할 수도 있다. 이러한 변형은 항체 성능이 추가로 개선되게 한다. 일반적으로, 인간화 항체는 하나 이상, 전형적으로는 2개의 가변 도메인을 실질적으로 모두 포함할 것이고, 여기서 모든 또는 실질적으로 모든 초가변 루프는 비-인간 이뮤노글로불린의 그것에 상응하고 모든 또는 실질적으로 모든 FR은 인간 이뮤노글로불린 서열의 그것이다 (상기 언급된 FR 치환(들)은 제외함). 또한, 인간화 항체는 임의로 이뮤노글로불린 불변 영역의 적어도 일부, 전형적으로 인간 이뮤노글로불린의 불변 영역의 적어도 일부를 포함할 것이다. 보다 상세한 내용에 대해 문헌 [Jones et al., Nature 321:522-525 (1986)]; [Riechmann et al., Nature 332:323-329 (1988)]; 및 [Presta, Curr. Op. Struct. Biol. 2:593-596 (1992)]을 참조한다.
본원에서 목적을 위해, "무손상 항체"는 중쇄 및 경쇄 가변 도메인, 뿐만 아니라 Fc 영역을 포함하는 항체이다. 불변 도메인은 천연 서열 불변 도메인 (예를 들어 인간 천연 서열 불변 도메인) 또는 이것의 아미노산 서열 변이체일 수 있다. 무손상 항체는 하나 이상의 이펙터 기능을 갖는 것이 바람직하다.
"천연 항체"는 일반적으로 2개의 동일한 경쇄 (L) 및 2개의 동일한 중쇄 (H)로 구성된 약 150,000 달톤의 이종사량체 당단백질이다. 각각의 경쇄는 1개의 디술피드 공유 결합에 의해 중쇄에 연결되고, 디술피드 연결부의 수는 상이한 이뮤노글로불린 이소형의 중쇄마다 달라진다. 또한, 각각의 중쇄 및 경쇄는 일정하게 이격된 쇄내 디술피드 브릿지를 갖는다. 각각의 중쇄는 한쪽 말단에 가변 도메인 (VH)을 갖고, 그 뒤에는 수많은 불변 도메인이 존재한다. 각각의 경쇄는 한쪽 말단에 가변 도메인 (VL) 및 다른쪽 말단에 불변 도메인을 가지며; 경쇄의 불변 도메인은 중쇄의 제1 불변 도메인과 정렬되고, 경쇄 가변 도메인은 중쇄의 가변 도메인과 정렬된다. 특정 아미노산 잔기는 경쇄 및 중쇄 가변 도메인 사이의 인터페이스를 형성한다고 여겨진다.
"네이키드 항체"는 세포독성 부분 또는 방사성 표지와 같은 이종성 분자에 접합되지 않은 항체 (본원에서 규정된 바와 같음)이다.
일부 실시양태에서, 항체 "이펙터 기능"은 항체의 Fc 영역 (천연 서열 Fc 영역 또는 아미노산 서열 변이체 Fc 영역)에 기인한 생물학적 활성을 지칭하고, 항체 이소형에 따라 달라진다. 항체 이펙터 기능의 예는 C1q 결합 및 보체 의존성 세포 세포독성; Fc 수용체 결합; 항체-의존성 세포-매개 세포독성 (ADCC); 포식작용; 세포 표면 수용체의 하향 조절을 포함한다.
"항체-의존성 세포-매개된 세포독성" 및 "ADCC"는 Fc 수용체 (FcR)를 발현하는 비특이적 세포독성 세포 (예를 들어, 천연 킬러 (NK) 세포, 호중구, 및 대식 세포)가 표적 세포 상의 결합된 항체를 인식하고, 연속해서 표적 세포의 용해를 유발시키는 세포-매개된 반응을 나타낸다. ADCC를 매개하는 주요 세포인 NK 세포는 FcγRIII만을 발현하는 반면, 단핵구는 FcγRI, FcγRII 및 FcγRIII를 발현한다. 조혈 세포 상에서의 FcR 발현은 문헌 [Ravetch and Kinet, Annu. Rev. Immunol 9:457-92 (1991)]의 464면의 표 3에 요약되어 있다. 관심 분자의 ADCC 활성을 평가하기 위하여, 미국 특허 번호 5,500,362 또는 5,821,337에 기재된 바와 같은 시험관내 ADCC 검정을 수행할 수 있다. 이러한 검정에 유용한 이펙터 세포는 말초혈 단핵 세포 (PBMC) 및 천연 킬러 (NK) 세포를 포함한다. 대안적으로 또는 추가로, 관심있는 분자의 ADCC 활성은 예를 들어 문헌 [Clynes et al., PNAS (USA) 95:652-656 (1998)]에 개시된 바와 같은 동물 모델에서 생체내 평가할 수 있다.
"인간 이펙터 세포"는 하나 이상의 FcR을 발현하고 이펙터 기능을 수행하는 백혈구이다. 일부 실시양태에서, 이러한 세포는 적어도 FcγRIII를 발현하고 ADCC 이펙터 기능을 수행한다. ADCC를 매개하는 인간 백혈구의 예로는 말초혈 단핵 세포 (PBMC), 천연 킬러 (NK) 세포, 단핵구, 세포독성 T 세포 및 호중구가 포함되고, PBMC 및 NK 세포가 바람직하다.
용어 "Fc 수용체" 또는 "FcR"은 항체의 Fc 영역에 결합하는 수용체를 기술하기 위해 사용된다. 일부 실시양태에서, FcR은 천연 서열 인간 FcR이다. 또한, 바람직한 FcR은 IgG 항체에 결합하는 수용체 (감마 수용체)이고, FcγRI, FcγRII 및 FcγRIII 서브클래스의 수용체를 포함하며, 여기에는 이들 수용체의 대립유전자 변이체 및 다르게 스플라이싱된 형태가 포함된다. FcγRII 수용체는 FcγRIIA ("활성화 수용체") 및 FcγRIIB ("억제 수용체")를 포함하고, 이들은 주로 세포질 도메인에서 상이한 유사한 아미노산 서열을 갖는다. 활성화 수용체 FcγRIIA는 그의 세포질 도메인에 면역수용체 티로신-기재의 활성화 모티프 (ITAM)를 함유한다. 억제 수용체 FcγRIIB는 그의 세포질 도메인 내에 면역수용체 티로신-기재의 억제 모티프 (ITIM)를 함유한다. (문헌 [Daeron, Annu. Rev. Immunol. 15:203-234 (1997)] 참조). FcR은 문헌 [Ravetch and Kinet, Annu. Rev. Immunol 9:457-92 (1991)]; [Capel et al., Immunomethods 4:25-34 (1994)]; 및 [de Haas et al., J. Lab. Clin. Med. 126:330-41 (1995)]에서 검토된다. 추후로 확인될 것을 포함하는 다른 FcR이 본원의 용어 "FcR"에 포함된다. 이 용어는 모체 IgG를 태아에게 전달하는 것을 담당하는 신생아 수용체 FcRn을 또한 포함한다 (문헌 [Guyer et al., J. Immunol. 117:587 (1976)] 및 [Kim et al., J. Immunol. 24:249 (1994)]).
(ii) 폴리클로날 항체
일부 실시양태에서, 항체는 폴리클로날 항체이다. 폴리클로날 항체는 관련 항원 및 아주반트의 다중 피하 (sc) 또는 복강내 (ip) 주사에 의해 동물에서 바람직하게 생성된다. 2관능성 또는 유도체화제, 예를 들어 말레이미도벤조일 술포숙신이미드 에스테르 (시스테인 잔기를 통한 접합), N-히드록시숙신이미드 (리신 잔기를 통함), 글루타르알데히드, 숙신산 무수물, SOCl2, 또는 R1N=C=NR (여기서, R 및 R1은 상이한 알킬기임)을 사용하여, 면역화될 종에서 면역원성인 폴리펩티드, 예를 들어 키홀 림펫 헤모시아닌, 혈청 알부민, 소 티로글로불린 또는 대두 트립신 억제제에 관련 항원을 접합시키는 것이 유용할 수 있다.
예를 들어 폴리펩티드 또는 접합체 100 ㎍ 또는 5 ㎍ (각각, 토끼 또는 마우스의 경우)을 3 부피의 프로인트 완전 아주반트와 합하고, 상기 용액을 여러 부위에 피내 주사함으로써, 동물을 항원, 면역원성 접합체 또는 유도체에 대해 면역화한다. 1개월 후, 프로인트 완전 아주반트 내의 펩티드 또는 접합체를 원래 양의 1/5 내지 1/10로 여러 부위에 피하 주사하여 동물을 부스팅한다. 7 내지 14일 후, 동물에서 채혈하여, 혈청을 항체 역가에 대해 검정한다. 역가가 정체기에 도달할 때까지 동물을 부스팅한다. 일부 실시양태에서, 동물을 동일 항원의 접합체로 부스팅하지만, 이것은 상이한 폴리펩티드에 접합되고/되거나 상이한 가교 시약을 통해 접합된 것이다. 접합체는 또한 재조합 세포 배양물에서 폴리펩티드 융합체로서 제조될 수도 있다. 또한, 백반과 같은 응집제를 적합하게 사용하여 면역 반응을 향상시킨다.
(iii) 모노클로날 항체
일부 실시양태에서, 항체는 모노클로날 항체이다. 모노클로날 항체는 실질적으로 동종인 항체 집단으로부터 수득되며, 즉 이러한 집단을 구성하는 개개의 항체는 모노클로날 항체의 생성 동안에 발생하여 일반적으로 소량으로 존재하는 가능한 변이체를 제외하고는 동일하고/하거나 동일한 에피토프에 결합한다. 따라서, 수식어구 "모노클로날"은 개별 또는 폴리클로날 항체의 혼합물이 아닌 것으로서의 항체의 특징을 가리킨다.
예를 들어, 모노클로날 항체는 문헌 [Kohler et al., Nature 256:495 (1975)]에 최초로 기재된 하이브리도마 방법을 사용하여 제조할 수 있거나 또는 재조합 DNA 방법 (미국 특허 번호 4,816,567)으로 제조할 수도 있다.
하이브리도마 방법에서, 마우스 또는 다른 적절한 숙주 동물, 예를 들어 햄스터는 면역화에 사용된 폴리펩티드에 특이적으로 결합할 항체를 생성하거나 또는 생성할 수 있는 림프구를 도출하기 위해 본원에 기재된 바와 같이 면역화된다. 대안적으로, 림프구를 시험관내에서 면역화시킬 수 있다. 이어서, 적합한 융합제, 예컨대 폴리에틸렌 글리콜을 사용하여 림프구를 골수종 세포와 융합시켜 하이브리도마 세포가 형성된다 (문헌 [Goding, Monoclonal Antibodies: Principles and Practice, pp. 59-103 (Academic Press, 1986)]).
이렇게 제조된 하이브리도마 세포를 융합되지 않은 모 골수종 세포의 성장 또는 생존을 억제하는 하나 이상의 물질을 바람직하게는 함유하는 적합한 배양 배지에 시딩하여 성장시킨다. 예를 들어, 모 골수종 세포에 하이포크산틴 구아닌 포스포리보실 트랜스퍼라제 (HGPRT 또는 HPRT) 효소가 없는 경우, 하이브리도마용 배양 배지는 전형적으로 하이포크산틴, 아미노프테린 및 티미딘을 포함할 것이며 (HAT 배지), 이러한 물질들은 HGPRT-결핍 세포의 성장을 방지한다.
일부 실시양태에서, 골수종 세포는 효율적으로 융합하고, 선택된 항체 생성 세포에 의한 항체의 안정적인 고수준 생성을 지지하고, 배지, 예컨대 HAT 배지에 민감한 세포이다. 이들 중에서, 일부 실시양태에서, 골수종 세포주는 뮤린 골수종 세포주, 예컨대 살크 인스티튜트 셀 디스트리뷰션 센터(Salk Institute Cell Distribution Center) (미국 캘리포니아주 샌 디에고)로부터 입수가능한 MOPC-21 및 MPC-11 마우스 종양 및 아메리칸 타입 컬쳐 콜렉션(American Type Culture Collection) (미국 메릴랜드주 록크빌)으로부터 입수가능한 SP-2 또는 X63-Ag8-653 세포로부터 유래된 것이다. 인간 골수종 및 마우스-인간 이종골수종 세포주 역시 인간 모노클로날 항체 생성에 대해 기재되어 있다 (문헌 [Kozbor, J. Immunol. 133:3001 (1984)]; [Brodeur et al., Monoclonal Antibody Production Techniques and Applications pp. 51-63 (Marcel Dekker, Inc., New York, 1987)]).
하이브리도마 세포가 성장하는 배양 배지를 항원에 대해 지시된 모노클로날 항체의 생성에 대해 검정한다. 일부 실시양태에서, 하이브리도마 세포에 의해 생성되는 모노클로날 항체의 결합 특이성을 면역침전법 또는 시험관내 결합 검정, 예컨대 방사선면역검정 (RIA) 또는 효소-연결된 면역흡착 검정 (ELISA)으로 결정한다.
모노클로날 항체의 결합 친화도는 예를 들어 문헌 [Munson et al., Anal. Biochem. 107:220 (1980)]의 스캐챠드 (Scatchard) 분석에 의해 결정할 수 있다.
목적하는 특이성, 친화도 및/또는 활성의 항체를 생성하는 하이브리도마 세포를 확인한 후, 클론을 한계 희석 절차에 의해 서브클로닝하고, 표준 방법에 의해 성장시킬 수 있다 (문헌 [Goding, Monoclonal Antibodies: Principles and Practice pp. 59-103 (Academic Press, 1986)]). 이러한 목적에 적합한 배양 배지는, 예를 들어, D-MEM 또는 RPMI-1640 배지를 포함한다. 또한, 하이브리도마 세포를 동물에서 복수 종양으로서 생체내 성장시킬 수 있다.
서브클론에 의해 분비된 모노클로날 항체는 예를 들어 폴리펩티드 A-세파로스, 히드록실아파타이트 크로마토그래피, 겔 전기영동, 투석 또는 친화도 크로마토그래피와 같은 통상적인 이뮤노글로불린 정제 절차에 의해 배양 배지, 복수액 또는 혈청으로부터 적합하게 분리된다.
모노클로날 항체를 코딩하는 DNA는 통상적인 절차 (예를 들어, 뮤린 항체의 중쇄 및 경쇄를 코딩하는 유전자에 특이적으로 결합할 수 있는 올리고뉴클레오티드 프로브 사용)를 이용하여 쉽게 단리 및 서열분석된다. 일부 실시양태에서, 하이브리도마 세포는 이러한 DNA의 공급원으로서 기능한다. 일단 단리되면, DNA를 발현 백터 내로 넣을 수 있고, 이후에 이를 다른 방식으로는 이뮤노글로불린 폴리펩티드를 생성하지 않는 숙주 세포, 예컨대 이. 콜라이(E. coli) 세포, 유인원 COS 세포, 차이니즈 햄스터 난소 (CHO) 세포 또는 골수종 세포로 형질감염시켜서 재조합 숙주 세포에서의 모노클로날 항체의 합성을 달성한다. 항체를 코딩하는 DNA의 박테리아에서의 재조합 발현에 대한 검토 문헌은 문헌 [Skerra et al., Curr. Opinion in Immunol. 5:256-262 (1993)] 및 [Pluckthun, Immunol. Revs., 130:151-188 (1992)]을 포함한다.
추가의 실시양태에서, 항체 또는 항체 단편을 문헌 [McCafferty et al., Nature 348:552-554 (1990)]에 기재된 기술을 이용하여 생성된 항체 파지 라이브러리로부터 단리할 수 있다. 문헌 [Clackson et al., Nature 352:624-628 (1991)] 및 [Marks et al., J. Mol. Biol. 222:581-597 (1991)]에는 파지 라이브러리를 사용한 뮤린 및 인간 항체의 단리가 각각 기재되어 있다. 후속 간행물들에는 쇄 셔플링에 의한 고친화도 (nM 범위) 인간 항체의 생성 (문헌 [Marks et al., Bio/Technology 10:779-783 (1992)]), 뿐만 아니라 매우 큰 파지 라이브러리를 구축하기 위한 전략으로서의 조합형 감염 및 생체내 재조합 (문헌 [Waterhouse et al., Nuc. Acids. Res. 21:2265-2266 (1993)])이 기재되어 있다. 따라서, 이러한 기술은 모노클로날 항체 단리를 위한 전통적인 모노클로날 항체 하이브리도마 기술의 실행가능한 대안이다.
DNA는 또한 예를 들어 상동성 뮤린 서열 대신에 인간 중쇄 및 경쇄 불변 도메인에 대한 코딩 서열을 치환시키거나 (미국 특허 번호 4,816,567; 문헌 [Morrison et al., Proc. Natl Acad. Sci. USA 81:6851 (1984)]), 또는 이뮤노글로불린 코딩 서열에 비-이뮤노글로불린 폴리펩티드에 대한 코딩 서열의 전부 또는 일부를 공유 결합에 의해 연결함으로써 변형시킬 수 있다.
전형적으로, 이러한 비-이뮤노글로불린 폴리펩티드는 항체의 불변 도메인 대신 사용되거나 항체의 한 항원 결합 부위의 가변 도메인 대신 사용되어, 항원에 대한 특이성을 갖는 하나의 항원 결합 부위 및 상이한 항원에 대한 특이성을 갖는 또 다른 항원 결합 부위를 포함하는 키메라 2가 항체를 생성시킨다.
(iv) 인간화 항체
일부 실시양태에서, 항체는 인간화 항체이다. 비-인간 항체를 인간화하는 방법은 당업계에 기재되어 있다. 일부 실시양태에서, 인간화 항체는 비-인간 공급원으로부터 그 내로 도입되는 하나 이상의 아미노산 잔기를 갖는다. 이들 비-인간 아미노산 잔기는 종종 "도입" 잔기라 지칭되고, 전형적으로는 "도입" 가변 도메인으로부터의 것이다. 인간화는 본질적으로 인간 항체의 상응하는 서열을 초가변 영역 서열로 치환함으로써 윈터(Winter) 및 동료들의 방법 (문헌 [Jones et al., Nature 321:522-525 (1986)]; [Riechmann et al., Nature 332:323-327 (1988)]; [Verhoeyen et al., Science 239:1534-1536 (1988)])에 따라 수행될 수 있다. 따라서, 이러한 "인간화" 항체는 무손상 인간 가변 도메인보다 실질적으로 더 적은 부분이 비-인간 종으로부터의 상응하는 서열로 치환된 키메라 항체 (미국 특허 번호 4,816,567)이다. 실제로, 인간화 항체는 전형적으로 일부 초가변 영역 잔기 및 가능하게는 일부 FR 잔기가 설치류 항체의 유사 부위로부터의 잔기로 치환된 인간 항체이다.
인간화 항체의 제조에 사용되는 인간 가변 도메인 경쇄 및 중쇄 둘 다의 선택은 항원성 감소에 매우 중요하다. 소위 "최적 맞춤(best-fit)" 방법에 따라, 설치류 항체의 가변 도메인 서열을 공지의 인간 가변 도메인 서열의 전체 라이브러리에 대해 스크리닝한다. 이어서, 설치류의 서열에 가장 근접한 인간 서열이 인간화 항체에 대한 인간 프레임워크 영역 (FR)으로서 받아들여진다 (문헌 [Sims et al., J. Immunol. 151:2296 (1993)]; [Chothia et al., J. Mol. Biol. 196:901 (1987)]). 또 다른 방법은 경쇄 또는 중쇄 가변 영역의 특정 하위군의 모든 인간 항체의 컨센서스(consensus) 서열로부터 유래된 특정 프레임워크를 이용한다. 동일한 프레임워크가 여러 개의 상이한 인간화 항체에 사용될 수 있다 (문헌 [Carter et al., Proc. Natl. Acad. Sci. USA 89:4285 (1992)]; [Presta et al., J. Immunol. 151:2623 (1993)]).
추가로, 항체가 항원에 대해 높은 친화도를 보유하고 다른 유리한 생물학적 특성을 보유하도록 인간화하는 것이 중요하다. 이 목적을 달성하기 위해서, 방법의 일부 실시양태에서, 인간화 항체는 모 서열 및 인간화 서열의 3차원 모델을 이용하는 모 서열 및 다양한 개념적 인간화 생성물의 분석 과정에 의해 제조된다. 3차원 이뮤노글로불린 모델은 통상적으로 이용가능하고, 당업자에게 익숙하다. 선택된 후보 이뮤노글로불린 서열의 가능한 3차원 입체 구조를 설명하고 디스플레이하는 컴퓨터 프로그램을 이용할 수 있다. 이러한 디스플레이를 조사하면 후보 이뮤노글로불린 서열의 기능에 있어서 잔기의 가능한 역할의 분석, 즉 후보 이뮤노글로불린이 그의 항원에 결합하는 능력에 영향을 미치는 잔기의 분석이 가능하다. 이러한 방식으로, FR 잔기는 수용자 서열 및 도입 서열로부터 선택 및 조합되어 원하는 항체 특징, 예를 들어 표적 항원(들)에 대한 친화도 증가를 달성할 수 있다. 일반적으로, 항원 결합에 대한 영향에는 초가변 영역 잔기가 직접적이고 가장 실질적으로 관여한다.
(v) 인간 항체
일부 실시양태에서, 항체는 인간 항체이다. 인간화에 대한 대안책으로서 인간 항체를 생성할 수 있다. 예를 들어, 면역화시, 내인성 이뮤노글로불린 생성의 부재 하에 인간 항체의 전체 레퍼토리를 생성할 수 있는 트랜스제닉 동물 (예를 들어, 마우스)을 생성하는 것이 현재 가능하다. 예를 들어, 키메라 및 배선 돌연변이 마우스에서 항체 중쇄 연결 영역 (JH) 유전자를 동형접합 결실시키면 내인성 항체의 생성이 완전히 억제된다고 기재된 바 있다. 인간 배선 이뮤노글로불린 유전자 어레이를 이같은 배선 돌연변이체 마우스에게 전달하면, 항원 접종 시 인간 항체가 생성될 것이다. 예를 들어, 문헌 [Jakobovits et al., Proc. Natl. Acad. Sci. USA 90:2551 (1993)]; [Jakobovits et al., Nature 362:255-258 (1993)]; [Bruggermann et al., Year in Immuno. 7:33 (1993)]; 및 미국 특허 번호 5,591,669; 5,589,369; 및 5,545,807을 참조한다.
대안적으로, 파지 디스플레이 기술 (문헌 [McCafferty et al., Nature 348:552-553 (1990)])이 면역화되지 않은 공여자로부터의 이뮤노글로불린 가변 (V) 도메인 유전자 레퍼토리로부터 시험관내에서 인간 항체 및 항체 단편을 생성하는데 이용될 수 있다. 이러한 기술에 따라, 항체 V 도메인 유전자를 사상 박테리오파지, 예컨대 M13 또는 fd의 주요 또는 소수의 코트 폴리펩티드 유전자로 프레임에 맞게 클로닝하고, 파지 입자의 표면상에 기능적 항체 단편으로서 디스플레이한다. 사상 입자는 파지 게놈의 단일 가닥 DNA 카피를 함유하기 때문에, 항체의 기능적 특성에 기초한 선택에 의해 이러한 특성을 나타내는 항체를 코딩하는 유전자도 선택된다. 따라서, 파지는 B 세포의 특성의 일부를 모방한다. 파지 디스플레이는 다양한 포맷으로 수행될 수 있고, 이에 대한 검토를 위해서는 예를 들어 문헌 [Johnson, Kevin S. and Chiswell, David J., Current Opinion in Structural Biology 3:564-571 (1993)]을 참조한다. V-유전자 절편의 여러 공급원이 파지 디스플레이에 사용될 수 있다. 문헌 [Clackson et al., Nature 352:624-628 (1991)]에서는 면역화된 마우스의 비장으로부터 유래된 V 유전자의 소형 무작위 조합형 라이브러리로부터 항-옥사졸론 항체의 다양한 어레이가 단리되었다. 비면역처리된 인간 공여자로부터의 V 유전자 레퍼토리를 제조할 수 있고, 다양한 항원 어레이 (자가항원 포함)에 대한 항체는 본질적으로 문헌 [Marks et al., J. Mol. Biol. 222:581-597 (1991)], 또는 [Griffith et al., EMBO J. 12:725-734 (1993)]에 기재된 기술에 따라 단리될 수 있다. 또한, 미국 특허 번호 5,565,332 및 5,573,905를 참조한다.
인간 항체는 또한 시험관내 활성화된 B 세포에 의해 생성될 수도 있다 (미국 특허 번호 5,567,610 및 5,229,275 참조).
(vi) 항체 단편
일부 실시양태에서, 항체는 항체 단편이다. 항체 단편 생성을 위한 다양한 기술이 개발되었다. 전통적으로, 이들 단편은 무손상 항체의 단백질분해성 분해를 통해 유래되었다 (예를 들어, 문헌 [Morimoto et al., Journal of Biochemical and Biophysical Methods 24:107-117 (1992)] 및 [Brennan et al., Science 229:81 (1985)] 참조). 그러나, 현재 이러한 단편들이 재조합 숙주 세포에 의해 직접적으로 생성될 수 있다. 예를 들어, 항체 단편은 상기 논의된 항체 파지 라이브러리로부터 단리될 수 있다. 대안적으로, Fab'-SH 단편은 이. 콜라이로부터 직접 회수되고 화학적으로 커플링되어 F(ab')2 단편을 형성할 수 있다 (문헌 [Carter et al., Bio/Technology 10:163-167 (1992)]). 또 다른 접근법에 따라, F(ab')2 단편은 재조합 숙주 세포 배양물로부터 직접 단리될 수 있다. 항체 단편의 생성을 위한 또 다른 기술들이 당업자에게 명백할 것이다. 다른 실시양태에서, 선택된 항체는 단일쇄 Fv 단편 (scFv)이다. WO 93/16185; 미국 특허 번호 5,571,894; 및 미국 특허 번호 5,587,458을 참조한다. 항체 단편은, 예를 들어 미국 특허 번호 5,641,870에 기재된 바와 같은, 예를 들어 "선형 항체"일 수도 있다. 이러한 선형 항체 단편은 단일특이적 또는 이중특이적일 수 있다.
일부 실시양태에서, 본원에 기재된 항체의 단편이 제공된다. 일부 실시양태에서, 항체 단편은 항원 결합 단편이다.
(vii) 이중특이적 항체
일부 실시양태에서, 항체는 이중특이적 항체이다. 이중특이적 항체는 2종 이상의 상이한 에피토프에 결합 특이성을 갖는 항체이다. 예시적인 이중특이적 항체는 2개의 상이한 에피토프에 결합할 수 있다. 대안적으로, 이중특이적 항체 결합 아암 (arm)은 세포 방어 메카니즘을 세포에 집중시키도록 백혈구 상의 촉발 (triggering) 분자, 예컨대 T-세포 수용체 분자 (예를 들어, CD2 또는 CD3), 또는 IgG에 대한 Fc 수용체 (FcγR), 예컨대 FcγRI (CD64), FcγRII (CD32) 및 FcγRIII (CD16)에 결합하는 아암과 조합될 수 있다. 이중특이적 항체는 전장 항체 또는 항체 단편 (예를 들어, F(ab')2 이중특이적 항체)으로 제조될 수 있다.
이중특이적 항체의 제조 방법은 당업계에 공지되어 있다. 전장 이중특이적 항체의 통상적인 생성법은 2개의 이뮤노글로불린 중쇄-경쇄 쌍의 공동 발현을 기초로 하며, 여기서 2개의 쇄는 상이한 특이성을 갖는다 (문헌 [Millstein et al., Nature 305:537-539 (1983)]). 이뮤노글로불린 중쇄 및 경쇄의 무작위 분류로 인해, 이들 하이브리도마 (쿼드로마(quadroma))는 10종의 상이한 항체 분자들의 잠재적인 혼합물을 생성하며, 이 중에서 오직 1종만이 정확한 이중특이적 구조를 갖는다. 통상적으로 친화도 크로마토그래피 단계에 의해 수행되는 상기 정확한 분자의 정제는 다소 성가시고 생성 수율이 낮다. 유사한 절차가 WO 93/08829, 및 문헌 [Traunecker et al., EMBO J., 10:3655-3659 (1991)]에 개시되어 있다.
다른 접근법에 따라, 원하는 결합 특이성 (항체 항원 결합 부위)을 갖는 항체 가변 도메인을 이뮤노글로불린 불변 도메인 서열에 융합시킨다. 일부 실시양태에서, 융합은 적어도 힌지, CH2 및 CH3 영역의 일부를 포함하는 이뮤노글로불린 중쇄 불변 도메인을 사용한다. 일부 실시양태에서, 경쇄 결합에 필요한 부위를 함유하는 제1 중쇄 불변 영역 (CH1)이 하나 이상의 융합체에 존재한다. 이뮤노글로불린 중쇄 융합체 및 원하는 경우에는 이뮤노글로불린 경쇄를 코딩하는 DNA를 별개의 발현 벡터 내로 삽입하고, 적합한 숙주 유기체 내로 공동형질감염시킨다. 이것은 구축에 사용된 3종의 폴리펩티드 쇄의 동일하지 않은 비율이 최적의 수율을 제공하는 실시양태에서 상기 3종의 폴리펩티드 단편의 상호 비율을 조절하는데 있어서 큰 유연성을 제공한다. 그러나, 동일한 비율의 2종 이상의 폴리펩티드 쇄의 발현으로 높은 수율이 수득되는 경우, 또는 비율이 특별한 유의성을 갖지 않는 경우, 2종 또는 모든 3종의 폴리펩티드 쇄에 대한 코딩 서열을 1개의 발현 벡터에 삽입할 수 있다.
이러한 접근법의 일부 실시양태에서, 이중특이적 항체는 한쪽 아암 내에 제1 결합 특이성을 갖는 하이브리드 이뮤노글로불린 중쇄, 및 다른쪽 아암 내의 하이브리드 이뮤노글로불린 중쇄-경쇄 쌍 (제2 결합 특이성을 제공함)으로 구성된다. 이중특이적 분자의 절반에만 이뮤노글로불린 경쇄가 존재하는 것이 용이한 분리 방법을 제공하기 때문에, 이러한 비대칭 구조는 원치않는 이뮤노글로불린 쇄 조합물로부터 원하는 이중특이적 화합물의 분리를 용이하게 하는 것으로 밝혀졌다. 이러한 접근법은 WO 94/04690에 개시되어 있다. 이중-특이적 항체의 생성의 추가의 상세내용에 대해, 예를 들어 문헌 [Suresh et al., Methods in Enzymology 121:210 (1986)]을 참조할 수 있다.
미국 특허 번호 5,731,168에 기재된 또 다른 접근법에 따라, 한쌍의 항체 분자들 사이의 인터페이스는 재조합 세포 배양물로부터 회수되는 이종이량체의 백분율(%)을 최대화하도록 조작될 수 있다. 일부 실시양태에서, 인터페이스는 항체 불변 도메인의 CH3 도메인의 적어도 일부를 포함한다. 이러한 방법에서, 1차 항체 분자의 인터페이스로부터 하나 이상의 작은 아미노산 측쇄가 보다 큰 측쇄 (예를 들어, 티로신 또는 트립토판)로 대체된다. 큰 아미노산 측쇄를 더 작은 아미노산 측쇄 (예를 들어, 알라닌 또는 트레오닌)로 대체함으로써 큰 측쇄(들)에 대한 동일하거나 유사한 크기의 보상 "공동(cavity)"이 2차 항체 분자의 인터페이스에 생성된다. 이는 동종이량체와 같은 다른 원치않는 최종-생성물에 비해 이종이량체의 수율을 증가시키는 메카니즘을 제공한다.
이중특이적 항체는 가교된 또는 "이종접합" 항체를 포함한다. 예를 들어, 이종접합체 내의 항체들 중 하나는 아비딘에 커플링되고, 다른 하나는 비오틴에 커플링될 수 있다. 이러한 항체들은, 예를 들어 원치않는 세포에 대한 면역계 세포의 표적화 (미국 특허 번호 4,676,980), 및 HIV 감염의 치료 (WO 91/00360, WO 92/200373, 및 EP 03089)를 위해서 제안되었다. 임의의 편리한 가교 방법을 이용하여 이종접합체 항체가 제조될 수 있다. 적합한 가교제가 당업계에 널리 공지되어 있고, 수많은 가교 기술과 함께 미국 특허 번호 4,676,980에 개시되어 있다.
항체 단편으로부터 이중특이적 항체를 생성시키는 기술이 또한 문헌에 기재되어 있다. 예를 들어, 화학적 연결을 이용하여 이중특이적 항체를 제조할 수 있다. 문헌 [Brennan et al., Science 229: 81 (1985)]은 무손상 항체를 단백질가수분해로 절단하여 F(ab')2 단편을 생성하는 절차를 기재한다. 이러한 단편을 디티올 착화제인 아비산나트륨의 존재 하에 환원시켜, 인접한 디티올들을 안정화시키고 분자간 디술피드 형성을 방지한다. 그 후 생성된 Fab' 단편을 티오니트로벤조에이트 (TNB) 유도체로 전환시킨다. 그 후 Fab'-TNB 유도체 중 하나를 메르캅토에틸아민으로의 환원에 의해 Fab'-티올로 재전환시키고 등몰량의 다른 Fab'-TNB 유도체와 혼합하여 이중특이적 항체를 형성시킨다. 생성된 이중특이적 항체를 효소의 선택적 고정화를 위한 효능제로서 사용할 수 있다.
재조합 세포 배양물로부터 직접적으로 이중특이적 항체 단편을 제조 및 단리하기 위한 다양한 기술이 또한 기재되었다. 예를 들어, 류신 지퍼를 사용하여 이중특이적 항체가 생성되었다. 문헌 [Kostelny et al., J. Immunol. 148(5):1547-1553 (1992)]. Fos 및 Jun 단백질로부터의 류신 지퍼 펩티드가 2개의 상이한 항체의 Fab' 부분에 유전자 융합에 의해 연결되었다. 항체 동종이량체가 힌지 영역에서 환원되어 단량체가 형성된 후, 다시 산화되어 항체 이종이량체가 형성되었다. 이러한 방법은 항체 동종이량체의 생성에 또한 이용될 수 있다. 문헌 [Hollinger et al., Proc. Natl. Acad. Sci. USA 90:6444-6448 (1993)]에 기재된 "디아바디" 기술은 이중특이적 항체 단편의 제조를 위한 대안적인 메카니즘을 제공한다. 이 단편은 동일한 쇄 상의 2개의 도메인이 쌍을 이루게 하기에는 너무 짧은 링커에 의해 경쇄 가변 도메인 (VL)에 연결된 중쇄 가변 도메인 (VH)을 포함한다. 따라서, 한 단편의 VH 및 VL 도메인이 또 다른 단편의 상보적인 VL 및 VH 도메인과 쌍을 이루게 되어, 2개의 항원 결합 부위가 형성된다. 단일쇄 Fv (sFv) 이량체를 사용하여 이중특이적 항체 단편을 제조하기 위한 또 다른 전략이 또한 보고되었다. 문헌 [Gruber et al., J. Immunol. 152:5368 (1994)]을 참조한다.
2가 초과의 항체가 고려된다. 예를 들어, 삼중특이적 항체를 제조할 수 있다. 문헌 [Tutt et al., J. Immunol. 147: 60 (1991)].
(viii) 다가 항체
일부 실시양태에서, 항체는 다가 항체이다. 다가 항체는 항체가 결합하는 항원을 발현하는 세포에 의해 2가 항체보다 신속하게 내재화 (및/또는 이화)될 수 있다. 본원에 제공된 항체는 3개 이상의 항원 결합 부위를 갖는 다가 항체 (IgM 클래스 이외의 것)일 수 있고 (예를 들어, 4가 항체), 이는 항체의 폴리펩티드 쇄를 코딩하는 핵산의 재조합 발현에 의해 쉽게 생성될 수 있다. 다가 항체는 이량체화 도메인 및 3개 이상의 항원 결합 부위를 포함할 수 있다. 바람직한 이량체화 도메인은 Fc 영역 또는 힌지 영역을 포함한다 (또는 이것으로 이루어진다). 이러한 시나리오에서, 항체는 Fc 영역, 및 Fc 영역의 아미노 말단에 3개 이상의 항원 결합 부위를 포함할 것이다. 본원에서의 바람직한 다가 항체는 3개 내지 약 8개, 그러나 바람직하게는 4개의 항원 결합 부위를 포함한다 (또는 이것으로 이루어진다). 다가 항체는 하나 이상의 폴리펩티드 쇄 (바람직하게는 2개의 폴리펩티드 쇄)를 포함하고, 여기서의 상기 폴리펩티드 쇄(들)은 2개 이상의 가변 도메인을 포함한다. 예를 들어, 폴리펩티드 쇄(들)은 VD1-(X1)n-VD2-(X2)n-Fc (여기서, VD1은 제1 가변 도메인이고, VD2는 제2 가변 도메인이고, Fc는 Fc 영역의 1개의 폴리펩티드 쇄이고, X1 및 X2는 아미노산 또는 폴리펩티드를 나타내고, n은 0 또는 1임)를 포함할 수 있다. 예를 들어, 폴리펩티드 쇄(들)은 VH-CH1-가요성 링커-VH-CH1-Fc 영역 쇄; 또는 VH-CH1-VH-CH1-Fc 영역 쇄를 포함할 수 있다. 본원에서의 다가 항체는 바람직하게는 2개 이상 (바람직하게는 4개)의 경쇄 가변 도메인 폴리펩티드를 추가로 포함한다. 본원에서의 다가 항체는 예를 들어 약 2개 내지 약 8개의 경쇄 가변 도메인 폴리펩티드를 포함할 수 있다. 본원에서 고려되는 경쇄 가변 도메인 폴리펩티드는 경쇄 가변 도메인을 포함하고, 임의로 CL 도메인을 추가로 포함한다.
(ix) 다른 항체 변형
본원에 제공된 항체를 예를 들어 항체의 항원-의존성 세포-매개 세포독성 (ADCC) 및/또는 보체 의존성 세포독성 (CDC)이 향상되도록 이펙터 기능과 관련하여 변형시키는 것이 바람직할 수 있다. 이것은 항체의 Fc 영역에 하나 이상의 아미노산 치환을 도입함으로써 달성될 수 있다. 대안적으로 또는 추가로, 시스테인 잔기(들)이 Fc 영역 내에 도입되어, 이 영역 내에서의 쇄간 디술피드 결합 형성을 허용할 수 있다. 이로써 생성된 동종이량체 항체는 개선된 내재화 능력 및/또는 증가된 보체-매개 세포 사멸 및 항체-의존성 세포성 세포독성 (ADCC)을 가질 수 있다. 문헌 [Caron et al., J. Exp Med. 176:1191-1195 (1992)] 및 [Shopes, B. J., Immunol. 148:2918-2922 (1992)]을 참조한다. 항종양 활성이 향상된 동종이량체성 항체는 문헌 [Wolff et al., Cancer Research 53:2560-2565 (1993)]에 기재된 바와 같이 이종이관능성 가교-링커를 사용하여 제조할 수도 있다. 대안적으로, 이중 Fc 영역을 갖는 항체가 조작될 수 있고, 이에 의해 향상된 보체 매개 용해 및 ADCC 능력을 가질 수 있다. 문헌 [Stevenson et al., Anti-Cancer Drug Design 3:219-230 (1989)]을 참조한다.
항체의 혈청 반감기를 증가시키기 위해, US 2006/0067930 (그 전문이 본원에 참고로 포함됨)에서 기재된 바와 같이 항체에서 아미노산 변경을 수행할 수 있다.
(D) 폴리펩티드 변이체 및 변형
본원에 기재된 폴리펩티드 (항체 포함)의 아미노산 서열 변형(들)이 감소된 점도를 갖는 폴리펩티드 제제 및 감소된 점도를 갖는 폴리펩티드 제제의 제조 방법에 사용될 수 있다.
(ii) 변이체 폴리펩티드
"폴리펩티드 변이체"는 폴리펩티드의 전장 천연 서열, 신호 펩티드가 없는 폴리펩티드 서열, 신호 펩티드가 있거나 없는 폴리펩티드의 세포외 도메인과 약 80% 이상의 아미노산 서열 동일성을 갖는 본원에 정의된 바와 같은 폴리펩티드, 바람직하게는 활성 폴리펩티드를 의미한다. 이러한 폴리펩티드 변이체는 예를 들어 하나 이상의 아미노산 잔기가 전장 천연 아미노산 서열의 N- 또는 C-말단에서 부가되거나 결실된 폴리펩티드를 포함한다. 통상적으로, TAT 폴리펩티드 변이체는 전장 천연 서열 폴리펩티드 서열, 신호 펩티드가 없는 폴리펩티드 서열, 신호 펩티드가 있거나 없는 폴리펩티드의 세포외 도메인에 대해 약 80% 이상의 아미노산 서열 동일성, 대안적으로 약 85%, 90%, 95%, 96%, 97%, 98%, 또는 99% 중 어느 하나 이상의 아미노산 서열 동일성을 가질 것이다. 임의로, 변이체 폴리펩티드는 천연 폴리펩티드 서열과 비교하여 하나 이하의 아미노산 치환, 대안적으로 천연 폴리펩티드 서열과 비교하여 약 2, 3, 4, 5, 6, 7, 8, 9, 또는 10개 중 어느 하나 이하의 보존적 아미노산 치환을 가질 것이다.
변이체 폴리펩티드는 N-말단 또는 C-말단에서 말단절단될 수 있거나, 또는 예를 들어 전장 천연 폴리펩티드와 비교하여 내부 잔기가 결여될 수 있다. 특정 변이체 폴리펩티드는 원하는 생물학적 활성에 필수적이지 않은 아미노산 잔기가 결여될 수 있다. 말단절단, 결실 및 삽입을 갖는 이들 변이체 폴리펩티드는 임의의 다수의 통상적인 기술에 의해 제조될 수 있다. 원하는 변이체 폴리펩티드는 화학적으로 합성될 수 있다. 또 다른 적합한 기술은 폴리머라제 연쇄 반응 (PCR)에 의한, 원하는 변이체 폴리펩티드를 코딩하는 핵산 단편의 단리 및 증폭을 포함한다. 핵산 단편의 원하는 말단을 규정하는 올리고뉴클레오티드는 PCR에서 5' 및 3' 프라이머에서 사용된다. 바람직하게는, 변이체 폴리펩티드는 본원에 개시된 천연 폴리펩티드와 하나 이상의 생물학적 및/또는 면역학적 활성을 공유한다.
아미노산 서열 삽입에는 길이 범위가 하나의 잔기 내지 100개 이상의 잔기를 함유하는 폴리펩티드에 이르는 아미노- 및/또는 카르복실-말단 융합 뿐만 아니라 단일 또는 다수 아미노산 잔기의 서열내 삽입이 포함된다. 말단 삽입의 예로는 N-말단 메티오닐 잔기가 있는 항체 또는 세포독성 폴리펩티드에 융합된 항체가 포함된다. 항체 분자의 다른 삽입 변이체에는 항체의 혈청 반감기를 증가시키는 효소 또는 폴리펩티드가 항체의 N- 또는 C-말단에 융합된 것이 포함된다.
예를 들어, 폴리펩티드의 결합 친화도 및/또는 다른 생물학적 특성을 개선시키는 것이 바람직할 수 있다. 폴리펩티드의 아미노산 서열 변이체는 적절한 뉴클레오티드 변화를 항체 핵산 내에 도입함으로써, 또는 펩티드 합성에 의해 제조된다. 이러한 변형은 예를 들어 폴리펩티드의 아미노산 서열 내 잔기로부터의 결실 및/또는 이들로의 삽입 및/또는 이들의 치환을 포함한다. 최종 구축물이 원하는 특성을 갖는다는 조건하에 결실, 삽입 및 치환의 임의 조합이 이루어져 최종 구축물에 도달된다. 아미노산 변화는 또한, 폴리펩티드 (예를 들어, 항체)의 번역 후 프로세싱을 변경시킬 수 있는데, 예컨대 글리코실화 부위의 수 또는 위치를 변화시킬 수 있다.
어느 아미노산 잔기가 원하는 활성에 불리한 영향을 주지 않으면서 삽입, 치환 또는 결실될 수 있는지를 결정할 때의 지침은 폴리펩티드의 서열을 공지의 상동성 폴리펩티드 분자의 서열과 비교하고, 높은 상동성 영역에서 이루어진 아미노산 서열 변화의 수를 최소화함으로써 찾아볼 수 있다.
돌연변이유발에 대해 바람직한 위치인 폴리펩티드 (예를 들어, 항체)의 특정 잔기 또는 영역의 확인에 유용한 방법은 문헌 [Cunningham and Wells, Science 244:1081-1085 (1989)]에 기재된 바와 같이 "알라닌 스캐닝 돌연변이유발"로 불린다. 여기서, 잔기 또는 표적 잔기들의 군이 확인되고 (예를 들어, 대전된 잔기, 예컨대 Arg, Asp, His, Lys, 및 Glu), 중성 또는 음으로 대전된 아미노산 (가장 바람직하게는 알라닌 또는 폴리알라닌)으로 치환되어 아미노산과 항원과의 상호작용에 영향을 미친다. 그 후, 치환에 대해 기능적 감수성을 나타내는 아미노산 위치가 치환 부위에 또는 치환 부위에 대해 추가적인 또는 다른 변이체를 도입함으로써 정련된다. 따라서, 아미노산 서열 변이를 도입하기 위한 부위는 미리 결정되지만, 돌연변이 그 자체의 성질을 미리 결정할 필요는 없다. 예를 들어, 주어진 부위에서의 돌연변이의 성능을 분석하기 위해, ala 스캐닝 또는 무작위 돌연변이유발을 표적 코돈 또는 영역에서 수행하고, 발현된 항체 변이체를 원하는 활성에 대하여 스크리닝한다.
또 다른 유형의 변이체는 아미노산 치환 변이체이다. 이러한 변이체에서는 항체 분자 내의 하나 이상의 아미노산 잔기가 상이한 잔기로 대체된다. 치환 돌연변이유발에 가장 흥미로운 부위에는 초가변 영역이 포함되지만, FR 변경 또한 고려된다. 보존적 치환은 "바람직한 치환"의 표제 하에 하기 표 1에 나타낸다. 이러한 치환이 생물학적 활성의 변화를 초래하면, 표 1에서 "예시적인 치환"으로 명명되거나, 아미노산 클래스에 대해 하기 추가로 기재된 바와 같은 보다 실질적인 변화를 도입하고 생성물을 스크리닝할 수 있다.
폴리펩티드의 생물학적 특성에 있어서의 실질적인 변형은 (a) 예를 들어 시트 또는 나선 입체 형태로서, 치환 영역 내의 폴리펩티드 백본의 구조, (b) 표적 부위에서의 분자의 전하 또는 소수성, 또는 (c) 측쇄의 부피를 유지하는 것에 대한 효과가 현저하게 상이한 치환을 선택함으로써 달성된다. 아미노산은 그의 측쇄 특성의 유사성에 따라 하기 군으로 나뉠 수 있다 (문헌 [A. L. Lehninger, Biochemistry second ed., pp. 73-75, Worth Publishers, New York (1975)]):
(1) 비극성: Ala (A), Val (V), Leu (L), Ile (I), Pro (P), Phe (F), Trp (W), Met (M)
(2) 대전되지 않은 극성: Gly (G), Ser (S), Thr (T), Cys (C), Tyr (Y), Asn (N), Gln (Q)
(3) 산성: Asp (D), Glu (E)
(4) 염기성: Lys (K), Arg (R), His (H).
대안적으로, 천연 발생 잔기는 공통적인 측쇄 특성에 기초하여 하기 군으로 나뉠 수 있다:
(1) 소수성: 노르류신, Met, Ala, Val, Leu, Ile;
(2) 중성 친수성: Cys, Ser, Thr, Asn, Gln;
(3) 산성: Asp, Glu;
(4) 염기성: His, Lys, Arg;
(5) 쇄 배향에 영향을 미치는 잔기: Gly, Pro;
(6) 방향족: Trp, Tyr, Phe.
비-보존적 치환은 이들 부류 중의 하나의 구성원을 또 다른 부류로 교환하는 것을 수반할 것이다.
또한, 항체의 적당한 형태 유지에 관여하지 않는 임의의 시스테인 잔기가 일반적으로 세린으로 치환되어 분자의 산화 안정성을 개선시키고 이상 가교를 방지할 수 있다. 역으로, 시스테인 결합(들)이 폴리펩티드에 부가되어 그의 안정성이 개선될 수 있다 (특히, 항체가 Fv 단편과 같은 항체 단편인 경우).
특히 바람직한 유형의 치환 변이체는 모 항체 (예를 들어, 인간화 항체)의 하나 이상의 초가변 영역 잔기를 치환하는 것을 수반하였다. 일반적으로, 추가적인 개발용으로 선택된 생성된 변이체(들)은 이들이 생성되는 모 항체에 비해 생물학적 특성이 개선될 것이다. 이러한 치환 변이체를 생성하는 편리한 방법은 파지 디스플레이를 사용한 친화도 성숙이다. 간략하게, 몇몇 초가변 영역 부위 (예를 들어, 6 내지 7개 부위)가 각각의 부위에서 모든 가능한 아미노 치환이 생성되도록 돌연변이된다. 이로써 생성된 항체 변이체를 사상 파지 입자로부터 각 입자 내에 패키지된 M13의 유전자 III 생성물에 대한 융합체로서 1가 방식으로 디스플레이시킨다. 이어서, 파지-디스플레이된 변이체를 본원에 개시된 바와 같이 그의 생물학적 활성 (예를 들어, 결합 친화도)에 대해 스크리닝한다. 변형을 위한 후보 초가변 영역 부위를 확인하기 위해, 알라닌-스캐닝 돌연변이유발을 수행하여 항원 결합에 유의하게 기여하는 초가변 영역 잔기를 확인할 수 있다. 대안적으로 또는 추가로, 항체와 표적 사이의 접촉 지점을 확인하기 위해서는 항원 항체 복합체의 결정 구조를 분석하는 것이 유익할 수 있다. 이같은 접촉 잔기와 이웃 잔기는 본원에서 상술된 기술에 따른 치환에 대한 후보이다. 일단 이같은 변이체가 생성되면, 변이체들의 패널을 본원에 기재된 바와 같이 스크리닝하고, 한가지 이상의 관련 검정에서 탁월한 특성을 갖는 항체를 추가적인 개발을 위해 선택할 수 있다.
폴리펩티드의 아미노산 변이체의 또 다른 유형은 항체의 원래의 글리코실화 패턴을 변경시킨다. 폴리펩티드는 비-아미노산 잔기를 포함할 수 있다. 예를 들어, 폴리펩티드는 글리코실화될 수 있다. 이러한 글리코실화는 숙주 세포 또는 숙주 유기체에서 폴리펩티드가 발현되는 동안 천연적으로 발생할 수 있거나, 인간 개입에서 비롯되는 의도적 변형일 수 있다. 변경은 폴리펩티드에서 발견되는 하나 이상의 탄수화물 잔기를 결실시키는 것 및/또는 폴리펩티드에 존재하지 않는 하나 이상의 글리코실화 부위를 부가하는 것을 의미한다.
폴리펩티드의 글리코실화는 전형적으로 N-연결되거나 O-연결된다. N-연결은 탄수화물 잔기가 아스파라긴 잔기의 측쇄에 부착된 것을 나타낸다. 트리펩티드 서열, 아스파라긴-X-세린 및 아스파라긴-X-트레오닌 (여기서, X는 프롤린을 제외한 임의의 아미노산임)이 아스파라긴 측쇄로 탄수화물 잔기를 효소적으로 부착시키기 위한 인식 서열이다. 따라서, 이러한 트리펩티드 서열 중 하나가 폴리펩티드에 존재함으로써 잠재적인 글리코실화 부위가 생성된다. O-연결된 글리코실화는 당 N-아세틸갈락토사민, 갈락토스 또는 크실로스 중의 하나가 히드록시아미노산, 가장 통상적으로는 세린 또는 트레오닌에 부착되는 것을 지칭하지만, 5-히드록시프롤린 또는 5-히드록시리신 또한 사용될 수 있다.
폴리펩티드에 글리코실화 부위를 부가하는 것은 항체가 하나 이상의 상기 기술된 트리펩티드 서열을 함유하도록 아미노산 서열을 변경시킴으로써 편리하게 달성된다 (N-연결된 글리코실화 부위의 경우). 또한 변경은 원래의 항체의 서열에 대한 하나 이상의 세린 또는 트레오닌 잔기의 부가 또는 치환에 의해 달성될 수 있다 (O-연결된 글리코실화 부위의 경우).
폴리펩티드 상에 존재하는 탄수화물 잔기의 제거는 화학적으로 또는 효소에 의해, 또는 글리코실화의 표적으로 기능하는 아미노산 잔기를 코딩하는 코돈의 돌연변이에 의한 치환에 의해 달성할 수 있다. 화학적 탈글리코실화 기술은 당업계에 공지되어 있고 기재되어 있다. 폴리펩티드 상의 탄수화물 잔기의 효소적 절단은 다양한 엔도- 및 엑소-글리코시다제의 사용에 의해 달성될 수 있다.
다른 변형은 글루타미닐 및 아스파라기닐 잔기의 각각 상응하는 글루타밀 및 아스파르틸 잔기로의 탈아미드화, 프롤린 및 리신의 히드록실화, 세릴 또는 트레오닐 잔기의 히드록실 기의 인산화, 리신, 아르기닌, 및 히스티딘 측쇄의 α-아미노 기의 메틸화, N-말단 아민의 아세틸화, 및 임의의 C-말단 카르복실 기의 아미드화를 포함한다.
(ii) 키메라 폴리펩티드
본원에 기재된 폴리펩티드는 다른 이종성 폴리펩티드 또는 아미노산 서열에 융합된 폴리펩티드를 포함하는 키메라 분자를 형성하는 방식으로 변형될 수 있다. 일부 실시양태에서, 키메라 분자는 항-태그 항체가 그에 대해 선택적으로 결합할 수 있는 에피토프를 제공하는 태그 폴리펩티드와 폴리펩티드의 융합체를 포함한다. 에피토프 태그는 일반적으로 폴리펩티드의 아미노- 또는 카르복실-말단에 위치한다. 이러한 에피토프-태그가 부착된 형태의 폴리펩티드의 존재는 태그 폴리펩티드에 대한 항체를 사용하여 검출할 수 있다. 또한, 에피토프 태그를 제공함으로써 항-태그 항체 또는 에피토프 태그에 결합하는 또 다른 유형의 친화도 매트릭스를 사용한 친화도 정제에 의해 폴리펩티드를 쉽게 정제할 수 있다.
대안적인 실시양태에서, 키메라 분자는 이뮤노글로불린 또는 이뮤노글로불린의 특정 구역과 폴리펩티드의 융합체를 포함할 수 있다. 키메라 분자의 2가의 형태의 경우 (또한 "이뮤노어드헤신"으로 언급됨). 본원에 사용된 용어 "이뮤노어드헤신"은 이종 폴리펩티드 ("어드헤신")의 결합 특이성을 이뮤노글로불린 불변 도메인의 이펙터 기능과 조합한 항체-유사 분자를 나타낸다. 구조적으로, 이뮤노어드헤신은 항체의 항원 인식 및 결합 부위가 아닌 (즉, "이종") 원하는 결합 특이성을 갖는 아미노산 서열 및 이뮤노글로불린 불변 도메인 서열의 융합물을 포함한다. 이뮤노어드헤신 분자의 어드헤신 부분은 전형적으로 수용체 또는 리간드의 적어도 결합 부위를 포함하는 인접한 아미노산 서열이다. 이뮤노어드헤신 내의 이뮤노글로불린 불변 도메인 서열은 임의의 이뮤노글로불린, 예컨대 IgG-1, IgG-2, IgG-3 또는 IgG-4 하위유형, IgA (IgA-1 및 IgA-2 포함), IgE, IgD 또는 IgM으로부터 수득될 수 있다.
Ig 융합체는 바람직하게는 Ig 분자 내의 하나 이상의 가변 영역 대신에 가용성 (막횡단 도메인이 결실된 또는 불활성화된) 형태의 폴리펩티드를 치환한 것을 포함한다. 특히 바람직한 실시양태에서, 이뮤노글로불린 융합체는 힌지, CH2 및 CH3, 또는 IgG1 분자의 힌지, CH1, CH2 및 CH3 영역을 포함한다.
(iii) 폴리펩티드 접합체
감소된 점도를 갖는 폴리펩티드 제제 및 감소된 점도를 갖는 폴리펩티드 제제의 제조 방법에 사용하기 위한 폴리펩티드는 세포독성제, 예컨대에 화학요법제, 성장 억제제, 독소 (예를 들어, 박테리아, 진균, 식물 또는 동물 기원의 효소 활성 독소 또는 이들의 단편) 또는 방사성 동위원소 (즉, 방사성접합체)에 접합될 수 있다.
이러한 접합체의 생성에 유용한 화학요법제가 사용될 수 있다. 또한, 사용될 수 있는 효소 활성 독소 및 그의 단편은 디프테리아 A 쇄, 디프테리아 독소의 비결합 활성 단편, (슈도모나스 아에루기노사 (Pseudomonas aeruginosa)로부터의) 외독소 A 쇄, 리신 A 쇄, 아브린 A 쇄, 모데신 A 쇄, 알파-사르신, 알레우리테스 포르디이(Aleurites fordii) 단백질, 디안틴 단백질, 피토라카 아메리카나(Phytolaca americana) 단백질 (PAPI, PAPII 및 PAP-S), 모모르디카 카란티아(momordica charantia) 억제제, 쿠르신, 크로틴, 사파오나리아 오피시날리스(sapaonaria officinalis) 억제제, 겔로닌, 미토겔린, 레스트릭토신, 페노마이신, 에노마이신 및 트리코테센을 포함한다. 다양한 방사성핵종은 방사성접합된 폴리펩티드의 생성에 이용가능하다. 예는 212Bi, 131I, 131In, 90Y, 및 186Re를 포함한다. 폴리펩티드 및 세포독성제의 접합체는 다양한 이관능성 단백질-커플링제, 예컨대 N-숙신이미딜-3-(2-피리딜디티올) 프로피오네이트 (SPDP), 이미노티올란 (IT), 이미도에스테르의 이관능성 유도체 (예컨대 디메틸 아디프이미데이트 HCL), 활성 에스테르 (예컨대 디숙신이미딜 수베레이트), 알데히드 (예컨대 글루타르알데히드), 비스-아지도 화합물 (예컨대 비스(p-아지도벤조일) 헥산디아민), 비스-디아조늄 유도체 (예컨대 비스-(p-디아조늄벤조일)-에틸렌디아민), 디이소시아네이트 (예컨대 톨루엔 2,6-디이소시아네이트) 및 비스-활성 플루오린 화합물 (예컨대 1,5-디플루오로-2,4-디니트로벤젠)를 이용하여 만들어진다. 예를 들어, 리신 면역독소는 문헌 [Vitetta et al., Science 238: 1098 (1987)]에 기재된 바와 같이 제조될 수 있다. 탄소-14-표지된 1-이소티오시아네이토벤질-3-메틸디에틸렌 트리아민펜타아세트산 (MX-DTPA)은 폴리펩티드에 대한 방사성뉴클레오티드의 접합을 위한 예시적인 킬레이트화제이다.
또한, 폴리펩티드 및 하나 이상의 소분자 독소, 예컨대 칼리케아미신, 메이탄시노이드, 트리코텐 및 CC1065, 및 독소 활성을 갖는 이들 독소의 유도체의 접합체도 본원에서 고려된다.
메이탄시노이드는 튜불린 중합을 억제함으로써 작용하는 유사분열 억제제이다. 메이탄신은 동아프리카산 관목 메이테누스 세라타 (Maytenus serrata)로부터 처음 단리되었다. 이후에, 특정 미생물이 또한 메이탄시노이드, 예컨대 메이탄시놀 및 C-3 메이탄시놀 에스테르를 생성하는 것으로 발견되었다. 합성 메이탄시놀 및 그의 유도체 및 유사체가 또한 고려된다. 폴리펩티드-메이탄시노이드 접합체를 제조하는 것으로 당업계에 공지된 다수의 연결 기가 있는데, 예를 들어 미국 특허 번호 5,208,020에 기재된 것이 포함된다. 이러한 연결 기에는 상기 언급된 특허에 기재된 바와 같은, 디술피드 기, 티오에테르 기, 산 불안정 기, 광불안정 기, 펩티다제 불안정 기 또는 에스테라제 불안정 기가 포함되는데, 디술피드 및 티오에테르 기가 바람직하다.
링커는 연결 유형에 따라 다양한 위치에서 메이탄시노이드 분자에 부착될 수 있다. 예를 들어, 에스테르 연결부는 통상적인 커플링 기술을 이용하여 히드록실기와의 반응으로 형성될 수 있다. 상기 반응은 히드록실기를 갖는 C-3 위치, 히드록시메틸로 변형된 C-14 위치, 히드록실기로 변형된 C-15 위치, 및 히드록실기를 갖는 C-20 위치에서 일어날 수 있다. 바람직한 실시양태에서, 상기 연결은 메이탄시놀 또는 메이탄시놀 유사체의 C-3 위치에서 형성된다.
관심있는 또 다른 접합체는 하나 이상의 칼리케아미신 분자와 접합된 폴리펩티드를 포함한다. 칼리케아미신 부류의 항생제는 피코몰 미만의 농도에서 이중 가닥 DNA 절단부를 생성할 수 있다. 칼리케아미신 부류의 접합체의 제조에 대해, 예를 들어, 미국 특허 번호 5,712,374를 참조한다. 사용할 수 있는 칼리케아미신의 구조 유사체는 γ1 I, a2 I, a3 I, N-아세틸-γ1 I, PSAG 및 θ1 I를 포함하나, 이에 제한되는 것은 아니다. 항체가 접합될 수 있는 또 다른 항-종양 약물은 항폴레이트인 QFA이다. 칼리케아미신 및 QFA는 둘 다 세포내 작용 부위를 갖고, 원형질막을 쉽게 통과하지 않는다. 따라서, 폴리펩티드 (예를 들어, 항체) 매개된 내재화를 통한 이들 제제의 세포 흡수는 이들의 세포독성 효과를 크게 향상시킨다.
본 발명의 폴리펩티드에 접합될 수 있는 다른 항종양제는 BCNU, 스트렙토조신, 빈크리스틴 및 5-플루오로우라실, 통합적으로 LL-E33288 복합체로 공지된 제제의 부류 뿐만 아니라 에스페라미신을 포함한다.
일부 실시양태에서, 폴리펩티드는 폴리펩티드와 뉴클레오티드분해 활성을 갖는 화합물 (예를 들어, 리보뉴클레아제 또는 DNA 엔도뉴클레아제, 예컨대 데옥시리보뉴클레아제; DNase) 사이의 접합체일 수 있다.
또 다른 실시양태에서, 폴리펩티드 (예를 들어, 항체)를 종양 예비표적화에 활용하기 위해 "수용체" (상기 스트렙타비딘)에 접합시킬 수 있고, 여기서 폴리펩티드 수용체 접합체는 환자에게 투여한 후에, 소거제를 사용하여 결합되지 않은 접합체를 순환계로부터 제거하고, 이어서 세포독성제 (예를 들어, 방사성 뉴클레오티드)에 접합된 "리간드" (예를 들어, 아비딘)를 투여한다.
일부 실시양태에서, 폴리펩티드는 전구약물 (예를 들어, 펩티딜 화학요법제)를 활성 항암 약물로 전환시키는 전구약물-활성화 효소에 접합될 수 있다. 면역접합체의 효소 성분은 이를 그의 보다 활성인 세포독성 형태로 전환시키도록 하는 방식으로 전구약물에 작용할 수 있는 임의의 효소를 포함한다.
본 발명의 방법에 유용한 효소는 포스페이트-함유 전구약물을 유리 약물로 전환시키는데 유용한 알칼리성 포스파타제; 술페이트-함유 전구약물을 유리 약물로 전환시키는데 유용한 아릴술파타제; 비독성 5-플루오로시토신을 항암 약물인 5-플루오로우라실로 전환시키는데 유용한 시토신 데아미나제; 펩티드-함유 전구약물을 유리 약물로 전환시키는데 유용한 프로테아제, 예를 들어 세라티아 프로테아제, 테르몰리신, 섭틸리신, 카르복시펩티다제 및 카텝신 (예를 들어 카텝신 B 및 L); D-아미노산 치환기를 함유하는 전구약물을 전환시키는데 유용한 D-알라닐카르복시펩티다제; 글리코실화된 전구약물을 유리 약물로 전환시키는데 유용한 탄수화물-절단 효소, 예를 들어 β-갈락토시다제 및 뉴라미니다제; β-락탐으로 유도체화된 약물을 유리 약물로 전환시키는데 유용한 β-락타마제; 및 아민 질소에서 각각 페녹시아세틸기 또는 페닐아세틸기로 유도체화된 약물을 유리 약물로 전환시키는데 유용한 페니실린 아미다제, 예컨대 페니실린 V 아미다제 또는 페니실린 G 아미다제를 포함하지만 이에 제한되지 않는다. 대안적으로, 효소 활성을 갖는 항체 (또한, 당업계에 "아브자임"으로 공지됨)를 사용하여 본 발명의 전구약물을 유리 활성 약물로 전환시킬 수 있다.
(iv) 기타
폴리펩티드의 또 다른 유형의 공유 변형은 폴리펩티드를 다양한 비-단백질성 중합체, 예를 들어 폴리에틸렌 글리콜, 폴리프로필렌 글리콜, 폴리옥시알킬렌, 또는 폴리에틸렌 글리콜 및 폴리프로필렌 글리콜의 공중합체 중 하나에 연결시키는 것을 포함한다. 폴리펩티드는 또한 예를 들어 코아세르베이션 기술 또는 인터페이스 중합으로 제조된 마이크로캡슐 (예를 들어 각각 히드록시메틸셀룰로스 또는 젤라틴-마이크로캡슐 및 폴리-(메틸메틸메타크릴레이트) 마이크로캡슐) 내에, 콜로이드성 약물 전달 시스템 (예를 들어 리포솜, 알부민 미소구, 마이크로유화액, 나노입자 및 나노캡슐) 내에 또는 마크로유화액 내에 포획될 수 있다. 이러한 기술은 문헌 [Remington's Pharmaceutical Sciences, 16th edition, Oslo, A., Ed., (1980)]에 개시되어 있다.
(D) 제제 및 방법에 사용하기 위한 폴리펩티드 수득
본원에 기재된 제제 및 방법에 사용된 폴리펩티드는 재조합 방법을 포함하여 당업계에 널리 공지된 방법을 사용하여 수득할 수 있다. 하기 부분은 이러한 방법에 대한 지침을 제공한다.
(i) 폴리뉴클레오티드
본원에서 구별없이 사용된 바와 같이, "폴리뉴클레오티드" 또는 "핵산"은 임의의 길이의 뉴클레오티드의 중합체를 나타내고, DNA 및 RNA를 포함한다.
폴리펩티드를 코딩하는 폴리뉴클레오티드는 폴리펩티드 mRNA를 보유하고 이를 검출가능한 수준에서 발현시키는 것으로 여겨지는 조직으로부터 제조된 cDNA 라이브러리를 포함하나 이에 제한되지는 않는 임의의 공급원으로부터 수득될 수 있다. 따라서, 폴리펩티드를 코딩하는 폴리뉴클레오티드는 편리하게는 인간 조직으로부터 제조된 cDNA 라이브러리로부터 수득될 수 있다. 폴리펩티드-코딩 유전자는 또한 게놈 라이브러리로부터 또는 공지의 합성 절차 (예를 들어, 자동화 핵산 합성)에 의해 얻을 수 있다.
예를 들어, 폴리뉴클레오티드는 전체 이뮤노글로불린 분자 쇄, 예컨대 경쇄 또는 중쇄를 코딩할 수 있다. 완전한 중쇄는 중쇄 가변 영역 (VH) 뿐만 아니라 중쇄 불변 영역 (CH)를 포함하고, 이는 전형적으로 3개의 불변 도메인 CH1, CH2 및 CH3; 및 "힌지" 영역을 포함할 것이다. 일부 상황에서, 불변 영역의 존재는 바람직할 수 있다.
폴리뉴클레오티드에 의해 코딩될 수 있는 다른 폴리펩티드는 항원-결합 항체 단편, 예컨대 단일 도메인 항체 ("dAb"), Fv, scFv, Fab' 및 F(ab')2 및 "미니바디"를 포함한다. 미니바디는 (전형적으로) CH1 및 CK 또는 CL 도메인을 절제한 2가 항체 단편이다. 미니바디는 종래 항체보다 더 작기 때문에 이들은 임상/진단 용도에서 보다 양호한 조직 침투를 달성하여야 하지만, 2가이므로 이들은 1가 항체 단편, 예컨대 dAb보다 더 높은 결합 친화도를 유지하여야 한다. 따라서, 문맥상 달리 지시되지 않는다면 본원에 사용된 용어 "항체"는 전체 항체 분자 뿐만 아니라 상기 논의된 유형의 항원-결합 항체 단편을 포함한다. 바람직하게는 코딩된 폴리펩티드에 존재하는 각각의 프레임워크 영역은 상응하는 인간 수용자 프레임워크와 관련하여 하나 이상의 아미노산 치환을 포함할 것이다. 따라서, 예를 들어 프레임워크 영역은 수용자 프레임워크 영역과 관련하여 총 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 또는 15개의 아미노산 치환을 포함할 수 있다.
적합하게는, 본원에 기재된 폴리뉴클레오티드는 단리 및/또는 정제될 수 있다. 일부 실시양태에서, 폴리뉴클레오티드는 단리된 폴리뉴클레오티드이다.
용어 "단리된 폴리뉴클레오티드"는 분자가 그의 정상적인 또는 천연 환경에서 제거 또는 분리되거나, 또는 그것이 그의 정상적인 또는 천연 환경에 존재하지 않는 방식으로 생성되는 것을 나타낸다. 일부 실시양태에서, 폴리뉴클레오티드는 정제된 폴리뉴클레오티드이다. 용어 정제된은 적어도 일부 오염 분자 또는 물질이 제거되는 것을 나타낸다.
적합하게는, 폴리뉴클레오티드는 적절한 폴리뉴클레오티드가 조성물에 존재하는 우세한 (즉, 가장 풍부한) 폴리뉴클레오티드를 구성하도록 실질적으로 정제된다.
중쇄 가변 도메인 및/또는 경쇄 가변 도메인을 코딩하는 삽입물을 포함하는 재조합 핵산은 본원에 기재된 방법에 사용될 수 있다. 정의에 의하면 이러한 핵산은 코딩 단일 가닥 핵산, 상기 코딩 핵산으로 이루어진 이중 가닥 핵산 및 이에 상보적인 핵산으로 이루어진 이중 가닥 핵산, 또는 이들 상보적 (단일 가닥) 핵산 자체를 포함한다.
변형(들)은 또한 항체의 중쇄 가변 도메인 및/또는 경쇄 가변 도메인 외부에서 만들어질 수 있다. 이러한 돌연변이체 핵산은 하나 이상의 뉴클레오티드가 동일한 아미노산(들)을 코딩하는 새로운 코돈을 갖는 다른 뉴클레오티드에 의해 치환된 사일런트 돌연변이체일 수 있다. 그러한 돌연변이체 서열은 다의성 서열일 수 있다. 다의성 서열은 제한되지 않는 수의 뉴클레오티드가 본래 코딩된 아미노산 서열을 변화시키지 않으면서 다른 뉴클레오티드에 의해 대체된다는 점에서 유전자 코드의 의미 내에서 다의성을 나타낸다. 이러한 다의성 서열은 중쇄 가변 도메인 및/또는 경쇄 가변 도메인의 최적 발현을 수득하기 위해, 특정한 숙주, 특히 효모, 박테리아 또는 포유동물 세포가 선호하는 특정 코돈의 그의 상이한 제한효소 부위 및/또는 빈도 때문에 유용할 수 있다.
본원에 규정된 특정한 특성을 갖는 폴리펩티드의 아미노산 서열(들)과 소정의 서열 동일성 또는 서열 상동성을 갖는 서열 또는 이러한 폴리펩티드를 코딩하는 임의의 뉴클레오티드 서열 (이하, "상동성 서열(들)"로 지칭됨)을 사용하는 것이 본원에서 제공된다. 여기서, 용어 "동족체"는 대상 아미노산 서열 및 대상 뉴클레오티드 서열과 특정 상동성을 갖는 엔티티(entity)를 의미한다. 여기서, 용어 "상동성"은 "동일성"과 동일할 수 있다.
일부 실시양태에서, 상동성 아미노산 서열 및/또는 뉴클레오티드 서열은 항체의 기능적 활성을 유지하고/거나 항체의 활성을 향상시키는 폴리펩티드를 코딩하여야 한다. 일부 실시양태에서, 상동성 서열은 대상 서열에 대해 75, 85 또는 90% 이상 동일할 수 있는, 바람직하게는 95 또는 98% 이상 동일할 수 있는 아미노산 서열을 포함하도록 선택된다. 전형적으로, 동족체는 대상 아미노산 서열과 동일한 활성 부위 등을 포함할 것이다. 상동성이 또한 유사성 (즉, 유사한 화학적 특성/기능을 갖는 아미노산 잔기)의 관점에서 고려될 수 있다. 일부 실시양태에서, 서열 동일성의 관점에서 상동성을 나타내는 것이 바람직하다.
본 명세서에서, 상동성 서열은 본원에 기재된 폴리펩티드를 코딩하는 뉴클레오티드 서열 (대상 서열)과 75, 85 또는 90% 이상 동일할 수 있는, 바람직하게는 95 또는 98% 이상 동일할 수 있는 뉴클레오티드 서열을 포함하도록 선택된다. 전형적으로, 동족체는 대상 서열과 동일한, 활성 부위 등을 코딩하는 서열을 포함할 것이다. 상동성이 또한 유사성 (즉, 유사한 화학적 특성/기능을 갖는 아미노산 잔기)의 관점에서 고려될 수 있다. 일부 실시양태에서, 서열 동일성의 관점에서 상동성을 나타내는 것이 바람직하다.
이러한 방법에는 천연 공급원으로부터의 단리 (천연 발생 아미노산 서열 변이체의 경우), 또는 폴리펩티드의 앞서 제조된 변이체 또는 비-변이체 버전의 올리고뉴클레오티드-매개 (또는 부위-지정) 돌연변이유발, PCR 돌연변이유발 및 카세트 돌연변이유발에 의한 제조가 포함되지만, 이들로 한정되는 것은 아니다.
(ii) 폴리뉴클레오티드의 발현
하기 설명은 주로 폴리뉴클레오티드를 코딩하는 폴리펩티드를 함유하는 벡터로 형질전환 또는 형질감염된 세포를 배양함으로써 폴리펩티드를 제조하는 것에 관한 것이다. 물론, 폴리펩티드를 제조하기 위해 당업계에 공지되어 있는 다른 방법을 사용할 수 있음이 고려된다. 예를 들어, 적절한 아미노산 서열 또는 그의 일부는 고체-상 기술을 이용한 직접적인 펩티드 합성 (예를 들어, 문헌 [Stewart et al., Solid-Phase Peptide Synthesis W.H. Freeman Co., San Francisco, Calif. (1969)]; [Merrifield, J. Am. Chem. Soc. 85:2149-2154 (1963)] 참조)에 의해 생성될 수 있다. 시험관내 단백질 합성은 수동 기술 또는 자동화에 의해 수행될 수 있다. 자동화 합성은 예를 들어 어플라이드 바이오시스템즈(Applied Biosystems) 펩티드 합성기 (미국 캘리포니아주 포스터 시티)를 제조사의 지침에 따라 사용하여 달성될 수 있다. 폴리펩티드의 다양한 부분들은 별개로 화학적으로 합성되고, 원하는 폴리펩티드를 생성하기 위해 화학적 또는 효소적 방법을 사용하여 조합될 수 있다.
본원에 기재된 폴리뉴클레오티드는 폴리펩티드의 생성을 위한 발현 벡터(들)에 삽입된다. 용어 "제어 서열"은 특정 숙주 유기체 내에서 작동가능하게 연결된 코딩 서열의 발현에 필요한 DNA 서열을 나타낸다. 제어 서열은 프로모터 (예를 들어, 천연 결합 또는 이종 프로모터), 신호 서열, 인핸서 요소, 및 전사 종결 서열을 포함하나, 이에 제한되지는 않는다.
폴리뉴클레오티드는 또 다른 폴리뉴클레오티드 서열과 기능적 관계로 배치될 때 "작동가능하게 연결"된다. 예를 들어, 프리서열 또는 분비 리더에 대한 핵산은 폴리펩티드가 그의 분비에 관여하는 프리단백질로서 발현되는 경우 폴리펩티드에 대한 핵산에 작동가능하게 연결되거나, 프로모터 또는 인핸서는 이것이 서열의 전사에 영향을 미치는 경우 코딩 서열에 작동가능하게 연결되거나, 또는 리보솜 결합 부위는 이것이 번역을 용이하게 하도록 배치되는 경우에 코딩 서열에 작동가능하게 연결된다. 일반적으로, "작동가능하게 연결된"은 연결될 핵산 서열이 인접하여 위치함을 의미하며, 분비 리더의 경우에는 인접하여 위치하고 리딩상 내에 존재하는 것을 의미한다. 그러나, 인핸서는 인접하여 위치할 필요가 없다. 연결은 편리한 제한 부위에서의 라이게이션을 통해 달성된다. 이러한 부위가 존재하지 않는 경우에는 합성 올리고뉴클레오티드 어댑터 또는 링커를 통상적인 관행에 따라 사용한다.
항체의 경우, 경쇄 및 중쇄는 동일하거나 상이한 발현 벡터에 클로닝될 수 있다. 이뮤노글로불린 쇄를 코딩하는 핵산 절편은 이뮤노글로불린 폴리펩티드의 발현을 보장하는 발현 벡터(들)의 제어 서열에 작동가능하게 연결된다.
선택 유전자 성분 - 통상적으로, 발현 벡터는 원하는 DNA 서열로 형질전환된 세포의 검출을 허용하도록 선택 마커 (예를 들어, 암피실린 내성, 히그로마이신 내성, 테트라시클린 내성, 카나마이신 내성 또는 네오마이신 내성)를 함유한다 (예를 들어, 미국 특허 번호 4,704,362 참조). 일부 실시양태에서, 선택 유전자는 (a) 항생제 또는 다른 독소, 예를 들어 암피실린, 네오마이신, 메토트렉세이트 또는 테트라시클린에 대한 내성을 부여하거나, (b) 영양요구성 결핍을 보완하거나, 또는 (c) 복합 배지로부터 얻을 수 없는 중요 영양분을 공급하는 단백질을 코딩하고, 예를 들어 바실러스 (Bacillus)의 경우에는 D-알라닌 라세마제를 코딩하는 유전자이다.
선택 반응식의 한 예는 숙주 세포의 성장을 정지시키기 위해 약물을 사용한다. 이종 유전자로 연속적으로 형질전환된 세포는 약물 내성을 부여하는 단백질을 생성하고, 이에 따라 선택 처방을 살린다. 이러한 우세한 선택의 예는 약물 네오마이신, 미코페놀산 및 히그로마이신을 사용한다.
포유동물 세포에 적합한 선택가능한 마커의 또 다른 예는 본원에 기재된 항체를 코딩하는 핵산을 취하는 세포 성분의 확인을 가능하게 하는 것, 예컨대 DHFR, 티미딘 키나제, 메탈로티오네인-I 및 -III, 바람직하게는 영장류 메탈로티오네인 유전자, 아데노신 데아미나제, 오르니틴 데카르복실라제 등이다.
예를 들어, DHFR 선택 유전자로 형질전환된 세포는 우선 DHFR의 경쟁적 길항제인 메토트렉세이트 (Mtx)를 함유하는 배양 배지에서 모든 형질전환체를 배양함으로써 확인한다. 야생형 DHFR을 사용할 때의 적절한 숙주 세포는 DHFR 활성이 결여된 차이니즈 햄스터 난소 (CHO) 세포주 (예를 들어, ATCC CRL-9096)이다.
대안적으로, 본원에 기재된 폴리펩티드, 야생형 DHFR 단백질, 및 또 다른 선택가능한 마커, 예컨대 아미노글리코시드 3'-포스포트랜스페라제 (APH)를 코딩하는 DNA 서열로 형질전환되거나 공동-형질전환된 숙주 세포 (특히 내인성 DHFR을 함유하는 야생형 숙주)를 아미노글리코시드성 항생제, 예를 들어, 카나마이신, 네오마이신 또는 G418과 같은 선택가능한 마커에 대한 선택제를 함유하는 배지에서의 세포 성장에 의해 선택할 수 있다. 미국 특허 번호 4,965,199를 참조한다.
효모에 사용하기 적합한 선택 유전자는 효모 플라스미드 YRp7에 존재하는 trp1 유전자이다 (문헌 [Stinchcomb et al., Nature 282:39 (1979)]). trp1 유전자는 트립토판에서 성장하는 능력이 결여된 효모의 돌연변이체 균주, 예를 들어 ATCC 번호 44076 또는 PEP4-1에 대한 선택 마커를 제공한다. 문헌 [Jones, Genetics 85:12 (1977)]. 이후, 효모 숙주 세포 게놈 내 trp1 병변의 존재는 트립토판 부재하에서 성장시켜 형질전환을 검출하는데 효과적인 환경을 제공한다. 유사하게, Leu2-결핍 효모 균주 (ATCC 20,622 또는 38,626)는 Leu2 유전자를 보유하는 공지된 플라스미드에 의해 보완된다.
또한, 1.6 ㎛ 원형 플라스미드 pKD1로부터 유래된 벡터는 클루이베로미세스(Kluyveromyces) 효모의 형질전환에 사용될 수 있다. 대안적으로, 재조합 송아지 키모신의 대량 생성용 발현 시스템이 K. 락티스(K. lactis)에 대해 보고되어 있다. 문헌 [Van den Berg, Bio/Technology 8:135 (1990)]. 클루이베로미세스의 산업적 균주에 의한 성숙 재조합 인간 혈청 알부민의 분비를 위한 안정한 다중 카피 발현 벡터도 개시된 바 있다. 문헌 [Fleer et al., Bio/Technology 9:968-975 (1991)].
신호 서열 성분 - 폴리펩티드는 직접적으로 뿐만 아니라, 바람직하게는 신호 서열, 또는 성숙한 폴리펩티드의 N-말단에 특이적 절단 부위를 갖는 다른 폴리펩티드인 이종성 폴리펩티드와의 융합 폴리펩티드로서 재조합 방식으로 생성될 수 있다. 바람직하게 선택된 이종 신호 서열은 숙주 세포에 의해 인식 및 프로세싱 (즉, 신호 펩티다제에 의해 절단)되는 것이다. 신호 서열은 예를 들어 알칼리성 포스파타제, 페니실리나제, 1 pp, 또는 열-안정성 엔테로톡신 II 리더의 군으로부터 선택된 원핵생물 신호 서열로 치환될 수 있다. 효모 분비의 경우에는, 천연 신호 서열을 예를 들어 효모 인버타제 리더, α 인자 리더 (사카로미세스(Saccharomyces) 및 클루이베로미세스 α-인자 리더를 포함함), 산-포스파타제 리더, 씨. 알비칸스(C. albicans) 글루코아밀라제 리더, 또는 WO 90/13646에 기재된 신호로 치환시킬 수 있다. 포유동물 세포 발현시에는, 포유동물 신호 서열 및 또한 바이러스 분비 리더, 예를 들어 단순 포진 gD 신호가 이용가능하다.
이러한 전구체 영역을 위한 핵산 서열은 본원에 기재된 폴리펩티드를 코딩하는 핵산 서열에 리딩 프레임에 맞게 라이게이션된다.
복제 기점 - 발현 벡터 및 클로닝 벡터는 둘 모두 벡터가 하나 이상의 선택된 숙주 세포 내에서 복제될 수 있게 하는 폴리뉴클레오티드 서열을 함유한다. 일반적으로, 클로닝 벡터에서는 상기 서열이 숙주 염색체 DNA와 상관없이 벡터를 복제할 수 있는 것이고, 복제 기점 또는 자율 복제 서열을 포함한다. 이러한 서열은 다양한 박테리아, 효모 및 바이러스에 대해 널리 공지되어 있다. 플라스미드 pBR322로부터의 복제 기점은 대부분의 그람-음성 박테리아에 적합하고, 2μ 플라스미드 기점은 효모에 적합하며, 다양한 바이러스 기점 (SV40, 폴리오마, 아데노바이러스, VSV 또는 BPV)은 포유동물 세포에서의 클로닝 벡터에 유용하다. 일반적으로, 복제 기점 성분은 포유동물 발현 벡터에서는 필요하지 않다 (전형적으로, SV40 기점은 단지 초기 프로모터를 함유하기 때문에 사용될 수 있음).
프로모터 성분 - 발현 및 클로닝 벡터는 통상적으로 숙주 유기체에 의해 인식되고, 폴리펩티드를 코딩하는 핵산에 작동가능하게 연결된 프로모터를 함유한다. 원핵 숙주와 함께 사용하기 적합한 프로모터에는 phoA 프로모터, β-락타마제 및 락토스 프로모터 시스템, 알칼리성 포스파타제 프로모터, 트립토판 (trp) 프로모터 시스템, 및 하이브리드 프로모터, 예컨대 tac 프로모터가 포함된다. 그러나, 다른 공지의 박테리아 프로모터도 적합하다. 박테리아 시스템에 사용하기 위한 프로모터는 또한 폴리펩티드를 코딩하는 DNA에 작동가능하게 연결된 샤인-달가노(S.D.) 서열도 함유할 것이다.
적합하게는, 발현 제어 서열은 진핵 숙주 세포 (예를 들어, COS 세포 - 예컨대 COS 7 세포 - 또는 CHO 세포)를 형질전환 또는 형질감염시킬 수 있는 벡터에서 진핵 프로모터 시스템이다. 벡터가 적절한 숙주로 혼입되면, 숙주는 높은 수준의 뉴클레오티드 서열 발현, 및 교차-반응 항체의 수집 및 정제에 적합한 조건하에 유지된다.
프로모터 서열은 진핵생물에 대해 공지되어 있다. 실질적으로 모든 진핵 유전자는 전사가 개시되는 부위로부터 대략 25 내지 30개 염기 상류에 위치하는 AT-풍부 영역을 갖는다. 많은 유전자의 전사 출발점으로부터 70개 내지 80개 염기 상류에 존재하는 또 다른 서열은 CNCAAT 영역 (여기서, N은 임의의 뉴클레오티드일 수 있음)이다. 코딩 서열의 3' 말단에 폴리 A 꼬리의 부가를 위한 신호일 수 있는 AATAAA 서열이 대부분의 진핵세포 유전자의 3' 말단에 존재한다. 모든 이러한 서열들이 진핵 발현 벡터 내로 적합하게 삽입된다.
효모 숙주를 이용한 경우에 사용하기 적합한 프로모터 서열의 예에는 3-포스포글리세레이트 키나제 또는 다른 글리콜분해 효소, 예를 들어 에놀라제, 글리세르알데히드-3-포스페이트 데히드로게나제, 헥소키나제, 피루베이트 데카르복실라제, 포스포프룩토키나제, 글루코스-6-포스페이트 이소머라제, 3-포스포글리세레이트 뮤타제, 피루베이트 키나제, 트리오스포스페이트 이소머라제, 포스포글루코스 이소머라제, 및 글루코키나제에 대한 프로모터가 포함된다.
성장 조건에 의해 제어되는 전사의 추가의 이점을 갖는 유도성 프로모터인 다른 효모 프로모터는 알콜 데히드로게나제 2, 이소시토크롬 C, 산 포스파타제, 질소 대사와 관련이 있는 분해 효소, 메탈로티오네인, 글리세르알데히드-3-포스페이트 데히드로게나제, 및 말토스 및 갈락토스 이용을 담당하는 효소에 대한 프로모터 영역이다. 효모 발현에 사용하기에 적합한 벡터 및 프로모터는 EP 73,657에 추가로 기재되어 있다. 또한, 효모 인핸서도 효모 프로모터와 함께 유리하게 사용된다.
포유동물 숙주 세포에서 벡터로부터의 본원에 기재된 폴리펩티드 전사는, 예를 들어 폴리오마 바이러스, 계두 바이러스, 아데노바이러스 (예컨대 아데노바이러스 2), 소 유두종 바이러스, 조류 육종 바이러스, 시토메갈로바이러스, 레트로바이러스, B형 간염 바이러스, 및 가장 바람직하게는 유인원 바이러스 40 (SV40)과 같은 바이러스 게놈으로부터 수득한 프로모터, 이종 포유동물 프로모터, 예를 들어 액틴 프로모터 또는 이뮤노글로불린 프로모터, 및 열-쇼크 프로모터에 의해 제어되는데, 단 이러한 프로모터는 숙주 세포 시스템과 상용가능하여야 한다.
SV40 바이러스의 초기 및 후기 프로모터는 SV40 바이러스 복제 기점을 또한 함유하는 SV40 제한 단편으로서 편리하게 수득하였다. 인간 시토메갈로바이러스의 극초기 프로모터가 HindIII E 제한 단편으로 편리하게 수득하였다. 소 파필로마 바이러스를 벡터로서 사용하는 포유동물 숙주에서 DNA를 발현하기 위한 시스템은 미국 특허 번호 4,419,446에 개시되어 있다. 이 시스템의 변형은 미국 특허 번호 4,601,978에 기재되어 있다. 또한, 단순 포진 바이러스로부터의 티미딘 키나제 프로모터의 조절 하에 마우스 세포에서 인간 β-인터페론 cDNA의 발현에 대해서는 문헌 [Reyes et al., Nature 297:598-601 (1982)]을 참조한다. 대안적으로, 라우스 육종 바이러스의 긴 말단 반복체를 프로모터로 사용할 수 있다.
인핸서 요소 성분 - 고등 진핵생물에 의해 본원에 기재 항-산화 LDL 폴리펩티드를 코딩하는 DNA를 전사하는 것은 종종 인핸서 서열을 벡터 내로 삽입함으로써 증가된다. 많은 인핸서 서열이 현재 포유동물 유전자 (글로빈, 엘라스타제, 알부민, α-태아단백질 및 인슐린)로부터 공지되어 있다. 그러나, 전형적으로는 진핵 세포 바이러스로부터의 인핸서를 사용할 것이다. 이것의 예는 복제 기점의 하류 쪽 (bp 100-270)의 SV40 인핸서, 시토메갈로바이러스 초기 프로모터 인핸서, 복제 기점 하류 쪽의 폴리오마 인핸서 및 아데노바이러스 인핸서를 포함한다. 또한, 진핵 프로모터의 활성화를 위한 증강 요소에 대한 문헌 [Yaniv, Nature 297:17-18 (1982)]을 참조한다. 인핸서는 폴리펩티드 코딩 서열에 대한 5' 또는 3' 위치에서 벡터 내로 스플라이싱될 수 있지만, 바람직하게는 프로모터로부터 5' 부위에 위치한다.
전사 종결 성분 - 진핵 숙주 세포 (효모, 진균, 곤충, 식물, 동물, 인간, 또는 다른 다세포 유기체로부터의 유핵 세포)에 사용되는 발현 벡터는 또한 전사의 종결 및 mRNA의 안정화에 필요한 서열을 함유할 것이다. 이러한 서열은 진핵생물 또는 바이러스 DNA 또는 cDNA의 5' 및 때때로 3' 비번역 영역으로부터 통상적으로 이용가능하다. 유용한 전사 종결 성분 중 하나는 소 성장 호르몬 폴리아데닐화 영역이다. WO94/11026 및 이에 개시된 발현 벡터를 참조한다.
폴리뉴클레오티드 서열 (예를 들어, 가변 중쇄 및/또는 가변 경쇄 코딩 서열 및 임의의 발현 제어 서열)를 함유하는 벡터는 세포 숙주의 유형에 따라 달라지는 널리 공지된 방법에 의해 숙주 세포 내로 전달될 수 있다. 예를 들어, 염화칼슘 형질감염이 원핵 세포에 대해 통상적으로 사용되는 반면, 인산칼슘 처리, 전기천공, 리포펙션(lipofection), 바이오리스틱스(biolistics) 또는 바이러스-기재 형질감염은 다른 세포 숙주에 대해 사용될 수 있다. (일반적으로 문헌 [Sambrook et al., Molecular Cloning: A Laboratory Manual (Cold Spring Harbor Press, 2nd ed., 1989] 참조). 포유동물 세포의 형질전환에 사용되는 다른 방법은 폴리브렌, 원형질체 융합, 리포솜, 전기천공 및 미세주사의 사용을 포함한다. 트랜스제닉 동물의 생성을 위해, 트랜스진은 수정란 내에 마이크로주사될 수 있거나, 또는 배아 줄기 세포의 게놈 내로 도입되고, 상기 세포의 핵을 제핵 난모세포 내로 전달할 수 있다.
중쇄 및 경쇄가 별도의 발현 벡터에 클로닝될 때, 벡터를 공동-형질감염시켜 무손상 이뮤노글로불린의 발현체 및 어셈블리를 수득한다. 발현되면, 전체 항체, 이들의 이량체, 개별 경쇄 및 중쇄, 또는 다른 이뮤노글로불린 형태가 황산암모늄 침전, 친화도 칼럼, 칼럼 크로마토그래피, HPLC 정제, 겔 전기영동 등을 비롯한 당업계의 표준 절차에 따라 정제될 수 있다 (일반적으로 문헌 [Scopes, Protein Purification (Springer-Verlag, N.Y., (1982)] 참조). 제약 용도를 위해, 동질성이 약 90% 내지 95% 이상인 실질적으로 순수한 이뮤노글로불린이 바람직하고, 98 내지 99% 이상의 동질성이 가장 바람직하다.
(iii) 구축물
전형적으로 구축물은 적합한 숙주에서 폴리뉴클레오티드에 의해 코딩되는 폴리펩티드(들)의 발현을 허용되는 발현 벡터일 것이다. 구축물은 예를 들어 다음 중 하나 이상을 포함할 수 있다: 숙주에서 활성인 프로모터; 하나 이상의 조절 서열, 예컨대 인핸서; 복제 기점; 및 마커, 바람직하게는 선택가능한 마커. 진핵생물 (및 특히 포유동물) 숙주가 바람직할 수 있더라도, 숙주는 진핵생물 또는 원핵생물 숙주일 수 있다. 적합한 프로모터의 선택은 분명히 어느 정도는 사용되는 숙주 세포에 의존할 것이지만, 인간 바이러스, 예컨대 HSV, SV40, RSV 등으로부터의 프로모터를 포함할 수 있다. 다수의 프로모터가 당업자에게 알려져 있다.
구축물은 3개의 경쇄 초가변 루프 또는 3개의 중쇄 초가변 루프를 포함하는 폴리펩티드를 코딩하는 폴리뉴클레오티드를 포함할 수 있다. 대안적으로, 폴리뉴클레오티드는 적합하게는 적절한 길이의 가요성 링커에 의해 연결되는 3개의 중쇄 초가변 루프 및 3개의 경쇄 초가변 루프를 포함하는 폴리펩티드를 코딩할 수 있다. 또 다른 가능성은 단일 구축물이 2개의 별도의 폴리펩티드 (하나는 경쇄 루프를 포함하고, 하나는 중쇄 루프를 포함함)를 코딩하는 폴리뉴클레오티드를 포함할 수 있다는 것이다. 별도의 폴리펩티드는 독립적으로 발현될 수 있거나 또는 단일 공통 오페론의 일부를 형성할 수 있다.
구축물은 하나 이상의 조절 특성, 예컨대 인핸서, 복제 기점 및 하나 이상의 마커 (선택가능하거나 또는 다름)를 포함할 수 있다. 구축물은 플라스미드, 효모 인공 염색체, 효모 미니-염색체의 형태를 취할 수 있거나, 바이러스, 특히 감쇠된 바이러스 또는 인간에 비-병원성인 유사한 바이러스의 게놈의 전체 또는 부분에 통합될 수 있다.
구축물은 편리하게는 포유동물, 바람직하게는 인간, 대상체에게 안전하게 투여하기 위해 제제화될 수 있다. 전형적으로, 이들은 다수의 분취액으로 제공될 것이고, 각각의 분취액은 하나 이상의 정상적인 성인 인간 대상체의 효과적인 면역화에 충분한 구축물을 함유한다.
구축물은 액체 또는 고체 형태로, 바람직하게는 전형적으로 사용전에 멸균 수성 액체로 재수화되는 동결건조 분말로 제공될 수 있다.
구축물은 아주반트, 또는 구축물의 투여에 반응하여 (예를 들어, 특정 항체 역가에 의해 측정된 바와 같이) 대상체의 면역 반응을 증가시키는 효과를 갖는 다른 성분과 제제화될 수 있다.
(iv) 벡터
용어 "벡터"는 발현 벡터 및 형질전환 벡터 및 셔틀 벡터를 포함한다.
용어 "발현 벡터"는 생체내 또는 시험관내 발현이 가능한 구축물을 의미한다.
용어 "형질전환 벡터"는 하나의 엔티티에서 또 다른 엔티티로 전달될 수 있는 구축물을 의미하고 - 이는 그 종의 것일 수 있거나 상이한 종의 것일 수 있다. 구축물이 하나의 종에서 다른 종으로 - 예컨대 에스케리키아 콜라이(Escherichia coli) 플라스미드에서 박테리아, 예컨대 바실러스 속으로 - 전달될 수 있는 경우, 형질전환 벡터는 때때로 "셔틀 벡터"로 지칭된다. 이는 심지어는 이. 콜라이 플라스미드로부터 아그로박테리움(Agrobacterium)으로 식물로 전달될 수 있는 구축물일 수 있다.
벡터는 본 발명에 포함되는 폴리펩티드의 발현을 제공하기 위해 하기 기재되는 적합한 숙주 세포로 형질전환될 수 있다. 다양한 벡터가 공개적으로 이용가능하다. 벡터는, 예를 들어 플라스미드, 코스미드, 바이러스 입자 또는 파지의 형태일 수 있다. 적절한 핵산 서열을 다양한 절차를 통해 벡터에 삽입할 수 있다. 일반적으로, 당업계 공지의 기술을 이용하여, DNA를 적절한 제한 엔도뉴클레아제 부위(들)에 삽입한다. 이들 성분 중 하나 이상을 함유하는 적합한 벡터의 구축은 당업자에게 공지된 표준 라이게이션 기술을 이용한다.
벡터는 예를 들어 복제 기점, 임의로 상기 폴리뉴클레오티드의 발현을 위한 프로모터 및 임의로 프로모터의 조절제와 함께 제공된 플라스미드, 바이러스 또는 파지 벡터일 수 있다. 벡터는 당업계에 널리 공지된 하나 이상의 선택가능한 마커 유전자를 함유할 수 있다.
이들 발현 벡터는 일반적으로 숙주 유기체 내에서 에피솜으로서 또는 숙주 염색체 DNA의 통합 부분으로서 복제가능하다.
(v) 숙주 세포
숙주 세포는 예를 들어 박테리아, 효모 또는 다른 진균 세포, 곤충 세포, 식물 세포 또는 포유동물 세포일 수 있다.
본 발명은 또한 본 발명에 따라 폴리펩티드를 생성하도록 유전자 조작된 트랜스제닉 다세포 숙주 유기체를 제공한다. 유기체는 예를 들어 트랜스제닉 포유동물 유기체 (예를 들어, 트랜스제닉 염소 또는 마우스 계통)일 수 있다.
적합한 원핵생물은 유박테리움, 예컨대 그람-음성 또는 그람-양성 유기체, 예를 들어 엔테로박테리아세아에 (Enterobacteriaceae), 예컨대 이. 콜라이를 포함하나 이에 제한되지는 않는다. 다양한 이. 콜라이 균주, 예컨대 이. 콜라이 K12 균주 MM294 (ATCC 31,446); 이. 콜라이 X1776 (ATCC 31,537); 이. 콜라이 균주 W3110 (ATCC 27,325) 및 K5 772 (ATCC 53,635)는 공개적으로 입수가능하다. 다른 적합한 원핵 숙주 세포는 엔테로박테리아세아에, 예컨대 에스케리키아 (예를 들어, 이. 콜라이, 엔테로박터 (Enterobacter), 에르위니아 (Erwinia), 클레브시엘라 (Klebsiella), 프로테우스 (Proteus), 살모넬라 (Salmonella), 예를 들어 살모넬라 티피뮤리움 (Salmonella typhimurium), 세라티아 (Serratia), 예를 들어 세라티아 마르세스칸스 (Serratia marcescans) 및 시겔라 (Shigella), 뿐만 아니라 바실러스, 예컨대 B. 서브틸리스 (B. subtilis) 및 B. 리케니포르미스 (B. licheniformis) (예를 들어, B. 리케니포르미스 41P), 슈도모나스, 예컨대 P. 아에루기노사 및 스트렙토미세스 (Streptomyces)를 포함한다. 이러한 예들은 제한적이기보다는 예시적이다. 균주 W3110은 재조합 폴리뉴클레오티드 생성물 발효를 위한 통상적인 숙주 균주이기 때문에 특히 바람직한 숙주 또는 모 숙주 중 하나이다. 바람직하게는, 숙주 세포는 최소량의 단백질분해 효소를 분비한다. 예를 들어, 균주 W3110은 숙주에 내인성인 폴리펩티드를 코딩하는 유전자에 유전자 돌연변이가 발생하도록 변형될 수 있고, 이러한 숙주의 예는 완전한 유전형 tonA를 갖는 이. 콜라이 W3110 균주 1A2, 완전한 유전형 tonA ptr3을 갖는 이. 콜라이 W3110 균주 9E4, 완전한 유전형 tonA ptr3 phoA E15 (argF-lac)169 degP ompT kan'를 갖는 이. 콜라이 W3110 균주 27C7 (ATCC 55,244), 완전한 유전형 tonA ptr3 phoA E15 (argF-lac)169 degP ompT rbs7 ilvG kan'를 갖는 이. 콜라이 W3110 균주 37D6, 비-카나마이신 내성 degP 결실 돌연변이를 갖는 균주 37D6인 이. 콜라이 W3110 균주 40B4, 및 돌연변이체 주변세포질 프로테아제를 갖는 이. 콜라이 균주를 포함한다. 대안적으로, 시험관내 클로닝 방법, 예를 들어 PCR 또는 다른 핵산 폴리머라제 반응이 적합하다.
이들 원핵 숙주에서, 전형적으로 숙주 세포와 상용가능한 발현 제어 서열 (예를 들어, 복제 기점)을 함유하는 발현 벡터를 제조할 수 있다. 또한, 임의의 수의 다양한 공지된 프로모터, 예를 들어 락토스 프로모터 시스템, 트립토판 (trp) 프로모터 시스템, 베타-락타마제 프로모터 시스템, 또는 파지 람다로부터의 프로모터 시스템이 존재할 것이다. 프로모터는 전형적으로 임의로는 오퍼레이터 서열과 함께 발현을 제어하고, 전사 및 번역을 개시하고 완료하기 위한 리보솜 결합 부위 서열 등을 가질 것이다.
진핵 미생물이 발현에 사용될 수 있다. 진핵 미생물, 예컨대 사상 진균류 또는 효모는 폴리펩티드 코딩 벡터에 적합한 클로닝 또는 발현 숙주이다. 사카로미세스 세레비지아에 (Saccharomyces cerevisiae)는 통상적으로 사용되는 보다 낮은 진핵 숙주 미생물이다. 다른 것은 스키조사카로미세스 폼베 (Schizosaccharomyces pombe); 클루이베로미세스 숙주, 예컨대, 예를 들어 K. 락티스 (MW98-8C, CBS683, CBS4574), K. 프라길리스 (K. fragilis) (ATCC 12,424), K. 불가리쿠스 (K. bulgaricus) (ATCC 16,045), K. 위케라미이 (K. wickeramii) (ATCC 24,178), K. 왈티이 (K. waltii) (ATCC 56,500), K. 드로소필라룸 (K. drosophilarum) (ATCC 36,906), K. 써모톨레란스 (K. thermotolerans), 및 K. 마르시아누스 (K. marxianus); 야로위아 (yarrowia) (EP 402,226); 피치아 파스토리스 (Pichia pastoris); 칸디다 (Candida); 트리코더마 레에시아 (Trichoderma reesia); 뉴로스포라 크라사 (Neurospora crassa); 슈와니오미세스 (Schwanniomyces), 예컨대 슈와니오미세스 옥시덴탈리스 (Schwanniomyces occidentalis); 및 사상 진균, 예컨대, 예를 들어 뉴로스포라 (Neurospora), 페니실륨 (Penicillium), 톨리포클라디움 (Tolypocladium) 및 아스페르길루스 (Aspergillus) 숙주, 예컨대 A. 니둘란스 (A. nidulans) 및 A. 니제르 (A. niger)를 포함한다. 메틸영양요구성 효모가 본원에서 적합하고, 한세눌라(Hansenula), 칸디다, 클로에케라(Kloeckera), 피치아, 사카로미세스, 토룰롭시스(Torulopsis) 및 로도토룰라(Rhodotorula)로 이루어진 속으로부터 선택된, 메탄올에서 성장할 수 있는 효모를 포함하지만 이에 제한되지 않는다. 사카로미세스는 경우에 따라 발현 조절 서열 (예를 들어, 프로모터), 복제 기점, 종결 서열 등을 갖는 적합한 벡터를 갖는 바람직한 효모 숙주이다. 전형적인 프로모터로는 3-포스포글리세레이트 키나제 및 다른 해당 효소가 있다. 유도가능한 효모 프로모터는 특히 알콜 데히드로게나제, 이소시토크롬 C, 및 말토스 및 갈락토스 사용을 담당하는 효소로부터의 프로모터를 포함한다.
미생물 이외에, 또한 포유동물 조직 세포 배양물을 사용하여 본원에 기재된 폴리펩티드를 발현 및 생성할 수 있고, 이는 일부 경우에 바람직하다 (문헌 [Winnacker, From Genes to Clones VCH Publishers, N.Y., N.Y. (1987)] 참조). 일부 실시양태의 경우, 이종 폴리펩티드 (예를 들어, 무손상 이뮤노글로불린)를 분비할 수 있는 수많은 적합한 숙주 세포주가 당업계에서 개발되었기 때문에, 진핵 세포 (예를 들어, COS7 세포)가 바람직할 수 있고, 이는 CHO 세포주, 다양한 Cos 세포주, HeLa 세포, 바람직하게는 골수종 세포주, 또는 형질전환된 B-세포 또는 하이브리도마를 포함한다.
일부 실시양태에서, 숙주 세포는 척추동물 숙주 세포이다. 유용한 포유동물 숙주 세포주의 예는 SV40에 의해 형질전환된 원숭이 신장 CV1 세포주 (COS-7, ATCC CRL 1651); 인간 배아 신장 세포주 (현탁액 배양에서의 성장을 위해 서브클로닝된 293 또는 293 세포); 새끼 햄스터 신장 세포 (BHK, ATCC CCL 10); 차이니즈 햄스터 난소 세포/-DHFR (CHO 또는 CHO-DP-12 세포주); 마우스 세르톨리 세포; 원숭이 신장 세포 (CV1 ATCC CCL 70); 아프리카 녹색 원숭이 신장 세포 (VERO-76, ATCC CRL-1587); 인간 자궁경부 암종 세포 (HELA, ATCC CCL 2); 개과동물 신장 세포 (MDCK, ATCC CCL 34); 버팔로 래트 간 세포 (BRL 3A, ATCC CRL 1442); 인간 폐 세포 (W138, ATCC CCL 75); 인간 간 세포 (Hep G2, HB 8065); 마우스 유방 종양 (MMT 060562, ATCC CCL51); TRI 세포; MRC 5 세포; FS4 세포; 및 인간 간종양 세포주 (Hep G2)이다.
대안적으로, 폴리펩티드-코딩 서열은 트랜스제닉 동물의 게놈으로의 도입 및 트랜스제닉 동물의 우유에서의 후속 발현을 위한 트랜스진에 통합될 수 있다. 적합한 트랜스진은 유선 특이적 유전자, 예컨대 카세인 또는 베타 락토글로불린으로부터 프로모터 및 인핸서와 작동가능하게 연결된 경쇄 및/또는 중쇄를 위한 코딩 서열을 포함한다.
대안적으로, 본원에 기재된 항체는 트랜스제닉 식물 (예를 들어, 담배, 메이즈, 대두 및 알팔파)에서 생성될 수 있다. 형질전환될 수 있는 작물 종의 증가와 커플링된 개선된 '플랜티바디(plantibody)' 벡터 (문헌 [Hendy et al., J. Immunol. Methods 231:137-146 (1999)]) 및 정제 전략은 이러한 방법에게 인간 및 동물 요법을 위해서 뿐만 아니라 또한 산업상 적용을 위해서 재조합 이뮤노글로불린을 생성하는 실용적이고 효율적인 수단을 제공한다 (예를 들어, 촉매 항체). 또한, 식물 생성된 항체는 안전하고 효과적인 것으로 나타났으며, 동물-유래된 물질의 사용을 방지한다. 또한, 식물 및 포유동물 세포-생성된 항체의 글리코실화 패턴에서의 차이는 항원 결합 또는 특이성에 거의 영향을 미치지 않거나 또는 전혀 미치지 않는다. 또한, 식물-유래의 분비 이량체 IgA 항체의 국소 경구 적용을 받은 환자에서 독성 또는 HAMA의 증거가 관찰되지 않았다 (문헌 [Larrick et al., Res. Immunol. 149:603-608 (1998)] 참조).
숙주 세포를 폴리펩티드 생성을 위해 본원에 기재된 발현 또는 클로닝 벡터로 형질감염 또는 형질전환시키고, 프로모터를 유도하거나, 형질전환체를 선택하거나, 목적하는 서열을 코딩하는 유전자를 증폭시키기 위해 적절하게 변형된 통상적인 영양 배지 내에서 배양한다. 배양 조건, 예컨대 배지, 온도, pH 등은 당업자가 과도한 실험 없이 선택할 수 있다. 일반적으로, 세포 배양물의 생산성을 최대화시키기 위한 원리, 프로토콜 및 실시 기술은 문헌 [Mammalian Cell Biotechnology: a Practical Approach M. Butler, ed. (IRL Press, 1991)]에서 찾아볼 수 있다.
진핵 세포 형질감염 및 원핵 세포 형질전환의 방법, 예를 들어 CaCl2, CaPO4, 리포솜-매개 및 전기천공은 당업자에게 공지되어 있다. 사용된 숙주 세포에 따라, 형질전환은 이러한 세포에 적절한 표준 기술을 이용하여 수행된다. 염화칼슘 또는 전기천공을 사용하는 칼슘 처리는 일반적으로 원핵생물에 사용된다. 문헌 [Shaw et al., Gene 23:315 (1983)] 및 WO 89/05859 (1989년 6월 29일 공개)에 기재된 바와 같이, 아그로박테리움 투메파시엔스(Agrobacterium tumefaciens)를 사용한 감염은 특정 식물 세포의 형질전환에 사용된다. 이러한 세포벽이 없는 포유동물 세포의 경우에는, 문헌 [Graham and van der Eb, Virology 52:456-457 (1978)]의 인산칼슘 침전 방법을 사용할 수 있다. 포유동물 세포 숙주 시스템 형질감염의 일반적인 측면은 미국 특허 번호 4,399,216에 기재되어 있다. 효모 내로의 형질전환은 문헌 [Van Solingen et al., J. Bact. 130:946 (1977)] 및 [Hsiao et al., Proc. Natl. Acad. Sci. (USA) 76:3829 (1979)]의 방법에 따라 전형적으로 수행된다. 그러나, DNA를 세포에 도입하기 위한 다른 방법, 예를 들어 핵 미세주입, 전기천공, 무손상 세포와 박테리아 원형질체의 융합, 또는 다가양이온, 예를 들어 폴리브렌, 폴리오르니틴에 의한 방법이 이용될 수도 있다. 포유동물 세포를 형질전환하는 다양한 기술에 대해서는 문헌 [Keown et al., Methods in Enzymology 185:527-537 (1990)] 및 [Mansour et al., Nature 336:348-352 (1988)]을 참조한다.
특히 글리코실화 및 Fc 이펙터 기능이 필요하지 않은 경우에, 예컨대 치료 항체가 세포독성제 (예를 들어, 독소)에 접합되고 면역접합체 자체가 종양 세포 파괴에서 유효성을 나타내는 경우, 폴리펩티드, 예를 들어 항체가 박테리아에서 생성될 수 있다. 전장 항체는 순환 반감기가 더 길다. 이. 콜라이 내에서의 생성은 보다 신속하고 보다 비용 효율적이다. 박테리아에서의 폴리펩티드의 발현에 대해, 예를 들어 발현 및 분비를 최적화하기 위한 신호 서열 및 번역 개시 영역 (TIR)이 기재되어 있는 미국 특허 번호 5,840,523 (이 특허는 본원에 참고로 포함됨)을 참조한다. 발현 후에, 항체를 가용성 분획물 중의 이. 콜라이 세포 페이스트로부터 단리하고, 예를 들어 이소형에 따라 단백질 A 또는 G 칼럼을 통해 정제할 수 있다. 최종 정제는 예를 들어 CHO 세포 내에서 발현된 항체를 정제하는 방법과 유사하게 수행될 수 있다.
본원에 기재된 글리코실화된 폴리펩티드의 발현에 적합한 숙주 세포는 다세포 유기체로부터 유래된다. 무척추동물 세포의 예로는 식물 및 곤충 세포가 포함된다. 수많은 바큘로바이러스 균주 및 변이체, 및 스포도프테라 프루기페르다(Spodoptera frugiperda) (쐐기벌레), 아에데스 아에집티(Aedes aegypti) (모기), 아에데스 알보픽투스(Aedes albopictus) (모기), 드로소필라 멜라노가스터(Drosophila melanogaster) (과실파리) 및 봄빅스 모리(Bombyx mori)와 같은 숙주로부터의 상응하는 허용성 곤충 숙주 세포가 확인된 바 있다. 다양한 형질감염용 바이러스 균주, 예를 들어, 아우토그라파 칼리포르니카(Autographa californica) NPV의 L-1 변이체, 및 봄빅스 모리 NPV의 Bm-5 균주가 공개적으로 입수가능하고, 이같은 바이러스들은, 특히 스포도프테라 프루기페르다 세포의 형질감염을 위해, 본 발명에 따라 본원에서 바이러스로 사용될 수 있다.
본 발명의 폴리펩티드를 생성하는데 사용되는 숙주 세포는 다양한 배지 중에서 배양될 수 있다. 시판 배지, 예컨대 햄 F10 (시그마(Sigma)), 최소 필수 배지 (MEM) (시그마), RPMI-1640 (시그마) 및 둘베코 변형 이글 배지(Dulbecco's Modified Eagle's Medium) ((DMEM) (시그마))가 숙주 세포의 배양에 적합하다. 임의의 이들 배지에는 필요에 따라 호르몬 및/또는 다른 성장 인자 (예컨대 인슐린, 트랜스페린 또는 표피 성장 인자), 염 (예컨대 염화나트륨, 칼슘, 마그네슘 및 포스페이트), 완충제 (예컨대 HEPES), 뉴클레오티드 (예컨대 아데노신 및 티미딘), 항생제 (예컨대 겐타마이신(GENTAMYCIN)TM 약물), 미량 원소 (통상적으로 마이크로몰 범위의 최종 농도로 존재하는 무기 화합물로서 정의됨) 및 글루코스 또는 등가의 에너지원이 보충될 수 있다. 또한, 임의의 다른 필요한 보충물을 당업자에게 공지된 적절한 농도로 포함시킬 수도 있다. 배양 조건, 예컨대 온도, pH 등은 발현을 위해 선택된 숙주 세포와 함께 이전에 이용된 것이고, 당업자에게 명백할 것이다.
(vi) 폴리펩티드의 정제
재조합 기술을 사용하는 경우, 폴리펩티드는 세포 내에서 또는 주변세포질 공간 내에서 생성될 수 있거나, 또는 배지로 직접 분비될 수 있다.
배양 배지로부터 또는 숙주 세포 용해물로부터 폴리펩티드를 회수할 수 있다. 막 결합형인 경우에는, 적합한 세제 용액 (예를 들어, 트리톤(Triton)-X 100)을 사용하거나 효소적 절단에 의해 이것을 막으로부터 방출시킬 수 있다. 폴리펩티드의 발현에 사용되는 세포는 다양한 물리적 또는 화학적 수단, 예컨대 동결-해동 주기, 초음파처리, 기계적 파괴 또는 세포 용해제에 의해 파괴할 수 있다.
재조합 세포 폴리펩티드로부터 폴리펩티드를 정제하는 것이 바람직할 수 있다. 하기 절차는 적합한 정제 절차의 예이다: 이온-교환 칼럼 상에서의 분획화; 에탄올 침전; 역상 HPLC; 실리카 또는 양이온-교환 수지, 예컨대 DEAE 상에서의 크로마토그래피; 크로마토포커싱; SDS-PAGE; 황산암모늄 침전; 예를 들어 세파덱스 G-75를 사용하는 겔 여과; 오염물, 예컨대 IgG를 제거하기 위한 단백질 A 세파로스 칼럼; 및 폴리펩티드의 에피토프-태그 부착된 형태에 결합하기 위한 금속 킬레이팅 칼럼. 다양한 폴리펩티드 정제 방법이 사용될 수 있고, 이러한 방법은 당업계에 공지되어 있다.
폴리펩티드가 세포 내에서 생성되는 경우, 제1 단계로서 입자형 잔해인 숙주 세포 또는 용해된 단편은 예를 들어 원심분리 또는 한외여과에 의해 제거된다. 문헌 [Carter et al., Bio/Technology 10: 163-167 (1992)]에는 이. 콜라이의 주변세포질 공간에 분비되는 폴리펩티드를 단리하는 절차가 기재되어 있다. 간략하게, 세포 페이스트를 아세트산나트륨 (pH 3.5), EDTA 및 페닐메틸술포닐플루오라이드 (PMSF)의 존재하에 약 30분에 걸쳐 해동시킨다. 세포 잔해는 원심분리로 제거할 수 있다. 폴리펩티드가 배지로 분비되는 경우, 일반적으로는 우선 이러한 발현 시스템으로부터의 상청액을 시판되는 폴리펩티드 농축 필터, 예를 들어 아미콘(Amicon) 또는 밀리포어 펠리콘(Millipore Pellicon) 한외여과 장치를 사용하여 농축시킨다. 단백질분해를 억제하기 위해 프로테아제 억제제, 예를 들어 PMSF를 임의의 이전 단계에 포함시킬 수 있고, 우발적인 오염물의 성장을 저해하기 위해 항생제를 포함시킬 수 있다.
세포로부터 제조된 폴리펩티드 조성물은, 예를 들어 히드록시아파타이트 크로마토그래피, 겔 전기영동, 투석, 및 친화도 크로마토그래피를 사용하여 정제할 수 있는데, 친화도 크로마토그래피가 바람직한 정제 기술이다. 친화도 리간드로서의 단백질 A의 적합성은 항체 내에 존재하는 임의의 이뮤노글로불린 Fc 도메인의 종 및 이소형에 따라 달라진다. 단백질 A는 인간 γ1, γ2 또는 γ4 중쇄를 기초로 하는 항체를 정제하는데 사용될 수 있다 (문헌 [Lindmark et al., J. Immunol. Meth. 62:1-13 (1983)]). 단백질 G는 모든 마우스 이소형 및 인간 γ3에 대해 권장된다 (문헌 [Guss et al., EMBO J. 5:15671575 (1986)]). 친화도 리간드가 부착되는 매트릭스는 가장 흔하게는 아가로스이지만, 다른 매트릭스도 이용가능하다. 기계적으로 안정한 매트릭스, 예컨대 공극이 제어된 유리 또는 폴리(스티렌디비닐)벤젠은 아가로스로 달성할 수 있는 것보다 더 빠른 유속 및 더 짧은 프로세싱 시간을 가능하게 한다. 항체가 CH3 도메인을 포함하는 경우, 베이커본드(Bakerbond) ABXTM 수지 (제이. 티. 베이커(J. T. Baker), 미국 뉴저지주 필립스버그)가 정제에 유용하다. 회수할 폴리펩티드에 따라, 폴리펩티드 정제를 위한 다른 기술, 예컨대 이온-교환 칼럼 상에서의 분획화, 에탄올 침전, 역상 HPLC, 실리카 상에서의 크로마토그래피, 헤파린 세파로스(SEPHAROSE)TM 상에서의 크로마토그래피, 음이온 또는 양이온 교환 수지 (예컨대, 폴리아스파르트산 칼럼) 상에서의 크로마토그래피, 크로마토포커싱, SDS-PAGE 및 황산암모늄 침전이 또한 사용될 수 있다.
임의의 예비 정제 단계(들) 후에, 관심 폴리펩티드 및 오염물을 포함하는 혼합물로 pH 약 2.5 내지 4.5의 용출 완충제를 사용하는, 바람직하게는 낮은 염 농도 (예를 들어, 약 0 내지 0.25 M 염)에서 수행되는 낮은 pH 소수성 상호작용 크로마토그래피를 실시할 수 있다.
V. 제제의 사용 방법
본원에 제공된 제제는 본원에 기재된 폴리펩티드 제제의 전달을 필요로 하는 대상체에게 상기 제제를 투여하는 것을 포함하는, 상기 대상체에게 본원에 기재된 폴리펩티드 제제를 전달하는 방법에 사용될 수 있다.
또한 본원에서 질환 또는 장애의 치료, 개선 및/또는 진행 지연을 필요로 하는 대상체에게 본원에 기재된 제제를 투여하는 것을 포함하는, 질환 또는 장애의 치료, 개선 및/또는 진행 지연 방법이 제공된다.
일부 실시양태에서, 질환 또는 장애는 암이다. 일부 실시양태에서, 질환 또는 장애는 염증성 질환이다. 일부 실시양태에서, 질환 또는 장애는 "세포 증식성 장애" 및 "증식성 장애"이다. 일부 실시양태에서, 질환 또는 장애는 종양이다. 일부 실시양태에서, 질환 또는 장애는 암이고, 폴리펩티드는 항체이다.
일부 실시양태에서, 폴리펩티드는 유효량으로 투여된다. 일부 실시양태에서, 폴리펩티드는 성장 억제량으로 투여된다. 일부 실시양태에서, 폴리펩티드는 세포독성량으로 투여된다.
본원에 사용된 "치료하다", "치료" 또는 "치료하는"은 임상 결과를 포함하여 유익하거나 원하는 결과를 얻기 위한 접근법이다. 본 발명의 목적에서, 유익하거나 원하는 임상 결과는 다음 중 하나 이상을 포함하나, 이에 제한되는 것은 아니다: 질환으로부터 발생하는 하나 이상의 증상을 감소시키는 것, 질환의 정도를 감소시키는 것, 질환을 안정화시키는 것 (예를 들어, 질환의 악화를 예방 또는 지연시키는 것), 질환의 진행을 지연 또는 감속시키는 것, 질환 상태를 개선시키는 것, 질환을 치료하는데 필요한 하나 이상의 다른 의약의 투여를 감소시키는 것, 및/또는 삶의 질을 증가시키는 것.
본원에 사용된 진행 "지연"은 질환의 발병을 지연, 방해, 감속, 저지, 안정화 및/또는 연기하는 것을 의미한다. 이러한 지연은 치료될 질환 및/또는 개체의 병력에 좌우되어 다양한 시간 길이의 지연일 수 있다.
일부 실시양태에서, 본원에 기재된 치료 방법은 질환의 하나 이상의 증상을 개선시킨다 (예를 들어, 질환의 하나 이상의 증상의 발생을 감소시키고, 그의 지속 기간을 감소시키고, 그의 중증도를 감소 또는 약화시킨다).
본원에서 "대상체"는 포유동물이다. 일부 실시양태에서, 포유동물은 인간이다.
"증상"은 대상체가 경험하는, 구조, 기능 또는 감각에서의 임의의 병적 현상 또는 정상 상태로부터의 이탈이다.
용어 "유효량"은 대상체에서 질환 또는 장애의 치료, 개선 및/또는 진행 지연을 위한 폴리펩티드의 양을 나타낸다. 암의 경우, 치료 유효량의 약물은 암 세포의 수 감소, 종양 크기의 감소, 말초 기관으로의 암 세포 침윤의 억제 (즉, 어느 정도 감속시키고 바람직하게는 중지시키는 것), 종양 전이의 억제 (즉, 어느 정도 감속시키고 바람직하게는 중지시키는 것), 종양 성장의 어느 정도의 억제, 및/또는 암과 연관된 하나 이상의 증상의 어느 정도의 경감을 유도할 수 있다. 약물이 기존 암 세포의 성장을 예방하고/거나 기존 암 세포를 사멸시킬 수 있는 정도라면, 이것은 세포증식 억제성 및/또는 세포독성일 수 있다.
폴리펩티드의 "성장 억제량"은 시험관내 또는 생체내에서 세포, 특히 종양 세포, 예를 들어 암 세포의 성장을 억제할 수 있는 양이다. 신생물성 세포 성장을 억제하기 위한 폴리펩티드의 "성장 억제량"은 경험적으로 및 통상적 방식으로 결정될 수 있다.
폴리펩티드의 "세포독성량"은 시험관내 또는 생체내에서 세포, 특히 종양 세포, 예를 들어 암 세포의 파괴를 야기할 수 있는 양이다. 신생물성 세포 성장을 억제하기 위한 폴리펩티드의 "세포독성량"은 경험적으로 및 통상적 방식으로 결정될 수 있다.
용어 "암" 및 "암성"은 조절되지 않는 세포 성장을 전형적인 특징으로 하는 대상체에서의 생리적 상태를 지칭하거나 기재한다. 암의 예는 암종, 림프종, 모세포종, 육종 및 백혈병 또는 림프양 악성종양을 포함하나, 이에 제한되지는 않는다. 이러한 암의 보다 특정한 예에는 편평세포암 (예를 들어, 상피 편평세포암), 소세포 폐암, 비-소세포 폐암, 폐의 선암 및 폐의 편평세포 암종을 비롯한 폐암, 복막암, 간세포암, 위장관암을 비롯한 위장암 또는 위암, 췌장암, 교아세포종, 자궁경부암, 난소암, 간암, 방광암, 요로암, 간종양, 유방암, 결장암, 직장암, 결장직장암, 자궁내막 또는 자궁 암종, 타액선 암종, 신장암 또는 신암, 전립선암, 외음부암, 갑상선암, 간 암종, 항문 암종, 음경 암종, 흑색종, 다발성 골수종 및 B-세포 림프종, 뇌암, 뿐만 아니라 두경부암, 및 관련 전이가 포함된다.
용어 "세포 증식성 장애" 및 "증식성 장애"는 일정 정도의 비정상적인 세포 증식과 연관된 장애를 나타낸다.
본원에서 사용된 "종양"은 모든 신생물성 세포 성장 및 증식 (악성 또는 양성 여부와 상관 없음), 및 모든 전암성 및 암성 세포 및 조직을 나타낸다.
폴리펩티드 제제는 공지의 방법에 따라, 예컨대 예를 들어 볼루스로서 또는 일정 시간에 걸친 연속 주입에 의한 정맥내 투여, 근내, 복강내, 뇌척수내, 피하, 관절내, 활액내, 경막내, 경구, 국소 또는 흡입 경로에 의한 투여에 의해 대상체에게 투여된다. 일부 실시양태에서, 폴리펩티드 제제는 피하 주사에 의해 투여된다.
질환의 치료, 개선 및/또는 진행 지연을 위해, 투여량 및 투여 방식은 공지된 기준에 따라 전문의가 선택할 것이다. 폴리펩티드의 적절한 투여량은 상기 규정한 바와 같은 치료될 질환의 유형, 질환의 중증도 및 과정, 폴리펩티드 제제가 이전에 투여되었는지 여부, 환자의 임상력 및 폴리펩티드의 제제에 대한 반응, 및 담당의의 판단에 따라 달라질 것이다. 폴리펩티드 제제는 한번에 또는 일련의 치료를 통해 환자에게 적합하게 투여된다. 질환의 유형 및 증증도에 따라, 예를 들어 1회 이상의 별개의 투여에 의해서든 연속 주입에 의해서든 간에 약 1 ㎍/kg 내지 약 50 ㎎/kg 체중 (예를 들어 1회 투여 당 약 0.1 내지 15 ㎎/kg)의 폴리펩티드가 환자에게 투여하기 위한 초기 후보 투여량일 수 있다. 상기 언급된 인자에 따라, 전형적인 1일 투여량은 약 1 ㎍/kg 내지 약 100 ㎎/kg 이상의 범위일 수 있다. 수일 또는 그보다 오랜 기간에 걸친 반복 투여의 경우, 상태에 따라서 치료는 질환 증상이 원하는 수준으로 저해될 때까지 지속된다. 이러한 요법의 진행은 통상의 방법 및 검정을 이용하고 전문의 또는 다른 당업자에게 공지되어 있는 기준에 기초하여 쉽게 모니터링될 수 있다.
다른 치료 처방은 폴리펩티드 제제의 투여와 조합될 수 있다. 폴리펩티드 제제는 단독으로, 또는 예를 들어 호르몬, 면역저해제, 항혈관신생제 또는 방사성 표지된 화합물과 조합 요법으로, 또는 수술, 한랭요법 및/또는 방사선요법과 함께 사용될 수 있다. 폴리펩티드 제제는 다른 형태의 통상적인 요법과 함께 그와 연속적으로 또는 통상적인 요법 전에 또는 후에 투여될 수 있다.
하나 이상의 추가의 치료제"와의 조합" 투여는 동시 (공동) 투여, 임의의 순서의 연속 투여 및 임의의 순서의 순차적 투여를 포함한다.
조합 투여는 별개의 제제 또는 단일 제약 제제를 사용하는 동시 투여, 어느 한 순서로의 연속 투여, 및 임의의 순서로의 연속 투여를 포함하고, 이때, 바람직하게는 2종 (또는 모든) 활성제가 이들의 생물학적 활성을 동시에 발휘하는 일정 기간이 존재한다. 바람직하게는, 이러한 조합 요법은 상승작용적 치료 효과를 유도한다.
VI. 제조품
본원에 기재된 폴리펩티드 제제가 제조품 내에 함유될 수 있다. 제조품은 폴리펩티드 제제를 함유하는 용기를 포함할 수 있다. 바람직하게는, 제조품은 (a) 용기 내에 본원에 기재된 폴리펩티드 제제를 포함하는 조성물을 포함하는 용기; 및 (b) 제제를 대상체에게 투여하기 위한 설명서를 갖는 포장 삽입물을 포함한다.
제조품은 용기, 및 용기상에 있거나 용기와 결합된 라벨 또는 포장 삽입물을 포함한다. 적합한 용기는 예를 들어 병, 바이알, 시린지 등을 포함한다. 다양한 물질, 예컨대 유리 또는 플라스틱으로부터 용기가 형성될 수 있다. 용기는 제제를 유지 또는 함유하고, 멸균 입구를 가질 수 있다 (예를 들어, 용기는 정맥내 용액 백 또는 피하 주사 바늘로 뚫을 수 있는 마개를 갖는 바이알일 수 있음). 조성물의 하나 이상의 활성제는 폴리펩티드이다. 라벨 또는 포장 삽입물은 제공되는 폴리펩티드 및 임의의 다른 약물의 투여량 및 간격에 대한 구체적 지침을 받은 대상체에서 조성물의 사용을 나타낸다. 제조품은 상업적 및 사용자 관점에서 바람직한 다른 물질, 예를 들어 다른 완충제, 희석제, 필터, 바늘 및 시린지를 추가로 포함할 수 있다. 일부 실시양태에서, 용기는 주사기이다. 일부 실시양태에서, 주사기는 추가로 주사 장치 내에 포함된다. 일부 실시양태에서, 주사 장치는 자동주사기이다.
"포장 삽입물"은 치료 제품의 시판되는 포장물 내에 통상적으로 포함되어 있으며 적응증, 사용법, 용량, 투여, 금기 사항, 이러한 포장 제품과 조합될 다른 치료 제품 및/또는 이러한 치료 제품의 사용에 관한 경고에 대한 정보를 함유하는 설명서를 나타내는데 사용된다.
본 발명의 추가의 상세한 사항이 하기의 비-제한적인 예에 의해 설명된다. 본 명세서 내의 모든 참조문헌의 개시내용은 본원에 참고로 명백히 포함된다.
실시예
실시예는 순수하게 본 발명을 예시하는 것으로, 따라서 어떠한 방식으로도 본 발명을 제한하는 것으로 간주되어서는 안 되며, 이는 또한 상기 논의된 본 발명의 측면 및 실시양태를 기재 및 상세하게 기술한다. 상기 예 및 상세한 설명은 예시 방식으로 제공된 것이고, 제한 방식으로 제공된 것은 아니다.
실시예 1 - 폴리펩티드 용액 점도에 대한 디메틸 술폭시드 및 디메틸아세트아미드의 효과
폴리펩티드 용액 점도에 대한 디메틸 술폭시드 및 디메틸아세트아미드의 효과를 연구하기 위해, 하기 실험을 수행하였다.
물질 및 방법
동일한 인간 프레임워크로부터 구축된 κ-경쇄로 구성된 다중 IgG1 전장 모노클로날 항체를 이 연구에 사용하였다. 이러한 항체를 클로닝하고, 차이니즈 햄스터 난소 세포주에서 발현시키고, 제넨테크 (미국 캘리포니아주 사우쓰 샌프란시스코)에서 정제하였다. 모든 시약은 ACS 등급이었다.
달리 언급되지 않는 한, rhuMAb 항-IFNα를 출발 물질로 사용하였다. 모든 폴리펩티드를 2-8℃에서 24시간 이상 동안 슬라이드-a-라이저 10,000 MWCO 투석 카세트 (써모 사이언티픽 피어스(Thermo Scientific Pierce))를 사용하여 적절한 조건으로 완충제 교환하였다. 카세트로부터 제거한 후에, 개별 용액의 pH를 메틀러 톨레도 세븐멀티(Mettler Toledo SevenMulti) pH 미터를 사용하여 주위 조건하에 측정하였다. 폴리펩티드 농도를 280 nm 및 320 nm에서 HP 8453 분광광도계를 사용하여 중력 측정에 의해 제조된 샘플로 결정하였다. 밀도를 25.00℃에서 안톤 파르(Anton Paar) DMA 5000 덴시토미터를 사용하여 측정하였다.
대략 500 ㎕ 샘플 분취액을 바람직한 부피-부피 백분율에 따라 공용매 (DMSO 또는 DMA)에서 스파이킹에 의해 제조하였다. 공용매의 부재하의 대조군을 측정하였으나, 동일한 폴리펩티드 농도를 유지하기 위해 첨가된 동일한 양의 각각의 제제 완충제를 함유하는 대조군을 비교를 위해 측정하였다.
모든 제제의 점도를 CP25-1 24.972 mm 원뿔체를 갖는 안톤 파르 피지카(Physica) MCR300 레오미터를 사용하여 측정하였다. 측정 온도를 펠티에(Peltier) 플레이트를 사용하여 15℃에서 제어하였다. 각각의 제제의 3개의 독립적이고 분리된 75 ㎕ 샘플을 1000/초의 전단 속도로 100초 시간 간격 동안 20회 측정하였다.
결과 및 논의
다중 폴리펩티드 용액의 전단 점도를 다양한 완충제 시스템 및 극성 용매의 존재 및 부재하에 측정하였다. 상대적으로 낮은 부피 대 부피 백분율 (1-10%)의 DMSO 및/또는 DMA의 첨가는 용액 점도를 다양한 정도로 감소시켰다 (도 1). 흥미롭게도, 완충제 성분 히스티딘 클로라이드는 높은 이온 강도에서 용액의 점도를 감소시켰으나, DMSO 및 DMA는 추가로 점도를 감소시키는 것으로 나타났다 (도 1).
극성 용매, DMSO 및 DMA는 모노클로날 항체 항-IFNα의 용액 점도를 최대한의 정도로 감소시켰다. 그러나, 유사한 효과가 3가지 다른 MAb에서 관찰되었다 (표 2). 완충제 성분 및 폴리펩티드 농도는 상이한 폴리펩티드 사이에서 달라졌으나, 각각의 개별 용액에 대한 DMSO 및 DMA의 점도 감소 효과는 명백하였다. 실제로, 용액 점도의 2-3배 감소가 일부 경우에 관찰되었다 (표 2).
극성 용매 DMSO 및 DMA의 점도 감소 특성을 추가로 연구하기 위해, 용액 pH를 5.2에서 6.5로 변화시키고, 전단 점도를 측정하였다. 용액 점도는 시험된 모든 용액 pH 값에 DMSO만큼 감소되었다 (도 2). 분명하게, 관찰된 효과는 극성 첨가제 DMSO의 직접적인 결과였다. 사실상, 용액 pH는 DMSO의 부재하의 용액 점도에 상당한 영향을 미치고, DMSO의 첨가는 pH 의존성 점도 변화를 감쇠시켰다 (도 2).
폴리펩티드 용액의 용해도 향상 및 점도 감소를 위한 또 다른 통상적인 부형제는 아르기닌 클로라이드이다. DMSO 및 DMA의 효과는 이들 극성 용매가 추가의 점도 감소 효과를 나타내는지 결정하기 위해 다양한 양의 아르기닌 클로라이드의 존재하에 연구하였다. 본원에서, 폴리펩티드 용액에 대한 DMSO 및 DMA의 첨가는 아르기닌 클로라이드의 존재하에 용액 점도를 추가로 감소시키는 것으로 나타났다 (도 3).
본원에서, 디메틸 술폭시드 및 디메틸 아세트아미드의 효과를 연구하였다. 분명하게, 이러한 극성 구성성분은 고농도 폴리펩티드 치료제의 용액 점도를 감소시켰다. DMO 및 DMA는 고농도 폴리펩티드 제제의 제조가능성 및 전달을 증가시키는데 사용될 수 있다.
Claims (45)
- (a) 약 50 ㎎/㎖ 초과의 양의 폴리펩티드 및 (b) 제제의 약 0.1% 내지 약 50% v/v의 양의 디메틸 술폭시드 (DMSO) 또는 디메틸아세트아미드 (DMA)를 포함하고, DMSO 또는 DMA의 부재하의 동일한 제제와 비교하여 감소된 점도를 갖는 액체 제제.
- 제1항에 있어서, 폴리펩티드가 2차 구조, 3차 구조 및/또는 4차 구조를 형성할 수 있는 것인 제제.
- 제2항에 있어서, 폴리펩티드가 2차 구조를 형성할 수 있는 것인 제제.
- 제3항에 있어서, 2차 구조가 β-시트인 제제.
- 제1항에 있어서, 폴리펩티드가 소수성인 제제.
- 제2항에 있어서, 폴리펩티드가 약 100개 아미노산 이상인 제제.
- 제1항에 있어서, 폴리펩티드가 약 5,000 달톤 초과의 분자량을 갖는 것인 제제.
- 제1항에 있어서, 폴리펩티드가 치료 폴리펩티드인 제제.
- 제1항에 있어서, 폴리펩티드가 항체인 제제.
- 제9항에 있어서, 항체가 모노클로날 항체인 제제.
- 제10항에 있어서, 모노클로날 항체가 키메라 항체, 인간화 항체 또는 인간 항체인 제제.
- 제10항에 있어서, 모노클로날 항체가 IgG 모노클로날 항체인 제제.
- 제9항에 있어서, 항체가 항원 결합 단편인 제제.
- 제13항에 있어서, 항원 결합 단편이 Fab 단편, Fab' 단편, F(ab')2 단편, scFv, Fv 및 디아바디로 이루어진 군으로부터 선택되는 것인 제제.
- 제1항에 있어서, DMSO 또는 DMA가 제제의 약 1% 내지 약 10% v/v의 양으로 존재하는 제제.
- 제15항에 있어서, DMSO 또는 DMA가 제제의 약 1% 내지 약 5% v/v의 양으로 존재하는 제제.
- 제1항에 있어서, 히스티딘을 더 포함하는 제제.
- 제17항에 있어서, 히스티딘이 약 10 mM 내지 약 100 mM의 양으로 존재하는 제제.
- 제1항에 있어서, 아르기닌-HCl을 더 포함하는 제제.
- 제19항에 있어서, 아르기닌-HCl이 약 50 mM 내지 약 200 mM의 양으로 존재하는 제제.
- 제1항에 있어서, 폴리펩티드가 약 100 ㎎/㎖ 이상의 양으로 존재하는 제제.
- 제21항에 있어서, 폴리펩티드가 약 100 ㎎/㎖ 내지 약 300 ㎎/㎖의 양으로 존재하는 제제.
- 제1항에 있어서, 점도가 DMSO 또는 DMA의 부재하의 동일한 제제와 비교하여 약 1 내지 약 1000 cP 감소된 제제.
- 제23항에 있어서, 점도가 DMSO 또는 DMA의 부재하의 동일한 제제와 비교하여 약 5 내지 약 100 cP 감소된 제제.
- 제1항에 있어서, 점도가 DMSO 또는 DMA의 부재하의 동일한 제제와 비교하여 약 1.2 내지 약 10배 감소된 제제.
- 제25항에 있어서, 점도가 DMSO 또는 DMA의 부재하의 동일한 제제와 비교하여 약 1.2 내지 약 5배 감소된 제제.
- 제1항에 있어서, 점도가 약 50 cP 이하인 제제.
- 제27항에 있어서, 점도가 약 25 cP 이하인 제제.
- 제1항에 있어서, pH가 약 5 내지 약 8인 제제.
- 제29항에 있어서, pH가 약 5 내지 약 6.5인 제제.
- 제1항에 있어서, DMSO 또는 DMA가 DMSO인 제제.
- 제1항에 있어서, DMSO 또는 DMA가 DMA인 제제.
- 제1항에 있어서, 주사에 의한 투여를 위해 제제화된 제제.
- 제33항에 있어서, 피하 주사에 의한 투여를 위해 제제화된 제제.
- 폴리펩티드 및 DMSO 또는 DMA를 조합하는 것을 포함하는, 제1항의 제제의 제조 방법.
- 제1항의 제제를 함유하는 용기를 포함하는 제조품.
- 제36항에 있어서, 용기가 주사기인 제조품.
- 제37항에 있어서, 주사기가 주사 장치 내에 추가로 함유된 제조품.
- 제38항에 있어서, 주사 장치가 자동주사기인 제조품.
- 질환 또는 장애의 치료를 필요로 하는 대상체에게 제8항의 제제를 투여하는 것을 포함하는, 질환 또는 장애를 치료하기 위한 제8항의 제제의 사용 방법.
- 제40항에 있어서, 제제를 주사에 의해 투여하는 방법.
- 제41항에 있어서, 제제를 피하 주사에 의해 투여하는 방법.
- 제1항의 제제를 투여하는 것을 포함하는, 제1항의 제제를 이를 필요로 하는 대상체에게 전달하는 방법.
- 제43항에 있어서, 제제를 주사에 의해 투여하는 방법.
- 제44항에 있어서, 제제를 피하 주사에 의해 투여하는 방법.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US23114009P | 2009-08-04 | 2009-08-04 | |
| US61/231,140 | 2009-08-04 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20120047995A true KR20120047995A (ko) | 2012-05-14 |
Family
ID=43544629
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020127005604A KR20120047995A (ko) | 2009-08-04 | 2010-08-03 | 감소된 점도를 갖는 농축 폴리펩티드 제제 |
Country Status (15)
| Country | Link |
|---|---|
| US (1) | US20130236448A1 (ko) |
| EP (1) | EP2461677A4 (ko) |
| JP (1) | JP2013501058A (ko) |
| KR (1) | KR20120047995A (ko) |
| CN (1) | CN102573459A (ko) |
| AU (1) | AU2010279569A1 (ko) |
| BR (1) | BR112012002596A2 (ko) |
| CA (1) | CA2769221A1 (ko) |
| IL (1) | IL217887A0 (ko) |
| MX (1) | MX2012001560A (ko) |
| NZ (1) | NZ598518A (ko) |
| RU (1) | RU2012108108A (ko) |
| SG (1) | SG178226A1 (ko) |
| WO (1) | WO2011017330A1 (ko) |
| ZA (1) | ZA201200760B (ko) |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9345661B2 (en) | 2009-07-31 | 2016-05-24 | Genentech, Inc. | Subcutaneous anti-HER2 antibody formulations and uses thereof |
| AR078161A1 (es) | 2009-09-11 | 2011-10-19 | Hoffmann La Roche | Formulaciones farmaceuticas muy concentradas de un anticuerpo anti cd20. uso de la formulacion. metodo de tratamiento. |
| EA029972B1 (ru) | 2011-02-09 | 2018-06-29 | ГЛЭКСОСМИТКЛАЙН ЭлЭлСи | Способы получения полипептидных композиций |
| FR2994390B1 (fr) | 2012-08-10 | 2014-08-15 | Adocia | Procede d'abaissement de la viscosite de solutions de proteines a concentration elevee |
| SI3043776T1 (sl) | 2013-09-11 | 2024-03-29 | Eagle Biologics, Inc. | Tekoče proteinske formulacije, ki vsebujejo vodotopna organska barvila |
| RU2742070C2 (ru) * | 2013-11-29 | 2021-02-02 | Дженентек, Инк. | Устройство и способы для отбора антител |
| WO2016019969A1 (en) | 2014-08-08 | 2016-02-11 | Ludwig-Maximilians-Universität München | Subcutaneously administered bispecific antibodies for use in the treatment of cancer |
| EP3200804A4 (en) | 2014-10-01 | 2018-04-18 | Eagle Biologics, Inc. | Polysaccharide and nucleic acid formulations containing viscosity-lowering agents |
| WO2019217927A1 (en) | 2018-05-10 | 2019-11-14 | Regeneron Pharmaceuticals, Inc. | High concentration vegf receptor fusion protein containing formulations |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AR013202A1 (es) * | 1997-07-10 | 2000-12-13 | Biotech Australia Pty Ltd | Vacunas no acuosas |
| EP2116265B1 (en) * | 2000-10-12 | 2020-12-23 | Genentech, Inc. | Reduced-viscosity concentrated protein formulations |
| GB0113179D0 (en) * | 2001-05-31 | 2001-07-25 | Novartis Ag | Organic compounds |
| US20060182740A1 (en) * | 2002-06-21 | 2006-08-17 | Biogen Idec, Inc. | Buffered formulations for concentrating antibodies and methods of use thereof |
| US20050158303A1 (en) * | 2003-04-04 | 2005-07-21 | Genentech, Inc. | Methods of treating IgE-mediated disorders comprising the administration of high concentration anti-IgE antibody formulations |
| GB0412530D0 (en) * | 2004-06-04 | 2004-07-07 | Camurus Ab | Formulation |
| AU2005249274B2 (en) * | 2004-06-04 | 2011-02-24 | Camurus Ab | Liquid depot formulations |
| CA2560007A1 (en) * | 2004-06-14 | 2005-12-22 | Usv Limited | Process for the preparation of peptides |
| ATE509634T1 (de) * | 2005-04-08 | 2011-06-15 | Amylin Pharmaceuticals Inc | Pharmazeutische formulierungen mit incretin- peptid und aprotisch-polarem lösungsmittel |
| BRPI0620316A2 (pt) * | 2005-12-21 | 2011-11-08 | Wyeth Corp | formulações de proteìnas com viscosidades reduzida e seus usos |
-
2010
- 2010-08-03 EP EP10807032.7A patent/EP2461677A4/en not_active Withdrawn
- 2010-08-03 US US13/388,962 patent/US20130236448A1/en not_active Abandoned
- 2010-08-03 WO PCT/US2010/044258 patent/WO2011017330A1/en active Application Filing
- 2010-08-03 BR BR112012002596A patent/BR112012002596A2/pt not_active IP Right Cessation
- 2010-08-03 SG SG2012007399A patent/SG178226A1/en unknown
- 2010-08-03 NZ NZ598518A patent/NZ598518A/en not_active IP Right Cessation
- 2010-08-03 CN CN2010800445005A patent/CN102573459A/zh active Pending
- 2010-08-03 AU AU2010279569A patent/AU2010279569A1/en not_active Abandoned
- 2010-08-03 JP JP2012523701A patent/JP2013501058A/ja active Pending
- 2010-08-03 RU RU2012108108/15A patent/RU2012108108A/ru not_active Application Discontinuation
- 2010-08-03 KR KR1020127005604A patent/KR20120047995A/ko not_active Application Discontinuation
- 2010-08-03 MX MX2012001560A patent/MX2012001560A/es not_active Application Discontinuation
- 2010-08-03 CA CA2769221A patent/CA2769221A1/en not_active Abandoned
-
2012
- 2012-01-31 ZA ZA2012/00760A patent/ZA201200760B/en unknown
- 2012-02-02 IL IL217887A patent/IL217887A0/en unknown
Also Published As
| Publication number | Publication date |
|---|---|
| ZA201200760B (en) | 2013-05-29 |
| IL217887A0 (en) | 2012-03-29 |
| JP2013501058A (ja) | 2013-01-10 |
| EP2461677A1 (en) | 2012-06-13 |
| SG178226A1 (en) | 2012-03-29 |
| MX2012001560A (es) | 2012-06-01 |
| CA2769221A1 (en) | 2011-02-10 |
| WO2011017330A8 (en) | 2011-04-21 |
| BR112012002596A2 (pt) | 2015-09-15 |
| CN102573459A (zh) | 2012-07-11 |
| RU2012108108A (ru) | 2013-09-10 |
| NZ598518A (en) | 2014-12-24 |
| US20130236448A1 (en) | 2013-09-12 |
| AU2010279569A1 (en) | 2012-03-01 |
| EP2461677A4 (en) | 2014-01-08 |
| WO2011017330A1 (en) | 2011-02-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20220064209A1 (en) | Methods of purifying polypeptides | |
| JP6979442B2 (ja) | オーバーロード/溶出クロマトグラフィー | |
| KR20120047995A (ko) | 감소된 점도를 갖는 농축 폴리펩티드 제제 | |
| US20220203347A1 (en) | Method for regeneration of an overload chromatography column | |
| US20230364020A1 (en) | Hydroxypropyl methyl cellulose derivatives to stabilize polypeptides | |
| NZ624317B2 (en) | Overload and elute chromatography |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |