JP7676331B2 - 生分解性超pH感受性ポリマー - Google Patents
生分解性超pH感受性ポリマー Download PDFInfo
- Publication number
- JP7676331B2 JP7676331B2 JP2021576271A JP2021576271A JP7676331B2 JP 7676331 B2 JP7676331 B2 JP 7676331B2 JP 2021576271 A JP2021576271 A JP 2021576271A JP 2021576271 A JP2021576271 A JP 2021576271A JP 7676331 B2 JP7676331 B2 JP 7676331B2
- Authority
- JP
- Japan
- Prior art keywords
- alkyl
- substituted
- hydrogen
- polymer
- alkanediyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G65/00—Macromolecular compounds obtained by reactions forming an ether link in the main chain of the macromolecule
- C08G65/02—Macromolecular compounds obtained by reactions forming an ether link in the main chain of the macromolecule from cyclic ethers by opening of the heterocyclic ring
- C08G65/32—Polymers modified by chemical after-treatment
- C08G65/329—Polymers modified by chemical after-treatment with organic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/19—Cytokines; Lymphokines; Interferons
- A61K38/20—Interleukins [IL]
- A61K38/2006—IL-1
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/19—Cytokines; Lymphokines; Interferons
- A61K38/20—Interleukins [IL]
- A61K38/2013—IL-2
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/19—Cytokines; Lymphokines; Interferons
- A61K38/20—Interleukins [IL]
- A61K38/208—IL-12
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/19—Cytokines; Lymphokines; Interferons
- A61K38/20—Interleukins [IL]
- A61K38/2086—IL-13 to IL-16
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/19—Cytokines; Lymphokines; Interferons
- A61K38/21—Interferons [IFN]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/34—Macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyesters, polyamino acids, polysiloxanes, polyphosphazines, copolymers of polyalkylene glycol or poloxamers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0014—Skin, i.e. galenical aspects of topical compositions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
- A61K9/0021—Intradermal administration, e.g. through microneedle arrays, needleless injectors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0031—Rectum, anus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0034—Urogenital system, e.g. vagina, uterus, cervix, penis, scrotum, urethra, bladder; Personal lubricants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0043—Nose
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0048—Eye, e.g. artificial tears
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0053—Mouth and digestive tract, i.e. intraoral and peroral administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/007—Pulmonary tract; Aromatherapy
- A61K9/0073—Sprays or powders for inhalation; Aerolised or nebulised preparations generated by other means than thermal energy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/06—Ointments; Bases therefor; Other semi-solid forms, e.g. creams, sticks, gels
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/08—Solutions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/10—Dispersions; Emulsions
- A61K9/107—Emulsions ; Emulsion preconcentrates; Micelles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/10—Dispersions; Emulsions
- A61K9/107—Emulsions ; Emulsion preconcentrates; Micelles
- A61K9/1075—Microemulsions or submicron emulsions; Preconcentrates or solids thereof; Micelles, e.g. made of phospholipids or block copolymers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/51—Nanocapsules; Nanoparticles
- A61K9/5107—Excipients; Inactive ingredients
- A61K9/513—Organic macromolecular compounds; Dendrimers
- A61K9/5146—Organic macromolecular compounds; Dendrimers obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyethylene glycol, polyamines, polyanhydrides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G64/00—Macromolecular compounds obtained by reactions forming a carbonic ester link in the main chain of the macromolecule
- C08G64/02—Aliphatic polycarbonates
- C08G64/0208—Aliphatic polycarbonates saturated
- C08G64/0225—Aliphatic polycarbonates saturated containing atoms other than carbon, hydrogen or oxygen
- C08G64/0241—Aliphatic polycarbonates saturated containing atoms other than carbon, hydrogen or oxygen containing nitrogen
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G64/00—Macromolecular compounds obtained by reactions forming a carbonic ester link in the main chain of the macromolecule
- C08G64/02—Aliphatic polycarbonates
- C08G64/0208—Aliphatic polycarbonates saturated
- C08G64/0225—Aliphatic polycarbonates saturated containing atoms other than carbon, hydrogen or oxygen
- C08G64/025—Aliphatic polycarbonates saturated containing atoms other than carbon, hydrogen or oxygen containing sulfur
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G64/00—Macromolecular compounds obtained by reactions forming a carbonic ester link in the main chain of the macromolecule
- C08G64/02—Aliphatic polycarbonates
- C08G64/0291—Aliphatic polycarbonates unsaturated
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G64/00—Macromolecular compounds obtained by reactions forming a carbonic ester link in the main chain of the macromolecule
- C08G64/18—Block or graft polymers
- C08G64/183—Block or graft polymers containing polyether sequences
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G64/00—Macromolecular compounds obtained by reactions forming a carbonic ester link in the main chain of the macromolecule
- C08G64/20—General preparatory processes
- C08G64/30—General preparatory processes using carbonates
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G64/00—Macromolecular compounds obtained by reactions forming a carbonic ester link in the main chain of the macromolecule
- C08G64/42—Chemical after-treatment
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G65/00—Macromolecular compounds obtained by reactions forming an ether link in the main chain of the macromolecule
- C08G65/02—Macromolecular compounds obtained by reactions forming an ether link in the main chain of the macromolecule from cyclic ethers by opening of the heterocyclic ring
- C08G65/32—Polymers modified by chemical after-treatment
- C08G65/329—Polymers modified by chemical after-treatment with organic compounds
- C08G65/331—Polymers modified by chemical after-treatment with organic compounds containing oxygen
- C08G65/332—Polymers modified by chemical after-treatment with organic compounds containing oxygen containing carboxyl groups, or halides, or esters thereof
- C08G65/3328—Polymers modified by chemical after-treatment with organic compounds containing oxygen containing carboxyl groups, or halides, or esters thereof heterocyclic
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G65/00—Macromolecular compounds obtained by reactions forming an ether link in the main chain of the macromolecule
- C08G65/02—Macromolecular compounds obtained by reactions forming an ether link in the main chain of the macromolecule from cyclic ethers by opening of the heterocyclic ring
- C08G65/32—Polymers modified by chemical after-treatment
- C08G65/329—Polymers modified by chemical after-treatment with organic compounds
- C08G65/333—Polymers modified by chemical after-treatment with organic compounds containing nitrogen
- C08G65/3332—Polymers modified by chemical after-treatment with organic compounds containing nitrogen containing carboxamide group
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G65/00—Macromolecular compounds obtained by reactions forming an ether link in the main chain of the macromolecule
- C08G65/02—Macromolecular compounds obtained by reactions forming an ether link in the main chain of the macromolecule from cyclic ethers by opening of the heterocyclic ring
- C08G65/32—Polymers modified by chemical after-treatment
- C08G65/329—Polymers modified by chemical after-treatment with organic compounds
- C08G65/334—Polymers modified by chemical after-treatment with organic compounds containing sulfur
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G65/00—Macromolecular compounds obtained by reactions forming an ether link in the main chain of the macromolecule
- C08G65/02—Macromolecular compounds obtained by reactions forming an ether link in the main chain of the macromolecule from cyclic ethers by opening of the heterocyclic ring
- C08G65/32—Polymers modified by chemical after-treatment
- C08G65/329—Polymers modified by chemical after-treatment with organic compounds
- C08G65/334—Polymers modified by chemical after-treatment with organic compounds containing sulfur
- C08G65/3342—Polymers modified by chemical after-treatment with organic compounds containing sulfur having sulfur bound to carbon and hydrogen
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G65/00—Macromolecular compounds obtained by reactions forming an ether link in the main chain of the macromolecule
- C08G65/34—Macromolecular compounds obtained by reactions forming an ether link in the main chain of the macromolecule from hydroxy compounds or their metallic derivatives
- C08G65/48—Polymers modified by chemical after-treatment
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L71/00—Compositions of polyethers obtained by reactions forming an ether link in the main chain; Compositions of derivatives of such polymers
- C08L71/02—Polyalkylene oxides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Polymers & Plastics (AREA)
- General Chemical & Material Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Immunology (AREA)
- Zoology (AREA)
- Gastroenterology & Hepatology (AREA)
- Dermatology (AREA)
- Dispersion Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Inorganic Chemistry (AREA)
- Otolaryngology (AREA)
- Nanotechnology (AREA)
- Optics & Photonics (AREA)
- Biophysics (AREA)
- Molecular Biology (AREA)
- Physics & Mathematics (AREA)
- Biomedical Technology (AREA)
- Microbiology (AREA)
- Pulmonology (AREA)
- Nutrition Science (AREA)
- Physiology (AREA)
- Gynecology & Obstetrics (AREA)
- Reproductive Health (AREA)
- Urology & Nephrology (AREA)
- Ophthalmology & Optometry (AREA)
- Oncology (AREA)
Description
本開示は、一般に、分子および細胞生物学、薬物送達、ならびナノテクノロジーの分野に関する。より具体的には、本開示は、治療剤の送達に使用され得る分解性ポリマーに関する。
刺激応答性材料は、近年、広範囲の医療用途へ急速に進出した(Blum et al., 2015; Reineke, 2016; Torchilin, 2014; Yang et al., 2016)。様々なpH感受性ポリマーおよびナノ粒子が、腫瘍イメージングおよび薬物送達用途のために設計および研究された(Moitra et al., 2013; Moitra et al., 2014; Zhang et al., 2015)。多くの生物学的用途について、初期エンドソーム対後期エンドソームのような異なる成熟状態でのオルガネラpH間の差、または腫瘍微小環境pHと正常組織pHとの差は、1 pH単位未満ほどの小さなpH差を含む小さなものであり(Casey et al., 2009; Gerweck and Seetharaman, 1996)、このため、従来の低分子または高分子pHセンサーが識別するのは困難である。近年、環境pHに対してバイナリー応答を有する一連の超pH感受性(UPS)コポリマーが開発された。異なる疎水性置換基を有する第3級アミンのようなイオン化可能な残基が、ポリ(メタクリル酸メチル)(PMMA)ポリマーの骨格上へ導入された。疎水性ミセル化は鋭いpH応答(例えば、0.25 pH単位以内の蛍光オン/オフ活性化)に寄与すると理論化された。結果として生じたトランジスター様ナノ粒子は、腫瘍イメージングおよび手術(Zhou et al., 2011a; Zhou et al., 2011b; Wang et al., 2013; Zhao et al., 2016)、エンドサイトーシスオルガネラおよびリソソーム異化のイメージおよび摂動(Wang et al., 2015; Wang et al., 2017)、ならびにがん免疫療法のためのナノワクチン(Wang et al., 2016; Luo et al., 2017)を含む、複数の生物学的用途において改善された精度を示した。
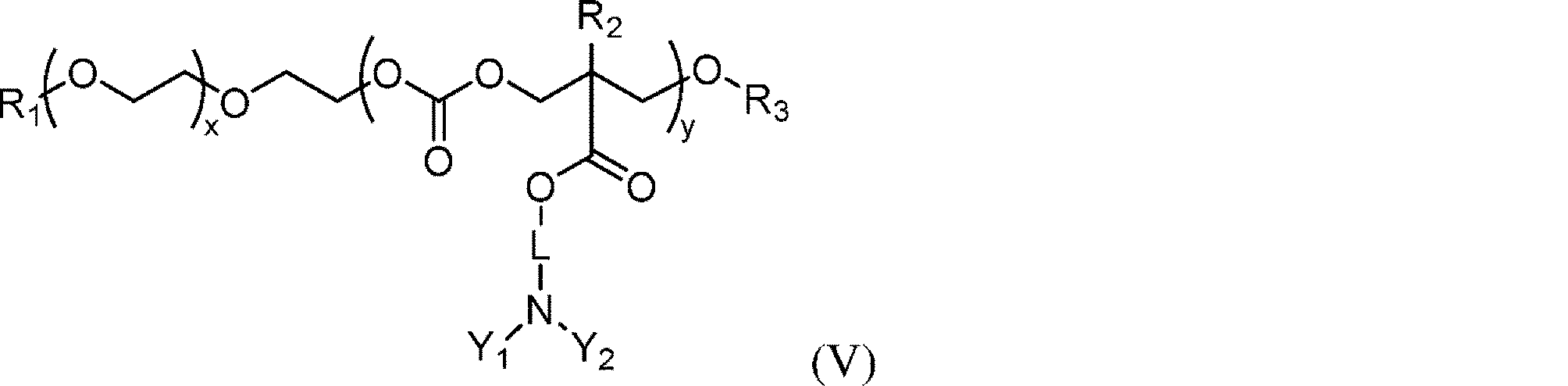
いくつかの局面において、本開示は、式:
のポリマーまたはその薬学的に許容される塩を提供し、
式中:
R1は、水素、アルキル(C≦8)、置換アルキル(C≦8)、またはチオール反応基であり;
mは、1~8の整数であり;
pおよびqは、各々独立して、1、2、または3であり;
xは、10~200の整数であり;
yは、20~200の整数であり;
zは、0~200の整数であり;
ここで、yまたはzのいずれかのモノマーはポリマー中にランダムに分布しており;
X1、X2、X1′、およびX2′は、各々独立して、OまたはNRaであり、ここで、
Raは、アルキル(C≦6)または置換アルキル(C≦6)であり;
R2およびR2′は、各々独立して、水素、アルキル(C≦8)、または置換アルキル(C≦8)であり;
R3は、水素、アルキル(C≦8)、または置換アルキル(C≦8)であり;
X3およびX3′は、各々独立して、OまたはNRbであり、ここで、
Rbは、水素、アルキル(C≦6)、または置換アルキル(C≦6)であり;
LおよびL′は、各々独立して、以下の式の基であり:
-X4-S(O)n-X5-
式中:
nは、0、1、または2であり;かつ
X4およびX5は、各々独立して、アルカンジイル(C≦8)または置換アルカンジイル(C≦8)であり;かつ
Y1、Y2、Y1′、およびY2′は、各々独立して、アルキル(C≦12)、置換アルキル(C≦12)、アルケニル(C≦12)、もしくは置換アルケニル(C≦12)であり;または、Y1およびY2もしくはY1′およびY2′は、一緒になり、かつ、アルカンジイル(C≦12)、アルケンジイル(C≦12)、またはいずれかの基の置換型である。
ここで:
R1は、水素、アルキル(C≦8)、置換アルキル(C≦8)、またはチオール反応基であり;
mは、1~8の整数であり;
pおよびqは、各々独立して、1、2、または3であり;
xは、10~200の整数であり;
yは、20~200の整数であり;
X1およびX2は、各々、OまたはNRaであり、ここで、
Raは、水素、アルキル(C≦6)、または置換アルキル(C≦6)であり;
R2は、水素、アルキル(C≦8)、または置換アルキル(C≦8)であり;
R3は、水素、アルキル(C≦8)、または置換アルキル(C≦8)であり;
X3は、OまたはNRbであり、ここで、
Rbは、水素、アルキル(C≦6)、または置換アルキル(C≦6)であり;
Lは、以下の式の基であり:
-X4-S(O)n-X5-
式中:
nは、0、1、または2であり;かつ
X4およびX5は、各々独立して、アルカンジイル(C≦8)または置換アルカンジイル(C≦8)であり;かつ
Y1およびY2は、各々独立して、アルキル(C≦12)、置換アルキル(C≦12)、アルケニル(C≦12)、もしくは置換アルケニル(C≦12)であり;または、Y1およびY2は、一緒になり、かつ、アルカンジイル(C≦12)、アルケンジイル(C≦12)、もしくはいずれかの基の置換型である。
ここで:
R1は、水素、アルキル(C≦8)、置換アルキル(C≦8)、またはチオール反応基であり;
mは、1~8の整数であり;
xは、10~200の整数であり;
yは、20~200の整数であり;
X1およびX2は、各々、OまたはNRaであり、ここで、
Raは、水素、アルキル(C≦6)、または置換アルキル(C≦6)であり;
R2は、水素、アルキル(C≦8)、または置換アルキル(C≦8)であり;
R3は、水素、アルキル(C≦8)、または置換アルキル(C≦8)であり;
X3は、OまたはNRbであり、ここで、
Rbは、水素、アルキル(C≦6)、または置換アルキル(C≦6)であり;
Lは、以下の式の基であり:
-X4-S(O)n-X5-
式中:
nは、0、1、または2であり;かつ
X4およびX5は、各々独立して、アルカンジイル(C≦8)または置換アルカンジイル(C≦8)であり;かつ
Y1およびY2は、各々独立して、アルキル(C≦12)、置換アルキル(C≦12)、アルケニル(C≦12)、もしくは置換アルケニル(C≦12)であり;または、Y1およびY2は、一緒になり、かつ、アルカンジイル(C≦12)、アルケンジイル(C≦12)、もしくはいずれかの基の置換型である。
ここで:
R1は、水素、アルキル(C≦8)、置換アルキル(C≦8)、またはチオール反応基であり;
xは、10~200の整数であり;
yは、20~200の整数であり;
X1およびX2は、各々、OまたはNRaであり、ここで、
Raは、水素、アルキル(C≦6)、または置換アルキル(C≦6)であり;
R2は、水素、アルキル(C≦8)、または置換アルキル(C≦8)であり;
R3は、水素、アルキル(C≦8)、または置換アルキル(C≦8)であり;
X3は、OまたはNRbであり、ここで、
Rbは、水素、アルキル(C≦6)、または置換アルキル(C≦6)であり;
Lは、以下の式の基であり:
-X4-S(O)n-X5-
式中:
nは、0、1、または2であり;かつ
X4およびX5は、各々独立して、アルカンジイル(C≦8)または置換アルカンジイル(C≦8)であり;かつ
Y1およびY2は、各々独立して、アルキル(C≦12)、置換アルキル(C≦12)、アルケニル(C≦12)、もしくは置換アルケニル(C≦12)であり;または、Y1およびY2は、一緒になり、かつ、アルカンジイル(C≦12)、アルケンジイル(C≦12)、もしくはいずれかの基の置換型である。
ここで:
R1は、水素、アルキル(C≦8)、置換アルキル(C≦8)、またはチオール反応基であり;
xは、10~200の整数であり;
yは、20~200の整数であり;
R2は、水素、アルキル(C≦8)、または置換アルキル(C≦8)であり;
R3は、水素、アルキル(C≦8)、または置換アルキル(C≦8)であり;
Lは、以下の式の基であり:
-X4-S(O)n-X5-
式中:
nは、0、1、または2であり;かつ
X4およびX5は、各々独立して、アルカンジイル(C≦8)または置換アルカンジイル(C≦8)であり;かつ
Y1およびY2は、各々独立して、アルキル(C≦12)、置換アルキル(C≦12)、アルケニル(C≦12)、もしくは置換アルケニル(C≦12)であり;または、Y1およびY2は、一緒になり、かつ、アルカンジイル(C≦12)、アルケンジイル(C≦12)、もしくはいずれかの基の置換型である。
ここで:
xは、10~200の整数であり;
yは、20~200の整数であり;
R2は、水素、アルキル(C≦8)、または置換アルキル(C≦8)であり;
Lは、以下の式の基であり:
-X4-S(O)n-X5-
式中:
nは、0、1、または2であり;かつ
X4およびX5は、各々独立して、アルカンジイル(C≦8)または置換アルカンジイル(C≦8)であり;かつ
Y1およびY2は、各々独立して、アルキル(C≦12)、置換アルキル(C≦12)、アルケニル(C≦12)、もしくは置換アルケニル(C≦12)であり;または、Y1およびY2は、一緒になり、かつ、アルカンジイル(C≦12)、アルケンジイル(C≦12)、もしくはいずれかの基の置換型である。
(A)本明細書に記載されるポリマー、および
(B)治療剤
を含む組成物であって、ポリマーが治療剤を封入している、組成物を提供する。
式:
のポリマーまたはその薬学的に許容される塩であって、
式中:
R 1 は、水素、アルキル (C≦8) 、置換アルキル (C≦8) 、またはチオール反応基であり;
mは、1~8の整数であり;
pおよびqは、各々独立して、1、2、または3であり;
xは、10~200の整数であり;
yは、20~200の整数であり;
zは、0~200の整数であり;
ここで、yまたはzのいずれかのモノマーは該ポリマー中にランダムに分布しており;
X 1 、X 2 、X 1 ′、およびX 2 ′は、各々独立して、OまたはNR a であり、ここで、
R a は、アルキル (C≦6) または置換アルキル (C≦6) であり;
R 2 およびR 2 ′は、各々独立して、水素、アルキル (C≦8) 、または置換アルキル (C≦8) であり;
R 3 は、水素、アルキル (C≦8) 、または置換アルキル (C≦8) であり;
X 3 およびX 3 ′は、各々独立して、OまたはNR b であり、ここで、
R b は、水素、アルキル (C≦6) 、または置換アルキル (C≦6) であり;
LおよびL′は、各々独立して、以下の式の基であり:
-X 4 -S(O) n -X 5 -
式中:
nは、0、1、または2であり;かつ
X 4 およびX 5 は、各々独立して、アルカンジイル (C≦8) または置換アルカンジイル (C≦8) であり;かつ
Y 1 、Y 2 、Y 1 ′、およびY 2 ′は、各々独立して、アルキル (C≦12) 、置換アルキル (C≦12) 、アルケニル (C≦12) 、もしくは置換アルケニル (C≦12) であり;または、Y 1 およびY 2 もしくはY 1 ′およびY 2 ′は、一緒になり、かつ、アルカンジイル (C≦12) 、アルケンジイル (C≦12) 、またはいずれかの基の置換型である、
ポリマー。
[本発明1002]
以下:
またはその薬学的に許容される塩としてさらに定義され、
ここで:
R 1 は、水素、アルキル (C≦8) 、置換アルキル (C≦8) 、またはチオール反応基であり;
mは、1~8の整数であり;
pおよびqは、各々独立して、1、2、または3であり;
xは、10~200の整数であり;
yは、20~200の整数であり;
X 1 およびX 2 は、各々、OまたはNR a であり、ここで、
R a は、水素、アルキル (C≦6) 、または置換アルキル (C≦6) であり;
R 2 は、水素、アルキル (C≦8) 、または置換アルキル (C≦8) であり;
R 3 は、水素、アルキル (C≦8) 、または置換アルキル (C≦8) であり;
X 3 は、OまたはNR b であり、ここで、
R b は、水素、アルキル (C≦6) 、または置換アルキル (C≦6) であり;
Lは、以下の式の基であり:
-X 4 -S(O) n -X 5 -
式中:
nは、0、1、または2であり;かつ
X 4 およびX 5 は、各々独立して、アルカンジイル (C≦8) または置換アルカンジイル (C≦8) であり;かつ
Y 1 およびY 2 は、各々独立して、アルキル (C≦12) 、置換アルキル (C≦12) 、アルケニル (C≦12) 、もしくは置換アルケニル (C≦12) であり;または、Y 1 およびY 2 は、一緒になり、かつ、アルカンジイル (C≦12) 、アルケンジイル (C≦12) 、もしくはいずれかの基の置換型である、
本発明1001のポリマー。
[本発明1003]
以下:
またはその薬学的に許容される塩としてさらに定義され、
ここで:
R 1 は、水素、アルキル (C≦8) 、置換アルキル (C≦8) 、またはチオール反応基であり;
mは、1~8の整数であり;
xは、10~200の整数であり;
yは、20~200の整数であり;
X 1 およびX 2 は、各々、OまたはNR a であり、ここで、
R a は、水素、アルキル (C≦6) 、または置換アルキル (C≦6) であり;
R 2 は、水素、アルキル (C≦8) 、または置換アルキル (C≦8) であり;
R 3 は、水素、アルキル (C≦8) 、または置換アルキル (C≦8) であり;
X 3 は、OまたはNR b であり、ここで、
R b は、水素、アルキル (C≦6) 、または置換アルキル (C≦6) であり;
Lは、以下の式の基であり:
-X 4 -S(O) n -X 5 -
式中:
nは、0、1、または2であり;かつ
X 4 およびX 5 は、各々独立して、アルカンジイル (C≦8) または置換アルカンジイル (C≦8) であり;かつ
Y 1 およびY 2 は、各々独立して、アルキル (C≦12) 、置換アルキル (C≦12) 、アルケニル (C≦12) 、もしくは置換アルケニル (C≦12) であり;または、Y 1 およびY 2 は、一緒になり、かつ、アルカンジイル (C≦12) 、アルケンジイル (C≦12) 、もしくはいずれかの基の置換型である、
本発明1001または本発明1002のポリマー。
[本発明1004]
以下:
またはその薬学的に許容される塩としてさらに定義され、
ここで:
R 1 は、水素、アルキル (C≦8) 、置換アルキル (C≦8) 、またはチオール反応基であり;
xは、10~200の整数であり;
yは、20~200の整数であり;
X 1 およびX 2 は、各々、OまたはNR a であり、ここで、
R a は、水素、アルキル (C≦6) 、または置換アルキル (C≦6) であり;
R 2 は、水素、アルキル (C≦8) 、または置換アルキル (C≦8) であり;
R 3 は、水素、アルキル (C≦8) 、または置換アルキル (C≦8) であり;
X 3 は、OまたはNR b であり、ここで、
R b は、水素、アルキル (C≦6) 、または置換アルキル (C≦6) であり;
Lは、以下の式の基であり:
-X 4 -S(O) n -X 5 -
式中:
nは、0、1、または2であり;かつ
X 4 およびX 5 は、各々独立して、アルカンジイル (C≦8) または置換アルカンジイル (C≦8) であり;かつ
Y 1 およびY 2 は、各々独立して、アルキル (C≦12) 、置換アルキル (C≦12) 、アルケニル (C≦12) 、もしくは置換アルケニル (C≦12) であり;または、Y 1 およびY 2 は、一緒になり、かつ、アルカンジイル (C≦12) 、アルケンジイル (C≦12) 、もしくはいずれかの基の置換型である、
本発明1001~1003のいずれかのポリマー。
[本発明1005]
以下:
またはその薬学的に許容される塩としてさらに定義され、
ここで:
R 1 は、水素、アルキル (C≦8) 、置換アルキル (C≦8) 、またはチオール反応基であり;
xは、10~200の整数であり;
yは、20~200の整数であり;
R 2 は、水素、アルキル (C≦8) 、または置換アルキル (C≦8) であり;
R 3 は、水素、アルキル (C≦8) 、または置換アルキル (C≦8) であり;
Lは、以下の式の基であり:
-X 4 -S(O) n -X 5 -
式中:
nは、0、1、または2であり;かつ
X 4 およびX 5 は、各々独立して、アルカンジイル (C≦8) または置換アルカンジイル (C≦8) であり;かつ
Y 1 およびY 2 は、各々独立して、アルキル (C≦12) 、置換アルキル (C≦12) 、アルケニル (C≦12) 、もしくは置換アルケニル (C≦12) であり;または、Y 1 およびY 2 は、一緒になり、かつ、アルカンジイル (C≦12) 、アルケンジイル (C≦12) 、もしくはいずれかの基の置換型である、
本発明1001~1004のいずれかのポリマー。
[本発明1006]
以下:
またはその薬学的に許容される塩としてさらに定義され、
ここで:
xは、10~200の整数であり;
yは、20~200の整数であり;
R 2 は、水素、アルキル (C≦8) 、または置換アルキル (C≦8) であり;
Lは、以下の式の基であり:
-X 4 -S(O) n -X 5 -
式中:
nは、0、1、または2であり;かつ
X 4 およびX 5 は、各々独立して、アルカンジイル (C≦8) または置換アルカンジイル (C≦8) であり;かつ
Y 1 およびY 2 は、各々独立して、アルキル (C≦12) 、置換アルキル (C≦12) 、アルケニル (C≦12) 、もしくは置換アルケニル (C≦12) であり;または、Y 1 およびY 2 は、一緒になり、かつ、アルカンジイル (C≦12) 、アルケンジイル (C≦12) 、もしくはいずれかの基の置換型である、
本発明1001~1005のいずれかのポリマー。
[本発明1007]
pが1である、本発明1001または本発明1002のポリマー。
[本発明1008]
qが1である、本発明1001、1002、または1007のいずれかのポリマー。
[本発明1009]
mが1、2、または3である、本発明1001~1003、1007、および1008のいずれかのポリマー。
[本発明1010]
mが2である、本発明1009のポリマー。
[本発明1011]
X 1 がOである、本発明1001~1004および1007~1010のいずれかのポリマー。
[本発明1012]
X 2 がOである、本発明1001~1004および1007~1011のいずれかのポリマー。
[本発明1013]
X 3 がOである、本発明1001~1004および1007~1012のいずれかのポリマー。
[本発明1014]
R 1 がアルキル (C≦8) または置換アルキル (C≦8) である、本発明1001~1005および1007~1013のいずれかのポリマー。
[本発明1015]
R 1 がアルキル (C≦8) である、本発明1014のポリマー。
[本発明1016]
R 1 がメチルである、本発明1015のポリマー。
[本発明1017]
R 3 が水素である、本発明1001~1005および1007~1016のいずれかのポリマー。
[本発明1018]
R 2 がアルキル (C≦8) または置換アルキル (C≦8) である、本発明1001~1017のいずれかのポリマー。
[本発明1019]
R 2 がアルキル (C≦8) である、本発明1018のポリマー。
[本発明1020]
R 2 がメチルである、本発明1019のポリマー。
[本発明1021]
LのX 4 が、アルカンジイル (C≦6) または置換アルカンジイル (C≦6) である、本発明1001~1020のいずれかのポリマー。
[本発明1022]
LのX 4 が、アルカンジイル (C≦6) である、本発明1021のポリマー。
[本発明1023]
LのX 4 が、-CH 2 CH 2 -である、本発明1022のポリマー。
[本発明1024]
LのX 5 が、アルカンジイル (C≦6) または置換アルカンジイル (C≦6) である、本発明1001~1023のいずれかのポリマー。
[本発明1025]
LのX 5 が、アルカンジイル (C≦6) である、本発明1024のポリマー。
[本発明1026]
LのX 5 が、-CH 2 CH 2 -である、本発明1025のポリマー。
[本発明1027]
nが0である、本発明1001~1026のいずれかのポリマー。
[本発明1028]
Y 1 が、アルキル (C≦12) または置換アルキル (C≦12) である、本発明1001~1027のいずれかのポリマー。
[本発明1029]
Y 1 が、アルキル (C2~12) または置換アルキル (C2~12) である、本発明1028のポリマー。
[本発明1030]
Y 1 がアルキル (C2~12) である、本発明1028または本発明1029のポリマー。
[本発明1031]
Y 1 が、メチル、エチル、n-プロピル、またはn-ブチルである、本発明1028~1030のいずれかのポリマー。
[本発明1032]
Y 2 が、アルキル (C≦12) または置換アルキル (C≦12) である、本発明1001~1031のいずれかのポリマー。
[本発明1033]
Y 2 が、アルキル (C2~12) または置換アルキル (C2~12) である、本発明1032のポリマー。
[本発明1034]
Y 2 がアルキル (C2~12) である、本発明1032または本発明1033のポリマー。
[本発明1035]
Y 2 が、メチル、エチル、n-プロピル、またはn-ブチルである、本発明1032~1034のいずれかのポリマー。
[本発明1036]
Y 1 およびY 2 が、一緒になり、かつ、アルカンジイル (C≦12) または置換アルカンジイル (C≦12) である、本発明1001~1027のいずれかのポリマー。
[本発明1037]
Y 1 およびY 2 が、一緒になり、かつ、アルカンジイル (C≦8) または置換アルカンジイル (C≦8) である、本発明1036のポリマー。
[本発明1038]
Y 1 およびY 2 が、一緒になり、かつ、アルカンジイル (C≦8) である、本発明1037のポリマー。
[本発明1039]
Y 1 およびY 2 が、一緒になり、かつ、-CH 2 CH 2 CH 2 CH 2 -、-CH 2 CH 2 CH 2 CH 2 CH 2 -、または-CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 -である、本発明1037のポリマー。
[本発明1040]
以下:
またはその薬学的に許容される塩としてさらに定義される、本発明1001~1039のいずれかのポリマー。
[本発明1041]
xが、40~160の整数である、本発明1001~1040のいずれかのポリマー。
[本発明1042]
xが、80~150の整数である、本発明1041のポリマー。
[本発明1043]
yが、40~180の整数である、本発明1001~1042のいずれかのポリマー。
[本発明1044]
yが、80~150の整数である、本発明1043のポリマー。
[本発明1045]
本発明1001~1044のいずれかの複数のポリマーを含む、ミセル。
[本発明1046]
(A)本発明1001~1044のいずれかのポリマー、および
(B)治療剤
を含む組成物であって、該ポリマーが該治療剤を封入している、組成物。
[本発明1047]
ポリマーがミセルを形成している、本発明1046の組成物。
[本発明1048]
ミセルが治療剤を完全に封入している、本発明1046または本発明1047の組成物。
[本発明1049]
治療剤が、免疫系に影響を与える薬剤である、本発明1046~1048のいずれかの組成物。
[本発明1050]
治療剤がサイトカインまたは免疫系調節剤である、本発明1049の組成物。
[本発明1051]
サイトカインが、IL-1β、IL-2、IL-12、またはIL-15である、本発明1050の組成物。
[本発明1052]
免疫系調節剤が、cGAMPまたは1型インターフェロンである、本発明1050の組成物。
[本発明1053]
治療剤が抗原である、本発明1049の組成物。
[本発明1054]
抗原が抗がん抗原である、本発明1053の組成物。
[本発明1055]
抗がん抗原がE7ペプチドである、本発明1054の組成物。
[本発明1056]
薬学的組成物として製剤化されており、かつ、賦形剤をさらに含む、本発明1046~1055のいずれかの組成物。
[本発明1057]
薬学的組成物が、経口的に、脂肪内に、動脈内に、関節内に、頭蓋内に、皮内に、病巣内に、筋肉内に、鼻腔内に、眼内に、心膜内に、腹腔内に、胸膜内に、前立腺内に、直腸内に、髄腔内に、気管内に、腫瘍内に、臍帯内に、膣内に、静脈内に、小胞内に、硝子体内に、リポソームによって、局所に、粘膜に、非経口的に、直腸に、結膜下に、皮下に、舌下に、局所的に、経頬的に、経皮的に、膣に、クリームで、脂質組成物で、カテーテルによって、洗浄によって、持続注入によって、注入によって、吸入によって、注射によって、局所送達によって、または局所灌流によって、投与するために製剤化されている、本発明1056の組成物。
[本発明1058]
薬学的組成物が、注射によって投与するために製剤化されている、本発明1057の組成物。
[本発明1059]
薬学的組成物が、動脈内投与、筋肉内投与、腹腔内投与、腫瘍内投与、または静脈内投与用に製剤化されている、本発明1057の組成物。
[本発明1060]
賦形剤がビヒクルである、本発明1056~1059のいずれかの組成物。
[本発明1061]
ビヒクルが、注射に適した水溶液である、本発明1060の組成物。
[本発明1062]
疾患または障害を処置する方法であって、
その必要がある患者へ、治療有効量の本発明1046~1061のいずれかの組成物を投与する工程を含み、
治療剤が、該疾患または障害を処置するために十分である、
方法。
[本発明1063]
疾患または障害ががんである、本発明1062の方法。
[本発明1064]
治療剤が、がんを標的とするように免疫系を調節することができる、本発明1062または本発明1063の方法。
[本発明1065]
治療剤が、1つまたは複数のがん細胞に対する免疫応答を生じさせる、本発明1062~1064のいずれかの方法。
本開示の他の目的、特徴および利点は、以下の詳細な説明から明らかになるであろう。しかし、詳細な説明および具体例は、本開示の具体的な態様を示しているが、例示のためのみに与えられていると理解されるべきであり、何故ならば、本開示の精神および範囲内における様々な変更および改変がこの詳細な説明から当業者に明らかになるためである。
いくつかの局面において、本開示は、特定の転移pHより上で解体し(dissemble)かつ分解性骨格を含有するpH応答性ナノ粒子を形成することができるポリマーを提供する。いくつかの態様において、これらのポリマーは、鋭いpH転移値を有し、かつ、ポリマーのクリアランスを加速させる1つまたは複数の分解性基を含有する。これらのポリマーは、広範囲のpH転移点を有し得、特異的組織への薬物化合物の送達のような、広範囲の用途を可能にする。いくつかの局面において、本開示は、がんを処置するために使用され得る免疫系調節剤のような治療剤を含む治療剤を体へ送達することなど、上述のようなpH応答性システムにおいてこれらのポリマーを使用する方法を提供する。
化学基の文脈において使用される場合、「水素」は-Hを意味し;「ヒドロキシ」は-OHを意味し;「オキソ」は=Oを意味し;「カルボニル」は-C(=O)-を意味し;「カルボキシ」は-C(=O)OH(-COOHまたは-CO2Hとも書く)を意味し;「ハロ」は独立に-F、-Cl、-Brまたは-Iを意味し;「アミノ」は-NH2を意味し;「ヒドロキシアミノ」は-NHOHを意味し;「ニトロ」は-NO2を意味し;イミノは=NHを意味し;「シアノ」は-CNを意味し;「イソシアニル」は-N=C=Oを意味し;「アジド」は-N3を意味し;一価の文脈で「ホスフェート」は-OP(O)(OH)2またはその脱プロトン型を意味し;二価の文脈で「ホスフェート」は-OP(O)(OH)O-またはその脱プロトン型を意味し;「メルカプト」は-SHを意味し;かつ「チオ」は=Sを意味し;「チオカルボニル」は-C(=S)-を意味し;「スルホニル」は-S(O)2-を意味し;かつ「スルフィニル」は-S(O)-を意味する。
は、任意選択の結合であり、存在する場合は単結合または二重結合である。記号
は単結合または二重結合である。従って、式
は、例えば、
を包含する。また、そのような環の原子は一つも2つ以上の二重結合の部分を形成しないことが理解される。さらに、共有結合の記号「-」は、1または2個の立体的原子を接続している場合、好ましい立体化学を示すものではないことが注意される。むしろ、それは全ての立体異性体およびその混合物を含むものである。記号
は、結合にわたって垂直にひかれた場合
、その基の結合点を示す。結合点を一義的に特定することにおいて読者を助けるために、結合点は典型的により大きな基に対してのみこのように特定されることが注意される。記号
は、くさびの太い端部に結合した基が「紙面から出る」場合の単結合を意味する。記号
は、くさびの太い端部に結合した基が「紙面の中に入る」場合の単結合を意味する。記号
は、二重結合の周囲のジオメトリー(例えば、EまたはZ)が定義されていない場合の単結合を意味する。このため、両方の選択肢、ならびにその組み合わせが意図されている。本出願で示される構造の原子上の定義されていない原子価はいずれも、その原子に結合した水素原子を暗に表す。炭素原子上の太い点は、その炭素に結合した水素は紙の平面から外側に配向されていることを示している。
における基「R」として描写される場合、安定な構造が形成される限りにおいて、変数は、描写された、暗示された、または明確に定義された水素を包含する、環原子のいずれかと結合した任意の水素原子と置き換わってもよい。変数が縮合環系上の「浮遊基」として、例えば、式:
における基「R」として描写される場合、特に断らない限り、変数は縮合環のどちらかの環原子のいずれかと結合した任意の水素原子と置き換わってもよい。置き換わることができる水素としては、安定な構造が形成される限りにおいて、描写された水素(例えば、上記の式の窒素と結合した水素)、暗示された水素(例えば、示されていないが存在すると理解される上記の式の水素)、明確に定義された水素、および、その存在が環原子との同一性に依存している任意選択の水素(例えば、基Xが-CH-に等しい場合、Xに結合した水素)が挙げられる。描写された例において、Rは、縮合環系の5員環または6員環のいずれかに存在してもよい。上記の式において、括弧で囲まれたRのすぐ後の下付き文字「y」は、数値変数を表す。特に指定が無い限り、この変数は0、1、2、または2より大きい全ての整数であることができ、環または環系の置換可能な水素原子の最大数によってのみ限定される。
本明細書に開示されるpH応答性ミセルおよびナノ粒子はブロックコポリマーを含む。ブロックコポリマーは、親水性ポリマーセグメントおよび疎水性ポリマーセグメントを含む。疎水性ポリマーセグメントはpH感受性である。例えば、疎水性ポリマーセグメントは、pH感受性にするためにイオン化可能アミン基を含むことができる。ブロックコポリマーは、これらのイオン化可能ブロックコポリマーの超分子自己組織化に基づいてpH活性化可能ミセル(pHAM)ナノ粒子を形成する。より高いpHでは、ブロックコポリマーはミセルに集合し、一方、より低いpHで、疎水性ポリマーセグメント中のアミン基のイオン化がミセルの解離をもたらす。イオン化可能基は、異なるpHで微調整可能な親水性/疎水性ブロックとして機能することができ、ミセルの動的自己組織化に直接影響を与えることができる。
本明細書に開示されるシステムおよび組成物は、異なるpHレベルに調整された単一のミセルまたは一連のミセルを利用する。さらに、ミセルは狭いpH転移範囲を有する。いくつかの態様において、ミセルは約1 pH単位未満のpH転移範囲を有する。様々な態様において、ミセルは約0.9 pH単位未満の、約0.8 pH単位未満の、約0.7 pH単位未満の、約0.6 pH単位未満の、約0.5pH単位未満の、約0.4 pH単位未満の、約0.3 pH単位未満の、約0.25 pH単位未満の、約0.2 pH単位未満の、または約0.1 pH単位未満のpH転移範囲を有する。狭いpH転移範囲は、有利なことに、pHの微妙な変化でフルオロフォアの完全なターンオンをもたらし得るより鋭いpH応答を提供する。
ミセルおよびナノ粒子は標的指向部分をさらに含んでもよい。標的指向部分は、ナノ粒子またはミセルを、例えば、特定の細胞表面受容体、細胞表面マーカー、または細胞小器官(例えば、核、ミトコンドリア、小胞体、葉緑体、アポプラスト、またはペルオキシソーム)へ標的指向させるために使用することができる。このような標的指向部分は、受容体リサイクリング、マーカーリサイクリング、細胞内pH調節、エンドサイトーシス輸送の研究において有利である。
いくつかの局面において、本開示は、組成物に1種類または複数種類の抗原成分を提供する。抗原は、免疫応答を促進する物質であり、それにより、抗体が該物質に対して特異的に生成される。免疫原性がより大きいことで、免疫系が適切な免疫応答を容易に発生する物質もあれば、抗原に対する抗体を生成するのに十分な免疫応答を生成するために助けを要する物質もある。大部分のがんは、抗原に対する抗体の生成を強化するために追加的な活性化を要する可能性がある。抗原のいくつかの非限定的な例には、がん特異的表面タンパク質またはがん細胞によって過剰発現される表面タンパク質のタンパク質またはそのフラグメントが含まれる。
多様な異なるペプチド、タンパク質フラグメント、またはタンパク質が、本組成物中に抗原として使用され得る。いくつかの非限定的な例は、5T4、707-AP(707アラニンプロリン)、9D7、AFP(α-胎児タンパク質)、AlbZIP HPG1、α5β1-インテグリン、α5β6-インテグリン、α-メチルアシル-補酵素Aラセマーゼ、ART-4(T細胞により認識される腺がん抗原4)、B7H4、BAGE-1(B抗原)、BCL-2、BING-4、CA15-3/CA27-29、CA19-9、CA72-4、CA125、カルレチキュリン、CAMEL(メラノーマ上CTL認識抗原)、CASP-8(カスパーゼ-8)、カテプシンB、カテプシンL、CD19、CD20、CD22、CD25、CD30、CD33、CD40、CD52、CD55、CD56、CD80、CEA(がん胎児性抗原)、CLCA2(カルシウム活性化塩素チャネル-2)、CML28、コアクトシン(Coactosin)様タンパク質、コラーゲンXXIII型、COX-2、CT-9/BRD6(ブロモドメイン精巣特異タンパク質)、Cten(C末端テンシン様タンパク質)、サイクリンB1、サイクリンD1、cyp-B(シクロフィリンB)、CYPB1(チトクロムP450 1B1)、DAM-10/MAGE-B1(分化抗原メラノーマ10)、DAM-6/MAGE-B2(分化抗原メラノーマ6)、EGFR/Her1、EMMPRIN(腫瘍細胞関連細胞外マトリックスメタロプロテイナーゼ誘導因子)、EpCam(上皮細胞接着分子)、EphA2(エフリンA型受容体2)、EphA3(エフリンA型受容体3)、ErbB3、EZH2(Zesteホモログエンハンサー2)、FGF-5(線維芽細胞増殖因子5)、FN(フィブロネクチン)、Fra-1(Fos関連抗原1)、G250/CAIX(糖タンパク質250)、GAGE-1(G抗原1)、GAGE-2(G抗原2)、GAGE-3(G抗原3)、GAGE-4(G抗原4)、GAGE-5(G抗原5)、GAGE-6(G抗原6)、GAGE-7b(G抗原7b)、GAGE-8(G抗原8)、GDEP(前立腺差次的発現遺伝子)、GnT-V(N-アセチルグルコサミニルトランスフェラーゼV)、gp100(糖タンパク質100kDa)、GPC3(グリピカン3)、HAGE(ヘリカーゼ抗原)、HAST-2(ヒト印環腫瘍-2)、ヘプシン、Her2/neu/ErbB2(ヒト上皮受容体-2/神経性)、HERV-K-MEL、HNE(ヒト好中球エラスターゼ)、ホメオボックスNKX3.1、HOM-TES-14/SCP-1、HOM-TES-85、HPV-E6、HPV-E7、HST-2、hTERT(ヒトテロメラーゼ逆転写酵素)、iCE(腸カルボキシルエステラーゼ)、IGF-1R、IL-13Ra2(インターロイキン13受容体α2鎖)、IL-2R、IL-5、未熟ラミニン受容体、カリクレイン2、カリクレイン4、Ki67、KIAA0205、KK-LC-1(北九州肺がん抗原1)、KM-HN-1、LAGE-1(L抗原)、リビン(livin)、MAGE-A1(メラノーマ抗原A1)、MAGE-A10(メラノーマ抗原A10)、MAGE-A12(メラノーマ抗原A12)、MAGE-A2(メラノーマ抗原A2)、MAGE-A3(メラノーマ抗原A3)、MAGE-A4(メラノーマ抗原A4)、MAGE-A6(メラノーマ抗原A6)、MAGE-A9(メラノーマ抗原A9)、MAGE-B1(メラノーマ抗原B1)、MAGE-B10(メラノーマ抗原B10)、MAGE-B16(メラノーマ抗原B16)、MAGE-B17(メラノーマ抗原B17)、MAGE-B2(メラノーマ抗原B2)、MAGE-B3(メラノーマ抗原B3)、MAGE-B4(メラノーマ抗原B4)、MAGE-B5(メラノーマ抗原B5)、MAGE-B6(メラノーマ抗原B6)、MAGE-C1(メラノーマ抗原C1)、MAGE-C2(メラノーマ抗原C2)、MAGE-C3(メラノーマ抗原C3)、MAGE-D1(メラノーマ抗原D1)、MAGE-D2(メラノーマ抗原D2)、MAGE-D4(メラノーマ抗原D4)、MAGE-E1(メラノーマ抗原E1)、MAGE-E2(メラノーマ抗原E2)、MAGE-F1(メラノーマ抗原F1)、MAGE-H1(メラノーマ抗原H1)、MAGEL2(MAGE様2)、マンマグロビンA、MART-1/Melan-A(T細胞により認識されるメラノーマ抗原1/メラノーマ抗原A)、MART-2(T細胞により認識されるメラノーマ抗原2)、マトリックスタンパク質22、MC1R(メラノコルチン1受容体)、M-CSF(マクロファージコロニー刺激因子遺伝子)、メソセリン、MG50/PXDN、MMP11(M期リンタンパク質11)、MN/CA IX抗原、MRP-3(多剤耐性関連タンパク質3)、MUC1(ムチン1)、MUC2(ムチン2)、NA88-A(患者M88のNA cDNAクローン)、N-アセチルグルコサミニルトランスフェラーゼ-V、Neo-PAP(Neo-ポリ(A)ポリメラーゼ)、NGEP、NMP22、NPM/ALK(ヌクレオフォスミン/未分化リンパ腫キナーゼ融合タンパク質)、NSE(神経特異的エノラーゼ)、NY-ESO-1(ニューヨーク食道(esophageous)1)、NY-ESO-B、OA1(眼白子症1型タンパク質)、OFA-iLRP(がん胎児抗原-未熟ラミニン受容体)、OGT(O-結合型N-アセチルグルコサミントランスフェラーゼ遺伝子)、OS-9、オステオカルシン、オステオポンチン、p15(タンパク質15)、p15、p190マイナーbcr-abl、p53、PAGE-4(前立腺GAGE様タンパク質4)、PAI-1(プラスミノーゲン活性化因子阻害物質1)、PAI-2(プラスミノーゲン活性化因子阻害物質2)、PAP(前立腺酸性ホスファターゼ)、PART-1、PATE、PDEF、Pim-1-キナーゼ、Pin1(プロピルイソメラーゼ)、POTE、PRAME(メラノーマ優先発現抗原)、プロステイン(prostein)、プロテイナーゼ3、PSA(前立腺特異抗原)、PSCA、PSGR、PSM、PSMA(前立腺特異膜抗原)、RAGE-1(腎性抗原)、RHAMM/CD168(ヒアルロン酸媒介運動性受容体)、RU1(腎遍在性1)、RU2(腎遍在性1)、S-100、SAGE(肉腫抗原)、SART-1(扁平上皮抗原拒絶腫瘍1)、SART-2(扁平上皮抗原拒絶腫瘍1)、SART-3(扁平上皮抗原拒絶腫瘍1)、SCC(扁平上皮がん抗原)、Sp17(精子タンパク質17)、SSX-1(滑膜肉腫Xブレークポイント1)、SSX-2/HOM-MEL-40(滑膜肉腫Xブレークポイント)、SSX-4(滑膜肉腫Xブレークポイント4)、STAMP-1、STEAP(6回膜貫通上皮抗原前立腺)、サバイビング(surviving)、サバイビン2B(イントロン2保持サバイビン)、TA-90、TAG-72、TARP、TGFb(TGFβ)、TGFbRII(TGFβ受容体II)、TGM-4(前立腺特異的トランスグルタミナーゼ)、TRAG-3(タキソール耐性関連タンパク質3)、TRG(テスチン(testin)関連遺伝子)、TRP-1(チロシン関連タンパク質1)、TRP-2/6b(TRP-2/新規エクソン6b)、TRP-2/INT2(TRP-2/イントロン2)、Trp-p8、チロシナーゼ、UPA(ウロキナーゼ型プラスミノーゲン活性化因子)、VEGF(血管内皮増殖因子)、VEGFR-2/FLK-1(血管内皮増殖因子受容体2)、WT1(ウィルムス腫瘍遺伝子)を含み、または例えば、α-アクチニン-4/m、ARTC1/m、bcr/abl(ブレークポイントクラスター領域-エーベルソン融合タンパク質)、β-カテニン/m(β-カテニン)、BRCA1/m、BRCA2/m、CASP-5/m、CASP-8/m、CDC27/m(細胞分裂周期27)、CDK4/m(サイクリン依存性キナーゼ4)、CDKN2A/m、CML66、COA-1/m、DEK-CAN(融合タンパク質)、EFTUD2/m、ELF2/m(伸長因子2)、ETV6-AML1(Ets異種遺伝子6/急性骨髄性白血病1遺伝子融合タンパク質)、FN1/m(フィブロネクチン1)、GPNMB/m、HLA-A*0201-R170I(HLA-A2遺伝子中のα2ドメインのα-ヘリックスの残基170におけるアルギニンからイソロイシンへの交換)、HLA-A11/m、HLA-A2/m、HSP70-2M(熱ショックタンパク質70-2変異型)、KIAA0205/m、K-Ras/m、LDLR-FUT(LDR-フコシルトランスフェラーゼ融合タンパク質)、MART2/m、ME1/m、MUM-1/m(メラノーマ遍在性変異型1)、MUM-2/m(メラノーマ遍在性変異型2)、MUM-3/m(メラノーマ遍在性変異型3)、ミオシンクラスI/m、neo-PAP/m、NFYC/m、N-Ras/m、OGT/m、OS-9/m、p53/m、Pml/RARα(前骨髄球性白血病/レチノイン酸受容体α)、PRDX5/m、PTPRK/m(受容体型タンパク質チロシンホスファターゼκ)、RBAF600/m、SIRT2/m、SYT-SSX-1(シナプトタグミンI/滑膜肉腫X融合タンパク質)、SYT-SSX-2(シナプトタグミンI/滑膜肉腫X融合タンパク質)、TEL-AML1(トランスロケーションEtsファミリー白血病/急性骨髄性白血病1融合タンパク質)、TGFβRII(TGFβ受容体II)、TPI/m(トリオースホスファターゼイソメラーゼ)を非限定的に含む群より選択される、がん疾患に発現される変異型抗原を含み得る。
本開示はまたキットを提供する。本明細書に開示される成分のいずれかをキット中に組み込むことができる。ある態様において、キットは、上述のpH応答性システムまたは組成物を含む。
以下の実施例は本開示の好ましい態様を実証するために含まれる。以下の実施例に開示される技術は、本開示の実施において十分に機能することが本発明者によって見出された技術を示し、従って、その実施のための好ましいモードを構成すると考えられ得ることが、当業者によって認識されるべきである。しかし、当業者は、本開示に照らし、本開示の精神および範囲から逸脱することなく、開示される具体的な態様において多くの変更を行い、同様または類似の結果を依然として得ることができることを認識するべきである。
1.材料
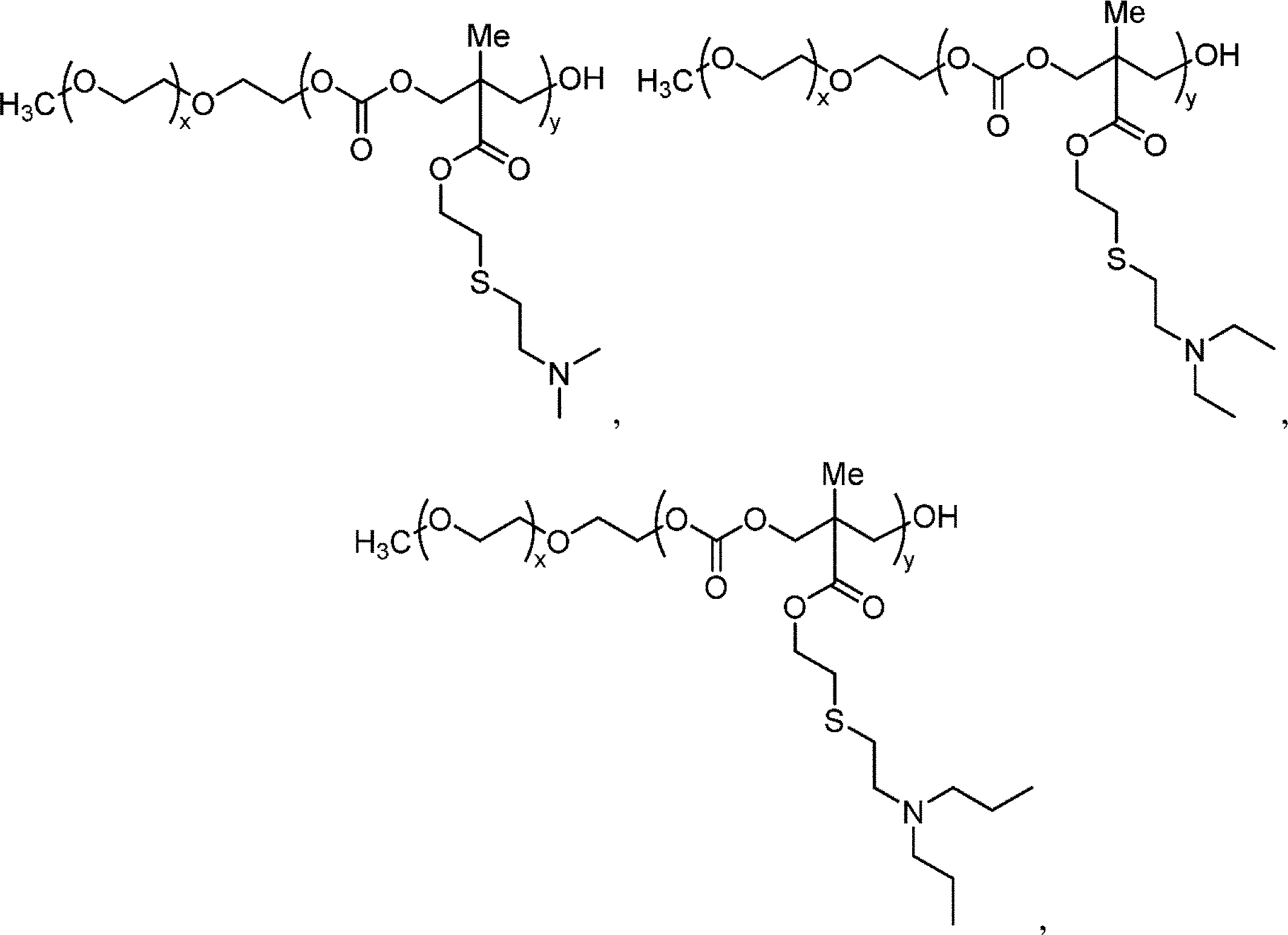
全ての試薬を、指定されない限り、商業的供給源から購入したかまたは合成し、さらに精製することなく使用した。それらは、ポリ(エチレングリコール)メチルエーテル(mPEG5k-OH、Mn = 5.4 × 103 g/mol、1H NMRによって測定した)、1-(3,5-ビス-トリフルオロメチル-フェニル)-3-シクロヘキシルチオ尿素(TU、合成した) (Natarajan et al., 2005)、1,8-ジアザビシクロ[5.4.0]ウンデカ-7-エン(DBU、≧99%、Sigma-Aldrich)、ジプロピルアミン(DPA、99%、Sigma-Aldrich)、ジブチルアミン(DBA、≧99.5%、Sigma-Aldrich)、ピロリジン(C5A、≧99%、Sigma-Aldrich)、ピペリジン(C6A、≧99.5%)、ヘキサメチレンイミン(C7A、99%、Sigma-Aldrich)、エチレンスルフィド(98%、Sigma-Aldrich)、2,2-ジメトキシ-2-フェニルアセトフェノン(DMPA、99%、Sigma-Aldrich)であった。2-ジメチルアミノエタンチオール塩酸塩(DMA-SH・HCl、95%)および2-ジエチルアミノエタンチオール塩酸塩(DEA-SH・HCl、95%)をSigma-Aldrichから購入した。他のアミノチオール塩酸塩分子(下記に示される)を、報告された通りに(Hao et al., 2015)合成した。
先ず、5-メチル-5-アリルオキシカルボニル-1,3-ジオキサン-2-オン(MAC)モノマーを報告された通りに(Hu et al., 2007)合成した。PEO-b-PMACコポリマーを、開始剤としてmPEG5k-OHを用いて開環重合(ROP)によって合成した([モノマー]/[開始剤] = 200)。典型的に、精製アルゴンで満たされたグローブボックス中において、シュレンク反応フラスコに0.4 g mPEG5k-OH、3.2 g MACモノマーおよび16.0 mLジクロロメタン(DCM)を入れた。3回の凍結-ポンプ-解凍サイクル後、重合を開始するために0.6 g TUおよび0.16 mL DBUを導入した。反応を30℃で15時間油浴中に置き、次いで安息香酸の添加によってクエンチした。DCM溶媒を蒸発によって除去し、濃縮残渣を過剰量の冷エーテル中へ沈殿させた。未反応出発物質および不純物を除去するために、精製プロセスを2回繰り返した。結果として生じたPEO-b-PMACコポリマーを400 MHz 1H NMR、ゲル浸透クロマトグラフィー(GPC、Viscotech GPCmax、PLgel 5μm MIXED-Dカラム、Polymer Labs製。1% v/v TEAを含むTHFを溶出剤として1.0 mL/分で使用した)によって特徴付けた。PEG123-b-PMAC125について、
PEO-b-P(MAC-SR・HCl)コポリマーを、アリル含有PEO-b-PMACとアミノチオール塩酸塩とのチオール-エン反応によって合成した。下記において、本発明者らは一例としてPEO-b-P(MAC-SDEA・HCl)の合成を選択した。先ず、0.1 g PEO123-b-PMAC125 (0.419 mmol)を石英フラスコ中の15 mL DMF中に溶解し、窒素下で10~20分間撹拌した。次いで、1.06 g DEA-SH・HCl (6.29 mmol)および21.5 mg DMPA (0.084 mmol)をフラスコ中へ添加した。さらに20分間窒素パージした後、反応を開始するためにフラスコをUV光(365 nm)下に置いた。12時間後、反応混合物を蒸留水中において透析し、凍結乾燥し、白色粉末が得られた。一連のPEO-b-P(MAC-SR・HCl)コポリマーを1H NMRおよびGPCによって確認した。結果を表1に要約する。
a PEO-b-PMACコポリマー前駆体についての繰り返し単位の数は140である。
b PEO-b-PMACコポリマー前駆体についての繰り返し単位の数は125である。
c Mw,GPC、Mn,GPCおよびPDI (Mw,GPC/Mn,GPC)は、GPC中において標準としてのポリスチレンおよび溶出溶媒としてのTHF (1% v/v TEA)を使用することによって得られた。
PEO-b-P(MAC-SC7A)を一例として使用する。典型的な手順において、10 mg PEO123-b-P(MAC-SC7A・HCl)135コポリマーを、150 mM NaClを含む蒸留水中に溶解した。最終pH値を8.0超に調節するために、NaOH溶液を添加した。3000 Da分子量カットオフ遠心管を用いた超遠心分離を3サイクル行うことによって、過剰なNaOHおよび塩を除去した。ポリマー濃度を1.0 mg/mLに調節するために、蒸留水をミセル溶液へ添加した。
PEO-b-P(MAC-SC7A)を一例として使用する。典型的な実験において、ポリマー濃度を1.0 mg/mLにするために、10 mg PEO123-b-P(MAC-SC7A・HCl)135コポリマーを、先ず、10 mL蒸留水中に溶解した。塩濃度を150 mMへ調節するために、NaClを添加した。次いで、PEO123-b-P(MAC-SC7A・HCl)135コポリマーを完全に脱プロトン化するために、NaOH溶液を添加した。撹拌下で少量(1μLずつ)の0.5 M HCl溶液を添加することによって、pH滴定を行った。pH値を、微小電極を備えるMettler Toledo pHメーターを使用して測定した。全範囲におけるpH減少を、総添加HCl体積の関数としてモニターした。完全プロトン化状態(100%プロトン化度)および脱プロトン化状態(0%プロトン化度)を、pH滴定曲線の一次微分の2つの極値点によって決定した。選択されたプロトン化度で、100μLのポリマー溶液を動的光散乱測定(DLS、Malvern Nano-ZSモデル、He-Neレーザー、λ= 633 nm)のために取り出した。他のPEO-b-P(MAC-SR)コポリマーも同様の滴定手順に従った。
ポリマー濃度を1.0 mg/mLにするために、PEO123-b-P(MAC-SC7A・HCl)135を、先ず、蒸留水中に溶解した。塩濃度を150 mMへ調節するために、NaClを添加した。滴定座標に基づいて、プロトン化度を95%および85%へ調節するために、対応する量の0.5 M NaOHを添加した。ポリマー溶液を0.2 mg/mLへ希釈し、銅グリッド上に落とした。グリッドを乾燥させ、蒸留水を使用してグリッドを数秒間リンスし、NaClを除去し、その後、ネガティブ染色のためにリンタングステン酸(PTA)を添加した。同様に、55%および45%のプロトン化度を有するPEO123-b-P(MAC-SDMA)135コポリマーをTEMによって画像化した。
pH 6.5および7.4の重水素化リン酸緩衝溶液をD2O中のNa2HPO4およびNaH2PO4 (50 mM)によって調製した。NaClを150 mMの最終濃度に達するまで添加した。pH 6.5溶液では、ポリマー濃度を5.0 mg/mLにするために、5.0 mg PEO123-b-P(MAC-SC7A・HCl)135コポリマーを1.0 mL 重水素化リン酸緩衝溶液中に溶解した。ポリマー溶液のpHを濃NaODおよびDCl溶液によって6.5へさらに調節した。管を次いで密封し、150 rpmの速度で37℃振盪機中へ置いた。ある時間で、ポリマー溶液を1H NMR測定のためにNMRチューブ中へ移した。ポリマー溶液のpHを1日おきに調節した。pH 7.4溶液研究を同様の手順に従って行った。
Marvin ITC200マイクロカロリーメーターを使用して、STING二量体およびdUPSコポリマー間の結合親和性を測定するために、ITCを使用した。25 mM HEPES (pH 6.5)を含有する緩衝液中において20℃で滴定を行った。滴定トレースをNITPICによって積分し、曲線をSEDFITによってフィッティングした。GUSSI (biophysics.swmed.edu/MBR/software.html)を使用して、図を作成した。
THP1-ISG細胞(5 × 105細胞/mL)を、37℃で5% CO2および正常O2レベル中にて48時間、完全培地(RPMI-1640、10%ウシ胎仔血清、100 U/mLペニシリンGナトリウムおよび100μg/mLストレプトマイシン)中においてホルボール12-ミリスタート13-アセタート(PMA)と共にインキュベートし、さらに24時間、新鮮培地を補充した。次いで、細胞を、48時間、異なるdUPSコポリマー(0.5μM)を含む新鮮培地と共にインキュベートした。細胞培養上清中のIRF誘導性Luciaルシフェラーゼのレベルを、ルシフェラーゼ検出試薬であるQUANTI-Luc(商標)を用いて評価した。
腫瘍特異的抗原ペプチドおよびPSC7Aナノ粒子を物理的に混合することによって、ナノワクチンを作製した。非分解性PC7Aベースのナノワクチンを比較のために使用した。6~8週齢のC57BL/6マウスの右大腿部に、2 × 105個のTC-1細胞またはB16F10メラノーマ細胞を皮下接種した。TC-1腫瘍モデルにおいて、接種後8、14、24日目に、PBS、E7p単独(0.5μg)、PSC7A NP単独(30μg)、低用量PSC7Aナノワクチン(6μg PSC7A NP中0.1μg E7p)、高用量PSC7Aナノワクチン(30μg PSC7A NP中0.5μg E7p)、および高用量PC7Aナノワクチン(30μg PC7A NP中0.5μg E7p)を、マウスの尾基部中へ皮下注射した。B16F10腫瘍モデルにおいて、接種後5、10、15日目に、PBS、Trp1,2単独(0.5μg Trp1214-237および0.5μg Trp2173-196)、PSC7A NP単独(30μg)、低用量PSC7Aナノワクチン(6μg PSC7A NP中0.1μg Trp1および0.1μg Trp2)、高用量PSC7Aナノワクチン(30μg PSC7A NP中0.5μg Trp1および0.5μg Trp2)、および高用量PC7Aナノワクチン(30μg PC7A NP中0.5μg Trp1および0.5μg Trp2)を、マウスの尾基部中へ皮下注射した。腫瘍増殖を、その後、デジタルキャリパーを用いて測定し、0.5 × 長さ × 幅2として計算した。腫瘍体積が2000 mm3に達した時点でマウスを犠牲にした。
OriginおよびGraphpad Prismを使用して統計解析を行った。データを平均値± s.e.m.として表す。データをt-検定によって解析し、P < 0.05 (***P < 0.001、**P < 0.01、*P < 0.05)の場合、統計的に有意と見なした。
スキーム1は、開環重合(ROP)を使用する生分解性UPSコポリマーの合成を示す(Chen et al., 1997; Brannigan and Dove, 2017; Feng et al., 2012)。最初に、アリル官能化ブロックコポリマー、ポリ(エチレンオキシド)-b-ポリ(5-メチル-5-アリルオキシカルボニル-1,3-ジオキサン-2-オン) (PEO-b-PMAC)を、ジクロロメタン(DCM)中において高分子開始剤としてのメトキシ末端ポリエチレングリコール(PEO)(mPEG5k-OH、Mn = 5.4 × 103 g/mol、1H NMRによって測定した)および環状モノマーとしての5-メチル-5-アリルオキシカルボニル-1,3-ジオキサン-2-オン(MAC)を使用して合成した。1-(3,5-ビス-トリフルオロメチル-フェニル)-3-シクロヘキシルチオ尿素(TU)および1,8-ジアザビシクロ[5.4.0]ウンデカ-7-エン(DBU)の有機共触媒を使用した。反応混合物を30℃で15時間加熱し、1H NMRによって測定してPMACセグメント中125~140個の繰り返し単位を有するPEO-b-PMACコポリマーが得られた。pH感受性を与えるために、PEO-b-PMACを、UV光(365 nm、スキーム1)下でチオール-エン反応によって一連のプロトン化第3級アミン(R・HCl)とさらに反応させた。結果として、生分解性超pH感受性コポリマーPEO-b-P(MAC-SR・HCl)のライブラリーを、プロトン化状態で合成した(表1)。PSRは、下記のブロックコポリマーPEO-b-P(MAC-SR・HCl)およびその脱プロトン化状態を指すために使用した。
PEG-b-P(MAC-SDPA) (pKa=6.1)ミセルを、T細胞増殖因子であるIL-2を腫瘍微小環境へ送達するために開発した。典型的な手順において、0.2 mg PEG-b-P(MAC-SDPA)を0.05 mLメタノール中に溶解し、次いで、0.5 mL PBS (pH 7.4)中へ滴下し、空のミセルを形成した。メタノールを限外濾過(100 kDa、5000 rpm/15分、2回について)によって除去した。ミセルをPBS中に再懸濁し、次いで、異なる量のヒト組換えIL-2タンパク質と混合した。
IL-2によって誘導されるJAK-STAT経路の活性化をモニターするために設計されているHEK-Blue(商標)IL-2レポーター細胞を使用して、IL-2機能を調べた。簡潔には、予め温めたPBSによって細胞をリンスし、フラスコから分離し、約280,000細胞/mLで細胞懸濁液を調製した。次いで、20μLの遊離IL-2またはIL-2積載PEG-b-P(MAC-SDPA)を平底96-ウェルプレートへ添加した。サンプルをCO2インキュベーター中において37℃で1ウェル当たり180μLの細胞懸濁液と共にインキュベートした(IL-2濃度:200、50、10、2、0.5、0.2、0.05、0.01 ng/mL;PEG-b-P(MAC-SDPA)濃度:40、10、2、0.4、0.1、0.04、0.01、0.002μg/mL)。24時間後、1ウェル当たり20μLの誘導HEK-Blue(商標)IL-2細胞上清を別の96-ウェルプレート中へ添加し、100μL QUANTI-Blue(商標)検出溶液と混合した。プレートを37℃インキュベーターで1時間インキュベートし、次いで、630 nmで分光光度計を使用してSEAPレベルを決定した。
B16F10メラノーマ腫瘍モデル中における遊離IL-2およびPEG-b-P(MAC-SDPA)-IL-2の腫瘍増殖阻害効果を評価した。C57bl/6jマウスに、先ず、B16F10細胞(100μL PBS中2.5 × 105細胞)を接種した。腫瘍が50~80 mm3のサイズに成長した時点で、マウスを無作為に5つの群に分けた。遊離IL-2またはPEG-b-P(MAC-SDPA)-IL-2を、1日目および5日目に腫瘍内にまたは静脈内に注射した(IL-2:1注射当たり1μg;PEG-b-P(MAC-SDPA):1注射当たり200μg)。
cGAMPは、STING経路を通してI型IFN産生をトリガーする、内因性セカンドメッセンジャーかつ高親和性リガンドである。それはアニオン性の高水溶性分子であり、その活性および治療効果は、低いバイオアベイラビリティおよび不十分な薬物様特性によって制限される。cGAMPの効率的な細胞質送達のために、本発明者らの生分解性PEG-b-P(MAC-SC7A)ミセルに基づいてナノ粒子を開発した。
ローディング効率(%) = (ローディングされたcGAMPの重量/総cGAMPの重量) × 100%。
インターフェロン遺伝子刺激因子(STING)は、自然免疫において重要な役割を果たす小胞体(ER)結合ホモ二量体タンパク質である(Barber, 2015; Ishikawa and Barber, 2008)。STING活性化は、がんに対するCD8+ T細胞応答を増強するI型インターフェロン(IFN)のアップレギュレーションをもたらす(Baccala et al., 2007; Fuertes et al., 2013; Zitvogel et al., 2015)。以前、腫瘍抗原の効率的な封入およびリンパ節常在性樹状細胞への細胞質送達を可能にする非分解性ポリマーナノ粒子、PC7A NPが報告された。このポリマーはまた、STINGに結合してこれを活性化し、抗原特異的T細胞の生成のために共刺激経路(CD80/CD86)をオンにする(Luo et al., 2017)。
を使用した。異なる群に、腫瘍接種後8、16および24日目に(図13Aに示される)尾基部で皮下注射した。PBS、E7pおよびPSC7A NP単独群を対照として使用した。結果は、E7pおよびPSC7A NP単独群はPBS対照と比べて最低限の腫瘍増殖阻害応答を有したことを示している。ほとんどの動物が腫瘍接種後30日以内に失われた。対照的に、E7p-PSC7A NP群は、劇的に改善された腫瘍増殖阻害および延長された生存期間をもたらした。低用量PSC7Aワクチン群(6μg PSC7A NP中0.1μg E7p)は、腫瘍接種から50日後で>50%の動物生存をもたらし、一方、高用量ワクチン群(30μg PSC7A NP中0.5μg E7p)は完全生存転帰を有した(図13A)。B16-F10メラノーマ腫瘍モデルについて、腫瘍関連抗原の組み合わせ(Trp1214-237およびTrp2173-196)をPSC7A NP中にローディングした。ペプチド-PSC7A NP群もまた、PBS対照およびペプチドまたはPSC7A NP単独群と比べて、有意に改善された腫瘍増殖阻害および延長された生存期間を示した(図13B)。これらの2つのモデルにおいて、PSC7Aナノワクチンは、同じ用量でのPC7Aナノワクチンと比較して、TC-1モデルにおいては僅かに改善された腫瘍阻害およびB16F10モデルにおいては同様の応答を示した(図14)。
特にSTING経路を通じて自然免疫系に能動的に関与するポリマーについて、治療中の反復投与に対する安全性表示が最も重要である。この研究において、ワクチン接種研究に使用したdUPS PSC7Aポリマーを、その非分解性PMMAベース前身であるPC7Aと直接比較した(図15A)。6~8週齢のC57BL/6マウスの右側腹部に、高用量のPSC7A NPまたはPC7A NP(300μg、ワクチン用量の10倍)を皮下注射した。注射から24時間後に血清を採取し、全身炎症性サイトカイン濃度を測定した。いずれのポリマーによっても処置から24時間後に、明らかな急性腎または肝毒性は観察されなかった(図15B)。概して、全身サイトカイン発現がPSC7A NPによってよりもPC7A NPによってより高度に誘導され(図15C)、これは、PSC7A NPに対するより少ない全身炎症反応を示している。主要臓器(心臓、肝臓、脾臓、および腎臓)の組織学的分析は、PBSと比較して、いずれのポリマーによる処置後も顕著な変化はない(図16)。
Claims (15)
- 式:
のポリマーまたはその薬学的に許容される塩であって、
式中:
R1は、水素、アルキル(C≦8)、置換アルキル(C≦8)、またはチオール反応基であり;
mは、1~8の整数であり;
pおよびqは、各々独立して、1、2、または3であり;
xは、10~200の整数であり;
yは、40~180の整数であり;
zは、0~200の整数であり;
ここで、yまたはzのいずれかのモノマーは該ポリマー中にランダムに分布しており;
X1、X2、X1′、およびX2′は、各々独立して、OまたはNRaであり、ここで、
Raは、アルキル(C≦6)または置換アルキル(C≦6)であり;
R2およびR2′は、各々独立して、水素、アルキル(C≦8)、または置換アルキル(C≦8)であり;
R3は、水素、アルキル(C≦8)、または置換アルキル(C≦8)であり;
X3およびX3′は、各々独立して、OまたはNRbであり、ここで、
Rbは、水素、アルキル(C≦6)、または置換アルキル(C≦6)であり;
LおよびL′は、各々独立して、以下の式の基であり:
-X4-S(O)n-X5-
式中:
nは、0、1、または2であり;かつ
X4およびX5は、各々独立して、アルカンジイル(C≦8)または置換アルカンジイル(C≦8)であり;かつ
Y1、Y2、Y1′、およびY2′は、各々独立して、アルキル(C≦12)、置換アルキル(C≦12)、アルケニル(C≦12)、もしくは置換アルケニル(C≦12)であり;または、Y1およびY2もしくはY1′およびY2′は、一緒になり、かつ、アルカンジイル(C≦12)、アルケンジイル(C≦12)、またはいずれかの基の置換型である、
ポリマー。 - 以下:
またはその薬学的に許容される塩としてさらに定義され、
ここで:
R1は、水素、アルキル(C≦8)、置換アルキル(C≦8)、またはチオール反応基であり;
mは、1~8の整数であり;
pおよびqは、各々独立して、1、2、または3であり;
xは、10~200の整数であり;
yは、40~180の整数であり;
X1およびX2は、各々、OまたはNRaであり、ここで、
Raは、水素、アルキル(C≦6)、または置換アルキル(C≦6)であり;
R2は、水素、アルキル(C≦8)、または置換アルキル(C≦8)であり;
R3は、水素、アルキル(C≦8)、または置換アルキル(C≦8)であり;
X3は、OまたはNRbであり、ここで、
Rbは、水素、アルキル(C≦6)、または置換アルキル(C≦6)であり;
Lは、以下の式の基であり:
-X4-S(O)n-X5-
式中:
nは、0、1、または2であり;かつ
X4およびX5は、各々独立して、アルカンジイル(C≦8)または置換アルカンジイル(C≦8)であり;かつ
Y1およびY2は、各々独立して、アルキル(C≦12)、置換アルキル(C≦12)、アルケニル(C≦12)、もしくは置換アルケニル(C≦12)であり;または、Y1およびY2は、一緒になり、かつ、アルカンジイル(C≦12)、アルケンジイル(C≦12)、もしくはいずれかの基の置換型である、
請求項1記載のポリマー。 - 以下:
またはその薬学的に許容される塩としてさらに定義され、
ここで:
R1は、水素、アルキル(C≦8)、置換アルキル(C≦8)、またはチオール反応基であり;
mは、1~8の整数であり;
xは、10~200の整数であり;
yは、40~180の整数であり;
X1およびX2は、各々、OまたはNRaであり、ここで、
Raは、水素、アルキル(C≦6)、または置換アルキル(C≦6)であり;
R2は、水素、アルキル(C≦8)、または置換アルキル(C≦8)であり;
R3は、水素、アルキル(C≦8)、または置換アルキル(C≦8)であり;
X3は、OまたはNRbであり、ここで、
Rbは、水素、アルキル(C≦6)、または置換アルキル(C≦6)であり;
Lは、以下の式の基であり:
-X4-S(O)n-X5-
式中:
nは、0、1、または2であり;かつ
X4およびX5は、各々独立して、アルカンジイル(C≦8)または置換アルカンジイル(C≦8)であり;かつ
Y1およびY2は、各々独立して、アルキル(C≦12)、置換アルキル(C≦12)、アルケニル(C≦12)、もしくは置換アルケニル(C≦12)であり;または、Y1およびY2は、一緒になり、かつ、アルカンジイル(C≦12)、アルケンジイル(C≦12)、もしくはいずれかの基の置換型である、
請求項1または請求項2記載のポリマー。 - 以下:
またはその薬学的に許容される塩としてさらに定義され、
ここで:
R1は、水素、アルキル(C≦8)、置換アルキル(C≦8)、またはチオール反応基であり;
xは、10~200の整数であり;
yは、40~180の整数であり;
X1およびX2は、各々、OまたはNRaであり、ここで、
Raは、水素、アルキル(C≦6)、または置換アルキル(C≦6)であり;
R2は、水素、アルキル(C≦8)、または置換アルキル(C≦8)であり;
R3は、水素、アルキル(C≦8)、または置換アルキル(C≦8)であり;
X3は、OまたはNRbであり、ここで、
Rbは、水素、アルキル(C≦6)、または置換アルキル(C≦6)であり;
Lは、以下の式の基であり:
-X4-S(O)n-X5-
式中:
nは、0、1、または2であり;かつ
X4およびX5は、各々独立して、アルカンジイル(C≦8)または置換アルカンジイル(C≦8)であり;かつ
Y1およびY2は、各々独立して、アルキル(C≦12)、置換アルキル(C≦12)、アルケニル(C≦12)、もしくは置換アルケニル(C≦12)であり;または、Y1およびY2は、一緒になり、かつ、アルカンジイル(C≦12)、アルケンジイル(C≦12)、もしくはいずれかの基の置換型である、
請求項1~3のいずれか一項記載のポリマー。 - 以下:
またはその薬学的に許容される塩としてさらに定義され、
ここで:
R1は、水素、アルキル(C≦8)、置換アルキル(C≦8)、またはチオール反応基であり;
xは、10~200の整数であり;
yは、40~180の整数であり;
R2は、水素、アルキル(C≦8)、または置換アルキル(C≦8)であり;
R3は、水素、アルキル(C≦8)、または置換アルキル(C≦8)であり;
Lは、以下の式の基であり:
-X4-S(O)n-X5-
式中:
nは、0、1、または2であり;かつ
X4およびX5は、各々独立して、アルカンジイル(C≦8)または置換アルカンジイル(C≦8)であり;かつ
Y1およびY2は、各々独立して、アルキル(C≦12)、置換アルキル(C≦12)、アルケニル(C≦12)、もしくは置換アルケニル(C≦12)であり;または、Y1およびY2は、一緒になり、かつ、アルカンジイル(C≦12)、アルケンジイル(C≦12)、もしくはいずれかの基の置換型である、
請求項1~4のいずれか一項記載のポリマー。 - 以下:
またはその薬学的に許容される塩としてさらに定義され、
ここで:
xは、10~200の整数であり;
yは、40~180の整数であり;
R2は、水素、アルキル(C≦8)、または置換アルキル(C≦8)であり;
Lは、以下の式の基であり:
-X4-S(O)n-X5-
式中:
nは、0、1、または2であり;かつ
X4およびX5は、各々独立して、アルカンジイル(C≦8)または置換アルカンジイル(C≦8)であり;かつ
Y1およびY2は、各々独立して、アルキル(C≦12)、置換アルキル(C≦12)、アルケニル(C≦12)、もしくは置換アルケニル(C≦12)であり;または、Y1およびY2は、一緒になり、かつ、アルカンジイル(C≦12)、アルケンジイル(C≦12)、もしくはいずれかの基の置換型である、
請求項1~5のいずれか一項記載のポリマー。 - pが1である、請求項1または請求項2記載のポリマー。
- qが1である、請求項1、2、または7のいずれか一項記載のポリマー。
- mが1、2、または3である、請求項1~3、7、および8のいずれか一項記載のポリマー。
- mが2である、請求項9記載のポリマー。
- X1、X2、およびX3がOである、請求項1~4および7~10のいずれか一項記載のポリマー。
- R1がアルキル(C≦8)または置換アルキル(C≦8)である、請求項1~5および7~11のいずれか一項記載のポリマー。
- (A)請求項1~13のいずれか一項記載のポリマー、および
(B)治療剤
を含む組成物であって、該ポリマーが該治療剤を封入している、組成物。 - 治療有効量の請求項14記載の組成物を含む、患者の疾患または障害を処置するための薬学的組成物であって、
治療剤が、該疾患または障害を処置するために十分である、
薬学的組成物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201962865187P | 2019-06-22 | 2019-06-22 | |
| US62/865,187 | 2019-06-22 | ||
| PCT/US2020/038915 WO2020263733A1 (en) | 2019-06-22 | 2020-06-22 | Biodegradable ultra-ph sensitive polymers |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2022536993A JP2022536993A (ja) | 2022-08-22 |
| JPWO2020263733A5 JPWO2020263733A5 (ja) | 2023-06-29 |
| JP7676331B2 true JP7676331B2 (ja) | 2025-05-14 |
Family
ID=74060349
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021576271A Active JP7676331B2 (ja) | 2019-06-22 | 2020-06-22 | 生分解性超pH感受性ポリマー |
Country Status (10)
| Country | Link |
|---|---|
| US (1) | US12365761B2 (ja) |
| EP (1) | EP3986467A4 (ja) |
| JP (1) | JP7676331B2 (ja) |
| KR (1) | KR20220024565A (ja) |
| CN (1) | CN114269387A (ja) |
| AU (1) | AU2020303968A1 (ja) |
| BR (1) | BR112021026025A2 (ja) |
| CA (1) | CA3144476A1 (ja) |
| IL (1) | IL289196A (ja) |
| WO (1) | WO2020263733A1 (ja) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2023546316A (ja) * | 2020-09-08 | 2023-11-02 | ザ ボード オブ リージェンツ オブ ザ ユニバーシティー オブ テキサス システム | 多価sting活性化組成物およびその使用法 |
| WO2025059229A1 (en) * | 2023-09-11 | 2025-03-20 | The Board Of Regents Of The University Of Texas System | Stimulator of interferon genes (sting)-cdc1 signature as a prognostic biomarker for cancer |
| WO2025059234A1 (en) * | 2023-09-11 | 2025-03-20 | The Board Of Regents Of The University Of Texas System | Biodegradable stimulator of interferon genes (sting) activating nanoparticle compositions and uses thereof |
| WO2025129124A1 (en) * | 2023-12-15 | 2025-06-19 | The Board Of Regents Of The University Of Texas System | Stimuli-responsive sting-activating polymer compositions and methods of use |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2017526753A (ja) | 2014-06-06 | 2017-09-14 | ザ ボード オブ リージェンツ オブ ザ ユニバーシティー オブ テキサス システム | pH応答性ポリマーのライブラリー及びそのナノプローブ |
| WO2019111121A1 (en) | 2017-12-05 | 2019-06-13 | International Business Machines Corporation | Block copolymers and self-assembling nanoparticles formed therefrom |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7208314B2 (en) | 2002-02-26 | 2007-04-24 | Mirus Bio Corporation | Compositions and methods for drug delivery using pH sensitive molecules |
| US7311901B2 (en) * | 2003-10-10 | 2007-12-25 | Samyang Corporation | Amphiphilic block copolymer and polymeric composition comprising the same for drug delivery |
| US7179867B2 (en) * | 2003-11-26 | 2007-02-20 | Industrial Technology Research Institute | Thermosensitive biodegradable copolymer |
| TWI388591B (zh) * | 2008-03-28 | 2013-03-11 | Ind Tech Res Inst | 溫度敏感性材料 |
| US8470891B2 (en) * | 2009-12-23 | 2013-06-25 | International Business Machines Corporation | Biodegradable block polymers for drug delivery, and methods related thereto |
| US8796405B2 (en) * | 2012-01-18 | 2014-08-05 | Wisconsin Alumni Research Foundation | Degradable polycations derived from amino acid vinyl esters |
| JP2019511483A (ja) | 2016-03-02 | 2019-04-25 | ザ ボード オブ リージェンツ オブ ザ ユニバーシティー オブ テキサス システム | 免疫療法のためのsting活性化ナノワクチン |
-
2020
- 2020-06-22 AU AU2020303968A patent/AU2020303968A1/en active Pending
- 2020-06-22 EP EP20831733.9A patent/EP3986467A4/en active Pending
- 2020-06-22 US US17/620,570 patent/US12365761B2/en active Active
- 2020-06-22 JP JP2021576271A patent/JP7676331B2/ja active Active
- 2020-06-22 BR BR112021026025A patent/BR112021026025A2/pt unknown
- 2020-06-22 CA CA3144476A patent/CA3144476A1/en active Pending
- 2020-06-22 CN CN202080058689.7A patent/CN114269387A/zh active Pending
- 2020-06-22 KR KR1020227001363A patent/KR20220024565A/ko not_active Ceased
- 2020-06-22 WO PCT/US2020/038915 patent/WO2020263733A1/en not_active Ceased
-
2021
- 2021-12-21 IL IL289196A patent/IL289196A/en unknown
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2017526753A (ja) | 2014-06-06 | 2017-09-14 | ザ ボード オブ リージェンツ オブ ザ ユニバーシティー オブ テキサス システム | pH応答性ポリマーのライブラリー及びそのナノプローブ |
| WO2019111121A1 (en) | 2017-12-05 | 2019-06-13 | International Business Machines Corporation | Block copolymers and self-assembling nanoparticles formed therefrom |
Also Published As
| Publication number | Publication date |
|---|---|
| US20220380534A1 (en) | 2022-12-01 |
| WO2020263733A1 (en) | 2020-12-30 |
| IL289196A (en) | 2022-02-01 |
| CN114269387A (zh) | 2022-04-01 |
| KR20220024565A (ko) | 2022-03-03 |
| AU2020303968A1 (en) | 2022-01-27 |
| EP3986467A4 (en) | 2023-07-19 |
| BR112021026025A2 (pt) | 2022-02-08 |
| CA3144476A1 (en) | 2020-12-30 |
| JP2022536993A (ja) | 2022-08-22 |
| EP3986467A1 (en) | 2022-04-27 |
| US12365761B2 (en) | 2025-07-22 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7676331B2 (ja) | 生分解性超pH感受性ポリマー | |
| AU2017225769B2 (en) | Sting activating nanovaccine for immunotherapy | |
| AU2020260131B2 (en) | Compositions and methods of manufacturing star polymers for ligand display and/or drug delivery | |
| ES2634237T3 (es) | Vacunación de recien nacidos y niños | |
| EP2387999A1 (en) | Histidine-containing solution for transfection and/or injection of nucleic acids and uses thereof | |
| HUP0400171A2 (en) | Lipid-polymer-conjugates | |
| JP7376694B2 (ja) | 再生可能資源に由来するポリマーおよび組成物 | |
| JP7575731B2 (ja) | 結合体、及び癌治療剤 | |
| HK40064239A (en) | Biodegradable ultra-ph sensitive polymers | |
| KR102138415B1 (ko) | 신규 peg 유도체 | |
| Wu et al. | A matrix metalloproteinase-responsive hydrogel delivers dendritic cell-targeting nanoparticles for sustained antitumor immunity | |
| WO2024190929A1 (ja) | タンパク質送達用pH応答性担体 | |
| JP2025174750A (ja) | がん組織への薬剤送達用担体として有用な生体適合性複合ポリマー | |
| WO2014123791A1 (en) | Nanoparticles containing a taxane and their use |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230621 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20230621 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20230807 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20240617 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20240708 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20241003 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20250107 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20250410 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20250430 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7676331 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |