JP7654591B2 - インターロイキン-19を標的とする化合物および方法 - Google Patents
インターロイキン-19を標的とする化合物および方法 Download PDFInfo
- Publication number
- JP7654591B2 JP7654591B2 JP2022077733A JP2022077733A JP7654591B2 JP 7654591 B2 JP7654591 B2 JP 7654591B2 JP 2022077733 A JP2022077733 A JP 2022077733A JP 2022077733 A JP2022077733 A JP 2022077733A JP 7654591 B2 JP7654591 B2 JP 7654591B2
- Authority
- JP
- Japan
- Prior art keywords
- seq
- rabbit
- antibody
- amino acid
- acid sequence
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
- C07K16/244—Interleukins [IL]
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/564—Immunoassay; Biospecific binding assay; Materials therefor for pre-existing immune complex or autoimmune disease, i.e. systemic lupus erythematosus, rheumatoid arthritis, multiple sclerosis, rheumatoid factors or complement components C1-C9
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
- G01N33/6863—Cytokines, i.e. immune system proteins modifying a biological response such as cell growth proliferation or differentiation, e.g. TNF, CNF, GM-CSF, lymphotoxin, MIF or their receptors
- G01N33/6869—Interleukin
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/34—Identification of a linear epitope shorter than 20 amino acid residues or of a conformational epitope defined by amino acid residues
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/52—Assays involving cytokines
- G01N2333/54—Interleukins [IL]
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/04—Endocrine or metabolic disorders
- G01N2800/042—Disorders of carbohydrate metabolism, e.g. diabetes, glucose metabolism
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/20—Dermatological disorders
- G01N2800/202—Dermatitis
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/20—Dermatological disorders
- G01N2800/205—Scaling palpular diseases, e.g. psoriasis, pytiriasis
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/24—Immunology or allergic disorders
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/34—Genitourinary disorders
- G01N2800/347—Renal failures; Glomerular diseases; Tubulointerstitial diseases, e.g. nephritic syndrome, glomerulonephritis; Renovascular diseases, e.g. renal artery occlusion, nephropathy
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Immunology (AREA)
- Molecular Biology (AREA)
- Engineering & Computer Science (AREA)
- Hematology (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Biochemistry (AREA)
- Biomedical Technology (AREA)
- Urology & Nephrology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Cell Biology (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Food Science & Technology (AREA)
- Analytical Chemistry (AREA)
- Physics & Mathematics (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- Microbiology (AREA)
- Biotechnology (AREA)
- Rheumatology (AREA)
- Rehabilitation Therapy (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
Description
a.配列番号66のアミノ酸配列を有するLCVRおよび配列番号70のアミノ酸配列を有するHCVR、
b.配列番号74のアミノ酸配列を有するLCVRおよび配列番号78のアミノ酸配列を有するHCVR、
c.配列番号82のアミノ酸配列を有するLCVRおよび配列番号86のアミノ酸配列を有するHCVR、
d.配列番号34のアミノ酸配列を有するLCVRおよび配列番号38のアミノ酸配列を有するHCVR、
e.配列番号42のアミノ酸配列を有するLCVRおよび配列番号46のアミノ酸配列を有するHCVR、
f.配列番号50のアミノ酸配列を有するLCVRおよび配列番号54のアミノ酸配列を有するHCVR、および
g.配列番号58のアミノ酸配列を有するLCVRおよび配列番号62のアミノ酸配列を有するHCVR、から選択されるLCVRおよびHCVRを含む抗体も提供する。
a.配列番号2のアミノ酸配列を有するLCおよび配列番号6のアミノ酸配列を有するHC、
b.配列番号10のアミノ酸配列を有するLCおよび配列番号14のアミノ酸配列を有するHC、
c.配列番号18のアミノ酸配列を有するLCおよび配列番号22のアミノ酸配列を有するHC、
d.配列番号26のアミノ酸配列を有するLCおよび配列番号30のアミノ酸配列を有するHC、
e.配列番号310のアミノ酸配列を有するLCおよび配列番号311のアミノ酸配列を有するHC、および
f.配列番号312のアミノ酸配列を有するLCおよび配列番号313のアミノ酸配列を有するHC、のアミノ酸配列に対して少なくとも95%の相同性を有するアミノ酸配列から選択される、またはそれらを有するLCおよびHCを含む抗体も提供する。
a.配列番号66のアミノ酸配列を有するLCVRおよび配列番号70のアミノ酸配列を有するHCVR、
b.配列番号74のアミノ酸配列を有するLCVRおよび配列番号78のアミノ酸配列を有するHCVR、
c.配列番号82のアミノ酸配列を有するLCVRおよび配列番号86のアミノ酸配列を有するHCVR、
d.配列番号34のアミノ酸配列を有するLCVRおよび配列番号38のアミノ酸配列を有するHCVR、
e.配列番号42のアミノ酸配列を有するLCVRおよび配列番号46のアミノ酸配列を有するHCVR、
f.配列番号50のアミノ酸配列を有するLCVRおよび配列番号54のアミノ酸配列を有するHCVR、および
g.配列番号58のアミノ酸配列を有するLCVRおよび配列番号62のアミノ酸配列を有するHCVR、から選択されるLCVRおよびHCVRを含む。
a.配列番号2のアミノ酸配列を有するLCおよび配列番号6のアミノ酸配列を有するHC、
b.配列番号10のアミノ酸配列を有するLCおよび配列番号14のアミノ酸配列を有するHC、
c.配列番号18のアミノ酸配列を有するLCおよび配列番号22のアミノ酸配列を有するHC、
d.配列番号26のアミノ酸配列を有するLCおよび配列番号30のアミノ酸配列を有するHC、および
e.配列番号310のアミノ酸配列を有するLCおよび配列番号311のアミノ酸配列を有するHC、ならびに
f.配列番号312のアミノ酸配列を有するLCおよび配列番号313のアミノ酸配列を有するHC、のアミノ酸配列に対して少なくとも95%の相同性を有するアミノ酸配列から選択される、またはそれらを有するLCおよびHCを含むヒトIL-19中和抗体も提供する。
対照標準を、同一のIL-19の第1のエピトープ領域(患者試料を接触させる際に使用される)に結合する第1の抗体と接触させるステップと、対照標準を、同一のIL-19の第2のエピトープ領域(患者試料を接触させる際に使用される)に結合し、検出可能な標識を有する第2の抗体と接触させるステップと、該検出可能なシグナルにより提供されたシグナルを検出するステップとを含む。いくつかの実施形態では、患者試料は、血液、血清、または血漿のうちの1つである。いくつかのより具体的な実施形態によれば、IL-19の第1のエピトープ領域は、IL-19の第2のエピトープ領域と部分的に重複する。さらに、いくつかの実施形態では、第1および第2の抗体と接触させる該ステップは、同時に起こる。いくつかの具体的な実施形態では、第1の抗体は、表1、2、または3に提供されるLCおよびHC CDRの組み合わせを含む。いくつかの実施形態では、第1の抗体は、表1、2、または3に提供されるLCおよびHC CDRに対して95%の相同性を有するLCおよびHC CDRの組み合わせを含む。いくつかの具体的な実施形態では、第2の抗体は、表1、2、または3に提供されるLCおよびHC CDRの組み合わせを含む。いくつかの実施形態では、第2の抗体は、表1、2、または3に提供されるLCおよびHC CDRに対して95%の相同性を有するLCおよびHC CDRの組み合わせを含む。より特定の実施形態では、第1および第2の抗体は、一緒にビンに入れられない。
本発明のマウス由来のIL-19抗体は、ハイブリドーマ方法論(例えば、Kohler et al.,Nature,256:495(1975)によって最初に記載されたような)を用いて生成される。簡潔に、マウスを組換えヒトIL-19で免疫化し、ヒトIL-19に結合する抗体を産生することができるリンパ球を単離し、ハイブリドーマ細胞を形成するのに好適な融合剤(fusing agent)を使用して骨髄腫細胞株と融合させる(Goding,Monoclonal Antibodies:Principles and Practice,pp.59-103(Academic Press,1986))。ハイブリドーマを好適な培養培地(好ましくは、融合していない骨髄腫細胞の生存を阻害する1つ以上の物質を含有する)に播種し、成長させる。次いで、ハイブリドーマによって産生されたモノクローナル抗体の結合特異性は、インビトロ結合アッセイ(例えば、免疫沈降、ラジオイムノアッセイ(RIA)、または酵素結合免疫吸着測定法(ELISA))によって決定される。好ましいハイブリドーマを、限界希釈手順によりサブクローニングし、動物の腹水腫瘍としてのインビボを含む標準的な方法により成長させることができる(Goding,Monoclonal Antibodies:Principles and Practice,pp.59-103(Academic Press,1986))。ハイブリドーマ(およびまたはサブクローン)によって分泌されたモノクローナル抗体は、例えば、親和性クロマトグラフィー(例えば、プロテインAまたはプロテインG-Sepharose)またはイオン交換クロマトグラフィー、ヒドロキシアパタイトクロマトグラフィー、ゲル電気泳動、透析などの従来の手順に従って精製される。抗体の親和性成熟は、当該分野で既知の方法に従って行われ得る。
ForteBioから入手可能なOctet Red96(登録商標)機器で測定されるバイオレイヤー干渉法(BLI)アッセイ(25℃のHBS-EP+泳動用緩衝液(GE Healthcare、10mMへぺス pH7.4+150mM NaCl+3mM EDTA+0.05%界面活性剤P20)を使用)を使用して、本発明の例示的なIL-19抗体の組換えヒトIL-19(配列番号1に記載のアミノ酸配列を有する)への結合を測定する。
高解像度線状エピトープマッピングのために、製造業者の指示に従って、ヒトIL-19に対する例示的な抗体M_1のPEPperCHIP(登録商標)ペプチドマイクロアレイ線状エピトープマッピングを行う。簡潔に、例示的な抗体M-1を、ヒトIL-19の重複する12量体ペプチド断片を含むカスタムPEPperCHIP(商標登録)ペプチドマイクロアレイとともにインキュベートする。スキャン強度は、製造業者のソフトウェアを使用して解像される。例示的な抗体M_1について、PEPperCHIP(登録商標)分析により、配列番号1の残基95~102(EPNPKILR)からなるエピトープが明らかになった。本発明の他のマウス由来およびウサギ由来の例示的な抗体は、線状エピトープを生じず、ヒトIL-19の立体配座エピトープ結合を示す。
ビニング実験は、特異的な抗原への結合についてペアワイズおよびコンビナトリアル様式で互いに競合するモノクローナル抗体を含む。「ビン」は、試験されるモノクローナル抗体のパネル内に表されるエピトープ領域に基づく相対的な概念である。試験パネルの他の抗体(または抗体のビン)に対して試験されるとき、2つの抗体が互いに対にならず、同一の遮断プロファイルを共有する場合、同一のビンに属する。本発明の例示的な抗体のビニングは、製造業者の指示に従って、ForteBioから入手可能なOctet Red96(登録商標)を使用する交差競合ビニングアッセイによって行われ得る。簡潔に、2つの抗体が重複するエピトープ領域を共有しているかを決定するために、例示的な抗体をビオチンで標識し、ストレプトアビジンセンサー先端部に捕捉する。次いで、コーティングされたバイオセンサー先端部を組換えヒトIL-19とともにインキュベートして、捕捉抗体結合部位を飽和させる。次いで、捕獲抗体-抗原複合体を検出抗体とともにインキュベートする。検出抗体が結合することができる場合、波長の変化が検出される。同一の結合プロファイルを有する抗体は、同一のビンにまとめられる。結果を表5に提示する。
本発明の抗体は、IL-19を中和すると予想される。本発明の抗体によるIL-19活性の中和は、IL-19/IL-19受容体結合アッセイ形式のうちの1つ以上、ならびに例えば以下に記載されるIL-19結合アッセイにより評価され得る。
尋常性乾癬は、現在、全身表面病変(BSA)の評価基準、ならびに/または紅斑の程度、乾癬病変の厚さおよび規模(PASI)の評価に基づいて測定されている。しかしながら、これらの方法で必要とされる主観的な入力を考えると、皮膚病変の重症度によっては直線的ではない場合がある。全体的な乾癬の活性を評価することが可能な単一の血液由来マーカーは同定されていない。したがって、重症度を決定するためのより客観的で再現性のある方法が望まれる。本発明は、血液、血清、および血漿などの患者試料中のIL-19レベルを測定するための高感度で特異的なアッセイを提供する。本明細書に示されるように、本発明のIL-19アッセイは、中等度から重度のPs0の患者の治療応答性(すなわち、予測バイオマーカー)、疾患の再発(すなわち、予後バイオマーカー)、疾患の発症、および疾患の重症度ための正確な診断ツールを提供する。
治療前の125人のPs0患者の血清におけるIL-19レベルの研究は、36人の健康なボランティア試料のIL-19血清レベルと比較された。本質的に上述のIL-19アッセイを使用して、ビン1から選択された捕捉抗体(具体的には、例示的なIL-19抗体M_1)、およびビン2から選択された検出抗体(具体的には、例示的なIL-19抗体M_2)で、各患者試料の血清IL-19濃度(pg/ml)が測定される。健康なボランティア(n=36)の血清IL-19濃度の幾何平均は、11pg/mLで測定される(4~51pg/mLの範囲、および21pg/mL未満で95%の信頼水準)が、Ps0患者(治療前)(n=112)の血清IL-19濃度の幾何平均は、87pg/mLで測定される。したがって、本発明は、Ps0患者の診断を可能にするIL-19血液ベースのアッセイを提供する。
IL-17を標的とする治療用抗体イキセキズマブで治療された125人のPs0患者の血清におけるIL-19レベルの研究が行われる。この研究には、10mg(n=24)、25mg(n=23)、75mg(n=26)、または150mg(n=28)のイキセキズマブまたはプラセボ(n=24)の5つの治療群の用量が含まれる。全ての治療用量の投与は皮下であり、用量は0週目から始まり、その後2週ごとに16週目まで(包括的)投与される。上述のIL-19アッセイを使用して、ビン1から選択された捕捉抗体(具体的には、例示的なIL-19抗体M_1)、およびビン5から選択された検出抗体(具体的には、例示的なIL-19抗体M_2)で、各患者の血清IL-19濃度(pg/ml)が、0週目(治療前投与)、2週目、および12週目に測定される。血清IL-19濃度レベル、PASI変化パーセント、およびPASI 75応答を表8~10に提供する。
FDA承認済みのTNFαアンタゴニストであるエンタネルセプト(entanercept)で治療したときに完全応答者であった35人のPs0患者の血清におけるIL-19レベルの研究が行われた。隔週で投与された50mgのエタネルセプト(n=35)またはプラセボの治療群を比較する。両治療群の投与は皮下である。上述のIL-19アッセイを使用して、ビン1から選択された捕捉抗体(具体的には、例示的なIL-19抗体M_1)、およびビン2から選択された検出抗体(具体的には、例示的なIL-19抗体M_2)で、各患者の血清IL-19濃度(pg/ml)が、0週目(治療前投与)、1週目、4週目、および12週目に測定される。IL-19レベルは、4および12週目にPASIの改善を伴う予後値について評価される。血清IL-19濃度レベルを表11に提示する。乾癬患者におけるIL-19血清レベルおよびPASIの相関関係を示す4週目の予後値(21ng/Lは健康な対象におけるIL-19の正常範囲の上限を示す)を表12に提示する。乾癬患者におけるIL-19血清レベルおよびPASIの相関関係を示す12週目の予後値P(21ng/Lは健康な対象のIL-19の正常範囲の上限を示す)を表13に提示する。
IL-23を標的とする治療用抗体ミリキズマブで治療されたPs0患者の血清におけるIL-19レベルの研究が行われる。5mg、20mg、60mg、120mg、200mg、350mg、600mgのミリキズマブまたはプラセボの8つの治療群が評価される。各治療群の投与は、単回皮下投与として0日目に行われる。上述のIL-19アッセイを使用して、ビン1から選択された捕捉抗体(具体的には、例示的なIL-19抗体M_1)、およびビン2から選択された検出抗体(具体的には、例示的なIL-19抗体M_2)で、各患者の血清IL-19濃度(pg/ml)が、訪問の2~12回目の間に測定される。IL-19レベルは、訪問の2~12回目の間にPASIの改善を伴う予後値についても評価される。血清IL-19濃度レベルを表14に提示する。8週目の血清レベルの比較を表15に提示する。そして、乾癬患者におけるIL-19血清レベルおよびPASIの相関関係を示す8週目の予後値(21ng/Lは健康な対象のIL-19の正常範囲の上限を示す)を表16に提示する。本発明のIL-19アッセイを示すPASIスコアの改善と相関する血清IL-19の減少は、IL-23抗体で治療されたPs0患者の診断および治療的予後のための有益なツールを提供する。
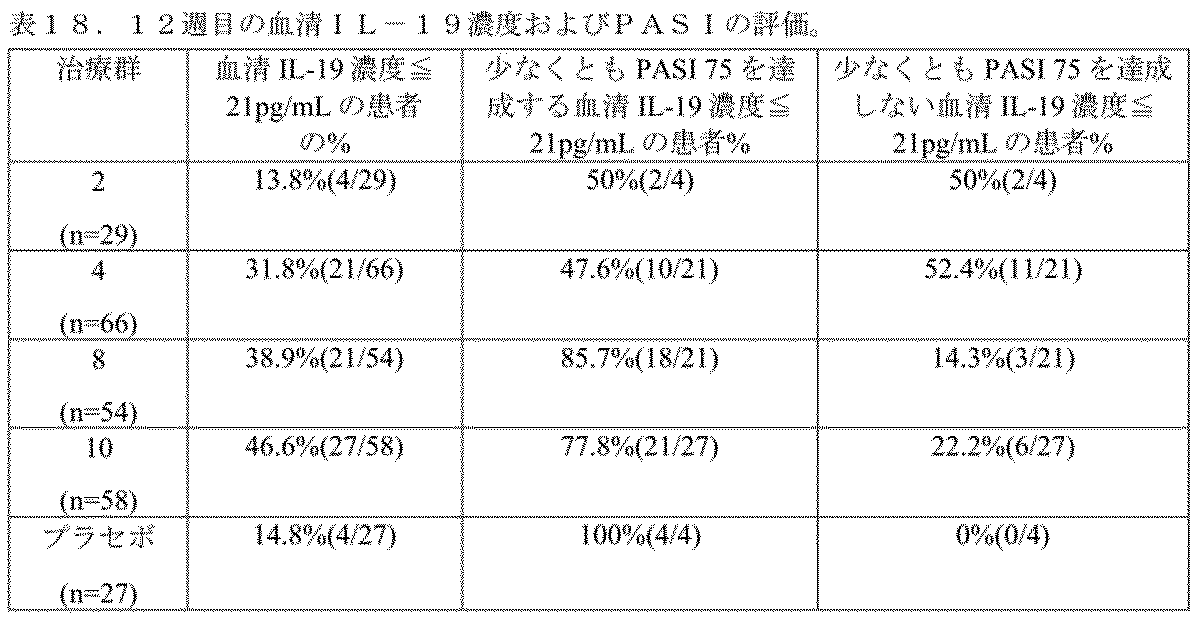
治療用選択的JAK1およびJAK2阻害剤バリシチニブで治療されたPs0患者の血清におけるIL-19レベルの研究が行われる。2mg、4mg、8mg、および10mgのバリシチニブまたはプラセボの治療群が評価される。各治療群は1日1回経口投与される。上述のIL-19アッセイを使用して、ビン1から選択された捕捉抗体(具体的には、例示的なIL-19抗体M_1)、およびビン2から選択された検出抗体(具体的には、例示的なIL-19抗体M_2)で、各患者の血清IL-19濃度(pg/ml)が、ベースラインおよび各治療後に測定される。IL-19レベルは、PASIの改善を伴う予後値についても評価される。血清IL-19濃度レベルを表17に提示する。乾癬患者におけるIL-19血清レベルとPASIとの相関関係を示すPASI予後データ(12週目)(21ng/Lは健康な対象におけるIL-19の正常範囲の上限を示す)を表18に提示する。データは、本発明のIL-19アッセイを示すPASIスコアの改善と相関する血清IL-19の減少が、JAK1およびJAK2阻害剤で治療されたPs0患者の診断および治療的予後のための有益なツールを提供することを示す。
治療用選択的JAK1およびJAK2阻害剤バリシチニブで治療された中等度から重度のアトピー性皮膚炎の123人の患者の血清におけるIL-19レベルの研究が行われる。2mgおよび4mgのバリシチニブまたはプラセボの治療群が比較される。各治療群は1日1回経口投与される。上述のIL-19アッセイを使用して、ビン1から選択された捕捉抗体(具体的には、例示的なIL-19抗体M_1)、およびビン2から選択された検出抗体(具体的には、例示的なIL-19抗体M_2)で、各患者の血清IL-19濃度(pg/ml)が、ベースライン(治療前)、ならびに4および16週目に測定される。IL-19レベルは、EASIスコアの改善を伴う予後値について評価される。血清IL-19濃度レベルを表19に提示する。AD患者におけるIL-19血清レベルの相関関係を示すEASIの予後値(16週目)(21ng/Lは健康な対象のIL-19の正常範囲の上限を示す)を表20に提示する。データは、AD患者のベースラインIL-19濃度が正常と比較して上昇している(AD患者の幾何平均は34pg/mL)ことが分かったことを示す。データは、本発明のIL-19アッセイを示す16週目のEASIスコアの改善と相関する4および16週目の血清IL-19の減少が、JAK1およびJAK2阻害剤で治療されたPs0患者の診断および治療的予後のための有益なツールを提供することも示す。
IL-19レベルは、健康なドナー(n=20)、腎不全患者(n=16)、腎不全ではない糖尿病患者(n=20)、および腎不全の糖尿病患者(n=21)において測定される。上述のIL-19アッセイを使用して、ビン1から選択された捕捉抗体(具体的には、例示的なIL-19抗体M_1)、およびビン2から選択された検出抗体(具体的には、例示的なIL-19抗体M_2)で、各患者のベースライン血清IL-19濃度(pg/ml)が測定される。データは、健康なドナー(8±1pg/mL)IL-19レベルと比較して、腎不全患者(40±6pg/mL)、腎不全ではない糖尿病患者(17±3pg/mL)、および腎不全の糖尿病患者(46±9pg/mL)のIL-19レベルが著しく上昇していることを示す。したがって、本発明のIL-19アッセイは、糖尿病および腎不全患者の診断および治療的予後のための有益なツールを提供する。
IL-17を標的とする治療用抗体イキセキズマブで治療された309人のPsA患者の血清におけるIL-19レベルの研究が行われる。この研究には、3つの治療群:(i.)抗IL-17治療群、ベースラインでイキセキズマブ160mgを投与し、続いてその後2週間ごとに12週間、80mgの用量を投与する(n=103)、(ii.)抗IL-17治療群、ベースラインでイキセキズマブ160mgを投与し、続いてその後4週間ごとに12週間、80mgの用量を投与する(n=107)、または(iii.)プラセボ(n=105)が含まれる。全ての治療用量の投与は皮下である。上述のIL-19アッセイを使用して、ビン1から選択された捕捉抗体(具体的には、例示的なIL-19抗体M_1)、およびビン2から選択された検出抗体(具体的には、例示的なIL-19抗体M_2)で、各患者の血清IL-19濃度(pg/ml)が、0週目(治療前投与)、4週目、および12週目に測定される。血清IL-19濃度レベルを表21に提示する。患者におけるIL-19血清レベルおよびPASIの相関関係を示す4および12週目のPASI予後値(21ng/Lは健康な対象のIL-19の正常範囲の上限を示す)を、それぞれ、表22および23に提示する。
配列番号1(ヒトIL-19)
MKLQCVSLWLLGTILILCSVDNHGLRRCLISTDMHHIEESFQEIKRAIQAKDTFPNVTILSTLETLQIIKPLDVCCVTKNLLAFYVDRVFKDHQEPNPKILRKISSIANSFLYMQKTLRQCQEQRQCHCRQEATNATRVIHDNYDQLEVHAAAIKSLGELDVFLAWINKNHEVMFSA
DIVMTQSPSSLAMSVGQKVTMSCKSSQSLLSSYNQKNYLAWYQQKPGQSPKLLVYFASTRPPGVPDRFIGSGSGSDFTLTISSVQAEDLADYFCQQHERLPITFGAGTKLELKRADAAPTVSIFPPSSEQLTSGGASVVCFLNNFYPKDINVKWKIDGSERQNGVLNSWTDQDSKDSTYSMSSTLTLTKDEYERHNSYTCEATHKTSTSPIVKSFNRNEC
KSSQSLLSSYNQKNYLA
FASTRPP
QQHERLPIT
EVQLQQSGPVLVKPGASVKMSCKASGYKFTDYFVGWVKQSHGKSLEWIGYVDPENGYTRCNQKFKGKATLTVDKSSSTAYMELNSLTSEDSAVYYCARYDYDWAWFTNWGQGTLVTVSAAKTTPPSVYPLAPGSAAQTNSMVTLGCLVKGYFPEPVTVTWNSGSLSSGVHTFPAVLQSDLYTLSSSVTVPSSTWPSETVTCNVAHPASSTKVDKKIVPRDCGCKPCICTVPEVSSVFIFPPKPKDVLTITLTPKVTCVVVDISKDDPEVQFSWFVDDVEVHTAQTQPREEQFNSTFRSVSELPIMHQDWLNGKEFKCRVNSAAFPAPIEKTISKTKGRPKAPQVYTIPPPKEQMAKDKVSLTCMITDFFPEDITVEWQWNGQPAENYKNTQPIMDTDGSYFVYSKLNVQKSNWEAGNTFTCSVLHEGLHNHHTEKSLSHSPGK
GYKFTDYFVG
YVDPENGYTRCNQKFKG
YDYDWAWFTN
DIVLTQSPESLAVSLGQRATISCRASESVDNYGISFIHWYQQKPGQPPKLLIYRASNLKSGIPARFSGRGSRTDFTLTINPVETDDVATYYCQQINKDPLTFGAGTKLELKRADAAPTVSIFPPSSEQLTSGGASVVCFLNNFYPKDINVKWKIDGSERQNGVLNSWTDQDSKDSTYSMSSTLTLTKDEYERHNSYTCEATHKTSTSPIVKSFNRNEC
RASESVDNYGISFIH
RASNLKS
QQINKDPLT
LVQLQQSDAELVKPGASLKISCKVSGYTFTDHALHWMKQRPEQGLEWIGYIYPRDGSTKYNEKFKGKATLTADRSSSTAYMELNSLTSEDSAVYFCARGWDFAMDYWGQGTSVTVSSAKTTPPSVYPLAPGSAAQTNSMVTLGCLVKGYFPEPVTVTWNSGSLSSGVHTFPAVLQSDLYTLSSSVTVPSSTWPSETVTCNVAHPASSTKVDKKIVPRDCGCKPCICTVPEVSSVFIFPPKPKDVLTITLTPKVTCVVVDISKDDPEVQFSWFVDDVEVHTAQTQPREEQFNSTFRSVSELPIMHQDWLNGKEFKCRVNSAAFPAPIEKTISKTKGRPKAPQVYTIPPPKEQMAKDKVSLTCMITDFFPEDITVEWQWNGQPAENYKNTQPIMDTDGSYFVYSKLNVQKSNWEAGNTFTCSVLHEGLHNHHTEKSLSHSPGK
GYTFTDHALH
YIYPRDGSTKYNEKFKG
GWDFAMDY
DIKMTQSPSSMYASLGERVTITCKASQDINSYLSWFQQKPGKSPKTLIYRANRLVDGVPSRFSGSGSGQDYSLTISSLEYEDMGIYFCLQYDDFPYTFGGGTKLEIKRADAAPTVSIFPPSSEQLTSGGASVVCFLNNFYPKDINVKWKIDGSERQNGVLNSWTDQDSKDSTYSMSSTLTLTKDEYERHNSYTCEATHKTSTSPIVKSFNRNEC
KASQDINSYLS
RANRLVD
LQYDDFPYT
QIQLVQSGPELKKPGETVKISCKASGYTFTTYGMSWVKQAPGKGLKWMVWINTYSGVPTYVDDFKGRFAFSLETSASTAYLQINNLKNEDTATYFCARRDEGFAYWGQGTLVTVSAAKTTPPSVYPLAPGSAAQTNSMVTLGCLVKGYFPEPVTVTWNSGSLSSGVHTFPAVLQSDLYTLSSSVTVPSSTWPSETVTCNVAHPASSTKVDKKIVPRDCGCKPCICTVPEVSSVFIFPPKPKDVLTITLTPKVTCVVVDISKDDPEVQFSWFVDDVEVHTAQTQPREEQFNSTFRSVSELPIMHQDWLNGKEFKCRVNSAAFPAPIEKTISKTKGRPKAPQVYTIPPPKEQMAKDKVSLTCMITDFFPEDITVEWQWNGQPAENYKNTQPIMDTDGSYFVYSKLNVQKSNWEAGNTFTCSVLHEGLHNHHTEKSLSHSPGK
GYTFTTYGMS
WINTYSGVPTYVDDFKG
RDEGFAY
DIVMTQSPSSLAMSVGQKVTMSCKSSQSLLSSYNQKNYLAWYQQKPGQSPKLLVYFASTRESGVPDRFIGSGSGSDFTLTISSVQAEDLADYFCQQHYSTPLTFGAGTKLELKRADAAPTVSIFPPSSEQLTSGGASVVCFLNNFYPKDINVKWKIDGSERQNGVLNSWTDQDSKDSTYSMSSTLTLTKDEYERHNSYTCEATHKTSTSPIVKSFNRNEC
KSSQSLLSSYNQKNYLA
FASTRES
QQHYSTPLT
EVQLQQSGPVLVKPGASVKMSCKASGYTFTDYYMNWVKQSHGKSLEWIGFINPYNDDTRCNQKFKGKATLTVDKSSSTAYMELNSLTSEDSAVYYCARYDGYWAWFAYWGQGTLVTVSAAKTTPPSVYPLAPGSAAQTNSMVTLGCLVKGYFPEPVTVTWNSGSLSSGVHTFPAVLQSDLYTLSSSVTVPSSTWPSETVTCNVAHPASSTKVDKKIVPRDCGCKPCICTVPEVSSVFIFPPKPKDVLTITLTPKVTCVVVDISKDDPEVQFSWFVDDVEVHTAQTQPREEQFNSTFRSVSELPIMHQDWLNGKEFKCRVNSAAFPAPIEKTISKTKGRPKAPQVYTIPPPKEQMAKDKVSLTCMITDFFPEDITVEWQWNGQPAENYKNTQPIMDTDGSYFVYSKLNVQKSNWEAGNTFTCSVLHEGLHNHHTEKSLSHSPGK
GYTFTDYYMN
FINPYNDDTRCNQKFKG
YDGYWAWFAY
AIDMTQTPASVSEPVGGTVTIKCQASQSISSYLAWYQQKPGQPPKLLIYSASTLASGVPSRFRGSGSGREFTLTISDLECADAATYYCQCHYHGSSYWDNSFGGGTEVVVK
QASQSISSYLA
SASTLAS
QCHYHGSSYWDNS
QQLEESGGGLVQPEGSLTLTCTASGFSFSSSYWICWVRQAPGKGLEWLACIDTGVSGDTYYANWAEGRFTISKTSSTTVTLQMTSLTAADTATYFCARDIFGSAIDNSLWGPGTLVTVSS
GFSFSSSYWIC
CIDTGVSGDTYYANWAEG
DIFGSAIDNSL
ADVVMTQTPASVEAAVGGTVTIKCQASESIGNALAWYQQKPGQPPKLLIYDASKLASGVPSRFKGSGSGTQFTLTISDLECADAATYYCQCHYHGSSYWDNSFGGGTEVVVK
QASESIGNALA
DASKLAS
QCHYHGSSYWDNS
QQLEESGGGLVQPEGSLTLTCTASGFSFSSSYWICWVRQAPGKGLEWLACIDTGVSGDTYYANWAKGRFTISKTSSTTVTLQMTSLTAADTATYFCARDIFGSAIDNSLWGPGTLVTVSS
GFSFSSSYWIC
CIDTGVSGDTYYANWAKG
DIFGSAIDNSL
ADVVMTQTPSSVEAAVGGTVTIKCQASQSIGSSLAWYQQKPGQRPKLLIYGASTLASGVPSRFKGSGSGTEFTLTISDLECADAATYYCQCHYHGSSYWDNSFGGGTEVVVK
QASQSIGSSLA
GASTLAS
QCHYHGSSYWDNS
QCQSLEESGGGLVEPEGSLTLTCKASGFSFSSSYWICWVRQAPGKGLEWIACTDTFSGDTYYASWAKGRFTISKTSSTTVTLRMTSLTDADTATYFCARDIFGTAVHISLWGPGTLVTVSS
GFSFSSSYWIC
CTDTFSGDTYYASWAKG
DIFGTAVHISL
ADVVMTQTPSSVSEPVGGTVTIKCQASQSIYSYLSWYQQKPGQPPKLLIYEASKLASGVPSRFKGSGSGTQFTLTISGVECADAATYYCQQGYSSSNVDNTFGGGTEVVVT
QASQSIYSYLS
EASKLAS
QQGYSSSNVDNT
QCQSVEESGGRLVTPGTPLTLTCTVSGIDLSIYAMGWVRQAPGKGLEYIGIIDTTGTAYYARWAKGRFTISKTSATVALKITSPTTEDTATYFCARDSGSLYYGSYALWGPGTLVTVSS
GIDLSIYAMG
IIDTTGTAYYARWAKG
DSGSLYYGSYAL
EIVMTQSPGTLSLSPGERATLSCRASQSISSGYLAWYQQKPGQAPRLLIYGASSRATGIPDRFSGSGSGTDFTLTISRLEPEDFATYYCLQFKSFPLTFGQGTKLEIKR
RASQSISSGYLA
GASSRAT
LQFKSFPLT
QVQLVQSGAEVKKPGSSVKVSCKASGGTFSSYAISWVRQAPGQGLEWMGGIIPIFGTANYAQKFQGRVTITADESTSTAYMELSSLRSEDTAVYYCARDGGDYGDMGYWGQGTLVTVSS
GGTFSSYAIS
GIIPIFGTANYAQKFQG
DGGDYGDMGY
EIVMTQSPDSLAVSLGERATINCKSSQSVLYRSNSKSYLAWYQQKPGQPPKLLIYWASTRESGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCQQYYSTPGSFGPGTKVEIKR
KSSQSVLYRSNSKSYLA
WASTRES
QQYYSTPGS
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAMSWVRQAPGKGLEWVSAISQSGGSTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARHPERGSRRGPYYYYMDVWGKGTTVTVSS
GFTFSSYAMS
AISQSGGSTYYADSVKG
HPERGSRRGPYYYYMDV
DIQLTQSPSSLSASLGDRVTITCRASQGISSWLAWYQQKPGKAPKLLIYAASTLQSGVPSRFSGSGSGTDFTLTISSLQPEDVATYYCQQYYDYSPWAFGQGTKLEIKR
RASQGISSWLA
AASTLQS
QQYYDYSPWA
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAMSWVRQAPGKGLEWVSAISGSGGSTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARGLSLLYYDLSENYFDYWGQ GTTVTVSS
GFTFSSYAMS
AISGSGGSTYYADSVKG
GLSLLYYDLSENYFDY
QASQSIYSYLS
EASKLAS
QQGYSSSNVDNT
GIDLSIYAMG
IIDTTGTAYYARWAKG
DSGSLYYGSYAL
QASESIYSSLA
GASTLAS
QCHYHGSSYWDNS
GFSFSSSYWIC
CTDTFSGDTYYASWAKG
DIFGTAVHISL
QASESIYSSLA
GASTLAS
QCHYHGSSYWDNS
GFSFSSSYWIC
CTDTFSGDTYYASWAKG
DIFGTAVHISL
QASQSIGSSLA
GASTLAS
QCHYHGSSYWDNS
GFSFSSSYWIC
CTDTFSGDTYYASWAKG
DIFGTAVHISL
QASESIYSSLA
GASTLAS
QCHYHGSSYWDNS
GFSFSSSYWIC
CTDTFSGDTYYASWAKG
DIFGTAVHISL
QASQSISSYLA
GASTLAS
QCHYHGSSYWDNS
GFSFSSSYWIC
CTDTFSGDTYYASWAKG
DIFGTAVHISL
QASQSISSYLA
GASTLAS
QSAVYSSSSGYGVP
GFSLSSYDMS
IIDSIGSIWYANWAKG
ESGPINTDYDL
QTSESFYSNNILS
EASKLAS
QSAIYDGSYIVT
GFSLSSYDMS
IIDSIGSIWYANWAKG
ESGPINTDYDL
QASQSISSYLA
GASTLAS
QSAVYSSSSGYGVP
GFSLSSYDMS
IIDSIGSIWYANWAKG
ESGPINTDYDL
QASQSISSYLA
GASTLAS
QSAVYSSSSGYGVP
GFSLSSYDMS
IIDSIGSIWYANWAKG
ESGPINTDYDL
QASESISSYLA
GASTLAS
QGYFGDYIYG
GFSLTSYAMS
IIGSPGTTGYATWAKG
GWFYYGMAL
PXQEHLTP
GASTLAX
QGYFGDYIYG
GFSLTSYAMS
IIGSPGTTGYATWAKG
GWFYYGMAL
QASESISSYLA
GASTLAS
QGYFGDYIYG
GFSLTSYAMS
IIGSPGTTGYATWAKG
GWFYYGMAL
配列番号168(ウサギ由来IL-19 Ab 18のLCDR1)
QASESISSYLA
GASTLAS
QGYFGDYIYG
GFSLTSYAMS
IIGSPGTTGYATWAKG
GWFYYGMAL
QASESISSYLA
GASTLAS
QGYFGDYIYG
GFSLTSYAMS
IIGSPGTTGYATWAKG
GWFYYGMAL
QASESISSYLA
GASTLAS
QGYFGDYIYG
GFSLTSYAMS
IIGSPGTTGYATWAKG
GWFYYGMAL
QASQSISNYLS
WASNLAS
LGEFSCSSADCFA
GFDLSNYAMT
AIHGSGVTDCASWTRG
ESAGINTDYDL
QASQSISNYLS
WASNLAS
LGEFSCSSADCFA
GFDLSNYAMT
AIHGSGVTDCASWTRG
ESAGINTDYDL
QASKSIGSYLS
RASTLAS
QAYYGDYIYD
GFSLSSYPMS
IIGSTGSTGYANWAKG
GWFYYGLDL
QASQSIGSYLS
RASTLAS
QAYYGDYIYD
GFSLSSYPMS
IIGSTGSTGYANWAKG
GWFYYGLDL
QASQSIGSYLA
DASDLAS
QSAVYDSSYVVT
GFSLSSYDMS
ISDSLGTTWYANWAKG
ESGDIRIDYDL
QASQSIGSYLA
DASDLAS
QSAVYDSSYVVT
GFSLSSYDMS
ISDSLGTTWYANWAKG
ESGDIRIDYDL
QASQSIGSYLA
DASDLAS
QSAVYDSSYVVT
GFSLSSYDMS
ISDSLGTTWYANWAKG
ESGDIRIDYDL
QASQSIGSYLA
DASDLAS
QSAVYDSSYVVT
GFSLSSYDMS
ISDSLGTTWYANWAKG
ESGDIRIDYDL
QASQSLNINYLS
SASTLAS
QQSVNYGRVDNI
GFTISNYHMS
RIVSYGGTYYANWAKG
DSSGSGFSFAL
QASQSITTSYLS
KASTLAS
QQSHNYGRVDNI
GFTISNYHMS
RIVSYGGTYYANWAKG
DSSGSGFSFAL
QASQSITTSYLS
KASTLAS
QQSHNYGRVDNI
GFTISNYHMS
RIVSYGGTYYANWAKG
DSSGSGFSFAL
QASQSITTSYLS
KASTLAS
QQSHNYGRVDNI
GFTISNYHMS
RIVSYGGTYYANWAKG
DSSGSGFSFAL
QASQSITTSYLS
KASTLAS
QQSHNYGRVDNI
GFTISNYHMS
RIVSYGGTYYANWAKG
DSSGSGFSFAL
QASQNIYSNLA
KASTLAS
QAYVGNYIYT
GFSLSSYPMS
IIGSSGSIGYASWAKG
GWFYYGMDL
QASQSIGSNLA
RASTLAS
QGYYGDGIYG
GFSLSSYPMS
LIGSSGTIYFATWAKG
GWFYYGMDL
QASQSISSWLS
GASTLAS
QSYYYISSSSYT
GFSLSSYPMS
LIGSSGTIYFATWAKG
GWFYYGMDL
QASQSISSYLA
SASTLAS
QCHYHGSSYWDNS
GFSFSSSYWIC
CIDTGVSGDTYYANWAEG
DIFGSAIDNSL
QASQNIYSNLA
GASNLES
QGGYSGGIYA
GFSLTRHAMS
AIHGSGVTDYASWAKG
GSGL
DIVMTQTPASVEAAVGGTVTIKCQASQSIYRYLSWYQQKPGQRPKLLIYGASNLASGVSSRFKGSGSGTEFTLTISDLECADAATYYCQSYYYSSSSGYGNVFGGGTEVVVK
QASQSIYRYLS
GASNLAS
QSYYYSSSSGYGNV
QEQLKESGGGLVQPGGSLKLSCKASGFDLSSYGVSWVRQAPGKGLEWIGYIDPVFGSTYYANWVNGRFTISSDNAQNTLYLQLNSLTAADTATYFCARGSGYVYYGYTYDLWGPGTLVTVSS
GFDLSSYGVS
YIDPVFGSTYYANWVNG
GSGYVYYGYTYDL
DIVMTQSPSSLAMSVGQKVTMSCKSSQSLLSSYNQKNYLAWYQRKPGQSPKLLVYFASQRATGVPDRFIGSGSGSDFTLTISSVQAEDLADYFCQQHTRLPITFGAGTKLELK
KSSQSLLSSYNQKNYLA
FASQRAT
QQHTRLPIT
EVQLQQSGPVLVKPGASVKMSCKASGYPFNDYFLGWVKQSHGKSLEWIGSINPDNDYTMSNQKFKGKATLTVDKSSSTAYMELNSLTSEDSAVYYCARYDYDWAWFAHWGQGTLVTVSA
GYPFNDYFLG
SINPDNDYTMSNQKFKG
YDYDWAWFAH
DIVMTQTPASVEAAVGGTVTIKCQASQSIYRYLSWYQQKPGQRPKLLIYGASNLASGVSSRFKGSGSGTEFTLTISDLECADAATYYCQSYYYSSSSGYGNVFGGGTEVVVKGDPVAPTVLIFPPAADQVATGTVTIVCVANKYFPDVTVTWEVDGTTQTTGIENSKTPQNSADCTYNLSSTLTLTSTQYNSHKEYTCKVTQGTTSVVQSFNRGDC
QEQLKESGGGLVQPGGSLKLSCKASGFDLSSYGVSWVRQAPGKGLEWIGYIDPVFGSTYYANWVNGRFTISSDNAQNTLYLQLNSLTAADTATYFCARGSGYVYYGYTYDLWGPGTLVTVSSGQPKAPSVFPLAPCCGDTPSSTVTLGCLVKGYLPEPVTVTWNSGTLTNGVRTFPSVRQSSGLYSLSSVVSVTSSSQPVTCNVAHPATNTKVDKTVAPSTCSKPTCPPPELLGGPSVFIFPPKPKDTLMISRTPEVTCVVVDVSQDDPEVQFTWYINNEQVRTARPPLREQQFNSTIRVVSTLPIAHQDWLRGKEFKCKVHNKALPAPIEKTISKARGQPLEPKVYTMGPPREELSSRSVSLTCMINGFYPSDISVEWEKNGKAEDNYKTTPAVLDSDGSYFLYSKLSVPTSEWQRGDVFTCSVMHEALHNHYTQKSISRSPGK
DIVMTQSPSSLAMSVGQKVTMSCKSSQSLLSSYNQKNYLAWYQRKPGQSPKLLVYFASQRATGVPDRFIGSGSGSDFTLTISSVQAEDLADYFCQQHTRLPITFGAGTKLELKRADAAPTVSIFPPSSEQLTSGGASVVCFLNNFYPKDINVKWKIDGSERQNGVLNSWTDQDSKDSTYSMSSTLTLTKDEYERHNSYTCEATHKTSTSPIVKSFNRNEC
EVQLQQSGPVLVKPGASVKMSCKASGYPFNDYFLGWVKQSHGKSLEWIGSINPDNDYTMSNQKFKGKATLTVDKSSSTAYMELNSLTSEDSAVYYCARYDYDWAWFAHWGQGTLVTVSAAKTTPPSVYPLAPGSAAQTNSMVTLGCLVKGYFPEPVTVTWNSGSLSSGVHTFPAVLQSDLYTLSSSVTVPSSTWPSETVTCNVAHPASSTKVDKKIVPRDCGCKPCICTVPEVSSVFIFPPKPKDVLTITLTPKVTCVVVDISKDDPEVQFSWFVDDVEVHTAQTQPREEQFNSTFRSVSELPIMHQDWLNGKEFKCRVNSAAFPAPIEKTISKTKGRPKAPQVYTIPPPKEQMAKDKVSLTCMITDFFPEDITVEWQWNGQPAENYKNTQPIMDTDGSYFVYSKLNVQKSNWEAGNTFTCSVLHEGLHNHHTEKSLSHSPGK
Claims (4)
- 軽鎖可変領域(LCVR)および重鎖可変領域(HCVR)を含む、ヒトIL-19に結合するモノクローナル抗体であって、前記LCVRが、相補性決定領域(CDR)のLCDR1、LCDR2、およびLCDR3を含み、前記HCVRが、CDRのHCDR1、HCDR2、およびHCDR3を含み、前記LCDR1のアミノ酸配列が、配列番号3であり、前記LCDR2のアミノ酸配列が、配列番号4であり、前記LCDR3のアミノ酸配列が、配列番号5であり、前記HCDR1のアミノ酸配列が、配列番号7であり、前記HCDR2のアミノ酸配列が、配列番号8であり、ならびに前記HCDR3のアミノ酸配列が、配列番号9である、抗体。
- 軽鎖(LC)および重鎖(HC)を含むモノクローナル抗体であって、前記LCのアミノ酸配列が、配列番号2であり、ならびに前記HCのアミノ酸配列が、配列番号6である、抗体。
- 軽鎖可変領域(LCVR)および重鎖可変領域(HCVR)を含む、ヒトIL-19に結合するモノクローナル抗体であって、前記LCVRが、相補性決定領域(CDR)のLCDR1、LCDR2、およびLCDR3を含み、前記HCVRが、CDRのHCDR1、HCDR2、およびHCDR3を含み、前記LCDR1のアミノ酸配列が、配列番号11であり、前記LCDR2のアミノ酸配列が、配列番号12であり、前記LCDR3のアミノ酸配列が、配列番号13であり、前記HCDR1のアミノ酸配列が、配列番号15であり、前記HCDR2のアミノ酸配列が、配列番号16であり、ならびに前記HCDR3のアミノ酸配列が、配列番号17である、抗体。
- 軽鎖(LC)および重鎖(HC)を含むモノクローナル抗体であって、前記LCのアミノ酸配列が、配列番号10であり、ならびに前記HCのアミノ酸配列が、配列番号14である、抗体。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2024188200A JP2025020209A (ja) | 2018-01-17 | 2024-10-25 | インターロイキン-19を標的とする化合物および方法 |
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201862618200P | 2018-01-17 | 2018-01-17 | |
| US62/618,200 | 2018-01-17 | ||
| PCT/US2019/013565 WO2019143585A1 (en) | 2018-01-17 | 2019-01-15 | Compounds and methods targeting interleukin-19 |
| JP2020538729A JP7365345B2 (ja) | 2018-01-17 | 2019-01-15 | インターロイキン-19を標的とする化合物および方法 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2020538729A Division JP7365345B2 (ja) | 2018-01-17 | 2019-01-15 | インターロイキン-19を標的とする化合物および方法 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2024188200A Division JP2025020209A (ja) | 2018-01-17 | 2024-10-25 | インターロイキン-19を標的とする化合物および方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2022110060A JP2022110060A (ja) | 2022-07-28 |
| JP7654591B2 true JP7654591B2 (ja) | 2025-04-01 |
Family
ID=65324578
Family Applications (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2020538729A Active JP7365345B2 (ja) | 2018-01-17 | 2019-01-15 | インターロイキン-19を標的とする化合物および方法 |
| JP2022077733A Active JP7654591B2 (ja) | 2018-01-17 | 2022-05-10 | インターロイキン-19を標的とする化合物および方法 |
| JP2023062719A Active JP7554305B2 (ja) | 2018-01-17 | 2023-04-07 | インターロイキン-19を標的とする化合物および方法 |
| JP2024188200A Pending JP2025020209A (ja) | 2018-01-17 | 2024-10-25 | インターロイキン-19を標的とする化合物および方法 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2020538729A Active JP7365345B2 (ja) | 2018-01-17 | 2019-01-15 | インターロイキン-19を標的とする化合物および方法 |
Family Applications After (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2023062719A Active JP7554305B2 (ja) | 2018-01-17 | 2023-04-07 | インターロイキン-19を標的とする化合物および方法 |
| JP2024188200A Pending JP2025020209A (ja) | 2018-01-17 | 2024-10-25 | インターロイキン-19を標的とする化合物および方法 |
Country Status (6)
| Country | Link |
|---|---|
| US (2) | US11591387B2 (ja) |
| EP (1) | EP3740503A1 (ja) |
| JP (4) | JP7365345B2 (ja) |
| CN (1) | CN111630066A (ja) |
| CA (1) | CA3087276A1 (ja) |
| WO (1) | WO2019143585A1 (ja) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA3249773A1 (en) | 2022-04-20 | 2023-10-26 | Lilly Co Eli | ANTIBODIES AND METHODS TARGETING INTERLEUKIN 19 |
| CA3275145A1 (en) | 2023-04-18 | 2024-10-24 | Moonlake Immunotherapeutics Ag | BIOMARKER-BASED TREATMENT AND DIAGNOSTIC METHODS FOR IL-17-DEPENDENT DISEASES |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20120034224A1 (en) | 2010-08-03 | 2012-02-09 | National Cheng Kung University | Treating Rheumatoid Arthritis with Anti-IL-19 Antibody |
| US20120034208A1 (en) | 2010-08-03 | 2012-02-09 | National Cheng Kung University | Treating Breast Cancer with Anti-IL-19 Antibody |
| US20120034225A1 (en) | 2010-08-03 | 2012-02-09 | National Cheng Kung University | Suppressing Bone Loss with Anti-IL-19 Antibody |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20040076606A1 (en) * | 2002-09-14 | 2004-04-22 | Ming-Shi Chang | Methods of modulating inflammation by administration of interleukin-19 and inhibitors of IL-19 binding |
| US20120144504A1 (en) * | 2005-10-16 | 2012-06-07 | Yeda Research And Development Co. Ltd. | Caspase-8 and skin disease |
| AU2009265808B2 (en) * | 2008-06-30 | 2014-10-23 | Novo Nordisk A/S | Anti-human interleukin-20 antibodies |
| JP2014533659A (ja) * | 2011-10-24 | 2014-12-15 | アッヴィ・インコーポレイテッド | スクレロスチンに対するイムノバインダー |
| EP2771687A4 (en) * | 2011-10-28 | 2015-07-01 | Merck Sharp & Dohme | IL-19 AS BIOMARKER FOR TSLP TREATMENT |
| EP2806883B1 (en) * | 2012-01-25 | 2019-04-24 | DNAtrix, Inc. | Biomarkers and combination therapies using oncolytic virus and immunomodulation |
| WO2013143026A1 (en) * | 2012-03-31 | 2013-10-03 | Abmart (Shanghai) Co., Ltd | Peptide and antibody libraries and uses thereof |
| EP2984487B1 (en) * | 2013-04-11 | 2019-03-27 | Cytocore, Inc. | Method for estimating the risk of dysplasia progressing to cancer in a subject |
-
2019
- 2019-01-15 CA CA3087276A patent/CA3087276A1/en active Pending
- 2019-01-15 JP JP2020538729A patent/JP7365345B2/ja active Active
- 2019-01-15 WO PCT/US2019/013565 patent/WO2019143585A1/en not_active Ceased
- 2019-01-15 EP EP19703831.8A patent/EP3740503A1/en active Pending
- 2019-01-15 CN CN201980008990.4A patent/CN111630066A/zh active Pending
-
2020
- 2020-06-17 US US16/903,731 patent/US11591387B2/en active Active
-
2022
- 2022-05-10 JP JP2022077733A patent/JP7654591B2/ja active Active
-
2023
- 2023-01-25 US US18/159,393 patent/US12459997B2/en active Active
- 2023-04-07 JP JP2023062719A patent/JP7554305B2/ja active Active
-
2024
- 2024-10-25 JP JP2024188200A patent/JP2025020209A/ja active Pending
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20120034224A1 (en) | 2010-08-03 | 2012-02-09 | National Cheng Kung University | Treating Rheumatoid Arthritis with Anti-IL-19 Antibody |
| US20120034208A1 (en) | 2010-08-03 | 2012-02-09 | National Cheng Kung University | Treating Breast Cancer with Anti-IL-19 Antibody |
| US20120034225A1 (en) | 2010-08-03 | 2012-02-09 | National Cheng Kung University | Suppressing Bone Loss with Anti-IL-19 Antibody |
Also Published As
| Publication number | Publication date |
|---|---|
| EP3740503A1 (en) | 2020-11-25 |
| US11591387B2 (en) | 2023-02-28 |
| CN111630066A (zh) | 2020-09-04 |
| US20230220062A1 (en) | 2023-07-13 |
| JP2023089090A (ja) | 2023-06-27 |
| JP7554305B2 (ja) | 2024-09-19 |
| JP2022110060A (ja) | 2022-07-28 |
| JP7365345B2 (ja) | 2023-10-19 |
| JP2021511496A (ja) | 2021-05-06 |
| JP2025020209A (ja) | 2025-02-12 |
| US20200354444A1 (en) | 2020-11-12 |
| US12459997B2 (en) | 2025-11-04 |
| CA3087276A1 (en) | 2019-07-25 |
| WO2019143585A1 (en) | 2019-07-25 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7544911B2 (ja) | ヒトタウを標的とする化合物および方法 | |
| KR101462307B1 (ko) | 항-헵시딘-25 선택적 항체 및 그의 용도 | |
| JP2025020209A (ja) | インターロイキン-19を標的とする化合物および方法 | |
| JP2023508023A (ja) | Cxcl10結合タンパク質及びその使用 | |
| KR102676458B1 (ko) | 보툴리눔 독소 a에 특이적인 항체, 이를 생산하는 하이브리도마 세포주, 및 이를 이용한 보툴리눔 독소 a 진단 키트 | |
| EA047294B1 (ru) | Соединения и способы нацеливания на тау человека | |
| HK1156326B (en) | Anti-hepcidin-25 selective antibodies and uses thereof |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220607 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20220607 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20230523 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230823 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20231003 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20231228 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20240301 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240328 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20240625 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20241025 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20241106 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20250218 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20250319 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7654591 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |