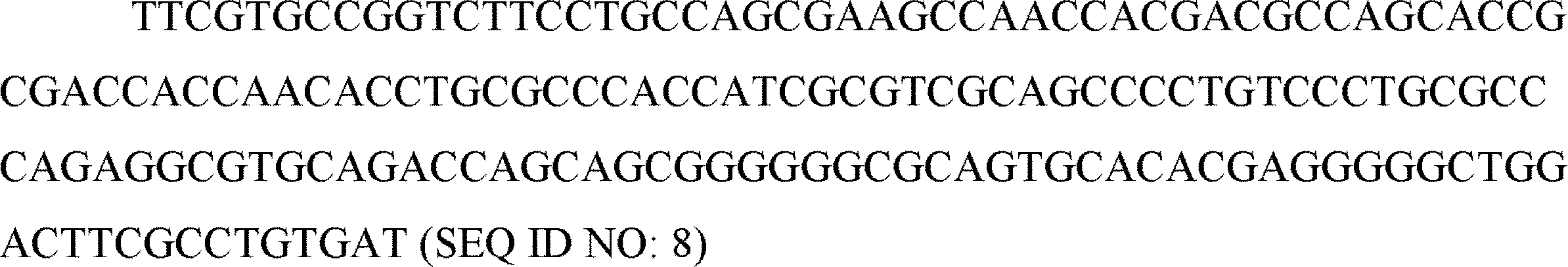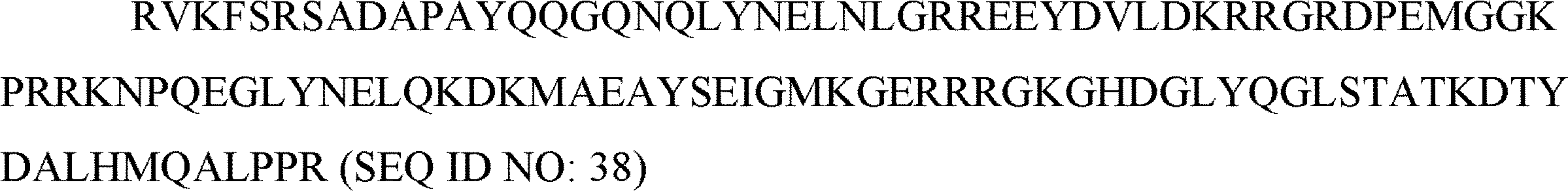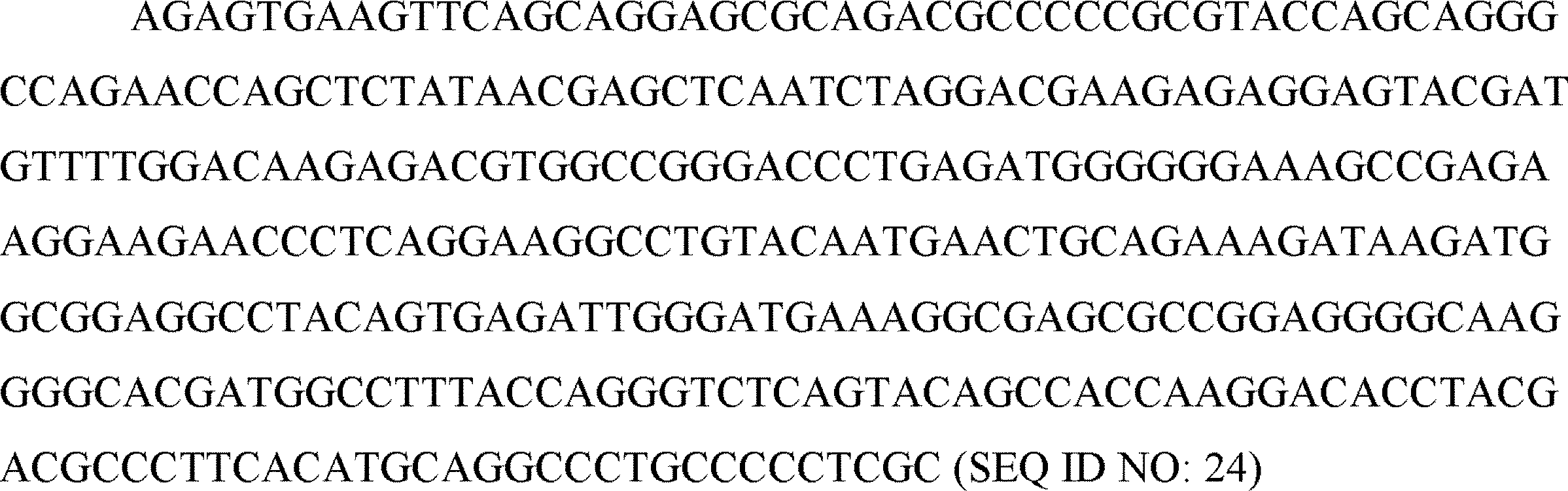JP7649755B2 - アセチルコリン受容体キメラ自己抗体受容体細胞の組成物および方法 - Google Patents
アセチルコリン受容体キメラ自己抗体受容体細胞の組成物および方法 Download PDFInfo
- Publication number
- JP7649755B2 JP7649755B2 JP2021567935A JP2021567935A JP7649755B2 JP 7649755 B2 JP7649755 B2 JP 7649755B2 JP 2021567935 A JP2021567935 A JP 2021567935A JP 2021567935 A JP2021567935 A JP 2021567935A JP 7649755 B2 JP7649755 B2 JP 7649755B2
- Authority
- JP
- Japan
- Prior art keywords
- cells
- caar
- cell
- achr
- domain
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0008—Antigens related to auto-immune diseases; Preparations to induce self-tolerance
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K40/00—Cellular immunotherapy
- A61K40/10—Cellular immunotherapy characterised by the cell type used
- A61K40/11—T-cells, e.g. tumour infiltrating lymphocytes [TIL] or regulatory T [Treg] cells; Lymphokine-activated killer [LAK] cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K40/00—Cellular immunotherapy
- A61K40/20—Cellular immunotherapy characterised by the effect or the function of the cells
- A61K40/22—Immunosuppressive or immunotolerising
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K40/00—Cellular immunotherapy
- A61K40/30—Cellular immunotherapy characterised by the recombinant expression of specific molecules in the cells of the immune system
- A61K40/31—Chimeric antigen receptors [CAR]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K40/00—Cellular immunotherapy
- A61K40/40—Cellular immunotherapy characterised by antigens that are targeted or presented by cells of the immune system
- A61K40/41—Vertebrate antigens
- A61K40/416—Antigens related to auto-immune diseases; Preparations to induce self-tolerance
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K40/00—Cellular immunotherapy
- A61K40/40—Cellular immunotherapy characterised by antigens that are targeted or presented by cells of the immune system
- A61K40/41—Vertebrate antigens
- A61K40/42—Cancer antigens
- A61K40/4202—Receptors, cell surface antigens or cell surface determinants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K40/00—Cellular immunotherapy
- A61K40/40—Cellular immunotherapy characterised by antigens that are targeted or presented by cells of the immune system
- A61K40/41—Vertebrate antigens
- A61K40/42—Cancer antigens
- A61K40/428—Undefined tumor antigens, e.g. tumor lysate or antigens targeted by cells isolated from tumor
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
- A61P21/04—Drugs for disorders of the muscular or neuromuscular system for myasthenia gravis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/7051—T-cell receptor (TcR)-CD3 complex
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/70517—CD8
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70571—Receptors; Cell surface antigens; Cell surface determinants for neuromediators, e.g. serotonin receptor, dopamine receptor
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70578—NGF-receptor/TNF-receptor superfamily, e.g. CD27, CD30, CD40, CD95
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/57—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2
- A61K2039/577—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2 tolerising response
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2239/00—Indexing codes associated with cellular immunotherapy of group A61K40/00
- A61K2239/46—Indexing codes associated with cellular immunotherapy of group A61K40/00 characterised by the cancer treated
- A61K2239/48—Blood cells, e.g. leukemia or lymphoma
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/01—Fusion polypeptide containing a localisation/targetting motif
- C07K2319/02—Fusion polypeptide containing a localisation/targetting motif containing a signal sequence
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/01—Fusion polypeptide containing a localisation/targetting motif
- C07K2319/03—Fusion polypeptide containing a localisation/targetting motif containing a transmembrane segment
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Immunology (AREA)
- Organic Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Epidemiology (AREA)
- Medicinal Chemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Cell Biology (AREA)
- Zoology (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Biochemistry (AREA)
- Molecular Biology (AREA)
- Gastroenterology & Hepatology (AREA)
- Toxicology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pharmacology & Pharmacy (AREA)
- Neurology (AREA)
- Biomedical Technology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Transplantation (AREA)
- Rheumatology (AREA)
- Microbiology (AREA)
- Mycology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Physical Education & Sports Medicine (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Peptides Or Proteins (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
Description
本出願は、米国特許法(35 U.S.C.)第119条(e)の下で、2019年5月13日に出願された米国特許仮出願第62/847,121号の優先権を主張し、該出願は、その全体が参照により本明細書に組み入れられる。
重症筋無力症(MG)は、ヒトにおける最も一般的な自己抗体媒介性疾患の1つであり、米国においては1年あたり3,000人の新たな患者が発生して、合計で25,000~50,000人の患者に蔓延し;米国、欧州、およびアジアにおいてほぼ100万人の患者が、重症筋無力症を有すると推定されている。神経筋接合部(NMJ)で発現したタンパク質の抗体攻撃により、筋力低下がもたらされ、これは、目の垂れ、複視、不安定な歩行、不明瞭発語、ならびに嚥下および呼吸の困難として現れる。MG患者によって産生される自己抗体は、補体を固定するかまたはアセチルコリン受容体(AChR)クラスターを偽ることによって、NMJを破壊する。AChRを介したシグナル伝達にとって不可欠であるAChRクラスターの形成は、膜貫通タンパク質である筋特異的キナーゼ(MuSK)の活性化に依存する。大部分のMG患者は、抗AChR抗体(85%)または抗MuSK抗体(4%)のいずれかを示す。患者のうちの11%は、「血清陰性」と分類され、これは、AChR、MuSK、または他のNMJタンパク質、例えばLRP4に対する低力価の抗体に起因している。呼吸を制御する筋肉の命を脅かす筋力低下のために機械的換気が必要であると定義される筋無力症クリーゼが、MG患者の10~20%において起こり;筋無力症クリーゼ由来の全死亡率は、4.5%である。
[本発明1001]
キメラ自己抗体受容体(CAAR)をコードするポリヌクレオチドであって、該CAARが、アセチルコリン受容体(AChR)自己抗原またはその断片を含む細胞外ドメイン、ならびに任意で、膜貫通ドメイン、共刺激分子の細胞内ドメイン、および/またはシグナル伝達ドメインを含む、前記ポリヌクレオチド。
[本発明1002]
前記AChR自己抗原またはその断片が、AChRのαサブユニット由来である、本発明1001のポリヌクレオチド。
[本発明1003]
前記AChR自己抗原またはその断片が、SEQ ID NO: 3、5、7、22、23、29、33、および42からなる群より選択される核酸配列を含む核酸配列によってコードされる、本発明1001のポリヌクレオチド。
[本発明1004]
前記AChR自己抗原またはその断片が、SEQ ID NO: 3、5、7、22、23、29、33、および42からなる群より選択される核酸配列に対して少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも81%、少なくとも82%、少なくとも83%、少なくとも84%、少なくとも85%、少なくとも86%、少なくとも87%、少なくとも88%、少なくとも89%、少なくとも90%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%の配列同一性を有する核酸配列を含む核酸配列によってコードされる、本発明1001のポリヌクレオチド。
[本発明1005]
前記AChR自己抗原またはその断片が、SEQ ID NO: 13、15、17、26、27、31、35、および44からなる群より選択されるアミノ酸配列を含む、本発明1001のポリヌクレオチド。
[本発明1006]
前記AChR自己抗原またはその断片が、SEQ ID NO: 13、15、17、26、27、31、35、および44からなる群より選択されるアミノ酸配列に対して少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも81%、少なくとも82%、少なくとも83%、少なくとも84%、少なくとも85%、少なくとも86%、少なくとも87%、少なくとも88%、少なくとも89%、少なくとも90%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%の配列同一性を有するアミノ酸配列を含む、本発明1001のポリヌクレオチド。
[本発明1007]
膜貫通ドメインが、CD8α膜貫通ドメインを含む、本発明1001~1006のいずれかのポリヌクレオチド。
[本発明1008]
CD8α膜貫通ドメインが、SEQ ID NO: 9を含む核酸配列によってコードされる、本発明1007のポリヌクレオチド。
[本発明1009]
CD8α膜貫通ドメインが、SEQ ID NO: 19のアミノ酸配列を含む、本発明1007のポリヌクレオチド。
[本発明1010]
共刺激分子の細胞内ドメインが、4-1BB細胞内ドメインを含む、本発明1001~1009のいずれかのポリヌクレオチド。
[本発明1011]
4-1BB細胞内ドメインが、SEQ ID NO: 10または16を含む核酸配列によってコードされる、本発明1010のポリヌクレオチド。
[本発明1012]
4-1BB細胞内ドメインが、SEQ ID NO: 20のアミノ酸配列を含む、本発明1010のポリヌクレオチド。
[本発明1013]
シグナル伝達ドメインが、CD3ζシグナル伝達ドメインを含む、本発明1001~1012のいずれかのポリヌクレオチド。
[本発明1014]
CD3ζシグナル伝達ドメインが、SEQ ID NO: 24またはSEQ ID NO: 53を含む核酸配列によってコードされる、本発明1013のポリヌクレオチド。
[本発明1015]
CD3ζシグナル伝達ドメインが、SEQ ID NO: 38のアミノ酸配列を含む、本発明1013のポリヌクレオチド。
[本発明1016]
前記CAARが、SEQ ID NO: 1、6、21、28、32、36、41、45、47、48、49、50、51、および52からなる群より選択される核酸配列を含む核酸配列によってコードされる、本発明1001~1015のいずれかのポリヌクレオチド。
[本発明1017]
前記CAARが、SEQ ID NO: 11、25、30、34、39、43、および46からなる群より選択されるアミノ酸配列を含む、本発明1001~1015のいずれかのポリヌクレオチド。
[本発明1018]
前記CAARが、ヒンジをさらに含む、本発明1001~1017のいずれかのポリヌクレオチド。
[本発明1019]
前記ヒンジが、SEQ ID NO: 8を含む核酸配列によってコードされる、本発明1018のポリヌクレオチド。
[本発明1020]
前記ヒンジが、SEQ ID NO: 18のアミノ酸配列を含む、本発明1018のポリヌクレオチド。
[本発明1021]
前記CAARが、アセチルコリン受容体(AChR)自己抗原またはその断片、キラー免疫グロブリン様受容体(KIR)膜貫通ドメイン、およびKIR細胞質ドメインを含む、本発明1001~1006のいずれかのポリヌクレオチド。
[本発明1022]
本発明1001~1020のいずれかのポリヌクレオチドを含む、ベクター。
[本発明1023]
レンチウイルスベクターである、本発明1022のベクター。
[本発明1024]
RNAベクターである、本発明1023のベクター。
[本発明1025]
CAARをコードするポリヌクレオチドに機能的に連結した誘導性プロモーターを含む、本発明1022~1024のいずれかのベクター。
[本発明1026]
アセチルコリン受容体(AChR)自己抗原またはその断片を含む細胞外ドメインを含む、キメラ自己抗体受容体(CAAR)。
[本発明1027]
アセチルコリン受容体(AChR)自己抗原またはその断片を含む細胞外ドメイン、ならびに任意で、膜貫通ドメイン、共刺激分子の細胞内ドメイン、および/またはシグナル伝達ドメインを含む、キメラ自己抗体受容体(CAAR)。
[本発明1028]
前記AChR自己抗原またはその断片が、AChRのαサブユニット由来である、本発明1026または本発明1027のCAAR。
[本発明1029]
前記AChR自己抗原またはその断片が、SEQ ID NO: 3、5、7、22、23、29、33、および42からなる群より選択される核酸配列によってコードされる、本発明1026または本発明1027のCAAR。
[本発明1030]
前記AChR自己抗原またはその断片が、SEQ ID NO: 3、5、7、22、23、29、33、および42からなる群より選択される核酸配列に対して少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも81%、少なくとも82%、少なくとも83%、少なくとも84%、少なくとも85%、少なくとも86%、少なくとも87%、少なくとも88%、少なくとも89%、少なくとも90%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%の配列同一性を有する核酸配列によってコードされる、本発明1026または本発明1027のCAAR。
[本発明1031]
前記AChR自己抗原またはその断片が、SEQ ID NO: 13、15、17、26、27、31、35、および44からなる群より選択されるアミノ酸配列を含む、本発明1026または本発明1027のCAAR。
[本発明1032]
前記AChR自己抗原またはその断片が、SEQ ID NO: 13、15、17、26、27、31、35、および44からなる群より選択されるアミノ酸配列に対して少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも81%、少なくとも82%、少なくとも83%、少なくとも84%、少なくとも85%、少なくとも86%、少なくとも87%、少なくとも88%、少なくとも89%、少なくとも90%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%の配列同一性を有するアミノ酸配列を含む、本発明1026または本発明1027のCAAR。
[本発明1033]
膜貫通ドメインが、CD8α膜貫通ドメインを含む、本発明1027~1032のいずれかのCAAR。
[本発明1034]
CD8α膜貫通ドメインが、SEQ ID NO: 9を含む核酸配列によってコードされる、本発明1033のCAAR。
[本発明1035]
CD8α膜貫通ドメインが、SEQ ID NO: 19のアミノ酸配列を含む、本発明1033のCAAR。
[本発明1036]
共刺激分子の細胞内ドメインが、4-1BB細胞内ドメインを含む、本発明1027~1035のいずれかのCAAR。
[本発明1037]
4-1BB細胞内ドメインが、SEQ ID NO: 10または16を含む核酸配列によってコードされる、本発明1036のCAAR。
[本発明1038]
4-1BB細胞内ドメインが、SEQ ID NO: 20のアミノ酸配列を含む、本発明1036のCAAR。
[本発明1039]
シグナル伝達ドメインが、CD3ζシグナル伝達ドメインを含む、本発明1027~1038のいずれかのCAAR。
[本発明1040]
CD3ζシグナル伝達ドメインが、SEQ ID NO: 24またはSEQ ID NO: 53を含む核酸配列によってコードされる、本発明1039のCAAR。
[本発明1041]
CD3ζシグナル伝達ドメインが、SEQ ID NO: 38のアミノ酸配列を含む、本発明1039のCAAR。
[本発明1042]
SEQ ID NO: 1、6、21、28、32、36、41、45、47、48、49、50、51、および52からなる群より選択される核酸配列によってコードされる、本発明1026~1041のいずれかのCAAR。
[本発明1043]
SEQ ID NO: 11、25、30、34、39、43、および46からなる群より選択されるアミノ酸配列を含む、本発明1026~1042のいずれかのCAAR。
[本発明1044]
アセチルコリン受容体(AChR)自己抗原またはその断片を含む細胞外ドメイン、キラー免疫グロブリン様受容体(KIR)膜貫通ドメイン、およびKIR細胞質ドメインを含む、本発明1026~1032のいずれかのCAAR。
[本発明1045]
本発明1026~1044のいずれかのCAARを含む、遺伝子改変細胞。
[本発明1046]
CAARを発現し、かつ、B細胞上の自己抗体ベースのBCRに対して高い親和性を有する、本発明1045の細胞。
[本発明1047]
CAARを発現し、かつ、
自己抗体を発現するB細胞、または
抗体分泌細胞へと成熟しうるB細胞
の死滅を誘導する、本発明1045または1046の細胞。
[本発明1048]
CAARを発現し、かつ、健常細胞に対する限定された毒性を有する、本発明1045~1047のいずれかの細胞。
[本発明1049]
ヘルパーT細胞、細胞傷害性T細胞、メモリーT細胞、調節性T細胞、γδT細胞、ナチュラルキラー細胞、サイトカイン誘導キラー細胞、それらの細胞株、Tメモリー幹細胞、多能性幹細胞に由来するT細胞、および他のエフェクター細胞からなる群より選択される、本発明1045~1048のいずれかの細胞。
[本発明1050]
(a)本発明1044のキメラ自己抗体受容体と、(b)DAP12とを含む、遺伝子改変細胞。
[本発明1051]
誘導性プロモーターに機能的に連結した、CAARをコードするポリヌクレオチドを含む、本発明1045~1050のいずれかの細胞。
[本発明1052]
本発明1001~1021のいずれかのポリヌクレオチド、本発明1026~1044のいずれかのCAAR、または本発明1045~1051のいずれかの細胞と、薬学的に許容される賦形剤とを含む、薬学的組成物。
[本発明1053]
対象において自己抗体媒介性神経筋接合部(NMJ)疾患を処置するための方法であって、該方法が、
キメラ自己抗体受容体(CAAR)をコードするポリヌクレオチドであって、AChR自己抗原またはその断片を含む細胞外ドメイン、ならびに任意で、膜貫通ドメイン、共刺激分子の細胞内ドメイン、および/またはシグナル伝達ドメインをコードする該ポリヌクレオチド
を含む、遺伝子改変細胞の有効量を、該対象に投与する段階を含み、それにより、該対象において自己抗体媒介性NMJ疾患を処置する、前記方法。
[本発明1054]
自己抗体媒介性神経筋接合部(NMJ)疾患のリスクがあるかまたはそれに罹患している対象においてNMJ損傷を阻止するかまたは低下させるための方法であって、該方法が、
キメラ自己抗体受容体(CAAR)をコードするポリヌクレオチドであって、AChR自己抗原またはその断片を含む細胞外ドメイン、ならびに任意で、膜貫通ドメイン、共刺激分子の細胞内ドメイン、および/またはシグナル伝達ドメインをコードする該ポリヌクレオチド
を含む、遺伝子改変細胞の有効量を、該対象に投与する段階を含み、それにより、該対象においてNMJ損傷を阻止するかまたは低下させる、前記方法。
[本発明1055]
対象において自己抗体媒介性神経筋接合部(NMJ)疾患を処置するための方法であって、該方法が、
(a)キメラ自己抗体受容体(CAAR)をコードするポリヌクレオチドであって、AChR自己抗原またはその断片を含む細胞外ドメイン、キラー免疫グロブリン様受容体(KIR)膜貫通ドメイン、およびKIR細胞質ドメインをコードする該ポリヌクレオチドと、
(b)DAP12をコードするポリヌクレオチドと
を含む、遺伝子改変細胞の有効量を、該対象に投与する段階を含み、それにより、該対象において自己抗体媒介性NMJ疾患を処置する、前記方法。
[本発明1056]
自己抗体媒介性神経筋接合部(NMJ)疾患のリスクがあるかまたはそれに罹患している対象においてNMJ損傷を阻止するかまたは低下させるための方法であって、該方法が、
(a)キメラ自己抗体受容体(CAAR)をコードするポリヌクレオチドであって、AChR自己抗原またはその断片を含む細胞外ドメイン、キラー免疫グロブリン様受容体(KIR)膜貫通ドメイン、およびKIR細胞質ドメインをコードする該ポリヌクレオチドと、
(b)DAP12をコードするポリヌクレオチドと
を含む、遺伝子改変細胞の有効量を、該対象に投与する段階を含み、それにより、該対象において自己抗体媒介性NMJ疾患を処置する、前記方法。
[本発明1057]
前記ポリヌクレオチドが、本発明1001~1020のいずれかのポリヌクレオチドである、本発明1053~1056のいずれかの方法。
[本発明1058]
前記CAARが、本発明1025~1042のいずれかのCAARである、本発明1053~1057のいずれかの方法。
[本発明1059]
前記自己抗体媒介性NMJ疾患が重症筋無力症(MG)である、本発明1053~1058のいずれかの方法。
[本発明1060]
前記対象がヒトである、本発明1053~1059のいずれかの方法。
[本発明1061]
前記遺伝子改変細胞がT細胞である、本発明1053~1060のいずれかの方法。
[本発明1062]
前記改変細胞が、B細胞を標的とする、本発明1053~1061のいずれかの方法。
本発明は、抗アセチルコリン受容体(AChR)B細胞受容体(BCR)に特異的なキメラ自己抗体受容体(CAAR)、該CAARを含む組成物、該CAARをコードするポリヌクレオチド、該CAARをコードするポリヌクレオチドを含むベクター、および該CAARを含む組換え細胞、例えば、T細胞を含む。
別に定める場合を除き、本明細書で用いる技術用語および科学用語はすべて、本発明が属する技術分野の当業者によって一般的に理解されているものと同じ意味を有する。本明細書中に記載されたものと同様または同等な任意の方法および材料を本発明の試験の実地におよび/または本発明の試験のための実地に用いることができるが、本明細書では好ましい材料および方法について説明する。本発明の説明および特許請求を行う上では、以下の専門用語を、その定義方法、定義が提供されている箇所に従って用いる。
キメラ自己抗体受容体(CAAR)
本発明は、活性化および自己抗体分泌後に自己抗体媒介性神経筋接合部(NMJ)疾患(例えば、重症筋無力症(MG))を引き起こしうる、自己抗体ベースのB細胞受容体を発現するB細胞を標的とするために、キメラ自己抗体受容体を使用することができるという発見に、一部基づく。本発明は、抗アセチルコリン受容体(AChR)B細胞受容体(BCR)に特異的なキメラ自己抗体受容体(CAAR)、該CAARを含む組成物、該CAARをコードするポリヌクレオチド、該CAARをコードするポリヌクレオチドを含むベクター、および該CAARを含む組換え細胞、例えば、T細胞を含む。本発明はまた、AChR CAARを発現する遺伝子改変細胞、例えば、遺伝子改変T細胞を作製する方法も含み、ここで、発現したCAARは、AChR細胞外ドメインを含む。
1つの態様において、本発明のCAARは、別の言い方では自己抗原またはその断片と呼ばれる、自己抗体結合ドメインを含む。本発明における使用のための自己抗原の選択は、標的とされる自己抗体またはBCRの種類(例えば、抗AChR)に依存する。例えば、自己抗原は、特定の自己抗体媒介性疾患状態、例えば、重症筋無力症(MG)に関連する、BCR発現B細胞などの標的細胞上のBCRまたは自己抗体を認識するため、選択されてもよい。
いくつかの態様において、AChRCAARは、AChR CAARの細胞外ドメインに融合している膜貫通ドメインを含む。1つの態様において、AChR CAARは、AChR CAAR中のドメインのうちの1つと天然で会合している膜貫通ドメインを含む。場合によっては、膜貫通ドメインは、受容体複合体の他のメンバーとの相互作用を最小限に抑えるために、同じまたは異なる表面膜タンパク質の膜貫通ドメインに対する結合を避けるように選択されるか、またはアミノ酸置換によって改変される。
いくつかの態様において、AChR CAARは、共刺激分子の細胞内ドメインを含む。本発明のAChR CAARの共刺激分子の細胞内ドメインは、AChR CAARがその中に配置されている免疫細胞の正常なエフェクター機能のうちの少なくとも1つの活性化の原因となる細胞質ドメインである。
(コドン最適化)を含む。
いくつかの態様において、AChR CAARは、シグナル伝達ドメインを含む。一次細胞質シグナル伝達配列は、刺激性様式または阻害性様式のいずれかで、TCR複合体の一次活性化を調節する。刺激性様式で作用する一次細胞質シグナル伝達配列は、免疫受容体チロシン活性化モチーフまたはITAMとして公知である、シグナル伝達モチーフを含有しうる。
を含むアミノ酸配列をコードする。
いくつかの態様において、AChR CAARおよびAChR CAARをコードするポリヌクレオチドは、ヒトT細胞表面糖タンパク質CD8α鎖シグナルペプチドを含む。ヒトCD8αシグナルペプチドは、T細胞表面への受容体の移行の原因となる。
を含む核酸配列によってコードされる。他の態様において、IgGシグナルペプチドは、
のアミノ酸配列を含む。いくつかの態様において、IgGシグナルペプチドは、SEQ ID NO: 2の核酸配列に対して少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも81%、少なくとも82%、少なくとも83%、少なくとも84%、少なくとも85%、少なくとも86%、少なくとも87%、少なくとも88%、少なくとも89%、少なくとも90%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%の配列同一性を有する核酸配列によってコードされる。いくつかの態様において、IgGシグナルペプチドは、SEQ ID NO: 12のアミノ酸配列に対して少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも81%、少なくとも82%、少なくとも83%、少なくとも84%、少なくとも85%、少なくとも86%、少なくとも87%、少なくとも88%、少なくとも89%、少なくとも90%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%の配列同一性を有するアミノ酸配列を含む。
1つの局面において、本発明は、キメラ自己抗体受容体(CAAR)をコードするポリヌクレオチドを含むベクターであって、該ポリヌクレオチドが、ヒトAChR自己抗原またはその断片を含む細胞外ドメイン、ならびに任意で、膜貫通ドメイン、および/または細胞内シグナル伝達ドメインを含む、ベクターを含む。1つの態様において、ベクターは、本明細書に記載されたようなCAARをコードする核酸配列のいずれかを含む。
別の局面において、本発明は、本明細書に開示されたAChRキメラ自己抗体受容体(CAAR)を含む遺伝子改変細胞を含む。
本発明はまた、自己抗体媒介性神経筋接合部(NMJ)疾患の文脈において、自己抗体発現細胞に関連する障害または自己免疫疾患を予防し、処置し、および/または管理するための方法も提供する。方法は、自己抗体発現細胞に結合する本発明のCAARを含む遺伝子改変細胞、例えば、T細胞を、それを必要とする対象に投与する段階を含む。1つの局面において、対象はヒトである。自己抗体媒介性NMJ疾患の非限定的な例には、重症筋無力症(MG)が非限定的に含まれる。
いくつかの態様において、細胞、例えば、T細胞に、エクスビボで形質導入する。増大および遺伝子改変の前に、T細胞(例えば、自己または同種T細胞)を対象から入手する。対象の例には、ヒト、イヌ、ネコ、マウス、ラット、およびそれらのトランスジェニック種が含まれる。T細胞は、皮膚、末梢血単核細胞、骨髄、リンパ節組織、臍帯血、胸腺組織、感染部位由来の組織、腹水、胸水、脾臓組織、および腫瘍を含む、数多くの供給源から入手することができる。本発明のある態様において、当技術分野において入手可能な任意のさまざまなT細胞株を用いることができる。本発明のある態様において、T細胞は、フィコール(商標)分離などの、当業者に公知の任意のさまざまな手法を用いて対象から収集された血液ユニットから得られる。1つの好ましい態様において、個体の流血由来の細胞はアフェレーシスによって入手される。アフェレーシス産物は、典型的には、T細胞、単球、顆粒球、B細胞を含むリンパ球、他の有核白血球、赤血球、および血小板を含む。1つの態様においては、アフェレーシスによって収集された細胞を、血漿画分を除去するために洗浄した上で、その後の処理段階のために細胞を適切な緩衝液または培地中に配置することができる。本発明の1つの態様においては、これらの細胞をリン酸緩衝食塩水(PBS)で洗浄する。1つの代替的な態様において、洗浄溶液はカルシウムを含まず、かつ、マグネシウムを含まないか、またはすべてではないものの多くの二価カチオンを含まない。この場合にも、驚くべきことに、カルシウム非存在下での最初の活性化段階により、活性化の増強がもたらされる。当業者は容易に理解するであろうが、洗浄段階は、半自動化された「フロースルー」遠心分離機(例えば、Cobe 2991細胞プロセッサー、Baxter CytoMate、またはHaemonetics Cell Saver 5など)を製造元の指示に従って用いることなどによって、当技術分野において公知の方法によって実現することができる。洗浄の後に、細胞を、例えば、Ca非含有、Mg非含有PBS、PlasmaLyte A、または緩衝剤を含むかもしくは含まない他の食塩液といった、種々の生体適合性緩衝液中に再懸濁させることができる。または、アフェレーシス試料の望ましくない成分を除去して、細胞を培養培地中に直接再懸濁させてもよい。
T細胞を、例えば、米国特許第6,352,694号;第6,534,055号;第6,905,680号;第6,692,964号;第5,858,358号;第6,887,466号;第6,905,681号;第7,144,575号;第7,067,318号;第7,172,869号;第7,232,566号;第7,175,843号;第5,883,223号;第6,905,874号;第6,797,514号;第6,867,041号;および米国特許出願公開第20060121005号に記載された方法を一般に用いて、活性化し、増大させる。
1つの局面において、本発明は、対象において自己抗体媒介性NMJ疾患を処置するための方法を含む。方法は、キメラ自己抗体受容体(CAAR)をコードするポリヌクレオチドであって、アセチルコリン受容体(AChR)自己抗原またはその断片、ならびに任意で、膜貫通ドメイン、共刺激分子の細胞内ドメイン、および/またはシグナル伝達ドメインをコードする該ポリヌクレオチドを含む、遺伝子改変細胞、例えば、T細胞の有効量を、対象に投与する段階を含み、それにより、該対象において自己抗体媒介性NMJ疾患を処置する。いくつかの態様において、ポリヌクレオチドは、KIRエレメントをさらにコードする。
ここで本発明を、以下の実験例を参照しながら説明する。これらの例は例示のみを目的として提供されるものであり、本発明はこれらの例に限定されるとは全くみなされるべきではなく、本明細書で提供される教示の結果として明らかになる任意かつすべての変更も包含するとみなされるべきである。
#1 pTRPE.α39P AChR.CD8H.BBz CAAR(核酸配列、SEQ ID NO: 1)
終止コドンを有さないpTRPE.α39P AChR.CD8H.BBz CAAR: 1-879(SEQ ID NO: 47)
#1 pTRPE.α39P AChR.CD8H.BBz CAAR(アミノ酸配列、SEQ ID NO: 11)
#2 pTRPE.α65P AChR.CD8H.BBz CAAR(核酸配列、SEQ ID NO: 21)
終止コドンを有さないpTRPE.α65P AChR.CD8H.BBz CAAR: 1-957(SEQ ID NO: 48)
#2 pTRPE.α65P AChR.CD8H.BBz CAAR(アミノ酸配列、SEQ ID NO: 25)
#3 pTRPE.α208 AChR.CD8H.BBz CAAR(核酸配列、SEQ ID NO: 28)
終止コドンを有さないpTRPE.α208 AChR.CD8H.BBz CAAR: 1-1386(SEQ ID NO: 49)
#3 pTRPE.α208 AChR.CD8H.BBz CAAR(アミノ酸配列、SEQ ID NO: 30)
#4 pTRPE.α210 AChR.CD8H.BBz CAAR(核酸配列、SEQ ID NO: 32)
終止コドンを有さないpTRPE.α210 AChR.CD8H.BBz CAAR: 1-1392(SEQ ID NO: 50)
#4 pTRPE.α210 AChR.CD8H.BBz CAAR(アミノ酸配列、SEQ ID NO: 34)
#5 pTRPE.α210 AChR.gs.BBz CAAR(核酸配列、SEQ ID NO: 36)
終止コドンを有さないpTRPE.α210 AChR.gs.BBz CAAR: 1-1263(SEQ ID NO: 51)
#5 pTRPE.α210 AChR.gs.BBz CAAR(アミノ酸配列、SEQ ID NO: 39)
#6 pTRPE.α211 AChR.CD8H.BBz CAAR(核酸配列、SEQ ID NO: 41)
終止コドンを有さないpTRPE.α211 AChR.CD8H.BBz CAAR: 1-1395(SEQ ID NO: 52)
#6 pTRPE.α211 AChR.CD8H.BBz CAAR(アミノ酸配列、SEQ ID NO: 43)
#7 pTRPE.α211 AChR.gs.BBz CAAR(核酸配列、SEQ ID NO: 45)
終止コドンを有さないpTRPE.α211 AChR.gs.BBz CAAR: 1-1266(SEQ ID NO: 6)
#7 pTRPE.α211 AChR.gs.BBz CAAR(アミノ酸配列、SEQ ID NO: 46)
1. Tzartos et al, 1981. JBC, 256:8635-8645.
2. Tzartos et al, 1983. FEBS Letters, 157:116-118.
3. Luo et al, 2009. J Neurosci, 29:13898-13908.
4. Kontou et al, 1996. FEBS Letters, 389:195-198
5. Papanastasiou et al, J Neuroimmunol,104:124-32.
6. Graus et al, 1997. Immunol Lett. 57:59-62.
7. Van der Neut Kolfschoten et al, 2007. Science, 317:1554-1557.
MG患者由来の自己抗体は、AChRクラスターおよびNMJを破壊することが、当技術分野において公知である。抗AChR抗体は、AChRクラスターを干渉する。AChRは、マルチサブユニット構造である。病原性自己抗体は、主要免疫原性領域(MIR)と呼ばれるαサブユニットのアミノ末端ドメイン中の定義された領域を、主として標的とする。
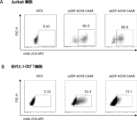
図6に示されるように、ルシフェラーゼベースの死滅アッセイにおいて、α39P AChR-CAART細胞およびα65P AChR-CAART細胞は、mAb 35ハイブリドーマ細胞およびNalm6 195細胞を死滅させたが、α65P AChR-CAART細胞のみが、Nalm6 192細胞を死滅させることができる。ルシフェラーゼベースの死滅アッセイは、以下のように実施した。T細胞(NTD、α39P、およびα65P)を、10:1のE:T比で各標的細胞(mAb 35ハイブリドーマ細胞、Nalm6 192、およびNalm6 195)と15~24時間、共インキュベートした。特異的溶解の%=[(試験細胞死-自然細胞死)/(最大細胞死-自然細胞死)]*100。自然細胞死:T細胞を含まない培地のみ。最大細胞死:検出前に1:1比の10% SDSで処理。
α208 AChR CAAR、α210 AChR CAAR、およびα211 AChR CAARの模式図を、図7に示す。α208 AChR CAAR、α210 AChR CAAR、およびα211 AChR CAARは、異なるアミノ酸長のAChR細胞外ドメインEC1、それに続くCD8ヒンジまたはグリシン-セリン(GS)リンカーのいずれか、CD8膜貫通ドメイン(TMD)、ならびにタンデムの細胞質シグナル伝達ドメインである4-1BBおよびCD3ζ(BBZ)を発現する。
図11に示されるように、ルシフェラーゼベースの死滅アッセイにおいて、α210.GS.BBz CAART細胞およびα211.GS.BBz AChR CAART細胞は、mAb 35ハイブリドーマ細胞、Nalm6 192、およびNalm6 195標的細胞を死滅させる(共培養の21時間後)。α210.GS.BBz CAART細胞およびα211.GS.BBz AChR CAART細胞と、mAb 35ハイブリドーマ細胞、Nalm6 192、およびNalm6 195標的細胞との共培養の上清は、培地のみ、NTD、またはNalm6 WT対照と比較して増加したhIFNγ濃度を有する(図12)。ルシフェラーゼベースの死滅アッセイを、以下のように実施した。T細胞(NTD、α210、およびα211)を、30:1のE:T比で標的細胞(Nalm6対照、Nalm6 192、Nalm6 195、およびmAb 35ハイブリドーマ細胞)と21時間、共インキュベートした。特異的溶解の%=[(試験細胞死-自然細胞死)/(最大細胞死-自然細胞死)]*100。自然細胞死:T細胞を含まない培地のみ。最大細胞死:検出前に1:1比の10% SDSで処理。
図15A~15Bは、Nalm6 192(図15A)またはNalm6 195(図15B)標的細胞のいずれかに対するα39P.CD8H.BBz CAART細胞およびα210.GS.BBz CAART細胞のインビボ効力を示す。図16は、Nalm6 192/195細胞(1:1比)の混合物に対するα210.GS.BBz CAART細胞およびα211.GS.BBz CAART細胞のインビボ効力を示す。Nalm6 637標的細胞に対するα210.GS.BBz CAART細胞のインビボの効力を、図17に示す。
本明細書で引用される各々のおよびあらゆる特許、特許出願、および刊行物の開示は、その全体が参照により本明細書に組み入れられる。本発明は、具体的な態様に関して開示されているが、本発明の他の態様および変形物が、本発明の真の精神および範囲から逸脱することなく、当業者によって考案されうることが明らかである。添付の特許請求の範囲は、すべてのそのような態様および等価の変形物を含むように解釈されることが意図される。
Claims (33)
- キメラ自己抗体受容体(CAAR)をコードするポリヌクレオチドであって、該CAARが、
アセチルコリン受容体(AChR)自己抗原またはその断片を含む細胞外ドメインであって、該AChR自己抗原またはその断片がSEQ ID NO: 35および44からなる群より選択されるアミノ酸配列を含む、細胞外ドメイン、ならびに任意で、膜貫通ドメイン、共刺激分子の細胞内ドメイン、および/またはシグナル伝達ドメインを含む、前記ポリヌクレオチド。 - 膜貫通ドメインが、CD8α膜貫通ドメインを含む、請求項1に記載のポリヌクレオチド。
- CD8α膜貫通ドメインが、SEQ ID NO: 19のアミノ酸配列を含む、請求項2に記載のポリヌクレオチド。
- 共刺激分子の細胞内ドメインが、4-1BB細胞内ドメインを含む、請求項1~3のいずれか一項に記載のポリヌクレオチド。
- 4-1BB細胞内ドメインが、SEQ ID NO: 20のアミノ酸配列を含む、請求項4に記載のポリヌクレオチド。
- シグナル伝達ドメインが、CD3ζシグナル伝達ドメインを含む、請求項1~5のいずれか一項に記載のポリヌクレオチド。
- CD3ζシグナル伝達ドメインが、SEQ ID NO: 38のアミノ酸配列を含む、請求項6に記載のポリヌクレオチド。
- 前記CAARが、SEQ ID NO: 34、39、43、および46からなる群より選択されるアミノ酸配列を含む、請求項1~7のいずれか一項に記載のポリヌクレオチド。
- 前記CAARが、キラー免疫グロブリン様受容体(KIR)膜貫通ドメイン、およびKIR細胞質ドメインを含む、請求項1に記載のポリヌクレオチド。
- 膜貫通ドメインが、CD28膜貫通ドメインを含む、請求項1に記載のポリヌクレオチド。
- 請求項1~10のいずれか一項に記載のポリヌクレオチドを含む、ベクター。
- レンチウイルスベクターまたはRNAベクターである、請求項11に記載のベクター。
- アセチルコリン受容体(AChR)自己抗原またはその断片を含む細胞外ドメインであって、該AChR自己抗原またはその断片がSEQ ID NO: 35および44からなる群より選択されるアミノ酸配列を含む、細胞外ドメインを含む、キメラ自己抗体受容体(CAAR)。
- 膜貫通ドメイン、共刺激分子の細胞内ドメイン、および/またはシグナル伝達ドメインをさらに含む、請求項13に記載のCAAR。
- 膜貫通ドメインが、CD8α膜貫通ドメインを含む、請求項14に記載のCAAR。
- CD8α膜貫通ドメインが、SEQ ID NO: 19のアミノ酸配列を含む、請求項15に記載のCAAR。
- 共刺激分子の細胞内ドメインが、4-1BB細胞内ドメインを含む、請求項14~16のいずれか一項に記載のCAAR。
- 4-1BB細胞内ドメインが、SEQ ID NO: 20のアミノ酸配列を含む、請求項17に記載のCAAR。
- シグナル伝達ドメインが、CD3ζシグナル伝達ドメインを含む、請求項14~18のいずれか一項に記載のCAAR。
- CD3ζシグナル伝達ドメインが、SEQ ID NO: 38のアミノ酸配列を含む、請求項19に記載のCAAR。
- SEQ ID NO: 34、39、43、および46からなる群より選択されるアミノ酸配列を含む、請求項13~20のいずれか一項に記載のCAAR。
- キラー免疫グロブリン様受容体(KIR)膜貫通ドメイン、およびKIR細胞質ドメインを含む、請求項13または14に記載のCAAR。
- 膜貫通ドメインが、CD28膜貫通ドメインを含む、請求項14に記載のCAAR。
- 請求項13~23のいずれか一項に記載のCAARを含む、遺伝子改変細胞。
- CAARを発現し、かつ、
(i)B細胞上の自己抗体ベースのBCRに対して高い親和性を有する、
(ii)自己抗体を発現するB細胞、もしくは抗体分泌細胞へと成熟しうるB細胞の死滅を誘導する、かつ/または
(iii)健常細胞に対する限定された毒性を有する、
請求項24に記載の細胞。 - ヘルパーT細胞、細胞傷害性T細胞、メモリーT細胞、調節性T細胞、γδT細胞、ナチュラルキラー細胞、サイトカイン誘導キラー細胞、それらの細胞株、Tメモリー幹細胞、多能性幹細胞に由来するT細胞、および他のエフェクター細胞からなる群より選択される、請求項24または25に記載の細胞。
- 細胞傷害性T細胞である、請求項24~26のいずれか一項に記載の細胞。
- (a)請求項22に記載のキメラ自己抗体受容体と、(b)DAP12とを含む、遺伝子改変細胞。
- 請求項1~10のいずれか一項に記載のポリヌクレオチド、請求項13~23のいずれか一項に記載のCAAR、または請求項24~28のいずれか一項に記載の細胞と、薬学的に許容される賦形剤とを含む、薬学的組成物。
- 請求項24~28のいずれか一項に記載の遺伝子改変細胞の治療的有効量を含む、治療用組成物。
- 治療が、対象において自己抗体媒介性神経筋接合部(NMJ)疾患を処置すること、または自己抗体媒介性神経筋接合部(NMJ)疾患のリスクがあるかもしくはそれに罹患している対象においてNMJ損傷を阻止するかもしくは低下させることを含む、請求項30に記載の治療用組成物。
- (a)CAARが、キラー免疫グロブリン様受容体(KIR)膜貫通ドメイン、およびKIR細胞質ドメインを含み、
(b)細胞が、DAP12をさらに含む、
請求項31に記載の治療用組成物。 - 前記自己抗体媒介性NMJ疾患が重症筋無力症(MG)である、請求項31に記載の治療用組成物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201962847121P | 2019-05-13 | 2019-05-13 | |
| US62/847,121 | 2019-05-13 | ||
| PCT/US2020/032486 WO2020231999A1 (en) | 2019-05-13 | 2020-05-12 | Compositions and methods of acetylcholine receptor chimeric autoantibody receptor cells |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2022533092A JP2022533092A (ja) | 2022-07-21 |
| JPWO2020231999A5 JPWO2020231999A5 (ja) | 2023-05-19 |
| JP7649755B2 true JP7649755B2 (ja) | 2025-03-21 |
Family
ID=73289319
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021567935A Active JP7649755B2 (ja) | 2019-05-13 | 2020-05-12 | アセチルコリン受容体キメラ自己抗体受容体細胞の組成物および方法 |
Country Status (10)
| Country | Link |
|---|---|
| US (2) | US20220242931A1 (ja) |
| EP (1) | EP3969587A4 (ja) |
| JP (1) | JP7649755B2 (ja) |
| KR (1) | KR20220007675A (ja) |
| CN (2) | CN114127287A (ja) |
| AU (1) | AU2020275776A1 (ja) |
| CA (1) | CA3139131A1 (ja) |
| IL (1) | IL287724A (ja) |
| MX (1) | MX2021013949A (ja) |
| WO (1) | WO2020231999A1 (ja) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2022136503A1 (en) * | 2020-12-22 | 2022-06-30 | Deutsches Zentrum Für Neurodegenerative Erkrankungen E. V. (Dzne) | Chimeric autoantibody receptor (caar) comprising a nicotinic acetylcholine receptor autoantigen |
| WO2022196719A1 (ja) * | 2021-03-17 | 2022-09-22 | 第一三共株式会社 | 抗アセチルコリン受容体自己抗体に対するキメラ受容体をコードする遺伝子 |
| CA3243757A1 (en) * | 2022-02-22 | 2023-08-31 | Juno Therapeutics, Inc. | CHIMERIC PROTEINASE 3 (PR3) AUTOANTIBODY RECEPTOR T LYMPHOCYTES AND ASSOCIATED METHODS AND USES |
| WO2025072450A1 (en) | 2023-09-26 | 2025-04-03 | Werewolf Therapeutics, Inc. | Enhanced adoptive cell therapy |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2011032188A (ja) | 2009-07-30 | 2011-02-17 | Nihon Pharmaceutical Co Ltd | 融合蛋白質 |
| WO2014145252A2 (en) | 2013-03-15 | 2014-09-18 | Milone Michael C | Targeting cytotoxic cells with chimeric receptors for adoptive immunotherapy |
| US20170051035A1 (en) | 2014-05-02 | 2017-02-23 | The Trustees Of The University Of Pennsylvania | Compositions and methods of chimeric autoantibody receptor t cells |
| WO2018049053A2 (en) | 2016-09-08 | 2018-03-15 | The Regents Of The University Of California | Peptides and uses thereof for diagnosing and treating myasthenia gravis |
| WO2018127585A1 (en) | 2017-01-06 | 2018-07-12 | Txcell | Monospecific regulatory t cell population with cytotoxicity for b cells |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| IL132972A0 (en) * | 1999-11-16 | 2001-03-19 | Yissum Res Dev Co | Pharmaceutical compositions comprising acetylcholinesterase antisense deoxynucleotides for the treatment of muscular and neuromuscular disorders |
| AU2003254016A1 (en) * | 2002-07-19 | 2004-02-09 | Catholic Healthcare West | Methods and compositions relating to chimeric nicotinic receptor subunits |
| KR100719020B1 (ko) * | 2005-09-28 | 2007-05-17 | 광주과학기술원 | 재조합 아세틸콜린 수용체 폴리펩티드, 폴리펩티드 유도체및 이를 유효성분으로 포함하는 중증근무력증 치료제 |
| CN103442768A (zh) * | 2011-01-18 | 2013-12-11 | 宾夕法尼亚大学董事会 | 治疗癌的组合物和方法 |
| KR20190003550A (ko) * | 2016-04-15 | 2019-01-09 | 더 트러스티스 오브 더 유니버시티 오브 펜실바니아 | 키메라 동종항원 수용체 t 세포의 조성물 및 방법 |
-
2020
- 2020-05-12 WO PCT/US2020/032486 patent/WO2020231999A1/en not_active Ceased
- 2020-05-12 EP EP20805549.1A patent/EP3969587A4/en active Pending
- 2020-05-12 CN CN202080050072.0A patent/CN114127287A/zh active Pending
- 2020-05-12 CN CN202511397173.6A patent/CN121204097A/zh active Pending
- 2020-05-12 KR KR1020217040645A patent/KR20220007675A/ko not_active Ceased
- 2020-05-12 US US17/595,203 patent/US20220242931A1/en not_active Abandoned
- 2020-05-12 AU AU2020275776A patent/AU2020275776A1/en active Pending
- 2020-05-12 MX MX2021013949A patent/MX2021013949A/es unknown
- 2020-05-12 CA CA3139131A patent/CA3139131A1/en active Pending
- 2020-05-12 JP JP2021567935A patent/JP7649755B2/ja active Active
-
2021
- 2021-10-31 IL IL287724A patent/IL287724A/en unknown
-
2025
- 2025-01-24 US US19/036,458 patent/US20260001934A1/en active Pending
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2011032188A (ja) | 2009-07-30 | 2011-02-17 | Nihon Pharmaceutical Co Ltd | 融合蛋白質 |
| WO2014145252A2 (en) | 2013-03-15 | 2014-09-18 | Milone Michael C | Targeting cytotoxic cells with chimeric receptors for adoptive immunotherapy |
| US20170051035A1 (en) | 2014-05-02 | 2017-02-23 | The Trustees Of The University Of Pennsylvania | Compositions and methods of chimeric autoantibody receptor t cells |
| WO2018049053A2 (en) | 2016-09-08 | 2018-03-15 | The Regents Of The University Of California | Peptides and uses thereof for diagnosing and treating myasthenia gravis |
| WO2018127585A1 (en) | 2017-01-06 | 2018-07-12 | Txcell | Monospecific regulatory t cell population with cytotoxicity for b cells |
Also Published As
| Publication number | Publication date |
|---|---|
| EP3969587A4 (en) | 2023-02-15 |
| CN114127287A (zh) | 2022-03-01 |
| JP2022533092A (ja) | 2022-07-21 |
| US20260001934A1 (en) | 2026-01-01 |
| CN121204097A (zh) | 2025-12-26 |
| AU2020275776A1 (en) | 2021-12-09 |
| MX2021013949A (es) | 2022-01-04 |
| WO2020231999A1 (en) | 2020-11-19 |
| CA3139131A1 (en) | 2020-11-19 |
| KR20220007675A (ko) | 2022-01-18 |
| EP3969587A1 (en) | 2022-03-23 |
| IL287724A (en) | 2021-12-01 |
| US20220242931A1 (en) | 2022-08-04 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20230303653A1 (en) | Compositions and methods of chimeric autoantibody receptor t cells | |
| US11884716B2 (en) | Compositions and methods of phospholipase A2 receptor chimeric autoantibody receptor T cells | |
| JP7618192B2 (ja) | 移植された組織を拒絶反応から保護するための方法 | |
| US20240425564A1 (en) | Compositions and methods of muscle specific kinase chimeric autoantibody receptor cells | |
| JP2022133308A (ja) | キメラアロ抗原受容体t細胞の組成物および方法 | |
| US20260001934A1 (en) | Compositions and methods of acetycholine receptor chimeric autoantibody receptor cells | |
| US20210269501A1 (en) | Compositions and methods of nkg2d chimeric antigen receptor t cells for controlling triple-negative breast cancer | |
| US20250179179A1 (en) | Compositions and methods for targeting gamma delta t cells with chimeric antigen receptors | |
| WO2018127584A1 (en) | Monospecific regulatory t cell population with cytotoxicity for b cells | |
| US20230167429A1 (en) | Compositions and methods of adamts13 chimeric autoantibody receptor cells | |
| US20250073265A1 (en) | Compositions and Methods of Chimeric Autoantibody Receptor Cells Expressing Extended Phospholipase A2 Receptor Fragments |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220216 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230511 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20230511 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20230531 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20240521 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20240523 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20240724 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20241122 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20250210 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20250310 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7649755 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |