JP7601802B2 - キシログルカン及びアルコールを含む、活性成分の制御放出のためのゲル形態の医薬組成物 - Google Patents
キシログルカン及びアルコールを含む、活性成分の制御放出のためのゲル形態の医薬組成物 Download PDFInfo
- Publication number
- JP7601802B2 JP7601802B2 JP2021576349A JP2021576349A JP7601802B2 JP 7601802 B2 JP7601802 B2 JP 7601802B2 JP 2021576349 A JP2021576349 A JP 2021576349A JP 2021576349 A JP2021576349 A JP 2021576349A JP 7601802 B2 JP7601802 B2 JP 7601802B2
- Authority
- JP
- Japan
- Prior art keywords
- xyloglucan
- concentration
- ethanol
- ethoxyethoxy
- composition
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/19—Cytokines; Lymphokines; Interferons
- A61K38/21—Interferons [IFN]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/10—Alcohols; Phenols; Salts thereof, e.g. glycerol; Polyethylene glycols [PEG]; Poloxamers; PEG/POE alkyl ethers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/36—Polysaccharides; Derivatives thereof, e.g. gums, starch, alginate, dextrin, hyaluronic acid, chitosan, inulin, agar or pectin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/06—Ointments; Bases therefor; Other semi-solid forms, e.g. creams, sticks, gels
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
- A61K9/0024—Solid, semi-solid or solidifying implants, which are implanted or injected in body tissue
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Engineering & Computer Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- General Chemical & Material Sciences (AREA)
- Inorganic Chemistry (AREA)
- Gastroenterology & Hepatology (AREA)
- Zoology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Immunology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biomedical Technology (AREA)
- Neurosurgery (AREA)
- Dermatology (AREA)
- Medicinal Preparation (AREA)
Description
本発明は、医薬活性成分(医薬有効成分)を含むゲル組成物に関する。
国際公開第2009/028764号(特許文献1)には、塩析特性を有する塩の存在下で高分子と熱可逆性多糖との複合体から得られたタンパク質を放出するためのゲルが記載されている。得られた処方物は室温で液体であり、注射するとゲルになり、ゲルからタンパク質が放出される。
本発明は、医薬活性成分を含むゲル形態の制御放出性組成物に関する。
本発明は、ゲル形態の制御放出性組成物であって、ゲルが、制御された効果的な方法で放出される医薬活性成分を含む制御放出性組成物を記載する。
・0.1重量%~10.0重量%濃度の精製キシログルカン水溶液を調製する工程、得られたキシログルカン溶液を第一級アルコール溶液(又はアルコール液)に添加して、第一級アルコールの濃度を5.0重量%~50.0重量%濃度とする工程
前記方法において、活性成分は、その溶解度に応じて両方の溶液に含まれてもよい。
実施例1:2-(2-エトキシエトキシ)エタノールによるキシログルカンゲル形成の測定
0.4重量%、1.0重量%、3.2重量%及び4.0重量%の濃度でキシログルカン水溶液を調製した。
キシログルカン水溶液を、0.4重量%、1.0重量%、3.2重量%及び4.0重量%の濃度で調製した。溶液を、表に示した濃度でプロピレングリコールと混合した。キシログルカン溶液は、必要量のキシログルカンを水中で混合し、完全に溶解するまで混合することによって作製された。
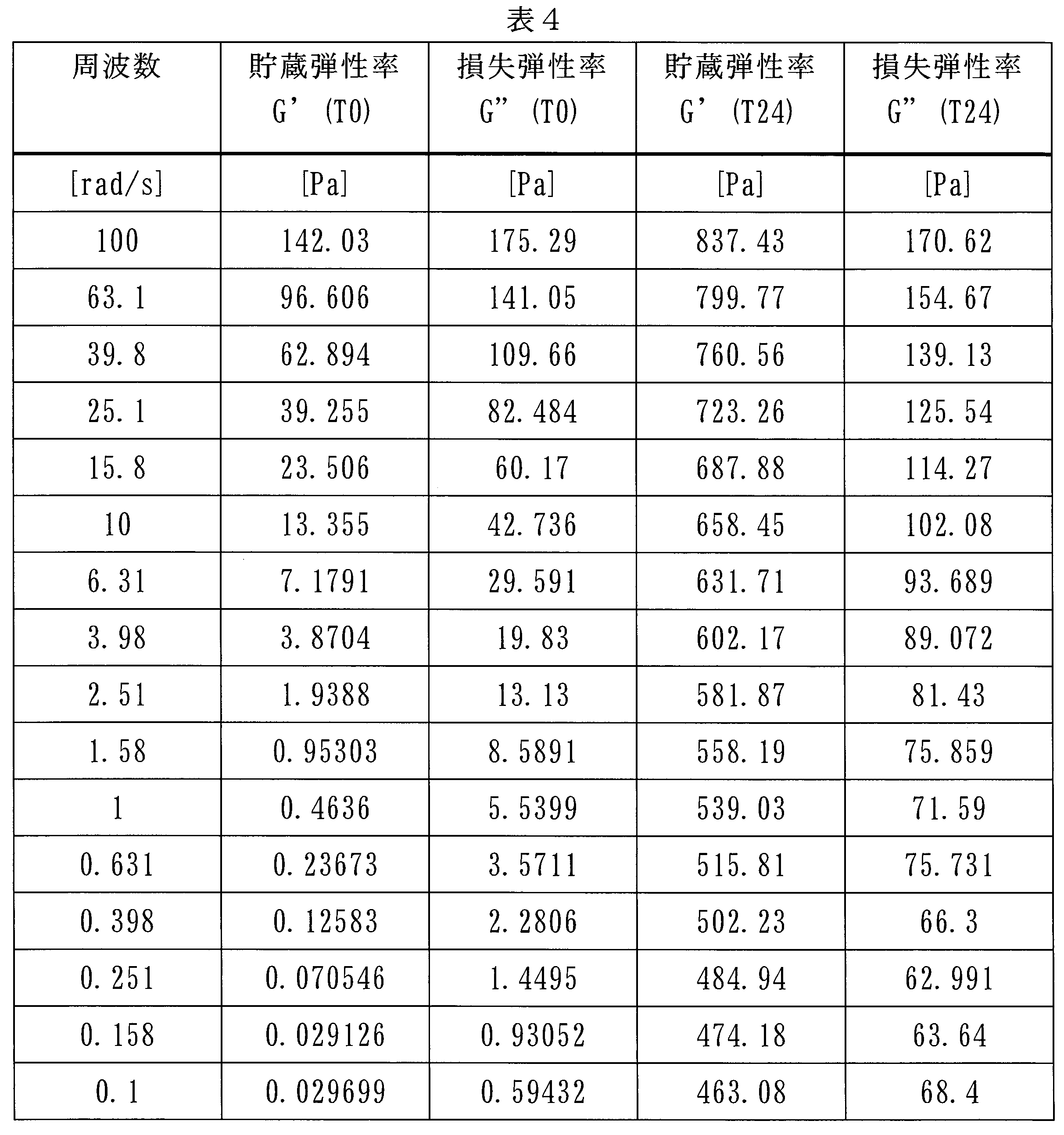
3.2%(w/w)濃度のキシログルカン水溶液40mlを10mlの2-(2-エトキシエトキシ)エタノールと混合した。溶液を2つのシリンジに入れ、レオメータープレートに直接押し出して(注出して)分析した。G’及びG”を、50mmのフラットコーンを使用して、37℃の温度に調整されたAntoon Paar MCR101レオメーターによって測定した。G’及びG”の測定を、T0及びT24で実行した。
この実施例は実施例3と同様に実施され、40mlの3.2%(w/w)キシログルカン水溶液を10mlの2-(2-エトキシエトキシ)エタノールと混合することによって得られた組成物の貯蔵弾性率(G’)及び損失弾性率(G”)の値を測定した。
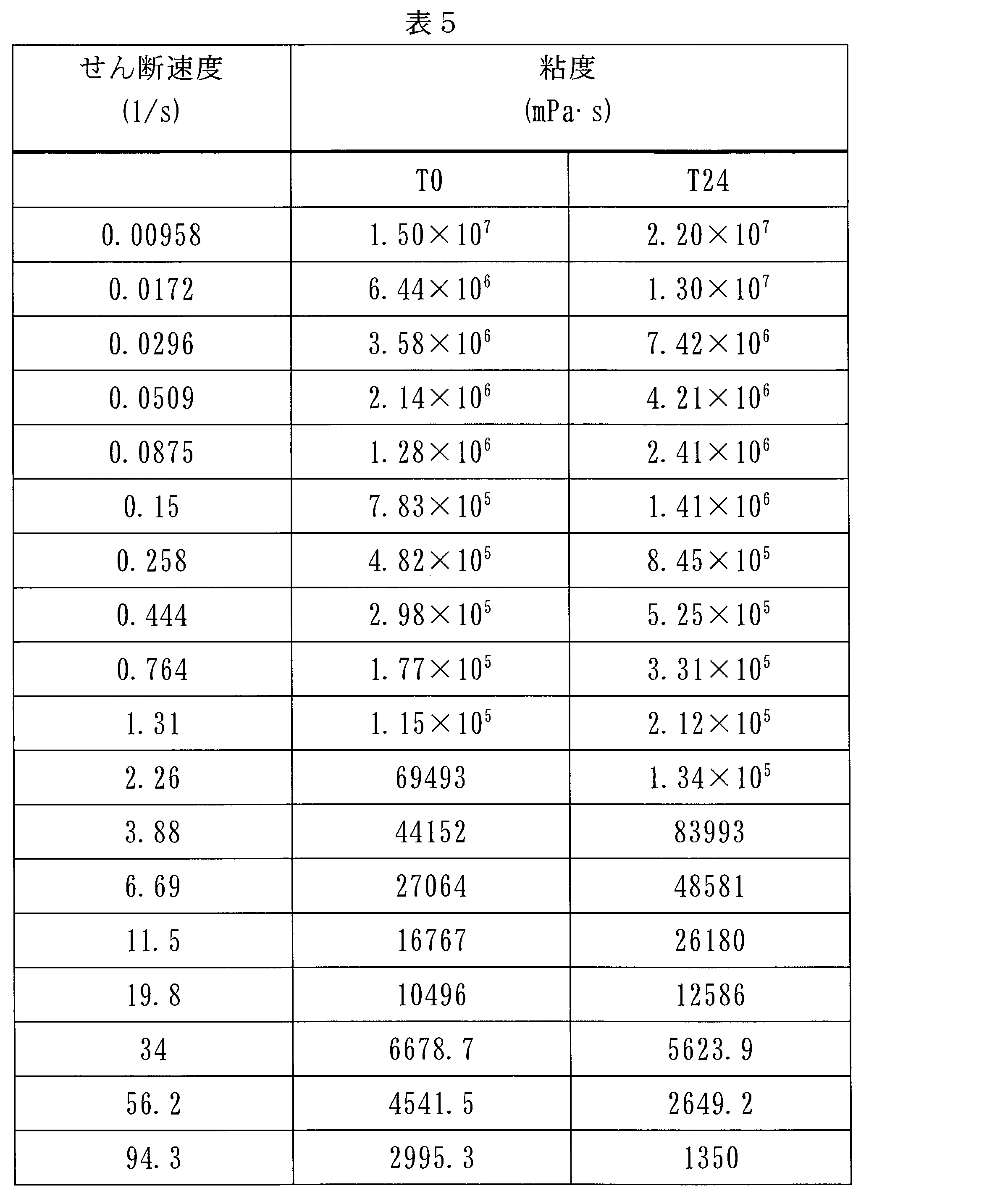
粘度値を、50mmのフラットコーン形状(flat cone geometry)を用いて、Antoon Paar MCR101レオメーターによって得た。この測定は37℃で実行された。表5は、40mlの3.2%(w/w)キシログルカン水溶液を10mlの2-(2-エトキシエトキシ)エタノールと混合することによって得られた組成物のT0及び24時間後での粘度値を報告する。
粘度値を、50mmのフラットコーン形状を用いて、Antoon Paar MCR101レオメーターによって得た。この測定は37℃で実行された。
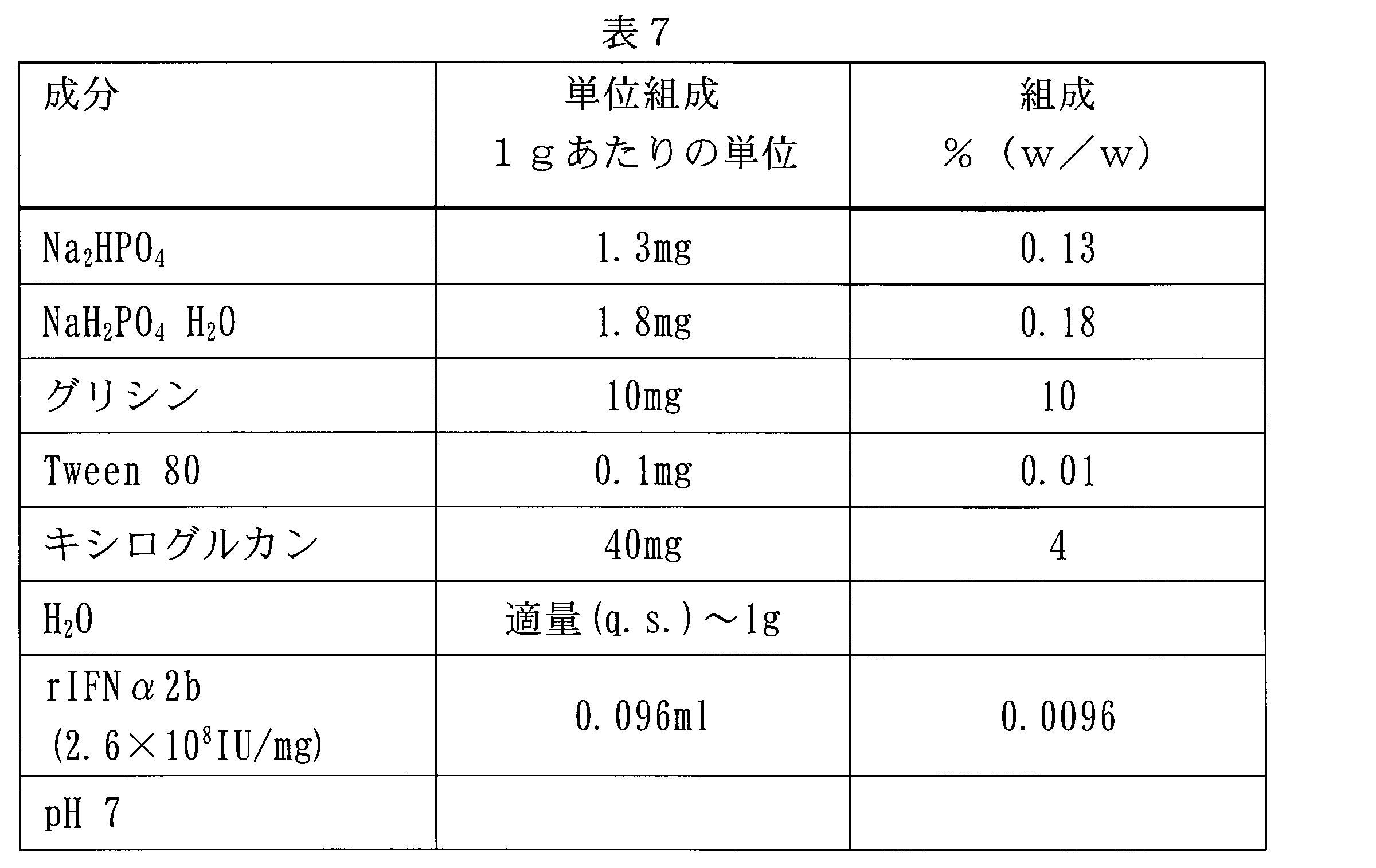
2.6×108IU/mgの割合で組換えIFN α2bを含む溶液を、pH7で4重量%キシログルカン溶液において調製した。単位組成を表7で報告する。
Claims (16)
- 医薬活性成分、キシログルカン及び2-(2-エトキシエトキシ)エタノールを含むゲル形態の制御放出性組成物であって、キシログルカンの濃度が0.1%(w/w)~10.0%(w/w)であり、2-(2-エトキシエトキシ)エタノールの濃度が20.0%(w/w)~50.0%(w/w)である、制御放出性組成物。
- 前記2-(2-エトキシエトキシ)エタノールの濃度が、20.0%(w/w)~30.0%(w/w)である請求項1記載の組成物。
- 前記キシログルカンの濃度が、1.0%(w/w)~5.0%(w/w)であり、かつ前記2-(2-エトキシエトキシ)エタノールの濃度が、20.0%(w/w)~50.0%(w/w)である請求項1記載の組成物。
- 前記キシログルカンの濃度が、1.0%(w/w)~5.0%(w/w)であり、かつ前記2-(2-エトキシエトキシ)エタノールの濃度が、20.0%(w/w)~30.0%(w/w)である請求項1記載の組成物。
- 前記キシログルカンの濃度が、2.0%(w/w)~5.0%(w/w)であり、かつ前記2-(2-エトキシエトキシ)エタノールの濃度が、20.0%(w/w)~50.0%(w/w)である請求項1記載の組成物。
- 前記キシログルカンの濃度が、2.0%(w/w)~5.0%(w/w)であり、かつ前記2-(2-エトキシエトキシ)エタノールの濃度が、20.0%(w/w)~30.0%(w/w)である請求項1記載の組成物。
- 4%(w/w)の前記キシログルカン及び50.0%(w/w)の前記2-(2-エトキシエトキシ)エタノールを含む請求項1記載の組成物。
- 100ラジアン/秒~0.1ラジアン/秒の周波数に供されたとき、貯蔵弾性率(G’)値が、T0において2000Pa~500Paであり、かつ24時間後に3000Pa~1000Paであることを特徴とする請求項1~7のいずれか一項に記載の組成物。
- 0秒-1~95秒-1のせん断速度に供されたとき、粘度値がT0において1×1010mPa・s~2×103mPa・sであり、かつ粘度値がT24において3×107mPa・s~1×103mPa・sであることを特徴とする請求項1~8のいずれか一項に記載の組成物。
- 前記医薬活性成分が、抗炎症剤、抗真菌剤、抗生物質、模倣(又は擬態)抗生物質、成長因子、消毒剤、抗腫瘍剤、タンパク質、ペプチド、保湿剤からなる群より選択される請求項1記載の組成物。
- 経腸、非経口、経皮又は経粘膜経路による投与のための請求項1記載の組成物。
- 経腸経路による投与が、経口、舌下又は直腸投与であり、非経口経路による投与が、皮下又は皮内投与であり、経皮又は経粘膜経路による投与が、膣、鼻又は口腔咽頭粘膜を介する請求項11記載の組成物。
- 以下の工程:
(a)精製キシログルカン水溶液を調製する工程;
(b)工程(a)のキシログルカン水溶液を2-(2-エトキシエトキシ)エタノールへ添加し、2-(2-エトキシエトキシ)エタノールの濃度を20.0%(w/w)~50.0%(w/w)濃度とする工程
を含む請求項1記載の組成物の調製方法であって、活性成分がその溶解性に応じて両方の溶液に含まれてもよい、方法。 - 使用時、使用前、又は保存されるゲルを調製する段階で溶液が混合される請求項13記載の方法。
- 前記活性成分の制御放出が有用である病状の処置に使用するための請求項1記載の組成物。
- 医療デバイスに含まれる請求項1記載の組成物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| IT102019000009273 | 2019-06-21 | ||
| IT201900009273 | 2019-06-21 | ||
| PCT/EP2020/066181 WO2020254179A1 (en) | 2019-06-21 | 2020-06-11 | Pharmaceutical compositions in the form of gel containing xyloglucan and alcohols for the controlled release of active ingredients |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2022537460A JP2022537460A (ja) | 2022-08-25 |
| JP7601802B2 true JP7601802B2 (ja) | 2024-12-17 |
Family
ID=68582095
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021576349A Active JP7601802B2 (ja) | 2019-06-21 | 2020-06-11 | キシログルカン及びアルコールを含む、活性成分の制御放出のためのゲル形態の医薬組成物 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US20220241193A1 (ja) |
| EP (1) | EP3986378B1 (ja) |
| JP (1) | JP7601802B2 (ja) |
| CN (1) | CN114096237A (ja) |
| EA (1) | EA202290122A1 (ja) |
| MX (1) | MX2021015776A (ja) |
| WO (1) | WO2020254179A1 (ja) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN115569110B (zh) * | 2022-10-18 | 2023-04-28 | 杨伊森(广州)生命科学技术有限公司 | 重组iii型胶原水凝胶组合物、制备方法及应用 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2007533604A (ja) | 2003-08-08 | 2007-11-22 | ミファルム ソシエタ ペル アチオニ | ヒドロキシエチルセルロースに基づく生体接着性ゲル |
| JP2008542324A (ja) | 2005-06-06 | 2008-11-27 | アルファ ワッセルマン ソシエタ ペル アチオニ | 医療用デバイスおよび医薬製剤において有用な粘膜付着性キシログルカン含有製剤 |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6432449B1 (en) | 1998-05-18 | 2002-08-13 | Amgen Inc. | Biodegradable sustained-release alginate gels |
| JP2002003398A (ja) | 2000-04-17 | 2002-01-09 | Ltt Institute Co Ltd | 徐放製剤、その製造法及びワクチン |
| KR100813224B1 (ko) | 2007-08-24 | 2008-03-13 | 한양대학교 산학협력단 | 단백질 약물전달용 온도 가역성 코아세르베이트 조합 겔 |
| US8623336B2 (en) * | 2008-12-15 | 2014-01-07 | Council Of Scientific & Industrial Research | Transparent xyloglucan/chitosan gel and a process for the preparation thereof |
| ITBO20110461A1 (it) * | 2011-07-29 | 2013-01-30 | Alfa Wassermann Spa | Composizioni farmaceutiche comprendenti rifaximina, processi per la loro preparazione e loro uso nel trattamento di infezioni vaginali. |
| EP3173067B1 (en) | 2015-11-16 | 2018-11-14 | Istanbul Universitesi Rektorlugu | Mucoadhesive buccal in situ gel formulation |
| JP6490134B2 (ja) * | 2017-04-05 | 2019-03-27 | Dsp五協フード&ケミカル株式会社 | キシログルカン含有ゲル状組成物 |
-
2020
- 2020-06-11 US US17/596,509 patent/US20220241193A1/en not_active Abandoned
- 2020-06-11 JP JP2021576349A patent/JP7601802B2/ja active Active
- 2020-06-11 MX MX2021015776A patent/MX2021015776A/es unknown
- 2020-06-11 CN CN202080049705.6A patent/CN114096237A/zh active Pending
- 2020-06-11 EP EP20733384.0A patent/EP3986378B1/en active Active
- 2020-06-11 EA EA202290122A patent/EA202290122A1/ru unknown
- 2020-06-11 WO PCT/EP2020/066181 patent/WO2020254179A1/en not_active Ceased
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2007533604A (ja) | 2003-08-08 | 2007-11-22 | ミファルム ソシエタ ペル アチオニ | ヒドロキシエチルセルロースに基づく生体接着性ゲル |
| JP2008542324A (ja) | 2005-06-06 | 2008-11-27 | アルファ ワッセルマン ソシエタ ペル アチオニ | 医療用デバイスおよび医薬製剤において有用な粘膜付着性キシログルカン含有製剤 |
Non-Patent Citations (2)
| Title |
|---|
| Biomaterials for Medicine,2014年,p.369-370 |
| Chemical Engineering Transactions,2016年,Vol.49,p.289-294 |
Also Published As
| Publication number | Publication date |
|---|---|
| MX2021015776A (es) | 2022-01-31 |
| US20220241193A1 (en) | 2022-08-04 |
| EP3986378A1 (en) | 2022-04-27 |
| EP3986378B1 (en) | 2025-12-17 |
| EA202290122A1 (ru) | 2022-03-17 |
| WO2020254179A1 (en) | 2020-12-24 |
| CN114096237A (zh) | 2022-02-25 |
| JP2022537460A (ja) | 2022-08-25 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101792200B1 (ko) | 열감응성 겔 마취제 조성물 | |
| US6565832B1 (en) | Spray composition with reduced dripping | |
| US20220362384A1 (en) | Composition for treating or preventing climacteric disorders | |
| JP7601802B2 (ja) | キシログルカン及びアルコールを含む、活性成分の制御放出のためのゲル形態の医薬組成物 | |
| JPH05247308A (ja) | ニュートン型粘性を示すカルボキシビニルポリマー | |
| EA049028B1 (ru) | Фармацевтическая композиция в форме геля, содержащая ксилоглюкан и спирт, для регулируемого высвобождения активных ингредиентов | |
| JP7331149B2 (ja) | 直腸および局所投与のためのゲル | |
| EP4142687B1 (en) | Composition for treating and/or preventing vestibulodynia | |
| JP2025513344A (ja) | 眼科用局所クリーム組成物 | |
| CA3190737A1 (en) | Sol-gel composition | |
| HK40086390A (zh) | 用於治疗和/或预防前庭痛的组合物 | |
| JP2010030978A (ja) | 多糖類微粒子状ゲル含有水分散体およびその製造方法ならびに多糖類微粒子状ゲル含有保湿剤と多糖類微粒子状ゲル含有眼科用組成物 | |
| JPWO2020176004A5 (ja) |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20230607 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20240321 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20240409 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20240619 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240920 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20241203 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20241205 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7601802 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |