JP7522397B2 - 生物発光酵素の長波長発光基質 - Google Patents
生物発光酵素の長波長発光基質 Download PDFInfo
- Publication number
- JP7522397B2 JP7522397B2 JP2020040703A JP2020040703A JP7522397B2 JP 7522397 B2 JP7522397 B2 JP 7522397B2 JP 2020040703 A JP2020040703 A JP 2020040703A JP 2020040703 A JP2020040703 A JP 2020040703A JP 7522397 B2 JP7522397 B2 JP 7522397B2
- Authority
- JP
- Japan
- Prior art keywords
- luminescence
- luminescent
- substrate
- enzyme
- bioluminescent
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Landscapes
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
Description
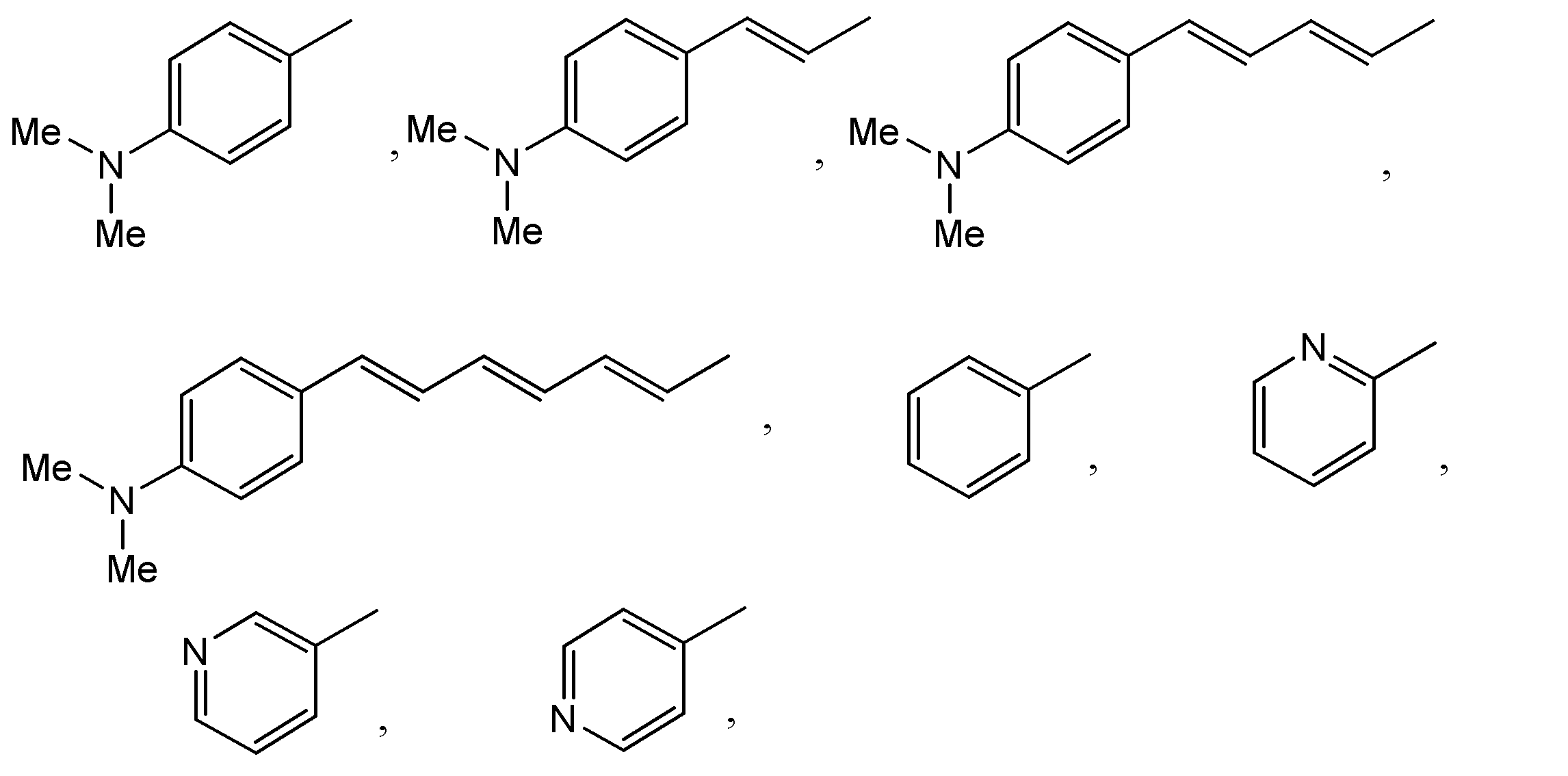
発光基質の創製においては、これまでの本発明者らの研究成果より海洋生物由来生物発光酵素の共通基質(セレンテラジン)の場合、C6番位置の官能基が発光性能に重要であるという考えの基で、C6番位置の官能基を調整した。まず本来基質のC6位に位置するフェノール基(Ph-OH)においてそのヒドロキシ基(OH基)をジメチルアミン基に替える試みをした。またC6番位置のフェノール基とイミダゾピラジノン骨格との間に2重結合を設けることにより、π結合を伸ばし長波長へのシフト効果を試みた。更に基質(セレンテラジン)のC2位のフェノール基をベンゼングループに置換する試みをした。本発明では、C2位がフェノール基を持つ場合を「1グループ」にし、ベンゼングループに置換した場合を「2グループ」に分類した。一方、C6位にピリジン基に替え、さらにC2位のフェノール基をベンゼングループに置換した場合を「3グループ」に分類した。
新規発光基質において、事前に生物発光酵素との結合モデルについて検討したとしても、実際に合成された基質が、思いもかけない新しい発光特性を持つ可能性がある。したがって、新規発光基質においては、できるだけ多くの発光酵素と組み合わせて発光性能を検討する必要がある。例えば、新規発光基質が特定発光酵素に選択的に発光する可能性があった場合、マルチカラーイメージングシステムを構成できる技術的な難関を克服したことになる。また、発光酵素との組み合わせにより、思いがけないレッドシフトした発光色を放つ可能性があり、発光スペクトルに関する綿密な評価も必要である。他に発光持続性や安定性も発光酵素との相性によって決まる側面があり、新規発光基質がどの発光酵素と最も合うかを綿密に評価する必要がある。
また、前述した新規発光基質とそれに最適な発光酵素が見つかった場合においても、その反応に影響する最適反応条件とそのバイオアッセイの検討が必要である。一般的にこれらの発光反応は酵素反応であるため、pHや温度、塩度など様々な要因により発光輝度と発光色、発光安定性が決まる。そのため、これらの要素に関する検討が必要である。
項1. 下記式(I):
項2.
R1はヒドロキシ基で置換されていてもよいベンジル基である、項1に記載のイミダゾピラジノン化合物。
項3.
R2は下記のいずれかの基
アラルキル基としては、ベンジル、フェネチル、ナフチルメチル、ビフェニリルメチルが挙げられる。
反応は、一般式(2)の化合物1モルに対して、一般式(1)の化合物を1~4モル程度使用し、酸の存在下または非存在下に65~100℃程度の温度で1~2時間反応させることで有利に進行する。
スキーム2で示している一般式(2)の化合物の製造法について説明する。
以下の反応式に従い、化合物(1a)と化合物(2a)から1シリーズの化合物1a~1dを製造した。
・化合物1a
物性値(MS、NMR):
; 1H-NMR (500 MHz, METHANOL-D3) δ 7.91 (s, 1 H), 7.44 (d, J = 6.9 Hz, 2 H), 7.38 (d, J = 7.4 Hz, 2 H), 7.28-7.31 (m, 2 H), 7.23 (t, J = 7.4 Hz, 1 H), 7.16 (d, J = 8.6 Hz, 2 H), 6.79 (d, J = 9.2 Hz, 2 H), 6.69 (dd, J = 8.9, 2.6 Hz, 2 H), 4.40 (s, 2H), 4.06 (s, 2 H), 2.97 (d, J = 12.0 Hz, 6 H)
; 13C-NMR (125 MHz, METHANOL-D3) δ 155.66, 151.51, 136.76, 129.47, 129.28, 128.45, 128.39, 127.26, 126.86, 114.85, 112.05, 105.63, 72.19, 60.92, 39.07
; HR-ESI-MS: m/z: [M+H]+ calcd for C28H27N4O2, 451.2134; found, 451.2130, [M+Na]+ calcd for C28H26N4O2Na, 473.1947; found, 473.1953.
物性値(MS、NMR):
; 1H-NMR (500 MHz, METHANOL-D3) δ 7.51 (s, 1 H), 7.37 (t, J = 7.7 Hz, 4 H), 7.30 (t, J = 7.4 Hz, 2 H), 7.23 (t, J = 7.2 Hz, 1 H), 7.14 (t, J = 8.3 Hz, 3 H), 6.68-6.73 (m, 5 H), 4.40 (s, 2 H), 4.04 (s, 2 H), 2.97 (s, 6 H)
; HR-ESI-MS: m/z: [M+H]+ calcd for C30H29N4O2, 477.2291; found, 477.2287, [M+Na]+ calcd for C30H28N4O2Na, 499.2104; found, 499.2094.
物性値(MS、NMR):
; 1H-NMR (500 MHz, METHANOL-D3) δ 7.47 (s, 1 H), 7.36 (d, J = 8.0 Hz, 2 H), 7.27-7.33 (m, 4 H), 7.23 (t, J = 7.4 Hz, 1 H), 7.14 (d, J = 8.6 Hz, 2 H), 7.02-7.09 (m, 1 H), 6.77 (dd, J = 15.2, 10.6 Hz, 1 H), 6.62-6.71 (m, 5 H), 6.33 (d, J = 15.5 Hz, 1 H), 4.38 (s, 2 H), 4.03 (s, 2 H), 3.87 (d, J = 14.9 Hz, 1 H), 2.95 (s, 6 H)
; HR-ESI-MS: m/z: [M+H]+ calcd for C32H31N4O2, 503.2447; found, 503.2463, [M+Na]+ calcd for C32H30N4O2Na, 525.2266; found, 525.2263.
物性値(MS、NMR):
; 1H-NMR (500 MHz, METHANOL-D3) δ 7.47 (s, 1H), 7.27-7.37 (comp., 7 H), 7.23 (t, J = 7.4 Hz, 1 H), 7.14 (d, J = 8.6 Hz, 2 H), 7.02-7.09 (m, 2 H), 6.77 (dd, J = 15.2, 10.6 Hz, 1 H), 6.62-6.71 (m, 6 H), 6.33 (d, J = 15.5 Hz, 1 H), 4.38 (s, 2 H), 4.03 (s, 2 H), 2.95 (s, 6 H)
; HR-ESI-MS: m/z: [M+H]+ calcd for C34H33N4O2, 529.2604; found, 529.2637, [M+Na]+ calcd for C34H32N4O2Na, 551.2423; found, 551.2409, [M+K]+ calcd for C34H32N4O2K, 567.2162; found, 567.2144.
以下の反応式に従い、化合物(1b)と化合物(2b)から2シリーズの化合物2a~2dを製造した。
・化合物2a
物性値(MS、NMR):
1H-NMR (500 MHz, METHANOL-D3): δ 7.95 (s, 1H), 7.64-7.79 (m, 3H), 7.53 (dt, J = 15.5, 7.0 Hz, 2H), 7.43-7.48 (m, 1H), 7.27-7.35 (m, 1H), 6.66-6.74 (m, 3H), 6.38-6.58 (m, 3H), 4.84 (s, 2H), 2.93 (s, 6H)
;ESI-MS: m/z: [M+H]+421.20,
物性値(MS、NMR):
1H-NMR (500 MHz, METHANOL-D3): δ 7.93 (s, 1H), 7.83 (d, J = 6.9 Hz, 3H), 7.47-7.62 (m, 4H), 7.33-7.42 (m, 3H), 7.14 (t, J = 7.4 Hz, 3H), 7.06 (t, J = 7.2 Hz, 2H), 6.92 (d, J = 6.9 Hz, 3H), 2.94 (s, 6H)
;ESI-MS: m/z: [M+H]+447.22
物性値(MS、NMR):
1H-NMR (500 MHz, METHANOL-D3) : δ 8.02 (1H), 7.88 (s, 4H), 7.71 (d, J = 7.4 Hz, 1H), 7.53 (q, J = 7.4 Hz, 5H), 6.67-6.80 (m, 5H), 4.10 (s, 2H), 3.93 (d, J = 6.3 Hz, 1H), 3.15 (s, 1H), 2.94 (s, 6H)
;ESI-MS: m/z: [M+H]+473.23
物性値(MS、NMR):
1H-NMR (500 MHz, METHANOL-D3): δ 8.00 (d, J = 5.7 Hz, 1H), 7.55-7.57(comp., 7 H), 7.30 (d, J = 8.6 Hz, 2H), 7.22 (t, J = 7.7 Hz, 1H), 7.12 (t, J = 7.4 Hz, 1H), 6.69-6.77 (m, 2H), 6.54-6.59 (m, 1H), 6.69-6.48 (m, 6H), 4.10 (s, 2H), 2.94 (s, 6H)
;ESI-MS: m/z: [M+H]+499.29
以下の反応式に従い、化合物(1)と化合物(2c)から3シリーズの化合物3a~3dを製造した。
・化合物3a
物性値(MS、NMR):
1H-NMR (500 MHz, METHANOL-D3): δ 8.65 (d, J = 4.0 Hz, 1H), 8.20 (d, J = 12.6 Hz, 3H), 7.88-7.94 (m, 1H), 7.59 (t, J = 3.2 Hz, 4H), 7.41 (t, J = 6.6 Hz, 1H), 7.32 (d, J = 6.9 Hz, 2H), 7.24 (t, J = 7.7 Hz, 2H), 7.14 (t, J = 7.4 Hz, 1H), 4.16 (s, 2H)
;ESI-MS: m/z: [M+H]+379.15
物性値(MS、NMR):
1H-NMR (500 MHz, METHANOL-D3): δ 9.16 (s, 1H), 8.59 (d, J = 2.9 Hz, 1H), 8.43 (d, J = 8.6 Hz, 1H), 8.21 (d, J = 23.5 Hz, 2H), 7.88 (s, 4H), 7.31 (d, J = 7.4 Hz, 2H), 7.24 (t, J = 7.7 Hz, 3H), 7.15 (d, J = 6.9 Hz, 1H), 4.16 (s, 2H)
;ESI-MS: m/z: [M+H]+379.11
物性値(MS、NMR):
1H-NMR (500 MHz, METHANOL-D3): δ 8.63 (d, J = 5.7 Hz, 2H), 8.32-8.21 (2H), 8.11 (d, J = 4.6 Hz, 2H), 7.88 (s, 1H), 7.56 (t, J = 3.4 Hz, 3H), 7.31 (d, J = 7.4 Hz, 2H), 7.24 (t, J = 7.7 Hz, 2H), 7.14 (s, 1H), 4.16 (s, 2H)
;ESI-MS: m/z: [M+H]+379.13
物性値(MS、NMR):
1H-NMR (500 MHz, METHANOL-D3 with 0.49 %TFA): δ 8.76 (s, 1H), 8.13 (d, J = 7.4 Hz, 2H), 8.03-8.04 (m, 2H), 7.51-7.66 (m, 6H), 7.23-7.31 (m, 6H), 4.30 (s, 2H)
;ESI-MS: m/z: [M+H]+ 378.14
Claims (3)
- 下記式(I):
R1はヒドロキシ基で置換されていてもよいベンジル基を示す。
R2は下記のいずれかの基を示す。
- 請求項1に記載のイミダゾピラジノン化合物と生物発光酵素との組み合わせにより生物発光を放つことを特徴とするバイオアッセイシステム。
- 生物発光酵素の遺伝子が組み込まれた形質転換細胞であって、さらに請求項1に記載のイミダゾピラジノン化合物を含み、前記生物発光酵素との組み合わせにより生物発光を放つことを特徴とする、形質転換細胞。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2020040703A JP7522397B2 (ja) | 2020-03-10 | 2020-03-10 | 生物発光酵素の長波長発光基質 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2020040703A JP7522397B2 (ja) | 2020-03-10 | 2020-03-10 | 生物発光酵素の長波長発光基質 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2021143129A JP2021143129A (ja) | 2021-09-24 |
| JP7522397B2 true JP7522397B2 (ja) | 2024-07-25 |
Family
ID=77765907
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2020040703A Active JP7522397B2 (ja) | 2020-03-10 | 2020-03-10 | 生物発光酵素の長波長発光基質 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP7522397B2 (ja) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN118084918A (zh) * | 2024-01-29 | 2024-05-28 | 中国药科大学 | 一种化学发光探针及其制备方法和在检测β淀粉样蛋白中的应用 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2018165265A (ja) | 2017-03-28 | 2018-10-25 | 国立大学法人電気通信大学 | 新規セレンテラジン誘導体 |
| JP2019507753A (ja) | 2016-02-15 | 2019-03-22 | プロメガ コーポレイションPromega Corporation | セレンテラジン類似体 |
-
2020
- 2020-03-10 JP JP2020040703A patent/JP7522397B2/ja active Active
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2019507753A (ja) | 2016-02-15 | 2019-03-22 | プロメガ コーポレイションPromega Corporation | セレンテラジン類似体 |
| JP2018165265A (ja) | 2017-03-28 | 2018-10-25 | 国立大学法人電気通信大学 | 新規セレンテラジン誘導体 |
Non-Patent Citations (2)
| Title |
|---|
| ACS Chem. Biol.,2019年,14,959-965 |
| Chem. Commun.,2015年,51,391-394 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2021143129A (ja) | 2021-09-24 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Azad et al. | Split-luciferase complementary assay: applications, recent developments, and future perspectives | |
| CN104781401B (zh) | 人工生物发光酶 | |
| Xing et al. | Techniques for the analysis of protein-protein interactions in vivo | |
| Liu et al. | A novel N-nitrosation-based ratiometric fluorescent probe for highly selective imaging endogenous nitric oxide in living cells and zebrafish | |
| Ozawa et al. | Advances in fluorescence and bioluminescence imaging | |
| Leng et al. | A wash-free SNAP-tag fluorogenic probe based on the additive effects of quencher release and environmental sensitivity | |
| EP3254113B1 (en) | Luciferase-based thermal shift assays | |
| US8709821B2 (en) | Luminescent substrate for liciferase | |
| Tamaki et al. | Color-tunable bioluminescence imaging portfolio for cell imaging | |
| Wang et al. | Two-isophorone fluorophore-based design of a ratiometric fluorescent probe and its application in the sensing of biothiols | |
| Hashimoto et al. | Novel in vitro protein fragment complementation assay applicable to high-throughput screening in a 1536-well format | |
| Kavyashree et al. | Rationally designed far-red emitting styryl chromones and a magnetic nanoconjugate for strip-based ‘on-site’detection of metabolic markers | |
| Baljinnyam et al. | Advances in luminescence-based technologies for drug discovery | |
| JP7522397B2 (ja) | 生物発光酵素の長波長発光基質 | |
| Lee et al. | Diversity-oriented optical imaging probe development | |
| JP5110573B2 (ja) | 多色生物発光可視化プローブセット、又は一分子型多色生物発光可視化プローブ | |
| Heinrich et al. | Photo-transformable genetically-encoded optical probes for functional highlighting in vivo | |
| JP6153140B2 (ja) | 人工生物発光酵素に用いるための発光基質 | |
| JP7668575B2 (ja) | 発光反応を触媒するペプチド | |
| Awais et al. | Illuminating intracellular signaling and molecules for single cell analysis | |
| JP2014100137A (ja) | 人工生物発光酵素 | |
| Warrier et al. | Fluorescent probes for biomedical applications (2009–2014) | |
| Kowada et al. | Subcellular Compartment-targeting Fluorescent Zn2+ Probes | |
| Kitada et al. | Visible Light Bioluminescence Imaging Platform for Animal Cell Imaging | |
| Kim et al. | Creating bioluminescent indicators to visualise biological events in living cells and animals |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A80 | Written request to apply exceptions to lack of novelty of invention |
Free format text: JAPANESE INTERMEDIATE CODE: A80 Effective date: 20200325 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20230216 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20240131 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20240213 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20240411 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240605 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20240618 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20240702 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7522397 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |