JP7253274B2 - Aav適合性ラミニン-リンカー重合タンパク質 - Google Patents
Aav適合性ラミニン-リンカー重合タンパク質 Download PDFInfo
- Publication number
- JP7253274B2 JP7253274B2 JP2020561690A JP2020561690A JP7253274B2 JP 7253274 B2 JP7253274 B2 JP 7253274B2 JP 2020561690 A JP2020561690 A JP 2020561690A JP 2020561690 A JP2020561690 A JP 2020561690A JP 7253274 B2 JP7253274 B2 JP 7253274B2
- Authority
- JP
- Japan
- Prior art keywords
- aav
- laminin
- sequences
- agent
- seq
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/713—Double-stranded nucleic acids or oligonucleotides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
- A61K48/005—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the 'active' part of the composition delivered, i.e. the nucleic acid delivered
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
- C12N15/86—Viral vectors
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; AVICULTURE; APICULTURE; PISCICULTURE; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2217/00—Genetically modified animals
- A01K2217/07—Animals genetically altered by homologous recombination
- A01K2217/075—Animals genetically altered by homologous recombination inducing loss of function, i.e. knock out
- A01K2217/077—Animals genetically altered by homologous recombination inducing loss of function, i.e. knock out heterozygous knock out animals displaying phenotype
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; AVICULTURE; APICULTURE; PISCICULTURE; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2267/00—Animals characterised by purpose
- A01K2267/03—Animal model, e.g. for test or diseases
- A01K2267/0306—Animal model for genetic diseases
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2750/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssDNA viruses
- C12N2750/00011—Details
- C12N2750/14011—Parvoviridae
- C12N2750/14111—Dependovirus, e.g. adenoassociated viruses
- C12N2750/14122—New viral proteins or individual genes, new structural or functional aspects of known viral proteins or genes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2750/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssDNA viruses
- C12N2750/00011—Details
- C12N2750/14011—Parvoviridae
- C12N2750/14111—Dependovirus, e.g. adenoassociated viruses
- C12N2750/14141—Use of virus, viral particle or viral elements as a vector
- C12N2750/14143—Use of virus, viral particle or viral elements as a vector viral genome or elements thereof as genetic vector
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Genetics & Genomics (AREA)
- Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Biotechnology (AREA)
- Molecular Biology (AREA)
- Organic Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Biomedical Technology (AREA)
- Zoology (AREA)
- Biochemistry (AREA)
- General Engineering & Computer Science (AREA)
- Wood Science & Technology (AREA)
- Epidemiology (AREA)
- Physics & Mathematics (AREA)
- Microbiology (AREA)
- Plant Pathology (AREA)
- Biophysics (AREA)
- Virology (AREA)
- Physical Education & Sports Medicine (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Neurology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
Description
本発明は、国立衛生研究所によって授与された助成金番号R01-DK36425の下で政府の支援を受けてなされた。政府は本発明において一定の権利を有する。
本出願は、ASCII形式で電子データ提出された配列表を包含し、その全体が参照により本明細書に援用される。。2019年5月8日に作成された上記のASCIIコピーは、10491_006542-WO0_V2_ST25.txtという名称であり、170KB(174,236バイト)のサイズである。
AAV適合性ラミニン-リンカータンパク質alphaLNNdDeltaG2short略語:
AAV:アデノ随伴ウイルス
rAAV:組換えアデノ随伴ウイルスまたはウイルスベクター
BM:基底膜
αLNNd:アルファラミニンN末端ドメイン結合タンパク質
αLNNdΔG2’:アルファラミニンN末端ドメインデルタG2短鎖タンパク質、alphaLNNdDeltaG2short
α-DG:α-ジストログリカン
βLNNdΔG2’:ベータラミニンN末端ドメインデルタG2短鎖タンパク質、betaLNNdDeltaG2short
ECM:細胞外マトリックス
γLNNdΔG2’:ガンマラミニンN末端ドメインデルタG2短鎖タンパク質、gammaLNNdDeltaG2short
LEドメイン:ラミニン型上皮成長因子様ドメイン
LGドメイン:ラミニンG様ドメイン
LMまたはLm:ラミニン
LNドメイン:ラミニンN末端ドメイン
本発明をより容易に理解することができるように、特定の技術的及び科学的用語を以下に具体的に定義する。本明細書の他の箇所で特に断りがない限り、本明細書で使用される他のすべての技術用語及び科学用語は、本発明が属する技術分野の当業者によって一般に理解されている。
いくつかの態様において、本発明は、単離されたAAVを提供する。AAVに関して本明細書で使用される場合、「単離された」という用語は、その天然の環境から(例えば、宿主細胞、組織、または対象から)単離された、または人工的に生成されたAAVを指す。単離されたAAVは、組換え法を用いて生成され得る。そのようなAAVは、本明細書において「組換えAAV」と称される。組換えAAV(rAAV)は、rAAVの導入遺伝子が1つ以上の所定の組織に特異的に送達されるように、組織特異的な標的化能を有することが好ましい。AAVキャプシドは、これらの組織特異的な標的化能を決定する上で重要な要素である。したがって、標的とされる組織に適切なキャプシドを有するrAAVを選択することができる。
本明細書に記載の「組換えAAV(rAAV)ベクター」は、典型的には、最低でも、導入遺伝子(例えば、αLNNdΔG2’をコードする)およびその調節配列、ならびに5’および3’AAV逆方向末端反復(ITR)からなる。キャプシドタンパク質にパッケージされ、選択された標的細胞に送達されるのは、この組換えAAVベクターである。いくつかの実施形態において、導入遺伝子は、ポリペプチド、タンパク質、機能性RNA分子(例えば、miRNA、miRNA阻害剤)または他の目的の遺伝子産物(例えば、αLNNdΔG2’)をコードする、ベクター配列と異種の核酸配列である。核酸コード配列は、標的組織の細胞における導入遺伝子の転写、翻訳、および/または発現を可能にする方法で、調節成分に作動可能に連結されている。
rAAVベクターの導入遺伝子配列の組成は、結果として得られるベクターが使用される用途に依存する。例えば、ある種の導入遺伝子配列は、発現時に検出可能なシグナルを生成するレポーター配列を含む。別の例において、導入遺伝子は、治療用αLNNdΔG2’タンパク質または治療用機能性RNAをコードする。別の例において、導入遺伝子は、研究目的で、例えば、導入遺伝子産物の機能を研究するために、例えば、導入遺伝子を保持する体細胞トランスジェニック動物モデルを作成するために使用されることが意図されるタンパク質または機能性RNAをコードする。別の例において、導入遺伝子は、疾患の動物モデルを作成するために使用されることが意図されるタンパク質または機能性RNAをコードする。適切な導入遺伝子コード配列は、当業者には明らかであろう。
rAAVSは、所望の組織の細胞をトランスフェクトし、過度の有害作用なく十分なレベルの遺伝子導入および発現を提供するのに十分な量で投与される。従来の薬学的に許容される投与経路は、限定されないが、選択された組織への直接送達(例えば、脳内投与、髄腔内投与)、静脈内、経口、吸入(鼻腔内および気管内送達を含む)、眼内、静脈内、筋肉内、皮下、皮内、腫瘍内、および他の非経口投与経路を含む。必要であれば、投与経路を組み合わせてもよい。
rAAVは、当該技術分野で既知の任意の適切な方法に従って、組成物中で対象に送達されてもよい。好ましくは生理学的に適合性のある担体(例えば、組成物中)に懸濁されたrAAVは、対象、例えば、ヒト、マウス、ラット、ネコ、イヌ、ヒツジ、ウサギ、ウマ、ウシ、ヤギ、ブタ、モルモット、ハムスター、ニワトリ、シチメンチョウ、または非ヒト霊長類(例えば、マカク)に投与されてもよい。特定の実施形態において、組成物は、rAAVを単独で、または1つ以上の他のウイルス(例えば、1つ以上の異なる導入遺伝子をコードする/有する第2のrAAV)と組み合わせて含み得る。
本発明は、rAAVビリオンを含む安定な医薬組成物を提供する。組成物は、凍結/解凍サイクルに供された場合、およびガラスを含む様々な材料で作られた容器に保存された場合であっても、安定かつ活性な状態を維持する。
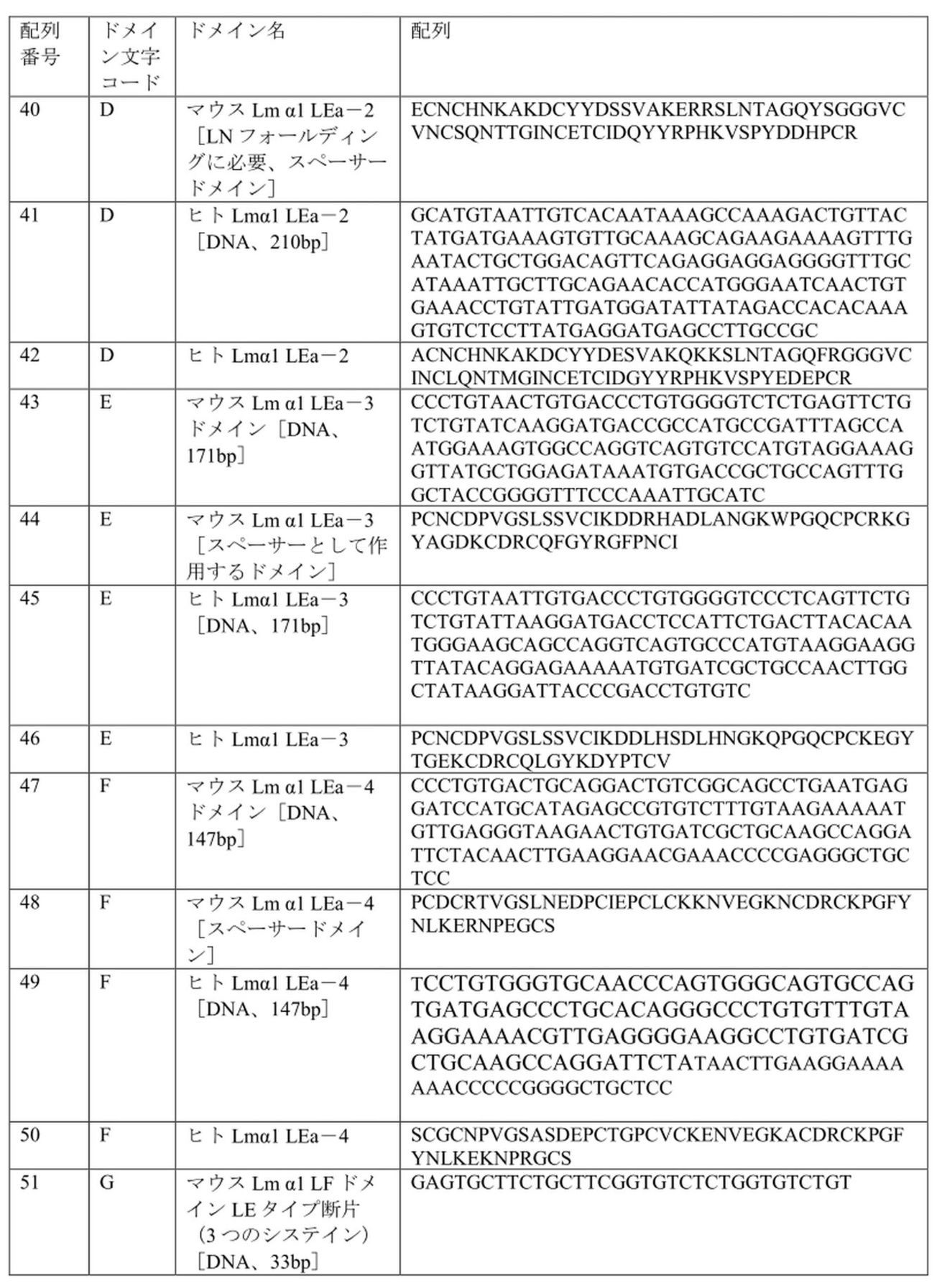
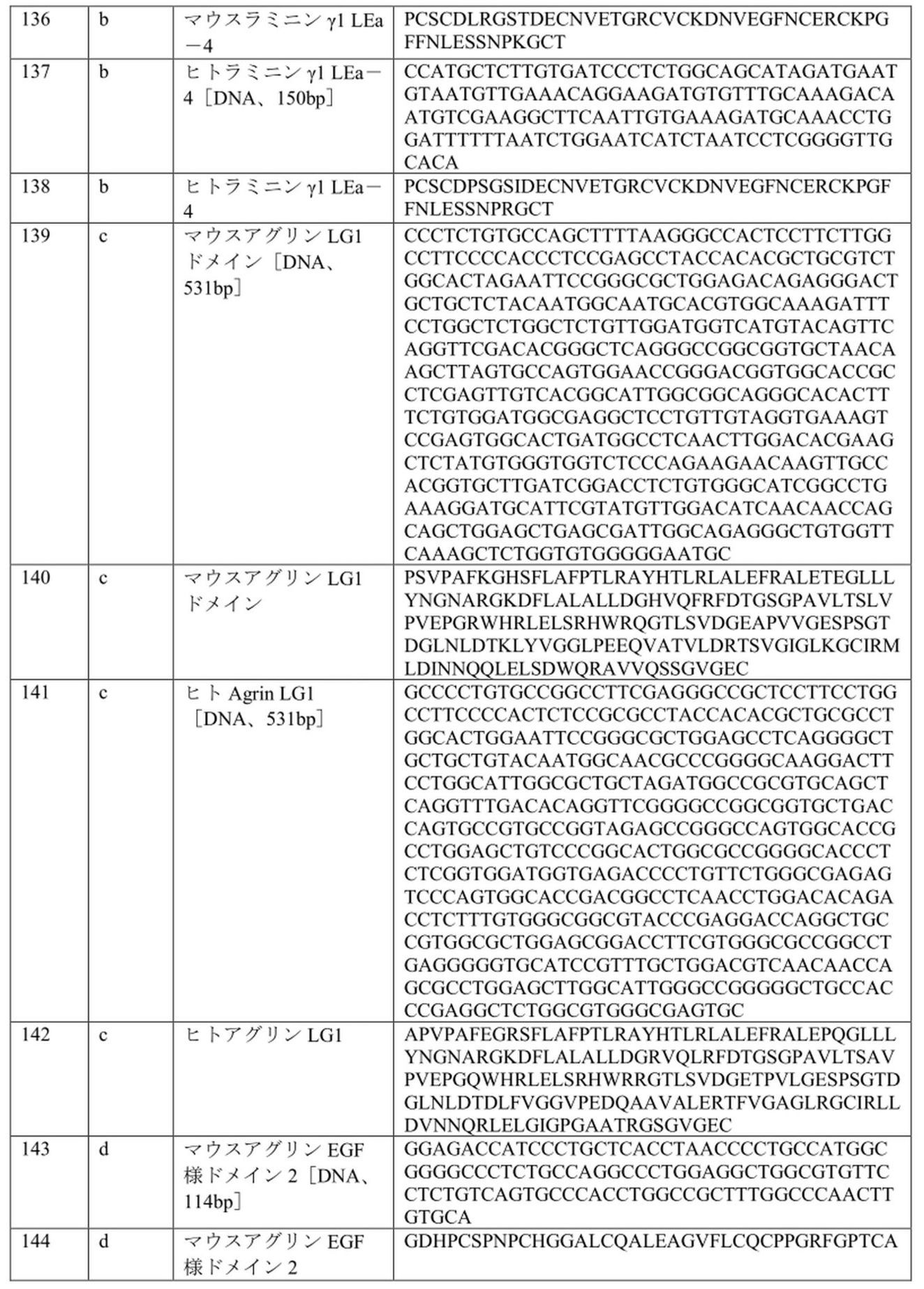
本発明はまた、本明細書に記載のαLNNdΔG2’タンパク質をコードする特定の構築物および核酸を含む。配列番号1および配列番号24を含む配列リストに列挙される選択された配列を含む特定の構築物および配列は、本発明の実施形態において有用であり得る。
本発明の組成の医薬組成物または滅菌組成物を調製するために、AAV-DJベクターまたは関連する組成物を、薬学的に許容される担体または賦形剤と混合することができる。例えば、Remington’s Pharmaceutical Sciences and U.S.Pharmacopeia:National Formulary,Mack Publishing Company,Easton,PA(1984)を参照されたい。
本発明はまた、キットの形で本発明の組合せの成分を含むキットを提供する。本発明のキットは、限定されないが、本明細書に記載される薬学的に許容される担体および/または化学療法薬を含む1つ以上のさらなる成分と合わせて、限定されないが、本明細書で論じられるrAAV-DJ-αLNNdΔG2’ベースの化合物を含む1つ以上の成分を含む。rAAV-DJ-αLNNdΔG2’ベースの化合物もしくは組成物および/または治療薬は、純粋な組成物として、または医薬組成物中に薬剤的に許容される担体と組み合わせて製剤化され得る。
分子生物学の標準的な方法は、Sambrook,Fritsch and Maniatis(1982&1989 2nd Edition,2001 3rd Edition)Molecular Cloning,A Laboratory Manual,Cold Spring Harbor Laboratory Press,Cold Spring Harbor,NY;Sambrook and Russell(2001)Molecular Cloning,3rd ed.,Cold Spring Harbor Laboratory Press,Cold Spring Harbor,NY;Wu(1993)Recombinant DNA,Vol.217,Academic Press,San Diego,CA)に記載されている。標準的な方法はまた、細菌細胞におけるクローニングおよびDNA突然変異誘発(第1巻)、哺乳動物細胞および酵母におけるクローニング(第2巻)、複合糖質およびタンパク質発現(第3巻)、ならびにバイオインフォマティクス(Vol.4)について記載するAusbel,et al.(2001)Current Protocols in Molecular Biology,Vols.1-4,John Wiley and Sons,Inc.New York,NYにも掲載されている。
AlphaLNNdDeltaG2short(αLNNdΔG2’)構構築物の開発
αLNNdpcDNA3.1 ZeoにおけるG2ナイドジェン-1ドメインの除去は、オーバーラップPCRで達成された。PCRの第1ラウンドで、1.2Kb-5’(F1noG2 1F 5’-ctgggtcactgtcaccctgg-3’(配列番号2)およびnoG2 2R 5’-atggattctgaagacagacaccagagacac-3’(配列番号3))および1.8Kb-3’(noG2 2F 5’-ctggtgtctgtcttcagaatccatgctac-3’(配列番号4)およびF1noG2 1R 5’-gaaggcacagtcgaggctgatcag-3’(配列番号5))生成物をαLNNdのG2ナイドジェン1ドメインの両側に作製した。それらを第2ラウンドのPCR(F1noG21FおよびF1noG21R)と一緒に3Kbの産物に縫い付け、EcoRIで2.4Kbに消化し、5.85KbのEcoRI αLNNd pcDNA 3.1 zeoベクターにライゲーションした(8.25Kb noG2 αLNNd pcDNA3.1 zeoプラスミドを作製)。オーバーラップPCR用プライマー(Bam shnoG2 1F 5’-cggcagcctgaatgaggatccatgcataga-3’(配列番号6)およびshnoG2 2R 5’-cacagtagttgatgggacagacacc-3’(配列番号7))および3’(shnoG2 2F 5’-gtctctggtgtctgtcccatcaacta-3’(配列番号8)およびsse shnoG2 1R 5’-gaggcacaaacatcccctgcagggtgggcc-3’(配列番号9)を用いてnoG2 αLNNDのさらなる2EGF(270bp)欠失を行い、それぞれ160bpおよび357bpの産物を生成した。第2ラウンドのPCR後、485bpのBamHI-SbfIで消化したインサートを、同様に消化したnoG2 αLNNd pcDNA3.1 zeoベクター(7.5Kb)にライゲーションした。短いnoG2αLNNdオープンリーディングフレーム(ORF)のN末端Mycタグを除去するために、1.5Kb BamHIインサートをF3-8mck-pA構築物からMCS-AAVベクター(4.6Kb Cell Biolabs、VPK-410-DJ)に移動し、6.1Kb AAV-5’F1タグなし-10プラスミドを生成した。短いnoG2αLNNDpcDNA3.1 zeoプラスミドをFseIおよびXhoIで消化して2.8 Kbインサートを作成し、同様に消化したAAV-5’F1タグなし-10ベクター(4.9Kb)にライゲーションした。最終的なベクターサイズは、3009bp(配列番号1)のalphaLNNdDeltaG2short(αLNNdΔG2’)のORFを含めて7.7Kbであった。
AAVウイルスの生成
αLNNdΔG2’-MCSプラスミドを、リン酸カルシウム一過性トランスフェクションの一般的な方法を使用して、AAV-DJ pHelper pHelperプラスミド(それぞれ配列番号1、17、20:図6~図8)(Cell Biolabs,Inc.、San Diego,CA)とともに接着HEK293に1:1:1の比率でトリプルトランスフェクトした。簡単に述べると、製造業者の指示(Sigma-Aldrich Corp.、St.Louis,MO、カタログ番号CAPHOS)に従って、12.5ug/150mm皿(プレップあたり10~150mm皿)を75%コンフルエントなHEK293細胞に一晩かけて加えた。AAVpro精製キット(Takara Bio USA,Inc.、Mountain View,CA、カタログ番号6666)を用いて、96時間後に培養物からウイルスを回収した。細胞の凍結融解またはTriton-100溶解、それに続くPEG8000および/または塩化セシウム遠心分離を含む、代替の精製方法が利用可能である。ウイルス力価は、リアルタイムPCR(AAVpro滴定キット、Takara Bio USA、Inc.、Mountain View,CA、カタログ番号6233)を用いて決定した。
AAVで生成したαLNNdΔG2’タンパク質の発現および分析
安定してトランスフェクトされた411 HEK293細胞を、約6x10vg/6ウェル皿で感染させた。4日後、室温で1時間のa-flagアガロースビーズを用いた免疫沈降、続いてウエスタンブロット分析によって馴化培地を評価した。ウエスタンブロットを切り取り、1μg/mlの抗フラッグ(上)または抗G2-G2ナイドジェン(下)で染色した。結果を図5Aに示す。さらに、馴化AAV 411 HEK293培地を高継代ラットシュワン細胞に1時間添加し、1ug/mlニワトリ抗α4および1:100抗ニワトリAlexa Fluor 647(Life Technologies、Carlsbad,CA、カタログ番号A-21449)を使用して、免疫蛍光法により411ラミニンアセンブリについて分析した。図5Cおよび5Dに示すように、Lm411アセンブリの大幅な増加は、AAVで生成されたαLNNdΔG2’タンパク質に起因していた。
症状を示すマウスにラミニンα2を戻す
アグリンの小型化形態(図3B)であるmag導入遺伝子(配列番号23)を発現するdy3K/dy3KマウスへのAAV-DJ-αLNNdΔG2’構築物の注射、およびαLNNd導入遺伝子を発現するdy3K/dy3KマウスへのAAV-DJ-αLNNdΔG2’構築物の注射を行って、ペアのリンカータンパク質の安定した既に特徴付けられた発現と併せて一度に1つのウイルス感染を評価し、各リンカータンパク質を個別に検証することで変動を最小限に抑える。最初の分析は筋肉に対して行われ、McKee,et al.,(2017)J Clin Invest 127(3):1075-1089;Reinhard,et al.,(2017)Sci Transl Med 9(396)に記載されている特定のリンカーおよびラミニン抗体を用いた免疫蛍光顕微鏡法を使用して、注射後の神経発現の程度および発現の持続性にしたがって、どの筋肉にαLNNdΔG2’およびmagが多く存在するかを決定する。
変異血清型キャプシドを有するAAVによるαLNNdΔG2’の発現
組織の特異性(例えば、骨格筋と心臓または主に肝臓のみ)を変更する目的で、異なるキャプシド血清型または複合血清型をコードするAAVベクターにαLNNdΔG2’DNAを挿入する。注:αLNNdΔG2’は、合成部位が標的細胞型である必要がない可溶性分泌タンパク質である。
ユビキチン化を低下させるように修飾されたAAVキャプシド配列
AAV-DJは、他のAAVと同様に、キャプシドにいくつかのリン酸化部位およびユビキチン化部位を含む。K137R、S503A、およびT251Aでのrep/capプラスミドの点突然変異は、インビトロおよびインビボでタンパク質発現を大幅に増加させることが分かった(Mao,Wang,Yan,Li,Wang and Li,2016,“Single point mutation in adeno-associated viral vectors -DJ capsid leads to improvement for gene delivery in vivo.BMC Biotechnology 16:1-8に記載されている)。AAVプラスミドは、この改善を導入するように容易に修飾することができる。
特殊なプロモーターを使用したAAVによるαLNNdΔG2’の発現
αLNNdΔG2’DNAを、(a)特異性の変更および/または(b)インサートの許容可能なオープンリーディングフレームの増加といった効果を有する異なるプロモーター/エンハンサーを用いてAAVベクターに挿入する。骨格筋および心臓におけるマイクロジストロフィンの発現を促進するために使用される例は、筋クレアチンキナーゼ遺伝子の基礎プロモーターおよび上流エンハンサーから改変された436bp CK8eプロモーター/エンハンサーである。CK8eプロモーター/エンハンサーは、J.N.Ramos et al.,2019,Molecular Therapy,27:623-635に記載されている。
代替シグナル配列を有するLmα1LNNdΔG2’の発現
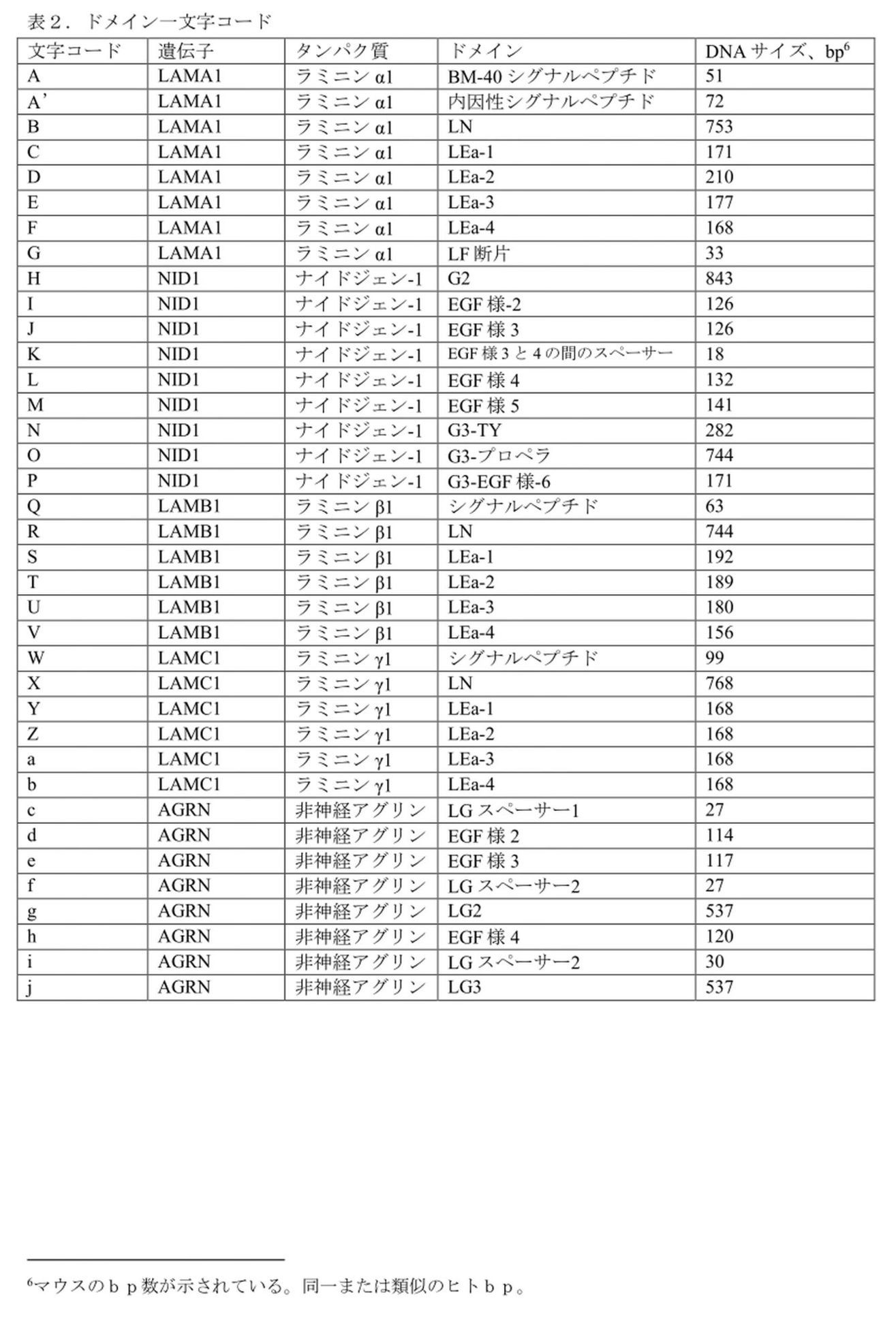
タンパク質αLNNdΔG2’および関連タンパク質は、配列番号25のヌクレオチド配列を有し、かつ下の表2で文字コードAが与えられているBM-40シグナル配列を使用して、インビトロおよびマウスで発現されている。代替方法は、配列番号27のヌクレオチド配列を有し、かつ表2で文字コードA’が与えられている内因性α1サブユニットシグナルペプチドでタンパク質を発現させることである。
機能強化のためのLmαLNNdΔG2’の簡略化と修飾
現在評価されているAAV-DJ構築物には、オープンリーディングフレームを代表する3.1kBのDNAを含めることができる。既存または計画中の他の構築物は、より大きな包含を可能にすることができる。許容されるタンパク質サイズについてAAV-DJ制限を基準にすると、J.Takagi et al.,2003,Nature 424:963-974に記載されるように、LmαLNNdΔG2’のナイドジェンG3ドメインのサイズをプロペラドメインのサイズ(約270残基、810bp)に縮小し、ラミニン結合を保持できることに留意されたい。393bpの減少によりドメインの再配置が可能になり、G2のIV型コラーゲンおよびパールカン結合ドメインを含めることができる。新しい配置では、ラミニンの重合をコラーゲン/パールカンの結合と組み合わせることができる。例として、(a)αLNNdG2Propeller(3.08 kB)および(b)αLNNdG2Propeller-2(3.02kB)が挙げられる。これらのそれぞれのドメイン構成を、表2に提供した文字ドメインコーディングを使用して下の表4に示す。ドメイン構成に使用されるドメインのヌクレオチド配列およびタンパク質配列は、表3および配列リストに提供される。別の配置では、ラミニン重合をジストログリカン結合と組み合わせることができ、その例は、αLNNdPropellerAgrinLG(3.6kB)である。αLNNdPropellerAgrinLGのドメイン構成を、表2に提供した文字ドメインコーディングを使用して下の表4に示す。ドメイン構成に使用されるドメインのヌクレオチド配列およびタンパク質配列は、表3および配列リストに提供される。
重合欠陥のある他のラミニンの修復
ピアソン症候群は、眼の異常を伴う先天性ネフローゼ症候群であり、早期の末期腎疾患、失明および死をもたらす。原因は、ラミニンβ2サブユニットをコードするLAMB2遺伝子のヌル、インフレーム削除、またはミスセンス変異である。これらの変異は、サブユニットの発現を妨げるか、またはサブユニットの特性を変更する。ミスセンス変異のいくつかは、β2LNドメインにクラスター化される(Maatejas et al.,2010,Hum Mutat.38:992-1002およびK.K.McKee,M.Aleksandrova and P.D.Yurchenco,2018,Matrix Biology 67:32-46を参照)。LNドメインはラミニンの重合を媒介する。これらの変異の影響として考えられるのは、低/非分泌型であり得るドメインをフォールディングできないことと、変異体を重合できないことである。ピアソン症候群の2つの高度に保存された変異体(S80RおよびH147R)をβ1サブユニット(S68RおよびH135R)に配置した後でそれらを評価した。どちらの変異も重合を大幅に減少させ、βLNNd(β1LN-LEaドメインがナイドジェンG3との融合においてα1LN-LEaと交換された)は、ラミニンがβLNドメインを欠いていたために重合できなかった組換えラミニンを救済できることが分かった(K.K.McKee,M.Aleksandrova and P.D.Yurchenco,2018,Matrix Biology 67:32-46に記載)。βLNNdは、ピアソンの欠陥をインビトロで修復することができるため、より短いβLNNdΔG2を使用して疾患を治療できることになる。同様に、重合に影響を与えるラミニンLN変異による他の疾患は、対応するLN-LEaセグメントが融合タンパク質のα1LN-LEaセグメントに置き換わった関連するラミニンリンカータンパク質の発現によって治療可能であると予想される。これらのタンパク質(βLNNdΔG2’、βLNNdG2Propeller、γLNNdΔG2’、およびγLNNdG2Propeller)は、表3および配列リストに提供されるドメイン構成で用いられたドメインの配列とともに、表2および4のドメイン構成によって説明される。
ジストログリカン結合活性のαLNNdΔG2への直接付加
完全なG3ドメイン複合体の代わりに、ナイドジェンプロペラドメインを採用すると、(許容されるAAVインサートのサイズとの関連から)ジストログリカン結合ドメインを付加する余地が生まれる。このタンパク質はαLNNdΔG2PropellerAgrinLGと称される。ドメイン構成は、表3および配列リストに提供されるドメイン構成で用いられたドメインの配列とともに、表2および4のドメイン構成に示される。この場合、サイズが大きくなると、標準的なAAV-DJウイルスにおける使用が妨げられ、より小さなCK8eプロモーターを含むもの等の、より大きなインサートを許容するウイルスが必要となる。
非経口注射によるタンパク質の送達
LmαLNNdΔG2’タンパク質およびその代替形態のいずれかを非経口的に注射して(腹腔内、血管内、筋肉内経路)、ウイルスによって送達される体細胞遺伝子治療の代替として、タンパク質を目的の組織標的に送達することができます。
製造プロセス中のウイルス力価を低下させる手段としてだけではなく、高濃度のウイルスに関連する安全性の懸念にも対応するように本明細書に記載の試験構築物の発現を最適化するために、αLNNdΔG2’導入遺伝子は、自由に利用可能なソフトウェアを使用したコドン最適化プロセスを用いて評価される(https://www.idtdna.com/CodonOpt)。さらに、必要に応じてコンセンサスコザックシーケンスが構築物に導入される。したがって、本明細書に記載される構築物または要素のいずれも、この様式でコドン最適化され得る。修飾された構築物のそれぞれは、マウスにおいて親コンストラクトと並行して試験される。簡単に述べると、構築物は側頭静脈を介して仔マウスに全身投与される。次いで、動物を2週間または3週間後に安楽死させ、各構築物からのタンパク質のレベルをQ-PCRおよびウエスタンブロット法によって決定する。最も迅速で高レベルの発現をもたらす構築物は、非ヒト霊長類研究における、また最終的にはヒト患者の臨床試験における最終的な使用について検討される。
参照資料
1.Donnelly,M.L.et al.(2001).The’cleavage’activities of foot-and-mouth disease virus 2A site directed mutants and naturally occurring’2A-like’sequences.J.Gen.Virol.82,1027-1041.
2.Foust,K.D.,Nurre,E.,Montgomery,C.L.,Hernandez,A.,Chan,C.M.and Kaspar,B.K.(2009).Intravascular AAV9 preferentially targets neonatal neurons and adult astrocytes.Nat.Biotech.27,59-65.
3.Grieger JC,Samulski RJ(2005)Adeno-associated virus as a gene therapy vector:vector development,production and clinical applications.Adv Biochem Eng Biotechnol.99,119-145.
4Grieger JC,Samulski RJ(2012)Adeno-associated virus vectorology,manufacturing,and clinical applications.Methods Enzymol.507,229-254.
5.Kariya S,Re DB,Jacquier A,Nelson K,Przedborski S,Monani UR(2012)Mutant superoxide dismutase 1(SOD1),a cause of amyotrophic lateral sclerosis,disrupts the recruitment of SMN,the spinal muscular atrophy protein to nuclear Cajal bodies.Hum Mol Genet.21,3421-3434.
6.Foust KD,Wang X,McGovern VL,Braun L,Bevan AK,Haidet AM,Le TT,Morales PR,Rich MM,Burghes AH,Kaspar BK(2010)Rescue of the spinal muscular atrophy phenotype in a mouse model by early postnatal delivery of SMN.Nat.Biotech.28,271-274.
7Fleming JO,Ting JY,Stohlman SA,Weiner LP(1983)Improvements in obtaining and characterizing mouse cerebrospinal fluid.Application to mouse hepatitis virus-induced encephalomyelitis.J Neuroimmunol.4,129-140.
8.Gao,G.P.,and Sena-Esteves,M.(2012).Introducing Genes into Mammalian Cells:Viral Vectors.In Molecular Cloning,Vol 2:A Laboratory Manual(M.R.Green and J.Sambrook eds.)pp.1209-1313.Cold Spring Harbor Laboratory Press,New York.
9.Rapti K,Louis-Jeune V,Kohlbrenner E,Ishikawa K,Ladage D,Zolotukhin S,Hajjar RJ,Weber(2012)Neutralizing antibodies against AAV serotypes 1,2,6,and 9 in sea of commonly used animal models.Mol.Ther.20,73-83.
10.Goulder PJ,Addo MM,Altfeld MA,Rosenberg ES,Tang Y,Govender U,Mngqundaniso N,Annamalai K,Vogel TU,Hammond M,Bunce M,Coovadia HM,Walker BD(2001)Rapid definition of five novel HLA-A*3002-restricted human immunodeficiency virus-specific cytotoxic T-lymphocyte epitopes by elispot and intracellular cytokine staining assays.J.Virol.75,1339-1347.
11Aumailley,M.,L.Bruckner-Tuderman,W.G.Carter,R.Deutzmann,D.Edgar,P.Ekblom,J.Engel,E.Engvall,E.Hohenester,J.C.Jones,H.K.Kleinman,M.P.
Marinkovich,G.R.Martin,U.Mayer,G.Meneguzzi,J.H.Miner,K.Miyazaki,M.
12.Patarroyo,M.Paulsson,V.Quaranta,J.R.Sanes,T.Sasaki,K.Sekiguchi,L.M.Sorokin,J.F.Talts,K.Tryggvason,J.Uitto,I.Virtanen,K.von der Mark,U.M.Wewer,Y.Yamada,and P.D.Yurchenco,A simplified laminin nomenclature.Matrix Biol,2005.24(5):p.326-32.
13.Jimenez-Mallebrera,C.,S.C.Brown,C.A.Sewry,and F.Muntoni,Congenital musculardystrophy:molecular and cellular aspects.Cell Mol Life Sci,2005.62(7-8):p.809-23.
14Sframeli,M.,A.Sarkozy,M.Bertoli,G.Astrea,J.Hudson,M.Scoto,R.Mein,M.Yau,R.Phadke,L.Feng,C.Sewry,A.N.S.Fen,C.Longman,G.McCullagh,V.Straub,S.Robb,A.Manzur,K.Bushby,and F.Muntoni,Congenital muscular dystrophies in the UK population:Clinical and molecular spectrum of a large cohort diagnosed over a 12-year period.Neuromuscul Disord,2017.27(9):p.793-803.
15.Allamand,V.,Y.Sunada,M.A.Salih,V.Straub,C.O.Ozo,M.H.Al-Turaiki,M.Akbar,T.Kolo,H.Colognato,X.Zhang,L.M.Sorokin,P.D.Yurchenco,K.Tryggvason,and K.P.Campbell,Mild congenital muscular dystrophy in two patients with an internally deleted laminin alpha2-chain.Hum Mol Genet,1997.6(5):p.747-52.
16.Gavassini,B.F.,N.Carboni,J.E.Nielsen,E.R.Danielsen,C.Thomsen,K.Svenstrup,L.Bello,M.A.Maioli,G.Marrosu,A.F.Ticca,M.Mura,M.G.Marrosu,G.Soraru,C.Angelini,J.Vissing,and E.Pegoraro,Clinical and molecular characterization of limb girdle muscular dystrophy due to LAMA2 mutations.Muscle Nerve,2011.44(5):p.703-9.
17.Bonnemann,C.G.,C.H.Wang,S.Quijano-Roy,N.Deconinck,E.Bertini,A.Ferreiro,F.Muntoni,C.Sewry,C.Beroud,K.D.Mathews,S.A.Moore,J.Bellini,A.Rutkowski,and K.N.North,Diagnostic approach to the congenital muscular dystrophies.Neuromuscul Disord,2014.24(4):p.289-311.
18.Chan,S.H.,A.R.Foley,R.Phadke,A.A.Mathew,M.Pitt,C.Sewry,and F.Muntoni,Limb girdle muscular dystrophy due to LAMA2 mutations:diagnostic difficulties due to associated peripheral neuropathy.Neuromuscul Disord,2014.24(8):p.677-83.
19.McKee,K.K.,D.Harrison,S.Capizzi,and P.D.Yurchenco,Role of laminin terminal globular domains in basement membrane assembly.J Biol Chem,2007.282(29):p.21437-47.
20.McKee,K.K.,D.H.Yang,R.Patel,Z.L.Chen,S.Strickland,J.Takagi,K.Sekiguchi,andP.D.Yurchenco,Schwann Cell Myelination Requires Integration of Laminin Activities.J Cell Sci,2012.125(19):p.4609-4619.PMC3500866
21.McKee,K.K.,S.Capizzi,and P.D.Yurchenco,Scaffold-forming and adhesivecontributions of synthetic laminin-binding proteins to basement membrane assembly.J Biol Chem,2009.284(13):p.8984-8994.PMC2659255
22.Smirnov,S.P.,P.Barzaghi,K.K.McKee,M.A.Ruegg,and P.D.Yurchenco,Conjugation of LG domains of agrins and perlecan to polymerizing laminin-2 promotes acetylcholine receptor clustering.J Biol Chem,2005.280(50):p.41449-57.
23.Chang,C.,H.L.Goel,H.Gao,B.Pursell,L.D.Shultz,D.L.Greiner,S.Ingerpuu,M.Patarroyo,S.Cao,E.Lim,J.Mao,K.K.McKee,P.D.Yurchenco,and A.M.Mercurio,Alaminin 511 matrix is regulated by TAZ and functions as the ligand for the alpha6Bbeta1 integrin to sustain breast cancer stem cells.Genes Dev,2015.29(1):p.1-6.PMC4281560
24.Colombelli,C.,M.Palmisano,Y.Eshed-Eisenbach,D.Zambroni,E.Pavoni,C.Ferri,S.Saccucci,S.Nicole,R.Soininen,K.K.McKee,P.D.Yurchenco,E.Peles,L.Wrabetz,and M.L.Feltri,Perlecan is recruited by dystroglycan to nodes of Ranvier and binds the clustering molecule gliomedin.J Cell Biol,2015.208(3):p.313-29.PMC4315246
25.Yazlovitskaya,E.M.,H.Y.Tseng,O.Viquez,T.Tu,G.Mernaugh,K.K.McKee,K.Riggins,V.Quaranta,A.Pathak,B.D.Carter,P.Yurchenco,A.Sonnenberg,R.T.Bottcher,A.Pozzi,and R.Zent,Integrin alpha3beta1 regulates kidney collecting duct development via TRAF6-dependent K63-linked polyubiquitination of Akt.Mol Biol Cell,2015.26(10):p.1857-74.PMC4436831
26.Reuten,R.,T.R.Patel,M.McDougall,N.Rama,D.Nikodemus,B.Gibert,J.G.Delcros,C.Prein,M.Meier,S.Metzger,Z.Zhou,J.Kaltenberg,K.K.McKee,T.Bald,T.Tuting,P.Zigrino,V.Djonov,W.Bloch,H.Clausen-Schaumann,E.Poschl,P.D.Yurchenco,M.Ehrbar,P.Mehlen,J.Stetefeld,and M.Koch,Structural decoding of netrin-4 reveals a regulatory function towards mature basement membranes.Nat Commun,2016.7:p.13515.PMC514367
Claims (20)
- alphaLNNdDeltaG2shortをコードする導入遺伝子を含む核酸配列を含み、該alphaLNNdDeltaG2shortが配列番号1又は配列番号24を含む、組換えアデノ随伴ベクター(rAAV)。
- 前記AAVはAAV8またはAAV-DJである、請求項1に記載の組換えAAV。
- CMVプロモーターをさらに含む、請求項1に記載の組換えAAV。
- 前記CMVプロモーターは配列番号12を含む、請求項3に記載の組換えAAV。
- 前記組換えベクターは逆方向末端反復(ITR)をさらに含む、請求項1に記載の組換えAAV。
- 前記逆方向末端反復(ITR)は、配列番号11を含む5’ITRである、請求項5に記載の組換えAAV。
- 前記逆方向末端反復(ITR)は、配列番号16を含む3’ITRである、請求項5に記載の組換えAAV。
- 請求項1に記載の組換えAAVおよび医薬担体を含む、医薬組成物。
- 請求項8に記載の組成物を含む容器ハウジングを含む、キット。
- 請求項1に記載の組換えAAVベクターを含む、対象におけるラミニン重合発現および基底膜アセンブリを回復させるための剤。
- 請求項1に記載の組換えAAVベクターを含む、ラミニンα-2欠損候群の治療剤。
- 請求項1に記載の組換えAAVベクターを含む、ラミニン欠損型筋ジストロフィーおよびラミニンα2欠損型筋ジストロフィーからなる群から選択されるラミニン欠損に関連する少なくとも1つの症状を軽減する剤。
- 請求項1に記載の組換えAAVベクターを含む、筋変性、筋再生、慢性筋炎、筋線維症、脳白質異常、末梢神経伝導速度低下、発作、中度精神遅滞、および呼吸不全からなる群から選択されるラミニンα2欠損に関連する症状の少なくとも1つを軽減する剤。
- 前記AAVはAAV8またはAAV-DJである、請求項11、12、または13に記載の剤。
- 前記組換えAAVはCMVプロモーターをさらに含む、請求項11、12、または13に記載の剤。
- 前記CMVプロモーターは配列番号12を含む、請求項15に記載の剤。
- 前記組換えベクターは逆方向末端反復(ITR)をさらに含む、請求項11、12、または13に記載の剤。
- 前記逆方向末端反復(ITR)は、配列番号11を含む5’ITRである、請求項17に記載の剤。
- 前記逆方向末端反復(ITR)は、配列番号16を含む3’ITRである、請求項17に記載の剤。
- 前記組換えAAVは、医薬担体をさらに含む医薬組成物内に含まれる、請求項11、12、または13に記載の剤。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201862668664P | 2018-05-08 | 2018-05-08 | |
| US62/668,664 | 2018-05-08 | ||
| PCT/US2019/031369 WO2019217582A1 (en) | 2018-05-08 | 2019-05-08 | Aav-compatible laminin-linker polymerization proteins |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2021522791A JP2021522791A (ja) | 2021-09-02 |
| JP7253274B2 true JP7253274B2 (ja) | 2023-04-06 |
Family
ID=68468357
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2020561690A Active JP7253274B2 (ja) | 2018-05-08 | 2019-05-08 | Aav適合性ラミニン-リンカー重合タンパク質 |
Country Status (10)
| Country | Link |
|---|---|
| US (1) | US20210207168A1 (ja) |
| EP (1) | EP3790394A4 (ja) |
| JP (1) | JP7253274B2 (ja) |
| KR (1) | KR102877876B1 (ja) |
| CN (1) | CN112154209A (ja) |
| AU (1) | AU2019265663B2 (ja) |
| CA (1) | CA3098871A1 (ja) |
| IL (1) | IL278393B2 (ja) |
| SG (1) | SG11202009914SA (ja) |
| WO (1) | WO2019217582A1 (ja) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20220079857A (ko) * | 2019-09-13 | 2022-06-14 | 루트거스, 더 스테이트 유니버시티 오브 뉴 저지 | Aav-상용성 라미닌-링커 중합 단백질 |
| EP3842452A1 (en) * | 2019-12-26 | 2021-06-30 | Universitat Autònoma de Barcelona | Scaffold proteins and therapeutic nanoconjugates based on nidogen |
| CN120118955A (zh) * | 2025-03-05 | 2025-06-10 | 广州派真生物技术有限公司 | 一种高产aav的包装质粒及应用 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2014513928A (ja) | 2011-03-11 | 2014-06-19 | アソシアシオン・アンスティテュ・ドゥ・ミオロジー | 無カプシドaavベクター、組成物ならびにベクター製造および遺伝子運搬のための方法 |
| JP2017505126A (ja) | 2014-01-21 | 2017-02-16 | フレイエ ユニヴェルシテイト ブリュッセルVrije Universiteit Brussel | 筋特異的核酸調節エレメント並びにその方法及び使用 |
Family Cites Families (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5399363A (en) | 1991-01-25 | 1995-03-21 | Eastman Kodak Company | Surface modified anticancer nanoparticles |
| US5478745A (en) | 1992-12-04 | 1995-12-26 | University Of Pittsburgh | Recombinant viral vector system |
| US5543158A (en) | 1993-07-23 | 1996-08-06 | Massachusetts Institute Of Technology | Biodegradable injectable nanoparticles |
| IE80468B1 (en) | 1995-04-04 | 1998-07-29 | Elan Corp Plc | Controlled release biodegradable nanoparticles containing insulin |
| US6001650A (en) | 1995-08-03 | 1999-12-14 | Avigen, Inc. | High-efficiency wild-type-free AAV helper functions |
| EP0931158A1 (en) | 1996-09-06 | 1999-07-28 | The Trustees Of The University Of Pennsylvania | An inducible method for production of recombinant adeno-associated viruses utilizing t7 polymerase |
| US6156303A (en) | 1997-06-11 | 2000-12-05 | University Of Washington | Adeno-associated virus (AAV) isolates and AAV vectors derived therefrom |
| WO2001073033A2 (en) * | 2000-03-29 | 2001-10-04 | Beth Israel Deaconess Medical Center, Inc. | Anti-angiogenic and anti-tumor properties of matin and other laminin domains |
| NZ618298A (en) | 2001-11-13 | 2015-04-24 | Univ Pennsylvania | A method of detecting and/or identifying adeno-associated virus (aav) sequences and isolating novel sequences identified thereby |
| EP2292780B1 (en) | 2003-09-30 | 2017-08-23 | The Trustees Of The University Of Pennsylvania | Adeno-associated virus (AAV) clades, sequences, vectors containing same, and uses thereof |
| JPWO2006043354A1 (ja) * | 2004-10-20 | 2008-05-22 | 独立行政法人放射線医学総合研究所 | 組込型の低線量放射線誘導性ベクター |
| EP2359865B1 (en) | 2005-04-07 | 2013-10-02 | The Trustees of The University of Pennsylvania | Method of increasing the function of an AAV vector |
| GB0724832D0 (en) * | 2007-12-20 | 2008-01-30 | Univ Manchester | Proteins and nucleic acids |
| US8632764B2 (en) | 2008-04-30 | 2014-01-21 | University Of North Carolina At Chapel Hill | Directed evolution and in vivo panning of virus vectors |
| TWI702955B (zh) * | 2012-05-15 | 2020-09-01 | 澳大利亞商艾佛蘭屈澳洲私營有限公司 | 使用腺相關病毒(aav)sflt-1治療老年性黃斑部退化(amd) |
| US9943574B2 (en) * | 2012-06-27 | 2018-04-17 | Arthrogen B.V. | Combination for treating an inflammatory disorder |
| PT3268024T (pt) * | 2015-03-10 | 2020-12-09 | Univ Columbia | Construtos de vetor viral recombinante glut1 adeno associado e métodos relacionados para restaurar a expressão de glut1 |
| GB201519303D0 (en) * | 2015-11-02 | 2015-12-16 | Imp Innovations Ltd | Phagemid vector |
-
2019
- 2019-05-08 US US17/058,625 patent/US20210207168A1/en active Pending
- 2019-05-08 JP JP2020561690A patent/JP7253274B2/ja active Active
- 2019-05-08 IL IL278393A patent/IL278393B2/en unknown
- 2019-05-08 EP EP19799178.9A patent/EP3790394A4/en active Pending
- 2019-05-08 KR KR1020207031675A patent/KR102877876B1/ko active Active
- 2019-05-08 SG SG11202009914SA patent/SG11202009914SA/en unknown
- 2019-05-08 WO PCT/US2019/031369 patent/WO2019217582A1/en not_active Ceased
- 2019-05-08 CN CN201980029037.8A patent/CN112154209A/zh active Pending
- 2019-05-08 AU AU2019265663A patent/AU2019265663B2/en active Active
- 2019-05-08 CA CA3098871A patent/CA3098871A1/en active Pending
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2014513928A (ja) | 2011-03-11 | 2014-06-19 | アソシアシオン・アンスティテュ・ドゥ・ミオロジー | 無カプシドaavベクター、組成物ならびにベクター製造および遺伝子運搬のための方法 |
| JP2017505126A (ja) | 2014-01-21 | 2017-02-16 | フレイエ ユニヴェルシテイト ブリュッセルVrije Universiteit Brussel | 筋特異的核酸調節エレメント並びにその方法及び使用 |
Non-Patent Citations (4)
| Title |
|---|
| Matrix Biol.,2018年04月,Vol. 67,pp. 32-46 |
| Molecular Biology of the Cell,2000年11月,Vol. 11,pp. 3911-3923 |
| The Journal of Clinical Investigation,2017年,Vol. 127, No. 3,pp. 1075-1089 |
| コスモ・バイオ株式会社,アデノ随伴ウイルス(AAV)発現ツール,インターネット, URL<https://www.cosmobio.co.jp/upfiles/catalog/pdf/catalog_11852.pdf>, 発行日: 2013-05-01, 検索日: 2022-05-17 |
Also Published As
| Publication number | Publication date |
|---|---|
| IL278393B2 (en) | 2023-11-01 |
| CA3098871A1 (en) | 2019-11-14 |
| KR20210006352A (ko) | 2021-01-18 |
| EP3790394A4 (en) | 2022-07-27 |
| KR102877876B1 (ko) | 2025-10-28 |
| EP3790394A1 (en) | 2021-03-17 |
| JP2021522791A (ja) | 2021-09-02 |
| AU2019265663B2 (en) | 2024-06-13 |
| CN112154209A (zh) | 2020-12-29 |
| WO2019217582A1 (en) | 2019-11-14 |
| IL278393B1 (en) | 2023-07-01 |
| IL278393A (ja) | 2020-12-31 |
| SG11202009914SA (en) | 2020-11-27 |
| US20210207168A1 (en) | 2021-07-08 |
| AU2019265663A1 (en) | 2020-10-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2023144087A (ja) | 組換えGlut1アデノ随伴ウイルスベクターコンストラクトおよびGlut1発現を回復させる方法 | |
| US20180214576A1 (en) | Transgenic expression of dnasei in vivo delivered by an adeno-associated virus vector | |
| CN116440292A (zh) | Danon病和其它自噬障碍的治疗方法 | |
| US20100137211A1 (en) | Methods and compositions for intra-articular coagulation proteins | |
| KR20220107243A (ko) | Apoe 유전자 요법 | |
| JP7253274B2 (ja) | Aav適合性ラミニン-リンカー重合タンパク質 | |
| US20220185862A1 (en) | Dna-binding domain transactivators and uses thereof | |
| US20220211737A1 (en) | Compositions and methods for treatment of friedreichs ataxia | |
| JP2025149978A (ja) | アルツハイマー病および他の神経変性障害の処置のためのレトロマーの安定化 | |
| JP2022547305A (ja) | Aav適合性ラミニン-リンカー重合タンパク質 | |
| US12441998B2 (en) | SLC2A1 lncRNA as a biologic and related treatments and methods | |
| EP3570896B1 (en) | Compositions for reducing sarcolipin expression and preventing and treating muscular dystrophy and cardiomyopathy and methods of use | |
| CA2978917C (en) | Recombinant glut1 adeno-associated viral vector constructs and related methods for restoring glut1 expression | |
| WO2020210592A1 (en) | Recombinant aav gene therapy for ngyl1 deficiency | |
| BR112017019294B1 (pt) | Vetor adeno-associado recombinante (raav), composição compreendendo o mesmo, e kit | |
| HK1242981B (en) | Recombinant glut1 adeno-associated viral vector constructs and related methods for restoring glut1 expression |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210708 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20210708 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20220513 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20220520 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20220819 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20221121 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20230221 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20230317 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7253274 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |