JP6870851B2 - 機能的な一本鎖抗体の製造方法 - Google Patents
機能的な一本鎖抗体の製造方法 Download PDFInfo
- Publication number
- JP6870851B2 JP6870851B2 JP2017095347A JP2017095347A JP6870851B2 JP 6870851 B2 JP6870851 B2 JP 6870851B2 JP 2017095347 A JP2017095347 A JP 2017095347A JP 2017095347 A JP2017095347 A JP 2017095347A JP 6870851 B2 JP6870851 B2 JP 6870851B2
- Authority
- JP
- Japan
- Prior art keywords
- fibroin
- protein
- silk
- fusion protein
- chain
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 238000004519 manufacturing process Methods 0.000 title claims description 18
- 108010022355 Fibroins Proteins 0.000 claims description 90
- 108090000623 proteins and genes Proteins 0.000 claims description 81
- 102000037865 fusion proteins Human genes 0.000 claims description 61
- 108020001507 fusion proteins Proteins 0.000 claims description 61
- 102000004169 proteins and genes Human genes 0.000 claims description 61
- 238000000034 method Methods 0.000 claims description 42
- 239000000427 antigen Substances 0.000 claims description 23
- 102000036639 antigens Human genes 0.000 claims description 23
- 108091007433 antigens Proteins 0.000 claims description 23
- 230000027455 binding Effects 0.000 claims description 16
- 150000003839 salts Chemical class 0.000 claims description 14
- 238000009991 scouring Methods 0.000 claims description 8
- 238000007865 diluting Methods 0.000 claims description 7
- 101710190239 Hexamerin Proteins 0.000 claims description 6
- 229910052739 hydrogen Inorganic materials 0.000 claims description 4
- 239000001257 hydrogen Substances 0.000 claims description 4
- 230000003176 fibrotic effect Effects 0.000 claims description 3
- 235000018102 proteins Nutrition 0.000 description 58
- 241000255789 Bombyx mori Species 0.000 description 47
- 239000000243 solution Substances 0.000 description 36
- 239000013598 vector Substances 0.000 description 24
- 108020004414 DNA Proteins 0.000 description 22
- 150000001413 amino acids Chemical class 0.000 description 21
- 210000004907 gland Anatomy 0.000 description 20
- 230000014509 gene expression Effects 0.000 description 18
- AMXOYNBUYSYVKV-UHFFFAOYSA-M lithium bromide Chemical compound [Li+].[Br-] AMXOYNBUYSYVKV-UHFFFAOYSA-M 0.000 description 18
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 14
- 108010013296 Sericins Proteins 0.000 description 12
- 235000001014 amino acid Nutrition 0.000 description 10
- 239000007864 aqueous solution Substances 0.000 description 10
- 239000000835 fiber Substances 0.000 description 10
- 239000011324 bead Substances 0.000 description 9
- 210000004027 cell Anatomy 0.000 description 9
- 235000013601 eggs Nutrition 0.000 description 9
- 239000012634 fragment Substances 0.000 description 9
- 108090000992 Transferases Proteins 0.000 description 8
- 238000000502 dialysis Methods 0.000 description 8
- 108090000765 processed proteins & peptides Proteins 0.000 description 8
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 7
- 102000004357 Transferases Human genes 0.000 description 7
- 241001465754 Metazoa Species 0.000 description 6
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 6
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 6
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 6
- 239000002299 complementary DNA Substances 0.000 description 6
- 238000010790 dilution Methods 0.000 description 6
- 239000012895 dilution Substances 0.000 description 6
- 239000005090 green fluorescent protein Substances 0.000 description 6
- 239000006166 lysate Substances 0.000 description 6
- 239000000203 mixture Substances 0.000 description 6
- 206010016654 Fibrosis Diseases 0.000 description 5
- 108010043121 Green Fluorescent Proteins Proteins 0.000 description 5
- 102000004144 Green Fluorescent Proteins Human genes 0.000 description 5
- 230000004761 fibrosis Effects 0.000 description 5
- 239000013612 plasmid Substances 0.000 description 5
- 102000004196 processed proteins & peptides Human genes 0.000 description 5
- 238000000746 purification Methods 0.000 description 5
- 238000005406 washing Methods 0.000 description 5
- 241000588724 Escherichia coli Species 0.000 description 4
- 239000000872 buffer Substances 0.000 description 4
- 210000004899 c-terminal region Anatomy 0.000 description 4
- 238000004090 dissolution Methods 0.000 description 4
- 230000000694 effects Effects 0.000 description 4
- 210000004408 hybridoma Anatomy 0.000 description 4
- 108020004999 messenger RNA Proteins 0.000 description 4
- 239000002773 nucleotide Substances 0.000 description 4
- 125000003729 nucleotide group Chemical group 0.000 description 4
- 229920001184 polypeptide Polymers 0.000 description 4
- 229920000136 polysorbate Polymers 0.000 description 4
- UXVMQQNJUSDDNG-UHFFFAOYSA-L Calcium chloride Chemical compound [Cl-].[Cl-].[Ca+2] UXVMQQNJUSDDNG-UHFFFAOYSA-L 0.000 description 3
- 239000004793 Polystyrene Substances 0.000 description 3
- 108010076504 Protein Sorting Signals Proteins 0.000 description 3
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 3
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 3
- 125000003295 alanine group Chemical group N[C@@H](C)C(=O)* 0.000 description 3
- 230000000903 blocking effect Effects 0.000 description 3
- 239000001110 calcium chloride Substances 0.000 description 3
- 229910001628 calcium chloride Inorganic materials 0.000 description 3
- 239000004202 carbamide Substances 0.000 description 3
- 239000003795 chemical substances by application Substances 0.000 description 3
- 239000011248 coating agent Substances 0.000 description 3
- 238000000576 coating method Methods 0.000 description 3
- 238000010586 diagram Methods 0.000 description 3
- 239000003085 diluting agent Substances 0.000 description 3
- 239000003623 enhancer Substances 0.000 description 3
- 108091006047 fluorescent proteins Proteins 0.000 description 3
- 102000034287 fluorescent proteins Human genes 0.000 description 3
- 239000000499 gel Substances 0.000 description 3
- 238000001879 gelation Methods 0.000 description 3
- 239000007788 liquid Substances 0.000 description 3
- ZJZXSOKJEJFHCP-UHFFFAOYSA-M lithium;thiocyanate Chemical compound [Li+].[S-]C#N ZJZXSOKJEJFHCP-UHFFFAOYSA-M 0.000 description 3
- 125000001360 methionine group Chemical group N[C@@H](CCSC)C(=O)* 0.000 description 3
- 229920002223 polystyrene Polymers 0.000 description 3
- 239000002243 precursor Substances 0.000 description 3
- 238000005215 recombination Methods 0.000 description 3
- 230000003252 repetitive effect Effects 0.000 description 3
- 238000003756 stirring Methods 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- 108020005345 3' Untranslated Regions Proteins 0.000 description 2
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 2
- 108020003589 5' Untranslated Regions Proteins 0.000 description 2
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 2
- 101710163595 Chaperone protein DnaK Proteins 0.000 description 2
- 241000255581 Drosophila <fruit fly, genus> Species 0.000 description 2
- 101710124870 Fibroin light chain Proteins 0.000 description 2
- 102000005720 Glutathione transferase Human genes 0.000 description 2
- 108010070675 Glutathione transferase Proteins 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 101710178376 Heat shock 70 kDa protein Proteins 0.000 description 2
- 101710152018 Heat shock cognate 70 kDa protein Proteins 0.000 description 2
- 241000282414 Homo sapiens Species 0.000 description 2
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 2
- LFTLOKWAGJYHHR-UHFFFAOYSA-N N-methylmorpholine N-oxide Chemical compound CN1(=O)CCOCC1 LFTLOKWAGJYHHR-UHFFFAOYSA-N 0.000 description 2
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 2
- 239000007984 Tris EDTA buffer Substances 0.000 description 2
- 108091023045 Untranslated Region Proteins 0.000 description 2
- 102000001392 Wiskott Aldrich Syndrome protein Human genes 0.000 description 2
- 108010093528 Wiskott Aldrich Syndrome protein Proteins 0.000 description 2
- MCMNRKCIXSYSNV-UHFFFAOYSA-N Zirconium dioxide Chemical compound O=[Zr]=O MCMNRKCIXSYSNV-UHFFFAOYSA-N 0.000 description 2
- 238000002835 absorbance Methods 0.000 description 2
- 210000000628 antibody-producing cell Anatomy 0.000 description 2
- 239000012620 biological material Substances 0.000 description 2
- ZCCIPPOKBCJFDN-UHFFFAOYSA-N calcium nitrate Chemical compound [Ca+2].[O-][N+]([O-])=O.[O-][N+]([O-])=O ZCCIPPOKBCJFDN-UHFFFAOYSA-N 0.000 description 2
- 210000000349 chromosome Anatomy 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- 238000000354 decomposition reaction Methods 0.000 description 2
- 239000003398 denaturant Substances 0.000 description 2
- 238000004925 denaturation Methods 0.000 description 2
- 230000036425 denaturation Effects 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 230000018109 developmental process Effects 0.000 description 2
- 239000004744 fabric Substances 0.000 description 2
- 108010021843 fluorescent protein 583 Proteins 0.000 description 2
- 230000003100 immobilizing effect Effects 0.000 description 2
- 210000000987 immune system Anatomy 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 229910052744 lithium Inorganic materials 0.000 description 2
- KWGKDLIKAYFUFQ-UHFFFAOYSA-M lithium chloride Chemical compound [Li+].[Cl-] KWGKDLIKAYFUFQ-UHFFFAOYSA-M 0.000 description 2
- YIXJRHPUWRPCBB-UHFFFAOYSA-N magnesium nitrate Chemical compound [Mg+2].[O-][N+]([O-])=O.[O-][N+]([O-])=O YIXJRHPUWRPCBB-UHFFFAOYSA-N 0.000 description 2
- 230000013011 mating Effects 0.000 description 2
- 210000000653 nervous system Anatomy 0.000 description 2
- 244000052769 pathogen Species 0.000 description 2
- 229920000642 polymer Polymers 0.000 description 2
- 238000007670 refining Methods 0.000 description 2
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 1
- BYEAHWXPCBROCE-UHFFFAOYSA-N 1,1,1,3,3,3-hexafluoropropan-2-ol Chemical compound FC(F)(F)C(O)C(F)(F)F BYEAHWXPCBROCE-UHFFFAOYSA-N 0.000 description 1
- GNSQPMMGUIWQJX-UHFFFAOYSA-N 1-chloroethane-1,2-diamine Chemical compound NCC(N)Cl GNSQPMMGUIWQJX-UHFFFAOYSA-N 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- 206010059866 Drug resistance Diseases 0.000 description 1
- 238000002965 ELISA Methods 0.000 description 1
- 238000012286 ELISA Assay Methods 0.000 description 1
- 102000002322 Egg Proteins Human genes 0.000 description 1
- 108010000912 Egg Proteins Proteins 0.000 description 1
- 108090000379 Fibroblast growth factor 2 Proteins 0.000 description 1
- 102100024785 Fibroblast growth factor 2 Human genes 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 229930186217 Glycolipid Natural products 0.000 description 1
- 241000238631 Hexapoda Species 0.000 description 1
- 101001052035 Homo sapiens Fibroblast growth factor 2 Proteins 0.000 description 1
- 102000008100 Human Serum Albumin Human genes 0.000 description 1
- 108091006905 Human Serum Albumin Proteins 0.000 description 1
- 108060003951 Immunoglobulin Proteins 0.000 description 1
- 108060001084 Luciferase Proteins 0.000 description 1
- 241001024304 Mino Species 0.000 description 1
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 206010035226 Plasma cell myeloma Diseases 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 108020004511 Recombinant DNA Proteins 0.000 description 1
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 description 1
- 229920002684 Sepharose Polymers 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- 241000196294 Spirogyra Species 0.000 description 1
- 101710120037 Toxin CcdB Proteins 0.000 description 1
- 102000008579 Transposases Human genes 0.000 description 1
- 108010020764 Transposases Proteins 0.000 description 1
- 238000001261 affinity purification Methods 0.000 description 1
- 239000011543 agarose gel Substances 0.000 description 1
- 238000004220 aggregation Methods 0.000 description 1
- 230000002776 aggregation Effects 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 238000012197 amplification kit Methods 0.000 description 1
- 210000004102 animal cell Anatomy 0.000 description 1
- 229940125644 antibody drug Drugs 0.000 description 1
- XMQFTWRPUQYINF-UHFFFAOYSA-N bensulfuron-methyl Chemical compound COC(=O)C1=CC=CC=C1CS(=O)(=O)NC(=O)NC1=NC(OC)=CC(OC)=N1 XMQFTWRPUQYINF-UHFFFAOYSA-N 0.000 description 1
- 239000007975 buffered saline Substances 0.000 description 1
- 239000001569 carbon dioxide Substances 0.000 description 1
- 229910002092 carbon dioxide Inorganic materials 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 239000003638 chemical reducing agent Substances 0.000 description 1
- 238000010367 cloning Methods 0.000 description 1
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 1
- 239000008367 deionised water Substances 0.000 description 1
- 229910021641 deionized water Inorganic materials 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000011033 desalting Methods 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 239000000539 dimer Substances 0.000 description 1
- 201000010099 disease Diseases 0.000 description 1
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 1
- 210000003278 egg shell Anatomy 0.000 description 1
- 108010048367 enhanced green fluorescent protein Proteins 0.000 description 1
- 238000011067 equilibration Methods 0.000 description 1
- 230000005284 excitation Effects 0.000 description 1
- 239000013604 expression vector Substances 0.000 description 1
- 238000000684 flow cytometry Methods 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 229960000789 guanidine hydrochloride Drugs 0.000 description 1
- PJJJBBJSCAKJQF-UHFFFAOYSA-N guanidinium chloride Chemical compound [Cl-].NC(N)=[NH2+] PJJJBBJSCAKJQF-UHFFFAOYSA-N 0.000 description 1
- 230000012447 hatching Effects 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 239000000833 heterodimer Substances 0.000 description 1
- 230000002519 immonomodulatory effect Effects 0.000 description 1
- 210000002865 immune cell Anatomy 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 229940124622 immune-modulator drug Drugs 0.000 description 1
- 238000003018 immunoassay Methods 0.000 description 1
- 102000018358 immunoglobulin Human genes 0.000 description 1
- 230000016784 immunoglobulin production Effects 0.000 description 1
- 238000011532 immunohistochemical staining Methods 0.000 description 1
- 238000001114 immunoprecipitation Methods 0.000 description 1
- 230000001678 irradiating effect Effects 0.000 description 1
- 239000004816 latex Substances 0.000 description 1
- 229920000126 latex Polymers 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 239000002923 metal particle Substances 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 238000000520 microinjection Methods 0.000 description 1
- 239000011259 mixed solution Substances 0.000 description 1
- 229940126619 mouse monoclonal antibody Drugs 0.000 description 1
- 201000000050 myeloid neoplasm Diseases 0.000 description 1
- 239000004745 nonwoven fabric Substances 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 108020004707 nucleic acids Proteins 0.000 description 1
- 102000039446 nucleic acids Human genes 0.000 description 1
- 150000007523 nucleic acids Chemical class 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- 230000000704 physical effect Effects 0.000 description 1
- 239000013600 plasmid vector Substances 0.000 description 1
- 108091033319 polynucleotide Proteins 0.000 description 1
- 102000040430 polynucleotide Human genes 0.000 description 1
- 239000002157 polynucleotide Substances 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 238000010379 pull-down assay Methods 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 238000003757 reverse transcription PCR Methods 0.000 description 1
- 125000003607 serino group Chemical group [H]N([H])[C@]([H])(C(=O)[*])C(O[H])([H])[H] 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 230000019491 signal transduction Effects 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- 150000003384 small molecules Chemical class 0.000 description 1
- VGTPCRGMBIAPIM-UHFFFAOYSA-M sodium thiocyanate Chemical compound [Na+].[S-]C#N VGTPCRGMBIAPIM-UHFFFAOYSA-M 0.000 description 1
- 230000003381 solubilizing effect Effects 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 230000009870 specific binding Effects 0.000 description 1
- 210000004989 spleen cell Anatomy 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 230000008685 targeting Effects 0.000 description 1
- 108700026220 vif Genes Proteins 0.000 description 1
- 238000001262 western blot Methods 0.000 description 1
Images
Description
(a)一本鎖抗体とフィブロインタンパク質との融合タンパク質を発現させた絹糸を精練せずに溶解する工程と、
(b)工程(a)で得られた前記融合タンパク質の溶解液を希釈して、前記融合タンパク質を線維化させることなく塩濃度を低下させる工程と、
を含む方法。
(a)一本鎖抗体とフィブロインタンパク質との融合タンパク質を発現させた絹糸を精練せずに溶解する工程と、
(b)工程(a)で得られた前記融合タンパク質の溶解液を希釈して、前記融合タンパク質を線維化させることなく塩濃度を低下させる工程と、
(c)工程(b)で得られた希釈された溶解液を担体に接触させる工程と
を含む方法。
本発明の「フィブロインH鎖」は、分子量が約35万Daのフィブロインタンパク質であり、典型例として、GenBankアクセッション No.NP_001106733.1で特定されるタンパク質のうちの22〜5263番目のアミノ酸配列からなるタンパク質(GenBankアクセッション No.NM_001113262.1で特定されるDNAのうちの64〜15789番目の塩基配列からなる遺伝子)が挙げられる。また、このタンパク質は、シグナルペプチド(GenBankアクセッション No.NP_001106733.1で特定されるタンパク質のうちの1〜21番目のアミノ酸配列からなるタンパク質)が前駆体より切断、除去されることにより得られる成熟型であるから、本発明の「フィブロインL鎖」としては、例えば、GenBankアクセッション No.NP_001106733.1で特定されるタンパク質(GenBankアクセッション No.NM_001113262.1で特定される遺伝子)が挙げられる。
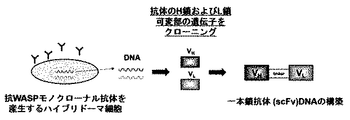
(1)ヒトやマウスの免疫細胞において、シグナル伝達分子として機能することが知られているWiskott−Aldrich syndrome protein(WASP)に特異的なモノクローナル抗体を産生するハイブリドーマから全RNAを抽出し、SMARTTM RACE cDNA amplification kit(Clontech社)を用いて5’−RACE法によりモノクローナル抗体のH鎖及びL鎖の可変部(VH,VL)の遺伝子をクローニングした。VH及びVLのDNAフラグメントをフレキシブルなリンカー配列(GGGGS×3)を介して結合した一本鎖抗体(scFv)を構築した(図1)。
(1)野生型(W1)及び組換えカイコ(S01, K27)が産生した繭を9M臭化リチウム−90mM Tris−HClで溶解し、シルク溶液中の組換えタンパク質の発現量についてSDS−PAGEとクマシー染色により確認した。内在性フィブロインL鎖に対して、S01カイコ産生繭では約10%程度、K27カイコ産生繭では5−8%程度が組換えタンパク質に置き換わていると推測された(図4)。これらの数値は、フィブロインL鎖との融合タンパク質として組換えカイコで発現させた時の平均的な値である。
本発明により得られる一本鎖抗体やそれを結合させた担体は、例えば、様々な病原体の検出・同定、除去や、疾病診断を目的とした新しいバイオマテリアルとして有効である。
<223> 人工的なポリヌクレオチド配列
配列番号:2
<223> 人工的なポリペプチド配列
Claims (4)
- 抗原に対して結合活性を有する一本鎖抗体の製造方法であって、
(a)一本鎖抗体とフィブロインタンパク質との融合タンパク質を発現させた絹糸を精
練せずに溶解する工程と、
(b)工程(a)で得られた前記融合タンパク質の溶解液を希釈して塩濃度を低下させる工程と、
(c)線維化していない状態で前記融合タンパク質を含む、希釈された溶解液を回収する工程と、
を含む方法。 - 抗原に対して結合活性を有する一本鎖抗体を保持する担体の製造方法であって、
(a)一本鎖抗体とフィブロインタンパク質との融合タンパク質を発現させた絹糸を精
練せずに溶解する工程と、
(b)工程(a)で得られた前記融合タンパク質の溶解液を希釈して塩濃度を低下させる工程と、
(c)線維化していない状態で前記融合タンパク質を含む、希釈された溶解液を回収する工程と、
(d)工程(c)で回収された希釈された溶解液を担体に接触させる工程と
を含む方法。 - 分子内又は分子間の水素結合を切断する性質を有する溶液で絹糸を溶解する、請求項1または2に記載の製造方法。
- 前記フィブロインタンパク質が、フィブロインL鎖、フィブロインH鎖およびフィブロヘキサメリンからなる群から選択される少なくとも一のタンパク質であることを特徴とする、請求項1から3のいずれかに記載の製造方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2017095347A JP6870851B2 (ja) | 2017-05-12 | 2017-05-12 | 機能的な一本鎖抗体の製造方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2017095347A JP6870851B2 (ja) | 2017-05-12 | 2017-05-12 | 機能的な一本鎖抗体の製造方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2018191523A JP2018191523A (ja) | 2018-12-06 |
| JP6870851B2 true JP6870851B2 (ja) | 2021-05-12 |
Family
ID=64568651
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2017095347A Active JP6870851B2 (ja) | 2017-05-12 | 2017-05-12 | 機能的な一本鎖抗体の製造方法 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP6870851B2 (ja) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPWO2022138758A1 (ja) * | 2020-12-25 | 2022-06-30 |
-
2017
- 2017-05-12 JP JP2017095347A patent/JP6870851B2/ja active Active
Also Published As
| Publication number | Publication date |
|---|---|
| JP2018191523A (ja) | 2018-12-06 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Xu et al. | Interactions between the Ig-superfamily proteins DIP-α and Dpr6/10 regulate assembly of neural circuits | |
| Yang et al. | Integrators of the cytoskeleton that stabilize microtubules | |
| Ogawa et al. | Generation of a transgenic silkworm that secretes recombinant proteins in the sericin layer of cocoon: production of recombinant human serum albumin | |
| Hede et al. | E-peptides control bioavailability of IGF-1 | |
| CA3072584A1 (en) | Ectopic olfactory receptors and uses thereof | |
| US10662251B2 (en) | TEM-1 diagnostic antibodies | |
| Pennington et al. | H-IPSE is a pathogen-secreted host nucleus-infiltrating protein (infiltrin) expressed exclusively by the Schistosoma haematobium egg stage | |
| JP2018529310A (ja) | ジユビキチン変異タンパク質に基づくHer2結合タンパク質 | |
| JPWO2006035741A1 (ja) | Es細胞特異的発現遺伝子及びその利用 | |
| CN103561765A (zh) | 补体因子b类似物及其用途 | |
| Potter et al. | Multiple isoforms of Nesprin1 are integral components of ciliary rootlets | |
| CN115354048B (zh) | 阿尔茨海默病动物模型的构建方法、用途和Aβ42重组表达载体 | |
| JP6870851B2 (ja) | 機能的な一本鎖抗体の製造方法 | |
| JP5812256B2 (ja) | 一本鎖抗体の製造方法 | |
| JP2008067612A (ja) | 機能的な抗体分子を生産するトランスジェニックカイコ | |
| IL302725A (en) | Rodents with an engineered DIVERSITY region of the heavy chain | |
| Xi et al. | Molecular assembly of recombinant chicken type II collagen in the yeast Pichia pastoris | |
| JP2008125367A (ja) | 組換えプロリン水酸化ヒトコラーゲンを生産する組換え細胞およびトランスジェニック生物 | |
| WO2015172752A9 (zh) | 血小板衍生生长因子b突变体、其制备方法及用途 | |
| Sugden et al. | Laminin N‐terminus α31 expression during development is lethal and causes widespread tissue‐specific defects in a transgenic mouse model | |
| WO2023008415A1 (ja) | ペプチドタグおよび当該ペプチドタグをコードする核酸 | |
| CN110128547B (zh) | 人源靶向补体抑制物蛋白mCR2-fH及应用 | |
| JP2022121306A (ja) | 抗β2ミクログロブリン抗体およびその使用 | |
| EP1335976B1 (en) | Modifier of organelle metalbolism | |
| Wright | Studies on the function and target-RNA recognition of RNA-binding proteins essential for mouse germ cell differentiation |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20191125 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20201009 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20201013 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20201201 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20210405 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20210408 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6870851 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |