JP6840086B2 - 薬物として、特に皮膚炎症性疾患において使用するためのフィブリノゲン由来の単離されたペプチドおよびそれらのフラグメント - Google Patents
薬物として、特に皮膚炎症性疾患において使用するためのフィブリノゲン由来の単離されたペプチドおよびそれらのフラグメント Download PDFInfo
- Publication number
- JP6840086B2 JP6840086B2 JP2017549280A JP2017549280A JP6840086B2 JP 6840086 B2 JP6840086 B2 JP 6840086B2 JP 2017549280 A JP2017549280 A JP 2017549280A JP 2017549280 A JP2017549280 A JP 2017549280A JP 6840086 B2 JP6840086 B2 JP 6840086B2
- Authority
- JP
- Japan
- Prior art keywords
- acnes
- seq
- fibrinogen
- cells
- protein
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 108090000765 processed proteins & peptides Proteins 0.000 title claims description 127
- 239000012634 fragment Substances 0.000 title claims description 88
- 102000008946 Fibrinogen Human genes 0.000 title claims description 77
- 108010049003 Fibrinogen Proteins 0.000 title claims description 77
- 229940012952 fibrinogen Drugs 0.000 title claims description 75
- 102000004196 processed proteins & peptides Human genes 0.000 title claims description 75
- 239000003814 drug Substances 0.000 title claims description 17
- 229940079593 drug Drugs 0.000 title claims description 16
- 208000027866 inflammatory disease Diseases 0.000 title claims description 14
- 241000186427 Cutibacterium acnes Species 0.000 claims description 128
- 108090000623 proteins and genes Proteins 0.000 claims description 75
- 102000004169 proteins and genes Human genes 0.000 claims description 73
- 206010000496 acne Diseases 0.000 claims description 50
- 208000002874 Acne Vulgaris Diseases 0.000 claims description 48
- 150000007523 nucleic acids Chemical class 0.000 claims description 44
- 108020004707 nucleic acids Proteins 0.000 claims description 43
- 102000039446 nucleic acids Human genes 0.000 claims description 43
- 238000011282 treatment Methods 0.000 claims description 41
- 239000013598 vector Substances 0.000 claims description 38
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 32
- 241000894006 Bacteria Species 0.000 claims description 31
- 229920001184 polypeptide Polymers 0.000 claims description 26
- 201000004681 Psoriasis Diseases 0.000 claims description 24
- 230000002265 prevention Effects 0.000 claims description 21
- 239000008194 pharmaceutical composition Substances 0.000 claims description 17
- 239000003795 chemical substances by application Substances 0.000 claims description 13
- 230000003993 interaction Effects 0.000 claims description 13
- 150000001875 compounds Chemical class 0.000 claims description 12
- 201000004624 Dermatitis Diseases 0.000 claims description 11
- 239000000203 mixture Substances 0.000 claims description 10
- 206010015150 Erythema Diseases 0.000 claims description 7
- 230000010065 bacterial adhesion Effects 0.000 claims description 5
- 230000001684 chronic effect Effects 0.000 claims description 5
- 208000003251 Pruritus Diseases 0.000 claims description 4
- 230000000813 microbial effect Effects 0.000 claims description 4
- 208000010201 Exanthema Diseases 0.000 claims description 3
- 239000013566 allergen Substances 0.000 claims description 3
- 239000002561 chemical irritant Substances 0.000 claims description 3
- 230000005670 electromagnetic radiation Effects 0.000 claims description 3
- 201000005884 exanthem Diseases 0.000 claims description 3
- 206010037844 rash Diseases 0.000 claims description 3
- 229940000425 combination drug Drugs 0.000 claims 3
- 210000004027 cell Anatomy 0.000 description 164
- 235000018102 proteins Nutrition 0.000 description 69
- 238000002474 experimental method Methods 0.000 description 48
- 239000007977 PBT buffer Substances 0.000 description 47
- 210000002510 keratinocyte Anatomy 0.000 description 38
- 238000004519 manufacturing process Methods 0.000 description 38
- 238000000034 method Methods 0.000 description 33
- 235000001014 amino acid Nutrition 0.000 description 32
- 102000018697 Membrane Proteins Human genes 0.000 description 31
- 108010052285 Membrane Proteins Proteins 0.000 description 31
- 150000001413 amino acids Chemical class 0.000 description 31
- 230000027455 binding Effects 0.000 description 30
- 230000000694 effects Effects 0.000 description 24
- 239000000463 material Substances 0.000 description 24
- 229940106780 human fibrinogen Drugs 0.000 description 22
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 21
- 230000021995 interleukin-8 production Effects 0.000 description 21
- 238000005259 measurement Methods 0.000 description 21
- 210000002950 fibroblast Anatomy 0.000 description 20
- 230000005764 inhibitory process Effects 0.000 description 19
- 102000004890 Interleukin-8 Human genes 0.000 description 18
- 108090001007 Interleukin-8 Proteins 0.000 description 18
- 230000001580 bacterial effect Effects 0.000 description 18
- 231100000673 dose–response relationship Toxicity 0.000 description 18
- 239000000284 extract Substances 0.000 description 18
- 230000002757 inflammatory effect Effects 0.000 description 18
- 230000003110 anti-inflammatory effect Effects 0.000 description 16
- 230000004054 inflammatory process Effects 0.000 description 16
- 239000003981 vehicle Substances 0.000 description 16
- 102100021435 Macrophage-stimulating protein receptor Human genes 0.000 description 15
- 239000003446 ligand Substances 0.000 description 15
- 210000001616 monocyte Anatomy 0.000 description 15
- 239000000243 solution Substances 0.000 description 15
- 102100038326 Beta-defensin 4A Human genes 0.000 description 14
- 206010061218 Inflammation Diseases 0.000 description 14
- 239000000872 buffer Substances 0.000 description 14
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 13
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 13
- 239000007924 injection Substances 0.000 description 13
- 238000002347 injection Methods 0.000 description 13
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 description 12
- MSFSPUZXLOGKHJ-UHFFFAOYSA-N Muraminsaeure Natural products OC(=O)C(C)OC1C(N)C(O)OC(CO)C1O MSFSPUZXLOGKHJ-UHFFFAOYSA-N 0.000 description 12
- 108010013639 Peptidoglycan Proteins 0.000 description 12
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 12
- 239000000499 gel Substances 0.000 description 12
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 12
- 241000283690 Bos taurus Species 0.000 description 11
- 102000010834 Extracellular Matrix Proteins Human genes 0.000 description 11
- 108010037362 Extracellular Matrix Proteins Proteins 0.000 description 11
- 101000884714 Homo sapiens Beta-defensin 4A Proteins 0.000 description 11
- 239000012528 membrane Substances 0.000 description 11
- 210000003491 skin Anatomy 0.000 description 11
- 238000012360 testing method Methods 0.000 description 11
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 10
- 238000002965 ELISA Methods 0.000 description 10
- 230000001070 adhesive effect Effects 0.000 description 10
- KWGKDLIKAYFUFQ-UHFFFAOYSA-M lithium chloride Chemical compound [Li+].[Cl-] KWGKDLIKAYFUFQ-UHFFFAOYSA-M 0.000 description 10
- 230000000638 stimulation Effects 0.000 description 10
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 9
- 241000699670 Mus sp. Species 0.000 description 9
- 229940098773 bovine serum albumin Drugs 0.000 description 9
- 231100000135 cytotoxicity Toxicity 0.000 description 9
- 230000003013 cytotoxicity Effects 0.000 description 9
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 9
- 238000011156 evaluation Methods 0.000 description 9
- 238000003556 assay Methods 0.000 description 8
- 210000005069 ears Anatomy 0.000 description 8
- 239000002609 medium Substances 0.000 description 8
- 239000003642 reactive oxygen metabolite Substances 0.000 description 8
- 210000004927 skin cell Anatomy 0.000 description 8
- 230000000699 topical effect Effects 0.000 description 8
- 238000011537 Coomassie blue staining Methods 0.000 description 7
- 108020004414 DNA Proteins 0.000 description 7
- 239000004793 Polystyrene Substances 0.000 description 7
- 238000002835 absorbance Methods 0.000 description 7
- 230000003833 cell viability Effects 0.000 description 7
- 230000022811 deglycosylation Effects 0.000 description 7
- 239000002158 endotoxin Substances 0.000 description 7
- 229920006008 lipopolysaccharide Polymers 0.000 description 7
- 229920002223 polystyrene Polymers 0.000 description 7
- 208000017520 skin disease Diseases 0.000 description 7
- 238000006467 substitution reaction Methods 0.000 description 7
- 230000001225 therapeutic effect Effects 0.000 description 7
- 102000012422 Collagen Type I Human genes 0.000 description 6
- 108010022452 Collagen Type I Proteins 0.000 description 6
- 241000588724 Escherichia coli Species 0.000 description 6
- 229940122245 Janus kinase inhibitor Drugs 0.000 description 6
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 6
- 231100000002 MTT assay Toxicity 0.000 description 6
- 238000000134 MTT assay Methods 0.000 description 6
- 239000000020 Nitrocellulose Substances 0.000 description 6
- 239000004264 Petrolatum Substances 0.000 description 6
- 239000000853 adhesive Substances 0.000 description 6
- 201000010099 disease Diseases 0.000 description 6
- 238000001727 in vivo Methods 0.000 description 6
- 208000015181 infectious disease Diseases 0.000 description 6
- 229910052744 lithium Inorganic materials 0.000 description 6
- 230000001404 mediated effect Effects 0.000 description 6
- 229920001220 nitrocellulos Polymers 0.000 description 6
- 125000003729 nucleotide group Chemical group 0.000 description 6
- 239000008188 pellet Substances 0.000 description 6
- 102000013415 peroxidase activity proteins Human genes 0.000 description 6
- 108040007629 peroxidase activity proteins Proteins 0.000 description 6
- 229940066842 petrolatum Drugs 0.000 description 6
- 235000019271 petrolatum Nutrition 0.000 description 6
- 238000000746 purification Methods 0.000 description 6
- 239000000523 sample Substances 0.000 description 6
- 239000011780 sodium chloride Substances 0.000 description 6
- 102000003886 Glycoproteins Human genes 0.000 description 5
- 108090000288 Glycoproteins Proteins 0.000 description 5
- 102000000447 Peptide-N4-(N-acetyl-beta-glucosaminyl) Asparagine Amidase Human genes 0.000 description 5
- 108010055817 Peptide-N4-(N-acetyl-beta-glucosaminyl) Asparagine Amidase Proteins 0.000 description 5
- 239000002253 acid Substances 0.000 description 5
- 229910002091 carbon monoxide Inorganic materials 0.000 description 5
- 238000005119 centrifugation Methods 0.000 description 5
- 238000001962 electrophoresis Methods 0.000 description 5
- 230000012010 growth Effects 0.000 description 5
- 230000028709 inflammatory response Effects 0.000 description 5
- 210000004698 lymphocyte Anatomy 0.000 description 5
- 239000011159 matrix material Substances 0.000 description 5
- 239000013642 negative control Substances 0.000 description 5
- 239000002773 nucleotide Substances 0.000 description 5
- 239000013641 positive control Substances 0.000 description 5
- 230000002829 reductive effect Effects 0.000 description 5
- 239000000725 suspension Substances 0.000 description 5
- 238000005406 washing Methods 0.000 description 5
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 4
- 208000002109 Argyria Diseases 0.000 description 4
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 4
- 102000013462 Interleukin-12 Human genes 0.000 description 4
- 108010065805 Interleukin-12 Proteins 0.000 description 4
- 240000001307 Myosotis scorpioides Species 0.000 description 4
- 239000007983 Tris buffer Substances 0.000 description 4
- 229920004890 Triton X-100 Polymers 0.000 description 4
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 4
- 238000004458 analytical method Methods 0.000 description 4
- 230000004071 biological effect Effects 0.000 description 4
- 108091006004 biotinylated proteins Proteins 0.000 description 4
- 239000003153 chemical reaction reagent Substances 0.000 description 4
- 239000013078 crystal Substances 0.000 description 4
- 102000037865 fusion proteins Human genes 0.000 description 4
- 108020001507 fusion proteins Proteins 0.000 description 4
- 239000001963 growth medium Substances 0.000 description 4
- 230000002401 inhibitory effect Effects 0.000 description 4
- 238000001840 matrix-assisted laser desorption--ionisation time-of-flight mass spectrometry Methods 0.000 description 4
- BDJRBEYXGGNYIS-UHFFFAOYSA-N nonanedioic acid Chemical compound OC(=O)CCCCCCCC(O)=O BDJRBEYXGGNYIS-UHFFFAOYSA-N 0.000 description 4
- 239000013612 plasmid Substances 0.000 description 4
- 238000002360 preparation method Methods 0.000 description 4
- 230000001105 regulatory effect Effects 0.000 description 4
- 230000004044 response Effects 0.000 description 4
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 4
- 238000000539 two dimensional gel electrophoresis Methods 0.000 description 4
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 3
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- 101710125298 Beta-defensin 2 Proteins 0.000 description 3
- 101710176951 Beta-defensin 4A Proteins 0.000 description 3
- 102000008186 Collagen Human genes 0.000 description 3
- 108010035532 Collagen Proteins 0.000 description 3
- 102000004127 Cytokines Human genes 0.000 description 3
- 108090000695 Cytokines Proteins 0.000 description 3
- 102000053602 DNA Human genes 0.000 description 3
- 206010014025 Ear swelling Diseases 0.000 description 3
- 108090001090 Lectins Proteins 0.000 description 3
- 102000004856 Lectins Human genes 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- 206010033733 Papule Diseases 0.000 description 3
- 108010089814 Plant Lectins Proteins 0.000 description 3
- 229920001213 Polysorbate 20 Polymers 0.000 description 3
- 206010037888 Rash pustular Diseases 0.000 description 3
- 239000012506 Sephacryl® Substances 0.000 description 3
- 206010040844 Skin exfoliation Diseases 0.000 description 3
- 102000004142 Trypsin Human genes 0.000 description 3
- 108090000631 Trypsin Proteins 0.000 description 3
- 230000004913 activation Effects 0.000 description 3
- 230000001464 adherent effect Effects 0.000 description 3
- 125000000539 amino acid group Chemical group 0.000 description 3
- 239000003242 anti bacterial agent Substances 0.000 description 3
- 230000000181 anti-adherent effect Effects 0.000 description 3
- OHDRQQURAXLVGJ-HLVWOLMTSA-N azane;(2e)-3-ethyl-2-[(e)-(3-ethyl-6-sulfo-1,3-benzothiazol-2-ylidene)hydrazinylidene]-1,3-benzothiazole-6-sulfonic acid Chemical compound [NH4+].[NH4+].S/1C2=CC(S([O-])(=O)=O)=CC=C2N(CC)C\1=N/N=C1/SC2=CC(S([O-])(=O)=O)=CC=C2N1CC OHDRQQURAXLVGJ-HLVWOLMTSA-N 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N biotin Natural products N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 3
- 210000004369 blood Anatomy 0.000 description 3
- 239000008280 blood Substances 0.000 description 3
- 210000004899 c-terminal region Anatomy 0.000 description 3
- 238000006243 chemical reaction Methods 0.000 description 3
- 238000003776 cleavage reaction Methods 0.000 description 3
- 229920001436 collagen Polymers 0.000 description 3
- 239000000356 contaminant Substances 0.000 description 3
- 238000012217 deletion Methods 0.000 description 3
- 230000037430 deletion Effects 0.000 description 3
- 230000035618 desquamation Effects 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 238000000502 dialysis Methods 0.000 description 3
- 230000029087 digestion Effects 0.000 description 3
- 208000035475 disorder Diseases 0.000 description 3
- 210000005175 epidermal keratinocyte Anatomy 0.000 description 3
- 239000013604 expression vector Substances 0.000 description 3
- 230000004927 fusion Effects 0.000 description 3
- 210000000609 ganglia Anatomy 0.000 description 3
- 238000000338 in vitro Methods 0.000 description 3
- 230000006698 induction Effects 0.000 description 3
- 210000004969 inflammatory cell Anatomy 0.000 description 3
- 239000002523 lectin Substances 0.000 description 3
- 230000003902 lesion Effects 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- 239000003726 plant lectin Substances 0.000 description 3
- 108091033319 polynucleotide Proteins 0.000 description 3
- 102000040430 polynucleotide Human genes 0.000 description 3
- 239000002157 polynucleotide Substances 0.000 description 3
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 3
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 239000000047 product Substances 0.000 description 3
- 238000000159 protein binding assay Methods 0.000 description 3
- 208000029561 pustule Diseases 0.000 description 3
- 230000010076 replication Effects 0.000 description 3
- 238000003757 reverse transcription PCR Methods 0.000 description 3
- 230000007017 scission Effects 0.000 description 3
- 230000028327 secretion Effects 0.000 description 3
- 238000000926 separation method Methods 0.000 description 3
- 239000000758 substrate Substances 0.000 description 3
- 239000006228 supernatant Substances 0.000 description 3
- 210000001519 tissue Anatomy 0.000 description 3
- 230000009466 transformation Effects 0.000 description 3
- 239000012588 trypsin Substances 0.000 description 3
- YMXHPSHLTSZXKH-RVBZMBCESA-N (2,5-dioxopyrrolidin-1-yl) 5-[(3as,4s,6ar)-2-oxo-1,3,3a,4,6,6a-hexahydrothieno[3,4-d]imidazol-4-yl]pentanoate Chemical compound C([C@H]1[C@H]2NC(=O)N[C@H]2CS1)CCCC(=O)ON1C(=O)CCC1=O YMXHPSHLTSZXKH-RVBZMBCESA-N 0.000 description 2
- VADKRMSMGWJZCF-UHFFFAOYSA-N 2-bromophenol Chemical compound OC1=CC=CC=C1Br VADKRMSMGWJZCF-UHFFFAOYSA-N 0.000 description 2
- UMCMPZBLKLEWAF-BCTGSCMUSA-N 3-[(3-cholamidopropyl)dimethylammonio]propane-1-sulfonate Chemical compound C([C@H]1C[C@H]2O)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(=O)NCCC[N+](C)(C)CCCS([O-])(=O)=O)C)[C@@]2(C)[C@@H](O)C1 UMCMPZBLKLEWAF-BCTGSCMUSA-N 0.000 description 2
- 208000020154 Acnes Diseases 0.000 description 2
- 229920001817 Agar Polymers 0.000 description 2
- 239000004342 Benzoyl peroxide Substances 0.000 description 2
- OMPJBNCRMGITSC-UHFFFAOYSA-N Benzoylperoxide Chemical compound C=1C=CC=CC=1C(=O)OOC(=O)C1=CC=CC=C1 OMPJBNCRMGITSC-UHFFFAOYSA-N 0.000 description 2
- BVKZGUZCCUSVTD-UHFFFAOYSA-M Bicarbonate Chemical compound OC([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-M 0.000 description 2
- FBPFZTCFMRRESA-ZXXMMSQZSA-N D-iditol Chemical compound OC[C@@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-ZXXMMSQZSA-N 0.000 description 2
- 238000012286 ELISA Assay Methods 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- ULGZDMOVFRHVEP-RWJQBGPGSA-N Erythromycin Chemical compound O([C@@H]1[C@@H](C)C(=O)O[C@@H]([C@@]([C@H](O)[C@@H](C)C(=O)[C@H](C)C[C@@](C)(O)[C@H](O[C@H]2[C@@H]([C@H](C[C@@H](C)O2)N(C)C)O)[C@H]1C)(C)O)CC)[C@H]1C[C@@](C)(OC)[C@@H](O)[C@H](C)O1 ULGZDMOVFRHVEP-RWJQBGPGSA-N 0.000 description 2
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 2
- 108010031186 Glycoside Hydrolases Proteins 0.000 description 2
- 102000005744 Glycoside Hydrolases Human genes 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- 101001033249 Homo sapiens Interleukin-1 beta Proteins 0.000 description 2
- 241000699666 Mus <mouse, genus> Species 0.000 description 2
- 206010054107 Nodule Diseases 0.000 description 2
- 108091028043 Nucleic acid sequence Proteins 0.000 description 2
- 241001494479 Pecora Species 0.000 description 2
- 101800001006 Putative helicase Proteins 0.000 description 2
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 2
- 235000014680 Saccharomyces cerevisiae Nutrition 0.000 description 2
- BQCADISMDOOEFD-UHFFFAOYSA-N Silver Chemical compound [Ag] BQCADISMDOOEFD-UHFFFAOYSA-N 0.000 description 2
- 108010090804 Streptavidin Proteins 0.000 description 2
- 239000004473 Threonine Substances 0.000 description 2
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 2
- 238000007792 addition Methods 0.000 description 2
- 239000008272 agar Substances 0.000 description 2
- 238000012870 ammonium sulfate precipitation Methods 0.000 description 2
- 230000000844 anti-bacterial effect Effects 0.000 description 2
- 229940088710 antibiotic agent Drugs 0.000 description 2
- 235000019400 benzoyl peroxide Nutrition 0.000 description 2
- WQZGKKKJIJFFOK-FPRJBGLDSA-N beta-D-galactose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@H]1O WQZGKKKJIJFFOK-FPRJBGLDSA-N 0.000 description 2
- 229960002685 biotin Drugs 0.000 description 2
- 239000011616 biotin Substances 0.000 description 2
- 239000004202 carbamide Substances 0.000 description 2
- 238000004113 cell culture Methods 0.000 description 2
- 239000006143 cell culture medium Substances 0.000 description 2
- 238000012512 characterization method Methods 0.000 description 2
- 208000037976 chronic inflammation Diseases 0.000 description 2
- 238000010367 cloning Methods 0.000 description 2
- 239000002299 complementary DNA Substances 0.000 description 2
- 239000012228 culture supernatant Substances 0.000 description 2
- 230000006378 damage Effects 0.000 description 2
- 239000006185 dispersion Substances 0.000 description 2
- 239000013613 expression plasmid Substances 0.000 description 2
- 238000000605 extraction Methods 0.000 description 2
- 239000007850 fluorescent dye Substances 0.000 description 2
- RWSXRVCMGQZWBV-WDSKDSINSA-N glutathione Chemical compound OC(=O)[C@@H](N)CCC(=O)N[C@@H](CS)C(=O)NCC(O)=O RWSXRVCMGQZWBV-WDSKDSINSA-N 0.000 description 2
- 108010085617 glycopeptide alpha-N-acetylgalactosaminidase Proteins 0.000 description 2
- 229910052737 gold Inorganic materials 0.000 description 2
- 239000010931 gold Substances 0.000 description 2
- 230000005283 ground state Effects 0.000 description 2
- 210000003780 hair follicle Anatomy 0.000 description 2
- 210000003494 hepatocyte Anatomy 0.000 description 2
- 210000002865 immune cell Anatomy 0.000 description 2
- 230000000977 initiatory effect Effects 0.000 description 2
- 238000001990 intravenous administration Methods 0.000 description 2
- 238000002372 labelling Methods 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 231100000252 nontoxic Toxicity 0.000 description 2
- 244000052769 pathogen Species 0.000 description 2
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 2
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 2
- 229920000053 polysorbate 80 Polymers 0.000 description 2
- 238000001556 precipitation Methods 0.000 description 2
- 230000000770 proinflammatory effect Effects 0.000 description 2
- 239000012460 protein solution Substances 0.000 description 2
- YGSDEFSMJLZEOE-UHFFFAOYSA-N salicylic acid Chemical compound OC(=O)C1=CC=CC=C1O YGSDEFSMJLZEOE-UHFFFAOYSA-N 0.000 description 2
- 229920006395 saturated elastomer Polymers 0.000 description 2
- 229910052709 silver Inorganic materials 0.000 description 2
- 239000004332 silver Substances 0.000 description 2
- 239000002356 single layer Substances 0.000 description 2
- 238000009097 single-agent therapy Methods 0.000 description 2
- 206010040882 skin lesion Diseases 0.000 description 2
- 231100000444 skin lesion Toxicity 0.000 description 2
- DAEPDZWVDSPTHF-UHFFFAOYSA-M sodium pyruvate Chemical compound [Na+].CC(=O)C([O-])=O DAEPDZWVDSPTHF-UHFFFAOYSA-M 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 238000001228 spectrum Methods 0.000 description 2
- 230000004936 stimulating effect Effects 0.000 description 2
- 238000003756 stirring Methods 0.000 description 2
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- 231100000331 toxic Toxicity 0.000 description 2
- 230000002588 toxic effect Effects 0.000 description 2
- 230000006433 tumor necrosis factor production Effects 0.000 description 2
- 229940099259 vaseline Drugs 0.000 description 2
- GVJXGCIPWAVXJP-UHFFFAOYSA-N 2,5-dioxo-1-oxoniopyrrolidine-3-sulfonate Chemical compound ON1C(=O)CC(S(O)(=O)=O)C1=O GVJXGCIPWAVXJP-UHFFFAOYSA-N 0.000 description 1
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 1
- HSTOKWSFWGCZMH-UHFFFAOYSA-N 3,3'-diaminobenzidine Chemical compound C1=C(N)C(N)=CC=C1C1=CC=C(N)C(N)=C1 HSTOKWSFWGCZMH-UHFFFAOYSA-N 0.000 description 1
- 125000000972 4,5-dimethylthiazol-2-yl group Chemical group [H]C([H])([H])C1=C(N=C(*)S1)C([H])([H])[H] 0.000 description 1
- 108010055851 Acetylglucosaminidase Proteins 0.000 description 1
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical compound [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 1
- ATRRKUHOCOJYRX-UHFFFAOYSA-N Ammonium bicarbonate Chemical compound [NH4+].OC([O-])=O ATRRKUHOCOJYRX-UHFFFAOYSA-N 0.000 description 1
- 229910000013 Ammonium bicarbonate Inorganic materials 0.000 description 1
- 108091093088 Amplicon Proteins 0.000 description 1
- 102000044503 Antimicrobial Peptides Human genes 0.000 description 1
- 108700042778 Antimicrobial Peptides Proteins 0.000 description 1
- 206010060968 Arthritis infective Diseases 0.000 description 1
- 108010077805 Bacterial Proteins Proteins 0.000 description 1
- 208000034309 Bacterial disease carrier Diseases 0.000 description 1
- BTBUEUYNUDRHOZ-UHFFFAOYSA-N Borate Chemical compound [O-]B([O-])[O-] BTBUEUYNUDRHOZ-UHFFFAOYSA-N 0.000 description 1
- 101710168515 Cell surface glycoprotein Proteins 0.000 description 1
- 102000019034 Chemokines Human genes 0.000 description 1
- 108010012236 Chemokines Proteins 0.000 description 1
- 241000193403 Clostridium Species 0.000 description 1
- 108020004635 Complementary DNA Proteins 0.000 description 1
- 108010014303 DNA-directed DNA polymerase Proteins 0.000 description 1
- 102000016928 DNA-directed DNA polymerase Human genes 0.000 description 1
- 102000000541 Defensins Human genes 0.000 description 1
- 108010002069 Defensins Proteins 0.000 description 1
- 102000007260 Deoxyribonuclease I Human genes 0.000 description 1
- 108010008532 Deoxyribonuclease I Proteins 0.000 description 1
- 206010012455 Dermatitis exfoliative Diseases 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 241000589566 Elizabethkingia meningoseptica Species 0.000 description 1
- 101000635852 Equus caballus Myoglobin Proteins 0.000 description 1
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 1
- 241000206602 Eukaryota Species 0.000 description 1
- 101150025121 FGB gene Proteins 0.000 description 1
- 101710128530 Fibrinogen-binding protein Proteins 0.000 description 1
- 102000016359 Fibronectins Human genes 0.000 description 1
- 108010067306 Fibronectins Proteins 0.000 description 1
- 241000233866 Fungi Species 0.000 description 1
- 101000609762 Gallus gallus Ovalbumin Proteins 0.000 description 1
- 102000006395 Globulins Human genes 0.000 description 1
- 108010044091 Globulins Proteins 0.000 description 1
- SXRSQZLOMIGNAQ-UHFFFAOYSA-N Glutaraldehyde Chemical compound O=CCCCC=O SXRSQZLOMIGNAQ-UHFFFAOYSA-N 0.000 description 1
- 108010024636 Glutathione Proteins 0.000 description 1
- 229920000209 Hexadimethrine bromide Polymers 0.000 description 1
- 102100034343 Integrase Human genes 0.000 description 1
- 102000015696 Interleukins Human genes 0.000 description 1
- 108010063738 Interleukins Proteins 0.000 description 1
- SHGAZHPCJJPHSC-NUEINMDLSA-N Isotretinoin Chemical compound OC(=O)C=C(C)/C=C/C=C(C)C=CC1=C(C)CCCC1(C)C SHGAZHPCJJPHSC-NUEINMDLSA-N 0.000 description 1
- 102100037644 Kelch-like protein 41 Human genes 0.000 description 1
- 108050003242 Kelch-like protein 41 Proteins 0.000 description 1
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 1
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 1
- 102000043136 MAP kinase family Human genes 0.000 description 1
- 108091054455 MAP kinase family Proteins 0.000 description 1
- 102000012750 Membrane Glycoproteins Human genes 0.000 description 1
- 108010090054 Membrane Glycoproteins Proteins 0.000 description 1
- 206010028470 Mycoplasma infections Diseases 0.000 description 1
- OVRNDRQMDRJTHS-KEWYIRBNSA-N N-acetyl-D-galactosamine Chemical group CC(=O)N[C@H]1C(O)O[C@H](CO)[C@H](O)[C@@H]1O OVRNDRQMDRJTHS-KEWYIRBNSA-N 0.000 description 1
- FSYKKLYZXJSNPZ-UHFFFAOYSA-N N-methylaminoacetic acid Natural products C[NH2+]CC([O-])=O FSYKKLYZXJSNPZ-UHFFFAOYSA-N 0.000 description 1
- 108010057466 NF-kappa B Proteins 0.000 description 1
- 102000003945 NF-kappa B Human genes 0.000 description 1
- 108091008099 NLRP3 inflammasome Proteins 0.000 description 1
- 206010067482 No adverse event Diseases 0.000 description 1
- 108091034117 Oligonucleotide Proteins 0.000 description 1
- 208000005141 Otitis Diseases 0.000 description 1
- 229930182555 Penicillin Natural products 0.000 description 1
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 1
- 102100038551 Peptide-N(4)-(N-acetyl-beta-glucosaminyl)asparagine amidase Human genes 0.000 description 1
- RVQDZELMXZRSSI-IUCAKERBSA-N Pro-Lys Chemical group NCCCC[C@@H](C(O)=O)NC(=O)[C@@H]1CCCN1 RVQDZELMXZRSSI-IUCAKERBSA-N 0.000 description 1
- GVUVRRPYYDHHGK-VQVTYTSYSA-N Pro-Thr Chemical group C[C@@H](O)[C@@H](C(O)=O)NC(=O)[C@@H]1CCCN1 GVUVRRPYYDHHGK-VQVTYTSYSA-N 0.000 description 1
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 1
- 102100030122 Protein O-GlcNAcase Human genes 0.000 description 1
- 108010092799 RNA-directed DNA polymerase Proteins 0.000 description 1
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 1
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 1
- 101710099182 S-layer protein Proteins 0.000 description 1
- 102000005871 S100 Calcium Binding Protein A7 Human genes 0.000 description 1
- 108010005256 S100 Calcium Binding Protein A7 Proteins 0.000 description 1
- 206010039793 Seborrhoeic dermatitis Diseases 0.000 description 1
- 238000012300 Sequence Analysis Methods 0.000 description 1
- 108010071390 Serum Albumin Proteins 0.000 description 1
- 102000007562 Serum Albumin Human genes 0.000 description 1
- 108020004682 Single-Stranded DNA Proteins 0.000 description 1
- 206010040880 Skin irritation Diseases 0.000 description 1
- 241000191940 Staphylococcus Species 0.000 description 1
- 241000194017 Streptococcus Species 0.000 description 1
- 241000193998 Streptococcus pneumoniae Species 0.000 description 1
- 238000000692 Student's t-test Methods 0.000 description 1
- OUUQCZGPVNCOIJ-UHFFFAOYSA-M Superoxide Chemical compound [O-][O] OUUQCZGPVNCOIJ-UHFFFAOYSA-M 0.000 description 1
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 1
- 208000007536 Thrombosis Diseases 0.000 description 1
- 102000008228 Toll-like receptor 2 Human genes 0.000 description 1
- 108010060888 Toll-like receptor 2 Proteins 0.000 description 1
- 239000013504 Triton X-100 Substances 0.000 description 1
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 1
- 229930003779 Vitamin B12 Natural products 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 208000038016 acute inflammation Diseases 0.000 description 1
- 230000006022 acute inflammation Effects 0.000 description 1
- LZCDAPDGXCYOEH-UHFFFAOYSA-N adapalene Chemical compound C1=C(C(O)=O)C=CC2=CC(C3=CC=C(C(=C3)C34CC5CC(CC(C5)C3)C4)OC)=CC=C21 LZCDAPDGXCYOEH-UHFFFAOYSA-N 0.000 description 1
- 229960002916 adapalene Drugs 0.000 description 1
- SHGAZHPCJJPHSC-YCNIQYBTSA-N all-trans-retinoic acid Chemical compound OC(=O)\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C SHGAZHPCJJPHSC-YCNIQYBTSA-N 0.000 description 1
- 150000004347 all-trans-retinol derivatives Chemical class 0.000 description 1
- 108010015684 alpha-N-Acetylgalactosaminidase Proteins 0.000 description 1
- 102000002014 alpha-N-Acetylgalactosaminidase Human genes 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- 238000003277 amino acid sequence analysis Methods 0.000 description 1
- 235000012538 ammonium bicarbonate Nutrition 0.000 description 1
- 239000001099 ammonium carbonate Substances 0.000 description 1
- 229960000723 ampicillin Drugs 0.000 description 1
- AVKUERGKIZMTKX-NJBDSQKTSA-N ampicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=CC=C1 AVKUERGKIZMTKX-NJBDSQKTSA-N 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 238000005349 anion exchange Methods 0.000 description 1
- 150000001450 anions Chemical class 0.000 description 1
- 230000003255 anti-acne Effects 0.000 description 1
- 229940121363 anti-inflammatory agent Drugs 0.000 description 1
- 239000002260 anti-inflammatory agent Substances 0.000 description 1
- 230000000845 anti-microbial effect Effects 0.000 description 1
- 230000000692 anti-sense effect Effects 0.000 description 1
- 229940121375 antifungal agent Drugs 0.000 description 1
- 239000003429 antifungal agent Substances 0.000 description 1
- 230000011641 antimicrobial peptide production Effects 0.000 description 1
- 239000012298 atmosphere Substances 0.000 description 1
- 208000010668 atopic eczema Diseases 0.000 description 1
- OHDRQQURAXLVGJ-UHFFFAOYSA-N azane;3-ethyl-2-[(3-ethyl-6-sulfo-1,3-benzothiazol-2-ylidene)hydrazinylidene]-1,3-benzothiazole-6-sulfonic acid Chemical compound [NH4+].[NH4+].S1C2=CC(S([O-])(=O)=O)=CC=C2N(CC)C1=NN=C1SC2=CC(S([O-])(=O)=O)=CC=C2N1CC OHDRQQURAXLVGJ-UHFFFAOYSA-N 0.000 description 1
- 230000008952 bacterial invasion Effects 0.000 description 1
- 244000052616 bacterial pathogen Species 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 229960003328 benzoyl peroxide Drugs 0.000 description 1
- 102000005936 beta-Galactosidase Human genes 0.000 description 1
- 108010005774 beta-Galactosidase Proteins 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 235000020958 biotin Nutrition 0.000 description 1
- 238000007413 biotinylation Methods 0.000 description 1
- 230000006287 biotinylation Effects 0.000 description 1
- 230000023555 blood coagulation Effects 0.000 description 1
- 229910021538 borax Inorganic materials 0.000 description 1
- KGBXLFKZBHKPEV-UHFFFAOYSA-N boric acid Chemical compound OB(O)O KGBXLFKZBHKPEV-UHFFFAOYSA-N 0.000 description 1
- 239000004327 boric acid Substances 0.000 description 1
- UDSAIICHUKSCKT-UHFFFAOYSA-N bromophenol blue Chemical compound C1=C(Br)C(O)=C(Br)C=C1C1(C=2C=C(Br)C(O)=C(Br)C=2)C2=CC=CC=C2S(=O)(=O)O1 UDSAIICHUKSCKT-UHFFFAOYSA-N 0.000 description 1
- 238000010804 cDNA synthesis Methods 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 238000003570 cell viability assay Methods 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 230000019522 cellular metabolic process Effects 0.000 description 1
- 230000014564 chemokine production Effects 0.000 description 1
- 229960005091 chloramphenicol Drugs 0.000 description 1
- WIIZWVCIJKGZOK-RKDXNWHRSA-N chloramphenicol Chemical compound ClC(Cl)C(=O)N[C@H](CO)[C@H](O)C1=CC=C([N+]([O-])=O)C=C1 WIIZWVCIJKGZOK-RKDXNWHRSA-N 0.000 description 1
- 239000003593 chromogenic compound Substances 0.000 description 1
- 230000002759 chromosomal effect Effects 0.000 description 1
- 230000006020 chronic inflammation Effects 0.000 description 1
- 208000037893 chronic inflammatory disorder Diseases 0.000 description 1
- 229960002227 clindamycin Drugs 0.000 description 1
- KDLRVYVGXIQJDK-AWPVFWJPSA-N clindamycin Chemical compound CN1C[C@H](CCC)C[C@H]1C(=O)N[C@H]([C@H](C)Cl)[C@@H]1[C@H](O)[C@H](O)[C@@H](O)[C@@H](SC)O1 KDLRVYVGXIQJDK-AWPVFWJPSA-N 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- AGVAZMGAQJOSFJ-WZHZPDAFSA-M cobalt(2+);[(2r,3s,4r,5s)-5-(5,6-dimethylbenzimidazol-1-yl)-4-hydroxy-2-(hydroxymethyl)oxolan-3-yl] [(2r)-1-[3-[(1r,2r,3r,4z,7s,9z,12s,13s,14z,17s,18s,19r)-2,13,18-tris(2-amino-2-oxoethyl)-7,12,17-tris(3-amino-3-oxopropyl)-3,5,8,8,13,15,18,19-octamethyl-2 Chemical compound [Co+2].N#[C-].[N-]([C@@H]1[C@H](CC(N)=O)[C@@]2(C)CCC(=O)NC[C@@H](C)OP(O)(=O)O[C@H]3[C@H]([C@H](O[C@@H]3CO)N3C4=CC(C)=C(C)C=C4N=C3)O)\C2=C(C)/C([C@H](C\2(C)C)CCC(N)=O)=N/C/2=C\C([C@H]([C@@]/2(CC(N)=O)C)CCC(N)=O)=N\C\2=C(C)/C2=N[C@]1(C)[C@@](C)(CC(N)=O)[C@@H]2CCC(N)=O AGVAZMGAQJOSFJ-WZHZPDAFSA-M 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 238000012937 correction Methods 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 238000003235 crystal violet staining Methods 0.000 description 1
- 238000005520 cutting process Methods 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- 150000001945 cysteines Chemical class 0.000 description 1
- 230000016396 cytokine production Effects 0.000 description 1
- 230000001472 cytotoxic effect Effects 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 230000035614 depigmentation Effects 0.000 description 1
- 238000000586 desensitisation Methods 0.000 description 1
- 238000003795 desorption Methods 0.000 description 1
- 230000001627 detrimental effect Effects 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- UQGFMSUEHSUPRD-UHFFFAOYSA-N disodium;3,7-dioxido-2,4,6,8,9-pentaoxa-1,3,5,7-tetraborabicyclo[3.3.1]nonane Chemical compound [Na+].[Na+].O1B([O-])OB2OB([O-])OB1O2 UQGFMSUEHSUPRD-UHFFFAOYSA-N 0.000 description 1
- 239000002612 dispersion medium Substances 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 229960003722 doxycycline Drugs 0.000 description 1
- XQTWDDCIUJNLTR-CVHRZJFOSA-N doxycycline monohydrate Chemical compound O.O=C1C2=C(O)C=CC=C2[C@H](C)[C@@H]2C1=C(O)[C@]1(O)C(=O)C(C(N)=O)=C(O)[C@@H](N(C)C)[C@@H]1[C@H]2O XQTWDDCIUJNLTR-CVHRZJFOSA-N 0.000 description 1
- 239000003937 drug carrier Substances 0.000 description 1
- 238000004520 electroporation Methods 0.000 description 1
- 238000010828 elution Methods 0.000 description 1
- 238000005538 encapsulation Methods 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 230000026502 entry into host cell Effects 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 238000006911 enzymatic reaction Methods 0.000 description 1
- 210000002615 epidermis Anatomy 0.000 description 1
- 210000002919 epithelial cell Anatomy 0.000 description 1
- 231100000321 erythema Toxicity 0.000 description 1
- 229960003276 erythromycin Drugs 0.000 description 1
- 238000001704 evaporation Methods 0.000 description 1
- 230000008020 evaporation Effects 0.000 description 1
- 230000005284 excitation Effects 0.000 description 1
- 238000013401 experimental design Methods 0.000 description 1
- 210000002744 extracellular matrix Anatomy 0.000 description 1
- 239000012091 fetal bovine serum Substances 0.000 description 1
- 230000001605 fetal effect Effects 0.000 description 1
- 102000025748 fibrinogen binding proteins Human genes 0.000 description 1
- 238000012921 fluorescence analysis Methods 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 238000005194 fractionation Methods 0.000 description 1
- 230000006870 function Effects 0.000 description 1
- 125000002519 galactosyl group Chemical group C1([C@H](O)[C@@H](O)[C@@H](O)[C@H](O1)CO)* 0.000 description 1
- 238000001641 gel filtration chromatography Methods 0.000 description 1
- 238000002523 gelfiltration Methods 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 210000004907 gland Anatomy 0.000 description 1
- 229960003180 glutathione Drugs 0.000 description 1
- 150000004676 glycans Chemical group 0.000 description 1
- 239000000118 hair dye Substances 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 108010037896 heparin-binding hemagglutinin Proteins 0.000 description 1
- 238000007489 histopathology method Methods 0.000 description 1
- 230000003054 hormonal effect Effects 0.000 description 1
- 238000010874 in vitro model Methods 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 230000008595 infiltration Effects 0.000 description 1
- 238000001764 infiltration Methods 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 239000002054 inoculum Substances 0.000 description 1
- 239000002198 insoluble material Substances 0.000 description 1
- 230000019734 interleukin-12 production Effects 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- PGLTVOMIXTUURA-UHFFFAOYSA-N iodoacetamide Chemical compound NC(=O)CI PGLTVOMIXTUURA-UHFFFAOYSA-N 0.000 description 1
- 238000004255 ion exchange chromatography Methods 0.000 description 1
- 230000002427 irreversible effect Effects 0.000 description 1
- 238000001155 isoelectric focusing Methods 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 239000007951 isotonicity adjuster Substances 0.000 description 1
- 229960005280 isotretinoin Drugs 0.000 description 1
- 238000000670 ligand binding assay Methods 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 238000011068 loading method Methods 0.000 description 1
- 239000006166 lysate Substances 0.000 description 1
- 239000012139 lysis buffer Substances 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 239000003550 marker Substances 0.000 description 1
- 238000001869 matrix assisted laser desorption--ionisation mass spectrum Methods 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 230000002906 microbiologic effect Effects 0.000 description 1
- 238000000520 microinjection Methods 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 150000002772 monosaccharides Chemical class 0.000 description 1
- 230000035772 mutation Effects 0.000 description 1
- HMQPEDMEOBLSQB-UHFFFAOYSA-N n-[2,5-dihydroxy-6-(hydroxymethyl)-4-[3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxyoxan-3-yl]acetamide Chemical group CC(=O)NC1C(O)OC(CO)C(O)C1OC1C(O)C(O)C(O)C(CO)O1 HMQPEDMEOBLSQB-UHFFFAOYSA-N 0.000 description 1
- 230000010807 negative regulation of binding Effects 0.000 description 1
- 230000031990 negative regulation of inflammatory response Effects 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 238000010899 nucleation Methods 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 229940127249 oral antibiotic Drugs 0.000 description 1
- NPKKRSHVJIQBKU-UHFFFAOYSA-N ornogenin Natural products CC(OC(=O)C=Cc1ccccc1)C2(O)CCC3(O)C4(O)CC=C5CC(O)CCC5(C)C4CC(OC(=O)C=Cc6ccccc6)C23C NPKKRSHVJIQBKU-UHFFFAOYSA-N 0.000 description 1
- 230000000399 orthopedic effect Effects 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-N papa-hydroxy-benzoic acid Natural products OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- 230000001991 pathophysiological effect Effects 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 229940049954 penicillin Drugs 0.000 description 1
- 238000000955 peptide mass fingerprinting Methods 0.000 description 1
- 108040002068 peptide-N4-(N-acetyl-beta-glucosaminyl)asparagine amidase activity proteins Proteins 0.000 description 1
- 230000008447 perception Effects 0.000 description 1
- 230000002085 persistent effect Effects 0.000 description 1
- 239000013600 plasmid vector Substances 0.000 description 1
- 229910052697 platinum Inorganic materials 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 239000011148 porous material Substances 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 238000011533 pre-incubation Methods 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 230000002335 preservative effect Effects 0.000 description 1
- 230000002062 proliferating effect Effects 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 229940055019 propionibacterium acne Drugs 0.000 description 1
- 238000000751 protein extraction Methods 0.000 description 1
- 230000004850 protein–protein interaction Effects 0.000 description 1
- 210000001938 protoplast Anatomy 0.000 description 1
- 230000001823 pruritic effect Effects 0.000 description 1
- 238000004451 qualitative analysis Methods 0.000 description 1
- 238000012205 qualitative assay Methods 0.000 description 1
- 238000004445 quantitative analysis Methods 0.000 description 1
- 238000012207 quantitative assay Methods 0.000 description 1
- 239000007692 rcm medium Substances 0.000 description 1
- 238000003259 recombinant expression Methods 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 230000000306 recurrent effect Effects 0.000 description 1
- 239000002824 redox indicator Substances 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000003362 replicative effect Effects 0.000 description 1
- 230000004043 responsiveness Effects 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 229960004889 salicylic acid Drugs 0.000 description 1
- 239000012266 salt solution Substances 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 239000012723 sample buffer Substances 0.000 description 1
- 239000012047 saturated solution Substances 0.000 description 1
- 210000001732 sebaceous gland Anatomy 0.000 description 1
- 208000008742 seborrheic dermatitis Diseases 0.000 description 1
- 238000012163 sequencing technique Methods 0.000 description 1
- 238000013207 serial dilution Methods 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 230000019491 signal transduction Effects 0.000 description 1
- 206010040872 skin infection Diseases 0.000 description 1
- 230000036556 skin irritation Effects 0.000 description 1
- 231100000475 skin irritation Toxicity 0.000 description 1
- 239000000344 soap Substances 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 239000001488 sodium phosphate Substances 0.000 description 1
- 229910000162 sodium phosphate Inorganic materials 0.000 description 1
- 229940054269 sodium pyruvate Drugs 0.000 description 1
- 239000004328 sodium tetraborate Substances 0.000 description 1
- 235000010339 sodium tetraborate Nutrition 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 230000009870 specific binding Effects 0.000 description 1
- 238000002798 spectrophotometry method Methods 0.000 description 1
- 230000003068 static effect Effects 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 229940031000 streptococcus pneumoniae Drugs 0.000 description 1
- 229960005322 streptomycin Drugs 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 210000001550 testis Anatomy 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 238000013518 transcription Methods 0.000 description 1
- 230000035897 transcription Effects 0.000 description 1
- 238000001890 transfection Methods 0.000 description 1
- 238000013519 translation Methods 0.000 description 1
- 230000032258 transport Effects 0.000 description 1
- 229960001727 tretinoin Drugs 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 1
- 210000004881 tumor cell Anatomy 0.000 description 1
- 239000013603 viral vector Substances 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 238000012800 visualization Methods 0.000 description 1
- 235000019163 vitamin B12 Nutrition 0.000 description 1
- 239000011715 vitamin B12 Substances 0.000 description 1
- 239000011800 void material Substances 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
- 238000001262 western blot Methods 0.000 description 1
- 210000005253 yeast cell Anatomy 0.000 description 1
- DGVVWUTYPXICAM-UHFFFAOYSA-N β‐Mercaptoethanol Chemical compound OCCS DGVVWUTYPXICAM-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/745—Blood coagulation or fibrinolysis factors
- C07K14/75—Fibrinogen
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0014—Skin, i.e. galenical aspects of topical compositions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/10—Anti-acne agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N7/00—Viruses; Bacteriophages; Compositions thereof; Preparation or purification thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Dermatology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Zoology (AREA)
- Genetics & Genomics (AREA)
- Biochemistry (AREA)
- Wood Science & Technology (AREA)
- Epidemiology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Pain & Pain Management (AREA)
- Gastroenterology & Hepatology (AREA)
- Hematology (AREA)
- Biophysics (AREA)
- Rheumatology (AREA)
- Molecular Biology (AREA)
- Toxicology (AREA)
- Microbiology (AREA)
- Immunology (AREA)
- Virology (AREA)
- Biotechnology (AREA)
- General Engineering & Computer Science (AREA)
- Biomedical Technology (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Peptides Or Proteins (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
Description
本発明によるフラグメント、単離された核酸分子、ベクターおよび宿主細胞から選択される少なくとも1つの化合物;および
好ましくは、乾癬および/または座瘡から選択される皮膚炎症性疾患、好ましくは、座瘡の治療および/または予防に使用される別の薬剤
を含んでなる組合せ物に関する。
別の定義がされない限り、本明細書に使用される総ての技術用語および科学用語は、本発明が属する技術分野の熟練者により共通に理解されているものと同じ意味を有する。
多くの病原性細菌に関して、宿主細胞の侵襲は、特異的リガンドを認識する細菌表面タンパク質またはアドヘシンにより媒介される。ブドウ球菌および連鎖球菌属などの皮膚関連細菌は、宿主細胞外マトリックス成分(ECM)と特異的に結合してそれらの標的細胞への接着を促進し、続いて定着および感染を誘発する、MSCRAMM(microbial surface components recognizing adhesive matrix molecules)と呼ばれる多数の細胞表面アドヘシンを発現する(Patti 1994)。宿主ECM成分は、多くの病原体が組織への定着および感染の開始のために用いている理想的な微生物接着標的である。
フィブリノゲンのサブユニットBβの配列から始め、本発明者らは、アクネ菌の接着タンパク質Pfgと結合することができ、従って、その標的タンパク質(フィブリノゲン)および宿主皮膚細胞へのアクネ菌の接着を阻害することができる特定のフラグメントを同定した。
別の側面において、本発明は、本発明によるフラグメントをコードする単離された核酸分子に関する。
本発明者らは、本発明のフラグメント、好ましくは、配列番号2、5および7〜13および47に相当するアミノ酸配列を有するフラグメントがアクネ菌のPfg接着タンパク質を認識してそれと結合し、従って、その標的リガンド(フィブリノゲン)および宿主皮膚細胞へのアクネ菌接着を阻害することを実証した。
本発明によるフラグメント、単離された核酸分子、ベクター、および宿主細胞から選択される少なくとも1つの化合物;および
好ましくは、乾癬および/または座瘡から選択される皮膚炎症性疾患、好ましくは座瘡の治療および/または予防のために使用される別の薬剤
を含んでなる、組合せ物に関する。
細菌株および増殖条件
アクネ菌6919株は、アメリカン・タイプ・カルチャー・コレクション(マナサス、VA)から入手し、アクネ菌RONおよびPIEは、関節感染患者から単離した。総ての株を嫌気条件下、補強クロストリジウム液体および固体培地(RCM)(Difco Laboratories、デトロイト、MI)中で増殖させた。アクネ菌を細菌保存株からRCM寒天プレートに移し、GasPak(商標)EZ嫌気容器システム(Becton Dickinson & Co、Sparks MD、USA)を使用することにより、嫌気条件下で5日間インキュベートした。単一コロニーを100mlのRCMに移し、上記のように増殖させた。次に、細菌懸濁液を最終10%のグリセロールの存在下、−80℃で凍結保存した。この保存株は「スタートストック」と呼ばれ、総ての実験に使用した。通常培養では、100mlのRCMまたは0.1%Tween80を添加したRCM(RCM+T80)を使用し、細菌を37℃で5日後に、4℃で10分間、7,000×gで遠心分離することにより採取した。ペレットをプールし、約30mlの冷PBSで洗浄し、再び上記のように遠心分離した。最後に、細菌ペレットをPBS[1.5mM KH2PO4、2.7mM Na2HPO4.7H2O、0.15M NaCl(pH7.4)]に懸濁させた(培養物容積から1:10)。細菌はまた、5%ヒツジ血液を補足したコロンビア寒天上でも、上記のように嫌気条件下、37℃で5〜8日間増殖させた。細菌をPBS中でばらばらにし(3mlのPBS/ペトリ皿)、表面タンパク質抽出に使用した。大量の培養物の場合、5日経過したアクネ菌のRCM培養物200mlを、予め37℃で平衡化した2リットルのRCMに対する接種物として使用した。嫌気条件を確保するために、培養物にN2を10分間大量に流し、封止した。2時間ごとに、10mlの培養物を採取して600nmでの吸光度およびpHを測定し、上記のように培養物にN2を流した。細菌を10分間、7,000×gで遠心分離し、ペレットをPBSに再懸濁させた。全表面タンパク質抽出物を以下のように得た。
表面タンパク質をPBS単独で、または2%SDSの存在下、60℃で20分間もしくは1%LiClの存在下、45℃で2時間、加熱抽出した(Shen 1993)。4℃、20分間、16,000×gでの遠心分離により細菌を除去した。過剰なSDSおよびLiClはPBSに対する透析下で除去した。得られた溶液をアクネ菌加熱抽出物(PAHE)と呼び、濃縮のため、4℃、撹拌下で1時間、80%飽和での硫酸アンモニウム沈降を施した。沈澱したタンパク質を4℃、30分間、22,000×gでの遠心分離後に取り出した後、PBSに再懸濁させ、PBSに対して徹底的に透析した。このタンパク質溶液を濃縮アクネ菌加熱抽出物(cPAHE)と呼んだ。タンパク質濃度を、Peterson(Peterson 1983)により記載された、標品としてBSAを用いるローリー法により決定した。
cPAHE、精製Pfgおよび市販のECMリガンドを、PBS中に1〜10mg/mlの濃度に調整し、4℃で一晩、[74mM四ホウ酸ナトリウム、60mMホウ酸(pH8.8)]に対して透析した。全アクネ菌を上記のようにPBS中に回収し、ペレットをホウ酸バッファーに再懸濁させた。この操作を2回繰り返した。タンパク質および全細菌を外的標識試薬スルホ−N−ヒドロキシスクシンイミド(NHS)−ビオチン(Sigma)を1mgのタンパク質に対して250μgのNHS−ビオチンの比率で用い、4℃で4時間、転倒撹拌しながらインキュベートした。反応を、1M NH4Clを加えることにより停止させた。余分なビオチン−NHSは、タンパク質溶液については4℃でPBSに対する透析によって、全細菌については遠心分離によって除去した。ビオチン化タンパク質調製物を−80℃で保存し、ビオチン化細菌を使用前に+4℃で保存した。ビオチン化細菌の調製物は調製後5日以内に使用した。
アクネ菌とリガンドの間の相互作用を特性評価するために、本発明者らは、定量的および定性的アッセイでビオチン化分子を使用した。アッセイの第1セットでは、標識タンパク質としてECMリガンド(フィブリノゲン、コラーゲンI、IV、VIおよびVIII)をビオチンとともに使用した。アッセイの第2セットでは、アクネ菌表面タンパク質(総抽出物および精製Pfg)をビオチン化した。定量分析については、非標識タンパク質を50mM炭酸水素塩、pH9.6バッファーに希釈して0.01〜50μg/mlの範囲のタンパク質濃度とし、次に、4℃で一晩、96ウェルポリスチレンプレートに固定化した。これらのウェルを0.2mlの0.05%Tween20含有PBS(PBS−Tween)で3回すすいだ。ビオチン化タンパク質(PBS−Tween中0.01〜16μg/ml)をウェルに加え、室温で1時間インキュベートした。ウェルを0.2mlのPBS−Tweenで3回すすいだ。ストレプトアビジンにコンジュゲートしたペルオキシダーゼ(PBS−Tween中0.5μg/ml)を加え、室温で30分間インキュベートした。洗浄後、結合したペルオキシダーゼを、発色性ペルオキシダーゼ基質ABTSを用いて検出した。定性分析については、非標識タンパク質(1レーン当たり10〜75μg)をSDS−PAGEにより分離し、次に、従前に記載されているように(Towbin、1979)ニトロセルロース膜(孔径0.45μm)に転写した。その後、膜を5%BSA、0.05%Tween20を含有するPBS(PBTバッファー)中、4℃で一晩、飽和させた。結合活性は、20mlのビオチン化タンパク質(0.1μg/ml)含有PBTとともに室温にて2時間、膜をインキュベートした後、PBTで3回洗浄することにより検出した。結合したビオチン化タンパク質は、ストレプトアビジンにコンジュゲートしたペルオキシダーゼ(PBT中0.5μg/ml)とともに室温で1時間、膜をインキュベートすることにより検出した。洗浄後、結合したペルオキシダーゼ活性を、CoCl2およびH2O2の存在下で3,3’−ジアミノベンジジンを用いて検出した(HarlowおよびLane、1988)。
13cm pH 10−3固定化pH勾配(IPGストリップ)(Amersham−Bioscience、スウェーデン)を、20℃で13時間、200μgのcPAHE由来タンパク質を含有したIEF溶液(8M尿素−2%CHAPS(wt/vol)−0.5%IPGバッファーpH4−7(vol/vol)−0.002%ブロモフェノールブルー)250μlで再水和物させた。等電点電気泳動は、Ettan IPGphorシステム(Amersham−Pharmacia、スウェーデン)を用い、20℃にて、1時間200V、1時間500V、30分8000V(勾配モード)、および3時間8000Vの4段階で行った。二次元に関しては、このIPGストリップを15分間、6M尿素−30%グリセロール(wt/vol)−0.05Mトリス−HCl−2%SDS(wt/vol)−0.002%ブロモフェノールブルー−100mM DTTの溶液中で、および15分間、6M尿素−30%グリセロール(wt/vol)−0.05Mトリス−HCl−2%SDS(wt/vol)−0.002%ブロモフェノールブルー−400mMヨードアセトアミド溶液中で揺動することにより平衡化した。次に、このIPGストリップを12%SDS−PAGEゲルに載せた。一般に、2つのゲルを70mAの一定電流で6時間、並行して泳動した。タンパク質を、グルタルアルデヒド工程を用いない銀染色によりゲル上で検出した。目的のスポットは、従前に記載されているようにBOAを用いて可視化した。銀染色されたゲルおよび膜を照合し、目的のスポットをゲルから切り出した。
二次元タンパク質スポットのゲル内トリプシン消化を、50%(vol/vol)アセトニトリルを含有する25mM炭酸水素アンモニウムバッファー(pH8.0)中で行った後、真空乾燥させた(Jonsson 2001)。再水和を0.02g/lのシーケンシンググレードの改変ブタトリプシン(Promega、マディソン、ウィスコンシン州)を含有する50mM炭酸水素アンモニウムバッファー(pH8.0)で行い、37℃で18時間消化を行い、0.4%(vol/vol)トリフルオロ酢酸を加えることにより停止させた。回収したペプチド溶液をマトリックスフィルム上にスポットし、室温で乾燥させた。サンプル付着物を純水ですすいだ後、337nm N2レーザーを備えたMALDI質量分光光度計(Applied Biosystems、Voyager DE super STR)内に挿入した。高速蒸発マトリックスフィルムは、アセトン中、4−ヒドロキシ−α−シアノケイ皮酸(Sigma)の飽和溶液を使用することにより、従前に記載されているように(Vorm、1994)作製した。総てのスペクトルの内部質量較正は、ブタトリプシン自己消化ペプチドを用いることにより達成した。ペプチド質量はSWISS−PROTおよびGenpeptデータベースで検索した。
cPAHE(16ml中90mg)を室温にて10分間5,000×gで遠心分離し、不溶性の材料を除去し、バッファーA[25mMトリス(pH8.0)]で平衡化したUNOsphereQ陰イオン交換カラム(2.5×10cm)(BioRad)にて流速24ml/時で実施するイオン交換クロマトグラフィーにより分画した。非結合タンパク質をバッファーA(24ml)で洗浄し、結合したタンパク質を、バッファーA+2M NaClを用い、0〜160(28ml)、160〜200mM(40ml)で段階的に溶出させた。Fg結合活性を含有する画分(1.5ml)をプールし、4℃で、バッファー0.1 M NH4HCO3、pH8.0に対して徹底的に透析することにより脱塩し、凍結乾燥させた。Pfgの最終精製は、0.1M NH4HCO3、pH8.0で平衡化したSephacryl S−300 HRカラム(1×120cm)(GE Healthcare)に、3mgのタンパク質を5mlの容量でロードすることにより、流速6ml/時(1.5ml/画分)にて24時間行った。Fg結合活性を含有する画分(1.5ml)をプールし、−20℃で保存した。
フィブリノゲンのどの部分がアクネ菌表面タンパク質により認識されるのか評価するために、タンパク質骨格の完全性を保持するためのグリカン部分を酵素的に除去した。フィブリノゲンはN結合およびO結合両方のグリカンを含有する糖タンパク質であることが示されているので(Debeire 1985;Reid Townsend 1982;L’Hote 1996)、グリカンを除去するためのエンドグリコシダーゼ、N−グリカナーゼおよびO−グリカナーゼを使用した。使用した酵素および試薬は総てProZyme(Prozyme、サンリアンドロ、カリフォルニア州)から購入した。精製市販ヒトおよびウシFg(100μg;Sigma)を、[0.4%SDS、200mM β−メルカプトエタノール、50mMリン酸ナトリウム(pH7.0)]を含有するバッファー中、5分間100℃で変性させ、室温で冷却した後、3%NP−40を加えた。N結合グリカンを除去するため、大腸菌(Escherichia coli)中のフラボバクテリウム・メニンゴセプチカム(Flavobacterium meningosepticum)リコンビナントPNGase F(N−グリカナーゼ)0.5Uを加え、37℃で24時間インキュベートした(最終容量50μl)。O結合グリカンを除去するため、Galβ(1−3)GalNAcコアだけがタンパク質と結合した状態で残るまで単糖類が除去されなければならないので、まず、変性ヒトフィブリノゲンを0.25Uのコレラ菌シアリダーゼA、ウシ精巣β−ガラクトシダーゼ、およびジャックビーンミールβ−N−アセチル−グルコサミニダーゼの存在下、37℃で3時間インキュベートした。次に、大腸菌中の肺炎連鎖球菌リコンビナント エンド−α−N−アセチル−ガラクトサミニダーゼ(O−グリカナーゼ)0.5Uを加え、37℃で24時間インキュベートした。酵素反応は、サンプルに電気泳動サンプルバッファーを加え、100℃で3分間変性させることにより停止させた。次に、N−およびO−脱グリコシル化Fgを、ビオチン化Pfgとの結合能に関して上記の結合アッセイを用いて試験した。脱グリコシル化反応は、クーマシーブルー染色の後のSDS−PAGE上で、脱グリコシル化前と後のフィブリノゲンの移動度のシフトによりモニタリングした。モニタリングはまた、下記のようにRCA−Iおよびジャカリン植物レクチンを用いることでも行った。
ヒトフィブリノゲンのBβ−サブユニットのフラグメントは、10%ウシ胎仔血清を添加したダルベッコの改変培地で培養したヒト肝細胞腫細胞株Hep−G2から抽出した全RNAからRT−PCRにより得た。簡単に述べれば、全RNAをTRIzol試薬(Invitrogen Ltd、ペイズリー、UK)を製造者の説明書に従って用いて単離し、DNアーゼI(Roche Molecular Biochemical)で処理した。RNA濃度をサンプルのA260値により決定した。相補的DNAを2μg全RNAからオリゴ(dT)プライマーおよび200Uのスーパースクリプト(商標)II逆転写酵素(Invitrogen Ltd.、ペイズリー、UK)を用いて作製し、その後、標準的PCR反応の鋳型として使用した。0.5UのハイフィデリティPlatinum(登録商標)Pfx DNAポリメラーゼ(Invitrogen Ltd.、ペイズリー、UK)を用い、最終容量25μlで、94℃15秒、50℃30秒および68℃45秒に設定した合計35サイクルのサイクル条件により標準的増幅を行った。プライマーは、フィブリノゲンcDNAの318、441、462および462bpフラグメントを増幅した。
大腸菌BL21DE3pLys株を種々のGST−フィブリノゲン−フラグメント融合タンパク質を生産するために使用した。細菌を100μg/mlのアンピシリンおよび40μg/mlのクロラムフェニコールを添加したLB培地(10ml)で一晩増殖させ、1lのLB培地への播種に使用した。30℃でインキュベートした培養物がOD650=0.7に達した際に、0.5mMイソプロピルα−D−チオガラクトシド(IPTG)を加えることによりタンパク質発現を誘導し、培養物をさらに4時間拡大増殖させた。培養物を5000×gで10分間の遠心分離により採取した。ペレットをPBSで1回洗浄し、溶解バッファーTEN−T(20mMトリスHCl pH:7.5、EDTA 0.5mM、NaCl 150mM、トリトンX−100 1%)に再懸濁させ、氷上バーストにより30秒音波処理を施し、DTT 2mM、N−ラウリルサルコシン1.5%を添加した。この溶解液を20分、20000×gで遠心分離し、上清を廃棄した。GST融合タンパク質を含有する不溶性のペレット画分をTEN−Tバッファー+8M尿素に溶かし、この溶液を20分、20,000×gでの遠心分離により明澄化した。可溶化したタンパク質をProtino GST/4Bカラム(Macherey&Nagel)にロードし、バッファー50mMトリス、10mMグルタチオン、pH8.0を用いて溶出させた。組換えペプチドを含有する画分(ドデシル硫酸ナトリウム−ポリアクリルアミドゲル電気泳動により決定)をプールした。最初の工程で、利用の直前に上清をPBSに対して透析し、尿素を除去した。
不死化ヒトケラチノサイト細胞株HaCaT、線維芽細胞MRC5は、1mMピルビン酸ナトリウムを含むダルベッコの改変イーグル培地−グルタマックス−I(DMEM)で増殖させた。不死化ヒト単球細胞株ThP1は、ロズウェルパーク記念研究所1640培地−グルタマックス−I(RPMI)で増殖させた。記載のように(Life Technologie)、37℃、5%CO2を含有する加湿雰囲気下、DMEMおよびRPMIには、0.1%および10%熱失活ウシ胎仔血清(Invitrogen)、および抗生剤/抗真菌剤溶液(10U/mlペニシリン、10μg/mlストレプトマイシン、0.25μg/mlアムホテリン)を添加した。初代ヒトケラチノサイト(NHDK)および線維芽細胞(HDF)をKGM−GoldおよびFGM−2 Bulletキットで、製造者(Lonza)によりそれぞれ記載されているように増殖させた。不死化細胞株に、マイコプラズマ感染症の不在を評価するために慣例の検査をした。
細菌懸濁液を600nmで所望の濃度に調整し、0.87〜7μMの範囲の終濃度のペプチドFg1およびFg2で37℃にて1時間前処理し、2時間、PBS SVF2%の溶液で予め飽和させたセルに付着させた。37℃で1時間のインキュベーションの後、結合していない細菌をPBSで3回洗浄することにより除去し、固定された細菌を0.5μg/mlのストレプトアビジン−ペルオキシダーゼ溶液により30分間検出する。3回の 洗浄の後、検出された細菌を基質ABTS(2,2’−アジノビス[3−エチルベンズチアゾリン−6−スルホン酸]−ジアンモニウム塩)により30分間現像し、410nmで読み取る。
総ての細胞株(5.104〜105細胞/ウェル)を96ウェルプレート(Corning Costar、ブリュトマ、フランス)に播種し、従前に記載されているように処理した。刺激後、細胞をPBSで3回洗浄し、100μl/ウェルの5μM DHE(O2 ・−の決定のため)または5μM H2−DCFDA(H2O2の決定のため)とともに30分間、従前に記載されているようにインキュベートし、蛍光強度を5時間にわたり、1時間毎に記録した。蛍光励起/発光極大はDHE:480/610nmおよびH2−DCFDA:507/525nmであった。実験の終了時に、接着細胞の数を下記のようにクリスタルバイオレットアッセイにより評価した。O2 ・−、およびH2O2は、Fusion分光蛍光計(PackardBell、パリ、フランス)での分光光度蛍光測定法によりアッセイした。ROSのレベルを以下のように各サンプルで計算し、任意単位(A.U.)として表した:反応性酸素種率(任意単位/分/106細胞)=(T5hでの蛍光強度[任意単位]−Toでの蛍光強度[任意単位]/300分/クリスタルバイオレットアッセイにより測定された接着細胞の数。
96ウェルプレートにて接着細胞の数を決定するためにクリスタルバイオレット染色を使用した。簡単に述べれば、試験化合物とともにインキュベートした後、培養培地を廃棄し、細胞を0.05%クリスタルバイオレット溶液(Sigma)とともに室温で30分間インキュベートした。PBSで洗浄後、100%メタノールを加え、吸光度をELISAマルチウェルリーダーにて540nmで分光光度測定法により測定した。96ウェルプレートにて細胞生存率を試験するためにMTT(1−(4,5−ジメチルチアゾール−2−イル)−3,5−ジフェニルホルマザン)アッセイを行った。細胞を細胞培養培地中0.2%MTT溶液とともに37℃で4時間インキュベートした。次に、MTT溶液を廃棄し、DMSOを加えて、生細胞で産生されるMTT−ホルマザン結晶を可溶化した。十分に混合した後、540nmで吸光度を測定した。
ヒトIL−1β、IL−8、IL−12、hBD−2、およびTNF−αタンパク質濃度は、刺激した細胞の上清において、種々のELISAセットキット(座瘡試験用にはeBioscienceからのReady−Set−Goキット、乾癬試験用にはR&D SystemsからのDuoセットIL−8キットおよびPeprotechからのBD−2 Human Development(hBD−2))を製造者の説明書に従って使用して測定した。本発明者らは、標準曲線のために組換えヒトIL−1β、IL−8、IL−12およびTNF−αの連続希釈液を使用した。540nmの波長補正で450nmにて光学密度を決定した。
試験群からのデータ間の差の統計的有意性は、対応のあるスチューデント検定により分析した。P≦0.05のレベルは有意であると認められる。統計的有意性はそれぞれ*(P≦0.05)、**(P≦0.01)、および***(P≦0.001)で示す。
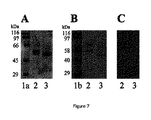
真核生物リガンドによるアクネ菌細胞表面タンパク質の同定
ECMリガンドにより認識されるアクネ菌表面タンパク質を同定するために、本発明者らは皮膚関連細菌により認識されるコラーゲンおよびフィブリノゲンなどの最も一般的なECMタンパク質を使用した。アクネ菌株をその推定表面タンパク質の発現を可能とするために3種類の異なる培地上で増殖させ、それらのタンパク質を、細菌懸濁液を塩化リチウムの存在下または不在下で加熱することにより抽出した。表面タンパク質を同定するために、アクネ菌の全タンパク質加熱抽出物を電気泳動により分離し、銀染色により検出した(図1B)。14〜100kDaの範囲のいくつかのバンドが検出され、見掛けの分子量が58kDaの1つのタンパク質は全タンパク質抽出物のおよそ>90%を占めた(図1B、レーン2)。RCMおよびRCM0.1%Tween20培地の間で大きな差は見られなかったが、加熱抽出単独よりもリチウムの存在下でより多くのタンパク質が抽出されるものと思われる。アクネ菌を、血液を濃縮した固形培地上で増殖させた場合には、両抽出物に58kDaが存在したが、リチウム加熱抽出物にのみ約90kDのタンパク質バンドと約20kDaの別のバンドが存在した(図1B、レーン3)。次に、推定アクネ菌表面アドヘシンを、ビオチン化リガンドを用いたウエスタンブロット法により同定した(図1A)。本発明者らは、58kDaタンパク質が、加熱抽出物およびリチウム加熱抽出物の両方で、用いられた増殖培地に依存せずにビオチン化フィブリノゲンにより認識されたことを見出した(図1A、レーン2)。コラーゲンによる認識は見られなかった(図1、レーン2)。コラーゲンVIでごくわずかで再現性のない認識が見られたが、特有なものとは考えられなかった。リチウム抽出物では認識の強度が高いことに着目することが興味深く、この方法を用いた回収がより良いことが示唆される。また、アクネ菌が異なる培地上で増殖していることが、認識される表面タンパク質の発現に劇的な影響を及ぼすことはなかった。これらの結果に従い、アクネ菌をRCM培地で増殖させ、リチウムの存在下で表面タンパク質を加熱抽出した。これらの結果を確認するために、アクネ菌全表面タンパク質をポリスチレンプレート上に固定化し、ビオチン化FgおよびコラーゲンIでプローブした(図2)。まず、数濃度のタンパク質抽出物を試験し、フィブリノゲンに対する結合活性がウェル当たり約6.25μg/mlタンパク質でプラトーに達すること、一方、コラーゲンIに関しては結合活性が検出されなかったことが示された。この結果を確認するために、ウェル当たり25μg/mlのタンパク質を固定化し、種々の量のビオチン化FgおよびコラーゲンIで試験した(図2B)。プラトーに達するフィブリノゲンとの強い結合活性が示され、認識される部位の飽和の可能性が示唆された。コラーゲンIとの結合活性は検出されず、フィブリノゲンとアクネ菌タンパク質抽出物の間の特異的相互作用が示された。これらの結果は、従前に示されている定性結果と一致する。58kDaタンパク質はまだ記載されたことがなく、従って、その特性評価をさらに進めた。58kDaはアクネ菌の表面から抽出されたフィブリノゲン結合タンパク質であることから、PFgと命名した。
アクネ菌表面抽出物を二次元ゲル電気泳動により分離した。一次元目は、10〜3の広い範囲にわたるIEFであった。二次元目は、12.5%SDS−PAGEで行い、その後、タンパク質を銀染色により検出した(図3A)。分離の後におよそ50のタンパク質スポットが見られた(図3A)。Pfgに相当するスポットの位置を決定するために、第2のゲルで並行泳動し、ビオチン化フィブリノゲンを用いてウエスタンリガンドブロットアッセイを行った(図3B)。Pfgは、2〜3個の主要スポットの下に見られ(図3B、レーン3)、銀染色ゲルにおけるスポットと一致していた(図3A、レーン3)。総てフィブリノゲンにより認識されるいくつかのスポットの存在は、Pfgがグリコシル化されているであろうことを示唆し、従って、一次元目でいくつかの等電点下で分離した。対象とするタンパク質スポットを切り出し、ゲル内消化後のペプチド混合物のMALDI−ToFによって同定した。図3Cは、図3Aに矢印で示したタンパク質スポットから生成されたトリプシンペプチド混合物のMALDI質量スペクトルを示す。実験的に得られた22のトリプシンペプチド質量は、予想ペプチド質量と、アミノ酸配列の57%にわたる0.1Da内で一致することが判明した。タンパク質配列データベース検索は、このタンパク質をアクネ菌仮想タンパク質、推定接着またはS−層タンパク質YP_056792(表3)(遺伝子ID 2933198、遺伝子座タグ PPA2127)の遺伝子の産物として同定した(Bruggemann 2004)。PPA2127遺伝子産物は、C末端に反復するプロリンおよびトレオニンリッチ領域を有する405アミノ酸の仮想タンパク質(プロリン−トレオニン反復タンパク質[PTRP])である。PTRPのアミノ酸配列分析は、C末端領域の324〜355番におけるモチーフPro−ThrまたはPro−Lysの16タンデムリピートの存在を示した。このタンパク質の理論的分子量は41.7kDaである。タンパク質配列分析によれば、ソルターゼの潜在的細胞アンカーモチーフに相当し、かつ、アクネ菌の膜上に存在する表面タンパク質との一致を支持する、C末端の400番におけるLPXTGモチーフの存在が明らかとなった。
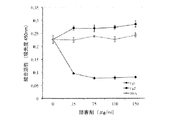
典型的なPfg精製の結果を表4にまとめる。大容量のアクネ菌リチウム抽出物の塩沈澱は、タンパク質の濃縮および得られる濃縮抽出物の比活性の若干の増加(1ユニットのタンパク質当たり1.45倍のフィブリノゲン結合活性)をもたらした(表4および図4C、D レーン3)。濃縮アクネ菌表面タンパク質を陰イオン交換カラムで分画した(図4A)。このステップで180mM濃度のNaClから始め、多量のタンパク質夾雑物が除かれた。フィブリノゲン結合活性を含有する画分は、160mMで始まるNaCl濃度で溶出された(図4A)。この画分はいくつかのわずかなタンパク質夾雑物とともに大きな割合のPfgを含有する(図4CおよびD、レーン4)。Pfgの最終精製はSephacryl高分解ゲル濾過により達成され、その際に総てのタンパク質夾雑物が完全に除去された(図4BおよびC、D、レーン5)。この工程の後に得られた純粋なPfgの量は0.23mgであり、比活性は1840U/mgであった(表4)。
Pfgがフィブリノゲンにより認識されることが示されたので、このECMリガンドをこの相互作用の性質を分析するために使用した。まず、フィブリノゲンの精製Pfgにより認識される能力を分析した(図5)。ヒトおよびウシFg(hFg、bFg)をポリスチレンプレートに固定化しビオチン化Pfgの結合活性を測定した。PfgのhFgおよびbFgに対する結合は用量依存的であり、hFgに対してより高い親和性を有することが示された。ウシ血清アルブミンを、結合活性を示さない陰性対照として使用した(図5A)。FgのどのサブユニットがPfgにより認識されるかを決定するために、Fgを電気泳動により分離し、結合アッセイを行った(図5B、C、D)。hFg(図5D、レーン3)およびbFg(図5D、レーン4)がPfgにより認識されることが示された。さらに、BβサブユニットはhFgおよびbFgの両方において強く認識され、hFgにおいてはAαサブユニットのみが認識されると思われる。γサブユニットならびに対照として用いた血清アルブミンに対する認識は見られなかった(図5D、レーン2)。これらの結果は、固定化フィブリノゲンで得られた結果と一致し、PfgのFgに対する特異的認識を示した。フィブリノゲンはN結合グリカンおよびO結合グリカンの両方を含有する糖タンパク質であることが示されている(Debeire 1985;Reid Townsend 1982;L’Hote 1996)。糖タンパク質のどの部分がアクネ菌表面タンパク質による認識に関与するか決定するために、精製フィブリノゲンをPNGase F−グリコシダーゼおよびO−グリコシダーゼで処理して、タンパク質骨格からそれぞれN結合グリカンおよびO結合グリカンを特異的に除去し、アクネ菌表面タンパク質抽出物により認識されるその能力に関して試験した(図6および7)。N結合グリカンを除去した後には、フィブリノゲンはなおPfgにより強く認識された(図6B、レーン3および5)。並行して、脱グリコシル化を、電気泳動分離およびクーマシーブルー染色の後の移動度のシフトの可視化により(図6A、レーン3および5)、また末端位のβ結合ガラクトシル残基を認識できるRCA−I植物レクチンを使用することにより評価した(図6C)(Green、1987)。本発明者らは、脱グリコシル化されたFgはRCA−Iレクチンによってはもはや認識されなかったことを示した(図6C、レーン3および5)。同じ結果がO結合グリカンを除去した後にも得られ(図7B、レーン3)、脱グリコシル化対照は、移動度シフトにより(図7A、レーン3)、またO結合グリカン上のGalβ(1−3)残基を特異的に認識しているジャカリン植物レクチン(Tachibana 2006)により(図7C、レーン3)検出されるように、酵素処理は総ての炭水化物を除去したことを示した。これらの結果は、フィブリノゲンのタンパク質骨格がアクネ菌表面タンパク質による認識プロセスに関与していたことを示す。
ヒトフィブリノゲンのBβサブユニットを4つの同等配列(Fg1、Fg2、Fg3、Fg4)に任意に分割し、これらをヒト肝細胞からRT−PCRにより得た。EcoRIおよびXhoIの制限部位を含有するアンプリコンを精製した後、これらのFgインサートの生産のためのプラスミドpBSKにクローニングし、それらをpGEX−4F−2発現プラスミドにクローニングした(図8A)。組換え大腸菌クローンに対してIPTG誘導を行い、全タンパク質を電気泳動により分析した。Fg1およびFg2、Fg3、Fg4のそれぞれに関して37kDaおよび43kDaの見掛けの分子量の組換えタンパク質が誘導後に過剰発現された(図8B)。ビオチン化Pfgとの接触はFg1のみが認識されたことを示した(図8C)。
Fg1のみがPfgを認識できることが示されたことから、ビオチン化Pfgを種々の濃度の精製Fg1で前処理し、固定化されたフィブリノゲンを認識するその能力を試験した。Fg2およびBSAを陰性対照として使用した(図9)。Fg1はPfgとヒトフィブリノゲンの間の認識を劇的に低下させたが、Fg2およびBSAは低下させなかったことが示された。
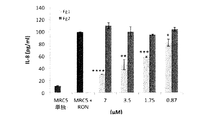
全アクネ菌をビオチン化により標識し、ペプチドで前処理し、または前処理せずに、種々の細胞株と接触させた。固定されていない細菌を除去した後、接着活性をストレプトアビジン−ペルオキシダーゼコンジュゲートおよび発色性基質を使用することにより、分光光度的に測定した。全ロットのFg1 Fg2産物およびペプチドを、本発明で使用する5つの細胞株で細胞傷害性を試験した。Fg1およびFg2は総ての細胞株で細胞傷害活性を示さないことが示された(図10)。
Fg1組換えペプチドの有効性を評価するために、前処理したアクネ菌6919、RONおよびPIE株により刺激されたHaCaT細胞NHDK、THP−1、MRC5およびHDFによるO2 ・−およびH2O2の生産を評価した。生産されたROSの量を無処理細菌で刺激した細胞により生産されたものと比較した。生産ベースラインは、無刺激細胞でROSを測定することにより得た。IL−1β、IL−8、IL−12およびTNF−αの生産もまた、上記に挙げた総ての条件で測定した。ROSの生産の測定は、単層細胞上で直接、特異的蛍光色素の存在下で分光光度蛍光測定により行った。並行して、サイトカイン生産の測定を細胞培養上清で行った。
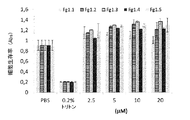
106残基を含有するFg1アミノ酸配列を、30〜36の間のアミノ酸残基を含有する3つの非オーバーラップ小配列に分割した(小Fg1関連ペプチド;Fg1.1、Fg1.2、およびFg1.3)。切断領域における推定活性の損失を避けるため、この切断部位から2つの切断領域でオーバーラップする2つの配列を作製した(Fg1.4およびFg1.5)(図16)。
I)細胞を、2.5〜20μMの範囲の終濃度のFg1.1、Fg1.2、Fg1.3、Fg1.4、およびFg1.5 小ペプチドで37℃にて1時間予め前処理したアクネ菌株により刺激する(37℃で18時間);
II)細胞を、まず、2.5〜20μMの範囲の終濃度の5つの小ペプチドで37℃にて24時間で前処理し、アクネ菌株により刺激した(37℃で18時間)。
Fg1およびFg2フラグメントの抗炎症特性をより一般に評価するために、LTA(リポテイコ酸、LPS(リポ多糖)およびPGN(ペプチドグリカン)で刺激したいくつかの細胞株(NHDK、THP−1、およびHDF)によるH2O2の生産をFg1またはFg2の存在下または不在下で測定した。
小フラグメントFg1.1.1、Fg1.1.2、Fg1.1.3、Fg1.1.4およびFg1.1.6の抗炎症性活性を評価した。
抗炎症応答に対するFg1.1.1ペプチドのイン・ビトロ有効性を示すこれまでの結果に従い、本発明者らは、イン・ビボ炎症モデルにおいてアクネ菌により誘導される炎症反応を阻害するその能力を試験した。
乾癬は、表皮ケラチノサイトの病態生理学的応答を誘発するTh17リンパ球浸潤により媒介される慢性炎症性疾患である。これに関して、ケラチノサイトは、炎症性応答に寄与することによってそれらの生物学的特性の調節に寄与する多くのサイトカインの標的である。このケラチノサイトの応答は、それらの分化および移動能の変動、ならびにサイトカイン、ケモカインおよび抗微生物ペプチドにより特徴付けられ、とりわけ、IL−8、hBD−2、S100A7、IL−12RA2の分泌が良好なマーカーとなる。
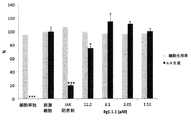
図30は、基底状態で、正常ヒト表皮ケラチノサイト(NHEK)が少量のIl−8を放出したことを示す(細胞単独)。この放出は、3つのサイトカインの組合せで処理することにより大幅に増加した(刺激細胞)。参照としてのJak阻害剤I(陽性対照)は、この会合の刺激効果を強く阻害した(67%阻害)。
図31は、基底状態で、正常ヒト表皮ケラチノサイトは極めて少量のβ−デフェンシン−2 タンパク質(hBD−2)を放出したことを示す(細胞単独)。この放出は、Il−17、TNF−αおよびOSMの組合せで処理することにより大幅に増加した(刺激細胞)。参照としてのJak阻害剤I(陽性対照)は、この会合の刺激効果を強く阻害した(80%阻害)。
Claims (14)
- 最適なグローバルアラインメントの後に配列番号1と少なくとも90%の同一性を有するアミノ酸配列を含んでなる、単離されたポリペプチド、または、最適なグローバルアラインメントの後に配列番号2、5および7〜13および47のいずれか1つと少なくとも90%の同一性を有するアミノ酸配列を含んでなる、そのフラグメントを含んでなる、皮膚炎症性疾患の治療および/または予防に使用するための薬剤。
- 配列番号1を含んでなる単離されたポリペプチドまたは配列番号2、5および7〜13および47のいずれか1つを含んでなる、そのフラグメントを含んでなる、請求項1に記載の薬剤。
- 前記ポリペプチドが、配列番号2、5および7〜13および47、または最適なグローバルアラインメントの後に配列番号2、5および7〜13および47の1つと少なくとも90%の同一性を有するポリペプチドから選択される、請求項1に記載の薬剤。
- 前記皮膚炎症性疾患が、紫外線(UVR)、電磁放射線、アレルゲンへの暴露、または化学刺激物との接触から生じる、皮膚掻痒および発赤を伴う偶発的発疹並びに慢性炎症性皮膚疾患から選択される、請求項1〜3のいずれか一項に記載の薬剤。
- 前記皮膚炎症性疾患が、座瘡である、請求項1〜4のいずれか一項に記載の薬剤。
- 前記ポリペプチドまたはそのフラグメントが、宿主細胞への細菌接着に関与する少なくとも1つの微生物タンパク質のフィブリノゲンとの相互作用を阻害することができ、前記細菌は好ましくはアクネ菌であり、フィブリノゲンは好ましくはヒトフィブリノゲンである、請求項1〜5のいずれか一項に記載の薬剤。
- 前記皮膚炎症性疾患が、乾癬である、請求項1〜4のいずれか一項に記載の薬剤。
- 配列番号7〜12の1つから選択されるアミノ酸配列を含んでなる、配列番号1の5〜15アミノ酸配列のフラグメント、または、配列番号2、5、13および47から選択されるフラグメント、前記フラグメントをコードする単離された核酸分子、前記核酸分子を含んでなるベクター、前記核酸分子または前記ベクターを含んでなる宿主細胞から選択される少なくとも1つの化合物と薬学上許容可能なビヒクルとを含んでなる、医薬組成物。
- 皮膚炎症性疾患の治療および/または予防に使用するための、請求項8に記載の医薬組成物。
- 前記皮膚炎症性疾患が、紫外線(UVR)、電磁放射線、アレルゲンへの暴露、または化学刺激物との接触から生じる、皮膚掻痒および発赤を伴う偶発的発疹並びに慢性炎症性皮膚疾患から選択される、請求項9に記載の医薬組成物。
- 乾癬および/または座瘡の治療および/または予防において使用するための、請求項8に記載の医薬組成物。
- 皮膚炎症性疾患の治療および/または予防における同時、個別または逐次使用のための、
a) 配列番号7〜12の1つから選択されるアミノ酸配列を含んでなる、配列番号1の5〜15アミノ酸配列のフラグメント、または、配列番号2、5、13および47から選択されるフラグメント、
前記フラグメントをコードする単離された核酸分子、
前記核酸分子を含んでなるベクター、
前記核酸分子または前記ベクターを含んでなる宿主細胞から選択される少なくとも1つの化合物;並びに
b) 別の薬剤
を含んでなる、組合せ医薬。 - 前記別の薬剤が、皮膚炎症性疾患の治療および/または予防のために使用される、請求項12に記載の組合せ医薬。
- 前記別の薬剤が、乾癬および/または座瘡の治療および/または予防のために使用される、請求項13に記載の組合せ医薬。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP15305414 | 2015-03-20 | ||
| EP15305414.3 | 2015-03-20 | ||
| PCT/EP2016/056179 WO2016150926A1 (en) | 2015-03-20 | 2016-03-21 | Isolated peptides and fragments thereof from fibrinogen for use as drugs, particularly in skin inflammatory diseases |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2018512844A JP2018512844A (ja) | 2018-05-24 |
| JP2018512844A5 JP2018512844A5 (ja) | 2019-04-25 |
| JP6840086B2 true JP6840086B2 (ja) | 2021-03-10 |
Family
ID=52807757
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2017549280A Active JP6840086B2 (ja) | 2015-03-20 | 2016-03-21 | 薬物として、特に皮膚炎症性疾患において使用するためのフィブリノゲン由来の単離されたペプチドおよびそれらのフラグメント |
Country Status (10)
| Country | Link |
|---|---|
| US (1) | US10323078B2 (ja) |
| EP (1) | EP3270950B1 (ja) |
| JP (1) | JP6840086B2 (ja) |
| CN (1) | CN107636011B (ja) |
| AU (1) | AU2016236297B2 (ja) |
| BR (1) | BR112017020008A8 (ja) |
| CA (1) | CA2979812C (ja) |
| DK (1) | DK3270950T3 (ja) |
| ES (1) | ES2880795T3 (ja) |
| WO (1) | WO2016150926A1 (ja) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN117304303A (zh) * | 2023-07-14 | 2023-12-29 | 杭州恩和生物科技有限公司 | 纤连蛋白截短片段、组合物及用途 |
Family Cites Families (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1004595B1 (en) * | 1989-04-10 | 2003-06-18 | Helix BioMedix, Inc. | Lytic and proliferative peptides and their use as pharmaceutic and phytopharmaceutic agents |
| US5639940A (en) * | 1994-03-03 | 1997-06-17 | Pharmaceutical Proteins Ltd. | Production of fibrinogen in transgenic animals |
| US6783961B1 (en) * | 1999-02-26 | 2004-08-31 | Genset S.A. | Expressed sequence tags and encoded human proteins |
| CA2296792A1 (en) | 1999-02-26 | 2000-08-26 | Genset S.A. | Expressed sequence tags and encoded human proteins |
| CA2453202C (en) | 2001-07-06 | 2012-10-16 | Oregon Health & Science University | Peptides which modulate blood coagulation and methods of use thereof |
| US20040142325A1 (en) * | 2001-09-14 | 2004-07-22 | Liat Mintz | Methods and systems for annotating biomolecular sequences |
| US20070172471A1 (en) * | 2003-04-23 | 2007-07-26 | Hansa Medical Ab | Method for identifying an anti- streptococcal agent and its use for treating streptococcal infections |
| EP1941043B1 (en) * | 2005-10-21 | 2011-04-13 | F. Hoffmann-La Roche AG | Method for the recombinant expression of a polypeptide |
| US20130280820A1 (en) * | 2005-12-16 | 2013-10-24 | Schering Corporation | Biomarkers for psoriasis |
| NZ574653A (en) * | 2006-08-04 | 2012-11-30 | Stb Lifesaving Technologies Inc | Solid dressing for treating wounded tissue |
| WO2008116468A2 (en) * | 2007-03-26 | 2008-10-02 | Dako Denmark A/S | Mhc peptide complexes and uses thereof in infectious diseases |
| CN101618211A (zh) * | 2008-07-03 | 2010-01-06 | 珠海联邦制药股份有限公司 | 一种乙肝多肽疫苗及其应用 |
| EP2310411B2 (en) * | 2008-07-09 | 2019-03-20 | ProFibrix BV | Recombinant fibrinogen |
| US20120052066A1 (en) * | 2008-11-07 | 2012-03-01 | Cesar Calderon | Markers and methods for assessing and treating lupus patients susceptible to photoprovocation |
| EP2550529B1 (en) * | 2010-03-23 | 2021-11-17 | Iogenetics, LLC. | Bioinformatic processes for determination of peptide binding |
| AU2012211537B2 (en) * | 2011-02-02 | 2016-12-08 | Academisch Ziekenhuis Leiden H.O.D.N. Lumc | Anti-carbamylated protein antibodies and the risk for arthritis |
-
2016
- 2016-03-21 ES ES16713796T patent/ES2880795T3/es active Active
- 2016-03-21 JP JP2017549280A patent/JP6840086B2/ja active Active
- 2016-03-21 BR BR112017020008A patent/BR112017020008A8/pt not_active IP Right Cessation
- 2016-03-21 US US15/559,984 patent/US10323078B2/en active Active
- 2016-03-21 EP EP16713796.7A patent/EP3270950B1/en active Active
- 2016-03-21 AU AU2016236297A patent/AU2016236297B2/en active Active
- 2016-03-21 CA CA2979812A patent/CA2979812C/en active Active
- 2016-03-21 WO PCT/EP2016/056179 patent/WO2016150926A1/en active Application Filing
- 2016-03-21 DK DK16713796.7T patent/DK3270950T3/da active
- 2016-03-21 CN CN201680026130.XA patent/CN107636011B/zh active Active
Also Published As
| Publication number | Publication date |
|---|---|
| US20180105574A1 (en) | 2018-04-19 |
| BR112017020008A8 (pt) | 2023-05-02 |
| CA2979812A1 (en) | 2016-09-29 |
| EP3270950B1 (en) | 2021-04-21 |
| CN107636011A (zh) | 2018-01-26 |
| BR112017020008A2 (pt) | 2018-06-19 |
| WO2016150926A1 (en) | 2016-09-29 |
| ES2880795T3 (es) | 2021-11-25 |
| US10323078B2 (en) | 2019-06-18 |
| JP2018512844A (ja) | 2018-05-24 |
| CN107636011B (zh) | 2021-07-02 |
| EP3270950A1 (en) | 2018-01-24 |
| DK3270950T3 (da) | 2021-06-07 |
| CA2979812C (en) | 2023-08-29 |
| AU2016236297A1 (en) | 2017-09-28 |
| AU2016236297B2 (en) | 2020-07-23 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6981878B2 (ja) | 抗菌療法 | |
| Li et al. | OM‐LV20, a novel peptide from odorous frog skin, accelerates wound healing in vitro and in vivo | |
| de Oliveira et al. | Global proteomic and functional analysis of Crotalus durissus collilineatus individual venom variation and its impact on envenoming | |
| EP1151009B1 (en) | Antimicrobial/endotoxin neutralizing polypeptide | |
| Gebrim et al. | Antitumor effects of snake venom chemically modified Lys49 phospholipase A2-like BthTX-I and a synthetic peptide derived from its C-terminal region | |
| Edström Hägerwall et al. | β-Microseminoprotein endows post coital seminal plasma with potent candidacidal activity by a calcium-and pH-dependent mechanism | |
| Lim et al. | Antimicrobial efficacy of granulysin‐derived synthetic peptides in acne vulgaris | |
| Sousa‐Filho et al. | Biochemical profile, biological activities, and toxic effects of proteins in the Rhinella schneideri parotoid gland secretion | |
| Farfán et al. | The immunomodulatory potential of phage therapy to treat acne: A review on bacterial lysis and immunomodulation | |
| JP6840086B2 (ja) | 薬物として、特に皮膚炎症性疾患において使用するためのフィブリノゲン由来の単離されたペプチドおよびそれらのフラグメント | |
| Fernandes et al. | Lactoferrin-derived peptide lactofungin is potently synergistic with amphotericin B | |
| Wu et al. | Inhibitory and anti‐inflammatory effects of two antimicrobial peptides moronecidin and temporin‐1Dra against Propionibacterium acnes in vitro and in vivo | |
| Popov et al. | Host-defense peptides AC12, DK16 and RC11 with immunomodulatory activity isolated from Hypsiboas raniceps skin secretion | |
| Kim et al. | Antimicrobial activity of antimicrobial peptide LPcin-YK3 derived from bovine lactophoricin | |
| Walker et al. | Isolation and partial characterization of a staphylococcal leukocyte cytotaxin | |
| KR20170030176A (ko) | 보툴리눔 독소의 정제 방법 | |
| US20190201487A1 (en) | nNIF AND nNIF-RELATED PEPTIDES AND RELATED METHODS | |
| Berlov et al. | Lactoferrin from canine neutrophils: isolation and physicochemical and antimicrobial properties | |
| Lee et al. | PEGylated lysozymes with anti-septic effects in human endothelial cells and in mice | |
| US11324801B2 (en) | NNIF and nNIF-related peptides and related methods | |
| Jalaei et al. | In vitro antihistamine-releasing activity of a peptide derived from wasp venom of Vespa orientalis | |
| TW202328175A (zh) | 乳鐵蛋白組合物及使用方法 | |
| JP2018512844A5 (ja) | ||
| BR112022021750A2 (pt) | Anticorpo monoclonal anti-apc, material biológico relacionado ao anticorpo monoclonal anti-apc, produto de preparação e uso do anticorpo monoclonal anti-apc ou do material biológico | |
| Hagerwall et al. | b-Microseminoprotein Endows Post Coital Seminal Plasma with Potent Candidacidal Activity by a Calcium-and pH-Dependent Mechanism |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190318 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20190318 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20200407 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20200707 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200907 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20200929 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20201225 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20210126 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20210216 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6840086 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313111 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313115 |
|
| R370 | Written measure of declining of transfer procedure |
Free format text: JAPANESE INTERMEDIATE CODE: R370 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313115 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313115 |
|
| R370 | Written measure of declining of transfer procedure |
Free format text: JAPANESE INTERMEDIATE CODE: R370 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313115 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313115 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |