JP6810023B2 - 構造的に多様な複合脂質を分析するための方法、組成物およびキット - Google Patents
構造的に多様な複合脂質を分析するための方法、組成物およびキット Download PDFInfo
- Publication number
- JP6810023B2 JP6810023B2 JP2017505546A JP2017505546A JP6810023B2 JP 6810023 B2 JP6810023 B2 JP 6810023B2 JP 2017505546 A JP2017505546 A JP 2017505546A JP 2017505546 A JP2017505546 A JP 2017505546A JP 6810023 B2 JP6810023 B2 JP 6810023B2
- Authority
- JP
- Japan
- Prior art keywords
- lipid
- fatty acid
- internal standard
- mixture
- acid residues
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 239000000203 mixture Substances 0.000 title claims description 481
- 150000002632 lipids Chemical class 0.000 title claims description 480
- 238000000034 method Methods 0.000 title claims description 77
- 150000004665 fatty acids Chemical group 0.000 claims description 450
- 235000014113 dietary fatty acids Nutrition 0.000 claims description 413
- 229930195729 fatty acid Natural products 0.000 claims description 413
- 239000000194 fatty acid Substances 0.000 claims description 413
- -1 cholesteryl ester Chemical class 0.000 claims description 70
- JZNWSCPGTDBMEW-UHFFFAOYSA-N Glycerophosphorylethanolamin Natural products NCCOP(O)(=O)OCC(O)CO JZNWSCPGTDBMEW-UHFFFAOYSA-N 0.000 claims description 65
- WTJKGGKOPKCXLL-RRHRGVEJSA-N phosphatidylcholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCCC=CCCCCCCCC WTJKGGKOPKCXLL-RRHRGVEJSA-N 0.000 claims description 62
- IPCSVZSSVZVIGE-UHFFFAOYSA-M hexadecanoate Chemical compound CCCCCCCCCCCCCCCC([O-])=O IPCSVZSSVZVIGE-UHFFFAOYSA-M 0.000 claims description 51
- 150000008104 phosphatidylethanolamines Chemical class 0.000 claims description 48
- 150000001982 diacylglycerols Chemical class 0.000 claims description 37
- DCXXMTOCNZCJGO-UHFFFAOYSA-N tristearoylglycerol Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(OC(=O)CCCCCCCCCCCCCCCCC)COC(=O)CCCCCCCCCCCCCCCCC DCXXMTOCNZCJGO-UHFFFAOYSA-N 0.000 claims description 26
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol group Chemical group [C@@H]1(CC[C@H]2[C@@H]3CC=C4C[C@@H](O)CC[C@]4(C)[C@H]3CC[C@]12C)[C@H](C)CCCC(C)C HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 claims description 24
- 238000005917 acylation reaction Methods 0.000 claims description 18
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 claims description 14
- 230000002194 synthesizing effect Effects 0.000 claims description 11
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 claims description 9
- 235000012000 cholesterol Nutrition 0.000 claims description 6
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerol Natural products OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 claims description 5
- 229960001231 choline Drugs 0.000 claims description 3
- OEYIOHPDSNJKLS-UHFFFAOYSA-N choline Chemical compound C[N+](C)(C)CCO OEYIOHPDSNJKLS-UHFFFAOYSA-N 0.000 claims description 3
- 230000015572 biosynthetic process Effects 0.000 claims description 2
- 238000003786 synthesis reaction Methods 0.000 claims description 2
- 239000000523 sample Substances 0.000 description 141
- 125000003473 lipid group Chemical group 0.000 description 125
- 241000894007 species Species 0.000 description 76
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 49
- 125000002252 acyl group Chemical group 0.000 description 46
- 229910052805 deuterium Inorganic materials 0.000 description 41
- 150000003904 phospholipids Chemical class 0.000 description 30
- 210000002966 serum Anatomy 0.000 description 24
- 235000021588 free fatty acids Nutrition 0.000 description 23
- 210000002381 plasma Anatomy 0.000 description 22
- AWUCVROLDVIAJX-UHFFFAOYSA-N alpha-glycerophosphate Natural products OCC(O)COP(O)(O)=O AWUCVROLDVIAJX-UHFFFAOYSA-N 0.000 description 20
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 20
- RYCNUMLMNKHWPZ-SNVBAGLBSA-N 1-acetyl-sn-glycero-3-phosphocholine Chemical compound CC(=O)OC[C@@H](O)COP([O-])(=O)OCC[N+](C)(C)C RYCNUMLMNKHWPZ-SNVBAGLBSA-N 0.000 description 18
- 229940049964 oleate Drugs 0.000 description 17
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 17
- 235000020777 polyunsaturated fatty acids Nutrition 0.000 description 17
- 238000004458 analytical method Methods 0.000 description 16
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 15
- 229940106189 ceramide Drugs 0.000 description 15
- TZCPCKNHXULUIY-RGULYWFUSA-N 1,2-distearoyl-sn-glycero-3-phosphoserine Chemical compound CCCCCCCCCCCCCCCCCC(=O)OC[C@H](COP(O)(=O)OC[C@H](N)C(O)=O)OC(=O)CCCCCCCCCCCCCCCCC TZCPCKNHXULUIY-RGULYWFUSA-N 0.000 description 14
- ZWZWYGMENQVNFU-UHFFFAOYSA-N Glycerophosphorylserin Natural products OC(=O)C(N)COP(O)(=O)OCC(O)CO ZWZWYGMENQVNFU-UHFFFAOYSA-N 0.000 description 14
- 239000012472 biological sample Substances 0.000 description 14
- CWRILEGKIAOYKP-SSDOTTSWSA-M [(2r)-3-acetyloxy-2-hydroxypropyl] 2-aminoethyl phosphate Chemical compound CC(=O)OC[C@@H](O)COP([O-])(=O)OCCN CWRILEGKIAOYKP-SSDOTTSWSA-M 0.000 description 13
- YDNKGFDKKRUKPY-JHOUSYSJSA-N C16 ceramide Natural products CCCCCCCCCCCCCCCC(=O)N[C@@H](CO)[C@H](O)C=CCCCCCCCCCCCCC YDNKGFDKKRUKPY-JHOUSYSJSA-N 0.000 description 12
- ATBOMIWRCZXYSZ-XZBBILGWSA-N [1-[2,3-dihydroxypropoxy(hydroxy)phosphoryl]oxy-3-hexadecanoyloxypropan-2-yl] (9e,12e)-octadeca-9,12-dienoate Chemical compound CCCCCCCCCCCCCCCC(=O)OCC(COP(O)(=O)OCC(O)CO)OC(=O)CCCCCCC\C=C\C\C=C\CCCCC ATBOMIWRCZXYSZ-XZBBILGWSA-N 0.000 description 12
- ZVEQCJWYRWKARO-UHFFFAOYSA-N ceramide Natural products CCCCCCCCCCCCCCC(O)C(=O)NC(CO)C(O)C=CCCC=C(C)CCCCCCCCC ZVEQCJWYRWKARO-UHFFFAOYSA-N 0.000 description 12
- 150000001875 compounds Chemical class 0.000 description 12
- VVGIYYKRAMHVLU-UHFFFAOYSA-N newbouldiamide Natural products CCCCCCCCCCCCCCCCCCCC(O)C(O)C(O)C(CO)NC(=O)CCCCCCCCCCCCCCCCC VVGIYYKRAMHVLU-UHFFFAOYSA-N 0.000 description 12
- 150000003905 phosphatidylinositols Chemical class 0.000 description 12
- 150000004671 saturated fatty acids Chemical class 0.000 description 12
- 210000002700 urine Anatomy 0.000 description 12
- 238000003556 assay Methods 0.000 description 11
- ZGSPNIOCEDOHGS-UHFFFAOYSA-L disodium [3-[2,3-di(octadeca-9,12-dienoyloxy)propoxy-oxidophosphoryl]oxy-2-hydroxypropyl] 2,3-di(octadeca-9,12-dienoyloxy)propyl phosphate Chemical compound [Na+].[Na+].CCCCCC=CCC=CCCCCCCCC(=O)OCC(OC(=O)CCCCCCCC=CCC=CCCCCC)COP([O-])(=O)OCC(O)COP([O-])(=O)OCC(OC(=O)CCCCCCCC=CCC=CCCCCC)COC(=O)CCCCCCCC=CCC=CCCCCC ZGSPNIOCEDOHGS-UHFFFAOYSA-L 0.000 description 11
- 238000004949 mass spectrometry Methods 0.000 description 11
- WWUZIQQURGPMPG-UHFFFAOYSA-N (-)-D-erythro-Sphingosine Natural products CCCCCCCCCCCCCC=CC(O)C(N)CO WWUZIQQURGPMPG-UHFFFAOYSA-N 0.000 description 10
- CRJGESKKUOMBCT-VQTJNVASSA-N N-acetylsphinganine Chemical compound CCCCCCCCCCCCCCC[C@@H](O)[C@H](CO)NC(C)=O CRJGESKKUOMBCT-VQTJNVASSA-N 0.000 description 10
- 150000002270 gangliosides Chemical class 0.000 description 10
- 229930000756 phytoceramide Chemical class 0.000 description 10
- WWUZIQQURGPMPG-KRWOKUGFSA-N sphingosine Chemical compound CCCCCCCCCCCCC\C=C\[C@@H](O)[C@@H](N)CO WWUZIQQURGPMPG-KRWOKUGFSA-N 0.000 description 10
- 150000003727 wax diesters Chemical class 0.000 description 10
- 150000002305 glucosylceramides Chemical class 0.000 description 9
- 238000004128 high performance liquid chromatography Methods 0.000 description 9
- 239000000126 substance Substances 0.000 description 9
- UFTFJSFQGQCHQW-UHFFFAOYSA-N triformin Chemical compound O=COCC(OC=O)COC=O UFTFJSFQGQCHQW-UHFFFAOYSA-N 0.000 description 9
- ZPDQFUYPBVXUKS-YADHBBJMSA-N 1-stearoyl-sn-glycero-3-phosphoserine Chemical compound CCCCCCCCCCCCCCCCCC(=O)OC[C@@H](O)COP(O)(=O)OC[C@H](N)C(O)=O ZPDQFUYPBVXUKS-YADHBBJMSA-N 0.000 description 8
- 239000004164 Wax ester Substances 0.000 description 8
- 239000012805 animal sample Substances 0.000 description 8
- 238000004587 chromatography analysis Methods 0.000 description 8
- 125000005313 fatty acid group Chemical group 0.000 description 8
- 238000004817 gas chromatography Methods 0.000 description 8
- 150000003626 triacylglycerols Chemical class 0.000 description 8
- 235000019386 wax ester Nutrition 0.000 description 8
- WRGQSWVCFNIUNZ-GDCKJWNLSA-N 1-oleoyl-sn-glycerol 3-phosphate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OC[C@@H](O)COP(O)(O)=O WRGQSWVCFNIUNZ-GDCKJWNLSA-N 0.000 description 7
- 239000002253 acid Substances 0.000 description 7
- 210000004369 blood Anatomy 0.000 description 7
- 239000008280 blood Substances 0.000 description 7
- 210000001175 cerebrospinal fluid Anatomy 0.000 description 7
- 125000001312 palmitoyl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 7
- 238000011002 quantification Methods 0.000 description 7
- HOMYIYLRRDTKAA-IXWJMURKSA-N soya-cerebroside II Natural products CCCCCCCCCCCCCC[C@H](O)C(=O)N[C@H](CO[C@@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O)[C@@H](O)C=CCCC=CCCCCCCCCC HOMYIYLRRDTKAA-IXWJMURKSA-N 0.000 description 7
- 235000021122 unsaturated fatty acids Nutrition 0.000 description 7
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 6
- 102000004895 Lipoproteins Human genes 0.000 description 6
- 108090001030 Lipoproteins Proteins 0.000 description 6
- 241000699670 Mus sp. Species 0.000 description 6
- WPIHMWBQRSAMDE-YCZTVTEBSA-N beta-D-galactosyl-(1->4)-beta-D-galactosyl-N-(pentacosanoyl)sphingosine Chemical compound CCCCCCCCCCCCCCCCCCCCCCCCC(=O)N[C@@H](CO[C@@H]1O[C@H](CO)[C@H](O[C@@H]2O[C@H](CO)[C@H](O)[C@H](O)[C@H]2O)[C@H](O)[C@H]1O)[C@H](O)\C=C\CCCCCCCCCCCCC WPIHMWBQRSAMDE-YCZTVTEBSA-N 0.000 description 6
- 238000005251 capillar electrophoresis Methods 0.000 description 6
- 210000004027 cell Anatomy 0.000 description 6
- 229940066279 eicosapentaenoate Drugs 0.000 description 6
- 238000005516 engineering process Methods 0.000 description 6
- 238000003018 immunoassay Methods 0.000 description 6
- UOXRPRZMAROFPH-IESLQMLBSA-N lysophosphatidylinositol Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@@H](O)COP(O)(=O)OC1[C@H](O)[C@@H](O)C(O)[C@@H](O)[C@H]1O UOXRPRZMAROFPH-IESLQMLBSA-N 0.000 description 6
- 238000005259 measurement Methods 0.000 description 6
- 150000002942 palmitic acid derivatives Chemical class 0.000 description 6
- 150000004670 unsaturated fatty acids Chemical class 0.000 description 6
- 238000002965 ELISA Methods 0.000 description 5
- 239000003153 chemical reaction reagent Substances 0.000 description 5
- 238000001514 detection method Methods 0.000 description 5
- 235000019387 fatty acid methyl ester Nutrition 0.000 description 5
- 238000002372 labelling Methods 0.000 description 5
- 239000000047 product Substances 0.000 description 5
- 210000003296 saliva Anatomy 0.000 description 5
- 239000007858 starting material Substances 0.000 description 5
- 125000003696 stearoyl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 5
- 238000012360 testing method Methods 0.000 description 5
- 238000004809 thin layer chromatography Methods 0.000 description 5
- 210000001519 tissue Anatomy 0.000 description 5
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 4
- 241001432959 Chernes Species 0.000 description 4
- 241000252212 Danio rerio Species 0.000 description 4
- 241000282412 Homo Species 0.000 description 4
- 241000124008 Mammalia Species 0.000 description 4
- 241000283973 Oryctolagus cuniculus Species 0.000 description 4
- 150000001783 ceramides Chemical class 0.000 description 4
- 230000000694 effects Effects 0.000 description 4
- 238000011156 evaluation Methods 0.000 description 4
- 239000007788 liquid Substances 0.000 description 4
- 210000002751 lymph Anatomy 0.000 description 4
- 239000012071 phase Substances 0.000 description 4
- 125000003203 triacylglycerol group Chemical group 0.000 description 4
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- 108090000790 Enzymes Proteins 0.000 description 3
- 102000004190 Enzymes Human genes 0.000 description 3
- OYHQOLUKZRVURQ-HZJYTTRNSA-N Linoleic acid Chemical compound CCCCC\C=C/C\C=C/CCCCCCCC(O)=O OYHQOLUKZRVURQ-HZJYTTRNSA-N 0.000 description 3
- JAZBEHYOTPTENJ-JLNKQSITSA-N all-cis-5,8,11,14,17-icosapentaenoic acid Chemical compound CC\C=C/C\C=C/C\C=C/C\C=C/C\C=C/CCCC(O)=O JAZBEHYOTPTENJ-JLNKQSITSA-N 0.000 description 3
- 125000004429 atom Chemical group 0.000 description 3
- 210000001124 body fluid Anatomy 0.000 description 3
- 239000010839 body fluid Substances 0.000 description 3
- 238000004364 calculation method Methods 0.000 description 3
- 238000010586 diagram Methods 0.000 description 3
- 229940000640 docosahexaenoate Drugs 0.000 description 3
- 239000000284 extract Substances 0.000 description 3
- 238000000605 extraction Methods 0.000 description 3
- IPCSVZSSVZVIGE-UHFFFAOYSA-N hexadecanoic acid Chemical compound CCCCCCCCCCCCCCCC(O)=O IPCSVZSSVZVIGE-UHFFFAOYSA-N 0.000 description 3
- 230000000984 immunochemical effect Effects 0.000 description 3
- 238000010813 internal standard method Methods 0.000 description 3
- 125000000403 lignoceroyl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 3
- 230000004060 metabolic process Effects 0.000 description 3
- 239000002207 metabolite Substances 0.000 description 3
- 235000021281 monounsaturated fatty acids Nutrition 0.000 description 3
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 3
- 238000007430 reference method Methods 0.000 description 3
- 239000000243 solution Substances 0.000 description 3
- ODIGIKRIUKFKHP-UHFFFAOYSA-N (n-propan-2-yloxycarbonylanilino) acetate Chemical compound CC(C)OC(=O)N(OC(C)=O)C1=CC=CC=C1 ODIGIKRIUKFKHP-UHFFFAOYSA-N 0.000 description 2
- PORPENFLTBBHSG-MGBGTMOVSA-N 1,2-dihexadecanoyl-sn-glycerol-3-phosphate Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP(O)(O)=O)OC(=O)CCCCCCCCCCCCCCC PORPENFLTBBHSG-MGBGTMOVSA-N 0.000 description 2
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 2
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 2
- 101100223822 Dictyostelium discoideum zfaA gene Proteins 0.000 description 2
- GVGLGOZIDCSQPN-PVHGPHFFSA-N Heroin Chemical compound O([C@H]1[C@H](C=C[C@H]23)OC(C)=O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4OC(C)=O GVGLGOZIDCSQPN-PVHGPHFFSA-N 0.000 description 2
- YASAKCUCGLMORW-UHFFFAOYSA-N Rosiglitazone Chemical compound C=1C=CC=NC=1N(C)CCOC(C=C1)=CC=C1CC1SC(=O)NC1=O YASAKCUCGLMORW-UHFFFAOYSA-N 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- 230000010933 acylation Effects 0.000 description 2
- 238000001042 affinity chromatography Methods 0.000 description 2
- 239000012491 analyte Substances 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- 150000001840 cholesterol esters Chemical class 0.000 description 2
- 238000007398 colorimetric assay Methods 0.000 description 2
- 239000013068 control sample Substances 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- CVSVTCORWBXHQV-UHFFFAOYSA-N creatine Chemical compound NC(=[NH2+])N(C)CC([O-])=O CVSVTCORWBXHQV-UHFFFAOYSA-N 0.000 description 2
- DDRJAANPRJIHGJ-UHFFFAOYSA-N creatinine Chemical compound CN1CC(=O)NC1=N DDRJAANPRJIHGJ-UHFFFAOYSA-N 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 229960002069 diamorphine Drugs 0.000 description 2
- 235000005911 diet Nutrition 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 239000003814 drug Substances 0.000 description 2
- 238000001962 electrophoresis Methods 0.000 description 2
- 238000002290 gas chromatography-mass spectrometry Methods 0.000 description 2
- BPMFZUMJYQTVII-UHFFFAOYSA-N guanidinoacetic acid Chemical compound NC(=N)NCC(O)=O BPMFZUMJYQTVII-UHFFFAOYSA-N 0.000 description 2
- 230000001900 immune effect Effects 0.000 description 2
- 238000001802 infusion Methods 0.000 description 2
- 239000010422 internal standard material Substances 0.000 description 2
- 238000004255 ion exchange chromatography Methods 0.000 description 2
- 230000014759 maintenance of location Effects 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 230000007935 neutral effect Effects 0.000 description 2
- 229910052757 nitrogen Inorganic materials 0.000 description 2
- 125000002525 phosphocholine group Chemical group OP(=O)(OCC[N+](C)(C)C)O* 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 238000004007 reversed phase HPLC Methods 0.000 description 2
- 235000003441 saturated fatty acids Nutrition 0.000 description 2
- 238000012216 screening Methods 0.000 description 2
- 229940076279 serotonin Drugs 0.000 description 2
- QZAYGJVTTNCVMB-UHFFFAOYSA-N serotonin Chemical compound C1=C(O)C=C2C(CCN)=CNC2=C1 QZAYGJVTTNCVMB-UHFFFAOYSA-N 0.000 description 2
- 238000001542 size-exclusion chromatography Methods 0.000 description 2
- 150000003408 sphingolipids Chemical class 0.000 description 2
- 238000010200 validation analysis Methods 0.000 description 2
- SFLSHLFXELFNJZ-QMMMGPOBSA-N (-)-norepinephrine Chemical compound NC[C@H](O)C1=CC=C(O)C(O)=C1 SFLSHLFXELFNJZ-QMMMGPOBSA-N 0.000 description 1
- UCTWMZQNUQWSLP-VIFPVBQESA-N (R)-adrenaline Chemical compound CNC[C@H](O)C1=CC=C(O)C(O)=C1 UCTWMZQNUQWSLP-VIFPVBQESA-N 0.000 description 1
- 229930182837 (R)-adrenaline Natural products 0.000 description 1
- MWXAIAMSOXOQJK-JIXVGTEKSA-N 1-hexadecanoyl-2-(4Z,7Z,10Z,13Z,16Z-docosapentaenoyl)-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CC\C=C/C\C=C/C\C=C/C\C=C/C\C=C/CCCCC MWXAIAMSOXOQJK-JIXVGTEKSA-N 0.000 description 1
- LIKMAJRDDDTEIG-UHFFFAOYSA-N 1-hexene Chemical compound CCCCC=C LIKMAJRDDDTEIG-UHFFFAOYSA-N 0.000 description 1
- WYEPBHZLDUPIOD-UHFFFAOYSA-N 4,6-dioxoheptanoic acid Chemical compound CC(=O)CC(=O)CCC(O)=O WYEPBHZLDUPIOD-UHFFFAOYSA-N 0.000 description 1
- LUZYTSCABOWJAC-HLJNGVMWSA-N 6-hydroxysphing-4E-enine Chemical compound CCCCCCCCCCCCC(O)\C=C\[C@@H](O)[C@@H](N)CO LUZYTSCABOWJAC-HLJNGVMWSA-N 0.000 description 1
- 101001073212 Arabidopsis thaliana Peroxidase 33 Proteins 0.000 description 1
- YZXBAPSDXZZRGB-DOFZRALJSA-M Arachidonate Chemical compound CCCCC\C=C/C\C=C/C\C=C/C\C=C/CCCC([O-])=O YZXBAPSDXZZRGB-DOFZRALJSA-M 0.000 description 1
- 239000004322 Butylated hydroxytoluene Substances 0.000 description 1
- NLZUEZXRPGMBCV-UHFFFAOYSA-N Butylhydroxytoluene Chemical compound CC1=CC(C(C)(C)C)=C(O)C(C(C)(C)C)=C1 NLZUEZXRPGMBCV-UHFFFAOYSA-N 0.000 description 1
- AERBNCYCJBRYDG-UHFFFAOYSA-N D-ribo-phytosphingosine Natural products CCCCCCCCCCCCCCC(O)C(O)C(N)CO AERBNCYCJBRYDG-UHFFFAOYSA-N 0.000 description 1
- 238000000018 DNA microarray Methods 0.000 description 1
- 206010012335 Dependence Diseases 0.000 description 1
- 102100035762 Diacylglycerol O-acyltransferase 2 Human genes 0.000 description 1
- 206010062506 Heparin-induced thrombocytopenia Diseases 0.000 description 1
- 208000005176 Hepatitis C Diseases 0.000 description 1
- 108700039791 Hepatitis C virus nucleocapsid Proteins 0.000 description 1
- SQUHHTBVTRBESD-UHFFFAOYSA-N Hexa-Ac-myo-Inositol Natural products CC(=O)OC1C(OC(C)=O)C(OC(C)=O)C(OC(C)=O)C(OC(C)=O)C1OC(C)=O SQUHHTBVTRBESD-UHFFFAOYSA-N 0.000 description 1
- 101000930020 Homo sapiens Diacylglycerol O-acyltransferase 2 Proteins 0.000 description 1
- 101001123325 Homo sapiens Peroxisome proliferator-activated receptor gamma coactivator 1-beta Proteins 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- 102000016600 Inosine-5'-monophosphate dehydrogenases Human genes 0.000 description 1
- 108050006182 Inosine-5'-monophosphate dehydrogenases Proteins 0.000 description 1
- 102000004218 Insulin-Like Growth Factor I Human genes 0.000 description 1
- 108090000723 Insulin-Like Growth Factor I Proteins 0.000 description 1
- FFFHZYDWPBMWHY-VKHMYHEASA-N L-homocysteine Chemical compound OC(=O)[C@@H](N)CCS FFFHZYDWPBMWHY-VKHMYHEASA-N 0.000 description 1
- 208000026251 Opioid-Related disease Diseases 0.000 description 1
- BRUQQQPBMZOVGD-XFKAJCMBSA-N Oxycodone Chemical compound O=C([C@@H]1O2)CC[C@@]3(O)[C@H]4CC5=CC=C(OC)C2=C5[C@@]13CCN4C BRUQQQPBMZOVGD-XFKAJCMBSA-N 0.000 description 1
- 229940080774 Peroxisome proliferator-activated receptor gamma agonist Drugs 0.000 description 1
- 102100028961 Peroxisome proliferator-activated receptor gamma coactivator 1-beta Human genes 0.000 description 1
- 108010030678 Phosphatidylethanolamine N-Methyltransferase Proteins 0.000 description 1
- 102000005920 Phosphatidylethanolamine N-methyltransferase Human genes 0.000 description 1
- 241000191967 Staphylococcus aureus Species 0.000 description 1
- BMQYVXCPAOLZOK-UHFFFAOYSA-N Trihydroxypropylpterisin Natural products OCC(O)C(O)C1=CN=C2NC(N)=NC(=O)C2=N1 BMQYVXCPAOLZOK-UHFFFAOYSA-N 0.000 description 1
- 208000032001 Tyrosinemia type 1 Diseases 0.000 description 1
- 230000005856 abnormality Effects 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- 150000001413 amino acids Chemical class 0.000 description 1
- 210000004381 amniotic fluid Anatomy 0.000 description 1
- 239000000427 antigen Substances 0.000 description 1
- 102000036639 antigens Human genes 0.000 description 1
- 108091007433 antigens Proteins 0.000 description 1
- 229940114078 arachidonate Drugs 0.000 description 1
- RORSDNHKRISNBL-UHFFFAOYSA-N azanium dichloromethane acetate Chemical compound C(Cl)Cl.C(C)(=O)[O-].[NH4+] RORSDNHKRISNBL-UHFFFAOYSA-N 0.000 description 1
- 230000000721 bacterilogical effect Effects 0.000 description 1
- 238000011953 bioanalysis Methods 0.000 description 1
- 230000031018 biological processes and functions Effects 0.000 description 1
- 239000000090 biomarker Substances 0.000 description 1
- 238000009640 blood culture Methods 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- RMRJXGBAOAMLHD-IHFGGWKQSA-N buprenorphine Chemical compound C([C@]12[C@H]3OC=4C(O)=CC=C(C2=4)C[C@@H]2[C@]11CC[C@]3([C@H](C1)[C@](C)(O)C(C)(C)C)OC)CN2CC1CC1 RMRJXGBAOAMLHD-IHFGGWKQSA-N 0.000 description 1
- 229960001736 buprenorphine Drugs 0.000 description 1
- 235000010354 butylated hydroxytoluene Nutrition 0.000 description 1
- 229940095259 butylated hydroxytoluene Drugs 0.000 description 1
- 238000003965 capillary gas chromatography Methods 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 238000013375 chromatographic separation Methods 0.000 description 1
- 239000002131 composite material Substances 0.000 description 1
- 229960003624 creatine Drugs 0.000 description 1
- 239000006046 creatine Substances 0.000 description 1
- 229940109239 creatinine Drugs 0.000 description 1
- 210000004748 cultured cell Anatomy 0.000 description 1
- 125000003074 decanoyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C(*)=O 0.000 description 1
- 230000002950 deficient Effects 0.000 description 1
- 238000001212 derivatisation Methods 0.000 description 1
- 125000004431 deuterium atom Chemical group 0.000 description 1
- 125000003374 diacylglycerol group Chemical group 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 150000001993 dienes Chemical class 0.000 description 1
- 230000037213 diet Effects 0.000 description 1
- 230000000378 dietary effect Effects 0.000 description 1
- OTKJDMGTUTTYMP-UHFFFAOYSA-N dihydrosphingosine Natural products CCCCCCCCCCCCCCCC(O)C(N)CO OTKJDMGTUTTYMP-UHFFFAOYSA-N 0.000 description 1
- 238000004819 disease profiling Methods 0.000 description 1
- 125000004050 enoyl group Chemical group 0.000 description 1
- 229960005139 epinephrine Drugs 0.000 description 1
- 210000003743 erythrocyte Anatomy 0.000 description 1
- 235000004626 essential fatty acids Nutrition 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 210000000416 exudates and transudate Anatomy 0.000 description 1
- 230000004129 fatty acid metabolism Effects 0.000 description 1
- 230000004907 flux Effects 0.000 description 1
- 238000000769 gas chromatography-flame ionisation detection Methods 0.000 description 1
- 208000010710 hepatitis C virus infection Diseases 0.000 description 1
- 239000002035 hexane extract Substances 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- CDAISMWEOUEBRE-GPIVLXJGSA-N inositol Chemical compound O[C@H]1[C@H](O)[C@@H](O)[C@H](O)[C@H](O)[C@@H]1O CDAISMWEOUEBRE-GPIVLXJGSA-N 0.000 description 1
- 229960000367 inositol Drugs 0.000 description 1
- 238000011835 investigation Methods 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 239000004816 latex Substances 0.000 description 1
- 229920000126 latex Polymers 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 235000020778 linoleic acid Nutrition 0.000 description 1
- OYHQOLUKZRVURQ-IXWMQOLASA-N linoleic acid Natural products CCCCC\C=C/C\C=C\CCCCCCCC(O)=O OYHQOLUKZRVURQ-IXWMQOLASA-N 0.000 description 1
- 230000037356 lipid metabolism Effects 0.000 description 1
- 210000004880 lymph fluid Anatomy 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 229910021645 metal ion Inorganic materials 0.000 description 1
- 230000008811 mitochondrial respiratory chain Effects 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 150000002759 monoacylglycerols Chemical class 0.000 description 1
- BMQYVXCPAOLZOK-XINAWCOVSA-N neopterin Chemical compound OC[C@@H](O)[C@@H](O)C1=CN=C2NC(N)=NC(=O)C2=N1 BMQYVXCPAOLZOK-XINAWCOVSA-N 0.000 description 1
- 239000012299 nitrogen atmosphere Substances 0.000 description 1
- 230000036963 noncompetitive effect Effects 0.000 description 1
- 229960002748 norepinephrine Drugs 0.000 description 1
- SFLSHLFXELFNJZ-UHFFFAOYSA-N norepinephrine Natural products NCC(O)C1=CC=C(O)C(O)=C1 SFLSHLFXELFNJZ-UHFFFAOYSA-N 0.000 description 1
- QIQXTHQIDYTFRH-GTFORLLLSA-N octadecanoic acid Chemical class CCCCCCCCCCCCCCCCC[14C](O)=O QIQXTHQIDYTFRH-GTFORLLLSA-N 0.000 description 1
- 201000005040 opiate dependence Diseases 0.000 description 1
- 229960002085 oxycodone Drugs 0.000 description 1
- YWAKXRMUMFPDSH-UHFFFAOYSA-N pentene Chemical compound CCCC=C YWAKXRMUMFPDSH-UHFFFAOYSA-N 0.000 description 1
- 239000003208 petroleum Substances 0.000 description 1
- 125000001095 phosphatidyl group Chemical group 0.000 description 1
- AERBNCYCJBRYDG-KSZLIROESA-N phytosphingosine Chemical compound CCCCCCCCCCCCCC[C@@H](O)[C@@H](O)[C@@H](N)CO AERBNCYCJBRYDG-KSZLIROESA-N 0.000 description 1
- 229940033329 phytosphingosine Drugs 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 238000003908 quality control method Methods 0.000 description 1
- 238000004445 quantitative analysis Methods 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 230000002829 reductive effect Effects 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 229960004586 rosiglitazone Drugs 0.000 description 1
- CDAISMWEOUEBRE-UHFFFAOYSA-N scyllo-inosotol Natural products OC1C(O)C(O)C(O)C(O)C1O CDAISMWEOUEBRE-UHFFFAOYSA-N 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 150000004666 short chain fatty acids Chemical class 0.000 description 1
- 230000008591 skin barrier function Effects 0.000 description 1
- 210000001626 skin fibroblast Anatomy 0.000 description 1
- 239000007790 solid phase Substances 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 238000002798 spectrophotometry method Methods 0.000 description 1
- OTKJDMGTUTTYMP-ZWKOTPCHSA-N sphinganine Chemical compound CCCCCCCCCCCCCCC[C@@H](O)[C@@H](N)CO OTKJDMGTUTTYMP-ZWKOTPCHSA-N 0.000 description 1
- 125000002657 sphingoid group Chemical group 0.000 description 1
- 229910001220 stainless steel Inorganic materials 0.000 description 1
- 239000010935 stainless steel Substances 0.000 description 1
- 239000012086 standard solution Substances 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 238000001308 synthesis method Methods 0.000 description 1
- 150000005672 tetraenes Chemical class 0.000 description 1
- 150000005671 trienes Chemical class 0.000 description 1
- 201000011296 tyrosinemia Diseases 0.000 description 1
- 201000007972 tyrosinemia type I Diseases 0.000 description 1
- 238000012795 verification Methods 0.000 description 1
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/92—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving lipids, e.g. cholesterol, lipoproteins, or their receptors
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/531—Production of immunochemical test materials
- G01N33/532—Production of labelled immunochemicals
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/58—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving labelled substances
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N30/00—Investigating or analysing materials by separation into components using adsorption, absorption or similar phenomena or using ion-exchange, e.g. chromatography or field flow fractionation
- G01N30/02—Column chromatography
- G01N30/04—Preparation or injection of sample to be analysed
- G01N2030/042—Standards
- G01N2030/045—Standards internal
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2405/00—Assays, e.g. immunoassays or enzyme assays, involving lipids
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2458/00—Labels used in chemical analysis of biological material
- G01N2458/15—Non-radioactive isotope labels, e.g. for detection by mass spectrometry
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2496/00—Reference solutions for assays of biological material
- G01N2496/80—Multi-analyte reference solutions containing cholesterol, glucose and the like
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2560/00—Chemical aspects of mass spectrometric analysis of biological material
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T436/00—Chemistry: analytical and immunological testing
- Y10T436/10—Composition for standardization, calibration, simulation, stabilization, preparation or preservation; processes of use in preparation for chemical testing
- Y10T436/104165—Lipid, cholesterol, or triglyceride standard or control
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Immunology (AREA)
- Molecular Biology (AREA)
- Urology & Nephrology (AREA)
- Hematology (AREA)
- Biomedical Technology (AREA)
- Chemical & Material Sciences (AREA)
- Physics & Mathematics (AREA)
- Biochemistry (AREA)
- Microbiology (AREA)
- Pathology (AREA)
- Cell Biology (AREA)
- Food Science & Technology (AREA)
- Medicinal Chemistry (AREA)
- Biotechnology (AREA)
- Analytical Chemistry (AREA)
- General Physics & Mathematics (AREA)
- General Health & Medical Sciences (AREA)
- Endocrinology (AREA)
- Biophysics (AREA)
- Investigating Or Analysing Biological Materials (AREA)
- Other Investigation Or Analysis Of Materials By Electrical Means (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Description
本出願は2014年7月30日出願の米国仮特許出願第62/031,099号の利益を主張し、その開示内容全体を参照により援用する。
本開示の一実施形態において、対象サンプル中の1または2以上の対応する脂質クラスに存在する脂質分子種の組成を表す内部標準として使用するための1または2以上の脂質分子混合物の合成方法であって、アシル基を少なくとも1つ有する脂質クラスについて、同位体標識された少なくとも2種類の脂肪酸の混合物を、脂質骨格上の単一位置にアシル化反応を介して付着させるステップ;アシル基を少なくとも1つ有する脂質クラスについて、少なくとも2種類の脂肪酸の混合物を、同位体標識された脂質骨格上の単一位置にアシル化反応を介して付着させるステップ;および、脂肪酸を少なくとも2つ有する脂質クラスについて、1つの同位体標識された脂肪酸を脂質骨格上の第1の位置にアシル化反応を介して付着させ、かつ、少なくとも2種類の脂肪酸の混合物を脂質骨格上の別位置にアシル化反応を介して付着させるステップ;のうちの1または2以上を含み、少なくとも2種類の脂肪酸の混合物は、対象サンプル中の対応する脂質クラスに存在する脂肪酸を表し、混合物中の各脂肪酸は、対象サンプル中の対応する脂質クラスに存在する脂質分子種中の脂肪酸の存在比率を表す比率で存在する、方法が提供される。対応する脂質クラスは、トリアシルグリセロール、ジアシルグリセロール、1−モノアシルグリセロール、リン脂質、ホスファチジルコリン、o−ホスファチジルコリン、ホスファチジルエタノールアミン、p−ホスファチジルエタノールアミン、コレステリルエステル、リゾホスファチジルコリン、リゾホスファチジルエタノールアミン、リゾホスファチジルセリン、リゾホスファチジルイノシトール、リゾホスファチジルグリセロール、リゾホスファチジン酸、リゾCDP−ジアシルグリセロール、CDP−ジアシルグリセロール、スフィンゴミエリン、カルジオリピン、ホスファチジルセリン、ホスファチジルイノシトール、ホスファチジルグリセロール、ホスファチジン酸、セラミド、ラクトシルセラミド、グルコシルセラミド、フィトセラミド、6−ヒドロキシセラミド、セレブロシド、ガングリオシド、ワックスエステル、および、ワックスジエステルの1または2以上を含み得る。1または2以上の脂質分子混合物のそれぞれにおける1または2以上の脂肪酸混合物は、表1、表2、表3、表4、表5、表6または表7に記載の1または2以上の脂質分子種混合物を含み得る。1または2以上の脂質分子混合物のそれぞれにおける1または2以上の脂肪酸混合物は、表1、表2、表3、表4、表5、表6または表7に記載の1または2以上の脂質分子種混合物からなり得る。
本開示の一実施形態において、対象サンプル中の1または2以上の対応する脂質クラスに存在する脂質分子種の組成を表す1または2以上の脂質分子混合物を含む、内部標準として使用するための組成物であって、各脂質分子混合物は、脂質骨格上の単一位置に少なくとも2種類の同位体標識された脂肪酸の混合物を有する脂質骨格であって、アシル基を少なくとも1つ有する脂質クラスのための脂質骨格;脂質骨格上の単一位置に少なくとも2種類の脂肪酸の混合物を有する同位体標識された脂質骨格であって、アシル基を少なくとも1つ有する脂質クラスのための脂質骨格;および、脂質骨格上の第1の位置に単一の同位体標識された脂肪酸を有し、かつ脂質骨格上の別位置に少なくとも2種類の脂肪酸の混合物を有する脂質骨格であって、脂肪酸を少なくとも2つ有する脂質クラスのための脂質骨格;のうちの1または2以上を含み、少なくとも2種類の脂肪酸の混合物は、対象サンプル中の対応する脂質クラスに存在する脂肪酸を表し、混合物中の各脂肪酸は、対象サンプル中の対応する脂質クラスに存在する脂質分子種中の脂肪酸の存在比率を表す比率で存在する、組成物が提供される。脂質クラスは、トリアシルグリセロール、ジアシルグリセロール、1−モノアシルグリセロール、リン脂質、ホスファチジルコリン、o−ホスファチジルコリン、ホスファチジルエタノールアミン、p−ホスファチジルエタノールアミン、コレステリルエステル、リゾホスファチジルコリン、リゾホスファチジルエタノールアミン、リゾホスファチジルセリン、リゾホスファチジルイノシトール、リゾホスファチジルグリセロール、リゾホスファチジン酸、リゾCDP−ジアシルグリセロール、CDP−ジアシルグリセロール、スフィンゴミエリン、カルジオリピン、ホスファチジルセリン、ホスファチジルイノシトール、ホスファチジルグリセロール、ホスファチジン酸、セラミド、ラクトシルセラミド、グルコシルセラミド、フィトセラミド、6−ヒドロキシセラミド、セレブロシド、ガングリオシド、ワックスエステル、および、ワックスジエステルの1または2以上を含み得る。1または2以上の脂質分子混合物のそれぞれにおける1または2以上の脂肪酸混合物は、表1、表2、表3、表4、表5、表6または表7に記載の1または2以上の脂質分子種混合物を含み得る。1または2以上の脂質分子混合物のそれぞれにおける1または2以上の脂肪酸混合物は、表1、表2、表3、表4、表5、表6または表7に記載の1または2以上の脂質分子種混合物からなり得る。
本開示の一実施形態において、対象サンプル中に存在する脂質分子を検出または定量する方法であって、i)対象サンプル中の1または2以上の対応する脂質クラスに存在する脂質分子種の組成を表す1または2以上の脂質分子混合物を有する既知量の組成物を対象サンプルに添加するステップであって、該組成物は、a)脂質骨格上の単一位置に少なくとも2種類の同位体標識された脂肪酸の混合物を有する脂質骨格であって、アシル基を少なくとも1つ有する脂質クラスのための脂質骨格;b)脂質骨格上の単一位置に少なくとも2種類の脂肪酸の混合物を有する同位体標識された脂質骨格であって、アシル基を少なくとも1つ有する脂質クラスのための脂質骨格;および、c)脂質骨格上の第1の位置に単一の同位体標識された脂肪酸を有し、かつ脂質骨格上の別位置に少なくとも2種類の脂肪酸の混合物を有する脂質骨格であって、脂肪酸を少なくとも2つ有する脂質クラスのための脂質骨格;のうちの1または2以上を含み、少なくとも2種類の脂肪酸の混合物は、対象サンプル中の対応する脂質クラスに存在する脂肪酸を表し、混合物中の各脂肪酸は、対象サンプル中の対応する脂質クラスに存在する脂質分子種中の脂肪酸の存在比率を表す比率で存在する、ステップ;および、ii)脂質分子種の組成を表す1または2以上の脂質分子混合物を有する組成物を内部標準として使用して、対象サンプル中の1または2以上の対応する脂質クラスのそれぞれに存在する脂質分子種を検出または定量するステップ、を含む方法が提供される。
一般的に、本開示のキットは、1または2以上の内部標準と、対象サンプル中の脂質を検出および/または定量するために内部標準を使用するための指示書とを含む。キットは、1または2以上の対照サンプルおよびサンプル収集レセプタクルを更に含み得る。キット中の各内部標準組成物は、1または2以上の脂質クラスの様々な組み合わせで一緒にパッケージ化され得るか、あるいは、それぞれ別個のバイアルまたは容器内にパッケージ化され得る。キットは、調製・使用のための指示を記載したラベルおよび/または添付文書、試料収集用レセプタクル、輸送用容器、および/または、出荷用封筒を含み得る。別個に梱包される更なるキットのコンポーネントには、対象サンプル中の脂質を検出および/または定量するためのバッファーおよび他の試薬が含まれ得る。
脂質代謝物含有量または脂質分子含有量のアッセイは、体液サンプル(例えば、血液、血漿、尿、脳脊髄液(CSF))、組織サンプル、細胞サンプル、皮膚サンプル、溶液、複合混合物、in vitro培養細胞、および、細胞培地などの任意のサンプルタイプについて実施され得る。いくつかの実施形態において、脂質分子の量は、脂質の複合混合物、血液、血漿、血清、単離リポタンパク質分画、唾液、尿、リンパ液、および、脳脊髄液からなる群から選択される1または2以上のサンプルから決定される。いくつかの実施形態において、アッセイは、全血液、血漿、血清または単離リポタンパク質分画について行われ得る。またいくつかの実施形態において、1または2以上のサンプルは血漿または血清である。
実施例1:内部標準混合物の合成組成物
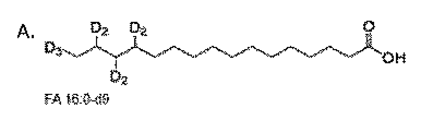
広範な脂質クラス(例えば、リン脂質)毎に単一の内部標準のみを通常使用する従来のリピドミクス戦略とは対照的に、本発明では、脂肪酸の混合物(脂質クラス毎に最大10個の脂肪酸)を含む内部標準を合成した。内部標準混合物(IS混合物)中の脂肪酸は、分析対象のサンプルタイプに存在する脂質クラスに見出される化学構造(脂質分子種)の多様性を表すように選択した。表1に示す各脂肪酸の濃度は各脂質クラスについて測定したものであり、脂質クラス内の残りの全ての脂肪酸は最も近い内部標準アナログに割り当て、また、その測定値を割り当てた。各脂質クラスについての総濃度は、その脂質クラスについての全ての分子種の値(測定値および割り当て値)を足すことにより計算した。
リン酸グリセロール頭部基から出発して、重水素標識パルミテート(16:0)をsn−1位にアシル化し、そして不飽和脂肪酸混合物をsn−2位にアシル化することにより、ホスファチジルコリン、o−ホスファチジルコリン、ホスファチジルエタノールアミンおよびp−ホスファチジルエタノールアミンについて例示のリン脂質内部標準を合成した。リン脂質、ホスファチジルコリンおよびホスファチジルエタノールアミンの標識戦略を図1に示す。
メタノール:ジクロロメタン抽出手順を使用して脂質をサンプルから抽出した。ジクロロメタン:メタノール(50:50)中の内部標準を抽出液に添加し、その後、一連の遠心・沈殿層回収工程を行った。1つに合わせた沈殿層のアリコートを窒素下で濃縮し、次いで10mM酢酸アンモニウムジクロロメタン:メタノール(50:50)0.25mLで戻した。インフュージョンMSを使用した分析のために、抽出物をインサートに移し、バイアルに入れた。インフュージョンMS分析を、Sciex SelexIonおよび500 QTRAPを組み合わせたnano PEEk tubingを用いたShimazdu LCで行った。サンプルはポジティブ・モードエレクトロスプレーおよびネガティブ・モードエレクトロスプレーの両方で分析した。5500 QTRAPスキャンをMRMモードで行ったところ、内部標準を含めて合計+1100MRMであった。
内部標準混合物の定量性能を評価するために、表1に示す内部標準の混合物を使用して、15個のヒト血清サンプル中の脂質分子種を測定した(トリプリケートで実施)。標識内部標準混合物下で血清サンプルから脂質を抽出し、上述の方法で脂質抽出物を分析した。トリプリケートサンプル中の1100個の測定脂質分子種のそれぞれの平均濃度を、内部標準混合物を使用して計算し、また、分析CVを計算して精度を求めた。15個のトリプリケートサンプルの平均濃度およびCV値を1100個の測定脂質分子種全てに対してプロットした。CV(%)と脂質分子種濃度との関係を示す散布図を図12に図示する。CVは最高濃度域における脂質分子種では低かったが、非常に低濃度(例えば、0.001μM)における所定の脂質分子種では10%と高かった。
((計算値−TrueMass値)/TrueMass値)×100
Claims (9)
- 異なる脂肪酸残基を含むコレステリルエステル(CE)の、同位体標識された内部標準組成物であって、
前記異なる脂肪酸残基は、16:0、16:1n7、18:1n9、18:2n6、20:3n6、20:4n6、20:5n3、および22:6n3を含む、内部標準組成物。 - 2以上の脂質クラスからの脂質分子種を含む、同位体標識された内部標準組成物であって、
前記脂質分子種のそれぞれは、
脂質骨格、1または2以上の脂肪酸残基、および、1または2以上の同位体標識を含み、
前記脂質分子種のそれぞれについて、
a)前記脂質骨格が1または2以上の同位体標識を含むか;または
b)前記1または2以上の脂肪酸残基が同位体標識を含み、
前記脂質分子種の前記2以上の脂質クラスは、
(i)異なる脂肪酸残基を含むコレステリルエステルであって、当該脂質分子種の脂質骨格に結合する前記異なる脂肪酸残基は16:0、16:1n7、18:1n9、18:2n6、20:3n6、20:4n6、20:5n3、および22:6n3を含む、コレステリルエステルと、
(ii)下記(a)〜(e)のうちの1つ以上と、を含む、内部標準組成物:
(a)異なる脂肪酸残基を含むホスファチジルコリンまたはエーテル結合型ホスファチジルコリンであって、パルミテート(16:0)残基が当該脂質分子種の脂質骨格に第1の位置において結合し、かつ、脂質骨格の別位置に結合する前記異なる脂肪酸残基は16:1n7、18:1n9、18:2n6、18:3n3、20:3n6、20:4n6、20:5n3、22:4n6、22:5n3、および22:6n3を含む、ホスファチジルコリンまたはエーテル結合型ホスファチジルコリン;
(b)異なる脂肪酸残基を含むホスファチジルエタノールアミンまたはプラズマローゲン型ホスファチジルエタノールアミンであって、ステアレート(18:0)残基が当該脂質分子種の脂質骨格に第1の位置において結合し、かつ、脂質骨格の別位置に結合する前記異なる脂肪酸残基は18:1n9、18:2n6、18:3n3、20:3n6、20:4n6、20:5n3、22:5n3、および22:6n3を含む、ホスファチジルエタノールアミンまたはプラズマローゲン型ホスファチジルエタノールアミン;
(c)異なる脂肪酸残基を含むスフィンゴミエリンであって、当該脂質分子種の脂質骨格に結合する前記異なる脂肪酸残基は16:0、24:0、18:1n9、および24:1n9を含む、スフィンゴミエリン;
(d)異なる脂肪酸残基を含むジアシルグリセロールであって、脂質骨格は未標識であり、同位体標識パルミテート(16:0)残基が当該脂質分子種の脂質骨格に第1の位置において結合し、かつ、脂質骨格の別位置に結合する前記異なる脂肪酸残基は16:0、18:0、18:1n9、18:2n6、18:3n3、20:4n6、20:5n3、および22:6n3を含む、ジアシルグリセロール;および
(e)異なる脂肪酸残基を含むトリアシルグリセロールであって、脂質骨格は未標識であり、同位体標識パルミテート(16:0)残基が当該脂質分子種の脂質骨格に第1の位置において結合し、かつ、脂質骨格の別位置に結合する前記異なる脂肪酸残基は16:0、18:0、18:1n9、18:2n6、18:3n3、20:3n6、20:4n6、および22:6n3を含む、トリアシルグリセロール。 - 同位体標識が2H、13Cまたは15Nを含む、請求項1または2に記載の内部標準組成物。
- 5%CE16:0
5%CE16:1n7
20%CE18:1n9
50%CE18:2n6
5%CE20:3n6
5%CE20:4n6
5%CE20:5n3
5%CE22:6n3
を含む、請求項1に記載の内部標準組成物。 - 異なる脂肪酸残基を含むコレステリルエステル(CE)の、同位体標識された内部標準組成物の合成方法であって、
異なる脂肪酸残基を、1または2以上の同位体標識を有するコレステロール頭部基にアシル化反応を介して付着させるステップを含み、
前記異なる脂肪酸残基は、16:0、16:1n7、18:1n9、18:2n6、20:3n6、20:4n6、20:5n3、および22:6n3を含む、方法。 - 2以上の脂質クラスからの脂質分子種を含む同位体標識された内部標準組成物の合成方法であって、前記脂質分子種のそれぞれは、脂質骨格、1または2以上の脂肪酸残基、および、1または2以上の同位体標識を含み、前記脂質分子種のそれぞれについて、
前記1または2以上の脂肪酸残基を、前記脂質骨格上の単一位置にアシル化反応を介して付着させるステップであって、前記1または2以上の脂肪酸残基が同位体標識されているステップ;および
前記1または2以上の脂肪酸残基を、前記脂質骨格上の単一位置にアシル化反応を介して付着させるステップであって、前記脂質骨格が同位体標識されているステップ;のうちの1以上を含み、
前記脂質分子種の前記2以上の脂質クラスは、
(i)異なる脂肪酸残基を含むコレステリルエステルであって、当該脂質分子種の脂質骨格に結合する前記異なる脂肪酸残基は16:0、16:1n7、18:1n9、18:2n6、20:3n6、20:4n6、20:5n3、および22:6n3を含む、コレステリルエステルと、
(ii)下記(a)〜(e)のうちの1つ以上と、を含む、内部標準組成物の合成方法:
(a)異なる脂肪酸残基を含むホスファチジルコリンまたはエーテル結合型ホスファチジルコリンであって、パルミテート(16:0)残基が当該脂質分子種の脂質骨格に第1の位置において結合し、かつ、脂質骨格の別位置に結合する前記異なる脂肪酸残基は16:1n7、18:1n9、18:2n6、18:3n3、20:3n6、20:4n6、20:5n3、22:4n6、22:5n3、および22:6n3を含む、ホスファチジルコリンまたはエーテル結合型ホスファチジルコリン;
(b)異なる脂肪酸残基を含むホスファチジルエタノールアミンまたはプラズマローゲン型ホスファチジルエタノールアミンであって、ステアレート(18:0)残基が当該脂質分子種の脂質骨格に第1の位置において結合し、かつ、脂質骨格の別位置に結合する前記異なる脂肪酸残基は18:1n9、18:2n6、18:3n3、20:3n6、20:4n6、20:5n3、22:5n3、および22:6n3を含む、ホスファチジルエタノールアミンまたはプラズマローゲン型ホスファチジルエタノールアミン;
(c)異なる脂肪酸残基を含むスフィンゴミエリンであって、当該脂質分子種の脂質骨格に結合する前記異なる脂肪酸残基は16:0、24:0、18:1n9、および24:1n9を含む、スフィンゴミエリン;
(d)異なる脂肪酸残基を含むジアシルグリセロールであって、脂質骨格は未標識であり、同位体標識パルミテート(16:0)残基が当該脂質分子種の脂質骨格に第1の位置において結合し、かつ、脂質骨格の別位置に結合する前記異なる脂肪酸残基は16:0、18:0、18:1n9、18:2n6、18:3n3、20:4n6、20:5n3、および22:6n3を含む、ジアシルグリセロール;および
(e)異なる脂肪酸残基を含むトリアシルグリセロールであって、脂質骨格は未標識であり、同位体標識パルミテート(16:0)残基が当該脂質分子種の脂質骨格に第1の位置において結合し、かつ、脂質骨格の別位置に結合する前記異なる脂肪酸残基は16:0、18:0、18:1n9、18:2n6、18:3n3、20:3n6、20:4n6、および22:6n3を含む、トリアシルグリセロール。 - 前記内部標準組成物は、
5%CE16:0
5%CE16:1n7
20%CE18:1n9
50%CE18:2n6
5%CE20:3n6
5%CE20:4n6
5%CE20:5n3
5%CE22:6n3
を含む、請求項5に記載の方法。 - (i)請求項1または2に記載の内部標準組成物の1または2以上と;、
(ii)対象サンプル中に存在する脂質分子種を検出または定量するために、請求項1に記載の前記コレステリルエステルおよび/または請求項2に記載の前記脂質分子種を内部標準として使用するための指示と、を含むキット。 - 前記脂質分子種の少なくとも1つは、1または2以上の同位体標識を有する脂質骨格を含み、前記脂質分子種の少なくとも1つは、1または2以上の同位体標識を有する脂肪酸残基を含む、請求項2に記載の内部標準組成物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201462031099P | 2014-07-30 | 2014-07-30 | |
| US62/031,099 | 2014-07-30 | ||
| PCT/US2015/042904 WO2016019140A1 (en) | 2014-07-30 | 2015-07-30 | Methods, compositions, and kits for analysis of structurally diverse complex lipids |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2017524708A JP2017524708A (ja) | 2017-08-31 |
| JP2017524708A5 JP2017524708A5 (ja) | 2018-09-06 |
| JP6810023B2 true JP6810023B2 (ja) | 2021-01-06 |
Family
ID=55218314
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2017505546A Active JP6810023B2 (ja) | 2014-07-30 | 2015-07-30 | 構造的に多様な複合脂質を分析するための方法、組成物およびキット |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US11181535B2 (ja) |
| EP (1) | EP3174991B1 (ja) |
| JP (1) | JP6810023B2 (ja) |
| CN (1) | CN107075539B (ja) |
| AU (1) | AU2015296304B2 (ja) |
| CA (1) | CA2955204A1 (ja) |
| WO (1) | WO2016019140A1 (ja) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2018183448A1 (en) * | 2017-03-31 | 2018-10-04 | Metabolon, Inc. | Comprehensive and quatitative lipid and tocopherol analysis |
| JP7306676B2 (ja) * | 2019-02-26 | 2023-07-11 | 国立大学法人九州大学 | 脂質プロファイリングシステム、脂質プロファイリング方法、及び脂質プロファイリングプログラム |
| AU2020287121A1 (en) * | 2019-06-04 | 2022-01-06 | Avanti Polar Lipids, Llc | Universal lipid quantitative standards for use in lipidomics |
| CN110609097A (zh) * | 2019-09-12 | 2019-12-24 | 谱尼测试集团股份有限公司 | 一种磷脂酰丝氨酸类化合物的筛查方法 |
Family Cites Families (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4224031A (en) * | 1977-11-15 | 1980-09-23 | Mee John M L | CI Mass spectrometric analysis of physiologically active compounds |
| GB0128498D0 (en) * | 2001-11-28 | 2002-01-23 | Inst Of Child Health | International standards for sphingolipids |
| WO2003078574A2 (en) | 2002-03-11 | 2003-09-25 | Lipomics Technologies, Inc. | Novel metabolic targets and markers |
| US7306952B2 (en) * | 2002-06-26 | 2007-12-11 | Washington University In St. Louis | Molecular fingerprinting of triglycerides in biological samples by electrospray ionization tandem mass spectrometry |
| US20070082399A1 (en) * | 2003-07-11 | 2007-04-12 | Tatiana A Egorova-Zachernyuk | Compositions and method for stable isotope labelling of biological compounds |
| CN100567967C (zh) * | 2006-08-31 | 2009-12-09 | 华南理工大学 | 一种定量测定纸浆树脂中甘油三酯含量的方法 |
| US20100159540A1 (en) * | 2007-03-26 | 2010-06-24 | Ana Rodriguez | Synthesis of resolvins and intermediates, compounds prepared thereby, and uses thereof |
| EP3059592A1 (en) * | 2008-05-28 | 2016-08-24 | Basf Se | Methods for assessing liver toxicity |
| US8263413B1 (en) * | 2008-10-17 | 2012-09-11 | Andrew S Hansen | Methods for analyzing lipids and membrane proteins in biological matter using stable isotopes and mass spectrometry |
| SG10201405974SA (en) * | 2009-10-01 | 2014-10-30 | Phenomenome Discoveries Inc | Serum-based biomarkers of pancreatic cancer and uses thereof for diseasedetection and diagnosis |
| EP2345897A1 (en) * | 2010-01-18 | 2011-07-20 | Nederlandse Organisatie voor toegepast -natuurwetenschappelijk onderzoek TNO | Improved method for the detection of polyunsaturated fatty acids |
| CN101824064A (zh) * | 2010-01-29 | 2010-09-08 | 上海化工研究院 | 一种13c标记胆甾醇羧酸酯的合成方法 |
| GB201213127D0 (en) * | 2012-07-24 | 2012-09-05 | Univ Dundee | Novel isotopic labelling method |
| US10705100B1 (en) * | 2013-09-11 | 2020-07-07 | HB Biotech, LLC | Methods for analyzing lipids and membrane proteins in biological matter using stable isotopes and mass spectrometry |
| CN103743851B (zh) * | 2014-02-14 | 2015-06-17 | 中国农业科学院油料作物研究所 | 一种食用油中甘油三酯的单柱二维液相色谱-质谱分析方法及其应用 |
-
2015
- 2015-07-30 EP EP15827995.0A patent/EP3174991B1/en active Active
- 2015-07-30 JP JP2017505546A patent/JP6810023B2/ja active Active
- 2015-07-30 WO PCT/US2015/042904 patent/WO2016019140A1/en active Application Filing
- 2015-07-30 CN CN201580040519.5A patent/CN107075539B/zh active Active
- 2015-07-30 AU AU2015296304A patent/AU2015296304B2/en active Active
- 2015-07-30 CA CA2955204A patent/CA2955204A1/en not_active Abandoned
-
2016
- 2016-08-30 US US15/251,579 patent/US11181535B2/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| CN107075539B (zh) | 2021-11-12 |
| US11181535B2 (en) | 2021-11-23 |
| US20170192023A1 (en) | 2017-07-06 |
| EP3174991A1 (en) | 2017-06-07 |
| EP3174991B1 (en) | 2024-03-20 |
| AU2015296304B2 (en) | 2019-08-29 |
| AU2015296304A1 (en) | 2017-02-02 |
| WO2016019140A1 (en) | 2016-02-04 |
| CA2955204A1 (en) | 2016-02-04 |
| CN107075539A (zh) | 2017-08-18 |
| JP2017524708A (ja) | 2017-08-31 |
| EP3174991A4 (en) | 2018-02-14 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Wiesner et al. | Lipid profiling of FPLC-separated lipoprotein fractions by electrospray ionization tandem mass spectrometry | |
| US20200116743A1 (en) | Method of Assessing Liver Triglyceride Levels Using a Body Fluid Sample | |
| Özbalci et al. | Quantitative analysis of cellular lipids by nano-electrospray ionization mass spectrometry | |
| Avela et al. | Advances in lipidomics | |
| JP6810023B2 (ja) | 構造的に多様な複合脂質を分析するための方法、組成物およびキット | |
| CA2799032A1 (en) | Methods to diagnose liver diseases | |
| Scherer et al. | Lipid profiling of lipoproteins by electrospray ionization tandem mass spectrometry | |
| Holčapek et al. | Lipidomic analysis of plasma, erythrocytes and lipoprotein fractions of cardiovascular disease patients using UHPLC/MS, MALDI-MS and multivariate data analysis | |
| CA2900031A1 (en) | Means and methods for assessing the quality of a biological sample | |
| CA2724422A1 (en) | Means and methods for assessing increased peroxisomal proliferation | |
| Dyńska-Kukulska et al. | Methods of extraction and thin-layer chromatography determination of phospholipids in biological samples | |
| Zhang et al. | Validation of a multiplexed and targeted lipidomics assay for accurate quantification of lipidomes | |
| Liu et al. | Lipidomics in milk: Recent advances and developments | |
| Zhang et al. | Development of a targeted hydrophilic interaction liquid chromatography-tandem mass spectrometry based lipidomics platform applied to a coronavirus disease severity study | |
| McDonald et al. | Approaches to lipid analysis | |
| Alqarni et al. | A High‐Throughput Method for the Analysis of Erythrocyte Fatty Acids and the Omega‐3 Index | |
| Torkhovskaya et al. | Human Blood Plasma Lipidome: Opportunities and Prospects of Its Analysis in Medical Chemistry | |
| Berry et al. | Analysis of polyunsaturated aminophospholipid molecular species using isotope-tagged derivatives and tandem mass spectrometry/mass spectrometry/mass spectrometry | |
| Gao et al. | Dual mass spectrometry as a tool to improve annotation and quantification in targeted plasma lipidomics | |
| Holcapek et al. | Mass spectrometry for lipidomics: methods and applications | |
| Hewelt-Belka et al. | Analytical strategies and applications in lipidomics | |
| Li | Development of metabolomics and lipidomics workflows for phosphorylated metabolites using ultra-high-performance liquid chromatography with tandem mass spectrometry | |
| Höring et al. | Direct Infusion (Shotgun) Electrospray Mass Spectrometry | |
| Zhang et al. | Development of a targeted HILIC-MS/MS based lipidomics platform applied to a coronavirus disease severity study | |
| Lin et al. | Comprehensive Mouse Skin Ceramide Analysis on a Solid-Phase and TLC Separation with High-Resolution Mass Spectrometry Platform |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180726 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20180726 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20190806 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20191021 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20191226 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200122 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20200526 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20200824 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200929 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20201201 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20201210 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6810023 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |