JP6644792B2 - ベンザゼピンスルホンアミド化合物 - Google Patents
ベンザゼピンスルホンアミド化合物 Download PDFInfo
- Publication number
- JP6644792B2 JP6644792B2 JP2017532712A JP2017532712A JP6644792B2 JP 6644792 B2 JP6644792 B2 JP 6644792B2 JP 2017532712 A JP2017532712 A JP 2017532712A JP 2017532712 A JP2017532712 A JP 2017532712A JP 6644792 B2 JP6644792 B2 JP 6644792B2
- Authority
- JP
- Japan
- Prior art keywords
- alkyl
- amino
- compound
- benzazepine
- carboxamide
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
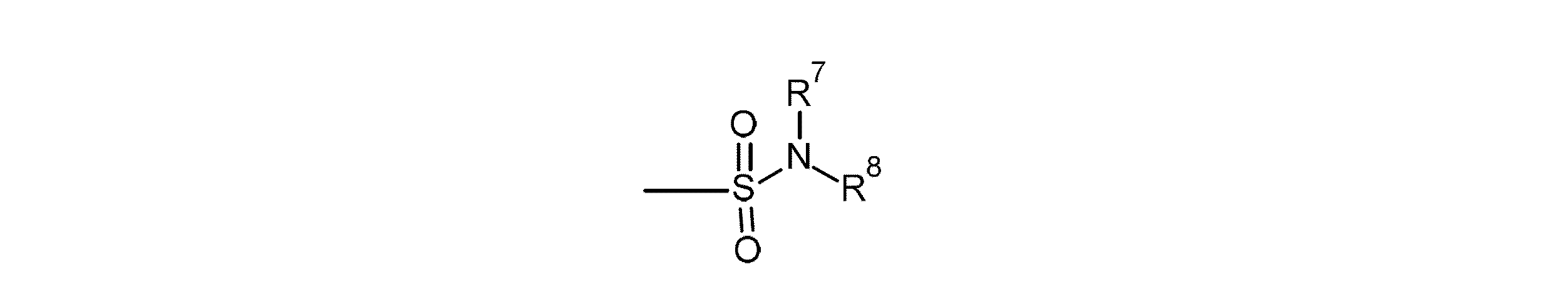
- -1 Benzazepine sulfonamide compound Chemical class 0.000 title claims description 47
- 150000001875 compounds Chemical class 0.000 claims description 257
- 125000000217 alkyl group Chemical group 0.000 claims description 46
- 238000002360 preparation method Methods 0.000 claims description 44
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 43
- 239000001257 hydrogen Substances 0.000 claims description 37
- 229910052739 hydrogen Inorganic materials 0.000 claims description 37
- 201000010099 disease Diseases 0.000 claims description 35
- 150000003839 salts Chemical class 0.000 claims description 34
- 238000011282 treatment Methods 0.000 claims description 34
- 150000002431 hydrogen Chemical class 0.000 claims description 30
- 239000000556 agonist Substances 0.000 claims description 25
- 238000000034 method Methods 0.000 claims description 23
- 229910052757 nitrogen Inorganic materials 0.000 claims description 21
- 206010028980 Neoplasm Diseases 0.000 claims description 20
- 201000011510 cancer Diseases 0.000 claims description 18
- 208000023275 Autoimmune disease Diseases 0.000 claims description 17
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 17
- 125000006239 protecting group Chemical group 0.000 claims description 17
- 125000000623 heterocyclic group Chemical group 0.000 claims description 16
- 230000001404 mediated effect Effects 0.000 claims description 15
- 239000003814 drug Substances 0.000 claims description 14
- 208000015181 infectious disease Diseases 0.000 claims description 14
- 125000004433 nitrogen atom Chemical group N* 0.000 claims description 12
- 208000035473 Communicable disease Diseases 0.000 claims description 11
- 239000008194 pharmaceutical composition Substances 0.000 claims description 11
- 239000003054 catalyst Substances 0.000 claims description 10
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 7
- 206010020751 Hypersensitivity Diseases 0.000 claims description 7
- 208000006673 asthma Diseases 0.000 claims description 7
- 230000007815 allergy Effects 0.000 claims description 6
- XHFJJDOEZOEMTL-UHFFFAOYSA-N 2-amino-8-(3-piperazin-1-ylsulfonylphenyl)-N,N-dipropyl-3H-1-benzazepine-4-carboxamide Chemical compound NC1=NC2=C(C=C(C1)C(=O)N(CCC)CCC)C=CC(=C2)C1=CC(=CC=C1)S(=O)(=O)N1CCNCC1 XHFJJDOEZOEMTL-UHFFFAOYSA-N 0.000 claims description 5
- VYFLNROVAFIPLP-UHFFFAOYSA-N 2-amino-8-[3-(3-hydroxypyrrolidin-1-yl)sulfonylphenyl]-N,N-dipropyl-3H-1-benzazepine-4-carboxamide Chemical compound NC1=NC2=C(C=C(C1)C(=O)N(CCC)CCC)C=CC(=C2)C1=CC(=CC=C1)S(=O)(=O)N1CC(CC1)O VYFLNROVAFIPLP-UHFFFAOYSA-N 0.000 claims description 5
- KJKMCOPGSVTGAP-XMMPIXPASA-N 2-amino-8-[3-[(3R)-3-hydroxypiperidin-1-yl]sulfonylphenyl]-N,N-dipropyl-3H-1-benzazepine-4-carboxamide Chemical compound NC1=NC2=C(C=C(C1)C(=O)N(CCC)CCC)C=CC(=C2)C1=CC(=CC=C1)S(=O)(=O)N1C[C@@H](CCC1)O KJKMCOPGSVTGAP-XMMPIXPASA-N 0.000 claims description 5
- MCLUNLQQUCBJRN-HSZRJFAPSA-N 2-amino-8-[3-[(3R)-3-hydroxypyrrolidin-1-yl]sulfonyl-5-(trifluoromethyl)phenyl]-N,N-dipropyl-3H-1-benzazepine-4-carboxamide Chemical compound NC1=NC2=C(C=C(C1)C(=O)N(CCC)CCC)C=CC(=C2)C1=CC(=CC(=C1)C(F)(F)F)S(=O)(=O)N1C[C@@H](CC1)O MCLUNLQQUCBJRN-HSZRJFAPSA-N 0.000 claims description 5
- KJKMCOPGSVTGAP-DEOSSOPVSA-N 2-amino-8-[3-[(3S)-3-hydroxypiperidin-1-yl]sulfonylphenyl]-N,N-dipropyl-3H-1-benzazepine-4-carboxamide Chemical compound NC1=NC2=C(C=C(C1)C(=O)N(CCC)CCC)C=CC(=C2)C1=CC(=CC=C1)S(=O)(=O)N1C[C@H](CCC1)O KJKMCOPGSVTGAP-DEOSSOPVSA-N 0.000 claims description 5
- YALPNIHFDNYZGU-UHFFFAOYSA-N 2-amino-8-[4-(3-hydroxypyrrolidin-1-yl)sulfonylphenyl]-N,N-dipropyl-3H-1-benzazepine-4-carboxamide Chemical compound NC1=NC2=C(C=C(C1)C(=O)N(CCC)CCC)C=CC(=C2)C1=CC=C(C=C1)S(=O)(=O)N1CC(CC1)O YALPNIHFDNYZGU-UHFFFAOYSA-N 0.000 claims description 5
- AOFYOBTXXBPKDK-UHFFFAOYSA-N 2-amino-N,N-dipropyl-8-(3-pyrrolidin-1-ylsulfonylphenyl)-3H-1-benzazepine-4-carboxamide Chemical compound NC1=NC2=C(C=C(C1)C(=O)N(CCC)CCC)C=CC(=C2)C1=CC(=CC=C1)S(=O)(=O)N1CCCC1 AOFYOBTXXBPKDK-UHFFFAOYSA-N 0.000 claims description 5
- 208000009329 Graft vs Host Disease Diseases 0.000 claims description 5
- 208000029462 Immunodeficiency disease Diseases 0.000 claims description 5
- 206010061218 Inflammation Diseases 0.000 claims description 5
- 206010040047 Sepsis Diseases 0.000 claims description 5
- 206010052779 Transplant rejections Diseases 0.000 claims description 5
- 230000002378 acidificating effect Effects 0.000 claims description 5
- 239000002671 adjuvant Substances 0.000 claims description 5
- 125000000304 alkynyl group Chemical group 0.000 claims description 5
- 208000026935 allergic disease Diseases 0.000 claims description 5
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 claims description 5
- 208000024908 graft versus host disease Diseases 0.000 claims description 5
- 230000007813 immunodeficiency Effects 0.000 claims description 5
- 230000004054 inflammatory process Effects 0.000 claims description 5
- BGQNKFYQOZJGLH-UHFFFAOYSA-N 2-amino-8-[5-(3-aminopyrrolidin-1-yl)sulfonylpyridin-3-yl]-N,N-dipropyl-3H-1-benzazepine-4-carboxamide Chemical compound NC1=NC2=C(C=C(C1)C(=O)N(CCC)CCC)C=CC(=C2)C=1C=NC=C(C=1)S(=O)(=O)N1CC(CC1)N BGQNKFYQOZJGLH-UHFFFAOYSA-N 0.000 claims description 4
- XULPMNAOWSEXEZ-UHFFFAOYSA-N 2-amino-N,N-dipropyl-8-(3-sulfamoylphenyl)-3H-1-benzazepine-4-carboxamide Chemical compound NC1=NC2=C(C=C(C1)C(=O)N(CCC)CCC)C=CC(=C2)C1=CC(=CC=C1)S(N)(=O)=O XULPMNAOWSEXEZ-UHFFFAOYSA-N 0.000 claims description 4
- IPWKHHSGDUIRAH-UHFFFAOYSA-N bis(pinacolato)diboron Chemical compound O1C(C)(C)C(C)(C)OB1B1OC(C)(C)C(C)(C)O1 IPWKHHSGDUIRAH-UHFFFAOYSA-N 0.000 claims description 4
- 229910052736 halogen Inorganic materials 0.000 claims description 4
- 150000002367 halogens Chemical class 0.000 claims description 4
- 230000008569 process Effects 0.000 claims description 4
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 4
- ZYIUHZMDBPZUPA-UHFFFAOYSA-N 2-amino-8-(5-piperazin-1-ylsulfonylpyridin-3-yl)-N,N-dipropyl-3H-1-benzazepine-4-carboxamide Chemical compound NC1=NC2=C(C=C(C1)C(=O)N(CCC)CCC)C=CC(=C2)C=1C=NC=C(C=1)S(=O)(=O)N1CCNCC1 ZYIUHZMDBPZUPA-UHFFFAOYSA-N 0.000 claims description 3
- PRZBRTYMVQYOER-UHFFFAOYSA-N 2-amino-8-[3-(2-hydroxyethylsulfamoyl)phenyl]-N,N-dipropyl-3H-1-benzazepine-4-carboxamide Chemical compound NC1=NC2=C(C=C(C1)C(=O)N(CCC)CCC)C=CC(=C2)C1=CC(=CC=C1)S(NCCO)(=O)=O PRZBRTYMVQYOER-UHFFFAOYSA-N 0.000 claims description 3
- FWMWVALUIIJRTE-UHFFFAOYSA-N 2-amino-8-[3-(3-hydroxyazetidin-1-yl)sulfonylphenyl]-N,N-dipropyl-3H-1-benzazepine-4-carboxamide Chemical compound NC1=NC2=C(C=C(C1)C(=O)N(CCC)CCC)C=CC(=C2)C1=CC(=CC=C1)S(=O)(=O)N1CC(C1)O FWMWVALUIIJRTE-UHFFFAOYSA-N 0.000 claims description 3
- TWNHOJCKFNSZLR-UHFFFAOYSA-N 2-amino-8-[3-(4-hydroxypiperidin-1-yl)sulfonylphenyl]-N,N-dipropyl-3H-1-benzazepine-4-carboxamide Chemical compound NC1=NC2=C(C=C(C1)C(=O)N(CCC)CCC)C=CC(=C2)C1=CC(=CC=C1)S(=O)(=O)N1CCC(CC1)O TWNHOJCKFNSZLR-UHFFFAOYSA-N 0.000 claims description 3
- SUFFDZSJDHSLCF-UHFFFAOYSA-N 2-amino-8-[3-(6-hydroxyhexylsulfamoyl)phenyl]-N,N-dipropyl-3H-1-benzazepine-4-carboxamide Chemical compound NC1=NC2=C(C=C(C1)C(=O)N(CCC)CCC)C=CC(=C2)C1=CC(=CC=C1)S(NCCCCCCO)(=O)=O SUFFDZSJDHSLCF-UHFFFAOYSA-N 0.000 claims description 3
- IVEUKFRCPXQIGV-HSZRJFAPSA-N 2-amino-8-[3-[(3R)-3-hydroxypyrrolidin-1-yl]sulfonyl-2-methylphenyl]-N,N-dipropyl-3H-1-benzazepine-4-carboxamide Chemical compound NC1=NC2=C(C=C(C1)C(=O)N(CCC)CCC)C=CC(=C2)C1=C(C(=CC=C1)S(=O)(=O)N1C[C@@H](CC1)O)C IVEUKFRCPXQIGV-HSZRJFAPSA-N 0.000 claims description 3
- LTWGYPYVURXKNE-HSZRJFAPSA-N 2-amino-8-[3-[(3R)-3-hydroxypyrrolidin-1-yl]sulfonyl-4-methoxyphenyl]-N,N-dipropyl-3H-1-benzazepine-4-carboxamide Chemical compound NC1=NC2=C(C=C(C1)C(=O)N(CCC)CCC)C=CC(=C2)C1=CC(=C(C=C1)OC)S(=O)(=O)N1C[C@@H](CC1)O LTWGYPYVURXKNE-HSZRJFAPSA-N 0.000 claims description 3
- MRESQYLCRKMHIV-XMMPIXPASA-N 2-amino-8-[3-[(3R)-3-hydroxypyrrolidin-1-yl]sulfonyl-5-methylphenyl]-N,N-dipropyl-3H-1-benzazepine-4-carboxamide Chemical compound NC1=NC2=C(C=C(C1)C(=O)N(CCC)CCC)C=CC(=C2)C1=CC(=CC(=C1)C)S(=O)(=O)N1C[C@@H](CC1)O MRESQYLCRKMHIV-XMMPIXPASA-N 0.000 claims description 3
- VYFLNROVAFIPLP-HSZRJFAPSA-N 2-amino-8-[3-[(3R)-3-hydroxypyrrolidin-1-yl]sulfonylphenyl]-N,N-dipropyl-3H-1-benzazepine-4-carboxamide Chemical compound NC1=NC2=C(C=C(C1)C(=O)N(CCC)CCC)C=CC(=C2)C1=CC(=CC=C1)S(=O)(=O)N1C[C@@H](CC1)O VYFLNROVAFIPLP-HSZRJFAPSA-N 0.000 claims description 3
- VYFLNROVAFIPLP-QHCPKHFHSA-N 2-amino-8-[3-[(3S)-3-hydroxypyrrolidin-1-yl]sulfonylphenyl]-N,N-dipropyl-3H-1-benzazepine-4-carboxamide Chemical compound NC1=NC2=C(C=C(C1)C(=O)N(CCC)CCC)C=CC(=C2)C1=CC(=CC=C1)S(=O)(=O)N1C[C@H](CC1)O VYFLNROVAFIPLP-QHCPKHFHSA-N 0.000 claims description 3
- KIWHHYOVAVOSIC-UHFFFAOYSA-N 2-amino-8-[3-[2-(2-hydroxyethoxy)ethylsulfamoyl]phenyl]-N,N-dipropyl-3H-1-benzazepine-4-carboxamide Chemical compound NC1=NC2=C(C=C(C1)C(=O)N(CCC)CCC)C=CC(=C2)C1=CC(=CC=C1)S(NCCOCCO)(=O)=O KIWHHYOVAVOSIC-UHFFFAOYSA-N 0.000 claims description 3
- IYINQZBASYPYNY-UHFFFAOYSA-N 2-amino-8-[3-[2-hydroxyethyl(methyl)sulfamoyl]phenyl]-N,N-dipropyl-3H-1-benzazepine-4-carboxamide Chemical compound NC1=NC2=C(C=C(C1)C(=O)N(CCC)CCC)C=CC(=C2)C1=CC(=CC=C1)S(N(C)CCO)(=O)=O IYINQZBASYPYNY-UHFFFAOYSA-N 0.000 claims description 3
- ZLDDGAXHLAIMJL-UHFFFAOYSA-N 2-amino-8-[3-[3-(hydroxymethyl)azetidin-1-yl]sulfonylphenyl]-N,N-dipropyl-3H-1-benzazepine-4-carboxamide Chemical compound NC1=NC2=C(C=C(C1)C(=O)N(CCC)CCC)C=CC(=C2)C1=CC(=CC=C1)S(=O)(=O)N1CC(C1)CO ZLDDGAXHLAIMJL-UHFFFAOYSA-N 0.000 claims description 3
- GJIJHXSJJPTBDK-UHFFFAOYSA-N 2-amino-N,N-dipropyl-8-(5-sulfamoylpyridin-3-yl)-3H-1-benzazepine-4-carboxamide Chemical compound NC1=NC2=C(C=C(C1)C(=O)N(CCC)CCC)C=CC(=C2)C=1C=NC=C(C=1)S(N)(=O)=O GJIJHXSJJPTBDK-UHFFFAOYSA-N 0.000 claims description 3
- 239000003937 drug carrier Substances 0.000 claims description 3
- 125000006661 (C4-C6) heterocyclic group Chemical group 0.000 claims description 2
- 125000004070 6 membered heterocyclic group Chemical group 0.000 claims description 2
- 125000005189 alkyl hydroxy group Chemical group 0.000 claims description 2
- 125000004356 hydroxy functional group Chemical group O* 0.000 claims 1
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 57
- 239000007787 solid Substances 0.000 description 32
- 238000005481 NMR spectroscopy Methods 0.000 description 26
- 239000000243 solution Substances 0.000 description 25
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 24
- 102000002689 Toll-like receptor Human genes 0.000 description 22
- 108020000411 Toll-like receptor Proteins 0.000 description 22
- ZJAYGKNATMSZHZ-UHFFFAOYSA-N 5-bromopyridine-3-sulfonamide Chemical compound NS(=O)(=O)C1=CN=CC(Br)=C1 ZJAYGKNATMSZHZ-UHFFFAOYSA-N 0.000 description 21
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 20
- WFHVDIRMZIDSGT-UHFFFAOYSA-N 1-(3-bromophenyl)sulfonylpyrrolidin-3-ol Chemical compound C1C(O)CCN1S(=O)(=O)C1=CC=CC(Br)=C1 WFHVDIRMZIDSGT-UHFFFAOYSA-N 0.000 description 19
- 101000800483 Homo sapiens Toll-like receptor 8 Proteins 0.000 description 17
- 239000000203 mixture Substances 0.000 description 17
- JHHZLHWJQPUNKB-UHFFFAOYSA-N pyrrolidin-3-ol Chemical compound OC1CCNC1 JHHZLHWJQPUNKB-UHFFFAOYSA-N 0.000 description 15
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 15
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 14
- 230000000694 effects Effects 0.000 description 14
- 239000011541 reaction mixture Substances 0.000 description 14
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 13
- 101000669402 Homo sapiens Toll-like receptor 7 Proteins 0.000 description 12
- 102100033110 Toll-like receptor 8 Human genes 0.000 description 12
- 238000006243 chemical reaction Methods 0.000 description 12
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 11
- 102100039390 Toll-like receptor 7 Human genes 0.000 description 11
- 239000011734 sodium Substances 0.000 description 11
- 239000002904 solvent Substances 0.000 description 11
- 229940124614 TLR 8 agonist Drugs 0.000 description 10
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 10
- 239000012876 carrier material Substances 0.000 description 10
- GCWKKGGVWDUSCJ-SECBINFHSA-N (3R)-1-(3-bromo-2-methylphenyl)sulfonylpyrrolidin-3-ol Chemical compound BrC=1C(=C(C=CC=1)S(=O)(=O)N1C[C@@H](CC1)O)C GCWKKGGVWDUSCJ-SECBINFHSA-N 0.000 description 9
- 125000004432 carbon atom Chemical group C* 0.000 description 9
- 210000004027 cell Anatomy 0.000 description 9
- 235000019439 ethyl acetate Nutrition 0.000 description 9
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 9
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 9
- 239000012044 organic layer Substances 0.000 description 9
- KDLHZDBZIXYQEI-UHFFFAOYSA-N palladium Substances [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 9
- PJGOLCXVWIYXRQ-UHFFFAOYSA-N 3-bromobenzenesulfonyl chloride Chemical compound ClS(=O)(=O)C1=CC=CC(Br)=C1 PJGOLCXVWIYXRQ-UHFFFAOYSA-N 0.000 description 8
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 8
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 8
- 239000002253 acid Substances 0.000 description 8
- 230000001363 autoimmune Effects 0.000 description 8
- 238000002953 preparative HPLC Methods 0.000 description 8
- 210000003491 skin Anatomy 0.000 description 8
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 7
- 230000004913 activation Effects 0.000 description 7
- JCWIWBWXCVGEAN-UHFFFAOYSA-L cyclopentyl(diphenyl)phosphane;dichloropalladium;iron Chemical compound [Fe].Cl[Pd]Cl.[CH]1[CH][CH][CH][C]1P(C=1C=CC=CC=1)C1=CC=CC=C1.[CH]1[CH][CH][CH][C]1P(C=1C=CC=CC=1)C1=CC=CC=C1 JCWIWBWXCVGEAN-UHFFFAOYSA-L 0.000 description 7
- 208000035475 disorder Diseases 0.000 description 7
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 6
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 6
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 6
- 238000006069 Suzuki reaction reaction Methods 0.000 description 6
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 6
- 125000003545 alkoxy group Chemical group 0.000 description 6
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 6
- 239000012043 crude product Substances 0.000 description 6
- 239000007788 liquid Substances 0.000 description 6
- 239000012299 nitrogen atmosphere Substances 0.000 description 6
- RFIOZSIHFNEKFF-UHFFFAOYSA-M piperazine-1-carboxylate Chemical compound [O-]C(=O)N1CCNCC1 RFIOZSIHFNEKFF-UHFFFAOYSA-M 0.000 description 6
- 238000000746 purification Methods 0.000 description 6
- 238000003756 stirring Methods 0.000 description 6
- 230000003612 virological effect Effects 0.000 description 6
- UNJJYPDSKBSWMS-SNVBAGLBSA-N (3R)-1-(3-bromophenyl)sulfonylpiperidin-3-ol Chemical compound BrC=1C=C(C=CC=1)S(=O)(=O)N1C[C@@H](CCC1)O UNJJYPDSKBSWMS-SNVBAGLBSA-N 0.000 description 5
- UNJJYPDSKBSWMS-JTQLQIEISA-N (3S)-1-(3-bromophenyl)sulfonylpiperidin-3-ol Chemical compound BrC=1C=C(C=CC=1)S(=O)(=O)N1C[C@H](CCC1)O UNJJYPDSKBSWMS-JTQLQIEISA-N 0.000 description 5
- WFHVDIRMZIDSGT-SECBINFHSA-N (3r)-1-(3-bromophenyl)sulfonylpyrrolidin-3-ol Chemical compound C1[C@H](O)CCN1S(=O)(=O)C1=CC=CC(Br)=C1 WFHVDIRMZIDSGT-SECBINFHSA-N 0.000 description 5
- XLDGAAATZAMDFD-SECBINFHSA-N (3r)-1-(5-bromo-2-methoxyphenyl)sulfonylpyrrolidin-3-ol Chemical compound COC1=CC=C(Br)C=C1S(=O)(=O)N1C[C@H](O)CC1 XLDGAAATZAMDFD-SECBINFHSA-N 0.000 description 5
- WFHVDIRMZIDSGT-VIFPVBQESA-N (3s)-1-(3-bromophenyl)sulfonylpyrrolidin-3-ol Chemical compound C1[C@@H](O)CCN1S(=O)(=O)C1=CC=CC(Br)=C1 WFHVDIRMZIDSGT-VIFPVBQESA-N 0.000 description 5
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 5
- MHUGRXNQCHZPNI-UHFFFAOYSA-N 1-(3-bromophenyl)sulfonylpiperidin-4-ol Chemical compound C1CC(O)CCN1S(=O)(=O)C1=CC=CC(Br)=C1 MHUGRXNQCHZPNI-UHFFFAOYSA-N 0.000 description 5
- VVEPZEYUGIZNCS-UHFFFAOYSA-N 1-(4-bromophenyl)sulfonylpyrrolidin-3-ol Chemical compound C1C(O)CCN1S(=O)(=O)C1=CC=C(Br)C=C1 VVEPZEYUGIZNCS-UHFFFAOYSA-N 0.000 description 5
- IQQGUKHFDQQKOL-UHFFFAOYSA-N 3-bromo-N-(6-hydroxyhexyl)benzenesulfonamide Chemical compound BrC=1C=C(C=CC=1)S(=O)(=O)NCCCCCCO IQQGUKHFDQQKOL-UHFFFAOYSA-N 0.000 description 5
- NLCXSGXFPPAOMI-UHFFFAOYSA-N 3-bromo-n-(2-hydroxyethyl)-n-methylbenzenesulfonamide Chemical compound OCCN(C)S(=O)(=O)C1=CC=CC(Br)=C1 NLCXSGXFPPAOMI-UHFFFAOYSA-N 0.000 description 5
- DITWPDQTAAIZQI-UHFFFAOYSA-N 3-bromo-n-[2-(2-hydroxyethoxy)ethyl]benzenesulfonamide Chemical compound OCCOCCNS(=O)(=O)C1=CC=CC(Br)=C1 DITWPDQTAAIZQI-UHFFFAOYSA-N 0.000 description 5
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 5
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 5
- 208000031888 Mycoses Diseases 0.000 description 5
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 5
- 125000004183 alkoxy alkyl group Chemical group 0.000 description 5
- 125000003118 aryl group Chemical group 0.000 description 5
- 239000002585 base Substances 0.000 description 5
- 125000001153 fluoro group Chemical group F* 0.000 description 5
- 102000045720 human TLR8 Human genes 0.000 description 5
- 238000002347 injection Methods 0.000 description 5
- 239000007924 injection Substances 0.000 description 5
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 5
- 230000000638 stimulation Effects 0.000 description 5
- OCPBBZQADAOTDT-UHFFFAOYSA-N tert-butyl 4-(3-bromophenyl)sulfonylpiperazine-1-carboxylate Chemical compound C1CN(C(=O)OC(C)(C)C)CCN1S(=O)(=O)C1=CC=CC(Br)=C1 OCPBBZQADAOTDT-UHFFFAOYSA-N 0.000 description 5
- 125000006275 3-bromophenyl group Chemical group [H]C1=C([H])C(Br)=C([H])C(*)=C1[H] 0.000 description 4
- 208000035143 Bacterial infection Diseases 0.000 description 4
- FKLJPTJMIBLJAV-UHFFFAOYSA-N Compound IV Chemical compound O1N=C(C)C=C1CCCCCCCOC1=CC=C(C=2OCCN=2)C=C1 FKLJPTJMIBLJAV-UHFFFAOYSA-N 0.000 description 4
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 4
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 4
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 4
- 241001465754 Metazoa Species 0.000 description 4
- FIWILGQIZHDAQG-UHFFFAOYSA-N NC1=C(C(=O)NCC2=CC=C(C=C2)OCC(F)(F)F)C=C(C(=N1)N)N1N=C(N=C1)C1(CC1)C(F)(F)F Chemical compound NC1=C(C(=O)NCC2=CC=C(C=C2)OCC(F)(F)F)C=C(C(=N1)N)N1N=C(N=C1)C1(CC1)C(F)(F)F FIWILGQIZHDAQG-UHFFFAOYSA-N 0.000 description 4
- 108010057466 NF-kappa B Proteins 0.000 description 4
- 102100023050 Nuclear factor NF-kappa-B p105 subunit Human genes 0.000 description 4
- 208000030852 Parasitic disease Diseases 0.000 description 4
- 239000004698 Polyethylene Substances 0.000 description 4
- 238000003556 assay Methods 0.000 description 4
- 125000004429 atom Chemical group 0.000 description 4
- 210000001185 bone marrow Anatomy 0.000 description 4
- 238000002648 combination therapy Methods 0.000 description 4
- 238000010511 deprotection reaction Methods 0.000 description 4
- 239000007903 gelatin capsule Substances 0.000 description 4
- 238000004128 high performance liquid chromatography Methods 0.000 description 4
- 239000003921 oil Substances 0.000 description 4
- 235000019198 oils Nutrition 0.000 description 4
- 229920005862 polyol Polymers 0.000 description 4
- 150000003077 polyols Chemical class 0.000 description 4
- 230000002265 prevention Effects 0.000 description 4
- 102000005962 receptors Human genes 0.000 description 4
- 108020003175 receptors Proteins 0.000 description 4
- BXNMTOQRYBFHNZ-UHFFFAOYSA-N resiquimod Chemical compound C1=CC=CC2=C(N(C(COCC)=N3)CC(C)(C)O)C3=C(N)N=C21 BXNMTOQRYBFHNZ-UHFFFAOYSA-N 0.000 description 4
- 229950010550 resiquimod Drugs 0.000 description 4
- 229910000029 sodium carbonate Inorganic materials 0.000 description 4
- 125000000472 sulfonyl group Chemical group *S(*)(=O)=O 0.000 description 4
- 208000024891 symptom Diseases 0.000 description 4
- 239000003826 tablet Substances 0.000 description 4
- 230000001225 therapeutic effect Effects 0.000 description 4
- DBEIQXBBGDSFAW-SECBINFHSA-N (3R)-1-[3-bromo-5-(trifluoromethyl)phenyl]sulfonylpyrrolidin-3-ol Chemical compound BrC=1C=C(C=C(C=1)C(F)(F)F)S(=O)(=O)N1C[C@@H](CC1)O DBEIQXBBGDSFAW-SECBINFHSA-N 0.000 description 3
- BIWOSRSKDCZIFM-RXMQYKEDSA-N (3r)-piperidin-3-ol Chemical compound O[C@@H]1CCCNC1 BIWOSRSKDCZIFM-RXMQYKEDSA-N 0.000 description 3
- JHHZLHWJQPUNKB-SCSAIBSYSA-N (3r)-pyrrolidin-3-ol Chemical compound O[C@@H]1CCNC1 JHHZLHWJQPUNKB-SCSAIBSYSA-N 0.000 description 3
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 3
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 3
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 3
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 3
- 206010009944 Colon cancer Diseases 0.000 description 3
- 229940126062 Compound A Drugs 0.000 description 3
- 102000004127 Cytokines Human genes 0.000 description 3
- 108090000695 Cytokines Proteins 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- NLDMNSXOCDLTTB-UHFFFAOYSA-N Heterophylliin A Natural products O1C2COC(=O)C3=CC(O)=C(O)C(O)=C3C3=C(O)C(O)=C(O)C=C3C(=O)OC2C(OC(=O)C=2C=C(O)C(O)=C(O)C=2)C(O)C1OC(=O)C1=CC(O)=C(O)C(O)=C1 NLDMNSXOCDLTTB-UHFFFAOYSA-N 0.000 description 3
- 241000282412 Homo Species 0.000 description 3
- 206010061598 Immunodeficiency Diseases 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- ZSXGLVDWWRXATF-UHFFFAOYSA-N N,N-dimethylformamide dimethyl acetal Chemical compound COC(OC)N(C)C ZSXGLVDWWRXATF-UHFFFAOYSA-N 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 3
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 108010060752 Toll-Like Receptor 8 Proteins 0.000 description 3
- 102000008208 Toll-Like Receptor 8 Human genes 0.000 description 3
- 235000011054 acetic acid Nutrition 0.000 description 3
- 239000004480 active ingredient Substances 0.000 description 3
- 125000000278 alkyl amino alkyl group Chemical group 0.000 description 3
- 125000003277 amino group Chemical group 0.000 description 3
- 125000004103 aminoalkyl group Chemical group 0.000 description 3
- 208000010668 atopic eczema Diseases 0.000 description 3
- 210000003719 b-lymphocyte Anatomy 0.000 description 3
- 239000012267 brine Substances 0.000 description 3
- 125000001309 chloro group Chemical group Cl* 0.000 description 3
- JNGZXGGOCLZBFB-IVCQMTBJSA-N compound E Chemical compound N([C@@H](C)C(=O)N[C@@H]1C(N(C)C2=CC=CC=C2C(C=2C=CC=CC=2)=N1)=O)C(=O)CC1=CC(F)=CC(F)=C1 JNGZXGGOCLZBFB-IVCQMTBJSA-N 0.000 description 3
- 239000006071 cream Substances 0.000 description 3
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 3
- 239000000706 filtrate Substances 0.000 description 3
- 230000002496 gastric effect Effects 0.000 description 3
- 125000002768 hydroxyalkyl group Chemical group 0.000 description 3
- NPZTUJOABDZTLV-UHFFFAOYSA-N hydroxybenzotriazole Substances O=C1C=CC=C2NNN=C12 NPZTUJOABDZTLV-UHFFFAOYSA-N 0.000 description 3
- 210000000987 immune system Anatomy 0.000 description 3
- 238000001727 in vivo Methods 0.000 description 3
- 238000001802 infusion Methods 0.000 description 3
- 239000004615 ingredient Substances 0.000 description 3
- 210000001616 monocyte Anatomy 0.000 description 3
- 230000003287 optical effect Effects 0.000 description 3
- 210000000056 organ Anatomy 0.000 description 3
- 238000007911 parenteral administration Methods 0.000 description 3
- 239000000825 pharmaceutical preparation Substances 0.000 description 3
- 239000000843 powder Substances 0.000 description 3
- 239000000047 product Substances 0.000 description 3
- LVTJOONKWUXEFR-FZRMHRINSA-N protoneodioscin Natural products O(C[C@@H](CC[C@]1(O)[C@H](C)[C@@H]2[C@]3(C)[C@H]([C@H]4[C@@H]([C@]5(C)C(=CC4)C[C@@H](O[C@@H]4[C@H](O[C@H]6[C@@H](O)[C@@H](O)[C@@H](O)[C@H](C)O6)[C@@H](O)[C@H](O[C@H]6[C@@H](O)[C@@H](O)[C@@H](O)[C@H](C)O6)[C@H](CO)O4)CC5)CC3)C[C@@H]2O1)C)[C@H]1[C@H](O)[C@H](O)[C@H](O)[C@@H](CO)O1 LVTJOONKWUXEFR-FZRMHRINSA-N 0.000 description 3
- 230000004044 response Effects 0.000 description 3
- 229920006395 saturated elastomer Polymers 0.000 description 3
- 150000003384 small molecules Chemical class 0.000 description 3
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 3
- 239000000126 substance Substances 0.000 description 3
- YBBRCQOCSYXUOC-UHFFFAOYSA-N sulfuryl dichloride Chemical compound ClS(Cl)(=O)=O YBBRCQOCSYXUOC-UHFFFAOYSA-N 0.000 description 3
- 239000000725 suspension Substances 0.000 description 3
- 201000000596 systemic lupus erythematosus Diseases 0.000 description 3
- XTXSHYWOXQLMFY-UHFFFAOYSA-N tert-butyl n-[8-bromo-4-(dipropylcarbamoyl)-3h-1-benzazepin-2-yl]carbamate Chemical compound N1=C(NC(=O)OC(C)(C)C)CC(C(=O)N(CCC)CCC)=CC2=CC=C(Br)C=C21 XTXSHYWOXQLMFY-UHFFFAOYSA-N 0.000 description 3
- 238000012360 testing method Methods 0.000 description 3
- 210000001519 tissue Anatomy 0.000 description 3
- 229940044616 toll-like receptor 7 agonist Drugs 0.000 description 3
- 238000011277 treatment modality Methods 0.000 description 3
- 238000011269 treatment regimen Methods 0.000 description 3
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 3
- 238000002255 vaccination Methods 0.000 description 3
- 239000001993 wax Substances 0.000 description 3
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 2
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-Ethyl-3-(3-dimethylaminopropyl)carbodiimide Substances CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 2
- PHZCHNAHWGSJRY-VMPITWQZSA-N 1-[(e)-2-(4-bromo-2-nitrophenyl)ethenyl]pyrrolidine Chemical compound [O-][N+](=O)C1=CC(Br)=CC=C1\C=C\N1CCCC1 PHZCHNAHWGSJRY-VMPITWQZSA-N 0.000 description 2
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 2
- QSPOQCXMGPDIHI-UHFFFAOYSA-N 2-amino-n,n-dipropyl-8-[4-(pyrrolidine-1-carbonyl)phenyl]-3h-1-benzazepine-4-carboxamide Chemical compound C1=C2N=C(N)CC(C(=O)N(CCC)CCC)=CC2=CC=C1C(C=C1)=CC=C1C(=O)N1CCCC1 QSPOQCXMGPDIHI-UHFFFAOYSA-N 0.000 description 2
- YEDUAINPPJYDJZ-UHFFFAOYSA-N 2-hydroxybenzothiazole Chemical compound C1=CC=C2SC(O)=NC2=C1 YEDUAINPPJYDJZ-UHFFFAOYSA-N 0.000 description 2
- LZPWAYBEOJRFAX-UHFFFAOYSA-N 4,4,5,5-tetramethyl-1,3,2$l^{2}-dioxaborolane Chemical compound CC1(C)O[B]OC1(C)C LZPWAYBEOJRFAX-UHFFFAOYSA-N 0.000 description 2
- GSXUXSXBEUJRAJ-UHFFFAOYSA-N 4-bromo-2-nitrobenzaldehyde Chemical compound [O-][N+](=O)C1=CC(Br)=CC=C1C=O GSXUXSXBEUJRAJ-UHFFFAOYSA-N 0.000 description 2
- 229960000549 4-dimethylaminophenol Drugs 0.000 description 2
- AVILRJQPDYPXFQ-UHFFFAOYSA-N 5-bromopyridine-3-sulfonyl chloride Chemical compound ClS(=O)(=O)C1=CN=CC(Br)=C1 AVILRJQPDYPXFQ-UHFFFAOYSA-N 0.000 description 2
- 206010059313 Anogenital warts Diseases 0.000 description 2
- 206010005003 Bladder cancer Diseases 0.000 description 2
- 208000003174 Brain Neoplasms Diseases 0.000 description 2
- 206010006187 Breast cancer Diseases 0.000 description 2
- 208000026310 Breast neoplasm Diseases 0.000 description 2
- 208000001333 Colorectal Neoplasms Diseases 0.000 description 2
- 208000000907 Condylomata Acuminata Diseases 0.000 description 2
- 241000701022 Cytomegalovirus Species 0.000 description 2
- 206010012438 Dermatitis atopic Diseases 0.000 description 2
- OKKJLVBELUTLKV-MZCSYVLQSA-N Deuterated methanol Chemical compound [2H]OC([2H])([2H])[2H] OKKJLVBELUTLKV-MZCSYVLQSA-N 0.000 description 2
- XTHFKEDIFFGKHM-UHFFFAOYSA-N Dimethoxyethane Chemical compound COCCOC XTHFKEDIFFGKHM-UHFFFAOYSA-N 0.000 description 2
- IAZDPXIOMUYVGZ-WFGJKAKNSA-N Dimethyl sulfoxide Chemical compound [2H]C([2H])([2H])S(=O)C([2H])([2H])[2H] IAZDPXIOMUYVGZ-WFGJKAKNSA-N 0.000 description 2
- 241000709661 Enterovirus Species 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- AEMRFAOFKBGASW-UHFFFAOYSA-N Glycolic acid Chemical compound OCC(O)=O AEMRFAOFKBGASW-UHFFFAOYSA-N 0.000 description 2
- 241000711549 Hepacivirus C Species 0.000 description 2
- 208000017604 Hodgkin disease Diseases 0.000 description 2
- 208000021519 Hodgkin lymphoma Diseases 0.000 description 2
- 208000010747 Hodgkins lymphoma Diseases 0.000 description 2
- 241000701085 Human alphaherpesvirus 3 Species 0.000 description 2
- 241000725303 Human immunodeficiency virus Species 0.000 description 2
- 241000701806 Human papillomavirus Species 0.000 description 2
- 102100026720 Interferon beta Human genes 0.000 description 2
- 108090000467 Interferon-beta Proteins 0.000 description 2
- 208000008839 Kidney Neoplasms Diseases 0.000 description 2
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 2
- 206010027476 Metastases Diseases 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- 101000574441 Mus musculus Alkaline phosphatase, germ cell type Proteins 0.000 description 2
- 241000186359 Mycobacterium Species 0.000 description 2
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 2
- 206010029098 Neoplasm skin Diseases 0.000 description 2
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 2
- 201000011152 Pemphigus Diseases 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- GLUUGHFHXGJENI-UHFFFAOYSA-N Piperazine Chemical compound C1CNCCN1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 description 2
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 2
- 206010060862 Prostate cancer Diseases 0.000 description 2
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 2
- LCTONWCANYUPML-UHFFFAOYSA-N Pyruvic acid Chemical compound CC(=O)C(O)=O LCTONWCANYUPML-UHFFFAOYSA-N 0.000 description 2
- 206010038389 Renal cancer Diseases 0.000 description 2
- 241000700584 Simplexvirus Species 0.000 description 2
- 208000000453 Skin Neoplasms Diseases 0.000 description 2
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- 210000001744 T-lymphocyte Anatomy 0.000 description 2
- 108010060825 Toll-Like Receptor 7 Proteins 0.000 description 2
- 102000008236 Toll-Like Receptor 7 Human genes 0.000 description 2
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 2
- 206010067584 Type 1 diabetes mellitus Diseases 0.000 description 2
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 description 2
- 208000024780 Urticaria Diseases 0.000 description 2
- 241000700605 Viruses Species 0.000 description 2
- HSOUGLHWSPWPOM-UHFFFAOYSA-N [3-(2-hydroxyethylsulfamoyl)phenyl]boronic acid Chemical compound OCCNS(=O)(=O)C1=CC=CC(B(O)O)=C1 HSOUGLHWSPWPOM-UHFFFAOYSA-N 0.000 description 2
- 239000013543 active substance Substances 0.000 description 2
- 125000003342 alkenyl group Chemical group 0.000 description 2
- 125000004448 alkyl carbonyl group Chemical group 0.000 description 2
- 230000000172 allergic effect Effects 0.000 description 2
- 150000001412 amines Chemical class 0.000 description 2
- 208000025009 anogenital human papillomavirus infection Diseases 0.000 description 2
- 201000004201 anogenital venereal wart Diseases 0.000 description 2
- 230000001772 anti-angiogenic effect Effects 0.000 description 2
- 239000002246 antineoplastic agent Substances 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 2
- 201000008937 atopic dermatitis Diseases 0.000 description 2
- GNVWVYIAQBJHGV-UHFFFAOYSA-N azetidin-3-ylmethanol Chemical compound OCC1CNC1 GNVWVYIAQBJHGV-UHFFFAOYSA-N 0.000 description 2
- 230000001580 bacterial effect Effects 0.000 description 2
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 2
- 125000001584 benzyloxycarbonyl group Chemical group C(=O)(OCC1=CC=CC=C1)* 0.000 description 2
- 230000004071 biological effect Effects 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 125000001246 bromo group Chemical group Br* 0.000 description 2
- RYYVLZVUVIJVGH-UHFFFAOYSA-N caffeine Chemical compound CN1C(=O)N(C)C(=O)C2=C1N=CN2C RYYVLZVUVIJVGH-UHFFFAOYSA-N 0.000 description 2
- 239000002775 capsule Substances 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- 238000002425 crystallisation Methods 0.000 description 2
- 230000008025 crystallization Effects 0.000 description 2
- NXQGGXCHGDYOHB-UHFFFAOYSA-L cyclopenta-1,4-dien-1-yl(diphenyl)phosphane;dichloropalladium;iron(2+) Chemical compound [Fe+2].Cl[Pd]Cl.[CH-]1C=CC(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1.[CH-]1C=CC(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1 NXQGGXCHGDYOHB-UHFFFAOYSA-L 0.000 description 2
- 229940127089 cytotoxic agent Drugs 0.000 description 2
- 210000004443 dendritic cell Anatomy 0.000 description 2
- 125000001028 difluoromethyl group Chemical group [H]C(F)(F)* 0.000 description 2
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 2
- 239000008298 dragée Substances 0.000 description 2
- 238000007876 drug discovery Methods 0.000 description 2
- 239000003623 enhancer Substances 0.000 description 2
- GBRSPJSJVMGTLY-UHFFFAOYSA-N ethyl 2-amino-8-bromo-3h-1-benzazepine-4-carboxylate Chemical compound N1=C(N)CC(C(=O)OCC)=CC2=CC=C(Br)C=C21 GBRSPJSJVMGTLY-UHFFFAOYSA-N 0.000 description 2
- UTBIWGNBEKFQQE-UHFFFAOYSA-N ethyl 8-bromo-2-[(2-methylpropan-2-yl)oxycarbonylamino]-3h-1-benzazepine-4-carboxylate Chemical compound N1=C(NC(=O)OC(C)(C)C)CC(C(=O)OCC)=CC2=CC=C(Br)C=C21 UTBIWGNBEKFQQE-UHFFFAOYSA-N 0.000 description 2
- 239000003925 fat Substances 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 125000000524 functional group Chemical group 0.000 description 2
- FVIZARNDLVOMSU-UHFFFAOYSA-N ginsenoside K Natural products C1CC(C2(CCC3C(C)(C)C(O)CCC3(C)C2CC2O)C)(C)C2C1C(C)(CCC=C(C)C)OC1OC(CO)C(O)C(O)C1O FVIZARNDLVOMSU-UHFFFAOYSA-N 0.000 description 2
- 125000005456 glyceride group Chemical group 0.000 description 2
- KWIUHFFTVRNATP-UHFFFAOYSA-N glycine betaine Chemical compound C[N+](C)(C)CC([O-])=O KWIUHFFTVRNATP-UHFFFAOYSA-N 0.000 description 2
- 125000001188 haloalkyl group Chemical group 0.000 description 2
- 201000010536 head and neck cancer Diseases 0.000 description 2
- 208000014829 head and neck neoplasm Diseases 0.000 description 2
- 125000001072 heteroaryl group Chemical group 0.000 description 2
- 229940088597 hormone Drugs 0.000 description 2
- 239000005556 hormone Substances 0.000 description 2
- 150000002430 hydrocarbons Chemical group 0.000 description 2
- DOUYETYNHWVLEO-UHFFFAOYSA-N imiquimod Chemical compound C1=CC=CC2=C3N(CC(C)C)C=NC3=C(N)N=C21 DOUYETYNHWVLEO-UHFFFAOYSA-N 0.000 description 2
- 230000036039 immunity Effects 0.000 description 2
- 238000009169 immunotherapy Methods 0.000 description 2
- 150000007529 inorganic bases Chemical class 0.000 description 2
- 230000000968 intestinal effect Effects 0.000 description 2
- 238000007918 intramuscular administration Methods 0.000 description 2
- 238000001990 intravenous administration Methods 0.000 description 2
- 201000010982 kidney cancer Diseases 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 208000032839 leukemia Diseases 0.000 description 2
- 201000007270 liver cancer Diseases 0.000 description 2
- 208000014018 liver neoplasm Diseases 0.000 description 2
- 201000005202 lung cancer Diseases 0.000 description 2
- 208000020816 lung neoplasm Diseases 0.000 description 2
- 206010025135 lupus erythematosus Diseases 0.000 description 2
- 230000001589 lymphoproliferative effect Effects 0.000 description 2
- 210000002540 macrophage Anatomy 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 230000036210 malignancy Effects 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 201000001441 melanoma Diseases 0.000 description 2
- 230000009401 metastasis Effects 0.000 description 2
- 208000037819 metastatic cancer Diseases 0.000 description 2
- 208000011575 metastatic malignant neoplasm Diseases 0.000 description 2
- 206010061289 metastatic neoplasm Diseases 0.000 description 2
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 2
- 231100000252 nontoxic Toxicity 0.000 description 2
- 230000003000 nontoxic effect Effects 0.000 description 2
- 239000002674 ointment Substances 0.000 description 2
- 150000007530 organic bases Chemical class 0.000 description 2
- 229910052760 oxygen Inorganic materials 0.000 description 2
- 239000001301 oxygen Substances 0.000 description 2
- NFHFRUOZVGFOOS-UHFFFAOYSA-N palladium;triphenylphosphane Chemical compound [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 NFHFRUOZVGFOOS-UHFFFAOYSA-N 0.000 description 2
- WLJNZVDCPSBLRP-UHFFFAOYSA-N pamoic acid Chemical compound C1=CC=C2C(CC=3C4=CC=CC=C4C=C(C=3O)C(=O)O)=C(O)C(C(O)=O)=CC2=C1 WLJNZVDCPSBLRP-UHFFFAOYSA-N 0.000 description 2
- 208000012111 paraneoplastic syndrome Diseases 0.000 description 2
- 230000035515 penetration Effects 0.000 description 2
- 239000000546 pharmaceutical excipient Substances 0.000 description 2
- 230000000144 pharmacologic effect Effects 0.000 description 2
- 208000005987 polymyositis Diseases 0.000 description 2
- 108091033319 polynucleotide Proteins 0.000 description 2
- 102000040430 polynucleotide Human genes 0.000 description 2
- 239000002157 polynucleotide Substances 0.000 description 2
- SCVFZCLFOSHCOH-UHFFFAOYSA-M potassium acetate Chemical compound [K+].CC([O-])=O SCVFZCLFOSHCOH-UHFFFAOYSA-M 0.000 description 2
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- 230000002685 pulmonary effect Effects 0.000 description 2
- 230000005855 radiation Effects 0.000 description 2
- 206010039073 rheumatoid arthritis Diseases 0.000 description 2
- YGSDEFSMJLZEOE-UHFFFAOYSA-N salicylic acid Chemical compound OC(=O)C1=CC=CC=C1O YGSDEFSMJLZEOE-UHFFFAOYSA-N 0.000 description 2
- 238000010898 silica gel chromatography Methods 0.000 description 2
- 201000010153 skin papilloma Diseases 0.000 description 2
- 239000012453 solvate Substances 0.000 description 2
- 239000007858 starting material Substances 0.000 description 2
- 238000007920 subcutaneous administration Methods 0.000 description 2
- 125000001424 substituent group Chemical group 0.000 description 2
- 229910052717 sulfur Inorganic materials 0.000 description 2
- 239000011593 sulfur Substances 0.000 description 2
- 230000009885 systemic effect Effects 0.000 description 2
- DYHSDKLCOJIUFX-UHFFFAOYSA-N tert-butoxycarbonyl anhydride Chemical compound CC(C)(C)OC(=O)OC(=O)OC(C)(C)C DYHSDKLCOJIUFX-UHFFFAOYSA-N 0.000 description 2
- LVGANUJXXKLLPQ-UHFFFAOYSA-N tert-butyl N-[4-(dipropylcarbamoyl)-8-(3-sulfamoylphenyl)-3H-1-benzazepin-2-yl]carbamate Chemical compound C(CC)N(C(=O)C=1CC(=NC2=C(C=1)C=CC(=C2)C1=CC(=CC=C1)S(N)(=O)=O)NC(OC(C)(C)C)=O)CCC LVGANUJXXKLLPQ-UHFFFAOYSA-N 0.000 description 2
- CWXPZXBSDSIRCS-UHFFFAOYSA-N tert-butyl piperazine-1-carboxylate Chemical compound CC(C)(C)OC(=O)N1CCNCC1 CWXPZXBSDSIRCS-UHFFFAOYSA-N 0.000 description 2
- YAPQBXQYLJRXSA-UHFFFAOYSA-N theobromine Chemical compound CN1C(=O)NC(=O)C2=C1N=CN2C YAPQBXQYLJRXSA-UHFFFAOYSA-N 0.000 description 2
- 210000001685 thyroid gland Anatomy 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- 230000000699 topical effect Effects 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- GETQZCLCWQTVFV-UHFFFAOYSA-N trimethylamine Chemical compound CN(C)C GETQZCLCWQTVFV-UHFFFAOYSA-N 0.000 description 2
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 2
- 208000035408 type 1 diabetes mellitus 1 Diseases 0.000 description 2
- 201000005112 urinary bladder cancer Diseases 0.000 description 2
- 235000015112 vegetable and seed oil Nutrition 0.000 description 2
- 239000008158 vegetable oil Substances 0.000 description 2
- HFVMEOPYDLEHBR-UHFFFAOYSA-N (2-fluorophenyl)-phenylmethanol Chemical compound C=1C=CC=C(F)C=1C(O)C1=CC=CC=C1 HFVMEOPYDLEHBR-UHFFFAOYSA-N 0.000 description 1
- QBYIENPQHBMVBV-HFEGYEGKSA-N (2R)-2-hydroxy-2-phenylacetic acid Chemical compound O[C@@H](C(O)=O)c1ccccc1.O[C@@H](C(O)=O)c1ccccc1 QBYIENPQHBMVBV-HFEGYEGKSA-N 0.000 description 1
- RCRUXZHMXFQVRF-UHFFFAOYSA-N (3-pyrrolidin-1-ylsulfonylphenyl)boronic acid Chemical compound OB(O)C1=CC=CC(S(=O)(=O)N2CCCC2)=C1 RCRUXZHMXFQVRF-UHFFFAOYSA-N 0.000 description 1
- PMNJSWJJYWZLHU-UHFFFAOYSA-N (3-sulfamoylphenyl)boronic acid Chemical compound NS(=O)(=O)C1=CC=CC(B(O)O)=C1 PMNJSWJJYWZLHU-UHFFFAOYSA-N 0.000 description 1
- OZVCYQUNBOUSPA-SNVBAGLBSA-N (3R)-1-(3-bromo-5-methylphenyl)sulfonylpyrrolidin-3-ol Chemical compound BrC=1C=C(C=C(C=1)C)S(=O)(=O)N1C[C@@H](CC1)O OZVCYQUNBOUSPA-SNVBAGLBSA-N 0.000 description 1
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 description 1
- BIWOSRSKDCZIFM-YFKPBYRVSA-N (3s)-piperidin-3-ol Chemical compound O[C@H]1CCCNC1 BIWOSRSKDCZIFM-YFKPBYRVSA-N 0.000 description 1
- JHHZLHWJQPUNKB-BYPYZUCNSA-N (3s)-pyrrolidin-3-ol Chemical compound O[C@H]1CCNC1 JHHZLHWJQPUNKB-BYPYZUCNSA-N 0.000 description 1
- 125000006701 (C1-C7) alkyl group Chemical group 0.000 description 1
- WBYWAXJHAXSJNI-VOTSOKGWSA-M .beta-Phenylacrylic acid Natural products [O-]C(=O)\C=C\C1=CC=CC=C1 WBYWAXJHAXSJNI-VOTSOKGWSA-M 0.000 description 1
- KZPYGQFFRCFCPP-UHFFFAOYSA-N 1,1'-bis(diphenylphosphino)ferrocene Chemical compound [Fe+2].C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1 KZPYGQFFRCFCPP-UHFFFAOYSA-N 0.000 description 1
- SAGKQVHXBDTCPH-UHFFFAOYSA-N 1-(3-bromophenyl)sulfonylpyrrolidine Chemical compound BrC1=CC=CC(S(=O)(=O)N2CCCC2)=C1 SAGKQVHXBDTCPH-UHFFFAOYSA-N 0.000 description 1
- ASOKPJOREAFHNY-UHFFFAOYSA-N 1-Hydroxybenzotriazole Chemical group C1=CC=C2N(O)N=NC2=C1 ASOKPJOREAFHNY-UHFFFAOYSA-N 0.000 description 1
- DQFQCHIDRBIESA-UHFFFAOYSA-N 1-benzazepine Chemical compound N1C=CC=CC2=CC=CC=C12 DQFQCHIDRBIESA-UHFFFAOYSA-N 0.000 description 1
- QSSXJPIWXQTSIX-UHFFFAOYSA-N 1-bromo-2-methylbenzene Chemical compound CC1=CC=CC=C1Br QSSXJPIWXQTSIX-UHFFFAOYSA-N 0.000 description 1
- WJIFKOVZNJTSGO-UHFFFAOYSA-N 1-bromo-3-methylbenzene Chemical compound CC1=CC=CC(Br)=C1 WJIFKOVZNJTSGO-UHFFFAOYSA-N 0.000 description 1
- 125000004973 1-butenyl group Chemical group C(=CCC)* 0.000 description 1
- 125000006017 1-propenyl group Chemical group 0.000 description 1
- 125000000530 1-propynyl group Chemical group [H]C([H])([H])C#C* 0.000 description 1
- 238000005160 1H NMR spectroscopy Methods 0.000 description 1
- HRLPSZDWLCYUGN-UHFFFAOYSA-N 1h-1-benzazepine-2-sulfonamide Chemical class N1C(S(=O)(=O)N)=CC=CC2=CC=CC=C21 HRLPSZDWLCYUGN-UHFFFAOYSA-N 0.000 description 1
- 125000004778 2,2-difluoroethyl group Chemical group [H]C([H])(*)C([H])(F)F 0.000 description 1
- GIAFURWZWWWBQT-UHFFFAOYSA-N 2-(2-aminoethoxy)ethanol Chemical compound NCCOCCO GIAFURWZWWWBQT-UHFFFAOYSA-N 0.000 description 1
- MSWZFWKMSRAUBD-IVMDWMLBSA-N 2-amino-2-deoxy-D-glucopyranose Chemical compound N[C@H]1C(O)O[C@H](CO)[C@@H](O)[C@@H]1O MSWZFWKMSRAUBD-IVMDWMLBSA-N 0.000 description 1
- 125000000022 2-aminoethyl group Chemical group [H]C([*])([H])C([H])([H])N([H])[H] 0.000 description 1
- 125000004974 2-butenyl group Chemical group C(C=CC)* 0.000 description 1
- 125000004200 2-methoxyethyl group Chemical group [H]C([H])([H])OC([H])([H])C([H])([H])* 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- 125000004975 3-butenyl group Chemical group C(CC=C)* 0.000 description 1
- 125000003349 3-pyridyl group Chemical group N1=C([H])C([*])=C([H])C([H])=C1[H] 0.000 description 1
- 125000004575 3-pyrrolidinyl group Chemical group [H]N1C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 1
- KZNXALJXBRSMFL-UHFFFAOYSA-N 4-bromo-1-methyl-2-nitrobenzene Chemical compound CC1=CC=C(Br)C=C1[N+]([O-])=O KZNXALJXBRSMFL-UHFFFAOYSA-N 0.000 description 1
- QJPJQTDYNZXKQF-UHFFFAOYSA-N 4-bromoanisole Chemical compound COC1=CC=C(Br)C=C1 QJPJQTDYNZXKQF-UHFFFAOYSA-N 0.000 description 1
- KMMHZIBWCXYAAH-UHFFFAOYSA-N 4-bromobenzenesulfonyl chloride Chemical compound ClS(=O)(=O)C1=CC=C(Br)C=C1 KMMHZIBWCXYAAH-UHFFFAOYSA-N 0.000 description 1
- SUTWPJHCRAITLU-UHFFFAOYSA-N 6-aminohexan-1-ol Chemical compound NCCCCCCO SUTWPJHCRAITLU-UHFFFAOYSA-N 0.000 description 1
- XEUDFCAJXSUGRQ-UHFFFAOYSA-N 8-bromo-2-[(2-methylpropan-2-yl)oxycarbonylamino]-3h-1-benzazepine-4-carboxylic acid Chemical compound C1=C(C(O)=O)CC(NC(=O)OC(C)(C)C)=NC2=CC(Br)=CC=C21 XEUDFCAJXSUGRQ-UHFFFAOYSA-N 0.000 description 1
- 208000026872 Addison Disease Diseases 0.000 description 1
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 1
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 1
- 206010027654 Allergic conditions Diseases 0.000 description 1
- 208000032671 Allergic granulomatous angiitis Diseases 0.000 description 1
- 208000024827 Alzheimer disease Diseases 0.000 description 1
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical compound [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 1
- 208000002267 Anti-neutrophil cytoplasmic antibody-associated vasculitis Diseases 0.000 description 1
- 208000003343 Antiphospholipid Syndrome Diseases 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- 201000002909 Aspergillosis Diseases 0.000 description 1
- 208000036641 Aspergillus infections Diseases 0.000 description 1
- 206010003591 Ataxia Diseases 0.000 description 1
- 201000001320 Atherosclerosis Diseases 0.000 description 1
- 206010003827 Autoimmune hepatitis Diseases 0.000 description 1
- 206010004146 Basal cell carcinoma Diseases 0.000 description 1
- 208000023328 Basedow disease Diseases 0.000 description 1
- 208000009137 Behcet syndrome Diseases 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- 208000008439 Biliary Liver Cirrhosis Diseases 0.000 description 1
- 208000033222 Biliary cirrhosis primary Diseases 0.000 description 1
- 208000019838 Blood disease Diseases 0.000 description 1
- YZJOVEPHWQPKFB-UHFFFAOYSA-N C1=CC=C2C(=C1)C=CC=C(N2)OC(=O)N Chemical compound C1=CC=C2C(=C1)C=CC=C(N2)OC(=O)N YZJOVEPHWQPKFB-UHFFFAOYSA-N 0.000 description 1
- XOGYOOQSGVXORV-UHFFFAOYSA-N C=[Br]c1cc(S(N2CC(CO)C2)(=O)=O)ccc1 Chemical compound C=[Br]c1cc(S(N2CC(CO)C2)(=O)=O)ccc1 XOGYOOQSGVXORV-UHFFFAOYSA-N 0.000 description 1
- 0 CN(*)C(C1=Cc(ccc(Br)c2)c2N=C(*)C1)=O Chemical compound CN(*)C(C1=Cc(ccc(Br)c2)c2N=C(*)C1)=O 0.000 description 1
- GAWIXWVDTYZWAW-UHFFFAOYSA-N C[CH]O Chemical group C[CH]O GAWIXWVDTYZWAW-UHFFFAOYSA-N 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 241000222122 Candida albicans Species 0.000 description 1
- 206010007134 Candida infections Diseases 0.000 description 1
- 206010048610 Cardiotoxicity Diseases 0.000 description 1
- 206010008342 Cervix carcinoma Diseases 0.000 description 1
- 102000009410 Chemokine receptor Human genes 0.000 description 1
- 108050000299 Chemokine receptor Proteins 0.000 description 1
- 102000019034 Chemokines Human genes 0.000 description 1
- 108010012236 Chemokines Proteins 0.000 description 1
- 241000606161 Chlamydia Species 0.000 description 1
- 208000006344 Churg-Strauss Syndrome Diseases 0.000 description 1
- WBYWAXJHAXSJNI-SREVYHEPSA-N Cinnamic acid Chemical compound OC(=O)\C=C/C1=CC=CC=C1 WBYWAXJHAXSJNI-SREVYHEPSA-N 0.000 description 1
- 206010009346 Clonus Diseases 0.000 description 1
- 208000015943 Coeliac disease Diseases 0.000 description 1
- 206010009900 Colitis ulcerative Diseases 0.000 description 1
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 1
- 229920002261 Corn starch Polymers 0.000 description 1
- 241000711573 Coronaviridae Species 0.000 description 1
- 208000011231 Crohn disease Diseases 0.000 description 1
- 208000006081 Cryptococcal meningitis Diseases 0.000 description 1
- 208000008953 Cryptosporidiosis Diseases 0.000 description 1
- 206010011502 Cryptosporidiosis infection Diseases 0.000 description 1
- 206010011878 Deafness Diseases 0.000 description 1
- 241000725619 Dengue virus Species 0.000 description 1
- 201000004624 Dermatitis Diseases 0.000 description 1
- 206010012434 Dermatitis allergic Diseases 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 206010013700 Drug hypersensitivity Diseases 0.000 description 1
- 208000017701 Endocrine disease Diseases 0.000 description 1
- 208000018428 Eosinophilic granulomatosis with polyangiitis Diseases 0.000 description 1
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical compound NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 1
- 208000004262 Food Hypersensitivity Diseases 0.000 description 1
- 208000018522 Gastrointestinal disease Diseases 0.000 description 1
- 206010018364 Glomerulonephritis Diseases 0.000 description 1
- 208000024869 Goodpasture syndrome Diseases 0.000 description 1
- 208000015023 Graves' disease Diseases 0.000 description 1
- IVDFJHOHABJVEH-UHFFFAOYSA-N HOCMe2CMe2OH Natural products CC(C)(O)C(C)(C)O IVDFJHOHABJVEH-UHFFFAOYSA-N 0.000 description 1
- 208000016621 Hearing disease Diseases 0.000 description 1
- 208000035186 Hemolytic Autoimmune Anemia Diseases 0.000 description 1
- 241000700721 Hepatitis B virus Species 0.000 description 1
- 241000238631 Hexapoda Species 0.000 description 1
- 201000002563 Histoplasmosis Diseases 0.000 description 1
- 101000914484 Homo sapiens T-lymphocyte activation antigen CD80 Proteins 0.000 description 1
- 206010020649 Hyperkeratosis Diseases 0.000 description 1
- 208000010159 IgA glomerulonephritis Diseases 0.000 description 1
- 206010021263 IgA nephropathy Diseases 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 208000022559 Inflammatory bowel disease Diseases 0.000 description 1
- 208000027601 Inner ear disease Diseases 0.000 description 1
- 102000002227 Interferon Type I Human genes 0.000 description 1
- 108010014726 Interferon Type I Proteins 0.000 description 1
- 102000013462 Interleukin-12 Human genes 0.000 description 1
- 108010065805 Interleukin-12 Proteins 0.000 description 1
- 102000004889 Interleukin-6 Human genes 0.000 description 1
- 108090001005 Interleukin-6 Proteins 0.000 description 1
- 208000005016 Intestinal Neoplasms Diseases 0.000 description 1
- LPHGQDQBBGAPDZ-UHFFFAOYSA-N Isocaffeine Natural products CN1C(=O)N(C)C(=O)C2=C1N(C)C=N2 LPHGQDQBBGAPDZ-UHFFFAOYSA-N 0.000 description 1
- 208000001126 Keratosis Diseases 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- 208000017119 Labyrinth disease Diseases 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 208000004554 Leishmaniasis Diseases 0.000 description 1
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 1
- 208000005777 Lupus Nephritis Diseases 0.000 description 1
- 206010025323 Lymphomas Diseases 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- PWHULOQIROXLJO-UHFFFAOYSA-N Manganese Chemical compound [Mn] PWHULOQIROXLJO-UHFFFAOYSA-N 0.000 description 1
- 206010027209 Meningitis cryptococcal Diseases 0.000 description 1
- 108700011259 MicroRNAs Proteins 0.000 description 1
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 1
- 208000005647 Mumps Diseases 0.000 description 1
- 241000186367 Mycobacterium avium Species 0.000 description 1
- 241000187479 Mycobacterium tuberculosis Species 0.000 description 1
- 102000010168 Myeloid Differentiation Factor 88 Human genes 0.000 description 1
- 108010077432 Myeloid Differentiation Factor 88 Proteins 0.000 description 1
- 208000002033 Myoclonus Diseases 0.000 description 1
- 241000872931 Myoporum sandwicense Species 0.000 description 1
- 201000002481 Myositis Diseases 0.000 description 1
- HTLZVHNRZJPSMI-UHFFFAOYSA-N N-ethylpiperidine Chemical compound CCN1CCCCC1 HTLZVHNRZJPSMI-UHFFFAOYSA-N 0.000 description 1
- OPKOKAMJFNKNAS-UHFFFAOYSA-N N-methylethanolamine Chemical compound CNCCO OPKOKAMJFNKNAS-UHFFFAOYSA-N 0.000 description 1
- MBBZMMPHUWSWHV-BDVNFPICSA-N N-methylglucamine Chemical compound CNC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO MBBZMMPHUWSWHV-BDVNFPICSA-N 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- 206010033128 Ovarian cancer Diseases 0.000 description 1
- 206010061535 Ovarian neoplasm Diseases 0.000 description 1
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 1
- 241001631646 Papillomaviridae Species 0.000 description 1
- 208000002606 Paramyxoviridae Infections Diseases 0.000 description 1
- 208000018737 Parkinson disease Diseases 0.000 description 1
- 101150003085 Pdcl gene Proteins 0.000 description 1
- 208000027086 Pemphigus foliaceus Diseases 0.000 description 1
- 208000031845 Pernicious anaemia Diseases 0.000 description 1
- 241000233872 Pneumocystis carinii Species 0.000 description 1
- 206010035664 Pneumonia Diseases 0.000 description 1
- 206010036105 Polyneuropathy Diseases 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 208000012654 Primary biliary cholangitis Diseases 0.000 description 1
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 description 1
- 201000004681 Psoriasis Diseases 0.000 description 1
- 206010037549 Purpura Diseases 0.000 description 1
- 241001672981 Purpura Species 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-N R-2-phenyl-2-hydroxyacetic acid Natural products OC(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-N 0.000 description 1
- 208000003782 Raynaud disease Diseases 0.000 description 1
- 208000012322 Raynaud phenomenon Diseases 0.000 description 1
- 108700008625 Reporter Genes Proteins 0.000 description 1
- 208000025747 Rheumatic disease Diseases 0.000 description 1
- 206010039710 Scleroderma Diseases 0.000 description 1
- 208000034189 Sclerosis Diseases 0.000 description 1
- 208000021386 Sjogren Syndrome Diseases 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- 229930182558 Sterol Chemical class 0.000 description 1
- 208000005718 Stomach Neoplasms Diseases 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- LSNNMFCWUKXFEE-UHFFFAOYSA-N Sulfurous acid Chemical compound OS(O)=O LSNNMFCWUKXFEE-UHFFFAOYSA-N 0.000 description 1
- 102100027222 T-lymphocyte activation antigen CD80 Human genes 0.000 description 1
- 229940124613 TLR 7/8 agonist Drugs 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- 206010043561 Thrombocytopenic purpura Diseases 0.000 description 1
- 201000007023 Thrombotic Thrombocytopenic Purpura Diseases 0.000 description 1
- 208000024770 Thyroid neoplasm Diseases 0.000 description 1
- 201000005485 Toxoplasmosis Diseases 0.000 description 1
- 108010018242 Transcription Factor AP-1 Proteins 0.000 description 1
- 102100023118 Transcription factor JunD Human genes 0.000 description 1
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 1
- 102100040247 Tumor necrosis factor Human genes 0.000 description 1
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 1
- 206010046851 Uveitis Diseases 0.000 description 1
- 241000700647 Variola virus Species 0.000 description 1
- 206010047115 Vasculitis Diseases 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 239000003463 adsorbent Substances 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 229940060265 aldara Drugs 0.000 description 1
- 125000001931 aliphatic group Chemical group 0.000 description 1
- 125000003282 alkyl amino group Chemical group 0.000 description 1
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 1
- AZDRQVAHHNSJOQ-UHFFFAOYSA-N alumane Chemical class [AlH3] AZDRQVAHHNSJOQ-UHFFFAOYSA-N 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 125000004202 aminomethyl group Chemical group [H]N([H])C([H])([H])* 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 229940121375 antifungal agent Drugs 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 239000003443 antiviral agent Substances 0.000 description 1
- 229940121357 antivirals Drugs 0.000 description 1
- 239000007900 aqueous suspension Substances 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 239000012300 argon atmosphere Substances 0.000 description 1
- 150000001499 aryl bromides Chemical class 0.000 description 1
- 208000037896 autoimmune cutaneous disease Diseases 0.000 description 1
- 201000005000 autoimmune gastritis Diseases 0.000 description 1
- 201000000448 autoimmune hemolytic anemia Diseases 0.000 description 1
- 208000010928 autoimmune thyroid disease Diseases 0.000 description 1
- GMWFCJXSQQHBPI-UHFFFAOYSA-N azetidin-3-ol Chemical compound OC1CNC1 GMWFCJXSQQHBPI-UHFFFAOYSA-N 0.000 description 1
- 208000022362 bacterial infectious disease Diseases 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- CSKNSYBAZOQPLR-UHFFFAOYSA-N benzenesulfonyl chloride Chemical compound ClS(=O)(=O)C1=CC=CC=C1 CSKNSYBAZOQPLR-UHFFFAOYSA-N 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 1
- MSWZFWKMSRAUBD-UHFFFAOYSA-N beta-D-galactosamine Natural products NC1C(O)OC(CO)C(O)C1O MSWZFWKMSRAUBD-UHFFFAOYSA-N 0.000 description 1
- 229960003237 betaine Drugs 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000002798 bone marrow cell Anatomy 0.000 description 1
- ZADPBFCGQRWHPN-UHFFFAOYSA-N boronic acid Chemical compound OBO ZADPBFCGQRWHPN-UHFFFAOYSA-N 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 1
- 229910000024 caesium carbonate Inorganic materials 0.000 description 1
- 229960001948 caffeine Drugs 0.000 description 1
- VJEONQKOZGKCAK-UHFFFAOYSA-N caffeine Natural products CN1C(=O)N(C)C(=O)C2=C1C=CN2C VJEONQKOZGKCAK-UHFFFAOYSA-N 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 201000003984 candidiasis Diseases 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-N carbonic acid Chemical compound OC(O)=O BVKZGUZCCUSVTD-UHFFFAOYSA-N 0.000 description 1
- 230000002612 cardiopulmonary effect Effects 0.000 description 1
- 231100000259 cardiotoxicity Toxicity 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 239000001913 cellulose Chemical class 0.000 description 1
- 235000010980 cellulose Nutrition 0.000 description 1
- 229920002678 cellulose Chemical class 0.000 description 1
- 201000010881 cervical cancer Diseases 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 125000004218 chloromethyl group Chemical group [H]C([H])(Cl)* 0.000 description 1
- 208000003167 cholangitis Diseases 0.000 description 1
- OEYIOHPDSNJKLS-UHFFFAOYSA-N choline Chemical compound C[N+](C)(C)CCO OEYIOHPDSNJKLS-UHFFFAOYSA-N 0.000 description 1
- 229960001231 choline Drugs 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 238000011097 chromatography purification Methods 0.000 description 1
- 230000012085 chronic inflammatory response Effects 0.000 description 1
- 208000025302 chronic primary adrenal insufficiency Diseases 0.000 description 1
- 235000013985 cinnamic acid Nutrition 0.000 description 1
- 229930016911 cinnamic acid Natural products 0.000 description 1
- 210000001072 colon Anatomy 0.000 description 1
- 208000029742 colonic neoplasm Diseases 0.000 description 1
- 238000004040 coloring Methods 0.000 description 1
- 210000002808 connective tissue Anatomy 0.000 description 1
- 239000010949 copper Substances 0.000 description 1
- 229910052802 copper Inorganic materials 0.000 description 1
- 239000008120 corn starch Substances 0.000 description 1
- 230000000139 costimulatory effect Effects 0.000 description 1
- 201000003278 cryoglobulinemia Diseases 0.000 description 1
- 239000012228 culture supernatant Substances 0.000 description 1
- 230000001934 delay Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000000586 desensitisation Methods 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- HPNMFZURTQLUMO-UHFFFAOYSA-N diethylamine Chemical compound CCNCC HPNMFZURTQLUMO-UHFFFAOYSA-N 0.000 description 1
- WEHWNAOGRSTTBQ-UHFFFAOYSA-N dipropylamine Chemical compound CCCNCCC WEHWNAOGRSTTBQ-UHFFFAOYSA-N 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 239000003480 eluent Substances 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 230000002124 endocrine Effects 0.000 description 1
- 210000002889 endothelial cell Anatomy 0.000 description 1
- 210000002919 epithelial cell Anatomy 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- CCIVGXIOQKPBKL-UHFFFAOYSA-M ethanesulfonate Chemical compound CCS([O-])(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-M 0.000 description 1
- VMQPCOUKVYLMMO-JXMROGBWSA-N ethyl (e)-3-(4-bromo-2-nitrophenyl)-2-(cyanomethyl)prop-2-enoate Chemical compound CCOC(=O)C(\CC#N)=C\C1=CC=C(Br)C=C1[N+]([O-])=O VMQPCOUKVYLMMO-JXMROGBWSA-N 0.000 description 1
- 125000006534 ethyl amino methyl group Chemical group [H]N(C([H])([H])*)C([H])([H])C([H])([H])[H] 0.000 description 1
- 229940012017 ethylenediamine Drugs 0.000 description 1
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 1
- 150000002191 fatty alcohols Chemical class 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 239000007941 film coated tablet Substances 0.000 description 1
- 239000007888 film coating Substances 0.000 description 1
- 238000009501 film coating Methods 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 238000003818 flash chromatography Methods 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 235000019634 flavors Nutrition 0.000 description 1
- 235000020932 food allergy Nutrition 0.000 description 1
- 235000019253 formic acid Nutrition 0.000 description 1
- 239000012458 free base Substances 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 230000002538 fungal effect Effects 0.000 description 1
- 206010017758 gastric cancer Diseases 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 229960002442 glucosamine Drugs 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 230000003394 haemopoietic effect Effects 0.000 description 1
- 125000005843 halogen group Chemical group 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 230000010370 hearing loss Effects 0.000 description 1
- 231100000888 hearing loss Toxicity 0.000 description 1
- 208000016354 hearing loss disease Diseases 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 208000014951 hematologic disease Diseases 0.000 description 1
- 208000018706 hematopoietic system disease Diseases 0.000 description 1
- 230000002440 hepatic effect Effects 0.000 description 1
- 125000003187 heptyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 210000003630 histaminocyte Anatomy 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- 102000045715 human TLR7 Human genes 0.000 description 1
- 230000036571 hydration Effects 0.000 description 1
- 238000006703 hydration reaction Methods 0.000 description 1
- 125000005113 hydroxyalkoxy group Chemical group 0.000 description 1
- 125000004029 hydroxymethyl group Chemical group [H]OC([H])([H])* 0.000 description 1
- 229960002751 imiquimod Drugs 0.000 description 1
- 210000002865 immune cell Anatomy 0.000 description 1
- 230000028993 immune response Effects 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 230000008595 infiltration Effects 0.000 description 1
- 238000001764 infiltration Methods 0.000 description 1
- 206010022000 influenza Diseases 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- 239000002198 insoluble material Substances 0.000 description 1
- 229960001388 interferon-beta Drugs 0.000 description 1
- 201000002313 intestinal cancer Diseases 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 229940125425 inverse agonist Drugs 0.000 description 1
- 229960004903 invert sugar Drugs 0.000 description 1
- 125000002346 iodo group Chemical group I* 0.000 description 1
- 239000003456 ion exchange resin Substances 0.000 description 1
- 229920003303 ion-exchange polymer Polymers 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 125000000555 isopropenyl group Chemical group [H]\C([H])=C(\*)C([H])([H])[H] 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- JJWLVOIRVHMVIS-UHFFFAOYSA-N isopropylamine Chemical compound CC(C)N JJWLVOIRVHMVIS-UHFFFAOYSA-N 0.000 description 1
- 208000017169 kidney disease Diseases 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 239000010410 layer Substances 0.000 description 1
- 239000012669 liquid formulation Substances 0.000 description 1
- 229940057995 liquid paraffin Drugs 0.000 description 1
- 229910052744 lithium Inorganic materials 0.000 description 1
- 208000019423 liver disease Diseases 0.000 description 1
- 210000001165 lymph node Anatomy 0.000 description 1
- 210000003712 lysosome Anatomy 0.000 description 1
- 230000001868 lysosomic effect Effects 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 1
- 229960002510 mandelic acid Drugs 0.000 description 1
- 229910052748 manganese Inorganic materials 0.000 description 1
- 239000011572 manganese Substances 0.000 description 1
- 230000000873 masking effect Effects 0.000 description 1
- 238000004949 mass spectrometry Methods 0.000 description 1
- 208000008585 mastocytosis Diseases 0.000 description 1
- 238000002483 medication Methods 0.000 description 1
- 229940071648 metered dose inhaler Drugs 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 1
- 125000004184 methoxymethyl group Chemical group [H]C([H])([H])OC([H])([H])* 0.000 description 1
- WBYWAXJHAXSJNI-UHFFFAOYSA-N methyl p-hydroxycinnamate Natural products OC(=O)C=CC1=CC=CC=C1 WBYWAXJHAXSJNI-UHFFFAOYSA-N 0.000 description 1
- 125000004674 methylcarbonyl group Chemical group CC(=O)* 0.000 description 1
- 125000001570 methylene group Chemical group [H]C([H])([*:1])[*:2] 0.000 description 1
- 230000000813 microbial effect Effects 0.000 description 1
- 229940016286 microcrystalline cellulose Drugs 0.000 description 1
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 1
- 239000008108 microcrystalline cellulose Substances 0.000 description 1
- 206010063344 microscopic polyangiitis Diseases 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 208000008588 molluscum contagiosum Diseases 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 201000006417 multiple sclerosis Diseases 0.000 description 1
- 208000010805 mumps infectious disease Diseases 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- 206010028417 myasthenia gravis Diseases 0.000 description 1
- 210000000066 myeloid cell Anatomy 0.000 description 1
- 239000007923 nasal drop Substances 0.000 description 1
- 229940100662 nasal drops Drugs 0.000 description 1
- 210000000822 natural killer cell Anatomy 0.000 description 1
- 239000006199 nebulizer Substances 0.000 description 1
- 210000005036 nerve Anatomy 0.000 description 1
- 230000002232 neuromuscular Effects 0.000 description 1
- 208000008795 neuromyelitis optica Diseases 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- 108020004707 nucleic acids Proteins 0.000 description 1
- 102000039446 nucleic acids Human genes 0.000 description 1
- 150000007523 nucleic acids Chemical class 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- 238000011275 oncology therapy Methods 0.000 description 1
- 210000004789 organ system Anatomy 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 230000003204 osmotic effect Effects 0.000 description 1
- 230000002611 ovarian Effects 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 239000006174 pH buffer Substances 0.000 description 1
- 229910052763 palladium Inorganic materials 0.000 description 1
- 201000002528 pancreatic cancer Diseases 0.000 description 1
- 208000008443 pancreatic carcinoma Diseases 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-N papa-hydroxy-benzoic acid Natural products OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 1
- 239000004031 partial agonist Substances 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 201000001976 pemphigus vulgaris Diseases 0.000 description 1
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 1
- 239000003208 petroleum Substances 0.000 description 1
- 210000000680 phagosome Anatomy 0.000 description 1
- 238000005191 phase separation Methods 0.000 description 1
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- UYWQUFXKFGHYNT-UHFFFAOYSA-N phenylmethyl ester of formic acid Natural products O=COCC1=CC=CC=C1 UYWQUFXKFGHYNT-UHFFFAOYSA-N 0.000 description 1
- HDOWRFHMPULYOA-UHFFFAOYSA-N piperidin-4-ol Chemical compound OC1CCNCC1 HDOWRFHMPULYOA-UHFFFAOYSA-N 0.000 description 1
- 230000036470 plasma concentration Effects 0.000 description 1
- 229920000768 polyamine Polymers 0.000 description 1
- 229920001223 polyethylene glycol Chemical class 0.000 description 1
- 229940068918 polyethylene glycol 400 Drugs 0.000 description 1
- 230000007824 polyneuropathy Effects 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 230000034190 positive regulation of NF-kappaB transcription factor activity Effects 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 235000011056 potassium acetate Nutrition 0.000 description 1
- 229910000027 potassium carbonate Inorganic materials 0.000 description 1
- 229910000160 potassium phosphate Inorganic materials 0.000 description 1
- 235000011009 potassium phosphates Nutrition 0.000 description 1
- 150000003141 primary amines Chemical class 0.000 description 1
- MFDFERRIHVXMIY-UHFFFAOYSA-N procaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1 MFDFERRIHVXMIY-UHFFFAOYSA-N 0.000 description 1
- 229960004919 procaine Drugs 0.000 description 1
- 230000000770 proinflammatory effect Effects 0.000 description 1
- 235000019260 propionic acid Nutrition 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 230000000541 pulsatile effect Effects 0.000 description 1
- 125000004076 pyridyl group Chemical group 0.000 description 1
- 229940107700 pyruvic acid Drugs 0.000 description 1
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 description 1
- 239000011347 resin Substances 0.000 description 1
- 229920005989 resin Polymers 0.000 description 1
- 210000001533 respiratory mucosa Anatomy 0.000 description 1
- 125000006413 ring segment Chemical group 0.000 description 1
- 229960004889 salicylic acid Drugs 0.000 description 1
- 150000003335 secondary amines Chemical class 0.000 description 1
- 230000003248 secreting effect Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 230000011664 signaling Effects 0.000 description 1
- 239000000741 silica gel Substances 0.000 description 1
- 229910002027 silica gel Inorganic materials 0.000 description 1
- 229940126586 small molecule drug Drugs 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 159000000000 sodium salts Chemical class 0.000 description 1
- 239000008109 sodium starch glycolate Substances 0.000 description 1
- 229940079832 sodium starch glycolate Drugs 0.000 description 1
- 229920003109 sodium starch glycolate Polymers 0.000 description 1
- 238000007614 solvation Methods 0.000 description 1
- 239000011877 solvent mixture Substances 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 239000008117 stearic acid Substances 0.000 description 1
- 150000003432 sterols Chemical class 0.000 description 1
- 235000003702 sterols Nutrition 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 201000011549 stomach cancer Diseases 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 201000011138 superficial basal cell carcinoma Diseases 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 230000009897 systematic effect Effects 0.000 description 1
- 238000007910 systemic administration Methods 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 125000004213 tert-butoxy group Chemical group [H]C([H])([H])C(O*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 125000006633 tert-butoxycarbonylamino group Chemical group 0.000 description 1
- DQQJBEAXSOOCPG-UHFFFAOYSA-N tert-butyl n-pyrrolidin-3-ylcarbamate Chemical compound CC(C)(C)OC(=O)NC1CCNC1 DQQJBEAXSOOCPG-UHFFFAOYSA-N 0.000 description 1
- XBXCNNQPRYLIDE-UHFFFAOYSA-N tert-butylcarbamic acid Chemical compound CC(C)(C)NC(O)=O XBXCNNQPRYLIDE-UHFFFAOYSA-N 0.000 description 1
- 125000005931 tert-butyloxycarbonyl group Chemical group [H]C([H])([H])C(OC(*)=O)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 150000003512 tertiary amines Chemical class 0.000 description 1
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 1
- 229960004559 theobromine Drugs 0.000 description 1
- 201000002510 thyroid cancer Diseases 0.000 description 1
- 206010043778 thyroiditis Diseases 0.000 description 1
- 238000011200 topical administration Methods 0.000 description 1
- 102000027257 transmembrane receptors Human genes 0.000 description 1
- 108091008578 transmembrane receptors Proteins 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
- 125000004205 trifluoroethyl group Chemical group [H]C([H])(*)C(F)(F)F 0.000 description 1
- YFTHZRPMJXBUME-UHFFFAOYSA-N tripropylamine Chemical compound CCCN(CCC)CCC YFTHZRPMJXBUME-UHFFFAOYSA-N 0.000 description 1
- 201000008827 tuberculosis Diseases 0.000 description 1
- 210000004881 tumor cell Anatomy 0.000 description 1
- 241000701161 unidentified adenovirus Species 0.000 description 1
- 229960005486 vaccine Drugs 0.000 description 1
- 239000012646 vaccine adjuvant Substances 0.000 description 1
- 229940124931 vaccine adjuvant Drugs 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 239000003039 volatile agent Substances 0.000 description 1
- 239000008215 water for injection Substances 0.000 description 1
- 238000009736 wetting Methods 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D223/00—Heterocyclic compounds containing seven-membered rings having one nitrogen atom as the only ring hetero atom
- C07D223/14—Heterocyclic compounds containing seven-membered rings having one nitrogen atom as the only ring hetero atom condensed with carbocyclic rings or ring systems
- C07D223/16—Benzazepines; Hydrogenated benzazepines
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/10—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a carbon chain containing aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Immunology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pulmonology (AREA)
- Communicable Diseases (AREA)
- Oncology (AREA)
- Pain & Pain Management (AREA)
- Rheumatology (AREA)
- Transplantation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
Description
[式中、
R1及びR2は、同じであるか又は異なり、C1−7−アルキル、ヒドロキシ−C2−7−アルキル、アミノ−C2−7−アルキル、C2−7−アルケニル及びC3−7−アルキニルからなる群より選択され;
R3は、水素又はC1−7アルキルであり;
R6は、水素又はC1−7アルキルであり;
R4及びR5の一方は、水素、C1−7−アルキル、ハロゲン−C1−7−アルキル及びC1−7−アルコキシからなる群より選択され,
R4及びR5の他方は
(ここで、R7及びR8は同じであるか又は異なり、水素、C1−7−アルキル、ハロゲン−C1−7−アルキル、ヒドロキシ−C1−7−アルキル、ヒドロキシ−C1−7−アルコキシ−C1−7−アルキル、アミノ−C1−7−アルキル、C1−7−アルキル−アミノ−C1−7−アルキル、アミノ−C1−7−アルコキシ−C1−7−アルキル、C1−7−アルキル−アミノ−C1−7−アルコキシ−C1−7−アルキル、アミノ−C1−7−アルキル−カルボニル及びC1−7−アルキル−アミノ−C1−7−アルキル−カルボニルからなる群より選択されるか、又は
R7及びR8は、それらが結合する窒素原子と共に、置換されていないか又はアミノ、C1−7−アルキル−アミノ、ヒドロキシ及びヒドロキシ−C1−7−アルキルからなる群より選択される一つの基で置換されている4から6員の複素環であって、R10が水素、アミノ−C1−7−アルキル及びC1−7−アルキル−アミノ−C1−7−アルキルからなる群より選択される、さらなるN−R10基を含んでもよい4から6員の複素環を形成する)であり;
YはN又はCR9
(ここでR9は水素、C1−7−アルキル及びハロゲン−C1−7−アルキルからなる群より選択される)である]
のベンザゼピン−4−カルボキサミド化合物又はその薬学的に許容される塩に関する。
[式中、
R1及びR2は、同じであるか又は異なり、C1−7−アルキル、ヒドロキシ−C2−7−アルキル、アミノ−C2−7−アルキル、C2−7−アルケニル及びC3−7−アルキニルからなる群より選択され;
R3は、水素又はC1−7アルキルであり;
R6は、水素又はC1−7アルキルであり;
R4及びR5の一方は、水素、C1−7−アルキル、ハロゲン−C1−7−アルキル及びC1−7−アルコキシからなる群より選択され、
R4及びR5の他方は
(ここで、R7及びR8は、同じであるか又は異なり、水素、C1−7−アルキル、ハロゲン−C1−7−アルキル、ヒドロキシ−C1−7−アルキル、ヒドロキシ−C1−7−アルコキシ−C1−7−アルキル、アミノ−C1−7−アルキル、C1−7−アルキル−アミノ−C1−7−アルキル、アミノ−C1−7−アルコキシ−C1−7−アルキル、C1−7−アルキル−アミノ−C1−7−アルコキシ−C1−7−アルキル、アミノ−C1−7−アルキル−カルボニル及びC1−7−アルキル−アミノ−C1−7−アルキル−カルボニルからなる群より選択されるか、又は
R7及びR8は、それらが結合する窒素原子と共に、置換されていないか又はアミノ、C1−7−アルキル−アミノ、ヒドロキシ及びヒドロキシ−C1−7−アルキルからなる群より選択される一つの基で置換されている4から6員の複素環であって、R10が水素、アミノ−C1−7−アルキル及びC1−7−アルキル−アミノ−C1−7−アルキルからなる群より選択される、さらなるN−R10基を含んでもよい4から6員の複素環を形成する)であり;
YはN又はCR9
(ここで、R9は、水素、C1−7−アルキル及びハロゲン−C1−7−アルキルからなる群より選択される)である]
の化合物又はその薬学的に許容される塩に関する。
R5が、
(ここで、R7及びR8は、同じであるか又は異なり、水素、C1−7−アルキル、ハロゲン−C1−7−アルキル、ヒドロキシ−C1−7−アルキル、ヒドロキシ−C1−7−アルコキシ−C1−7−アルキル、アミノ−C1−7−アルキル、C1−7−アルキル−アミノ−C1−7−アルキル、アミノ−C1−7−アルコキシ−C1−7−アルキル、C1−7−アルキル−アミノ−C1−7−アルコキシ−C1−7−アルキル、アミノ−C1−7−アルキル−カルボニル及びC1−7−アルキル−アミノ−C1−7−アルキル−カルボニルからなる群より選択されるか、又は
R7及びR8は、それらが結合する窒素原子と共に、置換されていないか又はアミノ、C1−7−アルキル−アミノ、ヒドロキシ及びヒドロキシ−C1−7−アルキルからなる群より選択される一つの基で置換されている4から6員の複素環であって、R10が水素、アミノ−C1−7−アルキル及びC1−7−アルキル−アミノ−C1−7−アルキルからなる群より選択される、さらなるN−R10基を含んでもよい4から6員の複素環を形成する)
である、式Iの化合物に関する。
R4が、
(ここで、R7及びR8は、同じであるか又は異なり、水素、C1−7−アルキル、ハロゲン−C1−7−アルキル、ヒドロキシ−C1−7−アルキル、ヒドロキシ−C1−7−アルコキシ−C1−7−アルキル、アミノ−C1−7−アルキル、C1−7−アルキル−アミノ−C1−7−アルキル、アミノ−C1−7−アルコキシ−C1−7−アルキル、C1−7−アルキル−アミノ−C1−7−アルコキシ−C1−7−アルキル、アミノ−C1−7−アルキル−カルボニル及びC1−7−アルキル−アミノ−C1−7−アルキル−カルボニルからなる群より選択されるか、又は
R7及びR8は、それらが結合する窒素原子と共に、置換されていないか又はアミノ、C1−7−アルキル−アミノ、ヒドロキシ及びヒドロキシ−C1−7−アルキルからなる群より選択される一つの基で置換されている4から6員の複素環であって、R10が水素、アミノ−C1−7−アルキル及びC1−7−アルキル−アミノ−C1−7−アルキルからなる群より選択される、さらなるN−R10基を含んでもよい4から6員の複素環を形成する)
である、式Iの化合物に関する。
2−アミノ−N,N−ジプロピル−8−(3−スルファモイルフェニル)−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−(2−ヒドロキシエチルスルファモイル)フェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−N,N−ジプロピル−8−(3−ピロリジン−1−イルスルホニルフェニル)−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−N,N−ジプロピル−8−(5−スルファモイル−3−ピリジル)−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−(3−ヒドロキシピロリジン−1−イル)スルホニルフェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[4−(3−ヒドロキシピロリジン−1−イル)スルホニルフェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−[(3R)−3−ヒドロキシピロリジン−1−イル]スルホニルフェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−[(3S)−3−ヒドロキシピロリジン−1−イル]スルホニルフェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−(3−ヒドロキシアゼチジン−1−イル)スルホニルフェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−[2−ヒドロキシエチル(メチル)スルファモイル]フェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−[2−(2−ヒドロキシエトキシ)エチルスルファモイル]フェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−(6−ヒドロキシヘキシルスルファモイル)フェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−[(4−ヒドロキシ−1−ピペリジル)スルホニル]フェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−[(3R)−3−ヒドロキシピロリジン−1−イル]スルホニル−5−(トリフルオロメチル)フェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−[(3R)−3−ヒドロキシピロリジン−1−イル]スルホニル−4−メトキシ−フェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−[3−(ヒドロキシメチル)アゼチジン−1−イル]スルホニルフェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−[[(3R)−3−ヒドロキシ−1−ピペリジル]スルホニル]フェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−[[(3S)−3−ヒドロキシ−1−ピペリジル]スルホニル]フェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−[(3R)−3−ヒドロキシピロリジン−1−イル]スルホニル−2−メチル−フェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−(5−ピペラジン−1−イルスルホニル−3−ピリジル)−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−(3−ピペラジン−1−イルスルホニルフェニル)−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[5−(3−アミノピロリジン−1−イル)スルホニル−3−ピリジル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−[(3R)−3−ヒドロキシピロリジン−1−イル]スルホニル−5−メチル−フェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
及びその薬学的に許容される塩である。
2−アミノ−N,N−ジプロピル−8−(3−ピロリジン−1−イルスルホニルフェニル)−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−(3−ヒドロキシピロリジン−1−イル)スルホニルフェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[4−(3−ヒドロキシピロリジン−1−イル)スルホニルフェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−[(3R)−3−ヒドロキシピロリジン−1−イル]スルホニル−5−(トリフルオロメチル)フェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−[[(3R)−3−ヒドロキシ−1−ピペリジル]スルホニル]フェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−[[(3S)−3−ヒドロキシ−1−ピペリジル]スルホニル]フェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−(3−ピペラジン−1−イルスルホニルフェニル)−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
及びその薬学的に許容される塩に関する。
a)式(II)
[式中、R1、及びR2は上記に定義される通りであり、PGは保護基である]の化合物を、式III
[式中、R3からR6及びYは上記に定義される通りである]の化合物と、塩基性条件下でPd触媒の存在下においてカップリングさせ、保護基PGを酸性条件下で除去して式I
[式中、R1からR6及びYは上記に定義される通りである]の化合物を得て、望ましい場合には、得られた化合物を薬学的に許容される塩に変換すること、又は
b)式II
[式中、R1及びR2は上記に定義される通りであり、PGは保護基である]の化合物を、ビス(ピナコラート)ジボロンと、塩基性条件下でPd触媒の存在下において反応させて式V
[式中、R1及びR2 は上記に定義される通りであり、PGは保護基である]のボロン酸エステルを得て、化合物Vを塩基性条件下でPd触媒の存在下において式
[式中、R3からR6及びYは上記に定義される通りである]の臭化物とカップリングさせ、保護基PGを酸性条件下で除去して式I
[式中、R1からR6及びYは上記に定義される通りである]の化合物を得て、望ましい場合には、得られた化合物を薬学的に許容される塩に変換すること
を含む。
以下の試験は、式Iの化合物の活性を決定するために実施された。
式Iの化合物及びその薬学的に許容される塩は、例えば,経腸、非経口又は局所投与のための薬学的調製物の形態で、医薬として使用することができる。式Iの化合物及びその薬学的に許容される塩は、全身投与(例えば、非経口)又は局所投与(例えば、局所若しくは病巣内注射)されうる。いくつかの例では、薬学的製剤は、局所、非経口、経口、膣内、子宮内、鼻腔内又は吸入投与される。本明細書に記載されるように、特定の組織がTLRアゴニストにとって好ましい標的である。したがって、TLRアゴニストのリンパ節、脾臓、骨髄、血液、並びにウイルスに曝された組織への投与は、好ましい投与の部位である。
Boc2O=ジ−tert−ブチル ジ炭酸、Boc=t−ブチル カルバメート、CD3OD=重水素化メタノール、d=日、DIPEA=N,N−ジイソプロピルエチルアミン、DCM=ジクロロメタン、DMAP:4−ジメチルアミノピリジン、DMF−DMA:N,N−ジメチルホルムアミド ジメチル アセタール、EA=エチルアセテート又はEtOAc、EC50=最大半量有効濃度、EDCI=1−(3−ジメチルアミノプロピル)−3−エチルカルボジイミド塩酸塩、h又はhr=時間、HOBT=N−ヒドロキシベンゾトリアゾール、HPLC=高速液体クロマトグラフィー、HPLC−UV=紫外線検出器付き高速液体クロマトグラフィー、Hz=hertz、mg=ミリグラム、MHz=メガヘルツ、min=分、mL=ミリリットル、mm=ミリメートル、mM=mmol/L、mmol=ミリモル、MS=質量分析、MW=分子量、NMR=核磁気共鳴、PE=石油エーテル、分取HPLC=調製用高速液体クロマトグラフィー、rt=室温、sat.=飽和した、TEA=トリエチルアミン、TFA=トリフルオロ酢酸、THF=テトラヒドロフラン、μM=マイクロモル、μm=マイクロメートル、UV=紫外線検出器、OD=光学濃度、Pd(dppf)2Cl2=[1,1′−Bis(ジフェニルホスフィノ)−フェロセン]ジクロロパラジウム(II)、TLR8=toll様受容体8、TLR7=toll様受容体7,NF−κB=活性化B細胞の核内因子カッパ軽鎖エンハンサー、SEAP=分泌胚性アルカリホスファターゼ、IFN−β=インターフェロン−ベータ。
DMF(1L)中、4−ブロモ−1−メチル−2−ニトロ−ベンゼン(100g、0.46mol)の溶液に対し、ピロリジン(39.6g、0.59mol)及びDMF−DMA(70g、0.59mol)を連続して加えた。反応混合物を100℃で4時間撹拌した後、溶媒を減圧下で濃縮し、褐色のオイルとして1−[(E)−2−(4−ブロモ−2−ニトロ−フェニル)ビニル]ピロリジン(化合物A、137g、粗製)を得て、これを次の工程に直接使用した。MS:m/z=297(M+H)+.
THF(1.7L)と水(2.0L)の混合物中、1−[(E)−2−(4−ブロモ−2−ニトロ−フェニル)ビニル]ピロリジン(化合物A、137g、0.47mol)の溶液に対し、NaIO4(298g、1.40mol)を複数回に分けて10℃で加えた。反応混合物を25℃で20時間撹拌した後濾過し、濾液をEA(3L)を用いて抽出した。分離した有機層をブラインで洗浄し、無水Na2SO4で乾燥させ、濾過し、濃縮して粗生成物を得た。この粗生成物を、PE中5%の酢酸エチルを用いたシリカゲルカラムクロマトグラフィーにより精製し、黄色の固体として4−ブロモ−2−ニトロ−ベンズアルデヒド(化合物B、66g、61%)を得た。MS:m/z=230(M+H)+.
トルエン(700mL)中、4−ブロモ−2−ニトロ−ベンズアルデヒド(化合物B、65g、0.28mol)の溶液に対し、エチル 3−シアノ−2−(トリフェニル ホスホラニリデン)プロピオナート(120g、0.31mol)を25℃で加えた。反応物を25℃で18時間撹拌した後、反応混合物を濃縮した。次いでメタノール(500mL)を加えた。溶液を冷蔵庫で4時間保管した後濾過し、白色の固体として2−[1−(4−ブロモ−2−ニトロ−フェニル)−(E)−メチリデン]−3−シアノ−プロピオン酸エチルエステル(化合物C、75g、78%)を得た。MS:m/z=298(M+H)+.
AcOH(1.1L)中、2−[1−(4−ブロモ−2−ニトロ−フェニル)−メタ−(E)−イリデン]−3−シアノ−プロピオン酸エチルエステル(化合物C、75g、0.22mol)の撹拌された溶液に対し、Fe(74g、1.33mol)を80℃で加えた。反応混合物を80℃で3時間加熱した後、反応混合物をセライトパッドを通して濾別した。セライトパッドを酢酸で洗浄した。混合濾液を真空中で濃縮し、飽和したNaHCO3溶液(300mL)で塩基性にした。次いで酢酸エチル(1L)を加え、混合物を撹拌した。溶解しない物質をセライトパッドを通してさらに濾別した。セライトパッドを酢酸エチル(800mL)で洗浄した。相分離後、有機層を収集し、水で洗浄し、Na2SO4で乾燥させ、真空中で濃縮して粗生成物を得た。粗生成物をジエチルエーテル(100mL)でさらにすすぎ、明黄色の固体としてエチル 2−アミノ−8−ブロモ−3H−1−ベンザゼピン−4−カルボキシレート(化合物D、50g、73%)を得た。MS:m/z=309(M+H)+.
DCM(500mL)中、エチル 2−アミノ−8−ブロモ−3H−1−ベンザゼピン−4−カルボキシレート(化合物D、50g、0.16mol)及びTEA(26.1g、0.26mol)の溶液に対し、DCM(100mL)中、Boc2O(56.6g、0.26mol)の溶液を0〜5℃で加えた。反応物を25℃で42時間撹拌した後、水(200mL)を加えた。有機層を分離し、ブラインで洗浄し、Na2SO4で乾燥させ、濾過し、濃縮した。残留物をEA及びPE中でスラリー化し、濾過して黄色の固体としてエチル 8−ブロモ−2−(tert−ブトキシカルボニルアミノ)−3H−1−ベンザゼピン−4−カルボキシレート(化合物E、57g、86%)を得た。MS:m/z=409(M+H)+.
THF(60mL)中、エチル 8−ブロモ−2−(tert−ブトキシカルボニルアミノ)−3H−1−ベンザゼピン−4−カルボキシレート(化合物E、10g、24.5mmol)の溶液に対し、EtOH(18mL)と水(18mL)の溶媒混合物中、水性LiOH(37mL、1M)を加えた。反応物を25℃で18時間撹拌した。EtOH(5mL)及び水(5mL)中、LiOH(10mL、1M)の溶液を加え、反応混合物を25℃で5時間さらに撹拌した。10%のクエン酸を用いて反応物をpH=5に酸性化した後、EAを用いて水層を抽出した。有機層を、混合し、無水Na2SO4で乾燥させ、濾過し、濃縮して、黄色の固体として8−ブロモ−2−(tert−ブトキシカルボニルアミノ)−3H−1−ベンザゼピン−4−カルボン酸(化合物F、9.6g、粗製)を得た。MS:m/z=380(M+H)+.
DCM(360mL)中、8−ブロモ−2−(tert−ブトキシカルボニルアミノ)−3H−1−ベンザゼピン−4−カルボン酸(化合物F、9.6g、25.3mmol)の溶液に対し、EDCI(12g、63.1mmol)、HOBT(4.1g、30.3mmol)、DIPEA(13g、101mmol)及びDMAP(770mg、6.3mmol)を10℃で連続して加えた。反応混合物を30分間25℃で撹拌した後、N−プロピルプロパン−1−アミン(3.8g、37.9mmol)を加えた。反応混合物を25℃で3時間撹拌した。次いで水を加え、DCMを用いて混合物を抽出した。溶媒を、減圧下で濃縮し、残留物を、シリカゲルクロマトグラフィー(PE:EA=5:1)により精製して、黄色の固体としてtert−ブチル N−[8−ブロモ−4−(ジプロピルカルバモイル)−3H−1−ベンザゼピン−2−イル]カルバメート(化合物G、8.6g、73%)を得た。1H−NMR(300MHz,DMSO−d6):δ ppm=10.25−10.07(m,1H),7.44−7.24(m,3H),6.86−6.79(m,1H),3.28−3.14(m,4H),3.13−3.01(m,2H),1.62−1.45(m,4H),1.43(s,9H),1.00−0.62(m,6H).MS:m/z=64(M+H)+.
2−アミノ−N、N−ジプロピル−8−(3−スルファモイルフェニル)−3H−1−ベンザゼピン−4−カルボキサミド
工程1:tert−ブチル N−[4−(ジプロピルカルバモイル)−8−(3−スルファモイルフェニル)−3H−1−ベンザゼピン−2−イル]カルバメート
マイクロ波管内において、tert−ブチル N−[8−ブロモ−4−(ジプロピルカルバモイル)−3H−1−ベンザゼピン−2−イル]カルバメート(化合物G、0.1g、215μmol)、3−スルファモイルフェニルボロン酸(86.6mg、431μmol)及びテトラキス(トリフェニルホスフィン)パラジウム(0)(4.98mg、4.31μmol)を、アルゴン雰囲気下において1,2−ジメトキシエタン(1.4mL)中に溶解した。Na2CO3(2Nの水溶液、323μL、646μmol)を加え、反応混合物を80℃に加熱し、4時間撹拌した。水を加え、粗生成物の懸濁液を、酢酸エチルを用いて抽出した。有機層を、Na2SO4で乾燥させ、濾過した。溶媒を真空中でエバポレートした。フラッシュクロマトグラフィー(シリカゲルカラム及び酢酸エチル/ヘプタン勾配を用いる)による精製後、生成物が、明黄色のワックス状固体(70mg、60%)として得られた。1H NMR(DMSO−d6、300MHz):δ ppm=10.08(br s,1H),8.19(s,1H),7.97(d,J=8.1Hz,1H),7.80(d,J=8.1Hz,1H),7.44−7.74(m,4H),7.42(s,2H),6.91(s,1H),3.20−3.34(m,4H),3.12(s,2H),1.45−1.63(m,4H),1.44(s,9H),0.70−0.94(m,6H).MS:m/z=541.3(M+H)+.
ジクロロメタン(2.3ml)中、tert−ブチル N−[4−(ジプロピルカルバモイル)−8−(3−スルファモイルフェニル)−3H−1−ベンザゼピン−2−イル]カルバメート(69mg、126μmol)の溶液に対し、TFA(860mg、581μl、7.55mmol)を加えた。明黄色の溶液を室温で1時間撹拌した。すべての揮発物はエバポレートし、分取HPLC後に生成物がオフホワイトの固体として(34mg、61%)得られた。1H NMR(DMSO−d6、300MHz):δ ppm=8.15(dd,J=1.7、1.7Hz,1H),7.91(m,1H),7.78(m,1H),7.64(dd,J=8.1Hz,1H),7.35−7.45(m,4H),7.27(dd,J=8.1、2.0Hz,1H),6.82(br s,2H),6.76(s,1H),3.25−3.35(m,4H),2.74(s,2H),1.50−1.65(m,4H),0.75−0.90(m,6H).MS:m/z=441.2(M+H)+.
2−アミノ−8−[3−(2−ヒドロキシエチルスルファモイル)フェニル]−N、N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド
標題化合物を、スキーム1に示した一般的合成経路に従って調製した。詳細な合成経路をスキーム4に示す。
DMF(4.5mL)と水(0.9ml)の混合物中、tert−ブチル N−[8−ブロモ−4−(ジプロピルカルバモイル)−3H−1−ベンザゼピン−2−イル]カルバメート(化合物G、110mg、0.215mmol)と[3−(2−ヒドロキシエチルスルファモイル)フェニル]−ボロン酸(化合物K、70mg、0.28mmol)の混合物に対し、Pd(dppf)2Cl2(12mg)とNa2CO3(113mg、1.07mmol)を加えた。反応物を脱気し、次いで3度窒素を充填した。反応混合物を、85〜90℃で2時間窒素下で撹拌した。溶解しない物質を濾過した後、水(3mL)とEtOAc(3mL)を加えた。有機層を分離し、濃縮して粗製tert−ブチル N−[4−(ジプロピルカルバモイル)−8−[3−(2−ヒドロキシエチルスルファモイル)フェニル]−3H−1−ベンザゼピン−2−イル]カルバメート(化合物L、80mg)を得た。MS:m/z=585(M+H)+.
DCM(2mL)中、tert−ブチル N−[4−(ジプロピルカルバモイル)−8−[3−(2−ヒドロキシエチルスルファモイル)−フェニル]−3H−1−ベンザゼピン−2−イル]カルバメート(化合物L、80mg)の溶液に対し、DCM(0.5mL)中TFA(0.5mL)を0℃で加えた。混合物を25℃で1.5時間撹拌した。溶媒を除去し、残留物を分取HPLCにより精製して明黄色の固体として2−アミノ−8−[3−(2−ヒドロキシエチル−スルファモイル)]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド(実施例2)(19mg、15%)を得た。1H NMR(CD3OD,400MHz):δ ppm=8.53(s,1H),8.18(t,J=1.6Hz,1H),7.88−8.02(m,2H),7.66−7.80(m,1H),7.53−7.64(m,2H),6.92−7.06(m,1H),3.58(t,J=6.0Hz,2H),3.47(br. s.,6H),3.03(t,J=5.9Hz,2H),1.72(dq,J=14.9、7.3Hz,4H),0.97(br. s.,6H).MS:m/z=485(M+H)+.
2−アミノ−N、N−ジプロピル−8−(3−ピロリジン−1−イルスルホニルフェニル)−3H−1−ベンザゼピン−4−カルボキサミド
標題化合物を、実施例2と同様に、但し[3−(2−ヒドロキシエチルスルファモイル)フェニル]−ボロン酸(化合物K)の代わりに(3−ピロリジン−1−イルスルホニルフェニル)ボロン酸を使用することにより、二工程で調製した。実施例3が明黄色の固体(36mg)として得られた。1H NMR(CD3OD,400MHz):δ ppm=8.53(s,1H),8.18(t,J=1.6Hz,1H),7.87−8.02(m,2H),7.67−7.79(m,1H),7.50−7.63(m,2H),6.94−7.08(m,1H),3.58(t,J=6.0Hz,2H),3.05−3.47(br.,8H),3.03(t,J=5.9Hz,2H),1.61−1.84(m,6H),0.97(br. s.,6H).MS:m/z=495(M+H)+.
2−アミノ−N、N−ジプロピル−8−(5−スルファモイル−3−ピリジル)−3H−1−ベンザゼピン−4−カルボキサミド
標題化合物を、スキーム2に示した一般的合成経路に従って調製した。詳細な合成経路をスキーム5に示す。
1,4−ジオキサン(3mL)中、tert−ブチル N−[8−ブロモ−4−(ジプロピルカルバモイル)−3H−1−ベンザゼピン−2−イル]カルバメート(化合物G、200mg、0.42mmol)の撹拌された溶液に対し、ビス(ピナコラート)ジボロン(112mg、0.44mmol)、酢酸カリウム(82mg、0.84mmol)及びPd(dppf)2Cl2(61mg、0.084mmol)をN2雰囲気下で加えた。次いで反応混合物を80℃で3時間撹拌し、さらに精製することなく次の工程に使用できるtert−ブチル N−[4−(ジプロピルカルバモイル)−8−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)−3H−1−ベンザゼピン−2−イル]カルバメート(化合物H)の溶液を得た。MS:m/z=512(M+H)+.
上記tert−ブチル N−[4−(ジプロピルカルバモイル)−8−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)−3H−1−ベンザゼピン−2−イル]カルバメート(化合物H)の1,4−ジオキサン溶液に対し、5−ブロモピリジン−3−スルホンアミド(CAS Registry No.62009−33−0、120mg、0.51mmol)、炭酸ナトリウム(89mg、0.84mmol)、水(1mL)及びPd(dppf)2Cl2(61mg、0.084mmol)をN2雰囲気下で加えた。反応混合物を100℃で2時間撹拌した後、溶解しない物質を濾過した。濾液を水(3mL)とEtOAc(3mL)で希釈し、有機層を分離し、Na2SO4で乾燥させ、濃縮して粗生成物を得た。この粗生成物を分取HPLCにより精製してtert−ブチル N−[4−(ジプロピルカルバモイル)−8−(5−スルファモイル−3−ピリジル)−3H−1−ベンザゼピン−2−イル]カルバメート(化合物J、80mg)を得た。MS:m/z=542(M+H)+.
DCM(2mL)中、tert−ブチル N−[4−(ジプロピルカルバモイル)−8−(5−スルファモイル−3−ピリジル)−3H−1−ベンザゼピン−2−イル]カルバメート(化合物J、80mg、0.15mmol)の溶液に対し、DCM(0.5mL)中TFA(0.5mL)を0℃で加えた。反応混合物を25℃で1.5時間撹拌した後、溶媒を除去し、残留物を分取HPLCにより精製して白色の固体として2−アミノ−N、N−ジプロピル−8−(5−スルファモイル−3−ピリジル)−3H−1−ベンザゼピン−4−カルボキサミド(実施例4)(8.2mg、13%)を得た。1H NMR(CD3CN,400MHz)δ ppm=12.86(br. s.,1H),9.49−9.21(m,1H),9.18(br. s.,1H),9.08(s,1H),8.80(br. s.,1H),7.88(s,1H),7.74(br. s.,1H),7.60(d,J=8.3Hz,1H),7.02(br. s.,2H),6.91(s,1H),3.43(br. s.,4H),3.32(br. s.,2H),1.66(d,J=6.8Hz,4H),0.90(br. s.,6H).MS:m/z=442(M+H)+.
2−アミノ−8−[3−(3−ヒドロキシピロリジン−1−イル)スルホニルフェニル]−N、N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド
標題化合物を、実施例4と同様に、但し5−ブロモピリジン−3−スルホンアミドの代わりに1−(3−ブロモフェニル)スルホニルピロリジン−3−オール(化合物5A)を使用することにより、2工程で調製した。実施例5を明黄色の固体(45mg)として得た。1H NMR(CD3OD,400MHz):δ ppm=8.53(br. s.,1H),8.11(s,1H),8.00(d,J=7.5Hz,1H),7.88(d,J=8.0Hz,1H),7.68−7.81(m,1H),7.50−7.61(m,2H),6.93−7.06(m,1H),4.32(dd,J=4.5、2.5Hz,1H),3.36−3.53(m,6H),3.26(d,J=10.8Hz,2H),1.61−2.02(m,8H),0.95ppm(br. s.,6H).MS:m/z=511(M+H)+.
DCM(10ml)及びTEA(505mg、5mmol)の撹拌された溶液に対し、ピロリジン−3−オール(170mg、2mmol)を25℃で加えた後、DCM(2mL)中、3−ブロモベンゼンスルホニル クロリド(370mg、1.5mmol)を加えた。次いで混合物をさらに2時間室温で撹拌した。反応混合物をブライン(10mL)で洗浄し、有機層をNa2SO4で乾燥させ、真空中で 濃縮し、さらに精製することなく次の工程で使用できる粗製1−(3−ブロモフェニル)スルホニルピロリジン−3−オール(化合物5−A、420mg)を得た。MS:m/z=306(M+H)+.
2−アミノ−8−[4−(3−ヒドロキシピロリジン−1−イル)スルホニルフェニル]−N、N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド
標題化合物を、実施例4と同様に、但し5−ブロモピリジン−3−スルホンアミドの代わりに1−(4−ブロモフェニル)スルホニルピロリジン−3−オール(化合物6A)を使用することにより、2工程で調製した。実施例6を明黄色の固体(55mg)として得た。1H NMR(CD3OD,400MHz):δ ppm=8.55(s,1H),7.84−8.01(m,4H),7.43−7.58(m,2H),6.95(s,1H),4.33(d,J=2.5Hz,1H),3.35−3.55(m,6H),3.24(d,J=10.8Hz,2H),1.58−2.00(m,8H),0.95(br. s.,6H).MS:m/z=511(M+H)+.
化合物6Aを、実施例5の化合物5Aと同様に、但し3−ブロモベンゼンスルホニル クロリドの代わりに4−ブロモベンゼンスルホニル クロリドを使用することにより、調製した。MS:m/z=306(M+H)+.
2−アミノ−8−[3−[(3R)−3−ヒドロキシピロリジン−1−イル]スルホニルフェニル]−N、N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド
標題化合物を、実施例4と同様に、但し5−ブロモピリジン−3−スルホンアミドの代わりに(3R)−1−(3−ブロモフェニル)スルホニルピロリジン−3−オール(化合物7A)を使用することにより、2工程で調製した。実施例7が、明黄色の固体(20mg)として得られた。1H NMR(CD3OD,400MHz):δ ppm=8.09(t,J=1.6Hz,1H),7.98(d,J=7.8Hz,1H),7.80−7.90(m,1H),7.65−7.77(m,1H),7.45−7.51(m,2H),7.35−7.43(m,1H),6.91(s,1H),4.32(dt,J=4.8、2.4Hz,1H),3.36−3.53(m,6H),3.26(d,J=11.3Hz,1H),2.83−2.97(m,1H),1.61−2.03(m,8H),0.93(br. s.,6H).MS:m/z=511(M+H)+.
化合物7Aを、実施例5の化合物5Aと同様に、但しピロリジン−3−オールの代わりに(3R)−ピロリジン−3−オールを使用することにより調製した。MS:m/z=306(M+H)+.
2−アミノ−8−[3−[(3S)−3−ヒドロキシピロリジン−1−イル]スルホニルフェニル]−N、N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド
標題化合物を、実施例4と同様に、但し5−ブロモピリジン−3−スルホンアミドの代わりに(3S)−1−(3−ブロモフェニル)スルホニルピロリジン−3−オール(化合物8A)を使用することにより、二工程で調製した。実施例8が、明黄色の固体(35mg)として得られた。1H NMR(CD3OD,400MHz):δ ppm=8.09(t,J=1.6Hz,1H),7.98(d,J=7.8Hz,1H),7.81−7.90(m,1H),7.65−7.78(m,1H),7.35−7.54(m,3H),6.91(s,1H),4.32(t,J=4.6、2.6Hz,1H),3.37−3.54(m,6H),3.23−3.29(m,1H),2.86−2.94(m,1H),1.57−2.02(m,8H),0.93(br. s.,6H).MS:m/z=511(M+H)+.
化合物8Aを、実施例5の化合物5Aと同様に、但しピロリジン−3−オールの代わりに(3S)−ピロリジン−3−オールを使用することにより調製した。MS:m/z=306(M+H)+.
2−アミノ−8−[3−(3−ヒドロキシアゼチジン−1−イル)スルホニルフェニル]−N、N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド
標題化合物を、実施例4と同様に、但し5−ブロモピリジン−3−スルホンアミドの代わりに1−(3−ブロモフェニル)スルホニルアゼチジン−3−オール(化合物9A)を使用することにより、2工程で調製した。実施例9が、明黄色の固体(10mg)として得られた。1H NMR(CD3OD,400MHz):δ ppm=8.00−8.12(m,2H),7.74−7.91(m,2H),7.35−7.55(m,3H),6.91(s,1H),4.34−4.50(m,1H),4.02(dd,J=8.9、6.7Hz,2H),3.39−3.61(m,6H),2.82−2.99(m,2H),1.59−1.81(m,4H),0.92(br. s.,6H).MS:m/z=497(M+H)+.
化合物9Aを、実施例5の化合物5Aと同様に、但しピロリジン−3−オールの代わりにアゼチジン−3−オールを使用することにより調製した。MS:m/z=292(M+H)+.
2−アミノ−8−[3−[2−ヒドロキシエチル(メチル)スルファモイル]フェニル]−N、N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド
標題化合物を、実施例4と同様に、但し5−ブロモピリジン−3−スルホンアミドの代わりに3−ブロモ−N−(2−ヒドロキシエチル)−N−メチル−ベンゼンスルホンアミド(化合物10A)を使用することにより、二工程で調製した。実施例10が、明黄色の固体(35mg)として得られた。1H NMR(CD3OD,400MHz):δ ppm=8.06(t,J=1.6Hz,1H),7.96−8.01(m,1H),7.83(dt,J=8.2、1.2Hz,1H),7.66−7.77(m,1H),7.30−7.52(m,3H),6.91(s,1H),3.72(t,J=5.8Hz,2H),3.38−3.55(m,4H),3.09−3.24(m,4H),2.88(s,3H),1.55−1.84(m,4H),0.93(br. s.,6H).MS:m/z=499(M+H)+.
化合物10Aを、実施例5の化合物5Aと同様に、但しピロリジン−3−オールの代わりに2−(メチルアミノ)エタノールを使用することにより調製した。MS:m/z=294(M+H)+.
2−アミノ−8−[3−[2−(2−ヒドロキシエトキシ)エチルスルファモイル]フェニル]−N、N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド
標題化合物を、実施例4と同様に、但し5−ブロモピリジン−3−スルホンアミドの代わりに3−ブロモ−N−[2−(2−ヒドロキシエトキシ)エチル]ベンゼンスルホンアミド(化合物11A)を使用することにより、二工程で調製した。実施例11が、明黄色の固体(20mg)として得られた。1H NMR(CD3OD,400MHz):δ ppm=8.18(t,J=1.8Hz,1H),7.95(d,J=7.8Hz,1H),7.87(d,J=8.3Hz,1H),7.62−7.73(m,1H),7.33−7.54(m,3H),6.91(s,1H),3.58−3.67(m,2H),3.25−3.54(m,8H),3.14(t,J=5.3Hz,2H),2.81−2.96(m,2H),1.60−1.78(m,4H),0.94(br. s.,6H).MS:m/z=529(M+H)+.
化合物11Aを、実施例5の化合物5Aと同様に、但しピロリジン−3−オールの代わりに2−(2−アミノエトキシ)エタノールを使用することにより調製した。MS:m/z=324(M+H)+.
2−アミノ−8−[3−(6−ヒドロキシヘキシルスルファモイル)フェニル]−N、N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド
標題化合物を、実施例4と同様に、但し5−ブロモピリジン−3−スルホンアミドの代わりに3−ブロモ−N−(6−ヒドロキシヘキシル)ベンゼンスルホンアミド(化合物12A)を使用することにより、二工程で調製した。実施例12が、明黄色の固体(15mg)として得られた。1H NMR(CD3OD,400MHz):δ ppm=8.55(br. s.,1H),8.15(s,1H),7.83−8.02(m,2H),7.61−7.76(m,1H),7.42−7.58(m,2H),6.98(s,1H),3.35−3.65(m,8H),2.92(t,J=6.9Hz,2H),1.56−1.85(m,4H),1.21−1.55(m,8H),0.50−1.14(m,6H).MS:m/z=541(M+H)+.
化合物12Aを、実施例5の化合物5Aと同様に、但しピロリジン−3−オールの代わりに6−アミノヘキサン−1−オールを使用することにより調製した。MS:m/z=336(M+H)+.
2−アミノ−8−[3−[(4−ヒドロキシ−1−ピペリジル)スルホニル]フェニル]−N、N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド
標題化合物を、実施例4と同様に、但し5−ブロモピリジン−3−スルホンアミドの代わりに1−(3−ブロモフェニル)スルホニルピペリジン−4−オール(化合物13A)を使用することにより、二工程で調製した。実施例13が、明黄色の固体(17mg)として得られた。1H NMR(CD3OD,400MHz):δ ppm=7.98−8.12(m,2H),7.84−7.92(m,1H),7.62−7.82(m,4H),7.09(s,1H),3.68(tt,J=7.8、3.6Hz,1H),3.36−3.58(m,8H),2.75−3.01(m,2H),1.91(ddd,J=9.8、6.7、3.4Hz,2H),1.50−1.81(m,6H),0.97(br. s,6H). MS:m/z=525(M+H)+.
化合物13Aを、実施例5の化合物5Aと同様に、但しピロリジン−3−オールの代わりにピペリジン−4−オールを使用して調製した。MS:m/z=320(M+H)+.
2−アミノ−8−[3−[(3R)−3−ヒドロキシピロリジン−1−イル]スルホニル−5−(トリフルオロメチル)フェニル]−N、N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド
標題化合物を、実施例4と同様に、但し5−ブロモピリジン−3−スルホンアミドの代わりにtert−ブチル N−[4−(ジプロピルカルバモイル)−8−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)−3H−1−ベンザゼピン−2−イル]カルバメート及び(3R)−1−[3−ブロモ−5−(トリフルオロメチル)フェニル]スルホニルピロリジン−3−オール(化合物14A)を使用して、二工程で調製した。実施例14が、明黄色の固体(20mg)として得られた。1H NMR(CD3OD,400MHz):δ ppm=8.37(s,1H),8.28(s,1H),8.13(s,1H),7.56−7.80(m,3H),7.07(s,1H),4.27−4.41(m,1H),3.36−3.59(m,8H),1.61−2.15(m,8H),0.98(br. s.,6H).MS:m/z=579(M+H)+.
化合物14Aを、実施例5の化合物5Aと同様に、但しピロリジン−3−オール及び3−ブロモ−ベンゼンスルホニル クロリドの代わりに(3R)−ピロリジン−3−オール及び3−ブロモ−5−(トリフルオロメチル)ベンゼンスルホニル クロリドを使用して調製した。MS:m/z=374(M+H)+.
2−アミノ−8−[3−[(3R)−3−ヒドロキシピロリジン−1−イル]スルホニル−4−メトキシ−フェニル]−N、N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド
標題化合物を、実施例4と同様に、但し5−ブロモピリジン−3−スルホンアミドの代わりに(3R)−1−(5−ブロモ−2−メトキシ−フェニル)スルホニルピロリジン−3−オール(化合物15A)を使用して、二工程で調製した。実施例15が、明黄色の固体(9mg)として得られた。1H NMR(CD3OD,400MHz):δ ppm=8.19(d,J=2.3Hz,1H),7.95(dd,J=8.7、2.4Hz,1H),7.49−7.60(m,3H),7.35(d,J=8.8Hz,1H),7.00(s,1H),4.34−4.46(m,1H),3.94−4.12(m,3H),3.36−3.66(m,8H),3.17−3.31(m,2H),1.82−2.10(m,2H),1.71(dq,J=14.9、7.5Hz,4H),0.96(br. s.,6H). MS:m/z=541(M+H)+.
化合物15Aを、実施例5の化合物5Aと同様に、但しピロリジン−3−オール及び3−ブロモ−ベンゼンスルホニル クロリドの代わりに(3R)−ピロリジン−3−オール及び5−ブロモ−2−メトキシ−ベンゼンスルホニル クロリドを使用して調製した。MS:m/z=336(M+H)+.
2−アミノ−8−[3−[3−(ヒドロキシメチル)アゼチジン−1−イル]スルホニルフェニル]−N、N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド
標題化合物を、実施例4と同様に、但し5−ブロモピリジン−3−スルホンアミドの代わりに[1−(3−ブロモフェニル)スルホニルアゼチジン−3−イル]メタノール(化合物16A)を使用して、二工程で調製した。実施例16が、明黄色の固体(10mg)として得られた。1H NMR(CD3OD,400MHz):δ ppm=8.02−8.18(m,2H),7.78−7.98(m,2H),7.60−7.76(m,3H),7.07(s,1H),3.77−3.97(m,3H),3.36−3.69(m,8H),2.42−2.74(m,2H),1.72(m,4H),0.96(br. s.,6H).MS:m/z=511(M+H)+.
化合物16Aを、実施例5の化合物5Aと同様に、但しピロリジン−3−オールの代わりにアゼチジン−3−イルメタノールを使用して調製した。MS:m/z=306(M+H)+.
2−アミノ−8−[3−[[(3R)−3−ヒドロキシ−1−ピペリジル]スルホニル]フェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド
標題化合物を、実施例4と同様に、但し5−ブロモピリジン−3−スルホンアミドの代わりに(3R)−1−(3−ブロモフェニル)スルホニルピペリジン−3−オール(化合物17A)を使用することにより、二工程で調製した。実施例17が、明黄色の固体(12mg)として得られた。1H NMR(CD3OD,400MHz):δ ppm=7.97−8.09(m,2H),7.70−7.89(m,2H),7.45−7.64(m,3H),6.93−7.06(m,1H),3.66−3.83(m,1H),3.36−3.64(m,8H),2.52−2.63(m,1H),2.43(dd,J=11.0、8.8Hz,1H),1.49−1.94(m,7H),1.17−1.37(m,1H),0.96(br. s.,6H).MS:m/z=525(M+H)+.
化合物17Aを、実施例5の化合物5Aと同様に、但しピロリジン−3−オールの代わりに(3R)−ピペリジン−3−オールを使用して調製した。MS:m/z=320(M+H)+.
2−アミノ−8−[3−[[(3S)−3−ヒドロキシ−1−ピペリジル]スルホニル]フェニル]−N、N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド
標題化合物を、実施例4と同様に、但し5−ブロモピリジン−3−スルホンアミドの代わりに(3S)−1−(3−ブロモフェニル)スルホニルピペリジン−3−オール(化合物18A)を使用することにより、二工程で調製した。実施例18が、明黄色の固体(5mg)として得られた。1H NMR(CD3OD,400MHz):δ ppm=7.97−8.13(m,2H),7.72−7.89(m,2H),7.53−7.70(m,3H),7.06(s,1H),3.68−3.79(m,1H),3.37−3.65(m,8H),2.51−2.71(m,1H),2.43(dd,J=11.0、8.8Hz,1H),1.51−1.94(m,7H),1.17−1.39(m,1H),0.96(br. s.,6H). MS:m/z=525(M+H)+.
化合物18Aを、実施例5の化合物5Aと同様に、但しピロリジン−3−オールの代わりに(3S)−ピペリジン−3−オールを使用して調製した。MS:m/z=320(M+H)+.
2−アミノ−8−[3−[(3R)−3−ヒドロキシピロリジン−1−イル]スルホニル−2−メチル−フェニル]−N、N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド
標題化合物を、実施例4と同様に、但し5−ブロモピリジン−3−スルホンアミドの代わりに(3R)−1−(3−ブロモ−2−メチル−フェニル)スルホニルピロリジン−3−オール(化合物19A)を使用して、二工程で調製した。実施例19が、明黄色の固体(12mg)として得られた。1H NMR(CD3OD,400MHz):δ ppm=8.02(dd,J=7.7、1.4Hz,1H),7.39−7.55(m,3H),7.11−7.22(m,2H),6.99(s,1H),4.43−4.55(m,1H),3.42−3.58(m,6H),3.20−3.22(m,5H),2.55(s,3H),1.91−2.19(m,2H),1.72(dq,J=14.9、7.3Hz,3H),0.97(br. s.,6H). MS:m/z=525(M+H)+.
化合物19Aを、実施例5の化合物5Aと同様に、但しピロリジン−3−オール及び3−ブロモ−ベンゼンスルホニル クロリドの代わりに(3R)−ピペリジン−3−オール及び3−ブロモ−2−メチル−ベンゼンスルホニル クロリドにより調製した。MS:m/z=320(M+H)+.
2−アミノ−8−(5−ピペラジン−1−イルスルホニル−3−ピリジル)−N、N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド
標題化合物を、実施例4と同様に、但し5−ブロモピリジン−3−スルホンアミドの代わりにtert−ブチル 4−[(5−ブロモ−3−ピリジル)スルホニル]ピペラジン−1−カルボキシレート(化合物20A)を使用することにより、二工程で調製した。実施例20が、褐色の固体(22.9mg)として得られた。1H NMR(CD3CN,400MHz)δ ppm=9.16(s,1H),8.89(s,1H),8.27(s,1H),7.48−7.36(m,3H),6.83(s,1H),5.72(s,2H),3.41−3.37(m,4H),3.01−2.98(m,4H),2.85−2.83(m,4H),2.78(s,2H),1.67−1.59(m. 4H),0.89(s,6H). MS:m/z=511(M+H)+.
DCM(3mL)中、1−boc−ピペラジン(219mg、1.17mmol)の撹拌された溶液に対し、TEA(157mg、1.56mmol)及び5−ブロモピリジン−3−スルホニル クロリド(200mg、0.78mmol)を、N2雰囲気下において0℃で連続して加えた。反応物を25℃で1時間撹拌した。水(3mL)を加え、DCM(3mL)を用いて混合物を抽出した。分離した有機層を、1Mの塩酸、飽和NaHCO3溶液で洗浄し、Na2SO4で乾燥させ、濃縮して、まったく精製せずに次の工程で使用できるtert−ブチル 4−[(5−ブロモ−3−ピリジル)スルホニル]ピペラジン−1−カルボキシレート(化合物20A,250mg)を得た。MS:m/z=406(M+H)+.
2−アミノ−8−(3−ピペラジン−1−イルスルホニルフェニル)−N、N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド
標題化合物を、実施例4と同様に、但し5−ブロモピリジン−3−スルホンアミドの代わりにtert−ブチル 4−(3−ブロモフェニル)スルホニルピペラジン−1−カルボキシレート(化合物21A)を使用することにより、二工程で調製した。実施例21が、明黄色の固体(10mg)として得られた。1H NMR(CDCl3,400MHz)δ ppm=8.04(s,1H),7.89(d,J=7.78Hz,1H),7.74(d,J=7.91Hz,1H),7.59−7.66(m,1H),7.52(d,J=1.63Hz,1H),7.37−7.43(m,1H),7.31(dd,J=8.09、1.82Hz,1H),6.86(s,1H),3.49(br. s.,4H),3.01−3.10(m,4H),2.91−2.99(m,4H),2.84(s,2H),1.69(dq,J=15.00、7.38Hz,4H),0.96(t,J=7.28Hz,6H). MS:m/z=510(M+H)+.
化合物21Aを、実施例20の化合物20Aと同様に、但し5−ブロモピリジン−3−スルホニル クロリドの代わりに3−ブロモベンゼンスルホニル クロリドを使用することにより調製した。MS:m/z=405(M+H)+.
2−アミノ−8−[5−(3−アミノピロリジン−1−イル)スルホニル−3−ピリジル]−N、N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド
標題化合物を、実施例4と同様に、但し5−ブロモピリジン−3−スルホンアミドの代わりにtert−ブチル N−[1−[(5−ブロモ−3−ピリジル)スルホニル]ピロリジン−3−イル]カルバメート(化合物22A)を使用することにより、二工程で調製した。実施例22が、黄色の固体(17mg)として得られた。1H NMR(CDCl3,400MHz)δ ppm=8.95−9.19(m,2H),8.37(s,1H),7.49−7.57(m,1H),7.39−7.49(m,1H),7.30−7.37(m,1H),6.82−6.91(m,1H),4.93−5.40(m,2H),3.23−3.72(m,8H),2.98−3.10(m,1H),2.83(s,2H),1.99−2.13(m,1H),1.68−1.90(m,5H),0.96(t,J=7.16Hz,6H).MS:m/z=511(M+H)+.
化合物22Aを、実施例20の化合物20Aと同様に、但し1−boc−ピペラジンの代わりにtert−ブチル ピロリジン−3−イルカルバメートを使用することにより調製した。MS:m/z=406(M+H)+.
2−アミノ−8−[3−[(3R)−3−ヒドロキシピロリジン−1−イル]スルホニル−5−メチル−フェニル]−N、N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド
標題化合物を、実施例4と同様に、但し5−ブロモピリジン−3−スルホンアミドの代わりに(3R)−1−(3−ブロモ−2−メチル−フェニル)スルホニルピロリジン−3−オール(化合物23A)を使用して、二工程で調製した。実施例23が、明黄色の固体(12mg)として得られた。1H NMR(CD3OD,400MHz):δ ppm=7.92(s,1H),7.84(s,1H),7.62−7.69(m,4H),7.07(s,1H),4.43−4.55(m,1H),3.40−3.58(m,6H),3.20−3.22(m,5H),2.55(s,3H),1.91−1.98(m,2H),1.72(m,3H),0.97(br. s.,6H). MS:m/z=525(M+H)+.
Claims (20)
- 式
[式中、
R1及びR2は、同じであるか又は異なり、C1−7−アルキル、ヒドロキシ−C2−7−アルキル、アミノ−C2−7−アルキル、C2−7−アルケニル及びC3−7−アルキニルからなる群より選択され;
R3は、水素又はC1−7アルキルであり;
R6は、水素又はC1−7アルキルであり;
R4及びR5の一方は、水素、C1−7−アルキル、ハロゲン−C1−7−アルキル及びC1−7−アルコキシからなる群より選択され、
R4及びR5の他方は
(ここで、R7及びR8は、同じであるか又は異なり、水素、C1−7−アルキル、ハロゲン−C1−7−アルキル、ヒドロキシ−C1−7−アルキル、ヒドロキシ−C1−7−アルコキシ−C1−7−アルキル、アミノ−C1−7−アルキル、C1−7−アルキル−アミノ−C1−7−アルキル、アミノ−C1−7−アルコキシ−C1−7−アルキル、C1−7−アルキル−アミノ−C1−7−アルコキシ−C1−7−アルキル、アミノ−C1−7−アルキル−カルボニル及びC1−7−アルキル−アミノ−C1−7−アルキル−カルボニルからなる群より選択されるか、又は
R7及びR8は、それらが結合する窒素原子と共に、置換されていないか又はアミノ、C1−7−アルキル−アミノ、ヒドロキシ及びヒドロキシ−C1−7−アルキルからなる群より選択される一つの基で置換されている4から6員の複素環であって、R10が水素、アミノ−C1−7−アルキル及びC1−7−アルキル−アミノ−C1−7−アルキルからなる群より選択される、さらなるN−R10基を含んでもよい4から6員の複素環を形成する)であり;
YはN又はCR9
(ここでR9は水素、C1−7−アルキル及びハロゲン−C1−7−アルキルからなる群より選択される)である]
の化合物又はその薬学的に許容される塩。 - R1がC1−7−アルキルである、請求項1に記載の式Iの化合物。
- R1がプロピルである、請求項1又は2に記載の式Iの化合物。
- R2がC1−7−アルキルである、請求項1から3のいずれか一項に記載の式Iの化合物。
- R3とR6が水素である、請求項1から4のいずれか一項に記載の式Iの化合物。
- R4が、水素、C1−7−アルキル、ハロゲン−C1−7−アルキル及びC1−7−アルコキシからなる群より選択され、
R5が、
(ここで、R7及びR8は、同じであるか又は異なり、水素、C1−7−アルキル、ハロゲン−C1−7−アルキル、ヒドロキシ−C1−7−アルキル、ヒドロキシ−C1−7−アルコキシ−C1−7−アルキル、アミノ−C1−7−アルキル、C1−7−アルキル−アミノ−C1−7−アルキル、アミノ−C1−7−アルコキシ−C1−7−アルキル、C1−7−アルキル−アミノ−C1−7−アルコキシ−C1−7−アルキル、アミノ−C1−7−アルキル−カルボニル及びC1−7−アルキル−アミノ−C1−7−アルキル−カルボニルからなる群より選択されるか、又は
R7及びR8は、それらが結合する窒素原子と共に、置換されていないか又はアミノ、C1−7−アルキル−アミノ、ヒドロキシ及びヒドロキシ−C1−7−アルキルからなる群より選択される一つの基で置換されている4から6員の複素環であって、R10が水素、アミノ−C1−7−アルキル及びC1−7−アルキル−アミノ−C1−7−アルキルからなる群より選択される、さらなるN−R10基を含んでもよい4から6員の複素環を形成する)
である、請求項1から5のいずれか一項に記載の式Iの化合物。 - R7及びR8が、同じであるか又は異なり、水素、C1−7−アルキル、ハロゲン−C1−7−アルキル、ヒドロキシ−C1−7−アルキル、ヒドロキシ−C1−7−アルコキシ−C1−7−アルキル、アミノ−C1−7−アルキル、C1−7−アルキル−アミノ−C1−7−アルキル、アミノ−C1−7−アルコキシ−C1−7−アルキル、C1−7−アルキル−アミノ−C1−7−アルコキシ−C1−7−アルキル、アミノ−C1−7−アルキル−カルボニル及びC1−7−アルキル−アミノ−C1−7−アルキル−カルボニルからなる群より選択される、請求項1から6のいずれか一項に記載の式Iの化合物。
- R7及びR8が、同じであるか又は異なり、水素、C1−7−アルキル、ヒドロキシ−C1−7−アルキル及びヒドロキシ−C1−7−アルコキシ−C1−7−アルキルからなる群より選択される、請求項1から7のいずれか一項に記載の式Iの化合物。
- R7及びR8が、それらが結合する窒素原子と共に、置換されていないか又はアミノ、C1−7−アルキル−アミノ、ヒドロキシ及びヒドロキシ−C1−7−アルキルからなる群より選択される一つの基で置換されている4から6員の複素環であって、R10が水素、アミノ−C1−7−アルキル及びC1−7−アルキル−アミノ−C1−7−アルキルからなる群より選択される、さらなるN−R10基を含んでもよい4から6員の複素環を形成する、請求項1から6のいずれか一項に記載の式Iの化合物。
- R7及びR8が、それらが結合する窒素原子と共に、アミノ、ヒドロキシ及びヒドロキシ−C1−7−アルキルからなる群より選択される一つの基で置換されている4から6員の複素環を形成する、請求項1から6又は9のいずれか一項に記載の式Iの化合物。
- YがNである、請求項1から10のいずれか一項に記載の式Iの化合物。
- YがCR9であり、ここでR9は水素、C1−7−アルキル及びハロゲン−C1−7−アルキルからなる群より選択される、請求項1から11のいずれか一項に記載の式Iの化合物。
- 2−アミノ−N,N−ジプロピル−8−(3−スルファモイルフェニル)−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−(2−ヒドロキシエチルスルファモイル)フェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−N,N−ジプロピル−8−(3−ピロリジン−1−イルスルホニルフェニル)−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−N,N−ジプロピル−8−(5−スルファモイル−3−ピリジル)−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−(3−ヒドロキシピロリジン−1−イル)スルホニルフェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[4−(3−ヒドロキシピロリジン−1−イル)スルホニルフェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−[(3R)−3−ヒドロキシピロリジン−1−イル]スルホニルフェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−[(3S)−3−ヒドロキシピロリジン−1−イル]スルホニルフェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−(3−ヒドロキシアゼチジン−1−イル)スルホニルフェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−[2−ヒドロキシエチル(メチル)スルファモイル]フェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−[2−(2−ヒドロキシエトキシ)エチルスルファモイル]フェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−(6−ヒドロキシヘキシルスルファモイル)フェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−[(4−ヒドロキシ−1−ピペリジル)スルホニル]フェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−[(3R)−3−ヒドロキシピロリジン−1−イル]スルホニル−5−(トリフルオロメチル)フェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−[(3R)−3−ヒドロキシピロリジン−1−イル]スルホニル−4−メトキシ−フェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−[3−(ヒドロキシメチル)アゼチジン−1−イル]スルホニルフェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−[[(3R)−3−ヒドロキシ−1−ピペリジル]スルホニル]フェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−[[(3S)−3−ヒドロキシ−1−ピペリジル]スルホニル]フェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−[(3R)−3−ヒドロキシピロリジン−1−イル]スルホニル−2−メチル−フェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−(5−ピペラジン−1−イルスルホニル−3−ピリジル)−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−(3−ピペラジン−1−イルスルホニルフェニル)−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[5−(3−アミノピロリジン−1−イル)スルホニル−3−ピリジル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−[(3R)−3−ヒドロキシピロリジン−1−イル]スルホニル−5−メチル−フェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
及びその薬学的に許容される塩
からなる群より選択される、請求項1に記載の式Iの化合物。 - 2−アミノ−N,N−ジプロピル−8−(3−ピロリジン−1−イルスルホニルフェニル)−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−(3−ヒドロキシピロリジン−1−イル)スルホニルフェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[4−(3−ヒドロキシピロリジン−1−イル)スルホニルフェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−[(3R)−3−ヒドロキシピロリジン−1−イル]スルホニル−5−(トリフルオロメチル)フェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−[[(3R)−3−ヒドロキシ−1−ピペリジル]スルホニル]フェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−[3−[[(3S)−3−ヒドロキシ−1−ピペリジル]スルホニル]フェニル]−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
2−アミノ−8−(3−ピペラジン−1−イルスルホニルフェニル)−N,N−ジプロピル−3H−1−ベンザゼピン−4−カルボキサミド、
及びその薬学的に許容される塩
からなる群より選択される、請求項1に記載の式Iの化合物。 - 請求項1から14のいずれか一項に記載の式Iの化合物を含む医薬。
- 請求項1から14のいずれか一項に記載の式Iの化合物を含む、TLRアゴニストにより媒介されうる疾患の治療のための医薬。
- 請求項1から14のいずれか一項に記載の式Iの化合物と、薬学的に許容される担体及び/又はアジュバントとを含む薬学的組成物。
- TLRアゴニストにより媒介されうる疾患の治療のための医薬の調製のための、請求項1から14のいずれか一項に記載の式Iの化合物の使用。
- がん、自己免疫疾患、炎症、敗血症、アレルギー、喘息、移植片拒絶、移植片対宿主病、免疫不全、及び感染症からなる群より選択される疾患の治療のための医薬の調製のための、請求項1から14のいずれか一項に記載の式Iの化合物の使用。
- 請求項1に定義される式Iの化合物の製造方法であって、
a)式II
[式中、R1及びR2は請求項1に定義される通りであり、PGは保護基である]の化合物を、式III
[式中、R3からR6及びYは請求項1に定義される通りである]の化合物と、塩基性条件下でPd触媒の存在下においてカップリングさせ、保護基PGを酸性条件下で除去して式I
[式中、R1からR6及びYは請求項1に定義される通りである]の化合物を得て、望ましい場合には、得られた化合物を、薬学的に許容される塩に変換すること、又は
b)式II
[式中、R1及びR2は請求項1に定義される通りであり、PGは保護基である]の化合物を、ビス(ピナコラート)ジボロンと、塩基性条件下でPd触媒の存在下において反応させて式V
[式中、R1及びR2は請求項1に定義される通りであり、PGは保護基である]のボロン酸エステルを得て、化合物Vを塩基性条件下でPd触媒の存在下において式
[式中、R3からR6及びYは請求項1に定義される通りである]の臭化物とカップリングさせ、保護基PGを酸性条件下で除去して式I
[式中、R1からR6及びYは請求項1に定義される通りである]の化合物を得て、望ましい場合には、得られた化合物を、薬学的に許容される塩に変換すること
を含む方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN2014094181 | 2014-12-18 | ||
| CNPCT/CN2014/094181 | 2014-12-18 | ||
| PCT/EP2015/079679 WO2016096778A1 (en) | 2014-12-18 | 2015-12-15 | Benzazepine sulfonamide compounds |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2017538723A JP2017538723A (ja) | 2017-12-28 |
| JP6644792B2 true JP6644792B2 (ja) | 2020-02-12 |
Family
ID=55077477
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2017532712A Active JP6644792B2 (ja) | 2014-12-18 | 2015-12-15 | ベンザゼピンスルホンアミド化合物 |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US9890124B2 (ja) |
| EP (1) | EP3233835B1 (ja) |
| JP (1) | JP6644792B2 (ja) |
| CN (1) | CN107148417B (ja) |
| WO (1) | WO2016096778A1 (ja) |
Families Citing this family (58)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP6893501B2 (ja) | 2015-09-17 | 2021-06-23 | エフ・ホフマン−ラ・ロシュ・アクチェンゲゼルシャフト | スルフィニルフェニル又はスルホンイミドイルフェニルベンザゼピン |
| EP3464245B1 (en) | 2016-05-23 | 2020-10-14 | H. Hoffnabb-La Roche Ag | Benzazepine dicarboxamide compounds with tertiary amide function |
| WO2017202703A1 (en) | 2016-05-23 | 2017-11-30 | F. Hoffmann-La Roche Ag | Benzazepine dicarboxamide compounds with secondary amide function |
| WO2017216054A1 (en) | 2016-06-12 | 2017-12-21 | F. Hoffmann-La Roche Ag | Dihydropyrimidinyl benzazepine carboxamide compounds |
| SG11201903042VA (en) | 2016-10-14 | 2019-05-30 | Precision Biosciences Inc | Engineered meganucleases specific for recognition sequences in the hepatitis b virus genome |
| WO2018156297A1 (en) * | 2017-02-24 | 2018-08-30 | Taiwanj Pharmaceuticals Co., Ltd | Sulfonamide or amide compounds, compositions and methods for the prophylaxis and/or treatment of autoimmune, inflammation or infection related disorders |
| EP3595668B1 (en) | 2017-03-15 | 2021-07-21 | Silverback Therapeutics, Inc. | Benzazepine compounds, conjugates, and uses thereof |
| US11203610B2 (en) | 2017-12-20 | 2021-12-21 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 2′3′ cyclic dinucleotides with phosphonate bond activating the sting adaptor protein |
| WO2019123340A1 (en) | 2017-12-20 | 2019-06-27 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 3'3' cyclic dinucleotides with phosphonate bond activating the sting adaptor protein |
| CN111433201B (zh) * | 2017-12-21 | 2022-05-27 | 江苏恒瑞医药股份有限公司 | 苯并氮杂䓬衍生物、其制备方法及其在医药上的应用 |
| CN109956903B (zh) * | 2017-12-22 | 2022-08-23 | 江苏恒瑞医药股份有限公司 | 苯并氮杂䓬衍生物、其制备方法及其在医药上的应用 |
| CN111788204B (zh) | 2018-02-26 | 2023-05-05 | 吉利德科学公司 | 作为hbv复制抑制剂的取代吡咯嗪化合物 |
| WO2019195181A1 (en) | 2018-04-05 | 2019-10-10 | Gilead Sciences, Inc. | Antibodies and fragments thereof that bind hepatitis b virus protein x |
| TWI818007B (zh) | 2018-04-06 | 2023-10-11 | 捷克科學院有機化學與生物化學研究所 | 2'3'-環二核苷酸 |
| TWI833744B (zh) | 2018-04-06 | 2024-03-01 | 捷克科學院有機化學與生物化學研究所 | 3'3'-環二核苷酸 |
| TW202005654A (zh) | 2018-04-06 | 2020-02-01 | 捷克科學院有機化學與生物化學研究所 | 2,2,─環二核苷酸 |
| US11142750B2 (en) | 2018-04-12 | 2021-10-12 | Precision Biosciences, Inc. | Optimized engineered meganucleases having specificity for a recognition sequence in the Hepatitis B virus genome |
| US20190359645A1 (en) | 2018-05-03 | 2019-11-28 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 2'3'-cyclic dinucleotides comprising carbocyclic nucleotide |
| WO2020028097A1 (en) | 2018-08-01 | 2020-02-06 | Gilead Sciences, Inc. | Solid forms of (r)-11-(methoxymethyl)-12-(3-methoxypropoxy)-3,3-dimethyl-8-0x0-2,3,8,13b-tetrahydro-1h-pyrido[2,1-a]pyrrolo[1,2-c] phthalazine-7-c arboxylic acid |
| CN112638901A (zh) * | 2018-08-28 | 2021-04-09 | 豪夫迈·罗氏有限公司 | 用于治疗自身免疫性疾病的新型吡咯烷基酰胺化合物 |
| CN112654618A (zh) * | 2018-09-06 | 2021-04-13 | 豪夫迈·罗氏有限公司 | 用于治疗自身免疫性疾病的新型环脒化合物 |
| BR112021004590A2 (pt) | 2018-09-12 | 2021-05-25 | Silverback Therapeutics, Inc. | composições para o tratamento de doença com conjugados imunoestimuladores |
| EP3849971A2 (en) * | 2018-09-12 | 2021-07-21 | Silverback Therapeutics, Inc. | Substituted benzazepine compounds, conjugates, and uses thereof |
| CN117105933A (zh) | 2018-10-31 | 2023-11-24 | 吉利德科学公司 | 具有hpk1抑制活性的取代的6-氮杂苯并咪唑化合物 |
| LT3873903T (lt) | 2018-10-31 | 2024-05-10 | Gilead Sciences, Inc. | Pakeistieji 6-azabenzimidazolo junginiai, kaip hpk1 inhibitoriai |
| JP7287708B2 (ja) | 2019-02-08 | 2023-06-06 | プロジェニア インコーポレイテッド | Toll-like受容体7または8アゴニストとコレステロールの結合体およびその用途 |
| WO2020178768A1 (en) | 2019-03-07 | 2020-09-10 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 3'3'-cyclic dinucleotide analogue comprising a cyclopentanyl modified nucleotide as sting modulator |
| EP3935066A1 (en) | 2019-03-07 | 2022-01-12 | Institute of Organic Chemistry and Biochemistry ASCR, V.V.I. | 3'3'-cyclic dinucleotides and prodrugs thereof |
| CA3129022C (en) | 2019-03-07 | 2023-08-01 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 2'3'-cyclic dinucleotides and prodrugs thereof |
| TWI751516B (zh) | 2019-04-17 | 2022-01-01 | 美商基利科學股份有限公司 | 類鐸受體調節劑之固體形式 |
| TW202212339A (zh) | 2019-04-17 | 2022-04-01 | 美商基利科學股份有限公司 | 類鐸受體調節劑之固體形式 |
| TWI826690B (zh) | 2019-05-23 | 2023-12-21 | 美商基利科學股份有限公司 | 經取代之烯吲哚酮化物及其用途 |
| CA3143156A1 (en) * | 2019-06-13 | 2020-12-17 | Bolt Biotherapeutics, Inc. | Macromolecule-supported aminobenzazepine compounds |
| KR20220034784A (ko) * | 2019-06-13 | 2022-03-18 | 볼트 바이오테라퓨틱스 인코퍼레이티드 | 아미노벤즈아제핀 화합물, 면역접합체, 및 이의 용도 |
| BR112022002720A2 (pt) | 2019-08-15 | 2022-10-11 | Silverback Therapeutics Inc | Formulações de conjugados de benzazepinas e usos das mesmas |
| WO2021034804A1 (en) | 2019-08-19 | 2021-02-25 | Gilead Sciences, Inc. | Pharmaceutical formulations of tenofovir alafenamide |
| BR112022006001A2 (pt) * | 2019-09-30 | 2022-07-12 | Bolt Biotherapeutics Inc | Imunoconjugado, composto de 8-amido-2-aminobenzazepina-ligante, composto de 5-amino-pirazoloazepina-ligante, composto de aminoquinolina-ligante, uso de um imunoconjugado e métodos para tratar câncer e para preparar um imunoconjugado |
| CR20220129A (es) | 2019-09-30 | 2022-05-06 | Gilead Sciences Inc | Vacunas para vhb y métodos de tratamiento de vhb |
| CA3151322A1 (en) | 2019-10-01 | 2021-04-08 | Silverback Therapeutics, Inc. | Combination therapy with immune stimulatory conjugates |
| EP4069729B1 (en) | 2019-12-06 | 2025-01-22 | Precision BioSciences, Inc. | Optimized engineered meganucleases having specificity for a recognition sequence in the hepatitis b virus genome |
| US11179473B2 (en) | 2020-02-21 | 2021-11-23 | Silverback Therapeutics, Inc. | Nectin-4 antibody conjugates and uses thereof |
| US20230100429A1 (en) | 2020-03-02 | 2023-03-30 | Progeneer Inc. | Live-pathogen-mimetic nanoparticles based on pathogen cell wall skeleton, and production method thereof |
| TW202421168A (zh) | 2020-03-20 | 2024-06-01 | 美商基利科學股份有限公司 | 4’-c-經取代-2-鹵基-2’-去氧腺苷核苷之前藥及其製造與使用方法 |
| JP2023532304A (ja) | 2020-07-01 | 2023-07-27 | エーアールエス ファーマシューティカルズ オペレーションズ,インク. | 抗asgr1抗体コンジュゲートおよびその使用 |
| CN116056725A (zh) | 2020-08-04 | 2023-05-02 | 蛋白科技先鋒 | 活性位点暂时灭活的功能性药物与Toll样受体7或8激动剂的缀合物及其用途 |
| JP7690222B2 (ja) | 2020-08-04 | 2025-06-10 | プロジェニア インコーポレイテッド | 動力学的制御が可能なアジュバントを含むmRNAワクチン |
| US20230355750A1 (en) | 2020-08-04 | 2023-11-09 | Progeneer Inc. | Kinetically acting adjuvant ensemble |
| AU2022274607A1 (en) | 2021-05-13 | 2023-11-16 | Gilead Sciences, Inc. | COMBINATION OF A TLR8 MODULATING COMPOUND AND ANTI-HBV siRNA THERAPEUTICS |
| US11999733B2 (en) | 2021-06-23 | 2024-06-04 | Gilead Sciences, Inc. | Diacylglycerol kinase modulating compounds |
| AU2022299051B2 (en) | 2021-06-23 | 2025-03-13 | Gilead Sciences, Inc. | Diacylglyercol kinase modulating compounds |
| US11932634B2 (en) | 2021-06-23 | 2024-03-19 | Gilead Sciences, Inc. | Diacylglycerol kinase modulating compounds |
| US11926628B2 (en) | 2021-06-23 | 2024-03-12 | Gilead Sciences, Inc. | Diacylglyercol kinase modulating compounds |
| AU2023216955A1 (en) * | 2022-02-09 | 2024-09-12 | Bolt Biotherapeutics, Inc. | Macromolecule-supported 8-sulfonyl-benzazepine compounds and their uses |
| TW202339806A (zh) * | 2022-02-09 | 2023-10-16 | 美商博特生物治療公司 | 8—磺醯基—苯并氮呯免疫結合物及其用途 |
| WO2025240246A1 (en) | 2024-05-13 | 2025-11-20 | Gilead Sciences, Inc. | Combination therapies with ribavirin |
| WO2025240242A1 (en) | 2024-05-13 | 2025-11-20 | Gilead Sciences, Inc. | Combination therapies with ribavirin |
| US20250345390A1 (en) | 2024-05-13 | 2025-11-13 | Gilead Sciences, Inc. | Combination therapies |
| WO2025240243A1 (en) | 2024-05-13 | 2025-11-20 | Gilead Sciences, Inc. | Combination therapies with bulevirtide and an inhibitory nucleic acid targeting hepatitis b virus |
Family Cites Families (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB0400895D0 (en) * | 2004-01-15 | 2004-02-18 | Smithkline Beecham Corp | Chemical compounds |
| TW201402124A (zh) * | 2005-08-19 | 2014-01-16 | Array Biopharma Inc | 作為類鐸受體(toll-like receptor)調節劑之8-經取代苯并氮雜呯 |
| JP5600104B2 (ja) * | 2008-08-01 | 2014-10-01 | ベンティアールエックス ファーマシューティカルズ, インコーポレイテッド | Toll様受容体アゴニスト処方物およびその使用 |
| ES2705101T3 (es) * | 2008-11-06 | 2019-03-21 | Ventirx Pharmaceuticals Inc | Métodos de síntesis de derivados de benzazepinas |
| JP5756804B2 (ja) * | 2009-08-18 | 2015-07-29 | ベンティアールエックス ファーマシューティカルズ, インコーポレイテッドVentiRx Pharmaceuticals,Inc. | Toll様レセプターモジュレーターとしての置換ベンゾアゼピン |
| CA2771484C (en) * | 2009-08-18 | 2019-01-15 | Ventirx Pharmaceuticals, Inc. | Substituted benzoazepines as toll-like receptor modulators |
| BR112013007678A2 (pt) * | 2010-10-01 | 2017-07-04 | Ventirx Pharmaceuticals Inc | método para tratamento de doenças alérgicas |
| DK2663555T3 (en) * | 2011-01-12 | 2017-03-27 | Ventirx Pharmaceuticals Inc | SUBSTITUTED BENZOAZEPINS AS MODULATORS OF TOLL-LIKE RECEPTORS |
| PL2663550T3 (pl) * | 2011-01-12 | 2017-07-31 | Ventirx Pharmaceuticals, Inc. | Podstawione benzoazepiny jako modulatory receptora toll-podobnego |
| MY191185A (en) * | 2015-03-06 | 2022-06-04 | Hoffmann La Roche | Benzazepine dicarboxamide compounds |
| JP6893501B2 (ja) * | 2015-09-17 | 2021-06-23 | エフ・ホフマン−ラ・ロシュ・アクチェンゲゼルシャフト | スルフィニルフェニル又はスルホンイミドイルフェニルベンザゼピン |
-
2015
- 2015-12-15 EP EP15821033.6A patent/EP3233835B1/en active Active
- 2015-12-15 JP JP2017532712A patent/JP6644792B2/ja active Active
- 2015-12-15 CN CN201580068187.1A patent/CN107148417B/zh active Active
- 2015-12-15 WO PCT/EP2015/079679 patent/WO2016096778A1/en not_active Ceased
-
2017
- 2017-06-14 US US15/622,553 patent/US9890124B2/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| CN107148417A (zh) | 2017-09-08 |
| US9890124B2 (en) | 2018-02-13 |
| EP3233835B1 (en) | 2019-01-23 |
| HK1243701A1 (zh) | 2018-07-20 |
| WO2016096778A1 (en) | 2016-06-23 |
| JP2017538723A (ja) | 2017-12-28 |
| US20170275253A1 (en) | 2017-09-28 |
| CN107148417B (zh) | 2020-09-08 |
| EP3233835A1 (en) | 2017-10-25 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6644792B2 (ja) | ベンザゼピンスルホンアミド化合物 | |
| JP6893501B2 (ja) | スルフィニルフェニル又はスルホンイミドイルフェニルベンザゼピン | |
| CN109311854B (zh) | 具有仲酰胺官能团的苯并氮杂卓二甲酰胺化合物 | |
| JP6728208B2 (ja) | ベンザゼピンジカルボキサミド化合物 | |
| CA2938280C (en) | 4-amino-imidazoquinoline compounds | |
| TW202144345A (zh) | Kras突變蛋白抑制劑 | |
| US20220233513A1 (en) | Compound used as ret kinase inhibitor and application thereof | |
| AU2016382372B2 (en) | Sulfonamide derivative and preparation method and use thereof | |
| EP3313825A1 (en) | Glucose uptake inhibitors | |
| CN115703761A (zh) | 作为wwp1抑制剂的化合物及其应用 | |
| CN109641909A (zh) | 雷帕霉素信号通路抑制剂的机理靶标及其治疗应用 | |
| WO2020187292A1 (zh) | 2-取代吡唑氨基-4-取代氨基-5-嘧啶甲酰胺类化合物、组合物及其应用 | |
| JP2017532299A (ja) | Ftl3およびjakの阻害剤としての大環状n−アリール−2−アミノ−4−アリール−ピリミジンポリエーテルの誘導体 | |
| KR20250013158A (ko) | 하이드록시아미드 유도체 및 이의 용도 | |
| CN111217814B (zh) | 一类联哌啶衍生物及其作为抗肿瘤药物的应用 | |
| CN107056754B (zh) | 内嵌脲类结构的wnt通路抑制剂 | |
| HK1243701B (zh) | 苯并氮杂䓬磺酰胺化合物 | |
| HK40114306A (zh) | 多环类化合物及其用途 | |
| HK1255303A1 (en) | Sulfinylphenyl or sulfonimidoylphenyl benzazepines | |
| HK1255303B (en) | Sulfinylphenyl or sulfonimidoylphenyl benzazepines | |
| HK40003986A (en) | Benzazepine dicarboxamide compounds with secondary amide function | |
| HK40003986B (zh) | 具有仲酰胺官能团的苯并氮杂卓二甲酰胺化合物 | |
| TW201910325A (zh) | 吲哚衍生物及其用途 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20181214 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20190827 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20190829 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20191127 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20191210 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20200108 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6644792 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |