JP6571694B2 - 生体試料用の試料ホルダ - Google Patents
生体試料用の試料ホルダ Download PDFInfo
- Publication number
- JP6571694B2 JP6571694B2 JP2016575376A JP2016575376A JP6571694B2 JP 6571694 B2 JP6571694 B2 JP 6571694B2 JP 2016575376 A JP2016575376 A JP 2016575376A JP 2016575376 A JP2016575376 A JP 2016575376A JP 6571694 B2 JP6571694 B2 JP 6571694B2
- Authority
- JP
- Japan
- Prior art keywords
- sample holder
- sample
- tubular member
- container
- support structure
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 239000000523 sample Substances 0.000 title claims description 219
- 239000012472 biological sample Substances 0.000 title claims description 34
- 239000012530 fluid Substances 0.000 claims description 41
- 238000001574 biopsy Methods 0.000 claims description 39
- 239000003153 chemical reaction reagent Substances 0.000 claims description 37
- 238000000034 method Methods 0.000 claims description 32
- 238000000605 extraction Methods 0.000 claims description 29
- 238000012546 transfer Methods 0.000 claims description 28
- 239000000463 material Substances 0.000 claims description 26
- 238000010186 staining Methods 0.000 claims description 25
- 239000012528 membrane Substances 0.000 claims description 23
- 230000003287 optical effect Effects 0.000 claims description 16
- 238000007689 inspection Methods 0.000 claims description 13
- 239000007788 liquid Substances 0.000 claims description 8
- 239000003795 chemical substances by application Substances 0.000 claims description 6
- 239000000758 substrate Substances 0.000 claims description 6
- 239000012780 transparent material Substances 0.000 claims description 5
- 229920005597 polymer membrane Polymers 0.000 claims description 3
- 239000000284 extract Substances 0.000 claims description 2
- 239000008191 permeabilizing agent Substances 0.000 claims description 2
- 239000012459 cleaning agent Substances 0.000 claims 1
- 239000012466 permeate Substances 0.000 claims 1
- 238000012545 processing Methods 0.000 description 17
- 210000001519 tissue Anatomy 0.000 description 17
- 238000004458 analytical method Methods 0.000 description 16
- 230000008901 benefit Effects 0.000 description 15
- 206010028980 Neoplasm Diseases 0.000 description 10
- 239000011148 porous material Substances 0.000 description 10
- 238000002405 diagnostic procedure Methods 0.000 description 9
- 238000001914 filtration Methods 0.000 description 9
- 239000012510 hollow fiber Substances 0.000 description 9
- 201000011510 cancer Diseases 0.000 description 8
- 210000004027 cell Anatomy 0.000 description 8
- 238000005520 cutting process Methods 0.000 description 6
- 238000013461 design Methods 0.000 description 6
- 238000003745 diagnosis Methods 0.000 description 6
- 230000035699 permeability Effects 0.000 description 5
- 238000005191 phase separation Methods 0.000 description 5
- 230000008569 process Effects 0.000 description 5
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 4
- 238000009792 diffusion process Methods 0.000 description 4
- 239000012188 paraffin wax Substances 0.000 description 4
- 230000007170 pathology Effects 0.000 description 4
- 229910052710 silicon Inorganic materials 0.000 description 4
- 239000010703 silicon Substances 0.000 description 4
- 239000000243 solution Substances 0.000 description 4
- 238000012360 testing method Methods 0.000 description 4
- 238000013459 approach Methods 0.000 description 3
- 238000006243 chemical reaction Methods 0.000 description 3
- 230000001419 dependent effect Effects 0.000 description 3
- 230000007613 environmental effect Effects 0.000 description 3
- 238000011049 filling Methods 0.000 description 3
- 239000000834 fixative Substances 0.000 description 3
- 239000011521 glass Substances 0.000 description 3
- 238000007901 in situ hybridization Methods 0.000 description 3
- 238000000386 microscopy Methods 0.000 description 3
- 230000001575 pathological effect Effects 0.000 description 3
- 230000035515 penetration Effects 0.000 description 3
- 239000000725 suspension Substances 0.000 description 3
- 210000004881 tumor cell Anatomy 0.000 description 3
- 238000011179 visual inspection Methods 0.000 description 3
- 238000005406 washing Methods 0.000 description 3
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 2
- 239000000090 biomarker Substances 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- 201000010099 disease Diseases 0.000 description 2
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 2
- 238000001125 extrusion Methods 0.000 description 2
- 238000007710 freezing Methods 0.000 description 2
- 230000008014 freezing Effects 0.000 description 2
- 238000005286 illumination Methods 0.000 description 2
- 230000003834 intracellular effect Effects 0.000 description 2
- 230000033001 locomotion Effects 0.000 description 2
- 230000008823 permeabilization Effects 0.000 description 2
- 239000004417 polycarbonate Substances 0.000 description 2
- 229920000515 polycarbonate Polymers 0.000 description 2
- -1 polypropylene Polymers 0.000 description 2
- 108090000623 proteins and genes Proteins 0.000 description 2
- 238000012163 sequencing technique Methods 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 210000005239 tubule Anatomy 0.000 description 2
- 239000004593 Epoxy Substances 0.000 description 1
- 206010064571 Gene mutation Diseases 0.000 description 1
- 108091028043 Nucleic acid sequence Proteins 0.000 description 1
- 239000004952 Polyamide Substances 0.000 description 1
- 239000004642 Polyimide Substances 0.000 description 1
- 239000004743 Polypropylene Substances 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- 150000003926 acrylamides Chemical class 0.000 description 1
- 150000001252 acrylic acid derivatives Chemical class 0.000 description 1
- 230000006978 adaptation Effects 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- 230000001070 adhesive effect Effects 0.000 description 1
- 150000001336 alkenes Chemical class 0.000 description 1
- 150000001408 amides Chemical class 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 239000000427 antigen Substances 0.000 description 1
- 102000036639 antigens Human genes 0.000 description 1
- 108091007433 antigens Proteins 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 239000012620 biological material Substances 0.000 description 1
- 230000031018 biological processes and functions Effects 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- 238000000339 bright-field microscopy Methods 0.000 description 1
- 238000005266 casting Methods 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 239000000919 ceramic Substances 0.000 description 1
- 210000000349 chromosome Anatomy 0.000 description 1
- 238000004891 communication Methods 0.000 description 1
- 238000004624 confocal microscopy Methods 0.000 description 1
- 238000011109 contamination Methods 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 229920001577 copolymer Polymers 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 229920006037 cross link polymer Polymers 0.000 description 1
- 238000005138 cryopreservation Methods 0.000 description 1
- 238000012258 culturing Methods 0.000 description 1
- 150000001925 cycloalkenes Chemical class 0.000 description 1
- 230000002380 cytological effect Effects 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 238000011847 diagnostic investigation Methods 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 239000003814 drug Substances 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 239000013013 elastic material Substances 0.000 description 1
- 229920001971 elastomer Polymers 0.000 description 1
- 125000003700 epoxy group Chemical group 0.000 description 1
- 238000005530 etching Methods 0.000 description 1
- 238000000799 fluorescence microscopy Methods 0.000 description 1
- 238000004186 food analysis Methods 0.000 description 1
- 238000004374 forensic analysis Methods 0.000 description 1
- 238000009396 hybridization Methods 0.000 description 1
- 230000002055 immunohistochemical effect Effects 0.000 description 1
- 238000003364 immunohistochemistry Methods 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- 238000001746 injection moulding Methods 0.000 description 1
- 230000010354 integration Effects 0.000 description 1
- 230000000968 intestinal effect Effects 0.000 description 1
- 238000003475 lamination Methods 0.000 description 1
- 150000002734 metacrylic acid derivatives Chemical class 0.000 description 1
- 238000002493 microarray Methods 0.000 description 1
- 238000001053 micromoulding Methods 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 108020004707 nucleic acids Proteins 0.000 description 1
- 102000039446 nucleic acids Human genes 0.000 description 1
- 150000007523 nucleic acids Chemical class 0.000 description 1
- JRZJOMJEPLMPRA-UHFFFAOYSA-N olefin Natural products CCCCCCCC=C JRZJOMJEPLMPRA-UHFFFAOYSA-N 0.000 description 1
- 238000000399 optical microscopy Methods 0.000 description 1
- 229920003229 poly(methyl methacrylate) Polymers 0.000 description 1
- 229920002647 polyamide Polymers 0.000 description 1
- 229920000647 polyepoxide Polymers 0.000 description 1
- 229920000728 polyester Polymers 0.000 description 1
- 229920001721 polyimide Polymers 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 239000004926 polymethyl methacrylate Substances 0.000 description 1
- 229920001155 polypropylene Polymers 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- 229920002635 polyurethane Polymers 0.000 description 1
- 239000004814 polyurethane Substances 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 238000010791 quenching Methods 0.000 description 1
- 238000010107 reaction injection moulding Methods 0.000 description 1
- 238000003753 real-time PCR Methods 0.000 description 1
- 210000000664 rectum Anatomy 0.000 description 1
- 230000010076 replication Effects 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 238000005070 sampling Methods 0.000 description 1
- 238000007789 sealing Methods 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 229920002379 silicone rubber Polymers 0.000 description 1
- 239000004945 silicone rubber Substances 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 230000009870 specific binding Effects 0.000 description 1
- 210000005070 sphincter Anatomy 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 238000013517 stratification Methods 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 238000002626 targeted therapy Methods 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- 238000003856 thermoforming Methods 0.000 description 1
- 229920001169 thermoplastic Polymers 0.000 description 1
- 229920002725 thermoplastic elastomer Polymers 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 150000003673 urethanes Chemical class 0.000 description 1
Images
Classifications
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N1/00—Sampling; Preparing specimens for investigation
- G01N1/02—Devices for withdrawing samples
- G01N1/04—Devices for withdrawing samples in the solid state, e.g. by cutting
- G01N1/08—Devices for withdrawing samples in the solid state, e.g. by cutting involving an extracting tool, e.g. core bit
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N1/00—Sampling; Preparing specimens for investigation
- G01N1/28—Preparing specimens for investigation including physical details of (bio-)chemical methods covered elsewhere, e.g. G01N33/50, C12Q
- G01N1/30—Staining; Impregnating ; Fixation; Dehydration; Multistep processes for preparing samples of tissue, cell or nucleic acid material and the like for analysis
- G01N1/31—Apparatus therefor
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B10/00—Other methods or instruments for diagnosis, e.g. instruments for taking a cell sample, for biopsy, for vaccination diagnosis; Sex determination; Ovulation-period determination; Throat striking implements
- A61B10/02—Instruments for taking cell samples or for biopsy
- A61B10/0233—Pointed or sharp biopsy instruments
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/10—Integrating sample preparation and analysis in single entity, e.g. lab-on-a-chip concept
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/16—Reagents, handling or storing thereof
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/06—Auxiliary integrated devices, integrated components
- B01L2300/0627—Sensor or part of a sensor is integrated
- B01L2300/0654—Lenses; Optical fibres
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/06—Auxiliary integrated devices, integrated components
- B01L2300/0681—Filter
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0832—Geometry, shape and general structure cylindrical, tube shaped
- B01L2300/0838—Capillaries
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0848—Specific forms of parts of containers
- B01L2300/0858—Side walls
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/12—Specific details about materials
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2400/00—Moving or stopping fluids
- B01L2400/04—Moving fluids with specific forces or mechanical means
- B01L2400/0403—Moving fluids with specific forces or mechanical means specific forces
- B01L2400/0406—Moving fluids with specific forces or mechanical means specific forces capillary forces
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2400/00—Moving or stopping fluids
- B01L2400/04—Moving fluids with specific forces or mechanical means
- B01L2400/0403—Moving fluids with specific forces or mechanical means specific forces
- B01L2400/0472—Diffusion
Description
Claims (17)
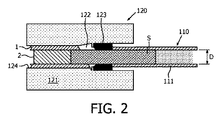
- 生検である生体試料のマイクロトミングを必要とせずに前記生体試料を検査するためのシステムであって、 試料ホルダと、少なくとも1つの補助部品とを含み、前記試料ホルダは、管状部材を含み、前記管状部材は、少なくとも部分的に透明材料からなり、前記少なくとも1つの補助部品の各々は、前記試料ホルダの前記管状部材の少なくとも一部に結合することができる支持構造を有し、 前記管状部材を構成する壁は、試薬を透過する領域を含むことを特徴とする、 システム。
- 前記管状部材は、0.2mm〜2mmの内径を有することを特徴とする、請求項1に記載のシステム。
- 前記管状部材は、少なくとも部分的に膜、又は多孔質高分子膜からなる、及び/又は、前記管状部材は、前記管状部材の前記壁に形成される流体チャネルを含み、前記管状部材内の試料は、前記流体チャネルを通じてアクセス可能であることを特徴とする、請求項1又は2に記載のシステム。
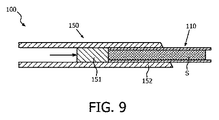
- 前記少なくとも1つの補助部品のうちの少なくとも1つは、コア針である抽出デバイスから前記試料ホルダに試料を移送する移送デバイスであり、該移送デバイスは、前記試料ホルダを接続可能な第1の端部と、前記抽出デバイスを接続可能な第2の端部とを備える、移送チャネルを含み、又は、 当該システムは、被検体から試料を抽出する抽出デバイスを含み、前記少なくとも1つの補助部品のうちの少なくとも1つは、コア針である抽出デバイスから前記試料ホルダに試料を移送する移送デバイスであり、該移送デバイスは、前記試料ホルダを接続可能な第1の端と、前記抽出デバイスを接続可能な第2の端部とを備える、移送チャネルを含むことを特徴とする、 請求項1乃至3のうちのいずれか1項に記載のシステム。
- 前記少なくとも1つの補助部品のうちの少なくとも1つは、被検体から前記生体試料を抽出する抽出デバイスであり、該抽出デバイスは、抽出された試料が前記試料ホルダにより取り込まれるように前記試料ホルダを収容する支持構造を有することを特徴とする、請求項1乃至3のうちのいずれか1項に記載のシステム。
- 前記少なくとも1つの補助部品のうちの少なくとも1つは、前記試料ホルダを交換可能に又は永久的に収容する支持構造を備える容器であることを特徴とする、請求項1乃至3のうちのいずれか1項に記載のシステム。
- 前記支持構造は、前記試料ホルダに対する前記移送デバイスの密閉接続を可能にすることを特徴とする、請求項4に記載のシステム。
- 前記試料ホルダ内の試料の画像を生成する光学装置を含むことを特徴とする、請求項1乃至7のうちのいずれか1項に記載のシステム。
- 前記少なくとも1つの補助部品のうちの少なくとも1つは、前記試料ホルダを交換可能に又は永久的に収容する支持構造を備える容器であり、前記試料ホルダは、前記容器に回転可能に収容され得る又は収容される、及び/又は、前記試料ホルダは、前記容器内で軸方向に移動可能であることを特徴とする、請求項1乃至8のいずれか1項に記載のシステム。
- 前記少なくとも1つの補助部品のうちの少なくとも1つは、前記試料ホルダを交換可能に又は永久的に収容する支持構造を備える容器であり、前記容器の前記支持構造は、少なくとも部分的に流体で満たされる、並びに、前記流体に浸漬されている前記試料ホルダを取り込む、空洞を定めることを特徴とする、請求項1乃至9のいずれか1項に記載のシステム。
- 前記少なくとも1つの補助部品のうちの少なくとも1つは、前記試料ホルダを交換可能に又は永久的に収容する支持構造を有する容器であり、該容器は、前記試料ホルダの前記管状部材の形状を有する穴を定める支持構造を備える基板を含むことを特徴とする、請求項1乃至10のいずれか1項に記載のシステム。
- 前記少なくとも1つの補助部品のうちの少なくとも1つは、前記試料ホルダを交換可能に又は永久的に収容する支持構造を備える容器であり、該容器は、前記試料ホルダの前記管状部材の周りの流体の流れを制御する流体系を含むことを特徴とする、請求項1乃至11のいずれか1項に記載のシステム。
- 試薬を透過する前記管状部材の前記壁の前記領域は、複数の開口又は孔を含む、請求項1乃至12のうちのいずれか1項に記載のシステム。
- 前記管状部材の前記壁は、光学的に透過性の膜材料で作られる、請求項1乃至13のうちのいずれか1項に記載のシステム。
- 生検である生体試料のマイクロトミングを必要とせずに前記生体試料を検査するための方法であって、 管状部材を有する試料ホルダに生体試料を移送するステップであって、前記管状部材は、少なくとも局所的に透明である壁を備え、該壁は、該壁が液体を透過する領域を含み、前記管状部材は、少なくとも部分的に透明材料からなる、ステップと、 少なくとも1つの試薬が前記管状部材内の前記生体試料に到達できるように、前記試料ホルダを液体である少なくとも1つの試薬に暴露するステップとを含む、 方法。
- 前記試料ホルダ内の前記生体試料の光学的検査を行うステップと、 前記試料ホルダから前記生体試料の関心領域を抽出するステップとのうちの少なくとも1つをさらに含むことを特徴とする、請求項15に記載の方法。
- 前記試薬は、固定剤、透過化剤、洗浄剤、アンチクエンチング剤、及び/又は染色剤を含むことを特徴とする、請求項15又は16に記載の方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP14175012.5 | 2014-06-30 | ||
| EP14175012 | 2014-06-30 | ||
| PCT/EP2015/064677 WO2016001126A1 (en) | 2014-06-30 | 2015-06-29 | Sample holder for biological samples |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2017524923A JP2017524923A (ja) | 2017-08-31 |
| JP2017524923A5 JP2017524923A5 (ja) | 2018-09-27 |
| JP6571694B2 true JP6571694B2 (ja) | 2019-09-04 |
Family
ID=51014221
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016575376A Active JP6571694B2 (ja) | 2014-06-30 | 2015-06-29 | 生体試料用の試料ホルダ |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US11513038B2 (ja) |
| EP (1) | EP3160644B1 (ja) |
| JP (1) | JP6571694B2 (ja) |
| CN (1) | CN106536054B (ja) |
| MX (1) | MX2016016469A (ja) |
| RU (1) | RU2686937C2 (ja) |
| TR (1) | TR201910628T4 (ja) |
| WO (1) | WO2016001126A1 (ja) |
Families Citing this family (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP3435759B1 (en) * | 2016-03-31 | 2021-04-21 | Snpshot Trustee Limited | Apparatus for sampling |
| EP3372981A1 (en) | 2017-03-10 | 2018-09-12 | Koninklijke Philips N.V. | Device for processing 3d biopsy tissue |
| EP3611695A1 (en) * | 2018-08-15 | 2020-02-19 | Koninklijke Philips N.V. | Generating annotation data of tissue images |
| DE102019121541B4 (de) * | 2019-08-09 | 2021-07-01 | Schott Ag | Aufnahme zum sterilen Halten eines Sensors für einen Bioreaktor sowie Bioreaktor mit Aufnahme zum sterilen Halten eines Sensors und Verfahren zur Vermehrung oder Kultivierung biologischen Materials |
| CN112221544B (zh) * | 2020-09-27 | 2022-06-17 | 北京理工大学重庆创新中心 | 一种集采样与检测一体化的微流控芯片 |
Family Cites Families (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3498909A (en) * | 1966-12-29 | 1970-03-03 | Mc Donnell Douglas Corp | Desalination apparatus and process |
| US3634651A (en) * | 1970-12-04 | 1972-01-11 | Becton Dickinson Co | Serological incubator |
| US4966707A (en) * | 1986-05-13 | 1990-10-30 | Celanese Corporation | Liquid/liquid extractions with microporous membranes |
| GB9409360D0 (en) * | 1994-05-11 | 1994-06-29 | Peas And Beans Limited | Improvements in or relating to gas collection |
| GB9426251D0 (en) * | 1994-12-24 | 1995-02-22 | Fsm Technologies Ltd | Device |
| JP3049537B2 (ja) | 1995-02-03 | 2000-06-05 | 悌二 竹崎 | 生検試料の定着支持方法とその定着支持剤及び包埋カセット |
| DE59805560D1 (de) * | 1997-01-13 | 2002-10-24 | Daniel Studer | Probenhalter für wasserhaltige Proben sowie Verfahren zu deren Verwendung |
| US7799521B2 (en) * | 1998-06-24 | 2010-09-21 | Chen & Chen, Llc | Thermal cycling |
| EP1169630B1 (en) | 1999-02-17 | 2017-02-01 | Lucid, Inc. | Cassette for facilitating optical sectioning of a retained tissue specimen |
| IT1305303B1 (it) | 1999-03-10 | 2001-05-04 | Farmigea Spa | Uso dell'olio essenziale di niaouli come promotore per la permeazionetransdermica. |
| DE10054621A1 (de) * | 1999-11-19 | 2001-05-23 | Leica Mikrosysteme Ag Wien | Biopsienadel |
| JP2002214093A (ja) | 2001-01-22 | 2002-07-31 | Murazumi Kogyo Kk | 医療検査用カセット |
| JP4058709B2 (ja) * | 2001-04-03 | 2008-03-12 | 悌二 竹崎 | 病理組織試料用カセットとそれを用いた包埋ブロックの成形方法 |
| JP4280690B2 (ja) | 2004-08-06 | 2009-06-17 | 社団法人 家畜改良事業団 | サンプル容器およびサンプル容器用圧着装置 |
| FR2878426B1 (fr) | 2004-11-30 | 2007-03-02 | Eric Peltier | Flacon de preparation d'une suspension cytologique |
| US8283134B2 (en) | 2005-12-27 | 2012-10-09 | Kyoto University | Cassette for fixing, embedding and slicing biological tissues and method of using the cassette |
| RU2298798C1 (ru) * | 2006-01-17 | 2007-05-10 | Общество с ограниченной ответственностью "Биочип-Аналитика" (ООО "Биочип-Аналитика") | Способ контроля биологической пробы в реакции латекс-агглютинации и аналитическая система для его осуществления |
| US20070163942A1 (en) | 2006-01-19 | 2007-07-19 | Toray Industries, Inc. | Hollow fiber membrane module |
| WO2010048208A1 (en) * | 2008-10-20 | 2010-04-29 | Spine View, Inc. | Retractor cannula system for accessing and visualizing spine and related methods |
| US7869049B2 (en) | 2009-05-06 | 2011-01-11 | Ut-Battelle, Llc | Determining biological tissue optical properties via integrating sphere spatial measurements |
-
2015
- 2015-06-29 JP JP2016575376A patent/JP6571694B2/ja active Active
- 2015-06-29 EP EP15734108.2A patent/EP3160644B1/en active Active
- 2015-06-29 TR TR2019/10628T patent/TR201910628T4/tr unknown
- 2015-06-29 WO PCT/EP2015/064677 patent/WO2016001126A1/en active Application Filing
- 2015-06-29 US US15/322,495 patent/US11513038B2/en active Active
- 2015-06-29 RU RU2017102491A patent/RU2686937C2/ru active
- 2015-06-29 MX MX2016016469A patent/MX2016016469A/es unknown
- 2015-06-29 CN CN201580036102.1A patent/CN106536054B/zh active Active
Also Published As
| Publication number | Publication date |
|---|---|
| RU2017102491A3 (ja) | 2019-01-28 |
| RU2017102491A (ru) | 2018-07-30 |
| US11513038B2 (en) | 2022-11-29 |
| CN106536054B (zh) | 2020-04-28 |
| EP3160644A1 (en) | 2017-05-03 |
| CN106536054A (zh) | 2017-03-22 |
| RU2686937C2 (ru) | 2019-05-06 |
| MX2016016469A (es) | 2017-04-10 |
| EP3160644B1 (en) | 2019-05-08 |
| WO2016001126A1 (en) | 2016-01-07 |
| US20170138822A1 (en) | 2017-05-18 |
| JP2017524923A (ja) | 2017-08-31 |
| TR201910628T4 (tr) | 2019-08-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6571694B2 (ja) | 生体試料用の試料ホルダ | |
| CN102165303B (zh) | 生物粒子捕集设备及其用途 | |
| US10168259B2 (en) | Microfluidic devices, systems, and methods for imaging tissue samples | |
| US8048669B2 (en) | Method and apparatus for preparing cells for microtome sectioning and archiving nucleic acids and proteins | |
| US20090311717A1 (en) | Microfluidic chip design comprising capillaries | |
| PT1563055E (pt) | Método de dispositivo para rápido embebimento do blocos de células | |
| US20140329300A1 (en) | Device for analyzing a sample and method of using the same | |
| JP2005300528A (ja) | 検体の検査方法に使用する分析要素。 | |
| CN111033238A (zh) | 定量的液体活检诊断系统与方法 | |
| JP2006038525A (ja) | 液体濾過器具及び乾式分析素子 | |
| WO2017087703A1 (en) | Sample processing and smearing apparatus and methods | |
| US20210252518A1 (en) | Biological sample holder and handler | |
| JP2013088387A (ja) | 標本作成方法および標本作成装置 | |
| US11555765B2 (en) | Tissue chamber | |
| KR101808044B1 (ko) | 이동식 혈중세포 검사장치 | |
| WO2013172796A2 (en) | Coverslip processor for staining of specimens on coverslips and method for staining of specimens on coverslips |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| RD03 | Notification of appointment of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7423 Effective date: 20170310 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20170420 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20180627 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180820 |
|
| A871 | Explanation of circumstances concerning accelerated examination |
Free format text: JAPANESE INTERMEDIATE CODE: A871 Effective date: 20180820 |
|
| A975 | Report on accelerated examination |
Free format text: JAPANESE INTERMEDIATE CODE: A971005 Effective date: 20180914 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20180925 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20181219 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20190226 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190513 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20190716 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20190808 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6571694 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |