JP6427552B2 - フラビウイルス中和抗体およびその使用方法 - Google Patents
フラビウイルス中和抗体およびその使用方法 Download PDFInfo
- Publication number
- JP6427552B2 JP6427552B2 JP2016502756A JP2016502756A JP6427552B2 JP 6427552 B2 JP6427552 B2 JP 6427552B2 JP 2016502756 A JP2016502756 A JP 2016502756A JP 2016502756 A JP2016502756 A JP 2016502756A JP 6427552 B2 JP6427552 B2 JP 6427552B2
- Authority
- JP
- Japan
- Prior art keywords
- antibody
- flavivirus
- seq
- antibodies
- virus
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/08—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from viruses
- C07K16/10—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from viruses from RNA viruses
- C07K16/1081—Togaviridae, e.g. flavivirus, rubella virus, hog cholera virus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
- A61P29/02—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID] without antiinflammatory effect
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/545—Medicinal preparations containing antigens or antibodies characterised by the dose, timing or administration schedule
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
- C07K2317/524—CH2 domain
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/71—Decreased effector function due to an Fc-modification
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2770/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses positive-sense
- C12N2770/00011—Details
- C12N2770/24011—Flaviviridae
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Virology (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Immunology (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Molecular Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biochemistry (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Communicable Diseases (AREA)
- Oncology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Epidemiology (AREA)
- Mycology (AREA)
- Microbiology (AREA)
- Pain & Pain Management (AREA)
- Rheumatology (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Description
本願は2013年3月15日に出願された米国特許出願第61/792,336号の恩典および同出願への優先権を主張し、同出願の内容は参照により本明細書にその全文が組み入れられる。
本発明は、概して、フラビウイルス中和抗体ならびにその使用方法に関する。
本発明は、米国国立衛生研究所によって交付されたAI0703431の下、政府の支援を受けてなされた。米国政府は本発明に一定の権利を有する。
ウエストナイルウイルスやデングウイルスなどのフラビウイルスは地球規模の健康に著しい脅威を与える。ウエストナイルウイルスは複数の種に致命的な髄膜炎または脳炎をもたらしうる熱病の原因になる。鳥と蚊はどちらもウエストナイルウイルスを運ぶことができ、そのことが世界的に驚くべきペースでのこのウイルスの伝播を可能にしてきた。同様に、デングウイルスの4つの血清型も蚊咬傷を介した伝染が可能であり、毎年、500,000例の入院と20,000例の死亡とを含む何千万例というデング熱のヒト症例の原因になり、マラリアに匹敵する経済的負担を伴う。
を、CDR2がアミノ酸配列
を、かつCDR3がアミノ酸配列
をそれぞれ含む、3つのCDRを持つ重鎖と、CDR1がアミノ酸配列
を、CDR2がアミノ酸配列
を、かつCDR3がアミノ酸配列
をそれぞれ含む、3つのCDRを持つ軽鎖とを有する、単離されたヒト化モノクローナル抗体を提供する。本抗体は、Fcγ受容体に結合しないように改変されたFc領域を有し、フラビウイルスに結合する。例示的なFc領域を本明細書において開示する。
a.アミノ酸配列
をそれぞれ含む3つのCDRを持つ、重鎖と、
b.アミノ酸配列
をそれぞれ含む3つのCDRを持つ、軽鎖と、
c. Fcγ受容体に結合しないように改変されたFc領域と
を含み、かつフラビウイルスに結合する、単離されたヒト化モノクローナル抗体。
[本発明1002]
SEQ ID NO: 1を有するV H アミノ酸配列と、SEQ ID NO: 3を有するV L アミノ酸配列と、Fcγ受容体に結合しないように改変されたFc領域とを含み、かつフラビウイルスに結合する、単離されたヒト化モノクローナル抗体。
[本発明1003]
SEQ ID NO: 2を有するV H ヌクレオチド配列と、SEQ ID NO: 4を有するV L ヌクレオチド配列と、Fcγ受容体に結合しないように改変されたFc領域とを含み、かつフラビウイルスに結合する、単離されたヒト化モノクローナル抗体。
[本発明1004]
フラビウイルス感染の抗体依存性増強に寄与しない、前記本発明のいずれかの抗体。
[本発明1005]
フラビウイルスを中和する、前記本発明のいずれかの抗体。
[本発明1006]
Fc領域がアミノ酸位置234および235に変異を含有する、前記本発明のいずれかの抗体。
[本発明1007]
変異がL234AおよびL235Aである、本発明1006の抗体。
[本発明1008]
Fc領域がSEQ ID NO: 7またはSEQ ID NO: 13のアミノ酸配列を含む、本発明1006の抗体。
[本発明1009]
改変されたFc領域が新生児型Fc受容体に結合する、前記本発明のいずれかの抗体。
[本発明1010]
フラビウイルスが、ウエストナイルウイルス、デングウイルス(血清型1〜4)、セントルイス脳炎ウイルス、黄熱ウイルス、日本脳炎ウイルス、およびマレー渓谷脳炎ウイルスである、前記本発明のいずれかの抗体。
[本発明1011]
植物において産生される、前記本発明のいずれかの抗体。
[本発明1012]
治療用作用物質に連結されている、前記本発明のいずれかの抗体。
[本発明1013]
前記治療用作用物質が、毒素、放射性標識、siRNA、小分子、またはサイトカインである、本発明1012の抗体。
[本発明1014]
前記サイトカインがTGF-βである、本発明1013の抗体。
[本発明1015]
前記本発明のいずれかの抗体を産生する、細胞。
[本発明1016]
対象に本発明1001〜1014のいずれかの抗体を投与する工程を含む、フラビウイルス感染の抗体依存性増強を防止する方法。
[本発明1017]
前記抗体がフラビウイルスによる初回感染後に投与される、本発明1016の方法。
[本発明1018]
本発明1001〜1013のいずれかの抗体とワクチンとを対象に投与する工程を含む、ワクチン効率を増加させる方法。
[本発明1019]
前記抗体と前記ワクチンが逐次的にまたは同時に投与される、本発明1018の方法。
[本発明1020]
前記ワクチンがウイルスワクチンである、本発明1018の方法。
[本発明1021]
フラビウイルス感染の症状を処置または軽減する方法であって、その必要がある対象に本発明1001〜1014のいずれかの抗体を含む組成物を投与する工程を含む、方法。
[本発明1022]
フラビウイルス感染の1つまたは複数の症状の発症を遅延させる方法であって、その必要がある対象に本発明1001〜1014のいずれかの抗体を含む組成物を投与する工程を含む、方法。
[本発明1023]
抗ウイルス剤を投与する工程をさらに含む、本発明1021または1022の方法。
[本発明1024]
抗ウイルス剤が、抗体、治療用作用物質に連結された抗体、または小分子である、本発明1023の方法。
[本発明1025]
前記抗体と抗ウイルス剤が逐次的にまたは同時に投与される、本発明1023の方法。
[本発明1026]
前記1つまたは複数の症状が、体重減少、麻痺、発熱、頭痛、悪心、嘔吐、発疹、および身体痛を含む、本発明1021〜1025のいずれかの方法。
[本発明1027]
前記フラビウイルスが、ウエストナイルウイルス、デングウイルス(血清型1〜4)、セントルイス脳炎ウイルス、黄熱ウイルス、日本脳炎ウイルス、またはマレー渓谷脳炎ウイルスである、本発明1001〜1026のいずれかの方法。
[本発明1028]
SEQ ID NO: 2、4および8の核酸配列を含む、核酸配列。
[本発明1029]
SEQ ID NO: 1、3および7または13を含むポリペプチドをコードする、核酸配列。
[本発明1030]
SEQ ID NO: 1、3および7または13を含むアミノ酸配列を含む、ポリペプチド。
[本発明1031]
本発明1028および1029の核酸を含む、ベクター。
[本発明1032]
本発明1031のベクターを含む、細胞。
[本発明1033]
植物細胞である、本発明1015または1032の細胞。
本発明の他の特徴および利点は、以下の詳細な説明および添付の特許請求の範囲から明らかになり、以下の詳細な説明および添付の特許請求の範囲に包含される。
本発明は、ウイルス感染の抗体依存性増強に寄与することなく、フラビウイルス科のメンバーによる感染を中和する抗体を提供する。ウエストナイルウイルスに結合してウエストナイルウイルスを中和する抗体は国際公開WO2005/123774に記載されており、その内容は参照により本明細書にその全文が組み入れられる。本発明の抗体は、抗体のFc領域がFc-ガンマ受容体に結合しないように、ウエストナイルウイルスに対する抗体mAb11を改変することによって作製された。したがって本改変抗体は、感染の抗体依存性増強に寄与しない。本明細書において開示する抗体および方法は、この抗体と、フラビウイルスによる感染ならびに関連する疾患および障害を処置または防止するための方法とに関係する。本発明の抗体mAB11-LALAは、本明細書において説明し、実施例において実証するとおり、フラビウイルス感染を防止し処置する能力が、野生型mAb11と比較して増加していた。
本明細書において使用する用語「抗体」は、免疫グロブリン分子および免疫グロブリン(Ig)分子の免疫学的に活性な部分、すなわち、抗原に特異的に結合する(抗原と免疫反応する)抗原結合部位を含有する分子を指す。「に特異的に結合する」または「と免疫反応する」とは、抗体が、所望の抗原の1つまたは複数の抗原決定基と反応し、他のポリペプチドとは反応しないことを意味する。抗体には、ポリクローナル抗体、モノクローナル抗体、およびキメラ抗体が含まれるが、それらに限定されるわけではない。
所望の特異性を有する抗体をスクリーニングするための方法として、例えば限定するわけではないが、酵素結合免疫吸着アッセイ(ELISA)および当技術分野内で公知の他の免疫学的に媒介される技法が挙げられる。
本発明の抗体または作用物質(本明細書では「活性化合物」ともいう)ならびにその誘導体、フラグメント、アナログおよびホモログは、投与に適した薬学的組成物に組み入れることができる。そのような組成物は、典型的には、抗体または作用物質と、薬学的に許容される担体とを含む。本明細書において使用する用語「薬学的に許容される担体」は、薬学的投与と適合するありとあらゆる溶媒、分散媒、コーティング、抗細菌剤および抗真菌剤、等張化剤および吸収遅延剤などを包含するものとする。適切な担体は、この分野における標準的参考書であるRemington's Pharmaceutical Sciencesの最新版に記載されており、この文献は参照により本明細書に組み入れられる。そのような担体または希釈剤の好ましい例として、水、食塩水、リンゲル液、デキストロース溶液、および5%ヒト血清アルブミンが挙げられるが、それらに限定されるわけではない。リポソームおよび固定油などの非水性媒体も使用することができる。薬学的に活性な物質のためのそのような媒質および作用物質の使用は、当技術分野において周知である。従来の媒質または作用物質は、それらが活性化合物と不適合でない限り、本組成物における使用が考えられる。補助活性化合物も組成物に組み入れることができる。
本発明は、調整因子、すなわちフラビウイルスと細胞膜との融合を調整するかまたは他の形で妨害する候補化合物もしくは試験化合物または候補作用物質もしくは試験作用物質(例えばペプチド、ペプチドミメティック、小分子または他の薬物)を同定するための方法(本明細書では「スクリーニングアッセイ」ともいう)を提供する。フラビウイルス感染を処置するのに有用な化合物を同定する方法も提供する。本発明は、本明細書に記載するスクリーニングアッセイを使って同定された化合物も包含する。
本発明の抗体は、例えば従来型のイムノアッセイなど、適当なアッセイによって検出することができる。例えば、フラビウイルスエンベロープタンパク質(例えばウエストナイルウイルスタンパク質E)またはそのフラグメントを固相に固定するアッセイを行うことができる。試料中の抗体が固相上の固定化されたポリペプチドに結合することを可能にするのに十分な時間にわたって、インキュベーションを維持する。この第1インキュベーションの後、固相を試料から分離する。未結合の材料と妨害物質、例えば試料中に同様に存在しうる非特異的タンパク質とを除去するために、固相を洗浄する。次に、固定化ポリペプチドに結合した関心対象の抗体を含有する固相を、第2の標識抗体またはビオチンもしくはアビジンなどのカップリング剤に結合した抗体と共にインキュベートする。この第2抗体は、もう一つの抗フラビウイルス抗体またはもう一つの抗体であることができる。抗体用の標識は当技術分野において周知であり、放射性核種、酵素(例えばマレイン酸デヒドロゲナーゼ、セイヨウワサビペルオキシダーゼ、グルコースオキシダーゼ、カタラーゼ)、蛍光物質(フルオレセインイソチオシアネート、ローダミン、フィコシアニン、フルオレスカミン(fluorescarmine))、ビオチンなどが挙げられる。標識抗体を固相と共にインキュベートし、固相に結合した標識を測定する。これらのイムノアッセイおよび他のイムノアッセイは、当業者であれば容易に行うことができる。
受動免疫化は、ウイルス疾患の予防および処置にとって有効で安全な戦略であることが判明している(Keller et al., Clin. Microbiol. Rev. 13:602-14(2000);Casadevall, Nat. Biotechnol. 20:114(2002);Shibata et al, Nat. Med. 5:204-10(1999);およびIgarashi et al., Nat. Med. 5:211-16(1999)参照;これらはそれぞれ参照により本明細書に組み入れられる)。中和ヒトモノクローナル抗体を使った受動免疫化は、フラビウイルス感染ならびに関連疾患および関連障害の緊急予防および緊急処置のための応急処置戦略になりうる。また同時に、これに代わる、もっと時間の掛かるワクチンおよび新薬の開発も進行中である。
免疫系に抗原決定基を効率よく提示するための足場として初めて抗体が使用されてから10年以上が経つ(Zanetti, Nature 355:476-77(1992);Zaghouani et al, Proc. Natl. Acad. Sci. USA 92:631-35(1995))。ペプチドは、IgG分子の不可分の一部として含まれ(例えば本明細書に記載の11Aまたは256IgG1モノクローナル抗体)、ペプチドエピトープの抗原性および免疫原性は遊離のペプチドと比較して著しく強化される。そのような強化は、おそらく、抗原-IgGキメラの長い半減期、より良い提示、およびそれぞれの自然の構造を模倣する束縛されたコンフォメーションによるのであろう。
DNAワクチンは安定であり、抗原に天然のプロセシングを受ける機会を与え、より長時間持続する応答を誘導することができる。DNAワクチンは、非常に魅力的な免疫化戦略であるものの、免疫応答を誘導するその潜在能力は著しく制限されることが多い。注入されたDNAが樹状細胞(DC)などのプロフェッショナルAPCによってあまり取り込まれないことが、そのような制限の主な原因であるだろう。抗原-Igキメラワクチンと組み合わせることで、APC抗原提示の強化に基づく前途有望な新しいDNAワクチン戦略が報告されており(Casares, et al, Viral Immunol. 10:129-36(1997);Gerloni et al, Nat. Biotech. 15:876-81(1997);Gerloni et al, DNA Cell Biol. 16:611-25(1997);You et al, Cancer Res. 61:3704-11(2001)参照)、これは、DCの表面にFc受容体(FcγR)が存在することを利用している。
一般に1種または複数種のモノクローナル抗体またはscFvの混合物およびそれらの組み合わせを含む治療用または予防用組成物が、ここに提供される。予防用ワクチンはフラビウイルス感染を防止するために使用することができ、治療用ワクチンはフラビウイルス感染後に個体を処置するために使用することができる。予防的使用には、ワクチン接種対象におけるフラビウイルスに対する抗体価を増加させることが含まれる。このようにして、フラビウイルスと接触するリスクが高い対象(すなわちウイルスを保因している蚊が生育している亜熱帯地域にいる対象)に、フラビウイルスに対する受動免疫を提供することができる。
本発明のワクチンは、他の抗ウイルスワクチンより優れた免疫防御特性および免疫治療特性を有する。
本発明は、フラビウイルス関連疾患またはフラビウイルス関連障害のリスクがある(または前記疾患もしくは障害にかかりやすい)対象を処置する予防的方法および治療的方法をどちらも提供する。そのような疾患または障害として、例えば発熱、髄膜炎、脳炎、黄熱、デング熱が挙げられるが、それらに限定されるわけではない。
一局面において、本発明は、本発明のモノクローナル抗体または本発明の方法に従って同定された作用物質を対象に投与することによって対象におけるフラビウイルス関連疾患またはフラビウイルス関連障害を防止するための方法を提供する。例えばモノクローナル抗体mAb-11、mAb11-LALA、およびその任意の変種であって、Fc領域が改変されることにより、Fc-ガンマ受容体への結合が低減または抑止されているものを、治療有効量で投与することができる。任意で、2種または3種以上の抗フラビウイルス抗体が同時投与される。
本発明のもう一つの局面は、患者におけるフラビウイルス関連疾患またはフラビウイルス関連障害を処置する方法に関する。一態様において、本方法は、フラビウイルスを中和する作用物質(例えば本明細書に記載するスクリーニングアッセイによって同定される作用物質および/または本発明の方法に従って同定されるモノクローナル抗体)または前記作用物質の組み合わせを、疾患または障害を患っている患者に投与する工程を伴う。
本発明は、2つまたは3つ以上の抗体、例えばmAb11-LALAまたはmAb11の変種であって、変種のFc領域がFcガンマ受容体に結合しないかFcガンマ受容体への結合が低減しているものを、当技術分野において公知の他のフラビウイルス中和抗体、例えばmAb11と共に投与することによる、患者におけるウエストナイル熱、髄膜炎、デング熱、黄熱または脳炎などのフラビウイルス関連疾患またはフラビウイルス関連障害の処置を提供する。もう一つの態様では、本発明は、本発明の抗体、例えば本明細書に記載するmAb11-LALAまたはmAb11変種を、当技術分野において公知の任意の抗ウイルス剤と共に投与することによって、患者におけるフラビウイルス関連疾患またはフラビウイルス関連障害を処置するための方法を提供する。抗ウイルス剤は、ペプチド、核酸、小分子、阻害剤、またはRNAiであることができる。
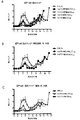
ここでは、マウスにおけるmAb11抗体(野生型と改変Fc領域を持つ変異型との両方)の投与の予防効果を調べる研究を説明する。この研究では40匹のマウスを評価し、その40匹を各8匹の5群に分割した。第1群では、マウスにアイソタイプ対照IgG対照抗体を投与した。第2群には250μg/マウス(約12.5mg/kg)の野生型mAb11を投与した。第3群には50μg/マウス(約2.5mg/kg)の野生型mAb11(wt mAb)を投与した。第4群には250μg/マウス(約12.5mg/kg)の、Fc領域にLALA変異を持つmAb11(mut mAb)を投与した。第5群には50μg/マウス(約2.5mg/kg)の、Fc領域にLALA変異を持つmAb11(mut mAb)を投与した。
本明細書において説明するように、本発明の抗体は、トランスジェニック植物において産生することができる。他の研究により、ヒトにおける処置のための投与に適したヒト化抗体が、植物中でうまく産生されることが示されている。さらにまた、植物における治療用抗体産生は哺乳動物細胞における抗体産生に代わる安価で効率のよい手段であり、そのうえ、動物病原性夾雑物も含まない。本発明のmAb11抗体(Fc領域にLALA変異を含有するもの;mutAb)の効力を調べるために、哺乳動物発現系から産生された抗体と植物(タバコ植物)から産生された抗体とをインビボで比較した。
本発明をその詳細な説明と共に記載したが、上記の説明は、本発明を例示しようとするものであって、添付の特許請求の範囲によって画定される本発明の範囲を限定する意図はない。他の局面、利点、および変更態様も、添付の特許請求の範囲の範囲内にある。
Claims (24)
- (i) アミノ酸配列
GYSTH (SEQ ID NO:21)、WDNPSSGDTTYAENFRG (SEQ ID NO:22)、およびGGDDYSFDH (SEQ ID NO:23)
をそれぞれ含む3つのCDRを持つ、重鎖と、
(ii) アミノ酸配列
RGDSLRSYYAS (SEQ ID NO:24)、GENNRPS (SEQ ID NO:25)、およびNSRDSSDHLLL (SEQ ID NO:26)
をそれぞれ含む3つのCDRを持つ、軽鎖と、
(iii) Fcγ受容体に結合しないように改変された、アミノ酸位置234および235に変異を有するFc領域と
を含む、単離されたヒト化モノクローナル抗体であって、
(a)変異がL234AおよびL235Aであり、位置234および235がSEQ ID NO: 20の位置240および241に対応し、かつ
(b)抗体がフラビウイルスに結合しかつそれを中和する、前記抗体。 - Fc領域がSEQ ID NO: 7またはSEQ ID NO: 13のアミノ酸配列を含む、請求項1記載の抗体。
- (i) アミノ酸配列
GYSTH (SEQ ID NO:21)、WDNPSSGDTTYAENFRG (SEQ ID NO:22)、およびGGDDYSFDH (SEQ ID NO:23)
をそれぞれ含む3つのCDRを持つ、重鎖と、
(ii) アミノ酸配列
RGDSLRSYYAS (SEQ ID NO:24)、GENNRPS (SEQ ID NO:25)、およびNSRDSSDHLLL (SEQ ID NO:26)
をそれぞれ含む3つのCDRを持つ、軽鎖と、
(iii) SEQ ID NO: 7またはSEQ ID NO: 13のアミノ酸配列を含むFc領域と
を含む、単離されたヒト化モノクローナル抗体であって、
フラビウイルスに結合しかつそれを中和する、前記抗体。 - フラビウイルス感染の抗体依存性増強に寄与しない、請求項1または3記載の抗体。
- 改変されたFc領域が新生児型Fc受容体に結合する、請求項1または3記載の抗体。
- フラビウイルスが、ウエストナイルウイルス、デングウイルス(血清型1〜4)、セントルイス脳炎ウイルス、黄熱ウイルス、日本脳炎ウイルス、またはマレー渓谷脳炎ウイルスである、請求項1または3記載の抗体。
- 植物において産生される、請求項1または3記載の抗体。
- 治療用作用物質に連結されている、請求項1または3記載の抗体。
- 前記治療用作用物質が、毒素、放射性標識、siRNA、小分子、またはサイトカインである、請求項8記載の抗体。
- 前記サイトカインがTGF-βである、請求項9記載の抗体。
- 請求項1記載の抗体を産生する、単離された細胞。
- 前記単離された細胞が植物細胞である、請求項11記載の単離された細胞。
- 請求項1または3抗体の有効量を含む、対象においてフラビウイルス感染の抗体依存性増強を低減させるための薬学的組成物。
- 前記抗体がフラビウイルスによる初回感染後に投与される、請求項13記載の薬学的組成物。
- 請求項1または3記載の抗体の有効量とワクチンを含む、対象においてワクチン効率を増加させるための薬学的組成物。
- 前記抗体と前記ワクチンが逐次的にまたは同時に投与される、請求項15記載の薬学的組成物。
- 前記ワクチンがウイルスワクチンである、請求項15記載の薬学的組成物。
- 請求項1または3記載の抗体を含む、その必要がある対象においてフラビウイルス感染の症状を処置または軽減するための薬学的組成物。
- 請求項1または3記載の抗体を含む、その必要がある対象においてフラビウイルス感染の1つまたは複数の症状の発症を遅延させるための薬学的組成物。
- 抗ウイルス剤と併用される、請求項18記載の薬学的組成物。
- 抗ウイルス剤が、抗体、治療用作用物質に連結された抗体、または小分子である、請求項20記載の薬学的組成物。
- 前記抗体と抗ウイルス剤が逐次的にまたは同時に投与される、請求項20記載の薬学的組成物。
- 前記1つまたは複数の症状が、体重減少、麻痺、発熱、頭痛、悪心、嘔吐、発疹、および身体痛を含む、請求項18記載の薬学的組成物。
- 前記フラビウイルスが、ウエストナイルウイルス、デングウイルス(血清型1〜4)、セントルイス脳炎ウイルス、黄熱ウイルス、日本脳炎ウイルス、またはマレー渓谷脳炎ウイルスである、請求項18記載の薬学的組成物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361792336P | 2013-03-15 | 2013-03-15 | |
| US61/792,336 | 2013-03-15 | ||
| PCT/US2014/028310 WO2014144061A2 (en) | 2013-03-15 | 2014-03-14 | Flavivirus neutralizing antibodies and methods of use thereof |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018202677A Division JP6734902B2 (ja) | 2013-03-15 | 2018-10-29 | フラビウイルス中和抗体およびその使用方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2016514675A JP2016514675A (ja) | 2016-05-23 |
| JP6427552B2 true JP6427552B2 (ja) | 2018-11-21 |
Family
ID=51538297
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016502756A Active JP6427552B2 (ja) | 2013-03-15 | 2014-03-14 | フラビウイルス中和抗体およびその使用方法 |
| JP2018202677A Active JP6734902B2 (ja) | 2013-03-15 | 2018-10-29 | フラビウイルス中和抗体およびその使用方法 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018202677A Active JP6734902B2 (ja) | 2013-03-15 | 2018-10-29 | フラビウイルス中和抗体およびその使用方法 |
Country Status (10)
| Country | Link |
|---|---|
| US (3) | US9822166B2 (ja) |
| EP (3) | EP2971042B1 (ja) |
| JP (2) | JP6427552B2 (ja) |
| AU (2) | AU2014227909C1 (ja) |
| BR (1) | BR112015021341B1 (ja) |
| CA (1) | CA2901358C (ja) |
| MX (2) | MX367668B (ja) |
| PH (1) | PH12015502164B1 (ja) |
| SG (1) | SG11201507359SA (ja) |
| WO (1) | WO2014144061A2 (ja) |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2971042B1 (en) * | 2013-03-15 | 2020-01-15 | Dana-Farber Cancer Institute, Inc. | Flavivirus neutralizing antibodies and methods of use thereof |
| RU2017125531A (ru) | 2014-12-19 | 2019-01-21 | Дана-Фарбер Кэнсер Инститьют, Инк. | Химерные антигенные рецепторы и способы их применения |
| WO2018010789A1 (en) * | 2016-07-13 | 2018-01-18 | Humabs Biomed Sa | Novel antibodies specifically binding to zika virus epitopes and uses thereof |
| EP3526257A2 (en) | 2016-10-14 | 2019-08-21 | Dana-Farber Cancer Institute, Inc. | Modular tetravalent bispecific antibody platform |
| GB201704126D0 (en) * | 2017-03-15 | 2017-04-26 | Blom Nihlén Kim Andrea | Vaccine |
| BR112020017296A2 (pt) * | 2018-03-01 | 2020-12-29 | Igm Biosciences, Inc. | Mutações de igm fc e de cadeia j que afetam a meia-vida sérica de igm |
| JP2021518104A (ja) | 2018-03-14 | 2021-08-02 | デイナ ファーバー キャンサー インスティチュート,インコーポレイテッド | 操作された細胞、t細胞免疫調節抗体、およびそれらの使用方法 |
| JP2021520854A (ja) * | 2018-04-11 | 2021-08-26 | タイチャン ピーティーイー.リミテッドTychan Pte.Ltd. | 黄熱を処置するための方法および組成物 |
| JP7471555B2 (ja) | 2020-02-20 | 2024-04-22 | 国立感染症研究所長 | フラビウイルス交差中和抗体及び医薬組成物 |
| RU2757488C1 (ru) * | 2020-11-10 | 2021-10-18 | Федеральное бюджетное учреждение науки "Государственный научный центр вирусологии и биотехнологии "Вектор" Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУН ГНЦ ВБ "Вектор" Роспотребнадзора) | Универсальный рекомбинантный вектор pBuc и плазмидная генетическая конструкция pBuc-7B4, обеспечивающая синтез и секрецию антитела 7В4 против вируса Западного Нила в клетках животных и полученная с использованием указанного вектора pBuc |
| CN116514963B (zh) * | 2023-04-21 | 2023-09-26 | 中国人民解放军军事科学院军事医学研究院 | 广谱识别黄病毒属病毒e蛋白的抗体fy2及其应用 |
Family Cites Families (35)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3773919A (en) | 1969-10-23 | 1973-11-20 | Du Pont | Polylactide-drug mixtures |
| FR2413974A1 (fr) | 1978-01-06 | 1979-08-03 | David Bernard | Sechoir pour feuilles imprimees par serigraphie |
| US4485045A (en) | 1981-07-06 | 1984-11-27 | Research Corporation | Synthetic phosphatidyl cholines useful in forming liposomes |
| US4522811A (en) | 1982-07-08 | 1985-06-11 | Syntex (U.S.A.) Inc. | Serial injection of muramyldipeptides and liposomes enhances the anti-infective activity of muramyldipeptides |
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| US4544545A (en) | 1983-06-20 | 1985-10-01 | Trustees University Of Massachusetts | Liposomes containing modified cholesterol for organ targeting |
| US4676980A (en) | 1985-09-23 | 1987-06-30 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Target specific cross-linked heteroantibodies |
| DE3788058T2 (de) | 1986-08-28 | 1994-04-21 | Teijin Ltd | Zelltoxischer antikörperkomplex und verfahren zu seiner herstellung. |
| US5223409A (en) | 1988-09-02 | 1993-06-29 | Protein Engineering Corp. | Directed evolution of novel binding proteins |
| GB8823869D0 (en) | 1988-10-12 | 1988-11-16 | Medical Res Council | Production of antibodies |
| AU641673B2 (en) | 1989-06-29 | 1993-09-30 | Medarex, Inc. | Bispecific reagents for aids therapy |
| US5013556A (en) | 1989-10-20 | 1991-05-07 | Liposome Technology, Inc. | Liposomes with enhanced circulation time |
| ATE356869T1 (de) | 1990-01-12 | 2007-04-15 | Amgen Fremont Inc | Bildung von xenogenen antikörpern |
| US5625126A (en) | 1990-08-29 | 1997-04-29 | Genpharm International, Inc. | Transgenic non-human animals for producing heterologous antibodies |
| CA2089661C (en) | 1990-08-29 | 2007-04-03 | Nils Lonberg | Transgenic non-human animals capable of producing heterologous antibodies |
| US5633425A (en) | 1990-08-29 | 1997-05-27 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| US5661016A (en) | 1990-08-29 | 1997-08-26 | Genpharm International Inc. | Transgenic non-human animals capable of producing heterologous antibodies of various isotypes |
| US5545806A (en) | 1990-08-29 | 1996-08-13 | Genpharm International, Inc. | Ransgenic non-human animals for producing heterologous antibodies |
| JPH06507398A (ja) | 1991-05-14 | 1994-08-25 | リプリジェン コーポレーション | Hiv感染治療のための異種複合抗体 |
| JPH06510115A (ja) | 1991-09-17 | 1994-11-10 | ユーロピアン エコノミック コミュニティー (イーイーシー) | X線励起下で表面を分光分析するための電子検出装置 |
| US5233409A (en) | 1992-02-25 | 1993-08-03 | Schwab Karl W | Color analysis of organic constituents in sedimentary rocks for thermal maturity |
| SG48760A1 (en) | 1992-07-24 | 2003-03-18 | Abgenix Inc | Generation of xenogenetic antibodies |
| EP1005870B1 (en) | 1992-11-13 | 2009-01-21 | Biogen Idec Inc. | Therapeutic application of chimeric antibodies to human B lymphocyte restricted differentiation antigen for treatment of B cell lymphoma |
| WO1995022618A1 (en) | 1994-02-22 | 1995-08-24 | Dana-Farber Cancer Institute | Nucleic acid delivery system, method of synthesis and uses thereof |
| ATE390933T1 (de) | 1995-04-27 | 2008-04-15 | Amgen Fremont Inc | Aus immunisierten xenomäusen stammende menschliche antikörper gegen il-8 |
| AU2466895A (en) | 1995-04-28 | 1996-11-18 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| US5916771A (en) | 1996-10-11 | 1999-06-29 | Abgenix, Inc. | Production of a multimeric protein by cell fusion method |
| US20020029391A1 (en) | 1998-04-15 | 2002-03-07 | Claude Geoffrey Davis | Epitope-driven human antibody production and gene expression profiling |
| UA89481C2 (uk) * | 2003-09-30 | 2010-02-10 | Центокор, Инк. | Еритропоетинові міметичні шарнірно-серцевинні міметитіла людини, композиції, способи та застосування |
| US20090130123A1 (en) | 2004-06-15 | 2009-05-21 | Erol Fikrig | Antibodies to west nile virus polypeptides |
| AU2009305113B2 (en) * | 2008-10-13 | 2015-07-16 | Institute For Research In Biomedicine | Dengue virus neutralizing antibodies and uses thereof |
| US20110165122A1 (en) * | 2009-11-10 | 2011-07-07 | The Regents Of The University Of California | Method for targeted and sustained antiviral therapy |
| KR20160044598A (ko) | 2011-03-29 | 2016-04-25 | 로슈 글리카트 아게 | 항체 Fc 변이체 |
| EP2971042B1 (en) * | 2013-03-15 | 2020-01-15 | Dana-Farber Cancer Institute, Inc. | Flavivirus neutralizing antibodies and methods of use thereof |
| US9111624B2 (en) | 2013-03-22 | 2015-08-18 | Katsuyuki Fujita | Semiconductor memory device |
-
2014
- 2014-03-14 EP EP14764455.3A patent/EP2971042B1/en active Active
- 2014-03-14 BR BR112015021341-3A patent/BR112015021341B1/pt active IP Right Grant
- 2014-03-14 WO PCT/US2014/028310 patent/WO2014144061A2/en not_active Ceased
- 2014-03-14 CA CA2901358A patent/CA2901358C/en active Active
- 2014-03-14 US US14/777,324 patent/US9822166B2/en active Active
- 2014-03-14 EP EP19213985.5A patent/EP3689902B1/en active Active
- 2014-03-14 AU AU2014227909A patent/AU2014227909C1/en active Active
- 2014-03-14 EP EP23181586.1A patent/EP4292657A3/en not_active Withdrawn
- 2014-03-14 SG SG11201507359SA patent/SG11201507359SA/en unknown
- 2014-03-14 JP JP2016502756A patent/JP6427552B2/ja active Active
- 2014-03-14 MX MX2015013232A patent/MX367668B/es active IP Right Grant
-
2015
- 2015-09-15 PH PH12015502164A patent/PH12015502164B1/en unknown
- 2015-09-15 MX MX2019010339A patent/MX2019010339A/es unknown
-
2017
- 2017-11-20 US US15/818,491 patent/US10400032B2/en active Active
-
2018
- 2018-06-06 AU AU2018204011A patent/AU2018204011C1/en active Active
- 2018-10-29 JP JP2018202677A patent/JP6734902B2/ja active Active
-
2019
- 2019-07-17 US US16/514,439 patent/US10899825B2/en active Active
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6734902B2 (ja) | フラビウイルス中和抗体およびその使用方法 | |
| US11505597B2 (en) | Middle east respiratory syndrome coronavirus neutralizing antibodies and methods of use thereof | |
| US7750123B2 (en) | Antibodies against SARS-CoV and methods of use thereof | |
| US20110159001A1 (en) | CROSS-NEUTRALIZING HUMAN MONOCLONAL ANTIBODIES TO SARS-CoV AND METHODS OF USE THEREOF | |
| WO2021212021A2 (en) | Coronavirus antibodies and methods of use thereof | |
| US20190276519A1 (en) | Immunogenetic restriction on elicitation of antibodies | |
| US20190233505A1 (en) | Methods of treating or preventing zika virus infection |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20160218 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20161215 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20171025 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20171106 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20180202 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180507 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20181001 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20181029 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6427552 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R157 | Certificate of patent or utility model (correction) |
Free format text: JAPANESE INTERMEDIATE CODE: R157 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |