JP6381445B2 - ニューロペプチドsレセプター(npsr)アンタゴニストの組成物および方法 - Google Patents
ニューロペプチドsレセプター(npsr)アンタゴニストの組成物および方法 Download PDFInfo
- Publication number
- JP6381445B2 JP6381445B2 JP2014546080A JP2014546080A JP6381445B2 JP 6381445 B2 JP6381445 B2 JP 6381445B2 JP 2014546080 A JP2014546080 A JP 2014546080A JP 2014546080 A JP2014546080 A JP 2014546080A JP 6381445 B2 JP6381445 B2 JP 6381445B2
- Authority
- JP
- Japan
- Prior art keywords
- phenyl
- tetrahydrofuro
- isobutyl
- pharmaceutical composition
- mmol
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 0 CI1=CC(C(SC2(*)*)=I)=C2C=*1 Chemical compound CI1=CC(C(SC2(*)*)=I)=C2C=*1 0.000 description 5
- JJIJASSYOJGEMZ-UHFFFAOYSA-N CC(C)CC(C(C(C1)=C2CCN1C(C(C1)NCc3c1ccc(O)c3)=O)OC2=O)c1ccccc1 Chemical compound CC(C)CC(C(C(C1)=C2CCN1C(C(C1)NCc3c1ccc(O)c3)=O)OC2=O)c1ccccc1 JJIJASSYOJGEMZ-UHFFFAOYSA-N 0.000 description 1
- XLORFENHWKDLQS-UHFFFAOYSA-N CC(C)CC(C(C1)=C2CCN1C(C(C1)C1c1ccccc1)=O)(c1ccccc1)OC2=O Chemical compound CC(C)CC(C(C1)=C2CCN1C(C(C1)C1c1ccccc1)=O)(c1ccccc1)OC2=O XLORFENHWKDLQS-UHFFFAOYSA-N 0.000 description 1
- VKEFVGBJAPHHBO-UHFFFAOYSA-N CC(C)CC(C(C1)=C2CCN1C(Cc1ccccc1N)=O)(c1ccccc1)OC2=O Chemical compound CC(C)CC(C(C1)=C2CCN1C(Cc1ccccc1N)=O)(c1ccccc1)OC2=O VKEFVGBJAPHHBO-UHFFFAOYSA-N 0.000 description 1
- OODXXMMBQZWYFY-UHFFFAOYSA-N CC(C)CC(C(C1)=C2CCN1C(NCc1ccccc1)=O)(c1cc(Cl)ccc1)OC2=O Chemical compound CC(C)CC(C(C1)=C2CCN1C(NCc1ccccc1)=O)(c1cc(Cl)ccc1)OC2=O OODXXMMBQZWYFY-UHFFFAOYSA-N 0.000 description 1
- OCPYFVRSWQLOJT-UHFFFAOYSA-N CC(C)CC(C(C1)=C2CCN1C(NCc1ccccc1)=O)(c1ccccc1)OC2=O Chemical compound CC(C)CC(C(C1)=C2CCN1C(NCc1ccccc1)=O)(c1ccccc1)OC2=O OCPYFVRSWQLOJT-UHFFFAOYSA-N 0.000 description 1
- NXJNGIJXZSMGAK-UHFFFAOYSA-N CCN(CC1)CC(C(CC(C)C)(c2ccccc2)O2)=C1C2=O Chemical compound CCN(CC1)CC(C(CC(C)C)(c2ccccc2)O2)=C1C2=O NXJNGIJXZSMGAK-UHFFFAOYSA-N 0.000 description 1
- IHQALJHBIDAWOM-UHFFFAOYSA-N CCc(cccc1)c1NC(CCc1ccccc1)=O Chemical compound CCc(cccc1)c1NC(CCc1ccccc1)=O IHQALJHBIDAWOM-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D491/00—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00
- C07D491/02—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00 in which the condensed system contains two hetero rings
- C07D491/04—Ortho-condensed systems
- C07D491/044—Ortho-condensed systems with only one oxygen atom as ring hetero atom in the oxygen-containing ring
- C07D491/048—Ortho-condensed systems with only one oxygen atom as ring hetero atom in the oxygen-containing ring the oxygen-containing ring being five-membered
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/22—Anxiolytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/26—Psychostimulants, e.g. nicotine, cocaine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
- A61P25/32—Alcohol-abuse
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
- A61P25/34—Tobacco-abuse
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
- A61P25/36—Opioid-abuse
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D491/00—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00
- C07D491/02—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00 in which the condensed system contains two hetero rings
- C07D491/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D491/00—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00
- C07D491/02—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00 in which the condensed system contains two hetero rings
- C07D491/10—Spiro-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D491/00—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00
- C07D491/02—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00 in which the condensed system contains two hetero rings
- C07D491/10—Spiro-condensed systems
- C07D491/107—Spiro-condensed systems with only one oxygen atom as ring hetero atom in the oxygen-containing ring
Description
本明細書に開示される主題は、ニューロペプチドSレセプターリガンドに関し、より特定的には、ニューロペプチドSレセプターのブロッキングに反応する疾患または病態の治療のためのニューロペプチドSレセプターアンタゴニストに関する。
本発明は、国立衛生研究所(National Institute of Health)により授与された助成金番号1R21MH081247−01および1R01MH087826−01A1に基づいて政府の支援を受けて行われた。政府は、本発明に関する一定の権利を有する。
ヒトニューロペプチドS(NPS)は、一次配列:SFRNGVGTGMKKTSFQRAKを示す20残基のペプチドである。また、この配列は、種間でよく保存されており、特に、NPSのセリン(S)N末端残基は、これまでに調べられたすべての種間で保存されている。従前のオーファンGタンパク質結合レセプター(GPCR)GPR154は、NPSと対形成した後NPSレセプターと命名され、NPSRと略記された。
本明細書には、高い親和性を有してニューロペプチドSレセプター(NPSR)に結合するように構成されたNPSRアンタゴニストが提供される。いくつかの実施形態では、提供されるNPSRアンタゴニストは、生物学的活性化合物の合成の中間体としての役割を果たしうる。特定の実施形態では、NPSRアンタゴニストは、薬学的に許容可能な塩の形態である。
本発明の実施形態の利点が容易に理解されるように、添付の図面に例示された特定の実施形態を参照することにより、以上に簡潔に説明した実施形態のより具体的な説明を行う。これらの図面は単にいくつかの実施形態を示しているにすぎないので、範囲を限定するものとみなすべきではないことを理解したうえで、添付の図面を用いてさらに具体的かつ詳細に、実施形態を記載して説明する。
本明細書全体を通して、特徴、利点、または類似の言葉に関する言及は、特徴および利点のすべてがいずれか1つの実施形態で実現されうることを意味するものではない。もっと正確に言えば、特徴および利点に言及する言葉は、特定の特徴、利点、または特性が、少なくとも1つの実施形態に含まれることを意味するものとみなされる。したがって、特徴および利点ならびに類似の言葉の考察は、本明細書全体を通して、同一の実施形態を言及するものでありうるが、必ずしもそうとはかぎらない。
本明細書に提供される分子は、高い親和性を有してNPSRに結合するので、NPSを排除または変位してアンタゴニストとして機能する。提供される分子は、コカイン中毒、物質乱用、物質乱用再発、パニック障害、恐怖症、心的外傷後ストレス障害、およびナルコレプシー、他の病態を含む睡眠障害の治療に有用でありうる。
レセプターアンタゴニストは、レセプターに結合することにより生物学的反応そのものを誘発しないが、天然リガンドまたはアゴニストにより媒介さる反応をブロックまたは弱めるタイプのレセプターリガンドまたは薬剤である。薬理学では、アンタゴニストは、そのコグネイトレセプターに対して親和性を有するが効力はなく、結合は、レセプターにおいて、相互作用を破壊するか、またはアゴニストもしくはインバースアゴニストの機能を阻害する。アンタゴニストは、レセプター上の活性部位もしくはアロステリック部位に結合することにより、その効力を発揮するか、またはレセプターの活性の生物学的調節に通常は関与しないユニークな結合部位で相互作用しうる。アンタゴニスト活性は、アンタゴニスト−レセプター複合体の寿命に依存して可逆または不可逆でありうる。また、さらには、アンタゴニストレセプター結合の性質に依存する。薬剤アンタゴニストは、レセプター上の構造的に規定された結合部位で内因性リガンドまたは基質と競合することにより、それらの効力を達成しうる。
神経科学では、推定伝達分子と未知機能「オーファン」レセプターとの結合は、新規な薬理学を呈するいくつか興味深いリガンド−レセプター対形成の同定に結びついてきた。ニューロペプチドSレセプター(NPSR)系は、NPSとの対形成を実証することにより、サトウ(Sato)および共同研究者によりに脱オーファン化され(1)、睡眠、栄養、不安、薬物乱用、炎症などの様々な生理学的状態を変調することが示されてきた。
中枢神経系(CNS)へのレセプターおよびペプチドの両方の局在化を規定することにより、NPS機能の第1の指標が提供された。in situハイブリダイゼーションでは、NPSR mRNAは、CNS全体にわたり広く発現されることが示された。特に、高レベルのNPSR mRNAは、視床、視床下部、皮質、海馬、および扁桃で同定された。しかしながら、ヒトNPS前駆体mRNAは、主に脳幹の青斑核(LC)に発現され、アミノ酸Arg Lysに近接する特異的切断部位で89アミノ酸のシグナルペプチドから切断される。LCへのmRNA局在化に起因して、Xuらは、NPSが覚醒、不安、またはその両方で役割を果たしうると推測した。
NPSレセプター系を用いた進行中の研究では、NPS関連薬剤治療に反応性しうるいくつかの潜在的な疾患状態、たとえば、ナルコレプシー、パニック障害、肥満症、薬物乱用、心的外傷後ストレス障害、および不安が規定され始めている。NPSレセプター系を介して作用する新しい薬剤の開発は、現在利用されている治療に対して耐性がないまたはそれに反応しない個体に有意に奏効しうる。NPSレセプター系は、非鎮静抗不安剤の標的として有望であった。NPS(i.c.v.)の投与は、覚醒状態を増大させると同時に、齧歯動物で不安を低減し、しかも、NPS媒介覚醒は、ノルアドレナリン作動性ニューロンにより制御されない。
扁桃のNPSレセプターは、薬物乱用および中毒に関与することがすでに示された領域に局在化する。それに加えて、NPSは、外側傍小脳脚核中にコルチコトロピン放出因子(CRF)と共に共局在化される。NPSは不安を低減するがCRFは不安を増大させるので、NPSとCRFとの共局在化は、興味深い。CRFは、薬物乱用挙動を変調することが示された。
NPSR mRNAは、傍梨状皮質/核および海馬台を含む学習および記憶の調節で知られる海馬領域で非常に高レベルで発現される。したがって、NPSは、記憶および記憶の固定に関与するように配置される。NPS投与(i.c.v.)は、新規な認識アッセイの性能を用量依存的に改善するので、記憶における生化学的役割が確認される。NPSは記憶および不安の両方を変調するので、部分的には記憶関連不安障害を治療できる可能性が示唆されることから、NPSが短期記憶から長期記憶(固定)への変換を改変する能力を調べた。
本明細書には、NPSレセプターの薬理学的特性解析のための小分子プローブとしておよびNPSR変調病態に対する治療剤として有用なNPSRアンタゴニストが提供される。本明細書に規定されるアンタゴニスト分子は、NPSRレセプターへのNPSの結合により引き起こされるかまたはそれにより悪化する病態を軽減するために使用されうる。いくつかの実施形態では、本明細書に規定されるNPSRアンタゴニストは、200nM未満のKe結合活性を有する。特定の実施形態では、NPSRアンタゴニストは、100nM未満のKe結合活性を有する。
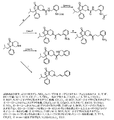
で示される化合物を含んで提供される。式中、点線は、飽和結合または不飽和結合を表し、ただし、すべての点線が不飽和結合を表すか、eとfとの間の点線のみが不飽和結合であるか、またはどの点線も不飽和結合を表さないかのいずれかであり、X1は、CH、CH2、N、またはN−R3であり、かつX2は、X1がNのときCHであり、X2は、X1がN−R3のときCH2であり、X2は、X1がCHのときNであり、かつX2は、X1がCH2のときN−R3であり、mは、0または1であり、かつ波線は、シス配置またはトランス配置を有する炭素に結合された結合を示す。Y1は、OまたはSであり、かつY2は、O、N、またはCH2である。R1、R2、およびR3に対する置換基は、以下に記載される。
式中、Y1は、OまたはSであり、かつY2は、O、N、またはCH2である。
である。式中、pは、環Bが存在するとき0または2であり、かつpは、環Bが存在しないとき2である。他の選択肢の表現では、R1およびR2は、一緒になって、次の構造の1つである(結合炭素はボールド体で示される)。
の1つである。式中、Y3は、環上の任意の位置に存在してもよく、かつ、H、ハロゲン、OH、C1〜4アルキル、C1〜4ヒドロキシアルキル、またはCF3を含む。
ただし、n=0〜3
式中、R5は、C1〜8アルキル、C3〜6シクロアルキル、C2〜8アルケニル、C2〜8アルキニル、C6〜10アリール、ヘテロ環、置換アリール、置換チオフェン、フラン、ピロール、天然アミノ酸側鎖、またはノルロイシン、シクロヘキシルアラニン、ホモシクロヘキシルアラニン、シクロヘキシルグリシン、2−アミノイソ酪酸、3−シクロペンチルアラニン、ノルバリン、およびホモフェニルアラニンからなる群から選択される非天然アミノ酸側鎖であり、かつR4は、C1〜8アルキル、C3〜6シクロアルキル、C2〜8アルケニル、C2〜8アルキニル、C6〜10アリール、ヘテロ環、置換アリール、置換チオフェン、フラン、ピロール、またはH、または
である。式中、Y4は、OまたはSでありうる。
として表されうる。式中、R6は、環上の任意の位置に存在してもよく、かつH、NH2、NHCOCH3、−OCH2CH3、NHCO(CH2)4CH3、N(CH3)2、NHCOOC(CH3)3、ハロゲン、
(ただし、nは0〜3である)
または以上で(3a)〜(3z)と記された構造の1つである。いくつかの実施形態では、R6に対する置換基は、環上のオルト位またはパラ位に存在しうる。
本明細書に提供される化合物は、好適な酸を用いてアミンのプロトン化により薬学的に許容可能な塩の形態をとりうる。当業者に公知の好適な酸としては、塩酸、ヨウ化水素酸、臭化水素酸、硫酸、リン、クエン酸、酢酸、フマル酸、酒石酸、およびギ酸が挙げられるが、これらに限定されるものではない。
合成
実施例1:R06039−455の全合成
1−(4−フルオロフェニル)−3−メチルブタン−1−オン。ジエチルエーテル(200mL)中の4−フルオロベンゾニトリル(6g、49.5mmol)の溶液にi−BuMgCl(THF中1M溶液)を添加し、反応混合物を加熱して16時間還流させた。反応混合物を室温に冷却し、混合物中に6N H2SO4(60mL)および氷(500mL)を注加し、次いで、0℃で30分間撹拌した。水性層をエチルアセテート(200mL)で抽出し、合わせた有機層をブライン(100mL)で洗浄し、脱水し(MgSO4)、そして濃縮した。残渣をカラムクロマトグラフィー(80g、SiO2、ヘキサン中0〜40%ジエチルエーテル/ジクロロメタン1:1)により精製し、無色油として1−(4−フルオロフェニル)−3−メチルブタン−1−オンを得た(3.72g、42%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 1.00 (d, J=6.78 Hz, 6 H), 2.29 (dt, J=13.47, 6.64 Hz, 1 H), 2.81 (d, J=6.78 Hz, 2 H), 7.06-7.19 (m, 2 H), 7.94-8.02 (m, 2 H); MS m/z 172 (ダイマー−OH) ++。
化合物1
3−(4−フルオロフェニル)−3−イソブチルフロ[3、4c]ピリジン−1(3H)−オン。−78℃の無水ジエチルエーテル(160mL)中の4−ジイソプロピルアミドピリジン(3.2g、15.54mmol)の溶液にジエチルエーテル(23.27mL)中のLDAの1M溶液を添加し、反応混合物を−78℃で2時間撹拌した。無水ジエチルエーテル(5mL)中の1−(4−フルオロフェニル)−3−メチルブタン−1−オン(3.5g、19.42mmol)の溶液を滴下し、−78℃で反応系を30分間撹拌した。反応混合物をブライン(100mL)でクエンチし、エチルアセテート(3×50mL)で抽出し、脱水し(MgSO4)、そして濃縮した。粗混合物を6N HCl(50mL)と共に12時間撹拌で、次いで、0℃に冷却した。水酸化ナトリウム(15g、37.5mmol)を3回に分けて添加し、反応混合物を0℃で30分間攪拌し、次いで、エチルアセテート(3×100mL)で抽出した。有機層を脱水し(MgSO4)、濃縮し、そしてカラムクロマトグラフィー(40g、SiO2、ヘキサン中0〜40%エチルアセテート)により精製し、灰白色固体として3−(4−フルオロフェニル)−3−イソブチルフロ[3,4c]ピリジン−1(3H)−オンを得た(296mg、7%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.80-0.91 (m, 6 H), 1.54-1.66 (m, 1 H), 2.06 (dd, J=14.88, 6.97 Hz, 1 H), 2.48 (dd, J=15.07, 5.27 Hz, 1 H), 7.04-7.14 (m, 2 H), 7.46-7.56 (m, 2 H), 7.77 (dd, J=5.09, 0.94 Hz, 1 H), 8.85 (d, J=4.90 Hz, 1 H), 9.01 (s, 1 H); MS m/z 286 (M+H) +。
化合物2
3−(4−フルオロフェニル)−3−イソブチル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン。0℃のジクロロメタン(5mL)中の3−(4−フルオロフェニル)−3−イソブチルフロ[3,4−c]ピリジン−1(3H)−オン(296mg、1.04mmol)の溶液にジエチルエーテル中の1N HClを添加した。反応混合物を0℃で40分間撹拌し、次いで、濾過し、沈殿した塩酸塩を高真空中に1時間乾燥させた。沈殿物をエタノール(10mL)中に再溶解し、PtO2(40mg)を添加し、反応混合物を40psiで30分間水素化した。混合物を珪藻土(真空中で濃縮濾液)のパッドに通して濾過した。残渣をジクロロメタン(50mL)中に再溶解し、飽和NaHCO3溶液と共に撹拌し、次いで、20分間濃縮した。残渣をカラムクロマトグラフィー(4g、SiO2、ジクロロメタン中0〜2.5%メタノール)により精製し、3−(4−フルオロフェニル)−3−イソブチル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オンを得た(160mg、53%。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.83-0.98 (m, 6 H), 1.56 (br. s., 1 H), 1.65 (ddd, J=13.37, 6.59, 5.27 Hz, 1 H), 1.72-1.81 (m, 1 H), 2.15-2.38 (m, 3 H), 2.84-3.05 (m, 2 H), 3.34-3.50 (m, 1 H), 3.58-3.73 (m, 1 H), 7.00-7.12 (m, 2 H), 7.27-7.34 (m, 2 H); MS m/z 290 (M+H) +, 288 (M−H)−。
R06039−455
3−(4−フルオロフェニル)−3−イソブチル5−(3−(ピペリジン−1−イル)プロパノイル)−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン。R06039−421に関連して記載した手順を利用し3−(ピペリジン−1−イル)プロパン酸(174mg、1.106mmol)および3−(4−フルオロフェニル)−3−イソブチル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン(160mg、0.553mmol)を3−(4−フルオロフェニル)−3−イソブチル5−(3−(ピペリジン−1−イル)プロパノイル)−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オンに変換した(64mg、27%)。所望の生成物をカラムクロマトグラフィー(12g、SiO2、ジクロロメタン中0〜2.5%メタノール)および半分取HPLCにより精製した。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.80-0.99 (m, 6 H), 1.56-1.71 (m, 7 H), 1.78 (dd, J=14.51, 7.35 Hz, 1 H), 2.27 (dd, J=14.69, 4.90 Hz, 1 H), 2.37-2.59 (m, 6 H), 2.62-2.83 (m, 5 H), 3.41 (dt, J=13.37, 6.50 Hz, 1 H), 3.66-3.79 (m, 1 H), 3.96 (d, J=19.59 Hz, 1 H), 4.65 (d, J=19.59 Hz, 1 H), 7.01-7.15 (m, 2 H), 7.28-7.38 (m, 2 H); 19F NMR (282 MHz, クロロホルム-d) δ ppm −113.6; MS m/z 429 (M+H) +; HPLC >96.8% (AUC), tR = 26.24分(30分で5〜66 % CH3CN)。
R06039−275
N−(2−アミノベンジル)−3−イソブチル−1−オキソ−3−フェニル−3,4,6,7−テトラヒドロフロ[3,4−c]ピリジン−5(1H)−カルボキサミド。無水THF(15mL)中のトリホスゲン(36mg、0.123mmol)およびトリエチルアミン(75mg、0.737mmol)の氷冷溶液に無水THF(2mL)中のtert−ブチル2−(アミノメチル)フェニルカルバメート(100mg、0.369mmol)を添加した。反応混合物を0℃で15分間撹拌し、次いで、室温に加温し、濃縮乾固させた。残渣を無水ジクロロメタン(15mL)中に再溶解させ、無水ジクロロメタン(2mL)中の3−イソブチル3−フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン(100mg、0.369mmol)(3−(4−フルオロフェニル)−3−イソブチル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−オン(3H)、スキーム1に関連して記載した方法に従って調製した)の溶液を添加し、混合物を室温で16時間撹拌した。反応混合物を濃縮し、カラムクロマトグラフィー(12g、SiO2、ヘキサン中0〜30%エチルアセテート)により精製し、無色油としてtert−ブチル2−((3−イソブチル−1−オキソ−3−フェニル−1,3,4,5,6,7−ヘキサヒドロフロ[3,4−c]ピリジン−5−カルボキサミド)メチル)フェニルカルバメートを得た(68mg、収率21%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.78-0.97 (m, 6 H), 1.50-1.55 (m, 9 H), 1.55-1.69 (m, 1 H), 1.77 (dd, J=14.51, 7.35 Hz, 1 H), 2.22-2.42 (m, 3 H), 3.12-3.46 (m, 1 H), 3.50-3.63 (m, 1 H), 3.88 (d, J=18.84 Hz, 1 H), 3.89-3.90 (m, 1 H), 4.25-4.36 (m, 2 H), 4.44 (d, J=18.84 Hz, 1 H), 5.78 (d, J=5.65 Hz, 1 H), 7.01 (dd, J=7.54, 1.13 Hz, 1 H), 7.14-7.26 (m, 2 H), 7.26-7.42 (m, 4 H), 7.69 (d, J=8.29 Hz, 1 H), 8.46-8.57 (m, 1 H); MS m/z 542 (M+Na)+, 518 (M−H)−。
R06039−409
3−イソブチル−1−オキソ−3−フェニルN−(2−(3−(ピペリジン−1−イル)プロパンアミド)ベンジル)−3,4,6,7−テトラヒドロフロ[3,4−c]ピリジン−5(1H)−カルボキサミド。R06039−409に関連して記載した手順を利用して3−(ピペリジン−1−イル)塩化プロパノイル(35mg、0.059mmol)を3−イソブチル−1−オキソ−3−フェニルN−(2−(3−(ピペリジン−1−イル)プロパンアミド)ベンジル)−3,4,6,7−テトラヒドロフロ[3,4−c]ピリジン−5(1H)−カルボキサミドに変換した(34mg、71%)。1H NMR (300 MHz, DMSO-d6) δ ppm 0.74-0.91 (m, 6 H), 1.30-1.55 (m, 8 H), 1.80-1.97 (m, 1 H), 2.16-2.41 (m, 10 H), 2.57 (t, J=6.59 Hz, 1 H), 2.78-3.13 (m, 1 H), 3.55-3.77 (m, 1 H), 3.80-3.99 (m, 1 H), 4.23 (d, J=5.65 Hz, 2 H), 4.37-4.57 (m, 1 H), 7.08 (s, 1 H), 7.20 (dd, J=4.90, 2.26 Hz, 1 H), 7.28-7.54 (m, 6 H), 7.68 (s, 1 H), 10.09 (s, 1 H); MS m/z 559 (M+H)+, 558 (M−H) −。
R06039−410
3−イソブチル−1−オキソ−3−フェニルN−(2−(3−(ピペリジン−1−イル)プロパンアミド)ベンジル)−3,4,6,7−テトラヒドロフロ[3,4−c]ピリジン−5(1H)−カルボキサミド。R06039−409に関連して記載した手順を利用して3−(ピペリジン−1−イル)塩化プロパノイル(35mg、0.059mmol)を3−イソブチル−1−オキソ−3−フェニルN−(2−(3−(ピペリジン−1−イル)プロパンアミド)ベンジル)−3,4,6,7−テトラヒドロフロ[3,4−c]ピリジン−5(1H)−カルボキサミドに変換した(34mg、71%)。1H NMR (300 MHz, DMSO-d6) δ ppm 0.74-0.91 (m, 6 H), 1.30-1.55 (m, 8 H), 1.80-1.97 (m, 1 H), 2.16-2.41 (m, 10 H), 2.57 (t, J=6.59 Hz, 1 H), 2.78-3.13 (m, 1 H), 3.55-3.77 (m, 1 H), 3.80-3.99 (m, 1 H), 4.23 (d, J=5.65 Hz, 2 H), 4.37-4.57 (m, 1 H), 7.08 (s, 1 H), 7.20 (dd, J=4.90, 2.26 Hz, 1 H), 7.28-7.54 (m, 6 H), 7.68 (s, 1 H), 10.09 (s, 1 H); MS m/z 559 (M+H)+, 558 (M−H) −。
R06039−412
N−(−ベンズアミドベンジル)−3−イソブチル−1−オキソ−3−フェニル−3,4,6,7−テトラヒドロフロ[3,4−c]ピリジン−5(1H)−カルボキサミド。R06039−409に関連して記載した手順を利用して塩化ベンゾイル(18mg、0.13mmol)をN−(2−ベンズアミドベンジル)−3−イソブチル−1−オキソ−3フェニル−3,4,6,7−テトラヒドロフロ[3,4−c]ピリジン−5(1H)−カルボキサミドに変換した(24mg、39%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.81-0.96 (m, 6 H), 1.57-1.72 (m, 1 H), 1.72-1.86 (m, 1 H), 1.72-1.87 (m, 1 H), 2.21-2.48 (m, 2 H), 3.20-3.36 (m, 1 H), 3.50 (m, J=13.60 Hz, 1 H), 3.67-3.75 (m, 1 H), 3.88 (d, J=18.84 Hz, 1 H), 4.28-4.46 (m, 2 H), 5.16-5.28 (m, 1 H), 7.17 (dd, J=7.35, 1.32 Hz, 1 H), 7.27-7.44 (m, 7 H), 7.45-7.65 (m, 3 H), 7.90-8.00 (m, 1 H), 8.05-8.16 (m, 2 H), 10.28 (s, 1 H); MS m/z 524 (M+H)+, 546 (M+23)+, 522 (M−H)−。
R06039−413
3−イソブチル−1−オキソ−3−フェニル−N−(2−(2−フェニルアセトアミド)ベンジル)−3,4,6,7−テトラヒドロフロ[3,4−c]ピリジン−5(1H)−カルボキサミド。ジクロロメタン(5mL)中のtert−ブチル2−((3−イソブチル−1−オキソ3−フェニル−1,3,4,5,6,7−ヘキサヒドロフロ[3,4−c]ピリジン5−カルボキサミド)メチル)フェニルカルバメート(62mg、0.119mmol)の氷冷溶液にTFA(1mL)を添加した。反応混合物を0℃で5時間攪拌し、濃縮乾固し、粗N−(2−アミノベンジル)−3−イソブチル−1−オキソ−3−フェニル−3,7−テトラヒドロフロ[3,4−c]ピリジン−5(1H)−カルボキサミド、4および6を得た。残渣にジクロロメタン(5mL)中の2−フェニル酢酸(32mg、0.238mmol)、BOP(79mg、0.179mmol)、およびN,N’−ジイソプロピルエチルアミン(62mg、0.477mmol)の溶液を添加し、そして室温で16時間撹拌した。粗反応混合物を濃縮乾固し、カラムクロマトグラフィー(12g、SiO2、ヘキサン中0〜100%エチルアセテート)により精製し、無色油とし3−イソブチル−1−オキソ−3−フェニル−N−(2−(2−フェニルアセトアミド)ベンジル)−3,4,6,7−テトラヒドロフロ[3,4−c]ピリジン−5(1H)−カルボキサミドを得た(66mg、93%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.81-0.98 (m, 6 H), 1.65 (dd, J=11.87, 6.59 Hz, 1 H), 1.73-1.84 (m, 1 H), 2.24-2.47 (m, 4 H), 3.30 (dt, J=13.19, 6.22 Hz, 1 H), 3.52 (dt, J=13.56, 5.09 Hz, 1 H), 3.75 (s, 2 H), 3.91 (d, J=18.84 Hz, 1 H), 4.21-4.48 (m, 2 H), 5.22 (br. s., 1 H), 6.97-7.09 (m, 1 H), 6.99-7.10 (m, 1 H), 7.18 (d, J=6.78 Hz, 1 H), 7.23-7.47 (m, 9 H), 7.75 (br. s., 1 H), 7.96 (d, J=7.91 Hz, 1 H), 9.65 (br. s., 1 H); MS m/z 538 (M+H) +, 560 (M+23) +, 536 (M−H)−。
R06039−414
3−イソブチル−1−オキソ−3−フェニルN−(2−(4−フェニルブタンアミド)ベンジル)−3,4,6,7−テトラヒドロフロ[3,4−c]ピリジン−5(1H)−カルボキサミド。R06039−413に関連して記載した手順を利用し4−フェニルブタン酸(32mg、0.191mmol)を3−イソブチル−1−オキソ−3−フェニルN−(2−(4−フェニルブタンアミド)ベンジル)−3,4,6,7−テトラヒドロフロ[3,4−c]ピリジン−5(1H)−カルボキサミドに変換した(39mg、72%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.83-0.96 (m, 6 H), 1.56-1.70 (m, 1 H), 1.71-1.85 (m, 1 H), 1.99-2.15 (m, 2 H), 2.23-2.41 (m, 3 H), 2.43-2.53 (m, 2 H), 2.68-2.77 (m, 2 H), 3.22-3.33 (m, 1 H), 3.51 (dt, J=13.56, 5.27 Hz, 1 H), 3.83-3.93 (m, 1 H), 4.27-4.44 (m, 3 H), 5.23 (d, J=4.90 Hz, 1 H), 7.01-7.11 (m, 1 H), 7.13-7.41 (m, 12 H), 8.05 (d, J=7.91 Hz, 1 H), 9.68 (s, 1 H); MS m/z 566 (M+H) +, 566 (M+23) +, 564 (M−H)+。
R06039−417
3−イソブチル−1−オキソ−3−フェニル−N−(2−(3−フェニルプロパンアミド)ベンジル)−3,4,6,7−テトラヒドロフロ[3,4−c]ピリジン−5(1H)−カルボキサミド。R06039−413に関連して記載した手順を利用して3−フェニルプロピオン酸(29mg、0.191mmol)を3−イソブチル−1−オキソ−3−フェニルN−(2−(3−フェニルプロパンアミド)ベンジル)−3,4,6,7−テトラヒドロフロ[3,4−c]ピリジン−5(1H)−カルボキサミドに変換した(34mg、71%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.80-0.97 (m, 6 H), 1.59-1.70 (m, 1 H), 1.75 (d, J=14.32 Hz, 1 H), 2.21-2.48 (m, 2 H), 2.71-2.81 (m, 2 H), 3.02-3.11 (m, 2 H), 3.21-3.33 (m, 1 H), 3.49 (d, J=13.56 Hz, 2 H), 3.89 (s, 1 H), 4.20-4.44 (m, 3 H), 5.02-5.13 (m, 1 H), 7.06 (d, J=1.13 Hz, 1 H), 7.14-7.39 (m, 12 H), 8.05 (s, 1 H), 9.72 (s, 1 H); MS m/z 553 (M+H) +, 575 (M+23) +, 551 (M−H)−。
R06039−418
(E)−N−(2−桂皮アミドベンジル)−3−イソブチル−1−オキソ−3−フェニル−3,4,6,7−テトラヒドロフロ[3,4−c]ピリジン−5(1H)−カルボキサミド。R06039−413に関連して記載した手順を利用してtrans−フェニルプロペン酸(21mg、0.143mmol)を(E)−N−(2−桂皮アミドベンジル)−3−イソブチル−1−オキソ−3−フェニル−3,4,6,7−テトラヒドロフロ[3,4−c]ピリジン−5(1H)−カルボキサミドに変換した(31mg、79%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.78-0.97 (m, 6 H), 1.59-1.69 (m, 1 H), 1.69-1.84 (m, 1 H), 2.25 (dd, J=14.51, 4.71 Hz, 1 H), 2.31-2.50 (m, 2 H), 3.24-3.39 (m, 1 H), 3.54 (dt, J=13.56, 5.09 Hz, 2 H), 3.92 (dt, J=18.84, 2.64 Hz, 1 H), 4.46 (dd, J=6.40, 1.88 Hz, 2 H), 5.16 (br. s., 1 H), 6.86 (d, J=15.45 Hz, 1 H), 7.02-7.12 (m, 1 H), 7.16-7.50 (m, 10 H), 7.57-7.66 (m, 2 H), 7.76 (d, J=15.82 Hz, 1 H), 8.31 (d, J=7.91 Hz, 1 H), 10.05 (br. s., 1 H); MS m/z 551 (M+H) +, 573 (M+23) +, 549 (M−H)−。
R06039−419
N−(2−ヘキサンアミドベンジル)−3−イソブチル−1−オキソ−3−フェニル−3,4,6,7−テトラヒドロフロ[3,4−c]ピリジン−5(1H)−カルボキサミド。R06039−413に関連して記載した手順を利用してヘキサン酸(17mg、0.143mmol)をN−(2−ヘキサンアミドベンジル)−3−イソブチル−1−オキソ−3−フェニル−3,4,6,7−テトラヒドロフロ[3,4−c]ピリジン−5(1H)−カルボキサミドに変換した(28mg、76%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.81-0.98 (m, 9 H), 1.33-1.43 (m, 4 H), 1.61-1.85 (m, 4 H), 2.26-2.46 (m, 5 H), 3.22-3.39 (m, 1 H), 3.46-3.61 (m, 1 H), 3.82-3.96 (m, 1 H), 4.28-4.48 (m, 3 H), 5.16 (br. s., 1 H), 7.07 (d, J=7.16 Hz, 1 H), 7.20 (dd, J=7.54, 1.51 Hz, 1 H), 7.24-7.46 (m, 6 H), 8.07 (d, J=8.29 Hz, 1 H), 9.58 (br. s., 1 H); MS m/z 519 (M+H) +, 540 (M+23) +, 517 (M−H)−。
R06039−411
3−イソブチル−3−フェニル−5−(1,2,3,4−テトラヒドロイソキノリン−2−カルボニル)−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン。R06039−275に関連して記載した手順を利用して1,2,3,4−テトラヒドロイソキノリンヒドロクロリド(130mg、0.766mmol)を3−イソブチル−3−フェニル−5−(1,2,3,4−テトラヒドロイソキノリン−2−カルボニル)−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オンに変換した(27mg、8%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.81-0.99 (m, 6 H), 1.66 (dd, J=6.78, 4.90 Hz, 1 H), 1.75-1.86 (m, 1 H), 2.29 (dd, J=14.69, 4.90 Hz, 1 H), 2.47 (td, J=4.99, 2.45 Hz, 2 H), 2.90 (t, J=5.65 Hz, 2 H), 3.29 (dd, J=6.78, 4.90 Hz, 1 H), 3.36-3.48 (m, 1 H), 3.51 (t, J=5.84 Hz, 1 H), 3.77-3.90 (m, 1 H), 4.12-4.23 (m, 1 H), 4.43 (s, 2 H), 7.07 (dd, J=5.27, 3.77 Hz, 1 H), 7.12-7.22 (m, 3 H), 7.28-7.44 (m, 5 H); MS m/z 431 (M+H) +, 453 (M+23) +, 429 (M−H)−。
R06039−416
N−(2−エトキシベンジル)−3−イソブチル−1−オキソ−3−フェニル−3,4,6,7−テトラヒドロフロ[3,4−c]ピリジン−5(1H)−カルボキサミド。THF中(5mL)の2−(2−ニトロフェニル)酢酸(79mg、0.435mmol)、3−イソブチル−3−フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン(50mg、0.184mmol)、およびN,N’ジイソプロピルエチルアミン(112mg、0.870mmol)の溶液にBOP試薬(144mg、0.326mmol)を添加し、混合物を室温で16時間攪拌した。粗反応混合物を濃縮乾固し、カラムクロマトグラフィー(12g、SiO2、ヘキサン中0〜100%エチルアセテート)により精製し、白色固体として3−イソブチル5−(2−(2−ニトロフェニル)アセチル)−3−フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オンを得た(57mg、60%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.80-1.01 (m, 6 H), 1.54-1.73 (m, 1 H), 1.74-1.87 (m, 1 H), 2.20-2.36 (m, 1 H), 2.37-2.63 (m, 2 H), 3.42-3.58 (m, 1 H), 3.76-3.92 (m, 1 H), 3.93-4.14 (m, 2 H), 4.40 (m, 1 H), 4.75 (d, J=19.59 Hz, 1 H), 7.19-7.42 (m, 6 H), 7.42-7.53 (m, 1 H), 7.53-7.64 (m, 1 H), 8.04-8.16 (m, 1 H); MS m/z 435 (M+H) +, 457 (M+23) +, 433(M−H)−。
R06039−421
3−イソブチル5−(2−(2−ニトロフェニル)アセチル)−3フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン。THF中(5mL)の2−(2−ニトロフェニル)酢酸(79mg、0.435mmol)、3−イソブチル3−フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−1(50mg、0.184mmol)、およびN,N’ジイソプロピルエチルアミン(112mg、0.870mmol)の溶液にBOP試薬(144mg、0.326mmol)を添加し、混合物を室温で16時間攪拌した。粗反応混合物を濃縮乾固し、カラムクロマトグラフィー(12g、SiO2、ヘキサン中0〜100%エチルアセテート)により精製し白色固体として3−イソブチル5−(2−(2−ニトロフェニル)アセチル)−3フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オンを得た(57mg、60%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.80-1.01 (m, 6 H), 1.54-1.73 (m, 1 H), 1.74-1.87 (m, 1 H), 2.20-2.36 (m, 1 H), 2.37-2.63 (m, 2 H), 3.42-3.58 (m, 1 H), 3.76-3.92 (m, 1 H), 3.93-4.14 (m, 2 H), 4.40 (m, 1 H), 4.75 (d, J=19.59 Hz, 1 H), 7.19-7.42 (m, 6 H), 7.42-7.53 (m, 1 H), 7.53-7.64 (m, 1 H), 8.04-8.16 (m, 1 H); MS m/z 435 (M+H) +, 457 (M+23) +, 433(M−H)−。
R06039−422
(E)3−イソブチル−5−(3−(2−ニトロフェニル)アクリロイル)−3−フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン。R06039−421に関連して記載した手順を利用してE−3−(2−ニトロフェニル)アクリル酸(84mg、0.435mmol)を(E)−3−イソブチル−5−(3−(2−ニトロフェニル)アクリロイル)−3−フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オンに変換した(90mg、92%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.82-0.89 (m, 3 H), 0.92-1.00 (m, 3 H), 1.54-1.77 (m, 1 H), 1.79-1.90 (m, 1 H), 2.35 (dd, J=14.51, 4.71 Hz, 1 H), 2.49 (br. s., 2 H), 3.45-3.64 (m, 1 H), 3.83-3.99 (m, 1 H), 4.02-4.19 (m, 1 H), 4.81 (d, J=19.59 Hz, 1 H), 6.72 (d, J=15.45 Hz, 1 H), 7.30-7.46 (m, 5 H), 7.49-7.71 (m, 3 H), 7.97 (d, J=15.45 Hz, 1 H), 8.06 (d, J=7.91 Hz, 1 H); MS m/z 447 (M+H) +, 469 (M+23) +, 445 (M−H)−。
R06039−423
5−(3−(2−アミノフェニル)プロパノイル)−3−イソブチル−3−フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン。エタノール/エチルアセテート/(3:1、20mL)中の(E)−3−イソブチル5−(3−(2−ニトロフェニル)アクリロイル)−の溶液に3−フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン(90mg、0.20mmol)にPd/C(10%、20mg)を添加した。H2(g)雰囲気下、室温で反応混合物を1時間激しく撹拌した。混合物を珪藻土のパッドに通して濾過し、濾液を真空中で濃縮し、残渣をカラムクロマトグラフィー(4g、SiO2、ヘキサン中0〜50%エチルアセテート)により精製し、5−(3−(2−アミノフェニル)プロパノイル)−3−イソブチル−3−フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−オン(3H)−1を得た(54mg、64%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.82-0.98 (m, 6 H), 1.59-1.71 (m, 1 H), 1.73-1.87 (m, 1 H), 2.18-2.37 (m, 2 H), 2.72 (d, J=6.78 Hz, 2 H), 2.87 (d, J=6.78 Hz, 2 H), 3.22-3.33 (m, 1 H), 3.46-3.66 (m, 2 H), 3.77-3.89 (m, 2 H), 3.92-4.04 (m, 1 H), 4.60-4.74 (m, 1 H), 6.59-6.64 (m, 2 H), 6.96-7.07 (m, 2 H), 7.28-7.44 (m, 5 H); MS m/z 419 (M+H) +。
R06039−424
5−(2−(2−アミノフェニル)アセチル)−3−イソブチル−3−フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン。R06039−423に関連して記載した手順を利用して3−イソブチル−5−(2−(2−ニトロフェニル)アセチル)−3フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オンを5−(2−(2−アミノフェニル)アセチル)−3−イソブチル−3−フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オンに変換した(40mg、75%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.80-0.96 (m, 6 H), 1.58-1.70 (m, 1 H), 1.72-1.85 (m, 1 H), 2.14-2.40 (m, 2 H), 3.43 (ddd, J=13.56, 7.91, 5.27 Hz, 1 H), 3.70 (s, 2 H), 3.80-4.02 (m, 2 H), 4.07 (s, 1 H), 4.32 (br. s., 2 H), 4.73 (d, J=19.59 Hz, 1 H), 6.64-6.75 (m, 2 H), 6.97-7.12 (m, 2 H), 7.29-7.45 (m, 5 H); MS m/z 405 (M+H) +, 427 (M+23) +, 403 (M−H)−。
R06039−427
5−(2−ナフトイル)−3−イソブチル−3−フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン。0℃のTHF(5mL)中の3−イソブチル−3−フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン(50mg、0.184mmol)およびN,N’ジイソプロピルエチルアミン(71mg、0.552mmol)の溶液に2−ナフトイルクロリド(35mg、0.184mmol)を添加し、反応混合物を0℃で30分間攪拌し、次いで、室温で一晩攪拌した。粗混合物を濃縮乾固し、カラムクロマトグラフィー(4g、SiO2、ヘキサン中0〜30%エチルアセテート)により精製し、白色固体として5−(2−ナフトイル)−3−イソブチル−3−フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オンを得た(68mg、87%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.77-1.08 (m, 6 H), 1.63-1.78 (m, 1 H), 1.79-1.95 (m, 1 H), 2.28-2.59 (m, 3 H), 3.28-3.60 (m, 1 H), 3.73 (br. s., 1 H), 4.09-4.27 (m, 1 H), 4.85 (br. s., 1 H), 7.29-7.51 (m, 6 H), 7.52-7.62 (m, 2 H), 7.77-7.98 (m, 4 H); MS m/z 426 (M+H) +, 449 (M+23) +, 424 (M−H)−。
R06039−428
3−イソブチル−3−フェニル−5−(3−フェニルプロピオロイル)−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン。R06039−421に関連して記載した手順を利用して3−フェニルプロピオル酸(54mg、0.369mmol)を3−イソブチル−3−フェニル−5−(3−フェニルプロピオロイル)−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オンに変換した(30mg、41%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.84-0.99 (m, 6 H), 1.60-1.75 (m, 1 H), 1.77-1.93 (m, 1 H), 2.27-2.38 (m, 1 H), 2.42-2.56 (m, 2 H), 3.68 (ddd, J=13.37, 7.72, 5.27 Hz, 1 H), 3.98-4.09 (m, 1 H), 4.16-4.26 (m, 1 H), 4.72-4.84 (m, 1 H), 7.29-7.50 (m, 9 H), 7.52-7.62 (m, 1 H); MS m/z 400 (M+H) +, 422 (M+23) +, 398 (M−H)−。
R06039−429
5−シンナモイル−3−イソブチル3−フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン。R06039−421に関連して記載した手順を利用してケイ皮酸(55mg、0.369mmol)を5−シンナモイル−3−イソブチル3−フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オンに変換した。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.81-0.99 (m, 6 H), 1.56-1.74 (m, 1 H), 1.84 (dd, J=14.69, 7.16 Hz, 1 H), 2.35 (dd, J=14.51, 4.71 Hz, 1 H), 2.48 (d, J=1.88 Hz, 2 H), 3.51 (d, J=5.27 Hz, 1 H), 3.93 (dt, J=9.04, 4.52 Hz, 1 H), 4.01-4.12 (m, 1 H), 4.85 (d, J=19.59 Hz, 1 H), 6.87 (d, J=15.45 Hz, 1 H), 7.28-7.45 (m, 8 H), 7.47-7.60 (m, 2 H), 7.69 (d, J=15.45 Hz, 1 H); MS m/z 402 (M+H) +, 424 (M+23) +, 400 (M−H)−。
R06039−432
3−イソブチル−3−フェニル−5−((S)−1,2,3,4−テトラヒドロイソキノリン−3−カルボニル)−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン。THF(5mL)中の(S)−2−(((9H−フルオレン−9−イル)メトキシ)カルボニル)−1,2,3,4−、テトラヒドロイソキノリン−3−カルボン酸(147mg、0.369mmol)、3−イソブチル3−フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン(50mg、0.184mmol)、およびN,N’−ジイソプロピルエチルアミン(112mg、0.870mmolの溶液にBOP試薬(144mg、0.326mmol)を添加し、混合物を室温で16時間攪拌した。反応混合物を濃縮乾固し、DMF(5mL)中20%ピペリジンに再溶解し、室温で1時間撹拌した。粗反応混合物を濃縮し、カラムクロマトグラフィー(12g、SiO2、ヘキサン中0〜100%エチルアセテート)により精製し、白色固体の形態でジアステレオ異性体の混合物として3−イソブチル−3−フェニル−5−((S)−1,2,3,4−テトラヒドロイソキノリン−3−カルボニル)−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オンを得た(54mg、68%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.81-1.01 (m, 6 H), 1.59-1.74 (m, 1 H), 1.75-1.88 (m, 1 H), 2.26-2.52 (m, 3 H), 2.71-2.85 (m, 1 H), 2.87-3.10 (m, 1 H), 3.37-3.72 (m, 2 H), 3.76-3.99 (m, 2 H), 4.00-4.15 (m, 3 H), 4.62-4.86 (m, 1 H), 7.01-7.22 (m, 4 H), 7.28-7.45 (m, 5 H); MS m/z 431 (M+H) +, 429 (M−H)−。
R06039−433
5−((R)−7−ヒドロキシ−1,2,3,4−テトラヒドロイソキノリン−3−カルボニル)−3−イソブチル−3−フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン。THF(5mL)中の(R)−2−(tert−ブトキシカルボニル)−7−ヒドロキシ−1,2,3,4−、テトラヒドロイソキノリン−3−カルボン酸(102mg、0.369mmol)、3−イソブチル−3−フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン(50mg、0.184mmol)、およびN,N’ジイソプロピルエチルアミン(112mg、0.870mmol)の溶液にBOP試薬(144mg、0.326mmol)を添加し、混合物を室温で16時間撹拌した。反応混合物を濃縮乾固し、粗反応混合物を濃縮し、カラムクロマトグラフィー(12g、SiO2、ヘキサン中0〜30%エチルアセテート)により精製した。精製画分をジクロロメタン(5mL)中に再溶解し、0℃に冷却し、TFA(1mL)と共に室温で5時間撹拌した。反応混合物を濃縮乾固し、ジクロロメタン(20mL)中に再溶解し、飽和NaHCO3溶液(5mL)、ブライン(5mL)で洗浄し、脱水し(MgSO4)、濃縮し、白色固体の形態でジアステレオ異性体の混合物として5−((R)−7−ヒドロキシ−1,2,3,4−テトラヒドロイソキノリン−3−カルボニル)−3−イソブチル−3−フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オンを得た(55mg、67%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.81-1.01 (m, 6 H), 1.58-1.88 (m, 2 H), 2.25-2.54 (m, 5 H), 2.65-2.97 (m, 2 H), 3.52 (d, J=6.40 Hz, 1 H), 3.75-3.95 (m, 2 H), 3.98-4.11 (m, 3 H), 4.56-4.86 (m, 1 H), 6.51 (s, 1 H), 6.59-6.73 (m, 1 H), 6.95 (t, J=8.48 Hz, 1 H), 7.28-7.45 (m, 5 H); MS m/z 447 (M+H) +。
R06039−434
3−イソブチル−3−フェニル−5−(3−(ピペリジン−1−イル)プロパノイル)−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン。R06039−421に関連して記載した手順を利用して3−(ピペリジニル)プロパン酸(58mg、0.369mmol)を3−イソブチル−3−フェニル−5−(3−(ピペリジン−1−イル)プロパノイル)−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オンに変換した(35mg、46%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.82-1.00 (m, 6 H), 1.44 (m, J=5.30 Hz, 1 H), 1.53-1.72 (m, 6 H), 1.79 (dd, J=14.51, 7.35 Hz, 1 H), 2.31 (dd, J=14.51, 4.71 Hz, 1 H), 2.37-2.52 (m, 6 H), 2.55-2.70 (m, 4 H), 3.30-3.44 (m, 1 H), 3.73 (dt, J=13.94, 4.90 Hz, 1 H), 3.96 (d, J=19.59 Hz, 1 H), 4.72 (d, J=19.59 Hz, 1 H), 7.29-7.47 (m, 5 H); MS m/z 411 (M+H) +, 409 (M−H)−。
R06039−448
3−イソブチル−3−フェニル−5−(3−(ピロリジン−1−イル)プロパノイル)−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン。R06039−421に関連して記載した手順を利用して3−(ピロリジン−1−イル)プロパン酸1(53mg、0.368mmol)を3−イソブチル−3−フェニル−5−(3−(ピロリジン−1−イル)プロパノイル)−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オンに変換した(10mg、15%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.81-1.00 (m, 6 H), 1.59-1.73 (m, 1 H), 1.74-1.88 (m, 4 H), 2.31 (dd, J=14.51, 4.71 Hz, 2 H), 2.42 (d, J=1.88 Hz, 2 H), 2.47-2.59 (m, 4 H), 2.59-2.70 (m, 2 H), 2.70-2.89 (m, 2 H), 3.37 (dt, J=13.37, 6.50 Hz, 1 H), 3.73 (dt, J=13.85, 4.94 Hz, 1 H), 3.89-4.05 (m, 1 H), 4.72 (d, J=19.59 Hz, 1 H), 7.28-7.47 (m, 5 H); MS m/z 397 (M+H) +, 395 (M−H)−。
R06039−478
3−イソブチル−3−フェニル−5−(3−(ジアゼパン−1−イル)プロパノイル)−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン。R06039−421に関連して記載した手順を利用して3−(ジアゼパン−1−イル)プロパン酸1(53mg、0.368mmol)を3−イソブチル−3−フェニル−5−(3−(ジアゼパン−1−イル)プロパノイル)−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−1に変換した(40mg、52%)。所望の生成物をカラムクロマトグラフィー(12g、SiO2、ジクロロメタン中0〜2.5%メタノール)および半分取HPLCにより精製し、TFA塩として特性解析した。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.80-0.89 (m, 3 H), 0.94 (d, J=6.78 Hz, 3 H), 1.56-2.05 (m, 11 H), 2.10-2.51 (m, 2 H), 3.01 (d, J=4.90 Hz, 4 H), 3.27-3.76 (m, 5 H), 4.01 (d, J=19.59 Hz, 2 H), 4.57 (s, 1 H), 7.30-7.49 (m, 5 H), 11.33-11.59 (m, 1 H); MS m/z 425 (M+H) +。
R06039−440
(E)−5−(3−(2−アミノフェニル)アクリロイル)− 3−イソブチル−3−フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン。(E)−3−イソブチル5−(3−(2−ニトロフェニル)アクリロイル)−3−フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン(25mg、0.092mmol)および塩化スズ(II)水和物(83mg、0.369mmol)の溶液をメタノール(15mL)中で2時間加熱した。反応混合物を室温に冷却し、濃縮乾固し、エチルアセテート(20mL)中に再溶解した。有機溶液を飽和NaHCO3溶液(5mL)、ブライン(5mL)で洗浄し、濃縮した。カラムクロマトグラフィー(4g、SiO2、ジクロロメタン中0〜5%のクロロホルム/メタノール/水酸化アンモニウム80:18:2)により精製し、白色固体として(E)−5−(3−(2−アミノフェニル)アクリロイル)−3−イソブチル−3−フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オンを得た。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.83-1.01 (m, 6 H), 1.62-1.75 (m, 1 H), 1.84 (dd, J=14.69, 7.16 Hz, 1 H), 2.35 (dd, J=14.69, 4.52 Hz, 1 H), 2.43-2.55 (m, 2 H), 3.51 (m, J=5.70 Hz, 1 H), 3.82-4.00 (m, 3 H), 4.09 (d, J=19.59 Hz, 1 H), 4.84 (d, J=19.21 Hz, 1 H), 6.66-6.86 (m, 3 H), 7.18 (t, J=7.54 Hz, 1 H), 7.29-7.48 (m, 6 H), 7.83 (d, J=15.07 Hz, 1 H); MS m/z 417 (M+H) +, 439 (M+23) +, 415 (M−H)−。
R06039−441
5−シンナモイル−3−イソブチル3−フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン。THF(5mL)中の3−イソブチル3−フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−1(50mg、0.184mmol)の溶液にtrans−桂皮アルデヒド(49mg、0.369mmol)を添加し、反応混合物を室温で1時間撹拌した。ナトリウムトリアセトキシボロヒドリド(117mg、0.553mmol)を添加し、反応混合物を室温でさらに2時間攪拌した。エチルアセテート(10mL)を添加し、有機溶液を飽和NaHCO3(10mL)、ブライン(10mL)で洗浄し、脱水(MgSO4)し、濃縮した。残渣をカラムクロマトグラフィー(12g、SiO2、ヘキサン中0〜20%エチルアセテート)により精製し、白色固体として5−シンナモイル−3−イソブチル3−フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オンを得た(45mg、63%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.73-1.05 (m, 6 H), 1.54-1.84 (m, 2 H), 2.20-2.48 (m, 3 H), 2.52-2.66 (m, 1 H), 2.73-2.89 (m, 1 H), 2.99-3.14 (m, 1 H), 3.19-3.37 (m, 2 H), 3.43 (d, J=17.71 Hz, 1 H), 6.23 (dt, J=15.82, 6.59 Hz, 1 H), 6.44-6.57 (m, 1 H), 7.20-7.46 (m, 10 H); MS m/z 388 (M+H) +, 410 (M+23) +, 386 (M−H)−。
R06039−444
5−(1H−インドール−2−カルボニル)−3−イソブチル−3−フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン。R06039−421に関連して記載した手順を利用して1H−インドール−2−カルボン酸(30mg、0.184mmol)を5−(1H−インドール−2−カルボニル)− 3−イソブチル−3−フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オンに変換した(26mg、35%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.79-1.02 (m, 6 H), 1.62-1.77 (m, 1 H), 1.85 (dd, J=14.51, 7.35 Hz, 1 H), 2.35 (dd, J=14.69, 4.52 Hz, 1 H), 2.46-2.71 (m, 2 H), 3.73-3.89 (m, 1 H), 4.19-4.43 (m, 2 H), 4.82 (d, J=19.59 Hz, 1 H), 6.76 (br. s., 1 H), 7.10-7.22 (m, 1 H), 7.27-7.48 (m, 7 H), 7.68 (d, J=7.91 Hz, 1 H), 9.10 (br. s., 1 H); MS m/z 415 (M+H) +, 437 (M+23) +, 413 (M−H)−。
R06039−445
5−((S)−2−アミノ−3−フェニルプロパノイル)−3−イソブチル−3−フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン。R06039−432に関連して記載した手順を利用して(S)−2−(((9H−フルオレン9−イル)メトキシ)カルボニルアミノ)−3−フェニルプロパン酸(30mg、0.184mmol)を−5−((S)−2−アミノ−3−フェニルプロパノイル)−3−イソブチル−3−フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オンに変換した。所望の生成物をカラムクロマトグラフィー(4g、SiO2、ジクロロメタン中0〜10%クロロホルム/メタノール/水酸化アンモニウム80:18:2)により精製し、白色固体として単離した(38mg、47%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.77-1.01 (m, 6 H), 1.59-1.87 (m, 2 H), 1.89-2.23 (m, 1 H), 2.30 (dd, J=14.51, 4.71 Hz, 1 H), 2.68-3.05 (m, 4 H), 3.15-3.63 (m, 3 H), 3.83-4.00 (m, 2 H), 4.68 (dd, J=19.59, 6.40 Hz, 1 H), 6.93-7.46 (m, 10 H); MS m/z 419 (M+H) +, 441 (M+23) +, 417 (M−H)−。
R06039−446
5−ベンゾイル−3−イソブチル3−フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン。R06039−427に関連して記載した手順を利用して塩化ベンゾイル(35mg、0.184mmol)を5−ベンゾイル−3−イソブチル3−フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オンに変換した(38mg、55%)。1H NMR (300 MHz, クロロホルム-d) δppm 0.78-1.06 (m, 6 H), 1.62-1.96 (m, 2 H), 2.27-2.59 (m, 3 H), 3.20-3.45 (m, 1 H), 3.54-3.81 (m, 1 H), 4.10 (d, J=19.97 Hz, 1 H), 4.67-4.97 (m, 1 H), 7.30-7.56 (m, 10 H); MS m/z 376 (M+H) +, 398 (M+23) +, 374 (M−H)−。
R06039−447
3−イソブチル−3−フェニル−5−((R)−1、2、3、4−テトラヒドロイソキノリン−3−カルボニル)−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン。R06039−433に関連して記載した手順を利用して(R)−2−(tert−ブトキシカルボニル)−1,2,3,4−テトラヒドロイソキノリン−3−カルボン酸(102mg、0.368mmol)を3−イソブチル−3−フェニル5−((R)−1、2、3、4−テトラヒドロイソキノリン−3−カルボニル)−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オンに変換した(15mg、19%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.81-1.03 (m, 6 H), 1.58-1.74 (m, 1 H), 1.80 (dd, J=14.69, 7.16 Hz, 1 H), 1.93-2.18 (m, 1 H), 2.26-2.64 (m, 3 H), 2.71-2.85 (m, 1 H), 2.98 (dd, J=16.58, 11.30 Hz, 1 H), 3.36-3.76 (m, 1 H), 3.78-4.07 (m, 3 H), 4.08-4.17 (m, 2 H), 4.79 (d, J=19.59 Hz, 1 H), 6.99-7.23 (m, 4 H), 7.29-7.46 (m, 5 H); MS m/z 431 (M+H) +, 429 (M−H)−。
R06039−449
N−((2S)−1−(3−イソブチル−1−オキソ3−フェニル−6,7−ジヒドロフロ[3,4−c]ピリジン−5(1H,3H,4H)−イル)−1−オキソ−3−フェニルプロパン2−イル)ベンズアミド。R06039−427に関連して記載した手順を利用して塩化ベンゾイル(6mg、0.041mmol)を5−((S)−2−アミノ−3−フェニルプロパノイル)−3−イソブチル−3−フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン(16mg、0.037mmol)に変換し、N−((2S)−1−(3−イソブチル−1−オキソ−3−フェニル−6,7−ジヒドロフロ[3,4−c]ピリジン−5(1H,3H,4H)−イル)−1−オキソ−3−フェニルプロパン2−イル)ベンズアミドを得た。所望の生成物をカラムクロマトグラフィー(4g、SiO2、ヘキサン中0〜100%ジクロロメタン/ジエチルエーテル)により精製し、無色油として単離した(13mg、69%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.76-0.95 (m, 6 H), 1.46-1.92 (m, 4 H), 2.06-2.39 (m, 2 H), 2.99-3.37 (m, 2 H), 3.40-3.62 (m, 1 H), 3.82-4.07 (m, 1 H), 4.60 (d, J=19.59 Hz, 1 H), 5.15-5.30 (m, 1 H), 5.31-5.50 (m, 1 H), 6.94-7.57 (m, 13 H), 7.70-7.85 (m, 2 H); MS m/z 523 (M+H) +, 521 (M−H)−。
R06039−450およびR06039−451
5−(インドリン−2−カルボニル)−3−イソブチル−3−フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン(ジアステレオ異性体の混合物)。R06039−421に関連して記載した手順を利用してインドリン−2−カルボン酸(60mg、0.368mmol)を5−(インドリン−2−カルボニル)−3−イソブチル−3−フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オンに変換した。所望の生成物をカラムクロマトグラフィー(12g、SiO2、ジクロロメタン中0〜2.5%メタノール)により精製し、ジアステレオマーの混合物として単離した。ジアステレオマーA(上側TLCスポット)、無色油(28mg、369%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.76-1.05 (m, 6 H), 1.60-1.87 (m, 2 H), 2.23-2.60 (m, 3 H), 3.09 (dd, J=15.64, 5.09 Hz, 1 H), 3.44-3.61 (m, 2 H), 3.63-3.77 (m, 1 H), 4.04 (d, J=19.59 Hz, 1 H), 4.24-4.46 (m, 1 H), 4.49-4.77 (m, 2 H), 6.67-6.86 (m, 2 H), 6.97-7.14 (m, 2 H), 7.28-7.47 (m, 5 H); MS m/z 417 (M+H) +, 439 (M+23) +, 415 (M−H)−。ジアステレオマーB(下側TLCスポット)、無色油(28mg、36%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.80-1.01 (m, 6 H), 1.48-1.85 (m, 2 H), 2.25-2.56 (m, 2 H), 3.15 (dd, J=15.64, 5.46 Hz, 1 H), 3.31-3.62 (m, 2 H), 3.74-3.87 (m, 1 H), 3.94-4.20 (m, 2 H), 4.35-4.46 (m, 1 H), 4.55-4.77 (m, 2 H), 6.70-6.83 (m, 2 H), 7.07 (d, J=5.27 Hz, 2 H), 7.29-7.49 (m, 5 H); MS m/z 417 (M+H) +, 439 (M+23) +, 415 (M−H)−。
R06039−452
trans−3−イソブチル−3−フェニル−5−(2つのフェニルシクロプロパンカルボニル)−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン。R06039−421に関連して記載した手順を利用してtrans−2−フェニルシクロプロピルカルボン酸(60mg、0.368mmol)をtrans−3−イソブチル−3−フェニル−5−(2−フェニルシクロプロパンカルボニル)−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オンに変換した(29.3mg、38%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.83-0.99 (m, 6 H), 1.28-1.38 (m, 2 H), 1.59-1.74 (m, 2 H), 1.80 (dd, J=14.51, 7.35 Hz, 1 H), 1.93-2.03 (m, 1 H), 2.25-2.56 (m, 3 H), 3.37-3.59 (m, 1 H), 3.80-4.04 (m, 1 H), 3.88-3.89 (m, 1 H), 4.74 (dd, J=19.59, 14.69 Hz, 1 H), 7.11 (t, J=6.78 Hz, 2 H), 7.17-7.43 (m, 8 H); MS m/z 417 (M+H) +, 439 (M+23) +, 415 (M−H)−。
R06039−453
cis−3−イソブチル−3−フェニル−5−(2−フェニルシクロプロパンカルボニル)−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン。R06039−421に関連して記載した手順を利用してcis−2−フェニルシクロプロピルカルボン酸(60mg、0.368mmol)をcis−3−イソブチル−3−フェニル−5−(2−フェニルシクロプロパンカルボニル)−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オンに変換した(25mg、33%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.77-0.93 (m, 6 H), 1.18-1.38 (m, 2 H), 1.48-1.80 (m, 3 H), 1.88 (dt, J=12.62, 6.12 Hz, 1 H), 2.11-2.30 (m, 2 H), 2.46-2.58 (m, 1 H), 3.07 (ddd, J=13.85, 9.51, 4.14 Hz, 1 H), 3.43-3.55 (m, 1 H), 4.00-4.14 (m, 1 H), 4.70 (d, J=19.59 Hz, 1 H), 7.03-7.43 (m, 10 H); MS m/z 417 (M+H) +, 439 (M+23) +, 415 (M−H)−。
R06039−454
5−(1−ナフトイル)−3−イソブチル3−フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン。R06039−421に関連して記載した手順を利用して1−ナフトエ酸(63mg、0.368mmol)を5−(1−ナフトイル)−3−イソブチル3−フェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オンに変換した(15.6mg、20%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.80-1.07 (m, 6 H), 1.65-1.82 (m, 1 H), 1.84-2.01 (m, 1 H), 2.23 (br. s., 1 H), 2.36-2.53 (m, 1 H), 3.04-3.30 (m, 1 H), 3.43 (td, J=8.95, 4.33 Hz, 1 H), 3.63-4.12 (m, 1 H), 4.25 (t, J=19.78 Hz, 1 H), 4.96-5.27 (m, 1 H), 7.31-7.59 (m, 8 H), 7.62-7.79 (m, 1 H), 7.81-7.98 (m, 3 H); MS m/z 426 (M+H) +, 448 (M+23) +, 424 (M−H)−。
R06039−237
3−イソブチル−1−オキソ−3−フェニルN−(2−(ピペリジン−1−イル)エチル)−3,4,6,7−テトラヒドロフロ[3,4−c]ピリジン−5(1H)−カルボチオアミド。ジクロロメタン(5mL)中の3−フェニル−3−イソブチル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン(50mg、0.18mmol)および1−(イソチオシアナトエチル)ピペリジン(45.7mg、0.28mmol)の混合物を室温で1時間攪拌した。溶媒を除去し、得られた残渣をシリカで精製し、所望の生成物を得た(52mg、64.0%)。1H NMR (300 Hz, CDCl3) δ 0.87 (t, J = 6.0, 3H), 0.96 (t, d = 6.0, 3H), 1.40-1.63 (m, 6H), 1.63-1.75 (m, 1H), 1.78-1.90 (m, 1H), 2.30-2.60 (m, 10H), 2.58-2.70 (m, 3H), 3.83-3.95 (m, 1H), 4.26 (d, J = 18.0, 1H), 5.17 (d, J = 18.0, 1H), 7.02 (br s, 1H), 7.26-7.40 (m, 5H)。
R06039−244
N−ベンジル−3−(3−(ベンジルオキシ)フェニル)−3−メチル−1−オキソ−3,4,6,7−テトラヒドロフロ[3,4−c]ピリジン−5(1H)−カルボキサミド。ジクロロメタン(5mL)中の3−(3−ベンジルオキシフェニル)−3−メチル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン(50mg、0.15mmol)およびベンジルイソシアネート(27μL、0.22mmol)の混合物を室温で1時間撹拌した。溶媒を除去し、得られた残渣をシリカで精製し、所望の生成物を得た(43mg、61.6%)。1H NMR (300 Hz, CDCl3) δ 1.84 (s, 3H), 2.38 (br s, 2H), 3.26-3.32 (m, 1H), 3.51-3.58 (m, 1H), 3.79 (d, J = 18.0, 1H), 4.37-4.30 (m, 3H), 4.94 (t, J = 6.0, 1H), 5.04 (s, 2H), 6.87-6.94 (m, 3H), 7.24-7.39 (m, 11H)。
R06039−243
N−ベンジル−3−(3−ヒドロキシフェニル)−3−メチル−1−オキソ−3,4,6,7−テトラヒドロフロ[3,4−c]ピリジン−5(1H)−カルボキサミド。ジクロロメタン(5mL)中の3−(3−ヒドロキシフェニル)−3−メチル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン(75mg、0.31mmol)およびベンジルイソシアネート(48μL、0.40mmol)の混合物を室温で1時間撹拌した。溶媒を除去し、得られた残渣をシリカで精製し、所望の生成物を与えた(68mg、58.8%)。1H NMR (300 Hz, CDCl3) δ 1.82 (s, 3H), 2.39 (br s, 2H), 3.30-3.40 (m, 1H), 3.42-3.55 (m, 1H), 3.94 (d, J = 18.0, 1H), 4.25-4.40 (m, 3H), 4.97 (t, J = 6.0, 1H), 6.77-6.84 (m, 2H), 7.15-7.38 (m, 7H)。
R06039−242
N−ベンジル−3−(3−クロロフェニル)−3−イソブチル−1−オキソ−3,4,6,7−テトラヒドロフロ[3,4−c]ピリジン−5(1H)−カルボキサミド。ジクロロメタン(5mL)中の3−(3−クロロフェニル)−3イソブチル−4,5,6,7−[3,4−c]ピリジン−1(3H)−オン(70mg、0.23mmol)およびベンジルテトラヒドロフロイソシアネート(42μL、0.34mmol)の混合物を室温で1時間撹拌した。溶媒を除去し、得られた残渣をシリカで精製し、所望の生成物を得た(105mg、100%)。1H NMR (300 Hz, CDCl3) δ 0.85 (d, J = 6.0, 3H), 0.93 (d, J = 6.0, 3H), 1.55-1.70 (m, 1H), 1.72-1.82 (m, 1H), 2.20-2.40 (m, 3H), 3.15-3.29 (m, 1H), 3.49-3.61 (m, 1H), 3.89 (d, J = 18.0, 1H), 4.39 (d, J = 3.0, 2H), 4.48 (d, J = 18.0, 1H), 5.22 (t, J = 6.0, 1H), 7.14-7.38 (m, 9H)。
R06039−246
3−イソブチル−1−オキソ−3−フェニル−3,4,6,7−テトラヒドロフロ[3,4−c]ピリジン−5(1H)−カルボキシミドアミド。ジメチルホルムアミド(10mL)中の3−フェニル−3−イソブチル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン(170mg、0.60mmol)、1、3−ビス−tert−ブトキシカルボニル−2−メチル−2−チオプソイドウレア(346mg、1.20mmol)、塩化水銀(II)(281mg、0.60mmol)、およびトリエチルアミン(0.2mL、1.20mmol)の混合物を50℃で20h攪拌した。反応を室温に冷却し、濾過した。飽和重炭酸ナトリウム溶液(15mL)を濾液に添加し、混合物をエチルアセテート(3×50mL)で抽出した。合わせた有機層を水およびブラインで洗浄し、MgSO4で脱水し、濃縮し、粗生成物を得た。さらなる精製を行うことなく、材料を次の工程で使用した。
R06039−222
N−ベンジル−3−ブチル−1−オキソ−3−フェニル−3,4,6,7−テトラヒドロフロ[3,4−c]ピリジン−5(1H)−カルボキサミド。ベンジルイソシアネート(.02g、0.14mmol)をジクロロメタン(5mL)中の3−フェニル−3−ブチル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン(化合物2と同様にして調製された 0.025g、0.09mmol)の溶液に添加し、室温で1時間撹拌した。溶媒を除去し、得られた残渣をシリカで精製し、所望の生成物を得た(0.018g、50%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.79 (t, J=7.16 Hz, 3 H), 1.06-1.33 (m, 4 H), 1.83-1.97 (m, 1 H), 2.14-2.43 (m, 3 H), 3.18-3.31 (m, 1 H), 3.36-3.51 (m, 1 H), 3.85 (dt, J=18.84, 2.64 Hz, 1 H), 4.26-4.39 (m, 3 H), 4.90 (t, J=5.27 Hz, 1 H), 7.11-7.36 (m, 10 H)。
R06039−225
N,3−ジベンジル−1−オキソ−3−フェニル−3,4,6,7−テトラヒドロフロ[3,4−c]ピリジン−5(1H)−カルボキサミド。ベンジルイソシアネート(.026g、0.2mmol)をジクロロメタン(5mL)中の3−フェニル−3−ベンジル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン(化合物2と同様にして調製された 0.05g、0.16mmol)の溶液に添加し、室温で1時間撹拌した。溶媒を除去し、得られた残渣をシリカで精製し、所望の生成物を得た(0.036g、50%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 1.93-2.08 (m, 1 H), 2.11-2.23 (m, 1 H), 3.11-3.35 (m, 2 H), 3.39-3.49 (m, 1 H), 3.52-3.62 (m, 1 H), 3.97-4.08 (m, 1 H), 4.42 (dd, J=5.27, 2.64 Hz, 2 H), 4.59 (dt, J=19.12, 2.12 Hz, 1 H), 4.90 (t, J=5.46 Hz, 1 H), 7.15-7.47 (m, 15 H)。
R06039−226
N−ベンジル−3−イソブチル−1−オキソ3−フェニル−3,4,6,7−テトラヒドロフロ[3,4−c]ピリジン−5(1H)−カルボキサミド。ベンジルイソシアネート(.02の9g、0.22mmol)をジクロロメタン(5mL)中の3−フェニル−3−イソブチル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン(化合物2と同様にして調製された 0.05g、0.184mmol)の溶液に添加し、室温で1時間撹拌した。溶媒を除去し、得られた残渣をシリカで精製し、所望の生成物を得た(0.051g、68%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.85 (d, J=6.40 Hz, 3 H), 0.89-0.98 (m, 3 H), 1.65 (ddd, J=13.56, 6.78, 4.90 Hz, 1 H), 1.73-1.87 (m, 1 H), 2.24-2.40 (m, 3 H), 3.27 (ddd, J=13.56, 7.35, 5.09 Hz, 1 H), 3.54 (dt, J=13.66, 5.23 Hz, 1 H), 3.92 (dt, J=18.84, 2.64 Hz, 1 H), 4.40 (d, J=5.65 Hz, 2 H), 4.49 (dt, J=19.12, 2.12 Hz, 1 H), 5.00 (t, J=5.46 Hz, 1 H), 7.21-7.42 (m, 10 H)。
R06039−221
N−ベンジル−1’−オキソ−1’,4’,6’,7’,10,11−ヘキサヒドロ−5’H−スピロ[ジベンゾ[a,d][7]アヌレン−5,3’−フロ[3,4−c]ピリジン]−5’−カルボキサミド。ベンジルイソシアネート(0.03g、0.21mmol)をジクロロメタン(5mL)中の1’,4’,6’,7’,10,11−ヘキサヒドロ−5’H−スピロ[ジベンゾ[a,d][7]アヌレン−5,3−’フロ[3,4−c]ピリジン−1(3H)−オン(化合物2と同様にして調製された 0.053g、0.14mmol)の溶液に添加し、室温で1時間撹拌した。溶媒を除去し、得られた残渣をシリカで精製し、所望の生成物を得た(0.048g、76%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 2.49 (tt, J=5.32, 2.59 Hz, 2 H), 3.05-3.19 (m, 4 H), 3.44 (t, J=5.65 Hz, 2 H), 4.08-4.12 (m, 2 H), 4.34 (d, J=5.27 Hz, 2 H), 4.85 (t, J=5.27 Hz, 1 H), 7.12-7.34 (m, 13 H)。
R06039−233
N−ベンジル−1’−オキソ−6,6’,7,7’,8,9−ヘキサヒドロ−1’H−スピロ[ベンゾ[7]アヌレン−5,3’−フロ[3,4−c]ピリジン]−5」(4’H)−カルボキサミド。ベンジルイソシアネート(0.033g、0.25mmol)をジクロロメタン(5mL)中の6’,7,7’,8,9−ヘキサヒドロ−1’H−スピロ[ベンゾ[7]アヌレン−5,3’−フロ[3,4−c]ピリジン]−1(3H)−オン(化合物2と同様にして調製された 0.068g、0.25mmol)の溶液に添加し、室温で1時間撹拌した。溶媒を除去し、得られた残渣をシリカで精製し、所望の生成物を得た(0.071g、71%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 1.62-1.77 (m, 1 H), 1.79-2.11 (m, 4 H), 2.12-2.27 (m, 1 H), 2.35-2.44 (m, 2 H), 2.78-2.92 (m, 1 H), 2.99-3.12 (m, 1 H), 3.53 (td, J=5.56, 2.07 Hz, 2 H), 4.18-4.32 (m, 1 H), 4.33-4.45 (m, 3 H), 5.14 (t, J=5.46 Hz, 1 H), 6.91-6.98 (m, 1 H), 7.07-7.38 (m, 8 H)。
R06039−240
N−ベンジル3−(ヒドロキシメチル)−1−オキソ−3−フェニル−3,4,6,7−テトラヒドロフロ[3,4−c]ピリジン−5(1H)−カルボキサミド。ベンジルイソシアネート(0.069g、0.52mmol)をジクロロメタン(10mL)中の3−フェニル3−ヒドロキシメチル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン(化合物2と同様にして調製された 0.128g、0.52mmol)の溶液に添加し、室温で1時間撹拌した。溶媒を除去し、得られた残渣をシリカで精製し、所望の生成物を得た(0.101g、51%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 2.18-2.47 (m, 2 H), 3.19-3.31 (m, 1 H), 3.63 (dt, J=13.75, 4.99 Hz, 1 H), 3.94-4.07 (m, 3 H), 4.07-4.18 (m, 1 H), 4.35 (d, J=5.65 Hz, 2 H), 4.47 (d, J=18.84 Hz, 1 H), 5.50 (t, J=5.65 Hz, 1 H), 7.15-7.25 (m, 4 H), 7.27-7.42 (m, 6 H)。
R06039−241
(5−(ベンジルカルバモイル)−1−オキソ−3−フェニル−1,3,4,5,6,7−ヘキサヒドロフロ[3,4−c]ピリジン−3−イル)メチルアセテート。R06039−240(0.050g、0.13mmol)をジクロロメタン(5mL)およびNEt3(16mg、0.016mmol)に溶解し、0℃に冷却した。塩化アセチル(13mg、0.16mmol)を反応混合物に添加し、0℃で30分間攪拌し、濃縮乾固した。粗混合物をカラムクロマトグラフィー(4g、SiO2、ヘキサン中0〜100%エチルアセテート)により精製し、(5−(ベンジルカルバモイル)−1−オキソ−3−フェニル−1,3,4,5,6,7−ヘキサヒドロフロ[3,4−c]ピリジン−3−イル)メチルアセテートを得た(0.031g、57%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 2.00 (s, 3 H), 2.42 (tt, J=4.85, 2.68 Hz, 2 H), 3.33 (ddd, J=13.66, 6.50, 5.09 Hz, 1 H), 3.58-3.69 (m, 1 H), 4.01 (dt, J=18.84, 2.64 Hz, 1 H), 4.35-4.45 (m, 3 H), 4.50 (d, J=12.06 Hz, 1 H), 4.85 (d, J=12.06 Hz, 1 H), 4.94 (t, J=5.46 Hz, 1 H), 7.23-7.45 (m, 10 H)。
R06039−245
N−ベンジル−3−ネオペンチル−1−オキソ−3−フェニル−3,4,6,7−テトラヒドロフロ[3,4−c]ピリジン−5(1H)−カルボキサミド。ベンジルイソシアネート(0.02g、0.15mmol)をジクロロメタン(10mL)中の3−フェニル−3−ネオペンチル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン(化合物2と同様にして調製された 0.043g、0.15mmol)の溶液に添加し、室温で1時間撹拌した。溶媒を除去し、得られた残渣をシリカで精製し、所望の生成物を得た(0.041g、63%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.87 (s, 9 H), 1.88 (d, J=14.88 Hz, 1 H), 2.28-2.43 (m, 2 H), 2.38 (d, J=14.88 Hz, 1 H), 3.16-3.28 (m, 1 H), 3.53 (s, 1 H), 3.96 (dt, J=19.03, 2.50 Hz, 1 H), 4.42 (d, J=5.65 Hz, 2 H), 4.59 (s, 1 H), 4.88-4.99 (m, 1 H), 7.20-7.41 (m, 10 H)。
R06039−270
N−ベンジル−3,3−ジイソブチル−1−オキソ−3,4,6,7−テトラヒドロフロ[3,4−c]ピリジン−5(1H)−カルボキサミド。ベンジルイソシアネート(0.04g、0.3mmol)をジクロロメタン(10mL)中の3,3−ジイソブチル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン(化合物2と同様にして調製された0.075g、0.30mmol))の溶液に添加し、室温で1時間撹拌した。溶媒を除去し、得られた残渣をシリカで精製し、所望の生成物を得た(0.042g、36%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.75-0.93 (m, 12 H), 1.39-1.60 (m, 4 H), 1.77-1.92 (m, 2 H), 2.28-2.45 (m, 2 H), 3.36-3.55 (m, 2 H), 4.03-4.18 (m, 2 H), 4.34-4.48 (m, 2 H), 4.85-5.03 (m, 1 H), 7.17-7.39 (m, 5 H)。
R06039−286
3−イソブチル−N−(2−(4−メチルピペラジン−1−イル)ベンジル)−1−オキソ−3−フェニル−3,4,6,7−テトラヒドロフロ[3,4−c]ピリジン−5(1H)−カルボキサミド。R06039−275に関連して記載したのと類似した手順によりトリホスゲンおよびトリエチルアミンを用いて[2−(4−メチルピペラジン−1−イル)フェニル]メタンアミンを3−シクロヘキシル−3−イソブチル−N−((2−(4−メチルピペラジン−1−イル)シクロヘキシル)メチル)−1−オキソ−3,4,6,7−テトラヒドロフロ[3,4−c]ピリジン−5(1H)−カルボキサミド変換した。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.82-0.90 (m, 3 H), 0.90-1.00 (m, 3 H), 1.58-1.73 (m, 1 H), 1.74-1.88 (m, 1 H), 2.25-2.46 (m, 3 H), 2.34 (s, 3 H), 2.49-2.67 (m, 4 H), 2.98 (t, J=4.90 Hz, 4 H), 3.23-3.38 (m, 1 H), 3.55 (dt, J=13.56, 5.09 Hz, 1 H), 3.93 (dt, J=19.21, 2.64 Hz, 1 H), 4.43-4.59 (m, 3 H), 6.05 (t, J=5.27 Hz, 1 H), 7.02-7.19 (m, 2 H), 7.22-7.43 (m, 7 H)。
R06039−202
N−ベンジル−3−オキソ−1,1−ジフェニル−3,4,6,7−テトラヒドロフロ[3,4−c]ピリジン−5(1H)−カルボキサミド。3−ジイソプロピルアミドピリジンをベンゾフェノンにカップリングして中間体1,1−ジフェニルフロ[3,4−c]ピリジン−3−オンを得たこと以外はR06039−222と同様にして、標記化合物を合成した。1,1−ジフェニルフロ[3,4−c]ピリジン−3−オンを同様にして3,3−ジフェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン(化合物2)に還元し、1,1−ジフェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−3−オンを得た。次いで、ベンジルイソシアネート(0.023g、0.17mmol)をジクロロメタン(10mL)中の1,1−ジフェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−3−オン(0.05g、0.17mmol)の溶液に添加し、室温で1時間撹拌した。溶媒を除去し、得られた残渣をシリカで精製し、所望の生成物を得た(0.038g、50%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 3.66-3.70 (dd, 2H, J = 6Hz), 4.10-4.15 (m, 2H), 4.34-4.42 (dd, 2H, J = 6Hz), 5.09 (t, 1 H, J = 6Hz), 7.20-7.38 (m, 15 H)。
R06039−211
(cis3a,7a)−N−ブチル−1−オキソ−3,3−ジフェニルヘキサヒドロフロ[3,4−c]ピリジン−5(1H)−カルボキサミド。10℃のMeOH中の3,3−ジフェニル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン(0.16g、0.55mmol)(20mL)をNaBH4(0.11g、3.0mmol)およびNiCl2水和物(0.04g、0.03mmol)で処理した。反応混合物は黒色に変化した。これを2時間かけて室温に達するようにした。反応を飽和NaHCO3(15mL)でクエンチし、EtOAc(3×20mL)で抽出した。抽出物を脱水し(MgSO4)、減圧下で濃縮した。得られた油をシリカ(クロロホルム/MeOH、NH4OH、80:18:2)で精製し、0.67mg(42%)のcis1,1−ジフェニル−ヘキサヒドロフロ[3,4−c]ピリジン−3−オンを得た。R06039−221と同様にして生成物をブチルイソシアネートで処理し、(cis3a,7a)−N−ブチル−1−オキソ−3,3−ジフェニルヘキサヒドロフロ[3,4−c]ピリジン−5(1H)−カルボキサミドを得た。
R060039−212
(trans3a,7a)−N−ブチル−1−オキソ−3,3−ジフェニルヘキサヒドロフロ[3,4−c]ピリジン−5(1H)−カルボキサミド。cis1,1−ジフェニルヘキサヒドロフロ[3,4−c]ピリジン−3−オン(0.12g、0.41mmol)をTHF中のNaH(60%、0.04g、1.02mmol)で処理し、0℃で30分間撹拌した。溶液をH2O(20mL)で希釈し、EtOAc(3×20mL)で抽出した。得られた有機層を合わせ、脱水し(MgSO4)、減圧下で濃縮し、シス異性体とトランス異性体との混合物として油を得た。R06039−221と同様にして混合物をブチルイソシアネートで処理した。シス異性体とトランス異性体との得られた混合物を分取HPLCで精製し、収率23%で純粋なトランス異性体を得た。1H NMR (300 MHz, クロロホルム-d) δ ppm 0.94 (t, J=7.16 Hz, 3 H), 1.30-1.71 (m, 6 H), 2.10-2.43 (m, 2 H), 2.59-2.90 (m, 2 H), 3.16-3.38 (m, 2 H), 3.74 (d, J=12.43 Hz, 1 H), 4.49 (br. s., 1 H), 4.96 (d, J=10.55 Hz, 1 H), 7.12-7.22 (m, 2 H), 7.28-7.44 (m, 6 H), 7.51-7.59 (m, 2 H)。
R06039−231
N−ベンジル3−(2−(ジメチルアミノ)エチル) −1−オキソ−3−フェニル−3,4,6,7−テトラヒドロフロ[3,4−c]ピリジン−5(1H)−カルボキサミド。ベンジルイソシアネート(0.017g、0.13mmol)をジクロロメタン(10mL)中の3−フェニル3−(2−ジメチルアミノ)エチル−4,5,6,7−テトラヒドロフロ[3,4−c]ピリジン−1(3H)−オン(化合物2と同様にして調製された 0.037g、0.13mmol)の溶液に添加し、室温で1時間撹拌した。溶媒を除去し、得られた残渣をシリカで精製し、所望の生成物を得た(0.015g、27%)。1H NMR (300 MHz, クロロホルム-d) δ ppm 2.15-2.19 (m, 6 H), 2.20-2.53 (m, 6 H), 3.23-3.38 (m, 1 H), 3.59 (d, J=13.56 Hz, 1 H), 3.86-3.98 (m, 1 H), 4.38-4.44 (m, 2 H), 4.49 (t, J=2.07 Hz, 1 H), 4.98 (br. s., 1 H), 7.20-7.44 (m, 10 H)。
インビトロ
実施例55:結合アッセイ
機能決定:NPSレセプターでの機能的アンタゴニストの同定では、無差別性(promiscuous)Gqタンパク質Ga16を安定して過剰発現するCHO細胞系RD−HGA16細胞(Molecular Devices)を利用した。各NPSレセプター変異体(NPS Ile 260 107およびAsn107)を安定に発現する2つの個別の細胞系を形成した。細胞にカルシウム感受性色素calcium3(Molecular Devices)を1時間負荷し、化合物を、FlexStationアッセイにおけるカルシウム動員による測定で、固有活性およびNPS活性阻害能に関して独立した実験でアッセイした。単一濃度の試験化合物の存在下および不在下で8点半対数NPS濃度反応曲線を作成することにより、試験化合物のKe値を決定した。NPS(A)およびNPS+試験化合物(A0)に対してEC50値を計算し、これらを用いて試験化合物Keを計算した。Prism(v5 forWindows, GraphPad Software; San Diego, CA)を用いて3パラメーターロジスティック式を濃度反応データにあてはめて、EC50値を計算した。
NPS誘導自発運動刺激の阻害方法:すべての試験で雄C57BL6マウスを使用する。マウスの脳室内にNPS(0.01、0.1、1nmol)または対照として生理食塩水(全量体積:2μl)を注入する。同時に、アンタゴニストを腹腔内注入で投与し、自発運動活動をモニターする。オープンフィールドは、自動ビデオ運動システム(PolyTrack, San Diego Instruments)によりモニターされる4つの近接した活動チャンバー(各50×50×50cm)からなる。自発運動活動を10分間にわたり記録する。仮想中心ゾーンを各観察範囲の中央の15×15cm2と規定する。中心ゾーンの照明は150ルクスである。立上り活動、よじ登り活動、および水平活動を定量して統計的有意性を評価する。
(1) Sato, S.S., Y.; Miyajima, N.; Yoshimura, K., 2002. Novel G-protein coupled receptor protein and DNA thereof. World Patent Application WO 02/31145 A1
(2) Xu, Y. L.; Reinscheid, R. K.; Huitron-Resendiz, S.; Clark, S. D.; Wang, Z.; Lin, S. H.; Brucher, F. A.; Zeng, J.; Ly, N. K.; Henriksen, S. J.; de Lecea, L.; Civelli, O. Neuropeptide S: a neuropeptide promoting arousal and anxiolytic-like effects. Neuron 2004, 43, 487-497.
(3) Rizzi, A.; Vergura, R.; Marzola, G.; Ruzza, C.; Guerrini, R.; Salvadori, S.; Regoli, D.; Calo, G. Neuropeptide S is a stimulatory anxiolytic agent: a behavioural study in mice. Br. J. Pharmacol. 2008.
(4) Reinscheid, R. K.; Xu, Y. L.; Okamura, N.; Zeng, J.; Chung, S.; Pai, R.; Wang, Z.; Civelli, O. Pharmacological characterization of human and murine neuropeptide s receptor variants. J Pharmacol Exp Ther 2005, 315, 1338-1345.
(5) Meis, S.; Bergado-Acosta, J. R.; Yanagawa, Y.; Obata, K.; Stork, O.; Munsch, T. Identification of a neuropeptide S responsive circuitry shaping amygdala activity via the endopiriform nucleus. PLoS ONE 2008, 3, e2695.
(6) Gottlieb, D. J.; O'Connor, G. T.; Wilk, J. B. Genome-wide association of sleep and circadian phenotypes. BMC Med Genet 2007, 8 Suppl 1, S9.
Claims (15)
- 構造(I):
[式中、
点線は、飽和結合または不飽和結合を表し、ただし、すべての点線が不飽和結合を表すか、eとfとの間の点線のみが不飽和結合であるか、またはどの点線も不飽和結合を表さないかのいずれかであり、
X1は、CH、CH2、N、またはN−R3であり、かつX2は、X1がNのときCHであり、X2は、X1がN−R3のときCH2であり、X2は、X1がCHのときNであり、かつX2は、X1がCH2のときN−R3であり、
mは、0または1であり、
波線は、シス配置またはトランス配置を有する炭素に結合された結合を示し、
Y1は、OまたはSであり、Y2はO、NH、またはCH2であり、
R1およびR2は、一緒になって、構造(II):
(ここで、pは、環Bが存在するとき0または2であり、かつpは、環Bが存在しないとき2である)
であり、または
R1およびR2は、それぞれ独立して、メチルアルコール、フェニル、直鎖状もしくは分岐状のC1〜8アルキル、C3〜6シクロアルキル、C2〜8アルケニル、C2〜8アルキニル、C6〜10アリール、またはヘテロ環、置換アリール、チオフェン、フラン、または以下の構造:
(ここで、Y3は、環上の任意の位置に存在してもよく、かつ、H、ハロゲン、OH、C1〜4アルキル、C1〜4ヒドロキシアルキル、またはCF3である)
の1つであり、かつ
R3は、−C(=NH)NH2、−CONH(CH2)3CH3、−CONH(CH2)4CH3、
{ここで、R6は、環上の任意の位置に存在してもよく、かつ、H、NH2、NHCOCH3、−OCH2CH3、NHCO(CH2)4CH3、N(CH3)2、NHCOOC(CH3)3、ハロゲン、
(ただし、nは0〜3である)
である}
であり、
またはR3は、
以下の構造:
{ここで、R5は、C1〜8アルキル、C3〜6シクロアルキル、C2〜8アルケニル、C2〜8アルキニル、C6〜10アリール、ヘテロ環、置換アリール、置換チオフェン、フラン、ピロール、天然アミノ酸側鎖、またはノルロイシン、シクロヘキシルアラニン、ホモシクロヘキシルアラニン、シクロヘキシルグリシン、2−アミノイソ酪酸、3−シクロペンチルアラニン、ノルバリン、およびホモフェニルアラニンからなる群から選択される非天然アミノ酸側鎖であり、かつR4は、C1〜8アルキル、C3〜6シクロアルキル、C2〜8アルケニル、C2〜8アルキニル、C6〜10アリール、ヘテロ環、置換アリール、置換チオフェン、フラン、ピロール、またはH、または
(ここで、Y4は、OまたはSである)
である)
の1つである}
で示されるニューロペプチドSレセプターアンタゴニスト又はその薬学的に許容可能な塩(但し、当該アンタゴニストは、
1,1−ジフェニル−フロ[3,4−c]ピリジン−(1H)−3−オン、
3,3−ジフェニル−フロ[3,4−c]ピリジン−1(3H)−オン又は
3,3−ジ−(4−ヒドロキシフェニル)−フロ[3,4−c]ピリジン−1−(3H)−オン
ではない)を含む、医薬組成物。 - R1がフェニルである、請求項1に記載の医薬組成物。
- R2がイソブチルである、請求項1に記載の医薬組成物。
- R1がフェニルであり、かつR2がイソブチルである、請求項1に記載の医薬組成物。
- X2がN−R3であり、かつX1がCH2である、請求項1に記載の医薬組成物。
- 更に生理学的に許容可能な担体を含む、請求項1に記載の医薬組成物。
- それを必要とする被験体においてニューロペプチドSレセプターに結合させるための医薬組成物であって、請求項1に記載のニューロペプチドSレセプターアンタゴニストの有効量を含み、被験体に投与される、医薬組成物。
- 医薬組成物の投与が、鳥、両生動物、魚、および哺乳動物からなる群から選択される被験体において効果を提供する、請求項8に記載の医薬組成物。
- 有効量の請求項1に記載のニューロペプチドSレセプターアンタゴニストを含み、哺乳動物に投与される、哺乳動物において、ニューロペプチドSレセプターへのアゴニストの結合に起因する疾患または病態の少なくとも1つを予防および/または治療するための医薬組成物であって、
当該疾患または病態が、物質乱用、物質乱用再発、パニック障害、恐怖症、心的外傷後ストレス障害、およびナルコレプシーを含む睡眠障害からなる群から選択される、医薬組成物。 - 物質乱用が、アヘン中毒、コカイン中毒、ニコチン中毒、およびエタノール中毒からなる群から選択される、請求項10に記載の医薬組成物。
- 経口摂取、注射、静脈内注射、錠剤、カプセル剤、シロップ剤、エアロゾル剤、トローチ剤、ボーラス剤、坐剤、軟膏剤、粉末剤、溶液剤、分散剤、エマルション剤、および懸濁剤からなる群から選択される経路を介して投与される、請求項10に記載の医薬組成物。
- 哺乳動物がヒトである、請求項10に記載の医薬組成物。
- ニューロペプチドSレセプターへのアゴニストの結合に起因する疾患または病態の少なくとも1つの予防剤および/または治療剤の製造のための、請求項1に記載のニューロペプチドSレセプターアンタゴニストの使用であって、
当該疾患または病態が、物質乱用、物質乱用再発、パニック障害、恐怖症、心的外傷後ストレス障害、およびナルコレプシーを含む睡眠障害からなる群から選択される、使用。 - 物質乱用が、アヘン中毒、コカイン中毒、ニコチン中毒、およびエタノール中毒からなる群から選択される、請求項14に記載の使用。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161568540P | 2011-12-08 | 2011-12-08 | |
| US61/568,540 | 2011-12-08 | ||
| PCT/US2012/068257 WO2013086200A1 (en) | 2011-12-08 | 2012-12-06 | Composition and method for neuropeptide s receptor (npsr) antagonists |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2015500293A JP2015500293A (ja) | 2015-01-05 |
| JP2015500293A5 JP2015500293A5 (ja) | 2015-12-24 |
| JP6381445B2 true JP6381445B2 (ja) | 2018-08-29 |
Family
ID=48574884
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014546080A Active JP6381445B2 (ja) | 2011-12-08 | 2012-12-06 | ニューロペプチドsレセプター(npsr)アンタゴニストの組成物および方法 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US9150582B2 (ja) |
| EP (1) | EP2788359B1 (ja) |
| JP (1) | JP6381445B2 (ja) |
| AU (1) | AU2012347758B2 (ja) |
| CA (1) | CA2858571C (ja) |
| ES (1) | ES2624853T3 (ja) |
| WO (1) | WO2013086200A1 (ja) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU2017246706B2 (en) * | 2016-04-04 | 2020-09-17 | Research Triangle Institute | Neuropeptide s receptor (NPSR) agonists |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS4917489B1 (ja) * | 1970-01-22 | 1974-05-01 | ||
| EP0140833B1 (de) * | 1983-09-15 | 1988-03-02 | Ciba-Geigy Ag | 5-und 6-Azaphthalide, ihre Isomerengemische, Verfahren zu ihrer Herstellung und ihre Verwendung in druck- und wärmeempfindlichen Aufzeichnungsmaterialien |
| AU648359B2 (en) * | 1990-11-22 | 1994-04-21 | Janssen Pharmaceutica N.V. | Isonicotinic acid derivatives |
| WO2002031145A1 (fr) | 2000-10-13 | 2002-04-18 | Takeda Chemical Industries, Ltd. | Nouvelle proteine de recepteur couple a une proteine g et son adn |
| CA2434044A1 (en) * | 2001-01-11 | 2002-07-18 | Bristol-Myers Squibb Pharma Company | 1,2-disubstituted cyclic inhibitors of matrix metallorproteases and tnf-alpha |
| WO2005110018A2 (en) * | 2004-04-23 | 2005-11-24 | The Regents Of The University Of California | Therapies which act on neuropeptide s receptors |
| WO2010056564A1 (en) * | 2008-11-13 | 2010-05-20 | Merck Sharp & Dohme Corp. | Quinolone neuropeptide s receptor antagonists |
| WO2010056567A1 (en) | 2008-11-13 | 2010-05-20 | Merck Sharp & Dohme Corp. | Imidazoisoindole neuropeptide s receptor antagonists |
-
2012
- 2012-12-06 WO PCT/US2012/068257 patent/WO2013086200A1/en active Application Filing
- 2012-12-06 US US14/363,079 patent/US9150582B2/en active Active
- 2012-12-06 JP JP2014546080A patent/JP6381445B2/ja active Active
- 2012-12-06 EP EP12854821.1A patent/EP2788359B1/en active Active
- 2012-12-06 ES ES12854821.1T patent/ES2624853T3/es active Active
- 2012-12-06 CA CA2858571A patent/CA2858571C/en active Active
- 2012-12-06 AU AU2012347758A patent/AU2012347758B2/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| EP2788359B1 (en) | 2017-03-01 |
| EP2788359A4 (en) | 2015-06-10 |
| EP2788359A1 (en) | 2014-10-15 |
| US9150582B2 (en) | 2015-10-06 |
| WO2013086200A1 (en) | 2013-06-13 |
| CA2858571A1 (en) | 2013-06-13 |
| JP2015500293A (ja) | 2015-01-05 |
| CA2858571C (en) | 2021-03-16 |
| AU2012347758B2 (en) | 2017-01-19 |
| ES2624853T3 (es) | 2017-07-17 |
| AU2012347758A1 (en) | 2014-06-05 |
| US20150057268A1 (en) | 2015-02-26 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US9974777B2 (en) | Tetrahydrocarboline derivative | |
| US8106087B2 (en) | Spiro-oxindole compounds and their uses as therapeutic agents | |
| JP5460324B2 (ja) | 治療剤としてのスピロ−オキシインドール化合物の使用 | |
| JP2015520140A (ja) | APP、BACE1、およびBACE2の阻害剤としての複素環式置換ヘキサヒドロピラノ[3,4−d][1,3]チアジン−2−アミン化合物 | |
| KR20140129065A (ko) | 축합 피롤디카복사미드 및 약제로서의 그의 용도 | |
| ES2640638T3 (es) | Compuestos de fenil-hexahidropirano[3,4-d][1,3]tiazin-2-amina sustituidos | |
| KR101586507B1 (ko) | 아미드 유도체 및 이를 함유하는 약학적 조성물 | |
| JP6381445B2 (ja) | ニューロペプチドsレセプター(npsr)アンタゴニストの組成物および方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20151106 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20151106 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20170106 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170331 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20170719 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170926 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20171114 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20180214 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180514 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20180514 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20180706 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180710 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20180718 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20180731 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6381445 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |