JP6270446B2 - Method for producing metal by molten salt electrolysis - Google Patents
Method for producing metal by molten salt electrolysis Download PDFInfo
- Publication number
- JP6270446B2 JP6270446B2 JP2013253128A JP2013253128A JP6270446B2 JP 6270446 B2 JP6270446 B2 JP 6270446B2 JP 2013253128 A JP2013253128 A JP 2013253128A JP 2013253128 A JP2013253128 A JP 2013253128A JP 6270446 B2 JP6270446 B2 JP 6270446B2
- Authority
- JP
- Japan
- Prior art keywords
- metal
- magnesium
- molten salt
- electrolytic
- chamber
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 229910052751 metal Inorganic materials 0.000 title claims description 84
- 239000002184 metal Substances 0.000 title claims description 84
- 150000003839 salts Chemical class 0.000 title claims description 47
- 238000005868 electrolysis reaction Methods 0.000 title claims description 44
- 238000004519 manufacturing process Methods 0.000 title claims description 15
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 claims description 75
- 229910052749 magnesium Inorganic materials 0.000 claims description 75
- 239000011777 magnesium Substances 0.000 claims description 75
- TWRXJAOTZQYOKJ-UHFFFAOYSA-L Magnesium chloride Chemical compound [Mg+2].[Cl-].[Cl-] TWRXJAOTZQYOKJ-UHFFFAOYSA-L 0.000 claims description 24
- 229910001629 magnesium chloride Inorganic materials 0.000 claims description 12
- WUKWITHWXAAZEY-UHFFFAOYSA-L calcium difluoride Chemical compound [F-].[F-].[Ca+2] WUKWITHWXAAZEY-UHFFFAOYSA-L 0.000 claims description 6
- 229910001634 calcium fluoride Inorganic materials 0.000 claims description 6
- 238000000034 method Methods 0.000 description 10
- KZBUYRJDOAKODT-UHFFFAOYSA-N Chlorine Chemical compound ClCl KZBUYRJDOAKODT-UHFFFAOYSA-N 0.000 description 8
- -1 magnesium nitride Chemical class 0.000 description 8
- 239000000395 magnesium oxide Substances 0.000 description 7
- CPLXHLVBOLITMK-UHFFFAOYSA-N magnesium oxide Inorganic materials [Mg]=O CPLXHLVBOLITMK-UHFFFAOYSA-N 0.000 description 7
- AXZKOIWUVFPNLO-UHFFFAOYSA-N magnesium;oxygen(2-) Chemical compound [O-2].[Mg+2] AXZKOIWUVFPNLO-UHFFFAOYSA-N 0.000 description 7
- 238000006243 chemical reaction Methods 0.000 description 6
- 238000005192 partition Methods 0.000 description 5
- 230000000694 effects Effects 0.000 description 4
- 150000004767 nitrides Chemical class 0.000 description 4
- RTAQQCXQSZGOHL-UHFFFAOYSA-N Titanium Chemical compound [Ti] RTAQQCXQSZGOHL-UHFFFAOYSA-N 0.000 description 3
- 229910052801 chlorine Inorganic materials 0.000 description 3
- 239000000460 chlorine Substances 0.000 description 3
- 238000001914 filtration Methods 0.000 description 3
- 230000003647 oxidation Effects 0.000 description 3
- 238000007254 oxidation reaction Methods 0.000 description 3
- 239000010936 titanium Substances 0.000 description 3
- 229910052719 titanium Inorganic materials 0.000 description 3
- XJDNKRIXUMDJCW-UHFFFAOYSA-J titanium tetrachloride Chemical compound Cl[Ti](Cl)(Cl)Cl XJDNKRIXUMDJCW-UHFFFAOYSA-J 0.000 description 3
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- 239000003638 chemical reducing agent Substances 0.000 description 2
- 230000000052 comparative effect Effects 0.000 description 2
- 238000000605 extraction Methods 0.000 description 2
- 230000005484 gravity Effects 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 1
- 239000006227 byproduct Substances 0.000 description 1
- 239000012320 chlorinating reagent Substances 0.000 description 1
- 230000006866 deterioration Effects 0.000 description 1
- 238000010828 elution Methods 0.000 description 1
- 239000010419 fine particle Substances 0.000 description 1
- 239000000155 melt Substances 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- 229910001512 metal fluoride Inorganic materials 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 239000002994 raw material Substances 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
Images
Landscapes
- Electrolytic Production Of Metals (AREA)
Description
本発明は、溶融塩電解による金属の製造方法に係り、特に、溶融塩電解により生成された金属マグネシウムの抜き出し方法に関する。 The present invention relates to a method for producing a metal by molten salt electrolysis, and particularly to a method for extracting metallic magnesium produced by molten salt electrolysis.
金属マグネシウムは還元性が強いため、四塩化チタンを原料としてスポンジチタンを製造する際の還元剤として使用されている。四塩化チタンをマグネシウムで還元すると、金属チタンが生成するともに、塩化マグネシウムが副生される。 Since magnesium metal is highly reducible, it is used as a reducing agent in the production of sponge titanium using titanium tetrachloride as a raw material. When titanium tetrachloride is reduced with magnesium, metallic titanium is produced and magnesium chloride is by-produced.
副生された塩化マグネシウムは、溶融塩電解により金属マグネシウムと塩素ガスに再生され、前記金属マグネシウムは、四塩化チタンの還元剤として利用され、一方、前記塩素ガスは、チタン鉱石の塩素化剤として再利用されている。この溶融塩電解工程は、電力を多量に使用する工程であるため、できる限り、電力ロスの少ない操業形態が望ましいとされている。 By-product magnesium chloride is regenerated into metal magnesium and chlorine gas by molten salt electrolysis, and the metal magnesium is used as a reducing agent for titanium tetrachloride, while the chlorine gas is used as a chlorinating agent for titanium ore. It has been reused. Since this molten salt electrolysis process is a process that uses a large amount of electric power, it is considered that an operation mode with as little power loss as possible is desirable.
金属マグネシウムの溶融塩電解に用いる溶融塩電解槽には、電解室と生成金属マグネシウムを保持しておく金属室が具備されており、電解室で製造された金属マグネシウム電解槽内に形成されている浴流れ乗って、金属室に移送されるように構成されている。 A molten salt electrolytic cell used for molten salt electrolysis of metallic magnesium is provided with an electrolytic chamber and a metal chamber for holding the produced metallic magnesium, and is formed in the metallic magnesium electrolytic cell manufactured in the electrolytic chamber. It is configured to ride on the bath flow and be transferred to the metal chamber.
このような操業形態の中で、まずは、電解室においては、電極表面で生成された金属マグネシウムが、浴流れに乗って浴表面に浮上するように構成されている。一方、金属マグネシウムが生成される陰極に対向する陽極では、溶融塩電解により、塩素ガスが生成する。これら陰極で生成した金属マグネシウムと陽極で生成した塩素ガスが接触すると、両者が再反応して塩化マグネシウムに戻り、このような再反応が一部生起されることにより電力のロスとなっている。 In such a mode of operation, first, in the electrolysis chamber, metallic magnesium produced on the electrode surface is configured to float on the bath surface on the bath flow. On the other hand, chlorine gas is generated by molten salt electrolysis at the anode facing the cathode from which metallic magnesium is generated. When the metal magnesium produced at the cathode and the chlorine gas produced at the anode come into contact with each other, both react again to return to magnesium chloride, and a part of such re-reaction causes a loss of power.
また、溶融塩電解では、前記したようなロス以外にも、電極間に通電した電流は、電解浴のジュール損による熱として消費され、これも電力のロスとして計上される。よって、陽極および陰極に通電された全電力のうち、80〜90%が電解に利用され、のこりの電力が、上記のようなロスとして消費されている。 In addition, in molten salt electrolysis, in addition to the loss as described above, the current passed between the electrodes is consumed as heat due to the Joule loss of the electrolytic bath, and this is also counted as a power loss. Therefore, 80 to 90% of the total power supplied to the anode and the cathode is used for electrolysis, and the remaining power is consumed as the above loss.
さらには、現場の操業設備においては、電解槽に保持されている電解浴には、塩化マグネシウムや金属マグネシウム以外にも、高温に熱せられた金属マグネシウムが大気と反応して生成した酸化物や窒化物が微量ではあるが混在している。 Furthermore, in the field operation equipment, in addition to magnesium chloride and metal magnesium, the electrolytic bath held in the electrolytic cell includes oxide and nitridation produced by the reaction of metal magnesium heated to high temperature with the atmosphere. A small amount of things are mixed.
これらの酸化物や窒化物は、微量ではあるが大気と金属マグネシウムとの反応により生成し続けるので、特に除去されない限り、電解槽内の金属室と電解室を循環しており、その間に、電解室を構成する陽極や陰極表面に付着する場合がある。 Since these oxides and nitrides continue to be generated by the reaction between the atmosphere and metallic magnesium, although they are in trace amounts, unless they are removed in particular, they circulate between the metal chamber and the electrolytic chamber in the electrolytic cell. It may adhere to the surface of the anode or cathode constituting the chamber.
前記した酸化マグネシウムや窒化マグネシウムは、微粒子ではあるが、不導体であるため、電解浴中に溶解している金属マグネシウムに電子を供給することができず、その結果、金属マグネシウムの生成速度の低下を招き、これは、電流効率の低下を意味し、好ましくない。 The magnesium oxide and magnesium nitride described above are fine particles, but are non-conductive, and therefore cannot supply electrons to the metal magnesium dissolved in the electrolytic bath, resulting in a decrease in the production rate of the metal magnesium. This means a decrease in current efficiency, which is not preferable.
このため、電解浴中に混在している酸化マグネシウムや窒化マグネシウムを事前にろ過分離する技術が知られている(例えば、特許文献1参照)。 For this reason, a technique is known in which magnesium oxide or magnesium nitride mixed in the electrolytic bath is filtered and separated in advance (see, for example, Patent Document 1).
しかしながら、ろ過という方法は、高温の溶融塩をハンドリングすることを意味し、安全上の観点から、操業の中でろ過を実施することには困難が伴う。 However, the method of filtration means that a high-temperature molten salt is handled, and it is difficult to carry out the filtration in operation from the viewpoint of safety.
また、生成された酸化マグネシウムや窒化マグネシウムのろ過精製に加えて、前記酸化マグネシウムや窒化マグネシウムの生成を抑制できるような方策をとることも重要であるが、電解槽自身が、減圧下で運転されているため、電解槽内への大気の進入を皆無にすることは困難である。 In addition to the filtration and purification of the produced magnesium oxide and magnesium nitride, it is also important to take measures that can suppress the production of the magnesium oxide and magnesium nitride, but the electrolytic cell itself is operated under reduced pressure. For this reason, it is difficult to eliminate air from entering the electrolytic cell.
このように、溶融塩電解槽における酸化物や窒化物の生成を抑制できるような技術が望まれている。本発明は、溶融塩電解による金属マグネシウムの製造方法に関し、特に、溶融塩電解槽から電解で生成した金属マグネシウムの効率的な抜き出し方法を提供することを目的とする。 Thus, a technique that can suppress the formation of oxides and nitrides in the molten salt electrolytic cell is desired. The present invention relates to a method for producing metallic magnesium by molten salt electrolysis, and in particular, an object thereof is to provide an efficient method for extracting metallic magnesium produced by electrolysis from a molten salt electrolytic cell.
上記課題について、鋭意検討を進めてきたところ、溶融塩電解槽内で生成した金属マグネシウムを系外に抜き出す際に、溶融塩電解で生成した溶融金属マグネシウム共に、電解浴も一緒に抜き出すことにより、系外に抜き出された金属マグネシウムを効率的に移送させることができるのみならず、その後の電解槽の運転における電流効率の低下も効果的に抑制できることを見出し、本発明を完成するに至った。 As a result of diligent studies on the above issues, when extracting magnesium metal generated in the molten salt electrolysis tank out of the system, both the molten metal magnesium generated by molten salt electrolysis and the electrolytic bath are also extracted together. Not only can the metal magnesium extracted out of the system be efficiently transferred, but also the reduction in current efficiency in the subsequent operation of the electrolytic cell can be effectively suppressed, and the present invention has been completed. .
即ち、本発明に係る溶融塩電解による金属の製造方法は、電解槽内の電解浴に陽極および陰極を浸漬してこれら電極間に通電し、陰極表面に生成した金属を電解槽から抜き出す際に、生成金属に電解浴を混在させた形で抜き出すことを特徴とするものである。 That is, in the method for producing a metal by molten salt electrolysis according to the present invention, the anode and the cathode are immersed in an electrolytic bath in the electrolytic cell, the current is passed between the electrodes, and the metal generated on the cathode surface is extracted from the electrolytic cell. The product metal is extracted in a mixed form of an electrolytic bath.
さらに、本発明に係る溶融塩電解による金属の製造方法においては、前記の電解槽から抜き出された生成金属に混在させる電解浴の重量が、電解槽より抜き出す金属の重量の1%〜2%の範囲とすることをさらなる特徴とするものである。 Furthermore, in the method for producing a metal by molten salt electrolysis according to the present invention, the weight of the electrolytic bath mixed with the generated metal extracted from the electrolytic cell is 1% to 2 % of the weight of the metal extracted from the electrolytic cell. It is a further feature to be in the range.
また、本発明に係る溶融塩電解による金属の製造方法においては、前記電解槽より抜き出す際に、フッ化カルシウムを配合することを特徴とするものである。 In the method for producing a metal by molten salt electrolysis according to the present invention, when extracting from the electrolytic cell, and is characterized in incorporating the calcium fluoride.
さらには、本発明に係る溶融塩電解による金属の製造方法においては、前記金属が、金属マグネシウムであることを特徴とするものである。 Further, in the method for producing a metal by molten salt electrolysis according to the present invention, the metal is characterized in that a magnesium metal.
また、本発明に係る溶融塩電解による金属の製造方法においては、前記電解浴には、塩化マグネシウムが含まれていることを特徴とするものである。 In the method for producing a metal by molten salt electrolysis according to the present invention, wherein the electrolytic bath, and is characterized in that it contains magnesium chloride.
溶融塩電解で生成した金属と電解浴とは、明確に分離しておらず、界面近傍では両者が混ざり合っている。そのため、金属のみを回収しようとすると電解浴側に金属が残留し、酸化物および窒化物の生成原因になっていたが、本発明に係る溶融塩電解の製造方法に従うことにより、金属周辺の電解浴と金属とが混合している領域からも電解浴ごと回収するので、溶融塩電解槽より抜き出された金属マグネシウムを円滑に移送できるのみならず、溶融塩電解槽のその後の電流効率の低下も効果的に維持することができる、という効果を奏するものである。 The metal produced by the molten salt electrolysis and the electrolytic bath are not clearly separated, and both are mixed in the vicinity of the interface. Therefore, when only the metal is recovered, the metal remains on the electrolytic bath side, causing the generation of oxides and nitrides. By following the manufacturing method of the molten salt electrolysis according to the present invention, the electrolysis around the metal is performed. Since the entire electrolytic bath is also recovered from the region where the bath and metal are mixed, not only can the metal magnesium extracted from the molten salt electrolyzer be smoothly transferred, but also the current efficiency of the molten salt electrolyzer is reduced thereafter. Can also be effectively maintained.
本発明の内容を、図面を用いて以下に詳細に説明する。以下の説明では、金属がマグネシウムであり、電解浴に少なくとも塩化マグネシウムを含む場合を例に説明する。
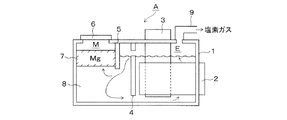
図1は、本発明に用いる溶融塩電解槽Aを模式的に表したものである。
溶融塩電解槽Aには、内部に溶融状態の電解浴8が保持されている。前記溶融塩電解槽Aは、内部に電極が配置されている電解室Eと前記電解室で生成された金属マグネシウムを溶融保持する金属室Mに区分されている。
The contents of the present invention will be described in detail below with reference to the drawings. In the following description, the case where the metal is magnesium and the electrolytic bath contains at least magnesium chloride will be described as an example.
FIG. 1 schematically shows a molten salt electrolytic cell A used in the present invention.
In the molten salt electrolysis tank A, a molten electrolytic bath 8 is held inside. The molten salt electrolytic cell A is divided into an electrolytic chamber E in which an electrode is disposed, and a metal chamber M that melts and holds metallic magnesium generated in the electrolytic chamber.
電解室Eには、陽極3が溶融塩電解槽の上方より、また、陰極2が溶融塩電解槽の側壁より、電解槽本体1の内部に向かって貫通配置されている。 In the electrolysis chamber E, the anode 3 is disposed so as to penetrate from above the molten salt electrolytic cell and the cathode 2 from the side wall of the molten salt electrolytic cell toward the inside of the electrolytic cell main body 1.
前記電解室Eの内部の陽極3の表面においては、電解浴8に含まれる塩化マグネシウムを構成する塩素イオンが電子を放出して、塩素ガスが生成する。陽極3の表面で生成した塩素ガスは、電解室Eの電解浴8中を上昇して、本体1に係合配置された吸引配管9より系外に抜き出される。 On the surface of the anode 3 inside the electrolytic chamber E, chlorine ions constituting the magnesium chloride contained in the electrolytic bath 8 emit electrons, and chlorine gas is generated. Chlorine gas generated on the surface of the anode 3 rises in the electrolytic bath 8 of the electrolysis chamber E, and is extracted out of the system from the suction pipe 9 engaged with the main body 1.
一方、電解室Eの陰極2の表面で生成した溶融マグネシウム滴7は、電解浴8中を浮上して、電解室Eから金属室Mに向かって形成されている浴流れに乗って。第1隔壁4および第2隔壁5の下端を通過して、金属室Mに移送される。 On the other hand, the molten magnesium droplet 7 generated on the surface of the cathode 2 in the electrolytic chamber E floats in the electrolytic bath 8 and rides on the bath flow formed from the electrolytic chamber E toward the metal chamber M. It passes through the lower ends of the first partition 4 and the second partition 5 and is transferred to the metal chamber M.
金属室Mに移送された金属マグネシウム7は、所定量蓄積された時点で、抜き出し操作により系外に間歇的に抜き出される。 When a predetermined amount of the metal magnesium 7 transferred to the metal chamber M is accumulated, it is intermittently extracted out of the system by the extraction operation.
これに対して、第2隔壁5下端部で溶融マグネシウム滴7を分離した電解浴8は、電解室Eに戻り、塩化マグネシウムの溶融塩電解に再び供される。 On the other hand, the electrolytic bath 8 from which the molten magnesium droplet 7 has been separated at the lower end of the second partition wall 5 returns to the electrolytic chamber E and is again used for molten salt electrolysis of magnesium chloride.
本発明は、このような操作の中で、金属室Mで蓄積された金属マグネシウム7の抜き出し方法に関するもので、電解槽の本体1の電解室Mの上部に載置された蓋6を開放して、図示しないノズルを金属室Mの溶融金属マグネシウム7層中に浸漬することを特徴とするものである。 The present invention relates to a method for extracting the metal magnesium 7 accumulated in the metal chamber M during such operations, and the lid 6 placed on the upper part of the electrolysis chamber M of the main body 1 of the electrolytic cell is opened. Then, a nozzle (not shown) is immersed in 7 layers of molten metal magnesium in the metal chamber M.
前記ノズルの大気側には、図示しない溶融金属マグネシウム7の保持容器が接続されており、前記保持容器内を減圧保持することにより、溶融塩電解槽A内の金属室Mに保持された溶融金属マグネシウム7を円滑に抜き出すことができる、という効果を奏する。 A molten metal magnesium 7 holding container (not shown) is connected to the atmosphere side of the nozzle, and the molten metal held in the metal chamber M in the molten salt electrolysis tank A by holding the inside of the holding container under reduced pressure. There exists an effect that magnesium 7 can be extracted smoothly.
前記ノズルを使用して溶融マグネシウム7を抜き出す際には、金属マグネシウム7層に存在する金属マグネシウム7を全量抜き取った後、次いで、前記ノズルの下端面をさらに下方に移動させる。このように、ノズルを下方に浸漬配置としてさらに抜き出しを行うことにより、金属マグネシウム7を僅かに含む電解浴8の一部も確実に抜き取ることができる。 When extracting the molten magnesium 7 using the nozzle, after extracting all the metallic magnesium 7 present in the metallic magnesium 7 layer, the lower end surface of the nozzle is then moved further downward. In this way, by further extracting the nozzle by immersing the nozzle downward, a part of the electrolytic bath 8 slightly containing the metal magnesium 7 can be reliably extracted.
即ち、本発明においては、金属室Mに浸漬配置したノズルから、電解浴8が検出されるまで、前記ノズルを下方に移動することを好ましい態様とするものである。その結果、金属室Mに生成保持された溶融金属マグネシウム7に加えて、電解浴8も一緒に抜きだすことができる、という効果を奏するものである。 That is, in the present invention, it is preferable to move the nozzle downward from the nozzle immersed in the metal chamber M until the electrolytic bath 8 is detected. As a result, in addition to the molten metal magnesium 7 generated and held in the metal chamber M, the electrolytic bath 8 can be extracted together.
このような操作を行うことで、溶融塩電解槽Mより抜き出された溶融金属マグネシウム7の一部には、電解浴8が含まれている。このような電解浴8は、溶融金属マグネシウム7よりも比重が大きいために、溶融金属マグネシウム7よりも下方に沈降する。その結果、図示しない保持容器の底面は、電解浴を介して溶融マグネシウム7と接触しているため、容器を構成する金属成分の溶出を効果的に抑制することができる、という効果を奏するものである。 By performing such an operation, an electrolytic bath 8 is included in a part of the molten metal magnesium 7 extracted from the molten salt electrolytic cell M. Such an electrolytic bath 8 has a specific gravity greater than that of the molten metal magnesium 7 and therefore settles below the molten metal magnesium 7. As a result, since the bottom surface of the holding container (not shown) is in contact with the molten magnesium 7 through the electrolytic bath, the elution of the metal components constituting the container can be effectively suppressed. is there.
本発明においては、溶融金属マグネシウム7の保持容器に溶融塩電解槽Mから抜き取った溶融マグネシウム7を払い出す際には、金属フッ化物(フッ化カルシウム等)を一緒に投入することを好ましい態様とするものである。 In the present invention, when the molten magnesium 7 extracted from the molten salt electrolytic cell M is discharged into the holding container for the molten metal magnesium 7, it is preferable to add a metal fluoride (calcium fluoride or the like) together. To do.
前記したフッ化カルシウムは、溶融金属マグネシウム7よりも比重が小さいために、生成金属マグネシウム7の表面に浮遊した形態を取らせることができる。 Since the above-mentioned calcium fluoride has a specific gravity smaller than that of the molten metal magnesium 7, the calcium fluoride can take a floating form on the surface of the generated metal magnesium 7.
前記したようなフッ化カルシウムの膜を形成保持させることにより、溶融金属マグネシウムと大気との接触を効果的に抑制でき、その結果、保持容器内において、溶融金属マグネシウムの酸化あるいは窒化ロスを効果的に抑制することができる、という効果を奏するものである。 By forming and holding the calcium fluoride film as described above, contact between the molten metal magnesium and the atmosphere can be effectively suppressed, and as a result, the oxidation or nitridation loss of the molten metal magnesium is effectively suppressed in the holding container. There is an effect that it can be suppressed.
前記のような方法で金属マグネシウムが抜き出された溶融塩電解槽Aの金属室Mには、生成金属が皆無の状態が形成される。 In the metal chamber M of the molten salt electrolysis cell A from which the metal magnesium has been extracted by the above method, a state in which no metal is formed is formed.
この際、電解浴8の塩化マグネシウムの含有量は低下しているため、適宜、塩化マグネシウムを溶融塩電解槽Aに補充することが好ましい。このような補充操作を加えることで、電解浴8中の塩化マグネシウム濃度を、一定に保持することができる、という効果を奏するものである。 At this time, since the content of magnesium chloride in the electrolytic bath 8 is lowered, it is preferable to appropriately replenish the molten salt electrolytic cell A with magnesium chloride. By adding such a replenishment operation, there is an effect that the magnesium chloride concentration in the electrolytic bath 8 can be kept constant.
なお、本発明とは異なり、金属マグネシウム7を抜き出す際に、電解浴8を混在させないで、生成金属マグネシウム7層のみを抜き出すような従来の態様とする場合では、金属室Mに溶融金属マグネシウム7の一部が残留している惧それがある。生成金属マグネシウム7の抜き取りの際には、溶融塩電解槽A内に大気が侵入しやすい状況といなっているため、溶融金属マグネシウム7の一部が金属室Mに残留すると、前記溶融金属マグネシウム7は、酸化あるは窒化され、その結果、電解浴中に、酸化マグネシウムや窒化マグネシウムが生成混入する惧それが高くなる。 Unlike the present invention, when extracting the magnesium metal 7, in the conventional mode in which only the generated metal magnesium 7 layer is extracted without mixing the electrolytic bath 8, the molten metal magnesium 7 is placed in the metal chamber M. There is a possibility that part of it remains. At the time of extracting the produced metal magnesium 7, it is said that the atmosphere easily enters the molten salt electrolysis tank A. Therefore, when a part of the molten metal magnesium 7 remains in the metal chamber M, the molten metal magnesium 7 As a result, oxidation or nitridation is caused, and as a result, magnesium oxide and magnesium nitride are likely to be generated and mixed in the electrolytic bath.
このような酸化マグネシウムや窒化マグネシウムが、電解室Eに移送されると、前電解室Eに配置されている陰極2や陽極1の表面に付着生成する場合がある。電解室Eに存在する電極に酸化マグネシウムや窒化マグネシウムが付着すると、同部位の導電性が欠如し、その結果、金属マグネシウム7や塩素ガスの生成効率の低下を招く。 When such magnesium oxide or magnesium nitride is transferred to the electrolysis chamber E, it may be deposited on the surface of the cathode 2 or the anode 1 disposed in the front electrolysis chamber E. When magnesium oxide or magnesium nitride adheres to the electrode present in the electrolysis chamber E, the conductivity of the same portion is lacking, and as a result, the production efficiency of the metal magnesium 7 and chlorine gas is reduced.
よって、本発明においては、金属室Mから生成金属マグネシウム7を抜き取る際には、生成金属マグネシウム7を全量抜き出すことを担保する意味から、電解浴の一部も一緒に抜き出すことが好ましい。 Therefore, in the present invention, when extracting the generated metal magnesium 7 from the metal chamber M, it is preferable to extract a part of the electrolytic bath together in order to ensure that the entire amount of generated metal magnesium 7 is extracted.
また、電解室Eに金属マグネシウムが残留すると、前記残留金属マグネシウム7が金属室Mから電解室Eへ戻り塩素と逆反応を起こす場合がある。前記した逆反応は、電流効率の悪化を招く。本発明では、上述のように金属室Mに金属マグネシウム7が残留しないような方策をとるため、前記したような塩素と金属マグネシウム7の逆反応を効果的に抑制することができる、という効果を奏するものである。 Further, when metallic magnesium remains in the electrolytic chamber E, the residual metallic magnesium 7 may return from the metallic chamber M to the electrolytic chamber E and cause a reverse reaction with chlorine. The reverse reaction described above causes deterioration of current efficiency. In the present invention, as described above, measures are taken so that the metal magnesium 7 does not remain in the metal chamber M, so that the reverse reaction of chlorine and metal magnesium 7 as described above can be effectively suppressed. It is what you play.
以上述べたように、本発明では、金属マグネシウム7を、電解浴に拡散した分までほぼ全量抜き出すことができ、また、生成金属マグネシウム7を抜き出した後の電解槽Aの電流効率の低下も効果的に抑制することができる、という効果を奏するものである。 As described above, in the present invention, almost all of the magnesium metal 7 can be extracted up to the amount diffused in the electrolytic bath, and the current efficiency of the electrolytic cell A after the metal magnesium 7 is extracted is also effective. The effect that it can suppress automatically is produced.
以下、実施例および比較例によって本発明をより詳細かつ具体的に説明する。
図1に示す電解槽を用いて、電解浴としてMgCl2、CaCl2およびNaClを含む浴を装入し、融点以上に加熱し、初回の溶融塩電解を所定の電力を通電して所定の時間で行った。溶融塩電解槽で生成された金属マグネシウムを電解槽から汲みだす際に、金属マグネシウムに電解浴が2%含まれる状況で、金属マグネシウムの汲み出しを継続した。その後、初回の電解において投入した電力を基準とし、二回目においても同等の電力を投入して同じ時間溶融塩電解を行った。
Hereinafter, the present invention will be described in more detail and specifically with reference to Examples and Comparative Examples.
Using the electrolytic cell shown in FIG. 1, a bath containing MgCl 2 , CaCl 2 and NaCl is inserted as an electrolytic bath, heated to the melting point or higher, and a predetermined electric power is applied to the initial molten salt electrolysis for a predetermined time. I went there. When the metallic magnesium produced in the molten salt electrolytic cell was pumped out of the electrolytic cell, the metallic magnesium was continuously pumped out in a state where the electrolytic bath contained 2% in the metallic magnesium. Thereafter, based on the electric power input in the first electrolysis, the same electric power was input in the second time and molten salt electrolysis was performed for the same time.
初回と二回目で生成された塩素ガス量の比較によって、溶融塩電解の電流効率の調査を行った。その結果、溶融塩電解の電流効率は、金属マグネシウムの抜き出し前と、同じ水準に維持された。 The current efficiency of molten salt electrolysis was investigated by comparing the amount of chlorine gas produced in the first and second rounds. As a result, the current efficiency of molten salt electrolysis was maintained at the same level as before extraction of metallic magnesium.
[比較例]
電解槽から金属マグネシウムを抜き出す際に、電解浴を含まない金属マグネシウム層のみの抜き出しを行った以外は実施例と同様にして初回と二回目の溶融塩電解を行い、実施例と同様にして金属マグネシウムの抜き出し後の溶融塩電解の電流効率を調査したところ、2%程度電流効率の低下が見られた。更には、用いた電極を電解槽から取り出して表面を調査した結果、酸化物および窒化物が付着しており、電流効率の低下の原因は、溶融電解で生成された金属マグネシウムの酸化あるいは窒化ロスに伴うものであることも確認された。
[Comparative example]
When extracting magnesium metal from the electrolytic bath, the first and second molten salt electrolysis were performed in the same manner as in Example except that only the metal magnesium layer not including the electrolytic bath was extracted. When the current efficiency of molten salt electrolysis after extracting magnesium was investigated, a decrease in current efficiency of about 2% was observed. Furthermore, as a result of taking out the used electrode from the electrolytic cell and investigating the surface, oxides and nitrides are adhered, and the cause of the decrease in current efficiency is the loss of oxidation or nitridation of metallic magnesium produced by molten electrolysis. It was also confirmed that this was accompanied.
本発明は、溶融塩電解による金属マグネシウムの製造に際し、特に、電流効率を高いレベルに維持することができる電解槽の操業方法に好適に利用できる。 INDUSTRIAL APPLICABILITY The present invention can be suitably used for a method of operating an electrolytic cell that can maintain current efficiency at a high level, particularly when producing metallic magnesium by molten salt electrolysis.
A:溶融塩電解槽
E:電解室
M:金属室
1:本体
2:陰極
3:陽極
4:第1隔壁
5:第2隔壁
6:蓋
7:溶融金属マグネシウム
8:電解浴
9:吸引配管
A: Molten salt electrolytic cell E: Electrolytic chamber M: Metal chamber 1: Body 2: Cathode 3: Anode 4: First partition 5: Second partition 6: Lid 7: Molten metal magnesium 8: Electrolytic bath 9: Suction piping
Claims (1)
電解槽内の電解浴に陽極および陰極を浸漬してこれら電極間に通電し、
前記陰極表面に生成した前記金属を電解槽から抜き出す際に、前記生成金属に電解浴を混在させた形で抜き出し、
前記電解槽から抜き出す生成金属に混在させる電解浴の重量を、電解槽より抜き出す金属の重量の1%〜2%の範囲とし、
前記抜き出しの際に、フッ化カルシウムを配合するものであり、
前記金属はマグネシウム、前記電解浴は塩化マグネシウムであることを特徴とする溶融塩電解による金属の製造方法。
A method for producing a metal by molten salt electrolysis, comprising:
Immerse the anode and cathode in the electrolytic bath in the electrolytic bath and energize between these electrodes,
When the metal generated on the cathode surface is extracted from the electrolytic cell, the metal is extracted in a mixed form with the electrolytic bath,
The weight of the electrolytic bath mixed with the generated metal extracted from the electrolytic cell is in the range of 1% to 2% of the weight of the metal extracted from the electrolytic cell ,
When extracting, calcium fluoride is blended,
The method for producing a metal by molten salt electrolysis , wherein the metal is magnesium and the electrolytic bath is magnesium chloride .
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2013253128A JP6270446B2 (en) | 2013-12-06 | 2013-12-06 | Method for producing metal by molten salt electrolysis |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2013253128A JP6270446B2 (en) | 2013-12-06 | 2013-12-06 | Method for producing metal by molten salt electrolysis |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2015110815A JP2015110815A (en) | 2015-06-18 |
| JP6270446B2 true JP6270446B2 (en) | 2018-01-31 |
Family
ID=53525846
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013253128A Active JP6270446B2 (en) | 2013-12-06 | 2013-12-06 | Method for producing metal by molten salt electrolysis |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP6270446B2 (en) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2760025C1 (en) * | 2018-07-11 | 2021-11-22 | Акционерное общество "Усть-Каменогорский титано-магниевый комбинат" | Method for obtaining magnesium and chlorine and electrolyzer for its implementation |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP7448444B2 (en) | 2020-08-28 | 2024-03-12 | 東邦チタニウム株式会社 | Method for using magnesium chloride storage container and method for producing metallic magnesium |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH01180993A (en) * | 1988-01-08 | 1989-07-18 | Sumitomo Light Metal Ind Ltd | Method for recovering rare-earth metal-iron-family transition metal alloy |
| JP4092129B2 (en) * | 2002-04-19 | 2008-05-28 | 株式会社大阪チタニウムテクノロジーズ | Sponge titanium manufacturing method and manufacturing apparatus |
| JP4199703B2 (en) * | 2004-06-30 | 2008-12-17 | 東邦チタニウム株式会社 | Method for producing metal by molten salt electrolysis |
| JP4247792B2 (en) * | 2004-10-12 | 2009-04-02 | 東邦チタニウム株式会社 | Method and apparatus for producing metal by molten salt electrolysis |
| JPWO2008102520A1 (en) * | 2007-02-19 | 2010-05-27 | 東邦チタニウム株式会社 | Metal production apparatus by molten salt electrolysis and metal production method using the same |
| JP5010529B2 (en) * | 2007-06-26 | 2012-08-29 | 東邦チタニウム株式会社 | Solution extracting apparatus and solution extracting method |
| WO2009107339A1 (en) * | 2008-02-27 | 2009-09-03 | 東邦チタニウム株式会社 | Manufacturing method for a reducing metal and an electrolytic apparatus to be used in the same |
-
2013
- 2013-12-06 JP JP2013253128A patent/JP6270446B2/en active Active
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2760025C1 (en) * | 2018-07-11 | 2021-11-22 | Акционерное общество "Усть-Каменогорский титано-магниевый комбинат" | Method for obtaining magnesium and chlorine and electrolyzer for its implementation |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2015110815A (en) | 2015-06-18 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4602986B2 (en) | Method for producing metallic calcium by molten salt electrolysis | |
| CN102732888A (en) | Method and system for regenerating and recycling acidic etching waste liquor | |
| US20070187255A1 (en) | Method for producing ti or ti alloy through reduction by ca | |
| JPWO2007034605A1 (en) | Reducing metal molten salt electrolysis apparatus, electrolysis method thereof, and method for producing refractory metal using reducing metal | |
| JP6270446B2 (en) | Method for producing metal by molten salt electrolysis | |
| US20170218478A1 (en) | Gold recovery | |
| EP1816221A1 (en) | PROCESS FOR PRODUCING Ti THROUGH Ca REDUCTION AND APPARATUS THEREFOR | |
| JP2007063585A (en) | MOLTEN SALT ELECTROLYSIS METHOD, ELECTROLYTIC CELL, AND METHOD FOR PRODUCING Ti BY USING THE SAME | |
| JP4395386B2 (en) | Method for producing Ti or Ti alloy by circulating Ca source | |
| JP2003306725A (en) | Method for producing titanium, method for producing pure metal and apparatus for producing pure metal | |
| JP7129828B2 (en) | Molten salt electrolysis method and metal magnesium production method | |
| JP2005264320A (en) | PROCESS FOR PRODUCING Ti OR Ti ALLOY BY REDUCTION OF Ca | |
| JP2007084847A (en) | METHOD AND DEVICE FOR PRODUCING Ti | |
| JP3896107B2 (en) | Diaphragm electrolysis method | |
| JP2009019250A (en) | Method and apparatus for producing metal | |
| US809089A (en) | Process of making caustic alkali. | |
| KR101717204B1 (en) | Apparatus for recovering metal including indium, system for recovering indium and method for recovering indium from indium-tin metral | |
| JP7061519B2 (en) | Molten salt moisture reduction method, molten salt electrolysis method, and molten metal manufacturing method | |
| JP7084696B2 (en) | Metal manufacturing method and sponge titanium manufacturing method | |
| JP7206152B2 (en) | Molten salt electrolysis method and metal magnesium production method | |
| WO2005035806A1 (en) | METHOD FOR PRODUCING Ti OR Ti ALLOY THROUGH REDUCTION BY Ca | |
| JPWO2008102520A1 (en) | Metal production apparatus by molten salt electrolysis and metal production method using the same | |
| WO2006115027A1 (en) | Molten salt electrolytic cell and process for producing metal using the same | |
| WO2004088000A2 (en) | Process for the electrolysis of aluminiumsulfide | |
| CN104313619B (en) | The regeneration treating method of low-concentration sulfuric acid copper sulfuric acid solution and device |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20160915 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20170524 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20170529 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170710 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20170913 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20171101 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20171109 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20171221 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20171226 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6270446 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |