JP6164657B2 - テルペン生合成を調節する転写因子 - Google Patents
テルペン生合成を調節する転写因子 Download PDFInfo
- Publication number
- JP6164657B2 JP6164657B2 JP2014514830A JP2014514830A JP6164657B2 JP 6164657 B2 JP6164657 B2 JP 6164657B2 JP 2014514830 A JP2014514830 A JP 2014514830A JP 2014514830 A JP2014514830 A JP 2014514830A JP 6164657 B2 JP6164657 B2 JP 6164657B2
- Authority
- JP
- Japan
- Prior art keywords
- plant
- nucleic acid
- terpene
- acid sequence
- polypeptide
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 235000007586 terpenes Nutrition 0.000 title claims description 127
- 150000003505 terpenes Chemical class 0.000 title claims description 122
- 230000015572 biosynthetic process Effects 0.000 title claims description 42
- 108091023040 Transcription factor Proteins 0.000 title description 62
- 102000040945 Transcription factor Human genes 0.000 title description 62
- 241000196324 Embryophyta Species 0.000 claims description 276
- 108090000623 proteins and genes Proteins 0.000 claims description 122
- 150000007523 nucleic acids Chemical class 0.000 claims description 121
- 108091028043 Nucleic acid sequence Proteins 0.000 claims description 94
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 79
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 78
- 229920001184 polypeptide Polymers 0.000 claims description 76
- 238000000034 method Methods 0.000 claims description 71
- 241000238631 Hexapoda Species 0.000 claims description 49
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 44
- 240000003768 Solanum lycopersicum Species 0.000 claims description 41
- 239000013598 vector Substances 0.000 claims description 38
- 239000012634 fragment Substances 0.000 claims description 31
- 235000007688 Lycopersicon esculentum Nutrition 0.000 claims description 26
- 230000001965 increasing effect Effects 0.000 claims description 26
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 claims description 25
- 101710205751 Alpha-terpineol synthase, chloroplastic Proteins 0.000 claims description 25
- 101710202687 Terpene synthase 5 Proteins 0.000 claims description 25
- 102000039446 nucleic acids Human genes 0.000 claims description 23
- 108020004707 nucleic acids Proteins 0.000 claims description 23
- 230000000694 effects Effects 0.000 claims description 22
- 101000850814 Zea mays (S)-beta-macrocarpene synthase Proteins 0.000 claims description 20
- 229930004725 sesquiterpene Natural products 0.000 claims description 20
- 229930003658 monoterpene Natural products 0.000 claims description 18
- 235000002577 monoterpenes Nutrition 0.000 claims description 18
- CDOSHBSSFJOMGT-UHFFFAOYSA-N linalool Chemical compound CC(C)=CCCC(C)(O)C=C CDOSHBSSFJOMGT-UHFFFAOYSA-N 0.000 claims description 17
- 150000002773 monoterpene derivatives Chemical class 0.000 claims description 17
- 239000002773 nucleotide Substances 0.000 claims description 17
- 125000003729 nucleotide group Chemical group 0.000 claims description 17
- 150000004354 sesquiterpene derivatives Chemical class 0.000 claims description 16
- 238000004519 manufacturing process Methods 0.000 claims description 15
- YHQGMYUVUMAZJR-UHFFFAOYSA-N α-terpinene Chemical compound CC(C)C1=CC=C(C)CC1 YHQGMYUVUMAZJR-UHFFFAOYSA-N 0.000 claims description 12
- 230000027455 binding Effects 0.000 claims description 11
- 150000001875 compounds Chemical class 0.000 claims description 11
- 241000258937 Hemiptera Species 0.000 claims description 10
- 230000002068 genetic effect Effects 0.000 claims description 10
- YKFLAYDHMOASIY-UHFFFAOYSA-N γ-terpinene Chemical compound CC(C)C1=CCC(C)=CC1 YKFLAYDHMOASIY-UHFFFAOYSA-N 0.000 claims description 10
- 239000001490 (3R)-3,7-dimethylocta-1,6-dien-3-ol Substances 0.000 claims description 8
- CDOSHBSSFJOMGT-JTQLQIEISA-N (R)-linalool Natural products CC(C)=CCC[C@@](C)(O)C=C CDOSHBSSFJOMGT-JTQLQIEISA-N 0.000 claims description 8
- 235000011299 Brassica oleracea var botrytis Nutrition 0.000 claims description 8
- 240000003259 Brassica oleracea var. botrytis Species 0.000 claims description 8
- 235000009854 Cucurbita moschata Nutrition 0.000 claims description 8
- 229930007744 linalool Natural products 0.000 claims description 8
- 239000000203 mixture Substances 0.000 claims description 8
- 241000238876 Acari Species 0.000 claims description 7
- 244000061458 Solanum melongena Species 0.000 claims description 7
- WSTYNZDAOAEEKG-UHFFFAOYSA-N Mayol Natural products CC1=C(O)C(=O)C=C2C(CCC3(C4CC(C(CC4(CCC33C)C)=O)C)C)(C)C3=CC=C21 WSTYNZDAOAEEKG-UHFFFAOYSA-N 0.000 claims description 6
- 235000002597 Solanum melongena Nutrition 0.000 claims description 6
- 235000002595 Solanum tuberosum Nutrition 0.000 claims description 6
- 244000061456 Solanum tuberosum Species 0.000 claims description 6
- 230000002018 overexpression Effects 0.000 claims description 6
- FQTLCLSUCSAZDY-UHFFFAOYSA-N (+) E(S) nerolidol Natural products CC(C)=CCCC(C)=CCCC(C)(O)C=C FQTLCLSUCSAZDY-UHFFFAOYSA-N 0.000 claims description 5
- 241001124076 Aphididae Species 0.000 claims description 5
- 235000002566 Capsicum Nutrition 0.000 claims description 5
- 229920000742 Cotton Polymers 0.000 claims description 5
- 241000219112 Cucumis Species 0.000 claims description 5
- 235000015510 Cucumis melo subsp melo Nutrition 0.000 claims description 5
- 240000001980 Cucurbita pepo Species 0.000 claims description 5
- 230000004568 DNA-binding Effects 0.000 claims description 5
- FQTLCLSUCSAZDY-ATGUSINASA-N Nerolidol Chemical compound CC(C)=CCC\C(C)=C\CC[C@](C)(O)C=C FQTLCLSUCSAZDY-ATGUSINASA-N 0.000 claims description 5
- 240000007377 Petunia x hybrida Species 0.000 claims description 5
- 235000005824 Zea mays ssp. parviglumis Nutrition 0.000 claims description 5
- 235000002017 Zea mays subsp mays Nutrition 0.000 claims description 5
- 235000005822 corn Nutrition 0.000 claims description 5
- WASNIKZYIWZQIP-AWEZNQCLSA-N nerolidol Natural products CC(=CCCC(=CCC[C@@H](O)C=C)C)C WASNIKZYIWZQIP-AWEZNQCLSA-N 0.000 claims description 5
- 240000004507 Abelmoschus esculentus Species 0.000 claims description 4
- 244000105624 Arachis hypogaea Species 0.000 claims description 4
- 235000000832 Ayote Nutrition 0.000 claims description 4
- 240000007124 Brassica oleracea Species 0.000 claims description 4
- 235000003899 Brassica oleracea var acephala Nutrition 0.000 claims description 4
- 235000011301 Brassica oleracea var capitata Nutrition 0.000 claims description 4
- 235000017647 Brassica oleracea var italica Nutrition 0.000 claims description 4
- 235000001169 Brassica oleracea var oleracea Nutrition 0.000 claims description 4
- 240000008067 Cucumis sativus Species 0.000 claims description 4
- 235000009852 Cucurbita pepo Nutrition 0.000 claims description 4
- 235000009804 Cucurbita pepo subsp pepo Nutrition 0.000 claims description 4
- 240000002395 Euphorbia pulcherrima Species 0.000 claims description 4
- 235000010469 Glycine max Nutrition 0.000 claims description 4
- 244000068988 Glycine max Species 0.000 claims description 4
- 235000005206 Hibiscus Nutrition 0.000 claims description 4
- 235000007185 Hibiscus lunariifolius Nutrition 0.000 claims description 4
- 244000284380 Hibiscus rosa sinensis Species 0.000 claims description 4
- 244000017020 Ipomoea batatas Species 0.000 claims description 4
- 235000002678 Ipomoea batatas Nutrition 0.000 claims description 4
- 235000003228 Lactuca sativa Nutrition 0.000 claims description 4
- 240000008415 Lactuca sativa Species 0.000 claims description 4
- 241000234435 Lilium Species 0.000 claims description 4
- 240000003183 Manihot esculenta Species 0.000 claims description 4
- 235000016735 Manihot esculenta subsp esculenta Nutrition 0.000 claims description 4
- 239000006002 Pepper Substances 0.000 claims description 4
- 235000016761 Piper aduncum Nutrition 0.000 claims description 4
- 240000003889 Piper guineense Species 0.000 claims description 4
- 235000017804 Piper guineense Nutrition 0.000 claims description 4
- 235000008184 Piper nigrum Nutrition 0.000 claims description 4
- 241000220317 Rosa Species 0.000 claims description 4
- 241001414989 Thysanoptera Species 0.000 claims description 4
- HFPZCAJZSCWRBC-UHFFFAOYSA-N p-cymene Chemical compound CC(C)C1=CC=C(C)C=C1 HFPZCAJZSCWRBC-UHFFFAOYSA-N 0.000 claims description 4
- 235000020232 peanut Nutrition 0.000 claims description 4
- 235000015136 pumpkin Nutrition 0.000 claims description 4
- 235000020354 squash Nutrition 0.000 claims description 4
- 235000017060 Arachis glabrata Nutrition 0.000 claims description 3
- 235000010777 Arachis hypogaea Nutrition 0.000 claims description 3
- 235000018262 Arachis monticola Nutrition 0.000 claims description 3
- 241001414720 Cicadellidae Species 0.000 claims description 3
- 241001465977 Coccoidea Species 0.000 claims description 3
- 235000010799 Cucumis sativus var sativus Nutrition 0.000 claims description 3
- 241001466042 Fulgoromorpha Species 0.000 claims description 3
- FJJCIZWZNKZHII-UHFFFAOYSA-N [4,6-bis(cyanoamino)-1,3,5-triazin-2-yl]cyanamide Chemical compound N#CNC1=NC(NC#N)=NC(NC#N)=N1 FJJCIZWZNKZHII-UHFFFAOYSA-N 0.000 claims description 3
- 230000001172 regenerating effect Effects 0.000 claims description 3
- 240000004244 Cucurbita moschata Species 0.000 claims description 2
- 235000010627 Phaseolus vulgaris Nutrition 0.000 claims description 2
- 244000046052 Phaseolus vulgaris Species 0.000 claims description 2
- 241000286209 Phasianidae Species 0.000 claims description 2
- 241000219146 Gossypium Species 0.000 claims 1
- 240000008042 Zea mays Species 0.000 claims 1
- 210000004027 cell Anatomy 0.000 description 60
- 230000014509 gene expression Effects 0.000 description 48
- 241000607479 Yersinia pestis Species 0.000 description 40
- 102000053187 Glucuronidase Human genes 0.000 description 28
- 108010060309 Glucuronidase Proteins 0.000 description 28
- 239000013615 primer Substances 0.000 description 28
- 239000002987 primer (paints) Substances 0.000 description 28
- 235000018102 proteins Nutrition 0.000 description 23
- 102000004169 proteins and genes Human genes 0.000 description 23
- 108020004414 DNA Proteins 0.000 description 22
- 241000894007 species Species 0.000 description 22
- -1 terpenoid compounds Chemical class 0.000 description 22
- 210000001519 tissue Anatomy 0.000 description 22
- 102000040430 polynucleotide Human genes 0.000 description 19
- 108091033319 polynucleotide Proteins 0.000 description 19
- 239000002157 polynucleotide Substances 0.000 description 19
- 230000037361 pathway Effects 0.000 description 18
- 230000009261 transgenic effect Effects 0.000 description 17
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 16
- 230000001105 regulatory effect Effects 0.000 description 16
- 230000035772 mutation Effects 0.000 description 13
- 238000013518 transcription Methods 0.000 description 13
- 230000035897 transcription Effects 0.000 description 13
- 230000000295 complement effect Effects 0.000 description 12
- ZNJFBWYDHIGLCU-HWKXXFMVSA-N jasmonic acid Chemical compound CC\C=C/C[C@@H]1[C@@H](CC(O)=O)CCC1=O ZNJFBWYDHIGLCU-HWKXXFMVSA-N 0.000 description 12
- 239000002243 precursor Substances 0.000 description 12
- 235000001014 amino acid Nutrition 0.000 description 11
- 150000001413 amino acids Chemical class 0.000 description 11
- UAHWPYUMFXYFJY-UHFFFAOYSA-N beta-myrcene Chemical compound CC(C)=CCCC(=C)C=C UAHWPYUMFXYFJY-UHFFFAOYSA-N 0.000 description 10
- 239000002299 complementary DNA Substances 0.000 description 10
- 230000006870 function Effects 0.000 description 10
- 239000000047 product Substances 0.000 description 10
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 9
- 239000002253 acid Substances 0.000 description 9
- 229910052799 carbon Inorganic materials 0.000 description 9
- 210000001938 protoplast Anatomy 0.000 description 9
- 239000000758 substrate Substances 0.000 description 9
- 238000012360 testing method Methods 0.000 description 9
- 239000011701 zinc Substances 0.000 description 9
- 229910052725 zinc Inorganic materials 0.000 description 9
- GVVPGTZRZFNKDS-YFHOEESVSA-N Geranyl diphosphate Natural products CC(C)=CCC\C(C)=C/COP(O)(=O)OP(O)(O)=O GVVPGTZRZFNKDS-YFHOEESVSA-N 0.000 description 8
- XMGQYMWWDOXHJM-UHFFFAOYSA-N limonene Chemical compound CC(=C)C1CCC(C)=CC1 XMGQYMWWDOXHJM-UHFFFAOYSA-N 0.000 description 8
- CBIDRCWHNCKSTO-UHFFFAOYSA-N prenyl diphosphate Chemical compound CC(C)=CCO[P@](O)(=O)OP(O)(O)=O CBIDRCWHNCKSTO-UHFFFAOYSA-N 0.000 description 8
- 239000000523 sample Substances 0.000 description 8
- 230000009466 transformation Effects 0.000 description 8
- NPNUFJAVOOONJE-ZIAGYGMSSA-N β-(E)-Caryophyllene Chemical compound C1CC(C)=CCCC(=C)[C@H]2CC(C)(C)[C@@H]21 NPNUFJAVOOONJE-ZIAGYGMSSA-N 0.000 description 8
- 102000004190 Enzymes Human genes 0.000 description 7
- 108090000790 Enzymes Proteins 0.000 description 7
- 241000896499 Solanum habrochaites Species 0.000 description 7
- 235000002560 Solanum lycopersicum Nutrition 0.000 description 7
- 230000009286 beneficial effect Effects 0.000 description 7
- 230000006696 biosynthetic metabolic pathway Effects 0.000 description 7
- 238000009395 breeding Methods 0.000 description 7
- 230000001488 breeding effect Effects 0.000 description 7
- 238000006243 chemical reaction Methods 0.000 description 7
- 238000010367 cloning Methods 0.000 description 7
- 230000037430 deletion Effects 0.000 description 7
- 238000012217 deletion Methods 0.000 description 7
- 239000012636 effector Substances 0.000 description 7
- NUHSROFQTUXZQQ-UHFFFAOYSA-N isopentenyl diphosphate Chemical compound CC(=C)CCO[P@](O)(=O)OP(O)(O)=O NUHSROFQTUXZQQ-UHFFFAOYSA-N 0.000 description 7
- 108020004999 messenger RNA Proteins 0.000 description 7
- 108091008146 restriction endonucleases Proteins 0.000 description 7
- 108010087432 terpene synthase Proteins 0.000 description 7
- 241000589155 Agrobacterium tumefaciens Species 0.000 description 6
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 6
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 6
- 238000003556 assay Methods 0.000 description 6
- 230000003828 downregulation Effects 0.000 description 6
- GVVPGTZRZFNKDS-JXMROGBWSA-N geranyl diphosphate Chemical compound CC(C)=CCC\C(C)=C\CO[P@](O)(=O)OP(O)(O)=O GVVPGTZRZFNKDS-JXMROGBWSA-N 0.000 description 6
- 230000036541 health Effects 0.000 description 6
- 230000037431 insertion Effects 0.000 description 6
- 238000003780 insertion Methods 0.000 description 6
- ZNJFBWYDHIGLCU-UHFFFAOYSA-N jasmonic acid Natural products CCC=CCC1C(CC(O)=O)CCC1=O ZNJFBWYDHIGLCU-UHFFFAOYSA-N 0.000 description 6
- 244000062645 predators Species 0.000 description 6
- 230000002441 reversible effect Effects 0.000 description 6
- 229930000044 secondary metabolite Natural products 0.000 description 6
- 238000006467 substitution reaction Methods 0.000 description 6
- KJTLQQUUPVSXIM-ZCFIWIBFSA-N (R)-mevalonic acid Chemical compound OCC[C@](O)(C)CC(O)=O KJTLQQUUPVSXIM-ZCFIWIBFSA-N 0.000 description 5
- AJPADPZSRRUGHI-RFZPGFLSSA-N 1-deoxy-D-xylulose 5-phosphate Chemical compound CC(=O)[C@@H](O)[C@H](O)COP(O)(O)=O AJPADPZSRRUGHI-RFZPGFLSSA-N 0.000 description 5
- FAMPSKZZVDUYOS-UHFFFAOYSA-N 2,6,6,9-tetramethylcycloundeca-1,4,8-triene Chemical compound CC1=CCC(C)(C)C=CCC(C)=CCC1 FAMPSKZZVDUYOS-UHFFFAOYSA-N 0.000 description 5
- 241000254127 Bemisia tabaci Species 0.000 description 5
- 108091026890 Coding region Proteins 0.000 description 5
- KJTLQQUUPVSXIM-UHFFFAOYSA-N DL-mevalonic acid Natural products OCCC(O)(C)CC(O)=O KJTLQQUUPVSXIM-UHFFFAOYSA-N 0.000 description 5
- 238000011529 RT qPCR Methods 0.000 description 5
- 230000008859 change Effects 0.000 description 5
- 230000002255 enzymatic effect Effects 0.000 description 5
- WTEVQBCEXWBHNA-JXMROGBWSA-N geranial Chemical compound CC(C)=CCC\C(C)=C\C=O WTEVQBCEXWBHNA-JXMROGBWSA-N 0.000 description 5
- 239000003147 molecular marker Substances 0.000 description 5
- 230000002829 reductive effect Effects 0.000 description 5
- 238000012163 sequencing technique Methods 0.000 description 5
- 239000004055 small Interfering RNA Substances 0.000 description 5
- 230000002103 transcriptional effect Effects 0.000 description 5
- 238000011144 upstream manufacturing Methods 0.000 description 5
- IBVJWOMJGCHRRW-UHFFFAOYSA-N 3,7,7-Trimethylbicyclo[4.1.0]hept-2-ene Chemical compound C1CC(C)=CC2C(C)(C)C12 IBVJWOMJGCHRRW-UHFFFAOYSA-N 0.000 description 4
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical class CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 4
- 241000589158 Agrobacterium Species 0.000 description 4
- ZAKOWWREFLAJOT-CEFNRUSXSA-N D-alpha-tocopherylacetate Chemical compound CC(=O)OC1=C(C)C(C)=C2O[C@@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1C ZAKOWWREFLAJOT-CEFNRUSXSA-N 0.000 description 4
- 241000255925 Diptera Species 0.000 description 4
- GLZPCOQZEFWAFX-UHFFFAOYSA-N Geraniol Chemical compound CC(C)=CCCC(C)=CCO GLZPCOQZEFWAFX-UHFFFAOYSA-N 0.000 description 4
- 244000299507 Gossypium hirsutum Species 0.000 description 4
- RRHGJUQNOFWUDK-UHFFFAOYSA-N Isoprene Chemical group CC(=C)C=C RRHGJUQNOFWUDK-UHFFFAOYSA-N 0.000 description 4
- 241001465754 Metazoa Species 0.000 description 4
- 241000208125 Nicotiana Species 0.000 description 4
- 101710093888 Pentalenene synthase Proteins 0.000 description 4
- 101710115850 Sesquiterpene synthase Proteins 0.000 description 4
- 241000209149 Zea Species 0.000 description 4
- 125000002015 acyclic group Chemical group 0.000 description 4
- 230000000692 anti-sense effect Effects 0.000 description 4
- NPNUFJAVOOONJE-UHFFFAOYSA-N beta-cariophyllene Natural products C1CC(C)=CCCC(=C)C2CC(C)(C)C21 NPNUFJAVOOONJE-UHFFFAOYSA-N 0.000 description 4
- NPNUFJAVOOONJE-UONOGXRCSA-N caryophyllene Natural products C1CC(C)=CCCC(=C)[C@@H]2CC(C)(C)[C@@H]21 NPNUFJAVOOONJE-UONOGXRCSA-N 0.000 description 4
- 238000004590 computer program Methods 0.000 description 4
- 201000010099 disease Diseases 0.000 description 4
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 4
- 229930004069 diterpene Natural products 0.000 description 4
- 230000002222 downregulating effect Effects 0.000 description 4
- 238000005516 engineering process Methods 0.000 description 4
- 230000000762 glandular Effects 0.000 description 4
- 235000001510 limonene Nutrition 0.000 description 4
- 229940087305 limonene Drugs 0.000 description 4
- 239000003550 marker Substances 0.000 description 4
- 210000000056 organ Anatomy 0.000 description 4
- 239000013612 plasmid Substances 0.000 description 4
- 210000002706 plastid Anatomy 0.000 description 4
- 239000000126 substance Substances 0.000 description 4
- CYIFVRUOHKNECG-UHFFFAOYSA-N tridecan-2-one Chemical compound CCCCCCCCCCCC(C)=O CYIFVRUOHKNECG-UHFFFAOYSA-N 0.000 description 4
- 108091005957 yellow fluorescent proteins Proteins 0.000 description 4
- 102000040650 (ribonucleotides)n+m Human genes 0.000 description 3
- OINNEUNVOZHBOX-QIRCYJPOSA-K 2-trans,6-trans,10-trans-geranylgeranyl diphosphate(3-) Chemical compound CC(C)=CCC\C(C)=C\CC\C(C)=C\CC\C(C)=C\COP([O-])(=O)OP([O-])([O-])=O OINNEUNVOZHBOX-QIRCYJPOSA-K 0.000 description 3
- VWFJDQUYCIWHTN-YFVJMOTDSA-N 2-trans,6-trans-farnesyl diphosphate Chemical compound CC(C)=CCC\C(C)=C\CC\C(C)=C\CO[P@](O)(=O)OP(O)(O)=O VWFJDQUYCIWHTN-YFVJMOTDSA-N 0.000 description 3
- 241000219194 Arabidopsis Species 0.000 description 3
- WTEVQBCEXWBHNA-UHFFFAOYSA-N Citral Natural products CC(C)=CCCC(C)=CC=O WTEVQBCEXWBHNA-UHFFFAOYSA-N 0.000 description 3
- 108010006731 Dimethylallyltranstransferase Proteins 0.000 description 3
- 102000005454 Dimethylallyltranstransferase Human genes 0.000 description 3
- VWFJDQUYCIWHTN-UHFFFAOYSA-N Farnesyl pyrophosphate Natural products CC(C)=CCCC(C)=CCCC(C)=CCOP(O)(=O)OP(O)(O)=O VWFJDQUYCIWHTN-UHFFFAOYSA-N 0.000 description 3
- 240000009088 Fragaria x ananassa Species 0.000 description 3
- OINNEUNVOZHBOX-XBQSVVNOSA-N Geranylgeranyl diphosphate Natural products [P@](=O)(OP(=O)(O)O)(OC/C=C(\CC/C=C(\CC/C=C(\CC/C=C(\C)/C)/C)/C)/C)O OINNEUNVOZHBOX-XBQSVVNOSA-N 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 241000124008 Mammalia Species 0.000 description 3
- 108700011259 MicroRNAs Proteins 0.000 description 3
- 241000207746 Nicotiana benthamiana Species 0.000 description 3
- 235000002637 Nicotiana tabacum Nutrition 0.000 description 3
- 240000005809 Prunus persica Species 0.000 description 3
- 235000006040 Prunus persica var persica Nutrition 0.000 description 3
- 238000012228 RNA interference-mediated gene silencing Methods 0.000 description 3
- 108020004511 Recombinant DNA Proteins 0.000 description 3
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 3
- 101000588121 Santalum album (+)-alpha-terpineol synthase Proteins 0.000 description 3
- 108020004459 Small interfering RNA Proteins 0.000 description 3
- 235000002634 Solanum Nutrition 0.000 description 3
- 241000207763 Solanum Species 0.000 description 3
- 101000610585 Solanum lycopersicum (R)-linalool synthase TPS5, chloroplastic Proteins 0.000 description 3
- 108091081024 Start codon Proteins 0.000 description 3
- 108700019146 Transgenes Proteins 0.000 description 3
- 238000007792 addition Methods 0.000 description 3
- 125000000539 amino acid group Chemical group 0.000 description 3
- 238000004166 bioassay Methods 0.000 description 3
- 230000008827 biological function Effects 0.000 description 3
- 230000001276 controlling effect Effects 0.000 description 3
- 239000000287 crude extract Substances 0.000 description 3
- 230000001351 cycling effect Effects 0.000 description 3
- 210000000172 cytosol Anatomy 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 230000018109 developmental process Effects 0.000 description 3
- 125000000567 diterpene group Chemical group 0.000 description 3
- 238000002290 gas chromatography-mass spectrometry Methods 0.000 description 3
- 230000009368 gene silencing by RNA Effects 0.000 description 3
- 239000004009 herbicide Substances 0.000 description 3
- 229930195733 hydrocarbon Natural products 0.000 description 3
- 230000002401 inhibitory effect Effects 0.000 description 3
- 230000002452 interceptive effect Effects 0.000 description 3
- 239000007788 liquid Substances 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- 230000001404 mediated effect Effects 0.000 description 3
- 230000037353 metabolic pathway Effects 0.000 description 3
- 239000002679 microRNA Substances 0.000 description 3
- 229910052757 nitrogen Inorganic materials 0.000 description 3
- 238000010397 one-hybrid screening Methods 0.000 description 3
- 244000052769 pathogen Species 0.000 description 3
- 238000011160 research Methods 0.000 description 3
- 238000012552 review Methods 0.000 description 3
- 230000003827 upregulation Effects 0.000 description 3
- NOOLISFMXDJSKH-UTLUCORTSA-N (+)-Neomenthol Chemical compound CC(C)[C@@H]1CC[C@@H](C)C[C@@H]1O NOOLISFMXDJSKH-UTLUCORTSA-N 0.000 description 2
- JXZQZARENYGJMK-CQSZACIVSA-N (-)-beta-curcumene Chemical compound CC(C)=CCC[C@@H](C)C1=CCC(C)=CC1 JXZQZARENYGJMK-CQSZACIVSA-N 0.000 description 2
- OPFTUNCRGUEPRZ-QLFBSQMISA-N (-)-beta-elemene Chemical compound CC(=C)[C@@H]1CC[C@@](C)(C=C)[C@H](C(C)=C)C1 OPFTUNCRGUEPRZ-QLFBSQMISA-N 0.000 description 2
- GRWFGVWFFZKLTI-IUCAKERBSA-N (-)-α-pinene Chemical compound CC1=CC[C@@H]2C(C)(C)[C@H]1C2 GRWFGVWFFZKLTI-IUCAKERBSA-N 0.000 description 2
- JSNRRGGBADWTMC-UHFFFAOYSA-N (6E)-7,11-dimethyl-3-methylene-1,6,10-dodecatriene Chemical compound CC(C)=CCCC(C)=CCCC(=C)C=C JSNRRGGBADWTMC-UHFFFAOYSA-N 0.000 description 2
- RXBQNMWIQKOSCS-UHFFFAOYSA-N (7,7-dimethyl-4-bicyclo[3.1.1]hept-3-enyl)methanol Chemical compound C1C2C(C)(C)C1CC=C2CO RXBQNMWIQKOSCS-UHFFFAOYSA-N 0.000 description 2
- 239000001707 (E,7R,11R)-3,7,11,15-tetramethylhexadec-2-en-1-ol Substances 0.000 description 2
- IBVJWOMJGCHRRW-DTWKUNHWSA-N 2-Carene Natural products C1CC(C)=C[C@H]2C(C)(C)[C@@H]12 IBVJWOMJGCHRRW-DTWKUNHWSA-N 0.000 description 2
- ARQXEQLMMNGFDU-JHZZJYKESA-N 4-methylumbelliferone beta-D-glucuronide Chemical compound C1=CC=2C(C)=CC(=O)OC=2C=C1O[C@@H]1O[C@H](C(O)=O)[C@@H](O)[C@H](O)[C@H]1O ARQXEQLMMNGFDU-JHZZJYKESA-N 0.000 description 2
- 241001143309 Acanthoscelides obtectus Species 0.000 description 2
- 108010000700 Acetolactate synthase Proteins 0.000 description 2
- 108010085238 Actins Proteins 0.000 description 2
- 241001425390 Aphis fabae Species 0.000 description 2
- 241000952610 Aphis glycines Species 0.000 description 2
- 241001600408 Aphis gossypii Species 0.000 description 2
- 241001448479 Aphis nerii Species 0.000 description 2
- 241000894006 Bacteria Species 0.000 description 2
- 235000004936 Bromus mango Nutrition 0.000 description 2
- 244000025254 Cannabis sativa Species 0.000 description 2
- BAVONGHXFVOKBV-UHFFFAOYSA-N Carveol Chemical compound CC(=C)C1CC=C(C)C(O)C1 BAVONGHXFVOKBV-UHFFFAOYSA-N 0.000 description 2
- 244000241235 Citrullus lanatus Species 0.000 description 2
- 235000012828 Citrullus lanatus var citroides Nutrition 0.000 description 2
- 108020004705 Codon Proteins 0.000 description 2
- 241000254173 Coleoptera Species 0.000 description 2
- 108020004635 Complementary DNA Proteins 0.000 description 2
- 108010009392 Cyclin-Dependent Kinase Inhibitor p16 Proteins 0.000 description 2
- NOOLISFMXDJSKH-UHFFFAOYSA-N DL-menthol Natural products CC(C)C1CCC(C)CC1O NOOLISFMXDJSKH-UHFFFAOYSA-N 0.000 description 2
- 102000053602 DNA Human genes 0.000 description 2
- 101150071534 EDS gene Proteins 0.000 description 2
- 241000206602 Eukaryota Species 0.000 description 2
- 244000020551 Helianthus annuus Species 0.000 description 2
- 235000003222 Helianthus annuus Nutrition 0.000 description 2
- 240000005979 Hordeum vulgare Species 0.000 description 2
- 235000007340 Hordeum vulgare Nutrition 0.000 description 2
- 241000255777 Lepidoptera Species 0.000 description 2
- 241000258916 Leptinotarsa decemlineata Species 0.000 description 2
- 108060001084 Luciferase Proteins 0.000 description 2
- 239000005089 Luciferase Substances 0.000 description 2
- 235000014826 Mangifera indica Nutrition 0.000 description 2
- 240000007594 Oryza sativa Species 0.000 description 2
- 235000007164 Oryza sativa Nutrition 0.000 description 2
- 229930012538 Paclitaxel Natural products 0.000 description 2
- 244000115721 Pennisetum typhoides Species 0.000 description 2
- 235000007195 Pennisetum typhoides Nutrition 0.000 description 2
- 101000610575 Physarum polycephalum Terpene synthase 4 Proteins 0.000 description 2
- BLUHKGOSFDHHGX-UHFFFAOYSA-N Phytol Natural products CC(C)CCCC(C)CCCC(C)CCCC(C)C=CO BLUHKGOSFDHHGX-UHFFFAOYSA-N 0.000 description 2
- 241000209056 Secale Species 0.000 description 2
- 235000007238 Secale cereale Nutrition 0.000 description 2
- 235000008515 Setaria glauca Nutrition 0.000 description 2
- 108091027967 Small hairpin RNA Proteins 0.000 description 2
- 235000014296 Solanum habrochaites Nutrition 0.000 description 2
- 240000007417 Solanum muricatum Species 0.000 description 2
- 241001136583 Solanum pennellii Species 0.000 description 2
- 235000011684 Sorghum saccharatum Nutrition 0.000 description 2
- 244000062793 Sorghum vulgare Species 0.000 description 2
- 235000009184 Spondias indica Nutrition 0.000 description 2
- 101150009367 TPS12 gene Proteins 0.000 description 2
- 101150104329 TPS15 gene Proteins 0.000 description 2
- 101150113729 TPS17 gene Proteins 0.000 description 2
- 101150114671 TPS9 gene Proteins 0.000 description 2
- MOYAFQVGZZPNRA-UHFFFAOYSA-N Terpinolene Chemical compound CC(C)=C1CCC(C)=CC1 MOYAFQVGZZPNRA-UHFFFAOYSA-N 0.000 description 2
- HNZBNQYXWOLKBA-UHFFFAOYSA-N Tetrahydrofarnesol Natural products CC(C)CCCC(C)CCCC(C)=CCO HNZBNQYXWOLKBA-UHFFFAOYSA-N 0.000 description 2
- 102100033159 Transcription factor 19 Human genes 0.000 description 2
- 101710119700 Transcription factor 19 Proteins 0.000 description 2
- 102000004357 Transferases Human genes 0.000 description 2
- 108090000992 Transferases Proteins 0.000 description 2
- 241000018137 Trialeurodes vaporariorum Species 0.000 description 2
- 235000021307 Triticum Nutrition 0.000 description 2
- 244000098338 Triticum aestivum Species 0.000 description 2
- 102100033254 Tumor suppressor ARF Human genes 0.000 description 2
- 241000700605 Viruses Species 0.000 description 2
- 241000219094 Vitaceae Species 0.000 description 2
- 101710185494 Zinc finger protein Proteins 0.000 description 2
- 102100023597 Zinc finger protein 816 Human genes 0.000 description 2
- 108091007916 Zinc finger transcription factors Proteins 0.000 description 2
- 102000038627 Zinc finger transcription factors Human genes 0.000 description 2
- ZSLZBFCDCINBPY-ZSJPKINUSA-N acetyl-CoA Chemical compound O[C@@H]1[C@H](OP(O)(O)=O)[C@@H](COP(O)(=O)OP(O)(=O)OCC(C)(C)[C@@H](O)C(=O)NCCC(=O)NCCSC(=O)C)O[C@H]1N1C2=NC=NC(N)=C2N=C1 ZSLZBFCDCINBPY-ZSJPKINUSA-N 0.000 description 2
- 230000004913 activation Effects 0.000 description 2
- BOTWFXYSPFMFNR-OALUTQOASA-N all-rac-phytol Natural products CC(C)CCC[C@H](C)CCC[C@H](C)CCCC(C)=CCO BOTWFXYSPFMFNR-OALUTQOASA-N 0.000 description 2
- VYBREYKSZAROCT-UHFFFAOYSA-N alpha-myrcene Natural products CC(=C)CCCC(=C)C=C VYBREYKSZAROCT-UHFFFAOYSA-N 0.000 description 2
- 239000003242 anti bacterial agent Substances 0.000 description 2
- 229940088710 antibiotic agent Drugs 0.000 description 2
- 230000001580 bacterial effect Effects 0.000 description 2
- 238000002306 biochemical method Methods 0.000 description 2
- 239000000872 buffer Substances 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- WTEVQBCEXWBHNA-YFHOEESVSA-N citral B Natural products CC(C)=CCC\C(C)=C/C=O WTEVQBCEXWBHNA-YFHOEESVSA-N 0.000 description 2
- NEHNMFOYXAPHSD-UHFFFAOYSA-N citronellal Chemical compound O=CCC(C)CCC=C(C)C NEHNMFOYXAPHSD-UHFFFAOYSA-N 0.000 description 2
- QMVPMAAFGQKVCJ-UHFFFAOYSA-N citronellol Chemical compound OCCC(C)CCC=C(C)C QMVPMAAFGQKVCJ-UHFFFAOYSA-N 0.000 description 2
- 125000004122 cyclic group Chemical group 0.000 description 2
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 2
- 239000005547 deoxyribonucleotide Substances 0.000 description 2
- 125000002637 deoxyribonucleotide group Chemical group 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- 238000010586 diagram Methods 0.000 description 2
- XPPKVPWEQAFLFU-UHFFFAOYSA-N diphosphoric acid Chemical compound OP(O)(=O)OP(O)(O)=O XPPKVPWEQAFLFU-UHFFFAOYSA-N 0.000 description 2
- 150000002148 esters Chemical class 0.000 description 2
- 239000011536 extraction buffer Substances 0.000 description 2
- 235000013305 food Nutrition 0.000 description 2
- 239000004459 forage Substances 0.000 description 2
- 230000004545 gene duplication Effects 0.000 description 2
- BRZYSWJRSDMWLG-CAXSIQPQSA-N geneticin Chemical compound O1C[C@@](O)(C)[C@H](NC)[C@@H](O)[C@H]1O[C@@H]1[C@@H](O)[C@H](O[C@@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](C(C)O)O2)N)[C@@H](N)C[C@H]1N BRZYSWJRSDMWLG-CAXSIQPQSA-N 0.000 description 2
- QBKSWRVVCFFDOT-UHFFFAOYSA-N gossypol Chemical compound CC(C)C1=C(O)C(O)=C(C=O)C2=C(O)C(C=3C(O)=C4C(C=O)=C(O)C(O)=C(C4=CC=3C)C(C)C)=C(C)C=C21 QBKSWRVVCFFDOT-UHFFFAOYSA-N 0.000 description 2
- 235000021021 grapes Nutrition 0.000 description 2
- 230000012010 growth Effects 0.000 description 2
- 230000002363 herbicidal effect Effects 0.000 description 2
- 238000012165 high-throughput sequencing Methods 0.000 description 2
- 238000009396 hybridization Methods 0.000 description 2
- 230000006698 induction Effects 0.000 description 2
- 230000001939 inductive effect Effects 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- 230000000749 insecticidal effect Effects 0.000 description 2
- 230000009545 invasion Effects 0.000 description 2
- 235000021374 legumes Nutrition 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 201000004792 malaria Diseases 0.000 description 2
- 229940041616 menthol Drugs 0.000 description 2
- 230000000813 microbial effect Effects 0.000 description 2
- 239000003607 modifier Substances 0.000 description 2
- 238000010369 molecular cloning Methods 0.000 description 2
- 229930003647 monocyclic monoterpene Natural products 0.000 description 2
- 150000002767 monocyclic monoterpene derivatives Chemical class 0.000 description 2
- 108091027963 non-coding RNA Proteins 0.000 description 2
- 102000042567 non-coding RNA Human genes 0.000 description 2
- 239000003921 oil Substances 0.000 description 2
- 210000003463 organelle Anatomy 0.000 description 2
- 229960001592 paclitaxel Drugs 0.000 description 2
- 244000045947 parasite Species 0.000 description 2
- BOTWFXYSPFMFNR-PYDDKJGSSA-N phytol Chemical compound CC(C)CCC[C@@H](C)CCC[C@@H](C)CCC\C(C)=C\CO BOTWFXYSPFMFNR-PYDDKJGSSA-N 0.000 description 2
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 2
- 230000008488 polyadenylation Effects 0.000 description 2
- 230000023603 positive regulation of transcription initiation, DNA-dependent Effects 0.000 description 2
- 230000032361 posttranscriptional gene silencing Effects 0.000 description 2
- 235000012015 potatoes Nutrition 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 238000007894 restriction fragment length polymorphism technique Methods 0.000 description 2
- 235000009566 rice Nutrition 0.000 description 2
- 238000007363 ring formation reaction Methods 0.000 description 2
- NDVASEGYNIMXJL-UHFFFAOYSA-N sabinene Chemical compound C=C1CCC2(C(C)C)C1C2 NDVASEGYNIMXJL-UHFFFAOYSA-N 0.000 description 2
- 238000012216 screening Methods 0.000 description 2
- 230000028327 secretion Effects 0.000 description 2
- 239000002689 soil Substances 0.000 description 2
- 238000007619 statistical method Methods 0.000 description 2
- 235000021012 strawberries Nutrition 0.000 description 2
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 2
- 239000008399 tap water Substances 0.000 description 2
- 235000020679 tap water Nutrition 0.000 description 2
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 2
- 231100000331 toxic Toxicity 0.000 description 2
- 230000002588 toxic effect Effects 0.000 description 2
- 230000005030 transcription termination Effects 0.000 description 2
- 238000013519 translation Methods 0.000 description 2
- KYWIYKKSMDLRDC-UHFFFAOYSA-N undecan-2-one Chemical compound CCCCCCCCCC(C)=O KYWIYKKSMDLRDC-UHFFFAOYSA-N 0.000 description 2
- APVKGMMYGFJZHY-UHFFFAOYSA-N vetivazulene Chemical compound C1=CC=C(C)C2=CC(C(C)C)=CC2=C1C APVKGMMYGFJZHY-UHFFFAOYSA-N 0.000 description 2
- 239000003039 volatile agent Substances 0.000 description 2
- 239000000341 volatile oil Substances 0.000 description 2
- OPFTUNCRGUEPRZ-UHFFFAOYSA-N (+)-beta-Elemen Natural products CC(=C)C1CCC(C)(C=C)C(C(C)=C)C1 OPFTUNCRGUEPRZ-UHFFFAOYSA-N 0.000 description 1
- NDVASEGYNIMXJL-NXEZZACHSA-N (+)-sabinene Natural products C=C1CC[C@@]2(C(C)C)[C@@H]1C2 NDVASEGYNIMXJL-NXEZZACHSA-N 0.000 description 1
- WTARULDDTDQWMU-RKDXNWHRSA-N (+)-β-pinene Chemical compound C1[C@H]2C(C)(C)[C@@H]1CCC2=C WTARULDDTDQWMU-RKDXNWHRSA-N 0.000 description 1
- WTARULDDTDQWMU-IUCAKERBSA-N (-)-Nopinene Natural products C1[C@@H]2C(C)(C)[C@H]1CCC2=C WTARULDDTDQWMU-IUCAKERBSA-N 0.000 description 1
- BAVONGHXFVOKBV-ZJUUUORDSA-N (-)-trans-carveol Natural products CC(=C)[C@@H]1CC=C(C)[C@@H](O)C1 BAVONGHXFVOKBV-ZJUUUORDSA-N 0.000 description 1
- CXENHBSYCFFKJS-UHFFFAOYSA-N (3E,6E)-3,7,11-Trimethyl-1,3,6,10-dodecatetraene Natural products CC(C)=CCCC(C)=CCC=C(C)C=C CXENHBSYCFFKJS-UHFFFAOYSA-N 0.000 description 1
- QMVPMAAFGQKVCJ-SNVBAGLBSA-N (R)-(+)-citronellol Natural products OCC[C@H](C)CCC=C(C)C QMVPMAAFGQKVCJ-SNVBAGLBSA-N 0.000 description 1
- LXJXRIRHZLFYRP-VKHMYHEASA-L (R)-2-Hydroxy-3-(phosphonooxy)-propanal Natural products O=C[C@H](O)COP([O-])([O-])=O LXJXRIRHZLFYRP-VKHMYHEASA-L 0.000 description 1
- 101710195549 (S)-beta-macrocarpene synthase Proteins 0.000 description 1
- 101150084750 1 gene Proteins 0.000 description 1
- VOXZDWNPVJITMN-ZBRFXRBCSA-N 17β-estradiol Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 VOXZDWNPVJITMN-ZBRFXRBCSA-N 0.000 description 1
- QKGNSWNKNMFYRE-UHFFFAOYSA-N 2,6,6-trimethylbicyclo[3.1.1]heptan-4-one Chemical compound CC1CC(=O)C2C(C)(C)C1C2 QKGNSWNKNMFYRE-UHFFFAOYSA-N 0.000 description 1
- RSEBUVRVKCANEP-UHFFFAOYSA-N 2-pyrroline Chemical compound C1CC=CN1 RSEBUVRVKCANEP-UHFFFAOYSA-N 0.000 description 1
- 108020005345 3' Untranslated Regions Proteins 0.000 description 1
- PSGQCCSGKGJLRL-UHFFFAOYSA-N 4-methyl-2h-chromen-2-one Chemical group C1=CC=CC2=C1OC(=O)C=C2C PSGQCCSGKGJLRL-UHFFFAOYSA-N 0.000 description 1
- QUTYKIXIUDQOLK-PRJMDXOYSA-N 5-O-(1-carboxyvinyl)-3-phosphoshikimic acid Chemical compound O[C@H]1[C@H](OC(=C)C(O)=O)CC(C(O)=O)=C[C@H]1OP(O)(O)=O QUTYKIXIUDQOLK-PRJMDXOYSA-N 0.000 description 1
- FVFVNNKYKYZTJU-UHFFFAOYSA-N 6-chloro-1,3,5-triazine-2,4-diamine Chemical compound NC1=NC(N)=NC(Cl)=N1 FVFVNNKYKYZTJU-UHFFFAOYSA-N 0.000 description 1
- KMRMUZKLFIEVAO-UHFFFAOYSA-N 7,7-dimethylbicyclo[3.1.1]hept-3-ene-4-carbaldehyde Chemical compound C1C2C(C)(C)C1CC=C2C=O KMRMUZKLFIEVAO-UHFFFAOYSA-N 0.000 description 1
- NVEQFIOZRFFVFW-UHFFFAOYSA-N 9-epi-beta-caryophyllene oxide Natural products C=C1CCC2OC2(C)CCC2C(C)(C)CC21 NVEQFIOZRFFVFW-UHFFFAOYSA-N 0.000 description 1
- 102000007469 Actins Human genes 0.000 description 1
- 102100022299 All trans-polyprenyl-diphosphate synthase PDSS1 Human genes 0.000 description 1
- 235000005254 Allium ampeloprasum Nutrition 0.000 description 1
- 240000006108 Allium ampeloprasum Species 0.000 description 1
- 244000291564 Allium cepa Species 0.000 description 1
- 235000002732 Allium cepa var. cepa Nutrition 0.000 description 1
- 108030004097 Alpha-humulene synthases Proteins 0.000 description 1
- 241000249058 Anthracothorax Species 0.000 description 1
- 241000569145 Aphis nasturtii Species 0.000 description 1
- 241000219195 Arabidopsis thaliana Species 0.000 description 1
- 101100293180 Arabidopsis thaliana MYB28 gene Proteins 0.000 description 1
- 101100293181 Arabidopsis thaliana MYB29 gene Proteins 0.000 description 1
- 101100025356 Arabidopsis thaliana MYB51 gene Proteins 0.000 description 1
- 101100132363 Arabidopsis thaliana MYB76 gene Proteins 0.000 description 1
- 101000662893 Arabidopsis thaliana Telomere repeat-binding factor 1 Proteins 0.000 description 1
- 101000662890 Arabidopsis thaliana Telomere repeat-binding factor 2 Proteins 0.000 description 1
- 101000662891 Arabidopsis thaliana Telomere repeat-binding factor 3 Proteins 0.000 description 1
- 101000662896 Arabidopsis thaliana Telomere repeat-binding factor 4 Proteins 0.000 description 1
- 101000662897 Arabidopsis thaliana Telomere repeat-binding factor 5 Proteins 0.000 description 1
- 101001022706 Arabidopsis thaliana Transcription factor MYB12 Proteins 0.000 description 1
- 241001465356 Atropa belladonna Species 0.000 description 1
- 229930192334 Auxin Natural products 0.000 description 1
- 241000254123 Bemisia Species 0.000 description 1
- 235000016068 Berberis vulgaris Nutrition 0.000 description 1
- 241000335053 Beta vulgaris Species 0.000 description 1
- 101710137820 Beta-caryophyllene synthase Proteins 0.000 description 1
- 241000167854 Bourreria succulenta Species 0.000 description 1
- 240000002791 Brassica napus Species 0.000 description 1
- 235000011293 Brassica napus Nutrition 0.000 description 1
- 235000000540 Brassica rapa subsp rapa Nutrition 0.000 description 1
- 241000219193 Brassicaceae Species 0.000 description 1
- 241000982106 Brevicoryne Species 0.000 description 1
- 241000907223 Bruchinae Species 0.000 description 1
- 241000282465 Canis Species 0.000 description 1
- 240000008574 Capsicum frutescens Species 0.000 description 1
- 239000004215 Carbon black (E152) Substances 0.000 description 1
- 241000931705 Cicada Species 0.000 description 1
- 240000006740 Cichorium endivia Species 0.000 description 1
- 108091062157 Cis-regulatory element Proteins 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- 235000005979 Citrus limon Nutrition 0.000 description 1
- 244000131522 Citrus pyriformis Species 0.000 description 1
- 241000675108 Citrus tangerina Species 0.000 description 1
- 240000004270 Colocasia esculenta var. antiquorum Species 0.000 description 1
- 108091035707 Consensus sequence Proteins 0.000 description 1
- 101710118490 Copalyl diphosphate synthase Proteins 0.000 description 1
- 235000009849 Cucumis sativus Nutrition 0.000 description 1
- 241000219122 Cucurbita Species 0.000 description 1
- VMYXUZSZMNBRCN-AWEZNQCLSA-N Curcumene Natural products CC(C)=CCC[C@H](C)C1=CC=C(C)C=C1 VMYXUZSZMNBRCN-AWEZNQCLSA-N 0.000 description 1
- 102100024462 Cyclin-dependent kinase 4 inhibitor B Human genes 0.000 description 1
- FCKYPQBAHLOOJQ-UHFFFAOYSA-N Cyclohexane-1,2-diaminetetraacetic acid Chemical compound OC(=O)CN(CC(O)=O)C1CCCCC1N(CC(O)=O)CC(O)=O FCKYPQBAHLOOJQ-UHFFFAOYSA-N 0.000 description 1
- LXJXRIRHZLFYRP-VKHMYHEASA-N D-glyceraldehyde 3-phosphate Chemical compound O=C[C@H](O)COP(O)(O)=O LXJXRIRHZLFYRP-VKHMYHEASA-N 0.000 description 1
- 102000052510 DNA-Binding Proteins Human genes 0.000 description 1
- 108700020911 DNA-Binding Proteins Proteins 0.000 description 1
- 102000004163 DNA-directed RNA polymerases Human genes 0.000 description 1
- 108090000626 DNA-directed RNA polymerases Proteins 0.000 description 1
- 235000002767 Daucus carota Nutrition 0.000 description 1
- 244000000626 Daucus carota Species 0.000 description 1
- 102000016911 Deoxyribonucleases Human genes 0.000 description 1
- 108010053770 Deoxyribonucleases Proteins 0.000 description 1
- 235000002723 Dioscorea alata Nutrition 0.000 description 1
- 235000007056 Dioscorea composita Nutrition 0.000 description 1
- 235000009723 Dioscorea convolvulacea Nutrition 0.000 description 1
- 235000005362 Dioscorea floribunda Nutrition 0.000 description 1
- 235000004868 Dioscorea macrostachya Nutrition 0.000 description 1
- 235000005361 Dioscorea nummularia Nutrition 0.000 description 1
- 235000005360 Dioscorea spiculiflora Nutrition 0.000 description 1
- 208000035240 Disease Resistance Diseases 0.000 description 1
- 241001555556 Ephestia elutella Species 0.000 description 1
- YQYJSBFKSSDGFO-UHFFFAOYSA-N Epihygromycin Natural products OC1C(O)C(C(=O)C)OC1OC(C(=C1)O)=CC=C1C=C(C)C(=O)NC1C(O)C(O)C2OCOC2C1O YQYJSBFKSSDGFO-UHFFFAOYSA-N 0.000 description 1
- 241000588724 Escherichia coli Species 0.000 description 1
- 108091029865 Exogenous DNA Proteins 0.000 description 1
- 108700024394 Exon Proteins 0.000 description 1
- 235000016623 Fragaria vesca Nutrition 0.000 description 1
- 235000011363 Fragaria x ananassa Nutrition 0.000 description 1
- 241000233866 Fungi Species 0.000 description 1
- 108700039691 Genetic Promoter Regions Proteins 0.000 description 1
- 241000134874 Geraniales Species 0.000 description 1
- GLZPCOQZEFWAFX-YFHOEESVSA-N Geraniol Natural products CC(C)=CCC\C(C)=C/CO GLZPCOQZEFWAFX-YFHOEESVSA-N 0.000 description 1
- 239000005792 Geraniol Substances 0.000 description 1
- UHDKBUSKUVYWQE-UHFFFAOYSA-N Germacren Natural products CC1=C/C2C(CCC=CCC1)C2(C)C UHDKBUSKUVYWQE-UHFFFAOYSA-N 0.000 description 1
- 108010048467 Germacrene C synthase Proteins 0.000 description 1
- 239000005562 Glyphosate Substances 0.000 description 1
- 241001147381 Helicoverpa armigera Species 0.000 description 1
- 241000255967 Helicoverpa zea Species 0.000 description 1
- 101000980919 Homo sapiens Cyclin-dependent kinase 4 inhibitor B Proteins 0.000 description 1
- 101150062179 II gene Proteins 0.000 description 1
- 206010061217 Infestation Diseases 0.000 description 1
- 102100034343 Integrase Human genes 0.000 description 1
- 108091092195 Intron Proteins 0.000 description 1
- 235000006350 Ipomoea batatas var. batatas Nutrition 0.000 description 1
- 108010065958 Isopentenyl-diphosphate Delta-isomerase Proteins 0.000 description 1
- 102100027665 Isopentenyl-diphosphate Delta-isomerase 1 Human genes 0.000 description 1
- PDSNLYSELAIEBU-UHFFFAOYSA-N Longifolene Chemical compound C1CCC(C)(C)C2C3CCC2C1(C)C3=C PDSNLYSELAIEBU-UHFFFAOYSA-N 0.000 description 1
- ZPUKHRHPJKNORC-UHFFFAOYSA-N Longifolene Natural products CC1(C)CCCC2(C)C3CCC1(C3)C2=C ZPUKHRHPJKNORC-UHFFFAOYSA-N 0.000 description 1
- 241000721715 Macrosiphum Species 0.000 description 1
- 240000007228 Mangifera indica Species 0.000 description 1
- 108091022912 Mannose-6-Phosphate Isomerase Proteins 0.000 description 1
- KMRMUZKLFIEVAO-RKDXNWHRSA-N Myrtenal Natural products C1[C@H]2C(C)(C)[C@@H]1CC=C2C=O KMRMUZKLFIEVAO-RKDXNWHRSA-N 0.000 description 1
- RXBQNMWIQKOSCS-RKDXNWHRSA-N Myrtenol Natural products C1[C@H]2C(C)(C)[C@@H]1CC=C2CO RXBQNMWIQKOSCS-RKDXNWHRSA-N 0.000 description 1
- 235000013418 Myrtus communis Nutrition 0.000 description 1
- 240000005125 Myrtus communis Species 0.000 description 1
- 241000332345 Myzus cerasi Species 0.000 description 1
- 241000180178 Myzus ornatus Species 0.000 description 1
- 241000721621 Myzus persicae Species 0.000 description 1
- 230000004988 N-glycosylation Effects 0.000 description 1
- 241000133259 Nasonovia Species 0.000 description 1
- 241000133263 Nasonovia ribisnigri Species 0.000 description 1
- GLZPCOQZEFWAFX-JXMROGBWSA-N Nerol Natural products CC(C)=CCC\C(C)=C\CO GLZPCOQZEFWAFX-JXMROGBWSA-N 0.000 description 1
- 108091092724 Noncoding DNA Proteins 0.000 description 1
- 108020004711 Nucleic Acid Probes Proteins 0.000 description 1
- 230000004989 O-glycosylation Effects 0.000 description 1
- 102000015636 Oligopeptides Human genes 0.000 description 1
- 108010038807 Oligopeptides Proteins 0.000 description 1
- 108700026244 Open Reading Frames Proteins 0.000 description 1
- UOZODPSAJZTQNH-UHFFFAOYSA-N Paromomycin II Natural products NC1C(O)C(O)C(CN)OC1OC1C(O)C(OC2C(C(N)CC(N)C2O)OC2C(C(O)C(O)C(CO)O2)N)OC1CO UOZODPSAJZTQNH-UHFFFAOYSA-N 0.000 description 1
- 244000025272 Persea americana Species 0.000 description 1
- 235000008673 Persea americana Nutrition 0.000 description 1
- 241001674048 Phthiraptera Species 0.000 description 1
- 244000064622 Physalis edulis Species 0.000 description 1
- 108020005120 Plant DNA Proteins 0.000 description 1
- 235000011751 Pogostemon cablin Nutrition 0.000 description 1
- 240000002505 Pogostemon cablin Species 0.000 description 1
- 108091036407 Polyadenylation Proteins 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 102000019337 Prenyltransferases Human genes 0.000 description 1
- 108050006837 Prenyltransferases Proteins 0.000 description 1
- WTARULDDTDQWMU-UHFFFAOYSA-N Pseudopinene Natural products C1C2C(C)(C)C1CCC2=C WTARULDDTDQWMU-UHFFFAOYSA-N 0.000 description 1
- LCTONWCANYUPML-UHFFFAOYSA-M Pyruvate Chemical compound CC(=O)C([O-])=O LCTONWCANYUPML-UHFFFAOYSA-M 0.000 description 1
- 238000001190 Q-PCR Methods 0.000 description 1
- 238000002123 RNA extraction Methods 0.000 description 1
- 108010092799 RNA-directed DNA polymerase Proteins 0.000 description 1
- 244000088415 Raphanus sativus Species 0.000 description 1
- 235000006140 Raphanus sativus var sativus Nutrition 0.000 description 1
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 1
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 1
- 108700008625 Reporter Genes Proteins 0.000 description 1
- 108010034634 Repressor Proteins Proteins 0.000 description 1
- 108091028664 Ribonucleotide Proteins 0.000 description 1
- 101150067286 STS1 gene Proteins 0.000 description 1
- 101100028967 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) PDR5 gene Proteins 0.000 description 1
- 108091081021 Sense strand Proteins 0.000 description 1
- 241000208292 Solanaceae Species 0.000 description 1
- 101100207341 Solanum lycopersicum TPS31 gene Proteins 0.000 description 1
- 235000011564 Solanum pennellii Nutrition 0.000 description 1
- 238000002105 Southern blotting Methods 0.000 description 1
- 241000256247 Spodoptera exigua Species 0.000 description 1
- 229940100389 Sulfonylurea Drugs 0.000 description 1
- 108700026226 TATA Box Proteins 0.000 description 1
- 101150047567 TPS14 gene Proteins 0.000 description 1
- 101150057061 TPS16 gene Proteins 0.000 description 1
- 108010006785 Taq Polymerase Proteins 0.000 description 1
- QHOPXUFELLHKAS-UHFFFAOYSA-N Thespesin Natural products CC(C)c1c(O)c(O)c2C(O)Oc3c(c(C)cc1c23)-c1c2OC(O)c3c(O)c(O)c(C(C)C)c(cc1C)c23 QHOPXUFELLHKAS-UHFFFAOYSA-N 0.000 description 1
- 108091036066 Three prime untranslated region Proteins 0.000 description 1
- 101710158136 Trans-prenyltransferase Proteins 0.000 description 1
- 108700009124 Transcription Initiation Site Proteins 0.000 description 1
- 241000018135 Trialeurodes Species 0.000 description 1
- 241000750338 Trialeurodes abutilonea Species 0.000 description 1
- 229920004890 Triton X-100 Polymers 0.000 description 1
- 239000013504 Triton X-100 Substances 0.000 description 1
- 101710174833 Tuberculosinyl adenosine transferase Proteins 0.000 description 1
- 241001389006 Tuta absoluta Species 0.000 description 1
- 101150027289 Ubash3b gene Proteins 0.000 description 1
- 102100040338 Ubiquitin-associated and SH3 domain-containing protein B Human genes 0.000 description 1
- 244000083398 Zea diploperennis Species 0.000 description 1
- PTFCDOFLOPIGGS-UHFFFAOYSA-N Zinc dication Chemical compound [Zn+2] PTFCDOFLOPIGGS-UHFFFAOYSA-N 0.000 description 1
- 101150067314 aadA gene Proteins 0.000 description 1
- 108020002494 acetyltransferase Proteins 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 239000012190 activator Substances 0.000 description 1
- 108091006088 activator proteins Proteins 0.000 description 1
- 150000001273 acylsugars Chemical class 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 150000001299 aldehydes Chemical class 0.000 description 1
- XCPQUQHBVVXMRQ-UHFFFAOYSA-N alpha-Fenchene Natural products C1CC2C(=C)CC1C2(C)C XCPQUQHBVVXMRQ-UHFFFAOYSA-N 0.000 description 1
- PFXFABJPDNHACA-UHFFFAOYSA-N alpha-copaene Natural products CC(C)C1C2CC(=CCC2C3(C)CC13)C PFXFABJPDNHACA-UHFFFAOYSA-N 0.000 description 1
- PSVBPLKYDMHILE-UHFFFAOYSA-N alpha-humulene Natural products CC1=C/CC(C)(C)C=CCC=CCC1 PSVBPLKYDMHILE-UHFFFAOYSA-N 0.000 description 1
- MVNCAPSFBDBCGF-UHFFFAOYSA-N alpha-pinene Natural products CC1=CCC23C1CC2C3(C)C MVNCAPSFBDBCGF-UHFFFAOYSA-N 0.000 description 1
- KQAZVFVOEIRWHN-UHFFFAOYSA-N alpha-thujene Natural products CC1=CCC2(C(C)C)C1C2 KQAZVFVOEIRWHN-UHFFFAOYSA-N 0.000 description 1
- VLXDPFLIRFYIME-QRTUWBSPSA-N alpha-ylangene Natural products C1C=C(C)[C@@H]2[C@@]3(C)CC[C@@H](C(C)C)[C@@H]2[C@H]31 VLXDPFLIRFYIME-QRTUWBSPSA-N 0.000 description 1
- 229940126575 aminoglycoside Drugs 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 239000003430 antimalarial agent Substances 0.000 description 1
- 239000002246 antineoplastic agent Substances 0.000 description 1
- 229940041181 antineoplastic drug Drugs 0.000 description 1
- 229930101531 artemisinin Natural products 0.000 description 1
- 210000004507 artificial chromosome Anatomy 0.000 description 1
- 239000005667 attractant Substances 0.000 description 1
- 239000002363 auxin Substances 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- SIKJAQJRHWYJAI-UHFFFAOYSA-N benzopyrrole Natural products C1=CC=C2NC=CC2=C1 SIKJAQJRHWYJAI-UHFFFAOYSA-N 0.000 description 1
- JGQFVRIQXUFPAH-UHFFFAOYSA-N beta-citronellol Natural products OCCC(C)CCCC(C)=C JGQFVRIQXUFPAH-UHFFFAOYSA-N 0.000 description 1
- 229930000790 beta-curcumene Natural products 0.000 description 1
- 229930006722 beta-pinene Natural products 0.000 description 1
- 229930003642 bicyclic monoterpene Natural products 0.000 description 1
- 150000001604 bicyclic monoterpene derivatives Chemical class 0.000 description 1
- 150000004334 bicyclic sesquiterpene derivatives Chemical class 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 239000007975 buffered saline Substances 0.000 description 1
- 239000001390 capsicum minimum Substances 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 229930007646 carveol Natural products 0.000 description 1
- 229940117948 caryophyllene Drugs 0.000 description 1
- BLUAFEHZUWYNDE-XRNKLDBLSA-N chembl77 Chemical compound C([C@@](OO1)(C)O2)C[C@H]3[C@H](C)CC[C@@H]4C31[C@@H]2OC(=O)[C@@H]4C BLUAFEHZUWYNDE-XRNKLDBLSA-N 0.000 description 1
- 238000007385 chemical modification Methods 0.000 description 1
- 235000019693 cherries Nutrition 0.000 description 1
- 235000003733 chicria Nutrition 0.000 description 1
- 108010069282 cis-prenyl transferase Proteins 0.000 description 1
- 229930003633 citronellal Natural products 0.000 description 1
- 235000000983 citronellal Nutrition 0.000 description 1
- 235000000484 citronellol Nutrition 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 230000000875 corresponding effect Effects 0.000 description 1
- 150000004445 curcumene derivatives Chemical class 0.000 description 1
- 210000000805 cytoplasm Anatomy 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 230000007123 defense Effects 0.000 description 1
- 230000002950 deficient Effects 0.000 description 1
- 108010060155 deoxyxylulose-5-phosphate synthase Proteins 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 230000029087 digestion Effects 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 239000000539 dimer Substances 0.000 description 1
- 235000004879 dioscorea Nutrition 0.000 description 1
- 235000011180 diphosphates Nutrition 0.000 description 1
- 150000004141 diterpene derivatives Chemical class 0.000 description 1
- 239000003814 drug Substances 0.000 description 1
- 230000005014 ectopic expression Effects 0.000 description 1
- 235000013399 edible fruits Nutrition 0.000 description 1
- 235000013601 eggs Nutrition 0.000 description 1
- 238000004520 electroporation Methods 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 210000003527 eukaryotic cell Anatomy 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 239000013604 expression vector Substances 0.000 description 1
- 229930009668 farnesene Natural products 0.000 description 1
- YYJNOYZRYGDPNH-MFKUBSTISA-N fenpyroximate Chemical compound C=1C=C(C(=O)OC(C)(C)C)C=CC=1CO/N=C/C=1C(C)=NN(C)C=1OC1=CC=CC=C1 YYJNOYZRYGDPNH-MFKUBSTISA-N 0.000 description 1
- 239000012467 final product Substances 0.000 description 1
- 150000007946 flavonol Chemical class 0.000 description 1
- HVQAJTFOCKOKIN-UHFFFAOYSA-N flavonol Natural products O1C2=CC=CC=C2C(=O)C(O)=C1C1=CC=CC=C1 HVQAJTFOCKOKIN-UHFFFAOYSA-N 0.000 description 1
- 235000011957 flavonols Nutrition 0.000 description 1
- 230000004907 flux Effects 0.000 description 1
- 239000003205 fragrance Substances 0.000 description 1
- 235000021022 fresh fruits Nutrition 0.000 description 1
- 235000011389 fruit/vegetable juice Nutrition 0.000 description 1
- 230000002538 fungal effect Effects 0.000 description 1
- 108020001507 fusion proteins Proteins 0.000 description 1
- 102000037865 fusion proteins Human genes 0.000 description 1
- LCWMKIHBLJLORW-UHFFFAOYSA-N gamma-carene Natural products C1CC(=C)CC2C(C)(C)C21 LCWMKIHBLJLORW-UHFFFAOYSA-N 0.000 description 1
- NGIVKZGKEPRIGG-UHFFFAOYSA-N gamma-curcumene Natural products CC(C)=CCCC(C)C1=CC=C(C)CC1 NGIVKZGKEPRIGG-UHFFFAOYSA-N 0.000 description 1
- BXWQUXUDAGDUOS-UHFFFAOYSA-N gamma-humulene Natural products CC1=CCCC(C)(C)C=CC(=C)CCC1 BXWQUXUDAGDUOS-UHFFFAOYSA-N 0.000 description 1
- 230000030279 gene silencing Effects 0.000 description 1
- 238000012226 gene silencing method Methods 0.000 description 1
- 229940113087 geraniol Drugs 0.000 description 1
- 229930193877 germacren Natural products 0.000 description 1
- 125000002042 germacrene group Chemical group 0.000 description 1
- 125000004383 glucosinolate group Chemical group 0.000 description 1
- XDDAORKBJWWYJS-UHFFFAOYSA-N glyphosate Chemical compound OC(=O)CNCP(O)(O)=O XDDAORKBJWWYJS-UHFFFAOYSA-N 0.000 description 1
- 229940097068 glyphosate Drugs 0.000 description 1
- 229930000755 gossypol Natural products 0.000 description 1
- 229950005277 gossypol Drugs 0.000 description 1
- 230000003054 hormonal effect Effects 0.000 description 1
- 101150029559 hph gene Proteins 0.000 description 1
- QBNFBHXQESNSNP-UHFFFAOYSA-N humulene Natural products CC1=CC=CC(C)(C)CC=C(/C)CCC1 QBNFBHXQESNSNP-UHFFFAOYSA-N 0.000 description 1
- 150000002430 hydrocarbons Chemical class 0.000 description 1
- MTNDZQHUAFNZQY-UHFFFAOYSA-N imidazoline Chemical compound C1CN=CN1 MTNDZQHUAFNZQY-UHFFFAOYSA-N 0.000 description 1
- 230000001976 improved effect Effects 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- PZOUSPYUWWUPPK-UHFFFAOYSA-N indole Natural products CC1=CC=CC2=C1C=CN2 PZOUSPYUWWUPPK-UHFFFAOYSA-N 0.000 description 1
- SEOVTRFCIGRIMH-UHFFFAOYSA-N indole-3-acetic acid Chemical compound C1=CC=C2C(CC(=O)O)=CNC2=C1 SEOVTRFCIGRIMH-UHFFFAOYSA-N 0.000 description 1
- RKJUIXBNRJVNHR-UHFFFAOYSA-N indolenine Natural products C1=CC=C2CC=NC2=C1 RKJUIXBNRJVNHR-UHFFFAOYSA-N 0.000 description 1
- 230000008595 infiltration Effects 0.000 description 1
- 238000001764 infiltration Methods 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 238000006317 isomerization reaction Methods 0.000 description 1
- 229930027917 kanamycin Natural products 0.000 description 1
- 229960000318 kanamycin Drugs 0.000 description 1
- SBUJHOSQTJFQJX-NOAMYHISSA-N kanamycin Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CN)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O2)O)[C@H](N)C[C@@H]1N SBUJHOSQTJFQJX-NOAMYHISSA-N 0.000 description 1
- 229930182823 kanamycin A Natural products 0.000 description 1
- 150000002576 ketones Chemical class 0.000 description 1
- 230000002147 killing effect Effects 0.000 description 1
- 238000003670 luciferase enzyme activity assay Methods 0.000 description 1
- 238000011880 melting curve analysis Methods 0.000 description 1
- 238000012269 metabolic engineering Methods 0.000 description 1
- 239000002207 metabolite Substances 0.000 description 1
- 238000000520 microinjection Methods 0.000 description 1
- 230000002438 mitochondrial effect Effects 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 238000001823 molecular biology technique Methods 0.000 description 1
- 229930001457 monocyclic sesquiterpene Natural products 0.000 description 1
- 150000001374 monocyclic sesquiterpene derivatives Chemical class 0.000 description 1
- 230000000877 morphologic effect Effects 0.000 description 1
- 238000003541 multi-stage reaction Methods 0.000 description 1
- 231100000350 mutagenesis Toxicity 0.000 description 1
- SYSQUGFVNFXIIT-UHFFFAOYSA-N n-[4-(1,3-benzoxazol-2-yl)phenyl]-4-nitrobenzenesulfonamide Chemical class C1=CC([N+](=O)[O-])=CC=C1S(=O)(=O)NC1=CC=C(C=2OC3=CC=CC=C3N=2)C=C1 SYSQUGFVNFXIIT-UHFFFAOYSA-N 0.000 description 1
- 230000037125 natural defense Effects 0.000 description 1
- 239000002853 nucleic acid probe Substances 0.000 description 1
- 210000004940 nucleus Anatomy 0.000 description 1
- 230000003204 osmotic effect Effects 0.000 description 1
- 229960001914 paromomycin Drugs 0.000 description 1
- UOZODPSAJZTQNH-LSWIJEOBSA-N paromomycin Chemical compound N[C@@H]1[C@@H](O)[C@H](O)[C@H](CN)O[C@@H]1O[C@H]1[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](N)C[C@@H](N)[C@@H]2O)O[C@@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O2)N)O[C@@H]1CO UOZODPSAJZTQNH-LSWIJEOBSA-N 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- GGHMUJBZYLPWFD-CUZKYEQNSA-N patchouli alcohol Chemical compound C1C[C@]2(C)[C@@]3(O)CC[C@H](C)[C@@H]2C[C@@H]1C3(C)C GGHMUJBZYLPWFD-CUZKYEQNSA-N 0.000 description 1
- 235000008779 pepino Nutrition 0.000 description 1
- 238000011056 performance test Methods 0.000 description 1
- 229930015704 phenylpropanoid Natural products 0.000 description 1
- 150000002995 phenylpropanoid derivatives Chemical class 0.000 description 1
- 238000013081 phylogenetic analysis Methods 0.000 description 1
- 238000000053 physical method Methods 0.000 description 1
- 108010071062 pinene cyclase I Proteins 0.000 description 1
- 239000004069 plant analysis Substances 0.000 description 1
- 238000003976 plant breeding Methods 0.000 description 1
- 229910052697 platinum Inorganic materials 0.000 description 1
- 235000021018 plums Nutrition 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 230000003234 polygenic effect Effects 0.000 description 1
- 229920001550 polyprenyl Polymers 0.000 description 1
- 125000001185 polyprenyl group Polymers 0.000 description 1
- 238000011176 pooling Methods 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 210000001236 prokaryotic cell Anatomy 0.000 description 1
- WPKVKNZNPQRHOD-UHFFFAOYSA-N prop-1-ene Chemical compound [CH2+]C=C WPKVKNZNPQRHOD-UHFFFAOYSA-N 0.000 description 1
- ZVJHJDDKYZXRJI-UHFFFAOYSA-N pyrroline Natural products C1CC=NC1 ZVJHJDDKYZXRJI-UHFFFAOYSA-N 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- GRWFGVWFFZKLTI-UHFFFAOYSA-N rac-alpha-Pinene Natural products CC1=CCC2C(C)(C)C1C2 GRWFGVWFFZKLTI-UHFFFAOYSA-N 0.000 description 1
- JXZQZARENYGJMK-UHFFFAOYSA-N rac-beta-Curcumen Natural products CC(C)=CCCC(C)C1=CCC(C)=CC1 JXZQZARENYGJMK-UHFFFAOYSA-N 0.000 description 1
- GGHMUJBZYLPWFD-UHFFFAOYSA-N rac-patchouli alcohol Natural products C1CC2(C)C3(O)CCC(C)C2CC1C3(C)C GGHMUJBZYLPWFD-UHFFFAOYSA-N 0.000 description 1
- KKOXKGNSUHTUBV-UHFFFAOYSA-N racemic zingiberene Natural products CC(C)=CCCC(C)C1CC=C(C)C=C1 KKOXKGNSUHTUBV-UHFFFAOYSA-N 0.000 description 1
- 238000003753 real-time PCR Methods 0.000 description 1
- 230000008707 rearrangement Effects 0.000 description 1
- 238000003259 recombinant expression Methods 0.000 description 1
- 238000010188 recombinant method Methods 0.000 description 1
- 230000008929 regeneration Effects 0.000 description 1
- 238000011069 regeneration method Methods 0.000 description 1
- 230000010076 replication Effects 0.000 description 1
- 230000001850 reproductive effect Effects 0.000 description 1
- 239000002336 ribonucleotide Substances 0.000 description 1
- 125000002652 ribonucleotide group Chemical group 0.000 description 1
- 229930006696 sabinene Natural products 0.000 description 1
- 230000024053 secondary metabolic process Effects 0.000 description 1
- 230000003584 silencer Effects 0.000 description 1
- 239000000243 solution Substances 0.000 description 1
- UNFWWIHTNXNPBV-WXKVUWSESA-N spectinomycin Chemical compound O([C@@H]1[C@@H](NC)[C@@H](O)[C@H]([C@@H]([C@H]1O1)O)NC)[C@]2(O)[C@H]1O[C@H](C)CC2=O UNFWWIHTNXNPBV-WXKVUWSESA-N 0.000 description 1
- 229960000268 spectinomycin Drugs 0.000 description 1
- 238000005507 spraying Methods 0.000 description 1
- 229960005322 streptomycin Drugs 0.000 description 1
- 235000000346 sugar Nutrition 0.000 description 1
- YROXIXLRRCOBKF-UHFFFAOYSA-N sulfonylurea Chemical class OC(=N)N=S(=O)=O YROXIXLRRCOBKF-UHFFFAOYSA-N 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 238000010189 synthetic method Methods 0.000 description 1
- 230000008685 targeting Effects 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 230000014621 translational initiation Effects 0.000 description 1
- 230000032258 transport Effects 0.000 description 1
- RRBYUSWBLVXTQN-VZCHMASFSA-N tricyclene Natural products C([C@@H]12)C3C[C@H]1C2(C)C3(C)C RRBYUSWBLVXTQN-VZCHMASFSA-N 0.000 description 1
- RRBYUSWBLVXTQN-UHFFFAOYSA-N tricyclene Chemical compound C12CC3CC2C1(C)C3(C)C RRBYUSWBLVXTQN-UHFFFAOYSA-N 0.000 description 1
- 229930007794 tricyclic monoterpene Natural products 0.000 description 1
- JLEXUIVKURIPFI-UHFFFAOYSA-N tris phosphate Chemical compound OP(O)(O)=O.OCC(N)(CO)CO JLEXUIVKURIPFI-UHFFFAOYSA-N 0.000 description 1
- 150000003648 triterpenes Chemical class 0.000 description 1
- 235000013311 vegetables Nutrition 0.000 description 1
- 238000012795 verification Methods 0.000 description 1
- 239000013603 viral vector Substances 0.000 description 1
- 238000003260 vortexing Methods 0.000 description 1
- 210000005253 yeast cell Anatomy 0.000 description 1
- 229930001895 zingiberene Natural products 0.000 description 1
- KKOXKGNSUHTUBV-LSDHHAIUSA-N zingiberene Chemical compound CC(C)=CCC[C@H](C)[C@H]1CC=C(C)C=C1 KKOXKGNSUHTUBV-LSDHHAIUSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/82—Vectors or expression systems specially adapted for eukaryotic hosts for plant cells, e.g. plant artificial chromosomes (PACs)
- C12N15/8241—Phenotypically and genetically modified plants via recombinant DNA technology
- C12N15/8242—Phenotypically and genetically modified plants via recombinant DNA technology with non-agronomic quality (output) traits, e.g. for industrial processing; Value added, non-agronomic traits
- C12N15/8243—Phenotypically and genetically modified plants via recombinant DNA technology with non-agronomic quality (output) traits, e.g. for industrial processing; Value added, non-agronomic traits involving biosynthetic or metabolic pathways, i.e. metabolic engineering, e.g. nicotine, caffeine
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01H—NEW PLANTS OR NON-TRANSGENIC PROCESSES FOR OBTAINING THEM; PLANT REPRODUCTION BY TISSUE CULTURE TECHNIQUES
- A01H5/00—Angiosperms, i.e. flowering plants, characterised by their plant parts; Angiosperms characterised otherwise than by their botanic taxonomy
- A01H5/12—Leaves
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/415—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from plants
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/82—Vectors or expression systems specially adapted for eukaryotic hosts for plant cells, e.g. plant artificial chromosomes (PACs)
- C12N15/8241—Phenotypically and genetically modified plants via recombinant DNA technology
- C12N15/8261—Phenotypically and genetically modified plants via recombinant DNA technology with agronomic (input) traits, e.g. crop yield
- C12N15/8271—Phenotypically and genetically modified plants via recombinant DNA technology with agronomic (input) traits, e.g. crop yield for stress resistance, e.g. heavy metal resistance
- C12N15/8279—Phenotypically and genetically modified plants via recombinant DNA technology with agronomic (input) traits, e.g. crop yield for stress resistance, e.g. heavy metal resistance for biotic stress resistance, pathogen resistance, disease resistance
- C12N15/8286—Phenotypically and genetically modified plants via recombinant DNA technology with agronomic (input) traits, e.g. crop yield for stress resistance, e.g. heavy metal resistance for biotic stress resistance, pathogen resistance, disease resistance for insect resistance
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P5/00—Preparation of hydrocarbons or halogenated hydrocarbons
- C12P5/007—Preparation of hydrocarbons or halogenated hydrocarbons containing one or more isoprene units, i.e. terpenes
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A40/00—Adaptation technologies in agriculture, forestry, livestock or agroalimentary production
- Y02A40/10—Adaptation technologies in agriculture, forestry, livestock or agroalimentary production in agriculture
- Y02A40/146—Genetically Modified [GMO] plants, e.g. transgenic plants
Landscapes
- Life Sciences & Earth Sciences (AREA)
- Health & Medical Sciences (AREA)
- Genetics & Genomics (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Organic Chemistry (AREA)
- Biotechnology (AREA)
- Molecular Biology (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- General Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biomedical Technology (AREA)
- General Health & Medical Sciences (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Microbiology (AREA)
- Botany (AREA)
- Plant Pathology (AREA)
- Physics & Mathematics (AREA)
- Cell Biology (AREA)
- Developmental Biology & Embryology (AREA)
- Environmental Sciences (AREA)
- Physiology (AREA)
- Gastroenterology & Hepatology (AREA)
- Nutrition Science (AREA)
- Medicinal Chemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Insects & Arthropods (AREA)
- Pest Control & Pesticides (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Breeding Of Plants And Reproduction By Means Of Culturing (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Peptides Or Proteins (AREA)
Description
本発明は、本明細書において提供される転写因子のポリペプチドまたは変異ポリペプチドをコードする、単離された、組換えられた、または合成されたポリヌクレオチドを提供する。本発明の実施形態は、単離された、組換えられたもしくは合成された配列番号1の核酸配列、または、配列番号1の核酸配列と少なくとも60%、65%、70%、75%、80%、85%、90%、92%、95%、96%、97%、98%または99%同一であり、配列番号2に示されているアミノ酸配列を有する転写因子をコードするその変異体、またはテルペン生合成を調節することができるその断片もしくは変異体を提供する。
本発明のある実施形態は、転写因子、転写因子と相同なポリペプチド、およびその変異体を提供する。
本発明の配列のホモログ、パラログ、オルソログおよび任意の他の変異体は、植物を、昆虫を駆除するまたはそれに抵抗する、あるいは、有益な生物、例えば、害虫の捕食者もしくは捕食寄生者または植物の花粉媒介者を誘引するようにすることによって同様に機能することが予測される。相同な配列は、配列番号1の核酸配列と実質的な配列同一性または類似性を共有する配列である。相同な配列は、単子葉または双子葉類を含む任意の植物、特に、これだけに限定されないが、トマト、コショウ、ナス、レタス、ヒマワリ、アブラナ、ブロッコリー、カリフラワーおよびキャベツ作物、キュウリ、メロン、スイカ、カボチャ(pumpkin)、カボチャ(squash)、ピーナッツ、ダイズ、綿、マメ、アボカド、タマネギ、エンダイブ、ニラ、根、例えば、クズウコン、ニンジン、ビート、カブ、ダイコン、ヤムイモ、キャッサバ、ジャガイモ、サツマイモなど、およびオクラを含む作物から得ることができる。相同な配列は、トウモロコシ、オオムギ、トウジンビエ、コムギ、ライムギ、モロコシ、イネ、タバコおよび飼料草を含む作物種に由来してもよい。相同な配列は、樹木種および新鮮な果実種、例えば、レモン、タンジェリン、オレンジ、ブドウ、モモ、セイヨウスモモ、フクサスグリ、サクランボ、メロン、イチゴ、およびマンゴーなどに由来してもよく、観葉植物種、例えば、ハイビスカス、ポインセチア、ユリ、アヤメ、バラおよびペチュニアなどに由来してもよい。さらに、相同な配列は、作物種の近縁野生種である植物種に由来してよい。
本発明の実施形態は、テルペンシンターゼ5(TPS5)およびテルペンシンターゼ11(TPS11)の少なくとも1つから選択されることが好ましい、テルペン生合成に関与する遺伝子の発現を上方制御または下方制御し、それにより、経路の下流の産物を改変するために使用することができるポリペプチド、ポリヌクレオチド、その断片またはキメラ遺伝子またはベクターを提供する。
「宿主細胞」または「形質転換された細胞」という句は、少なくとも1つの核酸分子、特に、転写されると害虫を駆除または誘引するために有用なテルペンをもたらす所望のタンパク質または核酸配列をコードするキメラ遺伝子を含む遺伝子操作された細胞を指す。宿主細胞は、植物細胞であることが好ましいが、真菌細胞、酵母細胞または細菌の細胞であってもよい。宿主細胞は核または細胞小器官のゲノムに組み込まれたキメラ遺伝子を含むことが好ましいが、染色体外に遺伝子を含有してもよい。
本発明の実施形態は、テルペン生合成の遺伝子の下方制御あるいは上方制御によって害虫に対する抵抗性を増大させ、それにより有益な昆虫を誘引するためまたは害虫を駆除するために植物から放出される揮発性テルペンのプロファイルの変更をもたらすための方法を提供する。
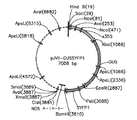
転写因子TF19(6)をコードする配列番号1のヌクレオチド配列:
(実施例1)
植物性材料、ホルモン処理およびRNA単離
トマト植物体(トマト(Solanum lycopersicum)栽培品種Moneymaker)を、温室内の土壌で、昼/夜温度23℃〜18℃および16/8時間の明/暗レジメンで4週間にわたって生長させた。毛状突起を、液体窒素で凍結させた幹片をボルテックスすることによって、50mlのチューブの底に収集した。残ったきれいな幹セグメントを徹底的にブラシでこすって残っている毛状突起材料を全て除去した(むきだしの幹試料)。幹全体(毛状突起を含む)および葉も液体窒素で凍結させ、材料をすりつぶし、Trizol(Invitrogen、Paisley、UK)を使用して全RNAを単離した。
構築物および安定な植物の形質転換
完全なSITPS5プロモーターおよびその5'欠失の系列を、PCRを使用して生成した。Sacl制限酵素部位を各フォワードプライマーの5'末端に創出し、リバースプライマーの3'末端にXbal制限酵素部位を創出した。50ngのプラスミドDNA pKG1662adp-SIMTS1 p:GUSを鋳型として使用し、0.25単位のPhusion Hot Startポリメラーゼ(Finnzymes、Espoo、Finland)、0.4mMの濃度の各プライマーおよび反応体積25μl中0.2mMの濃度のdNTPを用いた。MgCl2を、最終濃度0.3mMでPCRミックスに加えた。サイクリングプログラムを、98℃で1分、98℃で10秒を30サイクル、58℃で30秒、72℃で60秒、その後、72℃で5分の最終的な伸長、およびサーモサイクラーから取り出すまで12℃に冷却することに設定した。
トランスジェニック植物の分析
空のpBINplusベクターから1つのトランスジェニック系統が得られ、全長のSITPS5プロモーター構築物から4つの独立したトランスジェニック系統が得られ、1045bpのSITPS5プロモーター構築物から3つのトランスジェニック系統が得られ、805bpおよび612bpのSITPS5プロモーター構築物については5つのトランスジェニック系統が得られ、408bpのSITPS5プロモーター構築物については8つのトランスジェニック系統が得られ、207bpのSITPS5プロモーター構築物については9つのトランスジェニック系統が得られた。導入遺伝子の挿入を、異なるT0系統の葉から単離されたゲノムDNAに対するPCRによって検証した。
酵母ワンハイブリッドおよびクローン19(6)の同定
207bpのSITPS5プロモーター断片は、全長のプロモーターの毛状突起特異的活性よりは弱いものの、毛状突起特異的活性を示し(図2)、したがって、この断片を酵母ワンハイブリッド(Y1H)アッセイのために使用した。
リアルタイム定量的PCR
ABI 7500 Real Time PCR Systen(Applied Biosystems、Carlsbad、CA、USA)で、Platinum SYBR Green qPCR SuperMix-UDGキット(Invitrogen、Paisley、UK)を使用してRT-Q-PCRを実施した。各20μlの反応物は0.25μΜの各プライマー、0.1μlのROX参照色素および1μlの鋳型cDNAを含有した。サイクリングプログラムを50℃で2分、95℃で7分、95℃で15秒を45サイクル、および60℃で1分および融解曲線分析に設定した。プライマー対を、標準のcDNA希釈曲線を用いて特異性および直線性について試験した。トマトアクチン遺伝子(ACT)を構成的に発現される対照遺伝子として使用した。
トランス活性化アッセイ
DNA結合活性をトランス活性化アッセイにおいて確認した。Ncol制限酵素部位をフォワードプライマーの5'末端に創出し、Sacl制限酵素部位をリバースプライマーの3'末端に創出し、Phusion Hot Startポリメラーゼ(Finnzymes、Espoo、Finland)を使用して上記の通り実施したPCRにおいて全長のcDNA19(6)を生成した。50ngのプラスミドDNA pAD-GAL4-2.1_clone19(6)を鋳型として使用した。
TF19(6)配列同一性
ポリペプチド配列同一性を、Althsulら 1990年 J Mol Biol 215巻:403〜410頁に記載のBLASTアルゴリズムを使用して決定した。BLASTプログラムは、National Institute of Health、USAのウェブサイトでNational Center for Biotechnology Information(NCBI)を通じて公的に入手可能である。
昆虫バイオアッセイ
昆虫バイオアッセイを温室内の制御条件下で実施する。植物を、本発明の方法を用いて改変した。例えば:トマト(Solanum lycopersicum)を、pBIN 35S-19(6)(配列番号2のアミノ酸配列を有するタンパク質をコードする)を用い、アグロバクテリウム媒介形質転換の手段によって改変する。あるいは、突然変異誘発した集団内で、本発明の転写因子をコードする配列番号1の核酸配列またはその断片に1つまたは複数の突然変異を有するトマト(Solanum lycopersicum)突然変異体を同定する。改変された植物の害虫抵抗性を、Bleekerら、2011年 Phytochemistry 72巻:8〜73頁;および特許出願WO 2010/099,985に記載の選択試験および非選択試験において、改変されていない対照植物の害虫抵抗性と比較する。以下の昆虫クラスに対する抵抗性を決定する:鱗翅目;甲虫目;双翅目;半翅目(Hemiptera);ダニ目(Acari);総翅目(Thysanoptera)。
Claims (20)
- a)植物におけるテルペン生合成を増大させることができるポリペプチドをコードする、配列番号1の核酸配列を有する核酸;
b)配列番号2のアミノ酸配列または配列番号2のアミノ酸配列と少なくとも90%同一なアミノ酸配列を含む、植物におけるテルペン生合成を増大させることができるポリペプチドをコードする核酸;および
c)全長にわたって(a)の核酸配列と少なくとも95%同一であり、植物におけるテルペン生合成を増大させることができるポリペプチドをコードする核酸
を含む群から選択される、単離された、合成されたまたは組換えられた核酸。 - 請求項1に記載の核酸を含むキメラ遺伝子。
- 請求項1に記載の核酸または請求項2に記載のキメラ遺伝子を含むベクター。
- 請求項2に記載のキメラ遺伝子または請求項3に記載のベクターを含む宿主細胞。
- 植物におけるテルペン生合成を増大させることができ、
(a)配列番号2のアミノ酸配列;および
(b)(a)に記載のアミノ酸配列と少なくとも90%同一なアミノ酸配列
の群から選択されるアミノ酸配列を有する、DNA結合活性を有するポリペプチド。 - 前記植物におけるテルペン生合成に関与するポリペプチドをコードする少なくとも1つのヌクレオチド配列に作動可能に連結しているプロモーターの核酸配列に結合することができる、請求項5に記載のポリペプチド。
- テルペン生合成に関与する前記ポリペプチドがテルペンシンターゼ5(TPS5)およびテルペンシンターゼ11(TPS11)を含む群から選択される、請求項6に記載のポリペプチド。
- 前記プロモーターが毛状突起特異的プロモーターである、請求項6または7に記載のポリペプチド。
- 植物における少なくとも1つのテルペンの生成を増大させるための方法であって、
(a)植物細胞を、配列番号1に対して少なくとも90%の同一性を有し、植物におけるテルペン生合成を増大させることができるポリペプチドをコードする核酸またはその機能的断片を含むベクターを含む組成物と接触させるステップと、
(b)前記ベクターを用いて形質転換した前記植物細胞を選択するステップであって、前記植物細胞が前記核酸または前記断片を過剰発現しており、過剰発現により、前記細胞において、前記少なくとも1つのテルペンのレベルが形質転換されていない植物細胞と比較して増大する、ステップと、
(c)(b)の形質転換された細胞から前記植物を再生させるステップであって、前記植物の前記少なくとも1つのテルペンのレベルが、同じ遺伝的背景の形質転換されていない植物と比較して増大している、ステップと
を含む、方法。 - 前記テルペンが、昆虫を駆除するモノテルペンおよびセスキテルペンの少なくとも1つを含む、請求項9に記載の方法。
- 前記モノテルペンが、リナロール、パラ-シメン、γ-テルピネン、α-テルピネン、およびα-フェランドレンの群から選択される少なくとも1つの化合物を含む、請求項10に記載の方法。
- 前記セスキテルペンが、ネロリドール、ゲルマクレン、R-クルクメンおよび7-エピジンギベレンの群から選択される少なくとも1つの化合物を含む、請求項10に記載の方法。
- 前記昆虫が、吸液性昆虫を含む、請求項10から12までのいずれか一項に記載の方法。
- 前記吸液性昆虫が、キジラミ、コナジラミ、アブラムシ、コナカイガラムシ、ウンカおよびカイガラムシを含む、請求項13に記載の方法。
- 前記吸液性昆虫が、アザミウマ、ダニおよびヨコバイをさらに含む、請求項14に記載の方法。
- 前記植物が、トマト、コショウ、ナス、レタス、アブラナ、ブロッコリー、カリフラワー、キャベツ作物、キュウリ、メロン、カボチャ(pumpkin)、カボチャ(squash)、ピーナッツ、ダイズ、トウモロコシ、綿、マメ、キャッサバ、ジャガイモ、サツマイモおよびオクラの群から選択される少なくとも1つの作物である、請求項9から15までのいずれか一項に記載の方法。
- 前記植物が、ナス科から選択される少なくとも1つの植物を含む、請求項16に記載の方法。
- 前記植物が、ハイビスカス、ポインセチア、ユリ、アヤメ、バラおよびペチュニアの群から選択される少なくとも1つの観葉植物である、請求項9から15までのいずれか一項に記載の方法。
- 請求項2に記載のキメラ遺伝子を含む植物。
- 前記植物がナス科に属する、請求項19に記載の植物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161495399P | 2011-06-10 | 2011-06-10 | |
| US61/495,399 | 2011-06-10 | ||
| PCT/NL2012/050403 WO2012169893A1 (en) | 2011-06-10 | 2012-06-08 | Transcription factor modulating terpene biosynthesis |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2014516568A JP2014516568A (ja) | 2014-07-17 |
| JP2014516568A5 JP2014516568A5 (ja) | 2015-07-23 |
| JP6164657B2 true JP6164657B2 (ja) | 2017-07-19 |
Family
ID=46456980
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014514830A Expired - Fee Related JP6164657B2 (ja) | 2011-06-10 | 2012-06-08 | テルペン生合成を調節する転写因子 |
Country Status (5)
| Country | Link |
|---|---|
| US (2) | US9598473B2 (ja) |
| EP (1) | EP2718309B1 (ja) |
| JP (1) | JP6164657B2 (ja) |
| BR (1) | BR112013031709A2 (ja) |
| WO (1) | WO2012169893A1 (ja) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2015000992A1 (en) * | 2013-07-02 | 2015-01-08 | Rijk Zwaan Zaadteelt En Zaadhandel B.V. | Pepper with increased total content of terpenoids |
| MX2017001927A (es) | 2014-08-18 | 2017-04-27 | Rijk Zwaan Zaadteel En Zaadhandel B V | Plantas de tomate que permiten el establecimiento de los acaros. |
| CN108467899B (zh) * | 2017-02-23 | 2020-07-21 | 北京林业大学 | 筛选杨树生长和木材品质性状的miRNAs及其靶基因内SNP位点及筛选方法 |
| CN107419008B (zh) * | 2017-06-26 | 2021-07-13 | 上海惠皓医疗科技有限公司 | 一种早期精确诊断帕金森病的方法和试剂盒 |
| JP2019103400A (ja) * | 2017-12-08 | 2019-06-27 | キッコーマン株式会社 | イソプレノイドの製造方法並びにそのためのタンパク質、遺伝子及び形質転換体 |
| CN116240218A (zh) * | 2022-12-15 | 2023-06-09 | 南京林业大学 | 一种参与桂花花香物质合成OfWRKY84基因及其表达蛋白和应用 |
Family Cites Families (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DK152291D0 (da) | 1991-08-28 | 1991-08-28 | Danisco | Fremgangsmaade og kemiske forbindelser |
| US7960612B2 (en) * | 1998-09-22 | 2011-06-14 | Mendel Biotechnology, Inc. | Plant quality with various promoters |
| AU779162B2 (en) | 1999-02-05 | 2005-01-06 | Rijksuniversiteit Leiden | Method of modulating metabolite biosynthesis in recombinant cells |
| US20030096268A1 (en) | 2001-07-06 | 2003-05-22 | Michael Weiner | Method for isolation of independent, parallel chemical micro-reactions using a porous filter |
| US6902921B2 (en) | 2001-10-30 | 2005-06-07 | 454 Corporation | Sulfurylase-luciferase fusion proteins and thermostable sulfurylase |
| EP2159285B1 (en) | 2003-01-29 | 2012-09-26 | 454 Life Sciences Corporation | Methods of amplifying and sequencing nucleic acids |
| US7001081B2 (en) | 2003-05-22 | 2006-02-21 | 3M Innovative Properties Company | Strain relief boot with flexible extension for guiding fiber optic cable |
| FR2881143B1 (fr) * | 2005-01-27 | 2010-12-17 | Librophyt | Systeme de production de terpenoides dans les plantes |
| CA2623539C (en) | 2005-09-29 | 2015-12-15 | Keygene N.V. | High throughput screening of mutagenized populations |
| CN101952445A (zh) | 2007-12-21 | 2011-01-19 | 关键基因公司 | 毛状体特异性启动子 |
| WO2010099985A2 (en) | 2009-03-05 | 2010-09-10 | Keygene N.V. | Plant volatiles based on r-curcumene |
-
2012
- 2012-06-08 EP EP12731757.6A patent/EP2718309B1/en not_active Not-in-force
- 2012-06-08 BR BR112013031709A patent/BR112013031709A2/pt not_active IP Right Cessation
- 2012-06-08 WO PCT/NL2012/050403 patent/WO2012169893A1/en active Application Filing
- 2012-06-08 US US14/124,629 patent/US9598473B2/en not_active Expired - Fee Related
- 2012-06-08 JP JP2014514830A patent/JP6164657B2/ja not_active Expired - Fee Related
-
2017
- 2017-03-10 US US15/455,294 patent/US20170247713A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| EP2718309B1 (en) | 2018-04-04 |
| US20140173771A1 (en) | 2014-06-19 |
| BR112013031709A2 (pt) | 2016-12-06 |
| US20170247713A1 (en) | 2017-08-31 |
| JP2014516568A (ja) | 2014-07-17 |
| EP2718309A1 (en) | 2014-04-16 |
| WO2012169893A1 (en) | 2012-12-13 |
| US9598473B2 (en) | 2017-03-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Huang et al. | Variation of herbivore-induced volatile terpenes among Arabidopsis ecotypes depends on allelic differences and subcellular targeting of two terpene synthases, TPS02 and TPS03 | |
| US20170247713A1 (en) | Trichome-specific transcription factor modulating terpene biosynthesis | |
| DeBoer et al. | RNAi-mediated down-regulation of ornithine decarboxylase (ODC) leads to reduced nicotine and increased anatabine levels in transgenic Nicotiana tabacum L. | |
| KR102012531B1 (ko) | 니코티아나 타바쿰으로부터의 트레오닌 합성효소 및 그의 방법 및 용도 | |
| KR101965019B1 (ko) | 식물에서의 베타-다마세논의 조절 | |
| MX2010013722A (es) | Composiciones y metodos de uso de proteina quinasa quinasa quinasa activada por mitogeno. | |
| EP1859044A2 (en) | Resistance against parasitic weeds | |
| US20150059018A1 (en) | Methods and compositions for producing drimenol | |
| JP2016034270A (ja) | 高密度植栽に好適な植物体およびその利用 | |
| Shao et al. | Overexpression of FBR 41 enhances resistance to sphinganine analog mycotoxin‐induced cell death and Alternaria stem canker in tomato | |
| AU2013221024B2 (en) | Improving drought resistance in plants: UPL4 | |
| US9834784B2 (en) | Pest resistant plants | |
| JP2006502733A (ja) | 植物α−ファルネセン合成酵素およびそれをコードするポリヌクレオチド | |
| AU2012287963A1 (en) | Novel gene inducing elongation of roots or increasing biomass, and use therefor | |
| Ye et al. | Knock-out of BnHva22c reduces the susceptibility of Brassica napus to infection with the fungal pathogen Verticillium longisporum | |
| US20110225682A1 (en) | Polynucleotides encoding caryophyllene synthase and uses thereof | |
| RU2546877C2 (ru) | Фарнезен-синтаза | |
| Li | Study of genes modifying morphology, pathogen interactions and MEP-derived metabolites during barley root colonization by Piriformospora indica via stable root transformation system | |
| Mauro et al. | Analysis of the sirtuin genes in Arabidopsis thaliana |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140212 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140501 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20150605 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20150605 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20160322 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20160328 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20160627 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20160829 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20161128 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20170228 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170427 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20170515 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20170614 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6164657 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| LAPS | Cancellation because of no payment of annual fees |