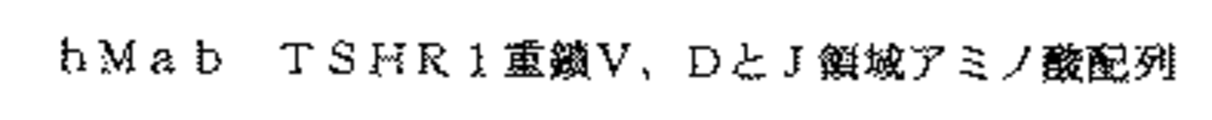JP5722927B2 - チロトロピン受容体の結合対象及びその使用 - Google Patents
チロトロピン受容体の結合対象及びその使用 Download PDFInfo
- Publication number
- JP5722927B2 JP5722927B2 JP2013007593A JP2013007593A JP5722927B2 JP 5722927 B2 JP5722927 B2 JP 5722927B2 JP 2013007593 A JP2013007593 A JP 2013007593A JP 2013007593 A JP2013007593 A JP 2013007593A JP 5722927 B2 JP5722927 B2 JP 5722927B2
- Authority
- JP
- Japan
- Prior art keywords
- binding
- tsh receptor
- tsh
- antibody
- molecule
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 230000027455 binding Effects 0.000 title claims abstract description 623
- 238000009739 binding Methods 0.000 title claims abstract description 623
- 102000015486 thyroid-stimulating hormone receptor activity proteins Human genes 0.000 title description 5
- 108040006218 thyroid-stimulating hormone receptor activity proteins Proteins 0.000 title description 5
- 102000003911 Thyrotropin Receptors Human genes 0.000 claims abstract description 599
- 108090000253 Thyrotropin Receptors Proteins 0.000 claims abstract description 599
- 239000012634 fragment Substances 0.000 claims abstract description 120
- 238000000034 method Methods 0.000 claims abstract description 88
- 230000003993 interaction Effects 0.000 claims abstract description 55
- 201000010099 disease Diseases 0.000 claims description 74
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 74
- 210000002966 serum Anatomy 0.000 claims description 70
- 230000005764 inhibitory process Effects 0.000 claims description 57
- 210000004027 cell Anatomy 0.000 claims description 53
- 230000000694 effects Effects 0.000 claims description 49
- 230000004936 stimulating effect Effects 0.000 claims description 42
- 210000001124 body fluid Anatomy 0.000 claims description 35
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 35
- 230000000638 stimulation Effects 0.000 claims description 34
- 239000010839 body fluid Substances 0.000 claims description 33
- 239000003446 ligand Substances 0.000 claims description 28
- 238000004519 manufacturing process Methods 0.000 claims description 25
- 208000023275 Autoimmune disease Diseases 0.000 claims description 24
- 230000002401 inhibitory effect Effects 0.000 claims description 24
- 238000012544 monitoring process Methods 0.000 claims description 23
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 23
- 238000012216 screening Methods 0.000 claims description 23
- 230000028993 immune response Effects 0.000 claims description 22
- 229920001184 polypeptide Polymers 0.000 claims description 20
- 230000003491 cAMP production Effects 0.000 claims description 19
- 210000004978 chinese hamster ovary cell Anatomy 0.000 claims description 17
- 102000005962 receptors Human genes 0.000 claims description 14
- 108020003175 receptors Proteins 0.000 claims description 14
- 238000000099 in vitro assay Methods 0.000 claims 1
- 238000003745 diagnosis Methods 0.000 abstract description 3
- 238000002560 therapeutic procedure Methods 0.000 abstract description 2
- 108010061174 Thyrotropin Proteins 0.000 description 159
- 102000011923 Thyrotropin Human genes 0.000 description 159
- 101000772267 Homo sapiens Thyrotropin receptor Proteins 0.000 description 69
- 102100029337 Thyrotropin receptor Human genes 0.000 description 67
- 125000003275 alpha amino acid group Chemical group 0.000 description 57
- 238000003556 assay Methods 0.000 description 48
- 239000002773 nucleotide Substances 0.000 description 47
- 125000003729 nucleotide group Chemical group 0.000 description 47
- 238000002360 preparation method Methods 0.000 description 44
- 239000012131 assay buffer Substances 0.000 description 40
- 210000004698 lymphocyte Anatomy 0.000 description 34
- 210000001519 tissue Anatomy 0.000 description 32
- 210000001685 thyroid gland Anatomy 0.000 description 30
- IVOMOUWHDPKRLL-KQYNXXCUSA-N Cyclic adenosine monophosphate Chemical compound C([C@H]1O2)OP(O)(=O)O[C@H]1[C@@H](O)[C@@H]2N1C(N=CN=C2N)=C2N=C1 IVOMOUWHDPKRLL-KQYNXXCUSA-N 0.000 description 29
- IVOMOUWHDPKRLL-UHFFFAOYSA-N UNPD107823 Natural products O1C2COP(O)(=O)OC2C(O)C1N1C(N=CN=C2N)=C2N=C1 IVOMOUWHDPKRLL-UHFFFAOYSA-N 0.000 description 29
- 229940095074 cyclic amp Drugs 0.000 description 29
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 26
- 108091022930 Glutamate decarboxylase Proteins 0.000 description 23
- 238000012360 testing method Methods 0.000 description 23
- 150000001413 amino acids Chemical class 0.000 description 18
- 102100035902 Glutamate decarboxylase 1 Human genes 0.000 description 17
- 238000004458 analytical method Methods 0.000 description 17
- 229940126619 mouse monoclonal antibody Drugs 0.000 description 17
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 16
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 16
- 241000699666 Mus <mouse, genus> Species 0.000 description 16
- 239000013615 primer Substances 0.000 description 16
- 239000012228 culture supernatant Substances 0.000 description 15
- 238000001727 in vivo Methods 0.000 description 15
- 108091033319 polynucleotide Chemical group 0.000 description 15
- 239000002157 polynucleotide Chemical group 0.000 description 15
- 102000040430 polynucleotide Human genes 0.000 description 15
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 14
- 208000015023 Graves' disease Diseases 0.000 description 13
- 108090000623 proteins and genes Proteins 0.000 description 13
- 108010032595 Antibody Binding Sites Proteins 0.000 description 12
- 208000023328 Basedow disease Diseases 0.000 description 12
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 12
- 238000002965 ELISA Methods 0.000 description 12
- 239000005557 antagonist Substances 0.000 description 12
- 230000003302 anti-idiotype Effects 0.000 description 12
- 229960002685 biotin Drugs 0.000 description 12
- 239000011616 biotin Substances 0.000 description 12
- 150000001875 compounds Chemical class 0.000 description 12
- 241000588724 Escherichia coli Species 0.000 description 11
- 239000013078 crystal Substances 0.000 description 11
- 230000008569 process Effects 0.000 description 11
- 239000011780 sodium chloride Substances 0.000 description 11
- 239000000427 antigen Substances 0.000 description 10
- 229940098773 bovine serum albumin Drugs 0.000 description 10
- 238000010367 cloning Methods 0.000 description 10
- 108091007433 antigens Proteins 0.000 description 9
- 102000036639 antigens Human genes 0.000 description 9
- 230000005784 autoimmunity Effects 0.000 description 9
- 239000003795 chemical substances by application Substances 0.000 description 9
- 238000003757 reverse transcription PCR Methods 0.000 description 9
- 108091028043 Nucleic acid sequence Proteins 0.000 description 8
- 230000009471 action Effects 0.000 description 8
- 239000000556 agonist Substances 0.000 description 8
- 238000010586 diagram Methods 0.000 description 8
- 230000004060 metabolic process Effects 0.000 description 8
- 239000000203 mixture Substances 0.000 description 8
- 229920003023 plastic Polymers 0.000 description 8
- 239000004033 plastic Substances 0.000 description 8
- 102000004169 proteins and genes Human genes 0.000 description 8
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 7
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 7
- 235000020958 biotin Nutrition 0.000 description 7
- 210000004369 blood Anatomy 0.000 description 7
- 239000008280 blood Substances 0.000 description 7
- 238000010790 dilution Methods 0.000 description 7
- 239000012895 dilution Substances 0.000 description 7
- 230000006870 function Effects 0.000 description 7
- 239000008103 glucose Substances 0.000 description 7
- BPHPUYQFMNQIOC-NXRLNHOXSA-N isopropyl beta-D-thiogalactopyranoside Chemical compound CC(C)S[C@@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O BPHPUYQFMNQIOC-NXRLNHOXSA-N 0.000 description 7
- 229960000874 thyrotropin Drugs 0.000 description 7
- 230000001748 thyrotropin Effects 0.000 description 7
- 102000008214 Glutamate decarboxylase Human genes 0.000 description 6
- 241000699670 Mus sp. Species 0.000 description 6
- 230000000903 blocking effect Effects 0.000 description 6
- 238000006243 chemical reaction Methods 0.000 description 6
- 238000001514 detection method Methods 0.000 description 6
- 239000003112 inhibitor Substances 0.000 description 6
- 239000000463 material Substances 0.000 description 6
- 238000005259 measurement Methods 0.000 description 6
- 239000013612 plasmid Substances 0.000 description 6
- 230000003389 potentiating effect Effects 0.000 description 6
- 230000035945 sensitivity Effects 0.000 description 6
- 238000006467 substitution reaction Methods 0.000 description 6
- 241000701044 Human gammaherpesvirus 4 Species 0.000 description 5
- 229930006000 Sucrose Natural products 0.000 description 5
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 5
- 208000024770 Thyroid neoplasm Diseases 0.000 description 5
- 125000000539 amino acid group Chemical group 0.000 description 5
- 230000008901 benefit Effects 0.000 description 5
- 239000003814 drug Substances 0.000 description 5
- 239000005720 sucrose Substances 0.000 description 5
- 201000002510 thyroid cancer Diseases 0.000 description 5
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 4
- 108010067060 Immunoglobulin Variable Region Proteins 0.000 description 4
- 102000017727 Immunoglobulin Variable Region Human genes 0.000 description 4
- 239000013504 Triton X-100 Substances 0.000 description 4
- 229920004890 Triton X-100 Polymers 0.000 description 4
- 238000007792 addition Methods 0.000 description 4
- AVKUERGKIZMTKX-NJBDSQKTSA-N ampicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=CC=C1 AVKUERGKIZMTKX-NJBDSQKTSA-N 0.000 description 4
- 229960000723 ampicillin Drugs 0.000 description 4
- 230000003466 anti-cipated effect Effects 0.000 description 4
- 239000007975 buffered saline Substances 0.000 description 4
- 238000012512 characterization method Methods 0.000 description 4
- 239000003153 chemical reaction reagent Substances 0.000 description 4
- 238000012217 deletion Methods 0.000 description 4
- 230000037430 deletion Effects 0.000 description 4
- 238000002474 experimental method Methods 0.000 description 4
- 230000003053 immunization Effects 0.000 description 4
- 238000002649 immunization Methods 0.000 description 4
- 238000000338 in vitro Methods 0.000 description 4
- 238000002372 labelling Methods 0.000 description 4
- 230000010807 negative regulation of binding Effects 0.000 description 4
- 238000002823 phage display Methods 0.000 description 4
- 239000000047 product Substances 0.000 description 4
- 238000013391 scatchard analysis Methods 0.000 description 4
- 238000012163 sequencing technique Methods 0.000 description 4
- 239000005495 thyroid hormone Substances 0.000 description 4
- 229940036555 thyroid hormone Drugs 0.000 description 4
- MZIYRTZAYQIAHW-UHFFFAOYSA-N 1-methyl-8-(2-methylpropyl)-3,7-dihydropurine-2,6-dione Chemical compound N1C(=O)N(C)C(=O)C2=C1N=C(CC(C)C)N2 MZIYRTZAYQIAHW-UHFFFAOYSA-N 0.000 description 3
- 208000026872 Addison Disease Diseases 0.000 description 3
- 108020004414 DNA Proteins 0.000 description 3
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 3
- 102000004190 Enzymes Human genes 0.000 description 3
- 108090000790 Enzymes Proteins 0.000 description 3
- 108010036012 Iodide peroxidase Proteins 0.000 description 3
- 241001529936 Murinae Species 0.000 description 3
- 102000014169 Steroid 21-Hydroxylase Human genes 0.000 description 3
- 108010011732 Steroid 21-Hydroxylase Proteins 0.000 description 3
- 102000009843 Thyroglobulin Human genes 0.000 description 3
- 108010034949 Thyroglobulin Proteins 0.000 description 3
- 102000014267 Thyroid peroxidases Human genes 0.000 description 3
- AUYYCJSJGJYCDS-LBPRGKRZSA-N Thyrolar Chemical compound IC1=CC(C[C@H](N)C(O)=O)=CC(I)=C1OC1=CC=C(O)C(I)=C1 AUYYCJSJGJYCDS-LBPRGKRZSA-N 0.000 description 3
- 206010067584 Type 1 diabetes mellitus Diseases 0.000 description 3
- 238000002835 absorbance Methods 0.000 description 3
- 210000003719 b-lymphocyte Anatomy 0.000 description 3
- 230000008827 biological function Effects 0.000 description 3
- 239000000872 buffer Substances 0.000 description 3
- 208000025302 chronic primary adrenal insufficiency Diseases 0.000 description 3
- 238000012875 competitive assay Methods 0.000 description 3
- 230000006552 constitutive activation Effects 0.000 description 3
- 206010012601 diabetes mellitus Diseases 0.000 description 3
- 230000004927 fusion Effects 0.000 description 3
- 210000004408 hybridoma Anatomy 0.000 description 3
- 238000001114 immunoprecipitation Methods 0.000 description 3
- 238000002955 isolation Methods 0.000 description 3
- 230000035772 mutation Effects 0.000 description 3
- 239000008188 pellet Substances 0.000 description 3
- 238000012545 processing Methods 0.000 description 3
- 230000001105 regulatory effect Effects 0.000 description 3
- 230000004044 response Effects 0.000 description 3
- 238000000926 separation method Methods 0.000 description 3
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 3
- 239000006228 supernatant Substances 0.000 description 3
- 230000001225 therapeutic effect Effects 0.000 description 3
- 229960002175 thyroglobulin Drugs 0.000 description 3
- 238000001262 western blot Methods 0.000 description 3
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 2
- LRFVTYWOQMYALW-UHFFFAOYSA-N 9H-xanthine Chemical compound O=C1NC(=O)NC2=C1NC=N2 LRFVTYWOQMYALW-UHFFFAOYSA-N 0.000 description 2
- 229920001817 Agar Polymers 0.000 description 2
- 102000004506 Blood Proteins Human genes 0.000 description 2
- 108010017384 Blood Proteins Proteins 0.000 description 2
- 108020004705 Codon Proteins 0.000 description 2
- 108020004635 Complementary DNA Proteins 0.000 description 2
- XUIIKFGFIJCVMT-GFCCVEGCSA-N D-thyroxine Chemical compound IC1=CC(C[C@@H](N)C(O)=O)=CC(I)=C1OC1=CC(I)=C(O)C(I)=C1 XUIIKFGFIJCVMT-GFCCVEGCSA-N 0.000 description 2
- 238000001712 DNA sequencing Methods 0.000 description 2
- 206010015108 Epstein-Barr virus infection Diseases 0.000 description 2
- ARPVSMCNIDAQBO-YUMQZZPRSA-N Gln-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@@H](N)CCC(N)=O ARPVSMCNIDAQBO-YUMQZZPRSA-N 0.000 description 2
- VLDVBZICYBVQHB-IUCAKERBSA-N His-Val Chemical compound CC(C)[C@@H](C([O-])=O)NC(=O)[C@@H]([NH3+])CC1=CN=CN1 VLDVBZICYBVQHB-IUCAKERBSA-N 0.000 description 2
- 206010020850 Hyperthyroidism Diseases 0.000 description 2
- 108060003951 Immunoglobulin Proteins 0.000 description 2
- 101150008942 J gene Proteins 0.000 description 2
- JOCBASBOOFNAJA-UHFFFAOYSA-N N-tris(hydroxymethyl)methyl-2-aminoethanesulfonic acid Chemical compound OCC(CO)(CO)NCCS(O)(=O)=O JOCBASBOOFNAJA-UHFFFAOYSA-N 0.000 description 2
- 108010067902 Peptide Library Proteins 0.000 description 2
- 229920001213 Polysorbate 20 Polymers 0.000 description 2
- 239000007994 TES buffer Substances 0.000 description 2
- 108010066702 Thyrotropin Alfa Proteins 0.000 description 2
- 230000004913 activation Effects 0.000 description 2
- 230000000996 additive effect Effects 0.000 description 2
- 239000002671 adjuvant Substances 0.000 description 2
- 238000001042 affinity chromatography Methods 0.000 description 2
- 239000008272 agar Substances 0.000 description 2
- 239000003708 ampul Substances 0.000 description 2
- 230000000692 anti-sense effect Effects 0.000 description 2
- 238000003149 assay kit Methods 0.000 description 2
- 238000004166 bioassay Methods 0.000 description 2
- 230000004071 biological effect Effects 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 238000004113 cell culture Methods 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 238000002405 diagnostic procedure Methods 0.000 description 2
- 230000002124 endocrine Effects 0.000 description 2
- 239000012894 fetal calf serum Substances 0.000 description 2
- 230000002068 genetic effect Effects 0.000 description 2
- 210000004602 germ cell Anatomy 0.000 description 2
- 230000001900 immune effect Effects 0.000 description 2
- 102000018358 immunoglobulin Human genes 0.000 description 2
- 238000011534 incubation Methods 0.000 description 2
- 239000003202 long acting thyroid stimulator Substances 0.000 description 2
- 210000002540 macrophage Anatomy 0.000 description 2
- 238000000302 molecular modelling Methods 0.000 description 2
- 238000002703 mutagenesis Methods 0.000 description 2
- 231100000350 mutagenesis Toxicity 0.000 description 2
- 210000005259 peripheral blood Anatomy 0.000 description 2
- 239000011886 peripheral blood Substances 0.000 description 2
- 102000013415 peroxidase activity proteins Human genes 0.000 description 2
- 108040007629 peroxidase activity proteins Proteins 0.000 description 2
- 239000008194 pharmaceutical composition Substances 0.000 description 2
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 2
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- 238000012552 review Methods 0.000 description 2
- 210000000952 spleen Anatomy 0.000 description 2
- 210000004989 spleen cell Anatomy 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- HKAVADYDPYUPRD-UHFFFAOYSA-N 1h-pyrazine-2-thione Chemical compound SC1=CN=CC=N1 HKAVADYDPYUPRD-UHFFFAOYSA-N 0.000 description 1
- NHBKXEKEPDILRR-UHFFFAOYSA-N 2,3-bis(butanoylsulfanyl)propyl butanoate Chemical compound CCCC(=O)OCC(SC(=O)CCC)CSC(=O)CCC NHBKXEKEPDILRR-UHFFFAOYSA-N 0.000 description 1
- YRNWIFYIFSBPAU-UHFFFAOYSA-N 4-[4-(dimethylamino)phenyl]-n,n-dimethylaniline Chemical compound C1=CC(N(C)C)=CC=C1C1=CC=C(N(C)C)C=C1 YRNWIFYIFSBPAU-UHFFFAOYSA-N 0.000 description 1
- 238000012232 AGPC extraction Methods 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- 101710098119 Chaperonin GroEL 2 Proteins 0.000 description 1
- 108010009685 Cholinergic Receptors Proteins 0.000 description 1
- 108010047041 Complementarity Determining Regions Proteins 0.000 description 1
- 101150097493 D gene Proteins 0.000 description 1
- 239000003155 DNA primer Substances 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 108010042407 Endonucleases Proteins 0.000 description 1
- 102000004533 Endonucleases Human genes 0.000 description 1
- 208000003807 Graves Disease Diseases 0.000 description 1
- 206010062767 Hypophysitis Diseases 0.000 description 1
- 102000018071 Immunoglobulin Fc Fragments Human genes 0.000 description 1
- 108010091135 Immunoglobulin Fc Fragments Proteins 0.000 description 1
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 1
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 1
- 108700005091 Immunoglobulin Genes Proteins 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- 206010028372 Muscular weakness Diseases 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 239000000020 Nitrocellulose Substances 0.000 description 1
- 206010035226 Plasma cell myeloma Diseases 0.000 description 1
- 108091081021 Sense strand Proteins 0.000 description 1
- 229920002684 Sepharose Polymers 0.000 description 1
- 238000012300 Sequence Analysis Methods 0.000 description 1
- 108010090804 Streptavidin Proteins 0.000 description 1
- 208000024799 Thyroid disease Diseases 0.000 description 1
- 102100027188 Thyroid peroxidase Human genes 0.000 description 1
- 208000026062 Tissue disease Diseases 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- 102000034337 acetylcholine receptors Human genes 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- -1 aliphatic amino acids Chemical class 0.000 description 1
- 150000001408 amides Chemical group 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 125000003118 aryl group Chemical group 0.000 description 1
- 239000011324 bead Substances 0.000 description 1
- 229960000074 biopharmaceutical Drugs 0.000 description 1
- 210000001185 bone marrow Anatomy 0.000 description 1
- 210000004899 c-terminal region Anatomy 0.000 description 1
- 238000011088 calibration curve Methods 0.000 description 1
- 229940041514 candida albicans extract Drugs 0.000 description 1
- YDMCWONVABEGBK-UHFFFAOYSA-N carbamimidoylazanium;phenoxide Chemical compound NC(N)=N.OC1=CC=CC=C1 YDMCWONVABEGBK-UHFFFAOYSA-N 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 230000002860 competitive effect Effects 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 239000003599 detergent Substances 0.000 description 1
- 238000009792 diffusion process Methods 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 239000003937 drug carrier Substances 0.000 description 1
- 230000008713 feedback mechanism Effects 0.000 description 1
- 230000001605 fetal effect Effects 0.000 description 1
- 239000012997 ficoll-paque Substances 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 210000005260 human cell Anatomy 0.000 description 1
- 244000052637 human pathogen Species 0.000 description 1
- 210000004754 hybrid cell Anatomy 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- 239000000960 hypophysis hormone Substances 0.000 description 1
- 210000003016 hypothalamus Anatomy 0.000 description 1
- 208000026278 immune system disease Diseases 0.000 description 1
- 238000003018 immunoassay Methods 0.000 description 1
- 230000002779 inactivation Effects 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 238000012332 laboratory investigation Methods 0.000 description 1
- 101150066555 lacZ gene Proteins 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 210000001165 lymph node Anatomy 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 229960004452 methionine Drugs 0.000 description 1
- 230000036473 myasthenia Effects 0.000 description 1
- 201000000050 myeloid neoplasm Diseases 0.000 description 1
- 239000013642 negative control Substances 0.000 description 1
- 229920001220 nitrocellulos Polymers 0.000 description 1
- 102000039446 nucleic acids Human genes 0.000 description 1
- 108020004707 nucleic acids Proteins 0.000 description 1
- 150000007523 nucleic acids Chemical class 0.000 description 1
- 238000006384 oligomerization reaction Methods 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 244000052769 pathogen Species 0.000 description 1
- 210000005105 peripheral blood lymphocyte Anatomy 0.000 description 1
- 210000001322 periplasm Anatomy 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 239000012071 phase Substances 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- 210000003635 pituitary gland Anatomy 0.000 description 1
- 238000002264 polyacrylamide gel electrophoresis Methods 0.000 description 1
- 239000013641 positive control Substances 0.000 description 1
- 238000003127 radioimmunoassay Methods 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 238000010188 recombinant method Methods 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 108091008146 restriction endonucleases Proteins 0.000 description 1
- 150000003384 small molecules Chemical class 0.000 description 1
- 239000007790 solid phase Substances 0.000 description 1
- 239000000243 solution Substances 0.000 description 1
- 230000009870 specific binding Effects 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 125000001424 substituent group Chemical group 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 239000012085 test solution Substances 0.000 description 1
- 102000004217 thyroid hormone receptors Human genes 0.000 description 1
- 108090000721 thyroid hormone receptors Proteins 0.000 description 1
- 229940034208 thyroxine Drugs 0.000 description 1
- XUIIKFGFIJCVMT-UHFFFAOYSA-N thyroxine-binding globulin Natural products IC1=CC(CC([NH3+])C([O-])=O)=CC(I)=C1OC1=CC(I)=C(O)C(I)=C1 XUIIKFGFIJCVMT-UHFFFAOYSA-N 0.000 description 1
- 238000011200 topical administration Methods 0.000 description 1
- 238000013518 transcription Methods 0.000 description 1
- 230000035897 transcription Effects 0.000 description 1
- 238000001890 transfection Methods 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 238000013519 translation Methods 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- 239000012137 tryptone Substances 0.000 description 1
- 229960005486 vaccine Drugs 0.000 description 1
- 238000003260 vortexing Methods 0.000 description 1
- 229940075420 xanthine Drugs 0.000 description 1
- 239000012138 yeast extract Substances 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2869—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against hormone receptors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/564—Immunoassay; Biospecific binding assay; Materials therefor for pre-existing immune complex or autoimmune disease, i.e. systemic lupus erythematosus, rheumatoid arthritis, multiple sclerosis, rheumatoid factors or complement components C1-C9
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/74—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving hormones or other non-cytokine intercellular protein regulatory factors such as growth factors, including receptors to hormones and growth factors
- G01N33/76—Human chorionic gonadotropin including luteinising hormone, follicle stimulating hormone, thyroid stimulating hormone or their receptors
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/575—Hormones
- G01N2333/59—Follicle-stimulating hormone [FSH]; Chorionic gonadotropins, e.g. HCG; Luteinising hormone [LH]; Thyroid-stimulating hormone [TSH]
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Immunology (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- Biomedical Technology (AREA)
- Hematology (AREA)
- Urology & Nephrology (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Biochemistry (AREA)
- Microbiology (AREA)
- Endocrinology (AREA)
- Cell Biology (AREA)
- Food Science & Technology (AREA)
- Biotechnology (AREA)
- Physics & Mathematics (AREA)
- Analytical Chemistry (AREA)
- Organic Chemistry (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- Neurology (AREA)
- Mycology (AREA)
- Rehabilitation Therapy (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Reproductive Health (AREA)
- Rheumatology (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Peptides Or Proteins (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Description
(a)TSH受容体抗体がTSHとTSH受容体調製物との結合を阻害する能力を測定する競合結合測定法、
(b)TSH受容体抗体が培養物においてTSH受容体を発現する細胞を刺激する能力を測定するバイオアッセイ、及び
(c)TSH受容体抗体によるTSH受容体調製物の免疫沈降。
J Sanders, Y Oda, S-A Roberts, M Maruyama, J Furmaniak, B Rees Smith、「チロトロピン受容体の機能−構造関係の理解」、Balliere's Clinical Endocrinology and Metabolism; Ed TF Davis 1997; 11(3): 451-479; Pub Balliere Tindall, London.
J Sanders, Y Oda, S Roberts, A Kiddie, T Richards, J Bolton, V McGrath, S Walters, D Jaskolski, J Furmaniak, B Rees Smith;「TSH受容体自己抗体と125I標識TSH受容体との相互作用」、Journal of Clinical Endocrinology and Metabolism 1999; 84(10): 3792-3802.
(i)1mg当たり国際標準NIBSC90/672少なくとも約15単位、更に好ましくは、1mg当たり国際標準NIBSC90/672少なくとも約30単位、更に好ましくは、1mg当たり国際標準NIBSC90/672少なくとも約60単位、又は更に好ましくは、1mg当たり国際標準NIBSC90/672少なくとも約120単位の、TSH受容体と結合するTSHに対する阻害活性、及び、
(ii)1mg当たり国際標準NIBSC90/672少なくとも約30単位、更に好ましくは、1mg当たり国際標準NIBSC90/672少なくとも約60単位、更に好ましくは、1mg当たり国際標準NIBSC90/672少なくとも約120単位、又は更に好ましくは、1mg当たり国際標準NIBSC90/672少なくとも約240単位の、TSH受容体を発現する細胞によるcAMP生成に対する刺激活性、
或いは、こうしたモノクローナル抗体又は組み換え抗体の一つ以上の断片によって特徴付けることが可能である。
(i)1mg当たり国際標準NIBSC90/672少なくとも約30単位、更に好ましくは、1mg当たり国際標準NIBSC90/672少なくとも約60単位、更に好ましくは、1mg当たり国際標準NIBSC90/672少なくとも約120単位、又は更に好ましくは、1mg当たり国際標準NIBSC90/672少なくとも約240単位の、TSH受容体と結合するTSHに対する阻害活性、及び、
(ii)1mg当たり国際標準NIBSC90/672少なくとも約50単位、更に好ましくは、1mg当たり国際標準NIBSC90/672少なくとも約100単位、更に好ましくは、1mg当たり国際標準NIBSC90/672少なくとも約200単位、又は更に好ましくは、1mg当たり国際標準NIBSC90/672少なくとも約400単位の、TSH受容体を発現する細胞によるcAMP生成に対する刺激活性、によって特徴付け可能であることが好ましい。
SEQ ID NO.1に示したようなVHドメインと、SEQ ID NO.2、SEQ ID NO.3、及びSEQ ID NO.4から選択されたアミノ酸配列を備えた一つ以上のVH CDRを含むVHドメインと、
によって構成されたグループから選択された抗体VHドメイン、及び/又は、
SEQ ID NO.6に示したようなVLドメインと、SEQ ID NO.7、SEQ ID NO.8、及びSEQ ID NO.9から選択されたアミノ酸配列を備えた一つ以上のVL CDRを含むVLドメインと、
によって構成されたグループから選択された抗体VLドメインを含む。
SEQ ID NO.2、SEQ ID NO.3、及びSEQ ID NO.4から選択されたアミノ酸配列を備えた一つ以上のVH CDRを含むVHドメイン
を含む抗体VHドメイン、及び/又は、
SEQ ID NO.7、SEQ ID NO.8、及びSEQ ID NO.9から選択されたアミノ酸配列を備えた一つ以上のVL CDRを含むVLドメイン、
を含む抗体VLドメイン、を含むことができる。
(i)1mg当たり国際標準NIBSC90/672少なくとも約15単位、更に好ましくは、1mg当たり国際標準NIBSC90/672少なくとも約30単位、更に好ましくは、1mg当たり国際標準NIBSC90/672少なくとも約60単位、又は更に好ましくは、1mg当たり国際標準NIBSC90/672少なくとも約120単位の、TSH受容体と結合するTSHに対する阻害活性、及び
(ii)1mg当たり国際標準NIBSC90/672少なくとも約30単位、更に好ましくは、1mg当たり国際標準NIBSC90/672少なくとも約60単位、更に好ましくは、1mg当たり国際標準NIBSC90/672少なくとも約120単位、又は更に好ましくは、1mg当たり国際標準NIBSC90/672少なくとも約240単位の、TSH受容体を発現する細胞によるcAMP生成に対する刺激活性、
或いは、抗体の一つ以上の断片によって特徴付け可能であることも更により好適となり得る。
(i)SEQ ID NO.1、SEQ ID NO.2、SEQ ID NO.3、SEQ ID NO.4、SEQ ID NO.6、SEQ ID NO.7、SEQ ID NO.8、又はSEQ ID NO.9に示したような、抗体VHドメイン、VLドメイン、又はCDRのアミノ酸配列を符号化する、SEQ ID NO.10、SEQ ID NO.11、SEQ ID NO.12、SEQ ID NO.13、SEQ ID NO.15、SEQ ID NO.16、SEQ ID NO.17、又はSEQ ID NO.18に示したようなヌクレオチド配列、
(ii)実質的に上記のようなTSH受容体の結合対象(通常、ヒトモノクローナル抗原)を符号化するか、或いは、実質的に上記のようなTSH受容体の結合対象(通常、ヒトモノクローナル抗原)の抗体VHドメイン、VLドメイン、又はCDRのアミノ酸配列を符号化する、ヌクレオチド配列、
(iii)遺伝コードの縮重により、コドン配列において(i)の任意の配列と異なるヌクレオチド配列、
(iv)(i)の任意の配列の対立変形物を含むヌクレオチド配列、
(v)(i)、(ii)、(iii)、又は(iv)の配列のいずれかの断片を含むヌクレオチド配列、及び特に、(i)、(ii)、(iii)、(iv)、又は(v)の配列のいずれかの断片を含み、実質的に上記のようなヒトモノクローナル抗体のFab断片、Fd断片、Fv断片、dAb断片、分離CDR領域、F(ab’)2断片、又はscFv断片を符号化するヌクレオチド配列、
(vi)ヌクレオチド塩基の突然変異、欠失、又は置換により、(i)の任意の配列と異なり、実質的に上記のようなTSH受容体の結合対象(通常は、ヒトモノクローナル抗体)を符号化するか、或いは、実質的に上記のようなTSH受容体の結合対象(通常は、ヒトモノクローナル抗体)の抗体VHドメイン、VLドメイン、又はCDRのアミノ酸配列を符号化するヌクレオチド配列。
(i)SEQ ID NO.19、SEQ ID NO.20、SEQ ID NO.21、SEQ ID NO.22、SEQ ID NO.24、SEQ ID NO.25、SEQ ID NO.26、又はSEQ ID NO.27に示したような、抗体VHドメイン、VLドメイン、又はCDRのアミノ酸配列を符号化する、SEQ ID NO.29、SEQ ID NO.30、SEQ ID NO.31、SEQ ID NO.32、SEQ ID NO.34、SEQ ID NO.35、SEQ ID NO.36、又はSEQ ID NO.37に示したようなヌクレオチド配列、
(ii)実質的に上記のようなTSH受容体の更なる結合対象(通常、マウスモノクローナル抗原)を符号化するか、或いは、実質的に上記のようなTSH受容体の更なる結合対象(通常、マウスモノクローナル抗原)の抗体VHドメイン、VLドメイン、又はCDRのアミノ酸配列を符号化する、ヌクレオチド配列、
(iii)遺伝コードの縮重により、コドン配列において(i)の任意の配列と異なるヌクレオチド配列、
(iv)(i)の任意の配列の対立変形物を含むヌクレオチド配列、
(v)(i)、(ii)、(iii)、又は(iv)の配列のいずれかの断片を含むヌクレオチド配列、及び特に、(i)、(ii)、(iii)、(iv)、又は(v)の配列のいずれかの断片を含み、実質的に上記のようなマウスモノクローナル抗体のFab断片、Fd断片、Fv断片、dAb断片、分離CDR領域、F(ab’)2断片、又はscFv断片を符号化するヌクレオチド配列、
(vi)ヌクレオチド塩基の突然変異、欠失、又は置換により、(i)の任意の配列と異なり、実質的に上記のようなTSH受容体の更なる結合対象(通常は、マウスモノクローナル抗体)を符号化するか、或いは、実質的に上記のようなTSH受容体の更なる結合対象(通常は、マウスモノクローナル抗体)の抗体VHドメイン、VLドメイン、又はCDRのアミノ酸配列を符号化するヌクレオチド配列。
アミノ酸配列
SEQ ID NO.1 VH
SEQ ID NO.2 VHCDRI
SEQ ID NO.3 VHCDRII
SEQ ID NO.4 VHCDRIII
SEQ ID NO.5 重鎖可変及び隣接定常領域
SEQ ID NO.6 VL
SEQ ID NO.7 VLCDRI
SEQ ID NO.8 VLCDRII
SEQ ID NO.9 VLCDRIII
ヌクレオチド配列
SEQ ID NO.10 VH
SEQ ID NO.11 VHCDRI
SEQ ID NO.12 VHCDRII
SEQ ID NO.13 VHCDRIII
SEQ ID NO.14 重鎖可変及び隣接定常領域
SEQ ID NO.15 VL
SEQ ID NO.16 VLCDRI
SEQ ID NO.17 VLCDRII
SEQ ID NO.18 VLCDRIII
9D33について:
アミノ酸配列
SEQ ID NO.19 VH
SEQ ID NO.20 VHCDRI
SEQ ID NO.21 VHCDRII
SEQ ID NO.22 VHCDRIII
SEQ ID NO.23 重鎖可変及び隣接定常領域
SEQ ID NO.24 VL
SEQ ID NO.25 VLCDRI
SEQ ID NO.26 VLCDRII
SEQ ID NO.27 VLCDRIII
SEQ ID NO.28 軽鎖可変及び隣接定常領域
ヌクレオチド配列
SEQ ID NO.29 VH
SEQ ID NO.30 VHCDRI
SEQ ID NO.31 VHCDRII
SEQ ID NO.32 VHCDRIII
SEQ ID NO.33 重鎖可変及び隣接定常領域
SEQ ID NO.34 VL
SEQ ID NO.35 VLCDRI
SEQ ID NO.36 VLCDRII
SEQ ID NO.37 VLCDRIII
SEQ ID NO.38 軽鎖可変及び隣接定常領域
hMab TSHR1についての上記配列は、更に、次の図4、5、6、及び7を参照して確認できる。
図4aは、ヌクレオチド配列自体を記載する図
図5は、以下と共に、hMab TSHR1重鎖アミノ酸配列を、隣接定常領域と併せて示す図
図5aは、アミノ酸配列自体を記載する図
図6は、以下と共に、hMab TSHR1軽鎖ヌクレオチド配列を示す図
図6aは、ヌクレオチド配列自体を記載する図
図7は、以下と共に、hMab TSHR1軽鎖アミノ酸配列を示す図
図7aは、アミノ酸配列自体を記載する図
図9は、以下と共に、9D33重鎖ヌクレオチド配列を、隣接定常領域と併せて示す図
図9aは、ヌクレオチド配列自体を記載する図
図10は、以下と共に、9D33重鎖アミノ酸配列を、隣接定常領域と併せて示す図
図10aは、アミノ酸配列自体を記載する図
図11は、以下と共に、9D33軽鎖ヌクレオチド配列を示す図
図11aは、ヌクレオチド配列自体を記載する図
図12は、以下と共に、9D33軽鎖アミノ酸配列を示す図
図12aは、アミノ酸配列自体を記載する図
(i)対象者からのリンパ球ソースを提供するステップを備え、対象者は、TSH受容体と結合するTSHの阻害に関して、血清1mL当たりNIBSC90/672約0.04単位より大きなTSH受容体抗体活性を有し、更に、
(ii)(i)の当該リンパ球ソースからリンパ球を分離するステップと、
(iii)分離リンパ球を不死化するステップと、
(iv)実質的に上記のようなTSH受容体に対するヒトモノクローナル抗体を分泌する不死化コロニを生成するために、不死化リンパ球をクローニングするステップと、を備える。
(i)対象者からのリンパ球ソースを提供するステップを備え、対象者は、TSH受容体を発現する細胞によるcAMP生成の刺激活性に関して、血清1mL当たりNIBSC90/672約0.1単位より大きなTSH受容体抗体活性を有し、更に
(ii)(i)の当該リンパ球ソースからリンパ球を分離するステップと、
(iii)分離リンパ球を不死化するステップと、
(iv)実質的に上記のようなTSH受容体に対するヒトモノクローナル抗体を分泌する不死化コロニを生成するために、不死化リンパ球をクローニングするステップと、を備えるプロセスとして定義できる。
(i)1mg当たり国際標準NIBSC90/672少なくとも約15単位、更に好ましくは、1mg当たり国際標準NIBSC90/672少なくとも約30単位、更に好ましくは、1mg当たり国際標準NIBSC90/672少なくとも約60単位、又は更に好ましくは、1mg当たり国際標準NIBSC90/672少なくとも約120単位の、TSH受容体と結合するTSHに対する阻害活性、及び、
(ii)1mg当たり国際標準NIBSC90/672少なくとも約30単位、更に好ましくは、1mg当たり国際標準NIBSC90/672少なくとも約60単位、更に好ましくは、1mg当たり国際標準NIBSC90/672少なくとも約120単位、又は更に好ましくは、1mg当たり国際標準NIBSC90/672少なくとも約240単位の、TSH受容体を発現する細胞によるcAMP生成に対する刺激活性、
或いは、こうしたヒトモノクローナル抗体又は組み換え抗体の一つ以上の断片によって特徴付けることが可能である。
(i)1mg当たり国際標準NIBSC90/672少なくとも約30単位、更に好ましくは、1mg当たり国際標準NIBSC90/672少なくとも約60単位、更に好ましくは、1mg当たり国際標準NIBSC90/672少なくとも約120単位、又は更に好ましくは、1mg当たり国際標準NIBSC90/672少なくとも約240単位の、TSH受容体と結合するTSHに対する阻害活性と、
(ii)1mg当たり国際標準NIBSC90/672少なくとも約50単位、又は更に好ましくは、1mg当たり国際標準NIBSC90/672少なくとも約100単位、又は更に好ましくは、1mg当たり国際標準NIBSC90/672少なくとも約200単位、又は更に好ましくは、1mg当たり国際標準NIBSC90/672少なくとも約400単位の、TSH受容体を発現する細胞によるcAMP生成に対する刺激活性と、によって特徴付け可能である。
(i)1mg当たり国際標準NIBSC90/672少なくとも約15単位、更に好ましくは、1mg当たり国際標準NIBSC90/672少なくとも約30単位、更に好ましくは、1mg当たり国際標準NIBSC90/672少なくとも約60単位、又は更に好ましくは、1mg当たり国際標準NIBSC90/672少なくとも約120単位の、TSH受容体と結合するTSHに対する阻害活性、及び
(ii)1mg当たり国際標準NIBSC90/672少なくとも約30単位、更に好ましくは、1mg当たり国際標準NIBSC90/672少なくとも約60単位、更に好ましくは、1mg当たり国際標準NIBSC90/672少なくとも約120単位、又は更により好ましくは、1mg当たり国際標準NIBSC90/672少なくとも約240単位の、TSH受容体を発現する細胞によるcAMP生成に対する刺激活性、
或いは、その一つ以上の断片によって特徴付け可能であることも、更により好適となり得る。
(a)当該対象者からの当該体液試料を提供するステップと、
(b)結合分子の一つ以上のペアを提供するステップと、を備え、当該結合ペアの第一の分子は、本発明によるTSH受容体の結合対象又は更なる結合対象(通常、ヒトモノクローナル抗体又は組み換え抗体)を含み、当該結合ペアの第二の分子は、当該結合対象又は更なる結合対象が相互作用する結合領域を含み、更に、
(c)当該結合ペアの当該第二の分子が(i)当該試料中に存在するTSH受容体に対する自己抗体、或いは(ii)TSH受容体の当該結合対象又は更なる結合対象(通常、ヒトモノクローナル抗体又は組み換え抗体)と相互作用できるように、結合分子の当該一つ以上のペアに当該試料を接触させるステップと、
(d)当該結合ペアの当該第二の分子と当該試料中に存在する当該自己抗体との相互作用をモニタリングし、これにより、当該試料中のTSH受容体に対する当該自己抗体の存在の示度を提供するステップと、を備える。
(a)当該対象者からの当該体液試料を提供するステップと、
(b)結合分子の一つ以上のペアを提供するステップと、を備え、当該結合ペアの第一の分子は、本発明によるTSH受容体の結合対象又は更なる結合対象(通常、ヒトモノクローナル抗体又は組み換え抗体)を含み、当該結合ペアの第二の分子は、当該結合対象又は更なる結合対象が相互作用する結合領域を含み、当該結合分子の相互作用は、0.4U/Lの国際標準NIBSC90/672に本質的に対応する当該試料における自己抗体力価が検出できるようなものであり、更に、
(c)当該結合ペアの当該第二の分子が(i)当該試料中に存在するTSH受容体に対する自己抗体、或いは(ii)本発明によるTSH受容体の当該結合対象又は更なる結合対象(通常、ヒトモノクローナル抗体又は組み換え抗体)と相互作用できるように、結合分子の当該一つ以上のペアに当該試料を接触させるステップと、
(d)当該結合ペアの当該第二の分子と当該試料中に存在する当該自己抗体との相互作用をモニタリングし、これにより、当該試料中のTSH受容体に対する当該自己抗体の存在の示度を提供するステップと、を備える。
(a)当該対象者からの当該体液試料を提供するステップと、
(b)結合分子の一つ以上のペアを提供するステップと、を備え、当該結合ペアの第一の分子は、TSH受容体に対するヒト又は非ヒトポリクローナル抗体を含み、当該結合ペアの第二の分子は、当該ポリクローナル抗体が相互作用する結合領域を含み、当該結合分子の相互作用は、0.4U/Lの国際標準NIBSC90/672に本質的に対応する当該試料における自己抗体力価が検出できるようなものであり、更に、
(c)当該結合ペアの当該第二の分子が(i)当該試料中に存在するTSH受容体に対する自己抗体、或いは(ii)当該ポリクローナル抗体と相互作用できるように、結合分子の当該一つ以上のペアに当該試料を接触させるステップと、
(d)当該結合ペアの当該第二の分子と当該試料中に存在する当該自己抗体との相互作用をモニタリングし、これにより、当該試料中のTSH受容体に対する当該自己抗体の存在の示度を提供するステップと、を備える。
(a)当該対象者からの当該体液試料を提供するステップと、
(b)結合分子の一つ以上のペアを提供するステップと、を備え、当該結合ペアの第一の分子は、TSH、或いはその一つ以上の変異体、類似体、誘導体、又は断片を含み、当該結合ペアの第二の分子は、当該TSH、或いはその一つ以上の変異体、類似体、誘導体、又は断片が相互作用する結合領域を含み、当該結合分子の相互作用は、0.4U/Lの国際標準NIBSC90/672に本質的に対応する当該試料における自己抗体力価が検出できるようなものであり、更に、
(c)当該結合ペアの当該第二の分子が(i)当該試料中に存在するTSH受容体に対する自己抗体、或いは(ii)当該TSH、或いはその一つ以上の変異体、類似体、誘導体、又は断片と相互作用できるように、結合分子の当該一つ以上のペアに当該試料を接触させるステップと、
(d)当該結合ペアの当該第二の分子と当該試料中に存在する当該自己抗体との相互作用をモニタリングし、これにより、当該試料中のTSH受容体に対する当該自己抗体の存在の示度を提供するステップと、を備える。
(a)当該対象者からの当該体液試料を提供するステップと、
(b)結合分子の一つ以上のペアを提供するステップと、を備え、当該結合ペアの第一の分子は、1010モル−1以上のTSH受容体に対する親和性を有するTSH受容体の結合対象を含み、当該結合ペアの第二の分子は、当該結合対象が相互作用する結合領域を含み、当該結合分子の相互作用は、0.4U/Lの国際標準NIBSC90/672に本質的に対応する当該試料における自己抗体力価が検出できるようなものであり、更に、
(c)当該結合ペアの当該第二の分子が(i)当該試料中に存在するTSH受容体に対する自己抗体、或いは(ii)TSHの当該結合対象と相互作用できるように、結合分子の当該一つ以上のペアに当該試料を接触させるステップと、
(d)当該結合ペアの当該第二の分子と当該試料中に存在する当該自己抗体との相互作用をモニタリングし、これにより、当該試料中のTSH受容体に対する当該自己抗体の存在の示度を提供するステップと、を備える。
(a)当該対象者からの当該体液試料を提供するステップと、
(b)TSH受容体とTSH受容体に反応して生成された自己抗体との相互作用を可能にする条件下で、当該試料を、(i)全長TSH受容体又は一つ以上のそのエピトープ、或いはTSH受容体の一つ以上のエピトープを含むポリペプチド、及び(ii)本発明によるTSH受容体の結合対象又は更なる結合対象(通常、ヒトモノクローナル抗体又は組み換え抗体)に接触させ、当該TSH受容体、又は当該一つ以上のそのエピトープ、或いは当該ポリペプチドが、当該試料中に存在するTSH受容体に対する自己抗体、或いはTSH受容体の当該結合対象又は更なる結合対象(通常、ヒトモノクローナル抗体又は組み換え抗体)と相互作用できるようにするステップと、
(c)当該TSH受容体、又は当該一つ以上のそのエピトープ、或いは当該ポリペプチドと当該試料中に存在する当該自己抗体との相互作用をモニタリングし、これにより、当該試料中のTSH受容体に対する当該自己抗体の存在の示度を提供するステップと、を備える。
(a)結合分子の一つ以上のペアを備え、当該結合ペアの第一の分子は、本発明によるTSH受容体の結合対象又は更なる結合対象(通常、ヒトモノクローナル抗体又は組み換え抗体)を含み、当該結合ペアの第二の分子は、当該結合対象又は更なる結合対象が相互作用する結合領域を含み、更に、
(b)当該結合ペアの当該第二の分子が(i)当該試料中に存在するTSH受容体に対する自己抗体、或いは(ii)TSH受容体の当該結合対象又は更なる結合対象(通常、ヒトモノクローナル抗体又は組み換え抗体)と相互作用できるように、当該対象者からの当該体液試料を結合分子の当該一つ以上のペアに接触させる手段と、
(c)当該結合ペアの当該第二の分子と当該試料中に存在する当該自己抗体との相互作用をモニタリングし、これにより、当該試料中のTSH受容体に対する当該自己抗体の存在の示度を提供する手段と、を備える。
(a)結合分子の一つ以上のペアを備え、当該結合ペアの第一の分子は、本発明によるTSH受容体の結合対象又は更なる結合対象(通常、ヒトモノクローナル抗体又は組み換え抗体)を含み、当該結合ペアの第二の分子は、当該結合対象又は更なる結合対象が相互作用する結合領域を含み、当該結合分子の相互作用は、0.4U/Lの国際標準NIBSC90/672に本質的に対応する当該試料における自己抗体力価が検出できるようなものであり、更に、
(b)当該結合ペアの当該第二の分子が(i)当該試料中に存在するTSH受容体に対する自己抗体、或いは(ii)本発明によるTSH受容体の当該結合対象又は更なる結合対象(通常、ヒトモノクローナル抗体又は組み換え抗体)と相互作用できるように、当該対象者からの当該体液試料を結合分子の当該一つ以上のペアに接触させる手段と、
(c)当該結合ペアの当該第二の分子と当該試料中に存在する当該自己抗体との相互作用をモニタリングし、これにより、当該試料中のTSH受容体に対する当該自己抗体の存在の示度を提供する手段と、を備える。
(a)結合分子の一つ以上のペアを備え、当該結合ペアの第一の分子は、TSH受容体に対するヒト又は非ヒトポリクローナル抗体を含み、当該結合ペアの第二の分子は、当該ポリクローナル抗体が相互作用する結合領域を含み、当該結合分子の相互作用は、0.4U/Lの国際標準NIBSC90/672に本質的に対応する当該試料における自己抗体力価が検出できるようなものであり、更に、
(b)当該結合ペアの当該第二の分子が(i)当該試料中に存在するTSH受容体に対する自己抗体、或いは(ii)当該ポリクローナル抗体と相互作用できるように、当該対象者からの当該体液試料を結合分子の当該一つ以上のペアに接触させる手段と、
(c)当該結合ペアの当該第二の分子と当該試料中に存在する当該自己抗体との相互作用をモニタリングし、これにより、当該試料中のTSH受容体に対する当該自己抗体の存在の示度を提供する手段と、を備える。
(a)結合分子の一つ以上のペアを備え、当該結合ペアの第一の分子は、TSH、或いはその一つ以上の変異体、類似体、誘導体、又は断片を含み、当該結合ペアの第二の分子は、当該TSH、或いはその一つ以上の変異体、類似体、誘導体、又は断片が相互作用する結合領域を含み、当該結合分子の相互作用は、0.4U/Lの国際標準NIBSC90/672に本質的に対応する当該試料における自己抗体力価が検出できるようなものであり、更に、
(b)当該結合ペアの当該第二の分子が(i)当該試料中に存在するTSH受容体に対する自己抗体、或いは(ii)当該TSH、或いはその一つ以上の変異体、類似体、誘導体、又は断片と相互作用できるように、当該対象者からの当該体液試料を結合分子の当該一つ以上のペアに接触させる手段と、
(c)当該結合ペアの当該第二の分子と当該試料中に存在する当該自己抗体との相互作用をモニタリングし、これにより、当該試料中のTSH受容体に対する当該自己抗体の存在の示度を提供する手段と、を備える。
(a)結合分子の一つ以上のペアを備え、当該結合ペアの第一の分子は、1010モル−1以上のTSH受容体に対する親和性を有するTSH受容体の結合対象を含み、当該結合ペアの第二の分子は、当該結合対象が相互作用する結合領域を含み、当該結合分子の相互作用は、0.4U/Lの国際標準NIBSC90/672に本質的に対応する当該試料における自己抗体力価が検出できるようなものであり、更に、
(b)当該結合ペアの当該第二の分子が(i)当該試料中に存在するTSH受容体に対する自己抗体、或いは(ii)TSH受容体の当該結合対象と相互作用できるように、当該対象者からの当該体液試料を結合分子の当該一つ以上のペアに接触させる手段と、
(c)当該結合ペアの当該第二の分子と当該試料中に存在する当該自己抗体との相互作用をモニタリングし、これにより、当該試料中のTSH受容体に対する当該自己抗体の存在の示度を提供する手段と、を備える。
(a)全長TSH受容体、又は一つ以上のそのエピトープ、或いはTSH受容体の一つ以上のエピトープを含むポリペプチドと、
(b)本発明によるTSH受容体の結合対象又は更なる結合対象(通常、ヒトモノクローナル抗体又は組み換え抗体)と
(c)TSH受容体とTSH受容体に反応して生成された自己抗体との相互作用を可能にする条件下で、当該対象者からの当該体液試料、当該TSH受容体、又は当該一つ以上のそのエピトープ、或いは当該ポリペプチドと、TSH受容体の当該結合対象又は更なる結合対象(通常、ヒトモノクローナル抗体又は組み換え抗体)とを接触させ、当該TSH受容体、又は当該一つ以上のそのエピトープ、或いは当該ポリペプチドが、当該試料中に存在するTSH受容体に対する自己抗体、或いはTSH受容体の当該結合対象又は更なる結合対象(通常、ヒトモノクローナル抗体又は組み換え抗体)と相互作用できるようにする手段と、
(d)当該TSH受容体、又は当該一つ以上のそのエピトープ、或いは当該ポリペプチドと当該試料中に存在する当該自己抗体との相互作用をモニタリングし、これにより、当該試料中のTSH受容体に対する当該自己抗体の存在の示度を提供する手段と、を備える。
(a)TSH又は関連リガンドを含有する疑いがある試料又は含有する試料を提供するステップと、
(b)結合分子の一つ以上のペアを提供するステップと、を備え、当該結合ペアの第一の分子は、本発明によるTSH受容体の結合対象又は更なる結合対象(通常、ヒトモノクローナル抗体又は組み換え抗体)を含み、当該結合ペアの第二の分子は、当該結合対象又は更なる結合対象が相互作用する結合領域を含み、更に、
(c)当該結合ペアの当該第二の分子が(i)当該試料中に存在するTSH又は関連リガンド、或いは(ii)TSH受容体の当該結合対象又は更なる結合対象(通常、ヒトモノクローナル抗体又は組み換え抗体)と相互作用できるように、結合分子の当該一つ以上のペアに当該試料を接触させるステップと、
(d)当該結合ペアの当該第二の分子と当該試料中に存在するTSH又は関連リガンドとの相互作用をモニタリングし、これにより、当該試料中のTSH又は関連リガンドの存在の示度を提供するステップと、を備える。
(a)結合分子の一つ以上のペアを備え、当該結合ペアの第一の分子は、本発明によるTSH受容体の結合対象又は更なる結合対象(通常、ヒトモノクローナル抗体又は組み換え抗体)を含み、当該結合ペアの第二の分子は、当該結合対象又は更なる結合対象が相互作用する結合領域を含み、更に、
(b)当該結合ペアの当該第二の分子が(i)当該試料中に存在するTSH又は関連リガンド、或いは(ii)TSH受容体の当該結合対象又は更なる結合対象(通常、ヒトモノクローナル抗体又は組み換え抗体)と相互作用できるように、TSH又は関連リガンドを含有する疑いがある試料又は含有する試料を結合分子の当該一つ以上のペアに接触させる手段と、
(c)当該結合ペアの当該第二の分子と当該試料中に存在するTSH又は関連リガンドとの相互作用をモニタリングし、これにより、当該試料中のTSH又は関連リガンドの存在の示度を提供するステップと、を備える。
(a)結合分子の一つ以上のペアを提供するステップを備え、当該結合ペアの第一の分子は、実質的に上記のようなTSH受容体の結合対象を含み、当該結合ペアの第二の分子は、当該結合対象が相互作用する結合領域を含み、更に、
(b)アッセイの対象となる更なる結合対象を、TSH受容体との結合について(a)の当該結合ペアの当該第一の分子と競合するTSH受容体の潜在的な更なる結合対象として提供するステップと、
(c)(a)の当該結合ペアの当該第二の分子が(i)(b)の当該更なる結合分子、或いは(ii)(a)の当該結合ペアの当該第一の分子と相互作用できるように、(b)の当該更なる結合分子を(a)の結合分子の当該一つ以上のペアに接触させるステップと、
(d)(a)の当該結合ペアの当該第二の分子と(b)の当該更なる結合分子との相互作用をモニタリングし、これにより、(b)の当該更なる結合分子がTSH受容体との結合について(a)の当該結合ペアの当該第一の分子と競合するかのアッセイを行うステップと、を備える。
(a)結合分子の一つ以上のペアを備え、当該結合ペアの第一の分子は、実質的に上記のようなTSH受容体の結合対象を含み、当該結合ペアの第二の分子は、当該結合対象が相互作用する結合領域を含み、更に、
(b)TSH受容体との結合について(a)の当該結合ペアの当該第一の分子と競合するTSH受容体の潜在的な更なる結合対象としてアッセイの対象となる更なる結合対象に、(a)の結合分子の当該一つ以上のペアを接触させ、(a)の当該結合ペアの当該第二の分子が(i)当該更なる結合分子、或いは(ii)(a)の当該結合ペアの当該第一の分子と相互作用できるようにする手段と、
(c)(a)の当該結合ペアの当該第二の分子と当該更なる結合分子との相互作用をモニタリングし、これにより、当該更なる結合分子がTSH受容体との結合について(a)の当該結合ペアの当該第一の分子と競合するかのアッセイを行う手段と、を備える。
材料及び方法
リンパ球の分離及びヒトモノクローナルTSH受容体自己抗体のクローニング
血液は、高レベルのTSH受容体に対する血清自己抗体(TRAb)を有するグレーブス病及び一型糖尿病の患者から取得した。この研究について、倫理委員会の承認を取得した。末梢血リンパ球を、血液試料20mLからFicoll−Paque(Amersham Biosciences、英国チャルフォントセントジャイルズ、HP8 4SP)で分離し、その後、エプスタインバーウイルス(EBV)(EuropeanCollection of Cell Culture−ECACC、英国ポートンダウン、SP4 0JG)に感染させ、以前に説明したようにマウスマクロファージ支持細胞層で培養した(N Hayakawa, LDKE Premawardhana, M powell, M Masuda, C Arnold, J Sanders, M Evans, S Chen, JC Jaume, S Baekkeskov, B Rees Smith, J Furmaniak、「グルタミン酸デカルボキシラーゼに対するヒトモノクローナル自己抗体の分離及び特徴付け」、Autoimmunity 2002; 35: 343-355)。次に、EBV不死化Bリンパ球を、マウス/ヒトハイブリッド細胞株K6H6/B5と融合し(WL Carroll, K Thilemans, J Dilley, R Levy、「ヒトB細胞腫瘍との融合対象としてのマウス×ヒトヘテロハイブリドーマ」、Journal of Immunological Methods 1986; 89: 61-72)、5細胞/ウェル及び最終時1/2細胞/ウェルで希釈を限定することにより二度クローニングし、単一のコロニを得た(RI Freshney, MG Freshney編、Culture of immortalized cells、Wiley-Liss, New York 1996; 283-297内のBJ Bolton, NK Spurr、「Bリンパ球」)。オリジナルのウェルと後続のクローンとは、可溶化TSH受容体と結合する125I−TSHの阻害により、TSH受容体に関してスクリーニングした(下記参照)。TSH受容体自己抗体を生成する単一のクローンを組織培養フラスコで成長させた。
マウスTSH受容体MAbは、以前に説明したように生成し(Y Oda, J Sanders, M Evans, A Kiddie, A Munkley, C James, T Richards, J Wills, J Furmaniak, B Rees Smith、「モノクローナル抗体を使用したヒトチロトロピン(TSH)受容体のエピトープ分析」、Thyroid 2000; 10: 1051-1059)、更に、pcDNA3.1においてクローニングした全長TSHR cDNAにより免疫性を与えたマウスから作成した(UA Hasan, AM Abai, DR Harper, BW Wren, WJW Morrow、「核酸免疫付与:第三世代ワクチンに関する概念及び手法」 Jpirnal of Immunological Methods 1999; 228:1-22)。
様々な罹患期間のグレーブス病患者からの血清を調査した。調査した患者の血清は、TSH受容体と結合する125I標識TSHの阻害を示した(下記参照)。加えて、アジソン病(A1及びA2)及び2l−OHに対する高レベルの自己抗体(1mL当たり113及び1970単位、RSRキット)を有する患者二人からの血清と、一型糖尿病(D1及びD2)及び高レベルのGAD65(1mL当たり3700及び37.5単位、RSRキット)を有する患者二人からの血清とを調査した。患者からは、調査についてのインフォームドコンセントを取得した。健康な供血者からの血清(Golden West Biologicals、米国ビスタ、CA92083から購入)も調査した。TRAbの第一の国際標準調製物(90/672)は、国立生物基準管理研究所(NIBSC、英国ポッターズバー、EN63QH)から取得した。
結合阻害アッセイは、以前に説明したようなTSH受容体被覆チューブを使用して実行した(J Sanders, Y Oda, S Roberts, A Kiddie, T Richards, J Bolton, V McGrath, S Walters, D Jaskolski, J Furmaniak, B Rees Smith、「TSH受容体自己抗体と125I標識TSH受容体との相互作用」、Journal of Clinical Endocrinology and Metabolism 1999; 84: 3797-3802)(RSR Ltdの試薬)。簡単に言うと、試料(組織培養上清、純化IgG又はFab断片、患者の血清又はNIBSC90/672基準)100μLを、TSH受容体被覆チューブにおいて、室温で二時間、穏やかに振動させて培養した。吸引後、チューブをアッセイ緩衝液(50mmol/L NaCl、10mmol/L トリスHCl pH7.8、0.1%Triton X−100)1mLにより二度洗浄した後、125I−TSH又は125I−MAb(5×104cpm)100μLを追加し、室温で一時間、振動させて培養した。その後、チューブをアッセイ緩衝液1mLで二度洗浄し、吸引して、ガンマカウンタにおいて計数した。
対照材料が存在する場合の結合cpm
使用した対照材料は、培地、健康な供血者の血清プール、或いはその他の記載のものとした。
モノクローナル自己抗体調製物と患者の血清とがhTSH受容体(細胞当たり約50,000受容体)を発現するCHO細胞において環状AMP(又はcAMP)の生成を刺激する能力(Y Oda, J Sanders, S Roberts, M Maruyama, R Kato, M Perez, VB Petersen, N Wedlock, J Furmaniak, B Rees Smith、「TSH受容体に対する抗体の結合特性」、Journal of Molecular Endocrinology 1998; 20: 233-244)は、R Latif, P Graves, TF Davies、「ヒトチロトロピン受容体のオリゴマ化」Journal of Biological Chemistry 2001; 276: 45217-45224の方法に従って実行した。簡単に言うと、CHO細胞を86ウェルプレートに接種し(ウェル当たり30,000細胞)、10%ウシ胎仔血清を含むDMEM(Invitrogen Ltd、英国ペイズリ、PA4 9RF)において24時間培養した。その後、ウシ胎仔血清なしで、DMEMにおいて、培養を更に24時間継続した。次に、DMEMを除去し、試験TSH、IgG、Fab、及び血清(1g/Lグルコースと、20mmol/LHepesと、222mmol/Lスクロースと、15g/Lウシ血清アルブミン(BSA)と、0.5mmol/L 3イソブチル−1−メチルキサンチン pH7.4と、を含有するNaClなしのハンクの緩衝食塩溶液において100μlを希釈)を追加し、37℃で一時間培養した。試験溶液の除去後、細胞を溶解させ、Amersham Biosciences、英国チャルフォントセントジャイルズ、HP8 4SPのBiotrak酵素イムノアッセイシステムを使用して、環状AMPのアッセイを行った。一部の実験では、患者の血清とTSHRに対するマウスモノクローナル抗体とがTSH又はhMAb TSHR1の刺激活性を阻害する能力を評価した。これは、(a)TSH又はsMAb TSHR1単独の刺激作用と(b)患者の血清又はマウスモノクローナル抗体が存在する場合のTSH又はsMAb TSHR1の刺激作用とを比較することで実行した。
トータルRNAは、酸フェノールグアニジン法(P Chomezynski, N Sacchi、「酸グアニジニウムチオシアネート−フェノール−クロロホルム抽出によるRNA分離の単一ステップ法」、Analytical Biochemistry 1987; 162: 156-159)を使用してTSH自己抗体を生成するクローンの1×107細胞から調製し、mRNAは、オリゴdT磁気ビーズ(Dynal Biotech Ltd、英国ウィラル、CH62 3QL)を使用して調製した。RT−PCR反応は、Invitrogen Ltd、英国ペイズリ、PA4 9RFからの試薬を使用して実行した。
全長TSH受容体を符号化するcDNAを、pYES2(invitrogen)においてT7プロモータの下流に配置し、in vitro TnTシステム(Promega UK Ltd)において使用して、以前に説明したように35S−メチオニンにより標識されたTSH受容体を生成した(L Prentice, J Sanders, M Perez, R Kato, J Sawicka, Y Oda, D Jaskoiski, J Furmaniak, B Rees Smith、「チロトロピン(TSH)受容体自己抗体は、invitro転写/翻訳システムにおいて生成されたTSH受容体と結合するように思えない」、Journal of Clinical Endocrinology and Metabolism 1997; 82: 1288-1292)。簡単に言うと、HSB(10mmol/LトリスHCl pH8.3、200mmol/L NaCl、及び1%Tween20を含有する10mg/mLウシ血清アルブミン)において希釈した35S標識TSH受容体(25000乃至30000cpm)50μLを、希釈した試験試料の重複50μLアリコートに追加し、室温で二時間培養した。その後、プロテインAセファロース(Sigma−Aldrich)の追加により免疫複合物を沈殿させ、シンチレーションカウンタにおいて計数した。
全長ヒトTSH受容体をCHO−K1細胞において発現させ、1%Triton X−100により抽出し、以前に説明したように、TSH受容体モノクローナル抗体親和性クロマトグラフィにより純化した(Y Oda, J Sanders, M Evans, A Kiddie, A Munkley, C James, T Richards, J Wills, J Furmaniak, B Rees Smith、「モノクローナル抗体を使用したヒトチロトロピン(TSH)受容体のエピトープ分析」、Thyroid 2000; 10: 1051-1059)。
ヒトTSH受容体の細胞外ドメイン全体をカバーする、それぞれの長さが25aaである26のペプチドは、J Morris博士から快く提供された(JC Morris, ER Bergert, DJ McCormick、「ヒトチロトロピン受容体の構造−機能研究。合成ヒトTSH受容体ペプチドによる標識チロトロピン(TSH)の結合の阻害」Journal of Biological Chemistry 1993; 268: 10900-10905)。M21−OH5 MAbと結合するヒト21−OHペプチド(C1、SSSRVPYKDRARLPL)(S Chen, J Sawicka, L Prentice, JF Sanders, H Tanaka, V Petersen, C Betterle, M Volpato, S Roberts, M Powell, B Rees Smith, J Furmaniak、「モノクローナル抗体のパネルを使用したステロイド21−ヒドロキシラーゼ上の自己抗体エピトープの分析」Journal of Clinical Endocrinology and Metabolism 1998; 83: 2977-2986)を陽性対照として使用し、GAD65に対するヒトモノクローナル抗体(N Hayakawa, LDKE Premawardhana, M Powell, M Masuda, C Arnold, J Sanders, M Evans, S Chen, JC Jaurne, S Baekkeskov, B Rees Smith, J Furimaniak、「グルタミン酸デカルボキシラーゼに対するヒトモノクローナル自己抗体の分離及び特徴付け」、Autoimmunity 2002; 35: 343-355)を陰性対照として使用した。ペプチドELISAは、以前に説明したように実施した(Y Oda, J Sanders, M Evans, A Kiddie, A Munkley, C James, T Richards, J Wills, J Furmaniak, B Rees Smith、「モノクローナル抗体を使用したヒトチロトロピン(TSH)受容体のエピトープ分析」、Thyroid 2000; 10: 1051-1059)。
(a)125I標識自己抗体
患者の血清を含む試験試料(100μL)を、TSH受容体被覆チューブ(RSR Ltd.)において、室温で二時間、穏やかに振動させて培養した。吸引後、チューブをアッセイ緩衝液1mLにより二度洗浄した後、標識自己抗体調製物(30,000cpm)を追加し、室温で一時間、振動させて培養した。その後、チューブをアッセイ緩衝液1mLで二度洗浄し、吸引して、ガンマカウンタにおいて計数した。125I標識自己抗体結合の阻害は、TSH結合の阻害に関する式を使用して計算した(上記参照)。
以前に説明した手順(J Bolton, J sanders, Y Oda, C Chapman, R Konno, J Furmaniak and B Rees Smith、「ELISAによる甲状腺刺激ホルモン受容体自己抗体の測定」、Clinical Chemistry, 1999; 45: 2285-2287)を使用した。簡単に言うと、患者の血清を含む試験試料(75μL)を、TSH受容体被覆ELISAプレートウェル(RSR Ltd)において、ELISAプレート振動装置上で振動(毎分200回)させて二時間培養した。次に、試験試料を除去し、ウェルをアッセイ緩衝液で一度洗浄し、その後、ビオチン標識モノクローナルTSH受容体自己抗体(100μL中1ng)又はビオチン標識ブタTSH(RSR Ltd、100μL中5ng)を追加し、室温で25分間、振動させて培養を継続した。ウェルを一度洗浄し、ストレプトアビジンペロキシダーゼ(RSR Ltd、100μL中10ng)を追加し、室温で20分間、振動させて培養を継続した。その後、ウェルを三度洗浄し、ペロキシダーゼ基質のテトラメチルベンジジン(RSR Ltd、100μL)を追加した。室温で30分間、振動なしで培養後、0.5M H2SO4 50μLを追加し、基質反応を停止し、各ウェルの吸光度をELISAプレートリーダにおいて450nmで読み取った。ビオチニル化MAb又はTSH結合の阻害は、次のように計算された指数として表現した。
450nmでの陰性血清対照の吸光度
TSH受容体被覆チューブに対するモノクローナル自己抗体結合のスキャッチャード分析
アッセイ緩衝液50μL中の未標識IgG又はFabと、125I標識hMAb IgG又はFab(アッセイ緩衝液中30,000cpm)50μLとを、室温で二時間、穏やかに振動させて培養し、アッセイ緩衝液1mLで二度洗浄し、ガンマカウンタにおいて計数した。結合したIgG又はFabの濃度を結合/遊離と対比してプロットし(G Scatchard、「小分子及びイオンに対する蛋白質の誘引」、Annals of the New York Academy of Sciences 1949; 51: 660-672)、結合定数を導いた。
患者の血清を含む試験試料(100μL)と界面活性剤可溶化TSH受容体(20μL)とを、室温で一時間培養した。次に、培養混合物の重複50μLアリコートを、TSH受容体自己抗体Fabにより被覆(10μg/mLを200μL、4℃で一晩経過後、洗浄及びポストコーティング)されたプラスチックチューブ(Nunc Maxisorp)に加えた。室温で一時間、穏やかに振動させて培養した後、チューブを洗浄し、125I標識TSH受容体C末端モノクローナル抗体4E31(J Sanders, Y Oda, A Kiddie, T Richards, J Bolton, V McGrath, S Walters, D Jaskolski, J Furmaniak, B Rees Smith;「TSH受容体自己抗体と125I標識TSH受容体との相互作用」、Journal of Clinical Endocrinology and Metabolism 1999; 84: 3797-3802)100μL(40,000cpm)を追加し、更に一時間、穏やかに振動させて培養を継続した。その後、チューブを洗浄し、125Iを計数した。
hMAb TSHR1重鎖RT−PCR産物(可変領域遺伝子分析の項参照)を、Xhol及びSpel限定エンドヌクレアーゼにより切断し、hMAb TSHR1軽鎖RT−PCR産物をSacl及びXbal限定エンドヌクレアーゼにより切断し、重鎖及び軽鎖cDNAの両方を、lacZプロモータの制御下で、Immunozap H/Lベクタ(Stratagene Europe、オランダ、アムステルダム)においてクローニングした(I Matthews, G Sims, S Ledwidge, D Stott, D Beeson, N Willcox, A Vincent、「筋無力症の経産婦におけるアセチルコリン受容体に対する抗体:胎児性抗原による免疫付与の証拠」、Laboratory Investigation 2002, 82: 1-11)。プラスミドDNAを、Qiagenミディプラスミド純化キット(Qiagen Ltd、英国クローリ、RH10 9AX)を使用して調製し、サンガ−クールソン法(F Sanger, S Nicklen, AR Coulson、「連鎖停止阻害物質によるDNA配列決定」、Proceedings of the National Academy of Sciences of the USA 1977; 74: 5463-5467)を使用して配列決定することでhMAb TSHR1重鎖及び軽鎖cDNAの存在を確認した。プラスミドDNAを二種類のE coli株、(a)XLl−Blue MRF’(Stratagene)及び(b)HB2151(AmershamBioscience)において形質転換し、LBアンピシリン(10g/Lトリプトン、5g/L酵母エキス、10g/LNaCl、終濃度100μg/mLアンピシリン)寒天プレート(15g/L寒天)上において、37℃で一晩成長させた。前培養物(LBアンピシリン3mL+1%グルコース中の一コロニ)を、37℃で一晩、振動させて成長させた。組み換えFabの生成は、グルコースが存在する場合に阻害される。一晩培養後の前培養物は、1/100に希釈し(LBアンピシリン50mL中0.5mL)、OD600が0.4乃至0.6となるまで37℃で成長させた。こうした培養物を、30℃で20分間振動させた。その後、イソプロピル−β−Dチオガラクトシド(IPTG)を追加して終濃度を1mmol/Lとし、培養物を30℃で一晩(16時間)、振動させて引き続き培養した。次に、培養物を4℃で30分間、3000rpmで遠心分離し、培養上清及びペレットを回収した。ペレットは、氷温TES緩衝液(0.2mol/LトリスHCl pH8.0、0.5mol/L EDTA、0.5mol/Lスクロース)中で渦動により再懸濁させた。H2O中で5倍に希釈した氷温TES緩衝液を更に1.5mL追加し、混合物を再度渦動させ、氷上で30分間培養し、その後、遠心分離して、第二の上清又はペリプラズム画分(PF)を得た。培養上清及びPFを、0.45μmフィルタにより濾過し、10mmol/LトリスpH7.5、50mmol/L NaClにおいて一晩透析した。非形質転換XLl−BlueMRF’及びHB2151細胞と、IPTGなしでグルコースにより成長させた、即ち、非誘導性の、hMAb TSHR1プラスミドにより形質転換したXLl−Blue MRF’(XLl−Blue MRF’/hMAb TSHR1)並びにhMAb TSHR1プラスミドにより形質転換したHB2151(HB2151/hMAb TSHR1)とからの培養上清又はPFも調製した。培養上清及びPFでは、(a)TSHRと結合するTSHを阻害する能力と、(b)TSHRを発現するCHO細胞における環状AMP生成を刺激する能力と、(c)ラジオイムノアッセイによる組み換えFabの総濃度とについてアッセイを行った。このアッセイでは、アッセイ緩衝液(50mmol/L NaCl、10mmol/LトリスHCl pH7.8、0.1%Triton X−100)において希釈した培養上清及びPFを含むキャリブレータ及び試験材料(100μLを重複して作成)を、Fab特異性ヤギ抗ヒトIgG(Sigma Aldrich、英国プール、BH12 4QH)によって被覆したプラスチックチューブにおいて、室温で一時間培養した。その後、チューブをアッセイ緩衝液(2×1mL)により洗浄し、125I標識hMAb TSHR1 Fab(30,000cpm)100μLを追加した後、室温で培養した。一時間後、チューブを再度洗浄し(2×1mL)、125Iを計数した。結合したものの計数は、キャリブレータ(5乃至500ng/mL)におけるFab(ハイブリドーマ生成hMAb TSHR1 Fab)の濃度と、このキャリブレーション曲線から外れて読み取られた様々な試験材料における組み換えFabの濃度とに対してプロットした。このアッセイの検出限界は、5乃至10ng/mLのFabとした。
組み換え4B4 Fab(4B4については、N Hayakawa, LDKE Premawardhana, M powell, M Masuda, C Arnold, J Sanders, M Evans, S Chen, JC Jaume, S Baekkeskov, B Rees Smith, J Furmaniak、「グルタミン酸デカルボキシラーゼに対するヒトモノクローナル自己抗体の分離及び特徴付け」、Autoimmunity 2002; 35: 343-355において詳細に説明される)及び組み換えハイブリッドFabは、組み換えhMAb TSHR1 Fabについて説明したように、HC及びLCのそれぞれをImmunozapH/Lベクタにおいてクローニングすることで生成し、HB2151細胞において発現させた。培養上清及びペリプラズム画分では、(a)TSHRと結合するTSHを阻害する能力と、(b)上記のような組み換えFabの総濃度とについてアッセイを行った。加えて、GAD Ab活性を、下記のように評価した。
GADに対するヒトモノクローナル抗体(4B4)との125I標識GAD(RSR Ltd、英国カーディフ、CF23 8HE)の結合を阻害するGAD Ab Fab調製物の能力に基づくアッセイを使用した。このアッセイでは、GAD Abアッセイ緩衝液(150mmol/L NaCl、50mmol/LトリスHClpH8.0、0.1%v/v Tween 20、1g/Lウシ血清アルブミン、0.5g/L NaN3)において希釈した試験試料(50μLを重複して作成)を、125I標識GAD(GADAbアッセイ緩衝液50μL中30,000cpm)と共に、室温で一時間培養した。その後、4B4 IgG 50μL(GAD Abアッセイ緩衝液中0.1μg/mL)を追加し、室温で24時間、培養を継続した。その後、固相プロテインA(GAD Abアッセイ緩衝液中50μL、RSR Ltdより)を追加し、4B4 IgG−125I標識GADの複合物を沈殿させた(プロテインAは、Fab及び125I標識GADの複合物とは反応しない)。プロテインAとの反応を室温で一時間継続させた後、遠心分離(1500gで30分間、4℃)により沈殿物をペレットにし、GAD Abアッセイ緩衝液1mLにより洗浄し、125Iを計数した。4B4 IgGが存在しない場合の125I標識GAD結合は、追加した総cpmの4乃至5%となった。
完全フロイントアジュバント内のhMAb TSHR1 Fab 50μgと、その25日後の不完全フロイントアジュバント内のhMAb TSHR1 Fab 50μgの第二の注射と、脾臓除去四日前のhMAb TSHR1 Fab 50μgの更なる注射とにより、生後六乃至八週間のBALB/cマウスに腹腔内で免疫付与した。抗体陽性マウス(下記参照)からの脾臓細胞を、マウス骨髄腫細胞株、及びTSHR MAbのために上機能に分離されたモノクローナル抗体に融合させた。マウス血清及び細胞培養ウェル内の抗イディオタイプ抗体のレベルは、TSHR被覆チューブと結合する125I−hMAb TSHR1 Fabの阻害によって測定した。特に、試験試料の重複60μLアリコート(アッセイ緩衝液:50mmol/L NaCl、10mmol/LトリスHClpH7.8、0.1%Triton X−100により希釈)を、125I−hMAb TSHR1 Fab(アッセイ緩衝液において希釈された30000cpm)と共に、室温で一時間培養した。混合物100μLを、開始緩衝液20μL(上記参照)と共に、重複TSHR被覆チューブ(RSR Ltd)へ移動させ、室温で更に二時間、振動させて培養を継続した。その後、チューブをアッセイ緩衝液2×1mLで洗浄し、125Iを計数した。hMAb TSHR1に反応する抗イディオタイプ抗体の存在は、標識hMAb TSHR1 FabのTSHR被覆チューブとの結合を阻害する試験試料の能力から明らかとなった。
患者の血液20mLから取得したリンパ球(30×106)を、マウスマクロファージの支持細胞層上のEBVの上清200μLと共に、48ウェルプレート上で、1ウェル当たり1×106で平板培養した。EBV感染後11日目に、125I−TSH結合の阻害について上清をモニタした。一つのウェルでは、結合の阻害について陽性であることが確認され、阻害のレベルは、16日目には90%の阻害を上回るまでに増加し、このレベルは24日目まで維持され、その後、低下した。培養物を拡張し、EBV感染後21、23、26、及び27日目にK6H6/B5細胞と融合させ、合計7回の融合実験を実施した。各融合物を3×96ウェルプレート(即ち、合計21枚のプレート)で平板培養し、125I−TSH結合阻害活性を有する抗体を安定して生成する一つのウェルを取得した。この後、三ラウンドの再クローニングを行い、TSH受容体と結合する標識TSHを阻害したヒトモノクローナル抗体を生成する単一のクローンを発生させた。このヒトモノクローナルTSH受容体自己抗体は、指定されたhMAb TSHR1となり、ラムダ軽鎖を有するサブクラスIgG1に含まれた。
(a)我々は、提供患者血清中のTSH受容体自己抗体と同様の特性を有するTSH受容体に対するヒトモノクローナル自己抗体を生成した。モノクローナル抗体は、組み換えFab調製物としても生成された。
(ii)TSHアゴニスト又はTSHアンタゴニスト活性の提供が関与する様々なinvivo用途
(iii)新型のTSH受容体自己抗体結合部位の特定及び提供
表1 TSH受容体と結合する125I標識hMAb TSHR1 IgGに対する患者血清の影響、及びTSH受容体と結合する125I標識TSHに対する影響との比較
表2 TSH受容体と結合する125I標識hMAb TSHR1 Fabに対する患者血清の影響、及びTSH受容体と結合する125I標識TSHに対する影響との比較
1 健康な供血者の血清プールで、この血清プールのみが存在する場合、総cpmの14.7%がTSHRと結合した。緩衝液のみが存在する場合、総cpmの16.3%がTSHRと結合した。
2 記載の単位は、NIBSC90/672国際TSHR自己抗体基準調製物である。
1 アッセイ緩衝液=1g/Lグルコースと、20mmol/LHepesと、222mmol/Lスクロースと、15g/Lウシ血清アルブミン(BSA)と、0.5mmol/L 2イソブチル−1−メチルキサンチンpH7.4と、を含有するハンクの緩衝食塩溶液(NaClなし)
2 アッセイ緩衝液における希釈
3 基礎値=アッセイ緩衝液のみが存在する場合に生成されるcAMP
ペリプラズム画分のアッセイ
A=試験試料が存在する場合の125I−TSH結合%
B=アッセイ緩衝液が存在する場合の125I−TSH結合%
a 非誘導細胞におけるTSHR Ab活性の検出は、IPTGが存在しない場合にFabの低レベルの発現を提供するプロモータの構成的活性によるものとした。
培養上清のアッセイ
培養上清のアッセイ
1 アッセイ緩衝液:1g/Lグルコースと、20mmol/L Hepesと、222mmol/Lスクロースと、15g/Lウシ血清アルブミン(BSA)と、0.5mmol/L 2イソブチル−1−メチルキサンチン pH7.4と、を含有するハンクの緩衝食塩溶液(NaClなし)
2 アッセイ緩衝液における希釈
3 基礎値=アッセイ緩衝液のみが存在する場合に生成される環状AMP
a 非誘導細胞における環状AMP刺激活性の検出は、IPTGが存在しない場合にFabの低レベルの発現を提供するプロモータの構成的活性によるものとした。総組み換えFabレベルは検出不可だったが(検出限界=5乃至10ng/mL)、環状AMP刺激アッセイは、僅か0.3ng/mLのhMAb TSHR1 Fabを検出可能である。
ペリプラズム画分のアッセイ
ペリプラズム画分のアッセイ
培養上清のアッセイ
1 全ての希釈は、アッセイ緩衝液(1g/Lグルコースと、20mmol/L Hepesと、222mmol/Lスクロースと、15g/Lウシ血清アルブミン(BSA)と、0.5mmol/L 2イソブチル−1−メチルキサンチン pH7.4と、を含有するハンクの緩衝食塩溶液(NaClなし))において行った。
2 基礎値=アッセイ緩衝液のみが存在する場合の環状AMP生成
3 2G2は、サイログロブリンに対するマウスモノクローナル抗体である(100μg/mLのIgG調製物)。
4 2B4及び9D33は、TSHRに対するマウスモノクローナル抗体である(100μg/mLのIgG調製物)。
1、2、4 表20の脚注参照。個々の実験では、サイログロブリンに対する対照マウスMAb(2G2 IgG100μg/mL)は、環状AMP生成のpTSH(0.5ng/mL)刺激に対する影響を有していないことが明らかとなった(pTSH及びアッセイ緩衝液=12.7×基礎値、pTSH及び2G2=11.7×基礎値)。
A=試験試料が存在する場合の結合%
B=アッセイ緩衝液が存在する場合の結合%
サイログロブリンに対する対照マウスMAb(2G2 0.001乃至100μg/mL)は、標識TSH、hMAbTSHR1、又は9D33の結合に影響しなかった。
1 HBDプール=健康な供血者の血清プール
G1乃至G20は、グレーブス病患者からの血清である。
D1及びD2は、一型糖尿病患者からのものである(グルタミン酸デカルボキシラーゼに対する自己抗体について陽性)。
A1及びA2は、アジソン病患者からのものである(ステロイド21−ヒドロキシラーゼ自己抗体について陽性)。
N1乃至N9は、健康な供血者からの血清である。
2 結合の阻害は、次の式を使用して計算した。
1 HBDプール=健康な供血者の血清プールであり、試験血清は、このプールにおいて希釈した。
血清A及びBは、TSHアンタゴニスト活性を有する。
血清C及びDは、TSHアゴニスト活性を有する。
2 結合の阻害は、表23で使用した式により計算した。
Claims (14)
- TSH受容体に対する免疫反応に関連する自己免疫疾患に罹患している疑いがある対象者、こうした疾患を起こしやすい対象者、こうした疾患を有する対象者、又はこうした疾患から回復中の対象者から取得した体液試料中のTSH受容体に対する自己抗体をスクリーニングする方法であって、
(a)結合分子の一つ以上のペアを提供するステップであって、
当該結合ペアの第一の分子は、(i)TSH受容体と反応するヒトモノクローナル若しくは組み換え抗体又はその1以上の断片、又は(ii)TSH受容体との結合について、前記ヒトモノクローナル抗体若しくは組み換え抗体又はその断片と競合する、TSH受容体の更なる抗体若しくはその断片を含み、
当該結合ペアの当該第一の分子は、1mg当たり国際標準NIBSC90/672少なくとも15単位の、TSH受容体でコーティングされた管を使用して決定されたTSH受容体への125I標識TSH結合に関する阻害活性を有し、
当該結合ペアの第二の分子は、全長TSH受容体、1以上のTSH受容体のエピトープ、又は1以上のTSH受容体のエピトープを含むポリペプチドであり、
(b)当該結合ペアの当該第二の分子が、(i)当該試料中に存在するTSH受容体に対する自己抗体、或いは(ii)前記ヒトモノクローナル抗体若しくは組み換え抗体又はその1以上の断片、又は前記TSH受容体の更なる抗体若しくはその断片と相互作用できるように、結合分子の当該一つ以上のペアに当該試料を接触させるステップと、
(c)当該結合ペアの当該第二の分子と当該試料中に存在する当該自己抗体との前記相互作用をモニタリングし、これにより、当該試料中のTSH受容体に対する当該自己抗体の存在の示度を提供するステップと、を備える方法。 - 前記ステップ(a)における前記結合分子の相互作用は、0.4U/Lの国際標準NIBSC90/672に本質的に対応する当該試料における自己抗体力価が検出できるものである、請求項1記載のTSH受容体に対する自己抗体をスクリーニングする方法。
- TSH及び関連リガンドの生体外(in vitro)アッセイを行う方法であって、
(a)結合分子の一つ以上のペアを提供するステップであって、
当該結合ペアの第一の分子は、(i)TSH受容体と反応するヒトモノクローナル抗体若しくは組み換え抗体又はその1以上の断片、又は(ii)TSH受容体との結合について、前記ヒトモノクローナル抗体若しくは組み換え抗体又はその断片と競合する、更なる抗体若しくはその断片を含み、
前記結合ペアの第一の分子は、1mg当たり国際標準NIBSC90/672少なくとも15単位の、TSH受容体でコーティングされた管を使用して決定されたTSH受容体への125I標識TSH結合に関する阻害活性を有し、
当該結合ペアの第二の分子は、前記抗体若しくはその断片、又は前記更なる抗体若しくはその断片が相互作用する結合領域を含み、
(b)当該結合ペアの当該第二の分子が(i)TSH又は関連リガンドを含有する疑いがある試料又は含有する試料中に存在するTSH又は関連リガンド、或いは(ii)前記ヒトモノクローナル抗体若しくは組み換え抗体又はその1以上の断片、又は前記TSH受容体の更なる抗体若しくはその断片と相互作用できるように、結合分子の当該一つ以上のペアに当該試料を接触させるステップと、
(c)当該結合ペアの当該第二の分子と当該試料中に存在するTSH又は関連リガンドとの前記相互作用をモニタリングし、これにより、当該試料中のTSH又は関連リガンドの存在の示度を提供するステップと、を備える方法。 - TSH受容体の更なる抗体又はその断片を特定する方法であって、更なる抗体又はその断片は、TSH受容体との結合が可能で、TSH受容体との結合について、TSH受容体と反応するヒトモノクローナル若しくは組み換え抗体又はその1以上の断片と競合し、
(a)結合分子の一つ以上のペアを提供するステップであって、
当該結合ペアの第一の分子は、(i)TSH受容体のヒトモノクローナル抗体若しくは組み換え抗体又はその断片を含み、
前記結合ペアの第一の分子は、1mg当たり国際標準NIBSC90/672少なくとも15単位の、TSH受容体でコーティングされた管を使用して決定されたTSH受容体への125I標識TSH結合に関する阻害活性を有し、
当該結合ペアの第二の分子は、前記抗体若しくはその断片、又は前記更なる抗体若しくはその断片が相互作用する結合領域を含み、
(b)アッセイの対象となる更なる結合分子を、TSH受容体との結合について(a)の当該結合ペアの当該第一の分子と競合するTSH受容体の潜在的な更なる抗体として提供するステップと、
(c)(a)の当該結合ペアの当該第二の分子が(i)(b)の当該更なる結合分子、或いは(ii)(a)の当該結合ペアの当該第一の分子と相互作用できるように、(b)の当該更なる結合分子を(a)の結合分子の当該一つ以上のペアに接触させるステップと、
(d)(a)の当該結合ペアの当該第二の分子と(b)の当該更なる結合分子との相互作用をモニタリングし、これにより、(b)の当該更なる結合分子がTSH受容体との結合について(a)の当該結合ペアの当該第一の分子と競合するかのアッセイを行うステップと、を備える方法。 - TSH受容体に対する免疫反応に関連する自己免疫疾患に罹患している疑いがある対象者、こうした疾患を起こしやすい対象者、こうした疾患を有する対象者、又はこうした疾患から回復中の対象者から取得した体液試料中のTSH受容体に対する自己抗体をスクリーニングするキットであって、
(a)結合分子の一つ以上のペアを備え、
当該結合ペアの第一の分子は、(i)TSH受容体と反応するヒトモノクローナル若しくは組み換え抗体又はTSH受容体との反応性を有するその1以上の断片、又は(ii)TSH受容体との結合について、前記ヒトモノクローナル若しくは組み換え抗体又はその断片と競合する、更なる抗体若しくはその断片を含み、
前記結合ペアの第一の分子は、1mg当たり国際標準NIBSC90/672少なくとも15単位の、TSH受容体でコーティングされた管を使用して決定されたTSH受容体への125I標識TSH結合に関する阻害活性を有し、
当該結合ペアの第二の分子は、前記抗体若しくはその断片又は前記更なる抗体若しくはその断片が相互作用する結合領域を含み、
(b)当該結合ペアの当該第二の分子が、(i)当該試料中に存在するTSH受容体に対する自己抗体、或いは(ii)前記ヒトモノクローナル若しくは組み換え抗体又はその1以上の断片、又は前記TSH受容体の更なる抗体若しくはその断片と相互作用できるように、当該対象者からの当該体液試料を結合分子の当該一つ以上のペアに接触させる手段と、
(c)当該結合ペアの当該第二の分子と当該試料中に存在する当該自己抗体との前記相互作用をモニタリングし、これにより、当該試料中のTSH受容体に対する当該自己抗体の存在の示度を提供する手段と、を備えるキット。 - 前記結合ペアの前記第一及び第二の分子の相互作用は、0.4U/Lの国際標準NIBSC90/672に本質的に対応する当該試料における自己抗体力価が検出できるものである、請求項5記載のキット。
- TSH受容体に対する免疫反応に関連する自己免疫疾患に罹患している疑いがある対象者、こうした疾患を起こしやすい対象者、こうした疾患を有する対象者、又はこうした疾患から回復中の対象者から取得した体液試料中のTSH受容体に対する自己抗体をスクリーニングするキットであって、
(a)結合分子の一つ以上のペアを備え、
当該結合ペアの第一の分子は、1010モル−1以上のTSH受容体に対する親和性を有する、TSH受容体のヒトモノクローナル抗体若しくは組み換え抗体又はその断片を含み、
当該結合ペアの第一の分子は、1mg当たり国際標準NIBSC90/672少なくとも15単位の、TSH受容体でコーティングされた管を使用して決定されたTSH受容体への125I標識TSH結合に関する阻害活性を有し、
当該結合ペアの第二の分子は、全長TSH受容体、全長TSH受容体のエピトープ、又は全長TSH受容体の1以上のエピトープを含むポリペプチドを含み、当該結合分子の前記相互作用は、0.4U/Lの国際標準NIBSC90/672に本質的に対応する当該試料における自己抗体力価が検出できるようなものであり、更に、
(b)当該結合ペアの当該第二の分子が、(i)当該試料中に存在するTSH受容体に対する自己抗体、或いは(ii)当該TSH受容体の抗体と相互作用できるように、当該対象者からの当該体液試料を結合分子の当該一つ以上のペアに接触させる手段と、
(c)当該結合ペアの当該第二の分子と当該試料中に存在する当該自己抗体との前記相互作用をモニタリングし、これにより、当該試料中のTSH受容体に対する当該自己抗体の存在の示度を提供する手段と、を備えるキット。 - TSH又は関連リガンドのアッセイを行うキットであって、
(a)結合分子の一つ以上のペアを備え、
当該結合ペアの第一の分子は、(i)TSH受容体と反応するヒトモノクローナル若しくは組み換え抗体又はその1以上の断片、又は(ii)TSH受容体との結合について、前記ヒトモノクローナル抗体若しくは組み換え抗体又はその断片と競合する、TSH受容体の更なる抗体若しくはその断片、を含み、
前記結合ペアの第一の分子は、1mg当たり国際標準NIBSC90/672少なくとも15単位の、TSH受容体でコーティングされた管を使用して決定されたTSH受容体への125I標識TSH結合に関する阻害活性を有し、
当該結合ペアの第二の分子は、前記抗体若しくはその断片、又は前記更なる抗体若しくはその断片が相互作用する結合領域を含み、更に、
(b)当該結合ペアの当該第二の分子が、(i)当該試料中に存在するTSH又は関連リガンド、或いは(ii)ヒトモノクローナル抗体若しくは組み換え抗体又はその1以上の断片、又は前記TSH受容体の更なる抗体若しくはその断片と相互作用できるように、TSH又は関連リガンドを含有する疑いがある試料又は含有する試料を、結合分子の当該一つ以上のペアに接触させる手段と、
(c)当該結合ペアの当該第二の分子と当該試料中に存在するTSH又は関連リガンドとの前記相互作用をモニタリングし、これにより、当該試料中のTSH又は関連リガンドの存在の示度を提供するステップと、を備えるキット。 - TSH受容体の更なる抗体又はその断片を特定するキットであって、前記更なる抗体又はその断片は、TSH受容体との結合が可能で、TSH受容体との結合について、TSH受容体と反応するヒトモノクローナル若しくは組み換え抗体又はその1以上の断片と競合し、
(a)結合分子の一つ以上のペアを備え、
当該結合ペアの第一の分子は、TSH受容体と反応するヒトモノクローナル若しくは組み換え抗体又はその1以上の断片を含み、
前記第一の分子は、1mg当たり国際標準NIBSC90/672少なくとも15単位の、TSH受容体でコーティングされた管を使用して決定されたTSH受容体への125I標識TSH結合に関する阻害活性を有し、
当該結合ペアの第二の分子は、前記抗体若しくはその断片又は前記更なる抗体若しくはその断片が相互作用する結合領域を含み、
(b)TSH受容体との結合について(a)の前記結合ペアの前記第一の分子と競合する、潜在的なTSH受容体の更なる抗体としてアッセイの対象となる更なる結合対象に、(a)の結合分子の当該一つ以上のペアを接触させ、(a)の当該結合ペアの当該第二の分子が(i)当該更なる結合分子、或いは(ii)(a)の当該結合ペアの当該第一の分子と相互作用できるようにする手段と、
(c)(a)の当該結合ペアの当該第二の分子と当該更なる結合分子との相互作用をモニタリングし、これにより、当該更なる結合分子がTSH受容体との結合について(a)の当該結合ペアの当該第一の分子と競合するかのアッセイを行う手段と、
を備えるキット。 - 前記ヒトモノクローナル若しくは組み換え抗体又はその1以上の断片は、TSH受容体と結合するTSHの阻害と、TSH受容体を発現する細胞によるcAMP生成の刺激とについて、患者の血清TSH受容体自己抗体の特徴を有する、請求項1〜4のいずれか1項に記載の方法又は請求項5〜9のいずれか1項に記載のキット。
- 前記ヒトモノクローナル若しくは組み換え抗体又はその1以上の断片は、1mg当たり国際標準NIBSC90/672少なくとも15単位の、TSH受容体でコーティングされた管を使用して決定されたTSH受容体への125I標識TSH結合に関する阻害活性により特徴付けられるか、又は前記TSH受容体への125I標識TSH結合に関する阻害活性が、1mg当たり国際標準NIBSC90/672少なくとも120単位である、請求項1〜4のいずれか1項に記載の方法又は請求項5〜9のいずれか1項に記載のキット。
- 前記ヒトモノクローナル若しくは組み換え抗体又はその1以上の断片は、1mg当たり国際標準NIBSC90/672少なくとも30単位である、1細胞当たり50,000ヒトTSH受容体を発現するCHO細胞によるcAMPの生成に関する刺激活性により特徴付けられるか、又は前記1細胞当たり50,000のヒトTSH受容体を発現するCHO細胞によるcAMPの生成に関する刺激活性が、1mg当たり国際標準NIBSC90/672少なくとも240単位である、請求項1〜4のいずれか1項に記載の方法又は請求項5〜9のいずれか1項に記載のキット。
- 前記ヒトモノクローナル若しくは組み換え抗体又はその1以上の断片は、
(i)1mg当たり国際標準NIBSC90/672少なくとも30単位の、TSH受容体でコーティングされた管を使用して決定されたTSH受容体への125I標識TSH結合に関する阻害活性;及び
(ii)1mg当たり国際標準NIBSC90/672少なくとも50単位である、1細胞当たり50,000ヒトTSH受容体を発現するCHO細胞によるcAMPの生成に関する刺激活性;
により特徴付けられる、請求項1〜4のいずれか1項に記載の方法又は請求項5〜9のいずれか1項に記載のキット。 - 前記更なる抗体又はそのフラグメントは、請求項11〜13のいずれか1項に記載のヒトモノクローナル又は組み換え抗体のために定義された特性を含む、請求項1〜4のいずれかに記載の方法又は請求項5〜9のいずれかに記載のキット。
Applications Claiming Priority (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GBGB0227964.4A GB0227964D0 (en) | 2002-11-29 | 2002-11-29 | Binding partners for the thyrotropin receptor and uses thereof |
| GB0227964.4 | 2002-11-29 | ||
| GB0302140.9 | 2003-01-29 | ||
| GBGB0302140.9A GB0302140D0 (en) | 2002-11-29 | 2003-01-29 | Binding partners for the thyrotropin receptor and uses thereof |
| GB0315147.9 | 2003-06-27 | ||
| GB0315147A GB0315147D0 (en) | 2002-11-29 | 2003-06-27 | Binding partners for the thyrotropin receptor and uses thereof |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2004570698A Division JP5314234B2 (ja) | 2002-11-29 | 2003-11-28 | チロトロピン受容体の結合対象及びその使用 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2013126987A JP2013126987A (ja) | 2013-06-27 |
| JP2013126987A5 JP2013126987A5 (ja) | 2013-12-05 |
| JP5722927B2 true JP5722927B2 (ja) | 2015-05-27 |
Family
ID=9948838
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013007593A Expired - Lifetime JP5722927B2 (ja) | 2002-11-29 | 2013-01-18 | チロトロピン受容体の結合対象及びその使用 |
Country Status (5)
| Country | Link |
|---|---|
| JP (1) | JP5722927B2 (ja) |
| AT (1) | ATE525086T1 (ja) |
| ES (2) | ES2371244T3 (ja) |
| GB (2) | GB0227964D0 (ja) |
| HU (1) | HUE034370T2 (ja) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP5304939B1 (ja) * | 2012-05-31 | 2013-10-02 | 大日本印刷株式会社 | 光学積層体、偏光板、偏光板の製造方法、画像表示装置、画像表示装置の製造方法及び画像表示装置の視認性改善方法 |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB9909661D0 (en) * | 1998-06-06 | 1999-06-23 | Rsr Ltd | Assays for TSH receptor autoantibodies |
| US8110664B2 (en) * | 2002-11-29 | 2012-02-07 | Rsr Limited | Binding partners for the thyrotropin receptor and uses thereof |
-
2002
- 2002-11-29 GB GBGB0227964.4A patent/GB0227964D0/en not_active Ceased
-
2003
- 2003-01-29 GB GBGB0302140.9A patent/GB0302140D0/en not_active Ceased
- 2003-11-28 ES ES03778537T patent/ES2371244T3/es not_active Expired - Lifetime
- 2003-11-28 HU HUE10184462A patent/HUE034370T2/en unknown
- 2003-11-28 AT AT03778537T patent/ATE525086T1/de active
- 2003-11-28 ES ES10184462.9T patent/ES2624241T3/es not_active Expired - Lifetime
-
2013
- 2013-01-18 JP JP2013007593A patent/JP5722927B2/ja not_active Expired - Lifetime
Also Published As
| Publication number | Publication date |
|---|---|
| GB0227964D0 (en) | 2003-01-08 |
| ATE525086T1 (de) | 2011-10-15 |
| JP2013126987A (ja) | 2013-06-27 |
| GB0302140D0 (en) | 2003-03-05 |
| ES2371244T3 (es) | 2011-12-28 |
| ES2624241T3 (es) | 2017-07-13 |
| HUE034370T2 (en) | 2018-02-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US8753637B2 (en) | Binding partners for the thyrotropin receptor and uses thereof | |
| JP5982698B2 (ja) | Dll4に特異的に結合する新規モノクローナル抗体及びその用途 | |
| US10613099B2 (en) | Cell lines expressing surface bound anti-idiotype antibodies against anti-CD22 antibodies and uses thereof | |
| JP7215759B2 (ja) | 4-1bb抗体およびその製造方法と使用 | |
| EP3878869A1 (en) | Nkg2a antibody, preparation method therefor and application thereof | |
| US20140243265A1 (en) | Antibodies to modified human igf-1/e peptides | |
| RU2710439C2 (ru) | Новое антитело против пресепсина | |
| US7935793B2 (en) | Treatment of inflammatory bowel diseases with anti-IP-10 antibodies | |
| US20120070845A1 (en) | Methods, systems and reagents for improved immunodetection | |
| CN115515984A (zh) | 一种抗cd19抗体的抗体及其制备和应用 | |
| JP2729159B2 (ja) | ヒトグリセンチンのモノクローナル抗体、この抗体を産生するハイブリドーマおよびそれを用いるヒトグリセンチンの定量法 | |
| EP1708961B1 (en) | Anti-ip-10 antibodies | |
| JP5722927B2 (ja) | チロトロピン受容体の結合対象及びその使用 | |
| JP2011160696A (ja) | 修飾ヒトigf−1/eペプチドに対する抗体 | |
| CN113999306A (zh) | 一种获得识别空间构象表位抗体的方法 | |
| JPWO2005056597A1 (ja) | 免疫グロブリンFc受容体タンパク質 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20131018 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20140624 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140919 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20150224 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20150326 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5722927 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| EXPY | Cancellation because of completion of term |