JP5646813B2 - 結石破砕によらない腎結石の治療方法 - Google Patents
結石破砕によらない腎結石の治療方法 Download PDFInfo
- Publication number
- JP5646813B2 JP5646813B2 JP2008510072A JP2008510072A JP5646813B2 JP 5646813 B2 JP5646813 B2 JP 5646813B2 JP 2008510072 A JP2008510072 A JP 2008510072A JP 2008510072 A JP2008510072 A JP 2008510072A JP 5646813 B2 JP5646813 B2 JP 5646813B2
- Authority
- JP
- Japan
- Prior art keywords
- composition
- polymer
- lumen
- calculus
- stone
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 239000004575 stone Substances 0.000 title claims description 80
- 208000000913 Kidney Calculi Diseases 0.000 title claims description 14
- 206010029148 Nephrolithiasis Diseases 0.000 title claims description 14
- 229920000642 polymer Polymers 0.000 claims description 126
- 239000000203 mixture Substances 0.000 claims description 114
- 239000000243 solution Substances 0.000 claims description 43
- 229920000208 temperature-responsive polymer Polymers 0.000 claims description 38
- 229920001983 poloxamer Polymers 0.000 claims description 36
- RVGRUAULSDPKGF-UHFFFAOYSA-N Poloxamer Chemical compound C1CO1.CC1CO1 RVGRUAULSDPKGF-UHFFFAOYSA-N 0.000 claims description 33
- 210000000626 ureter Anatomy 0.000 claims description 29
- 238000011144 upstream manufacturing Methods 0.000 claims description 24
- 239000000463 material Substances 0.000 claims description 21
- 229960000502 poloxamer Drugs 0.000 claims description 20
- 210000003734 kidney Anatomy 0.000 claims description 19
- 229920001987 poloxamine Polymers 0.000 claims description 19
- 229920002148 Gellan gum Polymers 0.000 claims description 18
- 229920001400 block copolymer Polymers 0.000 claims description 16
- KIUKXJAPPMFGSW-DNGZLQJQSA-N (2S,3S,4S,5R,6R)-6-[(2S,3R,4R,5S,6R)-3-Acetamido-2-[(2S,3S,4R,5R,6R)-6-[(2R,3R,4R,5S,6R)-3-acetamido-2,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-2-carboxy-4,5-dihydroxyoxan-3-yl]oxy-5-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-3,4,5-trihydroxyoxane-2-carboxylic acid Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 KIUKXJAPPMFGSW-DNGZLQJQSA-N 0.000 claims description 15
- 230000002572 peristaltic effect Effects 0.000 claims description 15
- 229920002674 hyaluronan Polymers 0.000 claims description 14
- 229960003160 hyaluronic acid Drugs 0.000 claims description 14
- 239000004372 Polyvinyl alcohol Substances 0.000 claims description 13
- 239000007924 injection Substances 0.000 claims description 13
- 238000002347 injection Methods 0.000 claims description 13
- 229920002451 polyvinyl alcohol Polymers 0.000 claims description 13
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 claims description 12
- 229910052791 calcium Inorganic materials 0.000 claims description 12
- 239000011575 calcium Substances 0.000 claims description 12
- 230000007704 transition Effects 0.000 claims description 12
- 229920002134 Carboxymethyl cellulose Polymers 0.000 claims description 11
- 229920001577 copolymer Polymers 0.000 claims description 11
- 229920001992 poloxamer 407 Polymers 0.000 claims description 11
- 210000003932 urinary bladder Anatomy 0.000 claims description 11
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 claims description 10
- 235000010443 alginic acid Nutrition 0.000 claims description 10
- 229920000615 alginic acid Polymers 0.000 claims description 10
- 239000001768 carboxy methyl cellulose Substances 0.000 claims description 10
- 235000010948 carboxy methyl cellulose Nutrition 0.000 claims description 10
- 239000008112 carboxymethyl-cellulose Substances 0.000 claims description 10
- 229940044476 poloxamer 407 Drugs 0.000 claims description 10
- 239000011734 sodium Substances 0.000 claims description 10
- 229910052708 sodium Inorganic materials 0.000 claims description 10
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 claims description 9
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 claims description 9
- 239000000783 alginic acid Substances 0.000 claims description 9
- 229960001126 alginic acid Drugs 0.000 claims description 9
- 150000004781 alginic acids Chemical class 0.000 claims description 9
- 229910052749 magnesium Inorganic materials 0.000 claims description 9
- 239000011777 magnesium Substances 0.000 claims description 9
- 239000011591 potassium Substances 0.000 claims description 9
- 229910052700 potassium Inorganic materials 0.000 claims description 9
- 235000010408 potassium alginate Nutrition 0.000 claims description 9
- 239000000737 potassium alginate Substances 0.000 claims description 9
- MZYRDLHIWXQJCQ-YZOKENDUSA-L potassium alginate Chemical compound [K+].[K+].O1[C@@H](C([O-])=O)[C@@H](OC)[C@H](O)[C@H](O)[C@@H]1O[C@@H]1[C@@H](C([O-])=O)O[C@@H](O)[C@@H](O)[C@H]1O MZYRDLHIWXQJCQ-YZOKENDUSA-L 0.000 claims description 9
- IXPNQXFRVYWDDI-UHFFFAOYSA-N 1-methyl-2,4-dioxo-1,3-diazinane-5-carboximidamide Chemical compound CN1CC(C(N)=N)C(=O)NC1=O IXPNQXFRVYWDDI-UHFFFAOYSA-N 0.000 claims description 8
- 235000010413 sodium alginate Nutrition 0.000 claims description 8
- 239000000661 sodium alginate Substances 0.000 claims description 8
- 229940005550 sodium alginate Drugs 0.000 claims description 8
- 239000003795 chemical substances by application Substances 0.000 claims description 7
- 210000000232 gallbladder Anatomy 0.000 claims description 7
- 208000001130 gallstones Diseases 0.000 claims description 7
- 230000002441 reversible effect Effects 0.000 claims description 7
- BTBUEUYNUDRHOZ-UHFFFAOYSA-N Borate Chemical compound [O-]B([O-])[O-] BTBUEUYNUDRHOZ-UHFFFAOYSA-N 0.000 claims description 6
- 241000124008 Mammalia Species 0.000 claims description 6
- 210000000496 pancreas Anatomy 0.000 claims description 6
- 210000003079 salivary gland Anatomy 0.000 claims description 6
- 229910052788 barium Inorganic materials 0.000 claims description 5
- DSAJWYNOEDNPEQ-UHFFFAOYSA-N barium atom Chemical compound [Ba] DSAJWYNOEDNPEQ-UHFFFAOYSA-N 0.000 claims description 5
- 239000000975 dye Substances 0.000 claims description 5
- 230000002708 enhancing effect Effects 0.000 claims description 5
- 210000002429 large intestine Anatomy 0.000 claims description 5
- 210000000813 small intestine Anatomy 0.000 claims description 5
- 102000016997 Lithostathine Human genes 0.000 claims description 4
- 108010014691 Lithostathine Proteins 0.000 claims description 4
- 229910052768 actinide Inorganic materials 0.000 claims description 4
- 150000001255 actinides Chemical class 0.000 claims description 4
- 229910052747 lanthanoid Inorganic materials 0.000 claims description 4
- 150000002602 lanthanoids Chemical class 0.000 claims description 4
- 229910052723 transition metal Inorganic materials 0.000 claims description 4
- 150000003624 transition metals Chemical class 0.000 claims description 4
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 claims description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 claims description 3
- 229910019142 PO4 Inorganic materials 0.000 claims description 3
- WNLRTRBMVRJNCN-UHFFFAOYSA-L adipate(2-) Chemical compound [O-]C(=O)CCCCC([O-])=O WNLRTRBMVRJNCN-UHFFFAOYSA-L 0.000 claims description 3
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 claims description 3
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 claims description 3
- 239000010452 phosphate Substances 0.000 claims description 3
- 229910052712 strontium Inorganic materials 0.000 claims description 3
- CIOAGBVUUVVLOB-UHFFFAOYSA-N strontium atom Chemical compound [Sr] CIOAGBVUUVVLOB-UHFFFAOYSA-N 0.000 claims description 3
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 claims description 3
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 claims description 3
- 229920002517 Poloxamer 338 Polymers 0.000 claims description 2
- 229920000578 graft copolymer Polymers 0.000 claims description 2
- 229920005604 random copolymer Polymers 0.000 claims description 2
- 125000004429 atom Chemical group 0.000 claims 1
- 238000010298 pulverizing process Methods 0.000 claims 1
- 238000000034 method Methods 0.000 description 115
- 239000000499 gel Substances 0.000 description 29
- 150000003839 salts Chemical class 0.000 description 13
- 239000000126 substance Substances 0.000 description 13
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 12
- -1 oxides thereof Chemical compound 0.000 description 11
- 210000002700 urine Anatomy 0.000 description 10
- 238000004090 dissolution Methods 0.000 description 9
- 239000012071 phase Substances 0.000 description 9
- 230000036760 body temperature Effects 0.000 description 7
- 230000000694 effects Effects 0.000 description 7
- 229920001451 polypropylene glycol Polymers 0.000 description 7
- 238000011282 treatment Methods 0.000 description 7
- 239000007864 aqueous solution Substances 0.000 description 6
- 239000012634 fragment Substances 0.000 description 6
- 239000007788 liquid Substances 0.000 description 6
- 239000000178 monomer Substances 0.000 description 6
- 210000001519 tissue Anatomy 0.000 description 6
- IAJILQKETJEXLJ-UHFFFAOYSA-N Galacturonsaeure Natural products O=CC(O)C(O)C(O)C(O)C(O)=O IAJILQKETJEXLJ-UHFFFAOYSA-N 0.000 description 5
- IAJILQKETJEXLJ-QTBDOELSSA-N aldehydo-D-glucuronic acid Chemical compound O=C[C@H](O)[C@@H](O)[C@H](O)[C@H](O)C(O)=O IAJILQKETJEXLJ-QTBDOELSSA-N 0.000 description 5
- 229940097043 glucuronic acid Drugs 0.000 description 5
- 229920001519 homopolymer Polymers 0.000 description 5
- 238000006467 substitution reaction Methods 0.000 description 5
- 238000001356 surgical procedure Methods 0.000 description 5
- 239000004971 Cross linker Substances 0.000 description 4
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 4
- 229920002359 Tetronic® Polymers 0.000 description 4
- 238000013459 approach Methods 0.000 description 4
- 230000015572 biosynthetic process Effects 0.000 description 4
- 239000006227 byproduct Substances 0.000 description 4
- 229920002678 cellulose Polymers 0.000 description 4
- 239000001913 cellulose Substances 0.000 description 4
- 230000008859 change Effects 0.000 description 4
- 201000001883 cholelithiasis Diseases 0.000 description 4
- 238000004132 cross linking Methods 0.000 description 4
- 201000010099 disease Diseases 0.000 description 4
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 4
- 238000001879 gelation Methods 0.000 description 4
- 238000011065 in-situ storage Methods 0.000 description 4
- 229920002503 polyoxyethylene-polyoxypropylene Polymers 0.000 description 4
- 239000000047 product Substances 0.000 description 4
- 0 CC(*)(C(*C12C)O*C1(C)O)[C@@]2(C)OC Chemical compound CC(*)(C(*C12C)O*C1(C)O)[C@@]2(C)OC 0.000 description 3
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 3
- OVRNDRQMDRJTHS-UHFFFAOYSA-N N-acelyl-D-glucosamine Chemical group CC(=O)NC1C(O)OC(CO)C(O)C1O OVRNDRQMDRJTHS-UHFFFAOYSA-N 0.000 description 3
- MBLBDJOUHNCFQT-LXGUWJNJSA-N N-acetylglucosamine Chemical group CC(=O)N[C@@H](C=O)[C@@H](O)[C@H](O)[C@H](O)CO MBLBDJOUHNCFQT-LXGUWJNJSA-N 0.000 description 3
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- XTXRWKRVRITETP-UHFFFAOYSA-N Vinyl acetate Chemical compound CC(=O)OC=C XTXRWKRVRITETP-UHFFFAOYSA-N 0.000 description 3
- 239000002253 acid Substances 0.000 description 3
- 239000013078 crystal Substances 0.000 description 3
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 3
- 238000009826 distribution Methods 0.000 description 3
- 239000003814 drug Substances 0.000 description 3
- 239000003623 enhancer Substances 0.000 description 3
- 230000003301 hydrolyzing effect Effects 0.000 description 3
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 3
- 230000003993 interaction Effects 0.000 description 3
- 150000002500 ions Chemical class 0.000 description 3
- CXKWCBBOMKCUKX-UHFFFAOYSA-M methylene blue Chemical compound [Cl-].C1=CC(N(C)C)=CC2=[S+]C3=CC(N(C)C)=CC=C3N=C21 CXKWCBBOMKCUKX-UHFFFAOYSA-M 0.000 description 3
- 229960000907 methylthioninium chloride Drugs 0.000 description 3
- 210000000056 organ Anatomy 0.000 description 3
- 239000002953 phosphate buffered saline Substances 0.000 description 3
- 229920001993 poloxamer 188 Polymers 0.000 description 3
- 229940044519 poloxamer 188 Drugs 0.000 description 3
- 229920001282 polysaccharide Polymers 0.000 description 3
- 239000005017 polysaccharide Substances 0.000 description 3
- 150000004804 polysaccharides Chemical class 0.000 description 3
- 229920002689 polyvinyl acetate Polymers 0.000 description 3
- 239000011118 polyvinyl acetate Substances 0.000 description 3
- 239000011780 sodium chloride Substances 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- 239000007858 starting material Substances 0.000 description 3
- 230000003068 static effect Effects 0.000 description 3
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- OVRNDRQMDRJTHS-FMDGEEDCSA-N N-acetyl-beta-D-glucosamine Chemical group CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O OVRNDRQMDRJTHS-FMDGEEDCSA-N 0.000 description 2
- 206010070834 Sensitisation Diseases 0.000 description 2
- 240000008042 Zea mays Species 0.000 description 2
- 235000005824 Zea mays ssp. parviglumis Nutrition 0.000 description 2
- 235000002017 Zea mays subsp mays Nutrition 0.000 description 2
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 2
- 239000000853 adhesive Substances 0.000 description 2
- 230000001070 adhesive effect Effects 0.000 description 2
- 125000000129 anionic group Chemical group 0.000 description 2
- 229920006318 anionic polymer Polymers 0.000 description 2
- 230000009286 beneficial effect Effects 0.000 description 2
- 125000002091 cationic group Chemical group 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- 230000008602 contraction Effects 0.000 description 2
- 239000002872 contrast media Substances 0.000 description 2
- 235000005822 corn Nutrition 0.000 description 2
- 230000001419 dependent effect Effects 0.000 description 2
- 238000000605 extraction Methods 0.000 description 2
- 238000000855 fermentation Methods 0.000 description 2
- 230000004151 fermentation Effects 0.000 description 2
- 239000012530 fluid Substances 0.000 description 2
- 238000005194 fractionation Methods 0.000 description 2
- 230000006870 function Effects 0.000 description 2
- 238000005227 gel permeation chromatography Methods 0.000 description 2
- 238000001415 gene therapy Methods 0.000 description 2
- 239000008187 granular material Substances 0.000 description 2
- 229910052739 hydrogen Inorganic materials 0.000 description 2
- 239000001257 hydrogen Substances 0.000 description 2
- 230000007062 hydrolysis Effects 0.000 description 2
- 238000006460 hydrolysis reaction Methods 0.000 description 2
- 230000028993 immune response Effects 0.000 description 2
- 238000001727 in vivo Methods 0.000 description 2
- 230000001965 increasing effect Effects 0.000 description 2
- 229910052500 inorganic mineral Inorganic materials 0.000 description 2
- 210000000244 kidney pelvis Anatomy 0.000 description 2
- 230000001404 mediated effect Effects 0.000 description 2
- 239000011707 mineral Substances 0.000 description 2
- 229950006780 n-acetylglucosamine Drugs 0.000 description 2
- 230000037361 pathway Effects 0.000 description 2
- 238000005191 phase separation Methods 0.000 description 2
- 239000002504 physiological saline solution Substances 0.000 description 2
- 238000006116 polymerization reaction Methods 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 108090000623 proteins and genes Proteins 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- 238000011084 recovery Methods 0.000 description 2
- 230000008313 sensitization Effects 0.000 description 2
- 229910052567 struvite Inorganic materials 0.000 description 2
- 239000004094 surface-active agent Substances 0.000 description 2
- 229940124597 therapeutic agent Drugs 0.000 description 2
- 238000002604 ultrasonography Methods 0.000 description 2
- 229920003169 water-soluble polymer Polymers 0.000 description 2
- IAJILQKETJEXLJ-KKQCNMDGSA-N (2r,3r,4r,5s)-2,3,4,5-tetrahydroxy-6-oxohexanoic acid Chemical group O=C[C@@H](O)[C@H](O)[C@@H](O)[C@@H](O)C(O)=O IAJILQKETJEXLJ-KKQCNMDGSA-N 0.000 description 1
- JWYVGKFDLWWQJX-UHFFFAOYSA-N 1-ethenylazepan-2-one Chemical compound C=CN1CCCCCC1=O JWYVGKFDLWWQJX-UHFFFAOYSA-N 0.000 description 1
- SQDAZGGFXASXDW-UHFFFAOYSA-N 5-bromo-2-(trifluoromethoxy)pyridine Chemical compound FC(F)(F)OC1=CC=C(Br)C=N1 SQDAZGGFXASXDW-UHFFFAOYSA-N 0.000 description 1
- FHVDTGUDJYJELY-UHFFFAOYSA-N 6-{[2-carboxy-4,5-dihydroxy-6-(phosphanyloxy)oxan-3-yl]oxy}-4,5-dihydroxy-3-phosphanyloxane-2-carboxylic acid Chemical compound O1C(C(O)=O)C(P)C(O)C(O)C1OC1C(C(O)=O)OC(OP)C(O)C1O FHVDTGUDJYJELY-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 241001474374 Blennius Species 0.000 description 1
- 244000132059 Carica parviflora Species 0.000 description 1
- 235000014653 Carica parviflora Nutrition 0.000 description 1
- 229920001287 Chondroitin sulfate Polymers 0.000 description 1
- OABOXRPGTFRBFZ-IMJSIDKUSA-N Cys-Cys Chemical compound SC[C@H](N)C(=O)N[C@@H](CS)C(O)=O OABOXRPGTFRBFZ-IMJSIDKUSA-N 0.000 description 1
- LEVWYRKDKASIDU-QWWZWVQMSA-N D-cystine Chemical compound OC(=O)[C@H](N)CSSC[C@@H](N)C(O)=O LEVWYRKDKASIDU-QWWZWVQMSA-N 0.000 description 1
- SHZGCJCMOBCMKK-UHFFFAOYSA-N D-mannomethylose Natural products CC1OC(O)C(O)C(O)C1O SHZGCJCMOBCMKK-UHFFFAOYSA-N 0.000 description 1
- 229920000045 Dermatan sulfate Polymers 0.000 description 1
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical compound NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 1
- 102000010834 Extracellular Matrix Proteins Human genes 0.000 description 1
- 108010037362 Extracellular Matrix Proteins Proteins 0.000 description 1
- GYHNNYVSQQEPJS-UHFFFAOYSA-N Gallium Chemical compound [Ga] GYHNNYVSQQEPJS-UHFFFAOYSA-N 0.000 description 1
- 229920002683 Glycosaminoglycan Polymers 0.000 description 1
- 229920002971 Heparan sulfate Polymers 0.000 description 1
- 238000012404 In vitro experiment Methods 0.000 description 1
- SHZGCJCMOBCMKK-JFNONXLTSA-N L-rhamnopyranose Chemical compound C[C@@H]1OC(O)[C@H](O)[C@H](O)[C@H]1O SHZGCJCMOBCMKK-JFNONXLTSA-N 0.000 description 1
- PNNNRSAQSRJVSB-UHFFFAOYSA-N L-rhamnose Natural products CC(O)C(O)C(O)C(O)C=O PNNNRSAQSRJVSB-UHFFFAOYSA-N 0.000 description 1
- 208000015924 Lithiasis Diseases 0.000 description 1
- BAQCROVBDNBEEB-UBYUBLNFSA-N Metrizamide Chemical compound CC(=O)N(C)C1=C(I)C(NC(C)=O)=C(I)C(C(=O)N[C@@H]2[C@H]([C@H](O)[C@@H](CO)OC2O)O)=C1I BAQCROVBDNBEEB-UBYUBLNFSA-N 0.000 description 1
- 125000003047 N-acetyl group Chemical group 0.000 description 1
- OVRNDRQMDRJTHS-RTRLPJTCSA-N N-acetyl-D-glucosamine Chemical compound CC(=O)N[C@H]1C(O)O[C@H](CO)[C@@H](O)[C@@H]1O OVRNDRQMDRJTHS-RTRLPJTCSA-N 0.000 description 1
- MBBZMMPHUWSWHV-BDVNFPICSA-N N-methylglucamine Chemical compound CNC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO MBBZMMPHUWSWHV-BDVNFPICSA-N 0.000 description 1
- 229930182473 O-glycoside Natural products 0.000 description 1
- 150000008444 O-glycosides Chemical class 0.000 description 1
- 241000199919 Phaeophyceae Species 0.000 description 1
- BQCADISMDOOEFD-UHFFFAOYSA-N Silver Chemical compound [Ag] BQCADISMDOOEFD-UHFFFAOYSA-N 0.000 description 1
- 241000790234 Sphingomonas elodea Species 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- RTAQQCXQSZGOHL-UHFFFAOYSA-N Titanium Chemical compound [Ti] RTAQQCXQSZGOHL-UHFFFAOYSA-N 0.000 description 1
- 208000004608 Ureteral Obstruction Diseases 0.000 description 1
- LEHOTFFKMJEONL-UHFFFAOYSA-N Uric Acid Chemical compound N1C(=O)NC(=O)C2=C1NC(=O)N2 LEHOTFFKMJEONL-UHFFFAOYSA-N 0.000 description 1
- TVWHNULVHGKJHS-UHFFFAOYSA-N Uric acid Natural products N1C(=O)NC(=O)C2NC(=O)NC21 TVWHNULVHGKJHS-UHFFFAOYSA-N 0.000 description 1
- 208000006568 Urinary Bladder Calculi Diseases 0.000 description 1
- 208000009911 Urinary Calculi Diseases 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 231100000460 acute oral toxicity Toxicity 0.000 description 1
- 125000002252 acyl group Chemical group 0.000 description 1
- 230000006978 adaptation Effects 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 229940072056 alginate Drugs 0.000 description 1
- AVJBPWGFOQAPRH-FWMKGIEWSA-N alpha-L-IdopA-(1->3)-beta-D-GalpNAc4S Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@H](OS(O)(=O)=O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O)[C@H](C(O)=O)O1 AVJBPWGFOQAPRH-FWMKGIEWSA-N 0.000 description 1
- MXZRMHIULZDAKC-UHFFFAOYSA-L ammonium magnesium phosphate Chemical compound [NH4+].[Mg+2].[O-]P([O-])([O-])=O MXZRMHIULZDAKC-UHFFFAOYSA-L 0.000 description 1
- CKMXBZGNNVIXHC-UHFFFAOYSA-L ammonium magnesium phosphate hexahydrate Chemical compound [NH4+].O.O.O.O.O.O.[Mg+2].[O-]P([O-])([O-])=O CKMXBZGNNVIXHC-UHFFFAOYSA-L 0.000 description 1
- 230000003444 anaesthetic effect Effects 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 210000001367 artery Anatomy 0.000 description 1
- 239000002969 artificial stone Substances 0.000 description 1
- 159000000009 barium salts Chemical class 0.000 description 1
- AEMOLEFTQBMNLQ-UHFFFAOYSA-N beta-D-galactopyranuronic acid Natural products OC1OC(C(O)=O)C(O)C(O)C1O AEMOLEFTQBMNLQ-UHFFFAOYSA-N 0.000 description 1
- 210000000941 bile Anatomy 0.000 description 1
- 210000000013 bile duct Anatomy 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 239000012620 biological material Substances 0.000 description 1
- 230000000740 bleeding effect Effects 0.000 description 1
- 229920005605 branched copolymer Polymers 0.000 description 1
- 244000309464 bull Species 0.000 description 1
- QXDMQSPYEZFLGF-UHFFFAOYSA-L calcium oxalate Chemical compound [Ca+2].[O-]C(=O)C([O-])=O QXDMQSPYEZFLGF-UHFFFAOYSA-L 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- 159000000007 calcium salts Chemical class 0.000 description 1
- OSGAYBCDTDRGGQ-UHFFFAOYSA-L calcium sulfate Inorganic materials [Ca+2].[O-]S([O-])(=O)=O OSGAYBCDTDRGGQ-UHFFFAOYSA-L 0.000 description 1
- ZOMBKNNSYQHRCA-UHFFFAOYSA-J calcium sulfate hemihydrate Chemical compound O.[Ca+2].[Ca+2].[O-]S([O-])(=O)=O.[O-]S([O-])(=O)=O ZOMBKNNSYQHRCA-UHFFFAOYSA-J 0.000 description 1
- 239000001569 carbon dioxide Substances 0.000 description 1
- 229910002092 carbon dioxide Inorganic materials 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 1
- 229920006317 cationic polymer Polymers 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 229940059329 chondroitin sulfate Drugs 0.000 description 1
- 230000007665 chronic toxicity Effects 0.000 description 1
- 231100000160 chronic toxicity Toxicity 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 239000003431 cross linking reagent Substances 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 108010004073 cysteinylcysteine Proteins 0.000 description 1
- 229960003067 cystine Drugs 0.000 description 1
- AEMOLEFTQBMNLQ-YBSDWZGDSA-N d-mannuronic acid Chemical compound O[C@@H]1O[C@@H](C(O)=O)[C@H](O)[C@@H](O)[C@H]1O AEMOLEFTQBMNLQ-YBSDWZGDSA-N 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000007682 dermal toxicity Effects 0.000 description 1
- 229940051593 dermatan sulfate Drugs 0.000 description 1
- 235000005911 diet Nutrition 0.000 description 1
- 230000037213 diet Effects 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 239000000539 dimer Substances 0.000 description 1
- 125000000600 disaccharide group Chemical group 0.000 description 1
- 238000007922 dissolution test Methods 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 238000012377 drug delivery Methods 0.000 description 1
- 210000001198 duodenum Anatomy 0.000 description 1
- 230000002526 effect on cardiovascular system Effects 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 210000002744 extracellular matrix Anatomy 0.000 description 1
- 238000001125 extrusion Methods 0.000 description 1
- 239000000835 fiber Substances 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 238000002594 fluoroscopy Methods 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 235000013373 food additive Nutrition 0.000 description 1
- 239000002778 food additive Substances 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 229910052733 gallium Inorganic materials 0.000 description 1
- 210000001035 gastrointestinal tract Anatomy 0.000 description 1
- 235000010492 gellan gum Nutrition 0.000 description 1
- 239000000216 gellan gum Substances 0.000 description 1
- 238000001476 gene delivery Methods 0.000 description 1
- 125000002791 glucosyl group Chemical group C1([C@H](O)[C@@H](O)[C@H](O)[C@H](O1)CO)* 0.000 description 1
- 125000003976 glyceryl group Chemical group [H]C([*])([H])C(O[H])([H])C(O[H])([H])[H] 0.000 description 1
- 150000002334 glycols Chemical class 0.000 description 1
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 1
- 229910052737 gold Inorganic materials 0.000 description 1
- 239000010931 gold Substances 0.000 description 1
- 239000010440 gypsum Substances 0.000 description 1
- 229910052602 gypsum Inorganic materials 0.000 description 1
- 239000011507 gypsum plaster Substances 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 229930195733 hydrocarbon Natural products 0.000 description 1
- 150000002430 hydrocarbons Chemical class 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- NTHXOOBQLCIOLC-UHFFFAOYSA-N iohexol Chemical compound OCC(O)CN(C(=O)C)C1=C(I)C(C(=O)NCC(O)CO)=C(I)C(C(=O)NCC(O)CO)=C1I NTHXOOBQLCIOLC-UHFFFAOYSA-N 0.000 description 1
- 238000005342 ion exchange Methods 0.000 description 1
- XQZXYNRDCRIARQ-LURJTMIESA-N iopamidol Chemical compound C[C@H](O)C(=O)NC1=C(I)C(C(=O)NC(CO)CO)=C(I)C(C(=O)NC(CO)CO)=C1I XQZXYNRDCRIARQ-LURJTMIESA-N 0.000 description 1
- 229960004647 iopamidol Drugs 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 238000007273 lactonization reaction Methods 0.000 description 1
- 229920005684 linear copolymer Polymers 0.000 description 1
- 239000007791 liquid phase Substances 0.000 description 1
- 239000013541 low molecular weight contaminant Substances 0.000 description 1
- 239000013627 low molecular weight specie Substances 0.000 description 1
- 231100000053 low toxicity Toxicity 0.000 description 1
- 159000000003 magnesium salts Chemical class 0.000 description 1
- 229960003194 meglumine Drugs 0.000 description 1
- 230000037353 metabolic pathway Effects 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 229910044991 metal oxide Inorganic materials 0.000 description 1
- 150000004706 metal oxides Chemical class 0.000 description 1
- 150000002739 metals Chemical class 0.000 description 1
- 229960000554 metrizamide Drugs 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- 239000005445 natural material Substances 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- TWNQGVIAIRXVLR-UHFFFAOYSA-N oxo(oxoalumanyloxy)alumane Chemical compound O=[Al]O[Al]=O TWNQGVIAIRXVLR-UHFFFAOYSA-N 0.000 description 1
- RVTZCBVAJQQJTK-UHFFFAOYSA-N oxygen(2-);zirconium(4+) Chemical compound [O-2].[O-2].[Zr+4] RVTZCBVAJQQJTK-UHFFFAOYSA-N 0.000 description 1
- 230000000704 physical effect Effects 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920003213 poly(N-isopropyl acrylamide) Polymers 0.000 description 1
- 229920002432 poly(vinyl methyl ether) polymer Polymers 0.000 description 1
- 229920000570 polyether Polymers 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 229920005862 polyol Polymers 0.000 description 1
- 150000003077 polyols Chemical class 0.000 description 1
- 229920001290 polyvinyl ester Polymers 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 230000035485 pulse pressure Effects 0.000 description 1
- 238000002601 radiography Methods 0.000 description 1
- 230000002829 reductive effect Effects 0.000 description 1
- 230000004043 responsiveness Effects 0.000 description 1
- 238000000518 rheometry Methods 0.000 description 1
- 230000001020 rhythmical effect Effects 0.000 description 1
- 210000001581 salivary duct Anatomy 0.000 description 1
- 238000007127 saponification reaction Methods 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 230000035939 shock Effects 0.000 description 1
- 238000004904 shortening Methods 0.000 description 1
- 229910052709 silver Inorganic materials 0.000 description 1
- 239000004332 silver Substances 0.000 description 1
- 231100000438 skin toxicity Toxicity 0.000 description 1
- 239000010802 sludge Substances 0.000 description 1
- 229940083542 sodium Drugs 0.000 description 1
- SJOULNBNMIRTRG-UHFFFAOYSA-M sodium;3-acetamido-5-(acetamidomethyl)-2,4,6-triiodobenzoate Chemical compound [Na+].CC(=O)NCC1=C(I)C(NC(C)=O)=C(I)C(C([O-])=O)=C1I SJOULNBNMIRTRG-UHFFFAOYSA-M 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 229910001220 stainless steel Inorganic materials 0.000 description 1
- 239000010935 stainless steel Substances 0.000 description 1
- 230000007666 subchronic toxicity Effects 0.000 description 1
- 231100000195 subchronic toxicity Toxicity 0.000 description 1
- 238000000194 supercritical-fluid extraction Methods 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 229920003002 synthetic resin Polymers 0.000 description 1
- 239000000057 synthetic resin Substances 0.000 description 1
- 230000009897 systematic effect Effects 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 150000004044 tetrasaccharides Chemical class 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- 229920001169 thermoplastic Polymers 0.000 description 1
- 239000004416 thermosoftening plastic Substances 0.000 description 1
- 230000009974 thixotropic effect Effects 0.000 description 1
- 230000000451 tissue damage Effects 0.000 description 1
- 231100000827 tissue damage Toxicity 0.000 description 1
- 229910052719 titanium Inorganic materials 0.000 description 1
- 239000010936 titanium Substances 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- 241000701161 unidentified adenovirus Species 0.000 description 1
- 229940116269 uric acid Drugs 0.000 description 1
- 208000008281 urolithiasis Diseases 0.000 description 1
- 210000004509 vascular smooth muscle cell Anatomy 0.000 description 1
- 210000003462 vein Anatomy 0.000 description 1
- 229920001567 vinyl ester resin Polymers 0.000 description 1
- 229910001928 zirconium oxide Inorganic materials 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/22—Implements for squeezing-off ulcers or the like on the inside of inner organs of the body; Implements for scraping-out cavities of body organs, e.g. bones; Calculus removers; Calculus smashing apparatus; Apparatus for removing obstructions in blood vessels, not otherwise provided for
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/32—Surgical cutting instruments
- A61B17/3205—Excision instruments
- A61B17/32056—Surgical snare instruments
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/10—Alcohols; Phenols; Salts thereof, e.g. glycerol; Polyethylene glycols [PEG]; Poloxamers; PEG/POE alkyl ethers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/36—Polysaccharides; Derivatives thereof, e.g. gums, starch, alginate, dextrin, hyaluronic acid, chitosan, inulin, agar or pectin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K49/00—Preparations for testing in vivo
- A61K49/0002—General or multifunctional contrast agents, e.g. chelated agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0053—Mouth and digestive tract, i.e. intraoral and peroral administration
- A61K9/0068—Rumen, e.g. rumen bolus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L24/00—Surgical adhesives or cements; Adhesives for colostomy devices
- A61L24/001—Use of materials characterised by their function or physical properties
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L24/00—Surgical adhesives or cements; Adhesives for colostomy devices
- A61L24/04—Surgical adhesives or cements; Adhesives for colostomy devices containing macromolecular materials
- A61L24/046—Surgical adhesives or cements; Adhesives for colostomy devices containing macromolecular materials obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/18—Drugs for disorders of the alimentary tract or the digestive system for pancreatic disorders, e.g. pancreatic enzymes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/04—Drugs for disorders of the urinary system for urolithiasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L71/00—Compositions of polyethers obtained by reactions forming an ether link in the main chain; Compositions of derivatives of such polymers
- C08L71/02—Polyalkylene oxides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B2017/00743—Type of operation; Specification of treatment sites
- A61B2017/00818—Treatment of the gastro-intestinal system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B2017/00831—Material properties
- A61B2017/0084—Material properties low friction
- A61B2017/00849—Material properties low friction with respect to tissue, e.g. hollow organs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B2017/00831—Material properties
- A61B2017/00853—Material properties low friction, hydrophobic and corrosion-resistant fluorocarbon resin coating (ptf, ptfe, polytetrafluoroethylene)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/22—Implements for squeezing-off ulcers or the like on the inside of inner organs of the body; Implements for scraping-out cavities of body organs, e.g. bones; Calculus removers; Calculus smashing apparatus; Apparatus for removing obstructions in blood vessels, not otherwise provided for
- A61B2017/22037—Fecal impaction removal
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/22—Implements for squeezing-off ulcers or the like on the inside of inner organs of the body; Implements for scraping-out cavities of body organs, e.g. bones; Calculus removers; Calculus smashing apparatus; Apparatus for removing obstructions in blood vessels, not otherwise provided for
- A61B2017/22082—Implements for squeezing-off ulcers or the like on the inside of inner organs of the body; Implements for scraping-out cavities of body organs, e.g. bones; Calculus removers; Calculus smashing apparatus; Apparatus for removing obstructions in blood vessels, not otherwise provided for after introduction of a substance
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B18/00—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body
- A61B2018/00315—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body for treatment of particular body parts
- A61B2018/00482—Digestive system
- A61B2018/005—Rectum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B18/00—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body
- A61B2018/00315—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body for treatment of particular body parts
- A61B2018/00505—Urinary tract
- A61B2018/00511—Kidney
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2400/00—Materials characterised by their function or physical properties
- A61L2400/06—Flowable or injectable implant compositions
Description
便宜のため、本明細書、実施例、および添付の特許請求の範囲で用いられている特定の用語を以下にまとめる。
結石は、腎臓、膵臓、尿管および胆嚢など、身体の特定部分で発現する。生体結石が、特にそれらが鉱物塩から成る場合に、石と称されることは珍しくない。例えば、胆管系で形成された結石は胆石と呼ばれる。膀胱で生じるものは、多くの場合、膀胱結石として知られている。腎臓に生じる結石は、しばしば腎結石と呼ばれる。結石は、また、尿管にも生じることがある;そこでは、それらは通常、腎臓に由来する結石の不完全な通過の結果である。唾液管または唾液腺に結石が観察される可能性もある。
ある実施形態では、ポリマープラグは、温度、pH変化および/またはイオン相互作用などの1つまたはそれ以上の物理的現象によって原位置(in situ)で生成される。他の実施形態では、本発明の方法に用いられるポリマーは、架橋可能なポリマーである。ある実施形態では、原位置で生成されるポリマープラグは、組織に対して非粘着性の物質である。
本発明は、結石症の治療方法を提供する。1つの実施態様では、管腔の入り口と管腔内の結石との間にポリマーを注入し、管腔を塞ぐポリマープラグを形成する;その後のぜん動運動によって、ポリマープラグが管腔内を進行し、結石を管腔外へと押し出す。
必要に応じて、前記管腔内の前記結石から上流の第2の位置に第2組成物を注入し、その際に前記第2組成物は前記結石と接触せず;その結果、ポリマープラグを形成する;さらに、前記ポリマープラグがぜん動運動によって前記管腔内を進行し、それによって前記結石を前記管腔の外へと押し進める、各工程を含む。
第2組成物を前記結石から上流へ第2の距離を離して前記管腔内に注入し、その際に該第2組成物は前記結石と接触せず;そこで第1組成物と第2組成物が混合され、その結果、ポリマープラグを形成し;
必要に応じて、第3組成物を前記結石から上流へ第3の距離を離して前記管腔内に注入し、その際に該第3組成物は前記結石と接触せず;
さらに、ぜん動運動によって前記ポリマープラグが前記管腔内を進行し、それによって前記結石を前記管腔から押し出す、各工程を含む。
ポリマーをプラスチックチューブに量り取った。所望の濃度を達成するために、25重量%(w%)に関して4を、20質量%(w%)に関して5をその質量に掛け、さらに生理食塩水を加えることによって所望の最終質量を達成した。溶液を4℃の冷蔵庫に置き、通常24時間以内に準備ができた。ゲル化点はブルックフィールド(Brookfield)粘度計での測定値であり、その粘度がプレート/コーン(plate/corn)の範囲(>102Pa・s(102,000cP))を越えた点をゲル化温度とした。
精製ポリマーを50mLの遠心チューブに量り取り、生理食塩水と100%のオムニパーク(Omnipaque)300との1:1混合物を特定の質量%に達するまで加えた。ゲル化点をブルックフィールド(Brookfield)粘度計で測定し、その粘度がプレート/コーン(plate/corn)の範囲を越えた(約102Pa・s(102,000cP)を超えた)点をゲル化温度とした。全ての溶液を37℃にまでさらに加熱し、物質がその粘度範囲を依然として上回り、かつ、ゲルの状態を保っていることを確認した。すべてのゲルが合格であった。
精製ポロキサマー407ゲルの溶解性について、0.5mlのゲルを37℃の生理食塩水で覆ったペトリ皿に注入し、試験を行った。ゲルにメチレンブルーを少量加えて可視化し、ゲルの溶解について視覚的に追跡した。溶解試験には、表面積が最小である球状;および、表面積が最大であるひも状;の2種類の形状のゲルが用いられ、その際、20ゲージのシリンジを用いて、ひも状のポリマーをペトリ皿の底に押し出した。
22.5%の精製されたポロキサマー407ゲルの溶解について、2.5mlのゲルを37℃の尿約100mlで覆ったペトリ皿に注入し、試験を行った。針のないシリンジを用いて、ひも状のポリマーをペトリ皿の底に押し出した。ゲルにメチレンブルーを少量加えて可視化し、ゲルの溶解について視覚的に追った。押し出しの際に、ひも状のポリマーは二つに折れた。ペトリ皿を静置し、ペトリ皿を毎分、視覚的に観察し、ペトリ皿を旋回させて完全に溶解したことを確認した。完全溶解に要した時間(約26分)は、2つのひも状のポリマーでまったく同じであった。
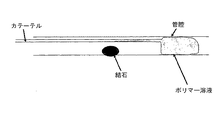
Medallion 5mlシリンジを用いてメチレンブルーで着色した、22.5重量%の精製ポロキサマーPF127を用いた。3匹の各ブタに、焼石膏(Plaster of Paris)でできた人造石を、切開部の2,3センチ上の右の尿管に外科的に移植した。次に、3Fのカテーテル(BioSphere Medical社製のEmbocath HIC 100、ロット# 03W-6930)で、同一の切開部から溶液を石の後方に注入した。注入の直前に、カテーテルに10ccの冷生理食塩水を流し、注入の間、カテーテルを冷えた状態に保ち、ポリマーがカテーテル内で硬化するのを回避した。各方法を、石と切開部の間の尿管に挿入したカメラでモニタした。
本明細書に記載される全ての米国特許および米国特許出願公開を、引用することによって本明細書に援用する。
当業者は、日常的な実験以上のものを用いることなく、本明細書に記載されている本発明の特定の実施形態の多くの等価物を確認できることを認識するであろう。そのような等価物は、添付の特許請求の範囲に含まれることが意図されている。
Claims (37)
- 破砕術によらないで結石症を治療するための組成物であって、逆熱応答性ポリマーを含有する第1組成物を含み、該第1組成物が、結石と接触しないように結石から上流へ所定の距離を離して哺乳類の管腔内に注入されてポリマープラグを形成し、該ポリマープラグがぜん動運動によって管腔内を進行し、それによって結石が管腔から押し出され、その際に破砕術が施されないことを特徴とする組成物。
- 前記逆熱応答性ポリマーが、ブロック共重合体、ランダム共重合体、グラフト重合体、または分岐鎖共重合体であることを特徴とする請求項1記載の組成物。
- 前記逆熱応答性ポリマーが、ブロック共重合体、または分岐鎖共重合体であることを特徴とする請求項2記載の組成物。
- 前記逆熱応答性ポリマーが、精製されたまたは精製されていないポロキサマーまたはポロキサミンであることを特徴とする請求項1記載の組成物。
- 前記逆熱応答性ポリマーが、精製されたまたは精製されていないポロキサミン1107、ポロキサミン1307、ポロキサマー338およびポロキサマー407より成る群から選択されることを特徴とする請求項4記載の組成物。
- 前記逆熱応答性ポリマーが、精製されたまたは精製されていないポロキサマー407であることを特徴とする請求項5記載の組成物。
- 前記第1組成物が、10℃〜40℃の転移温度を有することを特徴とする請求項1から6いずれか1項記載の組成物。
- 前記第1組成物が、15℃〜30℃の転移温度を有することを特徴とする請求項7記載の組成物。
- 前記第1組成物が、5%〜30%の前記逆熱応答性ポリマーを含むことを特徴とする請求項1から8いずれか1項記載の組成物。
- 前記第1組成物が、10%〜25%の前記逆熱応答性ポリマーを含むことを特徴とする請求項9記載の組成物。
- 前記逆熱応答性ポリマーが、1.5〜1.0の多分散指数を有することを特徴とする請求項1から10いずれか1項記載の組成物。
- 前記逆熱応答性ポリマーが、精製されたまたは精製されていないポロキサマーまたはポロキサミンであり、かつ、前記第1組成物が10℃〜40℃の転移温度を有することを特徴とする請求項1記載の組成物。
- 前記逆熱応答性ポリマーが、精製されたまたは精製されていないポロキサマーまたはポロキサミンであり、かつ、前記第1組成物が15℃〜30℃の転移温度を有することを特徴とする請求項1記載の組成物。
- 破砕術によらないで結石症を治療するための組成物であって、
架橋性ポリマーを含有する第1溶液と、リン酸塩、クエン酸塩、ホウ酸塩、コハク酸塩、マレイン酸塩、アジピン酸塩、シュウ酸塩、カルシウム、マグネシウム、バリウム、ストロンチウムまたはそれらの組合せを含有する第2溶液とを含む第1組成物を含み、該第1溶液および第2溶液がそれぞれ、結石と接触しないように結石から上流へ所定の距離を離して哺乳類の管腔内に注入され、第1溶液と第2溶液とが混合されてポリマープラグを形成し、該ポリマープラグがぜん動運動によって管腔内を進行し、それによって結石が管腔から押し出され、その際に破砕術が施されないことを特徴とする組成物。 - 前記第1溶液が、アルギン酸、アルギン酸ナトリウム、アルギン酸カリウム、ジェランナトリウム、ジェランカリウム、カルボキシメチルセルロース、ヒアルロン酸およびポリビニルアルコールから選択されるポリマーを含むことを特徴とする請求項14記載の組成物。
- 前記第1溶液が、アルギン酸、アルギン酸ナトリウム、アルギン酸カリウム、ジェランナトリウムおよびジェランカリウムからなる群より選択されるポリマーを含み;前記第2溶液が、カルシウム、マグネシウム、またはバリウムを含むことを特徴とする請求項14記載の組成物。
- 前記第1溶液が、アルギン酸、アルギン酸ナトリウムまたはアルギン酸カリウムからなる群より選択されるポリマーを含み、前記第2溶液がカルシウムを含むことを特徴とする請求項14記載の組成物。
- 前記第1溶液が、ジェランナトリウムおよびジェランカリウムからなる群より選択されるポリマーを含み、前記第2溶液がマグネシウムを含むことを特徴とする請求項14記載の組成物。
- 前記第1溶液がヒアルロン酸を含み、前記第2溶液がカルシウムを含むことを特徴とする請求項14記載の組成物。
- 前記第1溶液がポリビニルアルコールを含み、前記第2溶液がホウ酸塩を含むことを特徴とする請求項14記載の組成物。
- 前記第1組成物が、結石よりも1cm〜5cm上流の位置に注入されることを特徴とする請求項1から20いずれか1項記載の組成物。
- 前記第1組成物が、結石よりも2cm〜4cm上流の位置に注入されることを特徴とする請求項21記載の組成物。
- 前記第1組成物が、結石よりも3cm上流の位置に注入されることを特徴とする請求項22記載の組成物。
- コントラスト増強剤を含有する第2組成物をさらに含み、該第2組成物が、前記結石と接触しないように結石から上流へ所定の距離を離して前記管腔内に注入されることを特徴とする請求項1から23いずれか1項記載の組成物。
- 前記コントラスト増強剤が、放射線不透過性物質、常磁性体、重原子、遷移金属、ランタニド、アクチニド、色素および放射性核種含有物質より成る群から選択されることを特徴とする請求項24記載の組成物。
- 前記第1組成物の注入位置と前記第2組成物の注入位置の間隔が、3mm未満であることを特徴とする請求項24または25記載の組成物。
- 前記第1組成物の注入位置と前記第2組成物の注入位置の間隔が、1mm未満であることを特徴とする請求項26記載の組成物。
- 前記第1組成物の注入位置と前記第2組成物の注入位置の間隔が、0.5mm未満であることを特徴とする請求項27記載の組成物。
- 前記第1組成物の注入位置と前記第2組成物の注入位置の間隔が、0.1mm未満であることを特徴とする請求項28記載の組成物。
- 前記第1組成物が、経皮的アクセスデバイスを介して前記管腔内に注入されることを特徴とする請求項1から29いずれか1項記載の組成物。
- 前記第1組成物が、カテーテルまたはシリンジを介して前記管腔内に注入されることを特徴とする請求項1から29いずれか1項記載の組成物。
- 前記カテーテルが、ダブルルーメンカテーテルまたはトリプルルーメンカテーテルであることを特徴とする請求項31記載の組成物。
- 前記管腔が、腎臓、胆嚢、尿管、膀胱、膵臓、唾液腺、小腸または大腸であるか、あるいはその一部分であることを特徴とする請求項1から32いずれか1項記載の組成物。
- 前記管腔が、尿管または腎臓であるか、あるいはその一部分であることを特徴とする請求項33記載の組成物。
- 前記結石が、腎結石、膵石、唾石または胆石であることを特徴とする請求項1から32いずれか1項記載の組成物。
- 前記結石が、腎結石であることを特徴とする請求項35記載の組成物。
- 前記哺乳類がヒトであることを特徴とする請求項1から36いずれか1項記載の組成物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US67675705P | 2005-05-02 | 2005-05-02 | |
| US60/676,757 | 2005-05-02 | ||
| PCT/US2006/016208 WO2006119009A1 (en) | 2005-05-02 | 2006-04-27 | Non-lithotripsic kidney-stone therapy |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013066253A Division JP2013172971A (ja) | 2005-05-02 | 2013-03-27 | 結石破砕によらない腎結石の治療方法 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2008539869A JP2008539869A (ja) | 2008-11-20 |
| JP2008539869A5 JP2008539869A5 (ja) | 2009-06-25 |
| JP5646813B2 true JP5646813B2 (ja) | 2014-12-24 |
Family
ID=36928585
Family Applications (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008510072A Active JP5646813B2 (ja) | 2005-05-02 | 2006-04-27 | 結石破砕によらない腎結石の治療方法 |
| JP2013066253A Pending JP2013172971A (ja) | 2005-05-02 | 2013-03-27 | 結石破砕によらない腎結石の治療方法 |
| JP2015112997A Expired - Fee Related JP6076404B2 (ja) | 2005-05-02 | 2015-06-03 | 破砕術によらない結石症の治療のための組成物 |
| JP2016228021A Pending JP2017070768A (ja) | 2005-05-02 | 2016-11-24 | 破砕術によらない結石症の治療のための組成物 |
Family Applications After (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013066253A Pending JP2013172971A (ja) | 2005-05-02 | 2013-03-27 | 結石破砕によらない腎結石の治療方法 |
| JP2015112997A Expired - Fee Related JP6076404B2 (ja) | 2005-05-02 | 2015-06-03 | 破砕術によらない結石症の治療のための組成物 |
| JP2016228021A Pending JP2017070768A (ja) | 2005-05-02 | 2016-11-24 | 破砕術によらない結石症の治療のための組成物 |
Country Status (16)
| Country | Link |
|---|---|
| US (4) | US8361455B2 (ja) |
| EP (3) | EP2857041B9 (ja) |
| JP (4) | JP5646813B2 (ja) |
| KR (3) | KR20080033159A (ja) |
| CN (2) | CN101237887A (ja) |
| AU (1) | AU2006242509B2 (ja) |
| BR (1) | BRPI0611278A2 (ja) |
| CA (4) | CA2900229A1 (ja) |
| DK (2) | DK1877096T3 (ja) |
| ES (2) | ES2529130T3 (ja) |
| HK (1) | HK1205935A1 (ja) |
| MX (1) | MX2007013827A (ja) |
| PL (2) | PL1877096T3 (ja) |
| PT (2) | PT1877096E (ja) |
| SI (2) | SI1877096T1 (ja) |
| WO (1) | WO2006119009A1 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2015163273A (ja) * | 2005-05-02 | 2015-09-10 | ジェンザイム・コーポレーション | 破砕術によらない結石症の治療のための組成物 |
Families Citing this family (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20050143678A1 (en) | 2003-10-14 | 2005-06-30 | Pluromed, Inc. | Confinement of kidney-stone fragments during lithotripsy |
| US8062282B2 (en) * | 2006-02-13 | 2011-11-22 | Fossa Medical, Inc. | Methods and apparatus for temporarily occluding body openings |
| JP2009540965A (ja) | 2006-06-21 | 2009-11-26 | ザ ボード オブ トラスティーズ オブ ザ レランド スタンフォード ジュニア ユニバーシティー | 非結合管腔を接合するための組成物および方法 |
| US8608760B2 (en) * | 2006-06-21 | 2013-12-17 | The Board Of Trustees Of The Leland Stanford Junior University | Compositions and methods for joining non-conjoined lumens |
| US8197499B2 (en) | 2006-06-21 | 2012-06-12 | The Board Of Trustees Of The Leland Stanford Junior University | Compositions and methods for joining non-conjoined lumens |
| CN106236181A (zh) * | 2006-09-29 | 2016-12-21 | 普拉罗美德公司 | 碎石术期间预防结石和结石碎片后退的方法 |
| EP2094169A4 (en) * | 2006-12-11 | 2016-05-04 | Pluromed Inc | HEMOSTASIS OF PERFUSED ORGANS |
| KR20150032348A (ko) * | 2007-02-22 | 2015-03-25 | 플루로메드, 인코포레이티드 | 수술후 생물학적 유체 흐름을 제어하기 위한 역 감열 폴리머의 용도 |
| CN107029277A (zh) * | 2007-11-29 | 2017-08-11 | 健赞公司 | 使用纯化的逆向热敏聚合物的内镜粘膜切除 |
| US8172861B2 (en) * | 2007-12-20 | 2012-05-08 | Tautona Group, L.P. | Compositions and methods for joining non-conjoined lumens |
| US8563037B2 (en) * | 2009-02-06 | 2013-10-22 | Tautona Group, L.P. | Compositions and methods for joining non-conjoined lumens |
| WO2011085424A1 (de) * | 2010-01-13 | 2011-07-21 | Georg Bischof | Zusammensetzung zur erzeugung einer temporären darmokklusion |
| DE202013012275U1 (de) | 2013-04-23 | 2015-12-18 | Fraunhofer-Gesellschaft zur Förderung der angewandten Forschung e.V. | Kit zum Herstellen eines vernetzten Gels zum Umschließen von Nierensteinen und/oder Nierensteinfragmenten |
| EP2796101B1 (de) | 2013-04-23 | 2016-04-20 | Fraunhofer-Gesellschaft zur Förderung der angewandten Forschung e.V. | Kit zum Herstellen eines vernetzten Gels zum Umschließen von Nierensteinen und/oder Nierensteinfragmenten |
| ES2577102T3 (es) | 2013-04-23 | 2016-07-13 | Fraunhofer-Gesellschaft zur Förderung der angewandten Forschung e.V. | Sistema gelificante para eliminar fragmentos de cálculos renales |
| DE202013012287U1 (de) | 2013-04-23 | 2016-01-18 | Fraunhofer-Gesellschaft zur Förderung der angewandten Forschung e.V. | Gelbildendes System zum Entfernen von Nierensteinfragmenten |
| US10076537B2 (en) | 2014-05-02 | 2018-09-18 | Arthrodynamic Holdings, Llc | Glycosaminoglycan composition and method of use for kidney stone removal |
| CN106264642B (zh) * | 2016-07-27 | 2019-06-28 | 湖南瑞邦医疗科技发展有限公司 | 一次性使用温控液体凝胶封堵导管 |
| AU2019250128A1 (en) | 2018-10-15 | 2020-04-30 | Avent Inc. | Compositions, systems, kits, and methods for neural ablation |
| US11576744B2 (en) * | 2021-03-25 | 2023-02-14 | The Regents Of The University Of California | Thermosensitive bio-adhesive hydrogel for removal of ureteral and renal stones |
Family Cites Families (52)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4308905A (en) | 1980-03-24 | 1982-01-05 | Nancy Gallagher | Cover for air conditioner |
| US4608979A (en) * | 1984-02-22 | 1986-09-02 | Washington Research Foundation | Apparatus for the noninvasive shock fragmentation of renal calculi |
| JPS6116735A (ja) | 1984-07-03 | 1986-01-24 | 京都府 | 結石破砕装置 |
| DE3506873A1 (de) | 1985-02-27 | 1986-08-28 | Farco-Pharma GmbH, 5000 Köln | System zum auffangen von bruchstuecken, die anfallen beim zerkleinern von steinen in koerperhoehlen lebender menschen und warmbluetiger tiere |
| EP0200668A3 (en) * | 1985-04-25 | 1988-03-09 | FOGARTY, Thomas J. | Apparatus and method for dislodging and removing occlusive objects from body passages |
| US4781677A (en) | 1985-07-17 | 1988-11-01 | Wilcox Gilbert M | Method of treatment utilizing a double balloon nasobiliary occlusion catheter |
| US5567859A (en) | 1991-03-19 | 1996-10-22 | Cytrx Corporation | Polyoxypropylene/polyoxyethylene copolymers with improved biological activity |
| US4845125A (en) | 1987-11-10 | 1989-07-04 | Indianapolis Center For Advanced Research, Inc. | Chemolytic EDTA-citric acid composition for dissolution of calculi |
| US4979948A (en) | 1989-04-13 | 1990-12-25 | Purdue Research Foundation | Method and apparatus for thermally destroying a layer of an organ |
| US5059200A (en) | 1990-04-06 | 1991-10-22 | John Tulip | Laser lithotripsy |
| CA2106474C (en) | 1991-03-19 | 2004-02-10 | R. Martin Emanuele | Polyoxypropylene/polyoxyethylene copolymers with improved biological activity |
| US5696298A (en) | 1991-03-19 | 1997-12-09 | Cytrx Corporation | Polyoxypropylene/polyoxyethylene copolymers with improved biological activity |
| US5129910A (en) | 1991-07-26 | 1992-07-14 | The Regents Of The University Of California | Stone expulsion stent |
| US5599300A (en) | 1992-05-11 | 1997-02-04 | Arrow Precision Products, Inc. | Method for electrosurgically obtaining access to the biliary tree with an adjustably positionable needle-knife |
| US5536248A (en) | 1992-05-11 | 1996-07-16 | Arrow Precision Products, Inc. | Method and apparatus for electrosurgically obtaining access to the biliary tree and placing a stent therein |
| US6770066B1 (en) | 1992-05-11 | 2004-08-03 | Ballard Medical Products | Multi-lumen endoscopic catheter |
| US5843028A (en) | 1992-05-11 | 1998-12-01 | Medical Innovations Corporation | Multi-lumen endoscopic catheter |
| DE69320136T3 (de) | 1992-05-11 | 2005-07-14 | Medical Innovations Corp., Draper | Verbesserter gallenkatheter |
| US5401257A (en) | 1993-04-27 | 1995-03-28 | Boston Scientific Corporation | Ureteral stents, drainage tubes and the like |
| US5448363A (en) | 1993-08-09 | 1995-09-05 | Hager; Horst | Food sorting by reflection of periodically scanned laser beam |
| JP3107488B2 (ja) * | 1993-09-29 | 2000-11-06 | 株式会社資生堂 | 架橋ヒアルロン酸を用いた徐放性製剤及び塞栓剤 |
| US5531716A (en) | 1993-09-29 | 1996-07-02 | Hercules Incorporated | Medical devices subject to triggered disintegration |
| US5403324A (en) * | 1994-01-14 | 1995-04-04 | Microsonic Engineering Devices Company, Inc. | Flexible catheter with stone basket and ultrasonic conductor |
| DE4405656C2 (de) | 1994-02-22 | 1998-12-10 | Ferton Holding | Einrichtung zum Entfernen von Körpersteinen |
| US5860972A (en) * | 1995-10-26 | 1999-01-19 | Xintec Corporation | Method of detection and destruction of urinary calculi and similar structures |
| US5860872A (en) * | 1996-03-07 | 1999-01-19 | Vitale; Kevin | Batter's stride training device |
| US5814006A (en) | 1996-05-28 | 1998-09-29 | Planz; Konrad | Temporary stent in the urine path |
| US5855601A (en) | 1996-06-21 | 1999-01-05 | The Trustees Of Columbia University In The City Of New York | Artificial heart valve and method and device for implanting the same |
| US5800711A (en) | 1996-10-18 | 1998-09-01 | Mdv Technologies, Inc. | Process for the fractionation of polyoxyalkylene block copolymers |
| DE19881185C5 (de) | 1997-08-22 | 2008-07-10 | Karl Storz Gmbh & Co. Kg | Vorrichtung zur Zertrümmerung von Konkrementen |
| WO1999023952A1 (en) | 1997-11-12 | 1999-05-20 | William Dubrul | Biological passageway occlusion removal |
| US6149656A (en) | 1998-09-11 | 2000-11-21 | Volker Walz | Electrodynamic lithotriptor |
| US6309384B1 (en) * | 1999-02-01 | 2001-10-30 | Adiana, Inc. | Method and apparatus for tubal occlusion |
| CA2362332A1 (en) | 1999-02-19 | 2000-08-24 | Scimed Life Systems, Inc. | Laser lithotripsy device with suction |
| US6159220A (en) | 1999-03-11 | 2000-12-12 | Scimed Life Systems, Inc. | Medical retrieval device |
| US6214037B1 (en) | 1999-03-18 | 2001-04-10 | Fossa Industries, Llc | Radially expanding stent |
| US6709465B2 (en) | 1999-03-18 | 2004-03-23 | Fossa Medical, Inc. | Radially expanding ureteral device |
| US7214229B2 (en) | 1999-03-18 | 2007-05-08 | Fossa Medical, Inc. | Radially expanding stents |
| US6620172B1 (en) | 1999-07-01 | 2003-09-16 | Medsource Technologies, Inc. | Entraining biological calculi |
| US7039453B2 (en) | 2000-02-08 | 2006-05-02 | Tarun Mullick | Miniature ingestible capsule |
| US6440061B1 (en) | 2000-03-24 | 2002-08-27 | Donald E. Wenner | Laparoscopic instrument system for real-time biliary exploration and stone removal |
| US20040266983A1 (en) * | 2000-08-17 | 2004-12-30 | Reeve Lorraine E | Purified polyoxyalkylene block copolymers |
| US6761824B2 (en) | 2000-08-17 | 2004-07-13 | Reeve Lorraine E | Process for the fractionation of polymers |
| US6565530B2 (en) * | 2001-02-28 | 2003-05-20 | Scimed Life Systems, Inc. | Immobilizing objects in the body |
| US7041139B2 (en) | 2001-12-11 | 2006-05-09 | Boston Scientific Scimed, Inc. | Ureteral stents and related methods |
| EP1489983A4 (en) * | 2002-02-15 | 2010-11-10 | Boston Scient Corp | METHOD AND DEVICE FOR TREATING TISSUE IN ADDITION TO A BODY THROUGH THERMOCOMPRESSION AND MEDICAMENTS |
| US6949125B2 (en) | 2002-04-16 | 2005-09-27 | Boston Scientific Scimed, Inc. | Ureteral stent with end-effector and related methods |
| DE10224352A1 (de) * | 2002-06-01 | 2003-12-11 | Mueller Schulte Detlef | Thermosensitive Polymerträger mit veränderbarer physikalischer Struktur für die biochemische Analytik, Diagnostik und Therapie |
| US20050143678A1 (en) | 2003-10-14 | 2005-06-30 | Pluromed, Inc. | Confinement of kidney-stone fragments during lithotripsy |
| US7052489B2 (en) | 2003-12-05 | 2006-05-30 | Scimed Life Systems, Inc. | Medical device with deflecting shaft and related methods of manufacture and use |
| PL1877096T3 (pl) | 2005-05-02 | 2015-03-31 | Massachusetts Gen Hospital | Nielitotrypsyjne leczenie kamieni nerkowych |
| EP1892231A1 (en) | 2006-08-21 | 2008-02-27 | Bayer Schering Pharma Aktiengesellschaft | A large scale method for the deoxofluorination of ketones |
-
2006
- 2006-04-27 PL PL06758729T patent/PL1877096T3/pl unknown
- 2006-04-27 EP EP14191119.8A patent/EP2857041B9/en active Active
- 2006-04-27 ES ES12193441.8T patent/ES2529130T3/es active Active
- 2006-04-27 AU AU2006242509A patent/AU2006242509B2/en active Active
- 2006-04-27 KR KR1020077028231A patent/KR20080033159A/ko active Search and Examination
- 2006-04-27 EP EP06758729.5A patent/EP1877096B1/en active Active
- 2006-04-27 CA CA2900229A patent/CA2900229A1/en not_active Abandoned
- 2006-04-27 WO PCT/US2006/016208 patent/WO2006119009A1/en active Application Filing
- 2006-04-27 SI SI200631770T patent/SI1877096T1/sl unknown
- 2006-04-27 CN CNA2006800242466A patent/CN101237887A/zh active Pending
- 2006-04-27 PL PL12193441T patent/PL2601972T3/pl unknown
- 2006-04-27 DK DK06758729.5T patent/DK1877096T3/da active
- 2006-04-27 JP JP2008510072A patent/JP5646813B2/ja active Active
- 2006-04-27 DK DK12193441.8T patent/DK2601972T3/en active
- 2006-04-27 PT PT67587295T patent/PT1877096E/pt unknown
- 2006-04-27 PT PT121934418T patent/PT2601972E/pt unknown
- 2006-04-27 CA CA2606714A patent/CA2606714C/en active Active
- 2006-04-27 BR BRPI0611278-1A patent/BRPI0611278A2/pt not_active Application Discontinuation
- 2006-04-27 CA CA2985117A patent/CA2985117A1/en not_active Abandoned
- 2006-04-27 KR KR1020137021797A patent/KR101610796B1/ko active IP Right Grant
- 2006-04-27 ES ES06758729.5T patent/ES2458141T3/es active Active
- 2006-04-27 CN CN201510382009.8A patent/CN105056310A/zh active Pending
- 2006-04-27 EP EP12193441.8A patent/EP2601972B1/en active Active
- 2006-04-27 US US11/412,407 patent/US8361455B2/en active Active
- 2006-04-27 KR KR1020157000965A patent/KR101808201B1/ko active IP Right Grant
- 2006-04-27 SI SI200631885T patent/SI2601972T1/sl unknown
- 2006-04-27 CA CA2831752A patent/CA2831752A1/en not_active Abandoned
- 2006-04-27 MX MX2007013827A patent/MX2007013827A/es active IP Right Grant
-
2012
- 2012-12-14 US US13/714,933 patent/US20130178866A1/en not_active Abandoned
-
2013
- 2013-03-27 JP JP2013066253A patent/JP2013172971A/ja active Pending
-
2014
- 2014-04-22 US US14/259,103 patent/US9161767B2/en active Active
-
2015
- 2015-06-03 JP JP2015112997A patent/JP6076404B2/ja not_active Expired - Fee Related
- 2015-07-07 HK HK15106483.4A patent/HK1205935A1/xx unknown
- 2015-09-29 US US14/869,335 patent/US9968369B2/en active Active
-
2016
- 2016-11-24 JP JP2016228021A patent/JP2017070768A/ja active Pending
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2015163273A (ja) * | 2005-05-02 | 2015-09-10 | ジェンザイム・コーポレーション | 破砕術によらない結石症の治療のための組成物 |
| JP2017070768A (ja) * | 2005-05-02 | 2017-04-13 | ジェンザイム・コーポレーション | 破砕術によらない結石症の治療のための組成物 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6076404B2 (ja) | 破砕術によらない結石症の治療のための組成物 | |
| US20210353301A1 (en) | Methods for preventing retropulsion of concretions and fragments during lithotripsy | |
| US20160338707A1 (en) | Atraumatic Occlusion Balloons and Skirts, and Methods of Use Thereof |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20090427 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20090427 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20120214 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20120511 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20120522 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20120614 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20120621 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20120717 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20120724 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120810 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20121127 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130327 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20130517 |
|
| A912 | Re-examination (zenchi) completed and case transferred to appeal board |
Free format text: JAPANESE INTERMEDIATE CODE: A912 Effective date: 20130705 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20140516 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20140521 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20140618 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20140623 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20140718 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20140725 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20141106 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5646813 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313115 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |