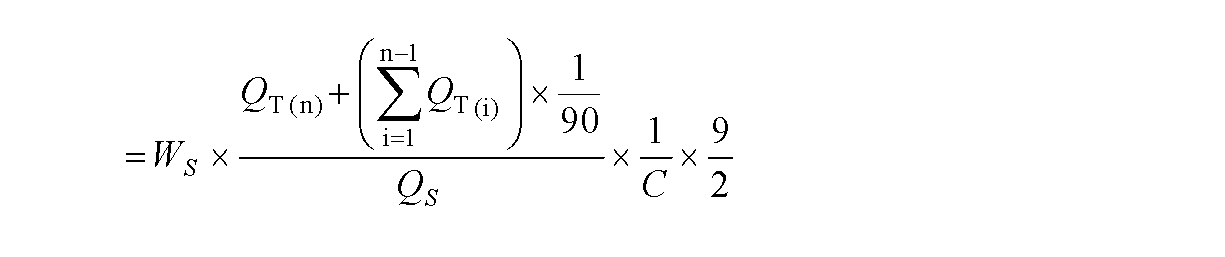JP5337430B2 - Orally disintegrating tablets - Google Patents
Orally disintegrating tablets Download PDFInfo
- Publication number
- JP5337430B2 JP5337430B2 JP2008216540A JP2008216540A JP5337430B2 JP 5337430 B2 JP5337430 B2 JP 5337430B2 JP 2008216540 A JP2008216540 A JP 2008216540A JP 2008216540 A JP2008216540 A JP 2008216540A JP 5337430 B2 JP5337430 B2 JP 5337430B2
- Authority
- JP
- Japan
- Prior art keywords
- disintegrating tablet
- mass
- polyvinyl alcohol
- water
- intraoral quick
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 239000006191 orally-disintegrating tablet Substances 0.000 title claims description 4
- 229920002451 polyvinyl alcohol Polymers 0.000 claims abstract description 56
- 235000019422 polyvinyl alcohol Nutrition 0.000 claims abstract description 56
- -1 polyoxyethylenes Polymers 0.000 claims abstract description 36
- 229920003171 Poly (ethylene oxide) Polymers 0.000 claims abstract description 23
- 239000004480 active ingredient Substances 0.000 claims abstract description 18
- 210000000214 mouth Anatomy 0.000 claims abstract description 16
- 229920002675 Polyoxyl Polymers 0.000 claims abstract description 13
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 claims abstract description 12
- 239000003826 tablet Substances 0.000 claims description 105
- 239000004372 Polyvinyl alcohol Substances 0.000 claims description 41
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 26
- WIGIZIANZCJQQY-RUCARUNLSA-N glimepiride Chemical compound O=C1C(CC)=C(C)CN1C(=O)NCCC1=CC=C(S(=O)(=O)NC(=O)N[C@@H]2CC[C@@H](C)CC2)C=C1 WIGIZIANZCJQQY-RUCARUNLSA-N 0.000 claims description 16
- 229960004346 glimepiride Drugs 0.000 claims description 16
- 239000000314 lubricant Substances 0.000 claims description 13
- 229920001223 polyethylene glycol Polymers 0.000 claims description 13
- 239000007884 disintegrant Substances 0.000 claims description 12
- 239000002202 Polyethylene glycol Substances 0.000 claims description 11
- 239000000203 mixture Substances 0.000 claims description 11
- WSVLPVUVIUVCRA-KPKNDVKVSA-N Alpha-lactose monohydrate Chemical group O.O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O WSVLPVUVIUVCRA-KPKNDVKVSA-N 0.000 claims description 9
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 9
- 235000014113 dietary fatty acids Nutrition 0.000 claims description 6
- 239000000194 fatty acid Substances 0.000 claims description 6
- 229930195729 fatty acid Natural products 0.000 claims description 6
- 239000003795 chemical substances by application Substances 0.000 claims description 5
- 238000002156 mixing Methods 0.000 claims description 5
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 claims description 4
- 239000006185 dispersion Substances 0.000 claims description 4
- 150000002170 ethers Chemical class 0.000 claims description 4
- 238000009472 formulation Methods 0.000 claims description 4
- 239000007788 liquid Substances 0.000 claims description 3
- 229920002503 polyoxyethylene-polyoxypropylene Polymers 0.000 claims description 3
- 239000004386 Erythritol Substances 0.000 claims description 2
- UNXHWFMMPAWVPI-UHFFFAOYSA-N Erythritol Natural products OCC(O)C(O)CO UNXHWFMMPAWVPI-UHFFFAOYSA-N 0.000 claims description 2
- 235000019414 erythritol Nutrition 0.000 claims description 2
- UNXHWFMMPAWVPI-ZXZARUISSA-N erythritol Chemical compound OC[C@H](O)[C@H](O)CO UNXHWFMMPAWVPI-ZXZARUISSA-N 0.000 claims description 2
- 229940009714 erythritol Drugs 0.000 claims description 2
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 claims description 2
- 239000007921 spray Substances 0.000 claims description 2
- 239000000945 filler Substances 0.000 claims 1
- 238000009477 fluid bed granulation Methods 0.000 claims 1
- 238000010828 elution Methods 0.000 abstract description 3
- 238000000034 method Methods 0.000 description 15
- 150000003839 salts Chemical class 0.000 description 11
- 238000004090 dissolution Methods 0.000 description 10
- 239000011230 binding agent Substances 0.000 description 9
- 238000012360 testing method Methods 0.000 description 9
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 8
- 239000001913 cellulose Substances 0.000 description 7
- 229920002678 cellulose Polymers 0.000 description 7
- 235000010980 cellulose Nutrition 0.000 description 7
- 239000000243 solution Substances 0.000 description 7
- 239000012086 standard solution Substances 0.000 description 7
- 238000003860 storage Methods 0.000 description 7
- 239000000126 substance Substances 0.000 description 7
- 238000004519 manufacturing process Methods 0.000 description 6
- 239000000047 product Substances 0.000 description 6
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 5
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 5
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 5
- WHNWPMSKXPGLAX-UHFFFAOYSA-N N-Vinyl-2-pyrrolidone Chemical compound C=CN1CCCC1=O WHNWPMSKXPGLAX-UHFFFAOYSA-N 0.000 description 5
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 5
- 229960000913 crospovidone Drugs 0.000 description 5
- 238000007922 dissolution test Methods 0.000 description 5
- 229940079593 drug Drugs 0.000 description 5
- 239000003814 drug Substances 0.000 description 5
- 239000008101 lactose Substances 0.000 description 5
- 229920000523 polyvinylpolypyrrolidone Polymers 0.000 description 5
- 235000013809 polyvinylpolypyrrolidone Nutrition 0.000 description 5
- 238000002360 preparation method Methods 0.000 description 5
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 4
- 150000001720 carbohydrates Chemical class 0.000 description 4
- 235000003599 food sweetener Nutrition 0.000 description 4
- 235000019359 magnesium stearate Nutrition 0.000 description 4
- 239000011812 mixed powder Substances 0.000 description 4
- 235000012239 silicon dioxide Nutrition 0.000 description 4
- 239000003765 sweetening agent Substances 0.000 description 4
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 3
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- 229920002261 Corn starch Polymers 0.000 description 3
- 239000004605 External Lubricant Substances 0.000 description 3
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 3
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 3
- 239000000654 additive Substances 0.000 description 3
- 239000007864 aqueous solution Substances 0.000 description 3
- 239000003086 colorant Substances 0.000 description 3
- 230000000052 comparative effect Effects 0.000 description 3
- 239000008120 corn starch Substances 0.000 description 3
- 230000000694 effects Effects 0.000 description 3
- 239000000796 flavoring agent Substances 0.000 description 3
- 235000010355 mannitol Nutrition 0.000 description 3
- 238000007127 saponification reaction Methods 0.000 description 3
- RMAQACBXLXPBSY-UHFFFAOYSA-N silicic acid Chemical compound O[Si](O)(O)O RMAQACBXLXPBSY-UHFFFAOYSA-N 0.000 description 3
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 2
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 2
- 239000004129 EU approved improving agent Substances 0.000 description 2
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 2
- TWRXJAOTZQYOKJ-UHFFFAOYSA-L Magnesium chloride Chemical compound [Mg+2].[Cl-].[Cl-] TWRXJAOTZQYOKJ-UHFFFAOYSA-L 0.000 description 2
- 229930195725 Mannitol Natural products 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- 229920002701 Polyoxyl 40 Stearate Polymers 0.000 description 2
- AUNGANRZJHBGPY-SCRDCRAPSA-N Riboflavin Chemical compound OC[C@@H](O)[C@@H](O)[C@@H](O)CN1C=2C=C(C)C(C)=CC=2N=C2C1=NC(=O)NC2=O AUNGANRZJHBGPY-SCRDCRAPSA-N 0.000 description 2
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- 229930006000 Sucrose Natural products 0.000 description 2
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 2
- 229960000583 acetic acid Drugs 0.000 description 2
- VJHCJDRQFCCTHL-UHFFFAOYSA-N acetic acid 2,3,4,5,6-pentahydroxyhexanal Chemical compound CC(O)=O.OCC(O)C(O)C(O)C(O)C=O VJHCJDRQFCCTHL-UHFFFAOYSA-N 0.000 description 2
- 230000000996 additive effect Effects 0.000 description 2
- 230000003474 anti-emetic effect Effects 0.000 description 2
- 239000002111 antiemetic agent Substances 0.000 description 2
- OSGAYBCDTDRGGQ-UHFFFAOYSA-L calcium sulfate Chemical compound [Ca+2].[O-]S([O-])(=O)=O OSGAYBCDTDRGGQ-UHFFFAOYSA-L 0.000 description 2
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 2
- 229950008138 carmellose Drugs 0.000 description 2
- 239000000812 cholinergic antagonist Substances 0.000 description 2
- 229910052802 copper Inorganic materials 0.000 description 2
- 239000010949 copper Substances 0.000 description 2
- 239000000706 filtrate Substances 0.000 description 2
- 235000013355 food flavoring agent Nutrition 0.000 description 2
- 239000003205 fragrance Substances 0.000 description 2
- 230000001771 impaired effect Effects 0.000 description 2
- UQSXHKLRYXJYBZ-UHFFFAOYSA-N iron oxide Inorganic materials [Fe]=O UQSXHKLRYXJYBZ-UHFFFAOYSA-N 0.000 description 2
- 238000004811 liquid chromatography Methods 0.000 description 2
- 239000000594 mannitol Substances 0.000 description 2
- NDLPOXTZKUMGOV-UHFFFAOYSA-N oxo(oxoferriooxy)iron hydrate Chemical compound O.O=[Fe]O[Fe]=O NDLPOXTZKUMGOV-UHFFFAOYSA-N 0.000 description 2
- 239000002245 particle Substances 0.000 description 2
- 238000006116 polymerization reaction Methods 0.000 description 2
- 229940099429 polyoxyl 40 stearate Drugs 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- BDERNNFJNOPAEC-UHFFFAOYSA-N propan-1-ol Chemical compound CCCO BDERNNFJNOPAEC-UHFFFAOYSA-N 0.000 description 2
- 210000003296 saliva Anatomy 0.000 description 2
- 239000012488 sample solution Substances 0.000 description 2
- KDYFGRWQOYBRFD-UHFFFAOYSA-N succinic acid Chemical compound OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 2
- 239000005720 sucrose Substances 0.000 description 2
- NOOLISFMXDJSKH-UTLUCORTSA-N (+)-Neomenthol Chemical compound CC(C)[C@@H]1CC[C@@H](C)C[C@@H]1O NOOLISFMXDJSKH-UTLUCORTSA-N 0.000 description 1
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 1
- DSSYKIVIOFKYAU-XCBNKYQSSA-N (R)-camphor Chemical compound C1C[C@@]2(C)C(=O)C[C@@H]1C2(C)C DSSYKIVIOFKYAU-XCBNKYQSSA-N 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 1
- OALHHIHQOFIMEF-UHFFFAOYSA-N 3',6'-dihydroxy-2',4',5',7'-tetraiodo-3h-spiro[2-benzofuran-1,9'-xanthene]-3-one Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC(I)=C(O)C(I)=C1OC1=C(I)C(O)=C(I)C=C21 OALHHIHQOFIMEF-UHFFFAOYSA-N 0.000 description 1
- MIDXCONKKJTLDX-UHFFFAOYSA-N 3,5-dimethylcyclopentane-1,2-dione Chemical compound CC1CC(C)C(=O)C1=O MIDXCONKKJTLDX-UHFFFAOYSA-N 0.000 description 1
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 1
- WBZFUFAFFUEMEI-UHFFFAOYSA-M Acesulfame k Chemical compound [K+].CC1=CC(=O)[N-]S(=O)(=O)O1 WBZFUFAFFUEMEI-UHFFFAOYSA-M 0.000 description 1
- 208000024827 Alzheimer disease Diseases 0.000 description 1
- 108010011485 Aspartame Proteins 0.000 description 1
- SGHZXLIDFTYFHQ-UHFFFAOYSA-L Brilliant Blue Chemical compound [Na+].[Na+].C=1C=C(C(=C2C=CC(C=C2)=[N+](CC)CC=2C=C(C=CC=2)S([O-])(=O)=O)C=2C(=CC=CC=2)S([O-])(=O)=O)C=CC=1N(CC)CC1=CC=CC(S([O-])(=O)=O)=C1 SGHZXLIDFTYFHQ-UHFFFAOYSA-L 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical class [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 1
- 241000206601 Carnobacterium mobile Species 0.000 description 1
- 241000723346 Cinnamomum camphora Species 0.000 description 1
- 235000005979 Citrus limon Nutrition 0.000 description 1
- 244000131522 Citrus pyriformis Species 0.000 description 1
- 229920002785 Croscarmellose sodium Polymers 0.000 description 1
- AUNGANRZJHBGPY-UHFFFAOYSA-N D-Lyxoflavin Natural products OCC(O)C(O)C(O)CN1C=2C=C(C)C(C)=CC=2N=C2C1=NC(=O)NC2=O AUNGANRZJHBGPY-UHFFFAOYSA-N 0.000 description 1
- NOOLISFMXDJSKH-UHFFFAOYSA-N DL-menthol Natural products CC(C)C1CCC(C)CC1O NOOLISFMXDJSKH-UHFFFAOYSA-N 0.000 description 1
- AANLCWYVVNBGEE-IDIVVRGQSA-L Disodium inosinate Chemical compound [Na+].[Na+].O[C@@H]1[C@H](O)[C@@H](COP([O-])([O-])=O)O[C@H]1N1C(NC=NC2=O)=C2N=C1 AANLCWYVVNBGEE-IDIVVRGQSA-L 0.000 description 1
- 208000008967 Enuresis Diseases 0.000 description 1
- IAYPIBMASNFSPL-UHFFFAOYSA-N Ethylene oxide Chemical compound C1CO1 IAYPIBMASNFSPL-UHFFFAOYSA-N 0.000 description 1
- 235000016623 Fragaria vesca Nutrition 0.000 description 1
- 240000009088 Fragaria x ananassa Species 0.000 description 1
- 235000011363 Fragaria x ananassa Nutrition 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 208000031226 Hyperlipidaemia Diseases 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 235000019501 Lemon oil Nutrition 0.000 description 1
- VTAJIXDZFCRWBR-UHFFFAOYSA-N Licoricesaponin B2 Natural products C1C(C2C(C3(CCC4(C)CCC(C)(CC4C3=CC2)C(O)=O)C)(C)CC2)(C)C2C(C)(C)CC1OC1OC(C(O)=O)C(O)C(O)C1OC1OC(C(O)=O)C(O)C(O)C1O VTAJIXDZFCRWBR-UHFFFAOYSA-N 0.000 description 1
- 235000006679 Mentha X verticillata Nutrition 0.000 description 1
- 244000246386 Mentha pulegium Species 0.000 description 1
- 235000016257 Mentha pulegium Nutrition 0.000 description 1
- 235000002899 Mentha suaveolens Nutrition 0.000 description 1
- 235000004357 Mentha x piperita Nutrition 0.000 description 1
- 235000001636 Mentha x rotundifolia Nutrition 0.000 description 1
- CERQOIWHTDAKMF-UHFFFAOYSA-N Methacrylic acid Chemical compound CC(=C)C(O)=O CERQOIWHTDAKMF-UHFFFAOYSA-N 0.000 description 1
- 239000005642 Oleic acid Substances 0.000 description 1
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 1
- 235000019502 Orange oil Nutrition 0.000 description 1
- 208000001132 Osteoporosis Diseases 0.000 description 1
- GOOHAUXETOMSMM-UHFFFAOYSA-N Propylene oxide Chemical compound CC1CO1 GOOHAUXETOMSMM-UHFFFAOYSA-N 0.000 description 1
- 206010039966 Senile dementia Diseases 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 244000228451 Stevia rebaudiana Species 0.000 description 1
- 239000004376 Sucralose Substances 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 229940100389 Sulfonylurea Drugs 0.000 description 1
- 239000000150 Sympathomimetic Substances 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- GUGOEEXESWIERI-UHFFFAOYSA-N Terfenadine Chemical compound C1=CC(C(C)(C)C)=CC=C1C(O)CCCN1CCC(C(O)(C=2C=CC=CC=2)C=2C=CC=CC=2)CC1 GUGOEEXESWIERI-UHFFFAOYSA-N 0.000 description 1
- 244000269722 Thea sinensis Species 0.000 description 1
- GWEVSGVZZGPLCZ-UHFFFAOYSA-N Titan oxide Chemical compound O=[Ti]=O GWEVSGVZZGPLCZ-UHFFFAOYSA-N 0.000 description 1
- JVOGSHDZLOJKKR-MXFMKSRJSA-I [Na+].[Na+].[Na+].[Mg++].CCc1c(C)c2cc3[n-]c(c(C)c3C=C)c(C)c3nc(C[C@H]3CCC([O-])=O)c(CC([O-])=O)c3[n-]c(cc1n2)c(C)c3C([O-])=O Chemical compound [Na+].[Na+].[Na+].[Mg++].CCc1c(C)c2cc3[n-]c(c(C)c3C=C)c(C)c3nc(C[C@H]3CCC([O-])=O)c(CC([O-])=O)c3[n-]c(cc1n2)c(C)c3C([O-])=O JVOGSHDZLOJKKR-MXFMKSRJSA-I 0.000 description 1
- 235000010358 acesulfame potassium Nutrition 0.000 description 1
- 229960004998 acesulfame potassium Drugs 0.000 description 1
- 239000000619 acesulfame-K Substances 0.000 description 1
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 230000032683 aging Effects 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 229930013930 alkaloid Natural products 0.000 description 1
- 150000003797 alkaloid derivatives Chemical class 0.000 description 1
- 208000026935 allergic disease Diseases 0.000 description 1
- 230000007815 allergy Effects 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 229940035676 analgesics Drugs 0.000 description 1
- 229960004543 anhydrous citric acid Drugs 0.000 description 1
- 230000000954 anitussive effect Effects 0.000 description 1
- 229940069428 antacid Drugs 0.000 description 1
- 239000003159 antacid agent Substances 0.000 description 1
- 239000000730 antalgic agent Substances 0.000 description 1
- 230000001458 anti-acid effect Effects 0.000 description 1
- 230000001387 anti-histamine Effects 0.000 description 1
- 230000003276 anti-hypertensive effect Effects 0.000 description 1
- 230000001754 anti-pyretic effect Effects 0.000 description 1
- 230000003356 anti-rheumatic effect Effects 0.000 description 1
- 230000000767 anti-ulcer Effects 0.000 description 1
- 229940125713 antianxiety drug Drugs 0.000 description 1
- 239000003146 anticoagulant agent Substances 0.000 description 1
- 229940127219 anticoagulant drug Drugs 0.000 description 1
- 239000001961 anticonvulsive agent Substances 0.000 description 1
- 239000000935 antidepressant agent Substances 0.000 description 1
- 229940005513 antidepressants Drugs 0.000 description 1
- 229960002708 antigout preparations Drugs 0.000 description 1
- 239000000739 antihistaminic agent Substances 0.000 description 1
- 229940034982 antineoplastic agent Drugs 0.000 description 1
- 239000002246 antineoplastic agent Substances 0.000 description 1
- 239000000164 antipsychotic agent Substances 0.000 description 1
- 229940005529 antipsychotics Drugs 0.000 description 1
- 239000002221 antipyretic Substances 0.000 description 1
- 239000003435 antirheumatic agent Substances 0.000 description 1
- 229940124575 antispasmodic agent Drugs 0.000 description 1
- 229940124584 antitussives Drugs 0.000 description 1
- 239000002249 anxiolytic agent Substances 0.000 description 1
- 230000002763 arrhythmic effect Effects 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 239000000605 aspartame Substances 0.000 description 1
- 235000010357 aspartame Nutrition 0.000 description 1
- IAOZJIPTCAWIRG-QWRGUYRKSA-N aspartame Chemical compound OC(=O)C[C@H](N)C(=O)N[C@H](C(=O)OC)CC1=CC=CC=C1 IAOZJIPTCAWIRG-QWRGUYRKSA-N 0.000 description 1
- 229960003438 aspartame Drugs 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- 229940124630 bronchodilator Drugs 0.000 description 1
- 229940067573 brown iron oxide Drugs 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- FNAQSUUGMSOBHW-UHFFFAOYSA-H calcium citrate Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O.[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O FNAQSUUGMSOBHW-UHFFFAOYSA-H 0.000 description 1
- 239000001354 calcium citrate Substances 0.000 description 1
- FUFJGUQYACFECW-UHFFFAOYSA-L calcium hydrogenphosphate Chemical compound [Ca+2].OP([O-])([O-])=O FUFJGUQYACFECW-UHFFFAOYSA-L 0.000 description 1
- CJZGTCYPCWQAJB-UHFFFAOYSA-L calcium stearate Chemical compound [Ca+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O CJZGTCYPCWQAJB-UHFFFAOYSA-L 0.000 description 1
- 235000013539 calcium stearate Nutrition 0.000 description 1
- 239000008116 calcium stearate Substances 0.000 description 1
- 235000011132 calcium sulphate Nutrition 0.000 description 1
- 229960000846 camphor Drugs 0.000 description 1
- 229930008380 camphor Natural products 0.000 description 1
- 235000013736 caramel Nutrition 0.000 description 1
- 239000004202 carbamide Substances 0.000 description 1
- 125000002057 carboxymethyl group Chemical group [H]OC(=O)C([H])([H])[*] 0.000 description 1
- 230000003177 cardiotonic effect Effects 0.000 description 1
- 239000003576 central nervous system agent Substances 0.000 description 1
- 230000002490 cerebral effect Effects 0.000 description 1
- OIQPTROHQCGFEF-UHFFFAOYSA-L chembl1371409 Chemical compound [Na+].[Na+].OC1=CC=C2C=C(S([O-])(=O)=O)C=CC2=C1N=NC1=CC=C(S([O-])(=O)=O)C=C1 OIQPTROHQCGFEF-UHFFFAOYSA-L 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 239000007958 cherry flavor Substances 0.000 description 1
- 230000001055 chewing effect Effects 0.000 description 1
- 229930002875 chlorophyll Natural products 0.000 description 1
- 235000019804 chlorophyll Nutrition 0.000 description 1
- ATNHDLDRLWWWCB-AENOIHSZSA-M chlorophyll a Chemical compound C1([C@@H](C(=O)OC)C(=O)C2=C3C)=C2N2C3=CC(C(CC)=C3C)=[N+]4C3=CC3=C(C=C)C(C)=C5N3[Mg-2]42[N+]2=C1[C@@H](CCC(=O)OC\C=C(/C)CCC[C@H](C)CCC[C@H](C)CCCC(C)C)[C@H](C)C2=C5 ATNHDLDRLWWWCB-AENOIHSZSA-M 0.000 description 1
- 235000019219 chocolate Nutrition 0.000 description 1
- 239000010630 cinnamon oil Substances 0.000 description 1
- 229960004106 citric acid Drugs 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 238000007906 compression Methods 0.000 description 1
- 230000006835 compression Effects 0.000 description 1
- 238000000748 compression moulding Methods 0.000 description 1
- 239000003218 coronary vasodilator agent Substances 0.000 description 1
- 238000005336 cracking Methods 0.000 description 1
- 229960001681 croscarmellose sodium Drugs 0.000 description 1
- 235000010947 crosslinked sodium carboxy methyl cellulose Nutrition 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- 235000019700 dicalcium phosphate Nutrition 0.000 description 1
- PCHPORCSPXIHLZ-UHFFFAOYSA-N diphenhydramine hydrochloride Chemical compound [Cl-].C=1C=CC=CC=1C(OCC[NH+](C)C)C1=CC=CC=C1 PCHPORCSPXIHLZ-UHFFFAOYSA-N 0.000 description 1
- 239000004194 disodium inosinate Substances 0.000 description 1
- 235000013890 disodium inosinate Nutrition 0.000 description 1
- 239000002934 diuretic Substances 0.000 description 1
- 230000001882 diuretic effect Effects 0.000 description 1
- 235000012489 doughnuts Nutrition 0.000 description 1
- 238000007908 dry granulation Methods 0.000 description 1
- 239000000686 essence Substances 0.000 description 1
- 235000019441 ethanol Nutrition 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- XUFQPHANEAPEMJ-UHFFFAOYSA-N famotidine Chemical compound NC(N)=NC1=NC(CSCCC(N)=NS(N)(=O)=O)=CS1 XUFQPHANEAPEMJ-UHFFFAOYSA-N 0.000 description 1
- 229960001596 famotidine Drugs 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 239000010419 fine particle Substances 0.000 description 1
- 235000019634 flavors Nutrition 0.000 description 1
- 235000002864 food coloring agent Nutrition 0.000 description 1
- 230000037406 food intake Effects 0.000 description 1
- 235000012631 food intake Nutrition 0.000 description 1
- 239000008369 fruit flavor Substances 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 239000012362 glacial acetic acid Substances 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 229960002989 glutamic acid Drugs 0.000 description 1
- 150000002334 glycols Chemical class 0.000 description 1
- LPLVUJXQOOQHMX-UHFFFAOYSA-N glycyrrhetinic acid glycoside Natural products C1CC(C2C(C3(CCC4(C)CCC(C)(CC4C3=CC2=O)C(O)=O)C)(C)CC2)(C)C2C(C)(C)C1OC1OC(C(O)=O)C(O)C(O)C1OC1OC(C(O)=O)C(O)C(O)C1O LPLVUJXQOOQHMX-UHFFFAOYSA-N 0.000 description 1
- 239000001685 glycyrrhizic acid Substances 0.000 description 1
- 229960004949 glycyrrhizic acid Drugs 0.000 description 1
- UYRUBYNTXSDKQT-UHFFFAOYSA-N glycyrrhizic acid Natural products CC1(C)C(CCC2(C)C1CCC3(C)C2C(=O)C=C4C5CC(C)(CCC5(C)CCC34C)C(=O)O)OC6OC(C(O)C(O)C6OC7OC(O)C(O)C(O)C7C(=O)O)C(=O)O UYRUBYNTXSDKQT-UHFFFAOYSA-N 0.000 description 1
- 235000019410 glycyrrhizin Nutrition 0.000 description 1
- LPLVUJXQOOQHMX-QWBHMCJMSA-N glycyrrhizinic acid Chemical compound O([C@@H]1[C@@H](O)[C@H](O)[C@H](O[C@@H]1O[C@@H]1C([C@H]2[C@]([C@@H]3[C@@]([C@@]4(CC[C@@]5(C)CC[C@@](C)(C[C@H]5C4=CC3=O)C(O)=O)C)(C)CC2)(C)CC1)(C)C)C(O)=O)[C@@H]1O[C@H](C(O)=O)[C@@H](O)[C@H](O)[C@H]1O LPLVUJXQOOQHMX-QWBHMCJMSA-N 0.000 description 1
- 238000005469 granulation Methods 0.000 description 1
- 230000003179 granulation Effects 0.000 description 1
- 235000009569 green tea Nutrition 0.000 description 1
- 235000012907 honey Nutrition 0.000 description 1
- 229940125697 hormonal agent Drugs 0.000 description 1
- 235000001050 hortel pimenta Nutrition 0.000 description 1
- 230000003301 hydrolyzing effect Effects 0.000 description 1
- 230000000147 hypnotic effect Effects 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 238000011835 investigation Methods 0.000 description 1
- WTFXARWRTYJXII-UHFFFAOYSA-N iron(2+);iron(3+);oxygen(2-) Chemical compound [O-2].[O-2].[O-2].[O-2].[Fe+2].[Fe+3].[Fe+3] WTFXARWRTYJXII-UHFFFAOYSA-N 0.000 description 1
- SZVJSHCCFOBDDC-UHFFFAOYSA-N iron(II,III) oxide Inorganic materials O=[Fe]O[Fe]O[Fe]=O SZVJSHCCFOBDDC-UHFFFAOYSA-N 0.000 description 1
- JEIPFZHSYJVQDO-UHFFFAOYSA-N iron(III) oxide Inorganic materials O=[Fe]O[Fe]=O JEIPFZHSYJVQDO-UHFFFAOYSA-N 0.000 description 1
- YOBAEOGBNPPUQV-UHFFFAOYSA-N iron;trihydrate Chemical compound O.O.O.[Fe].[Fe] YOBAEOGBNPPUQV-UHFFFAOYSA-N 0.000 description 1
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 1
- 239000010501 lemon oil Substances 0.000 description 1
- 229940031703 low substituted hydroxypropyl cellulose Drugs 0.000 description 1
- 238000005461 lubrication Methods 0.000 description 1
- 229910001629 magnesium chloride Inorganic materials 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 230000018984 mastication Effects 0.000 description 1
- 238000010077 mastication Methods 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 239000001683 mentha spicata herb oil Substances 0.000 description 1
- 229940041616 menthol Drugs 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 239000008368 mint flavor Substances 0.000 description 1
- 229910000403 monosodium phosphate Inorganic materials 0.000 description 1
- 235000019799 monosodium phosphate Nutrition 0.000 description 1
- 239000003158 myorelaxant agent Substances 0.000 description 1
- 239000004081 narcotic agent Substances 0.000 description 1
- 235000021096 natural sweeteners Nutrition 0.000 description 1
- 230000000422 nocturnal effect Effects 0.000 description 1
- 208000005346 nocturnal enuresis Diseases 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 1
- 239000003538 oral antidiabetic agent Substances 0.000 description 1
- 229940127209 oral hypoglycaemic agent Drugs 0.000 description 1
- 239000010502 orange oil Substances 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 239000002304 perfume Substances 0.000 description 1
- 239000000810 peripheral vasodilating agent Substances 0.000 description 1
- 229960002116 peripheral vasodilator Drugs 0.000 description 1
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- 230000035790 physiological processes and functions Effects 0.000 description 1
- 239000010665 pine oil Substances 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 1
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 1
- 229920000053 polysorbate 80 Polymers 0.000 description 1
- 229940068968 polysorbate 80 Drugs 0.000 description 1
- 229920002689 polyvinyl acetate Polymers 0.000 description 1
- 239000011118 polyvinyl acetate Substances 0.000 description 1
- 239000011148 porous material Substances 0.000 description 1
- VWBQYTRBTXKKOG-IYNICTALSA-M pravastatin sodium Chemical compound [Na+].C1=C[C@H](C)[C@H](CC[C@@H](O)C[C@@H](O)CC([O-])=O)[C@H]2[C@@H](OC(=O)[C@@H](C)CC)C[C@H](O)C=C21 VWBQYTRBTXKKOG-IYNICTALSA-M 0.000 description 1
- 229960001495 pravastatin sodium Drugs 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- 239000002994 raw material Substances 0.000 description 1
- HELXLJCILKEWJH-NCGAPWICSA-N rebaudioside A Chemical compound O([C@H]1[C@H](O)[C@@H](CO)O[C@H]([C@@H]1O[C@H]1[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O1)O)O[C@]12C(=C)C[C@@]3(C1)CC[C@@H]1[C@@](C)(CCC[C@]1([C@@H]3CC2)C)C(=O)O[C@H]1[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O1)O)[C@@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O HELXLJCILKEWJH-NCGAPWICSA-N 0.000 description 1
- 230000000241 respiratory effect Effects 0.000 description 1
- 235000019192 riboflavin Nutrition 0.000 description 1
- 229960002477 riboflavin Drugs 0.000 description 1
- 239000002151 riboflavin Substances 0.000 description 1
- 239000010666 rose oil Substances 0.000 description 1
- 235000019719 rose oil Nutrition 0.000 description 1
- 235000019204 saccharin Nutrition 0.000 description 1
- CVHZOJJKTDOEJC-UHFFFAOYSA-N saccharin Chemical compound C1=CC=C2C(=O)NS(=O)(=O)C2=C1 CVHZOJJKTDOEJC-UHFFFAOYSA-N 0.000 description 1
- 229940081974 saccharin Drugs 0.000 description 1
- 239000000901 saccharin and its Na,K and Ca salt Substances 0.000 description 1
- 239000000932 sedative agent Substances 0.000 description 1
- 229940125723 sedative agent Drugs 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 239000000741 silica gel Substances 0.000 description 1
- 229910002027 silica gel Inorganic materials 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- 210000002027 skeletal muscle Anatomy 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 235000017557 sodium bicarbonate Nutrition 0.000 description 1
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- AJPJDKMHJJGVTQ-UHFFFAOYSA-M sodium dihydrogen phosphate Chemical compound [Na+].OP(O)([O-])=O AJPJDKMHJJGVTQ-UHFFFAOYSA-M 0.000 description 1
- 235000019721 spearmint oil Nutrition 0.000 description 1
- 239000010675 spruce oil Substances 0.000 description 1
- 229910001220 stainless steel Inorganic materials 0.000 description 1
- 239000010935 stainless steel Substances 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 239000001384 succinic acid Substances 0.000 description 1
- 235000019408 sucralose Nutrition 0.000 description 1
- BAQAVOSOZGMPRM-QBMZZYIRSA-N sucralose Chemical compound O[C@@H]1[C@@H](O)[C@@H](Cl)[C@@H](CO)O[C@@H]1O[C@@]1(CCl)[C@@H](O)[C@H](O)[C@@H](CCl)O1 BAQAVOSOZGMPRM-QBMZZYIRSA-N 0.000 description 1
- 125000000472 sulfonyl group Chemical group *S(*)(=O)=O 0.000 description 1
- YROXIXLRRCOBKF-UHFFFAOYSA-N sulfonylurea Chemical class OC(=N)N=S(=O)=O YROXIXLRRCOBKF-UHFFFAOYSA-N 0.000 description 1
- 230000009747 swallowing Effects 0.000 description 1
- 229940127230 sympathomimetic drug Drugs 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 235000012222 talc Nutrition 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 239000012085 test solution Substances 0.000 description 1
- 239000000892 thaumatin Substances 0.000 description 1
- 235000010436 thaumatin Nutrition 0.000 description 1
- OGIDPMRJRNCKJF-UHFFFAOYSA-N titanium oxide Inorganic materials [Ti]=O OGIDPMRJRNCKJF-UHFFFAOYSA-N 0.000 description 1
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 1
- 235000013337 tricalcium citrate Nutrition 0.000 description 1
- 208000001072 type 2 diabetes mellitus Diseases 0.000 description 1
- 210000002700 urine Anatomy 0.000 description 1
- 239000008371 vanilla flavor Substances 0.000 description 1
- 239000005526 vasoconstrictor agent Substances 0.000 description 1
- 238000005550 wet granulation Methods 0.000 description 1
Landscapes
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
Description
本発明は、溶出性が改善され、かつ、口腔内で良好な崩壊性を示すとともに、実用的な錠剤硬度が確保され、服用時の口当たりが良い口腔内速崩壊錠、特にグリメピリド口腔内速崩壊錠、及びその製造法に関する。 The present invention has an improved dissolution property and exhibits good disintegration in the oral cavity, ensures a practical tablet hardness, and has a good mouthfeel when taken, especially glimepiride oral disintegration in the oral cavity The present invention relates to a lock and a method for producing the same.
近年、高齢化社会が進み、生理的諸機能の低下または老人性痴呆症などにより、食物摂取機能(咀嚼、嚥下など)の低下したまたは障害のある高齢者が増加している。また、高齢者の中には夜尿症患者も多く存在し、このような患者に対して錠剤を水で服用させた場合、服用困難あるいは、夜尿の懸念等の問題が生じてきている。一方、忙しい現代社会において時間および場所を選ばずに服用することができるという利点から、服用時に水を必要としない経口製剤の開発が求められている。
そこで、水なしでも服用可能な経口製剤の開発が種々なされており、その一つとして口腔内崩壊錠が盛んに開発されている。
In recent years, an aging society has progressed, and the number of elderly people with reduced or impaired food intake functions (such as mastication and swallowing) due to decreased physiological functions or senile dementia is increasing. In addition, there are many patients with nocturnal enuresis among elderly people, and when taking such patients with water, problems such as difficulty in taking or concern about nocturnal urine have arisen. On the other hand, because of the advantage that it can be taken at any time and place in a busy modern society, development of an oral preparation that does not require water at the time of taking is required.
Therefore, various oral preparations that can be taken without water have been developed, and as one of them, orally disintegrating tablets have been actively developed.
口腔内速崩壊錠は服用したときに速やかに崩壊することが必要であるが、服用までの保存、運搬等においては破損したりしない適度硬度を必要とすると共に、保存安定性も必要とされる。口腔内速崩壊錠の錠剤自体の保存安定性、特に加湿条件下での保存安定性の優れた口腔内速崩壊錠として、ファモチジンなどの薬剤、糖類及びポリビニルアルコールを配合した口腔内速崩壊錠が特許文献1に開示されている。 Intraoral quick disintegrating tablets need to disintegrate quickly when taken, but they need to have a moderate hardness that will not break during storage and transportation before taking, and storage stability is also required. . Orally rapidly disintegrating tablets containing a drug such as famotidine, saccharides and polyvinyl alcohol as an intraoral quick disintegrating tablet with excellent storage stability, especially storage stability under humidified conditions. It is disclosed in Patent Document 1.
また、特許文献2には、プラバスタチンナトリウムとD−マンニトール等の糖類とを混合し、ポリビニルアルコール等の結合剤を溶解した水及び/又は水溶解性有機溶媒を加えて練合し、充填穴に充填後フィルムを介して圧縮成形する速崩壊性錠剤が開示されている。
本発明者らは、溶出性が改善され、服用時の口当たりが良く、且つ実用的な錠剤硬度を有し、保存安定性等にも優れる口腔内速崩壊錠を開発すべく種々検討したところ、ポリビニルアルコール類を結合剤として使用したとき、ポリビニルアルコール類を多くすると薬剤の溶出性が改善される一方で、口腔内速崩壊錠で要求される速崩壊性が損なわれる傾向があることを見出した。そこで本発明者らは速崩壊性を損ねることなく、溶出性、特に、投与時初期の溶出性を満足させ得る方法を種々検討の結果、本発明を完成した。 The inventors of the present invention have made various studies in order to develop an orally rapidly disintegrating tablet with improved dissolution, good mouthfeel when taken, practical tablet hardness, excellent storage stability, etc. When polyvinyl alcohols were used as binders, it was found that increasing the number of polyvinyl alcohols improved the drug dissolution, while the rapid disintegration required for intraoral quick disintegrating tablets tended to be impaired. . Therefore, the present inventors have completed the present invention as a result of various investigations on methods that can satisfy the dissolution property, particularly the dissolution property at the initial stage of administration, without impairing the rapid disintegration property.
即ち、本発明者らは、上記課題を鋭意検討した結果、ポリビニルアルコール類を結合剤として使用する際に、水溶性ポリオキシエチレン類、特に、ステアリン酸ポリオキシルを併用することにより、上記課題を解決できることを見出し、本発明を完成させた。 That is, as a result of intensive studies on the above problems, the present inventors solved the above problems by using water-soluble polyoxyethylenes, in particular, polyoxyl stearate, when polyvinyl alcohols are used as a binder. The present invention has been completed by finding out what can be done.
即ち本発明は
(1)医薬活性成分、ポリビニルアルコール及びポリビニルアルコールコポリマーからなる群から選ばれる少なくとも一つのポリビニルアルコール類、及び、ポリエチレングリコール、ポリオキシエチレンポリオキシプロピレングリコール、ポリエチレングリコールエーテル及びポリエチレングリコール脂肪酸エステルからなる群から選ばれる少なくとも一つの水溶性ポリオキシエチレン類を含有し、口腔内速崩壊錠の総量に対して、ポリビニルアルコール類の含量が0.1〜3質量%及び水溶性ポリオキシエチレン類の含量が0.05〜1質量%であり、口腔内において30秒以内に崩壊する口腔内速崩壊錠(但し、エリスリトールを含むものを除く)、
(2) 賦形剤及び崩壊剤を更に含む上記(1)に記載の口腔内速崩壊錠、
(3)賦形剤含量が、口腔内速崩壊錠の総量に対して、50〜80質量%である上記(2)に記載の口腔内速崩壊錠、
(4) ポリビニルアルコール類の含量が0.3〜1質量%であることを特徴とする上記(3)に記載の口腔内速崩壊錠、
(5)口腔内速崩壊錠の総量に対して、崩壊剤含量が、0.5〜7質量%であり、かつ賦形剤及び崩壊剤の合計含量が、50〜98質量%である上記(2)〜(4)のいずれか一項に記載の口腔内速崩壊錠、
That is, the present invention
(1) pharmaceutically active ingredient, at least one polyvinyl alcohol selected from the group consisting of polyvinyl alcohol and polyvinyl alcohol copolymers, and polyethylene glycol, polyoxyethylene polyoxypropylene glycol, the group consisting of polyethylene glycol ethers and polyethylene glycol fatty acid esters At least one water-soluble polyoxyethylene selected from the group consisting of 0.1 to 3% by mass of polyvinyl alcohol and 0.1% by mass of water-soluble polyoxyethylene based on the total amount of the orally rapidly disintegrating tablet 0.05 to 1% by mass , rapidly disintegrating tablet in the oral cavity that disintegrates within 30 seconds in the oral cavity (excluding those containing erythritol) ,
(2) The intraoral quick disintegrating tablet according to (1), further comprising an excipient and a disintegrant;
(3) The intraoral rapidly disintegrating tablet according to the above (2 ), wherein the excipient content is 50 to 80% by mass with respect to the total amount of the orally rapidly disintegrating tablet,
(4) The intraoral rapidly disintegrating tablet according to (3) above, wherein the content of polyvinyl alcohol is 0.3 to 1% by mass,
(5) The above ( the disintegrant content is 0.5 to 7% by mass and the total content of the excipient and the disintegrant is 50 to 98% by mass with respect to the total amount of the orally rapidly disintegrating tablet ( 2 ) -orally fast disintegrating tablet according to any one of (4),
(6) ポリビニルアルコール類と水溶性ポリオキシエチレン類の含量の合計が口腔内速崩壊錠の総量に対して0.3〜1質量%であることを特徴とする上記(1)〜(5)のいずれか一項に記載の口腔内速崩壊錠、
(7) 製剤全体に対して、医薬活性成分を0.5〜5質量%、ポリビニルアルコール類を0.1〜3質量%、及び水溶性ポリオキシエチレン類を0.05〜1質量%を含み、残部が賦形剤、崩壊剤及びその他の医薬添加剤であることを特徴とする上記(1)〜(5)のいずれか一項に記載の口腔内速崩壊錠、
(8) ポリビニルアルコール類が、部分鹸化ポリビニルアルコールである上記(1)〜(7)のいずれか一項に記載の口腔内速崩壊錠、
(9) 部分鹸化ポリビニルアルコールが粘度3〜8mPa・S(4%、20℃)である部分鹸化ポリビニルアルコールである上記(8)に記載の口腔内速崩壊錠、
(10) 水溶性ポリオキシエチレン類が、ステアリン酸ポリオキシルである上記(1)〜(9)のいずれか一項に記載の口腔内速崩壊錠、
(11) 医薬活性成分がグリメピリドである上記(1)〜(10)のいずれか一項に記載の口腔内速崩壊錠、
(12)賦形剤が乳糖水和物である上記(2)〜(11)のいずれか一項に記載の口腔内速崩壊錠
(13) 賦形剤に、ポリビニルアルコール類含有溶液に水不溶性の医薬活性成分を均一に分散した分散液を噴霧して、流動層造粒し、得られた造粒物に、配合済みの賦形剤及び後で添加する滑沢剤を除く、水溶性ポリオキシエチレン類及びその他の医薬添加物を均一に混合し、得られた混合物に、滑沢剤を添加混合したのち、打錠することにより得られた上記(1)〜(12)のいずれか一項に記載の口腔内速崩壊錠、
に関するものである。
(6) The above (1) to (5), wherein the total content of polyvinyl alcohols and water-soluble polyoxyethylenes is 0.3 to 1% by mass with respect to the total amount of the rapidly disintegrating tablet in the oral cavity. Orally rapidly disintegrating tablet according to any one of
(7) 0.5 to 5% by mass of pharmaceutically active ingredient, 0.1 to 3% by mass of polyvinyl alcohols, and 0.05 to 1% by mass of water-soluble polyoxyethylenes with respect to the whole preparation In addition, the intraoral rapidly disintegrating tablet according to any one of the above (1) to (5) , wherein the balance is an excipient, a disintegrant and other pharmaceutical additives,
(8) The intraorally rapidly disintegrating tablet according to any one of (1) to (7), wherein the polyvinyl alcohol is partially saponified polyvinyl alcohol,
(9) The intraorally rapidly disintegrating tablet according to (8), wherein the partially saponified polyvinyl alcohol is a partially saponified polyvinyl alcohol having a viscosity of 3 to 8 mPa · S (4%, 20 ° C.),
(10) The intraorally rapidly disintegrating tablet according to any one of (1) to (9), wherein the water-soluble polyoxyethylene is polyoxyl stearate,
(11) The intraorally rapidly disintegrating tablet according to any one of (1) to (10), wherein the pharmaceutically active ingredient is glimepiride,
(12) The intraorally rapidly disintegrating tablet according to any one of (2) to (11), wherein the excipient is lactose hydrate.
(13) A dispersion liquid in which a water-insoluble pharmaceutically active ingredient is uniformly dispersed in a polyvinyl alcohol-containing solution is sprayed on the excipient, and fluidized bed granulation is carried out. Water-soluble polyoxyethylenes and other pharmaceutical additives, excluding the form and the lubricant to be added later, are mixed uniformly, and the resulting mixture is mixed with a lubricant and then tableted. the resulting (1) to (12) either orally fast disintegrating tablet according to one of,
It is about.
本発明によって得られる口腔内速崩壊錠は、錠剤自体の保存安定性等が優れると共に、初期の溶出性が改善され、且つ速崩壊性をも備えるものである。 The intraoral quick disintegrating tablet obtained by the present invention has excellent storage stability and the like of the tablet itself, has improved initial dissolution properties, and also has quick disintegrating properties.
本発明は、有効成分としての医薬活性成分、結合剤としてポリビニルアルコール類および、初期の溶出改善剤としてステアリン酸ポリオキシル等の水溶性ポリオキシエチレン類を含有する口腔内速崩壊錠に関する。最も好ましくは医薬活性成分とともに、ポリビニルアルコール類及びステアリン酸ポリオキシルを含有する口腔内速崩壊錠に関するものである。 The present invention relates to an orally rapidly disintegrating tablet containing a pharmaceutically active ingredient as an active ingredient, polyvinyl alcohol as a binder, and water-soluble polyoxyethylenes such as polyoxyl stearate as an initial dissolution improving agent. Most preferably, it relates to an orally rapidly disintegrating tablet containing polyvinyl alcohols and polyoxyl stearate together with pharmaceutically active ingredients.
本発明において「口腔内速崩壊錠」とは、口腔内の唾液のみで90秒以内、好ましくは60秒以内、さらに好ましくは30秒以内に崩壊し、水を摂取することなく口腔内で崩壊させて服用が可能な錠剤を意味する。また、この「口腔内速崩壊錠」は、錠剤のPTP取出し時において、割れ・欠けを生じない程度の錠剤硬度を有するものが好ましい。
具体的には、6〜8mm径の錠剤において、硬度が20N以上、好ましくは30N以上、さらに好ましくは40N以上、最も好ましくは45N以上である口腔内速崩壊錠が挙げられる。さらには、25℃相対湿度75%下1週間の条件で保存後の硬度が20N以上、好ましくは30N以上、さらに好ましくは40N以上、最も好ましくは45N以上である口腔内速崩壊錠が挙げられる。
なお以下において断りの無い限り、「部」は質量部を表すものとする。
In the present invention, “orally disintegrating tablet in the oral cavity” means disintegrating within 90 seconds, preferably within 60 seconds, more preferably within 30 seconds, with only saliva in the oral cavity, and disintegrating in the oral cavity without ingesting water. It means tablets that can be taken. Further, this “orally-fast disintegrating tablet” preferably has a tablet hardness that does not cause cracking or chipping when the PTP is taken out of the tablet.
Specifically, in tablets having a diameter of 6 to 8 mm, an orally rapidly disintegrating tablet having a hardness of 20 N or more, preferably 30 N or more, more preferably 40 N or more, and most preferably 45 N or more can be mentioned. Furthermore, an orally rapidly disintegrating tablet having a hardness after storage of 20 N or more, preferably 30 N or more, more preferably 40 N or more, and most preferably 45 N or more under the conditions of 25 ° C. and 75% relative humidity for 1 week.
In the following description, “part” represents part by mass unless otherwise specified.
本発明の口腔内速崩壊錠における医薬活性成分としては、通常、水不溶性の薬剤が使用される。例えば、解熱鎮痛消炎薬、向精神薬、抗不安薬、抗うつ薬、催眠鎮静薬、鎮痙薬、中枢神経作用薬、脳代謝改善剤、脳循環改善剤、抗てんかん剤、交感神経興奮剤、胃腸薬、制酸剤、抗潰瘍剤、鎮咳去痰剤、鎮吐剤、呼吸促進剤、気管支拡張剤、アレルギー用薬、歯科口腔用薬、抗ヒスタミン剤、強心剤、不整脈用剤、利尿薬、血圧降下剤、血管収縮薬、冠血管拡張薬、末梢血管拡張薬、高脂血症用剤、利胆剤、抗生物質、化学療法剤、糖尿病用剤、骨粗しょう症用剤、抗リウマチ薬、骨格筋弛緩薬、鎮けい剤、ホルモン剤、アルカロイド系麻薬、サルファ剤、痛風治療薬、血液凝固阻止剤、抗悪性腫瘍剤などから選ばれた1種または2種以上の成分が用いられる。
本発明の口腔内速崩壊錠における医薬活性成分含量は本発明の効果を達成しうる範囲で特に限定はない。通常は口腔内速崩壊錠の総量に対して、0.5〜10質量%程度、より好ましくは0.5〜5質量%程度、更に好ましくは0.5〜3質量%程度を使用するのが好ましい。
As the pharmaceutically active ingredient in the intraoral rapidly disintegrating tablet of the present invention, a water-insoluble drug is usually used. For example, antipyretic analgesics, antipsychotics, anti-anxiety drugs, antidepressants, hypnotic sedatives, antispasmodic drugs, central nervous system drugs, brain metabolism improving agents, cerebral circulation improving agents, antiepileptic agents, sympathomimetic drugs, Gastrointestinal, Antacid, Antiulcer, Antitussive, Antiemetic, Antiemetic, Respiratory, Bronchodilator, Allergy, Dental Oral, Antihistamine, Cardiotonic, Arrhythmic, Diuretic, Antihypertensive, Vasoconstrictor, Coronary vasodilator, Peripheral vasodilator, Hyperlipidemia, Biliate, Antibiotic, Chemotherapy, Diabetes, Osteoporosis, Antirheumatic, Skeletal muscle relaxant One or more components selected from antispasmodic agents, hormonal agents, alkaloid narcotics, sulfa drugs, anti-gout drugs, anticoagulants, anti-neoplastic agents and the like are used.
The content of the pharmaceutically active ingredient in the intraoral quick disintegrating tablet of the present invention is not particularly limited as long as the effect of the present invention can be achieved. Usually, about 0.5 to 10% by mass, more preferably about 0.5 to 5% by mass, and still more preferably about 0.5 to 3% by mass is used with respect to the total amount of the orally rapidly disintegrating tablet. preferable.
本発明は水不溶性の何れの医薬活性成分にも適用出来るが、グリメピリドが最も好ましく、以下グリメピリドを代表例として詳しく説明する。
グリメピリドは、化学名は1‐[[4‐[2‐[(3‐エチル‐4‐メチル‐2‐オキソ‐3‐ピロリン‐1‐イルカルボニル)アミノ]エチル]フェニル]スルホニル]‐3‐(4α‐メチルシクロヘキサン‐1β‐イル)尿素であって、スルホニルウレア系経口血糖降下剤として特にインスリン非依存型糖尿病に対して効能を有する。
The present invention can be applied to any water-insoluble pharmaceutically active ingredient, but glimepiride is most preferred, and glimepiride will be described in detail below as a representative example.
Glimepiride has the chemical name 1-[[4- [2-[(3-ethyl-4-methyl-2-oxo-3-pyrrolin-1-ylcarbonyl) amino] ethyl] phenyl] sulfonyl] -3- ( 4α-methylcyclohexane-1β-yl) urea, which is particularly effective as a sulfonylurea oral hypoglycemic agent for non-insulin dependent diabetes.
本発明に用いられるポリビニルアルコール類は、医薬品の分野において配合することが認められているものであれば特に制限されず、単独で、又は2種以上を組み合わせて使用することができる。
本発明の口腔内速崩壊錠に結合剤として使用するポリビニルアルコール類は、ポリビニルアルコール類に分類され、結合剤として使用されるものは何れでも良く、好ましいものとしては、ポリビニルアルコール、又は、ポリビニルアルコール(メタ)アクリル酸などのポリビニルアルコールコポリマーが挙げられる。通常ポリビニルアセテートを酸またはアルカリで加水分解して得られる部分加水分解物(部分鹸化物)または完全加水分解物であるポリビニルアルコールが好ましい。
本発明においては、通常1〜50mPa・S(4%水溶液、20℃:以下同じ)程度の粘度を有するポリビニルアルコールが好ましい。より好ましくは3〜30mPa・S程度、さらに好ましくは3〜8mPa・S、最も好ましくは4.8〜5.8mPa・S程度の粘度を有するポリビニルアルコールが使用される。
本発明において用いられるポリビニルアルコールは、完全鹸化物および部分鹸化物の何れでもよい。好ましいポリビニルアルコールは、鹸化度が通常70%以上、より好ましくは80%以上、より好ましくは85%以上のものであり、鹸化度70%以上の部分鹸化ポリビニルアルコールがより好ましい。最も好ましくは鹸化度が85%以上90%以下のものである。
またこれらのポリビニルアルコール類は、速崩壊錠の総量に対して、0.1〜3質量%程度、好ましくは0.1〜1質量%程度、更に好ましくは0.3〜0.6質量%程度用いるのが好ましい。
本発明の口腔内速崩壊錠には、ポリビニルアルコール類以外の他の結合剤を併用することもできるが通常ポリビニルアルコール類が主体であることが好ましく、例えば60%以上、より好ましくは80%、更に好ましくは90%以上で、単独が最も好ましい。
The polyvinyl alcohol used for this invention will not be restrict | limited especially if mix | blending in the field | area of a pharmaceutical is recognized, It can use individually or in combination of 2 or more types.
The polyvinyl alcohols used as the binder in the intraoral rapidly disintegrating tablet of the present invention are classified into polyvinyl alcohols, and any of them may be used as the binder, and preferable ones are polyvinyl alcohol or polyvinyl alcohol. Examples thereof include polyvinyl alcohol copolymers such as (meth) acrylic acid. Usually, polyvinyl alcohol which is a partial hydrolyzate (partially saponified product) or a complete hydrolyzate obtained by hydrolyzing polyvinyl acetate with an acid or an alkali is preferred.
In the present invention, polyvinyl alcohol having a viscosity of about 1 to 50 mPa · S (4% aqueous solution, 20 ° C .: hereinafter the same) is preferable. More preferably, polyvinyl alcohol having a viscosity of about 3 to 30 mPa · S, more preferably about 3 to 8 mPa · S, and most preferably about 4.8 to 5.8 mPa · S is used.
The polyvinyl alcohol used in the present invention may be either a completely saponified product or a partially saponified product. Preferred polyvinyl alcohol has a saponification degree of usually 70% or more, more preferably 80% or more, more preferably 85% or more, and more preferably partially saponified polyvinyl alcohol having a saponification degree of 70% or more. Most preferably, the saponification degree is 85% or more and 90% or less.
These polyvinyl alcohols are about 0.1 to 3% by mass, preferably about 0.1 to 1% by mass, more preferably about 0.3 to 0.6% by mass, based on the total amount of the rapidly disintegrating tablet. It is preferable to use it.
In the intraoral quick disintegrating tablet of the present invention, other binders other than polyvinyl alcohols can be used in combination, but usually it is preferably mainly polyvinyl alcohols, for example, 60% or more, more preferably 80%, More preferably, it is 90% or more, and alone is most preferable.
本発明の口腔内速崩壊錠でポリビニルアルコール類と併用する水溶性ポリオキシエチレン類とは、一般に、式:−(CH2CH2O)n−で示されるポリオキシエチレン骨格を有するポリマーをいう。
本発明で用いられる水溶性ポリオキシエチレン類は、本発明の効果を達成しうるもので、かつ医薬品の分野において配合することが認められているものであれば、その種類は特に制限されず、単独で、又は2種以上を組み合わせて使用することができる。かかる水溶性ポリオキシエチレン類としては、ポリエチレングリコール類(好ましくは平均分子量が190〜25,000程度のもの)、ポリオキシエチレンポリオキシプロピレングリコール類(好ましくは、プロピレンオキシドの平均重合度:5〜67程度、かつ、エチレンオキシドの平均重合度:42〜196程度であるもの)、ポリエチレングリコールエーテル類(たとえば、第十五改正日本薬局方記載のポリソルベート80(部分的にオレイン酸でエステル化された無水ソルビットのポリエチレングリコールエーテル)等)、ポリエチレングリコール脂肪酸エステル類(たとえば、第十五改正日本薬局方記載のステアリン酸ポリオキシル40等)などが挙げられる。
なかでも好ましい水溶性ポリオキシエチレン類は、上記ポリエチレングリコール類、ポリエチレングリコールエーテル類、ポリエチレングリコール脂肪酸エステル類であり、より好ましくはポリエチレングリコール脂肪酸エステル類であり、特に好ましくはステアリン酸ポリオキシル(ステアリン酸ポリオキシルの中ではステアリン酸ポリオキシル40がより好ましい)である。
またこれらの水溶性ポリオキシエチレン類は、口腔内速崩壊錠の総量に対して、0.01〜1質量%程度、より好ましくは0.05〜1質量%程度、更に好ましくは0.05〜0.2質量%程度用いるのが好ましい。
本発明においては、ポリビニルアルコール類と併用する水溶性ポリオキシエチレン類(好ましくはステアリン酸ポリオキシル)とのバランスが重要である。例えば、口腔内速崩壊錠の総量に対して、ポリビニルアルコール類を0.1〜3質量%、より好ましくは0.3〜1質量%、更に好ましくは0.3〜0.6質量%であるとき、水溶性ポリオキシエチレン類(好ましくはステアリン酸ポリオキシル)を、0.05〜0.3質量%、より好ましくは0.08〜0.2質量%含有するのが好ましい。そして、両者の合計が口腔内速崩壊錠の総量に対して0.3〜1質量%であるときより好ましい。
The water-soluble polyoxyethylenes used in combination with polyvinyl alcohol in the oral cavity rapid disintegrating tablet of the present invention, in general, the formula :-( CH 2 CH 2 O) n - refers to a polymer having a polyoxyethylene skeleton represented by .
The water-soluble polyoxyethylenes used in the present invention are not particularly limited as long as they can achieve the effects of the present invention and are recognized to be blended in the pharmaceutical field. It can be used alone or in combination of two or more. Examples of such water-soluble polyoxyethylenes include polyethylene glycols (preferably having an average molecular weight of about 190 to 25,000) and polyoxyethylene polyoxypropylene glycols (preferably, the average degree of polymerization of propylene oxide: 5 to 5). 67 and an average degree of polymerization of ethylene oxide: about 42 to 196), polyethylene glycol ethers (for example, polysorbate 80 described in Japanese Pharmacopoeia 15th (anhydrous partially esterified with oleic acid) And polyethylene glycol fatty acid esters (for example, polyoxyl 40 stearate described in the 15th revision Japanese Pharmacopoeia) and the like.
Among them, preferable water-soluble polyoxyethylenes are the above polyethylene glycols, polyethylene glycol ethers, polyethylene glycol fatty acid esters, more preferably polyethylene glycol fatty acid esters, and particularly preferably polyoxyl stearate (polyoxyl stearate). Among them, polyoxyl stearate 40 is more preferable.
Moreover, these water-soluble polyoxyethylenes are about 0.01-1 mass% with respect to the total amount of an intraoral quick disintegrating tablet, More preferably, it is about 0.05-1 mass%, More preferably, 0.05- It is preferable to use about 0.2% by mass.
In the present invention, balance with water-soluble polyoxyethylenes (preferably polyoxyl stearate) used in combination with polyvinyl alcohols is important. For example, the polyvinyl alcohol is 0.1 to 3% by mass, more preferably 0.3 to 1% by mass, and still more preferably 0.3 to 0.6% by mass with respect to the total amount of the orally rapidly disintegrating tablet. In some cases, it is preferable to contain water-soluble polyoxyethylenes (preferably polyoxyl stearate) in an amount of 0.05 to 0.3% by mass, more preferably 0.08 to 0.2% by mass. And when both total is 0.3-1 mass% with respect to the total amount of an intraoral quick disintegrating tablet, it is more preferable.
本発明の口腔内速崩壊錠に用いる賦形剤としては、例えば、白糖、乳糖、マンニトール及びグルコース等の糖類、結晶セルロース、クエン酸カルシウム、リン酸水素カルシウム及び硫酸カルシウム等が挙げられる。これら賦形剤は単独又は二種以上を混合して使用してもよい。これらの中で好ましいものとしては、乳糖又はマンニトールを挙げることができ、乳糖がもっとも好ましい。乳糖は、通常乳糖水和物が使用される。口腔内速崩壊錠における賦形剤の含量は他の添加剤の残部であるが、通常、口腔内速崩壊錠の総量に対して50〜80%程度、より好ましくは60〜75%程度である。賦形剤として乳糖(乳糖水和物)を使用する場合、場合により、少量の結晶セルロースの併用が好ましい。結晶セルロースの配合量は口腔内速崩壊錠の総量に対して、5〜20%、より好ましくは10〜15%程度である。
本発明の口腔内速崩壊錠に用いる崩壊剤としては、例えば、クロスポビドン、カルメロース、カルメロースカルシウム、クロスカルメロースナトリウム、カルボキシメチルスターチナトリウム、低置換度ヒドロキシプロピルセルロース、トウモロコシデンプン等が挙げられる。好ましいのはクロスポビドン、トウモロコシデンプン等であり、最も好ましくはクロスポビドンである。これらの崩壊剤は二種以上併用することもできるが、通常単独で使用される。崩壊剤の使用量は使用する崩壊剤にもよるので一概には言えないが口腔内速崩壊錠の総量に対して、0.5〜7%程度、より好ましくは1〜5%程度である。
本発明の口腔内速崩壊錠において、通常、口腔内速崩壊錠の総量に対して、賦形剤と崩壊剤とで併せて50〜98質量%程度、好ましくは併せて70〜97質量%程度、更に好ましくは併せて90〜97質量%程度である。
Examples of the excipient used in the intraoral quick disintegrating tablet of the present invention include saccharides such as sucrose, lactose, mannitol and glucose, crystalline cellulose, calcium citrate, calcium hydrogen phosphate and calcium sulfate. These excipients may be used alone or in admixture of two or more. Among these, lactose or mannitol can be mentioned as preferred, and lactose is most preferred. As lactose, lactose hydrate is usually used. The content of the excipient in the intraoral quick disintegrating tablet is the remainder of the other additives, but is usually about 50 to 80%, more preferably about 60 to 75% with respect to the total amount of the intraoral quick disintegrating tablet. . When using lactose (lactose hydrate) as an excipient, it is sometimes preferable to use a small amount of crystalline cellulose. The blending amount of the crystalline cellulose is about 5 to 20%, more preferably about 10 to 15% with respect to the total amount of the intraoral quick disintegrating tablet.
Examples of the disintegrant used in the orally rapidly disintegrating tablet of the present invention include crospovidone, carmellose, carmellose calcium, croscarmellose sodium, carboxymethyl starch sodium, low-substituted hydroxypropylcellulose, corn starch and the like. Preferred are crospovidone, corn starch and the like, most preferably crospovidone. These disintegrants can be used in combination of two or more, but are usually used alone. Although the amount of the disintegrant used depends on the disintegrant used, it cannot be generally specified, but it is about 0.5 to 7%, more preferably about 1 to 5% with respect to the total amount of the intraoral quick disintegrating tablet.
In the intraoral quick disintegrating tablet of the present invention, the excipient and the disintegrant are usually about 50 to 98% by mass, preferably about 70 to 97% by mass, based on the total amount of the intraoral quick disintegrating tablet. More preferably, the combined amount is about 90 to 97% by mass.
本発明の口腔内速崩壊錠は、さらに必要であれば錠剤の製造に一般に用いられる上記以外の種々の医薬用添加剤を含んでいてもよい。例えば、錠剤全質量に対し0〜10質量%、好ましくは0.1〜5質量%、更に好ましくは0.5〜4質量%の添加剤を含んでいてもよい。またこれらの物質は、単独または任意の割合で混合して使用してもよい。
上記以外の種々の医薬用添加剤としては、例えば甘味剤、矯味剤、香料、滑沢剤、流動化剤、着色剤などが挙げられる。
The intraoral quick disintegrating tablet of the present invention may further contain various pharmaceutical additives other than those generally used for tablet production, if necessary. For example, 0 to 10% by mass, preferably 0.1 to 5% by mass, and more preferably 0.5 to 4% by mass of an additive may be included with respect to the total mass of the tablet. These substances may be used alone or in admixture at any ratio.
Examples of various pharmaceutical additives other than the above include sweeteners, flavoring agents, fragrances, lubricants, fluidizing agents, and coloring agents.
本発明の口腔内速崩壊錠において使用する甘味剤としては、非糖質の天然甘味料や合成甘味料が好ましい。例えば、アセスルファムカリウム、アスパルテーム、サッカリン又はその塩、グリチルリチン酸又はその塩、ステビア又はその塩、スクラロース、ソーマチンなどが挙げられる。 The sweetener used in the intraoral quick disintegrating tablet of the present invention is preferably a non-saccharide natural sweetener or a synthetic sweetener. Examples thereof include acesulfame potassium, aspartame, saccharin or a salt thereof, glycyrrhizic acid or a salt thereof, stevia or a salt thereof, sucralose, thaumatin and the like.
矯味剤としては、例えば、アスコルビン酸及びその塩、グリシン、塩化ナトリウム、塩化マグネシウム、塩酸、希塩酸、クエン酸及びその塩、無水クエン酸、L−グルタミン酸及びその塩、コハク酸及びその塩、酢酸、酒石酸及びその塩、炭酸水素ナトリウム、フマル酸及びその塩、リンゴ酸及びその塩、氷酢酸、イノシン酸二ナトリウム、ハチミツなどが挙げられる。
香料とは、着香剤といわれるものを含み、例えばオレンジエッセンス、オレンジ油、カラメル、カンフル、ケイヒ油、スペアミント油、ストロベリーエッセンス、チョコレートエッセンス、チェリーフレーバー、トウヒ油、パインオイル、ハッカ油、バニラフレーバー、ビターエッセンス、フルーツフレーバー、ペパーミントエッセンス、ミックスフレーバー、ミントフレーバー、メントール、レモンパウダー、レモン油、ローズ油などが挙げられる。
Examples of the corrigent include ascorbic acid and its salt, glycine, sodium chloride, magnesium chloride, hydrochloric acid, dilute hydrochloric acid, citric acid and its salt, anhydrous citric acid, L-glutamic acid and its salt, succinic acid and its salt, acetic acid, Examples thereof include tartaric acid and its salt, sodium hydrogen carbonate, fumaric acid and its salt, malic acid and its salt, glacial acetic acid, disodium inosinate, honey and the like.
Perfumes include what are called flavoring agents, such as orange essence, orange oil, caramel, camphor, cinnamon oil, spearmint oil, strawberry essence, chocolate essence, cherry flavor, spruce oil, pine oil, mint oil, vanilla flavor. , Bitter essence, fruit flavor, peppermint essence, mixed flavor, mint flavor, menthol, lemon powder, lemon oil, rose oil and the like.
滑沢剤としては、例えばステアリン酸マグネシウム、ステアリン酸カルシウム、タルク、ショ糖脂肪酸エステルなどが挙げられる。通常ステアリン酸マグネシウムが使用される。
流動化剤としては、例えば含水二酸化ケイ素、軽質無水ケイ酸、重質無水ケイ酸、酸化チタンなどが挙げられる。
着色剤としては、例えば、食用赤色3号、食用黄色5号、食用青色1号などの食用色素、黄色三二酸化鉄、三二酸化鉄、褐色酸化鉄、黒酸化鉄、銅クロロフィル、銅クロロフィリンナトリウム、リボフラビン、抹茶末などが挙げられる。
これらの成分は本発明の口腔内速崩壊錠における崩壊性、成形性を損なわない範囲であれば、通常、任意の量を単独あるいは混合して使用することができる。
Examples of the lubricant include magnesium stearate, calcium stearate, talc, and sucrose fatty acid ester. Usually magnesium stearate is used.
Examples of the fluidizing agent include hydrous silicon dioxide, light anhydrous silicic acid, heavy anhydrous silicic acid, titanium oxide and the like.
Examples of the colorant include food colors such as food red No. 3, food yellow No. 5, food blue No. 1, yellow ferric oxide, ferric oxide, brown iron oxide, black iron oxide, copper chlorophyll, copper chlorophyllin sodium, Examples include riboflavin and powdered green tea.
Any amount of these components can be used alone or in combination as long as they do not impair the disintegration property and moldability of the intraoral rapidly disintegrating tablet of the present invention.
本発明の口腔内速崩壊錠は、下記の方法で製造することができる。
具体的な製造方法としては、活性成分(好ましくはグリメピリド)と製造原料を量り取り、V型混合機などの適当な混合機で混合した錠剤用混合末を後述する打錠機を用いて直接圧縮打錠して製造する方法などが挙げられる。また、錠剤用混合末を得るためにロール圧縮機により乾式造粒する方法や、必要により結合剤を分散または溶解させた水、アセトン、エチルアルコール、プロピルアルコール又はこれらの混合液を用いて湿式造粒を行う方法、さらには2つ以上の別群に分けて錠剤用混合末を製造する方法などを用いてもよい。錠剤用混合末を製造する際には必要に応じ、結合剤、矯味剤、流動化剤、滑沢剤、香料、甘味剤、着色剤などを混合してもよい。
また、本発明の口腔内速崩壊錠のより好ましい製造方法は、実施例に記載するように、ポリビニルアルコール含有溶液に水不溶性薬剤の微粒子を均一に分散した分散液を噴霧して、流動層造粒し、得られた造粒物に、水溶性ポリオキシエチレン類及び、配合済みの賦形剤及び後で添加する滑沢剤を除く、その他の医薬添加物を均一に混合し、得られた混合物に、滑沢剤を添加混合したのち、打錠する方法である。
本発明において医薬活性成分またはその薬学上許容される塩および添加物の粒子径は特に限定されないが、粒子径が小さい方が服用感に優れている。
The intraoral quick disintegrating tablet of the present invention can be produced by the following method.
As a specific production method, the active ingredient (preferably glimepiride) and production raw material are weighed, and mixed with a suitable mixer such as a V-type mixer, and directly mixed with a tableting machine to be described later. Examples of the method include tableting and manufacturing. Also, a dry granulation method using a roll compressor to obtain a mixed powder for tablets, or wet granulation using water, acetone, ethyl alcohol, propyl alcohol or a mixture thereof in which a binder is dispersed or dissolved as necessary. A method of granulating, or a method of producing a mixed powder for tablets by dividing into two or more separate groups may be used. When producing a mixed powder for tablets, a binder, a corrigent, a fluidizing agent, a lubricant, a fragrance, a sweetener, a coloring agent, and the like may be mixed as necessary.
Further, as described in the examples, a more preferable method for producing the intraoral rapidly disintegrating tablet of the present invention is to spray a dispersion in which fine particles of a water-insoluble drug are uniformly dispersed in a polyvinyl alcohol-containing solution, thereby forming a fluidized bed structure. The resulting granulated product was uniformly mixed with water-soluble polyoxyethylenes and other pharmaceutical additives, excluding blended excipients and lubricants added later. In this method, a lubricant is added to and mixed with the mixture, followed by tableting.
In the present invention, the particle size of the pharmaceutically active ingredient or pharmaceutically acceptable salt and additive thereof is not particularly limited, but the smaller the particle size, the better the feeling of dosing.
このようにして得られた錠剤用混合末を例えば単発打錠機、ロータリー式打錠機などを用いて200kg〜1000kg/杵、好ましくは、400kg〜800kg/杵の圧力を加え圧縮成形する。これより圧力が低いと錠剤硬度が不足し取扱上十分な硬度を確保できず、圧力が高いと崩壊が遅延するため好ましくない。
圧縮成形については、通常の打錠法を用いることができるが、外部滑沢打錠法を使用することもできる。外部滑沢打錠法により、滑沢剤の添加量を減らし、さらに崩壊速度を早くし、かつ錠剤硬度を向上させることができる。錠剤用混合末に滑沢剤を混合する通常の手法では100mgの錠剤に対して0.1〜1mgの滑沢剤が必要であるが、外部滑沢打錠法では0.5mg以下、場合により0.1mg以下の使用量での打錠が可能である。外部滑沢打錠を行う装置としては株式会社菊水製作所製のELS−P1タイプIIIなどがある。
The mixed powder for tablets thus obtained is compressed by applying a pressure of 200 kg to 1000 kg / kg, preferably 400 kg to 800 kg / kg, using a single tableting machine, a rotary tableting machine or the like. If the pressure is lower than this, the tablet hardness is insufficient and sufficient hardness for handling cannot be secured, and if the pressure is high, disintegration is delayed, which is not preferable.
For compression molding, a normal tableting method can be used, but an external lubrication tableting method can also be used. By the external lubricant tableting method, the amount of lubricant added can be reduced, the disintegration rate can be increased, and the tablet hardness can be improved. The usual method of mixing a lubricant with a powder mixture for tablets requires 0.1 to 1 mg of lubricant per 100 mg tablet, but the external lubricant tableting method requires 0.5 mg or less. Tableting with a use amount of 0.1 mg or less is possible. As an apparatus for external lubricant tableting, there is ELS-P1 type III manufactured by Kikusui Seisakusho Co., Ltd.
本発明の口腔内速崩壊錠は、どのような形状も採用することができ、例えば丸形、楕円形、球形、円柱状、棒状型、ドーナツ型の形状および積層錠、有核錠などであってもよく、さらにはコーティングによって被膜することもできる。また、識別性向上のためのマーク、文字などの刻印さらには分割用の割線を付けても良い。通常は円柱状の錠剤が使用される。 The intraoral quick disintegrating tablet of the present invention can adopt any shape, such as a round shape, an oval shape, a spherical shape, a cylindrical shape, a rod shape, a donut shape, a laminated tablet, and a dry-coated tablet. It may also be coated with a coating. Further, marks for improving the identification, characters, etc., or dividing lines for division may be added. Usually, cylindrical tablets are used.
本発明の口腔内速崩壊錠は、唾液により、口腔内で速やかに崩壊し、ざらつきを残さずに滑らかに服用可能である。本発明の口腔内速崩壊錠の口溶けは、通常1〜90秒、好ましくは1〜60秒、さらに好ましくは1〜30秒程度である。 The intraoral quick disintegrating tablet of the present invention is rapidly disintegrated in the oral cavity by saliva and can be taken smoothly without leaving a rough surface. The dissolution of the intraoral rapidly disintegrating tablet of the present invention is usually 1 to 90 seconds, preferably 1 to 60 seconds, and more preferably about 1 to 30 seconds.
また、一般的に口腔内速崩壊錠の硬度(錠剤硬度計による測定値)は、最低20N(2kgf)以上であれば問題の無い値であることが知られているが、本発明の口腔内速崩壊錠は30N(3kgf)以上、さらには40N(4kgf)以上でも良好な口腔内速崩壊性を示す。
なお、この製剤は口腔内で崩壊させることなく服用することや水と一緒に服用することもできる。
Moreover, it is generally known that the hardness (measured by a tablet hardness meter) of an orally rapidly disintegrating tablet is a value having no problem as long as it is at least 20 N (2 kgf) or more. Fast disintegrating tablets exhibit good intraoral rapid disintegration even at 30 N (3 kgf) or more, and even 40 N (4 kgf) or more.
In addition, this preparation can be taken without being disintegrated in the oral cavity or taken with water.
以下、本発明を実施例及び試験例により具体的に説明するが、本発明はこれら実施例に限定されるものではない。 EXAMPLES Hereinafter, although an Example and a test example demonstrate this invention concretely, this invention is not limited to these Examples.
実施例1〜3
ポリビニルアルコールを溶解させた水溶液(濃度11.3%w/w)に、グリメピリドをホモジナイザーで分散させた。流動層造粒機を用いて、その分散液を乳糖水和物に噴霧して流動層造粒した。 得られた造粒物に、滑沢剤を除く残り表記載の成分(結晶セルロース、クロスポビドン、トウモロコシデンプン、三二酸化鉄、軽質無水ケイ酸等)を加えて混合機を用いて均一に混合し、最後にステアリン酸マグネシウムを加えたのち、再度混合機で混合して打錠用顆粒を作製した。 次に打錠機を用い、直径6.0mmの円形状で隅角平の錠剤を作製した。得られた錠剤の硬度は50Nであった。得られた実施例1〜3の錠剤の処方を下記の表1に示す。
Examples 1-3
Glimepiride was dispersed with a homogenizer in an aqueous solution (concentration: 11.3% w / w) in which polyvinyl alcohol was dissolved. Using a fluidized bed granulator, the dispersion was sprayed onto lactose hydrate and fluidized bed granulated. To the resulting granulated product, add the ingredients listed in the remaining table (crystalline cellulose, crospovidone, corn starch, iron sesquioxide, light anhydrous silicic acid, etc.) excluding the lubricant and mix evenly using a mixer. Finally, magnesium stearate was added, and then mixed again with a mixer to prepare tablets for tableting. Next, using a tableting machine, a circular tablet with a diameter of 6.0 mm was prepared. The hardness of the obtained tablet was 50N. Table 1 below shows the formulation of the obtained tablets of Examples 1 to 3.
上記において、ポリビニルアルコール、ステアリン酸ポリオキシル40、乳糖水和物、結晶セルロースの各成分は下記のものを使用した。
ポリビニルアルコール:ポリビニルアルコール(部分けん化物)、商品名EG-05、日本合成化学工業株式会社製
ステアリン酸ポリオキシル40:商品名MYS-40MV、日光ケミカルズ株式会社製
乳糖水和物:乳糖水和物(200)、DMV製
結晶セルロース:商品名セオラスKG-1000、旭化成ケミカルズ株式会社製
In the above, the following components were used for each component of polyvinyl alcohol, polyoxyl 40 stearate, lactose hydrate, and crystalline cellulose.
Polyvinyl alcohol: Polyvinyl alcohol (partially saponified product), trade name EG-05, polyoxyl stearate 40 manufactured by Nippon Synthetic Chemical Industry Co., Ltd .: trade name MYS-40MV, lactose hydrate manufactured by Nikko Chemicals Co., Ltd .: lactose hydrate ( 200), DMV crystalline cellulose: trade name Theolas KG-1000, manufactured by Asahi Kasei Chemicals Corporation
また、上記における乳糖水和物、結晶セルロース、ステアリン酸マグネシウム及びステアリン酸ポリオキシル40は第十五改正日本薬局方記載のものを使用し、クロスポビドン、ポリビニルアルコールは医薬品添加物規格2003に記載のものを使用した。
上記実施例1〜3で得られた製剤に付き、人での口腔内崩壊試験を実施した結果、何れも、30秒以内で崩壊し、良好な崩壊性を示した。
なお、人での口腔内崩壊試験は下記の通り実施した。
被験者(3人)に対して、予めうがいにより口をすすぎ、30秒経過後に錠剤を舌の上に置き、口を閉じ、噛まずに形が完全に崩壊するまでの時間を測定した。
In addition, lactose hydrate, crystalline cellulose, magnesium stearate and polyoxyl 40 in the above are those described in the 15th revision Japanese Pharmacopoeia, and crospovidone and polyvinyl alcohol are those described in Pharmaceutical Additive Standard 2003. It was used.
As a result of carrying out an oral disintegration test in humans on the preparations obtained in Examples 1 to 3, all disintegrated within 30 seconds and showed good disintegration properties.
In addition, the oral disintegration test in humans was performed as follows.
For the subjects (3 persons), the mouth was rinsed in advance by gargle, and after 30 seconds, the tablet was placed on the tongue, the mouth was closed, and the time until the shape completely disintegrated without chewing was measured.
実施例4及び比較例1
処方を下記表2に示すものに変える以外は実施例1〜3と同様にして、実施例4及び比較例1の口腔内速崩壊錠を製造した。
Example 4 and Comparative Example 1
The intraoral quick disintegrating tablets of Example 4 and Comparative Example 1 were produced in the same manner as in Examples 1 to 3 except that the formulation was changed to that shown in Table 2 below.
この両者に付き、実施例1〜3と同様にして、口腔内崩壊試験を実施したところ、何れも良好な口腔内崩壊性を示した。
また、上記で得られた製剤に付き、表3の後に記載する方法で、活性成分の溶出試験を行ったところ表3の通りであった。
It attached to both, and when the oral disintegration test was implemented similarly to Examples 1-3, all showed favorable oral disintegration property.
Moreover, it was as Table 3 when the elution test of the active ingredient was done by the method described after Table 3 with respect to the formulation obtained above.
溶出試験方法
実施例4及び比較例1により得られた口腔内速崩壊錠を用いて、第十五改正日本薬局方に記載の溶出試験第2液による溶出試験を行った。
即ち、錠剤各1個をとり、試験液900mLを用い、パドル法により、毎分50回転で試験を行った。溶出試験を開始し、X分後に溶出液10mL以上をとり、孔径0.45μm以下のメンブランフィルターでろ過した。初めのろ液3mLを除き、次のろ液1mLを正確に量り、内標準溶液L 1mLを正確に加え、試料溶液とした。別に定量用グリメピリドを105℃で4時間乾燥し、その約22mgを精密に量り、移動相に溶かし、正確に200mLとする。この液1mLを正確に量り、移動相を加えて正確に100mLとした。この液1mLを正確に量り、内標準溶液L 1mLを正確に加え、標準溶液とした。試料溶液及び標準溶液50μLにつき、次の条件で液体クロマトグラフィーにより試験を行い、内標準物質のピーク面積に対するグリメピリドのピーク面積の比QT及びQSを求めた。
Dissolution test method Using the intraorally rapidly disintegrating tablets obtained in Example 4 and Comparative Example 1, a dissolution test using the second solution of dissolution test described in the 15th revision Japanese Pharmacopoeia was performed.
That is, one tablet was taken, and the test was performed at 900 rpm with the paddle method using 900 mL of the test solution. The elution test was started, and after 10 minutes, 10 mL or more of the eluate was taken and filtered through a membrane filter having a pore size of 0.45 μm or less. Except for 3 mL of the first filtrate, 1 mL of the next filtrate was accurately weighed, and 1 mL of the internal standard solution L was accurately added to obtain a sample solution. Separately, glimepiride for quantification is dried at 105 ° C. for 4 hours, and about 22 mg thereof is accurately weighed and dissolved in the mobile phase to make exactly 200 mL. 1 mL of this liquid was accurately weighed and the mobile phase was added to make exactly 100 mL. 1 mL of this solution was accurately weighed and 1 mL of internal standard solution L was accurately added to obtain a standard solution. The sample solution and 50 μL of the standard solution were tested by liquid chromatography under the following conditions, and the ratios Q T and Q S of glimepiride peak area to the peak area of the internal standard substance were determined.
n回目の溶出液採取時におけるグリメピリド(C24H34N4O5S)の表示量に対する溶出率(%)は、下記式で表すことができる。 The dissolution rate (%) with respect to the displayed amount of glimepiride (C 24 H 34 N 4 O 5 S) at the time of collecting the eluate at the n-th time can be expressed by the following formula.
WS:定量用グリメピリドの秤取量(mg)
C:1錠中のグリメピリド(C24H34N4O5S)の表示量(mg)
なお、内標準溶液Lとしては、パラオキシ安息香酸プロピルの移動相溶液(50万倍希釈液)を用いた。
溶出試験における試験条件を下記に示す。
検出器:紫外吸光光度計(測定波長:228nm)
カラム:内径4.6mm、長さ15cmのステンレス管に5μmの液体クロマトグラフィー用オクタデシルシリル化シリカゲルを充てんして使用。
カラム温度:25℃付近の一定温度
移動相:リン酸二水素ナトリウム0.5gを水500mLに溶かした液にアセトニトリル500mLを加え、5倍に希釈したリン酸水溶液でpHを3.5に調整した溶液。
流量:グリメピリドの保持時間が約10分になるように調整した。
なお上記溶出試験においては、標準溶液50μLにつき上記の条件で操作するとき、内標準物質、グリメピリドの順に溶出し、その分離度は10以上であった。また、標準溶液50μLにつき上記の条件で試験を6回繰り返すとき、内標準物質のピーク面積に対するグリメピリドのピーク面積の比の相対標準偏差は1.0%以下であった。
W S : Weighed amount of glimepiride for determination (mg)
C: Displayed amount of glimepiride (C 24 H 34 N 4 O 5 S) in 1 tablet (mg)
As the internal standard solution L, a mobile phase solution (diluted 500,000 times) of propyl paraoxybenzoate was used.
The test conditions in the dissolution test are shown below.
Detector: UV absorptiometer (measurement wavelength: 228 nm)
Column: A stainless steel tube having an inner diameter of 4.6 mm and a length of 15 cm is filled with 5 μm of octadecylsilylated silica gel for liquid chromatography.
Column temperature: Constant temperature around 25 ° C. Mobile phase: 500 mL of acetonitrile was added to a solution obtained by dissolving 0.5 g of sodium dihydrogen phosphate in 500 mL of water, and the pH was adjusted to 3.5 with a phosphoric acid aqueous solution diluted five times. solution.
Flow rate: Adjusted so that the retention time of glimepiride was about 10 minutes.
In the dissolution test, when operating with 50 μL of the standard solution under the above conditions, the internal standard substance and glimepiride were eluted in this order, and the degree of separation was 10 or more. When the test was repeated 6 times with 50 μL of the standard solution under the above conditions, the relative standard deviation of the ratio of the peak area of glimepiride to the peak area of the internal standard substance was 1.0% or less.
本発明の口腔内速崩壊錠は、上記のように、初期の溶出性が改善されるため、服用後の効果の発現を早めることが出来る。従って服用後に早めに効果の発現が必要な糖尿病薬などに適した口腔内速崩壊錠である。 Since the initial dissolution property of the intraoral quick disintegrating tablet of the present invention is improved as described above, it is possible to accelerate the onset of the effect after taking. Therefore, it is an intraoral quick disintegrating tablet suitable for diabetics and the like that need to be effective early after taking.
Claims (13)
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2008216540A JP5337430B2 (en) | 2008-08-26 | 2008-08-26 | Orally disintegrating tablets |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2008216540A JP5337430B2 (en) | 2008-08-26 | 2008-08-26 | Orally disintegrating tablets |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2010053043A JP2010053043A (en) | 2010-03-11 |
| JP5337430B2 true JP5337430B2 (en) | 2013-11-06 |
Family
ID=42069337
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008216540A Active JP5337430B2 (en) | 2008-08-26 | 2008-08-26 | Orally disintegrating tablets |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP5337430B2 (en) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP5664993B2 (en) * | 2009-08-28 | 2015-02-04 | トーアエイヨー株式会社 | Solid formulation containing glimepiride |
| JP6037687B2 (en) * | 2011-07-08 | 2016-12-07 | サノフィ株式会社 | Orally disintegrating tablets containing glimepiride |
| JP6245786B2 (en) * | 2011-10-17 | 2017-12-13 | 大同化成工業株式会社 | Pharmaceutical binding agent and preparation using the binding agent |
| JP7161176B2 (en) * | 2017-07-11 | 2022-10-26 | トーアエイヨー株式会社 | Orally disintegrating tablet and manufacturing method thereof |
| WO2021095092A1 (en) * | 2019-11-11 | 2021-05-20 | 大塚製薬株式会社 | Orally disintegrating tablet |
| JP7219979B2 (en) * | 2020-02-26 | 2023-02-09 | 日新製薬株式会社 | Orally disintegrating tablet having a coating layer |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2003176242A (en) * | 1996-07-12 | 2003-06-24 | Dai Ichi Seiyaku Co Ltd | Quickly disintegrable compression-molded material and method for producing the same |
| ES2327898T3 (en) * | 2000-03-01 | 2009-11-05 | EISAI R&D MANAGEMENT CO., LTD. | RAPID DISINTEGRATION TABLET CONTAINING POLI (VINYL ALCOHOL). |
| JP2001335469A (en) * | 2000-05-26 | 2001-12-04 | Lion Corp | Method for producing solid preparation |
| JP4138209B2 (en) * | 2000-06-29 | 2008-08-27 | エーザイ・アール・アンド・ディー・マネジメント株式会社 | Pravastatin-containing composition |
| JP2007314529A (en) * | 2006-04-28 | 2007-12-06 | Lion Corp | Granulated particle, tablet and method for producing granulated particle |
| JP2008169135A (en) * | 2007-01-11 | 2008-07-24 | Takada Seiyaku Kk | Method for producing glimepiride composition |
-
2008
- 2008-08-26 JP JP2008216540A patent/JP5337430B2/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| JP2010053043A (en) | 2010-03-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5537943B2 (en) | Fast disintegrating solid preparation | |
| JP5366233B2 (en) | Orally disintegrating tablets | |
| JP4435424B2 (en) | Tablets that disintegrate quickly in the oral cavity | |
| KR101612137B1 (en) | Orally disintegrating tablets | |
| JP2019081789A (en) | Orally disintegrating tablet | |
| JP5296456B2 (en) | Irbesartan-containing pharmaceutical composition with good dissolution and orally disintegrating tablet | |
| JP2009114113A (en) | Intraorally disintegrable tablet and method for producing the same | |
| WO2007074856A1 (en) | Method of producing solid preparation disintegrating in the oral cavity | |
| NZ542925A (en) | Use of cilicified microcrystalline cellulose to provide a tablet suitable for oral disintegration | |
| WO2013161823A1 (en) | Orally disintegrating tablet and method for producing same | |
| JP2001058944A (en) | Rapidly disintegrating solid formulation | |
| EP1961413A1 (en) | Rapidly disintegratable oral tablet | |
| WO2011019043A1 (en) | Tablet that disintegrates rapidly in the mouth and that contains two or more types of particles | |
| JP3996626B2 (en) | Orally disintegrating tablets | |
| JP5337430B2 (en) | Orally disintegrating tablets | |
| JP2000119175A (en) | Intraoral rapid disintegrative solid preparation | |
| JP2003034655A (en) | Fast degradable solid tablet | |
| JP2006076971A (en) | Orally disintegrating tablet | |
| KR20150002453A (en) | Chewable tablet formulation comprising tadalafil or a pharmaceutically acceptable salt thereof | |
| JP2010241760A (en) | Tablet quickly disintegrable in oral cavity that has unpleasant taste reduced, and method for preparing the same | |
| JP2003176242A (en) | Quickly disintegrable compression-molded material and method for producing the same | |
| EP2243468A1 (en) | Orally Disintegrating Dimebolin Compositions | |
| JP5275815B2 (en) | Orally disintegrating tablets and bitterness-suppressing preparations containing risperidone | |
| JP2015110663A (en) | Irbesartan-containing pharmaceutical composition with excellent elution property and orally disintegrable tablet | |
| JP2009196940A (en) | Tablet quickly disintegrating in oral cavity and its production method |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20110620 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20130214 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20130219 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130419 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20130730 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20130805 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5337430 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| S531 | Written request for registration of change of domicile |
Free format text: JAPANESE INTERMEDIATE CODE: R313531 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R153 | Grant of patent term extension |
Free format text: JAPANESE INTERMEDIATE CODE: R153 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R153 | Grant of patent term extension |
Free format text: JAPANESE INTERMEDIATE CODE: R153 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |