JP5273695B2 - ビフィズス菌を有効成分とするアレルギー予防および/または治療剤 - Google Patents
ビフィズス菌を有効成分とするアレルギー予防および/または治療剤 Download PDFInfo
- Publication number
- JP5273695B2 JP5273695B2 JP2006057675A JP2006057675A JP5273695B2 JP 5273695 B2 JP5273695 B2 JP 5273695B2 JP 2006057675 A JP2006057675 A JP 2006057675A JP 2006057675 A JP2006057675 A JP 2006057675A JP 5273695 B2 JP5273695 B2 JP 5273695B2
- Authority
- JP
- Japan
- Prior art keywords
- bifidobacterium longum
- allergy
- strain
- food
- bifidobacterium
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 206010020751 Hypersensitivity Diseases 0.000 title claims description 62
- 230000007815 allergy Effects 0.000 title claims description 60
- 208000026935 allergic disease Diseases 0.000 title claims description 59
- 239000004480 active ingredient Substances 0.000 title claims description 10
- 241000186000 Bifidobacterium Species 0.000 title description 53
- 230000002265 prevention Effects 0.000 title description 27
- 238000011282 treatment Methods 0.000 title description 27
- 241001608472 Bifidobacterium longum Species 0.000 claims description 85
- 229940009291 bifidobacterium longum Drugs 0.000 claims description 85
- 239000003795 chemical substances by application Substances 0.000 claims description 29
- 208000004262 Food Hypersensitivity Diseases 0.000 claims description 21
- 235000020932 food allergy Nutrition 0.000 claims description 21
- 239000000427 antigen Substances 0.000 claims description 20
- 102000036639 antigens Human genes 0.000 claims description 20
- 108091007433 antigens Proteins 0.000 claims description 20
- 238000004519 manufacturing process Methods 0.000 claims description 18
- 206010016946 Food allergy Diseases 0.000 claims description 16
- 230000003449 preventive effect Effects 0.000 claims description 14
- 210000001035 gastrointestinal tract Anatomy 0.000 claims description 4
- 239000013568 food allergen Substances 0.000 claims description 3
- 239000013566 allergen Substances 0.000 claims description 2
- 230000037406 food intake Effects 0.000 claims 1
- 235000013305 food Nutrition 0.000 description 61
- 239000000047 product Substances 0.000 description 53
- 239000000203 mixture Substances 0.000 description 35
- 241000186016 Bifidobacterium bifidum Species 0.000 description 33
- 229940002008 bifidobacterium bifidum Drugs 0.000 description 33
- 239000003814 drug Substances 0.000 description 24
- 238000012360 testing method Methods 0.000 description 24
- 238000000034 method Methods 0.000 description 23
- 238000006243 chemical reaction Methods 0.000 description 22
- 241000894006 Bacteria Species 0.000 description 21
- 229940124597 therapeutic agent Drugs 0.000 description 16
- 102000011632 Caseins Human genes 0.000 description 12
- 108010076119 Caseins Proteins 0.000 description 12
- 241001465754 Metazoa Species 0.000 description 11
- 239000005018 casein Substances 0.000 description 11
- 235000013350 formula milk Nutrition 0.000 description 11
- 235000013336 milk Nutrition 0.000 description 11
- 239000008267 milk Substances 0.000 description 11
- 210000004080 milk Anatomy 0.000 description 11
- 239000000843 powder Substances 0.000 description 11
- 241000699666 Mus <mouse, genus> Species 0.000 description 9
- BECPQYXYKAMYBN-UHFFFAOYSA-N casein, tech. Chemical compound NCCCCC(C(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(CC(C)C)N=C(O)C(CCC(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(C(C)O)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(COP(O)(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(N)CC1=CC=CC=C1 BECPQYXYKAMYBN-UHFFFAOYSA-N 0.000 description 9
- 235000021240 caseins Nutrition 0.000 description 9
- 230000036541 health Effects 0.000 description 9
- 241000700159 Rattus Species 0.000 description 8
- 230000000172 allergic effect Effects 0.000 description 8
- 208000010668 atopic eczema Diseases 0.000 description 8
- 235000008504 concentrate Nutrition 0.000 description 8
- 239000012141 concentrate Substances 0.000 description 8
- 210000003608 fece Anatomy 0.000 description 8
- 239000013641 positive control Substances 0.000 description 8
- 230000008569 process Effects 0.000 description 8
- 235000005911 diet Nutrition 0.000 description 7
- 230000037213 diet Effects 0.000 description 7
- 235000016709 nutrition Nutrition 0.000 description 7
- 210000002966 serum Anatomy 0.000 description 7
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 6
- 241000699670 Mus sp. Species 0.000 description 6
- 229920002472 Starch Polymers 0.000 description 6
- 102000007544 Whey Proteins Human genes 0.000 description 6
- 108010046377 Whey Proteins Proteins 0.000 description 6
- 230000001580 bacterial effect Effects 0.000 description 6
- 230000000694 effects Effects 0.000 description 6
- 235000013376 functional food Nutrition 0.000 description 6
- 230000000813 microbial effect Effects 0.000 description 6
- 239000003921 oil Substances 0.000 description 6
- 235000019198 oils Nutrition 0.000 description 6
- 239000000243 solution Substances 0.000 description 6
- 239000008107 starch Substances 0.000 description 6
- 235000019698 starch Nutrition 0.000 description 6
- 239000000126 substance Substances 0.000 description 6
- 230000001225 therapeutic effect Effects 0.000 description 6
- 230000037396 body weight Effects 0.000 description 5
- 210000000987 immune system Anatomy 0.000 description 5
- 230000002401 inhibitory effect Effects 0.000 description 5
- 229910052500 inorganic mineral Inorganic materials 0.000 description 5
- 239000011707 mineral Substances 0.000 description 5
- 235000010755 mineral Nutrition 0.000 description 5
- 239000013642 negative control Substances 0.000 description 5
- 230000001954 sterilising effect Effects 0.000 description 5
- 238000004659 sterilization and disinfection Methods 0.000 description 5
- 230000001629 suppression Effects 0.000 description 5
- 230000009885 systemic effect Effects 0.000 description 5
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 4
- 206010002198 Anaphylactic reaction Diseases 0.000 description 4
- SRBFZHDQGSBBOR-IOVATXLUSA-N D-xylopyranose Chemical compound O[C@@H]1COC(O)[C@H](O)[C@H]1O SRBFZHDQGSBBOR-IOVATXLUSA-N 0.000 description 4
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 4
- 206010039085 Rhinitis allergic Diseases 0.000 description 4
- 201000010105 allergic rhinitis Diseases 0.000 description 4
- PYMYPHUHKUWMLA-UHFFFAOYSA-N arabinose Natural products OCC(O)C(O)C(O)C=O PYMYPHUHKUWMLA-UHFFFAOYSA-N 0.000 description 4
- 208000006673 asthma Diseases 0.000 description 4
- SRBFZHDQGSBBOR-UHFFFAOYSA-N beta-D-Pyranose-Lyxose Natural products OC1COC(O)C(O)C1O SRBFZHDQGSBBOR-UHFFFAOYSA-N 0.000 description 4
- 235000015140 cultured milk Nutrition 0.000 description 4
- 238000005516 engineering process Methods 0.000 description 4
- 230000000968 intestinal effect Effects 0.000 description 4
- 239000008101 lactose Substances 0.000 description 4
- 239000000463 material Substances 0.000 description 4
- 244000005700 microbiome Species 0.000 description 4
- 235000018102 proteins Nutrition 0.000 description 4
- 102000004169 proteins and genes Human genes 0.000 description 4
- 108090000623 proteins and genes Proteins 0.000 description 4
- 208000024891 symptom Diseases 0.000 description 4
- 229930003231 vitamin Natural products 0.000 description 4
- 235000013343 vitamin Nutrition 0.000 description 4
- 239000011782 vitamin Substances 0.000 description 4
- 229940088594 vitamin Drugs 0.000 description 4
- 235000021119 whey protein Nutrition 0.000 description 4
- 241000186012 Bifidobacterium breve Species 0.000 description 3
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 3
- 206010010744 Conjunctivitis allergic Diseases 0.000 description 3
- 206010012438 Dermatitis atopic Diseases 0.000 description 3
- 229930091371 Fructose Natural products 0.000 description 3
- 239000005715 Fructose Substances 0.000 description 3
- RFSUNEUAIZKAJO-ARQDHWQXSA-N Fructose Chemical compound OC[C@H]1O[C@](O)(CO)[C@@H](O)[C@@H]1O RFSUNEUAIZKAJO-ARQDHWQXSA-N 0.000 description 3
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 3
- PVNIIMVLHYAWGP-UHFFFAOYSA-N Niacin Chemical compound OC(=O)C1=CC=CN=C1 PVNIIMVLHYAWGP-UHFFFAOYSA-N 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 244000062793 Sorghum vulgare Species 0.000 description 3
- 229930006000 Sucrose Natural products 0.000 description 3
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 3
- 208000002205 allergic conjunctivitis Diseases 0.000 description 3
- 208000003455 anaphylaxis Diseases 0.000 description 3
- 208000024998 atopic conjunctivitis Diseases 0.000 description 3
- 201000008937 atopic dermatitis Diseases 0.000 description 3
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 3
- 235000013361 beverage Nutrition 0.000 description 3
- 210000004369 blood Anatomy 0.000 description 3
- 239000008280 blood Substances 0.000 description 3
- 229910052799 carbon Inorganic materials 0.000 description 3
- 235000013351 cheese Nutrition 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 238000012258 culturing Methods 0.000 description 3
- 229940079593 drug Drugs 0.000 description 3
- 238000011156 evaluation Methods 0.000 description 3
- 239000008103 glucose Substances 0.000 description 3
- 208000030603 inherited susceptibility to asthma Diseases 0.000 description 3
- 239000007788 liquid Substances 0.000 description 3
- 239000012263 liquid product Substances 0.000 description 3
- 235000019713 millet Nutrition 0.000 description 3
- 238000010172 mouse model Methods 0.000 description 3
- 229910052757 nitrogen Inorganic materials 0.000 description 3
- 239000006072 paste Substances 0.000 description 3
- 238000011160 research Methods 0.000 description 3
- 239000005720 sucrose Substances 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 2
- GHOKWGTUZJEAQD-ZETCQYMHSA-N (D)-(+)-Pantothenic acid Chemical compound OCC(C)(C)[C@@H](O)C(=O)NCCC(O)=O GHOKWGTUZJEAQD-ZETCQYMHSA-N 0.000 description 2
- GVJHHUAWPYXKBD-UHFFFAOYSA-N (±)-α-Tocopherol Chemical group OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-UHFFFAOYSA-N 0.000 description 2
- OWEGMIWEEQEYGQ-UHFFFAOYSA-N 100676-05-9 Natural products OC1C(O)C(O)C(CO)OC1OCC1C(O)C(O)C(O)C(OC2C(OC(O)C(O)C2O)CO)O1 OWEGMIWEEQEYGQ-UHFFFAOYSA-N 0.000 description 2
- 108020004465 16S ribosomal RNA Proteins 0.000 description 2
- 208000035285 Allergic Seasonal Rhinitis Diseases 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical group OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 238000011814 C57BL/6N mouse Methods 0.000 description 2
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 2
- 241000238366 Cephalopoda Species 0.000 description 2
- 241000725101 Clea Species 0.000 description 2
- HMFHBZSHGGEWLO-SOOFDHNKSA-N D-ribofuranose Chemical compound OC[C@H]1OC(O)[C@H](O)[C@@H]1O HMFHBZSHGGEWLO-SOOFDHNKSA-N 0.000 description 2
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 2
- 208000005577 Gastroenteritis Diseases 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 2
- GUBGYTABKSRVRQ-PICCSMPSSA-N Maltose Natural products O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@@H](CO)OC(O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-PICCSMPSSA-N 0.000 description 2
- MUPFEKGTMRGPLJ-RMMQSMQOSA-N Raffinose Natural products O(C[C@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@@H](O[C@@]2(CO)[C@H](O)[C@@H](O)[C@@H](CO)O2)O1)[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 MUPFEKGTMRGPLJ-RMMQSMQOSA-N 0.000 description 2
- PYMYPHUHKUWMLA-LMVFSUKVSA-N Ribose Natural products OC[C@@H](O)[C@@H](O)[C@@H](O)C=O PYMYPHUHKUWMLA-LMVFSUKVSA-N 0.000 description 2
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 2
- 206010039509 Scab Diseases 0.000 description 2
- 108010073771 Soybean Proteins Proteins 0.000 description 2
- MUPFEKGTMRGPLJ-UHFFFAOYSA-N UNPD196149 Natural products OC1C(O)C(CO)OC1(CO)OC1C(O)C(O)C(O)C(COC2C(C(O)C(O)C(CO)O2)O)O1 MUPFEKGTMRGPLJ-UHFFFAOYSA-N 0.000 description 2
- 239000005862 Whey Substances 0.000 description 2
- HMFHBZSHGGEWLO-UHFFFAOYSA-N alpha-D-Furanose-Ribose Natural products OCC1OC(O)C(O)C1O HMFHBZSHGGEWLO-UHFFFAOYSA-N 0.000 description 2
- WQZGKKKJIJFFOK-PHYPRBDBSA-N alpha-D-galactose Chemical compound OC[C@H]1O[C@H](O)[C@H](O)[C@@H](O)[C@H]1O WQZGKKKJIJFFOK-PHYPRBDBSA-N 0.000 description 2
- 230000003266 anti-allergic effect Effects 0.000 description 2
- 239000000043 antiallergic agent Substances 0.000 description 2
- PYMYPHUHKUWMLA-WDCZJNDASA-N arabinose Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)C=O PYMYPHUHKUWMLA-WDCZJNDASA-N 0.000 description 2
- LFYJSSARVMHQJB-QIXNEVBVSA-N bakuchiol Chemical compound CC(C)=CCC[C@@](C)(C=C)\C=C\C1=CC=C(O)C=C1 LFYJSSARVMHQJB-QIXNEVBVSA-N 0.000 description 2
- GUBGYTABKSRVRQ-QUYVBRFLSA-N beta-maltose Chemical compound OC[C@H]1O[C@H](O[C@H]2[C@H](O)[C@@H](O)[C@H](O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@@H]1O GUBGYTABKSRVRQ-QUYVBRFLSA-N 0.000 description 2
- DLRVVLDZNNYCBX-ZZFZYMBESA-N beta-melibiose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1OC[C@@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@H](O)O1 DLRVVLDZNNYCBX-ZZFZYMBESA-N 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 235000015895 biscuits Nutrition 0.000 description 2
- 239000001045 blue dye Substances 0.000 description 2
- 235000008429 bread Nutrition 0.000 description 2
- 238000009395 breeding Methods 0.000 description 2
- 230000001488 breeding effect Effects 0.000 description 2
- 239000002775 capsule Substances 0.000 description 2
- 150000001720 carbohydrates Chemical class 0.000 description 2
- 238000005119 centrifugation Methods 0.000 description 2
- 238000000546 chi-square test Methods 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- 235000012495 crackers Nutrition 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 239000012153 distilled water Substances 0.000 description 2
- 238000001035 drying Methods 0.000 description 2
- 239000000428 dust Substances 0.000 description 2
- 239000000975 dye Substances 0.000 description 2
- 239000000284 extract Substances 0.000 description 2
- 238000001914 filtration Methods 0.000 description 2
- 239000000796 flavoring agent Substances 0.000 description 2
- 229930182830 galactose Natural products 0.000 description 2
- 239000007789 gas Substances 0.000 description 2
- 239000008187 granular material Substances 0.000 description 2
- 230000036039 immunity Effects 0.000 description 2
- 230000016784 immunoglobulin production Effects 0.000 description 2
- 230000006872 improvement Effects 0.000 description 2
- 230000006698 induction Effects 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 238000010253 intravenous injection Methods 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 150000002632 lipids Chemical class 0.000 description 2
- 235000021056 liquid food Nutrition 0.000 description 2
- 238000006386 neutralization reaction Methods 0.000 description 2
- 229960003512 nicotinic acid Drugs 0.000 description 2
- 235000001968 nicotinic acid Nutrition 0.000 description 2
- 239000011664 nicotinic acid Substances 0.000 description 2
- 230000035764 nutrition Effects 0.000 description 2
- 150000007524 organic acids Chemical class 0.000 description 2
- 239000000825 pharmaceutical preparation Substances 0.000 description 2
- 239000002504 physiological saline solution Substances 0.000 description 2
- 235000013550 pizza Nutrition 0.000 description 2
- 235000008476 powdered milk Nutrition 0.000 description 2
- 239000003531 protein hydrolysate Substances 0.000 description 2
- MUPFEKGTMRGPLJ-ZQSKZDJDSA-N raffinose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO[C@@H]2[C@@H]([C@@H](O)[C@@H](O)[C@@H](CO)O2)O)O1 MUPFEKGTMRGPLJ-ZQSKZDJDSA-N 0.000 description 2
- 235000020183 skimmed milk Nutrition 0.000 description 2
- 235000014214 soft drink Nutrition 0.000 description 2
- 229940001941 soy protein Drugs 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- 210000003462 vein Anatomy 0.000 description 2
- 150000003722 vitamin derivatives Chemical class 0.000 description 2
- 235000013618 yogurt Nutrition 0.000 description 2
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- FPIPGXGPPPQFEQ-UHFFFAOYSA-N 13-cis retinol Natural products OCC=C(C)C=CC=C(C)C=CC1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-UHFFFAOYSA-N 0.000 description 1
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 1
- 241000238876 Acari Species 0.000 description 1
- 244000298697 Actinidia deliciosa Species 0.000 description 1
- 235000009436 Actinidia deliciosa Nutrition 0.000 description 1
- 241000251468 Actinopterygii Species 0.000 description 1
- 229920001817 Agar Polymers 0.000 description 1
- 244000291564 Allium cepa Species 0.000 description 1
- 235000002732 Allium cepa var. cepa Nutrition 0.000 description 1
- 240000002234 Allium sativum Species 0.000 description 1
- 244000036975 Ambrosia artemisiifolia Species 0.000 description 1
- 235000003129 Ambrosia artemisiifolia var elatior Nutrition 0.000 description 1
- 244000144730 Amygdalus persica Species 0.000 description 1
- 241000244023 Anisakis Species 0.000 description 1
- 240000007087 Apium graveolens Species 0.000 description 1
- 235000015849 Apium graveolens Dulce Group Nutrition 0.000 description 1
- 235000010591 Appio Nutrition 0.000 description 1
- 244000105624 Arachis hypogaea Species 0.000 description 1
- 241000239290 Araneae Species 0.000 description 1
- 235000003261 Artemisia vulgaris Nutrition 0.000 description 1
- 240000006891 Artemisia vulgaris Species 0.000 description 1
- 206010003645 Atopy Diseases 0.000 description 1
- 241000972773 Aulopiformes Species 0.000 description 1
- 235000007319 Avena orientalis Nutrition 0.000 description 1
- 244000075850 Avena orientalis Species 0.000 description 1
- 241000219495 Betulaceae Species 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- 241000218645 Cedrus Species 0.000 description 1
- GHOKWGTUZJEAQD-UHFFFAOYSA-N Chick antidermatitis factor Natural products OCC(C)(C)C(O)C(=O)NCCC(O)=O GHOKWGTUZJEAQD-UHFFFAOYSA-N 0.000 description 1
- 240000004270 Colocasia esculenta var. antiquorum Species 0.000 description 1
- 241000272201 Columbiformes Species 0.000 description 1
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 1
- 244000241257 Cucumis melo Species 0.000 description 1
- 235000015510 Cucumis melo subsp melo Nutrition 0.000 description 1
- 244000301850 Cupressus sempervirens Species 0.000 description 1
- ZZZCUOFIHGPKAK-UHFFFAOYSA-N D-erythro-ascorbic acid Natural products OCC1OC(=O)C(O)=C1O ZZZCUOFIHGPKAK-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 description 1
- 241000052343 Dares Species 0.000 description 1
- 235000002767 Daucus carota Nutrition 0.000 description 1
- 244000000626 Daucus carota Species 0.000 description 1
- 241000238557 Decapoda Species 0.000 description 1
- 206010012442 Dermatitis contact Diseases 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 235000002723 Dioscorea alata Nutrition 0.000 description 1
- 235000007056 Dioscorea composita Nutrition 0.000 description 1
- 235000009723 Dioscorea convolvulacea Nutrition 0.000 description 1
- 235000005362 Dioscorea floribunda Nutrition 0.000 description 1
- 235000004868 Dioscorea macrostachya Nutrition 0.000 description 1
- 235000005361 Dioscorea nummularia Nutrition 0.000 description 1
- 235000005360 Dioscorea spiculiflora Nutrition 0.000 description 1
- 206010013700 Drug hypersensitivity Diseases 0.000 description 1
- 102000002322 Egg Proteins Human genes 0.000 description 1
- 108010000912 Egg Proteins Proteins 0.000 description 1
- 241000589586 Empedobacter brevis Species 0.000 description 1
- 240000008620 Fagopyrum esculentum Species 0.000 description 1
- 235000009419 Fagopyrum esculentum Nutrition 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 235000016623 Fragaria vesca Nutrition 0.000 description 1
- 240000009088 Fragaria x ananassa Species 0.000 description 1
- 235000011363 Fragaria x ananassa Nutrition 0.000 description 1
- 241000233866 Fungi Species 0.000 description 1
- 241000276438 Gadus morhua Species 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 206010018364 Glomerulonephritis Diseases 0.000 description 1
- 235000010469 Glycine max Nutrition 0.000 description 1
- 244000068988 Glycine max Species 0.000 description 1
- SQUHHTBVTRBESD-UHFFFAOYSA-N Hexa-Ac-myo-Inositol Natural products CC(=O)OC1C(OC(C)=O)C(OC(C)=O)C(OC(C)=O)C(OC(C)=O)C1OC(C)=O SQUHHTBVTRBESD-UHFFFAOYSA-N 0.000 description 1
- 241000238631 Hexapoda Species 0.000 description 1
- 240000005979 Hordeum vulgare Species 0.000 description 1
- 235000007340 Hordeum vulgare Nutrition 0.000 description 1
- 241000257303 Hymenoptera Species 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- 235000006350 Ipomoea batatas var. batatas Nutrition 0.000 description 1
- 240000007049 Juglans regia Species 0.000 description 1
- 235000009496 Juglans regia Nutrition 0.000 description 1
- 102000004407 Lactalbumin Human genes 0.000 description 1
- 108090000942 Lactalbumin Proteins 0.000 description 1
- 241000186660 Lactobacillus Species 0.000 description 1
- 108010063045 Lactoferrin Proteins 0.000 description 1
- 102000010445 Lactoferrin Human genes 0.000 description 1
- 102000008192 Lactoglobulins Human genes 0.000 description 1
- 108010060630 Lactoglobulins Proteins 0.000 description 1
- UPYKUZBSLRQECL-UKMVMLAPSA-N Lycopene Chemical group CC(=C/C=C/C=C(C)/C=C/C=C(C)/C=C/C1C(=C)CCCC1(C)C)C=CC=C(/C)C=CC2C(=C)CCCC2(C)C UPYKUZBSLRQECL-UKMVMLAPSA-N 0.000 description 1
- 235000007688 Lycopersicon esculentum Nutrition 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- 241000220225 Malus Species 0.000 description 1
- 235000011430 Malus pumila Nutrition 0.000 description 1
- 235000015103 Malus silvestris Nutrition 0.000 description 1
- 108010070551 Meat Proteins Proteins 0.000 description 1
- 240000005561 Musa balbisiana Species 0.000 description 1
- 235000018290 Musa x paradisiaca Nutrition 0.000 description 1
- 241000588653 Neisseria Species 0.000 description 1
- 241000244206 Nematoda Species 0.000 description 1
- 241000238413 Octopus Species 0.000 description 1
- 240000007594 Oryza sativa Species 0.000 description 1
- 235000007164 Oryza sativa Nutrition 0.000 description 1
- 235000019482 Palm oil Nutrition 0.000 description 1
- 241000237509 Patinopecten sp. Species 0.000 description 1
- 244000062780 Petroselinum sativum Species 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- 108010064851 Plant Proteins Proteins 0.000 description 1
- 241000209504 Poaceae Species 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 235000006040 Prunus persica var persica Nutrition 0.000 description 1
- 235000019484 Rapeseed oil Nutrition 0.000 description 1
- 235000019485 Safflower oil Nutrition 0.000 description 1
- 241001125046 Sardina pilchardus Species 0.000 description 1
- 241000269821 Scombridae Species 0.000 description 1
- 206010048908 Seasonal allergy Diseases 0.000 description 1
- 241000209056 Secale Species 0.000 description 1
- 235000007238 Secale cereale Nutrition 0.000 description 1
- BUGBHKTXTAQXES-UHFFFAOYSA-N Selenium Chemical compound [Se] BUGBHKTXTAQXES-UHFFFAOYSA-N 0.000 description 1
- 235000003434 Sesamum indicum Nutrition 0.000 description 1
- 244000040738 Sesamum orientale Species 0.000 description 1
- 240000003768 Solanum lycopersicum Species 0.000 description 1
- 244000061456 Solanum tuberosum Species 0.000 description 1
- 235000002595 Solanum tuberosum Nutrition 0.000 description 1
- 229910000831 Steel Inorganic materials 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- 241000121220 Tricholoma matsutake Species 0.000 description 1
- 235000021307 Triticum Nutrition 0.000 description 1
- 244000098338 Triticum aestivum Species 0.000 description 1
- 208000024780 Urticaria Diseases 0.000 description 1
- 241000256856 Vespidae Species 0.000 description 1
- FPIPGXGPPPQFEQ-BOOMUCAASA-N Vitamin A Natural products OC/C=C(/C)\C=C\C=C(\C)/C=C/C1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-BOOMUCAASA-N 0.000 description 1
- 229930003270 Vitamin B Chemical group 0.000 description 1
- 229930003268 Vitamin C Natural products 0.000 description 1
- 229930003316 Vitamin D Chemical group 0.000 description 1
- QYSXJUFSXHHAJI-XFEUOLMDSA-N Vitamin D3 Chemical group C1(/[C@@H]2CC[C@@H]([C@]2(CCC1)C)[C@H](C)CCCC(C)C)=C/C=C1\C[C@@H](O)CCC1=C QYSXJUFSXHHAJI-XFEUOLMDSA-N 0.000 description 1
- 229930003427 Vitamin E Natural products 0.000 description 1
- 229930003448 Vitamin K Chemical group 0.000 description 1
- 240000008042 Zea mays Species 0.000 description 1
- 235000005824 Zea mays ssp. parviglumis Nutrition 0.000 description 1
- 235000002017 Zea mays subsp mays Nutrition 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- FJJCIZWZNKZHII-UHFFFAOYSA-N [4,6-bis(cyanoamino)-1,3,5-triazin-2-yl]cyanamide Chemical compound N#CNC1=NC(NC#N)=NC(NC#N)=N1 FJJCIZWZNKZHII-UHFFFAOYSA-N 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 238000005273 aeration Methods 0.000 description 1
- 239000008272 agar Substances 0.000 description 1
- FPIPGXGPPPQFEQ-OVSJKPMPSA-N all-trans-retinol Chemical group OC\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-OVSJKPMPSA-N 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 239000010775 animal oil Substances 0.000 description 1
- 235000021120 animal protein Nutrition 0.000 description 1
- 235000003484 annual ragweed Nutrition 0.000 description 1
- 235000015278 beef Nutrition 0.000 description 1
- SQVRNKJHWKZAKO-UHFFFAOYSA-N beta-N-Acetyl-D-neuraminic acid Natural products CC(=O)NC1C(O)CC(O)(C(O)=O)OC1C(O)C(O)CO SQVRNKJHWKZAKO-UHFFFAOYSA-N 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 229960002685 biotin Drugs 0.000 description 1
- 235000020958 biotin Nutrition 0.000 description 1
- 239000011616 biotin Substances 0.000 description 1
- 235000006263 bur ragweed Nutrition 0.000 description 1
- 235000014121 butter Nutrition 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 229940041514 candida albicans extract Drugs 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 239000001569 carbon dioxide Substances 0.000 description 1
- 229910002092 carbon dioxide Inorganic materials 0.000 description 1
- 150000001746 carotenes Chemical group 0.000 description 1
- 235000005473 carotenes Nutrition 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 210000000991 chicken egg Anatomy 0.000 description 1
- 235000013330 chicken meat Nutrition 0.000 description 1
- 229960001231 choline Drugs 0.000 description 1
- OEYIOHPDSNJKLS-UHFFFAOYSA-N choline Chemical compound C[N+](C)(C)CCO OEYIOHPDSNJKLS-UHFFFAOYSA-N 0.000 description 1
- 235000015165 citric acid Nutrition 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 239000003240 coconut oil Substances 0.000 description 1
- 235000019864 coconut oil Nutrition 0.000 description 1
- 235000019516 cod Nutrition 0.000 description 1
- ACTIUHUUMQJHFO-UPTCCGCDSA-N coenzyme Q10 Chemical compound COC1=C(OC)C(=O)C(C\C=C(/C)CC\C=C(/C)CC\C=C(/C)CC\C=C(/C)CC\C=C(/C)CC\C=C(/C)CC\C=C(/C)CC\C=C(/C)CC\C=C(/C)CCC=C(C)C)=C(C)C1=O ACTIUHUUMQJHFO-UPTCCGCDSA-N 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 235000003488 common ragweed Nutrition 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 235000009508 confectionery Nutrition 0.000 description 1
- 238000012790 confirmation Methods 0.000 description 1
- 208000010247 contact dermatitis Diseases 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 229910052802 copper Inorganic materials 0.000 description 1
- 239000010949 copper Substances 0.000 description 1
- 235000005822 corn Nutrition 0.000 description 1
- 235000005687 corn oil Nutrition 0.000 description 1
- 239000002285 corn oil Substances 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 238000000354 decomposition reaction Methods 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 235000013325 dietary fiber Nutrition 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 235000004879 dioscorea Nutrition 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 201000005311 drug allergy Diseases 0.000 description 1
- 238000002036 drum drying Methods 0.000 description 1
- 235000013601 eggs Nutrition 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 210000003746 feather Anatomy 0.000 description 1
- 238000000855 fermentation Methods 0.000 description 1
- 230000004151 fermentation Effects 0.000 description 1
- 235000021107 fermented food Nutrition 0.000 description 1
- 235000019688 fish Nutrition 0.000 description 1
- 235000021323 fish oil Nutrition 0.000 description 1
- 235000019634 flavors Nutrition 0.000 description 1
- 235000012041 food component Nutrition 0.000 description 1
- 235000013355 food flavoring agent Nutrition 0.000 description 1
- 239000005417 food ingredient Substances 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 235000015203 fruit juice Nutrition 0.000 description 1
- WIGCFUFOHFEKBI-UHFFFAOYSA-N gamma-tocopherol Natural products CC(C)CCCC(C)CCCC(C)CCCC1CCC2C(C)C(O)C(C)C(C)C2O1 WIGCFUFOHFEKBI-UHFFFAOYSA-N 0.000 description 1
- 235000004611 garlic Nutrition 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 238000012252 genetic analysis Methods 0.000 description 1
- 238000005469 granulation Methods 0.000 description 1
- 230000003179 granulation Effects 0.000 description 1
- 239000007952 growth promoter Substances 0.000 description 1
- 244000005709 gut microbiome Species 0.000 description 1
- 210000004209 hair Anatomy 0.000 description 1
- 208000007475 hemolytic anemia Diseases 0.000 description 1
- 230000009610 hypersensitivity Effects 0.000 description 1
- 235000015243 ice cream Nutrition 0.000 description 1
- 230000006058 immune tolerance Effects 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 229960000367 inositol Drugs 0.000 description 1
- CDAISMWEOUEBRE-GPIVLXJGSA-N inositol Chemical compound O[C@H]1[C@H](O)[C@@H](O)[C@H](O)[C@H](O)[C@@H]1O CDAISMWEOUEBRE-GPIVLXJGSA-N 0.000 description 1
- 210000000936 intestine Anatomy 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- CSSYQJWUGATIHM-IKGCZBKSSA-N l-phenylalanyl-l-lysyl-l-cysteinyl-l-arginyl-l-arginyl-l-tryptophyl-l-glutaminyl-l-tryptophyl-l-arginyl-l-methionyl-l-lysyl-l-lysyl-l-leucylglycyl-l-alanyl-l-prolyl-l-seryl-l-isoleucyl-l-threonyl-l-cysteinyl-l-valyl-l-arginyl-l-arginyl-l-alanyl-l-phenylal Chemical compound C([C@H](N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H](C)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CS)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(O)=O)C1=CC=CC=C1 CSSYQJWUGATIHM-IKGCZBKSSA-N 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 235000021242 lactoferrin Nutrition 0.000 description 1
- 229940078795 lactoferrin Drugs 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 210000003563 lymphoid tissue Anatomy 0.000 description 1
- 235000020640 mackerel Nutrition 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- WPBNNNQJVZRUHP-UHFFFAOYSA-L manganese(2+);methyl n-[[2-(methoxycarbonylcarbamothioylamino)phenyl]carbamothioyl]carbamate;n-[2-(sulfidocarbothioylamino)ethyl]carbamodithioate Chemical compound [Mn+2].[S-]C(=S)NCCNC([S-])=S.COC(=O)NC(=S)NC1=CC=CC=C1NC(=S)NC(=O)OC WPBNNNQJVZRUHP-UHFFFAOYSA-L 0.000 description 1
- 235000013372 meat Nutrition 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 150000002739 metals Chemical class 0.000 description 1
- 235000020124 milk-based beverage Nutrition 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 235000013379 molasses Nutrition 0.000 description 1
- 230000004899 motility Effects 0.000 description 1
- 238000000465 moulding Methods 0.000 description 1
- 206010028417 myasthenia gravis Diseases 0.000 description 1
- 230000000474 nursing effect Effects 0.000 description 1
- 235000015097 nutrients Nutrition 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- 125000001477 organic nitrogen group Chemical group 0.000 description 1
- 239000001254 oxidized starch Substances 0.000 description 1
- 235000013808 oxidized starch Nutrition 0.000 description 1
- 238000004806 packaging method and process Methods 0.000 description 1
- 239000002540 palm oil Substances 0.000 description 1
- 229940055726 pantothenic acid Drugs 0.000 description 1
- 235000019161 pantothenic acid Nutrition 0.000 description 1
- 239000011713 pantothenic acid Substances 0.000 description 1
- 244000045947 parasite Species 0.000 description 1
- 230000008506 pathogenesis Effects 0.000 description 1
- 230000007310 pathophysiology Effects 0.000 description 1
- 235000020232 peanut Nutrition 0.000 description 1
- 235000011197 perejil Nutrition 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 229940127557 pharmaceutical product Drugs 0.000 description 1
- 150000003904 phospholipids Chemical class 0.000 description 1
- 239000011574 phosphorus Substances 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- SHUZOJHMOBOZST-UHFFFAOYSA-N phylloquinone Chemical group CC(C)CCCCC(C)CCC(C)CCCC(=CCC1=C(C)C(=O)c2ccccc2C1=O)C SHUZOJHMOBOZST-UHFFFAOYSA-N 0.000 description 1
- 235000021118 plant-derived protein Nutrition 0.000 description 1
- 201000004338 pollen allergy Diseases 0.000 description 1
- 235000015277 pork Nutrition 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- 230000005855 radiation Effects 0.000 description 1
- 235000009736 ragweed Nutrition 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 235000009566 rice Nutrition 0.000 description 1
- 239000005060 rubber Substances 0.000 description 1
- IKGXIBQEEMLURG-NVPNHPEKSA-N rutin Chemical compound O[C@@H]1[C@H](O)[C@@H](O)[C@H](C)O[C@H]1OC[C@@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@H](OC=2C(C3=C(O)C=C(O)C=C3OC=2C=2C=C(O)C(O)=CC=2)=O)O1 IKGXIBQEEMLURG-NVPNHPEKSA-N 0.000 description 1
- 235000005713 safflower oil Nutrition 0.000 description 1
- 239000003813 safflower oil Substances 0.000 description 1
- 235000019515 salmon Nutrition 0.000 description 1
- 235000019512 sardine Nutrition 0.000 description 1
- 235000020637 scallop Nutrition 0.000 description 1
- CDAISMWEOUEBRE-UHFFFAOYSA-N scyllo-inosotol Natural products OC1C(O)C(O)C(O)C(O)C1O CDAISMWEOUEBRE-UHFFFAOYSA-N 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 229910052711 selenium Inorganic materials 0.000 description 1
- 239000011669 selenium Substances 0.000 description 1
- 206010040400 serum sickness Diseases 0.000 description 1
- 238000007493 shaping process Methods 0.000 description 1
- SQVRNKJHWKZAKO-OQPLDHBCSA-N sialic acid Chemical compound CC(=O)N[C@@H]1[C@@H](O)C[C@@](O)(C(O)=O)OC1[C@H](O)[C@H](O)CO SQVRNKJHWKZAKO-OQPLDHBCSA-N 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 238000001694 spray drying Methods 0.000 description 1
- 239000010959 steel Substances 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 238000002636 symptomatic treatment Methods 0.000 description 1
- 208000011580 syndromic disease Diseases 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 230000020192 tolerance induction in gut-associated lymphoid tissue Effects 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 229960004747 ubidecarenone Drugs 0.000 description 1
- 238000001291 vacuum drying Methods 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 235000019155 vitamin A Nutrition 0.000 description 1
- 239000011719 vitamin A Substances 0.000 description 1
- NCYCYZXNIZJOKI-UHFFFAOYSA-N vitamin A aldehyde Chemical group O=CC=C(C)C=CC=C(C)C=CC1=C(C)CCCC1(C)C NCYCYZXNIZJOKI-UHFFFAOYSA-N 0.000 description 1
- 235000019156 vitamin B Nutrition 0.000 description 1
- 239000011720 vitamin B Chemical group 0.000 description 1
- 235000019154 vitamin C Nutrition 0.000 description 1
- 239000011718 vitamin C Substances 0.000 description 1
- 235000019166 vitamin D Nutrition 0.000 description 1
- 239000011710 vitamin D Chemical group 0.000 description 1
- 150000003710 vitamin D derivatives Chemical group 0.000 description 1
- 235000019165 vitamin E Nutrition 0.000 description 1
- 229940046009 vitamin E Drugs 0.000 description 1
- 239000011709 vitamin E Substances 0.000 description 1
- 235000019168 vitamin K Nutrition 0.000 description 1
- 239000011712 vitamin K Chemical group 0.000 description 1
- 150000003721 vitamin K derivatives Chemical group 0.000 description 1
- 229940045997 vitamin a Drugs 0.000 description 1
- 229940046008 vitamin d Drugs 0.000 description 1
- 229940046010 vitamin k Drugs 0.000 description 1
- 235000020234 walnut Nutrition 0.000 description 1
- 239000002699 waste material Substances 0.000 description 1
- 235000008939 whole milk Nutrition 0.000 description 1
- 210000002268 wool Anatomy 0.000 description 1
- 239000012138 yeast extract Substances 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
- 235000021249 α-casein Nutrition 0.000 description 1
- 235000021241 α-lactalbumin Nutrition 0.000 description 1
- 235000021247 β-casein Nutrition 0.000 description 1
- 235000021246 κ-casein Nutrition 0.000 description 1
Images
Description
[1] ビフィズス菌を有効成分とするアレルギー予防および/または治療剤、
[2] ビフィズス菌の処理物であって、当該ビフィズス菌の培養物、濃縮物、ペースト化物、噴霧乾燥物、凍結乾燥物、真空乾燥物、ドラム乾燥物、液状物、希釈物、破砕物から選ばれる少なくとも1つであるビフィズス菌処理物を有効成分とするアレルギー予防および/または治療剤、
[3] 前記ビフィズス菌がビフィドバクテリウム・ロンガム(Bifidobacterium longum)および/またはビフィドバクテリウム・ビフィダム(Bifidobacterium bifidum)である前記[1]〜[2]のいずれか1つに記載のアレルギー予防および/または治療剤、
[4] アレルギー予防および/または治療が血清IgE産生抑制によるものである前記[1]〜[3]のいずれか1つに記載のアレルギー予防および/または治療剤、
[5] 前記ビフィズス菌が、ビフィドバクテリウム・ロンガムOLB6001菌株(Bifidobacterium longum OLB6001、受託番号:FERM P−13610)、ビフィドバクテリウム・ロンガムOLB6290菌株(Bifidobacterium longum OLB6290、受託番号:NITE P−75)、およびビフィドバクテリウム・ビフィダムOLB6378(Bifidobacterium bifidum OLB6378、NITE BP−31)の群から選ばれてなる少なくとも1つのビフィズス菌である前記[1]〜[4]のいずれか1つに記載のアレルギー予防および/または治療剤、
[6] 前記[1]〜[5]のいずれか1つに記載のアレルギー予防および/または治療剤の有効量を含有せしめたアレルギー予防および/または治療用食品組成物、
[7] 乳児用調製粉乳、幼児用粉乳等食品、授乳婦用粉乳等食品、保健機能食品、病者用食品、または発酵乳である前記[6]記載のアレルギー予防および/または治療用食品組成物、
[8] アレルギー予防および/または治療用食品組成物を製造するための前記[1]〜[7]のいずれか1つに記載のアレルギー予防および/または治療剤の使用、
[9] アレルギー予防および/または治療用食品組成物が、乳児用調製粉乳、幼児用粉乳等食品、授乳婦用粉乳等食品、保健機能食品、病者用食品、または発酵乳である前記[8]記載の使用、
[10] ビフィズス菌、もしくはビフィドバクテリウム・ロンガムOLB6001菌株(Bifidobacterium longum OLB6001、受託番号:FERM P−13610)、ビフィドバクテリウム・ロンガムOLB6290菌株(Bifidobacterium longum OLB6290、受託番号:NITE P−75)、およびビフィドバクテリウム・ビフィダムOLB6378(Bifidobacterium bifidum OLB6378、NITE BP−31)の群から選ばれてなる少なくとも1つのビフィズス菌、もしくはその培養物、濃縮物、ペースト化物、噴霧乾燥物、凍結乾燥物、真空乾燥物、ドラム乾燥物、液状物、希釈物、破砕物から選ばれる少なくとも1つである処理物を用いることを特徴とする、アレルギー予防および/または治療用食品組成物の製造方法、
[11] ビフィドバクテリウム・ロンガムOLB6290菌株(Bifidobacterium longum OLB6290、受託番号:NITE P−75)、
[12] ビフィドバクテリウム・ロンガムOLB6001菌株(Bifidobacterium longum OLB6001、受託番号:FERM P−13610)、ビフィドバクテリウム・ロンガムOLB6290菌株(Bifidobacterium longum OLB6290、受託番号:NITE P−75)、およびビフィドバクテリウム・ビフィダムOLB6378(Bifidobacterium bifidum OLB6378、NITE BP−31)の群から選ばれてなる少なくとも1つのビフィズス菌の処理物であって、当該ビフィズス菌の培養物、濃縮物、ペースト化物、噴霧乾燥物、凍結乾燥物、真空乾燥物、ドラム乾燥物、液状物、希釈物、破砕物から選ばれる少なくとも1つであるビフィズス菌処理物、
[13] ビフィドバクテリウム・ロンガムOLB6001菌株(Bifidobacterium longum OLB6001、受託番号:FERM P−13610)、ビフィドバクテリウム・ロンガムOLB6290菌株(Bifidobacterium longum OLB6290、受託番号:NITE P−75)、およびビフィドバクテリウム・ビフィダムOLB6378(Bifidobacterium bifidum OLB6378、NITE BP−31)の群から選ばれてなる少なくとも1つのビフィズス菌または前記[12]記載のビフィズス菌処理物を含む食品組成物または飲料、
[14] ビフィドバクテリウム・ロンガムOLB6001菌株(Bifidobacterium longum OLB6001、受託番号:FERM P−13610)、ビフィドバクテリウム・ロンガムOLB6290菌株(Bifidobacterium longum OLB6290、受託番号:NITE P−75)、およびビフィドバクテリウム・ビフィダムOLB6378(Bifidobacterium bifidum OLB6378、NITE BP−31)の群から選ばれてなる少なくとも1つのビフィズス菌または前記[12]記載のビフィズス菌処理物を含む薬剤、
を提供するものである。
今回、食物抗原を経口的に投与することで血中に抗原特異的IgEが誘導される食物アレルギーモデルマウスを用いて成人および乳児の糞便より独自に分離した複数のビフィズス菌のIgE抑制能を比較検討した。その結果、検討した分離株の内、ビフィドバクテリウム・ロンガムOLB6001株(Bifidobacterium longum OLB6001、受託番号:FERM P−13610)、ビフィドバクテリウム・ロンガムOLB6290株(Bifidobacterium longum OLB6290、受託番号:NITE P−75)、およびビフィドバクテリウム・ビフィダムOLB6378(Bifidobacterium bifidum OLB6378、NITE BP−31)に特に強いIgE抑制能が存在するという新たな知見が得られた。したがって、ビフィドバクテリウム・ロンガムOLB6001株(Bifidobacterium longum OLB6001、受託番号:FERM P−13610)、ビフィドバクテリウム・ロンガムOLB6290株(Bifidobacterium longum OLB6290、受託番号:NITE P−75)、およびビフィドバクテリウム・ビフィダムOLB6378(Bifidobacterium bifidum OLB6378、NITE BP−31)を使用することにより、本発明の目的に叶う新規なアレルギー予防および/または治療剤、およびアレルギー予防および/または治療剤を含有せしめたアレルギー予防および/または治療用食品組成物を提供することが可能となった。
(1) 寄託機関名:独立行政法人産業技術総合研究所 特許生物寄託センター
(2) 連絡先:〒305−8566 茨城県つくば市東1−1−1 中央第6
電話番号029−861−6029
(3) 受託番号:FERM P−13610
(4) 識別のための表示:Bifidobacterium longum No.7
(5) 寄託日: 平成5年4月20日
(1) 寄託機関名:独立行政法人製品評価技術基盤機構 特許微生物寄託センター
(2) 連絡先:〒292−0818 千葉県木更津市かずさ鎌足2−5−8
電話番号0438−20−5580
(3) 受託番号:NITE P−75
(4) 識別のための表示:Bifidobacterium longum OLB6290
(5) 寄託日: 平成17年2月3日
(1) 寄託機関名:独立行政法人製品評価技術基盤機構 特許微生物寄託センター
(2) 連絡先:〒292-0818 千葉県木更津市かずさ鎌足2-5-8
電話番号0438-20-5580
(3) 受託番号:NITE BP−31
(4) 識別のための表示:Bifidobacterium bifidum OLB6378
(5) 原寄託日: 平成16年(2004年)10月26日
(6) ブタペスト条約に基づく寄託への移管日:2006年1月18日
また、本発明では75℃で60分間加熱処理を行って不活性化した菌体でもアレルギー抑制効果があることが分かった。したがって、本発明の菌体を含む処理物はその中の菌体が生菌体のみならず、死菌体または破砕物であっても有用である。これにより、これまで粉ミルクなど厳しい生物学的規格を有する製品においても添加することが可能となり、本発明の菌体は製品形態などによらず様々な製品にも応用できる。
すなわち、本発明のビフィズス菌、その処理物、それを有効成分とするアレルギー予防および/または治療剤、および医薬品としてのみならず、飲食品として予防および/または治療剤を含有してなるアレルギー予防および/または治療用食品組成物として使用することができる。
本発明のアレルギー予防および/または治療剤の適用可能なアレルギーの種類としては、これらに限定されないが、例えば、I型アレルギー、IV型アレルギー、花粉症、アトピー性皮膚炎、気管支喘息、アレルギー性結膜炎、アレルギー性鼻炎、アレルギー性胃腸炎、アナフィラキシー反応、薬物アレルギー、じんましん、血清病、溶血性貧血、接触性皮膚炎、重症筋無力症、グッドパスチェア症候群、糸球体腎炎等を挙げることができる。
本発明において予防および/または治療の対象となるアレルギーの原因となるアレルゲンの種類としては、これらに限定されないが、例えば食品(小麦、大麦、オーツ麦、ライ麦、そば、卵、乳、チーズ、落花生、米、トウモロコシ、アワ、キビ、ヒエ、大豆、じゃがいも、やまいも、にんにく、たまねぎ、ニンジン、パセリ、セロリ、トマト、オレンジ、もも、りんご、キウイフルーツ、メロン、イチゴ、バナナ、くるみ、ゴマ、まつたけ、あわび、いか、いくら、えび、かに、さけ、さば、アジ、イワシ、タラ、イカ、タコ、ホタテ、牛肉、鶏肉、豚肉、ゼラチン等)、動物(イヌ、ネコ、マウス、ラット、ハト等やその皮膚、体毛、糞、羽毛等)、昆虫(蛾、蟻、ユスリカ、スズメバチなど、およびこれら昆虫の分泌物、鱗粉)、ダニ、寄生虫(アニサキス、回虫など)、草木(スギ、ヒノキ、ブタクサ、イネ科植物、ヨモギ、ハンノキ等やその花粉、樹液等)、かび、ほこり、ハウスダスト、ゴム、金属、化学薬品、医薬品、等を挙げることができる。
また本発明のアレルギー予防および/または治療剤は、経口投与または非経口投与(筋肉内、皮下、静脈内、坐薬、経皮等)のいずれでも投与できる。本発明のアレルギー予防および/または治療剤を摂取できるのは、成年であってもよいが、乳幼児や老人であっても構わない。
なお本明細書において引用された全ての先行技術文献は、参照として本明細書に組み入れられる。
[被検菌株]
ヒトの糞便から単離したビフィドバクテリウム(Bifidobacterium)属の菌13株(Bifidobacterium longum OLB6001、 Bifidobacterium longum OLB6290、Bifidobacterium longum MEP170501、Bifidobacterium longum MEP170502、Bifidobacterium longum MEP170503、Bifidobacterium longum MEP170504、Bifidobacterium bifidum MEP170505、Bifidobacterium bifidum MEP170506、Bifidobacterium bifidum MEP170507、Bifidobacterium breve MEP170508、Bifidobacterium breve MEP170509、Bifidobacterium breve MEP170510、Bifidobacterium breve MEP170511)を以降の試験に供した。試験に供する菌をGAM培地で培養(37℃、一晩)した。集菌後、生理食塩水で2回、滅菌蒸留水で1回洗浄したのち、75℃で60分間加熱処理し、凍結乾燥した。
なお、菌株名にMEPと記載された菌株は明治乳業株式会社保有菌株である。
3週齢の雌性、C57BL/6Nマウス(各群n=10、日本クレア)に、上記方法にて得られた各ビフィズス菌加熱処理菌体を0.1%添加した表1に示す組成の飼料を2週間自由摂取させた(被検菌体投与群)。対照群には表1に示す組成の飼料を2週間自由摂取させた。その後7週間は、全ての群にMF飼料(オリエンタル酵母)を与えた。さらにその後2週間、被検菌体投与群には上記方法にて得られた各ビフィズス菌加熱処理菌体を0.1%添加した表1に示す組成の飼料を、対照群には表1に示す組成の飼料を自由摂取させた。飼育終了後、全採血を行い、それぞれのマウスの血清を用いてラット皮内急性アナフィラキシー反応(以降、PCA反応ともいう)試験を行い、抗カゼイン特異的IgE抗体の陽性率を対照群、被検菌体投与群の間で比較した。
7週齢の雄性、SDラット(日本SLC)の背部を除毛し、皮内にマウスの血清を25μlずつ注射した。マウスの血清の皮内注射より24時間後、カゼインを2mg/mlとエバンスブルー(和光純薬工業)を1%含む溶液0.5mlをラットの尾静脈に注射した。さらにカゼイン、エバンスブルーの静脈注射から30分後に、背部皮下のエバンスブルー色素の漏出の有無を目視判定し、色素漏出が認められたものをPCA反応陽性とした。各群10匹中のPCA反応陽性数を求め、対照群と被検菌体投与群のPCA反応陽性数をカイ二乗検定により危険率5%で有意差検定を行った。
結果を表2に示す。対照群では10匹中9匹でPCA反応陽性となった。一方、本発明のビフィズス菌加熱処理菌体投与群では菌株によりPCA反応陽性率が異なった。中でも、ビフィドバクテリウム・ロンガムOLB6001菌株(Bifidobacterium longum OLB6001、受託番号:FERM P−13610)、およびビフィドバクテリウム・ロンガムOLB6290菌株(Bifidobacterium longum OLB6290、受託番号:NITE P−75)投与群ではPCA反応陽性数が共に10匹中6匹と、対照群および他のビフィズス菌投与群(陽性数が10匹中7〜9匹)に比べ低いPCA反応陽性数を示した。いずれの群においても有意差は認められなかった。
試験菌株の中でも、PCA反応性の高かったビフィドバクテリウム・ロンガムOLB6001菌株(FERM P−13610)、およびビフィドバクテリウム・ロンガムOLB6290菌株(NITE P−75)投与群について、再度同様の経口投与試験を実施し、PCA反応によるIgE抑制試験を行った。結果を表3に示す。対照群のマウス15匹中13匹でPCA反応陽性となった。一方、ビフィドバクテリウム・ロンガムOLB6001菌株(FERM P−13610)投与群は10匹中6匹、ビフィドバクテリウム・ロンガムOLB6290菌株(受託番号:NITE P−75)投与群では10匹中5匹がPCA反応陽性となった。いずれも対照群に比べPCA反応陽性率は低値を示した。さらに、ビフィドバクテリウム・ロンガムOLB6290菌株(受託番号:NITE P−75)投与群は対照群に比べ、危険率5%水準(カイ二乗検定)で有意な差が確認された。
[被検菌株]
ヒトの糞便から単離したビフィドバクテリウム(Bifidobacterium)属の菌の中から、実施例1で加熱死菌体での有効性が確認されたビフィドバクテリウム・ロンガムOLB6290菌株(Bifidobacterium longum OLB6290、受託番号:NITE P−75)、および、それに加えて当社保有のビフィズス菌であるビフィドバクテリウム・ビフィダムOLB6378菌株(Bifidobacterium bifidum OLB6378、受託番号:NITE BP−31)を、以下の試験に供した。ビフィドバクテリウム・ロンガムOLB6290菌株はGAM培地で静置培養(37℃、一晩)した。さらに集菌後、生理食塩水で2回、滅菌蒸留水で1回洗浄したのち、75℃で60分間加熱処理し、凍結乾燥して菌体を得た。また、ビフィドバクテリウム・ビフィダムOLB6378菌株については、工業的に大量調製した菌体を試験に用いた。具体的には、ビフィドバクテリウム・ビフィダムOLB6378菌株をカゼイン分解培地に接種し、炭酸ガス雰囲気下に水酸化ナトリウムを適宜添加してpH6.0〜6.5の範囲になるように調整しながら中和培養(37℃、1晩)した。培養後に、集菌し、凍結乾燥して菌体を得た。この凍結乾燥物は生菌を含むものである。
3週齢の雌性、C57BL/6Nマウス(日本クレア)に、上記方法にて得られたビフィドバクテリウム・ロンガムOLB6290菌株またはビフィドバクテリウム・ビフィダムOLB6378菌株を摂取させた。OLB6290群(n=10)には、ビフィドバクテリウム・ロンガムOLB6290菌株の菌体を0.1%添加した表1に示す組成の飼料を、2週間自由摂取させた。OLB6378群(n=15)には、中和培養で得たビフィドバクテリウム・ビフィダムOLB6378菌株の菌体を0.1%添加した表1に示す組成の飼料を、2週間自由摂取させた。陽性対照群(n=15)には表1に示す組成の飼料を与えた。陰性対照群(n=3)には表1に示す組成の飼料からカゼインを除いた飼料を、2週間自由摂取させた。その後7週間は、全ての群にMF飼料(オリエンタル酵母)を与えた。さらにその後2週間、OLB6290群には、ビフィドバクテリウム・ロンガムOLB6290菌株の菌体を0.1%添加した表1に示す組成の飼料を、2週間自由摂取させた。OLB6378群には、中和培養で得たビフィドバクテリウム・ビフィダムOLB6378菌株の菌体を0.1%添加した表1に示す組成の飼料を、2週間自由摂取させた。陽性対照群には表1に示す組成の飼料を与えた。陰性対照群には表1に示す組成の飼料からカゼインを除いた飼料を、2週間自由摂取させた。飼育終了後、全採血を行い、それぞれのマウスの血清を用いてラット皮内急性アナフィラキシー反応(以降、PCA反応ともいう)試験を行い、抗カゼイン特異的IgE抗体の陽性率をOLB6290群、OLB6378群、陽性対照群、陰性対照群の間で比較した。
7週齢の雄性、SDラット(日本SLC)の背部を除毛し、皮内にマウスの血清を25μlずつ注射した。マウスの血清の皮内注射より24時間後、カゼインを2mg/mlとエバンスブルー(和光純薬工業)を1%含む溶液0.5mlをラットの尾静脈に注射した。さらにカゼイン、エバンスブルーの静脈注射から30分後に、背部皮下のエバンスブルー色素の漏出の有無を目視判定し、色素漏出が認められたものをPCA反応陽性とした。各群中のPCA反応陽性数を求め、各群の匹数で除してPCA反応陽性率を求めた。陽性対照群とOLB6290群、OLB6378群、陰性対照群のPCA反応陽性率をフィッシャーの直接確率法により危険率5%で有意差検定を行った。
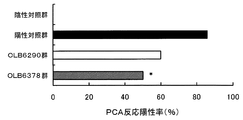
結果を図1に示す。陽性対照群のPCA反応陽性率は86%、陰性対照群のPCA反応陽性率は0%であった。一方、本発明のビフィズス菌を投与した群では菌株間によりPCA反応陽性率が異なったが、いずれも陽性対照群よりも低い値を示した。中でも、OLB6378群は陽性対照群よりも有意に(p<0.05)低いPCA反応陽性率を示した。
およびビフィドバクテリウム・ビフィダムOLB6378(Bifidobacterium bifidum OLB6378、受託番号:NITE BP−31)は、死菌のみならず生菌も、食物アレルギーモデルマウスへの経口投与において抗原特異的なIgE産生を抑制することが示された。
Claims (4)
- ビフィドバクテリウム・ロンガムOLB6290菌株(Bifidobacterium longum OLB6290、受託番号:NITE P−75)。
- ビフィドバクテリウム・ロンガムOLB6290菌株(Bifidobacterium longum OLB6290、受託番号:NITE P−75)を有効成分とする、食物アレルゲンの経口摂取のみにより誘導される食物アレルギーの予防剤。
- ビフィドバクテリウム・ロンガムOLB6290菌株(Bifidobacterium longum OLB6290、受託番号:NITE P−75)を有効成分とする、アレルゲンの経口摂取のみにより誘導される抗原特異的IgE抗体の産生の予防剤。
- ビフィドバクテリウム・ロンガムOLB6290菌株(Bifidobacterium longum OLB6290、受託番号:NITE P−75)を有効成分とする、腸管を介して発症するアレルギーの予防剤。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2006057675A JP5273695B2 (ja) | 2005-03-03 | 2006-03-03 | ビフィズス菌を有効成分とするアレルギー予防および/または治療剤 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2005059565 | 2005-03-03 | ||
| JP2005059565 | 2005-03-03 | ||
| JP2006057675A JP5273695B2 (ja) | 2005-03-03 | 2006-03-03 | ビフィズス菌を有効成分とするアレルギー予防および/または治療剤 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2006273852A JP2006273852A (ja) | 2006-10-12 |
| JP2006273852A5 JP2006273852A5 (ja) | 2009-04-09 |
| JP5273695B2 true JP5273695B2 (ja) | 2013-08-28 |
Family
ID=37208931
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2006057675A Expired - Fee Related JP5273695B2 (ja) | 2005-03-03 | 2006-03-03 | ビフィズス菌を有効成分とするアレルギー予防および/または治療剤 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP5273695B2 (ja) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN109069555A (zh) * | 2016-04-13 | 2018-12-21 | 株式会社明治 | 面向新生儿的用于改善脑功能的组合物 |
| KR20190007251A (ko) * | 2017-07-12 | 2019-01-22 | 대한민국(농촌진흥청장) | 피부염 치료용 비피도박테리움 롱검 kacc 91563 및 이를 함유하는 치즈 |
Families Citing this family (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2009067679A (ja) * | 2005-12-27 | 2009-04-02 | Univ Of Tokushima | 抗ヒスタミン作用を有する医薬 |
| US20080118473A1 (en) * | 2006-11-01 | 2008-05-22 | The Procter & Gamble Company | Methods of treating a respiratory condition comprising probiotic treatment |
| JP2008195673A (ja) * | 2007-02-14 | 2008-08-28 | Nippon Meat Packers Inc | 延命効果物質、および感染防御効果・ワクチン効果促進物質、前記物質の検定用コンストラクト、並びにそれらの用途 |
| AU2007347318A1 (en) * | 2007-02-22 | 2008-08-28 | Jurgen Schrezenmeir | Probiotic, gram-positive bacteria for the prophylaxis, suppression, or elimination of allergic reactions in humans |
| MX2009010418A (es) | 2007-03-28 | 2010-02-18 | Alimentary Health Ltd | Cepas de bacterias bifidas probioticas. |
| DK2134833T3 (en) * | 2007-03-28 | 2016-06-20 | Alimentary Health Ltd | Probiotic Bifidobacterium strain |
| JP2009057346A (ja) * | 2007-09-03 | 2009-03-19 | Kirin Holdings Co Ltd | 免疫バランス調節用組成物 |
| KR100930996B1 (ko) * | 2007-10-10 | 2009-12-11 | 임병윤 | 녹차와 유산균이 함유된 아토피 치료용 분유와 이유식 |
| CN102272287B (zh) * | 2009-03-04 | 2014-12-10 | 株式会社明治 | 冷冻干燥粉末状菌体及其制造方法 |
| US9439449B2 (en) | 2009-08-18 | 2016-09-13 | Nestec S.A. | Nutritional composition comprising Bifidobacterium longum strains and reducing food allergy symptoms, especially in infants and children |
| JP5737646B2 (ja) * | 2010-03-24 | 2015-06-17 | 森下仁丹株式会社 | 抗アレルギー剤 |
| EP2449890A1 (en) * | 2010-11-05 | 2012-05-09 | Nestec S.A. | Powdered cereal compositions comprising non-replicating probiotic microorganisms |
| EP2449891A1 (en) * | 2010-11-05 | 2012-05-09 | Nestec S.A. | Drinking yoghurt preparations containing non-replicating probiotic micro-organisms |
| TW201636010A (zh) * | 2014-12-26 | 2016-10-16 | Meiji Co Ltd | 有機酸的產生促進劑、發炎性腸疾病的預防及/或改善劑 |
| US20180303883A1 (en) * | 2015-10-19 | 2018-10-25 | Meiji Co., Ltd. | Anti-allergic agent for infants |
| BR112019015806A2 (pt) * | 2017-01-31 | 2020-03-31 | University-Industry Cooperation Group Of Kyung Hee University | Bactérias ácido-lácticas inovadoras e uso das mesmas |
Family Cites Families (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH10309178A (ja) * | 1997-05-09 | 1998-11-24 | Wakamoto Pharmaceut Co Ltd | ビフィズス菌を有効成分とする抗アレルギー剤および醗酵食品 |
-
2006
- 2006-03-03 JP JP2006057675A patent/JP5273695B2/ja not_active Expired - Fee Related
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN109069555A (zh) * | 2016-04-13 | 2018-12-21 | 株式会社明治 | 面向新生儿的用于改善脑功能的组合物 |
| EP3443969A4 (en) * | 2016-04-13 | 2019-11-20 | Meiji Co., Ltd. | COMPOSITION FOR ENHANCING BRAIN FUNCTION FOR NEWBORN |
| US10925906B2 (en) | 2016-04-13 | 2021-02-23 | Meiji Co., Ltd. | Composition for improving brain function for neonates |
| CN109069555B (zh) * | 2016-04-13 | 2022-07-26 | 株式会社明治 | 面向新生儿的用于改善脑功能的组合物 |
| KR20190007251A (ko) * | 2017-07-12 | 2019-01-22 | 대한민국(농촌진흥청장) | 피부염 치료용 비피도박테리움 롱검 kacc 91563 및 이를 함유하는 치즈 |
| KR101987678B1 (ko) * | 2017-07-12 | 2019-06-11 | 대한민국 | 피부염 치료용 비피도박테리움 롱검 kacc 91563 및 이를 함유하는 치즈 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2006273852A (ja) | 2006-10-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5273695B2 (ja) | ビフィズス菌を有効成分とするアレルギー予防および/または治療剤 | |
| JP4974881B2 (ja) | 免疫機能調整剤 | |
| KR101355770B1 (ko) | 면역조절 활성이 높은 유산균의 배양법 | |
| JP7088829B2 (ja) | 新生児向けの脳機能改善用組成物 | |
| US20190240268A1 (en) | Infection protective agent for infants | |
| US20190201459A1 (en) | Anti-allergic agent for infants | |
| WO2018190407A1 (ja) | Toll様受容体2活性化用組成物 | |
| JP2022157465A (ja) | 乳幼児用排便促進剤 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20090220 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20090220 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20120208 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120406 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20120406 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20121129 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130111 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20130508 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20130509 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 Ref document number: 5273695 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| S531 | Written request for registration of change of domicile |
Free format text: JAPANESE INTERMEDIATE CODE: R313531 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| LAPS | Cancellation because of no payment of annual fees |