JP5203183B2 - 等容性収縮中に心室機能を評価するための装置 - Google Patents
等容性収縮中に心室機能を評価するための装置 Download PDFInfo
- Publication number
- JP5203183B2 JP5203183B2 JP2008504183A JP2008504183A JP5203183B2 JP 5203183 B2 JP5203183 B2 JP 5203183B2 JP 2008504183 A JP2008504183 A JP 2008504183A JP 2008504183 A JP2008504183 A JP 2008504183A JP 5203183 B2 JP5203183 B2 JP 5203183B2
- Authority
- JP
- Japan
- Prior art keywords
- ventricular
- heart
- lead
- pacing
- crystal
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N1/00—Electrotherapy; Circuits therefor
- A61N1/18—Applying electric currents by contact electrodes
- A61N1/32—Applying electric currents by contact electrodes alternating or intermittent currents
- A61N1/36—Applying electric currents by contact electrodes alternating or intermittent currents for stimulation
- A61N1/362—Heart stimulators
- A61N1/3627—Heart stimulators for treating a mechanical deficiency of the heart, e.g. congestive heart failure or cardiomyopathy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B8/00—Diagnosis using ultrasonic, sonic or infrasonic waves
- A61B8/08—Detecting organic movements or changes, e.g. tumours, cysts, swellings
- A61B8/0858—Detecting organic movements or changes, e.g. tumours, cysts, swellings involving measuring tissue layers, e.g. skin, interfaces
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N1/00—Electrotherapy; Circuits therefor
- A61N1/18—Applying electric currents by contact electrodes
- A61N1/32—Applying electric currents by contact electrodes alternating or intermittent currents
- A61N1/36—Applying electric currents by contact electrodes alternating or intermittent currents for stimulation
- A61N1/362—Heart stimulators
- A61N1/365—Heart stimulators controlled by a physiological parameter, e.g. heart potential
- A61N1/368—Heart stimulators controlled by a physiological parameter, e.g. heart potential comprising more than one electrode co-operating with different heart regions
- A61N1/3684—Heart stimulators controlled by a physiological parameter, e.g. heart potential comprising more than one electrode co-operating with different heart regions for stimulating the heart at multiple sites of the ventricle or the atrium
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N1/00—Electrotherapy; Circuits therefor
- A61N1/18—Applying electric currents by contact electrodes
- A61N1/32—Applying electric currents by contact electrodes alternating or intermittent currents
- A61N1/36—Applying electric currents by contact electrodes alternating or intermittent currents for stimulation
- A61N1/362—Heart stimulators
- A61N1/365—Heart stimulators controlled by a physiological parameter, e.g. heart potential
- A61N1/368—Heart stimulators controlled by a physiological parameter, e.g. heart potential comprising more than one electrode co-operating with different heart regions
- A61N1/3684—Heart stimulators controlled by a physiological parameter, e.g. heart potential comprising more than one electrode co-operating with different heart regions for stimulating the heart at multiple sites of the ventricle or the atrium
- A61N1/36842—Multi-site stimulation in the same chamber
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N1/00—Electrotherapy; Circuits therefor
- A61N1/18—Applying electric currents by contact electrodes
- A61N1/32—Applying electric currents by contact electrodes alternating or intermittent currents
- A61N1/36—Applying electric currents by contact electrodes alternating or intermittent currents for stimulation
- A61N1/362—Heart stimulators
- A61N1/365—Heart stimulators controlled by a physiological parameter, e.g. heart potential
- A61N1/368—Heart stimulators controlled by a physiological parameter, e.g. heart potential comprising more than one electrode co-operating with different heart regions
- A61N1/3684—Heart stimulators controlled by a physiological parameter, e.g. heart potential comprising more than one electrode co-operating with different heart regions for stimulating the heart at multiple sites of the ventricle or the atrium
- A61N1/36843—Bi-ventricular stimulation
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N1/00—Electrotherapy; Circuits therefor
- A61N1/18—Applying electric currents by contact electrodes
- A61N1/32—Applying electric currents by contact electrodes alternating or intermittent currents
- A61N1/36—Applying electric currents by contact electrodes alternating or intermittent currents for stimulation
- A61N1/362—Heart stimulators
- A61N1/365—Heart stimulators controlled by a physiological parameter, e.g. heart potential
- A61N1/36514—Heart stimulators controlled by a physiological parameter, e.g. heart potential controlled by a physiological quantity other than heart potential, e.g. blood pressure
- A61N1/36528—Heart stimulators controlled by a physiological parameter, e.g. heart potential controlled by a physiological quantity other than heart potential, e.g. blood pressure the parameter being measured by means of ultrasound
Description
Claims (1)
- 心臓の心室機能を評価するための埋め込み可能医療デバイス(IMD)であって、
複数のリード線、及び気密封止されたハウジング内に封入される埋め込み可能医療デバイス回路と、
前記心臓の第1の位置に配置されるようになっている第1のソノマイクロメータ結晶を支持する第1のリード線と、
心臓の第2の位置に配置されるようになっている第2のソノマイクロメータ結晶を支持する第2のリード線と
を備え、前記第1の位置及び前記第2の位置は左心室の一部にわたり、前記第1のリード線及び前記第2のリード線は前記埋め込み可能医療デバイス回路に接続されるようになっており、前記埋め込み可能医療デバイスの前記ハウジングは患者に埋め込まれるように構成され、
前記デバイスは、
1つ又は複数の心周期中に、前記第1のソノマイクロメータ結晶及び前記第2のソノマイクロメータ結晶のうちの一方に周期的にエネルギーを供給することであって、それによって、前記第1のソノマイクロメータ結晶及び前記第2のソノマイクロメータ結晶のうちの他方に超音波周波数センス信号を生成させる、超音波周波数で放射される信号を放射する、供給すること、
前記放射される信号の放射と、前記センス信号のセンシングとの間の時間遅延の関数として前記第1のソノマイクロメータ結晶と前記第2のソノマイクロメータ結晶との間の距離を求めること、
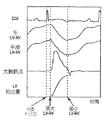
心臓の1心周期に亘る、前記第1の及び第2のソノマイクロメータ結晶の間の距離を測定して、時間の関数としての心室寸法信号を生成すること、
測定することであって、
a)前記心室寸法信号の期外収縮(PS)であって、該期外収縮(PS)の値は、前記心周期の心室充満段階の終わりに、又はその近くで生じる第1の極大値から、前記心周期の前記心室充満段階から心室駆出段階への移行中に生じる相対的な最小値までの、前記心室寸法信号の減少に等しい、前記期外収縮(PS)、及び
b)前記心室寸法信号の等容性拡張(IL)であって、該等容性拡張(IL)の値は、前記心周期の前記心室充満段階から前記心室駆出段階への移行中に生じる前記相対的な最小値から、前記心周期の前記心室駆出段階の始まり、又はその近くで生じる第2の極大値までの、前記心室寸法信号の増加に等しい、等容性拡張(IL)
のうちの少なくとも一方の値を測定すること、
前記期外収縮(PS)又は前記等容性拡張(IL)のそれぞれのうちの少なくとも一方の測定値と、対応する前記期外収縮(PS)若しくは前記等容性拡張(IL)のそれぞれのうちの少なくとも1つの基準値とを比較すること、
、及び
該埋め込み可能医療デバイスの動作を調整すること
が可能である、心臓の心室機能を評価するための埋め込み可能医療デバイス。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US11/097,706 US7233821B2 (en) | 2005-03-31 | 2005-03-31 | Method and apparatus for evaluating ventricular performance during isovolumic contraction |
| US11/097,706 | 2005-03-31 | ||
| PCT/US2006/010713 WO2006104869A2 (en) | 2005-03-31 | 2006-03-23 | Method and apparatus for evaluating ventricular performance during isovolumic contraction |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2008535555A JP2008535555A (ja) | 2008-09-04 |
| JP2008535555A5 JP2008535555A5 (ja) | 2009-03-05 |
| JP5203183B2 true JP5203183B2 (ja) | 2013-06-05 |
Family
ID=36950445
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008504183A Expired - Fee Related JP5203183B2 (ja) | 2005-03-31 | 2006-03-23 | 等容性収縮中に心室機能を評価するための装置 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US7233821B2 (ja) |
| EP (1) | EP1885443B1 (ja) |
| JP (1) | JP5203183B2 (ja) |
| AT (1) | ATE432107T1 (ja) |
| CA (1) | CA2600870A1 (ja) |
| DE (1) | DE602006006998D1 (ja) |
| WO (1) | WO2006104869A2 (ja) |
Families Citing this family (39)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20060247693A1 (en) | 2005-04-28 | 2006-11-02 | Yanting Dong | Non-captured intrinsic discrimination in cardiac pacing response classification |
| US7774064B2 (en) | 2003-12-12 | 2010-08-10 | Cardiac Pacemakers, Inc. | Cardiac response classification using retriggerable classification windows |
| US7647108B2 (en) * | 2004-09-30 | 2010-01-12 | Cardiac Pacemakers, Inc. | Methods and systems for selection of cardiac pacing electrode configurations |
| US7925329B2 (en) | 2004-10-08 | 2011-04-12 | Proteus Biomedical, Inc. | Implantable doppler tomography system |
| US7392086B2 (en) | 2005-04-26 | 2008-06-24 | Cardiac Pacemakers, Inc. | Implantable cardiac device and method for reduced phrenic nerve stimulation |
| US8948867B2 (en) | 2006-09-14 | 2015-02-03 | Cardiac Pacemakers, Inc. | Capture detection with cross chamber backup pacing |
| US8209013B2 (en) | 2006-09-14 | 2012-06-26 | Cardiac Pacemakers, Inc. | Therapeutic electrical stimulation that avoids undesirable activation |
| US9037239B2 (en) | 2007-08-07 | 2015-05-19 | Cardiac Pacemakers, Inc. | Method and apparatus to perform electrode combination selection |
| US8265736B2 (en) | 2007-08-07 | 2012-09-11 | Cardiac Pacemakers, Inc. | Method and apparatus to perform electrode combination selection |
| WO2009075949A1 (en) * | 2007-12-11 | 2009-06-18 | Cardiac Pacemakers, Inc. | Coronary vein hemodynamic sensor |
| US9149631B2 (en) * | 2007-12-13 | 2015-10-06 | Cardiac Pacemakers, Inc. | Cardiac lead placement using multiple spatially distributed sensors |
| EP2254661B1 (en) | 2008-02-14 | 2015-10-07 | Cardiac Pacemakers, Inc. | Apparatus for phrenic stimulation detection |
| US8273029B2 (en) * | 2008-02-18 | 2012-09-25 | Washington University | Pressure recovery index to assess cardiac function |
| WO2009134170A1 (en) * | 2008-04-29 | 2009-11-05 | St. Jude Medical Ab | Heart failure detecting medical device |
| US8818507B2 (en) * | 2008-05-27 | 2014-08-26 | Cardiac Pacemakers, Inc. | Coronary vein dimensional sensor and fixation apparatus |
| WO2010052303A1 (en) * | 2008-11-06 | 2010-05-14 | Oslo Universitetssykehus Hf | Analysis of ventricular electro-mechanical activation data |
| EP2358275A2 (en) | 2008-12-02 | 2011-08-24 | Proteus Biomedical, Inc. | Optimial drive frequency selection in electrical tomography |
| JP2012514500A (ja) * | 2009-01-06 | 2012-06-28 | プロテウス バイオメディカル インコーポレイテッド | 音響および光子断層撮影のための方法、システム、およびデバイス |
| WO2010135653A1 (en) * | 2009-05-22 | 2010-11-25 | Imacor Inc. | Tee-assisted cardiac resynchronization therapy with mechanical activation mapping |
| WO2010138450A1 (en) * | 2009-05-26 | 2010-12-02 | Cardiac Pacemakers, Inc. | System and method for rhythm identification and therapy discrimination using hemodynamic status information |
| WO2010141284A1 (en) * | 2009-06-01 | 2010-12-09 | Cardiac Pacemakers, Inc. | System and method for pacing rate control utilizing patient hemodynamic status information |
| JP2012528607A (ja) | 2009-06-01 | 2012-11-15 | カーディアック ペースメイカーズ, インコーポレイテッド | 患者の血行動態に基づく代償不全の検出および処置のためのシステムおよび方法 |
| US8758257B2 (en) * | 2009-12-24 | 2014-06-24 | Renzo Cecere | Instrument including a movement sensor for positioning an effective portion and method of using same |
| JP5597492B2 (ja) | 2010-09-08 | 2014-10-01 | 株式会社東芝 | 超音波診断装置、画像処理装置およびプログラム |
| US9095284B2 (en) | 2010-10-28 | 2015-08-04 | Medtronic, Inc. | Distance measurement using implantable acoustic transducers |
| US9883837B2 (en) | 2011-09-30 | 2018-02-06 | Jonathan M. Whitfield | Heart rate and pulse monitoring device |
| JP6522515B2 (ja) | 2013-01-22 | 2019-06-05 | デューク ユニバーシティ | 心臓再同期療法(crt)を最適化するためのシステム及び方法 |
| WO2015061453A1 (en) * | 2013-10-22 | 2015-04-30 | Msssachusetts Institute Of Technology | Peripheral neural interface via nerve regeneration to distal tissues |
| GB2563155A (en) | 2015-02-12 | 2018-12-05 | Foundry Innovation & Res 1 Ltd | Implantable devices and related methods for heart failure monitoring |
| WO2017024051A1 (en) | 2015-08-03 | 2017-02-09 | Foundry Innovation & Research 1, Ltd. | Devices and methods for measurement of vena cava dimensions, pressure, and oxygen saturation |
| US11179251B2 (en) | 2016-01-08 | 2021-11-23 | Massachusetts Institute Of Technology | Method and system for providing proprioceptive feedback and functionality mitigating limb pathology |
| US11701018B2 (en) | 2016-08-11 | 2023-07-18 | Foundry Innovation & Research 1, Ltd. | Wireless resonant circuit and variable inductance vascular monitoring implants and anchoring structures therefore |
| EP3496606A1 (en) | 2016-08-11 | 2019-06-19 | Foundry Innovation & Research 1, Ltd. | Systems and methods for patient fluid management |
| US11206992B2 (en) | 2016-08-11 | 2021-12-28 | Foundry Innovation & Research 1, Ltd. | Wireless resonant circuit and variable inductance vascular monitoring implants and anchoring structures therefore |
| CN110300546B (zh) | 2016-11-29 | 2023-03-31 | 铸造创新&研究第一有限责任公司 | 用于监测患者脉管系统和流体状态的系统和方法 |
| EP3629937A1 (en) | 2017-05-31 | 2020-04-08 | Foundry Innovation & Research 1, Ltd. | Implantable ultrasonic vascular sensor |
| EP3629921A1 (en) | 2017-05-31 | 2020-04-08 | Foundry Innovation & Research 1, Ltd. | Implantable sensors for vascular monitoring |
| US11318314B2 (en) * | 2018-06-14 | 2022-05-03 | Medtronic, Inc. | Delivery of cardiac pacing therapy for cardiac remodeling |
| JP7407821B2 (ja) | 2018-12-20 | 2024-01-04 | コーニンクレッカ フィリップス エヌ ヴェ | 対象者から生理学的尺度を取得するための方法及びシステム |
Family Cites Families (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2637807B1 (fr) * | 1988-10-14 | 1997-10-31 | Zacouto Fred | Dispositif de protection contre les affections liees au sang, notamment thromboses, embolies, hemorragies, hemopathies et presence d'elements anormaux dans le sang |
| CA1327631C (en) * | 1989-03-20 | 1994-03-08 | Non-Invasive Monitoring Systems, Inc. | System for non-invasive detection of changes of cardiac volumes and aortic pulses |
| FR2760369B1 (fr) * | 1997-03-07 | 1999-04-30 | Ela Medical Sa | Stimulateur cardiaque multisites pour le traitement des insuffisances cardiaques par stimulation |
| AU4601500A (en) * | 1999-05-18 | 2000-12-05 | Sonometrics Corporation | System for incorporating sonomicrometer functions into medical instruments and implantable biomedical devices |
| US6406422B1 (en) * | 2000-03-02 | 2002-06-18 | Levram Medical Devices, Ltd. | Ventricular-assist method and apparatus |
| US6738667B2 (en) * | 2000-12-28 | 2004-05-18 | Medtronic, Inc. | Implantable medical device for treating cardiac mechanical dysfunction by electrical stimulation |
| US7096064B2 (en) * | 2001-08-28 | 2006-08-22 | Medtronic, Inc. | Implantable medical device for treating cardiac mechanical dysfunction by electrical stimulation |
| US6795732B2 (en) * | 2001-10-30 | 2004-09-21 | Medtronic, Inc. | Implantable medical device employing sonomicrometer output signals for detection and measurement of cardiac mechanical function |
| US20050027323A1 (en) * | 2001-10-30 | 2005-02-03 | Medtronic, Inc. | Implantable medical device for monitoring cardiac blood pressure and chamber dimension |
| US6959214B2 (en) * | 2001-11-28 | 2005-10-25 | Medtronic, Inc. | Implantable medical device for measuring mechanical heart function |
| US7041061B2 (en) * | 2002-07-19 | 2006-05-09 | Cardiac Pacemakers, Inc. | Method and apparatus for quantification of cardiac wall motion asynchrony |
| JP2006518631A (ja) * | 2003-01-31 | 2006-08-17 | ザ ボード オブ トラスティーズ オブ ザ リーランド スタンフォード ジュニア ユニバーシティ | 心不全をモニタリングするための尖部運動の検出 |
| US6885889B2 (en) * | 2003-02-28 | 2005-04-26 | Medtronic, Inc. | Method and apparatus for optimizing cardiac resynchronization therapy based on left ventricular acceleration |
| US20040220640A1 (en) * | 2003-04-29 | 2004-11-04 | Medtronic, Inc. | Method and apparatus for determining myocardial electrical resitution and controlling extra systolic stimulation |
-
2005
- 2005-03-31 US US11/097,706 patent/US7233821B2/en active Active
-
2006
- 2006-03-23 EP EP06748629A patent/EP1885443B1/en not_active Not-in-force
- 2006-03-23 JP JP2008504183A patent/JP5203183B2/ja not_active Expired - Fee Related
- 2006-03-23 WO PCT/US2006/010713 patent/WO2006104869A2/en active Application Filing
- 2006-03-23 DE DE602006006998T patent/DE602006006998D1/de active Active
- 2006-03-23 CA CA002600870A patent/CA2600870A1/en not_active Abandoned
- 2006-03-23 AT AT06748629T patent/ATE432107T1/de not_active IP Right Cessation
Also Published As
| Publication number | Publication date |
|---|---|
| US20060224203A1 (en) | 2006-10-05 |
| EP1885443B1 (en) | 2009-05-27 |
| ATE432107T1 (de) | 2009-06-15 |
| WO2006104869A2 (en) | 2006-10-05 |
| EP1885443A2 (en) | 2008-02-13 |
| CA2600870A1 (en) | 2006-10-05 |
| WO2006104869A3 (en) | 2007-04-05 |
| WO2006104869A9 (en) | 2006-11-16 |
| JP2008535555A (ja) | 2008-09-04 |
| US7233821B2 (en) | 2007-06-19 |
| DE602006006998D1 (de) | 2009-07-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5203183B2 (ja) | 等容性収縮中に心室機能を評価するための装置 | |
| US11305124B2 (en) | System and method for pacing parameter optimization using heart sounds | |
| US7082330B2 (en) | Implantable medical device employing sonomicrometer output signals for detection and measurement of cardiac mechanical function | |
| JP5021478B2 (ja) | 心臓用システム | |
| US9265949B2 (en) | Method and apparatus for controlling cardiac therapy based on electromechanical timing | |
| JP5352240B2 (ja) | 心臓再同期療法パラメータの最適化 | |
| JP4711966B2 (ja) | 拡張期機能不全に対するページング・システム | |
| US9675315B2 (en) | Method and apparatus for cardiac function monitoring | |
| US8032214B2 (en) | Method and apparatus for optimizing ventricular synchrony during DDD resynchronization therapy using adjustable atrio-ventricular delays | |
| US20080288013A1 (en) | Pulmonary pressure monitoring | |
| US20100049063A1 (en) | Devices and methods for accelerometer-based characterization of cardiac function and identification of lv target pacing zones | |
| US10918858B2 (en) | Cardiac volume sensing via an implantable medical device in support of cardiac resynchronization therapy | |
| US7792581B2 (en) | Method and apparatus for treating diastolic heart failure | |
| US8781579B2 (en) | Implantable medical device for cardiac therapy | |
| US9186512B2 (en) | Method and apparatus for organ specific inflammation monitoring |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20090116 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20090116 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20110516 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20110518 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20110816 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20110823 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20110905 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20111004 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20111028 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120126 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20120224 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120229 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20130118 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20130213 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5203183 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20160222 Year of fee payment: 3 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |