JP4635157B2 - Method for producing cyclotriphosphazene derivative - Google Patents
Method for producing cyclotriphosphazene derivative Download PDFInfo
- Publication number
- JP4635157B2 JP4635157B2 JP2005258811A JP2005258811A JP4635157B2 JP 4635157 B2 JP4635157 B2 JP 4635157B2 JP 2005258811 A JP2005258811 A JP 2005258811A JP 2005258811 A JP2005258811 A JP 2005258811A JP 4635157 B2 JP4635157 B2 JP 4635157B2
- Authority
- JP
- Japan
- Prior art keywords
- cyclotriphosphazene
- group
- general formula
- reaction
- solution
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 0 *CCC1CCCCC1 Chemical compound *CCC1CCCCC1 0.000 description 3
Landscapes
- Fireproofing Substances (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
Description
本発明は、シクロトリホスファゼン誘導体の製造方法、特に、リン原子にフェノキシ基などのオキシアリール基が結合したシクロトリホスファゼン誘導体の製造方法に関する。 The present invention relates to a method for producing a cyclotriphosphazene derivative, and more particularly to a method for producing a cyclotriphosphazene derivative in which an oxyaryl group such as a phenoxy group is bonded to a phosphorus atom.
シクロトリホスファゼンを構成する三つの各リン原子のそれぞれにフェノキシ基などのオキシアリール基が二つずつ結合した構造を有するヘキサオキシアリール−シクロトリホスファゼンは、各種の樹脂材料の難燃剤として利用されている。例えば、特許文献1〜4には、フェノキシ基を有するシクロトリホスファゼン誘導体を難燃剤として含むエポキシ樹脂組成物が記載されており、また、特許文献5および6には、シアノフェノキシ基を有するシクロトリホスファゼン誘導体を難燃剤として含むエポキシ樹脂組成物が記載されている。この種のヘキサオキシアリール−シクロトリホスファゼンは、樹脂材料に添加しても誘電率を低く抑えることができることから、回路基板や電子素子の封止材等、電気・電子技術分野における樹脂材料用の難燃剤として特に有用である。 Hexaoxyaryl-cyclotriphosphazene having a structure in which two oxyaryl groups such as phenoxy groups are bonded to each of the three phosphorus atoms constituting cyclotriphosphazene is used as a flame retardant for various resin materials. Yes. For example, Patent Documents 1 to 4 describe an epoxy resin composition containing a cyclotriphosphazene derivative having a phenoxy group as a flame retardant, and Patent Documents 5 and 6 describe a cyclotriphosphine having a cyanophenoxy group. An epoxy resin composition containing a phosphazene derivative as a flame retardant is described. This kind of hexaoxyaryl-cyclotriphosphazene can keep the dielectric constant low even if it is added to the resin material, so that it can be used for resin materials in the electric and electronic technical fields such as circuit boards and electronic device sealing materials. It is particularly useful as a flame retardant.
ところで、上述のようなヘキサオキシアリール−シクロトリホスファゼンは、ヘキサクロロシクロトリホスファゼンなどの、シクロトリホスファゼンを構成する三つのリン原子のそれぞれに塩素などのハロゲン原子が二つずつ結合した構造を有するヘキサハロゲン化シクロトリホスファゼンを原料とし、このヘキサハロゲン化シクロトリホスファゼンの各ハロゲン原子をフェノキシ基やシアノフェノキシ基などのオキシアリール基で置換することにより製造されている。 By the way, the above-mentioned hexaoxyaryl-cyclotriphosphazene has a structure in which two halogen atoms such as chlorine are bonded to each of three phosphorus atoms constituting cyclotriphosphazene, such as hexachlorocyclotriphosphazene. It is produced by using halogenated cyclotriphosphazene as a raw material and replacing each halogen atom of the hexahalogenated cyclotriphosphazene with an oxyaryl group such as a phenoxy group or a cyanophenoxy group.
ヘキサハロゲン化シクロトリホスファゼンのリン原子に結合しているハロゲン原子(ここでは、「活性ハロゲン原子」と云う場合がある)をオキシアリール基で置換し、目的のヘキサオキシアリール−シクロトリホスファゼンを製造する方法は、例えば、上述の特許文献5および次の各特許文献に記載されているように、既に多数知られている。 The halogen atom bonded to the phosphorus atom of the hexahalogenated cyclotriphosphazene (herein sometimes referred to as “active halogen atom”) is substituted with an oxyaryl group to produce the desired hexaoxyaryl-cyclotriphosphazene Many methods are already known as described in, for example, the above-mentioned Patent Literature 5 and the following Patent Literatures.
◎特許文献5
4−シアノフェノールとフェノールとの混合物をヘキサハロゲン化シクロトリホスファゼンと反応させる方法。
◎特許文献7
ヘキサハロゲン化シクロトリホスファゼンに対し、フェノールのアルカリ金属塩を反応させる方法。
◎特許文献8
アルカリ金属の水酸化物または炭酸塩を脱酸剤として用い、ヘキサハロゲン化シクロトリホスファゼンとフェノールとを反応させる方法。
◎特許文献9
フェノール類とアルカリ金属水酸化物とで調製したフェノラート類を、ヘキサハロゲン化シクロトリホスファゼンと共沸脱水で水を除きながら反応させる方法。
◎特許文献10
相間移動触媒を使用し、ヘキサハロゲン化シクロトリホスファゼンとフェノール等とを水、塩基および水と非混合性の溶媒中で反応させる方法。
◎特許文献11
無機塩類、第三級アミンおよびジメチルアミノピリジンのような有機強塩基の存在下において、ヘキサハロゲン化シクロトリホスファゼンとフェノールとを反応させる方法。
◎特許文献12
鎖状または環式の三級アミン類またはアミド化合物の存在下、アルカリ金属フェノラートとヘキサハロゲン化シクロトリホスファゼンとを反応させる方法。
◎ Patent Document 5
A method of reacting a mixture of 4-cyanophenol and phenol with a hexahalogenated cyclotriphosphazene.
◎ Patent Document 7
A method of reacting an alkali metal salt of phenol with hexahalogenated cyclotriphosphazene.
◎ Patent Document 8
A method of reacting hexahalogenated cyclotriphosphazene with phenol using an alkali metal hydroxide or carbonate as a deoxidizer.
◎ Patent Document 9
A method of reacting phenolates prepared with phenols and alkali metal hydroxides with hexahalogenated cyclotriphosphazene while removing water by azeotropic dehydration.
◎ Patent Document 10
A method of reacting hexahalogenated cyclotriphosphazene with phenol or the like in a solvent immiscible with water, a base, and water using a phase transfer catalyst.
◎ Patent Document 11
A method of reacting a hexahalogenated cyclotriphosphazene with phenol in the presence of an inorganic salt, a tertiary amine and a strong organic base such as dimethylaminopyridine.
◎ Patent Document 12
A method of reacting an alkali metal phenolate with a hexahalogenated cyclotriphosphazene in the presence of a chain or cyclic tertiary amine or amide compound.
しかし、上記各製造方法では、ヘキサハロゲン化シクロトリホスファゼンの活性ハロゲン原子とオキシアリール基との置換反応が進行しにくい。このため、ヘキサハロゲン化シクロトリホスファゼンの活性ハロゲン原子の全てをオキシアリール基で置換するのは困難であり、製造されたシクロトリホスファゼン誘導体は、リン原子の一部に未反応の活性ハロゲン原子が残留する。すなわち、上記各製造方法により得られるシクロトリホスファゼン誘導体は、残留活性ハロゲン原子量が多い。残留活性ハロゲン原子量が多いシクロトリホスファゼン誘導体は、樹脂材料のガラス転移点(Tg)を低下させる傾向にあるため、樹脂材料の難燃性を高めるのが困難な場合があり、所要の効果を発揮しにくい。また、このようなシクロトリホスファゼン誘導体は、樹脂材料の誘電率を高める傾向にあるため、電気・電子技術分野における樹脂材料用の難燃剤としては使用しにくい。 However, in each of the above production methods, the substitution reaction between the active halogen atom of hexahalogenated cyclotriphosphazene and the oxyaryl group is difficult to proceed. For this reason, it is difficult to replace all the active halogen atoms of hexahalogenated cyclotriphosphazene with an oxyaryl group, and the produced cyclotriphosphazene derivative has an unreacted active halogen atom as part of the phosphorus atom. Remains. That is, the cyclotriphosphazene derivative obtained by the above production methods has a large amount of residual active halogen atoms. Cyclotriphosphazene derivatives with a large amount of residual active halogen atoms tend to lower the glass transition point (Tg) of the resin material, so it may be difficult to increase the flame retardancy of the resin material and exert the required effect Hard to do. In addition, such cyclotriphosphazene derivatives tend to increase the dielectric constant of the resin material, and are therefore difficult to use as flame retardants for resin materials in the electrical / electronic technical field.
本発明の目的は、ハロゲン化シクロトリホスファゼンの活性ハロゲン原子とオキシアリール基との置換を容易化することにある。 An object of the present invention is to facilitate substitution of an active halogen atom and an oxyaryl group of a halogenated cyclotriphosphazene.
本発明に係るシクロトリホスファゼン誘導体の製造方法は、下記の一般式(1a)で示されるヘキサハロゲン化シクロトリホスファゼンと下記の一般式(2)で示される有機塩とを、非水溶性溶媒中において下記の一般式(5)で示される四級アンモニウム塩および下記の一般式(6)で示される四級アンモニウムハライドのうちの少なくとも一つの存在下で反応させる工程を含んでいる。 The method for producing a cyclotriphosphazene derivative according to the present invention comprises a hexahalogenated cyclotriphosphazene represented by the following general formula (1a) and an organic salt represented by the following general formula (2) in a water-insoluble solvent. In the presence of at least one of a quaternary ammonium salt represented by the following general formula (5) and a quaternary ammonium halide represented by the following general formula (6).
この製造方法は、反応系から溶媒を除去し、反応生成物を溶融状態で反応させる工程をさらに含んでいる。 This production method further includes a step of removing the solvent from the reaction system and reacting the reaction product in a molten state.
この製造方法において用いられるヘキサハロゲン化シクロトリホスファゼンは、例えば、15重量%未満の割合でオクタハロゲン化シクロテトラホスファゼンを含んでいる。 The hexahalogenated cyclotriphosphazene used in this production method contains, for example, octahalogenated cyclotetraphosphazene in a proportion of less than 15% by weight.
この製造方法の第一の態様では、ヘキサハロゲン化シクロトリホスファゼン1.0モルに対し、有機塩を6.0モル未満の割合で用いる。この場合、本発明の製造方法によれば、通常、シクロトリホスファゼン誘導体として、ヘキサハロゲン化シクロトリホスファゼンの活性ハロゲン原子の一部が有機塩を示す一般式(2)に由来の−OY1基で置換された部分置換ハロゲン化シクロトリホスファゼンが得られる。 In the first embodiment of the production method, the organic salt is used in a proportion of less than 6.0 mol with respect to 1.0 mol of the hexahalogenated cyclotriphosphazene. In this case, according to the production method of the present invention, as a cyclotriphosphazene derivative, a —OY 1 group derived from the general formula (2) in which a part of the active halogen atom of the hexahalogenated cyclotriphosphazene generally represents an organic salt. A partially substituted halogenated cyclotriphosphazene substituted with is obtained.
また、この製造方法の第二の態様では、ヘキサハロゲン化シクロトリホスファゼン1.0モルに対し、有機塩を6.0モル以上の割合で用いる。この場合、本発明の製造方法によれば、通常、シクロトリホスファゼン誘導体として、ヘキサハロゲン化シクロトリホスファゼンの活性ハロゲン原子の実質的に全てが有機塩を示す一般式(2)に由来の−OY1基で置換されたシクロトリホスファゼン誘導体、すなわち、ヘキサオキシアリール−シクロトリホスファゼンが得られる。 In the second aspect of the production method, the organic salt is used in a proportion of 6.0 mol or more with respect to 1.0 mol of the hexahalogenated cyclotriphosphazene. In this case, according to the production method of the present invention, as a cyclotriphosphazene derivative, -OY derived from the general formula (2) in which substantially all of the active halogen atoms of the hexahalogenated cyclotriphosphazene generally represent an organic salt. A cyclotriphosphazene derivative substituted with one group, ie hexaoxyaryl-cyclotriphosphazene, is obtained.
このような第二の態様に係る製造方法においては、例えば、有機塩として、一般式(2)のY1が異なる二種類以上の有機塩の混合物を用いてもよい。この場合は、通常、ヘキサハロゲン化シクロトリホスファゼンの活性ハロゲン原子の実質的に全てが二種類の−OY1基により置換されたシクロトリホスファゼン誘導体、すなわち、ヘキサオキシアリール−シクロトリホスファゼンが得られる。 In the production method according to the second aspect, for example, a mixture of two or more kinds of organic salts having different Y 1 in the general formula (2) may be used as the organic salt. In this case, usually a cyclotriphosphazene derivative in which substantially all of the active halogen atoms of the hexahalogenated cyclotriphosphazene are substituted by two kinds of —OY 1 groups, ie, hexaoxyaryl-cyclotriphosphazene is obtained. .
この場合に用いられる有機塩の混合物は、例えば、一般式(2)のY1がフェニル基である第一の有機塩と、一般式(2)のY1が4−シアノフェニル基である第二の有機塩との混合物である。このような有機塩の混合物は、通常、ヘキサハロゲン化シクロトリホスファゼン1.0モルに対し、第一の有機塩を2.5〜3.5モル含み、第二の有機塩を少なくとも3.0モル含むものが好ましい。 The mixture of organic salts used in this case is, for example, a first organic salt in which Y 1 in the general formula (2) is a phenyl group and a first organic salt in which Y 1 in the general formula (2) is a 4-cyanophenyl group. It is a mixture with two organic salts. Such a mixture of organic salts usually contains 2.5 to 3.5 moles of the first organic salt and at least 3.0 moles of the second organic salt per 1.0 mole of hexahalogenated cyclotriphosphazene. Those containing moles are preferred.
本発明の他の観点に係るシクロトリホスファゼン誘導体の製造方法は、下記の一般式(1b)で示される部分置換ハロゲン化シクロトリホスファゼンと上記一般式(2)で示される有機塩とを、非水溶性溶媒中において上記一般式(5)で示される四級アンモニウム塩および上記一般式(6)で示される四級アンモニウムハライドのうちの少なくとも一つの存在下で反応させる工程を含んでいる。 A method for producing a cyclotriphosphazene derivative according to another aspect of the present invention comprises a partially substituted halogenated cyclotriphosphazene represented by the following general formula (1b) and an organic salt represented by the above general formula (2). A step of reacting in a water-soluble solvent in the presence of at least one of a quaternary ammonium salt represented by the above general formula (5) and a quaternary ammonium halide represented by the above general formula (6).
この製造方法は、反応系から非水溶性エーテル系溶媒を除去し、反応生成物を溶融状態で反応させる工程をさらに含んでいる。 This production method further includes a step of removing the water-insoluble ether solvent from the reaction system and reacting the reaction product in a molten state.
また、この製造方法では、通常、部分置換ハロゲン化シクロトリホスファゼンに含まれる全ハロゲン原子を上記一般式(2)に由来の−OY1基で置換するために必要な量の有機塩を用いる。 In this production method, an organic salt is usually used in an amount necessary to replace all halogen atoms contained in the partially substituted halogenated cyclotriphosphazene with the —OY 1 group derived from the general formula (2).
本発明に係るシクロトリホスファゼン誘導体の製造方法は、非水溶性溶媒中において所定の四級アンモニウム塩および四級アンモニウムハライドのうちの少なくとも一つの存在下で、ヘキサハロゲン化シクロトリホスファゼン若しくは部分置換ハロゲン化シクロトリホスファゼンと所定の有機塩とを反応させているため、ヘキサハロゲン化シクロトリホスファゼン若しくは部分置換ハロゲン化シクロトリホスファゼンの活性ハロゲン原子と有機塩に由来するオキシアリール基とを容易に置換することができる。 The method for producing a cyclotriphosphazene derivative according to the present invention includes a hexahalogenated cyclotriphosphazene or a partially substituted halogen in a water-insoluble solvent in the presence of at least one of a predetermined quaternary ammonium salt and a quaternary ammonium halide. Because the activated cyclotriphosphazene is reacted with the prescribed organic salt, the active halogen atom of the hexahalogenated cyclotriphosphazene or the partially substituted halogenated cyclotriphosphazene is easily substituted with the oxyaryl group derived from the organic salt. be able to.
本発明に係るシクロトリホスファゼン誘導体の製造方法は、出発物質として用いるハロゲン化シクロトリホスファゼンの種類により、二種類の形態、すなわち、以下に説明する第一の形態および第二の形態の二種類に分類することができる。 The method for producing a cyclotriphosphazene derivative according to the present invention can be divided into two types, that is, the first mode and the second mode described below, depending on the type of halogenated cyclotriphosphazene used as a starting material. Can be classified.
第一の形態
この形態に係るシクロトリホスファゼン誘導体の製造方法では、出発物質としてヘキサハロゲン化シクロトリホスファゼンを用いる。ここで用いられるヘキサハロゲン化シクロトリホスファゼンは、下記の一般式(1a)で示されるものであり、公知の物質である。
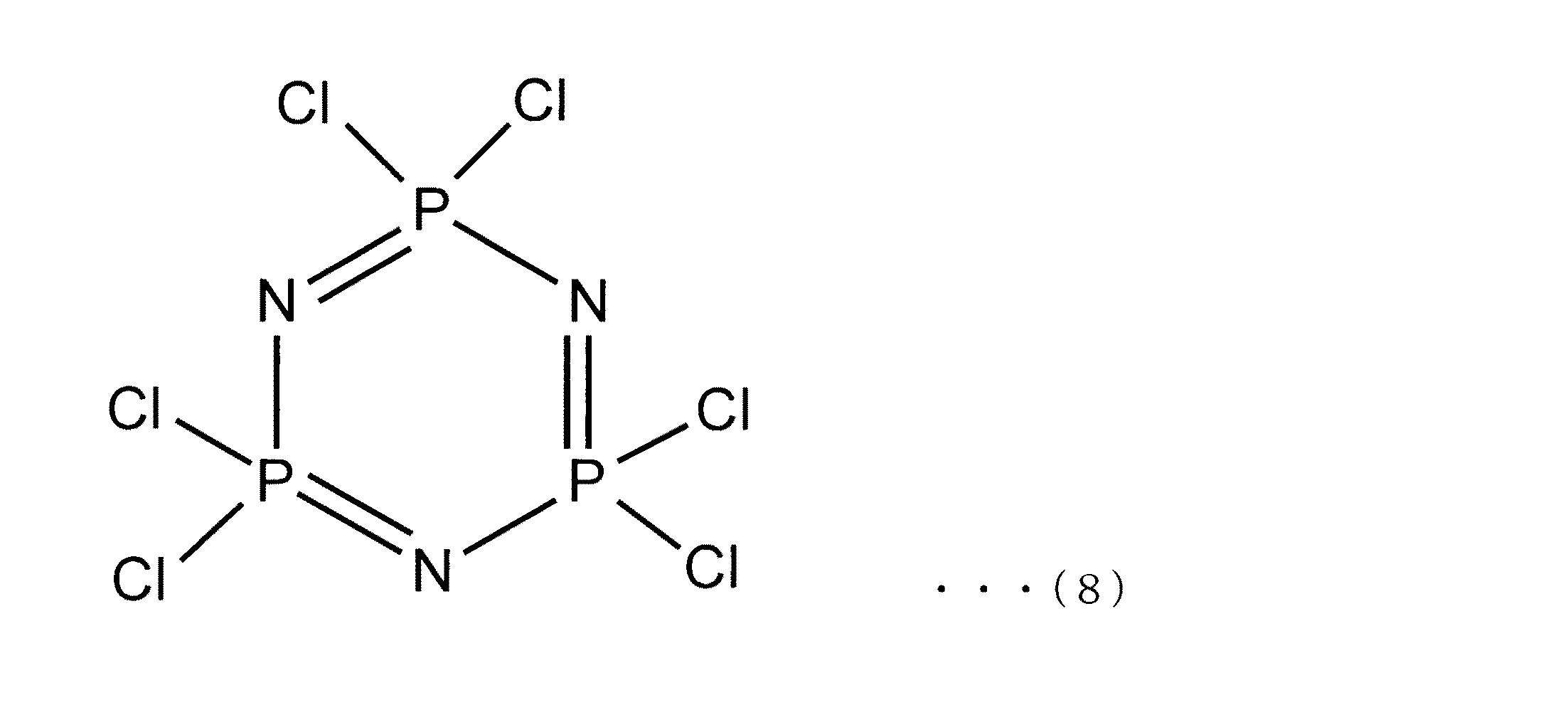
First Form In the method for producing a cyclotriphosphazene derivative according to this form, hexahalogenated cyclotriphosphazene is used as a starting material. The hexahalogenated cyclotriphosphazene used here is represented by the following general formula (1a) and is a known substance.
一般式(1a)中、Xは、フッ素、塩素、臭素などのハロゲン原子を示す。Xは、全てが同じハロゲン原子であってもよいし、一部が異なるハロゲン原子であってもよい。但し、本発明において用いられるヘキサハロゲン化シクロトリホスファゼンは、入手の容易性や反応性等の見地から、全てのXが塩素のものが好ましい。すなわち、ヘキサハロゲン化シクロトリホスファゼンとして好ましいものは、下記の式(8)で示されるヘキサクロロシクロトリホスファゼンである。 In general formula (1a), X represents a halogen atom such as fluorine, chlorine or bromine. All of X may be the same halogen atom, or a part of them may be different halogen atoms. However, the hexahalogenated cyclotriphosphazene used in the present invention is preferably one in which all Xs are chlorine from the viewpoint of availability and reactivity. That is, preferred as the hexahalogenated cyclotriphosphazene is hexachlorocyclotriphosphazene represented by the following formula (8).
上述のヘキサハロゲン化シクロトリホスファゼンは、例えば、特公昭56−38522号公報、特公昭58−19604号公報および特公昭63−31403号公報等に記載された公知の製造方法、すなわち、五ハロゲン化リン(例えば五塩化リン)とハロゲン化アンモニウム(例えば塩化アンモニウム)との反応に基づく製造方法により製造することができる。また、ヘキサハロゲン化シクロトリホスファゼンは、市販のものを用いることもできる。 The above-mentioned hexahalogenated cyclotriphosphazene is a known production method described in, for example, Japanese Patent Publication No. 56-38522, Japanese Patent Publication No. 58-19604 and Japanese Patent Publication No. 63-31403, that is, pentahalogenated. It can be produced by a production method based on a reaction between phosphorus (for example, phosphorus pentachloride) and ammonium halide (for example, ammonium chloride). Commercially available hexahalogenated cyclotriphosphazenes can also be used.
この形態の製造方法において用いられるヘキサハロゲン化シクロトリホスファゼンは、通常、上述の製造方法により得られるものや市販のものに対して再結晶や蒸留等の分離・精製工程を施した実質的な純品、すなわち、他のハロゲン化シクロホスファゼンや鎖状のハロゲン化ホスファゼンなどの不純物を含まない実質的な純品が好ましいが、下記の一般式(9)で示されるオクタハロゲン化シクロテトラホスファゼンを少量含んでいてもよい。例えば、ヘキサハロゲン化シクロトリホスファゼンとしてヘキサクロロシクロトリホスファゼンを用いる場合、それは、下記の式(10)で示されるオクタクロロシクロテトラホスファゼンを少量含んでいてもよい。なお、一般式(9)において、Xは、一般式(1)の場合と同様である。 The hexahalogenated cyclotriphosphazene used in the production method of this form is usually a substantially pure product obtained by separation and purification processes such as recrystallization and distillation on those obtained by the above production method and commercially available products. Products, that is, substantially pure products containing no impurities such as other halogenated cyclophosphazenes or chain-like halogenated phosphazenes, are preferred, but a small amount of octahalogenated cyclotetraphosphazene represented by the following general formula (9) is used. May be included. For example, when hexachlorocyclotriphosphazene is used as the hexahalogenated cyclotriphosphazene, it may contain a small amount of octachlorocyclotetraphosphazene represented by the following formula (10). In general formula (9), X is the same as in general formula (1).
この場合、ヘキサハロゲン化シクロトリホスファゼンに含まれるオクタハロゲン化シクロテトラホスファゼンの量は、通常、15重量%未満が好ましい。オクタハロゲン化シクロテトラホスファゼンの含有量が15重量%を超える場合は、目的の機能を備えたシクロトリホスファゼン誘導体、特に、シクロトリホスファゼン誘導体混合物を製造するのが困難になる場合がある。因みに、ヘキサハロゲン化シクロトリホスファゼンは、オクタハロゲン化シクロテトラホスファゼンの他に、再結晶や蒸留等の分離・精製工程により除去するのが困難な微量の大環状ハロゲン化ホスファゼンを含んでいてもよい。 In this case, the amount of octahalogenated cyclotetraphosphazene contained in the hexahalogenated cyclotriphosphazene is usually preferably less than 15% by weight. When the content of the octahalogenated cyclotetraphosphazene exceeds 15% by weight, it may be difficult to produce a cyclotriphosphazene derivative having a desired function, particularly a cyclotriphosphazene derivative mixture. Incidentally, the hexahalogenated cyclotriphosphazene may contain, in addition to the octahalogenated cyclotetraphosphazene, a trace amount of a macrocyclic halogenated phosphazene that is difficult to remove by a separation / purification process such as recrystallization or distillation. .
この形態に係るシクロトリホスファゼン誘導体の製造方法では、上述のヘキサハロゲン化シクロトリホスファゼンと有機塩とを溶媒中において反応させる。ここで用いられる有機塩は、下記の一般式(2)で示されるものである。 In the method for producing a cyclotriphosphazene derivative according to this embodiment, the above-described hexahalogenated cyclotriphosphazene and an organic salt are reacted in a solvent. The organic salt used here is represented by the following general formula (2).
一般式(2)において、M1はナトリウムやカリウムなどのアルカリ金属を示し、また、Y1は次の一般式(3)で示されるフェニル基若しくは置換フェニル基または次の一般式(4)で示されるビフェニル基若しくは置換ビフェニル基である。 In the general formula (2), M 1 represents an alkali metal such as sodium or potassium, and Y 1 represents a phenyl group or a substituted phenyl group represented by the following general formula (3) or the following general formula (4). The biphenyl group or substituted biphenyl group shown.
一般式(3)および(4)において、R1は、水素、アルキル基、シアノ基、アルコキシ基、アラルコキシ基またはカルボニル基含有基を示している。アルキル基は、通常、炭素数が1〜4のものであり、メチル基、エチル基、プロピル基、イソプロピル基、ブチル基、イソブチル基、sec−ブチル基およびtert−ブチル基などを例示することができる。また、アルコキシ基は、通常、炭素数が1〜4のアルキル基を有するものであり、具体的には、メトキシ基、エトキシ基、プロポキシ基、イソプロポキシ基、ブトキシ基、イソブトキシ基、sec−ブトキシ基およびtert−ブトキシ基を例示することができる。アラルコキシ基としては、例えば、ベンジルオキシ基、4−メチルベンジルオキシ基などの置換基を有するベンジルオキシ基を挙げることができる。カルボニル基含有基は、下記の一般式(11)で示されるものである。一般式(11)において、Aは、水素、水酸基、アルキル基、アルコキシ基またはアラルコキシ基を示している。ここでのアルキル基、アルコキシ基およびアラルコキシ基は、特に限定されるものではないが、例えば、上述のR1のアルキル基、アルコキシ基およびアラルコキシ基と同様のものである。一般式(3)および(4)において、R1の位置は特に限定されるものではないが、通常はパラ位が好ましい。 In the general formulas (3) and (4), R 1 represents hydrogen, an alkyl group, a cyano group, an alkoxy group, an aralkoxy group, or a carbonyl group-containing group. The alkyl group usually has 1 to 4 carbon atoms, and examples thereof include a methyl group, an ethyl group, a propyl group, an isopropyl group, a butyl group, an isobutyl group, a sec-butyl group, and a tert-butyl group. it can. The alkoxy group usually has an alkyl group having 1 to 4 carbon atoms, and specifically includes a methoxy group, an ethoxy group, a propoxy group, an isopropoxy group, a butoxy group, an isobutoxy group, a sec-butoxy group. Group and tert-butoxy group can be exemplified. Examples of the aralkoxy group include a benzyloxy group having a substituent such as a benzyloxy group and a 4-methylbenzyloxy group. The carbonyl group-containing group is represented by the following general formula (11). In the general formula (11), A represents hydrogen, a hydroxyl group, an alkyl group, an alkoxy group, or an aralkoxy group. The alkyl group, alkoxy group and aralkoxy group here are not particularly limited, but are the same as the alkyl group, alkoxy group and aralkoxy group of R 1 described above, for example. In the general formulas (3) and (4), the position of R 1 is not particularly limited, but usually the para position is preferred.
このような有機塩は、通常、フェノール、アルキル基、シアノ基、アルコキシ基、アラルコキシ基若しくはカルボニル基含有基を有するフェノール、パラフェニルフェノールまたはアルキル基、シアノ基、アルコキシ基、アラルコキシ基若しくはカルボニル基含有基を有するパラフェニルフェノールと、アルカリ金属若しくはアルカリ金属化合物またはこれらの混合物とを反応させる公知の方法により製造することができる。 Such organic salt usually contains phenol, alkyl group, cyano group, alkoxy group, aralkoxy group or carbonyl group-containing group, phenol, paraphenylphenol or alkyl group, cyano group, alkoxy group, aralkoxy group or carbonyl group It can be produced by a known method of reacting paraphenylphenol having a group with an alkali metal or an alkali metal compound or a mixture thereof.
一方、この反応工程において用いられる溶媒は、有機塩を分散または溶解することができる非水溶性溶媒である。このような溶媒としては、例えば、トルエン、キシレンおよびモノクロルベンゼンなどのベンゼン系溶媒、ジクロルメタンやジクロルエタンなどの塩素系溶媒、n−ヘキサンやn−ペンタン等の石油系溶媒、テトラヒドロフラン、テトラヒドロピランおよびシクロペンチルメチルエーテルやシクロペンチルエチルエーテル等のシクロペンチルアルキルエーテルなどのエーテル系溶媒並びにアセトニトリルを挙げることができる。これらの溶媒は、二種類以上のものが併用されてもよい。 On the other hand, the solvent used in this reaction step is a water-insoluble solvent capable of dispersing or dissolving the organic salt. Examples of such solvents include benzene solvents such as toluene, xylene and monochlorobenzene, chlorine solvents such as dichloromethane and dichloroethane, petroleum solvents such as n-hexane and n-pentane, tetrahydrofuran, tetrahydropyran and cyclopentylmethyl. Mention may be made of ether solvents such as ether and cyclopentyl alkyl ethers such as cyclopentyl ethyl ether, and acetonitrile. Two or more of these solvents may be used in combination.
このうち、この反応工程では、比較的低温でかつ短時間で効率的に本工程の反応を促進させることができ、しかも安価で経済的なことから、下記の一般式(12)で示されるエーテル系溶媒であるシクロペンチルアルキルエーテルを用いるのが好ましい。一般式(12)において、Rは、メチル基、エチル基、プロピル基等のアルキル基を示している。シクロペンチルアルキルエーテルのうち、特に好ましいものは、一般式(12)のRがメチル基であるシクロペンチルメチルエーテルである。シクロペンチルメチルエーテルは、沸点106℃、比重0.86、水との共沸温度83℃、水への溶解度1.1%、水の溶解度0.3%(23℃)、蒸発潜熱69.2Kcal/kgの物性を有する溶媒である。 Among these, in this reaction step, the reaction of this step can be efficiently promoted at a relatively low temperature in a short time, and since it is inexpensive and economical, the ether represented by the following general formula (12) It is preferable to use cyclopentyl alkyl ether which is a system solvent. In the general formula (12), R represents an alkyl group such as a methyl group, an ethyl group, or a propyl group. Of the cyclopentyl alkyl ethers, particularly preferred is cyclopentyl methyl ether in which R in the general formula (12) is a methyl group. Cyclopentyl methyl ether has a boiling point of 106 ° C., a specific gravity of 0.86, an azeotropic temperature of 83 ° C. with water, a solubility of 1.1% in water, a solubility of water of 0.3% (23 ° C.), a latent heat of vaporization of 69.2 Kcal / It is a solvent having physical properties of kg.
この形態の製造方法では、ヘキサハロゲン化シクロトリホスファゼンの活性ハロゲン原子と有機塩に由来のオキシアリール基(すなわち、一般式(2)に由来の−OY1基)との置換反応を円滑に進めるために、反応系に対し、次の一般式(5)で示される四級アンモニウム塩および次の一般式(6)で示される四級アンモニウムハライドのうちの少なくとも一つ(以下、「四級化合物」と云う場合がある)を添加する。 In the production method of this embodiment, the substitution reaction between the active halogen atom of hexahalogenated cyclotriphosphazene and the oxyaryl group derived from the organic salt (that is, -OY 1 group derived from the general formula (2)) smoothly proceeds. Therefore, for the reaction system, at least one of the quaternary ammonium salt represented by the following general formula (5) and the quaternary ammonium halide represented by the following general formula (6) (hereinafter referred to as “quaternary compound”). Is added).
一般式(5)において、Y1は、有機塩を示す一般式(2)のY1と同じ意味であり、この反応工程において用いる有機塩のY1と同じ基である。一方、一般式(6)において、Xは、フッ素、塩素、臭素などのハロゲン原子を示している。さらに、一般式(5)および(6)において、R3はアルキル基またはアラルキル基を示す。ここで、アルキル基は、通常、炭素数が1〜4のものであり、例えば、メチル基、エチル基、プロピル基、イソプロピル基、ブチル基、イソブチル基、sec−ブチル基およびtert−ブチル基などを挙げることができる。また、アラルキル基としては、例えば、ベンジル基、フェネチル基およびフェニルプロピル基などを挙げることができる。一般式(5)および(6)のR3は、全てが同じものであってもよいし、二種類以上のものであってもよい。因みに、一般式(5)で示される四級アンモニウム塩は、上述の有機塩に対してテトラアルキルアンモニウムハライド若しくはテトラアラルキルアンモニウムハライドを反応させると製造することができる。 In General Formula (5), Y 1 has the same meaning as Y 1 in General Formula (2) representing an organic salt, and is the same group as Y 1 in the organic salt used in this reaction step. On the other hand, in the general formula (6), X represents a halogen atom such as fluorine, chlorine or bromine. Further, in the general formulas (5) and (6), R 3 represents an alkyl group or an aralkyl group. Here, the alkyl group usually has 1 to 4 carbon atoms, such as a methyl group, an ethyl group, a propyl group, an isopropyl group, a butyl group, an isobutyl group, a sec-butyl group, and a tert-butyl group. Can be mentioned. Examples of the aralkyl group include a benzyl group, a phenethyl group, and a phenylpropyl group. All of R 3 in the general formulas (5) and (6) may be the same, or two or more thereof. Incidentally, the quaternary ammonium salt represented by the general formula (5) can be produced by reacting the above-mentioned organic salt with a tetraalkylammonium halide or a tetraaralkylammonium halide.
反応系に対して上述の四級アンモニウム塩を添加した場合は、反応系において、当該四級アンモニウム塩が相間移動触媒として機能し、ヘキサハロゲン化シクロトリホスファゼンの活性ハロゲン原子と有機塩を示す一般式(2)に由来の−OY1基との置換反応を促進するため、効率的に目的とするシクロトリホスファゼン誘導体を製造することができる。一方、反応系に対して上述の四級アンモニウムハライドを添加した場合は、反応系において、四級アンモニウムハライドと有機塩とが反応し、一般式(5)で示される四級アンモニウム塩が生成する。この四級アンモニウム塩は、相間移動触媒として機能し、ヘキサハロゲン化シクロトリホスファゼンの活性ハロゲン原子と有機塩を示す一般式(2)に由来の−OY1基との置換反応を促進することになるため、目的とするシクロトリホスファゼン誘導体の効率的な製造に寄与し得る。 When the above-described quaternary ammonium salt is added to the reaction system, the quaternary ammonium salt functions as a phase transfer catalyst in the reaction system, and exhibits an active halogen atom and an organic salt of hexahalogenated cyclotriphosphazene Since the substitution reaction with the —OY 1 group derived from the formula (2) is promoted, the target cyclotriphosphazene derivative can be efficiently produced. On the other hand, when the above-described quaternary ammonium halide is added to the reaction system, the quaternary ammonium halide and the organic salt react in the reaction system to produce a quaternary ammonium salt represented by the general formula (5). . This quaternary ammonium salt functions as a phase transfer catalyst and promotes the substitution reaction between the active halogen atom of hexahalogenated cyclotriphosphazene and the -OY 1 group derived from the general formula (2) representing an organic salt. Therefore, it can contribute to the efficient production of the desired cyclotriphosphazene derivative.
因みに、反応系に対して添加した四級アンモニウム塩および反応系において生成した四級アンモニウム塩に由来の−OY1基は、有機塩に由来の−OY1基と同じく、ヘキサハロゲン化シクロトリホスファゼンの活性ハロゲン原子との置換反応に関与する。 Incidentally, the -OY 1 group derived from the quaternary ammonium salt added to the reaction system and the quaternary ammonium salt produced in the reaction system is the same as the -OY 1 group derived from the organic salt, and is a hexahalogenated cyclotriphosphazene. Participates in a substitution reaction with an active halogen atom.
四級化合物の使用量は、反応促進効果、すなわち、ヘキサハロゲン化シクロトリホスファゼンの活性ハロゲン原子と有機塩に由来のオキシアリール基との置換反応促進効果の点で、通常、ヘキサハロゲン化シクロトリホスファゼンの1ユニットモルに対して1/100〜1/1000モルに設定するのが好ましい。ここで、ヘキサハロゲン化シクロトリホスファゼンの1ユニットモルとは、ヘキサハロゲン化シクロトリホスファゼンのPNX2単位を1ユニットとして表現したモル数を意味する。 The amount of the quaternary compound used is usually a hexahalogenated cyclotrimer in terms of a reaction promoting effect, that is, a substitution reaction promoting effect between an active halogen atom of hexahalogenated cyclotriphosphazene and an oxyaryl group derived from an organic salt. It is preferable to set to 1/100 to 1/1000 mol per 1 mol of phosphazene. Here, 1 unit mole of hexahalogenated cyclotriphosphazene means the number of moles expressed as 2 units of PNX 2 unit of hexahalogenated cyclotriphosphazene.
反応系に対して上述の四級化合物を添加する場合は、併せて、溶媒に対して非プロトン性極性溶媒を添加するのが好ましい。非プロトン性極性溶媒を併せて添加した場合は、反応をより促進する効果を期待することができる。非プロトン性極性溶媒としては、例えば、アセトニトリル、ジメチルスルホキシド、スルホラン、ジメチルアセトアミドおよびN−メチル−2−ピロリドンなどを用いることができる。 When the quaternary compound is added to the reaction system, it is preferable to add an aprotic polar solvent to the solvent. When an aprotic polar solvent is added together, an effect of further promoting the reaction can be expected. As the aprotic polar solvent, for example, acetonitrile, dimethyl sulfoxide, sulfolane, dimethylacetamide, N-methyl-2-pyrrolidone and the like can be used.
なお、上述の四級化合物に代えて、テトラ−n−ブチルホスホニウムクロライドのようなホスホニウム塩を用いた場合も本形態の製造方法を同様に実施することができる。 In addition, it can replace with the above-mentioned quaternary compound and the manufacturing method of this form can be implemented similarly also when using phosphonium salt like tetra-n-butylphosphonium chloride.
ヘキサハロゲン化シクロトリホスファゼンと有機塩との反応は、通常、ヘキサハロゲン化シクロトリホスファゼンを溶解した溶媒に対し、溶媒に溶解若しくは微粒子状で分散させた有機塩を滴下しながら進行させるのが好ましい。ここで、四級化合物は、ヘキサハロゲン化シクロトリホスファゼン側の溶媒に添加されていてもよいし、有機塩側の溶媒に添加されていてもよい。また、滴下終了後に四級化合物を添加し、反応を継続させることもできる。 The reaction between the hexahalogenated cyclotriphosphazene and the organic salt is usually preferably allowed to proceed while dropping the organic salt dissolved or finely dispersed in the solvent with respect to the solvent in which the hexahalogenated cyclotriphosphazene is dissolved. . Here, the quaternary compound may be added to the solvent on the hexahalogenated cyclotriphosphazene side or may be added to the solvent on the organic salt side. Moreover, a quaternary compound can be added after completion | finish of dripping, and reaction can also be continued.
この反応では、ヘキサハロゲン化シクロトリホスファゼンの活性ハロゲン原子が有機塩を示す一般式(2)に由来の−OY1基により置換され、目的とするシクロトリホスファゼン誘導体が得られる。 In this reaction, the active halogen atom of hexahalogenated cyclotriphosphazene is substituted with —OY 1 group derived from the general formula (2) representing an organic salt, and the intended cyclotriphosphazene derivative is obtained.
ヘキサハロゲン化シクロトリホスファゼンと有機塩との反応時の反応温度は、−30〜130℃の温度範囲に設定するのが好ましく、0〜120℃の温度範囲に設定するのがより好ましい。反応温度が−30℃未満の場合は、有機塩の種類によっては、上述の置換反応が進行しにくくなる可能性がある。逆に、130℃を超える場合は、反応速度が速くなり過ぎるため、目的とするシクロトリホスファゼン誘導体が得られにくくなる可能性がある。 The reaction temperature during the reaction between the hexahalogenated cyclotriphosphazene and the organic salt is preferably set to a temperature range of -30 to 130 ° C, more preferably set to a temperature range of 0 to 120 ° C. When the reaction temperature is lower than −30 ° C., the above substitution reaction may not easily proceed depending on the type of organic salt. On the other hand, when the temperature exceeds 130 ° C., the reaction rate becomes too fast, and it may be difficult to obtain the target cyclotriphosphazene derivative.
この反応時において、反応系中の水分量は、通常、100ppm以下に制御するのが好ましい。反応系の水分量が多い場合は、ヘキサハロゲン化シクロトリホスファゼンのリン原子と活性ハロゲン原子との結合部分が加水分解されてリン原子に対して水酸基が置換されたり、また、ヘキサハロゲン化シクロトリホスファゼンの分子間で−P−O−P−結合の生成が進行したりしやすくなる結果、目的とするシクロトリホスファゼン誘導体が得られにくくなる可能性がある。 During this reaction, the amount of water in the reaction system is usually preferably controlled to 100 ppm or less. When the amount of water in the reaction system is large, the bonding portion between the phosphorus atom and the active halogen atom of the hexahalogenated cyclotriphosphazene is hydrolyzed to replace the hydroxyl group with respect to the phosphorus atom, or the hexahalogenated cyclotriphosphazene. As a result of the formation of —P—O—P— bonds being likely to proceed between the phosphazene molecules, it may be difficult to obtain the desired cyclotriphosphazene derivative.
また、この形態における反応時間は、有機塩の種類、ヘキサハロゲン化シクロトリホスファゼンに対する有機塩の割合および反応温度等の要因により異なるが、通常は2〜10時間に設定するのが好ましい。 The reaction time in this embodiment varies depending on the type of organic salt, the ratio of the organic salt to the hexahalogenated cyclotriphosphazene, the reaction temperature, and the like, but it is usually preferably set to 2 to 10 hours.
この形態の製造方法では、反応終了後、反応液を室温、すなわち20〜35℃程度に戻し、反応液から副生物であるアルカリ金属ハロゲン化物や未反応の有機塩等を濾過処理により分離した後、反応液を洗浄する。反応液の洗浄では、通常、反応液に希アルカリ水溶液を添加し、反応液中に残留している過剰の有機塩および四級化合物等を希アルカリ水溶液に溶解する。そして、希アルカリ水溶液を反応液から分離した後、反応液に対して希硫酸洗浄および水洗を適用し、反応液中に生成したアルカリ金属ハロゲン塩(例えば食塩)などの不純物をさらに分離する。次に、このようにして洗浄された反応液から溶媒を除去し、例えば、その残留物に対してメタノール等のアルコール類の添加、還流、冷却および濾過の各処理をこの順に実施すると、目的とするシクロトリホスファゼン誘導体を高収率で得ることができる。 In the production method of this embodiment, after the reaction is completed, the reaction solution is returned to room temperature, that is, about 20 to 35 ° C., and alkali metal halides and unreacted organic salts which are by-products are separated from the reaction solution by filtration. The reaction solution is washed. In washing the reaction solution, a dilute alkaline aqueous solution is usually added to the reaction solution, and excess organic salts and quaternary compounds remaining in the reaction solution are dissolved in the dilute alkaline aqueous solution. And after isolate | separating dilute alkaline aqueous solution from a reaction liquid, dilute sulfuric acid washing | cleaning and water washing are applied with respect to a reaction liquid, and impurities, such as an alkali metal halogen salt (for example, salt) produced | generated in the reaction liquid, are further isolate | separated. Next, the solvent is removed from the reaction solution washed in this manner, and for example, the addition of alcohols such as methanol, reflux, cooling, and filtration are performed in this order on the residue. The cyclotriphosphazene derivative can be obtained in high yield.
この形態の製造方法により得られるシクロトリホスファゼン誘導体は、ヘキサハロゲン化シクロトリホスファゼンと有機塩との反応割合の設定により制御することができる。例えば、ヘキサハロゲン化シクロトリホスファゼン1.0モルに対し、有機塩を6.0モル未満、好ましくは3.0モル未満の割合で用いた場合(以下、「態様A」と云う)は、ヘキサハロゲン化シクロトリホスファゼンの活性ハロゲン原子の一部が上記−OY1基により置換されたシクロトリホスファゼン誘導体、すなわち、部分置換ハロゲン化シクロトリホスファゼンが得られやすい。 The cyclotriphosphazene derivative obtained by the production method of this embodiment can be controlled by setting the reaction ratio between the hexahalogenated cyclotriphosphazene and the organic salt. For example, when the organic salt is used in a proportion of less than 6.0 mol, preferably less than 3.0 mol, with respect to 1.0 mol of hexahalogenated cyclotriphosphazene (hereinafter referred to as “Aspect A”), A cyclotriphosphazene derivative in which a part of the active halogen atom of the halogenated cyclotriphosphazene is substituted with the -OY 1 group, that is, a partially substituted halogenated cyclotriphosphazene is easily obtained.
一方、ヘキサハロゲン化シクロトリホスファゼン1.0モルに対し、有機塩を6.0モル以上、好ましくは6.2モル以上の割合で用いた場合(以下、「態様B」と云う)は、ヘキサハロゲン化シクロトリホスファゼンの活性ハロゲン原子の実質的に全てが上記−OY1基により置換されたシクロトリホスファゼン誘導体、すなわち、ヘキサオキシアリール−シクロトリホスファゼンが得られやすい。例えば、有機塩として一般式(2)の基Y1がフェニル基のものを用いた場合、態様Bの製造方法によれば、シクロトリホスファゼン誘導体として、ヘキサフェノキシ−シクロトリホスファゼンが得られやすい。 On the other hand, when the organic salt is used in a proportion of 6.0 mol or more, preferably 6.2 mol or more per 1.0 mol of hexahalogenated cyclotriphosphazene (hereinafter referred to as “Aspect B”), A cyclotriphosphazene derivative in which substantially all of the active halogen atoms of the halogenated cyclotriphosphazene are substituted with the -OY 1 group, that is, hexaoxyaryl-cyclotriphosphazene is easily obtained. For example, when the organic salt having the group Y 1 in the general formula (2) is a phenyl group, according to the production method of the embodiment B, hexaphenoxy-cyclotriphosphazene is easily obtained as the cyclotriphosphazene derivative.
態様Bの場合、有機塩としては、一般式(2)のY1が異なる二種類以上の有機塩の混合物を用いることができる。例えば、有機塩の混合物として、一般式(2)のY1が所定の基Yaである第一の有機塩と、一般式(2)のY1が第一の有機塩のY1とは異なる所定の基Ybである第二の有機塩との混合物、すなわち、二種類の有機塩の混合物を用いることができる。このようにすると、ヘキサハロゲン化シクロトリホスファゼンの活性ハロゲン原子が−OYa基と−OYbとで置換されたヘキサオキシアリール−シクロトリホスファゼンが得られる。より具体的には、第一の有機塩として一般式(2)の基Y1がフェニル基のものを用い、第二の有機塩として一般式(2)の基Y1が4−シアノフェニル基のものを用いた場合、この態様Bの製造方法によれば、ヘキサハロゲン化シクロトリホスファゼンの一部の活性ハロゲン原子がフェノキシ基により置換され、また、残りの他のハロゲン原子が4−シアノフェノキシ基により置換された、数種類のシクロトリホスファゼン誘導体の混合物が得られる。 In the case of the aspect B, as the organic salt, a mixture of two or more kinds of organic salts having different Y 1 in the general formula (2) can be used. For example, as a mixture of an organic salt, different from Y 1 in the general formula (2) and the first organic salt is a predetermined group Ya, and Y 1 Y 1 of the first organic salt of the general formula (2) A mixture with the second organic salt which is the predetermined group Yb, that is, a mixture of two kinds of organic salts can be used. By doing so, hexaoxyaryl-cyclotriphosphazene in which the active halogen atom of hexahalogenated cyclotriphosphazene is substituted with -OYa group and -OYb is obtained. More specifically, as the first organic salt, the group Y 1 of the general formula (2) is a phenyl group, and as the second organic salt, the group Y 1 of the general formula (2) is a 4-cyanophenyl group. According to the production method of the embodiment B, a part of the active halogen atoms of the hexahalogenated cyclotriphosphazene is substituted with a phenoxy group, and the other halogen atoms are substituted with 4-cyanophenoxy. A mixture of several cyclotriphosphazene derivatives substituted with groups is obtained.
特に、態様Bにおいて、ヘキサハロゲン化シクロトリホスファゼンに対する第一の有機塩および第二の有機塩の量を所定の比率に設定すれば、上述のシクロトリホスファゼン誘導体混合物において、実質的に第一の有機塩および第二の有機塩の量の比率で二種類のアリールオキシ基(すなわち、−OYa基および−OYb基)を有するシクロトリホスファゼン誘導体が主成分として得られる。例えば、第一の有機塩として一般式(2)の基Y1がフェニル基のものを用い、第二の有機塩として一般式(2)の基Y1が4−シアノフェニル基のものを用いた場合、ヘキサハロゲン化シクロトリホスファゼン1.0モルに対して第一の有機塩を2.5〜3.5モル含み、かつ、第二の有機塩を少なくとも3.0モル含む有機塩の混合物を用いれば、ヘキサハロゲン化シクロトリホスファゼンの六つの活性ハロゲン原子のうちの三つがフェノキシ基により置換され、残りの三つの活性ハロゲン原子が4−シアノフェノキシ基により置換された、トリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼンを主成分として含むシクロトリホスファゼン誘導体混合物が得られる。 In particular, in embodiment B, if the amount of the first organic salt and the second organic salt relative to the hexahalogenated cyclotriphosphazene is set to a predetermined ratio, in the above-mentioned cyclotriphosphazene derivative mixture, A cyclotriphosphazene derivative having two kinds of aryloxy groups (that is, -OYa group and -OYb group) in the ratio of the amount of the organic salt and the second organic salt is obtained as a main component. For example, the first organic salt having the group Y 1 in the general formula (2) is a phenyl group, and the second organic salt having the group Y 1 in the general formula (2) having a 4-cyanophenyl group is used. A mixture of organic salts containing 2.5 to 3.5 moles of the first organic salt and at least 3.0 moles of the second organic salt to 1.0 mole of the hexahalogenated cyclotriphosphazene. , Triphenoxy-tri 4 in which three of the six active halogen atoms of the hexahalogenated cyclotriphosphazene are replaced by phenoxy groups and the remaining three active halogen atoms are replaced by 4-cyanophenoxy groups. A cyclotriphosphazene derivative mixture containing cyanophenoxy-cyclotriphosphazene as the main component is obtained.
なお、有機塩の混合物を用いる態様Bにおいて、触媒として上述の四級アンモニウム塩を添加する場合、四級アンモニウム塩としては、有機塩のY1と同じY1が用いられた数種類の四級アンモニウム塩を併用するのが好ましい。 In addition, in aspect B using a mixture of organic salts, when adding the above-described quaternary ammonium salt as a catalyst, the quaternary ammonium salt includes several types of quaternary ammonium using the same Y 1 as the organic salt Y 1. It is preferable to use a salt in combination.
態様Bにより得られるシクロトリホスファゼン誘導体若しくはシクロトリホスファゼン誘導体混合物、すなわち、ヘキサハロゲン化シクロトリホスファゼンの活性ハロゲン原子の実質的に全てが上記−OY1基により置換されたシクロトリホスファゼン誘導体若しくはシクロトリホスファゼン誘導体混合物は、活性ハロゲン原子と上記−OY1基との置換反応が円滑に進行しているため、通常、残留活性ハロゲン原子量が50ppm未満である。ここで、残留活性ハロゲン原子量は、シクロトリホスファゼン誘導体若しくはシクロトリホスファゼン誘導体混合物のリン原子に結合して残留している活性ハロゲン原子の量を意味し、次のようにして評価(測定)した場合の値である。 The cyclotriphosphazene derivative or cyclotriphosphazene derivative mixture obtained by the embodiment B, i.e., the cyclotriphosphazene derivative or the cyclotriphosphazene derivative in which substantially all of the active halogen atoms of the hexahalogenated cyclotriphosphazene are substituted by the -OY 1 group. In the phosphazene derivative mixture, since the substitution reaction between the active halogen atom and the —OY 1 group proceeds smoothly, the residual active halogen atom amount is usually less than 50 ppm. Here, the amount of residual active halogen atoms means the amount of active halogen atoms remaining bonded to the phosphorus atom of the cyclotriphosphazene derivative or cyclotriphosphazene derivative mixture, and evaluated (measured) as follows. Is the value of
磁器ルツボに試料(シクロトリホスファゼン誘導体若しくはシクロトリホスファゼン誘導体混合物)0.5〜1.0gおよび容量分析用炭酸ナトリウム1〜2gを加えて混合し、ホットプレート上で徐々に加熱した後、600〜700℃の電気炉内で強熱融解させる。冷却後、ルツボに希硝酸10mlを加えて徐々に加熱し、放冷した後、硝酸3〜5mlをさらに加えてかきまぜ、100mlメスフラスコ内に移し入れる。また、ルツボを蒸留水で洗浄し、その洗液も同じメスフラスコ内に加える。そして、当該メスフラスコの標線まで蒸留水を加え、測定用サンプルを得る。一方、容量分析用炭酸ナトリウム1〜2gを別の磁器ルツボに入れ、上記の操作と同じ操作によりブランク用サンプルを得る。得られた測定用サンプルおよびブランク用サンプルをそれぞれ同量(ハロゲンイオン濃度により5〜50ml)計り取り、自動電位差滴定装置を用いて0.01mol/硝酸銀水溶液で滴定する。なお、試料の全ハロゲン量が少ない場合は、測定用サンプルの全量を滴定に使用する。以上の結果から、次の計算式により、残留活性ハロゲン原子量を求める。 After adding 0.5 to 1.0 g of a sample (cyclotriphosphazene derivative or cyclotriphosphazene derivative mixture) and 1 to 2 g of sodium carbonate for volumetric analysis to a porcelain crucible, the mixture is gradually heated on a hot plate, and then 600 to It is melted by ignition in an electric furnace at 700 ° C. After cooling, add 10 ml of dilute nitric acid to the crucible and gradually heat it, let it cool, and then add 3-5 ml of nitric acid, stir and transfer to a 100 ml volumetric flask. In addition, the crucible is washed with distilled water, and the washing is also added to the same volumetric flask. And distilled water is added to the marked line of the volumetric flask to obtain a measurement sample. On the other hand, 1 to 2 g of sodium carbonate for volume analysis is put into another porcelain crucible, and a blank sample is obtained by the same operation as described above. The obtained measurement sample and blank sample are weighed in the same amount (5 to 50 ml depending on the halogen ion concentration), and titrated with 0.01 mol / silver nitrate aqueous solution using an automatic potentiometric titrator. When the total halogen content of the sample is small, the entire amount of the measurement sample is used for titration. From the above results, the amount of residual active halogen atoms is determined by the following calculation formula.
C:残留活性ハロゲン原子量(ppm)
V:測定用サンプルの滴定量(ml)
B:ブランク用サンプルの滴定量(ml)
f:0.01mol/硝酸銀水溶液のファクター
0.3545:0.01mol/硝酸銀水溶液1mlに対するハロゲンの量(mg/ml)
S:試料の採取量(mg)
C: Residual active halogen atom amount (ppm)
V: Titration volume of sample for measurement (ml)
B: Titration volume of blank sample (ml)
f: Factor of 0.01 mol / silver nitrate aqueous solution 0.3545: Amount of halogen to 1 ml of 0.01 mol / silver nitrate aqueous solution (mg / ml)
S: Amount of sample collected (mg)
態様Bの場合において、残留活性ハロゲン原子量がより少ないシクロトリホスファゼン誘導体若しくはシクロトリホスファゼン誘導体混合物を得る場合は、必要に応じ、次のような第二反応工程をさらに実施することができる。この第二反応工程では、先ず、溶媒を用いた上述の反応工程が終了後の反応液から溶媒を除去する。そして、それにより得られる残留物(すなわち、反応生成物)を溶融状態でさらに反応させる。ここでの反応時間は、通常、5〜10時間に設定するのが好ましい。このような第二反応工程を実施した場合、残留活性ハロゲン原子の置換反応が促進され、残留活性ハロゲン原子量がより少ないシクロトリホスファゼン誘導体若しくはシクロトリホスファゼン誘導体混合物を得ることができる。 In the case of the embodiment B, when a cyclotriphosphazene derivative or a mixture of cyclotriphosphazene derivatives having a smaller amount of residual active halogen atoms is obtained, the following second reaction step can be further performed as necessary. In this second reaction step, first, the solvent is removed from the reaction solution after the completion of the above-described reaction step using the solvent. And the residue (namely, reaction product) obtained by it is made to react further in a molten state. In general, the reaction time is preferably set to 5 to 10 hours. When such a 2nd reaction process is implemented, the substitution reaction of a residual active halogen atom is accelerated | stimulated and the cyclotriphosphazene derivative or cyclotriphosphazene derivative mixture with less residual active halogen atom amount can be obtained.
第二の形態
この形態に係るシクロトリホスファゼン誘導体の製造方法では、出発物質として部分置換ハロゲン化シクロトリホスファゼンを用いる。ここで用いられる部分置換ハロゲン化シクロトリホスファゼンは、下記の一般式(1b)で示されるものである。
Second Form In the method for producing a cyclotriphosphazene derivative according to this form, a partially substituted halogenated cyclotriphosphazene is used as a starting material. The partially substituted halogenated cyclotriphosphazene used here is represented by the following general formula (1b).
一般式(1b)中、Zは、フッ素、塩素、臭素などのハロゲン原子または下記の一般式(7a)若しくは一般式(7b)で示されるオキシアリール基を示している。但し、一般式(1b)において、少なくとも一つのZはハロゲン原子である。 In the general formula (1b), Z represents a halogen atom such as fluorine, chlorine or bromine, or an oxyaryl group represented by the following general formula (7a) or general formula (7b). However, in general formula (1b), at least one Z is a halogen atom.
一般式(7a)および(7b)において、R4は、水素、アルキル基、シアノ基、アルコキシ基、アラルコキシ基またはカルボニル基含有基を示している。ここでのアルキル基、アルコキシ基、アラルコキシ基およびカルボニル基含有基の例は、それぞれ、既述の一般式(3)および(4)のR1に関するアルキル基、アルコキシ基、アラルコキシ基およびカルボニル基含有基の例と同様である。また、一般式(7a)および(7b)において、R4の位置は特に限定されるものではないが、通常はパラ位が好ましい。 In the general formulas (7a) and (7b), R 4 represents hydrogen, an alkyl group, a cyano group, an alkoxy group, an aralkoxy group, or a carbonyl group-containing group. Examples of the alkyl group, alkoxy group, aralkoxy group and carbonyl group-containing group here are those containing the alkyl group, alkoxy group, aralkoxy group and carbonyl group relating to R 1 in the general formulas (3) and (4) described above, respectively. The same as the group example. In the general formulas (7a) and (7b), the position of R 4 is not particularly limited, but the para position is usually preferable.
このような部分置換ハロゲン化シクロトリホスファゼンとしては、例えば、上述の第一の形態の態様Aにおいて得られる、ヘキサハロゲン化シクロトリホスファゼンの活性ハロゲン原子の一部が上記−OY1基により置換されたシクロトリホスファゼン誘導体、すなわち、部分置換ハロゲン化シクロトリホスファゼンを用いることができる。 As such a partially substituted halogenated cyclotriphosphazene, for example, a part of the active halogen atom of the hexahalogenated cyclotriphosphazene obtained in the above-described embodiment A of the first embodiment is substituted with the -OY 1 group. Cyclotriphosphazene derivatives, that is, partially substituted halogenated cyclotriphosphazenes can be used.
この形態に係るシクロトリホスファゼン誘導体の製造方法では、上述の部分置換ハロゲン化シクロトリホスファゼンと有機塩とを溶媒中で反応させる。ここで用いられる有機塩は、第一の形態において用いられる、一般式(2)で示される有機塩と同様のものである。また、この有機塩において、一般式(2)におけるY1は、部分置換ハロゲン化シクロトリホスファゼンのオキシアリール基のアリール基と同じものであってもよいし、異なるものであってもよい。 In the method for producing a cyclotriphosphazene derivative according to this embodiment, the above partially substituted halogenated cyclotriphosphazene is reacted with an organic salt in a solvent. The organic salt used here is the same as the organic salt represented by the general formula (2) used in the first embodiment. In this organic salt, Y 1 in the general formula (2) may be the same as or different from the aryl group of the oxyaryl group of the partially substituted halogenated cyclotriphosphazene.
一方、この形態の製造方法において用いられる溶媒は、第一の形態において用いられる溶媒と同様のもの、すなわち、有機塩を分散または溶解することができる非水溶性溶媒である。また、この形態において用いられる溶媒は、比較的低温でかつ短時間で効率的に部分置換ハロゲン化トリシクロホスファゼンのハロゲン原子と上述の有機塩を示す一般式(2)に由来の−OY1基との置換反応を促進させることができ、しかも安価で経済的なことから、第一の形態の場合と同じく、上述の一般式(12)で示されるシクロペンチルアルキルエーテル、特に、シクロペンチルメチルエーテルが好ましい。 On the other hand, the solvent used in the production method of this embodiment is the same as the solvent used in the first embodiment, that is, a water-insoluble solvent capable of dispersing or dissolving the organic salt. In addition, the solvent used in this embodiment is a —OY 1 group derived from the general formula (2) showing the halogen atom of the partially substituted halogenated tricyclophosphazene and the above-described organic salt efficiently at a relatively low temperature and in a short time. The cyclopentyl alkyl ether represented by the above general formula (12), particularly cyclopentyl methyl ether is preferable, as in the case of the first embodiment. .
また、この形態の製造方法では、反応系に対し、上述の一般式(5)で示される四級アンモニウム塩および上述の一般式(6)で示される四級アンモニウムハライドのうちの少なくとも一つ(以下、「四級化合物」という場合がある)を添加する。但し、ここで用いられる四級アンモニウム塩は、通常、ここで用いる有機塩のY1と同じY1を有するものが好ましい。 In the production method of this embodiment, the reaction system is at least one of a quaternary ammonium salt represented by the above general formula (5) and a quaternary ammonium halide represented by the above general formula (6) ( Hereinafter, it may be referred to as “quaternary compound”). However, quaternary ammonium salts, as used herein, typically, it is preferable to have the same Y 1 and Y 1 of the organic salt used here.
上述の四級アンモニウム塩を添加した場合は、この形態の反応系において、当該四級アンモニウム塩が相間移動触媒として機能し、部分置換ハロゲン化シクロトリホスファゼンの活性ハロゲン原子と有機塩を示す一般式(2)に由来の−OY1基との置換反応を促進するため、より効率的に目的とするシクロトリホスファゼン誘導体を製造することができる。一方、上述の四級アンモニウムハライドを添加した場合は、この反応工程の反応系において、四級アンモニウムハライドと有機塩とが反応し、一般式(5)で示される四級アンモニウム塩が生成する。この四級アンモニウム塩は、相間移動触媒として機能し、部分置換ハロゲン化シクロトリホスファゼンの活性ハロゲン原子と有機塩を示す一般式(2)に由来の−OY1基との置換反応を促進することになるため、目的とするシクロトリホスファゼン誘導体の効率的な製造に寄与し得る。 When the above-mentioned quaternary ammonium salt is added, in this type of reaction system, the quaternary ammonium salt functions as a phase transfer catalyst, and represents a general formula showing an active halogen atom and an organic salt of a partially substituted halogenated cyclotriphosphazene Since the substitution reaction with the —OY 1 group derived from (2) is promoted, the target cyclotriphosphazene derivative can be produced more efficiently. On the other hand, when the above-described quaternary ammonium halide is added, the quaternary ammonium halide and the organic salt react in the reaction system of this reaction step to produce a quaternary ammonium salt represented by the general formula (5). This quaternary ammonium salt functions as a phase transfer catalyst and promotes a substitution reaction between the active halogen atom of the partially substituted halogenated cyclotriphosphazene and the —OY 1 group derived from the general formula (2) representing an organic salt. Therefore, it can contribute to the efficient production of the desired cyclotriphosphazene derivative.
因みに、添加した四級アンモニウム塩および反応系において生成した四級アンモニウム塩に由来の−OY1基は、有機塩に由来の−OY1基と同じく、部分置換ハロゲン化シクロトリホスファゼンの活性ハロゲン原子との置換反応に関与する。 Incidentally, the —OY 1 group derived from the added quaternary ammonium salt and the quaternary ammonium salt produced in the reaction system is the active halogen atom of the partially substituted halogenated cyclotriphosphazene, similarly to the —OY 1 group derived from the organic salt. Involved in the substitution reaction.
四級化合物の使用量は、反応促進効果、すなわち、部分置換ハロゲン化シクロトリホスファゼンの活性ハロゲン原子と有機塩に由来のオキシアリール基との置換反応促進効果の点で、通常、部分置換ハロゲン化シクロトリホスファゼンの1モルに対して1/100〜1/10000モルに設定するのが好ましい。 The amount of quaternary compound used is usually partially substituted halogenated in terms of the reaction promoting effect, that is, the effect of promoting the substitution reaction between the active halogen atom of the partially substituted halogenated cyclotriphosphazene and the oxyaryl group derived from the organic salt. It is preferable to set to 1/100 to 1 / 10,000 mol with respect to 1 mol of cyclotriphosphazene.
上述の四級化合物を添加する場合は、併せて、エーテル系溶媒に対して非プロトン性極性溶媒を添加するのが好ましい。非プロトン性極性溶媒を併せて添加した場合は、反応をより促進する効果を期待することができる。非プロトン性極性溶媒としては、例えば、アセトニトリル、ジメチルスルホキシド、スルホラン、ジメチルアセトアミドおよびN−メチル−2−ピロリドンなどを用いることができる。 When adding the above-mentioned quaternary compound, it is preferable to add an aprotic polar solvent to the ether solvent together. When an aprotic polar solvent is added together, an effect of further promoting the reaction can be expected. As the aprotic polar solvent, for example, acetonitrile, dimethyl sulfoxide, sulfolane, dimethylacetamide, N-methyl-2-pyrrolidone and the like can be used.
なお、上述の四級化合物に代えて、テトラ−n−ブチルホスホニウムクロライドのようなホスホニウム塩を用いた場合も本形態の製造方法を同様に実施することができる。 In addition, it can replace with the above-mentioned quaternary compound and the manufacturing method of this form can be implemented similarly also when using phosphonium salt like tetra-n-butylphosphonium chloride.
部分置換ハロゲン化シクロトリホスファゼンと有機塩との反応は、通常、有機塩を溶解若しくは微粒子状で分散させた溶媒を調製し、これに対して部分置換ハロゲン化シクロトリホスファゼンを滴下して進行させる。ここで滴下する部分置換ハロゲン化シクロトリホスファゼンは、通常、上述の溶媒に溶解したものであるが、部分置換ハロゲン化シクロトリホスファゼンとして上述の第一の形態により得られたもの(すなわち、上述の第一の形態の態様Aで得られたもの)を用いる場合は、第一の形態における濾過処理後の反応液であってもよい。また、この反応は、部分置換ハロゲン化シクロトリホスファゼンを溶解した溶媒に対し、溶媒に溶解若しくは微粒子状で分散させた有機塩を滴下しながら進行させることもできる。なお、四級化合物は、部分置換ハロゲン化シクロトリホスファゼン側の溶媒に添加されていてもよいし、有機塩側の溶媒に添加されていてもよい。また、滴下終了後に四級化合物を添加し、反応を継続させることもできる。 The reaction between the partially substituted halogenated cyclotriphosphazene and the organic salt is usually allowed to proceed by preparing a solvent in which the organic salt is dissolved or dispersed in a fine particle form, and dropping the partially substituted halogenated cyclotriphosphazene on this. . The partially substituted halogenated cyclotriphosphazene dripped here is usually one dissolved in the above-mentioned solvent, but obtained as the partially substituted halogenated cyclotriphosphazene according to the above first form (that is, the above-mentioned one) In the case of using the one obtained in the aspect A of the first form, the reaction liquid after the filtration treatment in the first form may be used. In addition, this reaction can also proceed while dropping an organic salt dissolved or finely dispersed in a solvent in which a partially substituted halogenated cyclotriphosphazene is dissolved. The quaternary compound may be added to the solvent on the partially substituted halogenated cyclotriphosphazene side or may be added to the solvent on the organic salt side. Moreover, a quaternary compound can be added after completion | finish of dripping, and reaction can also be continued.
ここでの反応では、部分置換ハロゲン化シクロトリホスファゼンの活性ハロゲン原子が有機塩を示す一般式(2)に由来の−OY1基により置換され、目的とするシクロトリホスファゼン誘導体が得られる。 In this reaction, the active halogen atom of the partially substituted halogenated cyclotriphosphazene is substituted with —OY 1 group derived from the general formula (2) representing an organic salt, and the target cyclotriphosphazene derivative is obtained.
部分置換ハロゲン化シクロトリホスファゼンと有機塩との反応時の反応温度は、通常、20℃から溶媒の沸点の温度範囲に設定するのが好ましい。特に、反応時間の短縮を図る観点から、この温度範囲の任意の温度範囲において、昇温しながら(例えば、段階的に昇温しながら)反応させるのが好ましい。反応温度が20℃未満の場合は、有機塩の種類によっては、部分置換ハロゲン化シクロトリホスファゼンと有機塩との反応が進行しにくくなる可能性がある。一方、反応温度を当初から溶媒の沸点に設定した場合は、目的とするシクロトリホスファゼン誘導体が得られにくくなる可能性がある。 The reaction temperature at the time of the reaction between the partially substituted halogenated cyclotriphosphazene and the organic salt is usually preferably set in a temperature range from 20 ° C. to the boiling point of the solvent. In particular, from the viewpoint of shortening the reaction time, it is preferable to carry out the reaction while raising the temperature (for example, raising the temperature stepwise) in an arbitrary temperature range of this temperature range. When the reaction temperature is less than 20 ° C., the reaction between the partially substituted halogenated cyclotriphosphazene and the organic salt may hardly proceed depending on the type of the organic salt. On the other hand, when the reaction temperature is set to the boiling point of the solvent from the beginning, the target cyclotriphosphazene derivative may be difficult to obtain.
この反応時において、反応系中の水分量は、通常、100ppm以下に制御するのが好ましい。反応系の水分量が多い場合は、部分置換ハロゲン化シクロトリホスファゼンのリン原子と活性ハロゲン原子との結合部分が加水分解されてリン原子に対して水酸基が置換されたり、また、部分置換ハロゲン化シクロトリホスファゼンの分子間で−P−O−P−結合の生成が進行したりしやすくなる結果、目的とするシクロトリホスファゼン誘導体が得られにくくなる可能性がある。 During this reaction, the amount of water in the reaction system is usually preferably controlled to 100 ppm or less. When the amount of water in the reaction system is large, the bonding part between the phosphorus atom and the active halogen atom of the partially substituted halogenated cyclotriphosphazene is hydrolyzed to replace the hydroxyl group with respect to the phosphorus atom. As a result of the formation of —P—O—P— bonds being likely to proceed between the molecules of cyclotriphosphazene, it may be difficult to obtain the desired cyclotriphosphazene derivative.
この反応工程において用いる有機塩の量は、通常、部分置換ハロゲン化シクロトリホスファゼンの活性ハロゲン原子の全てを有機塩を示す一般式(2)に由来の−OY1基により置換するために必要な量である。 The amount of the organic salt used in this reaction step is usually necessary to replace all of the active halogen atoms of the partially substituted halogenated cyclotriphosphazene with —OY 1 group derived from the general formula (2) representing the organic salt. Amount.
また、この形態における反応時間は、有機塩の種類、部分置換ハロゲン化シクロトリホスファゼンに対する有機塩の割合および反応温度等の要因により異なるが、通常は4〜6時間に設定するのが好ましい。 In addition, the reaction time in this embodiment varies depending on factors such as the type of organic salt, the ratio of the organic salt to the partially substituted halogenated cyclotriphosphazene, and the reaction temperature, but it is usually preferably set to 4 to 6 hours.
この形態の製造方法では、反応終了後、反応液を室温、すなわち20〜35℃程度に戻し、反応液から副生物であるアルカリ金属ハロゲン化物や未反応の有機塩等を濾過処理により分離した後、反応液を洗浄する。反応液の洗浄では、通常、反応液に希アルカリ水溶液を添加し、反応液中に残留している過剰の有機塩および四級化合物等を希アルカリ水溶液に溶解する。そして、希アルカリ水溶液を反応液から分離した後、反応液に対して希硫酸洗浄および水洗を適用し、反応液中に生成したアルカリ金属ハロゲン塩(例えば食塩)などの不純物をさらに分離する。次に、このようにして洗浄された反応液から溶媒を除去し、例えば、その残留物に対してメタノール等のアルコール類の添加、還流、冷却および濾過の各処理をこの順に実施すると、目的とするシクロトリホスファゼン誘導体を高収率で得ることができる。 In the production method of this embodiment, after the reaction is completed, the reaction solution is returned to room temperature, that is, about 20 to 35 ° C., and alkali metal halides and unreacted organic salts which are by-products are separated from the reaction solution by filtration. The reaction solution is washed. In washing the reaction solution, a dilute alkaline aqueous solution is usually added to the reaction solution, and excess organic salts and quaternary compounds remaining in the reaction solution are dissolved in the dilute alkaline aqueous solution. And after isolate | separating dilute alkaline aqueous solution from a reaction liquid, dilute sulfuric acid washing | cleaning and water washing are applied with respect to a reaction liquid, and impurities, such as an alkali metal halogen salt (for example, salt) produced | generated in the reaction liquid, are further isolate | separated. Next, the solvent is removed from the reaction solution washed in this manner, and for example, the addition of alcohols such as methanol, reflux, cooling, and filtration are performed in this order on the residue. The cyclotriphosphazene derivative can be obtained in high yield.
この形態の製造方法により得られるシクロトリホスファゼン誘導体は、部分置換ハロゲン化シクロトリホスファゼンの実質的に全ての活性ハロゲン原子がオキシアリール基、すなわち、有機塩に由来の−OY1基で置換されたものである。ここで、有機塩として、一般式(2)のOY1が部分置換ハロゲン化シクロトリホスファゼンのオキシアリール基(すなわちZ)と同じものを用いた場合、同じオキシアリール基を六つ含むシクロトリホスファゼン誘導体を得ることができる。例えば、部分置換ハロゲン化シクロトリホスファゼンがトリフェノキシハロゲン化シクロトリホスファゼンの場合、有機塩としてOY1がフェノキシ基のものを用いた場合、シクロトリホスファゼン誘導体として、主に、ヘキサフェノキシ−シクロトリホスファゼンが得られる。 In the cyclotriphosphazene derivative obtained by the production method of this embodiment, substantially all active halogen atoms of the partially substituted halogenated cyclotriphosphazene are substituted with oxyaryl groups, that is, -OY 1 groups derived from organic salts. Is. Here, when OY 1 of the general formula (2) is the same as the oxyaryl group (that is, Z) of the partially substituted halogenated cyclotriphosphazene as the organic salt, cyclotriphosphazene containing six of the same oxyaryl groups Derivatives can be obtained. For example, when the partially substituted halogenated cyclotriphosphazene is a triphenoxy halogenated cyclotriphosphazene, when an organic salt having an OY 1 of phenoxy group is used, the cyclotriphosphazene derivative is mainly hexaphenoxy-cyclotriphosphazene. Is obtained.
一方、有機塩として、一般式(2)のOY1が部分置換ハロゲン化シクロトリホスファゼンのオキシアリール基(すなわちZ)と異なるものを用いた場合、複数種類のオキシアリール基を六つ含むシクロトリホスファゼン誘導体を得ることができる。例えば、部分置換ハロゲン化シクロトリホスファゼンがトリフェノキシハロゲン化シクロトリホスファゼンの場合、有機塩としてOY1が4−シアノフェノキシ基のものを用いた場合、シクロトリホスファゼン誘導体として、主に、トリフェノキ−トリ4−シアノフェノキシ−シクロトリホスファゼンが得られる。 On the other hand, when OY 1 of the general formula (2) is different from the oxyaryl group (that is, Z) of the partially substituted halogenated cyclotriphosphazene as the organic salt, A phosphazene derivative can be obtained. For example, when the partially substituted halogenated cyclotriphosphazene is a triphenoxy halogenated cyclotriphosphazene, when an organic salt having OY 1 of 4-cyanophenoxy group is used, the cyclotriphosphazene derivative is mainly composed of triphenoxy-tri 4-Cyanophenoxy-cyclotriphosphazene is obtained.
この形態の製造方法により得られるシクロトリホスファゼン誘導体は、四級化合物を用いた上述の反応工程を経て得られるものであるため、通常、残留活性ハロゲン原子量が50ppm未満である。なお、残留活性ハロゲン原子量の意味および評価(測定)方法は、第一の形態の場合と同じである。 Since the cyclotriphosphazene derivative obtained by the production method of this embodiment is obtained through the above-described reaction step using a quaternary compound, the amount of residual active halogen atoms is usually less than 50 ppm. The meaning of the residual active halogen atom amount and the evaluation (measurement) method are the same as in the first embodiment.
この形態の製造方法において、残留活性ハロゲン原子量がより少ないシクロトリホスファゼン誘導体を得る場合は、必要に応じ、次のような第二反応工程をさらに実施することができる。この第二反応工程では、先ず、この形態での反応工程が終了後の反応液から溶媒を除去する。そして、それにより得られる残留物(すなわち、反応生成物)を溶融状態でさらに反応させる。ここでの反応時間は、通常、5〜10時間に設定するのが好ましい。このような第二反応工程を実施した場合、残留活性ハロゲン原子の置換反応が促進され、残留活性ハロゲン原子量がより少ないシクロトリホスファゼン誘導体を得ることができる。 In the production method of this embodiment, when a cyclotriphosphazene derivative having a smaller amount of residual active halogen atoms is obtained, the following second reaction step can be further performed as necessary. In the second reaction step, first, the solvent is removed from the reaction solution after the reaction step in this mode is completed. And the residue (namely, reaction product) obtained by it is made to react further in a molten state. In general, the reaction time is preferably set to 5 to 10 hours. When such a 2nd reaction process is implemented, the substitution reaction of a residual active halogen atom is accelerated | stimulated and the cyclotriphosphazene derivative with less residual active halogen atom amount can be obtained.
上述の第一の形態および第二の形態の製造方法によりそれぞれ製造された、三つのリン原子のそれぞれに二つのオキシアリール基が置換したシクロトリホスファゼン誘導体若しくはシクロトリホスファゼン誘導体混合物は、各種の熱可塑性樹脂および熱硬化性樹脂の改質剤として利用することができる。より具体的には、このようなシクロトリホスファゼン誘導体は、これらの樹脂に添加すると、当該樹脂からなる成形体に良好な難燃性および耐熱性を付与することができる。また、このシクロトリホスファゼン誘導体は、樹脂に添加しても、当該樹脂からなる成形体の誘電率を低く抑えることができる。このため、このようなシクロトリホスファゼン誘導体を含む樹脂材料は、回路基板や電子素子の封止材等、電気・電子技術分野における各種成形体や材料を製造するための樹脂材料として特に適している。 A cyclotriphosphazene derivative or a mixture of cyclotriphosphazene derivatives, each produced by the above-described production method of the first form and the second form and having two oxyaryl groups substituted on each of the three phosphorus atoms, is subjected to various heat sources. It can be used as a modifier for plastic resins and thermosetting resins. More specifically, when such a cyclotriphosphazene derivative is added to these resins, good flame retardancy and heat resistance can be imparted to a molded article made of the resin. Further, even when this cyclotriphosphazene derivative is added to a resin, the dielectric constant of a molded body made of the resin can be kept low. For this reason, a resin material containing such a cyclotriphosphazene derivative is particularly suitable as a resin material for manufacturing various molded products and materials in the electric / electronic technical field, such as a circuit board and a sealing material for electronic elements. .
このようなシクロトリホスファゼン誘導体若しくはシクロトリホスファゼン誘導体混合物は、従来から知られていた各種のホスファゼン類が達成できなかった効果、すなわち、各種樹脂、特に、エポキシ系樹脂、ポリイミド樹脂、ラジカル重合性樹脂およびこれらの変性樹脂等のガラス転移点(Tg)が低下するのを抑制するか若しくはTgを高める効果を奏するため、これらの樹脂材料からなる成形体の耐熱性をより効果的に高めることができる。 Such a cyclotriphosphazene derivative or a mixture of cyclotriphosphazene derivatives has an effect that various conventionally known phosphazenes cannot achieve, that is, various resins, in particular, epoxy resins, polyimide resins, radical polymerizable resins. In order to suppress the glass transition point (Tg) of these modified resins and the like from decreasing or to increase the Tg, the heat resistance of the molded body made of these resin materials can be more effectively increased. .
以下の実施例(以下の実施例のうち、本発明の実施例に該当するものは実施例6、8−b、9−c、10および11である)等において、「ユニットモル」は、ヘキサクロロシクロトリホスファゼンのPNCl2単位を一ユニットとして表現したモル数を意味する。また、高速液体クロマトグラフィーの結果を示す「%」は、ピークの単純面積比によるものである。以下の各実施例等において、高速液体クロマトグラフィーの分析条件は、次の通りである。 In the following examples (among the following examples, those corresponding to the examples of the present invention are Examples 6, 8-b, 9-c, 10 and 11), etc., “unit mole” is hexachloro This means the number of moles of PNCl 2 units of cyclotriphosphazene expressed as one unit. Further, “%” indicating the result of high performance liquid chromatography is based on the simple area ratio of the peak. In each of the following examples and the like, analysis conditions for high performance liquid chromatography are as follows.
カラム:Inertsil ODS−2
溶離液:アセトニトリル
検出器:UV 254nm
Column: Inertsil ODS-2
Eluent: Acetonitrile Detector: UV 254 nm
製造例1(ヘキサクロロシクロトリホスファゼンの製造)
攪拌装置、還流冷却器、滴下ロートおよび温度計を備えた1リットルの四頚フラスコにモノクロロベンゼン300g、塩化アンモニウム38.6g(0.72モル)および酸化亜鉛0.81g(9.9×10−3モル)を仕込んだ。また、滴下ロートには、モノクロロベンゼン300gに五塩化リン125g(0.6モル)を溶解した溶液を仕込んだ。
Production Example 1 (Production of hexachlorocyclotriphosphazene)
Stirrer, reflux condenser, monochlorobenzene 300g four-necked 1 liter flask equipped with a dropping funnel and a thermometer, ammonium chloride 38.6 g (0.72 mol) and zinc oxide 0.81g (9.9 × 10 - 3 mol) was charged. The dropping funnel was charged with a solution of 125 g (0.6 mol) of phosphorus pentachloride in 300 g of monochlorobenzene.
次に、四頚フラスコの内容物を攪拌しながら昇温させ、内温が132℃に到達した時点において、滴下ロートの内容物を15時間かけて滴下した。そして、滴下終了後、温度を130〜132℃に維持しながら、さらに2時間反応を続けた。反応終了後、反応液を冷却し、未反応の塩化アンモニウムをろ過により分離した。反応液を高速液体クロマトグラフィーにより分析したところ、当該反応液は、ヘキサクロロシクロトリホスファゼン78.8%、オクタクロロシクロテトラホスファゼン10.5%およびその他のホスファゼン類(大環状のクロロホスファゼンや鎖状のクロロホスファゼン等)10.7%を含んでいた。この反応液から特開昭58−130107号公報および米国特許明細書第4,522,689号に記載された蒸留精製法によりヘキサクロロシクロトリホスファゼンを取り出したところ、純度が97.8%のヘキサクロロシクロトリホスファゼンが得られた。ヘキサクロロシクロトリホスファゼンの収率は98%であった。 Next, the contents of the four-necked flask were heated while stirring, and when the internal temperature reached 132 ° C., the contents of the dropping funnel were dropped over 15 hours. And after completion | finish of dripping, reaction was continued for further 2 hours, maintaining temperature at 130-132 degreeC. After completion of the reaction, the reaction solution was cooled, and unreacted ammonium chloride was separated by filtration. When the reaction solution was analyzed by high performance liquid chromatography, the reaction solution was found to contain 78.8% hexachlorocyclotriphosphazene, 10.5% octachlorocyclotetraphosphazene and other phosphazenes (such as macrocyclic chlorophosphazene and chain-like compounds). Chlorophosphazene etc.) 10.7%. Hexachlorocyclotriphosphazene was extracted from this reaction solution by distillation purification described in JP-A-58-130107 and US Pat. No. 4,522,689. As a result, hexachlorocyclohexane having a purity of 97.8% was obtained. Triphosphazene was obtained. The yield of hexachlorocyclotriphosphazene was 98%.
製造例2(ヘキサクロロシクロトリホスファゼンの製造)
攪拌装置、還流冷却器、滴下ロートおよび温度計を備えた1リットルの四頚フラスコにモノクロロベンゼン300g、塩化アンモニウム38.6g(0.72モル)、酸化亜鉛0.81g(9.9×10−3モル)およびピリジン47.4g(0.6モル)を仕込んだ。また、滴下ロートには、モノクロロベンゼン300gに五塩化リン125g(0.6モル)を溶解した溶液を仕込んだ。
Production Example 2 (Production of hexachlorocyclotriphosphazene)
Stirrer, reflux condenser, monochlorobenzene 300g four-necked 1 liter flask equipped with a dropping funnel and a thermometer, ammonium chloride 38.6 g (0.72 mol), zinc oxide 0.81g (9.9 × 10 - 3 mol) and 47.4 g (0.6 mol) of pyridine were charged. The dropping funnel was charged with a solution of 125 g (0.6 mol) of phosphorus pentachloride in 300 g of monochlorobenzene.
次に、四頚フラスコの内容物を攪拌しながら昇温させ、内温が132℃に到達した時点において、滴下ロートの内容物を5時間かけて滴下した。そして、滴下終了後、温度を130〜132℃に維持しながら、さらに2時間反応を続けた。反応終了後、反応液を冷却し、未反応の塩化アンモニウムとピリジン塩酸塩とをろ過により分離した。反応液を高速液体クロマトグラフィーにより分析したところ、当該反応液は、ヘキサクロロシクロトリホスファゼン86.4%、オクタクロロシクロテトラホスファゼン4.5%およびその他のホスファゼン類(大環状のクロロホスファゼンや鎖状のクロロホスファゼン等)9.1%を含んでいた。この反応液から特開昭58−130107号公報および米国特許明細書第4,522,689号に記載された蒸留精製法によりヘキサクロロシクロトリホスファゼンを取り出したところ、純度が99.3%のヘキサクロロシクロトリホスファゼンが得られた。ヘキサクロロシクロトリホスファゼンの収率は99%であった。 Next, the contents of the four-necked flask were heated while stirring, and when the internal temperature reached 132 ° C., the contents of the dropping funnel were dropped over 5 hours. And after completion | finish of dripping, reaction was continued for further 2 hours, maintaining temperature at 130-132 degreeC. After completion of the reaction, the reaction solution was cooled, and unreacted ammonium chloride and pyridine hydrochloride were separated by filtration. When the reaction solution was analyzed by high performance liquid chromatography, the reaction solution was found to contain 86.4% hexachlorocyclotriphosphazene, 4.5% octachlorocyclotetraphosphazene, and other phosphazenes (macrocyclic chlorophosphazene and chain-like compounds). Chlorophosphazene and the like) 9.1%. Hexachlorocyclotriphosphazene was taken out from this reaction solution by distillation purification described in JP-A-58-130107 and US Pat. No. 4,522,689. Triphosphazene was obtained. The yield of hexachlorocyclotriphosphazene was 99%.
製造例3(ヘキサクロロシクロトリホスファゼンの製造)
攪拌装置、還流冷却器、滴下ロートおよび温度計を備えた1リットルの四頚フラスコにモノクロロベンゼン300g、塩化アンモニウム38.6g(0.72モル)および酸化亜鉛0.81g(9.9×10−3モル)を仕込んだ。また、滴下ロートには、モノクロロベンゼン300gに五塩化リン125g(0.6モル)を溶解した溶液を仕込んだ。
Production Example 3 (Production of hexachlorocyclotriphosphazene)
Stirrer, reflux condenser, monochlorobenzene 300g four-necked 1 liter flask equipped with a dropping funnel and a thermometer, ammonium chloride 38.6 g (0.72 mol) and zinc oxide 0.81g (9.9 × 10 - 3 mol) was charged. The dropping funnel was charged with a solution of 125 g (0.6 mol) of phosphorus pentachloride in 300 g of monochlorobenzene.
次に、四頚フラスコの内容物を攪拌しながら昇温させ、内温が132℃に到達した時点において、滴下ロートの内容物を15時間かけて滴下した。そして、滴下終了後、温度を130〜132℃に維持しながら、さらに2時間反応を続けた。反応終了後、反応液を冷却し、未反応の塩化アンモニウムをろ過により分離した。反応液(濾液)からモノクロルベンゼンを環状ジクロルホスファゼン混合物濃度が75重量%になるまで回収し、−5℃まで冷却すると、白色結晶が析出した。析出した結晶をろ過分離して乾燥すると、41g(収率59%)の白色結晶が得られた。当該結晶は、高速液体クロマトグラフィーにより分析したところ、オクタクロロシクロテトラホスファゼンを9.0%含むヘキサクロロシクロトリホスファゼン(ヘキサクロロシクロトリホスファゼン量91.0%)であった。 Next, the contents of the four-necked flask were heated while stirring, and when the internal temperature reached 132 ° C., the contents of the dropping funnel were dropped over 15 hours. And after completion | finish of dripping, reaction was continued for further 2 hours, maintaining temperature at 130-132 degreeC. After completion of the reaction, the reaction solution was cooled, and unreacted ammonium chloride was separated by filtration. Monochlorobenzene was recovered from the reaction solution (filtrate) until the concentration of the cyclic dichlorophosphazene mixture reached 75% by weight and cooled to −5 ° C. to precipitate white crystals. The precipitated crystals were separated by filtration and dried to obtain 41 g (yield 59%) of white crystals. When the crystal was analyzed by high performance liquid chromatography, it was hexachlorocyclotriphosphazene containing 9.0% of octachlorocyclotetraphosphazene (the amount of hexachlorocyclotriphosphazene was 91.0%).
参考例1(部分置換ハロゲン化シクロトリホスファゼンの製造)
(反応材料の調製)
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコにフェノール50.1g(0.52モル)を加え、これを200mlのシクロペンチルメチルエーテルに溶解した。一方、滴下ロートにナトリウムメトキシドを28重量%含むメタノール溶液100gを仕込んだ。そして、滴下ロートの内容物を45分かけて四頚フラスコ内に滴下した。その後、四頚フラスコの内容物を106℃まで加熱してメタノールとシクロペンチルメチルエーテルの一部とを留去し、全量が250mlに調整された、フェノールナトリウム塩のシクロペンチルメチルエーテル溶液(第一溶液)を調製した。
Reference Example 1 (Production of partially substituted halogenated cyclotriphosphazene)
(Preparation of reaction materials)
50.1 g (0.52 mol) of phenol was added to a 1 liter four-necked flask equipped with a stirrer, a reflux condenser, a dropping funnel and a thermometer, and this was dissolved in 200 ml of cyclopentyl methyl ether. On the other hand, 100 g of a methanol solution containing 28% by weight of sodium methoxide was charged into the dropping funnel. Then, the contents of the dropping funnel were dropped into the four-necked flask over 45 minutes. Thereafter, the contents of the four-necked flask were heated to 106 ° C. to distill off methanol and a portion of cyclopentyl methyl ether, and the total amount was adjusted to 250 ml. A solution of phenol sodium salt in cyclopentyl methyl ether (first solution) Was prepared.
さらに、製造例1で得られたヘキサクロロシクロトリホスファゼン65g(0.56ユニットモル)を150mlのシクロペンチルメチルエーテルに溶解して0℃以下に冷却し、ヘキサクロロシクロトリホスファゼンのシクロペンチルメチルエーテル溶液(第二溶液)を調製した。 Furthermore, 65 g (0.56 unit mol) of hexachlorocyclotriphosphazene obtained in Production Example 1 was dissolved in 150 ml of cyclopentyl methyl ether, cooled to 0 ° C. or lower, and a solution of hexachlorocyclotriphosphazene in cyclopentyl methyl ether (second solution). Solution) was prepared.
(部分置換ハロゲン化シクロトリホスファゼンの製造)
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第二溶液を仕込み、また、滴下ロートに第一溶液を仕込んだ。そして、第二溶液を0±5℃に維持しながら、第二溶液に対して第一溶液を150分かけて滴下した。滴下終了後、温度を20〜30℃に維持しながら2時間反応させた。反応終了後、反応液を濾過して食塩を分離し、この食塩を少量のシクロペンチルメチルエーテルを用いて洗浄した。これにより、塩素原子の一部がフェノキシ基により置換された部分置換ハロゲン化シクロトリホスファゼンを含む反応液を得た。
(Production of partially substituted halogenated cyclotriphosphazenes)
The second solution was charged into a 1 liter four-necked flask equipped with a stirrer, reflux condenser, dropping funnel and thermometer, and the first solution was charged into the dropping funnel. And the 1st solution was dripped over 150 minutes with respect to the 2nd solution, maintaining a 2nd solution at 0 +/- 5 degreeC. After completion of dropping, the reaction was allowed to proceed for 2 hours while maintaining the temperature at 20-30 ° C. After completion of the reaction, the reaction solution was filtered to separate sodium chloride, which was washed with a small amount of cyclopentyl methyl ether. As a result, a reaction solution containing a partially substituted halogenated cyclotriphosphazene in which a part of the chlorine atom was substituted with a phenoxy group was obtained.
実施例1(ヘキサオキシアリール−シクロトリホスファゼンの製造)
(反応材料の調製)
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに4−シアノフェノール80.5g(0.676モル)を加え、これを400mlのシクロペンチルメチルエーテルに溶解した。一方、滴下ロートにナトリウムメトキシドを28重量%含むメタノール溶液129.2g(ナトリウムメトキシド換算で0.67モル)を仕込んだ。そして、滴下ロートの内容物を150分かけて四頚フラスコ内に滴下した。その後、四頚フラスコの内容物を106℃まで加熱してメタノールとシクロペンチルメチルエーテルの一部とを留去し、全量が450mlに調整された、4−シアノフェノールナトリウム塩のシクロペンチルメチルエーテル溶液(第三溶液)を調製した。
Example 1 (Production of hexaoxyaryl-cyclotriphosphazene)
(Preparation of reaction materials)
To a 1 liter four-necked flask equipped with a stirrer, a reflux condenser, a dropping funnel and a thermometer, 80.5 g (0.676 mol) of 4-cyanophenol was added and dissolved in 400 ml of cyclopentyl methyl ether. On the other hand, 129.2 g (0.67 mol in terms of sodium methoxide) of a methanol solution containing 28% by weight of sodium methoxide was charged into the dropping funnel. The contents of the dropping funnel were dropped into the four-necked flask over 150 minutes. Thereafter, the contents of the four-necked flask were heated to 106 ° C. to distill off methanol and a part of cyclopentyl methyl ether, and the total amount was adjusted to 450 ml. Three solutions) were prepared.
(ヘキサオキシアリール−シクロトリホスファゼンの製造)
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第三溶液を仕込み、これにテトラブチルアンモニウムブロマイド1gを添加して溶解した。また、滴下ロートに参考例1で得られた反応液の全量を仕込んだ。そして、四頚フラスコの内容物の温度を25〜50℃に維持しつつ、当該内容物に対して反応液を150分かけて滴下した。滴下終了後、四頚フラスコを加熱し、シクロペンチルメチルエーテルの還流下で2時間反応させたところ、この反応液のピリジン/アニリン呈色反応がマイナスになった。反応をさらに4時間継続し、反応を終了した。
(Production of hexaoxyaryl-cyclotriphosphazene)
The third solution was charged into a 1 liter four-necked flask equipped with a stirrer, a reflux condenser, a dropping funnel and a thermometer, and 1 g of tetrabutylammonium bromide was added and dissolved therein. Further, the entire amount of the reaction solution obtained in Reference Example 1 was charged into the dropping funnel. And the reaction liquid was dripped over 150 minutes with respect to the said content, maintaining the temperature of the content of a 4 neck flask at 25-50 degreeC. After completion of the dropwise addition, the four-necked flask was heated and reacted for 2 hours under reflux of cyclopentyl methyl ether. As a result, the pyridine / aniline color reaction of this reaction solution became negative. The reaction was continued for an additional 4 hours to complete the reaction.
(分離・精製工程)
上述の反応工程で得られた反応液を25℃まで冷却した後に濾過し、反応で生成した食塩と未反応の4−シアノフェノールナトリウム塩とを分離した。このように処理した反応液を希アルカリ水溶液と水とで数回洗浄し、洗浄後の反応液からシクロペンチルメチルエーテルを回収した。残留物に含水メタノールを加えて濾過し、得られた結晶を乾燥したところ、その重量は139gであった(収率96.2%)。この結晶の融点は103〜125℃であった。また、この結晶は、高速液体クロマトグラフィーにより分析したところ、ジフェノキシ−テトラ4−シアノフェノキシ−シクロトリホスファゼン16.10%、トリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼン80.20%およびテトラフェノキシ−ジ4−シアノフェノキシ−シクロトリホスファゼン3.08%を含むシクロトリホスファゼン誘導体混合物であり、参考例1においてヘキサクロロシクロトリホスファゼンに対して使用したフェノールナトリウム塩と、本実施例において使用した4−シアノフェノールナトリウム塩との比率に対応したシクロトリホスファゼン誘導体、すなわち、トリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼンを主に含むことが判明した。また、このシクロトリホスファゼン誘導体混合物は、既述の方法により残留活性ハロゲン原子量(残留活性塩素量)を測定したところ、50ppm未満であった。
(Separation and purification process)
The reaction solution obtained in the above reaction step was cooled to 25 ° C. and then filtered to separate sodium chloride produced by the reaction from unreacted 4-cyanophenol sodium salt. The reaction solution treated in this manner was washed several times with a dilute alkaline aqueous solution and water, and cyclopentyl methyl ether was recovered from the washed reaction solution. Hydrous methanol was added to the residue and filtered, and the obtained crystals were dried, and the weight was 139 g (yield 96.2%). The melting point of this crystal was 103 to 125 ° C. Further, this crystal was analyzed by high performance liquid chromatography. -A cyclotriphosphazene derivative mixture containing 3.08% di-4-cyanophenoxy-cyclotriphosphazene, the phenol sodium salt used for hexachlorocyclotriphosphazene in Reference Example 1 and the 4- It was found that it mainly contains cyclotriphosphazene derivatives corresponding to the ratio with cyanophenol sodium salt, that is, triphenoxy-tri-4-cyanophenoxy-cyclotriphosphazene. Moreover, this cyclotriphosphazene derivative mixture was less than 50 ppm when the amount of residual active halogen atoms (the amount of residual active chlorine) was measured by the method described above.
参考例2(部分置換ハロゲン化シクロトリホスファゼンの製造)
(反応材料の調製)
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコにメタノール370ml、フェノール53.6g(0.57モル)および28重量%CH3ONa/メタノール溶液110g(CH3ONa換算で0.57モル)を加えて室温で1時間攪拌し、その後、四頚フラスコの内容物からメタノールを完全に留去した。これにより得られた白色結晶にテトラヒドロフラン690mlを加えて溶解し、溶液を10〜15℃に冷却した。これにより、フェノールナトリウム塩のテトラヒドロフラン溶液(第一溶液)を得た。
Reference Example 2 (Production of partially substituted halogenated cyclotriphosphazene)
(Preparation of reaction materials)
In a 1 liter four-necked flask equipped with a stirrer, reflux condenser, dropping funnel and thermometer, 370 ml of methanol, 53.6 g (0.57 mol) of phenol and 110 g of 28 wt% CH 3 ONa / methanol solution (CH 3 ONa) 0.57 mol in terms of conversion) was added and stirred at room temperature for 1 hour, and then methanol was completely distilled off from the contents of the four-necked flask. To the white crystals thus obtained, 690 ml of tetrahydrofuran was added for dissolution, and the solution was cooled to 10 to 15 ° C. As a result, a tetrahydrofuran solution (first solution) of phenol sodium salt was obtained.
また、製造例2で得られたヘキサクロロシクロトリホスファゼン65g(0.56ユニットモル)を150mlのテトラヒドロフランに溶解して−5〜5℃に冷却し、ヘキサクロロシクロトリホスファゼンのテトラヒドロフラン溶液(第二溶液)を調製した。 Further, 65 g (0.56 unit mol) of hexachlorocyclotriphosphazene obtained in Production Example 2 was dissolved in 150 ml of tetrahydrofuran and cooled to −5 to 5 ° C., and then a tetrahydrofuran solution of hexachlorocyclotriphosphazene (second solution). Was prepared.
(部分置換ハロゲン化シクロトリホスファゼンの製造)
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第二溶液を仕込み、また、滴下ロートに第一溶液を仕込んだ。そして、第二溶液を0±5℃に維持しながら、第二溶液に対して第一溶液を150分かけて滴下した。滴下終了後、温度を30〜40℃に維持しながら2時間反応させた。反応終了後、反応液からテトラヒドロフランの全量を留去し、残留物に500mlのシクロペンチルメチルエーテルを加えて攪拌し、均一に溶解した。このようにして得られたシクロペンチルメチルエーテル溶液を濾過して食塩を分離し、この食塩を少量のシクロペンチルメチルエーテルを用いて洗浄した。これにより、塩素原子の一部がフェノキシ基により置換された部分置換ハロゲン化シクロトリホスファゼンを含む反応液を得た。
(Production of partially substituted halogenated cyclotriphosphazenes)
The second solution was charged into a 1 liter four-necked flask equipped with a stirrer, reflux condenser, dropping funnel and thermometer, and the first solution was charged into the dropping funnel. And the 1st solution was dripped over 150 minutes with respect to the 2nd solution, maintaining a 2nd solution at 0 +/- 5 degreeC. After completion of dropping, the reaction was allowed to proceed for 2 hours while maintaining the temperature at 30 to 40 ° C. After completion of the reaction, the total amount of tetrahydrofuran was distilled off from the reaction solution, and 500 ml of cyclopentylmethyl ether was added to the residue and stirred to dissolve uniformly. The cyclopentyl methyl ether solution thus obtained was filtered to separate the sodium chloride, which was washed with a small amount of cyclopentyl methyl ether. As a result, a reaction solution containing a partially substituted halogenated cyclotriphosphazene in which a part of the chlorine atom was substituted with a phenoxy group was obtained.
実施例2(ヘキサオキシアリール−シクロトリホスファゼンの製造)
(反応材料の調製)
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに4−シアノフェノール73.3g(0.616モル)、シクロペンチルメチルエーテル400mlおよび粉末CH3ONa33.3g(0.616モル)を加え、60〜70℃で1時間攪拌した。その後、四頚フラスコの内容物からメタノールとシクロペンチルメチルエーテルの一部とを留去し、全量が500mlに調整された、スラリー状の4−シアノフェノールナトリウム塩のシクロペンチルメチルエーテル溶液(第三溶液)を得た。
Example 2 (Preparation of hexaoxyaryl-cyclotriphosphazene)
(Preparation of reaction materials)
In a 1 liter four-necked flask equipped with a stirrer, reflux condenser, dropping funnel and thermometer, 73.3 g (0.616 mol) of 4-cyanophenol, 400 ml of cyclopentyl methyl ether and 33.3 g of powdered CH 3 ONa (0.3. 616 mol) was added and stirred at 60-70 ° C. for 1 hour. Thereafter, methanol and a part of cyclopentyl methyl ether were distilled off from the contents of the four-necked flask, and the total amount was adjusted to 500 ml. A slurry of 4-cyanophenol sodium salt cyclopentyl methyl ether solution (third solution) Got.
(ヘキサオキシアリール−シクロトリホスファゼンの製造)
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに参考例2で得られた反応液の全量を仕込んだ。また、滴下ロートに第三溶液を仕込んだ。そして、四頚フラスコの内容物の温度を20〜25℃に維持しつつ、当該内容物に対して第二溶液の半量を加えて1時間攪拌した。その後、滴下ロート内に残留している第三溶液にトリメチルベンジルアンモニウムクロライド1gを加えて溶解し、滴下ロート内に残留している第二溶液の全量を四頚フラスコ内に滴下した。そして、滴下終了後、四頚フラスコを加熱し、シクロペンチルメチルエーテルの還流下で6時間反応させた。
(Production of hexaoxyaryl-cyclotriphosphazene)
The entire amount of the reaction solution obtained in Reference Example 2 was charged into a 1 liter four-necked flask equipped with a stirrer, a reflux condenser, a dropping funnel and a thermometer. In addition, the third solution was charged into the dropping funnel. Then, while maintaining the temperature of the contents of the four-necked flask at 20 to 25 ° C., half of the second solution was added to the contents and stirred for 1 hour. Thereafter, 1 g of trimethylbenzylammonium chloride was added to and dissolved in the third solution remaining in the dropping funnel, and the entire amount of the second solution remaining in the dropping funnel was dropped into the four-necked flask. And after completion | finish of dripping, the 4 neck flask was heated and it was made to react for 6 hours under the recirculation | reflux of cyclopentyl methyl ether.
(分離・精製工程)
上述の反応工程後の反応液を25℃まで冷却した後に濾過し、反応で生成した食塩と未反応の4−シアノフェノールナトリウム塩とを分離した。このように処理した反応液を希アルカリ水溶液と水とで数回洗浄し、洗浄後の反応液からシクロペンチルメチルエーテルを回収した。残留物に含水メタノールを加えて濾過し、得られた結晶を乾燥したところ、その重量は135.8gであった(収率96.8%)。また、結晶の融点を測定したところ、98.9〜120.3℃であった。さらに、この結晶は、高速液体クロマトグラフィーにより分析したところ、ジフェノキシ−テトラ4−シアノフェノキシ−シクロトリホスファゼン2.1%、トリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼン91.9%およびテトラフェノキシ−ジ4−シアノフェノキシ−シクロトリホスファゼン4.3%を含むシクロトリホスファゼン誘導体混合物であり、参考例2においてヘキサクロロシクロトリホスファゼンに対して使用したフェノールナトリウム塩と、本実施例において使用した4−シアノフェノールナトリウム塩との比率に対応したシクロトリホスファゼン誘導体、すなわち、トリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼンを主に含むことが判明した。また、このシクロトリホスファゼン誘導体混合物は、既述の方法により残留活性ハロゲン原子量(残留活性塩素量)を測定したところ、50ppm未満であった。
(Separation and purification process)
After cooling the reaction liquid after the above-mentioned reaction process to 25 degreeC, it filtered, and the salt produced | generated by reaction and unreacted 4-cyanophenol sodium salt were isolate | separated. The reaction solution treated in this manner was washed several times with a dilute alkaline aqueous solution and water, and cyclopentyl methyl ether was recovered from the washed reaction solution. The residue was filtered by adding water-containing methanol, and the obtained crystal was dried, and its weight was 135.8 g (yield 96.8%). Moreover, when melting | fusing point of the crystal was measured, it was 98.9-120.3 degreeC. Furthermore, the crystals were analyzed by high performance liquid chromatography. -A cyclotriphosphazene derivative mixture containing 4.3% of di4-cyanophenoxy-cyclotriphosphazene, the phenol sodium salt used for hexachlorocyclotriphosphazene in Reference Example 2 and the 4- It was found that it mainly contains cyclotriphosphazene derivatives corresponding to the ratio with cyanophenol sodium salt, that is, triphenoxy-tri-4-cyanophenoxy-cyclotriphosphazene. Moreover, this cyclotriphosphazene derivative mixture was less than 50 ppm when the amount of residual active halogen atoms (the amount of residual active chlorine) was measured by the method described above.
参考例3(部分置換ハロゲン化シクロトリホスファゼンの製造)
(反応材料の調製)
攪拌装置、還流冷却器、滴下ロートおよび温度計を備えた1リットルの四頚フラスコにフェノール47.2g(0.502モル)を加え、これを290mlのシクロペンチルメチルエーテルに溶解した。一方、滴下ロートに液状苛性ソーダ(NaOH20g/水20g)を仕込んだ。そして、シクロペンチルメチルエーテルの還流下において、四頚フラスコ内に滴下ロートの内容物を滴下して共沸脱水し、全量が250mlに調整された、フェノールナトリウム塩のシクロペンチルメチルエーテル溶液(第一溶液)を調製した。
Reference Example 3 (Production of partially substituted halogenated cyclotriphosphazene)
(Preparation of reaction materials)
To a 1 liter four-necked flask equipped with a stirrer, reflux condenser, dropping funnel and thermometer, 47.2 g (0.502 mol) of phenol was added and dissolved in 290 ml of cyclopentyl methyl ether. On the other hand, liquid caustic soda (NaOH 20 g / water 20 g) was charged into the dropping funnel. Then, under reflux of cyclopentyl methyl ether, the contents of the dropping funnel were dropped into the four-necked flask and azeotropically dehydrated, and the total amount was adjusted to 250 ml. A solution of phenol sodium salt in cyclopentyl methyl ether (first solution) Was prepared.
さらに、製造例3で得られた、オクタクロロシクロテトラホスファゼン9.0%を含むヘキサクロロシクロトリホスファゼン65g(0.56ユニットモル)を150mlのシクロペンチルメチルエーテルに溶解して0℃以下に冷却し、ヘキサクロロシクロトリホスファゼンのシクロペンチルメチルエーテル溶液(第二溶液)を調製した。 Furthermore, 65 g (0.56 unit mol) of hexachlorocyclotriphosphazene containing 9.0% of octachlorocyclotetraphosphazene obtained in Production Example 3 was dissolved in 150 ml of cyclopentyl methyl ether and cooled to 0 ° C. or lower. A solution of hexachlorocyclotriphosphazene in cyclopentyl methyl ether (second solution) was prepared.
(部分置換ハロゲン化シクロトリホスファゼンの製造)
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第一溶液を仕込み、また、滴下ロートに第二溶液を仕込んだ。そして、第一溶液を0〜10℃に維持しながら、第一溶液に対して第二溶液を80分かけて滴下した。滴下終了後、温度を20〜30℃に維持しながら1時間反応させた。さらに、50℃まで1時間かけて昇温し、同温度で4時間反応した。反応終了後、反応液を濾過して食塩を分離し、この食塩を少量のシクロペンチルメチルエーテルを用いて洗浄した。これにより、塩素原子の一部がフェノキシ基により置換された部分置換ハロゲン化シクロトリホスファゼンを含む反応液を得た。
(Production of partially substituted halogenated cyclotriphosphazenes)
The first solution was charged into a 1 liter four-necked flask equipped with a stirrer, a reflux condenser, a dropping funnel and a thermometer, and the second solution was charged into the dropping funnel. And the 2nd solution was dripped over 80 minutes with respect to the 1st solution, maintaining a 1st solution at 0-10 degreeC. After completion of dropping, the reaction was allowed to proceed for 1 hour while maintaining the temperature at 20-30 ° C. Furthermore, it heated up to 50 degreeC over 1 hour, and reacted at the same temperature for 4 hours. After completion of the reaction, the reaction solution was filtered to separate sodium chloride, which was washed with a small amount of cyclopentyl methyl ether. As a result, a reaction solution containing a partially substituted halogenated cyclotriphosphazene in which a part of the chlorine atom was substituted with a phenoxy group was obtained.
実施例3(ヘキサオキシアリール−シクロトリホスファゼンの製造)
(反応材料の調製)
攪拌装置、還流冷却器、滴下ロートおよび温度計を備えた1リットルの四頚フラスコに4−シアノフェノール84.3g(0.708モル)を加え、これを600mlのシクロペンチルメチルエーテルに溶解した。一方、滴下ロートに液状苛性カリ(KOH39g/水39g)を仕込んだ。そして、シクロペンチルメチルエーテルの還流下において、四頚フラスコ内に滴下ロートの内容物を滴下して共沸脱水し、全量が550mlに調整された、4−シアノフェノールカリウム塩のシクロペンチルメチルエーテル溶液(第三溶液)を調製した。
Example 3 (Preparation of hexaoxyaryl-cyclotriphosphazene)
(Preparation of reaction materials)
To a 1 liter four-necked flask equipped with a stirrer, reflux condenser, dropping funnel and thermometer, 84.3 g (0.708 mol) of 4-cyanophenol was added and dissolved in 600 ml of cyclopentyl methyl ether. Meanwhile, liquid caustic potash (KOH 39 g / water 39 g) was charged into the dropping funnel. Then, under the reflux of cyclopentyl methyl ether, the contents of the dropping funnel were dropped into the four-necked flask and subjected to azeotropic dehydration, and a cyclopentyl methyl ether solution of 4-cyanophenol potassium salt adjusted to 550 ml in total (first solution). Three solutions) were prepared.
(ヘキサオキシアリール−シクロトリホスファゼンの製造)
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第三溶液を仕込み、これにテトラブチルアンモニウムブロマイド1gを添加して溶解した。また、滴下ロートに参考例3で得られた反応液の全量を仕込んだ。そして、四頚フラスコの内容物の温度を25〜50℃に維持しつつ、当該内容物に対して反応液を30分かけて滴下した。滴下終了後、四頚フラスコを加熱し、シクロペンチルメチルエーテルの還流下で2時間反応したところ、この反応液のピリジン/アニリン呈色反応がマイナスになった。シクロペンチルメチルエーテルの還流下で反応をさらに4時間継続し、反応を終了した。
(Production of hexaoxyaryl-cyclotriphosphazene)
The third solution was charged into a 1 liter four-necked flask equipped with a stirrer, a reflux condenser, a dropping funnel and a thermometer, and 1 g of tetrabutylammonium bromide was added and dissolved therein. Further, the entire amount of the reaction solution obtained in Reference Example 3 was charged into the dropping funnel. And the reaction liquid was dripped over 30 minutes with respect to the said content, maintaining the temperature of the content of a 4 neck flask at 25-50 degreeC. After completion of the dropwise addition, the four-necked flask was heated and reacted for 2 hours under reflux of cyclopentyl methyl ether. As a result, the pyridine / aniline color reaction of this reaction solution became negative. The reaction was continued for an additional 4 hours under reflux of cyclopentyl methyl ether to complete the reaction.
(分離・精製工程)
上述の反応工程で得られた反応液を25℃まで冷却した後に濾過し、反応で生成した塩化カリウムと未反応の4−シアノフェノールカリウム塩とを分離した。このように処理した反応液を希アルカリ水溶液と水とで数回洗浄し、洗浄後の反応液からシクロペンチルメチルエーテルを完全に回収した。残留物に含水メタノールを加えて80℃に加熱し、1時間攪拌して25℃まで冷却してから濾過したところ、結晶が得られた。得られた結晶を乾燥したところ、その重量は122gであった(収率84.2%)。この結晶の融点は107〜112℃であった。また、この結晶は、高速液体クロマトグラフィーにより分析したところ、フェノキシ−ペンタ4−シアノフェノキシ−シクロトリホスファゼン3.2%、ジフェノキシ−テトラ4−シアノフェノキシ−シクロトリホスファゼン42.6%、トリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼン43.7%およびテトラフェノキシ−ジ4−シアノフェノキシ−シクロトリホスファゼン5.0%を含むシクロトリホスファゼン誘導体混合物であり、参考例3においてオクタクロロシクロテトラホスファゼン9.0%を含むヘキサクロロシクロトリホスファゼンに対して使用したフェノールナトリウム塩と、本実施例において用いた4−シアノフェノールカリウム塩との比率に対応したシクロトリホスファゼン誘導体、すなわち、ジフェノキシ−テトラ4−シアノフェノキシ−シクロトリホスファゼンとトリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼンとを主に含むことが判明した。また、このシクロトリホスファゼン誘導体混合物は、既述の方法により残留活性ハロゲン原子量(残留活性塩素量)を測定したところ、50ppm未満であった。
(Separation and purification process)
The reaction solution obtained in the above reaction step was cooled to 25 ° C. and then filtered to separate potassium chloride produced by the reaction and unreacted 4-cyanophenol potassium salt. The reaction solution thus treated was washed several times with a dilute aqueous alkali solution and water, and cyclopentyl methyl ether was completely recovered from the washed reaction solution. Hydrous methanol was added to the residue, heated to 80 ° C., stirred for 1 hour, cooled to 25 ° C., and filtered to obtain crystals. When the obtained crystal was dried, its weight was 122 g (yield 84.2%). The melting point of this crystal was 107-112 ° C. The crystals were analyzed by high performance liquid chromatography. As a result, 3.2% phenoxy-penta-4-cyanophenoxy-cyclotriphosphazene, 42.6% diphenoxy-tetra-4-cyanophenoxy-cyclotriphosphazene, triphenoxy- Cyclotriphosphazene derivative mixture containing 43.7% tri-4-cyanophenoxy-cyclotriphosphazene and 5.0% tetraphenoxy-di4-cyanophenoxy-cyclotriphosphazene. In Reference Example 3, octachlorocyclotetraphosphazene 9 A cyclotriphosphazene derivative corresponding to the ratio of phenol sodium salt used for hexachlorocyclotriphosphazene containing 0.0% to 4-cyanophenol potassium salt used in this example, Phenoxy - tetra 4-cyanophenoxy - Cyclotriphosphazene and Torifenokishi - tri 4-cyanophenoxy - that contains mainly a cyclotriphosphazene was found. Moreover, this cyclotriphosphazene derivative mixture was less than 50 ppm when the amount of residual active halogen atoms (the amount of residual active chlorine) was measured by the method described above.
参考例4(部分置換ハロゲン化シクロトリホスファゼンの製造)
(反応材料の調製)
攪拌装置、還流冷却器、滴下ロートおよび温度計を備えた1リットルの四頚フラスコにフェノール52.7g(0.56モル)を加え、これを290mlのシクロペンチルメチルエーテルに溶解した。一方、滴下ロートに液状苛性ソーダ(NaOH22.4g/水23g)を仕込んだ。そして、シクロペンチルメチルエーテルの還流下において、四頚フラスコ内に滴下ロートの内容物を滴下して共沸脱水し、全量が250mlに調整された、フェノールナトリウム塩のシクロペンチルメチルエーテル溶液(第一溶液)を調製した。
Reference Example 4 (Production of partially substituted halogenated cyclotriphosphazene)
(Preparation of reaction materials)
To a 1 liter four-necked flask equipped with a stirrer, reflux condenser, dropping funnel and thermometer, 52.7 g (0.56 mol) of phenol was added and dissolved in 290 ml of cyclopentyl methyl ether. Meanwhile, liquid caustic soda (NaOH 22.4 g / water 23 g) was charged into the dropping funnel. Then, under reflux of cyclopentyl methyl ether, the contents of the dropping funnel were dropped into the four-necked flask and azeotropically dehydrated, and the total amount was adjusted to 250 ml. A solution of phenol sodium salt in cyclopentyl methyl ether (first solution) Was prepared.
また、製造例3で得られた、オクタクロロシクロテトラホスファゼン9.0%を含むヘキサクロロシクロトリホスファゼン65g(0.56ユニットモル)を150mlのシクロペンチルメチルエーテルに溶解して0℃以下に冷却し、ヘキサクロロシクロトリホスファゼンのシクロペンチルメチルエーテル溶液(第二溶液)を調製した。 Further, 65 g (0.56 unit mol) of hexachlorocyclotriphosphazene containing 9.0% of octachlorocyclotetraphosphazene obtained in Production Example 3 was dissolved in 150 ml of cyclopentyl methyl ether and cooled to 0 ° C. or lower. A solution of hexachlorocyclotriphosphazene in cyclopentyl methyl ether (second solution) was prepared.
(部分置換ハロゲン化シクロトリホスファゼンの製造)
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第一溶液を仕込み、また、滴下ロートに第二溶液を仕込んだ。そして、第一溶液を0〜10℃に維持しながら、第一溶液に対して第二溶液を80分かけて滴下した。滴下終了後、温度を20〜30℃に維持しながら1時間反応させた。さらに、50℃まで1時間かけて昇温し、同温度で10時間反応した。反応終了後、反応液を濾過して食塩を分離し、この食塩を少量のシクロペンチルメチルエーテルを用いて洗浄した。これにより、塩素原子の一部がフェノキシ基により置換された部分置換ハロゲン化シクロトリホスファゼンを含む反応液を得た。
(Production of partially substituted halogenated cyclotriphosphazenes)
The first solution was charged into a 1 liter four-necked flask equipped with a stirrer, a reflux condenser, a dropping funnel and a thermometer, and the second solution was charged into the dropping funnel. And the 2nd solution was dripped over 80 minutes with respect to the 1st solution, maintaining a 1st solution at 0-10 degreeC. After completion of dropping, the reaction was allowed to proceed for 1 hour while maintaining the temperature at 20-30 ° C. Furthermore, it heated up to 50 degreeC over 1 hour, and reacted at the same temperature for 10 hours. After completion of the reaction, the reaction solution was filtered to separate sodium chloride, which was washed with a small amount of cyclopentyl methyl ether. As a result, a reaction solution containing a partially substituted halogenated cyclotriphosphazene in which a part of the chlorine atom was substituted with a phenoxy group was obtained.
実施例4(ヘキサオキシアリール−シクロトリホスファゼンの製造)
(反応材料の調製)
攪拌装置、還流冷却器、滴下ロートおよび温度計を備えた1リットルの四頚フラスコに4−シアノフェノール100g(0.84モル)、トルエン600ml、無水炭酸カリウム68.6g(0.5モル)および水70mlを加え、これを還流下で共沸脱水した。これにより、全量が550mlに調整された、4−シアノフェノールカリウム塩のトルエン溶液(第三溶液)を調製した。
Example 4 (Preparation of hexaoxyaryl-cyclotriphosphazene)
(Preparation of reaction materials)
In a 1-liter four-necked flask equipped with a stirrer, reflux condenser, dropping funnel and thermometer, 100 g (0.84 mol) of 4-cyanophenol, 600 ml of toluene, 68.6 g (0.5 mol) of anhydrous potassium carbonate and 70 ml of water was added and this was azeotropically dehydrated under reflux. Thereby, a toluene solution (third solution) of 4-cyanophenol potassium salt whose total amount was adjusted to 550 ml was prepared.
(ヘキサオキシアリール−シクロトリホスファゼンの製造)
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第三溶液を仕込んだ。また、滴下ロートに参考例4で得られた反応液を仕込んだ。そして、四頚フラスコ内の第三溶液の温度を25〜50℃に維持しつつ、当該内容物に対して反応液を30分かけて滴下した。滴下終了後、テトラブチルアンモニウムブロマイド1gを添加し、シクロペンチルメチルエーテルとトルエンとの還流下で2時間反応したところ、この反応液のピリジン/アニリン呈色反応がマイナスになった。シクロペンチルメチルエーテルとトルエンとの還流下で反応をさらに4時間継続し、反応を終了した。
(Production of hexaoxyaryl-cyclotriphosphazene)
The third solution was charged into a 1 liter four-necked flask equipped with a stirrer, reflux condenser, dropping funnel and thermometer. In addition, the reaction solution obtained in Reference Example 4 was charged into the dropping funnel. And the reaction liquid was dripped over 30 minutes with respect to the said content, maintaining the temperature of the 3rd solution in a four neck flask at 25-50 degreeC. After completion of the dropwise addition, 1 g of tetrabutylammonium bromide was added and reacted for 2 hours under reflux of cyclopentylmethyl ether and toluene. As a result, the pyridine / aniline color reaction of this reaction solution became negative. The reaction was continued for an additional 4 hours under reflux of cyclopentyl methyl ether and toluene to complete the reaction.
(分離・精製工程)
上述の反応工程で得られた反応液を25℃まで冷却した後に濾過し、反応で生成した塩化カリウムと未反応の4−シアノフェノールカリウム塩とを分離した。このように処理した反応液を希アルカリ水溶液と水とで数回洗浄し、洗浄後の反応液からシクロペンチルメチルエーテルとトルエンとを完全に回収した。残留物に含水メタノールを加えて80℃に加熱し、1時間攪拌して25℃まで冷却してから濾過したところ、結晶が得られた。得られた結晶を乾燥したところ、その重量は123gであった(収率85.5%)。この結晶の融点は89〜93℃であった。また、この結晶は、高速液体クロマトグラフィーにより分析したところ、ジフェノキシ−テトラ4−シアノフェノキシ−シクロトリホスファゼン17.6%、トリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼン64.2%およびテトラフェノキシ−ジ4−シアノフェノキシ−シクロトリホスファゼン14.0%を含むシクロトリホスファゼン誘導体混合物であり、参考例4においてオクタクロロシクロテトラホスファゼン9.0%を含むヘキサクロロシクロトリホスファゼンに対して使用したフェノールナトリウム塩と、本実施例において使用した4−シアノフェノールカリウム塩との比率に対応したシクロトリホスファゼン誘導体、すなわち、トリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼンを主に含むことが判明した。また、このシクロトリホスファゼン誘導体混合物は、既述の方法により残留活性ハロゲン原子量(残留活性塩素量)を測定したところ、50ppm未満であった。
(Separation and purification process)
The reaction solution obtained in the above reaction step was cooled to 25 ° C. and then filtered to separate potassium chloride produced by the reaction and unreacted 4-cyanophenol potassium salt. The reaction solution treated in this manner was washed several times with a dilute aqueous alkali solution and water, and cyclopentyl methyl ether and toluene were completely recovered from the washed reaction solution. Hydrous methanol was added to the residue, heated to 80 ° C., stirred for 1 hour, cooled to 25 ° C., and filtered to obtain crystals. When the obtained crystal was dried, its weight was 123 g (yield: 85.5%). The melting point of this crystal was 89-93 ° C. This crystal was analyzed by high performance liquid chromatography. As a result, 17.6% diphenoxy-tetra-4-cyanophenoxy-cyclotriphosphazene, 64.2% triphenoxy-tri-4-cyanophenoxy-cyclotriphosphazene and tetraphenoxy were obtained. -Phenol sodium used as a mixture of cyclotriphosphazene derivatives containing 14.0% of di4-cyanophenoxy-cyclotriphosphazene and used for hexachlorocyclotriphosphazene containing 9.0% of octachlorocyclotetraphosphazene in Reference Example 4 The cyclotriphosphazene derivative corresponding to the ratio of the salt to the 4-cyanophenol potassium salt used in this example, ie, triphenoxy-tri-4-cyanophenoxy-cyclotriphosphazene, is mainly used. It has been found that including. Moreover, this cyclotriphosphazene derivative mixture was less than 50 ppm when the amount of residual active halogen atoms (the amount of residual active chlorine) was measured by the method described above.
参考例5(部分置換ハロゲン化シクロトリホスファゼンの製造)
(反応材料の調製)
攪拌装置、還流冷却器、滴下ロートおよび温度計を備えた1リットルの四頚フラスコにハイドロキノンモノメチルエーテル37.2g(0.3モル)およびシクロペンチルメチルエーテル300mlを仕込んだ。一方、滴下ロートに液状苛性カリ(KOH16.8g/水17g)を仕込んだ。そして、シクロペンチルメチルエーテルの還流下において、四頚フラスコ内に滴下ロートの内容物を滴下して共沸脱水し、全量が250mlに調整された、ハイドロキノンモノメチルエーテルカリウム塩のシクロペンチルメチルエーテル溶液(第一溶液)を調製した。
Reference Example 5 (Production of partially substituted halogenated cyclotriphosphazene)
(Preparation of reaction materials)
Hydroquinone monomethyl ether (37.2 g, 0.3 mol) and cyclopentyl methyl ether (300 ml) were charged into a 1 liter four-necked flask equipped with a stirrer, a reflux condenser, a dropping funnel and a thermometer. Meanwhile, liquid caustic potash (KOH 16.8 g / water 17 g) was charged into the dropping funnel. Then, under reflux of cyclopentyl methyl ether, the contents of the dropping funnel were dropped into the four-necked flask and subjected to azeotropic dehydration, and the total amount of the hydroquinone monomethyl ether potassium salt in cyclopentyl methyl ether solution adjusted to 250 ml (first Solution) was prepared.
さらに、製造例1で得られたヘキサクロロシクロトリホスファゼン34.8g(0.3ユニットモル)を100mlのシクロペンチルメチルエーテルに溶解して25℃以下に冷却し、ヘキサクロロシクロトリホスファゼンのシクロペンチルメチルエーテル溶液(第二溶液)を調製した。 Further, 34.8 g (0.3 unit mol) of hexachlorocyclotriphosphazene obtained in Production Example 1 was dissolved in 100 ml of cyclopentylmethyl ether, cooled to 25 ° C. or lower, and a solution of hexachlorocyclotriphosphazene in cyclopentylmethyl ether ( A second solution was prepared.
(部分置換ハロゲン化シクロトリホスファゼンの製造)
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第一溶液を仕込み、また、滴下ロートに第二溶液を仕込んだ。そして、第一溶液を20〜25℃に維持しながら、第一溶液に対して第二溶液を60分かけて滴下した。滴下終了後、温度を20〜30℃に維持しながら1時間反応させた。さらに、60℃まで1時間かけて昇温し、同温度で10時間反応した。反応終了後、反応液を濾過して塩化カリウムを分離し、この塩化カリウムを少量のシクロペンチルメチルエーテルを用いて洗浄した。これにより、塩素原子の一部が4−メトキシフェノキシ基により置換された部分置換ハロゲン化シクロトリホスファゼンを含む反応液を得た。
(Production of partially substituted halogenated cyclotriphosphazenes)
The first solution was charged into a 1 liter four-necked flask equipped with a stirrer, a reflux condenser, a dropping funnel and a thermometer, and the second solution was charged into the dropping funnel. And the 2nd solution was dripped over 60 minutes with respect to the 1st solution, maintaining a 1st solution at 20-25 degreeC. After completion of dropping, the reaction was allowed to proceed for 1 hour while maintaining the temperature at 20-30 ° C. Furthermore, it heated up to 60 degreeC over 1 hour, and reacted at the same temperature for 10 hours. After completion of the reaction, the reaction solution was filtered to separate potassium chloride, and this potassium chloride was washed with a small amount of cyclopentyl methyl ether. This obtained the reaction liquid containing the partially substituted halogenated cyclotriphosphazene by which some chlorine atoms were substituted by 4-methoxyphenoxy group.
実施例5(ヘキサオキシアリール−シクロトリホスファゼンの製造)
(反応材料の調製)
攪拌装置、還流冷却器、滴下ロートおよび温度計を備えた1リットルの四頚フラスコにフェノール35.3g(0.375モル)とシクロペンチルメチルエーテル250mlとを仕込んだ。一方、滴下ロートに液状苛性カリ(KOH21g/水21g)を仕込んだ。そして、シクロペンチルメチルエーテルの還流下において、四頚フラスコ内に滴下ロートの内容物を滴下して共沸脱水し、全量が200mlに調整された、フェノールカリウム塩のシクロペンチルメチルエーテル溶液(第三溶液)を調製した。
Example 5 (Preparation of hexaoxyaryl-cyclotriphosphazene)
(Preparation of reaction materials)
A 1 liter four-necked flask equipped with a stirrer, a reflux condenser, a dropping funnel and a thermometer was charged with 35.3 g (0.375 mol) of phenol and 250 ml of cyclopentyl methyl ether. Meanwhile, liquid caustic potash (KOH 21 g / water 21 g) was charged into the dropping funnel. Then, under reflux of cyclopentyl methyl ether, the contents of the dropping funnel were dropped into the four-necked flask and azeotropically dehydrated, and the total amount was adjusted to 200 ml. A solution of phenol potassium salt in cyclopentyl methyl ether (third solution) Was prepared.
(ヘキサオキシアリール−シクロトリホスファゼンの製造)
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第三溶液を仕込み、また、滴下ロートに参考例5で得られた反応液の全量を仕込んだ。そして、四頚フラスコの内容物の温度を30〜50℃に維持しつつ、当該内容物に対して反応液を30分かけて滴下した。滴下終了後、テトラブチルアンモニウムブロマイド1gを添加して四頚フラスコを加熱し、シクロペンチルメチルエーテルの還流下で3時間反応したところ、この反応液のピリジン/アニリン呈色反応がマイナスになった。シクロペンチルメチルエーテルの還流下で反応をさらに4時間継続し、反応を終了した。
(Production of hexaoxyaryl-cyclotriphosphazene)
The third solution was charged into a 1 liter four-necked flask equipped with a stirrer, a reflux condenser, a dropping funnel and a thermometer, and the entire amount of the reaction solution obtained in Reference Example 5 was charged into the dropping funnel. And the reaction liquid was dripped with respect to the said content over 30 minutes, maintaining the temperature of the content of a four neck flask at 30-50 degreeC. After completion of the dropwise addition, 1 g of tetrabutylammonium bromide was added and the four-necked flask was heated and reacted for 3 hours under reflux of cyclopentylmethyl ether. As a result, the pyridine / aniline color reaction of this reaction solution became negative. The reaction was continued for an additional 4 hours under reflux of cyclopentyl methyl ether to complete the reaction.
(分離・精製工程)
上述の反応工程で得られた反応液を25℃まで冷却した後に濾過し、反応で生成した塩化カリウムと未反応のフェノールカリウム塩とを分離した。このように処理した反応液を希アルカリ水溶液と水とで数回洗浄し、洗浄後の反応液からシクロペンチルメチルエーテルを完全に回収したところ、69.2g(収率88.4%)のペースト状物が得られた。このペースト状物は、高速液体クロマトグラフィーにより分析したところ、ジフェノキシ−テトラ4−メトキシフェノキシ−シクロトリホスファゼン17.8%、トリフェノキシ−トリ4−メトキシフェノキシ−シクロトリホスファゼン70.8%およびテトラフェノキシ−ジ4−メトキシフェノキシ−シクロトリホスファゼン8.8%を含むシクロトリホスファゼン誘導体混合物であり、参考例5においてヘキサクロロシクロトリホスファゼンに対して使用したハイドロキノンモノメチルエーテルカリウム塩と、本実施例において用いたフェノールカリウム塩との比率に対応したシクロトリホスファゼン誘導体、すなわち、トリフェノキシ−トリ4−メトキシフェノキシ−シクロトリホスファゼンを主に含むことが判明した。また、このシクロトリホスファゼン誘導体混合物は、既述の方法により残留活性ハロゲン原子量(残留活性塩素量)を測定したところ、50ppm未満であった。
(Separation and purification process)
The reaction liquid obtained in the above reaction step was cooled to 25 ° C. and then filtered to separate potassium chloride produced by the reaction and unreacted phenol potassium salt. The reaction solution thus treated was washed several times with a dilute alkaline aqueous solution and water, and when cyclopentylmethyl ether was completely recovered from the washed reaction solution, 69.2 g (yield 88.4%) of a paste was obtained. Things were obtained. This paste was analyzed by high performance liquid chromatography. Diphenoxy-tetra-4-methoxyphenoxy-cyclotriphosphazene 17.8%, triphenoxy-tri-4-methoxyphenoxy-cyclotriphosphazene 70.8% and tetraphenoxy -A cyclotriphosphazene derivative mixture containing 8.8% of di-4-methoxyphenoxy-cyclotriphosphazene, and the hydroquinone monomethyl ether potassium salt used for hexachlorocyclotriphosphazene in Reference Example 5 and used in this example It has been found that it mainly contains a cyclotriphosphazene derivative corresponding to the ratio to the phenol potassium salt, that is, triphenoxy-tri-4-methoxyphenoxy-cyclotriphosphazene. Moreover, this cyclotriphosphazene derivative mixture was less than 50 ppm when the amount of residual active halogen atoms (the amount of residual active chlorine) was measured by the method described above.
実施例6(ヘキサオキシアリール−シクロトリホスファゼンの製造)
(反応材料の調製)
攪拌装置、還流冷却器、滴下ロートおよび温度計を備えた1リットルの四頚フラスコにフェノール35.3g(0.375モル)とシクロペンチルメチルエーテル250mlとを仕込んだ。一方、滴下ロートに液状苛性カリ(KOH21g/水21g)を仕込んだ。そして、シクロペンチルメチルエーテルの還流下において、四頚フラスコ内に滴下ロートの内容物を滴下して共沸脱水し、全量が200mlに調整された、フェノールカリウム塩のシクロペンチルメチルエーテル溶液(材料溶液)を調製した。
Example 6 (Preparation of hexaoxyaryl-cyclotriphosphazene)
(Preparation of reaction materials)
A 1 liter four-necked flask equipped with a stirrer, a reflux condenser, a dropping funnel and a thermometer was charged with 35.3 g (0.375 mol) of phenol and 250 ml of cyclopentyl methyl ether. Meanwhile, liquid caustic potash (KOH 21 g / water 21 g) was charged into the dropping funnel. Then, under reflux of cyclopentyl methyl ether, the contents of the dropping funnel were dropped into the four-necked flask and azeotropically dehydrated to obtain a cyclopentyl methyl ether solution of phenol potassium salt (material solution) adjusted to a total volume of 200 ml. Prepared.
(ヘキサオキシアリール−シクロトリホスファゼンの製造)
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに材料溶液を仕込み、また、滴下ロートに参考例5で得られた反応液の全量を仕込んだ。そして、四頚フラスコの内容物の温度を30〜50℃に維持しつつ、当該内容物に対して反応液を30分かけて滴下した。滴下終了後、四頚フラスコを加熱してシクロペンチルメチルエーテルの還流下で2時間反応し、シクロペンチルメチルエーテルの全量を回収した。続いて、反応液を120℃以上に維持し、溶融状態で10時間さらに反応させた。
(Production of hexaoxyaryl-cyclotriphosphazene)
The material solution was charged into a 1 liter four-necked flask equipped with a stirrer, reflux condenser, dropping funnel and thermometer, and the entire amount of the reaction solution obtained in Reference Example 5 was charged into the dropping funnel. And the reaction liquid was dripped with respect to the said content over 30 minutes, maintaining the temperature of the content of a four neck flask at 30-50 degreeC. After completion of the dropping, the four-necked flask was heated and reacted for 2 hours under reflux of cyclopentyl methyl ether to recover the entire amount of cyclopentyl methyl ether. Subsequently, the reaction solution was maintained at 120 ° C. or higher and further reacted in a molten state for 10 hours.
(分離・精製工程)
上述の反応工程で得られた反応液を100℃まで冷却し、シクロペンチルメチルエーテル450mlを加えて反応生成物を溶解した。この溶液を25℃に冷却して濾過し、反応で生成した塩化カリウムと未反応のフェノールカリウム塩とを分離した。このように処理した溶液を希アルカリ水溶液と水とで数回洗浄し、洗浄後の溶液からシクロペンチルメチルエーテルを完全に回収したところ、74.4g(収率95%)のペースト状物が得られた。このペースト状物は、高速液体クロマトグラフィーにより分析したところ、ジフェノキシ−テトラ4−メトキシフェノキシ−シクロトリホスファゼン8.9%、トリフェノキシ−トリ4−メトキシフェノキシ−シクロトリホスファゼン75.8%およびテトラフェノキシ−ジ4−メトキシフェノキシ−シクロトリホスファゼン13.5%を含むシクロトリホスファゼン誘導体混合物であり、参考例5においてヘキサクロロシクロトリホスファゼンに対して使用したハイドロキノンモノメチルエーテルカリウム塩と、本実施例において用いたフェノールカリウム塩との比率に対応したシクロトリホスファゼン誘導体、すなわち、トリフェノキシ−トリ4−メトキシフェノキシ−シクロトリホスファゼンを主に含むことが判明した。また、このシクロトリホスファゼン誘導体混合物は、既述の方法により残留活性ハロゲン原子量(残留活性塩素量)を測定したところ、20ppm未満であった。
(Separation and purification process)
The reaction solution obtained in the above reaction step was cooled to 100 ° C., and 450 ml of cyclopentyl methyl ether was added to dissolve the reaction product. The solution was cooled to 25 ° C. and filtered to separate potassium chloride produced by the reaction from unreacted phenol potassium salt. The solution thus treated was washed several times with a dilute alkaline aqueous solution and water, and when cyclopentyl methyl ether was completely recovered from the washed solution, 74.4 g (yield 95%) of a paste-like product was obtained. It was. The paste was analyzed by high performance liquid chromatography. Diphenoxy-tetra-4-methoxyphenoxy-cyclotriphosphazene 8.9%, triphenoxy-tri-4-methoxyphenoxy-cyclotriphosphazene 75.8% and tetraphenoxy -A cyclotriphosphazene derivative mixture containing 13.5% of di-4-methoxyphenoxy-cyclotriphosphazene, and hydroquinone monomethyl ether potassium salt used for hexachlorocyclotriphosphazene in Reference Example 5 and used in this example It was found that the cyclotriphosphazene derivative corresponding to the ratio with the phenol potassium salt, that is, triphenoxy-tri-4-methoxyphenoxy-cyclotriphosphazene was mainly contained. The cyclotriphosphazene derivative mixture was measured to have a residual active halogen atom content (residual active chlorine content) of less than 20 ppm by the method described above.
実施例7−a(部分置換ハロゲン化シクロトリホスファゼンの製造)
(反応材料の調製)
攪拌装置、還流冷却器、滴下ロートおよび温度計を備えた1リットルの四頚フラスコにフェノール28.2g(0.3モル)とシクロペンチルメチルエーテル300mlとを仕込んだ。一方、滴下ロートに液状苛性カリ(KOH16.8g(0.3モル)/水17g)を仕込んだ。そして、シクロペンチルメチルエーテルの還流下において、四頚フラスコ内に滴下ロートの内容物を滴下して共沸脱水し、全量が250mlに調整された、フェノールカリウム塩のシクロペンチルメチルエーテル溶液(第一溶液)を調製した。
Example 7-a (Preparation of partially substituted halogenated cyclotriphosphazenes)
(Preparation of reaction materials)
A 1 liter four-necked flask equipped with a stirrer, a reflux condenser, a dropping funnel and a thermometer was charged with 28.2 g (0.3 mol) of phenol and 300 ml of cyclopentyl methyl ether. On the other hand, liquid caustic potash (KOH 16.8 g (0.3 mol) / water 17 g) was charged into the dropping funnel. Then, under reflux of cyclopentyl methyl ether, the contents of the dropping funnel were dropped into the four-necked flask and azeotropically dehydrated, and the total amount was adjusted to 250 ml. A solution of phenol potassium salt in cyclopentyl methyl ether (first solution) Was prepared.
さらに、製造例1で得られた、ヘキサクロロシクロトリホスファゼン34.8g(0.3ユニットモル)を100mlのシクロペンチルメチルエーテルに溶解して25℃以下に冷却し、ヘキサクロロシクロトリホスファゼンのシクロペンチルメチルエーテル溶液(第二溶液)を調製した。 Further, 34.8 g (0.3 unit mol) of hexachlorocyclotriphosphazene obtained in Production Example 1 was dissolved in 100 ml of cyclopentylmethyl ether and cooled to 25 ° C. or lower, and a solution of hexachlorocyclotriphosphazene in cyclopentylmethyl ether was obtained. (Second solution) was prepared.
(部分置換ハロゲン化シクロトリホスファゼンの製造)
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第一溶液を仕込み、また、滴下ロートに第二溶液を仕込んだ。そして、第一溶液を20〜25℃に維持しながら、第一溶液に対して第二溶液を60分かけて滴下した。滴下終了後、温度を20〜30℃に維持しながら1時間反応させた。さらに、50℃まで1時間かけて昇温し、テトラブチルアンモニウムブロマイド0.5gを加えて同温度で2時間反応した。反応終了後、反応液を濾過して塩化カリウムを分離し、この塩化カリウムを少量のシクロペンチルメチルエーテルを用いて洗浄した。これにより、塩素原子の一部がフェノキシ基により置換された部分置換ハロゲン化シクロトリホスファゼンを含む反応液を得た。
(Production of partially substituted halogenated cyclotriphosphazenes)
The first solution was charged into a 1 liter four-necked flask equipped with a stirrer, a reflux condenser, a dropping funnel and a thermometer, and the second solution was charged into the dropping funnel. And the 2nd solution was dripped over 60 minutes with respect to the 1st solution, maintaining a 1st solution at 20-25 degreeC. After completion of dropping, the reaction was allowed to proceed for 1 hour while maintaining the temperature at 20-30 ° C. Further, the temperature was raised to 50 ° C. over 1 hour, 0.5 g of tetrabutylammonium bromide was added, and the mixture was reacted at the same temperature for 2 hours. After completion of the reaction, the reaction solution was filtered to separate potassium chloride, and this potassium chloride was washed with a small amount of cyclopentyl methyl ether. As a result, a reaction solution containing a partially substituted halogenated cyclotriphosphazene in which a part of the chlorine atom was substituted with a phenoxy group was obtained.
実施例7−b(ヘキサオキシアリール−シクロトリホスファゼンの製造)
(反応材料の調製)
攪拌装置、還流冷却器、滴下ロートおよび温度計を備えた1リットルの四頚フラスコに4−ヒドロキシ安息香酸エチル62.3g(0.375モル)、アセトニトリル650mlおよび水酸化カリウム21g(0.375モル)を仕込んだ。そして、これを40〜50℃で攪拌し、アセトニトリルの全量を回収した。その後、シクロペンチルメチルエーテルを200ml加え、4−ヒドロキシ安息香酸エチルカリウム塩のシクロペンチルメチルエーテル溶液(第三溶液)を調製した。
Example 7-b (Preparation of hexaoxyaryl-cyclotriphosphazene)
(Preparation of reaction materials)
In a 1 liter four-necked flask equipped with a stirrer, reflux condenser, dropping funnel and thermometer, 62.3 g (0.375 mol) of ethyl 4-hydroxybenzoate, 650 ml of acetonitrile and 21 g (0.375 mol) of potassium hydroxide were added. ). And this was stirred at 40-50 degreeC, and the whole quantity of acetonitrile was collect | recovered. Thereafter, 200 ml of cyclopentyl methyl ether was added to prepare a cyclopentyl methyl ether solution (third solution) of 4-hydroxybenzoic acid ethyl potassium salt.
(ヘキサオキシアリール−シクロトリホスファゼンの製造)
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第三溶液を仕込み、また、滴下ロートに実施例7−aで得られた反応液の全量を仕込んだ。そして、四頚フラスコの内容物の温度を30〜50℃に維持しつつ、当該内容物に対して反応液を30分かけて滴下した。滴下終了後、テトラブチルアンモニウムブロマイド1gを添加し、シクロペンチルメチルエーテルの還流下で3時間反応したところ、この反応液のピリジン/アニリン呈色反応がマイナスになった。シクロペンチルメチルエーテルの還流下で反応をさらに4時間継続し、反応を終了した。
(Production of hexaoxyaryl-cyclotriphosphazene)
The third solution was charged into a 1 liter four-necked flask equipped with a stirrer, a reflux condenser, a dropping funnel and a thermometer, and the entire amount of the reaction solution obtained in Example 7-a was charged into the dropping funnel. And the reaction liquid was dripped with respect to the said content over 30 minutes, maintaining the temperature of the content of a four neck flask at 30-50 degreeC. After completion of the dropwise addition, 1 g of tetrabutylammonium bromide was added and reacted for 3 hours under reflux of cyclopentyl methyl ether. As a result, the pyridine / aniline color reaction of this reaction solution became negative. The reaction was continued for an additional 4 hours under reflux of cyclopentyl methyl ether to complete the reaction.
(分離・精製工程)
上述の反応工程で得られた反応液を25℃まで冷却した後に濾過し、反応で生成した塩化カリウムと未反応の4−ヒドロキシ安息香酸エチルカリウム塩とを分離した。このように処理した反応液を希アルカリ水溶液と水とで数回洗浄し、洗浄後の反応液からシクロペンチルメチルエーテルを完全に回収したところ、82.6g(収率96%)の無色ペースト状物質が得られた。この無色ペースト状物質は、高速液体クロマトグラフィーにより分析したところ、ジフェノキシ−テトラ4−エトキシカルボニルフェノキシ−シクロトリホスファゼン3.9%、トリフェノキシ−トリ4−エトキシカルボニルフェノキシ−シクロトリホスファゼン89.9%およびテトラフェノキシ−ジ4−エトキシカルボニルフェノキシ−シクロトリホスファゼン8.8%を含むシクロトリホスファゼン誘導体混合物であり、実施例7−aにおいてヘキサクロロシクロトリホスファゼンに対して使用したフェノールカリウム塩と、本実施例において用いた4−ヒドロキシ安息香酸エチルカリウム塩との比率に対応したシクロトリホスファゼン誘導体、すなわち、トリフェノキシ−トリ4−エトキシカルボニルフェノキシ−シクロトリホスファゼンを主に含むことが判明した。また、このシクロトリホスファゼン誘導体混合物は、既述の方法により残留活性ハロゲン原子量(残留活性塩素量)を測定したところ、50ppm未満であった。
(Separation and purification process)
The reaction solution obtained in the above reaction step was cooled to 25 ° C. and then filtered to separate potassium chloride produced by the reaction from unreacted ethyl potassium salt of 4-hydroxybenzoic acid. The reaction solution thus treated was washed several times with a dilute alkaline aqueous solution and water, and when cyclopentylmethyl ether was completely recovered from the washed reaction solution, 82.6 g (yield 96%) of a colorless pasty substance was obtained. was gotten. This colorless paste was analyzed by high performance liquid chromatography. As a result, 3.9% diphenoxy-tetra-4-ethoxycarbonylphenoxy-cyclotriphosphazene, 89.9% triphenoxy-tri-4-ethoxycarbonylphenoxy-cyclotriphosphazene. And the phenol potassium salt used in Example 7-a for hexachlorocyclotriphosphazene, with 8.8% of tetraphenoxy-di-4-ethoxycarbonylphenoxy-cyclotriphosphazene. Cyclotriphosphazene derivatives corresponding to the ratio to 4-hydroxybenzoic acid ethyl potassium salt used in the examples, ie, triphenoxy-tri-4-ethoxycarbonylphenoxy-cyclotriphosphine It has been found that mainly including the Zen. Moreover, this cyclotriphosphazene derivative mixture was less than 50 ppm when the amount of residual active halogen atoms (the amount of residual active chlorine) was measured by the method described above.
実施例8−a(部分置換ハロゲン化シクロトリホスファゼンの製造)
(反応材料の調製)
攪拌装置、還流冷却器、滴下ロートおよび温度計を備えた1リットルの四頚フラスコにフェノール52.7g(0.56モル)を加え、これを290mlのシクロペンチルメチルエーテルに溶解した。一方、滴下ロートに液状苛性ソーダ(NaOH22.4g/水23g)を仕込んだ。そして、シクロペンチルメチルエーテルの還流下において、四頚フラスコ内に滴下ロートの内容物を滴下して共沸脱水し、全量が250mlに調整された、フェノールナトリウム塩のシクロペンチルメチルエーテル溶液(第一溶液)を調製した。
Example 8-a (Production of partially substituted halogenated cyclotriphosphazenes)
(Preparation of reaction materials)
To a 1 liter four-necked flask equipped with a stirrer, reflux condenser, dropping funnel and thermometer, 52.7 g (0.56 mol) of phenol was added and dissolved in 290 ml of cyclopentyl methyl ether. Meanwhile, liquid caustic soda (NaOH 22.4 g / water 23 g) was charged into the dropping funnel. Then, under reflux of cyclopentyl methyl ether, the contents of the dropping funnel were dropped into the four-necked flask and azeotropically dehydrated, and the total amount was adjusted to 250 ml. A solution of phenol sodium salt in cyclopentyl methyl ether (first solution) Was prepared.
また、製造例1で得られたヘキサクロロシクロトリホスファゼン65g(0.56ユニットモル)を150mlのトルエンに溶解して20℃以下に冷却し、ヘキサクロロシクロトリホスファゼンのトルエン溶液(第二溶液)を調製した。 Also, 65 g (0.56 unit mole) of hexachlorocyclotriphosphazene obtained in Production Example 1 was dissolved in 150 ml of toluene and cooled to 20 ° C. or lower to prepare a toluene solution (second solution) of hexachlorocyclotriphosphazene. did.
(部分置換ハロゲン化シクロトリホスファゼンの製造)
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第一溶液を仕込み、また、滴下ロートに第二溶液を仕込んだ。そして、第一溶液を10〜20℃に維持しながら、第一溶液に対して第二溶液を90分かけて滴下した。滴下終了後、温度を20〜30℃に維持しながら1時間反応させた。さらに、50℃まで1時間かけて昇温し、テトラブチルアンモニウムブロマイド0.5gを添加して同温度で2時間反応した。反応終了後、反応液を濾過して食塩を分離し、この食塩を少量のトルエンを用いて洗浄した。これにより、塩素原子の一部がフェノキシ基により置換された部分置換ハロゲン化シクロトリホスファゼンを含む反応液を得た。
(Production of partially substituted halogenated cyclotriphosphazenes)
The first solution was charged into a 1 liter four-necked flask equipped with a stirrer, a reflux condenser, a dropping funnel and a thermometer, and the second solution was charged into the dropping funnel. And the 2nd solution was dripped over 90 minutes with respect to the 1st solution, maintaining a 1st solution at 10-20 degreeC. After completion of dropping, the reaction was allowed to proceed for 1 hour while maintaining the temperature at 20-30 ° C. Furthermore, the temperature was raised to 50 ° C. over 1 hour, 0.5 g of tetrabutylammonium bromide was added, and the reaction was performed at the same temperature for 2 hours. After completion of the reaction, the reaction solution was filtered to separate sodium chloride, which was washed with a small amount of toluene. As a result, a reaction solution containing a partially substituted halogenated cyclotriphosphazene in which a part of the chlorine atom was substituted with a phenoxy group was obtained.
実施例8−b(ヘキサオキシアリール−シクロトリホスファゼンの製造)
(反応材料の調製)
また、攪拌装置、還流冷却器、滴下ロートおよび温度計を備えた1リットルの四頚フラスコに4−シアノフェノール70.1g(0.588モル)を入れ、これにトルエン600ml、無水炭酸カリウム68.6g(0.5モル)および水70gを加えた。そして、これを還流下で共沸脱水し、全量が550mlに調整された、4−シアノフェノールカリウム塩のトルエン溶液(第三溶液)を調製した。
Example 8-b (Preparation of hexaoxyaryl-cyclotriphosphazene)
(Preparation of reaction materials)
In addition, 70.1 g (0.588 mol) of 4-cyanophenol was placed in a 1 liter four-necked flask equipped with a stirrer, a reflux condenser, a dropping funnel and a thermometer, and 600 ml of toluene and anhydrous potassium carbonate 68. 6 g (0.5 mol) and 70 g of water were added. This was azeotropically dehydrated under reflux to prepare a toluene solution (third solution) of 4-cyanophenol potassium salt whose total amount was adjusted to 550 ml.
(ヘキサオキシアリール−シクロトリホスファゼンの製造)
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第二溶液を仕込み、これにテトラブチルアンモニウムブロマイド1gを添加して溶解した。また、滴下ロートに実施例8−aで得られた反応液を仕込んだ。そして、四頚フラスコの内容物の温度を25〜50℃に維持しつつ、当該内容物に対して反応液を30分かけて滴下した。滴下終了後、四頚フラスコを加熱し、シクロペンチルメチルエーテルとトルエンとを内温が120℃になるまで回収し、反応液の温度が120〜125℃の溶融状態でさらに5時間反応した。
(Production of hexaoxyaryl-cyclotriphosphazene)
The second solution was charged into a 1 liter four-necked flask equipped with a stirrer, a reflux condenser, a dropping funnel and a thermometer, and 1 g of tetrabutylammonium bromide was added and dissolved therein. Further, the reaction solution obtained in Example 8-a was charged into a dropping funnel. And the reaction liquid was dripped over 30 minutes with respect to the said content, maintaining the temperature of the content of a 4 neck flask at 25-50 degreeC. After completion of the dropping, the four-necked flask was heated, and cyclopentyl methyl ether and toluene were collected until the internal temperature reached 120 ° C., and the reaction solution was further reacted for 5 hours in a molten state at 120 to 125 ° C.
(分離・精製工程)
上述の反応工程で得られた反応液にトルエン300mlを加えて25℃まで冷却した後に濾過し、反応で生成した塩化カリウムと未反応の4−シアノフェノールカリウム塩とを分離した。このように処理した反応液を希アルカリ水溶液と水とで数回洗浄し、洗浄後の反応液からトルエンを完全に回収した。残留物にメタノールを加えて80℃に加熱し、1時間攪拌して20℃まで冷却してから濾過したところ、結晶が得られた。得られた結晶を乾燥したところ、その重量は136.2gであった(収率95%)。この結晶の融点は97〜112℃であった。また、この結晶は、高速液体クロマトグラフィーにより分析したところ、ジフェノキシ−テトラ4−シアノフェノキシシクロトリホスファゼン12.3%、トリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼン82.5%およびテトラフェノキシ−ジ4−シアノフェノキシ−シクロトリホスファゼン5.1%を含むシクロトリホスファゼン誘導体混合物であり、実施例8−aにおいてrヘキサクロロシクロトリホスファゼンに対して使用したフェノールナトリウム塩と、本実施例において用いた4−シアノフェノールカリウム塩との比率に対応したシクロトリホスファゼン誘導体、すなわち、トリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼンを主に含むことが判明した。また、このシクロトリホスファゼン誘導体混合物は、既述の方法により残留活性ハロゲン原子量(残留活性塩素量)を測定したところ、20ppm未満であった。
(Separation and purification process)
300 ml of toluene was added to the reaction solution obtained in the reaction step described above and cooled to 25 ° C., followed by filtration to separate potassium chloride produced by the reaction and unreacted 4-cyanophenol potassium salt. The reaction solution treated in this way was washed several times with dilute alkaline aqueous solution and water, and toluene was completely recovered from the washed reaction solution. Methanol was added to the residue, heated to 80 ° C., stirred for 1 hour, cooled to 20 ° C., and then filtered to obtain crystals. When the obtained crystal was dried, its weight was 136.2 g (yield 95%). The melting point of this crystal was 97-112 ° C. Further, this crystal was analyzed by high performance liquid chromatography. A mixture of cyclotriphosphazene derivatives containing 5.1% di4-cyanophenoxy-cyclotriphosphazene, used in this example with the phenol sodium salt used for r-hexachlorocyclotriphosphazene in Example 8-a. It was found that it mainly contains cyclotriphosphazene derivatives corresponding to the ratio to 4-cyanophenol potassium salt, that is, triphenoxy-tri-4-cyanophenoxy-cyclotriphosphazene. The cyclotriphosphazene derivative mixture was measured to have a residual active halogen atom content (residual active chlorine content) of less than 20 ppm by the method described above.
実施例9−a(部分置換ハロゲン化シクロトリホスファゼンの製造)
(反応材料の調製)
攪拌装置、還流冷却器、滴下ロートおよび温度計を備えた1リットルの四頚フラスコにフェノール53.6g(0.57モル)およびテトラヒドロフラン700mlを仕込み、60%NaH22.8gを加えて室温で1時間撹拌した。そして、テトラヒドロフランの沸点で2時間還流した後に10〜15℃に冷却し、フェノールナトリウム塩のテトラヒドロフラン溶液(第一溶液)を得た。
Example 9-a (Preparation of partially substituted halogenated cyclotriphosphazenes)
(Preparation of reaction materials)
A 1-liter four-necked flask equipped with a stirrer, reflux condenser, dropping funnel and thermometer was charged with 53.6 g (0.57 mol) of phenol and 700 ml of tetrahydrofuran, and 22.8 g of 60% NaH was added thereto for 1 hour at room temperature. Stir. And it refluxed at the boiling point of tetrahydrofuran for 2 hours, Then, it cooled to 10-15 degreeC, and the tetrahydrofuran solution (1st solution) of the phenol sodium salt was obtained.
また、製造例2で得られたヘキサクロロシクロトリホスファゼン65g(0.56ユニットモル)を150mlのテトラヒドロフランに溶解して−5〜5℃以下に冷却し、ヘキサクロロシクロトリホスファゼンのテトラヒドロフラン溶液(第二溶液)を調製した。 In addition, 65 g (0.56 unit mol) of hexachlorocyclotriphosphazene obtained in Production Example 2 was dissolved in 150 ml of tetrahydrofuran and cooled to −5 to 5 ° C. or lower to obtain a tetrahydrofuran solution of hexachlorocyclotriphosphazene (second solution). ) Was prepared.
(部分置換ハロゲン化シクロトリホスファゼンの製造)
攪拌装置、還流冷却器、滴下ロートおよび温度計を備えた1リットルの四頚フラスコに第一溶液を仕込み、また、滴下ロートに第二溶液を仕込んだ。そして、第一溶液を0±5℃に維持しながら、第一溶液に対して第二溶液を150分かけて滴下した。滴下終了後、テトラアンモニウムクロライド1gを加えて内温を30〜40℃に維持しながら2時間反応させた。反応終了後、反応液からテトラヒドロフランの全量を留去し、その残留物に500mlのトルエンを加えて撹拌し、均一に溶解した。このようにして得られたトルエン溶液をろ過して食塩を分離し、この食塩を少量のトルエンを用いて洗浄した。これにより、塩素原子の一部がフェノキシ基により置換された部分置換ハロゲン化シクロトリホスファゼンを含む反応液を得た。
(Production of partially substituted halogenated cyclotriphosphazenes)
The first solution was charged into a 1 liter four-necked flask equipped with a stirrer, reflux condenser, dropping funnel and thermometer, and the second solution was charged into the dropping funnel. And the 2nd solution was dripped over 150 minutes with respect to the 1st solution, maintaining a 1st solution at 0 +/- 5 degreeC. After completion of the dropwise addition, 1 g of tetraammonium chloride was added to react for 2 hours while maintaining the internal temperature at 30 to 40 ° C. After completion of the reaction, the total amount of tetrahydrofuran was distilled off from the reaction solution, and 500 ml of toluene was added to the residue and stirred to dissolve uniformly. The toluene solution thus obtained was filtered to separate sodium chloride, which was washed with a small amount of toluene. As a result, a reaction solution containing a partially substituted halogenated cyclotriphosphazene in which a part of the chlorine atom was substituted with a phenoxy group was obtained.
実施例9−b(ヘキサオキシアリール−シクロトリホスファゼンの製造)
(反応材料の調製)
攪拌装置、還流冷却器、滴下ロートおよび温度計を備えた1リットルの四頚フラスコに4−シアノフェノール73.3g(0.616モル)、アセトニトリル400ml、n−ヘキサン100mlおよび水酸化カリウム34.4g(0.616モル)を仕込んだ。そして、60〜70℃で撹拌しながら共沸脱水し、また、アセトニトリルとn−ヘキサンの全量を回収した。これにより得られた残渣にトルエン500mlを加え、スラリー状の4−シアノフェノールカリウム塩のトルエン溶液(第三溶液)を得た。
Example 9-b (Preparation of hexaoxyaryl-cyclotriphosphazene)
(Preparation of reaction materials)
In a 1 liter four-necked flask equipped with a stirrer, reflux condenser, dropping funnel and thermometer, 73.3 g (0.616 mol) of 4-cyanophenol, 400 ml of acetonitrile, 100 ml of n-hexane and 34.4 g of potassium hydroxide. (0.616 mol) was charged. And it azeotropically dehydrated, stirring at 60-70 degreeC, Moreover, the whole quantity of acetonitrile and n-hexane was collect | recovered. 500 ml of toluene was added to the residue thus obtained to obtain a slurry-like toluene solution (third solution) of 4-cyanophenol potassium salt.
(ヘキサオキシアリール−シクロトリホスファゼンの製造)
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第三溶液を仕込み、また、滴下ロートに実施例9−aで得られた反応液を仕込んだ。そして、第三溶液を20〜25℃に維持しつつ、第三溶液に対して滴下ロートの反応液の半量を加えて1時間撹拌した。その後、滴下ロート内に残留している反応液にトリメチルベンジルアンモニウムクロライド1gを加えて溶解し、当該反応液の全量を四頚フラスコ内に滴下した。滴下終了後、四頚フラスコを加熱し、トルエンの還流下で10時間反応させた。
(Production of hexaoxyaryl-cyclotriphosphazene)
The third solution was charged in a 1 liter four-necked flask equipped with a stirrer, a reflux condenser, a dropping funnel and a thermometer, and the reaction solution obtained in Example 9-a was charged in a dropping funnel. And half amount of the reaction liquid of the dropping funnel was added with respect to the 3rd solution, and it stirred for 1 hour, maintaining a 3rd solution at 20-25 degreeC. Thereafter, 1 g of trimethylbenzylammonium chloride was added to and dissolved in the reaction solution remaining in the dropping funnel, and the entire amount of the reaction solution was dropped into the four-necked flask. After completion of the dropwise addition, the four-necked flask was heated and reacted for 10 hours under toluene reflux.
(分離・精製工程)
上述の反応工程で得られた反応液を25℃まで冷却して濾過し、反応で生成した塩化カリウムと未反応の4−シアノフェノールカリウム塩とを分離した。このように処理した反応液を希アルカリ水溶液と水とで数回洗浄し、洗浄後の反応液からトルエンの全量を回収した。この残留物にメタノールを加えて溶解し、冷却したところ、結晶が得られた。得られた結晶をろ過して乾燥したところ、その重量は131.2g(収率91.5%)であった。この結晶の融点は95.9〜117.1℃であった。また、この結晶は、高速液体クロマトグラフィーにより分析したところ、ジフェノキシ−テトラ4−シアノフェノキシ−シクロトリホスファゼン5.1%、トリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼン86.3%およびテトラフェノキシ−ジ4−シアノフェノキシ−シクロトリホスファゼン7.9%を含むシクロトリホスファゼン誘導体混合物であり、実施例9−aにおいてヘキサクロロシクロトリホスファゼンに対して使用したフェノールナトリウム塩と本実施例において用いた4−シアノフェノールカリウム塩との比率に対応したシクロトリホスファゼン誘導体、すなわち、トリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼンを主に含むことが判明した。また、このシクロトリホスファゼン誘導体混合物は、既述の方法により残留活性ハロゲン原子量(残留活性塩素量)を測定したところ、50ppm未満であった。
(Separation and purification process)
The reaction solution obtained in the above reaction step was cooled to 25 ° C. and filtered to separate potassium chloride produced by the reaction from unreacted 4-cyanophenol potassium salt. The reaction solution thus treated was washed several times with a dilute alkaline aqueous solution and water, and the total amount of toluene was recovered from the washed reaction solution. When this residue was dissolved by adding methanol, and cooled, crystals were obtained. The obtained crystal was filtered and dried, and its weight was 131.2 g (yield 91.5%). The melting point of this crystal was 95.9 to 117.1 ° C. This crystal was analyzed by high performance liquid chromatography. As a result, 5.1% diphenoxy-tetra4-cyanophenoxy-cyclotriphosphazene, 86.3% triphenoxy-tri-4-cyanophenoxy-cyclotriphosphazene, and tetraphenoxy were obtained. A cyclotriphosphazene derivative mixture containing 7.9% of di-4-cyanophenoxy-cyclotriphosphazene, the phenol sodium salt used for hexachlorocyclotriphosphazene in Example 9-a and the 4 used in this example It has been found that it mainly contains cyclotriphosphazene derivatives corresponding to the ratio to -cyanophenol potassium salt, i.e., triphenoxy-tri-4-cyanophenoxy-cyclotriphosphazene. Moreover, this cyclotriphosphazene derivative mixture was less than 50 ppm when the amount of residual active halogen atoms (the amount of residual active chlorine) was measured by the method described above.
実施例9−c(ヘキサオキシアリール−シクロトリホスファゼンの製造)
(反応材料の調製)
攪拌装置、還流冷却器、滴下ロートおよび温度計を備えた1リットルの四頚フラスコに4−シアノフェノール73.3g(0.616モル)、アセトニトリル400ml、n−ヘキサン100mlおよび水酸化カリウム34.4g(0.616モル)を仕込んだ。そして、60〜70℃で撹拌しながら共沸脱水し、また、アセトニトリルとn−ヘキサンの全量を回収した。これにより得られた残渣にトルエン500mlを加え、スラリー状の4−シアノフェノールカリウム塩のトルエン溶液(第四溶液)を得た。
Example 9-c (Preparation of hexaoxyaryl-cyclotriphosphazene)
(Preparation of reaction materials)
In a 1 liter four-necked flask equipped with a stirrer, reflux condenser, dropping funnel and thermometer, 73.3 g (0.616 mol) of 4-cyanophenol, 400 ml of acetonitrile, 100 ml of n-hexane and 34.4 g of potassium hydroxide. (0.616 mol) was charged. And it azeotropically dehydrated, stirring at 60-70 degreeC, Moreover, the whole quantity of acetonitrile and n-hexane was collect | recovered. 500 ml of toluene was added to the residue thus obtained to obtain a slurry-like toluene solution (fourth solution) of 4-cyanophenol potassium salt.
(ヘキサオキシアリール−シクロトリホスファゼンの製造)
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第四溶液を仕込み、また、滴下ロートに実施例9−aで得られた反応液を仕込んだ。そして、第四溶液を20〜25℃に維持しつつ、第四溶液に対して滴下ロートの反応液の半量を加えて1時間撹拌した。その後、滴下ロート内に残留している反応液にトリメチルベンジルアンモニウムクロライド1gを加えて溶解し、当該反応液の全量を四頚フラスコ内に滴下した。滴下終了後、四頚フラスコを加熱してトルエンの全量を回収し、120〜125℃の溶融状態で5時間反応させた。
(Production of hexaoxyaryl-cyclotriphosphazene)
The fourth solution was charged into a 1 liter four-necked flask equipped with a stirrer, a reflux condenser, a dropping funnel, and a thermometer, and the reaction solution obtained in Example 9-a was charged into the dropping funnel. And while maintaining the 4th solution at 20-25 ° C, half of the reaction liquid of the dropping funnel was added to the 4th solution, and it stirred for 1 hour. Thereafter, 1 g of trimethylbenzylammonium chloride was added to and dissolved in the reaction solution remaining in the dropping funnel, and the entire amount of the reaction solution was dropped into the four-necked flask. After completion of the dropwise addition, the four-necked flask was heated to recover the entire amount of toluene, and reacted in a molten state at 120 to 125 ° C. for 5 hours.
(分離・精製工程)
上述の反応工程で得られた反応液にトルエン500mlを加え、溶液を調製した。そして、この溶液を25℃まで冷却して濾過し、反応で生成した塩化カリウムと未反応の4−シアノフェノールカリウム塩とを分離した。このように処理した溶液を希アルカリ水溶液と水とで数回洗浄し、洗浄後の溶液からトルエンの全量を回収した。この残留物にメタノールを加えて溶解し、冷却したところ、結晶が得られた。得られた結晶をろ過して乾燥したところ、その重量は135.1g(収率94.1%)であった。この結晶の融点は98.0〜118.3℃であった。また、この結晶は、高速液体クロマトグラフィーにより分析したところ、ジフェノキシ−テトラ4−シアノフェノキシ−シクロトリホスファゼン6.4%、トリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼン85.7%およびテトラフェノキシ−ジ4−シアノフェノキシ−シクロトリホスファゼン7.3%を含むシクロトリホスファゼン誘導体混合物であり、実施例9−aにおいてヘキサクロロシクロトリホスファゼンに対して使用したフェノールナトリウム塩と本実施例において用いた4−シアノフェノールカリウム塩との比率に対応したシクロトリホスファゼン誘導体、すなわち、トリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼンを主に含むことが判明した。また、このシクロトリホスファゼン誘導体混合物は、既述の方法により残留活性ハロゲン原子量(残留活性塩素量)を測定したところ、20ppm未満であった。
(Separation and purification process)
Toluene 500ml was added to the reaction liquid obtained at the above-mentioned reaction process, and the solution was prepared. The solution was cooled to 25 ° C. and filtered to separate potassium chloride produced by the reaction from unreacted 4-cyanophenol potassium salt. The solution thus treated was washed several times with a dilute alkaline aqueous solution and water, and the entire amount of toluene was recovered from the washed solution. When this residue was dissolved by adding methanol, and cooled, crystals were obtained. The obtained crystal was filtered and dried, and its weight was 135.1 g (yield 94.1%). The melting point of this crystal was 98.0-118.3 ° C. Further, this crystal was analyzed by high performance liquid chromatography. A cyclotriphosphazene derivative mixture containing 7.3% di-4-cyanophenoxy-cyclotriphosphazene, the phenol sodium salt used for hexachlorocyclotriphosphazene in Example 9-a and the 4 used in this example It has been found that it mainly contains cyclotriphosphazene derivatives corresponding to the ratio to -cyanophenol potassium salt, that is, triphenoxy-tri-4-cyanophenoxy-cyclotriphosphazene. The cyclotriphosphazene derivative mixture was measured to have a residual active halogen atom content (residual active chlorine content) of less than 20 ppm by the method described above.
実施例10(ヘキサオキシアリール−シクロトリホスファゼンの製造)
(反応材料の調製)
攪拌装置、還流冷却器、滴下ロートおよび温度計を備えた1リットルの四頚フラスコにハイドロキノンモノメチルエーテル38.1g(0.3075モル)、フェノール28.9g(0.3075モル)およびモノクロルベンゼン550mlを仕込んだ。一方、滴下ロートに液状苛性カリ(KOH34.4g/水34g)を仕込んだ。そして、モノクロルベンゼンの還流下において、四頚フラスコ内に滴下ロートの内容物を滴下して共沸脱水し、全量が500mlに調整された、ハイドロキノンモノメチルエーテルカリウム塩とフェノールカリウム塩とのモノクロルベンゼン溶液(第一溶液)を調製した。
Example 10 (Preparation of hexaoxyaryl-cyclotriphosphazene)
(Preparation of reaction materials)
Hydroquinone monomethyl ether 38.1 g (0.3075 mol), phenol 28.9 g (0.3075 mol) and monochlorobenzene 550 ml were placed in a 1 liter four-necked flask equipped with a stirrer, reflux condenser, dropping funnel and thermometer. Prepared. Meanwhile, liquid caustic potash (KOH 34.4 g / water 34 g) was charged into the dropping funnel. Then, under the reflux of monochlorobenzene, the contents of the dropping funnel were dropped into the four-necked flask and azeotropically dehydrated, and the monochlorobenzene solution of hydroquinone monomethyl ether potassium salt and phenol potassium salt was adjusted to a total volume of 500 ml. (First solution) was prepared.
さらに、製造例1で得られたヘキサクロロシクロトリホスファゼン34.8g(0.3ユニットモル)を100mlのモノクロルベンゼンに溶解して25℃以下に冷却し、ヘキサクロロシクロトリホスファゼンのモノクロルベンゼン溶液(第二溶液)を調製した。 Further, 34.8 g (0.3 unit mol) of hexachlorocyclotriphosphazene obtained in Production Example 1 was dissolved in 100 ml of monochlorobenzene and cooled to 25 ° C. or lower, and a monochlorobenzene solution of hexachlorocyclotriphosphazene (second solution) Solution) was prepared.
(ヘキサオキシアリール−シクロトリホスファゼンの製造)
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第一溶液を仕込み、また、滴下ロートに第二溶液を仕込んだ。そして、第一溶液を20〜25℃に維持しながら、第一溶液に対して第二溶液を120分かけて滴下した。滴下終了後、温度を20〜30℃に維持しながら1時間反応させた。さらに、60℃まで1時間かけて昇温し、テトラブチルアンモニウムブロマイド1gを加えた。その後、モノクロルベンゼンの還流下において2時間反応させたところ、この反応液のピリジン/アニリン呈色反応がマイナスになった。
(Production of hexaoxyaryl-cyclotriphosphazene)
The first solution was charged into a 1 liter four-necked flask equipped with a stirrer, reflux condenser, dropping funnel and thermometer, and the second solution was charged into the dropping funnel. And the 2nd solution was dripped over 120 minutes with respect to the 1st solution, maintaining a 1st solution at 20-25 degreeC. After completion of dropping, the reaction was allowed to proceed for 1 hour while maintaining the temperature at 20-30 ° C. Further, the temperature was raised to 60 ° C. over 1 hour, and 1 g of tetrabutylammonium bromide was added. Thereafter, the mixture was reacted for 2 hours under reflux of monochlorobenzene. As a result, the pyridine / aniline color reaction of this reaction solution became negative.
次に、反応液からモノクロルベンゼンの全量を回収し、内温120℃以上の溶融状態で5時間さらに反応させた。反応終了後、100℃まで冷却し、モノクロルベンゼン450mlを加えて反応生成物を溶解した。 Next, the entire amount of monochlorobenzene was recovered from the reaction solution, and further reacted for 5 hours in a molten state with an internal temperature of 120 ° C. or higher. After completion of the reaction, the reaction product was cooled to 100 ° C. and 450 ml of monochlorobenzene was added to dissolve the reaction product.
(分離・精製工程)
得られた反応生成物のモノクロルベンゼン溶液を25℃まで冷却した後に濾過し、反応で生成した塩化カリウムと未反応のハイドロキノンモノメチルエーテルカリウム塩およびフェノールカリウム塩を分離した。このように処理したモノクロルベンゼン溶液を希アルカリ水溶液と水とで数回洗浄し、洗浄後のモノクロルベンゼン溶液からモノクロルベンゼンを完全に回収したところ、74.4g(収率95%)のペースト状物質が得られた。このペースト状物質は、高速液体クロマトグラフィーにより分析したところ、ヘキサ4−メトキシフェノキシ−シクロトリホスファゼン0.9%、フェノキシ−ペンタ4−メトキシフェノキシ−シクロトリホスファゼン4.4%、ジフェノキシ−テトラ4−メトキシフェノキシ−シクロトリホスファゼン13.6%、トリフェノキシ−トリ4−メトキシフェノキシ−シクロトリホスファゼン49.7%、テトラフェノキシ−ジ4−メトキシフェノキシ−シクロトリホスファゼン20.7%、ペンタフェノキシ−4−メトキシフェノキシ−シクロトリホスファゼン6.3%およびヘキサフェノキシ−シクロトリホスファゼン1.1%を含むシクロトリホスファゼン誘導体混合物であり、ヘキサクロロシクロトリホスファゼンに対して使用したフェノールカリウム塩とハイドロキノンモノメチルエーテルカリウム塩との比率に対応したシクロトリホスファゼン誘導体、すなわち、トリフェノキシ−トリ4−メトキシフェノキシ−シクロトリホスファゼンを主に含むことが判明した。また、このシクロトリホスファゼン誘導体混合物は、既述の方法により残留活性ハロゲン原子量(残留活性塩素量)を測定したところ、20ppm未満であった。
(Separation and purification process)
The resulting monochlorobenzene solution of the reaction product was cooled to 25 ° C. and then filtered to separate potassium chloride produced by the reaction from unreacted hydroquinone monomethyl ether potassium salt and phenol potassium salt. The monochlorobenzene solution thus treated was washed several times with a dilute alkaline aqueous solution and water, and when monochlorobenzene was completely recovered from the washed monochlorobenzene solution, 74.4 g (yield 95%) of a pasty substance was obtained. was gotten. This pasty substance was analyzed by high performance liquid chromatography. As a result, 0.9% hexa-4-methoxyphenoxy-cyclotriphosphazene, 4.4% phenoxy-penta-4-methoxyphenoxy-cyclotriphosphazene, diphenoxy-tetra-4- 13.6% methoxyphenoxy-cyclotriphosphazene, 49.7% triphenoxy-tri-4-methoxyphenoxy-cyclotriphosphazene, 20.7% tetraphenoxy-di-4-methoxyphenoxy-cyclotriphosphazene, pentaphenoxy-4- A cyclotriphosphazene derivative mixture comprising 6.3% methoxyphenoxy-cyclotriphosphazene and 1.1% hexaphenoxy-cyclotriphosphazene, and used for hexachlorocyclotriphosphazene. Cyclotriphosphazene derivatives corresponding to the ratio of the Nord potassium salt of hydroquinone monomethyl ether potassium salt, i.e., Torifenokishi - tri 4-methoxyphenoxy - that contains mainly cyclotriphosphazene was found. The cyclotriphosphazene derivative mixture was measured to have a residual active halogen atom content (residual active chlorine content) of less than 20 ppm by the method described above.
実施例11(ヘキサオキシアリール−シクロトリホスファゼンの製造)
(反応材料の調製)
攪拌装置、還流冷却器、滴下ロートおよび温度計を備えた1リットルの四頚フラスコにフェノール28.9g(0.3075モル)、4−シアノフェノール36.6g(0.3075モル)、シクロペンチルメチルエーテル550mlおよびn−ヘキサン100mlを仕込んだ。一方、滴下ロートに液状水酸化カリウム(KOH34.4g/水34g)を仕込んだ。そして、シクロペンチルメチルエーテルおよびn−ヘキサンの還流下において、四頚フラスコ内に滴下ロートの内容物を滴下して共沸脱水し、全量が500mlに調整された、フェノールカリウム塩および4−シアノフェノールカリウム塩のシクロペンチルメチルエーテル溶液(第一溶液)を調製した。
Example 11 (Preparation of hexaoxyaryl-cyclotriphosphazene)
(Preparation of reaction materials)
In a 1 liter four-necked flask equipped with a stirrer, reflux condenser, dropping funnel and thermometer, phenol 28.9 g (0.3075 mol), 4-cyanophenol 36.6 g (0.3075 mol), cyclopentyl methyl ether 550 ml and n-hexane 100 ml were charged. On the other hand, liquid potassium hydroxide (KOH 34.4 g / water 34 g) was charged into the dropping funnel. Then, under reflux of cyclopentyl methyl ether and n-hexane, the contents of the dropping funnel were dropped into the four-necked flask and azeotropically dehydrated, and the total amount was adjusted to 500 ml. A solution of salt in cyclopentyl methyl ether (first solution) was prepared.
また、製造例1で得られたヘキサクロロシクロトリホスファゼン34.8g(0.3ユニットモル)を100mlのシクロペンチルメチルエーテルに溶解して25℃以下に冷却し、ヘキサクロロシクロトリホスファゼンのシクロペンチルメチルエーテル溶液(第二溶液)を調製した。 Further, 34.8 g (0.3 unit mol) of hexachlorocyclotriphosphazene obtained in Production Example 1 was dissolved in 100 ml of cyclopentylmethyl ether, cooled to 25 ° C. or lower, and a solution of hexachlorocyclotriphosphazene in cyclopentylmethyl ether ( A second solution was prepared.
(ヘキサオキシアリール−シクロトリホスファゼンの製造)
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第一溶液を仕込み、テトラブチルアンモニウムブロマイド1gを添加した。また、滴下ロートに第二溶液を仕込んだ。そして、第一溶液を20〜25℃に維持しつつ、第一溶液に対して第二溶液を120分かけて滴下した。滴下終了後、温度を20〜30℃に維持しながら1時間反応した。シクロペンチルメチルエーテルの還流下においてさらに2時間反応させた後、シクロペンチルメチルエーテルの全量を回収した。そして、その残留物を120〜125℃の溶融状態でさらに2時間反応させた。反応終了後、反応物を100℃まで冷却し、これにシクロペンチルメチルエーテル450mlを加えて溶液を調製した。
(Production of hexaoxyaryl-cyclotriphosphazene)
The first solution was charged into a 1 liter four-necked flask equipped with a stirrer, a reflux condenser, a dropping funnel and a thermometer, and 1 g of tetrabutylammonium bromide was added. Moreover, the 2nd solution was prepared to the dropping funnel. And the 2nd solution was dripped over 120 minutes with respect to the 1st solution, maintaining a 1st solution at 20-25 degreeC. After completion of dropping, the reaction was carried out for 1 hour while maintaining the temperature at 20-30 ° C. After further reaction for 2 hours under reflux of cyclopentyl methyl ether, the entire amount of cyclopentyl methyl ether was recovered. The residue was further reacted for 2 hours in a molten state at 120 to 125 ° C. After completion of the reaction, the reaction product was cooled to 100 ° C., and 450 ml of cyclopentyl methyl ether was added thereto to prepare a solution.
(分離・精製工程)
上述の反応工程で得られた溶液を25℃まで冷却して濾過し、反応で生成した塩化カリウム、未反応のフェノールカリウム塩および4−シアノフェノールカリウム塩を分離した。このように処理した溶液を希アルカリ水溶液と水とで数回洗浄し、洗浄後の溶液からシクロペンチルメチルエーテルを完全に回収した。この残留物に含水メタノールを加えて80℃に加熱し、1時間撹拌して25℃まで冷却したところ、結晶が得られた。得られた結晶をろ過して乾燥したところ、その重量は72.0g(収率93%)であった。この結晶の融点は77.4〜99.8℃であった。また、この結晶は、高速液体クロマトグラフィーにより分析したところ、ヘキサフェノキシ−シクロトリホスファゼン3.1%、ペンタフェノキシ−4−シアノフェノキシ−シクロトリホスファゼン7.6%、テトラフェノキシ−ジ4−シアノフェノキシ−シクロトリホスファゼン15.3%、トリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼン48.9%、ジフェノキシ−テトラ4−シアノフェノキシ−シクロトリホスファゼン18.5%およびフェノキシ−ペンタ4−シアノフェノキシ−シクロトリホスファゼン6.3%を含むシクロトリホスファゼン誘導体混合物であり、ヘキサクロロシクロトリホスファゼンに対して使用したフェノールカリウム塩と4−シアノフェノールカリウム塩との比率に対応したシクロトリホスファゼン誘導体、すなわち、トリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼンを主に含むことが判明した。また、このシクロトリホスファゼン誘導体混合物は、既述の方法により残留活性ハロゲン原子量(残留活性塩素量)を測定したところ、20ppm未満であった。
(Separation and purification process)
The solution obtained in the above reaction step was cooled to 25 ° C. and filtered to separate potassium chloride produced by the reaction, unreacted phenol potassium salt and 4-cyanophenol potassium salt. The solution thus treated was washed several times with a dilute alkaline aqueous solution and water, and cyclopentyl methyl ether was completely recovered from the washed solution. Hydrous methanol was added to the residue, heated to 80 ° C., stirred for 1 hour, and cooled to 25 ° C. to obtain crystals. The obtained crystal was filtered and dried, and its weight was 72.0 g (yield 93%). The melting point of this crystal was 77.4-99.8 ° C. The crystals were analyzed by high performance liquid chromatography. The results were 3.1% hexaphenoxy-cyclotriphosphazene, 7.6% pentaphenoxy-4-cyanophenoxy-cyclotriphosphazene, tetraphenoxy-di-4-cyanophenoxy. -Cyclotriphosphazene 15.3%, triphenoxy-tri-4-cyanophenoxy-cyclotriphosphazene 48.9%, diphenoxy-tetra4-cyanophenoxy-cyclotriphosphazene 18.5% and phenoxy-penta-4-cyanophenoxy- A cyclotriphosphazene derivative mixture containing 6.3% of cyclotriphosphazene, which is a cyclotope corresponding to the ratio of phenol potassium salt and 4-cyanophenol potassium salt used for hexachlorocyclotriphosphazene. Phosphazene derivatives, i.e., Torifenokishi - tri 4-cyanophenoxy - that contains mainly cyclotriphosphazene was found. The cyclotriphosphazene derivative mixture was measured to have a residual active halogen atom content (residual active chlorine content) of less than 20 ppm by the method described above.
比較例1−a
(反応材料の調製)
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコにフェノール59.2g(0.629モル)を加え、これを390mlのメタノールに溶解した。一方、滴下ロートにナトリウムメトキシドを28重量%含むメタノール溶液121.5g(ナトリウムメトキシド換算で0.629モル)を仕込んだ。そして、滴下ロートの内容物を45分かけて四頚フラスコ内に滴下した。四頚フラスコの内容物を30℃で1時間攪拌し、その後、メタノールの全量を留去した。これにより、73.3gのフェノールナトリウム塩を得た。得られたフェノールナトリウム塩をテトラヒドロフラン725mlに溶解し、フェノールナトリウム塩のテトラヒドロフラン溶液(第一溶液)を得た。
Comparative Example 1-a
(Preparation of reaction materials)
59.2 g (0.629 mol) of phenol was added to a 1 liter four-necked flask equipped with a stirrer, a reflux condenser, a dropping funnel and a thermometer, and this was dissolved in 390 ml of methanol. Meanwhile, 121.5 g of a methanol solution containing 28% by weight of sodium methoxide (0.629 mol in terms of sodium methoxide) was charged into the dropping funnel. Then, the contents of the dropping funnel were dropped into the four-necked flask over 45 minutes. The contents of the four-necked flask were stirred at 30 ° C. for 1 hour, and then the total amount of methanol was distilled off. As a result, 73.3 g of phenol sodium salt was obtained. The obtained phenol sodium salt was dissolved in 725 ml of tetrahydrofuran to obtain a tetrahydrofuran solution (first solution) of phenol sodium salt.
さらに、製造例1で得られたヘキサクロロシクロトリホスファゼン65g(0.56ユニットモル)を150mlのテトラヒドロフランに溶解して0℃以下に冷却し、ヘキサクロロシクロトリホスファゼンのテトラヒドロフラン溶液(第二溶液)を調製した。 Further, 65 g (0.56 unit mol) of hexachlorocyclotriphosphazene obtained in Production Example 1 was dissolved in 150 ml of tetrahydrofuran and cooled to 0 ° C. or lower to prepare a tetrahydrofuran solution (second solution) of hexachlorocyclotriphosphazene. did.
(反応工程)
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第二溶液を仕込み、また、滴下ロートに第一溶液を仕込んだ。そして、第一溶液を−5〜0℃に維持しながら、第二溶液に対して第一溶液を150分かけて滴下した。滴下終了後、温度を0〜5℃に維持しながら2時間反応させた。反応終了後、反応液を濾過し、少量のテトラヒドロフランを用いて洗浄した。反応液からテトラヒドロフランの全量を除去したところ、塩素原子の一部がフェノキシ基により置換された部分置換ハロゲン化シクロトリホスファゼンを含む、126.5gの白濁ペースト状物が得られた。
(Reaction process)
The second solution was charged into a 1 liter four-necked flask equipped with a stirrer, reflux condenser, dropping funnel and thermometer, and the first solution was charged into the dropping funnel. And the 1st solution was dripped over 150 minutes with respect to the 2nd solution, maintaining a 1st solution at -5-0 ° C. After completion of dropping, the reaction was allowed to proceed for 2 hours while maintaining the temperature at 0 to 5 ° C. After completion of the reaction, the reaction solution was filtered and washed with a small amount of tetrahydrofuran. When the total amount of tetrahydrofuran was removed from the reaction solution, 126.5 g of a cloudy pasty product containing partially substituted halogenated cyclotriphosphazene in which some of the chlorine atoms were substituted with phenoxy groups was obtained.
比較例1−b
(反応材料の調製)
4−シアノフェノール59.6g(0.5モル)をトリエチルアミン500mlに溶解し、4−シアノフェノールのトリエチルアミン溶液(第三液)を調製した。
(反応工程)
攪拌装置、還流冷却器および温度計を備えた1リットルのフラスコに比較例1−aで得られた白濁ペースト状物の全量を仕込み、これに第三液を加えた。そして、フラスコの内容物を還流下において10時間反応させたところ、反応液のピリジン/アニリン呈色反応がマイナスになった。
Comparative Example 1-b
(Preparation of reaction materials)
4-Cyanophenol 59.6 g (0.5 mol) was dissolved in 500 ml of triethylamine to prepare a triethylamine solution (third solution) of 4-cyanophenol.
(Reaction process)
In a 1 liter flask equipped with a stirrer, a reflux condenser and a thermometer, the whole amount of the cloudy paste obtained in Comparative Example 1-a was charged, and the third liquid was added thereto. When the contents of the flask were reacted for 10 hours under reflux, the pyridine / aniline color reaction of the reaction solution became negative.
(分離・精製工程)
上述の反応工程の反応終了後、反応液を1,500mlの冷水中に投入し、固液分離した。そして、分離された固相を希アルカリ水溶液と水とで数回洗浄し、さらにメタノール400mlで2回洗浄して乾燥したところ、65.5gの白色結晶が得られた(収率47.2%)。この結晶の融点は60〜102℃であった。また、得られた結晶を高速液体クロマトグラフィーにより分析したところ、この結晶は、ジフェノキシ−テトラ4−シアノフェノキシ−シクロトリホスファゼン1.69%、トリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼン76.08%およびテトラフェノキシ−ジ4−シアノフェノキシ−シクロトリホスファゼン18.72%を含むシクロトリホスファゼン誘導体混合物であり、比較例1−aにおいてヘキサクロロシクロトリホスファゼンに対して使用したフェノールナトリウム塩と、本比較例において用いた4−シアノフェノールとの比率に近いシクロトリホスファゼン誘導体、すなわち、トリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼンを主に含むことが判明した。但し、このシクロトリホスファゼン誘導体混合物は、既述の方法により残留活性ハロゲン原子量(残留活性塩素量)を測定したところ、2,400ppmであり、樹脂材料の改質剤としての利用は困難であった。
(Separation and purification process)
After completion of the reaction in the above reaction step, the reaction solution was poured into 1,500 ml of cold water and separated into solid and liquid. The separated solid phase was washed several times with a dilute alkaline aqueous solution and water, and further washed twice with 400 ml of methanol and dried to obtain 65.5 g of white crystals (yield 47.2%). ). The melting point of this crystal was 60 to 102 ° C. Further, when the obtained crystals were analyzed by high performance liquid chromatography, the crystals were found to be 1.69% diphenoxy-tetra4-cyanophenoxy-cyclotriphosphazene, triphenoxy-tri-4-cyanophenoxy-cyclotriphosphazene 76. A cyclotriphosphazene derivative mixture comprising 08% and tetraphenoxy-di4-cyanophenoxy-cyclotriphosphazene 18.72%, the phenol sodium salt used for hexachlorocyclotriphosphazene in Comparative Example 1-a It was found that the cyclotriphosphazene derivative close to the ratio to 4-cyanophenol used in the comparative example, that is, triphenoxy-tri-4-cyanophenoxy-cyclotriphosphazene was mainly contained. However, this cyclotriphosphazene derivative mixture had a residual active halogen atom content (residual active chlorine content) of 2,400 ppm as measured by the method described above, and was difficult to use as a modifier for resin materials. .
比較例2−a
(反応材料の調製)
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコにフェノール52.7g(0.56モル)を加え、これを390mlのメタノールに溶解した。一方、滴下ロートにナトリウムメトキシドを28重量%含むメタノール溶液108g(ナトリウムメトキシド換算で0.56モル)を仕込んだ。そして、滴下ロートの内容物を45分かけて四頚フラスコ内に滴下した。四頚フラスコの内容物を30℃で1時間攪拌した後、メタノールの全量を留去し、残留物を725mlのテトラヒドロフランに溶解してフェノールナトリウム塩のテトラヒドロフラン溶液(第一溶液)を調製した。
Comparative Example 2-a
(Preparation of reaction materials)
52.7 g (0.56 mol) of phenol was added to a 1 liter four-necked flask equipped with a stirrer, a reflux condenser, a dropping funnel and a thermometer, and this was dissolved in 390 ml of methanol. On the other hand, 108 g (0.56 mol in terms of sodium methoxide) of a methanol solution containing 28% by weight of sodium methoxide was charged into the dropping funnel. Then, the contents of the dropping funnel were dropped into the four-necked flask over 45 minutes. After the contents of the four-necked flask were stirred at 30 ° C. for 1 hour, the total amount of methanol was distilled off, and the residue was dissolved in 725 ml of tetrahydrofuran to prepare a phenol sodium salt tetrahydrofuran solution (first solution).
さらに、製造例1で得られたヘキサクロロシクロトリホスファゼン65g(0.56ユニットモル)を150mlのテトラヒドロフランに溶解して0℃以下に冷却し、ヘキサクロロシクロトリホスファゼンのテトラヒドロフラン溶液(第二溶液)を調製した。 Further, 65 g (0.56 unit mol) of hexachlorocyclotriphosphazene obtained in Production Example 1 was dissolved in 150 ml of tetrahydrofuran and cooled to 0 ° C. or lower to prepare a tetrahydrofuran solution (second solution) of hexachlorocyclotriphosphazene. did.
(反応工程)
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第二溶液を仕込み、また、滴下ロートに第一溶液を仕込んだ。そして、第一溶液を−5〜0℃に維持しながら、第二溶液に対して第一溶液を150分かけて滴下した。滴下終了後、温度を0〜5℃に維持しながら2時間反応させた。反応終了後、反応液を濾過し、少量のテトラヒドロフランを用いて洗浄した。反応液からテトラヒドロフランの全量を除去したところ、塩素原子の一部がフェノキシ基により置換された部分置換ハロゲン化シクロトリホスファゼンを含む白濁ペースト状物が得られた。
(Reaction process)
The second solution was charged into a 1 liter four-necked flask equipped with a stirrer, reflux condenser, dropping funnel and thermometer, and the first solution was charged into the dropping funnel. And the 1st solution was dripped over 150 minutes with respect to the 2nd solution, maintaining a 1st solution at -5-0 ° C. After completion of the dropwise addition, the reaction was allowed to proceed for 2 hours while maintaining the temperature at 0 to 5 ° C. After completion of the reaction, the reaction solution was filtered and washed with a small amount of tetrahydrofuran. When the total amount of tetrahydrofuran was removed from the reaction solution, a cloudy paste containing a partially substituted halogenated cyclotriphosphazene in which some of the chlorine atoms were substituted with phenoxy groups was obtained.
比較例2−b
(反応材料の調製)
4−シアノフェノール80g(0.67モル)をトリエチルアミン800mlに溶解し、4−シアノフェノールのトリエチルアミン溶液(第三液)を調製した。
Comparative Example 2-b
(Preparation of reaction materials)
80 g (0.67 mol) of 4-cyanophenol was dissolved in 800 ml of triethylamine to prepare a triethylamine solution (third solution) of 4-cyanophenol.
(反応工程)
攪拌装置、還流冷却器、滴下ロートおよび温度計を備えた1リットルの四頚フラスコに比較例2−aで得られた白濁ペースト状物の全量を加え、これを200mlのトリエチルアミンに溶解した。また、滴下ロートに第三液を仕込んだ。そして、四頚フラスコの内容物に対して第三液を滴下し、さらに、1gの4−ジメチルアミノピリジンを加えて還流下で25時間反応させたところ、ピリジン/アニリン呈色反応がマイナスになった。
(Reaction process)
The whole amount of the cloudy paste obtained in Comparative Example 2-a was added to a 1 liter four-necked flask equipped with a stirrer, a reflux condenser, a dropping funnel and a thermometer, and this was dissolved in 200 ml of triethylamine. In addition, the third liquid was charged into the dropping funnel. Then, when the third solution was added dropwise to the contents of the four-necked flask, and 1 g of 4-dimethylaminopyridine was added and reacted for 25 hours under reflux, the pyridine / aniline color reaction became negative. It was.
(分離・精製工程)
上述の反応工程の反応終了後、反応液を2,000mlの冷水中に投入し、固液分離した。そして、分離された固相をトルエンに溶解し、この溶液を希アルカリ水溶液と希硫酸とで数回洗浄し、さらに水洗した。洗浄後の溶液からトルエンを除去し、残留物に対してメタノールによる精製を数回繰り返して乾燥したところ、58.2gの結晶が得られた(収率40.6%)。この結晶の融点は100〜121.8℃であった。また、得られた結晶を高速液体クロマトグラフィーにより分析したところ、この結晶は、ジフェノキシ−テトラ4−シアノフェノキシ−シクロトリホスファゼン1.90%、トリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼン93.10%およびテトラフェノキシ−ジ4−シアノフェノキシ−シクロトリホスファゼン4.90%を含むシクロトリホスファゼン誘導体混合物であり、比較例2−aにおいてヘキサクロロシクロトリホスファゼンに対して使用したフェノールナトリウム塩と、本比較例において使用した4−シアノフェノールとの比率に対応したシクロトリホスファゼン誘導体、すなわち、トリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼンを主に含むことが判明した。但し、このシクロトリホスファゼン誘導体混合物は、既述の方法により残留活性ハロゲン原子量(残留活性塩素量)を測定したところ、800ppmであり、樹脂材料の改質剤としての利用は困難であった。
(Separation and purification process)
After completion of the above reaction step, the reaction solution was poured into 2,000 ml of cold water and subjected to solid-liquid separation. The separated solid phase was dissolved in toluene, and this solution was washed several times with a dilute alkaline aqueous solution and dilute sulfuric acid, and further washed with water. Toluene was removed from the washed solution, and the residue was repeatedly purified with methanol several times and dried to obtain 58.2 g of crystals (yield 40.6%). The melting point of this crystal was 100 to 121.8 ° C. Further, when the obtained crystals were analyzed by high performance liquid chromatography, the crystals were found to be 1.90% diphenoxy-tetra-4-cyanophenoxy-cyclotriphosphazene, triphenoxy-tri-4-cyanophenoxy-cyclotriphosphazene 93. A cyclotriphosphazene derivative mixture comprising 10% and 4.90% tetraphenoxy-di4-cyanophenoxy-cyclotriphosphazene, the phenol sodium salt used for hexachlorocyclotriphosphazene in Comparative Example 2-a It was found that the cyclotriphosphazene derivative corresponding to the ratio to 4-cyanophenol used in the comparative example, that is, triphenoxy-tri-4-cyanophenoxy-cyclotriphosphazene was mainly contained. However, this cyclotriphosphazene derivative mixture had a residual active halogen atom content (residual active chlorine content) of 800 ppm as measured by the method described above, and was difficult to use as a modifier for resin materials.
比較例3
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに4−シアノフェノール20.9g(0.175モル)、フェノール16.5g(0.175モル)およびトルエン135mlを仕込んだ。そして、四頚フラスコの内容物を攪拌しながら固形水酸化ナトリウム14g(0.35モル)を添加して還流下において反応させ、6時間かけて、生成した水を共沸脱水により除去した。その後、反応液を20℃まで冷却した。
Comparative Example 3
In a 1 liter four-necked flask equipped with a stirrer, reflux condenser, dropping funnel and thermometer, 20.9 g (0.175 mol) of 4-cyanophenol, 16.5 g (0.175 mol) of phenol and 135 ml of toluene were added. Prepared. Then, while stirring the contents of the four-necked flask, 14 g (0.35 mol) of solid sodium hydroxide was added and reacted under reflux, and the produced water was removed by azeotropic dehydration over 6 hours. Thereafter, the reaction solution was cooled to 20 ° C.
次に、製造例2で得られたヘキサクロロシクロトリホスファゼン15.5g(0.133ユニットモル)をモノクロルベンゼン80mlに溶解し、溶液を調製した。この溶液を滴下ロートに仕込み、常温の上述の反応液に対して40分かけて、内温30℃以下で滴下した。滴下終了後、1時間常温で反応させ、この反応液を12時間還流しながらさらに反応させた。反応終了後、ピリジン/アニリン発色テストを実施したが、赤色を呈した。反応液を冷却した後、水80mlを加えて全量を濾過し、固体分を分離して乾燥した。これにより、未反応の4−シアノフェノールナトリウム塩およびフェノールナトリウム塩(合計で21.1g)が燐片状の白色固体状態で回収された。一方、濾液を希アルカリ水溶液100mlと水100mlとで洗浄し、その有機層から減圧下で溶剤を除去してペースト状物を得た。このペースト状物は、高速液体クロマトグラフィーによる分析結果から、ヘキサフェノキシシクロトリホスファゼン65.3%、ペンタフェノキシ−モノ4−シアノフェノキシ−シクロトリホスファゼン25.1%、トリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼン4.7%、ジフェノキシ−テトラ4−シアノフェノキシ−シクロトリホスファゼン2.7%および未反応塩素分を含有するフェノキシシクロホスファゼン類の混合物と考えられる。したがって、この反応では、ヘキサクロロシクロトリホスファゼンに対して使用したフェノールと4−シアノフェノールとの比率に対応したシクロトリホスファゼン誘導体は実質的に得られなかった。また、ここで得られたフェノキシシクロトリホスファゼン類の混合物は、既述の方法により残留活性ハロゲン原子量(残留活性塩素量)を測定したところ、4,500ppmであり、樹脂材料の改質剤としての利用は困難であった。 Next, 15.5 g (0.133 unit mol) of hexachlorocyclotriphosphazene obtained in Production Example 2 was dissolved in 80 ml of monochlorobenzene to prepare a solution. This solution was charged into a dropping funnel and dropped at an internal temperature of 30 ° C. or lower over 40 minutes with respect to the above-mentioned reaction solution at room temperature. After completion of the dropwise addition, the mixture was reacted at room temperature for 1 hour, and this reaction solution was further reacted while refluxed for 12 hours. After completion of the reaction, a pyridine / aniline color development test was carried out, but it turned red. After the reaction solution was cooled, 80 ml of water was added, the whole amount was filtered, and the solid content was separated and dried. As a result, unreacted 4-cyanophenol sodium salt and phenol sodium salt (21.1 g in total) were recovered in the form of a scaly white solid. On the other hand, the filtrate was washed with 100 ml of dilute alkaline aqueous solution and 100 ml of water, and the solvent was removed from the organic layer under reduced pressure to obtain a paste. This paste-like product was found to be 65.3% hexaphenoxycyclotriphosphazene, 25.1% pentaphenoxy-mono-4-cyanophenoxy-cyclotriphosphazene, triphenoxy-tri-4-cyanophenoxy from the results of analysis by high performance liquid chromatography. -It is considered as a mixture of 4.7% cyclotriphosphazene, 2.7% diphenoxy-tetra4-cyanophenoxy-cyclotriphosphazene and phenoxycyclophosphazenes containing unreacted chlorine. Therefore, in this reaction, a cyclotriphosphazene derivative corresponding to the ratio of phenol and 4-cyanophenol used for hexachlorocyclotriphosphazene was not substantially obtained. In addition, the mixture of phenoxycyclotriphosphazenes obtained here was 4,500 ppm when the amount of residual active halogen atoms (the amount of residual active chlorine) was measured by the method described above, and was used as a modifier for resin materials. Use was difficult.
評価
エポキシ樹脂(JER株式会社の商品名“エピコート828”)、変性ポリフェニレンエーテル樹脂(日本G.E.プラスチックス株式会社の商品名“ノリル640−111”)、硬化剤(ジアミノジフェニルメタン)並びに実施例1〜4および実施例8−b(以下、これらを「評価実施例」と云う)のいずれかにおいて得られたシクロトリホスファゼン誘導体混合物を表1に示す割合で混合し、エポキシ樹脂組成物を調製した(試料1〜5)。また、比較のため、シクロトリホスファゼン誘導体混合物を添加せずに、同様のエポキシ樹脂組成物を調製した(試料6)。さらに、比較のため、評価実施例で得られたシクロトリホスファゼン誘導体混合物に代えてケミプロ化成株式会社の商品名“KD−302S”(ホスファゼン系難燃剤)を用いて同様のエポキシ樹脂組成物を調製した(試料7)。
Evaluation epoxy resin (trade name “Epicoat 828” from JER Corporation), modified polyphenylene ether resin (trade name “Noryl 640-111” from Japan GE Plastics Corporation), curing agent (diaminodiphenylmethane) and examples The cyclotriphosphazene derivative mixture obtained in any of 1 to 4 and Example 8-b (hereinafter referred to as “Evaluation Examples”) was mixed at the ratio shown in Table 1 to prepare an epoxy resin composition. (Samples 1 to 5). For comparison, a similar epoxy resin composition was prepared without adding the cyclotriphosphazene derivative mixture (Sample 6). Furthermore, for comparison, a similar epoxy resin composition was prepared using a trade name “KD-302S” (phosphazene flame retardant) of Chemipro Kasei Co., Ltd. instead of the cyclotriphosphazene derivative mixture obtained in the evaluation examples. (Sample 7).
上述のようにして得られた各エポキシ樹脂組成物を温度200℃、圧力3MPa、時間120分の硬化条件で板状に成形した。そして、得られた板状の成形物から0.2mm×125mm×13mmの試料を切出し、その難燃性とガラス転移点とを調べた。難燃性は、Underwriters Laboratoriesの“Test for Flammability of Plastics Materials−UL94”に従って平均値(AV)および最大値(MAX)を測定した。難燃性は、平均値(AV)が5秒以下であれば特に良好である。また、ガラス転移点は、セイコーインスツルメンツ株式会社製の粘弾性スペクトロメーター「DMS200」を用いて測定した。ガラス転移点は、180℃以上であれば良好であり、190℃以上であれば特に良好である。結果を表1に示す。 Each epoxy resin composition obtained as described above was molded into a plate shape under the curing conditions of a temperature of 200 ° C., a pressure of 3 MPa, and a time of 120 minutes. And the sample of 0.2 mm x 125 mm x 13 mm was cut out from the obtained plate-shaped molding, and the flame retardance and glass transition point were investigated. The flame retardancy was measured as an average value (AV) and a maximum value (MAX) according to “Test for Flammability of Plastics Materials—UL94” of Underwriters Laboratories. The flame retardancy is particularly good when the average value (AV) is 5 seconds or less. The glass transition point was measured using a viscoelastic spectrometer “DMS200” manufactured by Seiko Instruments Inc. The glass transition point is good if it is 180 ° C. or higher, and particularly good if it is 190 ° C. or higher. The results are shown in Table 1.
表1によると、評価実施例のシクロトリホスファゼン誘導体混合物を含む試料1〜5のエポキシ樹脂組成物からなる成形体は、シクロトリホスファゼン誘導体混合物を含まない試料6のエポキシ樹脂組成物からなる成形体に比べて難燃性が顕著に優れている。また、他のホスファゼン系難燃剤を用いた試料7と比較すると、試料1〜5の成形体は、ガラス転移点が大幅に低下していないことがわかる。 According to Table 1, the molded body made of the epoxy resin composition of Samples 1 to 5 containing the cyclotriphosphazene derivative mixture of the evaluation example is the molded body made of the epoxy resin composition of Sample 6 that does not contain the cyclotriphosphazene derivative mixture. The flame retardancy is significantly superior to Moreover, when compared with Sample 7 using other phosphazene-based flame retardants, it is found that the glass transition points of the molded bodies of Samples 1 to 5 are not significantly lowered.
Claims (9)
反応系から前記溶媒を除去し、反応生成物を溶融状態で反応させる工程と、
を含むシクロトリホスファゼン誘導体の製造方法。
Removing the solvent from the reaction system and reacting the reaction product in a molten state;
A process for producing a cyclotriphosphazene derivative comprising
反応系から前記溶媒を除去し、反応生成物を溶融状態で反応させる工程と、
を含むシクロトリホスファゼン誘導体の製造方法。
Removing the solvent from the reaction system and reacting the reaction product in a molten state;
A process for producing a cyclotriphosphazene derivative comprising
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2005258811A JP4635157B2 (en) | 2004-09-27 | 2005-09-07 | Method for producing cyclotriphosphazene derivative |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004279025 | 2004-09-27 | ||
| JP2005258811A JP4635157B2 (en) | 2004-09-27 | 2005-09-07 | Method for producing cyclotriphosphazene derivative |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2006117639A JP2006117639A (en) | 2006-05-11 |
| JP4635157B2 true JP4635157B2 (en) | 2011-02-16 |
Family
ID=36535865
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2005258811A Expired - Fee Related JP4635157B2 (en) | 2004-09-27 | 2005-09-07 | Method for producing cyclotriphosphazene derivative |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP4635157B2 (en) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103435653B (en) * | 2013-08-08 | 2015-12-02 | 清远市普塞呋磷化学有限公司 | A kind of preparation method of hexaphenoxycyclotriphosphazene |
| CN110759947A (en) * | 2019-11-07 | 2020-02-07 | 山东省海洋化工科学研究院 | Synthesis method of hexaphenoxycyclotriphosphazene |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH02502731A (en) * | 1988-06-23 | 1990-08-30 | アメリカ合衆国 | Method for producing isomers and intermediates of trisaryloxycyclotriphosphazene polymer precursor |
| JP2001192392A (en) * | 2000-01-11 | 2001-07-17 | Chemiprokasei Kaisha Ltd | Cyclic phosphazene compound, cyclic phosphazene mixed composition, phosphazene composition, flame-retardant comprising the composition as active ingredient and flame-retardant composition containing the flame- retardant |
Family Cites Families (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH11181429A (en) * | 1997-02-14 | 1999-07-06 | Otsuka Chem Co Ltd | Flame-retardant, flame-retardant resin composition and flame-retardant resin molded product |
-
2005
- 2005-09-07 JP JP2005258811A patent/JP4635157B2/en not_active Expired - Fee Related
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH02502731A (en) * | 1988-06-23 | 1990-08-30 | アメリカ合衆国 | Method for producing isomers and intermediates of trisaryloxycyclotriphosphazene polymer precursor |
| JP2001192392A (en) * | 2000-01-11 | 2001-07-17 | Chemiprokasei Kaisha Ltd | Cyclic phosphazene compound, cyclic phosphazene mixed composition, phosphazene composition, flame-retardant comprising the composition as active ingredient and flame-retardant composition containing the flame- retardant |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2006117639A (en) | 2006-05-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20180002261A1 (en) | Epoxy compound, method for producing the same, epoxy resin composition, and cured product thereof | |
| JP2009024167A (en) | Process for producing vinyl compound | |
| US8779162B2 (en) | Cyanate ester compounds and cured products thereof | |
| JP5662695B2 (en) | Novel diepoxy compounds | |
| WO2014185485A1 (en) | Method for producing biphenyl-skeleton-containing epoxy resin | |
| JP4635155B2 (en) | Method for producing cyclotriphosphazene derivative | |
| JP4635157B2 (en) | Method for producing cyclotriphosphazene derivative | |
| JP6138607B2 (en) | Epoxy resin and method for producing the epoxy resin | |
| JP4635156B2 (en) | Method for producing cyclotriphosphazene derivative | |
| JP2009107991A (en) | New hydroxymethyl-substituted or alkoxymethyl-substituted bisphenol compound | |
| JP6190256B2 (en) | Novel bis (hydroxyphenyl) benzoxazole compounds | |
| JPS6031516A (en) | Production of epoxy resin | |
| WO2011083537A1 (en) | Process for producing polyglycidyl ether | |
| JP6512970B2 (en) | Purification method of 6-hydroxy-2-naphthoic acid glycidyl ether ester | |
| JP4383180B2 (en) | Method for producing crystalline epoxy compound | |
| JP2000034345A (en) | Polyfunctional cyanic ester resin composition and cured product thereof | |
| US9249169B2 (en) | Process for the preparation of phosphonium sulfonates | |
| JP4336501B2 (en) | Novel 4,4 "-dialkoxyterphenyls | |
| JP3621996B2 (en) | Epoxy resin and method for producing the same | |
| JP4183131B2 (en) | Method for producing phosphonitrile ester | |
| JP6017363B2 (en) | Novel diepoxy compounds | |
| JP4141869B2 (en) | Curing accelerator | |
| KR20230052507A (en) | organic compounds containing 2-cyanoethyl group and preparing method thereof | |
| WO2003089442A1 (en) | A method of preparing phosphoric ester | |
| JP2015048325A (en) | Novel hydroxymethyl-substituted or alkoxymethyl-substituted trisphenol compound |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20080731 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20100311 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20100323 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100519 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20100928 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20101021 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20131203 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 4635157 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |