JP2020037569A - ホルボールエステルを含む組成物及びその使用法 - Google Patents
ホルボールエステルを含む組成物及びその使用法 Download PDFInfo
- Publication number
- JP2020037569A JP2020037569A JP2019202032A JP2019202032A JP2020037569A JP 2020037569 A JP2020037569 A JP 2020037569A JP 2019202032 A JP2019202032 A JP 2019202032A JP 2019202032 A JP2019202032 A JP 2019202032A JP 2020037569 A JP2020037569 A JP 2020037569A
- Authority
- JP
- Japan
- Prior art keywords
- phorbol
- tpa
- hiv
- treatment
- acetate
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Classifications
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N63/00—Biocides, pest repellants or attractants, or plant growth regulators containing microorganisms, viruses, microbial fungi, animals or substances produced by, or obtained from, microorganisms, viruses, microbial fungi or animals, e.g. enzymes or fermentates
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C69/00—Esters of carboxylic acids; Esters of carbonic or haloformic acids
- C07C69/02—Esters of acyclic saturated monocarboxylic acids having the carboxyl group bound to an acyclic carbon atom or to hydrogen
- C07C69/22—Esters of acyclic saturated monocarboxylic acids having the carboxyl group bound to an acyclic carbon atom or to hydrogen having three or more carbon atoms in the acid moiety
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/21—Esters, e.g. nitroglycerine, selenocyanates
- A61K31/215—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids
- A61K31/22—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids of acyclic acids, e.g. pravastatin
- A61K31/222—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids of acyclic acids, e.g. pravastatin with compounds having aromatic groups, e.g. dipivefrine, ibopamine
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N43/00—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds
- A01N43/34—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having rings with one nitrogen atom as the only ring hetero atom
- A01N43/46—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having rings with one nitrogen atom as the only ring hetero atom rings with more than six members
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/21—Esters, e.g. nitroglycerine, selenocyanates
- A61K31/215—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids
- A61K31/22—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids of acyclic acids, e.g. pravastatin
- A61K31/225—Polycarboxylic acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/21—Esters, e.g. nitroglycerine, selenocyanates
- A61K31/215—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids
- A61K31/22—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids of acyclic acids, e.g. pravastatin
- A61K31/23—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids of acyclic acids, e.g. pravastatin of acids having a carboxyl group bound to a chain of seven or more carbon atoms
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/55—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/56—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids
- A61K31/57—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids substituted in position 17 beta by a chain of two carbon atoms, e.g. pregnane or progesterone
- A61K31/573—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids substituted in position 17 beta by a chain of two carbon atoms, e.g. pregnane or progesterone substituted in position 21, e.g. cortisone, dexamethasone, prednisone or aldosterone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/60—Salicylic acid; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/60—Salicylic acid; Derivatives thereof
- A61K31/606—Salicylic acid; Derivatives thereof having amino groups
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/60—Salicylic acid; Derivatives thereof
- A61K31/618—Salicylic acid; Derivatives thereof having the carboxyl group in position 1 esterified, e.g. salsalate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C69/00—Esters of carboxylic acids; Esters of carbonic or haloformic acids
- C07C69/013—Esters of alcohols having the esterified hydroxy group bound to a carbon atom of a ring other than a six-membered aromatic ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C69/00—Esters of carboxylic acids; Esters of carbonic or haloformic acids
- C07C69/02—Esters of acyclic saturated monocarboxylic acids having the carboxyl group bound to an acyclic carbon atom or to hydrogen
- C07C69/22—Esters of acyclic saturated monocarboxylic acids having the carboxyl group bound to an acyclic carbon atom or to hydrogen having three or more carbon atoms in the acid moiety
- C07C69/33—Esters of acyclic saturated monocarboxylic acids having the carboxyl group bound to an acyclic carbon atom or to hydrogen having three or more carbon atoms in the acid moiety esterified with hydroxy compounds having more than three hydroxy groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2603/00—Systems containing at least three condensed rings
- C07C2603/02—Ortho- or ortho- and peri-condensed systems
- C07C2603/40—Ortho- or ortho- and peri-condensed systems containing four condensed rings
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Organic Chemistry (AREA)
- Emergency Medicine (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Virology (AREA)
- Oncology (AREA)
- Zoology (AREA)
- Engineering & Computer Science (AREA)
- Tropical Medicine & Parasitology (AREA)
- Hematology (AREA)
- Communicable Diseases (AREA)
- Molecular Biology (AREA)
- AIDS & HIV (AREA)
- Pest Control & Pesticides (AREA)
- Dentistry (AREA)
- Plant Pathology (AREA)
- Wood Science & Technology (AREA)
- Agronomy & Crop Science (AREA)
- Environmental Sciences (AREA)
- Microbiology (AREA)
- Biotechnology (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
Abstract
Description
腫瘍性疾患の治療における有効性は、ECOG機能状態尺度、カルノフスキー病態指数、血球の顕微鏡検査、骨髄穿刺及び生検、細胞遺伝学的解析、組織検査、免疫表現型検査、血液化学検査、全血球計算、リンパ節生検、末梢血塗抹標本、腫瘍または病変の目視検査、或いは当業者の知るところであるその他の悪性腫瘍及び腫瘍進行の評価及び(または)診断法など(ただしこれらに限らない)、数々の方法によって示される。
S180細胞を接種したマウスにおける末梢血白血球(WBC)及びヘモグロビン(Hb)数に対するTPAの効果:
サルコーマ180(S180)細胞をKwen−Mingマウスに接種した。3日目、マウスにTPAを50、100または200μg/kg/日で7日間腹腔内(i.p.)投与した。治療完了後2日目に処置したマウスの尾から血液試料を採取してWBC及びHb分析を行った。処置群(50、100、200μg/kg/日、7日間)のWBC数はそれぞれ16.1±7.4、18.7±3.0、20.7±3.4×109/Lであった。対照群のWBC数は、13.6±1.8×109/Lであった。処置群のHbは、136±11、149±12、149±10g/Lであり、対照群のHbは134±15g/Lであった。この結果はTPAのi.p.接種がマウスにおける末梢血WBC数を用量依存的に増加させる一方で、TPA処置マウスのHbレベルは対照マウスに比べ大きな影響を受けなかったことを示す。
投与量決定試験
TPAの塗布による強い局所刺激のため、TPAは患者に静脈内点滴(i.v.)で投与された。滅菌注射筒に入れたTPA溶液を無菌食塩水200mlに注入し、i.v.輸液によく混合した。
(1)1mg/患者/週のTPA投与:
溶液中のTPA 1mgが静脈内点滴向けに無菌食塩水200mlとよく混合され、静脈内点滴は16μg/分の速度で1時間内に終了した。TPA投与の1時間後、患者は悪寒を感じ始め、悪寒が約30分間持続した後に発熱が起こり(患者の体温は37.5〜39.5度に達し、3〜5時間持続した後、平常に戻った)、軽度から重度の発汗があった。上記の症状は患者にグルココルチコイドを投与することで軽減された。この用量のTPAは少数の患者に出血を引き起こし、数人の患者に短時間の呼吸困難が見られ、かつHbが尿中に検出された。しかし、これら副作用は短時間かつ可逆性であった。心臓機能、肝機能、腎機能、肺機能はすべて正常であった。
溶液中のTPA 0.5mgが静脈内点滴向けに生理食塩水200mlとよく混合され、静脈内点滴は8μg/分の速度で1時間内に終了した。投与後の反応はTPA用量1mgの場合と類似していたが、1mgの投与量よりも軽度であった。患者は少ない用量の方が容易に耐えることができた。時折、Hbが患者の尿中に検出された。呼吸困難は認められなかった。心臓機能、肝機能、腎機能、肺機能はすべて正常であった。
溶液中のTPA 0.25mgが静脈内点滴向けに生理食塩水200mlとよく混合され、静脈内点滴は4μg/分の速度で1時間内に終了した。投与後、悪寒や発熱などの症状はやはり認められたが、より高い投与量よりもずっと軽度であった。尿中にHbは検出されず、呼吸困難を生じた患者はいなかった。心臓機能、肝機能、腎機能、肺機能はすべて正常であった。
TPA治療を受けたHIV+患者の第1の臨床試験
1995年に輸血によってHIV感染し、HIVの標準治療では難治性の症状のある35〜52歳の患者12人(男性5人、女性7人)がTPA治療を受けた。無菌食塩水200ml中の体重補正用量のTPA(75μg/m2)が1時間にわたるi.v.により各患者に投与された。この投与量が治療の最初の3日間1日1回投与された。その後、この投与量が4日目から18日目まで1日おきに各患者に投与され、6ヶ月間の休息期間を経て、同一プロトコルに従い2回目の治療が行われた。
TPA治療を受けたHIV+患者の第2の臨床試験
実施例3の患者9人がTPAの第2の治療を受けた。これらの9人のうち7人が第2の試験の開始時に無症状であった。症状があり、以前にTPAの治療を受けていない10人目の患者(患者番号2a)がこの試験に加えられた。各患者には無菌食塩水200ml中の体重補正用量のTPA(75μg/m2)が静脈注射で1時間にわたり投与された。この投与量が1日1回、10日間連続して各患者に投与され、10日間の休息期間を挟んで3サイクル、合計30回TPAが投与された。患者5a、6a、8aはTPA治療開始から1ヶ月前に抗AIDS薬の摂取を停止し、3回目のサイクルの1ヶ月後に再度摂取を開始した。患者1〜4a、7a、及び9a〜10aは治療中も抗AIDS薬の摂取を継続した。
TPA治療を受けたHIV+患者の第3の臨床試験
男性2人、女性4人、37〜52歳の6人の患者(患者番号13〜18)がTPAの治療を受けた。これらの患者のうち4人が抗HIV薬と組み合わせて前の2回の臨床試験でTPA治療を受けた。残る2人の患者はTPA治療を受けたことはないが、以前に抗HIV薬レジメンを受けていた。第3の臨床試験開始の3日前にすべての治療が停止され、TPA治療の終了から60日後まで再開されなかった。標準HIV治療の再開は地域の保健機関によって要求された。
ケーススタディ
実施例3、4、5のプロトコルに従ってTPAで治療を受けた、最初に症状のあったAIDS患者の治療結果である。複数の試験に参加した患者は2つ以上の患者番号で識別されている場合がある。すべての患者識別番号は表1〜7の患者番号に対応する。
3回目のTPA治療サイクル後、発熱と下痢の問題はなくなった。CD3、CD4、CD8数、及びWBCとHIV量も上向きの傾向を示した。この患者の身体状態及び精神状態は正常に戻り、仕事ができるようになった。
TPAの6回目の投与の後、皮膚カンジダ症がなくなり始め、TPA治療の終了時には眩暈、頭痛、発熱、皮膚カンジダ症が改善され、徐々に消失した。食欲、体調、うつ状態が改善され、仕事に戻ることができた。
6ヵ月後、この患者は軽い下痢と眩暈を再発したため、再度TPAによる治療を受けた。TPA投与に伴い、2〜6時間持続する37.5〜38度に達する発熱が6回あった。8回目の投与から投与量を約150μgから250μgのTPAに増加した。副作用は起きなかった。TPA治療の終了時、症状は消失していた。この患者の体調は正常に戻り、仕事と通常の生活に戻った。この患者は1年間無症状であり、風邪もほとんど引いていない。CD3、4、8レベルに変化はなかったが、HIV量が増加した。
TPAによる再発性/難治性悪性腫瘍の治療
組織学的に診断された再発性/難治性血液悪性腫瘍/骨髄疾患を有する患者が、TPA(Xichuan Pharmaceuticals、中国河南省南陽)、デキサメタゾン、コリンマグネシウムトリサリチラートの組み合わせによる治療を受けた。急性骨髄性白血病(AML)の治療におけるTPAの治療上の使用を実証するための、以下で説明する比較方法が、その他の腫瘍性疾患及び悪性腫瘍の治療のためのTPA使用を実証するために適用される。本発明の方法及び組成物を用いた治療に適するその他の腫瘍性疾患と悪性疾患には、血液及び骨の悪性腫瘍及び多様な種類の固形腫瘍を含む癌のさまざまな形態が含まれる。ここで説明する特定のプロトコルに加え、治療の成功及び(または)寛解は、標的とするさまざまな腫瘍性及び悪性疾患について、幅広い既知の癌検出法及び評価法のいずれかを用いて判定される。例えば、固形腫瘍の大きさの縮小の判別、腫瘍の成長、段階、転移能、組織学的癌マーカーの存在/発現量などを評価する組織病理学的試験によって行われる。
ERK活性調節の測定
白血病の患者及びリンパ腫/固形腫瘍患者の末梢血単核細胞中の循環悪性細胞におけるリン酸化ERKレベルを測定する。実施例7のプロトコルに従って治療を受ける患者から、TPA投与の前及び後に血液試料を採取する。
NF−κB調節の測定
先の試験で、デキサメタゾン及びTPAの投与の後、患者においてNF−κB活性が調節されることを示した。加えて、デキサメタゾンがMKP‐1ERKホスファターゼ発現を誘導し、TPA細胞毒性を高めることが示された。次の試験は、TPA+デキサメタゾンによる治療を受けた患者においてNF−κB活性が治療上どのように調節されるかをさらに解明する。
白血病遺伝子発現における変化の判定
TPAは、生存促進ERK経路シグナリングを終結可能ないくつかの二重特異性ホスファターゼのRNA濃度を誘導する。リアルタイムRT−PCR及びオリゴヌクレオチドマイクロアレイ分析を使い、MAPK特異的DUSPなどのAMLシグナリング成分のRNA発現を調査するため、実施例7に従ってTPAによる治療を受けたAML患者からの投与前及び後に採取された血液試料を使用した。
(付記1)
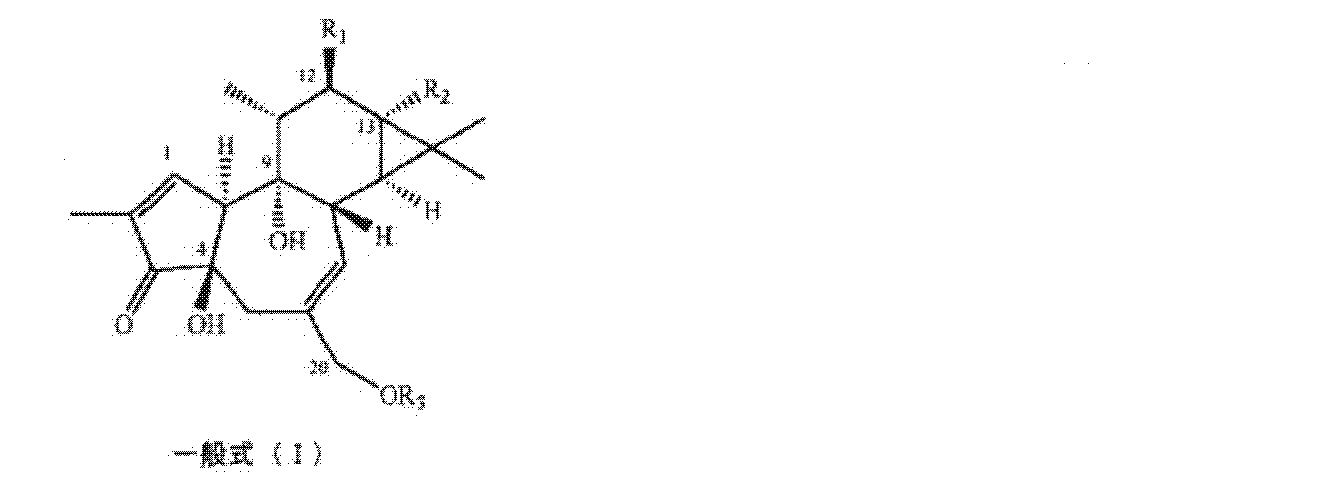
哺乳類被験体におけるHIV感染または疾患を抑制または治療する方法であって、一般式(I)のホルボールエステルまたは誘導体、或いはそれらの薬学的に許容される塩、異性体、鏡像体、溶媒和化合物、水和物、多形体、またはプロドラッグの有効量の前記被験体への投与を含むことを特徴とする方法。
(付記3)
付記1に記載の方法において、前記ホルボールエステルが、ホルボール13‐ブチレート、ホルボール12‐デカノエート、ホルボール13‐デカノエート、ホルボール12,13‐ジアセタート、ホルボール13,20‐ジアセタート、ホルボール12,13‐ジベンゾアート、ホルボール12,13‐ジブチレート、ホルボール12,13‐ジデカノエート、ホルボール12,13‐ジヘキサノエート、ホルボール12,13‐ジプロピオネート、ホルボール12‐ミリステート、ホルボール13‐ミリステート、ホルボール12,13,20‐トリアセタート、12‐デオキシホルボール13‐アンゲレート、12‐デオキシホルボール13‐アンゲレート20‐アセタート、12‐デオキシホルボール13‐イソブチレート、12‐デオキシホルボール13‐イソブチレート20‐アセタート、12‐デオキシホルボール13‐フェニルアセタート、12‐デオキシホルボール13‐フェニルアセタート20‐アセタート、12‐デオキシホルボール13‐テトラデカノエート、ホルボール12‐チグリエート13‐デカノエート、12‐デオキシホルボール13‐アセタート、ホルボール12‐アセタート、またはホルボール13‐アセタートであることを特徴とする方法。
(付記4)
付記1に記載の方法において、前記ホルボールエステルが12‐O‐テトラデカノイルホルボール‐13‐アセタートであることを特徴とする方法。
(付記5)
付記1に記載の方法において、さらに前記被験体におけるHIVを治療または抑制するための、前記一般式(I)のホルボールエステルまたは誘導体化合物との組み合わせ処方または併用治療レジメンで有効な、少なくとも1つの二次的抗レトロウイルス性またはその他の補助的治療剤の投与を含むことを特徴とする方法。
(付記6)
付記5に記載の方法において、前記少なくとも1つの二次的抗レトロウイルス性またはその他の補助的治療剤が、前記ホルボールエステルの前記被験体に対する投与と同時に、またはその前に、或いはその後に組み合わせて投与するプロトコルで前記被験体に投与されることを特徴とする方法。
(付記7)
付記5に記載の方法において、前記少なくとも1つの二次的抗レトロウイルス性またはその他の補助的治療剤が、プロテアーゼ阻害剤、核酸系逆転写酵素阻害剤、非核酸系逆転写酵素阻害剤、合剤、エントリー及び融合阻害剤、アシクロビル、アデホビルジピボキシル、アルデスロイキン、アムホテリシンb、アジスロマイシン、カルシウムハイドロキシアパタイト、クラリスロマイシン、ドキソルビシン、ドロナビノール、エンテカビル、エポエチンアルファ、エトポシド、フルコナゾール、ガンシクロビル、免疫グロブリン、インターフェロンα2、イソニアジド、イトラコナゾール、メゲストロール、パクリタキセル、PEGインターフェロンα2、ペンタミジン、ポリL−乳酸、リバビリン、リファブチン、リファンピン、ソマトロピン、テストステロン、トリメトレキサート、バルガンシクロビル;インテグラーゼ阻害剤、殺菌剤、及びIL−2からなるグループから選択されることを特徴とする方法。
(付記8)
付記1に記載の方法において、前記有効量が、隔日で約10〜1500μgの前記一般式(I)のホルボールエステルまたは誘導体化合物を含むことを特徴とする方法。
(付記9)
付記1に記載の方法において、前記有効量が、隔日で約150〜500μgの前記一般式(I)のホルボールエステルまたは誘導体化合物を含むことを特徴とする方法。
(付記10)
付記1に記載の方法において、前記一般式(I)の前記ホルボールエステル化合物または誘導体化合物の前記有効量が、一日一回投与されることを特徴とする方法。
(付記11)
哺乳類被験体におけるHIV感染またはAIDSの1つ以上の症状または疾患を抑制または治療する方法であって、一般式(I)のホルボールエステルまたは誘導体化合物、或いはそれらの薬学的に許容される塩、異性体、鏡像体、溶媒和化合物、水和物、多形体、またはプロドラッグの有効量の前記被験体への投与を含むことを特徴とする方法。
(付記13)
付記11に記載の方法において、前記ホルボールエステルが、ホルボール13‐ブチレート、ホルボール12‐デカノエート、ホルボール13‐デカノエート、ホルボール12,13‐ジアセタート、ホルボール13,20‐ジアセタート、ホルボール12,13‐ジベンゾアート、ホルボール12,13‐ジブチレート、ホルボール12,13‐ジデカノエート、ホルボール12,13‐ジヘキサノエート、ホルボール12,13‐ジプロピオネート、ホルボール12‐ミリステート、ホルボール13‐ミリステート、ホルボール12,13,20‐トリアセタート、12‐デオキシホルボール13‐アンゲレート、12‐デオキシホルボール13‐アンゲレート20‐アセタート、12‐デオキシホルボール13‐イソブチレート、12‐デオキシホルボール13‐イソブチレート20‐アセタート、12‐デオキシホルボール13‐フェニルアセタート、12‐デオキシホルボール13‐フェニルアセタート20‐アセタート、12‐デオキシホルボール13‐テトラデカノエート、ホルボール12‐チグリエート13‐デカノエート、12‐デオキシホルボール13‐アセタート、ホルボール12‐アセタート、またはホルボール13‐アセタートであることを特徴とする方法。
(付記14)
付記11に記載の方法において、前記ホルボールエステルが、12‐O‐テトラデカノイルホルボール‐13‐アセタートであることを特徴とする方法。
(付記15)
付記11に記載の方法において、さらに前記被験体におけるAIDSの症状または疾患を治療するための、前記一般式(I)のホルボールエステルまたは誘導体化合物との組み合わせ処方または併用治療レジメンで有効な、少なくとも1つの二次的抗レトロウイルス性またはその他の補助的治療剤の投与を含むことを特徴とする方法。
(付記16)
付記11に記載の方法において、前記少なくとも1つの二次的抗レトロウイルス性またはその他の補助的治療剤が、前記ホルボールエステルの前記被験体に対する投与と同時に、またはその前に、或いはその後に組み合わせて投与するプロトコルで前記被験体に投与されることを特徴とする方法。
(付記17)
付記11に記載の方法において、前記少なくとも1つの二次的抗レトロウイルス性またはその他の補助的治療剤が、プロテアーゼ阻害剤、核酸系逆転写酵素阻害剤、非核酸系逆転写酵素阻害剤、合剤、エントリー及び融合阻害剤、アシクロビル、アデホビルジピボキシル、アルデスロイキン、アムホテリシンb、アジスロマイシン、カルシウムハイドロキシアパタイト、クラリスロマイシン、ドキソルビシン、ドロナビノール、エンテカビル、エポエチンアルファ、エトポシド、フルコナゾール、ガンシクロビル、免疫グロブリン、インターフェロンα2、イソニアジド、イトラコナゾール、メゲストロール、パクリタキセル、PEGインターフェロンα2、ペンタミジン、ポリL−乳酸、リバビリン、リファブチン、リファンピン、ソマトロピン、テストステロン、トリメトレキサート、バルガンシクロビル;インテグラーゼ阻害剤、殺菌剤、及びIL−2からなるグループから選択されることを特徴とする方法。
(付記18)
付記11に記載の方法において、前記1つ以上のAIDSの症状または疾患が、口腔病変、倦怠感、皮膚カンジダ症、発熱、食欲不振、下痢、アフタ性潰瘍、吸収不全、血小板減少症、体重減少、貧血及びリンパ節腫脹、トリ型結核菌複合体、サルモネラ症、梅毒、神経梅毒、結核症、細菌性血管腫症、アスペルギルス症、カンジダ症、コクシジオイデス症、リステリア症、骨盤感染症、バーキットリンパ腫、クリプトコックス髄膜炎、ヒストプラスマ症、カポジ肉腫、リンパ腫、全身性非ホジキンリンパ腫、中枢神経原発リンパ腫、クリプトスポリジウム症、イソスポーラ症、微胞子虫症、カリニ肺炎、トキソプラズマ症、サイトメガロウイルス、肝炎、単純ヘルペス、帯状疱疹、ヒトパピローマウイルス、伝染性軟属腫、口腔毛状白板症、及び進行性巣性白質脳症であることを特徴とする方法。
(付記19)
AIDSを抑制または防止するために哺乳類被験体におけるHIV感染をコントロールする方法であって、一般式(I)のホルボールエステルまたは誘導体化合物、或いはそれらの薬学的に許容される塩、異性体、鏡像体、溶媒和化合物、水和物、多形体、またはプロドラッグの有効量の前記被験体への投与を含むことを特徴とする方法。
(付記21)
付記19に記載の方法において、前記ホルボールエステルが、ホルボール13‐ブチレート、ホルボール12‐デカノエート、ホルボール13‐デカノエート、ホルボール12,13‐ジアセタート、ホルボール13,20‐ジアセタート、ホルボール12,13‐ジベンゾアート、ホルボール12,13‐ジブチレート、ホルボール12,13‐ジデカノエート、ホルボール12,13‐ジヘキサノエート、ホルボール12,13‐ジプロピオネート、ホルボール12‐ミリステート、ホルボール13‐ミリステート、ホルボール12,13,20‐トリアセタート、12‐デオキシホルボール13‐アンゲレート、12‐デオキシホルボール13‐アンゲレート20‐アセタート、12‐デオキシホルボール13‐イソブチレート、12‐デオキシホルボール13‐イソブチレート20‐アセタート、12‐デオキシホルボール13‐フェニルアセタート、12‐デオキシホルボール13‐フェニルアセタート20‐アセタート、12‐デオキシホルボール13‐テトラデカノエート、ホルボール12‐チグリエート13‐デカノエート、12‐デオキシホルボール13‐アセタート、ホルボール12‐アセタート、またはホルボール13‐アセタートであることを特徴とする方法。
(付記22)
付記19に記載の方法において、前記ホルボールエステルが12‐O‐テトラデカノイルホルボール13‐アセタートであることを特徴とする方法。
(付記23)
哺乳類被験体におけるHIVを抑制または軽減するための組成物であって、一般式(I)のホルボールエステルまたは誘導体化合物、或いはそれらの薬学的に許容される塩、異性体、鏡像体、溶媒和化合物、水和物、多形体、またはプロドラッグの有効量を含むことを特徴とする組成物。
(付記25)
付記23に記載の組成物において、前記ホルボールエステルが、ホルボール13‐ブチレート、ホルボール12‐デカノエート、ホルボール13‐デカノエート、ホルボール12,13‐ジアセタート、ホルボール13,20‐ジアセタート、ホルボール12,13‐ジベンゾアート、ホルボール12,13‐ジブチレート、ホルボール12,13‐ジデカノエート、ホルボール12,13‐ジヘキサノエート、ホルボール12,13‐ジプロピオネート、ホルボール12‐ミリステート、ホルボール13‐ミリステート、ホルボール12,13,20‐トリアセタート、12‐デオキシホルボール13‐アンゲレート、12‐デオキシホルボール13‐アンゲレート20‐アセタート、12‐デオキシホルボール13‐イソブチレート、12‐デオキシホルボール13‐イソブチレート20‐アセタート、12‐デオキシホルボール13‐フェニルアセタート、12‐デオキシホルボール13‐フェニルアセタート20‐アセタート、12‐デオキシホルボール13‐テトラデカノエート、ホルボール12‐チグリエート13‐デカノエート、12‐デオキシホルボール13‐アセタート、ホルボール12‐アセタート、またはホルボール13‐アセタートであることを特徴とする組成物。
(付記26)
付記23に記載の組成物において、前記ホルボールエステルが12‐O‐テトラデカノイルホルボール13‐アセタートであることを特徴とする組成物。
(付記27)
付記23に記載の組成物において、さらに前記一般式(I)のホルボールエステルまたは誘導体化合物との組み合わせ処方で有効な、少なくとも1つの二次的または補助的治療剤を含むことを特徴とする組成物。
(付記28)
付記23に記載の組成物において、前記少なくとも1つの二次的または補助的治療剤が、プロテアーゼ阻害剤、核酸系逆転写酵素阻害剤、非核酸系逆転写酵素阻害剤、合剤、エントリー及び融合阻害剤、アシクロビル、アデホビルジピボキシル、アルデスロイキン、アムホテリシンb、アジスロマイシン、カルシウムハイドロキシアパタイト、クラリスロマイシン、ドキソルビシン、ドロナビノール、エンテカビル、エポエチンアルファ、エトポシド、フルコナゾール、ガンシクロビル、免疫グロブリン、インターフェロンα2、イソニアジド、イトラコナゾール、メゲストロール、パクリタキセル、PEGインターフェロンα2、ペンタミジン、ポリL−乳酸、リバビリン、リファブチン、リファンピン、ソマトロピン、テストステロン、トリメトレキサート、バルガンシクロビル;インテグラーゼ阻害剤、殺菌剤、及びIL−2からなるグループから選択されることを特徴とする組成物。
(付記29)
HIVの潜伏宿主を活性化する方法であって、一般式(I)のホルボールエステルまたは誘導体化合物、或いはそれらの薬学的に許容される塩、異性体、鏡像体、溶媒和化合物、水和物、多形体、またはプロドラッグの有効量の前記被験体への投与を含むことを特徴とする方法。
(付記31)
付記29に記載の方法において、前記ホルボールエステルが、ホルボール13‐ブチレート、ホルボール12‐デカノエート、ホルボール13‐デカノエート、ホルボール12,13‐ジアセタート、ホルボール13,20‐ジアセタート、ホルボール12,13‐ジベンゾアート、ホルボール12,13‐ジブチレート、ホルボール12,13‐ジデカノエート、ホルボール12,13‐ジヘキサノエート、ホルボール12,13‐ジプロピオネート、ホルボール12‐ミリステート、ホルボール13‐ミリステート、ホルボール12,13,20‐トリアセタート、12‐デオキシホルボール13‐アンゲレート、12‐デオキシホルボール13‐アンゲレート20‐アセタート、12‐デオキシホルボール13‐イソブチレート、12‐デオキシホルボール13‐イソブチレート20‐アセタート、12‐デオキシホルボール13‐フェニルアセタート、12‐デオキシホルボール13‐フェニルアセタート20‐アセタート、12‐デオキシホルボール13‐テトラデカノエート、ホルボール12‐チグリエート13‐デカノエート、12‐デオキシホルボール13‐アセタート、ホルボール12‐アセタート、またはホルボール13‐アセタートであることを特徴とする方法。
(付記32)
付記29に記載の方法において、前記ホルボールエステルが12‐O‐テトラデカノイルホルボール13‐アセタートであることを特徴とする方法。
(付記33)
付記29に記載の方法において、さらに前記一般式(I)のホルボールエステルまたは関連の或いは誘導体化合物との組み合わせ処方または併用治療レジメンで有効な、二次的抗レトロウイルス性またはその他の補助的治療剤の投与を含むことを特徴とする方法。
(付記34)
付記33に記載の方法において、前記二次的抗レトロウイルス性またはその他の補助的治療剤が、前記ホルボールエステルの前記被験体に対する投与と同時に、またはその前に、或いはその後に組み合わせて投与するプロトコルで前記被験体に投与されることを特徴とする方法。
(付記35)
付記33に記載の方法において、前記二次的抗レトロウイルス性またはその他の補助的治療剤が、プロテアーゼ阻害剤、核酸系逆転写酵素阻害剤、非核酸系逆転写酵素阻害剤、合剤、エントリー及び融合阻害剤、アシクロビル、アデホビルジピボキシル、アルデスロイキン、アムホテリシンb、アジスロマイシン、カルシウムハイドロキシアパタイト、クラリスロマイシン、ドキソルビシン、ドロナビノール、エンテカビル、エポエチンアルファ、エトポシド、フルコナゾール、ガンシクロビル、免疫グロブリン、インターフェロンα2、イソニアジド、イトラコナゾール、メゲストロール、パクリタキセル、PEGインターフェロンα2、ペンタミジン、ポリL−乳酸、リバビリン、リファブチン、リファンピン、ソマトロピン、テストステロン、トリメトレキサート、バルガンシクロビル;インテグラーゼ阻害剤、殺菌剤、及びIL−2からなるグループから選択されることを特徴とする方法。
(付記36)
付記29に記載の方法において、前記有効量が、隔日で約10〜1500μgの前記一般式(I)のホルボールエステルまたは誘導体化合物を含むことを特徴とする方法。
(付記37)
付記29に記載の方法において、前記有効量が、隔日で約150〜500μgの前記一般式(I)のホルボールエステルまたは誘導体化合物を含むことを特徴とする方法。
(付記38)
付記29に記載の方法において、前記一般式(I)の前記ホルボールエステル化合物または誘導体化合物の前記有効量が、一日一回投与されることを特徴とする方法。
(付記39)
Th1サイトカインの発現を増加させる方法であって、一般式(I)のホルボールエステルまたは誘導体、或いはそれらの薬学的に許容される塩、異性体、鏡像体、溶媒和化合物、水和物、多形体、またはプロドラッグの有効量の前記被験体への投与を含むことを特徴とする方法。
(付記41)
付記39に記載の方法において、前記ホルボールエステルが、ホルボール13‐ブチレート、ホルボール12‐デカノエート、ホルボール13‐デカノエート、ホルボール12、13‐ジアセタート、ホルボール13、20‐ジアセタート、ホルボール12、13‐ジベンゾアート、ホルボール12、13‐ジブチレート、ホルボール12、13‐ジデカノエート、ホルボール12、13‐ジヘキサノエート、ホルボール12、13‐ジプロピオネート、ホルボール12‐ミリステート、ホルボール13‐ミリステート、ホルボール12、13、20‐トリアセタート、12‐デオキシホルボール13‐アンゲレート、12‐デオキシホルボール13‐アンゲレート20‐アセタート、12‐デオキシホルボール13‐イソブチレート、12‐デオキシホルボール13‐イソブチレート20‐アセタート、12‐デオキシホルボール13‐フェニルアセタート、12‐デオキシホルボール13‐フェニルアセタート20‐アセタート、12‐デオキシホルボール13‐テトラデカノエート、ホルボール12‐チグリエート13‐デカノエート、2‐デオキシホルボール13‐アセタート、ホルボール12‐アセタート、またはホルボール13‐アセタートであることを特徴とする方法。
(付記42)
付記39に記載の方法において、前記ホルボールエステルが、12‐O‐テトラデカノイルホルボール13‐アセタートであることを特徴とする方法。
(付記43)
付記39に記載の方法において、さらにTh1サイトカインを促進するための、前記一般式(I)のホルボールエステルまたは誘導体化合物との組み合わせ処方または併用治療レジメンで有効な二次的またはその他の補助的治療剤の投与を含むことを特徴とする方法。(付記44)
付記43に記載の方法において、前記二次的または補助的治療剤が、前記ホルボールエステルの前記被験体に対する投与と同時に、またはその前に、或いはその後に組み合わせて投与するプロトコルで前記被験体に投与されることを特徴とする方法。
(付記45)
付記43に記載の方法において、前記二次的または補助的治療剤が、プロテアーゼ阻害剤、核酸系逆転写酵素阻害剤、非核酸系逆転写酵素阻害剤、合剤、エントリー及び融合阻害剤、アシクロビル、アデホビルジピボキシル、アルデスロイキン、アムホテリシンb、アジスロマイシン、カルシウムハイドロキシアパタイト、クラリスロマイシン、ドキソルビシン、ドロナビノール、エンテカビル、エポエチンアルファ、エトポシド、フルコナゾール、ガンシクロビル、免疫グロブリン、インターフェロンα2、イソニアジド、イトラコナゾール、メゲストロール、パクリタキセル、PEGインターフェロンα2、ペンタミジン、ポリL−乳酸、リバビリン、リファブチン、リファンピン、ソマトロピン、テストステロン、トリメトレキサート、バルガンシクロビル;インテグラーゼ阻害剤、殺菌剤、及びIL−2からなるグループから選択されることを特徴とする方法。
(付記46)
付記39に記載の方法において、前記有効量が、隔日で約10〜1500μgの前記一般式(I)のホルボールエステルまたは誘導体化合物を含むことを特徴とする方法。
(付記47)
付記39に記載の方法において、前記有効量が、隔日で約150〜500μgの前記一般式(I)のホルボールエステルまたは誘導体化合物を含むことを特徴とする方法。
(付記48)
付記40に記載の方法において、前記一般式(I)の前記ホルボールエステル化合物または誘導体化合物の前記有効量が、一日一回投与されることを特徴とする方法。
(付記49)
哺乳類被験体における腫瘍を治療または抑制する方法であって、
一般式(I)のホルボールエステルまたは誘導体、或いはそれらの薬学的に許容される塩、異性体、鏡像体、溶媒和化合物、水和物、多形体、またはプロドラッグの有効量、及び
前記被験体における腫瘍を治療または抑制するための、前記一般式(I)のホルボールエステルまたは誘導体化合物との組み合わせ処方または併用治療レジメンで有効な、少なくとも1つの二次的または補助的治療剤
の前記被験体への投与を含むことを特徴とする方法。
(付記51)
付記49に記載の方法において、前記ホルボールエステルが、ホルボール13‐ブチレート、ホルボール12‐デカノエート、ホルボール13‐デカノエート、ホルボール12,13‐ジアセタート、ホルボール13,20‐ジアセタート、ホルボール12,13‐ジベンゾアート、ホルボール12,13‐ジブチレート、ホルボール12,13‐ジデカノエート、ホルボール12,13‐ジヘキサノエート、ホルボール12,13‐ジプロピオネート、ホルボール12‐ミリステート、ホルボール13‐ミリステート、ホルボール12,13,20‐トリアセタート、12‐デオキシホルボール13‐アンゲレート、12‐デオキシホルボール13‐アンゲレート20‐アセタート、12‐デオキシホルボール13‐イソブチレート、12‐デオキシホルボール13‐イソブチレート20‐アセタート、12‐デオキシホルボール13‐フェニルアセタート、12‐デオキシホルボール13‐フェニルアセタート20‐アセタート、12‐デオキシホルボール13‐テトラデカノエート、ホルボール12‐チグリエート13‐デカノエート、12‐デオキシホルボール13‐アセタート、ホルボール12‐アセタート、またはホルボール13‐アセタートであることを特徴とする方法。
(付記52)
付記49に記載の方法において、前記ホルボールエステルが12‐O‐テトラデカノイルホルボール13‐アセタートであることを特徴とする方法。
(付記53)
付記49に記載の方法において、前記少なくとも1つの二次的または補助的治療剤が、前記ホルボールエステルの前記被験体に対する投与と同時に、またはその前に、或いはその後に組み合わせて投与するプロトコルで前記被験体に投与されることを特徴とする方法。(付記54)
付記49に記載の腫瘍を治療または抑制する方法において、前記少なくとも1つの二次的または補助的治療剤が、ドキソルビシン、ビタミンD3、シタラビン、シトシンアラビノシド、ダウノルビシン、シクロホスファミド、ゲムツズマブオゾガマイシン、イダルビシン、メルカプトプリン、ミトキサントロン、チオグアニン、アルデスロイキン、アスパラギナーゼ、カルボプラチン、リン酸エトポシド、フルダラビン、メトトレキサート、エトポシド、デキサメタゾン、及びコリンマグネシウムトリサリチラートからなるグループから選択されることを特徴とする方法。
(付記55)
付記49に記載の方法において、2つの二次的または補助的治療薬が前記被験体に投与されることを特徴とする方法。
(付記56)
付記55に記載の方法において、前記2つの二次的または補助的治療薬が、デキサメタゾン及びコリンマグネシウムトリサリチラートであることを特徴とする方法。
(付記57)
付記49に記載の方法において、前記有効量が毎日約10〜1500μgの前記一般式(I)のホルボールエステルまたは誘導体化合物を含むことを特徴とする方法。
(付記58)
付記49に記載の方法において、前記有効量が毎日約150〜500μgの前記一般式(I)のホルボールエステルまたは誘導体化合物を含むことを特徴とする方法。
(付記59)
付記49に記載の方法において、前記腫瘍が、血液悪性腫瘍/骨髄疾患により引き起こされた腫瘍であることを特徴とする方法。
(付記60)
付記59に記載の方法において、前記血液悪性腫瘍/骨髄疾患が白血病であることを特徴とする方法。
(付記61)
付記60に記載の方法において、前記白血病が急性骨髄性白血病であることを特徴とする方法。
(付記62)
付記49に記載の方法において、前記腫瘍が固形腫瘍であることを特徴とする方法。
(付記63)
付記49に記載の方法において、前記腫瘍が再発性腫瘍であることを特徴とする方法。
(付記64)
付記49に記載の方法において、前記腫瘍が難治性であることを特徴とする方法。
(付記65)
哺乳類被験体における腫瘍性疾患の1つ以上の症状または疾患を抑制または治療する方法であって、
一般式(I)のホルボールエステルまたは誘導体化合物、或いはそれらの薬学的に許容される塩、異性体、鏡像体、溶媒和化合物、水和物、多形体、またはプロドラッグの有効量、及び
前記被験体における腫瘍性疾患の症状を治療または防止するための、前記一般式(I)のホルボールエステルまたは誘導体化合物との組み合わせ処方または併用治療レジメンで有効な、少なくとも1つの二次的または補助的治療剤
の前記被験体への投与を含むことを特徴とする方法。
(付記67)
付記65に記載の方法において、前記ホルボールエステルが、ホルボール13‐ブチレート、ホルボール12‐デカノエート、ホルボール13‐デカノエート、ホルボール12,13‐ジアセタート、ホルボール13,20‐ジアセタート、ホルボール12,13‐ジベンゾアート、ホルボール12,13‐ジブチレート、ホルボール12,13‐ジデカノエート、ホルボール12,13‐ジヘキサノエート、ホルボール12,13‐ジプロピオネート、ホルボール12‐ミリステート、ホルボール13‐ミリステート、ホルボール12,13,20‐トリアセタート、12‐デオキシホルボール13‐アンゲレート、12‐デオキシホルボール13‐アンゲレート20‐アセタート、12‐デオキシホルボール13‐イソブチレート、12‐デオキシホルボール13‐イソブチレート20‐アセタート、12‐デオキシホルボール13‐フェニルアセタート、12‐デオキシホルボール13‐フェニルアセタート20‐アセタート、12‐デオキシホルボール13‐テトラデカノエート、ホルボール12‐チグリエート13‐デカノエート、12‐デオキシホルボール13‐アセタート、ホルボール12‐アセタート、またはホルボール13‐アセタートであることを特徴とする方法。
(付記68)
付記65に記載の方法において、前記ホルボールエステルが12‐O‐テトラデカノイルホルボール‐13‐アセタートであることを特徴とする方法。
(付記69)
付記68に記載の方法において、前記少なくとも1つの二次的または補助的治療剤が、前記ホルボールエステルの前記被験体に対する投与と同時に、またはその前に、或いはその後に組み合わせて投与するプロトコルで前記被験体に投与されることを特徴とする方法。(付記70)
付記68に記載の方法において、前記少なくとも1つの二次的または補助的治療剤が、ドキソルビシン、ビタミンD3、シタラビン、シトシンアラビノシド、ダウノルビシン、シクロホスファミド、ゲムツズマブオゾガマイシン、イダルビシン、メルカプトプリン、ミトキサントロン、チオグアニン、アルデスロイキン、アスパラギナーゼ、カルボプラチン、リン酸エトポシド、フルダラビン、メトトレキサート、エトポシド、デキサメタゾン、及びコリンマグネシウムトリサリチラートからなるグループから選択されることを特徴とする方法。
(付記71)
付記68に記載の方法において、前記腫瘍性疾患の1つ以上の症状または疾患が、貧血、慢性疲労、過度または容易な出血、打ち身、息切れ、点状出血、回帰熱、歯茎の腫れ、治りが遅い切り傷、骨と関節の不快感、反復性感染、体重減少、かゆみ、寝汗、リンパ節腫脹、発熱、腹痛と腹部の不快感、視覚障害、咳、食欲不振、胸の痛み、嚥下困難、腫れ、頻尿、排尿開始時の障害、失禁、尿の流れが弱いまたは止まったり出たりする、排尿時の痛みまたは灼熱感、勃起障害、射精時の疼痛、血尿または精液中の出血、頻繁な痛みまたはコリ、または虚弱であることを特徴とする方法。
(付記72)
腫瘍性疾患を有する哺乳類被験体において寛解を誘導する方法であって、
一般式(I)のホルボールエステルまたは誘導体化合物、或いはそれらの薬学的に許容される塩、異性体、鏡像体、溶媒和化合物、水和物、多形体、またはプロドラッグの有効量、及び
前記被験体における寛解を誘導するための、前記一般式(I)のホルボールエステルまたは誘導体化合物との組み合わせ処方または併用治療レジメンで有効な、少なくとも1つの二次的または補助的治療剤の投与を含むことを特徴とする方法。
(付記74)
付記72に記載の方法において、前記ホルボールエステルが、ホルボール13‐ブチレート、ホルボール12‐デカノエート、ホルボール13‐デカノエート、ホルボール12,13‐ジアセタート、ホルボール13,20‐ジアセタート、ホルボール12,13‐ジベンゾアート、ホルボール12,13‐ジブチレート、ホルボール12,13‐ジデカノエート、ホルボール12,13‐ジヘキサノエート、ホルボール12,13‐ジプロピオネート、ホルボール12‐ミリステート、ホルボール13‐ミリステート、ホルボール12,13,20‐トリアセタート、12‐デオキシホルボール13‐アンゲレート、12‐デオキシホルボール13‐アンゲレート20‐アセタート、12‐デオキシホルボール13‐イソブチレート、12‐デオキシホルボール13‐イソブチレート20‐アセタート、12‐デオキシホルボール13‐フェニルアセタート、12‐デオキシホルボール13‐フェニルアセタート20‐アセタート、12‐デオキシホルボール13‐テトラデカノエート、ホルボール12‐チグリエート13‐デカノエート、12‐デオキシホルボール13‐アセタート、ホルボール12‐アセタート、またはホルボール13‐アセタートであることを特徴とする方法。
(付記75)
付記72に記載の方法において、前記ホルボールエステルが12‐O‐テトラデカノイルホルボール13‐アセタートであることを特徴とする方法。
(付記76)
付記72に記載の方法において、前記少なくとも1つの二次的または補助的治療剤が、前記ホルボールエステルの前記被験体に対する投与と同時に、またはその前に、或いはその後に組み合わせて投与するプロトコルで前記被験体に投与されることを特徴とする方法。(付記77)
付記72に記載の方法において、前記少なくとも1つの二次的または補助的治療剤が、ドキソルビシン、ビタミンD3、シタラビン、シトシンアラビノシド、ダウノルビシン、シクロホスファミド、ゲムツズマブオゾガマイシン、イダルビシン、メルカプトプリン、ミトキサントロン、チオグアニン、アルデスロイキン、アスパラギナーゼ、カルボプラチン、リン酸エトポシド、フルダラビン、メトトレキサート、エトポシド、デキサメタゾン、及びコリンマグネシウムトリサリチラートからなるグループから選択されることを特徴とする方法。
(付記78)
腫瘍性疾患を有する哺乳類被験体において腫瘍のアポトーシスを誘導する方法であって、 一般式(I)のホルボールエステルまたは誘導体化合物、或いはそれらの薬学的に許容される塩、異性体、鏡像体、溶媒和化合物、水和物、多形体、またはプロドラッグの有効量、及び
前記被験体におけるアポトーシスを誘導するための、前記一般式(I)のホルボールエステルまたは誘導体化合物との組み合わせ処方または併用治療レジメンで有効な、少なくとも1つの二次的または補助的治療剤
の前記被験体への投与を含むことを特徴とする方法。
(付記80)
付記78に記載の方法において、前記ホルボールエステルが、ホルボール13‐ブチレート、ホルボール12‐デカノエート、ホルボール13‐デカノエート、ホルボール12,13‐ジアセタート、ホルボール13,20‐ジアセタート、ホルボール12,13‐ジベンゾアート、ホルボール12,13‐ジブチレート、ホルボール12,13‐ジデカノエート、ホルボール12,13‐ジヘキサノエート、ホルボール12,13‐ジプロピオネート、ホルボール12‐ミリステート、ホルボール13‐ミリステート、ホルボール12,13,20‐トリアセタート、12‐デオキシホルボール13‐アンゲレート、12‐デオキシホルボール13‐アンゲレート20‐アセタート、12‐デオキシホルボール13‐イソブチレート、12‐デオキシホルボール13‐イソブチレート20‐アセタート、12‐デオキシホルボール13‐フェニルアセタート、12‐デオキシホルボール13‐フェニルアセタート20‐アセタート、12‐デオキシホルボール13‐テトラデカノエート、ホルボール12‐チグリエート13‐デカノエート、12‐デオキシホルボール13‐アセタート、ホルボール12‐アセタート、またはホルボール13‐アセタートであることを特徴とする方法。
(付記81)
付記78に記載の方法において、前記ホルボールエステルが12‐O‐テトラデカノイルホルボール‐13‐アセタートであることを特徴とする方法。
(付記82)
付記78に記載の方法において、前記少なくとも1つの二次的または補助的治療剤が、前記ホルボールエステルの前記被験体に対する投与と同時に、またはその前に、或いはその後に組み合わせて投与するプロトコルで前記被験体に投与されることを特徴とする方法。(付記83)
付記82に記載の方法において、前記少なくとも1つの二次的または補助的治療剤が、ドキソルビシン、ビタミンD3、シタラビン、シトシンアラビノシド、ダウノルビシン、シクロホスファミド、ゲムツズマブオゾガマイシン、イダルビシン、メルカプトプリン、ミトキサントロン、チオグアニン、アルデスロイキン、アスパラギナーゼ、カルボプラチン、リン酸エトポシド、フルダラビン、メトトレキサート、エトポシド、デキサメタゾン、及びコリンマグネシウムトリサリチラートからなるグループから選択されることを特徴とする方法。
(付記84)
哺乳類被験体における腫瘍性疾患の抑制または治療に用いる組成物であって、
一般式(I)のホルボールエステルまたは誘導体化合物、或いはそれらの薬学的に許容される塩、異性体、鏡像体、溶媒和化合物、水和物、多形体、またはプロドラッグの有効量、及び
被験体における腫瘍の治療または抑制のための、前記一般式(I)のホルボールエステルまたは誘導体化合物との組み合わせ処方で有効な、少なくとも1つの二次的または補助的治療剤を含むことを特徴とする組成物。
(付記86)
付記84に記載の組成物において、前記ホルボールエステルが、ホルボール13‐ブチレート、ホルボール12‐デカノエート、ホルボール13‐デカノエート、ホルボール12,13‐ジアセタート、ホルボール13,20‐ジアセタート、ホルボール12,13‐ジベンゾアート、ホルボール12,13‐ジブチレート、ホルボール12,13‐ジデカノエート、ホルボール12,13‐ジヘキサノエート、ホルボール12,13‐ジプロピオネート、ホルボール12‐ミリステート、ホルボール13‐ミリステート、ホルボール12,13,20‐トリアセタート、12‐デオキシホルボール13‐アンゲレート、12‐デオキシホルボール13‐アンゲレート20‐アセタート、12‐デオキシホルボール13‐イソブチレート、12‐デオキシホルボール13‐イソブチレート20‐アセタート、12‐デオキシホルボール13‐フェニルアセタート、12‐デオキシホルボール13‐フェニルアセタート20‐アセタート、12‐デオキシホルボール13‐テトラデカノエート、ホルボール12‐チグリエート13‐デカノエート、12‐デオキシホルボール13‐アセタート、ホルボール12‐アセタート、またはホルボール13‐アセタートである組成物。
(付記87)
付記84に記載の組成物において、前記ホルボールエステルが12‐O‐テトラデカノイルホルボール13‐アセタートであることを特徴とする組成物。
(付記88)
付記84に記載の組成物において、前記少なくとも1つの二次的または補助的治療剤が、ドキソルビシン、ビタミンD3、シタラビン、シトシンアラビノシド、ダウノルビシン、シクロホスファミド、ゲムツズマブオゾガマイシン、イダルビシン、メルカプトプリン、ミトキサントロン、チオグアニン、アルデスロイキン、アスパラギナーゼ、カルボプラチン、リン酸エトポシド、フルダラビン、メトトレキサート、エトポシド、デキサメタゾン、及びコリンマグネシウムトリサリチラートからなるグループから選択されることを特徴とする組成物。
(付記89)
付記84に記載の組成物において、前記組成物が少なくとも2つの二次的または補助的治療薬を含むことを特徴とする組成物。
(付記90)
付記89に記載の組成物において、前記少なくとも2つの二次的または補助的治療薬が、デキサメタゾン及びコリンマグネシウムトリサリチラートであることを特徴とする組成物。
(付記91)
有効量が投与された場合に、哺乳類被験体においてHIV感染またはHIV感染により引き起こされる疾患を抑制または治療する薬剤を製造するための一般式(I)のホルボールエステルまたは誘導体、或いはそれらの薬学的に許容される塩、異性体、鏡像体、溶媒和化合物、水和物、多形体、またはプロドラッグの使用方法。
(付記93)
付記91に記載の方法において、前記ホルボールエステルが、ホルボール13‐ブチレート、ホルボール12‐デカノエート、ホルボール13‐デカノエート、ホルボール12,13‐ジアセタート、ホルボール13,20‐ジアセタート、ホルボール12,13‐ジベンゾアート、ホルボール12,13‐ジブチレート、ホルボール12,13‐ジデカノエート、ホルボール12,13‐ジヘキサノエート、ホルボール12,13‐ジプロピオネート、ホルボール12‐ミリステート、12‐O‐テトラデカノイルホルボール‐13‐アセタート、ホルボール13‐ミリステート、ホルボール12,13,20‐トリアセタート、12‐デオキシホルボール13‐アンゲレート、12‐デオキシホルボール13‐アンゲレート20‐アセタート、12‐デオキシホルボール13‐イソブチレート、12‐デオキシホルボール13‐イソブチレート20‐アセタート、12‐デオキシホルボール13‐フェニルアセタート、12‐デオキシホルボール13‐フェニルアセタート20‐アセタート、12‐デオキシホルボール13‐テトラデカノエート、ホルボール12‐チグリエート13‐デカノエート、12‐デオキシホルボール13‐アセタート、ホルボール12‐アセタート、またはホルボール13‐アセタートであることを特徴とする方法。
(付記94)
付記91に記載の方法において、前記一般式(I)のホルボールエステルまたは誘導体化合物が、組み合わせ処方または併用治療レジメンで有効な、少なくとも1つの二次的抗レトロウイルス性またはその他の補助的治療剤と共に使用されることを特徴とする方法。
(付記95)
付記4に記載の方法において、前記少なくとも1つの二次的抗レトロウイルス性またはその他の補助的治療剤が、プロテアーゼ阻害剤、核酸系逆転写酵素阻害剤、非核酸系逆転写酵素阻害剤、合剤、エントリー及び融合阻害剤、アシクロビル、アデホビルジピボキシル、アルデスロイキン、アムホテリシンb、アジスロマイシン、カルシウムハイドロキシアパタイト、クラリスロマイシン、ドキソルビシン、ドロナビノール、エンテカビル、エポエチンアルファ、エトポシド、フルコナゾール、ガンシクロビル、免疫グロブリン、インターフェロンα2、イソニアジド、イトラコナゾール、メゲストロール、パクリタキセル、PEGインターフェロンα2、ペンタミジン、ポリL−乳酸、リバビリン、リファブチン、リファンピン、ソマトロピン、テストステロン、トリメトレキサート、バルガンシクロビル;インテグラーゼ阻害剤、殺菌剤、及びIL−2からなるグループから選択されることを特徴とする方法。
(付記96)
付記91に記載の方法において、前記有効量が、隔日で10〜1500μgの前記一般式(I)のホルボールエステルまたは誘導体化合物を含むことを特徴とする方法。
(付記97)
付記91に記載の方法において、HIV感染により引き起こされる1つ以上の症状または疾患が、口腔病変、倦怠感、皮膚カンジダ症、発熱、食欲不振、下痢、アフタ性潰瘍、吸収不全、血小板減少症、体重減少、貧血及びリンパ節腫脹、トリ型結核菌複合体、サルモネラ症、梅毒、神経梅毒、結核症、細菌性血管腫症、アスペルギルス症、カンジダ症、コクシジオイデス症、リステリア症、骨盤感染症、バーキットリンパ腫、クリプトコックス髄膜炎、ヒストプラスマ症、カポジ肉腫、リンパ腫、全身性非ホジキンリンパ腫、中枢神経原発リンパ腫、クリプトスポリジウム症、イソスポーラ症、微胞子虫症、カリニ肺炎、トキソプラズマ症、サイトメガロウイルス、肝炎、単純ヘルペス、帯状疱疹、ヒトパピローマウイルス、伝染性軟属腫、口腔毛状白板症、及び進行性巣性白質脳症であることを特徴とする方法。
(付記98)
哺乳類被験体におけるHIVを抑制または軽減するための組成物であって、一般式(I)のホルボールエステルまたは誘導体化合物、或いはそれらの薬学的に許容される塩、異性体、鏡像体、溶媒和化合物、水和物、多形体、またはプロドラッグの有効量を含むことを特徴とする組成物。
(付記99)
有効量が投与された場合に、HIVに感染した哺乳類被験体においてHIVの潜伏宿主を活性化する薬剤を製造するための一般式(I)のホルボールエステルまたは誘導体化合物、或いはそれらの薬学的に許容される塩、異性体、鏡像体、溶媒和化合物、水和物、多形体、またはプロドラッグの使用方法。
(付記100)
有効量が投与された場合に、哺乳類被験体においてTh1サイトカインの発現を増加させる薬剤を製造するための一般式(I)のホルボールエステルまたは誘導体、或いはそれらの薬学的に許容される塩、異性体、鏡像体、溶媒和化合物、水和物、多形体、またはプロドラッグの使用方法。
(付記101)
有効量が投与された場合に、哺乳類被験体において腫瘍を治療または抑制する薬剤を製造するための一般式(I)のホルボールエステルまたは誘導体、或いはそれらの薬学的に許容される塩、異性体、鏡像体、溶媒和化合物、水和物、多形体、またはプロドラッグ、及び
前記被験体における腫瘍を治療または抑制するための、前記一般式(I)のホルボールエステルまたは誘導体化合物との組み合わせ処方または併用治療レジメンで有効な少なくとも1つの二次的または補助的治療剤の使用方法。
(付記102)
付記101に記載の方法において、前記少なくとも1つの二次的または補助的治療剤が、ドキソルビシン、ビタミンD3、シタラビン、シトシンアラビノシド、ダウノルビシン、シクロホスファミド、ゲムツズマブオゾガマイシン、イダルビシン、メルカプトプリン、ミトキサントロン、チオグアニン、アルデスロイキン、アスパラギナーゼ、カルボプラチン、リン酸エトポシド、フルダラビン、メトトレキサート、エトポシド、デキサメタゾン、及びコリンマグネシウムトリサリチラートからなるグループから選択されることを特徴とする方法。
(付記103)
付記101に記載の方法において、前記有効量が、毎日10〜1500μgの前記一般式(I)のホルボールエステルまたは誘導体化合物を含むことを特徴とする方法。
(付記104)
有効量が投与された場合に、腫瘍性疾患を有する哺乳類被験体において腫瘍のアポトーシスを誘導する薬剤を製造するための一般式(I)のホルボールエステルまたは誘導体、或いはそれらの薬学的に許容される塩、異性体、鏡像体、溶媒和化合物、水和物、多形体、またはプロドラッグ、及び
前記被験体におけるアポトーシスを誘導するための、前記一般式(I)のホルボールエステルまたは誘導体化合物との組み合わせ処方または併用治療レジメンで有効な、少なくとも1つの二次的または補助的治療剤の使用方法。
(付記105)
哺乳類被験体における腫瘍性疾患の抑制または治療に用いる組成物であって、
一般式(I)のホルボールエステルまたは誘導体化合物、或いはそれらの薬学的に許容される塩、異性体、鏡像体、溶媒和化合物、水和物、多形体、またはプロドラッグの有効量、及び
前記被験体における腫瘍の治療または抑制のための、前記一般式(I)のホルボールエステルまたは誘導体化合物との組み合わせ処方で有効な、少なくとも1つの二次的または補助的治療剤を含むことを特徴とする組成物。
本発明を明確に理解できるようにするため、例を挙げて詳細に説明してきたが、限定ではなく例示の目的で提示された特許請求の範囲から逸脱することなく種々の変更例及び変形例を実行することができることが、技術者には明らかであろう。前述の開示において、説明を簡略にするためにさまざまな刊行物及びその他の参考文献が引用されている。それら参考文献は、言及によりその開示内容全体が全目的で本明細書に組込まれる。ただし、本明細書で言及されるさまざまな刊行物は、本出願の出願日前の刊行物の開示のためにのみ提供され、本発明の出願人は先行発明を理由として前記開示に先行する権利を有する。
Claims (7)
- 哺乳類被験体においてHIV感染またはHIV感染により引き起こされる疾患を抑制または治療する薬剤を製造するための12‐O‐テトラデカノイルホルボール‐13‐アセタート(TPA)またはその薬学的に許容される塩の使用方法。
- 請求項1に記載の方法において、TPAまたはその薬学的に許容される塩が、組み合わせ処方または併用治療レジメンで有効な、少なくとも1つの二次的抗レトロウイルス性またはその他の補助的治療剤と共に使用されることを特徴とする方法。
- 請求項2に記載の方法において、前記少なくとも1つの二次的抗レトロウイルス性またはその他の補助的治療剤が、プロテアーゼ阻害剤、核酸系逆転写酵素阻害剤、非核酸系逆転写酵素阻害剤、アシクロビル、アデホビルジピボキシル、アルデスロイキン、アムホテリシンb、アジスロマイシン、カルシウムハイドロキシアパタイト、クラリスロマイシン、ドキソルビシン、ドロナビノール、エンテカビル、エポエチンアルファ、エトポシド、フルコナゾール、ガンシクロビル、免疫グロブリン、インターフェロンα2、イソニアジド、イトラコナゾール、メゲストロール、パクリタキセル、PEGインターフェロンα2、ペンタミジン、ポリL−乳酸、リバビリン、リファブチン、リファンピン、ソマトロピン、テストステロン、トリメトレキサート、バルガンシクロビル;インテグラーゼ阻害剤、殺菌剤、及びIL−2からなるグループから選択されることを特徴とする方法。
- 請求項1に記載の方法において、前記薬剤が、10〜1500μgの投与量のTPAを含むことを特徴とする方法。
- 請求項1に記載の方法において、HIV感染により引き起こされる1つ以上の症状または疾患が、口腔病変、倦怠感、皮膚カンジダ症、発熱、食欲不振、下痢、アフタ性潰瘍、吸収不全、血小板減少症、体重減少、貧血及びリンパ節腫脹、トリ型結核菌複合体、サルモネラ症、梅毒、神経梅毒、結核症、細菌性血管腫症、アスペルギルス症、カンジダ症、コクシジオイデス症、リステリア症、骨盤感染症、バーキットリンパ腫、クリプトコックス髄膜炎、ヒストプラスマ症、カポジ肉腫、リンパ腫、全身性非ホジキンリンパ腫、中枢神経原発リンパ腫、クリプトスポリジウム症、イソスポーラ症、微胞子虫症、カリニ肺炎、トキソプラズマ症、サイトメガロウイルス、肝炎、単純ヘルペス、帯状疱疹、ヒトパピローマウイルス、伝染性軟属腫、口腔毛状白板症、及び進行性巣性白質脳症であることを特徴とする方法。
- 哺乳類被験体におけるHIVを抑制または軽減するための組成物であって、12‐O‐テトラデカノイルホルボール‐13‐アセタートまたはその薬学的に許容される塩を含むことを特徴とする組成物。
- HIVに感染した哺乳類被験体においてHIVの潜伏宿主を減少させる薬剤を製造するための12‐O‐テトラデカノイルホルボール‐13‐アセタートまたはその薬学的に許容される塩の使用方法。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US89881007P | 2007-01-31 | 2007-01-31 | |
| US60/898,810 | 2007-01-31 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2017235841A Division JP6616387B2 (ja) | 2007-01-31 | 2017-12-08 | ホルボールエステルを含む組成物及びその使用法 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2020037569A true JP2020037569A (ja) | 2020-03-12 |
Family
ID=39674428
Family Applications (5)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009548304A Pending JP2010516813A (ja) | 2007-01-31 | 2008-01-30 | ホルボールエステルを含む組成物及びその使用法 |
| JP2013155621A Expired - Fee Related JP5923068B2 (ja) | 2007-01-31 | 2013-07-26 | ホルボールエステルを含む組成物及びその使用法 |
| JP2016002526A Pending JP2016056192A (ja) | 2007-01-31 | 2016-01-08 | ホルボールエステルを含む組成物及びその使用法 |
| JP2017235841A Active JP6616387B2 (ja) | 2007-01-31 | 2017-12-08 | ホルボールエステルを含む組成物及びその使用法 |
| JP2019202032A Pending JP2020037569A (ja) | 2007-01-31 | 2019-11-07 | ホルボールエステルを含む組成物及びその使用法 |
Family Applications Before (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009548304A Pending JP2010516813A (ja) | 2007-01-31 | 2008-01-30 | ホルボールエステルを含む組成物及びその使用法 |
| JP2013155621A Expired - Fee Related JP5923068B2 (ja) | 2007-01-31 | 2013-07-26 | ホルボールエステルを含む組成物及びその使用法 |
| JP2016002526A Pending JP2016056192A (ja) | 2007-01-31 | 2016-01-08 | ホルボールエステルを含む組成物及びその使用法 |
| JP2017235841A Active JP6616387B2 (ja) | 2007-01-31 | 2017-12-08 | ホルボールエステルを含む組成物及びその使用法 |
Country Status (24)
| Country | Link |
|---|---|
| US (8) | US20080226589A1 (ja) |
| EP (2) | EP2170053A4 (ja) |
| JP (5) | JP2010516813A (ja) |
| KR (2) | KR101187859B1 (ja) |
| CN (1) | CN101677542B (ja) |
| AU (1) | AU2008211081A1 (ja) |
| BR (1) | BRPI0806863B8 (ja) |
| CA (1) | CA2676551C (ja) |
| CY (1) | CY1117938T1 (ja) |
| ES (1) | ES2584327T3 (ja) |
| HR (1) | HRP20160902T1 (ja) |
| HU (1) | HUE029954T2 (ja) |
| IL (1) | IL200141A0 (ja) |
| LT (1) | LT2368555T (ja) |
| MX (1) | MX2009008179A (ja) |
| MY (2) | MY172303A (ja) |
| PH (1) | PH12017502257A1 (ja) |
| PL (1) | PL2368555T3 (ja) |
| PT (1) | PT2368555T (ja) |
| RS (1) | RS54988B1 (ja) |
| RU (1) | RU2472511C2 (ja) |
| SI (1) | SI2368555T1 (ja) |
| WO (1) | WO2008094657A1 (ja) |
| ZA (1) | ZA200905273B (ja) |
Families Citing this family (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU2008211081A1 (en) | 2007-01-31 | 2008-08-07 | Biosuccess Biotech Company | Compositions and methods of use of phorbol esters |
| US10369222B2 (en) | 2012-01-18 | 2019-08-06 | Biosuccess Biotech Co., Ltd. | Compositions and methods of use of phorbol esters for the treatment of stroke |
| US9533938B2 (en) | 2007-01-31 | 2017-01-03 | Biosuccess Biotech Co., Ltd. | Compositions and methods of use of phorbol esters for the treatment of stroke |
| US9636317B2 (en) | 2007-01-31 | 2017-05-02 | Biosuccess Biotech Co. Ltd. | Compositions and methods of use of phorbol esters |
| US11564901B2 (en) | 2007-01-31 | 2023-01-31 | Biosuccess Biotech Co., Ltd. | Compositions and methods of use of phorbol esters |
| US9974764B2 (en) | 2007-01-31 | 2018-05-22 | Biosuccess Biotech Co. Ltd. | Compositions and methods of use of phorbol esters in the treatment of neoplasms |
| US11696908B2 (en) | 2007-01-31 | 2023-07-11 | Biosuccess Biotech Co. Ltd. | Compositions and methods of use of phorbol esters |
| CA2995883C (en) | 2008-12-03 | 2023-01-24 | The Scripps Research Institute | Compounds and methods for stabilizing cell cultures |
| US8575216B2 (en) * | 2009-08-04 | 2013-11-05 | Rutgers, The State University Of New Jersey | Method of treatment for acute myelogenous leukemia |
| TWI619494B (zh) * | 2013-01-18 | 2018-04-01 | 華鴻新藥股份有限公司 | 巴豆酯之組成物及使用方法 |
| SG10201912642RA (en) | 2012-01-18 | 2020-02-27 | Biosuccess Biotech Co Ltd | Compositions and methods of use of phorbol esters |
| US9550722B2 (en) | 2012-01-18 | 2017-01-24 | Biosuccess Biotech Co. Ltd. | Compositions and methods of use of phorbal esters for the treatment of stroke |
| US10099996B2 (en) | 2012-01-18 | 2018-10-16 | Biosuccess Biotech Co. Ltd. | Compositions and methods of use of phorbol esters in the treatment of neoplasms |
| RU2488400C1 (ru) * | 2012-03-12 | 2013-07-27 | Вячеслав Владимирович Чеботарёв | Способ превентивного дифференцированного лечения лиц, контактных с больными заразной формой сифилиса |
| EP2919776B1 (en) | 2012-11-15 | 2017-02-01 | The U.S.A. as represented by the Secretary, Department of Health and Human Services | Methods of treating patients infected with hiv and htlv |
| TWI750481B (zh) * | 2013-01-18 | 2021-12-21 | 美商華鴻新藥股份有限公司 | 用於中風治療之巴豆酯組成物及使用方法 |
| MA40904A (fr) * | 2014-11-03 | 2017-09-12 | Hygeia Tech Inc | Compositions d'ester de phorbol et procédés pour traiter ou réduire la durée d'une cytopénie |
Family Cites Families (31)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB427857A (en) | 1934-08-02 | 1935-05-01 | Newsum Sons & Company Ltd H | A new or improved system of construction for skeleton structures, particularly vehicle body frames and door frames |
| US6080784A (en) * | 1986-06-11 | 2000-06-27 | Procyon Pharmaceuticals, Inc. | Protein kinase C modulators N |
| DE69130063T2 (de) * | 1990-05-30 | 1999-02-25 | The United States of America, represented by the Secretary, U.S. Department of Commerce, Washington, D.C. | Antivirales arzneimittel enthaltend prostratin |
| WO1992002484A1 (en) | 1990-07-30 | 1992-02-20 | Alder Research Center Limited Partnership | Protein kinase c modulators with anti-inflammatory and antiviral activity |
| RU2197964C2 (ru) * | 1995-04-12 | 2003-02-10 | Дзе Проктер Энд Гэмбл Компани | Фармацевтическая композиция, композиция стандартной лекарственной формы и способ лечения злокачественных новообразований, опухолей и вирусных инфекций |
| US6184248B1 (en) | 1996-09-05 | 2001-02-06 | Robert K. K. Lee | Compositions and methods for treatment of neurological disorders and neurodegenerative diseases |
| GB9620390D0 (en) | 1996-09-30 | 1996-11-13 | Eisai London Res Lab Ltd | Substances and their uses |
| US6063814A (en) * | 1997-04-14 | 2000-05-16 | Chang; Richard L. | Phorbol esters as anti-neoplastic and white blood cell elevating agents |
| CA2237877A1 (en) | 1998-06-26 | 1999-12-26 | Anthony Paolitto | Chest retractor for performing cardiac surgery |
| JP4110347B2 (ja) * | 1999-11-05 | 2008-07-02 | 大鵬薬品工業株式会社 | 抗hiv剤 |
| JP2001139468A (ja) * | 1999-11-11 | 2001-05-22 | Lead Chemical Co Ltd | 抗ウイルス作用を有するホルボール誘導体 |
| AU4317500A (en) * | 2000-05-02 | 2001-11-12 | Lead Chemical Co., Ltd. | Antibiral compositions containing phorbol derivatives as the main active ingredient |
| JP2004505047A (ja) | 2000-07-28 | 2004-02-19 | キャンサー・リサーチ・テクノロジー・リミテッド | 複合治療による癌治療 |
| US20070009529A1 (en) | 2002-03-26 | 2007-01-11 | New York University | Agents that dissolve arterial thrombi |
| US20080004332A1 (en) | 2002-03-07 | 2008-01-03 | Alkon Daniel L | Methods for alzheimer's disease treatment and cognitive enhancement |
| DE10244453A1 (de) | 2002-09-24 | 2004-04-01 | Phenomiques Gmbh | Hemmung der Proteinkinase C-alpha zur Behandlung von Krankheiten |
| AU2003242405A1 (en) | 2003-05-22 | 2004-12-13 | Lead Chemical Co., Ltd. | Compounds and preparaitons having antiviral effect |
| JP4006645B2 (ja) * | 2003-08-27 | 2007-11-14 | トヨタ自動車株式会社 | 排ガス浄化装置 |
| JP2005179201A (ja) * | 2003-12-16 | 2005-07-07 | Japan Science & Technology Agency | 抗hiv化合物とその利用 |
| CA2502109C (en) * | 2004-03-24 | 2010-02-23 | Yamasa Corporation | 4'-c-substituted-2-haloadenosine derivative |
| JP2008069182A (ja) | 2004-03-24 | 2008-03-27 | Yamasa Shoyu Co Ltd | 4’−c−置換−2−ハロアデノシン誘導体 |
| US8022103B2 (en) * | 2005-07-13 | 2011-09-20 | Salvia Sciences, Inc. | Ester prodrugs of prostratin and related phorbol compounds |
| WO2008024490A2 (en) | 2006-08-24 | 2008-02-28 | Theraquest Biosciences, Inc. | Oral pharmaceutical formulations of abuse deterrent cannabinoids and method of use |
| AU2008211081A1 (en) | 2007-01-31 | 2008-08-07 | Biosuccess Biotech Company | Compositions and methods of use of phorbol esters |
| EP2030631A1 (en) | 2007-08-31 | 2009-03-04 | Max-Planck-Gesellschaft zur Förderung der Wissenschaften e.V. | Means and methods for treating peripheral and cardiovascular diseases via modulation of arteriogenesis |
| US8575216B2 (en) | 2009-08-04 | 2013-11-05 | Rutgers, The State University Of New Jersey | Method of treatment for acute myelogenous leukemia |
| KR101144327B1 (ko) | 2010-04-02 | 2012-05-11 | 한국과학기술연구원 | Pkc 작용 활성제를 유효성분으로 함유하는 압상스 간질의 예방 및 치료용 조성물 |
| WO2011127288A2 (en) | 2010-04-07 | 2011-10-13 | La Jolla Institute For Allergy And Immunology | Methods and uses of nur77 and nur77 agonists to modulate macrophages and monocytes, and treat inflammation, inflammatory disease and cardiovascular disease |
| WO2011144901A1 (en) | 2010-05-20 | 2011-11-24 | The University Of Newcastle Upon Tyne | Expansion and directed differentiation of epidermal neural crest stem cells |
| SG10201912642RA (en) | 2012-01-18 | 2020-02-27 | Biosuccess Biotech Co Ltd | Compositions and methods of use of phorbol esters |
| JP5738207B2 (ja) * | 2012-01-27 | 2015-06-17 | 三菱電機株式会社 | 圧縮機、冷蔵庫、機器 |
-
2008
- 2008-01-30 AU AU2008211081A patent/AU2008211081A1/en not_active Abandoned
- 2008-01-30 WO PCT/US2008/001299 patent/WO2008094657A1/en not_active Ceased
- 2008-01-30 CA CA2676551A patent/CA2676551C/en not_active Expired - Fee Related
- 2008-01-30 SI SI200831648A patent/SI2368555T1/sl unknown
- 2008-01-30 LT LTEP10015894.8T patent/LT2368555T/lt unknown
- 2008-01-30 HU HUE10015894A patent/HUE029954T2/en unknown
- 2008-01-30 RS RS20160571A patent/RS54988B1/sr unknown
- 2008-01-30 BR BRPI0806863A patent/BRPI0806863B8/pt not_active IP Right Cessation
- 2008-01-30 EP EP08725016A patent/EP2170053A4/en not_active Withdrawn
- 2008-01-30 PL PL10015894T patent/PL2368555T3/pl unknown
- 2008-01-30 EP EP10015894.8A patent/EP2368555B1/en active Active
- 2008-01-30 PT PT100158948T patent/PT2368555T/pt unknown
- 2008-01-30 RU RU2009132345/15A patent/RU2472511C2/ru active
- 2008-01-30 KR KR1020097018188A patent/KR101187859B1/ko not_active Expired - Fee Related
- 2008-01-30 CN CN200880010630.XA patent/CN101677542B/zh not_active Expired - Fee Related
- 2008-01-30 MX MX2009008179A patent/MX2009008179A/es active IP Right Grant
- 2008-01-30 JP JP2009548304A patent/JP2010516813A/ja active Pending
- 2008-01-30 ES ES10015894.8T patent/ES2584327T3/es active Active
- 2008-01-30 MY MYPI20093116A patent/MY172303A/en unknown
- 2008-01-30 KR KR1020127014050A patent/KR20120091267A/ko not_active Ceased
- 2008-01-30 MY MYPI2017001013A patent/MY186986A/en unknown
- 2008-01-31 US US12/023,753 patent/US20080226589A1/en not_active Abandoned
-
2009
- 2009-07-29 IL IL200141A patent/IL200141A0/en active IP Right Grant
- 2009-07-29 ZA ZA200905273A patent/ZA200905273B/xx unknown
-
2013
- 2013-03-11 US US13/794,467 patent/US9132113B2/en not_active Expired - Fee Related
- 2013-07-26 JP JP2013155621A patent/JP5923068B2/ja not_active Expired - Fee Related
-
2015
- 2015-03-20 US US14/545,061 patent/US20150202178A1/en not_active Abandoned
- 2015-08-12 US US14/824,688 patent/US9603825B2/en not_active Expired - Fee Related
- 2015-09-03 US US14/756,365 patent/US20150374656A1/en not_active Abandoned
-
2016
- 2016-01-08 JP JP2016002526A patent/JP2016056192A/ja active Pending
- 2016-07-19 HR HRP20160902TT patent/HRP20160902T1/hr unknown
- 2016-07-19 CY CY20161100709T patent/CY1117938T1/el unknown
-
2017
- 2017-02-10 US US15/429,311 patent/US9907775B2/en active Active
- 2017-12-08 JP JP2017235841A patent/JP6616387B2/ja active Active
- 2017-12-11 PH PH12017502257A patent/PH12017502257A1/en unknown
-
2018
- 2018-11-05 US US16/180,881 patent/US20190071387A1/en not_active Abandoned
-
2019
- 2019-11-07 JP JP2019202032A patent/JP2020037569A/ja active Pending
-
2020
- 2020-03-09 US US16/812,770 patent/US20200207696A1/en not_active Abandoned
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6616387B2 (ja) | ホルボールエステルを含む組成物及びその使用法 | |
| KR102102677B1 (ko) | 포르볼 에스테르의 조성물 | |
| JP2004531468A5 (ja) | ||
| EP1089726A2 (en) | Composition comprising ss-hydroxy-ss-methylbutyric acid and at least one amino acid | |
| JP2016519166A (ja) | Hiv感染症を処置するための方法および組成物 | |
| JPS62265222A (ja) | 細胞膜の脂質構造および機能の修飾法並びにこれに使用する製剤組成物 | |
| US11564901B2 (en) | Compositions and methods of use of phorbol esters | |
| HK1142495A (en) | Compositions and methods of use of phorbol esters | |
| JP2000508654A (ja) | Dhea組合せ療法 | |
| JPH0748279A (ja) | 後天性免疫不全症候群の治療法 | |
| AU2012200980B2 (en) | Compositions and methods of use of phorbol esters | |
| Class et al. | Patent application title: Compositions And Methods Of Use Of Phorbol Esters Inventors: Zheng Tao Han (Zhengzhou, CN) Hung-Fong Chen (Taipei, TW) Assignees: BIOSUCCESS BIOTECH CO., LTD | |
| HK1156531B (en) | Compositions and methods of use of phorbolesters |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20191206 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20191206 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7422 Effective date: 20200515 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20200515 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20201006 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20201218 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210406 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20210907 |