本明細書中、キャリアポリペプチドおよび二本鎖オリゴヌクレオチドを含むナノ粒子を含むナノ粒子組成物であって、キャリアポリペプチドが、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含む、ナノ粒子組成物を記載する。
一態様では、キャリアポリペプチドおよび二本鎖オリゴヌクレオチドを含むナノ粒子を含むナノ粒子組成物であって、キャリアポリペプチドが、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含み、ナノ粒子組成物中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が約6:1未満である、ナノ粒子組成物を提供する。任意選択で、化学療法薬などの小分子薬物が、二本鎖オリゴヌクレオチドに結合している。キャリアポリペプチドおよび二本鎖オリゴヌクレオチドを組み合わせることにより、安定したナノ粒子の形成がもたらされる。本明細書中さらに記載されるように、これら安定したナノ粒子が、本組成物(および/またはナノ粒子)中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が6:1未満である場合であっても形成できることが、見いだされている。ナノ粒子組成物は、たとえば、化学療法薬抵抗性癌を含む癌の治療において有用であり得る。
別の態様では、化学療法薬抵抗性癌を有する対象を治療する方法であって、ナノ粒子を含む組成物を対象に投与することを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド;ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬を含む、方法を提供する。多くのタイプの癌は、特定の化学療法薬、たとえばドキソルビシン、ラパチニブ、またはHER2+抗体(トラスツズマブもしくはペルツズマブなど)に抵抗性である。薬物の濃度の増大は、多くの場合、有効ではなく、有意な望ましくない副作用をもたらし得る。本明細書中さらに記載されるように、本ナノ粒子組成物は、化学療法薬抵抗性癌細胞を殺滅するため、および化学療法薬抵抗性癌を有する患者を治療するために使用することができる。
ドキソルビシンは、様々な悪性腫瘍を治療するために使用できる例示的な化学療法薬である。しかしながらその有用性は、細胞における薬物排出機構により限定されている。細胞の排出の課題を克服するためにドキソルビシンを高用量にすることは、心筋症を含む有意な副作用のため一般的には得策ではない。また、リポソーマルドキソルビシン(「LipoDox」とも呼ばれている)は、細胞の取り込みを高めるために使用されているが、投与を続けていると有意な副作用がある。
本明細書中記載のナノ粒子を含む組成物が、リポソーマルドキソルビシンよりも標的とする癌細胞の殺滅に有効であることが、見いだされた。このナノ粒子はまた、抗体化学療法剤(抗HER2抗体、すなわちトラスツズマブなど)、または小分子化学療法剤、たとえばドキソルビシン(たとえばLipoDox)を含む化学療法薬に抵抗性がある癌細胞の殺滅にも有効である。よって、本明細書中記載のナノ粒子および組成物は、化学療法薬抵抗性癌を含む癌の治療に特に有用である。
定義
本明細書中使用される単数形「a」、「an」、および「the」は、特段文脈で明記されない限り複数形を含む。
本明細書中の「約」値またはパラメータへの言及は、この値またはパラメータ自体に対する変動を含む(および記載する)。たとえば、「約X」と表されている記載は、「X」の記載を含む。
用語「有効な」は、特段他の記載がない限り、これを使用する文脈の中で使用する場合に、意図した結果が、感染症もしくは疾患状態の治療、または本明細書中記載の別のものに関連するかどうかに関わらず、この結果をもたらすまたは生じさせる、ある量の化合物または構成要素を説明するために本明細書中で使用されている。
基準のポリペプチド配列に関する「パーセント(%)アミノ酸配列同一性」は、最大のパーセント配列同一性が得られるように配列を整列させ、必要に応じてギャップを導入した後に、いかなる保存的置換も配列同一性の一部として考慮しない場合の、基準のポリペプチド配列のアミノ酸残基と同一である候補配列中のアミノ酸残基のパーセンテージとして定義されている。パーセントアミノ酸配列同一性を決定することを目的とするアライメントは、当該分野の技能の範囲内にある様々な方法で、たとえば公開されているペアワイズシークエンスのコンピュータソフトウェアを使用して、達成することができる。当業者は、比較される配列の完全長にわたり最大のアライメントを達成するために必要とされるいずれかのアルゴリズムを含む、配列を整列させるための適切なパラメータを決定することができる。所定のアミノ酸配列Bに対する(to、with、またはagainst)、所定のアミノ酸配列Aのアミノ酸配列同一性(%)(あるいは、所定のアミノ酸配列Bに対して(to、with、またはagainst)特定の%アミノ酸配列同一性を有するまたは含む所定のアミノ酸配列Aと表現することができる)を、以下のように計算する:
100×分数X/Y
(式中、Xは、配列アライメントプログラムによるAおよびBのそのプログラムのアライメントにおける同一のマッチとしてスコア付けされたアミノ酸残基の数であり、Yは、Bのアミノ酸残基の総数である)。 アミノ酸配列Aの長さがアミノ酸配列Bの長さと等しくない場合、AのBに対する%アミノ酸配列同一性は、BのAに対する%アミノ酸配列同一性と等しくないことが認識されている。
本明細書中使用される用語「薬学的に許容される」は、化合物または組成物が、疾患の重症度および治療の必要性の観点から、過度に有害な副作用を伴うことなく本明細書中記載の治療を達成するために、ヒトを含む対象への投与に適していることを意味している。
用語「対象」または「患者」は、哺乳類を説明するために本明細書中同義で使用されている。対象の例として、ヒト、または動物(限定するものではないが、イヌ、ネコ、げっ歯類(マウス、ラット、もしくはハムスターなど)、ウマ、ヒツジ、ウシ、ブタ、ヤギ、ロバ、ウサギ、もしくは霊長類(サル、チンパンジー、オランウータン、ヒヒ、もしくはマカクザルなど)を含む)が、挙げられる。
用語「治療する(treat)」、「治療すること(treating)」、および「治療(treatment)」は、少なくとも1つの症状の緩和、阻害、抑制、もしくは除去を介した病態の改善、疾患進行の遅延、疾患の再発の遅延、または疾患の阻害を含む、疾患状態または病態を罹患した対象に利益を提供するいずれかの作用を表すように本明細書中同義で使用されている。
本明細書中記載の本発明の態様および多様性は、態様および多様性「からなる」および/または「から本質的になる」ことを含むことが、理解されている。
本明細書中記載の様々な実施形態の特性のうちの1つ、一部、またはすべてが、本発明の他の実施形態を形成するために組み合わせてもよいことを、理解すべきである。
本明細書中使用される節の見出しは、単に構成を目的とするものであり、記載の主題を限定するように解釈すべきではない。
ナノ粒子組成物
本明細書中記載のナノ粒子組成物は、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチドセグメントを含む、キャリアポリペプチドを含む。このナノ粒子はさらに二本鎖オリゴヌクレオチドを含む。二本鎖オリゴヌクレオチドはオリゴヌクレオチド結合セグメントに結合することができる。一部の実施形態では、小分子薬物が、二本鎖オリゴヌクレオチドに結合している。一部の実施形態では、本組成物中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対する比は、約6:1未満である。
未満である。
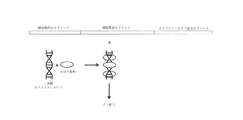
細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントは、単一のキャリアポリペプチドにおいて共に融合している。本明細書中記載のこれらセグメントはモジュール状であり、様々な組み合わせで組み合わせることができる。すなわち、キャリアポリペプチドは、記載の細胞標的化セグメント、細胞貫通セグメント、またはオリゴヌクレオチド結合セグメントのいずれかを含むことができる。図1は、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを有するキャリアポリペプチドを例示している。図1にさらに示されているように、二本鎖オリゴヌクレオチドとキャリアポリペプチドを組みわせることにより、ナノ粒子が形成される。任意選択で、ナノ粒子を形成する前に、二本鎖オリゴヌクレオチドを、小分子薬物とあらかじめ結合させる。
ナノ粒子は、二本鎖オリゴヌクレオチドとキャリアポリペプチドを組み合わせることにより、形成できる。一部の実施形態では、キャリアポリペプチドを二本鎖オリゴヌクレオチドと、約6:1未満(たとえば約4:1から約6:1未満、たとえば約4:1〜約4.5:1、約4.5:1〜約5:1、約5:1〜約5.5:1、約5.5:1から約6:1未満、約4:1、約4.5:1、約5:1、または約5.5)のモル比で組み合わせることにより、ナノ粒子組成物を形成する。よって、一部の実施形態では、ナノ粒子組成物は、キャリアポリペプチドおよび二本鎖オリゴヌクレオチドを、約6:1未満(たとえば約4:1から約6:1未満、たとえば約4:1〜約4.5:1、約4.5:1〜約5:1、約5:1〜約5.5:1、約5.5:1から約6:1未満、約4:1、約4.5:1、約5:1、または約5.5:1)のモル比で含む。ナノ粒子組成物における構成要素の比は、これら構成要素がナノ粒子に集合するかどうかに関わらず、組成物中の構成要素の全体的な比を表す。
一部の実施形態では、ナノ粒子組成物は、キャリアポリペプチドの二本鎖オリゴヌクレオチドに対する相同なモル比を有するナノ粒子を含む。一部の実施形態では、ナノ粒子は、キャリアポリペプチドおよび二本鎖オリゴヌクレオチドを、約6:1、約5:1、または約4:1のモル比で含む。ナノ粒子中の構成要素の比は、組成物の残りからナノ粒子を分離(たとえば組成物を遠心分離し、上清をデカントする)し、単離したナノ粒子中の構成要素を測定することにより、決定することができる。
細胞標的化セグメントは、細胞の表面に存在する分子と結合することができる。細胞標的化セグメントによるこの分子との結合により、ナノ粒子を、この細胞に標的化することができる。よって、細胞に存在する標的化した分子は、標的化した細胞に依存し得る。一部の実施形態では、標的化した分子は、癌抗原などの抗原である。一部の実施形態では、細胞標的化セグメントは、抗体、抗体フラグメント、サイトカイン、または受容体のリガンドである。
一部の実施形態では、細胞標的化セグメントは、標的とする細胞の表面の標的に結合する。たとえば一部の実施形態では、細胞標的化セグメントは、受容体などの細胞表面タンパク質と結合する。一部の実施形態では、細胞標的化セグメントは、4−IBB、5T4、腺癌抗原、α−フェトプロテイン、BAFF、C242抗原、CA−125、炭酸脱水酵素9(CA−IX)、c−MET、CCR4、CD152、CD19、CD20、CD200、CD22、CD221、CD23(IgE受容体)、CD28、CD30(TNFRSF8)、CD33、CD4、CD40、CD44v6、CD51、CD52、CD56、CD74、CD80、CEA、CNT0888、CTLA−4、DR5、EGFR、EpCAM、CD3、FAP、フィブロネクチンエクストラドメイン−B、葉酸受容体1、GD2、GD3ガングリオシド、糖タンパク質75、GPNMB、肝細胞増殖因子(HGF)、ヒト細胞分散因子受容体キナーゼ、IGF−1受容体、IGF−I、IgG1、Ll−CAM、IL−13、IL−6、インスリン様成長因子I受容体、インテグリンα5β1、インテグリンανβ3、MORAb−009、MS4A1、MUC1、ムチン CanAg、N−グリコリルノイラミン酸、NPC−1C、PDGF−R a、PDL192、ホスファチジルセリン、前立腺癌細胞、RANKL、RON、ROR1、SCH 900105、SDC1、SLAMF7、TAG−72、テネイシンC、TGFβ2、TGF−β、TRAIL−R1、TRAIL−R2、腫瘍抗原CTAA16.88、VEGF−A、VEGFR−1、VEGFR2、ビメンチン、インターナリンB、細菌のインベイシン(Inv)タンパク質、またはそれらのフラグメントに結合する。
一部の実施形態では、細胞標的化セグメントは、ヘレグリンまたはその受容体結合フラグメントであり、「Her」と呼ぶことができる。ヘレグリンは、たとえばヘレグリンαであり得る。配列番号2は、例示的な野生型のHer配列である。一部の実施形態では、細胞標的化セグメントは、配列番号2、または配列番号2と約80%以上、約85%以上、約90%以上、約92%以上、約93%以上、約94%以上、約95%以上、約96%以上、約97%以上、約98%以上、もしくは約99%以上のアミノ酸配列同一性を有するポリペプチドである。一部の実施形態では、細胞標的化セグメントは、ヘレグリン受容体、たとえばHER3と結合する。一部の実施形態では、細胞標的化セグメントは、たとえば配列番号2の約50%以下、約60%以下、約70%以下、約80%以下、約90%以下、または約95%以下の長さを有する、配列番号2の切断型である。一部の実施形態では、細胞標的化セグメントは、配列番号1の約50%〜約100%(配列番号1の約60%〜約95%または約70%〜約90%など)の長さを有する。細胞標的化セグメントの切断型は、HER3標的化特性を保持している。
一部の実施形態では、細胞標的化セグメントにより標的化された細胞は、ヒト細胞などの哺乳類の細胞である。一部の実施形態では、この細胞は、癌細胞などの疾患細胞である。一部の実施形態では、この細胞はHER3+癌細胞である。一部の実施形態では、この細胞は乳癌細胞(たとえばトリプルネガティブ乳癌細胞)、グリアの癌細胞、卵巣癌細胞、または前立腺癌細胞である。細胞標的化セグメントは、ナノ粒子を標的細胞に標的化する、標的化細胞の表面に存在する分子と結合することができる。
キャリアポリペプチドの細胞貫通セグメントは、細胞標的化セグメントにより標的化される細胞へのナノ粒子の流入を促進する。一部の実施形態では、細胞貫通セグメントは、ペントンベース(「PB」)タンパク質またはそのバリアントを含む(および一部の実施形態では、ペントンベース(「PB」)タンパク質またはそのバリアントである)。例として、一部の実施形態では、細胞貫通セグメントは、アデノウイルス血清型5(Ad5)のペントンベースタンパク質を含む(および一部の実施形態では、アデノウイルス血清型5(Ad5)のペントンベースタンパク質である)。一部の実施形態では、細胞貫通セグメントは、アミノ酸の多様性または欠失を伴うペントンベースタンパク質を含む(および一部の実施形態では、アミノ酸の多様性または欠失を伴うペントンベースタンパク質である)。アミノ酸の多様性は、保存的変異であり得る。一部の実施形態では、細胞貫通セグメントは、切断型のペントンベースタンパク質である。配列番号1は、例示的なペントンベースタンパク質である。一部の実施形態では、細胞貫通セグメントは、配列番号1、または配列番号1と約80%以上、約85%以上、約90%以上、約92%以上、約93%以上、約94%以上、約95%以上、約96%以上、約97%以上、約98%以上、もしくは約99%以上のアミノ酸配列同一性を有するポリペプチドである。一部の実施形態では、細胞貫通セグメントは、たとえば配列番号1の約50%以下、約60%以下、約70%以下、約80%以下、約90%以下、または約95%以下の長さを有する、配列番号1の切断型である。一部の実施形態では、細胞貫通セグメントは、配列番号1の約50%〜約100%(たとえば配列番号1の約60%〜約95%、または約70%〜90%)の長さを有する。
細胞貫通セグメントは、キャリアポリペプチドの細胞内局在を高める1つまたは複数のバリアントを含むことができる。たとえば、一部の実施形態では、細胞貫通セグメントは、キャリアポリペプチドを細胞質または核に優先的に局在化させる1つまたは複数のバリアントを含む。キャリアポリペプチドが(それ自体が小分子薬物に結合し得る)オリゴヌクレオチドと結合している実施形態では、バリアントの細胞貫通セグメントは、オリゴヌクレオチドおよび/または小分子薬物を細胞質または核に優先的に局在化させる。優先的な細胞下局在は、特定の小分子薬物に特に有益であり得る。たとえば、多くの化学療法剤は、癌細胞の核に局在化するDNAに結合することにより、機能する。核を優先的に標的とすることにより、結合した薬物は、機能する位置で濃縮される。他の小分子薬物は、細胞質で機能することができ、細胞質を優先的に標的とすることにより、薬物の効力を高めることができる。
細胞下局在を高める例示的な細胞貫通セグメントの変異は、国際特許公開公報第2014/022811号に論述されている。ペントンベースタンパク質におけるLeu60Trp変異は、細胞の細胞質に優先的に局在することが示されている。よって、一部の実施形態では、細胞貫通セグメントは、Leu60Trp変異を含むペントンベースタンパク質である。Lys375Glu、Val449Met、およびPro469Ser変異は、細胞の核に優先的に局在することが示されている。よって、一部の実施形態では、細胞貫通セグメントは、Lys375Glu、Val449Met、およびPro469Ser変異を含む、ペントンベースタンパク質である。一部の実施形態では、細胞貫通セグメントは、Lys375Glu、Val449Met、およびPro469Ser変異を含む、ペントンベースタンパク質である。アミノ酸の番号付けは、配列番号1の野生型のペントンベースポリペプチドを参照して行う。
オリゴヌクレオチド結合セグメントは、本ナノ粒子の二本鎖オリゴヌクレオチド構成要素と結合する。オリゴヌクレオチド結合セグメントは、たとえば静電結合、水素結合、またはイオン結合を介して、二本鎖オリゴヌクレオチドと結合する。一部の実施形態では、オリゴヌクレオチド結合セグメントは、DNA結合ドメインまたは二本鎖RNA結合ドメインである。一部の実施形態では、オリゴヌクレオチド結合セグメントは、カチオン性ドメインである。一部の実施形態では、オリゴヌクレオチド結合ドメインは、ポリリジン配列を含む。一部の実施形態では、オリゴヌクレオチド結合セグメントは、約3〜約30アミノ酸長、たとえば約3〜約10、約5〜約15、約10〜約20、約15〜約25、または約20〜約30アミノ酸長である。1つの例示的な実施形態では、オリゴヌクレオチド結合セグメントは、デカリジン(すなわち、配列番号4に示されている、10個の連続したリジンアミノ酸、または「K10」)を含む(および一部の実施形態では、デカリジンである)。
例示的なキャリアポリペプチドは、Her、ペントンベース(またはそのバリアント)、および正に荷電したオリゴヌクレオチド結合セグメントを含む。一部の実施形態では、キャリアポリペプチドは、Her、ペントンベースセグメント、およびポリリジンオリゴヌクレオチド結合セグメントを含む。一部の実施形態では、キャリアポリペプチドは、Her、ペントンベースセグメント、およびデカリジンオリゴヌクレオチド結合セグメント、たとえばHerPBK10(配列番号3)を含む。一部の実施形態では、キャリアポリペプチドは、配列番号3と約80%以上、約85%以上、約90%以上、約92%以上、約93%以上、約94%以上、約95%以上、約96%以上、約97%以上、約98%以上、または約99%以上のアミノ酸配列同一性を有するポリペプチドである。
キャリアポリペプチドは、二本鎖オリゴヌクレオチドと結合してナノ粒子を形成する。二本鎖オリゴヌクレオチドは、RNAまたはDNAであり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、siRNA、shRNA、またはmicroRNAを含む。二本鎖オリゴヌクレオチドは、たとえば、ステムループ構造を含み得るか、または2つの別々のRNA鎖を含み得る。二本鎖オリゴヌクレオチドは、完全に塩基対を形成する必要はなく、一部の実施形態では、1つまたは複数のバルジ、ループ、ミスマッチ、または他の二次構造を含む。一部の実施形態では、塩基のうち約80%以上が対形成しており、塩基のうち約85%以上が対形成しており、塩基のうち約90%以上が対形成しており、または塩基のうち約95%が対形成しており、または塩基のうち約100%が対形成している。一部の実施形態では、RNAは、T7−転写RNAなどの、三リン酸塩の5’末端を含む。一部の実施形態では、RNAは合成により生産されている。
一部の実施形態では、オリゴヌクレオチドは、約10塩基長〜約1000塩基長、たとえば約10塩基長〜約30塩基長、約20塩基長〜約40塩基長、約30塩基長〜約50塩基長、約40塩基長〜約60塩基長、約50塩基長〜約70塩基長、約60塩基長〜約80塩基長、約70塩基長〜約90塩基長、約80塩基長〜約100塩基長、約100塩基長〜約200塩基長、約200塩基長〜約300塩基長、約300塩基長〜約400塩基長、約400塩基長〜約500塩基長、約500塩基長〜約700塩基長、または約700塩基長〜約1000塩基長である。一部の実施形態では、オリゴヌクレオチドは、約25塩基長〜約35塩基長、たとえば約25塩基長、約26塩基長、約27塩基長、約28塩基長、約29塩基長、約30塩基長、約31塩基長、約32塩基長、約33塩基長、約34塩基長、または約35塩基長である。
一部の実施形態では、小分子化合物(小分子薬物など)は、たとえば静電相互作用により、または二本鎖オリゴヌクレオチドにインターカレートすることにより、二本鎖オリゴヌクレオチドに結合している。小分子薬物は、ドキソルビシンなどの化学療法剤であり得る。他の小分子化学療法剤として、他のアントラサイクリン(ダウノルビシン、エピルビシン、イダルビシン、ミトキサントロン、バルルビシンなど)、アルキル化剤もしくはアルキル化様作用剤(カルボプラチン、カルムスチン、シスプラチン、シクロホスファミド、メルファラン、プロカルバジン、もしくはチオテパなど)、またはタキサン(パクリタキセル、ドセタキセル、もしくはタキソテールなど)を挙げることができる。一部の実施形態では、小分子化合物は、約1000ダルトン以下、約900ダルトン以下、約800ダルトン以下、約700ダルトン以下、約600ダルトン以下、約500ダルトン以下、約400ダルトン以下、または約300ダルトン以下である。
一部の実施形態では、ナノ粒子組成物中の小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約60:1以下、たとえば約50:1以下、約40:1以下、約30:1以下、約20:1以下、約10:1以下、約5:1以下、約4:1以下、約3:1以下、約2:1以下、または約1:1以下である。一部の実施形態では、ナノ粒子組成物中の小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1、たとえば約1:1〜約10:1、約5:1〜約20:1、約10:1〜約30:1、約20:1〜約40:1、約30:1〜約50:1、または約40:1〜約60:1、約1:1、約1:10、約1:20、約1:30、約1:40、約1:50、または約1:60である。
一部の実施形態では、本ナノ粒子は、動的光散乱法によって測定した場合、一般的に直径50nm以下(たとえば、直径約45nm以下、約40nm以下、約35nm以下、約30nm以下、約25nm〜約50nm、約25nm〜約30nm、約30nm〜約35nm、約35nm〜約40nm、または約45nm〜約50nm)である。小分子薬物は、存在する場合には、それ自体がオリゴヌクレオチド結合セグメントに結合している二本鎖オリゴヌクレオチドに結合している。
一部の実施形態では、キャリアポリペプチドおよび二本鎖オリゴヌクレオチド(DNAなど)を含むナノ粒子を含む組成物であって、キャリアポリペプチドが、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含み、ナノ粒子組成物中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば4:1から約6:1未満、または約4:1)である、組成物を提供する。一部の実施形態では、細胞標的化セグメントは、HER3+癌細胞などの癌細胞と結合する。一部の実施形態では、この癌細胞は、化学療法薬抵抗性癌細胞である。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、二本鎖オリゴヌクレオチドは、アントラサイクリン(たとえばドキソルビシン)などの小分子薬物と結合している。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本組成物中のナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、キャリアポリペプチドおよび二本鎖オリゴヌクレオチド(DNAなど)を含むナノ粒子を含む組成物であって、キャリアポリペプチドが、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含み、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)である、組成物を提供する。一部の実施形態では、細胞標的化セグメントは、HER3+癌細胞などの癌細胞と結合する。一部の実施形態では、この癌細胞は、化学療法薬抵抗性癌細胞である。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、二本鎖オリゴヌクレオチドは、アントラサイクリン(たとえばドキソルビシン)などの小分子薬物と結合している。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本組成物中のナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、キャリアポリペプチドおよび二本鎖オリゴヌクレオチド(DNAなど)を含むナノ粒子を含む組成物であって、キャリアポリペプチドが、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含み、ナノ粒子組成物中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば4:1から約6:1未満、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含む(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントである)、組成物を提供する。一部の実施形態では、細胞標的化セグメントは、HER3+癌細胞などの癌細胞と結合する。一部の実施形態では、この癌細胞は、化学療法薬抵抗性癌細胞である。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、二本鎖オリゴヌクレオチドは、アントラサイクリン(たとえばドキソルビシン)などの小分子薬物と結合している(たとえば小分子薬物がインターカレートしている)。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本組成物中のナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、キャリアポリペプチドおよび二本鎖オリゴヌクレオチド(DNAなど)を含むナノ粒子を含む組成物であって、キャリアポリペプチドが、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含み、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含む(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントである)、組成物を提供する。一部の実施形態では、細胞標的化セグメントは、HER3+癌細胞などの癌細胞と結合する。一部の実施形態では、この癌細胞は、化学療法薬抵抗性癌細胞である。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、二本鎖オリゴヌクレオチドは、アントラサイクリン(たとえばドキソルビシン)などの小分子薬物と結合している(たとえば小分子薬物がインターカレートしている)。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本組成物中のナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、キャリアポリペプチドおよび二本鎖オリゴヌクレオチド(DNAなど)を含むナノ粒子を含む組成物であって、キャリアポリペプチドが、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含み、ナノ粒子組成物中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば4:1から約6:1未満、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントが正に荷電している、組成物を提供する。一部の実施形態では、細胞標的化セグメントは、HER3+癌細胞などの癌細胞と結合する。一部の実施形態では、この癌細胞は、化学療法薬抵抗性癌細胞である。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、二本鎖オリゴヌクレオチドは、アントラサイクリン(たとえばドキソルビシン)などの小分子薬物と結合している(たとえば小分子薬物がインターカレートしている)。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本組成物中のナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、キャリアポリペプチドおよび二本鎖オリゴヌクレオチド(DNAなど)を含むナノ粒子を含む組成物であって、キャリアポリペプチドが、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含み、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントが正に荷電している、組成物を提供する。一部の実施形態では、細胞標的化セグメントは、HER3+癌細胞などの癌細胞と結合する。一部の実施形態では、この癌細胞は、化学療法薬抵抗性癌細胞である。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、二本鎖オリゴヌクレオチドは、アントラサイクリン(たとえばドキソルビシン)などの小分子薬物と結合している(たとえば小分子薬物がインターカレートしている)。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本組成物中のナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、キャリアポリペプチドおよび二本鎖オリゴヌクレオチド(DNAなど)を含むナノ粒子を含む組成物であって、キャリアポリペプチドが、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含み、ナノ粒子組成物中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば4:1から約6:1未満、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントが正に荷電しており、細胞標的化セグメントが、ヘレグリンまたはそのバリアントを含む(および一部の実施形態ではヘレグリンまたはそのバリアントである)、組成物を提供する。一部の実施形態では、細胞標的化セグメントは、HER3+癌細胞などの癌細胞と結合する。一部の実施形態では、この癌細胞は、化学療法薬抵抗性癌細胞である。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、二本鎖オリゴヌクレオチドは、アントラサイクリン(たとえばドキソルビシン)などの小分子薬物と結合している(たとえば小分子薬物がインターカレートしている)。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本組成物中のナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、キャリアポリペプチドおよび二本鎖オリゴヌクレオチド(DNAなど)を含むナノ粒子を含む組成物であって、キャリアポリペプチドが、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含み、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントが正に荷電しており、細胞標的化セグメントが、ヘレグリンまたはそのバリアントを含む(および一部の実施形態ではヘレグリンまたはそのバリアントである)、組成物を提供する。一部の実施形態では、細胞標的化セグメントは、HER3+癌細胞などの癌細胞と結合する。一部の実施形態では、この癌細胞は、化学療法薬抵抗性癌細胞である。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、二本鎖オリゴヌクレオチドは、アントラサイクリン(たとえばドキソルビシン)などの小分子薬物と結合している(たとえば小分子薬物がインターカレートしている)。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本組成物中のナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、キャリアポリペプチドおよび二本鎖オリゴヌクレオチド(DNAなど)を含むナノ粒子を含む組成物であって、キャリアポリペプチドが、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含み、ナノ粒子組成物中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば4:1から約6:1未満、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントが、デカリジンを含み(および一部の実施形態ではデカリジンであり)、細胞標的化セグメントが、ヘレグリンまたはそのバリアントを含む(および一部の実施形態ではヘレグリンまたはそのバリアントである)、組成物を提供する。一部の実施形態では、細胞標的化セグメントは、HER3+癌細胞などの癌細胞と結合する。一部の実施形態では、この癌細胞は、化学療法薬抵抗性癌細胞である。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、二本鎖オリゴヌクレオチドは、アントラサイクリン(たとえばドキソルビシン)などの小分子薬物と結合している(たとえば小分子薬物がインターカレートしている)。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本組成物中のナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、キャリアポリペプチドおよび二本鎖オリゴヌクレオチド(DNAなど)を含むナノ粒子を含む組成物であって、キャリアポリペプチドが、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含み、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントが、デカリジンを含み(および一部の実施形態ではデカリジンであり)、細胞標的化セグメントが、ヘレグリンまたはそのバリアントを含む(および一部の実施形態ではヘレグリンまたはそのバリアントである)、組成物を提供する。一部の実施形態では、細胞標的化セグメントは、HER3+癌細胞などの癌細胞と結合する。一部の実施形態では、この癌細胞は、化学療法薬抵抗性癌細胞である。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、二本鎖オリゴヌクレオチドは、アントラサイクリン(たとえばドキソルビシン)などの小分子薬物と結合している(たとえば小分子薬物がインターカレートしている)。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本組成物中のナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、キャリアポリペプチドおよび二本鎖オリゴヌクレオチド(DNAなど)を含むナノ粒子を含む組成物であって、キャリアポリペプチドが、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含み、ナノ粒子組成物中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば4:1から約6:1未満、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントが、デカリジンを含み(および一部の実施形態ではデカリジンであり)、細胞標的化セグメントが、ヘレグリンまたはそのバリアントを含み(および一部の実施形態ではヘレグリンまたはそのバリアントであり)、化学療法薬(ドキソルビシンなど)が、二本鎖オリゴヌクレオチドの中にインターカレートしている、組成物を提供する。一部の実施形態では、細胞標的化セグメントは、HER3+癌細胞などの癌細胞と結合する。一部の実施形態では、この癌細胞は、化学療法薬抵抗性癌細胞である。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、化学療法薬:二本鎖オリゴヌクレオチドのモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本組成物中のナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、キャリアポリペプチドおよび二本鎖オリゴヌクレオチド(DNAなど)を含むナノ粒子を含む組成物であって、キャリアポリペプチドが、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含み、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントであり、オリゴヌクレオチド結合セグメントがデカリジンであり、細胞標的化セグメントがヘレグリンまたはそのバリアントであり、化学療法薬(ドキソルビシンなど)が、二本鎖オリゴヌクレオチドの中にインターカレートしている、組成物を提供する。一部の実施形態では、細胞標的化セグメントは、HER3+癌細胞などの癌細胞と結合する。一部の実施形態では、この癌細胞は、化学療法薬抵抗性癌細胞である。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、化学療法薬:二本鎖オリゴヌクレオチドのモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本組成物中のナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、キャリアポリペプチドおよび二本鎖DNAオリゴヌクレオチドを含むナノ粒子を含む組成物であって、キャリアポリペプチドが、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含み、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約4:1であり、キャリアポリペプチドがHerPBK10であり、ドキソルビシンが、二本鎖オリゴヌクレオチドの中にインターカレートしている、組成物を提供する。一部の実施形態では、細胞標的化セグメントは、HER3+癌細胞などの癌細胞と結合する。一部の実施形態では、この癌細胞は、化学療法薬抵抗性癌細胞である。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、化学療法薬:二本鎖オリゴヌクレオチドのモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本組成物中のナノ粒子の大きさの平均は、約50nm以下である。
ナノ粒子の生産
本明細書中記載のナノ粒子は、複数の二本鎖オリゴヌクレオチドと複数のキャリアポリペプチドを組み合わせることにより、生産することができる。一部の実施形態では、キャリアポリペプチド、二本鎖オリゴヌクレオチド、および任意選択で小分子薬物をインキュベートして、ナノ粒子を形成する。一部の実施形態では、オリゴヌクレオチドを、キャリアポリペプチドと組み合わせる前に、小分子薬物とプレインキュベートする。キャリアポリペプチドおよび二本鎖オリゴヌクレオチドを組み合わせると、ナノ粒子は自然に集合する。
一部の実施形態では、ナノ粒子組成物を作製する方法であって、キャリアポリペプチドおよび二本鎖オリゴヌクレオチドを約6:1未満のモル比で組み合わせることにより、複数のナノ粒子を形成することを含み、キャリアポリペプチドが、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含む、方法を提供する。一部の実施形態では、本方法は、キャリアポリペプチドおよび二本鎖オリゴヌクレオチドを組み合わせる前に、二本鎖オリゴヌクレオチドおよび小分子薬物を組み合わせることをさらに含む。
一部の実施形態では、一本鎖の相補的(または部分的に相補的)なオリゴヌクレオチドをアニールして、二本鎖オリゴヌクレオチドを形成する。オリゴヌクレオチドのアニーリングは、たとえば、おおよそ等モル量の一本鎖オリゴヌクレオチドそれぞれを組み合わせ、オリゴヌクレオチドを(たとえば約90℃以上に)加熱し、この混合物を(たとえばおよそ室温に)冷却することにより、起こり得る。
小分子薬物(化学療法剤、たとえばドキソルビシンなど)は、小分子薬物および二本鎖オリゴヌクレオチドを組み合わせることにより、二本鎖オリゴヌクレオチドに結合することができる。一部の実施形態では、小分子薬物および二本鎖オリゴヌクレオチドは、約60:1以下、約50:1以下、約40:1以下、約30:1以下、約20:1以下、約10:1以下、約5:1以下、約4:1以下、約3:1以下、約2:1以下、または約1:1以下のモル比で組み合わせる。一部の実施形態では、小分子薬物および二本鎖オリゴヌクレオチドは、約1:1〜約60:1、たとえば約1:1〜約10:1、約5:1〜約20:1、約10:1〜約30:1、約20:1〜約40:1、約30:1〜約50:1、または約40:1〜約60:1、約1:1、約1:10、約1:20、約1:30、約1:40、約1:50、または約1:60のモル比で組み合わせる。小分子薬物および二本鎖オリゴヌクレオチドを組み合わせると、小分子薬物は、たとえば二本鎖オリゴヌクレオチドの中にインターカレートすることにより、二本鎖オリゴヌクレオチドに結合する。
任意選択で小分子薬物と結合している二本鎖オリゴヌクレオチドを、キャリアポリペプチドと組み合わせてナノ粒子を形成する。一部の実施形態では、キャリアポリペプチドおよび二本鎖オリゴヌクレオチドは、約6:1未満(たとえば約4:1から約6:1未満、たとえば約4:1〜約4.5:1、約4.5:1〜約5:1、約5:1〜約5.5:1、約5.5:1から約6:1未満、約4:1、約4.5:1、約5:1、または約5.5)のモル比で組み合わせる。一部の実施形態では、キャリアポリペプチドおよび二本鎖オリゴヌクレオチドを、約4℃〜約22℃、たとえば約4℃〜約15℃、または約4℃〜約10℃でインキュベートする。一部の実施形態では、キャリアポリペプチドおよび二本鎖オリゴヌクレオチドを、約30分未満、約30分以上、約1時間以上、または約2時間以上、インキュベートする。二本鎖オリゴヌクレオチドとキャリアポリペプチドを組み合わせた後、ナノ粒子が自然に形成する。
一部の実施形態では、過剰量のオリゴヌクレオチド、小分子薬物、またはキャリアポリペプチドは、ナノ粒子を含む本組成物から除去される。たとえば、一部の実施形態では、ナノ粒子組成物を、サイズ排除クロマトグラフィーなどの精製ステップに供する。一部の実施形態では、未結合の構成要素を、超遠心分離によりナノ粒子から分離する。たとえば、一部の実施形態では、本組成物を、約100kD以下、約80kD以下、約70kD以下、約60kD以下、約50kD以下、約40kD以下、約30kD以下、または約20kD以下の分子量カットオフの遠心分離フィルターに加える。
任意選択で、得られたナノ粒子組成物を、透析、超遠心分離、またはタンジェンシャルフロー・フィルトレーションにより、バッファー交換に供する。一部の実施形態では、ナノ粒子は、たとえば超遠心分子により濃縮される。
一部の実施形態では、ナノ粒子組成物を作製する方法であって、キャリアポリペプチドおよび二本鎖オリゴヌクレオチド(DNAなど)を約6:1未満(たとえば約4:1から約6:1未満、または約4:1)のモル比で組み合わせることにより、複数のナノ粒子を形成することを含み、キャリアポリペプチドが、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含む、方法を提供する。一部の実施形態では、細胞貫通セグメントは、ペントンベースポリペプチドまたはそのバリアントを含む(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントである)。一部の実施形態では、オリゴヌクレオチド結合ドメインは、正に荷電している(デカリジンなど)。一部の実施形態では、細胞標的化ドメインは、ヘレグリンまたはそのバリアントを含む(および一部の実施形態では、ヘレグリンまたはそのバリアントである)。一部の実施形態では、細胞貫通セグメントは、ペントンベースポリペプチドまたはそのバリアントであり、オリゴヌクレオチド結合ドメインは、正に荷電しており(デカリジンなど)、細胞標的化ドメインは、ヘレグリンまたはそのバリアントである。一部の実施形態では、得られた本組成物中のナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、ナノ粒子組成物を作製する方法であって、二本鎖オリゴヌクレオチド(DNAなど)および小分子薬物(化学療法薬、たとえばドキソルビシンなど)を組み合わせることと、キャリアポリペプチドおよび二本鎖オリゴヌクレオチドを約6:1未満(たとえば約4:1から約6:1未満、または約4:1)のモル比で組み合わせることにより、複数のナノ粒子を形成することとを含み、キャリアポリペプチドが、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含む、方法を提供する。一部の実施形態では、細胞貫通セグメントは、ペントンベースポリペプチドまたはそのバリアントを含む(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントである)。一部の実施形態では、オリゴヌクレオチド結合ドメインは、正に荷電している(デカリジンなど)。一部の実施形態では、細胞標的化ドメインは、ヘレグリンまたはそのバリアントを含む(および一部の実施形態では、ヘレグリンまたはそのバリアントである)。一部の実施形態では、細胞貫通セグメントはペントンベースポリペプチドまたはそのバリアントであり、オリゴヌクレオチド結合ドメインは正に荷電しており(デカリジンなど)、細胞標的化ドメインは、ヘレグリンまたはそのバリアントである。一部の実施形態では、得られた本組成物中のナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、ナノ粒子組成物を作製する方法であって、二本鎖オリゴヌクレオチド(DNAなど)および小分子薬物(化学療法薬、たとえばドキソルビシンなど)を組み合わせることと、キャリアポリペプチドおよび二本鎖オリゴヌクレオチドを約6:1未満(たとえば約4:1から6:1未満、または約4:1)のモル比で組み合わせることにより、複数のナノ粒子を形成することと、上記複数のナノ粒子から、未結合のキャリアポリペプチドまたは二本鎖オリゴヌクレオチドを分離することとを含み、キャリアポリペプチドが、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含む、方法を提供する。一部の実施形態では、細胞貫通セグメントは、ペントンベースポリペプチドまたはそのバリアントを含む(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントである)。一部の実施形態では、オリゴヌクレオチド結合ドメインは、正に荷電している(デカリジンなど)。一部の実施形態では、細胞標的化ドメインは、ヘレグリンまたはそのバリアントを含む(および一部の実施形態では、ヘレグリンまたはそのバリアントである)。一部の実施形態では、細胞貫通セグメントはペントンベースポリペプチドまたはそのバリアントであり、オリゴヌクレオチド結合ドメインは正に荷電しており(デカリジンなど)、細胞標的化ドメインは、ヘレグリンまたはそのバリアントである。一部の実施形態では、得られた本組成物中のナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、ナノ粒子組成物を作製する方法であって、二本鎖オリゴヌクレオチド(DNAなど)および小分子薬物(化学療法薬、たとえばドキソルビシンなど)を組み合わせることと、二本鎖オリゴヌクレオチドから未結合の小分子薬物を分離することと、約6:1未満(たとえば約4:1から約6:1未満、または約4:1)のモル比でキャリアポリペプチドおよび二本鎖オリゴヌクレオチドを組み合わせることにより、複数のナノ粒子を形成することと、上記複数のナノ粒子から、未結合のキャリアポリペプチドまたは二本鎖オリゴヌクレオチドを分離することとを含み、キャリアポリペプチドが、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含む、方法を提供する。一部の実施形態では、細胞貫通セグメントは、ペントンベースポリペプチドまたはそのバリアントを含む(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントである)。一部の実施形態では、オリゴヌクレオチド結合ドメインは、正に荷電している(デカリジンなど)。一部の実施形態では、細胞標的化ドメインは、ヘレグリンまたはそのバリアントを含む(および一部の実施形態では、ヘレグリンまたはそのバリアントである)。一部の実施形態では、細胞貫通セグメントは、ペントンベースポリペプチドまたはそのバリアントであり、オリゴヌクレオチド結合ドメインは正に荷電しており(デカリジンなど)、細胞標的化ドメインはヘレグリンまたはそのバリアントである。一部の実施形態では、得られた本組成物中のナノ粒子の大きさの平均は、約50nm以下である。
癌治療
ナノ粒子組成物は、ナノ粒子を含む組成物の有効量を対象に投与することによって癌細胞を殺滅することにより、対象の癌の治療に有用であり得る。キャリアポリペプチドの細胞標的化セグメントは、癌細胞の表面の分子を標的とすることにより、化学療法剤(二本鎖オリゴヌクレオチドに結合できる)を癌細胞に送達することができる。一部の実施形態では、この癌は転移性である。一部の実施形態では、この癌は、本明細書中さらに記載されているように、化学療法薬抵抗性癌である。
一態様では、癌細胞を殺滅する方法であって、癌細胞を複数のナノ粒子と接触させることを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド;ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬を含み、複数のナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満である、方法を提供する。
別の態様では、癌を有する対象を治療する方法であって、ナノ粒子を含むナノ粒子組成物を対象に投与することを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド;ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬を含み、ナノ粒子組成物中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が約6:1未満である、方法を提供する。
別の態様では、癌細胞に化学療法剤を送達する方法であって、癌細胞を複数のナノ粒子と接触させることを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド;ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬を含み、複数のナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が約6:1未満である、方法を提供する。
一部の実施形態では、この癌はHER3+癌である。HER細胞標的化セグメントは、たとえば、ナノ粒子を癌細胞に標的化するために、HER3+癌細胞の表面に存在するHER3に結合することができる。
一部の実施形態では、ナノ粒子を含む組成物の有効量を、グリオーマ、乳癌、卵巣癌、または前立腺癌を治療するために対象に投与する。一部の実施形態では、これら癌のいずれか1つはHER3+である。一部の実施形態では、癌は、プロゲステロン受容体(PR)、エストロゲン受容体(ER)、またはHER2のうちの1つまたは複数に対してネガティブ(たとえばPR−、ER−、HER2−、PR−/ER−など)である。一部の実施形態では、この癌はトリプルネガティブ乳癌である。
一部の実施形態では、ナノ粒子を含む組成物は、グリオーマ細胞、乳癌細胞、卵巣癌細胞、または前立腺癌細胞などの癌細胞を殺滅するために使用する。一部の実施形態では、これら癌細胞のうちのいずれか1つはHER3+である。一部の実施形態では、癌細胞は、プロゲステロン受容体(PR)、エストロゲン受容体(ER)、またはHER2のうちの1つまたは複数に対してネガティブ(たとえばPR−、ER−、HER2−、PR−/ER−など)である。一部の実施形態では、この癌細胞はトリプルネガティブ乳癌細胞である。
一部の実施形態では、本明細書中記載のナノ粒子は、リポソーマルドキソルビシン(または「LipoDox」、たとえば商標名Doxil(登録商標)として販売される組成物)よりも効力が高い。例示的なナノ粒子は、キャリアポリペプチドおよび二本鎖オリゴヌクレオチドを、平均4:1から約6:1未満のモル比(キャリアポリペプチド対二本鎖オリゴヌクレオチド)で含み、小分子薬物(ドキソルビシンなど)を、平均約1:1〜約60:1のモル比(小分子薬物対オリゴヌクレオチド)で含む。たとえば、一部の実施形態では、ナノ粒子は、キャリアポリペプチドおよび二本鎖オリゴヌクレオチドを、平均約4:1のモル比(キャリアポリペプチド対二本鎖オリゴヌクレオチド)で含み、かつ、小分子薬物(ドキソルビシンなど)を、平均約10:1のモル比(小分子薬物:オリゴヌクレオチド)で含む。別の例では、一部の実施形態では、ナノ粒子は、キャリアポリペプチドおよび二本鎖オリゴヌクレオチドを、平均約4:1のモル比(キャリアポリペプチド:二本鎖オリゴヌクレオチド)で含み、かつ、小分子薬物(ドキソルビシンなど)を、平均約40:1のモル比(小分子薬物:オリゴヌクレオチド)で含む。
一部の実施形態では、癌細胞は、薬物の存在下で増殖する。一部の実施形態では、癌細胞の培養物は、薬物の存在下で縮小しない。一部の実施形態では、癌細胞は、薬物の存在下で殺滅されない。一部の実施形態では、癌細胞株の相対的な細胞の生存は、同じ癌細胞タイプの非薬物抵抗性細胞株が約0.5以下(たとえば約0.4以下、約0.3以下、または約0.2以下)の相対的な細胞生存を有する用量および時間の長さで、約0.7以上(たとえば約0.8以上、または約0.9以上)である。
一部の実施形態では、治療または殺滅すべき癌または癌細胞は、小分子薬物または抗体などの化学療法薬に非応答性である。一部の実施形態では、治療または殺滅すべき癌または癌細胞は、リポソーマルアントラサイクリンなどの化学療法薬のリポソーム製剤に非応答性である。一部の実施形態では、治療または殺滅すべき癌または癌細胞は、HER2+抗体化学療法剤、ラパチニブ、またはアントラサイクリンに対して非応答性である。一部の実施形態では、治療または殺滅すべき癌または癌細胞は、ドキソルビシン(ナノ粒子ドキソルビシンの形態、たとえばリポソーマルドキソルビシン、または非ナノ粒子製剤のドキソルビシンであり得る)に対して非応答性である。一部の実施形態では、治療または殺滅すべき癌または癌細胞は、ラパチニブに対して非応答性である。一部の実施形態では、治療または殺滅すべき癌または癌細胞は、トラスツズマブおよび/またはペルツズマブに対して非応答性である。
一部の実施形態では、記載の方法は、化学療法剤に対して非応答性である癌を有する対象を同定することと、本明細書中記載のナノ粒子を含む組成物の有効量を投与することとを含む。一部の実施形態では、癌または癌細胞は、抗HER2治療(抗HER2抗体、またはHER2の小分子阻害剤(たとえばラパチニブ))に対して非応答性である。一部の実施形態では、癌または癌細胞は、トラスツズマブおよび/またはペルツズマブなどの抗HER2抗体の治療に対して非応答性である。一部の実施形態では、癌または癌細胞は、ドキソルビシン(ドキソルビシンのリポソーム製剤、またはドキソルビシンの非ナノ粒子製剤など)に対して非応答性である。
一部の実施形態では、本明細書中記載のナノ粒子は、HER3+癌細胞、たとえばMDA−MB−435細胞の殺滅において、リポソーマルドキソルビシンよりも有効である。一部の実施形態では、本明細書中記載のナノ粒子は、HER3+癌細胞(MDA−MB−435細胞など)の殺滅に関して約10μM未満、たとえば約5μM未満のIC50を有する。一部の実施形態では、本明細書中記載のナノ粒子は、HER3+癌細胞(MDA−MB−435細胞など)の殺滅に関して、約2μM〜約10μMのIC50を有する。
一部の実施形態では、本明細書中記載のナノ粒子は、乳癌細胞、たとえばBT474乳癌細胞またはJIMT1乳癌細胞の殺滅において、リポソーマルドキソルビシンよりも有効である。一部の実施形態では、本明細書中記載のナノ粒子は、乳癌細胞(BT474乳癌細胞またはJIMT1乳癌細胞など)の殺滅に関して約10μM未満、たとえば約5μM未満、約1μM未満、または約0.5μM未満のIC50を有する。一部の実施形態では、本明細書中記載のナノ粒子は、乳癌細胞(BT474乳癌細胞またはJIMT1乳癌細胞など)の殺滅に関して約0.1μM〜約10μM、たとえば約0.5μM〜約10μM、または約0.5μM〜約1μMのIC50を有する。
一部の実施形態では、本明細書中記載のナノ粒子は、トリプルネガティブ乳癌細胞、たとえば4T1トリプルネガティブ乳癌細胞の殺滅において、リポソーマルドキソルビシンよりも有効である。一部の実施形態では、本明細書中記載のナノ粒子は、トリプルネガティブ乳癌細胞(4T1トリプルネガティブ乳癌細胞など)の殺滅に関して約10μM未満、たとえば約5μM未満、約1μM未満、または約0.5μM未満のIC50を有する。一部の実施形態では、本明細書中記載のナノ粒子は、トリプルネガティブ乳癌細胞(4T1トリプルネガティブ乳癌細胞など)の殺滅に関して約0.1μM〜約10μM、たとえば約0.5μM〜約10μM、または約0.5μM〜約1μMのIC50を有する。
一部の実施形態では、本明細書中記載のナノ粒子は、グリオーマ細胞、たとえばU251グリオーマ細胞の殺滅において、リポソーマルドキソルビシンよりも有効である。一部の実施形態では、本明細書中記載のナノ粒子は、グリオーマ細胞(U251グリオーマ細胞など)の殺滅に関して約10μM未満、たとえば約5μM未満、約1μM未満、または約0.5μM未満のIC50を有する。一部の実施形態では、本明細書中記載のナノ粒子は、グリオーマ細胞(U251グリオーマ細胞など)の殺滅に関して約0.1μM〜約10μM、たとえば約0.5μM〜約10μM、または約0.5μM〜約1μMのIC50を有する。
一部の実施形態では、本明細書中記載のナノ粒子は、卵巣癌細胞、たとえばSKOV3卵巣癌細胞の殺滅において、リポソーマルドキソルビシンよりも有効である。一部の実施形態では、本明細書中記載のナノ粒子は、卵巣癌細胞(SKOV3卵巣癌細胞など)の殺滅に関して約10μM未満、たとえば約5μM未満、または約1μM未満のIC50を有する。一部の実施形態では、本明細書中記載のナノ粒子は、卵巣癌細胞(SKOV3卵巣癌細胞など)の殺滅に関して約0.1μM〜約10μM、たとえば約0.5μM〜約10μM、または約0.5μM〜約1μMのIC50を有する。
一部の実施形態では、本明細書中記載のナノ粒子は、前立腺癌細胞、たとえばLNCaP−GFP前立腺癌細胞の殺滅において、リポソーマルドキソルビシンよりも有効である。一部の実施形態では、本明細書中記載のナノ粒子は、前立腺癌細胞(LNCaP−GFP前立腺癌細胞など)の殺滅に関して約10μM未満、たとえば約5μM未満、約1μM未満、または約0.5μM未満のIC50を有する。一部の実施形態では、本明細書中記載のナノ粒子は、前立腺癌細胞(LNCaP−GFP前立腺癌細胞など)の殺滅に関して約0.1μM〜約10μM、たとえば約0.5μM〜約10μM、または約0.5μM〜約1μMのIC50を有する。
一部の実施形態では、本明細書中記載のナノ粒子は、転移性癌細胞、たとえば骨転移性前立腺癌細胞(たとえばRANKLヒト骨転移性前立腺癌細胞)の殺滅において、リポソーマルドキソルビシンよりも有効である。一部の実施形態では、本明細書中記載のナノ粒子は、転移性癌細胞、たとえば骨転移性前立腺癌細胞(たとえばRANKLヒト骨転移性前立腺癌細胞)の殺滅に関して約10μM未満、たとえば約5μM未満、約1μM未満、または約0.5μM未満のIC50を有する。一部の実施形態では、本明細書中記載のナノ粒子は、転移性癌細胞、たとえば骨転移性前立腺癌細胞(たとえばRANKLヒト骨転移性前立腺癌細胞)の殺滅に関して約0.1μM〜約10μM、たとえば約0.5μM〜約10μM、または約0.5μM〜約1μMのIC50を有する。
一部の実施形態では、癌を有する対象を治療する方法は、放射線療法または外科手術などの二次的な治療をさらに含む。よって、一部の実施形態では、本明細書中記載のナノ粒子を含む組成物は、ネオアジュバント療法および/またはアジュバント療法として、癌を有する対象に投与される。たとえば、一部の実施形態では、トラスツズマブおよび/またはペルツズマブを、本明細書中記載のナノ粒子組成物を投与することを含む抗癌療法に対するアジュバントとして、使用する。
一部の実施形態では、対象は、本明細書中記載のナノ粒子の投与の前に、化学療法または放射線療法を経験していない。一部の実施形態では、対象は、化学療法または放射線療法を経験している。
一部の実施形態では、本明細書中記載のナノ粒子組成物を対象に投与する。一部の実施形態では、ナノ粒子組成物を、標的とする細胞へin vivoで送達するために、対象に投与する。一般的に、ナノ粒子組成物の用量および投与経路は、標準的な医薬の実務に従い、対象の体格状態によって決定される。一部の実施形態では、ナノ粒子組成物を、経口投与、経皮投与、吸入による投与、静脈内投与、動脈内投与、筋肉内投与、創傷部位への直接的な適用、外科施術部位への適用、腹腔内投与、坐薬による投与、皮下投与、皮内投与、経皮投与、吸入投与、胸膜内投与、脳室内投与、関節内投与、眼内投与、または脊髄内投与を含むいずれかの経路を介して、対象に投与する。一部の実施形態では、本組成物を、対象に静脈内投与する。
一部の実施形態では、本ナノ粒子組成物の投与量は、単回用量または反復用量である。一部の実施形態では、用量を、1日1回、1日2回、1日3回、または1日4回以上対象に提供する。一部の実施形態では、約1回以上(たとえば約2回以上、約3回以上、約4回以上、約5回以上、約6回以上、または約7回以上)の用量を1週間で提供する。一部の実施形態では、本組成物を、1週間に1回、2週間ごとに1回、3週間ごとに1回、4週間ごとに1回、3週間のうち2週間の間週1回、または4週間のうち3週間の間週1回、投与する。一部の実施形態では、複数回の用量を、数日、数週間、数ケ月、または数年にわたり提供する。一部の実施形態では、一連の治療は、約1回以上の投与(たとえば約2回以上の投与、約3回以上の投与、約4回以上の投与、約5回以上の投与、約7回以上の投与、約10回以上の投与、約15回以上の投与、約25回以上の投与、約40回以上の投与、約50回以上の投与、または約100回以上の投与)である。
一部の実施形態では、投与されるナノ粒子組成物の用量は、約200mg/m2以下の小分子薬物(ドキソルビシンなど)、約150mg/m2以下の小分子薬物(ドキソルビシンなど)、約100mg/m2以下の小分子薬物(ドキソルビシンなど)、約80mg/m2以下の小分子薬物(ドキソルビシンなど)、約70mg/m2以下の小分子薬物(ドキソルビシンなど)、約60mg/m2以下の小分子薬物(ドキソルビシンなど)、約50mg/m2以下の小分子薬物(ドキソルビシンなど)、約40mg/m2以下の小分子薬物(ドキソルビシンなど)、約30mg/m2以下の小分子薬物(ドキソルビシンなど)、約20mg/m2以下の小分子薬物(ドキソルビシンなど)、約15mg/m2以下の小分子薬物(ドキソルビシンなど)、約10mg/m2以下の小分子薬物(ドキソルビシンなど)、約5mg/m2以下の小分子薬物(ドキソルビシンなど)、または約1mg/m2以下の小分子薬物(ドキソルビシンなど)である。一部の実施形態では、投与される本ナノ粒子組成物の用量は、おおよそ同じ治療効果に関してリポソーマルドキソルビシンの用量よりも低い。一部の実施形態では、本ナノ粒子組成物の投与用量は、ほぼ同じ用量のリポソーマルドキソルビシンの治療効果と比較して、増大した治療効果を提供する。
一部の実施形態では、癌を有する対象を治療する方法であって、ナノ粒子を含むナノ粒子組成物を対象に投与することを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、ナノ粒子組成物中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば4:1から約6:1未満、または約4:1)である、方法を提供する。一部の実施形態では、この癌はHER3+癌である。一部の実施形態では、この癌は、乳癌(トリプルネガティブ乳癌など)、グリオーマ、卵巣癌、または前立腺癌であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本組成物中のナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌を有する対象を治療する方法であって、ナノ粒子を含むナノ粒子組成物を対象に投与することを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)である、方法を提供する。一部の実施形態では、この癌はHER3+癌である。一部の実施形態では、この癌は乳癌(トリプルネガティブ乳癌など)、グリオーマ、卵巣癌、または前立腺癌であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本組成物中のナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌を有する対象を治療する方法であって、ナノ粒子を含むナノ粒子組成物を対象に投与することを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、ナノ粒子組成物中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば4:1から約6:1未満、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含む(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントである)、方法を提供する。一部の実施形態では、この癌はHER3+癌である。一部の実施形態では、この癌は乳癌(トリプルネガティブ乳癌など)、グリオーマ、卵巣癌、または前立腺癌であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本組成物中のナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌を有する対象を治療する方法であって、ナノ粒子を含むナノ粒子組成物を対象に投与することを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含む(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントである)、方法を提供する。一部の実施形態では、この癌はHER3+癌である。一部の実施形態では、この癌は乳癌(トリプルネガティブ乳癌など)、グリオーマ、卵巣癌、または前立腺癌であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本組成物中のナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌を有する対象を治療する方法であって、ナノ粒子を含むナノ粒子組成物を対象に投与することを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、ナノ粒子組成物中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば4:1から約6:1未満、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントが正に荷電している、方法を提供する。一部の実施形態では、この癌はHER3+癌である。一部の実施形態では、この癌は乳癌(トリプルネガティブ乳癌など)、グリオーマ、卵巣癌、または前立腺癌であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本組成物中のナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌を有する対象を治療する方法であって、ナノ粒子を含むナノ粒子組成物を対象に投与することを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントが正に荷電している、方法を提供する。一部の実施形態では、この癌はHER3+癌である。一部の実施形態では、この癌は乳癌(トリプルネガティブ乳癌など)、グリオーマ、卵巣癌、または前立腺癌であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本組成物中のナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌を有する対象を治療する方法であって、ナノ粒子を含むナノ粒子組成物を対象に投与することを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、ナノ粒子組成物中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば4:1から約6:1未満、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントが正に荷電しており、細胞標的化セグメントが、ヘレグリンまたはそのバリアントを含む(および一部の実施形態では、ヘレグリンまたはそのバリアントである)、方法を提供する。一部の実施形態では、この癌はHER3+癌である。一部の実施形態では、この癌は乳癌(トリプルネガティブ乳癌など)、グリオーマ、卵巣癌、または前立腺癌であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本組成物中のナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌を有する対象を治療する方法であって、ナノ粒子を含むナノ粒子組成物を対象に投与することを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントが正に荷電しており、細胞標的化セグメントが、ヘレグリンまたはそのバリアントを含む(および一部の実施形態では、ヘレグリンまたはそのバリアントである)、方法を提供する。一部の実施形態では、この癌はHER3+癌である。一部の実施形態では、この癌は乳癌(トリプルネガティブ乳癌など)、グリオーマ、卵巣癌、または前立腺癌であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本組成物中のナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌を有する対象を治療する方法であって、ナノ粒子を含むナノ粒子組成物を対象に投与することを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、ナノ粒子組成物中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば4:1から約6:1未満、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントがデカリジンを含み(および一部の実施形態ではデカリジンであり)、細胞標的化セグメントが、ヘレグリンまたはそのバリアントを含む(および一部の実施形態では、ヘレグリンまたはそのバリアントである)、方法を提供する。一部の実施形態では、この癌はHER3+癌である。一部の実施形態では、この癌は乳癌(トリプルネガティブ乳癌など)、グリオーマ、卵巣癌、または前立腺癌であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本組成物中のナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌を有する対象を治療する方法であって、ナノ粒子を含むナノ粒子組成物を対象に投与することを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントがデカリジンを含み(および一部の実施形態ではデカリジンであり)、細胞標的化セグメントが、ヘレグリンまたはそのバリアントを含む(および一部の実施形態では、ヘレグリンまたはそのバリアントである)、方法を提供する。一部の実施形態では、この癌はHER3+癌である。一部の実施形態では、この癌は乳癌(トリプルネガティブ乳癌など)、グリオーマ、卵巣癌、または前立腺癌であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本組成物中のナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌を有する対象を治療する方法であって、ナノ粒子を含むナノ粒子組成物を対象に投与することを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、ナノ粒子組成物中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば4:1から約6:1未満、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントがデカリジンを含み(および一部の実施形態ではデカリジンであり)、細胞標的化セグメントが、ヘレグリンまたはそのバリアントを含み(および一部の実施形態では、ヘレグリンまたはそのバリアントであり)、化学療法薬(ドキソルビシンなど)が、二本鎖オリゴヌクレオチドの中にインターカレートしている、方法を提供する。一部の実施形態では、この癌はHER3+癌である。一部の実施形態では、この癌は乳癌(トリプルネガティブ乳癌など)、グリオーマ、卵巣癌、または前立腺癌であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本組成物中のナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌を有する対象を治療する方法であって、ナノ粒子を含むナノ粒子組成物を対象に投与することを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントがデカリジンを含み(および一部の実施形態ではデカリジンであり)、細胞標的化セグメントが、ヘレグリンまたはそのバリアントを含み(および一部の実施形態では、ヘレグリンまたはそのバリアントであり)、化学療法薬(ドキソルビシンなど)が、二本鎖オリゴヌクレオチドの中にインターカレートしている、方法を提供する。一部の実施形態では、この癌はHER3+癌である。一部の実施形態では、この癌は乳癌(トリプルネガティブ乳癌など)、グリオーマ、卵巣癌、または前立腺癌であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本組成物中のナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌を有する対象を治療する方法であって、ナノ粒子を含むナノ粒子組成物を対象に投与することを含み、上記ナノ粒子が、キャリアポリペプチドおよび二本鎖DNAオリゴヌクレオチドを含み、キャリアポリペプチドが、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含み、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が約4:1であり、キャリアポリペプチドがHerPBK10であり、ドキソルビシンが二本鎖オリゴヌクレオチドの中にインターカレートしている、方法を提供する。一部の実施形態では、この癌はHER3+癌である。一部の実施形態では、この癌は乳癌(トリプルネガティブ乳癌など)、グリオーマ、卵巣癌、または前立腺癌であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本組成物中のナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌細胞を殺滅する方法であって、癌細胞を複数のナノ粒子と接触させることを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、複数のナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば4:1から約6:1未満、または約4:1)である、方法を提供する。一部の実施形態では、癌細胞はHER3+癌細胞である。一部の実施形態では、癌細胞は、乳癌細胞(トリプルネガティブ乳癌細胞など)、グリアの癌細胞、卵巣癌細胞、または前立腺癌細胞であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、ナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌細胞を殺滅する方法であって、癌細胞を複数のナノ粒子と接触させることを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)である、方法を提供する。一部の実施形態では、癌細胞はHER3+癌細胞である。一部の実施形態では、癌細胞は、乳癌細胞(トリプルネガティブ乳癌細胞など)、グリアの癌細胞、卵巣癌細胞、または前立腺癌細胞であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、ナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌細胞を殺滅する方法であって、癌細胞を複数のナノ粒子と接触させることを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、複数のナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば4:1から約6:1未満、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含む(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントである)、方法を提供する。一部の実施形態では、癌細胞はHER3+癌細胞である。一部の実施形態では、癌細胞は、乳癌細胞(トリプルネガティブ乳癌細胞など)、グリアの癌細胞、卵巣癌細胞、または前立腺癌細胞であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、ナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌細胞を殺滅する方法であって、癌細胞を複数のナノ粒子と接触させることを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含む(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントである)、方法を提供する。一部の実施形態では、癌細胞はHER3+癌細胞である。一部の実施形態では、癌細胞は、乳癌細胞(トリプルネガティブ乳癌細胞など)、グリアの癌細胞、卵巣癌細胞、または前立腺癌細胞であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、ナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌細胞を殺滅する方法であって、癌細胞を複数のナノ粒子と接触させることを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、複数のナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば4:1から約6:1未満、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントが、正に荷電している、方法を提供する。一部の実施形態では、癌細胞はHER3+癌細胞である。一部の実施形態では、癌細胞は、乳癌細胞(トリプルネガティブ乳癌細胞など)、グリアの癌細胞、卵巣癌細胞、または前立腺癌細胞であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、ナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌細胞を殺滅する方法であって、癌細胞を複数のナノ粒子と接触させることを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントが、正に荷電している、方法を提供する。一部の実施形態では、癌細胞はHER3+癌細胞である。一部の実施形態では、癌細胞は、乳癌細胞(トリプルネガティブ乳癌細胞など)、グリアの癌細胞、卵巣癌細胞、または前立腺癌細胞であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、ナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌細胞を殺滅する方法であって、癌細胞を複数のナノ粒子と接触させることを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、複数のナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば4:1から約6:1未満、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントが、正に荷電しており、細胞標的化セグメントが、ヘレグリンまたはそのバリアントを含む(および一部の実施形態では、ヘレグリンまたはそのバリアントである)、方法を提供する。一部の実施形態では、癌細胞はHER3+癌細胞である。一部の実施形態では、癌細胞は、乳癌細胞(トリプルネガティブ乳癌細胞など)、グリアの癌細胞、卵巣癌細胞、または前立腺癌細胞であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、ナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌細胞を殺滅する方法であって、癌細胞を複数のナノ粒子と接触させることを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントが、正に荷電しており、細胞標的化セグメントが、ヘレグリンまたはそのバリアントを含む(および一部の実施形態では、ヘレグリンまたはそのバリアントである)、方法を提供する。一部の実施形態では、癌細胞はHER3+癌細胞である。一部の実施形態では、癌細胞は、乳癌細胞(トリプルネガティブ乳癌細胞など)、グリアの癌細胞、卵巣癌細胞、または前立腺癌細胞であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、ナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌細胞を殺滅する方法であって、癌細胞を複数のナノ粒子と接触させることを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、複数のナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば4:1から約6:1未満、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントが、デカリジンを含み(および一部の実施形態ではデカリジンであり)、細胞標的化セグメントが、ヘレグリンまたはそのバリアントを含む(および一部の実施形態では、ヘレグリンまたはそのバリアントである)、方法を提供する。一部の実施形態では、癌細胞はHER3+癌細胞である。一部の実施形態では、癌細胞は、乳癌細胞(トリプルネガティブ乳癌細胞など)、グリアの癌細胞、卵巣癌細胞、または前立腺癌細胞であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、ナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌細胞を殺滅する方法であって、癌細胞を複数のナノ粒子と接触させることを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントが、デカリジンを含み(および一部の実施形態ではデカリジンであり)、細胞標的化セグメントが、ヘレグリンまたはそのバリアントを含む(および一部の実施形態では、ヘレグリンまたはそのバリアントである)、方法を提供する。一部の実施形態では、癌細胞はHER3+癌細胞である。一部の実施形態では、癌細胞は、乳癌細胞(トリプルネガティブ乳癌細胞など)、グリアの癌細胞、卵巣癌細胞、または前立腺癌細胞であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、ナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌細胞を殺滅する方法であって、癌細胞を複数のナノ粒子と接触させることを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、複数のナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば4:1から約6:1未満、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントが、デカリジンを含み(および一部の実施形態ではデカリジンであり)、細胞標的化セグメントが、ヘレグリンまたはそのバリアントを含み(および一部の実施形態では、ヘレグリンまたはそのバリアントであり)、化学療法薬(ドキソルビシンなど)が、二本鎖オリゴヌクレオチドの中にインターカレートしている、方法を提供する。一部の実施形態では、癌細胞はHER3+癌細胞である。一部の実施形態では、癌細胞は、乳癌細胞(トリプルネガティブ乳癌細胞など)、グリアの癌細胞、卵巣癌細胞、または前立腺癌細胞であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、ナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌細胞を殺滅する方法であって、癌細胞を複数のナノ粒子と接触させることを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントが、デカリジンを含み(および一部の実施形態ではデカリジンであり)、細胞標的化セグメントが、ヘレグリンまたはそのバリアントを含み(および一部の実施形態では、ヘレグリンまたはそのバリアントであり)、化学療法薬(ドキソルビシンなど)が、二本鎖オリゴヌクレオチドの中にインターカレートしている、方法を提供する。一部の実施形態では、癌細胞はHER3+癌細胞である。一部の実施形態では、癌細胞は、乳癌細胞(トリプルネガティブ乳癌細胞など)、グリアの癌細胞、卵巣癌細胞、または前立腺癌細胞であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、ナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌細胞を殺滅する方法であって、癌細胞を複数のナノ粒子と接触させることを含み、上記ナノ粒子が、キャリアポリペプチドおよび二本鎖DNAオリゴヌクレオチドを含み、キャリアポリペプチドが、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含み、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が約4:1であり、キャリアポリペプチドがHerPBK10であり、ドキソルビシンが、二本鎖オリゴヌクレオチドの中にインターカレートしている、方法を提供する。一部の実施形態では、癌細胞はHER3+癌細胞である。一部の実施形態では、癌細胞は、乳癌細胞(トリプルネガティブ乳癌細胞など)、グリアの癌細胞、卵巣癌細胞、または前立腺癌細胞であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、ナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌細胞に化学療法剤を送達する方法であって、癌細胞を複数のナノ粒子と接触させることを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、複数のナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば4:1から約6:1未満、または約4:1)である、方法を提供する。一部の実施形態では、癌細胞はHER3+癌細胞である。一部の実施形態では、癌細胞は、乳癌細胞(トリプルネガティブ乳癌細胞など)、グリアの癌細胞、卵巣癌細胞、または前立腺癌細胞であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、ナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌細胞に化学療法剤を送達する方法であって、癌細胞を複数のナノ粒子と接触させることを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)である、方法を提供する。一部の実施形態では、癌細胞はHER3+癌細胞である。一部の実施形態では、癌細胞は、乳癌細胞(トリプルネガティブ乳癌細胞など)、グリアの癌細胞、卵巣癌細胞、または前立腺癌細胞であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、ナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌細胞に化学療法剤を送達する方法であって、癌細胞を複数のナノ粒子と接触させることを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、複数のナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば4:1から約6:1未満、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含む(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントである)、方法を提供する。一部の実施形態では、癌細胞はHER3+癌細胞である。一部の実施形態では、癌細胞は、乳癌細胞(トリプルネガティブ乳癌細胞など)、グリアの癌細胞、卵巣癌細胞、または前立腺癌細胞であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、ナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌細胞に化学療法剤を送達する方法であって、癌細胞を複数のナノ粒子と接触させることを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含む(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントである)、方法を提供する。一部の実施形態では、癌細胞はHER3+癌細胞である。一部の実施形態では、癌細胞は、乳癌細胞(トリプルネガティブ乳癌細胞など)、グリアの癌細胞、卵巣癌細胞、または前立腺癌細胞であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、ナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌細胞に化学療法剤を送達する方法であって、癌細胞を複数のナノ粒子と接触させることを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、複数のナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば4:1から約6:1未満、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントが、正に荷電している、方法を提供する。一部の実施形態では、癌細胞はHER3+癌細胞である。一部の実施形態では、癌細胞は、乳癌細胞(トリプルネガティブ乳癌細胞など)、グリアの癌細胞、卵巣癌細胞、または前立腺癌細胞であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、ナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌細胞に化学療法剤を送達する方法であって、癌細胞を複数のナノ粒子と接触させることを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントが、正に荷電している、方法を提供する。一部の実施形態では、癌細胞はHER3+癌細胞である。一部の実施形態では、癌細胞は、乳癌細胞(トリプルネガティブ乳癌細胞など)、グリアの癌細胞、卵巣癌細胞、または前立腺癌細胞であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、ナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌細胞に化学療法剤を送達する方法であって、癌細胞を複数のナノ粒子と接触させることを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、複数のナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば4:1から約6:1未満、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントが、正に荷電しており、細胞標的化セグメントが、ヘレグリンまたはそのバリアントを含む(および一部の実施形態では、ヘレグリンまたはそのバリアントである)、方法を提供する。一部の実施形態では、癌細胞はHER3+癌細胞である。一部の実施形態では、癌細胞は、乳癌細胞(トリプルネガティブ乳癌細胞など)、グリアの癌細胞、卵巣癌細胞、または前立腺癌細胞であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、ナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌細胞に化学療法剤を送達する方法であって、癌細胞を複数のナノ粒子と接触させることを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントが、正に荷電しており、細胞標的化セグメントが、ヘレグリンまたはそのバリアントを含む(および一部の実施形態では、ヘレグリンまたはそのバリアントである)、方法を提供する。一部の実施形態では、癌細胞はHER3+癌細胞である。一部の実施形態では、癌細胞は、乳癌細胞(トリプルネガティブ乳癌細胞など)、グリアの癌細胞、卵巣癌細胞、または前立腺癌細胞であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、ナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌細胞に化学療法剤を送達する方法であって、癌細胞を複数のナノ粒子と接触させることを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、複数のナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば4:1から約6:1未満、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントが、デカリジンを含み(および一部の実施形態では、デカリジンであり)、細胞標的化セグメントが、ヘレグリンまたはそのバリアントを含む(および一部の実施形態では、ヘレグリンまたはそのバリアントである)、方法を提供する。一部の実施形態では、癌細胞はHER3+癌細胞である。一部の実施形態では、癌細胞は、乳癌細胞(トリプルネガティブ乳癌細胞など)、グリアの癌細胞、卵巣癌細胞、または前立腺癌細胞であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、ナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌細胞に化学療法剤を送達する方法であって、癌細胞を複数のナノ粒子と接触させることを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントが、デカリジンを含み(および一部の実施形態では、デカリジンであり)、細胞標的化セグメントが、ヘレグリンまたはそのバリアントを含む(および一部の実施形態では、ヘレグリンまたはそのバリアントである)、方法を提供する。一部の実施形態では、癌細胞はHER3+癌細胞である。一部の実施形態では、癌細胞は、乳癌細胞(トリプルネガティブ乳癌細胞など)、グリアの癌細胞、卵巣癌細胞、または前立腺癌細胞であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、ナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌細胞に化学療法剤を送達する方法であって、癌細胞を複数のナノ粒子と接触させることを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、複数のナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば4:1から約6:1未満、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントが、デカリジンを含み(および一部の実施形態では、デカリジンであり)、細胞標的化セグメントが、ヘレグリンまたはそのバリアントを含み(および一部の実施形態では、ヘレグリンまたはそのバリアントであり)、化学療法薬(ドキソルビシンなど)が、二本鎖オリゴヌクレオチドの中にインターカレートしている、方法を提供する。一部の実施形態では、癌細胞はHER3+癌細胞である。一部の実施形態では、癌細胞は、乳癌細胞(トリプルネガティブ乳癌細胞など)、グリアの癌細胞、卵巣癌細胞、または前立腺癌細胞であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、ナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌細胞に化学療法剤を送達する方法であって、癌細胞を複数のナノ粒子と接触させることを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)であり、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントが、デカリジンを含み(および一部の実施形態では、デカリジンであり)、細胞標的化セグメントが、ヘレグリンまたはそのバリアントを含み(および一部の実施形態では、ヘレグリンまたはそのバリアントであり)、化学療法薬(ドキソルビシンなど)が、二本鎖オリゴヌクレオチドの中にインターカレートしている、方法を提供する。一部の実施形態では、癌細胞はHER3+癌細胞である。一部の実施形態では、癌細胞は、乳癌細胞(トリプルネガティブ乳癌細胞など)、グリアの癌細胞、卵巣癌細胞、または前立腺癌細胞であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、ナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、癌細胞に化学療法剤を送達する方法であって、癌細胞を複数のナノ粒子と接触させることを含み、上記ナノ粒子が、キャリアポリペプチドおよび二本鎖DNAオリゴヌクレオチドを含み、キャリアポリペプチドが、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含み、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が約4:1であり、キャリアアポリペプチドがHerPBK10であり、ドキソルビシンが、二本鎖オリゴヌクレオチドの中にインターカレートしている、方法を提供する。一部の実施形態では、癌細胞はHER3+癌細胞である。一部の実施形態では、癌細胞は、乳癌細胞(トリプルネガティブ乳癌細胞など)、グリアの癌細胞、卵巣癌細胞、または前立腺癌細胞であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、ナノ粒子の大きさの平均は、約50nm以下である。
薬物抵抗性癌を治療する方法
また、ナノ粒子組成物は、化学療法薬抵抗性癌の殺滅および化学療法薬抵抗性癌を有する対象の治療に有用であり得る。一部の実施形態では、化学療法薬抵抗性癌細胞を殺滅する方法であって、化学療法薬抵抗性癌細胞を複数のナノ粒子と接触させることを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド;ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬を含む、方法を提供する。
一部の実施形態では、化学療法薬抵抗性癌を有する対象を治療する方法であって、複数のナノ粒子を含む組成物を対象に投与することを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド;ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬を含む、方法を提供する。
一部の実施形態では、化学療法薬抵抗性癌に化学療法剤を送達する方法であって、化学療法薬抵抗性癌細胞を複数のナノ粒子と接触させることを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド;ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬を含む、方法を提供する。
また本明細書中記載の方法は、薬物(化学療法剤など)による前治療によって治療時に病状が進行している対象の治療にも有用である。たとえば、対象は、前治療による治療からおよそ1ケ月以内、2ケ月以内、3ケ月以内、4ケ月以内、5ケ月以内、6ケ月以内、7ケ月以内、8ケ月以内、9ケ月以内、10ケ月以内、11ケ月以内、または12ケ月以内に、病状が進行している。一部の実施形態では、癌を有する対象は、前治療による治療に対して、当初応答性であったが、前治療の休止からおよそ6ケ月後、7カ月後、8ケ月後、9カ月後、10カ月後、11カ月後、12カ月後、24カ月後、または36カ月後に、再発癌を発症する。
以下の説明は、例示的な実施形態として、前治療(ドキソルビシンベースの治療など)に対して抵抗性のある対象を説明しているが、本明細書中の説明は、前治療によって病状が進行している対象(たとえば応答できなかったため、および/または毒性のために)、前治療を続行することが適切ではない対象、前治療後に再発癌を有する対象、前治療に対して非応答性の対象、望ましい応答性の度合いが低い対象、および/または増強された応答性を呈する対象にも当てはまると理解される。本明細書中記載の方法は、本明細書中記載のナノ粒子組成物の投与を含む、癌を治療するためのすべての二次治療を含む。
本ナノ粒子は、in vivoまたはin vitroのいずれかで、化学療法薬抵抗性癌細胞を殺滅することができる。また、本ナノ粒子は、たとえば本ナノ粒子を含む組成物を薬物抵抗性癌細胞と混合することにより、in vitroで薬物抵抗性癌細胞を殺滅することができる。キャリアポリペプチドの細胞標的化セグメントは、癌細胞の表面に存在する分子に結合することができる。たとえば、一部の実施形態では、薬物抵抗性癌細胞は、HER3+細胞であり、細胞標的化セグメントは、HER3に結合する。また、本ナノ粒子は、たとえば薬物抵抗性癌を有する対象に本ナノ粒子を含む組成物を投与することにより、化学療法薬抵抗性癌をin vivoで殺滅するために使用することもできる。一部の実施形態では、本ナノ粒子を、たとえば薬物抵抗性癌を有する対象に本ナノ粒子を含む組成物の有効量を投与することにより、上記対象を治療するために使用する。
一部の実施形態では、薬物抵抗性癌は、抗体に対して抵抗性である。たとえば、一部の実施形態では、薬物抵抗性癌は、抗HER2抗体、たとえばトラスツズマブ(商標名Herceptin(登録商標)でも知られている)に対して抵抗性である。一部の実施形態では、薬物抵抗性癌は、ペルツズマブに対して抵抗性である。多くの場合、トラスツズマブまたはペルツズマブは、治療過程の間に、特定の癌のタイプにおいてその有効性を喪失する。このことは、乳癌の治療中に頻繁に起こる。しかしながら、記載のナノ粒子は、トラスツズマブ抵抗性癌細胞またはペルツズマブ抵抗性癌細胞をなおも標的とすることができ、よって、これら癌細胞の殺滅、またはトラスツズマブ抵抗性癌もしくはペルツズマブ抵抗性癌を有する患者の治療に有効である。
一部の実施形態では、本明細書中記載のナノ粒子は、リポソーマルドキソルビシンに抵抗性がある癌の治療に有効である。一部の実施形態では、本ナノ粒子は、HER2抗体(たとえばトラスツズマブまたはペルツズマブ)抵抗性癌の殺滅に有効である。一部の実施形態では、本ナノ粒子は、HER2抗体(たとえばトラスツズマブまたはペルツズマブ)抵抗性癌細胞、たとえばトラスツズマブ抵抗性BT474−TR乳癌細胞の殺滅に、リポソーマルドキソルビシンよりも有効である。一部の実施形態では、本明細書中記載のナノ粒子は、HER2抗体(たとえばトラスツズマブ)抵抗性乳癌細胞(たとえばトラスツズマブ抵抗性BT474−TR乳癌細胞)の殺滅に関して約10μM未満、たとえば約5μM未満、約1μM未満、または約0.5μM未満のIC50を有する。一部の実施形態では、本明細書中記載のナノ粒子は、HER2抗体(たとえばトラスツズマブ)抵抗性乳癌細胞(たとえばトラスツズマブ抵抗性BT474−TR乳癌細胞)の殺滅に関して約0.01μM〜約10μM、たとえば約0.1μM〜約1μM、または約0.5μM〜約1μMのIC50を有する。
一部の実施形態では、薬物抵抗性癌は、小分子化学療法剤、たとえばアントラサイクリン(たとえば、商標名Adriamycin(登録商標)でも知られている、ドキソルビシン)、またはチロシンキナーゼ阻害剤(たとえばラパチニブ)に抵抗性である。一部の実施形態では、薬物抵抗性癌は、LipoDoxに対して抵抗性である。
本明細書中記載のナノ粒子は、リポソーマルドキソルビシンとしてのドキソルビシンの当量で、ドキソルビシン抵抗性細胞株の細胞死を増大させ、このことは、本ナノ粒子が、ドキソルビシンに抵抗性を呈する患者の治療においてリポソーマルドキソルビシンよりも有効であることを表している。一部の実施形態では、本明細書中記載のナノ粒子は、小分子化学療法剤、たとえばドキソルビシンに対して抵抗性がある癌細胞(たとえば、A2780−ADRアドリアマイシン抵抗性のヒト卵巣癌細胞)の殺滅に、リポソーマルドキソルビシンよりも有効である。
一部の実施形態では、化学療法薬抵抗性癌を有する対象を治療する方法であって、ナノ粒子を含むナノ粒子組成物を対象に投与することを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含む、方法を提供する。一部の実施形態では、この癌はHER3+癌である。一部の実施形態では、この癌は乳癌(トリプルネガティブ乳癌など)、グリオーマ、卵巣癌、または前立腺癌であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、化学療法薬抵抗性癌は、HER2+抗体(たとえばトラスツズマブまたはペルツズマブ)、アントラサイクリン(ドキソルビシンなど)、またはチロシンキナーゼ阻害剤(ラパチニブなど)に対して抵抗性である。一部の実施形態では、ナノ粒子組成物中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比は、約6:1未満(たとえば4:1から約6:1未満、または約4:1)である。一部の実施形態では、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比は、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)である。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本組成物中のナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、化学療法薬抵抗性癌を有する対象を治療する方法であって、ナノ粒子を含むナノ粒子組成物を対象に投与することを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含む(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントである)、方法を提供する。一部の実施形態では、この癌はHER3+癌である。一部の実施形態では、この癌は乳癌(トリプルネガティブ乳癌など)、グリオーマ、卵巣癌、または前立腺癌であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、化学療法薬抵抗性癌は、HER2+抗体(たとえばトラスツズマブまたはペルツズマブ)、アントラサイクリン(ドキソルビシンなど)、またはチロシンキナーゼ阻害剤(ラパチニブなど)に対して抵抗性である。一部の実施形態では、ナノ粒子組成物中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比は、約6:1未満(たとえば4:1から約6:1未満、または約4:1)である。一部の実施形態では、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比は、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)である。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本組成物中のナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、化学療法薬抵抗性癌を有する対象を治療する方法であって、ナノ粒子を含むナノ粒子組成物を対象に投与することを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントが、正に荷電している、方法を提供する。一部の実施形態では、この癌はHER3+癌である。一部の実施形態では、化学療法薬抵抗性癌は、HER2+抗体(たとえばトラスツズマブまたはペルツズマブ)、アントラサイクリン(ドキソルビシンなど)、またはチロシンキナーゼ阻害剤(ラパチニブなど)に対して抵抗性である。一部の実施形態では、ナノ粒子組成物中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比は、約6:1未満(たとえば4:1から約6:1未満、または約4:1)である。一部の実施形態では、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比は、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)である。一部の実施形態では、この癌は乳癌(トリプルネガティブ乳癌など)、グリオーマ、卵巣癌、または前立腺癌であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本組成物中のナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、化学療法薬抵抗性癌を有する対象を治療する方法であって、ナノ粒子を含むナノ粒子組成物を対象に投与することを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントが、正に荷電しており、細胞標的化セグメントが、ヘレグリンまたはそのバリアントを含む(および一部の実施形態では、ヘレグリンまたはそのバリアントである)、方法を提供する。一部の実施形態では、この癌はHER3+癌である。一部の実施形態では、この癌は乳癌(トリプルネガティブ乳癌など)、グリオーマ、卵巣癌、または前立腺癌であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、化学療法薬抵抗性癌は、HER2+抗体(たとえばトラスツズマブまたはペルツズマブ)、アントラサイクリン(ドキソルビシンなど)、またはチロシンキナーゼ阻害剤(ラパチニブなど)に対して抵抗性である。一部の実施形態では、ナノ粒子組成物中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比は、約6:1未満(たとえば4:1から約6:1未満、または約4:1)である。一部の実施形態では、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比は、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)である。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本組成物中のナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、化学療法薬抵抗性癌を有する対象を治療する方法であって、ナノ粒子を含むナノ粒子組成物を対象に投与することを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントが、デカリジンを含み(および一部の実施形態では、デカリジンであり)、細胞標的化セグメントが、ヘレグリンまたはそのバリアントを含む(および一部の実施形態では、ヘレグリンまたはそのバリアントである)、方法を提供する。一部の実施形態では、この癌はHER3+癌である。一部の実施形態では、この癌は乳癌(トリプルネガティブ乳癌など)、グリオーマ、卵巣癌、または前立腺癌であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、化学療法薬抵抗性癌は、HER2+抗体(たとえばトラスツズマブまたはペルツズマブ)、アントラサイクリン(ドキソルビシンなど)、またはチロシンキナーゼ阻害剤(ラパチニブなど)に対して抵抗性である。一部の実施形態では、ナノ粒子組成物中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比は、約6:1未満(たとえば4:1から約6:1未満、または約4:1)である。一部の実施形態では、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比は、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)である。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本組成物中のナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、化学療法薬抵抗性癌を有する対象を治療する方法であって、ナノ粒子を含むナノ粒子組成物を対象に投与することを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントが、デカリジンを含み(および一部の実施形態では、デカリジンであり)、細胞標的化セグメントが、ヘレグリンまたはそのバリアントを含み(および一部の実施形態では、ヘレグリンまたはそのバリアントであり)、化学療法薬(ドキソルビシンなど)が、二本鎖オリゴヌクレオチドの中にインターカレートしている、方法を提供する。一部の実施形態では、この癌はHER3+癌である。一部の実施形態では、この癌は乳癌(トリプルネガティブ乳癌など)、グリオーマ、卵巣癌、または前立腺癌であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、化学療法薬抵抗性癌は、HER2+抗体(たとえばトラスツズマブまたはペルツズマブ)、アントラサイクリン(ドキソルビシンなど)、またはチロシンキナーゼ阻害剤(ラパチニブなど)に対して抵抗性である。一部の実施形態では、ナノ粒子組成物中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比は、約6:1未満(たとえば4:1から約6:1未満、または約4:1)である。一部の実施形態では、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比は、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)である。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本組成物中のナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、化学療法薬抵抗性癌を有する対象を治療する方法であって、ナノ粒子を含むナノ粒子組成物を対象に投与することを含み、上記ナノ粒子が、キャリアポリペプチドおよび二本鎖DNAオリゴヌクレオチドを含み、キャリアポリペプチドが、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含み、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が、約4:1であり、キャリアポリペプチドがHerPBK10であり、ドキソルビシンが、二本鎖オリゴヌクレオチドの中にインターカレートしている、方法を提供する。一部の実施形態では、この癌はHER3+癌である。一部の実施形態では、この癌は乳癌(トリプルネガティブ乳癌など)、グリオーマ、卵巣癌、または前立腺癌であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、化学療法薬抵抗性癌は、HER2+抗体(たとえばトラスツズマブまたはペルツズマブ)、アントラサイクリン(ドキソルビシンなど)、またはチロシンキナーゼ阻害剤(ラパチニブなど)に対して抵抗性である。一部の実施形態では、ナノ粒子組成物中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比は、約6:1未満(たとえば4:1から約6:1未満、または約4:1)である。一部の実施形態では、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比は、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)である。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本ナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、化学療法薬抵抗性癌細胞を殺滅する方法であって、化学療法薬抵抗性癌細胞を複数のナノ粒子と接触させることを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含む、方法を提供する。一部の実施形態では、癌細胞はHER3+癌細胞である。一部の実施形態では、癌細胞は、乳癌細胞(トリプルネガティブ乳癌細胞など)、グリアの癌細胞、卵巣癌細胞、または前立腺癌細胞であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、化学療法薬抵抗性癌は、HER2+抗体(たとえばトラスツズマブまたはペルツズマブ)、アントラサイクリン(ドキソルビシンなど)、またはチロシンキナーゼ阻害剤(ラパチニブなど)に対して抵抗性である。一部の実施形態では、ナノ粒子組成物中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比は、約6:1未満(たとえば4:1から約6:1未満、または約4:1)である。一部の実施形態では、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比は、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)である。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本組成物中のナノ粒子の大きさの平均は、約50nm以下である。一部の実施形態では、本ナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、化学療法薬抵抗性癌細胞を殺滅する方法であって、化学療法薬抵抗性癌細胞を複数のナノ粒子と接触させることを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含む(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントである)、方法を提供する。一部の実施形態では、癌細胞はHER3+癌細胞である。一部の実施形態では、癌細胞は、乳癌細胞(トリプルネガティブ乳癌細胞など)、グリアの癌細胞、卵巣癌細胞、または前立腺癌細胞であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、化学療法薬抵抗性癌は、HER2+抗体(たとえばトラスツズマブまたはペルツズマブ)、アントラサイクリン(ドキソルビシンなど)、またはチロシンキナーゼ阻害剤(ラパチニブなど)に対して抵抗性である。一部の実施形態では、ナノ粒子組成物中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比は、約6:1未満(たとえば4:1から約6:1未満、または約4:1)である。一部の実施形態では、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比は、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)である。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本ナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、化学療法薬抵抗性癌細胞を殺滅する方法であって、化学療法薬抵抗性癌細胞を複数のナノ粒子と接触させることを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントが正に荷電している、方法を提供する。一部の実施形態では、癌細胞はHER3+癌細胞である。一部の実施形態では、癌細胞は、乳癌細胞(トリプルネガティブ乳癌細胞など)、グリアの癌細胞、卵巣癌細胞、または前立腺癌細胞であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、化学療法薬抵抗性癌は、HER2+抗体(たとえばトラスツズマブまたはペルツズマブ)、アントラサイクリン(ドキソルビシンなど)、またはチロシンキナーゼ阻害剤(ラパチニブなど)に対して抵抗性である。一部の実施形態では、ナノ粒子組成物中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比は、約6:1未満(たとえば4:1から約6:1未満、または約4:1)である。一部の実施形態では、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比は、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)である。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本ナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、化学療法薬抵抗性癌細胞を殺滅する方法であって、化学療法薬抵抗性癌細胞を複数のナノ粒子と接触させることを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントが正に荷電しており、細胞標的化セグメントが、ヘレグリンまたはそのバリアントを含む(および一部の実施形態では、ヘレグリンまたはそのバリアントである)、方法を提供する。一部の実施形態では、癌細胞はHER3+癌細胞である。一部の実施形態では、化学療法薬抵抗性癌は、HER+2抗体(たとえばトラスツズマブまたはペルツズマブ)、アントラサイクリン(ドキソルビシンなど)、またはチロシンキナーゼ阻害剤(ラパチニブなど)に対して抵抗性である。一部の実施形態では、ナノ粒子組成物中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比は、約6:1未満(たとえば4:1から約6:1未満、または約4:1)である。一部の実施形態では、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比は、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)である。一部の実施形態では、癌細胞は、乳癌細胞(トリプルネガティブ乳癌細胞など)、グリアの癌細胞、卵巣癌細胞、または前立腺癌細胞であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本ナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、化学療法薬抵抗性癌細胞を殺滅する方法であって、化学療法薬抵抗性癌細胞を複数のナノ粒子と接触させることを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントが、デカリジンを含み(および一部の実施形態ではデカリジンであり)、細胞標的化セグメントが、ヘレグリンまたはそのバリアントを含む(および一部の実施形態では、ヘレグリンまたはそのバリアントである)、方法を提供する。一部の実施形態では、癌細胞はHER3+癌細胞である。一部の実施形態では、癌細胞は、乳癌細胞(トリプルネガティブ乳癌細胞など)、グリアの癌細胞、卵巣癌細胞、または前立腺癌細胞であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、化学療法薬抵抗性癌は、HER2+抗体(たとえばトラスツズマブまたはペルツズマブ)、アントラサイクリン(ドキソルビシンなど)、またはチロシンキナーゼ阻害剤(ラパチニブなど)に対して抵抗性である。一部の実施形態では、ナノ粒子組成物中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比は、約6:1未満(たとえば4:1から約6:1未満、または約4:1)である。一部の実施形態では、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比は、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)である。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本ナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、化学療法薬抵抗性癌細胞を殺滅する方法であって、化学療法薬抵抗性癌細胞を複数のナノ粒子と接触させることを含み、上記ナノ粒子が、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含むキャリアポリペプチド;オリゴヌクレオチド結合セグメントに結合した二本鎖オリゴヌクレオチド(DNAなど);ならびに二本鎖オリゴヌクレオチドに結合した化学療法薬(アントラサイクリン、たとえばドキソルビシンなど)を含み、細胞貫通セグメントが、ペントンベースポリペプチドまたはそのバリアントを含み(および一部の実施形態では、ペントンベースポリペプチドまたはそのバリアントであり)、オリゴヌクレオチド結合セグメントが、デカリジンを含み(および一部の実施形態ではデカリジンであり)、細胞標的化セグメントが、ヘレグリンまたはそのバリアントを含み(および一部の実施形態では、ヘレグリンまたはそのバリアントであり)、化学療法薬(ドキソルビシンなど)が、二本鎖オリゴヌクレオチドの中にインターカレートしている、方法を提供する。一部の実施形態では、癌細胞はHER3+癌細胞である。一部の実施形態では、癌細胞は、乳癌細胞(トリプルネガティブ乳癌細胞など)、グリアの癌細胞、卵巣癌細胞、または前立腺癌細胞であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、化学療法薬抵抗性癌は、HER2+抗体(たとえばトラスツズマブまたはペルツズマブ)、アントラサイクリン(ドキソルビシンなど)、またはチロシンキナーゼ阻害剤(ラパチニブなど)に対して抵抗性である。一部の実施形態では、ナノ粒子組成物中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比は、約6:1未満(たとえば4:1から約6:1未満、または約4:1)である。一部の実施形態では、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比は、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)である。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本ナノ粒子の大きさの平均は、約50nm以下である。
一部の実施形態では、化学療法薬抵抗性癌細胞を殺滅する方法であって、化学療法薬抵抗性癌細胞を複数のナノ粒子と接触させることを含み、上記ナノ粒子が、キャリアポリペプチドおよび二本鎖DNAオリゴヌクレオチドを含み、キャリアポリペプチドが、細胞標的化セグメント、細胞貫通セグメント、およびオリゴヌクレオチド結合セグメントを含み、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比が約4:1であり、キャリアポリペプチドがHerPBK10であり、ドキソルビシンが、二本鎖オリゴヌクレオチドの中にインターカレートしている、方法を提供する。一部の実施形態では、癌細胞はHER3+癌細胞である。一部の実施形態では、癌細胞は、乳癌細胞(トリプルネガティブ乳癌細胞など)、グリアの癌細胞、卵巣癌細胞、または前立腺癌細胞であり、このうちのいずれか1つがHER3+であり得る。一部の実施形態では、化学療法薬抵抗性癌は、HER2+抗体(たとえばトラスツズマブまたはペルツズマブ)、アントラサイクリン(ドキソルビシンなど)、またはチロシンキナーゼ阻害剤(ラパチニブなど)に対して抵抗性である。一部の実施形態では、ナノ粒子組成物中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比は、約6:1未満(たとえば4:1から約6:1未満、または約4:1)である。一部の実施形態では、ナノ粒子中のキャリアポリペプチドの二本鎖オリゴヌクレオチドに対するモル比は、約6:1未満(たとえば約4:1から約6:1未満、約5:1、または約4:1)である。一部の実施形態では、二本鎖オリゴヌクレオチドは、約20〜約50塩基長である。一部の実施形態では、小分子薬物の二本鎖オリゴヌクレオチドに対するモル比は、約1:1〜約60:1(たとえば約10:1または約40:1)である。一部の実施形態では、本ナノ粒子の大きさの平均は、約50nm以下である。
医薬組成物
一部の実施形態では、本明細書中記載の組成物は、本明細書中記載の複数のナノ粒子および薬学的に許容される賦形剤を含む医薬組成物として、製剤化されている。
一部の実施形態では、本医薬組成物は、散剤などの固体である。散剤は、たとえばナノ粒子を含む溶液を凍結乾燥することにより、形成することができる。散剤は、たとえば散剤を水系の液体(たとえば水またはバッファー)と混合することにより、再構成することができる。一部の実施形態では、本医薬組成物は、液体、たとえば水溶液(生理食塩水またはリンガー溶液など)に懸濁したナノ粒子である。一部の実施形態では、本医薬組成物は、薬学的に許容される賦形剤、たとえば充填剤、結合剤、コーティング剤、保存剤、滑沢剤、香料、甘味料、着色剤、溶媒、緩衝剤、キレート剤、または安定剤を含む。
薬学的に許容される充填剤の例として、セルロース、二塩基性リン酸カルシウム、炭酸カルシウム、結晶セルロース、スクロース、ラクトース、グルコース、マンニトール、ソルビトール、マルトール、アルファ化デンプン、コーンスターチ、またはポテトスターチが挙げられる。薬学的に許容される結合剤の例として、ポリビニルピロリドン、スターチ、ラクトース、キシリトール、ソルビトール、マルチトール、ゼラチン、スクロース、ポリエチレングリコール、メチルセルロース、またはセルロースが挙げられる。薬学的に許容されるコーティング剤の例として、ヒドロキシルプロピルメチルセルロース(HPMC)、シェラック、コーンタンパク質ゼイン、またはゼラチンが挙げられる。薬学的に許容される崩壊剤の例として、ポリビニルピロリドン、カルボキシメチルセルロース、またはデンプングリコール酸ナトリウムが挙げられる。薬学的に許容される潤沢剤の例として、ポリエチレングリコール、ステアリン酸マグネシウム、またはステアリン酸が挙げられる。薬学的に許容される保存剤の例として、メチルパラベン、エチルパラベン、プロピルパラベン、安息香酸、またはソルビン酸が挙げられる。薬学的に許容される甘味料の例として、スクロース、サッカリン、アスパルテーム、またはソルビトールが挙げられる。薬学的に許容される緩衝剤の例として、炭酸塩、クエン酸塩、グルコン酸塩、酢酸塩、リン酸塩、または酒石酸塩が挙げられる。
製造品およびキット
同様に、適切なパッケージにある本明細書中記載の組成物を含む製造品を、提供する。本明細書中記載の組成物に適したパッケージは、当該分野で知られており、たとえば、バイアル(密閉したバイアルなど)、容器、アンプル、ビン、ジャー、可撓性パッケージ(たとえば密閉したマイラーバッグまたはプラスチックバッグ)などが挙げられる。これら製造品は、さらに滅菌かつ/または密閉されていてもよい。
本発明はまた、本明細書中記載の組成物(または製造物品)を含むキットを提供し、本明細書中記載される使用などの、本組成物を使用する方法に関する説明書(複数可)をさらに含んでもよい。本明細書中記載されるキットは、他のバッファー、希釈剤、フィルター、ニードル、シリンジ、および本明細書中記載のいずれかの方法を行うための説明書を含む添付文書を含む、商業上の観点および使用者の観点から望ましい他の材料をさらに含んでもよい。
実施例
本明細書中提供される実施例は、単に例示の目的のために含まれており、本発明の範囲の範囲を限定するようには意図されていない。
実施例1:ナノ粒子の作製
キャリアポリペプチド、二本鎖DNAオリゴヌクレオチド、およびドキソルビシン(「HerDox」粒子と呼ぶ)を含むナノ粒子を、以下の方法を使用して作製した。
一本鎖の相補的DNAオリゴヌクレオチド(Eurofins Operon;配列は以下の通りである:LLAA−5:5’−CGCCTGAGCAACGCGGCGGGCATCCGCAAG−3’(配列番号5)およびLLAA−3:3’−GCGGACTCGTTGCGCCGCCCGTAGGCGTTC−5’)(配列番号6))を、等モル比の各オリゴヌクレオチドを沸騰水で5分間インキュベートすることにより、アニールした。次に、オリゴヌクレオチドを、室温で30分間冷却した。
次に、アニールした二本鎖のDNAオリゴヌクレオチドを、ドキソルビシンHClと1:40(DNA:Dox)のモル比で、室温で30分間インキュベートした。
次に、ドキソルビシンと結合した二本鎖DNAオリゴヌクレオチドを、Her細胞標的化セグメント、PB細胞貫通セグメント、およびデカリジン(「K10」)オリゴヌクレオチド結合セグメントを含むキャリアポリペプチド(「HerPBK10」)と、HEPES緩衝生理食塩水(HBS)中4:1(HerPBK10:DNA−ドキソルビシン)のモル比(よって、4:1:40(HerPBK10:DNA:ドキソルビシン)のモル比)でインキュベートした。キャリアポリペプチドおよびドキソルビシンと結合した二本鎖DNAオリゴヌクレオチドの混合物を、氷中で2時間揺動することにより、HerDox粒子を形成した。
次に、得られたナノ粒子に、超遠心分離を行った。具体的には、滅菌HBS 12mlを、滅菌の10%グリセロールで24時間プレインキュベートした50kDカットオフの遠心フィルター(Centrifugal Filter)(Amicon Ultra−15)に添加した。HerDox混合物を、遠心フィルター中の冷却したHBSに添加した。次に、フィルターチューブを、最終的な体積が200μL〜500μLnとなるまで、Beckman J6−HC遠心分離機で、2500RPM(5000×g)で10〜20分間回転させた。次に、濃縮したHerDoxを、1.7mLのマイクロチューブに移した。
空のナノ粒子を、HerDoxナノ粒子で記載されている通りではあるが、二本鎖オリゴヌクレオチドをドキソルビシンとインキュベートしていない二本鎖DNAオリゴヌクレオチド(ドキソルビシンなし)と、HerPBK10をインキュベートすることにより、調製した。同様の混合物を、HerPBK10対DNAのモル比2:1、3:1、4:1、5:1、および6:1を使用し、および/またはdsDNA対ドキソルビシンのモル比約1:10または約1:40を使用して作製することができる。
以下に記載の実施例に関する治療用量は、HerDox中のドキソルビシンの濃度を反映しており、これは、測定された吸光度(A480)をDoxの吸光度の検量線に対して外挿することにより決定した(SpectraMax MA; Molecular Devices, CA, USA)。空のナノ粒子(HerPBK10−DNA)に関する治療濃度の正規化は、HerDoxと比較したHerPBK10の含有量に基づいた。
実施例2:ナノ粒子の大きさ
HerPBK10キャリアポリペプチドを、ドキソルビシンをインターカレートした二本鎖DNA(dsDNA対ドキソルビシンのモル比1:10)と、2:1、3:1、4:1、5:1、または6:1のモル比で組み合わせた。次に、この混合物を動的光散乱法(DLS)に供し、得られたナノ粒子の直径を決定した。HerPBK10(オリゴヌクレオチドまたはドキソルビシンを含まない)およびドキソルビシンをインターカレートした二本鎖DNA(HerPBK10を含まない)の溶液も、同様にDLSにより測定した。結果を、図2に提示する。図2でわかるように、4:1、5:1、および6:1(HerPBK10対dsDNA)のモル比で組み合わせた場合に、約35nmのナノ粒子が形成された。
実施例3:ナノ粒子のCryoEM
ドキソルビシンを、二本鎖DNAと組み合わせた後、この混合物をHerPBK10キャリアポリペプチドと、4:1:10、4:1:40、または6:1:10(HerPBK10対dsDNA対ドキソルビシン)のモル比で組み合わせた。次に、この混合物を、CryoEMを使用してイメージングし、図3に提示した。図3に示されているように3つ全ての混合物が、同様の大きさおよび形態のナノ粒子を生産する。
実施例4:癌細胞および化学療法薬抵抗性癌細胞を殺滅するためのナノ粒子の使用
ドキソルビシンを含まないナノ粒子(HerPBK10対dsDNAのモル比が4:1、この実施例では「Empty Eosomes」と呼ぶ)、HerPBK10:dsDNA:ドキソルビシンのモル比が4:1;40のナノ粒子(この実施例では、Eos−001(4:1:40)と呼ぶ)、またはHerPBK10:dsDNA:ドキソルビシンのモル比が6:1;10であるナノ粒子(この実施例ではEos−001(6:1:10)と呼ぶ)を、様々なタイプの癌細胞を殺滅する能力に関して、LipoDoxと比較した。
様々な用量のナノ粒子を、MDA−MB−435(ヒト癌)細胞、BT474(ヒト乳癌)細胞、BT474−R(トラスツズマブ抵抗性ヒト乳癌)細胞、JIMT1(トラスツズマブに生来抵抗性である患者由来のヒト乳癌細胞)、U251(ヒトグリオーマ)細胞、A2780−ADR(ドキソルビシン抵抗性ヒト卵巣癌)細胞、4T1(マウストリプルネガティブ乳癌)細胞、SKOV3(ヒト卵巣癌)細胞、LNCaP−GFP(ヒト前立腺癌)細胞、RANKL(ヒト骨転移性前立腺癌細胞)、またはBT−549(ヒトトリプルネガティブ乳癌)細胞のいずれかと、インキュベートした。
細胞
SKBR3細胞およびMDA−MB−435細胞を、ATCCから得た。BT−474細胞およびJIMT1細胞を、シダーズ・サイナイ医療センター(Cedars−Sinai Medical Center)から得た。JIMT1細胞を除くすべての細胞を、完全培地DMEM(ダルベッコ改変イーグル培地)、10%熱失活ウシ胎児血清および100U/mLペニシリン/100μg/mLストレプトマイシン中、5%CO2下、37℃で維持した。JIMT1細胞を、RPMI(ロズウェルパーク記念研究所培地)、10%熱失活ウシ胎児血清、100U/mLペニシリン/100μg/mLストレプトマイシン、および1mMピルビン酸ナトリウム中、5%CO2下で維持した。
細胞表面のELISAアッセイ
様々な細胞株の表面に存在するHER1、HER2、HER3、またはHER4の相対量を、ELISAアッセイを使用して決定した。ウェルあたり8,000または10,000個の細胞を、壁が黒で底が透明な96ウェルプレートに播種し、5%CO2下37℃で48時間生育させた。細胞を、PBS+(1%MgCl2および1%CaCl2を含む1×リン酸緩衝生理食塩水(PBS))で1回洗浄し、PBS中4%パラホルムアルデヒド(PFA)で12分間揺動させながら固定し、次に、PBS中3%ウシ血清アルブミン(BSA)と共に軽く攪拌しながら3時間ブロックした。ブロッキング溶液を除去し、表記の一次抗体(HER1、HER2、HER3、またはHER4の抗体)を、PBS中3%BSAで希釈した1:500の希釈でプレートに添加し、揺動させながら4℃で一晩インキュベートした。プレートをPBSで3回洗浄し、この洗浄間に軽く攪拌しながら5分間インキュベートを行った。適切な二次抗体を、PBS中3%BSAで希釈した1:1000の希釈で添加し、プレートを軽く攪拌しながら室温で1時間インキュベートした。細胞をPBSで3回洗浄し、洗浄間に軽く攪拌しながら5分間インキュベートを行い、次にdiH2Oで1回洗浄した。すべての液体をウェルから除去し、テトラメチルベンジジン(TMB)基質(eBioscience)100μLを各ウェルに添加し、プレートを、暗所で軽く攪拌しながら約30分発色させた。十分青い色が発色した後、反応を、プレートリーダーを使用して650nmで吸光度を測定することにより、定量化した。1NHCl 100μLをプレートの各ウェルに添加して反応を停止させ、再度プレートを450nmで読み取った。TMB/HCl溶液を除去し、プレートを、1×PBSで2回洗浄した。100%エタノール中0.1%クリスタルバイオレット50μLを各ウェルに添加した。プレートを、軽く揺動させながら暗所で30分間インキュベートした。プレートをPBSで十分に洗浄し、95%エタノール100μLを各ウェルに添加して、細胞からクリスタルバイオレットを放出させた。次にプレートを590nmで読み取った。クリスタルバイオレットは、ウェルあたりの細胞数に近似しており、各アッセイの正規化およびプレート間の比較を可能にする。
細胞生存率アッセイ
記載の組成物へ曝露した後の相対的な細胞生存を、細胞生存率アッセイを使用して測定した。ウェルあたり15,000、10,000、または8,000個の細胞を、壁が黒く底が透明な96ウェルプレートに播種した。48時間後に、培地を吸引し、完全培地、および表記の濃度のEmpty Eosomes、Eos−001(4:1:40)、Eos−001(6:1:10)、またはLipoDoxと全量40μLで交換した。プレートを5%CO2下、37℃で4時間揺動させ、次に、完全培地60μLを各ウェルに添加し、全量を100μLにし、揺動させることなく、5%CO2下、37℃でインキュベーションを44時間継続した。インキュベーションの終了時に、相対的な細胞生存率を、製造社の説明の通りのMTSアッセイ(Promega)を介して、決定した。具体的には、培地をウェルから除去し、新鮮な完全培地100μLを各ウェルに添加した。調製したMTS試薬20μLを各ウェルに添加した。次に、プレートを、5%CO2下、37℃で揺動させながらインキュベートし、1時間目、2時間目、および3時間目に、分光光度計を使用して490nmで読み取りを行った。この結果を、以下の比に関して示す:無処置のグループの生存細胞数により除算した処置グループの生存細胞数。よって、細胞生存1.0は、処置した細胞および無処置の細胞が同じ度合で生存したことを表している。対して、0.2の比は、無処置の細胞のグループと比較して、処置した細胞のうち20%のみが生存したことを意味している。
結果
この結果を、図面に示す。図面を通して、「Empty Eosomes(4:1)」は、HerPBK10キャリアポリペプチドおよび二本鎖DNAオリゴヌクレオチドを4:1(HerPBK10:dsDNA)のモル比で含むが、ドキソルビシンを含まないナノ粒子を表し;「Empty Eosomes(6:1)」は、HerPBK10キャリアポリペプチドおよび二本鎖DNAオリゴヌクレオチドを6:1(HerPBK10:dsDNA)のモル比で含むが、ドキソルビシンを含まないナノ粒子を表し;「Eos−001(4:1:40)」は、HerPBK10キャリアポリペプチド、二本鎖DNAオリゴヌクレオチド、およびドキソルビシンを、4:1:40(HerPBK10:dsDNA:ドキソルビシン)のモル比で含むナノ粒子を表し;「Eos−001(6:1:10)」は、HerPBK10キャリアポリペプチド、二本鎖DNAオリゴヌクレオチド、およびドキソルビシンを、6:1:10(HerPBK10:dsDNA:ドキソルビシン)のモル比で含むナノ粒子を表し;「LipoDox」は、市販のリポソーマルドキソルビシンを表す。各図面の挿入図は、各細胞タイプの表面に存在するHER1、HER2、HER3、またはHER4の相対量である。
図4を見ると、LipoDoxおよびEmpty Eosomes(4:1)は、MDA−MB−435細胞の生存において特筆すべき効果を有していないことが示されている。対照的に、Eos−001(6:1:10)粒子は、1μM超のドキソルビシンの濃度で、MDA−MB−435細胞生存の有意な減少を実証している。Eos−001(4:1:40)粒子は、1μM超のドキソルビシンの濃度で、MDA−MB−435細胞生存のさらにより有意な減少を実証し、約10μMのドキソルビシンの濃度で生存しているのは細胞の20%未満である。挿入されたグラフは、様々なHER受容体の細胞表面のレベルを比較しており、HER3が、最も量が多い受容体であることが示されている。
図5Aを見ると、Empty Eosomes(4:1)が、BT474ヒト乳癌細胞の生存において特筆すべき効果を有していないことが示されている。LipoDox、Eos−001(6:1:10)、およびEos−001(4:1:40)は、それぞれ、BT474細胞の生存を減少させたが、Eos−001(4:1:40)がBT−474細胞の生存を最も有意に減少させた。図5Bを見ると、Empty Eosomes(4:1)またはEmpty Eosomes(6:1)のいずれも、BT474−Rトラスツズマブ抵抗性ヒト乳癌細胞の生存において特筆すべき効果を有していなかったことが示されている。LipoDoxは、約1μMドキソルビシンの投与後に、部分的に細胞生存を減少させた。しかしながら、Eos−001(4:1:40)またはEos−001(6:1:10)の投与は、おおよそ同じ濃度で、相対的な細胞生存をさらに大きく減少させた。
図6を見ると、JIMT1細胞に及ぼすLipoDoxの効果は、薬物濃度を約10倍増加させたにも関わらず、約40%生存で定常に達することが示されている。しかしながら、Eos−001(4:1:40)およびEos−001(6:1:10)は、より低い濃度でJIMT1細胞の生存を低減し、10%未満の生存率を達成した。挿入されたグラフは、様々なHER受容体の細胞表面でのレベルを比較している。
図7を見ると、LipoDoxが、Eos−001(4:1:40)またはEos−001(6:1:10)よりも有意に高い濃度のドキソルビシンで、U251ヒトグリオーマ細胞の生存を低減させることが示されている。Eos−001(4:1:40)またはEos−001(6:1:10)はいずれも、約10μMドキソルビシンの濃度で、約20%未満の生存をもたらしている。対照的に、LipoDoxの投与は、同じ濃度で約40%細胞生存をもたらしている。挿入されたグラフは、様々なHER受容体の細胞表面でのレベルを比較しており、HER3が最も量の多い受容体であることが示されている。
図8を見ると、Eos−001(4:1:40)が、LipoDoxよりもA2780−ADRドキソルビシン抵抗性ヒト卵巣癌細胞の細胞生存の減少に有意に高い効果を有することが示されている。
図9を見ると、Eos−001(4:1:40)が、LipoDoxよりも4T1マウストリプルネガティブ乳癌細胞の細胞生存の減少に有意に高い効果を有することが示されている。
図10を見ると、Eos−001(4:1:40)が、LipoDoxよりもSKOV3ヒト卵巣癌細胞の細胞生存の減少に有意に高い効果を有することが示されている。
図11Aを見ると、Eos−001(4:1:40)が、LipoDoxよりもLNCaP−GFPヒト前立腺癌細胞の細胞生存の減少に有意に高い効果を有することが示されている。図11Bを見ると、Eos−001(4:1:40)が、LipoDoxよりもRANKLヒト骨転移性前立腺癌細胞の細胞生存の減少に有意に高い効果を有することが示されている。図11Cは、LNCaP−GFP細胞およびRANKL細胞におけるHER1、HER2、HER3、およびHER4の相対的な発現を示している。
図12Aは、Eos−001(4:1:40)が、LipoDoxよりも、BT549トリプルネガティブ乳癌細胞の生存の減少に有意に高い効果を有することを示している。図12Bは、BT549細胞におけるHER1、HER2、HER3、およびHER4の相対的な発現を示している。
実施例5:化学療法薬抵抗性癌細胞の殺滅における抗HER2抗体の治療とナノ粒子の比較
BT474(ヒト乳癌)細胞、BT474−TR(トラスツズマブ抵抗性ヒト乳癌)細胞、SKBR3(ヒト乳癌)細胞、およびSKBR3−TR(トラスツズマブ抵抗性乳癌)細胞を、様々な濃度のEos−001、トラスツズマブ、またはトラスツズマブおよびペルツズマブの組み合わせとインキュベートした。Eos−001の濃度は、μMドキソルビシンで報告し、トラスツズマブまたはペルツズマブの濃度は、μM抗体で報告する。ウェルあたりの細胞を、壁が黒く底が透明な96ウェルプレートに播種した。48時間後に、培地を吸引し、完全培地、および表記の濃度のEos−001、トラスツズマブ(Tz)、もしくはトラスツズマブとペルツズマブとの組み合わせ(Tz+Pz)、または未処置の対照と全量40μLで交換した。プレートを、5%CO2下、37℃で4時間揺動させ、次に完全培地60μLを各ウェルに添加して全量を100μLにし、揺動させることなく、5%CO2下、37℃で44時間インキュベーションを継続した。インキュベートの終了時に、相対的な細胞生存率を、製造社の説明の通りのMTSアッセイ(Promega)を介して、決定した。具体的には、培地をウェルから除去し、新鮮な完全培地100μLを各ウェルに添加した。調製したMTS試薬20μLを各ウェルに添加した。次に、プレートを、5%CO2下、37℃で揺動させながらインキュベートし、1時間目、2時間目、および3時間目に、分光光度計を使用して490nmで読み取りを行った。この結果を、以下の比に関して示す:無処置のグループの生存細胞数により除算した処置グループの生存細胞数。
結果を、図13に示す。トラスツズマブ、ならびにトラスツズマブおよびペルツズマブの組み合わせによる処置はBT−474細胞の殺滅に有効であったがBT−474−TR細胞には有効ではなかった。Eos−001は、BT474細胞およびBT474−TR細胞の両方の殺滅に有効であり、Eos−001ナノ粒子が、トラスツズマブ、ならびにトラスツズマブおよびペルツズマブの組み合わせに抵抗性のある細胞の殺滅に有効であることを実証している。トラスツズマブもトラスツズマブおよびペルツズマブの組み合わせも、SKBR3細胞またはSKBR3−TR細胞の殺滅に有効ではなかった。しかしながら、Eos−001ナノ粒子は、SKBR3細胞株およびSKBR3−TR細胞株の殺滅に有効であった。
実施例6:トラスツズマブ、ペルツズマブ、およびEos−001ナノ粒子に対するBT474−TR細胞の感受性
BT−474−TR細胞のトラスツズマブまたはペルツズマブによる処置を、Eos−001による処置、Eos−001およびペルツズマブでの併用処置、または4時間のペルツズマブでの前処置後のEos−001による処置と比較した。ウェルあたりの細胞を、壁が黒く底が透明な96ウェルプレートにプレーティングした。48時間後に、培地を吸引し、完全培地、および表記の濃度のトラスツズマブ(Tz)、ペルツズマブ(Pz)、Eos−001、またはEos−001およびペルツズマブの組み合わせと、全量40μLで交換した。プレートを、5%CO2下、37℃で4時間揺動させ、次に完全培地60μLを各ウェルに添加して、全量を100μLにし、揺動させることなく、5%CO2下、37℃で44時間インキュベーションを継続した。Eos−001への曝露の前にペルツズマブで前処置した試料では、細胞を、表記の量のペルツズマブに全量40μLで4時間曝露し、細胞を、5%CO2下、37℃で4時間揺動させ、次に完全培地60μLおよび表記の量のEos−001を添加して全量を100μLにした。インキュベーションの終了時に、相対的な細胞生存率を、製造社の説明の通りのMTSアッセイ(Promega)を介して、決定した。具体的には、培地をウェルから除去し、新鮮な完全培地100μLを各ウェルに添加した。調製したMTS試薬20μLを各ウェルに添加した。次に、プレートを、5%CO2下、37℃で揺動させながらインキュベートし、分光光度計を使用して490nmで読み取りを行った。これらの結果を図14に示し、Eos−001が、トラスツズマブまたはペルツズマブよりも有効であることを表している。Eos−001とペルツズマブを組み合わせても、Eos−001の作用の競合阻害が起こらず、このことはEos−001の抗癌作用が、HER3への結合を介して仲介されるが、ペルツズマブが妨害するHER−2−HER3相互作用に依存していないことを示唆している。
実施例7:Eos−001ナノ粒子は、トラスツズマブ抵抗性細胞においてアップレギュレートしているHER3を標的とする。
トラスツズマブ抵抗性BT−474−TR細胞およびトラスツズマブ抵抗性SKBR3−TR細胞は、非抵抗性親細胞株と比較して、表面のHER3が増加している(図15A参照)。Eos−001ナノ粒子の、HER標的化の毒性の寄与を検証するために、HER3ペプチドを、競合阻害剤として使用した。HER3ペプチドを、ヘレグリン標的化ドメインと結合している、Eos−001粒子とプレインキュベートした。BT−474細胞、BT−474−TR細胞、SKBR3細胞、またはSKBR3−TR細胞を、Eos−001ナノ粒子の存在下、およびHER3ブロッキングペプチドの存在下または非存在下で、インキュベートした。HER3ブロッキングペプチドと共にEos−001によって処置した試料では、ナノ粒子およびHER3ブロッキングペプチドを、等モル比のHER3:HEPBK10で、冷却PBS中で1時間、組み合わせた。Eos−001ナノ粒子またはHER3ブロッキングペプチドによって処置したEos−001ナノ粒子を使用して、0.125μM(BT474細胞またはBT−474−TR細胞)または1μM(BSKBR3細胞またはSKBR3−TR細胞)の最終濃度で細胞を処置した。細胞の生存を、48時間後に測定し、偽処置生理食塩水によって処置した細胞と比較した。これらの結果を、図16Bに示す(N=3、*は、偽処置と比較してp<0.05を表す)。図15Bに示されているように、Eos−001ナノ粒子は単独で、4つすべての細胞タイプを殺滅した。驚くべきことに、Eos−001は、BT−474細胞よりもBT−474−TR細胞の殺滅に有効であった。HER3ペプチドの存在は、全ての細胞タイプの殺滅において、Eos−001の有効性を限定しており、Eos−001粒子のHER3の標的化を示している。
実施例8:トラスツズマブとのプレインキュベーションは、Eos−001ナノ粒子の活性を増強する。
HER3は、HER2阻害のわずか4時間後に、転写および翻訳によって増加する。非抵抗性細胞と比較してトラスツズマブ抵抗性細胞におけるEos−001ナノ粒子の高い効力は、トラスツズマブが、Eos−001ナノ粒子のアジュバントとして作用し、Her3の増加を誘導して抵抗性細胞に対するEos−001の標的化を増大させ得ることを示唆している。このことを試験するために、非トラスツズマブ抵抗性のSKBR3細胞、BT−474細胞、およびMDA−MB−435細胞、ならびにトラスツズマブ抵抗性のSKBR3−TR細胞およびBT−447−TR細胞を、トラスツズマブにより4時間または24時間前処置した後に、Eos−001による処置を行った。Eos−001は、トラスツズマブと比較してすべての細胞株において細胞の殺滅の改善を示したが、トラスツズマブによる4時間または12時間の前処置により、非抵抗性細胞株においてもEos−001の有効性が増大した。結果を、図16に示す。非トラスツズマブ抵抗性SKBR3細胞では、Eos−001単独では、最高投与濃度でも中程度の細胞死であったが、トラスツズマブによる4時間または24時間の前処置により、有効性が50%増加した。同様に、非トラスツズマブ抵抗性BT−474細胞は、トラスツズマブと比較して、Eos−001ナノ粒子により細胞死の中程度の増加を示したが、トラスツズマブによる処置と比較して、トラスツズマブによって4時間前処置した後では50%近く増加し、またはトラスツズマブによって24時間前処置した後では75%増加した。同様の結果が、MDA−MB−435細胞で見られた。トラスツズマブ抵抗性細胞株(SKBR3−TRおよびBT474−TR)では、トラスツズマブによる前処置によって、Eos−001に関して有効性の中程度の増加をもたらした。しかしながら、トラスツズマブ抵抗性BR3−TR細胞株およびBT−474−TR細胞株は、トラスツズマブによる前処置がなくともEos−001により効率的に殺滅される。これらの結果は、トラスツズマブなどのHER2阻害剤またはHER2抗体が、特に非トラスツズマブ抵抗性細胞株において、Eos−001による処置にとって有用なアジュバントとして作用できることを表している。
実施例9:化学療法薬抵抗性癌細胞の殺滅におけるラパチニブによる処置とナノ粒子の比較
BT474(ヒト乳癌)細胞、BT474−TR(トラスツズマブ抵抗性ヒト乳癌)細胞、SKBR3(ヒト乳癌)細胞、SKBR3−TR(トラスツズマブ抵抗性乳癌)細胞、およびJIMT−1(トラスツズマブ抵抗性、ペルツズマブ抵抗性ヒト乳癌)細胞を、様々な濃度のEos−001またはラパチニブとインキュベートした。Eos−001の濃度は、μMドキソルビシンで報告し、ラパチニブの濃度は、μMラパチニブで報告する。ウェルあたりの細胞を、壁が黒く底が透明な96ウェルプレートに播種した。48時間後に、培地を吸引し、完全培地、および表記の濃度のEos−001、ラパチニブ、または無処置の対照と、全量が40μLとなるように交換した。プレートを、5%CO2下、37℃で4時間揺動させ、次に、完全培地60μLを各ウェルに添加し、全量100μLにし、揺動させることなく、5%CO2下、37℃で44時間インキュベーションを継続した。インキュベーションの終了時に、相対的な細胞生存率を、製造社の説明の通りのMTSアッセイ(Promega)を介して、決定した。具体的には、培地をウェルから除去し、新鮮な完全培地100μLを各ウェルに添加した。調製したMTS試薬20μLを各ウェルに添加した。次に、プレートを、5%CO2下、37℃で揺動させながらインキュベートし、1時間目、2時間目、および3時間目に、分光光度計で、読み取りを490nmで行った。この結果を、以下の比に関して示す:無処置のグループの生存細胞数により除算した処置グループの生存細胞数。
結果を、図17に示す。Eos−001(破線、白丸)およびラパチニブ(実線)は、BT−474細胞およびSKBR3細胞の処置に同様に有効であった。ラパチニブは、トラスツマブ抵抗性細胞株BT−474−TRおよびSKBR3−TRの殺滅にわずかに有効であったが、Eos−001は、BT−474−TR細胞株およびSKBR3−TR細胞株の殺滅に有意により有効であった。Eos−001は、非抵抗性細胞株よりもトラスツズマブ抵抗性細胞株の殺滅に有効であった。さらに、ラパチニブは、トラスツズマブ抵抗性JIMT−1細胞株を殺滅することができなかったが、対してEos−001は、これら細胞の殺滅に有効であった。