JP2018538241A - 乳癌におけるカゼインキナーゼ1δの治療標的化 - Google Patents
乳癌におけるカゼインキナーゼ1δの治療標的化 Download PDFInfo
- Publication number
- JP2018538241A JP2018538241A JP2018519027A JP2018519027A JP2018538241A JP 2018538241 A JP2018538241 A JP 2018538241A JP 2018519027 A JP2018519027 A JP 2018519027A JP 2018519027 A JP2018519027 A JP 2018519027A JP 2018538241 A JP2018538241 A JP 2018538241A
- Authority
- JP
- Japan
- Prior art keywords
- ck1δ
- cancer
- breast cancer
- catenin
- alkyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5375—1,4-Oxazines, e.g. morpholine
- A61K31/5377—1,4-Oxazines, e.g. morpholine not condensed and containing further heterocyclic rings, e.g. timolol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
- C12Q1/6883—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material
- C12Q1/6886—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material for cancer
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/136—Screening for pharmacological compounds
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Medicinal Chemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Analytical Chemistry (AREA)
- Pathology (AREA)
- Immunology (AREA)
- Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Epidemiology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Physics & Mathematics (AREA)
- Biophysics (AREA)
- General Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Microbiology (AREA)
- Oncology (AREA)
- Biotechnology (AREA)
- Hospice & Palliative Care (AREA)
- Biochemistry (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
【選択図】図1
Description
本出願は、2015年10月13日付け出願の米国仮特許出願第62/240,689号(その開示の全体を参照により本明細書に組み入れることとする)の優先権を主張するものである。
本発明は、米国国立衛生研究所(National Institutes of Health)からのCA175094に基づく米国政府の援助によってなされた。米国政府は本発明において一定の権利を有する。
各Rは、独立して選択される水素もしくは(C1−C6)アルキルであり、または窒素原子に結合した2個のR基は該窒素原子と一緒になって、O、SおよびNR’(ここで、R’は水素または(C1−C6)アルキルである)からなる群から選択される1または2個のヘテロ原子を所望により更に含んでいてもよい5〜7員ヘテロシクリルを形成しうるものであり;
Ar1はアリールまたは5員もしくは6員ヘテロアリールであり、これは置換されていないか、または1〜3個の独立して選択されるハロ、(C1−C6)アルキル、(C1−C6)フルオロアルキル、(C1−C6)アルコキシル、シアノ、ニトロ、C(=O)NR2、OC(=O)NR2、N(R)C(=O)OR、N(R)C(=O)RまたはC(=O)ORで置換されている;
Het1は単環式または二環式ヘテロアリールであり、これは置換されていないか、または1〜3個の独立して選択されるハロ、(C1−C6)アルキル、(C1−C6)フルオロアルキル、(C1−C6)アルコキシル、シアノ、ニトロ、C(=O)NR2、OC(=O)NR2、N(R)C(=O)OR、N(R)C(=O)RまたはC(=O)ORで置換されている]
の化合物またはその医薬上許容される塩の有効な量または濃度とCK1δを接触させることを含む、CK1δの阻害方法に関する。
標的化治療の開発を導くためには、ヒトの癌の特異的駆動因子の特定が必要である。本発明において、本発明者らは、CSNK1Dがヒト乳房腫瘍において増幅され及び/又は過剰発現されること、ならびにCK1δが、このキナーゼを過剰発現するヒト乳癌亜型の未開発の標的化可能体(vulnerability)であることを示す。特に、CK1δの選択的ノックダウンまたは社内の高選択的かつ強力なCK1δインヒビターでの治療はエクスビボにおけるCK1δ発現性乳房腫瘍細胞のアポトーシス、三種陰性乳癌の同所性モデル(患者由来の異種移植片を含む)における強力な腫瘍退縮およびHER2+ 乳癌モデルにおける腫瘍増殖抑制を誘発する。特に、本発明者らは、Wnt/β−カテニンシグナル伝達が、CK1δを過剰発現するヒト腫瘍の特徴であること、CK1δの無効化がβ−カテニンの核蓄積およびT細胞因子転写活性を阻止すること、ならびに構成的に活性なβ−カテニンがCK1δの阻害またはサイレンシングの効果を無効にすることを示す。したがって、CK1δの阻害は、Wnt/β−カテニンの関与を伴うヒト乳癌における標的化治療のための有望な戦略に相当する。
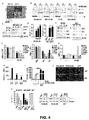
ヒト乳癌におけるCK1δおよびCK1εの関与を評価するために、本発明者らは、正常乳腺組織と比較して、ヒト乳房腫瘍検体における各アイソフォームの発現を調べた。癌ゲノムアトラス(TCGA)データセットの解析は、浸潤性乳癌(図1A)および独立したデータセットにおける、CK1δ(CSNK1D)の発現の高度な上昇を示した。4つの腫瘍乳癌亜型(Pam50固有分類)(18)にわたるCK1アイソフォーム発現の評価は、各主要クラスにわたる腫瘍のサブセット内でCK1δが広範に過剰発現されることを示した(図1B)。これとは対照的に、CK1ε発現は、基底様サブクラスに、より限局されており(図1B)、浸潤性乳癌とは関連していない。顕著なことには、遺伝子コピー数分析(TCGA)は、ヒト乳房腫瘍の3分の1以上(36%)でCSNK1D遺伝子座を含む17q25.3の増幅(高レベルおよび低レベル)を示しており、管腔Bおよび基底様クラスにおける増幅の、より高い頻度を示した。これとは対照的に、CSNK1E遺伝子座は乳癌において増幅されなかった(データ非表示)。特に、CSNK1Dコピー数はCK1δ転写産物の発現と有意に相関しており(p値<0.0001)、管腔A腫瘍と比較してHER2+、基底様および管腔B亜型において相関の増大が認められる(図1CおよびD)。これらの知見と一致して、免疫組織化学的分析は、正常乳房組織と比較した場合のヒト乳房腫瘍検体におけるCK1δの過剰発現を証明しており、ヒト乳癌細胞系のパネル全体にわたってCK1δが過剰発現された(図1E)。これとは対照的に、高いCK1ε発現は、分析された乳癌細胞系の僅か3つにおいて検出されたに過ぎず(図1E)、両方のCK1アイソフォームの発現は不死ヒトMCF10A乳房上皮細胞ならびにMCF7およびT47D ER+乳癌細胞においては低かった。
本発明者らは最近、CK1δよびCK1εの一連の小分子二重インヒビターの最初の構造活性相関を報告した(16)。例えば、SR−3029(図1F)は、並外れた効力および選択性を有するATP競合インヒビターであり、したがって、CK1δ/CK1ε生物学の理想的な小分子プローブである。細胞増殖アッセイは、CK1δを過剰発現する乳癌細胞型がCK1δ/CK1ε阻害に対して極めて感受性であることを示しており、低いナノモル範囲(5〜70nM)のEC50を示した。これとは対照的に、MCF7およびT47D乳癌細胞ならびにMCF10A細胞系(これらは全て、低レベルのCK1δを発現した)はSR−3029に対して2〜3桁低い感受性を示した(図1G)。CK1δを過剰発現する乳癌細胞に対するこの選択性はクローン原性増殖アッセイにおいて確認され、この場合、SR−3029はMDA−MB−231細胞のクローン原性増殖および生存を完全に阻止したが、MCF7乳癌細胞のコロニー形成能には全く影響を及ぼさなかった(図1H)。最後に、FACS分析は、SR−3029での処理がCK1δ過剰発現乳癌細胞の迅速なアポトーシスを選択的に誘発することを立証した(図1I)。
SR−3029は、インビボ試験に適した薬物動態学的特性を示す(16)。したがって、本発明者らは前臨床腫瘍モデルにおいてSR−3029の有効性を試験した。ホタルルシフェラーゼを発現するように操作されたMDA−MB−231 TNBC細胞を免疫不全ヌードマウスの乳房脂肪パッド内に移植し、7日後に処理を開始した。単一の物質として、SR−3029(20mg/kg、毎日、腹腔内)は腫瘍増殖を著しく妨げた(図2A、B)。実際、SR−3029療法を受けた被投与体の僅か2匹だけが腫瘍を発生し、これらは、ビヒクル処理マウスにおいて生じたものと比較してサイズが顕著に小さかった(図2B、C)。次に、同所性MDA−MB−231、MDA−MB−468(TNBC)、SKBR3およびBT474(HER2+)腫瘍異種移植片を、処理前に平均サイズ100mm3に到達させた。SR−3029(20mg/kg)の毎日のi.p.投与は全ての異種移植モデルにおいて顕著な腫瘍増殖抑制を引き起こした(図2D)。特に、侵襲性MDA−MB−231腫瘍の退縮は劇的なアポトーシス(図2E)および著しく延長した寿命(図2F)に関連づけられた。更に、体重、血液化学および組織完全性の組織化学的分析は、SR−3029の長期間の毎日の投与(48日間)が、明白な毒性を伴うことなく良好に耐容されることを示した(図2G)。
ヒト乳癌においてCK1δにより調節される経路を定め、CK1δ阻害に関する潜在的バイオマーカーを特定するために、TCGA患者の腫瘍データセットを、CK1δ過剰発現に関連した遺伝子シグネチャーに関して分析した。発現がCK1δ発現と有意に相関している612個の遺伝子を特定した(変化倍数>2、p値<0.05)。インジェヌイティ・パスウェイ分析(Ingenuity Pathway Analysis)(IPA)はカノニカル(canonical)Wnt経路の遺伝子[Wnt/β−カテニン標的(CCND1)、Wnt経路成分(FZD9)および該経路の内因性モジュレーター(WNT3、WNT9AおよびSFRP1)(分泌フリズルド(frizzled)関連タンパク質1)を含む]との有意な重複を特定した(図4A)。
各Rは、独立して選択される水素もしくは(C1−C6)アルキルであり、または窒素原子に結合した2個のR基は該窒素原子と一緒になって、O、SおよびNR’(ここで、R’は水素または(C1−C6)アルキルである)からなる群から選択される1または2個のヘテロ原子を所望により更に含んでいてもよい5〜7員ヘテロシクリルを形成しうるものであり;
Ar1はアリールまたは5員もしくは6員ヘテロアリールであり、これは置換されていないか、または1〜3個の独立して選択されるハロ、(C1−C6)アルキル、(C1−C6)フルオロアルキル、(C1−C6)アルコキシル、シアノ、ニトロ、C(=O)NR2、OC(=O)NR2、N(R)C(=O)OR、N(R)C(=O)RまたはC(=O)ORで置換されている;
Het1は単環式または二環式ヘテロアリールであり、これは置換されていないか、または1〜3個の独立して選択されるハロ、(C1−C6)アルキル、(C1−C6)フルオロアルキル、(C1−C6)アルコキシル、シアノ、ニトロ、C(=O)NR2、OC(=O)NR2、N(R)C(=O)OR、N(R)C(=O)RまたはC(=O)ORで置換されている]
の化合物またはその医薬上許容される塩の有効な量または濃度とCK1δを接触させることを含む、カゼインキナーゼ1δ(CK1δ)の阻害方法を提供しうる。
各Rは、独立して選択される水素もしくは(C1−C6)アルキルであり、または窒素原子に結合した2個のR基は該窒素原子と一緒になって、O、SおよびNR’(ここで、R’は水素または(C1−C6)アルキルである)からなる群から選択される1または2個のヘテロ原子を所望により更に含んでいてもよい5〜7員ヘテロシクリルを形成しうるものであり;
Ar1はアリールまたは5員もしくは6員ヘテロアリールであり、これは置換されていないか、または1〜3個の独立して選択されるハロ、(C1−C6)アルキル、(C1−C6)フルオロアルキル、(C1−C6)アルコキシル、シアノ、ニトロ、C(=O)NR2、OC(=O)NR2、N(R)C(=O)OR、N(R)C(=O)RまたはC(=O)ORで置換されている;
Het1は単環式または二環式ヘテロアリールであり、これは置換されていないか、または1〜3個の独立して選択されるハロ、(C1−C6)アルキル、(C1−C6)フルオロアルキル、(C1−C6)アルコキシル、シアノ、ニトロ、C(=O)NR2、OC(=O)NR2、N(R)C(=O)OR、N(R)C(=O)RまたはC(=O)ORで置換されている]
の化合物またはその医薬上許容される塩の有効量を、癌に罹患した患者に投与することを含む、癌の治療方法を提供する。
研究設計
この研究は、ヒト乳癌におけるCK1δおよびCK1εの関与を評価するために、ならびにヒト乳癌の前臨床モデルにおける社内の高特異的二重CK1δ/CK1εインヒビターの有効性を研究するために設計された。5つのヒト同所性乳房異種移植モデル、薬理学的および遺伝学的研究を用いて、このキナーゼを過剰発現する乳癌のサブセットにおける標的化CK1δを検証した。検出力分析は、90%の信頼度に関する各群内の腫瘍体積の標準偏差および群間の腫瘍体積の差異に基づいて、少なくとも7以上のnが必要であることを示唆した。したがって、本発明者らの実験は実験または対照(ビヒクル)コホート当たり7〜12匹の腫瘍担持マウスを含み、ここで、コホート間の腫瘍サイズ中央値が同じになるように無作為サンプリングを決定するために、マウスは処理(治療)前に無作為化された。全ての腫瘍サイズは実験期間を通して測定され、いずれのサンプルをも除外することなく図面においてグラフ化された。生存分析のために、マウスを、瀕死状態になったとき、および/または腫瘍が潰瘍化し若しくは1.2cm3以上に達したときに、安楽死させた。細胞に基づく全てのアッセイは三重重複で行い、少なくとも3回反復した。
全ての動物実験はScripps Florida IACUCにより承認されている。MDA−MB−231−Luc、MDA−MB−231、MDA−MB−468、SKBR3またはBT474細胞の安定プールを、6週齢雌無胸腺ヌードマウス(Charles River Laboratories)の乳房脂肪パッド内への2×106個の癌細胞の注射により確立した。BCM−4013患者由来異種移植片の確立は記載どおりであった(19)。簡潔に説明すると、新鮮な異種移植腫瘍断片(〜約1mm3)をレシピエントSCID/Bgマウス(Charles River Laboratories)の透明化乳房脂肪パッド内に移植した。毎日のi.p.注射により20mg/kgのSR−3029またはビヒクル(10:10:80,DMSO:Tween−80:水)でマウスを処理した。ルシフェリン(15mg/ml,Goldbio Technology)の皮下注射の後、キャリパーを使用して、またはIVIS 100イメージャ(露出時間,1〜60秒;ビンニング8;視野15cm;絞り値1;オープンフィルター)を使用する発光イメージングにより、示されている間隔で腫瘍体積を測定した。Living−Image(Xenogen)分析ソフトウェアを使用して、腫瘍関心領域(ROI)から平均放射輝度(p/s/cm2/sr)を決定した。
SR−3029またはビヒクル処理の72時間後、Cell−Titer Glo(Promega)を製造業者の指示に従い使用して、細胞増殖を測定した。非線形回帰および4パラメータアルゴリズム(GraphPad Prism5)を使用して、EC50値を決定した。クローン原性アッセイのために、6ウェルディッシュ内で500〜1000細胞/ウェルの密度で三重に細胞をプレーティングした。一晩のインキュベーションの後、SR−3029またはビヒクル(DMSO)を培地に72時間加え、細胞を7〜10日間増殖させ、その間に化合物の非存在下で2〜3日ごとに培地を交換した。コロニーを4% パラホルムアルデヒド/PBS中で固定し、50% エタノール中の0.5% メチレンブルーで室温で1時間染色し、水で脱染色した。低倍率光学顕微鏡を使用して、50個を超える細胞を有するコロニーを計数した。
特に示されていない限り、全ての化学物質はSigma Aldrichから購入した。MDA−MB−231、MDA−MB−436、MDA−MB−468、HS578T、BT474、SKBR3、MDA−MB−453、MCF7およびT47D乳癌細胞ならびに不死MCF−10A乳房上皮細胞はAmerican Type Culture Collection(ATCC)からのものであった。CK1δおよびCK1εのノックダウンのために、siRNA二本鎖を製造業者の説明(Qiagen)に従い調製し、特異的ノックダウン条件を、HiPerfectトランスフェクション試薬(Qiagen)を使用して最適化した。20nM 全siRNAの最終濃度を用いてノックダウンを達成した。FuGene6(Roche)を、製造業者の説明に従い、DNAトランスフェクションに使用した。
CK1δ(Y3989−Lv105−0200,GeneCopoeia)、GFP(EGFP−Lv105−0200,GeneCopoeia)、ルシフェラーゼまたはTCFレポーター7TFP(Addgene,Roel Nusse)を発現するレンチウイルスベクターをpPACKH1パッケージングプラスミドと共にHEK293T細胞にコトランスフェクトして、製造業者の推奨(System Biosciences)に従いレンチウイルス粒子を得た。特定のshRNAを安定に発現させるために、推奨プロトコール(38)に従い、shRNAオリゴヌクレオチドをTet−pLKO−Puroベクター内にクローニングし、Mission Packaging System(Sigma)を使用してレンチウイルスを作製した。MDA−MB−231細胞を最適化力価のレンチウイルスでトランスダクションし、ピューロマイシン(1μg/ml)またはブラスチシジン(ルシフェラーゼレンチウイルスの場合には5μg/ml)を含有する培地内で選択して、安定感染プールを増殖させた。
NuPAGE 4−12% Bis−Trisゲル(Invitrogen)を使用してSDS−PAGEゲル電気泳動を行い、トランス−ブロットトランスファー媒体(Biorad)を使用する半乾燥トランスファーによりPVDF膜に移した。膜をOdysseyブロッキングバッファー(LI−COR Biosciences)中でブロッキングし、一次抗体と共に4℃で一晩インキュベートした。TBST(20mM トリス,pH7.6,140mM NaClおよび0.1% Tween−20)での反復洗浄の後、ブロットを適切なIRDye結合二次抗体(LI−COR Biosciences)と共にインキュベートし、LI−COR Odysseyを使用してイメージングした。Odysseyソフトウェア(LI−COR Biosciences)を使用してバンドを定量した。この研究においては以下の抗体を使用した:CK1δおよびHistone H4(Abcam)、CK1ε、c−Myc(9E10)、サイクリン−D1およびβ−アクチン(Santa Cruz)、β−カテニン(Cell Signaling)、GAPDH(Millipore)およびCD44(R&D Systems)。
RNeasy Plus Mini Kit(Qiagen)を使用して全RNAを得、1〜2μgのRNAをSuperscript III First Strand Synthesis System(Life Technologies)で逆転写した。Power SYBR Green PCR Master Mix(Life Technologies)およびABI7900HT Fast Real−Time PCR Systemを使用して、定量的PCRを行った。ΔΔCt法を用いてGAPDH mRNA発現に対して正規化することにより得られた各関心遺伝子に関する相対発現値およびPrimer3アルゴリズムを使用して、イントロンにわたる遺伝子特異的プライマーペアを設計した。
凍結切片におけるアポトーシス検出のために、腫瘍および小腸を10% 緩衝化ホルマリン中で2時間固定し、20% スクロース中で一晩インキュベートし、OCT中で包埋した。凍結切片(5μM)をマウントし、ApopTag Red In Situ Kitを製造業者の説明(CHEMICON)に従い使用して染色した。H&E染色のために、組織を10% 緩衝化ホルマリン中で48時間固定し、70% エタノール/PBSに移し、パラフィン中で包埋した。脱パラフィン(AML Laboratories)後、5μM 切片上で染色を行った。
6ウェルディッシュ内に三重重複で播かれた2×105個の細胞をSR−3029またはビヒクルと共に72時間培養した。ついで細胞を回収し、Annexin V−FITCアポトーシス検出キット(BioVision)を製造業者の説明に従い使用してアネキシンV−FITCおよびPIで染色し、LSRI IIフローサイトメーター(Becton Dickinson)使用して分析した。スタウロスポリン(Cell Signaling)処理細胞(1μM)を陽性/補正対照として使用した。
TCFルシフェラーゼレポーター7TFP(39)を安定に発現するMDA−MB−231またはHEK293細胞をβ−カテニン−S33Yまたは空ベクター(pcDNA)でトランスフェクトした。18時間後、細胞を6000細胞/ウェルの密度で96ウェルプレート上に播いた。24時間後、細胞をSR−3029またはビヒクルで処理し、6時間インキュベートした後、1μg/ml 組換えヒトWnt3a(R&D Systems)またはPBSを加えた。3時間後、BriteLite Plus(Perkin Elmer)(これは等体積で培地に直接添加された)を使用してレポーターアッセイを行い、Spectramaxプレートリーダー(Molecular Devices)を使用して発光を読取った。
癌ゲノムアトラス(TCGA)データ検索;乳癌(BRCA)、腎乳頭状細胞癌(KIRC)および膀胱癌(BLCA)遺伝子発現およびコピー数データセットをTCGAポータル(http://tcga−data.nci.nih.gov/)からダウンロードした。発現プロファイリングのために、RNASeqV2プラットフォームからの20,475遺伝子のレベル3発現データをダウンロードした。
特に示されていない限り、図面における全ての値は平均±SEとして示されている。生存曲線は、カプラン−マイヤー法を用いて計算し、曲線間の差は、対数順位検定により決定した。相関係数は、ピアソン検定を用いて計算した。バイオインフォマティクス分析に関する詳細な情報は前記に示されている。全ての他の実験は、エクセルまたはプリズムにおいてスチューデント両側t検定を用いて分析した。ここで、0.05以下のp値が有意だとみなされた。
1. E.A.Rakha,J.S.Reis−Filho,F.Baehner,D.J.Dabbs,T.Decker,V.Eusebi,S.B.Fox,S.Ichihara,J.Jacquemier,S.R.Lakhani,J.Palacios,A.L.Richardson,S.J.Schnitt,F.C.Schmitt,P.H.Tan,G.M.Tse,S.Badve,I.O.Ellis,Breast cancer prognostic classification in the molecular era:the role of histological grade.Breast Cancer Res 12,207(2010)10.1186/bcr2607).
2. N.Cancer Genome Atlas,Comprehensive molecular portraits of human breast tumours.Nature 490,61−70(2012);published online EpubOct 4(10.1038/nature11412).
3. R.Siegel,J.Ma,Z.Zou,A.Jemal,Cancer statistics,2014.CA:a cancer journal for clinicians 64,9−29(2014);published online EpubJan−Feb(10.3322/caac.21208).
4. F.Andre,K.Slimane,T.Bachelot,A.Dunant,M.Namer,A.Barrelier,O.Kabbaj,J.P.Spano,H.Marsiglia,R.Rouzier,S.Delaloge,M.Spielmann,Breast cancer with synchronous metastases:trends in survival during a 14−year period.Journal of clinical oncology:official journal of the American Society of Clinical Oncology 22,3302−3308(2004);published online EpubAug 15(10.1200/JCO.2004.08.095).
5. L.Moja,L.Tagliabue,S.Balduzzi,E.Parmelli,V.Pistotti,V.Guarneri,R.D’Amico,Trastuzumab containing regimens for early breast cancer.The Cochrane database of systematic reviews 4,CD006243(2012)10.1002/14651858.CD006243.pub2).
6. L.Carey,E.Winer,G.Viale,D.Cameron,L.Gianni,Triple−negative breast cancer:disease entity or title of convenience? Nat Rev Clin Oncol 7,683−692(2010);published online EpubDec(10.1038/nrclinonc.2010.154).
7. C.M.Perou,Molecular stratification of triple−negative breast cancers.Oncologist 16 Suppl 1,61−70(2011)10.1634/theoncologist.2011−S1−61).
8. M.Kaucka,K.Plevova,S.Pavlova,P.Janovska,A.Mishra,J.Verner,J.Prochazkova,P.Krejci,J.Kotaskova,P.Ovesna,B.Tichy,Y.Brychtova,M.Doubek,A.Kozubik,J.Mayer,S.Pospisilova,V.Bryja,The Planar Cell Polarity Pathway Drives Pathogenesis of Chronic Lymphocytic Leukemia by the Regulation of B−Lymphocyte Migration.Cancer Research 73,1491−1501(2013);published online EpubMar 1(Doi 10.1158/0008−5472can−12−1752).
9. C.Brockschmidt,H.Hirner,N.Huber,T.Eismann,A.Hillenbrand,G.Giamas,B.Radunsky,O.Ammerpohl,B.Bohm,D.Henne−Bruns,H.Kalthoff,F.Leithauser,A.Trauzold,U.Knippschild,Anti−apoptotic and growth−stimulatory functions of CK1 delta and epsilon in ductal adenocarcinoma of the pancreas are inhibited by IC261 in vitro and in vivo.Gut 57,799−806(2008);published online EpubJun(10.1136/gut.2007.123695).
10. I.C.Tsai,M.Woolf,D.W.Neklason,W.W.Branford,H.J.Yost,R.W.Burt,D.M.Virshup,Disease−associated casein kinase I delta mutation may promote adenomatous polyps formation via a Wnt/beta−catenin independent mechanism.Int J Cancer 120,1005−1012(2007);published online EpubMar 1(10.1002/ijc.22368).
11. N.Rodriguez,J.Z.Yang,K.Hasselblatt,S.B.Liu,Y.L.Zhou,J.A.Rauh−Hain,S.K.Ng,P.W.Choi,W.P.Fong,N.Y.R.Agar,W.R.Welch,R.S.Berkowitz,S.W.Ng,Casein kinase I epsilon interacts with mitochondrial proteins for the growth and survival of human ovarian cancer cells.Embo Molecular Medicine 4,952−963(2012);published online EpubSep(DOI 10.1002/emmm.201101094).
12. H.Hirner,C.Gunes,J.Bischof,S.Wolff,A.Grothey,M.Kuhl,F.Oswald,F.Wegwitz,M.R.Bosl,A.Trauzold,D.Henne−Bruns,C.Peifer,F.Leithauser,W.Deppert,U.Knippschild,Impaired CK1 delta activity attenuates SV40−induced cellular transformation in vitro and mouse mammary carcinogenesis in vivo.PloS one 7,e29709(2012)10.1371/journal.pone.0029709).
13. J.K.Cheong,T.H.Nguyen,H.Wang,P.Tan,P.M.Voorhoeve,S.H.Lee,D.M.Virshup,IC261 induces cell cycle arrest and apoptosis of human cancer cells via CK1delta/epsilon and Wnt/beta−catenin independent inhibition of mitotic spindle formation.Oncogene 30,2558−2569(2011);published online EpubJun 2(10.1038/onc.2010.627).
14. S.Y.Kim,I.F.Dunn,R.Firestein,P.Gupta,L.Wardwell,K.Repich,A.C.Schinzel,B.Wittner,S.J.Silver,D.E.Root,J.S.Boehm,S.Ramaswamy,E.S.Lander,W.C.Hahn,CK1epsilon is required for breast cancers dependent on beta−catenin activity.PloS one 5,e8979(2010)10.1371/journal.pone.0008979).
15. S.Foldynova−Trantirkova,P.Sekyrova,K.Tmejova,E.Brumovska,O.Bernatik,W.Blankenfeldt,P.Krejci,A.Kozubik,T.Dolezal,L.Trantirek,V.Bryja,Breast cancer−specific mutations in CK1epsilon inhibit Wnt/beta−catenin and activate the Wnt/Rac1/JNK and NFAT pathways to decrease cell adhesion and promote cell migration.Breast Cancer Res 12,R30(2010)bcr2581[pii] 10.1186/bcr2581).
16. M.Bibian,R.J.Rahaim,J.Y.Choi,Y.Noguchi,S.Schurer,W.Chen,S.Nakanishi,K.Licht,L.H.Rosenberg,L.Li,Y.Feng,M.D.Cameron,D.R.Duckett,J.L.Cleveland,W.R.Roush,Development of highly selective casein kinase 1delta/1epsilon(CK1delta/epsilon) inhibitors with potent antiproliferative properties.Bioorganic & medicinal chemistry letters 23,4374−4380(2013);published online EpubAug 1(10.1016/j.bmcl.2013.05.075).
17. G.Finak,S.Sadekova,F.Pepin,M.Hallett,S.Meterissian,F.Halwani,K.Khetani,M.Souleimanova,B.Zabolotny,A.Omeroglu,M.Park,Gene expression signatures of morphologically normal breast tissue identify basal−like tumors.Breast Cancer Res 8,R58(2006)10.1186/bcr1608).
18. J.S.Parker,M.Mullins,M.C.Cheang,S.Leung,D.Voduc,T.Vickery,S.Davies,C.Fauron,X.He,Z.Hu,J.F.Quackenbush,I.J.Stijleman,J.Palazzo,J.S.Marron,A.B.Nobel,E.Mardis,T.O.Nielsen,M.J.Ellis,C.M.Perou,P.S.Bernard,Supervised risk predictor of breast cancer based on intrinsic subtypes.Journal of clinical oncology:official journal of the American Society of Clinical Oncology 27,1160−1167(2009);published online EpubMar 10(10.1200/JCO.2008.18.1370).
19. X.Zhang,S.Claerhout,A.Prat,L.E.Dobrolecki,I.Petrovic,Q.Lai,M.D.Landis,L.Wiechmann,R.Schiff,M.Giuliano,H.Wong,S.W.Fuqua,A.Contreras,C.Gutierrez,J.Huang,S.Mao,A.C.Pavlick,A.M.Froehlich,M.F.Wu,A.Tsimelzon,S.G.Hilsenbeck,E.S.Chen,P.Zuloaga,C.A.Shaw,M.F.Rimawi,C.M.Perou,G.B.Mills,J.C.Chang,M.T.Lewis,A renewable tissue resource of phenotypically stable,biologically and ethnically diverse,patient−derived human breast cancer xenograft models.Cancer research 73,4885−4897(2013);published online EpubAug 1(10.1158/0008−5472.CAN−12−4081).
20. K.R.Brennan,A.M.Brown,Wnt proteins in mammary development and cancer.J Mammary Gland Biol Neoplasia 9,119−131(2004);published online EpubApr(10.1023/B:JOMG.0000037157.94207.33).
21. F.C.Geyer,M.Lacroix−Triki,K.Savage,M.Arnedos,M.B.Lambros,A.MacKay,R.Natrajan,J.S.Reis−Filho,beta−Catenin pathway activation in breast cancer is associated with triple−negative phenotype but not with CTNNB1 mutation.Mod Pathol 24,209−231(2011);published online EpubFeb(10.1038/modpathol.2010.205).
22. V.Bryja,G.Schulte,E.Arenas,Wnt−3a utilizes a novel low dose and rapid pathway that does not require casein kinase 1−mediated phosphorylation of Dvl to activate beta−catenin.Cell Signal 19,610−616(2007);published online EpubMar(10.1016/j.cellsig.2006.08.011).
23. U.Knippschild,M.Kruger,J.Richter,P.Xu,B.Garcia−Reyes,C.Peifer,J.Halekotte,V.Bakulev,J.Bischof,The CK1 Family:Contribution to Cellular Stress Response and Its Role in Carcinogenesis.Front Oncol 4,96(2014)10.3389/fonc.2014.00096).
24. P.Wend,S.Runke,K.Wend,B.Anchondo,M.Yesayan,M.Jardon,N.Hardie,C.Loddenkemper,I.Ulasov,M.S.Lesniak,R.Wolsky,L.A.Bentolila,S.G.Grant,D.Elashoff,S.Lehr,J.J.Latimer,S.Bose,H.Sattar,S.A.Krum,G.A.Miranda−Carboni,WNT10B/beta−catenin signalling induces HMGA2 and proliferation in metastatic triple−negative breast cancer.EMBO molecular medicine 5,264−279(2013);published online EpubFeb(10.1002/emmm.201201320).
25. B.Schade,R.Lesurf,V.Sanguin−Gendreau,T.Bui,G.Deblois,S.A.O’Toole,E.K.A.Millar,S.J.Zardawi,E.Lopez−Knowles,R.L.Sutherland,V.Giguere,M.Kahn,M.Hallett,W.J.Muller,beta−Catenin Signaling Is a Critical Event in ErbB2−Mediated Mammary Tumor Progression.Cancer Research 73,4474−4487(2013);published online EpubJul 15(Doi 10.1158/0008−5472.Can−12−3925).
26. M.Moumen,A.Chiche,C.Decraene,V.Petit,A.Gandarillas,M.A.Deugnier,M.A.Glukhova,M.M.Faraldo,Myc is required for beta−catenin−mediated mammary stem cell amplification and tumorigenesis.Mol Cancer 12,132(2013);published online EpubOct 30(10.1186/1476−4598−12−132).
27. H.Al−Hussaini,D.Subramanyam,M.Reedijk,S.S.Sridhar,Notch signaling pathway as a therapeutic target in breast cancer.Molecular cancer therapeutics 10,9−15(2011);published online EpubJan(10.1158/1535−7163.MCT−10−0677).
28. C.Liu,Y.Li,M.Semenov,C.Han,G.H.Baeg,Y.Tan,Z.Zhang,X.Lin,X.He,Control of beta−catenin phosphorylation/degradation by a dual−kinase mechanism.Cell 108,837−847(2002);published online EpubMar 22(
29. J.I.Yook,X.Y.Li,I.Ota,C.Hu,H.S.Kim,N.H.Kim,S.Y.Cha,J.K.Ryu,Y.J.Choi,J.Kim,E.R.Fearon,S.J.Weiss,A Wnt−Axin2−GSK3beta cascade regulates Snail1 activity in breast cancer cells.Nat Cell Biol 8,1398−1406(2006);published online EpubDec(10.1038/ncb1508).
30. J.I.Yook,X.Y.Li,I.Ota,E.R.Fearon,S.J.Weiss,Wnt−dependent regulation of the E−cadherin repressor snail.J Biol Chem 280,11740−11748(2005);published online EpubMar 25(10.1074/jbc.M413878200).
31. A.Bafico,G.Liu,L.Goldin,V.Harris,S.A.Aaronson,An autocrine mechanism for constitutive Wnt pathway activation in human cancer cells.Cancer Cell 6,497−506(2004);published online EpubNov(10.1016/j.ccr.2004.09.032).
32. M.J.Higgins,J.Baselga,Targeted therapies for breast cancer.J Clin Invest 121,3797−3803(2011);published online EpubOct(10.1172/JCI57152).
33. J.K.Cheong,D.M.Virshup,Casein kinase 1:Complexity in the family.The international journal of biochemistry & cell biology 43,465−469(2011);published online EpubApr(10.1016/j.biocel.2010.12.004).
34. P.Polakis,Wnt signaling in cancer.Cold Spring Harb Perspect Biol 4,(2012);published online EpubMay(10.1101/cshperspect.a008052).
35. S.Y.Lin,W.Xia,J.C.Wang,K.Y.Kwong,B.Spohn,Y.Wen,R.G.Pestell,M.C.Hung,Beta−catenin,a novel prognostic marker for breast cancer:its roles in cyclin D1 expression and cancer progression.Proc Natl Acad Sci U S A 97,4262−4266(2000);published online EpubApr 11(10.1073/pnas.060025397).
36. W.H.Xu,Z.B.Liu,C.Yang,W.Qin,Z.M.Shao,Expression of dickkopf−1 and beta−catenin related to the prognosis of breast cancer patients with triple negative phenotype.PLoS One 7,e37624(2012)10.1371/journal.pone.0037624).
37. A.M.Brown,Wnt signaling in breast cancer:have we come full circle?Breast Cancer Res 3,351−355(2001).
38. D.Wiederschain,S.Wee,L.Chen,A.Loo,G.Yang,A.Huang,Y.Chen,G.Caponigro,Y.M.Yao,C.Lengauer,W.R.Sellers,J.D.Benson,Single−vector inducible lentiviral RNAi system for oncology target validation.Cell cycle 8,498−504(2009);published online EpubFeb 1.
39. C.Fuerer,R.Nusse,Lentiviral vectors to probe and manipulate the Wnt signaling pathway.PLoS One 5,e9370(2010)10.1371/journal.pone.0009370).
40. C.H.Mermel,S.E.Schumacher,B.Hill,M.L.Meyerson,R.Beroukhim,G.Getz,GISTIC2.0 facilitates sensitive and confident localization of the targets of focal somatic copy−number alteration in human cancers.Genome Biol 12,R41(2011)gb−2011−12−4−r41[pii]10.1186/gb−2011−12−4−r41).
本明細書中で言及されている全ての特許および刊行物を、各個の刊行物の全体が参照により本明細書に組み入れられると具体的かつ個別に示されている場合と同様に、参照により本明細書に組み入れることとする。
Claims (13)
- 式(I)
[式中、
各Rは、独立して選択される水素もしくは(C1−C6)アルキルであり、または窒素原子に結合した2個のR基は該窒素原子と一緒になって、O、SおよびNR’(ここで、R’は水素または(C1−C6)アルキルである)からなる群から選択される1または2個のヘテロ原子を所望により更に含んでいてもよい5〜7員ヘテロシクリルを形成しうるものであり;
Ar1はアリールまたは5員もしくは6員ヘテロアリールであり、これは置換されていないか、または1〜3個の独立して選択されるハロ、(C1−C6)アルキル、(C1−C6)フルオロアルキル、(C1−C6)アルコキシル、シアノ、ニトロ、C(=O)NR2、OC(=O)NR2、N(R)C(=O)OR、N(R)C(=O)RまたはC(=O)ORで置換されている;
Het1は単環式または二環式ヘテロアリールであり、これは置換されていないか、または1〜3個の独立して選択されるハロ、(C1−C6)アルキル、(C1−C6)フルオロアルキル、(C1−C6)アルコキシル、シアノ、ニトロ、C(=O)NR2、OC(=O)NR2、N(R)C(=O)OR、N(R)C(=O)RまたはC(=O)ORで置換されている]
の化合物またはその医薬上許容される塩の有効な量または濃度とカゼインキナーゼ1δ(CK1δ)を接触させることを含む、カゼインキナーゼ1δ(CK1δ)の阻害方法。 - 式(I)
[式中、
各Rは、独立して選択される水素もしくは(C1−C6)アルキルであり、または窒素原子に結合した2個のR基は該窒素原子と一緒になって、O、SおよびNR’(ここで、R’は水素または(C1−C6)アルキルである)からなる群から選択される1または2個のヘテロ原子を所望により更に含んでいてもよい5〜7員ヘテロシクリルを形成しうるものであり;
Ar1はアリールまたは5員もしくは6員ヘテロアリールであり、これは置換されていないか、または1〜3個の独立して選択されるハロ、(C1−C6)アルキル、(C1−C6)フルオロアルキル、(C1−C6)アルコキシル、シアノ、ニトロ、C(=O)NR2、OC(=O)NR2、N(R)C(=O)OR、N(R)C(=O)RまたはC(=O)ORで置換されている;
Het1は単環式または二環式ヘテロアリールであり、これは置換されていないか、または1〜3個の独立して選択されるハロ、(C1−C6)アルキル、(C1−C6)フルオロアルキル、(C1−C6)アルコキシル、シアノ、ニトロ、C(=O)NR2、OC(=O)NR2、N(R)C(=O)OR、N(R)C(=O)RまたはC(=O)ORで置換されている]
の化合物またはその医薬上許容される塩の有効量を、癌に罹患した患者に投与することを含む、癌の治療方法。 - 癌が、CK1δおよびβ−カテニンの両方の発現レベルのアップレギュレーションを示す癌である、請求項3記載の方法。
- 癌が乳癌、黒色腫、膠芽腫、髄芽腫、腎癌、膀胱癌もしくは結腸癌であり、または脳、肺もしくは骨に転移する癌であり、ただし、この場合、CK1δおよびβ−カテニン依存性の両方の上昇がそれらの転移性疾患に関与している、請求項3記載の方法。
- 乳癌が三種陰性サブクラスの乳癌(TNBC)またはHER+ 乳癌である、請求項4記載の方法。
- 癌の治療のための、請求項1記載の式(I)の化合物。
- 癌が乳癌、黒色腫、膠芽腫、髄芽腫、腎癌、膀胱癌もしくは結腸癌であり、または脳、肺もしくは骨に転移する癌であり、ただし、この場合、CK1δおよびβ−カテニン依存性の両方の上昇がそれらの転移性疾患に関与している、請求項8記載の化合物。
- 乳癌が三種陰性サブクラスの乳癌(TNBC)またはHER+ 乳癌である、請求項10記載の化合物。
- 患者におけるCK1δのレベルおよびβ−カテニンのレベルを決定すること、ならびにそれらのレベルの両方が上昇している場合には、抗癌薬としてCK1δインヒビターを選択することを含む、患者における癌の治療に有効な抗癌薬を特定する方法。
- CK1δおよびβ−カテニンレベルの上昇が患者において存在するかどうかを決定すること、ならびに両方のレベルが上昇している場合には、治療レジメンのためにCK1δインヒビターを選択することを含む、乳癌、黒色腫、膠芽腫、髄芽腫、または腎臓、膀胱もしくは結腸癌、または脳、肺もしくは骨に転移する癌の、患者における治療方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562240689P | 2015-10-13 | 2015-10-13 | |
| US62/240,689 | 2015-10-13 | ||
| PCT/US2016/055436 WO2017066055A1 (en) | 2015-10-13 | 2016-10-05 | THERAPEUTIC TARGETING OF CASEIN KINASE 1δ IN BREAST CANCER |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2018538241A true JP2018538241A (ja) | 2018-12-27 |
| JP2018538241A5 JP2018538241A5 (ja) | 2019-11-14 |
Family
ID=58517824
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018519027A Pending JP2018538241A (ja) | 2015-10-13 | 2016-10-05 | 乳癌におけるカゼインキナーゼ1δの治療標的化 |
Country Status (8)
| Country | Link |
|---|---|
| US (2) | US10603322B2 (ja) |
| EP (1) | EP3362452A4 (ja) |
| JP (1) | JP2018538241A (ja) |
| CN (1) | CN108431006A (ja) |
| AU (1) | AU2016338639A1 (ja) |
| CA (1) | CA3001903A1 (ja) |
| HK (1) | HK1259409A1 (ja) |
| WO (1) | WO2017066055A1 (ja) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2019145386A1 (en) | 2018-01-26 | 2019-08-01 | Roche Innovation Center Copenhagen A/S | Oligonucleotides for modulating csnk1d expression |
| US11666578B2 (en) | 2018-05-08 | 2023-06-06 | The University Of Florida Research Foundation, Inc. | Small molecule inhibitors of CDK12/CDK13 |
| BR112021003093A2 (pt) * | 2018-08-22 | 2021-05-11 | Merck Patent Gmbh | tratamento de câncer de mama triplo negativo que visa a inibição de tgf-beta |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2013130461A1 (en) * | 2012-02-29 | 2013-09-06 | The Scripps Research Institute | Wee1 degradation inhibitors |
| ES2638179T3 (es) * | 2013-01-16 | 2017-10-19 | Signal Pharmaceuticals, Llc | Compuestos de pirrolopirimidina sustituidos, composiciones de los mismos, y métodos de tratamiento con los mismos |
-
2016
- 2016-10-05 CN CN201680071705.XA patent/CN108431006A/zh active Pending
- 2016-10-05 JP JP2018519027A patent/JP2018538241A/ja active Pending
- 2016-10-05 US US15/768,257 patent/US10603322B2/en not_active Expired - Fee Related
- 2016-10-05 WO PCT/US2016/055436 patent/WO2017066055A1/en active Application Filing
- 2016-10-05 CA CA3001903A patent/CA3001903A1/en not_active Abandoned
- 2016-10-05 EP EP16855974.8A patent/EP3362452A4/en not_active Withdrawn
- 2016-10-05 AU AU2016338639A patent/AU2016338639A1/en not_active Abandoned
-
2019
- 2019-01-31 HK HK19101778.5A patent/HK1259409A1/zh unknown
- 2019-11-25 US US16/694,380 patent/US20200163972A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| WO2017066055A1 (en) | 2017-04-20 |
| US10603322B2 (en) | 2020-03-31 |
| EP3362452A4 (en) | 2019-06-12 |
| US20180311252A1 (en) | 2018-11-01 |
| EP3362452A1 (en) | 2018-08-22 |
| CN108431006A (zh) | 2018-08-21 |
| CA3001903A1 (en) | 2017-04-20 |
| US20200163972A1 (en) | 2020-05-28 |
| AU2016338639A1 (en) | 2018-05-10 |
| HK1259409A1 (zh) | 2019-11-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Rosenberg et al. | Therapeutic targeting of casein kinase 1δ in breast cancer | |
| Hao et al. | Targeted inhibition of β-catenin/CBP signaling ameliorates renal interstitial fibrosis | |
| Kim et al. | Abrogation of galectin-4 expression promotes tumorigenesis in colorectal cancer | |
| Zhang et al. | Reciprocal activation between PLK1 and Stat3 contributes to survival and proliferation of esophageal cancer cells | |
| Konishi et al. | γ-Secretase inhibitor prevents Notch3 activation and reduces proliferation in human lung cancers | |
| Li et al. | Non‐coding RNA MFI2‐AS1 promotes colorectal cancer cell proliferation, migration and invasion through miR‐574‐5p/MYCBP axis | |
| Zhang et al. | Demethylzeylasteral inhibits glioma growth by regulating the miR-30e-5p/MYBL2 axis | |
| Hu et al. | G9a and histone deacetylases are crucial for Snail2‐mediated E‐cadherin repression and metastasis in hepatocellular carcinoma | |
| T Sankpal et al. | Expression of specificity protein transcription factors in pancreatic cancer and their association in prognosis and therapy | |
| Wang et al. | CD24 mediates gastric carcinogenesis and promotes gastric cancer progression via STAT3 activation | |
| Zheng et al. | miR-145 sensitizes esophageal squamous cell carcinoma to cisplatin through directly inhibiting PI3K/AKT signaling pathway | |
| US20200163972A1 (en) | Therapeutic Targeting of Casein Kinase 1 Delta in Breast Cancer | |
| Guo et al. | Knockdown of FRAT1 expression by RNA interference inhibits human glioblastoma cell growth, migration and invasion | |
| Yao et al. | Hepatocyte nuclear factor 4α suppresses the aggravation of colon carcinoma | |
| Ho et al. | Inhibition of the H3K9 methyltransferase G9A attenuates oncogenicity and activates the hypoxia signaling pathway | |
| Wu et al. | CRCT1 regulated by microRNA-520 g inhibits proliferation and induces apoptosis in esophageal squamous cell cancer | |
| Han et al. | Long non‑coding RNA JPX promotes gastric cancer progression by regulating CXCR6 and autophagy via inhibiting miR‑197 | |
| Zhou et al. | Homeobox B4 inhibits breast cancer cell migration by directly binding to StAR‑related lipid transfer domain protein 13 | |
| WO2016020427A1 (en) | Macc1 inhibitors and use thereof in the treatment of cancer | |
| Han et al. | TIMP3 overexpression improves the sensitivity of osteosarcoma to cisplatin by reducing IL-6 production | |
| Xie et al. | Wilms’ tumor 1-associated protein contributes to chemo-resistance to cisplatin through the Wnt/β-catenin pathway in endometrial cancer | |
| Zhang et al. | miR‑802 inhibits the aggressive behaviors of non‑small cell lung cancer cells by directly targeting FGFR1 Retraction in/10.3892/ijo. 2022.5389 | |
| Zhu et al. | BRD9 is an essential regulator of glycolysis that creates an epigenetic vulnerability in colon adenocarcinoma | |
| Ning et al. | PCDH20 inhibits esophageal squamous cell carcinoma proliferation and migration by suppression of the mitogen-activated protein kinase 9/AKT/β-catenin pathway | |
| US20230131501A1 (en) | THERAPEUTIC USES OF INHIBITORS OF THE RNA-BINDING PROTEIN HuR |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20191003 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20191003 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20200821 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20200908 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20210330 |