JP2016540506A - 新規b細胞サイトカインの同定 - Google Patents
新規b細胞サイトカインの同定 Download PDFInfo
- Publication number
- JP2016540506A JP2016540506A JP2016533639A JP2016533639A JP2016540506A JP 2016540506 A JP2016540506 A JP 2016540506A JP 2016533639 A JP2016533639 A JP 2016533639A JP 2016533639 A JP2016533639 A JP 2016533639A JP 2016540506 A JP2016540506 A JP 2016540506A
- Authority
- JP
- Japan
- Prior art keywords
- cells
- cell
- disease
- lymphoma
- protein
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/52—Cytokines; Lymphokines; Interferons
- C07K14/54—Interleukins [IL]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
- C07K16/244—Interleukins [IL]
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
- C12N15/1136—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing against growth factors, growth regulators, cytokines, lymphokines or hormones
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
- G01N33/6863—Cytokines, i.e. immune system proteins modifying a biological response such as cell growth proliferation or differentiation, e.g. TNF, CNF, GM-CSF, lymphotoxin, MIF or their receptors
- G01N33/6869—Interleukin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/14—Type of nucleic acid interfering N.A.
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2320/00—Applications; Uses
- C12N2320/30—Special therapeutic applications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/52—Assays involving cytokines
- G01N2333/54—Interleukins [IL]
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/569—Immunoassay; Biospecific binding assay; Materials therefor for microorganisms, e.g. protozoa, bacteria, viruses
- G01N33/56966—Animal cells
- G01N33/56972—White blood cells
Abstract
Description
本発明は、米国国立保健研究所の認可番号第AI096278号において、政府支援の下でなされた。政府は、本発明において一定の権利を有する。
本願は、その開示が参照により本明細書に組み込まれる、2013年11月20日に出願された、米国特許仮出願第61/906,855号の優先権を主張する。
本発明は、IL40と称される新規サイトカインが関与する組成物及び方法に関する。
サイトカインは、免疫系を調節する低分子分泌タンパク質である。これらのタンパク質は、分類及び応答の大きさなど、免疫応答を調節する非常に重要な媒介物質である。例えば、インターロイキン、ケモカイン、腫瘍壊死因子スーパーファミリー及びインターフェロンが挙げられる。これらの多くは、現在、免疫療法として調査されている。これらは、自己免疫疾患、癌及び他の疾患に関与している。
;
a)IgG、IgM、IgA、IgDまたはIgE;
b)モノクローナル抗体;
c)Fab'、Fab、F(ab')2、シングルドメイン抗体(sdAb)、FvまたはscFv(単鎖Fv);
d)標識抗体;
e)中和抗体;または
f)a)〜e)の任意の組み合わせ。
a)サンプル中でのIL40の検出方法。本方法としては、
免疫検出方法において、IL40を検出するための検出剤として抗体を使用してIL40を免疫検出することが挙げられる。いくつかの実施形態では、免疫検出法は酵素結合免疫吸着法(ELISA)、組織学的方法、蛍光活性化細胞選別、ラジオイムノアッセイ(RIA)、免疫放射定量分析法、免疫組織化学的方法、蛍光免疫測定法、化学発光分析法、生物発光分析法、ウエスタンブロッティング法またはドットブロッティング法である。ELISA法では、所定のタンパク質の2つの異なる工ピトーを認識する2つの異なる抗体を使用して、比色分析法において抗体の1つに結合される基質の検出を介してタンパク質を検出することができる。組織学的方法では、標識抗体を使用して、新鮮凍結組織、またはホルマリン固定パラフィン包埋サンプルのいずれかにおいて、組織サンプル中でタンパク質を検出することができる。蛍光活性化細胞選別では、蛍光色素標識抗体を使用して、特定のタンパク質を発現させる細胞を検出することができる。分泌タンパク質の場合、当業者に既知の手技により、該タンパク質の細胞内染色が可能である利用可能な技術が存在する。ラジオイムノアッセイでは、放射性標識タンパク質を使用して、競合法中に存在する放射活性量を測定することによって(例えば、特定の抗体を使用することにより)、所与のサンプル中に存在するタンパク質の量を測定することができる。これらの分析法の変異型としては、抗体/標識化合物を使用して、特定の抗体の親和性/結合活性に依存する競合法を介して所定のサンプル中における特定のタンパク質の量を測定することを伴う。ウエスタンブロッティング法では、ゲルの移動後に特定の抗体を使用することにより所与のタンパク質を検出することができ、この方法では、技術者は検出されるタンパク質の分子量を知ることもできる。
b)IL40が関与する疾患の治療を必要とする対象における、IL40が関与する疾患の治療方法。この方法は、治療有効量の抗−IL40抗体を対象へ投与し、IL40を中和することを含む。いくつかの実施形態では、本疾患は、自己免疫疾患またはリンパ腫である。
c)サンプル中でのIL40の検出方法。本方法としは、IL40が関与する疾患のための診断法またはセラノスティクス法(theranostic)において検出剤として抗−IL40抗体を使用してIL40を免疫検出することが挙げられる。抗体の使用をベースにして、生理液中での可溶性タンパク質の存在を検出するために利用可能な多くの方法がある。最も一般的なものとしては、IL40の異なる工ピトープを認識する2つの異なる抗体を使用する酵素関連イムノアッセイである。そのうちの1つを生理液を配置するプレート中での捕捉抗体として使用する。この抗体をプレートに固着させて、液体内に存在するIL40を「捕捉」する。二次抗体は酵素に結合する。最終的に、基質を使用して、酵素により処理し、典型的には、ELISAリーダーで検出され得る所与の色を発現させる。他の方法としては、酵素基質の代わりに放射能を使用して、所与の液体中に存在するIL40の量を測定するラジオイムノアッセイが挙げられる。本液体は、異なる疾患を有する患者から得ることができる。典型的には、活性化B細胞は、さまざまな癌(リンパ腫,白血病)または炎症若しくは自己免疫疾患(リウマチ性関節炎、全身性エリテマトーデス、シェーグレン症候群、強直性脊椎炎、乾癬、その他のもの)の病原体において任意の役割を担っていることが判明した。いくつかの実施形態では、本疾患は、リンパ腫、白血病、免疫不全または自己免疫疾患である。特定の実施形態では、自己免疫疾患は全身性エリテマトーデス、リウマチ性関節炎または乾癬であり、免疫不全はIgA欠損症候群である。
d)IL40が発現する細胞のサブセットの精製方法または単離方法。本方法には、細胞のサブセットを精製するまたは単離するために、精製剤/単離剤として抗−IL40抗体を使用することを含む。抗体は、ハイブリドーマ培養から精製することができる。典型的には、最初に0.45mmフィルターを介して上清を濾過し、細胞片を除去する。好ましい方法としては、タンパク質A/Gクロマトグラフィーを含む。濾過したハイブリドーマ培養をA/Gタンパク質カラムに入れ、pHが変化することによって破断され、カラムから精製抗体が溶出する可能性がある結合基において、抗体分子がA/Gタンパク質に結合することになる。次に精製抗体をさまざまな蛍光色素により標識し、その後、蛍光活性化セルソーターにおいて分析することができる細胞懸濁液の染色に使用することができる。この手技により、抗体によって認識される抗原を発現する細胞サブセットを同定することとなり得る。いくつかの実施形態では、サブセットは蛍光活性化細胞選別(FACS)により精製または単離され、細胞サブセットを選択する。
a)IL40の配列変異型、多形体または種対応物;
b)IL40の置換変異型、挿入変異型または欠失変異型;
c)グリコシル化修飾IL40、化学修飾IL40及びIL40抱合体からなる群から選択されるIL40の非配列誘導体;
d)IL40の機能的変異体;
e)IL40の機能的活性セグメント、IL40の保存領域、またはIL40の非保存領域;
f)IL40の融合タンパク質;または
g)a)〜f)の任意の組み合わせ。
a)免疫細胞の誘導方法。本方法は、免疫細胞を誘導して、synaptogyrin2及び/若しくはB細胞によって産生される他のIL40誘導タンパク質を産生するため、または免疫細胞の分化または成熟を誘発するために活性剤としてペプチドまたはタンパク質を使用することを含む。細胞は、24時間インビトロで、組織培養培地、典型的には、RPMI1640若しくはDMEM若しくはウシ胎児血清、グルタミン及びメルカプトエタノールを補足した類似の培地を用いて、IL40と共にインキュベートすることができる(さまざまな濃度にて)。
b)IL40が関与する疾患の治療を必要とする対象における、IL40が関与する疾患の治療方法。本方法は、治療有効量のペプチドまたはタンパク質を対象へ投与することを含み、このペプチドまたはタンパク質はIL40アンタゴニストである。いくつかの実施形態では、本疾患は、自己免疫疾患またはリンパ腫である。
c)IL40が関与する疾患の治療を必要とする対象における、IL40が関与する疾患の治療方法。本方法は、治療有効量のIL40またはペプチド若しくはタンパク質を対象へ投与することを含み、このペプチドまたはタンパク質はIL40アンタゴニストである。いくつかの実施形態では、疾患はIgA欠損症候群、ホジキンリンパ腫若しくは非ホジキンリンパ腫、びまん性大細胞型リンパ腫、菌状息肉腫、マントル細胞リンパ腫、多発性骨髄腫または別のリンパ腫若しくは白血病;リウマチ性関節炎、全身性エリテマトーデス、シェーグレン症候群、橋本甲状腺炎、強皮症、グレーブス病、クローン病、潰瘍性大腸炎、原発性胆汁性肝硬変症、自己免疫性肝炎、多発性硬化症、乾癬、アトピー性皮膚炎、特発性肺胞線維症、過敏性肺炎、非特異的間質性肺炎または別の自己免疫疾患である。
d)IL40が関与する疾患の診断方法。本方法としては、診断法/セラノスティクス法において、標的またはサンプル対照としてペプチドまたはタンパク質を使用することを含む。抗体の使用をベースにして、唾液、血清、血漿精液、気管支肺胞洗浄液体、尿、涙、リンパ液、汗、胆汁、脳脊髄液などの生理液中での可溶性タンパク質の存在を検出するために利用可能な多くの方法がある。最も一般的な方法としては、IL40の異なる工ピトープを認識する2つの異なる抗体を使用する酵素結合(ELISA)免疫吸着法である。そのうちの1つを生理液を配置するプレート中での捕捉抗体として使用する。この抗体をプレートに固着させて、液体内に存在するIL40を「捕捉」する。二次抗体は酵素に結合する。最終的に、基質を使用して、酵素により処理し、典型的には、専用ELISAリーダーで検出され得る所与の色を発現させる。他の方法としては、酵素基質の代わりに放射能を使用して、所与の液体中に存在するIL40の量を測定するラジオイムノアッセイが挙げられる。本液体は、異なる疾患を有する患者から得ることができる。典型的には、活性化B細胞は、さまざまな癌または炎症若しくは自己免疫疾患の病原体において任意の役割を担っていることが判明した。いくつかの実施形態では、本疾患は、リンパ腫、自己免疫疾患、全身性エリテマトーデス、リウマチ性関節炎または乾癬である。
e)IL40の受容体の同定方法。本方法は、IL40受容体に結合するためのリガンドとしてペプチドまたはタンパク質を使用することを含む。IL40受容体は、その受容体に結合するために使用することができる標識IL40を用いて同定され得る。次に、抗−IL40または抗−標識抗体を使用してリガンド/受容体複合体を免疫沈降させることができる。こうした標識の例としては、His−タグ、フラグ−タグなどが挙げられる。また、受容体を発現するラジオイムノアッセイ細胞を介して最初に検出されるように、IL40を放射線標識することもできる。異なる細胞を放射線標識と共にインキュベートし、インキユベート後、細胞を洗浄するか、または粘度及び遊離対結合放射線標識IL40の遠心分離によって分離される勾配を介して通過させる。放射能を保持する細胞は、特定のIL40受容体を発現するものとする。
a)IL40遺伝子またはIL40 cDNAのヌクレオチド配列の一部または全体を含み、この核酸が本明細書に記載のIL40ペプチドまたはタンパク質をコードする;
b)別のヌクレオチド配列、標識(例えば、HIS−タグ若しくはFLAG)、またはビニルスルホン誘導体科染料、蛍光色素分子などの化学誘導体、またはプロテオミクスなど他の技術で一般的に使用される他のタグ(例えばビオチン)に共役結合されている。
c)プライマー、プローブ、アンチセンス分子、またはIL40遺伝子またはIL40 cDNA配列をベースとしたオリゴヌクレオチド、
d)異種核酸配列に付着した組換え型構造体、または
e)混合a)〜d)のいずれかを組み合わせたもの。
a)IL40が関与する疾患の治療を必要とする対象における、IL40が関与する疾患の治療方法。この方法は、治療有効量の核酸を対象へ投与することを含み、本核酸により、IL40の発現が減少する。いくつかの実施形態では、本疾患は、自己免疫疾患またはリンパ腫である。
b)IL40が関与する疾患の治療を必要とする対象における、IL40が関与する疾患の治療方法。この方法としては、治療有効量の核酸を対象へ投与することを含み、本核酸によりIL40の発現が減少する。いくつかの実施形態では、疾患はIgA欠損症候群、ホジキンリンパ腫若しくは非ホジキンリンパ腫、びまん性大細胞型リンパ腫,菌状息肉腫、マントル細胞リンパ腫、または別のリンパ腫若しくは白血病;リウマチ性関節炎、全身性エリテマトーデス、シェーグレン症候群、橋本甲状腺炎、強皮症、グレーブス病、クローン病、潰瘍性大腸炎、原発性胆汁性肝硬変症、自己免疫性肝炎、多発性硬化症、乾癬、アトピー性皮膚炎、特発性肺胞線維症、過敏性肺炎、非特異的間質性肺炎または別の自己免疫疾患である。また、いくつかの実施形態では、核酸はRNAi分子であってもよい。
c)IL40が関与する疾患の診断方法。本方法は、疾患の診断法/セラノスティクス法においてプローブとして核酸を使用することを含む。いくつかの実施形態では、本疾患は、リンパ腫、自己免疫疾患、全身性エリテマトーデス、リウマチ性関節炎または乾癬である。
またはf)a)〜e)のいずれかの組み合わせである。
a)IL40濃度は、免疫検出技術により測定することができる;
b)本方法は、これらに限定されないが、例えばインターロイキン6、インターロイキン10及び特定の免疫グロブリンなど別のバイオマーカーを測定すること更に含むことができる;
c)本方法は、自己免疫疾患またはリンパ腫の診断を必要とする患者において、自己免疫疾患またはリンパ腫を診断することができ、濃度の上昇により、リンパ腫または自己免疫疾患が示唆される;
d)IL40濃度の上昇により、リンパ腫または自己免疫疾患のIL40産生サブタイプを決定することができる;または
e)混合a)〜d)のいずれかを組み合わせたものである。
a)IL40、標識IL40、His−タグIL40、ビオチン標識IL40、またはこれらの組み合わせによりIL40応答細胞の標識を行うことと、標識細胞を単離、精製及び/または分離することを含む。これらのラベルにより標識された細胞は、例えば、HIS−タグに対する蛍光色素標識特異的抗体を用いることにより、また、蛍光活性化セルソーターを介してサンプルを実行することにより、または、ビオチン標識IL40の場合、類似した方法において蛍光色素標識ストレプトアビジンを使用することによって分離することができる。または、
b)IL40、標識IL40、His−タグIL40、ビオチン標識IL40、またはこれらの組み合わせによりIL40応答細胞の標識を行うことと、標識細胞を単離、精製及び/または分離することを含み、本細胞は、IL40受容体が発現する真核細胞または細菌由細胞である;
c)酵母2ハイブリッド系においてIL40に結合するタンパク質を同定する;または
d)IL40受容体発現細胞由来のメンブレン調製からのIL40結合タンパク質を免疫沈降させる。例えば、水性培地中において少量のガラスビーズ、セラミックビーズまたは鋼鉄ビーズを細胞サンプルと混合したものを用いて、IL40受容体を発現する細胞を破壊することができる。この混合物に対して、攪拌及び振盪により高水準攪拌を行う。ビーズは細胞と衝突し、細胞を破壊して、細胞間成分を放出させる。均質化中、機械的剪断(ボルテックス)を適度に行い、遠心分離によって分離できる最良のメンブレンまたは細胞内調製物となる。標識(HIS−タグであってもよい)に対して抗体を使用することにより、タンパク質複合体(その受容体に結合された標識IL40など)の免疫沈降を達成することができる。免疫沈降の分析及び配列決定により、この複合体中に存在するタンパク質が同定されるものとする。
a)インビトロまたはインビボにおいてB細胞の成長及び分化を促進する;
b)ハイブリドーマ培養物の成長を増大させる;
c)ハイブリドーマ培養物により抗体生成物が増加する;または
d)例えば、ヒト、イヌ、マウス、ネコ、ウシ、ウマ、ブタ、ヤギ、またはヒツジなど異なる哺乳類種由来のIL40を使用することにより、組織または細胞の種発生源を決定する。
自己免疫疾患は、全身性エリテマトーデス、リウマチ性関節炎、乾癬、グレーブス病、自己免疫性肝炎、原発性胆汁性肝硬変、橋本甲状腺炎、またはシェーグレン症候群であってもよく、
リンパ腫は、ホジキンリンパ腫及び非ホジキンリンパ腫、マントル細胞リンパ腫、びまん性大細胞型B細胞リンパ腫、濾胞性リンパ腫、慢性リンパ性白血病、急性リンパ性白血病、MALTリンパ腫、バーキットリンパ腫、菌状息肉腫、または多発性骨髄腫であってもよい。
a)薬学的に許容可能な担体、賦形剤またはそれらを組み合わせたものを含む;
b)滅菌製剤として使用される;
c)これらに限定されないが、抗−TNFa抗体(Remicade,Humira);抗−BAFF(Benlysta);抗−CD20(Rituximab);及び抗−CD30(Adcetris)など、自己免疫疾患またはリンパ腫を治療するための別の治療薬を含む;
d)例えば、エマルション、ミセルなどの緩効性または徐放性製剤である;
e)例えば、リポソーム、包接錯体、担体などの標的投与形態である;または
f)a)〜e)のいずれかの組み合わせである。
序論
近年特性が決定されたサイトカイン産生B細胞のサブセット、すなわち、B調節細胞(Breg/B10)、Bエフェクタ−1(Bel)及びBエフェクタ−2(Be2)細胞により、炎症及び自己免疫疾患におけるB細胞の役割が抗体生成物に優ることを示すエビデンスが示される。特に、これらは、サイトカイン生成能力を示す。本明細書では、インターロイキン−40(IL40)と称された活性化B細胞により作製された新規サイトカインについて記載する。IL40は、マウス及びヒトの両者の胎児肝臓及び骨髄において発現する未同定遺伝子(C17ORF99)によってコードされる。また、CD40L(またはLPS)によって刺激されたB細胞中に発現する。その産生は、いくつかのサイトカイン(IL−4、IL−13及びTGFβ)によって増強され、IFNγによって阻害される。IL40は24kDの分泌タンパク質であり、他の既知のサイトカインとの関連はない。Il40欠損マウス(Il40-/-)は、巨脾腫また改変B細胞表現型を呈し、パイエル板では、CD19+B細胞数の増大及びIgA産生細胞数の低下を有する。IL40の転写は、泌乳乳腺において誘導される。更に、IL40の転写がSLE患者由来のPBMC内及びMRLFas1pr/1prマウス由来の脾細胞内で上昇する。IL40はB細胞の発現及び分化への多面効果を有する新規B細胞誘導サイトカインであると結論付けられる。
(A)サイトカインとしてのIL40の同定
B.IL40は、B細胞により産生されたサイトカインである。
A.新規サイトカインの同定
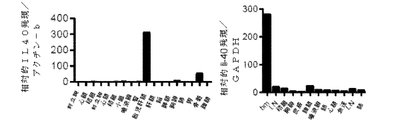
アノテーションされていない免疫系関連遺伝子(C17orf99)は、BIGEデータベースの解析を介して最初に同定した。C17orf99mRNAは、胎児肝臓、骨髄及び30時間抗−CD40+IL−4により活性化させたB細胞において多く発現し、他の部位での発現は、ほとんどまたはまったく認められない。すべての組織及びC17orf99の発現の平均強度の完全なリストを表1に提示する。ヒト遺伝子は、予測された20のアミノ酸(図1B)のN末端シグナル配列を有する265のアミノ酸のタンパク質をコードするオープンリーディングフレームを含有し、245のアミノ酸(約27KDa)の成熟タンパク質が予測される。BIGEデータベースにおいてIL40の発現の完全なリストは、表1に提供される。霊長類、イヌ及びマウスなどの哺乳類において相同遺伝子が同定された(6030468B19Rik、72%のタンパク質配列変換)が、ニワトリ及びゼブラフィッシュ(図2)中には存在しなかった。遺伝子は、造血臓器(ホメオスタシス)(9)においてかつ活性化Bリンパ球(炎症性)(2)によって産生された低分子分泌タンパク質(8)をコードするため、IL40(図1)と称している。BIGEの発現プロファイルは、ヒト組織RNA(図2A)のqRT−PCR解析を使用して、マウスRNAサンプルの同等の収集を用いて確認し、これは、免疫系関連組織及び特に骨髄においてマウス相同体が多くかつ特異的に発現していることが示された(図2B)。Pfam searchから、IL40は、現在公知のいかなるサイトカインファミリーにも属さずに(データに図示せず)、IL40が造血臓器及び活性化B細胞において産生された新規サイトカインであることがわかる。
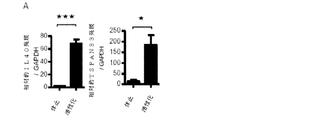
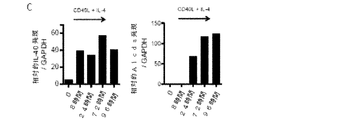
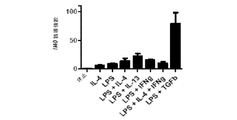
例えばIL−2、IL−7及びIL−15などのサイトカインの多くは、リンパ球の個体発生及び活性化の両方において機能を有するため(13)、本発明者らは、IL40は更にこれらのプロセスに関与している可能性があると仮定した。BIGEデータベースにおけるその発現パターンから、B細胞がCD40L+IL−4により刺激されるとき、IL40の発現が増加していることがわかる。この点を確認するために、休止または活性条件下において、PBMCから精製されたヒトB細胞におけるIL40の転写を抗−CD40+IL−4を用いて24時間測定し(図4A)、TSPAN33の発現と比較した(本発明者らが近年記述したB細胞活性化マーカー)(7)。IL40の転写は、TSPAN33(p=0.01)と共に50倍を超えて(p=0.002)上方制御したところ、活性化されたヒトB細胞によるIL40の発現が示された。これらの実験は、休止または活性条件下においてヒト2E2及びジャーカット(T細胞株)を使用して繰り返し行った(2E2活性化用の抗−CD40mAb及び抗−CD3+抗−CD28)(図5A)。IL40転写は、活性化2E2細胞においてのみ誘導された。LPS+IL−4によって活性化されたマウス脾細胞(図4B)及び同一条件下にて刺激されたA20−2JマウスB細胞(図5B)と類似の結果が得られた。IL40転写の反応速度を測定するために、C57Bl/6マウス由来のCdl9+B細胞(図6)にCD40L+IL−4により、8時間、24時間、72時間及び96時間刺激を与え、Il40及びAicda(遺伝子コードAID、活性化B細胞において免疫グロブリンクラススイッチに関与する酵素(14));遺伝子の発現をqRT−PCRによって測定した(図4C)。IL40 mRNAを8時間以内で上方制御し、その発現は96時間以上上昇し続けた。
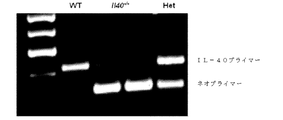
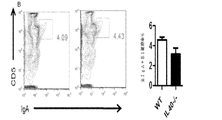
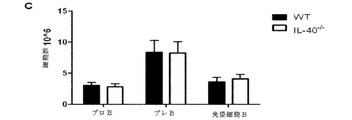
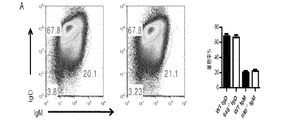
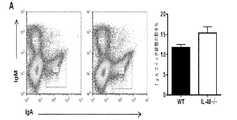
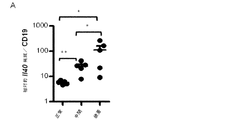
IL40の生物活性の特性を更に決定するために、IL40(6030468B19Rik)遺伝子の標的欠失を有する突然変異マウス株を得た(図8a、遺伝子型の決定を確認するには図9を参照されたい)。IL40−/−マウスは、生存可能であり、かつ受精し、体重増加または身体の大きさに欠陥はない(図10)。それぞれ、胸腺、腹腔、脾臓及び骨髄におけるT細胞サブセット(図11)、B1/B2の細胞比率(図12)、プラズマ細胞及び胚中心細胞のB細胞成熟(図13)、及びpro/pre/未成熟B細胞集団(図14)を比較し、WtとIL40−/−マウスとでは有意差のないことが判明した。しかし、6週齢までにIL40−/−マウスは巨脾症を呈し、IL40−/−マウスでは、長さ(0.0940±0.004対0.1360±0.0151cm、p=0.005)、腫瘤(0.1018±0.005対0.1366±0.0147g、p=0.0285)及び総細胞数(76.03±6.87対96.34±2.15*10^6細胞、p=0.0224)が増大した。CD19+B細胞対T細胞(CD3+)との比率を比較したとき、IL40−/−マウスは、Wtマウスと比較して、T細胞に対してより高い比率のB細胞を含むことが明らかになり、この差は統計的に有意であった(4.4対3.4、p=0.086(図8C)。更に、IL40−/−マウスでは、IgGl及びIgAはこれらの野生型(WT)対応物(それぞれ、616対189μg/mL、p=0.05及び10対21μg/mL、p=0.03)を上回る血清レベルの上昇を示した(図8F)。これらのデータからIl40−/−マウスにおけるB細胞のホメオスタシスが変化する可能性が示唆され、かつ、Il40は、B細胞の分化/生存において任意の役割を果たし得ることが示唆される。
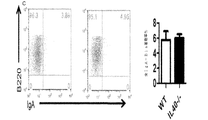
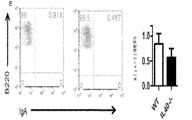
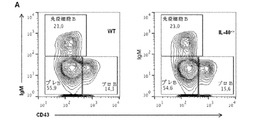
IL40-/-マウスは、血清IgA値の上昇を示すと考えられるため、粘膜免疫と結合した抗体イソタイプ、パイエル板、消化管の免疫監視に関与するリンパ結節関連の腸におけるプラズマ及び胚中心細胞の量を比較した(15)。パイエル板は、天然胚中心及びIgA分泌プラズマ細胞を含む(16)。胚中心細胞(B220+PNA+)の存在に関して、WT及びIL40-/-マウスのパイエル板から単細胞懸濁液を調製し、染色した(図15a)。IgAスイッチ胚中心細胞(PNA+B220hiIgMloIgA+)(図15B)及び全IgAスイッチ細胞(B220lo-hiPNA+IgA+)(図15C)をフローサイトメトリーにより測定した(17〜19)。IL40-/-マウスは、2倍超の胚中心細胞の減少(n=5、p=0.0005)、IgAスイッチ胚中心細胞では2.5倍の減少(n=5、p=0.0001)、及び全IgA陽性細胞(PNA+胚中心B220hi及びB220neg-loプラズマ細胞)では10倍の減少(n=5、p=0.0001)が認められた。更に、Wt及びIl40-/-マウスの糞塊中のIgA濃度は、ELISA(図15D)により測定し、IgA陽性細胞の欠失が粘膜におけるIgA分泌レベルに影響を与えるか否かを判断した。Wtマウスと比較して、IL40-/-の糞塊中のIgA値は2倍の減少が認められた(n=10、p=0.006)。IgAの欠失がIL40-/-マウス中に存在することにより、IL40が乳腺に発現するか否かを調査した。図15Eに示すように、乳腺内での泌乳時にIL40の発現が誘導される。総合すれば、これらの観測結果からIgA応答におけるIL40の役割が示唆される。
その後、本発明者らは、IL40がリンパ球に及ぼす効果をより詳細に調査することにした。この目的を達成するために、遺伝子アレイを用いて、休止及びWTまたはIl40-/-マウスのリンパ節から得たリンパ球を刺激したLPS+IL−4に関する国際的な遺伝子発現解析を実施した。
自己免疫疾患では、多くの場合、例えばIL−6、IL−21及びBLySなどの既知のB細胞サイトカインの量の異常調節が行われるため(7)、全身性エリテマトーデス(SLE)のMRL/Fas1pr/1prマウスモデル由来の脾細胞におけるIL40のmRNAの発現を測定した。このモデルでは、マウスは、抗−dsDNA(二重鎖DNA)抗体の産生と共に全身的自己免疫値及び免疫性糸球体腎炎の上昇を示し、そのいずれもがSLEの特徴である。幼若マウスは正常であると考えられ、9週の時点で目に見える症状は示さなかった。24週までにリンパ腺症及びいくつかの皮膚病変を伴う中間狼瘡症状が発現し、36週までに完全な狼瘡症状が明らかになり、多くの場合死に至る(25)。IL40mRNAの発現(図19)が増加することが判明した。マウスモデルにおいて検出されたIL40値の上昇により、IL40の異常調節がSLEの病理学に関与する場合もあり、また、本疾患の治療の対象を示し得ることが示唆される。
B細胞、CSR及びプラズマ細胞の分化
脾臓細胞をFBS(10%)、50mMβ−メルカプトエタノール及び1x抗生物質−抗かび物質混合物(15240−062;Invitrogen Corp.)の入ったRPMI中で37°Cにて48ウェルプレートで再懸濁し、以下の試薬により刺激した:IgAへのCSRに関して、大腸菌由来のLPS(5μg/ml)(055:B5;Sigma−Aldrich)及びTGF−β(2ng/ml;R&D Systems)及び抗−IgDデキストラン(Fina Biosolutions)。更に、IgGへのCSR用のrmIL−4(5ng/ml)とIgG3へのCSR用のIFN−γ(50ng/ml;PeproTech Inc.)とを組み合わせてLPSを使用した。表面Igを解析するために、FITC−抗−マウスIgGl(クローンA85−1)、抗−マウスIgG2a(クローンR19−15)、抗−マウスIgG2b(クローンR12−3)、抗−マウスIgG3(クローンR40−82)または、抗−マウスIgA(クローンC10−3)ラットmAb及びPE−抗−マウスCD45R(B220)(クローンRA3−6B2)ラットmAb(BD Biosciences)による染色後、第4日目に細胞を収集した。細胞はPBS中1%パラホルムアルデヒドで固定し、FACSにより解析した。
IL40受容体運搬細胞の同定
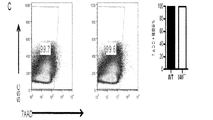
IL40受容体を運搬している細胞を判定するために、C57BL/6マウス由来の脾臓を収集し、均質化し、FACSチューブ(0.5×10E6細胞/チューブ)に入れた。まず、脾臓を氷上で30分間、FACSブロックバッファにてインキュベートした。次に、氷冷FACS洗浄により1回細胞を洗浄して、組換え型His−タグIL40(10μg/ml)で30分間氷上でインキュベートした。その後、細胞を2回洗浄し、氷上でウサギ抗−6x His標識抗体(1:500希釈)で30分間インキュベートした。次に、細胞を2回洗浄し、FITC(1:200希釈)、イソタイプ対照または他の細胞表面染色抗体に共役結合されたヤギ抗−ウサギ二次抗体でインキュベートした。結果は図20に示す。この実験から、IL40はB細胞に結合するが、T細胞に結合しないことがわかった。
ウサギ抗−6xHisタグ抗体(Abeam、カタログ番号ab9108)
FITCロバ抗−ウサギ(Biolegend、カタログ番号406403)
ウサギIgGイソタイプ対照(Santa Cruz、カタログ番号sc−2027)
PE抗−マウスCD45R/B220(Biolegend、カタログ番号103207)
APC抗−マウスCD8b.2抗体(Biolegend、カタログ番号140409)
PE抗−マウスCD3抗体(Biolegend、カタログ番号100307)
APC抗−マウスCD19抗体(Biolegend、カタログ番号115511)
受容体発現細胞のサイトカインに対する機能的応答。細胞においてIL40によって調節するバイオマーカー遺伝子を見出すために、脾臓、リンパ節、胸腺または骨髄などの免疫器官由来細胞をさまざまな量の組換え型マウスまたはヒトIL40(使用される細胞の発生源に依存して)と共にインキュベートし、その後、細胞をこれらの遺伝子のmRNAに転写させるために、数時間(6時間、8時間、24時間)インキュベートした。その後、細胞を採取して、Affymetrixの遺伝子アレイを用いてマイクロアレイ解析のために処理した。標準的技術を用いてmRNAを調製し、マイクロアレイを用いて、ハイブリダイゼーションのためにcDNAを産生している。マイクロアレイを読み取り、データは専有Affymetrixソフトウエアにより解析した。遺伝子は制御されている。
アゴニストまたはアンタゴニストの機能に関するIL40配列変異型の評価。受容体発現細胞の機能的応答を使用して、アゴニストまたはアンタゴニストを監視することができる。この目的を達成するために、アゴニストまたはアンタゴニストのいずれか一方を用いて受容体発現細胞をインキュベートし、qPCRによりIL40応答遺伝子の発現を監視することができる。これらの遺伝子の量により、IL40がその受容体に結合できるか否かが示される。キラー細胞は、これらのキラー細胞においてIL40によって誘導される遺伝子と同一の遺伝子誘導するIL40アゴニストを用いてインキュベートする。IL40及びそれぞれの候補アンタゴニストを用いてキラー細胞をインキュベートした場合、アンタゴニストにより、これらのバイオマーカー遺伝子の誘導をブロックするものとする。
受容体構造の同定の予測的実施例。サイトカインの受容体は、いくつかのタンパク質鎖から構成され得る。良好な結果をもたらす確立された方法を使用して、後述のようないくつかの可能な方法を使用してIL40受容体を同定することができる。
抗体の産生
方法A:マウスまたはウサギポリクローナル;免疫的選択。抗体は、組換え型ヒト、マウスまたはラットIL40により動物を免疫化することにより、作製することができる。ヒツジ、ヤギ、ロバまたはウマは、免疫化することができる。いくつかの免疫化量を用いることができ、また、抗体の作製は、ELISAによって監視することができる。一旦所望の応答が得られると、免疫化させた動物を出血させることにより、また血清を得ることにより、抗体を採取することができる。
サイトカインの発現のための核酸構造体
方法1:ヒトまたはマウス由来の細胞、IL40mRNAの発現を使用して、固定オリゴ−dTを用いるRT−PCRを実施することができる。次にIL40のためにデザインされたプライマーを用いて、IL40cDNAを増幅することができる。このcDNAを哺乳類、細菌または昆虫プラスミドベクターなどの高発現ベクターに挿入することができる。各系では、IL40遺伝子を含有するこのcDNAを適切な受容個体細胞に挿入して、その細胞がIL40タンパク質を産生することができるようにインキュベートすることができる。これらの細胞の上清を採取して、生化学的方法を用いてIL40を精製するために使用する。ヒトIL40 cDNA配列(配列番号4)を図21に示す。
IL40タンパク質の作製及び精製のための上記核酸構造体の使用
方法1:陽性または陰性選択剤(ネオマイシン/βガラクトシダーゼ/GFP)と共にIL40cDNAインサートを含有するプラスミドベクター構造体を使用して、IL40cDNAが挿入されるベクターに依存して、哺乳類(HEK、HELAなど)細胞株、昆虫細胞または細菌に形質移入することができる。プラスミドを発現する形質転換/形質移入細胞は、正の選択または負の選択を行い、組換え型プロテインを産生することのない細胞を除去することができる。高用量組換え型IL40は、形質移入細胞/形質転換細胞の上清または溶解産物から直接得ることができる。
IL40受容体発現細胞の単離(FACS単離)
方法A:単離、精製。IL40受容体(複数可)を運搬している細胞を判定するために、マウス脾臓を収集し、均質化し、FACSチューブ(0.5e6細胞/チューブ)に入れる。まず、FACSブロックバッファにより30分間氷上で脾細胞をインキュベートする。次に、氷冷FACS洗浄により1回細胞を洗浄して、組換え型His−タグIL40(10μg/ml)で30分間氷上でインキュベートする。その後、細胞を2回洗浄し、ウサギ抗−Hisタグ抗体(1:500希釈)で氷上で30分間インキュベートする。その後、細胞を2回洗浄し、FITC、イソタイプ対照または他の細胞表面染色抗体に共役結合されたヤギ抗−ウサギ二次抗体で30分間インキュベートする。この実験から、IL40はB細胞に結合し、陽性対照として使用できることがわかる。
方法C:動物における細胞の枯渇。抗−IL40受容体モノクローナル抗体の静脈内注射を使用して、IL40受容体−発現細胞を枯渇させることができる。抗体は、「裸」抗体であるか、または抗体薬物共役であってもよい。
IL40の影響を発見するためのIL40トランスジェニックまたはノックアウトマウスの使用。IL40-/-マウスを使用して、IL40の機能を調査することができる。このマウスを公表した(Tang, T. et al. A mouse knockout library for secreted and trasnmembrane proteins, 2010.Nat.Biotechnol.7:749−55)。観察された唯一の表現型は、マウスを免疫化したとき、血清中でIgG1が上昇した。このマウス由来の免疫組織を得ることができ、異なる剤(T細胞では抗−CD3及び抗−CD28;B細胞ではリポポリサッカリド(LPS)または抗−CD40及びIL4;単球ではLPS)により活性化することができる。次にマイクロアレイ分析を行って野生型とIL40-/-組織との間に特異的に発現する遺伝子を同定することができる。さまざまな組織のフローサイトメトリーによりマウスも表現型となっているか、または血液化学検査並びに血球計数を実施することができる。癌、自己免疫疾患または感染性疾患など、さまざまな疾患モデルでマウスを使用することができる。
以下の公開は、参照により本明細書に組み込まれる。
1.Oppenheim JJ.Cytokines:past, present, and future。International journal of hematology2001;74(l):3〜8。
2.Dinarello CA.Historical insights into cytokinesEuropean journal of immunology 2007;37 Suppl 1:S34−45。
3.Shi Y, Ullrich SJ, Zhang J, Connolly K, Grzegorzewski KJ, Barber MC, et al. A novel cytokine receptor−ligand pair Identification, molecular characterization, and in vivo immunomodulatory activity。The Journal of biological chemistry.
2000;275(25):19167〜76。
4.Zou Q, Wang Z, Guan X, Liu B, Wu Y, Lin Z. An approach for identifying cytokines based on a novel ensemble classifier. BioMed research international. 2013:2013:686090。
5.Lee J, Hever A, Willhite D, Zlotnik A, Hevezi P. Effects of RNA degradation on gene expression analysis of human postmortem tissues. FASEB journal : official publication of the Federation of American Societies for Experimental Biology. 2005;19(10):1356〜8。
6.Roth RB, Hevezi p, Lee J, Willhite D, Lechner SM, Foster AC, et al. Gene expression analyses reveal molecular relationships among 20 regions of the human CNS. Neurogenetics. 2006;7(2):67−80。
7.Luu VP, Hevezi P, Vences−Catalan F, Maravillas−Montero JL, White CA, Casali P, et al. TSPAN33 is a novel marker of activated and malignant B cells. Clinical Immunology. 2013;149(3, Part B):388〜99。
8.Ioannidou E. Therapeutic modulation of growth factors and cytokines in regenerative medicine. Current pharmaceutical design. 2006;12(19):2397〜408。
9.Velazquez L, Cheng AM, Fleming HE, Furlonger C, Vesely S, Bernstein A, et al. Cytokine signaling and hematopoietic homeostasis are disrupted in Lnk−deficient mice. The Journal of experimental medicine. 2002;195(12):1599〜611。
10.Clark HF, Gumey AL, Abaya E, Baker K, Baldwin D, Brush J, et al. The secreted protein discovery initiative (SPDI), a large−scale effort to identify novel human secreted and transmembrane proteins: a bioinformatics assessment. Genome research. 2003;13(10):2265〜70。
11.Xu Z, Fulop Z, Wu G, Pone EJ, Zhang J, Mai T, et al. 14−3−3 adaptor proteins recruit AID to 5’−AGCT−3’−rich switch regions for class switch recombination. Nature structural & molecular biology. 2010; 17(9):1124〜35。
12.Loignon M, Perret S, Kelly J, Boulais D, Cass B, Bisson L, et al. Stable high volumetric production of glycosylated human recombinant IFNalpha2b in HEK293 cells. BMC biotechnology. 2008:8:65。
13.Ma A, Koka R, Burkett P. Diverse functions of IL−2, IL−15, and IL−7 in lymphoid homeostasis. Annual review of immunology. 2006:24:657〜79。
14.Rosenberg BR, Papavasiliou FN. Beyond SHM and CSR:AID and related cytidine deaminases in the host response to viral infection Advances in immunology
2007:94:215〜44。
15.Lycke NY, Bemark M. The role of Peyer’s patches in synchronizing gut IgA responses. Frontiers in immunology 2012:3:329。
16.Fagarasan S, Kinoshita K, Muramatsu M, Ikuta K, Honjo T. In situ class switching and differentiation to IgA−producing cells in the gut lamina propria. Nature. 2001;413(6856):639〜43。
17.Park SR, Zan H, Pal Z, Zhang J, Al−Qahtani A, Pone EJ, et al. HoxC4 binds to the promoter of the cytidine deaminase AID gene to induce AID expression, class−switch DNA recombination and somatic hypermutation Nature immunology. 2009;10(5):540〜50。
18.Tezuka H, Abe Y, Iwata M, Takeuchi H, Ishikawa H, Matsushita M, et al. Regulation of lgA production by naturally occurring TNF/iNOS−producing dendritic cells.Nature. 2007;448(7156):929〜33。
19.Chen L, Chen Z, Baker K, Halvorsen EM, da Cunha AP, Flak MB, et al. The short isoform of the CEACAM1 receptor in intestinal T cells regulates mucosal immunity and homeostasis via Tfh cell induction.Immunity 2012;37(5):930〜46。
20.Muramatsu M, Kinoshita K, Fagarasan S, Yamada S, Shinkai Y, Honjo T. Class switch recombination and hypermutation require activation−induced cytidine deaminase (AID), a potential RNA editing enzyme. Cell. 2000; 102(5):553〜63。
21.Rada c, Di Noia JM, Neuberger MS.Mismatch recognition and uracil excision provide complementary paths to both Ig switching and the A/ T−focused phase of somatic mutation. Molecular cell. 2004; 16(2):163〜71。
22.Cato MH, Chintalapati SK, Yau IW, Omori SA, Rickert RC. Cyclin D3 is selectively required for proliferative expansion of germinal center B cells. Molecular and cellular biology.2011 ;31(1):127〜37。
23.Durandy A, Kracker S, Fischer A. Primary antibody deficiencies. Nature reviews Immunology. 2013;13(7):519〜33。
24.Bergqvist P, Gardby E, Stensson A, Bemark M, Lycke NY.Gut IgA class switch recombination in the absence of CD40 does not occur in the lamina propria and is independent of germinal centers. Journal of immunology.2006:177(11):772〜83。
25.Liu J, Karypis G, Hippen KL, Vegoe AL, Ruiz P, Gilkeson GS, et al. Genomic view of systemic autoimmunity in MRLlpr mice. Genes and immunity.2006;7(2):156〜68。
26.Pruitt KD, Harrow J, Harte RA, Wallin C, Diekhans M, Maglott DR, et al. The consensus coding sequence (CCDS) project: Identifying a common protein−coding gene set for the human and mouse genomes. Genome research. 2009;19(7):1316〜23。
27.Harte RA, Farrell CM, Loveland JE, Suner MM, Wilming L, Aken B, et al. Tracking and coordinating an international curation effort for the CCDS Project.
Database : the journal of biological databases and curation. 2012:2012:bas008。
28.Gray KA, Daugherty LC, Gordon SM, Seal RL, Wright MW, Bruford EA.
Genenames.org: the HGNC resources in 2013.Nucleic acids research.2013;41(Database issue):D545〜52。
29.Burkhardt AM, Tai KP, Flores−Guiterrez JP, Vilches−Cisneros N, Kamdar K, Barbosa−Quintana O, et al. CXCL17 is a mucosal chemokine elevated in idiopathic pulmonary fibrosis that exhibits broad antimicrobial activity.Journal of immunology.2012;188(12):6399−406。
30.Cazac BB, Roes J. TGF−beta receptor controls B cells responsiveness and induction of IgA in vivo.Immunity 2000:13(4):443〜51。
31.Gros MJ, Naquet p, Guinamard RR.Cell intrinsic TGF−beta l regulation of B cells.Journal of immunology.2008;180(12):8153〜8。
32.Klein J, Ju W, Heyer J, Wittek B, Haneke T, Knaus p, et al. B cells−specific deficiency for Smad2 in vivo leads to defects in TGF−beta−directed IgA switching and changes in B cells fate.Journal of immunology.2006;176(4):2389〜96。
33.Snapper CM, Waegell W, Beernink H, Dasch JR. Transforming growth factor−beta 1 is required for secretion of IgG of all subclasses by LPS−activated murine B cells in vitro. Journal of immunology.1993:151(9):4625〜36。
34.Wong SC, 0h E, Ng CH, Lam KP。Impaired germinal center formation and recall T− cell−dependent immune responses in mice lacking the costimulatory ligand B7〜H2。Blood.2003;102(4):1381〜8。
35.Good−Jacobson KL, Szumilas CG, Chen L, Sharpe AH, Tomayko MM, Shlomchik MJ. PD−1 regulates germinal center B cells survival and the formation and affinity of long−lived plasma cells. Nature immunology. 2010:11(6):535〜42。
36.Gohda M, Kunisawa J, Miura F, Kagiyama Y, Kurashima Y, Higuchi M, et al. Sphingosine 1−phosphate regulates the egress of IgA plasmablasts from Peyer’s patches for intestinal IgA responses.Journal of immunology.2008; 180(8):5335〜43。
37.Harris DP, Haynes L, Sayles PC, Duso DK, Eaton SM, Lepak NM, et al. Reciprocal regulation of polarized cytokine production by effector B and T cells. Nature immunology. 2000;1(6):475〜82。
38.Vilcek J, Feldmann M. Historical review:Cytokines as therapeutics and targets of therapeutics. Trends in pharmacological sciences.2004;25(4):201〜9。
39.Feldmann M. Many cytokines are very useful therapeutic targets in disease. The Journal of clinical investigation. 2008;118(ll):3533〜6。
40.Nakamura RM (1983) Monoclonal antibodies: methods and clinical laboratory applications. Clin Physiol Biochem 1: 160〜172。
41.Leenaars M, Hendriksen CF (2005) Critical steps in the production of polyclonal and monoclonal antibodies: evaluation and recommendations. ILAR J 46:269〜279。
42.Tomita M, Tsumoto K (2011) Hybridoma technologies for antibody production.Immunotherapy 3:371〜380。
43.Siegel DL (2002)Recombinant monoclonal antibody technology.Transfus Clin Biol 9:15〜22。
44.Glassy MC (1993) Production methods for generating human monoclonal antibodies.Hum Antibodies Hybridomas 4:154〜165。
45.Butler M, Meneses−Acosta A (2012) Recent advances in technology supporting biopharmaceutical production from mammalian cells. Appl Microbiol Biotechnol 96:885〜894。
46.Rasmussen SK, Naested H, Muller C, Tolstrup AB, Frandsen TP (2012) Recombinant antibody mixtures: production strategies and cost considerations. Arch Biochem Biophys 526: 139〜145。
47.Marichal−Gallardo PA, Alvarez MM (2012) State−of−the−art in downstream processing of monoclonal antibodies: process trends in design and validation. Biotechnol Prog 28:899〜916。
48.Chon JH, Zarbis−Papastoitsis G (2011) Advances in the production and downstream processing of antibodies. N Biotechnol 28:458〜463。
49.DiFede G, Bronte G, Rizzo S, Rolfo Cervetto C, Cocorullo G, et al.(2011) Monoclonal antibodies and antibody fragments: state of the art and future perspectives in the treatment of non−haemato logical tumors.Expert Opin Biol Ther 11:1433〜1445。
50.Chiarella P (2011) Production, novel assay development and clinical applications of monoclonal antibodies. Recent Pat Anticancer Drug Discov 6:258〜267。
51.Kaneko E, Niwa R (2011) Optimizing therapeutic antibody function: progress with Fc domain engineering.BioDrugs 25:1〜11。
52.Sczakiel G (2000) Theoretical and experimental approaches to design effective antisense oligonucleotides.Front Biosci 5:D194〜201。
53.Far RK, Leppert J, Frank K, Sczakiel G (2005) Technical improvements in the computational target search for antisense oligonucleotides. Oligonucleotides 15:223〜233。
54.Pascal, L.E., et al, BMC Genomics 2008, 9:246.
55.Gry,M. et al, BMC Genomics 2009, 10:365。
56.Bakhtiyari S, Haghani K, Basati G, Karimfar MH (2013) siRNA therapeutics in the treatment of diseases. Ther Deliv 4:45〜57。
57.Peek AS, Behlke MA (2007) Design of active small interfering RNAs.Curr Opin Mol Ther 9:110〜118。
58.Baranova A, Bode J, Manyam G, Emelianenko M (2011) An efficient algorithm for systematic analysis of nucleotide strings suitable for siRNA design. BMC Res Notes 4: 168.
59.Juliano, R.et al., Nucleic Acids Res. 2008 July; 36(12):4158−4171。
Claims (59)
- C17orf99ポリペプチド遺伝子産物(IL40)に対する抗体であって、
a)IgG、IgM、IgA、IgDまたはIgE;
b)モノクローナル抗体;
c)Fab'、Fab、F(ab')2、シングルドメイン抗体(sdAb)、FvまたはscFv(単鎖Fv);
d)標識抗体;
e)中和抗体;または
f)a)〜e)の任意の組み合わせである、
前記抗体。 - サンプル中のIL40の検出方法であって、
免疫検出方法において、検出剤として請求項1に記載の前記抗体を用いてIL40を免疫検出することを含む前記方法。 - 請求項2に記載の方法であって、前記免疫検出法は、酵素結合免疫吸着法(ELISA)、組織学的方法、蛍光活性化細胞選別、ラジオイムノアッセイ(RIA)、免疫放射定量分析法、免疫組織化学的方法、蛍光免疫測定法、化学発光分析法、生物発光分析法、ウエスタンブロッティング法またはドットブロッティング法である、前記方法。
- IL40が関与する疾患の治療を必要とする対象における、IL40が関与する疾患の治療方法であって、前記対象に治療有効量の請求項1の抗体を投与して、IL40を中和させることを含む前記方法。
- 前記疾患は、自己免疫疾患またはリンパ腫である、請求項4に記載の方法。
- IL40が関与する疾患のための診断法またはセラノスティクス法(theranostic)において検出剤として請求項1の前記抗体を用いて、IL40を免疫検出することを含む、サンプル中のIL40検出方法。
- 前記疾患は、リンパ腫、白血病、免疫不全または自己免疫疾患である、請求項6に記載の方法。
- 前記自己免疫疾患は全身性エリテマトーデス、リウマチ性関節炎または乾癬であり、前記免疫不全はIgA欠損症候群である、請求項7に記載の方法。
- IL40の前記アミノ酸配列の一部若しくは全部、またはIL40の成熟形態を含むペプチド若しくは単離タンパク質。
- 請求項9に記載のペプチドであって、
a)IL40の配列変異型、多形体または種対応物;
b)IL40の置換変異型、挿入変異型または欠失変異型;
c)以下からなる群から選択されるIL40の非配列誘導体;
グリコシル化修飾IL40、化学修飾IL40及びIL40抱合体;
d)IL40の機能的変異型:
e)IL40の機能的セグメント、IL40の保存領域、またはIL40の非保存領域;
f)IL40の融合タンパク質;または
g)a)〜f)の任意の組み合わせである、
前記ペプチドまたはタンパク質。 - IL40が関与する疾患の治療を必要とする対象における、IL40が関与する疾患の治療方法であって、
請求項9または請求項10に記載の治療有効量の前記ペプチドまたはタンパク質を前記対象へ投与することを含み、前記ペプチドまたはタンパク質はIL40アンタゴニストである、前記方法。 - 前記疾患は、自己免疫疾患またはリンパ腫である、請求項11に記載の方法。
- IL40が関与する疾患の治療を必要とする対象における、IL40が関与する疾患の治療方法であって、
治療有効量のIL40または請求項9または請求項10に記載の前記ペプチドまたはタンパク質を前記対象へ投与することを含み、前記ペプチドまたはタンパク質はIL40アゴニストである、前記方法。 - 前記疾患はIgA欠損症候群、ホジキンリンパ腫若しくは非ホジキンリンパ腫、びまん性大細胞型リンパ腫,菌状息肉腫、マントル細胞リンパ腫、多発性骨髄腫または別のリンパ腫若しくは白血病;リウマチ性関節炎、全身性エリテマトーデス、シェーグレン症候群、橋本甲状腺炎、強皮症、グレーブス病、クローン病、潰瘍性大腸炎、原発性胆汁性肝硬変症、自己免疫性肝炎、多発性硬化症、乾癬、アトピー性皮膚炎、特発性肺胞線維症、過敏性肺炎、非特異的間質性肺炎または別の自己免疫疾患である、請求項13に記載の方法。
- IL40の関与する疾患の診断法であって、診断/セラノスティクス法において標的またはサンプル対照として請求項9または請求項10に記載の前記ペプチドまたはタンパク質を使用することを含む、前記方法。
- 前記疾患は、リンパ腫、自己免疫疾患、全身性エリテマトーデス、リウマチ性関節炎または乾癬である、請求項15に記載の方法。
- IL40を発現する細胞のサブセットの精製方法または単離方法であって、精製剤/単離剤として請求項1に記載の抗体を用いて、前記細胞のサブセットを精製または単離することを含む方法。
- 前記サブセットは蛍光活性化細胞選別(FACS)により精製または単離され、前記細胞サブセットを選択する、請求項17に記載の方法。
- 前記細胞は、ハイブリドーマ、組換え型細菌細胞、組換え型酵母菌細胞または組換え型哺乳類細胞である、請求項1の抗体を産生する細胞。
- 請求項19に記載の前記細胞を含む動物。
- 前記機能的変異型はIL40のアゴニスト若しくはアンタゴニストであり、前記融合タンパク質は、共有結合構造体若しくは非共有結合構造体または標識構造体である、請求項10に記載のペプチドまたはタンパク質。
- 免疫細胞の誘導方法であって、synaptogyrin2及び/若しくはB細胞によって産生される他のIL40誘導タンパク質を産生するため、または前記免疫細胞の分化または成熟を誘発するために活性剤として請求項9または請求項10に記載の前記ペプチドまたはタンパク質を使用することを含む、前記方法。
- IL40受容体を同定する方法であって、前記IL40受容体に結合するためのリガンドとして請求項9または請求項10に記載の前記ペプチドまたはタンパク質を使用することを含む、前記方法。
- 前記細胞は、組換え型細菌細胞、組換え型酵母菌細胞または組換え型哺乳類細胞である、請求項9または請求項10に記載のペプチドまたはタンパク質を産生する細胞。
- 請求項24に記載の細胞を含む動物。
- IL40遺伝子またはIL40 cDNAのヌクレオチド配列の一部または全体を含む、核酸。
- IL40遺伝子またはIL40 cDNAのヌクレオチド配列の一部または全体を含む核酸であって、請求項9に記載のペプチドまたはタンパク質をコードする、前記核酸。
- 請求項26または請求項27に記載の核酸であって、
a)別のヌクレオチド配列、標識または化学的誘導体に共役結合される;
b)プライマー、プローブ、アンチセンス分子、またはIL40遺伝子またはIL40 cDNA配列をベースとしたオリゴヌクレオチドである;
c)異種核酸配列に付着した組換え型構造体である;または
d)a)〜c)の任意の組み合わせである;
前記核酸。 - 前記異種核酸配列は、プロモーター、エンハンサー、ベクターまたは発現ベクターである、請求項28に記載の核酸。
- IL40が関与する疾患の治療を必要とする対象における、IL40が関与する疾患の治療方法であって、前記対象に治療有効量の請求項26または請求項27に記載の核酸を投与することを含み、前記核酸によりIL40の発現が減少する、前記方法。
- 前記疾患は、自己免疫疾患またはリンパ腫である、請求項30に記載の方法。
- IL40が関与する疾患の治療を必要とする対象における、IL40が関与する疾患の治療方法であって、前記対象に治療有効量の請求項26または請求項27に記載の核酸を投与することを含み、前記核酸によりIL40の発現が増加する、前記方法。
- 前記疾患はIgA欠損症候群、ホジキンリンパ腫若しくは非ホジキンリンパ腫、びまん性大細胞型リンパ腫、菌状息肉腫、マントル細胞リンパ腫、または別のリンパ腫若しくは白血病;リウマチ性関節炎、全身性エリテマトーデス、シェーグレン症候群、橋本甲状腺炎、強皮症、グレーブス病、クローン病、潰瘍性大腸炎、原発性胆汁性肝硬変症、自己免疫性肝炎、多発性硬化症、乾癬、アトピー性皮膚炎、特発性肺胞線維症、過敏性肺炎、非特異的間質性肺炎または別の自己免疫疾患である、請求項32に記載の方法。
- 前記核酸はRNAi分子である、請求項30に記載の方法。
- IL40の関与する疾患の診断法であって、前記疾患の診断/セラノスティクス法においてプローブとして請求項26または請求項27に記載の核酸を使用することによってサンプルをプローブすることを含む、前記方法。
- 前記疾患は、リンパ腫、自己免疫疾患、全身性エリテマトーデス、リウマチ性関節炎または乾癬である、請求項35に記載の方法。
- 前記細胞は、組換え型細菌細胞、組換え型酵母菌細胞または組換え型哺乳類細胞である、請求項26または請求項27に記載の核酸の組換え型形態を含む細胞。
- 請求項37に記載の細胞を含む動物。
- IL40を発現する細胞のサブセットの選択方法であって、
IL40を発現する細胞を含む細胞集団にIL40を結合させる分子を添加することと、
選択された細胞の集団を提供するために前記IL40結合分子により標識された細胞を選択することとを含む、前記方法。 - 請求項39に記載の方法であって、
a)前記IL40発現細胞は、マウス細胞、ラット細胞、ヒト細胞である;
b)前記IL40結合分子は、抗−IL40抗体またはIL40受容体である;
c)前記選択細胞は、血液、体液、細胞懸濁液または患者サンプルから選択される;
d)前記選択細胞は、IL40発現細胞を調べるための調査ツールである;
e)前記選択細胞は血球であり、また
i)前記選択細胞により作製された免疫グロブリンのmRNA供給源;
ii)完全ヒト化抗体の新規作製方法の供給源であり;
または
f)a)〜e)のいずれかの組み合わせ、である前記方法。 - それを必要とする対象において、IL40が関与する疾患の治療方法であって、
治療有効量の請求項39に記載の選択細胞を前記対象へ投与することを含む、前記方法。 - 前記疾患はIgA欠損症候群、ホジキンリンパ腫若しくは非ホジキンリンパ腫、びまん性大細胞型リンパ腫、菌状息肉腫、マントル細胞リンパ腫、または別のリンパ腫若しくは白血病;リウマチ性関節炎、全身性エリテマトーデス、シェーグレン症候群、橋本甲状腺炎、強皮症、グレーブス病、クローン病、潰瘍性大腸炎、原発性胆汁性肝硬変症、自己免疫性肝炎、多発性硬化症、乾癬、アトピー性皮膚炎、特発性肺胞線維症、過敏性肺炎、非特異的間質性肺炎または別の自己免疫疾患である、請求項41に記載の方法。
- 対象中での活性化B細胞の検出方法であって、前記対象中での前記IL40濃度を測定することを含み、IL40濃度が対照よりも上昇する場合には、活性化B細胞が示唆される、前記方法。
- 請求項43に記載の方法であって、
a)前記IL40濃度は、免疫検出技術により測定される;
b)前記方法は更に、別のバイオマーカーを測定することを含む;
c)前記方法により、自己免疫疾患またはリンパ腫の診断を必要とする前記対象において、自己免疫疾患またはリンパ腫を診断し、前記濃度の上昇により、リンパ腫または自己免疫疾患が示唆される;
d)前記IL40濃度の上昇により、リンパ腫または自己免疫疾患のIL40産生サブタイプを決定する;または
e)a)〜d)のいずれかを組み合わせたものである、前記方法。 - 前記免疫検出方法はELISA法、組織学的方法、蛍光活性化細胞選別、ラジオイムノアッセイ(RIA)、免疫放射定量分析法、免疫組織化学的方法、蛍光免疫測定法、化学発光分析法、生物発光分析法、ウエスタンブロッティング法またはドットブロッティング法である、請求項44に記載の方法。
- リンパ腫または自己免疫疾患の治療を必要とする対象において、リンパ腫または自己免疫疾患の治療方法であって、前記対象、または前記対象の腫瘍、組織若しくは細胞に治療有効量の請求項1に記載の抗体、または請求項26若しくは請求項27に記載の核酸を投与することを含む、前記方法。
- 前記抗体は中和抗体であり、また前記核酸はアンチセンスRNAである、請求項46に記載の方法。
- 前記アンチセンスRNAはRNAi分子である、請求項47に記載の方法。
- 対象におけるIL40産生細胞の同定方法であって、請求項1に記載の抗体、または請求項26若しくは請求項27に記載の核酸をプローブとして使用し、前記細胞を同定することを含む、前記方法。
- 前記方法は、免疫組織化学的方法またはインサイチュハイブリダイゼーションを含む、請求項49に記載の方法。
- IL40受容体の同定方法であって、
a)IL40、標識IL40、His−タグIL40、またはこれらの組み合わせによりIL40応答細胞の標識を行うこと、及び前記標識細胞の単離、精製及び/または分離を行うこと;
b)IL40、標識IL40、His−タグIL40、またはこれらの組み合わせによりIL40応答細胞の標識を行うこと、及び前記標識細胞の単離、精製及び/または分離を行うことを含み、前記細胞は前記IL40受容体を発現する真核またはバクテリア細胞である;
c)酵母2ハイブリッド系においてIL40に結合するタンパク質を同定すること;または
d)前記IL40受容体発現細胞由来のメンブレン調製からのIL40結合タンパク質を免疫沈降させること、を含む前記方法。 - a)インビトロまたはインビボにおいてB細胞の成長及び分化を促進する;
b)ハイブリドーマ培養物の成長を増大させる;
c)ハイブリドーマ培養物による抗体生成物を増加させる;または
d)異なる哺乳類種由来のIL40を使用することにより、組織または細胞の種発生源を決定する;
ように免疫細胞をIL40またはその機能的変異型に曝露することを含むIL40の使用方法。 - 前記哺乳類種は、ヒト、イヌ、ネコ、ウシ、ウマ、ブタ、ヤギまたはヒツジである請求項52に記載の方法。
- 自己免疫、自己免疫疾患またはリンパ腫に関与する請求項1〜53のいずれか一項に記載の主題であって、
前記自己免疫疾患は、全身性エリテマトーデス、リウマチ性関節炎、乾癬、グレーブス病、自己免疫性肝炎、原発性胆汁性肝硬変、橋本甲状腺炎、またはシェーグレン症候群であり、
前記リンパ腫は、ホジキンリンパ腫及び非ホジキンリンパ腫、マントル細胞リンパ腫、びまん性大細胞型B細胞リンパ腫、濾胞性リンパ腫、慢性リンパ性白血病、MALTリンパ腫、バーキットリンパ腫、菌状息肉腫、または多発性骨髄腫である、主題。 - 前記抗体、ペプチド、タンパク質または核酸を局所的または全身に送達する、治療することまたは治療を含む請求項1〜53のいずれか一項に記載の主題。
- 診断法、診断、診断するまたは診断法/セラノスティクス法を含み、
前記方法をサンプル上で実施する、
請求項1〜53のいずれか一項に記載の主題。 - 前記サンプルは血清、血液、体液、腫瘍、組織、または細胞である請求項56に記載の主題。
- 抗体、ペプチド、タンパク質または核酸分子を含み、前記分子は、
a)薬学的に許容可能な担体、賦形剤またはそれらを組み合わせたものを含む;
b)滅菌配合物として使用される;
c)自己免疫疾患またはリンパ腫を治療するための別の治療薬を含む;
d)緩効性または徐放性製剤である;
e)標的投与形態である;
f)a)〜e)のいずれかの組み合わせである、
製剤処方である請求項1〜53のいずれか一項に記載の主題。 - 前記緩効性製剤または徐放製剤は、エマルションまたはミセルを含み、前記標的投与形態は、リポソーム、包接錯体または担体である、請求項58に記載の主題。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361906855P | 2013-11-20 | 2013-11-20 | |
| US61/906,855 | 2013-11-20 | ||
| PCT/US2014/066712 WO2015077506A2 (en) | 2013-11-20 | 2014-11-20 | Identification of a novel b cell cytokine |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2016540506A true JP2016540506A (ja) | 2016-12-28 |
| JP2016540506A5 JP2016540506A5 (ja) | 2018-09-06 |
Family
ID=53180393
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016533639A Pending JP2016540506A (ja) | 2013-11-20 | 2014-11-20 | 新規b細胞サイトカインの同定 |
Country Status (8)
| Country | Link |
|---|---|
| US (2) | US20160297860A1 (ja) |
| EP (1) | EP3071232A4 (ja) |
| JP (1) | JP2016540506A (ja) |
| CN (1) | CN105764527A (ja) |
| AU (1) | AU2014352891B2 (ja) |
| CA (1) | CA2929313A1 (ja) |
| MX (1) | MX2016006586A (ja) |
| WO (1) | WO2015077506A2 (ja) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP3352795B1 (en) * | 2015-09-21 | 2020-08-12 | The Regents of The University of California | Compositions and methods for target nucleic acid modification |
| WO2020163467A2 (en) * | 2019-02-08 | 2020-08-13 | BioLegend, Inc. | Uses of il-40 and methods for detecting il-40 activity |
| CN114231611A (zh) * | 2021-12-07 | 2022-03-25 | 中南大学湘雅二医院 | 干扰素诱导基因ifit3对b淋巴细胞活化及分化影响的研究方法 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20080039413A1 (en) * | 2003-10-21 | 2008-02-14 | Morris David W | Novel compositions and methods in cancer |
| EP2535714A1 (en) * | 2011-06-16 | 2012-12-19 | Istituto Nazionale Di Genetica Molecolare-INGM | Biomarkers for autoimmune liver diseases and uses thereof |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7517529B2 (en) * | 2003-04-08 | 2009-04-14 | Biotempt B.V. | Treatment of type I diabetes |
| US20110293605A1 (en) * | 2008-11-12 | 2011-12-01 | Hasige Sathish | Antibody formulation |
| JP5858785B2 (ja) * | 2009-07-29 | 2016-02-10 | シスメックス株式会社 | ヒトil−17産生ヘルパーt細胞検出用マーカーおよび試薬、並びにヒトil−17産生ヘルパーt細胞の検出方法 |
| US20120213768A1 (en) * | 2011-02-19 | 2012-08-23 | Baylor Research Institute | Diagnostic and Therapeutic Uses for B Cell Maturation Antigen |
| US9540657B2 (en) * | 2012-05-25 | 2017-01-10 | California Institute Of Technology | Expression of secreted and cell-surface polypeptides |
-
2014
- 2014-11-20 EP EP14864834.8A patent/EP3071232A4/en not_active Withdrawn
- 2014-11-20 MX MX2016006586A patent/MX2016006586A/es unknown
- 2014-11-20 JP JP2016533639A patent/JP2016540506A/ja active Pending
- 2014-11-20 WO PCT/US2014/066712 patent/WO2015077506A2/en active Application Filing
- 2014-11-20 CA CA2929313A patent/CA2929313A1/en not_active Abandoned
- 2014-11-20 CN CN201480063597.2A patent/CN105764527A/zh active Pending
- 2014-11-20 US US15/036,207 patent/US20160297860A1/en not_active Abandoned
- 2014-11-20 AU AU2014352891A patent/AU2014352891B2/en not_active Expired - Fee Related
-
2019
- 2019-11-21 US US16/690,395 patent/US20200087368A1/en not_active Abandoned
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20080039413A1 (en) * | 2003-10-21 | 2008-02-14 | Morris David W | Novel compositions and methods in cancer |
| EP2535714A1 (en) * | 2011-06-16 | 2012-12-19 | Istituto Nazionale Di Genetica Molecolare-INGM | Biomarkers for autoimmune liver diseases and uses thereof |
Non-Patent Citations (3)
| Title |
|---|
| ATLAS ANTIBODIES AB, ANTI-C17ORF99 PRODUCT DATASHEET, JPN6018039534, December 2012 (2012-12-01), ISSN: 0003893901 * |
| MOL. CELL. PROTEOMICS, vol. 11, no. 12, JPN6018039535, December 2012 (2012-12-01), pages 1885 - 1897, ISSN: 0003893902 * |
| UNIPROT: "Accession No.Q6UX52", HTTPS://WWW.UNIPROT.ORG/UNIPROT/Q6UX52.TXT, JPN6018039537, 23 January 2007 (2007-01-23), ISSN: 0003893903 * |
Also Published As
| Publication number | Publication date |
|---|---|
| CA2929313A1 (en) | 2015-05-28 |
| CN105764527A (zh) | 2016-07-13 |
| EP3071232A2 (en) | 2016-09-28 |
| US20200087368A1 (en) | 2020-03-19 |
| AU2014352891B2 (en) | 2019-09-12 |
| EP3071232A4 (en) | 2017-09-06 |
| WO2015077506A3 (en) | 2015-11-12 |
| AU2014352891A1 (en) | 2016-05-19 |
| MX2016006586A (es) | 2016-08-05 |
| US20160297860A1 (en) | 2016-10-13 |
| WO2015077506A2 (en) | 2015-05-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20110033451A1 (en) | Interleukin-17f antibodies and other il-17f signaling antagonists and uses therefor | |
| US7704503B2 (en) | Use of IL-17F in diagnosis and therapy of airway inflammation | |
| Lissilaa et al. | Although IL-6 trans-signaling is sufficient to drive local immune responses, classical IL-6 signaling is obligate for the induction of T cell-mediated autoimmunity | |
| Qing et al. | Pathogenic anti-DNA antibodies modulate gene expression in mesangial cells: involvement of HMGB1 in anti-DNA antibody-induced renal injury | |
| US20200087368A1 (en) | Identification of a novel b cell cytokine | |
| US20080241130A1 (en) | Methods and compositions for modulating il-17f/il-17a biological activity | |
| US20200255825A1 (en) | Biological materials and therapeutic uses thereof | |
| US20130045212A1 (en) | Biological Materials and Uses Thereof | |
| US11815434B2 (en) | Method for treating rheumatoid arthritis | |
| ZA200509143B (en) | GITR ligand and GITR ligand-related molecules and antibodies and uses thereof | |
| JP2021097682A (ja) | Card14を用いた治療、診断およびスクリーニング | |
| US20160039919A1 (en) | Biological Materials and Uses Thereof | |
| JP2008118862A (ja) | Nk細胞の機能調節剤およびそのスクリーニング法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20171120 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20171120 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20180615 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180726 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20180919 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20181005 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20181227 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20190301 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190405 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20190405 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20190726 |