JP2016515999A - 防汚物質 - Google Patents
防汚物質 Download PDFInfo
- Publication number
- JP2016515999A JP2016515999A JP2015555850A JP2015555850A JP2016515999A JP 2016515999 A JP2016515999 A JP 2016515999A JP 2015555850 A JP2015555850 A JP 2015555850A JP 2015555850 A JP2015555850 A JP 2015555850A JP 2016515999 A JP2016515999 A JP 2016515999A
- Authority
- JP
- Japan
- Prior art keywords
- phenylalanine
- peptide
- coat
- composition
- alanine
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09D—COATING COMPOSITIONS, e.g. PAINTS, VARNISHES OR LACQUERS; FILLING PASTES; CHEMICAL PAINT OR INK REMOVERS; INKS; CORRECTING FLUIDS; WOODSTAINS; PASTES OR SOLIDS FOR COLOURING OR PRINTING; USE OF MATERIALS THEREFOR
- C09D5/00—Coating compositions, e.g. paints, varnishes or lacquers, characterised by their physical nature or the effects produced; Filling pastes
- C09D5/16—Antifouling paints; Underwater paints
- C09D5/1606—Antifouling paints; Underwater paints characterised by the anti-fouling agent
- C09D5/1612—Non-macromolecular compounds
- C09D5/1625—Non-macromolecular compounds organic
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K5/00—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof
- C07K5/04—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof containing only normal peptide links
- C07K5/06—Dipeptides
- C07K5/06008—Dipeptides with the first amino acid being neutral
- C07K5/06078—Dipeptides with the first amino acid being neutral and aromatic or cycloaliphatic
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K5/00—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof
- C07K5/04—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof containing only normal peptide links
- C07K5/06—Dipeptides
- C07K5/06191—Dipeptides containing heteroatoms different from O, S, or N
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K5/00—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof
- C07K5/04—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof containing only normal peptide links
- C07K5/08—Tripeptides
- C07K5/0802—Tripeptides with the first amino acid being neutral
- C07K5/0812—Tripeptides with the first amino acid being neutral and aromatic or cycloaliphatic
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K5/00—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof
- C07K5/04—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof containing only normal peptide links
- C07K5/08—Tripeptides
- C07K5/0827—Tripeptides containing heteroatoms different from O, S, or N
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/04—Linear peptides containing only normal peptide links
- C07K7/06—Linear peptides containing only normal peptide links having 5 to 11 amino acids
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09D—COATING COMPOSITIONS, e.g. PAINTS, VARNISHES OR LACQUERS; FILLING PASTES; CHEMICAL PAINT OR INK REMOVERS; INKS; CORRECTING FLUIDS; WOODSTAINS; PASTES OR SOLIDS FOR COLOURING OR PRINTING; USE OF MATERIALS THEREFOR
- C09D5/00—Coating compositions, e.g. paints, varnishes or lacquers, characterised by their physical nature or the effects produced; Filling pastes
Abstract
Description
ここで、少なくとも1つの防汚部分は、フッ素(−F)及びフッ素原子含有基から選択され、前記少なくとも1つの表面吸着部分は、ジヒドロキシ−アミノ酸及びジヒドロキシ−アミノ酸含有基から選択され、
前記少なくとも1つの防汚部分と前記少なくとも1つの表面吸着部分は、以下に定義するように、共有結合又はリンカー基を介して互いに結合されている。別の態様では、少なくとも1つの防汚部分(又は基)と少なくとも1部分の表面吸着部分(又は基)とを含む二官能性化合物が提供され、
ここで、少なくとも1つの防汚部分は、フッ素(−F)及びフッ素原子含有基から選択され、且つ前記少なくとも1つの表面吸着部分は、3,4−ジヒドロキシ−L−フェニルアラニン(DOPA)及びDOPA含有基から選択され、
前記少なくとも1つの防汚部分と前記少なくとも1つの表面吸着部分は、以下に定義するように、共有結合又はリンカー基を介して互いに結合されている。
ここで、少なくとも1つの防汚部分が、フッ素(−F)及びフッ素原子含有基から選択され、且つ前記少なくとも1つの表面吸着部分が、3,4−ジヒドロキシ−L−フェニルアラニン(DOPA)及びDOPA含有基から選択され、
前記少なくとも1つの防汚部分と前記少なくとも1つの表面吸着部分は、以下に定義するように、共有結合又はリンカー基を介して互いに結合されている。別の態様では、一般式A−L−Fの化合物が提供され、ここで、Aは、表面吸着部分であり、Lは、AとFを連結する共有結合又はリンカー部分であり、Fは、防汚部分であり、A、L及びFの各々は、非加水分解性結合を介して、前記式に記載されるように互いに結合されている。一部の実施形態では、非加水分解性結合は、共有結合である。
−表面(物品の表面)への有機及び/又はバイオ−有機物質(ポリマー)の吸着を防止又は停止又は最小化又は低減すること;
−表面へのタンパク質及び/又は多糖及び/又はポリリピドの吸着を防止又は停止又は最小化又は低減すること;
−表面への多細胞生物の細胞又は微生物からの分泌を防止又は停止又は最小化又は低減すること;
−表面への多細胞生物の細胞又は微生物の吸着を防止又は停止又は最小化又は低減すること
のうち1つ又は複数を達成するための防汚剤として使用される。
ペプチド1:(1S,2S,3S)A=B=D=E=−H,C=−F
ペプチド2:(1S,2S,3R)A=B=D=E=−H,C=−F
ペプチド3:(1S,2R,3S)A=B=D=E=−H,C=−F
ペプチド4:(1S,2R,3R)A=B=D=E=−H,C=−F
ペプチド5:(1S,2S,3S)A=B=C=D=E=−F
ペプチド7:(1S,2S,3S)A=B=C=D=−H,E=−F
ペプチド8:(1S,2S,3R)A=B=C=D=−H,E=−F
ペプチド9:(1S,2R,3S)A=B=C=D=−H,E=−F
ペプチド10:(1S,2R,3R)A=B=C=D=−H,E=−F
ペプチド11:(1S,2S,3S)
ペプチド12:(1S,2S,3R)
ペプチド13:(1S,2R,3S)
ペプチド14:(1S,2R,3R)
NH2−L−DOPA−L−(4−F)−Phe−COOH ペプチド15
NH2−L−DOPA−D−(4−F)−Phe−COOH ペプチド16
NH2−L−DOPA−L−(4−F)−Phe−L−(4−F)−Phe−COOMe ペプチド17。
−「アルキル」、「アルケニル」及び「アルキニル」炭素鎖は、指定のない限り、各々が1〜20個の炭素、又は1若しくは2〜16個の炭素を含有する炭素鎖を指し、これらは、直鎖又は分岐状である。このような基の各々は、置換されていてもよい。一部の実施形態では、炭素鎖は、1〜10個の炭素原子を含有する。一部の実施形態では、炭素鎖は、1〜6個の炭素原子を含む。一部の実施形態では、炭素鎖は、2〜6個の炭素原子を含む。アルケニル炭素鎖は、2〜20個の炭素、又は2〜18個の炭素、又は2〜16個の炭素、又は2〜14個の炭素、又は2〜12個の炭素、又は2〜10個の炭素、又は2〜8個の炭素、又は2〜6個の炭素、又は2〜4個の炭素を含む。同様に、アルケニル炭素鎖は、1〜8個の二重結合、又は1〜7個の二重結合、又は1〜6個の二重結合、又は1〜5個の二重結合、又は1〜4個の二重結合、又は1〜3個の二重結合、又は1個の二重結合、又は2個の二重結合を含んでよい。アルキニル炭素鎖は、2〜20個の炭素、又は2〜18個の炭素、又は2〜16個の炭素、又は2〜14個の炭素、又は2〜12個の炭素、又は2〜10個の炭素、又は2〜8個の炭素、又は2〜6個の炭素、又は2〜4個の炭素を含んでよい。同様に、アルキニル炭素鎖は、1〜8個の三重結合、又は1〜7個の三重結合、又は1〜6個の三重結合、又は1〜5個の三重結合、又は1〜4個の三重結合、又は1〜3個の三重結合、又は1個の三重結合、又は2個の三重結合を含んでよい。例示的アルキル、アルケニル及びアルキニル基として、限定はしないが、メチル、エチル、プロピル、イソプロピル、イソブチル、n−ブチル、sec−ブチル、tert−ブチル、イソヘキシル、アリル(プロペニル)及びプロパルギル(プロピニル)が挙げられる。
(各*は、連結点を示し;
nは、0〜40であり;
mは、1〜40である)
を有する。
(a)表面への有機及び/又はバイオ−有機物質の吸着;
(b)表面へのタンパク質並びに/又は多糖及びポリリピドの吸着;
(c)表面への多細胞生物の細胞又は微生物からの分泌;
(d)表面への多細胞生物の細胞又は微生物の吸着
の1つ又は複数を防止又は停止又は最小化又は低減するために使用する。
ペプチド1:(1S,2S,3S)A=B=D=E=−H,C=−F
ペプチド2:(1S,2S,3R)A=B=D=E=−H,C=−F
ペプチド3:(1S,2R,3S)A=B=D=E=−H,C=−F
ペプチド4:(1S,2R,3R)A=B=D=E=−H,C=−F
ペプチド5:(1S,2S,3S)A=B=C=D=E=−F
ペプチド7:(1S,2S,3S)A=B=C=D=−H,E=−F
ペプチド8:(1S,2S,3R)A=B=C=D=−H,E=−F
ペプチド9:(1S,2R,3S)A=B=C=D=−H,E=−F
ペプチド10:(1S,2R,3R)A=B=C=D=−H,E=−F
NH2−L−DOPA−L−(4−F)−Phe−COOH ペプチド15
NH2−L−DOPA−D−(4−F)−Phe−COOH ペプチド16
NH2−L−DOPA−L−(4−F)−Phe−L−(4−F)−Phe−COOMe ペプチド17。
(b)表面への有機及び/又はバイオ−有機物質の吸着;
(b)表面へのタンパク質並びに/又は多糖及びポリリピドの吸着;
(c)表面への多細胞生物の細胞又は微生物からの分泌;
(d)表面への多細胞生物の細胞又は微生物の吸着
の1つ又は複数を防止又は停止又は最小化又は低減するための膜又はコートが提供される。
ペプチド1:(1S,2S,3S)A=B=D=E=−H,C=−F
ペプチド2:(1S,2S,3R)A=B=D=E=−H,C=−F
ペプチド3:(1S,2R,3S)A=B=D=E=−H,C=−F
ペプチド4:(1S,2R,3R)A=B=D=E=−H,C=−F
ペプチド5:(1S,2S,3S)A=B=C=D=E=−F
ペプチド7:(1S,2S,3S)A=B=C=D=−H,E=−F
ペプチド8:(1S,2S,3R)A=B=C=D=−H,E=−F
ペプチド9:(1S,2R,3S)A=B=C=D=−H,E=−F
ペプチド10:(1S,2R,3R)A=B=C=D=−H,E=−F
NH2−L−DOPA−L−(4−F)−Phe−COOH ペプチド15
NH2−L−DOPA−D−(4−F)−Phe−COOH ペプチド16
NH2−L−DOPA−L−(4−F)−Phe−L−(4−F)−Phe−COOMe ペプチド17
から選択される。
(c)表面への有機及び/又はバイオ−有機物質の吸着;
(b)表面へのタンパク質並びに/又は多糖及びポリリピドの吸着;
(c)表面への多細胞生物の細胞又は微生物からの分泌;
(d)表面への多細胞生物の細胞又は微生物の吸着
のうち1つ又は複数を防止又は停止又は最小化又は低減するための膜又はコートが提供される。
ペプチド1:(1S,2S,3S)A=B=D=E=−H,C=−F
ペプチド2:(1S,2S,3R)A=B=D=E=−H,C=−F
ペプチド3:(1S,2R,3S)A=B=D=E=−H,C=−F
ペプチド4:(1S,2R,3R)A=B=D=E=−H,C=−F
ペプチド5:(1S,2S,3S)A=B=C=D=E=−F
ペプチド7:(1S,2S,3S)A=B=C=D=−H,E=−F
ペプチド8:(1S,2S,3R)A=B=C=D=−H,E=−F
ペプチド9:(1S,2R,3S)A=B=C=D=−H,E=−F
ペプチド10:(1S,2R,3R)A=B=C=D=−H,E=−F
NH2−L−DOPA−L−(4−F)−Phe−COOH ペプチド15
NH2−L−DOPA−D−(4−F)−Phe−COOH ペプチド16
NH2−L−DOPA−L−(4−F)−Phe−L−(4−F)−Phe−COOMe ペプチド17
から選択される。
化学薬品、溶媒、タンパク質及び細菌は全て、市販している会社から購入し、別に記載されていない限り、納品されたまま使用した。Fmoc−DOPA(ac)−COOHは、Novabiochem/EMD chemicals(San−Diego,USA)から入手した。L及びD−4−フルオロフェニルアラニン、Boc−ペンタフルオロphe−COOHは、chem−impex Inc.(Wood Dale,USA)から購入した。溶媒及びTFAは、Bio−lab(Jerusalem,Israel)から購入した。NMR溶媒(CDCl3及びDMSO−d6)は、Sigma−Aldrich(Jerusalem,Israel)から購入した。Fmoc基の脱保護のためのピペリジンは、Alfa−Aesar(UK)から入手した。タンパク質BSA、フィブリノーゲン及びリゾチームは、それぞれ、Sigma−Aldrich(Jerusalem,Israel)、Chem impex INC.(Wood Dale,USA)及びMerck(Darmstadt,Germany)から入手した。緑膿菌(Pseudomonas aeruginosa)(ATCC27853)及び大腸菌(Escherichia coli)(ATCC1655)は、ATCC(Virginia,USA)から購入した。クリスタルバイオレットは、Merck(ドイツ)から入手した。
NMRスペクトルは、Bruker DRX400分光計を用いて、400.13MHz(1H)で取得した。ペプチドの質量は、Applied Biosystem Voyager−DE pro MALDI TOF質量分析計を用いて測定した。ペプチドは、非ラセミ化(recemization free)戦略を用いて、従来の溶液相法により合成した。N末端保護のためにBoc基及びFmoc基を用い、また、C末端はメチルエステルとして保護した。カップリングは、ジシクロヘキシルカルボジイミド/1−ヒドロキシベンゾトリアゾール(DCC/HOBt)により媒介した。中間化合物を1HNMR及びMALDI−TOF質量分析計により特性決定した後、最終ペプチドを1HNMR、13CNMR、19FNMR、MALDI−TOFにより十全に特性決定した。
スキーム2:反応及び条件:(i)DCC、HOBT、乾燥DCM(ii)DCM中の20%TFA、(iii)Fmoc−DOPA(ac)−COOH、DCC、HOBT、乾燥DCM(iv)DMF中の20%ピペリジン(V)DCM中の95%TFA/H2O
1.Boc−L−(4F)Phe−COOH 7a:ジオキサン(20mL)、水(20mL)及び1M NaOH(10mL)の混合物中のL−4F−Phe−COOH1.97g(10mモル)の溶液を撹拌し、氷水浴中で冷却した。ピロ炭酸ジ−tert−ブチル2.4g(11mモル)を添加し、撹拌を室温で6時間継続した。次に、溶液を真空下で約15〜20mLまで濃縮し、氷水浴中で冷却し、酢酸エチル(約30mL)の層で被覆した後、KHSO4の希薄溶液を酸化することにより、酸性化(pH2〜3)した。水相を酢酸エチルで抽出し、この操作を3回実施した。酢酸エチル抽出物を回収し、無水Na2SO4で乾燥させてから、真空下で蒸発させた。ろう状の固体として純粋な物質を取得した。
収率:2.115g(7.25mmol,72.5%)。
1H NMR(DMSO−d6,400MHz,δppm):12.60[s,1H COOH],7.29−7.25&7.11−7.07[m,4H,芳香族プロトン],4.10−3.00[m,1H,CαH 4F Phe],3.03−2.77[m,2H,CβH 4F Phe],1.33[s,9H,Boc]。
MALDI−TOF(マトリックス:α−シアノ−4−ヒドロキシケイ皮酸(CHCA)):m/z=[M+H]+284.12(計算値)、284.29(実測値)、[M+Na]+306.11(計算値)、306.25(実測値)。
収率:616.6mg(1.334mmol,75.5%)。
1H NMR(CDCl3,400MHz,δppm):7.16−7.12&6.99−6.90[m,8H,芳香族プロトン],6.27−6.25[d,1H,NH 4F Phe(3)],4.93[b,1H,NH 4F Phe(2)],4.77−4.72[m,1H,CαH 4F Phe(3)],4.28−4.27[m,1H,CαH 4F Phe(2)],3.67[s,3H,OMe],3.08−2.98[m,4H,CβH 4F Phe(2)及び4F Phe(3)],1.41[s,9H,Boc]。
MALDI−TOF(マトリックス:α−シアノ−4−ヒドロキシケイ皮酸(CHCA)):m/z=[M+Na]+ 485.18(計算値),485.45(実測値),[M+K]+501.16(計算値),501.32(実測値)。
収率:435.3mg(1.202mmol,92.6%)。
1H NMR(DMSO−d6,400MHz,δppm):9.06−9.05[d,1H,NH 4F Phe(3)],7.32−7.26&7.17−7.04[m,8H,芳香族プロトン],4.57−4.51[m,1H,CαH 4F Phe(3)],4.04−3.96[m,1H,CαH 4F Phe(2)],3.61[s,3H,OMe],3.18−2.91[m,4H,CβH 4F Phe(2)及び4F Phe(3)]。
MALDI−TOF(マトリックス:α−シアノ−4−ヒドロキシケイ皮酸(CHCA)):m/z=[M+2H]+364.14(計算値),364.34(実測値),[M+H2O]+ 480.15(計算値),480.35(計算値)。
収率:594.8mg(0.74mmol,62.4%)。
1H NMR(CDCl3,400MHz,δppm):7.77−7.75,7.54−7.50,7.42−7.38,7.33−7.29[d&m,8H,Fmoc 芳香族プロトン],7.05−6.86[m,8H,4F Phe(2)及び4F Phe(3)芳香族プロトン],6.62−6.55[s&m,3H,DOPA 芳香族プロトン],6.50[b,1H,NH 4F Phe(2)],6.19[b,1H,NH 4F Phe(3)],5.17[b,1H,NH DOPA],4.68−4.66[m,1H,CαH DOPA],4.54−4.52[m,1H,,CαH 4F Phe(2)],4.47−4.42[m,1H,,CαH 4F Phe(3)],4.31(b,2H,CβH Fmoc],4.20−4.17[m,1H,CαH Fmoc],3.65[s,3H,OMe],2.98−2.92[m,6H,CβH 4F Phe(2)4F Phe(3)&DOPA],1.62[s,6H,2×COCH3]。
MALDI−TOF(マトリックス:α−シアノ−4−ヒドロキシケイ皮酸(CHCA)):m/z=[M+H]+804.31(計算値),804.70(実測値),[M+Na+2H]+828.30(計算値),828.07(実測値),[M+K+H]+843.27(計算値),843.60(実測値)。
収率:275.6mg(0.474mmol,65.8%)。
1H NMR(DMSO−d6,400MHz,δppm):8.53[b,1H,NH 4F Phe(2)],7.96[b,1H,NH 4F Phe(3)],7.24−7.23,7.10−7.04[m,8H,4F Phe(2)及び4F Phe(3)芳香族プロトン],6.69−6.65,6.55−6.53[m,3H,DOPA 芳香族プロトン],5.56[m,1H,CαH DOPA],4.56[m,1H,CαH 4F Phe(2)],4.47[m,1H,4F Phe(3)],3.61[s,3H,OMe],3.12−2.73[m,6H,CβH 4F Phe(2)4F Phe(3)&DOPA],1.61−1.58[d,6H,2×COCH3]。
MALDI−TOF(マトリックス:α−シアノ−4−ヒドロキシケイ皮酸(CHCA)):m/z=[M+H]+582.23(計算値),582.25(実測値),[M+Na]+604.22(計算値),604.37(実測値),[M+K]+620.20(計算値),620.19(実測値)。
収率:139.1mg(0.257mmol,57.5%)。
1H NMR(DMSO−d6,500MHz,δppm):8.72−8.70[d,1H,NH 4F Phe(2)],8.66−8.64[d,1H,NH 4F Phe(3)],7.88[b,2H,OH DOPA],7.29−7.23,7.12−7.05[m,8H,4F Phe(2)及び4F Phe(3)芳香族プロトン],6.7−6.64,6.5−6.47[m,3H,DOPA 芳香族プロトン],4.60−4.58[m,1H,CαH 4F Phe(2)],4.53−4.52[m,1H,CαH 4F Phe(3)],3.83[m,1H,CαH DOPA],3.58[s,3H,OMe],3.08−2.75[m,6H,CβH 4F Phe(2)4F Phe(3)&DOPA]。13C NMR(DMSO−d6,125MHz,δppm):171.9,170.1,168.5,158.9,158.54,145.2,144.5,131.5,125.2,117.4,115.5,115.4,115.3,11.2,114.5,53.9,52.3,47.5,36.2,33.8,25.8,24.9。19F NMR(DMSO−d6,470MHz,δppm):−116.42,−116.71。
MALDI−TOF(マトリックス:α−シアノ−4−ヒドロキシケイ皮酸(CHCA)):m/z=[M+H]+542.20(計算値),542.57(実測値),[M+Na]+564.19(計算値),564.46(実測値),[M+K]+580.16(計算値),580.32(実測値)。
1.Boc−L−(4F)Phe(2)−D−(4F)Phe(3)−COOMe 8b:この化合物は、化合物8aと同じ手順で合成した。
1H NMR(CDCl3,400MHz,δppm):7.13−7.10&6.98−6.91[m,8H,芳香族プロトン],6.51[b,1H,NH 4F Phe(3)],4.91−4.89[d,1H,NH 4F Phe(2)],4.82−4.77[m,1H,CαH 4F Phe(3)],4.33[m,1H,CαH 4F Phe(1)],3.68[s,3H,OMe],3.09−2.93[m,4H,CβH 4F Phe(2)及び4F Phe(3)],1.38[s,9H,Boc]。
MALDI−TOF(マトリックス:α−シアノ−4−ヒドロキシケイ皮酸(CHCA)):m/z=[M+2H]+464.21(計算値),464.15(実測値),[M+Na+2H]+586.18(計算値),586.37,[M+K+H]+502.16(計算値),502.25(実測値)。
1H NMR(DMSO−d6,400MHz,δppm):8.34[d,1H,NH 4F Phe(3)],7.23−7.19&7.12−7.01[m,8H,芳香族プロトン],4.61−4.51[m,1H,CαH 4F Phe(3)],3.62[s,3H,OMe],3.44−3.41[m,1H,CαH 4F Phe(2)],3.03−2.74[m,4H,CβH 4F Phe(2)及び4F Phe(3)].2.35(b,2H,フリーNH2].
MALDI−TOF(マトリックス:α−シアノ−4−ヒドロキシケイ皮酸(CHCA)):m/z=[M+2H]+364.14(計算値),364.41(実測値).
1H NMR(DMSO−d6,400MHz,δppm):8.68−8.55[d,1H,NH Phe(2)],8.15−7.92[d,1H,NH 4F Phe(3)],7.88−7.86,7.61−6.96[d&m,16H,Fmoc 芳香族プロトン,4F Phe(2)及び4F Phe(3)芳香族プロトン],6.75&6.64[s,3H,DOPA 芳香族プロトン],5.83[d,1H,NH DOPA],4.62−4.53[m,2H,CαH 4F Phe(2)及びPhe(3)],4.14−4.02[m,3H,CαH DOPA & CβH Fmoc],3.63[s,3H,OMe],2.76−2.57[m,6H,CβH 4F Phe(2),4F Phe(3)& DOPA],1.55[s,6H,2×COCH3].
MALDI−TOF(マトリックス:α−シアノ−4−ヒドロキシケイ皮酸(CHCA)):m/z=[M+Na]+826.29(計算値),826.15(実測値),[M+K]+842.27(計算値),814.27(実測値).
1H NMR(DMSO−d6,400MHz,δppm):8.66−8.64[b,1H,NH 4F Phe(2)],7.95[b,1H,NH 4F Phe(3)],7.30−6.80[m,8H,4F Phe(2)及び4F Phe(3)芳香族プロトン],6.68−6.64,6.56−6.53[m,3H,DOPA 芳香族プロトン],5.57−5.55[ m,1H,CαH DOPA],4.56[m,1H,CαH 4F Phe(2)],4.47[m,1H,4F Phe(3)],3.63[s,3H,OMe],3.05−2.67[m,6H,CβH 4F Phe(2),4F Phe(3)&DOPA].1.59−1.57[s,6H,2×COCH3].
MALDI−TOF(マトリックス:α−シアノ−4−ヒドロキシケイ皮酸(CHCA)):m/z=[M+Na]+604.22(計算値),604.06(実測値),[M+K]+620.20(計算値),619.88(実測値).
1H NMR(DMSO−d6,500MHz,δppm):8.77−8.75[d,1H,NH 4F Phe(2)],8.66−8.64[d,1H,NH 4F Phe(3)],7.80[b,2H,OH DOPA],7.27−7.24,7.11−7.00[m,8H,4F Phe(2)及び4F Phe(3)芳香族プロトン],6.71−6.60[m,3H,DOPA 芳香族プロトン],5.15[b,2H,NH2],4.62−4.60[m,1H,CαH 4F Phe(2)],4.52−4.49[m,1H,CαH 4F Phe(3)],3.83[m,1H,CαH DOPA],3.65[s,3H,OMe],3.10−2.73[m,6H,CβH 4F Phe(2),4F Phe(3)& DOPA].13C NMR(DMSO−d6,125MHz,δppm):117.43,170.42,147.86,146.63,143.75,143.69,141.30,135.47,128.64,127.75,127.23,127.13,125.054,121.81,120.02,118.04,109.44,108.25,67.20,53.02,52.33,47.09,37.91,31.94,29.71,25.89.
19F NMR(DMSO−d6,470MHz,δppm):−116.43,−116.91.
MALDI−TOF(マトリックス:α−シアノ−4−ヒドロキシケイ皮酸(CHCA)):m/z=[M+H]+542.20(計算値),542.65(実測値),[M+Na]+564.19(計算値),564.55(実測値),[M+K]+580.16(計算値),580.57(実測値).
1.Boc−D−(4F)Phe−COOH 7b:化合物7aと同じ手順で、化合物7bを合成した。
1H NMR(DMSO−d6,400MHz,δppm):12.59[s,1H COOH],7.29−7.26&7.12−7.08[m,4H,芳香族プロトン],4.10−3.57[m,1H,CαH 4F Phe],3.03−2.77[m,2H,CβH 4F Phe],1.32[s,9H,Boc].
MALDI−TOF(マトリックス:α−シアノ−4−ヒドロキシケイ皮酸(CHCA)):m/z=[M+H]+284.12(計算値),284.36(実測値),[M+Na]+306.11(計算値),306.28(実測値).
1H NMR(CDCl3,400MHz,δppm):7.14−7.09&6.99−6.93[m,8H,芳香族プロトン],6.50[b,1H,NH 4F Phe(3)],4.88[b,1H,NH 4F Phe(2)],4.82−4.77[m,1H,CαH 4F Phe(3)],4.33[m,1H,CαH 4F Phe(2)],3.68[s,3H,OMe],3.09−2.91[m,4H,CβH 4F Phe(2)及び4F Phe(3)],1.38[s,9H,Boc].
MALDI−TOF(マトリックス:α−シアノ−4−ヒドロキシケイ皮酸(CHCA)):m/z=[M+Na]+ 485.18(計算値),485.88(実測値),[M+K]+501.16(計算値),501.75(observed).
1H NMR(DMSO−d6,400MHz,δppm):8.71−8.67[d,1H,NH 4F Phe(3)],7.25−7.21&7.12−7.03[m,8H,芳香族プロトン],5.49[b,2H,NH2],4.56−4.54[m,1H,CαH 4F Phe(2)],3.77−3.70[m,1H,CαH 4F Phe(3)],3.64[s,3H,OMe],3.07−2.57[m,4H,CβH 4F Phe(2)及び4F Phe(3)].
MALDI−TOF(マトリックス:α−シアノ−4−ヒドロキシケイ皮酸(CHCA)):m/z=[M+2H]+364.14(計算値),364.26(実測値).
1H NMR(CDCl3,400MHz,δppm):7.79−7.72,7.51−7.47,7.42−7.38,7.33−7.29[d&m,8H,Fmoc 芳香族プロトン]6.94−6.88「m,8H,4F Phe(2)及び4F Phe(3)芳香族プロトン],6.76−6.61[s&m,3H,DOPA 芳香族プロトン],6.54[b,1H,NH 4F Phe(2)],6.18[b,1H,NH 4F Phe(3)],5.20[b,1H,NH DOPA],4.76−4.68[m,1H,CαH DOPA],4.67−4.57[m,1H,,CαH 4F Phe(2)],4.43−4.35[m,1H,CαH 4F Phe(3)],],4.30−4.21[m,1H,CαH Fmoc],4.19−4.01(b,2H,CβH Fmoc],3.62[s,3H,OMe],3.09−2.75[m,6H,CβH 4F Phe(2),4F Phe(3)&DOPA],1.63[s,6H,2×COCH3].
MALDI−TOF(マトリックス:α−シアノ−4−ヒドロキシケイ皮酸(CHCA)):m/z=[M+H]+804.31(計算値),804.74(実測値),[M+Na+H]+827.30(計算値),827.32(実測値),[M+K+H]+843.27(計算値),843.62(実測値).
1H NMR(DMSO−d6,400MHz,δppm):8.66−8.64[b,1H,NH 4F Phe(2)],7.95[b,1H,NH 4F Phe(3)],7.29−6.81[m,8H,4F Phe(2)及び4F Phe(3)芳香族プロトン],6.68−6.64,6.54−6.53[m,3H,DOPA 芳香族プロトン],5.57−5.55[ m,1H,CαH DOPA],4.60[m,1H,CαH 4F Phe(2)],4.48[m,1H,4F Phe(3)],3.63[s,3H,OMe],2.88−2.73[m,6H,CβH 4F Phe(2),4F Phe(3)&DOPA].1.59−1.56[s,6H,2×COCH3].
MALDI−TOF(マトリックス:α−シアノ−4−ヒドロキシケイ皮酸(CHCA)):m/z=[M+H]+582.23(計算値),581.93(実測値),[M+Na]+604.22(計算値),604.01(実測値),[M+K]+620.20(計算値),619.85(実測値).
1H NMR(DMSO−d6,500MHz,δppm):8.72−8.71[d,1H,NH 4F Phe(2)],8.65−8.64[d,1H,NH 4F Phe(3)],7.89[b,2H,OH DOPA],7.28−7.23,7.12−7.06[m,8H,4F Phe(2)及び4F Phe(3)芳香族プロトン],6.67−6.64,6.49−6.47[m,3H,DOPA 芳香族プロトン],4.61−4.50[m,1H,CαH 4F Phe(2)&Phe(3)],3.85−3.80[m,1H,CαH DOPA],3.58[s,3H,OMe],3.05−2.72[m,6H,CβH 4F Phe(2),4F Phe(3)&DOPA].13C NMR(DMSO−d6,125MHz,δppm):171.9,170.9,168.6,162.5,160.6,158.5,158.23,145.7,145.1,133.8,133.7,133.5,131.5,125.8,120.7,117.3,116.1,115.5,115.4,115.3,115.2,54.3,53.9,52.4,46.2,37.3,37.0,36.2,26.7,25.3,24.7.
19F NMR(DMSO−d6,470MHz,δppm):−116.31,−116.53.
MALDI−TOF(マトリックス:α−シアノ−4−ヒドロキシケイ皮酸(CHCA)):m/z=[M+H]+542.20(計算値),542.51(実測値),[M+Na]+564.19(計算値),564.53(実測値),[M+K]+580.16(計算値),580.43(実測値).
1.Boc−D−(4F)Phe(2)−D−(4F)Phe(3)−COOMe 8d:この化合物は、化合物8aと同じ手順で合成した。
1H NMR(CDCl3,400MHz,δppm):7.18−7.15&7.01−6.925[m,8H,芳香族プロトン],6.25[d,1H,NH 4F Phe(3)],4.93[b,1H,NH 4F Phe(2)],4.77−4.76[m,1H,CαH 4F Phe(2)],4.30−4.28[m,1H,CαH 4F Phe(3)],3.7[s,3H,OMe],3.10−3.00[m,4H,CβH 4F Phe(2)及び4F Phe(3)],1.40[s,9H,Boc].
MALDI−TOF(マトリックス:α−シアノ−4−ヒドロキシケイ皮酸(CHCA)):m/z=[M+Na+H]+ 486.18(計算値),485.93(実測値),[M+K+H]+502.16(計算値),502.00(実測値).
1H NMR(DMSO−d6,400MHz,δppm):8.36−8.34[d,1H,NH 4F Phe(3)],8.02[b,1H,NH 4F Phe(2)],7.22−7.17&7.11−7.01[m,8H,芳香族プロトン],4.55−4.50[m,1H,CαH 4F Phe(3)],4.08−3.92[m,1H,CαH 4F Phe(2)],3.60[s,3H,OMe],3.04−2.84[m,4H,CβH 4F Phe(2)及び4F Phe(3)].
MALDI−TOF(マトリックス:α−シアノ−4−ヒドロキシケイ皮酸(CHCA)):m/z=[M+2H]+364.14(計算値),364.29(実測値),[M+Na+H]+486.13(計算値),486.33(実測値).
1H NMR(CDCl3,400MHz,δppm):7.77−7.75,7.55−7.43,7.42−7.40[d&m,8H,Fmoc 芳香族プロトン],694−6.55「m,8H,4F Phe(2)及び4F Phe(3)芳香族プロトン],6.71−6.52[m,3H,DOPA 芳香族プロトン],6.52−6.45[b,1H,NH 4F Phe(2)],6.15[b,1H,NH 4F Phe(3)],5.31[b,1H,NH DOPA],4.73−4.65[m,1H,CαH DOPA],4.64−4.56[m,CαH 4F Phe(2)],4.51−4.42[m,1H,CαH 4F Phe(3)],4.24−4.11[m,1H,CαH Fmoc],4.19(b,2H,CβH Fmoc],3.61[s,3H,OMe],3.08−2.72[m,6H,CβH 4F Phe(2)4F Phe(3)&DOPA],1.62[s,6H,2×COCH3].
MALDI−TOF(マトリックス:α−シアノ−4−ヒドロキシケイ皮酸(CHCA)):m/z=[M+Na+2H]+828.30(計算値),828.03(実測値),[M+K+2H]+844.27(計算値),844.12(実測値).
1H NMR(DMSO−d6,400MHz,δppm):8.58−8.53[d,1H,NH 4F Phe(2)],8.12[d,1H,NH 4F Phe(3)],7.31−7.09[m,8H,4F Phe(2)及び4F Phe(3)芳香族プロトン],6.69−6.68,6.61−6.60[m,3H,DOPA 芳香族プロトン],5.63−5.61[ m,1H,CαH DOPA],4.61[m,1H,CαH 4F Phe(2)],4.52[m,1H,4F Phe(3)],3.64[s,3H,OMe],3.15−2.65[m,6H,CβH 4F Phe(2),4F Phe(3)&DOPA].1.54[d,6H,2×COCH3].
MALDI−TOF(マトリックス:α−シアノ−4−ヒドロキシケイ皮酸(CHCA)):m/z=[M+Na]+604.22(計算値),604.23(実測値),[M+K]+620.20(計算値),620.12(実測値).
1H NMR(DMSO−d6,500MHz,δppm):8.80−8.77[d,1H,NH 4F Phe(2)],7.95[b,2H,OH DOPA],7.31−7.20,7.12−7.03[m,8H,4F Phe(2)及び4F Phe(3)芳香族プロトン],6.59−6.57,6.22−6.20[m,3H,DOPA 芳香族プロトン],5.58[b,2H,フリーNH2)],4.75−4.62[m,1H,CαH 4F Phe(2)],4.51−4.45[m,1H,CαH 4F Phe(3)],3.91−3.82[m,1H,CαH DOPA],3.62[s,3H,OMe],3.08−2.62[m,6H,CβH 4F Phe(2),4F Phe(3)&DOPA].13C NMR(DMSO−d6,125MHz,δppm):172.01,171.20,168.27,162.77,158.59,158.27,157.09,145.65,145.02,133.58,133.71,131.46,131.45,131.37,125.74,120.65,117.37,115.95,115.63,115.42,115.31,115.09,54.14,52.44,52.44,47.97,33.80,25.78,24.92.19F NMR(DMSO−d6,470MHz,δppm):−116.08,−116.42.
MALDI−TOF(マトリックス:α−シアノ−4−ヒドロキシケイ皮酸(CHCA)):m/z=[M+H]+542.20(計算値),542.85(実測値),[M+Na]+564.19(計算値),564.55(実測値),[M+K]+580.16(計算値),580.40(実測値).
1.Boc−L−(F5)Phe(2)−L−(F5)Phe(3)−COOMe 8e.
Boc−L−(F5)Phe−COOHは購入した。最初に、TFA/DCMの処理によりBoc基を脱保護してから、全ての溶媒を蒸発させた後、塩化チオニル及びメタノールで処理することにより、NH2−Phe(F5)−COOHのエステル化を行った。次に、化合物8aについて記載したように、Boc−L−(F5)Phe−COOHとNH2−L−(F5)Phe(3)−COOMeとのカップリングにより、化合物8eを合成した。
1H NMR(CDCl3,400MHz,δppm):6.52[b,1H,NH Phe(3)],4.93[b,1H,NH Phe(2)],4.92−4.85[m,1H,CαH Phe(3)],4.42−4.29[m,1H,CαH Phe(2)],3.81[s,3H,OMe],3.42−2.95[m,4H,CβH Phe(2)及びPhe(3)],1.44[s,9H,Boc].
MALDI−TOF(マトリックス:α−シアノ−4−ヒドロキシケイ皮酸(CHCA)):m/z=[M+Na+H]+ 630.11(計算値),630.08(実測値),[M+K+H]+646.08(計算値),646.13(実測値).
化合物9aと同じ手順で化合物9eを合成した。
1H NMR(DMSO−d6,400MHz,δppm):8.93−8.90[d,1H,NH Phe(3)],8.40[b,1H,フリーNH2],4.72−4.70[m,1H,CαH Phe(3)],3.90[m,1H,CαH Phe(2)],3.61[s,3H,OMe],3.17−2.99[m,4H,CβH Phe(2)及びPhe(3)].
MALDI−TOF(マトリックス:α−シアノ−4−ヒドロキシケイ皮酸(CHCA)):m/z=[M+Na+H]+530.05(計算値),530.16(実測値),[M+K+H]+546.03(計算値),646.53(実測値).
化合物10aと同じ手順で化合物10eを合成した。
1H NMR(DMSO−d6,400MHz,δppm):8.75−8.72[d,1H,NH Phe(2)],8.36−8.34[b,1H,NH Phe(3)],788−7.26[m,8H,Fmoc 芳香族プロトン],6.79−6.67[m,3H,DOPA 芳香族プロトン],5.57−5.55[b,1H,NH DOPA],4.66−4.63[m,2H,CβH Fmoc],4.14−4.09[m,3H,CαH DOPA,CαH Phe(2),CαH Phe(3)],3.62[s,3H,OMe],3.05−2.90[m,6H,CβHPhe(2),Phe(3)&DOPA],1.56[s,6H,2×COCH3].
MALDI−TOF(マトリックス:α−シアノ−4−ヒドロキシケイ皮酸(CHCA)):m/z=[M+Na]+970.21(計算値),970.22(実測値),[M+K]+986.19(計算値),986.04(実測値).
化合物11aについて記載したように、化合物11eを調製した。
1H NMR(DMSO−d6,400MHz,δppm):8.73−8.71[d,1H,NH Phe(2)],6.69−6.55[m,3H,DOPA 芳香族プロトン],5.57−5.55[d,1H,NH Phe(3)],4.64−6.63[m,1H,CαH DOPA],4.54[m,1H,CαH Phe(2)],4.13−4.08[m,1H,CαH Phe(3)],3.61[s,3H,OMe],3.15−2.67[m,6H,CβH Phe(2),Phe(3)&DOPA].1.60[s,6H,2×COCH3].
MALDI−TOF(マトリックス:α−シアノ−4−ヒドロキシケイ皮酸(CHCA)):m/z=[M+Na]+748.15(計算値),748.23(実測値),[M+K]+764.12(計算値),764.06(実測値).
化合物1について記載したように、化合物5を調製した。
1H NMR(DMSO−d6,400MHz,δppm):9.46[b,1H,NH Phe(2)],9.25[b,1H,NH Phe(2)],6.68−6.54[m,3H,DOPA 芳香族プロトン],4.69−4.65[m,2H,CαH Phe(1)&Phe(2)],4.55[m,1H,CαH DOPA],3.61[s,3H,OMe],3.01−2.95 67[m,6H,CβH Phe(2)Phe(2)&DOPA].13C NMR(DMSO−d6,100 MHz,δppm):193.6,158.5,158.2,144.3,140.8,139.5,133.7,129.9,128.5,127.8,124.4,53.8,44.2,33.8,30.5,29.4,22.6,17.6.19F(DMSO−d6,470MHz,δppm):−141.7,−142.4,−157.6,−163.1,−163.4.
MALDI−TOF(マトリックス:α−シアノ−4−ヒドロキシケイ皮酸(CHCA)):m/z=[M+Na]+748.15(計算値),748.23(実測値),[M+K]+764.12(計算値),764.06(実測値).
1.Boc−L−DOPA−COOH:
この化合物は、化合物7aと同様に合成した。
1H NMR(DMSO−d6,400MHz,δppm):9.13[b,2H 2×OH],7.35−7.33[d,1H,NH DOPA],7.03−6.88[m,3H,DOPA,芳香族プロトン],4.45−4.37[m,1H,CαH DOPA],3.22−2.92[m,1H,CβH DOPA],1.75[s,9H,OMe].
MALDI−TOF(マトリックス:α−シアノ−4−ヒドロキシケイ皮酸(CHCA)):m/z=[M+Na]+320.11(計算値),320.51(実測値),[M+K]+336.08(計算値),336.29(実測値).
この化合物は、化合物8aと同様に合成した。
1H NMR(CDCl3,400MHz,δppm):7.26−7.24[d,1H,NH Phe],6.90−6.50[m,7H,芳香族プロトン],5.24[b,1H,NH DOPA],4.82−4.77[m,1H,CαH DOPA],4.36[b,1H,CαH Phe],3.64[s,3H,OMe],2.99−2.87[m,4H,CβH DOPA&Phe],1.42[s,9H,Boc].
MALDI−TOF(マトリックス:α−シアノ−4−ヒドロキシケイ皮酸(CHCA)):m/z=[M+Na+H]+500.18(計算値),500.02(実測値),[M+K+H]+516.16(計算値),516.24(実測値).
この化合物は、化合物9aについて記載したように合成した。
1H NMR(DMSO−d6,400MHz,δppm):8.92&8.81[s,2H,2×OH],8.02[b,2H,フリーNH2],7.27−7.09[m,4H,aromatic proton phe],6.67−6.48[m,3H,芳香族プロトン DOPA],4.58−4.52[m,1H,CαH DOPA],3.90−3.86[b,1H,CαH Phe],3.61[s,3H,OMe],3.08−2.67[m,4H,CβH DOPA&Phe].13C NMR(DMSO−d6,100MHz,δppm):171.4,168.7,162.7,160.4,158.5,145.6,145.0,133.3,133.2,131.4,125.6,120.6,117.2,115.9,115.5,115.3,54.1,53.9,52.4,41.0,36.8,36.2,23.6.].19FNMR(DMSO−d6,470MHz,δppm):−(116.25−116.29).
MALDI−TOF(マトリックス:α−シアノ−4−ヒドロキシケイ皮酸(CHCA)):m/z=[M+H]+377.15(計算値),377.25(実測値),[M+Na]+399.24(計算値),399.13(実測値).
研究の過程で、下記の基板をペプチドで被覆した:シリコンウエハー、100nmチタン層を有するシリコンウエハー、400メッシュCopper−formvar(登録商標)/カーボングリッド。
10×10mmTi表面をエタノール中で5分音波処理し、TDWで洗浄した後、窒素下で乾燥させた。清浄な表面をペプチド溶液(メタノール中0.5mg/mL)中に浸漬し、室温で一晩放置した。次に、これらをメタノールで十分にすすいだ後、窒素下で乾燥させた。
Theta Lite光学張力計(Attemsion,Finland)を用いて接触角測定を実施した。各実験測定は、3回の反復からなり、記録した角度を平均した。
新しく切断したマイカ表面を、メタノール中濃度0.5mg/mLの様々なペプチド溶液中に一晩浸漬した。次に、新しいメタノールで表面を洗浄した後、N2下で乾燥させた。JPK装置(Nino Wizard3)において、ばね定数3N/mのSi3N2チップを用い、ACモードでAFM画像を撮影した。
Ge−ATR装置(Harrick Scientific’s VariGATR)を備えたFT−IR(Thermo scientific,Model Nicolet 6700)を用いて、ATRスペクトルを記録した。全ての表面について、350Nの力を加え、3000スキャン平均信号及び入射角65℃を用いた4cm−1解像能で、スペクトルを収集した。
Ti表面へのペプチド付着の試験には、QCM−D(Q−sense,Biolin Scientific)を使用した。フローモジュールE1システムで測定を実施した。また、5MHzの基本共振周波数を有するTiセンサーもQ−senseから購入し、納品されたまま使用した。各実験の前に、TiセンサーをOxygen/Plasma(Atto,Diener Electronic)で洗浄した後、2%SDS及びTDWですすぎ、最後にN2下で乾燥させた。全てのQCM−D実験は、プッシングモードで作動するデジタルペリスタルティックポンプ(IsmaTec Peristaltic Pump,IDEX)を用いて、フロースルー条件下で実施した。試験する溶液は、0.1mL/分の速度でセンサークリスタルチャンバーに注入した。有機溶媒適合性チューブ及びOリングをフローシステムに使用した。MeOHに、濃度0.5mg/mLでペプチドを溶解させた。
(式中、5MHz水晶の場合、C=17.7ng Hz−1であり、n=1,3,5,7,9,11,13オーバートーン次数である)。
Kratos AXIS UltraX線光電子分光計(Kratos Analytical Ltd.,Manchester,UK)を用いて、X線光電子分光法(XPS)測定を実施した。単色X線源(1,486.7 eV)を用いて、スペクトルを取得した。サンプル射出角は90°(すなわち、分析装置に対して直角)であった。分析チャンバー内の真空圧は2・10−9Torrに維持した。パスエネルギー20eV及び0.1eVステップサイズを用いて、F 1s、O 1s、C 1s及びTi 2ピークについて高解像能XPSスペクトルを収集した。Kratos Visionデータ整理処理ソフトウエア(Kratos Analytical Ltd.)及びCasa XPS(Casa Software Ltd.)を用いてデータ分析を実施した。
XPS測定を用いて、組織化層の厚さを計算することができる。本発明者らは、様々なサンプル深度から放出する光電子の標準的距離減衰式を用いて、これを実施した。厚さの計算は、Briggs et al.方法及びその他に基づく。Au基板の場合、被覆層厚さd(nm)は、下記式として表される:
(式中、IS及びIOは、それぞれ基板及び被覆層からのピークの強度であり、基板は、Ti 2p信号であり、層は、C 1s、O 1s、N 1s及びF 1sピークの強度の和であり、θは、射出角(本発明の場合、sinθ=1)であり、NS及びNOは、体積密度である)。基板(λS)及び被覆層(λO)についての非弾性平均自由行程(IMFP)パラメータは、それぞれ2.18nm及び3.3nmと想定された。S.Tougard QUASES−IMFP−TPP2Mソフトウエア(http://www.quases.com)を用いて計算した。非弾性電子平均自由行程は、Tanuma,Powell and Pennアルゴリズム[Penn,1994]から計算した。
ペプチドベースのコーティングの厚さは、α−SE分光エリプソメータ(J.A.Woollam,Lincoln,Nebraska,USA)を用いて測定した。測定は、波長380〜900nm、入射角70°で実施した。50nmTiと共に標準的Siを用いて、基板の光学的特性をあてはめた。コーシー(Cauchy)モデルに従って層の厚さ及び屈折率をあてはめた。初めにコーシー(Cauchy)式の係数を有機層(An=1.45,Bn=0.01及びCn=0)について決定し、角度オフセットを可能にした。次に、より正確な値を決定するように、パラメータのあてはめを実施した。
BSA、リゾチーム及びフィブリノーゲン(PBS中150μM)の50μLの単一タンパク質溶液をペトリ皿内の基板上にピペットで載せた。プレートを37℃の加湿インキュベータ内に2時間配置した。次に、基板をPBS(pH=7.43、10mM Nacl、150mM)で3回すすいだ後、1mLの2%(w/w)SDSの入ったエッペンドルフチューブに移した。サンプルを60分振盪し、室温で20分音波処理することにより、吸着したタンパク質を脱離させた。非干渉タンパク質アッセイ(Calbiochem,USA)を製造業者の指示に従い使用し、マイクロプレートリーダ(Synergy 2,BioTek)を480nmで用いて、SDS溶液中のタンパク質濃度を決定した。測定は全て3回反復し、平均した。
緑膿菌(Pseudomonas aeruginosa)及び大腸菌(Escherichia coli)を、それぞれ、ゆるく蓋をしたチューブ中のTSB培地(Fluka)及びLB培地(BD Difco)において、撹拌しながら(120rpm)37℃で一晩定常相まで増殖させた。次に、TSBで培養物を108CFU/mLまで希釈し、各培養物の3mLをペトリ皿に移した。基板をプレート内に水平に配置し、37℃で、緑膿菌(P.aeruginosa)によるバイオフィルムの形成のために9時間、また大腸菌(E.coli)によるバイオフィルムの形成のために96時間インキュベートした。十分な栄養素の供給を確実にするために、4.5時間毎に培地を新鮮なものと交換した。
インキュベーション後、基板を脱イオン水で3回穏やかにすすいだ後、0.2%クリスタルバイオレットで15分染色した。染色したサンプルを流水で洗浄し、空気乾燥させた。最後に、結合した色素を30%酢酸で溶離した。マイクロプレートリーダ(Synergy 2,BioTek)により590nmで吸光度の値を記録した。測定は全て3回反復し、平均した。
試験ペプチド1〜6の分子構造を以下に示す。本発明者らは、次の2種類のペプチドを調べることを選択した:1つは、ベンゼン環の各々にただ1個のフッ素原子を含み、もう1つは、5個含む。さらに、Lアミノ酸は、天然系において、より豊富であり、またDアミノ酸は、一般的プロテアーゼに耐性であり、更なる安定性を付与し得ることから、L又はDアミノ酸のいずれかを有するペプチドを試験した。ペプチドの第3のアミノ酸は、3,4−ジヒドロキシ−L−フェニルアラニン(DOPA)である(図2)。
浸漬被覆により、ペプチド膜を調製した。別に注記のない限り、実験は全て、0.01mg/mLのペプチド濃度で実施した。シリコンウエハー、100nmのチタン層で被覆したシリコンウエハー、又は400メッシュCopper−formvar(登録商標)/カーボングリッドのいずれかに膜を付着させた。電子顕微鏡を用いて、基板上の膜の形成を示す、膜中のひだ及び欠損を確認した。
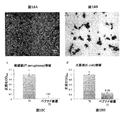
ペプチドベースのコーティングが、本当にタンパク質吸着を阻止したかどうかを決定するために、修飾した表面をFITC−BSA(蛍光標識タンパク質)とインキュベートした。入念な洗浄の後、蛍光顕微鏡検査により、表面に吸着したタンパク質の存在を分析した。この実験からの結果は、修飾した表面からの弱いシグナルと比較して、ベアシリコン基板上に広範なタンパク質吸着を示す強い蛍光シグナルをはっきりと示した。
ペプチドの防汚活性を決定するために、修飾したシリコン表面をBL21大腸菌(E.coli)培養物中に配置した。次に、表面をすすぎ、バッファー中で音波処理した後、バッファーを寒天プレートに塗布して、培養した。コロニーを計数し、コロニー形成単位(CFU)の数を計算した。
ペプチドが基板を被覆する能力を確認するために、アミン基が、DOPAの非隣接位置に配置されるような融合物に、ペプチド8を合成した。次に、ペプチドをそのアミン末端を介してフルオレセインと結合させ、浸漬被覆によりチタン基板上に付着させた。結果は、ベアチタン基板からの蛍光シグナルの非存在、及び修飾した表面からの強いシグナルを示した。このとから、ペプチドが基板を実際に被覆することがわかった。
Claims (180)
- 少なくとも2つのアミノ酸を含み、前記アミノ酸の少なくとも1つが、3,4−ジヒドロキシ−L−フェニルアラニン(DOPA)であり、前記アミノ酸の少なくとももう1つが、フッ素化されていることを特徴とするペプチド。
- 請求項1に記載のペプチドにおいて、防汚性であることを特徴とするペプチド。
- 請求項1に記載のペプチドにおいて、前記フッ素化アミノ酸が、前記少なくとも1つのDOPAと結合していることを特徴とするペプチド。
- 請求項1に記載のペプチドにおいて、少なくとも3〜8個のアミノ酸を含むことを特徴とするペプチド。
- 請求項1に記載のペプチドにおいて、少なくとも2〜8個のアミノ酸を含むことを特徴とするペプチド。
- 請求項1に記載のペプチドにおいて、少なくとも3〜6個のアミノ酸を含むことを特徴とするペプチド。
- 請求項1に記載のペプチドにおいて、少なくとも3〜5個のアミノ酸を含むことを特徴とするペプチド。
- 請求項1〜7のいずれか一項に記載のペプチドにおいて、各アミノ酸が、ペプチド結合を介して互いに結合していることを特徴とするペプチド。
- 請求項1〜7のいずれか一項に記載のペプチドにおいて、前記アミノ酸の少なくとも2つが、共有結合を介して互いに結合していることを特徴とするペプチド。
- 請求項1に記載のペプチドにおいて、一般式A−L−Fを有し、ここで、Aは、DOPAであり、Lは、AとFを連結する共有結合又はリンカー部分であり、Fは、フッ素化アミノ酸部分であることを特徴とするペプチド。
- 請求項10に記載のペプチドにおいて、AとL、又はLとFを結合する前記結合又はリンカーが、非加水分解性結合又はリンカー基であることを特徴とするペプチド。
- 請求項1〜11のいずれか一項に記載のペプチドにおいて、前記リンカーが、置換又は非置換炭素鎖から選択されることを特徴とするペプチド。
- 請求項12に記載のペプチドにおいて、前記リンカーが、2つ以上のアミノ酸から構成されることを特徴とするペプチド。
- 請求項12に記載のペプチドにおいて、前記リンカーが、1〜40個の炭素原子を含むことを特徴とするペプチド。
- 請求項1に記載のペプチドにおいて、2つ以上のDOPA部分を含むことを特徴とするペプチド。
- 請求項1に記載のペプチドにおいて、2つ以上のフッ素化アミノ酸を含むことを特徴とするペプチド。
- 請求項1に記載のペプチドにおいて、2つ以上のDOPA及び2つ以上のフッ素化アミノ酸部分を含むことを特徴とするペプチド。
- 請求項1に記載のペプチドにおいて、1つ又は複数のDOPA及び2つ以上のフッ素化アミノ酸部分を含むことを特徴とするペプチド。
- 請求項1に記載のペプチドにおいて、2つ以上のDOPA及び1つ又は複数のフッ素化アミノ酸を含むことを特徴とするペプチド。
- 請求項1〜20のいずれか一項に記載のペプチドにおいて、フッ素化されている前記アミノ酸が、天然若しくは非天然アミノ酸、アミノ酸類似体、α−若しくはβ形態、及びL−若しくはDアミノ酸から選択されることを特徴とするペプチド。
- 請求項21に記載のペプチドにおいて、前記アミノ酸が、アラニン、アルギニン、アスパラギン、アスパラギン酸、システイン、グルタミン酸、グルタミン、グリシン、ヒスチジン、イソロイシン、ロイシン、リシン、メチオニン、フェニルアラニン、プロリン、セリン、トレオニン、トリプトファン、チロシン、バリン、ピロリシン及びセレノシステイン;並びにホモアミノ酸、N−アルキルアミノ酸、デヒドロアミノ酸、芳香族アミノ酸及びα,α−二置換アミノ酸などのアミノ酸類似体、システイン、5−ヒドロキシリシン、4−ヒドロキシプロリン、a−アミノアジピン酸、a−アミノ−n−酪酸、3,4−ジヒドロキシフェニルアラニン、ホモセリン、α−メチルセリン、オルニチン、ピペコリン酸、オルト、メタ若しくはパラ−アミノ安息香酸、シトルリン、カナバニン、ノルロイシン、d−グルタミン酸、アミノ酪酸、L−フルオレニルアラニン、L−3−ベンゾチエニルアラニン及びチロキシンから選択されることを特徴とするペプチド。
- 請求項21に記載のペプチドにおいて、前記アミノ酸が、芳香族アミノ酸から選択されることを特徴とするペプチド。
- 請求項23に記載のペプチドにおいて、前記芳香族アミノ酸が、トリプトファン、チロシン、ナフチルアラニン、及びフェニルアラニンから選択されることを特徴とするペプチド。
- 請求項24に記載のペプチドにおいて、前記アミノ酸が、フェニルアラニン及び/又はその誘導体から選択されることを特徴とするペプチド。
- 請求項25に記載のペプチドにおいて、前記フェニルアラニン誘導体が、以下:4−メトキシ−フェニルアラニン、4−カルバムイミドイル−l−フェニルアラニン、4−クロロ−フェニルアラニン、3−シアノ−フェニルアラニン、4−ブロモ−フェニルアラニン、4−シアノ−フェニルアラニン、4−ヒドロキシメチル−フェニルアラニン、4−メチル−フェニルアラニン、1−ナフチル−アラニン、3−(9−アントリル)−アラニン、3−メチル−フェニルアラニン、m−アミジノフェニル−3−アラニン、フェニルセリン、ベンジルシステイン、4,4−ビフェニルアラニン、2−シアノ−フェニルアラニン、2,4−ジクロロ−フェニルアラニン、3,4−ジクロロ−フェニルアラニン、2−クロロ−フェニルアラニン、3,4−ジヒドロキシ−フェニルアラニン、3,5−ジブロモチロシン、3,3−ジフェニルアラニン、3−エチル−フェニルアラニン、3,4−ジフルオロ−フェニルアラニン、3−クロロ−フェニルアラニン、3−クロロ−フェニルアラニン、2−フルオロ−フェニルアラニン、3−フルオロ−フェニルアラニン、4−アミノ−L−フェニルアラニン、ホモフェニルアラニン、3−(8−ヒドロキシキノリン−3−イル)−l−アラニン、3−ヨード−チロシン、キヌレニン、3,4−ジメチル−フェニルアラニン、2−メチル−フェニルアラニン、m−チロシン、2−ナフチル−アラニン、5−ヒドロキシ−1−ナフタレン、6−ヒドロキシ−2−ナフタレン、メタ−ニトロ−チロシン、(β)−β−ヒドロキシ−l−チロシン、(β)−3−クロロ−β−ヒドロキシ−l−チロシン、o−チロシン、4−ベンゾイル−フェニルアラニン、3−(2−ピリジル)−アラニン、3−(3−ピリジル)−アラニン、3−(4−ピリジル)−アラニン、3−(2−キノリル)−アラニン、3−(3−キノリル)−アラニン、3−(4−キノリル)−アラニン、3−(5−キノリル)−アラニン、3−(6−キノリル)−アラニン、3−(2−キノキサリル)−アラニン、スチリルアラニン、ペンタフルオロ−フェニルアラニン、4−フルオロ−フェニルアラニン、フェニルアラニン、4−ヨード−フェニルアラニン、4−ニトロ−フェニルアラニン、ホスホチロシン、4−tert−ブチル−フェニルアラニン、2−(トリフルオロメチル)−フェニルアラニン、3−(トリフルオロメチル)−フェニルアラニン、4−(トリフルオロメチル)−フェニルアラニン、3−アミノ−L−チロシン、3,5−ジヨードチロシン、3−アミノ−6−ヒドロキシ−チロシン、チロシン、3,5−ジフルオロ−フェニルアラニン及び3−フルオロチロシンから選択されることを特徴とするペプチド。
- 請求項1に記載のペプチドにおいて、前記フッ素化アミノ酸が、o−フルオロフェニルアラニン、m−フルオロフェニルアラニン及びp−フルオロフェニルアラニンから選択されることを特徴とするペプチド。
- 請求項1に記載のペプチドにおいて、2〜12個のアミノ酸を含み、各アミノ酸が、芳香族アミノ酸から選択されることを特徴とするペプチド。
- 請求項28に記載のペプチドにおいて、一端にDOPAを、且つ他端に、o−フルオロフェニルアラニン、m−フルオロフェニルアラニン及びp−フルオロフェニルアラニンから選択されるフッ素化芳香族アミノ酸を含むことを特徴とするペプチド。
- 請求項28に記載のペプチドにおいて、ペプチドに沿って中間点のアミノ酸にDOPAを、且つペプチド末端の各々に、o−フルオロフェニルアラニン、m−フルオロフェニルアラニン及びp−フルオロフェニルアラニンから選択されるフッ素化芳香族アミノ酸を含むことを特徴とするペプチド。
- 請求項1〜30のいずれか一項に記載のペプチドにおいて、防汚剤としての使用を目的とすることを特徴とするペプチド。
- 請求項31に記載のペプチドにおいて、以下:
(d)表面への有機及び/又はバイオ−有機物質の吸着;
(b)表面へのタンパク質並びに/又は多糖及びポリリピドの吸着;
(c)表面への多細胞生物又は微生物の細胞からの分泌;
(d)表面への多細胞生物又は微生物の細胞の吸着
の1つ又は複数の防止又は停止又は最小化又は低減を目的とすることを特徴とするペプチド。 - 以下:
NH2−L−DOPA−L−(4−F)−Phe−COOH ペプチド15
NH2−L−DOPA−D−(4−F)−Phe−COOH ペプチド16
NH2−L−DOPA−L−(4−F)−Phe−L−(4−F)−Phe−COOMe ペプチド17
から選択されることを特徴とするペプチド。 - 請求項1〜41のいずれか一項に記載のペプチドを含むことを特徴とする製剤。
- 請求項42に記載の製剤において、すぐに使用できる防汚製剤であることを特徴とする製剤。
- 請求項1〜41のいずれか一項に記載の少なくとも1つのペプチドを含むことを特徴とする膜。
- 請求項44に記載の膜において、防汚及び/又はバイオフィルム抑制性であることを特徴とする膜。
- 請求項44又は45に記載の膜で被覆された少なくとも1つの表面領域を含むことを特徴とする物品又は装置。
- 請求項46に記載の物品又は装置において、海洋船舶、船舶の船体、医療機器、コンタクトレンズ、食品処理装置、飲料水供給装置、パイプライン、ケーブル、漁網、橋梁及び浸水物品の表面領域から選択されることを特徴とする物品又は装置。
- 請求項45に記載の膜において、細菌、珪藻、ヒドロイド、藻類、コケムシ、原生動物、マボヤ、チューブワーム、タイワンシジミ、ゼブラ貝及びフジツボから選択される生物によって引き起こされる生物付着の防止を目的とすることを特徴とする膜。
- 請求項48に記載の膜において、前記生物が、細菌であることを特徴とする膜。
- 請求項49に記載の膜において、前記細菌が、百日咳菌(Bordetella pertussis)、ボレリア・ブルグドルフェリ(Borrelia burgdorferi)、ブルセラ・アボルタス(Brucella abortus)、ブルセラ・カニス(Brucella canis)、ブルセラ・メリテンシス(Brucella melitensis)、ブルセラ・スイス(Brucella suis)、カンピロバクター・ジェジュニ(Campylobacter jejuni)、肺炎クラミジア(Chlamydia pneumonia)、オウム病クラミジア(Chlamydia psittaci)、トラコーマ・クラミジア(Chlamydia trachomatis)、ボツリヌス菌(Clostridium botulinum)、クロストリジウム・ディフィシル(Clostridium difficile)、ウェルシュ菌(Clostridium perfringens)、破傷風菌(Clostridium tetani)、ジフテリア菌(Corynebacterium diphtheria)、エンテロコッカス・フェカリス(Enterococcus faecalis)、エンテロコッカス・フェシウム(Enterococcus faecium)、大腸菌(Escherichia coli)(E.coli)、毒素原性大腸菌(Enterotoxigenic Escherichia coli)(ETEC)、腸管病原性大腸菌(Enteropathogenic E.coli)、野兎病菌(Francisella tularensis)、インフルエンザ菌(Haemophilus influenza)、ヘリコバクター・ピロリ(Helicobacter pylori)、レジオネラ・ニューモフィラ(Legionella pneumophila)、レプトスピラ・インターロガンス(Leptospira interrogans)、リステリア・モノサイトゲネス(Listeria monocytogenes)、らい菌(Mycobacterium leprae)、結核菌(Mycobacterium tuberculosis)、肺炎マイコプラズマ(Mycoplasma pneumonia)、淋菌(Neisseria gonorrhoeae)、髄膜炎菌(Neisseria meningitidis)、緑膿菌(Pseudomonas aeruginosa)、リケッチア・リケッチイ(Rickettsia rickettsii)、チフス菌(Salmonella typhi)、ネズミチフス菌(Salmonella typhimurium)、赤痢菌(Shigella sonnei)、表皮ブドウ球菌(Staphylococcus epidermidis)、スタフィロコッカス・サプロフィチカス(Staphylococcus saprophyticus)、ストレプトコッカス・アガラクティエ(Streptococcus agalactiae)、ミュータンス菌(Streptococcus mutans)、肺炎レンサ球菌(Streptococcus pneumonia)、化膿レンサ球菌(Streptococcus pyogenes)、梅毒トレポネマ(Treponema pallidum)、コレラ菌(Vibrio cholera)、ビブリオ・ハーベイ(Vibrio harveyi)及びペスト菌(Yersinia pestis)から選択されることを特徴とする膜。
- 請求項50に記載の膜において、前記細菌が、大腸菌(Escherichia coli)(E.coli)であることを特徴とする膜。
- 請求項50に記載の膜において、前記細菌が、緑膿菌(P.aeruginosa)であることを特徴とする膜。
- 請求項1〜41のいずれか一項に記載のペプチドの使用において、多細胞生物の細胞又は微生物の分泌物の透析装置表面への吸着を防止又は停止することにより、前記装置により治療中の患者からの血液細胞又は血液細胞から分泌されるタンパク質の付着を防止することを目的とすることを特徴とする使用。
- 表面への生物、生物からの有機及び/若しくはバイオ−有機物質の分泌物の沈積、付着、蓄積及び分散を阻害する方法において、請求項1〜41のいずれか一項に記載のペプチドを含む有効量の製剤と、前記表面を接触させるステップを含むことを特徴とする方法。
- 少なくとも1つの防汚部分と少なくとも1つの表面吸着部分とを有する化合物を含む膜又はコートにおいて、前記少なくとも1つの防汚部分が、フッ素(−F)及び少なくとも1個のフッ素原子を含有する基から選択され、且つ前記少なくとも1つの表面吸着部分が、3,4−ジヒドロキシ−L−フェニルアラニン(DOPA)及びDOPA含有基から選択されることを特徴とする膜。
- 請求項55に記載の膜又はコートにおいて、装置又は物品の表面領域上に形成されることを特徴とする膜。
- 少なくとも1つの防汚部分と少なくとも1つの表面吸着部分(又は基)とを含む二官能性化合物を含む膜又はコートにおいて、前記少なくとも1つの防汚部分が、フッ素(−F)及びフッ素原子を含有する少なくとも1つの基から選択され、且つ前記少なくとも1つの表面吸着部分が、ジヒドロキシ−アミノ酸及びジヒドロキシ−アミノ酸含有基から選択され、前記少なくとも1つの防汚部分と前記少なくとも1つの表面吸着部分は、共有結合又はリンカー部分を介して互いに結合されていることを特徴とする膜又はコート。
- 少なくとも1つの防汚部分と少なくとも1つの表面吸着部分とを含む、請求項55〜57のいずれか一項に記載の膜又はコートにおいて、前記少なくとも1つの防汚部分が、フッ素(−F)及びフッ素原子を含有する少なくとも1つの基から選択され、且つ前記少なくとも1つの表面吸着部分が、3,4−ジヒドロキシ−L−フェニルアラニン(DOPA)及びDOPA含有基から選択され、前記少なくとも1つの防汚部分と前記少なくとも1つの表面吸着部分は、共有結合又はリンカー部分を介して互いに結合されていることを特徴とする膜又はコート。
- 請求項55〜58のいずれか一項に記載の膜又はコートにおいて、前記化合物が、一般式A−L−Fを有し、ここで、Aは、表面吸着部分であり、Lは、AとFを連結する共有結合又はリンカー部分であり、Fは、防汚部分であり、A、L及びFの各々は、非加水分解性結合を介して、互いに結合されていることを特徴とする膜又はコート。
- 請求項55〜59のいずれか一項に記載の膜又はコートにおいて、前記表面への有機及び/又はバイオ−有機物質の吸着を防止又は停止するために防汚性であることを特徴とする膜又はコート。
- 請求項55〜60のいずれか一項に記載の膜又はコートにおいて、表面への多細胞生物の細胞又は微生物の分泌物の吸着を防止又は停止するために防汚性であることを特徴とする膜又はコート。
- 請求項57〜61のいずれか一項に記載の膜又はコートにおいて、前記表面吸着部分が、前記リンカー部分上の原子と連結、会合又は結合したDOPAであることを特徴とする膜又はコート。
- 請求項57〜62のいずれか一項に記載の膜又はコートにおいて、前記リンカー部分が、1炭素鎖であることを特徴とする膜又はコート。
- 請求項57〜63のいずれか一項に記載の膜又はコートにおいて、前記リンカー部分が、置換又は非置換炭素鎖から選択されることを特徴とする膜又はコート。
- 請求項57〜64のいずれか一項に記載の膜又はコートにおいて、前記リンカー部分が、アミノ酸及びペプチドから選択されることを特徴とする膜又はコート。
- 請求項57〜65のいずれか一項に記載の膜又はコートにおいて、前記リンカー部分が、1〜40個の炭素原子を含むことを特徴とする膜又はコート。
- 請求項57〜66のいずれか一項に記載の膜又はコートにおいて、前記リンカー部分が、置換若しくは非置換アルキル、置換若しくは非置換アルケニル、置換若しくは非置換アルキニル、置換若しくは非置換シクロアルキル、置換若しくは非置換シクロアルケニル、置換若しくは非置換シクロアルキニル、置換若しくは非置換アリール、置換若しくは非置換ヘテロアリール、置換若しくは非置換ヘテロシクリル、置換若しくは非置換−NR1R2、置換若しくは非置換−OR3、置換若しくは非置換−SR4、置換若しくは非置換−S(O)R5、置換若しくは非置換アルキレン−COOH、及び置換若しくは非置換エステルから選択される1つ又は複数の官能基によって置換されることを特徴とする膜又はコート。
- 請求項68に記載の膜又はコートにおいて、nが、1〜12であることを特徴とする膜又はコート。
- 請求項69に記載の膜又はコートにおいて、nが、1〜8であることを特徴とする膜又はコート。
- 請求項70に記載の膜又はコートにおいて、nが、1〜6であることを特徴とする膜又はコート。
- 請求項68〜71のいずれか一項に記載の膜又はコートにおいて、mが、1〜20であることを特徴とする膜又はコート。
- 請求項72に記載の膜又はコートにおいて、mが、1〜12であることを特徴とする膜又はコート。
- 請求項73に記載の膜又はコートにおいて、mが、1〜8であることを特徴とする膜又はコート。
- 請求項74に記載の膜又はコートにおいて、mが、1〜6であることを特徴とする膜又はコート。
- 請求項68〜75のいずれか一項に記載の膜又はコートにおいて、1つ又は複数の(CH2)n基が置換されることを特徴とする膜又はコート。
- 請求項57〜76のいずれか一項に記載の膜又はコートにおいて、前記リンカー部分が、アミノ酸であり、2又は3又は4又は5又は6又は7又は8又は9又は10又は11又は12又は13又は14又は15又は16又は17又は18又は19又は20又は21又は22又は23又は24又は25又は26又は27又は28又は29又は30又は31又は32又は33又は34又は35又は36又は37又は38又は39又は40個のアミノ酸を含むことを特徴とする膜又はコート。
- 請求項55〜77のいずれか一項に記載の膜又はコートにおいて、前記化合物が、アミド結合を介して互いに結合した2つのアミノ酸から構成され、ここで、一方のアミノ酸はDOPAであり、他方は、フッ素化アミノ酸であることを特徴とする膜又はコート。
- 請求項57〜78のいずれか一項に記載の膜又はコートにおいて、前記防汚部分が、一端で前記リンカーに結合し、前記表面吸着部分は、前記リンカー部分の他端に結合していることを特徴とする膜又はコート。
- 請求項57〜78のいずれか一項に記載の膜又はコートにおいて、前記防汚部分と前記表面吸着部分が、前記リンカー部分に沿って交互の位置にあることを特徴とする膜又はコート。
- 請求項57〜80のいずれか一項に記載の膜又はコートにおいて、前記リンカー部分が、2つ以上のアミノ酸のペプチドを含むか、又はそれから構成されることを特徴とする膜又はコート。
- 請求項55〜81のいずれか一項に記載の膜又はコートにおいて、前記化合物が、少なくとも2つのアミノ酸、少なくとも1つのDOPA及び少なくともフッ素化基(フッ素化アミノ酸であっても、そうでなくてもよい)を有するペプチドであることを特徴とする膜又はコート。
- 請求項82に記載の膜又はコートにおいて、前記ペプチドが、2〜40個のアミノ酸を含むことを特徴とする膜又はコート。
- 請求項83に記載の膜又はコートにおいて、前記ペプチドが、2、又は3、又は4、又は5、又は6、又は7、又は8又は9又は10又は11又は12個のアミノ酸を含むことを特徴とする膜又はコート。
- 請求項55〜84のいずれか一項に記載の膜又はコートにおいて、前記防汚部分が、天然又は非天然アミノ酸、アミノ酸類似体、α−又はβ形態、及びL−又はDアミノ酸から選択されるフッ素化アミノ酸であることを特徴とする膜又はコート。
- 請求項85に記載の膜又はコートにおいて、前記アミノ酸が、以下:アラニン、アルギニン、アスパラギン、アスパラギン酸、システイン、グルタミン酸、グルタミン、グリシン、ヒスチジン、イソロイシン、ロイシン、リシン、メチオニン、フェニルアラニン、プロリン、セリン、トレオニン、トリプトファン、チロシン、バリン、ピロリシン及びセレノシステイン;並びにホモアミノ酸、N−アルキルアミノ酸、デヒドロアミノ酸、芳香族アミノ酸及びα,α−二置換アミノ酸などのアミノ酸類似体、システイン、5−ヒドロキシリシン、4−ヒドロキシプロリン、a−アミノアジピン酸、a−アミノ−n−酪酸、3,4−ジヒドロキシフェニルアラニン、ホモセリン、α−メチルセリン、オルニチン、ピペコリン酸、オルト、メタ若しくはパラ−アミノ安息香酸、シトルリン、カナバニン、ノルロイシン、d−グルタミン酸、アミノ酪酸、L−フルオレニルアラニン、L−3−ベンゾチエニルアラニン及びチロキシンから選択されることを特徴とする膜又はコート。
- 請求項85に記載の膜又はコートにおいて、前記アミノ酸が、芳香族アミノ酸から選択されることを特徴とする膜又はコート。
- 請求項87に記載の膜又はコートにおいて、前記芳香族アミノ酸が、トリプトファン、チロシン、ナフチルアラニン、及びフェニルアラニンから選択されることを特徴とする膜又はコート。
- 請求項88に記載の膜又はコートにおいて、前記アミノ酸が、フェニルアラニン及びその誘導体から選択されることを特徴とする膜又はコート。
- 請求項89に記載の膜又はコートにおいて、前記フェニルアラニン誘導体が、以下:4−メトキシ−フェニルアラニン、4−カルバムイミドイル−l−フェニルアラニン、4−クロロ−フェニルアラニン、3−シアノ−フェニルアラニン、4−ブロモ−フェニルアラニン、4−シアノ−フェニルアラニン、4−ヒドロキシメチル−フェニルアラニン、4−メチル−フェニルアラニン、1−ナフチル−アラニン、3−(9−アントリル)−アラニン、3−メチル−フェニルアラニン、m−アミジノフェニル−3−アラニン、フェニルセリン、ベンジルシステイン、4,4−ビフェニルアラニン、2−シアノ−フェニルアラニン、2,4−ジクロロ−フェニルアラニン、3,4−ジクロロ−フェニルアラニン、2−クロロ−フェニルアラニン、3,4−ジヒドロキシ−フェニルアラニン、3,5−ジブロモチロシン、3,3−ジフェニルアラニン、3−エチル−フェニルアラニン、3,4−ジフルオロ−フェニルアラニン、3−クロロ−フェニルアラニン、3−クロロ−フェニルアラニン、2−フルオロ−フェニルアラニン、3−フルオロ−フェニルアラニン、4−アミノ−L−フェニルアラニン、ホモフェニルアラニン、3−(8−ヒドロキシキノリン−3−イル)−l−アラニン、3−ヨード−チロシン、キヌレニン、3,4−ジメチル−フェニルアラニン、2−メチル−フェニルアラニン、m−チロシン、2−ナフチル−アラニン、5−ヒドロキシ−1−ナフタレン、6−ヒドロキシ−2−ナフタレン、メタ−ニトロ−チロシン、(β)−β−ヒドロキシ−l−チロシン、(β)−3−クロロ−β−ヒドロキシ−l−チロシン、o−チロシン、4−ベンゾイル−フェニルアラニン、3−(2−ピリジル)−アラニン、3−(3−ピリジル)−アラニン、3−(4−ピリジル)−アラニン、3−(2−キノリル)−アラニン、3−(3−キノリル)−アラニン、3−(4−キノリル)−アラニン、3−(5−キノリル)−アラニン、3−(6−キノリル)−アラニン、3−(2−キノキサリル)−アラニン、スチリルアラニン、ペンタフルオロ−フェニルアラニン、4−フルオロ−フェニルアラニン、フェニルアラニン、4−ヨード−フェニルアラニン、4−ニトロ−フェニルアラニン、ホスホチロシン、4−tert−ブチル−フェニルアラニン、2−(トリフルオロメチル)−フェニルアラニン、3−(トリフルオロメチル)−フェニルアラニン、4−(トリフルオロメチル)−フェニルアラニン、3−アミノ−L−チロシン、3,5−ジヨードチロシン、3−アミノ−6−ヒドロキシ−チロシン、チロシン、3,5−ジフルオロ−フェニルアラニン及び3−フルオロチロシンから選択されることを特徴とする膜又はコート。
- 請求項85に記載の膜又はコートにおいて、前記フッ素化アミノ酸が、o−フルオロフェニルアラニン、m−フルオロフェニルアラニン及びp−フルオロフェニルアラニンから選択されることを特徴とする膜又はコート。
- 請求項85に記載の膜又はコートにおいて、前記化合物が、一端にDOPAを、且つ他端に、o−フルオロフェニルアラニン、m−フルオロフェニルアラニン及びp−フルオロフェニルアラニンから選択されるフッ素化芳香族アミノ酸を含むことを特徴とする膜又はコート。
- 請求項85に記載の膜又はコートにおいて、前記化合物が、前記ペプチドに沿って中間点のアミノ酸にDOPAを、且つ前記ペプチド末端の各々に、o−フルオロフェニルアラニン、m−フルオロフェニルアラニン及びp−フルオロフェニルアラニンから選択されるフッ素化芳香族アミノ酸を含むことを特徴とする膜又はコート。
- 請求項55〜93のいずれか一項に記載の膜又はコートにおいて、以下:
(e)表面への有機及び/又はバイオ−有機物質の吸着;
(b)表面へのタンパク質並びに/又は多糖及びポリリピドの吸着;
(c)表面への多細胞生物又は微生物の細胞からの分泌;
(d)表面への多細胞生物又は微生物の細胞の吸着
のうち1つ又は複数の防止又は停止又は最小化又は低減を目的とすることを特徴とする膜又はコート。 - 請求項55〜94のいずれか一項に記載の膜又はコートにおいて、前記化合物が、以下:
NH2−L−DOPA−L−(4−F)−Phe−COOH ペプチド15
NH2−L−DOPA−D−(4−F)−Phe−COOH ペプチド16
NH2−L−DOPA−L−(4−F)−Phe−L−(4−F)−Phe−COOMe ペプチド17
から選択されるペプチドであることを特徴とする膜又はコート。 - 請求項55〜103のいずれか一項に記載の膜又はコートで被覆された少なくとも1つの表面領域を含むことを特徴とする物品又は装置。
- 請求項104に記載の物品又は装置において、海洋船舶、船舶の船体、医療機器、コンタクトレンズ、食品処理装置、飲料水供給装置、パイプライン、ケーブル、漁網、橋梁及び浸水物品の表面領域から選択されることを特徴とする物品又は装置。
- 請求項55〜103のいずれか一項に記載の膜又はコートにおいて、細菌、珪藻、ヒドロイド、藻類、コケムシ、原生動物、マボヤ、チューブワーム、タイワンシジミ、ゼブラ貝及びフジツボから選択される生物によって引き起こされる生物付着の防止を目的とすることを特徴とする膜又はコート。
- 請求項106に記載の膜又はコートにおいて、前記生物が、細菌であることを特徴とする膜又はコート。
- 請求項107に記載の膜又はコートにおいて、前記細菌が、以下:百日咳菌(Bordetella pertussis)、ボレリア・ブルグドルフェリ(Borrelia burgdorferi)、ブルセラ・アボルタス(Brucella abortus)、ブルセラ・カニス(Brucella canis)、ブルセラ・メリテンシス(Brucella melitensis)、ブルセラ・スイス(Brucella suis)、カンピロバクター・ジェジュニ(Campylobacter jejuni)、肺炎クラミジア(Chlamydia pneumonia)、オウム病クラミジア(Chlamydia psittaci)、トラコーマ・クラミジア(Chlamydia trachomatis)、ボツリヌス菌(Clostridium botulinum)、クロストリジウム・ディフィシル(Clostridium difficile)、ウェルシュ菌(Clostridium perfringens)、破傷風菌(Clostridium tetani)、ジフテリア菌(Corynebacterium diphtheria)、エンテロコッカス・フェカリス(Enterococcus faecalis)、エンテロコッカス・フェシウム(Enterococcus faecium)、大腸菌(Escherichia coli)(E.coli)、毒素原性大腸菌(Enterotoxigenic Escherichia coli)(ETEC)、腸管病原性大腸菌(Enteropathogenic E.coli)、野兎病菌(Francisella tularensis)、インフルエンザ菌(Haemophilus influenza)、ヘリコバクター・ピロリ(Helicobacter pylori)、レジオネラ・ニューモフィラ(Legionella pneumophila)、レプトスピラ・インターロガンス(Leptospira interrogans)、リステリア・モノサイトゲネス(Listeria monocytogenes)、らい菌(Mycobacterium leprae)、結核菌(Mycobacterium tuberculosis)、肺炎マイコプラズマ(Mycoplasma pneumonia)、淋菌(Neisseria gonorrhoeae)、髄膜炎菌(Neisseria meningitidis)、緑膿菌(Pseudomonas aeruginosa)、リケッチア・リケッチイ(Rickettsia rickettsii)、チフス菌(Salmonella typhi)、ネズミチフス菌(Salmonella typhimurium)、赤痢菌(Shigella sonnei)、表皮ブドウ球菌(Staphylococcus epidermidis)、スタフィロコッカス・サプロフィチカス(Staphylococcus saprophyticus)、ストレプトコッカス・アガラクティエ(Streptococcus agalactiae)、ミュータンス菌(Streptococcus mutans)、肺炎レンサ球菌(Streptococcus pneumonia)、化膿レンサ球菌(Streptococcus Pyogenes)、梅毒トレポネマ(Treponema pallidum)、コレラ菌(Vibrio cholera)、ビブリオ・ハーベイ(Vibrio harveyi)及びペスト菌(Yersinia pestis)から選択されることを特徴とする膜又はコート。
- 請求項108に記載の膜又はコートにおいて、前記細菌が、大腸菌(Escherichia coli)(E.coli)であることを特徴とする膜又はコート。
- 請求項108に記載の膜又はコートにおいて、前記細菌が、緑膿菌(P.aeruginosa)であることを特徴とする膜又はコート。
- 装置又は物品の表面領域上に自己組織化防汚膜若しくはコートを形成することに使用するための、少なくとも1つの防汚部分と少なくとも1つの表面吸着部分とを含む化合物を含む組成物において、前記少なくとも1つの防汚部分が、フッ素(−F)及び少なくとも1個のフッ素原子を含有する基から選択され、且つ前記少なくとも1つの表面吸着部分が、3,4−ジヒドロキシ−L−フェニルアラニン(DOPA)及びDOPA含有基から選択されることを特徴とする組成物。
- 少なくとも1つの防汚部分と少なくとも1つの表面吸着部分(又は基)とを有する二官能性化合物を含む請求項111に記載の組成物において、前記少なくとも1つの防汚部分が、フッ素(−F)及びフッ素原子を含有する少なくとも1つの基から選択され、且つ前記少なくとも1つの表面吸着部分が、ジヒドロキシ−アミノ酸及びジヒドロキシ−アミノ酸含有基から選択され、前記少なくとも1つの防汚部分と前記少なくとも1つの表面吸着部分が、共有結合又はリンカー部分を介して互いに結合されていることを特徴とする組成物。
- 少なくとも1つの防汚部分と少なくとも1つの表面吸着部分とを有する請求項111〜112のいずれか一項に記載の組成物において、前記少なくとも1つの防汚部分が、フッ素(−F)及びフッ素原子を含有する少なくとも1つの基から選択され、且つ前記少なくとも1つの表面吸着部分が、3,4−ジヒドロキシ−L−フェニルアラニン(DOPA)及びDOPA含有基から選択され、前記少なくとも1つの防汚部分と前記少なくとも1つの表面吸着部分が、共有結合又はリンカー部分を介して互いに結合されていることを特徴とする組成物。
- 請求項111〜113のいずれか一項に記載の組成物において、前記化合物が、一般式A−L−Fを有し、ここで、Aは、表面吸着部分であり、Lは、AとFを連結する共有結合又はリンカー部分であり、Fは、防汚部分であり、A、L及びFの各々は、非加水分解性結合を介して、互いに結合されていることを特徴とする組成物。
- 請求項111〜114のいずれか一項に記載の組成物において、前記表面への有機及び/又はバイオ−有機物質の吸着を防止又は停止するために防汚性であることを特徴とする組成物。
- 請求項111〜114のいずれか一項に記載の組成物において、表面への多細胞生物の細胞又は微生物の分泌物の吸着を防止又は停止するために防汚性であることを特徴とする組成物。
- 請求項113に記載の組成物において、前記表面吸着部分が、前記リンカー部分上の原子と連結、会合又は結合したDOPAであることを特徴とする組成物。
- 請求項117に記載の組成物において、前記リンカー部分が、1炭素鎖であることを特徴とする組成物。
- 請求項117に記載の組成物において、前記リンカー部分が、置換又は非置換炭素鎖から選択されることを特徴とする組成物。
- 請求項117に記載の組成物において、前記リンカー部分が、アミノ酸及びペプチドから選択されることを特徴とする組成物。
- 請求項113〜120のいずれか一項に記載の組成物において、前記リンカー部分が、1〜40個の炭素原子を含むことを特徴とする組成物。
- 請求項113〜121のいずれか一項に記載の組成物において、前記リンカー部分が、以下:置換若しくは非置換アルキル、置換若しくは非置換アルケニル、置換若しくは非置換アルキニル、置換若しくは非置換シクロアルキル、置換若しくは非置換シクロアルケニル、置換若しくは非置換シクロアルキニル、置換若しくは非置換アリール、置換若しくは非置換ヘテロアリール、置換若しくは非置換ヘテロシクリル、置換若しくは非置換−NR1R2、置換若しくは非置換−OR3、置換若しくは非置換−SR4、置換若しくは非置換−S(O)R5、置換若しくは非置換アルキレン−COOH、及び置換若しくは非置換エステルから選択される1つ又は複数の官能基によって置換されることを特徴とする組成物。
- 請求項123に記載の組成物において、nが、1〜12であることを特徴とする組成物。
- 請求項123に記載の組成物において、nが、1〜8であることを特徴とする組成物。
- 請求項123に記載の組成物において、nが、1〜6であることを特徴とする組成物。
- 請求項123に記載の組成物において、mが、1〜20であることを特徴とする組成物。
- 請求項123に記載の組成物において、mが、1〜12であることを特徴とする組成物。
- 請求項123に記載の組成物において、mが、1〜8であることを特徴とする組成物。
- 請求項123に記載の組成物において、mが、1〜6であることを特徴とする組成物。
- 請求項125に記載の組成物において、1つ又は複数の(CH2)n基が置換されることを特徴とする組成物。
- 請求項123に記載の組成物において、前記リンカー部分が、アミノ酸であり、2又は3又は4又は5又は6又は7又は8又は9又は10又は11又は12又は13又は14又は15又は16又は17又は18又は19又は20又は21又は22又は23又は24又は25又は26又は27又は28又は29又は30又は31又は32又は33又は34又は35又は36又は37又は38又は39又は40個のアミノ酸を含むことを特徴とする組成物。
- 請求項112〜132のいずれか一項に記載の組成物において、前記化合物が、アミド結合を介して互いに結合した2つのアミノ酸から構成され、ここで、一方のアミノ酸はDOPAであり、他方は、フッ素化アミノ酸であることを特徴とする組成物。
- 請求項112〜132のいずれか一項に記載の組成物において、前記防汚部分が、一端で前記リンカーに結合し、前記表面吸着部分は前記リンカーの他端に結合していることを特徴とする組成物。
- 請求項112〜132のいずれか一項に記載の組成物において、前記防汚部分と前記表面吸着部分が、前記リンカーに沿って交互の位置にあることを特徴とする組成物。
- 請求項112〜132のいずれか一項に記載の組成物において、前記リンカーが、2つ以上のアミノ酸のペプチドを含むか、又はそれから構成されることを特徴とする組成物。
- 請求項112〜132のいずれか一項に記載の組成物において、前記化合物が、少なくとも2つのアミノ酸、少なくとも1つのDOPA及び少なくともフッ素化基(フッ素化アミノ酸であっても、そうでなくてもよい)を有するペプチドであることを特徴とする組成物。
- 請求項137に記載の組成物において、前記ペプチドが、2〜40個のアミノ酸を含むことを特徴とする組成物。
- 請求項138に記載の組成物において、前記ペプチドが、2、又は3、又は4、又は5、又は6、又は7、又は8又は9又は10又は11又は12個のアミノ酸を含むことを特徴とする組成物。
- 請求項112〜139のいずれか一項に記載の組成物において、前記防汚部分が、天然又は非天然アミノ酸、アミノ酸類似体、α−又はβ形態、及びL−又はDアミノ酸から選択されるフッ素化アミノ酸であることを特徴とする組成物。
- 請求項140に記載の組成物において、前記アミノ酸が、以下:アラニン、アルギニン、アスパラギン、アスパラギン酸、システイン、グルタミン酸、グルタミン、グリシン、ヒスチジン、イソロイシン、ロイシン、リシン、メチオニン、フェニルアラニン、プロリン、セリン、トレオニン、トリプトファン、チロシン、バリン、ピロリシン及びセレノシステイン;並びにホモアミノ酸、N−アルキルアミノ酸、デヒドロアミノ酸、芳香族アミノ酸及びα,α−二置換アミノ酸などのアミノ酸類似体、システイン、5−ヒドロキシリシン、4−ヒドロキシプロリン、a−アミノアジピン酸、a−アミノ−n−酪酸、3,4−ジヒドロキシフェニルアラニン、ホモセリン、α−メチルセリン、オルニチン、ピペコリン酸、オルト、メタ若しくはパラ−アミノ安息香酸、シトルリン、カナバニン、ノルロイシン、d−グルタミン酸、アミノ酪酸、L−フルオレニルアラニン、L−3−ベンゾチエニルアラニン及びチロキシンから選択されることを特徴とする組成物。
- 請求項112〜139のいずれか一項に記載の組成物において、前記アミノ酸が、芳香族アミノ酸から選択されることを特徴とする組成物。
- 請求項142に記載の組成物において、前記芳香族アミノ酸が、トリプトファン、チロシン、ナフチルアラニン、及びフェニルアラニンから選択されることを特徴とする組成物。
- 請求項143に記載の組成物において、前記アミノ酸が、フェニルアラニン及びその誘導体から選択されることを特徴とする組成物。
- 請求項144に記載の組成物において、前記フェニルアラニン誘導体が、以下:4−メトキシ−フェニルアラニン、4−カルバムイミドイル−l−フェニルアラニン、4−クロロ−フェニルアラニン、3−シアノ−フェニルアラニン、4−ブロモ−フェニルアラニン、4−シアノ−フェニルアラニン、4−ヒドロキシメチル−フェニルアラニン、4−メチル−フェニルアラニン、1−ナフチル−アラニン、3−(9−アントリル)−アラニン、3−メチル−フェニルアラニン、m−アミジノフェニル−3−アラニン、フェニルセリン、ベンジルシステイン、4,4−ビフェニルアラニン、2−シアノ−フェニルアラニン、2,4−ジクロロ−フェニルアラニン、3,4−ジクロロ−フェニルアラニン、2−クロロ−フェニルアラニン、3,4−ジヒドロキシ−フェニルアラニン、3,5−ジブロモチロシン、3,3−ジフェニルアラニン、3−エチル−フェニルアラニン、3,4−ジフルオロ−フェニルアラニン、3−クロロ−フェニルアラニン、3−クロロ−フェニルアラニン、2−フルオロ−フェニルアラニン、3−フルオロ−フェニルアラニン、4−アミノ−L−フェニルアラニン、ホモフェニルアラニン、3−(8−ヒドロキシキノリン−3−イル)−l−アラニン、3−ヨード−チロシン、キヌレニン、3,4−ジメチル−フェニルアラニン、2−メチル−フェニルアラニン、m−チロシン、2−ナフチル−アラニン、5−ヒドロキシ−1−ナフタレン、6−ヒドロキシ−2−ナフタレン、メタ−ニトロ−チロシン、(β)−β−ヒドロキシ−l−チロシン、(β)−3−クロロ−β−ヒドロキシ−l−チロシン、o−チロシン、4−ベンゾイル−フェニルアラニン、3−(2−ピリジル)−アラニン、3−(3−ピリジル)−アラニン、3−(4−ピリジル)−アラニン、3−(2−キノリル)−アラニン、3−(3−キノリル)−アラニン、3−(4−キノリル)−アラニン、3−(5−キノリル)−アラニン、3−(6−キノリル)−アラニン、3−(2−キノキサリル)−アラニン、スチリルアラニン、ペンタフルオロ−フェニルアラニン、4−フルオロ−フェニルアラニン、フェニルアラニン、4−ヨード−フェニルアラニン、4−ニトロ−フェニルアラニン、ホスホチロシン、4−tert−ブチル−フェニルアラニン、2−(トリフルオロメチル)−フェニルアラニン、3−(トリフルオロメチル)−フェニルアラニン、4−(トリフルオロメチル)−フェニルアラニン、3−アミノ−L−チロシン、3,5−ジヨードチロシン、3−アミノ−6−ヒドロキシ−チロシン、チロシン、3,5−ジフルオロ−フェニルアラニン及び3−フルオロチロシンから選択されることを特徴とする組成物。
- 請求項111〜145のいずれか一項に記載の組成物において、前記フッ素化アミノ酸が、o−フルオロフェニルアラニン、m−フルオロフェニルアラニン及びp−フルオロフェニルアラニンから選択されることを特徴とする組成物。
- 請求項147に記載の組成物において、前記化合物が、一端にDOPAを、且つ他端に、o−フルオロフェニルアラニン、m−フルオロフェニルアラニン及びp−フルオロフェニルアラニンから選択されるフッ素化芳香族アミノ酸を含むことを特徴とする組成物。
- 請求項112〜148のいずれか一項に記載の組成物において、前記化合物が、前記ペプチドに沿って中間点のアミノ酸にDOPAを、且つ前記ペプチド末端の各々に、o−フルオロフェニルアラニン、m−フルオロフェニルアラニン及びp−フルオロフェニルアラニンから選択されるフッ素化芳香族アミノ酸を含むことを特徴とする組成物。
- 請求項111〜148のいずれか一項に記載の組成物において、以下:
(f)表面への有機及び/又はバイオ−有機物質の吸着;
(b)表面へのタンパク質及び/又は多糖及びポリリピドの吸着;
(c)表面への多細胞生物又は微生物の細胞からの分泌;
(d)表面への多細胞生物又は微生物の細胞の吸着
のうち1つ又は複数を防止又は停止又は最小化又は低減することを目的とすることを特徴とする組成物。 - 請求項111〜149のいずれか一項に記載の組成物において、前記化合物が、以下:
NH2−L−DOPA−L−(4−F)−Phe−COOH ペプチド15
NH2−L−DOPA−D−(4−F)−Phe−COOH ペプチド16
NH2−L−DOPA−L−(4−F)−Phe−L−(4−F)−Phe−COOMe ペプチド17
から選択されるペプチドであることを特徴とする組成物。 - 請求項111〜149のいずれか一項に記載の組成物で被覆された少なくとも1つの表面領域を含むことを特徴とする物品又は装置。
- 請求項159に記載の物品又は装置において、海洋船舶、船舶の船体、医療機器、コンタクトレンズ、食品処理装置、飲料水供給装置、パイプライン、ケーブル、漁網、橋梁及び浸水物品の表面領域から選択されることを特徴とする物品又は装置。
- 請求項111〜149のいずれか一項に記載の組成物において、細菌、珪藻、ヒドロイド、藻類、コケムシ、原生動物、マボヤ、チューブワーム、タイワンシジミ、ゼブラ貝及びフジツボから選択される生物によって引き起こされる生物付着の防止を目的とすることを特徴とする組成物。
- 請求項161に記載の組成物において、前記生物が、細菌であることを特徴とする組成物。
- 請求項162に記載の組成物において、前記細菌が、以下:百日咳菌(Bordetella pertussis)、ボレリア・ブルグドルフェリ(Borrelia burgdorferi)、ブルセラ・アボルタス(Brucella abortus)、ブルセラ・カニス(Brucella canis)、ブルセラ・メリテンシス(Brucella melitensis)、ブルセラ・スイス(Brucella suis)、カンピロバクター・ジェジュニ(Campylobacter jejuni)、肺炎クラミジア(Chlamydia pneumonia)、オウム病クラミジア(Chlamydia psittaci)、トラコーマ・クラミジア(Chlamydia trachomatis)、ボツリヌス菌(Clostridium botulinum)、クロストリジウム・ディフィシル(Clostridium difficile)、ウェルシュ菌(Clostridium perfringens)、破傷風菌(Clostridium tetani)、ジフテリア菌(Corynebacterium diphtheria)、エンテロコッカス・フェカリス(Enterococcus faecalis)、エンテロコッカス・フェシウム(Enterococcus faecium)、大腸菌(Escherichia coli)(E.coli)、毒素原性大腸菌(Enterotoxigenic Escherichia coli)(ETEC)、腸管病原性大腸菌(Enteropathogenic E.coli)、野兎病菌(Francisella tularensis)、インフルエンザ菌(Haemophilus influenza)、ヘリコバクター・ピロリ(Helicobacter pylori)、レジオネラ・ニューモフィラ(Legionella pneumophila)、レプトスピラ・インターロガンス(Leptospira interrogans)、リステリア・モノサイトゲネス(Listeria monocytogenes)、らい菌(Mycobacterium leprae)、結核菌(Mycobacterium tuberculosis)、肺炎マイコプラズマ(Mycoplasma pneumonia)、淋菌(Neisseria gonorrhoeae)、髄膜炎菌(Neisseria meningitidis)、緑膿菌(Pseudomonas aeruginosa)、リケッチア・リケッチイ(Rickettsia rickettsii)、チフス菌(Salmonella typhi)、ネズミチフス菌(Salmonella typhimurium)、赤痢菌(Shigella sonnei)、表皮ブドウ球菌(Staphylococcus epidermidis)、スタフィロコッカス・サプロフィチカス(Staphylococcus saprophyticus)、ストレプトコッカス・アガラクティエ(Streptococcus agalactiae)、ミュータンス菌(Streptococcus mutans)、肺炎レンサ球菌(Streptococcus pneumonia)、化膿レンサ球菌(Streptococcus pyogenes)、梅毒トレポネマ(Treponema pallidum)、コレラ菌(Vibrio cholera)、ビブリオ・ハーベイ(Vibrio harveyi)及びペスト菌(Yersinia pestis)から選択されることを特徴とする組成物。
- 請求項163に記載の組成物において、前記細菌が、大腸菌(Escherichia coli)(E.coli)であることを特徴とする組成物。
- 請求項163に記載の組成物において、前記細菌が、緑膿菌(P.aeruginosa)であることを特徴とする組成物。
- 請求項111〜165のいずれか一項に記載の組成物を含むことを特徴とする防汚製剤。
- 請求項111〜165のいずれか一項に記載の組成物を含むことを特徴とする抗微生物製剤。
- 請求項111〜165のいずれか一項に記載の組成物を含むことを特徴とする抗菌製剤。
- 請求項1〜168のいずれか一項に記載の組成物と使用説明書とを含むことを特徴とするキット。
- 請求項111〜165のいずれか一項に記載の組成物の使用において、防汚製剤又は抗微生物製剤又は抗菌製剤の製造を目的とすることを特徴とする使用。
- 複数の化合物の膜又はコートを表面領域上に形成する方法において、前記化合物は、各々少なくとも1つの防汚部分と少なくとも1つの表面吸着部分とを含み、ここで、前記少なくとも1つの防汚部分が、フッ素(−F)及び少なくとも1個のフッ素原子を含有する基から選択され、且つ前記少なくとも1つの表面吸着部分が、3,4−ジヒドロキシ−L−フェニルアラニン(DOPA)及びDOPA含有基から選択され、前記方法が、前記表面領域を前記化合物と接触させるステップ、及び前記表面領域上でのその自己組織化を可能にするステップを含むことを特徴とする方法。
- 請求項171に記載の方法において、前記表面領域が、装置又は物品のものであることを特徴とする方法。
- 請求項171に記載の方法において、前記化合物が、製剤として提供されることを特徴とする方法。
- 請求項171に記載の方法において、前記膜又はコートが、防汚、抗微生物及び抗菌性から選択される特性を有することを特徴とする方法。
- 少なくとも1種の微生物を死滅させる方法において、前記微生物又は微生物の環境を請求項1に記載の少なくとも1つの化合物又は請求項111に記載の少なくとも1つの組成物と接触させることを特徴とする方法。
- 請求項175に記載の方法において、前記微生物が、細菌、珪藻、ヒドロイド、藻類、コケムシ、原生動物、マボヤ、チューブワーム、タイワンシジミ、ゼブラ貝及びフジツボから選択されることを特徴とする方法。
- 請求項176に記載の方法において、前記生物が、細菌であることを特徴とする方法。
- 請求項177に記載の方法において、前記細菌が、以下:百日咳菌(Bordetella pertussis)、ボレリア・ブルグドルフェリ(Borrelia burgdorferi)、ブルセラ・アボルタス(Brucella abortus)、ブルセラ・カニス(Brucella canis)、ブルセラ・メリテンシス(Brucella melitensis)、ブルセラ・スイス(Brucella suis)、カンピロバクター・ジェジュニ(Campylobacter jejuni)、肺炎クラミジア(Chlamydia pneumonia)、オウム病クラミジア(Chlamydia psittaci)、トラコーマ・クラミジア(Chlamydia trachomatis)、ボツリヌス菌(Clostridium botulinum)、クロストリジウム・ディフィシル(Clostridium difficile)、ウェルシュ菌(Clostridium perfringens)、破傷風菌(Clostridium tetani)、ジフテリア菌(Corynebacterium diphtheria)、エンテロコッカス・フェカリス(Enterococcus faecalis)、エンテロコッカス・フェシウム(Enterococcus faecium)、大腸菌(Escherichia coli)(E.coli)、毒素原性大腸菌(Enterotoxigenic Escherichia coli)(ETEC)、腸管病原性大腸菌(Enteropathogenic E.coli)、野兎病菌(Francisella tularensis)、インフルエンザ菌(Haemophilus influenza)、ヘリコバクター・ピロリ(Helicobacter pylori)、レジオネラ・ニューモフィラ(Legionella pneumophila)、レプトスピラ・インターロガンス(Leptospira interrogans)、リステリア・モノサイトゲネス(Listeria monocytogenes)、らい菌(Mycobacterium leprae)、結核菌(Mycobacterium tuberculosis)、肺炎マイコプラズマ(Mycoplasma pneumonia)、淋菌(Neisseria gonorrhoeae)、髄膜炎菌(Neisseria meningitidis)、緑膿菌(Pseudomonas aeruginosa)、リケッチア・リケッチイ(Rickettsia rickettsii)、チフス菌(Salmonella typhi)、ネズミチフス菌(Salmonella typhimurium)、赤痢菌(Shigella sonnei)、表皮ブドウ球菌(Staphylococcus epidermidis)、スタフィロコッカス・サプロフィチカス(Staphylococcus saprophyticus)、ストレプトコッカス・アガラクティエ(Streptococcus agalactiae)、ミュータンス菌(Streptococcus mutans)、肺炎レンサ球菌(Streptococcus pneumonia)、化膿レンサ球菌(Streptococcus pyogenes)、梅毒トレポネマ(Treponema pallidum)、コレラ菌(Vibrio cholera)、ビブリオ・ハーベイ(Vibrio harveyi)及びペスト菌(Yersinia pestis)から選択されることを特徴とする方法。
- 請求項178に記載の方法において、前記細菌が、大腸菌(Escherichia coli)(E.coli)であることを特徴とする方法。
- 請求項178に記載の方法において、前記細菌が、緑膿菌(P.aeruginosa)であることを特徴とする方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361758875P | 2013-01-31 | 2013-01-31 | |
| US61/758,875 | 2013-01-31 | ||
| PCT/IL2014/050106 WO2014118779A1 (en) | 2013-01-31 | 2014-01-30 | Antifouling materials |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2016515999A true JP2016515999A (ja) | 2016-06-02 |
| JP2016515999A5 JP2016515999A5 (ja) | 2017-11-02 |
Family
ID=50156824
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015555850A Pending JP2016515999A (ja) | 2013-01-31 | 2014-01-30 | 防汚物質 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US9631100B2 (ja) |
| EP (1) | EP2951195B1 (ja) |
| JP (1) | JP2016515999A (ja) |
| KR (1) | KR20150139828A (ja) |
| CN (1) | CN105143245B (ja) |
| CA (1) | CA2899384A1 (ja) |
| WO (1) | WO2014118779A1 (ja) |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101801521B (zh) | 2007-05-14 | 2015-06-17 | 纽约州立大学研究基金会 | 生物膜中细菌细胞内的生理学分散响应诱导 |
| US20170044097A1 (en) * | 2015-08-14 | 2017-02-16 | Indiana University Research And Technology Corporation | Antibacterials and/or modulators of biofilm formation and methods of using the same |
| WO2017042805A1 (en) | 2015-09-08 | 2017-03-16 | Yissum Research Development Company Of The Hebrew University Of Jerusalem Ltd | Novel compounds with dual activity |
| WO2017072759A1 (en) | 2015-10-26 | 2017-05-04 | Yissum Research Development Company Of The Hebrew University Of Jerusalem Ltd | Capsules and particles and uses thereof |
| CN109346235A (zh) * | 2016-03-20 | 2019-02-15 | 李忠波 | 一种输电用防霉防菌抗腐蚀电缆 |
| CN111669969B (zh) * | 2018-02-01 | 2022-02-25 | Agc株式会社 | 基材及共聚物 |
| US11541105B2 (en) | 2018-06-01 | 2023-01-03 | The Research Foundation For The State University Of New York | Compositions and methods for disrupting biofilm formation and maintenance |
| EP4326064A1 (en) | 2021-04-21 | 2024-02-28 | Yissum Research Development Company of the Hebrew University of Jerusalem Ltd. | Active polymeric films and polymeric compositions |
| WO2022229951A1 (en) * | 2021-04-26 | 2022-11-03 | Yissum Research Development Company Of The Hebrew University Of Jerusalem Ltd. | Antimicrobial agents and films made therefrom |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2007527871A (ja) * | 2004-02-27 | 2007-10-04 | ノースウエスタン ユニバーシティ | 重合化合物及び関連した使用方法 |
| WO2011122392A1 (ja) * | 2010-03-31 | 2011-10-06 | Dic株式会社 | 含フッ素スチレン化合物及びそれを用いた活性エネルギー線硬化性組成物 |
Family Cites Families (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7618937B2 (en) * | 2001-07-20 | 2009-11-17 | Northwestern University | Peptidomimetic polymers for antifouling surfaces |
| US7447039B2 (en) | 2006-10-17 | 2008-11-04 | Hon Hai Precision Industry Co., Ltd. | Motherboard configured to minimize or prevent damage to a chip thereon |
| WO2008089032A1 (en) * | 2007-01-11 | 2008-07-24 | Northwestern University | Fouling resistant coatings and methods of making same |
-
2014
- 2014-01-30 EP EP14706129.5A patent/EP2951195B1/en active Active
- 2014-01-30 CA CA2899384A patent/CA2899384A1/en not_active Abandoned
- 2014-01-30 WO PCT/IL2014/050106 patent/WO2014118779A1/en active Application Filing
- 2014-01-30 US US14/764,765 patent/US9631100B2/en active Active
- 2014-01-30 JP JP2015555850A patent/JP2016515999A/ja active Pending
- 2014-01-30 CN CN201480019858.0A patent/CN105143245B/zh active Active
- 2014-01-30 KR KR1020157022875A patent/KR20150139828A/ko not_active Application Discontinuation
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2007527871A (ja) * | 2004-02-27 | 2007-10-04 | ノースウエスタン ユニバーシティ | 重合化合物及び関連した使用方法 |
| WO2011122392A1 (ja) * | 2010-03-31 | 2011-10-06 | Dic株式会社 | 含フッ素スチレン化合物及びそれを用いた活性エネルギー線硬化性組成物 |
Non-Patent Citations (1)
| Title |
|---|
| ANGEW. CHEM. INT. ED., vol. 42, JPN6017048256, 2003, pages 4238 - 4241, ISSN: 0003702913 * |
Also Published As
| Publication number | Publication date |
|---|---|
| CA2899384A1 (en) | 2014-08-07 |
| KR20150139828A (ko) | 2015-12-14 |
| CN105143245A (zh) | 2015-12-09 |
| CN105143245B (zh) | 2021-02-05 |
| EP2951195B1 (en) | 2020-02-19 |
| US9631100B2 (en) | 2017-04-25 |
| US20150368480A1 (en) | 2015-12-24 |
| EP2951195A1 (en) | 2015-12-09 |
| WO2014118779A1 (en) | 2014-08-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP2951195B1 (en) | Antifouling materials | |
| US20180079912A1 (en) | Antifouling materials | |
| EP3594223B1 (en) | Treatment of biofilms | |
| US7618937B2 (en) | Peptidomimetic polymers for antifouling surfaces | |
| US10676509B2 (en) | Surface-immobilized antimicrobial peptoids | |
| US20210107939A1 (en) | Antimicrobial compounds | |
| Beyer et al. | Zwitterionic peptides reduce accumulation of marine and freshwater biofilm formers | |
| EP3347369B1 (en) | Novel compounds with dual activity | |
| EP4329492A1 (en) | Antimicrobial agents and films made therefrom | |
| Dolid et al. | The effect of end‐group substitution on surface self‐assembly of peptides | |
| Dalsin et al. | Versatile mussel adhesive-inspired biomimetic antifouling polymers | |
| CN117897456A (zh) | 具有抗微生物肽的聚合防污涂层 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170127 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20170127 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170922 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20171219 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20180306 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180516 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20180904 |