JP2016508769A - 医用画像処理 - Google Patents
医用画像処理 Download PDFInfo
- Publication number
- JP2016508769A JP2016508769A JP2015554281A JP2015554281A JP2016508769A JP 2016508769 A JP2016508769 A JP 2016508769A JP 2015554281 A JP2015554281 A JP 2015554281A JP 2015554281 A JP2015554281 A JP 2015554281A JP 2016508769 A JP2016508769 A JP 2016508769A
- Authority
- JP
- Japan
- Prior art keywords
- image
- signature
- signatures
- samples
- sample
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 238000012545 processing Methods 0.000 title claims abstract description 97
- 230000004044 response Effects 0.000 claims abstract description 23
- 241001465754 Metazoa Species 0.000 claims abstract description 13
- 238000002591 computed tomography Methods 0.000 claims abstract description 8
- 238000000034 method Methods 0.000 claims description 30
- 238000002595 magnetic resonance imaging Methods 0.000 claims description 24
- 238000004891 communication Methods 0.000 claims description 16
- 238000002600 positron emission tomography Methods 0.000 claims description 7
- 238000002604 ultrasonography Methods 0.000 claims description 5
- 230000008859 change Effects 0.000 claims description 4
- 238000002603 single-photon emission computed tomography Methods 0.000 claims description 4
- 238000004590 computer program Methods 0.000 claims 2
- 239000000523 sample Substances 0.000 description 71
- 238000013459 approach Methods 0.000 description 55
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 31
- 238000001514 detection method Methods 0.000 description 24
- 238000003745 diagnosis Methods 0.000 description 23
- 201000010099 disease Diseases 0.000 description 23
- 230000008569 process Effects 0.000 description 21
- 239000013598 vector Substances 0.000 description 21
- 108010064539 amyloid beta-protein (1-42) Proteins 0.000 description 20
- 238000009826 distribution Methods 0.000 description 18
- 208000024827 Alzheimer disease Diseases 0.000 description 15
- 230000006870 function Effects 0.000 description 11
- 206010028980 Neoplasm Diseases 0.000 description 10
- 238000002059 diagnostic imaging Methods 0.000 description 9
- 210000001519 tissue Anatomy 0.000 description 9
- 230000000007 visual effect Effects 0.000 description 9
- 210000001175 cerebrospinal fluid Anatomy 0.000 description 8
- 230000008021 deposition Effects 0.000 description 8
- 208000035475 disorder Diseases 0.000 description 8
- 206010003694 Atrophy Diseases 0.000 description 6
- 238000004458 analytical method Methods 0.000 description 6
- 230000037444 atrophy Effects 0.000 description 6
- 210000000056 organ Anatomy 0.000 description 6
- 238000011282 treatment Methods 0.000 description 6
- 238000003384 imaging method Methods 0.000 description 5
- 230000002159 abnormal effect Effects 0.000 description 4
- 210000004556 brain Anatomy 0.000 description 4
- 210000004027 cell Anatomy 0.000 description 4
- 238000000338 in vitro Methods 0.000 description 4
- 238000001727 in vivo Methods 0.000 description 4
- 208000035977 Rare disease Diseases 0.000 description 3
- 230000005856 abnormality Effects 0.000 description 3
- 239000002131 composite material Substances 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 230000006872 improvement Effects 0.000 description 3
- 230000001575 pathological effect Effects 0.000 description 3
- 239000000700 radioactive tracer Substances 0.000 description 3
- 230000011218 segmentation Effects 0.000 description 3
- 238000003860 storage Methods 0.000 description 3
- 238000012360 testing method Methods 0.000 description 3
- 108010090849 Amyloid beta-Peptides Proteins 0.000 description 2
- 102000013455 Amyloid beta-Peptides Human genes 0.000 description 2
- 208000003174 Brain Neoplasms Diseases 0.000 description 2
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 2
- 238000005481 NMR spectroscopy Methods 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 210000005013 brain tissue Anatomy 0.000 description 2
- 201000011510 cancer Diseases 0.000 description 2
- 239000000284 extract Substances 0.000 description 2
- 230000004770 neurodegeneration Effects 0.000 description 2
- 208000015122 neurodegenerative disease Diseases 0.000 description 2
- 230000005855 radiation Effects 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 238000010186 staining Methods 0.000 description 2
- 238000010561 standard procedure Methods 0.000 description 2
- 210000003478 temporal lobe Anatomy 0.000 description 2
- 238000010176 18-FDG-positron emission tomography Methods 0.000 description 1
- ZCXUVYAZINUVJD-AHXZWLDOSA-N 2-deoxy-2-((18)F)fluoro-alpha-D-glucose Chemical compound OC[C@H]1O[C@H](O)[C@H]([18F])[C@@H](O)[C@@H]1O ZCXUVYAZINUVJD-AHXZWLDOSA-N 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 208000014644 Brain disease Diseases 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- 208000019736 Cranial nerve disease Diseases 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 206010061296 Motor dysfunction Diseases 0.000 description 1
- 230000006978 adaptation Effects 0.000 description 1
- 230000006933 amyloid-beta aggregation Effects 0.000 description 1
- 210000001557 animal structure Anatomy 0.000 description 1
- 230000002547 anomalous effect Effects 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 238000009395 breeding Methods 0.000 description 1
- 230000001488 breeding effect Effects 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- OKTJSMMVPCPJKN-BJUDXGSMSA-N carbon-11 Chemical compound [11C] OKTJSMMVPCPJKN-BJUDXGSMSA-N 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 230000006835 compression Effects 0.000 description 1
- 238000007906 compression Methods 0.000 description 1
- 239000002872 contrast media Substances 0.000 description 1
- 208000014826 cranial nerve neuropathy Diseases 0.000 description 1
- 235000013365 dairy product Nutrition 0.000 description 1
- 230000001934 delay Effects 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 230000000971 hippocampal effect Effects 0.000 description 1
- 210000001320 hippocampus Anatomy 0.000 description 1
- 238000007689 inspection Methods 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- 230000001788 irregular Effects 0.000 description 1
- 239000006101 laboratory sample Substances 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000000203 mixture Substances 0.000 description 1
- 230000007659 motor function Effects 0.000 description 1
- 230000002981 neuropathic effect Effects 0.000 description 1
- 238000005457 optimization Methods 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- 238000001454 recorded image Methods 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 230000001953 sensory effect Effects 0.000 description 1
- 230000026676 system process Effects 0.000 description 1
- 230000002123 temporal effect Effects 0.000 description 1
- 238000012549 training Methods 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 230000002861 ventricular Effects 0.000 description 1
- 210000001835 viscera Anatomy 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06T—IMAGE DATA PROCESSING OR GENERATION, IN GENERAL
- G06T7/00—Image analysis
- G06T7/0002—Inspection of images, e.g. flaw detection
- G06T7/0012—Biomedical image inspection
- G06T7/0014—Biomedical image inspection using an image reference approach
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06T—IMAGE DATA PROCESSING OR GENERATION, IN GENERAL
- G06T7/00—Image analysis
-
- G—PHYSICS
- G16—INFORMATION AND COMMUNICATION TECHNOLOGY [ICT] SPECIALLY ADAPTED FOR SPECIFIC APPLICATION FIELDS
- G16H—HEALTHCARE INFORMATICS, i.e. INFORMATION AND COMMUNICATION TECHNOLOGY [ICT] SPECIALLY ADAPTED FOR THE HANDLING OR PROCESSING OF MEDICAL OR HEALTHCARE DATA
- G16H30/00—ICT specially adapted for the handling or processing of medical images
- G16H30/40—ICT specially adapted for the handling or processing of medical images for processing medical images, e.g. editing
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06T—IMAGE DATA PROCESSING OR GENERATION, IN GENERAL
- G06T2207/00—Indexing scheme for image analysis or image enhancement
- G06T2207/10—Image acquisition modality
- G06T2207/10072—Tomographic images
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06T—IMAGE DATA PROCESSING OR GENERATION, IN GENERAL
- G06T2207/00—Indexing scheme for image analysis or image enhancement
- G06T2207/10—Image acquisition modality
- G06T2207/10072—Tomographic images
- G06T2207/10088—Magnetic resonance imaging [MRI]
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06T—IMAGE DATA PROCESSING OR GENERATION, IN GENERAL
- G06T2207/00—Indexing scheme for image analysis or image enhancement
- G06T2207/10—Image acquisition modality
- G06T2207/10116—X-ray image
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06T—IMAGE DATA PROCESSING OR GENERATION, IN GENERAL
- G06T2207/00—Indexing scheme for image analysis or image enhancement
- G06T2207/10—Image acquisition modality
- G06T2207/10132—Ultrasound image
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06T—IMAGE DATA PROCESSING OR GENERATION, IN GENERAL
- G06T2207/00—Indexing scheme for image analysis or image enhancement
- G06T2207/30—Subject of image; Context of image processing
- G06T2207/30004—Biomedical image processing
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06T—IMAGE DATA PROCESSING OR GENERATION, IN GENERAL
- G06T2207/00—Indexing scheme for image analysis or image enhancement
- G06T2207/30—Subject of image; Context of image processing
- G06T2207/30196—Human being; Person
Landscapes
- Engineering & Computer Science (AREA)
- Health & Medical Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Medical Informatics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Radiology & Medical Imaging (AREA)
- Physics & Mathematics (AREA)
- Computer Vision & Pattern Recognition (AREA)
- General Physics & Mathematics (AREA)
- Theoretical Computer Science (AREA)
- Quality & Reliability (AREA)
- Epidemiology (AREA)
- Primary Health Care (AREA)
- Public Health (AREA)
- Measuring And Recording Apparatus For Diagnosis (AREA)
- Magnetic Resonance Imaging Apparatus (AREA)
- Image Processing (AREA)
- Image Analysis (AREA)
- Apparatus For Radiation Diagnosis (AREA)
Abstract
Description
Claims (25)
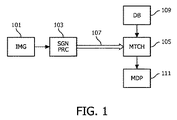
- 画像処理のための装置であって、
人若しくは動物の体の一部の特徴をあらわす第一の画像を受信するための受信器と、
前記第一の画像からシグネチャの画像関連セットを決定するシグネチャユニットと、
各サンプルがシグネチャのサンプル関連セットと医用データを有する、サンプルのセットを保存するためのサンプルストアと、
前記サンプルのセットの前記シグネチャのサンプル関連セットへの前記シグネチャの画像関連セットの比較に応じて前記サンプルのセットからマッチングサンプルのセットを決定するためのマッチングユニットと、
前記マッチングサンプルのセットのサンプルに含まれる医用データに応じて前記第一の画像に対する医用データを決定するように構成される決定ユニットとを有する、装置。 - 前記シグネチャの画像関連セットの少なくとも一部のシグネチャが局所画像情報をあらわす局所シグネチャである、請求項1に記載の装置。
- 前記シグネチャユニットが前記第一の画像を複数の画像セグメントに分割するように構成され、前記シグネチャユニットが、各々が前記画像セグメントに対する局所シグネチャを決定するために前記画像セグメントのサブセットを処理するように構成される複数の処理素子を持つ並列プロセッサを有する、請求項2に記載の装置。
- 前記画像セグメントへの分割が前記第一の画像の画像特性に依存しない、請求項3に記載の装置。
- 前記シグネチャユニットがさらに前記第一の画像の画像特性に応じて前記画像セグメントに対する画像セグメントサイズを決定するように構成される、請求項3に記載の装置。
- 前記マッチングユニットが、各々が前記局所シグネチャの画像関連セットの少なくとも一つのシグネチャを前記シグネチャのサンプル関連セットの少なくとも一つのシグネチャに比較するように構成される複数の並列処理素子を持つ並列プロセッサを有する、請求項1に記載の装置。
- 前記シグネチャユニットが第一の処理ユニットにおいて実装され、前記マッチングユニットが帯域幅制限通信リンクを介して前記第一のプロセッサに結合される個別の第二の処理ユニットにおいて実装される、請求項6に記載の装置。
- 前記シグネチャユニットが、各局所シグネチャが局所画像情報をあらわす複数の局所シグネチャを生成し、複数の局所シグネチャから前記シグネチャの画像関連セットの少なくとも一つのシグネチャを生成するように構成される、請求項1に記載の装置。
- 前記少なくとも一つのシグネチャが前記複数の局所シグネチャに対する統計的尺度をあらわす、請求項8に記載の装置。
- 前記少なくとも一つのシグネチャが少なくとも二つの局所シグネチャの相関測度をあらわす、請求項8に記載の装置。
- 前記第一の画像において少なくとも一つの画像オブジェクトを検出するための画像オブジェクト検出器をさらに有し、
前記シグネチャユニットが前記画像オブジェクトの特性に応じて前記シグネチャの画像関連セットの少なくとも一つのシグネチャを決定するように構成される、請求項1に記載の装置。 - 前記少なくとも一つの画像オブジェクトの特性が、
前記少なくとも一つの画像オブジェクトのオブジェクト境界特性、
前記少なくとも一つの画像オブジェクトの面積、
前記少なくとも一つの画像オブジェクトの体積、
前記少なくとも一つの画像オブジェクトのポーズ、
前記少なくとも一つの画像オブジェクトの位置、
前記少なくとも一つの画像オブジェクトの配向、
前記少なくとも一つの画像オブジェクトの輝度特性、
前記少なくとも一つの画像オブジェクトの色度特性、
前記少なくとも一つの画像オブジェクトのテクスチャ特性、
のうちの少なくとも一つである、請求項11に記載の装置。 - 前記少なくとも一つのシグネチャが第一の画像オブジェクトのモーメントに応じて決定される、請求項11に記載の装置。
- 前記シグネチャユニットが基準への前記特性の比較に応じて前記シグネチャの画像関連セットの少なくとも一つのシグネチャを決定するように構成される、請求項11に記載の装置。
- 前記シグネチャユニットが複数の画像オブジェクトの基準特性に対する画像特性の統計的偏差に応じて少なくとも一つのシグネチャを決定するように構成される、請求項14に記載の装置。
- ユーザ入力を受信するためのユーザインターフェースをさらに有し、前記シグネチャユニットが前記ユーザ入力に応じて前記シグネチャの画像関連セットの少なくとも一つのシグネチャを決定するように構成される、請求項1に記載の装置。
- 少なくとも一部のサンプルに対する前記シグネチャのサンプル関連セットのシグネチャが人若しくは動物の体の一部の関連画像の画像特性をあらわす、請求項1に記載の装置。
- 前記第一の画像が、
磁気共鳴イメージング画像、
コンピュータ断層撮影画像、
陽電子放射断層撮影画像、
単光子放射コンピュータ断層撮影画像、
超音波画像、
x線画像、
デジタル病理組織画像、
のうちの少なくとも一つである、請求項1に記載の装置。 - 前記シグネチャの画像関連セットの少なくとも一つのシグネチャが、前記画像の特性のウェーブレット表現を提供する、請求項1に記載の装置。
- 前記シグネチャユニットが基準を満たす画像オブジェクトを検出するように構成され、前記シグネチャの画像関連セットの少なくとも一つのシグネチャが前記基準を満たす画像オブジェクトの局所密度変化に応じて生成される、請求項1に記載の装置。
- 前記シグネチャの画像関連セットに応じて前記サンプルのセットを修正するための更新プロセッサをさらに有する、請求項1に記載の装置。
- 前記第一の画像が三次元画像である、請求項1に記載の装置。
- 前記シグネチャユニットと前記マッチングユニットが通信ネットワークを介して結合される、請求項1に記載の装置。
- 画像処理雄の方法であって、
人若しくは動物の体の一部の特徴をあらわす第一の画像を受信するステップと、
前記第一の画像からシグネチャの画像関連セットを決定するステップと、
各サンプルがシグネチャのサンプル関連セットと医用データを有する、サンプルのセットを提供するステップと、
前記サンプルのセットの前記シグネチャのサンプル関連セットへの前記シグネチャの画像関連セットの比較に応じて、前記サンプルのセットからマッチングサンプルのセットを決定するステップと、
前記マッチングサンプルのセットに関連する医用データに応じて前記第一の画像に対する医用データを決定するステップとを有する、方法。 - コンピュータ上で実行されるときに請求項24に記載の全ステップを実行するように構成されるコンピュータプログラムコード手段を有するコンピュータプログラム製品。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361757289P | 2013-01-28 | 2013-01-28 | |
| US61/757,289 | 2013-01-28 | ||
| PCT/IB2014/058321 WO2014115065A1 (en) | 2013-01-28 | 2014-01-16 | Medical image processing |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2016508769A true JP2016508769A (ja) | 2016-03-24 |
| JP2016508769A5 JP2016508769A5 (ja) | 2017-02-16 |
Family
ID=50114442
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015554281A Pending JP2016508769A (ja) | 2013-01-28 | 2014-01-16 | 医用画像処理 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US20150356733A1 (ja) |
| EP (1) | EP2948925A1 (ja) |
| JP (1) | JP2016508769A (ja) |
| CN (1) | CN104956399A (ja) |
| BR (1) | BR112015017602A2 (ja) |
| RU (1) | RU2681280C2 (ja) |
| WO (1) | WO2014115065A1 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN111094977A (zh) * | 2017-07-13 | 2020-05-01 | 古斯塔夫·鲁西研究所 | 监测抗pd-1/pd-l1治疗的肿瘤患者中肿瘤淋巴细胞浸润和预后的基于影像组学的成像工具 |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20160306936A1 (en) * | 2015-04-15 | 2016-10-20 | Canon Kabushiki Kaisha | Diagnosis support system, information processing method, and program |
| CN106798574A (zh) * | 2017-03-03 | 2017-06-06 | 伏冰 | 一种超声诊断系统 |
| JP7370865B2 (ja) * | 2017-05-05 | 2023-10-30 | コーニンクレッカ フィリップス エヌ ヴェ | 画像読影環境において所見ベースの関連する臨床的コンテキストを提供する動的システム |
| FR3076923A1 (fr) * | 2018-01-16 | 2019-07-19 | Stmicroelectronics (Rousset) Sas | Procede et circuit d'authentification |
| CN110322436B (zh) * | 2019-06-19 | 2020-10-02 | 广州金域医学检验中心有限公司 | 医学图像处理方法、装置、存储介质及设备 |
| FR3098949B1 (fr) | 2019-07-15 | 2023-10-06 | St Microelectronics Rousset | Fonction à sens unique |
| RU2757707C2 (ru) * | 2019-09-06 | 2021-10-20 | федеральное государственное автономное образовательное учреждение высшего образования "Южный федеральный университет" | Способ компьютерной диагностики деформаций суставов конечностей человека на цифровых медицинских рентгенографических изображениях |
| US11200671B2 (en) * | 2019-12-31 | 2021-12-14 | International Business Machines Corporation | Reference image guided object detection in medical image processing |
| WO2022047584A1 (en) * | 2020-09-03 | 2022-03-10 | Huron Technologies International Inc. | Systems and methods for automatically managing image data |
Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2004272357A (ja) * | 2003-03-05 | 2004-09-30 | Seiko Epson Corp | 画像認識結果提示装置、画像認識結果表示方法、画像認識結果提示プログラムおよび記録媒体 |
| JP2005199040A (ja) * | 2003-11-19 | 2005-07-28 | Ge Medical Systems Global Technology Co Llc | 病気の発見に役立つ画像データの処理方法及び装置 |
| JP2007157046A (ja) * | 2005-12-08 | 2007-06-21 | Nippon Telegr & Teleph Corp <Ntt> | コンテンツ特徴量登録方法及びコンテンツ検索方法及び装置及びプログラム |
| JP2008523876A (ja) * | 2004-12-17 | 2008-07-10 | コーニンクレッカ フィリップス エレクトロニクス エヌ ヴィ | 医療用診断イメージングにおいて医療的に有意味の記述を生成するための高性能分類器を自動的に確立するための方法及び装置 |
| US20080243395A1 (en) * | 2007-03-30 | 2008-10-02 | Fujifilm Corporation | Image diagnosis supporting apparatus and system |
| JP2010082001A (ja) * | 2008-09-29 | 2010-04-15 | Toshiba Corp | 画像表示装置 |
| JP2012203823A (ja) * | 2011-03-28 | 2012-10-22 | Kddi Corp | 画像認識装置 |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| NL1019368C2 (nl) * | 2001-11-14 | 2003-05-20 | Nutricia Nv | Preparaat voor het verbeteren van receptorwerking. |
| JP4188900B2 (ja) * | 2004-11-15 | 2008-12-03 | ザイオソフト株式会社 | 医療画像処理プログラム |
| US7736313B2 (en) * | 2004-11-22 | 2010-06-15 | Carestream Health, Inc. | Detecting and classifying lesions in ultrasound images |
| US8488857B2 (en) * | 2007-03-06 | 2013-07-16 | Koninklijke Philips Electronics N.V. | Automated diagnosis and alignment supplemented with positron emission tomography (PET) and magnetic resonance (MR) flow estimation |
| US20110172553A1 (en) * | 2007-12-18 | 2011-07-14 | New York University | QEEG Statistical Low Resolution Tomographic Analysis |
| US8388529B2 (en) * | 2008-07-08 | 2013-03-05 | International Business Machines Corporation | Differential diagnosis of neuropsychiatric conditions |
| EP2355703B1 (en) * | 2008-11-07 | 2018-05-30 | Department of Biotechnology | Automated classification technique for alzheimer's disease using magnetic resonance imaging signal from ventricular zone contour of brain |
| US9454823B2 (en) * | 2010-07-28 | 2016-09-27 | arian Medical Systems, Inc. | Knowledge-based automatic image segmentation |
-
2014
- 2014-01-16 CN CN201480006318.9A patent/CN104956399A/zh active Pending
- 2014-01-16 BR BR112015017602A patent/BR112015017602A2/pt not_active Application Discontinuation
- 2014-01-16 JP JP2015554281A patent/JP2016508769A/ja active Pending
- 2014-01-16 RU RU2015136525A patent/RU2681280C2/ru not_active IP Right Cessation
- 2014-01-16 EP EP14704903.5A patent/EP2948925A1/en not_active Withdrawn
- 2014-01-16 WO PCT/IB2014/058321 patent/WO2014115065A1/en active Application Filing
-
2015
- 2015-01-16 US US14/762,908 patent/US20150356733A1/en not_active Abandoned
Patent Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2004272357A (ja) * | 2003-03-05 | 2004-09-30 | Seiko Epson Corp | 画像認識結果提示装置、画像認識結果表示方法、画像認識結果提示プログラムおよび記録媒体 |
| JP2005199040A (ja) * | 2003-11-19 | 2005-07-28 | Ge Medical Systems Global Technology Co Llc | 病気の発見に役立つ画像データの処理方法及び装置 |
| JP2008523876A (ja) * | 2004-12-17 | 2008-07-10 | コーニンクレッカ フィリップス エレクトロニクス エヌ ヴィ | 医療用診断イメージングにおいて医療的に有意味の記述を生成するための高性能分類器を自動的に確立するための方法及び装置 |
| JP2007157046A (ja) * | 2005-12-08 | 2007-06-21 | Nippon Telegr & Teleph Corp <Ntt> | コンテンツ特徴量登録方法及びコンテンツ検索方法及び装置及びプログラム |
| US20080243395A1 (en) * | 2007-03-30 | 2008-10-02 | Fujifilm Corporation | Image diagnosis supporting apparatus and system |
| JP2010082001A (ja) * | 2008-09-29 | 2010-04-15 | Toshiba Corp | 画像表示装置 |
| JP2012203823A (ja) * | 2011-03-28 | 2012-10-22 | Kddi Corp | 画像認識装置 |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN111094977A (zh) * | 2017-07-13 | 2020-05-01 | 古斯塔夫·鲁西研究所 | 监测抗pd-1/pd-l1治疗的肿瘤患者中肿瘤淋巴细胞浸润和预后的基于影像组学的成像工具 |
| JP2020526844A (ja) * | 2017-07-13 | 2020-08-31 | アンスティテュ・ギュスターヴ・ルシー | 抗pd−1/pd−l1によって処置されたがん患者における腫瘍リンパ球浸潤及び転帰を監視するためのラジオミクスに基づくイメージングツール |
| CN111094977B (zh) * | 2017-07-13 | 2024-02-13 | 古斯塔夫·鲁西研究所 | 监测抗pd-1/pd-l1治疗的肿瘤患者中肿瘤淋巴细胞浸润和预后的基于影像组学的成像工具 |
Also Published As
| Publication number | Publication date |
|---|---|
| RU2681280C2 (ru) | 2019-03-05 |
| CN104956399A (zh) | 2015-09-30 |
| EP2948925A1 (en) | 2015-12-02 |
| BR112015017602A2 (pt) | 2017-07-11 |
| US20150356733A1 (en) | 2015-12-10 |
| WO2014115065A1 (en) | 2014-07-31 |
| RU2015136525A (ru) | 2017-03-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2681280C2 (ru) | Процесс обработки медицинских изображений | |
| US10383592B2 (en) | Apparatus and method for aiding imaging diagnosis | |
| Zhou et al. | Enhancing magnetic resonance imaging-driven Alzheimer’s disease classification performance using generative adversarial learning | |
| CN113711271A (zh) | 用于通过正电子发射断层摄影进行肿瘤分割的深度卷积神经网络 | |
| Pachauri et al. | Topology-based kernels with application to inference problems in Alzheimer's disease | |
| US9361686B2 (en) | Method and apparatus for the assessment of medical images | |
| US20080021301A1 (en) | Methods and Apparatus for Volume Computer Assisted Reading Management and Review | |
| Liu | Symmetry and asymmetry analysis and its implications to computer-aided diagnosis: A review of the literature | |
| WO2010115885A1 (en) | Predictive classifier score for cancer patient outcome | |
| US11151722B2 (en) | System and method for estimating synthetic quantitative health values from medical images | |
| EP2747658B1 (en) | Method to compute and present brain amyloid in gray matter | |
| US9147242B2 (en) | Processing system for medical scan images | |
| CN112529834A (zh) | 病理图像模式在3d图像数据中的空间分布 | |
| WO2013086026A1 (en) | System and method of automatically detecting tissue abnormalities | |
| Moser et al. | Automated fetal brain extraction from clinical ultrasound volumes using 3D convolutional neural networks | |
| US20110194741A1 (en) | Brain ventricle analysis | |
| Seo et al. | Visualizing Alzheimer's disease progression in low dimensional manifolds | |
| US11416994B2 (en) | Method and system for detecting chest x-ray thoracic diseases utilizing multi-view multi-scale learning | |
| Jiang et al. | Deep-learning-based segmentation and localization of white matter hyperintensities on magnetic resonance images | |
| Delmoral et al. | Segmentation of pathological liver tissue with dilated fully convolutional networks: A preliminary study | |
| WO2019190641A1 (en) | System and method for evaluation of dynamic data | |
| Goceri et al. | Computer-based segmentation, change detection and quantification for lesions in multiple sclerosis | |
| Mihaylova et al. | A brief survey of spleen segmentation in MRI and CT images | |
| JP2023511663A (ja) | 弱教師あり病変セグメンテーション | |
| Abd Hamid et al. | Incorporating attention mechanism in enhancing classification of alzheimer’s disease |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170111 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20170111 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20170214 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20171116 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20171128 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20180227 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180524 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20180918 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20181217 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190304 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20190528 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20191224 |