JP2013145732A - Lithium secondary battery - Google Patents
Lithium secondary battery Download PDFInfo
- Publication number
- JP2013145732A JP2013145732A JP2012026896A JP2012026896A JP2013145732A JP 2013145732 A JP2013145732 A JP 2013145732A JP 2012026896 A JP2012026896 A JP 2012026896A JP 2012026896 A JP2012026896 A JP 2012026896A JP 2013145732 A JP2013145732 A JP 2013145732A
- Authority
- JP
- Japan
- Prior art keywords
- secondary battery
- positive electrode
- negative electrode
- lithium secondary
- electrolyte
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E60/00—Enabling technologies; Technologies with a potential or indirect contribution to GHG emissions mitigation
- Y02E60/10—Energy storage using batteries
Landscapes
- Secondary Cells (AREA)
Abstract
Description
本発明は非水電解液を用いたリチウム二次電池に関する。 The present invention relates to a lithium secondary battery using a non-aqueous electrolyte.
近年、リチウム二次電池は、高エネルギー密度を有するため、移動体通信機器用電源、携帯用情報端末用電源などとして利用され、端末の普及と共にその市場が急速に伸びており、安全性の確保、サイクル特性やエネルギー密度の向上、高温保存特性等の改良を目的として、さまざまな研究がなされている。 In recent years, since lithium secondary batteries have high energy density, they have been used as power sources for mobile communication devices, portable information terminals, etc., and the market has grown rapidly with the spread of terminals, ensuring safety. Various studies have been conducted for the purpose of improving cycle characteristics, energy density, high-temperature storage characteristics, and the like.
上記リチウム二次電池の中でも、非水電解液を用いたリチウムイオン電池の分野においては、ビニレンカーボネートやビニルエチレンカーボネートなどの不飽和結合を有する環状カーボネートを非水電解液に添加することにより、正極/負極上に被膜を形成し、非水電解質中に含まれる電解質などの分解を抑制することによりサイクル特性を改善することが知られている(特許文献1、2)。しかしながら、このような不飽和結合を有する環状カーボネートが負極上に被膜を形成すると電池の内部抵抗(全抵抗のうち、抵抗器として意図的に回路に付加したものや回路中の目に見える配線に由来するものを除いた成分)が上がり、放電初期の電圧降下を引き起こす問題(IRドロップ)があり、改善の余地があった。 Among the lithium secondary batteries, in the field of lithium ion batteries using a non-aqueous electrolyte, a positive electrode is obtained by adding a cyclic carbonate having an unsaturated bond such as vinylene carbonate or vinyl ethylene carbonate to the non-aqueous electrolyte. / It is known to improve cycle characteristics by forming a film on the negative electrode and suppressing decomposition of the electrolyte contained in the non-aqueous electrolyte (Patent Documents 1 and 2). However, when a cyclic carbonate having such an unsaturated bond forms a film on the negative electrode, the internal resistance of the battery (of all the resistances, intentionally added to the circuit as a resistor or visible wiring in the circuit) There was a problem of causing a voltage drop at the initial stage of discharge (IR drop), and there was room for improvement.
本発明は上記の様な事情に着目してなされたものであって、その目的は、高温下でのサイクル特性に優れたリチウム二次電池を提供することにある。 The present invention has been made paying attention to the above-described circumstances, and an object thereof is to provide a lithium secondary battery excellent in cycle characteristics at high temperatures.
本発明者らは、非水電解液中に特定の化合物を用いることにより、正極/負極に適度な被膜が形成できることを見出して、上記課題を達成するリチウム二次電池が提供できることに到達し、本発明を完成するに至った。
すなわち、本発明のリチウム二次電池は、
リチウムイオンを吸蔵・放出可能な正極活物質を含有する正極、リチウムイオンを吸蔵・放出可能な負極活物質を含有する負極、非水電解液を備えたリチウム二次電池であって、
上記非水電解液は、一般式(1);(XSO2)(X’SO2)N−Li+(X、X’は、フッ素原子、炭素数1〜6のアルキル基又は炭素数1〜6のフルオロアルキル基を表し、X、X’の少なくとも一方はフッ素原子である。)で表される化合物、及び溶媒を含み、
正極又は負極の表面の、XPS測定による全原子の存在比を100%としたときのS原子の存在比が0.5%以上であることを特徴とする。
The present inventors have found that by using a specific compound in the non-aqueous electrolyte, an appropriate film can be formed on the positive electrode / negative electrode, and the lithium secondary battery that achieves the above problems can be provided. The present invention has been completed.
That is, the lithium secondary battery of the present invention is
A positive electrode containing a positive electrode active material capable of occluding and releasing lithium ions, a negative electrode containing a negative electrode active material capable of occluding and releasing lithium ions, and a lithium secondary battery comprising a non-aqueous electrolyte,
The non-aqueous electrolyte has the general formula (1); (XSO 2 ) (X′SO 2 ) N — Li + (X and X ′ are a fluorine atom, an alkyl group having 1 to 6 carbon atoms, or 1 to 1 carbon atoms. A fluoroalkyl group of 6, wherein at least one of X and X ′ is a fluorine atom), and a solvent,
The abundance ratio of S atoms is 0.5% or more when the abundance ratio of all atoms on the surface of the positive electrode or the negative electrode is 100% by XPS measurement.
本発明のリチウム二次電池は、高温下でのサイクル特性の向上を達成したものである。本発明のリチウム二次電池により、自動車搭載用(EV、PHEV、HEV)や定置電源用電池などの高温下で使用される分野においても劣化が少なく高い性能を発揮するものと考えられる。 The lithium secondary battery of the present invention achieves improved cycle characteristics at high temperatures. The lithium secondary battery of the present invention is considered to exhibit high performance with little deterioration even in fields used at high temperatures, such as for automobiles (EV, PHEV, HEV) and stationary power supply batteries.
前記課題を解決した本発明のリチウム二次電池とは、
リチウムイオンを吸蔵・放出可能な正極活物質を含有する正極、リチウムイオンを吸蔵・放出可能な負極活物質を含有する負極、非水電解液を備えたリチウム二次電池であって、上記非水電解液は、一般式(1);(XSO2)(X’SO2)N−Li+(X、X’は、フッ素原子、炭素数1〜6のアルキル基又は炭素数1〜6のフルオロアルキル基を表し、X、X’の少なくとも一方はフッ素原子である。)で表される化合物、及び溶媒を含み、
正極又は負極の表面の、XPS測定による全原子の存在比を100%としたときのS原子の存在比が0.5%以上であることを特徴とするリチウム二次電池
であるか、又は、
リチウムイオンを吸蔵・放出可能な正極活物質を含有する正極、リチウムイオンを吸蔵・放出可能な負極活物質を含有する負極、非水電解液を備えたリチウム二次電池であって、
上記非水電解液は、一般式(1);(XSO2)(X’SO2)N−Li+(X、X’は、フッ素原子、炭素数1〜6のアルキル基又は炭素数1〜6のフルオロアルキル基を表し、X、X’の少なくとも一方はフッ素原子である。)で表される化合物、及び溶媒を含み、
正極または負極の表面の、TOF−SIMS測定による正二次イオンのS原子含有フラグメントの規格化値が、2.0×10−4以上であることを特徴とするリチウム二次電池であるところに特徴を有する。
The lithium secondary battery of the present invention that has solved the above problems is
A positive electrode containing a positive electrode active material capable of occluding and releasing lithium ions, a negative electrode containing a negative electrode active material capable of occluding and releasing lithium ions, a lithium secondary battery comprising a non-aqueous electrolyte, The electrolytic solution is represented by the general formula (1); (XSO 2 ) (X′SO 2 ) N — Li + (X and X ′ are fluorine atoms, alkyl groups having 1 to 6 carbon atoms, or fluoro having 1 to 6 carbon atoms) An alkyl group, and at least one of X and X ′ is a fluorine atom.), And a solvent,
The lithium secondary battery is characterized in that the abundance ratio of S atoms on the surface of the positive electrode or negative electrode is 0.5% or more when the abundance ratio of all atoms by XPS measurement is 100%, or
A positive electrode containing a positive electrode active material capable of occluding and releasing lithium ions, a negative electrode containing a negative electrode active material capable of occluding and releasing lithium ions, and a lithium secondary battery comprising a non-aqueous electrolyte,
The non-aqueous electrolyte has the general formula (1); (XSO 2 ) (X′SO 2 ) N — Li + (X and X ′ are a fluorine atom, an alkyl group having 1 to 6 carbon atoms, or 1 to 1 carbon atoms. A fluoroalkyl group of 6, wherein at least one of X and X ′ is a fluorine atom), and a solvent,
The lithium secondary battery is characterized in that the normalized value of the S atom-containing fragment of the positive secondary ion on the surface of the positive electrode or the negative electrode measured by TOF-SIMS is 2.0 × 10 −4 or more. Have
本発明者らは、より高性能なリチウム二次電池を開発すべく検討を重ねていたところ、その非水電解液に、一般式(1)で表される化合物を使用することにより、電極表面に被膜を形成できることを見出し、これにより高温下でのサイクル特性を維持できることを見出し、本発明を完成した。以下、本発明について説明する。 The present inventors have repeatedly studied to develop a higher performance lithium secondary battery. By using a compound represented by the general formula (1) in the non-aqueous electrolyte, the surface of the electrode is obtained. The present inventors have found that a coating film can be formed on the surface, and that it is possible to maintain cycle characteristics at high temperatures, thereby completing the present invention. The present invention will be described below.
<電極表面のS濃度>
本発明のリチウム二次電池は、正極又は負極の表面の、XPS測定による全原子の存在比を100%としたときのS原子の存在比が0.5%以上である。このS原子の存在は、正極又は負極の表面上に後述する一般式(1)で表される化合物による被膜が形成されていることによるものである。好ましくは0.7%以上、より好ましくは1.0%以上である。XPS測定による全原子の存在比を100%としたときのS原子の存在比が0.5%以下であれば、一般式(1)で表わされる化合物によって形成される皮膜が薄く、十分な効果を発揮することができない。
また、S原子のうちS2pに帰属される原子のうち、165eV〜174eVにピークトップを持つ原子の面積をS1、160eV〜165eVにピークトップを持つ原子の面積をS2とした時に、存在する全S原子を100%とした場合にS2の存在割合が5%以上であることがより好ましい。より好ましくは7%以上、さらに好ましくは10%以上である。S2の存在割合が5%以下であれば、一般式(1)で表わされる化合物によって形成される皮膜が薄く、十分な効果を発揮することができない。正極又は負極表面のS原子の存在比は、例えば、下記のように測定することができる。測定までの表面の化学状態変化を抑制するために、セルの解体、電極の洗浄、サンプリング、装置への試料搬送はアルゴンなどの不活性雰囲気内で行うことが好ましい。
<S concentration on electrode surface>
In the lithium secondary battery of the present invention, the abundance ratio of S atoms is 0.5% or more, assuming that the abundance ratio of all atoms on the surface of the positive electrode or negative electrode by XPS measurement is 100%. The presence of this S atom is due to the formation of a film of a compound represented by the general formula (1) described later on the surface of the positive electrode or the negative electrode. Preferably it is 0.7% or more, More preferably, it is 1.0% or more. If the abundance ratio of S atoms is 0.5% or less when the abundance ratio of all atoms by XPS measurement is 100%, the film formed by the compound represented by the general formula (1) is thin and sufficient effect is obtained. Can not demonstrate.
Further, among the atoms belonging to S2p among S atoms, when the area of atoms having a peak top at 165 eV to 174 eV is S1, and the area of atoms having a peak top at 160 eV to 165 eV is S2, all the existing S When the number of atoms is 100%, the presence ratio of S2 is more preferably 5% or more. More preferably, it is 7% or more, More preferably, it is 10% or more. If the content ratio of S2 is 5% or less, the film formed by the compound represented by the general formula (1) is thin, and a sufficient effect cannot be exhibited. The abundance ratio of S atoms on the surface of the positive electrode or the negative electrode can be measured, for example, as follows. In order to suppress changes in the chemical state of the surface until measurement, it is preferable to disassemble the cell, clean the electrodes, sample, and transport the sample to the apparatus in an inert atmosphere such as argon.
XPS測定によるS原子の存在比の測定は、例えば、下記のように行うことができる。励起X線にはAl Kα線(1486.6eV)を用いた。X線径は200μmであり、光電子脱出角度は45°を用いる。Binding Energyの補正として、C1sピークにおける283eV〜285eVにピークトップを持つピーク(C−C、CHx 成分に帰属される)の頂点を284.6eVとした。9 points smoothingを行い、ピーク分割を行う。 The measurement of the abundance ratio of S atoms by XPS measurement can be performed as follows, for example. Al Kα ray (1486.6 eV) was used as the excitation X-ray. The X-ray diameter is 200 μm, and the photoelectron escape angle is 45 °. As a correction of Binding Energy, the peak of a peak having a peak top at 283 eV to 285 eV in the C1s peak (assigned to C—C and CHx components) was set to 284.6 eV. 9 points smoothing and peak splitting.
本発明のリチウム二次電池は、正極又は負極の表面5nm以下の範囲の、TOF−SIMS測定による正二次イオンのS原子を含有するフラグメントの規格化値の合計が2.0×10−4以上である。規格化値とは、TOF−SIMSで帰属しうる全イオン種(フラグメント)のピーク強度(counts)の合計値に対する割合である。S原子を含有するフラグメントとしては、検出された全イオン種のうち、CH2S+、C2H5S+などが挙げられ、Sを含有するイオン種全ての合計値が上記の範囲であればよい。このS原子を含有するフラグメントは、正極又は負極の表面上に後述する一般式(1)で表される化合物による被膜が形成されていることによるものである。正極又は負極表面のS原子を含有するフラグメントは、下記のように測定することができる。 In the lithium secondary battery of the present invention, the total normalized value of fragments containing S atoms of positive secondary ions measured by TOF-SIMS in the range of the surface of the positive electrode or negative electrode of 5 nm or less is 2.0 × 10 −4 or more. It is. The normalized value is a ratio to the total value of peak intensities (counts) of all ionic species (fragments) that can be assigned by TOF-SIMS. Examples of the fragment containing S atom include CH 2 S + and C 2 H 5 S + among all detected ionic species, and the total value of all ionic species containing S is within the above range. That's fine. This fragment containing S atoms is due to the fact that a film made of a compound represented by the following general formula (1) is formed on the surface of the positive electrode or the negative electrode. The fragment containing S atoms on the surface of the positive electrode or the negative electrode can be measured as follows.
1次イオンとしてBi3 ++を照射して、試料表面から放出された2次イオンは、正2次イオンおよび負二次イオンを検出する。 By irradiating Bi 3 ++ as primary ions, secondary ions emitted from the sample surface detect positive secondary ions and negative secondary ions.
<リチウム二次電池>
本発明に係るリチウム二次電池は、正極と負極とが、本発明に係る電解液が含浸されているセパレーターを介して、ケースに収納された構造を有している。本発明に係るリチウム二次電池の形状は任意であり、例えば、円筒型、角型、ラミネート型、コイン型、大型等のいずれであってもよい。また、電気自動車、ハイブリッド電気自動車などに搭載するための数10V〜数100Vを必要とする高電圧電源として、個々の電池を直列に接続して構成する電池モジュールとしてもよい。
<Lithium secondary battery>
The lithium secondary battery according to the present invention has a structure in which a positive electrode and a negative electrode are housed in a case via a separator impregnated with the electrolytic solution according to the present invention. The shape of the lithium secondary battery according to the present invention is arbitrary, and may be any of a cylindrical shape, a square shape, a laminate shape, a coin shape, a large size, and the like. Moreover, it is good also as a battery module comprised by connecting each battery in series as a high voltage power supply which requires several 10V-several 100V for mounting in an electric vehicle, a hybrid electric vehicle, etc.
<正極>
正極は、正極活物質、導電助剤、結着剤および分散用溶媒などを含む正極活物質組成物が正極集電体に担持されているものであり、通常シート状である。
<Positive electrode>
The positive electrode is a sheet in which a positive electrode active material composition containing a positive electrode active material, a conductive additive, a binder, a dispersion solvent and the like is supported on a positive electrode current collector, and is usually in a sheet form.
正極の製造方法は、例えば、正極集電体に正極活物質組成物をドクターブレード法などで塗工したり、浸漬した後に、乾燥する方法;正極活物質組成物を混練成形し乾燥して得たシートを正極集電体に導電性接着剤を介して接合し、プレス、乾燥する方法;液状潤滑剤を添加した正極活物質組成物を正極集電体上に成形した後、液状潤滑剤を除去し、次いで一軸または多軸方向に延伸する方法などが挙げられる。 The method for producing the positive electrode is, for example, a method in which the positive electrode active material composition is applied to the positive electrode current collector by the doctor blade method or the like and then dried; the positive electrode active material composition is kneaded, molded and dried. A method of joining the sheet to the positive electrode current collector via a conductive adhesive, pressing and drying; forming a positive electrode active material composition to which a liquid lubricant has been added on the positive electrode current collector; The method of removing and then extending | stretching to a uniaxial or multiaxial direction etc. is mentioned.
正極集電体の材料としては特に限定されず、例えば、アルミニウム、アルミニウム合金、SUS、チタンなどの導電性金属を用いることができる。中でも、薄膜に加工しやすく、安価であるという観点から、アルミニウムが好ましい。 The material of the positive electrode current collector is not particularly limited, and for example, a conductive metal such as aluminum, an aluminum alloy, SUS, or titanium can be used. Among these, aluminum is preferable from the viewpoint of being easily processed into a thin film and being inexpensive.
導電助剤としては、アセチレンブラック、カーボンブラック、グラファイト、金属粉末材料、単相カーボンナノチューブ、多層カーボンナノチューブ、気相法炭素繊維などが挙げられる。 Examples of the conductive assistant include acetylene black, carbon black, graphite, metal powder material, single-phase carbon nanotube, multi-walled carbon nanotube, and vapor grown carbon fiber.
結着剤としては、ポリビニリデンフロライド、ポリテトラフルオロエチレンなどのフッ素系樹脂;スチレン−ブタジエンゴム、ニトリルブタジエンゴムなどの合成ゴム;ポリアミドイミドなどのポリアミド系樹脂;ポリエチレン、ポリプロピレンなどのポリオレフィン系樹脂;ポリ(メタ)アクリル系樹脂;ポリアクリル酸;カルボキシメチルセルロースなどのセルロース系樹脂などが挙げられる。これらの結着剤は単独で使用してもよく、複数種を混合して使用してもよい。また、これらの結着剤は溶媒に溶けた状態であっても、溶媒に分散した状態であっても構わない。 As binders, fluorine resins such as polyvinylidene fluoride and polytetrafluoroethylene; synthetic rubbers such as styrene-butadiene rubber and nitrile butadiene rubber; polyamide resins such as polyamideimide; polyolefin resins such as polyethylene and polypropylene A poly (meth) acrylic resin; a polyacrylic acid; a cellulose resin such as carboxymethylcellulose; These binders may be used alone or in combination of two or more. These binders may be dissolved in a solvent or dispersed in a solvent.
導電助剤または結着剤の配合量は、電池の使用目的(出力重視、エネルギー重視など)、イオン伝導性などを考慮して適宜調整することができる。 The blending amount of the conductive auxiliary agent or the binder can be appropriately adjusted in consideration of the intended use of the battery (emphasis on output, importance on energy, etc.), ion conductivity, and the like.
正極を製造する際にして、正極活物質組成物に用いられる溶媒としては、N−メチルピロリドン、ジメチルホルムアミド、ジメチルアセトアミド、メチルエチルケトン、テトラヒドロフラン、アセトン、エタノール、酢酸エチル、水などが挙げられる。 Examples of the solvent used in the positive electrode active material composition when producing the positive electrode include N-methylpyrrolidone, dimethylformamide, dimethylacetamide, methyl ethyl ketone, tetrahydrofuran, acetone, ethanol, ethyl acetate, and water.
<正極活物質>
本発明のリチウム二次電池においては、正極活物質としては、リチウムイオンを吸蔵・放出可能であれば良く、従来公知のリチウム二次電池で使用される正極活物質を用いることができる。
<Positive electrode active material>
In the lithium secondary battery of the present invention, the positive electrode active material only needs to be able to occlude and release lithium ions, and a positive electrode active material used in a conventionally known lithium secondary battery can be used.
具体的には、コバルト酸リチウム、ニッケル酸リチウム、マンガン酸リチウム、LiNi1−x−yCoxMnyO2やLiNi1−x−yCoxAlyO2(0≦x≦1、0≦y≦1)で表される三元系酸化物などの遷移金属酸化物、LiAPO4(A=Fe、Mn、Ni、Co)などのオリビン構造を有する化合物、遷移金属を複数取り入れた固溶材料(電気化学的に不活性な層状のLi2MnO3と、電気化学的に活性な層状のLiMO(M=Co、Niなどの遷移金属)との固溶体)などを用いることができる。これらを単独で使用してもよく、複数組み合わせて使用してもよい。 Specifically, lithium cobalt acid, lithium nickel acid, lithium manganese acid, LiNi 1-x-y Co x Mn y O 2 or LiNi 1-x-y Co x Al y O 2 (0 ≦ x ≦ 1,0 ≦ y ≦ 1) transition metal oxides such as ternary oxides, compounds having an olivine structure such as LiAPO 4 (A = Fe, Mn, Ni, Co), and solid solutions incorporating a plurality of transition metals A material (a solid solution of an electrochemically inactive layered Li 2 MnO 3 and an electrochemically active layered LiMO (transition metals such as M = Co and Ni)) can be used. These may be used alone or in combination.
<負極>
負極は、負極活物質、分散用溶媒、結着剤および必要に応じて導電助剤などを含む負極活物質組成物が負極集電体に担持されているものであり、通常シート状である。
<Negative electrode>
The negative electrode is a sheet in which a negative electrode active material composition containing a negative electrode active material, a dispersion solvent, a binder, and a conductive auxiliary agent as necessary is supported on a negative electrode current collector, and is usually in the form of a sheet.
負極集電体の材料としては、銅、鉄、ニッケル、銀、ステンレス鋼SUS(SUSステンレス鋼)などの導電性金属を用いることができるが、薄膜に加工しやすいという観点から、銅が好ましい。 As a material of the negative electrode current collector, a conductive metal such as copper, iron, nickel, silver, and stainless steel SUS (SUS stainless steel) can be used. However, copper is preferable from the viewpoint of easy processing into a thin film.
負極活物質としては、従来公知のリチウム二次電池で使用される負極活物質を用いることができ、リチウムイオンを吸蔵・放出可能なものであればよい。具体的には、人造黒鉛、天然黒鉛などの黒鉛材料、石炭・石油ピッチから作られるメソフェーズ焼成体、難黒鉛化性炭素などの炭素材料、Si、Si合金、SiO等などのシリコンSi系負極材料、Sn合金等などのSn系負極材料、リチウム金属、リチウム−アルミニウム合金などのリチウム合金を用いることができる。 As a negative electrode active material, the negative electrode active material used with a conventionally well-known lithium secondary battery can be used, What is necessary is just what can occlude / release lithium ion. Specifically, graphite materials such as artificial graphite and natural graphite, mesophase fired bodies made from coal / petroleum pitch, carbon materials such as non-graphitizable carbon, silicon Si-based negative electrode materials such as Si, Si alloy, and SiO Sn-based negative electrode materials such as Sn alloy, and lithium alloys such as lithium metal and lithium-aluminum alloy can be used.
なお、負極の製造方法は正極の製造方法と同様の方法を採用することができる。負極に使用し得る導電助剤、結着剤、材料分散用の溶媒は、正極で用いられるものと同様のものを用いることができる。
<セパレータ>
セパレータは正負極を隔てるように配置されるものである。セパレータとしては、特に制限されるべきものではなく、従来公知のものを用いることができる。例えば、非水電解液を吸収・保持するポリマーからなる多孔性シート(例えば、ポリオレフィン系微多孔質セパレータやセルロース系セパレータなど)、不織布セパレータ、多孔質金属体などが挙げられる。中でも、有機溶媒に対して化学的に安定であるという性質を持つポリオレフィン系微多孔質セパレータが好適である。
In addition, the manufacturing method of a negative electrode can employ | adopt the method similar to the manufacturing method of a positive electrode. As the conductive auxiliary agent, binder, and material dispersion solvent that can be used for the negative electrode, the same ones as those used for the positive electrode can be used.
<Separator>
The separator is disposed so as to separate the positive and negative electrodes. The separator is not particularly limited, and a conventionally known separator can be used. For example, a porous sheet (for example, a polyolefin-based microporous separator or a cellulose-based separator) made of a polymer that absorbs and retains a nonaqueous electrolytic solution, a nonwoven fabric separator, a porous metal body, and the like can be given. Among these, a polyolefin microporous separator having a property of being chemically stable with respect to an organic solvent is preferable.
上記多孔性シートの材質は、ポリエチレン、ポリプロピレン、ポリプロピレン/ポリエチレン/ポリプロピレンの3層構造を有する積層体などが挙げられる。 Examples of the material for the porous sheet include polyethylene, polypropylene, and a laminate having a three-layer structure of polypropylene / polyethylene / polypropylene.
上記不織布セパレータの材質は、例えば、綿、レーヨン、アセテート、ナイロン、ポリエステル、ポリプロピレン、ポリエチレン、ポリイミド、アラミド、ガラスなどが挙げられ、非水電解液層に要求される機械強度などに応じて単独または混合して用いる。 Examples of the material of the nonwoven fabric separator include cotton, rayon, acetate, nylon, polyester, polypropylene, polyethylene, polyimide, aramid, glass, and the like, depending on the mechanical strength required for the nonaqueous electrolyte layer or the like. Used by mixing.
<非水電解液>
[一般式(1)で表される化合物]
本発明の非水電解液は、一般式(1);(XSO2)(X’SO2)N−Li+で表される化合物(1)を含むことを特徴とする。上記一般式(1)で表される化合物(1)を電解質中に含むことにより、電極上に被膜を形成し、内部抵抗の上昇を抑制し、放電電圧を高い値に維持させうることを見出した。
<Non-aqueous electrolyte>
[Compound represented by general formula (1)]
The non-aqueous electrolyte of the present invention is characterized by containing a compound (1) represented by the general formula (1); (XSO 2 ) (X′SO 2 ) N — Li + . It has been found that by containing the compound (1) represented by the general formula (1) in the electrolyte, a film can be formed on the electrode, the increase in internal resistance can be suppressed, and the discharge voltage can be maintained at a high value. It was.
上記一般式(1)中、X、X’は、フッ素原子、炭素数1〜6のアルキル基又は炭素数1〜6のフルオロアルキル基を表し、X、X’の少なくとも一方はフッ素原子である。炭素数1〜6アルキル基としては、直鎖状のアルキル基であるのが好ましく、例えば、メチル基、エチル基、プロピル基、イソプロピル基、ブチル基、ペンチル基、ヘキシル基が挙げられる。炭素数1〜6のフルオロアルキル基としては、上記アルキル基が有する水素原子の一部又は全部がフッ素原子で置換されたものが挙げられ、例えば、フルオロメチル基、ジフルオロメチル基、トリフルオロメチル基、フルオロエチル基、ジフルオロエチル基、トリフルオロエチル基、ペンタフルオロエチル基等が挙げられる。上記アルキル基又はフルオロアルキル基の中でも、フッ素原子、トリフルオロメチル基、ペンタフルオロエチル基が好ましい。好ましい化合物(1)としては、リチウムビス(フルオロスルホニル)イミド、リチウム(フルオロスルホニル)(トリフルオロメチルスルホニル)イミド、リチウム(フルオロスルホニル)(メチルスルホニル)イミド、リチウム(フルオロスルホニル)(ペンタフルオロエチルスルホニル)イミド、リチウム(フルオロスルホニル)(エチルスルホニル)イミドが挙げられ、より好ましくはリチウムビス(フルオロスルホニル)イミド、リチウム(フルオロスルホニル)(トリフルオロメチルスルホニル)イミド、リチウム(フルオロスルホニル)(ペンタフルオロエチルスルホニル)イミドであり、更に好ましくはリチウムビス(フルオロスルホニル)イミドである。 In the general formula (1), X and X ′ represent a fluorine atom, an alkyl group having 1 to 6 carbon atoms or a fluoroalkyl group having 1 to 6 carbon atoms, and at least one of X and X ′ is a fluorine atom. . The alkyl group having 1 to 6 carbon atoms is preferably a linear alkyl group, and examples thereof include a methyl group, an ethyl group, a propyl group, an isopropyl group, a butyl group, a pentyl group, and a hexyl group. Examples of the fluoroalkyl group having 1 to 6 carbon atoms include those in which some or all of the hydrogen atoms of the alkyl group are substituted with fluorine atoms, such as a fluoromethyl group, a difluoromethyl group, and a trifluoromethyl group. , Fluoroethyl group, difluoroethyl group, trifluoroethyl group, pentafluoroethyl group and the like. Among the alkyl groups or fluoroalkyl groups, a fluorine atom, a trifluoromethyl group, and a pentafluoroethyl group are preferable. Preferred compounds (1) include lithium bis (fluorosulfonyl) imide, lithium (fluorosulfonyl) (trifluoromethylsulfonyl) imide, lithium (fluorosulfonyl) (methylsulfonyl) imide, lithium (fluorosulfonyl) (pentafluoroethylsulfonyl) ) Imide, lithium (fluorosulfonyl) (ethylsulfonyl) imide, and more preferably lithium bis (fluorosulfonyl) imide, lithium (fluorosulfonyl) (trifluoromethylsulfonyl) imide, lithium (fluorosulfonyl) (pentafluoroethyl) Sulfonyl) imide, more preferably lithium bis (fluorosulfonyl) imide.
本発明の非水電解液中の化合物(1)の濃度は、0.01mol/L〜2.0mol/Lの範囲であることが好ましく、より好ましくは0.05mol/L〜1.0mol/L、さらに好ましくは0.1mol/L〜0.5mol/Lである。化合物(1)の濃度が0.01mol/L以下である場合は、電極上の被膜への作用が充分でなく、所望の電池性能が得られない恐れがある。化合物(1)の濃度が2.0mol/L以上である場合は非水電解液の粘度が高くなり伝導度が低下し電池性能が充分に発揮できない恐れがある。 The concentration of the compound (1) in the nonaqueous electrolytic solution of the present invention is preferably in the range of 0.01 mol / L to 2.0 mol / L, more preferably 0.05 mol / L to 1.0 mol / L. More preferably, it is 0.1 mol / L to 0.5 mol / L. When the concentration of the compound (1) is 0.01 mol / L or less, the effect on the film on the electrode is not sufficient, and the desired battery performance may not be obtained. When the concentration of the compound (1) is 2.0 mol / L or more, the viscosity of the non-aqueous electrolyte is increased, the conductivity is lowered, and the battery performance may not be sufficiently exhibited.
本発明のリチウム二次電池の非水電解液においては、化合物(1)は主たる電解質としても良いし、他の電解質を主たる電解質としてもよいが、他の電解質(後述する電解質(2))を主たる電解質とする形態が好ましい。 In the nonaqueous electrolytic solution of the lithium secondary battery of the present invention, the compound (1) may be a main electrolyte or another electrolyte may be a main electrolyte, but another electrolyte (an electrolyte (2) described later) may be used. The main electrolyte is preferred.
化合物(1)は、市販品を使用してもよく、また、従来公知の方法により合成したものを用いてもよい。 As the compound (1), a commercially available product may be used, or a compound synthesized by a conventionally known method may be used.
[電解質(2)]
本発明のリチウム二次電池においては、非水電解液中に化合物(1)に加えて他の電解質(電解質(2))を含有することが好ましい。電解質(2)については特に限定されず、各種蓄電デバイスの電解液において電解質として用いられる従来公知の電解質はいずれも使用することができる。電解質(2)としては、電解液中での解離定数が大きく、また、後述する溶媒と溶媒和し難いアニオンを生成するものが好ましい。具体的には、LiPF6、LiClO4、LiBF4、LiAsF6、LiSbF6、LiAlO4、LiAlCl4、LiCl及びLiIよりなる群から選択される1種以上の化合物等が本発明に係る電解質(2)として用いられる。これらの中でも、LiPF6、LiBF4が好ましく、より好ましくはLiPF6である。上記電解質(2)は、単独で又は2種以上を組み合わせて用いてもよい。
[Electrolyte (2)]
In the lithium secondary battery of the present invention, it is preferable to contain other electrolyte (electrolyte (2)) in addition to the compound (1) in the nonaqueous electrolytic solution. The electrolyte (2) is not particularly limited, and any conventionally known electrolyte used as an electrolyte in the electrolyte solution of various power storage devices can be used. The electrolyte (2) is preferably one that has a large dissociation constant in the electrolytic solution and generates an anion that is difficult to solvate with the solvent described later. Specifically, one or more compounds selected from the group consisting of LiPF 6 , LiClO 4 , LiBF 4 , LiAsF 6 , LiSbF 6 , LiAlO 4 , LiAlCl 4 , LiCl, and LiI can be used as the electrolyte (2 ). Among these, LiPF 6 and LiBF 4 are preferable, and LiPF 6 is more preferable. The electrolyte (2) may be used alone or in combination of two or more.
また、非水電解液中の電解質(2)の濃度は0.1mol/L以上、飽和濃度以下である事が好ましい。より好ましくは0.1mol/L〜2.5mol/Lであり、さらに好ましくは0.3mol/L〜2mol/L、さらに好ましくは0.4mol/L〜1.5mol/L、であり、最も好ましくは0.5mol/L〜1.2mol/Lである。電解質(2)の濃度が高すぎると非水電解液の粘度が高くなり伝導度が低下し電池性能が充分に発揮できない恐れがある。 Moreover, it is preferable that the density | concentration of the electrolyte (2) in a non-aqueous electrolyte is 0.1 mol / L or more and below a saturation concentration. More preferably, it is 0.1 mol / L to 2.5 mol / L, more preferably 0.3 mol / L to 2 mol / L, still more preferably 0.4 mol / L to 1.5 mol / L, and most preferably Is 0.5 mol / L to 1.2 mol / L. If the concentration of the electrolyte (2) is too high, the viscosity of the non-aqueous electrolyte is increased, the conductivity is lowered, and the battery performance may not be sufficiently exhibited.
また、非水電解液中の化合物(1)と電解質(2)の濃度は、化合物(1)と電解質(2)の濃度の和が、0.8mol/L〜2.5mol/Lであることが好ましく、さらに好ましくは1.0mol/L〜2.0mol/L、さらに好ましくは1.2mol/L〜1.5mol/Lである。 The concentration of the compound (1) and the electrolyte (2) in the non-aqueous electrolyte is such that the sum of the concentrations of the compound (1) and the electrolyte (2) is 0.8 mol / L to 2.5 mol / L. Is more preferable, 1.0 mol / L to 2.0 mol / L, more preferably 1.2 mol / L to 1.5 mol / L.
電解質(2)の非水電解液中に占める電解質の割合としては、本発明の非水電解液に含まれる電解質の総量中30mol%以上であるのが好ましい。より好ましくは50mol%以上である。また上限としては99mol%以下であればよい。 The proportion of the electrolyte (2) in the nonaqueous electrolytic solution is preferably 30 mol% or more in the total amount of the electrolyte contained in the nonaqueous electrolytic solution of the present invention. More preferably, it is 50 mol% or more. The upper limit may be 99 mol% or less.
本発明の非水電解液中における化合物(1)の配合量は、上記電解質(1)と化合物(2)の合計を100mol%としたときに化合物(2)が50mol%以下、0.1mol%以上であることが好ましい。より好ましくは0.5mol%以上、30mol%以下であり、さらに好ましくは1mol%以上、20mol%以下である。化合物(2)の配合量が少なすぎると、電極上の被膜への作用が充分でなく、所望の電池性能が得られない恐れがある。 The compounding amount of the compound (1) in the nonaqueous electrolytic solution of the present invention is such that the compound (2) is 50 mol% or less and 0.1 mol% when the total of the electrolyte (1) and the compound (2) is 100 mol%. The above is preferable. More preferably, they are 0.5 mol% or more and 30 mol% or less, More preferably, they are 1 mol% or more and 20 mol% or less. When the compounding amount of the compound (2) is too small, the effect on the film on the electrode is not sufficient, and the desired battery performance may not be obtained.
[溶媒]
本発明の非水電解液において、上記電解質類を溶解させる溶媒としては、従来、非水電解液に使用されている種々の非水溶媒を使用することができる。例えば、エチレンカーボネート、プロピレンカーボネート、ブチレンカーボネート、クロロエチレンカーボネートなどの環状カーボネート類;ジメチルカーボネート、エチルメチルカーボネート、ジエチルカーボネートなどの鎖状カーボネート類;テトラヒドロフラン、2−メチルテトラヒドロフラン、1,4−ジオキサン、1,1−ジメトキシエタン、1,2−ジメトキシエタン、1,2−ジエトキシエタン、1,2−ジブトキシエタンなどのエーテル類;γ−ブチロラクトン、γ−バレロラクトン、α−メチル−γ−ブチロラクトンなどのラクトン類;プロピオン酸メチルや酪酸メチルなどの鎖状カルボン酸エステル類などを使用することができる。これらの非水溶媒の中でも環状カーボネート類、鎖状カーボネート類等のカーボネート系溶媒は、電圧印加時に分解しにくく安定であるため好ましく使用できる。なお、上記非水溶媒は単独で使用してもよく、2種以上を混合して使用してもよい。
[solvent]
In the non-aqueous electrolyte of the present invention, various non-aqueous solvents conventionally used in non-aqueous electrolytes can be used as the solvent for dissolving the electrolytes. For example, cyclic carbonates such as ethylene carbonate, propylene carbonate, butylene carbonate, and chloroethylene carbonate; chain carbonates such as dimethyl carbonate, ethylmethyl carbonate, and diethyl carbonate; tetrahydrofuran, 2-methyltetrahydrofuran, 1,4-dioxane, 1 Ethers such as 1,2-dimethoxyethane, 1,2-dimethoxyethane, 1,2-diethoxyethane, 1,2-dibutoxyethane; γ-butyrolactone, γ-valerolactone, α-methyl-γ-butyrolactone, etc. Lactones of the above; chain carboxylic acid esters such as methyl propionate and methyl butyrate can be used. Among these non-aqueous solvents, carbonate solvents such as cyclic carbonates and chain carbonates are preferably used because they are difficult to decompose upon application of voltage and are stable. In addition, the said non-aqueous solvent may be used independently and may mix and use 2 or more types.
[添加剤]
本発明のリチウム二次電池の非水電解液にはサイクル特性の改善や安全性の向上のため、化合物(1)、電解質(2)、溶媒以外に添加剤を含んでいても良い。添加剤としては、ビニレンカーボネート(VC)、ビニルエチレンカーボネート(VEC)、メチルビニレンカーボネート(MVC)、エチルビニレンカーボネート(EVC)等の不飽和結合を有する環状カーボネート;フルオロエチレンカーボネート、トリフルオロプロピレンカーボネート、フェニルエチレンカーボネート及びエリスリタンカーボネート等のカーボネート化合物;無水コハク酸、無水グルタル酸、無水マレイン酸、無水シトラコン酸、無水グルタコン酸、無水イタコン酸、無水ジグリコール酸、シクロヘキサンジカルボン酸無水物、シクロペンタンテトラカルボン酸二無水物、フェニルコハク酸無水物等のカルボン酸無水物;エチレンサルファイト、1,3−プロパンスルトン、1,4−ブタンスルトン、メタンスルホン酸メチル、ブサルファン、スルホラン、スルホレン、ジメチルスルホン、テトラメチルチウラムモノスルフィド等の含硫黄化合物;1−メチル−2−ピロリジノン、1−メチル−2−ピペリドン、3−メチル−2−オキサゾリジノン、1,3−ジメチル−2−イミダゾリジノン、N−メチルスクシイミド等の含窒素化合物;モノフルオロリン酸塩、ジフルオロリン酸塩などのリン酸塩;ヘプタン、オクタン、シクロヘプタン等の炭化水素化合物などがあげられる。非水電解液にこれらの添加剤を用いる場合、その濃度としては0.1重量%〜5重量%であることが好ましい。
[Additive]
The nonaqueous electrolytic solution of the lithium secondary battery of the present invention may contain additives other than the compound (1), the electrolyte (2), and the solvent in order to improve cycle characteristics and safety. As additives, cyclic carbonates having unsaturated bonds such as vinylene carbonate (VC), vinyl ethylene carbonate (VEC), methyl vinylene carbonate (MVC), ethyl vinylene carbonate (EVC); fluoroethylene carbonate, trifluoropropylene carbonate, Carbonate compounds such as phenylethylene carbonate and erythritan carbonate; succinic anhydride, glutaric anhydride, maleic anhydride, citraconic anhydride, glutaconic anhydride, itaconic anhydride, diglycolic anhydride, cyclohexanedicarboxylic anhydride, cyclopentanetetra Carboxylic anhydrides such as carboxylic dianhydride and phenyl succinic anhydride; ethylene sulfite, 1,3-propane sultone, 1,4-butane sultone, methane sulfone Sulfur-containing compounds such as methyl, busulfan, sulfolane, sulfolene, dimethyl sulfone, tetramethylthiuram monosulfide; 1-methyl-2-pyrrolidinone, 1-methyl-2-piperidone, 3-methyl-2-oxazolidinone, 1,3- Nitrogen-containing compounds such as dimethyl-2-imidazolidinone and N-methylsuccinimide; phosphates such as monofluorophosphate and difluorophosphate; hydrocarbon compounds such as heptane, octane and cycloheptane It is done. When these additives are used in the non-aqueous electrolyte, the concentration is preferably 0.1% by weight to 5% by weight.
本発明の非水電解液における上記不飽和結合を有する環状カーボネートの濃度は0.01質量%〜5質量%であるのが好ましい。より好ましくは0.05質量%〜4質量%である。さらに好ましくは0.1質量%〜3質量%である。 It is preferable that the density | concentration of the cyclic carbonate which has the said unsaturated bond in the non-aqueous electrolyte of this invention is 0.01 mass%-5 mass%. More preferably, it is 0.05 mass%-4 mass%. More preferably, it is 0.1 mass%-3 mass%.
以下、実施例を挙げて本発明をより具体的に説明するが、本発明はもとより下記実施例によって制限を受けるものではなく、前・後記の趣旨に適合し得る範囲で適当に変更を加えて実施することも勿論可能であり、それらはいずれも本発明の技術的範囲に包含される。 EXAMPLES Hereinafter, the present invention will be described more specifically with reference to examples. However, the present invention is not limited by the following examples, but may be appropriately modified within a range that can meet the purpose described above and below. Of course, it is possible to implement them, and they are all included in the technical scope of the present invention.
[電解液の調製]
電解液調整例1
電解質(1)としてヘキサフルオロリン酸リチウム(LiPF6、キシダ化学株式会社製、LBGグレード)1.52g(10mmol)、化合物(2)としてリチウムビス(フルオロスルホニル)イミド(LiFSI)0.38g(2mmol)を10mLのメスフラスコに測り取り、エチレンカーボネート(EC)とエチルメチルカーボネート(EMC)(いずれも、キシダ化学株式会社製、LBGグレード)の体積比が3/7(EC/EMC)である混合溶媒でメスアップして電解液を調製し、これを電解液1とした。
[Preparation of electrolyte]
Electrolyte adjustment example 1
Electrolyte (1) lithium hexafluorophosphate as (LiPF 6, manufactured by Kishida Chemical Co., LBG grade) 1.52 g (10 mmol), lithium bis (fluorosulfonyl) as the compound (2) imide (LiFSI) 0.38 g (2 mmol ) Was measured in a 10 mL volumetric flask, and the volume ratio of ethylene carbonate (EC) and ethyl methyl carbonate (EMC) (both manufactured by Kishida Chemical Co., Ltd., LBG grade) was 3/7 (EC / EMC). An electrolyte was prepared by measuring the volume with a solvent, and this was designated as electrolyte 1.
電解液調整例2
電解質(1)としてヘキサフルオロリン酸リチウム(LiPF6、キシダ化学株式会社製、LBGグレード)1.82g(12mmol)を用いた事以外は電解液調整例1と同様にして電解液を調整し、これを電解液2とした。
Electrolyte adjustment example 2
An electrolyte solution was prepared in the same manner as in the electrolyte solution adjustment example 1 except that 1.82 g (12 mmol) of lithium hexafluorophosphate (LiPF 6 , LBG grade, manufactured by Kishida Chemical Co., Ltd.) was used as the electrolyte (1). Was used as electrolytic solution 2.
[ラミネートセルの作製と試験前の充放電]
正極活物質層の面積が12cm2(3×4cm)の市販の正極シート(活物質:コバルト酸リチウム、3mAh/cm2)1枚と、負極活物質層の面積が13.44cm2(3.2×4.2cm)の市販の負極シート(活物質:グラファイト、3.2mAh/cm2)1枚とを対向するように積層し、その間に1枚のポリオレフィン系セパレータを挟んだ。2枚のアルミニウムラミネートフィルムで正、負極のシートを挟み込み、アルミニウムラミネートフィルム内を電解液1、2で満たし、真空状態で密閉した。
[Production of laminate cell and charge / discharge before test]
One commercially available positive electrode sheet (active material: lithium cobaltate, 3 mAh / cm 2 ) having an area of the positive electrode active material layer of 12 cm 2 (3 × 4 cm) and an area of the negative electrode active material layer of 13.44 cm 2 (3. 2 × 4.2 cm) of a commercially available negative electrode sheet (active material: graphite, 3.2 mAh / cm 2 ) was laminated so as to face each other, and one polyolefin separator was sandwiched therebetween. The positive and negative electrode sheets were sandwiched between two aluminum laminate films, and the aluminum laminate film was filled with electrolytes 1 and 2 and sealed in a vacuum state.
充放電試験装置(ACD−01、アスカ電子株式会社製)を使用して、30℃で充放電速度0.2C(定電流モード)、3.5V〜4.2Vで1度充放電を行った後、ラミネートセルを開封してから、再度真空状態で密閉した。同条件で充放電を5回繰り返してラミネート型リチウム電池を完成させた。 Using a charge / discharge test apparatus (ACD-01, manufactured by Asuka Electronics Co., Ltd.), charge / discharge was performed once at 30 ° C. at a charge / discharge rate of 0.2 C (constant current mode) and 3.5 V to 4.2 V. Thereafter, the laminate cell was opened and then sealed again in a vacuum state. Under the same conditions, charging / discharging was repeated 5 times to complete a laminated lithium battery.
それぞれ得られた電池について、高温保存試験した後と、高温保存試験をせずに25℃で保管した電池に関して、セルの解体、電極の洗浄、サンプリング、装置への試料搬送をアルゴン雰囲気で行い、XPS、TOF−SIMSの測定を行った。電解液と実験条件を表1に示す。 For each of the batteries obtained, after the high-temperature storage test and for the battery stored at 25 ° C. without performing the high-temperature storage test, cell disassembly, electrode cleaning, sampling, and sample transport to the apparatus are performed in an argon atmosphere. XPS and TOF-SIMS were measured. The electrolytic solution and experimental conditions are shown in Table 1.
[高温保存試験]
得られたラミネート型リチウム電池を、30℃で充放電速度0.2C(定電流モード)で充放電を行った。このときの放電容量を初期放電容量(A)とする。ラミネート型リチウム電池を、30℃で充放電速度0.2C(定電流モード)で4.2Vまで充電を行い、80℃で1週間保管を行った。その後、30℃にて0.2Cで放電を行った。このときの放電容量を高温保管後の放電容量(B)とする。高温保管前後での容量維持率を以下の式により算出した。表2に、結果をまとめた。
容量維持率=高温保管後の放電容量(B)/初期放電容量(A)×100
[High temperature storage test]
The obtained laminated lithium battery was charged / discharged at 30 ° C. at a charge / discharge rate of 0.2 C (constant current mode). The discharge capacity at this time is defined as the initial discharge capacity (A). The laminated lithium battery was charged to 4.2 V at 30 ° C. at a charge / discharge rate of 0.2 C (constant current mode), and stored at 80 ° C. for 1 week. Thereafter, discharging was performed at 30 ° C. and 0.2 C. Let the discharge capacity at this time be the discharge capacity (B) after high-temperature storage. The capacity retention rate before and after high temperature storage was calculated by the following formula. Table 2 summarizes the results.
Capacity retention rate = discharge capacity after high temperature storage (B) / initial discharge capacity (A) × 100
[XPS測定条件]
装置:Quantera SXM(PHI社製)
励起X線:Monochromatic Al Kα線(1486.6eV)
X線径:200μm
光電子脱出角度:45°(試料表面に対する検出器の傾き)
測定元素:リチウム、炭素、酸素、フッ素、窒素、リン、コバルト
データ処理条件
スムージング:9 points smoothing
横軸補正:C1sピークにおける283eV〜285eVにピークトップを持つピーク(C−C,CHx成分に帰属される)の頂点を284.6eVとした。
[XPS measurement conditions]
Apparatus: Quantera SXM (manufactured by PHI)
Excitation X-ray: Monochromatic Al Kα ray (1486.6 eV)
X-ray diameter: 200 μm
Photoelectron escape angle: 45 ° (inclination of detector with respect to sample surface)
Measurement elements: Lithium, carbon, oxygen, fluorine, nitrogen, phosphorus, cobalt Data processing conditions Smoothing: 9 points smoothing
Horizontal axis correction: The peak of a peak having a peak top at 283 eV to 285 eV (attributed to C—C, CHx component) in the C1s peak was set to 284.6 eV.
[TOF−SIMS測定条件]
装置:TOF.SIMS5(ION−TOF社製)
1次イオン:Bi3++
2次イオン極性:正
[XPS測定結果]
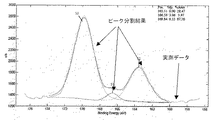
それぞれの電池の負極表面の分析結果を表3に示す。表中、存在割合は存在する全S原子に対するS1、S2の存在割合を示し、S原子の存在比は測定により得られた全原子を100%として算出したS原子の存在比を示す。また、測定結果を、データ処理条件により解析したXPSスペクトルを図1、図2に示した。
[TOF-SIMS measurement conditions]
Apparatus: TOF. SIMS5 (made by ION-TOF)
Primary ion: Bi3 ++
Secondary ion polarity: Positive [XPS measurement result]
Table 3 shows the analysis results of the negative electrode surface of each battery. In the table, the abundance ratio indicates the abundance ratio of S1 and S2 with respect to the total S atoms present, and the abundance ratio of S atoms indicates the abundance ratio of S atoms calculated with the total atoms obtained by measurement as 100%. Moreover, the XPS spectrum which analyzed the measurement result by data processing conditions was shown in FIG. 1, FIG.
LiFSIを電解液中に含まない実験例3、4では、S由来のピークが観察されなかった。これに対し、実験例1,2ではS(硫黄)由来のピークを観察することができた。このS由来のピークは、LiFSIに含まれる硫黄に由来するものと考えられる。この結果から、電解液中に含まれるLiFSIが負極表面に被膜を形成していることが判明した。 In Experimental Examples 3 and 4 in which LiFSI was not included in the electrolytic solution, no peak derived from S was observed. In contrast, in Experimental Examples 1 and 2, a peak derived from S (sulfur) could be observed. This S-derived peak is considered to be derived from sulfur contained in LiFSI. From this result, it was found that LiFSI contained in the electrolytic solution formed a film on the negative electrode surface.
[TOF−SIMS測定結果]
各電池の負極のTOF−SIMSの正二次イオンの測定結果を表4、同様に正極の測定結果を表5に示した。なお、表中の値は、帰属可能な総2次イオン強度に対して規格化した数値を表わす。Sを含有するフラグメントとしては、CH2S+、C2H5S+が検出されたので、その2種の検出値の和をS含有フラグメントとした。
[TOF-SIMS measurement results]
Table 4 shows the measurement results of the positive secondary ions of TOF-SIMS of the negative electrode of each battery, and Table 5 shows the measurement results of the positive electrode. In addition, the value in a table | surface represents the numerical value normalized with respect to the total secondary ion intensity which can be assigned. Since CH 2 S + and C 2 H 5 S + were detected as S-containing fragments, the sum of the two detected values was taken as the S-containing fragment.
表4、表5の結果から、実験例3、4と比較して実験例1,2はS含有フラグメントが強く観察されていることがわかる。電解液中にLiFSIを含む実験例1、2では、LiFSI中に含まれる硫黄原子が観測されており、電極上にLiFSIによる被膜が形成されていることが判明した。また、LiFSIの有無によるS由来のフラグメントの強度の差は、負極よりも正極側で顕著に現れており、さらに、満充電状態で高温保存した後の電池で差がさらに大きくなる結果となった。電池内で充放電を行うことにより、LiFSIが電極上に被膜形成することが明らかとなった。また、表2の結果から、電解液2を
用いた場合より電解液1を用いた電池が高温保存後の容量維持率が高いことがわかった。このことから、LiFSIが電解液中に含まれることにより、正極、負極表面に被膜が形成され、電池性能が向上していることがわかる。
From the results of Tables 4 and 5, it can be seen that S-containing fragments are observed more strongly in Experimental Examples 1 and 2 than in Experimental Examples 3 and 4. In Experimental Examples 1 and 2 containing LiFSI in the electrolytic solution, sulfur atoms contained in LiFSI were observed, and it was found that a film by LiFSI was formed on the electrode. In addition, the difference in the strength of the S-derived fragment due to the presence or absence of LiFSI appeared significantly on the positive electrode side than the negative electrode, and the difference was further increased in the battery after being stored at high temperature in a fully charged state. . It was clarified that LiFSI forms a film on the electrode by charging and discharging in the battery. Moreover, from the results in Table 2, it was found that the battery using the electrolytic solution 1 had a higher capacity retention rate after high-temperature storage than when the electrolytic solution 2 was used. From this, it can be seen that when LiFSI is contained in the electrolytic solution, a film is formed on the surfaces of the positive electrode and the negative electrode, and the battery performance is improved.
Claims (6)
上記非水電解液は、一般式(1);(XSO2)(X’SO2)N−Li+(X、X’は、フッ素原子、炭素数1〜6のアルキル基又は炭素数1〜6のフルオロアルキル基を表し、X、X’の少なくとも一方はフッ素原子である。)で表される化合物、及び溶媒を含み、
正極又は負極の表面において、XPS測定による全原子の存在比を100%としたときのS原子の存在比が0.5%以上であることを特徴とするリチウム二次電池。 A positive electrode containing a positive electrode active material capable of occluding and releasing lithium ions, a negative electrode containing a negative electrode active material capable of occluding and releasing lithium ions, and a lithium secondary battery comprising a non-aqueous electrolyte,
The non-aqueous electrolyte has the general formula (1); (XSO 2 ) (X′SO 2 ) N — Li + (X and X ′ are a fluorine atom, an alkyl group having 1 to 6 carbon atoms, or 1 to 1 carbon atoms. A fluoroalkyl group of 6, wherein at least one of X and X ′ is a fluorine atom), and a solvent,
A lithium secondary battery, wherein an abundance ratio of S atoms is 0.5% or more when an abundance ratio of all atoms by XPS measurement is 100% on a surface of a positive electrode or a negative electrode.
上記非水電解液は、一般式(1);(XSO2)(X’SO2)N−Li+(X、X’は、フッ素原子、炭素数1〜6のアルキル基又は炭素数1〜6のフルオロアルキル基を表し、X、X’の少なくとも一方はフッ素原子である。)で表される化合物、及び溶媒を含み、
正極または負極表面において、TOF−SIMSで測定した正二次イオンのS原子を含むフラグメントの規格化値の合計が2.0×10−4以上であることを特徴とするリチウム二次電池。 A positive electrode containing a positive electrode active material capable of occluding and releasing lithium ions, a negative electrode containing a negative electrode active material capable of occluding and releasing lithium ions, and a lithium secondary battery comprising a non-aqueous electrolyte,
The non-aqueous electrolyte has the general formula (1); (XSO 2 ) (X′SO 2 ) N — Li + (X and X ′ are a fluorine atom, an alkyl group having 1 to 6 carbon atoms, or 1 to 1 carbon atoms. A fluoroalkyl group of 6, wherein at least one of X and X ′ is a fluorine atom), and a solvent,
A lithium secondary battery, wherein a total of normalized values of fragments containing S atoms of positive secondary ions measured by TOF-SIMS is 2.0 × 10 −4 or more on a positive electrode or negative electrode surface.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2012026896A JP2013145732A (en) | 2011-12-16 | 2012-02-10 | Lithium secondary battery |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2011276315 | 2011-12-16 | ||
| JP2011276315 | 2011-12-16 | ||
| JP2012026896A JP2013145732A (en) | 2011-12-16 | 2012-02-10 | Lithium secondary battery |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2013145732A true JP2013145732A (en) | 2013-07-25 |
| JP2013145732A5 JP2013145732A5 (en) | 2015-04-16 |
Family
ID=49041408
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2012026896A Pending JP2013145732A (en) | 2011-12-16 | 2012-02-10 | Lithium secondary battery |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP2013145732A (en) |
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2014126256A1 (en) * | 2013-02-18 | 2014-08-21 | 株式会社日本触媒 | Electrolyte solution and lithium ion secondary battery provided with same |
| JP2015191737A (en) * | 2014-03-27 | 2015-11-02 | ダイキン工業株式会社 | Electrolyte and electrochemical device |
| JP2016539487A (en) * | 2014-09-30 | 2016-12-15 | エルジー・ケム・リミテッド | Method for manufacturing lithium secondary battery |
| WO2019198716A1 (en) * | 2018-04-09 | 2019-10-17 | 日産自動車株式会社 | Nonaqueous electrolyte secondary battery |
| US11764403B2 (en) | 2017-10-16 | 2023-09-19 | Gs Yuasa International Ltd. | Nonaqueous electrolyte secondary battery |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2001256966A (en) * | 2000-03-13 | 2001-09-21 | Hitachi Maxell Ltd | Nonaqueous secondary battery and method for charging the battery |
| JP2009129797A (en) * | 2007-11-27 | 2009-06-11 | Gs Yuasa Corporation:Kk | Nonaqueous electrolyte battery |
| JP2009146695A (en) * | 2007-12-13 | 2009-07-02 | Bridgestone Corp | Nonaqueous electrolyte and nonaqueous electrolyte secondary power source having the same |
| JP2010129449A (en) * | 2008-11-28 | 2010-06-10 | Sanyo Electric Co Ltd | Nonaqueous electrolyte for secondary battery and nonaqueous electrolyte secondary battery |
| JP2011150958A (en) * | 2010-01-25 | 2011-08-04 | Sony Corp | Nonaqueous electrolyte and nonaqueous electrolyte battery |
-
2012
- 2012-02-10 JP JP2012026896A patent/JP2013145732A/en active Pending
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2001256966A (en) * | 2000-03-13 | 2001-09-21 | Hitachi Maxell Ltd | Nonaqueous secondary battery and method for charging the battery |
| JP2009129797A (en) * | 2007-11-27 | 2009-06-11 | Gs Yuasa Corporation:Kk | Nonaqueous electrolyte battery |
| JP2009146695A (en) * | 2007-12-13 | 2009-07-02 | Bridgestone Corp | Nonaqueous electrolyte and nonaqueous electrolyte secondary power source having the same |
| JP2010129449A (en) * | 2008-11-28 | 2010-06-10 | Sanyo Electric Co Ltd | Nonaqueous electrolyte for secondary battery and nonaqueous electrolyte secondary battery |
| JP2011150958A (en) * | 2010-01-25 | 2011-08-04 | Sony Corp | Nonaqueous electrolyte and nonaqueous electrolyte battery |
Cited By (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2014126256A1 (en) * | 2013-02-18 | 2014-08-21 | 株式会社日本触媒 | Electrolyte solution and lithium ion secondary battery provided with same |
| JPWO2014126256A1 (en) * | 2013-02-18 | 2017-02-02 | 株式会社日本触媒 | Electrolytic solution and lithium ion secondary battery provided with the same |
| US10978740B2 (en) | 2013-02-18 | 2021-04-13 | Nippon Shokubai Co., Ltd. | Electrolyte solution and lithium ion secondary battery provided with same |
| JP2015191737A (en) * | 2014-03-27 | 2015-11-02 | ダイキン工業株式会社 | Electrolyte and electrochemical device |
| JP2016539487A (en) * | 2014-09-30 | 2016-12-15 | エルジー・ケム・リミテッド | Method for manufacturing lithium secondary battery |
| US10263293B2 (en) | 2014-09-30 | 2019-04-16 | Lg Chem, Ltd. | Manufacturing method of lithium secondary battery |
| US11764403B2 (en) | 2017-10-16 | 2023-09-19 | Gs Yuasa International Ltd. | Nonaqueous electrolyte secondary battery |
| WO2019198716A1 (en) * | 2018-04-09 | 2019-10-17 | 日産自動車株式会社 | Nonaqueous electrolyte secondary battery |
| CN111954952A (en) * | 2018-04-09 | 2020-11-17 | 日产自动车株式会社 | Nonaqueous electrolyte secondary battery |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6113496B2 (en) | Lithium secondary battery | |
| JP6483943B2 (en) | Lithium secondary battery | |
| JP6204647B2 (en) | Laminated alkaline metal battery | |
| JP6018820B2 (en) | Non-aqueous electrolyte for lithium secondary battery and lithium secondary battery provided with the same | |
| JP5357517B2 (en) | Lithium ion secondary battery | |
| WO2022239807A1 (en) | Non-aqueous electrolytic solution and secondary battery | |
| JP2014203748A (en) | Nonaqueous electrolytic solution for lithium ion secondary batteries, and lithium ion secondary battery having the same | |
| US8999589B2 (en) | Nonaqueous secondary battery | |
| JP2017069164A (en) | Lithium ion secondary battery | |
| JP5893517B2 (en) | Non-aqueous electrolyte | |
| JP2013145732A (en) | Lithium secondary battery | |
| JP2014531720A (en) | Lithium ion secondary battery with suppressed internal short circuit | |
| JP6208934B2 (en) | Lithium ion secondary battery | |
| JP5848587B2 (en) | Lithium secondary battery | |
| JPWO2019235469A1 (en) | Reduced graphene material | |
| JP2013145731A (en) | Lithium secondary battery | |
| JP2015062154A (en) | Lithium ion secondary battery | |
| JP2013084592A (en) | Alkali metal battery | |
| JP5727985B2 (en) | Battery electrode and battery using the same | |
| CN108352571A (en) | Non-aqueous electrolyte for secondary battery and secondary cell | |
| CN110574211A (en) | Lithium ion secondary battery, method for manufacturing lithium ion secondary battery, and electrolyte for lithium ion secondary battery | |
| JP6315775B2 (en) | Lithium ion secondary battery | |
| WO2024090573A1 (en) | Non-aqueous electrolyte solution and lithium-ion secondary battery using same | |
| JP2015018602A (en) | Nonaqueous electrolyte secondary battery | |
| WO2024106166A1 (en) | Non-aqueous electrolyte secondary battery |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20150119 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20150225 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20150925 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20150929 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20160308 |