JP2012201628A - 芳香族ハロゲン化合物の製造方法 - Google Patents
芳香族ハロゲン化合物の製造方法 Download PDFInfo
- Publication number
- JP2012201628A JP2012201628A JP2011067578A JP2011067578A JP2012201628A JP 2012201628 A JP2012201628 A JP 2012201628A JP 2011067578 A JP2011067578 A JP 2011067578A JP 2011067578 A JP2011067578 A JP 2011067578A JP 2012201628 A JP2012201628 A JP 2012201628A
- Authority
- JP
- Japan
- Prior art keywords
- group
- substituent
- formula
- compound
- aromatic
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
Landscapes
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
Description
本発明は芳香族ハロゲン化合物の製造方法に関する。
芳香族ハロゲン化合物は、機能性材料、医薬中間体等の用途において有用な化合物である。芳香族ハロゲン化合物を合成する方法としては、例えば、芳香族ボロン酸化合物に水とメタノールの存在下で臭化銅を作用させることにより芳香族臭素化合物を合成する方法が提案されている(非特許文献1)。
Synthesis,2005,547.
しかし、上述した方法では、目的とする芳香族ハロゲン化合物の収率が不十分である。
そこで、本発明の目的は、高収率で芳香族ハロゲン化合物が得られる製造方法を提供することにある。
本発明者らは、鋭意検討を行った結果、高収率で芳香族ハロゲン化合物が得られる製造方法を見出し、本発明を完成するに至った。
即ち、本発明は、下記式(1):
[式(1)中、Arは置換基を有していてもよい芳香族基を表し、R4は、水素原子、置換基を有していてもよいアルキル基、又は、置換基を有していてもよいアリール基を表す。複数個あるR4は、同一であっても異なっていてもよく、互いに結合して環を形成してもよい。nは1以上の整数である。]
で表される化合物(以下、「芳香族ボロン酸化合物」と言う。)を、下記式(2):
[式(2)中、R1及びR2は、それぞれ独立に、水素原子、置換基を有していてもよいアルキル基、又は、置換基を有していてもよいアリール基を表す。R3は、水素原子、置換基を有していてもよいアルキル基、置換基を有していてもよいアリール基、置換基を有していてもよいアルコキシ基、置換基を有していてもよいアリールオキシ基、又は、置換基を有していてもよいアミノ基を表す。R2とR3とは、互いに結合して環を形成してもよい。R5は、直接結合、置換基を有していてもよいアルキレン基、又は、置換基を有していてもよいアリーレン基を表す。]
で表される化合物の存在下で、ハロゲン化剤と反応させることを含む、下記式(3):
本発明の製造方法によれば、高収率で芳香族ハロゲン化合物を製造することができる。また、本発明の製造方法の好ましい実施形態では、芳香族ハロゲン化合物を製造することができる。
以下、本発明を詳細に説明する。
<芳香族ボロン酸化合物>
前記式(1)中、Arで表される置換基を有していてもよい芳香族基は、芳香環から水素原子n個を取り除いた残りの原子団である。芳香環には、芳香族炭化水素環、及び、芳香族複素環がある。これらの芳香族炭化水素環及び芳香族複素環は、単環、多環のいずれでもよい。
前記式(1)中、Arで表される置換基を有していてもよい芳香族基は、芳香環から水素原子n個を取り除いた残りの原子団である。芳香環には、芳香族炭化水素環、及び、芳香族複素環がある。これらの芳香族炭化水素環及び芳香族複素環は、単環、多環のいずれでもよい。
芳香族炭化水素環としては、例えば、芳香環を構成する炭素原子数が6〜20の芳香族炭化水素環が挙げられる。この芳香族炭化水素環としては、ベンゼン環等の単環式芳香族炭化水素環、ビフェニル環、ターフェニル環、ナフタレン環、アントラセン環、フェナントレン環、テトラセン環、クリセン環、ピレン環、ペリレン環等の多環式芳香族炭化水素環が好ましい。
芳香族複素環としては、例えば、芳香環を構成する原子数が5〜14であり、かつ、1〜3個の窒素原子、1〜3個の酸素原子、及び/又は、1〜3個の硫黄原子を含む、芳香族複素環が挙げられる。この芳香族複素環としては、フラン環、ピロール環、チオフェン環、ピリジン環、チアゾール環、イミダゾール環、オキサゾール環、ピリミジン環、トリアジン環等の単環式芳香族複素環、キノリン環、イソキノリン環、キノキサリン環、フェナントロリン環等の多環式芳香族複素環が好ましい。
芳香環としては、単環式芳香族炭化水素環、多環式芳香族炭化水素環及び多環式芳香族複素環が好ましく、単環式芳香族炭化水素環及び多環式芳香族炭化水素環がより好ましく、多環式芳香族炭化水素環が更に好ましく、アントラセン環、フェナントレン環、及び、ピレン環が特に好ましく、ピレン環がとりわけ好ましい。
Arで表される置換基を有していてもよい芳香族基が有し得る置換基としては、例えば、アルキル基、アルコキシ基、アリール基、1価の複素環基、カルボキシル基、置換カルボキシル基、アミノ基、置換アミノ基、ニトロ基、シアノ基、及び、ハロゲン原子が挙げられ、アルキル基、アルコキシ基、アリール基、1価の複素環基、及び、置換アミノ基が好ましく、アルキル基、アルコキシ基、アリール基、及び、1価の複素環基がより好ましく、アルキル基、及び、アルコキシ基が更に好ましい。これらの置換基における水素原子は、アルキル基、アルコキシ基、置換カルボキシル基等の置換基(以下、「二次置換基」と言う。)で置換されていてもよい。
置換基としてのアルキル基は、直鎖、分岐鎖、環状鎖のいずれでもよく、その炭素原子数は、二次置換基の炭素原子数を含めないで、1〜20が好ましく、1〜10がより好ましい。
前記アルキル基としては、例えば、メチル基、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、イソブチル基、sec−ブチル基、tert−ブチル基、n−ペンチル基、n−ヘキシル基、シクロヘキシル基、n−ヘプチル基、n−オクチル基、2−エチルヘキシル基、n−ノニル基、n−デシル基、n−ドデシル基が挙げられ、メチル基、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、イソブチル基、sec−ブチル基、tert−ブチル基、n−ペンチル基、n−ヘキシル基、シクロヘキシル基、n−ヘプチル基、n−オクチル基が好ましい。
前記アルキル基としては、例えば、メチル基、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、イソブチル基、sec−ブチル基、tert−ブチル基、n−ペンチル基、n−ヘキシル基、シクロヘキシル基、n−ヘプチル基、n−オクチル基、2−エチルヘキシル基、n−ノニル基、n−デシル基、n−ドデシル基が挙げられ、メチル基、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、イソブチル基、sec−ブチル基、tert−ブチル基、n−ペンチル基、n−ヘキシル基、シクロヘキシル基、n−ヘプチル基、n−オクチル基が好ましい。
置換基としてのアルコキシ基は、直鎖、分岐鎖、環状鎖のいずれでもよく、その炭素原子数は、二次置換基の炭素原子数を含めないで、1〜20が好ましく、1〜10がより好ましい。
前記アルコキシ基としては、例えば、メトキシ基、エトキシ基、n−プロピルオキシ基、イソプロピルオキシ基、n−ブトキシ基、イソブトキシ基、sec−ブトキシ基、tert−ブトキシ基、n−ペンチルオキシ基、n−ヘキシルオキシ基、シクロヘキシルオキシ基、n−ヘプチルオキシ基、n−オクチルオキシ基、2−エチルヘキシルオキシ基、n−ノニルオキシ基、n−デシルオキシ基、n−ドデシルオキシ基等が挙げられ、メトキシ基、エトキシ基、n−プロピルオキシ基、イソプロピルオキシ基、n−ブトキシ基、イソブトキシ基、sec−ブトキシ基、tert−ブトキシ基、n−ペンチルオキシ基、n−ヘキシルオキシ基、シクロヘキシルオキシ基が好ましい。
前記アルコキシ基としては、例えば、メトキシ基、エトキシ基、n−プロピルオキシ基、イソプロピルオキシ基、n−ブトキシ基、イソブトキシ基、sec−ブトキシ基、tert−ブトキシ基、n−ペンチルオキシ基、n−ヘキシルオキシ基、シクロヘキシルオキシ基、n−ヘプチルオキシ基、n−オクチルオキシ基、2−エチルヘキシルオキシ基、n−ノニルオキシ基、n−デシルオキシ基、n−ドデシルオキシ基等が挙げられ、メトキシ基、エトキシ基、n−プロピルオキシ基、イソプロピルオキシ基、n−ブトキシ基、イソブトキシ基、sec−ブトキシ基、tert−ブトキシ基、n−ペンチルオキシ基、n−ヘキシルオキシ基、シクロヘキシルオキシ基が好ましい。
置換基としてのアリール基は、芳香族炭化水素から水素原子1個を取り除いた残りの原子団であり、芳香族炭化水素環2個以上が直接結合してなる基、及び、ビニレン基等を介して結合してなる基を含む。アリール基において、芳香環を構成する炭素原子数は、二次置換基の炭素原子数を含めないで、6〜20が好ましく、6〜10がより好ましい。
前記アリール基としては、例えば、フェニル基、1−ナフチル基、2−ナフチル基、1−アントラセニル基、2−アントラセニル基、9−アントラセニル基、1−テトラセニル基、1−ピレニル基、2−ピレニル基、2−ペリレニル基、3−ペリレニル基、2−フルオレニル基、3−フルオレニル基、4−フルオレニル基が挙げられ、フェニル基、1−ナフチル基、2−ナフチル基、1−アントラセニル基、2−アントラセニル基、9−アントラセニル基、1−ピレニル基、2−ピレニル基、2−フルオレニル基が好ましく、フェニル基、1−ナフチル基、2−ナフチル基がより好ましい。
前記アリール基としては、例えば、フェニル基、1−ナフチル基、2−ナフチル基、1−アントラセニル基、2−アントラセニル基、9−アントラセニル基、1−テトラセニル基、1−ピレニル基、2−ピレニル基、2−ペリレニル基、3−ペリレニル基、2−フルオレニル基、3−フルオレニル基、4−フルオレニル基が挙げられ、フェニル基、1−ナフチル基、2−ナフチル基、1−アントラセニル基、2−アントラセニル基、9−アントラセニル基、1−ピレニル基、2−ピレニル基、2−フルオレニル基が好ましく、フェニル基、1−ナフチル基、2−ナフチル基がより好ましい。
置換基としての1価の複素環基は、複素環式化合物から水素原子1個を取り除いた残りの原子団である。複素環式化合物は、通常、芳香族複素環式化合物である。芳香族複素環式化合物は、芳香族複素環を構成する原子数が5〜14であり、かつ、1〜3個の窒素原子、1〜3個の酸素原子、及び/又は、1〜3個の硫黄原子を含む化合物であることが好ましく、芳香族複素環を構成する原子数が5〜10であり、かつ、1〜3個の窒素原子、1個若しくは2個の酸素原子、及び/又は、1個若しくは2個の硫黄原子を含む化合物であることがより好ましい。
前記1価の複素環基としては、例えば、フリル基、ピロリル基、チエニル基、ピリジル基、チアゾリル基、イミダゾリル基、オキサゾリル基、ピリミジル基、トリアジニル基、キノリル基、イソキノリル基、キノキサリリル基、フェナントリル基が挙げられ、チエニル基、ピリジル基、ピリミジル基、トリアジニル基、キノリル基が好ましく、チエニル基、ピリジル基、ピリミジル基、トリアジニル基がより好ましい。
前記1価の複素環基としては、例えば、フリル基、ピロリル基、チエニル基、ピリジル基、チアゾリル基、イミダゾリル基、オキサゾリル基、ピリミジル基、トリアジニル基、キノリル基、イソキノリル基、キノキサリリル基、フェナントリル基が挙げられ、チエニル基、ピリジル基、ピリミジル基、トリアジニル基、キノリル基が好ましく、チエニル基、ピリジル基、ピリミジル基、トリアジニル基がより好ましい。
置換基である置換カルボキシル基としては、例えば、カルボキシル基における水素原子が、アルキル基、アリール基又は1価の複素環基で置換されたカルボキシル基が挙げられる。その炭素原子数は、二次置換基の炭素原子数を含めないで、好ましくは2〜30であり、より好ましくは2〜20である。
前記置換カルボキシル基としては、例えば、メトキシカルボニル基、エトキシカルボニル基、プロピルオキシカルボニル基、イソプロピルオキシカルボニル基、ブトキシカルボニル基、イソブトキシカルボニル基、tert−ブトキシカルボニル基、ヘキシルオキシカルボニル基、シクロヘキシルオキシカルボニル基、フェノキシカルボニル基、ピリジルオキシカルボニル基が挙げられ、メトキシカルボニル基、エトキシカルボニル基、プロピルオキシカルボニル基、イソプロピルオキシカルボニル基、ブトキシカルボニル基、tert−ブトキシカルボニル基、ヘキシルオキシカルボニル基が好ましい。
前記置換カルボキシル基としては、例えば、メトキシカルボニル基、エトキシカルボニル基、プロピルオキシカルボニル基、イソプロピルオキシカルボニル基、ブトキシカルボニル基、イソブトキシカルボニル基、tert−ブトキシカルボニル基、ヘキシルオキシカルボニル基、シクロヘキシルオキシカルボニル基、フェノキシカルボニル基、ピリジルオキシカルボニル基が挙げられ、メトキシカルボニル基、エトキシカルボニル基、プロピルオキシカルボニル基、イソプロピルオキシカルボニル基、ブトキシカルボニル基、tert−ブトキシカルボニル基、ヘキシルオキシカルボニル基が好ましい。
置換基である置換アミノ基としては、アミノ基における水素原子の1〜2個が、アルキル基、アリール基及び1価の複素環基からなる群から選ばれる1〜2個の基で置換されたアミノ基が挙げられる。その炭素原子数は、二次置換基の炭素原子数を含めないで、好ましくは1〜40であり、より好ましくは2〜30である。
置換アミノ基が有し得るアルキル基の炭素原子数は、好ましくは1〜15であり、より好ましくは1〜8である。置換アミノ基が有し得るアルキル基としては、例えば、メチル基、n−ブチル基、tert−ブチル基、n−オクチル基が挙げられる。
前記置換アミノ基としては、例えば、メチルアミノ基、ジメチルアミノ基、ジイソプロピルアミノ基、ジ−n−ブチルアミノ基、ジ−n−ヘキシルアミノ基、ジシクロヘキシルアミノ基、フェニルアミノ基、ジフェニルアミノ基、ジ−1−ナフチルアミノ基、ジ−1−ビレニルアミノ基、ジピリジルアミノ基、ジピリミジルアミノ基、N,N−ビス(4−フェニルフェニル)アミノ基が挙げられる。
置換アミノ基が有し得るアルキル基の炭素原子数は、好ましくは1〜15であり、より好ましくは1〜8である。置換アミノ基が有し得るアルキル基としては、例えば、メチル基、n−ブチル基、tert−ブチル基、n−オクチル基が挙げられる。
前記置換アミノ基としては、例えば、メチルアミノ基、ジメチルアミノ基、ジイソプロピルアミノ基、ジ−n−ブチルアミノ基、ジ−n−ヘキシルアミノ基、ジシクロヘキシルアミノ基、フェニルアミノ基、ジフェニルアミノ基、ジ−1−ナフチルアミノ基、ジ−1−ビレニルアミノ基、ジピリジルアミノ基、ジピリミジルアミノ基、N,N−ビス(4−フェニルフェニル)アミノ基が挙げられる。
置換基であるハロゲン原子としては、例えば、フッ素原子、塩素原子、臭素原子、ヨウ素原子が挙げられ、塩素原子、臭素原子、ヨウ素原子が好ましい。
前記式(1)中、R4は、水素原子、置換基を有していてもよいアルキル基、又は、置換基を有していてもよいアリール基を表す。
R4で表される置換基を有していてもよいアルキル基の定義、例は、Arで表される置換基を有していてもよい芳香族基が有し得る置換基であるアルキル基の定義、例と同じである。但し、R4で表される置換基を有していてもよいアルキル基としては、メチル基、エチル基、n−プロピル基、イソプロピル基が好ましい。
前記アルキル基が有し得る置換基としては、例えば、アルコキシ基、アリール基、アミノ基、置換アミノ基、水酸基、ハロゲン原子が挙げられ、アルコキシ基、アミノ基、置換アミノ基、水酸基が好ましく、アルコキシ基、置換アミノ基がより好ましい。これらのアルコキシ基、アリール基、置換アミノ基、ハロゲン原子の定義、例は、Arで表される置換基を有していてもよい芳香族基が有し得る置換基であるアルコキシ基、アリール基、置換アミノ基、ハロゲン原子の定義、例と同じである。
前記アルキル基が有し得る置換基としては、例えば、アルコキシ基、アリール基、アミノ基、置換アミノ基、水酸基、ハロゲン原子が挙げられ、アルコキシ基、アミノ基、置換アミノ基、水酸基が好ましく、アルコキシ基、置換アミノ基がより好ましい。これらのアルコキシ基、アリール基、置換アミノ基、ハロゲン原子の定義、例は、Arで表される置換基を有していてもよい芳香族基が有し得る置換基であるアルコキシ基、アリール基、置換アミノ基、ハロゲン原子の定義、例と同じである。
R4で表される置換基を有していてもよいアリール基の定義、例は、Arで表される置換基を有していてもよい芳香族基が有し得る置換基であるアリール基の定義、例と同じである。但し、R4で表される置換基を有していてもよいアリール基としては、フェニル基が好ましい。
前記アリール基が有し得る置換基としては、例えば、アルキル基、アルコキシ基、アミノ基、置換アミノ基、置換カルボキシル基、水酸基、ハロゲン原子が挙げられ、アルキル基、アルコキシ基、アミノ基、置換アミノ基、置換カルボキシル基、ハロゲン原子が好ましく、アルキル基、アルコキシ基、置換アミノ基がより好ましい。これらのアルキル基、アルコキシ基、置換アミノ基、置換カルボキシル基、ハロゲン原子の定義、例は、Arで表される置換基を有していてもよい芳香族基が有し得る置換基であるアルキル基、アルコキシ基、アリール基、置換アミノ基、ハロゲン原子の定義、例と同じである。
前記アリール基が有し得る置換基としては、例えば、アルキル基、アルコキシ基、アミノ基、置換アミノ基、置換カルボキシル基、水酸基、ハロゲン原子が挙げられ、アルキル基、アルコキシ基、アミノ基、置換アミノ基、置換カルボキシル基、ハロゲン原子が好ましく、アルキル基、アルコキシ基、置換アミノ基がより好ましい。これらのアルキル基、アルコキシ基、置換アミノ基、置換カルボキシル基、ハロゲン原子の定義、例は、Arで表される置換基を有していてもよい芳香族基が有し得る置換基であるアルキル基、アルコキシ基、アリール基、置換アミノ基、ハロゲン原子の定義、例と同じである。
前記式(1)中、−B(OR4)2において、2個のR4は、共に水素原子であること、共に置換基を有していてもよいアルキル基であり該アルキル基が互いに結合して環を形成していること、共に置換基を有していてもよいアリール基であり該アリール基が互いに結合して環を形成していることが好ましく、共に水素原子であること、共に置換基を有していてもよいアルキル基であり該アルキル基が互いに結合して環を形成していることがより好ましい。
2個のR4が共に置換基を有していてもよいアルキル基であり該アルキル基が互いに結合して環を形成している場合、2個のR4は2価の基を表すことになる。このような2価の基としては、例えば、1,2−エタンジイル基、1,1,2,2、−テトラメチル−1,2−エタンジイル基、1,3−プロパンジイル基、2,2−ジメチル−1,3−プロパンジイル基が挙げられ、1,1,2,2、−テトラメチル−1,2−エタンジイル基、2,2−ジメチル−1,3−プロパンジイル基が好ましく、1,1,2,2、−テトラメチル−1,2−エタンジイル基がより好ましい。
2個のR4が共に置換基を有していてもよいアルキル基であり該アルキル基が互いに結合して環を形成している場合、2個のR4は2価の基を表すことになる。このような2価の基としては、例えば、1,2−エタンジイル基、1,1,2,2、−テトラメチル−1,2−エタンジイル基、1,3−プロパンジイル基、2,2−ジメチル−1,3−プロパンジイル基が挙げられ、1,1,2,2、−テトラメチル−1,2−エタンジイル基、2,2−ジメチル−1,3−プロパンジイル基が好ましく、1,1,2,2、−テトラメチル−1,2−エタンジイル基がより好ましい。
前記式(1)中、nは1以上の整数であり、芳香族ハロゲン化合物の収率がより高くなるので、1〜4の整数であることが好ましく、2〜4の整数であることがより好ましく、2であることが更に好ましい。n≧2である場合、−B(OR4)2が複数個存在することになり、それらは同一であっても異なっていてもよいが、それらは同一であることが好ましい。
前記式(1)で表される化合物としては、例えば、以下の化合物が挙げられる。
本発明の製造方法において、前記式(1)で表される化合物は、一種単独で用いても二種以上を併用してもよい。
<式(2)で表される化合物>
前記式(2)中、R1及びR2で表される置換基を有していてもよいアルキル基の定義は、R4で表される置換基を有していてもよいアルキル基の定義と同じである。前記アルキル基としては、例えば、メチル基、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、イソブチル基、sec−ブチル基、tert−ブチル基、n−ペンチル基、n−ヘキシル基、シクロヘキシル基、n−ヘプチル基、n−オクチル基、2−エチルヘキシル基、2−メトキシエチル基、2−アミノエチル基、N,N−ジメチル−3−アミノプロピル基、4−ヒドロキシブチル基、3−ブロモブチル基が挙げられ、メチル基、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、イソブチル基、sec−ブチル基、tert−ブチル基、n−ペンチル基、n−ヘキシル基、シクロヘキシル基、2−メトキシエチル基、2−アミノエチル基、N,N−ジメチル−3−アミノプロピル基、4−ヒドロキシブチル基、3−ブロモブチル基が好ましく、メチル基、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、イソブチル基、sec−ブチル基がより好ましく、メチル基、エチル基、n−プロピル基が更に好ましい。
前記式(2)中、R1及びR2で表される置換基を有していてもよいアルキル基の定義は、R4で表される置換基を有していてもよいアルキル基の定義と同じである。前記アルキル基としては、例えば、メチル基、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、イソブチル基、sec−ブチル基、tert−ブチル基、n−ペンチル基、n−ヘキシル基、シクロヘキシル基、n−ヘプチル基、n−オクチル基、2−エチルヘキシル基、2−メトキシエチル基、2−アミノエチル基、N,N−ジメチル−3−アミノプロピル基、4−ヒドロキシブチル基、3−ブロモブチル基が挙げられ、メチル基、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、イソブチル基、sec−ブチル基、tert−ブチル基、n−ペンチル基、n−ヘキシル基、シクロヘキシル基、2−メトキシエチル基、2−アミノエチル基、N,N−ジメチル−3−アミノプロピル基、4−ヒドロキシブチル基、3−ブロモブチル基が好ましく、メチル基、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、イソブチル基、sec−ブチル基がより好ましく、メチル基、エチル基、n−プロピル基が更に好ましい。
前記式(2)中、R1及びR2で表される置換基を有していてもよいアリール基の定義は、R4で表される置換基を有していてもよいアリール基の定義と同じである。前記アリール基としては、例えば、フェニル基、1−ナフチル基、2−ナフチル基、3,5−ジメチルフェニル基、2−メトキシフェニル基、4−アミノフェニル基、N,N−ジメチル−4−アミノフェニル基が挙げられ、フェニル基、4−アミノフェニル基、N,N−ジメチル−4−アミノフェニル基が好ましい。
前記式(2)中、R1及びR2としては、取り扱いやすく、かつ、芳香族ハロゲン化合物の収率がより高くなるので、水素原子、置換基を有していてもよいアルキル基が好ましく、置換基を有していてもよいアルキル基がより好ましい。
前記式(2)中、R3で表される置換基を有していてもよいアルキル基の定義は、R4で表される置換基を有していてもよいアルキル基の定義と同じである。前記アルキル基としては、例えば、メチル基、エチル基、イソプロピル基、2−メトキシエチル基、N,N−ジメチル−2−アミノエチル基が挙げられ、メチル基、エチル基、N,N−ジメチル−2−アミノエチル基が好ましく、メチル基、エチル基がより好ましい。
前記式(2)中、R3で表される置換基を有していてもよいアリール基の定義は、R4で表される置換基を有していてもよいアリール基の定義と同じである。前記アリール基としては、例えば、フェニル基、4−メトキシフェニル基が挙げられる。
前記式(2)中、R3で表される置換基を有していてもよいアルコキシ基の定義は、Arで表される置換基を有していてもよい芳香族基が有し得る置換基としてのアルコキシ基の定義と同じである。前記アルコキシ基が有し得る置換基としては、例えば、アリール基、アミノ基、置換アミノ基が挙げられ、アリール基が好ましい。前記アルコキシ基としては、例えば、メトキシ基、tert−ブトキシ基が挙げられ、メトキシ基が好ましい。
前記式(2)中、R3で表される置換基を有していてもよいアリールオキシ基は、置換基を有していてもよいアリール基とオキシ基(−O−)とが結合してなる基であり、該置換基を有していてもよいアリール基の定義、例は、R4で表される置換基を有していてもよいアリール基の定義、例と同じである。前記アリールオキシ基が有し得る置換基としては、例えば、アルキル基、アルコキシ基、アミノ基、置換アミノ基、水酸基、ハロゲン原子が挙げられ、アルキル基、アルコキシ基、アミノ基、置換アミノ基が好ましく、アルキル基、アルコキシ基、置換アミノ基がより好ましい。前記アリールオキシ基としては、例えば、フェノキシ基、2−メトキシフェノキシ基、1−ナフチルオキシ基が挙げられ、2−メトキシフェノキシ基が好ましい。
前記式(2)中、R3で表される置換基を有していてもよいアミノ基の定義、例は、Arで表される置換基を有していてもよい芳香族基が有し得る置換基としてのアミノ基、置換アミノ基の定義、例と同じである。
前記式(2)中、R3は、好ましくは、水素原子、置換基を有していてもよいアルキル基、置換基を有していてもよいアリール基であり、より好ましくは、水素原子、置換基を有していてもよいアルキル基であり、更に好ましくは、水素原子である。
前記式(2)中、R2とR3とが互いに結合して環を形成する場合、R2とR3とは一体となって2価の基を表すことになる。このような2価の基としては、例えば、1,3−プロパンジイル基、1,4−ブタンジイル基が挙げられ、1,3−プロパンジイル基が好ましい。
前記式(2)中、R5で表されるアルキレン基としては、例えば、メチレン基、1,1−エタンジイル基、1,2−エタンジイル基、1,3−プロパンジイル基が挙げられ、メチレン基、1,2−エタンジイル基が好ましい。
前記式(2)中、R5で表されるアリーレン基としては、例えば、o−フェニレン基、m−フェニレン基、p−フェニレン基が挙げられ、o−フェニレン基が好ましい。
前記式(2)中、R5は、好ましくは直接結合である。
前記式(2)で表される化合物としては、例えば、ホルムアミド、N−メチルホルムアミド、ホルムアニリド、4−メチルホルムアニリド、N−エチルアセトアミド、N−イソプロピルベンズアミド、アセトアニリド、N,N−ジフェニルホルムアミド、N,N−ジメチルホルムアミド(以下、「DMF」と言うことがある。)、N−メチルホルムアニリド、N,N−ジエチルホルムアミド、N,N−ジ−n−プロピルホルムアミド、N,N−ジイソプロピルホルムアミド、N,N−ジメチルアセトアミド 、N,N−ジメチルプロピオンアミド 、N,N−ジメチルベンズアミド 、N−アセチルエチレンジアミン、N−アセチルエタノールアミン、2−シアノ−N,N−ジプロピルアセトアミド、N−(4−メチルピリジン−2−イル)アセトアミド、4−ブロモ−3−クロロアセトアニリド、4−エトキシベンズアミド、1−メチル−2−ピロリドン(以下、「NMP」と言うことがある。))、2−ピペリドン、2−ピロリドン、1−(ジメチルアミノ)−2−プロパノン、3−ジメチルアミノプロピオフェノン、o−アミノアセトフェノン、m−アミノアセトフェノン、p−アミノアセトフェノン、3−ピロリジノン、1,3−ジアミノアセトン、尿素、1−メチル−3−フェニル尿素、トリメチル尿素、テトラメチル尿素、N−ブチル尿素、3−メチル−1,1−ジフェニル尿素、グリシンアミド、N−(3−アミノプロピル)−N−メチルカルバミン酸tert−ブチルエステル、N−メチル−N−フェニルウレタン、カルバミド酸フェニル、グリシンメチルエステル、L−アラニンメチルエステルが挙げられ、取り扱いやすく、かつ、芳香族ハロゲン化合物の収率がより高くなるので、N−メチルホルムアミド、4−メチルホルムアニリド、N−エチルアセトアミド、アセトアニリド、N,N−ジメチルホルムアミド、N−メチルホルムアニリド、N,N−ジエチルホルムアミド、N,N−ジメチルアセトアミド 、N,N−ジメチルプロピオンアミド 、N−アセチルエチレンジアミン、N−アセチルエタノールアミン、1−メチル−2−ピロリドン、2−ピロリドン、1−(ジメチルアミノ)−2−プロパノン、1−(ジメチルアミノ)−2−プロパノン、o−アミノアセトフェノンが好ましく、N,N−ジメチルホルムアミド、N−メチルホルムアニリド、N,N−ジエチルホルムアミド、N,N−ジメチルアセトアミド、N,N−ジメチルプロピオンアミド、1−メチル−2−ピロリドン、2−ピロリドンがより好ましく、N,N−ジメチルホルムアミド、N,N−ジエチルホルムアミド、N,N−ジメチルアセトアミド 、1−メチル−2−ピロリドンが更に好ましい。
前記式(2)で表される化合物は、溶媒として使用してもよいし、後述する溶媒に溶解させて使用してもよい。前記式(2)で表される化合物を溶媒として使用する場合は、反応温度において液体であるものであることが好ましい。
前記式(2)で表される化合物の割合は、芳香族ハロゲン化合物の収率がより高くなり、かつ、精製が容易であるので、前記式(1)で表される化合物1モル当たり、0.1モル以上が好ましく、1モル以上がより好ましく、1〜1000モルが更に好ましく、10〜500モルが特に好ましい。
本発明の製造方法において、前記式(2)で表される化合物は、一種単独で用いても二種以上を併用してもよい。
<ハロゲン化剤>
前記ハロゲン化剤としては、例えば、
[A]ハロゲン化銅(II)以外の銅塩とハロゲン化合物との組み合わせ、
[B]ハロゲン化銅(II)とハロゲン化合物との組み合わせ、及び、
[C]ハロゲン化銅(II)、
が挙げられ、取り扱いが容易であるので、[C]が好ましい。
前記ハロゲン化剤としては、例えば、
[A]ハロゲン化銅(II)以外の銅塩とハロゲン化合物との組み合わせ、
[B]ハロゲン化銅(II)とハロゲン化合物との組み合わせ、及び、
[C]ハロゲン化銅(II)、
が挙げられ、取り扱いが容易であるので、[C]が好ましい。
銅塩には、銅(I)塩、及び、銅(II)塩がある。
銅(I)塩としては、例えば、塩化銅(I)、臭化銅(I)、ヨウ化銅(I)等のハロゲン化銅(I)、酢酸銅(I)が挙げられる。
銅(II)塩としては、例えば、フッ化銅(II)、塩化銅(II)、臭化銅(II)、ヨウ化銅(II)等のハロゲン化銅(II)、硝酸銅(II)、硫酸銅(II)が挙げられ、塩化銅(II)、臭化銅(II)、ヨウ化銅(II)が好ましく、臭化銅(II)がより好ましい。
銅(I)塩としては、例えば、塩化銅(I)、臭化銅(I)、ヨウ化銅(I)等のハロゲン化銅(I)、酢酸銅(I)が挙げられる。
銅(II)塩としては、例えば、フッ化銅(II)、塩化銅(II)、臭化銅(II)、ヨウ化銅(II)等のハロゲン化銅(II)、硝酸銅(II)、硫酸銅(II)が挙げられ、塩化銅(II)、臭化銅(II)、ヨウ化銅(II)が好ましく、臭化銅(II)がより好ましい。
本発明の製造方法において、ハロゲン化剤のうちの銅塩の割合は、前記式(1)で表される化合物1モル当たり、通常、0.0001×nモル以上であり、好ましくは0.001×n〜1000×nモルであり、より好ましくは0.01×n〜100×nモルであり、更に好ましくは0.1×n〜10×nモルである。前記銅塩の割合が、前記式(1)で表される化合物1モル当たり、1×nモル以下である場合、ハロゲン化合物を併用することが好ましい。なお、nは、前記式(1)で表される化合物におけるnと同じであり、nが異なる2種以上の化合物を併用する場合には、平均値である。
前記ハロゲン化合物としては、例えば、
[i]塩素、臭素、ヨウ素、N−クロロスクシンイミド、N−ブロモスクシンイミド、N−ヨードスクシンイミド、1,3−ジブロモ−5,5−ジメチルヒダントイン、及び、
[ii]リチウムイオン、ナトリウムイオン、カリウムイオン、ルビジウムイオン、又は、セシウムイオンと、フッ化物イオン、塩化物イオン、臭化物イオン、又は、ヨウ化物イオンとからなる塩、
が挙げられる。
[i]塩素、臭素、ヨウ素、N−クロロスクシンイミド、N−ブロモスクシンイミド、N−ヨードスクシンイミド、1,3−ジブロモ−5,5−ジメチルヒダントイン、及び、
[ii]リチウムイオン、ナトリウムイオン、カリウムイオン、ルビジウムイオン、又は、セシウムイオンと、フッ化物イオン、塩化物イオン、臭化物イオン、又は、ヨウ化物イオンとからなる塩、
が挙げられる。
本発明の製造方法において、ハロゲン化剤のうちのハロゲン化合物の割合は、前記式(1)で表される化合物1モル当たり、通常、0.1×n〜100×nモルであり、好ましくは1×n〜60×nモルであり、より好ましくは1×n〜10×nモルである。
前記ハロゲン化剤としてハロゲン化銅(II)を使用する場合、芳香族ハロゲン化合物の収率がより高くなるので、水を併用することが好ましく、水を併用するとともに、前記式(2)で表される化合物として水との親和性が高い化合物を選択することがより好ましい。
水の種類としては、イオン交換水、蒸留水が好ましい。
本発明の製造方法において、水を用いる場合、水の割合は、前記式(1)で表される化合物1モル当たり、通常、0.1モル以上であり、芳香族ハロゲン化合物の収率がより高くなるので、好ましくは1モル以上であり、より好ましくは5モル以上であり、更に好ましくは5〜1000モルであり、特に好ましくは10〜500モルである。
本発明の製造方法において、ハロゲン化剤は、一種単独で用いても二種以上を併用してもよい。
<その他の成分>
本発明の製造方法では、芳香族ハロゲン化合物の収率がより高くなり、かつ、前記式(1)〜(3)で表される化合物の安定性が向上するので、反応温度は、0〜250℃が好ましく、0〜200℃がより好ましく、20〜180℃が更に好ましく、80〜150℃が特に好ましい。
本発明の製造方法において、通常、溶媒を用いる。この溶媒としては、例えば、メタノール、エタノール、イソプロパノール等のアルコール、ジエチルエーテル、テトラヒドロフラン等のエーテル、ヘキサン、トルエン、キシレン等の炭化水素系溶媒、アセトニトリル、アセトンが挙げられ、芳香族ハロゲン化合物の収率がより高くなるので、アルコール、アセトニトリルが好ましく、アルコールがより好ましく、イソプロパノールが更に好ましい。これらの溶媒としては、前記式(1)、(2)で表される化合物、及び、ハロゲン化剤との親和性が高いものが特に好ましい。
本発明の製造方法において、溶媒を用いる場合、溶媒の割合は、前記式(1)で表される化合物100重量部に対して、500重量部以下が好ましく、100重量部以下がより好ましく、50重量部以下が更に好ましい。
本発明の製造方法において、副反応を抑制するために、反応系中の脱酸素を行い、不活性ガス雰囲気下で反応を行うことが好ましい。不活性ガスとしては、例えば、窒素ガス、アルゴンガスが挙げられる。
本発明の製造方法において、反応時間は、通常、10分以上であり、好ましくは10分〜100時間であり、より好ましくは10分〜50時間であり、更に好ましくは30分〜24時間である。
本発明の製造方法において、各成分を混合する順番は制限されないが、副反応を抑制し易いので、加熱を行う場合には、加熱前に反応系中の脱酸素を行い、不活性ガス雰囲気下とすることが好ましい。
具体的には、まず、反応容器内部の気体を不活性ガスで置換し、次いで、前記式(1)で表される化合物、及び、前記式(2)で表される化合物を添加して混合し、ハロゲン化剤を添加した後、これらの混合物を加熱して反応温度まで昇温する方法が例示できる。この加熱は、ハロゲン化剤を添加する前に行ってもよい。
また、ハロゲン化剤としてハロゲン化銅(II)を使用する場合には、まず、反応容器内部の気体を不活性ガスで置換し、次いで、前記式(1)で表される化合物、及び、前記式(2)で表される化合物を添加して混合し、ハロゲン化銅(II)と水との混合物を添加した後、これらの混合物を加熱して反応温度まで昇温する方法が例示できる。この加熱は、ハロゲン化銅(II)を添加する前に行ってもよく、ハロゲン化銅(II)と水は別個に添加、混合してもよい。
これらの例示において、溶媒を用いる場合、前記式(1)で表される化合物、及び、前記式(2)で表される化合物を添加して混合する際に、溶媒も添加して混合することが好ましい。
具体的には、まず、反応容器内部の気体を不活性ガスで置換し、次いで、前記式(1)で表される化合物、及び、前記式(2)で表される化合物を添加して混合し、ハロゲン化剤を添加した後、これらの混合物を加熱して反応温度まで昇温する方法が例示できる。この加熱は、ハロゲン化剤を添加する前に行ってもよい。
また、ハロゲン化剤としてハロゲン化銅(II)を使用する場合には、まず、反応容器内部の気体を不活性ガスで置換し、次いで、前記式(1)で表される化合物、及び、前記式(2)で表される化合物を添加して混合し、ハロゲン化銅(II)と水との混合物を添加した後、これらの混合物を加熱して反応温度まで昇温する方法が例示できる。この加熱は、ハロゲン化銅(II)を添加する前に行ってもよく、ハロゲン化銅(II)と水は別個に添加、混合してもよい。
これらの例示において、溶媒を用いる場合、前記式(1)で表される化合物、及び、前記式(2)で表される化合物を添加して混合する際に、溶媒も添加して混合することが好ましい。
<芳香族ハロゲン化合物>
本発明の製造方法では、前記式(1)で表される化合物におけるn個の−B(OR4)2のうちm個がハロゲン原子Xに変換され、前記式(3)で表される化合物が得られる。そして、(n−m)個の−B(OR4)2が、未反応として残る。
本発明の製造方法では、前記式(1)で表される化合物におけるn個の−B(OR4)2のうちm個がハロゲン原子Xに変換され、前記式(3)で表される化合物が得られる。そして、(n−m)個の−B(OR4)2が、未反応として残る。
前記式(3)中、Ar及びR4は、前記と同じ意味を表す。
前記式(3)中、Xで表されるハロゲン原子は、ハロゲン化剤におけるハロゲン原子に由来する。例えば、ハロゲン化剤として臭化銅(II)を使用した場合、Xは臭素原子である。なお、Xは、−B(OR4)2が結合していたAr中の炭素原子に結合しているものであり、Arが置換基としてハロゲン原子を有する場合、該ハロゲン原子と、Xで表されるハロゲン原子とは、区別される。
本発明の製造方法において、前記式(1)中のnが2以上である場合、ハロゲン化剤及び/又は前記式(2)で表される化合物の割合を調節したり、反応温度及び/又は反応時間を調節したりすることで、前記式(3)中のmを調節することができる。
前記式(3)中、m=nであることが好ましい。m=nである芳香族ハロゲン化合物を得るためには、前記式(1)で表される化合物1モル当たり、ハロゲン化剤の割合を1×nモル以上とすればよい。
ハロゲン化剤としてハロゲン化銅(II)を使用して、m=nである芳香族ハロゲン化合物を得るためには、芳香族ハロゲン化合物の収率がより高くなり、かつ、精製が容易になるので、前記式(1)で表される化合物1モル当たり、ハロゲン化銅(II)の割合は、1×n〜1000×nモルとすることが好ましく、1×n〜100×nモルとすることがより好ましく、1×n〜10×nモルとすることが更に好ましく、2×n〜5×nモルとすることが特に好ましい。
ハロゲン化剤としてハロゲン化銅(II)を使用して、m=nである芳香族ハロゲン化合物を得るためには、芳香族ハロゲン化合物の収率がより高くなり、かつ、精製が容易になるので、前記式(1)で表される化合物1モル当たり、ハロゲン化銅(II)の割合は、1×n〜1000×nモルとすることが好ましく、1×n〜100×nモルとすることがより好ましく、1×n〜10×nモルとすることが更に好ましく、2×n〜5×nモルとすることが特に好ましい。
本発明の製造方法において、用いられる芳香族ボロン酸化合物と、得られる芳香族ハロゲン化合物との組み合わせの一例を、以下に示す。
本発明の製造方法において、反応系中に存在し得る不純物、未反応物等は、公知の方法で除去することができる。除去方法としては、例えば、不要成分の減圧留去、溶媒による洗浄除去、目的物の抽出、カラムクロマトグラフィーによる精製、再結晶、蒸留が挙げられ、また、ハロゲン化剤として銅塩を使用した場合には、酸、金属補足剤等による処理が挙げられる。
以下、実施例によって本発明を更に詳細に説明するが、本発明はこれらに限定されるものではない。
実施例において、高速液体クロマトグラフィー(以下、「HPLC」と言う。)による分析は、以下の条件で行った。
装置: 株式会社島津製作所製、Prominence(商品名)
カラム: 東京化成工業株式会社製
Kaseisorb LC ODS 2000−3(商品名)
4.6mmI.D.× 100mm
カラム温度: 40℃
移動相: 0.1体積%酢酸含有水/0.1体積%酢酸含有アセトニトリル
流量: 1.0mL/分
検出器: フォトダイオードアレイ検出器
装置: 株式会社島津製作所製、Prominence(商品名)
カラム: 東京化成工業株式会社製
Kaseisorb LC ODS 2000−3(商品名)
4.6mmI.D.× 100mm
カラム温度: 40℃
移動相: 0.1体積%酢酸含有水/0.1体積%酢酸含有アセトニトリル
流量: 1.0mL/分
検出器: フォトダイオードアレイ検出器
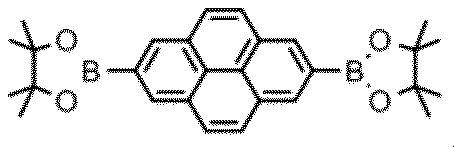
<合成例1>化合物1の合成
Chem.Commun.2005,2172−2174に記載の方法で、下記式:
Chem.Commun.2005,2172−2174に記載の方法で、下記式:
<実施例1>
窒素雰囲気下、化合物1(0.113g,0.25mmol)、CuBr2(0.273g,1.2mmol)、蒸留水(3.0g)、及び、DMF(4.8g)を100℃で5時間撹拌した。反応混合物をHPLC(検出波長254nm)で分析すると、化合物2の面積百分率は92.9%であった。
<実施例2>
窒素雰囲気下、化合物1(0.114g,0.25mmol)、CuBr2(0.278g,1.2mmol)、蒸留水(3.0g)、及び、NMP(5.2g)を100℃で14時間撹拌した。反応混合物をHPLC(検出波長254nm)で分析すると、化合物2の面積百分率は92.4%であった。
<実施例3>
窒素雰囲気下、化合物1(0.111g,0.24mmol)、CuBr2(0.277g,1.2mmol)、蒸留水(3.0g)、DMF(2.4g)、及び、イソプロピルアルコール(以下、「IPA」と言う。)(2.0g)を100℃で9時間撹拌した。反応混合物をHPLC(検出波長254nm)で分析すると、化合物2の面積百分率は94.6%であった。
窒素雰囲気下、化合物1(0.114g,0.25mmol)、CuBr2(0.278g,1.2mmol)、蒸留水(3.0g)、及び、NMP(5.2g)を100℃で14時間撹拌した。反応混合物をHPLC(検出波長254nm)で分析すると、化合物2の面積百分率は92.4%であった。
<実施例3>
窒素雰囲気下、化合物1(0.111g,0.24mmol)、CuBr2(0.277g,1.2mmol)、蒸留水(3.0g)、DMF(2.4g)、及び、イソプロピルアルコール(以下、「IPA」と言う。)(2.0g)を100℃で9時間撹拌した。反応混合物をHPLC(検出波長254nm)で分析すると、化合物2の面積百分率は94.6%であった。
<比較例1>
アルゴン雰囲気下、化合物1(0.227g,0.50mmol)、CuBr2(0.612g,2.7mmol)、蒸留水(10g)、及び、メタノール(7.9g)を還流下で17時間撹拌した。反応混合物をHPLC(検出波長254nm)で分析すると、化合物2の面積百分率は30.8%であった。
アルゴン雰囲気下、化合物1(0.227g,0.50mmol)、CuBr2(0.612g,2.7mmol)、蒸留水(10g)、及び、メタノール(7.9g)を還流下で17時間撹拌した。反応混合物をHPLC(検出波長254nm)で分析すると、化合物2の面積百分率は30.8%であった。
<比較例2>
アルゴン雰囲気下、化合物1(0.114g,0.25mmol)、CuBr2(0.289g,1.3mmol)、蒸留水(5.0g)、及び、IPA(16g)を100℃で10時間撹拌した。反応混合物をHPLC(検出波長254nm)で分析すると、化合物2の面積百分率は41.0%であった。
アルゴン雰囲気下、化合物1(0.114g,0.25mmol)、CuBr2(0.289g,1.3mmol)、蒸留水(5.0g)、及び、IPA(16g)を100℃で10時間撹拌した。反応混合物をHPLC(検出波長254nm)で分析すると、化合物2の面積百分率は41.0%であった。
<比較例3>
窒素雰囲気下、化合物1(0.229g,0.50mmol)、CuBr2(0.583g,2.6mmol)、蒸留水(7.0g)、及び、テトラヒドロフラン(8.9g)を還流下で6時間撹拌した。反応混合物をHPLC(検出波長254nm)で分析すると、化合物2の面積百分率は0.2%であった。
窒素雰囲気下、化合物1(0.229g,0.50mmol)、CuBr2(0.583g,2.6mmol)、蒸留水(7.0g)、及び、テトラヒドロフラン(8.9g)を還流下で6時間撹拌した。反応混合物をHPLC(検出波長254nm)で分析すると、化合物2の面積百分率は0.2%であった。
<比較例4>
窒素雰囲気下、化合物1(0.113g,0.25mmol)、CuBr2(0.276g,1.2mmol)、DMF(2.4g)、及び、IPA(2.0g)を100℃で6時間撹拌した。反応混合物をHPLC(検出波長254nm)で分析すると、化合物2の面積百分率は0.1%であった。
窒素雰囲気下、化合物1(0.113g,0.25mmol)、CuBr2(0.276g,1.2mmol)、DMF(2.4g)、及び、IPA(2.0g)を100℃で6時間撹拌した。反応混合物をHPLC(検出波長254nm)で分析すると、化合物2の面積百分率は0.1%であった。
[評価1]
実施例1〜3の製造方法によれば、比較例1〜4の製造方法に比べて、高収率で化合物2を得ることができた。
実施例1〜3の製造方法によれば、比較例1〜4の製造方法に比べて、高収率で化合物2を得ることができた。
<実施例4>
アルゴン雰囲気下、化合物3(0.260g,1.0mmol)、CuBr2(0.673g,3.0mmol)、蒸留水(10g)、及び、DMF(9.5g)を100℃で3時間撹拌した。反応混合物をHPLC(検出波長254nm)で分析すると、化合物4の面積百分率は94.6%であった。
<比較例5>
窒素雰囲気下、化合物3(0.263g,1.0mmol)、CuBr2(0.675g,3.0mmol)、蒸留水(10g)、及び、メタノール(7.9g)を還流下で3時間撹拌した。反応混合物をHPLC(検出波長254nm)で分析すると、化合物4の面積百分率は52.5%であった。
[評価2]
実施例4の製造方法によれば、比較例5の製造方法に比べて、高収率で化合物4を得ることができた。
実施例4の製造方法によれば、比較例5の製造方法に比べて、高収率で化合物4を得ることができた。
窒素雰囲気下、化合物5(0.030g,0.25mmol)、CuBr2(0.278g,1.2mmol)、蒸留水(3.0g)、DMF(2.4g)、及び、IPA(2.0g)を100℃で2時間撹拌した。反応混合物をHPLC(検出波長216nm)で分析すると、化合物6の面積百分率は98.8%であった。
[評価3]
実施例5の製造方法によれば、高収率で化合物6を得ることができた。
実施例5の製造方法によれば、高収率で化合物6を得ることができた。
<実施例6>
窒素雰囲気下、化合物7(0.084g,0.51mmol)、CuBr2(0.667g,3.0mmol)、蒸留水(10g)、及び、DMF(9.5g)を100℃で1時間30分撹拌した。反応混合物をHPLC(検出波長270nm)で分析すると、化合物8の面積百分率は67.6%であった。
<比較例6>
アルゴン雰囲気下、化合物7(0.085g,0.51mmol)、CuBr2(0.669g,3.0mmol)、蒸留水(10g)、及び、メタノール(7.9g)を還流下で1時間30分撹拌した。反応混合物をHPLC(検出波長270nm)で分析すると、化合物8の面積百分率は10.4%であった。
アルゴン雰囲気下、化合物7(0.085g,0.51mmol)、CuBr2(0.669g,3.0mmol)、蒸留水(10g)、及び、メタノール(7.9g)を還流下で1時間30分撹拌した。反応混合物をHPLC(検出波長270nm)で分析すると、化合物8の面積百分率は10.4%であった。
[評価4]
実施例6の製造方法によれば、比較例6の製造方法に比べて、高収率で化合物8を得ることができた。
実施例6の製造方法によれば、比較例6の製造方法に比べて、高収率で化合物8を得ることができた。
Claims (3)
- 下記式(1):
[式(1)中、Arは置換基を有していてもよい芳香族基を表し、R4は、水素原子、置換基を有していてもよいアルキル基、又は、置換基を有していてもよいアリール基を表す。複数個あるR4は、同一であっても異なっていてもよく、互いに結合して環を形成してもよい。nは1以上の整数である。]
で表される化合物を、下記式(2):
[式(2)中、R1及びR2は、それぞれ独立に、水素原子、置換基を有していてもよいアルキル基、又は、置換基を有していてもよいアリール基を表す。R3は、水素原子、置換基を有していてもよいアルキル基、置換基を有していてもよいアリール基、置換基を有していてもよいアルコキシ基、置換基を有していてもよいアリールオキシ基、又は、置換基を有していてもよいアミノ基を表す。R2とR3とは、互いに結合して環を形成してもよい。R5は、直接結合、置換基を有していてもよいアルキレン基、又は、置換基を有していてもよいアリーレン基を表す。]
で表される化合物の存在下で、ハロゲン化剤と反応させることを含む、下記式(3):
[式(3)中、Xはハロゲン原子を表す。mは1以上n以下の整数である。Ar及びR4は前記と同じ意味を表す。]
で表される化合物の製造方法。 - 前記式(2)中のR3が、水素原子、置換基を有していてもよいアルキル基、又は、置換基を有していてもよいアリール基である、請求項1に記載の製造方法。
- 前記式(2)中のR5が、直接結合である、請求項1又は2に記載の製造方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2011067578A JP2012201628A (ja) | 2011-03-25 | 2011-03-25 | 芳香族ハロゲン化合物の製造方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2011067578A JP2012201628A (ja) | 2011-03-25 | 2011-03-25 | 芳香族ハロゲン化合物の製造方法 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2012201628A true JP2012201628A (ja) | 2012-10-22 |
Family
ID=47182981
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011067578A Withdrawn JP2012201628A (ja) | 2011-03-25 | 2011-03-25 | 芳香族ハロゲン化合物の製造方法 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP2012201628A (ja) |
-
2011
- 2011-03-25 JP JP2011067578A patent/JP2012201628A/ja not_active Withdrawn
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Engelhart et al. | Pd-Catalyzed Coupling of Non-activated Dibromoarenes to 2, 3-Diaminoarenes: Formation of N, N′-Dihydropyrazines. | |
| US20080064878A1 (en) | Process for producing 1-pyridin-4-yl-indoles | |
| TW200835674A (en) | Process for preparing 2-amino-5-cyanobenzoic acid derivatives | |
| JP6765482B2 (ja) | 5,5−ジブロモ−5−フェニル吉草酸メチルエステル | |
| KR100614996B1 (ko) | 퍼플루오로알카디엔의 제조 방법 | |
| Nelson et al. | Nucleophilic perfluoroalkylation of nitrones | |
| TW201235336A (en) | Improved process for the preparation of 2,2-difluoroethylamine | |
| Norhafiefa et al. | Synthesis and characterization of alkoxy substituted p-cyano stilbene schiff bases | |
| EP3649101A1 (en) | Method for the preparation of 4-(heptafluoro-2-propyl) anilines | |
| JP2012201628A (ja) | 芳香族ハロゲン化合物の製造方法 | |
| Hjelmgaard et al. | Copper (I) mediated cross-coupling of amino acid derived organozinc reagents with acid chlorides | |
| CN103702978B (zh) | 制备2‑氨基‑5‑氰基‑n,3‑二甲基苯甲酰胺的方法 | |
| AU781641B2 (en) | Process for the preparation of 2-cyanopyridines | |
| CN103201251B (zh) | 由苄胺化合物起始制备2,2-二氟乙胺的方法 | |
| JP2012224557A (ja) | アミン化合物の製造方法 | |
| CN102093258B (zh) | 芳香型二脒化合物及其合成方法 | |
| JP4865337B2 (ja) | 2,3’−ビピリジル−6’−オンの製造方法 | |
| WO2019030187A1 (en) | PROCESS FOR THE PREPARATION OF 4- (HEPTAFLUORO-2-PROPYL) ANILINES | |
| AU2003215528A1 (en) | Method for manufacture of sertindole | |
| JP5754768B2 (ja) | 芳香族へテロ環化合物のニトリル化物の製造方法 | |
| JP2018162218A (ja) | 新規な環状尿素誘導体−三臭化水素酸塩 | |
| JP2025100292A (ja) | パーフルオロアルキレン基を有する芳香族化合物の製造方法 | |
| WO2025094700A1 (ja) | トリフルオロメタンスルホニル化剤組成物、及び、トリフルオロメタンスルホニルオキシ化合物の製造方法 | |
| JP5308692B2 (ja) | インドアニリン色素の製造方法 | |
| JP2005350427A (ja) | アルカン又はアルケン化合物の製造方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A300 | Withdrawal of application because of no request for examination |
Free format text: JAPANESE INTERMEDIATE CODE: A300 Effective date: 20140603 |