JP2010511632A - 5−リポキシゲナーゼ活性化タンパク質インヒビターおよび一酸化窒素モジュレーターを含んでいる組成物および治療法 - Google Patents
5−リポキシゲナーゼ活性化タンパク質インヒビターおよび一酸化窒素モジュレーターを含んでいる組成物および治療法 Download PDFInfo
- Publication number
- JP2010511632A JP2010511632A JP2009539527A JP2009539527A JP2010511632A JP 2010511632 A JP2010511632 A JP 2010511632A JP 2009539527 A JP2009539527 A JP 2009539527A JP 2009539527 A JP2009539527 A JP 2009539527A JP 2010511632 A JP2010511632 A JP 2010511632A
- Authority
- JP
- Japan
- Prior art keywords
- substituted
- unsubstituted
- modulator
- moiety
- flap
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- QAOAOVKBIIKRNL-UHFFFAOYSA-N CC(C)c(cc1)cc2c1[n](Cc(cc1)ccc1Cl)c(CC(C)(C)C(O)=O)c2SC(C)(C)C Chemical compound CC(C)c(cc1)cc2c1[n](Cc(cc1)ccc1Cl)c(CC(C)(C)C(O)=O)c2SC(C)(C)C QAOAOVKBIIKRNL-UHFFFAOYSA-N 0.000 description 1
- GGOIBOIDGMTXLN-UHFFFAOYSA-N CC(OCc1ncc(C)cc1)=O Chemical compound CC(OCc1ncc(C)cc1)=O GGOIBOIDGMTXLN-UHFFFAOYSA-N 0.000 description 1
- LCIROTSNBOFOAV-UHFFFAOYSA-N CCOC(C(C)(C)Cc([n](Cc1ccc(B2OC(C)(C)C(C)(C)O2)cc1)c(cc1)c2cc1OCc1ncc(C)cc1)c2SC(C)(C)C)=O Chemical compound CCOC(C(C)(C)Cc([n](Cc1ccc(B2OC(C)(C)C(C)(C)O2)cc1)c(cc1)c2cc1OCc1ncc(C)cc1)c2SC(C)(C)C)=O LCIROTSNBOFOAV-UHFFFAOYSA-N 0.000 description 1
- PKVLRDUHPGFYJO-UHFFFAOYSA-N CCOc(nc1)ccc1-c1ccc(C[n]2c(ccc(OCc3ncccc3)c3)c3c(SC(C)(C)C)c2CC(C)(C)C(OCC(CO)O)=O)cc1 Chemical compound CCOc(nc1)ccc1-c1ccc(C[n]2c(ccc(OCc3ncccc3)c3)c3c(SC(C)(C)C)c2CC(C)(C)C(OCC(CO)O)=O)cc1 PKVLRDUHPGFYJO-UHFFFAOYSA-N 0.000 description 1
- MJHGPZICGRYMDH-UHFFFAOYSA-N COc(cc1)ccc1NCc(cc1)ccc1Br Chemical compound COc(cc1)ccc1NCc(cc1)ccc1Br MJHGPZICGRYMDH-UHFFFAOYSA-N 0.000 description 1
- CGWMMQFGQVDRII-UHFFFAOYSA-N Nc(cc1)ccc1OCc1ncccc1 Chemical compound Nc(cc1)ccc1OCc1ncccc1 CGWMMQFGQVDRII-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/195—Carboxylic acids, e.g. valproic acid having an amino group
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/403—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil condensed with carbocyclic rings, e.g. carbazole
- A61K31/404—Indoles, e.g. pindolol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/08—Bronchodilators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/10—Drugs for disorders of the urinary system of the bladder
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/04—Antipruritics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/02—Drugs for disorders of the nervous system for peripheral neuropathies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/06—Antimigraine agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/10—Antimycotics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
- A61P33/02—Antiprotozoals, e.g. for leishmaniasis, trichomoniasis, toxoplasmosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/02—Antithrombotic agents; Anticoagulants; Platelet aggregation inhibitors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
Abstract
本明細書に開示するのは、5-リポキシゲナーゼ活性化タンパク質(FLAP)のインヒビターと哺乳動物中のNOレベルのモジュレーターを組み合わせた組成物および化合物である。NOモジュレーターは、哺乳動物中でNOの産生を誘発する薬物であるか、またはそれ自体が哺乳動物中でNOを産生する薬物である。さらに本明細書で開示するのは、こうした化合物の合成のための戦略、ならびにその複合化合物および組成物が所望の利点を提供するかどうかを試験するための方法である。また、FLAPインヒビターとNOモジュレーターを組み合わせた医薬組成物および製剤も本明細書に開示される。さらに本明細書に記載するのは、ヒトを含む哺乳動物の疾病、病態、および障害の治療のための、こうした組成物および化合物の使用方法である。こうした治療方法として、FLAPインヒビターとNOモジュレーターの哺乳動物への別々の投与、およびFLAPインヒビターとNOモジュレーターの哺乳動物への同時投与が含まれる。
Description
本出願は米国特許仮出願第60/868,024号、名称「5-リポキシゲナーゼ活性化タンパク質インヒビターおよび一酸化窒素モジュレーターを含んでいる組成物および治療法」(2006年11月30日受理)に基づく優先権を主張するものであり、この内容を参照として本明細書に組み入れる。
本開示は、医薬の分野、特定化すると、ロイコトリエン合成経路のインヒビター、特に5-リポキシゲナーゼ活性化タンパク質のインヒビターを配合した一酸化窒素モジュレーターによる、病態の治療のための方法および組成物に関係する。
一酸化窒素(NO)は、短命な無機フリーラジカルであって、重要な生物学的二次メッセンジャーである。NOはL-アルギニンから生化学的に合成され、一酸化窒素シンターゼと称される酵素の1ファミリーによって触媒される。哺乳動物には一酸化窒素シンターゼ(NOS)酵素の以下の3種のイソ型があり、互いに51-57%の相同性を共有している。
(i) 構成性Ca2+/カルモジュリン依存性酵素、内皮に局在し、受容体もしくは物理的刺激に応答してNOを放出し、平滑筋弛緩、血圧の低下、および血小板凝集の抑制の調節に関与する(eNOS);
(ii) 構成性Ca2+/カルモジュリン依存性酵素、主として神経組織中に見られ、受容体もしくは物理的刺激に応答してNOを放出し、長期増強作用にとって重要である(nNOS); ならびに
(iii) Ca2+非依存性酵素、血管平滑筋、マクロファージ、内皮細胞、および多数のその他の細胞のエンドトキシンおよびサイトカインによる活性化後に誘導される(iNOS)。
(ii) 構成性Ca2+/カルモジュリン依存性酵素、主として神経組織中に見られ、受容体もしくは物理的刺激に応答してNOを放出し、長期増強作用にとって重要である(nNOS); ならびに
(iii) Ca2+非依存性酵素、血管平滑筋、マクロファージ、内皮細胞、および多数のその他の細胞のエンドトキシンおよびサイトカインによる活性化後に誘導される(iNOS)。
NOSは活性のために5種の補助因子を必要とする複合体酵素である。そのN末端はオキシゲナーゼドメインであって、これにヘム、テトラヒドロビオプテリン(H4B)、およびL-アルギニンが結合する。そのC末端レダクターゼドメインは分子FAD(および多分FMN)、ならびにNADPHに結合する。以下を参照されたい: Huang, H., et al., J. Am. Chem. Soc., 123:2674-2676(2001)。
タンパク質、5-リポキシゲナーゼ活性化タンパク質(FLAP)は、ロイコトリエン合成の経路に関係している。特に、5-リポキシゲナーゼ活性化タンパク質(FLAP)はアラキドン酸との結合に関係し、これを5-リポキシゲナーゼに移送する。例えば以下を参照されたい: Abramovitz, M. et al., Eur. J. Biochem. 215:105-111(1993)。その後、5-リポキシゲナーゼはアラキドン酸の2ステップの酸素化および脱水を触媒することができて、中間体化合物、5-HPETE(5-ヒドロペルオキシエイコサテトラエン酸)に変換し、FLAPの存在中でこの5-HPETEをLTA4に変換させる。ロイコトリエンはロイコトリエン合成経路中でアラキドン酸から形成される生物学的化合物である(Samuelsson et al, Science, 220, 568-575, 1983)。これらは主として好酸球、好中球、マスト細胞、好塩基球、樹状細胞、マクロファージおよび単球によって合成される。ロイコトリエンは、例えば、平滑筋収縮、白血球活性化、サイトカイン分泌、および血管機能を含む、生物学的作用に関与するとされてきた。
発明の概要
本明細書に記載するのは、動物中のNOレベルを直接または間接的にモジュレートすることができる第1剤と動物中の5-リポキシゲナーゼ活性化タンパク質の活性を直接または間接的にモジュレートすることができる第2剤との併用を含んでいる、組成物、方法、技法および戦略である。第1剤に関しては、モジュレーションには以下が含まれる: NOのin vivo産生の増加、in vivo NO産生の抑制の減少、NO放出剤の供給、NOレベルの維持、またはNOレベルの低下の減少。第2剤に関しては、モジュレーションには以下が含まれる: FLAPの活性との拮抗、FLAPの活性の抑制、FLAPの活性の減少、FLAPへのアラキドン酸の供給性の低下、FLAPの転写の減少、FLAPの除去、分解、もしくは破壊の増加、およびFLAPの翻訳の減少。こうした併用剤の使用方法として、FLAPの抑制およびNOのモジュレーションが治療上の利益をもたらす、疾病、障害または病態がある患者を治療するための方法が含まれる。こうした疾病、障害または病態の例として以下が含まれる: 呼吸器、心血管、高血圧、骨吸収、悪性物および炎症性の疾病、障害および病態。
本明細書に記載するのは、動物中のNOレベルを直接または間接的にモジュレートすることができる第1剤と動物中の5-リポキシゲナーゼ活性化タンパク質の活性を直接または間接的にモジュレートすることができる第2剤との併用を含んでいる、組成物、方法、技法および戦略である。第1剤に関しては、モジュレーションには以下が含まれる: NOのin vivo産生の増加、in vivo NO産生の抑制の減少、NO放出剤の供給、NOレベルの維持、またはNOレベルの低下の減少。第2剤に関しては、モジュレーションには以下が含まれる: FLAPの活性との拮抗、FLAPの活性の抑制、FLAPの活性の減少、FLAPへのアラキドン酸の供給性の低下、FLAPの転写の減少、FLAPの除去、分解、もしくは破壊の増加、およびFLAPの翻訳の減少。こうした併用剤の使用方法として、FLAPの抑制およびNOのモジュレーションが治療上の利益をもたらす、疾病、障害または病態がある患者を治療するための方法が含まれる。こうした疾病、障害または病態の例として以下が含まれる: 呼吸器、心血管、高血圧、骨吸収、悪性物および炎症性の疾病、障害および病態。
第1剤として以下が可能である: (a) 動物の局所もしくは全身に直接NOを供給することができる部分; (b) 化学的もしくは酵素的反応時に、動物の局所もしくは全身に直接NOを供給することができる部分; (c) 照射時に、動物の局所もしくは全身に直接NOを供給することができる部分; (d) 動物の局所もしくは全身に間接的にNOを供給することができる部分; (e) 化学的もしくは酵素的反応時に、動物の局所もしくは全身に間接的にNOを供給することができる部分; (f) 照射時に、動物の局所もしくは全身に間接的にNOを供給することができる部分; (g) 第2剤に対して部分が1より多いNOを供給する、実施形態(a)〜(f)のいずれか; (h) 語句「に直接NOを供給することができる」を語句「で直接NOレベルをモジュレートすることができる」と交換するか、または語句「に間接的にNOを供給することができる」を語句「で間接的にNOレベルをモジュレートすることができる」と交換する実施形態(a)〜(f)のいずれか、換言すればモジュレーション実施形態; (i) 第1剤が細胞外で作用する、実施形態(a)〜(h)のいずれか; (j) 第1剤が細胞内で作用する、実施形態(a)〜(h)のいずれか; (k) 第1剤が細胞外および細胞内の両方で作用する、実施形態(a)〜(h)のいずれか; (l) 第2剤が5-リポキシゲナーゼ活性化タンパク質の活性を直接増加または促進する、実施形態(a)〜(k)のいずれか; (m) 第2剤が5-リポキシゲナーゼ活性化タンパク質の活性を間接的に増加または促進する、実施形態(a)〜(k)のいずれか; (n) 第2剤が5-リポキシゲナーゼ活性化タンパク質の活性を直接モジュレートする、実施形態(a)〜(k)のいずれか; (o) 第2剤が5-リポキシゲナーゼ活性化タンパク質の活性を間接的にモジュレートする、実施形態(a)〜(k)のいずれか; (p) 第2剤が5-リポキシゲナーゼ活性化タンパク質の活性を直接抑制する、実施形態(a)〜(k)のいずれか; (q) 第2剤が5-リポキシゲナーゼ活性化タンパク質の活性を間接的に抑制する、実施形態(a)〜(k)のいずれか; (r) 第2剤が局所的に作用する、実施形態(l)〜(q)のいずれか; (s) 第2剤が全身的に作用する、実施形態(l)
〜(q)のいずれか; (t) 第2剤が細胞内で作用する、実施形態(l)〜(q)のいずれか; (u) 第2剤が細胞外で作用する、実施形態(l)〜(q)のいずれか; (v) 第2剤が細胞内および細胞外で作用する、実施形態(l)〜(q)のいずれか; (w) 第1剤と第2剤が相乗的に作用して、患者に利益をもたらす、(a)〜(v)のいずれか; (x) 第1剤の活性によって、第1剤の不在中で投与する第2剤の治療上有効な量に比較して、第2剤の治療上有効な量が少なくなる、(a)〜(v)のいずれか; (y) 第2剤の活性によって、第2剤の不在中で投与する第1剤の治療上有効な量に比較して、第1剤の治療上有効な量が少なくなる、(a)〜(v)のいずれか; または(z) 第1剤が転写因子のモジュレートを介して作用する、(a)〜(y)のいずれか。
〜(q)のいずれか; (t) 第2剤が細胞内で作用する、実施形態(l)〜(q)のいずれか; (u) 第2剤が細胞外で作用する、実施形態(l)〜(q)のいずれか; (v) 第2剤が細胞内および細胞外で作用する、実施形態(l)〜(q)のいずれか; (w) 第1剤と第2剤が相乗的に作用して、患者に利益をもたらす、(a)〜(v)のいずれか; (x) 第1剤の活性によって、第1剤の不在中で投与する第2剤の治療上有効な量に比較して、第2剤の治療上有効な量が少なくなる、(a)〜(v)のいずれか; (y) 第2剤の活性によって、第2剤の不在中で投与する第1剤の治療上有効な量に比較して、第1剤の治療上有効な量が少なくなる、(a)〜(v)のいずれか; または(z) 第1剤が転写因子のモジュレートを介して作用する、(a)〜(y)のいずれか。
第1剤として、これを必要とする患者に投与したときに、結合形態のNOを化学的(酵素的を含む)に放出することによってNOを供給する、化合物または複合体が含まれる。こうした薬物は、化学的(酵素的を含む)に放出されることが可能な1、2、3、4、5、6、7、8、9、10もしくはそれ以上の結合NO基を持っている。例を挙げると、ダイマー、トリマー、オリゴマー、マルチマーまたはポリマー薬剤は、化学的(酵素的を含む)反応によって、所望のように放出されることが可能な2、3またはそれ以上の結合NO基を含んでいる。さらに、NOの放出は、光化学的、音響化学的、もしくは電気化学的活性化手段などの、別の活性化手段によって、発生させることもできる。
2種の薬剤は化学的に連結させるか、物理的に混合するかのいずれかである。化学的連結として、共有結合、イオン結合、水素結合、バンデルワールス相互作用またはこれらの併用が含まれる。化学的連結には、化学的連結基として作用することができる、治療上の活性がない部分もしくは治療上活性な部分に含まれる、架橋(もしくは連結)基を介して、FLAPインヒビターに接続させたNOモジュレーター分子、例えば、(FLAPインヒビター)-(架橋基)-(NOモジュレーター)も含まれる。NOをin vivoで放出する薬剤の場合、薬剤はとりわけ血管拡張性質を持ち、降圧性となる。第1剤は動物内のNOレベルを増加または維持することができる。その上、こうした組成物がさらに1医薬組成物の1成分となることができる。また、本明細書に記載するのは、疾病、障害または病態を治療するための方法であって、5-リポキシゲナーゼ活性化タンパク質のモジュレーションがその疾病、障害または病態の少なくとも1症候に有利に作用するものである。こうした治療方法は、動物内のNOレベルを直接または間接的にモジュレートすることができる第1剤と動物内の5-リポキシゲナーゼ活性化タンパク質の活性を直接または間接的にモジュレートすることができる第2剤の併用の投与を含んでいる。こうした薬剤の併用として、化学的連結薬剤、物理的混合薬剤、または物理的に分離された薬剤の連続もしくは同時投与が含まれる。
本明細書に記載する別の態様は、FLAPと拮抗するかこれを抑制し、かつ/またはNOレベルをin vivoでモジュレートするため、そして限定するわけではないが、高血圧、喘息、心筋梗塞、がん、および炎症性病態などの、NO依存性、NO介在性、ロイコトリエン依存性もしくはロイコトリエン介在性病態または疾病に悩む患者を治療するために使用する、式(I)の複合化合物、その医薬として許容される塩、医薬として許容されるN-オキシド、医薬として活性な代謝物、医薬として許容されるプロドラッグ、および医薬として許容される溶媒和物である。
Ax-L-B
式(I)
式中、
Aは、A'(A-X、A-H、A-、もしくはA+が含まれる)の形態ではNOモジュレーターである部分、または活性化/反応時にNOを産生する部分、または-NO2もしくは-ONO2から選択される部分であって、この際XはCOOH、CONH2、OH、NH2、ハロゲン、SH、もしくはCH3であり; xは0、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、17、19、もしくは20;
Lは、AおよびB部分を化学的に連結する結合または部分であって、化学的、酵素的、生物学的、光化学的、電気化学的、音響化学的、および(本明細書に記載する)その他の活性化手段によって、単一ステップまたは複数ステップによって開裂して、L'-AおよびB'、L'-BおよびA'、またはL'、A'およびB'を生成する;
BはB'(B-X、B-H、B-、もしくはB+が含まれる)の形態ではFLAPインヒビターである部分。
式(I)
式中、
Aは、A'(A-X、A-H、A-、もしくはA+が含まれる)の形態ではNOモジュレーターである部分、または活性化/反応時にNOを産生する部分、または-NO2もしくは-ONO2から選択される部分であって、この際XはCOOH、CONH2、OH、NH2、ハロゲン、SH、もしくはCH3であり; xは0、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、17、19、もしくは20;
Lは、AおよびB部分を化学的に連結する結合または部分であって、化学的、酵素的、生物学的、光化学的、電気化学的、音響化学的、および(本明細書に記載する)その他の活性化手段によって、単一ステップまたは複数ステップによって開裂して、L'-AおよびB'、L'-BおよびA'、またはL'、A'およびB'を生成する;
BはB'(B-X、B-H、B-、もしくはB+が含まれる)の形態ではFLAPインヒビターである部分。
Lはin vivoで容易に開裂するように、FLAPインヒビター上の好適な位置に接続される。例えば、FLAPインヒビターがカルボン酸を含有し、かつLがヒドロキシもしくはアミノ基を含有する場合、Lはエステルもしくはアミド結合を介してFLAPインヒビターの酸基と連結される。FLAPインヒビターがアミノ基を含有する場合、Lはアミド、カルボナートもしくはカルバマート基を介して接続される。FLAPインヒビターがアルコールもしくはフェノール基を含有する場合、Lはエーテル、エステル、カルボナートもしくはカルバマート基を介して接続される。1態様中、Lは単一ステップまたは複数ステップで開裂する部分である。1実施形態中、Ax-L-Bはin vivoで特定の部位のみで、または主に特定の部位で、FLAPインヒビターとNOモジュレーターに開裂する。単なる例示であるが、Ax-L-Bは投与時には完全性を維持しているが、主としてもしくは特定の細胞型のみで産生される特異的酵素(例えば、標的とするエステラーゼ)によって、FLAPインヒビターとNOモジュレーターに開裂する。別の実施形態中、FLAPインヒビターはAx-L-Bから(もしくはL-Bから)部位特異的経路(単一もしくは複数酵素)によって放出され、NOモジュレーターはAx-L-B(もしくはAx-L)から別の部位特異的経路(単一もしくは複数酵素)によって放出されるか、あるいは、FLAPインヒビターとNOモジュレーターの両方がAx-L-Bから同一の部位特異的経路(単一もしくは複数酵素)によって放出される。1態様中、開裂ステップ後、Lの1残基、または部分が「A」もしくは「B」とともに残留する。1態様中、さらなる開裂ステップで、「A」もしくは「B」とともになお残留しているL部分の別の部分もしくは残基を除去する。しかし、「A」基がNOモジュレーターとして作用し、「B」基がFLAPインヒビターとして作用することができるならば、開裂もしくはその後の反応後、「L」の1残基もしくは部分が「A」もしくは「B」とともに残留する。
1実施形態中、AまたはBがカルボン酸基を含むならば、エステルもしくはアミド結合を介してL-BもしくはL-A基と連結される。別の実施形態中、AもしくはBがアミノ基を含むならば、アミド、カルボナートもしくはカルバマート結合を介してL-BもしくはL-A基と連結される。さらに別の実施形態中、AもしくはBがアルコキシもしくはフェノキシ部分を含有するならば、これらの部分を介してL-BもしくはL-A基と連結される。
本開示は、1以上のFLAPインヒビターとスペーサー部分を介して共有結合している1以上のNOモジュレーター(患者内でNOを放出する薬物、または患者内で別様にNOを上昇させるかNOの産生を維持する薬物、または患者内で別様にNOレベルを維持する薬物が含まれる)を含むが、スペーサーによって併用療法がin vivoで作用することが可能になっている、組成物、方法、技法および戦略をも提供する。本明細書で使用する用語「放出する」、「上昇させる」、「維持する」、「抑制する」、および「低下させる」とは、1細胞、1細胞型、1疾病部位、1器官などに限定される効果を含む局所効果、または全身的効果のいずれかを示す。別の実施形態中、スペーサーは1以上のNOモジュレーター(患者内でNOを放出する薬物、または患者内で別様にNOを上昇させるかNOの産生を維持する薬物、または患者内で別様にNOレベルを維持する薬物が含まれる)のin vivoでの放出(例えば、促進された加水分解性放出)を可能にする。別の実施形態中、スペーサーは1以上のNOモジュレーター(患者内でNOを放出する薬物、または患者内で別様にNOを上昇させるかNOの産生を維持する薬物、または患者内で別様にNOレベルを維持する薬物が含まれる)の細胞外もしくは細胞内部位での放出(例えば、促進された加水分解性放出)を可能にする。別の実施形態では1以上のFLAPインヒビターのin vivoでの放出(例えば、促進された加水分解性放出)が可能になる。別の実施形態では1以上のFLAPインヒビターの細胞外もしくは細胞内部位での放出(例えば、促進された加水分解性放出)が可能になる。別の実施形態では1以上のNOモジュレーターと1以上のFLAPインヒビターの細胞外もしくは細胞内部位での放出(例えば、促進された加水分解性放出)が可能になる。
本明細書に記載する別の実施形態は、1以上のNOモジュレーター(患者内でNOを放出する薬物、または患者内で別様にNOを上昇させるかNOの産生を維持する薬物、または患者内で別様にNOレベルを維持する薬物が含まれる)のin vivoでの酵素的放出を可能にするか、別様に促進する、組成物、方法、技法および戦略を提供する。別の実施形態では、1以上のNOモジュレーター(患者内でNOを放出する薬物、または患者内で別様にNOを上昇させるかNOの産生を維持する薬物、または患者内で別様にNOレベルを維持する薬物が含まれる)の細胞外もしくは細胞内部位での酵素的放出が可能になるか、別様に促進される。別の実施形態では、1以上のFLAPインヒビターのin vivoでの酵素的放出が可能になるか、別様に促進される。別の実施形態では、1以上のFLAPインヒビターの細胞外もしくは細胞内部位での酵素的放出が可能になるか、別様に促進される。別の実施形態では、1以上のNOモジュレーター(患者内でNOを放出する薬物、または患者内で別様にNOを上昇させるかNOの産生を維持する薬物、または患者内で別様にNOレベルを維持する薬物が含まれる)および1以上のFLAPインヒビターの細胞外もしくは細胞内部位での酵素的放出が可能になるか、別様に促進される。
別の実施形態中、本明細書に記載するのは、その他の薬物の投与によって促進される、1以上のNOモジュレーター(患者内でNOを放出する薬物、または患者内で別様にNOを上昇させるかNOの産生を維持する薬物、または患者内で別様にNOレベルを維持する薬物が含まれる)のin vivoでの放出を含んでいる、組成物、方法、技法および戦略である。別の実施形態中、1以上のNOモジュレーター(患者内でNOを放出する薬物、または患者内で別様にNOを上昇させるかNOの産生を維持する薬物、または患者内で別様にNOレベルを維持する薬物が含まれる)の細胞外もしくは細胞内部位での放出が、その他の薬物の投与によって促進される。別の実施形態中、1以上のFLAPインヒビターのin vivoでの放出が、その他の薬物の投与によって促進される。別の実施形態中、1以上のFLAPインヒビターの細胞外もしくは細胞内部位での放出が、その他の薬物の投与によって促進される。別の実施形態中、1以上のNOモジュレーター(患者内でNOを放出する薬物、または患者内で別様にNOを上昇させるかNOの産生を維持する薬物、または患者内で別様にNOレベルを維持する薬物が含まれる)および1以上のFLAPインヒビターの細胞外もしくは細胞内部位での放出が、その他の薬物の投与によって促進される。
別の実施形態中、本明細書に記載するのは、NOを体外から哺乳動物に送達する、組成物、方法、技法および戦略である。あるいは、NOを1分子に安定的に接続し、このNO-コンジュゲート分子をFLAPインヒビターと同時投与するか、またはこのNO-コンジュゲート分子をFLAPインヒビターに直接化学的連結(共有結合、イオン結合、水素結合、バンデルワールス相互作用もしくはこれらの組み合わせを含む)させるか、またはこのNO-コンジュゲート分子を、化学的連結基として作用する、治療上の活性がない部分に含まれる架橋基を介して、FLAPインヒビターに接続させる、すなわち(FLAPインヒビター)-(架橋基)-(NOモジュレーター)とする。1実施形態中、化学的に連結させた複合組成物はin vivoで開裂して、2つの連結していない治療上活性な薬物を形成する。1実施形態中、NO-コンジュゲート体はNOを放出し、これが原形質膜に結合したグアニルシクラーゼまたは細胞質内可溶性グアニルシクラーゼを活性化して、血管拡張経路を含む多数の経路を作動させ、一方FLAP化合物は細胞に入って、ロイコトリエンの合成を抑制する。
本開示の別の態様は、本明細書に記載するNOモジュレーターおよび/またはFLAPモジュレーター(単独もしくは併用)、ならびに医薬として許容される希釈剤、賦形剤、または担体を含んでいる医薬組成物である。別の態様は、本明細書に記載するNOモジュレーターおよび/またはFLAPモジュレーター(単独もしくは併用)、ならびに医薬として許容される希釈剤、賦形剤、または担体を含んでいる医薬組成物の投与のための方法である。こうした投与の経路の例として、以下が含まれる: 静脈内、経口、直腸、エアロゾル、腸管外、眼内、肺内、経粘膜、経皮、経膣、耳、鼻、および局所投与。その上、単なる例示であるが、腸管外送達として以下が含まれる: 筋内、皮下、静脈内、髄内注射、また髄腔内、直接心室内、腹腔内、リンパ管内、および鼻腔内注射。
本開示の別の態様は、FLAPのモジュレーションが疾病、障害もしくは病態の少なくとも1症候に有利に影響を与える、その疾病、障害もしくは病態の治療のための方法である。こうした方法は、動物中のNOレベルを直接または間接的にモジュレートすることができる第1剤と、動物中の5-リポキシゲナーゼ活性化タンパク質の活性を直接または間接的にモジュレートすることができる第2剤の投与を含んでいる。こうした併用手法を使用して治療される疾病、障害もしくは病態として、以下が含まれる: 呼吸器、心血管、高血圧、NSAID-誘発性GI損傷、骨吸収、悪性物および炎症性の疾病、障害および病態。
本開示の別の態様は、NOレベルの増加もしくは維持が疾病、障害もしくは病態の少なくとも1症候に有利に影響を与える、その疾病、障害もしくは病態の治療のための方法である。こうした方法は、動物中のNOレベルを直接または間接的にモジュレートすることができる第1剤と動物中の5-リポキシゲナーゼ活性化タンパク質の活性を直接または間接的にモジュレートすることができる第2剤の投与を含んでいる。こうした併用手法を使用して治療される疾病、障害もしくは病態として、以下が含まれる: 呼吸器、心血管、高血圧、骨吸収、悪性物および炎症性の疾病、障害および病態。
別の態様は、哺乳動物に、有効量の少なくとも1種のFLAPインヒビターおよび少なくとも1種のNOモジュレーターを少なくとも1回投与することを含んでいる、ロイコトリエン依存性もしくはロイコトリエン介在病態または疾病を治療するための方法である(FLAPインヒビターおよびNOモジュレーターを単剤または多剤として投与する実施形態が含まれる)。
別の態様は、哺乳動物に、有効量の少なくとも1種のFLAPインヒビターおよび少なくとも1種のNOモジュレーターを少なくとも1回投与することを含んでいる、炎症を治療するための方法である(FLAPインヒビターおよびNOモジュレーターを単剤または多剤として投与する実施形態が含まれる)。
別の態様は、哺乳動物に、有効量の少なくとも1種のFLAPインヒビターおよび少なくとも1種のNOモジュレーターを少なくとも1回投与することを含んでいる、呼吸器疾病を治療するための方法である(FLAPインヒビターおよびNOモジュレーターを単剤または多剤として投与する実施形態が含まれる)。この態様の別の実施形態中、呼吸器疾病は喘息である。この態様の別の実施形態中、呼吸器疾病として、限定するわけではないが、以下が含まれる: 成人呼吸器不調症候群およびアレルギー性(外因性)喘息、非アレルギー性(内因性)喘息、急性重症喘息、慢性喘息、臨床性喘息、夜間喘息、アレルゲン誘発喘息、アスピリン感受性喘息、運動誘発喘息、イソカプニック(isocapnic)過換気症、小児発症喘息、成人発症喘息、咳型喘息、職業性喘息、ステロイド耐性喘息、ならびに季節性喘息。
別の態様は、哺乳動物に、有効量の少なくとも1種のFLAPインヒビターおよび少なくとも1種のNOモジュレーターを少なくとも1回投与することを含んでいる、慢性閉塞性肺疾患を予防するための方法である(FLAPインヒビターおよびNOモジュレーターを単剤または多剤として投与する実施形態が含まれる)。この態様の別の実施形態中、慢性閉塞性肺疾患として、限定するわけではないが以下が含まれる: 慢性気管支炎もしくは肺気腫、肺高血圧、間質性肺線維症および/または気道炎症ならびに嚢胞性線維症。
別の態様は、哺乳動物に、有効量の少なくとも1種のFLAPインヒビターおよび少なくとも1種のNOモジュレーターを少なくとも1回投与することを含んでいる、1疾病もしくは病態における粘膜分泌および/または浮腫の増加を予防するための方法である(FLAPインヒビターおよびNOモジュレーターを単剤または多剤として投与する実施形態が含まれる)。
別の態様は、哺乳動物に、有効量の少なくとも1種のFLAPインヒビターおよび少なくとも1種のNOモジュレーターを少なくとも1回投与することを含んでいる、血管収縮、アテローム性動脈硬化およびその続発性心筋虚血、心筋梗塞、大動脈瘤、脈管炎ならびに卒中を予防または治療するための方法である(FLAPインヒビターおよびNOモジュレーターを単剤または多剤として投与する実施形態が含まれる)。
別の態様は、哺乳動物に、有効量の少なくとも1種のFLAPインヒビターおよび少なくとも1種のNOモジュレーターを少なくとも1回投与することを含んでいる、器官虚血および/または内毒素ショック後の器官再かん流傷害を低下させるための方法である(FLAPインヒビターおよびNOモジュレーターを単剤または多剤として投与する実施形態が含まれる)。
別の態様は、哺乳動物に、有効量の少なくとも1種のFLAPインヒビターおよび少なくとも1種のNOモジュレーターを少なくとも1回投与することを含んでいる、哺乳動物中の血管収縮を低下させるための方法である(FLAPインヒビターおよびNOモジュレーターを単剤または多剤として投与する実施形態が含まれる)。
別の態様は、哺乳動物に、有効量の少なくとも1種のFLAPインヒビターおよび少なくとも1種のNOモジュレーターを少なくとも1回投与することを含んでいる、哺乳動物の血圧を低下させるかまたは上昇を予防するための方法である(FLAPインヒビターおよびNOモジュレーターを単剤または多剤として投与する実施形態が含まれる)。
別の態様は、哺乳動物に、有効量の少なくとも1種のFLAPインヒビターおよび少なくとも1種のNOモジュレーターを少なくとも1回投与することを含んでいる、好酸球および/または好塩基球および/または樹状細胞および/または好中球および/または単球の動員(recruitment)を予防するための方法である(FLAPインヒビターおよびNOモジュレーターを単剤または多剤として投与する実施形態が含まれる)。
別の態様は、哺乳動物に、有効量の少なくとも1種のFLAPインヒビターおよび少なくとも1種のNOモジュレーターを少なくとも1回投与することを含んでいる、異常な骨の再形成、減量もしくは増量の予防または治療するための方法である(FLAPインヒビターおよびNOモジュレーターを単剤または多剤として投与する実施形態が含まれる)。これらとして、例えば骨減少症、骨粗しょう症、パジェット病、がんおよびその他の疾病などの疾病もしくは病態が含まれる。
別の態様は、哺乳動物に、有効量の少なくとも1種のFLAPインヒビターおよび少なくとも1種のNOモジュレーターを少なくとも1回投与することを含んでいる、眼性炎症およびアレルギー性結膜炎、春季角結膜炎、ならびに乳頭状結膜炎を予防するための方法である(FLAPインヒビターおよびNOモジュレーターを単剤または多剤として投与する実施形態が含まれる)。
別の態様は、哺乳動物に、有効量の少なくとも1種のFLAPインヒビターおよび少なくとも1種のNOモジュレーターを少なくとも1回投与することを含んでいる、CNS障害を予防するための方法である(FLAPインヒビターおよびNOモジュレーターを単剤または多剤として投与する実施形態が含まれる)。CNS障害として限定するわけではないが、以下が含まれる: 多発硬化症、パーキンソン病、アルツハイマー病、卒中、脳虚血、網膜虚血、術後認知機能障害、片頭痛、末梢神経障害/神経痛、脊髄傷害、脳浮腫および頭部傷害。
別の態様は、哺乳動物に、有効量の少なくとも1種のFLAPインヒビターおよび少なくとも1種のNOモジュレーターを少なくとも1回投与することを含んでいる、がんの治療のための方法である(FLAPインヒビターおよびNOモジュレーターを単剤または多剤として投与する実施形態が含まれる)。がんのタイプとして限定するわけではないが、膵がんおよびその他の固形もしくは血液腫瘍が含まれる。
別の態様は、哺乳動物に、有効量の少なくとも1種のFLAPインヒビターおよび少なくとも1種のNOモジュレーターを少なくとも1回投与することを含んでいる、内毒性ショックおよび敗血性ショックを予防するための方法である(FLAPインヒビターおよびNOモジュレーターを単剤または多剤として投与する実施形態が含まれる)。
別の態様は、哺乳動物に、有効量の少なくとも1種のFLAPインヒビターおよび少なくとも1種のNOモジュレーターを少なくとも1回投与することを含んでいる、リウマチ性関節炎および変形性関節炎を予防するための方法である(FLAPインヒビターおよびNOモジュレーターを単剤または多剤として投与する実施形態が含まれる)。
別の態様は、哺乳動物に、有効量の少なくとも1種のFLAPインヒビターおよび少なくとも1種のNOモジュレーターを少なくとも1回投与することを含んでいる、GI疾病の進展を予防するための方法である(FLAPインヒビターおよびNOモジュレーターを単剤または多剤として投与する実施形態が含まれる)。こうした疾病として、単なる例示であるが、慢性胃炎、好酸球性胃腸炎、および胃運動機能障害が含まれる。
別の態様は、哺乳動物に、有効量の少なくとも1種のFLAPインヒビターおよび少なくとも1種のNOモジュレーターを少なくとも1回投与することを含んでいる、GI疾病を予防するための方法である(FLAPインヒビターおよびNOモジュレーターを単剤または多剤として投与する実施形態が含まれる)。こうした疾病として、単なる例示であるが、炎症性腸疾患、潰瘍性大腸炎およびクローン病が含まれる。
別の態様は、哺乳動物に、有効量の少なくとも1種のFLAPインヒビターおよび少なくとも1種のNOモジュレーターを少なくとも1回投与することを含んでいる、腎疾患を治療するための方法である(FLAPインヒビターおよびNOモジュレーターを単剤または多剤として投与する実施形態が含まれる)。こうした疾病として、単なる例示であるが、糸球体腎炎、シクロスポリン腎毒性腎虚血再かん流が含まれる。
別の態様は、哺乳動物に、有効量の少なくとも1種のFLAPインヒビターおよび少なくとも1種のNOモジュレーターを少なくとも1回投与することを含んでいる、急性もしくは慢性腎機能不全を予防または治療するための方法である(FLAPインヒビターおよびNOモジュレーターを単剤または多剤として投与する実施形態が含まれる)。
別の態様は、哺乳動物に、有効量の少なくとも1種のFLAPインヒビターおよび少なくとも1種のNOモジュレーターを少なくとも1回投与することを含んでいる、II型糖尿病を治療するための方法である(FLAPインヒビターおよびNOモジュレーターを単剤または多剤として投与する実施形態が含まれる)。
別の態様は、急性腎盂腎炎の腎臓などの、1以上の固体器官もしくは組織内の急性感染症の状態を縮小させるための方法である。
別の態様は、哺乳動物に、有効量の少なくとも1種のFLAPインヒビターおよび少なくとも1種のNOモジュレーターを少なくとも1回投与することを含んでいる、好酸球の動員もしくは活性化が関与する急性もしくは慢性障害を予防または治療するための方法である(FLAPインヒビターおよびNOモジュレーターを単剤または多剤として投与する実施形態が含まれる)。
別の態様は、哺乳動物に、有効量の少なくとも1種のFLAPインヒビターおよび少なくとも1種のNOモジュレーターを少なくとも1回投与することを含んでいる、非ステロイド抗炎症薬(選択的もしくは非選択的シクロオキシゲナーゼ-1または-2インヒビターを含む)に起因する胃腸管の急性もしくは慢性びらん性疾病または運動機能障害を予防または治療するための方法である(FLAPインヒビターおよびNOモジュレーターを単剤または多剤として投与する実施形態が含まれる)。
別の態様は、哺乳動物に、有効量の少なくとも1種のFLAPインヒビターおよび少なくとも1種のNOモジュレーターを少なくとも1回投与することを含んでいる、移植された器官または組織中の拒絶もしくは機能障害の予防または治療のための方法である(FLAPインヒビターおよびNOモジュレーターを単剤または多剤として投与する実施形態が含まれる)。
別の態様は、哺乳動物に、有効量の少なくとも1種のFLAPインヒビターおよび少なくとも1種のNOモジュレーターを少なくとも1回投与することを含んでいる、皮膚の炎症性応答を治療するための方法である(FLAPインヒビターおよびNOモジュレーターを単剤または多剤として投与する実施形態が含まれる)。こうした皮膚の炎症性応答の例として、以下が含まれる: 皮膚炎、接触皮膚炎、湿疹、じんましん、酒さ、および瘢痕。別の態様は、哺乳動物に、有効量の少なくとも1種のFLAPインヒビターおよび少なくとも1種のNOモジュレーターを少なくとも1回投与することを含んでいる、皮膚、関節、またはその他の組織もしくは器官の乾癬病巣を減少させるための方法である(FLAPインヒビターおよびNOモジュレーターを単剤または多剤として投与する実施形態が含まれる)。
別の態様は、哺乳動物に、有効量の少なくとも1種のFLAPインヒビターおよび少なくとも1種のNOモジュレーターを少なくとも1回投与することを含んでいる、単なる例示であるが、間質性膀胱炎を含む、膀胱炎の治療のための方法である(FLAPインヒビターおよびNOモジュレーターを単剤または多剤として投与する実施形態が含まれる)。
別の態様は、哺乳動物に、有効量の少なくとも1種のFLAPインヒビターおよび少なくとも1種のNOモジュレーターを少なくとも1回投与することを含んでいる、家族性地中海熱などの代謝症候群の治療のための方法である(FLAPインヒビターおよびNOモジュレーターを単剤または多剤として投与する実施形態が含まれる)。
別の態様は、哺乳動物に、有効量の少なくとも1種のFLAPインヒビターおよび少なくとも1種のNOモジュレーターを少なくとも1回投与することを含んでいる、高血圧の治療のための方法である(FLAPインヒビターおよびNOモジュレーターを単剤または多剤として投与する実施形態が含まれる)。
別の態様は、肺もしくは血管の感染症または炎症の症状下での抗生物質療法の効力の改善のための方法である。
別の態様は、肺疾患もしくは病態を持つ患者の肺の排気-血流マッチングの改善のための方法である。
本明細書に開示する方法は、以下の予防または回復のためにも有用である: 以下などの結果である急性肺血管収縮; 肺炎、外傷性傷害、吸引もしくは吸入傷害、肺内脂肪塞栓症、アシドーシス、肺の炎症、成人呼吸器不調症候群、急性肺浮腫、急性高山病、喘息、心臓手術後急性肺高血圧、新生児の持続性肺高血圧、周産期吸引症候群、ヒアリン膜疾病、急性肺血栓塞栓症、ヘパリン-プロタミン反応、敗血症、喘息、喘息体質、または低酸素症(片肺麻酔中に発症するものを含む); 同様に以下などの結果である可逆性要素を持つ慢性肺血管収縮; 慢性肺高血圧、気管支肺異形成、慢性肺血栓塞栓症、特発性もしくは原発性肺高血圧、または慢性低酸素症。
別の態様は、吐出NOの基底レベルが異常に高い場合の吐出NOのさらなる増加をともなう肺機能の改善方法である。
別の態様は、炎症後二次的に異常収縮した平滑筋細胞の弛緩方法である。
別の態様は、内皮機能、異常収縮した平滑筋の弛緩の相加または相乗的強化のための方法である。
別の態様は、1タイプの細胞へのNO補給からの別のタイプの細胞へのNO補給による有害作用の予防または排除のための方法である。
別の態様は、ロイコトリエンが介在またはこれによってモジュレートされるNO補給の有害作用の予防または低下方法である。
別の態様は、一酸化窒素補給が介在またはこれによってモジュレートされるロイコトリエン抑制の有害作用の予防または低下方法である。
別の態様は、哺乳動物に、有効量の少なくとも1種のFLAPインヒビターおよび少なくとも1種のNOモジュレーターを少なくとも1回投与することを含んでいる、勃起機能不全の治療のための方法である(FLAPインヒビターおよびNOモジュレーターを単剤または多剤として投与する実施形態が含まれる)。
別の態様は、哺乳動物に、有効量の少なくとも1種のFLAPインヒビターおよび少なくとも1種のNOモジュレーターを少なくとも1回投与することを含んでいる、肝腎症候群の治療のための方法である(FLAPインヒビターおよびNOモジュレーターを単剤または多剤として投与する実施形態が含まれる)。
別の態様は、少なくとも1種のロイコトリエンタンパク質の活性が疾病もしくは病態の病因および/または症候に寄与している、動物の炎症性疾病もしくは病態を治療するための医薬の製造における、少なくとも1種のFLAPインヒビターおよび少なくとも1種のNOモジュレーターの使用である(FLAPインヒビターおよびNOモジュレーターを単剤または多剤として投与する実施形態が含まれる)。この態様の1実施形態中、ロイコトリエン経路タンパク質は5-リポキシゲナーゼ活性化タンパク質(FLAP)である。この態様の詳細な、もしくは別の実施形態中、炎症性疾病もしくは病態は呼吸器、心血管、または増殖性疾病である。
前記のいずれかの態様中、その実施形態はさらに、投与が経腸、腸管外、またはその両方であって以下のものである: (a) 有効量の化合物もしくは化合物群を哺乳動物に全身投与する; (b) 有効量の化合物もしくは化合物群を哺乳動物に経口投与する; (c) 有効量の化合物もしくは化合物群を哺乳動物に静脈内投与する; (d) 有効量の化合物もしくは化合物群を吸入によって投与する; (e) 有効量の化合物もしくは化合物群を経鼻投与によって投与する; または (f) 有効量の化合物もしくは化合物群を注射によって哺乳動物に投与する; (g) 有効量の化合物もしくは化合物群を哺乳動物に局所(皮膚)投与する; (h) 有効量の化合物もしくは化合物群を眼内投与によって投与する、または (i) 有効量の化合物もしくは化合物群を哺乳動物に経直腸投与する。
前記のいずれかの態様中、その実施形態はさらに、哺乳動物がヒトであって、以下の実施形態が含まれる: (a) ヒトが以下からなる群から選択される喘息病態もしくは特質を持つ: アレルギー性(外因性)喘息、非アレルギー性(内因性)喘息、急性重症喘息、慢性喘息、臨床性喘息、夜間喘息、アレルゲン誘発喘息、アスピリン感受性喘息、運動誘発喘息、イソカプニック(isocapnic)過換気症、小児発症喘息、成人発症喘息、咳型喘息、職業性喘息、ステロイド耐性喘息、もしくは季節性喘息、または慢性閉塞性肺疾病、または肺高血圧または間質性肺線維症。前記のいずれかの態様中、詳細な実施形態は哺乳動物が肺の炎症のための動物モデルであるもので、その例は本明細書に提供されている。
前記のいずれかの態様中、その実施形態はさらに、有効量の化合物もしくは化合物群の単一投与を含み、以下の実施形態がさらに含まれる: (i) 化合物もしくは化合物群を1回投与する; (ii) 化合物もしくは化合物群を1日に複数回; (iii) 頻繁に、または; (iv) 連続的に、哺乳動物に投与する。
前記のいずれかの態様中、その実施形態はさらに、有効量の化合物もしくは化合物群の複数投与を含み、以下の実施形態がさらに含まれる: (i) 化合物もしくは化合物群を単一用量で投与する; (ii) 複数回投与間の時間が6時間毎; (iii) 化合物もしくは化合物群を哺乳動物に8時間毎に投与する。別のもしくはこの実施形態中でさらに、その方法は休薬日を含み、この際、化合物もしくは化合物群の投与を一時的に中断するか、または投与する化合物もしくは化合物群の用量を一時的に減少させ、この休薬日の終わりに、化合物もしくは化合物群の投与を最初にもどす。休薬日の長さは2日から1年まで変更することができる。
1態様中、NOモジュレーターおよびFLAPインヒビターを2つの別々の薬物として哺乳動物に投与する。この実施形態の詳細な態様中、NOモジュレーターおよびFLAPインヒビターを哺乳動物に同時に投与する。別の実施形態中、2つの薬物を順次投与する。1態様中、2つの薬物を1つの医薬組成物として哺乳動物に投与する。別の態様中、2つの薬物は同一の医薬組成物中にはない。
炎症の予防または治療が関与する、前記のいずれかの態様中、その実施形態はさらに以下を含んでいる: (a) 哺乳動物の炎症のモニター; (b) 哺乳動物の気管支収縮の測定; (c) 哺乳動物の好酸球および/または好塩基球および/または樹状細胞および/または好中球および/または単球および/またはリンパ球動員の測定; (d) 哺乳動物の粘膜分泌のモニター; (e) 哺乳動物の粘膜浮腫の測定; (e) 哺乳動物のカルシウムイオノフォア負荷血液中のLTB4レベルの測定; (f) 哺乳動物の排出尿中のLTE4レベルの測定; または(g) LTB4、LTC4、Il-6、CRP、SAA、MPO、EPO、MCP-1、MIP-α、sICAMs、Il-4、Il-13などのロイコトリエン駆動炎症バイオマーカーの測定による、患者の同定。
ロイコトリエン依存性もしくはロイコトリエン介在疾病または病態の予防または治療が関与する前記のいずれかの態様中、その実施形態はさらに、ロイコトリエン遺伝子ハプロタイプについてのスクリーニングによる、患者の同定を含んでいる。これもしくは別の実施形態中でさらに、ロイコトリエン遺伝子ハプロタイプはロイコトリエン経路遺伝子であり、一方、これもしくは別の実施形態中でさらに、ロイコトリエン遺伝子ハプロタイプは5-リポキシゲナーゼ活性化タンパク質(FLAP)ハプロタイプである。
ロイコトリエン依存性もしくはロイコトリエン介在疾病またはは病態の予防または治療が関与する前記のいずれかの態様中、その実施形態はさらに、以下のいずれかについて患者をモニターすることによる、患者の同定を含んでいる:
i) 少なくとも1種のロイコトリエン駆動炎症バイオマーカー; または
ii) ロイコトリエン修飾薬剤に対する少なくとも1種の機能性マーカー応答; または
iii) 少なくとも1種のロイコトリエン駆動炎症バイオマーカーおよびロイコトリエン修飾薬剤に対する少なくとも1種の機能性マーカー応答。
i) 少なくとも1種のロイコトリエン駆動炎症バイオマーカー; または
ii) ロイコトリエン修飾薬剤に対する少なくとも1種の機能性マーカー応答; または
iii) 少なくとも1種のロイコトリエン駆動炎症バイオマーカーおよびロイコトリエン修飾薬剤に対する少なくとも1種の機能性マーカー応答。
これもしくは別の実施形態中でさらに、ロイコトリエン駆動炎症バイオマーカーは以下からなる群から選択される: LTB4、システイニルロイコトリエン、CRP、SAA、MPO、EPO、MCP-1、MIP-α、sICAM、IL-6、IL-4、およびIL-13。一方、さらに詳細なもしくは別の実施形態中、機能性マーカー応答は有意な肺容量(FEV1)である。
ロイコトリエン依存性もしくはロイコトリエン介在疾病または病態の予防または治療が関与する前記のいずれかの態様中、実施形態はさらに、以下のいずれかによる、患者の同定を含んでいる:
i) 少なくとも1種のロイコトリエン遺伝子ハプロタイプについての患者のスクリーニング; または
ii) 少なくとも1種のロイコトリエン駆動炎症バイオマーカーについての患者のモニター; または
ii) ロイコトリエン修飾薬剤に対する少なくとも1種の機能性マーカー応答についての患者のモニター。
i) 少なくとも1種のロイコトリエン遺伝子ハプロタイプについての患者のスクリーニング; または
ii) 少なくとも1種のロイコトリエン駆動炎症バイオマーカーについての患者のモニター; または
ii) ロイコトリエン修飾薬剤に対する少なくとも1種の機能性マーカー応答についての患者のモニター。
これらもしくは別の実施形態中でさらに、ロイコトリエン遺伝子ハプロタイプはロイコトリエン経路遺伝子である。これもしくは別の実施形態中でさらに、ロイコトリエン遺伝子ハプロタイプは5-リポキシゲナーゼ活性化タンパク質(FLAP)ハプロタイプである。これもしくは別の実施形態中でさらに、ロイコトリエン駆動炎症バイオマーカーは以下からなる群から選択される: LTB4、システイニルロイコトリエン、CRP、SAA、MPO、EPO、MCP-1、MIP-α、sICAM、IL-6、IL-4、およびIL-13。一方、これもしくは別の実施形態中でさらに、機能性マーカー応答は有意な肺容量(FEV1)である。
ロイコトリエン依存性もしくはロイコトリエン介在疾病または病態の予防または治療が関与する前記のいずれかの態様中、その実施形態はさらに、以下の少なくとも2つによる、患者の同定を含んでいる:
i) 少なくとも1種のロイコトリエン遺伝子ハプロタイプについての患者のスクリーニング;
ii) 少なくとも1種のロイコトリエン駆動炎症バイオマーカーについての患者のモニター;
ii) ロイコトリエン修飾薬物に対する少なくとも1種の機能性マーカー応答についての患者のモニター。
i) 少なくとも1種のロイコトリエン遺伝子ハプロタイプについての患者のスクリーニング;
ii) 少なくとも1種のロイコトリエン駆動炎症バイオマーカーについての患者のモニター;
ii) ロイコトリエン修飾薬物に対する少なくとも1種の機能性マーカー応答についての患者のモニター。
これらもしくは別の実施形態中でさらに、ロイコトリエン遺伝子ハプロタイプはロイコトリエン経路遺伝子である。これもしくは別の実施形態中でさらに、ロイコトリエン遺伝子ハプロタイプは5-リポキシゲナーゼ活性化タンパク質(FLAP)ハプロタイプである。これもしくは別の実施形態中でさらに、ロイコトリエン駆動炎症バイオマーカーは以下からなる群から選択される: LTB4、システイニルロイコトリエン、CRP、SAA、MPO、EPO、MCP-1、MIP-α、sICAM、IL-6、IL-4、およびIL-13。一方、これもしくは別の実施形態中でさらに、機能性マーカー応答は有意な肺容量(FEV1)である。
ロイコトリエン依存性もしくはロイコトリエン介在疾病または病態の予防または治療が関与する前記のいずれかの態様中、その実施形態はさらに、以下による、患者の同定を含んでいる:
i) 少なくとも1種のロイコトリエン遺伝子ハプロタイプについての患者のスクリーニング; および
ii) 少なくとも1種のロイコトリエン駆動炎症バイオマーカーについての患者のモニター; および
ii) ロイコトリエン修飾薬物に対する少なくとも1種の機能性マーカー応答についての患者のモニター。
i) 少なくとも1種のロイコトリエン遺伝子ハプロタイプについての患者のスクリーニング; および
ii) 少なくとも1種のロイコトリエン駆動炎症バイオマーカーについての患者のモニター; および
ii) ロイコトリエン修飾薬物に対する少なくとも1種の機能性マーカー応答についての患者のモニター。
これらもしくは別の実施形態中でさらに、ロイコトリエン遺伝子ハプロタイプはロイコトリエン経路遺伝子である。これもしくはさらに別の実施形態中、ロイコトリエン遺伝子ハプロタイプは5-リポキシゲナーゼ活性化タンパク質(FLAP)ハプロタイプである。これもしくは別の実施形態中でさらに、ロイコトリエン駆動炎症バイオマーカーは以下からなる群から選択される: LTB4、システイニルロイコトリエン、CRP、SAA、MPO、EPO、MCP-1、MIP-α、sICAM、IL-6、IL-4、およびIL-13。一方、これもしくは別の実施形態中でさらに、機能性マーカー応答は有意な肺容量(FEV1)である。
別の態様は、有効量のFLAPモジュレーターを患者に投与することを含んでいる、ロイコトリエン依存性もしくはロイコトリエン介在疾病または病態の予防または治療であるが、この際患者は以下によって得られた情報を使用して同定されたものである:
i) 少なくとも1種のロイコトリエン遺伝子ハプロタイプについての患者のスクリーニング; および
ii) 少なくとも1種のロイコトリエン駆動炎症バイオマーカーについての患者のモニター; および
ii) ロイコトリエン修飾薬物に対する少なくとも1種の機能性マーカー応答についての患者のモニター。
i) 少なくとも1種のロイコトリエン遺伝子ハプロタイプについての患者のスクリーニング; および
ii) 少なくとも1種のロイコトリエン駆動炎症バイオマーカーについての患者のモニター; および
ii) ロイコトリエン修飾薬物に対する少なくとも1種の機能性マーカー応答についての患者のモニター。
これもしくは別の実施形態中でさらに、FLAPモジュレーターはFLAPインヒビターである。これもしくは別の実施形態中でさらに、ロイコトリエン遺伝子ハプロタイプはロイコトリエン経路遺伝子である。これもしくは別の実施形態中でさらに、ロイコトリエン遺伝子ハプロタイプは5-リポキシゲナーゼ活性化タンパク質(FLAP)ハプロタイプである。これもしくは別の実施形態中でさらに、ロイコトリエン駆動炎症バイオマーカーは以下からなる群から選択される: LTB4、システイニルロイコトリエン、CRP、SAA、MPO、EPO、MCP-1、MIP-α、sICAM、IL-6、IL-4、およびIL-13。一方、これもしくは別の実施形態中でさらに、機能性マーカー応答は有意な肺容量(FEV1)である。これもしくは別の実施形態中でさらに、3つの診断方法から得られた情報を1アルゴリズムで使用し、ここで情報を分析して、FLAPモジュレーターでの治療が必要な患者、その処方計画、および使用するFLAPモジュレーターのタイプを同定する。
本明細書に記載する方法および組成物のその他の目的、様相および利点は、以下の詳細な説明から明らかになるであろう。しかし、詳細な説明および特定の実施例は、特定の実施形態を示すものであるが、単に説明のために提供するものであることを理解すべきである。なぜならば、当業者にとっては、この詳細な説明から、本発明の精神および範囲内で多様な変更および改変が明らかになるはずであるからである。特許、特許出願、および刊行物を含む、本明細書に引用したすべての参考文献は、その全部を参照として本明細書に組み入れる。
本開示は、一酸化窒素レベルをモジュレートし、かつFLAPを抑制することによって、呼吸器、高血圧、心血管、および炎症性病態を治療するための、組成物、方法、戦略および技法を提供する。1実施形態中、こうした組成物、方法、戦略および技法は、患者の血管NOを増加させることによる、高血圧、内皮細胞機能障害および骨吸収の減少、ならびにFLAP活性の少なくとも部分的な抑制を含んでいる。
NOの生物学的特徴
NOは内皮依存性弛緩のほかに、食細胞の細胞毒性および中枢神経系の細胞-細胞連絡を含む多数の生物学的作用に関与している(Moncada, et al., Biochemical Pharmacology, 38:1709-1715(1989))。ニトログリセリンは体内でNOに変換されることによってNOを供給することができる薬物の1つである。ニトログリセリンはアテローム性動脈硬化などの心血管疾病の治療において、血管拡張薬としてヒトに投与されてきた。アテローム性動脈硬化では、動脈内で形成されたプラークが血流を低下させる。このため、心筋への酸素供給が減少し、その結果狭心症(胸痛)、そしてときにはさらに心筋梗塞となる。NOは膜結合もしくは可溶性グアニル酸シクラーゼを刺激することによって、血流量の欠乏を治療するために使用される。NOが内皮細胞で形成されると、すぐにその細胞外および隣接する平滑筋細胞中に拡散し、そこでグアニリルシクラーゼ上のヘム部分に結合し、その酵素を活性化して、GTPからcGMPを生成させる。増加したcGMPはキナーゼの1つを活性化し、これはその後カルシウムの平滑筋細胞への流入の抑制をもたらし、これによって平滑筋の緊張発生を減少させることによって血管が拡張し、結果的に血圧が低下する。この血管の血管拡張は酸素供給の増加をもたらし、それによって心臓を損傷および細胞死から防御する。
NOは内皮依存性弛緩のほかに、食細胞の細胞毒性および中枢神経系の細胞-細胞連絡を含む多数の生物学的作用に関与している(Moncada, et al., Biochemical Pharmacology, 38:1709-1715(1989))。ニトログリセリンは体内でNOに変換されることによってNOを供給することができる薬物の1つである。ニトログリセリンはアテローム性動脈硬化などの心血管疾病の治療において、血管拡張薬としてヒトに投与されてきた。アテローム性動脈硬化では、動脈内で形成されたプラークが血流を低下させる。このため、心筋への酸素供給が減少し、その結果狭心症(胸痛)、そしてときにはさらに心筋梗塞となる。NOは膜結合もしくは可溶性グアニル酸シクラーゼを刺激することによって、血流量の欠乏を治療するために使用される。NOが内皮細胞で形成されると、すぐにその細胞外および隣接する平滑筋細胞中に拡散し、そこでグアニリルシクラーゼ上のヘム部分に結合し、その酵素を活性化して、GTPからcGMPを生成させる。増加したcGMPはキナーゼの1つを活性化し、これはその後カルシウムの平滑筋細胞への流入の抑制をもたらし、これによって平滑筋の緊張発生を減少させることによって血管が拡張し、結果的に血圧が低下する。この血管の血管拡張は酸素供給の増加をもたらし、それによって心臓を損傷および細胞死から防御する。
NOは心血管系の外側の重要なシグナル伝達分子である。NOは脳内の神経細胞間のシグナル伝達に関与し、細菌および寄生虫感染に対する正常な防御に関係し、そして高血圧の治療のために使用することができる。あるいは、研究から、NOレベルの上昇が前炎症性であり得ることも示されている。例えば、NOは、誘発されたNOSのイソ型(iNOS)から生合成されるが、これは転写時にレギュレートされ、また普通は細菌産物および前炎症性サイトカインによって誘発される。その結果、喘息などの気道の炎症性疾患は共通して、気道上皮中のiNOSの発現の増加と、細菌もしくはウイルス感染に対するもう1つの宿主防御機構と推定される炎症性免疫細胞を特徴としている。iNOSからのNOの過剰産生の不利益として考えられるのは、そのペルオキシ亜硝酸への代謝の加速である。ペルオキシ亜硝酸およびその他の反応性窒素類の形成は、炎症性肺疾患の一因となり得る。以下を参照されたい: van der Vliet, A., et al., Respir. Res., 1:67-72(2000)。
iNOSとeNOS
誘導性一酸化窒素シンセターゼおよび内皮一酸化窒素シンセターゼは両者ともにNOを産生する能力がある。しかし、これら2つの酵素の細胞所在地は異なっている。eNOSは内皮細胞に見られ、iNOSは(気管支)上皮細胞、肺胞壁、およびマクロファージ中に見られる(Kharitonov SA,"Influence of different therapeutic strategies on exhaled NO and lung inflamation in asthma and COPD," Vascular Pharmacology, 2005 Dec;43(6):371-8)。吐出NOの増加は、気管支収縮の場合において、肺病変のみを反映するものと考えられてきた(Buchvald F,et al.)。吐出一酸化窒素から喘息学童の気管支収縮が予測される(Chest, 2005:128:1964-7)。平滑筋を含有する組織のロイコトリエン応答性は、その組織が解剖学的に正常であるか、そしてマクロファージなどのロイコトリエン産生細胞が移入されてきたかどうかの関数として変化する。こうした強化されたLT応答性はアテローム性動脈硬化の血管を示すものとされた(Allen S, et al., Circulation, 1998;97:2406-13)。
誘導性一酸化窒素シンセターゼおよび内皮一酸化窒素シンセターゼは両者ともにNOを産生する能力がある。しかし、これら2つの酵素の細胞所在地は異なっている。eNOSは内皮細胞に見られ、iNOSは(気管支)上皮細胞、肺胞壁、およびマクロファージ中に見られる(Kharitonov SA,"Influence of different therapeutic strategies on exhaled NO and lung inflamation in asthma and COPD," Vascular Pharmacology, 2005 Dec;43(6):371-8)。吐出NOの増加は、気管支収縮の場合において、肺病変のみを反映するものと考えられてきた(Buchvald F,et al.)。吐出一酸化窒素から喘息学童の気管支収縮が予測される(Chest, 2005:128:1964-7)。平滑筋を含有する組織のロイコトリエン応答性は、その組織が解剖学的に正常であるか、そしてマクロファージなどのロイコトリエン産生細胞が移入されてきたかどうかの関数として変化する。こうした強化されたLT応答性はアテローム性動脈硬化の血管を示すものとされた(Allen S, et al., Circulation, 1998;97:2406-13)。
したがって、NO補給の利益は、どの細胞型が関与するか、そしてそのNO誘発効果が相加的、相乗的または拮抗的利益のいずれであるかにかかっている。これまでNO応答性細胞型間の相互作用が強調されたことはなかった。さらに、吐出NOレベルの基底値および変化の解釈がNO補給の前後で異なるかもしれない(Agvald P, et al., Vacul Pharmacol, 2005,at Epub、印刷前)。
治療におけるNOモジュレーター
本明細書に記載する組成物、方法、戦略および技法にとって、多くの各種NOのモジュレーターが適切である。例えば、ニトロプルシドおよびニトログリセリンなどのニトロ血管拡張剤は、血管平滑筋の収縮性を抑制して、弛緩させるか血管緊張を低下させる。さらに、ニトロ血管拡張剤は部分的にはNO供与体として分類される。なぜならば、これらは目的の部位で代謝されて、NOを放出するからである。以下を参照されたい: Moncada, et al. Eur J Clin Invest. Aug;21(4):361-74(1991); Moncada, et al. Pharmacol Rev. 1991 Jun;43(2):109-42; Moncada, et al. Semin Perinatol. 1991 Feb;15(1):16-9。NOをモジュレートするその他のニトロ血管拡張剤として、限定するわけではないが、イソソルビド一硝酸、およびイソソルビド二硝酸が含まれる。
本明細書に記載する組成物、方法、戦略および技法にとって、多くの各種NOのモジュレーターが適切である。例えば、ニトロプルシドおよびニトログリセリンなどのニトロ血管拡張剤は、血管平滑筋の収縮性を抑制して、弛緩させるか血管緊張を低下させる。さらに、ニトロ血管拡張剤は部分的にはNO供与体として分類される。なぜならば、これらは目的の部位で代謝されて、NOを放出するからである。以下を参照されたい: Moncada, et al. Eur J Clin Invest. Aug;21(4):361-74(1991); Moncada, et al. Pharmacol Rev. 1991 Jun;43(2):109-42; Moncada, et al. Semin Perinatol. 1991 Feb;15(1):16-9。NOをモジュレートするその他のニトロ血管拡張剤として、限定するわけではないが、イソソルビド一硝酸、およびイソソルビド二硝酸が含まれる。
好適な一酸化窒素モジュレーターとして、in vivoで内在性NOを刺激するか内在性内皮由来の弛緩因子(EDRF)のレベルを上昇させるか、あるいは一酸化窒素シンターゼの基質である化合物を含む、一酸化窒素誘導物質が含まれる。こうした化合物として例えば以下が含まれる: L-アルギニン、L-ホモアルギニン、およびN-ヒドロキシ-L-アルギニン、これらには以下が含まれる: そのニトロソ化およびニトロシル化類似体(例えば、ニトロソ化L-アルギニン、ニトロシル化L-アルギニン、ニトロソ化N-ヒドロキシ-L-アルギニン、ニトロシル化N-ヒドロキシ-L-アルギニン、ニトロソ化L-ホモアルギニンおよびニトロシル化L-ホモアルギニン)、L-アルギニンの前駆体および/または生理学的に許容されるその塩、例えば、シトルリン、オルニチン、グルタミン、リシン、少なくともこれらのアミノ酸の1種を含んでいるポリペプチドなど、酵素アルギナーゼのインヒビター(例えば、N-ヒドロキシ-L-アルギニンおよび2(群)-アミノ-6-ボロノヘキサン酸)ならびに一酸化窒素シンターゼの基質、サイトカイン、アデノシン、ブラジキニン、カルレチキュリン、ビサコジル、およびフェノールフタレン。EDRFは内皮によって分泌される血管弛緩因子の1つであって、一酸化窒素またはそれに密接に関連する誘導体として同定された(Palmer et al, Nature, 327:524-526(1987); Ignarro et al, Proc. Natl. Acad. Sci. USA, 84:9265-9269(1987))。NOレベルを増加させるために使用することができる別の化合物として以下が含まれる: ナトリウム ニトロプルシド; Molsidomine(モルシドミン); 3-モルホリノシドノニミン(SIN-1); 1,2,3,4-オキサトリアゾリウム、5-アミノ-3-(3,4-ジクロロフェニル)-クロリド(GEA 3162); 1,2,3,4-オキサトリアゾリウム、5-アミノ-3-(3-クロロ-2-メチル-フェニル)クロリド(GEA502- 4); 1,2,3,4-オキサトリアゾリウム、3-(3-クロロ-2-メチルフェニル)-5-[[[シアノメチルアミノ-]カルボニル]アミノ]-ヒドロキシド内塩(GEA 5583); S-ニトロソ-N-アセチル-D,L-ペニシラミン(SNAP); Glyco-SNAP-1、グリコ-SNAP-2,2,2'-(ヒドロキシニトロソヒドラゾノ)ビス-エタナミン(NOC-18)および(+/-)-(E)-4-エチル-2-[(E)-ヒドロキシイミノ]-5-ニトロ-3-ヘキセンアミド(NOR-3); 1-[(4',5'-ビス(カルボキシメトキシ)-2'-ニトロフェニル)メトキシ]-2-オキソ-3,3,ジエチル-1-トリアゼン 二カリウム塩(CNO-4); [1-(4'、5'-ビス(カルボキシメトキシ)-2'-ニトロフェニル)メトキシ]-2-オキソ-3,3-ジエチル-1-トリアジン ジアセトキシメチルエステル(CNO-5); ニトログリセリン、ジエチルアミン-NO(DEA/NO)、IPA/NO、スペルミン-NO(SPER/NO)、亜硫酸-NO(SULFI/NO)、OXI/NO、およびDETA/NO; シクレタニン; スルホンアミドNO供与体 GEA 3268、(1,2,3,4-オキサトリアゾリウム、3-(3-クロロ-2-メチルフェニル)-5-[[(4-メトキシフェニル)-スルホニル]アミノ]-、ヒドロキシド内塩)およびGEA5145、(1,2,3,4-オキサトリアゾリウム、3-(3-クロロ-2-メチルフェニル)-5-[(メチルスルホニル)アミノ]-、ヒドロキシド内塩); スルホンアミドGEA 3175。前記NOモジュレーターのいずれでも、本明細書に記載する複合組成物および療法で使用することができる。1実施形態中、スタチンはすべて、潜在的NOモジュレーターとして除外される。
肺高血圧
肺高血圧は急性または慢性のいずれかである。急性肺高血圧は一般的に、肺血管の平滑筋の収縮が原因となる可逆的現象である可能性が高く、以下などの病態が発端となる: 低酸素症(高山病として)、アシドーシス、炎症、または肺塞栓症。慢性肺高血圧は肺の断面積の減少をもたらす肺血管の構造上の大きな変化に特徴がある。これは例えば、慢性低酸素症、血栓塞栓症に起因するか、または未知の原因による(特発性もしくは原発性肺高血圧)。
肺高血圧は急性または慢性のいずれかである。急性肺高血圧は一般的に、肺血管の平滑筋の収縮が原因となる可逆的現象である可能性が高く、以下などの病態が発端となる: 低酸素症(高山病として)、アシドーシス、炎症、または肺塞栓症。慢性肺高血圧は肺の断面積の減少をもたらす肺血管の構造上の大きな変化に特徴がある。これは例えば、慢性低酸素症、血栓塞栓症に起因するか、または未知の原因による(特発性もしくは原発性肺高血圧)。
肺高血圧は、成人呼吸器不調症候群(ARDS)および新生児の持続性肺高血圧症(PPHN)などの、いくつかの致命的な臨床病態に関係するとされてきた(Zapol et al., Acute Respiratory Failure, p. 241-273, Marcel Dekker, New York(1985); Peckham, J. Ped. 93:1005(1978))。PPHNは主として満期出産乳児の障害で、肺血管抵抗の上昇、肺動脈高血圧、ならびに新生児心臓の動脈管および卵円孔開存症による血液の右から左への短絡に特徴がある。死亡率は12〜50%の範囲である(Fox, Pediatrics 59:205(1977); Dworetz, Pediatrics 84:1(1989))。肺高血圧は「cor pulmonale」または肺性心として知られている致死性の可能性がある心疾患をもたらすこともある(Fishman、"Pulmonary diseases and Disorders" 2nd Ed., McGraw-Hill, New York(1988))。
ニトロプルシド、ヒドララジン、およびカルシウムチャネルブロッカーなどの全身的血管拡張作用を持つ薬物の投与による、肺高血圧の治療のための試行が実施されてきた。これらの薬物は肺血圧の低下には有効であるが、これらは典型的には無差別な効果を発揮して、肺だけでなく、全身的血圧も低下させる。全身的な血管抵抗の多大な減少の結果、静脈流中の血液の危険な滞留、末梢低血圧(ショック)、右心室虚血、そして結果的に心不全となる(Zapol(1985); Radermacher, Anaesthesiology 68:152(1988); Vlahakes, Circulation 63:87(1981))。例えば、ARDSによる急性肺高血圧の治療のため、15名の患者に静脈ニトロプルシドを投与したとき、平均PAPは29.6から24.2 mmHgに減少し、肺血管抵抗(PVR)は平均32%減少したが、平均全身動脈血圧は89.6 mmHgから許容しえない低レベルの70 mmHgに低下した(Zapol et al., 1985)。静脈ニトロプルシドは肺高血圧の臨床治療には推奨されなかった。なぜならば「QVA/QTの増加によって、肺の気体交換を著しく悪化させる」 (異常短絡による静脈と動脈の血液の混合)からである(Radermacher(1988))。
血管の生理学的弛緩は、血管内面の内皮細胞による非常に不安定な非プロスタノイド内皮由来弛緩因子(EDRF)の放出の結果であることが報告されている。EDRFは血管平滑筋内で酵素、グアニル酸シクラーゼを刺激して、その結果環状GMPの増加をもたらし、その筋肉の弛緩の原因となり、それによって血管収縮を逆行させる。Ignarro et al., Proc. Natl. Acad. Sci. USA 84:9265(1987)およびPalmer et al., Nature 327:524(1987)では、動脈および静脈の内皮によって一酸化窒素(NO)として放出された血管平滑筋弛緩因子が同定されている。NOはニトロプルシドおよび三硝酸グリセリルなどの有機硝酸エステルの分解によって産生されることも確信されている(Ignarro, Circ. Res. 65:1(1989); Furchgott, FASEB J. 3:2007(1989))。
ロイコトリエン抑制依存性一酸化窒素補給の有害作用の予防または改善
NO補給は多くの状況において明らかに有益な効果を持っているが、NOは(全身性)低血圧で現れるように全身的に過剰に存在するか、一定の組織もしくは器官で過剰に存在することがある(局所性低血圧)。NO過剰産生とLTB4過剰は、出血性ショックおよび蘇生の状況下で、有害作用と関連があるとされた(Kiang JG, Cell Res 2004;14:450-9)。
NO補給は多くの状況において明らかに有益な効果を持っているが、NOは(全身性)低血圧で現れるように全身的に過剰に存在するか、一定の組織もしくは器官で過剰に存在することがある(局所性低血圧)。NO過剰産生とLTB4過剰は、出血性ショックおよび蘇生の状況下で、有害作用と関連があるとされた(Kiang JG, Cell Res 2004;14:450-9)。
その上、NOは全身性もしくは肺高血圧、またはその他の血管緊張障害の患者の平滑筋を弛緩させるが、NOはまた、関節炎の炎症を悪化させる(Reddy SV, Int Immunopharmacol 2005;5:1085-90. Epub 2004 12.15)。こうした悪化作用は部分的にロイコトリエンが介在するものと見られる。
したがって、本明細書に記載する治療方法、製剤および組成物の別の利点は、同時にLTB4の過剰産生がある場合のNO過剰の有害作用を制限することである。
ロイコトリエン抑制のNO応答性有害作用の予防または改善
ロイコトリエンの薬理学的抑制にともなう有害作用の発生率は小さく、プラセボと差異がないようである(Antileukotriene Working Group, Ann Allergy Asthma Immunol., 2001:86(6 Suppl 1):18-23)。システイニルロイコトリエン1受容体の遮断による消化不良の発生率(2.1%)はプラセボ(1.1%)より高いようである(PDR Electronic Library, 2005, Thomson)。NO補給は消化不良にともなう病態に効果的である(Mourad, FH, et al., Eur J Gastroenterol Hepatol., 2000, 12(1):81-4)。
ロイコトリエンの薬理学的抑制にともなう有害作用の発生率は小さく、プラセボと差異がないようである(Antileukotriene Working Group, Ann Allergy Asthma Immunol., 2001:86(6 Suppl 1):18-23)。システイニルロイコトリエン1受容体の遮断による消化不良の発生率(2.1%)はプラセボ(1.1%)より高いようである(PDR Electronic Library, 2005, Thomson)。NO補給は消化不良にともなう病態に効果的である(Mourad, FH, et al., Eur J Gastroenterol Hepatol., 2000, 12(1):81-4)。
抗生物質療法の効力の改善
一酸化窒素不足は、特に感染症および随伴する炎症の状況下で、抗生物質の有効性を制限するようである(Carlsson S、et al., Antimicrob Agents Chemother., 2005, 49(6):2352-5)。その上、アテローム性動脈硬化の状況下では、NO機能と感染の両方の異常性が関連しているとされた(Bouwman JJ et al., Eur J Clin Invest., 2005:35(9):573-82)。
一酸化窒素不足は、特に感染症および随伴する炎症の状況下で、抗生物質の有効性を制限するようである(Carlsson S、et al., Antimicrob Agents Chemother., 2005, 49(6):2352-5)。その上、アテローム性動脈硬化の状況下では、NO機能と感染の両方の異常性が関連しているとされた(Bouwman JJ et al., Eur J Clin Invest., 2005:35(9):573-82)。
炎症が誘発する平滑筋の異常収縮
一定の障害では、炎症が腸の運動性を抑制する(Ozaki H, et al., Inflammopharmacology, 2005, 13:103-11)。別の病態では、過運動性となる(Physicians Desk Reference 2005)。炎症が異常平滑筋収縮をもたらす場合、抗炎症性活性と平滑筋弛緩活性を併合して持つ薬物が特に有用となるものとみられる。
一定の障害では、炎症が腸の運動性を抑制する(Ozaki H, et al., Inflammopharmacology, 2005, 13:103-11)。別の病態では、過運動性となる(Physicians Desk Reference 2005)。炎症が異常平滑筋収縮をもたらす場合、抗炎症性活性と平滑筋弛緩活性を併合して持つ薬物が特に有用となるものとみられる。
NSAID誘発胃病変/NSAID誘発胃傷害
1態様中、創傷の治療のためにNOモジュレーターおよびFLAPモジュレーターを使用する。1態様中、NSAIDが誘発する胃病変の治療のために、NOモジュレーターおよびFLAPモジュレーターを使用する。さらに別の態様は、有効量のNOモジュレーター、FLAPインヒビター、もしくは式(I)の化合物を少なくとも1回哺乳動物に投与することを含んでいる、NSAIDが誘発する胃病変の予防または治療のための方法である。
1態様中、創傷の治療のためにNOモジュレーターおよびFLAPモジュレーターを使用する。1態様中、NSAIDが誘発する胃病変の治療のために、NOモジュレーターおよびFLAPモジュレーターを使用する。さらに別の態様は、有効量のNOモジュレーター、FLAPインヒビター、もしくは式(I)の化合物を少なくとも1回哺乳動物に投与することを含んでいる、NSAIDが誘発する胃病変の予防または治療のための方法である。
ロイコトリエンの生物学的性質
ロイコトリエン(LT)は、細胞膜からのアラキドン酸の放出と、5-リポキシゲナーゼ、5-リポキシゲナーゼ活性化タンパク質、LTA4ヒドロラーゼおよびLTC4シンターゼの作用によるロイコトリエンへの変換によって産生される、強力な収縮および炎症の仲介体である。ロイコトリエン合成経路、または5-リポキシゲナーゼ経路には、アラキドン酸がロイコトリエンのLTB4、またはシステイニルロイコトリエンのLTC4、LTD4、およびLTE4に変換される、一連の酵素的反応が関与している。この経路は主として核包膜で発生し、報告がある。例えば以下を参照されたい: Wood, JW et al, J. Exp. Med., 178: 1935-1946, 1993; Peters-Golden, Am. J. Respir. Crit. Care Med. 157:S227-S232, 1998; Drazen, et al., ed. 5-Ripoxygenase Products in Asthma, Pung Biology in Health and Disease Series, Vol. 120, Chs. 1, 2, and 7, Marcel Dekker, Inc. NY, 1998。ロイコトリエン合成経路に使用されるタンパク質成分として、5-リポキシゲナーゼ(5-LO)、5-リポキシゲナーゼ活性化タンパク質、LTA4ヒドロラーゼ、およびLTC4シンターゼが含まれる。ロイコトリエンの合成は例えば以下の文献に記載されている: Samuelsson et al, Science, 220, 568-575, 1983; Peters-Golden, Am J Respir Crit Care Med 157:S227-S232(1998)。ロイコトリエンは好酸球、好中球、好塩基球、リンパ球、マクロファージ、単球およびマスト細胞を含む各種細胞によってアラキドン酸から直接合成される。例えば活性化された好中球からの過剰のLTA4は、細胞間経路によって細胞に入ることができる。体内の大部分の細胞にはLTA4ヒドロラーゼがあるので、LTB4を産生することができる。血小板および内皮細胞にはLTC4シンターゼがあるので、細胞間経路によってLTA4を供給されたとき、LTC4を作成することができる。
ロイコトリエン(LT)は、細胞膜からのアラキドン酸の放出と、5-リポキシゲナーゼ、5-リポキシゲナーゼ活性化タンパク質、LTA4ヒドロラーゼおよびLTC4シンターゼの作用によるロイコトリエンへの変換によって産生される、強力な収縮および炎症の仲介体である。ロイコトリエン合成経路、または5-リポキシゲナーゼ経路には、アラキドン酸がロイコトリエンのLTB4、またはシステイニルロイコトリエンのLTC4、LTD4、およびLTE4に変換される、一連の酵素的反応が関与している。この経路は主として核包膜で発生し、報告がある。例えば以下を参照されたい: Wood, JW et al, J. Exp. Med., 178: 1935-1946, 1993; Peters-Golden, Am. J. Respir. Crit. Care Med. 157:S227-S232, 1998; Drazen, et al., ed. 5-Ripoxygenase Products in Asthma, Pung Biology in Health and Disease Series, Vol. 120, Chs. 1, 2, and 7, Marcel Dekker, Inc. NY, 1998。ロイコトリエン合成経路に使用されるタンパク質成分として、5-リポキシゲナーゼ(5-LO)、5-リポキシゲナーゼ活性化タンパク質、LTA4ヒドロラーゼ、およびLTC4シンターゼが含まれる。ロイコトリエンの合成は例えば以下の文献に記載されている: Samuelsson et al, Science, 220, 568-575, 1983; Peters-Golden, Am J Respir Crit Care Med 157:S227-S232(1998)。ロイコトリエンは好酸球、好中球、好塩基球、リンパ球、マクロファージ、単球およびマスト細胞を含む各種細胞によってアラキドン酸から直接合成される。例えば活性化された好中球からの過剰のLTA4は、細胞間経路によって細胞に入ることができる。体内の大部分の細胞にはLTA4ヒドロラーゼがあるので、LTB4を産生することができる。血小板および内皮細胞にはLTC4シンターゼがあるので、細胞間経路によってLTA4を供給されたとき、LTC4を作成することができる。
アラキドン酸はポリ不飽和脂肪酸の1種であって、主として体細胞の膜内に存在する。細胞の外側からの炎症性刺激が提供されると、カルシウムが放出され、ホスホリパーゼA2(PLA2)および5-LOに結合する。細胞の活性化の結果、PLA2および5-LOが細胞質から小胞体および/または核膜に移動し、そこでFLAPの存在中、放出されたアラキドン酸は5-HPETE中間体を経由してそのエポキシドLTA4に変換される。細胞型に応じて、LTA4はすぐに、核に結合したLTC4シンターゼによってLTC4に、または細胞質LTA4ヒドロラーゼの作用によってLTB4に変換される。LTB4はまだ特性決定されていない輸送物質によって細胞から外に出され、別の細胞、またはこれが作成された細胞を、2種のGタンパク質に連結した受容体(GPCR)、すなわちBLT1RもしくはBLT2R、の1つとの高親和性結合によって、活性化する。LTC4はMRP-1アニオンポンプによって血液に輸送され、γ-グルタミルトランスペプチダーゼの作用によって迅速にLTD4に変換され、LTD4はその後、ジペプチダーゼの作用によってLTE4に変換される。LTC4、LTD4およびLTE4はシステイニルロイコトリエン(または以前はアナフィラキシーの緩慢反応性物質、SRS-A)と総称される。システイニルロイコトリエンは別の細胞、またはこれが作成された細胞を、2種のGPCR、すなわちCysLT1RもしくはCysLT2Rの1つとの高親和性結合によって、活性化する。CysLT1受容体はヒト気道好酸球、好中球、マクロファージ、マスト細胞、B-リンパ球および平滑筋中に見られ、気管支収縮を誘発する: Zhu et al, Am J Respir Cell Mol Biol Epub Aug 25(2005)。CysLT2受容体はヒト気道好酸球、マクロファージ、ヒト肺血管系のマスト細胞中に所在する: Figueroa et al, Clin Exp Allergy 33:1380-1388(2003)。
5-リポキシゲナーゼ活性化タンパク質は、RBL-2H3細胞中でロイコトリエンの形成を調節する2種類のマルチマー複合体を形成することが示された; Mandal et al, PNAS, 101, 6587-6592(2004)。第1複合体は5-リポキシゲナーゼ活性化タンパク質のホモダイマーまたはホモトリマーの形成であり、第2は5-リポキシゲナーゼ活性化タンパク質およびLTC4シンターゼが関与するヘテロダイマーまたはヘテロトリマーの形成である。LTC4シンターゼの5-リポキシゲナーゼ活性化タンパク質との密接な関係ならびにLTC4シンターゼの低発現レベルは、すべてのLTC4シンターゼがヘテロマルチマー内で5-リポキシゲナーゼ活性化タンパク質と結びついていることを意味している。LTC4の形成はヘテロダイマーもしくはヘテロトリマーによって調節されているらしく、一方5-リポキシゲナーゼ活性化タンパク質のホモダイマーもしくはホモトリマーはLTA4の生成に関係し、これがその後のLTB4への変換で利用できる。5-リポキシゲナーゼの阻害の結果、ロイコトリエンの形成の完全な下流の阻害となる。対照的に、5-リポキシゲナーゼ活性化タンパク質の別種マルチマー複合体の存在は、それぞれのマルチマー複合体に選択的な5-リポキシゲナーゼ活性化タンパク質インヒビターの調製によって、LTB4またはシステイニルロイコトリエン類、LTC4、LTD4およびLTE4の産生の抑制を別様に調節する可能性を提供する。こうして、本明細書に記載するFLAPインヒビターの1実施形態は、FLAPのマルチマー複合体のそれぞれに選択的なFLAPインヒビターである。
疾病におけるロイコトリエンの関与は文献に記載されている。例えば以下を参照されたい: Busse, Clin. Exp. Allergy 26:868-79, 1996; O'Byrne, Chest 111(Supp. 2): 27S-34S, 1977; Sheftell, F.D., et al., Headache, 40:158-163, 2000; Klickstein et al., J. Clin. Invest., 66:1166-1170, 1950; およびDavidson et al., Ann. Rheum. Dis., 42:677-679, 1983。ロイコトリエンはヒト皮膚で顕著な炎症性応答をもたらす。ヒト疾病でのロイコトリエンの関与の証拠が乾癬で見られ、この場合ロイコトリエンが乾癬病変で検出されている(Kragballe et al., Arch. Dermatol., 119:548-552, 1983)。
例えば、炎症性応答は、局所血管で3つのタイプの変化を反映するものと示唆されている。最初の変化は血管直径の増加で、その結果局所血流が増加し、温度、赤みの増加、および特に小血管の表面での血流速度の低下をもたらす。第2の変化は、血管内面の内皮細胞の活性化であって、循環白血球の結合を促進する接着分子を発現させる。遅くなった血流と誘発された接着分子の組み合わせによって、白血球が内皮に付着し、組織内に移動することが可能になる。これは溢出として知られるプロセスである。これらの変化は活性化されたマクロファージによって産生されたサイトカインおよびロイコトリエンによって開始される。炎症が始まったとき、感染の部位に引き寄せられる最初の細胞は一般的に好中球である。単球がそれに続き、これはさらに組織マクロファージに分化する。炎症の後期では、その他の白血球、好酸球およびリンパ球なども感染部位に入っていく。局所血管の第3の主要な変化は血管透過性の増加である。血管壁内面の内皮細胞は互いに緊密に結合しないで分割され、血液からの液体およびタンパク質の流出および組織中のそれらの局所蓄積をもたらす(以下参照: Janeway, et al., Immunobiology: the immune system in health and dissease, 5th ed., Garland Publishing, New York, 2001)。
LTB4は単離された気管および肺実質の比較的弱い収縮をもたらし、これらの収縮はシクロオキシゲナーゼのインヒビターによって一部遮断されるので、この収縮はプロスタグランジンの放出から二次的なものであることが示唆される。しかし、LTB4は好酸球およびマスト細胞の前駆細胞に対する強力な走化性物質であることがわかり、LTB4受容体BLT1-/-ノックアウトマウスは好酸球性炎症およびT細胞仲介アレルギー性気道過敏性から保護される(Miyahara et al., J Immunol 174:4979-4784; Weller et al., J Exp Med 201:1961-1971(2005))。
ロイコトリエン、C4およびD4は強力な平滑筋収縮性物質であり、ヒトを含む多様な種で、気管支収縮を促進する(Dahlen et al., Nature, 288:484-486, 1980)。これらの化合物は著しい血行力学的作用を持ち、冠状血管を収縮させ、その結果心拍出効率を低下させる(Marone et al., in Biology of Leukotrienes, ed. By R. Levi and R.D. Krell, Ann. New York Acad. Sci. 524:321-333, 1988)。ロイコトリエンは血管収縮物質としても作用するが、異種の血管床では著しい差異を呈する。ロイコトリエンが心筋虚血後の心再かん流傷害に寄与することを示唆する報告がある(Barst and Mullane, Eur. J. Pharmacol., 114: 383-387, 1985; Sasaki et al., Cardiovasc. Res., 22: 142-148, 1988)。LTC4およびLTD4は、CysLT2受容体およびおそらくその他のまだ確定されていないCysLT受容体の活性化によって毛細管内皮細胞の退縮を促進することによって、直接血管透過性を増加させるものとみられる[Lotzer et al Arterioscler Thromb Vasc Biol 23: e32-36(2003)]。LTB4は、2つのアテローム性動脈硬化マウスモデル、すなわち低密度受容体、リポタンパク質受容体欠失(LDLr-/-)およびアポリポタンパク質E-欠失(ApoE-/-)マウスで、アテローム性動脈硬化の進行を強化する(Aiello et al, Arterioscler Thromb Vasc Biol 22:443-449(2002); Subbarao et al, Arterioscler Thromb Vasc Biol 24:369-375(2004); Heller et al Circulation 112:578-586(2005))。LTB4もアテローム性動脈硬化進行の既知のエンハンサーである、ヒト単球化学走化性タンパク質(MCP-1)を増加させることが示されている(Huang et al Aterioscler Thromb Vasc Biol 24:1783-1788(2004))。
ロイコトリエン合成経路中のFLAPの役割は顕著である。なぜならば、FLAPは5-リポキシゲナーゼと協同して、ロイコトリエンの合成のための経路の最初のステップを実行するからである。したがって、ロイコトリエン合成経路は、例えば、血管および炎症性障害、増殖性疾病、ならびに非がん性障害を含む、ロイコトリエン依存性もしくはロイコトリエン介在疾病または病態の治療で有用な化合物についての多数の標的を提供する。
本明細書に記載する方法、化合物、医薬組成物および医薬を使用して治療される、ロイコトリエン依存性もしくはロイコトリエン介在病態として、限定するわけではないが、以下が含まれる: 骨疾患および障害、心血管疾患および障害、炎症性疾患および障害、皮膚疾患および障害、眼疾患および障害、がんおよびその他の増殖性疾患および障害、呼吸器疾患および障害、ならびに非がん性障害。
治療におけるFLAP阻害
ロイコトリエンは喘息の患者の気道の炎症に関与することが知られている。モンテルカスト(SingulairTM)などのCysLT1受容体アンタゴニストは、喘息およびアレルギー性鼻炎に有効であることが示された[Reiss et al. Arch Intern Med 158:1213-1220(1998); Phillip et al., Clin Exp Allergy 32:1020-1028(2002)]。CysLT1Rアンタゴニスト、プランルカスト(OnonTM)およびザフィルルカスト(AccolateTM)も喘息に有効であることが示された。
ロイコトリエンは喘息の患者の気道の炎症に関与することが知られている。モンテルカスト(SingulairTM)などのCysLT1受容体アンタゴニストは、喘息およびアレルギー性鼻炎に有効であることが示された[Reiss et al. Arch Intern Med 158:1213-1220(1998); Phillip et al., Clin Exp Allergy 32:1020-1028(2002)]。CysLT1Rアンタゴニスト、プランルカスト(OnonTM)およびザフィルルカスト(AccolateTM)も喘息に有効であることが示された。
喘息で効力が示された5-リポキシゲナーゼインヒビター、ジレウトン(ZyfloTM)を含む、多数の薬物がロイコトリエン形成を抑制するように設計された: Israel et al., Ann Intern Med 119:1059-1066(1993)。5-リポキシゲナーゼインヒビター、ZD2138はアスピリン誘発喘息の結果であるFEV1の低下を抑制する効力が示された: Nasser et al, Thorax, 49; 749-756(1994)。その他の5-リポキシゲナーゼインヒビターとして以下が含まれる: CJ-13,610(Mano et al, Chem. Pharm. Bull., 53, 965-973, 2005)、ABT-761(atreleuton; Stewart et al, J. Med. Chem., 1997, 40, 1955-1968)、AZD-4407(European Pa10t EP 623614)、L-739,010(Hamel et al, J. Med. Chem., 40, 2866-2875, 1997)、Wy-50,295(Musser and Kreft, Drugs of the Future, 15, 73-80, 1990)、TMK688(Tohda et al, Clin. Exp. Allergy, 27, 110-118, 1997)。以下も参照されたい: Young, Eur. J. Med. Chem., 34, 671-685, 1999およびWerz Expert Opin. Ther. Pa10ts, 15, 505-519, 2005。以下のロイコトリエン合成インヒビターが喘息での効力を示している: MK-0591、5-リポキシゲナーゼ活性化タンパク質(FLAP)の特異的インヒビター、Brideau, et al., Ca. J. Physiol. Pharmacol. 70:799-807(1992)、MK-886、5-リポキシゲナーゼ活性化タンパク質(FLAP)の特異的インヒビター、Friedman et al Am Rev Respir Dis., 147: 839-844(1993)、およびBAY X1005、5-リポキシゲナーゼ活性化タンパク質(FLAP)の特異的インヒビター、Fructmann et al, Agents Actions 38: 188-195(1993)。
FLAP阻害は血管炎症に関与する単球、好中球およびその他の細胞からLTB4を減少させ、それによってアテローム性動脈硬化の進行を減少させる。FLAPインヒビター、MK-886はブタ頚動脈損傷モデルでの血管形成術後の血管収縮応答を減少させることが示された: Provost et al., Brit J Pharmacol 123: 251-258(1998)。MK-886は内皮傷害のラット光化学的モデルでの大腿部動脈内膜過形成を抑制することも示された: Kondo et al., Thromb Haemost 79:635-639(1998)。5-リポキシゲナーゼインヒビター、ジレウトンはマウスモデルでの腎虚血を減少させることが示された: Nimesh et al., Mol Pharm 66:220-227(2004)。
FLAPモジュレーターは、単なる例示であるが以下を含む多様な疾病または病態の治療のために使用されてきた: (i) 炎症(例えば以下参照: Leff AR et al.、Ann Allergy Asthma Immunol 2001;86(Suppl 1)4-8; Riccioni G、et al.、Ann Clin Lab Sci. 2004、34(4):379-870; (ii) 以下を含む呼吸器疾病、喘息、成人呼吸器不調症候群およびアレルギー性(外因性)喘息、非アレルギー性(内因性)喘息、急性重症喘息、慢性喘息、臨床性喘息、夜間喘息、アレルゲン誘発喘息、アスピリン感受性喘息、運動誘発喘息、イソカプニック(isocapnic)過換気症、小児発症喘息、成人発症喘息、咳型喘息、職業性喘息、ステロイド耐性喘息、季節性喘息(例えば以下参照: Riccioni et al, Ann. Clin. Lab. Sci., v34, 379-387(2004)); (iii) 以下を含む慢性閉塞性肺疾病、慢性気管支炎もしくは肺気腫、間質性肺線維症および/または気道炎症および嚢胞性線維症(例えば以下参照: Kostikas K et al., Chest 2004;127:1553-9); (iv) 疾病もしくは病態での粘膜分泌および/または浮腫の増加(例えば以下参照: Shahab R et al., J Laryngol Otol., 2004;118;500-7); (v) 血管収縮、アテローム性動脈硬化およびその続発性心筋虚血、心筋梗塞、大動脈瘤、脈管炎および卒中(例えば以下参照: Jala et al, Trends in Immunol., v25, 315-322(2004)およびMehrabian et al, Curr. Opin. Lipidol., v14, 447-457(2003)); (vi) 器官虚血および/または内毒素ショック後の臓器再かん流傷害の低下(例えば以下参照: Matsui N, Fukuishi N, Fukuyama Y, Yasui Y, Akagi M.,"Protective effect of the 5-lipoxygenase inhibitor ardisiaquinone A on hepatic ischemia-reperfusion injury in rats", Planta Med. 2005 Aug;71(8):717-20); (vii) 血管の収縮の低下(例えば以下参照: Stanke-Labesque F et al., Br J Pharmacol. 2003 Sep;140(1):186-94); (viii) 血圧の低下または上昇予防(例えば以下参照: Stanke-Labesque F et al., Br J Pharmacol. 2003 Sep;140(1):186-94, およびWalch L, et al., Br J Pharmacol. 2002 Dec; 137(8):1339-45); (ix) 好酸球および/または好塩基球および/または樹状細胞および/または好中球および/または単球動員の防止(例えば以下参照: Miyahara N et al., Immunol. 2005 Apr 15;174(8):4979-84); (x) 骨減少症、骨粗しょう症、パジェット病、がんおよびその他の疾病を含む異常な骨の再形成、減量または増量(例えば以下参照: Anderson GI, et al., Biomed Mater Res. 2001;58(4):406-140; (xi) 眼性炎症およびアレルギー性結膜炎、春季角結膜炎、ならびに乳頭状結膜炎(例えば以下参照: Lambiase et al, Arch. Opthalmol., v121, 615-620(2003)); (xii) 限定するわけではないが、多発硬化症、パーキンソン病、アルツハイマー病、卒中、脳虚血、網膜虚血、術後認知機能障害、片頭痛を含むCNS障害(例えば以下参照: de Souza Carvalho D, et al., Headache. 2002 Nov-Dec;42(10):1044-7; Sheftell F、et al.、Headache. 2000 Feb;40(2):158-63); (xiii) 末梢神経障害/神経痛、脊髄(例えば以下参照: Akpek EA, et al., Spine. 1999 Jan 15;24(2):128-32)、脳浮腫および頭部傷害; (xiv) 限定するわけではないが、膵がんおよびその他の固形もしくは血液腫瘍を含むがん(例えば以下参照: Poff and Balazy、Curr. Drug Targets Inflamm. Allergy, v3, 19-33(2004)およびSteele et al, Cancer Epidemiology & Prevention, v8, 467-483(1999); (xv) 内毒性ショックおよび敗血性ショック(例えば以下参照: Leite MS, et al., Schock. 2005 Feb;23(2):173-8); (xvi) リウマチ性関節炎および変形性関節炎(例えば以下参照: Al10 R, et al., Ann Rheum Dis. 2004 Feb;63(2):170-6); (xvii) 単なる例示であるが、慢性胃炎、好酸球性胃腸炎、および胃運動機能障害を含むGI疾病の増加の予防(例えば Gyomber et al, J Gastroenterol Hepatol., v11,922-927(1996); Quack I et al., BMC Gastroenterol v18,24(2005); Cuzzocrea S, et al., Lab Invest. 2005 Jun;85(6):808-22); (xviii) 単なる例示であるが、糸球体腎炎、シクロスポリン腎毒性腎虚血再かん流を含む、腎疾患(例えば以下参照: Guasch et al., Kidney Int.,v56, 261-267; Butterly et al, Kidney Int., v 57、2586-2593(2000); Guasch A et al. Kidney Int. 1999;56:261-7; Butterly DW et al. Kidney Int. 2000;57:2586-93); (xix) 急性もしくは慢性腎機能不全の予防または治療(例えば以下参照: Maccarrone M, et al., J Am Soc Nephrol. 1999;10:1991-6); (xx) 急性腎盂腎炎の腎臓などの、1以上の固体器官もしくは組織内の急性感染症の状態の縮小(例えば以下参照: Tardif M、et al., Antimicrob Agents Chemother. 1994 Jul;38(7):1555-60);
(xxi) 好酸球の動員もしくは活性化が関与する急性もしくは慢性障害の予防または治療(例えば以下参照: Quack I, al. BMC Gastroenterol., 2005;5:24;(xxii) 非ステロイド抗炎症薬(選択的もしくは非選択的シクロオキシゲナーゼ-1または-2インヒビターを含む)に起因する胃腸管の急性もしくは慢性びらん性疾病または運動機能障害の予防または治療(例えば以下参照: Marusova IB, et al., Eksp Klin Farmakol, 2002;65:16-8およびGyomber E, et al., J. Gastroenterol. Hepatol., 1996, 11, 922-7およびMartin St et al., Eur J Gastroenterol. Hepatol., 2005, 17:983-6);(xxiii) II型糖尿病の治療(例えば以下参照: Valdivielso JM, et al., J Nephrol. 2003 Jan-Feb;16(1):85-94; Parlapiano C, et al., Diabetes Res Clin Pract. 1999 Oct;46(1):43-5);(xxiv) 単なる例示であるが、家族性地中海熱などの代謝症候群の治療(例えば以下参照: Bentancur AG、et al., Clin Exp Rheumatol. 2004 Jul-Aug;22(4 Suppl 34):S56-8);(xxv) 肝腎症候群の治療(例えば以下参照: Capella GL., Prostaglandins Leukot Essent Fatty Acids. 2003 Apr;68(4):263-5); ならびに(xxvi) 肺高血圧。
(xxi) 好酸球の動員もしくは活性化が関与する急性もしくは慢性障害の予防または治療(例えば以下参照: Quack I, al. BMC Gastroenterol., 2005;5:24;(xxii) 非ステロイド抗炎症薬(選択的もしくは非選択的シクロオキシゲナーゼ-1または-2インヒビターを含む)に起因する胃腸管の急性もしくは慢性びらん性疾病または運動機能障害の予防または治療(例えば以下参照: Marusova IB, et al., Eksp Klin Farmakol, 2002;65:16-8およびGyomber E, et al., J. Gastroenterol. Hepatol., 1996, 11, 922-7およびMartin St et al., Eur J Gastroenterol. Hepatol., 2005, 17:983-6);(xxiii) II型糖尿病の治療(例えば以下参照: Valdivielso JM, et al., J Nephrol. 2003 Jan-Feb;16(1):85-94; Parlapiano C, et al., Diabetes Res Clin Pract. 1999 Oct;46(1):43-5);(xxiv) 単なる例示であるが、家族性地中海熱などの代謝症候群の治療(例えば以下参照: Bentancur AG、et al., Clin Exp Rheumatol. 2004 Jul-Aug;22(4 Suppl 34):S56-8);(xxv) 肝腎症候群の治療(例えば以下参照: Capella GL., Prostaglandins Leukot Essent Fatty Acids. 2003 Apr;68(4):263-5); ならびに(xxvi) 肺高血圧。
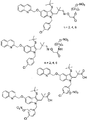
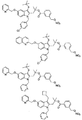
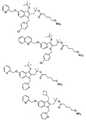
以下のいくつかのFLAPインヒビターの記載があるが、その開示の全部を参照として、本明細書に記載する複合組成物および方法で使用することができる薬物の例として、組み入れる: Gillard et al, Can. J. Physiol. Pharmacol., 67, 456-464, 1989; Evans et al, Molecular Pharmacol., 40, 22-27, 1991; Brideau et al, Can. J. Physiol. Pharmacol., 1992 Jun;70(6):799-807; Musser et al, J. Med. Chem., 35, 2501-2524, 1992; Steinhilber, Curr. Med. Chem. 6(1):71-85, 1999; Riendeau, Bioorg Med Chem Lett., 15(14):3352-5, 2005; Flamand, et al., Mol. Pharmacol. 62(2):250-6, 2002; Folco, et al., Am. J. Respir. Crit. Care Med. 161(2 Pt 2):S112-6, 2000; Hakonarson, JAMA, 293(18):2245-56, 2005。
FLAPと結合してロイコトリエンの合成を抑制する薬物の限定するわけではない例が以下の刊行物に記載されているが、その開示の全部を参照として組み入れる: Ford-Hutchinson, et al., Ann. Rev. Biochem., 63:383-417(1994); Rouzer, et al., J. Biol. Chem., 265:1436-42(1990); およびGorenne, et al., J. Pharmacol. Exp. Ther., 268:868-72(1994)。FLAPに結合する薬物の限定するわけではない別の例が以下の特許および特許出願に記載されているが、その開示の全部を参照として、本明細書に記載する複合組成物および方法で使用することができる薬物の例として、組み入れる: 米国特許第6,756,399および6,436,924号、ならびに米国特許出願公開第20020022650および20010025040号。その上、以下のFLAPインヒビターが本明細書に記載する複合組成物および方法で使用することができる薬物の例である; Abbott-72694; Abbott-81834; Abbott-93178; インドールならびに以下などのキノリン化合物; MK-591、MK-886、BAY X 1005、BAY Y 1015、、ETH603、ETH615、ETH647、WAY-121520、ならびにWY 50295。FLAPインヒビターは以下に記載された化合物から選択することもできる: 米国特許第4,929,626; 4970215; 5,081,138; 5,095,031; 5,204,344; 5,126,354; 5,221,678; 5,229,516; 5,272,145; 5,283,252; 5,288,743; 5,292,769; 5,304,563; 5,399,699; 5,459,150; 5,512,581; 5,597,833; 5,668,146; 5,668,150; 5,691,351; 5,714,488; 5,783,586; 5,795,900; および5,843,968号。
FLAPインヒビターの限定するわけではない別の例が以下の特許公開公報に記載されているが、その開示の全部を参照として、本明細書に記載する複合組成物および方法で使用することができる薬物の例として、組み入れる: 米国特許公開番号; 2007/0123522、米国特許公開番号; 2007/0105866、米国特許公開番号; 2007/0219206、米国特許公開番号; 2007/0225285、米国特許公開番号; 2007/0244128、国際特許公開番号; WO 07/056021、国際特許公開番号; WO07/056220、国際特許公開番号; WO07/056338、国際特許公開番号; WO07/047207。
式中、
Aはそれぞれ独立してNもしくはCR5から選択され、A'はそれぞれC-Z-Y、NもしくはCR5、ただし一方のA'がC-Z-Yかつ他方のA'がNもしくはCR5、ただしAのN基の数とA'のN基の数の和が1もしくは2;
Zは以下から選択され: 結合、-CR1=CR1-、-C≡C-、-C(R2)n-、-C(R1)2O-、-OC(R1)2-、-C(R1)2S(O)m-、-S(O)mC(R1)2-、-C(R1)2NH-、-NHC(R1)2-、-C(R2)2C(R1)2O-、-C(R1)2OC(R1)2-、-OC(R1)2C(R2)2-、-C(O)NH-、-NHC(=O)-、ここでR1はそれぞれ独立してH、CF3、もしくは場合によって置換された低級アルキル; そしてR2はそれぞれ独立してH、OH、OMe、CF3、もしくは場合によって置換された低級アルキル; mは0、1もしくは2; nは0、1、2、もしくは3;
Yは-L1-(置換もしくは非置換ヘテロシクロアルキル)、-L1-(置換もしくは非置換ヘテロアリール)、-L1-(置換もしくは非置換アリール)または-L1-C(=NR3)N(R4)2、-L1-NR4C(=NR3)N(R4)2、-L1-NR4C(=CHR3)N(R4)2;
ここでR3は独立して以下から選択され; H、-S(=O)2R4、-S(=O)2NH2、-C(O)R4、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル;
R4はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル; または2つのR4基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; またはR3とR4基が連携して5-、6-、7-、もしくは8員ヘテロ環形成し;
ここでL1は結合、置換もしくは非置換アルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル、置換もしくは非置換ヘテロアルキル;
R6はH、-L2-(置換もしくは非置換アルキル)、-L2-(置換もしくは非置換シクロアルキル)、-L2-(置換もしくは非置換アルケニル)、-L2-(置換もしくは非置換シクロアルケニル)、-L2-(置換もしくは非置換ヘテロシクロアルキル)、-L2-(置換もしくは非置換ヘテロアリール)、または-L2-(置換もしくは非置換アリール)、ここでL2は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-C(=O)-、-(置換もしくは非置換C1-C6アルキル)、または-(置換もしくは非置換C2-C6アルケニル);
R7はL3-X-L4-G、ここで、
Xは結合、-O-、-C(=O)-、-S-、-S(=O)-、-S(=O)2-、-NH-、-NR8、-NHC(=O)-、-C(=O)NH-、-NR8C(=O)-、-C(=O)NR8-、-S(=O)2NH-、-NHS(=O)2-、-S(=O)2NR8-、-NR8S(=O)2-、-OC(=O)NH-、-NHC(=O)O-、-OC(=O)NR8-、-NR8C(=O)O-、-CH=NO-、-ON=CH-、-NR9C(=O)NR9-、ヘテロアリール、アリール、-NR9C(=NR10)NR9-、-NR9C(=NR10)-、-C(=NR10)NR9-、-OC(=NR10)-、もしくは-C(=NR10)O-;
L3は結合、置換もしくは非置換アルキル、置換もしくは非置換シクロアルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル、置換もしくは非置換アリール、置換もしくは非置換ヘテロアリール、置換もしくは非置換ヘテロシクロアルキル;
L4は結合、場合によって置換もしくは非置換アルキル、場合によって置換もしくは非置換シクロアルキル、場合によって置換もしくは非置換アルケニル、場合によって置換もしくは非置換アルキニル;
GはH、-CO2H、テトラゾリル、-NHS(=O)2R8、-S(=O)2N(R9)2、-OH、-OR8、-C(=O)CF3、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R8、-CN、-N(R9)2、-C(=NR10)N(R8)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-CO2R8、-C(=O)R8、-C(=O)N(R9)2、-SR8、-S(=O)R8、-S(=O)2R8、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-NHC(=O)O-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-;
またはGはW-G1であって、ここでWは置換もしくは非置換アリール、置換もしくは非置換ヘテロシクロアルキルまたは置換もしくは非置換ヘテロアリール、そしてG1はH、-CO2H、テトラゾリル、-NHS(=O)2R8、-S(=O)2N(R9)、-OH、-OR8、-C(=O)CF3、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R8、-CN、-N(R9)2、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-CO2R8、-C(=O)NH2、-C(=O)NHR8、もしくは-C(=O)N(R8)2;
R8はそれぞれ独立して以下から選択され; 置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル;
R9はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル; または2つのR9基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; またはR8とR9が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し;
R10はそれぞれ独立して以下から選択され; H、-S(=O)2R8、-S(=O)2NH2、-C(=O)R8、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル;
R5はH、ハロゲン、-N3、-CN、-ONO2、-L6-(置換もしくは非置換C1-C3アルキル)、-L6-(置換もしくは非置換C2-C4アルケニル)、-L6-(置換もしくは非置換ヘテロアリール)、または-L6-(置換もしくは非置換アリール)、ここでL6は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-NH-、-C(=O)-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)-、もしくは-C(=O)NH-;
R11はL7-G、L7-(置換もしくは非置換シクロアルキル)-G、L7-(置換もしくは非置換シクロアルケニル)-G、L7-(置換もしくは非置換ヘテロアリール)-G、またはL7-(置換もしくは非置換アリール)-G、L7-(置換もしくは非置換ヘテロシクロアルキル)-G、ここでL7は結合、-C(=O)-、-C(=O)NH-、(置換もしくは非置換C1-C6アルキル)、または(置換もしくは非置換C2-C6アルケニル);
R12はH、もしくはL8-L9-R13、ここでL8は結合、(置換もしくは非置換C1-C6アルキル)、または(置換もしくは非置換C2-C4アルケニル); L9は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-NH-、-C(=O)-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; R13はH、(置換もしくは非置換C1-C6アルキル)、(置換もしくは非置換アリール)、(置換もしくは非置換ヘテロアリール)、または(置換もしくは非置換ヘテロシクロアルキル);
またはR7とR12が連携して4〜8員ヘテロ環を形成し;
あるいは前記化合物の溶媒和物、または医薬として許容される塩、または医薬として許容されるプロドラッグ。
Aはそれぞれ独立してNもしくはCR5から選択され、A'はそれぞれC-Z-Y、NもしくはCR5、ただし一方のA'がC-Z-Yかつ他方のA'がNもしくはCR5、ただしAのN基の数とA'のN基の数の和が1もしくは2;
Zは以下から選択され: 結合、-CR1=CR1-、-C≡C-、-C(R2)n-、-C(R1)2O-、-OC(R1)2-、-C(R1)2S(O)m-、-S(O)mC(R1)2-、-C(R1)2NH-、-NHC(R1)2-、-C(R2)2C(R1)2O-、-C(R1)2OC(R1)2-、-OC(R1)2C(R2)2-、-C(O)NH-、-NHC(=O)-、ここでR1はそれぞれ独立してH、CF3、もしくは場合によって置換された低級アルキル; そしてR2はそれぞれ独立してH、OH、OMe、CF3、もしくは場合によって置換された低級アルキル; mは0、1もしくは2; nは0、1、2、もしくは3;
Yは-L1-(置換もしくは非置換ヘテロシクロアルキル)、-L1-(置換もしくは非置換ヘテロアリール)、-L1-(置換もしくは非置換アリール)または-L1-C(=NR3)N(R4)2、-L1-NR4C(=NR3)N(R4)2、-L1-NR4C(=CHR3)N(R4)2;
ここでR3は独立して以下から選択され; H、-S(=O)2R4、-S(=O)2NH2、-C(O)R4、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル;
R4はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル; または2つのR4基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; またはR3とR4基が連携して5-、6-、7-、もしくは8員ヘテロ環形成し;
ここでL1は結合、置換もしくは非置換アルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル、置換もしくは非置換ヘテロアルキル;
R6はH、-L2-(置換もしくは非置換アルキル)、-L2-(置換もしくは非置換シクロアルキル)、-L2-(置換もしくは非置換アルケニル)、-L2-(置換もしくは非置換シクロアルケニル)、-L2-(置換もしくは非置換ヘテロシクロアルキル)、-L2-(置換もしくは非置換ヘテロアリール)、または-L2-(置換もしくは非置換アリール)、ここでL2は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-C(=O)-、-(置換もしくは非置換C1-C6アルキル)、または-(置換もしくは非置換C2-C6アルケニル);
R7はL3-X-L4-G、ここで、
Xは結合、-O-、-C(=O)-、-S-、-S(=O)-、-S(=O)2-、-NH-、-NR8、-NHC(=O)-、-C(=O)NH-、-NR8C(=O)-、-C(=O)NR8-、-S(=O)2NH-、-NHS(=O)2-、-S(=O)2NR8-、-NR8S(=O)2-、-OC(=O)NH-、-NHC(=O)O-、-OC(=O)NR8-、-NR8C(=O)O-、-CH=NO-、-ON=CH-、-NR9C(=O)NR9-、ヘテロアリール、アリール、-NR9C(=NR10)NR9-、-NR9C(=NR10)-、-C(=NR10)NR9-、-OC(=NR10)-、もしくは-C(=NR10)O-;
L3は結合、置換もしくは非置換アルキル、置換もしくは非置換シクロアルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル、置換もしくは非置換アリール、置換もしくは非置換ヘテロアリール、置換もしくは非置換ヘテロシクロアルキル;
L4は結合、場合によって置換もしくは非置換アルキル、場合によって置換もしくは非置換シクロアルキル、場合によって置換もしくは非置換アルケニル、場合によって置換もしくは非置換アルキニル;
GはH、-CO2H、テトラゾリル、-NHS(=O)2R8、-S(=O)2N(R9)2、-OH、-OR8、-C(=O)CF3、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R8、-CN、-N(R9)2、-C(=NR10)N(R8)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-CO2R8、-C(=O)R8、-C(=O)N(R9)2、-SR8、-S(=O)R8、-S(=O)2R8、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-NHC(=O)O-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-;
またはGはW-G1であって、ここでWは置換もしくは非置換アリール、置換もしくは非置換ヘテロシクロアルキルまたは置換もしくは非置換ヘテロアリール、そしてG1はH、-CO2H、テトラゾリル、-NHS(=O)2R8、-S(=O)2N(R9)、-OH、-OR8、-C(=O)CF3、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R8、-CN、-N(R9)2、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-CO2R8、-C(=O)NH2、-C(=O)NHR8、もしくは-C(=O)N(R8)2;
R8はそれぞれ独立して以下から選択され; 置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル;
R9はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル; または2つのR9基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; またはR8とR9が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し;
R10はそれぞれ独立して以下から選択され; H、-S(=O)2R8、-S(=O)2NH2、-C(=O)R8、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル;
R5はH、ハロゲン、-N3、-CN、-ONO2、-L6-(置換もしくは非置換C1-C3アルキル)、-L6-(置換もしくは非置換C2-C4アルケニル)、-L6-(置換もしくは非置換ヘテロアリール)、または-L6-(置換もしくは非置換アリール)、ここでL6は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-NH-、-C(=O)-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)-、もしくは-C(=O)NH-;
R11はL7-G、L7-(置換もしくは非置換シクロアルキル)-G、L7-(置換もしくは非置換シクロアルケニル)-G、L7-(置換もしくは非置換ヘテロアリール)-G、またはL7-(置換もしくは非置換アリール)-G、L7-(置換もしくは非置換ヘテロシクロアルキル)-G、ここでL7は結合、-C(=O)-、-C(=O)NH-、(置換もしくは非置換C1-C6アルキル)、または(置換もしくは非置換C2-C6アルケニル);
R12はH、もしくはL8-L9-R13、ここでL8は結合、(置換もしくは非置換C1-C6アルキル)、または(置換もしくは非置換C2-C4アルケニル); L9は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-NH-、-C(=O)-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; R13はH、(置換もしくは非置換C1-C6アルキル)、(置換もしくは非置換アリール)、(置換もしくは非置換ヘテロアリール)、または(置換もしくは非置換ヘテロシクロアルキル);
またはR7とR12が連携して4〜8員ヘテロ環を形成し;
あるいは前記化合物の溶媒和物、または医薬として許容される塩、または医薬として許容されるプロドラッグ。
式中、
Zは以下から選択され: -N(R1)-、-S(=O)m-、-CR1=CR1-、-C≡C-、-C(R1)2[C(R2)2]n-、-[C(R2)2]nC(R1)2O-、-OC(R1)2[C(R2)2]n-、-[C(R2)2]nC(R1)2S(O)m-、-S(O)mC(R1)2[C(R2)2]n-、-[C(R2)2]nC(R1)2NR1-、-NR1C(R1)2[C(R2)2]n-、-[C(R2)2]nO[C(R1)2]n-、-[C(R1)2]nO[C(R2)2]n-、-C(=O)NR2-、-NR2C(=O)-、-NR2C(=O)O-、-OC(=O)NR2-、-S(=O)2NR2-、-CR1=N-N-、-NR2C(=O)NR2-、-OC(=O)O-、S(=O)2NR2、もしくは-NR2S(=O)2-、ここでR1はそれぞれ独立してH、CF3、もしくは場合によって置換された低級アルキル; または同一の炭素上の2つのR1が結合してオキソ(=O)を形成し; R2はそれぞれ独立してH、OH、OMe、CF3、もしくは場合によって置換された低級アルキル、または同一の炭素上の2つのR2が結合してオキソ(=O)を形成し; mは0、1もしくは2; nはそれぞれ独立して0、1、2、もしくは3;
YはH、-CO2H、テトラゾリル、-NHS(=O)2R3b、-S(=O)2N(R4)2、-OH、-OR3b、-C(=O)(C1-C5フルオロアルキル)、-C(=O)NHS(=O)2R3b、-S(=O)2NHC(O)R4、-CN、-N(R4)2、-N(R4)C(=O)R4、-C(=NR3)N(R4)2、-NR4C(=NR3)N(R4)2、-NR4C(=CHR3)N(R4)2、-C(=O)NR4C(=NR3)N(R4)2、-C(O)NR4C(=CHR3)N(R4)2、-CO2R3b、-C(=O)R4、-C(=O)N(R4)2、-SR3b、-S(=O)R3b、-S(=O)2R3b、-L1-(置換もしくは非置換アルキル)、-L1-(置換もしくは非置換アルケニル)、-L1-(置換もしくは非置換アルキニル)、-L1-(置換もしくは非置換シクロアルキル)、-L1-(置換もしくは非置換ヘテロシクロアルキル)、-L1-(置換もしくは非置換ヘテロアリール)、-L1-(置換もしくは非置換アリール)、-L1-C(=NR4)N(R4)2、-L1-NR4C(=NR4)N(R4)2、または-L1-NR4C(=CHR3)N(R4)2;
ここでL1は結合、置換もしくは非置換アルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル、置換もしくは非置換ヘテロシクロアルキル、置換もしくは非置換ヘテロアリール、置換もしくは非置換シクロアルキル、置換もしくは非置換ヘテロアルキル、置換もしくは非置換ヘテロアルケニル、置換もしくは非置換ヘテロアルキニル、または置換もしくは非置換アリール;
ここで各置換基は-LsRs、ここでLsはそれぞれ独立して以下から選択され; 結合、-O-、-C(=O)-、-S-、-S(=O)-、-S(=O)2-、-NHC(=O)-、-C(=O)NH-、S(=O)2NH-、-NHS(=O)2、-OC(=O)NH-、-NHC(=O)O-、-OC(=O)O-、-NHC(=O)NH-、-C(=O)O-、-OC(=O)-、C1-C6アルキル、C2-C6アルケニル、-C1-C6フルオロアルキル、ヘテロアリール、アリール、もしくはヘテロシクロアルキル; そしてRsはそれぞれ独立して以下から選択され; H、ハロゲン、-N(R4)2、-CN、-NO2、N3、-S(=O)2NH2、低級アルキル、低級シクロアルキル、-C1-C6フルオロアルキル、ヘテロアリール、もしくはヘテロアルキル;
R3は独立して以下から選択され; H、-S(=O)2R8、-S(=O)2NH2、-C(O)R8、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル; R3bはそれぞれ独立して以下から選択され; 置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; R4はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; あるいは2つのR4基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; あるいはR3bとR4が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し;
R6はH、L2-(置換もしくは非置換アルキル)、L2-(置換もしくは非置換シクロアルキル)、L2-(置換もしくは非置換アルケニル)、L2-(置換もしくは非置換シクロアルケニル)、L2-(置換もしくは非置換ヘテロシクロアルキル)、L2-(置換もしくは非置換ヘテロアリール)、またはL2-(置換もしくは非置換アリール)、ここでL2は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-C(=O)-、-CH(OH)-、-(置換もしくは非置換C1-C6アルキル)、または-(置換もしくは非置換C2-C6アルケニル);
R7は以下から選択され:
(i) L3-X-L4-G1、ここでL3は置換もしくは非置換アルケニル、置換もしくは非置換アルキニル、置換もしくは非置換アリール、置換もしくは非置換ヘテロアリール、置換もしくは非置換ヘテロシクロアルキル; Xは結合、-O-、-C(=O)-、-CR9(OR9)-、-S-、-S(=O)-、-S(=O)2-、-NR9-、-NR9C(=O)-、-C(O)NR9-、-S(=O)2NR9-、-NR9S(=O)2-、-OC(=O)NR9-、-NR9C(=O)O-、-CH=NO-、-ON=CH-、-NR9C(=O)NR9-、ヘテロアリール、アリール、-NR9C(=NR10)NR9-、-NR9C(=NR10)-、-C(=NR10)NR9-、-OC(=NR10)-、もしくは-C(=NR10)O-; L4は結合、置換もしくは非置換アルキル、置換もしくは非置換シクロアルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル; G1はH、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OR9、-C(=O)CF3、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R9、-CN、-N(R9)2、-N(R9)C(O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CR10)N(R9)2、-C(=O)NR9C(=NR10)N(R9)2、-C(=O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、-S(=O)2R8、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-OC(=O)O-、-NHC(=O)NH-、-NHC(=O)O-、-O(=O)CNH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; またはG1はW-G5であって、ここでWは置換もしくは非置換アリール、置換もしくは非置換ヘテロシクロアルキルまたは置換もしくは非置換ヘテロアリール、そしてG5はH、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OH、-OR8、-C(=O)CF3、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R9、-CN、-N(R9)2、-N(R9)C(O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(=O)NR9C(=NR10)N(R9)2、-C(=O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、もしくは-S(=O)2R8; R8はそれぞれ独立して以下から選択され; 置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; R9はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; あるいは2つのR9基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; あるいはR8とR9が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; そしてR10はそれぞれ独立して以下から選択され; H、-S(=O)2R8、-S(=O)2NH2、-C(=O)R8、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル;
(ii) L3-X-L4-G2、ここでL3は結合、置換もしくは非置換アルキル、置換もしくは非置換シクロアルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル、置換もしくは非置換アリール、置換もしくは非置換ヘテロアリール、置換もしくは非置換ヘテロシクロアルキル; Xは-NR9C(=O)-、-C(O)NR9-、-S(=O)2NR9-、-NR9S(=O)2-、-OC(=O)NR9-、-NR9C(=O)O-、-CH=NO-、-ON=CH-、-NR9C(=O)NR9-、ヘテロアリール、アリール、-NR9C(=NR10)NR9-、-NR9C(=NR10)-、-C(=NR10)NR9-、-OC(=NR10)-、もしくは-C(=NR10)O-; L4は結合、置換もしくは非置換アルキル、置換もしくは非置換シクロアルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル; G2はH、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OR9、-C(=O)CF3、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R9、-CN、-N(R9)2、-N(R9)C(O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CR10)N(R9)2、-C(=O)NR9C(=NR10)N(R9)2、-C(=O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、-S(=O)2R8、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-OC(=O)O-、-NHC(=O)NH-、-NHC(=O)O-、-O(=O)CNH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; またはG2はW-G5であって、ここでWは置換もしくは非置換アリール、置換もしくは非置換ヘテロシクロアルキルまたは置換もしくは非置換ヘテロアリール、そしてG5はH、テトラゾリル、-NHS(=O)2R8、-S(=O)2N(R9)2、-OH、-OR8、-C(=O)CF3、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R9、-CN、-N(R9)2、-N(R9)C(O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(=O)NR9C(=NR10)N(R9)2、-C(=O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、もしくは-S(=O)2R8; R8はそれぞれ独立して以下から選択され; 置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; R9はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; あるいは2つのR9基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; あるいはR8とR9が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; そしてR10はそれぞれ独立して以下から選択され; H、-S(=O)2R8、-S(=O)2NH2、-C(=O)R8、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル;
(iii) L3-X-L4-G3、ここでXは結合、-O-、-C(=O)-、-CR9(OR9)-、-S-、-S(=O)-、-S(=O)2-、-NR9-、-NR9C(=O)-、-C(O)NR9-、-S(=O)2NR9-、-NR9S(=O)2-、-OC(=O)NR9-、-NR9C(=O)O-、-CH=NO-、-ON=CH-、-NR9C(=O)NR9-、ヘテロアリール、アリール、-NR9C(=NR10)NR9-、-NR9C(=NR10)-、-C(=NR10)NR9-、-OC(=NR10)-、もしくは-C(=NR10)O-; L3は結合、置換もしくは非置換アルキル、置換もしくは非置換シクロアルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル、置換もしくは非置換アリール、置換もしくは非置換ヘテロアリール、置換もしくは非置換ヘテロシクロアルキル; L4は(置換もしくは非置換アルケニル)または(置換もしくは非置換アルキニル); G3はH、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OR9、-C(=O)CF3、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R9、-CN、-N(R9)2、-N(R9)C(O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(=O)NR9C(=NR10)N(R9)2、-C(=O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、-S(=O)2R8、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-OC(=O)O-、-NHC(=O)NH-、-NHC(=O)O-、-O(=O)CNH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; あるいはG3はW-G5であって、ここでWは置換もしくは非置換アリール、置換もしくは非置換ヘテロシクロアルキルまたは置換もしくは非置換ヘテロアリール、そしてG5はH、テトラゾリル、-NHS(=O)2R8、-S(=O)2N(R9)2、-OH、-OR8、-C(=O)CF3、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R9、-CN、-N(R9)2、-N(R9)C(O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(=O)NR9C(=NR10)N(R9)2、-C(=O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、もしくは-S(=O)2R8; R8はそれぞれ独立して以下から選択され; 置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; R9はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; あるいは2つのR9基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; あるいはR8とR9が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; そしてR10はそれぞれ独立して以下から選択され; H、-S(=O)2R8、-S(=O)2NH2、-C(=O)R8、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル;
あるいは
(iv) L3-X-L4-G4、ここでL3は結合、置換もしくは非置換アルキル、置換もしくは非置換シクロアルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル、置換もしくは非置換アリール、置換もしくは非置換ヘテロアリール、置換もしくは非置換ヘテロシクロアルキル; Xは結合、-O-、-C(=O)-、-CR9(OR9)-、-S-、-S(=O)-、-S(=O)2-、-NR9-、-NR9C(=O)-、-C(O)NR9-、-S(=O)2NR9-、-NR9S(=O)2-、-OC(=O)NR9-、-NR9C(=O)O-、-CH=NO-、-ON=CH-、-NR9C(=O)NR9-、ヘテロアリール、アリール、-NR9C(=NR10)NR9-、-NR9C(=NR10)-、-C(=NR10)NR9-、-OC(=NR10)-、もしくは-C(=NR10)O-; L4は結合、置換もしくは非置換アルキル、置換もしくは非置換シクロアルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル; G4は-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CR10)N(R9)2、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-NHC(=O)O-、-OC(=O)NH-、-C(=O)O-もしくは-OC(=O)-; あるいはG4は-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; あるいはG4はW-G5であって、ここでWは置換もしくは非置換アリール、置換もしくは非置換ヘテロシクロアルキルまたは置換もしくは非置換ヘテロアリール、そしてG5はH、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OH、-OR8、-C(=O)CF3、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R9、-CN、-N(R9)2、-N(R9)C(O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(=O)NR9C(=NR10)N(R9)2、-C(=O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、もしくは-S(=O)2R8; R8はそれぞれ独立して以下から選択され; 置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; R9はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; あるいは2つのR9基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; あるいはR8とR9が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; そしてR10はそれぞれ独立して以下から選択され; H、-S(=O)2R8、-S(=O)2NH2、-C(=O)R8、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル;
R5はH、ハロゲン、-N3、-CN、-ONO2、-L6-(置換もしくは非置換C1-C6アルキル)、-L6-(置換もしくは非置換C2-C8アルケニル)、-L6-(置換もしくは非置換ヘテロアリール)、または-L6-(置換もしくは非置換アリール)、ここでL6は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-NH-、-C(=O)-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-NHC(=O)NH-、もしくは-C(=O)NH-;
R11はL7-L10-G6、ここでL7は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-NH-、-C(=O)-、-C(=O)NH-、-NHC(=O)-、(置換もしくは非置換C1-C6アルキル)、または(置換もしくは非置換C2-C6アルケニル); L10は結合、(置換もしくは非置換アルキル)、(置換もしくは非置換シクロアルキル)、(置換もしくは非置換シクロアルケニル)、(置換もしくは非置換ヘテロアリール)、(置換もしくは非置換アリール)、または(置換もしくは非置換ヘテロシクロアルキル); そしてG6はH、-CN、-SCN、-N3、-NO2、ハロゲン、-OR9、-C(=O)CF3、-C(=O)R9、-SR8、-S(=O)R8、-S(=O)2R8、-N(R9)2、テトラゾリル、-NHS(=O)2R8、-S(=O)2N(R9)2、-C(=O)NHS(=O)2R8、-S(=O)2NHC(=O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-NHC(=O)O-、-NHC(=O)NH-、-OC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; あるいはG6はW-G7、ここでWは(置換もしくは非置換シクロアルキル)、(置換もしくは非置換シクロアルケニル)、(置換もしくは非置換アリール)、(置換もしくは非置換ヘテロシクロアルキル)または(置換もしくは非置換ヘテロアリール); そしてG7はH、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OH、-OR8、-C(=O)CF3、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R9、-CN、-N(R9)2、-N(R9)C(O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(O)NR9C(=NR10)N(R9)2、-C(O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、-S(=O)2R8、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-NH-、-NHC(=O)O-、-NHC(=O)NH-、-OC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-もしくは-OC(=O)-;
R12はL8-L9-R13、ここでL8は結合、(置換もしくは非置換C1-C6アルキル)、または(置換もしくは非置換C2-C4アルケニル); L9は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-NH-、-C(=O)-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)NH-、-OC(=O)O-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; R13はH、(置換もしくは非置換C1-C6アルキル)、(置換もしくは非置換C3-C6シクロアルキル)、(置換もしくは非置換アリール)、(置換もしくは非置換ヘテロアリール)、または(置換もしくは非置換ヘテロシクロアルキル);
あるいはR7とR12が連携して4〜8員ヘテロ環を形成している。
Zは以下から選択され: -N(R1)-、-S(=O)m-、-CR1=CR1-、-C≡C-、-C(R1)2[C(R2)2]n-、-[C(R2)2]nC(R1)2O-、-OC(R1)2[C(R2)2]n-、-[C(R2)2]nC(R1)2S(O)m-、-S(O)mC(R1)2[C(R2)2]n-、-[C(R2)2]nC(R1)2NR1-、-NR1C(R1)2[C(R2)2]n-、-[C(R2)2]nO[C(R1)2]n-、-[C(R1)2]nO[C(R2)2]n-、-C(=O)NR2-、-NR2C(=O)-、-NR2C(=O)O-、-OC(=O)NR2-、-S(=O)2NR2-、-CR1=N-N-、-NR2C(=O)NR2-、-OC(=O)O-、S(=O)2NR2、もしくは-NR2S(=O)2-、ここでR1はそれぞれ独立してH、CF3、もしくは場合によって置換された低級アルキル; または同一の炭素上の2つのR1が結合してオキソ(=O)を形成し; R2はそれぞれ独立してH、OH、OMe、CF3、もしくは場合によって置換された低級アルキル、または同一の炭素上の2つのR2が結合してオキソ(=O)を形成し; mは0、1もしくは2; nはそれぞれ独立して0、1、2、もしくは3;
YはH、-CO2H、テトラゾリル、-NHS(=O)2R3b、-S(=O)2N(R4)2、-OH、-OR3b、-C(=O)(C1-C5フルオロアルキル)、-C(=O)NHS(=O)2R3b、-S(=O)2NHC(O)R4、-CN、-N(R4)2、-N(R4)C(=O)R4、-C(=NR3)N(R4)2、-NR4C(=NR3)N(R4)2、-NR4C(=CHR3)N(R4)2、-C(=O)NR4C(=NR3)N(R4)2、-C(O)NR4C(=CHR3)N(R4)2、-CO2R3b、-C(=O)R4、-C(=O)N(R4)2、-SR3b、-S(=O)R3b、-S(=O)2R3b、-L1-(置換もしくは非置換アルキル)、-L1-(置換もしくは非置換アルケニル)、-L1-(置換もしくは非置換アルキニル)、-L1-(置換もしくは非置換シクロアルキル)、-L1-(置換もしくは非置換ヘテロシクロアルキル)、-L1-(置換もしくは非置換ヘテロアリール)、-L1-(置換もしくは非置換アリール)、-L1-C(=NR4)N(R4)2、-L1-NR4C(=NR4)N(R4)2、または-L1-NR4C(=CHR3)N(R4)2;
ここでL1は結合、置換もしくは非置換アルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル、置換もしくは非置換ヘテロシクロアルキル、置換もしくは非置換ヘテロアリール、置換もしくは非置換シクロアルキル、置換もしくは非置換ヘテロアルキル、置換もしくは非置換ヘテロアルケニル、置換もしくは非置換ヘテロアルキニル、または置換もしくは非置換アリール;
ここで各置換基は-LsRs、ここでLsはそれぞれ独立して以下から選択され; 結合、-O-、-C(=O)-、-S-、-S(=O)-、-S(=O)2-、-NHC(=O)-、-C(=O)NH-、S(=O)2NH-、-NHS(=O)2、-OC(=O)NH-、-NHC(=O)O-、-OC(=O)O-、-NHC(=O)NH-、-C(=O)O-、-OC(=O)-、C1-C6アルキル、C2-C6アルケニル、-C1-C6フルオロアルキル、ヘテロアリール、アリール、もしくはヘテロシクロアルキル; そしてRsはそれぞれ独立して以下から選択され; H、ハロゲン、-N(R4)2、-CN、-NO2、N3、-S(=O)2NH2、低級アルキル、低級シクロアルキル、-C1-C6フルオロアルキル、ヘテロアリール、もしくはヘテロアルキル;
R3は独立して以下から選択され; H、-S(=O)2R8、-S(=O)2NH2、-C(O)R8、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル; R3bはそれぞれ独立して以下から選択され; 置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; R4はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; あるいは2つのR4基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; あるいはR3bとR4が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し;
R6はH、L2-(置換もしくは非置換アルキル)、L2-(置換もしくは非置換シクロアルキル)、L2-(置換もしくは非置換アルケニル)、L2-(置換もしくは非置換シクロアルケニル)、L2-(置換もしくは非置換ヘテロシクロアルキル)、L2-(置換もしくは非置換ヘテロアリール)、またはL2-(置換もしくは非置換アリール)、ここでL2は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-C(=O)-、-CH(OH)-、-(置換もしくは非置換C1-C6アルキル)、または-(置換もしくは非置換C2-C6アルケニル);
R7は以下から選択され:
(i) L3-X-L4-G1、ここでL3は置換もしくは非置換アルケニル、置換もしくは非置換アルキニル、置換もしくは非置換アリール、置換もしくは非置換ヘテロアリール、置換もしくは非置換ヘテロシクロアルキル; Xは結合、-O-、-C(=O)-、-CR9(OR9)-、-S-、-S(=O)-、-S(=O)2-、-NR9-、-NR9C(=O)-、-C(O)NR9-、-S(=O)2NR9-、-NR9S(=O)2-、-OC(=O)NR9-、-NR9C(=O)O-、-CH=NO-、-ON=CH-、-NR9C(=O)NR9-、ヘテロアリール、アリール、-NR9C(=NR10)NR9-、-NR9C(=NR10)-、-C(=NR10)NR9-、-OC(=NR10)-、もしくは-C(=NR10)O-; L4は結合、置換もしくは非置換アルキル、置換もしくは非置換シクロアルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル; G1はH、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OR9、-C(=O)CF3、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R9、-CN、-N(R9)2、-N(R9)C(O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CR10)N(R9)2、-C(=O)NR9C(=NR10)N(R9)2、-C(=O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、-S(=O)2R8、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-OC(=O)O-、-NHC(=O)NH-、-NHC(=O)O-、-O(=O)CNH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; またはG1はW-G5であって、ここでWは置換もしくは非置換アリール、置換もしくは非置換ヘテロシクロアルキルまたは置換もしくは非置換ヘテロアリール、そしてG5はH、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OH、-OR8、-C(=O)CF3、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R9、-CN、-N(R9)2、-N(R9)C(O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(=O)NR9C(=NR10)N(R9)2、-C(=O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、もしくは-S(=O)2R8; R8はそれぞれ独立して以下から選択され; 置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; R9はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; あるいは2つのR9基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; あるいはR8とR9が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; そしてR10はそれぞれ独立して以下から選択され; H、-S(=O)2R8、-S(=O)2NH2、-C(=O)R8、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル;
(ii) L3-X-L4-G2、ここでL3は結合、置換もしくは非置換アルキル、置換もしくは非置換シクロアルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル、置換もしくは非置換アリール、置換もしくは非置換ヘテロアリール、置換もしくは非置換ヘテロシクロアルキル; Xは-NR9C(=O)-、-C(O)NR9-、-S(=O)2NR9-、-NR9S(=O)2-、-OC(=O)NR9-、-NR9C(=O)O-、-CH=NO-、-ON=CH-、-NR9C(=O)NR9-、ヘテロアリール、アリール、-NR9C(=NR10)NR9-、-NR9C(=NR10)-、-C(=NR10)NR9-、-OC(=NR10)-、もしくは-C(=NR10)O-; L4は結合、置換もしくは非置換アルキル、置換もしくは非置換シクロアルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル; G2はH、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OR9、-C(=O)CF3、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R9、-CN、-N(R9)2、-N(R9)C(O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CR10)N(R9)2、-C(=O)NR9C(=NR10)N(R9)2、-C(=O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、-S(=O)2R8、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-OC(=O)O-、-NHC(=O)NH-、-NHC(=O)O-、-O(=O)CNH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; またはG2はW-G5であって、ここでWは置換もしくは非置換アリール、置換もしくは非置換ヘテロシクロアルキルまたは置換もしくは非置換ヘテロアリール、そしてG5はH、テトラゾリル、-NHS(=O)2R8、-S(=O)2N(R9)2、-OH、-OR8、-C(=O)CF3、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R9、-CN、-N(R9)2、-N(R9)C(O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(=O)NR9C(=NR10)N(R9)2、-C(=O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、もしくは-S(=O)2R8; R8はそれぞれ独立して以下から選択され; 置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; R9はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; あるいは2つのR9基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; あるいはR8とR9が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; そしてR10はそれぞれ独立して以下から選択され; H、-S(=O)2R8、-S(=O)2NH2、-C(=O)R8、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル;
(iii) L3-X-L4-G3、ここでXは結合、-O-、-C(=O)-、-CR9(OR9)-、-S-、-S(=O)-、-S(=O)2-、-NR9-、-NR9C(=O)-、-C(O)NR9-、-S(=O)2NR9-、-NR9S(=O)2-、-OC(=O)NR9-、-NR9C(=O)O-、-CH=NO-、-ON=CH-、-NR9C(=O)NR9-、ヘテロアリール、アリール、-NR9C(=NR10)NR9-、-NR9C(=NR10)-、-C(=NR10)NR9-、-OC(=NR10)-、もしくは-C(=NR10)O-; L3は結合、置換もしくは非置換アルキル、置換もしくは非置換シクロアルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル、置換もしくは非置換アリール、置換もしくは非置換ヘテロアリール、置換もしくは非置換ヘテロシクロアルキル; L4は(置換もしくは非置換アルケニル)または(置換もしくは非置換アルキニル); G3はH、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OR9、-C(=O)CF3、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R9、-CN、-N(R9)2、-N(R9)C(O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(=O)NR9C(=NR10)N(R9)2、-C(=O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、-S(=O)2R8、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-OC(=O)O-、-NHC(=O)NH-、-NHC(=O)O-、-O(=O)CNH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; あるいはG3はW-G5であって、ここでWは置換もしくは非置換アリール、置換もしくは非置換ヘテロシクロアルキルまたは置換もしくは非置換ヘテロアリール、そしてG5はH、テトラゾリル、-NHS(=O)2R8、-S(=O)2N(R9)2、-OH、-OR8、-C(=O)CF3、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R9、-CN、-N(R9)2、-N(R9)C(O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(=O)NR9C(=NR10)N(R9)2、-C(=O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、もしくは-S(=O)2R8; R8はそれぞれ独立して以下から選択され; 置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; R9はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; あるいは2つのR9基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; あるいはR8とR9が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; そしてR10はそれぞれ独立して以下から選択され; H、-S(=O)2R8、-S(=O)2NH2、-C(=O)R8、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル;
あるいは
(iv) L3-X-L4-G4、ここでL3は結合、置換もしくは非置換アルキル、置換もしくは非置換シクロアルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル、置換もしくは非置換アリール、置換もしくは非置換ヘテロアリール、置換もしくは非置換ヘテロシクロアルキル; Xは結合、-O-、-C(=O)-、-CR9(OR9)-、-S-、-S(=O)-、-S(=O)2-、-NR9-、-NR9C(=O)-、-C(O)NR9-、-S(=O)2NR9-、-NR9S(=O)2-、-OC(=O)NR9-、-NR9C(=O)O-、-CH=NO-、-ON=CH-、-NR9C(=O)NR9-、ヘテロアリール、アリール、-NR9C(=NR10)NR9-、-NR9C(=NR10)-、-C(=NR10)NR9-、-OC(=NR10)-、もしくは-C(=NR10)O-; L4は結合、置換もしくは非置換アルキル、置換もしくは非置換シクロアルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル; G4は-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CR10)N(R9)2、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-NHC(=O)O-、-OC(=O)NH-、-C(=O)O-もしくは-OC(=O)-; あるいはG4は-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; あるいはG4はW-G5であって、ここでWは置換もしくは非置換アリール、置換もしくは非置換ヘテロシクロアルキルまたは置換もしくは非置換ヘテロアリール、そしてG5はH、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OH、-OR8、-C(=O)CF3、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R9、-CN、-N(R9)2、-N(R9)C(O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(=O)NR9C(=NR10)N(R9)2、-C(=O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、もしくは-S(=O)2R8; R8はそれぞれ独立して以下から選択され; 置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; R9はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; あるいは2つのR9基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; あるいはR8とR9が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; そしてR10はそれぞれ独立して以下から選択され; H、-S(=O)2R8、-S(=O)2NH2、-C(=O)R8、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル;
R5はH、ハロゲン、-N3、-CN、-ONO2、-L6-(置換もしくは非置換C1-C6アルキル)、-L6-(置換もしくは非置換C2-C8アルケニル)、-L6-(置換もしくは非置換ヘテロアリール)、または-L6-(置換もしくは非置換アリール)、ここでL6は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-NH-、-C(=O)-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-NHC(=O)NH-、もしくは-C(=O)NH-;
R11はL7-L10-G6、ここでL7は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-NH-、-C(=O)-、-C(=O)NH-、-NHC(=O)-、(置換もしくは非置換C1-C6アルキル)、または(置換もしくは非置換C2-C6アルケニル); L10は結合、(置換もしくは非置換アルキル)、(置換もしくは非置換シクロアルキル)、(置換もしくは非置換シクロアルケニル)、(置換もしくは非置換ヘテロアリール)、(置換もしくは非置換アリール)、または(置換もしくは非置換ヘテロシクロアルキル); そしてG6はH、-CN、-SCN、-N3、-NO2、ハロゲン、-OR9、-C(=O)CF3、-C(=O)R9、-SR8、-S(=O)R8、-S(=O)2R8、-N(R9)2、テトラゾリル、-NHS(=O)2R8、-S(=O)2N(R9)2、-C(=O)NHS(=O)2R8、-S(=O)2NHC(=O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-NHC(=O)O-、-NHC(=O)NH-、-OC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; あるいはG6はW-G7、ここでWは(置換もしくは非置換シクロアルキル)、(置換もしくは非置換シクロアルケニル)、(置換もしくは非置換アリール)、(置換もしくは非置換ヘテロシクロアルキル)または(置換もしくは非置換ヘテロアリール); そしてG7はH、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OH、-OR8、-C(=O)CF3、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R9、-CN、-N(R9)2、-N(R9)C(O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(O)NR9C(=NR10)N(R9)2、-C(O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、-S(=O)2R8、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-NH-、-NHC(=O)O-、-NHC(=O)NH-、-OC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-もしくは-OC(=O)-;
R12はL8-L9-R13、ここでL8は結合、(置換もしくは非置換C1-C6アルキル)、または(置換もしくは非置換C2-C4アルケニル); L9は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-NH-、-C(=O)-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)NH-、-OC(=O)O-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; R13はH、(置換もしくは非置換C1-C6アルキル)、(置換もしくは非置換C3-C6シクロアルキル)、(置換もしくは非置換アリール)、(置換もしくは非置換ヘテロアリール)、または(置換もしくは非置換ヘテロシクロアルキル);
あるいはR7とR12が連携して4〜8員ヘテロ環を形成している。
式中、
Zは以下から選択され: -N(R1)-、-S(=O)m-、-CR1=CR1-、-C≡C-、-C(R1)2[C(R2)2]n-、-[C(R2)2]nC(R1)2O-、-OC(R1)2[C(R2)2]n-、-[C(R2)2]nC(R1)2S(O)m-、-S(=O)mC(R1)2[C(R2)2]n-、-[C(R2)2]nC(R1)2NR1-、-NR1C(R1)2[C(R2)2]n-、-[C(R2)2]nO[C(R1)2]n-、-[C(R1)2]nO[C(R2)2]n-、-C(=O)NR2-、-NR2C(=O)-、-NR2C(=O)O-、-OC(=O)NR2-、-S(=O)2NR2-、-CR1=N-N-、-NR2C(=O)NR2-、-OC(=O)O-、S(=O)2NR2、もしくは-NR2S(=O)2-、ここでR1はそれぞれ独立してH、CF3、もしくは場合によって置換された低級アルキル; または同一の炭素上の2つのR1が結合してオキソ(=O)を形成し; R2はそれぞれ独立してH、OH、OMe、CF3、もしくは場合によって置換された低級アルキル、または同一の炭素上の2つのR2が結合してオキソ(=O)を形成し; mは0、1もしくは2; nはそれぞれ独立して0、1、2、もしくは3;
YはH、-CO2H、テトラゾリル、-NHS(=O)2R3b、S(=O)2N(R4)2、-OH、-OR3b、-C(=O)(C1-C5フルオロアルキル)、-C(=O)NHS(=O)2R3b、-S(=O)2NHC(O)R4、-CN、-N(R4)2、-N(R4)C(=O)R4、-C(=NR3)N(R4)2、-NR4C(=NR3)N(R4)2、-NR4C(=CHR3)N(R4)2、-C(O)NR4C(=NR3)N(R4)2、-C(O)NR4C(=CHR3)N(R4)2、-CO2R3b、-C(=O)R4、-C(=O)N(R4)2、-SR3b、-S(=O)R3b、-S(=O)2R3b、-L1-(置換もしくは非置換アルキル)、-L1-(置換もしくは非置換アルケニル)、-L1-(置換もしくは非置換アルキニル)、-L1-(置換もしくは非置換シクロアルキル)、-L1-(置換もしくは非置換ヘテロシクロアルキル)、-L1-(置換もしくは非置換ヘテロアリール)、-L1-(置換もしくは非置換アリール)または-L1-C(=NR4)N(R4)2、-L1-NR4C(=NR4)N(R4)2、-L1-NR4C(=CR3)N(R4)2;
ここでL1は結合、置換もしくは非置換アルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル、置換もしくは非置換ヘテロシクロアルキル、置換もしくは非置換ヘテロアリール、置換もしくは非置換シクロアルキル、置換もしくは非置換ヘテロアルキル、置換もしくは非置換ヘテロアルケニル、置換もしくは非置換ヘテロアルキニル、または置換もしくは非置換アリール;
ここで各置換基は-LsRs、ここでLsはそれぞれ独立して以下から選択され; 結合、-O-、-C(=O)-、-S-、-S(=O)-、-S(=O)2-、-NHC(=O)-、-C(=O)NH-、S(=O)2NH-、-NHS(=O)2、-OC(=O)NH-、-NHC(=O)O-、-OC(=O)O-、-NHC(=O)NH-、-C(=O)O-、-OC(=O)-、C1-C6アルキル、C2-C6アルケニル、-C1-C6フルオロアルキル、ヘテロアリール、アリール、もしくはヘテロシクロアルキル; そしてRsはそれぞれ独立して以下から選択され; H、ハロゲン、-N(R4)2、-CN、-NO2、N3、-S(=O)2NH2、低級アルキル、低級シクロアルキル、-C1-C6フルオロアルキル、ヘテロアリール、もしくはヘテロアルキル;
R3はそれぞれ独立して以下から選択され; H、-S(=O)2R8、-S(=O)2NH2、-C(O)R8、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル; R3bはそれぞれ独立して以下から選択され; 置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; R4はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; あるいは2つのR4基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; あるいはR3bとR4が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し;
R6はH、L2-(置換もしくは非置換アルキル)、L2-(置換もしくは非置換シクロアルキル)、L2-(置換もしくは非置換アルケニル)、L2-(置換もしくは非置換シクロアルケニル)、L2-(置換もしくは非置換ヘテロシクロアルキル)、L2-(置換もしくは非置換ヘテロアリール)、またはL2-(置換もしくは非置換アリール)、ここでL2は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-C(=O)-、-CH(OH)-、-(置換もしくは非置換C1-C6アルキル)、または-(置換もしくは非置換C2-C6アルケニル);
R7はHまたは置換もしくは非置換アルキル;
R5はH、ハロゲン、-N3、-CN、-ONO2、-L6-(置換もしくは非置換C1-C6アルキル)、-L6-(置換もしくは非置換C2-C6アルケニル)、-L6-(置換もしくは非置換ヘテロアリール)、または-L6-(置換もしくは非置換アリール)、ここでL6は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-NH-、-C(=O)-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-NHC(=O)NH-、もしくは-C(=O)NH-;
R11はL7-L10-G6、ここでL7は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-NH-、-C(=O)-、-C(=O)NH-、-NHC(=O)-、(置換もしくは非置換C1-C6アルキル)、または(置換もしくは非置換C2-C6アルケニル); L10は結合、(置換もしくは非置換アルキル)、(置換もしくは非置換シクロアルキル)、(置換もしくは非置換シクロアルケニル)、(置換もしくは非置換ヘテロアリール)、(置換もしくは非置換アリール)、または(置換もしくは非置換ヘテロ環); そしてG6はH、-CN、-SCN、-N3、-NO2、ハロゲン、-OR9、-C(=O)CF3、-C(=O)R9、-SR8、-S(=O)R8、-S(=O)2R8、-N(R9)2、テトラゾリル、-NHS(=O)2R8、-S(=O)2N(R9)2、-C(=O)NHS(=O)2R8、-S(=O)2NHC(=O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-NHC(=O)O-、-NHC(=O)NH-、-OC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; あるいはG6はW-G7、ここでWは(置換もしくは非置換シクロアルキル)、(置換もしくは非置換シクロアルケニル)、(置換もしくは非置換アリール)、(置換もしくは非置換ヘテロシクロアルキル)または(置換もしくは非置換ヘテロアリール); そしてG7はH、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OH、-OR8、-C(=O)CF3、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R9、-CN、-N(R9)2、-N(R9)C(=O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(=O)NR9C(=NR10)N(R9)2、-C(=O)NR9C(=CR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、-S(=O)2R8、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-NH-、-NHC(=O)O-、-NHC(=O)NH-、-OC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-もしくは-OC(=O)-;
R12はL3-X-L4-G1、ここでL3は結合、置換もしくは非置換アルキル、置換もしくは非置換シクロアルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル、置換もしくは非置換アリール、置換もしくは非置換ヘテロアリール、置換もしくは非置換ヘテロ環; Xは結合、-O-、-C(=O)-、-CR9(OR9)-、-S-、-S(=O)-、-S(=O)2-、-NR9-、-NR9C(=O)-、-C(O)NR9-、-S(=O)2NR9-、-NR9S(=O)2-、-OC(=O)NR9-、-NR9C(=O)O-、-CH=NO-、-ON=CH-、-NR9C(=O)NR9-、ヘテロアリール、アリール、-NR9C(=NR10)NR9-、-NR9C(=NR10)-、-C(=NR10)NR9-、-OC(=NR10)-、もしくは-C(=NR10)O-; L4は結合、置換もしくは非置換アルキル、置換もしくは非置換シクロアルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル; G1はテトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OR9、-C(=O)CF3、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R9、-CN、-N(R9)2、-N(R9)C(O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(=O)NR9C(=NR10)N(R9)2、-C(O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、-S(=O)2R8、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-OC(=O)O-、-NHC(=O)NH-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; またはG1はW-G5であって、ここでWは置換もしくは非置換アリール、置換もしくは非置換ヘテロシクロアルキルまたは置換もしくは非置換ヘテロアリール、そしてG5はH、テトラゾリル、-NHS(=O)2R8、-S(=O)2N(R9)2、-OH、-OR8、-C(=O)CF3、-C(=O)NHS(=O)2R8、-S(=O)2NHC(=O)R9、-CN、-N(R9)2、-N(R9)C(=O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(=O)NR9C(=NR10)N(R9)2、-C(O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、もしくは-S(=O)2R8; R8はそれぞれ独立して以下から選択され; 置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; R9はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; あるいは2つのR9基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; あるいはR8とR9が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; そしてR10はそれぞれ独立して以下から選択される; H、-S(=O)2R8、-S(=O)2NH2、-C(=O)R8、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル;
(d)
Zは以下から選択され: -N(R1)-、-S(=O)m-、-CR1=CR1-、-C≡C-、-C(R1)2[C(R2)2]n-、-[C(R2)2]nC(R1)2O-、-OC(R1)2[C(R2)2]n-、-[C(R2)2]nC(R1)2S(O)m-、-S(=O)mC(R1)2[C(R2)2]n-、-[C(R2)2]nC(R1)2NR1-、-NR1C(R1)2[C(R2)2]n-、-[C(R2)2]nO[C(R1)2]n-、-[C(R1)2]nO[C(R2)2]n-、-C(=O)NR2-、-NR2C(=O)-、-NR2C(=O)O-、-OC(=O)NR2-、-S(=O)2NR2-、-CR1=N-N-、-NR2C(=O)NR2-、-OC(=O)O-、S(=O)2NR2、もしくは-NR2S(=O)2-、ここでR1はそれぞれ独立してH、CF3、もしくは場合によって置換された低級アルキル; または同一の炭素上の2つのR1が結合してオキソ(=O)を形成し; R2はそれぞれ独立してH、OH、OMe、CF3、もしくは場合によって置換された低級アルキル、または同一の炭素上の2つのR2が結合してオキソ(=O)を形成し; mは0、1もしくは2; nはそれぞれ独立して0、1、2、もしくは3;
YはH、-CO2H、テトラゾリル、-NHS(=O)2R3b、S(=O)2N(R4)2、-OH、-OR3b、-C(=O)(C1-C5フルオロアルキル)、-C(=O)NHS(=O)2R3b、-S(=O)2NHC(O)R4、-CN、-N(R4)2、-N(R4)C(=O)R4、-C(=NR3)N(R4)2、-NR4C(=NR3)N(R4)2、-NR4C(=CHR3)N(R4)2、-C(O)NR4C(=NR3)N(R4)2、-C(O)NR4C(=CHR3)N(R4)2、-CO2R3b、-C(=O)R4、-C(=O)N(R4)2、-SR3b、-S(=O)R3b、-S(=O)2R3b、-L1-(置換もしくは非置換アルキル)、-L1-(置換もしくは非置換アルケニル)、-L1-(置換もしくは非置換アルキニル)、-L1-(置換もしくは非置換シクロアルキル)、-L1-(置換もしくは非置換ヘテロシクロアルキル)、-L1-(置換もしくは非置換ヘテロアリール)、-L1-(置換もしくは非置換アリール)または-L1-C(=NR4)N(R4)2、-L1-NR4C(=NR4)N(R4)2、-L1-NR4C(=CR3)N(R4)2;
ここでL1は結合、置換もしくは非置換アルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル、置換もしくは非置換ヘテロシクロアルキル、置換もしくは非置換ヘテロアリール、置換もしくは非置換シクロアルキル、置換もしくは非置換ヘテロアルキル、置換もしくは非置換ヘテロアルケニル、置換もしくは非置換ヘテロアルキニル、または置換もしくは非置換アリール;
ここで各置換基は-LsRs、ここでLsはそれぞれ独立して以下から選択され; 結合、-O-、-C(=O)-、-S-、-S(=O)-、-S(=O)2-、-NHC(=O)-、-C(=O)NH-、S(=O)2NH-、-NHS(=O)2、-OC(=O)NH-、-NHC(=O)O-、-OC(=O)O-、-NHC(=O)NH-、-C(=O)O-、-OC(=O)-、C1-C6アルキル、C2-C6アルケニル、-C1-C6フルオロアルキル、ヘテロアリール、アリール、もしくはヘテロシクロアルキル; そしてRsはそれぞれ独立して以下から選択され; H、ハロゲン、-N(R4)2、-CN、-NO2、N3、-S(=O)2NH2、低級アルキル、低級シクロアルキル、-C1-C6フルオロアルキル、ヘテロアリール、もしくはヘテロアルキル;
R3はそれぞれ独立して以下から選択され; H、-S(=O)2R8、-S(=O)2NH2、-C(O)R8、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル; R3bはそれぞれ独立して以下から選択され; 置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; R4はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; あるいは2つのR4基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; あるいはR3bとR4が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し;
R6はH、L2-(置換もしくは非置換アルキル)、L2-(置換もしくは非置換シクロアルキル)、L2-(置換もしくは非置換アルケニル)、L2-(置換もしくは非置換シクロアルケニル)、L2-(置換もしくは非置換ヘテロシクロアルキル)、L2-(置換もしくは非置換ヘテロアリール)、またはL2-(置換もしくは非置換アリール)、ここでL2は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-C(=O)-、-CH(OH)-、-(置換もしくは非置換C1-C6アルキル)、または-(置換もしくは非置換C2-C6アルケニル);
R7はHまたは置換もしくは非置換アルキル;
R5はH、ハロゲン、-N3、-CN、-ONO2、-L6-(置換もしくは非置換C1-C6アルキル)、-L6-(置換もしくは非置換C2-C6アルケニル)、-L6-(置換もしくは非置換ヘテロアリール)、または-L6-(置換もしくは非置換アリール)、ここでL6は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-NH-、-C(=O)-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-NHC(=O)NH-、もしくは-C(=O)NH-;
R11はL7-L10-G6、ここでL7は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-NH-、-C(=O)-、-C(=O)NH-、-NHC(=O)-、(置換もしくは非置換C1-C6アルキル)、または(置換もしくは非置換C2-C6アルケニル); L10は結合、(置換もしくは非置換アルキル)、(置換もしくは非置換シクロアルキル)、(置換もしくは非置換シクロアルケニル)、(置換もしくは非置換ヘテロアリール)、(置換もしくは非置換アリール)、または(置換もしくは非置換ヘテロ環); そしてG6はH、-CN、-SCN、-N3、-NO2、ハロゲン、-OR9、-C(=O)CF3、-C(=O)R9、-SR8、-S(=O)R8、-S(=O)2R8、-N(R9)2、テトラゾリル、-NHS(=O)2R8、-S(=O)2N(R9)2、-C(=O)NHS(=O)2R8、-S(=O)2NHC(=O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-NHC(=O)O-、-NHC(=O)NH-、-OC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; あるいはG6はW-G7、ここでWは(置換もしくは非置換シクロアルキル)、(置換もしくは非置換シクロアルケニル)、(置換もしくは非置換アリール)、(置換もしくは非置換ヘテロシクロアルキル)または(置換もしくは非置換ヘテロアリール); そしてG7はH、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OH、-OR8、-C(=O)CF3、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R9、-CN、-N(R9)2、-N(R9)C(=O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(=O)NR9C(=NR10)N(R9)2、-C(=O)NR9C(=CR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、-S(=O)2R8、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-NH-、-NHC(=O)O-、-NHC(=O)NH-、-OC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-もしくは-OC(=O)-;
R12はL3-X-L4-G1、ここでL3は結合、置換もしくは非置換アルキル、置換もしくは非置換シクロアルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル、置換もしくは非置換アリール、置換もしくは非置換ヘテロアリール、置換もしくは非置換ヘテロ環; Xは結合、-O-、-C(=O)-、-CR9(OR9)-、-S-、-S(=O)-、-S(=O)2-、-NR9-、-NR9C(=O)-、-C(O)NR9-、-S(=O)2NR9-、-NR9S(=O)2-、-OC(=O)NR9-、-NR9C(=O)O-、-CH=NO-、-ON=CH-、-NR9C(=O)NR9-、ヘテロアリール、アリール、-NR9C(=NR10)NR9-、-NR9C(=NR10)-、-C(=NR10)NR9-、-OC(=NR10)-、もしくは-C(=NR10)O-; L4は結合、置換もしくは非置換アルキル、置換もしくは非置換シクロアルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル; G1はテトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OR9、-C(=O)CF3、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R9、-CN、-N(R9)2、-N(R9)C(O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(=O)NR9C(=NR10)N(R9)2、-C(O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、-S(=O)2R8、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-OC(=O)O-、-NHC(=O)NH-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; またはG1はW-G5であって、ここでWは置換もしくは非置換アリール、置換もしくは非置換ヘテロシクロアルキルまたは置換もしくは非置換ヘテロアリール、そしてG5はH、テトラゾリル、-NHS(=O)2R8、-S(=O)2N(R9)2、-OH、-OR8、-C(=O)CF3、-C(=O)NHS(=O)2R8、-S(=O)2NHC(=O)R9、-CN、-N(R9)2、-N(R9)C(=O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(=O)NR9C(=NR10)N(R9)2、-C(O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、もしくは-S(=O)2R8; R8はそれぞれ独立して以下から選択され; 置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; R9はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; あるいは2つのR9基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; あるいはR8とR9が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; そしてR10はそれぞれ独立して以下から選択される; H、-S(=O)2R8、-S(=O)2NH2、-C(=O)R8、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル;
(d)
式中、
Zは以下から選択され: -N(R1)-、-S(=O)m-、-CR1=CR1-、-C≡C-、-C(R1)2[C(R2)2]n-、-[C(R2)2]nC(R1)2O-、-OC(R1)2[C(R2)2]n-、-[C(R2)2]nC(R1)2S(O)m-、-S(=O)mC(R1)2[C(R2)2]n-、-[C(R2)2]nC(R1)2NR1-、-NR1C(R1)2[C(R2)2]n-、-[C(R2)2]nO[C(R1)2]n-、-[C(R1)2]nO[C(R2)2]n-、-C(O)NR2-、-NR2C(=O)-、-NR2C(=O)O-、-OC(=O)NR2-、-S(=O)2NR2-、-CR1=N-N-、-NR2C(=O)NR2-、-OC(=O)O-、S(=O)2N(R2)、もしくは-N(R2)S(=O)2-、ここでR1はそれぞれ独立してH、CF3、もしくは場合によって置換された低級アルキル; または同一の炭素上の2つのR1が結合してオキソ(=O)を形成し; R2はそれぞれ独立してH、OH、OMe、CF3、もしくは場合によって置換された低級アルキル、または同一の炭素上の2つのR2が結合してオキソ(=O)を形成し; mは0、1もしくは2; nはそれぞれ独立して0、1、2、もしくは3;
YはH、-CO2H、テトラゾリル、-NHS(=O)2R3b、S(=O)2N(R4)2、-OH、-OR3b、-C(=O)(C1-C5フルオロアルキル)、-C(=O)NHS(=O)2R3b、-S(=O)2NHC(O)R4、-CN、-N(R4)2、-N(R4)C(=O)R4、-C(=NR3)N(R4)2、-NR4C(=NR3)N(R4)2、-NR4C(=CHR3)N(R4)2、-C(=O)NR4C(=NR3)N(R4)2、-C(=O)NR4C(=CHR3)N(R4)2、-CO2R3b、-C(=O)R4、-C(=O)N(R4)2、-SR3b、-S(=O)R3b、-S(=O)2R3b、-L1-(置換もしくは非置換アルキル)、-L1-(置換もしくは非置換アルケニル)、-L1-(置換もしくは非置換アルキニル)、-L1-(置換もしくは非置換シクロアルキル)、-L1-(置換もしくは非置換ヘテロシクロアルキル)、-L1-(置換もしくは非置換ヘテロアリール)、-L1-(置換もしくは非置換アリール)または-L1-C(=NR4)N(R4)2、-L1-NR4C(=NR4)N(R4)2、-L1-NR4C(=CHR3)N(R4)2;
ここでL1は結合、置換もしくは非置換アルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル、置換もしくは非置換ヘテロシクロアルキル、置換もしくは非置換ヘテロアリール、置換もしくは非置換シクロアルキル、置換もしくは非置換ヘテロアルキル、置換もしくは非置換ヘテロアルケニル、置換もしくは非置換ヘテロアルキニル、または置換もしくは非置換アリール;
ここで各置換基は-LsRs、ここでLsはそれぞれ独立して以下から選択され; 結合、-O-、-C(=O)-、-S-、-S(=O)-、-S(=O)2-、-NHC(=O)-、-C(=O)NH-、S(=O)2NH-、-NHS(=O)2、-OC(=O)NH-、-NHC(=O)O-、-OC(=O)O-、-NHC(=O)NH-、-C(=O)O-、-OC(=O)-、C1-C6アルキル、C2-C6アルケニル、-C1-C6フルオロアルキル、ヘテロアリール、アリール、もしくはヘテロシクロアルキル; そしてRsはそれぞれ独立して以下から選択され; H、ハロゲン、-N(R4)2、-CN、-NO2、N3、-S(=O)2NH2、低級アルキル、低級シクロアルキル、-C1-C6フルオロアルキル、ヘテロアリール、もしくはヘテロアルキル;
R3はそれぞれ独立して以下から選択され; H、-S(=O)2R8、-S(=O)2NH2、-C(=O)R8、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル; R3bはそれぞれ独立して以下から選択され; 置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; R4はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; あるいは2つのR4基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; あるいはR3bとR4が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し;
R6はH、L2-(置換もしくは非置換アルキル)、L2-(置換もしくは非置換シクロアルキル)、L2-(置換もしくは非置換アルケニル)、L2-(置換もしくは非置換シクロアルケニル)、L2-(置換もしくは非置換ヘテロシクロアルキル)、L2-(置換もしくは非置換ヘテロアリール)、またはL2-(置換もしくは非置換アリール)、ここでL2は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-C(=O)-、-CH(OH)-、-(置換もしくは非置換C1-C6アルキル)、または-(置換もしくは非置換C2-C6アルケニル);
R7はL3-X-L4-G1、ここでL3は結合、置換もしくは非置換アルキル、置換もしくは非置換シクロアルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル、置換もしくは非置換アリール、置換もしくは非置換ヘテロアリール、置換もしくは非置換ヘテロシクロアルキル; Xは結合、-O-、-C(=O)-、-CR9(OR9)-、-S-、-S(=O)-、-S(=O)2-、-NR9-、-NR9C(=O)-、-C(=O)NR9-、-S(=O)2NR9-、-NR9S(=O)2-、-OC(=O)NR9-、-NR9C(=O)O-、-CH=NO-、-ON=CH-、-NR9C(O)NR9-、ヘテロアリール、アリール、-NR9C(=NR10)NR9-、-NR9C(=NR10)-、-C(=NR10)NR9-、-OC(=NR10)-、もしくは-C(=NR10)O-; L4は結合、置換もしくは非置換アルキル、置換もしくは非置換シクロアルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル; G1はH、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OR9、-C(=O)CF3、-C(=O)NHS(=O)2R8、-S(=O)2NHC(=O)R9、-CN、-N(R9)2、-N(R9)C(=O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(O)NR9C(=NR10)N(R9)2、-C(=O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、-S(=O)2R8、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-OC(=O)O-、-NHC(=O)NH-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; またはG1はW-G5であって、ここでWは置換もしくは非置換アリール、置換もしくは非置換ヘテロシクロアルキルまたは置換もしくは非置換ヘテロアリール、そしてG5はH、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OH、-OR8、-C(=O)CF3、-C(=O)NHS(=O)2R8、-S(=O)2NHC(=O)R9、-CN、-N(R9)2、-N(R9)C(=O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(=O)NR9C(=NR10)N(R9)2、-C(=O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、もしくは-S(=O)2R8; R8はそれぞれ独立して以下から選択され; 置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; R9はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; あるいは2つのR9基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; あるいはR8とR9が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; そしてR10はそれぞれ独立して以下から選択され; H、-S(=O)2R8、-S(=O)2NH2、-C(=O)R8、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル;
R5はH、ハロゲン、-N3、-CN、-ONO2、-L6-(置換もしくは非置換C1-C6アルキル)、-L6-(置換もしくは非置換C2-C6アルケニル)、-L6-(置換もしくは非置換ヘテロアリール)、または-L6-(置換もしくは非置換アリール)、ここでL6は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-NH-、-C(=O)-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)-、もしくは-C(=O)NH-;
R11はL7-L10-G6、ここでL7は結合、-C(=O)-、-C(=O)NH-、(置換もしくは非置換C1-C6アルキル)、または(置換もしくは非置換C2-C6アルケニル); L10は(置換もしくは非置換シクロアルキル)、(置換もしくは非置換シクロアルケニル)、(置換もしくは非置換ヘテロアリール)、(置換もしくは非置換アリール)、または(置換もしくは非置換ヘテロシクロアルキル); そしてG6はテトラゾリル、-NHS(=O)2R8、-C(=O)NHS(=O)2R8、-S(=O)2NHC(=O)R8、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-OC(=O)O-、-NHC(=O)NH-、-NHC(=O)O-、、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; あるいはG6はW-G7、ここでWは(置換もしくは非置換シクロアルキル)、(置換もしくは非置換シクロアルケニル)、(置換もしくは非置換アリール)、(置換もしくは非置換ヘテロシクロアルキル)または(置換もしくは非置換ヘテロアリール); そしてG7はテトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OH、-C(=O)CF3、-C(=O)NHS(=O)2R8、-S(=O)2NHC(O)R8、-N(R9)2、-C(=NR10)N(R8)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(=O)N(R9)2、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、-L5-(置換もしくは非置換ヘテロシクロアルキル)、または-L5-(置換もしくは非置換アリール)、ここでL5は-OC(=O)O-、-NHC(=O)NH-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-;
R12はL8-L9-R13、ここでL8は結合、(置換もしくは非置換C1-C6アルキル)、または(置換もしくは非置換C2-C4アルケニル); L9は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-NH-、-C(=O)-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)NH-、-OC(=O)O-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; R13はH、(置換もしくは非置換C1-C6アルキル)、(置換もしくは非置換C3-C6シクロアルキル)、(置換もしくは非置換アリール)、(置換もしくは非置換ヘテロアリール)、または(置換もしくは非置換ヘテロシクロアルキル); あるいはR7とR12が連携して4〜8員ヘテロ環を形成している;
(e)
Zは以下から選択され: -N(R1)-、-S(=O)m-、-CR1=CR1-、-C≡C-、-C(R1)2[C(R2)2]n-、-[C(R2)2]nC(R1)2O-、-OC(R1)2[C(R2)2]n-、-[C(R2)2]nC(R1)2S(O)m-、-S(=O)mC(R1)2[C(R2)2]n-、-[C(R2)2]nC(R1)2NR1-、-NR1C(R1)2[C(R2)2]n-、-[C(R2)2]nO[C(R1)2]n-、-[C(R1)2]nO[C(R2)2]n-、-C(O)NR2-、-NR2C(=O)-、-NR2C(=O)O-、-OC(=O)NR2-、-S(=O)2NR2-、-CR1=N-N-、-NR2C(=O)NR2-、-OC(=O)O-、S(=O)2N(R2)、もしくは-N(R2)S(=O)2-、ここでR1はそれぞれ独立してH、CF3、もしくは場合によって置換された低級アルキル; または同一の炭素上の2つのR1が結合してオキソ(=O)を形成し; R2はそれぞれ独立してH、OH、OMe、CF3、もしくは場合によって置換された低級アルキル、または同一の炭素上の2つのR2が結合してオキソ(=O)を形成し; mは0、1もしくは2; nはそれぞれ独立して0、1、2、もしくは3;
YはH、-CO2H、テトラゾリル、-NHS(=O)2R3b、S(=O)2N(R4)2、-OH、-OR3b、-C(=O)(C1-C5フルオロアルキル)、-C(=O)NHS(=O)2R3b、-S(=O)2NHC(O)R4、-CN、-N(R4)2、-N(R4)C(=O)R4、-C(=NR3)N(R4)2、-NR4C(=NR3)N(R4)2、-NR4C(=CHR3)N(R4)2、-C(=O)NR4C(=NR3)N(R4)2、-C(=O)NR4C(=CHR3)N(R4)2、-CO2R3b、-C(=O)R4、-C(=O)N(R4)2、-SR3b、-S(=O)R3b、-S(=O)2R3b、-L1-(置換もしくは非置換アルキル)、-L1-(置換もしくは非置換アルケニル)、-L1-(置換もしくは非置換アルキニル)、-L1-(置換もしくは非置換シクロアルキル)、-L1-(置換もしくは非置換ヘテロシクロアルキル)、-L1-(置換もしくは非置換ヘテロアリール)、-L1-(置換もしくは非置換アリール)または-L1-C(=NR4)N(R4)2、-L1-NR4C(=NR4)N(R4)2、-L1-NR4C(=CHR3)N(R4)2;
ここでL1は結合、置換もしくは非置換アルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル、置換もしくは非置換ヘテロシクロアルキル、置換もしくは非置換ヘテロアリール、置換もしくは非置換シクロアルキル、置換もしくは非置換ヘテロアルキル、置換もしくは非置換ヘテロアルケニル、置換もしくは非置換ヘテロアルキニル、または置換もしくは非置換アリール;
ここで各置換基は-LsRs、ここでLsはそれぞれ独立して以下から選択され; 結合、-O-、-C(=O)-、-S-、-S(=O)-、-S(=O)2-、-NHC(=O)-、-C(=O)NH-、S(=O)2NH-、-NHS(=O)2、-OC(=O)NH-、-NHC(=O)O-、-OC(=O)O-、-NHC(=O)NH-、-C(=O)O-、-OC(=O)-、C1-C6アルキル、C2-C6アルケニル、-C1-C6フルオロアルキル、ヘテロアリール、アリール、もしくはヘテロシクロアルキル; そしてRsはそれぞれ独立して以下から選択され; H、ハロゲン、-N(R4)2、-CN、-NO2、N3、-S(=O)2NH2、低級アルキル、低級シクロアルキル、-C1-C6フルオロアルキル、ヘテロアリール、もしくはヘテロアルキル;
R3はそれぞれ独立して以下から選択され; H、-S(=O)2R8、-S(=O)2NH2、-C(=O)R8、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル; R3bはそれぞれ独立して以下から選択され; 置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; R4はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; あるいは2つのR4基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; あるいはR3bとR4が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し;
R6はH、L2-(置換もしくは非置換アルキル)、L2-(置換もしくは非置換シクロアルキル)、L2-(置換もしくは非置換アルケニル)、L2-(置換もしくは非置換シクロアルケニル)、L2-(置換もしくは非置換ヘテロシクロアルキル)、L2-(置換もしくは非置換ヘテロアリール)、またはL2-(置換もしくは非置換アリール)、ここでL2は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-C(=O)-、-CH(OH)-、-(置換もしくは非置換C1-C6アルキル)、または-(置換もしくは非置換C2-C6アルケニル);
R7はL3-X-L4-G1、ここでL3は結合、置換もしくは非置換アルキル、置換もしくは非置換シクロアルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル、置換もしくは非置換アリール、置換もしくは非置換ヘテロアリール、置換もしくは非置換ヘテロシクロアルキル; Xは結合、-O-、-C(=O)-、-CR9(OR9)-、-S-、-S(=O)-、-S(=O)2-、-NR9-、-NR9C(=O)-、-C(=O)NR9-、-S(=O)2NR9-、-NR9S(=O)2-、-OC(=O)NR9-、-NR9C(=O)O-、-CH=NO-、-ON=CH-、-NR9C(O)NR9-、ヘテロアリール、アリール、-NR9C(=NR10)NR9-、-NR9C(=NR10)-、-C(=NR10)NR9-、-OC(=NR10)-、もしくは-C(=NR10)O-; L4は結合、置換もしくは非置換アルキル、置換もしくは非置換シクロアルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル; G1はH、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OR9、-C(=O)CF3、-C(=O)NHS(=O)2R8、-S(=O)2NHC(=O)R9、-CN、-N(R9)2、-N(R9)C(=O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(O)NR9C(=NR10)N(R9)2、-C(=O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、-S(=O)2R8、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-OC(=O)O-、-NHC(=O)NH-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; またはG1はW-G5であって、ここでWは置換もしくは非置換アリール、置換もしくは非置換ヘテロシクロアルキルまたは置換もしくは非置換ヘテロアリール、そしてG5はH、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OH、-OR8、-C(=O)CF3、-C(=O)NHS(=O)2R8、-S(=O)2NHC(=O)R9、-CN、-N(R9)2、-N(R9)C(=O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(=O)NR9C(=NR10)N(R9)2、-C(=O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、もしくは-S(=O)2R8; R8はそれぞれ独立して以下から選択され; 置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; R9はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; あるいは2つのR9基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; あるいはR8とR9が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; そしてR10はそれぞれ独立して以下から選択され; H、-S(=O)2R8、-S(=O)2NH2、-C(=O)R8、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル;
R5はH、ハロゲン、-N3、-CN、-ONO2、-L6-(置換もしくは非置換C1-C6アルキル)、-L6-(置換もしくは非置換C2-C6アルケニル)、-L6-(置換もしくは非置換ヘテロアリール)、または-L6-(置換もしくは非置換アリール)、ここでL6は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-NH-、-C(=O)-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)-、もしくは-C(=O)NH-;
R11はL7-L10-G6、ここでL7は結合、-C(=O)-、-C(=O)NH-、(置換もしくは非置換C1-C6アルキル)、または(置換もしくは非置換C2-C6アルケニル); L10は(置換もしくは非置換シクロアルキル)、(置換もしくは非置換シクロアルケニル)、(置換もしくは非置換ヘテロアリール)、(置換もしくは非置換アリール)、または(置換もしくは非置換ヘテロシクロアルキル); そしてG6はテトラゾリル、-NHS(=O)2R8、-C(=O)NHS(=O)2R8、-S(=O)2NHC(=O)R8、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-OC(=O)O-、-NHC(=O)NH-、-NHC(=O)O-、、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; あるいはG6はW-G7、ここでWは(置換もしくは非置換シクロアルキル)、(置換もしくは非置換シクロアルケニル)、(置換もしくは非置換アリール)、(置換もしくは非置換ヘテロシクロアルキル)または(置換もしくは非置換ヘテロアリール); そしてG7はテトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OH、-C(=O)CF3、-C(=O)NHS(=O)2R8、-S(=O)2NHC(O)R8、-N(R9)2、-C(=NR10)N(R8)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(=O)N(R9)2、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、-L5-(置換もしくは非置換ヘテロシクロアルキル)、または-L5-(置換もしくは非置換アリール)、ここでL5は-OC(=O)O-、-NHC(=O)NH-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-;
R12はL8-L9-R13、ここでL8は結合、(置換もしくは非置換C1-C6アルキル)、または(置換もしくは非置換C2-C4アルケニル); L9は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-NH-、-C(=O)-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)NH-、-OC(=O)O-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; R13はH、(置換もしくは非置換C1-C6アルキル)、(置換もしくは非置換C3-C6シクロアルキル)、(置換もしくは非置換アリール)、(置換もしくは非置換ヘテロアリール)、または(置換もしくは非置換ヘテロシクロアルキル); あるいはR7とR12が連携して4〜8員ヘテロ環を形成している;
(e)
式中、
Zは以下から選択され: -NR1C(=O)O-、-NR1C(=O)NR1-、-CR1=N-N-、ここでR1はそれぞれ独立してH、CF3、もしくは場合によって置換された低級アルキル;
YはH、-CO2H、テトラゾリル、-NHS(=O)2R3b、S(=O)2N(R4)2、-OH、-OR3b、-C(=O)(C1-C5フルオロアルキル)、-C(=O)NHS(=O)2R3b、-S(=O)2NHC(O)R4、-CN、-N(R4)2、-N(R4)C(=O)R4、-C(=NR3)N(R4)2、-NR4C(=NR3)N(R4)2、-NR4C(=CHR3)N(R4)2、-C(=O)NR4C(=NR3)N(R4)2、-C(=O)NR4C(=CHR3)N(R4)2、-CO2R3b、-C(=O)R4、-C(=O)N(R4)2、-SR3b、-S(=O)R3b、-S(=O)2R3b、-L1-(置換もしくは非置換アルキル)、-L1-(置換もしくは非置換アルケニル)、-L1-(置換もしくは非置換アルキニル)、-L1-(置換もしくは非置換シクロアルキル)、-L1-(置換もしくは非置換ヘテロシクロアルキル)、-L1-(置換もしくは非置換ヘテロアリール)、-L1-(置換もしくは非置換アリール)、-L1-C(=NR4)N(R4)2、-L1-NR4C(=NR4)N(R4)2、または-L1-NR4C(=CHR3)N(R4)2;
ここでL1は結合、置換もしくは非置換アルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル、置換もしくは非置換ヘテロシクロアルキル、置換もしくは非置換ヘテロアリール、置換もしくは非置換シクロアルキル、置換もしくは非置換ヘテロアルキル、置換もしくは非置換ヘテロアルケニル、置換もしくは非置換ヘテロアルキニル、または置換もしくは非置換アリール;
ここで各置換基は-LsRs、ここでLsはそれぞれ独立して以下から選択され; 結合、-O-、-C(=O)-、-S-、-S(=O)-、-S(=O)2-、-NHC(=O)-、-C(=O)NH-、S(=O)2NH-、-NHS(=O)2、-OC(O)NH-、-NHC(O)O-、-OC(O)O-、-NHC(O)NH-、-C(O)O-、-OC(O)-、C1-C6アルキル、C2-C6アルケニル、-C1-C6フルオロアルキル、ヘテロアリール、アリール、もしくはヘテロ環; そしてRsはそれぞれ独立して以下から選択され; H、ハロゲン、-N(R4)2、-CN、-NO2、N3、-S(=O)2NH2、低級アルキル、低級シクロアルキル、-C1-C6フルオロアルキル、ヘテロアリール、もしくはヘテロアルキル;
R3はそれぞれ独立して以下から選択され; H、-S(=O)2R8、-S(=O)2NH2、-C(=O)R8、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル; R3bはそれぞれ独立して以下から選択され; 置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; R4はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; あるいは2つのR4基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; あるいはR3bとR4が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し;
R6はH、L2-(置換もしくは非置換アルキル)、L2-(置換もしくは非置換シクロアルキル)、L2-(置換もしくは非置換アルケニル)、L2-(置換もしくは非置換シクロアルケニル)、L2-(置換もしくは非置換ヘテロシクロアルキル)、L2-(置換もしくは非置換ヘテロアリール)、またはL2-(置換もしくは非置換アリール)、ここでL2は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-C(=O)-、-CH(OH)-、-(置換もしくは非置換C1-C6アルキル)、または-(置換もしくは非置換C2-C6アルケニル);
R7はL3-X-L4-G1、ここでL3は結合、置換もしくは非置換アルキル、置換もしくは非置換シクロアルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル、置換もしくは非置換アリール、置換もしくは非置換ヘテロアリール、置換もしくは非置換ヘテロシクロアルキル; Xは結合、-O-、-C(=O)-、-CR9(OR9)-、-S-、-S(=O)-、-S(=O)2-、-NR9-、-NR9C(=O)-、-C(=O)NR9-、-S(=O)2NR9-、-NR9S(=O)2-、-OC(=O)NR9-、-NR9C(=O)O-、-CH=NO-、-ON=CH-、-NR9C(=O)NR9-、ヘテロアリール、アリール、-NR9C(=NR10)NR9-、-NR9C(=NR10)-、-C(=NR10)NR9-、-OC(=NR10)-、もしくは-C(=NR10)O-; L4は結合、置換もしくは非置換アルキル、置換もしくは非置換シクロアルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル; G1はH、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OR9、-C(=O)CF3、-C(=O)NHS(=O)2R8、-S(=O)2NHC(=O)R9、-CN、-N(R9)2、-N(R9)C(=O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(O)NR9C(=NR10)N(R9)2、-C(=O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、-S(=O)2R8、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-OC(=O)O-、-NHC(=O)NH-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; またはG1はW-G5であって、ここでWは置換もしくは非置換アリール、置換もしくは非置換ヘテロシクロアルキルまたは置換もしくは非置換ヘテロアリール、そしてG5はH、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OH、-OR8、-C(=O)CF3、-C(=O)NHS(=O)2R8、-S(=O)2NHC(=O)R9、-CN、-N(R9)2、-N(R9)C(=O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(=O)NR9C(=NR10)N(R9)2、-C(=O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、もしくは-S(=O)2R8; R8はそれぞれ独立して以下から選択され; 置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; R9はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; あるいは2つのR9基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; あるいはR8とR9が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; そしてR10はそれぞれ独立して以下から選択され; H、-S(=O)2R8、-S(=O)2NH2、-C(=O)R8、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル;
R5はH、ハロゲン、-N3、-CN、-ONO2、-L6-(置換もしくは非置換C1-C6アルキル)、-L6-(置換もしくは非置換C2-C6アルケニル)、-L6-(置換もしくは非置換ヘテロアリール)、または-L6-(置換もしくは非置換アリール)、ここでL6は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-NH-、-C(=O)-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-NHC(=O)NH-、もしくは-C(=O)NH-;
R11はL7-L10-G6、ここでL7は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-NH-、-C(=O)-、-C(=O)NH-、-NHC(=O)-、(置換もしくは非置換C1-C6アルキル)、または(置換もしくは非置換C2-C6アルケニル); L10は結合、(置換もしくは非置換シクロアルキル)、(置換もしくは非置換シクロアルケニル)、(置換もしくは非置換ヘテロアリール)、(置換もしくは非置換アリール)、または(置換もしくは非置換ヘテロシクロアルキル); そしてG6はH、-CN、-SCN、-N3、-NO2、ハロゲン、-OR9、-C(=O)CF3、-C(=O)R9、-SR8、-S(=O)R8、-S(=O)2R8、-N(R9)2、テトラゾリル、-NHS(=O)2R8、-S(=O)2N(R9)2、-C(=O)NHS(=O)2R8、-S(=O)2NHC(=O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-NHC(=O)O-、-NHC(=O)NH-、-OC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; あるいはG6はW-G7、ここでWは(置換もしくは非置換シクロアルキル)、(置換もしくは非置換シクロアルケニル)、(置換もしくは非置換アリール)、(置換もしくは非置換ヘテロシクロアルキル)または(置換もしくは非置換ヘテロアリール); そしてG7はテトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OH、-OR8、-C(=O)CF3、-C(=O)NHS(=O)2R8、-S(=O)2NHC(=O)R9、-CN、-N(R9)2、-N(R9)C(=O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(O)NR9C(=NR10)N(R9)2、-C(O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、-S(=O)2R8、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアルキル)、-L5-(置換もしくは非置換ヘテロアリール)、-L5-(置換もしくは非置換ヘテロシクロアルキル)、または-L5-(置換もしくは非置換アリール)、ここでL5は-NH-、-NHC(=O)O-、-NHC(=O)NH-、-OC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH、-C(=O)O-、もしくは-OC(=O)-;
R12はL8-L9-R13、ここでL8は結合、(置換もしくは非置換C1-C6アルキル)、または(置換もしくは非置換C2-C4アルケニル); L9は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-NH-、-C(=O)-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)NH-、-OC(=O)O-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; R13はH、(置換もしくは非置換C1-C6アルキル)、(置換もしくは非置換C3-C6シクロアルキル)、(置換もしくは非置換アリール)、(置換もしくは非置換ヘテロアリール)、または(置換もしくは非置換ヘテロシクロアルキル); あるいはR7とR12が連携して4〜8員ヘテロ環を形成している;
(f)
Zは以下から選択され: -NR1C(=O)O-、-NR1C(=O)NR1-、-CR1=N-N-、ここでR1はそれぞれ独立してH、CF3、もしくは場合によって置換された低級アルキル;
YはH、-CO2H、テトラゾリル、-NHS(=O)2R3b、S(=O)2N(R4)2、-OH、-OR3b、-C(=O)(C1-C5フルオロアルキル)、-C(=O)NHS(=O)2R3b、-S(=O)2NHC(O)R4、-CN、-N(R4)2、-N(R4)C(=O)R4、-C(=NR3)N(R4)2、-NR4C(=NR3)N(R4)2、-NR4C(=CHR3)N(R4)2、-C(=O)NR4C(=NR3)N(R4)2、-C(=O)NR4C(=CHR3)N(R4)2、-CO2R3b、-C(=O)R4、-C(=O)N(R4)2、-SR3b、-S(=O)R3b、-S(=O)2R3b、-L1-(置換もしくは非置換アルキル)、-L1-(置換もしくは非置換アルケニル)、-L1-(置換もしくは非置換アルキニル)、-L1-(置換もしくは非置換シクロアルキル)、-L1-(置換もしくは非置換ヘテロシクロアルキル)、-L1-(置換もしくは非置換ヘテロアリール)、-L1-(置換もしくは非置換アリール)、-L1-C(=NR4)N(R4)2、-L1-NR4C(=NR4)N(R4)2、または-L1-NR4C(=CHR3)N(R4)2;
ここでL1は結合、置換もしくは非置換アルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル、置換もしくは非置換ヘテロシクロアルキル、置換もしくは非置換ヘテロアリール、置換もしくは非置換シクロアルキル、置換もしくは非置換ヘテロアルキル、置換もしくは非置換ヘテロアルケニル、置換もしくは非置換ヘテロアルキニル、または置換もしくは非置換アリール;
ここで各置換基は-LsRs、ここでLsはそれぞれ独立して以下から選択され; 結合、-O-、-C(=O)-、-S-、-S(=O)-、-S(=O)2-、-NHC(=O)-、-C(=O)NH-、S(=O)2NH-、-NHS(=O)2、-OC(O)NH-、-NHC(O)O-、-OC(O)O-、-NHC(O)NH-、-C(O)O-、-OC(O)-、C1-C6アルキル、C2-C6アルケニル、-C1-C6フルオロアルキル、ヘテロアリール、アリール、もしくはヘテロ環; そしてRsはそれぞれ独立して以下から選択され; H、ハロゲン、-N(R4)2、-CN、-NO2、N3、-S(=O)2NH2、低級アルキル、低級シクロアルキル、-C1-C6フルオロアルキル、ヘテロアリール、もしくはヘテロアルキル;
R3はそれぞれ独立して以下から選択され; H、-S(=O)2R8、-S(=O)2NH2、-C(=O)R8、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル; R3bはそれぞれ独立して以下から選択され; 置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; R4はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; あるいは2つのR4基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; あるいはR3bとR4が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し;
R6はH、L2-(置換もしくは非置換アルキル)、L2-(置換もしくは非置換シクロアルキル)、L2-(置換もしくは非置換アルケニル)、L2-(置換もしくは非置換シクロアルケニル)、L2-(置換もしくは非置換ヘテロシクロアルキル)、L2-(置換もしくは非置換ヘテロアリール)、またはL2-(置換もしくは非置換アリール)、ここでL2は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-C(=O)-、-CH(OH)-、-(置換もしくは非置換C1-C6アルキル)、または-(置換もしくは非置換C2-C6アルケニル);
R7はL3-X-L4-G1、ここでL3は結合、置換もしくは非置換アルキル、置換もしくは非置換シクロアルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル、置換もしくは非置換アリール、置換もしくは非置換ヘテロアリール、置換もしくは非置換ヘテロシクロアルキル; Xは結合、-O-、-C(=O)-、-CR9(OR9)-、-S-、-S(=O)-、-S(=O)2-、-NR9-、-NR9C(=O)-、-C(=O)NR9-、-S(=O)2NR9-、-NR9S(=O)2-、-OC(=O)NR9-、-NR9C(=O)O-、-CH=NO-、-ON=CH-、-NR9C(=O)NR9-、ヘテロアリール、アリール、-NR9C(=NR10)NR9-、-NR9C(=NR10)-、-C(=NR10)NR9-、-OC(=NR10)-、もしくは-C(=NR10)O-; L4は結合、置換もしくは非置換アルキル、置換もしくは非置換シクロアルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル; G1はH、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OR9、-C(=O)CF3、-C(=O)NHS(=O)2R8、-S(=O)2NHC(=O)R9、-CN、-N(R9)2、-N(R9)C(=O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(O)NR9C(=NR10)N(R9)2、-C(=O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、-S(=O)2R8、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-OC(=O)O-、-NHC(=O)NH-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; またはG1はW-G5であって、ここでWは置換もしくは非置換アリール、置換もしくは非置換ヘテロシクロアルキルまたは置換もしくは非置換ヘテロアリール、そしてG5はH、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OH、-OR8、-C(=O)CF3、-C(=O)NHS(=O)2R8、-S(=O)2NHC(=O)R9、-CN、-N(R9)2、-N(R9)C(=O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(=O)NR9C(=NR10)N(R9)2、-C(=O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、もしくは-S(=O)2R8; R8はそれぞれ独立して以下から選択され; 置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; R9はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; あるいは2つのR9基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; あるいはR8とR9が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; そしてR10はそれぞれ独立して以下から選択され; H、-S(=O)2R8、-S(=O)2NH2、-C(=O)R8、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル;
R5はH、ハロゲン、-N3、-CN、-ONO2、-L6-(置換もしくは非置換C1-C6アルキル)、-L6-(置換もしくは非置換C2-C6アルケニル)、-L6-(置換もしくは非置換ヘテロアリール)、または-L6-(置換もしくは非置換アリール)、ここでL6は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-NH-、-C(=O)-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-NHC(=O)NH-、もしくは-C(=O)NH-;
R11はL7-L10-G6、ここでL7は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-NH-、-C(=O)-、-C(=O)NH-、-NHC(=O)-、(置換もしくは非置換C1-C6アルキル)、または(置換もしくは非置換C2-C6アルケニル); L10は結合、(置換もしくは非置換シクロアルキル)、(置換もしくは非置換シクロアルケニル)、(置換もしくは非置換ヘテロアリール)、(置換もしくは非置換アリール)、または(置換もしくは非置換ヘテロシクロアルキル); そしてG6はH、-CN、-SCN、-N3、-NO2、ハロゲン、-OR9、-C(=O)CF3、-C(=O)R9、-SR8、-S(=O)R8、-S(=O)2R8、-N(R9)2、テトラゾリル、-NHS(=O)2R8、-S(=O)2N(R9)2、-C(=O)NHS(=O)2R8、-S(=O)2NHC(=O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-NHC(=O)O-、-NHC(=O)NH-、-OC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; あるいはG6はW-G7、ここでWは(置換もしくは非置換シクロアルキル)、(置換もしくは非置換シクロアルケニル)、(置換もしくは非置換アリール)、(置換もしくは非置換ヘテロシクロアルキル)または(置換もしくは非置換ヘテロアリール); そしてG7はテトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OH、-OR8、-C(=O)CF3、-C(=O)NHS(=O)2R8、-S(=O)2NHC(=O)R9、-CN、-N(R9)2、-N(R9)C(=O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(O)NR9C(=NR10)N(R9)2、-C(O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、-S(=O)2R8、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアルキル)、-L5-(置換もしくは非置換ヘテロアリール)、-L5-(置換もしくは非置換ヘテロシクロアルキル)、または-L5-(置換もしくは非置換アリール)、ここでL5は-NH-、-NHC(=O)O-、-NHC(=O)NH-、-OC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH、-C(=O)O-、もしくは-OC(=O)-;
R12はL8-L9-R13、ここでL8は結合、(置換もしくは非置換C1-C6アルキル)、または(置換もしくは非置換C2-C4アルケニル); L9は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-NH-、-C(=O)-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)NH-、-OC(=O)O-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; R13はH、(置換もしくは非置換C1-C6アルキル)、(置換もしくは非置換C3-C6シクロアルキル)、(置換もしくは非置換アリール)、(置換もしくは非置換ヘテロアリール)、または(置換もしくは非置換ヘテロシクロアルキル); あるいはR7とR12が連携して4〜8員ヘテロ環を形成している;
(f)
式中、
Zは以下から選択され: -N(R1)-、-S(O)m-、-CR1=CR1-、-C≡C-、-C(R1)2[C(R2)2]n-、-[C(R2)2]nC(R1)2O-、-OC(R1)2[C(R2)2]n-、-[C(R2)2]nC(R1)2S(O)m-、-S(O)mC(R1)2[C(R2)2]n-、-[C(R2)2]nC(R1)2NR1-、-NR1C(R1)2[C(R2)2]n-、-[C(R2)2]nO[C(R1)2]n-、-[C(R1)2]nO[C(R2)2]n-、-C(=O)NR2-、-NR2C(=O)-、-NR2C(=O)O-、-OC(=O)NR2-、-S(=O)2NR2-、-CR1=N-N-、-NR2C(=O)NR2-、-OC(=O)O-、S(=O)2NR2、もしくは-NR2S(=O)2-、ここでR1はそれぞれ独立してH、CF3、もしくは場合によって置換された低級アルキル; または同一の炭素上の2つのR1が結合してオキソ(=O)を形成し; R2はそれぞれ独立してH、OH、OMe、CF3、もしくは場合によって置換された低級アルキル、または同一の炭素上の2つのR2が結合してオキソ(=O)を形成し; mは0、1もしくは2; nはそれぞれ独立して0、1、2、もしくは3;
Yは-C(=O)NHS(=O)2R3b、-S(=O)2NHC(=O)R4、-C(=O)NR4C(=NR3)N(R4)2、-C(O)NR4C(=CHR3)N(R4)2、-C(=O)N(R4)2、-L1-(置換もしくは非置換ヘテロシクロアルキル)、-L1-C(=NR4)N(R4)2、-L1-NR4C(=NR3)N(R4)2、または-L1-NR4C(=CHR3)N(R4)2、ただし、ヘテロ原子が直接Zに結合している場合は、そのヘテロシクロアルキルは置換され;
ここでL1は、結合、置換もしくは非置換アルキル、置換もしくは非置換アルケニル、または置換もしくは非置換アルキニル、置換もしくは非置換ヘテロシクロアルキル、置換もしくは非置換ヘテロアリール、置換もしくは非置換シクロアルキル、置換もしくは非置換ヘテロアルキル、置換もしくは非置換ヘテロアルケニル、または置換もしくは非置換ヘテロアルキニル;
ここで各置換基は-LsRs、ここでLsはそれぞれ独立して以下から選択され; 結合、-O-、-C(=O)-、-S-、-S(=O)-、-S(=O)2-、-NHC(O)-、-C(O)NH-、S(=O)2NH-、-NHS(=O)2、-OC(O)NH-、-NHC(O)O-、-OC(O)O-、-NHC(O)NH-、-C(O)O-、-OC(O)-、C1-C6アルキル、C2-C6アルケニル、-C1-C6フルオロアルキル、ヘテロアリール、アリール、もしくはヘテロ環; そしてRsはそれぞれ独立して以下から選択され; H、ハロゲン、-N(R4)2、-CN、-NO2、N3、-S(=O)2NH2、低級アルキル、低級シクロアルキル、-C1-C6フルオロアルキル、ヘテロアリール、もしくはヘテロアルキル;
R3はそれぞれ独立して以下から選択され; H、-S(=O)2R8、-S(=O)2NH2、-C(=O)R8、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル; R3bはそれぞれ独立して以下から選択され; 置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; R4はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; あるいは2つのR4基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; あるいはR3bとR4が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し;
R6はH、L2-(置換もしくは非置換アルキル)、L2-(置換もしくは非置換シクロアルキル)、L2-(置換もしくは非置換アルケニル)、L2-(置換もしくは非置換シクロアルケニル)、L2-(置換もしくは非置換ヘテロシクロアルキル)、L2-(置換もしくは非置換ヘテロアリール)、またはL2-(置換もしくは非置換アリール)、ここでL2は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-C(=O)-、-CH(OH)-、-(置換もしくは非置換C1-C6アルキル)、または-(置換もしくは非置換C2-C6アルケニル);
R7はL3-X-L4-G1、ここでL3は結合、置換もしくは非置換アルキル、置換もしくは非置換シクロアルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル、置換もしくは非置換アリール、置換もしくは非置換ヘテロアリール、置換もしくは非置換ヘテロシクロアルキル; Xは結合、-O-、-C(=O)-、-CR9(OR9)-、-S-、-S(=O)-、-S(=O)2-、-NR9-、-NR9C(=O)-、-C(=O)NR9-、-S(=O)2NR9-、-NR9S(=O)2-、-OC(=O)NR9-、-NR9C(=O)O-、-CH=NO-、-ON=CH-、-NR9C(=O)NR9-、ヘテロアリール、アリール、-NR9C(=NR10)NR9-、-NR9C(=NR10)-、-C(=NR10)NR9-、-OC(=NR10)-、もしくは-C(=NR10)O-; L4は結合、置換もしくは非置換アルキル、置換もしくは非置換シクロアルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル; G1はH、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OR9、-C(=O)CF3、-C(=O)NHS(=O)2R8、-S(=O)2NHC(=O)R9、-CN、-N(R9)2、-N(R9)C(=O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(=O)NR9C(=NR10)N(R9)2、-C(=O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、-S(=O)2R8、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-OC(=O)O-、-NHC(=O)NH-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; またはG1はW-G5であって、ここでWは置換もしくは非置換アリール、置換もしくは非置換ヘテロシクロアルキルまたは置換もしくは非置換ヘテロアリール、そしてG5はH、テトラゾリル、-NHS(=O)2R8、-S(=O)2N(R9)2、-OH、-OR8、-C(=O)CF3、-C(=O)NHS(=O)2R8、-S(=O)2NHC(=O)R9、-CN、-N(R9)2、-N(R9)C(=O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(=O)NR9C(=NR10)N(R9)2、-C(=O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、もしくは-S(=O)2R8; R8はそれぞれ独立して以下から選択され; 置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; R9はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; あるいは2つのR9基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; あるいはR8とR9が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; そしてR10はそれぞれ独立して以下から選択され; H、-S(=O)2R8、-S(=O)2NH2、-C(=O)R8、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル;
R5はH、ハロゲン、-N3、-CN、-ONO2、-L6-(置換もしくは非置換C1-C6アルキル)、-L6-(置換もしくは非置換C2-C6アルケニル)、-L6-(置換もしくは非置換ヘテロアリール)、または-L6-(置換もしくは非置換アリール)、ここでL6は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-NH-、-C(=O)-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-NHC(=O)NH-、もしくは-C(=O)NH-;
R11はL7-L10-G6、ここでL7は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-NH-、-C(=O)-、-C(=O)NH-、-NHC(=O)-、(置換もしくは非置換C1-C6アルキル)、または(置換もしくは非置換C2-C6アルケニル); L10は結合、(置換もしくは非置換アルキル)、(置換もしくは非置換シクロアルキル)、(置換もしくは非置換シクロアルケニル)、(置換もしくは非置換ヘテロアリール)、(置換もしくは非置換アリール)、または(置換もしくは非置換ヘテロシクロアルキル)); そしてG6はH、-CN、-SCN、-N3、-NO2、ハロゲン、-OR9、-C(=O)CF3、-C(=O)R9、-SR8、-S(=O)R8、-S(=O)2R8、-N(R9)2、テトラゾリル、-NHS(=O)2R8、-S(=O)2N(R9)2、-C(=O)NHS(=O)2R8、-S(=O)2NHC(=O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-NHC(=O)O-、-NHC(=O)NH-、-OC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; あるいはG6はW-G7、ここでWは(置換もしくは非置換シクロアルキル)、(置換もしくは非置換シクロアルケニル)、(置換もしくは非置換アリール)、(置換もしくは非置換ヘテロシクロアルキル)または(置換もしくは非置換ヘテロアリール); そしてG7はH、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OH、-OR8、-C(=O)CF3、-C(=O)NHS(=O)2R8、-S(=O)2NHC(=O)R9、-CN、-N(R9)2、-N(R9)C(=O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(=O)NR9C(=NR10)N(R9)2、-C(=O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、-S(=O)2R8、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアルキル)、-L5-(置換もしくは非置換ヘテロアリール)、-L5-(置換もしくは非置換ヘテロシクロアルキル)、または-L5-(置換もしくは非置換アリール)、ここでL5は-NH-、-NHC(=O)O-、-NHC(=O)NH-、-OC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH、-C(=O)O-、もしくは-OC(=O)-;
R12はL8-L9-R13、ここでL8は結合、(置換もしくは非置換C1-C6アルキル)、または(置換もしくは非置換C2-C4アルケニル); L9は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-NH-、-C(=O)-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)NH-、-OC(=O)O-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; R13はH、(置換もしくは非置換C1-C6アルキル)、(置換もしくは非置換C3-C6シクロアルキル)、(置換もしくは非置換アリール)、(置換もしくは非置換ヘテロアリール)、または(置換もしくは非置換ヘテロシクロアルキル); あるいはR7とR12が連携して4〜8員ヘテロ環を形成している;
(g)
Zは以下から選択され: -N(R1)-、-S(O)m-、-CR1=CR1-、-C≡C-、-C(R1)2[C(R2)2]n-、-[C(R2)2]nC(R1)2O-、-OC(R1)2[C(R2)2]n-、-[C(R2)2]nC(R1)2S(O)m-、-S(O)mC(R1)2[C(R2)2]n-、-[C(R2)2]nC(R1)2NR1-、-NR1C(R1)2[C(R2)2]n-、-[C(R2)2]nO[C(R1)2]n-、-[C(R1)2]nO[C(R2)2]n-、-C(=O)NR2-、-NR2C(=O)-、-NR2C(=O)O-、-OC(=O)NR2-、-S(=O)2NR2-、-CR1=N-N-、-NR2C(=O)NR2-、-OC(=O)O-、S(=O)2NR2、もしくは-NR2S(=O)2-、ここでR1はそれぞれ独立してH、CF3、もしくは場合によって置換された低級アルキル; または同一の炭素上の2つのR1が結合してオキソ(=O)を形成し; R2はそれぞれ独立してH、OH、OMe、CF3、もしくは場合によって置換された低級アルキル、または同一の炭素上の2つのR2が結合してオキソ(=O)を形成し; mは0、1もしくは2; nはそれぞれ独立して0、1、2、もしくは3;
Yは-C(=O)NHS(=O)2R3b、-S(=O)2NHC(=O)R4、-C(=O)NR4C(=NR3)N(R4)2、-C(O)NR4C(=CHR3)N(R4)2、-C(=O)N(R4)2、-L1-(置換もしくは非置換ヘテロシクロアルキル)、-L1-C(=NR4)N(R4)2、-L1-NR4C(=NR3)N(R4)2、または-L1-NR4C(=CHR3)N(R4)2、ただし、ヘテロ原子が直接Zに結合している場合は、そのヘテロシクロアルキルは置換され;
ここでL1は、結合、置換もしくは非置換アルキル、置換もしくは非置換アルケニル、または置換もしくは非置換アルキニル、置換もしくは非置換ヘテロシクロアルキル、置換もしくは非置換ヘテロアリール、置換もしくは非置換シクロアルキル、置換もしくは非置換ヘテロアルキル、置換もしくは非置換ヘテロアルケニル、または置換もしくは非置換ヘテロアルキニル;
ここで各置換基は-LsRs、ここでLsはそれぞれ独立して以下から選択され; 結合、-O-、-C(=O)-、-S-、-S(=O)-、-S(=O)2-、-NHC(O)-、-C(O)NH-、S(=O)2NH-、-NHS(=O)2、-OC(O)NH-、-NHC(O)O-、-OC(O)O-、-NHC(O)NH-、-C(O)O-、-OC(O)-、C1-C6アルキル、C2-C6アルケニル、-C1-C6フルオロアルキル、ヘテロアリール、アリール、もしくはヘテロ環; そしてRsはそれぞれ独立して以下から選択され; H、ハロゲン、-N(R4)2、-CN、-NO2、N3、-S(=O)2NH2、低級アルキル、低級シクロアルキル、-C1-C6フルオロアルキル、ヘテロアリール、もしくはヘテロアルキル;
R3はそれぞれ独立して以下から選択され; H、-S(=O)2R8、-S(=O)2NH2、-C(=O)R8、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル; R3bはそれぞれ独立して以下から選択され; 置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; R4はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; あるいは2つのR4基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; あるいはR3bとR4が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し;
R6はH、L2-(置換もしくは非置換アルキル)、L2-(置換もしくは非置換シクロアルキル)、L2-(置換もしくは非置換アルケニル)、L2-(置換もしくは非置換シクロアルケニル)、L2-(置換もしくは非置換ヘテロシクロアルキル)、L2-(置換もしくは非置換ヘテロアリール)、またはL2-(置換もしくは非置換アリール)、ここでL2は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-C(=O)-、-CH(OH)-、-(置換もしくは非置換C1-C6アルキル)、または-(置換もしくは非置換C2-C6アルケニル);
R7はL3-X-L4-G1、ここでL3は結合、置換もしくは非置換アルキル、置換もしくは非置換シクロアルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル、置換もしくは非置換アリール、置換もしくは非置換ヘテロアリール、置換もしくは非置換ヘテロシクロアルキル; Xは結合、-O-、-C(=O)-、-CR9(OR9)-、-S-、-S(=O)-、-S(=O)2-、-NR9-、-NR9C(=O)-、-C(=O)NR9-、-S(=O)2NR9-、-NR9S(=O)2-、-OC(=O)NR9-、-NR9C(=O)O-、-CH=NO-、-ON=CH-、-NR9C(=O)NR9-、ヘテロアリール、アリール、-NR9C(=NR10)NR9-、-NR9C(=NR10)-、-C(=NR10)NR9-、-OC(=NR10)-、もしくは-C(=NR10)O-; L4は結合、置換もしくは非置換アルキル、置換もしくは非置換シクロアルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル; G1はH、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OR9、-C(=O)CF3、-C(=O)NHS(=O)2R8、-S(=O)2NHC(=O)R9、-CN、-N(R9)2、-N(R9)C(=O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(=O)NR9C(=NR10)N(R9)2、-C(=O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、-S(=O)2R8、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-OC(=O)O-、-NHC(=O)NH-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; またはG1はW-G5であって、ここでWは置換もしくは非置換アリール、置換もしくは非置換ヘテロシクロアルキルまたは置換もしくは非置換ヘテロアリール、そしてG5はH、テトラゾリル、-NHS(=O)2R8、-S(=O)2N(R9)2、-OH、-OR8、-C(=O)CF3、-C(=O)NHS(=O)2R8、-S(=O)2NHC(=O)R9、-CN、-N(R9)2、-N(R9)C(=O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(=O)NR9C(=NR10)N(R9)2、-C(=O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、もしくは-S(=O)2R8; R8はそれぞれ独立して以下から選択され; 置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; R9はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; あるいは2つのR9基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; あるいはR8とR9が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; そしてR10はそれぞれ独立して以下から選択され; H、-S(=O)2R8、-S(=O)2NH2、-C(=O)R8、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル;
R5はH、ハロゲン、-N3、-CN、-ONO2、-L6-(置換もしくは非置換C1-C6アルキル)、-L6-(置換もしくは非置換C2-C6アルケニル)、-L6-(置換もしくは非置換ヘテロアリール)、または-L6-(置換もしくは非置換アリール)、ここでL6は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-NH-、-C(=O)-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-NHC(=O)NH-、もしくは-C(=O)NH-;
R11はL7-L10-G6、ここでL7は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-NH-、-C(=O)-、-C(=O)NH-、-NHC(=O)-、(置換もしくは非置換C1-C6アルキル)、または(置換もしくは非置換C2-C6アルケニル); L10は結合、(置換もしくは非置換アルキル)、(置換もしくは非置換シクロアルキル)、(置換もしくは非置換シクロアルケニル)、(置換もしくは非置換ヘテロアリール)、(置換もしくは非置換アリール)、または(置換もしくは非置換ヘテロシクロアルキル)); そしてG6はH、-CN、-SCN、-N3、-NO2、ハロゲン、-OR9、-C(=O)CF3、-C(=O)R9、-SR8、-S(=O)R8、-S(=O)2R8、-N(R9)2、テトラゾリル、-NHS(=O)2R8、-S(=O)2N(R9)2、-C(=O)NHS(=O)2R8、-S(=O)2NHC(=O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-NHC(=O)O-、-NHC(=O)NH-、-OC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; あるいはG6はW-G7、ここでWは(置換もしくは非置換シクロアルキル)、(置換もしくは非置換シクロアルケニル)、(置換もしくは非置換アリール)、(置換もしくは非置換ヘテロシクロアルキル)または(置換もしくは非置換ヘテロアリール); そしてG7はH、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OH、-OR8、-C(=O)CF3、-C(=O)NHS(=O)2R8、-S(=O)2NHC(=O)R9、-CN、-N(R9)2、-N(R9)C(=O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(=O)NR9C(=NR10)N(R9)2、-C(=O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、-S(=O)2R8、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアルキル)、-L5-(置換もしくは非置換ヘテロアリール)、-L5-(置換もしくは非置換ヘテロシクロアルキル)、または-L5-(置換もしくは非置換アリール)、ここでL5は-NH-、-NHC(=O)O-、-NHC(=O)NH-、-OC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH、-C(=O)O-、もしくは-OC(=O)-;
R12はL8-L9-R13、ここでL8は結合、(置換もしくは非置換C1-C6アルキル)、または(置換もしくは非置換C2-C4アルケニル); L9は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-NH-、-C(=O)-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)NH-、-OC(=O)O-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; R13はH、(置換もしくは非置換C1-C6アルキル)、(置換もしくは非置換C3-C6シクロアルキル)、(置換もしくは非置換アリール)、(置換もしくは非置換ヘテロアリール)、または(置換もしくは非置換ヘテロシクロアルキル); あるいはR7とR12が連携して4〜8員ヘテロ環を形成している;
(g)
式中、
Zは以下から選択され: -N(R1)-、-S(=O)m-、-CR1=CR1-、-C≡C-、-C(R1)2[C(R2)2]n-、-[C(R2)2]nC(R1)2O-、-OC(R1)2[C(R2)2]n-、-[C(R2)2]nC(R1)2S(O)m-、-S(O)mC(R1)2[C(R2)2]n-、-[C(R2)2]nC(R1)2NR1-、-NR1C(R1)2[C(R2)2]n-、-[C(R2)2]nO[C(R1)2]n-、-[C(R1)2]nO[C(R2)2]n-、-C(=O)NR2-、-NR2C(=O)-、-NR2C(=O)O-、-OC(=O)NR2-、-S(=O)2NR2-、-CR1=N-N-、-NR2C(=O)NR2-、-OC(=O)O-、S(=O)2NR2、もしくは-NR2S(=O)2-、ここでR1はそれぞれ独立してH、CF3、もしくは場合によって置換された低級アルキル; または同一の炭素上の2つのR1が結合してオキソ(=O)を形成し; R2はそれぞれ独立してH、OH、OMe、CF3、もしくは場合によって置換された低級アルキル、または同一の炭素上の2つのR2が結合してオキソ(=O)を形成し; mは0、1もしくは2; nはそれぞれ独立して0、1、2、もしくは3;
YはH、-CO2H、テトラゾリル、-NHS(=O)2R3b、S(=O)2N(R4)2、-OH、-OR3b、-C(=O)(C1-C5フルオロアルキル)、-C(=O)NHS(=O)2R3b、-S(=O)2NHC(=O)R4、-CN、-N(R4)2、-N(R4)C(=O)R4、-C(=NR3)N(R4)2、-NR4C(=NR3)N(R4)2、-NR4C(=CHR3)N(R4)2、-C(=O)NR4C(=NR3)N(R4)2、-C(=O)NR4C(=CHR3)N(R4)2、-CO2R3b、-C(=O)R4、-C(=O)N(R4)2、-SR3b、-S(=O)R3b、-S(=O)2R3b、-L1-(置換もしくは非置換アルキル)、-L1-(置換もしくは非置換アルケニル)、-L1-(置換もしくは非置換アルキニル)、-L1-(置換もしくは非置換シクロアルキル)、-L1-(置換もしくは非置換ヘテロシクロアルキル)、-L1-(置換もしくは非置換ヘテロアリール)、-L1-(置換もしくは非置換アリール)、または-L1-C(=NR4)N(R4)2、-L1-NR4C(=NR4)N(R4)2、-L1-NR4C(=CHR3)N(R4)2;
ここでL1は結合、置換もしくは非置換アルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル、置換もしくは非置換ヘテロシクロアルキル、置換もしくは非置換ヘテロアリール、置換もしくは非置換シクロアルキル、置換もしくは非置換ヘテロアルキル、置換もしくは非置換ヘテロアルケニル、置換もしくは非置換ヘテロアルキニル、または置換もしくは非置換アリール;
ここで各置換基は-LsRs、ここでLsはそれぞれ独立して以下から選択され; 結合、-O-、-C(=O)-、-S-、-S(=O)-、-S(=O)2-、-NHC(=O)-、-C(=O)NH-、S(=O)2NH-、-NHS(=O)2、-OC(O)NH-、-NHC(O)O-、-OC(O)O-、-NHC(O)NH-、-C(O)O-、-OC(O)-、C1-C6アルキル、C2-C6アルケニル、-C1-C6フルオロアルキル、ヘテロアリール、アリール、もしくはヘテロ環; そしてRsはそれぞれ独立して以下から選択され; H、ハロゲン、-N(R4)2、-CN、-NO2、N3、-S(=O)2NH2、低級アルキル、低級シクロアルキル、-C1-C6フルオロアルキル、ヘテロアリール、もしくはヘテロアルキル;
R3はそれぞれ独立して以下から選択され; H、-S(=O)2R8、-S(=O)2NH2、-C(O)R8、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル; R3bはそれぞれ独立して以下から選択され; 置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; R4はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; あるいは2つのR4基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; あるいはR3bとR4が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し;
R6はH、L2-(置換もしくは非置換アルキル)、L2-(置換もしくは非置換シクロアルキル)、L2-(置換もしくは非置換アルケニル)、L2-(置換もしくは非置換シクロアルケニル)、L2-(置換もしくは非置換ヘテロシクロアルキル)、L2-(置換もしくは非置換ヘテロアリール)、またはL2-(置換もしくは非置換アリール)、ここでL2は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-C(=O)-、-CH(OH)-、-(置換もしくは非置換C1-C6アルキル)、または-(置換もしくは非置換C2-C6アルケニル);
R7はHまたは置換もしくは非置換アルキル;
R5はH、ハロゲン、-N3、-CN、-ONO2、-L6-(置換もしくは非置換C1-C6アルキル)、-L6-(置換もしくは非置換C2-C6アルケニル)、-L6-(置換もしくは非置換ヘテロアリール)、または-L6-(置換もしくは非置換アリール)、ここでL6は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-NH-、-C(=O)-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-NHC(=O)NH-、もしくは-C(O)NH-;
R11は(置換もしくは非置換ヘテロアリール)または(置換もしくは非置換ヘテロシクロアルキル); そして
R12はL8-L9-R13、ここでL8は結合、(置換もしくは非置換C1-C6アルキル)、または(置換もしくは非置換C2-C4アルケニル); L9は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-NH-、-C(=O)-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)NH-、-OC(=O)O-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; R13はH、(置換もしくは非置換C1-C6アルキル)、(置換もしくは非置換C3-C6シクロアルキル)、(置換もしくは非置換アリール)、(置換もしくは非置換ヘテロアリール)、または(置換もしくは非置換ヘテロシクロアルキル);
(h)
Zは以下から選択され: -N(R1)-、-S(=O)m-、-CR1=CR1-、-C≡C-、-C(R1)2[C(R2)2]n-、-[C(R2)2]nC(R1)2O-、-OC(R1)2[C(R2)2]n-、-[C(R2)2]nC(R1)2S(O)m-、-S(O)mC(R1)2[C(R2)2]n-、-[C(R2)2]nC(R1)2NR1-、-NR1C(R1)2[C(R2)2]n-、-[C(R2)2]nO[C(R1)2]n-、-[C(R1)2]nO[C(R2)2]n-、-C(=O)NR2-、-NR2C(=O)-、-NR2C(=O)O-、-OC(=O)NR2-、-S(=O)2NR2-、-CR1=N-N-、-NR2C(=O)NR2-、-OC(=O)O-、S(=O)2NR2、もしくは-NR2S(=O)2-、ここでR1はそれぞれ独立してH、CF3、もしくは場合によって置換された低級アルキル; または同一の炭素上の2つのR1が結合してオキソ(=O)を形成し; R2はそれぞれ独立してH、OH、OMe、CF3、もしくは場合によって置換された低級アルキル、または同一の炭素上の2つのR2が結合してオキソ(=O)を形成し; mは0、1もしくは2; nはそれぞれ独立して0、1、2、もしくは3;
YはH、-CO2H、テトラゾリル、-NHS(=O)2R3b、S(=O)2N(R4)2、-OH、-OR3b、-C(=O)(C1-C5フルオロアルキル)、-C(=O)NHS(=O)2R3b、-S(=O)2NHC(=O)R4、-CN、-N(R4)2、-N(R4)C(=O)R4、-C(=NR3)N(R4)2、-NR4C(=NR3)N(R4)2、-NR4C(=CHR3)N(R4)2、-C(=O)NR4C(=NR3)N(R4)2、-C(=O)NR4C(=CHR3)N(R4)2、-CO2R3b、-C(=O)R4、-C(=O)N(R4)2、-SR3b、-S(=O)R3b、-S(=O)2R3b、-L1-(置換もしくは非置換アルキル)、-L1-(置換もしくは非置換アルケニル)、-L1-(置換もしくは非置換アルキニル)、-L1-(置換もしくは非置換シクロアルキル)、-L1-(置換もしくは非置換ヘテロシクロアルキル)、-L1-(置換もしくは非置換ヘテロアリール)、-L1-(置換もしくは非置換アリール)、または-L1-C(=NR4)N(R4)2、-L1-NR4C(=NR4)N(R4)2、-L1-NR4C(=CHR3)N(R4)2;
ここでL1は結合、置換もしくは非置換アルキル、置換もしくは非置換アルケニル、置換もしくは非置換アルキニル、置換もしくは非置換ヘテロシクロアルキル、置換もしくは非置換ヘテロアリール、置換もしくは非置換シクロアルキル、置換もしくは非置換ヘテロアルキル、置換もしくは非置換ヘテロアルケニル、置換もしくは非置換ヘテロアルキニル、または置換もしくは非置換アリール;
ここで各置換基は-LsRs、ここでLsはそれぞれ独立して以下から選択され; 結合、-O-、-C(=O)-、-S-、-S(=O)-、-S(=O)2-、-NHC(=O)-、-C(=O)NH-、S(=O)2NH-、-NHS(=O)2、-OC(O)NH-、-NHC(O)O-、-OC(O)O-、-NHC(O)NH-、-C(O)O-、-OC(O)-、C1-C6アルキル、C2-C6アルケニル、-C1-C6フルオロアルキル、ヘテロアリール、アリール、もしくはヘテロ環; そしてRsはそれぞれ独立して以下から選択され; H、ハロゲン、-N(R4)2、-CN、-NO2、N3、-S(=O)2NH2、低級アルキル、低級シクロアルキル、-C1-C6フルオロアルキル、ヘテロアリール、もしくはヘテロアルキル;
R3はそれぞれ独立して以下から選択され; H、-S(=O)2R8、-S(=O)2NH2、-C(O)R8、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル; R3bはそれぞれ独立して以下から選択され; 置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; R4はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; あるいは2つのR4基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; あるいはR3bとR4が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し;
R6はH、L2-(置換もしくは非置換アルキル)、L2-(置換もしくは非置換シクロアルキル)、L2-(置換もしくは非置換アルケニル)、L2-(置換もしくは非置換シクロアルケニル)、L2-(置換もしくは非置換ヘテロシクロアルキル)、L2-(置換もしくは非置換ヘテロアリール)、またはL2-(置換もしくは非置換アリール)、ここでL2は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-C(=O)-、-CH(OH)-、-(置換もしくは非置換C1-C6アルキル)、または-(置換もしくは非置換C2-C6アルケニル);
R7はHまたは置換もしくは非置換アルキル;
R5はH、ハロゲン、-N3、-CN、-ONO2、-L6-(置換もしくは非置換C1-C6アルキル)、-L6-(置換もしくは非置換C2-C6アルケニル)、-L6-(置換もしくは非置換ヘテロアリール)、または-L6-(置換もしくは非置換アリール)、ここでL6は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-NH-、-C(=O)-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-NHC(=O)NH-、もしくは-C(O)NH-;
R11は(置換もしくは非置換ヘテロアリール)または(置換もしくは非置換ヘテロシクロアルキル); そして
R12はL8-L9-R13、ここでL8は結合、(置換もしくは非置換C1-C6アルキル)、または(置換もしくは非置換C2-C4アルケニル); L9は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-NH-、-C(=O)-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)NH-、-OC(=O)O-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-; R13はH、(置換もしくは非置換C1-C6アルキル)、(置換もしくは非置換C3-C6シクロアルキル)、(置換もしくは非置換アリール)、(置換もしくは非置換ヘテロアリール)、または(置換もしくは非置換ヘテロシクロアルキル);
(h)
式中、
Zは以下から選択され: [C(R1)2]m[C(R2)2]n、[C(R2)2]n[C(R1)2]mO、O[C(R1)2]m[C(R2)2]n、[C(R2)2]nO[C(R1)2]n、もしくは[C(R1)2]nO[C(R2)2]n、ここでR1はそれぞれ独立してH、CF3、もしくは場合によって置換された低級アルキル; または同一の炭素上の2つのR1が結合してオキソ(=O)を形成し; R2はそれぞれ独立してH、OH、OMe、CF3、もしくは場合によって置換された低級アルキル、または同一の炭素上の2つのR2が結合してオキソ(=O)を形成し; mは0、1もしくは2; nはそれぞれ独立して0、1、2、もしくは3;
YはHまたは-(置換もしくは非置換アリール); または-(置換もしくは非置換ヘテロアリール); ここでYもしくはZ上の各置換基は-LsRs、ここでLsはそれぞれ独立して以下から選択され; 結合、-O-、-C(=O)-、-S-、-S(=O)-、-S(=O)2-、-NHC(O)-、-C(O)NH-、S(=O)2NH-、-NHS(=O)2、-OC(O)NH-、-NHC(O)O-、-OC(O)O-、-NHC(O)NH-、-C(O)O-、-OC(O)-、置換もしくは非置換C1-C6アルキル、C2-C6アルケニル、-C1-C6フルオロアルキル、置換もしくは非置換ヘテロアリール、置換もしくは非置換炭素環アリール; そしてRsはそれぞれ独立して以下から選択され; H、ハロゲン、-N(R4)2、-CN、-NO2、N3、-S(=O)2NH2、置換もしくは非置換低級アルキル、置換もしくは非置換低級低級シクロアルキル、-C1-C6フルオロアルキル、置換もしくは非置換アリール、置換もしくは非置換ヘテロアリール、または置換もしくは非置換ヘテロアルキル;
R6はH、L2-(置換もしくは非置換アルキル)、L2-(置換もしくは非置換シクロアルキル)、L2-(置換もしくは非置換アルケニル)、L2-(置換もしくは非置換シクロアルケニル)、L2-(置換もしくは非置換ヘテロシクロアルキル)、L2-(置換もしくは非置換ヘテロアリール)、またはL2-(置換もしくは非置換アリール)、ここでL2は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-C(O)-、-CH(OH)-、-(置換もしくは非置換C1-C6アルキル)、または-(置換もしくは非置換C2-C6アルケニル);
R7はL3-X-L4-G1、
ここでL3は置換もしくは非置換アルキル;
Xは結合、-O-、-C(=O)-、-C(=O)O-、-CR9(OR9)-、-S-、-S(=O)-、-S(=O)2-、-NR9-、-NR9C(=O)-、-C(=O)NR9-、-NR9C(=O)NR9-;
L4は結合または置換もしくは非置換アルキル;
G1はH、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OR9、-C(=O)CF3、-C(=O)NHS(=O)2R8、-S(=O)2NHC(=O)R9、-CN、-N(R9)2、-N(R9)C(=O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(O)NR9C(=NR10)N(R9)2、-C(O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(O)R9、-C(O)N(R9)2、-SR8、-S(=O)R8、-S(=O)2R8、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換ヘテロアルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-OC(O)O-、-NHC(O)NH-、-NHC(O)O、-O(O)CNH-、-NHC(O)、-C(O)NH、-C(O)O、もしくは-OC(O);
またはG1はW-G5であって、ここでWは置換もしくは非置換炭素環アリール、置換もしくは非置換ヘテロシクロアルキルまたは置換もしくは非置換ヘテロアリール、そしてG5はH、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OH、-OR8、-C(=O)CF3、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R9、-CN、-N(R9)2、-N(R9)C(O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(O)NR9C(=NR10)N(R9)2、-C(O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(O)R9、-CON(R9)2、-SR8、-S(=O)R8、もしくは-S(=O)2R8;
R8はそれぞれ独立して以下から選択され; 置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、置換もしくは非置換フェニルまたは置換もしくは非置換ベンジル;
R9はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、置換もしくは非置換フェニルまたは置換もしくは非置換ベンジル; あるいは2つのR9基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; あるいはR8とR9が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; そして
R10はそれぞれ独立して以下から選択され; H、-S(=O)2R8、-S(=O)2NH2、-C(O)R8、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル;
R5はH、ハロゲン、置換もしくは非置換C1-C6アルキル、置換もしくは非置換O-C1-C6アルキル;
R11はL7-L10-G6、ここでL7は結合; L10は(置換もしくは非置換ヘテロアリール)、(置換もしくは非置換アリール)、または(置換もしくは非置換ヘテロシクロアルキル);
G6は-OR9、-C(=O)R9、-C(=O)OR9、-S(=O)R8、-S(=O)2R8、-N(R9)2、テトラゾリル、-NHS(=O)2R8、-S(=O)2N(R9)2、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R9、-C(=O)N(R9)2、NR9C(O)R9、C(R9)2C(=O)N(R9)2、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換炭素環アリール)、ここでL5は-O-、C(=O)、S、S(=O)、S(=O)2、-NH-、-NHC(O)O-、-NHC(O)NH-、-OC(O)O-、-OC(O)NH-、-NHC(O)-、-C(O)NH、-C(O)O-、もしくは-OC(O)-;
あるいはG6はW-G7、ここでWは(置換もしくは非置換ヘテロシクロアルキル)、(置換もしくは非置換アリール)または(置換もしくは非置換ヘテロアリール); そしてG7はH、ハロゲン、CN、NO2、N3、CF3、OCF3、C1-C6アルキル、C3-C6シクロアルキル、-C1-C6フルオロアルキル、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OH、-OR8、-C(=O)CF3、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R9、-CN、-N(R9)2、-N(R9)C(O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(O)NR9C(=NR10)N(R9)2、-C(O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(O)R9、-CON(R9)2、-SR8、-S(=O)R8、-S(=O)2R8、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアルキル)、-L5-(置換もしくは非置換ヘテロアリール)、-L5-(置換もしくは非置換ヘテロシクロアルキル)、または-L5-(置換もしくは非置換アリール)、ここでL5は結合、-O-、C(=O)、S、S(=O)、S(=O)2、-NH、-NHC(O)O-、-NHC(O)NH-、-OC(O)O-、-OC(O)NH-、-NHC(O)-、-C(O)NH-、-C(O)O-、もしくは-OC(O)-;
R12はH、(置換もしくは非置換C1-C6アルキル)、(置換もしくは非置換C3-C6シクロアルキル);
(i)
Zは以下から選択され: [C(R1)2]m[C(R2)2]n、[C(R2)2]n[C(R1)2]mO、O[C(R1)2]m[C(R2)2]n、[C(R2)2]nO[C(R1)2]n、もしくは[C(R1)2]nO[C(R2)2]n、ここでR1はそれぞれ独立してH、CF3、もしくは場合によって置換された低級アルキル; または同一の炭素上の2つのR1が結合してオキソ(=O)を形成し; R2はそれぞれ独立してH、OH、OMe、CF3、もしくは場合によって置換された低級アルキル、または同一の炭素上の2つのR2が結合してオキソ(=O)を形成し; mは0、1もしくは2; nはそれぞれ独立して0、1、2、もしくは3;
YはHまたは-(置換もしくは非置換アリール); または-(置換もしくは非置換ヘテロアリール); ここでYもしくはZ上の各置換基は-LsRs、ここでLsはそれぞれ独立して以下から選択され; 結合、-O-、-C(=O)-、-S-、-S(=O)-、-S(=O)2-、-NHC(O)-、-C(O)NH-、S(=O)2NH-、-NHS(=O)2、-OC(O)NH-、-NHC(O)O-、-OC(O)O-、-NHC(O)NH-、-C(O)O-、-OC(O)-、置換もしくは非置換C1-C6アルキル、C2-C6アルケニル、-C1-C6フルオロアルキル、置換もしくは非置換ヘテロアリール、置換もしくは非置換炭素環アリール; そしてRsはそれぞれ独立して以下から選択され; H、ハロゲン、-N(R4)2、-CN、-NO2、N3、-S(=O)2NH2、置換もしくは非置換低級アルキル、置換もしくは非置換低級低級シクロアルキル、-C1-C6フルオロアルキル、置換もしくは非置換アリール、置換もしくは非置換ヘテロアリール、または置換もしくは非置換ヘテロアルキル;
R6はH、L2-(置換もしくは非置換アルキル)、L2-(置換もしくは非置換シクロアルキル)、L2-(置換もしくは非置換アルケニル)、L2-(置換もしくは非置換シクロアルケニル)、L2-(置換もしくは非置換ヘテロシクロアルキル)、L2-(置換もしくは非置換ヘテロアリール)、またはL2-(置換もしくは非置換アリール)、ここでL2は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-C(O)-、-CH(OH)-、-(置換もしくは非置換C1-C6アルキル)、または-(置換もしくは非置換C2-C6アルケニル);
R7はL3-X-L4-G1、
ここでL3は置換もしくは非置換アルキル;
Xは結合、-O-、-C(=O)-、-C(=O)O-、-CR9(OR9)-、-S-、-S(=O)-、-S(=O)2-、-NR9-、-NR9C(=O)-、-C(=O)NR9-、-NR9C(=O)NR9-;
L4は結合または置換もしくは非置換アルキル;
G1はH、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OR9、-C(=O)CF3、-C(=O)NHS(=O)2R8、-S(=O)2NHC(=O)R9、-CN、-N(R9)2、-N(R9)C(=O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(O)NR9C(=NR10)N(R9)2、-C(O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(O)R9、-C(O)N(R9)2、-SR8、-S(=O)R8、-S(=O)2R8、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換ヘテロアルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-OC(O)O-、-NHC(O)NH-、-NHC(O)O、-O(O)CNH-、-NHC(O)、-C(O)NH、-C(O)O、もしくは-OC(O);
またはG1はW-G5であって、ここでWは置換もしくは非置換炭素環アリール、置換もしくは非置換ヘテロシクロアルキルまたは置換もしくは非置換ヘテロアリール、そしてG5はH、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OH、-OR8、-C(=O)CF3、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R9、-CN、-N(R9)2、-N(R9)C(O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(O)NR9C(=NR10)N(R9)2、-C(O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(O)R9、-CON(R9)2、-SR8、-S(=O)R8、もしくは-S(=O)2R8;
R8はそれぞれ独立して以下から選択され; 置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、置換もしくは非置換フェニルまたは置換もしくは非置換ベンジル;
R9はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、置換もしくは非置換フェニルまたは置換もしくは非置換ベンジル; あるいは2つのR9基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; あるいはR8とR9が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; そして
R10はそれぞれ独立して以下から選択され; H、-S(=O)2R8、-S(=O)2NH2、-C(O)R8、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル;
R5はH、ハロゲン、置換もしくは非置換C1-C6アルキル、置換もしくは非置換O-C1-C6アルキル;
R11はL7-L10-G6、ここでL7は結合; L10は(置換もしくは非置換ヘテロアリール)、(置換もしくは非置換アリール)、または(置換もしくは非置換ヘテロシクロアルキル);
G6は-OR9、-C(=O)R9、-C(=O)OR9、-S(=O)R8、-S(=O)2R8、-N(R9)2、テトラゾリル、-NHS(=O)2R8、-S(=O)2N(R9)2、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R9、-C(=O)N(R9)2、NR9C(O)R9、C(R9)2C(=O)N(R9)2、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換炭素環アリール)、ここでL5は-O-、C(=O)、S、S(=O)、S(=O)2、-NH-、-NHC(O)O-、-NHC(O)NH-、-OC(O)O-、-OC(O)NH-、-NHC(O)-、-C(O)NH、-C(O)O-、もしくは-OC(O)-;
あるいはG6はW-G7、ここでWは(置換もしくは非置換ヘテロシクロアルキル)、(置換もしくは非置換アリール)または(置換もしくは非置換ヘテロアリール); そしてG7はH、ハロゲン、CN、NO2、N3、CF3、OCF3、C1-C6アルキル、C3-C6シクロアルキル、-C1-C6フルオロアルキル、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OH、-OR8、-C(=O)CF3、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R9、-CN、-N(R9)2、-N(R9)C(O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(O)NR9C(=NR10)N(R9)2、-C(O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(O)R9、-CON(R9)2、-SR8、-S(=O)R8、-S(=O)2R8、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアルキル)、-L5-(置換もしくは非置換ヘテロアリール)、-L5-(置換もしくは非置換ヘテロシクロアルキル)、または-L5-(置換もしくは非置換アリール)、ここでL5は結合、-O-、C(=O)、S、S(=O)、S(=O)2、-NH、-NHC(O)O-、-NHC(O)NH-、-OC(O)O-、-OC(O)NH-、-NHC(O)-、-C(O)NH-、-C(O)O-、もしくは-OC(O)-;
R12はH、(置換もしくは非置換C1-C6アルキル)、(置換もしくは非置換C3-C6シクロアルキル);
(i)
式中、
Zは[C(R2)2]nC(R1)2O、ここで
R1はそれぞれ独立してH、CF3、もしくは場合によって置換された低級アルキル; または同一の炭素上の2つのR1が結合してオキソ(=O)を形成し; R2はそれぞれ独立してH、OH、OMe、CF3、もしくは場合によって置換された低級アルキル、または同一の炭素上の2つのR2が結合してオキソ(=O)を形成し; nは0、1、2、もしくは3;
Yは-(置換もしくは非置換アリール); または-(置換もしくは非置換ヘテロアリール); ここでYもしくはZ上の各置換基は-LsRs、ここでLsはそれぞれ独立して以下から選択され; 結合、-O-、-C(=O)-、-S-、-S(=O)-、-S(=O)2-、-NHC(=O)-、-C(=O)NH-、S(=O)2NH-、-NHS(=O)2、-OC(=O)NH-、-NHC(=O)O-、-OC(=O)O-、-NHC(=O)NH-、-C(=O)O-、-OC(=O)-、置換もしくは非置換C1-C6アルキル、C2-C6アルケニル、-C1-C6フルオロアルキル、置換もしくは非置換ヘテロアリール、置換もしくは非置換アリール、または置換もしくは非置換ヘテロシクロアルキル; そしてRsはそれぞれ独立して以下から選択され; H、ハロゲン、-N(R4)2、-CN、-NO2、N3、-S(=O)2NH2、置換もしくは非置換低級アルキル、置換もしくは非置換低級低級シクロアルキル、-C1-C6フルオロアルキル、置換もしくは非置換アリール、置換もしくは非置換ヘテロアリール、または置換もしくは非置換ヘテロアルキル;
G1はH、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OR9、-C(=O)CF3、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R9、-CN、-N(R9)2、-N(R9)C(O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(O)NR9C(=NR10)N(R9)2、-C(O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(O)R9、-CON(R9)2、-SR8、-S(=O)R8、-S(=O)2R8、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-OC(=O)O-、-NHC(=O)NH-、-NHC(=O)O、-O(=O)NH-、-NHC(=O)、-C(=O)NH、-C(=O)O、もしくは-OC(=O);
またはG1はW-G5であって、ここでWは置換もしくは非置換アリール、置換もしくは非置換ヘテロシクロアルキルまたは置換もしくは非置換ヘテロアリール、そしてG5はH、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OH、-OR8、-C(=O)CF3、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R9、-CN、-N(R9)2、-N(R9)C(O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(O)NR9C(=NR10)N(R9)2、-C(O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-CON(R9)2、-SR8、-S(=O)R8、もしくは-S(=O)2R8;
R8はそれぞれ独立して以下から選択され; 置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、置換もしくは非置換フェニルまたは置換もしくは非置換ベンジル;
R9はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、置換もしくは非置換フェニルまたは置換もしくは非置換ベンジル; あるいは
2つのR9基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; あるいは
R8とR9が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し;
R10はそれぞれ独立して以下から選択され; H、-S(=O)2R8、-S(=O)2NH2、-C(O)R8、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル;
G6はW-G7、ここでWは(置換もしくは非置換ヘテロシクロアルキル)、(置換もしくは非置換アリール)または(置換もしくは非置換ヘテロアリール); そして
G7はH、ハロゲン、CN、NO2、N3、CF3、OCF3、C1-C6アルキル、C1-C6ヘテロアルキル、C3-C6シクロアルキル、-C1-C6フルオロアルキル、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OH、-OR8、-C(=O)CF3、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R9、-CN、-N(R9)2、-N(R9)C(O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(O)NR9C(=NR10)N(R9)2、-C(O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-CON(R9)2、-SR8、-S(=O)R8、-S(=O)2R8、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアルキル)、-L5-(置換もしくは非置換ヘテロアリール)、-L5-(置換もしくは非置換ヘテロシクロアルキル)、または-L5-(置換もしくは非置換アリール)、ここでL5は結合、-O-、C(=O)、S、S(=O)、S(=O)2、-NH、-NHC(=O)O-、-NHC(=O)NH-、-OC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-;
あるいはこれらの溶媒和物、または医薬として許容される塩、または医薬として許容されるプロドラッグ。
Zは[C(R2)2]nC(R1)2O、ここで
R1はそれぞれ独立してH、CF3、もしくは場合によって置換された低級アルキル; または同一の炭素上の2つのR1が結合してオキソ(=O)を形成し; R2はそれぞれ独立してH、OH、OMe、CF3、もしくは場合によって置換された低級アルキル、または同一の炭素上の2つのR2が結合してオキソ(=O)を形成し; nは0、1、2、もしくは3;
Yは-(置換もしくは非置換アリール); または-(置換もしくは非置換ヘテロアリール); ここでYもしくはZ上の各置換基は-LsRs、ここでLsはそれぞれ独立して以下から選択され; 結合、-O-、-C(=O)-、-S-、-S(=O)-、-S(=O)2-、-NHC(=O)-、-C(=O)NH-、S(=O)2NH-、-NHS(=O)2、-OC(=O)NH-、-NHC(=O)O-、-OC(=O)O-、-NHC(=O)NH-、-C(=O)O-、-OC(=O)-、置換もしくは非置換C1-C6アルキル、C2-C6アルケニル、-C1-C6フルオロアルキル、置換もしくは非置換ヘテロアリール、置換もしくは非置換アリール、または置換もしくは非置換ヘテロシクロアルキル; そしてRsはそれぞれ独立して以下から選択され; H、ハロゲン、-N(R4)2、-CN、-NO2、N3、-S(=O)2NH2、置換もしくは非置換低級アルキル、置換もしくは非置換低級低級シクロアルキル、-C1-C6フルオロアルキル、置換もしくは非置換アリール、置換もしくは非置換ヘテロアリール、または置換もしくは非置換ヘテロアルキル;
G1はH、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OR9、-C(=O)CF3、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R9、-CN、-N(R9)2、-N(R9)C(O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(O)NR9C(=NR10)N(R9)2、-C(O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(O)R9、-CON(R9)2、-SR8、-S(=O)R8、-S(=O)2R8、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-OC(=O)O-、-NHC(=O)NH-、-NHC(=O)O、-O(=O)NH-、-NHC(=O)、-C(=O)NH、-C(=O)O、もしくは-OC(=O);
またはG1はW-G5であって、ここでWは置換もしくは非置換アリール、置換もしくは非置換ヘテロシクロアルキルまたは置換もしくは非置換ヘテロアリール、そしてG5はH、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OH、-OR8、-C(=O)CF3、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R9、-CN、-N(R9)2、-N(R9)C(O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(O)NR9C(=NR10)N(R9)2、-C(O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-CON(R9)2、-SR8、-S(=O)R8、もしくは-S(=O)2R8;
R8はそれぞれ独立して以下から選択され; 置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、置換もしくは非置換フェニルまたは置換もしくは非置換ベンジル;
R9はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、置換もしくは非置換フェニルまたは置換もしくは非置換ベンジル; あるいは
2つのR9基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; あるいは
R8とR9が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し;
R10はそれぞれ独立して以下から選択され; H、-S(=O)2R8、-S(=O)2NH2、-C(O)R8、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル;
G6はW-G7、ここでWは(置換もしくは非置換ヘテロシクロアルキル)、(置換もしくは非置換アリール)または(置換もしくは非置換ヘテロアリール); そして
G7はH、ハロゲン、CN、NO2、N3、CF3、OCF3、C1-C6アルキル、C1-C6ヘテロアルキル、C3-C6シクロアルキル、-C1-C6フルオロアルキル、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OH、-OR8、-C(=O)CF3、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R9、-CN、-N(R9)2、-N(R9)C(O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(O)NR9C(=NR10)N(R9)2、-C(O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-CON(R9)2、-SR8、-S(=O)R8、-S(=O)2R8、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアルキル)、-L5-(置換もしくは非置換ヘテロアリール)、-L5-(置換もしくは非置換ヘテロシクロアルキル)、または-L5-(置換もしくは非置換アリール)、ここでL5は結合、-O-、C(=O)、S、S(=O)、S(=O)2、-NH、-NHC(=O)O-、-NHC(=O)NH-、-OC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-;
あるいはこれらの溶媒和物、または医薬として許容される塩、または医薬として許容されるプロドラッグ。
式中、
Zは以下から選択され: -C(R1)2[C(R2)2]n-、-[C(R2)2]nC(R1)2O-、-OC(R1)2[C(R2)2]n-、-[C(R2)2]nC(R1)2S(O)m-、-S(O)mC(R1)2[C(R2)2]n-、-[C(R2)2]nO[C(R1)2]n-、または-[C(R1)2]nO[C(R2)2]n-; R1はそれぞれ独立してH、CF3、もしくは場合によって置換された低級アルキル; または同一の炭素上の2つのR1が結合してオキソ(=O)を形成し; R2はそれぞれ独立してH、OH、OMe、CF3、もしくは場合によって置換された低級アルキル、または同一の炭素上の2つのR2が結合してオキソ(=O)を形成し; mは0、1もしくは2; nはそれぞれ独立して0、1、2、もしくは3;
YはH、-CO2H、テトラゾリル、(置換もしくは非置換アルキル)、(置換もしくは非置換ヘテロシクロアルキル基)、(置換もしくは非置換ヘテロアリール)、または(置換もしくは非置換アリール);
R6はH、L2-(置換もしくは非置換アルキル)、L2-(置換もしくは非置換シクロアルキル)、L2-(置換もしくは非置換アルケニル)、L2-(置換もしくは非置換シクロアルケニル)、L2-(置換もしくは非置換ヘテロシクロアルキル基)、L2-(置換もしくは非置換ヘテロアリール)、またはL2-(置換もしくは非置換アリール); L2は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-C(=O)-、-CH(OH)-、-(置換もしくは非置換C1-C6アルキル)、または-(置換もしくは非置換C2-C6アルケニル);
R7はHもしくは低級アルキル;
R5はH、ハロゲン、-N3、-CN、-ONO2、-L6-(置換もしくは非置換C1-C6アルキル)、-L6-(置換もしくは非置換C2-C6アルケニル)、-L6-(置換もしくは非置換ヘテロアリール)、または-L6-(置換もしくは非置換アリール)、ここでL6は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-NH-、-C(=O)-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-NHC(=O)NH-、もしくは-C(=O)NH-;
R11はL7-L10-G6;ここで
L7は結合; L10は(置換もしくは非置換ヘテロアリール)、(置換もしくは非置換アリール)、または(置換もしくは非置換ヘテロシクロアルキル基);
G6はH、-CN、-SCN、-N3、-NO2、ハロゲン、-OR9、-C(=O)CF3、-C(=O)R9、-SR8、-S(=O)R8、-S(=O)2R8、-N(R9)2、テトラゾリル、-NHS(=O)2R8、-S(=O)2N(R9)2、-C(=O)NHS(=O)2R8、-S(=O)2NHC(O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換炭素環アリール)、ここでL5は-NHC(=O)O-、-NHC(=O)NH-、-OC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH、-C(=O)O-、もしくは-OC(=O)-; あるいは
あるいはG6はW-G7、ここでWは(置換もしくは非置換シクロアルキル)、(置換もしくは非置換シクロアルケニル) 、(置換もしくは非置換アリール)、(置換もしくは非置換ヘテロシクロアルキル基)または(置換もしくは非置換ヘテロアリール); そしてG7はH、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OH、-OR8、-C(=O)CF3、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R9、-CN、-N(R9)2、-N(R9)C(=O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(O)NR9C(=NR10)N(R9)2、-C(O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-CON(R9)2、-SR8、-S(=O)R8、もしくは-S(=O)2R8、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアルキル)、-L5-(置換もしくは非置換ヘテロアリール)、-L5-(置換もしくは非置換ヘテロシクロアルキル)、または-L5-(置換もしくは非置換アリール)、ここでL5は結合、-NH、-NHC(=O)O-、-NHC(=O)NH-、-OC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-;
R12はL3-X-L4-G1、ここで、
L3は結合、低級アルキル、もしくはアルケニル; Xは結合; L4は結合、低級アルキル、非置換アルケニル、もしくはアルキニル;
G1はテトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OR9、-C(=O)CF3、-C(=O)NHS(=O)2R8、-S(=O)2NHC(=O)R9、-CN、-N(R9)2、-N(R9)C(=O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CR10)N(R9)2、-C(=O)NR9C(=NR10)N(R9)2、-C(=O)NR9C(=CR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、-S(=O)2R8、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-OC(=O)O-、-NHC(=O)NH-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-;
R8はそれぞれ独立して以下から選択され; 置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; R9はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; あるいは2つのR9基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; あるいはR8とR9が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; そして
R10はそれぞれ独立して以下から選択され; H、-S(=O)2R8、-S(=O)2NH2、-C(O)R8、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル; あるいはこれらの溶媒和物、または医薬として許容される塩、または医薬として許容されるプロドラッグ。
Zは以下から選択され: -C(R1)2[C(R2)2]n-、-[C(R2)2]nC(R1)2O-、-OC(R1)2[C(R2)2]n-、-[C(R2)2]nC(R1)2S(O)m-、-S(O)mC(R1)2[C(R2)2]n-、-[C(R2)2]nO[C(R1)2]n-、または-[C(R1)2]nO[C(R2)2]n-; R1はそれぞれ独立してH、CF3、もしくは場合によって置換された低級アルキル; または同一の炭素上の2つのR1が結合してオキソ(=O)を形成し; R2はそれぞれ独立してH、OH、OMe、CF3、もしくは場合によって置換された低級アルキル、または同一の炭素上の2つのR2が結合してオキソ(=O)を形成し; mは0、1もしくは2; nはそれぞれ独立して0、1、2、もしくは3;
YはH、-CO2H、テトラゾリル、(置換もしくは非置換アルキル)、(置換もしくは非置換ヘテロシクロアルキル基)、(置換もしくは非置換ヘテロアリール)、または(置換もしくは非置換アリール);
R6はH、L2-(置換もしくは非置換アルキル)、L2-(置換もしくは非置換シクロアルキル)、L2-(置換もしくは非置換アルケニル)、L2-(置換もしくは非置換シクロアルケニル)、L2-(置換もしくは非置換ヘテロシクロアルキル基)、L2-(置換もしくは非置換ヘテロアリール)、またはL2-(置換もしくは非置換アリール); L2は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-C(=O)-、-CH(OH)-、-(置換もしくは非置換C1-C6アルキル)、または-(置換もしくは非置換C2-C6アルケニル);
R7はHもしくは低級アルキル;
R5はH、ハロゲン、-N3、-CN、-ONO2、-L6-(置換もしくは非置換C1-C6アルキル)、-L6-(置換もしくは非置換C2-C6アルケニル)、-L6-(置換もしくは非置換ヘテロアリール)、または-L6-(置換もしくは非置換アリール)、ここでL6は結合、-O-、-S-、-S(=O)-、-S(=O)2-、-NH-、-C(=O)-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-NHC(=O)NH-、もしくは-C(=O)NH-;
R11はL7-L10-G6;ここで
L7は結合; L10は(置換もしくは非置換ヘテロアリール)、(置換もしくは非置換アリール)、または(置換もしくは非置換ヘテロシクロアルキル基);
G6はH、-CN、-SCN、-N3、-NO2、ハロゲン、-OR9、-C(=O)CF3、-C(=O)R9、-SR8、-S(=O)R8、-S(=O)2R8、-N(R9)2、テトラゾリル、-NHS(=O)2R8、-S(=O)2N(R9)2、-C(=O)NHS(=O)2R8、-S(=O)2NHC(O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換炭素環アリール)、ここでL5は-NHC(=O)O-、-NHC(=O)NH-、-OC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH、-C(=O)O-、もしくは-OC(=O)-; あるいは
あるいはG6はW-G7、ここでWは(置換もしくは非置換シクロアルキル)、(置換もしくは非置換シクロアルケニル) 、(置換もしくは非置換アリール)、(置換もしくは非置換ヘテロシクロアルキル基)または(置換もしくは非置換ヘテロアリール); そしてG7はH、テトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OH、-OR8、-C(=O)CF3、-C(O)NHS(=O)2R8、-S(=O)2NHC(O)R9、-CN、-N(R9)2、-N(R9)C(=O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CHR10)N(R9)2、-C(O)NR9C(=NR10)N(R9)2、-C(O)NR9C(=CHR10)N(R9)2、-CO2R9、-C(=O)R9、-CON(R9)2、-SR8、-S(=O)R8、もしくは-S(=O)2R8、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアルキル)、-L5-(置換もしくは非置換ヘテロアリール)、-L5-(置換もしくは非置換ヘテロシクロアルキル)、または-L5-(置換もしくは非置換アリール)、ここでL5は結合、-NH、-NHC(=O)O-、-NHC(=O)NH-、-OC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-;
R12はL3-X-L4-G1、ここで、
L3は結合、低級アルキル、もしくはアルケニル; Xは結合; L4は結合、低級アルキル、非置換アルケニル、もしくはアルキニル;
G1はテトラゾリル、-NHS(=O)2R8、S(=O)2N(R9)2、-OR9、-C(=O)CF3、-C(=O)NHS(=O)2R8、-S(=O)2NHC(=O)R9、-CN、-N(R9)2、-N(R9)C(=O)R9、-C(=NR10)N(R9)2、-NR9C(=NR10)N(R9)2、-NR9C(=CR10)N(R9)2、-C(=O)NR9C(=NR10)N(R9)2、-C(=O)NR9C(=CR10)N(R9)2、-CO2R9、-C(=O)R9、-C(=O)N(R9)2、-SR8、-S(=O)R8、-S(=O)2R8、-L5-(置換もしくは非置換アルキル)、-L5-(置換もしくは非置換アルケニル)、-L5-(置換もしくは非置換ヘテロアリール)、または-L5-(置換もしくは非置換アリール)、ここでL5は-OC(=O)O-、-NHC(=O)NH-、-NHC(=O)O-、-OC(=O)NH-、-NHC(=O)-、-C(=O)NH-、-C(=O)O-、もしくは-OC(=O)-;
R8はそれぞれ独立して以下から選択され; 置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; R9はそれぞれ独立して以下から選択され; H、置換もしくは非置換低級アルキル、置換もしくは非置換低級シクロアルキル、フェニルまたはベンジル; あるいは2つのR9基が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; あるいはR8とR9が連携して5-、6-、7-、もしくは8員ヘテロ環を形成し; そして
R10はそれぞれ独立して以下から選択され; H、-S(=O)2R8、-S(=O)2NH2、-C(O)R8、-CN、-NO2、ヘテロアリール、もしくはヘテロアルキル; あるいはこれらの溶媒和物、または医薬として許容される塩、または医薬として許容されるプロドラッグ。
前記FLAPインヒビターのいずれでも、本明細書に記載する複合組成物および療法で使用することができる。
複合化合物
1態様中、式(I)の複合化合物、それらの医薬として許容される塩、医薬として許容されるN-オキシド、医薬として許容されるプロドラッグ、および医薬として許容される溶媒和物は、in vivoでFLAPと拮抗するかこれを抑制し、かつ/またはNOレベルをモジュレートするので、限定するわけではないが、以下を含むNO依存性、NO介在性、ロイコトリエン依存性もしくはロイコトリエン介在病態または疾病がある患者を治療するために使用される: 高血圧、喘息、心筋梗塞、がん、胃腸病変、胃腸傷害、および炎症性病態。
1態様中、式(I)の複合化合物、それらの医薬として許容される塩、医薬として許容されるN-オキシド、医薬として許容されるプロドラッグ、および医薬として許容される溶媒和物は、in vivoでFLAPと拮抗するかこれを抑制し、かつ/またはNOレベルをモジュレートするので、限定するわけではないが、以下を含むNO依存性、NO介在性、ロイコトリエン依存性もしくはロイコトリエン介在病態または疾病がある患者を治療するために使用される: 高血圧、喘息、心筋梗塞、がん、胃腸病変、胃腸傷害、および炎症性病態。
Ax-L-B
式(I)
式中、
Aは、A'(A-X、A-H、A-、もしくはA+が含まれる)の形態でNOモジュレーターである部分、または活性化/反応時にNOを産生する部分、または-NO2もしくは-ONO2から選択される部分であって、ここでXはCOOH、CONH2、OH、NH2、ハロゲン、SH、もしくはCH3; xは0、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、17、19、もしくは20である。
式(I)
式中、
Aは、A'(A-X、A-H、A-、もしくはA+が含まれる)の形態でNOモジュレーターである部分、または活性化/反応時にNOを産生する部分、または-NO2もしくは-ONO2から選択される部分であって、ここでXはCOOH、CONH2、OH、NH2、ハロゲン、SH、もしくはCH3; xは0、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、17、19、もしくは20である。
好適なNOモジュレーターとして以下が含まれる: ニトロプルシド、ニトログリセリン、イソソルビド一硝酸、およびイソソルビド二硝酸; in vivoで内在性NOを刺激するか内在性内皮由来の弛緩因子(EDRF)のレベルを上昇させるか、以下を含む一酸化窒素シンターゼのための基質である化合物; アルギニン、ホモアルギニン、およびN-ヒドロキシアルギニン、そのニトロソ化およびニトロシル化類似体を含む(例えば、ニトロソ化アルギニン、ニトロシル化アルギニン、ニトロソ化N-ヒドロキシアルギニン、ニトロシル化N-ヒドロキシアルギニン、ニトロソ化ホモアルギニンおよびニトロシル化ホモアルギニン); 以下を含むアルギニンの前駆体および/または生理学的に許容されるその塩; 例えば、シトルリン、オルニチン、グルタミン、リシン、これらのアミノ酸の少なくとも1つを含んでいるポリペプチド; 酵素アルギナーゼのインヒビター(例えば、N-ヒドロキシ-L-アルギニンおよび2(S)-アミノ-6-ボロノヘキサン酸)ならびに一酸化窒素シンターゼの基質; サイトカイン、アデノシン、ブラジキニン、カルレチキュリン、ビサコジル、フェノールフタレン; モルシドミン; 3-モルホリノシドノニミン(SIN-1); 1,2,3,4-オキサトリアゾリウム、5-アミノ-3-(3,4-ジクロロフェニル)-クロリド(GEA 3162); 1,2,3,4-オキサトリアゾリウム、5-アミノ-3-(3-クロロ-2-メチル-フェニル)クロリド(GEA502-4); 1,2,3,4-オキサトリアゾリウム、3-(3-クロロ-2-メチルフェニル)-5-[[[シアノメチルアミノ-]カルボニル]アミノ]-ヒドロキシド内塩(GEA 5583); S-ニトロソ-N-アセチル-D,L-ペニシラミン(SNAP); Glyco-SNAP-1; Glyco-SNAP-2,2,2'-(ヒドロキシニトロソヒドラゾノ)ビス-エタナミン(NOC-18)および(+/-)-(E)-4-エチル-2-[(E)-ヒドロキシイミノ]-5-ニトロ-3-ヘキセンアミド(NOR-3); 1-[(4',5'-ビス(カルボキシメトキシ)-2'-ニトロフェニル)メトキシ]-2-オキソ-3,3,ジエチル-1-トリアゼン二カリウム塩(CNO-4); [1-(4'、5'-ビス(カルボキシメトキシ)-2'-ニトロフェニル)メトキシ]-2-オキソ-3,3-ジエチル-1-トリアジン ジアセトキシメチルエステル(CNO-5); b ジエチルアミン-NO(DEA/NO)、IPA/NO、スペルミン-NO(SPER/NO)、亜硫酸-NO(SULFI/NO)、OXI/NO、およびDETA/NO; シクレタニン; スルホンアミドNO供与体 GEA 3268、(1,2,3,4-オキサトリアゾリウム、3-(3-クロロ-2-メチルフェニル)-5-[[(4-メトキシフェニル)-スルホニル]アミノ]-、ヒドロキシド内塩)およびGEA 5145、(1,2,3,4-オキサトリアゾリウム、3-(3-クロロ-2-メチルフェニル)-5-[(メチルスルホニル)アミノ]-、ヒドロキシド内塩); スルホンアミドGEA 3175; S-ニトロソチオール; 亜硝酸; 硝酸、N-オキソ-N-ニトロソアミン、SPM 3672、SPM 5185、SPM 5186およびこれらの類似体。1実施形態中、すべてのスタチンは、可能なNOモジュレーターとして除外する。
Ax-L-Bとして、Aが、それ自身がA基1個について1またはそれ以上のNO分子を産生もしくは供給することができる部分である構造が含まれ、単なる例示であるが、トリニトログリセリンがあり、A基1個について3つのNO分子を産生もしくは供給することができる。1態様中、「L」基は複数のA基を含有し、このそれぞれがA基1個について1以上のNO分子を産生する。別の態様中、Bは1以上の-L-Ax基と結合し、ここでA基のそれぞれがA基1個について1以上のNO分子を産生する。別の態様中、式(I)の化合物は2個以上の「A」基を含有し、それぞれの「A」基は同一、異種、またはいくつかの「A」基が同一で、かついくつかの「A」基が異種である。複数の「A」基が異種の場合の実施形態中ならば、式(I)の化合物は、同一もしくは異種の開裂/活性化経路によって、開裂された「A」部分を放出、供給または産生する。1態様中、式(I)の化合物は2以上の「A」基を含有し、各「A」基が同一または異種の「L」基を持っている。
Lは結合またはA部分およびB部分と化学的に連結している部分であって、(単一ステップもしくは複数ステップ; 化学的、酵素的、生物学的、光化学的、電気化学的、音響化学的、および本明細書に記載するその他の活性化手段によって)開裂して、-L'-Aと-B'、-L'-Bと-A'、または-L'、-A'および-B'を産生する。1態様中、LはFLAPインヒビター上の、これがin vivoで容易に開裂する好適な位置に、接続される。例えば、FLAPインヒビターがカルボン酸を含有する場合ならば、Lはエステルまたはアミド結合を介してFLAPインヒビターの酸基とカップリングする。FLAPインヒビターがアミノ基を含有する場合では、Lはアミド、カルボナートまたはカルバマート基を介して接続される。FLAPインヒビターがアルコールもしくはフェノール基を含有する場合は、Lはエーテル、エステル、カルボナートまたはカルバマート基を介して接続される。1態様中、Lは単一ステップまたは複数ステップで開裂可能な部分である。
1態様中、式(I)の化合物(Ax-L-B)は、in vivoで特定の部位で、FLAPインヒビターとNOモジュレーターのみに、または主としてこれらに開裂する。単なる例示であるが、Ax-L-Bは投与時には完全性を維持しているが、特定の細胞型でのみ、または主としてそこで産生される特異的酵素(例えば、標的とするエステラーゼ)によって、FLAPインヒビターとNOモジュレーターに開裂する。1態様中、そのFLAPインヒビターはAx-L-Bから(もしくは-L-Bから)、部位特異的経路の1つ(単一もしくは複数酵素)によって放出され、NOモジュレーターはAx-L-B(もしくはAx-L)から、別の部位特異的経路(単一もしくは複数酵素)によって放出される。あるいは、FLAPインヒビターとNOモジュレーターの両方がAx-L-Bから同一の部位特異的経路(単一もしくは複数酵素)によって放出される。
1態様中、開裂ステップ後に、Lの1残基、もしくは部分が、「A」または「B」とともに残留する。その後の開裂ステップで、「A」または「B」とともになお残留しているL基の別の部分もしくは残基が除去される。しかし、「A」基がNOモジュレーターとして作用し、「B」基がFLAPインヒビターとして作用することができるならば、開裂またはその後の反応後に、「L」の1残基もしくは部分が「A」または「B」とともに残留する。
Bは、B'(B-X、B-H、B-、もしくはB+が含まれる)の形態でFLAPインヒビターである部分である。
1態様中、AまたはBがカルボン酸基を含み、エステルまたはアミド結合を介して-L-B基または-L-A基に連結される。別の態様中、AまたはBがアミノ基を含み、アミド、カルボナートまたはカルバマート結合を介して-L-B基または-L-A基に連結される。別の態様中、AまたはBがアルコキシまたはフェノキシ部分を含有し、これらの部分を介して-L-B基または-L-A基に連結される。
1態様中、FLAPインヒビターは以下から選択される: Abbott-81834; Abbott-93178; MK-591(MK0591)、MK-886、BAY X 1005、BAY Y 1015、ETH603、ETH615、ETH647、WAY-121520、およびWY 50295。別の態様中、FLAPインヒビターは以下に記載された化合物から選択される: 米国特許第4929626、4970215、5081138、5095031、5204344、5126354、5221678、5229516、5272145、5283252、5288743、5292,769、5304563、5399699、5459150、5512581、5597833、5668146、5668150、5691351、5714488、5783586、5795900、および5843968号。別の態様中、FLAPインヒビターは、本明細書中で別に記載するFLAP化合物(a)〜(h)のいずれかから選択される。さらに別の態様中、FLAPインヒビターは以下に記載された化合物から選択される: 米国特許公開番号2007/0123522、米国特許公開番号2007/0105866、米国特許公開番号2007/0219206、米国特許公開番号2007/0225285、米国特許公開番号2007/0244128、国際特許公開番号WO 07/056021、国際特許公開番号WO 07/056220、国際特許公開番号WO 07/056338、国際特許公開番号WO 07/047207。これらの全部を、参照として本明細書に組み入れる。
1態様中、Lは結合であって、本明細書に記載するNOモジュレーターが本明細書に記載するFLAPインヒビターに直接連結されている。
表1の化合物の名称は以下である。
3-[3-tert-ブチルスルファニル-1-(4-クロロ-ベンジル)-5-イソプロピル-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 6-ニトロオキシ-ヘキシルエステル(化合物1-1b); 3-[3-tert-ブチルスルファニル-1-[4-(6-メトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 6-ニトロオキシ-ヘキシルエステル(化合物1-2b); 3-{5-((S)-1-アセチル-2,3-ジヒドロ-1H-インドール-2-イルメトキシ)-3-tert-ブチルスルファニル-1-[4-(6-メトキシ-ピリダジン-3-イル)-ベンジル]-1H-インドール-2-イル}-2,2-ジメチル-プロピオン酸 6-ニトロオキシ-ヘキシルエステル(化合物1-3b); 3-[3-tert-ブチルスルファニル-1-(4-クロロ-ベンジル)-5-((S)-1-イソブチリル-ピロリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 6-ニトロオキシ-ヘキシルエステル(化合物1-4b); 3-{3-tert-ブチルスルファニル-5-(5-メチル-ピリジン-2-イルメトキシ)-1-[4-(5-ニトロオキシメチル-ピリジン-2-イル)-ベンジル]-1H-インドール-2-イル}-2,2-ジメチル-プロピオン酸(化合物1-5b); 3-[3-tert-ブチルスルファニル-1-[4-(6-エトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 2-ヒドロキシ-3-ニトロオキシ-プロピルエステル(化合物1-6b); および3-[3-tert-ブチルスルファニル-1-[4-(6-エトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 イソソルビド-5-一硝酸エステル(化合物1-7b)。
複合化合物の合成
式(I)の複合化合物は、本明細書に記載する方法を使用するか、または当分野で既知の方法を本明細書に記載する方法と組み合わせて使用して、合成される。その上、本明細書に提示する溶媒、温度およびその他の反応条件は、当業者の実務および知識にしたがって変更することができる。
式(I)の複合化合物は、本明細書に記載する方法を使用するか、または当分野で既知の方法を本明細書に記載する方法と組み合わせて使用して、合成される。その上、本明細書に提示する溶媒、温度およびその他の反応条件は、当業者の実務および知識にしたがって変更することができる。
式(I)の化合物および前節で記載した構造を持つ化合物の合成のために使用する出発物質は、Aldrich Chemical Co.(Milwaukee, Wis.)、Sigma Chemical Co.(St. Louis, Mo.)などの販売業者から取得するか、または出発物質を合成することができる。本明細書に記載する化合物、および別種の置換基を持つその他の関連化合物は、例えば以下に記載されているような技法および物質を使用して合成する: March, ADVANCED ORGANIC VHEMISTRY 4th Ed., (Wiley 1992); Carey and Sundberg, ADVANCED ORGANIC CHEMISTRY 4th Ed., Vols. A and B(Plenum 2000, 2001)、およびGreen and Wuts, PROTECTIVE GROUPS IN ORGANIC SYNTHESIS 3rd Ed., (Wiley 1999)(これらの全部を参照として組み入れる)。本明細書に開示する化合物の調製のための一般的方法は、当分野で既知の反応から導きだすことができ、またその反応を適切な試薬および条件の使用によって、改変することができる。一指針として、以下の合成方法を利用することができる。
求電子剤と求核剤の反応による共有結合の形成
本明細書に記載する化合物は、各種の求電子剤または求核剤を使用して改変し、新しい官能基または置換基を形成させることができる。「共有結合およびその前駆体の例」の表題の表2に、利用し得る各種の求電子剤および求核剤の組み合わせを与え、そのための指針として使用することができる、共有結合および前駆体官能基の選定した例を列挙する。前駆体官能基を求電子基および求核基として示す。
本明細書に記載する化合物は、各種の求電子剤または求核剤を使用して改変し、新しい官能基または置換基を形成させることができる。「共有結合およびその前駆体の例」の表題の表2に、利用し得る各種の求電子剤および求核剤の組み合わせを与え、そのための指針として使用することができる、共有結合および前駆体官能基の選定した例を列挙する。前駆体官能基を求電子基および求核基として示す。
保護基の使用
記載する反応中で、反応性官能基、例えばヒドロキシ、アミノ、イミノ、チオまたはカルボキシ基を、その反応中で望ましくない関与を避けるために、これらが最終産物中で所望される場所で、保護する必要があることがある。保護基を使用して反応性部分のいくつかまたは全部を遮蔽して、これらの基が化学的反応に参加するのを防止した後、その保護基を除去する。各保護基が別々の手段で除去可能であることが好ましい。全体として異なる反応条件下で開裂する保護基が、分別除去の要求を満足する。保護基は酸、塩基、および水素分解によって除去することができる。トリチル、ジメトキシトリチル、アセタールおよびt-ブチルジメチルシリルなどの基は酸不安定性であって、水素分解で除去が可能なCbz基、および塩基不安定性のFmoc基で保護されたアミノ基の存在中で、カルボキシおよびヒドロキシ反応性部分を保護するために使用することができる。カルボン酸およびヒドロキシ反応性部分は、限定するわけではないが、t-ブチルカルバマートなどの酸不安定性基、または酸および塩基の両方に安定性であるが加水分解で除去可能なカルバマートで遮蔽したアミンの存在中で、メチル、エチル、およびアセチルなどの塩基不安定性の基で遮蔽することができる。
記載する反応中で、反応性官能基、例えばヒドロキシ、アミノ、イミノ、チオまたはカルボキシ基を、その反応中で望ましくない関与を避けるために、これらが最終産物中で所望される場所で、保護する必要があることがある。保護基を使用して反応性部分のいくつかまたは全部を遮蔽して、これらの基が化学的反応に参加するのを防止した後、その保護基を除去する。各保護基が別々の手段で除去可能であることが好ましい。全体として異なる反応条件下で開裂する保護基が、分別除去の要求を満足する。保護基は酸、塩基、および水素分解によって除去することができる。トリチル、ジメトキシトリチル、アセタールおよびt-ブチルジメチルシリルなどの基は酸不安定性であって、水素分解で除去が可能なCbz基、および塩基不安定性のFmoc基で保護されたアミノ基の存在中で、カルボキシおよびヒドロキシ反応性部分を保護するために使用することができる。カルボン酸およびヒドロキシ反応性部分は、限定するわけではないが、t-ブチルカルバマートなどの酸不安定性基、または酸および塩基の両方に安定性であるが加水分解で除去可能なカルバマートで遮蔽したアミンの存在中で、メチル、エチル、およびアセチルなどの塩基不安定性の基で遮蔽することができる。
カルボン酸およびヒドロキシ反応性部分も、ベンジル基などの加水分解によって除去可能な保護基で遮蔽することができ、一方酸と水素結合する能力があるアミン基は、Fmocなどの塩基不安定性基で遮蔽することができる。カルボン酸反応性部分は、本明細書に例示したような、単純なエステル化合物に変換することによって保護するか、または2,4-ジメトキシベンジルなどの酸化的に除去可能な保護基で遮蔽し、一方共存するアミノ基はフッ化物不安定性のシリルカルバマートで遮蔽することができる。
アリル遮蔽性基は酸-および塩基-保護基の存在中で有用である。なぜならば、前者は安定性であり、その後金属もしくはπ酸触媒によって除去することができるからである。例えば、アリル遮蔽したカルボン酸は、酸不安定性t-ブチルカルバマートもしくは塩基不安定性アセタートアミン保護基の存在中でPd0触媒反応によって脱保護することができる。さらに別の保護基の形態は、化合物もしくは中間体が接続される樹脂である。その残基が樹脂に接続されている間は、その官能基は遮蔽されていて、反応することができない。樹脂から放出されると、その官能基は反応に利用可能になる。
その他の保護基、そして保護基の作製およびそれらの除去に適用可能な技法の詳細な説明は、以下に記載されている: Greene and Wuts, Protective Groups in Organic Synthesis, 3rd Ed., John Wiley & Sons, New York, NY, 1999、およびKocienski, Protective Groups, Thieme Verlag, New York, NY, 1994、これらの全部を参照として本明細書に組み入れる。
式(I)の化合物の合成
1態様中、式(I)の化合物は反応スキームIにしたがって合成される。式I-5のエステルは、式I-1のカルボン酸から出発して、スキームIに示すようにして調製する(ここでRCO2Hは本明細書に記載するFLAPインヒビター)。式I-1のカルボン酸の対応する式I-2の酸塩化物への変換は、標準条件を使用(例えばSOCl2を使用)して達成される。この酸塩化物を次に、テトラヒドロフラン(THF)などの有機溶媒中、Et3Nなどの塩基の存在中で、構造Br-L1-OHのブロモ(またはクロロまたはヨウ化)アルコールと反応させ、式I-3の化合物を生成させる。あるいは、式I-1のカルボン酸を、ジメチルホルムアミド(DMF)などの溶媒中、NaHなどの塩基を使用して、式I-4のナトリウム塩などの金属塩に変換させる。その後、Br-L1-Brなどのジハロ誘導体の転移によって、式I-3の化合物を生成させる。アセトニトリル中でのAgNO3での式I-3の化合物の処理で、式I-5の最終産物を生成させる。1態様中、式I-4のナトリウム塩をBr-L1-ONO2と反応させて、式I-5の化合物が得られる。
1態様中、式(I)の化合物は反応スキームIにしたがって合成される。式I-5のエステルは、式I-1のカルボン酸から出発して、スキームIに示すようにして調製する(ここでRCO2Hは本明細書に記載するFLAPインヒビター)。式I-1のカルボン酸の対応する式I-2の酸塩化物への変換は、標準条件を使用(例えばSOCl2を使用)して達成される。この酸塩化物を次に、テトラヒドロフラン(THF)などの有機溶媒中、Et3Nなどの塩基の存在中で、構造Br-L1-OHのブロモ(またはクロロまたはヨウ化)アルコールと反応させ、式I-3の化合物を生成させる。あるいは、式I-1のカルボン酸を、ジメチルホルムアミド(DMF)などの溶媒中、NaHなどの塩基を使用して、式I-4のナトリウム塩などの金属塩に変換させる。その後、Br-L1-Brなどのジハロ誘導体の転移によって、式I-3の化合物を生成させる。アセトニトリル中でのAgNO3での式I-3の化合物の処理で、式I-5の最終産物を生成させる。1態様中、式I-4のナトリウム塩をBr-L1-ONO2と反応させて、式I-5の化合物が得られる。
別の態様中、式(I)の化合物は反応スキームIIにしたがって合成される。スキームIIに記載する経路を使用して、式II-3のアミドを調製する。式I-2の酸塩化物を一般構造H2N-L1-OHのアミノアルコールと連結させると、式II-1のアミドが得られる。式II-1のアミドのハロゲン化剤での処理で式II-2のブロミド(もしくはクロリド)が得られ、これをアセトニトリル中のAgNO3と反応させると、式II-3の化合物が得られる。
別の態様中、式(I)の化合物は反応スキームIIIにしたがって合成される。スキームIIIに示すように、ヒドロキシル含有化合物(例えばアルコールまたはフェノールまたはN-ヒドロキシウレア)を、式III-3の対応するONO2連結誘導体に変換する。式III-1のナトリウム塩(ここでRONaは本明細書に記載するヒドロキシ部分を持つFLAPインヒビターのナトリウム塩である)が得られる、ヒドロキシル基のナトリウム塩への変換は、THFなどの溶媒中のNaHなどの塩基を使用して、達成される。次に式III-1のナトリウム塩をBr-L1-Brなどのジブロモ誘導体と反応させて、式III-2のブロモ化合物を生成させる。式III-2のブロモ化合物を上記のように式III-3の化合物に変換させる。あるいは、一般構造III-1の化合物をDMFなどの双極性非プロトン溶媒中のブロモ連結NO3試薬で処理して、所望の化合物III-3が得られる。
さらに別の態様中、式(I)の化合物は、反応スキームIVにしたがって合成される(ここでR-OHが本明細書に記載するFLAPインヒビターである)。式IV-1のクロロ酸を、CH3CNなどの溶媒中のAgNO3を使用して、対応する式IV-2のニトロエステルに変換する(以下参照: Breschi et al, J. Med. Chem., 2004, 47, p5597-5600)。その後、標準的エステル化条件(例えばTHF中のDCCおよびDMAP)を使用する、式IV-2のニトロエステルの、ヒドロキシ基(-OH)を含有するFLAP化合物との連結で、一般構造IV-3の化合物が生成する。
別の形態の化合物
便宜上、この節および本明細書のその他の部分で記載する化合物の形態およびその他の特徴については、例示として「式(I)」などの単一の式を使用する。しかし、本明細書に記載する化合物の形態およびその他の特徴は、式(I)、FLAPインヒビター、NOモジュレーターの範囲内にある、本明細書で提示するすべての式、そしてこれらの一般的カテゴリーの範囲内にあるすべての特定の化合物に同等に当てはめられる。
便宜上、この節および本明細書のその他の部分で記載する化合物の形態およびその他の特徴については、例示として「式(I)」などの単一の式を使用する。しかし、本明細書に記載する化合物の形態およびその他の特徴は、式(I)、FLAPインヒビター、NOモジュレーターの範囲内にある、本明細書で提示するすべての式、そしてこれらの一般的カテゴリーの範囲内にあるすべての特定の化合物に同等に当てはめられる。
1実施形態中、式(I)の化合物を、その親化合物中に存在する酸性プロトンを金属イオン、例えばアルカリ金属イオン、アルカリ土類イオン、もしくはアルミニウムイオンと置換するか、または有機塩基と配位させて形成する、医薬として許容される塩として調製する。別の実施形態中、開示した化合物の塩形態を、出発物質または中間体の塩を使用して調製する。
1実施形態中、式(I)の化合物を、この化合物の遊離塩基形態と、限定するわけではないが以下を含む、医薬として許容される無機または有機酸と反応させることによって、医薬として許容される酸付加塩(医薬として許容される塩の1タイプ)として調製する: 無機酸; 塩酸、臭素酸、硫酸、硝酸、リン酸 メタリン酸など; ならびに有機酸; 酢酸、プロピオン酸、ヘキサン酸、シクロペンタンプロピオン酸、グリコール酸、ピルビン酸、乳酸、マロン酸、コハク酸、リンゴ酸、マレイン酸、フマル酸、トルエンスルホン酸、酒石酸、トリフルオロ酢酸、クエン酸、安息香酸、3-(4-ヒドロキシベンゾイル)安息香酸、ケイヒ酸、マンデル酸、アリールスルホン酸、メタンスルホン酸、エタンスルホン酸、1,2-エタンジスルホン酸、2-ヒドロキシエタンスルホン酸、ベンゼンスルホン酸、2-ナフタレンスルホン酸、4-メチルビシクロ-[2.2.2]オクト-2-エン-1-カルボン酸、グルコヘプトン酸、4,4'-メチレンビス-(3-ヒドロキシ-2-エン-1-カルボン酸)、3-フェニルプロピオン酸、トリメチル酢酸、tert-ブチル酢酸、ラウリル硫酸、グルコン酸、グルタミン酸、ヒドロキシナフト酸、サリチル酸、ステアリン酸、およびムコン酸。
あるいは、式(I)の化合物を、この化合物の遊離酸形態と、限定するわけではないが以下を含む、医薬として許容される無機または有機塩基と反応させることによって、医薬として許容される塩基付加塩(医薬として許容される塩の1タイプ)として調製する: 有機塩基; エタノールアミン、ジエタノールアミン、トリエタノールアミン、トロメタミン、N-メチルグルカミン、など; ならびに無機塩基; 水酸化アルミニウム、水酸化カルシウム、水酸化カリウム、炭酸ナトリウム、水酸化ナトリウム、など。
医薬として許容される塩への言及には、その溶媒付加形態または結晶形態、特に溶媒和物または多形が含まれるものと解釈すべきである。溶媒和物は化学量論量もしくは非化学量論量の溶媒を含有し、水、エタノールなどの医薬として許容される溶媒での結晶化の過程で形成される。溶媒が水の場合は水和物が形成され、溶媒がアルコールならばアルコール和物が形成される。式(I)の化合物の溶媒和物は、本明細書に記載する工程で、好都合に調製または形成される。単なる例示であるが、式(I)の化合物の水和物は、限定するわけではないが以下を含む有機溶媒を使用する、水性/有機溶媒混合物からの再結晶化によって、好都合に調製される: ジオキサン、テトラヒドロフラン、エタノール、酢酸エチルまたはメタノール。1実施形態中、本明細書で提供する化合物は非溶媒和形態で存在する。別の実施形態中、本明細書で提供する化合物は溶媒和物形態で存在する。一般的に、溶媒和物形態は、本明細書で提供する化合物の目的および方法にとって、非溶媒和形態と同等であるものと考えられる。
式(I)の化合物には、多形としても知られている結晶形態が含まれる。多形には、1化合物と同一の元素組成の別種の結晶充填配置が含まれる。多形は通常別種のX線回折パターン、赤外線スペクトル、融点、密度、硬度、結晶形、光学的および電気的性質、安定性、ならびに溶解度を持っている。再結晶化溶媒、結晶化速度、および保存温度などの各種の要因に起因して、単一の結晶形態が供与される。式(I)の化合物には、共結晶として知られている結晶形態も含まれる。
1態様中、式(I)の化合物のN-オキシドから、限定するわけではないが、アセトニトリル、エタノール、水性ジオキサンなどの好適な不活性有機溶媒中、0〜80℃で、限定するわけではないが以下などの還元剤で処理することによって、非酸化形態の式(I)の化合物を調製する: 硫黄、二酸化硫黄、トリフェニルホスフィン、水素化ホウ素リチウム、水素化ホウ素ナトリウム、三塩化リン、三臭化物、など。
1態様中、式(I)の化合物をプロドラッグとして調製する。プロドラッグとは一般的に、対象体への投与およびその後の吸収後に、代謝経路による変換などのいくつかの経路を介して、活性な、またはより活性な種類に変換される薬物前駆体である。いくつかのプロドラッグは、そのプロドラッグ上に、この薬物を低活性にし、かつ/または溶解性もしくはその他の何らかの性質を与える、化学的基を存在させている。プロドラッグからこの化学的基が開裂し、かつ/または改変されると、活性な薬物が生成する。プロドラッグは有用であることが多い。なぜならば、状況によっては、これらの方が親薬物よりも投与が容易なことがあるからである。例えば、これらが経口投与によって生体利用可能であるのに、親薬物はそうではない。プロドラッグは医薬組成物中で親薬物よりも改善された溶解性を持つこともある。プロドラッグの限定するわけではない例は、細胞膜の透過性を促進するために、エステル(「プロドラッグ」)として投与する、式(I)の化合物である。この場合、移動するには水溶性が不利であるが、細胞内に入ると、そこで活性な完全体のカルボン酸に代謝によって加水分解され、ここでは水溶性が有利になる。プロドラッグの別の例は、酸基の1つに結合した短いペプチド(ポリアミノ酸)であって、この場合ペプチドは代謝されて活性な部分が現れる。
1態様中、プロドラッグを、部位特異的組織への薬物の輸送を強化するための改変物質として使用するために、可逆的薬物誘導体として設計する。現在まで、水が主要な溶媒である領域を標的とするため、治療用化合物の有効な溶解性を増加させるように、プロドラッグの設計がされてきた。例えば以下を参照されたい: Fedorak et al., Am. J. Physiol., 269:G210-218(1995); McLoed et al., Gastroenterol, 106:405-413(1994); Hochhaus et al., Biomed. Chrom., 6:283-286(1992); J. Larsen and H. Bundgaard, Int. J. Pharmaceutics, 37、87(1987); J. Larsen et al., Int. J. Pharmaceutics, 47, 103(1988); Sinkula et al., J. Pharm. Sci., 64:181-210(1975); T. Higuchi and V. Stella, Pro-drugs as Novel Delivery Systems, Vol. 14 of the A.C.S. Symposium Series; および Edward B. Roche, Bioreversible Carriers in Drug Design, American Pharmaceutical Association and Pergamon Press, 1987。これらの全部を本明細書に組み入れる。
式(I)の化合物のプロドラッグ誘導体は当業者に知られている方法によって調製される(さらに詳細について、例えば以下参照: Saulnier et al., (1994)、Bioorganic and Medicinal Chemistry Letters, Vol. 4, p. 1985)。単なる例示であるが、1態様中、式(I)の非誘導体化化合物を、限定するわけではないが、1,1-アシルオキシアルキルカルバノクロリド酸、パラ-ニトロフェニルカルボナートなどの、好適なカルバミル化剤と反応させることによって、適切なプロドラッグを調製する。本明細書に記載する化合物のプロドラッグ形態であって、そのプロドラッグがin vivoで代謝されて、本明細書に提示する誘導体を産生するものは、特許請求の範囲内に含まれる。実際、本明細書に記載する化合物のいくつかは、別の誘導体または活性化合物のプロドラッグでもある。
いくつかの実施形態中、式(I)の化合物の芳香環部分上の部位は各種の代謝反応をしやすく、したがって芳香環構造上の適切な置換基、単なる例示であるが、ハロゲンまたはアルキル基など、の組み込みは、その代謝経路を低下、最少化または排除する。
いくつかの実施形態中、本明細書に記載する化合物は、同位元素(例えば放射性同位元素)あるいは限定するわけではないが、発色団もしくは蛍光部分の使用、生物発光標識、または化学発光標識を含む別の手段によって、標識される。
いくつかの実施形態中、式(I)の化合物は1以上の立体中心を持ち、それぞれの中心がRもしくはS配置をとっていることがある。本明細書に提示する化合物には、ジアステレオマー、エナンチオマー、およびエピマー形態、ならびにこれらの適切な混合物のすべてが含まれる。いくつかの実施形態中、式(I)の化合物を、その化合物のラセミ混合物を光学的に活性な分割剤と反応させて、一対のジアステレオ異性体化合物を形成させ、このジアステレオマーを分離し、そして光学的に純粋なエナンチオマーを回収することによって、個別の立体異性体として調製する。1実施形態中、本明細書に記載する化合物の共有結合性ジアステレオマー誘導体を使用して、エナンチオマーの分割を実施する。別の実施形態中、分離可能な錯体(例えば、結晶ジアステレオマー塩)を使用して、エナンチオマーの分割を実施する。ジアステレオマーは別種の物理的性質(例えば、融点、沸点、溶解性、反応性、その他)を持ち、これらの相違性の利点によって、容易に分離される。いくつかの実施形態中、ジアステレオマーを、キラルクロマトグラフィー、または溶解度の差に基づく分離/分割技法によって、分離する。その後、分割剤とともに、ラセミ化をもたらさない任意の実用的手段によって、光学的に純粋なエナンチオマーを回収する。化合物の立体異性体をそのラセミ混合物から分割するために適用できる、この技法のさらに詳細な説明は以下から知ることができる: Jean Jacques, Andre Collet, Samuel H. Wilen, "Enantiomers、Racemates and Resolutions," John Wiley And Sons, Inc., 1981。この全部を参照として本明細書に組み入れる。
いくつかの実施形態中、本明細書で提供する化合物は幾何異性体として存在することがある。本明細書で提供する化合物および方法には、cis、trans、syn、anti、entgegen(E)、およびzusammen(Z)異性体とそれらの適切な混合物のすべてが含まれる。いくつかの状況下では、化合物は互変異性体として存在する。本明細書に示す化合物および方法によって提供される、すべての互変異性体が、本明細書に記載する式の範囲内に含まれる。本明細書で示す化合物および方法のその他の実施形態中、単一の調製ステップで生成するエナンチオマーおよび/もしくはジアステレオ異性体の混合物、組み合わせ、または相互変換も、本明細書に記載する適用にとって有用である。
所定の用語
別に明記しないかぎり、明細書および特許請求の範囲を含む本出願で使用する以下の用語は、下記の定義を持っている。明細書および添付する特許請求の範囲で使用する、単数形「a」、「an」および「the」には、文脈から明確にそれ以外を示していない限り、複数指示が含まれることに留意すべきである。標準的化学用語の定義は、以下を含む参考書にある: Carey and Sundberg "ADVANCED ORGANIC CHEMISTRY 4TH ED." Vols. A(2000) and B(2001), Plenum Press, New York。それ以外を指示しないかぎり、当業者にとって常套的な、マススペクトル分析、NMR、HPLC、タンパク質化学、生化学、組換えDNA技法および薬理学の方法を使用する。
別に明記しないかぎり、明細書および特許請求の範囲を含む本出願で使用する以下の用語は、下記の定義を持っている。明細書および添付する特許請求の範囲で使用する、単数形「a」、「an」および「the」には、文脈から明確にそれ以外を示していない限り、複数指示が含まれることに留意すべきである。標準的化学用語の定義は、以下を含む参考書にある: Carey and Sundberg "ADVANCED ORGANIC CHEMISTRY 4TH ED." Vols. A(2000) and B(2001), Plenum Press, New York。それ以外を指示しないかぎり、当業者にとって常套的な、マススペクトル分析、NMR、HPLC、タンパク質化学、生化学、組換えDNA技法および薬理学の方法を使用する。
「アルコキシ」基とは(アルキル)O基、ここでアルキルは本明細書で定義のとおりである。
「アルキル」基とは、脂肪族炭化水素基である。アルキル部分は「飽和アルキル」基の場合があり、これは不飽和(例えば炭素-炭素二重結合または炭素-炭素三重結合)単位を何ら含有しないことを意味している。アルキル部分は「不飽和アルキル」部分のこともあり、これは少なくとも1個の不飽和単位を含有することを意味している。アルキル部分は、飽和または不飽和にかかわらず、分枝、直鎖、または環状でもよい。アルキルの接続位置は環の一部でないsp3炭素原子である。
「アルキル」部分は1〜10炭素原子である(本明細書中のいずれでも、「1〜10」などの数的範囲は、与えられた範囲内の各整数を表す。例えば、「1〜10炭素原子」は、アルキル基が1炭素原子、2炭素原子、3炭素原子、その他、10炭素原子を含めてここまでで構成されていることを意味している。ただし、本定義では、数的範囲が定義されていない、用語「アルキル」の場合も包含している)。アルキル基は1〜5炭素原子の「低級アルキル」のこともある。本明細書に記載する化合物のアルキル基は「C1-C4アルキル」または同様の表示で示されることがある。単なる例示であるが、「C1-C4アルキル」は、アルキル鎖内に1から4個の炭素原子がある、すなわち、アルキル鎖が以下で構成される群から選択されることを指示している: メチル、エチル、プロピル、イソプロピル、n-ブチル、イソ-ブチル、sec-ブチル、およびt-ブチル。典型的なアルキル基として限定するわけではないが、以下が含まれる: メチル、エチル、プロピル、イソプロピル、ブチル、イソブチル、tert-ブチル、ペンチル、ヘキシル、アリル、ブト-2-エニル、ブト-3-エニル、シクロプロピルメチル、シクロブチルメチル、シクロペンチルメチル、シクロヘキシルメチル、など。1態様中、アルキルはC1-C6アルキルである。
用語「アルキルアミン」とは、-N(アルキル)xHy基であって、ここでxおよびyは以下の群から選択される: x=1、y=1およびx=2、y=0。いくつかの実施形態中、x=2かつy=0の場合、アルキル基はこれが接続されている窒素原子とともに環系を形成している。
用語「アルケニル」とは、アルキル基の最初の2つの原子が芳香族基の一部ではない二重結合を形成しているアルキル基の1タイプである。すなわち、アルケニル基は原子群-C(R)=C(R)2で始まり、ここでRはこのアルケニル基のその他の部分であって、同一でも異なっていてもよい。アルケニル基の限定するわけではない例として以下が含まれる: -CH=CH2、-C(CH3)=CH2、-CH=CHCH3および-C(CH3)=CHCH3。アルケニル部分は分枝、直鎖、または環状(この場合、「シクロアルケニル」基としても知られている)である。1態様中、アルケニルはC2-C6アルケニルである。
用語「アルキニル」とは、アルキル基の最初の2つの原子が三重結合を形成しているアルキル基の1タイプである。すなわち、アルキニル基は原子群-C≡C-Rで始まり、ここでRはこのアルキニル基のその他の部分であって、同一でも異なっていてもよい。アルケニル基の限定するわけではない例として以下が含まれる: -C≡CH、-C≡CCH3および-C≡CCH2CH3。1態様中、アルキニルはC2-C6アルキニルである。
「アミド」は式-C(=O)NHRまたは-NHC(=O)Rの化学的部分であって、ここでRは以下からなる群から選択される: アルキル、シクロアルキル、アリール、ヘテロアリール(環内炭素を介して結合)およびヘテロ脂環式(環内炭素を介して結合)。1態様中、アミドは式(I)の化合物、FLAPインヒビターまたはNOモジュレーターに接続したアミノ酸またはペプチド分子であって、これによってプロドラッグを形成している。アミド基を調製するためには、本明細書に記載する化合物上のどのアミン、またはカルボキシル側鎖でも使用することができる。こうしたアミドを作成するための操作法および特異的基として、例えば以下に記載されているものが含まれる: Greene and Wuts, Protective Groups in Organic Synthesis, 3rd Ed., John Wiley & Sons, New York, NY, 1999、この全部を参照として本明細書に組み入れる。
用語「芳香族」とは、4n+2個のπ電子を含有している非局在化π電子系を持つ平面環であって、ここでnは整数である。芳香環は5、6、7、8、9、10、または11以上の原子で形成させることができる。芳香族は場合によって置換されていてもよい。用語「芳香族」として、炭素環アリール(「アリール」、例えば、フェニル)およびヘテロ環アリール(または「ヘテロアリール」もしくは「ヘテロ芳香族」)基(例えば、ピリジン)の両方が含まれる。この用語として、単環または縮合ポリ環(すなわち、隣接する炭素原子対を共有している環)基が含まれる。
用語「炭素環」とは、環の骨格を形成する原子がすべて炭素原子である環または環系である。したがってこの用語は、環骨格が炭素とは別の原子を少なくとも1個含有している、ヘテロ環からの炭素環とは識別される。
本明細書で使用する、用語「アリール」とは、環を形成している原子のそれぞれが炭素原子である芳香環である。アリール環は5、6、7、8、9、または10以上の炭素原子で形成される。アリール基は場合によって置換されていてもよい。アリール基の例として限定するわけではないが、フェニル、およびナフタレニルが含まれる。構造によって、アリール基はモノラジカルまたはジラジカル(すなわち、アリーレン基)である。
用語「シクロアルキル」とは、モノ環状またはポリ環状脂肪族、非芳香族ラジカルであって、ここで環を形成する原子(すなわち骨格原子)のそれぞれが炭素原子である。シクロアルキルは飽和、または部分的不飽和でもよい。シクロアルキルは芳香環と縮合していてもよく、その接続点は芳香環炭素原子ではない炭素である。シクロアルキル基として3〜10環原子を持つ基が含まれる。低級シクロアルキルとはC3-C8シクロアルキルである。シクロアルキル基の具体例として、限定するわけではないが、以下の部分などが含まれる。
いくつかの実施形態中、シクロアルキル基は以下から選択される: シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチル、およびシクロオクチル。シクロアルキル基は置換されていても、非置換でもよい。構造に応じて、シクロアルキル基は、モノラジカル、またはジラジカル(すなわち、限定するわけではないが以下などのシクロアルキレン基: シクロプロパン-1,1-ジイル、シクロブタン-1,1-ジイル、シクロペンタン-1,1-ジイル、シクロヘキサン-1,1-ジイル、シクロヘプタン-1,1-ジイル、など)が可能である。
用語「ヘテロ環」とは、それぞれO、SおよびNから選択される1〜4個のヘテロ原子を含有するヘテロ芳香族およびヘテロ脂環基であって、ここで各ヘテロ環基がその環系に4〜10原子を持ち、ただしこの基の環は隣接する2つのOもしくはS原子を含有しない。非芳香族ヘテロ環基には、その環系に4原子しか持たない基が含まれるが、芳香族ヘテロ環基はその環系に少なくとも5原子を持っていなければならない。ヘテロ環基にはベンゾ縮合環系が含まれる。4員ヘテロ環基の例はアゼチジニル(アゼチジンから誘導)である。5員ヘテロ環基の例はチアゾリルである。6員ヘテロ環基の例はピリジル、そして10員ヘテロ環基の例はキノリニルである。非芳香族ヘテロ環基の例は以下である: ピロリジニル、テトラヒドロフラニル、ジヒドロフラニル、テトラヒドロチエニル、テトラヒドロピラニル、ジヒドロピラニル、テトラヒドロチオピラニル、ピペリジノ、モルホリノ、チオモルホリノ、チオキサニル、ピペラジニル、アゼチジニル、オキセタニル、チエタニル、ホモピペリジニル、オキセパニル、チエパニル、オキサゼピニル、ジアゼピニル、チアゼピニル、1,2,3,6-テトラヒドロピリジニル、2-ピロリニル、3-ピロリニル、インドリニル、2H-ピラニル、4H-ピラニル、ジオキサニル、1,3-ジオキソラニル、ピラゾリニル、ジチアニル、ジチオラニル、ジヒドロピラニル、ジヒドロチエニル、ジヒドロフラニル、ピラゾリジニル、イミダゾリニル、イミダゾリジニル、3-アザビシクロ[3.1.0]ヘキサニル、3-アザビシクロ[4.1.0]ヘプタニル、3H-インドリルおよびキノリジニル。芳香族ヘテロ環基の例は以下である: ピリジニル、イミダゾリル、ピリミジニル、ピラゾリル、トリアゾリル、ピラジニル、テトラゾリル、フリル、チエニル、イソキサゾリル、チアゾリル、オキサゾリル、イソチアゾリル、ピロリル、キノリニル、イソキノリニル、インドリル、ベンズイミダゾリル、ベンゾフラニル、シンノリニル、インダゾリル、インドリジニル、フタラジニル、ピリダジニル、トリアジニル、イソインドリル、プテリジニル、プリニル、オキサジアゾリル、チアジアゾリル、フラザニル、ベンゾフラザニル、ベンゾチオフェニル、ベンゾチアゾリル、ベンゾキサゾリル、キナゾリニル、キノキサリニル、ナフチリジニル、およびフロピリジニル。上掲の基から誘導される、前記の基は、可能な限り、C-接続でもN-接続でもよい。例えば、ピロールから誘導される基は、ピロール-1-イル(N-接続)でもピロール-3-イル(C-接続)でもよい。さらに、イミダゾールから誘導される基は、イミダゾール-1-イルもしくはイミダゾール-3-イル(両者ともN-接続)またはイミダゾール-2-イル、イミダゾール-4-イルもしくはイミダゾール-5-イル(すべてC-接続)である。ヘテロ環基には、ベンゾ縮合環系と、ピロリジン-2-オンなどの1もしくは2個のオキソ(=O)部分で置換された環系が含まれる。
用語「ヘテロアリール」または別称で「ヘテロ芳香族」とは、1以上の環原子がヘテロ原子であるアリール基であって、そのヘテロ原子は窒素、酸素および硫黄から選択される。ヘテロアリール基の具体例として、以下の部分などが含まれる。
N含有「ヘテロ芳香族」または「ヘテロアリール」部分とは、その環の骨格原子の少なくとも1個が窒素原子である芳香族基である。
「ヘテロ脂環」基または「ヘテロシクロアルキル」とは、窒素、酸素および硫黄から選択されるヘテロ原子を少なくとも1個含んでいるシクロアルキル基である。そのラジカルはアリールまたはヘテロアリールと縮合していてもよい。非芳香族ヘテロ環とも称されるヘテロシクロアルキル基として、以下などが含まれる。
いくつかの実施形態中、ヘテロシクロアルキルは以下から選択される: ピロリジニル、テトラヒドロフラニル、テトラヒドロチエニル、テトラヒドロピラニル、テトラヒドロチオピラニル、ピペリジニル、モルホリニル、チオモルホリニル、ピペラジニル、およびインドリニル。用語、ヘテロ脂環には、限定するわけではないが単糖類、二糖類およびオリゴ糖類を含む、炭水化物のすべての環形態も含まれる。1態様中、ヘテロシクロアルキルはC2-C8ヘテロシクロアルキルである。C2-C8ヘテロシクロアルキルとは、存在するヘテロ原子を除外した、ヘテロシクロアルキルを形成している炭素原子の数である。
用語「エステル」とは、式COORを持つ化学的部分であって、ここでRは以下からなる群から選択される: アルキル、シクロアルキル、アリール、ヘテロアリール(環内炭素を介して結合)およびヘテロ脂環(環内炭素を介して結合)。本明細書に記載する化合物上のヒドロキシ、またはカルボキシル側鎖のどれでも、エステル化することができる。こうしたエステルを作成するための操作法および特定の基の例は以下などから知ることができる: Greene and Wuts, Protective Groups in Organic Synthesis, 3rd Ed., John Wiley & Sons, New York, NY, 1999、この全部を参照として本明細書に組み入れる。
用語「ハロ」または別称として「ハロゲン」もしくは「ハロゲン化物」は、フルオロ、クロロ、ブロモまたはヨードの意味である。
用語「ハロアルキル」とは、1以上の水素原子が1以上のハロゲン原子で置換されているアルキル基である。1態様中、ハロアルキルはC1-C6ハロアルキルである。
用語「ハロアルケニル」とは、1以上の水素原子が1以上のハロゲン原子で置換されているアルケニル基である。1態様中、ハロアルケニルはC2-C6ハロアルケニルである。
用語「ハロアルキニル」とは、1以上の水素原子が1以上のハロゲン原子で置換されているアルキニル基である。1態様中、ハロアルキニルはC2-C6ハロアルキニルである。
用語「ハロアルコキシ」とは、1以上の水素原子が1以上のハロゲン原子で置換されているアルコキシ基である。1態様中、ハロアルコキシはC1-C6ハロアルコキシである。
用語「フルオロアルキル」とは、1以上の水素原子がフッ素原子で置換されているアルキル基である。1態様中、フルオロアルキルはC1-C4フルオロアルキルである。
用語「フルオロアルコキシ」とは、1以上の水素原子がフッ素原子で置換されているアルコキシ基である。1態様中、フルオロアルコキシはC1-C4フルオロアルコキシである。
用語「ヘテロアルキル」とは、アルキルの1以上の骨格原子が、炭素以外の原子、例えば、酸素、窒素、硫黄、リンもしくはこれらの組み合わせから選択される、アルキル基である。1態様中、ヘテロアルキルはC1-C6ヘテロアルキルである。
用語「ヘテロアルケニル」とは、アルケニルの1以上の骨格原子が、炭素以外の原子、例えば、酸素、窒素、硫黄、リンもしくはこれらの組み合わせから選択される、アルケニル基である。1態様中、ヘテロアルケニルはC2-C6ヘテロアルケニルである。
用語「ヘテロアルキニル」とは、アルキニルの1以上の骨格原子が、炭素以外の原子、例えば、酸素、窒素、硫黄、リンもしくはこれらの組み合わせから選択される、アルキニル基である。1態様中、ヘテロアルキニルはC2-C6ヘテロアルキニルである。
用語「結合」または「単結合」とは、2個の原子、または2個の部分間の化学的結合であって、その結合によって連結された原子がより大きなサブ構造の一部であるとみなされるものである。
用語「員環」はいずれの環状構造も含まれる。用語「員」は、その環を構成する骨格原子の数を表すことを意味している。これについて、例えば、シクロヘキシル、ピリジニル、ピラニルおよびチオピラニルは6員環であり、シクロペンチル、ピロリル、フラニル、およびチオフェニルは5員環である。
用語「部分」とは、1分子の特定の区域または官能基である。化学的部分は1分子内にはめ込まれるか、それに付属している化学的実体として認識されることが多い。
「シアノ」基とはCN基である。
「イソシアナート」基とはNCO基である。
「イソチオシアナート」基とはNCS基である。
「メルカプチル」基とは(アルキル)S基である。
「スルフィニル」基とはS(=O)である。
「スルホニル」基とはS(=O)2である。
「チオシアナート」基とはCNS基である。
用語「場合によって置換された」または「置換された」は、対象の基が個別に、かつ独立して以下から選択される1以上の別の基(群)で置換されたことを意味している: アルキル、シクロアルキル、アリール、ヘテロアリール、ヘテロ脂環、ヒドロキシ、アルコキシ、アリールオキシ、メルカプト、アルキルチオ、アリールチオ、アルキルスルホキシド、アリールスルホキシド、アルキルスルホン、アリールスルホン、シアノ、ハロ、カルボニル、チオカルボニル、ニトロ、ハロアルキル、フルオロアルキル、およびアミノ(モノおよびジ置換されたアミノ基が含まれる)、ならびにこれらの保護された誘導体。例をあげると、任意の置換基はLsRsであり、ここで各Lsは独立して以下から選択される: 結合、-O-、-C(=O)-、-S-、-S(=O)-、-S(=O)2-、-NH-、-NHC(O)-、-C(O)NH-、S(=O)2NH-、-NHS(=O)2、-OC(O)NH-、-NHC(O)O-、-(C1-C6アルキル)、または-(C2-C6アルケニル); そして各Rsは独立して以下から選択される: H、アルキル、フルオロアルキル、シクロアルキル、アリール、ヘテロアリール、またはヘテロアルキル。上記置換基の保護誘導体を形成する保護性基は、上記のGreene and Wutsなどの文献から知ることができる。
一定の実施形態中、本明細書に提示する化合物は1以上の立体中心を所有し、それぞれの中心がRもしくはS配置をとっていることがある。本明細書に提示する化合物には、ジアステレオマー、エナンチオマー、およびエピマー形態、ならびにこれらの適切な混合物のすべてが含まれる。立体異性体は、所望ならば、キラルクロマトグラフィーカラムによる分離などの方法によって、取得される。
本明細書に記載する方法および製剤として、以下が含まれる: 式(I)の構造を持つ化合物のN-オキシド、結晶形態(多形としても知られている)、共結晶もしくは医薬として許容される塩、FLAPインヒビターもしくはNOモジュレーター、同様に、同一のタイプの活性を持つ、これらの化合物の活性な代謝物。いくつかの状況下で、化合物は互変異性体として存在する。すべての互変異性体が、本明細書に示す化合物の範囲内である。その上、本明細書に記載する化合物は非溶媒和物として、また水、エタノールなどの医薬として許容される溶媒との溶媒和物形態で存在させることが可能である。本明細書に示す化合物の溶媒和物形態も、本明細書に開示したものとみなされる。
一定の医薬用語
製剤、組成物または成分に関して、本明細書で使用する用語「許容される」は、治療される対象体の一般的健康に、持続性の不利益な影響がないことを意味している。
製剤、組成物または成分に関して、本明細書で使用する用語「許容される」は、治療される対象体の一般的健康に、持続性の不利益な影響がないことを意味している。
本明細書で使用する用語「アゴニスト」とは、別の分子の活性または受容体部位の活性を強化する、化合物、薬物、酵素活性化物質またはホルモンモジュレーターなどの分子である。
本明細書で使用する用語「アンタゴニスト」とは、別の分子の作用または受容体部位の活性を減少または抑制する、化合物、薬物、酵素インヒビターまたはホルモンモジュレーターなどの分子である。
本明細書で使用する用語「喘息」とは、どんな原因(内因性、外因性、もしくはその両方; アレルギー性もしくは非アレルギー性)でも、気道収縮にともなう肺気流の変化に特徴がある、肺のあらゆる障害である。用語、喘息は原因を示す1以上の形容詞とともに使用される。
本明細書で使用する用語「骨疾病」とは、限定するわけではないが、不適切な骨の再形成、減量または増量、骨減少症、骨軟化症、骨線維症、およびパジェット病を含む、骨の疾病または病態である[Garcia, "Leukotriene B4 stimulates osteoclastic bone resorption both in intro and in vivo", J Bone Miner Res. 1996;11:1619-27]。
本明細書で使用する用語「心血管疾病」とは、限定するわけではないが以下を含む、心臓もしくは血管またはその両方に及ぶ疾病である: 不整脈; アテローム性動脈硬化およびその続発症; 狭心症; 心筋虚血; 心筋梗塞; 心臓もしくは血管動脈瘤; 脈管炎、卒中; 四肢、器官もしくは組織の末梢閉塞性動脈疾患; 脳、心臓もしくはその他の臓器または組織の虚血後の再かん流傷害; 内毒素、手術、もしくは外傷性ショック; 高血圧、心臓弁膜症、心不全、異常血圧; ショック; 血管収縮(片頭痛に随伴するものを含む); 血管異常、炎症、単一器官もしくは組織に限局される不全症[Lotzer K et al., "The 5-lipoxygenase pathway in arterial wall biology and atherosclerosis", Biochim Biophys Acta 2005;1736:30-7; Helgadottir A et al., "The gene encoding 5-lipoxygenase activateing protein confers risk of myocardial infarction and stroke", Nat Genet. 2004 Mar;36(3):233-9. Epub 2004 Feb 8; [Heise CE、Evans JF et al., "Characterization of the human cysteinyl leukotriene 2 receptor", J Biol Chem. 2000 Sep 29;275(39):30531-6]。
本明細書で使用する用語「がん」とは、細胞の異常成長であって、制御不能状態で増殖し、場合によっては転移(伝播)する傾向があるものである。がんのタイプとして、限定するわけではないが、以下が含まれる: 固形腫瘍(膀胱、腸、脳、乳房、子宮内膜、心臓、腎臓、肺、リンパ組織(リンパ腫)、卵巣、すい臓もしくはその他の内分泌器官(甲状腺)、前立腺、皮膚(メラノーマ)などのもの)または血液腫瘍(白血病など)[Ding XZ et al., Anticancer Drugs. 2005 Jun;16(5):467-73. Chen X et al., Clin Cancer Res. 2004 Oct 1;10(19):6703-9]。
本明細書で使用する用語「担体」とは、化合物の細胞もしくは組織中への取り込みを促進する、比較的低毒性の化合物または薬物である。
本明細書で使用する用語「併用投与」などは、選択した治療薬群の一患者への投与を包含することを意味し、その薬物群を単剤として、あるいは同一もしくは別の投与経路で、または同一もしくは別の時間に投与する、別々の薬物として、投与する、治療処方を含むことを想定している。
本明細書で使用する用語「皮膚障害」とは表皮の障害である。こうした皮膚障害として、限定するわけではないが、以下などの表皮の増殖性もしくは炎症性障害が含まれる: アトピー性皮膚炎、水疱性疾患、膠原線維症、接触皮膚湿疹、カワサキ病、酒さ、Sjogren-Larsso症候群、じんましん[Wedi B et al., BioDrugs. 2001;15(11):729-43]。
用語「希釈剤」とは、対象の化合物の送達前の希釈に使用される化合物である。希釈剤は、より安定な環境を提供することができるので、化合物を安定化するためにも使用される。当分野では、限定するわけではないが、リン酸緩衝化生理食塩水などの、バッファー溶液(pH調節もしくは維持の作用もする)に溶解させた塩を、希釈剤として利用する。
本明細書で使用する用語「有効量」または「治療上有効量」とは、治療する疾病もしくは病態の1以上の症状を何らかの程度緩和するのに十分な、投与される薬物もしくは化合物の量である。その結果、疾病の症候、症状、もしくは原因の低下および/または軽減、あるいは生体系のその他の何らかの望ましい変更がもたらされる。例えば、治療での使用の「有効量」は、疾病の症状の臨床上有意な減少をもたらすのに必要とされる、本明細書に開示した化合物を含んでいる組成物の量である。個々のいずれの場合でも、適切な「有効」量は、用量漸増試験などの技法を使用して、決定することができる。
本明細書で使用する用語「強化する」または「強化」は、所望の効果の強度または期間のそれぞれ増加または延長を意味している。これについて、治療薬の効果の強化に関しては、用語「強化」とは、ある系での別の治療薬の効果の強度または期間をそれぞれ増加または延長する能力である。本明細書で使用する、「強化に有効な量」とは、所望の系内の別の治療薬の効果を強化するのに適切な量である。
本明細書で使用する用語「酵素切断可能な連結基」とは、1以上の酵素によって分断することができる、不安定もしくは分断性連結である。
本明細書で使用する用語「線維症」または「線維化障害」とは、急性もしくは慢性炎症後に細胞および/またはコラーゲンの異常蓄積をともなう病態であって、限定するわけではないが、心臓、腎臓、関節、肺、もしくは皮膚などの個々の器官または組織の線維症が含まれ、また、特発性肺線維症および特発性間質性肺炎などの障害が含まれる[Charbeneau RP et al.、, "Eicosanoids: mediators and therapeutic targets in fibrotic lung disease", Clin Sci(Lond). 2005 Jun;108(6):479-91]。
用語「医原性」とは、医療もしくは手術療法によって引き起こされたか悪化した、ロイコトリエン依存性もしくはロイコトリエン介在性病態、障害、または疾病を意味する。
用語「炎症性障害」とは、以下の1以上の症候に特徴がある疾病または病態である: 痛み('dolor'、有害物質の産生および神経の刺激)、熱('calor'、血管拡張)、赤み('rubor'、血管拡張および血流増加)、腫れ('tumor'、体液の過剰の流入または流出の制限)、および機能消失('functio laesa'、部分的もしくは完全、一時的もしくは持続的)。炎症には多くの形態があり、限定するわけではないが以下の炎症が含まれる: 急性、粘着性、萎縮性、カタル性、慢性、肝硬変性、拡散性、播種性、滲出性、線維素性、線維化性、限局性、肉芽腫性、過形成性、肥大性、間質性、転移性、壊死性、閉塞性、実質性、形成性、多産性、増殖性、偽膜性、化膿性、硬化性、漿液形成性、漿液性、単純性、特異性、亜急性、化膿促進性、毒性、外傷性、および/または潰瘍性。炎症性障害として限定するわけではないが、以下に罹患するものが含まれる: 血管(多発動脈炎、側頭動脈炎); 関節(関節炎: 結晶性、骨性、乾癬性、反応性、リウマチ性、Reiter); 胃腸管(疾患); 皮膚(皮膚炎); または複数器官および組織(全身性エリテマトーデス)[Harrison's Principles of Internal Medicine, 16th Edition, Kasper DL, et al, Editors; McGraw-Hill, publishers]。
用語「間質性膀胱炎」とは、解剖学的異常性、感染、毒素、外傷または腫瘍が原因ではない、下腹部の不快感、頻繁でときには痛みのある排尿に特徴がある障害である[Bouchelouche K et al., "The cysteinyl leukotrine D4 recaptor antagonst montelukast for the treatment of interstitial cystitis", J Urol 2001;166:1734]。
本明細書で使用する用語「ロイコトリエン駆動性仲介体」とは、細胞のロイコトリエン刺激の過剰産生が病因である患者中で産生され得る分子であって、単なる例示であるが、以下などがある: LTB4、LTC4、LTE4、システイニルロイコトリエン、単球炎症性タンパク質(MIP-1α)、インターロイキン-8(IL-8)、インターロイキン-4(IL-4)、インターロイキン-13(IL-13)、単球化学誘引性タンパク質(MCP-1)、可溶性細胞内接着分子(sICAM; 可溶性ICAM)、ミエロペルオキシダーゼ(MPO)、好酸球ペルオキシダーゼ(EPO)、ならびに一般的炎症分子、インターロイキン-6(Il-6)、C-反応性タンパク質(CRP)、および血清アミロイドAタンパク質(SAA)。
本明細書で使用する用語「ロイコトリエン依存性」とは、1以上のロイコトリエンが存在しなければ発症しないか、同程度には発症しない、病態または障害である。
本明細書で使用する用語「ロイコトリエン介在性」とは、ロイコトリエンの不在中でも発症することがあるが、1以上のロイコトリエンの存在中で発症することができる、病態または障害である。
用語「ロイコトリエン応答性患者」とは、以下のいずれかで選択された患者である:FLAPハプロタイプのいずれかの特定の遺伝子型決定、もしくはロイコトリエン経路内の1以上の別の遺伝子の遺伝子型決定、あるいは、ジレウトン(ZyfloTM)、モンテルカスト(SingulairTM)、プランルカスト(OnonTM)、ザフィルルカスト(AccolateTM)などのいずれかの別のロイコトリエンモジュレーターに対する既往の陽性臨床性応答による患者の表現型の決定、または炎症性細胞の過剰ロイコトリエン刺激を示すロイコトリエン駆動性仲介体のプロフィル。これらはロイコトリエンモジュレーター療法に最もよく応答しやすいものである。本特許出願の場合、ロイコトリエン経路専用の合成もしくはシグナル伝達遺伝子のいずれかの多形性が、患者のロイコトリエンモジュレーター療法(酵素インヒビターもしくは受容体アンタゴニスト)に対する応答性をより大きいかより小さいものにすることがある。ロイコトリエン経路専用の遺伝子は以下である: 5-リポキシゲナーゼ(ALOX5)、5-リポキシゲナーゼ活性化タンパク質(ALOX5AP)、LTA4ヒドロラーゼ(LTA4H)、LTC4シンターゼ(LTC4S)、LTB4受容体1(LTB4R1; BLT1)、LTB4受容体2(LTB4R2; BLT2)、システイニルロイコトリエン受容体1(CysLT1R)、システイニルロイコトリエン受容体2(CysLT2R)。何らかの遺伝子の何らかの多形性または多形の組み合わせの結果、ロイコトリエンの病因としての作用を低下させる目的での療法に対して、患者の感受性が変更される。ロイコトリエンモジュレーター療法に対して最良の応答をするとみられる患者の選択には、ロイコトリエン経路遺伝子の多形の知見、またロイコトリエン駆動性仲介体の発現の知見が含まれる。患者の選択は、ロイコトリエン経路遺伝子型単独、表現型単独(バイオマーカー)または遺伝子型および表現型の両方の組み合わせを基礎として、行われる。
用語「キット」および「製造品」は同義語として使用される。
用語「LTNO」とは、FLAPインヒビターおよびNOモジュレーターであるあらゆる薬物、ならびにFLAPインヒビター薬とNOモジュレーター薬の複合薬である。
本明細書に開示する化合物の「代謝物」とは、その化合物が代謝されたときに形成される化合物の誘導体である。用語「活性な代謝物」とは、その化合物が代謝されたときに形成される化合物の生物学的に活性な誘導体である。本明細書で使用する用語「代謝される」とは、特定の物質が生体によって変化を受ける過程(限定するわけではないが、加水分解反応および酵素によって触媒される反応が含まれる)の全体である。これについては、酵素はある化合物に対して特異的な構造の変化をもたらす。例えば、チトクロームP450は多様な酸化および還元反応を触媒するが、二リン酸ウリジングルクロニルトランスフェラーゼは、活性化されたグルクロン酸分子の芳香族アルコール、脂肪族アルコール、カルボン酸、アミンおよび遊離のスルフィドリル基への転換を触媒する。代謝についてのそれ以上の情報は以下から得られる: The Pharmacological Basis of Therapeutics, 9th Edition, McGraw-Hill(1996)。本明細書に開示する化合物の代謝物は、化合物の宿主への投与およびその宿主からの組織サンプル分析によるか、in vitroでの化合物の肝細胞とのインキュベーションおよび生成する化合物の分析によって、同定される。
本明細書で使用する用語「モジュレート」は、標的の活性を変更するように、その標的と直接または間接的に相互作用することを意味し、単なる例示であるが以下が含まれる: 、標的の活性の強化、標的の活性の維持、標的の活性の延長、標的の生体利用性の変更、標的の活性の減少、標的の活性への危害、標的の破壊、または標的の消滅の増加。
本明細書で使用する用語「モジュレーター」とは、標的をモジュレートする分子または薬剤である。1態様中、モジュレーターはアンタゴニストである。別の実施形態中、モジュレーターはインヒビターである。
本明細書で使用する用語「NOモジュレーター」とは、NOの起源として作用するか、NOを直接または間接的に供給することができるか、NOレベルを直接または間接的に増加させるか、あるいはNOレベルを直接または間接的に維持することができる、分子または部分である。直接とは、その直後の作用が所望の結果をもたらす、相互作用のことである(例えば、NOを放出する薬物)。間接的作用はその他のすべての相互作用を包含する。NOを直接供給する薬物は「直接NO供給体」; NOレベルを直接モジュレートする薬物は「直接NOレベルモジュレーター」; NOレベルを直接維持する薬物は「直接NOメンテナー」とも称される。
本明細書で使用する用語「神経変性疾患」または「神経系障害」とは、脳、脊髄もしくは末梢神経系の構造または機能を変化させる病態であって、限定するわけではないが以下が含まれる: アルツハイマー病、脳浮腫、脳虚血、多発硬化症、ニューロパシー、パーキンソン病、鈍的もしくは外科的外傷後に見られるもの(術後認知機能障害および脊髄もしくは脳幹傷害)、そして変性椎間板疾患および坐骨神経痛などの障害の神経学的症状。頭字語「CNS」とは、中枢神経系、すなわち脳および脊髄の障害である[Sugaya K、et al., Jpn J Pharmacol. 2000 Feb;82(2):85-94; Yu GL, et al., Pharmacology. 2005 Jan;73(1):31-40.; Zhang WP, et al., Acta Pharmacol Sin. 2002 Oct;23(10):871-7]。
本明細書で使用する用語「眼球疾患」または「眼科疾病」とは、片眼もしくは両眼および可能性として周囲組織に及ぶ疾病である。眼球もしくは眼科疾病として、限定するわけではないが、以下が含まれる: 結膜炎、網膜炎、強膜炎、ブドウ膜炎、アレルギー性結膜炎、春季結膜炎、乳頭結膜炎[Toriyama S., Nippon Ganka Gakkai Zasshi. 2000 Jun;104(6):396-40; Chen F, et al., Ophthalmic Res. 1991;23(2):84-91]。
「医薬として許容される」とは、本明細書で使用する場合、化合物の生物学的活性または性質を無効にしないで、かつ比較的毒性が低い、担体または希釈剤などの物質である。すなわち、その物質は望ましくない生物学的作用をもたらすことなく、またはこれが含まれる組成物のいずれかの成分と有害な相互作用をすることなく、個体に投与することができる。
用語「医薬として許容される塩」とは、投与される生体に顕著な刺激をもたらさず、かつその化合物の生物学的活性および性質を無効にしない、化合物の製剤である。いくつかの実施形態中、医薬として許容される塩は、式(I)の化合物、FLAPインヒビター、もしくはNOモジュレーターと以下などの酸との反応、あるいは当分野で既知のその他の方法によって得られる: 塩酸、臭素酸、硫酸、硝酸、リン酸、メタンスルホン酸、エタンスルホン酸、p-トルエンスルホン酸、サリチル酸など。医薬として許容される塩は、本明細書に記載する化合物と塩基を反応させて以下などの塩を形成させることによって、得ることができる: アンモニウム塩、ナトリウムもしくはカリウム塩などのアルカリ金属塩、カルシウムもしくはマグネシウム塩などのアルカリ土類金属塩、ジシクロヘキシルアミン、N-メチル-D-グルカミン、トリス(ヒドロキシメチル)メチルアミンなどの有機塩基の塩、ならびにアルギニン、リシン、などのアミノ酸との塩。
本明細書で使用する用語「配合医薬」は、2以上の活性成分を混合または配合した結果の産物を意味し、活性成分群の固定および非固定配合の両方が含まれる。用語「固定配合」は、活性成分群、例えばNOモジュレーター(NOを患者内で放出する薬物あるいは患者内のNOを別様に上昇させるか、またはNOの産生を維持する薬物、あるいは患者内のNOレベルを維持する薬物が含まれる)およびFLAPインヒビターの両方を、単一の実質体または投与剤形の形態で、同時に患者に投与することを意味する。用語「非固定配合」は、活性成分群、例えばNOモジュレーター(NOを患者内で放出する薬物あるいは患者内のNOを別様に上昇させるか、またはNOの産生を維持する薬物、あるいは患者内のNOレベルを維持する薬物が含まれる)およびFLAPインヒビターを、別個の実質体で、同時に、並行して、または順次、その間の時間制限をともなわずに、患者に投与することを意味し、この際、こうした投与が患者の体内の2つの化合物の効果的なレベルを提供するものである。後者はカクテル療法、例えば、3種以上の活性成分の投与にも適用される。
用語「医薬組成物」とは、1以上のNOモジュレーター(NOを患者内で放出する薬物あるいは患者内のNOを別様に上昇させるか、またはNOの産生を維持する薬物、あるいは患者内のNOレベルを維持する薬物が含まれる)および1以上のFLAPインヒビター、ならびに担体、安定剤、希釈剤、分散剤、懸濁剤、増粘剤、および/または賦形剤などの、その他の化学的成分の混合物である。医薬組成物は配合治療薬の患者への投与を促進する。配合治療薬の投与の技法は当分野に多数存在し、限定するわけではないが以下が含まれる: 静脈内、経口、エアロゾル、経直腸、経膣、経尿道、舌下、腸管外、眼内、肺および局所投与。
「プロドラッグ」とは、in vivoで親薬物に変換される薬物である。プロドラッグは、ある状況下では、親薬物よりも投与が容易であるので、有用なことが多い。いくつかの実施形態中、プロドラッグは、経口投与によって生体利用性であるが、親の方はそうではない。別の実施形態中、プロドラッグは医薬組成物中で親薬物よりも改善された溶解性を持つ。限定するわけではないプロドラッグの1例は、エステル(「プロドラッグ」)として投与される化合物であって、これは細胞膜の透過移動を促進するためであり、ここでは運動性にとっては水溶性が不利益であるが、その後水溶性が有利である細胞の内側に入ると、代謝によって加水分解されて活性な実質体である、カルボン酸になる。プロドラッグの別の例は、酸基と結合した短いペプチド(ポリアミノ酸)であって、この場合、このペプチドが代謝されて活性な部分を表出させる。
本明細書で使用する用語「呼吸器疾患」とは、鼻、咽喉、喉頭、気管、気管支、および肺などの、呼吸に関与する器官が罹患する疾病である。呼吸器疾患として、限定するわけではないが以下が含まれる: 喘息、成人呼吸器不調症候群およびアレルギー性(外因性)喘息、非アレルギー性(内因性)喘息、急性重症喘息、慢性喘息、臨床性喘息、夜間喘息、アレルゲン誘発喘息、アスピリン感受性喘息、運動誘発喘息、イソカプニック(isocapnic)過換気症、小児発症喘息、成人発症喘息、咳型喘息、職業性喘息、ステロイド耐性喘息、季節性喘息、季節性アレルギー性鼻炎、通年性アレルギー性鼻炎、慢性気管支炎もしくは肺気腫を含む慢性閉塞性肺疾病、肺高血圧、間質性肺線維症および/または気道炎症および嚢胞性線維症、ならびに低酸素症[Evans JF, Allergology International 2005;54:187-90); Kemp JP., I drugs. 2000 Apr;3(4):430-41; Riccioni G, et al., Allergy Asthma Proc. 2004 Nov-Dec;25(6):445-8]。
用語「対象体」または「患者」は、哺乳動物および非哺乳動物を包含し、本明細書に特定した病態、疾病もしくは障害があるかその傾向がある個体である。哺乳動物の例として、限定するわけではないが以下のいずれでも含まれる: 哺乳動物綱: ヒト、非ヒト霊長類、チンパンジー、ならびにその他の類人猿およびサルの種など; 家畜動物、ウシ、ウマ、ヒツジ、ヤギ、ブタなど; 愛玩動物、ウサギ、イヌおよびネコなど; げっ歯類を含む実験動物、ラット、マウスおよびモルモットなど。非哺乳動物の例として、限定するわけではないが、鳥、魚などが含まれる。本明細書に提供する方法および組成物の1実施形態中、哺乳動物はヒトである。
本明細書で使用する用語「治療する」「治療すること」または「治療」には、疾病もしくは病態の症候を緩和する、弱める、もしくは改善する、その他の症候を予防する、症候の基底にある代謝原因を改善また防止する、疾病もしくは病態を抑制する、例えば、疾病もしくは病態の進行を留める、疾病もしくは病態を軽減する、疾病もしくは病態の退縮をもたらす、疾病もしくは病態に起因する病態を軽減する、または疾病もしくは病態の症候を停止させる、ことが含まれる。
投与の経路
好適な投与の経路として、例えば以下が含まれる: 経口、経直腸、経粘膜、経皮、肺、眼内または腸内投与; 以下を含む腸管外送達、筋内、皮下、静脈内、髄内注射、さらに髄腔内、直接心室内、腹腔内、または鼻腔内注射。
好適な投与の経路として、例えば以下が含まれる: 経口、経直腸、経粘膜、経皮、肺、眼内または腸内投与; 以下を含む腸管外送達、筋内、皮下、静脈内、髄内注射、さらに髄腔内、直接心室内、腹腔内、または鼻腔内注射。
いくつかの実施形態中、本明細書に記載する化合物(群)は、全身的様相ではなく、例えば、多くの場合デポ製品もしくは持続放出製剤として、化合物(群)の器官中への直接の注射によって、局所に投与される。1態様中、長期作用製剤を、(例えば皮下もしくは筋内への) インプラントまたは筋内注射によって、投与する。別の態様中、薬物の投与を、標的を定めた薬物送達システム、例えば、器官特異的抗体でコーティングしたリポソームによって、達成する。リポソームはその器官を選択的に標的とし、ここで取り込まれる。いくつかの実施形態中、薬物を、迅速放出製剤の形態、長期化放出製剤の形態、または中間体放出製剤の形態で、提供する。
医薬組成物/製剤
医薬組成物は、活性化合物をその後医薬として使用される調製品に加工するのを促進する、賦形剤および補助剤を含んでいる、1以上の生理学的に許容される担体を使用して、常套的様相で製剤化する。適正な製剤は、選択する投与経路によって決まる。周知の技法、担体、および賦形剤のいずれでも好適であり、当分野で知られている通りである。本明細書に記載する医薬組成物の概要は、例えば以下から知ることができる: Remington: The Science and Practice of Pharmacy, Nineteenth Ed(Easton, Pa.: Mack Publishing Company, 1995); Hoover, John E., Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, Pennsylvania 1975; Liberman, H.A. and Lachman, L., Eds., Pharmaceutical Dosage Forms, Marcel Decker, New York, N.Y., 1980; and Pharmaceutical Dosage Forms and Drug Delivery Systems, 7th Ed.(Lippincott Williams & Wilkins1999)、これらの全部を参照として本明細書に組み入れる。
医薬組成物は、活性化合物をその後医薬として使用される調製品に加工するのを促進する、賦形剤および補助剤を含んでいる、1以上の生理学的に許容される担体を使用して、常套的様相で製剤化する。適正な製剤は、選択する投与経路によって決まる。周知の技法、担体、および賦形剤のいずれでも好適であり、当分野で知られている通りである。本明細書に記載する医薬組成物の概要は、例えば以下から知ることができる: Remington: The Science and Practice of Pharmacy, Nineteenth Ed(Easton, Pa.: Mack Publishing Company, 1995); Hoover, John E., Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, Pennsylvania 1975; Liberman, H.A. and Lachman, L., Eds., Pharmaceutical Dosage Forms, Marcel Decker, New York, N.Y., 1980; and Pharmaceutical Dosage Forms and Drug Delivery Systems, 7th Ed.(Lippincott Williams & Wilkins1999)、これらの全部を参照として本明細書に組み入れる。
本明細書に提供するのは、式(I)の化合物、FLAPインヒビター、NOモジュレーター、またはFLAPインヒビターとNOモジュレーターの混合物、ならびに医薬として許容される希釈剤(群)、賦形剤(群)、もしくは担体(群)を含んでいる、医薬組成物である。いくつかの実施形態中、本明細書に記載する化合物を、別の配合治療薬として、式(I)の化合物、FLAPインヒビター、NOモジュレーター、またはFLAPインヒビターとNOモジュレーターの混合物をその他の活性成分と混合した医薬組成物として、投与する。
本明細書で使用する医薬組成物とは、式(I)の化合物、FLAPインヒビター、NOモジュレーター、またはFLAPインヒビターとNOモジュレーターの混合物と、以下などのその他の化学的成分との混合物である: 担体、安定剤、希釈剤、分散剤、懸濁剤、増粘剤、および/または賦形剤。医薬組成物は、化合物の生体への投与を促進する。本明細書に提供する治療もしくは使用方法の実践においては、治療上有効量の本明細書に提供する式(I)の化合物、FLAPインヒビター、NOモジュレーター、またはFLAPインヒビターとNOモジュレーターの混合物を医薬組成物として、治療すべき疾病もしくは病態を持つ哺乳動物に投与する。好ましくは、哺乳動物はヒトである。治療上有効な量は、疾病の重篤度、対象体の年齢および相対的な健康度、使用する化合物の効力ならびにその他の要因に応じて、広範囲に変えることができる。化合物は、単独で、または混合物の成分として1以上の治療薬と併用して、使用される。
静脈内注射用には、式(I)の化合物、FLAPインヒビター、NOモジュレーター、またはFLAPインヒビターとNOモジュレーターの混合物を、水性溶液、好ましくはハンクス液、リンゲル液、もしくは生理食塩水バッファーなどの生理学的に適合するバッファー中で、製剤化する。経粘膜投与のためには、透過すべき関門に適切な浸透剤を製剤中に使用する。こうした浸透剤は当分野で一般的に知られている。その他の腸管外注射用には、適切な製剤として、好ましくは生理学的に適合性のバッファーもしくは賦形剤を含む水性または非水性溶液が含まれる。こうした賦形剤は当分野で一般的に知られている。
経口投与用には、式(I)の化合物、FLAPインヒビター、NOモジュレーター、またはFLAPインヒビターとNOモジュレーターの混合物を、この活性化合物と、当分野で周知の医薬として許容される担体もしくは賦形剤を配合することによって、容易に製剤化される。こうした担体は、本明細書に記載する化合物を、治療すべき患者が経口摂取するための、錠剤、粉剤、丸剤、糖衣錠、カプセル、液剤、ゲル、シロップ、エリキシル、スラリー、懸濁剤など、に製剤化することを可能にする。
経口使用のための医薬調製品は、1以上の固体賦形剤と1以上の本明細書に記載する化合物を混合し、場合によって生成した混合物を摩砕し、そして顆粒の混合物を、所望ならば好適な補助剤を添加後、加工して、錠剤または糖衣錠核を取得する。好適な賦形剤は特に以下である: ラクトース、ショ糖、マンニトール、もしくはソルビトールを含む糖類などのフィラー; 以下などのセルロース調製品: 例えば、トウモロコシでんぷん、小麦でんぷん、米でんぷん、ジャガイモでんぷん、ゼラチン、トラガカントガム、メチルセルロース、微結晶セルロース、ヒドロキシプロピルメチルセルロース、カルボキシメチルセルロースナトリウム; またはその他、以下など:ポリビニルピロリドン(PVPもしくはポビドン)またはリン酸カルシウム。所望ならば以下などの崩壊剤を添加する: 架橋クロスカルメロース(croscarmellose)ナトリウム、ポリビニルピロリドン、アガー、もしくはアルギン酸またはアルギン酸ナトリウムなどのそれらの塩。
糖衣錠核には好適なコーティングをほどこす。この目的のため、濃縮した糖溶液を使用する。これは場合によって以下を含有する: アラビアゴム、タルク、ポリビニルピロリドン、カルボポールゲル、ポリエチレングリコール、および/または二酸化チタン、ラッカー溶液、ならびに好適な有機溶媒または溶媒混合物。いくつかの実施形態中、活性化合物の別種の配合用量を識別または特性決定するために、錠剤または糖衣錠コーティング剤に染料もしくは顔料を添加する。
経口投与用の医薬調製品として、ゼラチン製のプッシュフィットカプセル、ならびにゼラチンとグリセロールもしくはソルビトールなどの可塑剤で作成される軟質密封カプセルが含まれる。プッシュフィットカプセルは以下などとの混合物中の活性成分を含有している: ラクトースなどのフィラー、でんぷんなどのバインダー、および/またはタルクもしくはステアリン酸マグネシウムなどの滑剤、そして場合によって、安定剤。軟質カプセルでは、活性化合物を以下などの好適な液体に溶解または懸濁させる: 脂肪族油、液体パラフィン、または液状ポリエチレングリコール。いくつかの実施形態中、安定剤を添加する。経口投与用のすべての製剤は、こうした投与に好適な剤形にすべきである。
バッカルもしくは舌下投与用には、組成物は常套的手法で製剤化した錠剤、トローチまたはゲルの形態とする。腸管外注射には、ボーラス注射または連続注入が関与する。注射用の製剤は単位投与剤形で、例えば、アンプルまたは保存剤を添加した多回用量容器で、提供される。1態様中、式(I)、FLAPインヒビター、NOモジュレーター、またはFLAPインヒビターとNOモジュレーターの混合物の医薬組成物は、油性もしくは水性ベヒクル中の、滅菌懸濁液、溶液またはエマルジョンとして、腸管外注射に好適な形態であり、また場合によって懸濁、安定化および/または分散剤などの製剤化剤を含有する。腸管外投与用の医薬製剤として、水溶性形態の活性化合物の水溶液が含まれる。その上、活性化合物の懸濁液は、適切な油性注射用懸濁液として調製される。好適な親油性溶媒またはベヒクルとして、ゴマ油などの脂肪族油、またはオレイン酸エチルもしくはトリグリセリドなどの合成脂肪酸エステル、あるいはリポソームが含まれる。水性注射用懸濁液は、カルボキシメチルセルロースナトリウム、ソルビトール、もしくはデキストランなどの、その懸濁液の粘性を増加させる物質を含有する。場合によって、懸濁液は、化合物の溶解度を増加させて、高濃縮溶液の調製を可能にする、好適な安定剤または薬剤をも含有する。あるいは、活性成分は、使用前に好適なベヒクル、例えば、滅菌した発熱物質を含まない水との組成用に、粉末形態である。
いくつかの実施形態中、式(I)の化合物、FLAPインヒビター、NOモジュレーター、またはFLAPインヒビターとNOモジュレーターの混合物を、局所投与し、また以下などの多様な局所投与可能な組成物に製剤化する: 溶液、懸濁液、ローション、ジェル、ペースト、医薬用スティック、バーム、クリームまたは軟膏。いくつかの実施形態中、こうした医薬化合物に、安定剤、等張性強化剤、バッファーおよび保存剤を含有させる。
いくつかの実施形態中、式(I)の構造を持つ化合物、FLAPインヒビター、NOモジュレーター、またはFLAPインヒビターとNOモジュレーターの混合物の、経皮投与に好適な製剤は、経皮送達用具および経皮送達パッチを使用し、またいくつかの実施形態中、これらはポリマー中に溶解させ、かつ/または分散させた、親油性エマルジョンまたは緩衝化水溶液、あるいは接着性である。いくつかの実施形態中、こうしたパッチは医薬の連続、パルス送達もしくは用時送達用に構築される。さらに別の実施形態中、式(I)の化合物、FLAPインヒビター、NOモジュレーター、またはFLAPインヒビターとNOモジュレーターの混合物の経皮送達は、イオントフォレーゼパッチなどの手段で達成される。1態様中、経皮パッチは、式(I)の化合物、FLAPインヒビター、NOモジュレーター、またはFLAPインヒビターとNOモジュレーターの混合物の制御された送達を提供する。いくつかの実施形態中、速度制御膜の使用、または化合物のポリマーマトリックスもしくはゲル中での捕捉によって、吸収の速度を遅くする。逆に、吸収強化剤を使用して、吸収を増加させる。吸収強化剤もしくは担体として、皮膚の通過を補助する、吸収性の、医薬として許容される溶媒が含まれる。例えば、経皮用具は、裏当て材、化合物と場合によって担体を含有している貯留具、場合によって化合物を対象体の皮膚に制御された既定の速度で長期間にわたって送達するための速度制御バリア、ならびにこの用具を皮膚に固定するための手段を含んでいる絆創膏である。
吸入による投与のためには、式(I)の化合物、FLAPインヒビター、NOモジュレーター、またはFLAPインヒビターとNOモジュレーターの混合物は、エアロゾル、ミストまたは粉末の形態である。式(I)の化合物、FLAPインヒビター、NOモジュレーター、またはFLAPインヒビターとNOモジュレーターの混合物の医薬組成物を、例えば以下などの好適な推進剤を使用する、加圧パックまたはネブライザーからのエアロゾルスプレーの形態で、好都合に送達する: ジクロロジフルオロメタン、トリクロロフルオロメタン、ジクロロテトラフルオロエタン、二酸化炭素またはその他の好適なガス。加圧エアロゾルの場合、既定量を送達するバルブを装備することによって、投与単位を決定する。吸入器または吹き入れ器で使用するための、化合物の粉末ミックスとラクトースもしくはでんぷんなどの好適な粉末基剤を含有する、単なる例示であるが、ゼラチンのカプセルおよびカートリッジを製剤化することができる。
1態様中、式(I)の化合物、FLAPインヒビター、NOモジュレーター、またはFLAPインヒビターとNOモジュレーターの混合物を、以下などの直腸組成物に製剤化する: 浣腸剤、直腸ゲル、直腸フォーム、直腸エアロゾル、坐剤、ゼリー坐剤、または滞留浣腸剤、これらはカカオバターもしくはその他のグリセリドなどの慣用の坐薬基剤、またポリビニルピロリドン、PEGなどの合成ポリマーを含有する。組成物の坐剤形態では、限定するわけではないが脂肪酸グリセリドの混合物などの、場合によってカカオバターと組み合わせた低融点ワックスが、最初に融解する。
膣投与に好適な製剤は、活性成分(群)のほかに適切であることが当分野で知られている賦形剤を含有する、ペッサリー、錠剤、タンポン、クリーム、ジェル、ペースト、フォームまたはスプレー製剤として提供される。別の好適な製剤として、ブジーなどの尿道坐剤が含まれる。
医薬組成物は、活性化合物を医薬として使用することができる調製品に加工するのを促進する、賦形剤および補助剤を含んでいる、1以上の生理学的に許容される担体を使用して、常套的様相で製剤化する。適正な製剤は、選択する投与経路によって決まる。周知の技法、担体、および賦形剤のいずれでも好適であり、当分野で知られている通りである。1態様中、式(I)の化合物、FLAPインヒビター、NOモジュレーター、またはFLAPインヒビターとNOモジュレーターの混合物を含んでいる医薬組成物は、単なる例示であるが、以下などの、常套的様相で製造される: 慣用の混合、溶解、顆粒化、糖衣作製、研和、乳化、カプセル化、封入または圧縮工程。
医薬組成物には、少なくとも1種の医薬として許容される担体、希釈剤もしくは賦形剤(すなわち非活性成分)と、活性成分として、本明細書に記載する式(I)の化合物、FLAPインヒビター、NOモジュレーター、またはFLAPインヒビターとNOモジュレーターの混合物を、遊離酸もしくは遊離塩基の形態、または医薬として許容される塩形態で、含ませることになる。その上、本明細書に記載する方法および医薬組成物は、同一のタイプの活性を持つ、N-オキシド、結晶形態(多形としても知られている)、またこれらの化合物の活性な代謝物の使用が含まれる。状況によっては、化合物は互変異性体として存在する。すべての互変異性体が本明細書に提示する化合物の範囲内に含まれる。その上、本明細書に記載する化合物は非溶媒和物とともに、水、エタノールなどの医薬として許容される溶媒との溶媒和物形態で存在する。本明細書に提示する化合物の溶媒和物形態も、本明細書に開示したものとみなす。その上、医薬組成物には、その他の医療または製薬用の薬物、担体、保存剤、安定剤、湿潤剤もしくは乳化剤などのアジュバント、溶解促進剤、浸透圧を調節するための塩および/またはバッファーが含まれる。状況によっては、医薬組成物はその他の治療上の価値がある物質をも含有する。
本明細書に記載する化合物を含んでいる組成物の調製のための方法として、化合物を1以上の不活性な、医薬として許容される賦形剤もしくは担体とともに製剤化して、固体、半固体または液体を形成させることが含まれる。固体組成物として、限定するわけではないが、粉剤、錠剤、分散性顆粒、カプセル、カシェ、および坐剤が含まれる。液体組成物として、本明細書に開示する化合物が溶解している溶液、化合物を含んでいるエマルジョン、または化合物を含んでいるリポソーム、ミセルもしくはナノ粒子を含有する溶液、が含まれる。半固体組成物として、限定するわけではないが、ジェル、懸濁液およびクリームが含まれる。組成物は、溶液もしくは懸濁液、使用前に液体中の溶液もしくは懸濁液にするのに好適な固体、またはエマルジョンでもよい。これらの組成物には、湿潤もしくは乳化剤、pHバッファーなどの、微量の非毒性補助剤を含有させることもある。
式(I)の化合物、FLAPインヒビター、NOモジュレーター、またはFLAPインヒビターとNOモジュレーターの混合物を含んでいる組成物を、説明上薬物が溶液中、懸濁液中、またはその両方に存在している液体形態のものとする。典型的には、組成物を溶液または懸濁液として投与する場合、前者の薬物は溶液中に存在し、後者の薬物は液体マトリックスの懸濁液中に粒子形態として存在する。いくつかの実施形態中、液体組成物としてゲル製剤が含まれる。別の実施形態中、液体組成物は水性である。
状況によっては、水性懸濁液は懸濁剤として1以上のポリマーをも含有する。有用なポリマーとして、セルロースポリマー、例えば、ヒドロキシプロピル メチルセルロースなどの水溶性ポリマー、および架橋カルボキシル含有ポリマーなどの非水溶性ポリマーが含まれる。状況によっては、組成物は例えば以下から選択される粘膜接着性ポリマーをも含んでいる: カルボキシメチルセルロース、カルボマー(アクリル酸ポリマー)、ポリ(メタクリル酸メチル)、ポリアクリルアミド、ポリカルボフィル、アクリル酸/アクリル酸ブチルコポリマー、アルギン酸ナトリウムおよびデキストラン。
1態様中、医薬組成物に、式(I)の化合物、FLAPインヒビター、NOモジュレーター、またはFLAPインヒビターとNOモジュレーターの混合物の溶解性を促進するための可溶化剤を含ませる。用語「可溶化剤」には、一般的に、薬物のミセル溶液または真正溶液の形成をもたらす薬剤が含まれる。一定の許容される非イオン性界面活性剤、例えばポリソルベート80、は可溶化剤として有用となり得るもので、同様に眼科で許容されているグリコール類、ポリグリコール類、例えば、ポリエチレングリコール400、およびグリコールエーテル類なども可能である。
別の態様中、医薬組成物に、以下などの1以上のpH調整剤またはバッファー剤をも含ませる: 酸、酢酸、ホウ酸、クエン酸、乳酸、リン酸および塩酸など; 塩基、水酸化ナトリウム、リン酸ナトリウム、ホウ酸ナトリウム、クエン酸ナトリウム、酢酸ナトリウム、乳酸ナトリウムおよびtris-ヒドロキシメチルアミノメタンなど; ならびにクエン酸/デキストロース、炭酸水素ナトリウムおよび塩化アンモニウムなどのバッファー。こうした酸、塩基およびバッファーは、組成物のpHを許容される範囲に維持するのに必要な量を含ませる。
いくつかの実施形態中、医薬組成物に、組成物の浸透圧を許容される範囲のものにするのに必要な量の1以上の塩をも含ませる。こうした塩として、以下が含まれる: ナトリウム、カリウムもしくはアンモニウムカチオン、および塩化物、クエン酸、アスコルビン酸、ホウ酸、リン酸、炭酸水素、硫酸、チオ硫酸もしくは亜硫酸水素アニオンを持つもの。好適な塩として以下が含まれる: 塩化ナトリウム、塩化カリウム、チオ硫酸ナトリウム、亜硫酸水素ナトリウムおよび硫酸アンモニウム。
その他の有用な組成物に、微生物活性を抑制するために、1以上の保存剤をも含ませてもよい。好適な保存剤として以下が含まれる: 水銀含有物質、メルフェンおよびチオメルサールなど; 安定化した二酸化塩素; ならびに第四級アンモニウム化合物、塩化ベンズアルコニウム、ホウ化セチルトリメチルアンモニウムおよび塩化セチルピリジニウムなど。
別の実施形態中、医薬組成物に、物理的安定性を強化するため、またはその他の目的で、1以上の界面活性剤を含ませる。好適な非イオン界面活性剤として以下が含まれる: ポリオキシエチレン脂肪酸グリセリドおよび植物油、例えば、ポリオキシエチレン(60)、水素化ひまし油; ならびにポリオキシエチレンアルキルエーテル類およびアルキルフェニルエーテル類、例えば、オクトキシノール10、オクトキシノール40。
別の実施形態中、医薬組成物に、必要ならば化学的安定性を強化するために、1以上の抗酸化剤を含ませる。好適な抗酸化剤として、単なる例示であるが、アスコルビン酸およびメタ亜硫酸水素ナトリウムが含まれる。
いくつかの実施形態中、水性懸濁液組成物の単回用量を再密封が不可能な容器に梱包する。あるいは、複数回用量の再密封が可能な容器を使用する。この場合は、組成物中に保存剤を含ませるのが、典型的である。
あるいは、疎水性医薬化合物のための別の送達システムを使用する。リポソームおよびエマルジョンは、疎水性薬物のための送達ベヒクルまたは担体の周知の例である。N-メチルピロリドンなどの一定の有機溶媒も使用される。ただし、通常、より大きい毒性の負担がかかる。いくつかの実施形態中、治療薬を含有する固体疎水性ポリマーの半透性マトリックスなどの、持続放出システムを使用して、化合物を送達する。各種の持続放出性マトリックスが確立されており、当業者には周知である。持続放出性カプセルは、その化学的性質に応じて、2,3時間から10時間まで、化合物を放出する、治療薬の化学的性質および生物学的安定性に応じて、タンパク質安定化のためのその他の戦略を使用する。
1態様中、本明細書に記載する製剤には、抗酸化剤、金属キレート剤、チオール含有化合物およびその他の一般的安定剤が有効である。こうした安定剤の例として、限定するわけではないが、以下が含まれる: (a) 約0.5%〜約2% w/vグリセロール、(b) 約0.1%〜約1% w/vメチオニン、(c) 約0.1%〜約2% w/vモノチオグリセロール、(d) 約1 mM〜約10 mM EDTA、(e) 約0.01%〜約2% w/vアスコルビン酸、(f) 0.003%〜約0.02% w/vポリソルベート80、(g) 0.001%〜約0.05% w/vポリソルベート20、(h) アルギニン、(i) ヘパリン、(j) 硫酸デキストラン、(k) シクロデキストリン、(l) ペントサンポリ硫酸およびその他のヘパリノイド、(m) マグネシウムおよび亜鉛などの2価カチオン; または(n) これらの併用。
投薬方法および治療計画
便宜上、本節および本明細書中の別の部分に記載する投薬方法および治療計画は、一例として単一の化合物式、「式(I)」などを使用する。その上、本明細書に記載する投与方法および治療方法は、本明細書に提示する、式(I)、FLAPインヒビター、NOモジュレーターの範囲内であるすべての化合物、または化合物もしくは薬物の併用または混合物、同様にこれらの一般的カテゴリーの範囲内にあるすべての特定の化合物に同等に適用される。
便宜上、本節および本明細書中の別の部分に記載する投薬方法および治療計画は、一例として単一の化合物式、「式(I)」などを使用する。その上、本明細書に記載する投与方法および治療方法は、本明細書に提示する、式(I)、FLAPインヒビター、NOモジュレーターの範囲内であるすべての化合物、または化合物もしくは薬物の併用または混合物、同様にこれらの一般的カテゴリーの範囲内にあるすべての特定の化合物に同等に適用される。
1実施形態中、ロイコトリエン依存性もしくはロイコトリエン介在疾病または病態の治療のための医薬の調製において、式(I)の化合物を使用する。その上、本明細書に記載する、疾病もしくは病態のいずれかの治療を必要とする対象体のその治療方法には、少なくとも1種の式(I)の化合物、または医薬として許容される塩、医薬として許容されるN-オキシド、医薬として活性な代謝物、医薬として許容されるプロドラッグ、あるいはこれらの医薬として許容される溶媒和物を含有する医薬組成物の治療上有効な量を、その対象体に投与することが関与する。
本明細書に記載する化合物(群)を含有する組成物は、予防および/または治療処置のために投与される。治療適用では、疾病もしくは病態をすでに持つ患者に、疾病もしくは病態を治癒させるか、その症候を少なくとも部分的に停止させるのに十分な量の組成物を、投与する。この用途に有効な量は以下に応じて決まる: 疾病もしくは病態の重篤度および経過、以前の療法、患者の健康状態、体重、およびその薬物への応答、ならびに治療する実務医の判断。治療上有効な量を(限定するわけではないが、用量漸増臨床試験を含む)常用の試験によって、決定することは、当業者の技術範囲であるとみなされる。
予防適用においては、特定の疾病、障害もしくは病態に罹患しやすいか、または別の危険性を持つ患者に、本明細書に記載する化合物を含有する組成物を投与する。こうした量は「予防上有効な量または用量」と定義される。この用途でも、正確な量は患者の健康状態、体重などによって決まる。予防上有効な量を(限定するわけではないが、用量漸増臨床試験を含む)常用の試験によって、決定することは、当業者の技術範囲であるとみなされる。患者に使用する場合、この用途のための有効量は以下に応じて決まる: 疾病、障害もしくは病態の重篤度および経過、以前の療法、患者の健康状態およびその薬物への応答、ならびに治療する実務医の判断。
1態様中、患者の病態が改善されない症例においては、医師の裁量によって、その患者の疾病もしくは病態の症候を改善もしくは別様に制御するか、または限定するため、化合物の投与を、その患者の一生涯を含む、長期間にわたって慢性的に実施する。
患者の病態が改善されない症例においては、医師の裁量によって、化合物の投与を、連続的に実施する; あるいは、投与する薬物の用量を一定の期間、一時的に低下させるか、一時的に中断する(すなわち、「休薬日」)。休薬日の長さは2日から1年まで差異があり、単なる例示であるが以下が含まれる: 2日、3日、4日、5日、6日、7日、10日、12日、15日、20日、28日、35日、50日、70日、100日、120日、150日、180日、200日、250日、280日、300日、320日、350日、および365日。休薬期間中の用量の低下は10%〜100%とすることができ、単なる例示であるが以下が含まれる: 10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、および100%。
患者の病態が改善された後、必要ならば、維持用の用量を投与する。その後、投与量もしくは投与頻度、またはその両方を、症候の関数として、改善された疾病、障害もしくは病態が保持されるレベルまで、低下させる。1態様中、患者は長期間にわたって、症候の何らかの再発があれば、断続的治療を必要とする。
こうした量に対応する、所定の薬物の量は、以下などの要因に応じて変更させる: 特定の化合物、疾病の症状およびその重篤度、治療が必要な対象体もしくは宿主の個性(例えば、体重)。しかしこれらは、例えば以下を含む、その症例の特定の周囲環境にしたがって、当分野で知られた手法で、常套的に決定することができる: 投与される特定の薬物、投与の経路、治療する病態、および治療する対象体もしくは宿主。しかし、一般的に、ヒト成人の治療のために使用する用量は、典型的には0.02〜5000 mg/日の範囲である。1態様中、ヒト成人の治療のために使用する用量は、1〜1500 mg/日の範囲である。いくつかの実施形態中、所望の用量は、単回用量、または同時に(もしくは短時間に)または適切な間隔、例えば1日に2、3、4もしくはそれ以上に分けた用量で、投与する、分割用量で、好都合に提供される。
いくつかの実施形態中、本明細書に記載する医薬組成物は、正確な投与量の単回投与に好適な、単位投与剤形である。単位投与剤形では、製剤は、適切な量の1以上の化合物を含有する単位用量に分割される。1態様中、単位投与剤は、別々の量の製剤を含有する包装品の形態である。限定するわけではない例は、包装された錠剤もしくはカプセル、およびバイアルもしくはアンプルに入った粉剤である。1態様中、水性懸濁液組成物を再密封が不可能な単回用量容器に梱包する。あるいは、再密封可能な複数回用量容器を使用する。この場合、組成物に保存剤を含ませるのが典型的である。単なる例示であるが、腸管外注射用の製剤は、限定するわけではないがアンプルなどの単位投与剤形で、または保存剤を添加して、複数回用量容器で、提供される。
本明細書に記載する式(I)の化合物に適切な1日の投与量は、約0.01〜2.5 mg/体重kgである。限定するわけではないが、ヒトを含む、大きい哺乳動物に指定される1日の投与量は、約0.5 mg〜約1000 mgの範囲であって、限定するわけではないが、1日に4回までなどの分割用量で、または長期放出形態で、好都合に投与される。経口投与のために好適な単位投与剤形は約1〜1000 mgの活性成分を含んでいる。前記の範囲は単に示唆的なものである。なぜならば、個々の治療計画についての変数の種類は大きく、これらの推奨される数値からの相当の離脱は稀なことではない。こうした投与量は、限定するわけではないが、以下などの多数の変数に応じて変更される: 使用する化合物の活性、治療する疾病もしくは病態、投与モード、個々の対象体の必要性、治療する疾病もしくは病態の重篤度、および実務医の判断。
こうした治療計画の毒性および治療効力は、限定するわけではないが、LD50(集団の50%に致死性である用量)およびED50(集団の50%に治療効果がある用量)の決定を含む、細胞培養または実験動物での標準的医薬操作法によって、決定される。毒性と治療効果間の用量比が治療指数であり、LD50とED50の比率として表現することができる。高治療指数を提示する化合物が好ましい。細胞培養アッセイおよび動物研究から得られたデータを、ヒトでの使用のための投与量範囲を製剤化するのに使用する。こうした化合物の投与量は、好ましくは、最少の毒性とともにED50が含まれる範囲内の循環濃度になるものである。1態様中、投与量は、この範囲内で、使用する投与剤形および利用する投与経路に応じて、変更される。
NO依存性、NO介在性、ロイコトリエン依存性もしくはロイコトリエン介在疾病または病態の予防および/または治療のための複合化合物の使用ならびに方法
便宜上、本節および本明細書中の別の部分に記載する、NO依存性、NO介在性(もしくはNO関連)、ロイコトリエン依存性またはロイコトリエン介在(もしくはロイコトリエン関連)疾病または病態を予防かつ/あるいは治療するための複合化合物の使用およびその方法では、一例として単一の式、「式(I)」などを使用する。その上、本明細書に記載する投与方法および治療方法は、本明細書に提示する、式(I)、FLAPインヒビター、NOモジュレーターの範囲内であるすべての式の化合物、または化合物もしくは薬物の併用または混合物、同様にこれらの一般的カテゴリーの範囲内にあるすべての特定の化合物に同等に適用される。
便宜上、本節および本明細書中の別の部分に記載する、NO依存性、NO介在性(もしくはNO関連)、ロイコトリエン依存性またはロイコトリエン介在(もしくはロイコトリエン関連)疾病または病態を予防かつ/あるいは治療するための複合化合物の使用およびその方法では、一例として単一の式、「式(I)」などを使用する。その上、本明細書に記載する投与方法および治療方法は、本明細書に提示する、式(I)、FLAPインヒビター、NOモジュレーターの範囲内であるすべての式の化合物、または化合物もしくは薬物の併用または混合物、同様にこれらの一般的カテゴリーの範囲内にあるすべての特定の化合物に同等に適用される。
NO依存性、NO介在性(もしくはNO関連)、ロイコトリエン依存性またはロイコトリエン介在(もしくはロイコトリエン関連)疾病または病態の併用療法は、NOレベルをモジュレートし、またFLAPの活性をモジュレートするように設計される。こうしたNOモジュレーションは本明細書に記載する通りである。こうしたFLAPモジュレーションとして、単なる例示であるが、FLAP活性を抑制またはこれと拮抗させることが含まれる。例えば、FLAPインヒビターを投与して、個体中のロイコトリエンの合成を減少させるか、あるいはFLAP mRNAもしくはFLAP mRNAの特異的スプライシング変異体の発現または利用可能性をダウンレギュレートまたは減少させることができるようにする。天然のFLAP mRNAもしくは特定のスプライシング変異体の発現または利用可能性がダウンレギュレートまたは減少すると、欠陥核酸もしくは特定のスプライシング変異体の発現または活性が最少化し、それによって欠陥核酸もしくは特定のスプライシング変異体の悪影響を最少化することができる。
1態様によれば、本明細書に記載する組成物および方法として、以下のための組成物および方法が含まれる: すでに臨床的に診断されたNO依存性、NO介在性(もしくはNO関連)、ロイコトリエン依存性またはロイコトリエン介在(もしくはロイコトリエン関連)疾病または病態の進行の治療、予防、逆行、中断または遅延: NO依存性、NO介在性(もしくはNO関連)、ロイコトリエン依存性またはロイコトリエン介在(もしくはロイコトリエン関連)疾病または病態に随伴するか、これらと関連がある症候の治療。これは、式(I)の化合物または式(I)の化合物を含む医薬組成物もしくは医薬の対象体への投与による。その対象体は、投与時にNO依存性、NO介在性(もしくはNO関連)、ロイコトリエン依存性またはロイコトリエン介在(もしくはロイコトリエン関連)疾病または病態をすでに持っているか、NO依存性、NO介在性(もしくはNO関連)、ロイコトリエン依存性またはロイコトリエン介在(もしくはロイコトリエン関連)疾病または病態を発症する危険性を持っているか、のいずれかである。対象体のNO依存性、NO介在性(もしくはNO関連)、ロイコトリエン依存性またはロイコトリエン介在(もしくはロイコトリエン関連)疾病または病態の症候は、当業者が判定し、また標準的医学書に記載されている。
哺乳動物の5-リポキシゲナーゼ活性化タンパク質の活性は、有効量の少なくとも1種の式(I)の化合物、または式(I)の化合物を含む医薬組成物もしくは医薬の、哺乳動物への(少なくとも1回の)投与によって、直接または間接的にモジュレートされる。こうしたモジュレーションとして、限定するわけではないが、5-リポキシゲナーゼ活性化タンパク質の活性の低下および/または抑制が含まれる。その上、哺乳動物のロイコトリエンの活性は、有効量の少なくとも1種の式(I)の化合物、または式(I)の化合物を含む医薬組成物もしくは医薬の、哺乳動物への(少なくとも1回の)投与によって、直接または間接的にモジュレートされる。こうしたモジュレーションとして、限定するわけではないが、5-リポキシゲナーゼ活性化タンパク質の活性の低下および/または抑制が含まれる。
1態様中、NO依存性、NO介在性(もしくはNO関連)、ロイコトリエン依存性またはロイコトリエン介在(もしくはロイコトリエン関連)疾病または病態の予防および/または治療 は、有効量の少なくとも1種の式(I)の化合物、または式(I)の化合物を含む医薬組成物もしくは医薬の、哺乳動物への少なくとも1回の投与を含んでいる。一例として、炎症性疾患もしくは病態の予防および/または治療は、有効量の少なくとも1種の式(I)の化合物、または式(I)の化合物を含む医薬組成物もしくは医薬の、哺乳動物への少なくとも1回の投与を含んでいる。有効量の少なくとも1種の式(I)の化合物、または式(I)の化合物を含む医薬組成物もしくは医薬の、哺乳動物への少なくとも1回の投与を含んでいる1方法によって治療することができる、NO依存性、NO介在性(もしくはNO関連)、ロイコトリエン依存性またはロイコトリエン介在(もしくはロイコトリエン関連)疾病または病態として、限定するわけではないが以下が含まれる: 骨疾患および障害、心血管疾患および障害、炎症性疾患および障害、皮膚疾患および障害、眼疾患および障害、がんおよびその他の増殖性疾患および障害、呼吸器疾患および障害、ならびに非がん性障害。
1態様中、NO依存性、NO介在性(もしくはNO関連)、ロイコトリエン依存性またはロイコトリエン介在(もしくはロイコトリエン関連)疾病または病態の予防および/または治療 は、有効量の少なくとも1種の式(I)の化合物、または式(I)の化合物を含む医薬組成物もしくは医薬の、哺乳動物への少なくとも1回の投与を含んでいる。一例として、炎症性疾患もしくは病態の予防および/または治療は、有効量の少なくとも1種の式(I)の化合物、または式(I)の化合物を含む医薬組成物もしくは医薬の、哺乳動物への少なくとも1回の投与を含んでいる。有効量の少なくとも1種の式(I)の化合物、または式(I)の化合物を含む医薬組成物もしくは医薬の、哺乳動物への少なくとも1回の投与を含んでいる1方法によって治療することができる、NO依存性、NO介在性(もしくはNO関連)、ロイコトリエン依存性またはロイコトリエン介在(もしくはロイコトリエン関連)疾病または病態として、限定するわけではないが以下が含まれる: 骨疾患および障害、心血管疾患および障害、炎症性疾患および障害、皮膚疾患および障害、眼疾患および障害、がんおよびその他の増殖性疾患および障害、呼吸器疾患および障害、ならびに非がん性障害。
単なる例示であるが、本明細書に記載する予防/治療方法に含まれるものとして、有効量の少なくとも1種の式(I)の化合物、または式(I)の化合物を含む医薬組成物もしくは医薬の、哺乳動物への少なくとも1回の投与を含んでいる、呼吸器疾患の治療方法がある。一例として、呼吸器疾患は喘息である; Riccioni et al, Ann. Clin. Lab. Sci., v34, 379-387(2004)、参照。付け加えると、呼吸器疾患として、限定するわけではないが、以下が含まれる: 成人呼吸器不調症候群およびアレルギー性(外因性)喘息、非アレルギー性(内因性)喘息、急性重症喘息、慢性喘息、臨床性喘息、夜間喘息、アレルゲン誘発喘息、アスピリン感受性喘息、運動誘発喘息、イソカプニック過換気症、小児発症喘息、成人発症喘息、咳型喘息、職業性喘息、ステロイド耐性喘息、季節性喘息、アレルギー性鼻炎、血管反応、エンドトキシンショック、線維化成長、肺線維症、アレルギー性疾病、慢性炎症、ならびに成人呼吸器不調症候群。
単なる例示であるが、こうした治療方法に含まれるものとして、有効量の少なくとも1種の式(I)の化合物、または式(I)の化合物を含む医薬組成物もしくは医薬の、哺乳動物への少なくとも1回の投与を含んでいる、慢性閉塞性肺疾患の予防方法がある。付け加えると、慢性閉塞性肺疾患として、限定するわけではないが、以下が含まれる: 慢性気管支炎もしくは肺気腫、肺高血圧、間質性肺線維症および/または気道炎症ならびに嚢胞性線維症。
単なる例示であるが、こうした治療方法に含まれるものとして、有効量の少なくとも1種の式(I)の化合物、または式(I)の化合物を含む医薬組成物もしくは医薬の、哺乳動物への少なくとも1回の投与を含んでいる、疾病もしくは病態における粘膜分泌の増加および/または浮腫の予防方法がある。
単なる例示であるが、本明細書に記載する予防/治療方法に含まれるものとして、有効量の少なくとも1種の式(I)の化合物、または式(I)の化合物を含む医薬組成物もしくは医薬の、哺乳動物への少なくとも1回の投与を含んでいる、以下の予防または治療方法がある: 血管収縮、アテローム性動脈硬化およびその続発性心筋虚血、心筋梗塞、大動脈瘤、脈管炎および卒中; Jala et al, Trends in Immunol., v25, 315-322(2004)、およびmehrabian et al, Curr. Opin. Lipidol., v14, 447-457(2003)。
単なる例示であるが、本明細書に記載する予防/治療方法に含まれるものとして、有効量の少なくとも1種の式(I)の化合物、または式(I)の化合物を含む医薬組成物もしくは医薬の、哺乳動物への少なくとも1回の投与を含んでいる、以下の方法がある: 心筋虚血および/またはエンドトキシンショック後の心臓再かん流傷害の低下。
単なる例示であるが、本明細書に記載する予防/治療方法に含まれるものとして、有効量の少なくとも1種の式(I)の化合物、または式(I)の化合物を含む医薬組成物もしくは医薬の、哺乳動物への少なくとも1回の投与を含んでいる、哺乳動物の血管収縮の低下方法がある。
単なる例示であるが、本明細書に記載する予防/治療方法に含まれるものとして、有効量の少なくとも1種の式(I)の化合物、または式(I)の化合物を含む医薬組成物もしくは医薬の、哺乳動物への少なくとも1回の投与を含んでいる、哺乳動物の血圧の低下方法または増加の予防方法がある。
単なる例示であるが、本明細書に記載する予防/治療方法に含まれるものとして、有効量の少なくとも1種の式(I)の化合物、または式(I)の化合物を含む医薬組成物もしくは医薬の、哺乳動物への少なくとも1回の投与を含んでいる、好酸球および/または好塩基球および/または樹状細胞および/または好中球および/または単球の動員の予防方法がある。
単なる例示であるが、本明細書に記載する予防/治療方法に含まれるものとして、有効量の少なくとも1種の式(I)の化合物、または式(I)の化合物を含む医薬組成物もしくは医薬の、哺乳動物への少なくとも1回の投与を含んでいる、以下の予防または治療方法がある: 例として骨減少症、骨軟化症、骨線維症、パジェット病、がんおよびその他の疾病を含む、骨の再形成、減量または増量。
単なる例示であるが、本明細書に記載する予防/治療方法に含まれるものとして、有効量の少なくとも1種の式(I)の化合物、または式(I)の化合物を含む医薬組成物もしくは医薬の、哺乳動物への少なくとも1回の投与を含んでいる、以下の予防方法がある: 眼性炎症およびアレルギー性結膜炎、春季角結膜炎、および乳頭結膜炎; Lambiase et al, Arch. Opthalmol., v121, 615-620(2003)。
単なる例示であるが、本明細書に記載する予防/治療方法に含まれるものとして、有効量の少なくとも1種の式(I)の化合物、または式(I)の化合物を含む医薬組成物もしくは医薬の、哺乳動物への少なくとも1回の投与を含んでいる、以下の予防方法がある: 眼性炎症およびアレルギー性結膜炎、春季角結膜炎、および乳頭結膜炎; Lambiase et al, Arch. Opthalmol., v121, 615-620(2003)。
単なる例示であるが、本明細書に記載する予防/治療方法に含まれるものとして、有効量の少なくとも1種の式(I)の化合物、または式(I)の化合物を含む医薬組成物もしくは医薬の、哺乳動物への少なくとも1回の投与を含んでいる、CNS障害の予防方法がある。CNS障害として、限定するわけではないが、以下が含まれる: 多発硬化症、パーキンソン病、アルツハイマー病、卒中、脳虚血、網膜虚血、術後認知機能障害、片頭痛、末梢神経障害/神経痛、脊髄傷害、脳浮腫および頭部傷害。
単なる例示であるが、本明細書に記載する予防/治療方法に含まれるものとして、有効量の少なくとも1種の式(I)の化合物、または式(I)の化合物を含む医薬組成物もしくは医薬の、哺乳動物への少なくとも1回の投与を含んでいる、がんの治療方法がある。がんのタイプとして、限定するわけではないが、膵臓がんおよびその他の固形もしくは血液腫瘍が含まれる。以下を参照されたい: Poff and Balazy, Curr. Drug Targets Inflamm. Allergy, v3, 19-33(2004)およびSteele et al, Cancer Epidemiology & Prevention, v8, 467-483(1999)。
単なる例示であるが、本明細書に記載する予防/治療方法に含まれるものとして、有効量の少なくとも1種の式(I)の化合物、または式(I)の化合物を含む医薬組成物もしくは医薬の、哺乳動物への少なくとも1回の投与を含んでいる、エンドトキシンショックおよび敗血性ショックの予防方法がある。
単なる例示であるが、本明細書に記載する予防/治療方法に含まれるものとして、有効量の少なくとも1種の式(I)の化合物、または式(I)の化合物を含む医薬組成物もしくは医薬の、哺乳動物への少なくとも1回の投与を含んでいる、リウマチ性関節炎および骨関節炎の予防方法がある。
単なる例示であるが、本明細書に記載する予防/治療方法に含まれるものとして、有効量の少なくとも1種の式(I)の化合物、または式(I)の化合物を含む医薬組成物もしくは医薬の、哺乳動物への少なくとも1回の投与を含んでいる、GI増加疾患の予防方法がある。こうしたGI疾患として、単なる例示であるが、炎症性腸疾患(IBD)、大腸炎およびクローン病が含まれる。
単なる例示であるが、本明細書に記載する予防/治療方法に含まれるものとして、有効量の少なくとも1種の式(I)の化合物、または式(I)の化合物を含む医薬組成物もしくは医薬の、哺乳動物への少なくとも1回の投与を含んでいる、炎症の減少、また移植拒絶の予防または腫瘍の予防もしくは治療または創傷の治癒の加速のための方法がある。
単なる例示であるが、本明細書に記載する予防/治療方法に含まれるものとして、有効量の少なくとも1種の式(I)の化合物、または式(I)の化合物を含む医薬組成物もしくは医薬の、哺乳動物への少なくとも1回の投与を含んでいる、移植された器官または組織中の拒絶もしくは機能障害の予防または治療のための方法がある。
単なる例示であるが、本明細書に記載する予防/治療方法に含まれるものとして、有効量の少なくとも1種の式(I)の化合物、または式(I)の化合物を含む医薬組成物もしくは医薬の、哺乳動物への少なくとも1回の投与を含んでいる、II型糖尿病の治療方法がある。
単なる例示であるが、本明細書に記載する予防/治療方法に含まれるものとして、有効量の少なくとも1種の式(I)の化合物、または式(I)の化合物を含む医薬組成物もしくは医薬の、哺乳動物への少なくとも1回の投与を含んでいる、皮膚の炎症性応答の治療方法がある。こうした皮膚の炎症性応答の例として、以下が含まれる: 乾癬、皮膚炎、接触皮膚炎、湿疹、じんましん、酒さ、創傷治癒および瘢痕。別の態様中、有効量の少なくとも1種の式(I)の化合物、または式(I)の化合物を含む医薬組成物もしくは医薬の、哺乳動物への少なくとも1回の投与を含んでいる、皮膚、関節、またはその他の組織もしくは器官の乾癬性病変の低下方法がある。
単なる例示であるが、本明細書に記載する予防/治療方法に含まれるものとして、有効量の少なくとも1種の式(I)の化合物、または式(I)の化合物を含む医薬組成物もしくは医薬の、哺乳動物への少なくとも1回の投与を含んでいる、単なる例示であるが、間質性膀胱炎を含む膀胱炎の治療方法がある。
単なる例示であるが、本明細書に記載する予防/治療方法に含まれるものとして、有効量の少なくとも1種の式(I)の化合物、または式(I)の化合物を含む医薬組成物もしくは医薬の、哺乳動物への少なくとも1回の投与を含んでいる、家族性地中海熱などの代謝症候群の治療方法がある。
本開示は、限定するわけではないが、以下を含む病態および障害の治療および予防のための、複合化合物、組成物、および方法を包含する: 高血圧、アテローム性動脈硬化、糖尿病、慢性心不全、大動脈および脳動脈瘤、卒中、敗血症、骨粗しょう症および骨吸収障害、全身性エリテマトーデスおよび多発硬化症を含む自己免疫疾患、リウマチ性関節炎および骨関節炎を含む関節炎、アルツハイマー認知症、筋萎縮性側索硬化症およびパーキンソン病を含む神経疾患、炎症性疾患(例えば、敗血症、成人呼吸器不調症候群、炎症性腸疾患、および播種性血管内凝縮)、線維筋痛、痛覚過敏症および異痛症を含む、炎症の結果である痛み、神経障害痛、ならびに結腸および膵臓がんを含むがん。
本開示は、限定するわけではないが、以下を含む患者、特にヒトの呼吸器病態の治療および予防のための、複合化合物、組成物、および方法を包含する: 無呼吸、石綿症、無気肺、ベリリウム症、気管支疾患、気管支拡張症、細気管支炎、特発性器質化肺炎、気管支炎、気管支肺異形成、通常の風邪、咳、胸膜膿胸、喉頭蓋炎、喀血、低酸素症、カルタジュナー症候群、胎便吸引、胸膜疾病、胸膜滲出、胸膜炎、肺炎気胸、肺胞タンパク症、慢性閉塞性肺疾患、肺高血圧、肺浮腫、肺塞栓症、肺肺気腫、肺線維症、呼吸器不調症候群 − 新生児、呼吸器過敏症、呼吸管疾患、呼吸管感染、鼻硬化症、シミター症候群、重症急性呼吸器症候群、珪肺症、喘鳴、気管狭窄症、ヴェーゲナー肉芽腫、職業性肺疾病および百日咳。
本開示は、慢性および/または急性疾病ならびに病態の治療および予防のための、複合化合物、組成物、および方法をも包含する。本開示は、局所および/もしくは全身的呼吸器ならびに/または心血管病態の治療および予防のための、複合化合物、組成物、および方法をも包含する。これらは例えば、限定するわけではないが、以下などの広範囲にわたる組織および器官の炎症を治療または予防するために、使用される: 皮膚、筋肉、結合組織(例えば、腱および靭帯)、血管、神経組織、関節、胃腸管(例えば、胃ならびに大腸および小腸)、肝臓、脾臓、肺、および腎臓。
診断の方法:
患者同定のための診断方法
便宜上、本節および本明細書中の別の部分に記載する、診断および/または患者同定方法と、それに基づく治療方法では、一例として単一の式、「式(I)」などを使用する。その上、本明細書に記載する診断および/または患者同定方法と、それに基づく治療方法は、本明細書に提示する、式(I)、FLAPインヒビター、NOモジュレーターの範囲内であるすべての式の化合物、または化合物もしくは薬物の併用または混合物、同様にこれらの一般的カテゴリーの範囲内にあるすべての特定の化合物に同等に適用される。
患者同定のための診断方法
便宜上、本節および本明細書中の別の部分に記載する、診断および/または患者同定方法と、それに基づく治療方法では、一例として単一の式、「式(I)」などを使用する。その上、本明細書に記載する診断および/または患者同定方法と、それに基づく治療方法は、本明細書に提示する、式(I)、FLAPインヒビター、NOモジュレーターの範囲内であるすべての式の化合物、または化合物もしくは薬物の併用または混合物、同様にこれらの一般的カテゴリーの範囲内にあるすべての特定の化合物に同等に適用される。
式(I)の化合物、FLAPインヒビターもしくはNOモジュレーター、または式(I)の化合物、FLAPインヒビターもしくはNOモジュレーターを含む、本明細書に記載する医薬組成物もしくは医薬での治療のために選択される、「ロイコトリエン応答性患者」のスクリーニングは、本明細書に記載する技術および方法を使用して、達成される。技術および方法の例として、以下が含まれる: 遺伝子ハプロタイプの評価(遺伝子型分析)、バイオマーカーのモニター/測定(表現型分析)、機能性マーカーのモニター/測定(表現型分析)、これらはロイコトリエン経路の既知のモジュレーター、またはそのいずれかの組み合わせに対する患者の応答を指示するものである。
遺伝子型分析: FLAP多形
ヒトFLAPは精製され、クローン化されているが、これは18 kダルトンの膜結合タンパク質であり、ヒト好中球で最も高度に発現される。FLAP遺伝子は13q12に所在し、この遺伝子はいくつかの集団で、心筋梗塞と卒中の両方の危険度の増加に関連しているとされた。FLAPをコードする遺伝子の多数の多形およびハプロタイプが個体で同定されている(米国特許出願 2005113408; Sayers, Clin. Exp. Allergy, 33(8):1103-10, 2003; Kedda, et al., Clin. Exp. Allergy, 35(3):332-8, 2005)。いくつかの集団で、特定のFLAPハプロタイプが心筋梗塞と卒中に関連があるとされた(Helgadottir A et al Nature Genet 36:233-239(2004); Helgadottir A et al Am J Hum Genet 76:505-509(2004); Lohmussaar E et al Stroke 36: 731-736(2005); Kajimoto K et al Circ J 69:1029-1034(2005))。以前、一定の遺伝子の多形が、所定の療法に対する応答性、例えば、特定の化学療法剤に対するがんの応答性と相関することが証明された(Erichsen, et al., Br. J. Cancer, 90(4):747-51, 2004; Sullivan, et al., Oncogene, 23(19):3328-37, 2004)。したがって、本明細書に記載する複合化合物および療法での治療について検討中の患者を、そのFLAP多形またはハプロタイプに基づいて、治療に対する応答の可能性についてスクリーニングすることができる。
ヒトFLAPは精製され、クローン化されているが、これは18 kダルトンの膜結合タンパク質であり、ヒト好中球で最も高度に発現される。FLAP遺伝子は13q12に所在し、この遺伝子はいくつかの集団で、心筋梗塞と卒中の両方の危険度の増加に関連しているとされた。FLAPをコードする遺伝子の多数の多形およびハプロタイプが個体で同定されている(米国特許出願 2005113408; Sayers, Clin. Exp. Allergy, 33(8):1103-10, 2003; Kedda, et al., Clin. Exp. Allergy, 35(3):332-8, 2005)。いくつかの集団で、特定のFLAPハプロタイプが心筋梗塞と卒中に関連があるとされた(Helgadottir A et al Nature Genet 36:233-239(2004); Helgadottir A et al Am J Hum Genet 76:505-509(2004); Lohmussaar E et al Stroke 36: 731-736(2005); Kajimoto K et al Circ J 69:1029-1034(2005))。以前、一定の遺伝子の多形が、所定の療法に対する応答性、例えば、特定の化学療法剤に対するがんの応答性と相関することが証明された(Erichsen, et al., Br. J. Cancer, 90(4):747-51, 2004; Sullivan, et al., Oncogene, 23(19):3328-37, 2004)。したがって、本明細書に記載する複合化合物および療法での治療について検討中の患者を、そのFLAP多形またはハプロタイプに基づいて、治療に対する応答の可能性についてスクリーニングすることができる。
その上、ロイコトリエン経路に専用の任意の合成もしくはシグナル伝達遺伝子の多形は、ロイコトリエンモジュレーター療法(FLAPもしくは5-LOインヒビターまたはロイコトリエン受容体アンタゴニストのいずれか)に対して応答性が高いか応答性が低い患者をもたらす。ロイコトリエン経路に専用の遺伝子は、5-リポキシゲナーゼ、5-リポキシゲナーゼ活性化タンパク質、LTA4ヒドロラーゼ、LTC4シンターゼ、LTB4受容体1(BLT1)、LTB4受容体2(BLT2)、システイニルロイコトリエン受容体1(CysLT1R)、システイニルロイコトリエン受容体2(CysLT2R)である。例えば、5-LO遺伝子はアスピリン不耐性喘息および気道過敏反応性と関連があるとされた(Choi JH et al Hum Genet 114:337-344(2004); Kim, SH et al Allergy 60:760-765(2005))。5-LOのプロモーター領域の遺伝子変異体が喘息患者の5LOインヒビターに対す臨床上の応答を予測することが示された(Drazen et al, Nature Genetics, 22, p168-170, (1999))。LTC4シンターゼ遺伝子はアトピーおよび喘息に関連があるとされた(Moissidis I et al Genet Med 7:406-410(2005))。CysLT2受容体は喘息およびアトピーに関連があるとされた(Thompson MD et al Pharmacogenetics 13:641-649(2003); Pillai SG et al Pharmacogenetics 14:627-633(2004); Park JS et al Pharmacogenet Genomics 15:483-492(2005); Fukai H et al Pharmacogenetics 14:683-690(2004))。どのロイコトリエン経路遺伝子のどの多形または多形もしくはハプロタイプのどの組み合わせでも、ロイコトリエンの病因的影響を低下させることを目的とした療法に対する、患者の感受性を変更する結果になる。本明細書に記載するロイコトリエンモジュレーター療法に対して最良の応答をする患者の選択には、ロイコトリエン経路遺伝子の多形の知見、またロイコトリエン駆動仲介体の発現の知見が含まれる。患者の選択は、ロイコトリエン経路遺伝子型単独、表現型単独(バイオマーカーもしくは機能性マーカー)または遺伝子型と表現型の何らかの組み合わせに基づいて、実行される。
本明細書に記載する「ハプロタイプ」とは、遺伝子マーカー(「対立遺伝子」)の組み合わせである。ハプロタイプは1以上の対立遺伝子(例えば、単一SNPを含有するハプロタイプ)、2以上の対立遺伝子、3以上の対立遺伝子、4以上の対立遺伝子、または5以上の対立遺伝子を含んでいることがある。遺伝子マーカーはFLAPと関係がある「多形部位」での特定の「対立遺伝子」である。1集団内で2以上の配列が可能なヌクレオチド位置を、本明細書では「多形性部位」と称する。多形性部位が長さ1個のヌクレオチドである場合、この部位を1ヌクレオチド多形(「SNP」)と称する。例えば、特定の染色体位置で、1集団の1つがアデニンを持ち、その集団の別の1つが同一の位置にチミンを持つならば、この位置は多形性部位であり、より特定化すると、この多形性部位はSNPの1つである。多形性部位は、置換、挿入もしくは欠失に基づいて配列の区別が可能である。多形性部位に関しての配列のそれぞれの変異形は、本明細書中で、多形性部位の「対立遺伝子」と称される。これについては、前例中で、SNPはアデニン対立遺伝子とチミン対立遺伝子の両方が可能である。
典型的には、参照配列はある特定の1配列を称する。参照配列と相違がある対立遺伝子は、「変異体」対立遺伝子と称される。本明細書で使用する用語「変異体FLAP」とは、参照FLAP配列とは相違があるが、その他の点では実質的に同様である、1配列である。本明細書に記載するハプロタイプを構成する遺伝子マーカーはFLAP変異体である。一定の実施形態中、FLAP変異体は参照配列と少なくとも約90%同一性である。別の実施形態中、FLAP変異体は参照配列と少なくとも約91%同一性である。別の実施形態中、FLAP変異体は参照配列と少なくとも約92%同一性である。別の実施形態中、FLAP変異体は参照配列と少なくとも約93%同一性である。別の実施形態中、FLAP変異体は参照配列と少なくとも約94%同一性である。別の実施形態中、FLAP変異体は参照配列と少なくとも約95%同一性である。別の実施形態中、FLAP変異体は参照配列と少なくとも約96%同一性である。別の実施形態中、FLAP変異体は参照配列と少なくとも約97%同一性である。別の実施形態中、FLAP変異体は参照配列と少なくとも約98%同一性である。別の実施形態中、FLAP変異体は参照配列と少なくとも約99%同一性である。
その上、一定の実施形態中、FLAP変異体は参照配列と少なくとも1個の塩基が相違しているが、別の実施形態中、FLAP変異体は参照配列と少なくとも2個の塩基が相違している。別の実施形態中、FLAP変異体は参照配列と少なくとも3個の塩基が相違しており、さらに別の実施形態中、FLAP変異体は参照配列と少なくとも4個の塩基が相違している。
その上、一定の実施形態中、FLAP変異体は参照配列と少なくとも1個の塩基が相違しているが、別の実施形態中、FLAP変異体は参照配列と少なくとも2個の塩基が相違している。別の実施形態中、FLAP変異体は参照配列と少なくとも3個の塩基が相違しており、さらに別の実施形態中、FLAP変異体は参照配列と少なくとも4個の塩基が相違している。
その他の変異体は、1ポリペプチド、例えば、FLAPポリペプチドに影響を与える変更を含んでいてもよい。参照ヌクレオチド配列にコードされるポリペプチドは特定の参照アミノ酸配列を持つ「参照」ポリペプチド、そして変異体対立遺伝子によってコードされるポリペプチドは変異体アミノ酸配列を持つ「変異体」ポリペプチドと称される。参照ヌクレオチド配列と比較したときの、FLAP核酸配列の相違として、以下が含まれる: 1ヌクレオチド、もしくは2以上のヌクレオチドの挿入もしくは欠失であって、その結果フレームシフトをもたらすもの; 少なくとも1ヌクレオチドの変更であって、コードされたアミノ酸の変更をもたらすもの; 少なくとも1ヌクレオチドの変更であって、中途停止コドンの生成をもたらすもの; 数個のヌクレオチドの欠失であって、このヌクレオチドにコードされた1以上のアミノ酸の欠失をもたらすもの; 不均等組換えもしくは遺伝子変換による、1もしくは数個のヌクレオチドの挿入であって、コード配列の遮断をもたらすもの; 配列の全部もしくは一部の二重化; 転移; または上に詳細に記載したように、ヌクレオチド配列の再配列。こうした配列の変更は、FLAP核酸にコードされたポリペプチドを変化させる。例えば、核酸配列内の変更がフレームシフトの原因になる場合、そのフレームシフトはコードされたアミノ酸の変更をもたらし、かつ/または中途停止コドンの生成をもたらして、切断されたポリペプチドの生成の原因になることがある。
一例として、心筋梗塞(MI)、急性冠状動脈症候群(ACS)、卒中もしくは末梢動脈閉塞疾患(PAOD)の罹患性と関係する多形は、1以上のヌクレオチドの同義変更(すなわち、アミノ酸配列の変更をもたらさない変更)であり得る。こうした多形は、例えば、スプライス部位を変更するか、発現レベルを減少もしくは増加させるか、mRNAの安定性もしくは輸送に影響するか、またはポリペプチドの転写もしくは翻訳に別様に影響を与える。下記のハプロタイプは、MI、ACS、卒中もしくはPAODでない個体よりも、MI、ACS、卒中もしくはPAODである個体中に頻繁に見られる。したがって、これらのハプロタイプは、個体のMI、ACS、卒中もしくはPAODの罹患性を検出するための予測値になることができる。
数種のFLAP遺伝子の変異体が、患者における心筋梗塞の発生率と相関性を持つことが報告されており(Hakonarson, JAMA, 293(18):2245-56, 2005)、喘息の発症リスクと関係があると報告されているプラスFLAP遺伝子マーカーが、米国特許第6,531,279号に記載されている。FLAP配列変異体を同定するための方法が、例えば以下に記載されている: U.S. 公開番号2005/0113408、および米国特許第6,531,279号。これらの全部を参照として本明細書に組み入れる。
単なる例示であるが、心筋梗塞もしくは卒中の罹患性に関係するハプロタイプの1つは、13q12-13座にマーカーSG13S99、SG13S25、SG13S377、SG13S106、SG13S32およびSG13S35を含んでいる。または、SG13S99、SG13S25、SG13S377、SG13S106、SG13S32およびSG13S35のそれぞれでの、対立遺伝子 T、G、G、G、AおよびGの存在(B6ハプロタイプ)から、心筋梗塞もしくは卒中の罹患性が診断される。または、心筋梗塞もしくは卒中の罹患性に関係するハプロタイプの1つは、13q12-13座にマーカーSG13S99、SG13S25、SG13S106、SG13S30およびSG13S42を含んでいる。または、SG13S99、SG13S25、SG13S106、SG13S30およびSG13S42のそれぞれでの、対立遺伝子T、G、G、GおよびAの存在(B5ハプロタイプ)から、心筋梗塞もしくは卒中の罹患性が診断される。または、心筋梗塞もしくは卒中の罹患性に関係するハプロタイプの1つは、13q12-13座にマーカーSG13S25、SG13S106、SG13S30およびSG13S42を含んでいる。または、SG13S25、SG13S106、SG13S30およびSG13S42のそれぞれでの、対立遺伝子G、G、GおよびAの存在(B4ハプロタイプ)から、心筋梗塞もしくは卒中の罹患性が診断される。または、心筋梗塞もしくは卒中の罹患性に関係するハプロタイプの1つは、13q12-13座にマーカーSG13S25、SG13S106、SG13S30およびSG13S32を含んでいる。または、SG13S25、SG13S106、SG13S30およびSG13S32のそれぞれでの、対立遺伝子G、G、GおよびAの存在(Bs4ハプロタイプ)から、心筋梗塞もしくは卒中の罹患性が診断される。ここに記載した実施形態中、本明細書に記載する複合化合物および療法での治療を検討中の患者について、こうしたハプロタイプに基づいて、本明細書に記載する複合化合物および療法に対する応答の可能性について、スクリーニングすることができる。
単なる例示であるが、心筋梗塞もしくは卒中の罹患性に関係するハプロタイプの1つは、13q12-13座にマーカーSG13S99、SG13S25、SG13S114、SG13S89およびSG13S32を含んでいる。または、SG13S99、SG13S25、SG13S114、SG13S89およびSG13S32のそれぞれでの、対立遺伝子T、G、T、GおよびAの存在(A5ハプロタイプ)から、心筋梗塞もしくは卒中の罹患性が診断される。または、心筋梗塞もしくは卒中の罹患性に関係するハプロタイプの1つは、13q12-13座にマーカーSG13S25、SG13S114、SG13S89およびSG13S32を含んでいる。または、SG13S25、SG13S114、SG13S89およびSG13S32のそれぞれでの、対立遺伝子G、T、GおよびAの存在(A4ハプロタイプ)から、心筋梗塞もしくは卒中の罹患性が診断される。ここに記載した実施形態中、本明細書に記載する複合化合物および療法での治療を検討中の患者について、こうしたハプロタイプに基づいて、本明細書に記載する複合化合物および療法に対する応答の可能性について、スクリーニングすることができる。
ハプロタイプの検出は、多形部位での配列の検出について、当分野で知られている方法によって、達成することができる。したがって、FLAP、5-LOもしくはその他のロイコトリエン経路遺伝子多形の遺伝子型選択を使用して、患者を選択することができる。ロイコトリエン経路遺伝子多形もしくはハプロタイプの存在または不在は、例えば以下を含む、各種の方法によって、判定することができる: 酵素的増幅の使用、制限断片長多形の分析、核酸配列決定、個体からの核酸電気泳動分析、またはこれらの任意の併用。一定の実施形態中、SNPもしくはハプロタイプの判定から、式(I)の化合物での治療に応答するか、または利益を得る患者が同定される。一例として、個体の心筋梗塞もしくは卒中の罹患性を診断する方法は、一定の1ヌクレオチド多形(SNP)もしくは一定のハプロタイプの存在または不在の判定を含み、この場合、そのSNPもしくはハプロタイプの存在から、心筋梗塞もしくは卒中の罹患性が診断される。
LTA4ヒドロラーゼをコードする遺伝子の1変異体が心筋梗塞のリスクの増加と関係があることが示された; Helgadottir et al, Nature Genetics、オンライン公開 2005。アメリカ合衆国からの3つの集団でのLTA4ヒドロラーゼをコードするLTA-4H遺伝子全域のハプロタイプ(hapK)は、ヨーロッパ系アメリカ人の1集団ではわずかなリスク(1.16)を与えるが、アフリカ系アメリカ人では3倍のリスクを与える。
表現型分析: バイオマーカー
1態様中、本明細書に記載する複合化合物および療法での治療について検討中の患者を、ロイコトリエン駆動炎症バイオマーカー表現型に基づいて、治療に対する応答の可能性についてスクリーニングする。
1態様中、本明細書に記載する複合化合物および療法での治療について検討中の患者を、ロイコトリエン駆動炎症バイオマーカー表現型に基づいて、治療に対する応答の可能性についてスクリーニングする。
ロイコトリエン駆動炎症バイオマーカー表現型に基づく患者のスクリーニングを、ロイコトリエン経路遺伝子ハプロタイプ検出の変法として使用するか、その補充とすることができる。本明細書で使用する用語「バイオマーカー」とは、正常な生物学的過程、病的過程、または治療介入に対する薬理学的応答の指標として、測定および評価することができる、特徴の1つである。これについて、バイオマーカーは、体内またはその産物中で測定され、結果もしくは疾病の発生に影響するか、またはそれを予測する、あらゆる物質、構造もしくは過程である。バイオマーカーは、感染、作用および感受性のマーカーに分類される。1態様中、バイオマーカーは生理学的終点、一例として血圧、または分析終点、例を示すと、血中グルコース、もしくはコレステロール濃度である。バイオマーカーをモニターおよび/または測定するために使用する技法として、限定するわけではないが、以下が含まれる: NMR、LC-MS、LC-MS/MS、GC-MS、GC-MS/MS、HPLC-MS、HPLC-MS/MS、FT-MS、FT-MS/MS、ICP-MS、ICP-MS/MS、ペプチド/タンパク質配列決定、核酸配列決定、電気泳動技法、イムノアッセイ、イムノブロッティング、in-situハイブリダイゼーション、蛍光in-situハイブリダイゼーション、PCR、放射性イムノアッセイ、および酵素イムノアッセイ。1ヌクレオチド多形(SNP)は、一定の疾病への傾向、ならびに化学療法剤および抗ウイルス薬などの薬物に対する感受性もしくは応答性についてのバイオマーカーの同定にも有用である。これらの技法、または任意のその併用を使用して、ロイコトリエン依存性もしくはロイコトリエン介在疾病または病態について患者をスクリーニングするが、この際、こうした患者は本明細書に記載する複合化合物および療法で、効果的に治療される。
単なる例示であるが、限定するわけではないが以下などを含む、強化された炎症性血液バイオマーカーについてのスクリーニングによって、式(I)の化合物、または式(I)の化合物を含む本明細書に記載する薬物の配合物での治療について、患者を選択する: 刺激されたLTB4、LTC4、LTE4、ミエロペルオキシダーゼ(MPO)、好酸球ペルオキシダーゼ(EPO)、C-反応性タンパク質(CRP)、可溶性細胞内接着分子(sICAM)、単球化学誘引タンパク質(MCP-1)、単球炎症性タンパク質(MIP-1α)、インターロイキン-6(IL-6)、TH2 T細胞活性化物質のインターロイキン4(IL-4)、および13(IL-13)ならびにその他の炎症性サイトカイン。一定の実施形態中、限定するわけではないが、喘息およびCOPDを含む炎症性呼吸器疾病、または心血管疾病を持つ患者を、一群のロイコトリエン駆動炎症性バイオマーカーの使用によって、式(I)の化合物を使用するロイコトリエン合成阻害に対して最も応答性があるものとして選択する。
表現型分析: 機能性マーカー
本明細書に記載する複合化合物および療法での治療について検討中の患者を、ロイコトリエン経路の既知のモジュレーターに対する応答についてスクリーニングする。ロイコトリエン経路の既知のモジュレーターに対する患者の応答の1指標として、機能性マーカーの評価による患者のスクリーニングは、ロイコトリエン経路遺伝子ハプロタイプ検出(遺伝子型分析)および/またはロイコトリエン駆動炎症性バイオマーカー表現型のモニター/測定による患者のスクリーニングの変法として使用するか、その補充とすることができる。機能性マーカーとして、限定するわけではないが、ロイコトリエン依存性病態もしくは疾病、または現行もしくは過去の薬物治療計画の知見に関係する、あらゆる物理的特性が含まれる。
本明細書に記載する複合化合物および療法での治療について検討中の患者を、ロイコトリエン経路の既知のモジュレーターに対する応答についてスクリーニングする。ロイコトリエン経路の既知のモジュレーターに対する患者の応答の1指標として、機能性マーカーの評価による患者のスクリーニングは、ロイコトリエン経路遺伝子ハプロタイプ検出(遺伝子型分析)および/またはロイコトリエン駆動炎症性バイオマーカー表現型のモニター/測定による患者のスクリーニングの変法として使用するか、その補充とすることができる。機能性マーカーとして、限定するわけではないが、ロイコトリエン依存性病態もしくは疾病、または現行もしくは過去の薬物治療計画の知見に関係する、あらゆる物理的特性が含まれる。
単なる例示であるが、肺容積および/または機能の評価を、呼吸器疾患などのロイコトリエン依存性もしくはロイコトリエン介在疾病または病態のための、機能性マーカーとして使用することができる。1態様中、肺機能試験を使用して、こうしたロイコトリエン依存性もしくはロイコトリエン介在疾病または病態を持つ患者を、式(I)の化合物または式(I)の化合物を含む医薬組成物もしくは医薬を使用する治療について、スクリーニングする。こうした試験として、限定するわけではないが、以下の評価が含まれる: 肺気量および肺容量、1回換気量など、予備吸気量、予備呼気量、残留量、吸気容量、機能的残余容量、肺活量、総肺容量、毎分呼吸量、肺胞換気量、時間肺活量、ならびに換気能。肺気量および肺容量の測定方法として、限定するわけではないが、以下が含まれる: 最大呼気フローボリューム曲線、1秒間努力呼気量(FEV1)、ピーク呼気速度。その上、本明細書に記載する患者評価のための機能性マーカーとして使用するその他の肺機能試験には、限定するわけではないが、以下が含まれる: 呼吸筋力、最大吸気圧、最大呼気圧、経横隔膜圧、換気分布、1回呼吸窒素試験、肺窒素排出、および気体移動。
その上、患者現行もしくは過去の治療計画の知見を機能性マーカーとして使用して、式(I)の化合物または式(I)の化合物を含む医薬組成物もしくは医薬を使用する治療について、患者のスクリーニングの補助とすることができる。単なる例示であるが、こうした治療計画として、以下を使用する過去もしくは現行の治療が含まれる: ジレウトン(ZyfloTM)、モンテルカスト(SingulairTM)、プランルカスト(OnonTM)、ザフィルルカスト(AccolateTM)。
いくつかの実施形態中、本明細書に記載する複合化合物および療法での治療について検討中の患者を、限定するわけではないが、以下を含む機能性マーカーについてスクリーニングする: 好酸球および/または好塩基球、および/または好中球、および/または単球および/または樹状細胞および/またはリンパ球動員の低下、粘膜分泌の減少、粘膜浮腫の減少、ならびに/あるいは気管支拡張の増加。
ロイコトリエン依存性もしくはロイコトリエン介在疾病または病態について治療が必要な患者の同定方法として、患者サンプルを分析して、得られた情報を使用して、可能な治療方法を同定する方法が含まれる。当業者はこの情報を、限定するわけではないが年齢、体重、性別、摂食、および医学的病態を含む、その他の患者情報と結合させて、治療方法を選定することが予想される。また、決定過程では、情報のそれぞれに特定の重点が置かれることも予想される。一定の実施形態中、上記の診断方法から得られた情報と、限定するわけではないが年齢、体重、性別、摂食、および医学的病態を含む、その他の患者情報を、1治療方法を解明するために使用する1アルゴリズムに組み込む。この際、決定過程では、情報のそれぞれに特定の重点が置かれる。
別の実施形態中、FLAP NO併用療法は、ハプロタイプもしくはロイコトリエン応答性表現型によって選択された、喘息を含む呼吸器疾患がある患者に特に有用である。喘息と関連づけたFLAPの1ヌクレオチド多形および/または特異的ハプロタイプが以下に完全に記載されている: Blumenfeldらの米国特許、Genset S.A. US 6,531,279 B1。その上、ロイコトリエン合成およびシグナル伝達経路に関る遺伝子のいずれかの多形および/または特異的ハプロタイプは、特定の患者について、FLAP阻害に対する応答性がより大きいか小さい傾向を示す。
併用療法:
本開示は、本明細書に記載する疾病、病態もしくは障害、または随伴する症候、あるいはその合併症の治療のための、1以上のNOモジュレーター(患者内でNOを放出する薬物、または患者内で別様にNOを上昇させるかNOの産生を維持する薬物、または患者内で別様にNOレベルを維持する薬物が含まれる)と、1以上のFLAPインヒビターの投与を含んでいる併用療法を特徴とする。NOモジュレーター(患者内でNOを放出する薬物、または患者内で別様にNOを上昇させるかNOの産生を維持する薬物、または患者内で別様にNOレベルを維持する薬物が含まれる)はFLAPインヒビターのものとは異なる作用機構を持つことが予想されるので、開示されたFLAPインヒビターとの併用は、それぞれの薬物の単独使用に比較して、併用治療もしくは医薬効力の達成のために必要なそれぞれの薬物の量を低下させ、それによって1以上の有害副作用を低下させる可能性の利点がある。さらに、こうした配合組成物もしくは療法を、本明細書に記載する診断分析とさらに組み合わせて使用すると、その患者を治療するために使用する特定の配合組成物もしくは療法を最適化することができる。
本開示は、本明細書に記載する疾病、病態もしくは障害、または随伴する症候、あるいはその合併症の治療のための、1以上のNOモジュレーター(患者内でNOを放出する薬物、または患者内で別様にNOを上昇させるかNOの産生を維持する薬物、または患者内で別様にNOレベルを維持する薬物が含まれる)と、1以上のFLAPインヒビターの投与を含んでいる併用療法を特徴とする。NOモジュレーター(患者内でNOを放出する薬物、または患者内で別様にNOを上昇させるかNOの産生を維持する薬物、または患者内で別様にNOレベルを維持する薬物が含まれる)はFLAPインヒビターのものとは異なる作用機構を持つことが予想されるので、開示されたFLAPインヒビターとの併用は、それぞれの薬物の単独使用に比較して、併用治療もしくは医薬効力の達成のために必要なそれぞれの薬物の量を低下させ、それによって1以上の有害副作用を低下させる可能性の利点がある。さらに、こうした配合組成物もしくは療法を、本明細書に記載する診断分析とさらに組み合わせて使用すると、その患者を治療するために使用する特定の配合組成物もしくは療法を最適化することができる。
各活性成分(式Iの化合物、もしくはFLAPインヒビターとNOモジュレーターの配合物、またはこれらの配合物を含む)の投薬量の規模は、障害自体、特定の活性成分、および投与経路によって変更されるものである。用量および/または用量頻度も、患者の年齢、体重、応答、および医学的既往症にしたがって、変更されるものである。好適な投薬計画は、これらの要因を十分考慮し、例えば、文献に報告があり、またPhysician's Desk References(登録商標)(54th ed.、2000)で推奨されている用量にしたがって、当業者が選択することができる。
本明細書に記載する併用治療薬は、予防および/または治療的処置のために投与することができる。用語「治療する」は、予防および/または治療的処置のいずれかを示すために使用される。治療適用では、すでに疾病、病態もしくは障害がある患者に、その疾病、障害もしくは病態の症候を治癒または少なくとも部分的に中断させるのに十分な量の組成物を投与する。このために効果的な量は以下によって決まる: 疾病、障害もしくは病態の重篤度および経過、以前の療法、患者の健康状態およびその薬物に対する応答、ならびに治療する実務医の判断。当業者は、公開された文献を参照して、その他もしくは同様の薬物での経験、実験(例えば、用量漸増臨床試験)、またはこうした方法の併用によって、治療上有効な量を決定することができる。
予防適用においては、本明細書に記載する併用治療薬を、特定の疾病、障害もしくは病態にかかりやすいか、または別のリスクがある患者に投与する。こうした量は「予防上有効な量もしくは用量」と定義される。この用途では、正確な量はやはり、患者の健康状態、体重、など如何による。当業者は、公開された文献を参照して、その他もしくは同様の薬物での経験、実験(例えば、用量漸増臨床試験)、またはこうした方法の併用によって、治療上有効な量を決定することができる。
患者の病態が改善されない症例においては、医師の裁量によって、その患者の疾病もしくは病態の症候を改善もしくは別様に制御するか、または限定するため、化合物の投与を、その患者の一生涯を含む、長期間にわたって慢性的に実施する。患者の状態が改善されない症例においては、医師の裁量によって、化合物の投与を、連続的に実施する; あるいは、投与する薬物の用量を一定の期間、一時的に低下させるか、一時的に中断する(すなわち、「休薬日」)。休薬日の長さは2日から1年まで差異があり、休薬期間中の用量の低下は10%〜100%とすることができる。
患者の病態が改善されない症例においては、医師の裁量によって、その患者の疾病もしくは病態の症候を改善もしくは別様に制御するか、または限定するため、化合物の投与を、その患者の一生涯を含む、長期間にわたって慢性的に実施する。患者の状態が改善されない症例においては、医師の裁量によって、化合物の投与を、連続的に実施する; あるいは、投与する薬物の用量を一定の期間、一時的に低下させるか、一時的に中断する(すなわち、「休薬日」)。休薬日の長さは2日から1年まで差異があり、休薬期間中の用量の低下は10%〜100%とすることができる。
患者の病態が改善された後、必要ならば、維持用の用量を投与する。その後、投与量もしくは投与頻度、またはその両方を、症候の関数として、改善された疾病、障害もしくは病態が保持されるレベルまで、低下させる。しかし、患者は長期間にわたって、症候の何らかの再発があれば、断続的治療を必要とする。
本明細書に記載する併用療法の概念は、1以上のFLAPインヒビターと1以上のNOモジュレーター(患者内でNOを放出する薬物、または患者内で別様にNOを上昇させるかNOの産生を維持する薬物、または患者内で別様にNOレベルを維持する薬物が含まれる)の、これらの治療薬の共同作用が有益な効果をもたらすことを想定した特定の治療計画の一部としての、投与を包含する。便宜上、少なくとも1種のFLAPインヒビターと少なくとも1種のNOモジュレーター(患者内でNOを放出する薬物、または患者内で別様にNOを上昇させるかNOの産生を維持する薬物、または患者内で別様にNOレベルを維持する薬物が含まれる)の投与を組み合わせた併用療法を、NO-FLAP療法と称することとする。本明細書に記載するNO-FLAP療法中、NOモジュレーター(患者内でNOを放出する薬物、または患者内で別様にNOを上昇させるかNOの産生を維持する薬物、または患者内で別様にNOレベルを維持する薬物が含まれる)とFLAPインヒビターを、同時にまたは順次投与することができる。同時に投与する場合、NOモジュレーター(患者内でNOを放出する薬物、または患者内で別様にNOを上昇させるかNOの産生を維持する薬物、または患者内で別様にNOレベルを維持する薬物が含まれる)とFLAPインヒビターを化学的に連結するか、物理的に混合するか、または2種の別々の医薬組成物として提供することができる。本明細書に記載する配合組成物として、化学的に連結されて1化合物を形成している、NOモジュレーター(患者内でNOを放出する薬物、または患者内で別様にNOを上昇させるかNOの産生を維持する薬物、または患者内で別様にNOレベルを維持する薬物が含まれる)およびFLAPインヒビターが含まれる。ただし、こうした化学的連結は患者への投与前またはその後のいずれかで発生する。また、上記のように化学的に連結した化合物、または化学的に連結していないが、物理的に混合された薬物群のいずれかを含んでいる医薬組成物も、配合組成物に含まれる。
併用の有益な効果として、限定するわけではないが、治療薬の併用がもたらす薬物動態学的または薬理学的共同作用が含まれる。これらの治療薬の併用投与は、典型的には既定の時間(選択された併用に応じて、通常、分、時間、日もしくは週間)、実施される。本明細書に記載する併用療法は一般的に、別々の単一治療処方の一部としてのこれらの2以上の治療薬の投与であって、偶然かつ任意に本発明の併用を招いたものを包含することは想定していない。正しくは、併用療法は、これらの治療薬の同時もしくは順次形式での投与であって、すなわちこの際、各治療薬を同時にまたは別の時間に投与するもの、を想定している。同時投与として、例えば、各治療薬が固定された比率で入っている単一カプセルを1個、または各治療薬についての単一カプセルを複数個、対象体に投与するものが含まれる。同時投与は、例えば、1以上のNOモジュレーター(患者内でNOを放出する薬物、または患者内で別様にNOを上昇させるかNOの産生を維持する薬物、または患者内で別様にNOレベルを維持する薬物が含まれる)を含有する1カプセルと1以上のFLAPインヒビターを含有する1カプセルを同時に投与することによって、達成することができる。各治療薬の順次投与は、例えば、1以上のNOモジュレーター(患者内でNOを放出する薬物、または患者内で別様にNOを上昇させるかNOの産生を維持する薬物、または患者内で別様にNOレベルを維持する薬物が含まれる)を含有する1カプセルをある時間に投与した後、別の時間に、1以上のFLAPインヒビターを含有する1カプセルを投与することによって、達成することができる。
図1に、本明細書に記載する配合組成物および療法のために可能な1実施形態を提示する。図1中、NO-FLAP療法は化学的に連結させた薬物によって達成される。図1中、2つの薬物間に引かれた線は以下を含む任意の化学的連結の形態を表している: 連結基「L」、共有結合、イオン結合、水素結合、バンデルワールス相互作用、または前記の任意の組み合わせ。さらに、化学的連結は2つの薬物間で直接である必要はなく、むしろ治療上活性でない部分に含まれている架橋基が化学的連結として作用し、すなわち、(FLAPインヒビター)-(架橋基)-(NOモジュレーター)とすることができる。さらに、化学的に連結された配合組成物は、場合によってin vivoで開裂されて、2つの連結されていない治療上活性な薬物を形成してもよい。開裂反応(群)はいかのいずれかによって発生させることができる: 酵素的(もしくはその他の何らかの生物学的薬物による)、化学的(患者に投与された別の化合物による、2つの連結された薬物の開裂を含む)、電気化学的、光化学的、音響化学的、別の活性化機構の介在、または上記の任意の併用。さらに、開裂反応(群)は標的化酵素反応(標的化エステラーゼを含む)を介して部位特異的に発生するか、または開裂反応(群)を一般的に利用可能な経路を介して、発生させることができる。
図2は、本明細書に記載する併用療法の1実施形態を提示するものである。この手法では、患者を最初に診断する。その過程は任意に以下を含む: 患者のFLAPハプロタイプ、その他のロイコトリエン経路特異的遺伝子の多形の決定、バイオマーカーおよびロイコトリエン応答性表現型の使用、ならびに/または機能性マーカーの使用。診断情報とともに実務医が入手できるその他の情報に基づいて、患者にNO-FLAP療法を投与する。これとして、配合組成物(化学的に連結されたもの、物理的に混合されたもの、もしくは物理的に分離されたもの)の同時または順次投与が含まれる。必要ならば、実務医の裁量により(かつその療法に対する患者の応答に基づいて)NO-FLAP療法を継続する。
図3は、本明細書に記載するNO-FLAP配合組成物および療法の3種の実施形態を提示するものである。同一の「丸剤」で投与する場合、NO-FLAP配合組成物としては、化学的連結された薬物、および物理的に混合されたものの両方が含まれるものと解釈すべきである。図3には、「丸剤」形態を利用する1実施形態が記載されている。しかし、「丸剤」形態は説明目的のみのためであって、本明細書に記載し、かつ/または当分野で開示された(単なる例示であるが以下を含む: "Remington: The Science and Practice of Pharmacy", 20th ed.(2000) 投与剤形のいずれでも使用することができることを理解すべきである。
各治療薬の順次もしくは同時投与は、限定するわけではないが、以下を含む、任意の適切な経路によって効果を上げることができる: 経口経路、静脈内経路、直腸経路、筋内経路、および粘膜組織を経由する直接吸収。治療薬は同一の経路または別々の経路によって投与される。例えば、選択した組み合わせの第1治療薬を静脈内注射によって投与し、一方組み合わせの他方の治療薬を経口投与する。あるいは、例えば、全治療薬を経口投与するか、または全治療薬を静脈内注射によって投与する。「併用療法」は、上記の治療薬をその他の生物学的に活性な成分とさらに併用して投与することも包含している。
一定の例中、本明細書に記載する少なくとも1種の併用治療薬(または医薬として許容される塩、エステル、アミド、プロドラッグ、もしくは溶媒和物)を別の治療薬と併用して投与することが適切な場合がある。単なる例示であるが、本明細書に記載する併用療法の1つを受けているときに、患者が経験する副作用の1つが炎症であるならば、当初の併用療法と組み合わせて、その他の抗炎症薬を投与するのが適切な場合がある。あるいは、単なる例示であるが、本明細書に記載する化合物の1つの治療有効性を、アジュバントの投与によって、強化することができる(すなわち、それ自身ではアジュバントは最少の治療上の利益しか持たないが、別の治療薬と併用すると、患者への全体としての治療上の利益が強化される)。あるいは、単なる例示であるが、本明細書に記載する化合物の1つをやはり治療上の利益を持つ別の治療薬(治療計画も含まれる)とともに投与することによって、患者が経験する利点を増加させることができる。1態様中、単なる例示であるが、本明細書に記載する化合物の1つの投与が関与する喘息のための治療において、喘息のための別の治療薬もしくは療法を患者に施すことによっても、治療上の利益を増加させる。どんな場合でも、治療する疾病、障害もしくは病態に関らず、患者が経験する全体としての利点は単純に併用療法と治療薬の相加性であるか、または患者が相乗的利点を経験することもある。相加的および相乗的利点の両方が、本明細書に記載する併用方法および療法に包含される。
本明細書に記載する1実施形態中、ロイコトリエン依存性もしくはロイコトリエン介在病態または疾病の治療のための方法として、式(I)の化合物、FLAPインヒビターおよび/またはNOモジュレーターを、限定するわけではないが喘息などの呼吸器病態もしくは障害の治療に使用される治療薬と併用して、患者に投与することが含まれる。限定するわけではないが喘息などの呼吸器病態もしくは障害の治療に使用される治療薬として、以下が含まれる: グルココルチコイド類、シクレソニド、ベクロメタゾン、ブデソニド、フルニソリド、フルチカゾン、モメタゾン、およびトリアムシノロンなど; ロイコトリエン修飾剤、モンテルカスト、ザフィルルカスト、プランルカスト、およびジレウトンなど; マスト細胞安定剤、クロモグリケート(クロモリン)、およびネドクロミルなど; 抗ムスカリン/抗コリン作動薬、イプラトロピウム、オキシトロピウム、およびチオトロピウムなど; メチルキサンチン類、テオフィリンおよびアミノフィリンなど; 抗ヒスタミン薬、メピラミン(ピリラミン)、アンタゾリン、ジフェンヒドラミン、カルビノキサミン、ドキシラミン、クレマスチン、ジメンヒドリネート、フェニラミン、クロルフェナミン(クロルフェニラミン)、デキシクロルフェナミン、ブロムフェニラミン、トリプロリジン、シクリジン、クロルシクリジン、ヒドロキシジン、メクリジン、プロメタジン、アリメマジン(トリメプラジン)、シプロヘプタジン、アザタジン、ケトチフェン、アクリバスチン、アステミゾール、セチリジン、ロラタジン、ミゾラスチン、テルフェナジン、フェキソフェナジン、レボセチリジン、デスロラタジン、フェキソフェナジンなど; オマリズマブ、IgEブロッカー; ベータ2-アドレナリン受容体アゴニスト、以下など: 短時間作用性ベータ2-アドレナリン受容体アゴニスト、サルブタモール(アルブテロール)、レバルブテロール、テルブタリン、ピルブテロール、プロカテロール、メタプロテレノール、フェノテロール、ビトルテロールメシレートなど; ならびに長期作用性ベータ2-アドレナリン受容体アゴニスト、サルメテロール、ホルモテロール、バムブテロールなど。
本明細書に記載する1実施形態中、ロイコトリエン依存性もしくはロイコトリエン介在病態または疾病の治療のための方法として、式(I)の化合物、FLAPインヒビターおよび/またはNOモジュレーターを、限定するわけではないが以下などの、喘息の治療に使用される1以上の薬物と併用して、患者に投与することが含まれる: 併用吸入剤(フルチカゾンおよびサルメテロール経口吸入(例えばAdvair));吸入ベータ-2アゴニスト(アルブテロール吸入剤; アルブテロールネブライザー溶液; ホルモテロール; イソプロテレノール経口吸入; レバルブテロール; メタプロテレノール吸入; ピルブテロール酢酸塩経口吸入; サルメテロールエアロゾル吸入; サルメテロール粉末吸入; テルブタリン吸入剤); 吸入コルチコステロイド(ベクロメタゾン経口吸入; ブデソニド吸入溶液; ブデソニド吸入剤; フルニソリド経口吸入; フルチカゾン吸入エアロゾル; 経口吸入用フルチカゾン粉末; モメタゾン吸入粉末; トリアムシノロン経口吸入); ロイコトリエン修飾剤(モンテルカスト; ザフィルルカスト; ジレウトン); マスト細胞安定剤(クロモリン吸入剤; ネドクロミル経口吸入); モノクローナル抗体(オマリズマブ); 経口ベータ-2アゴニスト(アルブテロール経口シロップ; アルブテロール経口錠剤; メタプロテレノール; テルブタリン); 気管支拡張薬(アミノフィリン; オキシトリフィリン; テオフィリン)。
本明細書に記載する1実施形態中、ロイコトリエン依存性もしくはロイコトリエン介在病態または疾病の治療のための方法として、式(I)の化合物、FLAPインヒビターおよび/またはNOモジュレーターを、限定するわけではないが以下などの、アレルギーの治療に使用される1以上の薬物と併用して、患者に投与することが含まれる: 抗ヒスタミン薬と充血除去薬の併用(セチリジンとプソイドエフェドリン; デスロラタジンとプソイドエフェドリンER; フェキソフェナジンとプソイドエフェドリン; ロラタジンとプソイドエフェドリン); 抗ヒスタミン薬(アゼラスチン鼻スプレー; ブロムフェニラミン; ブロムフェニラミン経口懸濁液; カルビノキサミン; セチリジン; クロルフェニアミン; クレマスチン; デスロラタジン; デキシクロルフェニラミンER; デキシクロルフェニラミン経口シロップ; ジフェンヒドラミン経口薬; フェキソフェナジン; ロラタジン; プロメタジン); 充血除去薬(プソイドエフェドリン); ロイコトリエン修飾剤(モンテルカスト; モンテルカスト顆粒); 鼻抗コリン薬(イプラトロピウム); 鼻コルチコステロイド(ベクロメタゾン鼻吸入用; ブデソニド鼻吸入剤; フルニソリド鼻吸入用; フルチカゾン鼻吸入用; モメタゾン鼻スプレー; トリアムシノロン鼻吸入用; トリアムシノロン鼻スプレー); 鼻充血除去薬(フェニレフリン); 鼻マスト細胞安定剤(クロモリン鼻スプレー)。
本明細書に記載する1実施形態中、ロイコトリエン依存性もしくはロイコトリエン介在病態または疾病の治療のための方法として、式(I)の化合物、FLAPインヒビターおよび/またはNOモジュレーターを、限定するわけではないが以下などの、慢性閉塞性肺疾病(COPD)の治療に使用される1以上の薬物と併用して、患者に投与することが含まれる: 抗コリン薬-イプラトロピウムブロミド経口吸入用); 配合吸入剤(アルブテロールトとイプラトロピウム(例えばCombivent、DuoNeb); フルチカゾンとサルメテロール経口吸入用(例えばAdvair)); コルチコステロイド(デキサメタゾン錠剤; フルドロコルチゾン酢酸塩; ヒドロコルチゾン錠剤; メチルプレドニゾロン; プレドニゾロン液; プレドニゾン経口剤; トリアムシノロン経口剤); 吸入用ベータ-2アゴニスト(アルブテロール吸入剤; アルブテロールネブライザー液; ホルモテロール; イソプロテレノール経口吸入剤; レバルブテロール; メタプロテレノール吸入剤; ピルブテロール酢酸塩経口吸入剤; サルメテロールエアロゾル吸入剤; サルメテロール粉末吸入剤; テルブタリン吸入剤); 吸入用コルチコステロイド(ベクロメタゾン経口吸入剤; ブデソニド吸入液; ブデソニド吸入剤; フルニソリド経口吸入剤; フルチカゾン吸入用エアロゾル; 経口吸入用フルチカゾン粉剤; トリアムシノロン経口吸入剤); 粘液溶解薬(グアイフェネシン); 経口ベータ-2アゴニスト(アルブテロール経口シロップ; アルブテロール経口錠剤; メタプロテレノール; テルブタリン); 気管支拡張薬(アミノフィリン; オキシトリフィリン; テオフィリン)。
本明細書に記載する1実施形態中、ロイコトリエン依存性もしくはロイコトリエン介在病態または疾病の治療のための方法として、式(I)の化合物、FLAPインヒビターおよび/またはNOモジュレーターを、限定するわけではないが非ステロイド抗炎症性薬(NSAID)およびコルチコステロイド(グルココルチコイド)などの、抗炎症性薬物の治療に使用される1以上の薬物と併用して、患者に投与することが含まれる。
NSAIDとして、限定するわけではないが、以下が含まれる: アスピリン、サリチル酸、ゲンチジン酸、コリン サリチル酸マグネシウム、コリン サリチル酸塩、コリン サリチル酸マグネシウム、コリン サリチル酸塩、サリチル酸マグネシウム、サリチル酸ナトリウム、ジフルニザール、カルプロフェン、フェノプロフェン、フェノプロフェン カルシウム、フルロビプロフェン、イブプロフェン、ケトプロフェン、ナブトン、ケトロラック、ケトロラック トロメタミン、ナプロキセン、オキサプロジン、ジクロフェナック、エトドラック、インドメタシン、スリンダック、トルメチン、メクロフェナメート、メクロフェナメート ナトリウム、メフェナミン酸、ピロキシカム、メロキシカム、COX-2特異的インヒビター(限定するわけではないが、セレコキシブ、レフェコキシブ、バルデコキシブ、パレコキシブ、エトリコキシブ、ルミラコキシブ、CS-502、JTE-522、L-745,337およびNS398など)。
コルチコステロイド類として、限定するわけではないが、以下が含まれる: ベタメタゾン(Celestone)、プレドニゾン(Deltasone)、アルクロメタゾン、アルドステロン、アムシノニド、ベクロメタゾン、ベタメタゾン、ブデソニド、シクレソニド、クロベタゾール、クロベタゾン、クロコルトロン、クロプレドノール、コルチゾン、コルチバゾール、デフラザコルト、デオキシコルチコステロン、デソニド、デソキシムタゾン、デソキシコルトン、デキサメタゾン、ジフロラゾン、ジフルコルトロン、ジフルプレドネート、フルクロロロン、フルドロコルチゾン、フルドロキシコルチド、フルメタゾン、フルニソリド、フルオシノロン アセトニド、フルオシノニド、フルオコルチン、フルオコルトロン、フルオロメトロン、フルペロロン、フルプレドニドン、フルチカゾン、ホルモコルタール、ハルシノニド、ハロメタゾン、ヒドロコルチゾン/コルチゾール、ヒドロコルチゾン アセポネート、ヒドロコルチゾン ブテプレート、ヒドロコルチゾン ブチレート、ロテプレドノール、メドリゾン、メプレドニゾン、メチルプレドニゾロン、メチルプレドニゾロン アセポネート、モメタゾン フロエート、パラメタゾン、プレドニカルベート、プレドニゾン/プレドニゾロン、リメキソロン、チココルトール、トリアムシノロン、およびウロベタゾール。
コルチコステロイドは直接にはロイコトリエン産生を抑制しないので、したがって1実施形態中、ステロイド剤との共投薬によって、さらに抗炎症性の利点が得られる。
本明細書に記載する1実施形態中、ロイコトリエン依存性もしくはロイコトリエン介在病態または疾病の治療のための方法として、式(I)の化合物、FLAPインヒビターおよび/またはNOモジュレーターを、限定するわけではないが以下などの、抗炎症性薬物と併用して、患者に投与することが含まれる: ポリ不飽和脂肪酸類(PUFA)、ドコサヘキサエン酸(DHA)、エイコサペンタエン酸(EPA)およびアルファ-リノレン酸(ALA)など。
別の薬物が関与する併用療法の別の例は、アテローム性動脈硬化などの、ロイコトリエン依存性もしくはロイコトリエン介在病態または疾病の治療のための方法である。こうした方法は、本明細書に記載する化合物、医薬組成物、もしくは医薬を、以下からなる群から選択される少なくとも1種のその他の薬物と併用して、患者に投与することを含んでいる: HMG-CoAレダクターゼインヒビター(例えば、ラクトン化もしくはジヒドロキシ開環酸形態のスタチンならびにそれらの医薬として許容される塩およびエステル、限定するわけではないが、ロバスタチン; シンバスタチン; ジヒドロキシ開環酸シンバスタチン、特にそのアンモニウムもしくはカルシウム塩; プラバスタチン、特にそのナトリウム塩; フルバスタチン、特にそのナトリウム塩; アトルバスタチン、特にそのカルシウム塩; ニスバスタチン、NK-104とも称される; ロスバスタチンなど); 脂質変更作用とその他の医薬活性の両方を持つ薬物; HMG-CoAシンターゼインヒビター; コレステロール吸収インヒビター、エゼチミベなど; コレステロールエステル転移タンパク質(CETP)インヒビター、例えばJTT-705およびCP529、414; スクアレンエポキシダーゼインヒビター; スクアレンシンセターゼインヒビター(スクアレンシンターゼインヒビターとしても知られている); アシル-コエンザイムA: コレステロールアシルトランスフェラーゼ(ACAT)インヒビター、ACAT-1もしくはACAT-2の選択的インヒビター、そしてACAT-1および-2の二重インヒビターが含まれる; ミクロソームトリグリセリド転移タンパク質(MTP)インヒビター; プロブコール; ナイアシン; 胆汁酸抑制薬; LDL(低密度リポタンパク質)受容体誘導物質; 血小板凝集インヒビター、例えばグリコタンパク質IIb/IIIaフィブリノーゲン受容体アンタゴニストおよびアスピリン; ヒトペルオキシゾーム増殖活性化受容体ガンマ(PPARγ)アゴニスト、普通グリタゾンと称される化合物を含む、例えばトログリタゾン、ピオグリタゾンおよびロシグリタゾンなど、ならびにチアゾリジンジオンとして知られる構造クラス内に含まれる化合物およびチアゾリジンジオン構造クラス以外のPPARγアゴニストが含まれる; PPARαアゴニスト、クロフィブレート、フェノフィブレートなど、微小化フェノフィブレート、およびゲムフィブロジルが含まれる; PPAR二重α/γアゴニスト、5-[(2,4-ジオキソ-5-チアゾリジニル)メチル]-2-メトキシ-N-[[4-(トリフルオロメチル)フェニル]メチル]-ベンズアミド、KRP-297として知られている、など; ビタミンB6(ピリドキシンとしても知られている)およびこれらの医薬として許容される塩、HCI塩など; ビタミンB12(シアノコバラミンとしても知られている); 葉酸またはその医薬として許容される塩もしくはエステル、ナトリウム塩およびメチルグルカミン塩など; 抗酸化性ビタミン、ビタミンCおよびEならびにベータカロテン; ベータ-遮断薬; アンギオテンシンIIアンタゴニスト、ロサルタンなど; アンギオテンシン変換酵素インヒビター、エナラプリルおよびカプトプリルなど; カルシウムチャネルブロッカー、ニフェジピンおよびジルチアザムなど; エンドセリンアンタゴニスト; ABC1遺伝子発現を強化する薬物; FXRおよびLXRリガンド、インヒビターおよびアゴニストの両方が含まれる; ビスホスホナート化合物、アレンドロネートナトリウムなど; ならびにシクロオキシゲナーゼ-2インヒビター、ロフェコキシブおよびセレコキシブなど。
本明細書に記載する1実施形態中、式(I)の化合物、FLAPインヒビターおよび/またはNOモジュレーターを、以下などの降圧薬と併用して、投与または製剤化する: 利尿薬(例えばループ利尿薬: ブメタニド、エタクリン酸、フロセミド、トルセミド; チアジド利尿薬: クロルタリドン、エピチジド、ヒドロクロロチアジドおよびクロロチアジド、ベンドロフルメチアジド; チアジド様利尿薬: インダパミド、クロルタリドン、メトラゾン; カリウム保持性利尿薬: アミロリド、トリアムテレン、スピロノラクトン); アドレナリン受容体アンタゴニスト(例えばベータ遮断薬: アテノロール、メトプロロール、ナドロール、オキシプレノロール、ピンドロール、プロプラノロール、チモロール; アルファ遮断薬: ドキサゾシン、フェントラミン、インドラミン、フェノキシベンザミン、プラゾシン、テラゾシン、トラゾリン; 混合アルファ+ベータ遮断薬: ブシンドロール、カルベジロール、ラベタロール); アドレナリン受容体アゴニスト(例えばアルファ-2アゴニスト: クロニジン、メチルドーパ); カルシウムチャネルブロッカー(例えばジヒドロピリジン: アムロジピン、フェロジピン、イスラジピン、レルカニジピン、ニフェジピン(Adalat(登録商標))、ニモジピン、ニトレンジピン; 非ジヒドロピリジン: ジルチアゼム、ベラパミル); ACEインヒビター(例えばカプトプリル、エナラプリル、ホシノプリル、リシノプリル、ペリンドプリル、キナプリル、ラミプリル、トランドプリル、ベンザプリル); アンギオテンシンII受容体アンタゴニスト(例えばカンデサルタン、エプロサルタン、イルベサルタン、ロサルタン、オルメサルタン、テルミサルタン、バルサルタン); アルドステロンアンタゴニスト(例えばエプレレノン、スピロノラクトン); 血管拡張薬(例えばナトリウム ニトロプルシド); 中心作用性アドレナリン薬(例えばクロニジン、グアナベンズ、メチルドーパ); アドレナリンニューロンブロッカー: グアネチジン、レセルピン。
1実施形態中、鎮痛性および/または抗炎症性化合物を、式(I)の化合物、FLAPインヒビター、もしくはNOモジュレーターと併用して投与する。鎮痛性および/または抗炎症性化合物として、限定するわけではないが、以下が含まれる: アスピリン、カルバスピリン、コリン サリチル酸塩、ジフルニサール、サリチル酸マグネシウム、サリチル酸アミド、サリチル酸、サルサレート、チオサリチル酸ナトリウム、アセトアミノフェン、フェナセチン、アミノピリン、メフェナミン酸、メトトリメプラジン、オキシフェンブタゾン、フェニルブタゾン、インドメタシン、イブプロフェン、スリンダック、ピロキシカム、メクロフェナメート、ゾメピラック、コデイン、モルフィン、メペリジン、ペチニン、アルファプロジン、フェンタニル、レボルファノール、メタドン、フェナゾシン、ブトルファノール、エトベプトジン、ナルブフィン、ペンタゾシン、プロポキシフェン、フェノプロフェン、ナプロキセン、トルメトンなど。
本明細書に記載する別の実施形態中、ロイコトリエン依存性もしくはロイコトリエン介在病態または疾病の治療のための方法として、FLAPインヒビターを、NSAIDとNO-供与体、またはNSAIDとプロトンポンプインヒビターと併用して、患者に投与するものが含まれる。1態様中、式(I)の化合物をNSAIDとともに投与する。
プロトンポンプインヒビターとして、限定するわけではないが、オメプラゾール、ランソプラゾール、エソメプラゾール、パントプラゾール、ラベプラゾールが含まれる。
本明細書に記載する配合組成物および療法として、以下の使用が含まれる: 式(I)の化合物; NOモジュレーターとともに(同時もしくは順次)投与されるFLAPインヒビター; NOモジュレーターとともに(同時もしくは順次) 投与される式(I)の化合物; およびFLAPインヒビターとともに(同時もしくは順次)投与される式(I)の化合物。
単なる例示であるが、併用療法の代表的な投与順序は、以下のとおりである: 第1剤がNOモジュレーター(患者内でNOを放出する薬物、または患者内で別様にNOを上昇させるかNOの産生を維持する薬物、または患者内で別様にNOレベルを維持する薬物が含まれる)、第2剤がFLAPインヒビター。併用療法の別の代表的な投与順序は、以下のとおりである: 第1剤がFLAPインヒビター、第2剤がNOモジュレーター(患者内でNOを放出する薬物、または患者内で別様にNOを上昇させるかNOの産生を維持する薬物、または患者内で別様にNOレベルを維持する薬物が含まれる)。化合物の別の代表的な投与順序は、以下のとおりである: 第1剤がNOモジュレーター(患者内でNOを放出する薬物、または患者内で別様にNOを上昇させるかNOの産生を維持する薬物、または患者内で別様にNOレベルを維持する薬物が含まれる)、第2剤がFLAPインヒビター、そして第3の薬物がNOモジュレーター(患者内でNOを放出する薬物、または患者内で別様にNOを上昇させるかNOの産生を維持する薬物、または患者内で別様にNOレベルを維持する薬物が含まれる)。併用療法の別の代表的な投与順序は、以下のとおりである: 第1剤がFLAPインヒビター、第2剤がNOモジュレーター(患者内でNOを放出する薬物、または患者内で別様にNOを上昇させるかNOの産生を維持する薬物、または患者内で別様にNOレベルを維持する薬物が含まれる)、第3薬がFLAPインヒビター。併用療法の別の代表的な投与順序は、以下のとおりである: 式(I)の化合物の投与、その一定時間後、同一の式(I)の化合物の投与。単なる例示であるが、さらに以下が含まれる: 1薬物をもう1種と同時で、かつ最後の薬物の投与前に投与する; 1薬物をもう1種と同時で、かつ最後の薬物の投与後に投与する; 3種の薬物全部を同時に投与する; そして、特定の薬物を複数用量投与する。これらの例のいずれでも、記載した投与を、その療法に対する患者の結果に基づき、実務医の裁量によって、反復することができる。その療法に、本明細書に記載する1薬物もしくは薬物群の複数回投与が関与する場合は、複数投薬間の間隔は、0週間から4週間未満まで変更される。
キット/製品
本明細書に記載する併用治療適用での使用のため、キットおよび製品も本明細書に記載する。こうしたキットには、輸送箱、包装品、または容器であって、バイアル、チューブなどの1以上の容器が入れられるように仕切りがついたものが含まれる。この容器(群)のそれぞれが、本明細書に記載する方法で使用する別々の要素を含んでいる。好適な容器として、例えば、ビン、バイアル、注射器、および試験管が含まれる。容器はガラスもしくはプラスチックなどの多様な材料で形成することができる。
本明細書に記載する併用治療適用での使用のため、キットおよび製品も本明細書に記載する。こうしたキットには、輸送箱、包装品、または容器であって、バイアル、チューブなどの1以上の容器が入れられるように仕切りがついたものが含まれる。この容器(群)のそれぞれが、本明細書に記載する方法で使用する別々の要素を含んでいる。好適な容器として、例えば、ビン、バイアル、注射器、および試験管が含まれる。容器はガラスもしくはプラスチックなどの多様な材料で形成することができる。
例えば、容器(群)は、本明細書に記載する1以上の化合物を、場合によって1組成物として、または本明細書に開示する別の薬物と組み合わせて含んでいる。容器(群)は場合によって、滅菌取り出し口を持っている(例えば、容器は皮下注射針で貫通可能な栓を持つ静脈内溶液バッグまたはバイアルである)。こうしたキットは場合によって、化合物を、識別表示またはラベルまたは本明細書に記載する方法での使用に関係する説明書とともに、含んでいる。
1態様中、1キットは典型的には1以上のその他の容器を含み、それぞれが本明細書に記載する1化合物の使用のために、販売者および使用者の観点から望ましい、1以上の各種の物質を含んでいる(試薬など、場合によって濃縮形態、および/または用具)。こうした物質の限定するわけではない例として、限定するわけではないが、以下が含まれる: バッファー、希釈剤、フィルター、針、注射器; 輸送箱、包装品、容器、バイアルおよび/またはチューブ、内容物および/または使用説明を表示したラベル、ならびに使用説明の包装添付書。説明書のセットも典型的には含まれる。
1実施形態中、ラベルは容器上またはこれに接続されている。1実施形態中、ラベルを形成している文字、数字もしくはその他の特徴が接着、型打ちされているか、または容器自体に刻み付けられている。容器がこの容器を入れた貯蔵器もしくは輸送箱内に存在する場合、ラベルは例えば、包装添付品として、容器に接続させる。1実施形態中、ラベルは、内容物が特定の治療適用に使用されるものであることを指定するために使用される。1態様中、ラベルには、本明細書に記載する方法などでの、内容物の使用の指示も説明されている。
実施例
以下の例は、式(I)の化合物、FLAPインヒビター、NOモジュレーター、およびFLAPインヒビターとNOモジュレーターの併用の、有効性および安全性を試験するため、また式(I)の化合物、FLAPインヒビター、NOモジュレーター、およびFLAPインヒビターとNOモジュレーターの併用の医薬組成物を形成するための、説明的方法を提供する。便宜上、実施例では、「式(I)」などの単一の式を使用する。しかし、その実施例は、式(I)、FLAPインヒビター、NOモジュレーター、およびFLAPインヒビターとNOモジュレーターの併用の範囲内にある、本明細書で提示するすべての式、そしてこれらの一般式の範囲内にあるすべての特定の化合物に同等に適用される。これらの実施例は説明目的のためのみであって、本明細書に提供した特許請求の範囲を限定するために提供するものではない。
以下の例は、式(I)の化合物、FLAPインヒビター、NOモジュレーター、およびFLAPインヒビターとNOモジュレーターの併用の、有効性および安全性を試験するため、また式(I)の化合物、FLAPインヒビター、NOモジュレーター、およびFLAPインヒビターとNOモジュレーターの併用の医薬組成物を形成するための、説明的方法を提供する。便宜上、実施例では、「式(I)」などの単一の式を使用する。しかし、その実施例は、式(I)、FLAPインヒビター、NOモジュレーター、およびFLAPインヒビターとNOモジュレーターの併用の範囲内にある、本明細書で提示するすべての式、そしてこれらの一般式の範囲内にあるすべての特定の化合物に同等に適用される。これらの実施例は説明目的のためのみであって、本明細書に提供した特許請求の範囲を限定するために提供するものではない。
米国特許第5,081,138号、1992年1月4日発行、に記載された操作法を使用して調製した。
(例2a)
3-[3-tert-ブチルスルファニル-1-[4-(6-メトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸(化合物1-2a)の合成
3-[3-tert-ブチルスルファニル-1-[4-(6-メトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸(化合物1-2a)の合成
ステップ1: [4-(6-メトキシ-ピリジン-3-イル)-フェニル]-メタノール
DME/H2O(60mL、2:1)中の(4-ヒドロキシメチルフェニル)ホウ酸(Combi-Blocks; 10.0g、65.8mmol)に、5-ブロモ-2-メトキシピリジン(Combi-Blocks; 13.6g、72.4mmol)および炭酸カリウム(45.5g、328.9mmol)を添加した。反応物をN2で20分、脱気した。テトラキス(トリフェニルホスフィン)パラジウム(0)(0.760g、0.66mmol)を添加し、反応物をさらに15分、脱気した。次に反応物をN2下、80℃に16時間、加熱した。LCMSで生成物の形成を確認した。反応物をH2OおよびEtOAc間で分配し、水性層をEtOAcで2回、抽出した。まとめた有機層をMgSO4上で 乾燥し、ろ過し、濃縮し、EtOAcと練和して、所望の生成物を取得した。
DME/H2O(60mL、2:1)中の(4-ヒドロキシメチルフェニル)ホウ酸(Combi-Blocks; 10.0g、65.8mmol)に、5-ブロモ-2-メトキシピリジン(Combi-Blocks; 13.6g、72.4mmol)および炭酸カリウム(45.5g、328.9mmol)を添加した。反応物をN2で20分、脱気した。テトラキス(トリフェニルホスフィン)パラジウム(0)(0.760g、0.66mmol)を添加し、反応物をさらに15分、脱気した。次に反応物をN2下、80℃に16時間、加熱した。LCMSで生成物の形成を確認した。反応物をH2OおよびEtOAc間で分配し、水性層をEtOAcで2回、抽出した。まとめた有機層をMgSO4上で 乾燥し、ろ過し、濃縮し、EtOAcと練和して、所望の生成物を取得した。
ステップ2: メタンスルホン酸 4-(6-メトキシ-ピリジン-3-イル)-ベンジルエステル
[4-(6-メトキシ-ピリジン-3-イル)-フェニル]-メタノール(0.43g、2.0mmol)をCH2Cl2(10mL)に溶解させ、N2で0℃に冷却した。トリエチルアミン(446uL、3.2mmol)を添加し、その後メタンスルホニルクロライド(170uL、2.2mmol)を添加し、反応物を0℃で30分、その後室温で30分、撹拌した。TLC分析で生成物の形成を確認し、そして反応物をH2OおよびCH2Cl2間で分配し、水性相をCH2Cl2で2回抽出した。まとめた有機層をMgSO4上で乾燥し、ろ過し、濃縮して、所望の生成物を灰白色固体として取得した。
[4-(6-メトキシ-ピリジン-3-イル)-フェニル]-メタノール(0.43g、2.0mmol)をCH2Cl2(10mL)に溶解させ、N2で0℃に冷却した。トリエチルアミン(446uL、3.2mmol)を添加し、その後メタンスルホニルクロライド(170uL、2.2mmol)を添加し、反応物を0℃で30分、その後室温で30分、撹拌した。TLC分析で生成物の形成を確認し、そして反応物をH2OおよびCH2Cl2間で分配し、水性相をCH2Cl2で2回抽出した。まとめた有機層をMgSO4上で乾燥し、ろ過し、濃縮して、所望の生成物を灰白色固体として取得した。
ステップ3: N-[4-(ピリジン-2-イルメトキシ)-フェニル]-アセトアミド
DMF(1L)中の4-アセトアミドフェノール(Sigma-Aldrich; 73.6g)、2-クロロメチルピリジン塩酸(80g)および炭酸セシウム(320g)の混合物を70℃で2日間撹拌した。混合物を冷却し、H2O(2L)に注ぎ入れ EtOAcで6回抽出した。有機層をブラインで洗浄し、MgSO4上で乾燥し、ろ過して、褐色固体(114g)を取得し、これをそのまま次のステップで使用した。
DMF(1L)中の4-アセトアミドフェノール(Sigma-Aldrich; 73.6g)、2-クロロメチルピリジン塩酸(80g)および炭酸セシウム(320g)の混合物を70℃で2日間撹拌した。混合物を冷却し、H2O(2L)に注ぎ入れ EtOAcで6回抽出した。有機層をブラインで洗浄し、MgSO4上で乾燥し、ろ過して、褐色固体(114g)を取得し、これをそのまま次のステップで使用した。
ステップ4: 4-(ピリジン-2-イルメトキシ)-フェニルアミン塩酸塩
EtOH(1L)中のN-[4-(ピリジン-2-イルメトキシ)-フェニル]-アセトアミド(114g)に、H2O(200mL)中の水酸化カリウム(50g)を添加した。反応物を110℃に2日間加熱し、その後さらに水酸化カリウム(H2O 100mL中20g)を添加し、さらに2日間、加熱を継続した。溶液を室温まで冷却し、濃縮し、そして残渣をEtOAcおよびH2O間で分配した。水性層をEtOAcで3回抽出し、まとめた有機層をブラインで洗浄し、MgSO4上で乾燥し、ろ過した。この溶液にEtOAc中の飽和HClを添加すると、すぐに沈殿が生成した。ろ過によって固体を回収し、その後真空下で乾燥して、表記化合物をピンク色固体(95g)として取得した。
EtOH(1L)中のN-[4-(ピリジン-2-イルメトキシ)-フェニル]-アセトアミド(114g)に、H2O(200mL)中の水酸化カリウム(50g)を添加した。反応物を110℃に2日間加熱し、その後さらに水酸化カリウム(H2O 100mL中20g)を添加し、さらに2日間、加熱を継続した。溶液を室温まで冷却し、濃縮し、そして残渣をEtOAcおよびH2O間で分配した。水性層をEtOAcで3回抽出し、まとめた有機層をブラインで洗浄し、MgSO4上で乾燥し、ろ過した。この溶液にEtOAc中の飽和HClを添加すると、すぐに沈殿が生成した。ろ過によって固体を回収し、その後真空下で乾燥して、表記化合物をピンク色固体(95g)として取得した。
ステップ5: [4-(ピリジン-2-イルメトキシ)-フェニル]-ヒドラジン 二塩酸
H2O(1L)中の4-(ピリジン-2-イルメトキシ)-フェニルアミン塩酸塩(95g)に0℃で、H2O(100mL)中の硝酸ナトリウム(26g)を添加した。45分間でジアゾニウム塩を生成させ、その後、急速撹拌下のH2O(1L)中のヒドロスルファィトナトリウム(350g)とエーテル(1L)の混合物に、0℃で15分間、徐々に注ぎ入れた。撹拌を40分間継続した後、濃水酸化カリウムを使用して、混合物を塩基性にした。EtOAcで2回抽出後、まとめた有機層をH2Oおよびブラインで洗浄し、MgSO4上で乾燥し、ろ過した。この溶液に、EtOAc中の飽和HClを添加すると、すぐに沈殿が生成した。ろ過によって固体を回収した後、真空下で乾燥して、表記化合物を褐色固体(75g)として取得した。
H2O(1L)中の4-(ピリジン-2-イルメトキシ)-フェニルアミン塩酸塩(95g)に0℃で、H2O(100mL)中の硝酸ナトリウム(26g)を添加した。45分間でジアゾニウム塩を生成させ、その後、急速撹拌下のH2O(1L)中のヒドロスルファィトナトリウム(350g)とエーテル(1L)の混合物に、0℃で15分間、徐々に注ぎ入れた。撹拌を40分間継続した後、濃水酸化カリウムを使用して、混合物を塩基性にした。EtOAcで2回抽出後、まとめた有機層をH2Oおよびブラインで洗浄し、MgSO4上で乾燥し、ろ過した。この溶液に、EtOAc中の飽和HClを添加すると、すぐに沈殿が生成した。ろ過によって固体を回収した後、真空下で乾燥して、表記化合物を褐色固体(75g)として取得した。
ステップ6: 3-[3-tert-ブチルスルファニル-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 エチルエステル
[4-(ピリジン-2-イルメトキシ)-フェニル]-ヒドラジン 二塩酸(75g)、エチル 5-(t-ブチルチオ)-2,2-ジメチル-4-オキソ-ペンタノアート(米国特許第5,288,743号、1994年2月22日発行、に記載された操作法にしたがって調製; 64g)、酢酸ナトリウム(40g)、および酢酸(400mL)をトルエン(800mL)中に混合し、室温で3日間、撹拌した。混合物をH2Oに注ぎ入れ、固体炭酸ナトリウムで塩基性にした。混合物をEtOAcで3回抽出した後、まとめた有機層をH2Oで2回、ブラインで1回洗浄し、MgSO4上で乾燥し、ろ過し、濃縮して、暗赤-黒色油を取得した。シリカゲルクロマトグラフィー(ヘキサン中、0〜20% EtOAc)による母液の精製によって、68gの表記化合物を黄色固体として取得した。
[4-(ピリジン-2-イルメトキシ)-フェニル]-ヒドラジン 二塩酸(75g)、エチル 5-(t-ブチルチオ)-2,2-ジメチル-4-オキソ-ペンタノアート(米国特許第5,288,743号、1994年2月22日発行、に記載された操作法にしたがって調製; 64g)、酢酸ナトリウム(40g)、および酢酸(400mL)をトルエン(800mL)中に混合し、室温で3日間、撹拌した。混合物をH2Oに注ぎ入れ、固体炭酸ナトリウムで塩基性にした。混合物をEtOAcで3回抽出した後、まとめた有機層をH2Oで2回、ブラインで1回洗浄し、MgSO4上で乾燥し、ろ過し、濃縮して、暗赤-黒色油を取得した。シリカゲルクロマトグラフィー(ヘキサン中、0〜20% EtOAc)による母液の精製によって、68gの表記化合物を黄色固体として取得した。
ステップ7: 3-[3-tert-ブチルスルファニル-1-[4-(6-メトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 エチルエステル
3-[3-tert-ブチルスルファニル-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 エチルエステル(ステップ4; 0.73g、1.7mmol)をDMF(10mL)に溶解させ、N2下で-10℃に冷却した。水素化ナトリウム(ミネラル油中60%分散物; 0.08g、2.0mmol)を一部ずつ添加し、反応物を-10℃で45分、泡が消えるまで、撹拌した。この暗茶-赤系溶液に、DMF(7mL)中のメタンスルホン酸 4-(6-メトキシ-ピリジン-3-イル)-ベンジルエステルを滴下した。次に反応物を-10℃で1時間撹拌し、徐々に室温まで加温した。16時間後、LCMS生成物の形成を確認した。反応物を飽和NH4Clで急冷し、メチル tert-ブチルエーテル(MTBE)およびH2Oで希釈した。水性相をMTBEで2回抽出した。まとめた有機層をMgSO4上で乾燥し、ろ過し、濃縮し、粗生成物をシリカゲルクロマトグラフィーによって精製して、所望の生成物を取得した。
3-[3-tert-ブチルスルファニル-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 エチルエステル(ステップ4; 0.73g、1.7mmol)をDMF(10mL)に溶解させ、N2下で-10℃に冷却した。水素化ナトリウム(ミネラル油中60%分散物; 0.08g、2.0mmol)を一部ずつ添加し、反応物を-10℃で45分、泡が消えるまで、撹拌した。この暗茶-赤系溶液に、DMF(7mL)中のメタンスルホン酸 4-(6-メトキシ-ピリジン-3-イル)-ベンジルエステルを滴下した。次に反応物を-10℃で1時間撹拌し、徐々に室温まで加温した。16時間後、LCMS生成物の形成を確認した。反応物を飽和NH4Clで急冷し、メチル tert-ブチルエーテル(MTBE)およびH2Oで希釈した。水性相をMTBEで2回抽出した。まとめた有機層をMgSO4上で乾燥し、ろ過し、濃縮し、粗生成物をシリカゲルクロマトグラフィーによって精製して、所望の生成物を取得した。
ステップ8: 3-[3-tert-ブチルスルファニル-1-[4-(6-メトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸
3-[3-tert-ブチルスルファニル-1-[4-(6-メトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 エチルエステル(21.5g、33.7mmol)をTHF(100mL)およびMeOH(100mL)に溶解させ、透明液になるまで撹拌した。水性水酸化リチウム(3N; 56mL、168.5mmol)を添加し、反応物を80℃で2時間還流させた。LCMSで生成物の形成を確認し、その後反応物を室温まで冷却し、EtOAcおよびH2O間で分配した。水性溶液のpHを、水性10% HClでpH 1に調整し、水性相をEtOAcで3回抽出した。まとめた有機層をH2Oで洗浄し、MgSO4上で乾燥し、ろ過し、濃縮して、所望の遊離酸を取得した。
3-[3-tert-ブチルスルファニル-1-[4-(6-メトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 エチルエステル(21.5g、33.7mmol)をTHF(100mL)およびMeOH(100mL)に溶解させ、透明液になるまで撹拌した。水性水酸化リチウム(3N; 56mL、168.5mmol)を添加し、反応物を80℃で2時間還流させた。LCMSで生成物の形成を確認し、その後反応物を室温まで冷却し、EtOAcおよびH2O間で分配した。水性溶液のpHを、水性10% HClでpH 1に調整し、水性相をEtOAcで3回抽出した。まとめた有機層をH2Oで洗浄し、MgSO4上で乾燥し、ろ過し、濃縮して、所望の遊離酸を取得した。
(例3a)
3-{5-((S)-1-アセチル-2,3-ジヒドロ-1H-インドール-2-イルメトキシ)-3-tert-ブチルスルファニル-1-[4-(6-メトキシ-ピリダジン-3-イル)-ベンジル]-1H-インドール-2-イル}-2,2-ジメチル-プロピオン酸(化合物1-3a)の合成
3-{5-((S)-1-アセチル-2,3-ジヒドロ-1H-インドール-2-イルメトキシ)-3-tert-ブチルスルファニル-1-[4-(6-メトキシ-ピリダジン-3-イル)-ベンジル]-1H-インドール-2-イル}-2,2-ジメチル-プロピオン酸(化合物1-3a)の合成
ステップ1: N-BOC-(S)-2-(トルエン-4-スルホニルオキシメチル)-2,3-ジヒドロ-インドール
N-BOC-(S)-2-ヒドロキシメチル-2,3-ジヒドロ-インドール(3.44g、13.8mmol)をCH2Cl2(20mL)に溶解させた。トルエンスルホニルクロライド(3.42g、17.9mmol)およびピリジン(10mL)を添加し、反応物を室温で36時間撹拌した。反応混合物をCH2Cl2で希釈し、H2Oとともに30分、激しく撹拌した。水性層をCH2Cl2で抽出し、まとめた有機物をMgSO4上で乾燥し、ろ過し、濃縮し、粗物質をシリカゲルクロマトグラフィー(100% CH2Cl2)によって精製して、所望の生成物を灰白色固体として取得した。
N-BOC-(S)-2-ヒドロキシメチル-2,3-ジヒドロ-インドール(3.44g、13.8mmol)をCH2Cl2(20mL)に溶解させた。トルエンスルホニルクロライド(3.42g、17.9mmol)およびピリジン(10mL)を添加し、反応物を室温で36時間撹拌した。反応混合物をCH2Cl2で希釈し、H2Oとともに30分、激しく撹拌した。水性層をCH2Cl2で抽出し、まとめた有機物をMgSO4上で乾燥し、ろ過し、濃縮し、粗物質をシリカゲルクロマトグラフィー(100% CH2Cl2)によって精製して、所望の生成物を灰白色固体として取得した。
ステップ2: N-(4-ブロモ-ベンジル)-N-(4-メトキシ-フェニル)-ヒドラジン塩酸塩
トルエン(1.6L)中の4-メトキシフェニルヒドラジン塩酸塩(100g)、4-ブロモベンジルブロミド(150g)およびトリエチルアミン(167mL)の溶液を100℃に3時間加熱した。溶液を冷却し、ジエチルエーテル(800mL)を添加して、沈殿を生成させ、これをろ過によって除去した。ろ液を濃縮し、残渣をEtOAc(1L)に溶解させた。EtOAc中のHClの飽和溶液を添加し、ろ過によって沈殿を回収し、真空乾燥して、クリーム色固体(167g)を取得した。
トルエン(1.6L)中の4-メトキシフェニルヒドラジン塩酸塩(100g)、4-ブロモベンジルブロミド(150g)およびトリエチルアミン(167mL)の溶液を100℃に3時間加熱した。溶液を冷却し、ジエチルエーテル(800mL)を添加して、沈殿を生成させ、これをろ過によって除去した。ろ液を濃縮し、残渣をEtOAc(1L)に溶解させた。EtOAc中のHClの飽和溶液を添加し、ろ過によって沈殿を回収し、真空乾燥して、クリーム色固体(167g)を取得した。
ステップ3: 3-[1-(4-ブロモ-ベンジル)-3-tert-ブチルスルファニル-5-メトキシ-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 エチルエステル
トルエン(1.6L)中のN-(4-ブロモ-ベンジル)-N-(4-メトキシ-フェニル)-ヒドラジン塩酸塩(167g)、エチル 5-(t-ブチルチオ)-2,2-ジメチル-4-オキソ-ペンタノアート(米国特許第5,288,743号、1994年2月22日発行、に記載された操作法にしたがって調製; 130g)、酢酸ナトリウム(80g)、および酢酸(800mL)の溶液を室温で4日間撹拌した。混合物をH2Oに注ぎ入れ、EtOAcで4回抽出した後、ブラインで洗浄し、MgSO4上で乾燥し、ろ過し、濃縮して、暗赤-黒色油を取得した。ヘキサン:EtOAc(20:1)とともに練和して、表記化合物を灰白色固体(105g)として取得した。母液(ヘキサン中20% EtOAc)のシリカゲルクロマトグラフィーによって、表記化合物16gを取得し、回収物をまとめると、所望のインドール121gが得られた。
トルエン(1.6L)中のN-(4-ブロモ-ベンジル)-N-(4-メトキシ-フェニル)-ヒドラジン塩酸塩(167g)、エチル 5-(t-ブチルチオ)-2,2-ジメチル-4-オキソ-ペンタノアート(米国特許第5,288,743号、1994年2月22日発行、に記載された操作法にしたがって調製; 130g)、酢酸ナトリウム(80g)、および酢酸(800mL)の溶液を室温で4日間撹拌した。混合物をH2Oに注ぎ入れ、EtOAcで4回抽出した後、ブラインで洗浄し、MgSO4上で乾燥し、ろ過し、濃縮して、暗赤-黒色油を取得した。ヘキサン:EtOAc(20:1)とともに練和して、表記化合物を灰白色固体(105g)として取得した。母液(ヘキサン中20% EtOAc)のシリカゲルクロマトグラフィーによって、表記化合物16gを取得し、回収物をまとめると、所望のインドール121gが得られた。
ステップ4: 3-[1-(4-ブロモ-ベンジル)-3-tert-ブチルスルファニル-5-ヒドロキシ-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 エチルエステル
CH2Cl2(400mL)中の3-[1-(4-ブロモ-ベンジル)-3-tert-ブチルスルファニル-5-メトキシ-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 エチルエステル(121g)および2-メチル-2-プロパンチオール(200mL)に、0℃で、塩化アルミニウム(100g)を一部ずつ5分間で添加した。2時間後、混合物を氷への添加によって注意深く反応停止させた後、1N HCl(500mL)を添加した。混合物をCH2Cl2で2回抽出し、まとめた有機層をH2Oで洗浄し、MgSO4上で乾燥し、ろ過し、濃縮した。残渣のヘキサン:EtOAc(5:1)との練和によって、表記化合物を固体(96g)として取得した。
CH2Cl2(400mL)中の3-[1-(4-ブロモ-ベンジル)-3-tert-ブチルスルファニル-5-メトキシ-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 エチルエステル(121g)および2-メチル-2-プロパンチオール(200mL)に、0℃で、塩化アルミニウム(100g)を一部ずつ5分間で添加した。2時間後、混合物を氷への添加によって注意深く反応停止させた後、1N HCl(500mL)を添加した。混合物をCH2Cl2で2回抽出し、まとめた有機層をH2Oで洗浄し、MgSO4上で乾燥し、ろ過し、濃縮した。残渣のヘキサン:EtOAc(5:1)との練和によって、表記化合物を固体(96g)として取得した。
ステップ5: 3-{3-tert-ブチルスルファニル-5-ヒドロキシ-1-[4-(4,4,5,5-テトラメチル-[1,3,2]ジオキサボロラン-2-イル)-ベンジル]-1H-インドール-2-イル}-2,2-ジメチル-プロピオン酸 エチルエステル
3-[1-(4-ブロモ-ベンジル)-3-tert-ブチルスルファニル-5-ヒドロキシ-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 エチルエステル(5.0g、9.6mmol)、ビス(ピナコラト)ジボロン(Combi-Blocks; 2.94g、11.6mmol)、および酢酸カリウム(2.75g、28.9mmol)を耐圧フラスコ中の1,4-ジオキサン(30mL)に溶解させ、N2で30分脱気した。Pd(dppf)Cl2(0.79g、1.0mmol)を添加し、反応混合物をさらに30分、N2で脱気した。次にフラスコを密封し、反応物を110℃に一晩加熱した。反応混合物をH2OおよびEtOAc間で分配し、水性層をEtOAcで3回抽出し、その後まとめた有機層をH2O、ブラインで洗浄し、MgSO4上で乾燥し、ろ過し、濃縮した。粗物質をシリカゲルクロマトグラフィー(ヘキサン中0〜50% EtOAc)によって精製して、所望の生成物を取得した。
3-[1-(4-ブロモ-ベンジル)-3-tert-ブチルスルファニル-5-ヒドロキシ-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 エチルエステル(5.0g、9.6mmol)、ビス(ピナコラト)ジボロン(Combi-Blocks; 2.94g、11.6mmol)、および酢酸カリウム(2.75g、28.9mmol)を耐圧フラスコ中の1,4-ジオキサン(30mL)に溶解させ、N2で30分脱気した。Pd(dppf)Cl2(0.79g、1.0mmol)を添加し、反応混合物をさらに30分、N2で脱気した。次にフラスコを密封し、反応物を110℃に一晩加熱した。反応混合物をH2OおよびEtOAc間で分配し、水性層をEtOAcで3回抽出し、その後まとめた有機層をH2O、ブラインで洗浄し、MgSO4上で乾燥し、ろ過し、濃縮した。粗物質をシリカゲルクロマトグラフィー(ヘキサン中0〜50% EtOAc)によって精製して、所望の生成物を取得した。
ステップ6: 3-{3-tert-ブチルスルファニル-5-ヒドロキシ-1-[4-(6-メトキシ-ピリダジン-3-イル)-ベンジル]-1H-インドール-2-イル}-2,2-ジメチル-プロピオン酸 エチルエステル
3-{3-tert-ブチルスルファニル-5-ヒドロキシ-1-[4-(4,4,5,5-テトラメチル-[1,3,2]ジオキサボロラン-2-イル)-ベンジル]-1H-インドール-2-イル}-2,2-ジメチル-プロピオン酸 エチルエステル(0.5g、0.88mmol)、3-クロロ-6-メトキシピリダジン(Sigma-Aldrich; 0.19g、1.3mmol)、および炭酸カリウム(0.3g、2.2mmol)をDME(6mL)およびH2O(2mL)に溶解させ、N2で10分間脱気した。テトラキス(トリフェニルホスフィン)パラジウム(0)(0.1g、0.09mmol)を添加し、反応混合物をN2でさらに15分間脱気した。溶液を85℃に一晩加熱した後、室温まで冷却し、EtOAcおよびH2Oで希釈した。水性層をEtOAcで3回抽出し、まとめた有機層をH2O、ブラインで洗浄し、MgSO4上で乾燥し、ろ過し、濃縮した。粗物質をシリカゲルクロマトグラフィー(ヘキサン中0〜75% EtOAc)で精製して、所望の生成物を取得した。
3-{3-tert-ブチルスルファニル-5-ヒドロキシ-1-[4-(4,4,5,5-テトラメチル-[1,3,2]ジオキサボロラン-2-イル)-ベンジル]-1H-インドール-2-イル}-2,2-ジメチル-プロピオン酸 エチルエステル(0.5g、0.88mmol)、3-クロロ-6-メトキシピリダジン(Sigma-Aldrich; 0.19g、1.3mmol)、および炭酸カリウム(0.3g、2.2mmol)をDME(6mL)およびH2O(2mL)に溶解させ、N2で10分間脱気した。テトラキス(トリフェニルホスフィン)パラジウム(0)(0.1g、0.09mmol)を添加し、反応混合物をN2でさらに15分間脱気した。溶液を85℃に一晩加熱した後、室温まで冷却し、EtOAcおよびH2Oで希釈した。水性層をEtOAcで3回抽出し、まとめた有機層をH2O、ブラインで洗浄し、MgSO4上で乾燥し、ろ過し、濃縮した。粗物質をシリカゲルクロマトグラフィー(ヘキサン中0〜75% EtOAc)で精製して、所望の生成物を取得した。
ステップ7: (S)-2-{3-tert-ブチルスルファニル-2-(2-カルボキシ-2-メチル-プロピル)-1-[4-(6-メトキシ-ピリダジン-3-イル)-ベンジル]-1H-インドール-5-イルオキシメチル}-2,3-ジヒドロ-インドール-1-カルボン酸 tert-ブチルエステル
DMF(2mL)中の3-{3-tert-ブチルスルファニル-5-ヒドロキシ-1-[4-(6-メトキシ-ピリダジン-3-イル)-ベンジル]-1H-インドール-2-イル}-2,2-ジメチル-プロピオン酸 エチルエステル(0.2g、0.37mmol)に、N-BOC-(S)-2-(トルエン-4-スルホニルオキシメチル)-2,3-ジヒドロ-インドール(0.18g、0.45mmol)、炭酸セシウム(0.24g、0.74mmol)、および触媒性ヨウ化カリウムを添加した。反応物を60℃に一晩加熱した後、LCMS分析で反応の完結が示された。反応混合物をEtOAcで希釈し、H2Oで洗浄し、Na2SO4上で乾燥し、ろ過し、濃縮した。残渣をシリカゲルクロマトグラフィー(ヘキサン中0〜30% EtOAc)によって精製して、所望の生成物を取得した。
DMF(2mL)中の3-{3-tert-ブチルスルファニル-5-ヒドロキシ-1-[4-(6-メトキシ-ピリダジン-3-イル)-ベンジル]-1H-インドール-2-イル}-2,2-ジメチル-プロピオン酸 エチルエステル(0.2g、0.37mmol)に、N-BOC-(S)-2-(トルエン-4-スルホニルオキシメチル)-2,3-ジヒドロ-インドール(0.18g、0.45mmol)、炭酸セシウム(0.24g、0.74mmol)、および触媒性ヨウ化カリウムを添加した。反応物を60℃に一晩加熱した後、LCMS分析で反応の完結が示された。反応混合物をEtOAcで希釈し、H2Oで洗浄し、Na2SO4上で乾燥し、ろ過し、濃縮した。残渣をシリカゲルクロマトグラフィー(ヘキサン中0〜30% EtOAc)によって精製して、所望の生成物を取得した。
ステップ8: 3-{5-((S)-1-アセチル-2,3-ジヒドロ-1H-インドール-2-イルメトキシ)-3-tert-ブチルスルファニル-1-[4-(6-メトキシ-ピリダジン-3-イル)-ベンジル]-1H-インドール-2-イル}-2,2-ジメチル-プロピオン酸 エチルエステル
(S)-2-{3-tert-ブチルスルファニル-2-(2-カルボキシ-2-メチル-プロピル)-1-[4-(6-メトキシ-ピリダジン-3-イル)-ベンジル]-1H-インドール-5-イルオキシメチル}-2,3-ジヒドロ-インドール-1-カルボン酸 tert-ブチルエステル(0.23g、0.30mmol)をCH2Cl2(1.5mL)に溶解させた。TFA(1.5mL)を添加し、反応物を室温で10分間、LCMS分析によって出発物質が見られなくなるまで、撹拌した。溶液を真空濃縮し、粗生成物、3-{3-tert-ブチルスルファニル-5-[(S)-1-(2,3-ジヒドロ-1H-インドール-2-イル)メトキシ]-1-[4-(6-メトキシ-ピリダジン-3-イル)-ベンジル]-1H-インドール-2-イル}-2,2-ジメチル-プロピオン酸 エチルエステル(0.2g、0.30mmol)をCH2Cl2(1mL)に溶解させた。ジイソプロピルエチルアミン(0.5mL)を添加し、その後無水酢酸(0.03 mL、0.35mmol)を添加し、反応物を室温で、LCMS分析によって完結するまで、撹拌した。反応をメタノールで停止させ、10分間撹拌し、真空下で蒸発乾固させた。残渣をシリカゲルクロマトグラフィー(ヘキサン中0〜40% EtOAc)によって精製して、所望の生成物を取得した。
(S)-2-{3-tert-ブチルスルファニル-2-(2-カルボキシ-2-メチル-プロピル)-1-[4-(6-メトキシ-ピリダジン-3-イル)-ベンジル]-1H-インドール-5-イルオキシメチル}-2,3-ジヒドロ-インドール-1-カルボン酸 tert-ブチルエステル(0.23g、0.30mmol)をCH2Cl2(1.5mL)に溶解させた。TFA(1.5mL)を添加し、反応物を室温で10分間、LCMS分析によって出発物質が見られなくなるまで、撹拌した。溶液を真空濃縮し、粗生成物、3-{3-tert-ブチルスルファニル-5-[(S)-1-(2,3-ジヒドロ-1H-インドール-2-イル)メトキシ]-1-[4-(6-メトキシ-ピリダジン-3-イル)-ベンジル]-1H-インドール-2-イル}-2,2-ジメチル-プロピオン酸 エチルエステル(0.2g、0.30mmol)をCH2Cl2(1mL)に溶解させた。ジイソプロピルエチルアミン(0.5mL)を添加し、その後無水酢酸(0.03 mL、0.35mmol)を添加し、反応物を室温で、LCMS分析によって完結するまで、撹拌した。反応をメタノールで停止させ、10分間撹拌し、真空下で蒸発乾固させた。残渣をシリカゲルクロマトグラフィー(ヘキサン中0〜40% EtOAc)によって精製して、所望の生成物を取得した。
ステップ9: 3-{5-((S)-1-アセチル-2,3-ジヒドロ-1H-インドール-2-イルメトキシ)-3-tert-ブチルスルファニル-1-[4-(6-メトキシ-ピリダジン-3-イル)-ベンジル]-1H-インドール-2-イル}-2,2-ジメチル-プロピオン酸
3-{5-((S)-1-アセチル-2,3-ジヒドロ-1H-インドール-2-イルメトキシ)-3-tert-ブチルスルファニル-1-[4-(6-メトキシ-ピリダジン-3-イル)-ベンジル]-1H-インドール-2-イル}-2,2-ジメチル-プロピオン酸 エチルエステル(0.05g、0.07mmol)を、MeOH(0.1mL)、THF(0.1mL)、およびH2O(0.1mL)に溶解させた。水酸化リチウム(0.02g、0.58mmol)を添加し、反応物を12時間、tlc分析によって出発物質が見られなくなるまで、加熱した。反応物をH2Oで希釈し、クエン酸でpH 5まで酸性化し、EtOAcで抽出した。まとめた有機層をH2Oで洗浄し、MgSO4上で乾燥し、ろ過し、濃縮した。残渣をシリカゲルクロマトグラフィー(ヘキサン中0〜40% EtOAc)によって精製して、所望の生成物を取得した。
3-{5-((S)-1-アセチル-2,3-ジヒドロ-1H-インドール-2-イルメトキシ)-3-tert-ブチルスルファニル-1-[4-(6-メトキシ-ピリダジン-3-イル)-ベンジル]-1H-インドール-2-イル}-2,2-ジメチル-プロピオン酸 エチルエステル(0.05g、0.07mmol)を、MeOH(0.1mL)、THF(0.1mL)、およびH2O(0.1mL)に溶解させた。水酸化リチウム(0.02g、0.58mmol)を添加し、反応物を12時間、tlc分析によって出発物質が見られなくなるまで、加熱した。反応物をH2Oで希釈し、クエン酸でpH 5まで酸性化し、EtOAcで抽出した。まとめた有機層をH2Oで洗浄し、MgSO4上で乾燥し、ろ過し、濃縮した。残渣をシリカゲルクロマトグラフィー(ヘキサン中0〜40% EtOAc)によって精製して、所望の生成物を取得した。
(例4a)
3-[3-tert-ブチルスルファニル-1-(4-クロロ-ベンジル)-5-((S)-1-イソブチリル-ピロリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸(化合物1-4a)の合成
3-[3-tert-ブチルスルファニル-1-(4-クロロ-ベンジル)-5-((S)-1-イソブチリル-ピロリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸(化合物1-4a)の合成
ステップ1: N-BOC-(S)-2-(トルエン-4-スルホニルオキシメチル)ピロリジン
N-BOC-(S)-2-ヒドロキシメチルピロリジン(1.0g、5.0mmol)をピリジン(3mL)に溶解させ、トルエンスルホニルクロライド(1.04g、5.5mmol)を添加した。tlc分析によって反応が完結するまで、室温で撹拌し、その後真空濃縮した。粗物質をシリカゲルクロマトグラフィー(ヘキサン中0〜10% EtOAc)によって精製して、所望の生成物を取得した。
N-BOC-(S)-2-ヒドロキシメチルピロリジン(1.0g、5.0mmol)をピリジン(3mL)に溶解させ、トルエンスルホニルクロライド(1.04g、5.5mmol)を添加した。tlc分析によって反応が完結するまで、室温で撹拌し、その後真空濃縮した。粗物質をシリカゲルクロマトグラフィー(ヘキサン中0〜10% EtOAc)によって精製して、所望の生成物を取得した。
ステップ2: N-(4-クロロ-ベンジル)-N-(4-メトキシ-フェニル)-ヒドラジン塩酸塩
CH2Cl2(250mL)中の4-メトキシフェニルヒドラジン塩酸塩(10.0g、57.3mmol)、4-クロロベンジルクロリド(9.2g、57.2mmol)、テトラブチルアンモニウムブロミド(3.7g、11.5mmol)、およびジイソプロピルエチルアミン(20mL、115mmol)の溶液を室温で数日撹拌した。反応混合物をH2Oで希釈し、有機層を分離し、MgSO4上で乾燥し、ろ過し、濃縮した。残渣をトルエン(200mL)およびジエチルエーテル(100mL)中に入れ、0℃で1,4-ジオキサン中の1当量の4N HClを添加した。混合物を室温で2時間撹拌し、その後蒸発乾固して、所望の生成物を紫色固体として取得した。
CH2Cl2(250mL)中の4-メトキシフェニルヒドラジン塩酸塩(10.0g、57.3mmol)、4-クロロベンジルクロリド(9.2g、57.2mmol)、テトラブチルアンモニウムブロミド(3.7g、11.5mmol)、およびジイソプロピルエチルアミン(20mL、115mmol)の溶液を室温で数日撹拌した。反応混合物をH2Oで希釈し、有機層を分離し、MgSO4上で乾燥し、ろ過し、濃縮した。残渣をトルエン(200mL)およびジエチルエーテル(100mL)中に入れ、0℃で1,4-ジオキサン中の1当量の4N HClを添加した。混合物を室温で2時間撹拌し、その後蒸発乾固して、所望の生成物を紫色固体として取得した。
ステップ3: 3-[1-(4-クロロ-ベンジル)-3-tert-ブチルスルファニル-5-メトキシ-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 エチルエステル
N-(4-クロロ-ベンジル)-N-(4-メトキシ-フェニル)-ヒドラジン塩酸塩(~16g、57.3mmol)、エチル 5-(t-ブチルチオ)-2,2-ジメチル-4-オキソ-ペンタノアート(米国特許第5,288,743号、1994年2月22日発行、に記載された操作法にしたがって調製; 14.8g、57.3mmol)、酢酸ナトリウム(5.2g)、および酢酸(66mL)をトルエン(120mL)中に混合し、室温、暗所で5日間撹拌した。混合物をEtOAcおよびH2O間で分配し、有機層を固体NaHCO3とともに撹拌し、ろ過し、蒸発させた。残渣をシリカゲルクロマトグラフィー(ヘキサン中0〜55% CH2Cl2)によって精製し、単離した生成物をヘキサンから再結晶させて、所望の生成物を取得した。
N-(4-クロロ-ベンジル)-N-(4-メトキシ-フェニル)-ヒドラジン塩酸塩(~16g、57.3mmol)、エチル 5-(t-ブチルチオ)-2,2-ジメチル-4-オキソ-ペンタノアート(米国特許第5,288,743号、1994年2月22日発行、に記載された操作法にしたがって調製; 14.8g、57.3mmol)、酢酸ナトリウム(5.2g)、および酢酸(66mL)をトルエン(120mL)中に混合し、室温、暗所で5日間撹拌した。混合物をEtOAcおよびH2O間で分配し、有機層を固体NaHCO3とともに撹拌し、ろ過し、蒸発させた。残渣をシリカゲルクロマトグラフィー(ヘキサン中0〜55% CH2Cl2)によって精製し、単離した生成物をヘキサンから再結晶させて、所望の生成物を取得した。
ステップ4: 3-[1-(4-クロロ-ベンジル)-3-tert-ブチルスルファニル-5-ヒドロキシ-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 エチルエステル
塩化アルミニウム(0.820g 6.15mmol)を2-メチル-2-プロパンチオール(1.8mL、16mmol)中に懸濁させ、0℃まで冷却した。CH2Cl2(2.4mL)中の3-[1-(4-クロロ-ベンジル)-3-tert-ブチルスルファニル-5-メトキシ-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 エチルエステル(1.0gm 2.0mmol)を添加し、反応物を室温まで加温した。3時間後、tlc分析によれば反応が完結していたので、溶液をCH2Cl2で希釈し、氷冷水性10% HClで洗浄した。水性層をで3回抽出し、まとめた有機物をMgSO4上で乾燥し、ろ過し、濃縮して、所望の生成物を無色泡状物として取得した。
塩化アルミニウム(0.820g 6.15mmol)を2-メチル-2-プロパンチオール(1.8mL、16mmol)中に懸濁させ、0℃まで冷却した。CH2Cl2(2.4mL)中の3-[1-(4-クロロ-ベンジル)-3-tert-ブチルスルファニル-5-メトキシ-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 エチルエステル(1.0gm 2.0mmol)を添加し、反応物を室温まで加温した。3時間後、tlc分析によれば反応が完結していたので、溶液をCH2Cl2で希釈し、氷冷水性10% HClで洗浄した。水性層をで3回抽出し、まとめた有機物をMgSO4上で乾燥し、ろ過し、濃縮して、所望の生成物を無色泡状物として取得した。
ステップ5:(S)-2-[3-tert-ブチルスルファニル-1-(4-クロロ-ベンジル)-2-(2-エトキシカルボニル-2-メチル-プロピル)-1H-インドール-5-イルオキシメチル]-ピロリジン-1-カルボン酸 tert-ブチルエステル
DMF(2.5mL)中の3-[1-(4-クロロ-ベンジル)-3-tert-ブチルスルファニル-5-ヒドロキシ-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 エチルエステル(0.5g、1.05mmol)に、N-BOC-(S)-2-(トルエン-4-スルホニルオキシメチル)ピロリジン(0.39g、1.10mmol)および炭酸セシウム(0.69g、2.1mmol)を添加した。反応物を45℃で2時間撹拌した後、触媒性ヨウ化カリウムを添加し、反応物を60℃に一晩加熱した。反応混合物をEtOAcで希釈し、H2Oで洗浄し、Na2SO4上で乾燥し、ろ過し、濃縮した。残渣をシリカゲルクロマトグラフィー(ヘキサン中0〜15% EtOAc)によって精製して、所望の生成物を取得した。
DMF(2.5mL)中の3-[1-(4-クロロ-ベンジル)-3-tert-ブチルスルファニル-5-ヒドロキシ-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 エチルエステル(0.5g、1.05mmol)に、N-BOC-(S)-2-(トルエン-4-スルホニルオキシメチル)ピロリジン(0.39g、1.10mmol)および炭酸セシウム(0.69g、2.1mmol)を添加した。反応物を45℃で2時間撹拌した後、触媒性ヨウ化カリウムを添加し、反応物を60℃に一晩加熱した。反応混合物をEtOAcで希釈し、H2Oで洗浄し、Na2SO4上で乾燥し、ろ過し、濃縮した。残渣をシリカゲルクロマトグラフィー(ヘキサン中0〜15% EtOAc)によって精製して、所望の生成物を取得した。
ステップ6: 3-[3-tert-ブチルスルファニル-1-(4-クロロ-ベンジル)-5-((S)-1-イソブチリル-ピロリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 エチルエステル
(S)-2-[3-tert-ブチルスルファニル-1-(4-クロロ-ベンジル)-2-(2-エトキシカルボニル-2-メチル-プロピル)-1H-インドール-5-イルオキシメチル]-ピロリジン-1-カルボン酸 tert-ブチルエステル(0.94g、1.43mmol)をCH2Cl2(5mL)に溶解させた。TFA(2mL)を添加し、反応物を室温で4時間、tlc分析によって出発物質が見られなくなるまで、撹拌した。溶液を真空濃縮し、粗生成物、3-[3-tert-ブチルスルファニル-1-(4-クロロ-ベンジル)-5-((S)-ピロリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 エチルエステル(0.2g、0.31mmol)をCH2Cl2(3mL)に溶解させた。ジイソプロピルエチルアミン(1mL)を添加した後、イソブチリルクロリド(0.36mL、0.34mmol)を添加し、反応物を室温で1時間撹拌した。反応をメタノールで停止させ、10分間撹拌し、真空下で蒸発乾固させた。残渣をシリカゲルクロマトグラフィー(ヘキサン中0〜40% EtOAc)によって精製して、所望の生成物を取得した。
(S)-2-[3-tert-ブチルスルファニル-1-(4-クロロ-ベンジル)-2-(2-エトキシカルボニル-2-メチル-プロピル)-1H-インドール-5-イルオキシメチル]-ピロリジン-1-カルボン酸 tert-ブチルエステル(0.94g、1.43mmol)をCH2Cl2(5mL)に溶解させた。TFA(2mL)を添加し、反応物を室温で4時間、tlc分析によって出発物質が見られなくなるまで、撹拌した。溶液を真空濃縮し、粗生成物、3-[3-tert-ブチルスルファニル-1-(4-クロロ-ベンジル)-5-((S)-ピロリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 エチルエステル(0.2g、0.31mmol)をCH2Cl2(3mL)に溶解させた。ジイソプロピルエチルアミン(1mL)を添加した後、イソブチリルクロリド(0.36mL、0.34mmol)を添加し、反応物を室温で1時間撹拌した。反応をメタノールで停止させ、10分間撹拌し、真空下で蒸発乾固させた。残渣をシリカゲルクロマトグラフィー(ヘキサン中0〜40% EtOAc)によって精製して、所望の生成物を取得した。
ステップ7: 3-[3-tert-ブチルスルファニル-1-(4-クロロ-ベンジル)-5-((S)-1-イソブチリル-ピロリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸
3-[3-tert-ブチルスルファニル-1-(4-クロロ-ベンジル)-5-((S)-1-イソブチリル-ピロリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 エチルエステル(0.16g、0.26mmol)をMeOH(1mL)、THF(1mL)、およびH2O(1mL)に溶解させた。水酸化リチウム(0.6g、1.43mmol)を添加し、反応物を、tlc分析によって出発物質が見られなくなるまで、12時間加熱した。反応物をH2Oで希釈し、クエン酸でpH 5に酸性化し、EtOAcで抽出した。まとめた有機層をH2Oで洗浄し、MgSO4上で乾燥し、ろ過し、濃縮した。残渣をシリカゲル上で(ヘキサン中0〜40% EtOAc)で精製して、所望の生成物を取得した。
3-[3-tert-ブチルスルファニル-1-(4-クロロ-ベンジル)-5-((S)-1-イソブチリル-ピロリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 エチルエステル(0.16g、0.26mmol)をMeOH(1mL)、THF(1mL)、およびH2O(1mL)に溶解させた。水酸化リチウム(0.6g、1.43mmol)を添加し、反応物を、tlc分析によって出発物質が見られなくなるまで、12時間加熱した。反応物をH2Oで希釈し、クエン酸でpH 5に酸性化し、EtOAcで抽出した。まとめた有機層をH2Oで洗浄し、MgSO4上で乾燥し、ろ過し、濃縮した。残渣をシリカゲル上で(ヘキサン中0〜40% EtOAc)で精製して、所望の生成物を取得した。
(例5a)
3-[3-tert-ブチルスルファニル-1-[4-(5-ヒドロキシメチル-ピリジン-2-イル)-ベンジル]-5-(5-メチル-ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸(化合物1-5a)の合成
3-[3-tert-ブチルスルファニル-1-[4-(5-ヒドロキシメチル-ピリジン-2-イル)-ベンジル]-5-(5-メチル-ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸(化合物1-5a)の合成
ステップ1: 2,5-ジメチル-ピリジン 1-オキシド
2,5-ルチジン(5.0g、46.7mmol)をCHCl3(125mL)に溶解させ、0℃まで冷却した。m-クロロペルオキシ安息香酸(70%; 13.9g、55.2mmol)を添加し、反応物を室温で一晩撹拌した。混合物を飽和水性Na2CO3で洗浄し、Na2SO4上で乾燥し、ろ過し、濃縮して、所望の生成物(5.7g)を取得した。
2,5-ルチジン(5.0g、46.7mmol)をCHCl3(125mL)に溶解させ、0℃まで冷却した。m-クロロペルオキシ安息香酸(70%; 13.9g、55.2mmol)を添加し、反応物を室温で一晩撹拌した。混合物を飽和水性Na2CO3で洗浄し、Na2SO4上で乾燥し、ろ過し、濃縮して、所望の生成物(5.7g)を取得した。
ステップ2: 酢酸 5-メチル-ピリジン-2-イルメチルエステル
2,5-ジメチル-ピリジン 1-オキシド(5.7g、46.7mmol)を無水酢酸(25mL)に溶解させ、100℃で1時間還流加熱した。混合物を室温まで冷却し、エタノール(2.7mL、46.7mmol)を徐々に添加して、反応を停止させた。溶液を蒸発乾固し、シリカゲルクロマトグラフィーによって精製して、所望の生成物(7.7g)を取得した。
2,5-ジメチル-ピリジン 1-オキシド(5.7g、46.7mmol)を無水酢酸(25mL)に溶解させ、100℃で1時間還流加熱した。混合物を室温まで冷却し、エタノール(2.7mL、46.7mmol)を徐々に添加して、反応を停止させた。溶液を蒸発乾固し、シリカゲルクロマトグラフィーによって精製して、所望の生成物(7.7g)を取得した。
ステップ3: (5-メチル-ピリジン-2-イル)-メタノール
酢酸 5-メチル-ピリジン-2-イルメチルエステル(7.7g、46.7mmol)を濃HCl(20mL)に溶解させ、1時間還流させた。反応物を冷却し、蒸発乾固して、オレンジ色固体を取得し、これをそのまま次の反応で使用した。
酢酸 5-メチル-ピリジン-2-イルメチルエステル(7.7g、46.7mmol)を濃HCl(20mL)に溶解させ、1時間還流させた。反応物を冷却し、蒸発乾固して、オレンジ色固体を取得し、これをそのまま次の反応で使用した。
ステップ4: 2-クロロメチル-5-メチル-ピリジン
(5-メチル-ピリジン-2-イル)-メタノール(1.0g、8.1mmol)をチオニルクロリド(3mL)に溶解させ、N2下、室温で30分、撹拌した。混合物を蒸発乾固して、 所望の生成物を塩酸塩として取得し、これをそのままその後の反応で使用した。
(5-メチル-ピリジン-2-イル)-メタノール(1.0g、8.1mmol)をチオニルクロリド(3mL)に溶解させ、N2下、室温で30分、撹拌した。混合物を蒸発乾固して、 所望の生成物を塩酸塩として取得し、これをそのままその後の反応で使用した。
ステップ5: 3-{3-tert-ブチルスルファニル-5-(5-メチル-ピリジン-2-イルメトキシ)-1-[4-(4,4,5,5-テトラメチル-[1,3,2]ジオキサボロラン-2-イル)-ベンジル]-1H-インドール-2-イル}-2,2-ジメチル-プロピオン酸 エチルエステル
3-{3-tert-ブチルスルファニル-5-ヒドロキシ-1-[4-(4,4,5,5-テトラメチル-[1,3,2]ジオキサボロラン-2-イル)-ベンジル]-1H-インドール-2-イル}-2,2-ジメチル-プロピオン酸 エチルエステル(4.53g、8.0mmol)、2-クロロメチル-5-メチル-ピリジン(1.71g、9.6mmol)、炭酸セシウム(7.80g、24.0mmol)、およびテトラブチルアンモニウムブロミド(0.13g、0.4mmol)を、3:1 MeCN:DMF(100mL)中で混合した。反応物を90℃に4時間、その後、70℃に一晩加熱した。LCMS分析は出発物質の15%が残留していたので、さらに2-クロロメチル-5-メチル-ピリジン(0.5g)および炭酸セシウム(1.5g)を添加し、温度を105℃に2時間上昇させた。LCMS分析で出発物質が見られなくなった後、混合物をH2Oで希釈し、EtOAcで抽出した。まとめた有機層をMgSO4上で乾燥し、ろ過し、濃縮し、残渣をシリカゲルクロマトグラフィーによって精製して、所望の生成物(3.78g)を取得した。
3-{3-tert-ブチルスルファニル-5-ヒドロキシ-1-[4-(4,4,5,5-テトラメチル-[1,3,2]ジオキサボロラン-2-イル)-ベンジル]-1H-インドール-2-イル}-2,2-ジメチル-プロピオン酸 エチルエステル(4.53g、8.0mmol)、2-クロロメチル-5-メチル-ピリジン(1.71g、9.6mmol)、炭酸セシウム(7.80g、24.0mmol)、およびテトラブチルアンモニウムブロミド(0.13g、0.4mmol)を、3:1 MeCN:DMF(100mL)中で混合した。反応物を90℃に4時間、その後、70℃に一晩加熱した。LCMS分析は出発物質の15%が残留していたので、さらに2-クロロメチル-5-メチル-ピリジン(0.5g)および炭酸セシウム(1.5g)を添加し、温度を105℃に2時間上昇させた。LCMS分析で出発物質が見られなくなった後、混合物をH2Oで希釈し、EtOAcで抽出した。まとめた有機層をMgSO4上で乾燥し、ろ過し、濃縮し、残渣をシリカゲルクロマトグラフィーによって精製して、所望の生成物(3.78g)を取得した。
ステップ6: 3-[3-tert-ブチルスルファニル-1-[4-(5-ヒドロキシメチル-ピリジン-2-イル)-ベンジル]-5-(5-メチル-ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 エチルエステル
3-{3-tert-ブチルスルファニル-5-(5-メチル-ピリジン-2-イルメトキシ)-1-[4-(4,4,5,5-テトラメチル-[1,3,2]ジオキサボロラン-2-イル)-ベンジル]-1H-インドール-2-イル}-2,2-ジメチル-プロピオン酸 エチルエステル(3.78g、5.63mmol)、2-クロロ-5-ヒドロキシメチルピリジン(0.973g、6.76mmol)、および炭酸カリウム(2.72g、19.7mmol)を2:1 DME:H2O(60mL)中で混合し、N2で10分間脱気した。テトラキス(トリフェニルホスフィン)パラジウム(0)(0.325g、0.28mmol)を添加し、反応物を80℃で一晩撹拌した。分析用LCMSで出発物質が見られなくなった後、混合物をH2Oで希釈し、EtOAcで抽出し、まとめた有機層をMgSO4上で乾燥し、ろ過し、濃縮した。残渣をシリカゲルクロマトグラフィーによって精製して、所望の生成物(2.96g)を取得した。
3-{3-tert-ブチルスルファニル-5-(5-メチル-ピリジン-2-イルメトキシ)-1-[4-(4,4,5,5-テトラメチル-[1,3,2]ジオキサボロラン-2-イル)-ベンジル]-1H-インドール-2-イル}-2,2-ジメチル-プロピオン酸 エチルエステル(3.78g、5.63mmol)、2-クロロ-5-ヒドロキシメチルピリジン(0.973g、6.76mmol)、および炭酸カリウム(2.72g、19.7mmol)を2:1 DME:H2O(60mL)中で混合し、N2で10分間脱気した。テトラキス(トリフェニルホスフィン)パラジウム(0)(0.325g、0.28mmol)を添加し、反応物を80℃で一晩撹拌した。分析用LCMSで出発物質が見られなくなった後、混合物をH2Oで希釈し、EtOAcで抽出し、まとめた有機層をMgSO4上で乾燥し、ろ過し、濃縮した。残渣をシリカゲルクロマトグラフィーによって精製して、所望の生成物(2.96g)を取得した。
ステップ7: 3-[3-tert-ブチルスルファニル-1-[4-(5-ヒドロキシメチル-ピリジン-2-イル)-ベンジル]-5-(5-メチル-ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸
1:1 MeOH:THF(12mL)中の3-[3-tert-ブチルスルファニル-1-[4-(5-ヒドロキシメチル-ピリジン-2-イル)-ベンジル]-5-(5-メチル-ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 エチルエステル(0.415g、0.64mmol)に、水性LiOH(1N; 3.0mL)を添加し、反応混合物を65℃で2時間撹拌した。溶液をpH 5-6に中和し、EtOAcで抽出した。まとめた有機層をMgSO4上で乾燥し、ろ過し、濃縮して、所望の生成物(0.420g)を取得した。
1:1 MeOH:THF(12mL)中の3-[3-tert-ブチルスルファニル-1-[4-(5-ヒドロキシメチル-ピリジン-2-イル)-ベンジル]-5-(5-メチル-ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 エチルエステル(0.415g、0.64mmol)に、水性LiOH(1N; 3.0mL)を添加し、反応混合物を65℃で2時間撹拌した。溶液をpH 5-6に中和し、EtOAcで抽出した。まとめた有機層をMgSO4上で乾燥し、ろ過し、濃縮して、所望の生成物(0.420g)を取得した。
(例6a)
3-[3-tert-ブチルスルファニル-1-[4-(6-エトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 2,3-ジヒドロキシ-プロピルエステル(化合物1-6a)の合成
ステップ1: 3-[3-tert-ブチルスルファニル-1-[4-(6-エトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 ナトリウム塩
EtOH(3mL)中の3-[3-tert-ブチルスルファニル-1-[4-(6-エトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸(米国特許公開番号 2007/0105866に記載された操作法にしたがって調製; 化合物2〜94参照; 0.067g、0.107mmol)に、1N 水性NaOH(0.11mL、0.109mmol)を添加し、溶液を室温で15分間撹拌した。その後、混合物を濃縮乾固し、残渣を脱イオンH2Oに溶解させ、凍結させた。凍結乾燥によってH2Oを除去して、所望の塩を白色粉末として取得した。
EtOH(3mL)中の3-[3-tert-ブチルスルファニル-1-[4-(6-エトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸(米国特許公開番号 2007/0105866に記載された操作法にしたがって調製; 化合物2〜94参照; 0.067g、0.107mmol)に、1N 水性NaOH(0.11mL、0.109mmol)を添加し、溶液を室温で15分間撹拌した。その後、混合物を濃縮乾固し、残渣を脱イオンH2Oに溶解させ、凍結させた。凍結乾燥によってH2Oを除去して、所望の塩を白色粉末として取得した。
ステップ2: 3-[3-tert-ブチルスルファニル-1-[4-(6-エトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 2,2-ジメチル-[1,3]ジオキソラン-4-イルメチルエステル
3-[3-tert-ブチルスルファニル-1-[4-(6-エトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 ナトリウム塩(0.500g、0.77mmol)をジクロロエタン(3mL)に溶解させ、0℃まで冷却した。オキサリルクロリド(0.08mL、0.92mmol)を添加し、反応物を15分間撹拌した。次に、DL-1,2-イソプロピリデングリセロール(0.163g、1.23mmol)、ジイソプロピルエチルアミン(0.40mL、2.30mmol)、および触媒性DMAPを添加し、混合物を室温で一晩撹拌した。分析用LCMSで出発物質が見られなくなった後、溶液をEtOAcおよびH2O間で分配し、水性層をEtOAcで抽出した。まとめた有機層をMgSO4上で乾燥し、ろ過し、濃縮し、残渣をシリカゲルクロマトグラフィーによって精製して、所望の生成物を取得した。
3-[3-tert-ブチルスルファニル-1-[4-(6-エトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 ナトリウム塩(0.500g、0.77mmol)をジクロロエタン(3mL)に溶解させ、0℃まで冷却した。オキサリルクロリド(0.08mL、0.92mmol)を添加し、反応物を15分間撹拌した。次に、DL-1,2-イソプロピリデングリセロール(0.163g、1.23mmol)、ジイソプロピルエチルアミン(0.40mL、2.30mmol)、および触媒性DMAPを添加し、混合物を室温で一晩撹拌した。分析用LCMSで出発物質が見られなくなった後、溶液をEtOAcおよびH2O間で分配し、水性層をEtOAcで抽出した。まとめた有機層をMgSO4上で乾燥し、ろ過し、濃縮し、残渣をシリカゲルクロマトグラフィーによって精製して、所望の生成物を取得した。
ステップ3: 3-[3-tert-ブチルスルファニル-1-[4-(6-エトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 2,3-ジヒドロキシ-プロピルエステル
THF(2mL)およびH2O(1mL)中の3-[3-tert-ブチルスルファニル-1-[4-(6-エトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 2,2-ジメチル-[1,3]ジオキソラン-4-イルメチルエステル(0.080g、0.11mmol)に、HCl(1,4-ジオキサン中4N; 0.5mL)を添加し、反応物を、LCMS分析によって出発物質が見られなくなるまで、室温で撹拌した。混合物を飽和水性NaHCO3で反応停止させ、EtOAcで2回抽出した。まとめた有機層をMgSO4上で乾燥し、ろ過し、濃縮し、残渣をシリカゲルクロマトグラフィーによって精製して、所望の生成物を取得した。
THF(2mL)およびH2O(1mL)中の3-[3-tert-ブチルスルファニル-1-[4-(6-エトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 2,2-ジメチル-[1,3]ジオキソラン-4-イルメチルエステル(0.080g、0.11mmol)に、HCl(1,4-ジオキサン中4N; 0.5mL)を添加し、反応物を、LCMS分析によって出発物質が見られなくなるまで、室温で撹拌した。混合物を飽和水性NaHCO3で反応停止させ、EtOAcで2回抽出した。まとめた有機層をMgSO4上で乾燥し、ろ過し、濃縮し、残渣をシリカゲルクロマトグラフィーによって精製して、所望の生成物を取得した。
(例7a)
3-[3-tert-ブチルスルファニル-1-[4-(6-エトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 イソソルビドエステル(化合物1-7a)の合成
3-[3-tert-ブチルスルファニル-1-[4-(6-エトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 イソソルビドエステル(化合物1-7a)の合成
ステップ1: 3-[3-tert-ブチルスルファニル-1-[4-(6-エトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 イソソルビドエステル
3-[3-tert-ブチルスルファニル-1-[4-(6-エトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 ナトリウム塩(0.500g、0.77mmol)をジクロロエタン(3mL)に溶解させ、0℃まで冷却した。オキサリルクロリド(0.08mL、0.92mmol)を添加し、反応物を15分間撹拌した。次に、イソソルビド(0.169g、1.55mmol)、ジイソプロピルエチルアミン(0.50mL、2.86mmol)、および触媒性DMAPを添加し、混合物を室温で一晩撹拌した。分析用LCMSで出発物質が見られなくなった後、溶液をEtOAcおよびH2O間で分配し、水性層をEtOAcで抽出した。まとめた有機層をMgSO4上で乾燥し、ろ過し、濃縮し、残渣をシリカゲルクロマトグラフィーによって精製して、所望の生成物を取得した。
3-[3-tert-ブチルスルファニル-1-[4-(6-エトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 ナトリウム塩(0.500g、0.77mmol)をジクロロエタン(3mL)に溶解させ、0℃まで冷却した。オキサリルクロリド(0.08mL、0.92mmol)を添加し、反応物を15分間撹拌した。次に、イソソルビド(0.169g、1.55mmol)、ジイソプロピルエチルアミン(0.50mL、2.86mmol)、および触媒性DMAPを添加し、混合物を室温で一晩撹拌した。分析用LCMSで出発物質が見られなくなった後、溶液をEtOAcおよびH2O間で分配し、水性層をEtOAcで抽出した。まとめた有機層をMgSO4上で乾燥し、ろ過し、濃縮し、残渣をシリカゲルクロマトグラフィーによって精製して、所望の生成物を取得した。
一般的操作法:
DMF(5 ml)中の酸A(1.26 mmol)および硝酸6-ブロモヘキシル(F. Conrad Engelhardt et al, J. Org. Chem., 2006, 71, 480-491; 1.4 mmol)の混合物に、Cs2CO3(6 mmol)を添加した。混合物を室温で一晩撹拌した。水を添加し、反応混合物を酢酸エチルで抽出した。抽出物をブラインで洗浄し、Na2SO4上で乾燥し、ろ過し、溶媒を減圧下で蒸発させた。得られた残渣をクロマトグラフィー(シリカゲル、3:1 Hex:EtOAcで溶出)によって精製して、生成物Bを取得した。
DMF(5 ml)中の酸A(1.26 mmol)および硝酸6-ブロモヘキシル(F. Conrad Engelhardt et al, J. Org. Chem., 2006, 71, 480-491; 1.4 mmol)の混合物に、Cs2CO3(6 mmol)を添加した。混合物を室温で一晩撹拌した。水を添加し、反応混合物を酢酸エチルで抽出した。抽出物をブラインで洗浄し、Na2SO4上で乾燥し、ろ過し、溶媒を減圧下で蒸発させた。得られた残渣をクロマトグラフィー(シリカゲル、3:1 Hex:EtOAcで溶出)によって精製して、生成物Bを取得した。
(例1b)
3-[3-tert-ブチルスルファニル-1-(4-クロロ-ベンジル)-5-イソプロピル-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 6-ニトロオキシ-ヘキシルエステル(化合物1-1b)の合成
3-[3-tert-ブチルスルファニル-1-(4-クロロ-ベンジル)-5-イソプロピル-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 6-ニトロオキシ-ヘキシルエステル(化合物1-1b)の合成
ステップ1: 3-[3-tert-ブチルスルファニル-1-(4-クロロ-ベンジル)-5-イソプロピル-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 6-ニトロオキシ-ヘキシルエステル
DMF(5 ml)中の3-[3-tert-ブチルスルファニル-1-(4-クロロ-ベンジル)-5-イソプロピル-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸(1.26 mmol)および硝酸6-ブロモヘキシル(F. Conrad Engelhardt et al, J. Org. Chem., 2006, 71, 480-491; 1.4 mmol)の混合物に、CsCO3(6 mmol)を添加した。混合物を室温で一晩撹拌した。H2Oを添加し、反応混合物を酢酸エチルで抽出した。抽出物をブラインで洗浄し、Na2SO4上で乾燥し、ろ過し、溶媒を減圧下で蒸発させた。得られた残渣をシリカゲルクロマトグラフィー(ヘキサン中25% EtOAc)によって精製して、所望の生成物を取得した。
DMF(5 ml)中の3-[3-tert-ブチルスルファニル-1-(4-クロロ-ベンジル)-5-イソプロピル-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸(1.26 mmol)および硝酸6-ブロモヘキシル(F. Conrad Engelhardt et al, J. Org. Chem., 2006, 71, 480-491; 1.4 mmol)の混合物に、CsCO3(6 mmol)を添加した。混合物を室温で一晩撹拌した。H2Oを添加し、反応混合物を酢酸エチルで抽出した。抽出物をブラインで洗浄し、Na2SO4上で乾燥し、ろ過し、溶媒を減圧下で蒸発させた。得られた残渣をシリカゲルクロマトグラフィー(ヘキサン中25% EtOAc)によって精製して、所望の生成物を取得した。
1H NMR δ 7.63(s、1H)、7.19(d、2H)、7.02(s、2H)、6.74(d、2H)、5.32(s、2H)、4.38(t、2H)、3.97(t、2H)、3.25(s、2H)、3.01(m、1H)、1.62-1.15(m、29H).
(例2b)
3-[3-tert-ブチルスルファニル-1-[4-(6-メトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 6-ニトロオキシ-ヘキシルエステル(化合物1-2b)の合成
(例2b)
3-[3-tert-ブチルスルファニル-1-[4-(6-メトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 6-ニトロオキシ-ヘキシルエステル(化合物1-2b)の合成
ステップ1: 3-[3-tert-ブチルスルファニル-1-[4-(6-メトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 6-ニトロオキシ-ヘキシルエステル
以下の出発物質: 3-[3-tert-ブチルスルファニル-1-[4-(6-メトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸および硝酸 6-ブロモヘキシルを使用して、実施例1b、ステップ1に記載した操作法にしたがって調製した。
以下の出発物質: 3-[3-tert-ブチルスルファニル-1-[4-(6-メトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸および硝酸 6-ブロモヘキシルを使用して、実施例1b、ステップ1に記載した操作法にしたがって調製した。
1H NMR(CDCl3) δ 8.6(d、1H)、8.31(d、1H)、7.70(dd、2H)、7.57(d、1H)、7.38(d、2H)、7.32(d、1H)、7.20(m、1H)、7.08(d、1H)、6.89(dd、1H)、6.84(d、2H)、6.77(d、1H)、5.41(s、2H)、5.27(s、2H)、4.36(t、2H)、3.96(m、5H)、3.28(s、2H)、1.57-1.20(m、23H).
(例3b)
3-{5-((S)-1-アセチル-2,3-ジヒドロ-1H-インドール-2-イルメトキシ)-3-tert-ブチルスルファニル-1-[4-(6-メトキシ-ピリダジン-3-イル)-ベンジル]-1H-インドール-2-イル}-2,2-ジメチル-プロピオン酸 6-ニトロオキシ-ヘキシルエステル(化合物1-3b)の合成
(例3b)
3-{5-((S)-1-アセチル-2,3-ジヒドロ-1H-インドール-2-イルメトキシ)-3-tert-ブチルスルファニル-1-[4-(6-メトキシ-ピリダジン-3-イル)-ベンジル]-1H-インドール-2-イル}-2,2-ジメチル-プロピオン酸 6-ニトロオキシ-ヘキシルエステル(化合物1-3b)の合成
ステップ1: 3-{5-((S)-1-アセチル-2,3-ジヒドロ-1H-インドール-2-イルメトキシ)-3-tert-ブチルスルファニル-1-[4-(6-メトキシ-ピリダジン-3-イル)-ベンジル]-1H-インドール-2-イル}-2,2-ジメチル-プロピオン酸 6-ニトロオキシ-ヘキシルエステル
以下の出発物質: 3-{5-((S)-1-アセチル-2,3-ジヒドロ-1H-インドール-2-イルメトキシ)-3-tert-ブチルスルファニル-1-[4-(6-メトキシ-ピリダジン-3-イル)-ベンジル]-1H-インドール-2-イル}-2,2-ジメチル-プロピオン酸および硝酸6-ブロモヘキシルを使用して、実施例1b、ステップ1に記載した操作法にしたがって調製した。
以下の出発物質: 3-{5-((S)-1-アセチル-2,3-ジヒドロ-1H-インドール-2-イルメトキシ)-3-tert-ブチルスルファニル-1-[4-(6-メトキシ-ピリダジン-3-イル)-ベンジル]-1H-インドール-2-イル}-2,2-ジメチル-プロピオン酸および硝酸6-ブロモヘキシルを使用して、実施例1b、ステップ1に記載した操作法にしたがって調製した。
1H NMR(CDCl3) δ 7.86(d、2H)、7.70(d、1H)、7.24(d、1H)、7.21(dd、4H)、6.87(d、2H)、6.73(d、1H)、5.42(s、2H)、4.34(t、2H)、4.23(s、3H)、3.97(t、2H)、3.3(m、4H)、1.62-1.20(m、23H).
(例4b)
3-[3-tert-ブチルスルファニル-1-(4-クロロ-ベンジル)-5-((S)-1-イソブチリル-ピロリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 6-ニトロオキシ-ヘキシルエステル(化合物1-4b)の合成
(例4b)
3-[3-tert-ブチルスルファニル-1-(4-クロロ-ベンジル)-5-((S)-1-イソブチリル-ピロリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 6-ニトロオキシ-ヘキシルエステル(化合物1-4b)の合成
ステップ1: 3-[3-tert-ブチルスルファニル-1-(4-クロロ-ベンジル)-5-((S)-1-イソブチリル-ピロリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 6-ニトロオキシ-ヘキシルエステル
以下の出発物質: 3-[3-tert-ブチルスルファニル-1-(4-クロロ-ベンジル)-5-((S)-1-イソブチリル-ピロリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸および硝酸 6-ブロモヘキシルを使用して、実施例1b、ステップ1に記載した操作法にしたがって調製した。
以下の出発物質: 3-[3-tert-ブチルスルファニル-1-(4-クロロ-ベンジル)-5-((S)-1-イソブチリル-ピロリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸および硝酸 6-ブロモヘキシルを使用して、実施例1b、ステップ1に記載した操作法にしたがって調製した。
1H NMR(CDCl3) δ 8.12-8.07(m、1H)、7.29-7.24(m、2H)、7.23-7.16(m、2H)、7.04-6.95(m、1H)、6.86-6.75(m、1H)、6.74-6.67(m、2H)、5.38-5.29(m、2H)、4.72-4.67(m、1H)、4.52-4.43(m、1H)、4.42-4.36(m、2H)、4.22-4.01(m、2H)、4.00-3.72(m、2H)、3.71-3.46(m、3H)、3.47-3.35(m、1H)、3.30-3.18(m、2H)、2.23-1.84(m、3H)、1.69-1.44(m、6H)、1.35-1.17(m、15H)、1.17-1.18(m、3H)、0.94-0.82(m、2H).
(例5b)
3-{3-tert-ブチルスルファニル-5-(5-メチル-ピリジン-2-イルメトキシ)-1-[4-(5-ニトロオキシメチル-ピリジン-2-イル)-ベンジル]-1H-インドール-2-イル}-2,2-ジメチル-プロピオン酸(化合物1-5b)の合成
(例5b)
3-{3-tert-ブチルスルファニル-5-(5-メチル-ピリジン-2-イルメトキシ)-1-[4-(5-ニトロオキシメチル-ピリジン-2-イル)-ベンジル]-1H-インドール-2-イル}-2,2-ジメチル-プロピオン酸(化合物1-5b)の合成
ステップ4: 3-[3-tert-ブチルスルファニル-1-[4-(5-クロロメチル-ピリジン-2-イル)-ベンジル]-5-(5-メチル-ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸
CH2Cl2(10mL)中の3-[3-tert-ブチルスルファニル-1-[4-(5-ヒドロキシメチル-ピリジン-2-イル)-ベンジル]-5-(5-メチル-ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸(0.195g、0.31mmol)に、チオニルクロリド(0.45mL、6.2mmol)を添加し、反応物を室温で1時間撹拌した。混合物を濃縮した後、THF(20mL)に溶解させ、水性LiOH(1N; 4.0mL)で処理した。20分間激しく撹拌した後、反応を水性HCl(1N、5mL)で停止させ、EtOAc(100mL)およびH2O(20mL)間で分配した。有機層をH2Oおよびブラインで洗浄し、MgSO4上で乾燥し、ろ過し、濃縮して、所望の生成物(0.175g)とした。
CH2Cl2(10mL)中の3-[3-tert-ブチルスルファニル-1-[4-(5-ヒドロキシメチル-ピリジン-2-イル)-ベンジル]-5-(5-メチル-ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸(0.195g、0.31mmol)に、チオニルクロリド(0.45mL、6.2mmol)を添加し、反応物を室温で1時間撹拌した。混合物を濃縮した後、THF(20mL)に溶解させ、水性LiOH(1N; 4.0mL)で処理した。20分間激しく撹拌した後、反応を水性HCl(1N、5mL)で停止させ、EtOAc(100mL)およびH2O(20mL)間で分配した。有機層をH2Oおよびブラインで洗浄し、MgSO4上で乾燥し、ろ過し、濃縮して、所望の生成物(0.175g)とした。
ステップ5: 3-{3-tert-ブチルスルファニル-5-(5-メチル-ピリジン-2-イルメトキシ)-1-[4-(5-ニトロオキシメチル-ピリジン-2-イル)-ベンジル]-1H-インドール-2-イル}-2,2-ジメチル-プロピオン酸
3-[3-tert-ブチルスルファニル-1-[4-(5-クロロメチル-ピリジン-2-イル)-ベンジル]-5-(5-メチル-ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸(0.173g、0.27mmol)を室温でMeCN(5mL)に溶解させた。硝酸銀(0.064g、0.38mmol)およびテトラブチルアンモニウムブロミド(0.010g、0.03mmol)を添加し、反応物をフォイルで覆い、80℃で5時間加熱した。分析用LCMSで出発物質が見られなくなった後、混合物をEtOAcおよびH2O間で分配した。水性層をEtOAcで抽出し、まとめた有機層をMgSO4上で乾燥し、ろ過し、濃縮した。残渣を調製用HPLCによって精製して、所望の生成物(0.048g)を取得した。
3-[3-tert-ブチルスルファニル-1-[4-(5-クロロメチル-ピリジン-2-イル)-ベンジル]-5-(5-メチル-ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸(0.173g、0.27mmol)を室温でMeCN(5mL)に溶解させた。硝酸銀(0.064g、0.38mmol)およびテトラブチルアンモニウムブロミド(0.010g、0.03mmol)を添加し、反応物をフォイルで覆い、80℃で5時間加熱した。分析用LCMSで出発物質が見られなくなった後、混合物をEtOAcおよびH2O間で分配した。水性層をEtOAcで抽出し、まとめた有機層をMgSO4上で乾燥し、ろ過し、濃縮した。残渣を調製用HPLCによって精製して、所望の生成物(0.048g)を取得した。
(例6b)
3-[3-tert-ブチルスルファニル-1-[4-(6-エトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 2-ヒドロキシ-3-ニトロオキシ-プロピルエステル(化合物1-6b)の合成
3-[3-tert-ブチルスルファニル-1-[4-(6-エトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 2-ヒドロキシ-3-ニトロオキシ-プロピルエステル(化合物1-6b)の合成
ステップ1: 3-ニトロオキシ-プロパン-1,2-ジオール
THF(23mL)中のグリセロール(0.92g、10.0mmol)に、硝酸銀(1.70g、10.0mmol)を添加し、その後チオニルクロリド(0.73mL、10.0mmol)を滴下した。溶液を室温で一晩撹拌し、反応の経過中、沈殿が徐々に出現した。混合物をEtOAcおよびH2O間で分配し、水性層をEtOAcで抽出した。まとめた有機層をMgSO4上で乾燥し、ろ過し、濃縮し、残渣をシリカゲルクロマトグラフィー(ヘキサン中0-50% EtOAc)によって精製して、所望の生成物を取得した。
THF(23mL)中のグリセロール(0.92g、10.0mmol)に、硝酸銀(1.70g、10.0mmol)を添加し、その後チオニルクロリド(0.73mL、10.0mmol)を滴下した。溶液を室温で一晩撹拌し、反応の経過中、沈殿が徐々に出現した。混合物をEtOAcおよびH2O間で分配し、水性層をEtOAcで抽出した。まとめた有機層をMgSO4上で乾燥し、ろ過し、濃縮し、残渣をシリカゲルクロマトグラフィー(ヘキサン中0-50% EtOAc)によって精製して、所望の生成物を取得した。
ステップ2: 3-[3-tert-ブチルスルファニル-1-[4-(6-エトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 2-ヒドロキシ-3-ニトロオキシ-プロピルエステル
3-[3-tert-ブチルスルファニル-1-[4-(6-エトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 ナトリウム塩(0.400g、0.62mmol)をジクロロエタン(3mL)に溶解させ、0℃まで冷却した。オキサリルクロリド(0.06mL、0.69mmol)を添加し、反応物を15分間撹拌した。その後3-ニトロオキシ-プロパン-1,2-ジオール(0.169g、1.23mmol)、ジイソプロピルエチルアミン(0.40mL、2.30mmol)、および触媒性DMAPを添加し、混合物を室温で一晩撹拌した。分析用LCMSで出発物質が見られなくなった後、混合物をEtOAcおよびH2O間で分配し、水性層をEtOAcで抽出した。まとめた有機層をMgSO4上で乾燥し、ろ過し、濃縮し、残渣をシリカゲルクロマトグラフィーによって精製して、所望の生成物を取得した。
3-[3-tert-ブチルスルファニル-1-[4-(6-エトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 ナトリウム塩(0.400g、0.62mmol)をジクロロエタン(3mL)に溶解させ、0℃まで冷却した。オキサリルクロリド(0.06mL、0.69mmol)を添加し、反応物を15分間撹拌した。その後3-ニトロオキシ-プロパン-1,2-ジオール(0.169g、1.23mmol)、ジイソプロピルエチルアミン(0.40mL、2.30mmol)、および触媒性DMAPを添加し、混合物を室温で一晩撹拌した。分析用LCMSで出発物質が見られなくなった後、混合物をEtOAcおよびH2O間で分配し、水性層をEtOAcで抽出した。まとめた有機層をMgSO4上で乾燥し、ろ過し、濃縮し、残渣をシリカゲルクロマトグラフィーによって精製して、所望の生成物を取得した。
(例7b)
3-[3-tert-ブチルスルファニル-1-[4-(6-エトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 イソソルビド-5-一硝酸エステル(化合物1-7b)の合成
3-[3-tert-ブチルスルファニル-1-[4-(6-エトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 イソソルビド-5-一硝酸エステル(化合物1-7b)の合成
ステップ1: 3-[3-tert-ブチルスルファニル-1-[4-(6-エトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 イソソルビド-5-一硝酸エステル
3-[3-tert-ブチルスルファニル-1-[4-(6-エトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 ナトリウム塩(0.500g、0.77mmol)をジクロロエタン(3mL)に溶解させ、0℃まで冷却した。ジイソプロピルエチルアミン(0.30mL、1.72mmol)を添加し、その後オキサリルクロリド(0.08mL、0.92mmol)を添加し、反応物を15分間撹拌した。次に、イソソルビド-5-一硝酸(0.250g、1.31mmol)および触媒性DMAPを添加し、混合物を室温で一晩撹拌した。分析用LCMSで出発物質が見られなくなった後、溶液をEtOAcおよびH2O間で分配し、水性層をEtOAcで抽出した。まとめた有機層をMgSO4上で乾燥し、ろ過し、濃縮し、残渣をシリカゲルクロマトグラフィー(CH2Cl2中0-3% MeOH)によって精製して、所望の生成物を取得した。
3-[3-tert-ブチルスルファニル-1-[4-(6-エトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸 ナトリウム塩(0.500g、0.77mmol)をジクロロエタン(3mL)に溶解させ、0℃まで冷却した。ジイソプロピルエチルアミン(0.30mL、1.72mmol)を添加し、その後オキサリルクロリド(0.08mL、0.92mmol)を添加し、反応物を15分間撹拌した。次に、イソソルビド-5-一硝酸(0.250g、1.31mmol)および触媒性DMAPを添加し、混合物を室温で一晩撹拌した。分析用LCMSで出発物質が見られなくなった後、溶液をEtOAcおよびH2O間で分配し、水性層をEtOAcで抽出した。まとめた有機層をMgSO4上で乾燥し、ろ過し、濃縮し、残渣をシリカゲルクロマトグラフィー(CH2Cl2中0-3% MeOH)によって精製して、所望の生成物を取得した。
FLAP結合アッセイ
FLAP結合アッセイの限定するわけではない例は以下の通りである。
FLAP結合アッセイの限定するわけではない例は以下の通りである。
記載されているように、パック入りのヒト多形核細胞ペレット(1.8 x 109細胞)(Biological Speciality Corporation)を再懸濁させ、溶融させ、100,000 g膜を調製した(Charleson et al. Mol. Pharmacol, 41, 873-879, 1992)。100,000 xg ペレット膜をTris-Tweenアッセイバッファー(100 mM Tris HCl pH 7.4、140 mM NaCl、2 mM EDTA、0.5 mM DTT、5% グリセロール、0.05% Tween 20)に再懸濁させて、タンパク質濃度が50-100 ug/mLになるようにした。膜懸濁液 10 uLを、96ウェルMilliporeプレート、Tris-Tweenバッファー78μL、3H MK88610μLもしくは3H 3-[5-(ピリド-2-イルメトキシ)-3-tert-ブチルチオ-1-ベンジル-インドール-2-イル]-2,2-ジメチルプロピオン酸(もしくは125I MK591 誘導体、Eggler et al, J. Labelled Compounds and Radiopharmaceuticals, 1994, vXXXIV, 1147))を〜30,000 cpmまで、インヒビター2μ L、に添加し、室温で30分間インキュベートした。氷冷洗浄バッファー100μLをインキュベーション混合物に添加した。その後、プレートをろ過し、氷冷Tris-Tweenバッファー200μLで3x洗浄し、シンチレーションボトムをシールし、シンチラント100μLを添加し、15分間振蕩した後、TopCountでカウントした。特異的結合は、10μM MK886の存在中で全体の放射活性結合から非特異的結合を差し引いたものとして定義されるように、決定した。薬物滴定曲線のGraphpad Prism分析を使用して、IC50を決定した。
ヒト白血球抑制アッセイ
ヒト白血球抑制アッセイの限定するわけではない例は以下の通りである。
ヒト白血球抑制アッセイの限定するわけではない例は以下の通りである。
同意しているヒトボランティアから血液をとり、ヘパリンチューブに入れ、等容量の3%デキストラン、0.9%生理食塩水を添加した。赤血球細胞の沈降後、残存する赤血球細胞の低張液溶解を実施し、白血球を1000 rpmで沈降させた。ペレットを1.25 x 105細胞/mLで再懸濁させ、20% DMSO中の20% DMSO(ベヒクル)2.5μLもしくは薬物2.5μLを含有するウェルに分注した。サンプルを37℃で5分間インキュベートし、カルシウムイオノフォアA23817(50 mM DMSO原液から、アッセイの直前にHanks平衡化塩溶液(Invitrogen)で1.25 mMに希釈)2μLを添加し、溶液を混合し、37℃で30分間インキュベートした。サンプルを4℃で10分、1,000 rpm(〜200 x g)で遠心分離し、血漿を除去し、ELISA(Assay Designs)を使用して、1:4希釈物をLTB4濃度についてアッセイした。ベヒクルLTB4の50% 抑制(IC50)を達成する薬物濃度を、%抑制対log薬物濃度の非線形回帰(Graphpad Prism)によって、決定した。表1-4に提示した化合物はこのアッセイで1 nM〜5μMのアッセイ濃度だった。このアッセイで試験した実施例1に提示した化合物は、約2μMより低い活性である。
ヒト血液LTB 4 抑制アッセイ
ヒト血液LTB4抑制アッセイの限定するわけではない例は以下の通りである。
ヒト血液LTB4抑制アッセイの限定するわけではない例は以下の通りである。
同意しているヒトボランティアから血液をとり、ヘパリンチューブに入れ、50% DMSO中の50% DMSO(ベヒクル)2.5μLもしくは薬物2.5μLを含有するウェルに125μlを分注した。サンプルを37℃で5分間インキュベートした。カルシウムイオノフォアA23817(50 mM DMSO原液から、アッセイの直前にHanks平衡化塩溶液(Invitrogen)で1.25 mMに希釈)2μLを添加し、溶液を混合し、37℃で30分間インキュベートした。サンプルを4℃で10分、1,000 rpm(〜200 x g)で遠心分離し、血漿を除去し、ELISA(Assay Designs)を使用して、1:100希釈物をLTB4濃度についてアッセイした。ベヒクルLTB4の50% 抑制(IC50)を達成する薬物濃度を、%抑制対log薬物濃度の非線形回帰(Graphpad Prism)によって、決定した。
ラット腹膜炎症および浮腫アッセイ
ラット腹膜炎症および浮腫アッセイの限定するわけではない例は以下の通りである。
ラット腹膜炎症および浮腫アッセイの限定するわけではない例は以下の通りである。
ロイコトリエン生合成インヒビターのin vivo効力を、腹膜炎症のラットモデルを使用して、評価した。雄Sprague-Dawleyラット(体重200〜300グラム)に、チモサン(5 mg/mL)を含有する生理食塩水3 mLの単回腹腔内(i.p.)注射し、直後にEvansブルーダイ(1.5%溶液2 mL)を静脈内(i.v.)注射した。チモサン注射の2〜4時間前に、化合物を経口投与(0.5%メチルセルロースベヒクル中3 mL/kg)した。チモサン注射の1〜2時間後、ラットを麻酔し、腹腔をリン酸塩緩衝化生理食塩水溶液(PBS) 10 mLで洗い出した。生成した液を1,200 rpmで10分間遠心分離した。分光分析計(吸光610 nm)を使用して上清のEvansブルーダイの量を定量することによって、血管浮腫を評価した。上清中のLTB4およびシステイニルロイコトリエン濃度をELISAによって評価した。血漿漏出(Evansブルーダイ)抑制ならびに腹膜のLTB4およびシステイニルロイコトリエンの抑制の50%を達成する薬物濃度は、%抑制対log薬物濃度の非線形回帰(Graphpad Prism)によって、算出することができる。
NO放出: 非観血式血圧測定
NO放出についてのアッセイの限定するわけではない1例は、以下の通りである。
NO放出についてのアッセイの限定するわけではない1例は、以下の通りである。
コンピュータ化非観血式tail-cuff収集システム(モデルXBP1000; Kent Scientific Corporation)を使用して、ラット高血圧モデルの血圧の低下を評価した。血圧記録期間より前に、雄Sprague-Dawleyラット(体重200〜300グラム)を、標準的げっ歯類ホルダー(XBP-RM, Kent Scientific)に、連続した3日間(1時間の期間)、馴化させた。この馴化フェーズ後、Val5-アンギオテンシンII(Sigma)を含有する浸透圧ミニポンプ(Alzetモデル 2001)を使用し、0.7mg/kg/日の速度で7日目まで注入して(Ishizaka et al., 1999, FEBS Letters)、高血圧を誘発した。注入の0、5および7日目に、動物をホルダーにもどし、膨張式tail-cuffに固定して、収縮期血圧、拡張期血圧および心拍数を測定した。注入の7日目、基底値の記録後、化合物を経口投与し(0.5%メチルセルロースベヒクル中3 ml/kg)、その血圧低下能力について評価した。収縮期血圧の50%抑制を達成する薬物濃度は、%抑制対log薬物濃度の非線形回帰(Graphpad Prism)によって、算出することができる。
ラット胃病変操作法
ラットの胃病変は、ナプロキセンなどの非ステロイド抗炎症性薬物(NSAID)の摂取によって、誘発することができる。この効果は投与後4〜6時間で明白になる。NSAID-誘発胃病変の予防に対する2種の薬物の治療効果は、相加性を試験するため、分割投薬手法を使用して、最初に単独療法で、その後併用療法による。試験した2種の薬物には以下が含まれる: 1) 3-[3-tert-ブチルスルファニル-1-[4-(6-エトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸(米国特許公開番号 2007/0105866に記載された操作法にしたがって調製; 化合物2〜94参照)、5-リポキシゲナーゼ活性化タンパク質(FLAP)インヒビターおよび2) イソソルビド一硝酸(一酸化窒素供与体)。
ラットの胃病変は、ナプロキセンなどの非ステロイド抗炎症性薬物(NSAID)の摂取によって、誘発することができる。この効果は投与後4〜6時間で明白になる。NSAID-誘発胃病変の予防に対する2種の薬物の治療効果は、相加性を試験するため、分割投薬手法を使用して、最初に単独療法で、その後併用療法による。試験した2種の薬物には以下が含まれる: 1) 3-[3-tert-ブチルスルファニル-1-[4-(6-エトキシ-ピリジン-3-イル)-ベンジル]-5-(ピリジン-2-イルメトキシ)-1H-インドール-2-イル]-2,2-ジメチル-プロピオン酸(米国特許公開番号 2007/0105866に記載された操作法にしたがって調製; 化合物2〜94参照)、5-リポキシゲナーゼ活性化タンパク質(FLAP)インヒビターおよび2) イソソルビド一硝酸(一酸化窒素供与体)。
操作法: 24時間絶食させた雄Sprague-Dawleyラット(体重200〜300グラム)に、ナプロキセン(40 mg/kg)の単回経口用量の投与によって、胃病変を誘発させた。研究の単独療法フェーズでは、化合物2〜94を1、10および30 mg/kgで調製し、ナプロキセンと同時投与した。別に、イソソルビド一硝酸を3、10、30および100 mg/kgで調製し、ナプロキセンと同時投与した。この実験フェーズからのED50(最大効果の半分をもたらす用量として定義)を使用して、研究の併用療法フェーズのための用量を算出した。この場合は、化合物2〜94およびイソソルビド一硝酸をともに製剤化し、ナプロキセンと同時投与した。試験した分割投薬には以下が含まれる: ED50値の2、1、1/2および1/4倍。すべての条件中、投薬の4時間後に、ラットをイソフルラン吸入によって麻酔し、胃を切除して、小弯に沿って切開し、水道水を使用して、内容物を完全に洗い落とした。その後、各胃の粘膜層側を上にして、平らに固定して、10Xの露出でデジタル画像を取得した。その後、これらの画像を使用して、病変の総面積をmm2で測定した。個々の胃について、病変指数(LI)を次式によって算出した。
LI = [病変面積(mm2) / 胃総面積(mm2)] x 100
次に、個々の薬物の効果を、次式を使用して、ナプロキセン単独グループに比較した、各投薬グループについてのLIの抑制パーセントを算出することによって、判定した。
次に、個々の薬物の効果を、次式を使用して、ナプロキセン単独グループに比較した、各投薬グループについてのLIの抑制パーセントを算出することによって、判定した。
% 抑制 = 100 - [LI治療 / LI対照(ナプロキセン) x 100]
結果: 化合物2〜94は、ナプロキセン誘発胃病変の用量依存性抑制をもたらし、算定したED50値は5mg/kgであった。イソソルビドは、ナプロキセン誘発胃病変の用量依存性抑制をもたらし、算定したED50値は15mg/kgであった。これらの数値から、我々は以下の投薬分率を選定した: 2 x ED50(10 mg/kg化合物2〜94 + 30 mg/kg イソソルビド一硝酸)、1 x ED50(5 mg/kg化合物2〜94 + 15 mg/kg イソソルビド一硝酸)、1/2 ED50(2.5 mg/kg化合物2〜94 + 7.5 mg/kg イソソルビド一硝酸)および1/4 ED50(1.25 mg/kg化合物2〜94 + 3.75 mg/kg イソソルビド一硝酸)。その結果、ED50投薬分率は2.5 mg/kg化合物2〜94 + 7.5 mg/kg イソソルビド一硝酸の併用投薬であることがわかった。合計の投薬分率値は、以下の式から1である。
結果: 化合物2〜94は、ナプロキセン誘発胃病変の用量依存性抑制をもたらし、算定したED50値は5mg/kgであった。イソソルビドは、ナプロキセン誘発胃病変の用量依存性抑制をもたらし、算定したED50値は15mg/kgであった。これらの数値から、我々は以下の投薬分率を選定した: 2 x ED50(10 mg/kg化合物2〜94 + 30 mg/kg イソソルビド一硝酸)、1 x ED50(5 mg/kg化合物2〜94 + 15 mg/kg イソソルビド一硝酸)、1/2 ED50(2.5 mg/kg化合物2〜94 + 7.5 mg/kg イソソルビド一硝酸)および1/4 ED50(1.25 mg/kg化合物2〜94 + 3.75 mg/kg イソソルビド一硝酸)。その結果、ED50投薬分率は2.5 mg/kg化合物2〜94 + 7.5 mg/kg イソソルビド一硝酸の併用投薬であることがわかった。合計の投薬分率値は、以下の式から1である。
(イソソルビド一硝酸を含む化合物2〜94のED50) / (化合物2〜94単独のED50)
+
(化合物2〜94を含むイソソルビド一硝酸のED50) / (イソソルビド単独のED50)
少数値は、単独ED50値のどれほどの割合が対応する併用のED50値に占められるかを指示している。1に近い数値は、相加的相互作用を意味し、> 1の数値は拮抗的相互作用を意味し、< 1の数値は相乗的相互作用を意味している。我々の数値1は、FLAPインヒビター化合物2〜94とNO-供与体、イソソルビド一硝酸は相加的相互作用であることを意味している。
+
(化合物2〜94を含むイソソルビド一硝酸のED50) / (イソソルビド単独のED50)
少数値は、単独ED50値のどれほどの割合が対応する併用のED50値に占められるかを指示している。1に近い数値は、相加的相互作用を意味し、> 1の数値は拮抗的相互作用を意味し、< 1の数値は相乗的相互作用を意味している。我々の数値1は、FLAPインヒビター化合物2〜94とNO-供与体、イソソルビド一硝酸は相加的相互作用であることを意味している。
図7Aは、化合物2〜94(黒丸)およびイソソルビド一硝酸(白丸)を使用する、ナプロキセン誘発病変の用量依存性抑制を示している。
図7Bは、化合物2〜94およびイソソルビド一硝酸の分割投薬を使用する、ナプロキセン誘発病変の用量依存性抑制を示している。
図8は、化合物2〜94単独(30 mg/kg、斜線柱)、イソソルビド一硝酸単独(100 mg/kg、白柱)および併用治療として化合物2〜94+イソソルビド一硝酸(10 mg/kg + 30 mg/kg、黒柱)によって達成される最大抑制を示している。
医薬組成物
例8a: 腸管外組成物
注射による投与に好適な腸管外医薬組成物の調製のために、式(I)の化合物の水溶性塩100 mgをDMSOに溶解させた後、0.9%滅菌生理食塩水10 mLと混合する。混合物を注射による投与に好適な単位投与剤形に組み込む。
例8a: 腸管外組成物
注射による投与に好適な腸管外医薬組成物の調製のために、式(I)の化合物の水溶性塩100 mgをDMSOに溶解させた後、0.9%滅菌生理食塩水10 mLと混合する。混合物を注射による投与に好適な単位投与剤形に組み込む。
例8b: 経口組成物
経口送達用の医薬組成物の調製のために、式(I)の化合物100 mgをでんぷん750 mgと混合する。混合物を、経口投与に好適な硬質ゼラチンカプセルなどの、経口単位投与剤形に組み込む。
経口送達用の医薬組成物の調製のために、式(I)の化合物100 mgをでんぷん750 mgと混合する。混合物を、経口投与に好適な硬質ゼラチンカプセルなどの、経口単位投与剤形に組み込む。
例8c: 舌下用(硬質トローチ)組成物
硬質トローチなどの、口腔送達用の医薬組成物の調製のため、式(I)の化合物100 mgを、ライトコーンシロップ1.6 mL、蒸留水2.4 mL、およびミントエキス0.42 mLを混合した粉末糖420 mgと混合する。混合物を緩やかに混合し、型に流し入れて、口腔投与に好適なトローチを形成させる。
硬質トローチなどの、口腔送達用の医薬組成物の調製のため、式(I)の化合物100 mgを、ライトコーンシロップ1.6 mL、蒸留水2.4 mL、およびミントエキス0.42 mLを混合した粉末糖420 mgと混合する。混合物を緩やかに混合し、型に流し入れて、口腔投与に好適なトローチを形成させる。
例8d: 吸入組成物
吸入送達用の医薬組成物の調製のため、式(I)の化合物20 mgを、無水クエン酸50 mgおよび0.9%塩化ナトリウム溶液100 mLと混合する。混合物を、吸入投与に好適な、ネブライザーなどの吸入送達用単位に組み込む。
吸入送達用の医薬組成物の調製のため、式(I)の化合物20 mgを、無水クエン酸50 mgおよび0.9%塩化ナトリウム溶液100 mLと混合する。混合物を、吸入投与に好適な、ネブライザーなどの吸入送達用単位に組み込む。
例8e: 直腸ゲル組成物
直腸送達用の医薬組成物の調製のため、式(I)の化合物100 mgを、メチルセルロース(1500 mPa)2.5 g、メチルパラペン100 mg、グリセリン5 gおよび精製水100 mLと混合する。生成したゲル混合物を、直腸投与に好適な、シリンジなどの直腸送達用単位に組み込む。
直腸送達用の医薬組成物の調製のため、式(I)の化合物100 mgを、メチルセルロース(1500 mPa)2.5 g、メチルパラペン100 mg、グリセリン5 gおよび精製水100 mLと混合する。生成したゲル混合物を、直腸投与に好適な、シリンジなどの直腸送達用単位に組み込む。
例8f: 局所ゲル組成物
医薬用局所ゲル組成物の調製のため、式(I)の化合物100 mgを、ヒドロキシプロピルセルロース1.75 g、プロピレングリコール10 mL、ミリスチン酸イソプロピル10 mLおよび精製アルコールUSP100 mLと混合する。その後、生成したゲル混合物を、局所投与に好適な、チューブなどの容器に組み込む。
医薬用局所ゲル組成物の調製のため、式(I)の化合物100 mgを、ヒドロキシプロピルセルロース1.75 g、プロピレングリコール10 mL、ミリスチン酸イソプロピル10 mLおよび精製アルコールUSP100 mLと混合する。その後、生成したゲル混合物を、局所投与に好適な、チューブなどの容器に組み込む。
例8g: 点眼液組成物
点眼液組成物の調製のため、式(I)の化合物100 mgを、精製水100 mL中のNaCl 0.9 gと混合し、0.2ミクロンフィルターを使用してろ過する。その後、生成した等張液を、点眼投与に好適な、点眼容器などの容器などの、眼科送達単位に組み込む。
点眼液組成物の調製のため、式(I)の化合物100 mgを、精製水100 mL中のNaCl 0.9 gと混合し、0.2ミクロンフィルターを使用してろ過する。その後、生成した等張液を、点眼投与に好適な、点眼容器などの容器などの、眼科送達単位に組み込む。
式(I)の複合化合物
式(I)の化合物の限定するわけではない例を、図4〜6に提示する。こうした化合物は、本明細書に記載する方法を使用して、調製することができる。
式(I)の化合物の限定するわけではない例を、図4〜6に提示する。こうした化合物は、本明細書に記載する方法を使用して、調製することができる。
本明細書に記載する実施例および実施形態は説明目的のためのみであって、当業者に示唆される各種の改変または変更は、本出願の精神および範囲、ならびに添付する特許請求の範囲内に含まれるものである。本明細書に引用したすべての刊行物、特許および特許出願は、すべての目的について、参照として本明細書に組み入れる。
Claims (60)
- NOモジュレーター、FLAPインヒビター、ならびに医薬として許容される希釈剤、医薬として許容される賦形剤、および医薬として許容される担体から選択される少なくとも1種の医薬として許容される不活性成分を含んでいる、医薬組成物。
- 医薬組成物が、静脈内医薬組成物、経口医薬組成物、直腸医薬組成物、エアロゾル医薬組成物、腸管外医薬組成物、眼用医薬組成物、肺用医薬組成物、経粘膜医薬組成物、経皮医薬組成物、膣用医薬組成物、耳用医薬組成物、鼻用医薬組成物、および局所医薬組成物である、請求項1に記載の医薬組成物。
- 医薬組成物が腸管外送達、経口送達、または鼻内送達用に製剤化されている、請求項2に記載の医薬組成物。
- NOモジュレーターが以下から選択される、請求項1に記載の医薬組成物: ニトロプルシド、ニトログリセリン、イソソルビド一硝酸、イソソルビド二硝酸、アルギニン、ホモアルギニン、N-ヒドロキシ-アルギニン、ニトロソ化アルギニン、ニトロシル化アルギニン、ニトロソ化N-ヒドロキシ-アルギニン、ニトロシル化N-ヒドロキシ-アルギニン、ニトロソ化ホモアルギニン、ニトロシル化ホモアルギニン、シトルリン、オルニチン、グルタミン、リシン、N-ヒドロキシ-L-アルギニン、2(S)-アミノ-6-ボロノヘキサン酸、アデノシン、ブラジキニン、カルレチキュリン、ビスアコジル、フェノールフタレン、モルシドミン、3-モルホリノシドノニミン(SIN-1)、1,2,3,4-オキサトリアゾリウム、5-アミノ-3-(3,4-ジ-クロロフェニル)-クロリド(GEA 3162)、1,2,3,4-オキサトリアゾリウム、5-アミノ-3-(3-クロロ-2-メチル-フェニル)クロリド(GEA502-4)、1,2,3,4-オキサトリアゾリウム、3-(3-クロロ-2-メチルフェニル)-5-[[[シアノメチルアミノ-]カルボニル]アミノ]-ヒドロキシド内塩(GEA 5583); S-ニトロソ-N-アセチル-D,L-ペニシラミン(SNAP); グリコ-SNAP-1; グリコ-SNAP-2,2,2'-(ヒドロキシニトロソヒドラゾノ)ビス-エタナミン(NOC-18)および(+/-)-(E)-4-エチル-2-[(E)-ヒドロキシイミノ]-5-ニトロ-3-ヘキセンアミド(NOR-3); 1-[(4',5'-ビス(カルボキシメトキシ)-2'-ニトロフェニル)メトキシ]-2-オキソ-3,3,ジエチル-1-トリアゼン 二カリウム塩(CNO-4); [1-(4'、5'-ビス(カルボキシメトキシ)-2'-ニトロフェニル)メトキシ]-2-オキソ-3,3-ジエチル-1-トリアジン ジアセトキシメチルエステル(CNO-5); b ジエチルアミン-NO(DEA/NO)、IPA/NO、スペルミン-NO(SPER/NO)、亜硫酸-NO(SULFI/NO)、OXI/NO、DETA/NO; シクレタニン; GEA 3268、(1,2,3,4-オキサトリアゾリウム、3-(3-クロロ-2-メチルフェニル)-5-[[(4-メトキシフェニル)-スルホニル]アミノ]-、ヒドロキシド内塩); GEA 5145、(1,2,3,4-オキサトリアゾリウム、3-(3-クロロ-2-メチルフェニル)-5-[(メチルスルホニル)アミノ]-、ヒドロキシド内塩); スルホンアミド GEA 3175; S-ニトロソチオール; 亜硝酸; 硝酸、N-オキソ-N-ニトロソアミン、SPM 3672、SPM 5185、およびSPM 5186。
- FLAPインヒビターがFLAP化合物(a)-(j)のいずれかの構造を持つ、請求項1に記載の医薬組成物。
- NOモジュレーターとFLAPインヒビターが化学的に連結している、請求項1に記載の医薬組成物。
- NOモジュレーターとFLAPインヒビターが化学的に連結して、式(I)の化合物を形成している、請求項6に記載の医薬組成物:
Ax-L-B
式(I)
式中、
Aは、a) A'の形態でNOモジュレーターである部分であって、A'はA-X、A-H、A-、もしくはA+; XはCOOH、CONH2、OH、NH2、ハロゲン、SH、もしくはCH3である;
b) 活性化/反応時にNOを産生する部分; または
c) -NO2および-ONO2から選択される部分であって、
xは0、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、17、19、もしくは20;
Lは結合またはA部分およびB部分と化学的に連結している部分であって、単一ステップもしくは複数ステップで、化学的、酵素的、生物学的、光化学的、電気化学的、または音響化学的手段によって、in vivoで開裂して、-L'-Aと-B'、-L'-Bと-A'、または-L'、-A'および-B'を産生する;
Bは、B'の形態でFLAPインヒビターである部分であって、B'はB-X、B-H、B-、もしくはB+; Xは-CO2H、-CONH2、-OH、-NH2、ハロゲン、-SH、-CH3もしくは-CH2OHである。 - NOモジュレーターがNO放出物質またはNO誘導物質である、請求項6に記載の医薬組成物。
- 請求項1〜8のいずれか1項に記載の医薬組成物をヒトに投与することを含んでいる、ヒトのNSAID誘発胃病変もしくは高血圧の治療方法。
- 少なくとも1種の症候が患者のNOレベルの結果である、疾病、障害もしくは病態を持つ患者の治療方法であって、FLAPインヒビターおよびNOモジュレーターの投与を含んでおり、この際FLAPインヒビターとNOモジュレーターを時間的に離して、または同時に投与する、治療方法。
- FLAPインヒビターがDG-031(BAY-X1003)、MK-0591またはFLAP化合物(a)-(j)のいずれかの構造を持つ、請求項10に記載の方法。
- NOモジュレーターがNO放出物質またはNO誘導物質である、請求項10に記載の方法。
- NOモジュレーターの患者への投与から生起する少なくとも1種の有害作用の改善またはを排除方法であって、この際少なくとも1種の有害作用がロイコトリエン依存性であるか、ロイコトリエンでモジュレートされるものであり、FLAPインヒビターの患者への投与を含み、ここでFLAPインヒビターをNOモジュレーターの投与前、同時またはその後に投与する、方法。
- FLAPインヒビターがFLAP化合物(a)-(j)のいずれかの構造を持つ、請求項13に記載の方法。
- NOモジュレーターがNO放出物質またはNO誘導物質である、請求項13に記載の方法。
- 患者へのロイコトリエン療法の少なくとも1種の有害作用の改善または排除方法であって、この際少なくとも1種の有害作用がNO依存性であるか、NOでモジュレートされるものであり、NOモジュレーターの患者への投与を含み、ここでNOモジュレーターをFLAPインヒビターの投与前、同時またはその後に投与する、方法。
- FLAPインヒビターがDG-031(BAY-X1003)、MK-0591またはFLAP化合物(a)-(j)のいずれかの構造を持つ、請求項16に記載の方法。
- NOモジュレーターがNO放出物質またはNO誘導物質である、請求項16に記載の方法。
- 以下からなる群から選択される少なくとも1以上の薬物の患者への投与をさらに含んでいる、請求項16に記載の方法: 抗炎症薬、免疫抑制剤、抗生物質、気管支拡張薬、血管拡張薬、または降圧薬。
- 患者の気管支拡張薬の有効性の改善方法であって、FLAPインヒビターおよびNOモジュレーターの投与を含み、ここでFLAPインヒビターおよびNOモジュレーターを気管支拡張薬の投与前、同時またはその後に投与する、方法。
- FLAPインヒビターがFLAP化合物(a)-(j)のいずれかの構造を持つ、請求項20に記載の方法。
- NOモジュレーターがNO放出物質またはNO誘導物質である、請求項20に記載の方法。
- 患者の抗炎症薬の有効性の改善方法であって、この際、抗炎症薬は1以上の天然/合成/半合成グルココルチコイド、ロイコトリエン合成インヒビター、ロイコトリエン受容体ブロッカー、抗ヒスタミンから選択されるものであり、FLAPインヒビターおよびNOモジュレーターの投与を含み、ここでFLAPインヒビターおよびNOモジュレーターを抗炎症薬の投与前、同時またはその後に投与する、方法。
- FLAPインヒビターがFLAP化合物(a)-(j)のいずれかの構造を持つ、請求項23に記載の方法。
- NOモジュレーターがNO放出物質またはNO誘導物質である、請求項23に記載の方法。
- 喘息、COPD、嚢胞性線維症、肺炎、外傷性傷害、吸引もしくは吸入傷害、肺脂肪塞栓症、アシドーシス、肺炎症、成人呼吸器不調症候群、急性高山病、心臓手術後の急性肺高血圧、新生児の持続性肺高血圧、周産期吸引症候群、ヒアリン膜疾病、急性肺血栓塞栓症、急性肺浮腫、ヘパリン-プロタミン反応、敗血症、低酸素症からなる群から選択される肺もしくは血管感染および臨床性病態を持つ患者の抗生物質の有効性の改善方法であって、FLAPインヒビターおよびNOモジュレーターの投与を含み、ここでFLAPインヒビターおよびNOモジュレーターを抗生物質の投与前、同時またはその後に投与する、方法。
- FLAPインヒビターがDG-031(BAY-X1003)、MK-0591またはFLAP化合物(a)-(j)のいずれかの構造を持つ、請求項26に記載の方法。
- NOモジュレーターがNO放出物質またはNO誘導物質である、請求項26に記載の方法。
- 抗生物質が以下の1以上から選定される、請求項26に記載の方法: 抗細菌薬、抗真菌薬、抗原虫薬、または抗ウイルス薬。
- 抗細菌薬が以下の1以上から選定される、請求項29に記載の方法: 天然/合成/半合成アミノグリコシド、ベータ-ラクタム、セファロスポリン、免疫モジュレーターもしくは免疫刺激剤、ケトライド、マクロライド、オキサゾリジオン、ペニシリン、キノロン、テイコプラニンもしくはクリンダマイシンもしくはストレプトマイシンもしくはバンコマイシンもしくはオリトバンシン、およびデフォルミラーゼインヒビター、およびリボソームインヒビター、およびクオラムセンシング(quorum sensing)インヒビター、またはこれらの類似体。
- 少なくとも1種の症候が5-リポキシゲナーゼ活性化タンパク質の活性の結果である、疾病、障害もしくは病態を持つ患者の治療方法であって、FLAPインヒビターおよびNOモジュレーターの投与を含んでおり、この際FLAPインヒビターとNOモジュレーターを時間的に離して、または同時に投与する、治療方法。
- FLAPインヒビターがFLAP化合物(a)-(j)のいずれかの構造を持つ、請求項31に記載の方法。
- NOモジュレーターがNO放出物質またはNO誘導物質である、請求項31に記載の方法。
- 式(I)の構造を持つ化合物:
Ax-L-B
式(I)
式中、
Aは、a) A'の形態でNOモジュレーターである部分であって、A'はA-X、A-H、A-、もしくはA+; XはCOOH、CONH2、OH、NH2、ハロゲン、SH、もしくはCH3である;
b) 活性化/反応時にNOを産生する部分; または
c) -NO2および-ONO2から選択される部分であって、
xは0、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、17、19、もしくは20;
Lは結合またはA部分およびB部分と化学的に連結している部分であって、単一ステップもしくは複数ステップで、化学的、酵素的、生物学的、光化学的、電気化学的、または音響化学的手段によって、in vivoで開裂して、-L'-Aと-B'、-L'-Bと-A'、または-L'、-A'および-B'を産生する;
Bは、B'の形態でFLAPインヒビターである部分であって、B'はB-X、B-H、B-、もしくはB+; Xは-CO2H、-CONH2、-OH、-NH2、ハロゲン、-SH、-CH3もしくは-CH2OHである。 - A'が以下から選択される、請求項34に記載の化合物: ニトロプルシド、ニトログリセリン、イソソルビド一硝酸、イソソルビド二硝酸、アルギニン、ホモアルギニン、N-ヒドロキシ-アルギニン、ニトロソ化アルギニン、ニトロシル化アルギニン、ニトロソ化N-ヒドロキシ-アルギニン、ニトロシル化N-ヒドロキシ-アルギニン、ニトロソ化ホモアルギニン、ニトロシル化ホモアルギニン、シトルリン、オルニチン、グルタミン、リシン、N-ヒドロキシ-L-アルギニン、2(S)-アミノ-6-ボロノヘキサン酸、アデノシン、ブラジキニン、カルレチキュリン、ビスアコジル、フェノールフタレン、モルシドミン、3-モルホリノシドノニミン(SIN-1)、1,2,3,4-オキサトリアゾリウム、5-アミノ-3-(3,4-ジ-クロロフェニル)-クロリド(GEA 3162)、1,2,3,4-オキサトリアゾリウム、5-アミノ-3-(3-クロロ-2-メチル-フェニル)クロリド(GEA502-4)、1,2,3,4-オキサトリアゾリウム、3-(3-クロロ-2-メチルフェニル)-5-[[[シアノメチルアミノ-]カルボニル]アミノ]-ヒドロキシド内塩(GEA 5583); S-ニトロソ-N-アセチル-D,L-ペニシラミン(SNAP); グリコ-SNAP-1; グリコ-SNAP-2,2,2'-(ヒドロキシニトロソヒドラゾノ)ビス-エタナミン(NOC-18)および(+/-)-(E)-4-エチル-2-[(E)-ヒドロキシイミノ]-5-ニトロ-3-ヘキセンアミド(NOR-3); 1-[(4',5'-ビス(カルボキシメトキシ)-2'-ニトロフェニル)メトキシ]-2-オキソ-3,3,ジエチル-1-トリアゼン 二カリウム塩(CNO-4); [1-(4'、5'-ビス(カルボキシメトキシ)-2'-ニトロフェニル)メトキシ]-2-オキソ-3,3-ジエチル-1-トリアジン ジアセトキシメチルエステル(CNO-5); b ジエチルアミン-NO(DEA/NO)、IPA/NO、スペルミン-NO(SPER/NO)、亜硫酸-NO(SULFI/NO)、OXI/NO、DETA/NO; シクレタニン; GEA 3268、(1,2,3,4-オキサトリアゾリウム、3-(3-クロロ-2-メチルフェニル)-5-[[(4-メトキシフェニル)-スルホニル]アミノ]-、ヒドロキシド内塩); GEA 5145、(1,2,3,4-オキサトリアゾリウム、3-(3-クロロ-2-メチルフェニル)-5-[(メチルスルホニル)アミノ]-、ヒドロキシド内塩); スルホンアミド GEA 3175; S-ニトロソチオール; 亜硝酸; 硝酸、N-オキソ-N-ニトロソアミン、SPM 3672、SPM 5185、およびSPM 5186。
- Lが結合である、請求項34に記載の化合物。
- B'がFLAP化合物(a)-(j)のいずれかの構造を持つ、請求項34に記載の方法。
- 少なくとも1種の症候が患者のロイコトリエンの活性の結果であるかまたはこれに関係がある、疾病、障害もしくは病態を持つ患者の治療方法であって、式(I)の構造を持つ化合物の患者への投与を含んでいる、治療方法:
Ax-L-B
式(I)
式中、
Aは、a) A'の形態でNOモジュレーターである部分であって、A'はA-X、A-H、A-、もしくはA+; XはCOOH、CONH2、OH、NH2、ハロゲン、SH、もしくはCH3である;
b) 活性化/反応時にNOを産生する部分; または
c) -NO2および-ONO2から選択される部分であって、
xは0、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、17、19、もしくは20;
Lは結合またはA部分およびB部分と化学的に連結している部分であって、単一ステップもしくは複数ステップで、化学的、酵素的、生物学的、光化学的、電気化学的、または音響化学的手段によって、in vivoで開裂して、-L'-Aと-B'、-L'-Bと-A'、または-L'、-A'および-B'を産生する;
Bは、B'の形態でFLAPインヒビターである部分であって、B'はB-X、B-H、B-、もしくはB+; Xは-CO2H、-CONH2、-OH、-NH2、ハロゲン、-SH、-CH3もしくは-CH2OHである。 - 化合物が図4、図5、または図6に提示されている化合物のいずれかから選択される、請求項38に記載の方法。
- 少なくとも1種の症候が患者のNOレベルの結果である、疾病、障害もしくは病態を持つ患者の治療方法であって、式(I)の構造を持つ化合物の患者への投与を含んでいる、治療方法:
Ax-L-B
式(I)
式中、
Aは、a) A'の形態でNOモジュレーターである部分であって、A'はA-X、A-H、A-、もしくはA+; XはCOOH、CONH2、OH、NH2、ハロゲン、SH、もしくはCH3である;
b) 活性化/反応時にNOを産生する部分; または
c) -NO2および-ONO2から選択される部分であって、
xは0、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、17、19、もしくは20;
Lは結合またはA部分およびB部分と化学的に連結している部分であって、単一ステップもしくは複数ステップで、化学的、酵素的、生物学的、光化学的、電気化学的、または音響化学的手段によって、in vivoで開裂して、-L'-Aと-B'、-L'-Bと-A'、または-L'、-A'および-B'を産生する;
Bは、B'の形態でFLAPインヒビターである部分であって、B'はB-X、B-H、B-、もしくはB+; Xは-CO2H、-CONH2、-OH、-NH2、ハロゲン、-SH、-CH3もしくは-CH2OHである。 - 化合物が図4、図5、または図6に提示されている化合物のいずれかから選択される、請求項40に記載の方法。
- 式(I)の構造を持つ化合物を、抗炎症薬、免疫抑制剤、抗生物質、気管支拡張薬、血管拡張薬、または降圧薬からなる群から選択される1以上の別の薬物と併用して投与することを含んでいる、相加的または相乗的治療効果を達成するための方法:
Ax-L-B
式(I)
式中、
Aは、a) A'の形態でNOモジュレーターである部分であって、A'はA-X、A-H、A-、もしくはA+; XはCOOH、CONH2、OH、NH2、ハロゲン、SH、もしくはCH3である;
b) 活性化/反応時にNOを産生する部分; または
c) -NO2および-ONO2から選択される部分であって、
xは0、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、17、19、もしくは20;
Lは結合またはA部分およびB部分と化学的に連結している部分であって、単一ステップもしくは複数ステップで、化学的、酵素的、生物学的、光化学的、電気化学的、または音響化学的手段によって、in vivoで開裂して、-L'-Aと-B'、-L'-Bと-A'、または-L'、-A'および-B'を産生する;
Bは、B'の形態でFLAPインヒビターである部分であって、B'はB-X、B-H、B-、もしくはB+; Xは-CO2H、-CONH2、-OH、-NH2、ハロゲン、-SH、-CH3もしくは-CH2OHである。 - 化合物が図4、図5、または図6に提示されている化合物のいずれかから選択される、請求項42に記載の方法。
- 患者の気管支拡張薬の有効性の改善方法であって、式(I)の構造を持つ化合物の患者への投与を含み、ここでFLAPインヒビターおよびNOモジュレーターを気管支拡張薬の投与前、同時またはその後に投与する、方法:
Ax-L-B
式(I)
式中、
Aは、a) A'の形態でNOモジュレーターである部分であって、A'はA-X、A-H、A-、もしくはA+であり; XはCOOH、CONH2、OH、NH2、ハロゲン、SH、もしくはCH3である;
b) 活性化/反応時にNOを産生する部分; または
c) -NO2および-ONO2から選択される部分であって、
xは0、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、17、19、もしくは20;
Lは結合またはA部分およびB部分と化学的に連結している部分であって、単一ステップもしくは複数ステップで、化学的、酵素的、生物学的、光化学的、電気化学的、または音響化学的手段によって、in vivoで開裂して、-L'-Aと-B'、-L'-Bと-A'、または-L'、-A'および-B'を産生する;
Bは、B'の形態でFLAPインヒビターである部分であって、B'はB-X、B-H、B-、もしくはB+; Xは-CO2H、-CONH2、-OH、-NH2、ハロゲン、-SH、-CH3もしくは-CH2OHである。 - 化合物が図4、図5、または図6に提示されている化合物のいずれかから選択される、請求項44に記載の方法。
- 患者の抗炎症薬の有効性の改善方法であって、この際、抗炎症薬は1以上の天然/合成/半合成グルココルチコイド、ロイコトリエン合成インヒビター、ロイコトリエン受容体ブロッカー、抗ヒスタミンから選択されるものであり、式(I)の構造を持つ化合物の投与を含み、ここで式(I)の構造を持つ化合物を抗炎症薬の投与前、同時またはその後に投与する、方法:
Ax-L-B
式(I)
式中、
Aは、a) A'の形態でNOモジュレーターである部分であって、A'はA-X、A-H、A-、もしくはA+; XはCOOH、CONH2、OH、NH2、ハロゲン、SH、もしくはCH3である;
b) 活性化/反応時にNOを産生する部分; または
c) -NO2および-ONO2から選択される部分であって、
xは0、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、17、19、もしくは20;
Lは結合またはA部分およびB部分と化学的に連結している部分であって、単一ステップもしくは複数ステップで、化学的、酵素的、生物学的、光化学的、電気化学的、または音響化学的手段によって、in vivoで開裂して、-L'-Aと-B'、-L'-Bと-A'、または-L'、-A'および-B'を産生する;
Bは、B'の形態でFLAPインヒビターである部分であって、B'はB-X、B-H、B-、もしくはB+; Xは-CO2H、-CONH2、-OH、-NH2、ハロゲン、-SH、-CH3もしくは-CH2OHである。 - 化合物が図4、図5、または図6に提示されている化合物のいずれかから選択される、請求項46に記載の方法。
- 喘息、COPD、嚢胞性線維症、肺炎、外傷性傷害、吸引もしくは吸入傷害、肺脂肪塞栓症、アシドーシス、肺炎症、成人呼吸器不調症候群、急性高山病、心臓手術後の急性肺高血圧、新生児の持続性肺高血圧、周産期吸引症候群、ヒアリン膜疾病、急性肺血栓塞栓症、急性肺浮腫、ヘパリン-プロタミン反応、敗血症、低酸素症からなる群から選択される肺もしくは血管感染および臨床性病態を持つ患者の抗生物質の有効性の改善方法であって、式(I)の構造を持つ化合物の投与を含み、ここで化合物を抗生物質の投与前、同時またはその後に投与する、方法:
Ax-L-B
式(I)
式中、
Aは、a) A'の形態でNOモジュレーターである部分であって、A'はA-X、A-H、A-、もしくはA+; XはCOOH、CONH2、OH、NH2、ハロゲン、SH、もしくはCH3である;
b) 活性化/反応時にNOを産生する部分; または
c) -NO2および-ONO2から選択される部分であって、
xは0、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、17、19、もしくは20;
Lは結合またはA部分およびB部分と化学的に連結している部分であって、単一ステップもしくは複数ステップで、化学的、酵素的、生物学的、光化学的、電気化学的、または音響化学的手段によって、in vivoで開裂して、-L'-Aと-B'、-L'-Bと-A'、または-L'、-A'および-B'を産生する;
Bは、B'の形態でFLAPインヒビターである部分であって、B'はB-X、B-H、B-、もしくはB+; Xは-CO2H、-CONH2、-OH、-NH2、ハロゲン、-SH、-CH3もしくは-CH2OHである。 - 化合物が図4、図5、または図6に提示されている化合物のいずれかから選択される、請求項48に記載の方法。
- 異常に上昇した患者の呼気中の吐出NO基底レベルを検出した後、有効量のLTNOを投与することを含んでいる、患者の肺障害の診断および治療方法であって、この際、患者の呼気中の吐出NOが無変化であるか、またはさらに増加することによって、改善された肺機能を検出する、方法。
- LTNOが式(I)の構造を持つ化合物である、請求項50に記載の方法:
Ax-L-B
式(I)
式中、
Aは、a) A'の形態でNOモジュレーターである部分であって、A'はA-X、A-H、A-、もしくはA+; XはCOOH、CONH2、OH、NH2、ハロゲン、SH、もしくはCH3である;
b) 活性化/反応時にNOを産生する部分; または
c) -NO2および-ONO2から選択される部分であって、
xは0、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、17、19、もしくは20;
Lは結合またはA部分およびB部分と化学的に連結している部分であって、単一ステップもしくは複数ステップで、化学的、酵素的、生物学的、光化学的、電気化学的、または音響化学的手段によって、in vivoで開裂して、-L'-Aと-B'、-L'-Bと-A'、または-L'、-A'および-B'を産生する;
Bは、B'の形態でFLAPインヒビターである部分であって、B'はB-X、B-H、B-、もしくはB+; Xは-CO2H、-CONH2、-OH、-NH2、ハロゲン、-SH、-CH3もしくは-CH2OHである。 - 化合物が図4、図5、または図6に提示されている化合物のいずれかから選択される、請求項51に記載の方法。
- LTNOがFLAPインヒビターとNOモジュレーターの配合物である、請求項50に記載の方法。
- FLAPインヒビターがFLAP化合物(a)-(j)のいずれかの構造を持つ、請求項53に記載の方法。
- NOモジュレーターがNO放出物質またはNO誘導物質である、請求項53に記載の方法。
- スタチン、コレステリルエステル転移タンパク質(CETP)のインヒビター、またはコレステロール吸収インヒビター(VytorinおよびZetiaなどの薬物を含む)の投与をさらに含んでいる、請求項48または50に記載の方法。
- 式(I)の構造を持つ化合物の患者への投与を含んでいる、患者の高血圧の治療方法:
Ax-L-B
式(I)
式中、
Aは、a) A'の形態でNOモジュレーターである部分であって、A'はA-X、A-H、A-、もしくはA+; XはCOOH、CONH2、OH、NH2、ハロゲン、SH、もしくはCH3である;
b) 活性化/反応時にNOを産生する部分; または
c) -NO2および-ONO2から選択される部分であって、
xは0、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、17、19、もしくは20;
Lは結合またはA部分およびB部分と化学的に連結している部分であって、単一ステップもしくは複数ステップで、化学的、酵素的、生物学的、光化学的、電気化学的、または音響化学的手段によって、in vivoで開裂して、-L'-Aと-B'、-L'-Bと-A'、または-L'、-A'および-B'を産生する;
Bは、B'の形態でFLAPインヒビターである部分であって、B'はB-X、B-H、B-、もしくはB+; Xは-CO2H、-CONH2、-OH、-NH2、ハロゲン、-SH、-CH3もしくは-CH2OHである。 - 化合物が図4、図5、または図6に提示されている化合物のいずれかから選択される、請求項57に記載の方法。
- 式(I)の構造を持つ化合物の患者への投与を含んでいる、患者のNSAID-誘発胃病変の治療方法:
Ax-L-B
式(I)
式中、
Aは、a) A'の形態でNOモジュレーターである部分であって、A'はA-X、A-H、A-、もしくはA+; XはCOOH、CONH2、OH、NH2、ハロゲン、SH、もしくはCH3である;
b) 活性化/反応時にNOを産生する部分; または
c) -NO2および-ONO2から選択される部分であって、
xは0、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、17、19、もしくは20;
Lは結合またはA部分およびB部分と化学的に連結している部分であって、単一ステップもしくは複数ステップで、化学的、酵素的、生物学的、光化学的、電気化学的、または音響化学的手段によって、in vivoで開裂して、-L'-Aと-B'、-L'-Bと-A'、または-L'、-A'および-B'を産生する;
Bは、B'の形態でFLAPインヒビターである部分であって、B'はB-X、B-H、B-、もしくはB+; Xは-CO2H、-CONH2、-OH、-NH2、ハロゲン、-SH、-CH3もしくは-CH2OHである。 - 化合物が図4、図5、または図6に提示されている化合物のいずれかから選択される、請求項59に記載の方法。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US86802406P | 2006-11-30 | 2006-11-30 | |
| PCT/US2007/086188 WO2008067566A1 (en) | 2006-11-30 | 2007-11-30 | Compositions and treatments comprising 5-lipoxygenase-activating protein inhibitors and nitric oxide modulators |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2010511632A true JP2010511632A (ja) | 2010-04-15 |
| JP2010511632A5 JP2010511632A5 (ja) | 2011-01-20 |
Family
ID=39468284
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009539527A Pending JP2010511632A (ja) | 2006-11-30 | 2007-11-30 | 5−リポキシゲナーゼ活性化タンパク質インヒビターおよび一酸化窒素モジュレーターを含んでいる組成物および治療法 |
Country Status (4)
| Country | Link |
|---|---|
| US (1) | US20100068301A1 (ja) |
| EP (1) | EP2086531A4 (ja) |
| JP (1) | JP2010511632A (ja) |
| WO (1) | WO2008067566A1 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2016514141A (ja) * | 2013-03-14 | 2016-05-19 | シャイアー ヒューマン ジェネティック セラピーズ インコーポレイテッド | B2−ブラジキニン受容体媒介の血管浮腫の治療方法 |
Families Citing this family (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8399666B2 (en) | 2005-11-04 | 2013-03-19 | Panmira Pharmaceuticals, Llc | 5-lipoxygenase-activating protein (FLAP) inhibitors |
| US7977359B2 (en) | 2005-11-04 | 2011-07-12 | Amira Pharmaceuticals, Inc. | 5-lipdxygenase-activating protein (FLAP) inhibitors |
| GB2431927B (en) | 2005-11-04 | 2010-03-17 | Amira Pharmaceuticals Inc | 5-Lipoxygenase-activating protein (FLAP) inhibitors |
| TW200920369A (en) | 2007-10-26 | 2009-05-16 | Amira Pharmaceuticals Inc | 5-lipoxygenase activating protein (flap) inhibitor |
| WO2010068311A1 (en) | 2008-05-23 | 2010-06-17 | Amira Pharmaceuticals, Inc. | 5-lipoxygenase-activating protein inhibitor |
| US8546431B2 (en) | 2008-10-01 | 2013-10-01 | Panmira Pharmaceuticals, Llc | 5-lipoxygenase-activating protein (FLAP) inhibitors |
| WO2011157798A1 (en) | 2010-06-16 | 2011-12-22 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods and compositions for stimulating reepithelialisation during wound healing |
| US20130310421A1 (en) * | 2012-05-18 | 2013-11-21 | Temple University - Of The Commonwealth System Of Higher Education | Treatment of amyloid beta amyloidosis |
| WO2014031586A2 (en) * | 2012-08-20 | 2014-02-27 | Tallikut Pharmaceuticals, Inc. | Methods for treating cardiovascular diseases |
| GB201317363D0 (en) | 2013-10-01 | 2013-11-13 | Eisai Ltd | Novel compounds |
| DK3102209T3 (da) | 2014-02-04 | 2021-07-12 | Bioscience Pharma Partners Llc | Anvendelse af flap-hæmmere til at reducere neuroinflammationsmedieret læsion i centralnervesystemet |
| US10350223B2 (en) | 2015-03-03 | 2019-07-16 | Richard W. Yee | Compositions and methods for treating ocular diseases |
| US20180177724A1 (en) * | 2015-07-02 | 2018-06-28 | The Regents Of The University Of California | Site-targeted nano-liposomal nitroglycerin therapeutics |
| CN108434439B (zh) * | 2018-01-23 | 2020-02-07 | 中国人民解放军总医院 | 钙网蛋白的医药用途 |
| CN109187832B (zh) * | 2018-09-30 | 2021-07-30 | 华润三九医药股份有限公司 | Lc-ms/ms测定去氧肾上腺素浓度的方法及样品的前处理方法 |
Family Cites Families (36)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5081138A (en) | 1986-12-17 | 1992-01-14 | Merck Frosst Canada, Inc. | 3-hetero-substituted-n-benzyl-indoles and prevention of leucotriene synthesis therewith |
| DE3814504A1 (de) | 1988-04-29 | 1989-11-09 | Bayer Ag | (alpha)-substituierte 4-(chinolin-2-yl-methoxy)phenylessigsaeuren und -ester, verfahren zu ihrer herstellung und ihre verwendung in arzneimitteln |
| DE3900261A1 (de) | 1988-05-31 | 1989-12-07 | Bayer Ag | Substituierte 4-(chinolin-2-yl-methoxy) phenyl-essigsaeure-derivate |
| US5204344A (en) | 1989-08-22 | 1993-04-20 | Merck Frosst Canada, Inc. | (Quinolin-2-ylmethoxy)indoles as inhibitors of the biosynthesis of leukotrienes |
| US5272145A (en) | 1989-08-22 | 1993-12-21 | Merck Frosst Canada, Inc. | (Quinolin-2-ylmethoxy)indoles as inhibitors of the biosynthesis of leukotrienes |
| DE3927931A1 (de) | 1989-08-24 | 1991-02-28 | Bayer Ag | Disubstituierte (chinolin-2-yl-methoxy)phenylessigsaeure-derivate |
| US5229516A (en) | 1989-10-27 | 1993-07-20 | American Home Products Corporation | Substituted indole-, indene-, pyranoindole- and tetrahydrocarbazole-alkanoic acid derivatives as inhibitors of PLA2 and lipoxygenase |
| US5221678A (en) | 1990-07-26 | 1993-06-22 | Merck Frosst Canada, Inc. | (quinolin-2-ylmethoxy)tetrahydrocarbazoles as inhibitors of the biosynthesis of leukotrienes |
| US5095031A (en) | 1990-08-20 | 1992-03-10 | Abbott Laboratories | Indole derivatives which inhibit leukotriene biosynthesis |
| US5304563A (en) | 1991-02-22 | 1994-04-19 | Bayer Aktiengesellschaft | 2-substituted quinolines, and their use in medicaments |
| DE4139751A1 (de) | 1991-12-03 | 1993-06-09 | Bayer Ag, 5090 Leverkusen, De | Thiazolyl substituierte chinolylmethoxyphenylessigsaeurederivate |
| DE4128681A1 (de) | 1991-08-29 | 1993-03-04 | Bayer Ag | Substituierte mandelsaeurederivate, verfahren zu ihrer herstellung sowie ihre verwendung in arzneimitteln |
| DE4226519A1 (de) | 1992-08-11 | 1994-02-17 | Bayer Ag | 3-Substituierte Chinolylmethoxy-phenylessigsäurederivate |
| US5288743A (en) | 1992-11-20 | 1994-02-22 | Abbott Laboratories | Indole carboxylate derivatives which inhibit leukotriene biosynthesis |
| IL109254A (en) | 1993-04-29 | 1999-03-12 | Zeneca Ltd | History of the tetrahydropyran and tetrahydropuran site preparation and pharmaceutical preparations containing them |
| US5399699A (en) | 1994-01-24 | 1995-03-21 | Abbott Laboratories | Indole iminooxy derivatives which inhibit leukotriene biosynthesis |
| US5512581A (en) | 1994-07-18 | 1996-04-30 | Abbott Laboratories | Iminoxycarboxylates and derivatives as inhibitors of leukotriene biosynthesis |
| US5668146A (en) | 1995-10-03 | 1997-09-16 | Abbott Laboratories | Symmetrical bis-heteroarylmethoxyphenyliminoxyalkyl carboxylates as inhibitors of leukotriene biosynthesis |
| US5795900A (en) | 1995-10-03 | 1998-08-18 | Abbott Laboratories | Symmetrical bis-heteroaryl-methoxy-phenylalkyl carboxylates as inhibitors of leukotriene biosynthesis |
| US5714488A (en) | 1995-10-03 | 1998-02-03 | Abbott Laboratories | Bis-heteroarylylmethoxyphenyl ketone derivatives as inhibitors of leukotriene biosynthesis |
| US5691351A (en) | 1996-02-06 | 1997-11-25 | Abbott Laboratories | Bis-(Heteroarylmethoxyphenyl)cycloalkyl carboxylates as inhibitors of leukotriene biosynthesis |
| US5668150A (en) | 1996-07-26 | 1997-09-16 | Abbott Laboratories | Non-symmetrical bis-heteroarylmethoxyphenylalkyl carboxylates as inhibitors of leukotriene biosynthesis |
| US5783586A (en) | 1996-10-01 | 1998-07-21 | Abbott Laboratories | Heteroarylmethoxyphenylthioalkyl carboxylates as inhibitors of leukotriene biosynthesis |
| DK1071710T4 (da) | 1998-04-15 | 2011-12-12 | Merck Serono Biodevelopment | Genomisk sekvens for 5-lipoxygenase-aktiveringsproteinet (FLAP), polymorfe markører deri og fremgangsmåder til påvisning af astma |
| DE10007203A1 (de) | 2000-02-17 | 2001-08-23 | Asta Medica Ag | Neue Kombination nichtsedierender Antihistaminika mit Substanzen, die die Leukotrienwirkung beeinflussen, zur Behandlung der Rhinitis/Konjunktivitis |
| AU2002222910A1 (en) | 2000-07-13 | 2002-01-30 | Bristol-Myers Squibb Company | Method of modulating microglial activation for the treatment of acute and chronic neurodegenerative disorders |
| US6756399B2 (en) | 2001-06-29 | 2004-06-29 | The United States Of America As Represented By The Department Of Health And Human Services | Use of lipoxygenase inhibitors and PPAR ligands as anti-cancer therapeutic and intervention agents |
| US7851486B2 (en) | 2002-10-17 | 2010-12-14 | Decode Genetics Ehf. | Susceptibility gene for myocardial infarction, stroke, and PAOD; methods of treatment |
| US7405302B2 (en) | 2005-10-11 | 2008-07-29 | Amira Pharmaceuticals, Inc. | 5-lipoxygenase-activating protein (FLAP) inhibitors |
| US20070244128A1 (en) | 2005-11-04 | 2007-10-18 | Amira Pharmaceuticals, Inc. | 5-lipoxygenase-activating protein (flap) inhibitors |
| US20070219206A1 (en) | 2005-11-04 | 2007-09-20 | Amira Pharmaceuticals, Inc. | 5-lipoxygenase-activating protein (flap) inhibitors |
| US7977359B2 (en) | 2005-11-04 | 2011-07-12 | Amira Pharmaceuticals, Inc. | 5-lipdxygenase-activating protein (FLAP) inhibitors |
| US20070225285A1 (en) | 2005-11-04 | 2007-09-27 | Amira Pharmaceuticals, Inc. | 5-lipoxygenase-activating protein (flap) inhibitors |
| GB2431927B (en) * | 2005-11-04 | 2010-03-17 | Amira Pharmaceuticals Inc | 5-Lipoxygenase-activating protein (FLAP) inhibitors |
| ATE498460T1 (de) | 2005-11-08 | 2011-03-15 | Surmodics Inc | Ultradünne photopolymer-beschichtungen und verwendungen davon |
| TW200920369A (en) * | 2007-10-26 | 2009-05-16 | Amira Pharmaceuticals Inc | 5-lipoxygenase activating protein (flap) inhibitor |
-
2007
- 2007-11-30 JP JP2009539527A patent/JP2010511632A/ja active Pending
- 2007-11-30 EP EP07865056A patent/EP2086531A4/en not_active Withdrawn
- 2007-11-30 US US12/517,166 patent/US20100068301A1/en not_active Abandoned
- 2007-11-30 WO PCT/US2007/086188 patent/WO2008067566A1/en active Application Filing
Non-Patent Citations (1)
| Title |
|---|
| JPN6013002139; Bioorganic & Medicinal Chemistry Letters Vol.9, No.16, 1999, p.2391-2396 * |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2016514141A (ja) * | 2013-03-14 | 2016-05-19 | シャイアー ヒューマン ジェネティック セラピーズ インコーポレイテッド | B2−ブラジキニン受容体媒介の血管浮腫の治療方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2008067566A1 (en) | 2008-06-05 |
| EP2086531A4 (en) | 2009-09-30 |
| US20100068301A1 (en) | 2010-03-18 |
| EP2086531A1 (en) | 2009-08-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2010511632A (ja) | 5−リポキシゲナーゼ活性化タンパク質インヒビターおよび一酸化窒素モジュレーターを含んでいる組成物および治療法 | |
| JP5406716B2 (ja) | インドール化合物 | |
| JP5320590B2 (ja) | 5−リポキシゲナーゼ活性化タンパク質(flap)阻害剤 | |
| JP5506707B2 (ja) | 5−リポキシゲナーゼ活性化タンパク質(flap)阻害剤 | |
| US7960544B2 (en) | Useful indole compounds | |
| US20100204282A1 (en) | Reverse indoles as 5-lipoxygenase-activating protein (FLAP) inhibitors | |
| US20090118503A1 (en) | Faah inhibitors | |
| JP2010526817A (ja) | 5−リポキシゲナーゼ活性化タンパク質(flap)阻害剤 | |
| JP2011521912A (ja) | プロスタグランジンd2受容体の三環式アンタゴニスト | |
| CN110483492A (zh) | 二肽基肽酶i抑制剂 | |
| JP2010526818A (ja) | 5−リポキシゲナーゼ活性化タンパク質(flap)阻害剤 | |
| US11059833B2 (en) | BCKDK inhibitors | |
| US20210047337A1 (en) | Triazolopyrimidines, their preparation and use | |
| US20100298343A1 (en) | 5-lipoxygenase-activating protein (flap) inhibitors | |
| US20130005721A1 (en) | Indolizine inhibitors of 5-lipoxygenase | |
| ES2693382T3 (es) | Cristal de derivado de azol benceno como inhibidor de xantina oxidasa | |
| US20120214840A1 (en) | Indolizine inhibitors of 5-lipoxygenase |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20101122 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20101122 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20130122 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20130702 |