JP2005102645A - Method for determining sterilization effect on microorganism - Google Patents
Method for determining sterilization effect on microorganism Download PDFInfo
- Publication number
- JP2005102645A JP2005102645A JP2003343425A JP2003343425A JP2005102645A JP 2005102645 A JP2005102645 A JP 2005102645A JP 2003343425 A JP2003343425 A JP 2003343425A JP 2003343425 A JP2003343425 A JP 2003343425A JP 2005102645 A JP2005102645 A JP 2005102645A
- Authority
- JP
- Japan
- Prior art keywords
- sample
- microorganisms
- microorganism
- sterilization
- measuring
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Abstract
Description
本発明は、試料中に含まれる個々の微生物の増殖活性を測定することにより、微生物の殺菌処理効果を迅速に測定する方法に関する。 The present invention relates to a method for rapidly measuring the sterilization effect of microorganisms by measuring the proliferation activity of individual microorganisms contained in a sample.
食品、医薬品、化粧品等の様々な工業製品、工業分野で、微生物の増殖による製品等の品質低下,食中毒事件が問題になっている。このため、微生物の増殖を抑制する目的で、加熱,紫外線照射,放射線照射,オゾン処理,エチレンオキサイドガス処理、電解水,各種薬剤による殺菌・消毒処理法が検討・開発されている。 In various industrial products such as foods, pharmaceuticals, and cosmetics, and in the industrial field, quality deterioration of products due to the growth of microorganisms and food poisoning cases have become problems. For this reason, sterilization / disinfection treatment methods using heating, ultraviolet irradiation, radiation irradiation, ozone treatment, ethylene oxide gas treatment, electrolyzed water, and various chemicals have been studied and developed for the purpose of suppressing the growth of microorganisms.
これらの殺菌・消毒処理法の効果を判定するためには、(1)微生物を含む試料について、殺菌・消毒法を施し、(2)処理後の試料を標準寒天培地等の適当な増殖培地と混合した後に、適当な条件(温度,好気性/嫌気性雰囲気,etc)下で24〜48時間培養した後、(3)微生物が増殖して形成したコロニー数を計数し、生菌数をCFU(colony formation Unit)として求め、(4)殺菌未処理の対照試料の生菌数との比較によって殺菌・消毒処理法の効果を判定する。 In order to determine the effects of these sterilization / disinfection methods, (1) sterilization / disinfection methods are applied to samples containing microorganisms, and (2) the treated samples are treated with an appropriate growth medium such as a standard agar medium. After mixing, the cells were cultured for 24 to 48 hours under appropriate conditions (temperature, aerobic / anaerobic atmosphere, etc), and (3) the number of colonies formed by the growth of microorganisms was counted. (4) Determine the effect of the sterilization / disinfection treatment method by comparing with the number of viable bacteria in the unsterilized control sample.
また、滅菌処理が十分であるか否かを判断するための指標としてB.subtilis芽胞などを用い、滅菌処理された芽胞の多角光散乱と滅菌処理されなかった多角光散乱とを比較することにより、滅菌処理の有効性を検出する方法が知られている(例えば、特許文献1参照。)。 In addition, by using B. subtilis spores or the like as an index for determining whether sterilization is sufficient or not, by comparing multi-angle light scattering of sterilized spores with non-sterilized multi-angle light scattering A method for detecting the effectiveness of sterilization is known (for example, see Patent Document 1).
また、細菌試料を生菌特異的にあるいは死菌特異的に蛍光染色した後に、フローサイトメータあるいは、蛍光顕微鏡で、生菌あるいは死菌を選択的に計数する方法が知られている。
コロニーを計数する方法は、コロニーが形成されるのに長い時間が必要とされるので、殺菌・消毒処理効果の判定に時間がかかる。 In the method of counting colonies, it takes a long time for the colonies to be formed, so it takes time to determine the effect of the sterilization / disinfection treatment.
芽胞の多角光散乱を比較する方法では、多角光散乱の差異が必ずしも滅菌率の差異と一致しないという問題がある。 In the method for comparing the multi-angle light scattering of the spore, there is a problem that the difference in multi-angle light scattering does not necessarily coincide with the difference in sterilization rate.
生菌又は死菌特異性の蛍光色素を用いる方法では、例えば、細胞膜透過性を基に、微生物の生死を判定するために、必ずしも蛍光色素の染色性と微生物の生死が一致しないという問題がある。 In the method using a live or dead fungus-specific fluorescent dye, there is a problem that, for example, in order to determine the viability of a microorganism based on cell membrane permeability, the dyeability of the fluorescent dye does not necessarily match the viability of the microorganism. .
本発明は、このような事情を考慮してなされたもので、試料中に含まれる個々の微生物の増殖活性を測定することにより、迅速かつ正確に、微生物の殺菌処理効果を測定する方法を提供するものである。 The present invention has been made in view of such circumstances, and provides a method for measuring the sterilization effect of microorganisms quickly and accurately by measuring the proliferation activity of individual microorganisms contained in a sample. To do.
本発明は、殺菌対象から殺菌処理された試料を採取し、その試料を予め所定時間培養した後、試料中に含まれる個々の微生物の増殖活性を電気的又は光学的に測定することを特徴とする微生物の殺菌処理効果測定方法を提供する。 The present invention is characterized by collecting a sterilized sample from a sterilization target, culturing the sample in advance for a predetermined time, and then measuring the proliferation activity of individual microorganisms contained in the sample electrically or optically. Provided is a method for measuring the sterilization effect of microorganisms.
発明者は、殺菌処理後の試料を培養することにより、微生物の増殖活性に変化が生じ、その増殖活性を電気的又は光学的に測定することにより、生微生物数を効果的に検出・計数することができることを見出した。これにより、その生微生物数から微生物の殺菌処理効果を測定することが可能となり、本発明の完成に至った。例えば、検出される生微生物の数が所定の数値以下であるか否かを調べることにより、殺菌処理の効果が十分であるか否かを測定することができる。 The inventor changes the growth activity of microorganisms by culturing a sample after sterilization treatment, and effectively detects and counts the number of living microorganisms by measuring the growth activity electrically or optically. I found that I can do it. Thereby, it became possible to measure the sterilization effect of microorganisms from the number of living microorganisms, and the present invention was completed. For example, it is possible to measure whether or not the effect of the sterilization treatment is sufficient by examining whether or not the number of detected live microorganisms is equal to or less than a predetermined value.
本発明における試料の培養工程にかかる時間は、微生物の増殖活性を変化させるのに必要な時間で足りる。この時間は、微生物がコロニーを形成するまでにかかる時間よりもはるかに短いため、本発明により短時間で殺菌処理効果を測定することが可能となる。 The time required for the sample culturing step in the present invention is sufficient for changing the growth activity of the microorganism. Since this time is much shorter than the time required for the microorganisms to form colonies, the present invention makes it possible to measure the sterilization effect in a short time.
本発明の方法では、個々の微生物の増殖活性を電気的又は光学的に測定することにより、生微生物を直接的に計数し、殺菌処理効果を測定できるため、グロスでpHや多角光散乱などの差異から間接的に殺菌処理効果を測定する方法と比較して、信頼性が高い。 In the method of the present invention, by measuring the growth activity of individual microorganisms electrically or optically, live microorganisms can be directly counted and the bactericidal treatment effect can be measured. Compared to the method of indirectly measuring the sterilization effect from the difference, the reliability is high.
本発明の方法は、試料を培養することにより、生微生物と死微生物との間に、所定の増殖活性について差異が生じることを利用するため、従来の生菌又は死菌特異性の蛍光色素を用いる方法のように、蛍光色素の細胞膜透過性と微生物の生死との間の不一致による誤差が生じず、信頼性が高い。 Since the method of the present invention utilizes the fact that a predetermined growth activity is different between a living microorganism and a dead microorganism by culturing a sample, a conventional fluorescent dye specific to a living or dead microorganism is used. Like the method used, there is no error due to inconsistency between the cell membrane permeability of the fluorescent dye and the life and death of the microorganism, and the reliability is high.
本発明の第1の実施形態による微生物の殺菌処理効果測定方法は、殺菌対象から殺菌処理された試料を採取し、その試料を予め所定時間培養した後、試料中に含まれる個々の微生物の増殖活性を電気的又は光学的に測定することを特徴とする。 The method for measuring the effect of sterilization treatment of microorganisms according to the first embodiment of the present invention involves collecting a sample sterilized from a sterilization target, culturing the sample in advance for a predetermined time, and then proliferating individual microorganisms contained in the sample. The activity is measured electrically or optically.
まず、殺菌対象から殺菌処理された試料を採取し、その試料を予め所定時間培養する工程について説明する。 First, a process of collecting a sterilized sample from a sterilization target and culturing the sample for a predetermined time in advance will be described.
殺菌処理とは、例えば、化学的・物理的手段により、微生物を死滅させ又は不活性にさせることをいう。具体的には、例えば、(1)試料に紫外線/放射線を照射すること、(2)試料に殺菌効果を有する化学物質を加えること、(3)試料を加熱処理することなどが含まれる。 The sterilization treatment refers to killing or inactivating microorganisms by chemical / physical means, for example. Specifically, for example, (1) irradiating the sample with ultraviolet rays / radiation, (2) adding a chemical substance having a bactericidal effect to the sample, and (3) heating the sample are included.
微生物の種類は限定されず、殺菌対象に、1種類又は複数の種類の微生物が含まれていてもよい。微生物とは、その大きさについては、例えば、径又は長さが0.1μm〜500μm程度のものをいう。 The type of microorganism is not limited, and one or more types of microorganisms may be included in the sterilization target. Microorganisms refer to those having a diameter or length of about 0.1 μm to 500 μm, for example.
試料を予め所定時間培養するとは、試料を予め所定時間、試料に含まれる微生物の生育にとって好適な環境に置くことをいう。 Incubating a sample in advance for a predetermined time refers to placing the sample in an environment suitable for the growth of microorganisms contained in the sample for a predetermined time in advance.
微生物の生育にとって好適な環境は、測定対象とする試料、微生物によって異なり、実施の形態は特に限定されるものではない。例えば、測定対象とする微生物が細菌の場合は、液体培地の使用が好適である。具体的には、例えば、一般細菌を増殖させるためには、普通ブイヨン培地,ハートインヒュージョンブイヨン培地,トリプトソイブイヨン培地などが好適に使用される。 The environment suitable for the growth of microorganisms differs depending on the sample and microorganism to be measured, and the embodiment is not particularly limited. For example, when the microorganism to be measured is a bacterium, it is preferable to use a liquid medium. Specifically, for example, a normal bouillon medium, a heart infusion broth medium, a tryptic soy bouillon medium, or the like is preferably used for growing general bacteria.
測定試料が液体の場合は、そのまま測定試料と液体培地を混合するだけでよい。また、測定試料が固形,半固形の場合、試料と生理食塩水,ペプトン水等適当な希釈液とを混合してストマッカー等を用いてホモジナイズした後に、試料と液体培地を混合することが好ましい。 When the measurement sample is liquid, it is only necessary to mix the measurement sample and the liquid medium as they are. When the measurement sample is solid or semi-solid, it is preferable to mix the sample and a liquid medium after mixing the sample with an appropriate diluent such as physiological saline and peptone water and homogenizing using a stomacher or the like.
ホモジナイズ後の試料に最小径100μm以上の微生物以外の粒子が存在する場合は、測定の精度が低化するため、染色液とのメッシュを用いてろ過をすることが好ましい。メッシュの大きさは、100μm程度であることが好ましい。ろ過は、培養開始前、好ましくはフローサイトメータでの測定前に実施することが好適である。ホモジナイズする際に,希釈液の代わりに培養に使用する液体培地を用いれば、工程が簡略化できる。 When the homogenized sample contains particles other than microorganisms having a minimum diameter of 100 μm or more, it is preferable to perform filtration using a mesh with a staining solution in order to reduce measurement accuracy. The size of the mesh is preferably about 100 μm. Filtration is preferably performed before the start of culture, preferably before measurement with a flow cytometer. When homogenizing, the process can be simplified if a liquid medium used for culture is used instead of the diluent.
培養は、微生物の種類によって増殖培養可能な温度域が存在するが、増殖至適温度で培養することが好適である。例えば、低温菌では27℃前後,中温菌では37℃前後,高温菌では55℃前後が好適である。例えば、食中毒を引き起こす病原菌あるいは、腐敗・変敗菌の多くは、中温菌であり、37℃前後で活発に増殖する。 Although there is a temperature range in which culture can be performed depending on the type of microorganism, culture is preferably performed at an optimal growth temperature. For example, about 27 ° C. is suitable for thermophilic bacteria, 37 ° C. is suitable for mesophilic bacteria, and 55 ° C. is suitable for thermophilic bacteria. For example, many pathogenic bacteria that cause food poisoning or spoilage / degradation bacteria are mesophilic bacteria, and actively proliferate around 37 ° C.
これらの条件以外にも、特殊な菌では、塩,pH,酸素濃度等、増殖条件として種々の条件が要求される場合がある。試験対象となる微生物の増殖条件は詳細に検討されており、種々の文献,教科書が容易に入手可能である。 In addition to these conditions, special bacteria may require various conditions as growth conditions such as salt, pH, and oxygen concentration. The growth conditions of the microorganisms to be tested have been studied in detail, and various documents and textbooks are readily available.
所定時間とは、微生物の増殖活性を変化させるのに必要な時間をいう。「変化させる」とは、例えば、生微生物と死微生物との間で電気的又は光学的手段により区別できる程度の差異を生じさせることをいう。微生物の増殖活性が最大に近づく培養時間が好適であり、培養時間としては、対数期に入る直前、誘導期の末期まで培養することが好ましい。 The predetermined time refers to the time required to change the growth activity of the microorganism. “Varying” refers to, for example, causing a difference between live and dead microorganisms that can be distinguished by electrical or optical means. A culture time in which the growth activity of microorganisms approaches the maximum is suitable, and the culture time is preferably cultured immediately before entering the logarithmic phase or until the end of the induction phase.
例えば、大腸菌では、37℃前後で、1時間〜2時間前後培養することが好ましい。 For example, in E. coli, it is preferable to culture at around 37 ° C. for about 1 to 2 hours.
次に、試料中に含まれる微生物の増殖活性を電気的又は光学的に測定する工程について説明する。 Next, the step of measuring the growth activity of microorganisms contained in the sample electrically or optically will be described.
微生物の増殖活性とは、試料を培養することにより変化し、光学的又は電気的に測定される微生物の特性をいい、より詳しくは、例えば、フローサイトメータのような粒子検出計数装置により検出される微生物の特性をいう。具体的には、例えば、微生物の大きさ、長さ、体積、及び、微生物の細胞内含有物、例えば、核酸含有量などがある。 The growth activity of microorganisms refers to the characteristics of microorganisms that change by culturing a sample and are measured optically or electrically. More specifically, it is detected by a particle detection and counting device such as a flow cytometer. The characteristics of microorganisms. Specifically, there are, for example, the size, length, and volume of microorganisms, and intracellular contents of microorganisms such as nucleic acid content.
「微生物の増殖活性を電気的又は光学的に測定する」とは、例えば、微生物の増殖活性に基づいて、電気的又は光学的な手段を用いて、生微生物と死微生物とを区別して微生物を個別に検出して計数することをいう。これにより、試料中の生微生物の数から殺菌処理効果を測定することができる。 “Electrically or optically measuring the growth activity of microorganisms” means, for example, based on the growth activity of microorganisms, by distinguishing between live and dead microorganisms using electrical or optical means. Refers to individual detection and counting. Thereby, the bactericidal treatment effect can be measured from the number of living microorganisms in the sample.
電気的又は光学的測定は、例えば、フローサイトメータを用いて行うことができる。フローサイトメータは個々の微粒子からの電気的又は光学的信号を得ることができる。フローサイトメータとしては、例えば、光学式フローサイトメータ、電気抵抗式フローサイトメータなどを用いることができる。フローサイトメータは、約1〜500ミクロン程度の微粒子を計測できるものが好ましい。 Electrical or optical measurements can be made using, for example, a flow cytometer. Flow cytometers can obtain electrical or optical signals from individual particulates. As the flow cytometer, for example, an optical flow cytometer, an electric resistance type flow cytometer, or the like can be used. The flow cytometer is preferably capable of measuring fine particles of about 1 to 500 microns.
光学式フローサイトメータとしては、シスメックス株式会社より発売されているBACTANA、ベックマン・クールター社より発売されているEPICSシリーズ,ベクトン・ディッキンソン社より発売されているFACSシリーズを用いることができる。 As the optical flow cytometer, BACTANA released from Sysmex Corporation, EPICS series released from Beckman Coulter, and FACS series released from Becton Dickinson can be used.
電気抵抗式フローサイトメータは、クールター原理として良く知られる測定原理を用いた粒子計測装置で有り、例えば、シスメックス株式会社より販売されているSD-2000,CDA-500などの装置が好適に使用できる。 The electric resistance type flow cytometer is a particle measuring device using a measurement principle well known as a Coulter principle. For example, devices such as SD-2000 and CDA-500 sold by Sysmex Corporation can be suitably used. .
微生物の増殖活性として微生物の核酸含有量を測定する場合、蛍光染色した核酸から発せられる蛍光の強度に基づいて、微生物の核酸含有量を測定することができる。 When measuring the nucleic acid content of a microorganism as the growth activity of the microorganism, the nucleic acid content of the microorganism can be measured based on the intensity of fluorescence emitted from the fluorescently stained nucleic acid.
例えば、(a)試料中の微生物を核酸特異性の蛍光色素で染色し、(b)得られた試料を光学式フローサイトメータに導入し、染色された個々の微生物に光を照射し、(c)個々の微生物から発せられる、微生物の核酸含有量を表す蛍光の強度に基づいて微生物を光学式フローサイトメータにより個別に検出して計数する工程により測定することができる。また、核酸特異性の蛍光色素で染色する代わりに、蛍光標識核酸プローブで標識してもよい。 For example, (a) a microorganism in a sample is stained with a nucleic acid-specific fluorescent dye, (b) the obtained sample is introduced into an optical flow cytometer, and light is applied to each stained microorganism ( c) Based on the intensity of fluorescence emitted from individual microorganisms and representing the nucleic acid content of the microorganisms, the microorganisms can be individually measured and counted by an optical flow cytometer. Further, instead of staining with a nucleic acid-specific fluorescent dye, it may be labeled with a fluorescently labeled nucleic acid probe.
核酸特異性の蛍光色素には、微生物中の核酸(RNA、DNA)を特異的に染色するとともに、光を吸収し、蛍光を発するものが用いられる。ここで、「核酸を特異的に染色する」とは、主に核酸を染色することをいい、本発明の目的を逸脱しない範囲で、例えば、培養中に増加あるいは活性化する微生物中のタンパク質、酵素など、核酸以外のものを染色する場合を除外するものではない。従って、「核酸特異性の蛍光色素」には、本発明の目的を逸脱しない範囲で、例えば、微生物中のタンパク質、酵素など、核酸以外のものを染色する蛍光色素も含まれる。このような蛍光色素には、例えば、特開平9−104683、特開2001−258590に記載の色素を用いることができる。この色素を用いると、1分以内に微生物の核酸を染色することができ、好適である。 As the nucleic acid-specific fluorescent dye, one that specifically stains nucleic acid (RNA, DNA) in a microorganism, absorbs light, and emits fluorescence is used. Here, “specifically stain nucleic acid” mainly refers to staining nucleic acid, and within a range that does not depart from the purpose of the present invention, for example, a protein in a microorganism that is increased or activated during culture, It does not exclude the case of staining something other than nucleic acids, such as enzymes. Therefore, the “nucleic acid-specific fluorescent dye” includes, for example, fluorescent dyes that stain other than nucleic acids such as proteins and enzymes in microorganisms without departing from the object of the present invention. As such fluorescent dyes, for example, dyes described in JP-A-9-104683 and JP-A-2001-258590 can be used. When this dye is used, the nucleic acid of the microorganism can be stained within 1 minute, which is preferable.
微生物の核酸の染色は基本的に核酸特異性の蛍光色素と緩衝剤を含む水溶液である染色液を用いて行われる。染色を行う前に試料を希釈液で希釈する。その希釈液には、微生物の細胞膜を損傷させ、色素が細胞内に入りやすくするため、又は、微粒子の分散を改善するための薬剤、例えば、界面活性剤を加えることが好ましい。また、蛍光色素の安定性が悪い場合には,色素をエチレングリコール等の溶液で保存し、使用時に希釈液と混合して使用することが好適である。 Microbial nucleic acid staining is basically performed using a staining solution that is an aqueous solution containing a nucleic acid-specific fluorescent dye and a buffer. Dilute the sample with diluent before staining. It is preferable to add an agent, for example, a surfactant, for damaging the cell membrane of the microorganism and facilitating the dye to enter the cell or for improving the dispersion of the fine particles. In addition, when the stability of the fluorescent dye is poor, it is preferable to store the dye in a solution such as ethylene glycol and mix it with a diluent at the time of use.
核酸が染色された微生物は、フローサイトメータからのレーザ等の光を吸収し、染色された核酸の量を表す強度の蛍光を発し、フローサイトメータは、蛍光を検出し、蛍光の強度を測定する。この蛍光の強度の違いに基づいて、生微生物と死微生物を区別して計数することができ、生微生物の数より、殺菌処理効果を測定することができる。 Microorganisms that have been stained with nucleic acid absorb light such as laser from the flow cytometer, and emit fluorescence with an intensity that represents the amount of stained nucleic acid. The flow cytometer detects fluorescence and measures the intensity of fluorescence. To do. Based on the difference in fluorescence intensity, live and dead microorganisms can be distinguished and counted, and the bactericidal treatment effect can be measured from the number of live microorganisms.
微生物の増殖活性として微生物の大きさを測定する場合、微生物から発せられる散乱光強度に基づいて、微生物の大きさを測定することができる。 When measuring the size of a microorganism as the growth activity of the microorganism, the size of the microorganism can be measured based on the intensity of scattered light emitted from the microorganism.
例えば、(a)試料を光学式フローサイトメータに導入し、個々の微生物に光を照射し、(b)個々の微生物により散乱された、微生物の大きさを表す散乱光の強度に基づいて微生物を光学式フローサイトメータにより個別に検出して計数する工程により測定することができる。 For example, (a) a sample is introduced into an optical flow cytometer, each individual microorganism is irradiated with light, and (b) a microorganism based on the intensity of scattered light representing the size of the microorganism scattered by the individual microorganism. Can be measured by a process of individually detecting and counting with an optical flow cytometer.
微生物に光を照射すると、微生物で光が散乱し、光学式フローサイトメータは、微生物の大きさを表す散乱光を検出し、散乱光の強度を測定する。測定された微生物の大きさの違いに基づいて、生微生物と死微生物を区別して計数することができ、生微生物の数より、殺菌処理効果を測定することができる。なお、「散乱光」には、前方散乱光、側方散乱光及び後方散乱光などが含まれる。 When a microorganism is irradiated with light, the light is scattered by the microorganism, and the optical flow cytometer detects scattered light indicating the size of the microorganism and measures the intensity of the scattered light. Based on the difference in the size of the measured microorganism, live microorganisms and dead microorganisms can be distinguished and counted, and the sterilization effect can be measured from the number of live microorganisms. The “scattered light” includes forward scattered light, side scattered light, back scattered light, and the like.
増殖により、長さの変化する微生物、例えば、酵母、納豆菌などでは、散乱光の強度の代わりに、散乱光のパルス幅を用いてもよい。散乱光のパルス幅は、散乱光を検出している時間から測定することができる。測定された微生物のパルス幅の違いに基づいて、生微生物と死微生物を区別して計数することができ、生微生物の数より、殺菌処理効果を測定することができる。 For microorganisms whose length changes due to growth, such as yeast and natto, the pulse width of the scattered light may be used instead of the intensity of the scattered light. The pulse width of the scattered light can be measured from the time when the scattered light is detected. Based on the difference in the measured pulse widths of microorganisms, live microorganisms and dead microorganisms can be distinguished and counted, and the sterilization effect can be measured from the number of living microorganisms.
微生物の増殖活性として微生物の大きさ(体積)を測定する場合、微生物の存在により変化する電極間電気抵抗値に基づいて、微生物の大きさ(体積)を測定することができる。 When measuring the size (volume) of a microorganism as the growth activity of the microorganism, the size (volume) of the microorganism can be measured based on the inter-electrode electrical resistance value that changes due to the presence of the microorganism.
例えば、(a)試料を、オリフィスと、オリフィスを介して電解液によって電気的に接続された一対の電極とを備える電気抵抗式フローサイトメータに導入し、(b)電解液中の個々の微生物がオリフィスを通過する際の、微生物の体積を表す電極間電気抵抗値に基づいて微生物を電気抵抗式フローサイトメータにより個別に検出して計数する工程により測定することができる。 For example, (a) a sample is introduced into an electric resistance type flow cytometer comprising an orifice and a pair of electrodes electrically connected through the orifice with an electrolyte, and (b) individual microorganisms in the electrolyte The microorganisms can be measured by a process of individually detecting and counting microorganisms with an electric resistance type flow cytometer based on the inter-electrode electrical resistance value representing the volume of the microorganisms when passing through the orifice.
オリフィスとは、微細な貫通孔であり、例えば、直径が30μm〜200μm程度のものを用いることができ、直径が約100μmのものが好ましい。 An orifice is a fine through-hole, for example, those having a diameter of about 30 μm to 200 μm can be used, and those having a diameter of about 100 μm are preferable.
一対の電極がオリフィスを介して電解液によって電気的に接続され、電解液中の微粒子がオリフィスを通過する際に生じる電極間電気抵抗値の変化を電気パルスとして検出し、そのパルス高さから微粒子の体積を正確に計測できる。また、体積の違いによって、微生物と微生物以外の粒子を区別して計数することができる。 A pair of electrodes are electrically connected by an electrolyte solution through an orifice, and a change in the inter-electrode electrical resistance value that occurs when particles in the electrolyte solution pass through the orifice is detected as an electric pulse. Can accurately measure the volume. Further, the microorganisms and the particles other than the microorganisms can be distinguished and counted by the difference in volume.
測定された微生物の体積の違いに基づいて、生微生物と死微生物を区別して計数することができ、生微生物の数より、殺菌処理効果を測定することができる。 Based on the measured difference in the volume of microorganisms, live microorganisms and dead microorganisms can be distinguished and counted, and the sterilization effect can be measured from the number of living microorganisms.
本発明の方法は、殺菌処理前の試料と殺菌処理された試料とに対して同様の処理・測定を行って得られた両者の結果を比較する工程をさらに備えていてもよい。 The method of the present invention may further include a step of comparing the results obtained by performing the same treatment and measurement on the sample before the sterilization treatment and the sample subjected to the sterilization treatment.
殺菌処理を施した試料と施していない試料ついて得られた結果を比較することにより、殺菌処理後も生存している微生物の数量について、相対値を得ることができ、より正確に殺菌処理効果を測定することができる。 By comparing the results obtained for the sterilized and non-sterilized samples, it is possible to obtain a relative value for the number of microorganisms that are still alive after sterilization. Can be measured.
すなわち、相対値を得ることにより、殺菌対象に含まれる微生物数に左右されずに正確に殺菌処理効果を測定することができる。また、殺菌処理後の生微生物数の絶対値により殺菌処理効果を測定した場合には、培養時間の変動により、測定結果に一定のばらつきが生じるが、生微生物数の相対値により殺菌処理効果を測定した場合は、比較する2つの試料中の生微生物数が概ね同じ割合で増加するため、培養時間の変動による測定結果のばらつきが小さい。 That is, by obtaining the relative value, the sterilization effect can be accurately measured without being influenced by the number of microorganisms included in the sterilization target. In addition, when the effect of sterilization treatment is measured by the absolute value of the number of living microorganisms after sterilization treatment, a certain variation occurs in the measurement result due to fluctuations in the culture time. When measured, the number of viable microorganisms in the two samples to be compared increases at approximately the same rate, so that the variation in measurement results due to fluctuations in the culture time is small.
次に本発明の第2の実施形態について説明する。
本発明の第2の実施形態による微生物の殺菌処理効果測定方法は、殺菌対象から第1の試料と第2の試料とを採取し、第1の試料を殺菌処理し、第1の試料と第2の試料とそれぞれ所定時間培養した後、第1と第2の試料中に含まれる微生物の増殖活性をそれぞれ電気的又は光学的に測定することを特徴とする。
Next, a second embodiment of the present invention will be described.
The method for measuring the effect of sterilization treatment of microorganisms according to the second embodiment of the present invention collects the first sample and the second sample from the sterilization target, sterilizes the first sample, and performs the first sample and the second sample. After culturing with each of the two samples for a predetermined time, the proliferation activity of the microorganisms contained in the first and second samples is measured electrically or optically, respectively.
少なくとも第1の試料について殺菌処理を施せばよく、第2試料については、殺菌処理を施しても施さなくてもよい。すなわち、第2の試料には、殺菌処理を施さず、第1の試料に施した殺菌処理の効果を測定してもよく、また、第2の試料に、第1試料に施したものとは異なる殺菌処理を施し、2つの殺菌処理の効果を比較してもよい。
第1及び第2の実施形態の共通する部分についての説明は、第1の実施形態についての説明が、第2の実施形態についても適用される。
At least the first sample may be sterilized, and the second sample may or may not be sterilized. In other words, the second sample may be subjected to the sterilization treatment without performing the sterilization treatment, and the second sample may be measured with respect to the first sample. Different sterilization treatments may be applied and the effects of the two sterilization treatments may be compared.
Regarding the description of the common parts of the first and second embodiments, the description of the first embodiment is applied to the second embodiment.
なお、本発明は、試料の培養により、増殖活性が明確に変化しない場合にも適用できる。この場合、生微生物と死微生物を区別して検出して計数することができないが、第1及び第2の試料に含まれる生微生物を培養により十分に増殖させると、実質的に死微生物の数を無視することができる。 In addition, this invention is applicable also when proliferation activity does not change clearly by culture | cultivation of a sample. In this case, it is impossible to detect and count live microorganisms and dead microorganisms separately, but if the live microorganisms contained in the first and second samples are sufficiently grown by culturing, the number of dead microorganisms is substantially reduced. Can be ignored.
この結果、培養後の微生物数の比は、培養前の生微生物数の比を反映しているといえ、培養後の微生物数を比較することにより、殺菌処理効果を測定することができる。 As a result, it can be said that the ratio of the number of microorganisms after culturing reflects the ratio of the number of living microorganisms before culturing, and the sterilizing effect can be measured by comparing the number of microorganisms after culturing.
その理由は、培養前の生微生物数が少ないほど、培養後の微生物数が少なくなるため、殺菌処理効果が高い程、培養後の微生物数が少なくなるためである。例えば、微生物が対数増殖期に入り、第1の試料に含まれる生微生物数と第2の試料に含まれる生微生物との間の差異が明確となる時間培養することが望ましい。 The reason is that the smaller the number of living microorganisms before culturing, the smaller the number of microorganisms after culturing, and the higher the sterilization effect, the smaller the number of microorganisms after culturing. For example, it is desirable to culture for a period of time during which the difference between the number of viable microorganisms contained in the first sample and the viable microorganism contained in the second sample becomes clear as the microorganism enters the logarithmic growth phase.
この発明において、フローサイトメータを使用する場合には、試料中の細菌濃度として102/mL〜103/mL以上が好適であり、測定試料中の初期細菌濃度が低い場合。例えば、100/mLの初期濃度の大腸菌を103/mL以上の濃度まで増殖するには、約4-5時間の培養時間が必要である。 In the present invention, when a flow cytometer is used, the bacterial concentration in the sample is preferably 10 2 / mL to 10 3 / mL or more, and the initial bacterial concentration in the measurement sample is low. For example, in order to grow E. coli having an initial concentration of 10 0 / mL to a concentration of 10 3 / mL or more, a culture time of about 4-5 hours is required.
本発明の実施例を以下に示す。本発明の実施形態は以下の実施例に限定されるものでは無い。 Examples of the present invention are shown below. The embodiments of the present invention are not limited to the following examples.
測定用試料の調製
大腸菌をハートインヒュージョンブイヨン培地にて一昼夜培養した試料を生理食塩水で希釈し、初期濃度105/mLの試料を調製した。この試料を45-80℃で10分間加熱することにより殺菌処理を施した。殺菌処理後の試料1mLとハートインヒュージョンブイヨン培地9mLを混合し、37℃で2時間培養した。
Preparation of Sample for Measurement A sample obtained by culturing E. coli in a heart- infusion broth medium overnight was diluted with physiological saline to prepare a sample with an initial concentration of 10 5 / mL. This sample was sterilized by heating at 45-80 ° C. for 10 minutes. 1 mL of the sample after sterilization treatment and 9 mL of heart infusion broth medium were mixed and cultured at 37 ° C. for 2 hours.
次に、一定時間培養後の上記試料50μLに希釈液340μLを添加して攪拌した後、染色液10μLを添加し、40℃で20秒間インキュベートすることにより、核酸特異性の蛍光色素での染色を行い、測定用試料を調製した。 Next, after adding 340 μL of diluent to 50 μL of the sample after incubation for a certain period of time and stirring, add 10 μL of staining solution and incubate at 40 ° C. for 20 seconds to stain with a nucleic acid-specific fluorescent dye. The measurement sample was prepared.
試薬は以下の組成のものを使用した。
(希釈液)
クエン酸二水塩 21.6g/L
ミリスチルトリメチルアンモニウムブロマイド 1g/L
精製水 1.0L
NaOHでpH2.5に調製した
(染色液)
下記の構造を有する色素 50mg
Reagents having the following composition were used.
(Diluted solution)
Citric acid dihydrate 21.6 g / L
Myristyltrimethylammonium bromide 1g / L
Purified water 1.0L
Adjusted to pH 2.5 with NaOH (staining solution)
50 mg of dye having the following structure
測定方法
633nmの赤色半導体レーザを光源とするフローサイトメータを用いて、調製した試料について赤色蛍光(650nm以上)強度及び前方散乱光強度を測定した。
Measurement Method Using a flow cytometer using a red semiconductor laser of 633 nm as a light source, the intensity of red fluorescence (650 nm or more) and the intensity of forward scattered light were measured for the prepared sample.
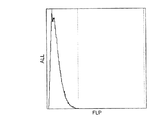
図1、2は、殺菌処理を施していない試料について測定した蛍光強度のヒストグラムである。図1は、培養前のものであり、図2は培養後のものである。 1 and 2 are histograms of fluorescence intensity measured for a sample that has not been sterilized. FIG. 1 is before culture, and FIG. 2 is after culture.
図3、4は、55℃で10分間加熱することによる殺菌処理を施した試料について測定した蛍光強度のヒストグラムである。図3は、培養前のものであり、図4は培養後のものである。 3 and 4 are histograms of fluorescence intensities measured for samples that have been sterilized by heating at 55 ° C. for 10 minutes. FIG. 3 is the one before culture, and FIG. 4 is the one after culture.
図1〜図4において、横軸は蛍光強度(FLP)、縦軸は各強度の蛍光を発した微生物の度数(ALL)、縦方向の破線はディスクリレベルを示す。 1 to 4, the horizontal axis represents fluorescence intensity (FLP), the vertical axis represents the frequency (ALL) of microorganisms emitting fluorescence of each intensity, and the vertical broken line represents the discreet level.
図1、2を比較すると、培養前(図1)には、大部分の微生物が発した蛍光の強度はディスクリレベルより小さかったのに対し、培養後(図2)には、大部分がディスクリレベル以上になっていることが分かる。これは、培養により生微生物中の核酸量が増加したためである。 Comparing FIGS. 1 and 2, the intensity of the fluorescence emitted by most microorganisms was smaller than the discreet level before culturing (FIG. 1), whereas most of the fluorescence after culturing (FIG. 2). You can see that it is above the discretion level. This is because the amount of nucleic acid in the living microorganism increased due to the culture.
図3、4を比較すると、培養前(図3)、培養後(図4)ともに、大部分の微生物が発した蛍光の強度はディスクリレベルより小さいことが分かる。これは、殺菌処理により、大部分の微生物が死滅し、生微生物の数が非常に少なくなったためである。 Comparing FIGS. 3 and 4, it can be seen that the intensity of fluorescence emitted by most microorganisms is smaller than the discreet level both before (FIG. 3) and after (FIG. 4). This is because most of the microorganisms were killed by the sterilization treatment, and the number of living microorganisms became very small.
殺菌処理の有無により、培養後の測定において、ディスクリレベル以上の強度の蛍光を発した微生物数が異なっており、殺菌処理の効果を反映していると言える。 Depending on the presence or absence of the sterilization treatment, the number of microorganisms emitting fluorescence with an intensity higher than the discrete level differs in the measurement after culturing, which can be said to reflect the effect of the sterilization treatment.
図4のヒストグラムのディスクリレベル以上の微生物数は、2.5×103/mLであり、図2のヒストグラムのディスクリレベル以上の微生物数は、4.63×106/mLであった。両者を除することにより、殺菌処理による微生物の抑制率が求まる。
抑制率=抑制試料測定値/対照試料測定値
=2.50×103/4.63×106=5.40×10-4
となる。
The number of microorganisms above the discrete level in the histogram of FIG. 4 was 2.5 × 10 3 / mL, and the number of microorganisms above the discrete level of the histogram in FIG. 2 was 4.63 × 10 6 / mL. . By removing both, the suppression rate of microorganisms by sterilization treatment can be obtained.
Inhibition rate = suppressed sample measured value / control sample measured value = 2.50 × 10 3 /4.63×10 6 = 5.40 × 10 −4
It becomes.
図5〜図8は、前方散乱光強度(FSCP)に対する度数(ALL)を示すヒストグラムであり、図1〜図4についての測定で用いた試料と同じ試料を用いて測定された。 5 to 8 are histograms showing the frequency (ALL) with respect to the forward scattered light intensity (FSCP), and were measured using the same sample as that used in the measurement for FIGS.
図5、6は、殺菌処理を施していない試料について測定した結果を示す。図5は、培養前のものであり、図6は培養後のものである。 5 and 6 show the results of measurement on a sample that has not been sterilized. FIG. 5 shows the result before culture, and FIG. 6 shows the result after culture.
図7、8は、55℃で10分間加熱することによる殺菌処理を施した試料について測定した結果を示す。図7は、培養前のものであり、図8は培養後のものである。
従って,図5〜図8は、それぞれ、図1〜図4に対応する。
7 and 8 show the measurement results of a sample that has been sterilized by heating at 55 ° C. for 10 minutes. FIG. 7 shows the result before culture, and FIG. 8 shows the result after culture.
Accordingly, FIGS. 5 to 8 correspond to FIGS. 1 to 4, respectively.
図5〜図8は、図1〜図4と同じ傾向を示し、前方散乱光を用いても、殺菌処理の効果を測定することができることを示す。つまり、殺菌処理を施していない試料(図5,6)では、培養により生微生物の大きさが大きくなったため、前方散乱光強度が強くなる。一方、殺菌処理を施した試料(図7,8)では、殺菌処理により大部分の微生物が死滅し、生微生物の数が非常に少なくなったため、培養しても前方散乱光強度に変化が生じていない。 FIGS. 5-8 shows the same tendency as FIGS. 1-4, and shows that the effect of a sterilization process can be measured even if it uses forward scattered light. That is, in the sample that has not been sterilized (FIGS. 5 and 6), the intensity of the forward scattered light is increased because the size of the live microorganisms is increased by the culture. On the other hand, in the sterilized sample (FIGS. 7 and 8), most of the microorganisms were killed by the sterilization process, and the number of living microorganisms was very small. Not.
有効性の検証
本発明の方法の有効性を検証するために、同一の条件で殺菌処理を施した試料について、従来の方法と本発明の方法を用いて抑制率を求め、両者を比較した。
Verification of effectiveness In order to verify the effectiveness of the method of the present invention, the inhibition rate was determined using the conventional method and the method of the present invention for samples that were sterilized under the same conditions, and the two were compared.
従来の方法として、以下の手順で、微生物の抑制率を求めた。
まず、実施例1と同一の条件で大腸菌を含む試料を調製し、その試料について実施例1と同一の条件で加熱による殺菌処理を行った。殺菌処理後の試料1mLを約20mLの寒天培地と混釈したのち、35℃で48時間培養し、コロニー数をカウントした。
As a conventional method, the inhibition rate of microorganisms was determined by the following procedure.
First, a sample containing E. coli was prepared under the same conditions as in Example 1, and the sample was sterilized by heating under the same conditions as in Example 1. After 1 mL of the sterilized sample was mixed with about 20 mL of agar medium, it was cultured at 35 ° C. for 48 hours, and the number of colonies was counted.
殺菌処理を施さなかった試料についても同様の方法でコロニー数をカウントした。殺菌処理を施した試料についての測定値を、殺菌処理を施さなかった試料についての測定値で除することにより、微生物の抑制率を求めた。 The number of colonies was counted in the same manner for the samples that were not sterilized. The inhibition rate of microorganisms was determined by dividing the measured value for the sample that had been sterilized by the measured value for the sample that had not been sterilized.
殺菌処理のための加熱処理の温度を45℃から5℃刻みで80℃まで変化させ、それぞれの温度における抑制率を従来の方法と本発明の方法を用いて求めた。その結果を表1に示した。 The temperature of the heat treatment for sterilization treatment was changed from 45 ° C. to 80 ° C. in increments of 5 ° C., and the inhibition rate at each temperature was determined using the conventional method and the method of the present invention. The results are shown in Table 1.
図9は、表1に示された、従来の方法により求められた抑制率と、本発明の方法により求められた抑制率との関係を示すグラフである。このグラフは、両者がよく相関していることを示し、それゆえに、本発明の方法の有効性を示している。 FIG. 9 is a graph showing the relationship between the inhibition rate obtained by the conventional method shown in Table 1 and the inhibition rate obtained by the method of the present invention. This graph shows that both are well correlated, and thus the effectiveness of the method of the present invention.
また、本発明による測定値の列を見ると、加熱処理温度が高いもの、すなわち、殺菌処理効果が高いものほど、測定値が小さくなっており、80℃で加熱処理を施したものについては、微生物が検出されなかった。この結果は、生微生物数の絶対値を測定することによって、相対値を求めなくても、本発明の方法により、殺菌処理効果を測定することができることを示している。 Also, when looking at the measured value column according to the present invention, the higher the heat treatment temperature, that is, the higher the sterilization effect, the smaller the measured value, and the one subjected to the heat treatment at 80 ° C. Microorganisms were not detected. This result shows that the bactericidal effect can be measured by the method of the present invention without determining the relative value by measuring the absolute value of the number of living microorganisms.
Claims (7)
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2003343425A JP2005102645A (en) | 2003-10-01 | 2003-10-01 | Method for determining sterilization effect on microorganism |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2003343425A JP2005102645A (en) | 2003-10-01 | 2003-10-01 | Method for determining sterilization effect on microorganism |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2005102645A true JP2005102645A (en) | 2005-04-21 |
| JP2005102645A5 JP2005102645A5 (en) | 2006-11-16 |
Family
ID=34537403
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2003343425A Pending JP2005102645A (en) | 2003-10-01 | 2003-10-01 | Method for determining sterilization effect on microorganism |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP2005102645A (en) |
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2009058233A (en) * | 2007-08-29 | 2009-03-19 | Nagasaki Prefecture | Method for determining contamination level of bathing facility, method for determining microbicidal effect of microbicide in bathtub water and method for controlling water quality of bathtub water |
| JP2010513847A (en) * | 2006-06-27 | 2010-04-30 | バイオヴィジラント システムズ インコーポレイテッド | Pathogen detection by simultaneous measurement of particle size and fluorescence |
| WO2013013853A1 (en) * | 2011-05-17 | 2013-01-31 | Fresenius Kabi Anti Infectives S.R.L | Method for testing and monitoring the sterility of plant production units |
| JPWO2011024672A1 (en) * | 2009-08-27 | 2013-01-31 | シャープ株式会社 | Display control device |
| JP2014135935A (en) * | 2013-01-17 | 2014-07-28 | Azbil Corp | System and method for detecting microorganism |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2002542836A (en) * | 1999-05-03 | 2002-12-17 | アイシーエフ テクノロジーズ, インコーポレーテッド | Methods, compositions and kits for biological indicators of sterilization |
-
2003
- 2003-10-01 JP JP2003343425A patent/JP2005102645A/en active Pending
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2002542836A (en) * | 1999-05-03 | 2002-12-17 | アイシーエフ テクノロジーズ, インコーポレーテッド | Methods, compositions and kits for biological indicators of sterilization |
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2010513847A (en) * | 2006-06-27 | 2010-04-30 | バイオヴィジラント システムズ インコーポレイテッド | Pathogen detection by simultaneous measurement of particle size and fluorescence |
| JP2009058233A (en) * | 2007-08-29 | 2009-03-19 | Nagasaki Prefecture | Method for determining contamination level of bathing facility, method for determining microbicidal effect of microbicide in bathtub water and method for controlling water quality of bathtub water |
| JPWO2011024672A1 (en) * | 2009-08-27 | 2013-01-31 | シャープ株式会社 | Display control device |
| WO2013013853A1 (en) * | 2011-05-17 | 2013-01-31 | Fresenius Kabi Anti Infectives S.R.L | Method for testing and monitoring the sterility of plant production units |
| JP2014135935A (en) * | 2013-01-17 | 2014-07-28 | Azbil Corp | System and method for detecting microorganism |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US8026079B2 (en) | Method for detection of microorganism and kit for detection of microorganism | |
| JP3837006B2 (en) | Bacterial staining method and detection method | |
| JP2007007421A (en) | Device and method for rapidly determining effectiveness of sterilization or disinfection process | |
| EP2326727B1 (en) | Flow cytometry-based systems and methods for detecting microbes | |
| JP4236893B2 (en) | Bacteria counting method and bacteria counting apparatus | |
| EP2789692B1 (en) | Method for measuring cells, and reagent for cell measurement | |
| JP2002542836A (en) | Methods, compositions and kits for biological indicators of sterilization | |
| CN107250374A (en) | Spectral intensity ratio (SIR) analysis enumerated for quick viable microbial | |
| CN110218763A (en) | A method of in edible raw egg pathogenic bacteria and total bacteria count carry out quantitative detection | |
| JP2005102645A (en) | Method for determining sterilization effect on microorganism | |
| RU2570637C1 (en) | Method to detect toxicity of medium by extent of suppression of growth of microorganism test cultures | |
| Monfort et al. | Cell cycle characteristics and changes in membrane potential during growth of Escherichia coli as determined by a cyanine fluorescent dye and flow cytometry | |
| JP2002168870A (en) | METHOD FOR MEASURING pH IN MICROBE CELL AT LOW pH REGION BY FLOW CYTOMETER | |
| NL1032315C2 (en) | Control system for UV lamps, as well as control system for determining the viability of microorganisms. | |
| JP2006067974A (en) | Method for measuring sterilization effect on microorganism | |
| JP4278936B2 (en) | Microorganism measurement method | |
| CN111999237B (en) | Method for evaluating effect of mild spore killing method | |
| JP4876251B2 (en) | Method for determining the presence ratio of live bacteria, dead bacteria and pseudo-viable bacteria | |
| Ogodo et al. | Principles of applied microbiology and biotechnology: Technique for the screening of antimicrobial herbs | |
| JP5100361B2 (en) | Method for evaluating physiological state of microbial cells | |
| ES2893198T3 (en) | A method of quantifying the capacity of individual bacterial cell cultures using culture-independent parameters | |
| RU2117291C1 (en) | Method of quantitative determination of bacteria in biopreparation | |
| Slominski et al. | Quantitation of Microorganisms | |
| WO2008013512A1 (en) | Method for determining the quantity of microbiological objects during cultivation thereof | |
| CN117384995A (en) | Method for rapidly detecting viable bacteria in water |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20060927 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20060927 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20090707 |
|
| A521 | Written amendment |
Effective date: 20090825 Free format text: JAPANESE INTERMEDIATE CODE: A523 |
|
| A02 | Decision of refusal |
Effective date: 20091208 Free format text: JAPANESE INTERMEDIATE CODE: A02 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100204 |
|
| A911 | Transfer of reconsideration by examiner before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20100315 |
|
| A912 | Removal of reconsideration by examiner before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A912 Effective date: 20100430 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20110811 |