EP1614466A2 - System and method to prevent air bubbles in a hybridization chamber - Google Patents
System and method to prevent air bubbles in a hybridization chamber Download PDFInfo
- Publication number
- EP1614466A2 EP1614466A2 EP05105498A EP05105498A EP1614466A2 EP 1614466 A2 EP1614466 A2 EP 1614466A2 EP 05105498 A EP05105498 A EP 05105498A EP 05105498 A EP05105498 A EP 05105498A EP 1614466 A2 EP1614466 A2 EP 1614466A2
- Authority
- EP
- European Patent Office
- Prior art keywords
- pressure
- hybridization
- chamber
- agitation
- hybridisierkammern
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Ceased
Links
Images
Classifications
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
- B01L3/50273—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip characterised by the means or forces applied to move the fluids
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01F—MIXING, e.g. DISSOLVING, EMULSIFYING OR DISPERSING
- B01F31/00—Mixers with shaking, oscillating, or vibrating mechanisms
- B01F31/65—Mixers with shaking, oscillating, or vibrating mechanisms the materials to be mixed being directly submitted to a pulsating movement, e.g. by means of an oscillating piston or air column
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01F—MIXING, e.g. DISSOLVING, EMULSIFYING OR DISPERSING
- B01F33/00—Other mixers; Mixing plants; Combinations of mixers
- B01F33/30—Micromixers
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/14—Process control and prevention of errors
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/06—Auxiliary integrated devices, integrated components
- B01L2300/0627—Sensor or part of a sensor is integrated
- B01L2300/0636—Integrated biosensor, microarrays
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0809—Geometry, shape and general structure rectangular shaped
- B01L2300/0822—Slides
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0861—Configuration of multiple channels and/or chambers in a single devices
- B01L2300/0877—Flow chambers
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/14—Means for pressure control
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2400/00—Moving or stopping fluids
- B01L2400/04—Moving fluids with specific forces or mechanical means
- B01L2400/0475—Moving fluids with specific forces or mechanical means specific mechanical means and fluid pressure
- B01L2400/0487—Moving fluids with specific forces or mechanical means specific mechanical means and fluid pressure fluid pressure, pneumatics
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L7/00—Heating or cooling apparatus; Heat insulating devices
- B01L7/52—Heating or cooling apparatus; Heat insulating devices with provision for submitting samples to a predetermined sequence of different temperatures, e.g. for treating nucleic acid samples
Definitions
- the invention relates to a system with hybridization chambers for hybridizing nucleic acid samples, proteins or tissue sections immobilized on microscope slides.
- each hybridization chamber is defined as a substantially gap-shaped, with a liquid substantially fillable space between one of these slides and a lid.
- Each lid is arranged opposite the slide in such a way that the hybridization chamber is sealed off from the ambient air.
- Such a system comprises an agitation device with which liquids in the hybridization chambers can be moved relative to the samples immobilized on the object carriers.
- the invention also relates, according to the preamble of independent claim 14, to a corresponding method for preventing air bubbles in the hybridization chambers of a system for hybridizing nucleic acid samples, proteins or tissue sections immobilized on slides.
- a corresponding method for preventing air bubbles in the hybridization chambers of a system for hybridizing nucleic acid samples, proteins or tissue sections immobilized on slides According to this method, all substantially gap-shaped, between one of these slides and a lid arranged hybridization chambers are filled with a liquid substantially.
- the lid is arranged in such a way relative to the slide that the hybridization chamber is sealed off from the ambient air.
- DNA samples deoxyribose nucleic acid
- microarrays of such samples provides research with an important technique for the simultaneous analysis of thousands of genes.
- This technique involves the immobilization of DNA probes from many genes on a solid substrate surface, e.g. on a glass slide for a light microscope.
- the DNA samples are preferably stored in an array of sample spots or "spots", i. arranged in a two-dimensional grid on the substrate and one can later - starting from a certain position within such an array on the origin of the corresponding DNA sample infer.
- pattern suspensions are also used which contain DNA, cDNA and / or proteins or polypeptides.
- RNA patterns may be labeled with a so-called "tag” or "label", i. be provided with a molecule which is e.g. emits a fluorescent light having a specific wavelength.
- Immobilized samples may also include amino acid-containing (e.g., proteins, peptides) or nucleic acid-containing (e.g., cDNA, RNA) probes. Samples added to the immobilized samples may comprise any molecules or chemical compounds that hybridize or otherwise associate with the immobilized samples.
- the RNA patterns hybridize or bind to the immobilized DNA samples and together form hybrid DNA-RNA strands.
- differences in the hybridization among the DNA samples can be determined by measuring the intensity and wavelength dependency of the fluorescence of each individual microarray element to determine whether the level of gene expression in the DNA sample varies the examined DNA samples.
- DNA microarrays have become established as successful tools, and devices for performing DNA hybridization have been continually improved (see, for example, US 6,238,910 or EP 1 260 265 A1 of the Applicant of the current patent application).
- These documents disclose a device for providing a hybridization space for the hybridization of nucleic acid samples on a slide.
- These devices are designed to be movable relative to the slide and comprise an annular seal or sealing surface for closing the gap-shaped hybridization space with respect to the ambient air, wherein a surface of this slide is acted upon by the seal or sealing surface.
- these devices include lines for feeding or discharging media into the hybridization space or out of the hybridization space as well as a sample feed.
- An improved temperature control and movement of the liquid with e.g. RNA patterns against DNA samples immobilized on the slide are also disclosed.
- the object of the present invention relates to the provision of an alternative system or an alternative method, with which the formation of air bubbles in a hybridization chamber can be prevented in a simple manner.
- a system described above comprises means for preventing air bubbles in the Hybridisierhuntn, which is designed as a pressure means for establishing a chamber pressure in the Hybridisierhuntn, wherein This chamber pressure thereby independent of agitation pressure differences over that in the ambient air prevailing, normal atmospheric pressure is that the system comprises at least one spring element, which communicates with the liquid volume used for the hybridization and resiliently counteracts the agitation pressure differences exerted by the agitator on the pressure chamber agitation pressure differences.
- FIG. 1 shows a diagram of a system 1 suitable for carrying out the method according to the invention.
- vessels 2 for the storage of liquid hybridization media, such as washing liquids (W 3, W 2, W 1), prehybridization buffer ( VP), alcohol cleaning fluid (AR), distilled water (AD), and a container 3 with inert gas (N2).
- Each of these vessels 2 is preceded by an individual valve 4, via which these media can be supplied to the hybridization chambers 5 (S 1, S 2, S 3, S 4) (shown on the right-hand side).
- the valve lines 4 comprehensive media lines 6 open into a manifold 7, which in turn opens into a feed pump 8, which is preceded by a vent valve 9.
- This feed pump 8 draws liquid media from the vessels 2 via the collecting line 7 and pumps them via the distribution line 10 into the inlet lines 11, which open into the hybridization chambers 5 via an inlet valve 12.
- the hybridizing media leave the Hybridisierhuntn 5 via an outlet 13, which each comprise an outlet valve 14 and open into a manifold 15.
- This manifold 15 in turn opens into a waste line 16, which is closable by means of a waste valve 17.
- the distribution line 10 and the manifold 15 can communicate with each other via a connecting line 18 and a connecting valve 19. From this connecting line 18 branches off a discharge line 20 with a relief valve 21 and flows into a sump 22 with a loading or vent 23.
- the sump 22 downstream of a feed pump 24 which is connected via a transition line 25 to the waste line 16.
- the system 1 is equipped with an agitation mechanism or with an agitation device 32, as is known from the European patent application EP 1 260 265 A1 of the applicant of the current patent application.
- the content of this patent application EP 1 260 265 A1 is hereby expressly incorporated by reference, so that this content is part of the present patent application.
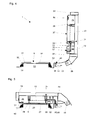
- FIG. 2 shows a vertical longitudinal section through a hybridization chamber 5 corresponding to FIG. 1 of EP 1 260 265 A1.
- the cover 26 of this arrangement is movable relative to the slide 27 (in this case pivotable about an axis, so that the hybridization space 5 is replaced by a simple
- An annular sealing surface 28 serves to close off the hybridization space 5 by acting on a surface 29 of this slide 27.
- This sealing surface 28 may be a stepped surface of the lid 26 lying flat on the surface 29 of the slide 27; For example, a lip seal may also be used, but an O-ring seal is preferred as the sealing surface 28.
- the arrangement comprises lines 11, 13 for feeding or discharging media into the hybridization space 5 or out of the hybridization space 5.
- Such media may include reagents for carrying out the hybridization reaction, such as washings or inert gases (such as nitrogen) for drying the hybridization products on the slides 27 and for blowing out the Hybridisierhuntn 5 and the media lines 11,13 be.
- These supply and discharge lines 11, 13 for hybridization media preferably open into a respective agitation space 30, 30 '.
- the assembly also includes a sealable pattern feeder 31 through which RNA-containing liquids or other sample liquids can be pipetted by hand.
- the pattern feeder 31 is preferably closed with a plastic plug (not shown).
- an automatic or robotized pattern feeder may be provided, as disclosed in different embodiments in EP 1 260 265 A1.
- the arrangement comprises a media-separating agitation device 32 for moving liquids against samples of nucleic acids, proteins or tissue sections immobilized on the surface 29 of the slides 27.
- the agitation device 32 of the arrangement comprises a membrane 33. This membrane 33 separates a pressure space 34, which can be filled with a pressure fluid (gas or liquid) via a pressure line 35, from an agitation space 30, which flows over a Agitation line 36 is connected to the Hybridisierraum 5.
- RNA sample liquid and closing the pattern feed 31 preferably air or another gas (but it could also be a liquid) is introduced into the pressure space 34 via the pressure line 35 or discharged therefrom, so that the membrane 33 bends at the same rhythm and correspondingly reduces or increases the agitation space 30.
- the sample liquid is moved in the same rhythm of overpressure or underpressure and relaxation in Hybridisierraum 5 against one or the other end, where preferably at the directed towards the interior of the Hybridisierraums 5 surface 37 of the lid 26 each have a Querströmkanal 38,38 'is located.
- a second agitation space 30 ' is connected to the hybridization space 5 via a second agitation conduit 36 '. If a pressure surge delivered to the pressure chamber 34 now presses the first diaphragm 33 into the first agitation space 30, this pulse is transmitted via the first agitation conduit 36 to the sample fluid in the hybridization space 5 transfer.
- the pattern liquid differs somewhat from the second agitation conduit 36 '(and may even partially fill it) and increases the pressure in the second agitation space 30'.
- the second membrane 33 ' bends upwards and is elastically stretched.
- a sample liquid having a minimum volume in the range of approximately 100 ⁇ l
- a negative pressure in the pressure chamber 34 is generated, so that the backward movement of the sample liquid opposite the preceding pressure surge in the hybridization chamber 5 is enhanced.
- FIG 3 shows a plan view of the arrangement of Figure 2, seen from below.
- the O-ring seal 28 laterally delimits the hybridization space 5, which has at its opposite ends a respective cross-flow channel 38, 38 ', which are provided as a depression in the surface 37 of the cover 26.
- the slide 27 here a glass slide for light microscopy
- the handle panel 55 are shown in dashed lines.
- the Abdschreibfeder 56 which presses on the handle panel 55 of the slide 27. When opening the Hybridisierraums 5 this Abd Wegfeder 56 facilitates the automatic separation of the slide 27 from the lid 26.
- All lines 11, 13, 35 for the supply and removal of media preferably open in a common connection plane 57 of the cover 26, which is arranged substantially parallel to the hybridization space 5 and preferably at the same height as the hybridization space 5.
- the mouth openings of the lines 11,13,35 can, as shown offset from each other or on a transverse to the Device 1 extending line (not shown) may be arranged.
- Recesses empty arrows, see Fig. 2) reduce the heat flow from or to the lid 26th
- the pressure lines 35 are shown in dashed lines in Figure 1 and start from a pressure distribution line 39.
- a pressure distribution line 39 open a compensation line 40 with a balancing valve 41, a pressure supply line 42 with a pressure relief valve 43 and a vacuum supply line 44 with a vacuum valve 45.
- the pressure is preferably generated with a low-cost gas (eg air) in a pressure pump 46, in a pressure vessel 47 stored and fed into the pressure supply line 42.
- the negative pressure is generated in a lower pressure pump 48, stored in a vacuum reservoir 49 and fed into the vacuum supply line 44.
- the inert gas container 3 is connected via a gas valve 50 and a gas line 51 to the distribution line 10, which open into the hybridization chambers 5 via inlet lines 11 and one inlet valve 12 each.
- inert gas e.g., with nitrogen gas
- all of the hybridization chambers 5 may be exhausted via the distribution line 10 and the inlet pipes 11 via the outlet pipes 13 and the manifold 15.
- the distribution line 10 can be blown into the collecting container 22. If only the gas valve 50, the connection valve 19 and the waste valve 17 are opened, then the distribution line 10 and the manifold 15 can be blown out via the waste line 16.
- FIG. 4 shows a vertical longitudinal section corresponding to FIG. 2 through an arrangement with a hybridization chamber 5, wherein the folding frame 54 with the cover 26 of the system 1 inserted therein is unfolded.
- the covers 26 are arranged parallel to each other and in a group of four, because this arrangement just allows a measure of a contact plate 53 of the temperature control thermostat on which a transport frame 52 in the size of a microplate with four parallel to each other slides 27 fits.
- Each of these groups of four is assigned to a contact plate 53 connected to a temperature controller.
- a contact plate 53 is thus designed for planar reception of the four slides 27 of a transport frame 52.
- the frame 52 comprises longitudinal walls, transverse walls and intermediate walls extending substantially parallel to the transverse walls. These walls surround openings which completely penetrate the frame 52, these openings allowing direct contact between the contact plate 53 of the thermostat and the slides 27. Because the slides 27 are held softly in the frame 52 and because the contact plate 53 is formed so that the frame 52 can be slightly lowered toward it, the slides 27 lie directly on the surface of the contact plate 53.
- Each quad of a processing unit comprises one an axis 58 pivotable and lockable relative to a base plate 59 folding frame 54 with four seats, in each of these seats a lid 26 can be inserted.
- Each such process unit also comprises a connection plate 60 for sealingly connecting each of an inlet line 11, outlet line 13 and pressure line 35 of the system 1 with the inlet line 11, outlet line 13 and pressure line 35 of a lid 26.
- As seals for these compounds preferably O arranged on the system side Rings preferred (not shown).
- FIG. 5 shows a vertical longitudinal section corresponding to FIG. 2 through an arrangement with a hybridization chamber 5, wherein the cover 26 of the system inserted into a folding frame 54 is closed. All four hybridization spaces 5 of a group of four defined by a contact plate 53 and such a folding frame 54 are thus associated with the temperature control of a temperature control device.
- Each group of four procedural unit comprises, as described above, a pivotable about an axis 58 and lockable against a base plate 59 folding frame 54 with four seats, wherein in each of these seats, a lid 26 is inserted.
- the folding frame 54 also has a central joint (not shown) with a parallel to the axis 58 mobility. So that the seals 28 close off the hybridization chambers 5 reliably, an additional pressure is exerted on the cover via the snap-on frame 54 26, this can be accomplished via screws, rocker arms or similar known devices (not shown).
- the present invention is based on the recognition that by generating an overpressure in the hybridization chambers 5, the spontaneous occurrence of air bubbles during hybridization can be prevented.
- the chamber pressure should be above the prevailing in the ambient air, normal atmospheric pressure.
- a chamber pressure which is at least 100 mbar to at most 1.4 bar higher than the ambient pressure is preferred. Even higher pressures in the chamber are possible if counteracted by a sufficiently large contact pressure for sealing the chamber.
- the required overpressure in the hybridization chambers 5 can be achieved from one of the vessels 2 by means of a liquid, for example by means of a hybridization medium pressed by the feed pump 8 into the hybridization chambers 5 (see FIG. If a system 1 comprising this hybridization chamber 5 has an agitation device 32 for moving the hybridization media with respect to the immobilized samples, then this system preferably also comprises a spring element which resiliently counteracts the pressure differences generated by the agitation device 32.
- a spring element may be an elastic tube piece (not shown) in a corresponding inlet or outlet to the hybridization chamber 5; but it can also be a spring loaded Expansion vessel (not shown) may be provided, which is connected via a line to the Hybridisierhunt 5.
- inert gas can also be forced out of the container 3 into the distribution line 10 and the inlet lines 11 and the required pressure can be built up via an inlet valve 12 into the hybridization chambers 5 already filled with samples and hybridization media.
- inert gases such as N 2 (nitrogen), which do not undergo any chemical interaction or reactions with the hybridization media. It may also be advantageous if the inert gases are not soluble in the Hybridisiermedien.
- the gas cushion thus constructed which is directly related to the liquid volume used for the hybridization, serves as a spring element for resilient counteraction to the agitation pressure differences. If this is necessary, for example because of a minimal but constant pressure drop across the O-ring seals 28, the required chamber pressure may be sporadically corrected or renewed during the many hours of hybridization.
- one or both of the valves 12, 14 may be kept open for this purpose.
- Another alternative is to use a pressure pump and a pressure vessel (similar to those elements labeled 46 and 47 in FIG. 1) or a gas vessel (such as the N 2 vessel 3 in FIG. 1). to connect to the manifold 15 and to build up the pressure in the Hybridisierhuntn 5 via an opening of the exhaust valves 14.
- An additional alternative to providing a gas cushion serving as a spring member for resiliently counteracting the agitation pressure differentials is that of a pressure pump and a pressure vessel (similar to the elements indicated at 46 and 47 in Fig. 1) or a gas vessel (such as Figs For example, the N 2 tank 3 in Fig. 1) to lead gas into one of the lines which open into at least one of the distribution line 10 or manifold 15.
- one or both of the valves 12, 14 may be kept open.
- the agitator 32 may be used during the preliminary agitation of the hybridization media in the hybridization chambers 5 or even during the hybridization itself.
- simply an agitation pressure in the pressure chamber 34 must be generated, which is higher by about 0.5 to 1 bar than the desired chamber pressure of 100 mbar to 1.4 bar above the ambient pressure.
- the pressure to be used for the agitation moves (depending on the ambient pressure) in the range of approx. 1.6 - 2.4 bar.
- the second diaphragm 33 ' forms in this case a spring element which acts resiliently against this agitation pressure.
- the hybridized samples are dried on the microscope slides 27 by opening only the valves 12, 14 and 21. Then the inert gas valve 50 is opened and the distribution line 10, the inlet lines 11, the Hybridisierhuntn 5, the outlet lines 13 and the manifold 15 through the open relief valve 21, the discharge line 20, the sump 22 and the vent 23 are flushed with inert gas until the samples dry are.
- step c) can be carried out with an inert gas (eg N 2 ):
- an inert gas eg N 2
- chemical interactions between the gaseous spring element N 2 and the samples can be excluded.
- the physical fundamentals were investigated. For this purpose, several 100 slides without samples were processed.
- the basic requirement is of course that the contact pressure on the cover 26, the O-ring 28 and the slide 27 is sufficiently large, ie, significantly higher than the chamber pressure generated.
- the hybridization chambers 5 used comprised between the cover 26 and the slide 27 an area of 21 ⁇ 65 mm. The chamber pressure was increased by 1 bar, ie by 10 5 N / m 2 above the normal pressure of the environment.
- the hybridization procedure (buffer preparation, pattern injection, program definition on the hybridization systems used) was carried out according to the technical instructions of Alopex (ALOPEX GmbH, Fritz-Hornschuch-Str. 9, D-95326 Kulmbach, Federal Republic of Germany). In each case two slides 27 were inserted into the hybridization systems SN22 and PT3 and processed at 43 ° C. or at 61 ° C.
- results show not only that both devices used give very useful results. Rather, the results obtained in the two devices SN22 and PT3 (ordered by temperature) are so similar to each other that an influence of the increased pressure on the hybridization can be excluded.
- inventive method is not limited to the use in hybridization. It can also be used in other devices or used to prevent the occurrence of unwanted air bubbles. Such devices or instruments may e.g. from the field of microfluidics technology, such as "lab on a chip” systems.
- FIG. 6 shows a diagram of a second device or system suitable for carrying out the method according to the invention.
- This system 1 'differs from the system 1 shown in FIG. 1 essentially in that each lid 26 is assigned two hybridizing chambers 5A, 5B. These two hybridization chambers 5A, 5B can be arranged over a single slide with, for example, two identical DNA microarrays. However, it is also possible to use two smaller slides 27, each of which together with one cover 26 only defines one hybridization chamber 5 (not shown).
- Each Hybridisierhunt 5A, 5B is supplied by the distribution line 10 via a respective individual inlet valve 12A, 12B and one individual inlet line 11A, 11B with liquids, such as washing buffer or Hybridisiermedien.
- all Hybridisierhuntn either self-sufficient, ie independently or jointly, ie operated simultaneously.
- each cover 26 of this particularly preferred system 1 has its own hybridization chamber 5A, 5B each with its own
- This agitation space 30 is in each case connected to an agitation line 36 with the hybridization chamber 5A, 5B, wherein the membrane 33 separates the agitation space 30 from a pressure space 34.
- These pressure chambers 34 are filled via the pressure line 35 with a pressurized fluid and sporadically, for example, acted upon pulsating with the agitation pressure.
- the membranes 33 of the hybridization chambers 5A, 5B are charged in series, i. synchronous.
- each diaphragm 33 is pressurized with a separate pressure line 35 (parallel) (not shown).
- outlets 13A, 13B of a lid 26 open into the outlet 13 of the same and are, as already described in Figure 1, supplied via the outlet valve 14 of the manifold 15.
- the outlet duct 13 has an enlarged diameter and thus provides the space in which a gas cushion serving as a spring element can be accommodated.
- This spring element is - directly via a continuous fluid line, or indirectly (separated by a membrane) - in communication with the volume of liquid used for the hybridization.
- This spring element resiliently counteracts the agitation pressure differences exerted by the agitation device 32 on the pressure chamber 34 (similar to what has already been described in connection with FIG. 1).
- a spring element - no matter how it is formed - is preferably elastic or compressible or stretchable and compensates for the Agitations réelleunter Kunststoffe in the Hybridisierhuntn 5, so that the chamber pressure over a certain time, for example during the entire hybridization, so far above that in the ambient air prevailing, normal atmospheric pressure is that in the Hybridisiermedium no gas bubbles can form.
- the preferred system 1 comprises a blow line 62, which via a blow valve 63 preferably leads straight to the point where the outlet 13B opens into the outlet line 13.
- This blow line 62 is operated as follows: First, each hybridization chamber 5A, 5B is filled with wash buffer. In this case, the inlet lines 11A, 11B and the outlets 13A, 13B and the outlet 13 are also filled with washing buffer. After the sample liquids are pipetted in, the pattern feeders 31 and the inlet valves 12A, 12B are closed again. The exhaust valves 14 remain open. If the blow valves 63 are now opened, gas from a compressor or a pressure accumulator flows via the individual blow lines 64 into the outlet lines 13 and displaces the wash buffer from these outlet lines 13. This gas then forms the gas cushion in the outlet line 13 , The gas cushion has the necessary volume to successfully serve as a spring element.
- the spring element can be regarded as part of the Agitationsmechanismus; in fact, it is not necessary here to attach a second membrane 33 '. However, if the cross section of the outlet 13 is too small, In order to make available the entire space required for the spring element effect, a second membrane 33 '(cf., for example, FIG. 1) can additionally be provided.
- Figure 7 shows a schematic view of a particular, first arrangement of a lid 26 with a hybridization chamber 5, seen from below.
- the essential difference from the embodiment already shown in FIG. 3 lies here in the outlet conduit 13 with the enlarged diameter, whereby the space for a gas cushion serving as a spring element is made available.
- the individual outlet 13 'of the hybridization chamber 5 opens into this outlet line 13 in the vicinity of its end.
- the individual blow line 64 assigned to this hybridization chamber 5 also discharges in the same region.
- All media lines each have a connection opening which is located in the common connection plane 57 of the Cover 26 is located. These five openings are preferably arranged on a line, but they can also be arranged arbitrarily. All other parts correspond to the embodiment of Fig. 3.
- a second membrane 33 ' is provided, which closes a second agitation space 30'.
- the second diaphragm 33 'in this case serves to support the spring element arranged as a gas cushion in the outlet line 13.
- FIG. 8 shows a schematic view of a particular, second arrangement of a lid 26 with two Hybridisierhuntn 5A, 5B, seen from below.
- the cover 26 has an outlet duct 13 with the enlarged diameter, whereby the space for a gas cushion serving as a spring element is made available.
- the provided cavity is sufficient to guarantee the effect as a spring element, therefore, both hybridization chambers 5A, 5B lying behind one another have no second membrane 33 'and no second agitation space 30'.
- the two individual outlets 13A, 13B open into this outlet line 13, wherein an orifice near the end and the other mouth is located somewhere in a central region of the outlet duct 13.
- the agitation in the Hybridisierhuntn 5A, 5B is operated via a common Agitations effet 35.
- an individual agitation line may each lead to the agitation chambers 30 of the two hybridization chambers 5A, 5B (not shown).
- the pressure line 35 could branch within the lid, so that only one common connection for the individual pressure lines on the common connection plane 57 of the lid 26 would be necessary.
- it could also be provided to provide the two hybridization chambers 5A, 5B each with an individual and independent agitation device 32. This would be accomplished with an additional pressure line 42 'and pressure distribution line 39' and with an individual agitation line 35 'which can be filled per hybridization chamber 5A, 5B via an additional connection in the common connection plane 57 of the cover 26 (not shown).
- a single slide 27 may have a plurality of regions preferably provided with a nucleotide array, so that a plurality of hybridization chambers 5 per cover 26 and slide 27 may be operated with a divided cover 26 (see for example Fig. 8).
- smaller slides 27 ' may also be provided which essentially define just a single, smaller hybridization chamber 5 so that the plurality of hybridization chambers 5 per cover 26, but on a plurality of slides 27, can be operated.
Landscapes
- Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Health & Medical Sciences (AREA)
- Dispersion Chemistry (AREA)
- Analytical Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Hematology (AREA)
- Clinical Laboratory Science (AREA)
- Apparatus Associated With Microorganisms And Enzymes (AREA)
- Degasification And Air Bubble Elimination (AREA)
Abstract
Description
Die Erfindung betrifft gemäss dem Oberbegriff des unabhängigen Anspruchs 1 ein System mit Hybridisierkammern zum Hybridisieren von auf Objektträgern immobilisierten Nukleinsäureproben, Proteinen oder Gewebeschnitten. Dabei ist jede Hybridisierkammer als ein im wesentlichen spaltförmiger, mit einer Flüssigkeit im wesentlichen befüllbarer Raum zwischen einem dieser Objektträger und einem Deckel definiert. Je ein Deckel ist derart gegenüber dem Objektträger angeordnet, dass die Hybridisierkammer gegenüber der Umgebungsluft abgedichtet ist. Ein solches System umfasst eine Agitationseinrichtung, mit welcher Flüssigkeiten in den Hybridisierkammern gegenüber den auf den Objektträgern immobilisierten Proben bewegt werden können. Die Erfindung betrifft zudem, gemäss dem Oberbegriff des unabhängigen Anspruchs 14, ein entsprechendes Verfahren zum Verhindern von Luftblasen in den Hybridisierkammern eines Systems zum Hybridisieren von auf Objektträgern immobilisierten Nukleinsäureproben, Proteinen oder Gewebeschnitten. Gemäss diesem Verfahren werden alle im wesentlichen spaltförmigen, zwischen einem dieser Objektträger und einem Deckel angeordnete Hybridisierkammern mit einer Flüssigkeit im wesentlichen gefüllt. Dabei wird der Deckel derart gegenüber dem Objektträger angeordnet, dass die Hybridisierkammer gegenüber der Umgebungsluft abgedichtet ist.According to the preamble of
Die Verwendung von DNA-Proben (DNA = Desoxyribosenukleinsäure) und insbesondere von Mikroarrays solcher Proben stellt der Forschung eine wichtige Technik zur gleichzeitigen bzw. simultanen Analyse von Tausenden von Genen zur Verfügung. Diese Technik umfasst die Immobilisierung von DNA-Proben aus vielen Genen auf einer festen Substrat-Oberfläche, wie z.B. auf einem gläsernen Objektträger für ein Lichtmikroskop. Die DNA-Proben werden bevorzugt in einem Array von Probenflecken oder "spots", d.h. in einem zweidimensionalen Gitter auf dem Substrat angeordnet und man kann später - ausgehend von einer bestimmten Position innerhalb eines solchen Arrays auf den Ursprung der entsprechenden DNA-Probe zurückschliessen. Die Technik umfasst typischerweise die Kontaktierung des DNA-Proben-Arrays mit RNA-Muster-Suspensionen bzw. -Lösungen (RNA = Ribosenukleinsäure) um damit spezifische Nukleotidsequenzen in den DNA-Proben nachzuweisen. Typischerweise werden auch Muster-Suspensionen verwendet, welche DNA, cDNA und/oder Proteine bzw. Polypeptide enthalten.The use of DNA samples (DNA = deoxyribose nucleic acid), and especially microarrays of such samples, provides research with an important technique for the simultaneous analysis of thousands of genes. This technique involves the immobilization of DNA probes from many genes on a solid substrate surface, e.g. on a glass slide for a light microscope. The DNA samples are preferably stored in an array of sample spots or "spots", i. arranged in a two-dimensional grid on the substrate and one can later - starting from a certain position within such an array on the origin of the corresponding DNA sample infer. The technique typically involves contacting the DNA sample array with RNA pattern suspensions (RNA = ribose nucleic acid) to detect specific nucleotide sequences in the DNA samples. Typically, pattern suspensions are also used which contain DNA, cDNA and / or proteins or polypeptides.
RNA-Muster können mit einem sogenannten "tag" oder "label", d.h. einem Molekül versehen sein, welches z.B. ein Fluoreszenzlicht mit einer spezifischen Wellenlänge aussendet. Immobilisierte Proben können auch aminosäurehaltige (z.B. Proteine, Peptide) oder nukleinsäurehaltige (z.B. cDNA, RNA) Proben umfassen. Zu den immobilisierten Proben zugegebene Muster können beliebige Moleküle bzw. chemische Verbindungen umfassen, welche mit den immobilisierten Proben hybridisieren oder sich sonstwie mit diesen verbinden.RNA patterns may be labeled with a so-called "tag" or "label", i. be provided with a molecule which is e.g. emits a fluorescent light having a specific wavelength. Immobilized samples may also include amino acid-containing (e.g., proteins, peptides) or nucleic acid-containing (e.g., cDNA, RNA) probes. Samples added to the immobilized samples may comprise any molecules or chemical compounds that hybridize or otherwise associate with the immobilized samples.
Unter guten experimentellen Bedingungen hybridisieren bzw. binden die RNA-Muster an die immobilisierten DNA-Proben und bilden mit diesen zusammen hybride DNA-RNA-Stränge. Für jede der immobilisierten DNA-Proben und für spezielle RNA-Muster kann man Unterschiede in der Hybridisierung unter den DNA-Proben durch die Messung der Intensität und der Wellenlängenabhängigkeit der Fluoreszenz jedes einzelnen Mikroarray-Elements feststellen und so herausfinden, ob der Grad der Genexpression in den untersuchten DNA-Proben variiert. Mit der Verwendung von DNA-Mikroarrays können somit über die Expression von grossen Mengen von Genen und über deren Expressionsmuster umfassende Aussagen gemacht werden, obwohl nur geringe Mengen an biologischem Material eingesetzt werden müssen.Under good experimental conditions, the RNA patterns hybridize or bind to the immobilized DNA samples and together form hybrid DNA-RNA strands. For each of the immobilized DNA samples and for specific RNA patterns, differences in the hybridization among the DNA samples can be determined by measuring the intensity and wavelength dependency of the fluorescence of each individual microarray element to determine whether the level of gene expression in the DNA sample varies the examined DNA samples. With the use of DNA microarrays comprehensive statements can thus be made about the expression of large quantities of genes and their expression patterns, although only small amounts of biological material must be used.
DNA-Mikroarrays haben sich als erfolgreiche Werkzeuge etabliert und die Geräte zur Durchführung der DNA-Hybridisierung wurden laufend verbessert (vgl. z.B. US 6,238,910 oder EP 1 260 265 A1 des Anmelders der aktuellen Patentanmeldung). Diese Dokumente offenbaren eine Vorrichtung zum Bereitstellen eines Hybridisierraums für die Hybridisierung von Nukleinsäureproben auf einem Objektträger. Diese Vorrichtungen sind gegenüber dem Objektträger bewegbar ausgebildet und umfassen eine ringförmige Dichtung oder Dichtfläche zum Abschliessen des spaltförmigen Hybridisierraums gegenüber der Umgebungsluft, wobei durch die Dichtung oder Dichtfläche eine Oberfläche dieses Objektträgers beaufschlagt wird. Zudem umfasst diese Vorrichtungen Leitungen zum Zu- bzw. Ableiten von Medien in den Hybridisierraum hinein bzw. aus dem Hybridisierraum heraus sowie eine Probenzuführung. Eine verbesserte Temperaturkontrolle und eine Bewegung der Flüssigkeit mit z.B. RNA-Mustern gegenüber auf dem Objektträger immobilisierten DNA-Proben ist ebenfalls offenbart.DNA microarrays have become established as successful tools, and devices for performing DNA hybridization have been continually improved (see, for example, US 6,238,910 or EP 1 260 265 A1 of the Applicant of the current patent application). These documents disclose a device for providing a hybridization space for the hybridization of nucleic acid samples on a slide. These devices are designed to be movable relative to the slide and comprise an annular seal or sealing surface for closing the gap-shaped hybridization space with respect to the ambient air, wherein a surface of this slide is acted upon by the seal or sealing surface. In addition, these devices include lines for feeding or discharging media into the hybridization space or out of the hybridization space as well as a sample feed. An improved temperature control and movement of the liquid with e.g. RNA patterns against DNA samples immobilized on the slide are also disclosed.
Es kommt einerseits immer wieder vor, dass Luftblasen beim Einfüllen von Flüssigkeiten oder auch später in der Hybridisierkammer entstehen. Andererseits wurde versucht (vgl. z.B. US 6,186,659), Luftblasen gezielt als Agitationsmittel einzusetzen, um in der Hybridisierkammer eine gründlichere Durchmischung der Reagenzien zu erzielen. Im allgemeinen sind aber im Hybridisiermedium anwesende Luftblasen nicht erwünscht, weil diese den meist sehr dünnen Flüssigkeitsfilm über den immobilisierten Proben stören. Dies kann zu einer Inhomogenität der Verteilung von Reagenzien im Hybridisiermedium und damit zu einer Verfälschung der Hybridisier-Resultate führen; schlimmstenfalls verdrängen grössere Luftblasen sogar das Hybridisiermedium von Teilen der auf dem Objektträger immobilisierten Proben.It happens on the one hand again and again that air bubbles occur during the filling of liquids or later in the hybridization chamber. On the other hand, attempts have been made (see, for example, US Pat. No. 6,186,659) to use air bubbles specifically as agitating agents in order to achieve more thorough mixing of the reagents in the hybridization chamber. In general, however, air bubbles present in the hybridization medium are undesirable because they disturb the usually very thin liquid film over the immobilized samples. This can lead to an inhomogeneity of the distribution of reagents in the hybridization medium and thus to a falsification of the hybridization results; in the worst case, larger bubbles even displace the hybridization medium from parts of the slides immobilized on the slide.
Aus dem Stand der Technik sind zudem zahlreiche Methoden bekannt, um das spontane Auftreten von Luftblasen oder das Verbleiben derselben in der Kammer zu behindern. So wurde z.B. ein nichtparalleles Anordnen der die Hybridisierkammer definierenden Objektträger und Deckel vorgeschlagen (vgl. US 5,922, 591), oder die Hybridisiermedien werden während dem ganzen Hybridisierprozess aus der Kammer hinaus und wieder hinein befördert. Das Beimischen von Agenzien zu dem Hybridisiermedium, welche die Oberflächenspannung reduzieren oder das Behandeln der Oberflächen der Kammer mit wasserabstossenden chemischen Verbindungen mit dem Ziel, die Bildung von Luftblasen zu behindern, ist ebenfalls bekannt.In addition, numerous methods are known from the prior art to hinder the spontaneous occurrence of air bubbles or the retention of the same in the chamber. For example, a non-parallel arrangement of the slides and lids defining the hybridization chamber has been proposed (see US 5,922,591), or the hybridization media are transported out of the chamber and back into it throughout the hybridization process. The admixing of agents to the hybridization medium, which reduce the surface tension or treating the surfaces of the chamber with water repellent chemical compounds with the aim of hindering the formation of air bubbles is also known.
Aus US 6,458,526 ist eine Anordnung bekannt, mir welcher in den Hybridisierraum hineinragende "Blasenhälften 140" aus einem mit Lösungsmittel gesättigten Gas erzeugt werden. Es handelt sich bei diesen "Blasenhälften" eigentlich um kalottenförmige Grenzflächen von Gasräumen mit einem definierten Krümmungsradius. Diese "Blasenhälften" befinden sich an definierten Stellen der Kammer, wo sie die Hybridisierung der Proben nicht stören können. In einem vom Hybridisierraum abgetrennten Kompartiment befindet sich ein Lösungsmittel 160, welches im Hybridisiermedium enthalten ist. Über diesem Lösungsmittel wird eine gesättigte Atmosphäre 150 aufrecht erhalten, welche konstant mit den Gasräumen hinter den "Blasenhälften 140" verbunden ist (vgl. Fig. 2 in US 6,458,526). Damit wird konstant eine mit dem Lösungsmittel gesättigte Atmosphäre an die kalottenförmigen Grenzflächen gebracht und dadurch der Partialdruck des im Hybridisiermedium anwesenden Lösungsmittel so beeinflusst, dass allenfalls vorhandene Luftblasen schrumpfen und eliminiert werden. Dieses Verfahren hat den Nachteil, dass diese kalottenförmigen Grenzflächen mittels speziellen Vorrichtungen geschaffen und aufrechterhalten werden müssen.From US Pat. No. 6,458,526, an arrangement is known which produces "bubble halves 140" protruding into the hybridization space from a solvent-saturated gas. These "bubble halves" are actually dome-shaped interfaces of gas spaces with a defined radius of curvature. These "bubble halves" are located at defined locations in the chamber where they can not interfere with the hybridization of the samples. In a compartment separated from the hybridization space there is a solvent 160 which is contained in the hybridization medium. Over this solvent, a saturated atmosphere 150 is maintained, which is constantly connected to the gas spaces behind the "bubble halves 140" (see Figure 2 in US 6,458,526). Thus, an atmosphere saturated with the solvent is constantly brought to the dome-shaped boundary surfaces and thereby the partial pressure of the solvent present in the hybridization medium is influenced so that any existing air bubbles shrink and are eliminated. This method has the disadvantage that these dome-shaped interfaces must be created and maintained by means of special devices.
Die Aufgabe der vorliegenden Erfindung betrifft das Bereitstellen eines alternativen Systems bzw. eines alternativen Verfahrens, mit welchem das Ausbilden von Luftblasen in einer Hybridisierkammer auf einfache Art und Weise verhindert werden kann.The object of the present invention relates to the provision of an alternative system or an alternative method, with which the formation of air bubbles in a hybridization chamber can be prevented in a simple manner.
Diese Aufgabe wird gemäss einem ersten Aspekt und dem kennzeichnenden Teil des unabhängigen Anspruchs 1 dadurch gelöst, dass ein eingangs beschriebenes System eine Einrichtung zum Verhindern von Luftblasen in den Hybridisierkammern umfasst, welche als Druckeinrichtung zum Aufbauen eines Kammer-Drucks in den Hybridisierkammern ausgebildet ist, wobei dieser Kammer-Druck dadurch unabhängig von Agitationsdruckunterschieden über dem in der Umgebungsluft herrschenden, normalen atmosphärischen Druck liegt, dass das System zumindest ein Federelement umfasst, welches mit dem für die Hybridisierung verwendeten Flüssigkeitsvolumen in Verbindung steht und federnd den durch die Agitationseinrichtung auf den Druckraum ausgeübten Agitationsdruckunterschieden entgegenwirkt. Diese Aufgabe wird gemäss einem zweiten Aspekt und dem kennzeichnenden Teil des unabhängigen Anspruchs 14 dadurch gelöst, dass mittels einer Druckeinrichtung in einem eingangs beschriebenen System ein mit einer Druckeinrichtung dieses Systems in den Hybridisierkammern ein Kammer-Druck ausgebildet wird, der dadurch unabhängig von Agitationsdruckunterschieden über dem in der Umgebungsluft herrschenden, normalen atmosphärischen Druck liegt, dass das System ein Federelement umfasst, welches mit dem für die Hybridisierung verwendeten Flüssigkeitsvolumen in Verbindung steht und federnd den durch die Agitationseinrichtung auf den Druckraum ausgeübten Agitationsdruckunterschieden entgegenwirkt. Zusätzliche, bevorzugte erfinderische Merkmale ergeben sich jeweils aus den abhängigen Ansprüchen.This object is solved according to a first aspect and the characterizing part of
Das erfindungsgemässe System bzw. das erfindungsgemässe Verfahren wird nun an Hand von schematischen, den Umfang der Erfindung nicht beschränkenden Zeichnungen von beispielhaften Ausführungsformen im Detail erläutert. Dabei zeigen:
- Fig. 1
- ein Schema eines zum Ausführen des erfindungsgemässen Verfahrens geeigneten, ersten Geräts bzw. Systems;
- Fig. 2
- einen der Fig. 1 von EP 1 260 265 A1 entsprechenden senkrechten Längsschnitt durch eine Anordnung mit einer Hybridisierkammer;
- Fig. 3
- eine der Fig. 2 entsprechende, schematische Ansicht einer Anordnung mit einer Hybridisierkammer, von unten gesehen;
- Fig. 4
- einen der Fig. 2 entsprechenden, senkrechten Längsschnitt durch eine Anordnung mit einer Hybridisierkammer, Deckel des Systems aufgeklappt;
- Fig. 5
- einen der Fig. 2 entsprechenden, senkrechten Längsschnitt durch eine Anordnung mit einer Hybridisierkammer, Deckel des Systems geschlossen.
- Fig. 6
- ein Schema eines zum Ausführen des erfindungsgemässen Verfahrens geeigneten, zweiten Geräts bzw. Systems;
- Fig. 7
- eine schematische Ansicht einer besonderen, ersten Anordnung eines Deckels mit einer Hybridisierkammer, von unten gesehen;
- Fig. 8
- eine schematische Ansicht einer besonderen, zweiten Anordnung eines Deckels mit zwei Hybridisierkammern, von unten gesehen.
- Fig. 1
- a diagram of a first device or system suitable for carrying out the method according to the invention;
- Fig. 2
- one of Figure 1 of
EP 1 260 265 A1 corresponding vertical longitudinal section through an arrangement with a hybridization chamber. - Fig. 3
- a corresponding schematic view of an arrangement with a hybridization chamber, seen from below;
- Fig. 4
- one of Figure 2 corresponding, vertical longitudinal section through an arrangement with a hybridization, lid of the system unfolded;
- Fig. 5
- one of the Fig. 2 corresponding, vertical longitudinal section through an arrangement with a hybridization chamber, lid of the system closed.
- Fig. 6
- a diagram of a suitable for carrying out the inventive method, second device or system;
- Fig. 7
- a schematic view of a particular, first arrangement of a lid with a Hybridisierkammer, seen from below;
- Fig. 8
- a schematic view of a particular, second arrangement of a lid with two Hybridisierkammern, seen from below.
Figur 1 zeigt ein Schema eines zum Ausführen des erfindungsgemässen Verfahrens geeigneten Systems 1. Auf der linken Seite dieses Schemas sind eine Anzahl Gefässe 2 für die Aufbewahrung von flüssigen Hybridisiermedien, wie Waschflüssigkeiten ( W 3, W 2, W 1), Prähybridisier-Puffer (V-P), Alkohol-Reinigungsflüssigkeit (A-R), destilliertes Wasser (A.D.), sowie einen Behälter 3 mit Inertgas (N2) dargestellt. Jedem dieser Gefässe 2 ist ein individuelles Ventil 4 vorgeschaltet, über welches diese Medien den (auf der rechten Seite dargestellten) Hybridisierkammern 5 (S 1, S 2, S 3, S 4) zugeführt werden können. Die das Ventil 4 umfassenden Medienleitungen 6 münden in eine Sammelleitung 7, die wiederum in eine Förderpumpe 8 mündet, der ein Belüftungsventil 9 vorgeschaltet ist. Diese Förderpumpe 8 saugt über die Sammelleitung 7 flüssige Medien aus den Gefässen 2 an und pumpt sie über die Verteilleitung 10 in die Einlassleitungen 11, die über ein Einlassventil 12 in die Hybridisierkammern 5 münden. Die Hybridsiermedien verlassen die Hybridisierkammern 5 über eine Auslassleitung 13, welche je ein Auslassventil 14 umfassen und in eine Sammelleitung 15 einmünden. Diese Sammelleitung 15 mündet ihrerseits in eine Abfallleitung 16, welche mittels eines Abfallventils 17 verschliessbar ist. Die Verteilleitung 10 und die Sammelleitung 15 können über eine Verbindungsleitung 18 und ein Verbindungsventil 19 miteinander kommunizieren. Von dieser Verbindungsleitung 18 zweigt eine Entlastungsleitung 20 mit einem Entlastungsventil 21 ab und mündet in einen Sammelbehälter 22 mit einer Be- bzw. Entlüftungsöffnung 23. Dem Sammelbehälter 22 nachgeschaltet ist eine Förderpumpe 24, die über eine Übergangsleitung 25 mit der Abfallleitung 16 verbunden ist.1 shows a diagram of a
Zum besseren Verteilen der Hybridisiermedien in den Hybridisierkammern 5 ist das System 1 mit einem Agitationsmechanismus bzw. mit einer Agitationseinrichtung 32 ausgerüstet, wie diese aus der europäischen Patentanmeldung EP 1 260 265 A1 des Anmelders der aktuellen Patentanmeldung bekannt ist. Auf den Inhalt dieser Patentanmeldung EP 1 260 265 A1 wird hier ausdrücklich Bezug genommen, so dass dieser Inhalt als Teil der vorliegenden Patentanmeldung gilt.For better distribution of the Hybridisiermedien in the
Figur 2 zeigt einen der Fig. 1 von EP 1 260 265 A1 entsprechenden, senkrechten Längsschnitt durch eine Hybridisierkammer 5. Der Deckel 26 dieser Anordnung ist gegenüber dem Objektträger 27 bewegbar (hier um eine Achse schwenkbar ausgebildet, so dass der Hybridisierraum 5 durch eine einfache Bewegung geöffnet und geschlossen werden kann. Eine ringförmige Dichtfläche 28 dient zum Abschliessen des Hybridisierraums 5 durch Beaufschlagen einer Oberfläche 29 dieses Objektträgers 27. Diese Dichtfläche 28 kann eine abgesetzte Oberfläche des Deckels 26 sein, welche flach auf der Oberfläche 29 des Objektträgers 27 liegt; alternativ dazu kann z.B. auch eine Lippendichtung verwendet werden. Bevorzugt wird jedoch eine O-Ring-Dichtung als Dichtfläche 28. Die Anordnung umfasst Leitungen 11,13 zum Zu- bzw. Ableiten von Medien in den Hybridisierraum 5 hinein bzw. aus dem Hybridisierraum 5 heraus. Solche Medien können Reagenzien zum Durchführen der Hybridisierungsreaktion, wie z.B. Waschflüssigkeiten oder Puffer-Lösungen, aber auch inerte Gase (wie z.B. Stickstoff) zum Trocknen der Hybridisierungsprodukte auf den Objektträgern 27 bzw. zum Ausblasen der Hybridisierkammern 5 und der Medienleitungen 11,13 sein. Diese Zu- bzw. Ableitungen 11,13 für Hybridisiermedien münden bevorzugt in je einen Agitationsraum 30, 30'. Die Anordnung umfasst zudem eine verschliessbare Musterzuführung 31, durch welche von Hand RNA-enthaltende Flüssigkeiten oder andere Musterflüssigkeiten zupipettiert werden können. Die Musterzuführung 31 wird vorzugsweise mit einem Kunststoffpfropfen (nicht gezeigt) verschlossen. Alternativ dazu kann eine automatische bzw. robotisierte Musterzuführung vorgesehen werden, wie diese in unterschiedlichen Ausführungsformen in EP 1 260 265 A1 offenbart sind.FIG. 2 shows a vertical longitudinal section through a
Die Anordnung umfasst eine medientrennende Agitationseinrichtung 32 zum Bewegen von Flüssigkeiten gegenüber auf der Oberfläche 29 der Objektträger 27 immobilisierten Proben von Nukleinsäuren, Proteinen oder Gewebeschnitten. In der in Figur 2 gezeigten Ausführungsform umfasst die Agitationseinrichtung 32 der Anordnung eine Membran 33. Diese Membran 33 trennt einen Druckraum 34, der über eine Druckleitung 35 mit einem Druckfluid (Gas oder Flüssigkeit) befüllbar ausgebildet ist, von einem Agitationsraum 30, der über eine Agitationsleitung 36 mit dem Hybridisierraum 5 verbunden ist. Nach dem Erreichen des thermischen Gleichgewichtes der Anordnung, dem Zugeben eines bestimmten Volumens an RNA-Musterflüssigkeit und dem Verschliessen der Musterzuführung 31 wird über die Druckleitung 35 vorzugsweise Luft oder ein anderes Gas (es könnte aber auch eine Flüssigkeit sein) stossweise in den Druckraum 34 gebracht oder daraus abgelassen, so dass sich die Membran 33 im gleichen Rhythmus durchbiegt und entsprechend den Agitationsraum 30 verkleinert bzw. vergrössert. Dadurch wird die Musterflüssigkeit im gleichen Rhythmus des Über- bzw. Unterdrucks und Entspannens im Hybridisierraum 5 gegen das eine oder das andere Ende bewegt, wo sich vorzugsweise an der gegen das Innere des Hybridisierraums 5 gerichteten Oberfläche 37 des Deckels 26 je ein Querströmkanal 38,38' befindet.The arrangement comprises a media-separating
Diese Querströmkanäle 38,38' erleichtern einerseits das Querverteilen der in der Musterlösung enthaltenen RNA-Moleküle. Dadurch wird bewirkt, dass die Musterflüssigkeit bzw. die Waschflüssigkeiten homogen über das gesamte im Hybridisierraum 5 anwesende Volumen verteilt werden. Zudem dienen die Querströmkanäle 38,38' auch als Flüssigkeits-Reservoir, so dass bei der durch die in der Vorrichtung eingebauten Agitationseinrichtung 32 erzeugte Pendelbewegung (gefüllter Doppelpfeil) der Musterlösung nicht dazuführt, dass Teile des Hybridisierraums 5 unbeabsichtigt trocken liegen.On the one hand, these
Vorzugsweise ist ein zweiter, ebenfalls mit einer Membran 33' versehener Agitationsraum 30' über eine zweite Agitationsleitung 36' mit dem Hybridisierraum 5 verbunden. Wenn jetzt ein auf den Druckraum 34 abgegebener Druckstoss die erste Membran 33 in den ersten Agitationsraum 30 drückt, wird dieser Impuls über die erste Agitationsleitung 36 auf die Musterflüssigkeit im Hybridisierraum 5 übertragen. Die Musterflüssigkeit weicht etwas gegen die zweite Agitationsleitung 36' aus (kann diese sogar zum Teil füllen) und erhöht den Druck im zweiten Agitationsraum 30'. Dadurch biegt sich die zweite Membran 33' nach oben und wird dabei elastisch gedehnt. Sobald der Überdruck im Druckraum 34 nachlässt, federn beide Membranen 33,33' in ihre Ruheposition zurück und bewegen die Musterflüssigkeit im Hybridisierraum 4 in die entgegengesetzte Richtung. Durch diese Pendelbewegung kann mit der gezeigten Anordnung eine Musterflüssigkeit mit einem minimalen Volumen (im Bereich von ca. 100 µl) in weniger als einer Minute praktisch homogen im Hybridisierraum 5 verteilt werden. Vorzugsweise wird unmittelbar anschliessend an den Druckabbau im Druckraum 34 ein Unterdruck im Druckraum 34 erzeugt, so dass die dem vorangehenden Druckstoss entgegengesetzte Rückwärtsbewegung der Musterflüssigkeit im Hybridisierraum 5 noch verstärkt wird.Preferably, a second agitation space 30 ', also provided with a membrane 33', is connected to the
Figur 3 zeigt eine Draufsicht auf die Anordnung von Figur 2, von unten gesehen. Die O-Ring-Dichtung 28 begrenzt lateral den Hybridisierraum 5, der an seinen einander entgegengesetzten Enden je einen Querströmkanal 38,38' aufweist, welche als Vertiefung in der Oberfläche 37 des Deckels 26 vorgesehen sind. Der Objektträger 27 (hier ein Glasobjektträger für die Lichtmikroskopie) und dessen Grifffeld 55 sind gestrichelt eingezeichnet. Klar ersichtlich ist auch die Abdrückfeder 56, welche auf das Grifffeld 55 des Objektträgers 27 drückt. Beim Öffnen des Hybridisierraums 5 erleichtert diese Abdrückfeder 56 die automatische Trennung des Objektträgers 27 vom Deckel 26. Ebenfalls ersichtlich ist die Linienführung der Einlassleitung 11, der Auslassleitung 13 und der Druckleitung 35 sowie die Anordnung der Agitationsräume 30,30' und der Musterzuführung 31. Die Agitationsleitungen 36,36' und die Musterzuführung 31 münden in den Querströmkanälen 38,38'.Figure 3 shows a plan view of the arrangement of Figure 2, seen from below. The O-
Alle Leitungen 11,13,35 zum Zu- bzw. Abführen von Medien münden vorzugsweise in einer gemeinsamen Anschlussebene 57 des Deckels 26, welche im Wesentlichen parallel zum Hybridisierraum 5 und vorzugsweise auf der gleichen Höhe wie der Hybridisierraum 5 angeordnet ist. Die Mündungsöffnungen der Leitungen 11,13,35 können wie gezeigt versetzt zu einander oder auf einer quer zu der Vorrichtung 1 verlaufenden Linie (nicht gezeigt) angeordnet sein. Aussparungen (leere Pfeile, vgl. Fig. 2) reduzieren den Wärmefluss von oder zu dem Deckel 26.All
Die Druckleitungen 35, von welchen für jede der Hybridisierkammern 5 eine bestimmt ist, sind in Figur 1 gestrichelt dargestellt und gehen von einer Druckverteilleitung 39 aus. In diese Druckverteilleitung 39 münden eine Ausgleichsleitung 40 mit einem Ausgleichsventil 41, eine Überdruckzuleitung 42 mit einem Überdruckventil 43 und eine Unterdruckzuleitung 44 mit einem Unterdruckventil 45. Der Überdruck wird vorzugsweise mit einem kostengünstigen Gas (z.B. Luft) in einer Überdruckpumpe 46 erzeugt, in einem Überdruckbehälter 47 gespeichert und in die Überdruckzuleitung 42 eingespeist. Der Unterdruck wird in einer Untererdruckpumpe 48 erzeugt, in einem Unterdruckbehälter 49 gespeichert und in die Unterdruckzuleitung 44 eingespeist.The pressure lines 35, one of which is intended for each of the
Der Inertgasbehälter 3 ist über ein Gasventil 50 und eine Gasleitung 51 mit der Verteilleitung 10 verbunden, welche über Einlassleitungen 11 und je ein Einlassventil 12 in die Hybridisierkammern 5 münden. Mit Inertgas (z.B. mit Stickstoffgas) können je nach Ventilstellungen alle Hybridisierkammern 5 (einzeln oder in Gruppen) via die Verteilleitung 10 und die Einlassleitungen 11 über die Auslassleitungen 13 und die Sammelleitung 15 ausgeblasen werden.The
Werden nur das Gasventil 50, das Verbindungsventil 19 und das Entlastungsventil 21 geöffnet, so kann die Verteilleitung 10 in den Sammelbehälter 22 ausgeblasen werden. Werden nur das Gasventil 50, das Verbindungsventil 19 und das Abfallventil 17 geöffnet, so können die Verteilleitung 10 und die Sammelleitung 15 über die Abfallleitung 16 ausgeblasen werden.If only the
Figur 4 zeigt einen der Fig. 2 entsprechenden, senkrechten Längsschnitt durch eine Anordnung mit einer Hybridisierkammer 5, wobei der Klapprahmen 54 mit dem darin eingesetzten Deckel 26 des Systems 1 aufgeklappt ist. Bevorzugt sind die Deckel 26 parallel zueinander und in einer Vierergruppe angeordnet, weil diese Anordnung gerade ein Mass für eine Kontaktplatte 53 des Temperaturkontrollthermostaten zulässt, auf welche ein Transportrahmen 52 in der Grösse einer Mikroplatte mit vier parallel zu einander angeordneten Objektträgern 27 passt.FIG. 4 shows a vertical longitudinal section corresponding to FIG. 2 through an arrangement with a
Jede dieser Vierergruppen ist einer an ein Temperatursteuergerät angeschlossenen Kontaktplatte 53 zugeordnet. Eine solche Kontaktplatte 53 ist somit zur flächigen Aufnahme der vier Objektträger 27 eines Transportrahmens 52 ausgebildet. Der Rahmen 52 umfasst Längswände, Querwände und im Wesentlichen parallel zu den Querwänden verlaufende Zwischenwände. Diese Wände umgeben Öffnungen, welche den Rahmen 52 vollständig durchdringen, wobei diese Öffnungen den direkten Kontakt zwischen der Kontaktplatte 53 des Thermostaten und den Objektträgern 27 ermöglichen. Weil die Objektträger 27 im Rahmen 52 sanft federnd gehalten sind und weil die Kontaktplatte 53 so ausgebildet ist, dass der Rahmen 52 ihr gegenüber etwas abgesenkt werden kann, liegen die Objektträger 27 direkt auf der Oberfläche der Kontaktplatte 53. Jede Vierergruppe einer Verfahrenseinheit umfasst eine um eine Achse 58 schwenkbare und gegenüber einer Grundplatte 59 verriegelbaren Klapprahmen 54 mit vier Sitzen, wobei in jeden dieser Sitze ein Deckel 26 einlegbar ist. Jede solche Verfahrenseinheit umfasst zudem eine Anschlussplatte 60 zum dichtenden Verbinden je einer Einlassleitung 11, Auslassleitung 13 und Druckleitung 35 des Systems 1 mit der Einlassleitung 11, Auslassleitung 13 und Druckleitung 35 eines Deckels 26. Als Dichtungen für diese Verbindungen werden vorzugsweise auf der Systemseite angeordnete O-Ringe bevorzugt (nicht gezeigt).Each of these groups of four is assigned to a
Figur 5 zeigt einen der Fig. 2 entsprechenden, senkrechten Längsschnitt durch eine Anordnung mit einer Hybridisierkammer 5, wobei der in einen Klapprahmen 54 eingesetzte Deckel 26 des Systems geschlossen ist. Alle vier Hybridisierräume 5 einer durch eine Kontaktplatte 53 und einen solchen Klapprahmen 54 definierten Vierergruppe sind somit der Temperaturkontrolle eines Temperatursteuergeräts zugeordnet. Jede Vierergruppe einer Verfahrenseinheit umfasst, wie oben beschrieben, eine um eine Achse 58 schwenkbare und gegenüber einer Grundplatte 59 verriegelbaren Klapprahmen 54 mit vier Sitzen, wobei in jeden dieser Sitze ein Deckel 26 einlegbar ist. Um sicherzustellen, dass die Deckel 26 planparallel zu den Objektträgern 27 platziert werden können, weist der Klapprahmen 54 zudem noch ein Mittelgelenk (nicht gezeigt) mit einer zur Achse 58 parallelen Beweglichkeit auf. Damit die Dichtungen 28 die Hybridisierräume 5 zuverlässig abschliessen, wird über den Klapprahmen 54 ein zusätzlicher Druck auf die Deckel 26 ausgeübt, dies kann über Schrauben, Kipphebel oder ähnliche bekannte Vorrichtungen (nicht gezeigt) bewerkstelligt werden.FIG. 5 shows a vertical longitudinal section corresponding to FIG. 2 through an arrangement with a
Die vorliegende Erfindung beruht auf der Erkenntnis, dass mittels Erzeugen eines Überdrucks in den Hybridisierkammern 5 das spontane Auftreten von Luftblasen während dem Hybridisieren verhindert werden kann. Dabei soll der Kammer-Druck über dem in der Umgebungsluft herrschenden, normalen atmosphärischen Druck liegen. Bevorzugt wird ein Kammerdruck, der mindestens um 100 mbar bis maximal um 1.4 bar höher ist als der Umgebungsdruck. Selbst höhere Drücke in der Kammer sind möglich, falls ihnen ein genügend grosser Anpressdruck zum Dichthalten der Kammer entgegenwirkt.The present invention is based on the recognition that by generating an overpressure in the
Tatsächlich treten unter diesen Druckverhältnissen während der Hybridisierung keine Luftblasen mehr auf. Der diesem Phänomen zu Grunde liegende Funktionsmechanismus ist nicht restlos aufgeklärt. Es wird jedoch angenommen, dass der erhöhte Druck einerseits die Diffusionsrichtung im Bereich der O-Ring-Dichtung 28 bestimmt bzw. definiert, so dass keine Gasmoleküle der Umgebungsluft mehr in die Hybridisierkammer 5 diffundieren können. Andererseits findet auf Grund ihrer Druckabhängigkeit sicher auch eine Verschiebung der Phasengrenzen im Hybridisiermedium statt, so dass die spontane Luftblasenbildung unterdrückt wird. Im Zusammenhang mit dieser Erfindung werden deshalb alle Gasblasen im Hybridisiermedium - ungeachtet des Entstehungsprozesses in der Hybridisierkammer 5 - als "Luftblasen" bezeichnet.In fact, no air bubbles occur under these pressure conditions during hybridization. The underlying mechanism of this phenomenon is not completely clear. However, it is assumed that the increased pressure on the one hand determines or defines the direction of diffusion in the region of the O-
Erfindungsgemäss kann der verlangte Überdruck in den Hybridisierkammern 5 mittels einer Flüssigkeit, wie z.B. mittels eines von der Förderpumpe 8 in die Hybridisierkammern 5 gedrücktes Hybridisiermedium aus einem der Gefässe 2 erreicht werden (vgl. Fig. 1). Falls ein diese Hybridisierkammer 5 umfassendes System 1 eine Agitationseinrichtung 32 zum Bewegen der Hybridisiermedien gegenüber den immobilisierten Proben aufweist, so umfasst dieses System bevorzugt auch ein Federelement, welches den durch die Agitationseinrichtung 32 erzeugten Druckunterschieden federnd entgegenwirkt. Ein solches Federelement kann ein elastisches Rohrstück (nicht gezeigt) in einer entsprechenden Zu- oder Ableitung zu der Hybridisierkammer 5 sein; es kann aber auch ein federnd beaufschlagtes Expansionsgefäss (nicht gezeigt) vorgesehen sein, welches über eine Leitung mit der Hybridisierkammer 5 verbunden ist.According to the invention, the required overpressure in the
Alternativ dazu kann auch Inertgas aus dem Behälter 3 in die Verteilleitung 10 und die Einlassleitungen 11 gedrückt und über je ein Einlassventil 12 der verlangte Druck in den mit Proben und Hybridisiermedien bereits gefüllten Hybridisierkammern 5 aufgebaut werden. Bevorzugt sind Inertgase wie N2 (Stickstoff), die keine chemische Wechselwirkung oder Reaktionen mit den Hybridisiermedien eingehen. Es kann zudem von Vorteil sein, wenn die Inertgase in den Hybridisiermedien nicht löslich sind. Zudem besteht die Möglichkeit, das aus einer Druckpumpe und einem Druckbehälter (ähnlich wie bei den mit 46 und 47 bezeichneten Elementen in Fig. 1) stammende Gas in die Verteilleitung 10 einzuleiten. Nach dem Druckaufbau können alle Ventile wieder geschlossen und die Hybridisierung durchgeführt werden. Dabei dient das so aufgebaute Gaskissen, welches direkt mit dem für die Hybridisierung verwendeten Flüssigkeitsvolumen in Verbindung steht, als Federelement zum federnden Entgegenwirken auf die Agitationsdruckunterschiede. Falls dies, z.B. wegen eines minimalen aber konstanten Druckverlustes über die O-Ring-Dichtungen 28, erforderlich sein sollte, kann der verlangte Kammerdruck während der zumeist viele Stunden dauernden Hybridisierung sporadisch korrigiert oder erneuert bzw. konstant gehalten werden. Zu diesem Zweck können wahlweise auch eines oder beide der Ventile 12,14 (vgl. Fig. 1) offen gehalten werden.Alternatively, inert gas can also be forced out of the
Eine weitere Alternative (in den Figuren nicht dargestellt) besteht darin, eine Druckpumpe und einen Druckbehälter (ähnlich wie die mit 46 und 47 bezeichneten Elemente in Fig. 1) oder einen Gasbehälter (wie z.B. der N2-Behälter 3 in Fig. 1) mit der Sammelleitung 15 zu verbinden und den Druck in den Hybridisierkammern 5 über ein Öffnen der Auslassventile 14 aufzubauen. Eine zusätzliche Alternative zum Bereitstellen eines Gaskissens, das als Federelement zum federnden Entgegenwirken auf die Agitationsdruckunterschiede dient, besteht darin, das aus einer Druckpumpe und einem Druckbehälter (ähnlich wie die mit 46 und 47 bezeichneten Elemente in Fig. 1) oder aus einem Gasbehälter (wie z.B. der N2-Behälter 3 in Fig. 1) stammende Gas in eine der Leitungen zu führen, welche in zumindest eine der Verteilleitung 10 oder Sammelleitung 15 münden. Entsprechend können eines oder beide der Ventile 12,14 (vgl. Fig. 1) offen gehalten werden.Another alternative (not shown in the figures) is to use a pressure pump and a pressure vessel (similar to those elements labeled 46 and 47 in FIG. 1) or a gas vessel (such as the N 2 vessel 3 in FIG. 1). to connect to the manifold 15 and to build up the pressure in the
Wird ein System 1 mit Anordnungen verwendet, welche (wie oben beschrieben) zwei Agitationsmembranen 33,33' umfassen, so kann während dem vorbereitenden Agitieren der Hybridisationsmedien in den Hybridisierkammern 5 oder auch während dem Hybridisieren selbst, die Agitationseinrichtung 32 verwendet werden. Dabei muss einfach ein Agitationsdruck im Druckraum 34 erzeugt werden, der um ca. 0.5 bis 1 bar höherer ist als der gewünschte Kammerdruck von 100 mbar bis 1.4 bar über dem Umgebungsdruck. Der für die Agitation aufzuwendende Druck bewegt sich (je nach Umgebungsdruck) somit im Bereich von ca. 1.6 - 2.4 bar. Die zweite Membran 33' bildet in diesem Fall ein Federelement, welches diesem Agitationsdruck federnd entgegen wirkt.If a
Typischerweise wird eine Hybridisierung wie folgt durchgeführt:
- a) Ausspülen von Luftblasen und Flüssigkeitsresten aus der Verteilleitung 10 und der
Sammelleitung 15. Zu diesem Zweck werden nur die Ventile 4 (A.D.), 19und 17 geöffnet und es wird mit der Förderpumpe 8 destilliertes Wasser aus dem Gefäss 2 (A.D.) über das Ventil 4 (A.D.) indie Verteilleitung 10 gepumpt. Das destillierte Wasser strömt durchdas Verbindungsventil 19 indie Sammelleitung 15 und von dort überdas Abfallventil 17 indie Abfallleitung 16.
Gleichzeitig werden dieHybridisierkammern 5 aufgebaut. Dies geschieht durch das Auflegen von (vorzugsweise ineinem Transportrahmen 52 gehaltenen)Objektträgern 27 mit darauf immobilisierten Proben auf dieKontaktplatte 53 eines Thermostats, durch dasEinsetzen von Deckeln 26 inden Klapprahmen 54 desSystems 1 zum Hybridisierenvon auf Objektträgern 27 immobilisierten Nukleinsäureproben, Proteinen oder Gewebeschnitten und durch das Verschliessen der Hybridisierkammern 5 mittels Herunterklappen derDeckel 26 auf die Objektträger 24 (vgl. Fig. 4 und 5). Dieses Herunterklappen verbindet dieEnden der Einlassleitungen 11,der Auslassleitungen 12 und der Druckleitungen 35der Agitationseinrichtung 32 jeder einzelnen Hybridisierkammer 5 mit den entsprechenden Leitungsenden desSystems 1. Vorzugsweise werden - entsprechend den vier ineinem Transportrahmen 52 aufgenommenen Objektträgern 27 -vier Deckel 26 ineinen Klapprahmen 54 eingesetzt. - b) Füllen und Thermostatisieren der Hybridisierkammern 5 mit Prähybridisier-Puffer. Zu diesem Zweck werden nur die Ventile 4 (V-P), 12, 14
und 17 geöffnet und es wird mit der Förderpumpe 8 Prähybridisier-Puffer aus dem Gefäss 2 (V-P) über das Ventil 4 (V-P) indie Verteilleitung 10 und von dort über dieEinlassventile 12 indie Hybridisierkammern 5 gepumpt. Ein Teil des Prähybridisier-Puffers verlässt dieHybridisierkammern 5 über dieAuslassventile 14 und dieSammelleitung 15 und gelangt überdas Abfallventil 17 indie Abfallleitung 16. Dieser Vorgang verlangt besondere Beachtung, weil hier zum ersten Mal Luftblasen indie Hybridisierkammern 5 eingeschleppt werden können. - c) Ausblasen der Verteilleitung 10 und der
Sammelleitung 15. Zu diesem Zweck werden nur dieVentile und 17 geöffnet und es wird mit der Förderpumpe 8 Luftüber das Belüftungsventil 9 angesaugt und über dieVerteilleitung 10,das Verbindungsventil 19 indie Sammelleitung 15 und von dort überdas Abfallventil 17 indie Abfallleitung 16 gepumpt. - d) Probenzugabe in
die Hybridisierkammern 5. Zu diesem Zweck werden nur dieVentile 14 und 21 geöffnet. Die Proben werden mit einer Pipette über dieMusterzuführung 31im Deckel 26 indie Hybridisierkammern 5 gepresst. Dadurch wird ein entsprechendes Volumen Prähybridisier-Puffer ausden Hybridisierkammern 5 indie Auslassleitung 13 mitden geöffneten Auslassventilen 14 verdrängt. Dies wiederum verdrängt ein entsprechende Volumen Luft aus derSammelleitung 15. Diese verdrängte Luft strömt durchdas geöffnete Entlastungsventil 21 indie Entlastungsleitung 20 und gelangt inden Sammelbehälter 22, den sie über dieEntlüftungsöffnung 23 verlässt. Dieser Vorgang verlangt besondere Beachtung, weil hier zum zweiten Mal Luftblasen indie Hybridisierkammern 5 eingeschleppt werden können. - e) Gleichmässiges Verteilen der Hybridisiermedien in
den Hybridisierkammern 5 und gegenüber den aufden Objektträgern 27 immobilisierten Proben. Zu diesem Zweck sind zuerst alle Ventile geschlossen. Dann wird der Kammerdruck wie schon beschrieben erhöht und dieAgitationseinrichtung 32 in Betrieb genommen.
Alle eventuell inden Hybridisierkammern 5 vorhandenen Luftblasen werden bei diesem Druckaufbau eliminiert. - f) Hybridisieren der Proben während beispielsweise 17 Stunden. Währen der Hybridisierung können die Medien in
den Hybridisierkammern 5 konstant oder intermittierend agitiert werden. Dieser Vorgang verlangt besondere Beachtung, weil hier Luftblasen spontan inden Hybridisierkammern 5 entstehen können. Um dies zu verhindern, kann der Kammerdruck während der Hybridisierung korrigierend angepasst und konstant gehalten bzw. gemäss einem individuellen Programm verändert werden. Ein solches Programm kann das Erhöhen und Erniedrigen des Kammerdruckes in bestimmten Druck- und Zeitschritten definieren, so dass ein schonendes Hybridisieren der Proben gewährleistet ist, die eine solch spezielle Behandlung verlangen. - g) Waschen der hybridisierten Proben mit Puffern. Zu diesem Zweck wird zuerst der Kammerdruck auf Normaldruck reguliert, indem die
Auslassventile 14und das Abfallventil 17 geöffnet werden. Darauf werden Waschflüssigkeiten mittels der Förderpumpe 8 sequentiell und je nach Bedarf ausden Gefässen 2 durch die entsprechend geöffneten Ventile 4 indie Verteilleitung 10 und von da über die geöffneten Einlassventile 12 und dieEinlassleitungen 11 indie Hybridisierkammern 5 gepumpt. Die Waschflüssigkeiten und Waschabfälle verlassen dieHybridisierkammern 5 über dieAuslassleitungen 13 und die bereits geöffneten Auslassventile 14, werden inder Sammelleitung 15 zusammengeführt und durchdas geöffnete Abfallventil 17 indie Abfallleitung 16 abgeführt. - h) Trocknen der hybridisierten Proben auf
den Objektträgern 27. Zu diesem Zweck werden nur dieVentile und 17 geöffnet. Daraufwird das Inertgasventil 50 geöffnet und dieVerteilleitung 10, dieEinlassleitungen 11, dieHybridisierkammern 5, dieAuslassleitungen 13 und die Sammelleitung 15 überdas geöffnete Abfallventil 17 und dieAbfallleitung 16 mit Inertgas durchgespült bis die Proben trocken sind.
Anschliessend könne die fertigen Proben entnommen werden.
- a) rinsing out of air bubbles and liquid residues from the
distribution line 10 and the manifold 15. For this purpose, only the valves 4 (AD), 19 and 17 are opened and it is with thefeed pump 8 distilled water from the vessel 2 (AD) on the Valve 4 (AD) is pumped into thedistribution line 10. The distilled water flows through the connectingvalve 19 into the manifold 15 and from there via thewaste valve 17 into thewaste line 16.
At the same time theHybridisierkammern 5 are constructed. This is done by placing slides (preferably held in a transport frame 52) with samples immobilized thereon onto thecontact plate 53 of a thermostat, insertinglids 26 into thesnap frame 54 of thesystem 1 to hybridize nucleic acid samples, proteins immobilized onslides 27 or tissue sections and by closing theHybridisierkammern 5 by folding down thelid 26 on the slides 24 (see Fig. 4 and 5). This folding down connects the ends of theinlet ducts 11, theoutlet ducts 12 and thepressure ducts 35 of the agitation means 32 of eachindividual hybridizing chamber 5 to the respective duct ends of thesystem 1. Preferably, four covers 26 are inserted into a snap-inframe 54, corresponding to the four slides 27 received in atransport frame 52. - b) filling and thermostating the
Hybridisierkammern 5 with prehybridization buffer. For this purpose, only the valves 4 (VP), 12, 14 and 17 are opened and it is with thefeed pump 8 prehybridization buffer from the vessel 2 (VP) via the valve 4 (VP) in thedistribution line 10 and from there via theintake valves 12 are pumped into theHybridisierkammern 5. A part of the prehybridization buffer leaves theHybridisierkammern 5 via theoutlet valves 14 and the manifold 15 and passes through thewaste valve 17 in thewaste line 16. This process requires special attention, because here for the first time air bubbles can be introduced into theHybridisierkammern 5. - c) blowing out of the
distribution line 10 and the manifold 15. For this purpose, only thevalves vent valve 9 and thedistribution line 10, the connectingvalve 19 into the manifold 15th and pumped from there via thewaste valve 17 into thewaste line 16. - d) Sampling in the
Hybridisierkammern 5. For this purpose, only thevalves lid 26 into thehybridization chambers 5. As a result, a corresponding volume of prehybridization buffer is displaced from thehybridization chambers 5 into theoutlet line 13 with theoutlet valves 14 open. This in turn displaces a corresponding volume of air from the manifold 15. This displaced air flows through theopen relief valve 21 in thedischarge line 20 and enters thesump 22, which it leaves via thevent opening 23. This process requires special attention, because here for the second time air bubbles can be introduced into theHybridisierkammern 5. - e) Uniform distribution of the Hybridisiermedien in the
Hybridisierkammern 5 and with respect to the immobilized on theslides 27 samples. For this purpose, first all valves are closed. Then, the chamber pressure is increased as already described and theagitator 32 is put into operation.
Any air bubbles that may be present in thehybridization chambers 5 are eliminated in this pressure build-up. - f) hybridizing the samples for, for example, 17 hours. During hybridization, the media in the
hybridization chambers 5 can be agitated constantly or intermittently. This process requires special attention because here air bubbles can spontaneously arise in theHybridisierkammern 5. To prevent this, the chamber pressure during the hybridization can be corrected and kept constant or changed according to an individual program. Such a program may define increasing and decreasing the chamber pressure in certain pressure and time increments so as to ensure gentle hybridization of the samples requiring such special treatment. - g) washing the hybridized samples with buffers. For this purpose, first, the chamber pressure is regulated to normal pressure by opening the
exhaust valves 14 and thewaste valve 17. Thereafter, washing liquids are pumped by means of thefeed pump 8 sequentially and as needed from thevessels 2 through the correspondinglyopen valves 4 in thedistribution line 10 and from there via theopen inlet valves 12 and the inlet lines 11 in theHybridisierkammern 5. The washing liquids and wastes leave theHybridisierkammern 5 via the outlet lines 13 and the alreadyopen exhaust valves 14 are merged in the manifold 15 and discharged through theopen waste valve 17 into thewaste line 16. - h) drying the hybridized samples on the
slides 27. For this purpose, only thevalves inert gas valve 50 is opened and thedistribution line 10, the inlet lines 11, thehybridization chambers 5, the outlet lines 13 and the manifold 15 are flushed through the openedwaste valve 17 and thewaste line 16 with inert gas until the samples are dry.
Subsequently, the finished samples can be removed.
Alternativ zum eben beschriebenen Verfahrensschritt h) erfolgt das Trocknen der hybridisierten Proben auf den Objektträgern 27, indem nur die Ventile 12, 14 und 21 geöffnet werden. Darauf wird das Inertgasventil 50 geöffnet und die Verteilleitung 10, die Einlassleitungen 11, die Hybridisierkammern 5, die Auslassleitungen 13 und die Sammelleitung 15 über das geöffnete Entlastungsventil 21, die Entlastungsleitung 20, den Sammelbehälter 22 und die Entlüftungsöffnung 23 mit Inertgas durchgespült bis die Proben trocken sind.As an alternative to process step h) just described, the hybridized samples are dried on the microscope slides 27 by opening only the
Bevorzugt wird auch eine alternative Ausführungsform des erfindungsgemässen Verfahrens, bei der auf die zweite Membran 33' der Agitationseinrichtung 32 verzichtet werden kann. Zu diesem Zweck muss ein anderes Medium die Funktion dieses Federelements übernehmen. Dies wird dadurch erreicht, dass nach dem Einfüllen aller an der Hybridisierung teilnehmenden Proben und Medien in die Hybridisierkammern 5 alle Ventile geschlossen (vgl. Schritte a-d) und darauf die Auslassventile 13 wieder geöffnet werden. Damit wird das mit Luft gefüllte Volumen der Sammelleitung 15 sowie der direkt anschliessende Teil der Abfallleitung 16 mit den mit Flüssigkeit gefüllten Volumina der Hybridisierkammern 5 verbunden. Die zwischen den geschlossenen Ventilen 17, 19 sowie 21 und den Musterflüssigkeiten in den Hybridisierkammern 5 eingeschlossene Luft ist elastisch komprimierbar und bildet nun das gewünschte Federelement.An alternative embodiment of the method according to the invention in which the second membrane 33 'of the
Alternativ kann der Schritt c) mit einem Inertgas (z.B. N2) ausgeführt werden: In diesem Fall können chemische Wechselwirkungen zwischen dem gasförmigen Federelement N2 und den Proben ausgeschlossen werden.Alternatively, step c) can be carried out with an inert gas (eg N 2 ): In this case, chemical interactions between the gaseous spring element N 2 and the samples can be excluded.
In einer ersten Versuchsreihe wurde die physikalischen Grundlagen untersucht. Dazu wurden mehrere 100 Objektträger ohne Proben bearbeitet. Die vorzugsweise aus einem Elastomer bestehenden O-Ring-Dichtungen 28 aus z.B. Neopren, Silikon, gedrehtem PTFE, Polyethylen oder Viton verhinderten alle erfolgreich einen Flüssigkeitsverlust. Grundvoraussetzung ist selbstverständlich, dass der Anpressdruck auf den Deckel 26, den O-Ring 28 und den Objektträger 27 genügend gross, d.h. deutlich höher als der erzeugte Kammerdruck ist. Die verwendeten Hybridisierkammern 5 umfassten zwischen dem Deckel 26 und dem Objektträger 27 eine Fläche von 21 x 65 mm. Der Kammerdruck wurde um 1 bar, d.h. um 105 N/m2 über den Normaldruck der Umgebung angehoben. Bei einer aktuellen, wirksamen Fläche von 13.65 cm2 oder 1.365 x 10-3 m2 musste somit eine Kraft von mehr als 136.5 N bzw. von ca. 13.9 kp pro Hybridisierkammer 5 aufgewendet werden, damit sich diese nicht spontan öffnen konnten. Es wird angenommen, dass auch andere Dichtungsformen und Dichtungsmaterialien genügen und einen Flüssigkeitsaustritt verhindern, falls eine entsprechend dem Überdruck in der Hybridisierkammer 5 gewählte Schliesskraft auf den Deckel 26, die Dichtung 28 und den Objektträger 27 ausgeübt wird.In a first series of experiments, the physical fundamentals were investigated. For this purpose, several 100 slides without samples were processed. The preferably made of an elastomer O-
Während beim Standardgerät SN22 im Laufe des Bearbeitens von Slides bzw. Objektträgern mit hydrophoben Oberflächen regelmässig Luftblasen zu beobachten waren, wurden beim erfindungsgemässen Prototypen keinerlei Luftblasen festgestellt.While air bubbles were regularly observed in the standard device SN22 during the processing of slides or slides with hydrophobic surfaces, no air bubbles were detected in the prototype according to the invention.
Zum Durchführen eines Beispiels einer erfindungsgemäss unter erhöhtem Druck durchgeführten Hybridisierung wurden zwei Systeme zeitparallel und unabhängig voneinander eingesetzt. Es handelt sich dabei um ein Standardgerät des Anmelders (Tecan HS 400, Seriennummer 22; kurz SN22 genannt), welches bei Normaldruck betrieben wurde und um einen erfindungsgemässen Prototypen (kurz PT3 genannt), der bei einem um 0.8 bis 1.0 bar erhöhtem Kammerdruck betrieben wurde. Beide Geräte waren mit einem einander entsprechenden Agitationsmechanismus ausgerüstet, wie er grundsätzlich weiter oben beschrieben wurde. Diese Agitationseinrichtung 32 in SN22 wurde mit ca. 0.5 bar, diejenige in PT3 mit einem Agitationsdruck von ca. 1.5 bar betrieben. Bei beiden Geräte wurde das Einhalten der genauen Temperatur vorher überprüft; sie wurden (abgesehen von den erwähnten, testbedingten Unterschieden) mit genau gleichen Parametern (z.B. Temperaturen) betrieben. Dadurch wurde ermöglicht, dass von den erzielten Resultaten direkte Rückschlüsse auf die Ursachen gezogen werden konnten.To carry out an example of a hybridization performed according to the invention under elevated pressure, two systems were used simultaneously and independently of each other. This is a standard device of the applicant (Tecan HS 400,
Die Hybridisierungsprozedur (Pufferzubereitung, Musterinjektion, Programmdefinierung an den verwendeten Hybridisier-Systemen) wurde gemäss den technischen Instruktionen von Alopex (ALOPEX GmbH, Fritz-Hornschuch-Str. 9, D-95326 Kulmbach, Bundesrepublik Deutschland) durchgeführt. In die Hybridisier-Systeme SN22 und PT3 wurden jeweils je zwei Objektträger 27 eingesetzt und bei 43 °C bzw. bei 61 °C prozessiert. Von den folgenden bearbeiteten Proben werden die Resultate besprochen:
Das ausgeführte Programm für jeden Probelauf lautet im Detail:
a) Zubereitung der "HybCheck Waschpuffer 1 und 2 lt. Herstellerangaben;
b) Lösen von lyophilisierten, fluoreszenzmarkierten Oligonukleotiden in 250 µl auf eine Hybridisiertemperatur (43 °C bzw. 61 °C) vorgewärmtem HybCheck Puffer für die Hybridisierung;
c) Einlegen von je 2 Objektträgern (mit je 6 Sub Arrays) auf Position 1 und 2 in das Hybridisier-System, Verwendung der grossen Hybridisierungskammern (63,5 mm x 20 mm);
d) Schliessen der Hybridisierungskammern und Starten des Hybridisierungsprogrammes;
e) Hybridisierungsprogramm:
- 1. Erstes Waschen bei 43 °C bzw. 61 °C,
Dauer 30 sec; - 2. Injektion von 105 µl der Oligonukleotidlösung bei 43 °C bzw. 61 °C in jede Kammer;
- 3. Hybridisierung bei 43 °C bzw. 61 °C; bei starker Agitation und während 60 min;
- 4.
Waschschritt 1bei 23 °C (Kanal 1) während 30 sec;Absaugen während 30 sec; 2 Wiederholungen; - 5.
Waschschritt 2bei 23 °C (Kanal 2) während 30 sec;Absaugen während 30 sec; 2 Wiederholungen; - 6. Trocknen der objektträger während 3 min bei 23 °C;
f) Nach Beendigung der Hybridisierung wurden beide Objektträger herausgenommen und in einen Laser Scanner (Tecan LS400) eingelegt;
g) Messeinstellung des Laser Scanners:
h) Nach Messung im Laser Scanner wurden die erhaltenen Rohdaten ausgewertet wie folgt:
Hybridisierung bei 43 °C:
- 1. 6 Sub Arrays (6x9 Spots) auf einem Objektträger (Microslide)
- 2. Perfect Match (PM) bei 43 °C: 24 Spots pro Slide (4 pro Sub Array)
- 3. Mismatch 1 (MM1) bei 43 °C: 24 Spots pro Slide (4 pro Sub Array)
- 4. Mismatch 2 (MM2) bei 43 °C: 24 Spots pro Slide (4 pro Sub Array)
- 5. Negative Controls: 36 Spots pro Slide (6 pro Sub Array)
- 6. Von allen PM's und MM1's pro Microslide (24 Einzelwerte) wurde der Mittelwert, die Standartabweichung und der CV berechnet. Dabei gilt: CV = (Standartabweichung/Mittelwert) x 100
- 7. Diskriminierung PM:MM1 (1:5) sowie Diskriminierung PM:MM2 (1:20) berechnet
- 8. Die CV-Wert und die Diskriminierungs-Werte als "OK" (falls CV über ein ganzes Slide < 18%) oder "failed" angegeben.
Hybridisierung bei 61 °C:
- 1. 6 Sub Arrays (6x9 Spots) auf einem Objektträger (Microslide)
- 2. Perfect Match (PM) bei 61°C: 24 Spots pro Slide (4 pro Sub Array)
- 3. Mismatch 1 (MM1) bei 61°C: 24 Spots pro Slide (4 pro Sub Array)
- 4. Mismatch 2 (MM2) bei 61°C: 24 Spots pro Slide (4 pro Sub Array)
- 5. Negativkontrollen: 36 Spots pro Slide (6 pro Sub Array)
- 6. Von allen PM's und MM1's pro Microslide (24 Einzelwerte) wurde der Mittelwert, die Standartabweichung und der CV berechnet. Dabei gilt: CV = (Standartabweichung/Mittelwert) x 100
- 7. Diskriminierung PM:MM1 (1:5) sowie Diskriminierung PM:MM2 (1:20) berechnet
- 8. Die CV-Werte und die Diskriminierungs-Werte als "OK" (falls CV über ein ganzes Slide < 18%) oder "failed" angegeben.
a) Preparation of the "
b) dissolving lyophilized, fluorescently labeled oligonucleotides in 250 μl HybCheck buffer for hybridization preheated to a hybridization temperature (43 ° C and 61 ° C respectively);
c) placing 2 slides (each with 6 sub-arrays) in
d) closing the hybridization chambers and starting the hybridization program;
e) Hybridization program:
- 1. First wash at 43 ° C or 61 ° C,
duration 30 sec; - 2. Injection of 105 μl of the oligonucleotide solution at 43 ° C or 61 ° C into each chamber;
- 3. hybridization at 43 ° C or 61 ° C; with strong agitation and during 60 min;
-
4th washing step 1 at 23 ° C (channel 1) for 30 sec; Suction for 30 sec; 2 repetitions; - 5. wash
step 2 at 23 ° C (channel 2) for 30 sec; Suction for 30 sec; 2 repetitions; - 6. drying the slides during 3 min at 23 ° C;
f) After hybridization was complete, both slides were removed and placed in a laser scanner (Tecan LS400);
g) Measurement setting of the laser scanner:
h) After measurement in the laser scanner, the obtained raw data were evaluated as follows:
Hybridization at 43 ° C:
- 1. 6 sub arrays (6x9 spots) on a microscope slide (Microslide)
- 2. Perfect Match (PM) at 43 ° C: 24 spots per slide (4 per sub array)
- 3. Mismatch 1 (MM1) at 43 ° C: 24 spots per slide (4 per sub array)
- 4. Mismatch 2 (MM2) at 43 ° C: 24 spots per slide (4 per sub array)
- 5. Negative Controls: 36 spots per slide (6 per sub array)
- 6. Of all PMs and MM1's per Microslide (24 individual values) the mean, the standard deviation and the CV were calculated. Where: CV = (standard deviation / mean) x 100
- 7. Discrimination PM: MM1 (1: 5) as well as Discrimination PM: MM2 (1:20) calculated
- 8. The CV value and the discrimination values are indicated as "OK" (if CV over an entire slide <18%) or "failed".
Hybridization at 61 ° C:
- 1. 6 sub arrays (6x9 spots) on a microscope slide (Microslide)
- 2. Perfect Match (PM) at 61 ° C: 24 spots per slide (4 per sub array)
- 3. Mismatch 1 (MM1) at 61 ° C: 24 spots per slide (4 per sub array)
- 4. Mismatch 2 (MM2) at 61 ° C: 24 spots per slide (4 per sub array)
- 5. Negative controls: 36 spots per slide (6 per sub array)
- 6. Of all PMs and MM1's per Microslide (24 individual values) the mean, the standard deviation and the CV were calculated. Where: CV = (standard deviation / mean) x 100
- 7. Discrimination PM: MM1 (1: 5) as well as Discrimination PM: MM2 (1:20) calculated
- 8. The CV values and the discrimination values are indicated as "OK" (if CV over an entire slide <18%) or "failed".
Die folgenden Ergebnisse wurden erzielt:The following results were achieved:
Die gezeigten Resultate belegen nicht nur, dass beide verwendeten Geräte sehr brauchbare Resultate liefern. Vielmehr sind die in den beiden Geräten SN22 und PT3 erzielten Resultate (nach Temperaturen geordnet) einander so ähnlich, dass ein Einfluss des erhöhten Druckes auf die Hybridisierung ausgeschlossen werden kann.The results show not only that both devices used give very useful results. Rather, the results obtained in the two devices SN22 and PT3 (ordered by temperature) are so similar to each other that an influence of the increased pressure on the hybridization can be excluded.
Das erfindungsgemässe Verfahren ist nicht auf den Einsatz in Hybridisierkammern beschränkt. Es kann auch in anderen Geräten angewendet bzw. eingesetzt werden, um dort das Auftreten von unerwünschten Luftblasen zu verhindern. Solche Geräte oder Instrumente können z.B. aus dem Bereich der Microfluidics-Technologie stammen, wie etwa "Lab on a Chip" - Systeme.The inventive method is not limited to the use in hybridization. It can also be used in other devices or used to prevent the occurrence of unwanted air bubbles. Such devices or instruments may e.g. from the field of microfluidics technology, such as "lab on a chip" systems.
Die Figur 6 zeigt ein Schema eines zum Ausführen des erfindungsgemässen Verfahrens geeigneten, zweiten Geräts bzw. Systems. Dieses System 1' unterscheidet sich von dem in Figur 1 dargestellten System 1 im wesentlichen dadurch, dass jedem Deckel 26 zwei Hybridisierkammern 5A,5B zugeordnet sind. Diese beiden Hybridisierkammern 5A,5B können über einem einzelnen Objektträger mit beispielsweise zwei identischen DNA-Mikroarrays angeordnet werden. Es können aber auch zwei kleinere Objektträger 27 eingesetzt werden, von welchen jedes mit dem einen Deckel 26 zusammen nur jeweils eine Hybridisierkammer 5 definiert (nicht gezeigt). Jede Hybridisierkammer 5A,5B wird von der Verteilleitung 10 über je ein individuelles Einlassventil 12A,12B und je eine individuelle Einlassleitung 11A,11B mit Flüssigkeiten, wie Waschpuffer oder Hybridisiermedien versorgt. Somit können alle Hybridisierkammern wahlweise autark, d.h. unabhängig voneinander oder aber gemeinsam, d.h. simultan betrieben werden.FIG. 6 shows a diagram of a second device or system suitable for carrying out the method according to the invention. This system 1 'differs from the
Um die in den beiden Hybridisierkammern 5A,5B unter jeweils einem Deckel 26 anwesenden Flüssigkeiten gegenüber den auf den Objektträgern immobilisierten Proben bewegen zu können, verfügt jeder Deckel 26 dieses besonders bevorzugten Systems 1' für jede einzelne Hybridisierkammer 5A,5B über einen eigenen, mit je einer Membran 33 versehenen Agitationsraum 30. Dieser Agitationsraum 30 ist jeweils mit einer Agitationsleitung 36 mit der Hybridisierkammer 5A,5B verbunden, wobei die Membran 33 den Agitationsraum 30 von einem Druckraum 34 trennt. Diese Druckräume 34 werden über die Druckleitung 35 mit einem Druckfluid befüllt und sporadisch, z.B., pulsierend mit dem Agitationsdruck beaufschlagt. In Figur 6 erfolgt die Beaufschlagung der Membranen 33 der Hybridisierkammern 5A,5B in Serie, d.h. synchron. Dies hat den Vorteil einer vereinfachten Bauweise, bei der nach dem Überdruckventil 43 keine weiteren Ventile oder Steuerelemente in der Druckverteilleitung 39 oder in den zu den Druckräumen 34 führenden Druckleitungen 35 vorgesehen werden müssen. Es kann jedoch auch vorgesehen sein, dass jede Membran 33 mit einer separaten Druckleitung 35 (parallel) unter Druck gesetzt wird (nicht gezeigt).In order to be able to move the liquids present in each of the two
Die Auslasse 13A,13B eines Deckels 26 münden in die Auslassleitung 13 desselben und werden, wie bereits bei Figur 1 beschrieben, über das Auslassventil 14 der Sammelleitung 15 zugeführt. Gemäss einer bevorzugten Ausführungsform dieses Systems 1' weist die Auslassleitung 13 einen vergrösserten Durchmesser auf und stellt so den Raum bereit, in welche ein als Federelement dienendes Gaskissen Platz findet. Dieses Federelement steht - direkt über eine durchgängige Fluidleitung, oder indirekt (durch ein Membran getrennt) - mit dem für die Hybridisierung verwendeten Flüssigkeitsvolumen in Verbindung. Dieses Federelement wirkt federnd den durch die Agitationseinrichtung 32 auf den Druckraum 34 ausgeübten Agitationsdruckunterschieden entgegen (ähnlich wie bereits im Zusammenhang mit Figur 1 beschrieben). Damit wird erreicht, dass der Kammer-Druck, der mittels einer Druckeinrichtung zum Verhindern von Luftblasen in den Hybridisierkammern 5 aufgebaut wird, unabhängig von Agitationsdruckunterschieden über dem in der Umgebungsluft herrschenden, normalen atmosphärischen Druck gehalten werden kann. Als Federelemente können auch Membranen dienen, welche direkt mit den Medien in den Hybridisierkammern 5 beaufschlagt werden, oder welche durch ein Flüssigkeitskissen oder ein Gaskissen von diesen Medien getrennt sind. Ein Federelement - egal wie es ausgebildet ist - ist vorzugsweise elastisch bzw. komprimier oder dehnbar ausgebildet und gleicht die Agitationsdruckunterschiede in den Hybridisierkammern 5 aus, so dass der Kammerdruck über eine bestimmte Zeit, z.B. während des ganzen Hybridisiervorgangs, so weit über dem in der Umgebungsluft herrschenden, normalen atmosphärischen Druck liegt, dass sich im Hybridisiermedium keine Gasblasen bilden können.The
Zusätzlich zum dort beschriebenen System 1, umfasst das hier vorgestellte, bevorzugte System 1' eine Blasleitung 62, welche über ein Blasventil 63 vorzugsweise gerade zu der Stelle führt, wo der Auslass 13B in die Auslassleitung 13 mündet.In addition to the
Mit dieser Blasleitung 62 wird wie folgt verfahren:
Zuerst wird jede Hybridisierkammer 5A,5B mit Waschpuffer gefüllt. Dabei werden die Einlassleitungen 11A,11B sowie die Auslässe 13A,13B und die Auslassleitung 13 ebenfalls mit Waschpuffer gefüllt. Nach dem Einpipetieren der Musterflüssigkeiten werden die Musterzuführungen 31 und die Einlassventile 12A,12B wieder geschlossen. Die Auslassventile 14 bleiben geöffnet. Werden nun die Blasventile 63 geöffnet, so dringt Gas aus einem Kompressor oder einem Druckspeicher über die individuellen Blasleitungen 64 in die Auslassleitungen 13 ein und verdrängt den Waschpuffer aus diesen Auslassleitungen 13. Dieses Gas bildet dann das Gaskissen in der Auslassleitung 13. Durch deren vergrösserten Durchmesser, weist das Gaskissen das notwendige Volumen auf, um erfolgreich als Federelement dienen zu können. Durch die beim Agitieren auftretenden Druckspitzen wird das Gas in den Auslassleitungen entsprechend komprimiert und federt beim Nachlassen des Agitationsdruckes zurück. Dadurch entsteht die gewünschte Pendelbewegung der Medien im den Hybridisierkammern 5. In dieser eben beschriebenen Ausführungsform kann das Federelement als Teil des Agitationsmechanismus betrachtet werden; tatsächlich erübrigt sich hier das Anbringen einer zweiten Membran 33'. Ist allerdings der Querschnitt der Auslassleitung 13 zu klein, um den ganzen für die Federelement-Wirkung benötigten Raum zur Verfügung zu stellen, so kann ergänzend doch eine zweite Membran 33' (vgl. z.B. Fig. 1) vorgesehen werden.This
First, each
Figur 7 zeigt eine schematische Ansicht einer besonderen, ersten Anordnung eines Deckels 26 mit einer Hybridisierkammer 5, von unten gesehen. Der wesentliche Unterschied zu der in Figur 3 bereits gezeigten Ausführungsform liegt hier in der Auslassleitung 13 mit dem vergrösserten Durchmesser, wodurch der Raum für ein als Federelement dienendes Gaskissen bereit gestellt wird. In diese Auslassleitung 13 mündet in der Nähe ihres Endes der individuelle Auslass 13' der Hybridisierkammer 5. In dem gleichen Bereich mündet auch die dieser Hybridisierkammer 5 zugeordnete, individuelle Blasleitung 64. Alle Medienleitungen weisen je eine Anschlussöffnung auf, die in der gemeinsamen Anschlussebene 57 des Deckels 26 liegt. Diese fünf Öffnungen sind bevorzugt auf einer Linie angeordnet, sie können aber auch beliebig angeordnet sein. Alle anderen Teile entsprechen der Ausführungsform von Fig. 3. In diesem Ausführungsbeispiel ist eine zweite Membran 33' vorgesehen, welche einen zweiten Agitationsraum 30' verschliesst. Die zweite Membran 33' dient in diesem Fall zur Unterstützung des als Gaskissen in der Auslassleitung 13 angeordneten Federelements. Der zweite Agitationsraum 30' ist hier als geschlossener Raum ausgebildet und enthält ein Gaskissen, welches über die Membran 33' zusammendrückbar und wieder expandierbar ausgebildet ist. Falls die Auslassleitung 13 ein genügend grosses Gaskissen bereitstellt, kann auf die zweite Membran 33' und den zweiten Agitationsraum 30' verzichtet werden (vgl. Fig. 8).Figure 7 shows a schematic view of a particular, first arrangement of a
Figur 8 zeigt eine schematische Ansicht einer besonderen, zweiten Anordnung eines Deckels 26 mit zwei Hybridisierkammern 5A,5B, von unten gesehen. Wie die in Figur 7 gezeigte Ausführungsform, weist hier der Deckel 26 eine Auslassleitung 13 mit dem vergrösserten Durchmesser auf, wodurch der Raum für ein als Federelement dienendes Gaskissen bereit gestellt wird. In diesem Fall genügt der bereitgestellte Hohlraum, um die Wirkung als Federelement zu garantieren, deshalb weisen beide hinter einander liegenden Hybridisierkammern 5A,5B keine zweite Membran 33' und keinen zweiten Agitationsraum 30' auf. Die beiden individuellen Auslasse 13A,13B münden in diese Auslassleitung 13, wobei eine Mündung nahe dem Ende und die andere Mündung irgendwo in einem Mittenbereich der Auslassleitung 13 liegt. Die Agitation in den Hybridisierkammern 5A,5B wird über eine gemeinsame Agitationsleitung 35 betrieben.Figure 8 shows a schematic view of a particular, second arrangement of a
Alternativ kann auch je eine individuelle Agitationsleitung zu den Agitationskammern 30 der beiden Hybridisierkammern 5A,5B führen (nicht gezeigt). In diesem alternativen Falle könnte sich die Druckleitung 35 innerhalb des Deckel verzweigen, so dass nur ein gemeinsamer Anschluss für die individuellen Druckleitungen auf der gemeinsamen Anschlussebene 57 des Deckels 26 notwendig wäre. Es könnte aber auch vorgesehen sein, die beiden Hybridisierkammern 5A,5B mit je einer individuellen und unabhängigen Agitationseinrichtung 32 zu versehen. Dies wäre mit einer zusätzlichen Druckleitung 42' und Druckverteilleitung 39' sowie mit einer, pro Hybridisierkammer 5A,5B über einen zusätzlichen Anschluss in der gemeinsamen Anschlussebene 57 des Deckels 26 befüllbaren, individuellen Agitationsleitung 35' zu bewerkstelligen (nicht gezeigt).Alternatively, an individual agitation line may each lead to the
Sinngemäss könnten auch mehr als zwei, z.B. drei Hybridisierkammern 5 pro Deckel 26 angeordnet werden. Die Anzahl der Hybridisierkammern 5 pro Deckel 26 ist lediglich durch die Praktikabilität der Anordnung der dazu notwendigen Zu- und Ableitungen, Dichtungen und Agitationsvorrichtungen limitiert. Dabei kann wahlweise ein einziger Objektträger 27 mehrere vorzugsweise mit einem Nukleotidarray versehene Bereiche aufweisen, so dass mit einem unterteilten Deckel 26 (vgl. z.B. Fig. 8) mehrere Hybridisierkammern 5 pro Deckel 26 und Objektträger 27 betrieben werden können. Es können aber auch kleinere Objektträger 27' vorgesehen sein, welche im wesentlichen gerade eine einzelne, kleinere Hybridisierkammer 5 definieren, so dass die mehrere Hybridisierkammern 5 pro Deckel 26, jedoch auf mehreren Objektträgern 27 betrieben werden können.By analogy, more than two, e.g. three
Claims (20)
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP10172196.7A EP2255880B1 (en) | 2005-06-21 | 2005-06-21 | System and method to prevent air bubbles in a hybridization chamber |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CH11442004 | 2004-07-08 | ||
| DE202004012163U DE202004012163U1 (en) | 2004-07-08 | 2004-08-04 | System for hybridizing immobilized nucleic acid samples, in sealed hybridizing chambers, has a pressure assembly to build up the chamber pressures over ambient atmospheric levels to prevent the formation of air bubbles |
| US10/931,432 US7615370B2 (en) | 2004-07-08 | 2004-09-01 | System having device for preventing air bubbles in a hybridization chamber and corresponding method |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| EP10172196.7A Division EP2255880B1 (en) | 2005-06-21 | 2005-06-21 | System and method to prevent air bubbles in a hybridization chamber |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| EP1614466A2 true EP1614466A2 (en) | 2006-01-11 |
| EP1614466A3 EP1614466A3 (en) | 2006-05-10 |
Family
ID=35106752
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| EP05105498A Ceased EP1614466A3 (en) | 2004-07-08 | 2005-06-21 | System and method to prevent air bubbles in a hybridization chamber |
Country Status (2)
| Country | Link |
|---|---|
| EP (1) | EP1614466A3 (en) |
| JP (1) | JP4819421B2 (en) |
Cited By (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2008098094A1 (en) * | 2007-02-06 | 2008-08-14 | Network Biosystems, Inc. | Devices and methods for the performance of miniaturized in vitro assays |
| EP2186565A1 (en) | 2008-11-13 | 2010-05-19 | Tecan Trading AG | Measuring device and method for determining fluid parameters specified by a laboratory |
| WO2011006177A1 (en) * | 2009-07-15 | 2011-01-20 | Ait Austrian Institute Of Technology Gmbh | Sample carrier |
| US8425861B2 (en) | 2007-04-04 | 2013-04-23 | Netbio, Inc. | Methods for rapid multiplexed amplification of target nucleic acids |
| US9550985B2 (en) | 2009-06-15 | 2017-01-24 | Netbio, Inc. | Methods for forensic DNA quantitation |
| CN108431199A (en) * | 2016-01-05 | 2018-08-21 | 日本板硝子株式会社 | Reaction treating device, reaction treatment container, reaction treatment method |
| CN112683801A (en) * | 2021-01-21 | 2021-04-20 | 上海菁一科技有限公司 | Spectrophotometry test method sample treatment test capsule |
| CN114289091A (en) * | 2022-01-18 | 2022-04-08 | 四川沃文特生物技术有限公司 | Buffer tank for refrigeration system of automatic analysis equipment |
| EP4046717A3 (en) * | 2015-05-29 | 2022-12-14 | Illumina, Inc. | Sample carrier and assay system for conducting designated reactions |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN102740976B (en) | 2010-01-29 | 2016-04-20 | 精密公司 | Sampling-response microfluidic cartridge |
| KR102090934B1 (en) * | 2012-01-09 | 2020-03-19 | 퍼킨엘머 헬스 사이언시즈, 아이엔씨. | Microfluidic reactor system |
| KR102102123B1 (en) | 2012-12-21 | 2020-04-20 | 퍼킨엘머 헬스 사이언시즈, 아이엔씨. | Fluidic circuits and related manufacturing methods |
| KR20150097764A (en) | 2012-12-21 | 2015-08-26 | 마이크로닉스 인코포레이티드. | Portable fluorescence detection system and microassay cartridge |
| JP6935167B2 (en) | 2012-12-21 | 2021-09-15 | ペルキネルマー ヘルス サイエンシーズ, インコーポレイテッド | Low elasticity film for microfluidic use |
| US10386377B2 (en) | 2013-05-07 | 2019-08-20 | Micronics, Inc. | Microfluidic devices and methods for performing serum separation and blood cross-matching |
| CA2911303C (en) | 2013-05-07 | 2021-02-16 | Micronics, Inc. | Methods for preparation of nucleic acid-containing samples using clay minerals and alkaline solutions |
| JP6484222B2 (en) | 2013-05-07 | 2019-03-13 | マイクロニクス, インコーポレイテッド | Devices for nucleic acid preparation and analysis |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6948843B2 (en) * | 1998-10-28 | 2005-09-27 | Covaris, Inc. | Method and apparatus for acoustically controlling liquid solutions in microfluidic devices |
| US6607907B2 (en) * | 2000-05-15 | 2003-08-19 | Biomicro Systems, Inc. | Air flow regulation in microfluidic circuits for pressure control and gaseous exchange |
| ATE288316T1 (en) * | 2001-05-25 | 2005-02-15 | Tecan Trading Ag | SYSTEM WITH PROCESS UNIT FOR HYBRIDIZING NUCLEIC ACID SAMPLES, PROTEINS AND TISSUE SECTIONS |
| US6684966B2 (en) * | 2001-10-18 | 2004-02-03 | Baker Hughes Incorporated | PCD face seal for earth-boring bit |
| DE10258398A1 (en) * | 2002-12-11 | 2004-08-12 | Hans-Knöll-Institut für Naturstoff-Forschung e.V. | DNA amplification method |
-
2005
- 2005-06-21 EP EP05105498A patent/EP1614466A3/en not_active Ceased
- 2005-07-08 JP JP2005200121A patent/JP4819421B2/en not_active Expired - Fee Related
Non-Patent Citations (1)
| Title |
|---|
| None |
Cited By (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2008098094A1 (en) * | 2007-02-06 | 2008-08-14 | Network Biosystems, Inc. | Devices and methods for the performance of miniaturized in vitro assays |
| US9494519B2 (en) | 2007-04-04 | 2016-11-15 | Netbio, Inc. | Methods for rapid multiplexed amplification of target nucleic acids |
| US8425861B2 (en) | 2007-04-04 | 2013-04-23 | Netbio, Inc. | Methods for rapid multiplexed amplification of target nucleic acids |
| EP2186565A1 (en) | 2008-11-13 | 2010-05-19 | Tecan Trading AG | Measuring device and method for determining fluid parameters specified by a laboratory |
| US10538804B2 (en) | 2009-06-15 | 2020-01-21 | Ande Corporation | Methods for forensic DNA quantitation |
| US9550985B2 (en) | 2009-06-15 | 2017-01-24 | Netbio, Inc. | Methods for forensic DNA quantitation |
| US11441173B2 (en) | 2009-06-15 | 2022-09-13 | Ande Corporation | Optical instruments and systems for forensic DNA quantitation |
| WO2011006177A1 (en) * | 2009-07-15 | 2011-01-20 | Ait Austrian Institute Of Technology Gmbh | Sample carrier |
| EP4046717A3 (en) * | 2015-05-29 | 2022-12-14 | Illumina, Inc. | Sample carrier and assay system for conducting designated reactions |
| US12076725B2 (en) | 2015-05-29 | 2024-09-03 | Illumina, Inc. | Fluidic device and method for preparing a sample substrate |
| CN108431199B (en) * | 2016-01-05 | 2022-04-08 | 日本板硝子株式会社 | Reaction processing apparatus and reaction processing method |
| US11351552B2 (en) | 2016-01-05 | 2022-06-07 | Nippon Sheet Glass Company, Limited | Reaction processor, reaction processing vessel, and reaction processing method |
| EP3401386A4 (en) * | 2016-01-05 | 2019-12-25 | Nippon Sheet Glass Company, Limited | Reaction treatment device, reaction treatment container, and reaction treatment method |
| CN108431199A (en) * | 2016-01-05 | 2018-08-21 | 日本板硝子株式会社 | Reaction treating device, reaction treatment container, reaction treatment method |
| CN112683801A (en) * | 2021-01-21 | 2021-04-20 | 上海菁一科技有限公司 | Spectrophotometry test method sample treatment test capsule |
| CN112683801B (en) * | 2021-01-21 | 2023-04-28 | 上海菁一科技有限公司 | Spectrophotometry sample treatment test capsule |
| CN114289091A (en) * | 2022-01-18 | 2022-04-08 | 四川沃文特生物技术有限公司 | Buffer tank for refrigeration system of automatic analysis equipment |
| CN114289091B (en) * | 2022-01-18 | 2023-03-28 | 四川沃文特生物技术有限公司 | Buffer tank for refrigeration system of automatic analysis equipment |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2006084459A (en) | 2006-03-30 |
| JP4819421B2 (en) | 2011-11-24 |
| EP1614466A3 (en) | 2006-05-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP1614466A2 (en) | System and method to prevent air bubbles in a hybridization chamber | |
| EP1260265B1 (en) | System with processing set for the hybridisation of samples of nucleic acid, proteines and tissues | |
| DE69115674T2 (en) | APPARATUS FOR CARRYING OUT BIOCHEMICAL REACTIONS | |
| EP2255880B1 (en) | System and method to prevent air bubbles in a hybridization chamber | |
| DE69509925T3 (en) | METHOD AND DEVICE FOR PREPARING MICROMATRICES FOR BIOLOGICAL SAMPLES | |
| DE202004012163U1 (en) | System for hybridizing immobilized nucleic acid samples, in sealed hybridizing chambers, has a pressure assembly to build up the chamber pressures over ambient atmospheric levels to prevent the formation of air bubbles | |
| DE60034033T2 (en) | DEVICE FOR SCREENING CRYSTALLIZATION CONDITIONS IN SOLUTIONS FOR CRYSTAL BREEDING | |
| DE60125312T2 (en) | microarray | |
| DE60307645T2 (en) | HIGH-THROUGHPUT ASSAY FOR MEASURING CELLULAR ANSWERS WITH THE HELP OF MICROARRAYS | |
| DE10393406T5 (en) | Parallel loading of arrays | |
| DE10145568A1 (en) | Process for the cultivation and analysis of microbial single cell cultures | |
| DE20022783U1 (en) | Small volume chemical and biochemical reaction system | |
| DE10011022A1 (en) | Apparatus for performing synthesis, analysis or transport processes with a process fluid has a reaction zone with controlled delivery of a process fluid and control fluids with inner analysis and reaction interfaces at the side walls | |
| US7615370B2 (en) | System having device for preventing air bubbles in a hybridization chamber and corresponding method | |
| DE202004011272U1 (en) | Device for providing a hybridization chamber and for influencing air bubbles therein | |
| DE69221479T2 (en) | METHOD FOR FORMING A MATRIX OF BIOLOGICAL PARTICLES | |
| DE112008003552T9 (en) | Thermocycler instrument and method for performing PCR | |
| EP1379622B1 (en) | Method and device for cultivating and/or distributing particles | |
| EP1616619A1 (en) | Device and method to influence air bubbles in a hybridizaion chamber | |
| DE10346451B4 (en) | Method for monitoring changes and conditions in reaction chambers | |
| EP2126540B1 (en) | Fumigation device and system | |
| EP3609995B1 (en) | Method for processing a liquid sample | |
| WO2009132616A2 (en) | Supply system | |
| EP1287328B1 (en) | Device and method for the treatment of substrate-bound probes | |
| DE112018007861T5 (en) | Biochemical cassette and biochemical analyzer |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PUAI | Public reference made under article 153(3) epc to a published international application that has entered the european phase |
Free format text: ORIGINAL CODE: 0009012 |
|
| AK | Designated contracting states |
Kind code of ref document: A2 Designated state(s): AT BE BG CH CY CZ DE DK EE ES FI FR GB GR HU IE IS IT LI LT LU MC NL PL PT RO SE SI SK TR |
|
| AX | Request for extension of the european patent |
Extension state: AL BA HR LV MK YU |
|
| 17P | Request for examination filed |
Effective date: 20051212 |
|
| PUAL | Search report despatched |
Free format text: ORIGINAL CODE: 0009013 |
|
| AK | Designated contracting states |
Kind code of ref document: A3 Designated state(s): AT BE BG CH CY CZ DE DK EE ES FI FR GB GR HU IE IS IT LI LT LU MC NL PL PT RO SE SI SK TR |
|
| AX | Request for extension of the european patent |
Extension state: AL BA HR LV MK YU |
|
| AKX | Designation fees paid |
Designated state(s): CH DE FR GB LI |
|
| 17Q | First examination report despatched |
Effective date: 20070710 |
|
| APBK | Appeal reference recorded |
Free format text: ORIGINAL CODE: EPIDOSNREFNE |
|
| APBN | Date of receipt of notice of appeal recorded |
Free format text: ORIGINAL CODE: EPIDOSNNOA2E |
|
| APAV | Appeal reference deleted |
Free format text: ORIGINAL CODE: EPIDOSDREFNE |
|
| APBT | Appeal procedure closed |
Free format text: ORIGINAL CODE: EPIDOSNNOA9E |
|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: THE APPLICATION HAS BEEN REFUSED |
|
| 18R | Application refused |
Effective date: 20100824 |