EP0628540B1 - 2-Oximino-2-phenyl-acetamide - Google Patents
2-Oximino-2-phenyl-acetamide Download PDFInfo
- Publication number
- EP0628540B1 EP0628540B1 EP94108040A EP94108040A EP0628540B1 EP 0628540 B1 EP0628540 B1 EP 0628540B1 EP 94108040 A EP94108040 A EP 94108040A EP 94108040 A EP94108040 A EP 94108040A EP 0628540 B1 EP0628540 B1 EP 0628540B1
- Authority
- EP
- European Patent Office
- Prior art keywords
- carbon atoms
- chain
- straight
- branched
- atoms
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- FCVQWDOQFWTHET-UHFFFAOYSA-N 2-hydroxyimino-2-phenylacetamide Chemical class NC(=O)C(=NO)C1=CC=CC=C1 FCVQWDOQFWTHET-UHFFFAOYSA-N 0.000 title claims description 16
- -1 nitro, formyl Chemical group 0.000 claims description 231
- 125000004432 carbon atom Chemical group C* 0.000 claims description 201
- 125000000217 alkyl group Chemical group 0.000 claims description 100
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 claims description 93
- 125000003545 alkoxy group Chemical group 0.000 claims description 75
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 claims description 74
- 239000000460 chlorine Substances 0.000 claims description 74
- 229910052801 chlorine Inorganic materials 0.000 claims description 74
- 229910052731 fluorine Inorganic materials 0.000 claims description 74
- 239000011737 fluorine Substances 0.000 claims description 74
- 125000004438 haloalkoxy group Chemical group 0.000 claims description 45
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 45
- 125000001188 haloalkyl group Chemical group 0.000 claims description 42
- 229910052736 halogen Inorganic materials 0.000 claims description 41
- 150000002367 halogens Chemical class 0.000 claims description 41
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 37
- 125000001246 bromo group Chemical group Br* 0.000 claims description 32
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 claims description 31
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 31
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 claims description 30
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 claims description 30
- 229910052794 bromium Inorganic materials 0.000 claims description 30
- 125000005843 halogen group Chemical group 0.000 claims description 28
- 125000003917 carbamoyl group Chemical group [H]N([H])C(*)=O 0.000 claims description 27
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 27
- 125000000109 phenylethoxy group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])([H])O* 0.000 claims description 27
- 125000001424 substituent group Chemical group 0.000 claims description 27
- 239000001257 hydrogen Substances 0.000 claims description 24
- 229910052739 hydrogen Inorganic materials 0.000 claims description 24
- 239000001301 oxygen Substances 0.000 claims description 23
- 229910052760 oxygen Inorganic materials 0.000 claims description 23
- 150000001875 compounds Chemical class 0.000 claims description 22
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 claims description 21
- 238000000034 method Methods 0.000 claims description 19
- 125000003342 alkenyl group Chemical group 0.000 claims description 18
- 125000003302 alkenyloxy group Chemical group 0.000 claims description 18
- 125000004453 alkoxycarbonyl group Chemical group 0.000 claims description 18
- 125000004448 alkyl carbonyl group Chemical group 0.000 claims description 18
- 125000005196 alkyl carbonyloxy group Chemical group 0.000 claims description 18
- 125000004644 alkyl sulfinyl group Chemical group 0.000 claims description 18
- 125000004390 alkyl sulfonyl group Chemical group 0.000 claims description 18
- 125000004414 alkyl thio group Chemical group 0.000 claims description 18
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 18
- 125000004663 dialkyl amino group Chemical group 0.000 claims description 18
- 125000000623 heterocyclic group Chemical group 0.000 claims description 18
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical group [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 claims description 17
- 125000005278 alkyl sulfonyloxy group Chemical group 0.000 claims description 17
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 claims description 16
- 230000008569 process Effects 0.000 claims description 16
- 229910052757 nitrogen Inorganic materials 0.000 claims description 15
- 238000002360 preparation method Methods 0.000 claims description 13
- 125000005842 heteroatom Chemical group 0.000 claims description 12
- 125000000876 trifluoromethoxy group Chemical group FC(F)(F)O* 0.000 claims description 12
- 125000004214 1-pyrrolidinyl group Chemical group [H]C1([H])N(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 claims description 9
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 claims description 9
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 claims description 9
- 125000005336 allyloxy group Chemical group 0.000 claims description 9
- 125000004369 butenyl group Chemical group C(=CCC)* 0.000 claims description 9
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 claims description 9
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 claims description 9
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 claims description 9
- 125000003754 ethoxycarbonyl group Chemical group C(=O)(OCC)* 0.000 claims description 9
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 claims description 9
- 125000004573 morpholin-4-yl group Chemical group N1(CCOCC1)* 0.000 claims description 9
- 125000000587 piperidin-1-yl group Chemical group [H]C1([H])N(*)C([H])([H])C([H])([H])C([H])([H])C1([H])[H] 0.000 claims description 9
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 claims description 9
- 239000002253 acid Substances 0.000 claims description 8
- 150000001412 amines Chemical class 0.000 claims description 6
- 239000011230 binding agent Substances 0.000 claims description 6
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 claims description 6
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 claims description 6
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 claims description 6
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 claims description 6
- NRNOFFFWOYJUCR-UHFFFAOYSA-N 2-hydroxyimino-2-phenylacetic acid Chemical class ON=C(C(O)=O)C1=CC=CC=C1 NRNOFFFWOYJUCR-UHFFFAOYSA-N 0.000 claims description 5
- 125000005034 trifluormethylthio group Chemical group FC(S*)(F)F 0.000 claims description 5
- 239000004606 Fillers/Extenders Substances 0.000 claims description 4
- 241000607479 Yersinia pestis Species 0.000 claims description 4
- 229910021529 ammonia Inorganic materials 0.000 claims description 4
- 239000003085 diluting agent Substances 0.000 claims description 4
- 239000000575 pesticide Substances 0.000 claims description 4
- 239000013543 active substance Substances 0.000 claims description 3
- 125000004435 hydrogen atom Chemical class [H]* 0.000 claims 12
- 239000005864 Sulphur Substances 0.000 claims 3
- 150000003254 radicals Chemical class 0.000 description 20
- 239000004480 active ingredient Substances 0.000 description 19
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 18
- 241000196324 Embryophyta Species 0.000 description 17
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 16
- 239000000203 mixture Substances 0.000 description 13
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 12
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 12
- CODNYICXDISAEA-UHFFFAOYSA-N bromine monochloride Chemical compound BrCl CODNYICXDISAEA-UHFFFAOYSA-N 0.000 description 12
- 125000000262 haloalkenyl group Chemical group 0.000 description 12
- 150000002431 hydrogen Chemical class 0.000 description 12
- 239000002904 solvent Substances 0.000 description 12
- 238000012360 testing method Methods 0.000 description 12
- 244000052769 pathogen Species 0.000 description 11
- 239000000126 substance Substances 0.000 description 11
- 239000003995 emulsifying agent Substances 0.000 description 10
- 230000001717 pathogenic effect Effects 0.000 description 10
- 125000004995 haloalkylthio group Chemical group 0.000 description 8
- 230000001681 protective effect Effects 0.000 description 8
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 8
- 229910001868 water Inorganic materials 0.000 description 8
- MYMOFIZGZYHOMD-UHFFFAOYSA-N Dioxygen Chemical compound O=O MYMOFIZGZYHOMD-UHFFFAOYSA-N 0.000 description 7
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 6
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 6
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 6
- 201000010099 disease Diseases 0.000 description 6
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 6
- 125000005291 haloalkenyloxy group Chemical group 0.000 description 6
- 125000004441 haloalkylsulfonyl group Chemical group 0.000 description 6
- 239000007788 liquid Substances 0.000 description 6
- 125000004170 methylsulfonyl group Chemical group [H]C([H])([H])S(*)(=O)=O 0.000 description 6
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 6
- 238000005507 spraying Methods 0.000 description 6
- 241001668536 Oculimacula yallundae Species 0.000 description 5
- 241000736122 Parastagonospora nodorum Species 0.000 description 5
- 241000228453 Pyrenophora Species 0.000 description 5
- 125000002877 alkyl aryl group Chemical group 0.000 description 5
- 238000006243 chemical reaction Methods 0.000 description 5
- 239000008187 granular material Substances 0.000 description 5
- 125000004440 haloalkylsulfinyl group Chemical group 0.000 description 5
- 229920000151 polyglycol Polymers 0.000 description 5
- 239000010695 polyglycol Substances 0.000 description 5
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N silicon dioxide Inorganic materials O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 5
- 238000005160 1H NMR spectroscopy Methods 0.000 description 4
- 241000371644 Curvularia ravenelii Species 0.000 description 4
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 4
- BAVYZALUXZFZLV-UHFFFAOYSA-N Methylamine Chemical compound NC BAVYZALUXZFZLV-UHFFFAOYSA-N 0.000 description 4
- 241000233622 Phytophthora infestans Species 0.000 description 4
- 241001281803 Plasmopara viticola Species 0.000 description 4
- 241000209140 Triticum Species 0.000 description 4
- 235000021307 Triticum Nutrition 0.000 description 4
- 239000000969 carrier Substances 0.000 description 4
- 239000012141 concentrate Substances 0.000 description 4
- 238000011081 inoculation Methods 0.000 description 4
- 238000004519 manufacturing process Methods 0.000 description 4
- 239000000843 powder Substances 0.000 description 4
- 229910052717 sulfur Inorganic materials 0.000 description 4
- 239000011593 sulfur Substances 0.000 description 4
- 239000000725 suspension Substances 0.000 description 4
- WYRSGXAIHNMKOL-UHFFFAOYSA-N $l^{1}-sulfanylethane Chemical compound CC[S] WYRSGXAIHNMKOL-UHFFFAOYSA-N 0.000 description 3
- ZWEHNKRNPOVVGH-UHFFFAOYSA-N 2-Butanone Chemical compound CCC(C)=O ZWEHNKRNPOVVGH-UHFFFAOYSA-N 0.000 description 3
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 3
- 241000190150 Bipolaris sorokiniana Species 0.000 description 3
- 241001480061 Blumeria graminis Species 0.000 description 3
- 101100116570 Caenorhabditis elegans cup-2 gene Proteins 0.000 description 3
- 101100116572 Drosophila melanogaster Der-1 gene Proteins 0.000 description 3
- 241001330975 Magnaporthe oryzae Species 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- 241000317981 Podosphaera fuliginea Species 0.000 description 3
- 241001337928 Podosphaera leucotricha Species 0.000 description 3
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 3
- 241000520648 Pyrenophora teres Species 0.000 description 3
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 3
- 241000228452 Venturia inaequalis Species 0.000 description 3
- 230000009471 action Effects 0.000 description 3
- JFDZBHWFFUWGJE-UHFFFAOYSA-N benzonitrile Chemical compound N#CC1=CC=CC=C1 JFDZBHWFFUWGJE-UHFFFAOYSA-N 0.000 description 3
- 125000004786 difluoromethoxy group Chemical group [H]C(F)(F)O* 0.000 description 3
- 231100000676 disease causative agent Toxicity 0.000 description 3
- 150000002148 esters Chemical class 0.000 description 3
- 238000011156 evaluation Methods 0.000 description 3
- 125000001153 fluoro group Chemical group F* 0.000 description 3
- 239000000417 fungicide Substances 0.000 description 3
- PNDPGZBMCMUPRI-UHFFFAOYSA-N iodine Chemical compound II PNDPGZBMCMUPRI-UHFFFAOYSA-N 0.000 description 3
- ZOTBXTZVPHCKPN-UHFFFAOYSA-N methyl 2-methoxyimino-2-[2-[(2-methylphenoxy)methyl]phenyl]acetate Chemical compound CON=C(C(=O)OC)C1=CC=CC=C1COC1=CC=CC=C1C ZOTBXTZVPHCKPN-UHFFFAOYSA-N 0.000 description 3
- 230000002829 reductive effect Effects 0.000 description 3
- 239000011435 rock Substances 0.000 description 3
- 239000012312 sodium hydride Substances 0.000 description 3
- 229910000104 sodium hydride Inorganic materials 0.000 description 3
- 239000002689 soil Substances 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- 239000007921 spray Substances 0.000 description 3
- 239000007858 starting material Substances 0.000 description 3
- 125000004434 sulfur atom Chemical group 0.000 description 3
- 238000011282 treatment Methods 0.000 description 3
- NFDXQGNDWIPXQL-UHFFFAOYSA-N 1-cyclooctyldiazocane Chemical compound C1CCCCCCC1N1NCCCCCC1 NFDXQGNDWIPXQL-UHFFFAOYSA-N 0.000 description 2
- PAMIQIKDUOTOBW-UHFFFAOYSA-N 1-methylpiperidine Chemical compound CN1CCCCC1 PAMIQIKDUOTOBW-UHFFFAOYSA-N 0.000 description 2
- WADSJYLPJPTMLN-UHFFFAOYSA-N 3-(cycloundecen-1-yl)-1,2-diazacycloundec-2-ene Chemical compound C1CCCCCCCCC=C1C1=NNCCCCCCCC1 WADSJYLPJPTMLN-UHFFFAOYSA-N 0.000 description 2
- 241001149961 Alternaria brassicae Species 0.000 description 2
- 241000123650 Botrytis cinerea Species 0.000 description 2
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 2
- 241000906476 Cercospora canescens Species 0.000 description 2
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 2
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 2
- XTHFKEDIFFGKHM-UHFFFAOYSA-N Dimethoxyethane Chemical group COCCOC XTHFKEDIFFGKHM-UHFFFAOYSA-N 0.000 description 2
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 2
- 241000223218 Fusarium Species 0.000 description 2
- 241000223194 Fusarium culmorum Species 0.000 description 2
- 240000005979 Hordeum vulgare Species 0.000 description 2
- 235000007340 Hordeum vulgare Nutrition 0.000 description 2
- 241000342321 Hyaloperonospora brassicae Species 0.000 description 2
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical class [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 2
- UQSXHKLRYXJYBZ-UHFFFAOYSA-N Iron oxide Chemical compound [Fe]=O UQSXHKLRYXJYBZ-UHFFFAOYSA-N 0.000 description 2
- 235000007688 Lycopersicon esculentum Nutrition 0.000 description 2
- JLTDJTHDQAWBAV-UHFFFAOYSA-N N,N-dimethylaniline Chemical compound CN(C)C1=CC=CC=C1 JLTDJTHDQAWBAV-UHFFFAOYSA-N 0.000 description 2
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 2
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 2
- 240000007594 Oryza sativa Species 0.000 description 2
- 235000007164 Oryza sativa Nutrition 0.000 description 2
- 241000201565 Peronospora viciae f. sp. pisi Species 0.000 description 2
- 241000233614 Phytophthora Species 0.000 description 2
- 241000233626 Plasmopara Species 0.000 description 2
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 2
- ATUOYWHBWRKTHZ-UHFFFAOYSA-N Propane Chemical compound CCC ATUOYWHBWRKTHZ-UHFFFAOYSA-N 0.000 description 2
- 241001281805 Pseudoperonospora cubensis Species 0.000 description 2
- 241000342307 Pseudoperonospora humuli Species 0.000 description 2
- 241001123569 Puccinia recondita Species 0.000 description 2
- 241000228454 Pyrenophora graminea Species 0.000 description 2
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 2
- 241000918584 Pythium ultimum Species 0.000 description 2
- 241000221662 Sclerotinia Species 0.000 description 2
- 241000221696 Sclerotinia sclerotiorum Species 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 2
- WQDUMFSSJAZKTM-UHFFFAOYSA-N Sodium methoxide Chemical compound [Na+].[O-]C WQDUMFSSJAZKTM-UHFFFAOYSA-N 0.000 description 2
- 240000003768 Solanum lycopersicum Species 0.000 description 2
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 2
- 241001617088 Thanatephorus sasakii Species 0.000 description 2
- 241000722093 Tilletia caries Species 0.000 description 2
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 2
- 241000221577 Uromyces appendiculatus Species 0.000 description 2
- 241000514371 Ustilago avenae Species 0.000 description 2
- 241000007070 Ustilago nuda Species 0.000 description 2
- 150000001338 aliphatic hydrocarbons Chemical class 0.000 description 2
- 239000007795 chemical reaction product Substances 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- MVPPADPHJFYWMZ-UHFFFAOYSA-N chlorobenzene Chemical compound ClC1=CC=CC=C1 MVPPADPHJFYWMZ-UHFFFAOYSA-N 0.000 description 2
- JHIVVAPYMSGYDF-UHFFFAOYSA-N cyclohexanone Chemical compound O=C1CCCCC1 JHIVVAPYMSGYDF-UHFFFAOYSA-N 0.000 description 2
- 239000012973 diazabicyclooctane Substances 0.000 description 2
- 239000002270 dispersing agent Substances 0.000 description 2
- 239000000975 dye Substances 0.000 description 2
- 150000002170 ethers Chemical class 0.000 description 2
- 235000013312 flour Nutrition 0.000 description 2
- 125000002485 formyl group Chemical group [H]C(*)=O 0.000 description 2
- 150000008282 halocarbons Chemical class 0.000 description 2
- 244000005700 microbiome Species 0.000 description 2
- SYSQUGFVNFXIIT-UHFFFAOYSA-N n-[4-(1,3-benzoxazol-2-yl)phenyl]-4-nitrobenzenesulfonamide Chemical class C1=CC([N+](=O)[O-])=CC=C1S(=O)(=O)NC1=CC=C(C=2OC3=CC=CC=C3N=2)C=C1 SYSQUGFVNFXIIT-UHFFFAOYSA-N 0.000 description 2
- 125000000449 nitro group Chemical class [O-][N+](*)=O 0.000 description 2
- 239000003960 organic solvent Substances 0.000 description 2
- 239000003208 petroleum Substances 0.000 description 2
- 150000002989 phenols Chemical class 0.000 description 2
- SCVFZCLFOSHCOH-UHFFFAOYSA-M potassium acetate Chemical compound [K+].CC([O-])=O SCVFZCLFOSHCOH-UHFFFAOYSA-M 0.000 description 2
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 2
- 239000013558 reference substance Substances 0.000 description 2
- 235000009566 rice Nutrition 0.000 description 2
- 238000003756 stirring Methods 0.000 description 2
- VZGDMQKNWNREIO-UHFFFAOYSA-N tetrachloromethane Chemical compound ClC(Cl)(Cl)Cl VZGDMQKNWNREIO-UHFFFAOYSA-N 0.000 description 2
- GETQZCLCWQTVFV-UHFFFAOYSA-N trimethylamine Chemical compound CN(C)C GETQZCLCWQTVFV-UHFFFAOYSA-N 0.000 description 2
- 239000008096 xylene Substances 0.000 description 2
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 1
- OCJBOOLMMGQPQU-UHFFFAOYSA-N 1,4-dichlorobenzene Chemical compound ClC1=CC=C(Cl)C=C1 OCJBOOLMMGQPQU-UHFFFAOYSA-N 0.000 description 1
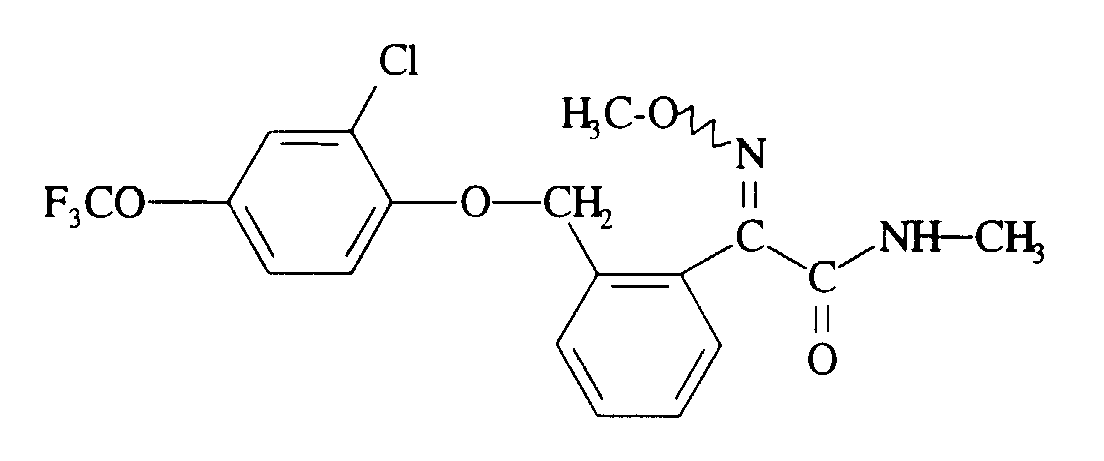
- XLEMFKNEDKRSGZ-UHFFFAOYSA-N 2-[2-[[2-chloro-4-(trifluoromethoxy)phenoxy]methyl]phenyl]-2-methoxyimino-n-methylacetamide Chemical compound CNC(=O)C(=NOC)C1=CC=CC=C1COC1=CC=C(OC(F)(F)F)C=C1Cl XLEMFKNEDKRSGZ-UHFFFAOYSA-N 0.000 description 1
- SCVJRXQHFJXZFZ-KVQBGUIXSA-N 2-amino-9-[(2r,4s,5r)-4-hydroxy-5-(hydroxymethyl)oxolan-2-yl]-3h-purine-6-thione Chemical compound C1=2NC(N)=NC(=S)C=2N=CN1[C@H]1C[C@H](O)[C@@H](CO)O1 SCVJRXQHFJXZFZ-KVQBGUIXSA-N 0.000 description 1
- LSTYNKXVEMLNBE-UHFFFAOYSA-N 2-chloro-4-(trifluoromethoxy)phenol Chemical compound OC1=CC=C(OC(F)(F)F)C=C1Cl LSTYNKXVEMLNBE-UHFFFAOYSA-N 0.000 description 1
- ISFFCSPHFNWPST-UHFFFAOYSA-N 2-methoxyimino-2-phenylacetic acid Chemical class CON=C(C(O)=O)C1=CC=CC=C1 ISFFCSPHFNWPST-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- 244000215068 Acacia senegal Species 0.000 description 1
- 229920001817 Agar Polymers 0.000 description 1
- RGCKGOZRHPZPFP-UHFFFAOYSA-N Alizarin Natural products C1=CC=C2C(=O)C3=C(O)C(O)=CC=C3C(=O)C2=C1 RGCKGOZRHPZPFP-UHFFFAOYSA-N 0.000 description 1
- 241000223600 Alternaria Species 0.000 description 1
- USFZMSVCRYTOJT-UHFFFAOYSA-N Ammonium acetate Chemical compound N.CC(O)=O USFZMSVCRYTOJT-UHFFFAOYSA-N 0.000 description 1
- 239000005695 Ammonium acetate Substances 0.000 description 1
- ATRRKUHOCOJYRX-UHFFFAOYSA-N Ammonium bicarbonate Chemical compound [NH4+].OC([O-])=O ATRRKUHOCOJYRX-UHFFFAOYSA-N 0.000 description 1
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 1
- 235000003276 Apios tuberosa Nutrition 0.000 description 1
- 241000235349 Ascomycota Species 0.000 description 1
- 241000221198 Basidiomycota Species 0.000 description 1
- ZOXJGFHDIHLPTG-UHFFFAOYSA-N Boron Chemical compound [B] ZOXJGFHDIHLPTG-UHFFFAOYSA-N 0.000 description 1
- 241001465180 Botrytis Species 0.000 description 1
- 229910021532 Calcite Inorganic materials 0.000 description 1
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 1
- 241001157813 Cercospora Species 0.000 description 1
- 241000760356 Chytridiomycetes Species 0.000 description 1
- 241000228437 Cochliobolus Species 0.000 description 1
- 244000060011 Cocos nucifera Species 0.000 description 1
- 235000013162 Cocos nucifera Nutrition 0.000 description 1
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 1
- 240000008067 Cucumis sativus Species 0.000 description 1
- 235000010799 Cucumis sativus var sativus Nutrition 0.000 description 1
- ZAFNJMIOTHYJRJ-UHFFFAOYSA-N Diisopropyl ether Chemical compound CC(C)OC(C)C ZAFNJMIOTHYJRJ-UHFFFAOYSA-N 0.000 description 1
- 241000221787 Erysiphe Species 0.000 description 1
- 241000510928 Erysiphe necator Species 0.000 description 1
- 229920000084 Gum arabic Polymers 0.000 description 1
- 239000005909 Kieselgur Substances 0.000 description 1
- 241000228456 Leptosphaeria Species 0.000 description 1
- NTIZESTWPVYFNL-UHFFFAOYSA-N Methyl isobutyl ketone Chemical compound CC(C)CC(C)=O NTIZESTWPVYFNL-UHFFFAOYSA-N 0.000 description 1
- UIHCLUNTQKBZGK-UHFFFAOYSA-N Methyl isobutyl ketone Natural products CCC(C)C(C)=O UIHCLUNTQKBZGK-UHFFFAOYSA-N 0.000 description 1
- ZOKXTWBITQBERF-UHFFFAOYSA-N Molybdenum Chemical compound [Mo] ZOKXTWBITQBERF-UHFFFAOYSA-N 0.000 description 1
- 208000031888 Mycoses Diseases 0.000 description 1
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 1
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 1
- 244000061176 Nicotiana tabacum Species 0.000 description 1
- 235000002637 Nicotiana tabacum Nutrition 0.000 description 1
- 241000233654 Oomycetes Species 0.000 description 1
- 241001223281 Peronospora Species 0.000 description 1
- 241001503460 Plasmodiophorida Species 0.000 description 1
- 241000896242 Podosphaera Species 0.000 description 1
- 239000004372 Polyvinyl alcohol Substances 0.000 description 1
- 241000682843 Pseudocercosporella Species 0.000 description 1
- 241001281802 Pseudoperonospora Species 0.000 description 1
- 241000221300 Puccinia Species 0.000 description 1
- 241000231139 Pyricularia Species 0.000 description 1
- 241000233639 Pythium Species 0.000 description 1
- 206010039509 Scab Diseases 0.000 description 1
- 239000004113 Sepiolite Substances 0.000 description 1
- 241001533598 Septoria Species 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- 241000579741 Sphaerotheca <fungi> Species 0.000 description 1
- 241001300423 Strophostyles Species 0.000 description 1
- LSNNMFCWUKXFEE-UHFFFAOYSA-N Sulfurous acid Chemical compound OS(O)=O LSNNMFCWUKXFEE-UHFFFAOYSA-N 0.000 description 1
- 241000722133 Tilletia Species 0.000 description 1
- GWEVSGVZZGPLCZ-UHFFFAOYSA-N Titan oxide Chemical compound O=[Ti]=O GWEVSGVZZGPLCZ-UHFFFAOYSA-N 0.000 description 1
- 241000221576 Uromyces Species 0.000 description 1
- 241000221566 Ustilago Species 0.000 description 1
- 241000317942 Venturia <ichneumonid wasp> Species 0.000 description 1
- BZHJMEDXRYGGRV-UHFFFAOYSA-N Vinyl chloride Chemical class ClC=C BZHJMEDXRYGGRV-UHFFFAOYSA-N 0.000 description 1
- 240000008042 Zea mays Species 0.000 description 1
- 235000005824 Zea mays ssp. parviglumis Nutrition 0.000 description 1
- 235000002017 Zea mays subsp mays Nutrition 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- 239000000205 acacia gum Substances 0.000 description 1
- 235000010489 acacia gum Nutrition 0.000 description 1
- 239000000642 acaricide Substances 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 239000008272 agar Substances 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 125000002723 alicyclic group Chemical group 0.000 description 1
- 125000001931 aliphatic group Chemical group 0.000 description 1
- HFVAFDPGUJEFBQ-UHFFFAOYSA-M alizarin red S Chemical compound [Na+].O=C1C2=CC=CC=C2C(=O)C2=C1C=C(S([O-])(=O)=O)C(O)=C2O HFVAFDPGUJEFBQ-UHFFFAOYSA-M 0.000 description 1
- 229910000102 alkali metal hydride Inorganic materials 0.000 description 1
- 150000008046 alkali metal hydrides Chemical class 0.000 description 1
- 229910000095 alkaline earth hydride Inorganic materials 0.000 description 1
- 150000008055 alkyl aryl sulfonates Chemical class 0.000 description 1
- 150000008051 alkyl sulfates Chemical class 0.000 description 1
- 229940045714 alkyl sulfonate alkylating agent Drugs 0.000 description 1
- 150000008052 alkyl sulfonates Chemical class 0.000 description 1
- 150000001408 amides Chemical class 0.000 description 1
- 235000019257 ammonium acetate Nutrition 0.000 description 1
- 229940043376 ammonium acetate Drugs 0.000 description 1
- 239000001099 ammonium carbonate Substances 0.000 description 1
- 235000012501 ammonium carbonate Nutrition 0.000 description 1
- 150000003868 ammonium compounds Chemical class 0.000 description 1
- 239000000908 ammonium hydroxide Substances 0.000 description 1
- 235000011114 ammonium hydroxide Nutrition 0.000 description 1
- 125000000129 anionic group Chemical group 0.000 description 1
- 125000003118 aryl group Chemical group 0.000 description 1
- 229960000892 attapulgite Drugs 0.000 description 1
- 239000002585 base Substances 0.000 description 1
- 229910052796 boron Inorganic materials 0.000 description 1
- 230000001680 brushing effect Effects 0.000 description 1
- 239000001273 butane Substances 0.000 description 1
- VSGNNIFQASZAOI-UHFFFAOYSA-L calcium acetate Chemical compound [Ca+2].CC([O-])=O.CC([O-])=O VSGNNIFQASZAOI-UHFFFAOYSA-L 0.000 description 1
- 239000001639 calcium acetate Substances 0.000 description 1
- 235000011092 calcium acetate Nutrition 0.000 description 1
- 229960005147 calcium acetate Drugs 0.000 description 1
- 239000001569 carbon dioxide Substances 0.000 description 1
- 229910002092 carbon dioxide Inorganic materials 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 1
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 1
- 235000013339 cereals Nutrition 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 150000008422 chlorobenzenes Chemical class 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 239000008199 coating composition Substances 0.000 description 1
- 239000010941 cobalt Substances 0.000 description 1
- 229910017052 cobalt Inorganic materials 0.000 description 1
- GUTLYIVDDKVIGB-UHFFFAOYSA-N cobalt atom Chemical compound [Co] GUTLYIVDDKVIGB-UHFFFAOYSA-N 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- 229910052802 copper Inorganic materials 0.000 description 1
- 239000010949 copper Substances 0.000 description 1
- 235000005822 corn Nutrition 0.000 description 1
- GUJOJGAPFQRJSV-UHFFFAOYSA-N dialuminum;dioxosilane;oxygen(2-);hydrate Chemical compound O.[O-2].[O-2].[O-2].[Al+3].[Al+3].O=[Si]=O.O=[Si]=O.O=[Si]=O.O=[Si]=O GUJOJGAPFQRJSV-UHFFFAOYSA-N 0.000 description 1
- 229940117389 dichlorobenzene Drugs 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- 239000010459 dolomite Substances 0.000 description 1
- 229910000514 dolomite Inorganic materials 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 239000003814 drug Substances 0.000 description 1
- 238000010410 dusting Methods 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 239000003480 eluent Substances 0.000 description 1
- 230000001804 emulsifying effect Effects 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 238000005538 encapsulation Methods 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 239000003337 fertilizer Substances 0.000 description 1
- 239000006260 foam Substances 0.000 description 1
- 238000005187 foaming Methods 0.000 description 1
- 230000000855 fungicidal effect Effects 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 239000003630 growth substance Substances 0.000 description 1
- 239000004009 herbicide Substances 0.000 description 1
- GNOIPBMMFNIUFM-UHFFFAOYSA-N hexamethylphosphoric triamide Chemical compound CN(C)P(=O)(N(C)C)N(C)C GNOIPBMMFNIUFM-UHFFFAOYSA-N 0.000 description 1
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 230000001965 increasing effect Effects 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 150000007529 inorganic bases Chemical class 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- 239000001023 inorganic pigment Substances 0.000 description 1
- 239000002917 insecticide Substances 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 150000002576 ketones Chemical class 0.000 description 1
- 239000000787 lecithin Substances 0.000 description 1
- 229920005610 lignin Polymers 0.000 description 1
- WPBNNNQJVZRUHP-UHFFFAOYSA-L manganese(2+);methyl n-[[2-(methoxycarbonylcarbamothioylamino)phenyl]carbamothioyl]carbamate;n-[2-(sulfidocarbothioylamino)ethyl]carbamodithioate Chemical class [Mn+2].[S-]C(=S)NCCNC([S-])=S.COC(=O)NC(=S)NC1=CC=CC=C1NC(=S)NC(=O)OC WPBNNNQJVZRUHP-UHFFFAOYSA-L 0.000 description 1
- 239000004579 marble Substances 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- LDPXOYHMGOQPIV-UHFFFAOYSA-N methyl 2-[2-(bromomethyl)phenyl]-2-methoxyiminoacetate Chemical compound CON=C(C(=O)OC)C1=CC=CC=C1CBr LDPXOYHMGOQPIV-UHFFFAOYSA-N 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 235000010981 methylcellulose Nutrition 0.000 description 1
- 235000010755 mineral Nutrition 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 229910052750 molybdenum Inorganic materials 0.000 description 1
- 239000011733 molybdenum Substances 0.000 description 1
- 229910052901 montmorillonite Inorganic materials 0.000 description 1
- PSHKMPUSSFXUIA-UHFFFAOYSA-N n,n-dimethylpyridin-2-amine Chemical compound CN(C)C1=CC=CC=N1 PSHKMPUSSFXUIA-UHFFFAOYSA-N 0.000 description 1
- IJDNQMDRQITEOD-UHFFFAOYSA-N n-butane Chemical compound CCCC IJDNQMDRQITEOD-UHFFFAOYSA-N 0.000 description 1
- JIKUXBYRTXDNIY-UHFFFAOYSA-N n-methyl-n-phenylformamide Chemical compound O=CN(C)C1=CC=CC=C1 JIKUXBYRTXDNIY-UHFFFAOYSA-N 0.000 description 1
- OFBQJSOFQDEBGM-UHFFFAOYSA-N n-pentane Natural products CCCCC OFBQJSOFQDEBGM-UHFFFAOYSA-N 0.000 description 1
- 229940042880 natural phospholipid Drugs 0.000 description 1
- 150000002825 nitriles Chemical class 0.000 description 1
- JCXJVPUVTGWSNB-UHFFFAOYSA-N nitrogen dioxide Inorganic materials O=[N]=O JCXJVPUVTGWSNB-UHFFFAOYSA-N 0.000 description 1
- 235000015097 nutrients Nutrition 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- 238000005580 one pot reaction Methods 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- 239000011368 organic material Substances 0.000 description 1
- 239000012074 organic phase Substances 0.000 description 1
- TWNQGVIAIRXVLR-UHFFFAOYSA-N oxo(oxoalumanyloxy)alumane Chemical compound O=[Al]O[Al]=O TWNQGVIAIRXVLR-UHFFFAOYSA-N 0.000 description 1
- 229910052625 palygorskite Inorganic materials 0.000 description 1
- 239000006072 paste Substances 0.000 description 1
- CNMBRKNJGAKOIO-UHFFFAOYSA-N phenyl 2-methoxyiminoacetate Chemical compound CON=CC(=O)OC1=CC=CC=C1 CNMBRKNJGAKOIO-UHFFFAOYSA-N 0.000 description 1
- 150000003904 phospholipids Chemical class 0.000 description 1
- 239000001007 phthalocyanine dye Substances 0.000 description 1
- 239000002798 polar solvent Substances 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 239000011118 polyvinyl acetate Substances 0.000 description 1
- 229920002689 polyvinyl acetate Polymers 0.000 description 1
- 229920002451 polyvinyl alcohol Polymers 0.000 description 1
- 235000011056 potassium acetate Nutrition 0.000 description 1
- 239000011736 potassium bicarbonate Substances 0.000 description 1
- 229910000028 potassium bicarbonate Inorganic materials 0.000 description 1
- 235000015497 potassium bicarbonate Nutrition 0.000 description 1
- 229910000027 potassium carbonate Inorganic materials 0.000 description 1
- TYJJADVDDVDEDZ-UHFFFAOYSA-M potassium hydrogencarbonate Chemical compound [K+].OC([O-])=O TYJJADVDDVDEDZ-UHFFFAOYSA-M 0.000 description 1
- 229940086066 potassium hydrogencarbonate Drugs 0.000 description 1
- 235000011118 potassium hydroxide Nutrition 0.000 description 1
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- 239000001294 propane Substances 0.000 description 1
- 239000003380 propellant Substances 0.000 description 1
- FVSKHRXBFJPNKK-UHFFFAOYSA-N propionitrile Chemical compound CCC#N FVSKHRXBFJPNKK-UHFFFAOYSA-N 0.000 description 1
- 230000004224 protection Effects 0.000 description 1
- 239000003531 protein hydrolysate Substances 0.000 description 1
- 239000008262 pumice Substances 0.000 description 1
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 1
- 239000010453 quartz Substances 0.000 description 1
- 239000000376 reactant Substances 0.000 description 1
- 238000001953 recrystallisation Methods 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 229910052624 sepiolite Inorganic materials 0.000 description 1
- 235000019355 sepiolite Nutrition 0.000 description 1
- 239000000741 silica gel Substances 0.000 description 1
- 229910002027 silica gel Inorganic materials 0.000 description 1
- 150000004760 silicates Chemical class 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- 239000001632 sodium acetate Substances 0.000 description 1
- 235000017281 sodium acetate Nutrition 0.000 description 1
- ODZPKZBBUMBTMG-UHFFFAOYSA-N sodium amide Chemical compound [NH2-].[Na+] ODZPKZBBUMBTMG-UHFFFAOYSA-N 0.000 description 1
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 1
- 235000017557 sodium bicarbonate Nutrition 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 235000017550 sodium carbonate Nutrition 0.000 description 1
- QDRKDTQENPPHOJ-UHFFFAOYSA-N sodium ethoxide Chemical compound [Na+].CC[O-] QDRKDTQENPPHOJ-UHFFFAOYSA-N 0.000 description 1
- 235000011121 sodium hydroxide Nutrition 0.000 description 1
- 239000000243 solution Substances 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 125000000446 sulfanediyl group Chemical group *S* 0.000 description 1
- 150000003462 sulfoxides Chemical class 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 150000003512 tertiary amines Chemical class 0.000 description 1
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 1
- CZDYPVPMEAXLPK-UHFFFAOYSA-N tetramethylsilane Chemical compound C[Si](C)(C)C CZDYPVPMEAXLPK-UHFFFAOYSA-N 0.000 description 1
- OGIDPMRJRNCKJF-UHFFFAOYSA-N titanium oxide Inorganic materials [Ti]=O OGIDPMRJRNCKJF-UHFFFAOYSA-N 0.000 description 1
- IMFACGCPASFAPR-UHFFFAOYSA-N tributylamine Chemical compound CCCCN(CCCC)CCCC IMFACGCPASFAPR-UHFFFAOYSA-N 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 235000013311 vegetables Nutrition 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D319/00—Heterocyclic compounds containing six-membered rings having two oxygen atoms as the only ring hetero atoms
- C07D319/04—1,3-Dioxanes; Hydrogenated 1,3-dioxanes
- C07D319/08—1,3-Dioxanes; Hydrogenated 1,3-dioxanes condensed with carbocyclic rings or ring systems
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N37/00—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom having three bonds to hetero atoms with at the most two bonds to halogen, e.g. carboxylic acids
- A01N37/44—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom having three bonds to hetero atoms with at the most two bonds to halogen, e.g. carboxylic acids containing at least one carboxylic group or a thio analogue, or a derivative thereof, and a nitrogen atom attached to the same carbon skeleton by a single or double bond, this nitrogen atom not being a member of a derivative or of a thio analogue of a carboxylic group, e.g. amino-carboxylic acids
- A01N37/50—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom having three bonds to hetero atoms with at the most two bonds to halogen, e.g. carboxylic acids containing at least one carboxylic group or a thio analogue, or a derivative thereof, and a nitrogen atom attached to the same carbon skeleton by a single or double bond, this nitrogen atom not being a member of a derivative or of a thio analogue of a carboxylic group, e.g. amino-carboxylic acids the nitrogen atom being doubly bound to the carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C249/00—Preparation of compounds containing nitrogen atoms doubly-bound to a carbon skeleton
- C07C249/04—Preparation of compounds containing nitrogen atoms doubly-bound to a carbon skeleton of oximes
- C07C249/12—Preparation of compounds containing nitrogen atoms doubly-bound to a carbon skeleton of oximes by reactions not involving the formation of oxyimino groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C251/00—Compounds containing nitrogen atoms doubly-bound to a carbon skeleton
- C07C251/32—Oximes
- C07C251/34—Oximes with oxygen atoms of oxyimino groups bound to hydrogen atoms or to carbon atoms of unsubstituted hydrocarbon radicals
- C07C251/48—Oximes with oxygen atoms of oxyimino groups bound to hydrogen atoms or to carbon atoms of unsubstituted hydrocarbon radicals with the carbon atom of at least one of the oxyimino groups bound to a carbon atom of a six-membered aromatic ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D307/00—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom
- C07D307/77—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom ortho- or peri-condensed with carbocyclic rings or ring systems
- C07D307/87—Benzo [c] furans; Hydrogenated benzo [c] furans
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D317/00—Heterocyclic compounds containing five-membered rings having two oxygen atoms as the only ring hetero atoms
- C07D317/08—Heterocyclic compounds containing five-membered rings having two oxygen atoms as the only ring hetero atoms having the hetero atoms in positions 1 and 3
- C07D317/44—Heterocyclic compounds containing five-membered rings having two oxygen atoms as the only ring hetero atoms having the hetero atoms in positions 1 and 3 ortho- or peri-condensed with carbocyclic rings or ring systems
- C07D317/46—Heterocyclic compounds containing five-membered rings having two oxygen atoms as the only ring hetero atoms having the hetero atoms in positions 1 and 3 ortho- or peri-condensed with carbocyclic rings or ring systems condensed with one six-membered ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D319/00—Heterocyclic compounds containing six-membered rings having two oxygen atoms as the only ring hetero atoms
- C07D319/10—1,4-Dioxanes; Hydrogenated 1,4-dioxanes
- C07D319/14—1,4-Dioxanes; Hydrogenated 1,4-dioxanes condensed with carbocyclic rings or ring systems
- C07D319/16—1,4-Dioxanes; Hydrogenated 1,4-dioxanes condensed with carbocyclic rings or ring systems condensed with one six-membered ring
- C07D319/20—1,4-Dioxanes; Hydrogenated 1,4-dioxanes condensed with carbocyclic rings or ring systems condensed with one six-membered ring with substituents attached to the hetero ring
Definitions
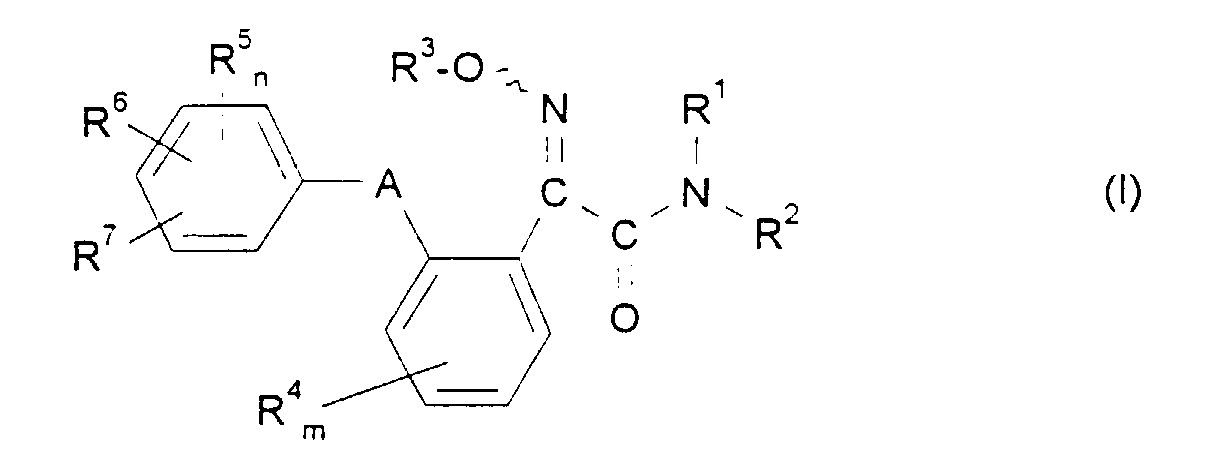
- the invention relates to new 2-oximino-2-phenyl-acetamides, a process for their Manufacture and its use as a pesticide.
- the compounds of formula (I) may optionally, depending on the type of the substituents as geometric and / or optical isomers or mixtures of isomers different composition.
- the invention relates to both the pure Isomers as well as mixtures of isomers.
- the 2-oximino-2-phenyl-acetamides according to the invention show a significantly better formula (I) against plant-damaging microorganisms Effectiveness as 2-methoximino-2- [2- (2-methylphenoxymethyl) phenyl] acetic acid methyl ester, which is a constitutionally similar, known active ingredient Direction of action is.
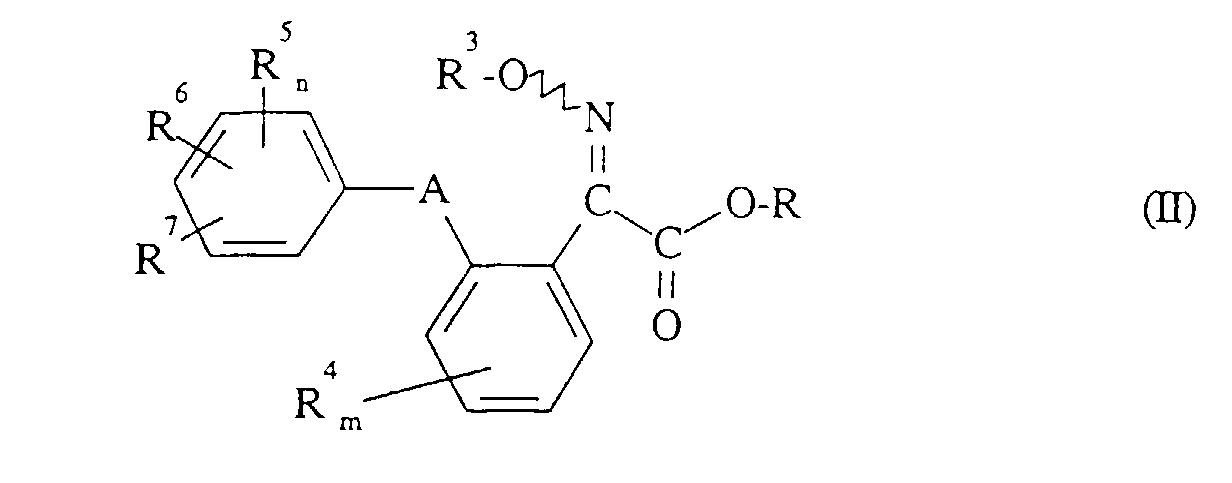
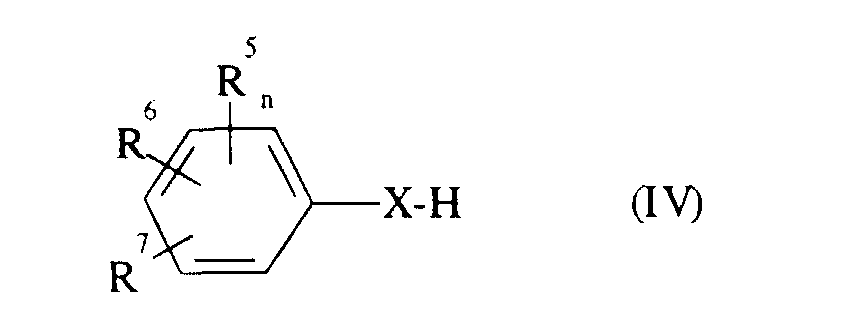
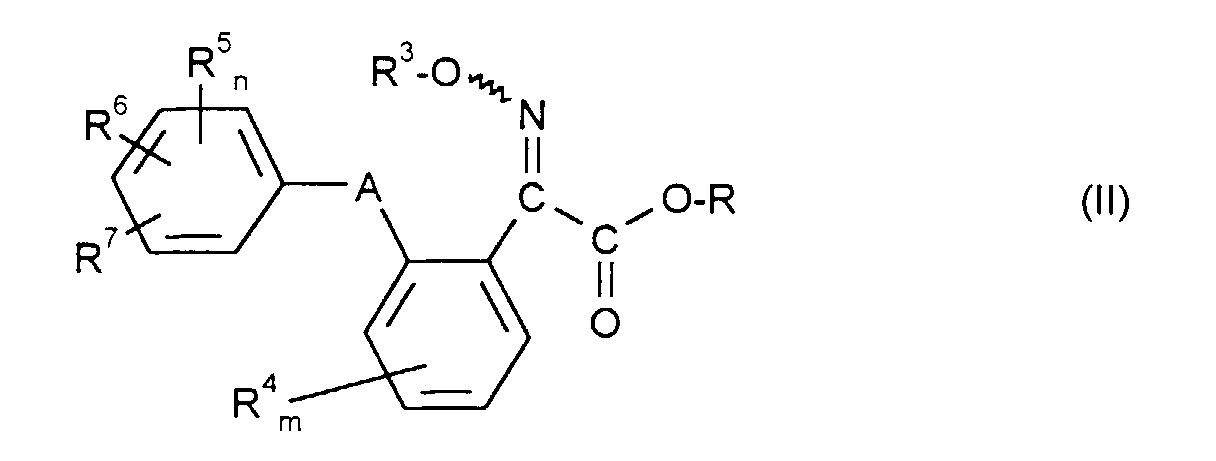
- Formula (II) provides a general definition of the 2-oximino-2-phenyl-acetic acid esters required as starting compounds for carrying out the process according to the invention.
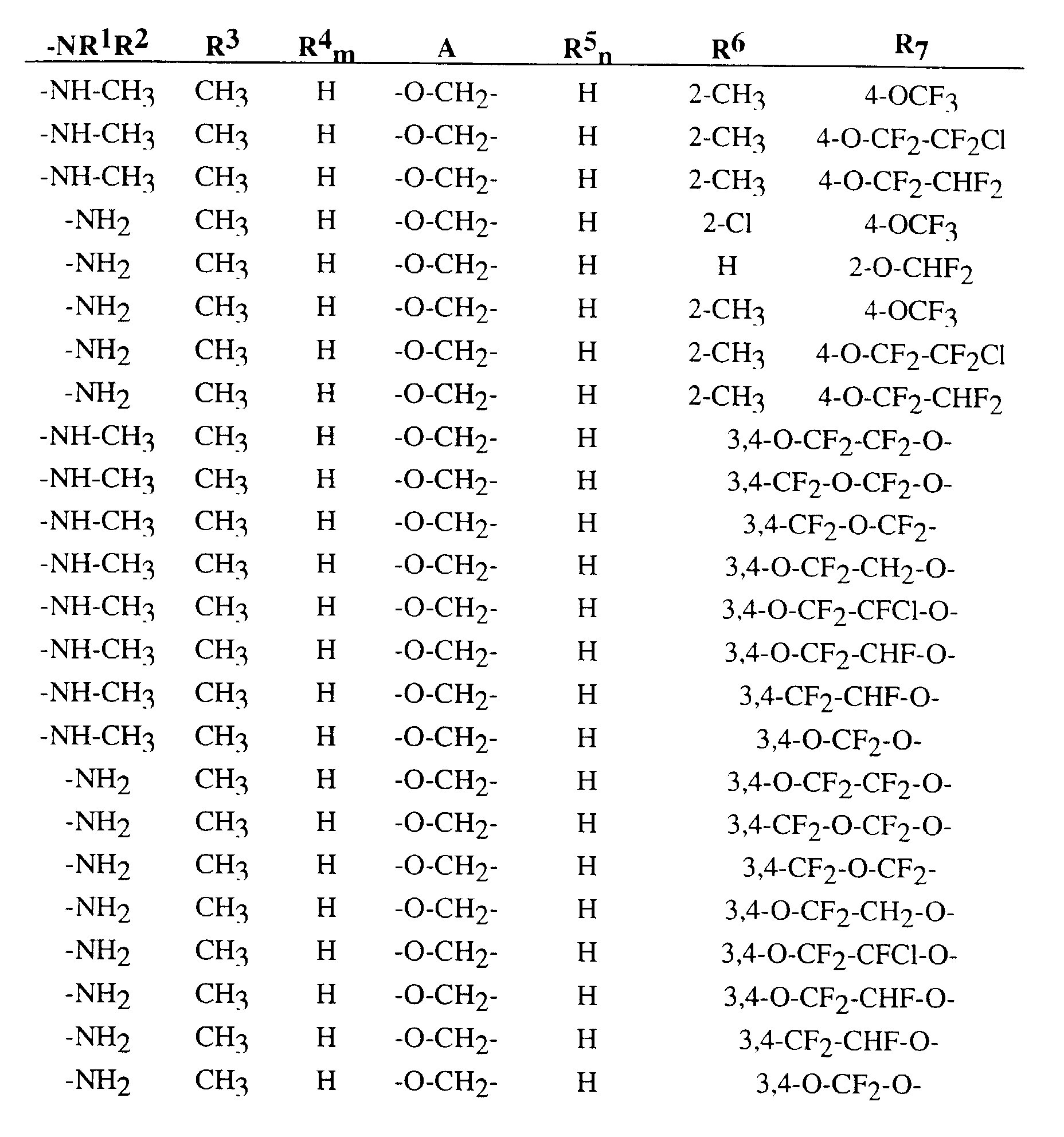
- R 3 , R 4 , R 5 , R 6 , R 7 , A, m and n preferably represent those radicals and indices which have already been described in connection with the description of the compounds of the formula (I) according to the invention preferred for these substituents and these indices were mentioned.
- R preferably represents straight-chain or branched alkyl having 1 to 4 carbon atoms, in particular methyl or ethyl.
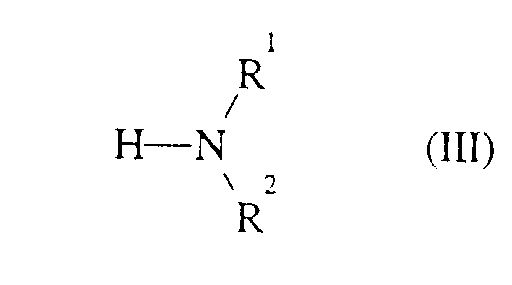
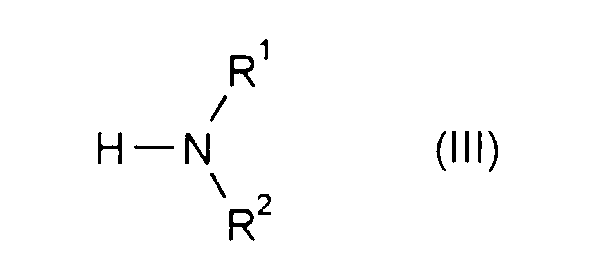
- Formula (III) provides a general definition of the amines or ammonia required as starting materials for carrying out the process according to the invention.
- R 1 and R 2 preferably represent those radicals which have already been mentioned as preferred for these substituents in connection with the description of the compounds of the formula (I) according to the invention.
- the amines of the formula (III) and ammonia are generally known compounds of organic chemistry.
- Suitable diluents for carrying out the process according to the invention inert organic solvents.
- Aliphatic, alicyclic or aromatic, optionally halogenated hydrocarbons such as petrol, benzene, toluene, xylene, chlorobenzene, dichlorobenzene, petroleum ether, Hexane, cyclohexane, dichloromethane, chloroform, carbon tetrachloride; Ether, such as diethyl ether, diisopropyl ether, dioxane, tetrahydrofuran or ethylene glycol dimethyl or diethyl ether; Nitriles such as acetonitrile, propionitrile or benzonitrile; Amides, such as N, N-dimethylformamide, N, N-dimethylacetamide, N-methylformanilide, N-methylpyrrolidone or hexamethylphosphoric triamide or sulfoxides such as dimethyl sulfox
- Alkaline earth or alkali metal hydrides are preferably usable, -hydroxides, -amides, -alcoholates, -acetates, -carbonates or -hydrogencarbonate as well as ammonium compounds, such as sodium hydride, sodium amide, Sodium methylate, sodium ethylate, potassium tert-butoxide, sodium hydroxide, Potassium hydroxide, ammonium hydroxide, sodium acetate, potassium acetate, calcium acetate, Ammonium acetate, sodium carbonate, potassium carbonate, potassium hydrogen carbonate, sodium hydrogen carbonate or ammonium carbonate and tertiary amines, such as Trimethylamine, triethylamine, tributylamine, N, N-dimethylaniline, pyridine, N-methylpiperidine, N, N-dimethyla
- reaction temperatures can be carried out when carrying out the process according to the invention Process can be varied over a wide range. Generally you work at temperatures between -30 ° C and + 150 ° C, preferably at temperatures between -20 ° C and + 120 ° C.
- the process according to the invention is usually carried out under normal pressure. However, it is also possible to work under increased or reduced pressure.
- 2-oximino-2-phenyl-acetic acid ester is used per mole of formula (II) generally 1.0 to 3.0 moles, preferably 1.0 to 1.5 mol of amine of the formula (III) and optionally 0.1 to 3.0 Mol, preferably 0.5 to 1.5 mol of acid binder.
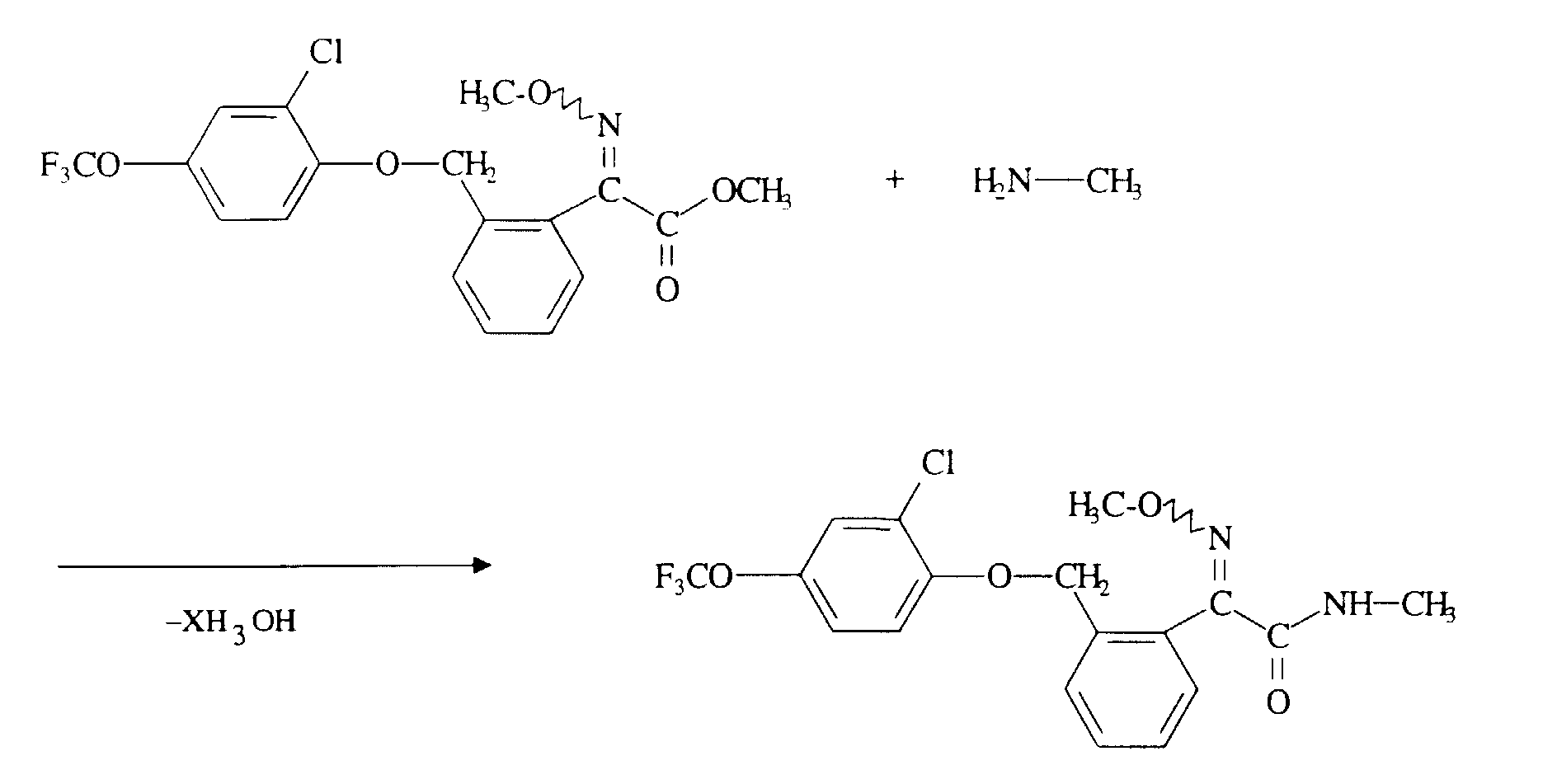
- 2-Oximino-2-phenyl-acetic acid ester of the formula (II) in a preceding reaction in the Manufacture reaction vessel and then directly in a without isolation so-called "one-pot reaction” according to the inventive method to implement. Carrying out the reaction, working up and isolating the reaction products takes place in the usual way.
- the end products of the formula (I) are purified using customary methods, for example by column chromatography or by recrystallization.
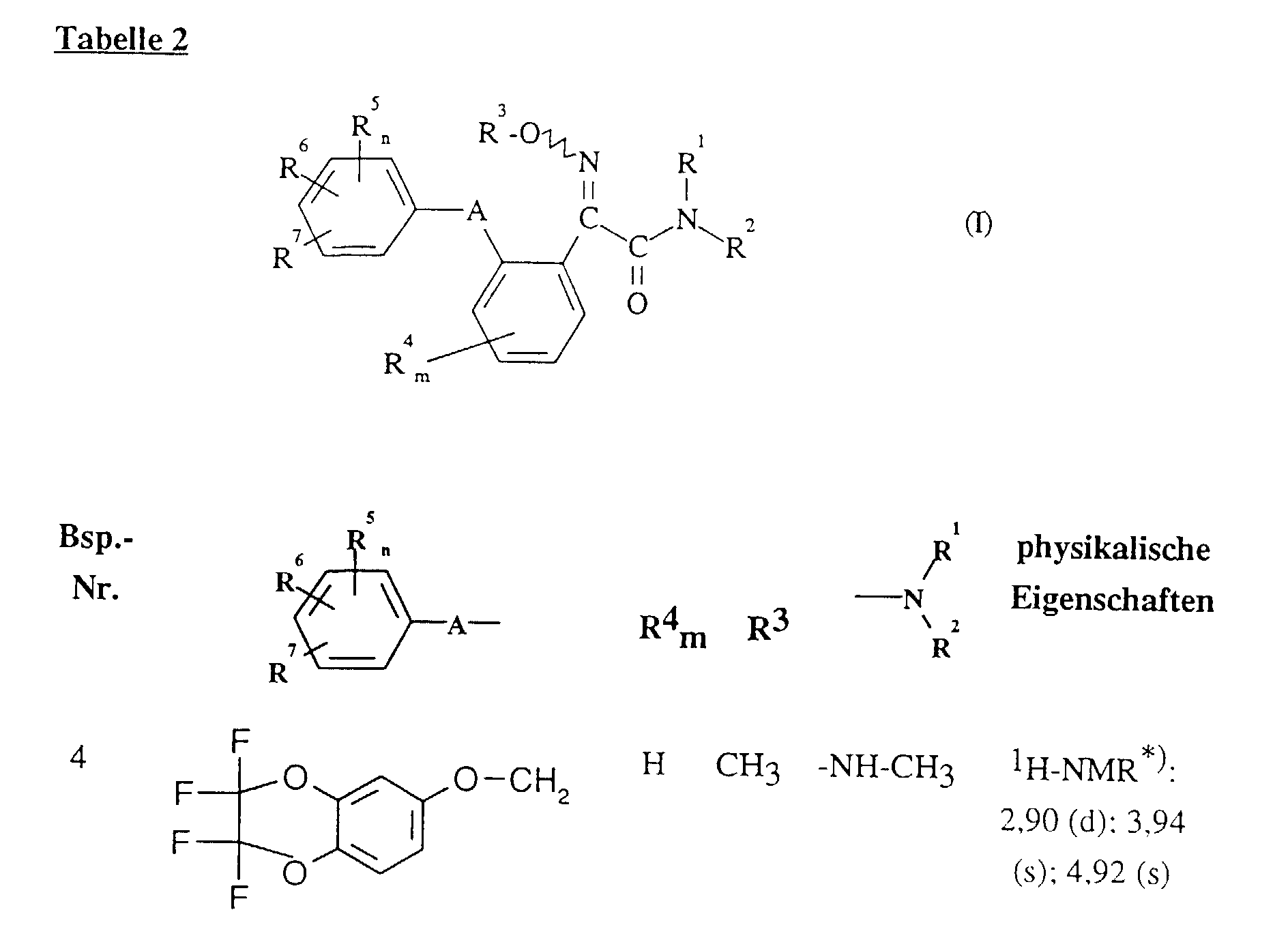
- the characterization is carried out using the melting point or, in the case of non-crystallizing compounds, using the refractive index or proton nuclear magnetic resonance spectroscopy ( 1 H-NMR).
- the active compounds according to the invention have a strong action against pests and can be useful to combat unwanted microorganisms be used.
- the active ingredients are for use as pesticides, particularly suitable as fungicides.
- Fungicidal agents in crop protection are used to control Plasmodiophoromycetes, Oomycetes, Chytridiomycetes, Zygomycetes, Ascomycetes. Basidiomycetes, Deuteromycetes.
- the active compounds according to the invention can be used to combat them with particularly good success of diseases in fruit and vegetable growing, such as against the Pathogen of the tomato brown rot (Phytophthora infestans) or against the pathogen of the downy mildew of vine (Plasmopara viticola) or against the pathogen of Sclerotinia rot on beans (Sclerotinia sclerotiorum) or against the pathogen of the Apple scab (Venturia inaequalis) or against the pathogen of the real cucumber mildew (Sphaerotheca fuliginea) or against the pathogen of apple mildew (Podosphaera leucotricha) or against the pathogen of the real vine mildew (Uncinula necator) or for combating cereal diseases such as against the causative agent of broken wheat (Pseudocercosporella herpotrichoides) or against the pathogen of powdery mildew (Erysiphe graminis) or against the caus
- the active ingredients can depend on their respective physical and / or chemical properties are converted into common formulations, such as solutions, Emulsions, suspensions, powders, foams, pastes, granules, aerosols, Fine encapsulation in polymeric substances and in coating compositions for seeds, as well ULV cold and warm fog formulations.
- formulations are made in a known manner, e.g. by mixing of the active substances with extenders, i.e. liquid solvents, under pressure liquefied gases and / or solid carriers, optionally using of surface-active agents, i.e. emulsifiers and / or dispersants and / or foam-generating agents.
- extenders i.e. liquid solvents
- surface-active agents i.e. emulsifiers and / or dispersants and / or foam-generating agents.
- surface-active agents i.e. emulsifiers and / or dispersants and / or foam-generating agents.
- organic solvents are also used as auxiliary solvents become.
- aromatics such as xylene, toluene, alkylnaphthalenes, chlorinated aromatics or chlorinated aliphatic Hydrocarbons, such as chlorobenzenes, chlorethylenes, or methylene chloride, aliphatic hydrocarbons such as cyclohexane or paraffins, e.g.
- natural rock flour such as kaolins, clays, talc, chalk, quartz, attapulgite, montmorillonite or Diatomaceous earth and synthetic rock powder, such as highly disperse silica, aluminum oxide and silicates
- Solid carriers for granules are possible: e.g. broken and fractionated natural rocks such as calcite, marble, pumice, sepiolite, Dolomite and synthetic granules from inorganic and organic flours and granules made of organic material such as sawdust, coconut shells, corn cobs and tobacco stems; come as emulsifying and / or foam-generating agents in question: e.g.
- non-ionic and anionic emulsifiers such as polyoxyethylene fatty acid esters, Polyoxyethylene fatty alcohol ethers, e.g. Alkylaryl polyglycol ethers, alkyl sulfonates, Alkyl sulfates, aryl sulfonates and protein hydrolyzates; as a dispersant are possible: e.g. Lignin sulfite liquor and methyl cellulose.
- Adhesives such as carboxymethyl cellulose, natural, can be used in the formulations and synthetic, powdery, granular or latex-shaped polymers are used, such as gum arabic, polyvinyl alcohol, polyvinyl acetate, and natural phospholipids, such as cephalins and lecithins and synthetic phospholipids.
- Other additives can be mineral and vegetable oils.
- Dyes such as inorganic pigments, e.g. Iron oxide, titanium oxide, ferrocyan blue and organic dyes such as alizarin, azo and metal phthalocyanine dyes and trace nutrients such as salts of iron, manganese, boron, copper, cobalt, Molybdenum and zinc can be used.
- the formulations generally contain between 0.1 and 95 percent by weight Active ingredient, preferably between 0.5 and 90%.
- the active compounds according to the invention can be mixed with in the formulations other known active ingredients are present, such as fungicides, insecticides, acaricides and Herbicides and in mixtures with fertilizers and growth regulators.
- the active compounds can be used as such, in the form of their formulations or in the formulations prepared from them Application forms, such as ready-to-use solutions, suspensions, wettable powders, Pastes, soluble powders, dusts and granules can be used.
- the Application takes place in the usual way, e.g. by pouring, spraying, spraying, Scattering, dusting, foaming, brushing, etc. It is also possible to use the Apply active ingredients according to the ultra-low-volume process or the active ingredient preparation or inject the active ingredient into the soil yourself. It can also do that Seeds of the plants are treated.
- the drug concentrations in the Application forms can be varied in a larger area: They are generally between 1 and 0.0001% by weight, preferably between 0.5 and 0.001% by weight.
- amounts of active ingredient are generally from 0.001 to 50 g per kilogram of seed, preferably 0.01 to 10 g.
- active ingredient concentrations are from 0.00001 to 0.1 % By weight, preferably from 0.0001 to 0.02% by weight, is required at the site of action.
- a part by weight is mixed to produce a suitable preparation of active compound Active ingredient with the specified amounts of solvent and emulsifier and dilute the concentrate with water to the desired concentration.
- the plants are then in an incubation cabin at 20 ° C and a relative 100% humidity set up.
- Evaluation is carried out 3 days after the inoculation.
- Example 1 shows one Active ingredient concentration of 10 ppm in the spray liquid an efficiency of over 80%, while the comparison substance (A) only has an efficiency of 71% having.
- a part by weight is mixed to produce a suitable preparation of active compound Active ingredient with the specified amounts of solvent and emulsifier and dilute the concentrate with water to the desired concentration.
- Example 1 shows one Active ingredient concentration of 2.5 ppm in the spray liquid an efficiency of over 80%, while the comparison substance (A) has an efficiency of 40% having.
- a part by weight is mixed to produce a suitable preparation of active compound Active ingredient with the specified amounts of solvent and emulsifier and dilute the concentrate with water to the desired concentration.
- Example 1 shows one Active ingredient concentration of 100 ppm in the spray liquid an efficiency of over 90%, while the reference substance (A) has an efficiency of 74% having.
- solvent 12.4 parts by weight of dimethylformamide Emulsifier 0.6 parts by weight of alkyl aryl polyglycol ether
- the plants are grown in a greenhouse at a temperature of approx. 10 ° C and a relative humidity of approx. 80%.
- Evaluation is carried out 21 days after the inoculation.
- Example 1 shows one Active ingredient concentration of 400 g / ha an efficiency of 100%, while the Comparative substance (A) has no effect.
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Health & Medical Sciences (AREA)
- Environmental Sciences (AREA)
- Engineering & Computer Science (AREA)
- Dentistry (AREA)
- General Health & Medical Sciences (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Plant Pathology (AREA)
- Pest Control & Pesticides (AREA)
- Agronomy & Crop Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Agricultural Chemicals And Associated Chemicals (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Heterocyclic Compounds That Contain Two Or More Ring Oxygen Atoms (AREA)
- Furan Compounds (AREA)
Description
- R1
- für Wasserstoff, geradkettiges oder verzweigtes Alkyl mit 1 bis 8 Kohlenstoffatomen oder geradkettiges oder verzweigtes Alkoxy mit 1 bis 8 Kohlenstoffatomen steht,
- R2
- für Wasserstoff, geradkettiges oder verzweigtes Alkyl mit 1 bis 8 Kohlenstoffatomen oder geradkettiges oder verzweigtes Alkoxy mit 1 bis 8 Kohlenstoffatomen steht,
- R3
- für Wasserstoff, geradkettiges oder verzweigtes Alkyl mit 1 bis 8 Kohlenstoffatomen oder geradkettiges oder verzweigtes Alkoxy mit 1 bis 8 Kohlenstoffatomen steht,
- R4
- für Halogen, Cyano, Nitro, Formyl, Carbamoyl, Thiocarbamoyl,
jeweils geradkettiges oder verzweigtes Alkyl, Alkoxy, Alkylthio,
Alkylsulfinyl oder Alkylsulfonyl mit jeweils 1 bis 6 Kohlenstoffatomen, jeweils
geradkettiges oder verzweigtes Alkenyl oder Alkenyloxy mit jeweils 2 bis 6
Kohlenstoffatomen, jeweils geradkettiges oder verzweigtes Halogenalkyl, Halogenalkoxy,
Halogenalkylthio, Halogenalkylsulfinyl oder Halogenalkylsulfonyl
mit jeweils 1 bis 6 Kohlenstoffatomen und 1 bis 13 gleichen oder verschiedenen
Halogenatomen, jeweils geradkettiges oder verzweigtes Halogenalkenyl oder
Halogenalkenyloxy mit jeweils 2 bis 6 Kohlenstoffatomen und 1 bis 13 gleichen
oder verschiedenen Halogenatomen, jeweils geradkettiges oder verzweigtes N-Alkylamino,
Dialkylamino, Alkylcarbonyl, Alkylcarbonyloxy, Alkoxycarbonyl,
ALkylsulfonyloxy, Hydroximinoalkyl oder Alkoximinoalkyl mit jeweils 1 bis 6
Kohlenstoffatomen in den einzelnen Alkyl- bzw. Alkoxyteilen, außerdem für
gegebenenfalls einfach bis dreifach, gleichartig oder verschieden durch Halogen
und/oder Alkyl mit 1 bis 4 Kohlenstoffatomen substituiertes Cycloalkyl mit 3 bis
7 Kohlenstoffatomen steht,
ferner für gegebenenfalls einfach bis dreifach, gleichartig oder verschieden durch Halogen und/oder Alkyl mit 1 bis 4 Kohlenstoffatomen substituiertes 3- bis 7-gliedriges Heterocyclyl mit 2 bis 6 Kohlenstoffatomen und 1 bis 3 gleichen oder verschiedenen Heteroatomen, wie Stickstoff, Sauerstoff und/oder Schwefel steht,
und weiterhin
für Phenyl, Phenoxy, Benzyl, Benzyloxy, Phenylethyl oder Phenylethyloxy steht, wobei jeder dieser Reste im Phenylteil einfach bis fünffach, gleichartig oder verschieden substituiert sein kann durch Halogen, geradkettiges oder verzweigtes Alkyl mit 1 bis 4 Kohlenstoffatomen, geradkettiges oder verzweigtes Halogenalkyl mit 1 bis 4 Kohlenstoffatomen und 1 bis 9 gleichen oder verschiedenen Halogenatomen, geradkettiges oder verzweigtes Alkoxy mit 1 bis 4 Kohlenstoffatomen und/oder geradkettiges oder verzweigtes Halogenalkoxy mit 1 bis 4 Kohlenstoffatomen und 1 bis 9 gleichen oder verschiedenen Halogenatomen, - R5
- für Halogen, Cyano, Nitro, Formyl, Carbamoyl,
Thiocarbamoyl, jeweils geradkettiges oder verzweigtes Alkyl, Alkoxy, Alkylthio,
Alkylsulfinyl oder Alkylsulfonyl mit jeweils 1 bis 6 Kohlenstoffatomen,
jeweils geradkettiges oder verzweigtes Alkenyl oder Alkenyloxy mit jeweils 2
bis 6 Kohlenstoffatomen, jeweils geradkettiges oder verzweigtes Halogenalkyl,
Halogenalkoxy, Halogenalkylthio, Halogenalkylsulfinyl oder Halogenalkylsulfonyl
mit jeweils 1 bis 6 Kohlenstoffatomen und 1 bis 13 gleichen oder verschiedenen
Halogenatomen, jeweils geradkettiges oder verzweigtes Halogenalkenyl
oder Halogenalkenyloxy mit jeweils 2 bis 6 Kohlenstoffatomen und 1 bis 13
gleichen oder verschiedenen Halogenatomen, jeweils geradkettiges oder verzweigtes
N-Alkylamino, Dialkylamino, Alkylcarbonyl, Alkylcarbonyloxy, Alkoxycarbonyl,
Alkylsulfonyloxy oder Hydroximinoalkyl mit jeweils
1 bis 6 Kohlenstoffatomen in den einzelnen Alkyl- bzw. Alkoxy-teilen,
außerdem für gegebenenfalls einfach bis dreifach, gleichartig oder verschieden
durch Halogen und/oder Alkyl mit 1 bis 4 Kohlenstoffatomen substituiertes
Cycloalkyl mit 3 bis 7 Kohlenstoffatomen steht,
ferner für gegebenenfalls einfach bis dreifach, gleichartig oder verschieden durch Halogen und/oder Alkyl mit 1 bis 4 Kohlenstoffatomen substituiertes 3- bis 7-gliedriges Heterocyclyl mit 2 bis 6 Kohlenstoffatomen und 1 bis 3 gleichen oder verschiedenen Heteroatomen, wie Stickstoff, Sauerstoff und/oder
Schwefel steht,
und weiterhin,
für Phenyl, Phenoxy, Benzyl, Benzyloxy, Phenylethyl oder Phenylethyloxy steht, wobei jeder dieser Reste im Phenylteil einfach bis fünffach, gleichartig oder verschieden substituiert sein kann durch Halogen, geradkettiges oder verzweigtes Alkyl mit 1 bis 4 Kohlenstoffatomen, geradkettiges oder verzweigtes Halogenalkyl mit 1 bis 4 Kohlenstoffatomen und 1 bis 9 gleichen oder verschiedenen Halogenatomen, geradkettiges oder verzweigtes Alkoxy mit 1 bis 4 Kohlenstoffatomen, geradkettiges oder verzweigtes Halogenalkoxy mit 1 bis 4 Kohlenstoffatomen und 1 bis 9 gleichen oder verschiedenen Halogenatomen, - m
- für die Zahlen 0, 1, 2, 3 oder 4 steht, wobei R4 für gleiche oder verschiedene Reste stehen kann, wenn m für 2, 3 oder 4 steht.
- n
- für die Zahlen 1, 2 oder 3 steht, wobei R5 für gleiche oder verschiedene Reste stehen kann. wenn n für 2, 3 oder 4 steht.
- A
- für eine Gruppierung der Formel -CH2-O-, -O-CH2-. -CH2-S- oder -S-CH2- steht,
- R6
- für Wasserstoff, Halogen, Cyano, Nitro, Formyl, Carbamoyl,
Thiocarbamoyl, jeweils geradkettiges oder verzweigtes Alkyl, Alkoxy,
Alkylthio, Alkylsulfinyl oder Alkylsulfonyl mit jeweils 1 bis 6 Kohlenstoffatomen,
jeweils geradkettiges oder verzweigtes Alkenyl oder Alkenyloxy mit
jeweils 2 bis 6 Kohlenstoffatomen, jeweils geradkettiges oder verzweigtes Halogenalkyl,
Halogenalkoxy, Halogenalkylthio, Halogenalkylsulfinyl oder Halogenalkylsulfonyl
mit jeweils 1 bis 6 Kohlenstoffatomen und 1 bis 13 gleichen
oder verschiedenen Halogenatomen, jeweils geradkettiges oder verzweigtes
Halogenalkenyl oder Halogenalkenyloxy mit jeweils 2 bis 6 Kohlenstoffatomen
und 1 bis 13 gleichen oder verschiedenen Halogenatomen, jeweils geradkettiges
oder verzweigtes N-Alkylamino, Dialkylamino, Alkylcarbonyl,
Alkylcarbonyloxy, Alkoxycarbonyl, Alkylsulfonyloxy oder Hydroximinoalkyl
mit jeweils 1 bis 6 Kohlenstoffatomen in den einzelnen Alkyl-bzw.
Alkoxyteilen, außerdem für gegebenenfalls einfach bis dreifach, gleichartig
oder verschieden durch Halogen und/oder Alkyl mit 1 bis 4 Kohlenstoffatomen
substituiertes Cycloalkyl mit 3 bis 7 Kohlenstoffatomen steht,
ferner für gegebenenfalls einfach bis dreifach, gleichartig oder verschieden durch Halogen und/oder Alkyl mit 1 bis 4 Kohlenstoffatomen substituiertes 3- bis 7-gliedriges Heterocyclyl mit 2 bis 6 Kohlenstoffatomen und 1 bis 3 gleichen oder verschiedenen Heteroatomen, wie Stickstoff, Sauerstoff und/oder Schwefel steht,
und weiterhin
für Phenyl, Phenoxy, Benzyl, Benzyloxy, Phenylethyl oder Phenylethyloxy steht, wobei jeder dieser Reste im Phenylteil einfach bis fünffach, gleichartig oder verschieden substituiert sein kann durch Halogen, geradkettiges oder verzweigtes Alkyl mit 1 bis 4 Kohlenstoffatomen, geradkettiges oder verzweigtes Halogenalkyl mit 1 bis 4 Kohlenstoffatomen und 1 bis 9 gleichen oder verschiedenen Halogenatomen, geradkettiges oder verzweigtes Alkoxy mit 1 bis 4 Kohlenstoffatomen und oder geradkettiges oder verzweigtes Halogenalkoxy mit 1 bis 4 Kohlenstoffatomen und 1 bis 9 gleichen oder verschiedenen Halogenatomen; - R7
- für jeweils geradkettiges oder verzweigtes Halogenalkoxy oder Halogenalkylthio mit jeweils 1 bis 8 Kohlenstoffatomen und 1 bis 17 gleichen oder verschiedenen Halogenatomen - insbesondere Fluor, Chlor, Brom und/oder Iod steht,
- R6 und R7
- außerdem auch gemeinsam vorzugsweise für einen gegebenenfalls einfach bis sechsfach, gleichartig oder verschieden durch Halogen, geradkettiges oder verzweigtes Halogenalkyl mit 1 bis 6 Kohlenstoffatomen und 1 bis 13 gleichen oder verschiedenen Halogenatomen - insbesondere Fluor, Chlor, Brom und/oder Iod - substituierten zweifach verknüpften Alkandiylrest mit 1 bis 5 Kohlenstoffatomen stehen, der 1 bis 3 Sauerstoff- und/oder Schwefelatome enthält,
- R3, R4, R5, R6, R7, A, m und n
- die oben angegebenen Bedeutungen haben und
- R
- für Alkyl steht,
- R1 und R2
- die oben angegebenen Bedeutungen haben,
- R1
- steht besonders bevorzugt für Wasserstoff, geradkettiges oder verzweigtes Alkyl mit 1 bis 6 Kohlenstoffatomen oder geradkettiges oder verzweigtes Alkoxy mit 1 bis 6 Kohlenstoffatomen.
- R2
- steht besonders bevorzugt für Wasserstoff, geradkettiges oder verzweigtes Alkyl mit 1 bis 6 Kohlenstoffatomen oder geradkettiges oder verzweigtes Alkoxy mit 1 bis 6 Kohlenstoffatomen.
- R3
- steht besonders bevorzugt für Wasserstoff, geradkettiges oder verzweigtes Alkyl mit 1 bis 6 Kohlenstoffatomen oder geradkettiges oder verzweigtes Alkoxy mit 1 bis 6 Kohlenstoffatomen.
- R4
- steht besonders bevorzugt für Fluor, Chlor, Brom, Cyano, Nitro, Formyl,
Carbamoyl, Thiocarbamoyl, jeweils geradkettiges oder verzweigtes Alkyl,
Alkoxy, Alkylthio, Alkylsulfinyl oder Alkylsulfonyl mit jeweils 1 bis 4 Kohlenstoffatomen,
jeweils geradkettiges oder verzweigtes Alkenyl oder Alkenyloxy
mit jeweils 2 bis 4 Kohlenstoffatomen, jeweils geradkettiges oder verzweigtes
Halogenalkyl, Halogenalkoxy, Halogenalkylthio, Halogenalkylsulfinyl oder
Halogenalkylsulfonyl mit jeweils 1 bis 4 Kohlenstoffatomen und 1 bis 9 Fluor-,
Chlor- und/oder Bromatomen, jeweils geradkettiges oder verzweigtes
Halogenalkenyl oder Halogenalkenyloxy mit jeweils 2 bis 4 Kohlenstoffatomen
und 1 bis 9 Fluor-, Chlor- und/oder Bromatomen, jeweils geradkettiges oder
verzweigtes N-Alkylamino, Dialkylamino, Alkylcarbonyl, Alkylcarbonyloxy.
Alkoxycarbonyl, Alkylsulfonyloxy, Hydroximinoalkyl oder Alkoximinoalkyl mit
jeweils 1 bis 4 Kohlenstoffatomen in den einzelnen Alkyl- bzw. Alkoxyteilen,
außerdem für gegebenenfalls einfach bis dreifach, gleichartig oder verschieden
durch Fluor, Chlor, Methyl und/oder Ethyl substituiertes Cycloalkyl mit 3 bis 6
Kohlenstoffatomen,
ferner für gegebenenfalls einfach bis dreifach, gleichartig oder verschieden durch Fluor, Chlor, Methyl und/oder Ethyl substituiertes, 3- bis 7-gliedriges Heterocyclyl mit 2 bis 5 Kohlenstoffatomen und 1 bis 3 gleichen oder verschiedenen Heteroatomen, wie Stickstoff, Sauerstoff und/oder Schwefel,
und weiterhin
für Phenyl, Phenoxy, Benzyl, Benzyloxy, Phenylethyl oder Phenylethyloxy, wobei jeder dieser Reste im Phenylteil einfach bis fünffach, gleichartig oder verschieden substituiert sein kann durch Fluor, Chlor, Brom, geradkettiges oder verzweigtes Alkyl mit 1 bis 3 Kohlenstoffatomen, geradkettiges oder verzweigtes Halogenalkyl mit 1 bis 3 Kohlenstoffatomen und 1 bis 7 Fluor-, Chlor- und/oder Bromatomen, geradkettiges oder verzweigtes Alkoxy mit 1 bis 3 Kohlenstoffatomen und/oder geradkettiges oder verzweigtes Halogenalkoxy mit 1 bis 3 Kohlenstoffatomen und 1 bis 7 Fluor-, Chlor- und/oder Bromatomen. - R5
- steht besonders bevorzugt für Fluor, Chlor, Brom, Cyano, Nitro, Formyl,
Carbamoyl, Thiocarbamoyl, jeweils geradkettiges oder verzweigtes Alkyl, Alkoxy,
Alkylthio, Alkylsulfinyl oder Alkylsulfonyl mit jeweils 1 bis 4 Kohlenstoffatomen,
jeweils geradkettiges oder verzweigtes Alkenyl oder Alkenyloxy mit
jeweils 2 bis 4 Kohlenstoffatomen, jeweils geradkettiges oder verzweigtes Halogenalkyl,
Halogenalkoxy, Halogenalkylthio, Halogenalkylsulfinyl oder Halogenalkylsulfonyl
mit jeweils 1 bis 4 Kohlenstoffatomen und 1 bis 9 Fluor-, Chlor-
und/oder Bromatomen, jeweils geradkettiges oder verzweigtes Halogenalkenyl
oder Halogenalkenyloxy mit jeweils 2 bis 4 Kohlenstoffatomen und 1 bis 9
Fluor-, Chlor- und/oder Bromatomen, jeweils geradkettiges oder verzweigtes
N-Alkylamino, Dialkylamino, Alkylcarbonyl, Alkylcarbonyloxy,
Alkoxycarbonyl, Alkylsulfonyloxy oder Hydroximinoalkyl mit
jeweils 1 bis 4 Kohlenstoffatomen in den einzelnen Alkyl- bzw. Alkoxyteilen,
außerdem für gegebenenfalls einfach bis dreifach, gleichartig oder verschieden
durch Fluor, Chlor, Methyl und/oder Ethyl substituiertes Cycloalkyl mit 3 bis 6
Kohlenstoffatomen,
ferner für gegebenenfalls einfach bis dreifach, gleichartig oder verschieden durch Fluor, Chlor, Methyl und/oder Ethyl substituiertes, 3- bis 7-gliedriges Heterocyclyl mit 2 bis 5 Kohlenstoffatomen und 1 bis 3 gleichen oder verschiedenen Heteroatomen, wie Stickstoff, Sauerstoff und/oder Schwefel,
und weiterhin
für Phenyl, Phenoxy, Benzyl, Benzyloxy, Phenylethyl oder Phenylethyloxy, wobei jeder dieser Reste im Phenylteil einfach bis fünffach, gleichartig oder verschieden substituiert sein kann durch Fluor, Chlor, Brom, geradkettiges oder verzweigtes Alkyl mit 1 bis 3 Kohlenstoffatomen, geradkettiges oder verzweigtes Halogenalkyl mit 1 bis 3 Kohlenstoffatomen und 1 bis 7 Fluor-, Chlor- und/oder Bromatomen, geradkettiges oder verzweigtes Alkoxy mit 1 bis 3 Kohlenstoffatomen und/oder geradkettiges oder verzweigtes Halogenalkoxy mit 1 bis 3 Kohlenstoffatomen und 1 bis 7 Fluor-, Chlor- und/oder Bromatomen. - m
- steht besonders bevorzugt für die Zahlen 0, 1, 2 oder 3, wobei R4 für gleiche oder verschiedene Reste stehen kann, wenn m für 2 oder 3 steht.
- n
- steht besonders bevorzugt für die Zahlen 1, 2 oder 3, wobei R5 für gleiche oder verschiedene Reste stehen kann, wenn n für 2 oder 3 steht.
- A
- steht besonders bevorzugt für eine Gruppierung der Formel -CH2-O-, -O-CH2-, -CH2-S- oder -S-CH2-,
- R6
- steht besonders bevorzugt für Wasserstoff, Fluor, Chlor, Brom. Cyano, Nitro.
Formyl, Carbamoyl, Thiocarbamoyl, jeweils geradkettiges oder verzweigtes
Alkyl, Alkoxy, Alkylthio, Alkylsulfinyl oder Alkylsulfonyl mit jeweils 1 bis 4
Kohlenstoffatomen, jeweils geradkettiges oder verzweigtes Alkenyl oder
Alkenyloxy mit jeweils 2 bis 4 Kohlenstoffatomen, jeweils geradkettiges oder
verzweigtes Halogenalkyl, Halogenalkoxy, Halogenalkylthio, Halogenalkylsulfinyl
oder Halogenalkylsulfonyl mit jeweils 1 bis 4 Kohlenstoffatomen und 1
bis 9 Fluor-, Chlor- und/oder Bromatomen, jeweils geradkettiges oder verzweigtes
Halogenalkenyl oder Halogenalkenyloxy mit jeweils 2 bis 4 Kohlenstoffatomen
und 1 bis 9 Fluor-, Chlor- und/oder Bromatomen, jeweils
geradkettiges oder verzweigtes N-Alkylamino, Dialkylamino, Alkylcarbonyl,
Alkylcarbonyloxy, Alkoxycarbonyl, Alkylsulfonyloxy oder Hydroximinoalkyl
mit jeweils 1 bis 4 Kohlenstoffatomen in den einzelnen Alkyl-bzw.
Alkoxyteilen,
außerdem für gegebenenfalls einfach bis dreifach, gleichartig oder verschieden durch Fluor, Chlor, Methyl und/oder Ethyl substituiertes Cycloalkyl mit 3 bis 6 Kohlenstoffatomen,
ferner für gegebenenfalls einfach bis dreifach, gleichartig oder verschieden durch Fluor, Chlor, Methyl und/oder Ethyl substituiertes, 3- bis 7-gliedriges Heterocyclyl mit 2 bis 5 Kohlenstoffatomen und 1 bis 3 gleichen oder verschiedenen Heteroatomen, wie Stickstoff, Sauerstoff und/oder Schwefel,
und weiterhin
für Phenyl, Phenoxy, Benzyl, Benzyloxy, Phenylethyl oder Phenylethyloxy, wobei jeder dieser Reste im Phenylteil einfach bis fünffach, gleichartig oder verschieden substituiert sein kann durch Fluor, Chlor, Brom, geradkettiges oder verzweigtes Alkyl mit 1 bis 3 Kohlenstoffatomen, geradkettiges oder verzweigtes Halogenalkyl mit 1 bis 3 Kohlenstoffatomen und 1 bis 7 Fluor-, Chlor- und/oder Bromatomen, geradkettiges oder verzweigtes Alkoxy mit 1 bis 3 Kohlenstoffatomen und/oder geradkettiges oder verzweigtes Halogenalkoxy mit 1 bis 3 Kohlenstoffatomen und 1 bis 7 Fluor-, Chlor- und/oder Bromatomen. - R7
- steht besonders bevorzugt für jeweils geradkettiges oder verzweigtes Halogenalkoxy oder Halogenalkylthio mit jeweils 1 bis 4 Kohlenstoffatomen und 1 bis 9 Fluor-, Chlor- und/oder Bromatomen.
- R6 und R7
- stehen außerdem auch gemeinsam besonders bevorzugt für einen gegebenenfalls einfach bis sechsfach, gleichartig oder verschieden durch Fluor, Chlor, Brom, geradkettiges oder verzweigtes Alkyl mit 1 bis 4 Kohlenstoffatomen und/oder geradkettiges oder verzweigtes Halogenalkyl mit 1 bis 4 Kohlenstoffatomen und 1 bis 9 Fluor-, Chlor- und/oder Bromatomen substituierten zweifach verknüpften Alkandiylrest mit 1 bis 4 Kohlenstoffatomen, der 1 oder 2 Sauerstoff- und/oder Schwefelatome enthält.
- R1
- steht ganz besonders bevorzugt für Wasserstoff, geradkettiges oder verzweigtes Alkyl mit 1 bis 4 Kohlenstoffatomen oder für geradkettiges oder verzweigtes Alkoxy mit 1 bis 4 Kohlenstoffatomen.
- R2
- steht ganz besonders bevorzugt für Wasserstoff, geradkettiges oder verzweigtes Alkyl mit 1 bis 4 Kohlenstoffatomen oder für geradkettiges oder verzweigtes Alkoxy mit 1 bis 4 Kohlenstoffatomen.
- R3
- steht ganz besonders bevorzugt für Wasserstoff, geradkettiges oder verzweigtes Alkyl mit 1 bis 4 Kohlenstoffatomen oder für geradkettiges oder verzweigtes Alkoxy mit 1 bis 4 Kohlenstoffatomen.
- R4
- steht ganz besonders bevorzugt für Fluor, Chlor, Brom, Cyano, Nitro, Formyl, Carbamoyl, Thiocarbamoyl, Methyl, Ethyl, n- oder i-Propyl, n-, i-, s- oder t-Butyl, Methoxy, Ethoxy, n- oder i-Propoxy, n-, i-, s- oder t-Butoxy, Methylthio, Ethylthio, Methylsulfinyl, Methylsulfonyl, Allyl, Butenyl, Allyloxy, Butenyloxy, Trifluormethyl, Trifluormethoxy, Difluormethoxy, Trifluormethylthio, Difluorchlormethylthio, Trifluormethylsulfinyl, Trifluormethylsulfonyl, Dimethylamino, Diethylamino, Acetyl, Acetoxy, Methylsulfonyloxy, Ethylsulfonyloxy, Methoxycarbonyl, Ethoxycarbonyl, Hydroximinomethyl, Hydroximinoethyl, Cyclopropyl, Cyclopentyl, Cyclohexyl, 1-Pyrrolidinyl, 1-Piperidinyl, 1-Perhydroazepinyl, 4-Morpholinyl oder für Phenyl. Phenoxy, Benzyl. Benzyloxy, Phenylethyl oder Phenylethyloxy, wobei jeder der sechs letztgenannten Reste im Phenylteil einfach bis dreifach, gleichartig oder verschieden substituiert sein kann durch Fluor, Chlor, Brom, Methyl, Ethyl, Methoxy, Ethoxy, Trifluormethyl und/oder Trifluormethoxy.
- R5
- steht ganz besonders bevorzugt für Fluor, Chlor, Brom, Cyano. Nitro, Formyl, Carbamoyl, Thiocarbamoyl, Methyl, Ethyl, n- oder i-Propyl, n-, i-, s- oder t-Butyl, Methoxy, Ethoxy, n- oder i-Propoxy, n-, i-, s- oder t-Butoxy, Methylthio, Ethylthio, Methylsulfinyl, Methylsulfonyl, Allyl, Butenyl, Allyloxy, Butenyloxy, Trifluormethyl, Trifluormethoxy, Difluormethoxy, Trifluormethylthio, Difluorchlormethylthio, Trifluormethylsulfinyl, Trifluormethylsulfonyl, Dimethylamino, Diethylamino, Acetyl, Acetoxy, Methylsulfonyloxy, Ethylsulfonyloxy, Methoxycarbonyl, Ethoxycarbonyl, Hydroximinomethyl, Hydroximinoethyl, Cyclopropyl, Cyclopentyl, Cyclohexyl, 1-Pyrrolidinyl, 1-Piperidinyl, 1-Perhydroazepinyl, 4-Morpholinyl oder für Phenyl, Phenoxy, Benzyl, Benzyloxy, Phenylethyl oder Phenylethyloxy, wobei jeder der sechs letztgenannten Reste im Phenylteil einfach bis dreifach, gleichartig oder verschieden substituiert sein kann durch Fluor, Chlor, Brom, Methyl, Ethyl, Methoxy, Ethoxy, Trifluormethyl und/oder Trifluormethoxy.
- m
- steht ganz besonders bevorzugt für die Zahlen 0, 1 oder 2, wobei R4 für gleiche oder verschiedene Reste stehen kann, wenn m für 2 steht.
- n
- steht ganz besonders bevorzugt für die Zahlen 1 oder 2, wobei R5 für gleiche oder verschiedene Reste stehen kann, wenn n für 2 steht.
- A
- steht ganz besonders bevorzugt für eine Gruppierung der Formel -CH2-O-, -O-CH2-, -CH2-S- oder -S-CH2-.
- R6
- steht ganz besonders bevorzugt für Wasserstoff, Fluor, Chlor, Brom, Cyano, Nitro, Formyl, Carbamoyl, Thiocarbamoyl, Methyl, Ethyl, n- oder i-Propyl, n-, i-, s- oder t-Butyl, Methoxy, Ethoxy, n- oder i-Propoxy, n-, i-, s- oder t-Butoxy, Methylthio, Ethylthio, Methylsulfinyl, Methylsulfonyl. Allyl, Butenyl. Allyloxy, Butenyloxy, Trifluormethyl. Trifluormethoxy, Difluormethoxy, Trifluormethylthio, Difluorchlormethylthio, Trifluormethylsulfinyl, Trifluormethylsulfonyl, Dimethylamino, Diethylamino, Acetyl, Acetoxy, Methylsulfonyloxy, Ethylsulfonyloxy, Methoxycarbonyl, Ethoxycarbonyl, Hydroximinomethyl, Hydroximinoethyl, Methoximinomethyl, Methoximinoethyl, Ethoximinomethyl, Ethoximinoethyl, Cyclopropyl, Cyclopentyl, Cyclohexyl, 1-Pyrrolidinyl, 1-Piperidinyl, 1-Perhydroazepinyl, 4-Morpholinyl oder für Phenyl, Phenoxy, Benzyl, Benzyloxy, Phenylethyl oder Phenylethyloxy, wobei jeder der sechs letztgenannten Reste im Phenylteil einfach bis dreifach, gleichartig oder verschieden substituiert sein kann durch Fluor, Chlor, Brom, Methyl, Ethyl, Methoxy, Ethoxy, Trifluormethyl und/oder Trifluormethoxy.
- R7
- steht ganz besonders bevorzugt für geradkettiges oder verzweigtes Halogenalkoxy mit 1 bis 3 Kohlenstoffatomen und 1 bis 7 Fluor-, Chlor- und/oder Bromatomen oder für geradkettiges oder verzweigtes Halogenalkylthio mit 1 bis 3 Kohlenstoffatomen und 1 bis 7 Fluor-, Chlor- und/oder Bromatomen.
- R6 und R7
- stehen außerdem gemeinsam ganz besonders bevorzugt für einen gegebenenfalls einfach bis vierfach, gleich oder verschieden durch Fluor, Chlor, Brom, Methyl, Ethyl und/oder Trifluormethyl substituierten zweifach verknüpften Alkandiylrest mit 1 bis 3 Kohlenstoffatomen, der 1 bis 2 Sauerstoff-oder Schwefelatome enthält.
- R5, R6, R7 und n
- die oben angegebene Bedeutung haben und
- X
- für Sauerstoff oder Schwefel steht,
- R, R3, R4 und m
- die oben angegebene Bedeutung haben und
- X
- für Halogen steht,
- 1H-NMR (CDCl3/Tetramethylsilan): d =
- 2.88 (d, 3H); 3,93 (s, 3H); 5,06 (s, 2H); 6,75 (s, 1H); 7,2 (m, 7H) ppm
| Lösungsmittel | 4,7 Gewichtsteile Aceton |
| Emulgator | 0,3 Gewichtsteile Alkyl-Aryl-Polyglykolether |
| Lösungsmittel | 4,7 Gewichtsteile Aceton |
| Emulgator | 0,3 Gewichtsteile Alkyl-Aryl-Polyglykolether |
| Lösungsmittel | 4,7 Gewichtsteile Aceton |
| Emulgator | 0,3 Gewichtsteile Alkyl-Aryl-Polyglykolether |
| Lösungsmittel | 12,4 Gewichtsteile Dimethylformamid |
| Emulgator | 0,6 Gewichtsteile Alkyl-Aryl-Polyglykolether |
Claims (8)
- 2-Oximino-2-phenyl-acetamide der Formel (I) gemäß Anspruch 1, in denen
- R1
- für Wasserstoff, geradkettiges oder verzweigtes Alkyl mit 1 bis 8 Kohlenstoffatomen oder geradkettiges oder verzweigtes Alkoxy mit 1 bis 8 Kohlenstoffatomen steht,
- R2
- für Wasserstoff, geradkettiges oder verzweigtes Alkyl mit 1 bis 8 Kohlenstoffatomen oder geradkettiges oder verzweigtes Alkoxy mit 1 bis 8 Kohlenstoffatomen steht,
- R3
- für Wasserstoff, geradkettiges oder verzweigtes Alkyl mit 1 bis 8 Kohlenstoffatomen oder geradkettiges oder verzweigtes Alkoxy mit 1 bis 8 Kohlenstoffatomen steht,
- R4
- für Halogen, Cyano, Nitro, Formyl, Carbamoyl, Thiocarbamoyl,
jeweils geradkettiges oder verzweigtes Alkyl, Alkoxy, Alkylthio,
Alkylsulfinyl oder Alkylsulfonyl mit jeweils 1 bis 6 Kohlenstoffatomen,
jeweils geradkettiges oder verzweigtes Alkenyl oder
Alkenyloxy mit jeweils 2 bis 6 Kohlenstoffatomen, jeweils geradkettiges
oder verzweigtes Halogenalkyl, Halogenalkoxy, Halogenalkylthio,
Halogenalkylsulfinyl oder Halogenalkylsulfonyl mit jeweils
1 bis 6 Kohlenstoffatomen und 1 bis 13 gleichen oder verschiedenen
Halogenatomen, jeweils geradkettiges oder verzweigtes
Halogenalkenyl oder Halogenalkenyloxy mit jeweils 2 bis 6 Kohlenstoffatomen
und 1 bis 13 gleichen oder verschiedenen Halogenatomen,
jeweils geradkettiges oder verzweigtes N-Alkylamino, Dialkylamino,
Alkylcarbonyl, Alkylcarbonyloxy, Alkoxycarbonyl, Alkylsulfonyloxy,
Hydroximinoalkyl oder Alkoximinoalkyl mit jeweils 1
bis 6 Kohlenstoffatomen in den einzelnen Alkyl-bzw. Alkoxyteilen
steht, außerdem für gegebenenfalls einfach bis dreifach, gleichartig
oder verschieden durch Halogen und/oder Alkyl mit 1 bis 4 Kohlenstoffatomen
substituiertes Cycloalkyl mit 3 bis 7 Kohlenstoffatomen
steht,
ferner für gegebenenfalls einfach bis dreifach, gleichartig oder verschieden durch Halogen und/oder Alkyl mit 1 bis 4 Kohlenstoffatomen substituiertes 3-bis 7-gliedriges Heterocyclyl mit 2 bis 6 Kohlenstoffatomen und 1 bis 3 gleichen oder verschiedenen Heteroatomen steht,
und weiterhin
für Phenyl, Phenoxy, Benzyl, Benzyloxy, Phenylethyl oder Phenylethyloxy steht, wobei jeder dieser Reste im Phenylteil einfach bis fünffach, gleichartig oder verschieden substituiert sein kann durch Halogen, geradkettiges oder verzweigtes Alkyl mit 1 bis 4 Kohlenstoffatomen, geradkettiges oder verzweigtes Halogenalkyl mit 1 bis 4 Kohlenstoffatomen und 1 bis 9 gleichen oder verschiedenen Halogenatomen, geradkettiges oder verzweigtes Alkoxy mit 1 bis 4 Kohlenstoffatomen und/oder geradkettiges oder verzweigtes Halogenalkoxy mit 1 bis 4 Kohlenstoffatomen und 1 bis 9 gleichen oder verschiedenen Halogenatomen, - R5
- für Halogen, Cyano, Nitro, Formyl, Carbamoyl, Thiocarbamoyl, jeweils
geradkettiges oder verzweigtes Alkyl, Alkoxy, Alkylthio,
Alkylsulfinyl oder Alkylsulfonyl mit jeweils 1 bis 6 Kohlenstoffatomen,
jeweils geradkettiges oder verzweigtes Alkenyl oder Alkenyloxy
mit jeweils 2 bis 6 Kohlenstoffatomen, jeweils geradkettiges
oder verzweigtes Halogenalkyl, Halogenalkoxy, Halogenalkylthio,
Halogenalkylsulfinyl oder Halogenalkylsulfonyl mit jeweils 1 bis 6
Kohlenstoffatomen und 1 bis 13 gleichen oder verschiedenen Halogenatomen,
jeweils geradkettiges oder verzweigtes Halogenalkenyl
oder Halogenalkenyloxy mit jeweils 2 bis 6 Kohlenstoffatomen und
1 bis 13 gleichen oder verschiedenen Halogenatomen, jeweils geradkettiges
oder verzweigtes N-Alkylamino, Dialkylamino, Alkylcarbonyl,
Alkylcarbonyloxy, Alkoxycarbonyl, Alkylsulfonyloxy oder
Hydroximinoalkyl mit jeweils 1 bis 6 Kohlenstoffatomen in den einzelnen
Alkyl-bzw. Alkoxyteilen steht, außerdem für gegebenenfalls
einfach bis dreifach, gleichartig oder verschieden durch Halogen
und/oder Alkyl mit 1 bis 4 Kohlenstoffatomen substituiertes
Cycloalkyl mit 3 bis 7 Kohlenstoffatomen steht,
ferner für gegebenenfalls einfach bis dreifach, gleichartig oder verschieden durch Halogen und/oder Alkyl mit 1 bis 4 Kohlenstoffatomen substituiertes 3-bis 7-gliedriges Heterocyclyl mit 2 bis 6 Kohlenstoffatomen und 1 bis 3 gleichen oder verschiedenen Heteroatomen steht,
und weiterhin,
für Phenyl, Phenoxy, Benzyl, Benzyloxy, Phenylethyl oder Phenylethyloxy steht, wobei jeder dieser Reste im Phenylteil einfach bis fünffach, gleichartig oder verschieden substituiert sein kann durch Halogen, geradkettiges oder verzweigtes Alkyl mit 1 bis 4 Kohlenstoffatomen, geradkettiges oder verzweigtes Halogenalkyl mit 1 bis 4 Kohlenstoffatomen und 1 bis 9 gleichen oder verschiedenen Halogenatomen, geradkettiges oder verzweigtes Alkoxy mit 1 bis 4 Kohlenstoffatomen, geradkettiges oder verzweigtes Halogenalkoxy mit 1 bis 4 Kohlenstoffatomen und 1 bis 9 gleichen oder verschiedenen Halogenatomen, - m
- für die Zahlen 0, 1, 2, 3 oder 4 steht,
- n
- für die Zahlen 1, 2 oder 3 steht,
- A
- für eine Gruppierung der Formel -CH2-O-, -O-CH2-, -CH2-S-oder -S-CH2- steht,
- R6
- für Wasserstoff, Halogen, Cyano, Nitro, Formyl, Carbamoyl, Thiocarbamoyl,
jeweils geradkettiges oder verzweigtes Alkyl, Alkoxy,
Alkylthio, Alkylsulfinyl oder Alkylsulfonyl mit jeweils 1 bis 6
Kohlenstoffatomen, jeweils geradkettiges oder verzweigtes Alkenyl
oder Alkenyloxy mit jeweils 2 bis 6 Kohlenstoffatomen, jeweils
geradkettiges oder verzweigtes Halogenalkyl, Halogenalkoxy, Halogenalkylthio,
Halogenalkylsulfinyl oder Halogenalkylsulfonyl mit
jeweils 1 bis 6 Kohlenstoffatomen und 1 bis 13 gleichen oder verschiedenen
Halogenatomen, jeweils geradkettiges oder verzweigtes
Halogenalkenyl oder Halogenalkenyloxy mit jeweils 2 bis 6 Kohlenstoffatomen
und 1 bis 13 gleichen oder verschiedenen Halogenatomen,
jeweils geradkettiges oder verzweigtes N-Alkylamino, Dialkylamino,
Alkylcarbonyl, Alkylcarbonyloxy, Alkoxycarbonyl
Alkylsulfonyloxy oder Hydroximinoalkyl mit jeweils 1 bis 6 Kohlenstoffatomen
in den einzelnen Alkyl- bzw. Alkoxyteilen steht,
außerdem für gegebenenfalls einfach bis dreifach, gleichartig oder
verschieden durch Halogen und/oder Alkyl mit 1 bis 4 Kohlenstoffatomen
substituiertes Cycloalkyl mit 3 bis 7 Kohlenstoffatomen
steht,
ferner für gegebenenfalls einfach bis dreifach, gleichartig oder verschieden durch Halogen und/oder Alkyl mit 1 bis 4 Kohlenstoffatomen substituiertes 3-bis 7-gliedriges Heterocyclyl mit 2 bis 6 Kohlenstoffatomen und 1 bis 3 gleichen oder verschiedenen Heteroatomen steht,
und weiterhin
für Phenyl, Phenoxy, Benzyl, Benzyloxy, Phenylethyl oder Phenylethyloxy steht, wobei jeder dieser Reste im Phenylteil einfach bis fünffach, gleichartig oder verschieden substituiert sein kann durch Halogen, geradkettiges oder verzweigtes Alkyl mit 1 bis 4 Kohlenstoffatomen, geradkettiges oder verzweigtes Halogenalkyl mit 1 bis 4 Kohlenstoffatomen und 1 bis 9 gleichen oder verschiedenen Halogenatomen, geradkettiges oder verzweigtes Alkoxy mit 1 bis 4 Kohlenstoffatomen und oder geradkettiges oder verzweigtes Halogenalkoxy mit 1 bis 4 Kohlenstoffatomen und 1 bis 9 gleichen oder verschiedenen Halogenatomen,
und - R7
- für jeweils geradkettiges oder verzweigtes Halogenalkoxy oder Halogenalkylthio mit jeweils 1 bis 8 Kohlenstoffatomen und 1 bis 17 gleichen oder verschiedenen Halogenatomen steht oder
- R6 und R7
- gemeinsam für einen gegebenenfalls einfach bis sechsfach, gleichartig oder verschieden durch Halogen, geradkettiges oder verzweigtes Halogenalkyl mit 1 bis 6 Kohlenstoffatomen und 1 bis 13 gleichen oder verschiedenen Halogenatomen substituierten zweifach verknüpften Alkandiylrest mit 1 bis 5 Kohlenstoffatomen stehen, der 1 bis 3 Sauerstoff- und/oder Schwefelatome enthält.
- Verbindungen der Formel (I) gemäß Anspruch 1, in denen
- R1
- für Wasserstoff, geradkettiges oder verzweigtes Alkyl mit 1 bis 6 Kohlenstoffatomen oder geradkettiges oder verzweigtes Alkoxy mit 1 bis 6 Kohlenstoffatomen steht,
- R2
- für Wasserstoff, geradkettiges oder verzweigtes Alkyl mit 1 bis 6 Kohlenstoffatomen oder geradkettiges oder verzweigtes Alkoxy mit 1 bis 6 Kohlenstoffatomen steht,
- R3
- für Wasserstoff, geradkettiges oder verzweigtes Alkyl mit 1 bis 6 Kohlenstoffatomen oder geradkettiges oder verzweigtes Alkoxy mit 1 bis 6 Kohlenstoffatomen steht,
- R4
- für Fluor, Chlor, Brom, Cyano, Nitro, Formyl, Carbamoyl,
Thiocarbamoyl, jeweils geradkettiges oder verzweigtes Alkyl,
Alkoxy, Alkylthio, Alkylsulfinyl oder Alkylsulfonyl mit jeweils 1
bis 4 Kohlenstoffatomen, jeweils geradkettiges oder verzweigtes
Alkenyl oder Alkenyloxy mit jeweils 2 bis 4 Kohlenstoffatomen,
jeweils geradkettiges oder verzweigtes Halogenalkyl, Halogenalkoxy,
Halogenalkylthio, Halogenalkylsulfinyl oder Halogenalkylsulfonyl
mit jeweils 1 bis 4 Kohlenstoffatomen und 1 bis 9 Fluor-,
Chlor- und/oder Bromatomen, jeweils geradkettiges oder verzweigtes
Halogenalkenyl oder Halogenalkenyloxy mit jeweils 2 bis 4
Kohlenstoffatomen und 1 bis 9 Fluor-, Chlor- und/oder
Bromatomen, jeweils geradkettiges oder verzweigtes N-Alkylamino,
Dialkylamino, Alkylcarbonyl, Alkylcarbonyloxy, Alkoxycarbonyl,
Alkylsulfonyloxy, Hydroximinoalkyl oder Alkoximinoalkyl mit
jeweils 1 bis 4 Kohlenstoffatomen in den einzelnen Alkyl- bzw.
Alkoxyteilen,
außerdem für gegebenenfalls einfach bis dreifach, gleichartig oder verschieden durch Fluor, Chlor, Methyl und/oder Ethyl substituiertes Cycloalkyl mit 3 bis 6 Kohlenstoffatomen,
ferner für gegebenenfalls einfach bis dreifach, gleichartig oder verschieden durch Fluor, Chlor, Methyl und/oder Ethyl substituiertes, 3-bis 7-gliedriges Heterocyclyl mit 2 bis 5 Kohlenstoffatomen und 1 bis 3 gleichen oder verschiedenen Heteroatomen, wie Stickstoff, Sauerstoff und/oder Schwefel,
und weiterhin
für Phenyl, Phenoxy, Benzyl, Benzyloxy, Phenylethyl oder Phenylethyloxy, wobei jeder dieser Reste im Phenylteil einfach bis fünffach, gleichartig oder verschieden substituiert sein kann durch Fluor, Chlor, Brom, geradkettiges oder verzweigtes Alkyl mit 1 bis 3 Kohlenstoffatomen, geradkettiges oder verzweigtes Halogenalkyl mit 1 bis 3 Kohlenstoffatomen und 1 bis 7 Fluor-, Chlor- und/oder Bromatomen, geradkettiges oder verzweigtes Alkoxy mit 1 bis 3 Kohlenstoffatomen und/oder geradkettiges oder verzweigtes Halogenalkoxy mit 1 bis 3 Kohlenstoffatomen und 1 bis 7 Fluor-, Chlor-und/oder Bromatomen steht, - R5
- für Fluor, Chlor, Brom, Cyano, Nitro, Formyl, Carbamoyl,
Thiocarbamoyl, jeweils geradkettiges oder verzweigtes Alkyl, Alkoxy,
Alkylthio, Alkylsulfinyl oder Alkylsulfonyl mit jeweils 1 bis 4
Kohlenstoffatomen, jeweils geradkettiges oder verzweigtes Alkenyl
oder Alkenyloxy mit jeweils 2 bis 4 Kohlenstoffatomen, jeweils geradkettiges
oder verzweigtes Halogenalkyl, Halogenalkoxy, Halogenalkylthio,
Halogenalkylsulfinyl oder Halogenalkylsulfonyl mit jeweils
1 bis 4 Kohlenstoffatomen und 1 bis 9 Fluor-, Chlor-und/oder
Bromatomen, jeweils geradkettiges oder verzweigtes Halogenalkenyl
oder Halogenalkenyloxy mit jeweils 2 bis 4 Kohlenstoffatomen und
1 bis 9 Fluor-, Chlor-und/oder Bromatomen, jeweils geradkettiges
oder verzweigtes N-Alkylamino, Dialkylamino, Alkylcarbonyl,
Alkylcarbonyloxy, Alkoxycarbonyl, Alkylsulfonyloxy oder Hydroximinoalkyl
mit jeweils 1 bis 4 Kohlenstoffatomen in den einzelnen
Alkyl-bzw. Alkoxyteilen,
außerdem für gegebenenfalls einfach bis dreifach, gleichartig oder verschieden durch Fluor, Chlor, Methyl und/oder Ethyl substituiertes Cycloalkyl mit 3 bis 6 Kohlenstoffatomen,
ferner für gegebenenfalls einfach bis dreifach, gleichartig oder verschieden durch Fluor, Chlor, Methyl und/oder Ethyl substituiertes, 3- bis 7-gliedriges Heterocyclyl mit 2 bis 5 Kohlenstoffatomen und 1 bis 3 gleichen oder verschiedenen Heteroatomen, wie Stickstoff, Sauerstoff und/oder Schwefel,
und weiterhin
für Phenyl, Phenoxy, Benzyl, Benzyloxy, Phenylethyl oder Phenylethyloxy, wobei jeder dieser Reste im Phenylteil einfach bis fünffach, gleichartig oder verschieden substituiert sein kann durch Fluor, Chlor, Brom, geradkettiges oder verzweigtes Alkyl mit 1 bis 3 Kohlenstoffatomen, geradkettiges oder verzweigtes Halogenalkyl mit 1 bis 3 Kohlenstoffatomen und 1 bis 7 Fluor-, Chlor-und/oder Bromatomen, geradkettiges oder verzweigtes Alkoxy mit 1 bis 3 Kohlenstoffatomen und/oder geradkettiges oder verzweigtes Halogenalkoxy mit 1 bis 3 Kohlenstoffatomen und 1 bis 7 Fluor-, Chlor-und/oder Bromatomen steht, - m
- für die Zahlen 0, 1, 2 oder 3 steht, wobei R4 für gleiche oder verschiedene Reste stehen kann, wenn m für 2 oder 3 steht,
- n
- für die Zahlen 1, 2 oder 3 steht, wobei R5 für gleiche oder verschiedene Reste stehen kann, wenn n für 2 oder 3 steht,
- A
- für eine Gruppierung der Formel -CH2-O-, -O-CH2-, -CH2-S-oder -S-CH2- steht,
- R6
- für Wasserstoff, Fluor, Chlor, Brom, Cyano, Nitro, Formyl, Carbamoyl,
Thiocarbamoyl, jeweils geradkettiges oder verzweigtes
Alkyl, Alkoxy, Alkylthio, Alkylsulfinyl oder Alkylsulfonyl mit
jeweils 1 bis 4 Kohlenstoffatomen, jeweils geradkettiges oder
verzweigtes Alkenyl oder Alkenyloxy mit jeweils 2 bis 4 Kohlenstoffatomen,
jeweils geradkettiges oder verzweigtes Halogenalkyl,
Halogenalkoxy, Halogenalkylthio, Halogenalkylsulfinyl oder
Halogenalkylsulfonyl mit jeweils 1 bis 4 Kohlenstoffatomen und 1
bis 9 Fluor-, Chlor-und/oder Bromatomen, jeweils geradkettiges
oder verzweigtes Halogenalkenyl oder Halogenalkenyloxy mit
jeweils 2 bis 4 Kohlenstoffatomen und 1 bis 9 Fluor-, Chlor-
und/oder Bromatomen, jeweils geradkettiges oder verzweigtes
N-Alkylamino, Dialkylamino, Alkylcarbonyl, Alkylcarbonyloxy,
Alkoxycarbonyl, Alkylsulfonyloxy oder Hydroximinoalkyl mit
jeweils 1 bis 4 Kohlenstoffatomen in den einzelnen Alkyl-bzw.
Alkoxyteilen,
außerdem für gegebenenfalls einfach bis dreifach, gleichartig oder verschieden durch Fluor, Chlor, Methyl und/oder Ethyl substituiertes Cycloalkyl mit 3 bis 6 Kohlenstoffatomen,
ferner für gegebenenfalls einfach bis dreifach, gleichartig oder verschieden durch Fluor, Chlor, Methyl und/oder Ethyl substituiertes, 3- bis 7-gliedriges Heterocyclyl mit 2 bis 5 Kohlenstoffatomen und 1 bis 3 gleichen oder verschiedenen Heteroatomen, wie Stickstoff, Sauerstoff und/oder Schwefel,
und weiterhin
für Phenyl, Phenoxy, Benzyl, Benzyloxy, Phenylethyl oder Phenylethyloxy, wobei jeder dieser Reste im Phenylteil einfach bis fünffach, gleichartig oder verschieden substituiert sein kann durch Fluor, Chlor, Brom, geradkettiges oder verzweigtes Alkyl mit 1 bis 3 Kohlenstoffatomen, geradkettiges oder verzweigtes Halogenalkyl mit 1 bis 3 Kohlenstoffatomen und 1 bis 7 Fluor-, Chlor-und/oder Bromatomen, geradkettiges oder verzweigtes Alkoxy mit 1 bis 3 Kohlenstoffatomen und/oder geradkettiges oder verzweigtes Halogenalkoxy mit 1 bis 3 Kohlenstoffatomen und 1 bis 7 Fluor-, Chlor- und/oder Bromatomen steht, - R7
- für jeweils geradkettiges oder verzweigtes Halogenalkoxy oder Halogenalkylthio mit jeweils 1 bis 4 Kohlenstoffatomen und 1 bis 9 Fluor-, Chlor-und/oder Bromatomen steht,
- R6 und R7
- außerdem auch gemeinsam für einen gegebenenfalls einfach bis sechsfach, gleichartig oder verschieden durch Fluor, Chlor, Brom, geradkettiges oder verzweigtes Alkyl mit 1 bis 4 Kohlenstoffatomen und/oder geradkettiges oder verzweigtes Halogenalkyl mit 1 bis 4 Kohlenstoffatomen und 1 bis 9 Fluor-, Chlor- und/oder Bromatomen substituierten zweifach verknüpften Alkandiylrest mit 1 bis 4 Kohlenstoffatomen, der 1 oder 2 Sauerstoff-und/oder Schwefelatome enthält stehen.
- Verbindungen der Formel (I) gemäß Anspruch 1, in denen
- R1
- für Wasserstoff, geradkettiges oder verzweigtes Alkyl mit 1 bis 4 Kohlenstoffatomen oder für geradkettiges oder verzweigtes Alkoxy mit 1 bis 4 Kohlenstoffatomen steht,
- R2
- für Wasserstoff, geradkettiges oder verzweigtes Alkyl mit 1 bis 4 Kohlenstoffatomen oder für geradkettiges oder verzweigtes Alkoxy mit 1 bis 4 Kohlenstoffatomen steht,
- R3
- für Wasserstoff, geradkettiges oder verzweigtes Alkyl mit 1 bis 4 Kohlenstoffatomen oder für geradkettiges oder verzweigtes Alkoxy mit 1 bis 4 Kohlenstoffatomen steht,
- R4
- für Fluor, Chlor, Brom, Cyano, Nitro, Formyl, Carbamoyl, Thiocarbamoyl, Methyl, Ethyl, n-oder i-Propyl, n-, i-, s-oder t-Butyl, Methoxy, Ethoxy, n-oder i-Propoxy, n-, i-, s-oder t-Butoxy, Methylthio, Ethylthio, Methylsulfinyl, Methylsulfonyl, Allyl, Butenyl, Allyloxy, Butenyloxy, Trifluormethyl, Trifluormethoxy Difluormethoxy, Trifluormethylthio, Difluorchlormethylthio, Trifluormethyl sulfinyl, Trifluormethylsulfonyl, Dimethylamino, Diethylamino, Acetyl, Acetoxy, Methylsulfonyloxy, Ethylsulfonyloxy, Methoxycarbonyl, Ethoxycarbonyl, Hydroximinomethyl, Hydroximinoethyl, Methoximinomethyl, Methoximinoethyl, Ethoximinomethyl, Ethoximinoethyl, Cyclopropyl, Cyclopentyl, Cyclohexyl, 1-Pyrrolidinyl, 1-Piperidinyl, 1-Perhydroazepinyl, 4-Morpholinyl oder für Phenyl, Phenoxy, Benzyl, Benzyloxy, Phenylethyl oder Phenylethyloxy, wobei jeder der sechs letztgenannten Reste im Phenylteil einfach bis dreifach, gleichartig oder verschieden substituiert sein kann durch Fluor, Chlor, Brom, Methyl, Ethyl, Methoxy, Ethoxy, Trifluormethyl und/oder Trifluormethoxy steht,
- R5
- für Fluor, Chlor, Brom, Cyano, Nitro, Formyl, Carbamoyl, Thiocarbamoyl, Methyl, Ethyl, n-oder 1-Propyl, n-, i-, s-oder t-Butyl, Methoxy, Ethoxy, n-oder i-Propoxy, n-, i-, s- oder t-Butoxy, Methylthio, Ethylthio, Methylsulfinyl, Methylsulfonyl, Allyl, Butenyl, Allyloxy, Butenyloxy, Trifluormethyl, Trifluormethoxy, Difluormethoxy, Trifluormethylthio, Difluorchlormethylthio, Trifluormethylsulfinyl, Trifluormethylsulfonyl, Dimethylamino, Diethylamino, Acetyl, Acetoxy, Methylsulfonyloxy, Ethylsulfonyloxy, Methoxycarbonyl, Ethoxycarbonyl, Hydroximinomethyl, Hydroximinoethyl, Cyclopropyl, Cyclopentyl, Cyclohexyl, 1-Pyrrolidinyl, 1-Piperidinyl, 1-Perhydroazepinyl, 4-Morpholinyl oder für Phenyl, Phenoxy, Benzyl, Benzyloxy, Phenylethyl oder Phenylethyloxy, wobei jeder der sechs letztgenannten Reste im Phenylteil einfach bis dreifach, gleichartig oder verschieden substituiert sein kann durch Fluor, Chlor, Brom, Methyl, Ethyl, Methoxy, Ethoxy, Trifluormethyl und/oder Trifluormethoxy steht,
- m
- für die Zahlen 0, 1 oder 2 steht, wobei R4 für gleiche oder verschiedene Reste stehen kann, wenn m für 2 steht,
- n
- für die Zahlen 1 oder 2 steht, wobei R5 für gleiche oder verschiedene Reste stehen kann, wenn n für 2 steht.
- A
- für eine Gruppierung der Formel -CH2-O-, -O-CH2-, -CH2-S-oder -S-CH2- steht,
- R6
- für Wasserstoff, Fluor, Chlor, Brom, Cyano, Formyl, Formyl, Carbamoyl, Thiocarbamoyl, Methyl, Ethyl, n-oder i-Propyl, n-, i-, s-oder t-Butyl, Methoxy, Ethoxy, n-oder i-Propoxy, n-, i-, s-oder t-Butoxy, Methylthio, Ethylthio, Methylsulfinyl, Methylsulfonyl, Allyl, Butenyl, Allyloxy, Butenyloxy, Trifluormethyl, Trifluormethoxy, Difluormethoxy, Trifluormethylthio, Difluorchlormethylthio, Trifluormethylsulfinyl, Trifluormethylsulfonyl, Dimethylamino, Diethylamino, Acetyl, Acetoxy, Methylsulfonyloxy, Ethylsulfonyloxy, Methoxycarbonyl, Ethoxycarbonyl, Hydroximinomethyl, Hydroximinoethyl, Cyclopropyl, Cyclopentyl, Cyclohexyl, 1-Pyrrolidinyl, 1-Piperidinyl, 1-Perhydroazepinyl, 4-Morpholinyl oder für Phenyl, Phenoxy, Benzyl, Benzyloxy, Phenylethyl oder Phenylethyloxy, wobei jeder der sechs letztgenannten Reste im Phenylteil einfach bis dreifach, gleichartig oder verschieden substituiert sein kann durch Fluor, Chlor, Brom, Methyl, Ethyl, Methoxy, Ethoxy, Trifluormethyl und/oder Trifluormethoxy steht,
- R7
- für geradkettiges oder verzweigtes Halogenalkoxy mit 1 bis 3 Kohlenstoffatomen und 1 bis 7 Fluor-, Chlor-und/oder Bromatomen oder für geradkettiges oder verzweigtes Halogenalkylthio mit 1 bis 3 Kohlenstoffatomen und 1 bis 7 Fluor-, Chlor-und/oder Bromatomen steht,
- R6 und R7
- außerdem gemeinsam für einen gegebenenfalls einfach bis vierfach, gleich oder verschieden durch Fluor, Chlor, Brom, Methyl, Ethyl und/oder Trifluormethyl substituierten zweifach verknüpften Alkandiylrest mit 1 bis 3 Kohlenstoffatomen, der 1 bis 2 Sauerstoff-oder Schwefelatome enthält, stehen.
- Verfahren zur Herstellung von 2-Oximino-2-phenyl-acetamiden der Formel in welcher
- R1, R2, R3, R4, R5, R6, R7, m, n und A
- die in Anspruch 1 angegebenen Bedeutungen haben,
- R2, R4, R5, R6, R7, A, m und n
- die oben angegebenen Bedeutungen haben und
- R
- für Alkyl steht,
- R1 und R2
- die oben angegebenen Bedeutungen haben,
- Schädlingsbekämpfungsmittel, gekennzeichnet durch einen Gehalt an mindestens einem 2-Oximino-2-phenyl-acetamid der Formel (I) gemäß Anspruch 1.
- Verwendung von 2-Oximino-2-phenyl-acetamiden der Formel (I) gemäß Anspruch 1 zur Bekämpfung von Schädlingen.
- Verfahren zur Bekämpfung von Schädlingen, dadurch gekennzeichnet, daß man 2-Oximino-2-phenyl-acetamide der Formel (I) gemäß Anspruch 1 auf die Schädlinge und/oder deren Lebensraum ausbringt.
- Verfahren zur Herstellung von Schädlingsbekämpfungsmitteln, dadurch gekennzeichnet, daß man 2-Oximino-2-phenyl-acetamide der Formel (I) gemäß Anspruch 1 mit Streckmitteln und/oder oberflächenaktiven Stoffen vermischt.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE4318917 | 1993-06-07 | ||
| DE4318917A DE4318917A1 (de) | 1993-06-07 | 1993-06-07 | 2-Oximino-2-phenyl-acetamide |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| EP0628540A1 EP0628540A1 (de) | 1994-12-14 |
| EP0628540B1 true EP0628540B1 (de) | 1999-01-20 |
Family
ID=6489832
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| EP94108040A Expired - Lifetime EP0628540B1 (de) | 1993-06-07 | 1994-05-25 | 2-Oximino-2-phenyl-acetamide |
Country Status (10)
| Country | Link |
|---|---|
| US (1) | US5534550A (de) |
| EP (1) | EP0628540B1 (de) |
| JP (1) | JPH072750A (de) |
| KR (1) | KR950000652A (de) |
| CN (1) | CN1105659A (de) |
| BR (1) | BR9402180A (de) |
| DE (2) | DE4318917A1 (de) |
| HU (1) | HUT67895A (de) |
| IL (1) | IL109890A0 (de) |
| ZA (1) | ZA943943B (de) |
Families Citing this family (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE4426940A1 (de) * | 1994-07-29 | 1996-02-01 | Bayer Ag | N-Alkoxy-amidin-Derivate |
| RU2167853C2 (ru) * | 1995-01-30 | 2001-05-27 | Байер Аг | Амиды алкоксиминоуксусной кислоты, фунгицидное средство на их основе и способ борьбы с грибковыми заболеваниями растений |
| CA2206148A1 (en) * | 1996-06-06 | 1997-12-06 | Ted Tsutomu Fujimoto | Benzyloxy substituted aromatics and their use as fungicides and insecticides |
| KR100311846B1 (ko) | 1999-07-05 | 2001-10-18 | 우종일 | 신규 아크릴레이트계 살균제 |
| KR100352942B1 (ko) * | 1999-09-08 | 2002-09-16 | 한국화학연구원 | 술파이드 또는 술폰기가 치환된 불소화 비닐옥시아세트아미드 유도체, 이의 제조 방법 및 이를 포함하는 제초제 조성물 |
| DE19956920A1 (de) | 1999-11-26 | 2001-05-31 | Bayer Ag | Verfahren zur Herstellung von 2-(2-Hydrodyphenyl)-2-(alkoxyimino)-N-methyl-acetamid-Derivaten |
| CN1711024A (zh) | 2002-11-12 | 2005-12-21 | 巴斯福股份公司 | 提高耐受草甘膦的豆类产率的方法 |
| BRPI0708283A2 (pt) * | 2006-03-14 | 2011-05-24 | Basf Se | método para induzir toleráncia contra bacterioses de plantas, e, uso das combinações |
| AU2007229569B2 (en) | 2006-03-24 | 2012-07-12 | Basf Se | Method for combating phytopathogenic fungi |
| US20100234366A1 (en) * | 2006-03-29 | 2010-09-16 | Bsf Se | Use of Strobilurins for the Treatment of Disorders of Iron Metabolism |
| CL2008001181A1 (es) | 2007-04-23 | 2009-10-23 | Basf Se | Metodo para mejorar la salud de la planta y/o controlar plagas en plantas con al menos una modificacion transgenica relacionada con el aumento del rendimiento que consiste en la aplicacion de una composicion quimica que comprende al menos un ingrediente activo seleccionado de insecticidas, fungicidas o herbicidas. |
| NZ581625A (en) * | 2007-06-29 | 2012-08-31 | Basf Se | Strobilurins for increasing the resistance of plants to abiotic stress |
| AU2010277748A1 (en) | 2009-07-28 | 2012-03-08 | Basf Se | A method for increasing the level of free amino acids in storage tissues of perennial plants |
| KR20120106941A (ko) | 2009-09-25 | 2012-09-27 | 바스프 에스이 | 식물에서의 암꽃의 조기낙화를 감소시키는 방법 |
| WO2017076982A1 (en) * | 2015-11-04 | 2017-05-11 | Syngenta Participations Ag | Microbiocidal anilide derivatives |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5185342A (en) * | 1989-05-17 | 1993-02-09 | Shionogi Seiyaku Kabushiki Kaisha | Alkoxyiminoacetamide derivatives and their use as fungicides |
| JP2897789B2 (ja) * | 1990-11-16 | 1999-05-31 | 塩野義製薬株式会社 | アルコキシイミノ酢酸アミド化合物およびその農業用殺菌剤としての用途 |
| JP3121061B2 (ja) * | 1991-10-04 | 2000-12-25 | 塩野義製薬株式会社 | アルコキシイミノアセトアミド類製造用中間体の製造法およびそれに用いる中間体 |
| ATE172597T1 (de) * | 1992-07-15 | 1998-11-15 | Basf Ag | Substituierte oximether und ihre verwendung zur bekämpfung von schädlingen |
-
1993
- 1993-06-07 DE DE4318917A patent/DE4318917A1/de not_active Withdrawn
-
1994
- 1994-05-25 DE DE59407673T patent/DE59407673D1/de not_active Expired - Fee Related
- 1994-05-25 EP EP94108040A patent/EP0628540B1/de not_active Expired - Lifetime
- 1994-05-31 US US08/251,807 patent/US5534550A/en not_active Expired - Fee Related
- 1994-06-02 JP JP6142236A patent/JPH072750A/ja active Pending
- 1994-06-02 KR KR1019940012426A patent/KR950000652A/ko not_active Withdrawn
- 1994-06-03 IL IL10989094A patent/IL109890A0/xx unknown
- 1994-06-06 HU HU9401691A patent/HUT67895A/hu unknown
- 1994-06-06 BR BR9402180A patent/BR9402180A/pt not_active Application Discontinuation
- 1994-06-06 ZA ZA943943A patent/ZA943943B/xx unknown
- 1994-06-07 CN CN94106539A patent/CN1105659A/zh active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| ZA943943B (en) | 1995-02-01 |
| HUT67895A (en) | 1995-05-29 |
| JPH072750A (ja) | 1995-01-06 |
| CN1105659A (zh) | 1995-07-26 |
| US5534550A (en) | 1996-07-09 |
| KR950000652A (ko) | 1995-01-03 |
| IL109890A0 (en) | 1994-10-07 |
| EP0628540A1 (de) | 1994-12-14 |
| DE4318917A1 (de) | 1994-12-08 |
| DE59407673D1 (de) | 1999-03-04 |
| HU9401691D0 (en) | 1994-09-28 |
| BR9402180A (pt) | 1995-05-02 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP0628540B1 (de) | 2-Oximino-2-phenyl-acetamide | |
| EP0389901B1 (de) | Thiadiazol-substituierte Acrylsäureester und neue Zwischenprodukte | |
| EP0248288A2 (de) | Trisubstituierte 1,3,5-Triazin-2,4,6-trione | |
| EP0584625B1 (de) | Pyridyloxy-acrylsäureester | |
| EP0464381A2 (de) | 2-Methoximinocarbonsäureester | |
| EP0281731A2 (de) | 1-Aminomethyl-3-aryl-4-cyano-pyrrole | |
| EP0331966B1 (de) | Substituierte Acrylsäureester | |
| EP0531821B1 (de) | 1-Alkoxyhexatrien-2-carbonsäureester | |
| EP0554729B1 (de) | Substituierte Aminosäureamide | |
| DE4341066A1 (de) | Oxa(Thia)-diazol-oxy-phenylacrylate | |
| DE4239727A1 (de) | Pyridyl-1,2,4-thiadiazole | |
| EP0590458A1 (de) | Substituierte Thiophencarbonsäureamide | |
| EP0608739B1 (de) | Cycloalkylcarbonsäureanilide | |
| EP0277537B1 (de) | 1-Aminomethyl-3-aryl-4-cyano-pyrrole | |
| EP0557860B1 (de) | Substituierte Pyridylpyrimidine und ihre Verwendung als Schädlingsbekämpfungsmittel | |
| DE3805059A1 (de) | Heterocyclisch substituierte acrylsaeureester | |
| WO1992017066A1 (de) | Substituierte salicylamide, mittel gegen pflanzenkrankheiten | |
| EP0422461A2 (de) | Trisubstituierte 1,3,5-Triazin-2,4,6-trione | |
| DE4328385A1 (de) | 2-Oximino-2-pyridyl-essigsäurederivate | |
| EP0387499B1 (de) | Substituierte Oximether sowie deren Verwendung als Schädlingsbekämpfungsmittel | |
| DE3831402A1 (de) | Substituierte pyrimidyl- bzw. pyridylalkinole, verfahren zu ihrer herstellung und ihre verwendung in schaedlingsbekaempfungsmitteln | |
| DE4316431A1 (de) | 3-Methoxy-2-phenyl-acrylsäureester | |
| EP0269929A1 (de) | Chlor-1,2,4-oxadiazole | |
| DE4314272A1 (de) | 3-Methoxy-2-phenyl-acrylsäureester | |
| DE3707687A1 (de) | Benzaldoxim-carbamat-derivate |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PUAI | Public reference made under article 153(3) epc to a published international application that has entered the european phase |
Free format text: ORIGINAL CODE: 0009012 |
|
| AK | Designated contracting states |
Kind code of ref document: A1 Designated state(s): BE CH DE ES FR GB GR IT LI NL PT |
|
| 17P | Request for examination filed |
Effective date: 19950428 |
|
| 17Q | First examination report despatched |
Effective date: 19960403 |
|
| GRAG | Despatch of communication of intention to grant |
Free format text: ORIGINAL CODE: EPIDOS AGRA |
|
| GRAG | Despatch of communication of intention to grant |
Free format text: ORIGINAL CODE: EPIDOS AGRA |
|
| GRAH | Despatch of communication of intention to grant a patent |
Free format text: ORIGINAL CODE: EPIDOS IGRA |
|
| GRAH | Despatch of communication of intention to grant a patent |
Free format text: ORIGINAL CODE: EPIDOS IGRA |
|
| GRAA | (expected) grant |
Free format text: ORIGINAL CODE: 0009210 |
|
| AK | Designated contracting states |
Kind code of ref document: B1 Designated state(s): BE CH DE ES FR GB GR IT LI NL PT |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: NL Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 19990120 Ref country code: IT Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT;WARNING: LAPSES OF ITALIAN PATENTS WITH EFFECTIVE DATE BEFORE 2007 MAY HAVE OCCURRED AT ANY TIME BEFORE 2007. THE CORRECT EFFECTIVE DATE MAY BE DIFFERENT FROM THE ONE RECORDED. Effective date: 19990120 Ref country code: GR Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 19990120 Ref country code: ES Free format text: THE PATENT HAS BEEN ANNULLED BY A DECISION OF A NATIONAL AUTHORITY Effective date: 19990120 |
|
| REG | Reference to a national code |
Ref country code: CH Ref legal event code: EP |
|
| ET | Fr: translation filed | ||
| GBT | Gb: translation of ep patent filed (gb section 77(6)(a)/1977) |
Effective date: 19990129 |
|
| REF | Corresponds to: |
Ref document number: 59407673 Country of ref document: DE Date of ref document: 19990304 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: PT Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 19990420 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: LI Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 19990531 Ref country code: CH Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 19990531 Ref country code: BE Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 19990531 |
|
| NLV1 | Nl: lapsed or annulled due to failure to fulfill the requirements of art. 29p and 29m of the patents act | ||
| PLBE | No opposition filed within time limit |
Free format text: ORIGINAL CODE: 0009261 |
|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: NO OPPOSITION FILED WITHIN TIME LIMIT |
|
| BERE | Be: lapsed |
Owner name: BAYER A.G. Effective date: 19990531 |
|
| REG | Reference to a national code |
Ref country code: CH Ref legal event code: PL |
|
| 26N | No opposition filed | ||
| REG | Reference to a national code |
Ref country code: GB Ref legal event code: IF02 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: FR Payment date: 20060424 Year of fee payment: 13 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: DE Payment date: 20060428 Year of fee payment: 13 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: GB Payment date: 20060524 Year of fee payment: 13 |
|
| GBPC | Gb: european patent ceased through non-payment of renewal fee |
Effective date: 20070525 |
|
| REG | Reference to a national code |
Ref country code: FR Ref legal event code: ST Effective date: 20080131 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: DE Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20071201 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: GB Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20070525 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: FR Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20070531 |