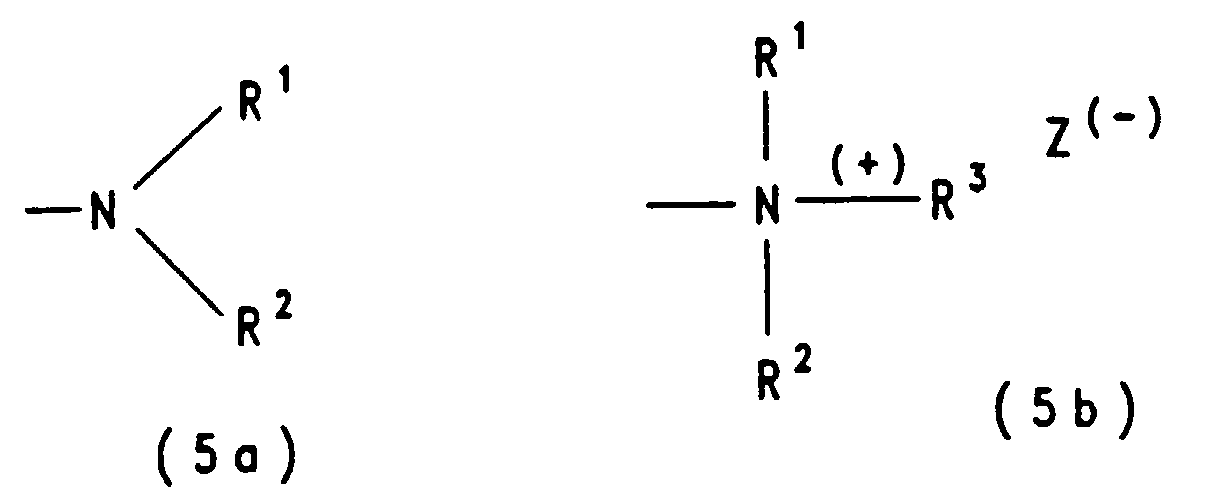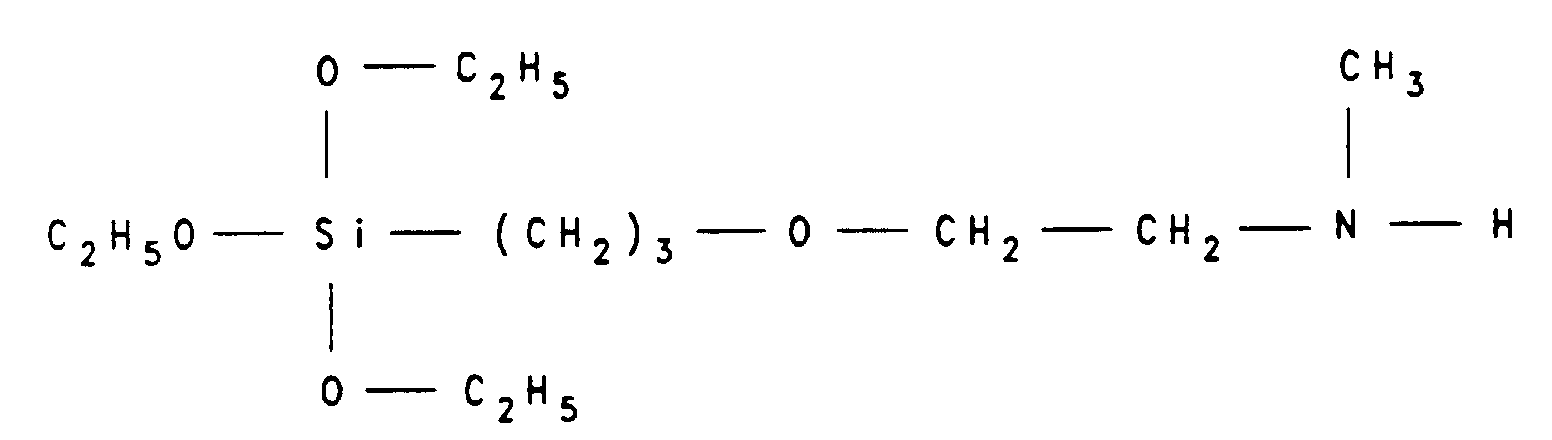EP0590397B1 - Process for the preparation of dyes following the ink-jet print technique on modified fiber materials with anionic textile dyesstuffs - Google Patents
Process for the preparation of dyes following the ink-jet print technique on modified fiber materials with anionic textile dyesstuffs Download PDFInfo
- Publication number
- EP0590397B1 EP0590397B1 EP93114661A EP93114661A EP0590397B1 EP 0590397 B1 EP0590397 B1 EP 0590397B1 EP 93114661 A EP93114661 A EP 93114661A EP 93114661 A EP93114661 A EP 93114661A EP 0590397 B1 EP0590397 B1 EP 0590397B1
- Authority
- EP
- European Patent Office
- Prior art keywords
- carbon atoms
- group
- methyl
- substituted
- ethoxy
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 239000000975 dye Substances 0.000 title claims abstract description 81
- 238000000034 method Methods 0.000 title claims abstract description 66
- 230000008569 process Effects 0.000 title claims abstract description 34
- 125000000129 anionic group Chemical group 0.000 title claims abstract description 16
- 239000002657 fibrous material Substances 0.000 title claims description 52
- 239000004753 textile Substances 0.000 title description 5
- 238000002360 preparation method Methods 0.000 title description 4
- 150000001875 compounds Chemical class 0.000 claims abstract description 40
- 239000007864 aqueous solution Substances 0.000 claims abstract description 34
- 239000000985 reactive dye Substances 0.000 claims abstract description 16
- 238000004043 dyeing Methods 0.000 claims abstract description 15
- 238000007641 inkjet printing Methods 0.000 claims abstract description 10
- 229920003043 Cellulose fiber Polymers 0.000 claims abstract description 8
- 239000003792 electrolyte Substances 0.000 claims abstract description 7
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims abstract description 7
- 125000000623 heterocyclic group Chemical group 0.000 claims abstract description 5
- 239000007921 spray Substances 0.000 claims abstract description 5
- QGZKDVFQNNGYKY-UHFFFAOYSA-O ammonium group Chemical group [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 claims abstract description 4
- -1 amino, sulfo, hydroxyl Chemical group 0.000 claims description 260
- 125000004432 carbon atom Chemical group C* 0.000 claims description 137
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 61
- 125000000217 alkyl group Chemical group 0.000 claims description 57
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims description 48
- 125000003545 alkoxy group Chemical group 0.000 claims description 44
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 41
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 41
- 239000001257 hydrogen Substances 0.000 claims description 35
- 229910052739 hydrogen Inorganic materials 0.000 claims description 35
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 26
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 25
- 125000000020 sulfo group Chemical group O=S(=O)([*])O[H] 0.000 claims description 25
- 125000003277 amino group Chemical group 0.000 claims description 24
- 125000002947 alkylene group Chemical group 0.000 claims description 18
- 229910052736 halogen Inorganic materials 0.000 claims description 15
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 15
- 125000001424 substituent group Chemical group 0.000 claims description 15
- 125000003342 alkenyl group Chemical group 0.000 claims description 14
- 150000002367 halogens Chemical class 0.000 claims description 14
- 229910052783 alkali metal Inorganic materials 0.000 claims description 9
- 150000001450 anions Chemical class 0.000 claims description 9
- 125000005842 heteroatom Chemical group 0.000 claims description 8
- 229910052757 nitrogen Inorganic materials 0.000 claims description 7
- 125000000843 phenylene group Chemical group C1(=C(C=CC=C1)*)* 0.000 claims description 6
- 150000001340 alkali metals Chemical class 0.000 claims description 5
- 125000004185 ester group Chemical group 0.000 claims description 5
- 125000000304 alkynyl group Chemical group 0.000 claims description 4
- 229910052799 carbon Inorganic materials 0.000 claims description 4
- 125000004430 oxygen atom Chemical group O* 0.000 claims description 4
- 125000003368 amide group Chemical group 0.000 claims description 3
- PXBRQCKWGAHEHS-UHFFFAOYSA-N dichlorodifluoromethane Chemical group FC(F)(Cl)Cl PXBRQCKWGAHEHS-UHFFFAOYSA-N 0.000 claims description 3
- 125000004433 nitrogen atom Chemical group N* 0.000 claims description 3
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical group [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 claims description 2
- 125000002993 cycloalkylene group Chemical group 0.000 claims description 2
- 229910052710 silicon Inorganic materials 0.000 claims description 2
- 150000003573 thiols Chemical class 0.000 claims 1
- 239000000463 material Substances 0.000 abstract description 34
- 239000003513 alkali Substances 0.000 abstract description 16
- 238000011282 treatment Methods 0.000 abstract description 13
- 239000000835 fiber Substances 0.000 abstract description 12
- 238000005406 washing Methods 0.000 abstract description 11
- 239000002351 wastewater Substances 0.000 abstract description 4
- 238000010438 heat treatment Methods 0.000 abstract description 3
- 125000000467 secondary amino group Chemical group [H]N([*:1])[*:2] 0.000 abstract description 3
- 125000001453 quaternary ammonium group Chemical group 0.000 abstract 1
- 125000001302 tertiary amino group Chemical group 0.000 abstract 1
- 239000004744 fabric Substances 0.000 description 45
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 30
- 229910001868 water Inorganic materials 0.000 description 28
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 27
- 239000000243 solution Substances 0.000 description 24
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 22
- 229920000742 Cotton Polymers 0.000 description 21
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical class OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 21
- 239000000203 mixture Substances 0.000 description 20
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 19
- GLUUGHFHXGJENI-UHFFFAOYSA-N Piperazine Chemical compound C1CNCCN1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 description 18
- 150000003254 radicals Chemical class 0.000 description 18
- 238000010521 absorption reaction Methods 0.000 description 15
- 238000001035 drying Methods 0.000 description 15
- 150000002431 hydrogen Chemical class 0.000 description 14
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 13
- 238000006243 chemical reaction Methods 0.000 description 13
- 239000000976 ink Substances 0.000 description 13
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 12
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 10
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 10
- 229910000077 silane Inorganic materials 0.000 description 10
- YUYCVXFAYWRXLS-UHFFFAOYSA-N trimethoxysilane Chemical compound CO[SiH](OC)OC YUYCVXFAYWRXLS-UHFFFAOYSA-N 0.000 description 10
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 9
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 9
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 9
- 229960000583 acetic acid Drugs 0.000 description 9
- 229910052801 chlorine Inorganic materials 0.000 description 9
- 238000007639 printing Methods 0.000 description 9
- 238000009835 boiling Methods 0.000 description 8
- 239000003795 chemical substances by application Substances 0.000 description 8
- 239000000460 chlorine Substances 0.000 description 8
- 125000001301 ethoxy group Chemical group [H]C([H])([H])C([H])([H])O* 0.000 description 8
- 239000003086 colorant Substances 0.000 description 7
- 229910052700 potassium Inorganic materials 0.000 description 7
- 239000011591 potassium Substances 0.000 description 7
- 239000000047 product Substances 0.000 description 7
- 239000002904 solvent Substances 0.000 description 7
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 7
- UXFLNUWFPUQCPF-UHFFFAOYSA-N 2-[[3-[1-[diethoxy(methyl)silyl]ethyl]phenyl]methoxy]-n-methylethanamine Chemical compound CCO[Si](C)(OCC)C(C)C1=CC=CC(COCCNC)=C1 UXFLNUWFPUQCPF-UHFFFAOYSA-N 0.000 description 6
- AFOSIXZFDONLBT-UHFFFAOYSA-N divinyl sulfone Chemical class C=CS(=O)(=O)C=C AFOSIXZFDONLBT-UHFFFAOYSA-N 0.000 description 6
- 150000003839 salts Chemical class 0.000 description 6
- 150000004756 silanes Chemical class 0.000 description 6
- 238000003756 stirring Methods 0.000 description 6
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 5
- 229910052794 bromium Inorganic materials 0.000 description 5
- 238000001816 cooling Methods 0.000 description 5
- 239000012362 glacial acetic acid Substances 0.000 description 5
- AJDUTMFFZHIJEM-UHFFFAOYSA-N n-(9,10-dioxoanthracen-1-yl)-4-[4-[[4-[4-[(9,10-dioxoanthracen-1-yl)carbamoyl]phenyl]phenyl]diazenyl]phenyl]benzamide Chemical compound O=C1C2=CC=CC=C2C(=O)C2=C1C=CC=C2NC(=O)C(C=C1)=CC=C1C(C=C1)=CC=C1N=NC(C=C1)=CC=C1C(C=C1)=CC=C1C(=O)NC1=CC=CC2=C1C(=O)C1=CC=CC=C1C2=O AJDUTMFFZHIJEM-UHFFFAOYSA-N 0.000 description 5
- 239000000758 substrate Substances 0.000 description 5
- IZXIZTKNFFYFOF-UHFFFAOYSA-N 2-Oxazolidone Chemical compound O=C1NCCO1 IZXIZTKNFFYFOF-UHFFFAOYSA-N 0.000 description 4
- VFGBQAWXILJPOY-UHFFFAOYSA-N 2-[[4-[1-[diethoxy(methyl)silyl]ethyl]phenyl]methoxy]-n-methylethanamine Chemical compound CCO[Si](C)(OCC)C(C)C1=CC=C(COCCNC)C=C1 VFGBQAWXILJPOY-UHFFFAOYSA-N 0.000 description 4
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 4
- PAYRUJLWNCNPSJ-UHFFFAOYSA-N Aniline Chemical compound NC1=CC=CC=C1 PAYRUJLWNCNPSJ-UHFFFAOYSA-N 0.000 description 4
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 4
- WCUXLLCKKVVCTQ-UHFFFAOYSA-M Potassium chloride Chemical compound [Cl-].[K+] WCUXLLCKKVVCTQ-UHFFFAOYSA-M 0.000 description 4
- OSGAYBCDTDRGGQ-UHFFFAOYSA-L calcium sulfate Chemical compound [Ca+2].[O-]S([O-])(=O)=O OSGAYBCDTDRGGQ-UHFFFAOYSA-L 0.000 description 4
- 229920002678 cellulose Polymers 0.000 description 4
- 239000001913 cellulose Substances 0.000 description 4
- 125000000753 cycloalkyl group Chemical group 0.000 description 4
- 238000005470 impregnation Methods 0.000 description 4
- 238000012986 modification Methods 0.000 description 4
- 239000001007 phthalocyanine dye Substances 0.000 description 4
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 3
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 3
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 3
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 3
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 3
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 3
- 239000002253 acid Substances 0.000 description 3
- 125000006193 alkinyl group Chemical group 0.000 description 3
- 150000001414 amino alcohols Chemical class 0.000 description 3
- 239000000987 azo dye Substances 0.000 description 3
- 239000002585 base Substances 0.000 description 3
- 125000003917 carbamoyl group Chemical group [H]N([H])C(*)=O 0.000 description 3
- 229910052802 copper Inorganic materials 0.000 description 3
- 239000010949 copper Substances 0.000 description 3
- MGNCLNQXLYJVJD-UHFFFAOYSA-N cyanuric chloride Chemical compound ClC1=NC(Cl)=NC(Cl)=N1 MGNCLNQXLYJVJD-UHFFFAOYSA-N 0.000 description 3
- GAURFLBIDLSLQU-UHFFFAOYSA-N diethoxy(methyl)silicon Chemical compound CCO[Si](C)OCC GAURFLBIDLSLQU-UHFFFAOYSA-N 0.000 description 3
- 230000032050 esterification Effects 0.000 description 3
- 238000005886 esterification reaction Methods 0.000 description 3
- 239000000706 filtrate Substances 0.000 description 3
- 239000011737 fluorine Substances 0.000 description 3
- 229910052731 fluorine Inorganic materials 0.000 description 3
- 238000004508 fractional distillation Methods 0.000 description 3
- 150000002440 hydroxy compounds Chemical class 0.000 description 3
- 125000000250 methylamino group Chemical group [H]N(*)C([H])([H])[H] 0.000 description 3
- 125000004170 methylsulfonyl group Chemical group [H]C([H])([H])S(*)(=O)=O 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 230000000051 modifying effect Effects 0.000 description 3
- NFBAXHOPROOJAW-UHFFFAOYSA-N phenindione Chemical class O=C1C2=CC=CC=C2C(=O)C1C1=CC=CC=C1 NFBAXHOPROOJAW-UHFFFAOYSA-N 0.000 description 3
- 239000001044 red dye Substances 0.000 description 3
- 229910052708 sodium Inorganic materials 0.000 description 3
- 239000011734 sodium Substances 0.000 description 3
- 125000003396 thiol group Chemical class [H]S* 0.000 description 3
- 239000000080 wetting agent Substances 0.000 description 3
- 239000001043 yellow dye Substances 0.000 description 3
- 125000000022 2-aminoethyl group Chemical group [H]C([*])([H])C([H])([H])N([H])[H] 0.000 description 2
- KQIGMPWTAHJUMN-UHFFFAOYSA-N 3-aminopropane-1,2-diol Chemical compound NCC(O)CO KQIGMPWTAHJUMN-UHFFFAOYSA-N 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- VYZAMTAEIAYCRO-UHFFFAOYSA-N Chromium Chemical compound [Cr] VYZAMTAEIAYCRO-UHFFFAOYSA-N 0.000 description 2
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 2
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 2
- OPKOKAMJFNKNAS-UHFFFAOYSA-N N-methylethanolamine Chemical compound CNCCO OPKOKAMJFNKNAS-UHFFFAOYSA-N 0.000 description 2
- YGYAWVDWMABLBF-UHFFFAOYSA-N Phosgene Chemical compound ClC(Cl)=O YGYAWVDWMABLBF-UHFFFAOYSA-N 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- 239000004952 Polyamide Substances 0.000 description 2
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 2
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical compound N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 description 2
- 229920000297 Rayon Polymers 0.000 description 2
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 2
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 description 2
- 125000001931 aliphatic group Chemical group 0.000 description 2
- 239000012670 alkaline solution Substances 0.000 description 2
- 125000003282 alkyl amino group Chemical group 0.000 description 2
- 150000001412 amines Chemical class 0.000 description 2
- 229910021529 ammonia Inorganic materials 0.000 description 2
- 125000003710 aryl alkyl group Chemical group 0.000 description 2
- 150000005840 aryl radicals Chemical class 0.000 description 2
- CREXVNNSNOKDHW-UHFFFAOYSA-N azaniumylideneazanide Chemical group N[N] CREXVNNSNOKDHW-UHFFFAOYSA-N 0.000 description 2
- IOJUPLGTWVMSFF-UHFFFAOYSA-N benzothiazole Chemical compound C1=CC=C2SC=NC2=C1 IOJUPLGTWVMSFF-UHFFFAOYSA-N 0.000 description 2
- 229910000019 calcium carbonate Inorganic materials 0.000 description 2
- 125000005521 carbonamide group Chemical group 0.000 description 2
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 2
- 125000001309 chloro group Chemical group Cl* 0.000 description 2
- 229910052804 chromium Inorganic materials 0.000 description 2
- 239000011651 chromium Substances 0.000 description 2
- AOLYLEFSPFALGJ-UHFFFAOYSA-N copper formazan Chemical compound [Cu].NN=CN=N AOLYLEFSPFALGJ-UHFFFAOYSA-N 0.000 description 2
- 238000000354 decomposition reaction Methods 0.000 description 2
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 2
- 238000004821 distillation Methods 0.000 description 2
- SNRUBQQJIBEYMU-UHFFFAOYSA-N dodecane Chemical compound CCCCCCCCCCCC SNRUBQQJIBEYMU-UHFFFAOYSA-N 0.000 description 2
- 229920001971 elastomer Polymers 0.000 description 2
- 238000001914 filtration Methods 0.000 description 2
- 125000005843 halogen group Chemical group 0.000 description 2
- RBTKNAXYKSUFRK-UHFFFAOYSA-N heliogen blue Chemical compound [Cu].[N-]1C2=C(C=CC=C3)C3=C1N=C([N-]1)C3=CC=CC=C3C1=NC([N-]1)=C(C=CC=C3)C3=C1N=C([N-]1)C3=CC=CC=C3C1=N2 RBTKNAXYKSUFRK-UHFFFAOYSA-N 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 229910052744 lithium Inorganic materials 0.000 description 2
- 239000000155 melt Substances 0.000 description 2
- 238000005517 mercerization Methods 0.000 description 2
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- 230000007935 neutral effect Effects 0.000 description 2
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 2
- TVMXDCGIABBOFY-UHFFFAOYSA-N octane Chemical compound CCCCCCCC TVMXDCGIABBOFY-UHFFFAOYSA-N 0.000 description 2
- 229920002647 polyamide Polymers 0.000 description 2
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 2
- 239000001103 potassium chloride Substances 0.000 description 2
- 235000011164 potassium chloride Nutrition 0.000 description 2
- 125000002572 propoxy group Chemical group [*]OC([H])([H])C(C([H])([H])[H])([H])[H] 0.000 description 2
- 230000005855 radiation Effects 0.000 description 2
- 239000002994 raw material Substances 0.000 description 2
- 239000011541 reaction mixture Substances 0.000 description 2
- 238000010992 reflux Methods 0.000 description 2
- 239000005060 rubber Substances 0.000 description 2
- 125000001439 semicarbazido group Chemical group [H]N([H])C(=O)N([H])N([H])* 0.000 description 2
- 239000000344 soap Substances 0.000 description 2
- 238000005507 spraying Methods 0.000 description 2
- 239000007858 starting material Substances 0.000 description 2
- 238000010025 steaming Methods 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- CYRMSUTZVYGINF-UHFFFAOYSA-N trichlorofluoromethane Chemical group FC(Cl)(Cl)Cl CYRMSUTZVYGINF-UHFFFAOYSA-N 0.000 description 2
- QQQSFSZALRVCSZ-UHFFFAOYSA-N triethoxysilane Chemical compound CCO[SiH](OCC)OCC QQQSFSZALRVCSZ-UHFFFAOYSA-N 0.000 description 2
- 238000005292 vacuum distillation Methods 0.000 description 2
- 210000002268 wool Anatomy 0.000 description 2
- RHUYHJGZWVXEHW-UHFFFAOYSA-N 1,1-Dimethyhydrazine Chemical compound CN(C)N RHUYHJGZWVXEHW-UHFFFAOYSA-N 0.000 description 1
- JYEUMXHLPRZUAT-UHFFFAOYSA-N 1,2,3-triazine Chemical group C1=CN=NN=C1 JYEUMXHLPRZUAT-UHFFFAOYSA-N 0.000 description 1
- 125000000355 1,3-benzoxazolyl group Chemical group O1C(=NC2=C1C=CC=C2)* 0.000 description 1
- HYZJCKYKOHLVJF-UHFFFAOYSA-N 1H-benzimidazole Chemical compound C1=CC=C2NC=NC2=C1 HYZJCKYKOHLVJF-UHFFFAOYSA-N 0.000 description 1
- VEPOHXYIFQMVHW-XOZOLZJESA-N 2,3-dihydroxybutanedioic acid (2S,3S)-3,4-dimethyl-2-phenylmorpholine Chemical compound OC(C(O)C(O)=O)C(O)=O.C[C@H]1[C@@H](OCCN1C)c1ccccc1 VEPOHXYIFQMVHW-XOZOLZJESA-N 0.000 description 1
- KZTWONRVIPPDKH-UHFFFAOYSA-N 2-(piperidin-1-yl)ethanol Chemical compound OCCN1CCCCC1 KZTWONRVIPPDKH-UHFFFAOYSA-N 0.000 description 1
- 125000000094 2-phenylethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])([H])* 0.000 description 1
- MTJGVAJYTOXFJH-UHFFFAOYSA-N 3-aminonaphthalene-1,5-disulfonic acid Chemical compound C1=CC=C(S(O)(=O)=O)C2=CC(N)=CC(S(O)(=O)=O)=C21 MTJGVAJYTOXFJH-UHFFFAOYSA-N 0.000 description 1
- KSCAZPYHLGGNPZ-UHFFFAOYSA-N 3-chloropropyl(triethoxy)silane Chemical compound CCO[Si](OCC)(OCC)CCCCl KSCAZPYHLGGNPZ-UHFFFAOYSA-N 0.000 description 1
- KEZMLECYELSZDC-UHFFFAOYSA-N 3-chloropropyl-diethoxy-methylsilane Chemical compound CCO[Si](C)(OCC)CCCCl KEZMLECYELSZDC-UHFFFAOYSA-N 0.000 description 1
- YMTRNELCZAZKRB-UHFFFAOYSA-N 3-trimethoxysilylaniline Chemical compound CO[Si](OC)(OC)C1=CC=CC(N)=C1 YMTRNELCZAZKRB-UHFFFAOYSA-N 0.000 description 1
- SJECZPVISLOESU-UHFFFAOYSA-N 3-trimethoxysilylpropan-1-amine Chemical compound CO[Si](OC)(OC)CCCN SJECZPVISLOESU-UHFFFAOYSA-N 0.000 description 1
- SEMURSKJWYPYKW-UHFFFAOYSA-N 4-(aminomethyl)-1,3-oxazolidin-2-one Chemical compound NCC1COC(=O)N1 SEMURSKJWYPYKW-UHFFFAOYSA-N 0.000 description 1
- HVBSAKJJOYLTQU-UHFFFAOYSA-N 4-aminobenzenesulfonic acid Chemical compound NC1=CC=C(S(O)(=O)=O)C=C1 HVBSAKJJOYLTQU-UHFFFAOYSA-N 0.000 description 1
- CNODSORTHKVDEM-UHFFFAOYSA-N 4-trimethoxysilylaniline Chemical compound CO[Si](OC)(OC)C1=CC=C(N)C=C1 CNODSORTHKVDEM-UHFFFAOYSA-N 0.000 description 1
- 125000002373 5 membered heterocyclic group Chemical group 0.000 description 1
- HUHZAMBLEKHDBP-UHFFFAOYSA-N 5-(aminomethyl)-1,3-oxazolidin-2-one Chemical compound NCC1CNC(=O)O1 HUHZAMBLEKHDBP-UHFFFAOYSA-N 0.000 description 1
- 125000004070 6 membered heterocyclic group Chemical group 0.000 description 1
- PBWGZYPICGDRCF-UHFFFAOYSA-N CNC(=C=C)NCC Chemical group CNC(=C=C)NCC PBWGZYPICGDRCF-UHFFFAOYSA-N 0.000 description 1
- BHPQYMZQTOCNFJ-UHFFFAOYSA-N Calcium cation Chemical compound [Ca+2] BHPQYMZQTOCNFJ-UHFFFAOYSA-N 0.000 description 1
- 244000025254 Cannabis sativa Species 0.000 description 1
- 235000012766 Cannabis sativa ssp. sativa var. sativa Nutrition 0.000 description 1
- 235000012765 Cannabis sativa ssp. sativa var. spontanea Nutrition 0.000 description 1
- KXDHJXZQYSOELW-UHFFFAOYSA-N Carbamic acid Chemical class NC(O)=O KXDHJXZQYSOELW-UHFFFAOYSA-N 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- 240000000491 Corchorus aestuans Species 0.000 description 1
- 235000011777 Corchorus aestuans Nutrition 0.000 description 1
- 235000010862 Corchorus capsularis Nutrition 0.000 description 1
- 241000219146 Gossypium Species 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical group C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 1
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 1
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 1
- 229920000571 Nylon 11 Polymers 0.000 description 1
- 229920001007 Nylon 4 Polymers 0.000 description 1
- 229920002292 Nylon 6 Polymers 0.000 description 1
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 1
- SJEYSFABYSGQBG-UHFFFAOYSA-M Patent blue Chemical compound [Na+].C1=CC(N(CC)CC)=CC=C1C(C=1C(=CC(=CC=1)S([O-])(=O)=O)S([O-])(=O)=O)=C1C=CC(=[N+](CC)CC)C=C1 SJEYSFABYSGQBG-UHFFFAOYSA-M 0.000 description 1
- PCNDJXKNXGMECE-UHFFFAOYSA-N Phenazine Natural products C1=CC=CC2=NC3=CC=CC=C3N=C21 PCNDJXKNXGMECE-UHFFFAOYSA-N 0.000 description 1
- WTKZEGDFNFYCGP-UHFFFAOYSA-N Pyrazole Chemical compound C=1C=NNC=1 WTKZEGDFNFYCGP-UHFFFAOYSA-N 0.000 description 1
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 1
- BLRPTPMANUNPDV-UHFFFAOYSA-N Silane Chemical compound [SiH4] BLRPTPMANUNPDV-UHFFFAOYSA-N 0.000 description 1
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 1
- PJANXHGTPQOBST-VAWYXSNFSA-N Stilbene Natural products C=1C=CC=CC=1/C=C/C1=CC=CC=C1 PJANXHGTPQOBST-VAWYXSNFSA-N 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- 125000000738 acetamido group Chemical group [H]C([H])([H])C(=O)N([H])[*] 0.000 description 1
- 125000003668 acetyloxy group Chemical group [H]C([H])([H])C(=O)O[*] 0.000 description 1
- 239000000980 acid dye Substances 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 125000003647 acryloyl group Chemical group O=C([*])C([H])=C([H])[H] 0.000 description 1
- 125000004442 acylamino group Chemical group 0.000 description 1
- 125000004423 acyloxy group Chemical group 0.000 description 1
- 150000001338 aliphatic hydrocarbons Chemical class 0.000 description 1
- 229910001508 alkali metal halide Inorganic materials 0.000 description 1
- 150000008045 alkali metal halides Chemical class 0.000 description 1
- 150000004996 alkyl benzenes Chemical class 0.000 description 1
- IYABWNGZIDDRAK-UHFFFAOYSA-N allene Chemical group C=C=C IYABWNGZIDDRAK-UHFFFAOYSA-N 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 125000004397 aminosulfonyl group Chemical group NS(=O)(=O)* 0.000 description 1
- MDFFNEOEWAXZRQ-UHFFFAOYSA-N aminyl Chemical compound [NH2] MDFFNEOEWAXZRQ-UHFFFAOYSA-N 0.000 description 1
- 150000008064 anhydrides Chemical class 0.000 description 1
- 125000002490 anilino group Chemical group [H]N(*)C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- PYKYMHQGRFAEBM-UHFFFAOYSA-N anthraquinone Natural products CCC(=O)c1c(O)c2C(=O)C3C(C=CC=C3O)C(=O)c2cc1CC(=O)OC PYKYMHQGRFAEBM-UHFFFAOYSA-N 0.000 description 1
- 239000001000 anthraquinone dye Substances 0.000 description 1
- 150000004056 anthraquinones Chemical class 0.000 description 1
- 230000002744 anti-aggregatory effect Effects 0.000 description 1
- 150000004945 aromatic hydrocarbons Chemical class 0.000 description 1
- 125000001691 aryl alkyl amino group Chemical group 0.000 description 1
- 125000001769 aryl amino group Chemical group 0.000 description 1
- 125000003118 aryl group Chemical group 0.000 description 1
- 125000004104 aryloxy group Chemical group 0.000 description 1
- 125000004429 atom Chemical group 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- POJOORKDYOPQLS-UHFFFAOYSA-L barium(2+) 5-chloro-2-[(2-hydroxynaphthalen-1-yl)diazenyl]-4-methylbenzenesulfonate Chemical compound [Ba+2].C1=C(Cl)C(C)=CC(N=NC=2C3=CC=CC=C3C=CC=2O)=C1S([O-])(=O)=O.C1=C(Cl)C(C)=CC(N=NC=2C3=CC=CC=C3C=CC=2O)=C1S([O-])(=O)=O POJOORKDYOPQLS-UHFFFAOYSA-L 0.000 description 1
- 150000001555 benzenes Chemical class 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 1
- 229940092714 benzenesulfonic acid Drugs 0.000 description 1
- 150000008107 benzenesulfonic acids Chemical class 0.000 description 1
- WDEQGLDWZMIMJM-UHFFFAOYSA-N benzyl 4-hydroxy-2-(hydroxymethyl)pyrrolidine-1-carboxylate Chemical compound OCC1CC(O)CN1C(=O)OCC1=CC=CC=C1 WDEQGLDWZMIMJM-UHFFFAOYSA-N 0.000 description 1
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 230000000740 bleeding effect Effects 0.000 description 1
- 239000001045 blue dye Substances 0.000 description 1
- 125000004063 butyryl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 229910001424 calcium ion Inorganic materials 0.000 description 1
- QXDMQSPYEZFLGF-UHFFFAOYSA-L calcium oxalate Chemical compound [Ca+2].[O-]C(=O)C([O-])=O QXDMQSPYEZFLGF-UHFFFAOYSA-L 0.000 description 1
- 235000009120 camo Nutrition 0.000 description 1
- 125000002837 carbocyclic group Chemical group 0.000 description 1
- 150000004649 carbonic acid derivatives Chemical class 0.000 description 1
- 229920006317 cationic polymer Polymers 0.000 description 1
- 235000005607 chanvre indien Nutrition 0.000 description 1
- HFIYIRIMGZMCPC-UHFFFAOYSA-J chembl1326377 Chemical compound [Na+].[Na+].[Na+].[Na+].[O-]S(=O)(=O)C1=CC2=CC(S([O-])(=O)=O)=C(N=NC=3C=CC(=CC=3)S(=O)(=O)CCOS([O-])(=O)=O)C(O)=C2C(N)=C1N=NC1=CC=C(S(=O)(=O)CCOS([O-])(=O)=O)C=C1 HFIYIRIMGZMCPC-UHFFFAOYSA-J 0.000 description 1
- 150000001805 chlorine compounds Chemical class 0.000 description 1
- 125000002668 chloroacetyl group Chemical group ClCC(=O)* 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 150000004700 cobalt complex Chemical class 0.000 description 1
- MPMSMUBQXQALQI-UHFFFAOYSA-N cobalt phthalocyanine Chemical compound [Co+2].C12=CC=CC=C2C(N=C2[N-]C(C3=CC=CC=C32)=N2)=NC1=NC([C]1C=CC=CC1=1)=NC=1N=C1[C]3C=CC=CC3=C2[N-]1 MPMSMUBQXQALQI-UHFFFAOYSA-N 0.000 description 1
- 238000004590 computer program Methods 0.000 description 1
- 239000007859 condensation product Substances 0.000 description 1
- 239000000356 contaminant Substances 0.000 description 1
- 238000011109 contamination Methods 0.000 description 1
- 238000010924 continuous production Methods 0.000 description 1
- 150000004696 coordination complex Chemical class 0.000 description 1
- 150000004699 copper complex Chemical class 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 125000004093 cyano group Chemical group *C#N 0.000 description 1
- 125000006310 cycloalkyl amino group Chemical group 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000004956 cyclohexylene group Chemical group 0.000 description 1
- 125000004979 cyclopentylene group Chemical group 0.000 description 1
- 238000009990 desizing Methods 0.000 description 1
- 239000003599 detergent Substances 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 125000000664 diazo group Chemical group [N-]=[N+]=[*] 0.000 description 1
- 125000001664 diethylamino group Chemical group [H]C([H])([H])C([H])([H])N(*)C([H])([H])C([H])([H])[H] 0.000 description 1
- PKTOVQRKCNPVKY-UHFFFAOYSA-N dimethoxy(methyl)silicon Chemical compound CO[Si](C)OC PKTOVQRKCNPVKY-UHFFFAOYSA-N 0.000 description 1
- 125000002147 dimethylamino group Chemical group [H]C([H])([H])N(*)C([H])([H])[H] 0.000 description 1
- PPSZHCXTGRHULJ-UHFFFAOYSA-N dioxazine Chemical compound O1ON=CC=C1 PPSZHCXTGRHULJ-UHFFFAOYSA-N 0.000 description 1
- 239000000982 direct dye Substances 0.000 description 1
- 230000005684 electric field Effects 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 150000002170 ethers Chemical class 0.000 description 1
- 125000000031 ethylamino group Chemical group [H]C([H])([H])C([H])([H])N([H])[*] 0.000 description 1
- 238000001704 evaporation Methods 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 210000004209 hair Anatomy 0.000 description 1
- 239000011487 hemp Substances 0.000 description 1
- 125000000717 hydrazino group Chemical group [H]N([*])N([H])[H] 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-M hydrogensulfate Chemical compound OS([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-M 0.000 description 1
- 239000005457 ice water Substances 0.000 description 1
- 239000002563 ionic surfactant Substances 0.000 description 1
- 238000009981 jet dyeing Methods 0.000 description 1
- 230000033001 locomotion Effects 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- NYGZLYXAPMMJTE-UHFFFAOYSA-M metanil yellow Chemical group [Na+].[O-]S(=O)(=O)C1=CC=CC(N=NC=2C=CC(NC=3C=CC=CC=3)=CC=2)=C1 NYGZLYXAPMMJTE-UHFFFAOYSA-M 0.000 description 1
- REODOQPOCJZARG-UHFFFAOYSA-N n-[[diethoxy(methyl)silyl]methyl]cyclohexanamine Chemical compound CCO[Si](C)(OCC)CNC1CCCCC1 REODOQPOCJZARG-UHFFFAOYSA-N 0.000 description 1
- 150000002790 naphthalenes Chemical class 0.000 description 1
- 238000006386 neutralization reaction Methods 0.000 description 1
- 125000004999 nitroaryl group Chemical group 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- 239000002736 nonionic surfactant Substances 0.000 description 1
- 239000004745 nonwoven fabric Substances 0.000 description 1
- UUEVFMOUBSLVJW-UHFFFAOYSA-N oxo-[[1-[2-[2-[2-[4-(oxoazaniumylmethylidene)pyridin-1-yl]ethoxy]ethoxy]ethyl]pyridin-4-ylidene]methyl]azanium;dibromide Chemical compound [Br-].[Br-].C1=CC(=C[NH+]=O)C=CN1CCOCCOCCN1C=CC(=C[NH+]=O)C=C1 UUEVFMOUBSLVJW-UHFFFAOYSA-N 0.000 description 1
- 125000001820 oxy group Chemical group [*:1]O[*:2] 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 125000000951 phenoxy group Chemical group [H]C1=C([H])C([H])=C(O*)C([H])=C1[H] 0.000 description 1
- 125000003170 phenylsulfonyl group Chemical group C1(=CC=CC=C1)S(=O)(=O)* 0.000 description 1
- 229920000728 polyester Polymers 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 229920000137 polyphosphoric acid Polymers 0.000 description 1
- 229920006306 polyurethane fiber Polymers 0.000 description 1
- 229910000027 potassium carbonate Inorganic materials 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 230000001376 precipitating effect Effects 0.000 description 1
- 239000001294 propane Substances 0.000 description 1
- QQONPFPTGQHPMA-UHFFFAOYSA-N propylene Natural products CC=C QQONPFPTGQHPMA-UHFFFAOYSA-N 0.000 description 1
- 125000004805 propylene group Chemical group [H]C([H])([H])C([H])([*:1])C([H])([H])[*:2] 0.000 description 1
- 230000002633 protecting effect Effects 0.000 description 1
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 1
- 239000000376 reactant Substances 0.000 description 1
- 239000012429 reaction media Substances 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 230000002829 reductive effect Effects 0.000 description 1
- 230000003578 releasing effect Effects 0.000 description 1
- 239000008237 rinsing water Substances 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- ZNCPFRVNHGOPAG-UHFFFAOYSA-L sodium oxalate Chemical compound [Na+].[Na+].[O-]C(=O)C([O-])=O ZNCPFRVNHGOPAG-UHFFFAOYSA-L 0.000 description 1
- 229940039790 sodium oxalate Drugs 0.000 description 1
- 229910052938 sodium sulfate Inorganic materials 0.000 description 1
- 235000011152 sodium sulphate Nutrition 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 229910001220 stainless steel Inorganic materials 0.000 description 1
- 239000010935 stainless steel Substances 0.000 description 1
- PJANXHGTPQOBST-UHFFFAOYSA-N stilbene Chemical compound C=1C=CC=CC=1C=CC1=CC=CC=C1 PJANXHGTPQOBST-UHFFFAOYSA-N 0.000 description 1
- 235000021286 stilbenes Nutrition 0.000 description 1
- 229950000244 sulfanilic acid Drugs 0.000 description 1
- 229910052717 sulfur Inorganic materials 0.000 description 1
- 239000011593 sulfur Substances 0.000 description 1
- HIFJUMGIHIZEPX-UHFFFAOYSA-N sulfuric acid;sulfur trioxide Chemical compound O=S(=O)=O.OS(O)(=O)=O HIFJUMGIHIZEPX-UHFFFAOYSA-N 0.000 description 1
- XTHPWXDJESJLNJ-UHFFFAOYSA-N sulfurochloridic acid Chemical class OS(Cl)(=O)=O XTHPWXDJESJLNJ-UHFFFAOYSA-N 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 229920002994 synthetic fiber Polymers 0.000 description 1
- 239000012209 synthetic fiber Substances 0.000 description 1
- 229930192474 thiophene Natural products 0.000 description 1
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 1
- PZJJKWKADRNWSW-UHFFFAOYSA-N trimethoxysilicon Chemical group CO[Si](OC)OC PZJJKWKADRNWSW-UHFFFAOYSA-N 0.000 description 1
- 239000000984 vat dye Substances 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 229920002554 vinyl polymer Polymers 0.000 description 1
- 239000002699 waste material Substances 0.000 description 1
- 239000008096 xylene Substances 0.000 description 1
- 229910052727 yttrium Inorganic materials 0.000 description 1
Classifications
-
- D—TEXTILES; PAPER
- D06—TREATMENT OF TEXTILES OR THE LIKE; LAUNDERING; FLEXIBLE MATERIALS NOT OTHERWISE PROVIDED FOR
- D06P—DYEING OR PRINTING TEXTILES; DYEING LEATHER, FURS OR SOLID MACROMOLECULAR SUBSTANCES IN ANY FORM
- D06P1/00—General processes of dyeing or printing textiles, or general processes of dyeing leather, furs, or solid macromolecular substances in any form, classified according to the dyes, pigments, or auxiliary substances employed
- D06P1/44—General processes of dyeing or printing textiles, or general processes of dyeing leather, furs, or solid macromolecular substances in any form, classified according to the dyes, pigments, or auxiliary substances employed using insoluble pigments or auxiliary substances, e.g. binders
- D06P1/64—General processes of dyeing or printing textiles, or general processes of dyeing leather, furs, or solid macromolecular substances in any form, classified according to the dyes, pigments, or auxiliary substances employed using insoluble pigments or auxiliary substances, e.g. binders using compositions containing low-molecular-weight organic compounds without sulfate or sulfonate groups
- D06P1/642—Compounds containing nitrogen
- D06P1/6426—Heterocyclic compounds
-
- D—TEXTILES; PAPER
- D06—TREATMENT OF TEXTILES OR THE LIKE; LAUNDERING; FLEXIBLE MATERIALS NOT OTHERWISE PROVIDED FOR
- D06P—DYEING OR PRINTING TEXTILES; DYEING LEATHER, FURS OR SOLID MACROMOLECULAR SUBSTANCES IN ANY FORM
- D06P5/00—Other features in dyeing or printing textiles, or dyeing leather, furs, or solid macromolecular substances in any form
-
- D—TEXTILES; PAPER
- D06—TREATMENT OF TEXTILES OR THE LIKE; LAUNDERING; FLEXIBLE MATERIALS NOT OTHERWISE PROVIDED FOR
- D06B—TREATING TEXTILE MATERIALS USING LIQUIDS, GASES OR VAPOURS
- D06B1/00—Applying liquids, gases or vapours onto textile materials to effect treatment, e.g. washing, dyeing, bleaching, sizing or impregnating
- D06B1/02—Applying liquids, gases or vapours onto textile materials to effect treatment, e.g. washing, dyeing, bleaching, sizing or impregnating by spraying or projecting
-
- D—TEXTILES; PAPER
- D06—TREATMENT OF TEXTILES OR THE LIKE; LAUNDERING; FLEXIBLE MATERIALS NOT OTHERWISE PROVIDED FOR
- D06P—DYEING OR PRINTING TEXTILES; DYEING LEATHER, FURS OR SOLID MACROMOLECULAR SUBSTANCES IN ANY FORM
- D06P1/00—General processes of dyeing or printing textiles, or general processes of dyeing leather, furs, or solid macromolecular substances in any form, classified according to the dyes, pigments, or auxiliary substances employed
- D06P1/38—General processes of dyeing or printing textiles, or general processes of dyeing leather, furs, or solid macromolecular substances in any form, classified according to the dyes, pigments, or auxiliary substances employed using reactive dyes
-
- D—TEXTILES; PAPER
- D06—TREATMENT OF TEXTILES OR THE LIKE; LAUNDERING; FLEXIBLE MATERIALS NOT OTHERWISE PROVIDED FOR
- D06P—DYEING OR PRINTING TEXTILES; DYEING LEATHER, FURS OR SOLID MACROMOLECULAR SUBSTANCES IN ANY FORM
- D06P1/00—General processes of dyeing or printing textiles, or general processes of dyeing leather, furs, or solid macromolecular substances in any form, classified according to the dyes, pigments, or auxiliary substances employed
- D06P1/44—General processes of dyeing or printing textiles, or general processes of dyeing leather, furs, or solid macromolecular substances in any form, classified according to the dyes, pigments, or auxiliary substances employed using insoluble pigments or auxiliary substances, e.g. binders
- D06P1/52—General processes of dyeing or printing textiles, or general processes of dyeing leather, furs, or solid macromolecular substances in any form, classified according to the dyes, pigments, or auxiliary substances employed using insoluble pigments or auxiliary substances, e.g. binders using compositions containing synthetic macromolecular substances
- D06P1/5264—Macromolecular compounds obtained otherwise than by reactions involving only unsaturated carbon-to-carbon bonds
- D06P1/5292—Macromolecular compounds obtained otherwise than by reactions involving only unsaturated carbon-to-carbon bonds containing Si-atoms
-
- D—TEXTILES; PAPER
- D06—TREATMENT OF TEXTILES OR THE LIKE; LAUNDERING; FLEXIBLE MATERIALS NOT OTHERWISE PROVIDED FOR
- D06P—DYEING OR PRINTING TEXTILES; DYEING LEATHER, FURS OR SOLID MACROMOLECULAR SUBSTANCES IN ANY FORM
- D06P3/00—Special processes of dyeing or printing textiles, or dyeing leather, furs, or solid macromolecular substances in any form, classified according to the material treated
- D06P3/58—Material containing hydroxyl groups
- D06P3/60—Natural or regenerated cellulose
- D06P3/66—Natural or regenerated cellulose using reactive dyes
-
- D—TEXTILES; PAPER
- D06—TREATMENT OF TEXTILES OR THE LIKE; LAUNDERING; FLEXIBLE MATERIALS NOT OTHERWISE PROVIDED FOR
- D06P—DYEING OR PRINTING TEXTILES; DYEING LEATHER, FURS OR SOLID MACROMOLECULAR SUBSTANCES IN ANY FORM
- D06P5/00—Other features in dyeing or printing textiles, or dyeing leather, furs, or solid macromolecular substances in any form
- D06P5/30—Ink jet printing
Definitions
- Textile materials such as woven, knitted, game and nonwovens which contain cellulose fibers can be dyed using anionic dyes by known processes.
- spraying techniques have been added to the classic dyeing methods of printing, exhausting and padding processes, which was first used on paper under the name "Ink-Jet Printing", later also on textile materials.
- All processes have in common that alkali is required for fixing the dye to the fiber, especially when dyeing with reactive dyes.
- the alkali is added to the dyeing process before, after or during the application of the dye to the fiber material; After fixing, the alkali must be removed together with dye hydrolyzates in complex washing processes.
- the dye hydrolyzates produced in conventional processes cause heavy bleeding or at least a blurring of sharp contours if they cannot be washed out sufficiently.
- the ink-jet or ink-jet printing process is the only way of producing color images quickly, quietly and in high resolution.
- This process typically uses aqueous inks that are sprayed directly onto the substrate in small droplets.
- a distinction is made between a continuous process in which the ink is pressed evenly through a nozzle and directed onto the paper or into an ink catcher by an electric field, depending on the pattern to be printed, and an interrupted ink jet or "drop-on-demand""-Procedure, in which the ink is ejected only where a colored dot is to be set, in the latter method exerting pressure on the ink system via a piezoelectric crystal or a heated cannula (bubble or thermo-jet method) and so on an ink drop is thrown out.
- Such Procedures are in text. Chem. Color. 19 (8), 23-29, and 21 (6), 27-32.
- R 10 is preferably hydrogen or alkyl of 1 to 3 carbon atoms, such as methyl and ethyl, and particularly preferably hydrogen, methyl or ethyl, especially hydrogen.
- R 11 is preferably hydrogen, alkyl of 1 to 4 carbon atoms, in particular methyl and ethyl, phenyl or alkyl of 2 to 4 carbon atoms, which is substituted by methoxy or ethoxy, of which less preferably hydrogen.
- the group of the formula (8a) preferably represents a secondary amino group, such as in particular the methylamino or ethylamino group.
- radicals R A and R B represents an alkyl group with a group of the formula (5a) or (5b).
- alkyl, alkenyl and alkylene radicals mentioned for the above formula radicals can be straight-chain or branched. Within the scope of their given meaning, the individual formula residues can have meanings which are the same or different from one another.
- Compounds (1), (2), (3a) and (3b) which can be used according to the invention are, for example, ⁇ -sulfato-ethylamine, 2-oxo-1,3-oxazolidine, 4-aminomethyl-2-oxo-1,3-oxazolidine, 5-aminomethyl-2-oxo-1,3-oxazolidine, 4- (trimethylammonium-methyl) -2-oxo-1,3-oxazolidine chloride, 5- (trimethylammonium-methyl) -2-oxo-1,3- oxazolidine chloride, 1- (trimethylammonium methyl) ethylene carbonate chloride, N- ( ⁇ -sulfatoethyl) piperazine, N- [ ⁇ - ( ⁇ '-sulfatoethoxy) ethyl] piperazine, N- ( ⁇ -sulfato- ⁇ - hydroxypropyl) piperidine, N- ( ⁇ -sulfato- ⁇ -hydroxypropyl)
- Silane compounds of the general formula (4) which can be used according to the invention are, for example: [ ⁇ - ( ⁇ '-aminoethoxy) propyl] trimethoxy silane, [ ⁇ - ( ⁇ '-aminoethylamino) propyl] trimethoxy silane, [ ⁇ - ( ⁇ '-aminoethoxy) propyl] methyl diethoxy silane, [ ⁇ - ( ⁇ '-aminoethyl amino) propyl] methyl dimethoxy silane, 3- or 4-aminophenyltrimethoxy silane , [ ⁇ - (4-aminophenoxy) propyl] trimethoxysilane, N- [ ⁇ - (trimethoxysilyl) propyl] -N, N-di- ( ⁇ '-aminoethyl) amine, ( ⁇ -aminopropyl ) -trimethoxy-silane, ( ⁇ -aminopropyl) -ethoxy-dimethyl-
- the compounds (1) and (2) which can be used according to the invention can be prepared in accordance with known procedures, as described in large numbers in the literature (see Houben-Weyl, Methods of Organic Chemistry, 4th edition, volume E4, pages 82-88 and 192 ff.), for example by reacting an alkanediol which has a latent nitrogen-containing functional group in the side chain with phosgene in aqueous solution at a pH between 7 and 9 to prepare the heterocycloaliphatic carbonates or, for example, by reacting Aminoalkanols with phosgene in aqueous solution to the heterocycloaliphatic carbamic acid compounds (2-oxo-1,3-oxazolidines).
- the compounds (3a) and (3b) which can be used according to the invention can be prepared in such a way that their corresponding hydroxyl-containing compounds are esterified in a conventional manner by reaction with the acids or the corresponding acylating agents, where, if one of compounds containing amino groups with more than one hydroxyl group, preferably only one of these hydroxyl groups esterified.
- Such procedures are known in the literature; the compounds which can be used according to the invention can be prepared analogously to such known procedures.
- the esterification of amino alcohols to their sulfuric acid esters is described in Houben-Weyl, Methods of Organic Chemistry, Volume VI / 2, pages 452-457, and Volume E11, pages 997 ff.
- Esterification and acylating agents which can serve as starting compounds for the preparation of the compounds containing ester and amino groups which can be used according to the invention are, for example, sulfuric acid, phosphoric acid, polyphosphoric acid, lower alkane carboxylic acids and their chlorides or anhydrides, such as, for example, acetic acid (glacial acetic acid) and acetic anhydride, benzenesulfonic acid and the on the benzene nucleus by substituents from the group sulfo, carboxy, lower alkyl, lower alkoxy and nitro substituted benzenesulfonic acids or their sulfochlorides.
- the sulfato compounds can be prepared from the corresponding hydroxy compounds by adding the hydroxy compounds in the required amount, ie preferably an equimolar amount, of concentrated sulfuric acid and stirring them at a temperature between 5 and 30 ° C. for some time until the solution is complete. They are isolated from the sulfuric acid solution by pouring the solution onto ice and neutralization, by precipitating the sulfate ions using calcium carbonate as calcium sulfate and then filtering and evaporating the aqueous solution.
- the example of the sulfato compounds gives crystalline or semi-crystalline substances which can be used directly in the process of modifying the fiber material.
- silane compounds used in accordance with the invention are described in large numbers in the literature and some are commercially available. Not known as species Silane compounds can be synthesized analogously to the procedures for the preparation of the known silane compounds, such as, for example, analogously to the information in German Patent DE-C-1 186 061.
- the starting compounds of the general formulas (15a) and (15b) are prepared in a conventional manner by starting from the corresponding hydroxy compound (amino alcohol) and using the metallic alkali metal, such as sodium and especially potassium, in a manner known per se in the implements solvents mentioned above.
- the reaction takes place at a temperature between 50 and 150 ° C., preferably between 80 and 110 ° C. It is advantageous to choose a solvent with a boiling point which is sufficiently high that the alkali metal can be heated above its melting point in order to simplify and accelerate the reaction.
- Solvents suitable for this are, in particular, aliphatic hydrocarbons with a boiling range from 70 to 150 ° C., such as heptane and dodecane, and mixtures thereof, furthermore aromatic hydrocarbons, such as, for example, alkyl-substituted benzenes and naphthalenes, such as in particular toluene and xylene, and furthermore aliphatic, in particular cycloaliphatic Ether compounds such as tetrahydrofuran.
- aliphatic hydrocarbons with a boiling range from 70 to 150 ° C. such as heptane and dodecane, and mixtures thereof
- aromatic hydrocarbons such as, for example, alkyl-substituted benzenes and naphthalenes, such as in particular toluene and xylene
- aliphatic, in particular cycloaliphatic Ether compounds such as tetrahydrofuran.
- Fiber materials are understood to mean natural and synthetic fiber materials which contain hydroxyl and / or carbonamide groups, such as silk, wool and other animal hair, and also synthetic polyamide fiber materials and polyurethane fiber materials, for example polyamide-4, polyamide-6 and polyamide-11, and in particular fiber materials which Base bodies of ⁇ , ⁇ -glucose contain, such as cellulose fiber materials, for example cotton, hemp, jute and linen, and their regenerated derivatives, such as viscose silk and cellulose, or mixtures of such fiber materials, the fiber material in the present ink-jet dyeing process as a flat structure (Piece goods), such as woven or knitted fabrics, must be present.
- anionic dyes are meant those which are anionic, i.e. contain acidic groups, such as sulfo and carboxy groups, or their salts, such as alkali metal salts, and are accordingly water-soluble.
- anionic dyes which have a fiber-reactive group, i.e. a group that is usually able to react with the carbonamide or hydroxy groups of the fiber material and to be able to form a connection with them.
- the modification of the fiber material with the amino group-containing compounds can be carried out, for example, in such a way that the fiber material with one of these compounds which can be used according to the invention or a mixture of such compounds in alkaline aqueous solution and the compound containing amino groups at a temperature between 60 and 230 ° C., preferably between 90 and 190 ° C, can act on the fiber material.
- the concentration of this compound in the alkaline aqueous solution is generally between 1 and 20% by weight, preferably between 5 and 10% by weight.
- the alkaline agent such as sodium hydroxide, sodium carbonate and potassium carbonate, is dissolved in a concentration between 0.1 and 20% by weight, preferably between 5 and 10% by weight.
- this alkaline aqueous solution has a pH between 10 and 14.
- the fiber material can be present both in the modification and in the modified form when used in the dyeing process according to the invention in a mixture with other fiber materials, for example in the form of cotton / polyester fiber materials and in the form of blended fabrics with other fiber materials.
- the amino group-containing compounds which can be used to modify the fiber material can be brought into contact with the fiber material in an alkaline aqueous solution in a variety of ways, for example by treating the fiber material in an alkaline, aqueous solution of the amino group-containing compound (analogously to a dye-drawing process) at a temperature between 15 and 100 ° C, the modification of the fiber material already taking place, in particular at the higher temperatures.
- Other possibilities are to pad the fiber material with the aqueous, alkaline solution, to splash or to spray the solution onto the fiber material.
- the impregnation of the fiber material with this alkaline, aqueous solution occurs by introducing the fiber material into this solution or by padding (padding), the impregnated material is then squeezed out by excess liquor so that the absorption of this aqueous, alkaline solution between 50 and 120% by weight, preferably between 70 and 100% by weight, based on the fiber material.
- the impregnation (by padding, splashing or treatment in the solution itself) takes place at a temperature between 10 and 60 ° C., preferably at a temperature between 15 and 30 ° C.
- the solution is sprayed onto the fiber material, which usually takes place at a temperature between 10 and 40 ° C, a liquid absorption of preferably between 10 and 50% by weight.
- the amino group-containing compound that can be used according to the invention can also advantageously be applied to the cellulose fiber material to be modified directly after the mercerization process, in which the mercerized material still contains the alkali, for example by using the aqueous solution to obtain the one obtained after the mercerization process Alkali-impregnated material, if necessary, squeezed to a required liquid content and the alkaline-impregnated material impregnated with the aqueous solution of the compound containing amino groups that can be used according to the invention, the impregnation being carried out by padding, spraying and similar process steps which are customary and known in the art.
- the impregnated material is dried; as a rule, the drying of the compound modifying the fiber is carried out simultaneously with the drying, a temperature between 100 and 230 ° C., in particular between 120 and 190 ° C., preferably being chosen for the drying and fixing. As a rule, drying and simultaneous fixing take place by treatment with hot air for 1 to 5 minutes.
- the fiber-modifying compound can be fixed on the fiber material by simple drying at higher temperatures; it can be hung up in drying cabinets to dry and fix the modifying compound on the fiber material and exposed to the required higher temperatures, such as 80 to 105 ° C.
- the modified fiber material is aftertreated by rinsing with cold and hot water and optionally by treatment in an aqueous bath containing a small amount of an acid, such as acetic acid, to remove the alkali from the fiber material and then drying.
- an acid such as acetic acid
- the dye solutions are applied to the modified fiber material (woven, knitted or non-woven) with the help of commercially available inkjet printers, which are converted if necessary for large-scale purposes.
- Neutral, preferably aqueous, solutions of the anionic dyes are used, the anionic dyes preferably containing a fiber-reactive group.
- the dye solutions can contain auxiliaries such as are usually present in the inks for inkjet printers, such as anti-aggregation agents such as N-methyl-pyrrolidone, dimethylformamide and dimethylacetamide, and wetting agents such as ionic or non-ionic surfactants.
- auxiliaries that are usually required for dyeing with anionic, in particular fiber-reactive, dyes can be dispensed with.
- anionic dyes are expediently used in the form free from electrolyte salts, such as sodium chloride and sodium sulfate.
- electrolyte salts such as sodium chloride and sodium sulfate.
- commercially available dye preparations with up to 50% by weight of electrolyte salt can generally also be applied without problems in the process according to the invention using the inkjet printing technique.
- multi-color printing several ink cartridges can be connected in series, which can be controlled with the means common today to generate the print on the moving material web. Modern multi-chamber inkjet cartridges can also be used, with which several colors can be applied in one pass.
- the dye solution (ink) is applied to the modified material to be colored in accordance with the inkjet printing process, specifically in tiny drops of ink.
- the material dyed in this way is then subjected to a treatment with superheated steam, hot air or by means of another energy, such as by means of radiation with electromagnetic waves in the microwave or radio frequency range, the dyes being fixed on the modified fiber material.
- a treatment with superheated steam, hot air or by means of another energy such as by means of radiation with electromagnetic waves in the microwave or radio frequency range
- the dyeing process can be carried out without exposure to any waste water which, for example, contains dye, alkali and electrolyte salts which have not been fixed according to the dyeing processes hitherto customary, or without exposure to other waste products.
- any waste water which, for example, contains dye, alkali and electrolyte salts which have not been fixed according to the dyeing processes hitherto customary, or without exposure to other waste products.
- strongly colored print samples with the usual good fastness properties are obtained.
- Different deeply colored shades of the same color tone can be achieved very easily by using the inkjet process, for example by controlling the application quantity of the dye solution, for example by overprinting the same line several times, or by rasterizing and printing a fine dot pattern, which is the case with today's inkjet -Printers, depending on the process, can even be over 400 dpi.
- a large number of color intensities (color saturations) can be obtained without having to recreate the dyeing liquor.
- All water-soluble, preferably anionic dyes which preferably have one or more sulfo and / or carboxy groups and which can optionally contain fiber-reactive groups, are suitable for the dyeing methods according to the invention.
- fiber-reactive dyes they can belong to the class of azo development dyes, direct dyes, vat dyes and acid dyes, which include, for example, azo dyes, copper complex, cobalt complex and chromium complex azo dyes, copper and nickel phthalocyanine dyes, anthraquinone and copper formazan - And triphendioxazine dyes.
- azo development dyes direct dyes
- vat dyes and acid dyes which include, for example, azo dyes, copper complex, cobalt complex and chromium complex azo dyes, copper and nickel phthalocyanine dyes, anthraquinone and copper formazan - And triphendioxazine dyes.
- azo dyes copper complex, cobalt complex and
- Fiber-reactive dyes are those organic dyes that contain 1, 2, 3 or 4 fiber-reactive residues of the aliphatic, aromatic or heterocyclic series contain. Such dyes have been extensively described in the literature.
- the dyes can belong to a wide variety of dye classes, for example the class of monoazo, disazo, polyazo and metal complex azo dyes, such as 1: 1 copper, 1: 2 chromium and 1: 2 cobalt complex monoazo and -Disazo dyes, further the series of anthraquinone dyes, copper and cobalt phthalocyanine dyes, copper formazan dyes, azomethine, nitroaryl, dioxazine, triphendioxazine, phenazine and stilbene dyes.
- monoazo, disazo, polyazo and metal complex azo dyes such as 1: 1 copper, 1: 2 chromium and 1: 2 cobalt complex monoazo and -Disazo dyes, further the series of anthraquinone dyes, copper and cobalt phthalocyanine dyes, copper formazan dyes, azomethine, nitroaryl, dioxazine, triphendioxazine, phena
- Fiber-reactive dyes are understood to mean those which have a “fiber-reactive” group, ie a group which contains the hydroxyl groups of cellulose, the amino, carboxy, hydroxyl and thiol groups of wool and silk or the amino and possibly carboxy groups of synthetic polyamides can react to form a covalent chemical bond.
- the fiber-reactive residue can be bound to the dye residue directly or via a bridge member; it is preferably directly or via an optionally monoalkylated amino group, such as, for example, a group of the formula -NH-, -N (CH 3 ) -, -N (C 2 H 5 ) - or -N (C 3 H 7 ) -, or via an aliphatic radical, such as a methylene, ethylene or propylene radical or an alkylene radical of 2 to 8 carbon atoms, which is interrupted by one or two oxi and / or amino groups, or via a bridge member containing an amino group, such as for example a phenylamino group attached to the dye residue.
- an optionally monoalkylated amino group such as, for example, a group of the formula -NH-, -N (CH 3 ) -, -N (C 2 H 5 ) - or -N (C 3 H 7 ) -, or via an aliphatic radical,
- Particularly interesting fiber-reactive radicals are fluorine and chloro-1,3,5-triazine radicals of the formula (16) in which Hal is chlorine or fluorine and Q is an amino, alkylamino, N, N-dialkylamino, cycloalkylamino, N, N-dicycloalkylamino, aralkylamino, arylamino, N-alkyl-N-cyclohexylamino, N- Alkyl-N-arylamino group or an amino group which contains a heterocyclic radical which may have a further fused-on carbocyclic ring, or amino groups in which the amino nitrogen atom is a member of an N-heterocyclic ring which optionally contains further heteroatoms, and hydrazino and semicarbazido groups , where the alkyl radicals mentioned can be straight-chain or branched and low molecular weight and higher molecular weight, preferably those having 1 to 6 carbon atoms.
- Suitable cycloalkyl, aralkyl and aryl radicals are, in particular, cyclohexyl, benzyl, phenethyl, phenyl and naphthyl radicals; Heterocyclic residues are especially furan, thiophene, pyrazole, pyridine, pyrimidine, quinoline, benzimidazole, benzothiazole and benzoxazole residues.
- Amino groups in which the amino nitrogen atom is a member of an N-heterocyclic ring, are preferably residues of six-membered N-heterocyclic compounds which may contain nitrogen, oxygen or sulfur as further heteroatoms.
- alkyl, cycloalkyl, aralkyl and aryl radicals mentioned above, the heterocyclic radicals and the N-heterocyclic rings can additionally be substituted, for example by halogen, such as fluorine, chlorine and bromine, nitro, cyano, trifluoromethyl, sulfamoyl, carbamoyl, C. 1 -C 4 alkyl, C 1 -C 4 alkoxy, acylamino groups such as acetylamino or benzoylamino, ureido, hydroxy, carboxy, sulfomethyl or sulfo.
- halogen such as fluorine, chlorine and bromine
- sulfamoyl carbamoyl
- C. 1 -C 4 alkyl C 1 -C 4 alkoxy
- acylamino groups such as acetylamino or benzoylamino, urei
- amino groups are: -NH 2 , methylamino, ethylamino, propylamino, isopropylamino, butylamino, hexylamino, ⁇ -methoxyethylamino, ⁇ -methoxypropylamino, ⁇ -ethoxyethylamino, N, N-dimethylamino, N, N-diethylamino, ⁇ - Chloroethylamino, ⁇ -cyanoethylamino, ⁇ -cyanopropylamino, ⁇ -carboxyethylamino, sulfomethylamino, ⁇ -sulfoethylamino, ⁇ -hydroxyethylamino, N, N-di- ⁇ -hydroxyethylamino, ⁇ -hydroxypropylamino, benzylamino, phenethylamino, cyclohexylamino, pheni
- Q can be an amino radical of the general formula -NR 20 R 21 , in which R 20 is hydrogen or alkyl of 1 to 4 carbon atoms, such as methyl or ethyl, and R 21 is phenyl, which is directly by a fiber-reactive radical of the vinylsulfone series or is substituted by a methylamino, ethylamino, methylene, ethylene or propylene group and which can also be substituted by 1 or 2 substituents from the group methoxy, ethoxy, methyl, ethyl, chlorine, carboxy and sulfo, or R 21 alkyl of 2 to 4 carbon atoms, such as ethyl or n-propyl, which is substituted by a fiber-reactive group of the vinylsulfone series, or alkylenephenyl with an alkylene radical of 1 to 4 carbon atoms, the phenyl of which is substituted by a fiber-reactive radical of the vinylsulfone series
- Fiber-reactive groups of the vinylsulfone series are those of the general formula -SO 2 -Y, in which Y is vinyl or ethyl which is substituted in the ⁇ -position by an alkali-eliminable substituent, such as, for example, chlorine, sulfato, phosphato, thiosulfato, acetyloxy, Sulfobenzoyloxy and dimethylamino.
- the dyeings of the modified cellulose fiber materials obtainable in the manner according to the invention do not require any further aftertreatment after the dye has been fixed on the substrate, in particular no complicated aftertreatment process including washing. If necessary at all, it is sufficient to rinse the colored substrate once or several times with warm or hot and, if appropriate, cold water, which may optionally contain a nonionic wetting agent or a fiber-reactive aftertreatment agent, such as, for example, condensation products from one mole of cyanuric chloride and two moles of 4- ( ⁇ -Sulfatoethylsulfonyl) aniline, from equivalent amounts of cyanuric chloride, 4- ( ⁇ -sulfatoethylsulfoanyl) aniline and 4,8-disulfo-2-amino-naphthalene or from equivalent amounts of cyanuric chloride, 4-sulfo-aniline and 4.8- Disulfo-2-aminonaphthalene.
- a fiber-reactive aftertreatment agent is advisable if the fiber material modified according to the invention has been dyed only in slight depths of shade or if a dye has been used which does not have satisfactory fiber reactivity. In these cases, there are still sufficient dye-reactive spots on the modified fiber, which, for example, can react with other dyes in rinsing baths contaminated with these dyes.
- the still active areas of the invention modified fiber is deactivated, and the originally desired clear color is obtained even in a rinsing water used in a technical process and contaminated with dyes.
- a final boiling treatment of the colored substrate with a washing solution to improve the fastness properties is not necessary.
- an amino group-containing compound which can be used according to the invention and which serves to modify the fiber material
- a mixture of 750 parts by volume of a 100% strength sulfuric acid and 75 parts by volume of a 20% sulfuric acid-containing sulfuric acid (20% strength oleum) is added 10 ° C slowly with stirring 500 parts by volume of N- ( ⁇ -hydroxyethyl) piperidine, the reaction temperature being kept between 20 and 25 ° C with constant cooling.
- the reaction mixture is stirred into 1000 parts of ice water, the pH is adjusted to 4 with calcium carbonate, the batch is briefly heated to 50 ° C. and the calcium sulfate formed is then filtered off. Calcium ions still present are precipitated from the filtrate with sodium oxalate.
- the aqueous solution of the N- ( ⁇ -sulfatoethyl) piperidine is evaporated to dryness under reduced pressure. A yellow, oily product is obtained which crystallizes and melts at 124 ° C. with decomposition.
- N- ( ⁇ -sulfato- ⁇ -hydroxypropyl) piperidine To prepare N- ( ⁇ -sulfato- ⁇ -hydroxypropyl) piperidine, slowly add 100 parts of N- ( ⁇ , ⁇ -dihydroxypropyl) piperidine to 67 parts of 100% sulfuric acid with stirring at 20 ° C. . The mixture is stirred for a further hour and the piperidine compound according to the invention is isolated in the manner described in Example A. It is initially obtained as an oily product which crystallizes after some time. It melts at 170 to 175 ° C with decomposition.
- N- ( ⁇ -sulfato- ⁇ -hydroxy-propyl) pyrrolidine 50 parts of N- ( ⁇ , ⁇ -dihydroxy-propyl) pyrrolidine in 98 parts of 100% sulfuric acid are slowly added with stirring at 20 ° C. . The batch is stirred for a further hour and the compound formed is then isolated as an oily product in the manner given in Example A.
- a silane compound which can be used according to the invention 67.9 parts of N-methylaminoethanol are slowly added to 35.2 parts of potassium in 1000 parts by volume of tetrahydrofuran, the exothermic reaction being kept at a temperature between 30 and 40 ° C. by external cooling. The mixture is then heated under reflux until the potassium has reacted completely (about 5 hours). The mixture is then cooled to about 20 ° C. and 190.3 parts of ⁇ -chloropropyl- (methyl) - (diethoxy) -silane are added, the reaction temperature being kept below 40 ° C. by external cooling if necessary.
- Example A To prepare a silane compound which can be used according to the invention, the procedure of Example A is followed, but the equivalent amount of ⁇ -chloropropyl-triethoxysilane is used instead of the ⁇ -chloropropyl-methyl-diethoxy-silane compound.
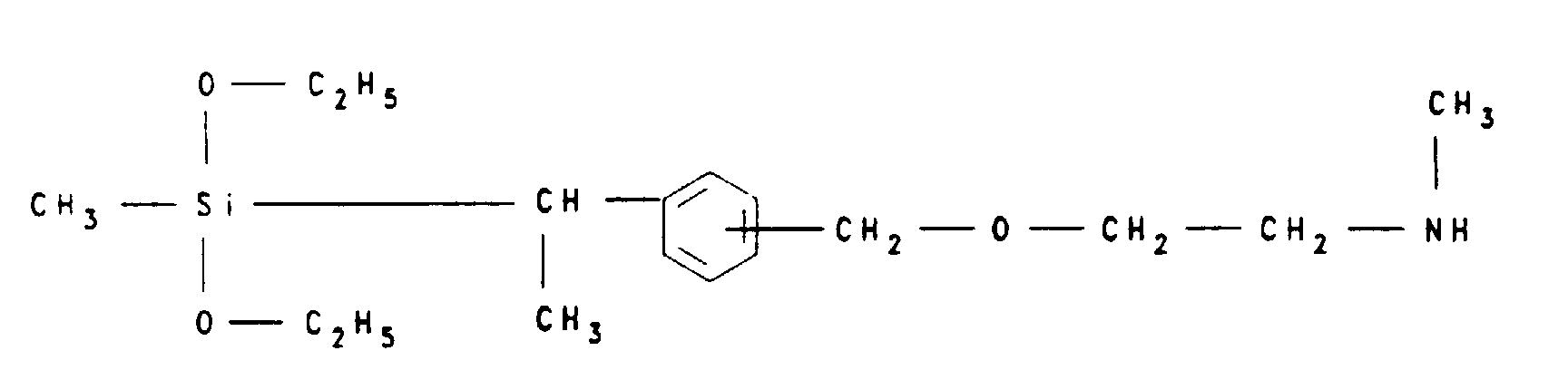
- the [ ⁇ - ( ⁇ '-N-methylaminoethoxy) propyl] triethoxysilane of the formula according to the invention is obtained by fractional distillation at a boiling range between 104 and 118 ° C at 5 • 10 -2 mbar.
- a silane compound is prepared according to the procedure of Example A, but instead of the ⁇ -chloropropyl-methyl-diethoxy-silane compound, the equivalent amount of ( ⁇ -chloropropyl) - (dimethyl) - (ethoxy) -silane is used.
- the compound according to the invention [ ⁇ - ( ⁇ '-N-methylaminoethoxy) propyl] - (dimethyl) - (ethoxy) silane of the formula is obtained by fractional distillation at a boiling range between 90 and 105 ° C at 5 • 10 -2 mbar.
- a mercerized and bleached cotton fabric is impregnated with an aqueous solution of 50 parts of sodium hydroxide and 100 parts of the monosulfate of 2,3-dihydroxy-1-aminopropane in 1000 parts of water at a temperature between 25 and 30 ° C with a liquor absorption of 85% and then to Fixation of the aminopropane compound on the fiber material treated with hot air at 150 ° C. for about 3 minutes, the impregnated fabric drying at the same time.
- the modified material is then freed from excess alkali by treatment with cold water at 60 ° C.
- the thus modified, dried material is passed under a stainless steel sheet with the aid of a rubber roller and printed in one operation with the aqueous solutions of fiber-reactive dyes in the basic colors of the subtractive color mixture by means of an ink jet print head which works according to the "drop on demand" process.
- the web is then passed through a continuously working microwave dryer for fixation.
- the dyed material can then be finished by washing; however, a short, hot wash bath and subsequent drying is usually sufficient.
- the fabric obtained shows a very sharp color print of the chosen pattern; the dye itself has good wash fastness.
- the fabric obtained shows a very sharp color print of the chosen pattern; the dye itself has good wash fastness.
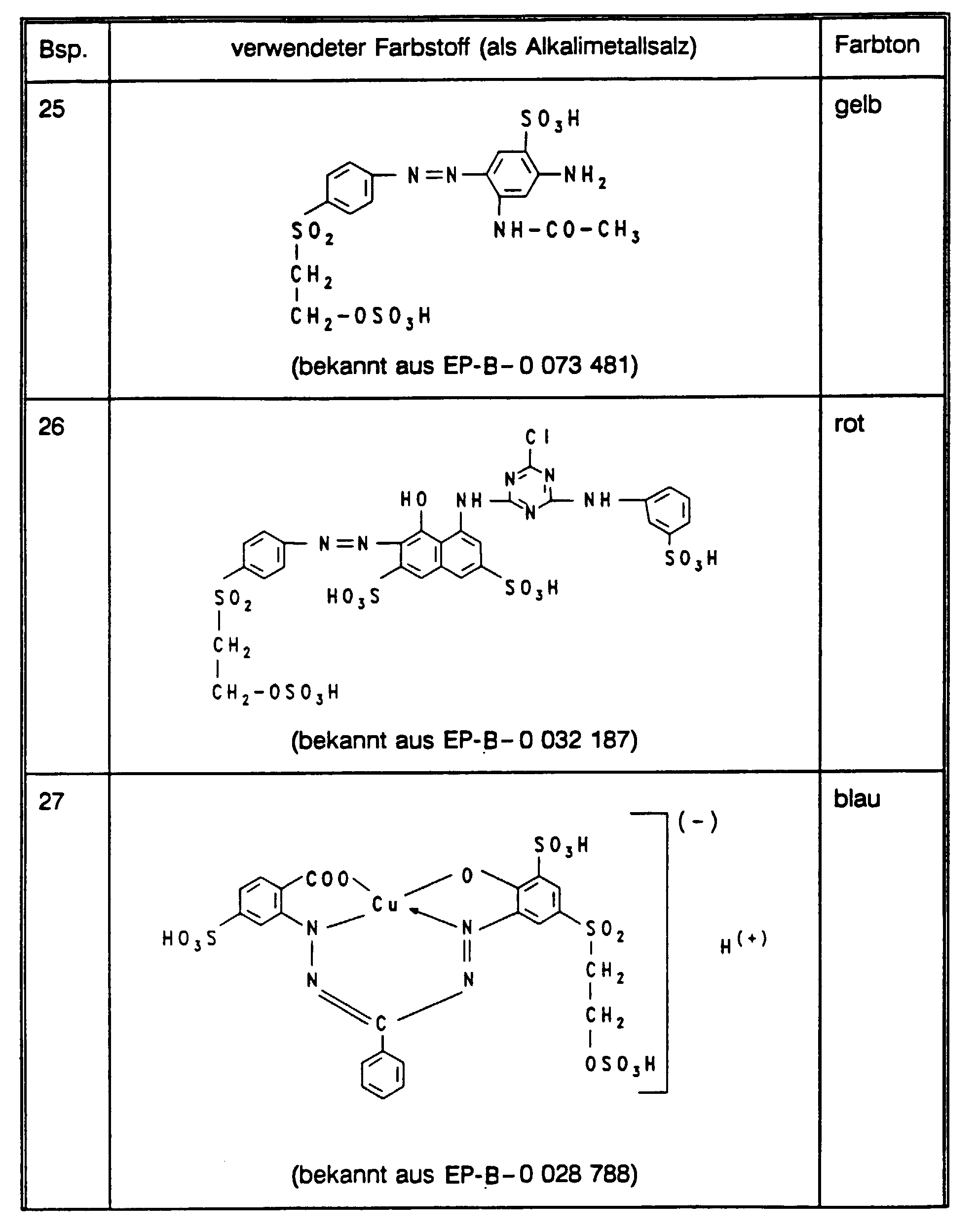
- a cellulose fiber material modified according to the invention such as, for example, a cellulose fiber material modified in accordance with the above exemplary embodiments, is printed on using the procedure of an inkjet printer, for example analogously using one of the methods described in the above exemplary embodiments, using aqueous solutions of one or more known dyes specified in the table examples below (the dyes are written in the form of the free acid; however, they are used in the form of their alkali metal salts). Clear, strong-colored print samples are obtained with the color shade given in the respective table example and the fastness properties, in particular good fastness to washing, which are good for the respective dye.
Landscapes
- Engineering & Computer Science (AREA)
- Textile Engineering (AREA)
- Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Coloring (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Ink Jet Recording Methods And Recording Media Thereof (AREA)
Abstract
Description
Textilmaterialien, wie Gewebe, Gewirke, Game und Vliesstoffe, die Cellulosefasern enthalten, können nach bekannten Verfahren mit anionischen Farbstoffen gefärbt werden. In neuerer Zeit kommt zu den klassischen Färbemethoden der Druck-, Auszieh- und Klotz-Verfahren eine moderne Sprühtechnik hinzu, die unter dem Namen "Ink-Jet-Printing" zuerst auf Papier, später auch auf Textilmaterialien angewendet wurde. Allen Verfahren ist gemeinsam, daß für die Fixierung des Farbstoffes auf der Faser, insbesondere beim Färben mit Reaktivfarbstoffen, Alkali benötigt wird. Das Alkali wird vor, nach oder während der Applikation des Farbstoffes auf das Fasermaterial dem Färbeprozeß zugefügt; nach der Fixierung muß das Alkali jedoch in aufwendigen Waschprozessen zusammen mit Farbstoffhydrolysaten entfernt werden. Besonders die in herkömmlichen Prozessen entstehenden Farbstoffhydrolysate verursachen bei ungenügender Auswaschbarkeit starke Anblutungen oder zumindest ein Verwischen scharfer Konturen.Textile materials such as woven, knitted, game and nonwovens which contain cellulose fibers can be dyed using anionic dyes by known processes. In recent times, modern spraying techniques have been added to the classic dyeing methods of printing, exhausting and padding processes, which was first used on paper under the name "Ink-Jet Printing", later also on textile materials. All processes have in common that alkali is required for fixing the dye to the fiber, especially when dyeing with reactive dyes. The alkali is added to the dyeing process before, after or during the application of the dye to the fiber material; After fixing, the alkali must be removed together with dye hydrolyzates in complex washing processes. In particular, the dye hydrolyzates produced in conventional processes cause heavy bleeding or at least a blurring of sharp contours if they cannot be washed out sufficiently.
Das Ink-Jet- oder Tintenstrahl-Druckverfahren bietet von den berührungslosen Druckverfahren die einzige Möglichkeit, schnell, leise und in hoher Auflösung farbige Bilder zu produzieren. Bei diesem Verfahren vewendet man üblicherweise wäßrige Tinten, die in kleinen Tröpfchen direkt auf das Substrat gesprüht werden. Man unterscheidet dabei ein kontinuierliches Verfahren, bei dem die Tinte gleichmäßig durch eine Düse gepreßt und durch ein elektrisches Feld, abhängig vom zu druckenden Muster, auf das Papier oder in einen Farbfänger gelenkt wird, und ein unterbrochenes Tintenstrahl- oder "Drop-on-Demand"-Verfahren, bei dem der Tinttenausstoß nur dort erfolgt, wo ein farbiger Punkt gesetzt werden soll, wobei bei dem letztgenannten Verfahren über einen piezoelektrischen Kristall oder eine beheizte Kanüle (Bubble- oder Thermo-Jet-Verfahren) Druck auf das Tintensystem ausgeübt und so ein Tintentropfen herausgeschleudert wird. Solche Verfahrensweisen sind in Text. Chem. Color. 19 (8), 23-29, und 21 (6), 27-32, beschrieben.The ink-jet or ink-jet printing process is the only way of producing color images quickly, quietly and in high resolution. This process typically uses aqueous inks that are sprayed directly onto the substrate in small droplets. A distinction is made between a continuous process in which the ink is pressed evenly through a nozzle and directed onto the paper or into an ink catcher by an electric field, depending on the pattern to be printed, and an interrupted ink jet or "drop-on-demand""-Procedure, in which the ink is ejected only where a colored dot is to be set, in the latter method exerting pressure on the ink system via a piezoelectric crystal or a heated cannula (bubble or thermo-jet method) and so on an ink drop is thrown out. Such Procedures are in text. Chem. Color. 19 (8), 23-29, and 21 (6), 27-32.
Es ist weiterhin bekannt, daß man durch Zusatz alkaliabspaltender Mittel, wie beispielsweise Halogenacetaten, und anschließendem Dämpfen auch unter Verwendung von Reaktivfarbstoffen nach dem Ink-Jet-Verfahren färben kann (vgl. bspw. Japanische Patentanmeldungs-Veröffentlichungen Sho-63-068680 und Hei-3-205179). Des weiteren ist aus der japanischen PatentanmeldungsVeröffentlichung Sho-63-085188 bekannt, ein Textilmaterial mit einem kationischen Polymer zu beschichten und dieses anschließend mit anionischen Farbstoffen im Tintenstrahl-Druckverfahren zu färben. In diesem Verfahren wird keine kovalente Bindung wie beim Einsatz von Reaktivfarbstoffen erzielt, aber es wird die Substratcharakteristik entscheidend durch die Polymerauflage verändert.It is also known that by adding alkali-releasing agents, such as halogen acetates, and then steaming, reactive dyes can also be used to dye using the ink-jet method (cf., for example, Japanese patent application publications Sho-63-068680 and Hei- 3-205179). Furthermore, it is known from Japanese Patent Application Publication Sho-63-085188 to coat a textile material with a cationic polymer and then to dye it with anionic dyes using the ink-jet printing process. In this process no covalent bond is achieved as with the use of reactive dyes, but the substrate characteristics are significantly changed by the polymer coating.
Mit der vorliegenden Erfindung wurde nunmehr ein Verfahren zum Färben von flächigen Fasermaterialien, insbesondere solchen von oder mit Cellulosefasern, mit anionischen Farbstoffen, insbesondere solchen mit faserreaktiven Gruppen, gefunden, mit welchem brillante Färbungen in hellen und in tiefen Tönen mit guter Farbstärke unter hervorragender Konturenschärfe erhalten werden, das dadurch gekennzeichnet ist, daß man eine wäßrige Farbstoffiösung, die alkalifrei und vorzugsweise elektrolytarm oder gänzlich elektrolytfrei ist, auf ein Fasermaterial appliziert, das durch eine Verbindung vorbehandelt und modifiziert wurde, die eine Verbindung entsprechend den allgemeinen Formeln (1), (2), (3a), (3b) und (4) ist
- M
- ist ein Wasserstoffatom oder ein Alkalimetall, wie Natrium, Kalium oder Lithium;
- k
- ist die Zahl 1 oder 2, bevorzugt 2;
- RA
- ist Wasserstoff oder Alkyl von 1 bis 3 C-Atomen, das durch Hydroxy oder eine Gruppe der Formel (5a) oder (5b)
R1 Wasserstoff, Methyl oder Ethyl ist,
R2 Wasserstoff, Methyl oder Ethyl ist und
R3 Wasserstoff, Methyl oder Ethyl ist oder
R1 und R2 zusammen mit dem N-Atom einen aus einem Alkylenrest von 5 bis 8 C-Atomen oder zwei Alkylenresten von 1 bis 4 C-Atomen und einem Sauerstoffatom oder einer Aminogruppe der Formel -NH-gebildeten gesättigten heterocyclischen Rest darstellen, wie beispielsweise den N-Piperazino-, N-Piperidino- oder N-Morpholino-Rest, und
Z(-) ein einwertiges Anion bedeutet, wie beispielsweise das Chlorid- oder Hydrogensulfat-Anion, oder ein einem einwertigen Anion äquivalenter Teil eines mehrwertigen Anions ist, wie beispielsweise des Sulfatanions; - RB
- hat eine der für RA angegebenen Bedeutungen;
- X
- ist eine Gruppe -O- oder -NH- ;
- ER
- ist eine Estergruppe;
- A und N
- bilden zusammen mit 1 oder 2 Alkylengruppen von 1 bis 4 C-Atomen den bivalenten Rest eines heterocyclischen Ringes, bevorzugt eines 5- oder 6-gliedrigen heterocyclischen Ringes, wie beispielsweise des Piperazin-, Piperidin- oder Morpholinringes, worin
- A
- ein Sauerstoffatom oder eine Gruppe der allgemeinen Formel (a), (b) oder (c)
R ein Wasserstoffatom oder eine Aminogruppe ist oder eine Alkylgruppe von 1 bis 6 C-Atomen, bevorzugt von 1 bis 4 C-Atomen, bedeutet, die durch 1 oder 2 Substituenten aus der Gruppe Amino, Sulfo, Hydroxy, Sulfato, Phosphato und Carboxy substituiert sein kann, oder eine Alkylgruppe von 3 bis 8 C-Atomen, bevorzugt von 3 bis 5 C-Atomen, ist, die durch 1 oder 2 Heterogruppen, die aus den Gruppen -O- und -NH- ausgewählt sind, unterbrochen ist und durch eine Amino-, Sulfo-. Hydroxy-, Sulfato- oder Carboxygruppe substituiert sein kann,
R3 Wasserstoff, Methyl oder Ethyl ist
R4 Wasserstoff, Methyl oder Ethyl ist und
Z(-) die obengenannte Bedeutung hat; - B
- ist die Aminogruppe der Formel H2N- oder eine Amino- bzw. Ammoniumgruppe der allgemeinen Formel (d) oder (e)
R3, R4 und Z(-) eine der obengenannten Bedeutungen besitzt und
R5 Methyl oder Ethyl ist und
R6 Wasserstoff, Methyl oder Ethyl bedeutet; - p
- ist die Zahl 1 oder 2, bevorzugt 1;
- alkylen ist ein geradkettiger oder verzweigter Alkylenrest von 2 bis 6 C-Atomen, bevorzugt von 2 bis 4 C-Atomen, der durch 1 oder 2 Hydroxygruppen substituiert sein kann, oder ist ein geradkettiger oder verzweigter, bevorzugt geradkettiger, Alkylenrest von 3 bis 8 C-Atomen, bevorzugt von 3 bis 5 C-Atomen, der durch 1 oder 2 Heterogruppen, die aus den Gruppen -O-und -NH- ausgewählt sind, unterbrochen ist;
- alk ist ein geradkettiger oder verzweigter Alkylenrest von 2 bis 6 C-Atomen, bevorzugt von 2 bis 4 C-Atomen, oder ist ein geradkettiger oder verzweigter, bevorzugt geradkettiger, Alkylenrest von 3 bis 8 C-Atomen, bevorzugt von 3 bis 5 C-Atomen, der durch 1 oder 2 Heterogruppen, die aus den Gruppen -O- und -NH- ausgewählt sind, unterbrochen ist, und ist bevorzugt ein geradkettiger oder verzweigter Alkylenrest von 2 bis 6 C-Atomen, bevorzugt von 2 bis 4 C-Atomen;
- m
- ist die Zahl 1 oder 2, bevorzugt 1;
- n
- ist eine Zahl von 1 bis 4, bevorzugt 1 oder 2;
die Amino-, Hydroxy- und Estergruppen in den Verbindungen (3a) und (3b) können sowohl an einem primären, sekundären oder tertiären C-Atom des Alkylenrestes gebunden sein; - RC
- ist Wasserstoff, Alkoxy von 1 bis 8 C-Atomen, vorzugsweise von 1 bis 4 C-Atomen, wie Methoxy, Ethoxy und Propoxy, Halogen, wie Chlor und Brom, Hydroxy, Alkoxy von 2 bis 4 C-Atomen, vorzugsweise Ethoxy, das durch Alkoxy von 1 bis 4 C-Atomen, vorzugsweise Methoxy und Ethoxy, substituiert ist, N-Morpholino, N-Imidazolino oder eine Gruppe der Formel (6)
- RD
- ist eine Gruppe der allgemeinen Formel (7a) oder (7b)
a ist die Zahl Null oder 1;
b ist eine ganze Zahl von Null bis 10, vorzugsweise Null oder 1 bis 5 und insbesondere Null oder 1 bis 3;
c ist die Zahl 1;
die Summe von (a + b) ist bevorzugt gleich 1 oder größer als 1, insbesondere bevorzugt 1, 2, 3 oder 4;
R7 hat eine der Bedeutungen von RC;
R8 ist Alkoxy von 1 bis 8 C-Atomen, vorzugsweise von 1 bis 4 C-Atomen, wie Ethoxy und Methoxy, das durch Alkoxy von 1 bis 4 C-Atomen substituiert sein kann, Alkyl von 1 bis 8 C-Atomen, vorzugsweise von 1 bis 4 C-Atomen, wie Ethyl und Methyl, Alkenyl von 2 bis 8 C-Atomen, vorzugsweise von 2 bis 4 C-Atomen, oder Phenylen-alkyl mit einem Alkylrest von 1 bis 4 C-Atomen, wobei der Phenylenrest durch Substituenten aus der Gruppe Methyl, Ethyl, Methoxy, Ethoxy, Sulfo und Carboxy substituiert sein kann, und wobei diese Reste R8 noch durch eine Gruppe T substituiert sein können;
R9 hat eine der Bedeutungen von RC oder RE;
D ist Alkylen von 1 bis 6 C-Atomen, vorzugsweise von 2 bis 4 C-Atomen, das durch Hydroxy, Methoxy, Ethoxy, Sulfo, Sulfato oder Carboxy substituiert sein kann, oder ist Phenylen, das durch Methoxy, Ethoxy, Methyl, Ethyl, Sulfo und/oder Carboxy substituiert sein kann, oder ist Phenylen-alkylen, Alkylen-phenylen, Alkylen-phenylen-alkylen oder Phenylen-alkylen-phenylen, wobei die Alkylengruppen dieser Reste solche von 1 bis 6 C-Atomen, vorzugsweise von 1 bis 4 C-Atomen, sind und durch Hydroxy, Methoxy, Ethoxy, Sulfo, Sulfato oder Carboxy substituiert sein können und die Phenylenreste durch Methoxy, Ethoxy, Methyl, Ethyl, Sulfo und/oder Carboxy substituiert sein können;
X1 ist eine Gruppe der Formel -S- oder -O-, und ist vorzugsweise eine Gruppe der Formel -O- ;
E ist Cycloalkylen von 5 bis 8 C-Atomen, wie Cyclohexylen und Cyclopentylen, oder Alkylen von 1 bis 6 C-Atomen, vorzugsweise von 1 bis 4 C-Atomen, insbesondere von 2 oder 3 C-Atomen, das durch Hydroxy, Methoxy, Ethoxy, Sulfato, Sulfo oder Carboxy substituiert sein kann, oder ist Phenylen, das durch Methoxy, Ethoxy, Methyl, Ethyl, Sulfo und/oder Carboxy substituiert sein kann, vorzugsweise Alkylen von 2 bis 4 C-Atomen;
X2 ist eine Gruppe der Formel -S- , -O-, -NH- oder -N(R)- in welcher R Alkyl von 1 bis 4 C-Atomen, wie Methyl oder Ethyl, ist, und vorzugsweise -O- oder -NH- ;
G ist Alkylen von 1 bis 6 C-Atomen, vorzugsweise von 2 bis 4 C-Atomen, das durch Hydroxy, Methoxy, Ethoxy, Sulfo, Sulfato oder Carboxy substituiert sein kann, oder ist Phenylen, das durch Methoxy, Ethoxy, Methyl, Ethyl, Sulfo und/oder Carboxy substituiert sein kann, oder ist Phenylen-alkylen, Alkylen-phenylen, Alkylen-phenylen-alkylen oder Phenylen-alkylen-phenylen, wobei die Alkylengruppen dieser Reste solche von 1 bis 6 C-Atomen, vorzugsweise von 1 bis 4 C-Atomen, sind und durch Hydroxy, Methoxy, Ethoxy, Sulfo, Sulfato oder Carboxy substituiert sein können und die Phenylenreste durch Methoxy, Ethoxy, Methyl, Ethyl, Sulfo und/oder Carboxy substituiert sein können, oder G kann eine direkte Bindung sein, und ist vorzugsweise Alkylen von 2 bis 4 C-Atomen oder eine direkte Bindung;
T ist Hydroxy, Thiol oder vorzugsweise eine Gruppe der allgemeinen Formel (8a) oder (8b), insbesondere der Formel (8a)
R10 Wasserstoff oder Alkyl von 1 bis 4 C-Atomen ist, das durch Phenyl, Sulfophenyl, Amino, Thio oder Hydroxy substituiert sein kann,
R11 Wasserstoff, Phenyl, Sulfophenyl oder Alkyl von 1 bis 4 C-Atomen ist, das durch Phenyl, Sulfophenyl, Methoxy, Ethoxy, Amino, Thio oder Hydroxy substituiert sein kann,
R12 Wasserstoff oder Alkyl von 1 bis 4 C-Atomen ist, das substituiert sein kann, wie beispielsweise durch Hydroxy, Amino, Thio, Carboxy oder Sulfo, oder Alkenyl von 2 bis 6 C-Atomen, vorzugsweise von 2 bis 4 C-Atomen, ist, und
Z(-) die obengenannte Bedeutung hat;
K ist ein Rest der allgemeinen Formel (9) - RE
- ist Wasserstoff, Halogen, wie Chlor und Brom, Hydroxy, Alkyl von 1 bis 8 C-Atomen, vorzugsweise von 1 bis 4 C-Atomen, wie Ethyl und Methyl, Alkenyl von 2 bis 8 C-Atomen, vorzugsweise von 2 bis 4 C-Atomen, Alkinyl von 3 bis 8 C-Atomen, vorzugsweise von 3 bis 5 C-Atomen, oder Phenyl oder eine Gruppe der allgemeinen Formel (7a) oder (7b), vorzugsweise Alkyl von 1 bis 4 C-Atomen, oder eine Gruppe der allgemeinen Formel (7a) oder (7b);
- RG
- hat eine der für RC oder RE genannten Bedeutungen;
mindestens einer der an das Siliciumatom gebundenen Substituenten ist ein hydrolysierfähiger Substituent aus der Gruppe Wasserstoff, Halogen, Alkoxy, Phenoxy, Amino und Amido, wie beispielsweise solche, die anfangs für den Formelrest RC genannt sind, wobei hiervon Alkoxyreste bevorzugt sind, und daß man die Applikation der Farbstofflösung unter Auwendung der Ink-Jet-Printing-Sprühtechnik (worunter alle Minimalauftrags-Sprühtechniken verstanden werden) durchführt.
- M
- is a hydrogen atom or an alkali metal such as sodium, potassium or lithium;
- k
- is the number 1 or 2, preferably 2;
- R A
- is hydrogen or alkyl of 1 to 3 carbon atoms, which is substituted by hydroxy or a group of the formula (5a) or (5b)
R 1 is hydrogen, methyl or ethyl,
R 2 is hydrogen, methyl or ethyl and
R 3 is hydrogen, methyl or ethyl or
R 1 and R 2 together with the N atom represent a saturated heterocyclic radical formed from an alkylene radical of 5 to 8 C atoms or two alkylene radicals of 1 to 4 C atoms and an oxygen atom or an amino group of the formula -NH, such as for example the N-piperazino, N-piperidino or N-morpholino radical, and
Z (-) represents a monovalent anion, such as the chloride or hydrogen sulfate anion, or a part of a polyvalent anion equivalent to a monovalent anion, such as the sulfate anion; - R B
- has one of the meanings given for R A ;
- X
- is a group -O- or -NH-;
- HE
- is an ester group;
- A and N
- together with 1 or 2 alkylene groups of 1 to 4 carbon atoms form the divalent radical of a heterocyclic ring, preferably a 5- or 6-membered heterocyclic ring, such as the piperazine, piperidine or morpholine ring, in which
- A
- an oxygen atom or a group of the general formula (a), (b) or (c)
R is a hydrogen atom or an amino group or an alkyl group of 1 to 6 carbon atoms, preferably of 1 to 4 carbon atoms, which can be substituted by 1 or 2 substituents from the group amino, sulfo, hydroxy, sulfato, phosphato and carboxy, or an alkyl group of 3 to 8 carbon atoms, preferably 3 to 5 carbon atoms, which is substituted by 1 or 2 Hetero groups which are selected from the groups -O- and -NH- are interrupted and by an amino, sulfo. Hydroxy, sulfato or carboxy group can be substituted,
R 3 is hydrogen, methyl or ethyl
R 4 is hydrogen, methyl or ethyl and
Z (-) has the meaning given above; - B
- is the amino group of the formula H 2 N or an amino or ammonium group of the general formula (d) or (e)
R 3 , R 4 and Z (-) has one of the meanings given above and
R 5 is methyl or ethyl and
R 6 represents hydrogen, methyl or ethyl; - p
- is the number 1 or 2, preferably 1;
- alkylene is a straight-chain or branched alkylene radical of 2 to 6 carbon atoms, preferably of 2 to 4 carbon atoms, which can be substituted by 1 or 2 hydroxyl groups, or is a straight-chain or branched, preferably straight-chain, alkylene radical of 3 to 8 carbon atoms -Atoms, preferably from 3 to 5 carbon atoms, which is interrupted by 1 or 2 hetero groups selected from the groups -O-and -NH-;
- alk is a straight-chain or branched alkylene radical of 2 to 6 carbon atoms, preferably of 2 to 4 carbon atoms, or is a straight-chain or branched, preferably straight-chain, alkylene radical of 3 to 8 carbon atoms, preferably of 3 to 5 carbon atoms, which is interrupted by 1 or 2 hetero groups selected from the groups -O- and -NH-, and is preferably a straight-chain or branched alkylene radical of 2 to 6 carbon atoms, preferably of 2 up to 4 carbon atoms;
- m
- is the number 1 or 2, preferably 1;
- n
- is a number from 1 to 4, preferably 1 or 2;
the amino, hydroxyl and ester groups in the compounds (3a) and (3b) can be bound either to a primary, secondary or tertiary carbon atom of the alkylene radical; - R C
- is hydrogen, alkoxy of 1 to 8 carbon atoms, preferably of 1 to 4 carbon atoms, such as methoxy, ethoxy and propoxy, halogen, such as chlorine and bromine, hydroxy, alkoxy of 2 to 4 carbon atoms, preferably ethoxy, that is substituted by alkoxy of 1 to 4 carbon atoms, preferably methoxy and ethoxy, N-morpholino, N-imidazolino or a group of the formula (6)
- R D
- is a group of the general formula (7a) or (7b)
a is the number zero or 1;
b is an integer from zero to 10, preferably zero or 1 to 5 and in particular zero or 1 to 3;
c is the number 1;
the sum of (a + b) is preferably 1 or greater than 1, particularly preferably 1, 2, 3 or 4;
R 7 has one of the meanings of R C ;
R 8 is alkoxy of 1 to 8 carbon atoms, preferably of 1 to 4 carbon atoms, such as ethoxy and methoxy, which can be substituted by alkoxy of 1 to 4 carbon atoms, alkyl of 1 to 8 carbon atoms, preferably from 1 to 4 carbon atoms, such as ethyl and methyl, alkenyl from 2 to 8 carbon atoms, preferably from 2 to 4 carbon atoms, or phenylene-alkyl with an alkyl radical of 1 to 4 carbon atoms, the phenylene radical being Substituents from the group methyl, ethyl, methoxy, ethoxy, sulfo and carboxy can be substituted, and these radicals R 8 can also be substituted by a group T;
R 9 has one of the meanings of R C or R E ;
D is alkylene of 1 to 6 carbon atoms, preferably of 2 to 4 carbon atoms, which can be substituted by hydroxy, methoxy, ethoxy, sulfo, sulfato or carboxy, or is phenylene, which is substituted by methoxy, ethoxy, methyl, ethyl , Sulfo and / or carboxy may be substituted, or is phenylene-alkylene, alkylene-phenylene, alkylene-phenylene-alkylene or phenylene-alkylene-phenylene, the alkylene groups of these radicals having from 1 to 6 carbon atoms, preferably from 1 to 4 carbon atoms, and can be substituted by hydroxy, methoxy, ethoxy, sulfo, sulfato or carboxy and the phenylene radicals can be substituted by methoxy, ethoxy, methyl, ethyl, sulfo and / or carboxy;
X 1 is a group of the formula -S- or -O-, and is preferably a group of the formula -O-;
E is cycloalkylene of 5 to 8 carbon atoms, such as cyclohexylene and cyclopentylene, or alkylene of 1 to 6 carbon atoms, preferably of 1 to 4 carbon atoms, in particular of 2 or 3 carbon atoms, which can be replaced by hydroxyl, methoxy, Ethoxy, sulfato, sulfo or carboxy can be substituted, or is phenylene, which can be substituted by methoxy, ethoxy, methyl, ethyl, sulfo and / or carboxy, preferably alkylene of 2 to 4 carbon atoms;
X 2 is a group of the formula -S-, -O-, -NH- or -N (R) - in which R is alkyl of 1 to 4 carbon atoms, such as methyl or ethyl, and preferably -O- or -NH-;
G is alkylene of 1 to 6 carbon atoms, preferably of 2 to 4 carbon atoms, which can be substituted by hydroxy, methoxy, ethoxy, sulfo, sulfato or carboxy, or is phenylene, which is substituted by methoxy, ethoxy, methyl, ethyl , Sulfo and / or carboxy may be substituted, or is phenylene-alkylene, alkylene-phenylene, alkylene-phenylene-alkylene or phenylene-alkylene-phenylene, the alkylene groups of these radicals having from 1 to 6 carbon atoms, preferably from 1 to 4 carbon atoms, and can be substituted by hydroxy, methoxy, ethoxy, sulfo, sulfato or carboxy and the phenylene radicals can be substituted by methoxy, ethoxy, methyl, ethyl, sulfo and / or carboxy, or G can be a direct bond , and is preferably alkylene of 2 to 4 carbon atoms or a direct bond;
T is hydroxy, thiol or preferably a group of the general formula (8a) or (8b), in particular of the formula (8a)
R 10 is hydrogen or alkyl of 1 to 4 carbon atoms, which can be substituted by phenyl, sulfophenyl, amino, thio or hydroxy,
R 11 is hydrogen, phenyl, sulfophenyl or alkyl of 1 to 4 carbon atoms, which can be substituted by phenyl, sulfophenyl, methoxy, ethoxy, amino, thio or hydroxy,
R 12 is hydrogen or alkyl of 1 to 4 carbon atoms, which can be substituted, for example by hydroxy, amino, thio, carboxy or sulfo, or alkenyl of 2 to 6 carbon atoms, preferably of 2 to 4 carbon atoms , is and
Z (-) has the meaning given above;
K is a radical of the general formula (9) - R E
- is hydrogen, halogen, such as chlorine and bromine, hydroxy, alkyl of 1 to 8 carbon atoms, preferably of 1 to 4 carbon atoms, such as ethyl and methyl, alkenyl of 2 to 8 carbon atoms, preferably of 2 to 4 carbon atoms Atoms, alkynyl of 3 to 8 carbon atoms, preferably of 3 to 5 carbon atoms, or phenyl or a group of the general formula (7a) or (7b), preferably alkyl of 1 to 4 carbon atoms, or a group of the general formula (7a) or (7b);
- R G
- has one of the meanings given for R C or R E ;
at least one of the substituents bonded to the silicon atom is a hydrolyzable substituent from the group consisting of hydrogen, halogen, alkoxy, phenoxy, amino and amido, such as, for example, those which are initially mentioned for the formula radical R C , of which alkoxy radicals are preferred, and that carries out the application of the dye solution using the ink-jet printing spray technique (which includes all minimum-order spray techniques).
Der Rest der Formel (9) und der diesem in Formel (7a) entsprechende Rest der allgemeinen Formel -[D-X1]a-[E-X2]b-G- ist bevorzugt ein Rest der allgemeinen Formel (10a), (10b), (10c), (10d), (10e), (10f), (10g), (10h), (10i) oder (10j), bevorzugt hiervon ein Rest der allgemeinen Formel (10c), (10d), (10e), (10f), (10h), (10i) oder (10j):
-(CH2)r-O-(CH2)s- (10c)
-(CH2)r-O-(CH2)s-CH(OH)-CH2- (10 d)
-(CH2)r-NH-(CH2)s- (10f)
-(CH2)r-S-(CH2)s- (10g)
- r
- eine ganze Zahl von 1 bis 6, vorzugsweise von 2 bis 4, ist,
- s
- eine ganze Zahl von Null bis 6, vorzugsweise von 1 bis 4, bedeutet,
- t
- eine ganze Zahl von Null bis 4, vorzugsweise 1 oder 2, ist,
- v
- eine ganze Zahl von 1 bis 4, vorzugsweise 2 oder 3, ist,
- z
- eine ganze Zahl von 1 bis 10, vorzugsweise 1 bis 5 und insbesondere 1, ist, und
- ALK
- einen geradkettigen oder verzweigten Alkylenrest von 1 bis 8 C-Atomen bedeutet, wobei der verzweigte Alkylenrest vorzugsweise ein solcher der Formel
- (CH 2 ) r -O- (CH 2 ) s - (10c)
- (CH 2 ) r -O- (CH 2 ) s -CH (OH) -CH 2 - (10 d)
- (CH 2 ) r -NH- (CH 2 ) s - (10f)
- (CH 2 ) r -S- (CH 2 ) s - (10g)
- r
- is an integer from 1 to 6, preferably from 2 to 4,
- s
- is an integer from zero to 6, preferably from 1 to 4,
- t
- is an integer from zero to 4, preferably 1 or 2,
- v
- is an integer from 1 to 4, preferably 2 or 3,
- e.g.
- is an integer from 1 to 10, preferably 1 to 5 and in particular 1, and
- ALK
- is a straight-chain or branched alkylene radical of 1 to 8 carbon atoms, the branched alkylene radical preferably being one of the formula
R10 ist bevorzugt Wasserstoff oder Alkyl von 1 bis 3 C-Atomen, wie Methyl und Ethyl, und insbesondere bevorzugt Wasserstoff, Methyl oder Ethyl, besonders Wasserstoff. R11 ist bevorzugt Wasserstoff, Alkyl von 1 bis 4 C-Atomen, insbesondere Methyl und Ethyl, Phenyl oder Alkyl von 2 bis 4 C-Atomen, das durch Methoxy oder Ethoxy substituiert ist, hiervon weniger bevorzugt Wasserstoff. Bevorzugt stellt die Gruppe der Formel (8a) eine sekundäre Aminogruppe dar, wie insbesondere die Methylamino- oder Ethylaminogruppe.R 10 is preferably hydrogen or alkyl of 1 to 3 carbon atoms, such as methyl and ethyl, and particularly preferably hydrogen, methyl or ethyl, especially hydrogen. R 11 is preferably hydrogen, alkyl of 1 to 4 carbon atoms, in particular methyl and ethyl, phenyl or alkyl of 2 to 4 carbon atoms, which is substituted by methoxy or ethoxy, of which less preferably hydrogen. The group of the formula (8a) preferably represents a secondary amino group, such as in particular the methylamino or ethylamino group.
Bevorzugt stellt nur einer der Reste RA und RB eine Alkylgruppe mit einer Gruppe der Formel (5a) oder (5b) dar.Preferably only one of the radicals R A and R B represents an alkyl group with a group of the formula (5a) or (5b).
Die für die obigen Formelreste erwähnten Alkyl-, Alkenyl- und Alkylenreste können geradkettig oder verzweigt sein. Die einzelnen Formelreste können, im Rahmen ihrer gegebenen Bedeutung, zueinander gleiche oder voneinander verschiedene Bedeutungen besitzen.The alkyl, alkenyl and alkylene radicals mentioned for the above formula radicals can be straight-chain or branched. Within the scope of their given meaning, the individual formula residues can have meanings which are the same or different from one another.
Erfindungsgemäß verwendbare Verbindungen (1), (2), (3a) und (3b) sind beispielsweise β-Sulfato-ethylamin, 2-Oxo-1,3-oxazolidin, 4-Aminomethyl-2-oxo-1,3-oxazolidin, 5-Aminomethyl-2-oxo-1,3-oxazolidin, 4-(Trimethylammonium-methyl)-2-oxo-1,3-oxazolidin-chlorid, 5-(Trimethylammonium-methyl)-2-oxo-1,3-oxazolidinchlorid, 1-(Trimethylammonium-methyl)-ethylencarbonat-chlorid, N-(β-Sulfatoethyl)-piperazin, N-[β-(β'-Sulfatoethoxy)-ethyl]-piperazin, N-(γ-Sulfato-β-hydroxy-propyl)-piperidin, N-(γ-Sulfato-β-hydroxy-propyl)pyrrolidin, N-(β-Sulfatoethyl)-piperidin, die Salze des 3-Sulfato-2-hydroxy-1-(trimethylammonium)-propans, wie 3-Sulfato-2-hydroxy-1-(trimethylammonium)-propan-sulfat, 2-Sulfato-3-hydroxy-1-amino-propan, 3-Sulfato-2-hydroxy-1-amino-propan, 1-Sulfato-3-hydroxy-2-amino-propan, 3-Hydroxy-1-sulfato-2-amino-propan, 2,3-Disulfato-1-amino-propan und 1,3-Disulfato-2-amino-propan sowie Derivate dieser Verbindungen mit einer anderen Estergruppe statt der Sulfatogruppe, wie mit der Phosphatogruppe, einer Alkanoyloxygruppe von 2 bis 5 C-Atomen, wie der Acetyloxygruppe, der p-Tosyloxy- und 3,4,5-Trimethyl-phenylsulfonyloxy-Gruppe.Compounds (1), (2), (3a) and (3b) which can be used according to the invention are, for example, β-sulfato-ethylamine, 2-oxo-1,3-oxazolidine, 4-aminomethyl-2-oxo-1,3-oxazolidine, 5-aminomethyl-2-oxo-1,3-oxazolidine, 4- (trimethylammonium-methyl) -2-oxo-1,3-oxazolidine chloride, 5- (trimethylammonium-methyl) -2-oxo-1,3- oxazolidine chloride, 1- (trimethylammonium methyl) ethylene carbonate chloride, N- (β-sulfatoethyl) piperazine, N- [β- (β'-sulfatoethoxy) ethyl] piperazine, N- (γ-sulfato-β- hydroxypropyl) piperidine, N- (γ-sulfato-β-hydroxypropyl) pyrrolidine, N- (β-sulfatoethyl) piperidine, the salts of 3-sulfato-2-hydroxy-1- (trimethylammonium) propane such as 3-sulfato-2-hydroxy-1- (trimethylammonium) propane sulfate, 2-sulfato-3-hydroxy-1-aminopropane, 3-sulfato-2-hydroxy-1-aminopropane, 1- Sulfato-3-hydroxy-2-amino-propane, 3-hydroxy-1-sulfato-2-amino-propane, 2,3-disulfato-1-amino-propane and 1,3-disulfato-2-amino-propane as well Derivatives of these compounds with a different ester group instead of the sulfato group, as with de r phosphato group, an alkanoyloxy group of 2 to 5 carbon atoms, such as the acetyloxy group, the p-tosyloxy and 3,4,5-trimethyl-phenylsulfonyloxy group.
Von den erfindungsgemäß verwendbaren Silanverbindungen der allgemeinen Formel (4) sind insbesondere diejenigen hervorzuheben, die eine sekundäre Aminogruppe enthalten und die der allgemeinen Formel (11)
- RC
- eine der obengenannten Bedeutungen besitzt,
- RH
- eine Gruppe der allgemeinen Formel (12a) oder (12b)
r eine ganze Zahl von 1 bis 6, vorzugsweise von 2 bis 4, ist,
t eine ganze Zahl von Null bis 4, vorzugsweise 1 oder 2, ist,
v eine ganze Zahl von 1 bis 4, vorzugsweise 2 oder 3, ist,
z eine ganze Zahl von 1 bis 10, vorzugsweise 1 bis 5 und insbesondere 1, ist, und
ALK einen geradkettigen oder verzweigten Alkylenrest von 1 bis 8 C-Atomen bedeutet, wobei der verzweigte Alkylenrest vorzugsweise ein solcher der Formel
T1 eine Aminogruppe der allgemeinen Formel (8c)
R13 Wasserstoff oder Alkyl von 1 bis 4 C-Atomen ist, das durch Phenyl, Sulfophenyl, Amino, Thio oder Hydroxy substituiert sein kann, oder Carbamoyl ist, das mono- oder disubstituiert sein kann, wie beispielsweise durch Substituenten aus der Gruppe Alkyl von 1 bis 4 C-Atomen, Phenyl, Sulfophenyl, Cycloalkyl von 5 bis 8 C-Atomen und Alkyl von 2 bis 4 C-Atomen, das durch Amino, Thio oder Hydroxy substituiert ist, und bevorzugt Alkyl von 1 bis 4 C-Atomen, wie Methyl und Ethyl, ist; - RK
- Wasserstoff, Alkoxy von 1 bis 8 C-Atomen, vorzugsweise von 1 bis 4 C-Atomen, wie Propoxy, Ethoxy und Methoxy, das durch Alkoxy von 1 bis 4 C-Atomen substituiert sein kann, Halogen, wie Chlor und Brom, Hydroxy, Alkyl von 1 bis 8 C-Atomen, vorzugsweise von 1 bis 4 C-Atomen, wie Ethyl und Methyl, Alkenyl von 2 bis 8 C-Atomen, vorzugsweise von 2 bis 4 C-Atomen, Alkinyl von 3 bis 8 C-Atomen, vorzugsweise von 3 bis 5 C-Atomen, oder Phenyl oder eine Gruppe der allgemeinen Formel (12a) oder (12b) ist und vorzugsweise Alkyl von 1 bis 4 C-Atomen, Alkoxy von 1 bis 4 C-Atomen, durch Alkoxy von 1 bis 4 C-Atomen substituiertes Alkoxy von 2 bis 4 C-Atomen oder eine Gruppe der allgemeinen Formel (12a) oder (12b) bedeutet, und
- RM
- eine der für RC und RK genannten Bedeutungen hat.
- R C
- has one of the meanings mentioned above,
- R H
- a group of the general formula (12a) or (12b)
r is an integer from 1 to 6, preferably from 2 to 4,
t is an integer from zero to 4, preferably 1 or 2,
v is an integer from 1 to 4, preferably 2 or 3,
z is an integer from 1 to 10, preferably 1 to 5 and in particular 1, and
ALK means a straight-chain or branched alkylene radical of 1 to 8 carbon atoms, the branched alkylene radical preferably being one of the formula
T 1 is an amino group of the general formula (8c)
R 13 is hydrogen or alkyl of 1 to 4 carbon atoms, which may be substituted by phenyl, sulfophenyl, amino, thio or hydroxy, or carbamoyl, which may be mono- or disubstituted, such as by substituents from the group of alkyl of 1 to 4 carbon atoms, phenyl, sulfophenyl, cycloalkyl of 5 to 8 carbon atoms and alkyl of 2 to 4 carbon atoms, which is substituted by amino, thio or hydroxy, and preferably alkyl of 1 to 4 carbon atoms, such as methyl and ethyl; - R K
- Hydrogen, alkoxy of 1 to 8 carbon atoms, preferably of 1 to 4 carbon atoms, such as propoxy, ethoxy and methoxy, which can be substituted by alkoxy of 1 to 4 carbon atoms, halogen, such as chlorine and bromine, hydroxy, Alkyl of 1 to 8 carbon atoms, preferably of 1 to 4 carbon atoms, such as ethyl and methyl, alkenyl of 2 to 8 carbon atoms, preferably of 2 to 4 carbon atoms, alkynyl of 3 to 8 carbon atoms, is preferably from 3 to 5 carbon atoms, or phenyl or a group of the general formula (12a) or (12b) and is preferably alkyl from 1 to 4 carbon atoms, alkoxy from 1 to 4 carbon atoms, by alkoxy from 1 to 4 carbon atoms substituted alkoxy of 2 to 4 carbon atoms or a group of the general formula (12a) or (12b), and
- R M
- has one of the meanings given for R C and R K.
Erfindungsgemäß verwendbare Silanverbindungen der allgemeinen Formel (4) sind beispielsweise:
[γ-(β'-Amino-ethoxy)-propyl]-trimethoxy-silan, [γ-(β'-Aminoethyl-amino)-propyl]-trimethoxy-silan, [γ-(β'-Aminoethoxy)-propyl]-methyl-diethoxy-silan, [γ-(β'-Aminoethyl-amino)-propyl]-methyl-dimethoxy-silan, 3- oder 4-Aminophenyl-trimethoxy-silan, [γ-(4-Aminophenoxy)-propyl]-trimethoxy-silan, N-[γ-(Trimethoxy-silyl)-propyl]-N,N-di-(β'-aminoethyl)-amin, (γ-Aminopropyl)-trimethoxy-silan, (γ-Aminopropyl)-ethoxy-dimethyl-silan, (γ-Aminopropyl)-methyl-diethoxy-silan, N,N-Bis-[γ-(triethoxy-silyl)-propyl]-amin, [γ-(N,N-Dimethylamino)-propyl]-trimethoxy-silan, [γ-(N-Methylamino)-propyl]-trimethoxy-silan, (δ-Aminobutyl)-trimethoxy-silan, {4-[N-(β-Aminoethyl)-amino]-methyl}-phenethyl-trimethoxy-silan, [(N-Cyclohexyl-amino)-methyl]-methyl-diethoxy-silan, [γ-(N-N-Diethyl-amino)-propyl]-trimethoxy-silan, [y-(β'-N-Methylamino-ethoxy)-propyl]-methyl-diethoxy-silan, [γ-(β'-N-Methylamino-ethoxy)-propyl]-triethoxy-silan, [γ-(β'-N-Methylamino-ethoxy)-propyl]-dimethyl-ethoxy-silan, 1-{3'-[β-(N-Methylamino)-ethoxy-methyl]-phenyl}-eth-1-yl-(diethoxy)-(methyl)-silan, 2-{4'-[β-(N-Methylamino)-ethoxy-methyl]-phenyl}-eth-2-yl-(diethoxy)-(methyl)-silan, 1-{4'-[β-(N-Methylamino)-ethoxy-methyl]-phenyl}-eth-1-yl-(diethoxy)-(methyl)-silan, 2-{3'-[β-(N-Methylamino)-ethoxy-methyl]-phenyl}-eth-2-yl-(diethoxy)-(methyl)-silan, {γ-[β'-(β"-Aminoethyl)-aminoethyl]-propyl}-trimethoxy-silan und 1,3-Di-(y-aminopropyl)-1,1,3,3-tetramethyl-disiloxan.Silane compounds of the general formula (4) which can be used according to the invention are, for example:
[γ- (β'-aminoethoxy) propyl] trimethoxy silane, [γ- (β'-aminoethylamino) propyl] trimethoxy silane, [γ- (β'-aminoethoxy) propyl] methyl diethoxy silane, [γ- (β'-aminoethyl amino) propyl] methyl dimethoxy silane, 3- or 4-aminophenyltrimethoxy silane , [γ- (4-aminophenoxy) propyl] trimethoxysilane, N- [γ- (trimethoxysilyl) propyl] -N, N-di- (β'-aminoethyl) amine, (γ-aminopropyl ) -trimethoxy-silane, (γ-aminopropyl) -ethoxy-dimethyl-silane, (γ-aminopropyl) -methyl-diethoxy-silane, N, N-bis- [γ- (triethoxysilyl) propyl] amine, [γ- (N, N-dimethylamino) propyl] trimethoxy silane, [γ- (N-methylamino) propyl] trimethoxy silane, (δ-aminobutyl) trimethoxy silane, {4- [N- (β-aminoethyl) amino] methyl} phenethyl trimethoxy silane, [(N-cyclohexyl amino) methyl] methyl diethoxy silane, [γ- (NN diethyl amino) propyl] - trimethoxysilane, [y- (β'-N -methylaminoethoxy) propyl] methyldiethoxysilane, [γ- (β'-N -methylaminoethoxy) propyl] triethoxysilane, [γ - (β'-N-Methylamino-ethoxy) -propyl] -dimethyl-ethoxysilane, 1- {3 '- [β- (N-Methylamino) -ethoxy-methyl] -phenyl} -eth-1-yl- (diethoxy) - (methyl) -silane, 2- {4 '- [β- (N-methy lamino) -ethoxy-methyl] -phenyl} -eth-2-yl- (diethoxy) - (methyl) -silane, 1- {4 '- [β- (N-methylamino) -ethoxy-methyl] -phenyl} - eth-1-yl- (diethoxy) - (methyl) -silane, 2- {3 '- [β- (N-methylamino) -ethoxy-methyl] -phenyl} -eth-2-yl- (diethoxy) - ( methyl) silane, {γ- [β '- (β "aminoethyl) aminoethyl] propyl} trimethoxysilane and 1,3-di (y-aminopropyl) -1,1,3,3-tetramethyl disiloxane.
Die erfindungsgemäß verwendbaren Verbindungen (1) und (2) können gemäß bekannten Verfahrensweisen hergestellt werden, wie sie zahlreich in der Literatur beschrieben sind (s. Houben-Weyl, Methoden der Organischen Chemie, 4. Aufl., Band E4, Seiten 82-88 und 192 ff.), so beispielsweise durch Umsetzung eines Alkandiols, das in der Seitenkette eine latente stickstoffhaltige funktionelle Gruppe aufweist, mit Phosgen in wäßriger Lösung bei einem pH-Wert zwischen 7 und 9 zur Herstellung der hetero-cycloaliphatischen Carbonate oder beispielsweise durch Umsetzung von Aminoalkanolen mit Phosgen in wäßriger Lösung zu den hetero-cycloaliphatischen Carbaminsäureverbindungen (2-Oxo-1,3-oxazolidinen).The compounds (1) and (2) which can be used according to the invention can be prepared in accordance with known procedures, as described in large numbers in the literature (see Houben-Weyl, Methods of Organic Chemistry, 4th edition, volume E4, pages 82-88 and 192 ff.), for example by reacting an alkanediol which has a latent nitrogen-containing functional group in the side chain with phosgene in aqueous solution at a pH between 7 and 9 to prepare the heterocycloaliphatic carbonates or, for example, by reacting Aminoalkanols with phosgene in aqueous solution to the heterocycloaliphatic carbamic acid compounds (2-oxo-1,3-oxazolidines).
Die erfindungsgemäß verwendbaren Verbindungen (3a) und (3b) können so hergestellt werden, daß man deren entsprechenden hydroxygruppenhaltigen Verbindungen in üblicher Weise durch Umsetzung mit den Säuren bzw. den entsprechenden Acylierungsmitteln verestert, wobei man, sofern man von aminogruppenhaltigen Verbindungen mit mehr als einer Hydroxygruppe ausgeht, bevorzugt nur eine dieser Hydroxygruppen verestert. Solche Verfahrensweisen sind in der Literatur bekannt; die Herstellung der erfindungsgemäßen verwendbaren Verbindungen kann analog solchen bekannten Verfahrensweisen durchgeführt werden. So wird beispielsweise in Houben-Weyl, Methoden der Organischen Chemie, Band VI/2, Seiten 452-457, und Band E11, Seiten 997 ff., die Veresterung von Aminoalkoholen zu deren Schwefelsäureestern beschrieben. Weitere gängige Modifizierungen solche Verfahrensweisen beruhen darauf, daß man beispielsweise den Aminoalkohol in einen großen Überschuß an rauchender Schwefelsäure einrührt (s. Chem. Ber. 51, 1160) oder auf der Verwendung indifferenter Lösungsmittel, die als Reaktionsmedium bei der Veresterung dienen, wobei der Einsatz äquimolarer Mengen an konzentrierter Schwefelsäure möglich ist (s. DE-C- 825 841). Veresterungs- und Acylierungsmittel, die als Ausgangsverbindungen zur Herstellung der erfindungsgemäß verwendbaren ester- und aminogruppenhaltigen Verbindungen dienen können, sind beispielsweise Schwefelsäure, Phosphorsäure, Polyphosphorsäure, niedere Alkancarbonsäuren und deren Chloride oder Anhydride, wie bspw. Essigsäure (Eisessig) und Acetanhydrid, Benzolsulfonsäure und die am Benzolkern durch Substituenten aus der Gruppe Sulfo, Carboxy, niederes Alkyl, niederes Alkoxy und Nitro substituierten Benzolsulfonsäuren bzw. deren Sulfochloride. Beispielsweise kann man die Sulfatoverbindungen aus den entsprechenden Hydroxyverbindungen herstellen, indem man die Hydroxyverbindungen in die erforderliche Menge, d.h. bevorzugt äquimolare Menge, konzentrierter Schwefelsäure eingibt und sie bei einer Temperatur zwischen 5 und 30°C einige Zeit bis zur vollständigen Lösung verrührt. Man isoliert sie aus der Schwefelsäurelösung durch Aufgießen der Lösung auf Eis und Neutralisation, durch Fällung der Sulfationen mittels Calciumcarbonat als Calciumsulfat und anschließende Filtration und Eindampfen der wäßrigen Lösung. Am Beispiel der Sulfatoverbindungen erhält man kristalline oder halbkristalline Substanzen, die direkt in den Prozeß der Modifizierung des Fasermaterials eingesetzt werden können.The compounds (3a) and (3b) which can be used according to the invention can be prepared in such a way that their corresponding hydroxyl-containing compounds are esterified in a conventional manner by reaction with the acids or the corresponding acylating agents, where, if one of compounds containing amino groups with more than one hydroxyl group, preferably only one of these hydroxyl groups esterified. Such procedures are known in the literature; the compounds which can be used according to the invention can be prepared analogously to such known procedures. For example, the esterification of amino alcohols to their sulfuric acid esters is described in Houben-Weyl, Methods of Organic Chemistry, Volume VI / 2, pages 452-457, and Volume E11, pages 997 ff. Other common modifications of such procedures are based on, for example, stirring the amino alcohol into a large excess of fuming sulfuric acid (see Chem. Ber. 51 , 1160) or on the use of indifferent solvents which serve as the reaction medium in the esterification, the use of which equimolar amounts of concentrated sulfuric acid is possible (see DE-C-825 841). Esterification and acylating agents which can serve as starting compounds for the preparation of the compounds containing ester and amino groups which can be used according to the invention are, for example, sulfuric acid, phosphoric acid, polyphosphoric acid, lower alkane carboxylic acids and their chlorides or anhydrides, such as, for example, acetic acid (glacial acetic acid) and acetic anhydride, benzenesulfonic acid and the on the benzene nucleus by substituents from the group sulfo, carboxy, lower alkyl, lower alkoxy and nitro substituted benzenesulfonic acids or their sulfochlorides. For example, the sulfato compounds can be prepared from the corresponding hydroxy compounds by adding the hydroxy compounds in the required amount, ie preferably an equimolar amount, of concentrated sulfuric acid and stirring them at a temperature between 5 and 30 ° C. for some time until the solution is complete. They are isolated from the sulfuric acid solution by pouring the solution onto ice and neutralization, by precipitating the sulfate ions using calcium carbonate as calcium sulfate and then filtering and evaporating the aqueous solution. The example of the sulfato compounds gives crystalline or semi-crystalline substances which can be used directly in the process of modifying the fiber material.
Die erfindungsgemäß verwendeten Silanverbindungen sind zahlreich in der Literatur beschrieben und teilweise im Handel erhältlich. Als Species nicht bekannte Silanverbindungen können analog den Verfahrensweisen der Herstellung der bekannten Silanverbindungen, wie beispielsweise analog den Angaben der deutschen Patentschrift DE-C-1 186 061, synthetisiert werden.The silane compounds used in accordance with the invention are described in large numbers in the literature and some are commercially available. Not known as species Silane compounds can be synthesized analogously to the procedures for the preparation of the known silane compounds, such as, for example, analogously to the information in German Patent DE-C-1 186 061.
Insbesondere lassen sich beispielsweise die Silanverbindungen der allgemeinen Formel (11) herstellen, indem man eine Verbindung der allgemeinen Formel (13)
- RC
- eine der obengenannten Bedeutungen besitzt,
- RP
- ein Rest der allgemeinen Formel (14a) oder (14b)
-(CH2)r-Hal (14b)
ist, in welchen
ALK, t und r eine der obengenannten Bedeutungen besitzen und
Hal für ein Halogenatom, vorzugsweise Chloratom, steht, - RR
- Wasserstoff, Alkoxy von 1 bis 8 C-Atomen, vorzugsweise von 1 bis 4 C-Atomen, Atomen, wie Propoxy, Ethoxy und Methoxy, das durch Alkoxy von 1 bis 4 substituiert sein kann, Halogen, wie Chlor und Brom, Hydroxy, Alkyl von 1 bis 8 C-Atomen, vorzugsweise von 1 bis 4 C-Atomen, wie Ethyl und Methyl, Alkenyl von 2 bis 8 C-Atomen, vorzugsweise von 2 bis 4 C-Atomen, Alkinyl von 3 bis 8 C-Atomen, vorzugsweise von 3 bis 5 C-Atomen, oder Phenyl oder eine Gruppe der allgemeinen Formel (14a) oder (14b) ist und vorzugsweise Alkyl von 1 bis 4 C-Atomen, Alkoxy von 1 bis 4 C-Atomen, durch Alkoxy von 1 bis 4 C-Atomen substituiertes Alkoxy von 2 bis 4 C-Atomen oder eine Gruppe der allgemeinen Formel (14a) oder (14b) bedeutet, und
- RT
- eine der für RC oder RR genannten Bedeutungen besitzt,
MeO - (CH2)r - T1 (15a)
MeO - (CH2)v - T1 (15b)
in welchen r, v und T1 eine der obengenannten Bedeutungen besitzen und Me für eine Alkalimetall, wie Natrium und insbesondere Kalium, steht, in einem polaren, organischen, gegebenenfalls mit Wasser mischbaren Lösemittel, das gegenüber den Reaktanten, wie insbesondere Alkoholaten, inert ist, bei einer Temperatur zwischen 0 und 50°C, vorzugsweise zwischen 10 und 40°C, umsetzt.In particular, for example, the silane compounds of the general formula (11) can be prepared by using a compound of the general formula (13)
- R C
- has one of the meanings mentioned above,
- R P
- a radical of the general formula (14a) or (14b)
- (CH 2 ) r -Hal (14b)
is in which
ALK, t and r have one of the meanings mentioned above and
Hal represents a halogen atom, preferably chlorine atom, - R R
- Hydrogen, alkoxy of 1 to 8 carbon atoms, preferably of 1 to 4 carbon atoms, atoms such as propoxy, ethoxy and methoxy, which can be substituted by alkoxy of 1 to 4, halogen, such as chlorine and bromine, hydroxy, alkyl from 1 to 8 carbon atoms, preferably from 1 to 4 carbon atoms, such as ethyl and methyl, alkenyl from 2 to 8 carbon atoms, preferably from 2 to 4 carbon atoms, alkynyl from 3 to 8 carbon atoms, preferably from 3 to 5 carbon atoms, or phenyl or a group of the general formula (14a) or (14b) and preferably alkyl from 1 to 4 carbon atoms, alkoxy from 1 to 4 carbon atoms, by alkoxy from 1 to 4 C atoms substituted alkoxy of 2 to 4 carbon atoms or a group of the general formula (14a) or (14b), and
- R T
- has one of the meanings mentioned for R C or R R ,
MeO - (CH 2 ) r - T 1 (15a)
MeO - (CH 2 ) v - T 1 (15b)
in which r, v and T 1 have one of the meanings mentioned above and Me stands for an alkali metal, such as sodium and in particular potassium, in a polar, organic, optionally water-miscible solvent which is inert to the reactants, such as, in particular, alcoholates , at a temperature between 0 and 50 ° C, preferably between 10 and 40 ° C.
Die Ausgangsverbindungen der allgemeinen Formel (15a) und (15b) werden in üblicher Weise hergestellt, indem man von der entsprechenden Hydroxyverbindung (Aminoalkohol) ausgeht und diesen mit dem metallischen Alkalimetall, wie Natrium und insbesondere Kalium, in an und für sich bekannter Verfahrensweise in den oben erwähnten Lösemitteln umsetzt. In der Regel erfolgt die Umsetzung bei einer Temperatur zwischen 50 und 150°C, vorzugsweise zwischen 80 und 110°C. Vorteilhaft wählt man als Lösemittel ein solches mit genügend hohem Siedepunkt, damit das Alkalimetall über seinen Schmelzpunkt erwärmt werden kann, um die Reaktionsführung zu vereinfachen und zu beschleunigen.The starting compounds of the general formulas (15a) and (15b) are prepared in a conventional manner by starting from the corresponding hydroxy compound (amino alcohol) and using the metallic alkali metal, such as sodium and especially potassium, in a manner known per se in the implements solvents mentioned above. As a rule, the reaction takes place at a temperature between 50 and 150 ° C., preferably between 80 and 110 ° C. It is advantageous to choose a solvent with a boiling point which is sufficiently high that the alkali metal can be heated above its melting point in order to simplify and accelerate the reaction.
Hierfür geeignete Lösemittel sind insbesondere aliphatische Kohlenwasserstoffe mit einem Siedebereich von 70 bis 150°C, wie beispielsweise Heptan und Dodecan, und Gemische derselben, desweiteren aromatische Kohlenwasserstoffe, wie beispielsweise alkylsubstituierte Benzole und Naphthaline, wie insbesondere Toluol und Xylol, und desweiteren aliphatische, insbesondere cycloaliphatische, Etherverbindungen, wie beispielsweise Tetrahydrofuran.Solvents suitable for this are, in particular, aliphatic hydrocarbons with a boiling range from 70 to 150 ° C., such as heptane and dodecane, and mixtures thereof, furthermore aromatic hydrocarbons, such as, for example, alkyl-substituted benzenes and naphthalenes, such as in particular toluene and xylene, and furthermore aliphatic, in particular cycloaliphatic Ether compounds such as tetrahydrofuran.
Bei der Umsetzung der Verbindungen der allgemeinen Formel (13) mit einer Verbindung der allgemeinen Formel (15a) oder (15b) wird das entsprechende Alkalihalogenid frei und fällt als kristallines Salz aus. Es wird nach der Umsetzung abgetrennt, beispielsweise durch Filtration, und aus dem hiervon befreiten Ansatz wird mittels fraktionierter Destillation das Lösemittel entfernt und die synthetisierte Silanverbindung gewonnen.When the compounds of the general formula (13) are reacted with a compound of the general formula (15a) or (15b), the corresponding alkali metal halide is released and precipitates out as a crystalline salt. It is separated off after the reaction, for example by filtration, and the solvent is removed from the batch freed from this by means of fractional distillation and the synthesized silane compound is obtained.
Unter Fasermaterialien werden natürliche und synthetische Fasermaterialien verstanden, die Hydroxy- und/oder Carbonamidgruppen enthalten, wie Seide, Wolle und andere Tierhaare sowie synthetische Polyamidfasermaterialien und Polyurethanfasermaterialien, beispielsweise Polyamid-4, Polyamid-6 und Polyamid-11, und insbesondere Fasermaterialien, die den Grundkörper der α,β-Glucose enthalten, wie Cellulosefasermaterialien, beispielsweise Baumwolle, Hanf, Jute und Leinen, und deren regenerierten Abkömmlinge, wie Viskoseseide und Zellwolle, oder Mischungen aus solchen Fasermaterialien, wobei das Fasermaterial im vorliegenden Ink-Jet-Färbeverfahren als flächenhaftes Gebilde (Stückware), wie Gewebe oder Gewirke, vorliegen muß.Fiber materials are understood to mean natural and synthetic fiber materials which contain hydroxyl and / or carbonamide groups, such as silk, wool and other animal hair, and also synthetic polyamide fiber materials and polyurethane fiber materials, for example polyamide-4, polyamide-6 and polyamide-11, and in particular fiber materials which Base bodies of α, β-glucose contain, such as cellulose fiber materials, for example cotton, hemp, jute and linen, and their regenerated derivatives, such as viscose silk and cellulose, or mixtures of such fiber materials, the fiber material in the present ink-jet dyeing process as a flat structure (Piece goods), such as woven or knitted fabrics, must be present.
Unter "anionischen Farbstoffen" werden solche verstanden, die anionische, d.h. saure Gruppen, wie Sulfo- und Carboxygruppen, bzw. deren Salze, wie Alkalimetallsalze, enthalten und demgemäß wasserlöslich sind. Insbesondere werden hierunter solche anionischen Farbstoffe verstanden, die eine faserreaktive Gruppe besitzen, d.h. eine Gruppe, die üblicherweise mit den Carbonamid- oder Hydroxygruppen des Fasermaterials zu reagieren und mit diesen eine Verbindung einzugehen vermögen.By "anionic dyes" are meant those which are anionic, i.e. contain acidic groups, such as sulfo and carboxy groups, or their salts, such as alkali metal salts, and are accordingly water-soluble. In particular, these are understood to mean those anionic dyes which have a fiber-reactive group, i.e. a group that is usually able to react with the carbonamide or hydroxy groups of the fiber material and to be able to form a connection with them.
Die Modifizierung des Fasermaterials mit den aminogruppenhaltigen Verbindungen, wie den der Formeln (1), (2), (3a), (3b) und/oder (4), kann beispielsweise in der Weise durchgeführt werden, daß man das Fasermaterial mit einer dieser erfindungsgemäß verwendbaren Verbindungen oder einem Gemisch solcher Verbindungen in alkalisch wäßriger Lösung in Kontakt bringt und die aminogruppenhaltige Verbindung bei einer Temperatur zwischen 60 und 230°C, vorzugsweise zwischen 90 und 190°C, auf das Fasermaterial einwirken läßt. Die Konzentration dieser Verbindung in der alkalischen wäßrigen Lösung liegt in der Regel zwischen 1 und 20 Gew.-%, vorzugsweise zwischen 5 und 10 Gew.-%. Das alkalisch wirkende Mittel, wie beispielsweise Natriumhydroxid, Natriumcarbonat und Kaliumcarbonat, ist in einer Konzentration zwischen 0,1 und 20 Gew.-%, vorzugsweise zwischen 5 und 10 Gew.-%, gelöst. In der Regel besitzt diese alkalische wäßrige Lösung einen pH-Wert zwischen 10 und 14.The modification of the fiber material with the amino group-containing compounds, such as those of the formulas (1), (2), (3a), (3b) and / or (4), can be carried out, for example, in such a way that the fiber material with one of these compounds which can be used according to the invention or a mixture of such compounds in alkaline aqueous solution and the compound containing amino groups at a temperature between 60 and 230 ° C., preferably between 90 and 190 ° C, can act on the fiber material. The concentration of this compound in the alkaline aqueous solution is generally between 1 and 20% by weight, preferably between 5 and 10% by weight. The alkaline agent, such as sodium hydroxide, sodium carbonate and potassium carbonate, is dissolved in a concentration between 0.1 and 20% by weight, preferably between 5 and 10% by weight. As a rule, this alkaline aqueous solution has a pH between 10 and 14.
Das Fasermaterial kann sowohl beim Modifizieren als auch in der modifizierten Form beim Einsatz in das erfindungsgemäße Färbeverfahren auch im Gemisch mit anderen Fasermaterialien, wie beispielsweise in Form von Baumwolle/Polyester-Fasermaterialien und in Form von Mischgeweben mit anderen Fasermaterialien, vorliegen.The fiber material can be present both in the modification and in the modified form when used in the dyeing process according to the invention in a mixture with other fiber materials, for example in the form of cotton / polyester fiber materials and in the form of blended fabrics with other fiber materials.
Die zur Modifizierung des Fasermaterials verwendbaren aminogruppenhaltigen Verbindungen können in vielfältiger Weise in alkalisch wäßriger Lösung mit dem Fasermaterial in Kontakt gebracht werden, so beispielsweise durch Behandeln des Fasermaterials in einer alkalischen, wäßrigen Lösung der aminogruppenhaltigen Verbindung (analog einem Färbe-Ausziehverfahren) bei einer Temperatur zwischen 15 und 100°C, wobei insbesondere bei den höheren Temperaturen die Modifizierung des Fasermaterials bereits erfolgt. Andere Möglichkeiten sind, das Fasermaterial mit der wäßrigen, alkalischen Lösung zu klotzen, zu pflatschen oder die Lösung auf das Fasermaterial aufzusprühen. Geschieht die Imprägnierung des Fasermaterials mit dieser alkalischen, wäßrigen Lösung durch Einbringen des Fasermaterials in diese Lösung oder durch Foulardieren (Klotzen), so wird das imprägnierte Material anschließend von überschüssiger Flotte so abgequetscht, so daß die Aufnahme an dieser wäßrigen, alkalischen Lösung zwischen 50 und 120 Gew.-%, vorzugsweise zwischen 70 und 100 Gew.-%, bezogen auf das Fasermaterial, beträgt. In der Regel erfolgt das Imprägnieren (durch Klotzen, Pflatschen oder Behandlung in der Lösung selbst) bei einer Temperatur zwischen 10 und 60°C, vorzugsweise bei einer Temperatur zwischen 15 und 30°C. Beim Aufsprühen der Lösung auf das Fasermaterial, das in der Regel bei einer Temperatur zwischen 10 und 40°C erfolgt, wird eine Flüssigkeitsaufnahme von bevorzugt zwischen 10 und 50 Gew.-% gewählt.The amino group-containing compounds which can be used to modify the fiber material can be brought into contact with the fiber material in an alkaline aqueous solution in a variety of ways, for example by treating the fiber material in an alkaline, aqueous solution of the amino group-containing compound (analogously to a dye-drawing process) at a temperature between 15 and 100 ° C, the modification of the fiber material already taking place, in particular at the higher temperatures. Other possibilities are to pad the fiber material with the aqueous, alkaline solution, to splash or to spray the solution onto the fiber material. If the impregnation of the fiber material with this alkaline, aqueous solution occurs by introducing the fiber material into this solution or by padding (padding), the impregnated material is then squeezed out by excess liquor so that the absorption of this aqueous, alkaline solution between 50 and 120% by weight, preferably between 70 and 100% by weight, based on the fiber material. As a rule, the impregnation (by padding, splashing or treatment in the solution itself) takes place at a temperature between 10 and 60 ° C., preferably at a temperature between 15 and 30 ° C. When the solution is sprayed onto the fiber material, which usually takes place at a temperature between 10 and 40 ° C, a liquid absorption of preferably between 10 and 50% by weight.
Ist das Fasermaterial ein mercerisiertes Cellulosefasermaterial, so kann die erfindungsgemäß verwendbare aminogruppenhaltige Verbindung auch vorteilhaft auf das zu modifizierende Cellulosefasermaterial direkt nach dem Mercerisierungsprozeß aufgebracht werden, bei welchem das mercerisierte Material das Alkali noch enthält, indem man beispielsweise das nach dem Mercerisierungsprozeß erhältliche, mit dem wäßrigen Alkali imprägnierte Material gegebenenfalls auf einen erforderlichen Flüssigkeitsgehalt abquetscht und das alkalisch imprägnierte Material mit der wäßrigen Lösung der erfindungsgemäß verwendbaren aminogruppenhaltigen Verbindung imprägniert, wobei die Imprägnierung durch Überklotzen, durch Aufsprühen und ähnliche, in der Technik übliche und bekannte Verfahrensschritte vorgenommen werden kann.If the fiber material is a mercerized cellulose fiber material, the amino group-containing compound that can be used according to the invention can also advantageously be applied to the cellulose fiber material to be modified directly after the mercerization process, in which the mercerized material still contains the alkali, for example by using the aqueous solution to obtain the one obtained after the mercerization process Alkali-impregnated material, if necessary, squeezed to a required liquid content and the alkaline-impregnated material impregnated with the aqueous solution of the compound containing amino groups that can be used according to the invention, the impregnation being carried out by padding, spraying and similar process steps which are customary and known in the art.
Nach Imprägnieren des Fasermaterials auf einem der oben angegebenen verschiedenen Wege, ausgenommen der Vorbehandlung nach einer Ausziehverfahrensweise, wird das imprägnierte Material getrocknet; in der Regel wird mit der Trocknung gleichzeitig die Fixierung der die Faser modifizierenden Verbindung durchgeführt, wobei man für die Trocknung und Fixierung bevorzugt eine Temperatur zwischen 100 und 230°C, insbesondere zwischen 120 und 190°C, wählt. In der Regel erfolgt die Trocknung und gleichzeitige Fixierung durch Behandlung mittels Heißluft während 1 bis 5 Minuten. Die Fixierung der die Faser modifizierenden Verbindung auf dem Fasermaterial kann durch einfaches Trocknen bei höheren Temperaturen erfolgen; so kann es zur Trocknung und zur Fixierung der modifizierenden Verbindung auf dem Fasermaterial in Trockenschränken aufgehängt und den erforderlichen höheren Temperaturen, wie bspw. 80 bis 105°C, ausgesetzt werden.After impregnation of the fiber material in one of the various ways specified above, except for the pretreatment according to a pull-out procedure, the impregnated material is dried; as a rule, the drying of the compound modifying the fiber is carried out simultaneously with the drying, a temperature between 100 and 230 ° C., in particular between 120 and 190 ° C., preferably being chosen for the drying and fixing. As a rule, drying and simultaneous fixing take place by treatment with hot air for 1 to 5 minutes. The fiber-modifying compound can be fixed on the fiber material by simple drying at higher temperatures; it can be hung up in drying cabinets to dry and fix the modifying compound on the fiber material and exposed to the required higher temperatures, such as 80 to 105 ° C.
Die Nachbehandlung des modifizierten Fasermaterials erfolgt durch Spülen mit kaltem und heißem Wasser und gegebenenfalls durch Behandeln in einem eine geringe Menge einer Säure, wie Essigsäure, enthaltendem wäßrigen Bad zur Entfernung des Alkalis aus dem Fasermaterial und anschließendes Trocknen. In den Färbeprozeß soll möglichst ein neutral reagierendes Fasermaterial eingesetzt werden.The modified fiber material is aftertreated by rinsing with cold and hot water and optionally by treatment in an aqueous bath containing a small amount of an acid, such as acetic acid, to remove the alkali from the fiber material and then drying. In the dyeing process should use a neutral reacting fiber material if possible.
Die Applikation der Farbstofflösungen auf das modifizierte Fasermaterial (Gewebe, Gewirke oder Vlies) erfolgt mit Hilfe handelsüblicher Tintenstrahl-Drucker, die erforderlichenfalls für großtechnische Zwecke umgerüstet werden. Verwendet werden neutrale, vorzugsweise wäßrige Lösungen der anionischen Farbstoffe, wobei die anionischen Farbstoffe bevorzugt eine faserreaktive Gruppe enthalten. Die Farbstofflösungen können Hilfsmittel enthalten, wie sie üblicherweise in den Tinten für Tintenstrahldrucker erforderlichenfalls enthalten sind, wie beispielsweise Antiaggregationsmittel, wie N-Methyl-pyrrolidon, Dimethylformamid und Dimethylacetamid, und Netzmittel, wie ionische oder nicht-ionische Tenside. Auf andere Hilfsmittel, die üblicherweise beim Färben mit anionischen, insbesondere faserreaktiven, Farbstoffen benötigt werden, kann verzichtet werden. Ihr Einsatz ist sogar unzweckmäßig und nachteilig. Zweckmäßigerweise werden die anionischen Farbstoffe in der von Elektrolytsalzen, wie Natriumchlorid und Natriumsulfat, freien Form eingesetzt. Aber auch handelsübliche Farbstoffpräparationen mit bis zu 50 Gew.-% an Elektrolytsalz lassen sich in der Regel problemlos bei dem erfindungsgemäßen Verfahren mit der Tintenstrahl-Drucktechnik applizieren. Beim Mehrfarbendruck können mehrere Tintenkartuschen hintereinander geschaltet werden, die sich zur Erzeugung des Druckes auf der sich bewegenden Materialbahn mit den heutzutage üblichen Mitteln steuern lassen. Es können auch moderne Mehrkammer-Tintenstrahlpatronen eingesetzt werden, mit welchen in einem Durchgang gleichzeitig mehrere Farben aufgetragen werden können.The dye solutions are applied to the modified fiber material (woven, knitted or non-woven) with the help of commercially available inkjet printers, which are converted if necessary for large-scale purposes. Neutral, preferably aqueous, solutions of the anionic dyes are used, the anionic dyes preferably containing a fiber-reactive group. The dye solutions can contain auxiliaries such as are usually present in the inks for inkjet printers, such as anti-aggregation agents such as N-methyl-pyrrolidone, dimethylformamide and dimethylacetamide, and wetting agents such as ionic or non-ionic surfactants. Other auxiliaries that are usually required for dyeing with anionic, in particular fiber-reactive, dyes can be dispensed with. Their use is even inappropriate and disadvantageous. The anionic dyes are expediently used in the form free from electrolyte salts, such as sodium chloride and sodium sulfate. However, commercially available dye preparations with up to 50% by weight of electrolyte salt can generally also be applied without problems in the process according to the invention using the inkjet printing technique. In multi-color printing, several ink cartridges can be connected in series, which can be controlled with the means common today to generate the print on the moving material web. Modern multi-chamber inkjet cartridges can also be used, with which several colors can be applied in one pass.
Der Auftrag der Farbstofflösung (Tinte) auf das zu färbende modifizierte Material erfolgt, gemäß dem Tintenstrahl-Druckverfahren, gezielt in winzigen Tintentropfen. Das auf diese Weise gefärbte Material wird anschließend einer Behandlung mit Heißdampf, Heißluft oder mittels einer anderen Energie, wie mittels Bestrahlung mit elektromagnetischen Wellen im Mikrowellen- oder Radiofrequenzbereich, unterworfen, wobei die Fixierung der Farbstoffe auf dem modifizierten Fasermaterial erfolgt. Insbesondere wegen der geringen Menge an Farbstofflösung, die auf das Material mittels des Tintenstrahl-Druckverfahrens aufgebracht wird, ist eine anschließende Wäschebehandlung des gefärbten Materials in der Regel nicht erforderlich. Man erreicht auf diese Weise, daß der Färbeprozeß ohne Belastung durch irgendwelche Abwässer, die nach den bisher üblichen Färbeverfahren beispielsweise nicht fixierten Farbstoff, Alkali und Elektrolytsalze enthalten, oder ohne Belastung durch andere Abfallprodukte durchgeführt werden kann. Es werden gemäß dem erfindungsgemäßen Verfahren farbstarke Druckmuster mit den üblichen guten Echtheitseigenschaften erhalten.The dye solution (ink) is applied to the modified material to be colored in accordance with the inkjet printing process, specifically in tiny drops of ink. The material dyed in this way is then subjected to a treatment with superheated steam, hot air or by means of another energy, such as by means of radiation with electromagnetic waves in the microwave or radio frequency range, the dyes being fixed on the modified fiber material. Especially because of the small amount of dye solution that is on the Subsequent laundry treatment of the colored material is generally not required by means of the ink jet printing process. It is achieved in this way that the dyeing process can be carried out without exposure to any waste water which, for example, contains dye, alkali and electrolyte salts which have not been fixed according to the dyeing processes hitherto customary, or without exposure to other waste products. In accordance with the method according to the invention, strongly colored print samples with the usual good fastness properties are obtained.
Unterschiedlich tief gefärbte Nuancen des gleichen Farbtons sind durch Verwendung des Tintenstrahl-Verfahrens sehr einfach erzielbar, so durch Steuerung der Auftragsmenge der Farbstofflösung, zum Beispiel durch mehrfaches Überdrucken derselben Zeile, oder auch durch Aufrasterung und Drucken eines feinen Punkterasters, das bei heutigen Ink-Jet-Druckern, je nach Verfahren, sogar über 400 dpi liegen kann. Ohne einen Neuansatz der Färbeflotte lassen sich so eine Vielzahl von Farbintensitäten (Farbsättigungen) erhalten.Different deeply colored shades of the same color tone can be achieved very easily by using the inkjet process, for example by controlling the application quantity of the dye solution, for example by overprinting the same line several times, or by rasterizing and printing a fine dot pattern, which is the case with today's inkjet -Printers, depending on the process, can even be over 400 dpi. A large number of color intensities (color saturations) can be obtained without having to recreate the dyeing liquor.
Für die erfindungsgemäße Färbeweise sind alle wasserlöslichen, vorzugsweise anionischen Farbstoffe, die bevorzugt eine oder mehrere Sulfo- und/oder Carboxygruppen besitzen und die gegebenenfalls faserreaktive Gruppen enthalten können, geeignet. Sie können außer der Klasse der faserreaktiven Farbstoffe der Klasse der Azo-Entwicklungsfarbstoffe, der Direktfarbstoffe, der Küpenfarbstoffe und der Säurefarbstoffe angehören, die beispielsweise Azofarbstoffe, Kupferkomplex-, Kobaltkomplex- und Chromkomplex-Azofarbstoffe, Kupfer- und Nickelphthalocyanin-Farbstoffe, Anthrachinon-, Kupferformazan- und Triphendioxazinfarbstoffe sein können. Solche Farbstoffe sind zahlreich in der Literatur beschrieben und dem Fachmann allseits geläufig.All water-soluble, preferably anionic dyes, which preferably have one or more sulfo and / or carboxy groups and which can optionally contain fiber-reactive groups, are suitable for the dyeing methods according to the invention. In addition to the class of fiber-reactive dyes, they can belong to the class of azo development dyes, direct dyes, vat dyes and acid dyes, which include, for example, azo dyes, copper complex, cobalt complex and chromium complex azo dyes, copper and nickel phthalocyanine dyes, anthraquinone and copper formazan - And triphendioxazine dyes. Such dyes have been described in numerous literature and are well known to those skilled in the art.
Von den oben erwähnten, für das erfindungsgemäße Färbeverfahren verwendbaren Farbstoffen werden bevorzugt die faserreaktiven Farbstoffe eingesetzt. Faserreaktive Farbstoffe sind solche organische Farbstoffe, die 1, 2, 3 oder 4 faserreaktive Reste der aliphatischen, aromatischen oder heterocyclischen Reihe enthalten. Solche Farbstoffe sind zahlreich in der Literatur beschrieben. Die Farbstoffe können den verschiedensten Farbstoffklassen angehören, wie beispielsweise der Klasse der Monoazo-, Disazo-, Polyazo- und Metallkomplex-Azofarbstoffe, wie 1:1-Kupfer-, 1:2-Chrom- und 1:2-Kobaltkomplex-Monoazo- und -Disazofarbstoffe, weiterhin der Reihe der Anthrachinonfarbstoffe, Kupfer- und Kobaltphthalocyaninfarbstoffe, Kupferformazanfarbstoffe, Azomethin-, Nitroaryl-, Dioxazin-, Triphendioxazin-, Phenazin- und Stilbenfarbstoffe. Unter faserreaktive Farbstoffen werden solche verstanden, die eine "faserreaktive" Gruppe besitzen, d.h. eine Gruppe, die mit den Hydroxygruppen der Cellulose, den Amino-, Carboxy-, Hydroxy- und Thiolgruppen von Wolle und Seide oder mit den Amino- und eventuellen Carboxygruppen von synthetischen Polyamiden unter Bildung einer kovalenten chemischen Bindung zu reagieren vermag. Der faserreaktive Rest kann direkt oder über ein Brückenglied an den Farbstoffrest gebunden sein; vorzugsweise ist er direkt oder über eine gegebenenfalls monoalkylierte Aminogruppe, wie beispielsweise eine Gruppe der Formel -NH- , -N(CH3)-, -N(C2H5)- oder -N(C3H7)- , oder über einen aliphatischen Rest, wie einen Methylen-, Ethylen- oder Propylen-Rest oder einen Alkylenrest von 2 bis 8 C-Atomen, der durch eine oder zwei Oxi- und/oder Aminogruppen unterbrochen ist, oder über ein eine Aminogruppe enthaltendes Brückenglied, wie beispielsweise eine Phenylaminogruppe, an den Farbstoffrest gebunden.Of the above-mentioned dyes which can be used for the dyeing process according to the invention, the fiber-reactive dyes are preferably used. Fiber-reactive dyes are those organic dyes that contain 1, 2, 3 or 4 fiber-reactive residues of the aliphatic, aromatic or heterocyclic series contain. Such dyes have been extensively described in the literature. The dyes can belong to a wide variety of dye classes, for example the class of monoazo, disazo, polyazo and metal complex azo dyes, such as 1: 1 copper, 1: 2 chromium and 1: 2 cobalt complex monoazo and -Disazo dyes, further the series of anthraquinone dyes, copper and cobalt phthalocyanine dyes, copper formazan dyes, azomethine, nitroaryl, dioxazine, triphendioxazine, phenazine and stilbene dyes. Fiber-reactive dyes are understood to mean those which have a “fiber-reactive” group, ie a group which contains the hydroxyl groups of cellulose, the amino, carboxy, hydroxyl and thiol groups of wool and silk or the amino and possibly carboxy groups of synthetic polyamides can react to form a covalent chemical bond. The fiber-reactive residue can be bound to the dye residue directly or via a bridge member; it is preferably directly or via an optionally monoalkylated amino group, such as, for example, a group of the formula -NH-, -N (CH 3 ) -, -N (C 2 H 5 ) - or -N (C 3 H 7 ) -, or via an aliphatic radical, such as a methylene, ethylene or propylene radical or an alkylene radical of 2 to 8 carbon atoms, which is interrupted by one or two oxi and / or amino groups, or via a bridge member containing an amino group, such as for example a phenylamino group attached to the dye residue.
Faserreaktive Reste sind beispielsweise: Vinylsulfonyl, β-Chlorethylsulfonyl, β-Sulfatoethylsulfonyl, β-Acetoxy-ethylsulfonyl, β-Phosphatoethylsulfonyl, β-Thiosulfatoethylsulfonyl, N-Methyl-N-(β-sulfatoethyl-sulfonyl)-amino, Acryloyl, -CO-CCl=CH2, -CO-CH=CH-Cl, -CO-CCl=CHCl, -CO-CCl=CH-CH3, -CO-CBr=CH2, -CO-CH=CH-Br, -CO-CBr=CH-CH3, -CO-CCl=CH-COOH, -CO-CH=CCl-COOH, -CO-CBr=CH-COOH, -CO-CH=CBr-COOH, -CO-CCI=CCI-COOH, -CO-CBr=CBr-COOH, β-Chlor- oder β-Brompropionyl, 3-Phenylsulfonylpropionyl, 3-Methylsulfonylpropionyl, 3-Chlor-3-phenylsulfonylpropionyl, 2,3-Dichlorpropionyl, 2,3-Dibrompropionyl, 2-Fluor-2-chlor-3,3-difluorcyclobutan-2-carbonyl, 2,2,3,3-Tetrafluorcyclobutan-1-carbonyl oder -1-sulfonyl, β-(2,2,3,3-Tetrafluorcyclobutyl-1)-acryloyl, α- oder β-Methylsulfonylacryloyl, Propiolyl, Chloracetyl, Bromacetyl, 4-(β-Chlorethylsuffonyl)-butyryl, 4-Vinylsulfonyl-butyryl, 5-(β-Chlorethylsulfonyl)-valeryl, 5-Vinylsulfonyl-valeryl, 6-(β-Chlorethylsulfonyl)-caproyl, 6-Vinylsulfonyl-caproyl, 4-Fluor-3-nitro-benzoyl, 4-Fluor-3-nitro-phenylsulfonyl, 4-Fluor-3-methylsulfonyl-benzoyl, 4-Fluor-3-cyano-benzoyl, 2-Fluor-5-methylsulfonyl-benzoyl, 2,4-Dichlortriazinyl-6, 2,4-Dichlorpyrimidinyl-6, 2,4,5-Trichlorpyrimidinyl-6, 2,4-Dichlor-5-nitro- oder -5-methyl- oder -5-carboxymethyl- oder -5-carboxy- oder -5-cyano- oder -5-vinyl- oder -5-sulfo- oder -5-mono-, di- oder -trichlormethyl- oder -5-methylsulfonylpyrimidinyl-6, 2,5-Dichlor-4-methylsulfonyl-pyrimidinyl-6, 2-Fluor-4-pyrimidinyl, 2,6-Difluor-4-pyrimidinyl, 2,6-Difluor-5-chlor-4-pyrimidinyl, 2-Fluor-5,6-dichlor-4-pyrimidinyl, 2,6-Difluor-5-methyl-4-pyrimidinyl, 2,5-Difluor-6-methyl-4-pyrimidinyl, 2-Fluor-5-methyl-6-chlor-4-pyrimidinyl, 2-Fluor-5-nitro-6-chlor-4-pyrimidinyl, 5-Brom-2-fluor-4-pyrimidinyl, 2-Fluor-5-cyan-4-pyrimidinyl, 2-Fluor-5-methyl-4-pyrimidinyl, 2,5,6-Trifluor-4-pyrimidinyl, 5-Chlor-6-chlormethyl-2-fluor-4-pyrimidinyl, 2,6-Difluor-5-brom-4-pyrimidinyl, 2-Fluor-5-brom-6-chlor-methyl-4-pyrimidinyl, 2,6-Difluor-5-chlormethyl-4-pyrimidinyl, 2,6-Difluor-5-nitro-4-pyrimidinyl, 2-Fluor-6-methyl-4-pyrimidinyl, 2-Fluor-5-chlor-6-methyl-4-pyrimidinyl, 2-Fluor-5-chlor-4-pyrimidinyl, 2-Fluor-6-chlor-4-pyrimidinyl, 6-Trifluormethyl-5-chlor-2-fluor-4-pyrimidinyl, 6-Trifluormethyl-2-fluor-4-pyrimidinyl, 2-Fluor-5-nitro-4-pyrimidinyl, 2-Fluor-5-trifluormethyl-4-pyrimidinyl, 2-Fluor-5-phenyl- oder -5-methylsulfonyl-4-pyrimidinyl, 2-Fluor-5-carbonamido-4-pyrimidinyl, 2-Fluor-5-carbomethoxy-4-pyrimidinyl, 2-Fluor-5-brom-6-trifluormethyl-4-pyrimidinyl, 2-Fluor-6-carbonamido-4-pyrimidinyl, 2-Fluor-6-carbomethoxy-4-pyrimidinyl, 2-Fluor-6-phenyl-4-pyrimidinyl, 2-Fluor-6-cyan-4-pyrimidinyl, 2,6-Difluor-5-methylsulfonyl-4-pyrimidinyl, 2-Fluor-5-sulfonamido-4-pyrimidinyl, 2-Fluor-5-chlor-6-carbomethoxy-4-pyrimidinyl, 2,6-Difluor-5-trifluormethyl-4-pyrimidinyl, 2,4-Bis(methylsulfonyl)-pyrimidinyl-4, 2,5-Bis-(methyl-sulfonyl)-5-chlor-pyrimidinyl-4, 2-Methylsulfonylpyrimidinyl-4, 2-Phenylsulfonyl-pyrimidinyl-4, 2-Methylsulfonyl-5-chlor-6-methyl-pyrimidinyl-4, 2-Methylsulfonyl-5-brom-6-methylpyrimidinyl-4, 2-Methylsulfonyl-5-chlor-6-ethyl-pyrimidinyl-4, 2-Methylsulfonyl-5-chlor-6-methyl-pyrimidinyl-4, 2-Methylsulfonyl-5-nitro-6-methyl-pyrimidinyl-4, 2,5,6-Tris-methylsulfonyl-pyrimidinyl-4, 2-Methylsulfonyl-5,6-dimethyl-pyrimidinyl-4, 2-Ethylsulfonyl-5-chlor-6-methylpyrimidinyl-4, 2-Methylsulfonyl-6-chlorpyrimidinyl-4, 2,6-Bis-(methylsulfonyl)-5-chlor-pyrimidinyl-4, 2-Methylsulfonyl-6-carboxy-pyrimidinyl-4, 2-Methylsulfonyl-5-sulfopyrimidinyl-4, 2-Methylsulfonyl-6-carbomethoxy-pyrimidinyl-4, 2-Methylsulfonyl-5-carboxy-pyrimidinyl-4, 2-Methylsulfonyl-5-cyan-6-methoxy-pyrimidinyl-4, 2-Methylsulfonyl-5-chlor-pyrimidinyl-4, 2-Sulfoethylsulfonyl-6-methylpyrimidinyl-4, 2-Methylsulfonyl-5-brom-pyrimidinyl-4, 2-Phenylsulfonyl-5-chlor-pyrimidinyl-4, 2-Carboxymethylsulfonyl-5-chlor-6-methyl-pyrimidinyl-4, 2,4-Dichlorpyrimidin-6-carbonyl oder -6-sulfonyl, 2,4-Dichlorpyrimidin-5-carbonyl oder -5-sulfonyl, 2-Chlor-4-methylpyrimidin-5-carbonyl, 2-Methyl-4-chlorpyrimidin-5-carbonyl, 2-Methylthio-4-fluorpyrimidin-5-carbonyl, 6-Methyl-2,4-dichlorpyrimidin-5-carbonyl, 2,4,6-Trichlorpyrimidin-5-carbonyl, 2,4-Dichlorpyrimidin-5-sulfonyl, 2,4-Dichlor-6-methyl-pyrimidin-5-carbonyl oder -5-sulfonyl, 2-Methylsulfonyl-6-chlorpyrimidin-4 und -5-carbonyl, 2,6-Bis(methylsulfonyl)-pyrimidin-4 oder -5-carbonyl, 2-Ethylsulfonyl-6-chlorpyrimidin-5-carbonyl, 2,4-Bis-(methylsulfonyl)-pyrimidin-5-sulfonyl, 2-Methylsulfonyl-4-chlor-6-methylpyrimidin-5-sulfonyl oder -5-carbonyl, 2-Chlorchinoxalin-3-carbonyl, 2- oder 3-Monochlorchinoxalin-6-carbonyl, 2- oder 3-Monochlorchinoxalin-6-sulfonyl, 2,3-Dichlorchinoxalin-5- oder -6-carbonyl, 2,3-Dichlorchinoxalin-5- oder -6-sulfonyl, 1,4-Dichlorphthalazin-6-sulfonyl oder -6-carbonyl, 2,4-Dichlorchinazolin-7- oder -6-sulfonyl oder -carbonyl, 2,4,6-Trichlorchinazolin-7- oder -8-sulfonyl, 2- oder 3- oder 4-(4',5'-Dichlor-pyridazon-6'-yl-1')-phenylsulfonyl oder -carbonyl, β-(4',5'-Dichlorpyridazinon-6'-yl-1')-propionyl, 3,6-Dichlorpyridazin-4-carbonyl oder -4-sulfonyl, 2-Chlorbenzthiazol-5- oder -6-carbonyl oder -5- oder -6-sulfonyl, 2-Arylsulfonyl- oder 2-Alkylsulfonylbenzthiazol-5- oder -6-carbonyl oder -5- oder -6-sulfonyl, wie 2-Methylsulfonyl- oder 2-Ethylsulfonylbenzthiazol-5- oder -6-sulfonyl oder -carbonyl, 2-Phenylsulfonyl-benzthiazol-5- oder -6-sulfonyl oder -carbonyl und die entsprechenden im ankondensierten Benzolring Sulfogruppen enthaltenden 2-Sulfonylbenzthiazol-5- oder -6-carbonyl- oder -sulfonyl-Derivate, 2-Chlorbenzoxazol-5- oder -6-carbonyl oder -sulfonyl, 2-Chlorbenzimidazol-5- oder-6-carbonyl oder -sulfonyl, 2-Chlor-1-methylbenzimidazol-5- oder -6-carbonyl oder-sulfonyl, 2-Chlor-4-methylthiazol-(1,3)-5-carbonyl oder -4- oder -5-sulfonyl; ammoniumgruppenhaltige Triazinringe, wie 2-Trimethylammonium-4-phenylamino- und -4-(o, m- oder p-Sulfophenyl)-amino-triazinyl-6, 2-(1,1-Dimethylhydrazinium)-4-und -4-(o-, m- oder p-Sulfophenyl)-aminotriazinyl-6, 2-(2-Isopropyliden-1,1-dimethyl)-hydrazinium-4-phenylamino- und -4-(o-, m- oder p-sulfophenyl)-aminotriazinyl-6, 2-N-Aminopyrrolidinium-, 2-N-Aminopiperidinium-4-phenylamino- oder -4-(o-, m- oder p-Sulfophenyl)-aminotriazinyl-6, 4-Phenylamino- oder 4-(Sulfophenylamino)-triazinyl-6, die in 2-Stellung über eine Stickstoffbindung das 1,4-Bis-aza-bicyclo[2,2,2]octan oder das 1,2-Bis-aza-bicyclo-[0,3,3]-octan quartär gebunden enthalten, 2-Pyridinium-4-phenylamino- oder -4-(o-, m- oder p-sulfophenyl)-amino-triazinyl-6 sowie entsprechende 2-Oniumtriazinyl-6-Reste, die in 4-Stellung durch Alkylamino, wie Methylamino, Ethylamino oder β-Hydroxyethylamino, oder Alkoxy, wie Methoxy oder Ethoxy, oder Aryloxy, wie Phenoxy oder Sulfophenoxy, substituiert sind.Fiber-reactive radicals are, for example: vinylsulfonyl, β-chloroethylsulfonyl, β-sulfatoethylsulfonyl, β-acetoxy-ethylsulfonyl, β-phosphatoethylsulfonyl, β-thiosulfatoethylsulfonyl, N-methyl-N- (β-sulfatoethyl-sulfonyl) -amino, acryloyl, -CO- CCl = CH 2 , -CO-CH = CH-Cl, -CO-CCl = CHCl, -CO-CCl = CH-CH 3 , -CO-CBr = CH 2 , -CO-CH = CH-Br, -CO -CBr = CH-CH 3 , -CO-CCl = CH-COOH, -CO-CH = CCl-COOH, -CO-CBr = CH-COOH, -CO-CH = CBr-COOH, -CO-CCI = CCI -COOH, -CO-CBr = CBr-COOH, β-chloro- or β-bromopropionyl, 3-phenylsulfonylpropionyl, 3-methylsulfonylpropionyl, 3-chloro-3-phenylsulfonylpropionyl, 2,3-dichloropropionyl, 2,3-dibromopropionyl, 2 -Fluoro-2-chloro-3,3-difluorocyclobutane-2-carbonyl, 2,2,3,3-tetrafluorocyclobutane-1-carbonyl or -1-sulfonyl, β- (2,2,3,3-tetrafluorocyclobutyl-1 ) -acryloyl, α- or β-methylsulfonylacryloyl, Propiolyl, chloroacetyl, bromoacetyl, 4- (β-chloroethylsuffonyl) butyryl, 4-vinylsulfonylbutyryl, 5- (β-chloroethylsulfonyl) valeryl, 5-vinylsulfonylvaleryl, 6- (β-chloroethylsulfonyl) caproyl, 6- Vinylsulfonyl-caproyl, 4-fluoro-3-nitro-benzoyl, 4-fluoro-3-nitro-phenylsulfonyl, 4-fluoro-3-methylsulfonyl-benzoyl, 4-fluoro-3-cyano-benzoyl, 2-fluoro-5- methylsulfonyl-benzoyl, 2,4-dichlorotriazinyl-6, 2,4-dichloropyrimidinyl-6, 2,4,5-trichloropyrimidinyl-6, 2,4-dichloro-5-nitro- or -5-methyl- or -5- carboxymethyl- or -5-carboxy- or -5-cyano- or -5-vinyl- or -5-sulfo- or -5-mono-, di- or -trichloromethyl- or -5-methylsulfonylpyrimidinyl-6, 2.5 -Dichlor-4-methylsulfonyl-pyrimidinyl-6, 2-fluoro-4-pyrimidinyl, 2,6-difluoro-4-pyrimidinyl, 2,6-difluoro-5-chloro-4-pyrimidinyl, 2-fluoro-5.6 -dichloro-4-pyrimidinyl, 2,6-difluoro-5-methyl-4-pyrimidinyl, 2,5-difluoro-6-methyl-4-pyrimidinyl, 2-fluoro-5-methyl-6-chloro-4-pyrimidinyl , 2-fluoro-5-nitro-6-chloro-4-pyrimidinyl, 5-bromo-2-fluoro-4-pyrimidinyl, 2-fluoro-5- cyan-4-pyrimidinyl, 2-fluoro-5-methyl-4-pyrimidinyl, 2,5,6-trifluoro-4-pyrimidinyl, 5-chloro-6-chloromethyl-2-fluoro-4-pyrimidinyl, 2,6- Difluoro-5-bromo-4-pyrimidinyl, 2-fluoro-5-bromo-6-chloro-methyl-4-pyrimidinyl, 2,6-difluoro-5-chloromethyl-4-pyrimidinyl, 2,6-difluoro-5- nitro-4-pyrimidinyl, 2-fluoro-6-methyl-4-pyrimidinyl, 2-fluoro-5-chloro-6-methyl-4-pyrimidinyl, 2-fluoro-5-chloro-4-pyrimidinyl, 2-fluoro 6-chloro-4-pyrimidinyl, 6-trifluoromethyl-5-chloro-2-fluoro-4-pyrimidinyl, 6-trifluoromethyl-2-fluoro-4-pyrimidinyl, 2-fluoro-5-nitro-4-pyrimidinyl, 2- Fluoro-5-trifluoromethyl-4-pyrimidinyl, 2-fluoro-5-phenyl- or -5-methylsulfonyl-4-pyrimidinyl, 2-fluoro-5-carbonamido-4-pyrimidinyl, 2-fluoro-5-carbomethoxy-4- pyrimidinyl, 2-fluoro-5-bromo-6-trifluoromethyl-4-pyrimidinyl, 2-fluoro-6-carbonamido-4-pyrimidinyl, 2-fluoro-6-carbomethoxy-4-pyrimidinyl, 2-fluoro-6-phenyl- 4-pyrimidinyl, 2-fluoro-6-cyan-4-pyrimidinyl, 2,6-difluoro-5-methylsulfonyl-4-pyrimidinyl, 2-fluoro-5-sulfonamido-4-pyrimidinyl, 2-fluoro-5-chloro 6-carbomethox y-4-pyrimidinyl, 2,6-difluoro-5-trifluoromethyl-4-pyrimidinyl, 2,4-bis (methylsulfonyl) pyrimidinyl-4, 2,5-bis (methylsulfonyl) -5-chloropyrimidinyl -4, 2-methylsulfonylpyrimidinyl-4, 2-phenylsulfonyl-pyrimidinyl-4, 2-methylsulfonyl-5-chloro-6-methyl-pyrimidinyl-4, 2-methylsulfonyl-5-bromo-6-methylpyrimidinyl-4, 2-methylsulfonyl -5-chloro-6-ethyl-pyrimidinyl-4, 2-methylsulfonyl-5-chloro-6-methyl-pyrimidinyl-4, 2-methylsulfonyl-5-nitro-6-methyl-pyrimidinyl-4, 2,5,6 -Tris-methylsulfonyl-pyrimidinyl-4, 2-methylsulfonyl-5,6-dimethyl-pyrimidinyl-4, 2-ethylsulfonyl-5-chloro-6-methylpyrimidinyl-4, 2-methylsulfonyl-6-chloropyrimidinyl-4, 2,6-bis (methylsulfonyl) -5-chloropyrimidinyl-4, 2-methylsulfonyl-6-carboxypyrimidinyl-4, 2-methylsulfonyl-5-sulfopyrimidinyl-4, 2-methylsulfonyl-6-carbomethoxy-pyrimidinyl- 4,2-methylsulfonyl-5-carboxypyrimidinyl-4,2-methylsulfonyl-5-cyano-6-methoxypyrimidinyl-4,2,2-methylsulfonyl-5-chloropyrimidinyl-4,2,2-sulfoethylsulfonyl-6-methylpyrimidinyl- 4, 2-methylsulfonyl-5-bromo-pyrimidinyl-4, 2-phenylsulfonyl-5-chloro-pyrimidinyl-4, 2-carboxymethylsulfonyl-5-chloro-6-methyl-pyrimidinyl-4, 2,4-dichloropyrimidine-6- carbonyl or -6-sulfonyl, 2,4-dichloropyrimidine-5-carbonyl or -5-sulfonyl, 2-chloro-4-methylpyrimidine-5-carbonyl, 2-methyl-4-chloropyrimidine-5-carbonyl, 2-methylthio- 4-fluoropyrimidine-5-carbonyl, 6-methyl-2,4-dichloropyrimidine-5-carbonyl, 2,4,6-trichloropyrimidine-5-carbonyl, 2,4-dichloropyrimidine-5-sulfonyl, 2,4-dichloro- 6-methyl-pyrimidine-5-carbonyl or -5-sulfonyl, 2-methylsulfonyl-6-chloropyrimidine-4 and -5-carbonyl, 2,6-bis (methylsulfonyl) pyrimidine-4 or -5-carbonyl, 2- Ethylsulfonyl-6- chloropyrimidine-5-carbonyl, 2,4-bis (methylsulfonyl) pyrimidine-5-sulfonyl, 2-methylsulfonyl-4-chloro-6-methylpyrimidine-5-sulfonyl or -5-carbonyl, 2-chloroquinoxaline-3-carbonyl , 2- or 3-monochloroquinoxaline-6-carbonyl, 2- or 3-monochloroquinoxaline-6-sulfonyl, 2,3-dichloroquinoxaline-5- or -6-carbonyl, 2,3-dichloroquinoxaline-5- or -6-sulfonyl , 1,4-dichlorophthalazin-6-sulfonyl or -6-carbonyl, 2,4-dichloroquinazoline-7- or -6-sulfonyl or -carbonyl, 2,4,6-trichloroquinazoline-7- or -8-sulfonyl, 2 - or 3- or 4- (4 ', 5'-dichloropyridazon-6'-yl-1') phenylsulfonyl or carbonyl, β- (4 ', 5'-dichloropyridazinon-6'-yl-1' ) -propionyl, 3,6-dichloropyridazin-4-carbonyl or -4-sulfonyl, 2-chlorobenzthiazole-5- or -6-carbonyl or -5- or -6-sulfonyl, 2-arylsulfonyl- or 2-alkylsulfonylbenzothiazole-5 - or -6-carbonyl or -5- or -6-sulfonyl, such as 2-methylsulfonyl- or 2-ethylsulfonylbenzthiazole-5- or -6-sulfonyl or -carbonyl, 2-phenylsulfonyl-benzothiazole-5- or -6-sulfonyl or carbonyl and the corresponding 2-sulfonylbenzothiazole-5 or -6-carbonyl or -sulfonyl derivatives, 2-chlorobenzoxazole-5- or -6-carbonyl or -sulfonyl, 2-chlorobenzimidazole-5- or-6, containing sulfo groups in the fused benzene ring -carbonyl or -sulfonyl, 2-chloro-1-methylbenzimidazole-5- or -6-carbonyl or -sulfonyl, 2-chloro-4-methylthiazole- (1,3) -5-carbonyl or -4- or -5- sulfonyl; triazine rings containing ammonium groups, such as 2-trimethylammonium-4-phenylamino- and -4- (o, m- or p-sulfophenyl) -amino-triazinyl-6, 2- (1,1-dimethylhydrazinium) -4-and -4- (o-, m- or p-sulfophenyl) aminotriazinyl-6, 2- (2-isopropylidene-1,1-dimethyl) hydrazinium-4-phenylamino- and -4- (o-, m- or p-sulfophenyl) aminotriazinyl-6, 2-N-aminopyrrolidinium-, 2-N-aminopiperidinium-4-phenylamino- or -4- (o-, m- or p-sulfophenyl) -aminotriazinyl-6, 4-phenylamino- or 4- (sulfophenylamino) triazinyl-6, which, in the 2-position, the 1,4-bis-aza-bicyclo [2,2,2] octane or the 1,2-bis-aza-bicyclo- [ Contain 0.3,3] octane bound in a quaternary manner, 2-pyridinium-4-phenylamino- or -4- (o-, m- or p-sulfophenyl) -amino-triazinyl-6 and corresponding 2-oniumtriazinyl-6 radicals which are substituted in the 4-position by alkylamino, such as methylamino, ethylamino or β-hydroxyethylamino, or alkoxy, such as methoxy or ethoxy, or aryloxy, such as phenoxy or sulfophenoxy.
Besonders interessante faserreaktive Reste sind Fluor- und Chlor-1,3,5-triazinreste der Formel (16)
Weiterhin kann Q ein Aminorest der allgemeinen Formel -NR20R21 sein, in welcher R20 Wasserstoff oder Alkyl von 1 bis 4 C-Atomen, wie Methyl oder Ethyl, ist und R21 Phenyl bedeutet, das durch einen faserreaktiven Rest der Vinylsulfonreihe direkt oder über eine Methylamino-, Ethylamino-, Methylen-, Ethylen- oder Propylengruppe substituiert ist und das noch durch 1 oder 2 Substituenten aus der Gruppe Methoxy, Ethoxy, Methyl, Ethyl, Chlor, Carboxy und Sulfo substituiert sein kann, oder R21 Alkyl von 2 bis 4 C-Atomen ist, wie Ethyl oder n-Propyl, das durch eine faserreaktive Gruppe der Vinylsulfonreihe substituiert ist, oder Alkylenphenyl mit einem Alkylenrest von 1 bis 4 C-Atomen ist, dessen Phenyl durch einen faserreaktiven Rest der Vinylsulfonreihe substituiert ist, oder in welcher R20 und R21 beide Alkyl von 2 bis 4 C-Atomen, wie Ethyl und n-Propyl, sind, die durch eine faserreaktive Gruppe der Vinylsulfonreihe substituiert sind, oder in welcher R20 und R21 beide Alkylen von 3 bis 8 C-Atomen bedeuten, die durch 1 oder 2 Oxi- und/oder Aminogruppen unterbrochen sind und an die endständig eine faserreaktive Gruppe der Vinylsulfonreihe gebunden ist.Furthermore, Q can be an amino radical of the general formula -NR 20 R 21 , in which R 20 is hydrogen or alkyl of 1 to 4 carbon atoms, such as methyl or ethyl, and R 21 is phenyl, which is directly by a fiber-reactive radical of the vinylsulfone series or is substituted by a methylamino, ethylamino, methylene, ethylene or propylene group and which can also be substituted by 1 or 2 substituents from the group methoxy, ethoxy, methyl, ethyl, chlorine, carboxy and sulfo, or R 21 alkyl of 2 to 4 carbon atoms, such as ethyl or n-propyl, which is substituted by a fiber-reactive group of the vinylsulfone series, or alkylenephenyl with an alkylene radical of 1 to 4 carbon atoms, the phenyl of which is substituted by a fiber-reactive radical of the vinylsulfone series, or in which R 20 and R 21 are both alkyl of 2 to 4 carbon atoms, such as ethyl and n-propyl, which are substituted by a fiber-reactive group from the vinylsulfone series, or in which R 20 and R 21 are both alkylene of 3 to 8 carbon atoms, which are interrupted by 1 or 2 oxy and / or amino groups and to which a fiber-reactive group is terminated Vinyl sulfone series is bound.
Faserreaktive Gruppen der Vinylsulfonreihe sind solche der allgemeinen Formel -SO2-Y, in welcher Y Vinyl bedeutet oder Ethyl ist, das in β-Stellung durch einen alkalisch eliminierbaren Substituenten substituiert ist, wie beispielsweise durch Chlor, Sulfato, Phosphato, Thiosulfato, Acetyloxy, Sulfobenzoyloxy und Dimethylamino.Fiber-reactive groups of the vinylsulfone series are those of the general formula -SO 2 -Y, in which Y is vinyl or ethyl which is substituted in the β-position by an alkali-eliminable substituent, such as, for example, chlorine, sulfato, phosphato, thiosulfato, acetyloxy, Sulfobenzoyloxy and dimethylamino.
Die in erfindungsgemäßer Weise erhältlichen Färbungen der modifizierten Cellulosefasermaterialien benötigen, wie bereits erwähnt, nach der Fixierung des Farbstoffes auf dem Substrat keine weitere Nachbehandlung, insbesondere keinen aufwendigen Nachbehandlungsprozeß unter Einbeziehung einer Wäsche. Sofern überhaupt erforderlich, genügt ein übliches ein- oder mehrmaliges Spülen des gefärbten Substrates mit warmem oder heißem und gegebenenfalls kaltem Wasser, das gegebenenfalls ein nichtionogenes Netzmittel oder ein faserreaktives Nachbehandlungsmittel enthalten kann, wie beispielsweise Kondensationsprodukte aus einem Mol Cyanurchlorid und zwei Mol 4-(β-Sulfatoethylsulfonyl)-anilin, aus äquivalenten Mengen an Cyanurchlorid, 4-(β-Sulfatoethylsulfoanyl)-anilin und 4,8-Disulfo-2-amino-naphthalin oder aus äquivalenten Mengen an Cyanurchlorid, 4-Sulfo-anilin und 4,8-Disulfo-2-aminonaphthalin. Die Verwendung eines faserreaktiven Nachbehandlungsmittels empfiehlt sich dann, wenn das erfindungsgemäß modifizierte Fasermaterial nur in leichten Farbtiefen gefärbt wurde oder ein Farbstoff eingesetzt wurde, der keine zufriedenstellende Faserreaktivität besitzt. In diesen Fällen sind noch ausreichend färbeaktive Stellen auf der modifizierten Faser vorhanden, die beispielsweise mit anderen Farbstoffen in mit diesen Farbstoffen verunreinigten Spülbädern zu reagieren vermögen. Durch diese Nachbehandlung werden die noch aktiven Stellen der erfindungsgemäß modifizierten Faser desaktiviert, und man erhält auch bei einem in einem technischen Prozeß verwendeten, mit Farbstoffen verunreinigten Spülwasser die ursprünglich gewünschte klare Färbung. Darüberhinaus ist eine Kochendbehandlung des gefärbten Substrates mit einer Waschlösung zur Verbesserung der Echtheitseigenschaften nicht erforderlich.The dyeings of the modified cellulose fiber materials obtainable in the manner according to the invention, as already mentioned, do not require any further aftertreatment after the dye has been fixed on the substrate, in particular no complicated aftertreatment process including washing. If necessary at all, it is sufficient to rinse the colored substrate once or several times with warm or hot and, if appropriate, cold water, which may optionally contain a nonionic wetting agent or a fiber-reactive aftertreatment agent, such as, for example, condensation products from one mole of cyanuric chloride and two moles of 4- (β -Sulfatoethylsulfonyl) aniline, from equivalent amounts of cyanuric chloride, 4- (β-sulfatoethylsulfoanyl) aniline and 4,8-disulfo-2-amino-naphthalene or from equivalent amounts of cyanuric chloride, 4-sulfo-aniline and 4.8- Disulfo-2-aminonaphthalene. The use of a fiber-reactive aftertreatment agent is advisable if the fiber material modified according to the invention has been dyed only in slight depths of shade or if a dye has been used which does not have satisfactory fiber reactivity. In these cases, there are still sufficient dye-reactive spots on the modified fiber, which, for example, can react with other dyes in rinsing baths contaminated with these dyes. Through this aftertreatment, the still active areas of the invention modified fiber is deactivated, and the originally desired clear color is obtained even in a rinsing water used in a technical process and contaminated with dyes. In addition, a final boiling treatment of the colored substrate with a washing solution to improve the fastness properties is not necessary.
Die nachstehenden Beispiele dienen zur Erläuterung der Erfindung. Die darin genannten Teile sind Gewichtsteile, die Prozentangaben stellen Gewichtsprozente dar, sofern nicht anders vermerkt. Gewichtsteile beziehen sich zu Volumenteilen wie Kilogramm zu Liter.The following examples serve to illustrate the invention. The parts mentioned are parts by weight, the percentages are percentages by weight, unless stated otherwise. Parts by weight relate to parts by volume such as kilograms to liters.
Zur Synthese einer erfindungsgemäß verwendbaren aminogruppenhaltigen Verbindung, die zur Modifizierung des Fasermaterials dient, gibt man zu einer Mischung aus 750 Vol.-Teilen einer 100%iger Schwefelsäure und 75 Vol.-Teilen einer 20 % Schwefeltrioxid enthaltenden Schwefelsäure (20 %iges Oleum) von 10°C unter Rühren langsam 500 Vol.-Teile N-(β-Hydroxyethyl)-piperidin, wobei man unter ständigem Kühlen die Reaktionstemperatur zwischen 20 und 25°C hält. Nach Beendigung der Umsetzung rührt man das Reaktionsgemisch in 1000 Teile Eiswasser ein, stellt mit Calciumcarbonat einen pH-Wert von 4 ein, erwärmt den Ansatz kurzzeitig auf 50°C und filtriert danach das gebildete Calciumsulfat ab. Noch vorhandene Calciumionen werden aus dem Filtrat mit Natriumoxalat gefällt. Nach Abtrennung des Calciumoxalats wird die wäßrige Lösung des N-(β-Sulfatoethyl)-piperidins unter reduziertem Druck zur Trockene eingedampft. Es wird ein gelbes, öliges Produkt erhalten, das kristallisiert und bei 124°C unter Zersetzung schmilzt.For the synthesis of an amino group-containing compound which can be used according to the invention and which serves to modify the fiber material, a mixture of 750 parts by volume of a 100% strength sulfuric acid and 75 parts by volume of a 20% sulfuric acid-containing sulfuric acid (20% strength oleum) is added 10 ° C slowly with stirring 500 parts by volume of N- (β-hydroxyethyl) piperidine, the reaction temperature being kept between 20 and 25 ° C with constant cooling. After the reaction has ended, the reaction mixture is stirred into 1000 parts of ice water, the pH is adjusted to 4 with calcium carbonate, the batch is briefly heated to 50 ° C. and the calcium sulfate formed is then filtered off. Calcium ions still present are precipitated from the filtrate with sodium oxalate. After the calcium oxalate has been separated off, the aqueous solution of the N- (β-sulfatoethyl) piperidine is evaporated to dryness under reduced pressure. A yellow, oily product is obtained which crystallizes and melts at 124 ° C. with decomposition.
Zur Herstellung eines Gemisches der Verbindungen 3-Sulfato-2-hydroxy-1-amino-propan und 2-Sulfato-3-hydroxy-1-amino-propan trägt man unter Rühren 92,9 Teile 2,3-Dihydroxy-1-amino-propan in 98 Teilen 96%iger Schwefelsäure ein, wobei die Reaktionstemperatur durch Außenkühlung bei 20 bis 25°C gehalten wird. Die Aufarbeitung des Reaktionsgemisches und die Isolierung des 3-Sulfato-2-hydroxy-1-amino-propans erfolgt in gleicher Weise, wie im Beispiel A beschrieben.To produce a mixture of the compounds 3-sulfato-2-hydroxy-1-aminopropane and 2-sulfato-3-hydroxy-1-aminopropane, 92.9 parts of 2,3-dihydroxy-1-amino are added with stirring -propane in 98 parts of 96% sulfuric acid, the reaction temperature being kept at 20 to 25 ° C. by external cooling. The reaction mixture is worked up and the 3-sulfato-2-hydroxy-1-aminopropane is isolated in the same manner as described in Example A.
Man trägt bei einer Temperatur von 20°C langsam unter Rühren 100 Teile 2,3-Dihydroxy-1-(trimethylammonium)-propan-chlorid in 110 Teile 100%ige Schwefelsäure ein, rührt den Ansatz zur Beendigung der Umsetzung noch einige Stunden weiter und isoliert die gebildete Esterverbindung in der im Beispiel A angegebenen Weise. Man erhält ein öliges Produkt als Gemisch aus 3-Sulfato-2-hydroxy-1-(trimethylammonium)-propan- und 2-Sulfato-3-hydroxy-1-(trimethylammonium)-propan-sulfat.100 parts of 2,3-dihydroxy-1- (trimethylammonium) propane chloride are slowly introduced into 110 parts of 100% strength sulfuric acid at a temperature of 20.degree. C., the mixture is stirred for a few hours and the reaction is ended isolates the ester compound formed in the manner given in Example A. An oily product is obtained as a mixture of 3-sulfato-2-hydroxy-1- (trimethylammonium) propane and 2-sulfato-3-hydroxy-1- (trimethylammonium) propane sulfate.
Zur Herstellung von N-(γ-Sulfato-β-hydroxy-propyl)-piperidin gibt man langsam unter rühren bei 20°C 100 Teile N-(β,γ-Dihydroxy-propyl)-piperidin in 67 Teile 100%ige Schwefelsäure ein. Man rührt den Ansatz noch einige Stunden weiter und isoliert die erfindungsgemäße Piperidinverbindung in der im Beispiel A beschriebenen Weise. Sie wird zunächst als öliges Produkt erhalten, das nach einiger Zeit kristallisiert. Es schmilzt bei 170 bis 175°C unter Zersetzung.To prepare N- (γ-sulfato-β-hydroxypropyl) piperidine, slowly add 100 parts of N- (β, γ-dihydroxypropyl) piperidine to 67 parts of 100% sulfuric acid with stirring at 20 ° C. . The mixture is stirred for a further hour and the piperidine compound according to the invention is isolated in the manner described in Example A. It is initially obtained as an oily product which crystallizes after some time. It melts at 170 to 175 ° C with decomposition.
Zur Herstellung von N-(γ-Sulfato-β-hydroxy-propyl)-pyrrolidin trägt man langsam unter Rühren bei 20°C 50 Teile N-(β,γ-Dihydroxy-propyl)-pyrrolidin in 98 Teile 100%ige Schwefelsäure ein. Man rührt den Ansatz noch einige Stunden weiter und isoliert sodann die gebildete Verbindung in der im Beispiel A angegebenen Weise als öliges Produkt.To prepare N- (γ-sulfato-β-hydroxy-propyl) pyrrolidine, 50 parts of N- (β, γ-dihydroxy-propyl) pyrrolidine in 98 parts of 100% sulfuric acid are slowly added with stirring at 20 ° C. . The batch is stirred for a further hour and the compound formed is then isolated as an oily product in the manner given in Example A.
Zur Herstellung einer erfindungsgemäß verwendbaren Silanverbindung gibt man 67,9 Teile N-Methylamino-ethanol langsam zu 35,2 Teilen Kalium in 1000 Vol.-Teilen Tetrahydrofuran, wobei man die exotherme Reaktion durch Außenkühlung auf einer Temperatur zwischen 30 und 40°C hält. Anschließend erhitzt man den Ansatz am Rückfluß bis zur vollständigen Umsetzung des Kaliums (etwa 5 Stunden). Danach kühlt man den Ansatz auf etwa 20°C ab und gibt 190,3 Teile γ-Chlorpropyl-(methyl)-(diethoxy)-silan hinzu, wobei man die Reaktionstemperatur erforderlichenfalls unter 40°C durch Außenkühlung hält. Nach erfolgter Umsetzung wird das ausgefallene Kaliumchlorid abfiltriert und das Filtrat durch Destillation von Tetrahydrofuran befreit. Das Produkt wird danach einer Vakuumdestillation unterworfen. Die Verbindung [γ-(β'-N-Methylamino-ethoxy)-propyl]-methyl-diethoxy-silan der Formel
Zur Herstellung einer erfindungsgemäß verwendbaren Silanverbindung verfährt man gemäß der Verfahrensweise des Beispieles A, setzt jedoch anstelle der γ-Chlorpropyl-methyl-diethoxy-silan-Verbindung die äquivalente Menge an γ-Chlorpropyl-triethoxy-silan ein. Man gewinnt das erfindungsgemäße [γ-(β'-N-Methylamino-ethoxy)-propyl]-triethoxy-silan der Formel
Zur Herstellung einer Silanverbindung verfährt man gemäß der Verfahrensweise des Beispieles A, setzt jedoch anstelle der γ-Chlorpropyl-methyl-diethoxy-silan-Verbindung die äquivalente Menge an (γ-Chlorpropyl)-(dimethyl)-(ethoxy)-silan ein. Man gewinnt die erfindungsgemäße Verbindung [γ-(β'-N-Methylamino-ethoxy)-propyl]-(dimethyl)-(ethoxy)-silan der Formel
36,7 Teile N-Methylamino-ethanol gibt man langsam zu 20,1 Teilen Kalium in 700 Vol.-Teilen Tetrahydrofuran, wobei man die exotherme Reaktion durch Außenkühlung auf einer Temperatur zwischen 30 und 40°C hält. Anschließend erhitzt man den Ansatz am Rückfluß bis zur vollständigen Umsetzung des Kaliums (etwa 5 Stunden) und gibt danach bei einer Temperatur zwischen 20 und 35°C 147,7 Teile eines Gemisches (im Verhältnis der meta-/para-Isomeren von etwa 70:30) von [3'- und 4'-Chlormethyl-phenyl-1- und -2-ethyl]-methyl-diethoxy-silan hinzu. Nach erfolgter Umsetzung wird das ausgefallene Kaliumchlorid abfiltriert und das Filtrat durch Destillation von Tetrahydrofuran befreit. Das Produkt wird danach einer Vakuumdestillation unterworfen. Die als Gemisch erhaltenen erfindungsgemäßen Verbindungen, die den Formeln
- 1-{3'-[β-(N-Methylamino)-ethoxy-methyl]-phenyl}-eth-1-yl-(diethoxy)-(methyl)-silan: Kdp.: 165°C/10 mbar ;
- 1-{4'-[β-(N-Methylamino)-ethoxy-methyl]-phenyl}-eth-1-yl-(diethoxy)-(methyl)-silan: Kdp.: 174°C/10 mbar ;
- 2-{3'-[β-(N-Methylamino)-ethoxy-methyl]-phenyl}-eth-2-yl-(diethoxy)-(methyl)-silan: Kdp.: 185°C/10 mbar ;
- 2-{4'-[β-(N-Methylamino)-ethoxy-methyl]-phenyl]-eth-2-yl-(diethoxy)-(methyl)-silan: Kdp.: 197°C/10 mbar.
- 1- {3 '- [β- (N-Methylamino) -ethoxy-methyl] -phenyl} -eth-1-yl- (diethoxy) - (methyl) -silane: bp: 165 ° C / 10 mbar;
- 1- {4 '- [β- (N-Methylamino) -ethoxy-methyl] -phenyl} -eth-1-yl- (diethoxy) - (methyl) -silane: bp: 174 ° C / 10 mbar;
- 2- {3 '- [β- (N-Methylamino) -ethoxy-methyl] -phenyl} -eth-2-yl- (diethoxy) - (methyl) -silane: bp: 185 ° C / 10 mbar;
- 2- {4 '- [β- (N-Methylamino) -ethoxy-methyl] -phenyl] -eth-2-yl- (diethoxy) - (methyl) -silane: bp: 197 ° C / 10 mbar.
- a) Ein Gewebe aus mercerisierter und gebleichter Baumwolle wird mit einer 20 bis 25°C warmen wäßrigen Lösung von 50 Teilen Natriumhydroxid und 50 Teilen 2-Oxo-1,3-oxazolidin in 1000 Teilen Wasser mit einer Flottenaufnahme von 75 % imprägniert. Anschließend wird das Material während 45 Sekunden mit Heißluft von 180°C behandelt, wobei sowohl die Trocknung als auch die Fixierung der Oxazolidinonverbindung auf dem Gewebe erfolgt. Anschließend wird das Material in kaltem und 60°C heißem Wasser und gegebenenfalls in einem essigsäurehaltigen wäßrigen Bad behandelt, bis restliches Alkali aus dem Gewebe entfernt ist.a) A fabric of mercerized and bleached cotton is impregnated with a 20 to 25 ° C aqueous solution of 50 parts of sodium hydroxide and 50 parts of 2-oxo-1,3-oxazolidine in 1000 parts of water with a liquor absorption of 75%. The material is then treated with hot air at 180 ° C. for 45 seconds, with both the drying and the fixing of the oxazolidinone compound taking place on the tissue. The material is then treated in cold and hot water at 60 ° C. and, if appropriate, in an aqueous bath containing acetic acid until residual alkali has been removed from the tissue.
-
b) Das modifizierte Baumwollgewebe wird mittels einer oder zweier Walzen zur Führung und Spannung des Gewebes unter einem Ink-Jet-Drucker hindurchgeführt und mittels einer wäßrigen 6%igen Farbstofflösung des aus der DE-A- 19 43 904 bekannten Farbstoffes der Formel
Es wird bei minimalem Flottenauftrag und geringster Abwasserbelastung ein farbstarker konturscharfer roter Druck erhalten, der gute Allgemeinechtheiten, insbesondere gute Wasch- und Lichtechtheiten, besitzt.With a minimal liquor application and minimal wastewater pollution, a strong, sharp red color print is obtained, which has good general fastness properties, in particular good fastness to washing and light.
- a) Ein mercerisiertes und gebleichtes Baumwollgewebe wird mit einer wäßrigen Lösung von 37,5 Teilen Natriumhydroxid und 75 Teilen 2-Oxo-1,3-oxazolidin in 1000 Teilen Wasser bei einer Temperatur zwischen 25 und 30°C mit einer Flottenaufnahme von 85 % imprägniert und anschließend zur Fixierung der Oxazolidinonverbindung auf dem Fasermaterial etwa 2,5 Minuten mit Heißluft von 150°C behandelt, wobei gleichzeitig die Trocknung des imprägnierten Gewebes erfolgt. Das modifizierte Material wird anschließend durch Behandlung mit kaltem und 60°C heißem Wasser von überschüssigem Alkali befreit.a) A mercerized and bleached cotton fabric is impregnated with an aqueous solution of 37.5 parts of sodium hydroxide and 75 parts of 2-oxo-1,3-oxazolidine in 1000 parts of water at a temperature between 25 and 30 ° C with a liquor absorption of 85% and then treated to fix the oxazolidinone compound on the fiber material for about 2.5 minutes with hot air at 150 ° C., the impregnated fabric being dried at the same time. The modified material is then freed from excess alkali by treatment with cold water at 60 ° C.
- b) Das modifizierte, getrocknete Gewebe wird beispielsweise in einem handelsüblichen Büro-Tintenstrahldrucker mit wasserlöslichen faserreaktiven Farbstoffen bedruckt, wobei die Grundfarben der subtraktiven Farbmischung (Gelb, Cyan, Magenta und zusätzlich Schwarz) in einem Arbeitsgang aufgetragen werden. Zur anschließenden Fixierung verwendet man einen Dämpfer bei 105°C und wäscht anschließend heiß nach.b) The modified, dried fabric is printed, for example, in a commercially available office inkjet printer with water-soluble fiber-reactive dyes, the basic colors of the subtractive color mixture (yellow, cyan, magenta and additionally black) being applied in one operation. For the subsequent fixation, use a damper at 105 ° C and then wash it hot.
- a) Ein Gewebe aus mercerisierter und gebleichter Baumwolle wird mit einer 25 bis 30°C warmen wäßrigen Lösung von 80 Teilen [γ-(β'-Amino-ethoxy)-propyl]-trimethoxy-silan in 1000 Teilen Wasser, die mit Eisessig auf einen pH-Wert von 5,5 eingestellt ist, mit einer Flottenaufnahme von 72 % imprägniert. Anschließend wird das Material während 5 Minuten mit Heißluft von 130°C getrocknet und die Silanverbindung gleichzeitig auf dem Material fixiert.a) A fabric made of mercerized and bleached cotton is washed with a 25 to 30 ° C aqueous solution of 80 parts of [γ- (β'-amino-ethoxy) propyl] trimethoxy silane in 1000 parts of water with glacial acetic acid a pH of 5.5 is set, impregnated with a liquor absorption of 72%. The material is then dried with hot air at 130 ° C. for 5 minutes and the silane compound is simultaneously fixed on the material.
- b) Das so modifizierte, getrocknete Baumwollgewebe wird auf einer Unterlage befestigt und in einem handelsüblichen Büro-Tintenstrahldrucker mit wäßrigen Lösungen von faserreaktiven Farbstoffen bedruckt, wobei die Grundfarben der subtraktiven Farbmischung (Gelb, Cyan, Magenta und zusätzlich Schwarz) in vier einzelnen Gängen hintereinander aufgetragen werden. Zur anschließenden Fixierung verwendet man einen Dämpfer bei 105°C und wäscht anschließend heiß nach.b) The modified, dried cotton fabric is attached to a base and printed with aqueous solutions of fiber-reactive dyes in a commercially available office inkjet printer, the basic colors of the subtractive color mixture (yellow, cyan, magenta and additionally black) being applied in four individual courses in succession will. For the subsequent fixation, use a damper at 105 ° C and then wash it hot.
-
c) Zur Herstellung eines orangen Druckes kann man beispielsweise den aus der EP-A- 0 061 151 bekannten Farbstoff der Formel
- a) Ein mercerisiertes und gebleichtes Baumwollgewebe wird mit einer wäßrigen Lösung von 50 Teilen [γ-(β'-Aminoethyl-amino)-propyl]-trimethoxy-silan in 1000 Teilen Wasser, die mit Eisessig auf einen pH-Wert von 5,5 eingestellt ist, bei einer Temperatur von 25 bis 30°C mit einer Flottenaufnahme von 72 % geklotzt. Anschließend erfolgt die Fixierung der Silanverbindung auf der Baumwolle und die gleichzeitige Trocknung des geklotzten Gewebes durch etwa fünfminütige Behandlung mit Heißluft von 130°C.a) A mercerized and bleached cotton fabric is washed with an aqueous solution of 50 parts of [γ- (β'-aminoethylamino) propyl] trimethoxysilane in 1000 parts of water, which is brought to pH 5.5 with glacial acetic acid is set, padded at a temperature of 25 to 30 ° C with a liquor absorption of 72%. The silane compound is then fixed on the cotton and the padded fabric is simultaneously dried by treatment with hot air at 130 ° C. for about five minutes.
- b) Das so modifizierte, getrocknete Baumwollgewebe wird auf einem Flachbettdrucker unter ausschließlicher Bewegung des Druckkopfes in einem Arbeitsgang unter Verwendung eines faserreaktiven Farbstoffes, wie beispielsweise eines in den vorhergehenden oder nachfolgenden Beispielen beschriebenen Farbstoffes, bedruckt. Anschließend wird das bedruckte Material mit Trockenhitze zwecks Fixierung des Farbstoffes behandelt und gegebenenfalls, sofern dies erforderlich erscheint, anschließend kalt gewaschen.b) The modified, dried cotton fabric is on a flatbed printer with exclusive movement of the print head in one Operation printed using a fiber-reactive dye, such as a dye described in the preceding or following examples. The printed material is then treated with dry heat to fix the dye and, if necessary, is then washed cold.
- a) Ein mercerisiertes und gebleichtes Baumwollgewebe wird mit einer wäßrigen Lösung von 50 Teilen [γ-(β'-Aminoethyl-amino)-propyl]-trimethoxy-silan in 1000 Teilen Wasser, die mit Eisessig auf einen pH-Wert von 5,5 eingestellt ist, bei einer Temperatur von 25 bis 30°C mit einer Flottenaufnahme von 72 % geklotzt. Anschließend erfolgt die Fixierung der Silanverbindung auf der Baumwolle und die gleichzeitige Trocknung des geklotzten Gewebes durch etwa fünfminütige Behandlung mit Heißluft von 130°C.a) A mercerized and bleached cotton fabric is washed with an aqueous solution of 50 parts of [γ- (β'-aminoethylamino) propyl] trimethoxysilane in 1000 parts of water, which is brought to pH 5.5 with glacial acetic acid is set, padded at a temperature of 25 to 30 ° C with a liquor absorption of 72%. The silane compound is then fixed on the cotton and the padded fabric is simultaneously dried by treatment with hot air at 130 ° C. for about five minutes.
- b) Das so modifizierte Baumwollgewebe wird mit Hilfe einer oder zweier Gummiwalzen direkt eingezogen und in einem Arbeitsgang mit faserreaktiven Farbstoffen in den Grundfarben der substraktiven Farbmischung mittels einem Ink-Jet-Drucker bedruckt. Die anschließende Fixierung kann beispielsweise durch Mikrowellenbestrahlung erfolgen. Die Farbstoffe sind auf dem Material echt fixiert, so daß eine Nachwäsche in der Regel nicht erforderlich erscheint.b) The cotton fabric modified in this way is drawn in directly with the aid of one or two rubber rollers and printed in one operation with fiber-reactive dyes in the basic colors of the subtractive color mixture using an ink-jet printer. The subsequent fixation can be carried out, for example, by microwave radiation. The dyes are really fixed on the material, so that a post-wash does not usually appear necessary.
- a) Ein Gewebe aus einer handelsüblichen Polyacrylfaser wird mit einer Flottenaufnahme von 84 %, bezogen auf das Gewicht des Fasermaterials, mit einer wäßrigen Lösung von 50 Teilen [β-(γ'-Aminopropyl-amino)-ethyl]-trimethoxy-silan in 1000 Teilen Wasser, die mit Eisessig auf einen pH-Wert von 5,5 eingestellt ist, geklotzt. Das geklotzte Gewebe wird danach fünf Minuten einer Temperatur von 100°C ausgesetzt, wobei sowohl die Fixierung der Silanverbindung auf dem Material als auch die Trocknung des Materials erfolgt.a) A fabric made from a commercially available polyacrylic fiber with a liquor absorption of 84%, based on the weight of the fiber material, with an aqueous solution of 50 parts of [β- (γ'-aminopropylamino) ethyl] trimethoxy silane in 1000 Parts of water, which is adjusted to pH 5.5 with glacial acetic acid, are padded. The padded fabric is then exposed to a temperature of 100 ° C. for five minutes, whereby both the fixing of the silane compound on the material and the drying of the material take place.
- b) Das so modifizierte Gewebe wird in einem handelsüblichen Tintenstrahldrucker unter Verwendung einer wäßrigen Lösung eines schwarzen Reaktivfarbstoffes und wäßriger Lösungen von faserreaktiven Farbstoffen, deren Grundfarben Gelb, Cyan und Magenta einer substraktiven Farbmischung entsprechen, bedruckt. Die Farbstoffe werden anschließend in einem Dämpfer bei 130°C fixiert. Auf eine Nachwäsche kann verzichtet werden.b) The fabric modified in this way is printed in a commercially available inkjet printer using an aqueous solution of a black reactive dye and aqueous solutions of fiber-reactive dyes whose basic colors yellow, cyan and magenta correspond to a subtractive color mixture. The dyes are then fixed in a steamer at 130 ° C. After-washing is not necessary.
-
c) Zur Herstellung eines brillantroten, konturscharfen Druckes kann in der unter b) angegebenen Verfahrensweise verfahren werden, indem man mittels einem handelsüblichen Tintenstrahldrucker lediglich die wäßrige Lösung des aus Beispiel 1 der Europäischen Patentschrift EP-B- 0 032 187 bekannten Farbstoffes der Formel
Es wird ein waschechter Druck mit scharfen Konturen erhalten.A real print with sharp contours is obtained.
- a) Ein Gewebe aus handelsüblicher reiner Seide wird mit der im Beispiel 3 angegebenen Silanlösung mit einer Flottenaufnahme von 80 % imprägniert und anschließend bei 120°C während 3 Minuten getrocknet, wobei gleichzeitig die Fixierung der Silanverbindung auf der Seidenfaser erfolgt.a) A fabric made of commercially available pure silk is impregnated with the silane solution given in Example 3 with a liquor absorption of 80% and then dried at 120 ° C. for 3 minutes, the silane compound being fixed on the silk fiber at the same time.
- b) Das so modifizierte Material wird auf einer Unterlage befestigt und in einem handelsüblichen Büro-Tintenstrahldrucker mit wäßrigen Farbstofflösungen bedruckt, wobei die Grundfarben der subtraktiven Farbmischung (Gelb, Cyan, Magenta und zusätzlich Schwarz) in vier einzelnen Gängen hintereinander aufgetragen werden. Die Farbstoffe werden anschließend auf dem Material mittels eines Dämpfers bei 105°C fixiert. Das in einem konturenscharfen Druckmuster gefärbte Material wird anschließend heiß nachgewaschen.b) The material modified in this way is attached to a base and printed in a commercial office inkjet printer with aqueous dye solutions, the basic colors of the subtractive color mixture (yellow, cyan, magenta and additionally black) in four individual courses be applied in a row. The dyes are then fixed on the material using a damper at 105 ° C. The material dyed in a sharp-edged print pattern is then washed hot.
- a) Ein Gewebe aus mercerisierter und gebleichter Baumwolle wird mit einer 20 bis 25°C warmen wäßrigen Lösung von 50 Teilen Natriumhydroxid und 50 Teilen 1-N-(β-Sulfatoethyl)-piperazin in 1000 Teilen Wasser mit einer Flottenaufnahme von 90% imprägniert. Anschließend wird das Material während 2,5 min mit Heißluft von 150°C behandelt, wobei sowohl die Trocknung als auch die Fixierung der Piperazinverbindung auf dem Gewebe erfolgt. Anschließend wird das so erhaltene Material in kaltem und 60°C heißem Wasser und gegebenenfalls in einem essigsäurehaltigen wäßrigen Bad behandelt, bis restliches Alkali aus dem Gewebe entfernt ist.a) A fabric of mercerized and bleached cotton is impregnated with a 20 to 25 ° C aqueous solution of 50 parts of sodium hydroxide and 50 parts of 1-N- (β-sulfatoethyl) piperazine in 1000 parts of water with a liquor absorption of 90%. The material is then treated with hot air at 150 ° C. for 2.5 minutes, with both the drying and the fixing of the piperazine compound taking place on the tissue. The material thus obtained is then treated in cold water at 60 ° C. and, if appropriate, in an aqueous bath containing acetic acid until residual alkali has been removed from the tissue.
-
b) Das modifizierte Baumwollgewebe wird in einem handelsüblichen Tintenstrahldrucker mit einer wäßrigen Lösung des aus der EP-A- 0 061 151 bekannten Farbstoffes der Formel
- a) Ein Gewebe aus mercerisierter und gebleichter Baumwolle wird mit einer 20 bis 25°C warmen wäßrigen Lösung von 50 Teilen Natriumhydroxid und 50 Teilen des Monosulfats des 2,3-Dihydroxy-1-aminopropan in 1000 Teilen Wasser mit einer Flottenaufnahme von 90 % geklotzt. Das imprägnierte Material wird danach 2,5 Minuten mit Heißluft von 150°C zur Fixierung der Aminopropanverbindung auf dem Material unter gleichzeitiger Trocknung behandelt und danach in kaltem und 60°C heißem Wasser bis zur vollständigen Entfernung des überschüssigen Alkalis gewaschen und danach getrocknet.a) A fabric of mercerized and bleached cotton is padded with a 20 to 25 ° C aqueous solution of 50 parts of sodium hydroxide and 50 parts of the monosulfate of 2,3-dihydroxy-1-aminopropane in 1000 parts of water with a liquor absorption of 90% . The impregnated material is then treated with hot air at 150 ° C. for 2.5 minutes to fix the aminopropane compound on the material with simultaneous drying and then washed in cold and 60 ° C. hot water until the excess alkali has been completely removed and then dried.
-
b) Das so modifizierte Gewebe wird in einem handelsüblichen Büro-Tintenstrahldrucker mit der wäßrigen Lösung des aus der europäischen Patentschrift EP-B- 158 233 bekannten Farbstoffes der Formel
Ein mercerisiertes und gebleichtes Baumwollgewebe wird mit einer wäßrigen Lösung von 50 Teilen Natriumhydroxid und 100 Teilen des Monosulfats des 2,3-Dihydroxy-1-aminopropan in 1000 Teilen Wasser bei einer Temperatur zwischen 25 und 30°C mit einer Flottenaufnahme von 85 % imprägniert und anschließend zur Fixierung der Aminopropanverbindung auf dem Fasermaterial etwa 3 Minuten mit Heißluft von 150°C behandelt, wobei gleichzeitig die Trocknung des imprägnierten Gewebes erfolgt. Das modifizierte Material wird anschließend durch Behandlung mit kaltem und 60°C heißem Wasser von überschüssigem Alkali befreit.A mercerized and bleached cotton fabric is impregnated with an aqueous solution of 50 parts of sodium hydroxide and 100 parts of the monosulfate of 2,3-dihydroxy-1-aminopropane in 1000 parts of water at a temperature between 25 and 30 ° C with a liquor absorption of 85% and then to Fixation of the aminopropane compound on the fiber material treated with hot air at 150 ° C. for about 3 minutes, the impregnated fabric drying at the same time. The modified material is then freed from excess alkali by treatment with cold water at 60 ° C.
Das so modifizierte, getrocknete Material wird mit Hilfe einer Gummiwalze unter einem Edelstahlblech hindurchgeführt und in einem Arbeitsgang mit den wäßrigen Lösungen von faserreaktiven Farbstoffen in den Grundfarben der subtraktiven Farbmischung mittels einem Tintenstrahldruckkopf, der nach dem "Drop on Demand"-Verfahren arbeitet, bedruckt. Anschließend wird die Warenbahn zur Fixierung durch einen kontinuierlich arbeitenden Mikrowellentrockner geführt. Das gefärbte Material kann anschließend noch durch Waschen fertiggestellt werden; in der Regel reicht allerdings ein kurzes, heißes Waschbad und anschließende Trocknung aus.The thus modified, dried material is passed under a stainless steel sheet with the aid of a rubber roller and printed in one operation with the aqueous solutions of fiber-reactive dyes in the basic colors of the subtractive color mixture by means of an ink jet print head which works according to the "drop on demand" process. The web is then passed through a continuously working microwave dryer for fixation. The dyed material can then be finished by washing; however, a short, hot wash bath and subsequent drying is usually sufficient.
- a) Ein Gewebe aus mercerisierter und gebleichter Baumwolle wird mit einer 20 bis 25°C warmen wäßrigen Lösung von 50 Teilen Natriumhydroxid und 32 Teilen 1-N-(β-Sulfatoethyl)-piperazin in 1000 Teilen Wasser mit einer Flottenaufnahme von 90 %, bezogen auf das Gewicht des Gewebes, in einem handelsüblichen Foulard imprägniert. Anschließend wird das foulardierte Gewebe getrocknet; die Fixierung der Piperazinverbindung auf dem Gewebe erfolgt mittels einer Hitzebehandlung bei 180°C. Danach wird das Gewebe in kaltem und in etwa 60°C heißem Wasser gespült, bis restliches Alkali aus dem Gewebe entfernt ist.a) A fabric of mercerized and bleached cotton is obtained with a 20 to 25 ° C aqueous solution of 50 parts of sodium hydroxide and 32 parts of 1-N- (β-sulfatoethyl) piperazine in 1000 parts of water with a liquor absorption of 90% on the weight of the fabric, impregnated in a commercially available foulard. The padded fabric is then dried; the piperazine compound is fixed on the tissue by means of heat treatment at 180 ° C. The tissue is then rinsed in cold water at approximately 60 ° C. until residual alkali has been removed from the tissue.
- b) Das gemäß a) modifizierte Gewebe wird in einem handelsüblichen Tintenstrahldrucker, der nach dem "Continous-Flow-Prinzip" arbeitet, auf eine Walze gespannt. Unter Rotation der Walze druckt man unter Anwendung von wäßrigen Lösungen von vier Farbstoffen gemäß der Vierfarbdrucktechnik ein Mehrfarbenbild aus (die Steuerung des Ausstosses der Farbstofflösungen im Ink-Jet-Drucker kann beispielsweise durch ein Computerprogramm erfolgen). Nach erfolgtem Druck wird das Gewebe bei 105°C während 15 Minuten gedämpft; anschließend erfolgt eine Nachbehandlung in einem heißen, seifenhaltigen Waschbad mit anschließendem Spülen mit heißem und kaltem Wasser. Um Anschmutzungen des Fonds zu verhindern, kann man dem Waschbad geringe Mengen an Ammoniak oder Diethanolamin zusetzen. Als im Vierfarbendruck anwendbare Farbstoffe können beispielsweise die folgenden eingesetzt werden: Der aus Beispiel 2 der DE-A-1 179 317 bekannte Kupferphthalocyaninfarbstoff als "Cyan-Komponente"; der aus Beispiel 56 der DE-B- 2 634 909 bekannte gelbe Farbstoff; der aus Beispiel 3 der EP-A-0 158 233 bekannte rote Farbstoff als "Magenta-Komponente"; der aus der Tabelle in Spalten 17/18 der DE-B-1 544 538 bekannte schwarze Farbstoff.b) The fabric modified according to a) is stretched on a roller in a commercially available inkjet printer which works according to the "continuous flow principle". While the roller is rotating, a multicolor image is printed out using aqueous solutions of four dyes using the four-color printing technique (the ejection of the dye solutions in the ink-jet printer can be controlled, for example, by a computer program). After printing, the tissue is at 105 ° C for 15 minutes steamed; this is followed by post-treatment in a hot, soap-containing washing bath followed by rinsing with hot and cold water. To prevent contamination of the fund, small amounts of ammonia or diethanolamine can be added to the wash bath. The following can be used, for example, as dyes which can be used in four-color printing: the copper phthalocyanine dye known from Example 2 of DE-A-1 179 317 as the "cyan component"; the yellow dye known from Example 56 of DE-B-2 634 909; the red dye known from Example 3 of EP-A-0 158 233 as "magenta component"; the black dye known from the table in columns 17/18 of DE-B-1 544 538.
Das erhaltene Gewebe zeigt einen sehr scharfen Farbdruck des gewählten Musters; die Färbung selbst besitzt eine gute Waschechtheit.The fabric obtained shows a very sharp color print of the chosen pattern; the dye itself has good wash fastness.
- a) Ein Viskosegewebe wird in einem handelsüblichen Foulard mit einer 20 bis 25°C warmen wäßrigen Lösung von 50 Teilen Natriumhydroxid und 32 Teilen 1-N-(β-Sulfatoethyl)-piperazin in 1000 Teilen Wasser mit einer Flottenaufnahme von 90 %, bezogen auf das Gewicht des Gewebes, imprägniert. Das Gewebe wird anschließend getrocknet und einer etwa 45 Sekunden dauernden Hitzebehandlung bei 180°C unterworfen, wobei die Fixierung der Piperazinverbindung auf dem Gewebe erfolgt. Anschließend erfolgt eine Nachbehandlung in kaltem und in etwa 60°C heißem Wasser, bis restliches Alkali aus dem Gewebe entfernt ist.a) A viscose fabric is in a commercially available foulard with a 20 to 25 ° C warm aqueous solution of 50 parts of sodium hydroxide and 32 parts of 1-N- (β-sulfatoethyl) piperazine in 1000 parts of water with a liquor absorption of 90%, based on the weight of the fabric, impregnated. The fabric is then dried and subjected to a heat treatment at 180 ° C. for about 45 seconds, the piperazine compound being fixed on the fabric. This is followed by post-treatment in cold and hot water at around 60 ° C until residual alkali has been removed from the tissue.
- b) Nach dem Trocknen wird das unter a) erhaltene modifizierte Baumwollgewebe gemäß den Angaben des Bespieles 11b) in den dort genannten handelsüblichen Tintenstrahldrucker gemäß einem Vierfarbendruck bedruckt, wobei die vier Farbstoffkomponenten die folgenden sein können: Der aus Beispiel 2 der DE-A-1 179 317 bekannte Kupferphthalocyaninfarbstoff als "Cyan-Komponente"; der aus der US-A- 3 926 944 bekannte gelbe Farbstoff (22); der aus Beispiel 15 der Deutschen Auslegeschrift 1 126 647 bekannte rote Farbstoff als "Magenta-Komponente" und der aus Colour Index bekannte schwarze Farbstoff C.I. Reactive Black 5.b) After drying, the modified cotton fabric obtained under a) is printed in accordance with the information in Example 11b) in the commercially available inkjet printer mentioned there in accordance with four-color printing, the four dye components being the following: The one from Example 2 of DE-A-1 179,317 known copper phthalocyanine dye as "cyan component"; the yellow dye (22) known from US-A-3,926,944; the one from Example 15 the German Auslegeschrift 1 126 647 known red dye as "magenta component" and the black dye known from Color Index CI Reactive Black 5.
Das erhaltene Gewebe zeigt einen sehr scharfen Farbdruck des gewählten Musters; die Färbung selbst besitzt eine gute Waschechtheit.The fabric obtained shows a very sharp color print of the chosen pattern; the dye itself has good wash fastness.
- a) Ein Baumwoll-Köper (Qualität rohweiß, Rohware, Gewicht 200 g/kg) wird mit einer wäßrigen Flotte, die 60 Teile 1-N-(β-Sulfatoethyl)-piperazin, 100 Teile Natriumhydroxid, 5 Teile eines handelsüblichen nichtionischen Netz- und Waschmittels und 6 Teile eines handelsüblichen Mittels zum Stabilisieren der Flotte und zur Faserschonung in 1000 Teilen Wasser enthält, mit einer Flottenaufnahme von 100 % imprägniert. Das imprägnierte Gewebe wird aufgedockt und einer Temperatur zwischen 95 und 103°C während 60 Minuten ausgesetzt. Anschließend erfolgt eine Nachbehandlung des Gewebes in kochendem Wasser, dem ein handelsübliches Tensid zugesetzt sein kann, um die auf dem Gewebe befindlichen wasserlöslichen Verunreinigungen zu entfernen. Nach weiterem Spülen mit warmen und kaltem Wasser und Trocknen erhält man ein textiles Gewebe mit einem Entschlichtungsgrad von 9 (Bewertung nach Tegewa) und einer Saughöhe von 6,5 cm/30 min.a) A cotton twill (quality raw white, raw material, weight 200 g / kg) is washed with an aqueous liquor containing 60 parts of 1-N- (β-sulfatoethyl) piperazine, 100 parts of sodium hydroxide, 5 parts of a commercially available nonionic and detergent and 6 parts of a commercial agent for stabilizing the liquor and for protecting the fibers in 1000 parts of water, impregnated with a liquor absorption of 100%. The impregnated fabric is docked and exposed to a temperature between 95 and 103 ° C for 60 minutes. The fabric is then post-treated in boiling water, to which a commercially available surfactant can be added in order to remove the water-soluble contaminants on the fabric. After further rinsing with warm and cold water and drying, a textile fabric with a degree of desizing of 9 (Tegewa rating) and a suction head of 6.5 cm / 30 min are obtained.
-
b) Das gemäß a) modifizierte Baumwollgewebe wird in einen Tintenstrahldrucker, der nach dem Piezo-Prinzip arbeitet, eingespannt. Mit Hilfe eines Computers druckt man ein Mehrfarbenbild unter Anwendung der Lösungen von drei Farbstoffen gemäß der Dreifarbendruck-Technik aus, wobei als Farbstoffe die folgenden eingesetzt werden können:
Der aus Beispiel 21 der DE-B- 2 634 909 bekannte blaue Farbstoff; der aus der US-A- 3 926 944 bekannte gelbe Farbstoff (22); der aus Beispiel 1 der EP-A-0 022 575 bekannte rote Farbstoff als "Magenta-Komponente". Nach dem Druckvorgang werden die Farbstoffe durch 15-minütiges Dämpfen mit Heißdampf von 105°C auf dem Gewebe fixiert, das danach in einem heißen, seifenhaltigen Waschbad gewaschen und anschließend mit warmem und kaltem Wasser klar gespült wird. Um Anschmutzungen des Weißfonds zu verhindern, kann man dem Waschbad geringe Mengen an Ammoniak oder Diethanolamin zusetzen.b) The cotton fabric modified according to a) is clamped in an inkjet printer which works according to the piezo principle. With the help of a computer, a multicolor image is printed out using the solutions of three dyes according to the three-color printing technique, the following being used as dyes:
The blue dye known from Example 21 of DE-B-2 634 909; the yellow dye (22) known from US-A-3,926,944; the red dye known from Example 1 of EP-A-0 022 575 as the "magenta component". After the printing process, the dyes are fixed on the fabric by steaming for 15 minutes with superheated steam at 105 ° C then washed in a hot, soap-containing washing bath and then rinsed clear with warm and cold water. To prevent soiling of the white fund, small amounts of ammonia or diethanolamine can be added to the wash bath.
Zur Herstellung weiterer Färbungen nach der erfindungsgemäßen Verfahrensweise geht man von einem erfindungsgemäß modifizierten Cellulosefasermaterial aus, wie beispielsweise von einem gemäß den obigen Ausführungsbeispielen modifizierten Cellulosefasermaterial, bedruckt dieses nach der Verfahrensweise eines Tintenstrahl-Druckers, beispielsweise analog nach einer der in den obigen Ausführungsbeispielen beschriebenen Methoden, unter Anwendung wäßriger Lösungen eines oder mehrerer in den nachfolgenden Tabellenbeispielen angegebenen, bekannten Farbstoffe (die Farbstoffe sind in Form der freien Säure geschrieben; sie werden jedoch in Form ihrer Alkalimetallsalze eingesetzt). Man erhält klare, farbstarke Druckmuster mit den in dem jeweiligen Tabellenbeispiel angegebenen Farbton und den für den jeweiligen Farbstoff guten Echtheitseigenschaften, insbesondere guten Waschechtheiten.
Claims (3)
- A process for dyeing sheetlike fiber materials, in particular those made of or containing cellulose fibers, with anionic dyes, in particular those having fiber-reactive groups, which comprises applying an alkali-free and preferably low-electrolyte or completely electrolyte-free aqueous solution of the anionic dye by the inkjet printing spray technique to a fiber material which has been pretreated and modified with a compound of the formula (1) or (2)
- The process of claim 1, wherein the dye is a fiber-reactive dye.
- A sheetlike fiber material dyed as claimed in claim 1.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE4232331 | 1992-09-26 | ||
| DE4232331 | 1992-09-26 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| EP0590397A1 EP0590397A1 (en) | 1994-04-06 |
| EP0590397B1 true EP0590397B1 (en) | 1997-03-12 |
Family
ID=6468933
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| EP93114661A Expired - Lifetime EP0590397B1 (en) | 1992-09-26 | 1993-09-13 | Process for the preparation of dyes following the ink-jet print technique on modified fiber materials with anionic textile dyesstuffs |
Country Status (13)
| Country | Link |
|---|---|
| US (1) | US5348557A (en) |
| EP (1) | EP0590397B1 (en) |
| JP (1) | JPH06192976A (en) |
| KR (1) | KR940007285A (en) |
| CN (1) | CN1087694A (en) |
| AT (1) | ATE150110T1 (en) |
| BR (1) | BR9303904A (en) |
| CA (1) | CA2106893A1 (en) |
| DE (1) | DE59305724D1 (en) |
| IL (1) | IL107082A0 (en) |
| MX (1) | MX9305879A (en) |
| TR (1) | TR27347A (en) |
| TW (1) | TW228543B (en) |
Families Citing this family (23)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE4306432A1 (en) * | 1993-03-02 | 1994-09-08 | Hoechst Ag | Process for printing and dyeing textiles (reverse reserve printing) |
| DE4306433A1 (en) * | 1993-03-02 | 1994-09-08 | Hoechst Ag | Ink-jet single-phase reactive printing |
| DE4402210A1 (en) * | 1994-01-26 | 1995-07-27 | Hoechst Ag | Process for the production of aminated cotton fibers |
| DE4422758A1 (en) * | 1994-06-29 | 1996-01-04 | Hoechst Ag | Aminated viscose fibres, dyeable in absence of salt or alkali |
| ATE273412T1 (en) | 1994-04-15 | 2004-08-15 | Canon Kk | INKJET PRINTING FABRIC, INKJET PRINTING METHODS AND PRINTS PRODUCED THEREFROM |
| DE59502732D1 (en) * | 1994-05-17 | 1998-08-13 | Dystar Textilfarben Gmbh & Co | Amination of cellulosic synthetic fibers |
| DE4417211A1 (en) * | 1994-05-17 | 1995-11-23 | Hoechst Ag | Modified cellulose@ synthetic fibres with affinity for reactive dyes |
| JP3584094B2 (en) * | 1994-10-25 | 2004-11-04 | キヤノン株式会社 | Fabric for inkjet printing, printing method and printed matter |
| US5830240A (en) * | 1996-10-23 | 1998-11-03 | Solutia Inc. | Fibers and textile materials having enhanced dyeability and finish compositions used thereon |
| US5944852A (en) * | 1996-10-23 | 1999-08-31 | Solutia Inc. | Dyeing process |
| US6200667B1 (en) | 1997-03-24 | 2001-03-13 | Canon Kabushiki Kaisha | Cloth for textile printing, and textile printing process using the cloth and print obtained thereby |
| US6350872B1 (en) | 1998-10-28 | 2002-02-26 | The Virkler Company | Salt free dyeing of cellulosic fibers with anionic dyes |
| DE10004954A1 (en) * | 2000-02-04 | 2001-08-16 | Dystar Textilfarben Gmbh & Co | Aqueous printing inks for use by the inkjet printing process, their production and their use on textile fiber materials |
| US6962735B2 (en) * | 2001-08-31 | 2005-11-08 | Milliken & Company | Textile printing substrate |
| JP5245147B2 (en) * | 2007-07-19 | 2013-07-24 | 独立行政法人産業技術総合研究所 | Nitrogenous organosilicon compounds |
| US8071694B2 (en) * | 2008-02-20 | 2011-12-06 | Sabic Innovative Plastics Ip B.V. | Thermoplastic polycarbonate/polyester blend compositions with improved mechanical properties |
| JP5639347B2 (en) * | 2009-06-18 | 2014-12-10 | 旭化成せんい株式会社 | Mixed yarn or fabric dyed product of polyamide fiber, cellulose fiber and polyurethane fiber |
| JPWO2013047386A1 (en) | 2011-09-30 | 2015-03-26 | 富士フイルム株式会社 | Aqueous coloring composition for textile printing, textile printing method, and fabric |
| WO2013067700A1 (en) * | 2011-11-10 | 2013-05-16 | Rhodia (China) Co., Ltd. | Cyclic (poly)glycerol sulphates and preparation and use thereof |
| WO2013067915A1 (en) * | 2011-11-10 | 2013-05-16 | Rhodia Operations | Novel method to manufacture surface active compounds such as sulfate betaine |
| PT106070A (en) | 2011-12-23 | 2013-06-24 | Yd Ynvisible S A | SOLUTION OF ELECTROLYTE, PRINTING METHOD OF THE SAME AND SOLID ELECTROLYT RESULTING |
| WO2015170596A1 (en) * | 2014-05-08 | 2015-11-12 | コニカミノルタ株式会社 | Inkjet printing method and inkjet printing device |
| CN108193525B (en) * | 2018-02-01 | 2020-05-05 | 东莞长联新材料科技股份有限公司 | Treatment liquid for textile pigment ink-jet printing, preparation method of treatment liquid and pigment ink-jet printing method |
Family Cites Families (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB479341A (en) * | 1936-06-03 | 1938-02-03 | British Celanese | Improvements in the treatment of filaments, threads, fabrics, films, and like materials |
| US3653952A (en) * | 1958-06-26 | 1972-04-04 | Union Carbide Corp | Dyeable resin bonded fibrous substrates |
| FR1294236A (en) * | 1961-04-12 | 1962-05-26 | Dow Corning | Process for dyeing non-siliceous textile fibers |
| DE1927920A1 (en) * | 1969-05-31 | 1970-12-03 | Bayer Ag | Process for reducing the dye affinity of fiber materials made of polyacrylonitrile |
| FR2226504B1 (en) * | 1973-04-19 | 1976-12-17 | Ciba Geigy Ag | |
| DE3609984A1 (en) * | 1986-03-25 | 1987-10-01 | Bayer Ag | METHOD FOR TREATING FIBER MATERIALS |
| JPH0674390B2 (en) * | 1986-09-10 | 1994-09-21 | 三菱化成株式会社 | Ink for ink-jet printing and dyeing method |
| JPS6385188A (en) * | 1986-09-26 | 1988-04-15 | 東レ株式会社 | Ink jet dyeing method |
| DE3643386A1 (en) * | 1986-12-19 | 1988-06-23 | Hoechst Ag | AZO COMPOUNDS CONTAINING CYAN GROUPS, METHOD FOR THE PRODUCTION THEREOF AND THEIR USE AS DYES |
| JP2734709B2 (en) * | 1990-01-05 | 1998-04-02 | 東レ株式会社 | Ink jet dyeing fabric and ink jet dyeing method using the same |
| TW223134B (en) * | 1991-05-11 | 1994-05-01 | Hoechst Ag | |
| TW211595B (en) * | 1991-12-07 | 1993-08-21 | Hoechst Ag |
-
1993
- 1993-07-26 TW TW082105948A patent/TW228543B/zh active
- 1993-09-13 EP EP93114661A patent/EP0590397B1/en not_active Expired - Lifetime
- 1993-09-13 DE DE59305724T patent/DE59305724D1/en not_active Expired - Fee Related
- 1993-09-13 AT AT93114661T patent/ATE150110T1/en not_active IP Right Cessation
- 1993-09-22 JP JP5236544A patent/JPH06192976A/en not_active Withdrawn
- 1993-09-23 US US08/125,939 patent/US5348557A/en not_active Expired - Fee Related
- 1993-09-23 IL IL107082A patent/IL107082A0/en unknown
- 1993-09-24 TR TR00843/93A patent/TR27347A/en unknown
- 1993-09-24 CA CA002106893A patent/CA2106893A1/en not_active Abandoned
- 1993-09-24 BR BR9303904A patent/BR9303904A/en not_active Application Discontinuation
- 1993-09-24 MX MX9305879A patent/MX9305879A/en unknown
- 1993-09-25 CN CN93118107A patent/CN1087694A/en active Pending
- 1993-09-25 KR KR1019930019728A patent/KR940007285A/en not_active Application Discontinuation
Also Published As
| Publication number | Publication date |
|---|---|
| IL107082A0 (en) | 1993-12-28 |
| JPH06192976A (en) | 1994-07-12 |
| US5348557A (en) | 1994-09-20 |
| TR27347A (en) | 1995-01-13 |
| KR940007285A (en) | 1994-04-26 |
| MX9305879A (en) | 1994-05-31 |
| DE59305724D1 (en) | 1997-04-17 |
| BR9303904A (en) | 1994-04-26 |
| EP0590397A1 (en) | 1994-04-06 |
| CA2106893A1 (en) | 1994-03-27 |
| CN1087694A (en) | 1994-06-08 |
| TW228543B (en) | 1994-08-21 |
| ATE150110T1 (en) | 1997-03-15 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP0590397B1 (en) | Process for the preparation of dyes following the ink-jet print technique on modified fiber materials with anionic textile dyesstuffs | |
| EP0546476B1 (en) | Process for making a modified fiber material and process for dyeing the modified fiber material with anionic dyestuffs | |
| EP0513656A1 (en) | Process for dyeing of silanes modified with fibermaterials, the modification of fibermaterials with silanes | |
| EP0922735B1 (en) | Method for dyeing or printing and new reactive dyes | |
| DE2558931A1 (en) | TRANSFER PRINTING PROCESS FOR HYDROPHILES OR MIXTURES OF HYDROPHILIC AND SYNTHETIC FIBER MATERIAL WITH REACTIVE DISPERSION DYES | |
| DE4417718A1 (en) | Reactive dyes for inkjet printing | |
| EP0613977B1 (en) | Process for printing and dyeing of textiles | |
| EP0197418B1 (en) | Reactive azo dyes | |
| EP0613975B1 (en) | Reactive ink-jet one-phase printing | |
| EP0144093B1 (en) | Storage-stable printing pastes and their use | |
| EP0309405A1 (en) | Process for dyeing or printing a natural or synthetic fibrous polyamide material with reactive dyes | |
| EP0199950A1 (en) | Process for dyeing or printing fibre materials containing hydroxyl groups with new reactive dyes | |
| EP0352222B1 (en) | Fibre-reactive formazane dyes, process for their preparation and their use | |
| DE4327301A1 (en) | Process and use of reactive disperse dyes for dyeing or printing aminated, textile cotton and cotton / polyester blended fabrics | |
| EP0356394A2 (en) | Reactive dyes, their preparation and their use | |
| EP0209494B1 (en) | Process for dyeing or printing with shade stability | |
| EP0580091B1 (en) | Process for the manufacturing of a modified fibrous material and process for dyeing this modified fibrous material with anionic dyestuffs | |
| EP0410931B1 (en) | Fibre reactive formazane dyes, methods of their preparation and their use | |
| EP0889098A2 (en) | Azo dyes, process for their preparation and the use thereof | |
| EP0410930B1 (en) | Fibre reactive formazane dyes, methods of their preparation and use | |
| EP0341206A1 (en) | Fiber reactive formazane dyes | |
| DE4210270A1 (en) | Dyeing textile esp. cotton modified with aq. amino gp.-contg. silane cpd. | |
| EP0575744A1 (en) | Silane-containing dyestuffs, process for their preparation and their use | |
| DE1795140A1 (en) | Phthalocyanine dyes and process for their preparation |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PUAI | Public reference made under article 153(3) epc to a published international application that has entered the european phase |
Free format text: ORIGINAL CODE: 0009012 |
|
| AK | Designated contracting states |
Kind code of ref document: A1 Designated state(s): AT BE CH DE DK ES FR GB IT LI NL PT |
|
| 17P | Request for examination filed |
Effective date: 19940816 |
|
| 17Q | First examination report despatched |
Effective date: 19950509 |
|
| GRAG | Despatch of communication of intention to grant |
Free format text: ORIGINAL CODE: EPIDOS AGRA |
|
| GRAH | Despatch of communication of intention to grant a patent |
Free format text: ORIGINAL CODE: EPIDOS IGRA |
|
| GRAH | Despatch of communication of intention to grant a patent |
Free format text: ORIGINAL CODE: EPIDOS IGRA |
|
| RBV | Designated contracting states (corrected) |
Designated state(s): AT BE CH DE FR GB IT LI NL |
|
| GRAA | (expected) grant |
Free format text: ORIGINAL CODE: 0009210 |
|
| AK | Designated contracting states |
Kind code of ref document: B1 Designated state(s): AT BE CH DE FR GB IT LI NL |
|
| REF | Corresponds to: |
Ref document number: 150110 Country of ref document: AT Date of ref document: 19970315 Kind code of ref document: T |
|
| REG | Reference to a national code |
Ref country code: CH Ref legal event code: EP |
|
| REF | Corresponds to: |
Ref document number: 59305724 Country of ref document: DE Date of ref document: 19970417 |
|
| ITF | It: translation for a ep patent filed | ||
| GBT | Gb: translation of ep patent filed (gb section 77(6)(a)/1977) |
Effective date: 19970515 |
|
| ET | Fr: translation filed | ||
| PLBE | No opposition filed within time limit |
Free format text: ORIGINAL CODE: 0009261 |
|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: NO OPPOSITION FILED WITHIN TIME LIMIT |
|
| 26N | No opposition filed | ||
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: GB Payment date: 19980702 Year of fee payment: 6 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: NL Payment date: 19980703 Year of fee payment: 6 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: BE Payment date: 19980707 Year of fee payment: 6 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: AT Payment date: 19980708 Year of fee payment: 6 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: FR Payment date: 19980715 Year of fee payment: 6 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: CH Payment date: 19980818 Year of fee payment: 6 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: DE Payment date: 19981027 Year of fee payment: 6 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: GB Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 19990913 Ref country code: AT Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 19990913 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: LI Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 19990930 Ref country code: CH Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 19990930 Ref country code: BE Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 19990930 |
|
| BERE | Be: lapsed |
Owner name: HOECHST A.G. Effective date: 19990930 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: NL Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20000401 |
|
| GBPC | Gb: european patent ceased through non-payment of renewal fee |
Effective date: 19990913 |
|
| REG | Reference to a national code |
Ref country code: CH Ref legal event code: PL |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: FR Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20000531 |
|
| NLV4 | Nl: lapsed or anulled due to non-payment of the annual fee |
Effective date: 20000401 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: DE Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20000701 |
|
| REG | Reference to a national code |
Ref country code: FR Ref legal event code: ST |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: IT Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20050913 |